Изобретение относится к области медицины, а именно к генетике и ревматологии, и предназначено для прогнозирования ответа на терапию препаратом олокизумаб на основе панели эпигенетических маркеров.
Уровень техники
Ревматоидный артрит представляет собой хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением суставов и аутоиммунными нарушениями. В настоящее время число больных аутоиммунными артритами достигает почти 1% населения мира, что делает его актуальной проблемой современного здравоохранения [A Cribbs, M Feldmann et al. Towards an understanding of the role of DNA methylation in rheumatoid arthritis: therapeutic and diagnostic implications. Ther Adv Musculoskel Dis 2015, Vol. 7(5): p. 206–219]. Характерной особенностью ревматоидного артрита является выраженный клинический полиморфизм, заключающийся в широкой вариабельности симптомов и клинических форм. В настоящее время ревматоидный артрит рассматривают как мультифакториальное заболевание, которое развивается при наличии генетической предрасположенности и провоцирующих факторов внешней среды. Кроме того, не исключается возможность влияния эпигенетических факторов и механизмов [Sparks J.A., Costenbader K.H. Genetics, environment, and gene-environment interactions in the development of systemic rheumatic diseases (2014) Rheum Dis Clin North Am; 40(4): p. 637-657].
Диагностика ревматоидного артрита, как правило, основывается на клинической и лабораторной оценке признаков и симптомов. В основном, лабораторное исследование пациента с подозрением на ревматоидный артрит включает определение концентрации ряда антител в сыворотке или плазме крови, известных как ревматоидный фактор, и антител против циклического цитруллинированного пептида. Такие доступные в настоящее время лабораторные тесты для диагностики и определения прогноза ревматоидного артрита неточны и несовершенны, кроме того, из-за неспецифичности клинических симптомов, ревматоидный артрит сложно диагностировать на ранних стадиях. Таким образом, продолжает оставаться актуальным поиск более эффективных методик для диагностики ревматоидного артрита и персонализированный подбор подходящей терапии. МикроРНК, использование которых в качестве биомаркера для различных заболеваний подтверждено рядом исследований, являются перспективными кандидатами как для диагностики ревматоидного артрита, так и для прогнозирования ответа на терапию. МикроРНК представляют собой короткие некодирующие РНК длиной 19-25 нуклеотидов, которые регулируют экспрессию генов, подавляя их трансляцию или вызывая деградацию. МикроРНК принимают участие во многих биологических процессах, таких как клеточный рост, дифференцировка, апоптоз, метаболизм и иммунный ответ и нарушение их регуляции было показано при разных патологиях, включая ревматоидный артрит [Tavasolian F, Abdollahi E, Rezaei R, et al., Altered Expression of MicroRNAs in Rheumatoid Arthritis. J Cell Biochem, 2018. 119(1): p. 478-487].
МикроРНК удовлетворяют всем требованиям, предъявляемым к биомаркерам. Они дифференциально экспрессируются в сравнении со здоровыми донорами, как при ревматоидном артрите, так и при других аутоиммунных заболеваниях. Большим преимуществом микроРНК является то, что они легко детектируются в жидкостях тела, таких как кровь, слюна и моча, что позволяет использовать их в неинвазивной диагностике. При этом циркулирующие и внеклеточные микроРНК устойчивы к активности РНКаз и остаются стабильными при хранении и разморозке проб. Они легко могут быть измерены количественно как в тканях, так и в биологических жидкостях с помощью ПЦР или микрочипов. Кроме того, экспрессия микроРНК изменяется в зависимости от активности заболевания и его клинических проявлений, что позволяет использовать их не только для диагностики ревматоидного артрита, но и в качестве клинических маркеров для прогноза ответа на терапию [Tavasolian F, Abdollahi E, Rezaei R, et al., Altered Expression of MicroRNAs in Rheumatoid Arthritis. J Cell Biochem, 2018. 119(1): p. 478-487].
К препаратам, применяемых для лечения ревматоидного артрита, относится один из эффективных ингибиторов сигнального пути IL6/IL6R - олокизумаб (Olokizumab). Препарат разработан в рамках лицензионного соглашения с бельгийской фармацевтической компанией UCB Pharma S.A. и выведен российской группой компаний «Р-Фарм» на международный уровень. Олокизумаб является человеческим моноклональным антителом, блокирующим сборку лиганд-рецепторного комплекса IL6/IL6R. В настоящее время проходят испытания III фазы CREDO (Clinical Rheumatoid Arthritis Development for Olokizumab) в России, Европе, США и Азии. Среди опубликованных источников не обнаружены данные о возможных генетических и эпигенетических предикторах ответа на олокизумаб или побочных эффектов препарата.
Из уровня техники известен способ прогнозирования эффективности лечения ревматоидного артрита моноклональными антителами к TNF-α, а именно препаратом инфликсимаб [RU2485511C2]. В данном способе проводят исследования аллельного полиморфизма промотора гена TNF-α в позиции -857, и при выявлении гетерозиготного состояния либо гомозиготного носительства аллеля Т прогнозируют высокую вероятность эффективности терапии, а при выявлении гомозиготного носительства аллеля С прогнозируют повышенную вероятность неэффективности терапии.
Кроме того, известен способ прогноза эффективности лечения ревматоидного артрита симвастатином – синтетическим ингибитором ГМГ-КоА-редуктазы [RU2367430C2]. Способ основан на измерении уровня сывороточного IL-10, и при его содержании более 6,5 пг/мл прогнозируют эффективный клинический ответ на терапию симвастатином.
Известен ряд способов использования микроРНК, как одиночных, так и в составе панелей, в виде биомаркеров для диагностики ревматоидного артрита, определения прогноза или реакции на терапию различными препаратами.
Так, пациенты с низким уровнем miR-22 и высоким уровнем miR-886-3p в цельной крови до начала лечения показывают лучшие результаты при лечении адалимумабом [Krintel, S.B., et al., Prediction of treatment response to adalimumab: a double-blind placebo-controlled study of circulating microRNA in patients with early rheumatoid arthritis. Pharmacogenomics J, 2016. 16(2): p. 141-6.].
МикроРНК miR-10a может быть, как диагностическим, так и прогностическим маркером для определения эффективности терапии метотрексатом. Было показано повышение ее экспрессии после лечения метотрексатом [Hong, H., H. Yang, and Y. Xia, Circulating miR-10a as Predictor of Therapy Response in Rheumatoid Arthritis Patients Treated with Methotrexate. Curr Pharm Biotechnol, 2018. 19(1): p. 79-86].
Три циркулирующих в крови микроРНК miR-24, miR-26a и miR-125a-5p, каждая из которых сама по себе является маркером РА с чувствительностью и специфичностью 63.7 и 89.5%, 53.9 и 94.3%, 64.7 и 89.5%, соответственно, при их объединении достигают чувствительности 78.4% и специфичности 92.3% и, таким образом, более эффективны при диагностике ревматоидного артрита [WO2014/034685]. Кроме того, данные микроРНК (за исключением miR-125a-5p) коррелируют с такими показателями активности заболевания как скорость оседания эритроцитов, содержание C-реактивного белка, ревматоидного фактора, антител к циклическому цитруллинсодержащему пептиду и DAS28 и, таким образом, являются не только диагностическим, но и прогностическим маркером ревматоидного артрита.
Также известен способ прогнозирования эффективности лечения ревматоидного артрита препаратом ритуксимаб [Isabelle Duroux-Richard, Yves-Marie Pers, Sylvie Fabre, Meryem Ammari, Dominique Baeten, Guillaume Cartron, Isabelle Touitou, Christian Jorgensen, Florence Apparailly, "Circulating miRNA-125b Is a Potential Biomarker Predicting Response to Rituximab in Rheumatoid Arthritis", Mediators of Inflammation, vol. 2014, Article ID 342524, 9 pages, 2014.]. В данном исследовании предиктором клинической эффективности ритуксимаба (препарат, представляющий собой антитела к CD20 антигену) является высокий уровень экспрессии miR-125b.
Наиболее близким к предлагаемому решению является способ определения ответа на анти-TNF/DMARD терапию посредством оценки экспрессии двух микроРНК miR-23 и miR-223 [WO 2015/177368 от 22.05.2015]. Способ включает этап выделения РНК из сыворотки крови и оценки экспрессии указанных микроРНК каким-либо из существующих методов, включая ПЦР в реальном времени, использование микрочипов или нозерн-блот, и сравнение со средним значением экспрессии для неответчиков на терапию анти-TNF/DMARD (инфликсимаб, адалимумаб и этанерцепт). В исследование были включены 95 пациентов с ревматоидным артритом после прогрессирования на фоне лечения метотрексатом, и комбинация из двух указанных микроРНК показала высокую чувствительность и специфичность при определении групп ответчиков и неответчиков на терапию одним из анти-TNF/DMARD препаратов, что делает данные микроРНК хорошим прогностическим биомаркером.
Однако, ни один из известных аналогов не направлен на оценку эффективности лечения препаратом олокизумаб.
Технической проблемой, на решение которой направлено изобретение, является определение предикторов развития эффективного клинического ответа на лечение олокизумабом у больных ревматоидным артритом, что позволило бы индивидуализировать терапию.
Раскрытие сущности изобретения
Техническим результатом предложенного изобретения является обеспечение возможности прогнозирования эффективности лечения ревматоидного артрита препаратом олокизумаб.
Технический результат достигается при реализации способа, включающего использование эпигенетических маркеров, а именно панели из трех микроРНК: miR-26b, miR-451, miR-522, экспрессия которых ассоциирована с эффективностью олокизумаба при лечении ревматоидного артрита. При уровнях экспрессии miR-26b < -13.92, miR-451 < -12.08, miR-522 < -17.46 прогнозируют эффективный клинический ответ на терапию олокизумабом. Экспрессию указанных микроРНК измеряют в плазме крови пациентов методом полимеразной цепной реакции в реальном времени.
Способ позволяет разделить пациентов на группы отвечающих на лечение олокизумабом (ответчиков) и неответчиков, и, таким образом, дает возможность персонализированно подобрать терапию для больных ревматоидным артритом.
Таким образом, в предлагаемом способе так же, как и в известном способе-прототипе, производят оценку уровня экспрессии панели микроРНК, но состоящей из трех микроРНК, показавших ассоциацию с эффективностью лечения препаратом олокизумаб по данным предварительного исследования.
Способ может применяться для оценки эффективности лечения олокизумабом у индивидов европеоидной расы, в частности, российских пациентов.
Краткое описание чертежей
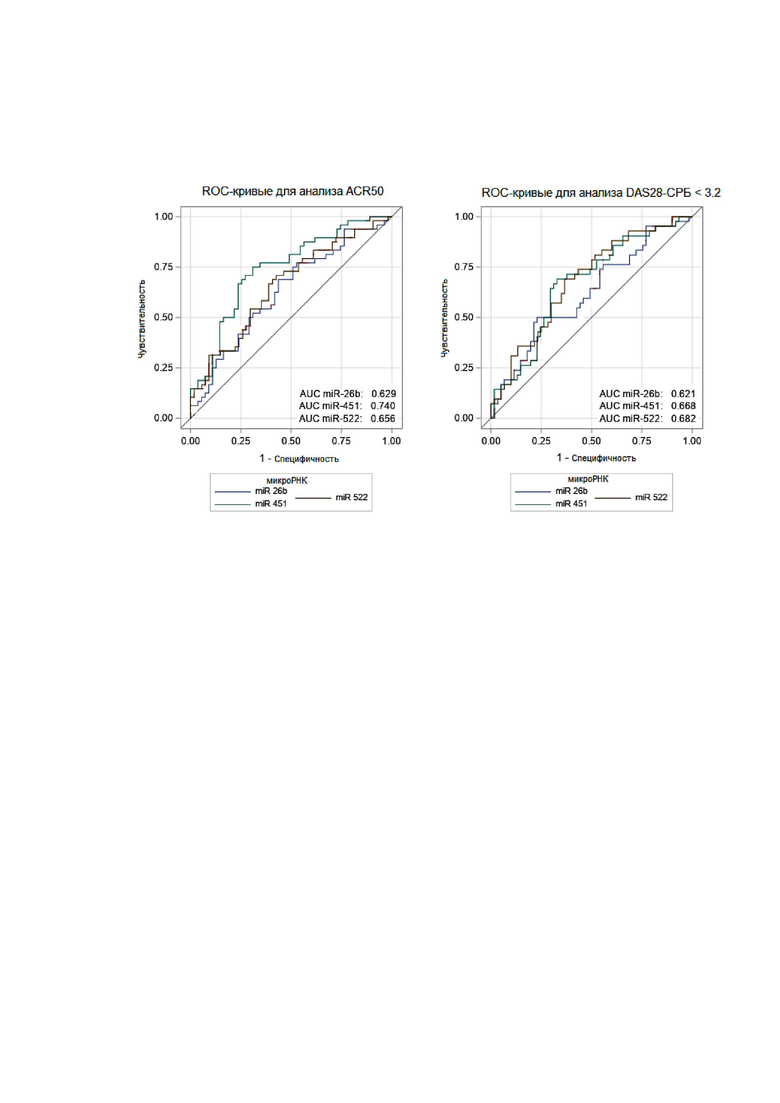
Изобретение поясняется графиками, где на чертеже представлены ROC-кривые (receiver-operator characteristic) для оценки предсказательной способности биомаркеров miR-26b, miR-451, miR-522, отражающие ассоциации между уровнями экспрессии данных маркеров и характеристиками эффективности терапии олокизумабом ACR50 и DAS28.
Осуществление изобретения
Ниже представлено более детальное описание реализации заявляемого изобретения, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
На этапе пробоподготовки кровь пациента с диагностированным ревматоидным артритом (например, в количестве 4 мл) собирают в стерильные пробирки, содержащие ЭДТА, и получают из нее плазму с помощью центрифугирования (2000g, 10 мин). Из полученной плазмы выделяют тотальную РНК в количестве не менее 10 нг/мкл с помощью, например, набора miRNeasy Serum/Plasma kit (Qiagen, Хильден, Германия). При этом концентрацию полученной РНК измеряют на спектрофотометре для микрообъемов, например, NanoDrop 2000 (Thermo Fisher Scientific, Нью-Йорк, США). Далее осуществляют обратную транскрипцию 300 нг РНК с применением, например, набора MiScript II RT Kit (Qiagen) с добавлением экзогенного контроля в соответствии с протоколом производителя. ПЦР в реальном времени выполняют в трех повторностях для каждой анализируемой микроРНК, а также экзогенного контроля cel-miR-39-3p с использованием, например, набора MiScript SYBR Green PCR Kit (Qiagen) и праймеров для микроРНК (miR-451: 5’- AAACCGTTACCATTACTGAGTAAAA -3’, miR-26b: 5’-GTTCAAGTAATTCAGGATAGGAAAA-3’, miR-522: 5’- CTCTAGAGGGAAGCGCTTTCT -3’), например, на приборе CFX96 Real-Time PCR Detection System (Bio-Rad, Геркулес, США) по рекомендованной производителем программе. Экспрессию микроРНК нормализуют относительно экзогенного контроля cel-miR-39-3p и рассчитывают с использованием метода 2-ΔΔCt [Livak, K.J., and Schmittgen, T.D. (2001). Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 25, 402-408.].
При получении значений экспрессии miR-26b < -13.92, miR-451 < -12.08, miR-522 < -17.46 прогнозируют эффективный клинический ответ на терапию олокизумабом. Более высокий уровень экспрессии по меньшей мере одного маркера статистически значимо является независимым предиктором худшего клинического ответа на лечение олокизумабом. Клинический эффект оценивают, например, с использованием шкалы DAS28.
В ходе предварительного исследования были рассмотрены микроРНК, потенциально ассоциированные с развитием, течением и ответом на терапию ревматоидного артрита: miR-29, miR-16, miR-155, miR-20a, miR-451, miR-26b, miR-522, miR-192, miR-137. Экспрессию данных микроРНК измеряли до начала лечения, через 12 и 24 недели после начала лечения препаратом олокизумаб в пробах плазмы крови 103 пациентов с ревматоидным артритом и получавших терапию препаратом олокизумаб в рамках клинического исследования CL04041022 «Рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование фазы III, проводимое в параллельных группах, для оценки эффективности и безопасности олокизумаба у пациентов со среднетяжелым или тяжелым ревматоидным артритом, недостаточно контролируемым терапией метотрексатом». На каждом визите пациентов осуществляли оценку безопасности, включавшую клиническое обследование.
Пациенты были разделены на группы ответчиков и неответчиков по показателям эффективности терапии ACR50 (улучшение состояния на 50% согласно критериям Американской коллегии ревматологов) и DAS28 (индекс активности заболевания (Disease Activity Score 28-joint Count)). Относительный уровень экспрессии микроРНК (dCt) определялся по значению пороговых циклов (Сt) как Ct референсной РНК (cel-miR-39-3p) – Ct исследуемой микроРНК.
Сравнение исходного уровня каждой микроРНК между ответчиками и неответчиками с помощью непараметрического критерия Манна–Уитни и включение статистически значимых результатов в анализ с применением ROC-кривых (receiver operating characteristic, рабочая характеристика приёмника) выявили достоверные ассоциации для miR-451, miR-26b и miR-522 с ответом по показателям эффективности терапии ACR50 и DAS28. Изначально повышенный уровень всех трех микроРНК до начала терапии свидетельствовал о худшем клиническом ответе на лечение олокизумабом. Полученные данные были подтверждены в ходе однофакторного регрессионного анализа с помощью логистической регрессии с последующим многофакторным анализом. Построенные в ходе анализа ROC-кривые для miR-26b, miR-451 и miR-522 представлены на Фиг.
Для повышения точности анализа в качестве прогностической панели была выбрана комбинация из трех микроРНК: miR-26b, miR-451 и miR-522. Для каждой из микроРНК было определено пороговое значение, ниже которого пациента относят к группе ответчиков на лечение олокизумабом. В таблице 1 представлены полученные для каждой из трех микроРНК значения AUC (площади под ROC-кривой) и пороговые значения dCt. Пациентов, попадающих в эту группу по всем микроРНК, относят к более предпочтительным кандидатам для терапии олокизумабом при условии соблюдения действующих клинических рекомендации профессиональных медицинских ассоциаций по назначению DMARD-препаратов.
Использование в клинической практике заявляемого способа позволяет отобрать пациентов, у которых наступает прогрессия после лечения метотрексатом, и они с достоверно более высокой вероятностью относительно среднепопуляционного уровня будут отвечать на терапию олокизумабом.
Таблица 1. МикроРНК, тестируемые для прогноза эффективности олокизумаба у больных ревматоидным артритом на второй линии терапии
Обозначения: ROC - receiver operating characteristic, рабочая характеристика приёмника; ДИ – доверительный интервал.
Настоящее изобретение поясняется конкретными примерами выполнения, демонстрирующими возможность достижения требуемого технического результата.
Пример 1
Пациентка П., 56 лет, с диагнозом ревматоидный артрит серопозитивный М05.8, активность II, стадия III, ФК II, прогрессирование на фоне лечения метотрексатом, DAS28-СРБ = 5.7.
Метод исследования: ПЦР в реальном времени для определения экспрессии в плазме крови микроРНК, ассоциированных с эффективностью олокизумаба, расчет и прогнозирование ответа на терапию олокизумабом.
Результат исследования: Определенные значения относительной экспрессии микроРНК miR-26b, miR-451 и miR-522 указаны в Таблице 2.
Таблица 2
Заключение: относительная экспрессия всех трех микроРНК ниже пороговых значений, что ассоциируется с эффективностью олокизумаба.
Терапия: Пациенту был назначен олокизумаб в дозировке 64 мг каждые 2 недели подкожно. Заметное снижение среднего уровня С-реактивного белка (СРБ) в плазме наблюдалось к 2 неделе лечения и сохранялось в течение 24 недель на протяжении всего периода лечения. Была достигнута низкая активность заболевания (DAS28 < 3.2). Негативных явлений не наблюдалось.
Пример 2
Пациент В., 64 года, с диагнозом ревматоидный артрит серонегативный M06.0, гормонозависимый, активность II, стадия III, ФК II, прогрессирование на фоне лечения метотрексатом, DAS28-СРБ = 6.1.
Метод исследования: ПЦР в реальном времени для определения экспрессии в плазме крови микроРНК, ассоциированных с эффективностью олокизумаба, расчет и прогнозирование ответа на терапию олокизумабом.
Результат исследования: Определенные значения относительной экспрессии микроРНК miR-26b, miR-451 и miR-522 указаны в Таблице 3.
Таблица 3
Заключение: относительная экспрессия всех трех микроРНК выше пороговых значений. Таким образом, экспрессия панели микроРНК ассоциирована с неэффективностью олокизумаба (эффективностью, не превышающей среднепопуляционные характеристики).
Пациенту был назначен олокизумаб в дозировке 64 мг каждые 2 недели подкожно. Однако в ходе лечения лишь к 24 недели были достигнуты показатели, соответствующие умеренной активности заболевания (DAS28=3,5).
Пример 3
Пациент М., 52 года, с диагнозом ревматоидный артрит серопозитивный М05.8, активность II, стадия II, ФК II, прогрессирование на фоне лечения метотрексатом, DAS28-СРБ = 4.8.
Метод исследования: ПЦР в реальном времени для определения экспрессии в плазме крови микроРНК, ассоциированных с эффективностью олокизумаба, расчет и прогнозирование ответа на терапию олокизумабом.
Результат исследования: Определенные значения относительной экспрессии микроРНК miR-26b, miR-451 и miR-522 указаны в Таблице 4.
Таблица 4
Заключение: относительная экспрессия всех трех микроРНК ниже пороговых значений, что ассоциируется с эффективностью олокизумаба.
Терапия: Пациенту был назначен олокизумаб в дозировке 64 мг каждые 4 недели подкожно. Выраженный эффект развивался приблизительно через 12 недель от начала введения препарата и сохранялся на протяжении всего периода лечения (24 недели). В ходе лечения была достигнута низкая активность заболевания (DAS28 < 3.2).
Таким образом, использование панели из трех микроРНК miR-26b, miR-451, miR-522, экспрессия которых ассоциирована с развитием и прогрессией ревматоидного артрита, позволяет спрогнозировать клинический ответ на лечение олокизумабом. Данный способ может быть использован для персонализированного подбора терапии для больных ревматоидным артритом, в частности, в российской популяции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА ПРЕПАРАТОМ ОЛОКИЗУМАБ НА ОСНОВЕ ГЕНОТИПИРОВАНИЯ | 2020 |
|
RU2749247C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КЛИНИЧЕСКОЙ ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ ТАКСАНОВ ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2023 |
|
RU2836870C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ТЕРАПИИ МЕТОТРЕКСАТОМ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ | 2020 |
|
RU2753793C1 |
| Способ коррекции артериальной ригидности у больных ревматоидным артритом | 2016 |
|
RU2623082C1 |
| СПОСОБ ПРОГНОЗА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА СИМВАСТАТИНОМ | 2008 |
|
RU2367430C1 |
| Способ коррекции вазомоторной дисфункции эндотелия и артериальной ригидности у больных ревматоидным артритом | 2018 |
|
RU2696285C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ВКЛЮЧЕНИЯ ИНФЛИКСИМАБА В ТЕРАПИЮ ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ | 2010 |
|
RU2416799C1 |
| Способ диагностики и/или прогноза острого повреждения почек | 2012 |
|
RU2657422C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ АКТИВНОСТИ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ | 2022 |
|
RU2790525C1 |
| СПОСОБ КОРРЕКЦИИ СТРУКТУРНО-ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ АРТЕРИАЛЬНОГО РУСЛА У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ | 2015 |
|
RU2572709C1 |
Изобретение относится к медицине, а именно к генетике и ревматологии, и может быть использовано для прогнозирования эффективности лечения ревматоидного артрита препаратом олокизумаб. Проводят определение уровня экспрессии эпигенетических маркеров в плазме крови, полученной у пациента c ревматоидным артритом: miR-26b, miR-451, miR-522. При полученных значениях miR-26b < -13.92, miR-451 < -12.08, miR-522 < -17.46 прогнозируют эффективный клинический ответ на терапию олокизумабом. Способ обеспечивает возможность прогнозирования эффективности лечения ревматоидного артрита препаратом олокизумаб за счет определения предикторов развития эффективного клинического ответа на лечение олокизумабом у больных ревматоидным артритом - эпигенетических маркеров. 1 з.п. ф-лы, 1 ил., 4 табл., 3 пр.
1. Способ прогнозирования эффективности лечения ревматоидного артрита препаратом олокизумаб, включающий определение уровня экспрессии эпигенетических маркеров в плазме крови, полученной у пациента c ревматоидным артритом: miR-26b, miR-451, miR-522, и при полученных значениях miR-26b < -13,92, miR-451 < -12,08, miR-522 < -17,46 прогнозируют эффективный клинический ответ на терапию олокизумабом.
2. Способ по п. 1, характеризующийся тем, что уровень экспрессии эпигенетических маркеров в плазме крови определяют методом полимеразной цепной реакции в реальном времени.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА МОНОКЛОНАЛЬНЫМИ АНТИТЕЛАМИ К ФНО-АЛЬФА НА ОСНОВЕ АЛЛЕЛЬНОГО ПОЛИМОРФИЗМА ПРОМОТОРА ГЕНА ФНО | 2011 |
|
RU2485511C2 |
| СПОСОБ ПРОГНОЗА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА СИМВАСТАТИНОМ | 2008 |
|
RU2367430C1 |
| WO 2015177368 A1, 26.11.2015 | |||
| WO 2014034685 A1, 06.03.2014 | |||
| BURE I.V | |||
| et al | |||
| Analysis of miRNA expression in patients with rheumatoid arthritis during Olokizumab treatment | |||
| J Pers Med | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| CHUROV A.V | |||
| et al | |||
| MicroRNAs in rheumatoid arthritis: Altered | |||
Авторы
Даты
2021-06-07—Публикация
2020-09-28—Подача