Перекрестная ссылка на родственные заявки
[0001] Данная заявка заявляет приоритет согласно предварительной заявки на патент США№62/220028, поданной 17 сентября 2015; предварительной заявки на патент США№62/242669, поданной 16 октября, 2015; предварительной заявки на патент США. №62/250756, поданной 4 ноября, 2015, каждая из которых включена в данный документ в полном объеме посредством ссылки.
Ссылка на перечень последовательностей, представленный в электронном виде с помощью EFS-Web
[0002] Содержание представленного в электронном виде перечня последовательностей (Название:2921_077PC03_SL. txt, Размер: 19451 бит и Дата создания: 13 сентября 2016) включена в данный документ в полном объеме посредством ссылки.
Область изобретения
[0003] Область изобретения обычно относится к комбинациям анти-FOLR1 иммуноконъюгата с анти-ФРЭС агентом, агентом на основе платины и/или доксорубицином, а также к применению комбинаций при лечении рака, например, рака яичников.
Уровень техники
[0004] Рак является одной из ведущих причин смерти в развитом мире, причем за один год только в Соединенных Штатах у более миллиона человек диагностируют рак и 500 000 человек умирают от него. В целом, по оценкам, у более 1 из 3 человек разовьётся рак в какой-то форме в течение их жизни.
[0005] Рецептор фолиевой кислоты 1 (FOLR1), также известный как рецептор фолиевой кислоты альфа (FRα) или белок связывающий фолиевую кислоту, представляет собой гликопротеин заякоренный посредством гликозилфосфатидилинозитола (GPI) с сильным связывающим сродством к фолиевой кислоте и восстановленным производным фолиевой кислоты (см. Leung et al., Clin. Biochem. 46:1462-1468 (2013)). FOLR1 опосредует доставку физиологического фолата, 5-метилтетрагидрофолата, внутрь клеток. Экспрессия FOLR1 в нормальных тканях ограничена апикальной мембраной эпителиальных клеток в проксимальных канальцах почки, альвеолярных пневмоцитах легких, мочевого пузыря, яичек, сосудистого сплетения и щитовидной железы (Weitman S D, et al., Cancer Res. 52:3396-3401 (1992); Antony A C, Ann. Rev. Nutr. 16:501-521 (1996); Kalli K R, et al., Gynecol. Oncol. 108:619-626 (2008)). FOLR1 сверхэкспрессируется в опухолях эпителиального происхождения, включая опухоли яичников, матки, груди, эндометриальные, поджелудочные, почечные, легких, колоректальные и опухоли головного мозга. Данная модель экспрессии FOLR1 делает ее желательной целью для FOLR1-направленной терапии рака
[0006] Фактор роста эндотелия сосудов-A (ФРЭС), также известный как фактор проницаемости сосудов (VPF), является прототипным членом семейства белков ФРЭС и ключевым регулятором ангиогенеза (Hoeben et al., Pharmacol. Rev. 56:549-580 (2004); Ferrara et al., Nat. Med. 9:669-676 (2003)). Ангиогенез представляет собой процесс развития нового кровеносного сосуда из ранее существовавшей сосудистой сети и имеет важное значение для по меньшей мере заживления ран, регенерации органов и женской репродуктивной системы (Hoeben et al., supra; Ferrara et al., supra). Ангиогенез также важен для нескольких патологических процессов, включая развитие опухоли, рост опухоли и метастазы (Hoeben et al., supra; Ferrara et al., supra). ФРЭС является проангиогенным фактором, высоко экспрессируется в нормальных легких, почках, сердце, надпочечниках, печени, селезенке и тканях слизистой оболочки желудка и высоко экспрессируется во многих опухолях человека (Hoeben et al., supra). Его повышение или мисэкспрессия в опухолях и проангиогенная функция делают ФРЭС желательной мишенью для целенаправленной терапии рака.
[0007] Цисплатин и карбоплатин, которые являются аналогами платины и алкилирующими химиотерапевтическими средствами, использовались в монотерапии или в сочетании с другими агентами для лечения различных твердых опухолей на протяжении десятилетий (Lokich et al., Annals. Of Oncology 9:13-21 (1998)). Сообщалось, что карбоплатин уменьшает желудочно-кишечные эффекты по сравнению с цисплатином (Lokich et al.). Однако карбоплатин вызывает отрицательный побочный эффект подавления костного мозга (Lokich et al.). Таким образом, желательно повысить эффективность и переносимость лечения цисплатин и карбоплатинга.
[0008] Доксорубицин, антрациклиновый антибиотический химиотерапевтический агент, также применяли в качестве лечения различных видов рака в монотерапии или в сочетании с другими химиотерапевтическими средствами, такими как паклитаксел (митотическое ингибирующее химиотерапевтическое средство, называемое TAXOL® (Bristol Myers Squibb), см Gehl et al., Annals of Oncology, 7:687-639 (1996)). Пригодность доксорубицина в качестве средства для лечения рака ограничена его токсичностью, в частности, кардиотоксичностью доксорубицина (см. Tacar et al., J. of Pharmacy & Pharmacology, 65:157-170 (2013)). Таким образом, также желательно повысить эффективность и переносимость лечения с доксорубицином. Также была разработана инкапсулированная форма липосом соли гидрохлорида (HCL) доксорубицина. Липосомальная доставка доксорубицина HCL улучшает проникновение лекарства в опухоли и уменьшает выведение лекарственных средств, тем самым увеличивая продолжительность терапевтических эффектов лекарственного средства. Липосомальный препарат доксорубицина также модулирует токсичность, в частности сердечные эффекты, обычно наблюдаемые с противоопухолевыми препаратами антрациклинов.
[0009] Управление по контролю качества продуктов и лекарств США (FDA) одобрило комбинированное лечение бевацизумабом (антитело к ФРЭС называемое, как AVASTIN® (GENENTECH, INC.)) с карбоплатином и паклитакселом в качестве первой линии лечения распространенного рака, неороговевающего немелкоклеточного рака легких (НМРЛ) (см. Cohen et al., Oncologist 12:713-718 (2007)). Комбинация карбоплатина и паклитаксела (СР-терапия) была предыдущей первой линией лечения для НМРЛ (Sandler et al., N. Engl. J. of Medicine 355:2542-2550 (2006)). В в то время как добавление бевацизумаба к терапии СР повысило эффект выживания пациентов, данная трехкомпонентная комбинированная терапия (BV / CP) привела к увеличению смертей, связанных с лечением, и более высокой частоте как негематологических, так и гематологических нежелательных эффектов Cohen et al., supra на Таблицах 4-5). Совсем недавно бевацизумаб также был одобрен в сочетании с химиотерапевтическими средствами для лечения рака шейки матки, устойчивого к препаратам платины, рецидивирующего эпителиального рака яичников, рака фаллопиевых труб и первичного перитонеального рака.
[0010] Остается неудовлетворенная медицинская потребность в более эффективных методах лечения, например, комбинированных терапиях, нацеленных на экспрессирующие FOLR1 опухолевые клетки, для лечения рака.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТНИЯ
[0011] В данном документе предложены комбинации анти-FOLR1 иммуноконъюгата (например, IMGN853) с анти-ФРЭС агентом, агентом на основе платины и/или доксорубицином. Также в данном документе представлены способы лечения пациента больного раком с применением такой комбинации. Как описано более подробно ниже, применение анти-FOLR1 иммуноконъюгата (например, IMGN853) в комбинации с анти-ФРЭС агентом, агентом на основе платины и/или доксорубицином может привести к синергической эффективности против опухолей. Например, анти-ФРЭС агент, агент на основе платины и/или доксорубицин могут потенцировать эффективность анти-FOLR1 иммуноконъюгата (например, IMGN853) и/или анти-FOLR1 иммуноконъюгат (например, IMGN853) может потенцировать эффективность анти-ФРЭС агента, агента на основе платины и/или доксорубицина. Применением комбинации анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина, сумма их эффективности может быть достигнута даже при применении меньших и/или менее частых доз анти-FOLR1 иммуноконъюгата (например, IMGN853) и/или анти-ФРЭС агента, агента на основе платины и/или доксорубицина. Кроме того, эта комбинация может вызывать не более сильную токсичность, чем анти-ФРЭС агент, агент на основе платины и/или доксорубицин в монотерапии, анти-FOLR1 иммуноконъюгат (например, IMGN853) в монотерапии, и/или либо анти-ФРЭС агент, либо агент на основе платины и/или доксорубицин или анти-FOLR1 иммуноконъюгат (например, IMGN853).
[0012] В одном случае, способ лечения пациента, больного раком включает введение пациенту, нуждающемуся в этом, иммуноконъюгата, который связывается c FOLR1, причем иммуноконъюгат содержит антитело или его антигенсвязывающий фрагмент, содержащий последовательность SEQ ID NO: 9 определяющей комплементарность области (CDR)1 вариабельной области тяжёлой цепи (VH), последовательность SEQ ID NO: 10 CDR2 VH и последовательность SEQ ID NO: 12 CDR3 VH и последовательность SEQ ID NO: 6 CDR1 вариабельной области лёгкой цепи (VL) , последовательность SEQ ID NO: 7 CDR2 VL и последовательность SEQ ID NO: 8 CDR3 VL и анти-ФРЭС агент, агент на основе платины, доксорубицин или их комбинацию
[0013] В одном случае, способ лечения пациента, больного раком, включает введение пациенту, нуждающемуся в этом, иммуноконъюгата, который связывается c FOLR1, причем иммуноконъюгат содержит антитело или его антигенсвязывающий фрагмент, содержащий последовательность SEQ ID NO: 19 CDR1 VH , последовательность SEQ ID NO: 11 CDR2 VH и последовательность SEQ ID NO: 12 CDR3 VH и последовательность SEQ ID NO: 6 CDR1 вариабельной области лёгкой цепи (VL) , последовательность SEQ ID NO: 7 CDR2 VL и последовательность SEQ ID NO: 8 CDR3 VL и анти-ФРЭС агент, агент на основе платины, доксорубицин или их комбинацию
[0014] В одном случае, иммуноконъюгат (например, IMGN853) вводят в комбинации с анти-ФРЭС агентом (например, бевацизумаб). В одном случае, иммуноконъюгат (например, IMGN853) вводят в комбинации с агентом на основе платины. В одном случае, иммуноконъюгат вводят в комбинации с доксорубицином.
[0015] В одном случае, иммуноконъюгат (например, IMGN853) вводят в комбинации с анти-ФРЭС агентом и агентом на основе платины. В одном случае, иммуноконъюгат (например, IMGN853) вводят в комбинации с анти-ФРЭС агентом и доксорубицином. В одном случае, иммуноконъюгат (например, IMGN853) вводят в комбинации с агентом на основе платины и доксорубицином.
[0016] В одном случае, иммуноконъюгат, который связывается с FOLR1, содержит антитело или его антигенсвязывающий фрагмент, который содержит VH содержащую последовательность SEQ ID NO: 3 и VL содержащую последовательность SEQ ID NO: 5. В одном случае, антитело или антигенсвязывающий фрагмент представляет собой huMov19.
[0017] В одном случае, иммуноконъюгат (например, IMGN853) содержит цитотоксин, при том, что цитотоксин представляет собой майтанзиноид. В одном случае, майтанзиноид представляет собой DM4.
[0018] В одном случае, иммуноконъюгат (например, IMGN853) содержит линкер при том, что линкер представляет собой сульфо-SPDB.
[0019] В одном случае, иммуноконъюгат представляет собой IMGN853.
[0020] В одном случае, введение представляет собой терапию первой линии. В одном случае, введение представляет собой терапию второй линии. В одном случае, введение представляет собой терапию третьей линии.
[0021] В одном случае, иммуноконъюгат (например, IMGN853) вводят внутривенно или внутрибрюшинно.
[0022] В одном случае, введение иммуноконъюгата (например, IMGN853) с анти-ФРЭС агентом, агентом на основе платины, доксорубицином или их комбинацией, вызывает синергический эффект.
[0023] В одном случае, введение иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента не вызывает более сильную токсичность, чем введение иммуноконъюгата в монотерапии или анти-ФРЭС агента в монотерапии. В одном случае, введение иммуноконъюгата (например, IMGN853) и агента на основе платины не вызывает более сильную токсичность, чем введение иммуноконъюгата в монотерапии или агента на основе платины в монотерапии. В одном случае, введение иммуноконъюгата (например, IMGN853) и доксорубицина не вызывает более сильную токсичность, чем введение иммуноконъюгата в монотерапии или доксорубицина в монотерапии. В одном случае, введение иммуноконъюгата (например, IMGN853), анти-ФРЭС агента и агента на основе платины не вызывает более сильную токсичность, чем введение таксола, анти-ФРЭС агента или агента на основе платины при том, что агент на основе платины представляет собой карбоплатин или цисплатин.
[0024] В одном случае, иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели или один раз каждые четыре недели. В одном случае, иммуноконъюгат (например, IMGN853) вводят в дозе около 4 мг/кг для скорректированного идеального веса тела (AIBW), в дозе около 5 мг/кг AIBW или в дозе около 6 мг/кг AIBW.
[0025] В одном случае, иммуноконъюгат (например, IMGN853) вводят еженедельно. В одном случае, иммуноконъюгат (например, IMGN853) вводят в дозе около 1,1 мг/кг AIBW, около 1,8 мг/кг AIBW, около 2,0 мг/кг AIBW или около 2,5 мг/кг AIBW.
[0026] В одном случае, иммуноконъюгат (например, IMGN853) вводят один раз каждые две недели. В одном случае, иммуноконъюгат (например, IMGN853) вводят в дозе около 2,0 мг/кг AIBW, около 2,5 мг/кг AIBW, около 3,0 мг/кг AIBW, около 3,5 мг/кг AIBW или около 4,0 мг/кг AIBW.
[0027] В одном случае, анти-ФРЭС агент содержит антитело или его антигенсвязывающий фрагмент, который связывается с ФРЭС или рецептор ФРЭС. В одном случае, антитело или его антигенсвязывающий фрагмент, который связывается с ФРЭС, представляет собой бевацизумаб. В одном случае, антитело или его антигенсвязывающий фрагмент, который связывается с ФРЭС, является в высокой степени схожим с бевацизумабом и не имеет клинически значимых различий в отношении безопасности и эффективности по сравнению с бевацизумабом (например, ABP 215 (Amgen), BCD-021 (Biocad)).
[0028] В одном случае, анти-ФРЭС агент содержит ингибитор тирозинкиназы. В одном случае, ингибитор тирозинкиназы выбирают из группы, состоящей из цедираниба, пазопаниба, акситиниба, ваталаниба, семаксаниба, сунитиниба, сорафениба, рамуцирумаба и афлиберцепта.
[0029] В одном случае, анти-ФРЭС агент содержит растворимый рецептор ФРЭС. В одном случае, растворимый рецептор ФРЭС представляет собой ФРЭС-TRAP.
[0030] В одном случае, анти-ФРЭС агент вводят один раз каждые 3 недели или один раз каждые 2 недели. В одном случае, анти-ФРЭС агент вводят в дозе около 15 мг/кг, около 10 мг/кг или около 7,5 мг/кг.
[0031] В одном случае, бевацизумаб вводят один раз каждые 3 недели в дозе 15 мг/кг. В одном случае, бевацизумаб вводят один раз каждые 2 недели в дозе 10 мг/кг.
[0032] В одном случае, агент на основе платины представляет собой карбоплатин. В одном случае, карбоплатин вводят один раз каждые три недели. В одном случае, карбоплатин вводят в дозе для получения площади под фармакокинетической кривой (AUC), равной 4 мг/мл·мин, 5 мг/мл⋅мин, 6 мг/мл⋅мин или 7 мг/мл⋅мин.
[0033] В одном случае, агент на основе платины представляет собой цисплатин. В одном случае, цисплатин вводят каждые три недели или один раз каждые четыре недели. В одном случае, цисплатин вводят в дозе около 50-70 мг/м2, около 75-100 мг/м2 или около 100 мг/м2.
[0034] В одном случае, доксорубицин представляет собой пегилированный доксорубицин, липосомальный доксорубицин или пегилированный липосомальный доксорубицин. В одном случае, доксорубицин вводят один раз каждые четыре недели. В одном случае, доксорубицин вводят в дозе 30 мг/м2, 35 мг/м2, 40 мг/м2, 45 мг/м2 или 50 мг/м2.
[0035] В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые три недели в дозе 15 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 4 мг/кг AIBW. В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые три недели в дозе 15 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 5 мг/кг AIBW. В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые три недели в дозе 15 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 6 мг/кг AIBW.
[0036] В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые две недели в дозе 10 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 4 мг/кг AIBW. В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые две недели в дозе 10 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 5 мг/кг AIBW. В одном случае, анти-ФРЭС агент представляет собой бевацизумаб, бевацизумаб вводят один раз каждые две недели в дозе 10 мг/кг и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 6 мг/кг AIBW.
[0037] В одном случае, карбоплатин вводят с бевацизумабом и иммуноконъюгатом (например, IMGN853). В одном случае, карбоплатин вводят один раз каждые три недели. В одном случае, карбоплатин вводят в дозе для получения площади под фармакокинетической кривой (AUC), равной 4 мг/мл·мин, 5 мг/мл⋅мин, 6 мг/мл⋅мин или 7 мг/мл⋅мин.
[0038] В одном случае, агент на основе платины представляет собой карбоплатин, карбоплатин вводят один раз каждые три недели для получения AUC, равной 4 мг/мл·мин, и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 4 мг/кг AIBW.
[0039] В одном случае, агент на основе платины представляет собой карбоплатин, карбоплатин вводят один раз каждые три недели для получения AUC, равной 4 мг/мл·мин, и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 5 мг/кг AIBW.
[0040] В одном случае, агент на основе платины представляет собой карбоплатин, карбоплатин вводят один раз каждые три недели для получения AUC, равной 5 мг/мл·мин, и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 5 мг/кг AIBW.
[0041] В одном случае, агент на основе платины представляет собой карбоплатин, карбоплатин вводят один раз каждые три недели для получения AUC, равной 5 мг/мл·мин, и иммуноконъюгат (например, IMGN853) вводят один раз каждые три недели в дозе 6 мг/кг AIBW.
[0042] В одном случае, доксорубицин представляет собой пегилированный липосомальный доксорубицин (PLD), PLD вводят один раз каждые четыре недели в дозе около 30 мг/м2 и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 4 мг/кг AIBW.
[0043] В одном случае, доксорубицин представляет собой PLD, PLD вводят один раз каждые четыре недели в дозе около 30 мг/м2 и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 5 мг/кг AIBW.
[0044] В одном случае, доксорубицин представляет собой PLD, PLD вводят один раз каждые четыре недели в дозе около 40 мг/м2 и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 5 мг/кг AIBW.
[0045] В одном случае, доксорубицин представляет собой PLD, PLD вводят один раз каждые четыре недели в дозе около 40 мг/м2 и иммуноконъюгат (например, IMGN853) вводят один раз каждые четыре недели в дозе 6 мг/кг AIBW.
[0046] В одном случае, рак представляет собой рак яичников, перитонеальный рак, рак фаллопиевой трубы, рак эндометрия или рак легких.
[0047] В одном случае, рак представляет собой рак яичников. В одном случае, рак яичников рак яичников представляет собой эпителиальный рак яичников. В одном случае, рак яичников является устойчивым, рецидивирующим или невосприимчивым к лечению препаратами платины.
[0048] В одном случае, рак является невосприимчивым к лечению препаратами платины. В одном случае, рак является первичным, невосприимчивым к лечению препаратами платины. В одном случае, рак является чувствительным к препаратам платины.
[0049] В одном случае, рак представляет собой устойчивый к препаратам платины рецидивирующий эпителиальный рак яичников, рак фаллопиевой трубы или первичный перитонеальный рак.
[0050] В одном случае, рак представляет собой рак яичников и введение приводит к понижению CA125. В одном случае, перитонеальный рак представляет собой первичный перитонеальный рак. В одном случае, рак эндометрия представляет собой серозный рак эндометрия. В одном случае, рак легких выбирают из группы, состоящей из немелкоклеточного рака легкого (НМРЛ), аденокарциномы и бронхиолальвеолярной карциномы.
[0051] В одном случае рак ранее не лечили бевацизумабом. В одном случае, рак ранее не лечили бевацизумабом (т.e. пациент является " не получавшим терапию бевацизумаба").
[0052] В одном случае, рак является метастатическим или распространенным.
[0053] В одном случае, рак экспрессирует FOLR1. В одном случае, экспрессия FOLR1 измеряют с помощью иммуногистохимии (имеет ИГХ показатель окрашивания, равный). В одном случае, имеет ИГХ показатель окрашивания, равный имеет показатель окрашивания, равный по меньшей мере 1 гетеро, по меньшей мере 1 гомо, по меньшей мере 2 гетеро, по меньшей мере 2 гомо, или по меньшей мере 3 гетеро. В одном случае, по меньшей мере 25%, по меньшей мере 33%, по меньшей мере 50%, по меньшей мере 66% или по меньшей мере 75% клеток в образце получали от пациента, который имеет имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный). В одном случае, по меньшей мере 25%, по меньшей мере 33%, по меньшей мере 50%, по меньшей мере 66%, или по меньшей мере 75% клеток в образце получали от пациента, который имеет имеет ИГХ показатель окрашивания, равный по меньшей мере 3.
[0054] В одном случае, способ дополнительно включает введение стероида пациенту. В одном случае, стероид представляет собой дексаметезон. В одном случае, стероид вводят в глазной капле. В одном случае, глазная капля представляет собой не содержащую консервантов, смазывающую глазную каплю.
[0055] В одном случае, иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент, агент на основе платины доксорубицин или их комбинацией вводят в виде отдельных фармацевтических композиций.
[0056] Также в данном документе предложены наборы. В одном случае, набор содержит иммуноконъюгат, который связывается c FOLR1, причем иммуноконъюгат содержит антитело или его антигенсвязывающий фрагмент, cодержащий последовательность SEQ ID NO: 9 CDR1 VH, последовательность SEQ ID NO: 10 CDR2 VH и последовательность SEQ ID NO: 12 CDR3 VH и последовательность SEQ ID NO: 6 CDR1 VL, последовательность SEQ ID NO: 7 CDR2 VL и последовательность SEQ ID NO: 8 CDR3 VL; и анти-ФРЭС агент, агент на основе платины или доксорубицин; и инструкции для введения иммуноконъюгата с анти-ФРЭС агентом, агентом на основе платины или доксорубицином. В одном случае, анти-ФРЭС агент представляет собой антитело к ФРЭС. В одном случае, антитело к ФРЭС представляет собой бевацизумаб. В одном случае, анти-ФРЭС агент представляет собой ингибитор тирозинкиназы. В одном случае, ингибитор тирозинкиназы выбирают из группы, состоящей из цедираниба, пазопаниба, акситиниба, ваталаниба, семаксаниба, сунитиниба, сорафениба, рамуцирумаба и афлиберцепта. В одном случае, анти-ФРЭС агент представляет собой растворимый рецептор ФРЭС. В одном случае, растворимый рецептор ФРЭС представляет собой ФРЭС-TRAP. В одном случае, агент на основе платины представляет собой карбоплатин или цисплатин. В одном случае, доксорубицин представляет собой пегилированный липосомальный доксорубицин. В одном случае, иммуноконъюгат представляет собой IMGN853.
[0057] Кроме того, в данном документе представлены способы инструктирования человека больного раком. В одном случае, способ включает в себя предоставление инструкций для приема лечения рака иммуноконъюгатом (например, IMGN853), который связывается с FOLR1 и анти-ФРЭС агентом, агентом на основе платины, доксорубицином или их комбинацией. В одном случае, анти-ФРЭС агент представляет собой антитело к ФРЭС. В одном случае, антитело к ФРЭС представляет собой бевацизумаб. В одном случае, анти-ФРЭС агент представляет собой ингибитор тирозинкиназы. В одном случае, ингибитор тирозинкиназы выбирают из группы, состоящей из цедираниба, пазопаниба, акситиниба, ваталаниба, семаксаниба, сунитиниба, сорафениба, рамуцирумаба и афлиберцепта. В одном случае, анти-ФРЭС агент представляет собой растворимый рецептор ФРЭС. В одном случае, растворимый рецептор ФРЭС представляет собой ФРЭС-TRAP. В одном случае, агент на основе платины представляет собой карбоплатин или цисплатин. В одном случае, доксорубицин представляет собой пегилированный липосомальный доксорубицин. В одном случае, иммуноконъюгат представляет собой IMGN853.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0058] На ФИГ. 1 изображена противораковая активность для IMGN853 (5 мг/кг), пегилированного липосомального доксорубицина (PLD) (4 мг/кг) и IMGN853+PLD комбинированной терапии в модели опухоли эпителиального рака яичников.
[0059] На ФИГ. 2A изображена противораковая активность для IMGN853 (5 мг/кг), бевацизумаба (5 мг/кг) и комбинированной терапии IMGN853+бевацизумаб в модели опухоли серозного рака яичников.
[0060] На ФИГ. 2B изображена противораковая активность IMGN853 (2,5 мг/кг), бевацизумаба (5 мг/кг) и комбинированной терапии IMGN853+бевацизумаб в модели опухоли серозного рака яичников.
[0061] На ФИГ. 3 изображена противораковая активность для IMGN853 (1. 25 мг/кг), паклитаксела (10 мг/кг), комбинированной терапияи бевацизумаб (5 мг/кг), IMGN853 + бевацизумаб комбинированной терапии и комбинированной терапии паклитаксел + бевацизумаб в модели опухоли серозного рака яичников.
[0062] На ФИГ. 4 изображена противораковая активность для IMGN853 (5 мг/кг), бевацизумаба (5 мг/кг) и комбинированной терапии IMGN853 + бевацизумаб в модели опухоли эпителиального рака яичников.
[0063] На ФИГ. 5 изображена противораковая активность для IMGN853 (5 мг/кг), паклитаксела (10 мг/кг), бевацизумаба (5 мг/кг), комбинированной терапии паклитаксел + бевацизумаб и комбинированной терапии IMGN853 + бевацизумаб в модели опухоли эпителиального рака яичников.
[0064] На ФИГ. 6 изображена противораковая активность для IMGN853 (3 мг/кг), IMGN853 (1,5 мг/кг), бевацизумаба (5 мг/кг), комбинированной терапии IMGN853 (3 мг/кг) + бевацизумаб и комбинированной терапии IMGN853 (1,5 мг/кг) + бевацизумаб в модели опухоли немелкоклеточного рака легких.
[0065] На ФИГ. 7 изображена противораковая активность для комбинированной терапии IMGN853 (5 мг/кг) + карбоплатин (100 мг/кг), трехкомпонентной комбинированной терапии IMGN853 (5 мг/кг) + карбоплатин(100 мг/кг) + бевацизумаб (5 мг/кг), комбинированной терапии паклитаксел (10 мг/кг) + карбоплатин (100 мг/кг) и трехкомпонентной комбинированной терапии паклитаксел (100 мг/кг) + карбоплатин(100 мг/кг) + бевацизумаб (5 мг/кг) в модели опухоли немелкоклеточного рака легких.
[0066] На ФИГ. 8 изображена противораковая активность для IMGN853 (2,5 мг/кг), цедираниба (1,5 мг/кг) и комбинированной терапии IMGN853 + цедираниб в модели опухоли серозного рака яичников.
[0067] На ФИГ. 9A изображены клетки IGROV-1, обработанные градиентами концентраций IMGN853, карбоплатина или ими двумя и воздействие на пролиферацию. Показатель аддитивности (CI) был рассчитан с использованием анализа медианного эффекта. Изображены данные из двух независимых экспериментов, определенных для ряда концентраций лекарственного средства и дробного эффекта (Fa) от 0,4 до 0,7. Точки данных ниже пунктирной линии представляют собой синергию между парами лекарственных средств.
[0068] На ФИГ. 9В изображены клетки IGROV-1, обработанные карбоплатином (20 мкМ) или IMGN853 (8 нМ), как в монотерапии, так и в комбинации, в течение 6 часов. Клетки промывали и распределение клеточного цикла определяли после 24-часового культивирования в среде, свободной от лекарственного средства.
[0069] На ФИГ. 9C изображены клетки IGROV-1, подвергнутые воздействию карбоплатина (40 мкМ) или IMGN853 (16 нМ), отдельно или в комбинации, в течение 6 часов с последующей инкубацией в среде, свободной от лекарственного средства, в течение дополнительных 18 часов. Клеточные экстракты были подвергнуты иммуноблоттингу для γH2AX или актина (контроль загрузки), как указано
[0070] На ФИГ. 9D изображена противораковая активность IMGN853 (2,5 мг/кг) или карбоплатина (80 мг/кг), в монотерапии и в комбинации (n = 7 мыши/группа) производных ксенотрансплантатов рака яичников, чувствительных к действию препаратов платины (PDXs), представленных у мышей SCID. Данные выражены в виде средней и среднеквадратичного отклонения среднего (SEM) для каждой точки времени.
[0071] На ФИГ. 9E изображена противораковая активность двух последовательных недельных доз носителя, карбоплатина (80 мг/кг, и/п) плюс паклитаксела (10 мг/кг), карбоплатина плюс PLD (4 мг / кг) или карбоплатина плюс IMGN853 (5 мг/кг) у мышей, несущих опухоли PDX чувствительные к препаратам платины (n = 7 мыши/группа).
[0072] На ФИГ. 10А изображены клетки IGROV-1, обработанные возрастающими концентрациями IMGN853, доксорубицина или ими двумя и их влияние на пролиферацию. Показатель аддитивности (CI) был рассчитан с использованием анализа медианного эффекта. Показаны данные из 3 независимых экспериментов, причем точки ниже пунктирной линии представляют собой синергию между парами лекарственных средств.
[0073] На ФИГ. 10В изображены клетки IGROV-1, обработанные доксорубицином (200 нМ) или IMGN853 (8 нМ), как в монотерапии, так и в комбинации, в течение 6 часов. Клетки промывали, и распределение клеточного цикла определяли после 24-часового культивирования в среде, свободной от лекарственного средства.
[0074] На ФИГ. 10C изображена противораковая активность двух последовательных недельных доз IMGN853 (5 мг/кг) и PLD (4 мг/кг) в монотерапии или в комбинации (n = 8 мыши / группа) в устойчивом к препаратам платины РDX раку яичников, представленному у мышей SCID. Данные выражены как среднее значение и SEM для каждой точки времени.
[0075] На ФИГ. 10D изображен вес тел у мышей, измеренный два раза в неделю. Средние значения наносятся относительно контроля-носителя.
[0076] На ФИГ. 11A изображена противоопухолевая активность только для IMGN853 (3 м /кг) или в сочетании с бевацизумабом, вводимым либо в виде единичной дозы 5 мг/кг, либо в виде двух последовательных недельных доз 2,5 мг/кг (QWx2) у мышей с установленными OV-90 ксенотрансплантатами (n = 7 мыши/группа)
[0077] На ФИГ. 11B изображены объемы опухоли, измеренные в конце исследования, и индивидуальные размеры опухоли, изображены в соответствии с группой лечения у мышей, несущих PDX рак яичников, устойчивый к действию препаратов платины, получающих две последовательные еженедельные дозы бевацизумаба (5 мг/кг), самого по себе или в комбинации, как с паклитакселом (10 мг/кг), так и IMGN853 (5 мг/кг). Рост опухоли контролировали до 102 дней. *P < 0,02; ** P < 0,0X; ns, незначительное.
[0078] На ФИГ. 12А изображены мыши-опухоленосители OV-90, обработанные одной дозой носителя, IMGN853 (2,5 мг/кг), бевацизумабом (5 мг/кг) или IMGN853 плюс бевацизумаб и опухоли брали для анализа через 4 дня. Гистологическое окрашивание (гематоксилин-эозин) выявило наличие крупных центральных некротических зон в опухолях у обработанных комбинацией мышей. Оригинальное увеличение, 4X; масштабные метки, 2 мм (для комбинационной панели, 600 мкм).
[0079] На ФИГ. 12B изображены опухолевые экстракты, полученные с помощью иммуноблоттинга для γH2AX или актина (контроль загрузки), как указано.
[0080] На ФИГ. 12C изображена иммуногистохимическая оценка экспрессии CD31 (верхняя панель) и обнаружение майтанзина (антитело к MAY; нижняя панель) в опухолевых тканях на 4-й день. Для каждой группы изображены типичные микрофотографии из одной из трех опухолей. Оригинальное увеличение, 20X; масштабные метки, 200 мкм.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0081] В данном изобретении предлагаются комбинации анти-FOLR1 иммуноконъюгата с анти-ФРЭС агентом, агентом на основе платины, доксорубицином или их комбинацией и применение комбинаций при лечении рака.
I. Определения
[0082] Чтобы облегчить понимание данного изобретения, ряд терминов и фраз определяется ниже
[0083] Термин "FOLR1", в контексте данного документа, относится к любому нативному полипептиду FOLR1 человека, если не указано иное. FOLR1 также упоминается как "рецептор фолиевой кислоты человека 1", "рецептор фолиевой кислоты альфа (FR-α)", и "FRα". Термин «FOLR1» охватывает «полноразмерный», непроцессированный полипептид FOLR1, а также любую форму полипептида FOLR1, которая возникает в результате процессинга внутри клетки. Термин также включает в себя встречающиеся в природе варианты FOLR1, например, те, которые закодированы вариантами сплайсинга и аллельными вариантами. Описанные в данном документе полипептиды FOLR1 могут быть выделены из множества источников, например, из тканей человека или из другого источника или получены рекомбинантными или синтетическими способами. Там, где конкретно указано, «FOLR1» можно использовать для обозначения нуклеиновой кислоты, которая кодирует полипептид FOLR1. Известны последовательности FOLR1 человека и включают, например, последовательности, общедоступные под номером доступа UniProtKBP15328 (включая изоформы). В контексте данного документа, термин «FOLR1 человека» относится к FOLR1, содержащему последовательность SEQ ID NO: 1.
[0084] Термин «ФРЭС» в контексте данного документа, относится к любому нативному полипептиду ФРЭС человека, если не указано иное. ФРЭС также называют фактором роста эндотелия сосудов A, ФРЭС-A, фактором сосудистой проницаемости и VPF. Термин «ФРЭС» охватывает «полноразмерный», непроцессированный полипептид ФРЭС, а также любую форму полипептида ФРЭС, которая возникает в результате процессинга в клетке. Термин также включает в себя встречающиеся в природе варианты ФРЭС, например, те, которые кодируются вариантами сплайсинга и аллельными вариантами. Описанные в данном документе полипептиды ФРЭС могут быть выделены из множества источников, например, из тканей человека или из другого источника или получены рекомбинантными или синтетическими способами. Там, где конкретно указано, «ФРЭС» можно использовать для обозначения нуклеиновой кислоты, которая кодирует полипептид ФРЭС. Последовательности ФРЭС человека известны и включают, например, последовательности, общедоступные под номером доступа UniProtKBP15692 (включая изоформы).
[0085] Термин «антитело» означает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид или комбинации вышеуказанного через по меньшей мере один сайт распознавания антигена в вариабельной области молекулы иммуноглобулина. В контексте данного документа, термин «антитело» включает в себя интактные поликлональные антитела, интактные моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, слитые белки, содержащие антитело и любую другую модифицированную молекулу иммуноглобулина, при условии, что антитела проявляют желаемую биологическую активность. Антитело может быть любого из пяти основных классов иммуноглобулинов:IgA, IgD, IgE, IgG и IgM или подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), основанных на идентичности их константных доменов тяжелой цепи, называемых альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов имеют различные и хорошо известные структуры субъединиц и трехмерные конфигурации. Антитела могут быть голыми или конъюгированными с другими молекулами, такими как токсины, радиоизотопы и т. д.
[0086] Термин «фрагмент антитела» относится к части интактного антитела. «Антигенсвязывающий фрагмент» относится к части интактного антитела, который связывается с антигеном. Антигенсвязывающий фрагмент может содержать антигенные определяющие вариабельные области интактного антитела. Примеры фрагментов антител включают, но не ограничиваются ими, Fab, Fab', F(ab')2 и Fv фрагменты, линейные антитела и одноцепочечные антитела.
[0087] «Блокирующим» антителом или «антитело-антагонист» является такое, которое ингибирует или уменьшает биологическую активность связываемого им антигена, такого как FOLR1 или ФРЭС. В некоторых вариантах реализации изобретения блокирующие антитела или антитела-антагонисты, по существу, или полностью ингибируют биологическую активность антигена. Биологическая активность может быть уменьшена на 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%.
[0088] Термин «антитело анти-FOLR1 иммуноконъюгата» или «антитело, которое связывается с FOLR1» относится к антителу, которое способно связывать FOLR1 с достаточной аффинностью, так что антитело пригодно в качестве диагностического и/или терапевтического агента при нацеливании на FOLR1 (например, антитело huMov19 (M9346A). Степень связывания антитела анти-FOLR1 иммуноконъюгата с несвязанным белком не-FOLR1 может быть меньше, чем около 10% связывания антитела с FOLR1, измеренная, например, радиоиммуноанализом (RIA).
[0089] Термин "анти-ФРЭС агент" относится к агентам, которые способны ингибировать путь ФРЭС. Анти-ФРЭС агенты включают, например, антитела к ФРЭС (например, Бевацизумаб ABP 215 (Amgen), BCD-021 (Biocad), и т.д.) или антитела к рецептору ФРЭС (например, рамуцирумаб), ингибиторы тирозин-киназы (TKI) (например, Цедираниб или RECENTIN® (IPR Pharmaceuticals Inc.), см. Nikolinakos et al., J. Thoracic Oncology 3(6) Suppl. 2:S131-S134 (2008)) и растворимые рецепторы ФРЭС (например, ФРЭС-Trap; см., например, Holash et al., PNAS 99(17) 11393-11398 (2002)).
[0090] Термин «антитело к ФРЭС» или «антитело, которое связывается с ФРЭС» относится к антителу, которое способно связывать ФРЭС с достаточной аффинностью, так что антитело пригодно в качестве терапевтического агента при нацеливании на ФРЭС (например, бевацизумаб). Степень связывания антитела к ФРЭС с несвязанным, не-ФРЭС-белком может быть менее чем около 10% связывания антитела с ФРЭС, при измерении, например, радиоиммуноанализом (RIA). В некоторых вариантах реализации изобретения, антитело, которое связывается с ФРЭС, имеет константу диссоциации (Kd), равную ≤1 мкМ, ≤100 нM, ≤10 нM, ≤1 нM, или ≤0.1 нM. В некоторых вариантах реализации изобретения, антитело или его антигенсвязывающий фрагмент, который связывается с ФРЭС, представляет собой бевацизумаб. В некоторых вариантах реализации изобретения, антитело или его антигенсвязывающий фрагмент, который связывается с ФРЭС, является в высокой степени схожим с бевацизумабом и не имеет клинически значимых различий в отношении безопасности и эффективности по сравнению с бевацизумабом (например, ABP 215 (Amgen), BCD-021 (Biocad)).
[0091] Термин "Бевацизумаб" относится к конкретному антителу к ФРЭС. Бевацизумаб представляет собой рекомбинантное гуманизированное моноклональное антитело IgG1, которое содержит антиген-связывающие определяющие комплементарности области, полученные из мышиного иммуноконъюгата антитела к FOLR1 ФРЭС-моноклонального антитела А. 4. 6. 1 (см. Presta et al. Cancer Res. 57:4593-4599 (1997); патент США№6054297; патенте США. №7365166; патенте США№7622115; патенте США№8778340). Бевацизумаб представляет собой активный компонент в Avastin® (Genentech, Inc.)(Id.).
[0092] Термин "паклитаксел" или "PAC" относится к соединению, связанному с регистрационным номером CAS 33069-62-4. Паклитаксел представляет собой активный компонент в TAXOL® (Bristol-Myers Squibb Company), Onxol и ABRAXANE® (Abraxis Bioscience, LLC). Паклитаксел считается митотическим ингибирующим химиотерапевтическим агентом, который связывает тубулин и ингибирует разборку микротрубочек, чтобы предотвратить деление клеток и индуцировать апоптоз.
[0093] Термин «агент на основе платины» относится к химиотерапевтическим агентам на основе платины. Агенты на основе платины включают цисплатин, карбоплатин и оксалиплатин.
[0094] Термин «цисплатин» относится к соединению, связанному с регистрационным номером CAS для 15663-27-1. Цисплатин представляет собой активный компонент в PLATINOL® (Bristol-Myers Company) и цисплатин также называется как "cisplatinum". Цисплатин считается платиносодержащим алкилирующим химиотерапевтическим агентом, который связывается с нуклеофильными группами в ДНК и вызывает внутринитевые и межнитевые поперечные сшивки ДНК, а также поперечные сшивки ДНК-белка, что приводит к ингибированию апоптоза и клеточного роста.
[0095] Термин «карбоплатин» или «Карбо» относится к соединению, связанному с регистрационным номером CAS 41575-94-4. Карбоплатин представляет собой активный компонент в PARAPLATIN® (Bristol-Myers Squibb Co., Corp.). Карбоплатин содержит атом платины в комплексе с двумя аммониевыми группами и циклобутандикарбоксильным остатком. Данный агент активируется внутриклеточно с образованием реакционноспособных комплексов платины, которые связываются с нуклеофильными группами, такими как сайты, богатые GC, в ДНК, тем самым индуцируя внутринитевые и межнитевые поперечные сшивки ДНК, а также поперечные сшивки ДНК-белка. Указанные вызванные карбоплатином ДНК и протеиновые эффекты приводят к ингибированию апоптоза и клеточного роста. Данный агент обладает противоопухолевой активностью, аналогичной активности его исходного соединения, цисплатина, но более стабилен и менее токсичен.
[0096] Термин "доксорубицин" относится к соединению, связанному с регистрационным номером CAS 23214-92-8. Доксорубицин также упоминается как «гидроксидаунорубицин» или «доксорубицин гидрохлорид». Доксорубицин представляет собой активный компонент в «Адриамицине» и «Рубекс». Липосомальный доксорубицин (то есть доксорубицин, инкапсулированный в липидную сферу или липосому) представляет собой активный компонент в MYOCET® (Cephalon UK, Ltd.). Пегилированный липосомальный доксорубицин (PLD) (липосомальный доксорубицин, к которому присоединены полиэтиленгликолевые полимеры) представляет собой активный компонент в DOXIL® (Liposom Technology, Inc.) и «Caelyx® (Janssen)». Считается, что доксорубицин является антрациклиновым антибиотическим химиотерапевтическим агентом, который интеркалирует между парами оснований в спирали ДНК для предотвращения репликации ДНК. Кроме того, доксорубицин ингибирует топоизомеразу II, что приводит к увеличенному содержанию и стабилизированному расщепляемому фермент-ДНК-связанному комплексу во время репликации ДНК и впоследствии предотвращает лигирование нуклеотидной нити после двунитевого разрыва. Доксорубицин также образует свободные от кислорода радикалы, что приводит к цитотоксичности, вторичной к пероксидному окислению липидов клеточных мембран.
[0097] Термины «линия лечения» или «линия терапии» относятся к терапевтическому режиму, который может включать, но не ограничивается, хирургию, лучевую терапию, химиотерапию, дифференцирующую терапию, биотерапию, иммунную терапию или введение одного или более агентов противораковых препаратов (например, цитотоксический агент, антипролиферативное соединение, и/или ингибитор ангиогенеза).
[0098] Термины «лечение первой линии», «терапия первой линии» и «терапия передней линии» относятся к предпочтительной и стандартной первоначальной терапии для конкретного патологического состояния, например, рака данного типа и стадии. Данные способы лечения отличаются от способов лечения «второй линии», которые испробованы, когда терапия первой линии не работает адекватно. Способы «третьей линии» испробуют, когда терапия первой линии и терапия второй линии не работают адекватно.
[0099] Например, комбинация анти-FOLR1 иммуноконъюгата (например, IMGN853) с анти-ФРЭС агентом, агентом на основе платины и /или доксорубицином, предложенными в данном документе, может быть дана в виде терапия первой линии, терапия второй линии (например, у пациентов с чувствительным к препаратам платины или устойчивым к препаратам платины эпителиальным раком яичников, раком фаллопиевой трубы или первичным перитонеальным раком), или в виде терапии третьей линии (например, у пациентов с чувствительным к препаратам платины или устойчивым к препаратам платины эпителиальным раком яичников, раком фаллопиевой трубы или первичным перитонеальным раком). Комбинация иммуноконъюгата FOLR1 (например, IMGN853) с анти-ФРЭС агентом, агентом на основе платины, и/или доксорубицином, предложенными в данном документе, может быть дана в виде терапии одной линии у пациентов, получавших 0, 1, 2, 3, 4, 5, 6 или более линий терапии до лечения комбинацией иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агентом, агентом на основе платины и/или доксорубицином, предложенными в данном документе. Комбинация иммуноконъюгата FOLR1 (например, IMGN853) с анти-ФРЭС агентом, агент на основе платины, и/или доксорубицин предложенных в данном документе, может быть дана в виде одной линии терапии у пациентов, получивших по меньшей мере 1, по меньшей мере 2, или по меньшей мере 3 линии терапии до лечения комбинацией иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агентом, агентом на основе платины и/или доксорубицином, предложенными в данном документе. В некоторых вариантах реализации изобретения комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина, предложенных в данном документе, может быть дана в виде одной линии терапии у пациентов, получавших не более чем 1, не более чем 2, не более чем 3, не более чем 4, не более чем 5 или не более чем 6 линий терапии. В некоторых вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина, предложенные в данном документе, могут быть даны в качестве адъювантной терапии или неоадъювантной терапии.
[0100] Термин «адъювантная терапия» относится к системной терапии после операции. Адъювантная терапия в самом широком смысле представляет собой лечение, данное в дополнение к первичной терапии для уничтожения любых раковых клеток, которые могут распространиться, даже если распространение не может быть обнаружено радиологическими или лабораторными тестами.
[0101] Термин «неоадъювантная терапия» относится к системной терапии, назначенной до операции.
[0102] Термин «IMGN853» относится к описанному в данном документе иммуноконъюгату, содержащему антитело huMov19 (M9346A), sulfoSPDB-линкер и DM4 майтанзиноид. Антитело huMov19 (M9346A) представляет собой антитело против FOLR1, содержащее последовательность SEQ ID NO: 3 вариабельной области тяжелой цепи и последовательность SEQ ID NO: 5 вариабельной области легкой цепи. DM4 относится к N2'-деацетил-N2 '-(4-меркапто-4-метил-1-оксопентил)майтанзину. «SulfoSPDB» относится к N-сукцинимидил-4- (2-пиридилдитио)-2-сульфобутаноат)-ному линкеру.
[0103] «Моноклональное» антитело или антигенсвязывающий фрагмент относится к гомогенному антителу или антигенсвязывающему фрагменту популяции, участвующей в высокоспецифическом распознавании и связывании одной антигенной детерминанты или эпитопа. Это контрастирует с поликлональными антителами, которые обычно включают различные антитела, нацеленные против различных антигенных детерминант. Термин «моноклональное» антитело или антигенсвязывающий фрагмент включает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (такие как Fab, Fab ', F(ab') 2, Fv), одноцепочечные (scFv) мутанты, слитые белки, содержащие часть антитела и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена. Кроме того, «моноклональное» антитело или антигенсвязывающий фрагмент относится к таким антителам и антигенсвязывающим фрагментам, полученным любым количеством способов, включая, но не ограничиваясь ими, гибридому, выбор бактериофагов, рекомбинантную экспрессию и трансгенных животных.
[0104] Термин «гуманизированное» антитело или антигенсвязывающий фрагмент относится к формам нечеловеческих (например, мышиных) антител или антигенсвязывающих фрагментов, которые являются специфическими целями иммуноглобулина, химерными иммуноглобулинами или их фрагментами, которые содержат минимальные нечеловеческие (например, мышиные) последовательности. Как правило, гуманизированными антителами или антигенсвязывающими фрагментами являются человеческие иммуноглобулины, в которых остатки из определяющей комплементарность области (CDR) заменяются остатками CDR нечеловеческих видов (например, мыши, крысы, кролика, хомяка), которые имеют желаемую специфичность, аффинность и способность («привитой CDR») (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)). В некоторых случаях остатки Fv каркасной области (FR) человеческого иммуноглобулина заменяются соответствующими остатками в антителе или фрагменте из нечеловеческих видов, которые имеют желаемую специфичность, аффинность и способность. Гуманизированное антитело или антигенсвязывающий фрагмент его можно дополнительно модифицировать путем замещения дополнительных остатков как в каркасной области Fv, так и/или внутри замещенных нечеловеческих остатков, чтобы уточнить и оптимизировать антитело или антигенсвязывающий фрагмент его специфичности, аффинности и/или способности. В общем, гуманизированное антитело или его антигенсвязывающий фрагмент будет содержать по существу все из по меньшей мере одного: и обычно двух или трех вариабельных доменов, содержащих все или практически все области CDR, которые соответствуют нечеловеческому иммуноглобулину, тогда как все или практически все FR-области соответствуют консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело или его антигенсвязывающий фрагмент могут также содержать по меньшей мере часть константной области иммуноглобулина или домена (Fc), как правило, иммуноглобулина человека. Примеры способов, используемых для создания гуманизированных антител, описаны в патенте США№5225539; Roguska et al., Proc. Natl. Acad. Sci., USA, 91(3):969-973 (1994) и Roguska et al., Protein Eng. 9(10):895-904 (1996). В некоторых вариантах реализации изобретения «гуманизированное антитело» представляет собой антитело с измененной поверхностью.
[0105] «Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, либо индивидуально, либо в комбинации. Вариабельные области тяжелой и легкой цепей состоят из четырех каркасных областей (FR), связанных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в непосредственной близости с помощью FR и с CDR из другой цепи, способствуют образованию антигенсвязывающего сайта антител. Существуют по меньшей мере два метода определения CDR:(1) подход, основанный на вариабельности межвидовой последовательности (т.е. Kabat et al., Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.),"Кабат"); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al., J. Molec. Biol. 273:927-948 (1997)). Кроме того, комбинации этих двух подходов иногда используются в данной области техники для определения CDR.
[0106] Номенклатура Кабата обычно используется при обращении к остатку в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al. ,Sequences of Immunological Interest. (5th еd., 1991, National Institutes of Health, Bethesda, Md.)("Кабат").
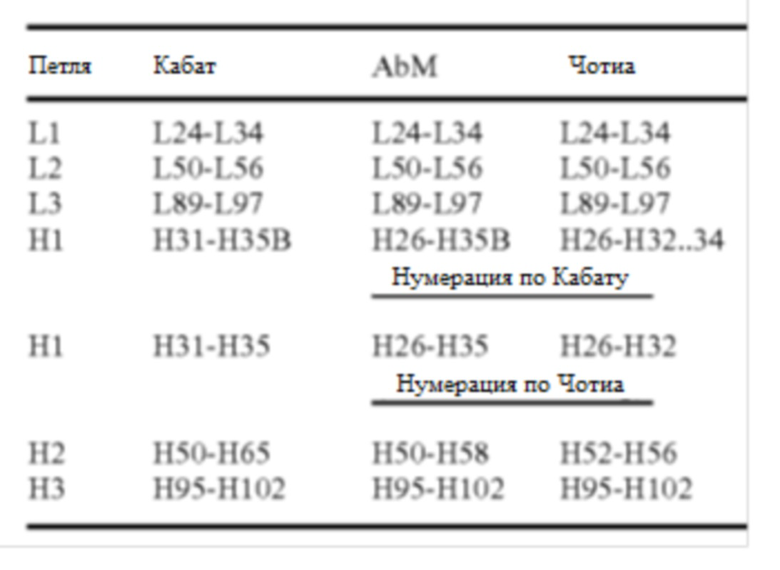
[0107] Нумерация положения аминокислоты по Кабату относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи для компиляции антител в Kabat et al. (Sequences of Immunological Interest. (5th ed., 1991, National Institutes of Health, Bethesda, Md.),"Кабат"). Используя данную систему нумерации, фактическая линейная аминокислотная последовательность может содержать меньшее или дополнительное количество аминокислот, что соответствует укорачиванию или вставке в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать одну аминокислотную вставку (остаток 52а по Кабату) после остатка 52 из Н2 и вставленные остатки (например, остатки 82а, 82b и 82с и т. д. по Кабату) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Кабату можно определить для данного антитела путем выравнивания в областях гомологии последовательности антитела со «стандартной» нумерацией Кабата. Вместо этого Чотиа ссылается на расположение структурных петель (Chothia и Lesk, J. Mol. Biol. 196:901-917 (1987)). Конец петли Чотиа CDR-H1 при нумерации с использованием соглашения о нумерации по Кабату варьируется между H32 и H34 в зависимости от длины петли (это связано с тем, что схема нумерации по Кабату помещает вставки на H35A и H35B, если ни 35A, ни 35B не присутствует, петля заканчивается на 32, если присутствует только 35A, петлия заканчивается на 33, если присутствуют оба 35A и 35B, петля заканчивается на 34). Гипервариабельные области AbM представляют собой компромисс между CDR по Кабату и структурными петлями Чотиа и используются программным обеспечением для моделирования антител AbM от Oxford Molecular.
[0108] Термин «человеческое» антитело или антигенсвязывающий фрагмент означает антитело или его антигенсвязывающий фрагмент, продуцируемый человеком, или антитело или его антигенсвязывающий фрагмент, имеющий аминокислотную последовательность, соответствующую антителу или антигенсвязывающему фрагменту, продуцированному человеком, полученному с использованием любого метода, известного в данной области техники. Данное определение человеческого антитела или антигенсвязывающего фрагмента включает в себя интактные или полноразмерные антитела и их фрагменты.
[0109] Термин «химерные» антитела или антигенсвязывающий фрагменты относится к антителам или антигенсвязывающим фрагментам, в которых аминокислотная последовательность получена из двух или более видов. Как правило, вариабельная область как легкой, так и тяжелой цепей соответствует вариабельной области антител или антигенсвязывающих фрагментов, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.) с желаемой специфичностью, аффинностью и способностью, тогда как константные области гомологичны последовательностям в антителах или антигенсвязывающих фрагментах, полученных из другого (обычно человека), чтобы избежать проявления иммунного ответа у данных видов.
[0110] Термин «эпитоп» или «антигенная детерминанта» используются в данном документе взаимозаменяемо и относятся к той части антигена, которая может быть распознана и специфически связана определенным антителом. Когда антиген является полипептидом, эпитопы могут образовываться как из заменимых аминокислот, так и из незаменимых аминокислот, сопоставленных с третичным сгибанием белка. Эпитопы, образованные из заменимых аминокислот, обычно сохраняются при денатурации белка, тогда как эпитопы, образованные путем третичного сгибания, обычно теряются при денатурации белка. Эпитоп обычно включает в себя по меньшей мере 3 и более обычно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
[0111] «Аффинность связывания» обычно относится к силе суммарного количества нековалентных взаимодействий между одним связывающим сайтом молекулы (например, антителом) и ее связывающим партнером (например, антигеном). Если не указано иное, в данном документе «аффинность связывания» относится к аффинности собственного связывания, которая отражает взаимодействие 1:1 между членами связывающей пары (например, антитело и антиген). Аффинность молекулы X для ее партнера Y обычно может быть представлена константой диссоциации (Kd). Аффинность может быть измерена обычными методами, известными в данной области техники, включая описанные в данном документе. Низкоаффинные антитела обычно связывают антиген медленно и склонны легко диссоциировать, тогда как высокоаффинные антитела обычно связывают антиген быстрее и имеют тенденцию оставаться связанными дольше. В данной области техники известны различные способы измерения аффинности связывания, любой из которых может быть использован для целей данного изобретения. Конкретные иллюстративные варианты реализации изобретения описаны ниже.
[0112] «Или лучше» при использовании в данном документе для обозначения аффинности связывания относится к более сильному связыванию между молекулой и ее связывающим партнером. «Или лучше» при использовании в данном документе относится к более сильному связыванию, представленному меньшим численным значением Kd. Например, антитело, которое имеет аффинность к антигену равную «0,6 нМ или лучшую», аффинность антитела к антигену составляет <0,6 нМ, т.е. 0. 59 нM, 0. 58 нM, 0. 57 нM и т.д. или любое значение, меньшее чем 0. 6 нМ.
[0113] Под «специфическим связыванием» обычно подразумевается, что антитело связывается с эпитопом через его антигенсвязывающий домен и что связывание влечет за собой некоторую комплементарность между антигенсвязывающим доменом и эпитопом. Согласно данному определению, антитело, как говорят, «специфически связывается» с эпитопом, когда оно связывается с данным эпитопом через его антигенсвязывающий домен более легко, чем оно связывается со случайным, неродственнным эпитопом. Термин «специфичность» используется в данном документе для определения относительной аффинности, с которой определенное антитело связывается с определенным эпитопом. Например, антитело «А» может считаться имеющим более высокую специфичность для данного эпитопа, чем антитело «В» или антитело «А» можно связывать с эпитопом «С» с более высокой специфичностью, чем у родственного эпитопа «D».
[0114] Под «предпочтительным связыванием» подразумевается, что антитело специфически связывается с эпитопом более легко, чем оно связывается с родственным, аналогичным, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое «предпочтительно связывается» с данным эпитопом, скорее всего будет связываться с данным эпитопом, чем родственным эпитопом, хотя такое антитело может перекрестно вступать в реакцию с родственным эпитопом.
[0115] Говорят, что антитело «конкурентно ингибирует» связывание эталонного антитела с данным эпитопом, если оно предпочтительно связывается с данным эпитопом или перекрывающимся эпитопом в той степени, в которой он блокирует, до некоторой степени, связывание эталонного антитела с эпитопом. Конкурентоспособное ингибирование может быть определено любым способом, известным в данной области техники, например, конкурентными ИФА. Можно сказать, что антитело конкурентно ингибирует связывание эталонного антитела с данным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60% или по меньшей мере на 50%.
[0116] Фраза «по существу аналогичная» или «по существу одна и та же» в контексте данного документа означает достаточно высокую степень подобия между двумя числовыми значениями (как правило, одна связана с антителом по данному изобретению, а другая связана с эталонным / компараторным антителом), так что специалист в данной области техники рассмотрел бы разницу между двумя указанными значениями с небольшим значением или отсутствием биологического и/или статистического значения в контексте биологической характеристики, измеренной указанными значениями (например, значения Kd). Разница между указанными двумя значениями может быть менее чем около 50%, менее чем около 40%, менее чем около 30%, менее чем около 20% или менее чем около 10% в зависимости от значения для эталонного / компараторного антитела.
[0117] Полипептид, антитело, полинуклеотид, вектор, клетка или композиция, которая является «выделенной», представляет собой полипептид, антитело, полинуклеотид, вектор, клетку или композицию, которая находится в форме, не обнаруженной в природе. Выделенные полипептиды, антитела, полинуклеотиды, векторы, клетка или композиции включают такие, которые были очищены до такой степени, что они больше не находятся в форме, в которой они обнаружены в природе. В некоторых вариантах реализации изобретения антитело, полинуклеотид, вектор, клетка или композиция, которая выделена, является по существу чистой.
[0118] В контексте данного документа, термин «по существу чистый» относится к материалу, который является по меньшей мере мере на 50% чистым (т.е. без примесей), по меньшей мере на 90% чистым, по меньшей мере на 95% чистым, по меньшей мере на 98% чистым или по меньшей мере на 99% чистым.
[0119] Термин «иммуноконъюгат» или «конъюгат», в контексте данного документа, относится к соединению или его производному, которое связано с клеточно-связывающим агентом (то есть антителом анти-FOLR1 иммуноконъюгата или его фрагментом) и определяется общей формулой: C-L-A, где C = цитотоксин, L = линкер и A = антитело или его антигенсвязывающий фрагмент, например, анти-FOLR1 иммуноконъюгат или фрагмент антитела. Иммуноконъюгаты также могут быть определены общей формулой в обратном порядке: A-L-C.
[0120] «Линкер» представляет собой любой химический фрагмент, который способен связывать соединение, обычно лекарственное средство (такое как майтанзиноид), с клеточно-связывающим агентом (таким как иммуноконъюгата антитела к FOLR1 или его фрагмент) стабильным ковалентным образом. Линкеры могут быть восприимчивыми к или быть по существу устойчивыми, например, к расщеплению дисульфидной связи в условиях, при которых соединение или антитело остается активным. Подходящие линкеры хорошо известны в данной области техники и включают, например, дисульфидные группы и тиоэфирные группы
[0121] Термин «рак» и «раковый» относятся к физическому состоянию у млекопитающих или описывают физиологическое состояние, при котором популяция клеток характеризуется нерегулируемым ростом клеток. Примеры рака включают, но не ограничиваются ими, карциному, бластому и саркому. Более конкретные примеры таких раковых образований включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легких, плоскоклеточный рак легкого, перитонеальный рак, включая первичный перитонеальный рак (PPC), гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичников (в том числе эпителиальный рак яичников (EOC) и распространенный EOC), рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, колоректальный рак, рак эндометрия (или карцинома матки), карцинома слюнной железы, рак непаренхиматозных клеток (почки), рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени, различные типы рака головы и шеи, кости, гипофиза, яичка и рак мозга (см., например, патент США№8709432); патент США№8834877; Zwicke et al., Nano Reviews 3:18496-18506 (2012)). Рак может представлять собой рак, который экспрессирует FOLR1 («FOLR1-экспрессирующий рак» или « FRα положительный» рак).
[0122] Термин «раковая клетка», «опухолевая клетка» и грамматические эквиваленты относятся к общей популяции клеток, полученных из опухоли или предраковых поражений, включая как неопухолевые клетки, которые составляют основную массу популяции опухолевых клеток, так и опухолевые стволовые клетки (раковые стволовые клетки). В контексте данного документа, термин «опухолевая клетка» будет модифицироваться термином «нетуморогенная» при обращении исключительно к тем опухолевым клеткам, у которых отсутствует способность обновляться и дифференцироваться, чтобы отличать указанные опухолевые клетки от раковых стволовых клеток.
[0123] «Распространенный» рак представляет собой тот, который распространился за пределы участка или органа происхождения, либо путем локального вторжения, либо метастазов. Термин «распространенный» рак включает как локально распространенный, так и метастатический процесс.
[0124] «Метастатический» рак относится к раку, который распространился из одной части тела в другую часть тела.
[0125] «Резистентный» рак представляет собой тот, который прогрессирует, хотя противоопухолевое лечение, такое как химиотерапия, вводят больному раком. Примером резистентного рака является тот, который является невосприимчивым к лечению препаратами платины
[0126] Пациент является «невосприимчивым к лечению препаратами платины», если пациент не реагирует на терапию на основе платины и показывает прогрессию в течение курса терапии или в течение 4 недель после последней дозы. «Устойчивые к препаратам платины» пациенты прогрессируют в течение 6 месяцев после терапии на основе платины. «Частично чувствительные к препаратам платины» пациенты прогрессируют между 6 и 12 месяцами терапии на основе платины. «Чувствительные к препаратам платины» пациенты прогрессируют с интервалом более 12 месяцев.
[0127] «Рецидивирующий» рак представляет собой тот, который затормозил либо на начальном участке, либо на отдаленном участке, после ответа на начальную терапию.
[0128] Термин «субъект» относится к любому животному (например, млекопитающему), включая, но не ограничиваясь ими, людей, не-человекообразных приматов, грызунов и т. п., которые должны быть получателями определенного лечения. Как правило, термины «субъект» и «пациент» используются в данном документе взаимозаменяемо в отношении человека.
[0129] «Пациент, переносящий рецидив» представляет собой пациента, у которого есть признаки или симптомы рака после ремиссии. Необязательно, у пациента происходит рецидив после адъювантной или неоадъювантной терапии.
[0130] Введение «в комбинации с» одним или более терапевтическими агентами включает одновременное (параллельное) или последовательное введение в любом порядке.
[0131] Комбинированная терапия может обеспечить «синергию» и доказать «синергизм», то есть, когда эффект, достигаемый при совместном применении активных компонентов больше суммы эффектов, которые возникают в результате применения соединений отдельно. Синергический эффект может быть достигнут, когда активными компонентами являются:(1) совместно приготовленная и введенная или доставленная одновременно комбинированная единичная лекарственная форма; (2) доставляемые серийно, чередованием или параллельно в отдельном виде препараты; или (3) путем какого-либо другого режима. При доставке в альтернативной терапии синергический эффект может быть достигнут, когда соединения вводят или доставляют последовательно, например, с помощью различных инъекций в отдельных шприцах
[0132] Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, чтобы обеспечить эффективную биологическую активность активного компонента, и который не содержит дополнительных компонентов, которые неприемлемо токсичны для субъекта, которому бы вводили препарат. Препарат может быть стерильным.
[0133] «Эффективное количество» антитела, иммуноконъюгата или другого лекарственного средства, согласно данному описанию, представляет собой количество, достаточное для осуществления конкретно заявленной цели. «Эффективное количество» может быть определено эмпирически и в обычном порядке применительно к заявленной цели.
[0134] Термин «терапевтически эффективное количество» относится к количеству антитела, иммуноконъюгата или другого лекарственного средства, эффективному для «лечения» заболевания или расстройства у субъекта или млекопитающего. В случае рака терапевтически эффективное количество лекарственного средства может уменьшить количество раковых клеток; уменьшить размер опухоли или опухолевую нагрузку; ингибировать (то есть замедлять до некоторой степени и в определенном варианте реализации, останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть замедлять до некоторой степени и в определенном варианте реализации, останавливать) метастазы опухолей; ингибировать, до некоторой степени, рост опухоли; уменьшить до некоторой степени один или более симптомов, связанных с раком; и/или приводить к благоприятному ответу, такому как повышенная выживаемость без прогрессирования заболевания (PFS), безрецидивная выживаемость (DFS) или общая выживаемость (ОС), полная ремиссия (ПР), частичная ремиссия (ЧР) или, в некоторых случаях стабильное заболевание (SD), снижение прогрессирования заболевания (PD), сокращение времени до прогрессирования (ТТР), уменьшение СА125 в случае рака яичников или любая их комбинация. См. определение в данном документе для "лечения". В той степени, в которой лекарственное средство может предотвратить рост и/или убить существующие раковые клетки, он может быть цитостатическим и/или цитотоксическим. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, но необязательно, поскольку профилактическую дозу применяют у субъектов до или на более ранней стадии заболевания, профилактически эффективное количество будет меньше терапевтически эффективного количества.
[0135] Термин «положительно реагирует», как правило, относится к обусловливанию благоприятного состояния субъекту. Что касается лечения рака, указанный термин относится к оказанию терапевтического воздействия на субъекта. Положительные терапевтические эффекты при раке можно измерить несколькими способами (См., W. A. Weber, J. Nucl. Med. 50:1S-10S (2009)). Например, ингибирование роста опухоли, экспрессию молекулярного маркера, экспрессию сывороточного маркера и методы молекулярной визуализации можно использовать для оценки терапевтической эффективности противоракового терапевтического средства. Log10 гибель клеток (LCK) может быть использован для количественной оценки гибели опухолевых клеток. Log10 гибель клеток (LCK) рассчитывается по формуле LCK = (T-C) / Td × 3.32, где (T-C) (или задержка роста опухоли (TGD)) является медианным временем (в днях) для группы лечения и опухолей контрольной группы для достижения заданного размера (исключаются выжившие без опухолей). Td представляет собой время удвоения опухоли (оценивается по нелинейной экспоненциальной кривой, соответствующей ежедневной медиане роста контрольной опухоли), и 3.32 представляет собой количество удвоений клеток на логарифм роста клеток. Способность уменьшать объем опухоли можно оценить, например, путем измерения значения % T/C, которое представляет собой средний объем опухоли принимавших лечения субъектов, деленный на средний объем опухоли контрольных субъектов. Что касается ингибирования роста опухоли, то согласно стандарту NCI T/C ≤42% является минимальным уровнем противоопухолевой активности. T/C <10% считается высоким уровнем противоопухолевой активности, при этом T/C (%) = средний объем опухоли принимавшего лечение субъектов / средний объем опухоли контрольного субъекта × 100. Благоприятный ответ можно оценить, например, по увеличенной выживаемости без прогрессирования заболевания (PFS), по безрецидивной выживаемости (DFS) или по общей выживаемости (ОС), полной ремиссии (ПР), частичной ремиссии (ЧР) или, в некоторых случаях, - по стабильному заболеванию (SD), снижению прогрессирующего заболевания (PD), сокращению времени до прогрессирования (ТТП), уменьшению СА125 в случае рака яичников или любой их комбинации.
[0136] PFS, DFS и OS могут быть измерены стандартами, установленными Национальным институтом рака и Управлением по контролю качеством продуктов и лекарств США. См. Johnson et al., J. Clin. Oncol. 21(7):1404-1411 (2003).
[0137] «Выживаемость без прогрессирования заболевания» (PFS) относится к времени от набора пациентов до прогрессирования заболевания или смерти. PFS обычно измеряют с использованием метода Каплана-Мейера и критериев оценки ответа в стандартах на твердые опухоли (RECIST) 1.1. Как правило, выживаемость без прогрессирования заболевания относится к ситуации, когда пациент остается живым, без ухудшающегося рака.
[0138] «Время до прогрессирования опухоли» (ТТП) определяется как время от регистрации до прогрессирования заболевания. TTP обычно измеряют с использованием критериев RECIST 1. 1.
[0139] «Полный ответ» или «полная ремиссия» или «ПР» указывает на исчезновение всех признаков опухоли или рака в ответ на лечение. Это не всегда означает, что он был излечен.
[0140] «Частичная ремиссия» или «ЧР» относится к уменьшению размера или объема одной или более опухолей или поражений или в степени рака в организме в ответ на лечение.
[0141] «Стабильное заболевание» относится к заболеванию без прогрессирования или рецидива. В стабильном заболевании нет достаточного уменьшения размера опухоли, чтобы квалифицировать частичную ремиссию или достаточное увеличение опухоли, чтобы квалифицировать прогрессирование заболевания.
[0142] «Прогрессирование заболевания» относится к появлению еще одного нового поражения или опухолей и/или однозначного прогрессирования существующих нецелевых поражений. Прогрессирование заболевания также может относиться к росту опухоли более чем на 20% с начала лечения либо из-за увеличения массы, либо при распространении опухоли.
[0143] «Безрецидивная выживаемость» (DFS) относится к длительности времени и после лечения, когда пациент избавлен от болезни.
[0144] «Общая выживаемость» (ОВ) относится к времени от набора пациентов до смерти или подвергнуто цензуре на дату, известную последней. ОВ включает увеличение продолжительности жизни по сравнению с наивными или необработанными людьми или пациентами. Общая выживаемость относится к ситуации, когда пациент остается живым в течение определенного периода времени, например, один год, пять лет и т.д., например, с момента постановки диагноза или лечения.
[0145] Под «продлением выживаемости» или «увеличением вероятности выживания» подразумевают увеличение PFS и/или ОС у субъекта, получающего лечение, по отношению к не получающему лечение субъекту или по сравнению с контрольным протоколом лечения пациента, например, используемого в стандарте ухода за любым взятым типом рака.
[0146] «Снижение уровня СА125» можно оценить в соответствии с руководством Международной группы по изучению злокачественных опухолей женской репродуктивной системы (GCIG). Например, уровни CA125 можно измерить до начала лечения, чтобы установить исходный уровень СА125. Уровни СА125 можно измерять один или более раз во время или после лечения, а снижение уровней СА125 во времени по сравнению с исходным уровнем считается снижением уровня СА125
[0147] Термин «повышенная экспрессия» или «сверхэкспрессия» FOLR1 в конкретном образце опухоли, ткани или клетки относится к FOLR1 (полипептиду FOLR1 или нуклеиновой кислоте, кодирующей такой полипептид), который присутствует на уровне выше, чем тот, который присутствует в здоровой или непатологической (нативной, дикого типа) ткани или клетках того же типа или происхождения. Такая повышенная экспрессия или сверхэкспрессия могут быть вызваны, например, мутацией, амплификацией гена, повышенной транскрипцией, увеличенной трансляцией или повышенной стабильностью белка.
[0148] Термины, такие как «лечащий» или «лечение» или «лечить» или «облегчающий» или «облегчение», относятся к терапевтическим мерам, которые вылечивают, замедляют, уменьшают симптомы и/или останавливают прогрессирование диагностированного патологического состояния или расстройства. Таким образом, те, кто нуждается в лечении, включают тех, у которых уже диагностированы или подозреваются расстройства. В некоторых вариантах реализации изобретения субъект успешно «лечится» от рака в соответствии со способами по данному изобретению, если пациент показывает одно или более из следующего: уменьшение количества или полное отсутствие раковых клеток; уменьшение опухолевой массы; ингибирование или отсутствие инфильтрации раковых клеток в периферические органах, включая, например, распространение рака в мягкие ткани и кости; ингибирование или отсутствие метастаза опухоли; ингибирование или отсутствие роста опухоли; облегчение одного или более симптомов, связанных с конкретным видом рака; снижение заболеваемости и смертности; улучшение качества жизни; уменьшение туморогенности, туморогенной частоты или туморогенной способности опухоли; уменьшение числа или частоты раковых стволовых клеток в опухоли; дифференцировка опухолевых клеток в нетуморогенное состояние; повышенная выживаемость без прогрессирования (PFS), безрецидивная выживаемость (DFS) или общая выживаемость (ОС), полная ремиссия (ПР), частичная ремиссия (ЧР), стабильное заболевание (SD), снижение прогрессирующего заболевания (PD), сокращенное время до прогрессирования (ТТП), снижение СА125 в случае рака яичников или любая их комбинация.
[0149] Профилактические или предупредительные меры относятся к мерам, которые предупреждают и/или замедляют развитие целевого патологического состояния или расстройства. Таким образом, те, кто нуждается в профилактических мерах или предупредительных мерах, включают тех, кто подвержен расстройству, и тех, кому следует предотвратить расстройство.
[0150] Термин «инструктаж» означает предоставление указаний на применяемую терапию, лекарственное средство, лечение, схемы лечения и т.п. Любыми способами, например, в письменной форме, например, в виде листовок-вкладышей в упаковке или других письменных рекламных материалов.
[0151] Термины «полипептид», «пептид» и «белок» используются в данном документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и его можно прервать неаминокислотами. Термины также включают аминокислотный полимер, который был модифицирован естественным путем или путем вмешательства; например, путем образования дисульфидных связей, гликозилирования, липидации, ацетилирования, фосфорилирования или путем любых других манипуляций или модификаций, такиех как конъюгация с метящим компонентом. К определению также относятся, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, не встречающиеся в природе аминокислоты и т.д.), а также другие модификации, известные в данной области техники. Понятно, что, поскольку полипептиды по данному изобретению основаны на антителах, в некоторых вариантах реализации изобретения полипептиды могут встречаться как в виде отдельных цепей, так и связанные цепей.
[0152] Термин «идентичный» или процент «идентичности» в контексте двух или более нуклеиновых кислот или полипептидов относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют определенный процент нуклеотидов или аминокислотных остатков, которые являются одинаковыми, когда сравнивали и выравнивали (вводили гэпы, если необходимо) для максимального соответствия, не считая каких-либо консервативных аминокислотных замещений, как часть идентичности последовательности. Процент идентичности может быть измерен с помощью программного обеспечения для сравнения последовательностей или алгоритмов, или путем визуального контроля. В данной области техники известны различные алгоритмы и программное обеспечение, которые могут применяться для получения выравниваний аминокислотных или нуклеотидных последовательностей. Одним из таких неограничивающих примеров алгоритма выравнивания последовательностей является алгоритм, описанный в Karlin et al., Proc. Natl. Acad. Sci., 87:2264-2268 (1990), как изменено в Karlin et al., Proc. Natl. Acad. Sci., 90:5873-5877 (1993) и включены в программы NBLAST и XBLAST (Altschul et al., Nucleic Acids Res., 25:3389-3402 (1991)). В некоторых вариантах реализации изобретения, могут применять Gapped BLAST, как описано в Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997). BLAST-2, WU-BLAST-2 (Altschul et al., Methods in Enzymology, 266:460-480 (1996)), ALIGN, ALIGN-2 (Genentech, Южный Сан Франциско, Калифорния) или Megalign (DNASTAR) являются дополнительными общедоступными программными программами, которые могут использоваться для выравнивания последовательностей. В некоторых вариантах реализации изобретения, определяется процент идентичности между двумя нуклеотидными последовательностями (используя программу GAP в программном обеспечении GCG (например, используя матрицу NWSgapdna. CMP и штраф за открытие гэпа, равный 40, 50, 60, 70 или 90 и штраф за продолжение гэпа, равный 1, 2, 3, 4, 5 или 6). В некоторых вариантах реализации изобретения программа GAP в программном пакете GCG, который включает в себя алгоритм Нидлмана-Вунша (J. Mol. Biol. (48):444-453 (1970)) могут быть использованы для определения процента идентичности между двумя аминокислотными последовательностями (например, используя как матрицу Blossum 62, так и матрицу PAM250 и штраф за открытие гэпа 16, 14, 12, 10, 8, 6 или 4 и штраф за продолжение гэпа 1, 2, 3, 4, 5). Альтернативно, в некоторых вариантах реализации изобретения процент идентичности между нуклеотидными или аминокислотными последовательностями определяется с использованием алгоритма Майерса и Миллера (CABIOS, 4:11-17 (1989)). Например, процент идентичности может быть определен с помощью программы ALIGN (версия 2. 0) и с использованием PAM120 с таблицей вычетов, штрафом за продолжение гэпа, равным 12, и штрафом за гэп, равным 4. Соответствующие параметры для максимального выравнивания с помощью конкретного программного обеспечения выравнивания могут быть определены специалистом в данной области техники. В некоторых вариантах реализации изобретения, используются параметры выравнивания по умолчанию в программном обеспечении. В некоторых вариантах реализации изобретения, процент идентичности «Х» первой аминокислотной последовательности ко второй аминокислотной последовательности вычисляется, как 100 х (Y/Z), где Y представляет собой количество аминокислотных остатков, оцененных как идентичные совпадения при выравнивании первой и второй последовательности (в соответствии с выравниванием с помощью визуального контроля или конкретной программой выравнивания последовательностей), а Z представляет собой общее количество остатков во второй последовательности. Если длина первой последовательности длиннее второй последовательности, процент идентичности первой последовательности по отношению ко второй последовательности будет выше, чем процент идентичности второй последовательности к первой последовательности.
[0153] В качестве неограничивающего примера, независимо от того, имеет ли какой-либо конкретный полинуклеотид определенный процент идентичности в последовательности (например, по меньшей мере на 80% идентичен, по меньшей мере на 85% идентичен, по ментшей мере на 90% идентичен и в некоторых вариантах реализации изобретения, по меньшей мере на 95 %, 96%, 97%, 98% или 99% идентичен) по отношению к контрольной последовательности, в определенных вариантах реализации изобретения можно определить с помощью программы Bestfit (Wisconsin Sequence Analysis Package, Version 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Мадисон, WI 53711). В Bestfit используется алгоритм поиска локальной гомологии Смита-Уотермана (Advances in Applied Mathematics 2:482 489 (1981)) для того, чтобы найти лучший сегмент гомологии между двумя последовательностями. При использовании программы Bestfit или любой другой программы выравнивания последовательностей для определения того, является ли конкретная последовательность, например, на 95% идентичной эталонной последовательности по данному изобретению, параметры устанавливаются так, чтобы процент идентичности вычислялся по всей длине эталонной нуклеотидной последовательности и, которая допускает пробелы в гомологии до 5% от общего числа нуклеотидов в эталонной последовательности.
[0154] В некоторых вариантах реализации изобретения две нуклеиновые кислоты или полипептида по данному изобретению по существу идентичны, то есть они имеют по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% и в некоторых вариантах реализации изобретения, по меньшей мере, 95%, 96%, 97%, 98%, 99% идентичность нуклеотидных или аминокислотных остатков при сравнении и выравнивании для максимального соответствия, при измерении с использованием алгоритма сравнения последовательностей или путем визуального осмотра. Идентичность может существовать с областью последовательностей, длина которой составляет по меньшей мере около 10, около 20, около 40-60 остатков или любое целое значение между ними, может быть более длинной областью, чем 60-80 остатков, например, по меньшей мере около 90-100 остатков и в некоторых вариантах реализации изобретения последовательности по существу идентичны по всей длине сравниваемых последовательностей, таких как кодирующая область нуклеотидной последовательности, например.
[0155] «Консервативное замещение аминокислот» представляет собой такое, при котором один аминокислотный остаток заменен другим аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области техники, включая основные боковые цепи (например, лизин, аргинин, гистидин), боковые цепи с кислотными остатками (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Например, замещение фенилаланина на тирозин представляет собой консервативное замещение. В некоторых вариантах реализации изобретения консервативные замещения в последовательностях полипептидов и антител по данному изобретению не отменяет связывания полипептида или антитела, содержащего аминокислотную последовательность, с антигеном(ами), то есть с FOLR1 или ФРЭС, с которым связывается полипептид или антитело. Способы идентификации нуклеотидных и аминокислотных консервативных замещений, которые не устраняют связывание антигена, хорошо известны в данной области техники (см., например, Brummell et al., Biochem. 32:1180-1 187 (1993); Kobayashi et al., Protein Eng. 12(10):879-884 (1999); и Burks et al., Proc. Natl. Acad. Sci. USA 94: 412-417 (1997)).
[0156] В контексте данного изобретения и формулы изобретения, формы единственного числа включают формы множественного числа, если контекст явно не диктует иное.
[0157] Понятно, что везде, в данном документе описаны варианты реализации изобретения с помощью слова «содержащий», в противном случае также предоставляются аналогичные варианты реализации изобретения, описанные в терминах «состоящий из» и/или «состоящий по существу из».
[0158] Термин "и/или" используемый в фразе, такой как "A и/или B" в данном документе предназначен, чтобы включить оба "A и B", "A или B", "A" и "B. "Аналогично, термин «и /или», используемый в фразе, такой как «A, B, и/или C», предназначен для охвата каждого из следующих вариантов реализации изобретения: A, B и C; A, B, или C; A или C; A или B; B или C; A и C; A и B; B и C; A (в монотерапии); B (в монотерапии); и C (в монотерапии).
II. Анти-FOLR1 иммуноконъюгаты
[0159] В данном документе описаны способы введения иммуноконъюгатов, которые специфически связывают FOLR1 (например, IMGN853). Данные агенты упоминаются в данном документе, как «FOLR1-иммуноконъюгаты или анти-FOLR1 иммуноконъюгаты». Аминокислотные и нуклеотидные последовательности для FOLR1 человека известны в данной области техники и также представлены в данном документе, как SEQ ID NO: 1 и SEQ ID NO: 2, соответственно.
SEQ ID NO:1 - рецептор фолиевой кислоты-1 человека
MAQRMTTQLLLLLVWVAVVGEAQTRIAWARTELLNVCMNAKHHKEKPGPEDKLHEQCRPWRKNACCSTNTSQEAHKDVSYLYRFNWNHCGEMAPACKRHFIQDTCLYECSPNLGPWIQQVDQSWRKERVLNVPLCKEDCEQWWEDCRTSYTCKSNWHKGWNWTSGFNKCAVGAACQPFHFYFPTPTVLCNEIWTHSYKVSNYSRGSGRCIQMWFDPAQGNPNEEVARFYAAAMSGAGPWAAWPFLLSLALMLLWLLS
SEQ ID NO:2 - нуклеотдная последовательность рецептора фолиевой кислоты-1 человека
atggctcagcggatgacaacacagctgctgctccttctagtgtgggtggctgtagtaggggaggctcagacaaggattgcatgggccaggactgagcttctcaatgtctgcatgaacgccaagcaccacaaggaaaagccaggccccgaggacaagttgcatgagcagtgtcgaccctggaggaagaatgcctgctgttctaccaacaccagccaggaagcccataaggatgtttcctacctatatagattcaactggaaccactgtggagagatggcacctgcctgcaaacggcatttcatccaggacacctgcctctacgagtgctcccccaacttggggccctggatccagcaggtggatcagagctggcgcaaagagcgggtactgaacgtgcccctgtgcaaagaggactgtgagcaatggtgggaagattgtcgcacctcctacacctgcaagagcaactggcacaagggctggaactggacttcagggtttaacaagtgcgcagtgggagctgcctgccaacctttccatttctacttccccacacccactgttctgtgcaatgaaatctggactcactcctacaaggtcagcaactacagccgagggagtggccgctgcatccagatgtggttcgacccagcccagggcaaccccaatgaggaggtggcgaggttctatgctgcagccatgagtggggctgggccctgggcagcctggcctttcctgcttagcctggccctaatgctgctgtggctgctcagc
[0160] анти-FOLR1 иммуноконъюгаты содержат клеточно-связывающий агент, связанный с цитотоксином. Клеточно-связывающие агенты могут быть анти-FOLR1 антителами или их антигенсвязывающими фрагментами. Примеры терапевтически эффективных анти-FOLR1 антител можно найти в заявках публ. США № 2012/0009181, который включен в данный документ посредством ссылки. Примером терапевтически эффективного антитела к FOLR1 является huMov19 (M9346A) (содержащий последовательности SEQ ID NO: 3 и SEQ ID NO: 5). Полипептиды SEQ ID NO: 3-5 содержат вариабельный домен тяжелой цепи huMov19 (M9346A), версии 1,00 вариабельного домена легкой цепи и версии 1. 60 вариабельного домена легкой цепи huMov19, соответственно. В некоторых вариантах реализации изобретения, huMov19 анти-FOLR1 антитело состоит из вариабельного домена тяжелой цепи, представленной SEQ ID NO: 3, и вариабельного домена легкой цепи, представленной SEQ ID NO: 5 (версия 1. 60 huMov19). В некоторых вариантах реализации изобретения, антитело huMov19 (M9346A) кодируется плазмидами, депонированными в Американской коллекции типовых культур (АТСС), расположенной на University Boulevard 10801, Манассас, VA 20110, 7 апреля 2010 года в соответствии с условиями Будапештского договора и имеющими депозитный номер АТСС. PTA-10772 и PTA-10773 или 10774.
[0161] Аминокислотные последовательности huMov19 представлены в Таблицах1-4 ниже:
Таблица 1: Вариабельные аминокислотные последовательности тяжелой цепи CDR
GYFMN (SEQ ID NO:9)
RIHPYDGDTFYNQKFQG (SEQ ID NO:10)
YDGSRAMDY (SEQ ID NO:12)
GYTFTGYFMN (SEQ ID NO:19)
RIHPYDGDTF (SEQ ID NO:11)
YDGSRAMDY (SEQ ID NO:12)
Таблица 2: Вариабельные аминокислотные последовательности CDR легкой цепи
Таблица 3: Аминокислотные последовательности с вариабельной цепью антитела к FOLR1
версия 1,00
версия 1. 60
Таблица 4: Полноразмерные тяжелые и легкие цепи аминокислотных последовательности
версия 1,00
версия 1. 60
[0162] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгаты содержат гуманизированные антитела или антигенсвязывающие фрагменты. В некоторых вариантах реализации изобретения гуманизированное антитело или фрагмент представляет собой антитело с измененной поверхностью или его антигенсвязывающий фрагмент. В других вариантах реализации изобретения анти-FOLR1 иммуноконъюгаты содержит полностью человеческое антитело или антигенсвязывающий фрагмент.
[0163] В некоторых вариантах реализации изобретения, анти-FOLR1 иммуноконъюгаты имеют один или более следующих эффектов: ингибируют пролиферацию опухолевых клеток, уменьшают онкогенность опухоли за счет снижения частоты раковых стволовых клеток в опухоли, ингибируют рост опухоли, увеличивают выживаемость пациентов, инициирует гибель опухолевых клеток, дифференциируют опухолевые клетки в неонкогенное состояние или предотвращают или уменьшают метастаз опухолевых клеток.
[0164] В некоторых вариантах реализации изобретения, анти-FOLR1 иммуноконъюгат содержит антитело, которое обладает связанной с антителом клеточной цитотоксичностью (ADCC).
[0165] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгаты способны уменьшать объем опухоли. Способность анти-FOLR1 иммуноконъюгата уменьшить объем опухоли можно оценить, например, путем измерения значения % T/C, которое представляет собой средний объем опухоли, принимавших лечение субъектов, разделенный на средний объем опухоли контрольных субъектов. В некоторых вариантах реализации изобретения, иммуноконъюгаты или другие агенты, которые специфически связывают FOLR1 человека, приводя к гибели клеток с помощью цитотоксического агента. Например, в некоторых вариантах реализации изобретения антитело к антителу FOLR1 человека конъюгируют с майтанзиноидом, который активируется в опухолевых клетках, экспрессирующих FOLR1 интернализацией белка. В некоторых вариантах реализации изобретения, анти-FOLR1 иммуноконъюгаты способны ингибировать рост опухоли. В некоторых вариантах реализации изобретения, анти-FOLR1 иммуноконъюгаты способны ингибировать рост опухоли in vivo (например, в модели ксенотрансплантата мыши и/или человека, больного раком). В некоторых вариантах реализации изобретения, анти-FOLR1 иммуноконъюгаты способны снижать СА125 у пациентов с раком яичников.
[0166] Связывающие FOLR1 молекулы могут быть антителами или антигенсвязывающими фрагментами, которые специфически связываются с FOLR1, которые содержат CDR huMov19 (M9346A) до четырех (т.е. 0, 1, 2, 3 или 4) консервативных аминокислотных замещений на CDR, например, где антитела или фрагменты не включают шесть CDR мышиного Mov19 (т.e. SEQ ID NO: 6-9, 16 и 12). Полипептиды могут содержать одну из индивидуальных вариабельных легких цепей или вариабельных тяжелых цепей, описанных в данном документе. Антитела и полипептиды могут также содержать как вариабельную легкую цепь, так и вариабельную тяжелую цепь.
[0167] В некоторых вариантах реализации изобретения связывающая FOLR1 молекула представляет собой антитело или антигенсвязывающий фрагмент, содержащий последовательности SEQ ID NO: 6-10 и последовательность SEQ ID NO: 12. В некоторых вариантах реализации изобретения связывающая FOLR1 молекула представляет собой антитело или антигенсвязывающий фрагмент, содержащий последовательности SEQ ID NO: 6-9 и последовательности SEQ ID NO: 11 и 12. В некоторых вариантах реализации изобретения связывающая FOLR1 молекула представляет собой антитело или антигенсвязывающий его фрагмент, содержащий последовательности SEQ ID NO: 6-8, 19, 11 и 12.
[0168] Также предложены полипептиды, которые содержат полипептид, имеющий по меньшей мере около 90% идентичности последовательности с SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5. В некоторых вариантах реализации изобретения, полипептид содержит полипептид, имеющий по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98%, или по меньшей мере около 99% идентичности последовательности с SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5 Таким образом, в некоторых вариантах осуществления полипептид включает (a) полипептид, имеющий по меньшей мере около 95% идентичности последовательности с SEQ ID NO: 3 и/или (b) полипептид, имеющий по меньшей мере около 95% идентичности последовательности с SEQ ID NO: 4 или SEQ ID NO: 5. В некоторых вариантах реализации изобретения, полипептид включает (а) полипептид, имеющий аминокислотную последовательность SEQ ID NO: 3; и/или (б) полипептид, имеющий аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 5. В некоторых вариантах реализации изобретения, полипептид представляет собой антитело, и/или полипептид специфически связывается с FOLR1. В некоторых вариантах реализации изобретения, полипептид представляет собой мышиное, химерное или гуманизированное антитело, которое специфически связывается с FOLR1. В некоторых вариантах реализации изобретения, полипептид, имеющий определенный процент идентичности последовательности с SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5, отличается от SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5 консервативными аминокислотыми замещениями только.
[0169] Полипептиды могут содержать одну из отдельных легких цепей или тяжелых цепей, описанных в данном документе. Антитела и полипептиды могут также содержать как легкую цепь, так и тяжелую цепь.
[0170] Моноклональные антитела могут быть получены с использованием гибридомных методов, таких как описанные Kohler и Milstein в (1975) Nature 256:495. Используя метод гибридомы, мышь, хомяк или другое подходящее животное-хозяин иммунизируют, как описано выше, чтобы вызвать продуцирование лимфоцитами антител, которые будут специфически связываться с иммунизирующим антигеном. Лимфоциты также могут быть иммунизированы in vitro. После иммунизации лимфоциты выделяют и сливают с подходящей клеточной линией миеломы, используя, например, полиэтиленгликоль, для образования гибридомных клеток, которые затем могут быть выбраны из неслитых лимфоцитов и клеток миеломы. Гибридомы, которые продуцируют моноклональные антитела, направленные специфически против выбранного антигена, как определено путем иммунопреципитации, иммуноблоттинга или путем анализа связывания in vitro (например, радиоиммуноанализа (RIA), иммуноферментного анализа с ферментным связыванием (ИФА)), могут затем размножаться либо в культуре in vitro, используя принятые методы (Goding, Monoclonal Antibodies:Principles и Practice, Academic Press, 1986) или in vivo как асцитные опухоли у животного. Моноклональные антитела затем могут быть очищены от культуральной среды или асцитной жидкости, как описано для поликлональных антител выше.
[0171] Альтернативно, моноклональные антитела также могут быть получены с использованием рекомбинантных методов ДНК, как описано в патенте США 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или клеток гибридомы, так как посредством RT-PCR с использованием олигонуклеотидных праймеров, которые специфически амплифицируют гены, кодирующие тяжелые и легкие цепи антитело и последовательности определяется принятыми методами. Выделенные полинуклеотиды, кодирующие тяжелые и легкие цепи, затем клонируют в пригодные векторы экспрессии, которые при трансфекции в клетки-хозяева, такие как клетки E. coli, клетки COS обезьян, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, моноклональные антитела генерируются клетками-хозяевами. Кроме того, рекомбинантные моноклональные антитела или их фрагменты из желаемых видов могут быть выделены из библиотек отображений фагов, экспрессирующих CDR желаемых видов, как описано в (McCafferty et al., 1990, Nature, 348:552-554; Clackson et al., 1991, Nature, 352:624-628; и Marks et al., 1991, J. Mol. Biol., 222:581-597).
[0172] Полинуклеотид(ы), кодирующий моноклональное антитело, можно дополнительно модифицировать несколькими различными способами, используя рекомбинантную технологию ДНК для генерации альтернативных антител. В некоторых вариантах реализации изобретения константные домены легкой и тяжелой цепей, например мышиного моноклонального антитела, могут быть замещены 1) для тех областей, например, человеческого антитела с образованием химерного антитела или 2) для неиммуноглобулинового полипептида для генерации слитое антитело. В некоторых вариантах реализации изобретения константные области усекаются или удаляются для получения желаемого фрагмента антитела моноклонального антитела. Для оптимизации специфичности, аффинности и т.д. моноклонального антитела можно использовать высокой плотности сайт-направленный мутагенез вариабельной области.
[0173] В некоторых вариантах реализации изобретения моноклональное антитело против человеческого FOLR1 представляет собой гуманизированное антитело. В некоторых вариантах реализации изобретения гуманизированное антитело представляет собой антитело с измененной поверхностью. В некоторых вариантах реализации изобретения, такие антитела используются терапевтически для снижения антигенности и ответа HAMA (человеческого антимышиного антитела) при введении человеку. Гуманизированные антитела могут быть получены с использованием различных методов, известных в данной области техники. В некоторых вариантах реализации изобретения анти-FOLR1 антитело является человеческим антителом.
[0174] Антитела человека могут быть непосредственно получены с использованием различных методов, известных в данной области техники. Иммортализованные человеческие В-лимфоциты, иммунизированные in vitro или выделенные из иммунизированного индивидуума, которые продуцируют антитело, направленное против целевого антигена, могут быть получены (см., например, Cole et al., Monoclonal Antibodies и Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., 1991, J. Immunol., 147 (1):86-95; и патент США 5750373). Кроме того, человеческое антитело может быть выбрано из фаговой библиотеки, где данная фаговая библиотека экспрессирует человеческие антитела, как описано, например, в Vaughan et al., 1996, Nat. Biotech., 14:309-314, Sheets et al., 1998, Proc. Nat’l. Acad. Sci., 95:6157-6162, Hoogenboom и Winter, 1991, J. Mol. Biol. , 227:381 и Marks et al., 1991, J. Mol. Biol., 222:581). Способы получения и использования фаговых библиотек антител также описаны в патентах США№5969108, 6172197, 5885793, 6521404; 6544731; 6555313; 6582915; 6593081; 6300064; 6653068; 6706484; и 7264963; и Rothe et al., 2007, J. Mol. Bio., doi:10. 1016/j. jmb. 2007. 12,018 (каждый из которых включен в полном объеме посредством ссылки)). Стратегии созревания аффинности и стратегии перетасовки цепей (Marks et al., 1992, Bio/Technology 10:779-783, включенный в полном объеме посредством ссылки) известны в данной области техники и могут быть использованы для получения высокоаффинных человеческих антител.
[0175] Гуманизированные антитела также могут быть получены у трансгенных мышей, содержащих локусы иммуноглобулина человека, которые способны при иммунизации продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенного иммуноглобулина. Данный подход описан в патентах США 5545807; 5545806; 5569825; 5625026; 5633425; и 5661016.
[0176] Полипептиды по данному изобретению могут быть рекомбинантными полипептидами, природными полипептидами или синтетическими полипептидами, содержащими антитело или его фрагмент против FOLR1 человека.
[0177] Полипептиды и аналоги можно дополнительно модифицировать, чтобы они содержали дополнительные химические фрагменты, которые обычно не являются частью белка. Данные дериватизированные фрагменты могут улучшить растворимость, биологическое время полужизни или абсорбцию белка. Данные фрагменты могут также уменьшать или устранять любые желаемые побочные эффекты белков и тому подобное. Обзор данных фрагментов можно найти в REMINGTON'S PHARMACEUTICAL SCIENCES, 20th ed., Mack Publishing Co., Истон, Пенсильвания (2000).
[0178] Способы, известные в данной области техники для очистки антител и других белков, также включают, например, такие, которые описаны в патентах США №2008/0312425, 2008/0177048 и 2009/0187005, каждый из которых включен в данное описание в полном объеме посредством ссылки.
[0179] Пригодные лекарственные средства или пролекарства известны в данной области техники. Лекарства или пролекарства могут представлять собой цитотоксические агенты. Цитотоксический агент, используемый в цитотоксическом конъюгате по данному изобретению, может быть любым соединением, которое приводит к гибели клетки или индуцирует гибель клеток или каким-то образом снижает жизнеспособность клеток и включает, например, майтанзиноид и майтанзиноидные аналогов.
[0180] Такие конъюгаты могут быть получены с использованием линкера для связывания лекарственного средства или пролекарства с антителом или функциональным эквивалентом. Пригодные линкеры хорошо известны в данной области техники и включают, например, дисульфидные группы, тиоэфирные группы, кислотоустойчивые группы, фотолабильные группы, пептидазные лабильные группы и эстеразные лабильные группы.
[0181] Лекарственное средство или пролекарство можно, например, связывать с анти-FOLR1 антителом или его фрагментом через дисульфидную связь. Молекула линкера или сшивающий агент содержит реакционноспособную химическую группу, которая может вступать в реакцию с анти-FOLR1 антителом или его фрагментом. Реакционноспособными химическими группами для реакции с клеточно-связывающим агентом могут быть N-сукцинимидиловые эфиры и N-сульфосукцинимидиловые эфиры. Кроме того, молекула линкера содержит реакционноспособную химическую группу, которая может представлять собой дитиопиридильную группу, которая может вступать в реакцию с лекарственным средством с образованием дисульфидной связи. Молекулы линкера включают, например, N-сукцинимидил 3-(2-пиридилдитио)пропионат (SPDP) (см., например, Carlsson et al., Biochem. J., 173:723-737 (1978)), N-сукцинимидил 4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США 4563304), N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноат(сульфо-SPDB) (см. публикацию патента США 20090274713), N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP) (см., например, CAS регистрационный номер 341498-08-6), 2-иминотиолан или ацетилсукциновый ангидрид. Например, антитело или клеточно-связывающий агент может быть модифицирован сшивающими реагентами и антитело или клеточно-связывающий агент, содержащий свободные или защищенные тиольные группы, полученные таким образом, затем вводят в реакцию с дисульфид- или тиолсодержащим майтанзиноидом для получения конъюгатов. Конъюгаты могут быть очищены с помощью хроматографии, включая, но не ограничиваясь этим, ВЭЖХ, эксклюзионную, адсорбционную, ионообменную и аффинный захват, диализ или тангенциальную поточную фильтрацию.
[0182] В другом аспекте данного изобретения анти-FOLR1 антитело связано с цитотоксическими лекарственными средствами через дисульфидные связи и спейсер полиэтиленгликоля для повышения активности, растворимости или эффективности иммуноконъюгата. Такие расщепляемые гидрофильные линкеры описаны в WO2009/0134976. Дополнительным преимуществом схемы данного линкера является желаемое высокое отношение мономеров и минимальная агрегация конъюгата антитело-лекарственное средство. В частности, в этом аспекте представлены конъюгаты клеточно-связывающих агентов и лекарственных средств, связанных через дисульфидную группу (-S-S-), несущую спейсер полипропиленгликоля ((CH2CH2O)n=1-14) с узким диапазоном содержания лекарственного средства, равного 2-8, которые показывают биологическую активность относительно высокой силы в отношении раковых клеток и имеют желаемые биохимические свойства с высоким выходом конъюгации и высоким соотношением мономеров с минимальной агрегацией белка.
[0183] Также могут быть получены конъюгаты антитело-майтанзиноид с нерасщепляемыми линкерами. Такие сшивающие средства описаны в данной области техники (см. публикацию патента США 20050169933) и включают, но не ограничиваются ими, N-сукцинимидил 4-(малеимидометил)циклогексанкарбоксилат (SMCC). В некоторых вариантах реализации изобретения антитело модифицируют сшивающими реагентами, такими как сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилат (SMCC), сульфо-SMCC, малеимидобензоил-N-гидроксисукцинимидный эфир (MBS), сульфо-MBS или сукцинимидил-иодацетат, как описано в литературе, для введения 1-10 реакционноспособных групп (Yoshitake et al., Eur. J. Biochem., 101:395-399 (1979); Hashida et al., J. Applied Biochem. ,56-63 (1984); и Liu et al., Biochem., 18:690-697 (1979)). Модифицированное антитело затем вводят в реакцию с тиолсодержащим майтанзиноидным производным с получением конъюгата. Конъюгат может быть очищен путем гель-фильтрации через колонку Sephadex G25 или путем диализа или тангенциальной поточной фильтрации. Модифицированные антитела обрабатывают тиолсодержащими конъюгатами майанзиноида (1-2 молярного эквивалента / малеимидная группа) и антитело-майтанзиноид очищают гель-фильтрацией через колонку Sephadex G-25, хроматографируют на колонке с керамическим гидроксиапатитом, диализом или тангенциальной поточной фильтрацией или их комбинацией. Как правило, связаны между собой 1-10 майтанзиноидов на антитело. Один из способов заключается в модификации антител сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилатом (SMCC) с целью введения малеимидных групп с последующей реакцией модифицированного антитела с тиолсодержащим майтанзиноидом с образованием тиоэфир-связанного конъюгата. Снова образуются конъюгаты с 1-10 молекулами лекарственного средства на молекулу антитела. Аналогичным образом изготавливаются конъюгаты майтанзиноидных антител, фрагментов антител и других белков.
[0184] В другом аспекте изобретения антитело FOLR1 связывается с лекарственным средством через нерасщепляемую связь посредством спейсера ПЭГ. Пригодные сшивающие реагенты, содержащие гидрофильные цепи ПЭГ, которые образуют линкер между лекарственным средством и анти-FOLR1 антителом- или фрагментом, также хорошо известны в данной области техники или коммерчески доступны (например, от Quanta Biodesign, Powell, Ohio). Пригодные ПЭГ-содержащие сшивающие средства также могут быть синтезированы из коммерчески доступных ПЭГ с использованием стандартных методов синтетической химии, известных специалистам в данной области техники. Лекарственные средства могут быть подвергнуты взаимодействию с бифункциональными ПЭГ-содержащими сшивающими средствами с получением соединений следующей формулы, Z -Xl-(-CH2-CH2-O-)n-Yp-D, способами, подробно описанными в публикации US 20090274713 и в WO2009/0134976, которые затем могут взаимодействовать с клеточно-связывающим агентом с получением конъюгата. Альтернативно, связывание с клеткой может быть модифицировано с помощью бифункционального сшивающего средства ПЭГ для введения тиол-реакционноспособной группы (такой как малеимид или галогенацетамид), которая затем может быть обработана тиолсодержащим майтанзиноидом для получения конъюгата. В другом способе связывание клеток может быть модифицировано с помощью бифункционального сшивающего средства ПЭГ, чтобы ввести тиольный фрагмент, который затем может быть обработан тиол-реакционноспособным майтанзиноидом (таким как майтанзиноид, несущий малеимид или галогенацетамид), для получения конъюгата.
[0185] Примеры пригодных ПЭГ-содержащих линкеров включают линкеры, содержащие сложный эфир N-сукцинимидилового эфира или фрагмент N-сульфосукцинимидилового эфира для реакции с анти-FOLR1 антителом или его фрагментом, а также фрагмент на основе малеимидо- или галогенацетила для реакции с данным соединением. ПЭГ спейсер может быть включен в любое сшивающее средство, известное в данной области техники, способами, описанными в данном документе.
[0186] В некоторых вариантах реализации изобретения линкер представляет собой линкер, содержащий по меньшей мере одну заряженную группу, как описано, например, в патенте США № 2012/0282282, содержание которого в полном обьеме включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения заряженными или прозаряженными поперечно-сшитыми линкерами являются те, которые содержат сульфонатные, фосфатные, карбоксильные или четвертичные аммониевые заместители, которые значительно увеличивают растворимость конъюгатов модифицированного клеточно-связывающего агента и клеточно-связывающего лекарственного средства, особенно для конъюгатов моноклональное антитело-лекарственное средство с от 2 до 20 лекарственными средствами / связанное антитело. Конъюгаты, полученные из линкеров, содержащих прозаряженный фрагмент, продуцируют один или более заряженных фрагментов после того, как конъюгат метаболизируется в клетке. В некоторых вариантах реализации изобретения линкер выбирают из группы, состоящей из: N-сукцинимидил-4-(2-пиридилдитио)-2-сульфопентаноата (сульфо-SPP) и N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноата (сульфо-SPDB).
[0187] Многие из описанных в данном документе линкеров подробно описаны в патентах США№ 2005/0169933, 2009/0274713, и 2012/0282282, и WO2009/0134976; содержание которого в полном обьеме включено в данный документ посредством ссылки.
[0188] Настоящее изобретение включает аспекты, в которых от около 2 до около 8 молекул лекарственного средства («содержание лекарственного средства»), например майтанзиноида, связаны с анти-FOLR1 антителом или его фрагментом "Содержание лекарственного средства", в контексте данного документа, относится к числу молекул лекарственного средства (например, майтанзиноида), которые могут быть присоединены к клеточно-связывающему агенту (например, антителу к FOLR1 или его фрагменту). В одном аспекте число молекул лекарственного средства, которые могут быть присоединены к клеточно-связывающему агенту, может составлять в среднем от около 2 до около 8 (например, 1. 9, 2.0, 2. 1, 2. 2, 2. 3, 2. 4, 2. 5, 2. 6, 2. 7, 2. 8, 2. 9, 3.0, 3. 1, 3. 2, 3. 3, 3. 4, 3. 5, 3. 6, 3. 7, 3. 8, 3. 9, 4.0, 4. 1, 4. 2, 4. 3, 4. 4, 4. 5, 4. 6, 4. 7, 4. 8, 4. 9, 5.0, 5. 1, 5. 2, 5. 3, 5. 4, 5. 5, 5. 6, 5. 7, 5. 8, 5. 9, 6.0, 6. 1, 6. 2, 6. 3, 6. 4, 6. 5, 6. 6, 6. 7, 6. 8, 6. 9, 7.0, 7. 1, 7. 2, 7. 3, 7. 4, 7. 5, 7. 6, 7. 7, 7. 8, 7. 9, 8.0, 8.1). Могут применяться N2’-деацетил-N2’-(3-меркапто-1-оксопропил)-майтанзин (DM1) и N2’-деацетил-N2’-(4-меркапто-4-метил-1-оксопентил) майтанзин (DM4).
[0189] Таким образом, в одном аспекте иммуноконъюгат содержит 1 майтанзиноид на антитело. В другом аспекте иммуноконъюгат содержит 2 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 3 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 4 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 5 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 6 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 7 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат содержит 8 майтанзиноидов на антитело.
[0190] В одном аспекте, иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 1 до около 8 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 2 до около 7 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 2 до около 6 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 2 до около 5 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 3 до около 5 майтанзиноидов на антитело. В другом аспекте иммуноконъюгат (например, иммуноконъюгат, содержащий линкер SPDB и майтанзиноид DM4) содержит около 3 до около 4 майтанзиноидов на антитело.
[0191] В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 2 до около 8 (например, 1. 9, 2.0, 2. 1, 2. 2, 2. 3, 2. 4, 2. 5, 2. 6, 2. 7, 2. 8, 2. 9, 3.0, 3. 1, 3. 2, 3. 3, 3. 4, 3. 5, 3. 6, 3. 7, 3. 8, 3. 9, 4.0, 4. 1, 4. 2, 4. 3, 4. 4, 4. 5, 4. 6, 4. 7, 4. 8, 4. 9, 5.0, 5. 1, 5. 2, 5. 3, 5. 4, 5. 5, 5. 6, 5. 7, 5. 8, 5. 9, 6.0, 6. 1, 6. 2, 6. 3, 6. 4, 6. 5, 6. 6, 6. 7, 6. 8, 6. 9, 7.0, 7. 1, 7. 2, 7. 3, 7. 4, 7. 5, 7. 6, 7. 7, 7. 8, 7. 9, 8.0, 8.1) молекул лекарственного средства (например, майтанзиноидов), прикрепленных к антителу. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 1 до около 8 молекул лекарственного средства (например, майтанзиноидов) на антитело. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 2 до около 7 молекул лекарственного средства (например, майтанзиноидов) на антитело. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 2 до около 6 молекул лекарственного средства (например, майтанзиноидов) на антитело. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 2 до около 5 молекул лекарственного средства (например, майтанзиноидов) на антитело. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 3 до около 5 молекул лекарственного средства (например, майтанзиноидов) на антитело. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 3 до около 4 молекул лекарственного средства (например, майтанзиноидов) на антитело.
[0192] В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 2±0,5, около 3±0,5, около 4±0,5, около 5±0,5, около 6±0,5, около 7±0,5 или около 8±0,5 молекул лекарственного средства (например, майтанзиноидов), прикрепленных к антителу. В одном аспекте композиция, содержащая иммуноконъюгаты, имеет в среднем около 3,5±0,5 молекул лекарственного средства (например, майтанзиноидов) на антитело.
[0193] Анти-FOLR1 антитело или его фрагмент можно модифицировать реакцией бифункционального сшивающего реагента с анти-FOLR1 антителом или его фрагментом, приводя таким образом к ковалентному присоединению молекулы линкера к антителу к FOLR1 или его фрагменту. В контексте данного документа, «бифункциональный сшивающий реагент» представляет собой любой химический фрагмент, который ковалентно связывает клеточно-связывающий агент с лекарственным средством, таким как лекарственные средства, описанные в данном документе. В другом способе часть линкерного фрагмента обеспечивается лекарственным средством. В этом отношении лекарственное средство содержит связывающий фрагмент, который является частью большей молекулы линкера, которая применяется для присоединения клеточно-связывающего агента к лекарственному средству. Например, для образования майтанзиноида DM1 боковая цепь в гидроксильной группе C-3 майтанзина модифицирована с образованием свободной сульфгидрильной группы (SH). Данная тиолированная форма майтанзина может взаимодействовать с модифицированным клеточно-связывающим агентом с образованием конъюгата. Поэтому конечный линкер собирается из двух компонентов, один из которых обеспечивается сшивающим реагентом, а другой обеспечивается боковой цепью из DM1.
[0194] Молекулы лекарственного средства также могут быть связаны с молекулами антитела через промежуточную молекулу-носитель, такую как сывороточный альбумин.
[0195] В контексте данного документа, выражение «связанный с клеточно-связывающим агентом» или «связанный с антителом к или фрагментом FOLR1» относится к молекуле конъюгата, содержащей по меньшей мере одно лекарственное производное, связанное с клеточно-связывающим агентом, анти-FOLR1 антителом, или фрагментом через пригодный линкер или его предшественник. Иллюстративными примерами линкеров являются SPDB или сульфо-SPDB.
[0196] В некоторых вариантах реализации изобретения, цитотоксическими агентами, пригодными в данном изобретении, являются майтанзиноиды и майтанзиноидные аналоги. Примеры пригодных майтанзиноидов включают сложные эфиры майтанзинола и аналоги майтанзинола. Включены любые лекарственные средства, которые ингибируют образование микротрубочек и которые являются высокотоксичными для клеток млекопитающих, такие как майтанзинол, а также аналоги майтанзинола .
[0197] Примеры пригодных эфиров майтанзинола включают такие, которые имеют модифицированное ароматическое кольцо, и такие, которые имеют модификации в других положениях. Такие пригодные майтанзиноиды описаны в патентах США № 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 5208020; 5416064; 5475092; 5585499; 5846545; 6333410; 7276497 и 7473796.
[0198] В некотором варианте реализации изобретения, в иммуноконъюгатах по данному изобретению применяют тиол-содержащий майтанзиноид (DM1), формально называемый N2’-деацетил-N2’-(3-меркапто-1-оксопропил)-майтанзином в качестве цитотоксического агента. DM1 представлен следующей структурной формулой (I):
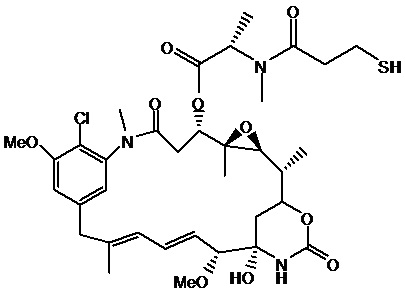 (I)
(I)
[0199] В другом варианте реализации изобретения, в конъюгатах по данному изобретению применяют тиол-содержащий майтанзиноид N2’-деацетил-N2’(4-метил-4-меркапто-1-оксопентил)-майтинзин (например, DM4) в виде цитотоксического агента. DM4 представлен следующей структурной формулой (II):
 (II)
(II)
[0200] Другой майтанзиноид, содержащий боковую цепь, которая содержит стерически затрудненную тиольную связь, представляет собой N2’-деацетил-N-2’(4-меркапто-1-оксопентил)-майтанзин (называемый DM3), представлен следующей структурной формулой (III):
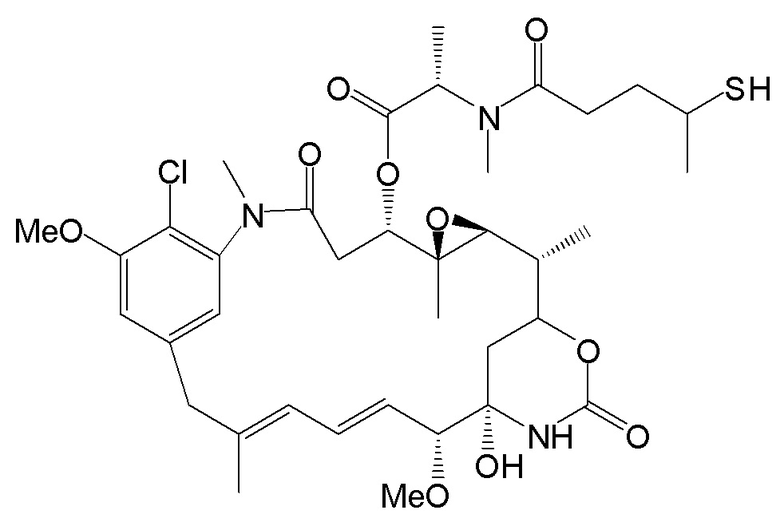 (III)
(III)
[0201] Каждый из майтанзиноидов, описанный в патенте США № 5208020 и 7276497, также может быть использован в конъюгате по данному изобретению. В этом отношении полное описание 5208020 и 7276697 включено в данный документ посредством ссылки.
[0202] Многие положений в майтанзиноиде могут служить в качестве положения для образования химической связи с линкерным фрагментом. Например, предполагается, что пригодными являются положение С-3, имеющее гидроксильную группу, положение С-14, модифицированное гидроксиметилом, положение С-15, модифицированное гидрокси-группой и С-20, имеющее гидрокси-группу. В некоторых вариантах реализации изобретения положение С-3 служит в качестве положения для химического связывания линкерного фрагмента и в некоторых конкретных вариантах реализации изобретения положение C-3 майтанзинола служит в качестве положения для химического связывания линкерного фрагмента.
[0203] Структурные представления некоторых конъюгатов приведены ниже:
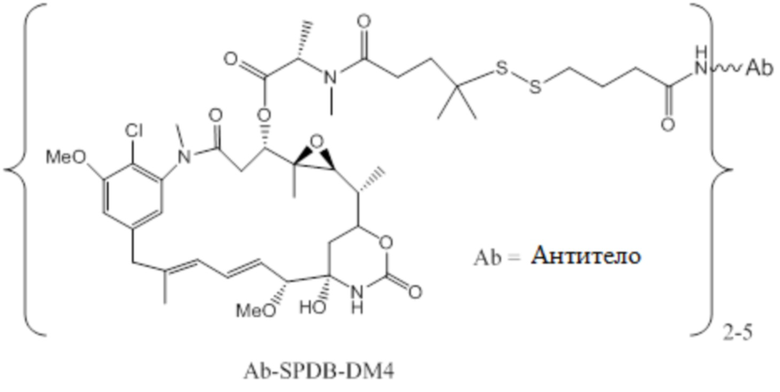 (IV)
(IV)
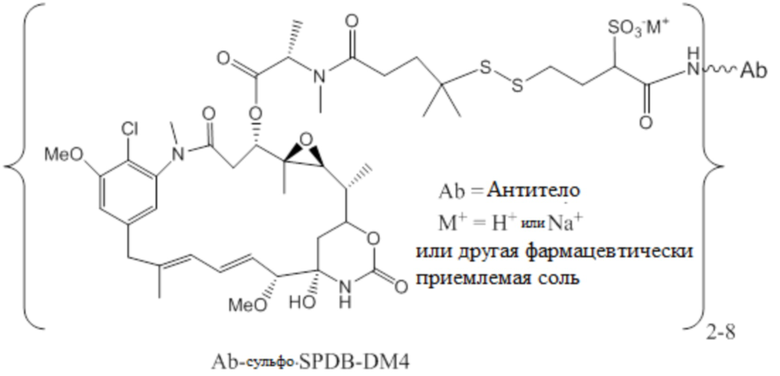 (V)
(V)
 (VI)
(VI)
 (VII)
(VII)
 (VIII)
(VIII)
 (IX)
(IX)
 (X)
(X)
 (XI)
(XI)
[0204] В данном изобретении также включены любые стереоизомеры и их смеси для любых соединений или конъюгатов, изображенных любыми структурами выше.
[0205] Несколько описаний для получения таких антител-майтанзиноидных конъюгатов приведены в патентах США № 6333410, 6441063, 6716821 и 7368565, каждый из которых включен в данный документ в полном объеме посредством ссылки.
[0206] В общем, раствор антитела в водном буфере можно инкубировать с молярным избытком майтанзиноидов, имеющих дисульфидный фрагмент, который несет реакционноспособную группу. Реакционную смесь можно гасить добавлением избытка амина (такого как этаноламин, таурин и т.д.). Конъюгат майтанзиноид-антитело затем может быть очищен гель-фильтрацией.
[0207] Среднее число молекул майанзиноида, связанное на молекулу антитела, можно определить, измеряя спектрофотометрически отношение оптической плотности при 252 нм и 280 нм. Среднее число молекул майтанзиноида/антитела может быть равно, например, 1-10 или 2-5. Среднее число молекул майтанзиноида/антитела может быть равно, например, от около 3 до около 4. Среднее число молекул майтанзиноида/антитела может быть равно около 3. 5.
[0208] Конъюгаты антител с майтанзиноидом или другими препаратами можно оценить по их способности подавлять пролиферацию различных нежелательных клеточных линий in vitro. Например, клеточные линии, такие как клеточная линия лимфомы человека Daudi и клеточная линия лимфомы человека Ramos, могут быть легко использованы для оценки цитотоксичности указанных соединений. Клетки, подлежащие оценке, могут подвергаться воздействию соединений в течение 4-5 дней и выжившие фракции клеток измеряли в анализах прямого связывания известными способами. Затем IC50 значения могут быть рассчитаны по результатам анализов.
[0209] Иммуноконъюгаты могут, в соответствии с некоторыми вариантами реализации изобретения, описанными в данном документе, быть интернализированными в клетки. Таким образом, иммуноконъюгат может оказывать терапевтический эффект, когда он поглощается или интернализирован клеткой, экспрессирующей FOLR1. В некоторых конкретных вариантах реализации изобретения, иммуноконъюгат содержит антитело, фрагмент антитела или полипептид, связанный с цитотоксическим агентом расщепляемым линкером и цитотоксическим агентом, отщепляемый от антитела, фрагмента антитела или полипептида, где он интернализируется клеткой, экспрессирующей FOLR1.
[0210] В некоторых вариантах реализации изобретения иммуноконъюгаты способны уменьшать объем опухоли. Например, в некоторых вариантах реализации изобретения, лечение иммуноконъюгатом приводит к значению %T/C, равному менее чем около 50%, менее чем около 45%, менее чем около 40%, менее чем около 35%, менее чем около 30%, менее чем около 25%, менее чем около 20%, менее чем около 15%, менее чем около 10%, или менее чем около 5%. В некоторых конкретных вариантах реализации изобретения, иммуноконъюгат может уменьшать размер опухоли в ксенотрансплантатной модели KB, OVCAR-3, IGROV-1 и/или OV-90. В некоторых вариантах реализации изобретения иммуноконъюгаты способны ингибировать метастаз.
III. Анти-ФРЭС агенты
[0211] В данном документе описаны способы введения иммуноконъюгатов антитела к FOLR1, таких как IMGN853, в комбинации с агентами, которые специфически связывают ФРЭС (например, Бевацизумаб) или рецептор ФРЭС. Анти-ФРЭС агенты включают, например, антитела к ФРЭС или антитела к рецептору ФРЭС (например, Бевацизумаб), ингибиторы тирозинкиназы (TKI) (например, Цедираниб) и растворимые рецепторы ФРЭС (например, ФРЭС-Trap). Анти-ФРЭС агенты известны в данной области техники, и некоторые примеры приведены в Meadows и Hurwitz, Cold Spring Harbor Perspectives in Medicine 2: a006577 (2012), которая включена в данный документ в полном объеме посредством ссылки.
[0212] В некоторых вариантах реализации изобретения, анти-ФРЭС агенты способны ингибировать рост опухоли. В некоторых вариантах реализации изобретения, анти-ФРЭС агенты способны ингибировать рост опухоли in vivo (например, в модели ксенотрансплантата мыши и/или человека, имеющего рак). В некоторых вариантах реализации изобретения, анти-ФРЭС агенты способны ингибировать ангиогенез.
[0213] В некоторых вариантах реализации изобретения, анти-ФРЭС агенты являютсяантителами к ФРЭС или к рецептору ФРЭС, или их антигенсвязывающим фрагментам.
[0214] Полноразмерные аминокислотные последовательности для ФРЭС-A человека предоставлены в UniProtKB с номером доступа. P15692 и в данном документе, как SEQ ID NO: 17:
[0215] MNFLLSWVHWSLALLLYLHHAKWSQAAPMAEGGGQNHHEVVKFMDVYQRSYCHPIETLVDIFQEYPDEIEYIFKPSCVPLMRCGGCCNDEGLECVPTEESNITMQIMRIKPHQGQHIGEMSFLQHNKCECRPKKDRARQEKKSVRGKGKGQKRKRKKSRYKSWSVYVGARCCLMPWSLPGPHPCGPCSERRKHLFVQDPQTCKCSCKNTDSRCKARQLELNERTCRCDKPRR (SEQ ID NO: 17), сигнальная последовательность которой представляет собой MNFLLSWVHWSLALLLYLHHAKWSQA (SEQ ID NO: 18).
[0216] Так, в некоторых вариантах реализации изобретения, антитело к ФРЭС или его антигенсвязывающий фрагмент связывается с эпитопом в SEQ ID NO: 17 или с эпитопом в зрелой версии SEQ ID NO: 17 (т. e. SEQ ID NO:17 без сигнальной последовательности).
[0217] Антитела к ФРЭС и их антигенсвязывающие фрагменты могут содержать полипептиды, содержащие вариабельные легкие цепи или вариабельные тяжелые цепи, описанные в данном документе. Антитела к ФРЭС и полипептиды могут также содержать как вариабельную легкую цепь, так и вариабельную тяжелую цепь. Антитела к ФРЭС и их вариабельные легкие цепи и вариабельные тяжелые цепи описаны в по меньшей мере патенте США. № 6884879; патенте США №6054297; патенте США. №7069901; патенте США№7365066; патенте США№7060269; патенте США№7622015; патенте США№8,778,340; и патенте США№7297334, все из которых включены в данное описание в полном объеме посредством ссылки.
[0218] В некоторых вариантах реализации изобретения антитело к ФРЭС представляет собой бевацизумаб, ABP 215 (Amgen), BCD-021 (Biocad) или ранибизумаб. В некоторых вариантах реализации изобретения антитело к ФРЭС представляет собой бевацизумаб, ABP 215 (Amgen) или BCD-021 (Biocad). В некоторых вариантах реализации изобретения антитело к ФРЭС представляет собой бевацизумаб.
[0219] В некоторых вариантах реализации изобретения антитело к рецептору ФРЭС или его антигенсвязывающий фрагмент связывается с рецептором ФРЭС-1, рецептором ФРЭС-2 или рецептором ФРЭС-3. В некоторых вариантах реализации изобретения антитело к рецептору ФРЭС или его антигенсвязывающий фрагмент связывается с рецептором ФРЭС-2. В некоторых вариантах реализации изобретения антитело к рецептору ФРЭС представляет собой рамуцирумаб.
[0220] В некоторых вариантах реализации изобретения, анти-ФРЭС агенты представляют собой ингибиторы тирозинкиназы. Ингибитор тирозинкиназы может ингибировать, например, рецептор ФРЭС-1, рецептор ФРЭС-2 и/или рецептор ФРЭС-3. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой цедираниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой пазопаниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой акситиниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой ваталаниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой семаксаниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой сунитиниб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой сорафениб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой рамуцирумаб. В некоторых вариантах реализации изобретения ингибитор тирозинкиназы представляет собой афлиберцепт.
[0221] В некоторых вариантах реализации изобретения, анти-ФРЭС агенты являются растворимыми белками рецепторов ФРЭС. Растворимые белки рецептора ФРЭС могут включать внеклеточный лигандсвязывающий домен рецептора ФРЭС-1. Растворимые белки рецептора ФРЭС могут включать внеклеточный лигандсвязывающий домен рецептора ФРЭС-2. Растворимые белки рецептора ФРЭС могут включать внеклеточный лигандсвязывающий домен рецептора ФРЭС-1 и рецептора ФРЭС-2. В некоторых вариантах реализации изобретения растворимый рецептор ФРЭС представляет собой ФРЭС-Trap (Aflibercept), слитый белок, объединяющий Fc-часть человеческого IgG1 с основными внеклеточными лиганд-связывающими доменами рецептора ФРЭС-1 и рецептора ФРЭС-2 человека.
IV. Агенты на основе платины
[0222] В данном документе описаны способы введения иммуноконъюгатов антитела к FOLR1, таких как IMGN853, в комбинации с агентами на основе платины, например, цисплатином, карбоплатином или оксалиплатином.
[0223] Цисплатин - представляет собой агент на основе алкилирующей химиотерапии на основе платины, который продуцирует аддукты ДНК и, следовательно, является цитотоксичным по отношению к клеткам, лишенным эксцизионной репарации (см. Huang et al., PNAS 91:10394-10398 (1994)). Цисплатин является исходным соединением для карбоплатина. Подобно цисплатину, карбоплатин продуцирует аддукты ДНК, которые являются цитотоксичными для клетки, лишенной эксцизионной репарации. Иллюстративные примеры цисплатинов включают Platinol и Platinol-AQ.
[0224] Карбоплатин считается терапевтическим эквивалентом цисплатина (проявляющий эффективность в тех же и дополнительных тканях по сравнению с цисплатином), но с гораздо отличающимся (лучшим) профилем токсичности (Lokich et al., Annals. Of Oncology 9:13-21 (1998)). Иллюстративные примеры карбоплатинов включают параплатин.
[0225] Оксалиплатин представляет собой препарат на основе платины третьего поколения. Иллюстративные примеры оксаплатинов включают Eloxatin®.
[0226] Введение агента на основе платины в комбинации с иммуноконъюгатом антитела к FOLR1 (например, IMGN853) может уменьшить количество и/или частоту приемов агента на основе платины, необходимых для достижения такой же эффективности, тем самым снижая токсичность терапии. Введение агента на основе платины в комбинации с иммуноконъюгатом антитела к FOLR1 (например, IMGN853) может также повысить эффективность терапии.
[0227] В некоторых вариантах реализации изобретения агент на основе платины представляет собой цисплатин, карбоплатин, или оксалиплатин. В некоторых вариантах реализации изобретения агент на основе платины представляет собой цисплатин или карбоплатин. В некоторых вариантах реализации изобретения агент на основе платины представляет собой цисплатин. В некоторых вариантах реализации изобретения агент на основе платины представляет собой карбоплатин.
V. Доксорубицин
[0228] В данном документе описаны способы введения иммуноконъюгатов антитела к FOLR1, таких как IMGN853, в комбинации с доксорубицином.
[0229] Доксорубицин является антрациклиновым антибиотическим химиотерапевтическим агентом, который связывает ДНК-ассоциированные ферменты, такие как топоизомеразы и могут интеркалировать пары оснований ДНК, тем самым создавая ряд цитотоксических эффектов с последующим апоптозом клетки (Tacar et al., J. of Pharmacy & Pharmacology, 65:157-170 (2013)).
[0230] В некоторых вариантах реализации изобретения доксорубицин является пегилированным. В некоторых вариантах реализации изобретения доксорубицин не является пегилированным.
[0231] В некоторых вариантах реализации изобретения доксорубицин является липосомальным. В некоторых вариантах реализации изобретения доксорубицин не является липосомальным.
[0232] В некоторых вариантах реализации изобретения доксорубицин является пегилированным, липосомальным доксорубицином.
[0233] Иллюстративные примеры доксорубицинов включают MYOCET® (Cephalon UK, Ltd.), DOX-NP (Avanti Polar Lipids, Inc.), CAELYX® (Janssen) и DOXIL® (Liposom Technology, Inc.).
[0234] Введение доксорубицина в комбинации с иммуноконъюгатом антитела к FOLR1 (например, IMGN853) может уменьшить количество и/или частоту приема доксорубицина, необходимые для достижения такой же эффективности, тем самым снижая токсичность терапии. Введение доксорубицина в комбинации с иммуноконъюгатом антитела к FOLR1 (например, IMGN853) может также повысить эффективность терапии.
VI. Фармацевтические композиции и наборы
[0235] В соответствии с данным документом, анти-FOLR1 иммуноконъюгаты (например, IMGN853) может применяться в комбинации с анти-ФРЭС агентами (например, бевацизумаб), агентом на основе платины и/или доксорубицином для лечения рака.
[0236] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент (например, бевацизумаб) содержатся в одной и той же фармацевтической композиции. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб) содержатся в двух отдельных фармацевтических композициях в одном наборе. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгата (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб). В других вариантах реализации изобретения набор содержит анти-ФРЭС агент (например, бевацизумаб) и инструкции для введения анти-ФРЭС агента (например, бевацизумаб) и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0237] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины содержатся в одной и той же фармацевтической композиции. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины содержатся в двух отдельных фармацевтических композициях в одном наборе. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853) и агента на основе платины. В других вариантах реализации изобретения набор содержит агент на основе платины и инструкции для введения агента на основе платины и иммуноконъюгата антитела к FOLR1 (например, IMGN853).
[0238] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин содержатся в одной и той же фармацевтической композиции. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин содержатся в двух отдельных фармацевтических композициях в одном наборе. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853) и доксорубицина. В других вариантах реализации изобретения набор содержит доксорубицин и инструкции для введения агента на основе платины и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0239] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853), анти-ФРЭС агент (например, бевацизумаб) и агент на основе платины содержатся в одной и той же фармацевтической композиции. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853), анти-ФРЭС агент (например, бевацизумаб) и агент на основе платины содержатся в двух или трех отдельных фармацевтических композициях в пределах одного набора.
[0240] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), анти-ФРЭС агента (например, бевацизумаб) и агента на основе платины. В других вариантах реализации изобретения набор содержит анти-ФРЭС агент (например, бевацизумаб) и инструкции для введения анти-ФРЭС агента (например, бевацизумаб), анти-FOLR1 иммуноконъюгата (например, IMGN853) и агента на основе платины. В других вариантах реализации изобретения набор содержит агент на основе платины и инструкции для введения агента на основе платины, анти-ФРЭС агента (например, бевацизумаб) и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0241] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент (например, бевацизумаб) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), анти-ФРЭС агента (например, бевацизумаб) и агента на основе платины. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), агента на основе платины и анти-ФРЭС агента (например, бевацизумаб). В других вариантах реализации изобретения набор содержит анти-ФРЭС агент (например, бевацизумаб) и агент на основе платины и инструкции для введения анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0242] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), анти-ФРЭС агента (например, бевацизумаб) и доксорубицина. В других вариантах реализации изобретения набор содержит анти-ФРЭС агент (например, бевацизумаб) и инструкции для введения анти-ФРЭС агента (например, бевацизумаб), анти-FOLR1 иммуноконъюгата (например, IMGN853) и доксорубицина. В других вариантах реализации изобретения набор содержит доксорубицин и инструкции для введения доксорубицина, анти-ФРЭС агента (например, бевацизумаб) и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0243] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент (например, бевацизумаб) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), анти-ФРЭС агента (например, бевацизумаб) и доксорубицина. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), доксорубицина и анти-ФРЭС агента (например, бевацизумаб). В других вариантах реализации изобретения набор содержит анти-ФРЭС агент (например, бевацизумаб) и доксорубицин и инструкции для введения анти-ФРЭС агента (например, бевацизумаб), доксорубицина и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0244] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), агента на основе платины и доксорубицина. В других вариантах реализации изобретения набор содержит агент на основе платины и инструкции для введения агента на основе платины, анти-FOLR1 иммуноконъюгата (например, IMGN853) и доксорубицина. В других вариантах реализации изобретения набор содержит доксорубицин и инструкции для введения доксорубицина, агента на основе платины и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0245] В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), агента на основе платины и доксорубицин. В других вариантах реализации изобретения набор содержит анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин и инструкции для введения анти-FOLR1 иммуноконъюгата (например, IMGN853), доксорубицина и агента на основе платины. В других вариантах реализации изобретения набор содержит агент на основе платины и доксорубицин и инструкции для введения агента на основе платины, доксорубицина и анти-FOLR1 иммуноконъюгата (например, IMGN853).
[0246] В некоторых вариантах реализации изобретения, предложенные в данном документе, фармацевтические композиции включают анти-FOLR1 иммуноконъюгат (например, IMGN853), анти-ФРЭС агент (например, бевацизумаб), агент на основе платины и/или доксорубицин и фармацевтически приемлемый носитель. В некоторых вариантах реализации изобретения, фармацевтические композиции дополнительно содержат консервант. Данные фармацевтические композиции находят применение в ингибировании роста опухоли и лечении рака у людей.
[0247] Фармацевтические композиции для применения по данному изобретению могут быть введены любым количеством способов для местного или системного лечения. Введение может быть местным, таким как трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки; ингаляционным (например, путем ингаляции или инсуффляции порошков или аэрозолей, в том числе распылением, интратрахеальным, интраназальным, эпидермальным и трансдермальным); пероральным; или парентеральным, включая внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; или внутричерепным (например, интратекальное или внутрижелудочковое) введение. В некоторых вариантах реализации изобретения фармацевтическая композиция составлена для внутривенного (в/в) введения. В некоторых вариантах реализации изобретения фармацевтическая композиция составлена для интраперитонеальное (и/п) введения.
VII. Способы применения
[0248] В соответствии с данным документом, анти-FOLR1 иммуноконъюгаты (например, IMGN853) могут быть применены в комбинации с анти-ФРЭС агентами (например, бевацизумаб), агентами на основе платины и/или доксорубицином для лечения рака.
VII. A. Выбор рака
[0249] Виды рака, которые можно лечить с помощью данных способов, включают, но не ограничиваются ими, новообразования, опухоли, метастазы или любое заболевание или расстройство, характеризующееся неконтролируемым ростом клеток. Рак может быть первичный или метастатический раком. Конкретные примеры видов рака, которые можно лечить с помощью способов, охватываемых данным изобретением, включают, но не ограничиваются ими, рак яичников, перитонеальный рак, рак фаллопиевой трубы, рак легкого, колоректальный рак, рак поджелудочной железы, рак печени, рак молочной железы, рак матки, рак непаренхиматозных клеток (почки), рак предстательной железы, рак желудочно-кишечного тракта, меланому, рак шейки матки, рак мочевого пузыря, глиобластому, рак эндометрия и рак головы и шеи.
[0250] Более конкретные примеры таких видов рака включают рак яичников, эпителиальный рак яичников, первичный перитонеальный рак яичника или рак фаллопиевой трубы яичников. В некоторых вариантах реализации изобретения пациент ранее не лечил рак яичников. В некотором варианте реализации изобретения, у субъекта недавно диагностировали, субъект ранее не лечил рак яичников (например, ранее не лечил с помощью антитела к ФРЭС, например, бевацизумаба ("не получавший лечения бевацизумабом")). В других вариантах реализации изобретения субъект ранее лечил рак яичников (например, ранее лечился антителомк ФРЭС, например, бевацизумабом). В некоторых вариантах реализации изобретения у субъекта недавно диагностировали, субъект ранее не лечил (например, ранее не лечил с помощью антитела к ФРЭС, например, бевацизумаба («не принимавший лечения бевацизумабом»)), со стадией III (суб-оптимально и макроскопически оптимально циторедуцированный) и IV стадией эпителиального рака яичников, первичным перитонеальным раком или раком фаллопиевых труб. В других вариантах реализации изобретения субъект ранее лечился от (например, ранее лечился с антителом к ФРЭС, например, бевацизумабом) III стадии (суб оптимально и макроскопически оптимально дебютировал) и IV стадии эпителиального рака яичников, первичного перитонеального рака или рака фаллопиевых труб. В некоторых вариантах реализации изобретения субъект болен чувствительным к препаратам платины рецидивирующим эпителиальным раком яичников, первичным перитонеальным раком или раком фаллопиевых труб. В других вариантах реализации изобретения субъект болен устойчивым к препаратам платины рецидивирующим эпителиальным раком яичников, первичным перитонеальным раком или раком фаллопиевых труб.
[0251] В некоторых вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина у которого диагностировали или который болен раком яичников, эпителиальным раком яичников, первичным перитонеальным раком яичников, или рак фаллопиевых труб матки который не получил лечение антителом к ФРЭС, например, бевацизумабом ("не получавший лечение бевацизумабом"). В других вариантах реализации изобретения комбинацию иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина дают пациенту у которого диагностировали или который болен раком яичников, эпителиальным раком яичников, первичным перитонеальным раком яичников, или рак фаллопиевых труб матки, который получил лечение антителом к ФРЭС, например, бевацизумабом. В некоторых аспектах вышеуказанных вариантов реализации изобретения рак является устойчивым к платине, чувствительным к платине, чувствительным к платине рекуррентным, устойчивым к платине рекуррентным, невосприимчивым к лечению препаратами платины, первичным, невосприимчивым к лечению препаратами платины или рецидивирующим.
[0252] Комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может быть введена пациенту, который ранее не лечился бевацизумабом. В некоторых вариантах реализации изобретения бевацизумаб вводили в качестве единственного агента в предыдущем лечении. В некоторых вариантах реализации изобретениям бевацизумаб вводили в составе комбинированной терапии в предыдущем лечении.
[0253] Комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может быть введена пациенту, который ранее не лечился бевацизумабом (т.e. пациент является "не получавшим лечения бевацизумабом").
[0254] В некоторых вариантах реализации изобретения, рак представляет собой рак яичников, перитонеальный, фаллопиевых труб, эндометрия или рак легких. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в рак яичников, перитонеальный, фаллопиевых труб, эндометрия или рак легких в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в рак яичников, перитонеальный, фаллопиевых труб, эндометрия или рак легких в качестве адъювантной терапии или неоадъювантной терапии.
[0255] В некоторых вариантах реализации изобретения, рак представляет собой рак яичников. В некоторых вариантах реализации изобретения, рак яичников представляет собой эпителиальный рак яичников (EOC). В некоторых вариантах реализации изобретения, рак яичников (например, EOC) является устойчивым к препаратам платины, рецидивирующим или резистентным. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в EOC, например, EOC устойчивый к препаратам платины, рецидивирующий или резистентный, в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в EOC, например, устойчивый к препаратам платины EOC, рецидивирующий или резистентный, в качестве адъювантной терапии или неоадъювантной терапии.
[0256] В некоторых вариантах реализации изобретения, рак представляет собой перитонеальный рак. В некоторых вариантах реализации изобретения, перитонеальный рак представляет собой первичный перитонеальный рак. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в первичный перитонеальный рак в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в первичный перитонеальный рак в качестве адъювантной терапии или неоадъювантной терапии.
[0257] В некоторых вариантах реализации изобретения, рак представляет собой рак эндометрия. В некоторых вариантах реализации изобретения, рак эндометрия представляет собой серозный рак эндометрия. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в серозный рак эндометрия в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в серозный рак эндометрия в качестве адъювантной терапии или неоадъювантной терапии.
[0258] В некоторых вариантах реализации изобретения, рак представляет собой рак легкого. В некоторых вариантах реализации изобретения, рак легких представляет собой немелкоклеточный рак легкого (НМРЛ). В некоторых вариантах реализации изобретения, рак легких представляет собой аденокарциному или бронхиолальвеолярную карциному. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в рак легких, например, НМРЛ, аденокарциному или бронхиолальвеолярную карциному в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введен в рак легких, например, НМРЛ, аденокарциному или бронхиолальвеолярную карциному в качестве адъювантной терапии или неоадъювантной терапии.
[0259] В некоторых вариантах реализации изобретения, рак является невосприимчивым к лечению препаратами платины. В некоторых вариантах реализации изобретения, рак является первичным, невосприимчивым к лечению препаратами платины. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в рак, невосприимчивым к лечению препаратами платины, или первичный рак, невосприимчивым к лечению препаратами платины, в качестве терапии первой линии, терапии второй линии, терапия третьей линии или четвертой или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в рак, невосприимчивым к лечению препаратами платины или первичный рак, невосприимчивым к лечению препаратами платины в качестве адъювантной терапии или неоадъювантной терапии.
[0260] В некоторых вариантах реализации изобретения, рак является чувствительным к препаратам платины. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в чувствительный к препаратам платины рак в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой, или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в чувствительный к препаратам платины рак в качестве адъювантной терапии или неоадъювантной терапии.
[0261] В некоторых вариантах реализации изобретения, рак представляет собой метастатический или прогрессирующий рак. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины, и/или доксорубицина может быть введен в метастатический или прогрессирующий рак в качестве терапии первой линии, терапии второй линии, терапии третьей линии или четвертой или более высокого номера линии терапии. Комбинация иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина может быть введена в метастатический или прогрессирующий рак в качестве адъювантной терапии или неоадъювантной терапии.
[0262] Введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии «второй линии» включает введение, в котором терапия первой линии представляла собой, например, введение единственного агента, введение комбинации агентов, хирургической операции, облучение или их комбинации.
[0263] Введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии "третьей линии" включает введение, в котором терапия первой линии представляла собой, например, введение единственного агента, введение комбинации агентов, хирургическую операцию, облучение или их комбинацию и при том. что терапия второй линии представляла собой, например, введение единственного агента, введение комбинации агентов, хирургическую операцию, облучение или их комбинацию. Так, введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии "третьей линии" также включает, например, введение, следующее за терапией первой линии, которая представляла собой введение единственного агента, и терапии второй линии, которая представляла собой введение комбинации агентов. Введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии "третьей линии" также включает, например, введение, следующее за терапией первой линии, которое представляло собой введение комбинации агентов, и терапии второй линии, которая представляла собой введение единственного агента. Введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии "третьей линии" также включает, например, введение, следующее за терапией первой линии, которое представляло собой введение комбинации агентов, и терапии второй линии, которая представляла собой введение комбинации агентов. Введение комбинации иммуноконъюгатов антитела к FOLR1 (например, IMGN853) и анти-ФРЭС агента (например, бевацизумаб), агента на основе платины и/или доксорубицина в качестве терапии "третьей линии" также включает, например, введение, следующее за терапией первой линии, которое представляло собой введение комбинации агентов и хирургическую операцию, и терапии второй линии, которая представляла собой введение комбинации агентов.
[0264] В некоторых вариантах реализации изобретения рак представляет собой рак, который экспрессирует FOLR1 (полипептид или нуклеиновая кислота). В некоторых вариантах реализации изобретения комбинация анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина вводят больному с повышенным уровнем экспрессии FOLR1, например, как описано в опубликованной заявке на патент США №2012/0282175 или международной опубликованной заявке №WO 2012/135675, обе из которых включены в данный документ в полном объеме посредством ссылки. Иллюстративные примеры антител, анализы и наборы для обнаружения FOLR1 приведены в WO 2014/036495 и WO 2015/031815, оба из которых включены в данный документ в полном объеме посредством ссылки. Таким образом, в некоторых вариантах реализации изобретения экспрессию белка FOLR1 замеряют с помощью иммуногистохимии (ИГХ) и с учетом показателя интенсивности окрашивания и/или показателя однородности окрашивания путем сравнения с контрольными (например, калиброванными контрольными средствами), имеющими определенные показатели (например, показатель интенсивности 3 дается испытуемому образцу, если интенсивность сравнима с калиброванным контролем уровня 3 или интенсивность 2 (умеренный) дается испытуемому образцу, если интенсивность сравнима с калиброванным уровнем 2). Однородность окрашивания (то есть, по меньшей мере 25% и менее чем 75% клеток окрашивается) или «гомогенная» (т. е. по меньшей мере 75% клеток окрашивается) вместо «фокальной» (т.е. более чем 0 % и менее чем 25% окрашенных клеток) также свидетельствует об увеличении экспрессии FOLR1. Интенсивность окрашивания и показатели однородности окрашивания могут быть использованы в монотерапии или в комбинации (например, 2 гомо, 2 гетеро, 3 гомо, 3 гетеро, и т.д.). В другом примере увеличение экспрессии FOLR1 может быть определено путем обнаружения увеличения по меньшей мере в 2 раза, по меньшей мере в 3 раза или по меньшей мере в 5 раз) относительно контрольных значений (например, уровень экспрессии в ткани или клетки у субъекта без рака или с раком, который не имеет повышенных значений FOLR1). В некоторых вариантах реализации изобретения показатель однородности окрашивания основан на проценте окрашенных клеток.
[0265] В некоторых вариантах реализации изобретения рак представляет собой рак, который экспрессирует FOLR1 на уровне 1 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак, который экспрессирует FOLR1 на уровне 2 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак, который экспрессирует FOLR1 на уровне 3 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак легких, который экспрессирует FOLR1 на уровне 2 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак легких, который экспрессирует FOLR1 на уровне 3 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак яичников, который экспрессирует FOLR1 на уровне 2 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак яичников, который экспрессирует FOLR1 на уровне 3 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой рак эндометрия, который экспрессирует FOLR1 на уровне 2 гетеро или выше по ИГХ. В некоторых вариантах реализации изобретения рак представляет собой эндометриоидный рак, который экспрессирует FOLR1 на уровне 1 гетеро или выше по ИГХ.
[0266] В некоторых вариантах реализации изобретения по меньшей мере одна клетка в образце, полученном от пациента, имеет FOLR1 показатель равный по меньшей мере 1. В некоторых вариантах реализации изобретения по меньшей мере одна клетка в образце, полученном от пациента, имеет FOLR1 показатель равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения по меньшей мере одна клетка в образце, полученном от пациента, имеет FOLR1 показатель равный по меньшей мере 3.
[0267] В некоторых вариантах реализации изобретения по меньшей мере 25% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания равный по меньшей мере 1. В некоторых вариантах реализации изобретения по меньшей мере 33% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 1. В некоторых вариантах реализации изобретения по меньшей мере 50% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 1. В некоторых вариантах реализации изобретения по меньшей мере 66% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 1. В некоторых вариантах реализации изобретения по меньшей мере 75% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 1.
[0268] В некоторых вариантах реализации изобретения по меньшей мере 25% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения по меньшей мере 33% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения 25-75% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения по меньшей мере 50% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения по меньшей мере 66% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный). В некоторых вариантах реализации изобретения по меньшей мере 75% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 2 (умеренный).
[0269] В некоторых вариантах реализации изобретения по меньшей мере 25% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 3. В некоторых вариантах реализации изобретения по меньшей мере 33% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 3. В некоторых вариантах реализации изобретения по меньшей мере 50% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 3. В некоторых вариантах реализации изобретения по меньшей мере 66% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 3. В некоторых вариантах реализации изобретения по меньшей мере 75% клеток в образце, полученном от пациента, имеют FOLR1 имеет ИГХ показатель окрашивания, равный по меньшей мере 3.
[0270] В некоторых вариантах реализации изобретения, иммунологическое обнаружение (с помощью иммуногистохимии) FOLR1 оценивается с использованием H-показателей. H-показатели объединяют показатели интенсивности окрашивания (например, показатель от 0 до 3, где 0 не представляет никакого окрашивания, а 3 представляет собой сильное окрашивание) с процентным соотношением клеток, которые являются положительными для окрашивания мембран (то есть однородности). H-показатель может быть рассчитан следующим образом:
H показатель = [0*(процент окрашенных клеток при интенсивности 0)] + [1*(процент окрашенных клеток при интенсивности 1)] + [2*(процент окрашенных клеток при интенсивности 2)] + [3*(процент окрашенных клеток при интенсивности 3)]. Соответственно, H-показатель может находится в диапазоне от 0 (нет окрашивания клеточных мембран) до 300 (окрашивание всех клеточных мембран с интенсивностью 3).
VII. B. Дозирование
[0271] В соответствии с данным документом, анти-FOLR1 иммуноконъюгат (например, IMGN853) может быть введен в определенной дозе и/или с определенными временными интервалами. Введение анти-FOLR1 иммуноконъюгата (например, IMGN853) может быть, например, внутривенным или внутрибрюшинным. Предложены схемы приема препарата для анти-FOLR1 иммуноконъюгата (например, IMGN853), например, в WO 2014/186403, WO 2015/054400 и WO 2015/149018, каждая из которых включена в данный документ в полном объеме посредством ссылки.
[0272] Например, анти-FOLR1 иммуноконъюгат (например, IMGN853) может быть введен в дозе от около 0. 15 мг/кг до около 7 мг/кг, где килограммы веса тела приводятся к идеальной весу тела (IBW), сухому весу тела (LBW), площади поверхности тела (BSA), или скорректированной идеальному весу тела (AIBW). анти-FOLR1 иммуноконъюгат (например, IMGN853) также может быть введен в дозе от около 1 мг/кг до около 6 мг/кг IBW, LBW, BSA или AIBW. анти-FOLR1 иммуноконъюгат (например, IMGN853) также может быть введен в дозе от около 3 мг/кг до около 6 мг/кг IBW, LBW, BSA или AIBW. анти-FOLR1 иммуноконъюгат (например, IMGN853) также может быть введен, используя фракционированное дозирование.
[0273] анти-FOLR1 иммуноконъюгат (например, IMGN853) может быть введен в дозе от около 0. 15 мг/кг до около 7 мг/кг на основании суммарной весу тела (TBW). анти-FOLR1 иммуноконъюгат (например, IMGN853) также может быть введен в дозе от около 1 мг/кг до около 6 мг/кг TBW. анти-FOLR1 иммуноконъюгат (например, IMGN853) также может быть введен в дозе от около 3 мг/кг до около 6 мг/кг TBW.
[0274] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0275] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0276] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели в дозе около 2,0 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели в дозе около 2,5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели в дозе около 3 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели в дозе около 3,5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые две недели в дозе около 4 мг/кг AIBW.
[0277] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят еженедельно. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждую неделю в дозе около 1,1 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждую неделю в дозе около 1,8 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждую неделю в дозе около 2,0 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждую неделю в дозе около 2,5 мг/кг AIBW.
[0278] В некоторых вариантах реализации изобретения анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят один раз в неделю в течение трех недель по четырехнедельной схеме (например, в дни 1, 8 и 15 из 28-дневного цикла).
[0279] В соответствии с данным документом, анти-ФРЭС агент может быть введен в определенной дозе и/или с определенными временными интервалами. Агент антител к ФРЭС (например, бевацизумаб) также может быть введен, используя фракционированное дозирование. Введение анти-ФРЭС агента (например, бевацизумаб) может быть, например, внутривенным.
[0280] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла).
[0281] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят в дозе около 15 мг/кг. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят в дозе около 10 мг/кг. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят в дозе около 7,5 мг/кг.
[0282] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят дважды каждые четыре недели в дозе около 10 мг/кг каждый раз. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 7,5 мг/кг.
[0283] В некоторых вариантах реализации изобретения анти-ФРЭС агент представляет собой растворимый рецептор ФРЭС, такой как ФРЭС-TRAP. В некоторых вариантах реализации изобретения анти-ФРЭС агент, такой как ФРЭС-TRAP, вводят каждые две недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент, такой как ФРЭС-TRAP, вводят в дозе около 4 мг/кг. В некоторых вариантах реализации изобретения анти-ФРЭС агент, такой как ФРЭС-TRAP, вводят каждые две недели в дозе около 4 мг/кг.
[0284] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0285] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0286] В соответствии с данным документом, агент на основе платины может быть введен в определенной дозе и/или с определенными временными интервалами. Введение агента на основе платины может быть, например, внутривенным. Данный агент на основе платины может представлять собой, например, карбоплатин или цисплатин.
[0287] В соответствии с данным документом, карбоплатин может быть введен в определенной дозе и/или с определенными временными интервалами. Введение карбоплатина может быть, например, внутривенным.
[0288] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели.
[0289] Можно использовать формулу для расчета дозировки, основанную на скорости клубочковой фильтрации пациента (СКФ в мл/мин) и целевой площади под фармакокинетической кривой для инъекции карбоплатина во времени (AUC в мг/мл· мин): Суммарная доза (мг) = (целевая AUC) × (СКФ + 25).
[0290] В некоторых вариантах реализации изобретения карбоплатин вводят в дозе, которая вызывает AUC, равную 4 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят в дозе, которая вызывает AUC, равную 5 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят в дозе, которая вызывает AUC, равную 6 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят в дозе, которая вызывает AUC, равную 7 мг/мл·мин.
[0291] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин.
[0292] В некоторых вариантах реализации изобретения карбоплатин вводят каждые четыре недели.
[0293] В некоторых вариантах реализации изобретения карбоплатин вводят в дозе 360 мг/м2. В некоторых вариантах реализации изобретения карбоплатин вводят в дозе около 300 мг/м2.
[0294] В некоторых вариантах реализации изобретения карбоплатин вводят каждые четыре недели в дозе 360 мг/м2. В некоторых вариантах реализации изобретения карбоплатин вводят каждые четыре недели в дозе около 300 мг/м2.
[0295] В соответствии с данным документом, цисплатин может быть введен в определенной дозе и/или с определенными временными интервалами. Введение цисплатина может быть, например, внутривенным.
[0296] В некоторых вариантах реализации изобретения цисплатин вводят каждые четыре недели. В некоторых вариантах реализации изобретения цисплатин вводят каждые три недели.
[0297] В некоторых вариантах реализации изобретения цисплатин вводят в дозе около 100 мг/м2. В некоторых вариантах реализации изобретения цисплатин вводят в дозе около 75-100 мг/м2. В некоторых вариантах реализации изобретения цисплатин вводят в дозе около 50-70 мг/м2. В некоторых вариантах реализации изобретения цисплатин вводят в дозе около 20 мг/м2.
[0298] В некоторых вариантах реализации изобретения цисплатин вводят каждые четыре недели в дозе около 100 мг/м2. В некоторых вариантах реализации изобретения цисплатин вводят каждые четыре недели в дозе около 75-100 мг/м2.
[0299] В некоторых вариантах реализации изобретения цисплатин вводят каждые три недели в дозе около 50-70 мг/м2.
[0300] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0301] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0302] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин. и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0303] В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0304] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0305] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0306] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0307] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые три недели в дозе около 15 мг/кг, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые три недели в дозе около 6 мг/кг AIBW.
[0308] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 4 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0309] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 5 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0310] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 6 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0311] В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения анти-ФРЭС агент (например, бевацизумаб) вводят каждые две недели в дозе около 10 мг/кг или около 7,5 мг/кг или вводят дважды каждые четыре недели (например, в дни 1 и 15 из 28-дневного цикла) в дозе около 10 мг/кг каждый раз, карбоплатин вводят каждые три недели в дозе, которая вызывает AUC, равную 7 мг/мл·мин, и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0312] В соответствии с данным документом, доксорубицин может быть введен в определенной дозе и/или с определенными временными интервалами. Введение доксорубицина (например, пегилированный липосомальный доксорубицин (PLD)) может быть, например, внутривенным.
[0313] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели.
[0314] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят в дозе около 30 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят в дозе около 35 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят в дозе около 40 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят в дозе около 45 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят в дозе около 50 мг/м2.
[0315] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 30 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 35 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 40 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 45 мг/м2. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 50 мг/м2.
[0316] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 30 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 30 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 30 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 30 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0317] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 35 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 35 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 35 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 35 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0318] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 40 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 40 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 40 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 40 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0319] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 45 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 45 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 45 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 45 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0320] В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 50 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 50 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 4 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 50 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 5 мг/кг AIBW. В некоторых вариантах реализации изобретения доксорубицин (например, PLD) вводят каждые четыре недели в дозе около 50 мг/м2 и анти-FOLR1 иммуноконъюгат (например, IMGN853) вводят каждые четыре недели в дозе около 6 мг/кг AIBW.
[0321] В одном случае, иммуноконъюгат, который связывается с FOLR1 (например, IMGN853), и анти-ФРЭС агент вводят одновременно. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент вводят в виде отдельных фармацевтических композиций. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент вводят в одной и той же фармацевтической композиции. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и анти-ФРЭС агент вводятся последовательно. В таких случаях агент на основе платины или доксорубицин может необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с анти-FOLR1 иммуноконъюгатом (например, IMGN853). Aгент на основе платины или доксорубицин может также необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с анти-ФРЭС агентом. Агент на основе платины или доксорубицин может также необязательно вводиться последовательно с анти-FOLR1 иммуноконъюгатом (например, IMGN853) и/или анти-ФРЭС агентом в любом порядке.
[0322] В одном случае, иммуноконъюгат, который связывается с FOLR1 (например, IMGN853), и агент на основе платины вводят одновременно. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины вводят в виде отдельных фармацевтических композиций. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины вводят в одной и той же фармацевтической композиции. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и агент на основе платины вводятся последовательно. В таких случаях анти-ФРЭС агент или доксорубицин может необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с анти-FOLR1 иммуноконъюгатом (например, IMGN853). Агент антител к ФРЭС или доксорубицин может также необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с агентом на основе платины. Агент антител к ФРЭС или доксорубицин может также необязательно вводиться последовательно с анти-FOLR1 иммуноконъюгатом (например, IMGN853) и/или агентом на основе платины.
[0323] В одном случае, иммуноконъюгат, который связывается с FOLR1 (например, , IMGN853) и доксорубицин вводят одновременно. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин вводят в виде отдельных фармацевтических композиций. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин вводят в одной и той же фармацевтической композиции. В одном случае, анти-FOLR1 иммуноконъюгат (например, IMGN853) и доксорубицин вводят последовательно. В таких случаях анти-ФРЭС агент или агент на основе платины может необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с анти-FOLR1 иммуноконъюгатом (например, IMGN853). Агент антител к ФРЭС или агент на основе платины может также необязательно вводиться одновременно (в той же фармацевтической композиции или отдельной фармацевтической композиции) с доксорубицином. Агент антител к ФРЭС или агент на основе платины может также необязательно вводиться последовательно с анти-FOLR1 иммуноконъюгатом (например, IMGN853) и/или доксорубицином.
VII. C. Оценка и мониторинг
[0324] В некоторых вариантах реализации изобретения, комбинация анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина пригодно для ингибирования роста опухоли. В некоторых вариантах реализации изобретения, комбинация анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина является пригодной для индуцирования дифференцировки опухолевых клеток. В некоторых вариантах реализации изобретения, комбинация анти-FOLR1 иммуноконъюгата (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина пригодна для уменьшения объема опухоли.
[0325] Например, в некоторых вариантах реализации изобретения, лечение комбинацией иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицин приводит к значению %T/C, равному менее чем около 50%, менее чем около 45%, менее чем около 40%, менее чем около 35%, менее чем около 30%, менее чем около 25%, менее чем около 20%, менее чем около 15%, менее чем около 10% или менее чем около 5%.
[0326] В некоторых конкретных вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может уменьшать размер опухоли ксенотрансплантатной модели рака яичников (например, эпителиального рака яичников) и/или рака легких. В некоторых конкретных вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может уменьшать размер опухоли ксенотрансплантатной модели ST088, OV90, и/или IGROV-1. В некоторых конкретных вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может уменьшать размер опухоли в ксенотрансплантатной модели H2110.
[0327] В некоторых вариантах реализации изобретения комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина способна ингибировать метастаз. В некоторых вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина может уменьшить онкогенность опухоли. Способы in vivo могут представлять собой способы применения.
[0328] В некоторых вариантах реализации изобретения, комбинация иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина вызывает синергический эффект. Например, комбинация анти-ФРЭС агента (например, бевацизумаб) и иммуноконъюгата FOLR1 (например, IMGN853) может являться синергичной в результате того, что анти-ФРЭС агент (например, бевацизумаб) увеличивает или потенцирует локализацию или активность опухоли IMGN853. Таким образом, в некоторых вариантах реализации изобретения, анти-ФРЭС агент (например, бевацизумаб) вводят до введения иммуноконъюгата FOLR1 (например, IMGN853).
[0329] В некоторых вариантах реализации изобретения, введение комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина не производит более сильной токсичности, чем введение анти-ФРЭС агента, агента на основе платины и/или доксорубицина. В некоторых вариантах реализации изобретения введение комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина не производит более сильной токсичности, чем введение анти-FOLR1 иммуноконъюгата. В некоторых вариантах реализации изобретения введение комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина не производит более сильной токсичности, чем введение как анти-FOLR1 иммуноконъюгата, так и анти-ФРЭС агента, агента на основе платины и/или доксорубицина.
[0330] Каждый из вышеперечисленных аспектов может дополнительно включать мониторинг субъекта на предмет рецидива рака. Мониторинг может быть выполнен, например, путем оценки выживаемости без прогрессирования (PFS), общей выживаемости (OS), частоты объективных ответа (ORR) полной ремиссии (ПР), частичной ремиссии (ЧР). В одном варианте реализации изобретения PFS оценивают после начала лечения. В некоторых вариантах реализации изобретения PFS продолжается примерно на около 1 месяц, 1,2 месяца, 2 месяца, 2,9 месяца, 3 месяца, 3,8 месяца, 4 месяца, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 1 год, около 2 лет, около 3 лет и т. д., по сравнению с контролем. В одном варианте реализации изобретения PFS продолжается от около 2,9 месяца до 3,8 месяца с режимом лечения, объединяющим иммуноконъюгат FOLR1 (например, IMGN853) и анти-ФРЭС агент, агент на основе платины и/или доксорубицин по сравнению с контролем. В одном варианте реализации изобретения PFS продолжается по меньшей мере на около 3,8 месяца с режимом лечения, объединяющим иммуноконъюгат FOLR1 (например, IMGN853) и анти-ФРЭС агент, агент на основе платины и/или доксорубицин по сравнению с контролем. В другом варианте реализации изобретения, PFS продолжается на около 2,3 месяца с режимом лечения, объединяющим иммуноконъюгат FOLR1 (например, IMGN853) и анти-ФРЭС агент, агент на основе платины и/или доксорубицин по сравнению с контролем. В одном варианте реализации изобретения PFS продолжается на около 6 месяцев с режимом лечения, объединяющим иммуноконъюгат FOLR1 (например, IMGN853) и анти-ФРЭС агент, агент на основе платины и/или доксорубицин по сравнению с контролем.
VII. D. Дополнительные способы лечения
[0331] Стероид может быть введен в дополнение к комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина. В некоторых вариантах реализации изобретения введение стероида в дополнение к комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина приводит к снижению головных болей по сравнению с введением только комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина.
[0332] Стероид может быть введен в то же время, что и иммуноконъюгат, до введения иммуноконъюгата, и/или после введения иммуноконъюгата. В некоторых вариантах реализации изобретения стероид вводят в течение около недели, около пяти дней, около трех дней, около двух дней или около одного дня или за 24 часа до введения иммуноконъюгата. В некоторых вариантах реализации изобретения стероид вводят в течение одного дня после введения иммуноконъюгата. В некоторых вариантах реализации изобретения стероид вводят несколько раз. В некоторых вариантах реализации изобретения стероид вводят за около одного дня до введения иммуноконъюгата и в тот же день, что и введение иммуноконъюгата. Стероид может быть введен любым путём, включая, например, местное, ингаляционное, пероральное, парентеральное или внутричерепное введение. В некоторых вариантах реализации изобретения введение является пероральным. В некоторых вариантах реализации изобретения введение является внутривенным. В некоторых вариантах реализации изобретения введение является, как пероральным, так и внутривенным.
[0333] В некоторых вариантах реализации изобретения стероид вводят в глазной капле. В некоторых вариантах реализации изобретения глазные капли не содержат консервантов, представляют собой смазывающие глазные капли.
[0334] Другой анальгетик или другое лекарство для профилактики или лечения головных болей также может быть введено в дополнение к комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина. Например, ацетаминофин и/или дефенгидрамин может быть введен в дополнение к комбинации иммуноконъюгата FOLR1 (например, IMGN853) и анти-ФРЭС агента, агента на основе платины и/или доксорубицина. Анальгетик может быть введен до, в то же время или после введения иммуноконъюгата и может быть введен любым подходящим путем введения. В некоторых вариантах реализации изобретения анальгетик вводят перорально.
[0335] Варианты реализации данного изобретения могут быть дополнительно определены со ссылкой на следующие неограничивающие примеры, которые подробно описывают получение определенных антител по данному изобретению и способов применения антител по данному изобретению. Специалистам в данной области техники будет очевидно, что многие модификации как материалов, так и способов могут быть реализованы на практике без отхода от объема данного описания.
Примеры
[0336] Понятно, что примеры и варианты реализации, описанные в данном документе, предназначены только для иллюстративных целей, и что различные модификации или изменения в свете этого будут предложены специалистам в данной области техники и должны быть включены в дух и область применения данной заявки
Пример 1
Комбинированная терапия IMGN853 + PLD более активна, чем монотерапия IMGN853 и монотерапия PLD в модели опухоли ST088 эпителиального рак яичников
[0337] Противоопухолевую активность IMGN853 оценивали как для монотерапии, так и в комбинации с пегилированным липосомальным доксорубицином (PLD) у самцов мышей SCID, несущих ксенотрансплантаты опухоли ST088 человеческого эпителиального рака яичников, полученного от пациента. Мыши CB17 SCID были отобраны в группы (n = 8 на группу) по объему опухоли и впоследствии получали дозы. Группы включали контрольную группу, получавшую дозу буфера препарата IMGN853 (носитель) («контроль» на Фиг.1), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 5 мг/кг один раз в семь дней (в неделю) в течение двух недель (QWx2) («IMGN853» на Фиг.1), группу, получавшую отдельно взятый агент PLD, который вводили в дозе 4 мг/кг QWx2 («PLD» на Фиг.1) и группу, получавшую комбинацию IMGN853 + PLD, которую вводили в дозе 5 мкг/кг QWx2 в комбинации IMGN853 с 4 мг/кг дозы QWx2 PLD («IMGN853 + PLD» на Фиг.1).
[0338] Объемы опухолей измеряли два раза в неделю в трех измерениях с помощью циркуля. Вес тела измеряли два раза в неделю в качестве показателя токсичности тестируемого агента. Активность оценивали, как описано в Bissery et al., Cancer Res. 51:4845-4852 (1991), на Фиг.1 изображены результаты.
[0339] IMGN853, введенный в дозе 5 мг/кг QWx2, был активен в качестве монотерапии (T/C 31%, 0/8 частичных ремиссий (ЧР) и 0/8 полных ремиссий (ПР)). Кроме того, монотерапия IMGN853 хорошо переносилась без заметной потери веса тела. PLD, введенный в дозе 4 мг/кг QWx2, также был активен в качестве монотерапии (T/C 21%, 0/8 PR и 0/8 CR). Монотерапия PLD привела к средней 19%-ной потере веса тела (BWL) с крайним упадком (дневная доза 15-го дня). Комбинация IMGN853 + PLD была в высокой степени активной и более активной, чем монотерапии IMGN853 и PLD (T/C 10%, 0/8 PR и 0/8 CR). Комбинированная терапия с IMGN853 и PLD привела к потере веса, которая была сопоставима с монотерапией PLD (с крайним упадком 16%). См. Фиг.1. Таким образом, комбинированная терапия с IMGN853 и PLD повышала эффективность без повышения токсичности.
Пример 2
Комбинированная терапия IMGN853 (5 мг/кг) + бевацизумаб более активна, чем монотерапия IMGN853 и монотерапия антителом бевацизумаба в модели опухоли рака яичника OV90
[0340] Противоопухолевую активность IMGN853 оценивали как для монотерапии, так и в комбинации с антителом к ФРЭС бевацизумаба у самцов мышей SCID, несущих ксенотрансплантаты OV90 серозной опухоли яичника. Мышей отбирали в группы (n = 6 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Группы включали контрольную группу, которая получала однократную дозу (1X) буфера препарата IMGN853 («носитель» на Фиг.2A), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 5 мг/кг 1X («IMGN853» на Фиг.2A), группу, получавшую отдельно взятый агент бевацизумаб, который вводили в дозе 5 мг/кг 1X («бевацизумаб» на Фиг.2А) и группу, получавшую комбинацию IMGN853 + бевацизумаб, которой вводили дозы 5 мг/кг 1X IMGN853 в комбинации с 5 мг/кг 1X бевацизумаба («IMGN853 + бевацизумаб» на Фиг.2A).
[0341] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko и Reynolds, Cancer Chemother. Pharmacol. 24:148-54 (1989)) Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.2A изображены результаты.
[0342] При 5 мг / кг однократная доза IMGN853 была активной в качестве монотерапии (T/C 36%, 1/5 CR и 0/5 выживших без опухолей (TFS)). При 5 мг/кг однократная доза бевацизумаба также была активной в качестве монотерапией (T/C 37%, 0/6 CR и 0/6 TFS). Комбинация IMGN853 + бевацизумаб (5 мг/кг каждого) была в высокой степени активной и более активной, чем монотерапия IMGN853 и монотерапия бевацизумабом (T/C 9%, 6/6 CR 1/6 TFS). См. Фиг.2A. Все способы лечения хорошо переносились без заметной потери веса тела, наблюдаемой в любой группе лечения. Таким образом, комбинированная терапия с IMGN853 и бевацизумабом повысила эффективность без повышения токсичности.
Пример 3
Комбинированная терапия IMGN853 (2,5 мг/кг) + бевацизумаб более активна, чем монотерапия IMGN853 и монотерапия бевацизумабом в модели опухоли рака яичника OV90
[0343] Противоопухолевую активность IMGN853 оценивали как для монотерапии, так и в комбинации с антителом к ФРЭС бевацизумаба у самцов мышей SCID, несущих ксенотрансплантаты OV90 серозной опухоли яичника. Мышей отбирали в группы (n = 6 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Группы включали контрольную группу, которая получала однократную дозу (1X) буфера препарата IMGN853 («носитель» на Фиг.2B), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 2,5 мг/кг 1X («IMGN853» на Фиг.2B), группу, получавшую отдельно взятый агет бевацизумаб, который вводили в дозе 5 мг/кг 1X («бевацизумаб» на Фиг.2B) и группу, которая получала комбинацию IMGN853 + бевацизумаб, которой вводили дозу 2,5 мг/кг 1X IMGN853 в комбинации с 5 мг/кг 1X бевацизумаба («IMGN853 + бевацизумаб " на Фиг.2B).
[0344] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.2B изображены результаты.
[0345] При 2,5 мг /кг однократная доза IMGN853 была активной в качестве монотерапии (T/C 36%, 0/6 CR и 0/6 TFS). При 5,0 мг/кг была активна однократная доза бевацизумаба (T/C 31%, 0/6 CR и 0/6 TFS). В качестве монотерапии бевацизумаб проявлял противоопухолевую активность сопоставимую с IMGN853 в указанных дозах; но ни индуцированное агентом ингибирование роста опухоли, ни регресс опухоли. В резком контрасте комбинация IMGN853 плюс бевацизумаб приводила к устойчивому регрессу опухоли у всех животных (Фиг.2B). Комбинация IMGN853 + бевацизумаб (2,5 мг/кг IMNG853 + 5 мг/кг бевацизумаб) была более активной, чем монотерапия IMGN853 и монотерапия бевацизумабом обе (T/C 17%, 6/6 CR и 0/6 TFS). См. Фиг.2B. Примечательно, что аналогичная комбинированное преимущество было достигнуто, когда доза IMGN853 была дополнительно уменьшена до 1,25 мг/кг (Фиг.3). Все способы лечения хорошо переносились без заметной потери веса тела, наблюдаемой в любой группе лечения. Таким образом, комбинированная терапия с IMGN853 и бевацизумабом повысила эффективность без повышения токсичности.
[0346] Затем были исследованы эффекты фракционированного дозирования бевацизумаба, при которых животным вводили бевацизумаб либо в виде однократной дозы 5 мг/кг, либо двух доз 2,5 мг/кг (QWx2), как в виде монотерапии, так и в комбинации с 3 мг/кг IMGN853 (Фиг.11А). Сплит-дозирование не влияло на эффективность бевацизумаба и аналогичные (умеренный) подавляющие эффекты роста наблюдались после лечения отдельно взятым агентом IMGN853. Воздействие обоих комбинированных режимов приводило к быстрой стабилизации опухоли и резким регрессам (до 38% в течение 10 дней после лечения), особенно в типологической группе IMGN853 плюс 5 мг/кг бевацизумаба, где двухкомпонентная терапия была лечебной для всех семи животных (Фиг.11A). Еще раз, комбинированное лечение IMGN853 и бевацизумабом хорошо переносилось.
[0347] Наконец, эффективность IMGN853 оценивалась в комбинации с бевацизумабом в той же устойчивой к препаратам платины PDX-модели, изображенной на Фиг.11B. В отличие от умеренной активности, наблюдаемой при монотерапии IMGN853, воздействие отдельно взятого бевацизумаба (5 мг/кг, в дозе QWx2) приводило к длительному контролю роста указанных агрессивных опухолей (данные не приведены), хотя CR не наблюдали в течение 102-дневного исследования. В соответствии с результатами OV-90 комбинация IMGN853 и бевацизумаба (оба 5 мг/кг, QWx2) превосходила, как отдельно взятый агент, так и индуцировала регресс опухоли у всех мышей. CR наблюдали у 7/8 животных. Действительно, анализ объемов опухолей в конце исследования показал значительное снижение опухолевой массы в группе, получавшей комбинацию, по сравнению с животными, получавшими бевацизумаб в монотерапии (Фиг.11В). Более того, данный эффект не был повторен у животных, которые получали комбинацию бевацизумаба и паклитаксела (10 мг/кг), что указывает на то, что терапевтическое преимущество, получаемое при добавлении IMGN853 к антиангиогенному агенту, функционально специфично для молекулы ADC.
Пример 4
Комбинированная терапия IMGN853 (1,25 мг/кг) + бевацизумаб более активна, чем монотерапия IMGN853, монотерапия бевацизумабом и комбинация бевацизумаб + паклитаксел в модели опухоли рака яичников OV90
[0348] Противоопухолевую активность IMGN853 оценивали в комбинации с бевацизумабом у самцов мышей SCID, несущих ксенотрансплантаты серозной опухоли яичника OV90. Мышей отбирали в группы (n = 8 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Все способы лечения состояли из однократных доз (1X). Группы включали контрольную группу, которой вводили дозу буфера препарата IMGN853 («носитель» на Фиг.3), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 1,25 мг/ кг 1X («IMGN853-1,25» на Фиг.3), группу, получавшую отдельно взятый агент паклитаксел, который вводили в дозе 10 мг/кг 1X («Паклитаксел-10» на Фиг.3), группу, получавшую отдельно взятый агент бевацизумаб, который вводили в дозе 5 мг/кг 1X («Бевацизумаб-5» на Фиг.3), группу, получавшую комбинацию IMGN853 + бевацизумаб, которую вводили в дозах 1,25 мг/кг 1X и 5мг/кг 1X, соответственно («IMGN853 + BEV» на Фиг.3) и группу, получавшую комбинацию паклитаксел + бевацизумаб, которые вводили в дозе 10 мг/кг 1X и 5 мг/кг 1X, соответственно («PAC + BEV» на Фиг.3).
[0349] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.3 изображены результаты.
[0350] При 1,25 мг/кг однократная доза IMGN853 была активной в качестве монотерапии (T/C 37%, 0/7 CR и 0/7 TFS) Однократная доза паклитаксела была неактивной (T/C 94%, 0/6 CR и 0/6 TFS). Однократная доза бевацизумаба была активной (T/C 22%, 0/8 CR и 0/8 TFS). Комбинация паклитаксел + бевацизумаб была активной (T/C 12%, 0/8 CR и 0/8 TFS). Комбинация IMGN853 + бевацизумаб была в высокой степени активной и более активной, чем все виды лечения с отдельно взятым агентом, а также комбинированное лечение паклитаксел + бевацизумаб (T/C 5%, 5/8 CR и 0/8 TFS). См. Фиг.3. Все способы лечения хорошо переносились. Таким образом, комбинация бевацизумаба с IMGN853 была более эффективной, чем комбинация бевацизумаба с другой терапией.
Пример 5
Комбинированная терапия IMGN853 + бевацизумаб более активна, чем монотерапия IMGN853 и монотерапии бевацизумабом в модели опухоли яичников IGROV
[0351] Противоопухолевую активность IMGN853 оценивали как для монотерапии, так и в комбинации с бевацизумабом у самцов мышей SCID, несущих ксенотрансплантаты опухоли яичника IGROV-1. Мышей отбирали в группы (n = 6 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Все способы лечения состояли из однократных доз (1X). Группы включали контрольную группу, которой вводили дозу с буфером препарата IMGN853 («носитель» на Фиг.4), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 5 мг /кг 1X («IMGN853-5» на Фиг.4), группу, получавшую отдельно взятый агент бевацизумаб, который вводили в дозе 5 мг/кг 1X («Бевацизумаб-5» на Фиг.4) и группу, получавшую комбинацию IMGN853 + бевацизумаб, которой вводили дозу 5 мг/кг IMGN853 и 5 мг/кг бевацизумаба («IMGN853 + BEV» на Фиг.4).
[0352] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.4 изображены результаты.
[0353] IMGN853 активен в качестве монотерапии (T/C 20%, 0/4 CR и 0/4 TFS). Бевацизумаб не активен в качестве монотерапии (T/C 51%, 0/4 CR и 0/4 TFS). Комбинированная терапия IMGN853 + бевацизумаб была в высокой степени активной и более активной, чем монотерапии IMGN853 и бевацизумаба (T/C 5%, 3/6 CR и 0/6 TFS). См. Фиг.4. Все способы лечения хорошо переносились без заметной потери веса тела, наблюдаемой в любой группе лечения. Таким образом, комбинированная терапия с IMGN853 и бевацизумабом повысила эффективность без повышения токсичности.
Пример 6
Комбинированная терапия IMGN853 + бевацизумаб более активна, чем монотерапия IMGN853, монотерапия бевацизумабом и комбинированная терапия паклитаксел + бевацизумаб в опухолевой модели ST088 эпителиального рака яичников
[0354] Противоопухолевую активность IMGN853 оценивали как монотерапию и в комбинации с бевацизумабом у самцов SCID-мышей, несущих ксенотрансплантаты опухоли, полученные из ST088 человеческого эпителиального рака яичников (EOC). Мыши CB17 SCID были отобраны в группы (n = 8 на группу) по объему опухоли и впоследствии получали дозы. Группы включали контрольную группу, которой вводили дозу буфера препарата IMGN853 (носитель) («контроль» на Фиг.5), группу, получавшую отдельно взятый IMGN853, которой вводили дозу 5 мг/кг QWx2 («IMGN853» на Фиг.5), группу, получавшую отдельно взятый агент белацизумаб, который вводили в дозе 5 мг/кг QWx2 («Bev» на Фиг.5) и группы, получавшей комбинацию IMGN853 + бевацизумаб, которой вводили дозу 5 мг/кг QWx2 IMGN853 и 5 мг/кг QWx2 бевацизумаба («IMGN853 + Bev» на Фиг.5).
[0355] Для сравнения, другой группе мышей вводили паклитаксел в 10 мг/кг QWx2, а дополнительной группе мышей вводили паклитаксел 10 мг/кг QWx2 в комбинации с бевацизумабом в 5 мг/кг QWx2.
[0356] Объемы опухолей измеряли два раза в неделю в трех измерениях с помощью циркуля. Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.5 изображает результаты.
[0357] IMGN853, который вводили в дозе 5 мг/кг QWx2 был активен в качестве монотерапии (T/C 31%) без миссии (0/8 PR и 0/8 CR). Бевацизумаб вводили в дозе 5 мг/кг QWx2, был в высокой степени активен в качестве монотерапии (T/C 6%); однако ремиссий не было (0/8 PR и 0/8 CR). Паклитаксел, который вводили в дозе 10 мг/кг QWx2 был неактивным (T/C 71%, 0/8 PR и 0/8 CR). Комбинированная терапия паклитаксел + бевацизумаб была в высокой степени активной (T/C 6%, 6/8 PR и 0/8 CR). Комбинированная терапия IMGN853 + бевацизумаб также была в высокой степени активной (T/C 3%, 7/8 PR и 0/8 CRs). Средний объем опухоли для группы, получавшей лечение в виде комбинации IMGN853 + бевацизумаб, был меньше, чем средний объем опухоли для группы, получавшей лечение в виде комбинации паклитаксел + бевацизумаб в последний день исследования (день 109 после дозирования 37 по сравнению с а + х + + ×463 мм3, соответственно). См. Фиг.5. Все способы лечения хорошо переносились без заметной потери веса тела, наблюдаемой в любой группе лечения.
Пример 7
Комбинированная терапия IMGN853 + бевацизумаб более активна, чем монотерапия IMGN853 и монотерапия бевацизумабом в модели опухолей немелкоклеточного рака легкого H2110
[0358] Противоопухолевую активность IMGN853 оценивали как для монотерапии, так и в комбинации с бевацизумабом у самцов SCID мышей, несущих ксенотрансплантаты опухоли немелкоклеточного рака легкого (НМРЛ) H2110. Мышей отбирали в группы (n = 6-10 на группу) по объему опухоли и впоследствии им вводили дозы на 7-й день после инокуляции. Все способы лечения состояли из однократных доз (1X). Группы включали контрольную группу, которой ввели дозу буфера препарата IMGN853 («носитель» на Фиг.6), группу с отдельно взятым IMGN853, который вводили в дозе 3 мг/кг («IMGN853 3 мг/кг» на Фиг.6), группу, с отдельно взятым агентом IMGN853, который вводили в дозе 1,5 мг/кг («IMGN853 1,5 мг/кг» на Фиг.6), группу с отдельно взятым агентом бевацизумаб, который вводили в дозе 5 мг/кг («Бевацизумаб 5мг/кг» на Фиг.6), группу, получавшую комбинацию IMGN853 + бевацизумаб, которой вводили дозу 5 мг/кг бевацизумаба и 3 мг/кг IMGN853 («IMGN853 3мг/кг + Bev 5 мг/кг» на Фиг.6) и группу, получавшую комбинацию IMGN853 + бевацизумаб, которой вводили дозу 5 мг/кг бевацизумаба и 1,5 мг кг IMGN853 («IMGN853 1,5 мг/кг + Bev 5 мг/кг» на Фиг.6).
[0359] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности тестируемого агента. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.6 изображены результаты.
[0360] IMGN853 был активным в качестве монотерапии в дозе 3 мг/кг 1X (T/C 25%, 2/6 PR, 0/6 CR и 0/6 TFS), не неактивным в дозе 1,5 мг/кг 1X (T/C 64%, 1/6 PR, 0/6 CR и 0/6 TFS). Единичная доза бевацизумаба 5 мг/кг 1X также была активной в качестве монотерапии (T/C 22%, 0/6 PR, 0/6 CR и 0/6 TFS). Комбинация IMGN853 в дозе 3 мг/кг 1X + бевацизумаб в дозе 5 мг/кг 1X была в высокой степени активна (T/C 0%, 10/10 PR, 6/10 CR и 4/10 TFS). Комбинация IMGN853 в дозе 1,5 мг/кг 1X + бевацизумаб в дозе 5 мг/кг 1X также была в высокой степени активна (T/C 9%, 3/10 PR, 1/10 CR и 0/10 TFS). Наблюдалась заметная потеря веса тела. Поскольку группа, принимавшая лечение носителем, испытала падение на 11% по сравнению с исходным весом после 25-й недели после инокуляции, потерю веса тела связывали с болезнью. Группа, принимавшая монотерапию IMGN853 в дозе 3 мг/кг испытала 9%-ную потерю веса тела на 42-й день после инокуляции, тогда как группа, принимавшая монотерапию IMGN853 в дозе 1,5 мг/кг, испытала 8%-ную потерю веса тела на 25-й день после инокуляции. У группы, принимавшей монотерапию бевацизумаба, была 9%-ная потеря веса тела на 49-й день после инокуляции. См. Фиг.6. Комбинированная терапия IMGN853 + бевацизумаб хорошо переносилась без заметной потери веса тела. Таким образом, комбинированная терапия с IMGN853 и бевацизумабом повышала эффективность при снижении токсичности.
Пример 8
Комбинированная терапия IMGN853 + карбоплатин более активна, чем комбинированная терапия паклитаксел + карбоплатин в модели опухоли рака яичников OV90
[0361] Противоопухолевую активность IMGN853 оценивали как для комбинированной терапии с карбоплатином, так и для трехкомпонентной комбинированной терапии с карбоплатином и бевацизумабом у самцов мышей SCID, несущих ксенотрансплантаты опухоли OV90 рака яичников. Мышей отбирали в группы (n = 6 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Все способы лечения состояли из однократных доз (1X). Группы включали контрольную группу, которой вводили дозу буфера препарата IMGN853 («носитель» на Фиг.7), группу, получавшую комбинированную терапию IMGN853 +карбоплантин, которой вводили дозу 5мг/кг 1X и 100 мг /кг 1X, соответственно («CARBO + IMGN853» на Фиг.7), группу, получавшую трехкомпонентную комбинированную терапию IMGN853 + карбоплатин + бевацизумаб, которой вводили дозу в 5мг /кг 1X, 100 мг/кг 1X и 5 мг/кг 1X, соответственно («CARBO + IMGN853 + Bev» на Фиг.7), группу, получавшую комбинированную терапию паклитаксел + карбоплантинга, которой вводили дозу 10 мг кг 1X и 100 мг/кг 1X соответственно («CARBO + PAC» на Фиг.7) и группу, получавшую трехкомпонентную комбинированную терапию паклитаксел + карбоплатин + бевацизумаб, которой вводили дозу 10 мг/кг 1X, 100 мг/кг 1X и 5 мг/кг 1X, соответственно («CARBO + PAC + Bev» на Фиг.7).
[0362] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.7 изображены результаты.
[0363] Комбинация IMGN853 + карбоплатин была в высокой степени активна (T/C 10%, 3/6 CR и 0/6 TFS). Комбинация паклитаксел + карбоплатин была в высокой степени активна (45% T/C, 0/6 CR и 0/6 TFS). Трехкомпонентная комбинация IMGN853 + карбоплатин+ бевацизумаб была в высокой степени активна (5% T/C, 6/6 CR и 0/6 TFS). Трехкомпонентная комбинированная терапия паклитаксел + карбоплатин+ бевацизумаб была активна (16% T/C, 1/6 CR и 0/6 TFS). Комбинированная терапия IMGN853+ карбоплатин и трехкомпонентная комбинация IMGN853 + карбоплатин+ бевацизумаб были более активны, чем их паклитаксел-содержащие эквивалентные схемы лечения (то есть более активные, чем паклитаксел + карбоплатин и более, чем паклитаксел + карбоплатин+ бевацизумаб). См. Фиг.7.
[0364] Трехкомпонентная комбинированная терапия паклитаксел + карбоплатин+ бевацизумаб приводила к заметно большей потере веса (BWL), с крайним упадком (6. 9%) по сравнению с трехкомпонентной комбинаицей IMGN853 + карбоплатин+ бевацизумаб (2. 9% BWL). Крайний упадок BWL для комбинации IMGN853 + карбоплатин (12. 9%) был сопоставим с крайним упадком BWL лечения паклитаксел + карбоплан (11. 1%). Таким образом, трехкомпонентная комбинированная терапия с IMGN853, карбоплатином и бевацизумабом повысила эффективность при снижении токсичности по сравнению с трехкомпонентной комбинированной терапии с паклитакселом, карбоплатином и бевацизумабом.
Пример 9
Комбинированная терапия IMGN853 + цедираниб более активна, чем монотерапия IMGN853 и цедираниб в модели опухоли рака яичников OV90
[0365] Противоопухолевую активность IMGN853 оценивали в комбинации с анти-ФРЭС агентом цедираниб у самцов мышей SCID, несущих ксенотрансплантаты серозной опухоли яичника OV90. Мышей отбирали в группы (n = 6 на группу) по объему опухоли и впоследствии им вводили дозы на 14-й день после инокуляции. Группы включали контрольную группу, которой вводили дозу буфера препарата IMGN853 («носитель» на Фиг.8), группу, получавшую отдельно взятый агент IMGN853, который вводили в дозе 2,5 мг/кг 1 × («IMGN853 2,5 мг/кг» на Фиг.8), группы, получавшую отдельно взятый агент цедираниб, который вводили в дозе 1,5 мг/кг 1 раз в день в течение пяти дней (qdx5) («Цедираниб 1,5 мг/кг qdx5» на Фиг.8) и группы, получавшей комбинированную терапию IMGN853 + цедираниб, которую вводили в дозе 2,5 мг/кг 1x IMGN853 и 1,5 мг/кг qdx5 цедираниб («IMGN853 + Цедираниб» на Фиг.8).
[0366] Объемы опухолей измеряли один-два раза в неделю в трех измерениях с помощью циркуля. Объем опухоли выражали в мм3, используя формулу V = Длина × Ширина × Высота × 1/2 (Tomayko 1989). Вес тела измеряли два раза в неделю в качестве показателя токсичности тестируемого агента. Активность оценивали, как описано в Bissery et al. (1991). На Фиг.8 изображены результаты.
[0367] Монотерапия IMGN853 была активна (T/C 31%, T-C 13 дни, LCK 0. 5 и 0/6 PR). Монотерапия цедиранибом была неактивна (T/C 80%, T-C 4 дни, LCK 0. 1 и 0/6 PR). Комбинация IMGN853 + цедираниб была активна (T/C 13% с 1/6 PRs), но T-C (47) и LCK (1. 7) были более активны, чем каждая из монотерапий IMGN853 или цедираниб. См. Фиг.8. Все виды терапии хорошо переносились с минимальной потерей веса тела.
Пример 10
Клиническое исследование для оценки комбинаций IMGN853 с бевацизумабом, карбоплатином и/или доксорубицином
[0368] Результаты доклинических исследований, оценивающих активность IMGN853 как отдельно взятого агента и активность IMGN853 в комбинации с бевацизумабом, карбоплатином или PLD в ксенотрансплантатных моделях рака яичников, описанных выше, показали, что IMGN853 в комбинации с бевацизумабом, карбоплатином и/или PLD являются перспективными схемами лечения для оценки в клинических испытаниях эпителиального рак яичников (EOC), как в рецидивирующей, так и в зараннее проведенной терапии.
Проведено клиническое исследование фазы 1b, в котором оцениваются двойные комбинации IMGN853 с бевацизумабом, карбоплатином и/или PLD у пациентов с FRα-p-положительным раком яичников. Исследование включает два компонента: компонент для подбора дозы для определения максимально переносимой дозы (MTD) и рекомендуемое дозирование для комбинации IMGN853 + бевацизумаб, IMGN853 + карбоплатин и IMGN853 + PLD; и компонент для увеличения дозы. В компоненте увеличения дозы до максимальной оцениваются две типологические группы увеличения:(1) комбинация IMGN853 + бевацизумаб у пациентов, которые ранее не получали лечение бевацизумабом («не получавшие лечения бевацизумабом») и (2) комбинация IMGN853 + бевацизумаб у пациентов, которые получили предыдущее лечение бевацизумабом. Дополнительные возможные типологические группы включают: (1) комбинацию с IMGN853 + карбоплатин у пациентов, которые ранее не получали бевацизумаб («не получавшие лечения бевацизумабом»), (2) комбинацию IMGN853 + PLD у пациентов, которые ранее не получали лечение бевацизумабом («не получавшие лечения бевацизумабом»), (3) трехкомпонентную комбинацию IMGN853 + бевацизумаб + PLD у пациентов, которые не получали предшествующего лечения бевацизумабом («не получавшие лечения бевацизумабом»), или (4) трехкомпонентную комбинацию IMGN853 + бевацизумаб + карбоплатинатина у пациентов, которые ранее не получали лечение бевацизумаб («не получавшие лечения бевацизумабом»); (5) комбинация пациентов с IMGN853 + карбоплатинамином, которым предшествовало лечение бевацизумаб, (6) комбинация IMGN853 + PLD у пациентов, прошедших предварительное лечение бевацизумабом, (7) трехкомпонентную комбинацию IMGN853 + бевацизумаб + PLD у пациентов, которые получили предварительное лечение бевацизумабом, или (8) трехкомпонентную комбинацию IMGN853 + бевацизумаб + карбоплатинай у пациентов которые получили предыдущее лечение бевацизумабом; (9) трехкомпонентную комбинацию IMGN853 + бевацизумаб + карбоплатин; и/или (10) трехкомпонентную комбинацию IMGN853 + бевацизумаб + PLD. Ответы на комбинированную терапию оцениваются с использованием критериев RECIST и Международной группы по изучению злокачественных опухолей женской репродуктивной системы (GCIG) (при необходимости).
Пример 11
Комбинация IMGN853 с карбоплатином промотирует синергическое ингибирование роста и эффекты пертурбации клеточного цикла in vitro и IMGN853 потенцируют противоопухолевую активность карбоплатина in vivo
[0369] Карбоплатин в комбинации с паклитакселом представлял собой химиотерапевтический стандарт ухода за пациентами EOC в лечении адъювантом первой линии. Для проверки того, могла ли совместное лечение IMGN853 улучшить активность карбоплатина в EOC, были оценены комбинированные эффекты IMGN853 и воздействия карбоплатина при ингибировании роста клеточной линии карциномы яичников, чувствительной к платине, IGROV-1. Клетки IGROV-1 получали обработку in vitro с увеличивающимися концентрациями IMGN853, карбоплатина, или обоих и комбинированную активность оценивали с использованием анализа медианного эффекта (Фиг.9A). Комбинация была синергичной, что свидетельствует о том, что IMGN853 увеличил действие соединения платины в данных опухолевых клетках яичника.
[0370] Анализ клеточного цикла показал, что воздействие карбоплатина приводило к накоплению клеток IGROV-1 в обеих фазах S и G2/M (Фиг.9B), ранее сообщалось о предшествующих клеточной гибели, вызванной данным агентом в клеточной линии яичников. Обработка IMGN853 в монотерапии приводила к обогащению клеток в G2/M в соответствии с хорошо установленной антимитотической активностью майтанзиноидов. В соответствии с указанными результатами совместная обработка обоими агентами привело к получению почти всех жизнеспособных клеток, накапливающихся в G2/M. Также были исследованы изменения экспрессии в фосфорилированной форме гистона H2AX (γH2AX), чувствительном индикаторе повреждения ДНК, который возникает в ответ на алкилирующие агенты или в результате митотической катастрофы. Отдельно взятый агент IMGN853 индуцировал экспрессию γH2AX в клетках IGROV-1 и до уровней выше, чем наблюдаемые после воздействия карбоплатина в монотерапии. Комбинированная терапия увеличивала степень регуляции γH2AX, что свидетельствует об усиленном повреждении ДНК и соответствует катастрофическому фенотипу (Фиг.9C).
[0371] Чтобы исследовать, были ли эти клеточные эффекты in vitro переведены на улучшенную эффективность in vivo, мыши, несущие ксенотрансплантаты (PX), полученные от индивидуума с EOC, получали лечение IMGN853 и карбоплатиномом, как в виде отдельно взятых агентов, так и в комбинации (Фиг.9D). Ранее было установлено, что IMGN853 демонстрирует устойчивую активность отдельно взятого агента в указанной чувствительной к платине модели PDX (данные не приведены); поэтому была выбрана субоптимальная доза IMGN853, позволяющая оценивать потенциальные комбинированные улучшения эффективности. Животные получали одно введение IMGN853 (2,5 мг/кг) или карбоплатина (80 мг/кг) и каждая схема лечения в виде монотерапи ингибировала рост опухоли (значения T/C 43% и 20% на 39 день, соответственно). В соответствии с вышеприведенными результатами in vitro одновременное лечение обоими агентами приводила к существенному усилению противоопухолевой активности, ингибируя рост опухоли на 97% (т. е. T/C значение 3%) в той же временной точке. Важно отметить, что комбинация IMGN853 с терапией на основе платины хорошо переносилась, без токсичности или потери веса тела, наблюдаемой в ходе исследования.
[0372] Преимущество применения комбинированной терапии, полученная с помощью IMGN853/карбоплантин, сравнивалась с клинически значимыми химиотерапевтическими комбинациями в той же модели PDX. Опухоленесущие животные получали две последовательные недельные дозы (QWx2) карбоплатина (80 мг/кг, и/п) в комбинации с i. v. паклитакселом (10 мг/кг), PLD (4 мг/кг) или IMGN853 (5 мг/кг). Как и ожидалось, лечение с дублетом карбоплатин-паклитаксел было эффективным в этой модели чувствительности к препаратам платины (Фиг.9Е). Комбинированная терапия карбоплатина и PLD, обычно указываемая в чувствительной к лечению препаратами платины ремиссии, также была активной в подавлении роста опухоли. Примечательно, что комбинированная терапия IMGN853 плюс карбоплатин вызывала наибольшую степень ингибирования роста опухоли, включая полные ремиссии (CR) в 6 из 7 мышей-опухоленосителей. Напротив, только 2 CR наблюдались с комбинацией карбоплатин/PLD, и ни одна из них не наблюдалась в группе, получавшей карбоплатин/паклитаксел. В данной модели хорошо переносился дублет карбоплатин-паклитаксел, хотя у животных из групп, получавших PLD/карбоплатин и IMGN853/карбоплантин, наблюдалась некоторая отсроченная токсичность (данные не показаны). Более высокая частота возникновения CR была в значительной степени показателем лучшей продолжительности реакции для комбинации, и в целом данные дополнительно поддерживают комбинацию IMGN853 с карбоплатином для улучшения ответа на терапию препаратами платины в EOC.
Пример 12
Комбинация IMGN853 и PLD-лечения приводит к превосходной терапевтической активности в устойчивых к препаратам платины PDX-опухолях
[0373] В клинической практике PLD является широко используемой терапией второй линии для рецидивирующего и/или устойчивого к препаратам платины EOC, при этом лечение демонстрирует превосходную переносимость к доксорубицину. Подобно тому, что наблюдалось для карбоплатина, комбинация IMGN853 и доксорубицина была синергичной по отношению к антипролиферативной активности in vitro для клеточной линии IGROV-1 (Фиг.10A) и приводила к более выраженной S плюс G2 /M задержке клеточного цикла (Фиг.10B).
[0374] Чтобы расширить наблюдения in vitro, комбинацию IMGN853 и PLD исследовали в устойчивой к препаратам платины модели EOC PDX (Фиг.10C). Обработанные несущей средой животные быстро прогрессировали и были удалены из исследования, когда опухоли достигли объемов между 1500-2000 мм3. Дозировка QWx2 IMGN853 (5 мг/кг) ингибировала рост опухоли на 81% на 49 день, и аналогичная степень ингибирования (83%) наблюдалась, когда PLD (4 мг/кг) вводили в том же режиме применения. Даже при указанных эффективных уровнях дозы комбинированное лечение привело к улучшению и устойчивому противоопухолевому ответу, полностью прекратив рост опухоли в данной агрессивной модели EOC. Важно отметить, что все схемы были хорошо переносимы, и добавление IMGN853 к PLD не давало дополнительной токсичности или изменений в весе тела по сравнению с лечением в монотерапии PLD (Фиг.10D). Таким образом, в контексте устойчивого к препаратам платины заболевания комбинация IMGN853 с PLD привела к превосходной, долговременной эффективности по сравнению с активностью отдельно взятого какого-либо соединения в монотерапии.
[0375] Данное исследование также подтверждает вывод о том, что синергические улучшения в противоопухолевой активности, наблюдаемые при комбинации IMGN85 / PLD in vitro, приводят к улучшенной и долговременной эффективности по сравнению с соответствующими лечениями отдельно взятым средством и, что важно, демонстрируют хорошую переносимость в устойчивой к препаратам платины модели PDX. Ранее сообщалось о преимуществе комбинирования для PLD с другим FRα-нацеливающим соединением, винтафолидом, в доклинических моделях EOC, что вызвало поздние клинические оценки данной комбинации в последующих стадиях II и III клинических испытаний на человеке. Не желая связывать себя теорией, IMGN853 обладает более широким спектром биологической активности по сравнению с винтафолидом, включая более эффективную полезную нагрузку, более длительное время циркуляции и «цитотоксичность наблюдателя», то есть способность уничтожать соседние FRα-негативные или низко экспрессирующие опухолевые клетки и, таким образом, результаты дают убедительное обоснование для комбинации IMGN853 и PLD у пациентов с рецидивом заболевания.
Пример 13
Комбинация IMGN853-бевацизумаб вызывает быстрое микрососудистое нарушение и обширное некротическое повреждение в ксенотрансплантатах OV-90
[0376] Чтобы продвинуть механистическое понимание превосходной эффективности, наблюдаемой с IMGN853 в присутствии бевацизумаба in vivo, опухоли OV-90 у животных, обработанных либо IMGN853 (2,5 мг/кг), бевацизумабом (5 мг/кг), либо их комбинацией, брали для анализа через 4 дня после введения дозы и исследовали (Фиг.12А-12С). Стоит отметить, что комбинированная терапия полностью остановила рост опухоли в указанный ранний момент времени, измеряемый по изменениям объемов опухолей, в отличие от только задержек, наблюдаемых при соответствующем введении доз единственного агента (например, см. Фиг.2B). Гистологическое (гематоксилин-эозин) окрашивание показало, что опухоли из мышей обработанных комбинацией, структурно состоят из крупных некротических ядер, окруженных меньшим ободком жизнеспособных клеток на периферии (Фиг.12A). Данная степень клеточного разрушения не наблюдалась ни в одной из других групп лечения, и это согласуется с быстрой стабилизацией опухоли, которой назначили режим дозирования. Затем, в виде фармакодинамического показания, уровни опухоли γH2AX измеряли с помощью иммуноблоттинга (Фиг.12B). Как и ожидалось, экспрессия γH2AX была незначительной в опухолях у мышей, обработанных носителем, но была сильно вызвана после лечения отдельно взятым агентом IMGN853. В соответствии с наблюдаемыми улучшениями в противоопухолевой активности добавление бевацизумаба к IMGN853 приводило к дальнейшему повышению уровней γH2AX по сравнению с теми, которые наблюдались при монотерапии IMGN853.
[0377] Интересно отметить, что усиление γH2AX наблюдалось также в опухолях после воздействия одного бевацизумаба, хотя и в меньшей степени, чем IMGN853 (Фиг.12B). Хотя генотоксические оповреждения являются первичными стимуляторами γH2AX, накопление данного белка может также возникать в ответ на гипоксию. Таким образом, данный результат позволяет предположить, что повышенные гипоксические состояния, возникающие в результате вызванного бевацизумабом повреждения сосудов, вносят свой вклад в профиль повреждения амплифицированной ДНК. Для изучения эффектов, связанных с лечением на микрососудах, проводилось иммуногистохимическое окрашивание маркером CD31 эндотелиальных клеток (Фиг.12С, верхняя панель). Опухоли из контроля и мышей, обработанных IMGN853, имели многочисленные крупные сосуды, размеры которых уменьшились и показали потерю целостности просвета после лечения бевацизумабом. Примечательно, что двойное введение IMGN853 и бевацизумаба привело к заметным изменениям в микроциркуляторной части опухоли. Указанные изменения включали четкое сокращение числа крупных разветвленных сосудистых структур с меньшими CD31-окрашенными пятнами, без четких просветов и преимущественно локализованными в областях периферического края. Дополнительное окрашивание соответствующих образцов ткани антителом к майтанзину подтвердило направленную на опухоль доставку IMGN853 у мышей, получавших ADC-содержащие схемы (Фиг.12C, нижняя панель).
[0378] Не желая связывать себя теорией, возможно, что присутствие бевацизумаба способствует лучшему проникновению в опухоль и воздействию ADC, что приводит к более эффективному уничтожению опухолевых клеток. В этой связи хорошо известно, что лечение бевацизумабом может вызвать нормализацию сосудистой сети опухоли, что, как было предложено, приводит к снижению тканевого давления и улучшению доставки лекарств. Однако существуют доклинические и клинические наблюдения за уменьшенным поглощением опухоли как химиотерапевтических препаратов, так и антител после антиангиогенной терапии.
***
[0379] Следует принимать во внимание, что раздел «Подробное описание сущности изобретения», а не разделы «Сущность изобретения» и «Реферат», предназначены для использования в толковании формулы изобретения. В разделах Сущность изобретения и Реферат излагаются один или более, но не все, иллюстративные варианты реализации данного изобретения, как это предусмотрено изобретателем (ями) и, таким образом, не предназначены для ограничения данного изобретения и прилагаемой формулы изобретения любым способом.
[0380] Данное изобретение было описано выше с помощью функциональных структурных элементов, иллюстрирующих реализацию указанных функций и их взаимосвязей. Границы указанных функциональных структурных элементов были произвольно определены в данном документе для удобства описания. Альтернативные границы могут быть определены до тех пор, пока указанные функции и их отношения будут надлежащим образом выполнены.
[0381] Вышеупомянутое описание конкретных вариантов реализации изобретения полностью раскрывает общий предмет изобретения, который другие могут, применяя знания в пределах уровня техники, легко изменять и/или адаптировать для различных применений таких конкретных вариантов реализации без необоснованных экспериментов без отхода из общей концепции данного изобретения. Следовательно, предусмотрено, что такие адаптации и модификации должны быть в пределах значения и диапазона эквивалентов описанных вариантов реализации изобретения на основе представленных здесь идеи и руководства. Следует понимать, что фразология или терминология в данном документе предназначена для описания и не ограничения, так что терминология или фразеология данного описания должна интерпретироваться специалистом в данной области техники в свете идеи и руководства.
Охват и объем данного изобретения не должны ограничиваться каким-либо из вышеописанных иллюстративных примеров вариантов реализации изобретения, но должны быть определены только в соответствии со следующей формулой изобретения и ее эквивалентами.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> IMMUNOGEN, INC.
PONTE, JOSE
PINKAS, JAN
RUIZ-SOTO, RODRIGO R.
<120> ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ АНТИ-FOLR1
ИММУНОКОНЪЮГАТЫ
<130> 2921.077PC03/EKS/CLD/MKK
<150> 62/220,028
<151> 2015-09-17
<150> 62/242,669
<151> 2015-10-16
<150> 62/250,756
<151> 2015-11-04
<160> 19
<170> PatentIn версия 3.5
<210> 1
<211> 257
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Ile Ala Trp Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Arg Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Gln Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Ala Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr His Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Phe Leu Leu Ser Leu Ala Leu Met Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 2
<211> 771
<212> ДНК
<213> Homo sapiens
<400> 2
atggctcagc ggatgacaac acagctgctg ctccttctag tgtgggtggc tgtagtaggg 60
gaggctcaga caaggattgc atgggccagg actgagcttc tcaatgtctg catgaacgcc 120
aagcaccaca aggaaaagcc aggccccgag gacaagttgc atgagcagtg tcgaccctgg 180
aggaagaatg cctgctgttc taccaacacc agccaggaag cccataagga tgtttcctac 240
ctatatagat tcaactggaa ccactgtgga gagatggcac ctgcctgcaa acggcatttc 300
atccaggaca cctgcctcta cgagtgctcc cccaacttgg ggccctggat ccagcaggtg 360
gatcagagct ggcgcaaaga gcgggtactg aacgtgcccc tgtgcaaaga ggactgtgag 420
caatggtggg aagattgtcg cacctcctac acctgcaaga gcaactggca caagggctgg 480
aactggactt cagggtttaa caagtgcgca gtgggagctg cctgccaacc tttccatttc 540
tacttcccca cacccactgt tctgtgcaat gaaatctgga ctcactccta caaggtcagc 600
aactacagcc gagggagtgg ccgctgcatc cagatgtggt tcgacccagc ccagggcaac 660
cccaatgagg aggtggcgag gttctatgct gcagccatga gtggggctgg gccctgggca 720
gcctggcctt tcctgcttag cctggcccta atgctgctgt ggctgctcag c 771
<210> 3
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> FOLR1 Антитело huMov19 - VH
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 4
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> FOLR1 Антитело huMov19 - VL версия 1.00
<400> 4
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 5
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> FOLR1 Антитело huMov19 - VL версия 1.60
<400> 5
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 6
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VL-CDR1
<400> 6
Lys Ala Ser Gln Ser Val Ser Phe Ala Gly Thr Ser Leu Met His
1 5 10 15
<210> 7
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VL-CDR2
<400> 7
Arg Ala Ser Asn Leu Glu Ala
1 5
<210> 8
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VL-CDR3
<400> 8
Gln Gln Ser Arg Glu Tyr Pro Tyr Thr
1 5
<210> 9
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VH-CDR1, определенная по Кабату
<400> 9
Gly Tyr Phe Met Asn
1 5
<210> 10
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VH-CDR2, определенная по Кабату
<400> 10
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe Gln
1 5 10 15
Gly
<210> 11
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VH-CDR2, определенная по AbM
<400> 11
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe
1 5 10
<210> 12
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VH-CDR3, определенная по Кабату и AbM
<400> 12
Tyr Asp Gly Ser Arg Ala Met Asp Tyr
1 5
<210> 13
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 - Тяжелая полноразмерная аминокислотная последовательность
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 14
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 - Легкая версия 1.00 полноразмерная аминокислотная последовательность
<400> 14
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 15
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 - Легкая версия 1.60 полноразмерная аминокислотная последовательность
<400> 15
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 16
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> muMOV19 VH-CDR2, определенная по Кабату
<400> 16
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Asn Phe Lys
1 5 10 15
Asp
<210> 17
<211> 232
<212> PRT
<213> Homo sapiens
<400> 17
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Ala Pro Met Ala Glu Gly
20 25 30
Gly Gly Gln Asn His His Glu Val Val Lys Phe Met Asp Val Tyr Gln
35 40 45
Arg Ser Tyr Cys His Pro Ile Glu Thr Leu Val Asp Ile Phe Gln Glu
50 55 60
Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys Pro Ser Cys Val Pro Leu
65 70 75 80
Met Arg Cys Gly Gly Cys Cys Asn Asp Glu Gly Leu Glu Cys Val Pro
85 90 95
Thr Glu Glu Ser Asn Ile Thr Met Gln Ile Met Arg Ile Lys Pro His
100 105 110
Gln Gly Gln His Ile Gly Glu Met Ser Phe Leu Gln His Asn Lys Cys
115 120 125
Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg Gln Glu Lys Lys Ser Val
130 135 140
Arg Gly Lys Gly Lys Gly Gln Lys Arg Lys Arg Lys Lys Ser Arg Tyr
145 150 155 160
Lys Ser Trp Ser Val Tyr Val Gly Ala Arg Cys Cys Leu Met Pro Trp
165 170 175
Ser Leu Pro Gly Pro His Pro Cys Gly Pro Cys Ser Glu Arg Arg Lys
180 185 190
His Leu Phe Val Gln Asp Pro Gln Thr Cys Lys Cys Ser Cys Lys Asn
195 200 205
Thr Asp Ser Arg Cys Lys Ala Arg Gln Leu Glu Leu Asn Glu Arg Thr
210 215 220
Cys Arg Cys Asp Lys Pro Arg Arg
225 230
<210> 18
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> Сигнальная последовательность ФРЭС-А человека
<400> 18
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala
20 25
<210> 19
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> huMov19 (M9346A) VH-CDR1, определенная по AbM
<400> 19
Gly Tyr Thr Phe Thr Gly Tyr Phe Met Asn
1 5 10
<---

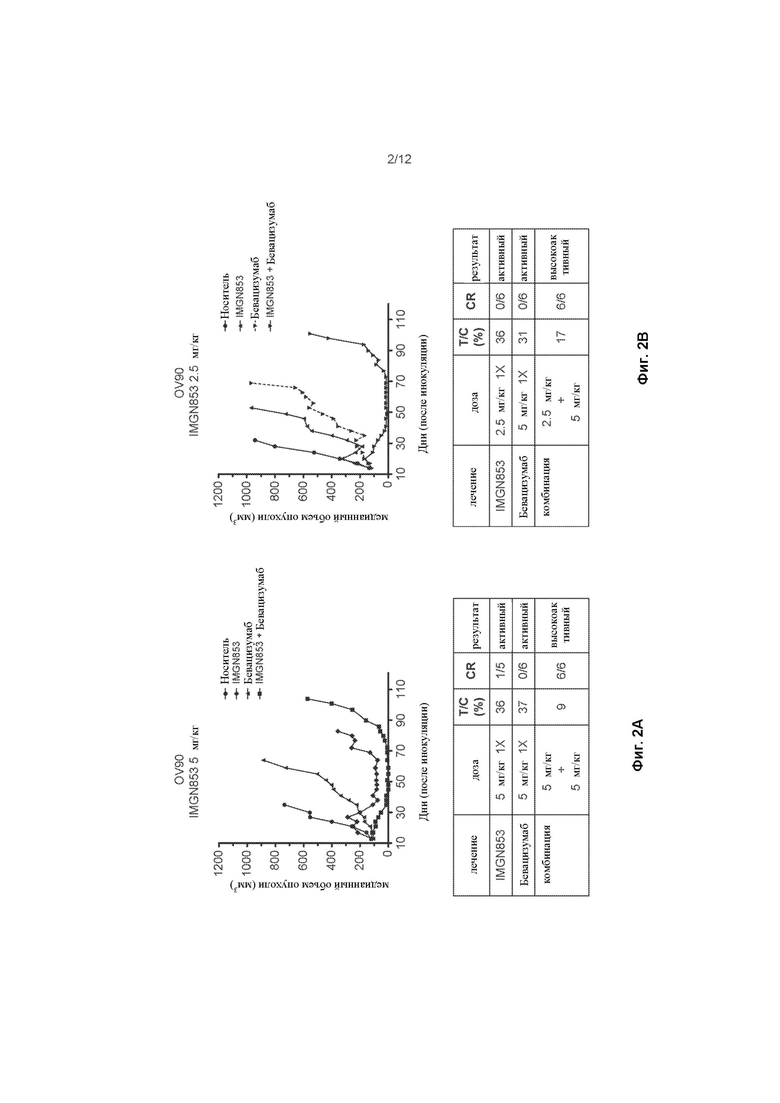
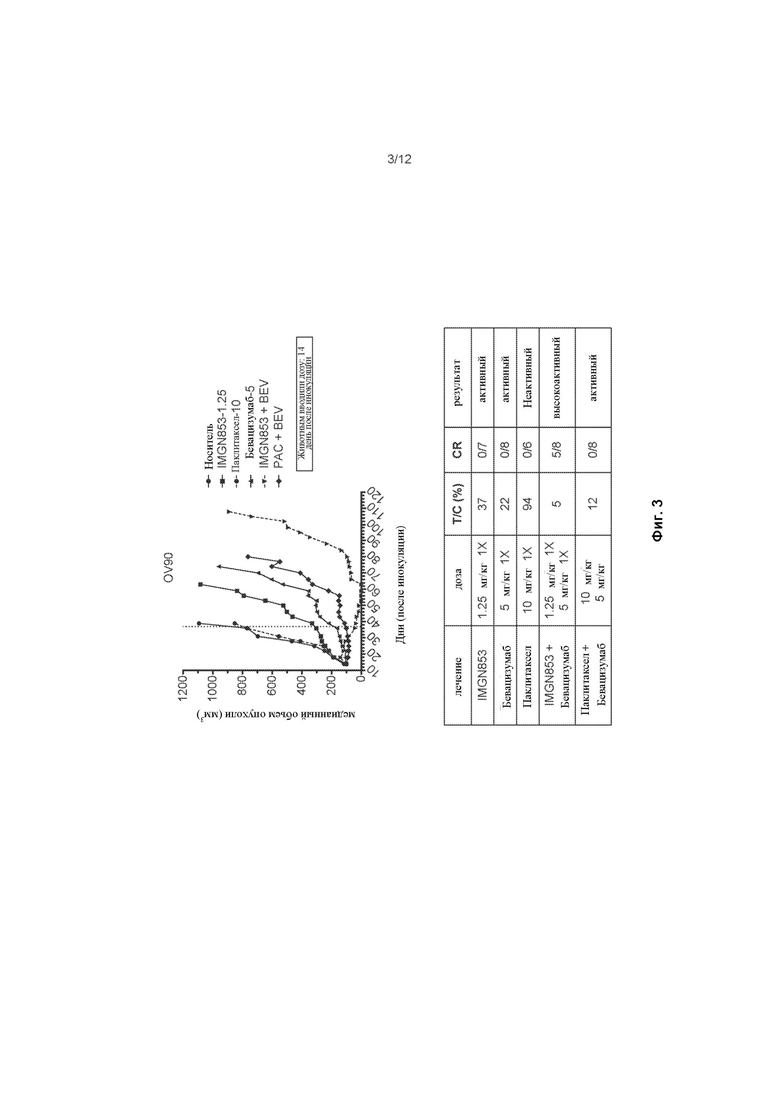
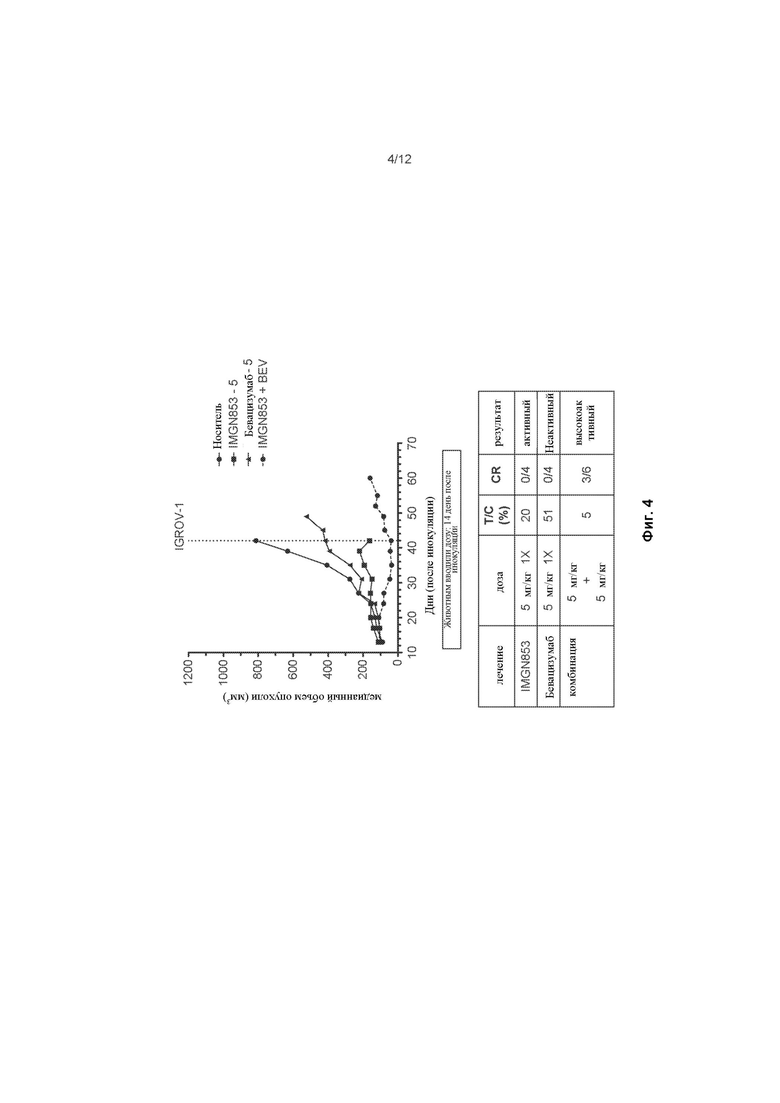
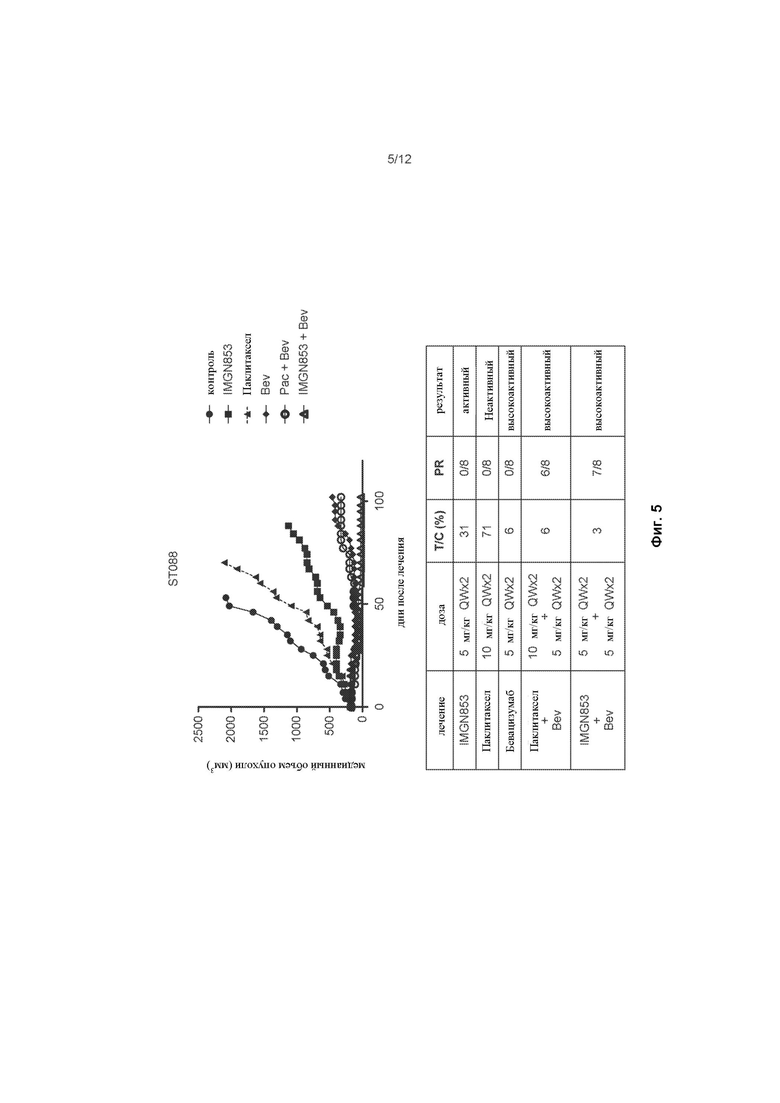
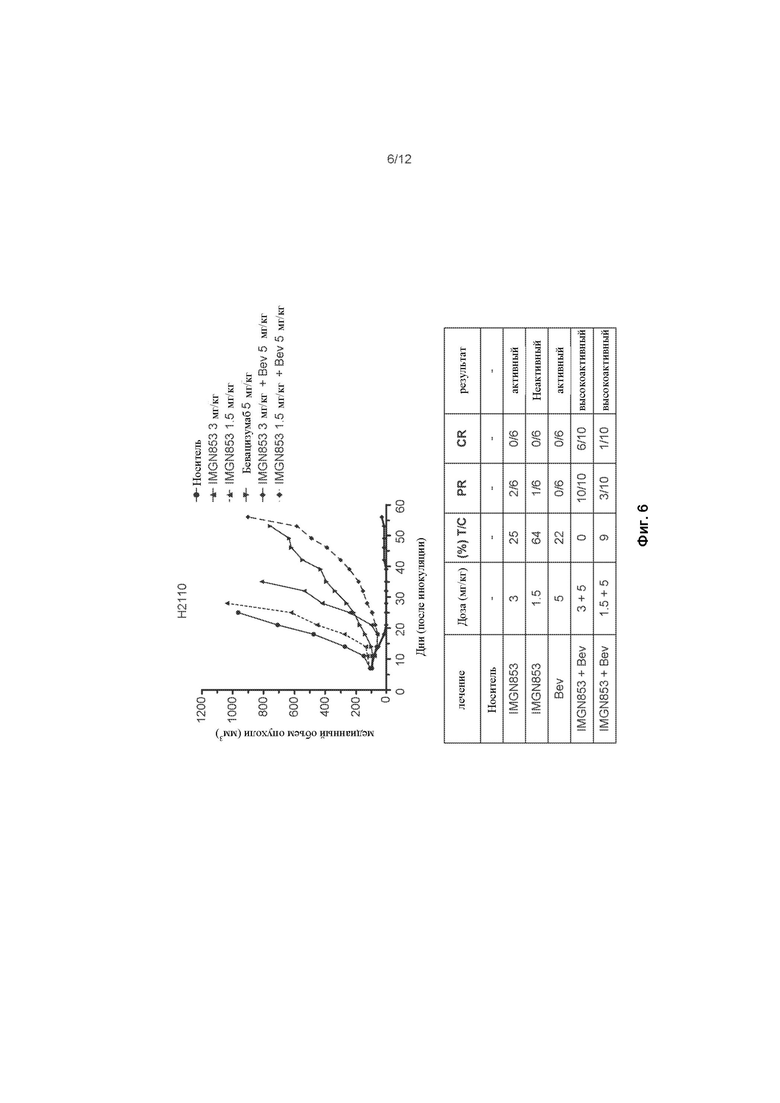

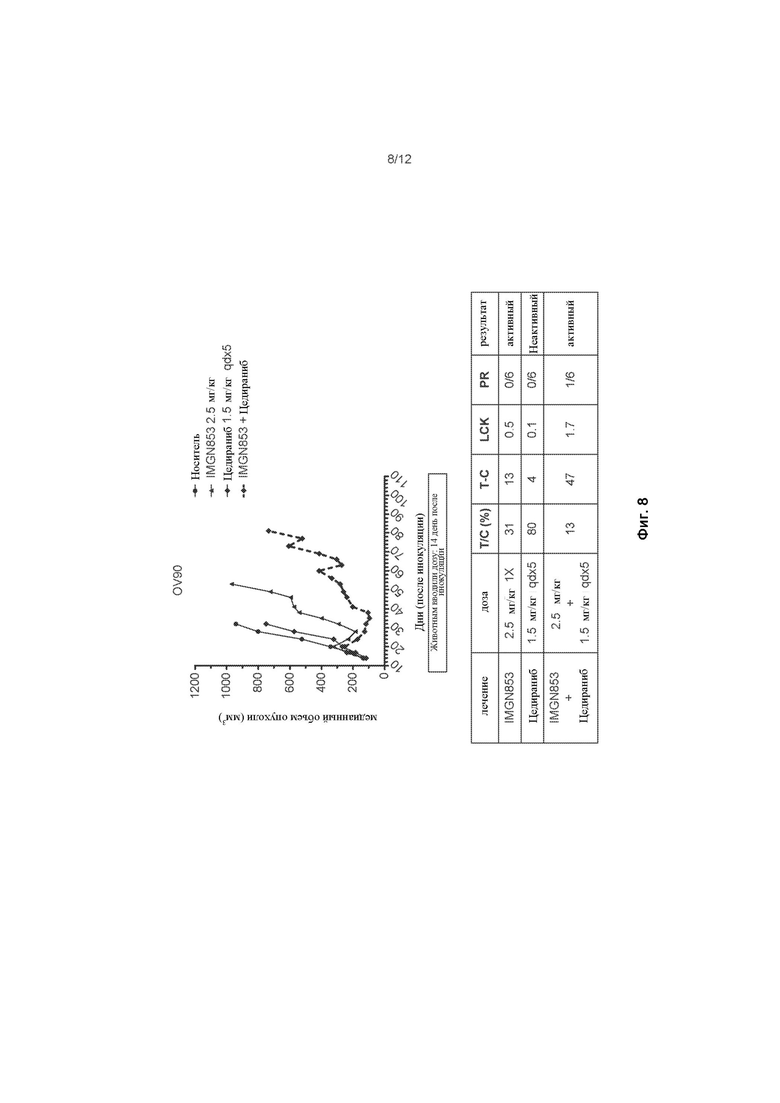
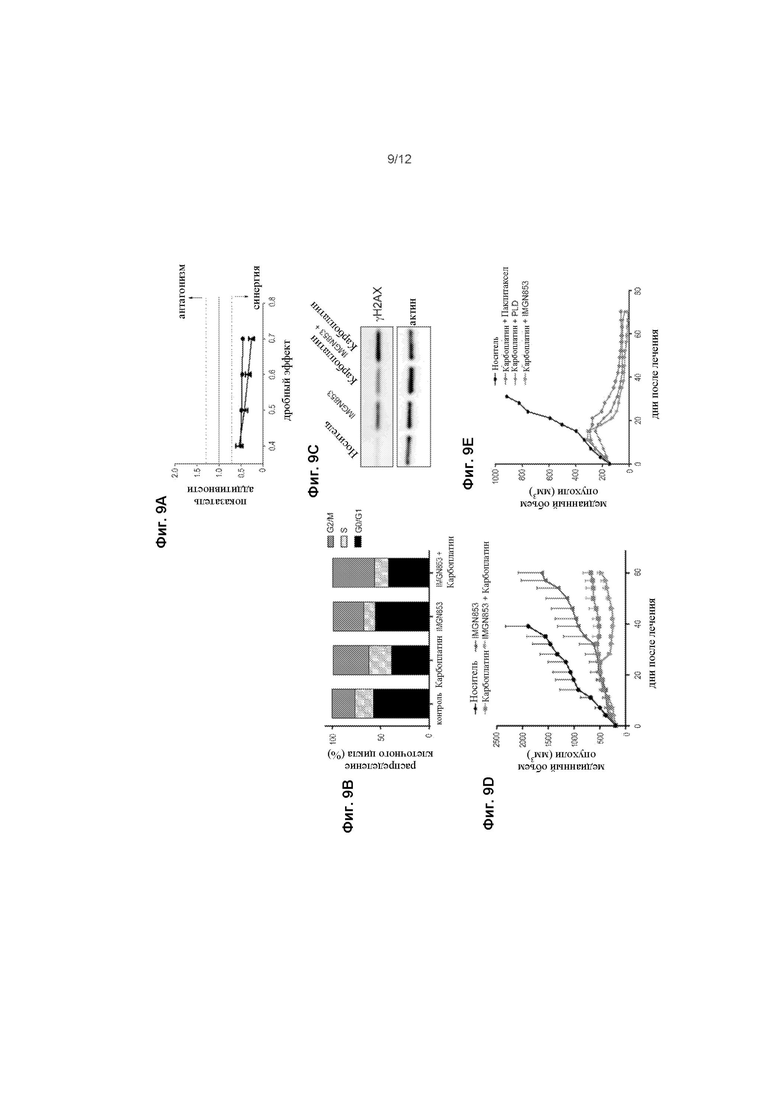
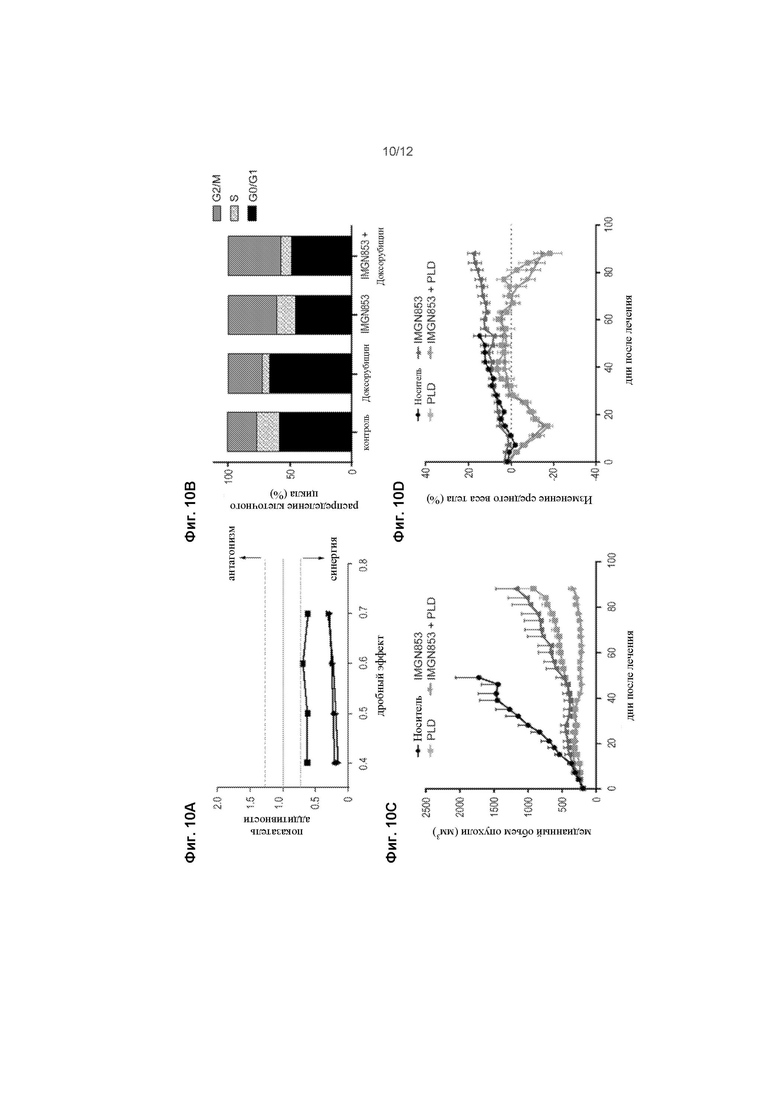
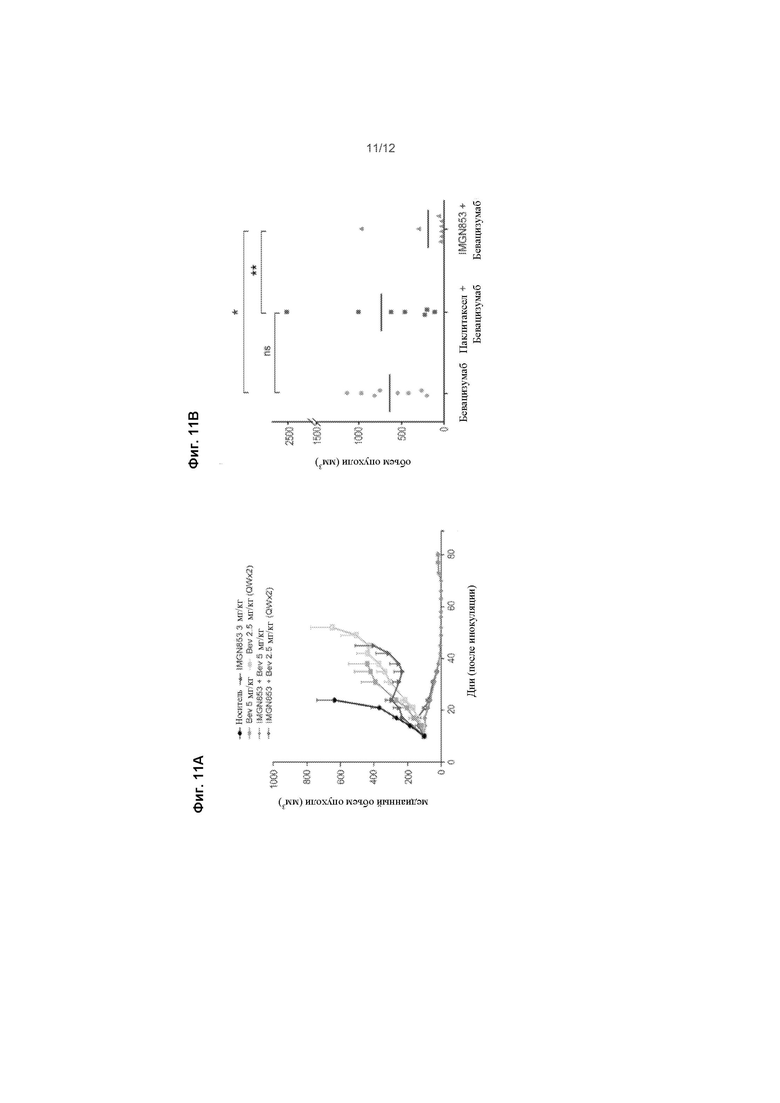

Изобретение относится к области биохимии, в частности к способу лечения пациента, больного раком, экспрессирующим рецептор фолиевой кислоты 1 (FOLR1), включающему введение указанному пациенту, нуждающемуся в этом, иммуноконъюгата, который связывается с FOLR1, а также бевацизумаба, карбоплатина или пегидированного липосомального доксорубицина (PLD). Также раскрыт способ лечения пациента, больного FOLR1-экспрессирующим раком, включающий введение указанному пациенту, нуждающемуся в этом, иммуноконъюгата, который связывается с FOLR1, а также бевацизумаба, бевацизумаба и пегилированного липосомального доксорубицина (PLD) или карбоплатина и пегилированного липосомального доксорубицина. Изобретение может быть эффективно использовано в комбинированных терапиях, нацеленных на экспрессирующие FOLR1 опухолевые клетки, для лечения рака. 2 н. и 34 з.п. ф-лы, 4 табл., 13 пр., 12 ил.
1. Способ лечения пациента, больного раком, экспрессирующим рецептор фолиевой кислоты 1 (FOLR1), включающий введение указанному пациенту, нуждающемуся в этом,
(а) иммуноконъюгата, который связывается с FOLR1, причем указанный иммуноконъюгат содержит (i) антитело или его антигенсвязывающий фрагмент, содержащий последовательность SEQ ID NO: 9 или 19 определяющей комплементарность области (CDR)1 вариабельной области тяжёлой цепи (VH), последовательность SEQ ID NO: 10 или 11 CDR2 VH и последовательность SEQ ID NO: 12 CDR3 VH, и последовательность SEQ ID NO: 6 CDR1 вариабельной области лёгкой цепи (VL), последовательность SEQ ID NO: 7 CDR2 VL, последовательность SEQ ID NO: 8 CDR3 VL, и (ii) майтанзиноид, причем указанный майтанзиноид связан с антителом или его антигенсвязывающим фрагментом посредством N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноата (сульфо-SPDB), и
(b) (i) бевацизумаба, (ii) карбоплатина или (iii) пегилированного липосомального доксорубицина (PLD).
2. Способ по п. 1, отличающийся тем, что иммуноконъюгат вводят в комбинации с бевацизумабом.
3. Способ по п. 1, отличающийся тем, что иммуноконъюгат вводят в комбинации с карбоплатином.
4. Способ по п. 1, отличающийся тем, что иммуноконъюгат вводят в комбинации с пегилированным липосомальным доксорубицином (PLD).
5. Способ лечения пациента, больного FOLR1-экспрессирующим раком, включающий введение указанному пациенту, нуждающемуся в этом,
(а) иммуноконъюгата, который связывается с FOLR1, причем указанный иммуноконъюгат содержит (i) антитело или его антигенсвязывающий фрагмент, содержащий последовательность SEQ ID NO: 9 определяющей комплементарность области (CDR)1 вариабельной области тяжёлой цепи (VH), последовательность SEQ ID NO: 10 CDR2 VH и последовательность SEQ ID NO: 12 CDR3 VH, и последовательность SEQ ID NO: 6 CDR1 вариабельной области лёгкой цепи (VL), последовательность SEQ ID NO: 7 CDR2 VL, последовательность SEQ ID NO: 8 CDR3 VL, и (ii) майтанзиноид, причем указанный майтанзиноид связан с антителом или его антигенсвязывающим фрагментом посредством N-сукцинимидил-4- (2-пиридилдитио)-2-сульфобутаноата (сульфо-SPDB), и
(b) (i) бевацизумаба;
(ii) бевацизумаба и пегилированного липосомального доксорубицина (PLD); или
(iii) карбоплатина и пегилированного липосомального доксорубицина (PLD).
6. Способ по любому из пп. 1-5, отличающийся тем, что иммуноконъюгат, который связывается с FOLR1, содержит антитело или его антигенсвязывающий фрагмент, который содержит VH, содержащую последовательность SEQ ID NO: 3, и VL, содержащую последовательность SEQ ID NO: 5.
7. Способ по любому из пп. 1-6, отличающийся тем, что иммуноконъюгат содержит антитело, содержащее (i) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13, и (ii) a легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 15, и при этом майтанзиноид представляет собой DM4.
8. Способ по любому из пп. 1-7, отличающийся тем, что иммуноконъюгат содержит антитело, содержащее (i) тяжелую цепь, содержащую аминокислотную последовательность, идентичную аминокислотной последовательности тяжелой цепи, кодируемой плазмидой, депонированной в Американской коллекции типовых культур (ATCC) под номером PTA-10772, и (ii) легкую цепь, содержащую аминокислотную последовательность, идентичную аминокислотной последовательности легкой цепи, кодируемой плазмидой, депонированной в Американской коллекции типовых культур (ATCC) под номером PTA-10774, и при этом майтанзиноид представляет собой DM4.
9. Способ по любому из пп. 1-6, отличающийся тем, что майтанзиноид представляет собой DM4.
10. Способ по любому из пп. 1-9, отличающийся тем, что иммуноконъюгат вводят один раз каждые три недели в дозе 6 мг/кг скорректированного идеального веса тела (AIBW).
11. Способ по любому из пп. 1-9, отличающийся тем, что иммуноконъюгат вводят один раз каждые четыре недели в дозе 5 мг/кг скорректированного идеального веса тела (AIBW) или один раз каждые четыре недели в дозе 6 мг/кг скорректированного идеального веса тела (AIBW).
12. Способ по любому из пп. 1-9, характеризующийся тем, что иммуноконъюгат вводят один раз каждые три недели в дозе 5 мг/кг AIBW.
13. Способ по любому из пп. 1, 2 или 5-12, отличающийся тем, что бевацизумаб вводят один раз каждые три недели в дозе 15 мг/кг.
14. Способ по любому из пп. 1, 2 или 5-12, отличающийся тем, что бевацизумаб вводят два раза каждые четыре недели в дозе 10 мг/кг.
15. Способ по любому из пп. 1, 3 или 5-12, отличающийся тем, что карбоплатин вводят один раз каждые три недели в дозе, дающей площадь под кривой (AUC) 5 мг/мл·мин или 6 мг/мл·мин.
16. Способ по любому из пп. 1 или 4-12, отличающийся тем, что PLD вводят один раз каждые четыре недели в дозе 40 мг/м2 или один раз каждые четыре недели в дозе 30 мг/м2.
17. Способ по любому из пп. 1-16, отличающийся тем, что иммуноконъюгат содержит от примерно 1 майтанзиноида на антитело до примерно 8 майтанзиноидов на антитело, при этом необязательно иммуноконъюгат содержит от примерно 3 майтанзиноидов на антитело до примерно 4 майтанзиноидов на антитело.
18. Способ по любому из пп. 1-17, который дополнительно включает введение пациенту стероида, причем стероид вводят в глазной капле.
19. Способ по любому из пп. 1-18, отличающийся тем, что рак представляет собой рак яичников, перитонеальный рак, рак фаллопиевых труб, рак эндометрия или рак легких.
20. Способ по п. 19, отличающийся тем, что рак яичников является устойчивым к препаратам платины.
21. Способ по любому из пп. 1-20, отличающийся тем, что экспрессию FOLR1 измеряют с помощью иммуногистохимии (ИГХ).
22. Способ по п. 21, отличающийся тем, что по меньшей мере 50% клеток в образце, полученном от пациента, имеют иммуногистохимический показатель (ИГХ), равный по меньшей мере 2.
23. Способ по п. 21, отличающийся тем, что по меньшей мере 75% клеток в образце, полученном от пациента, имеют иммуногистохимический показатель (ИГХ), равный по меньшей мере 2.
24. Способ по п. 21, отличающийся тем, что по меньшей мере 50% клеток в образце, полученном от пациента, имеют иммуногистохимический показатель (ИГХ), равный по меньшей мере 3.
25. Способ по п. 21, отличающийся тем, что по меньшей мере 75% клеток в образце, полученном от пациента, имеют иммуногистохимический показатель (ИГХ), равный по меньшей мере 3.
26. Способ по любому из пп. 1-25, отличающийся тем, что иммуноконъюгат и бевацизумаб, карбоплатин, пегилированный липосомальный доксорубицин (PLD), или их комбинацию вводят в отдельных фармацевтических композициях.
27. Способ по любому из пп. 1-26, отличающийся тем, что рак ранее лечили бевацизумабом.
28. Способ по любому из пп. 1-26, отличающийся тем, что рак ранее не лечили бевацизумабом.
29. Способ по любому из пп. 1-28, отличающийся тем, что рак является первично невосприимчивым к лечению препаратами платины.
30. Способ по любому из пп. 1-28, отличающийся тем, что рак устойчив к препаратам платины.
31. Способ по любому из пп. 1-19 и 21, отличающийся тем, что рак является чувствительным к препаратам платины.
32. Способ по любому из пп. 1-26 или 28-31, отличающийся тем, что введение представляет собой терапию первой линии.
33. Способ по любому из пп. 1-31, отличающийся тем, что введение представляет собой терапию второй линии.
34. Способ по любому из пп. 1-31, отличающийся тем, что введение представляет собой терапию третьей линии.
35. Способ по любому из пп. 1-31, отличающийся тем, что введение представляет собой терапию четвертой линии.
36. Способ по любому из пп. 1-31, отличающийся тем, что пациент получил 4 линии терапии до указанного введения.
| WO2015054400 A2, 16.04.2015 | |||
| WO2006090928 A1, 31.08.2006 | |||
| US2012009181 A1, 12.01.2012 | |||
| WO2012138749 A1, 11.10.2012 | |||
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF) | 2008 |
|
RU2514148C2 |
Авторы
Даты
2021-06-17—Публикация
2016-09-16—Подача