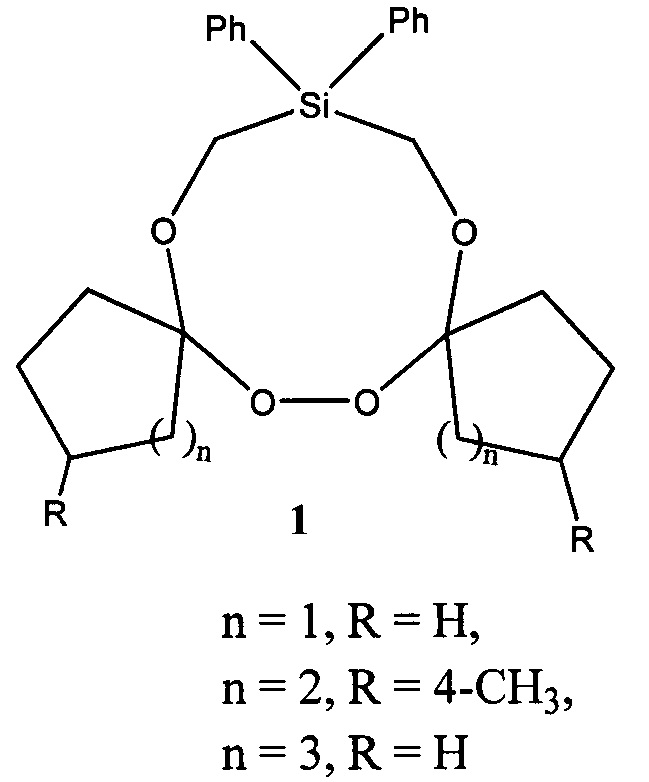
Предлагаемое изобретение относится к области органической химии, конкретно, к дифенилтетраоксасиладиспироалканам общей формулы (1) и способу их получения.
Кремнийсодержащие органические пероксиды широко применяются при получении полимеров (W. von Hahn, Metzinger L. Makromol. Chem. 1956, 21, 113-119. Semchikov Yu.D., Kopylova N.A., Yablokova N.Y., Nistratova L.N. Eur. Polym. J. 1986, 22, 569. Терман Л.М., Бревнова Т.Н., Сутина О.Д., Семенов В.В., Ганюшкин А.В. Изв. АН СССР. Сер. хим. 1980, 629. Сапожников Д.А., Сахарова А.А., Волкова Т.В., Никулина A.M., Терентьев А.О., Борисов Д.А., Афоничева О.В., Коростылев Е.В., Выгодский Я.С.. Изв. АН. Сер. Физ., 2010, 1081. Копылова Н.А., Кабанова Е.Г., Яблокова Н.В., Семчиков Ю.Д., Пузанкова В.А. Высокомол. соединения. Сер. А, 1981, 31, 301. Фомин В.А., Петрухин И.В. Журн. общ. химии, 1997, 67, 6321), в качестве реагентов гидроксилирования (Taddei М., Ricci A. Synthesis, 1986, 633. Camici L., Dembech P., Ricci A., Seconi G., Taddei M. Tetrahedron, 1988, 44, 4197. Davis F.A., Lal G.S., Wei J. Tetrahedron Lett., 1988, 29, 4269), пероксидирования (Dussault P.H., Lee I.Q., Lee H.-J., Lee R.J., Niu Q.J., Schultz J.A., Zope U.R.. J. Org. Chem., 2000, 65, 8407. Ahmed A., Dussault P.H. Tetrahedron, 2005, 61, 4657. Dai P., Dussault P.H. Org. Lett., 2005, 7, 4333. Dai P., Trullinger Т.K., Liu X., Dussault P.H. J. Org. Chem., 2006, 71, 2283.) и окисления (Camporeale M., Fiorani Т., Troisi L., Adam W., Curci R., Edwards J.O. J. Org. Chem., 1990, 55, 93. Ahmed A., Dussault P.H. Tetrahedron, 2005, 61, 4657).
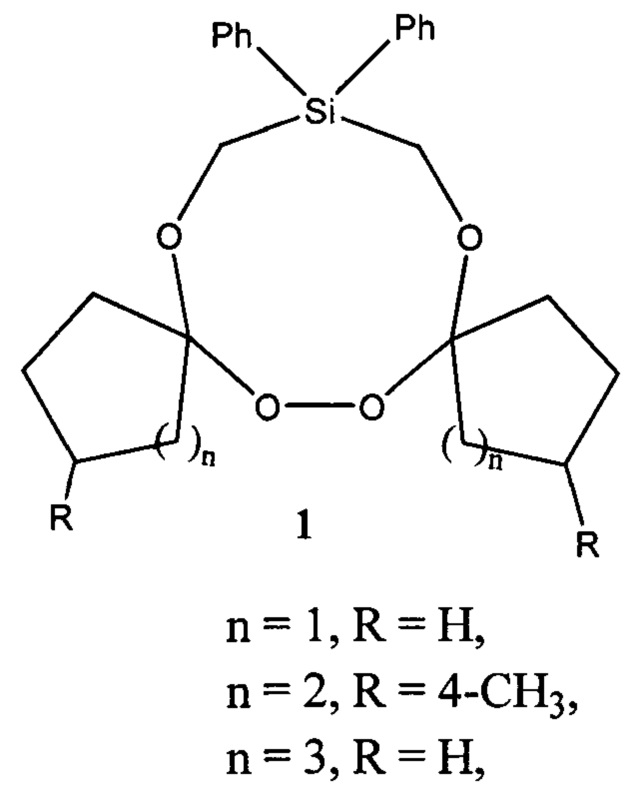
Известен способ получения 1,2,4,5,7,8-гексаоксасилонанов формулы 4, основанный на реакции диалкилдихлорсиланов 3 с 1,1'-бис(гидроперокси)пероксидами 2 в присутствии оснований (Terent'ev А.О., Platonov М.М., Tursina A.I., Chernyshev V.V., Nikishin G.I. J. Org. Chem., 2008, 73, 3169) по схеме:
Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
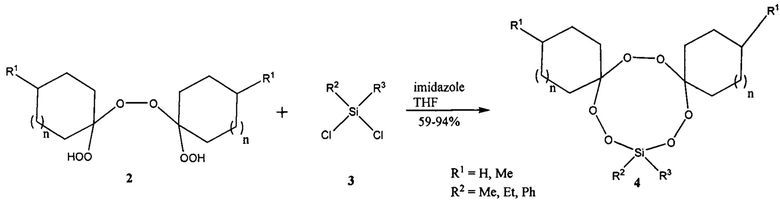
Известен способ получения 9-членных 1,2,7,8-тетраокса-3,6-дисилонанов 7a-h с выходом до 95% конденсацией 1,2-бис(диметилхлорсилил)этана 6 с гем-бисгидропероксидами 5 в присутствии 2.1 эквивалентов имидазола (Arzumanyan A.V., Novikov R.A., Terent'ev А.О., Platonov M.M., Lakhtin V.G., Arkhipov D.E., Korlyukov A.A., Chernyshev V.V., Fitch A.N., Zdvizhkov A.T., Krylov I.B., Tomilov Y.V., Nikishin G.I. Organometallics 2014, 33, 2230).
Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
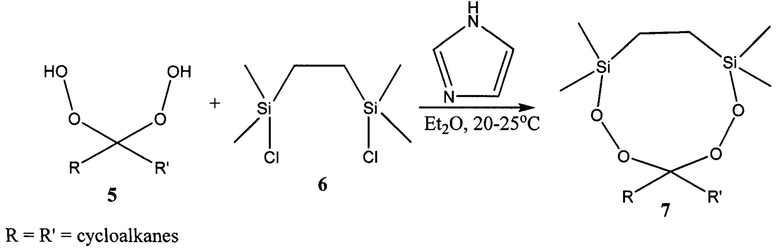
Известен способ получения 12-членных циклических пероксидов 10а-с с выходом 77-90% взаимодействием 1,1'-дигидропероксипероксидов 8а-с с дихлордисиланом 9 в присутствии имидазола (Arzumanyan A.V., Novikov R.A., Terent'ev А.О., Platonov M.M., Lakhtin V.G., Arkhipov D.E., Korlyukov A.A., Chernyshev V.V., Fitch A.N., Zdvizhkov A.T., Krylov I.B., Tomilov Y.V., Nikishin G.I. Organometallics 2014, 33, 2230).
Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
Известен способ получения 18-членных Si-содержащих тетрапероксидов 12 из 1,2-бис(диметилхлорсилил)этена 11 и 1,1-бис(гидроперокси)-4-трет-бутилциклогексана 5с в присутствии имидазола (Arzumanyan A.V., Novikov R.A., Terent'ev А.О., Platonov M.M., Lakhtin V.G., Arkhipov D.E., Korlyukov A.A., Chernyshev V.V., Fitch A.N., Zdvizhkov A.T., Krylov I.B., Tomilov Y.V., Nikishin G.I. Organometallics 2014, 33, 2230).

Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
Известен способ получения гексасиланонапероксида 14 (30%) в смеси с тетрасилагексапероксидом 15 (50%) реакцией бис(диметилхлорсилил)этина 13 с 1,1'-дигидропероксиди(циклогептил)пероксидом 8b в присутствии имидазола (Arzumanyan A.V., Novikov R.A., Terent'ev А.О., Platonov M.M., Lakhtin V.G., Arkhipov D.E., Korlyukov A.A., Chernyshev V.V., Fitch A.N., Zdvizhkov A.T., Krylov I.B., Tomilov Y.V., Nikishin G.I. Organometallics 2014, 33, 2230). Пероксиды 14 и 15 малостабильные соединения, самопроизвольно разлагаются за 1-2 суток при хранении в реакционной массе в ЯМР-ампуле даже при температурах ниже 0°С.
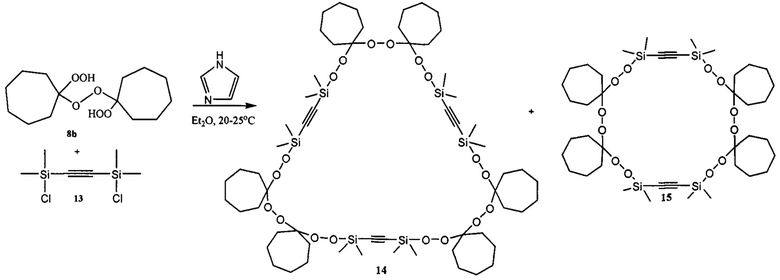
Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
Известен способ получения силамакропероксидов, содержащих два 9-членных циклов, соединенных -СН2-СН2-, -СН=СН- и -С≡С-мостиком 20а,b, 21-23 взаимодействием тетрахлордисиланов 16а, 17b, 18, 19 с дигидропероксипероксидами 8а-с в диэтиловом эфире при температуре 20-25°С с использованием имидазола в качестве основания (Arzumanyan A.V., Terent'ev А.О., Novikov R.A., Lakhtin V.G., Chernyshev V.V., Fitch A.N., Nikishin G.I.. Eur. J. Org. Chem. 2014, 6877).
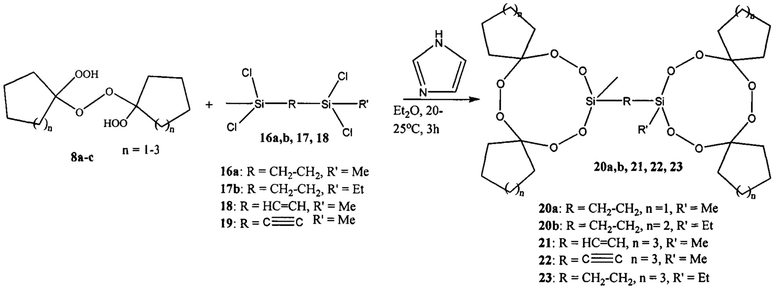
Известным способом не могут быть получены дифенилтетраоксасиладиспироалканы общей формулы (1).
Таким образом, в литературе отсутствуют сведения о способах получения дифенилтетраоксасиладиспироалканов формулы (1).
Предлагается новый способ селективного получения дифенилтетраоксасиладиспироалканов общей формулы (1).
Сущность способа заключается во взаимодействии дифенилгексаоксасиладиспироалкана (16,16-дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекан, или 3,12-диметил-18,18-дифенил-7,8,15,16,20,21-гексаокса-18-силадиспиро[5.2.59.76]геникозан, или 20,20-дифенил-8,9,17,18,22,23-гексаокса-20-силадиспиро[6.2.610.77]трикозан) с трифенилфосфином, взятыми в мольном соотношении дифенилгексаоксасиладиспироалкан : PPh3=10:10 при комнатной температуре (~20°С) и атмосферном давлении в диэтиловом эфире в качестве растворителя в течение 4-6 ч, предпочтительно 5 ч. Выход дифенилтетраоксасиладиспироалканов (1) составляет 65-76%. Реакция проходит по схеме:
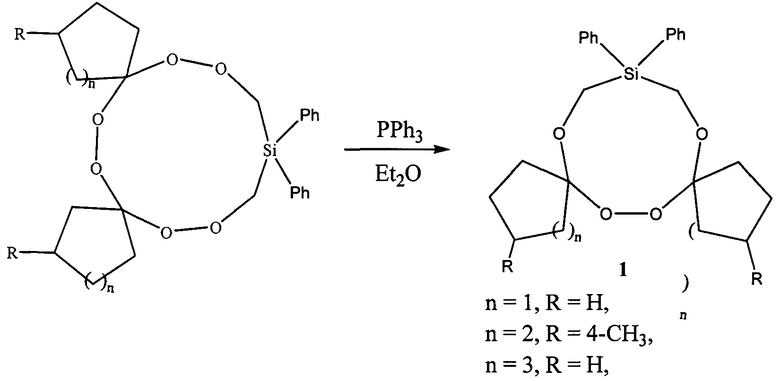
Дифенилтетраоксасиладиспироалканы (1) образуются только лишь с участием дифенилгексаоксасиладиспироалканов и трифенилфосфина. В присутствии других восстановителей (например, тиомочевины) целевые продукты (1) не образуются. Без катализатора реакция не идет.
Реакции проводили при температуре 20°С. При температуре выше 20°С (например, 60°С) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 20°С (например, -10°С) снижается скорость реакции. Опыты проводили в диэтиловом эфире, т.к. в нем хорошо растворяются исходные реагенты.
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходных соединений 1,1'-дигидропероксипероксидов с дихлордисиланом в присутсвии 2.1 эквивалента имидазола. Способ не позволяет получать дифенилтетраоксасиладиспироалканы общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются дифенилгексаоксасиладиспироалканы и трифенилфосфин. В отличие от известных предлагаемый способ позволяет получать индивидуальные дифенилтетраоксасиладиспироалканы общей формулы (1).
Способ поясняется следующими примерами:
ПРИМЕР 1. Синтез исходного бис(метоксиметил)дифенилсилана (получен по методике: Tacke, Reinhold; Link, Matthias; Bentlage-Felten, Anke; Zilch, Harald. Zeitschrift fuer Naturforschung, Teil B: Anorganische Chemie, Organische Chemie, 1985, 40B(7), 942). В круглодонную колбу, снабженной обратным холодильником помещают 0.7 г (4 ммоль) дифенилсилана, 0.24 г (8 ммоль) параформа и 20 мл СН3ОН кипятят в течении 3 часов до полного растворения параформа. Из реакционной массы выделяют бис(метоксиметил)дифенилсилана с выходом 95%.
ПРИМЕР 2. Синтез исходного 1,1'-перокси-бис-(1-гидропероксициклопентан) (получен по методике: Разуваев Г.А., Этлис B.C., Кириллов Н.И., Сакмарина Е.М. Высокомол. соединения, 1961, 8, 1176-1180). В реактор с мешалкой и капельной воронкой загружали смесь из 9.87 г (90 ммоль) 31% р-ра Н2О2, 0.9 г (25 ммоль) конц HCl и 7.35 мл воды и при перемешивании и охлаждении льдом прикапывали 2.52 г (30 ммоль) циклопентанон. Из реакционной массы выделяют 1,1'-перокси-бис-(1-гидропероксициклопентан) с выходом 83%.
ПРИМЕР 3. Синтез исходного 16,16-дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекана. В сосуд Шленка, установленный на магнитной мешалке, помещают 5 мл тетрагидрофурана, 2.34 г (10 ммоль) 1,1'-перокси-бис-(1-гидропероксициклопентан (получен по методике: Разуваев Г.А., Этлис B.C., Кириллов Н.И., Сакмарина Е.М. Высокомол. соединения, 1961, 8, 1176-1180), 0.02 г (0.05 ммоль) La(NO3)3⋅6H2O и 2.72 г (10 ммоль) бис(метоксиметил)дифенилсилана (получен по методике: Tacke, Reinhold; Link, Matthias; Bentlage-Felten, Anke; Zilch, Harald. Zeitschrift fuer Naturforschung, Teil B: Anorganische Chemie, Organische Chemie, 1985, 40B(7), 942) перемешивают в течение 5 часов при 20°С. Из реакционной массы выделяют 16,16-дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекан с выходом 66%.
ПРИМЕР 4. В сосуд Шленка, установленный на магнитной мешалке, помещают 5 мл диэтилового эфира, 4.98 г (10 ммоль) 16,16-дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекан, 2.62 г (10 ммоль) трифенилфосфина, перемешивают в течение 5 часов при 20°С. Из реакционной массы выделяют 15,15-дифенил-6,7,13,17-тетраокса-15-силадиспиро[4.2.48.55]гептадекан с выходом 74%.
Другие примеры, подтверждающие способ, приведены в табл. 1.
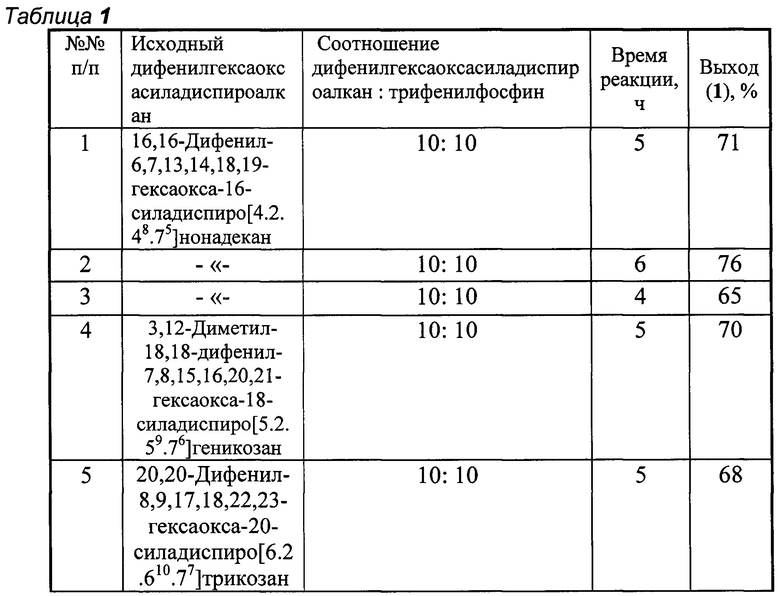
Все опыты проводили в тетрагидрофуране при комнатной температуре (~20°С).
16,16-Дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекан (19). Б/ц масло; Rf 0.79 (PE/Et2O=10/1). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.69-1.76 м (8Н, СН2), 1.85-2.05 м (8Н, СН2), 4.08-4.22 м (4Н, СН2), 7.22-7.46 м (4Н, СН), 7.63-7.71 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.5, 33.1, 62.0, 116.0, 121.1, 127.9, 130.3, 134.3. MALDI TOF/TOF, m/z: 441 [М-Н]+. Найдено, % С, 65.11; Н, 6.81. C24H30O6Si. Вычислено, %: С, 65.13; Н, 6.83%.
3,12-Диметил-18,18-дифенил-7,8,15,16,20,21-гексаокса-18-силадиспиро[5.2.59.76]геникозан (20). Б/ц масло; Rf 0.79 (PE/Et2O=10/1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.03-1.04 м (6Н, СН3), 1.36-1.44 м (8Н, СН2), 1.67-1.70 м (8Н, СН2), 4.07-4.19 м (4Н, СН2), 7.30-7.45 м (4Н, СН), 7.65-7.70 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 21.0, 31.3, 34.8, 40.8, 60.5, 117.0, 127.8, 130.2, 134.4, 135.2. MALDI TOF/TOF, m/z: 497 [М-Н]+. Найдено, % С, 67.42; Н, 7.65. C28H38O6Si. Вычислено, % С, 67.44; Н, 7.68.
20,20-Дифенил-8,9,17,18,22,23-гексаокса-20-силадиспиро[6.2.610.77]трикозан (21). Б/ц масло Rf 0.80 (PE/Et2O=10/1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.46-1.74 м (16Н, СН2), 1.84-2.07 м (8Н, СН2), 4.02-4.17 м (4Н, СН2), 7.35-7.47 м (4Н, СН), 7.67-7.74 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.7, 25.7, 27.2, 61.3, 116.7, 127.9, 130.5, 134.4, 135.1. MALDI TOF/TOF, m/z: 497 [М-Н]+. Найдено, % С, 67.44; Н, 7.68. C28H38O6Si: вычислено, % С, 67.42; Н, 7.66.
15,15-Дифенил-6,7,13,17-тетраокса-15-силадиспиро[4.2.48.55]гептадекан. Белый порошок; Tпл 96-97°С, Rf 0.70 (PE/Et2O=10/1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.65-1.70 м (8Н, СН2), 1.83-2.00 м (8Н, СН2), 4.00-4.05 м (4Н, СН2), 7.20-7.44 м (4Н, СН), 7.61-7.70 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.4, 33.0, 59.7, 116.0, 126.9, 127.8, 130.5, 134.6. MALDI TOF/TOF, m/z: 409 [М-Н]+. Найдено, % С, 70.19; Н, 7.35. C24H30O4Si. Вычислено, %: С, 70.21; Н, 7.37.
3,12-Диметил-17,17-дифенил-7,8,15,19-тетраокса-17-силадиспиро[5.2.59.56]нонадекан. Белый порошок; Тпл 83-84°С, Rf 0.75 (PE/Et2O=10/1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.02-1.03 м (6Н, СН3), 1.34-1.44 м (8Н, СН2), 1.67-1.70 м (8Н, СН2), 3.97-4.00 м (4Н, СН2), 7.33-7.45 м (4Н, СН), 7.68-7.70 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 21.0, 31.3, 34.8, 40.8, 60.5, 117.0, 127.8, 130.2, 134.4, 135.2. MALDI TOF/TOF, m/z: 465 [М-Н]+. Найдено, % С, 72.04; Н, 8.20. C28H38O4Si. Вычислено, %: С, 72.06; Н, 8.21.
19,19-Дифенил-8,9,17,21-тетраокса-19-силадиспиро[6.2.610.57]геникозан. Белый порошок; Tпл 93-94°С, Rf 0.72 (PE/Et2O=10/1). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.44-1.69 м (16Н, СН2), 1.83-2.02 м (8Н, СН2), 3.92-4.01 м (4Н, СН2), 7.30-7.45 м (4Н, СН), 7.65-7.71 м (6Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.3, 26.1, 27.0, 58.9, 116.0, 127.0, 130.2, 134.5, 135.0. MALDI TOF/TOF, m/z: 465 [М-Н]+. Найдено, % С, 72.03; Н, 8.19. C28H38O4Si. Вычислено, %: С, 72.06; Н, 8.21.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИФЕНИЛГЕКСАОКСАСИЛАДИСПИРОАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2750321C1 |
| ДИФЕНИЛТЕТРАОКСАСИЛАСПИРОАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2751035C1 |
| 3,3-ДИАЛКИЛ-7,7-ДИФЕНИЛ-1,2,4,5,7-ТЕТРАОКСАСИЛОКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2770047C1 |
| Замещенные трициклические органические монопероксиды и способ их получения | 2020 |
|
RU2752760C1 |
| Способ получения трициклических органических дипероксидов | 2020 |
|
RU2752957C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕКСАОКСАТИОДИСПИРОАЛКАНОВ | 2020 |
|
RU2739314C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛ-N,N-ДИ(АЛКАДИИНИЛ)АМИНОВ | 2015 |
|
RU2626008C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИС-(1,5,3-ДИТИАЗЕПАН-3-ИЛ)ЦИКЛОГЕКСАНОВ | 2014 |
|
RU2574069C1 |
| N,N'-ДИ(АЛКАДИИНИЛ)ДИАЗАЦИКЛОАЛКАНЫ И СПОСОБ ПОЛУЧЕНИЯ N,N'-ДИ(АЛКАДИИНИЛ)ДИАЗАЦИКЛОАЛКАНОВ, ПРОЯВЛЯЮЩИХ ФУНГИЦИДНУЮ АКТИВНОСТЬ ПО ОТНОШЕНИЮ К ГРИБАМ Bipolaris sorokiniana и Rhizoctonia solani | 2019 |
|
RU2727138C1 |
Изобретение относится к области органической химии, к способам получения кремнийсодержащих органических пероксидов. Предложены дифенилтетраоксасиладиспироалканы формулы (1) и способ их получения взаимодействием дифенилгексаоксасиладиспироалканов с трифенилфосфином. Технический результат - возможность селективного получения соединений формулы (1) с хорошим выходом. Предложенные дифенилтетраоксасиладиспироалканы могут быть использованы при получении полимеров, в качестве реагентов гидроксилирования, пероксидирования и окисления. 2 н.п. ф-лы, 1 табл., 4 пр.
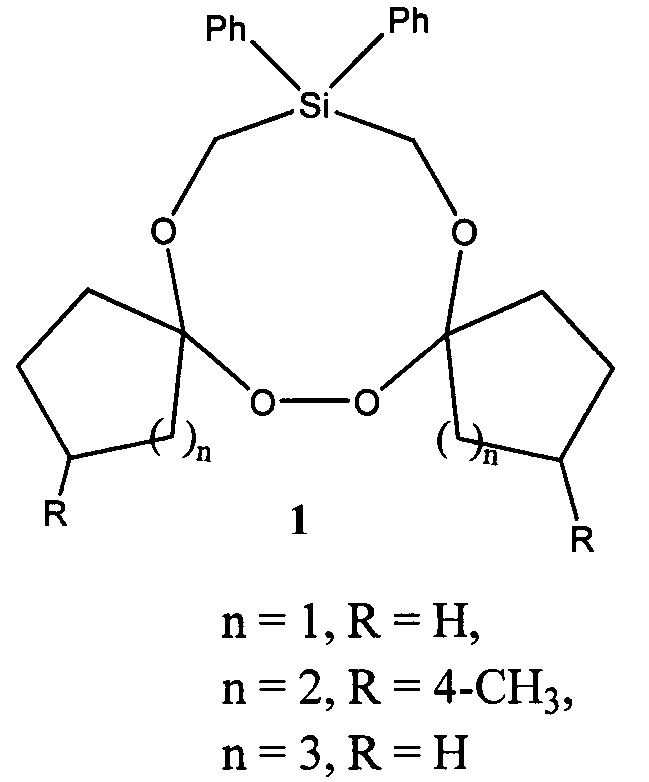
1. Дифенилтетраоксасиладиспироалкан общей формулы (1):
2. Способ получения дифенилтетраоксасиладиспироалканов (1), отличающийся тем, что дифенилгексаоксасиладиспироалканы (16,16-дифенил-6,7,13,14,18,19-гексаокса-16-силадиспиро[4.2.48.75]нонадекан или 3,12-диметил-18,18-дифенил-7,8,15,16,20,21-гексаокса-18-силадиспиро[5.2.59.76]геникозан или 20,20-дифенил-8,9,17,18,22,23-гексаокса-20-силадиспиро[6.2.610.77]трикозан) подвергают взаимодействию с трифенилфосфином при мольном соотношении дифенилгексаоксасиладиспироалкан : PPh3=10:10, при комнатной температуре (~20°С) и атмосферном давлении в тетрагидрофуране в качестве растворителя в течение 4-6 ч.
| Arzumanyan A.V | |||
| et al | |||
| Six peroxide groups in one molecule - synthesis of nine-membered bicyclic silyl peroxides | |||
| Eur | |||
| J | |||
| Org | |||
| Chem., 2014, vol.31, p.6877 | |||
| Arzumanyan A.V | |||
| et al | |||
| Synthesis of silicon-containing macrocyclic peroxides | |||
| Organometallics, 2014, vol.33 | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Арзуманян А.В | |||
| Новые классы циклических кремнийорганических | |||
Авторы
Даты
2021-06-25—Публикация
2020-11-02—Подача