ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке испрашивается приоритет согласно предварительной заявке на патент США №62/710327, поданной 16 февраля 2018 г. и предварительной заявке на патент США №62/710333, поданной 16 февраля 2018 г., и предварительной заявке на патент США №62/710362, поданной 16 февраля 2018 г., и предварительной заявке на патент США №62/710461, поданной 16 февраля 2018 г.; причем полное содержание всех данных заявок тем самым включается в данный документ посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В большинстве современных платформ секвенирования используются технология «секвенирования посредством синтеза» (SBS) и основанные на флуоресценции способы выявления. В качестве дополнений SBS желательны альтернативные способы секвенирования, которые обеспечивают более дешевое, быстрое и удобное секвенирование и выявление нуклеиновых кислот. Привлекательным подходом является секвенирование на основе заряда.
В современной технологии секвенирования посредством синтеза (SBS) используются нуклеотиды, которые модифицированы в двух положениях: 1) 3'-гидроксил (3'-ОН) дезоксирибозы и 2) 5-положение пиримидинов или 7-положение пуринов азотистых оснований (А, Т, С, G). 3'-ОН группа блокируется азидометильной группой для создания обратимых нуклеотидных терминаторов. Это может предотвращать дальнейшую элонгацию после добавления одиночного нуклеотида. Каждое из азотистых оснований отдельно модифицируется флуорофором для обеспечения флуоресцентной индикации, которая идентифицирует включение одного основания. Затем 3'-ОН блокирующая группа и флуорофор удаляются, и цикл повторяется.
Современная цена модифицированных нуклеотидов может быть высокой из-за синтетических сложностей модификации как 3'-ОН дезоксирибозы, так и азотистого основания. Есть несколько возможных способов уменьшения цены модифицированных нуклеотидов. Одним способом является перемещение считываемой метки на 5'-концевой фосфат вместо азотистого основания. В одном примере это устраняет потребность в отдельной стадии расщепления и обеспечивает выявление прибывающего нуклеотида в реальном времени. Во время включения пирофосфат вместе с меткой высвобождается в качестве побочного продукта процесса элонгации, таким образом, не участвует расщепляемая связь.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Приведенные в данном документе примеры включают способ выявления нуклеотида, включенного в растущую полинуклеотидную нить полимеразой, и композиции для применения в указанном способе. Одним примером, приведенным в данном документе, является способ выявления, с использованием проводящего канала, нуклеотида, несущего заряженную метку, во время такого включения и соединений таких нуклеотидов с такими заряженными метками. В одном примере предложены нуклеотиды, имеющие заряженные метки, включающие фосфодиэфирные группы, аминокислоты, дендронную архитектуру и другие архитектурные структуры, которые увеличивают плотность заряда, способы связывания нуклеотидов с заряженными метками с увеличенной плотностью заряда и способы применения нуклеотидов, имеющих заряженные метки с увеличенной плотностью заряда.
В одном аспекте предложен способ, включающий выявление включения меченого нуклеотида в растущую полинуклеотидную нить, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, где данная полимераза связана с проводящим каналом твердой подложки посредством связки, причем меченый нуклеотид представляет собой соединение Формулы I
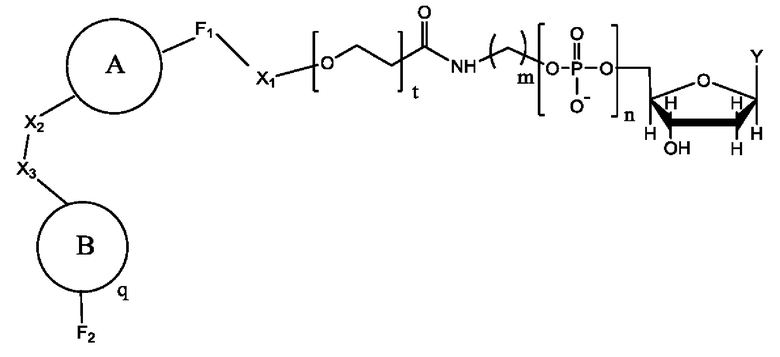
в которой n представляет собой целое число от 3 до 10, m представляет собой целое число от 1 до 10, t представляет собой целое число от 0 до 50, X1 представляет собой прямую связь, С1-С10алкил, С1-С10оксаалкил, С1-С10тиаалкил или С1-С10азаалкил, Х2 представляет собой С1-С20алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, Х3 представляет собой прямую связь или олигонуклеотид, где данный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала, F1, выбран из флуорофора и прямой связи, и F2 отсутствует или представляет собой флуорофор,
А представляет собой 
 или амидную связь, и
или амидную связь, и
Y выбран из 
и  q представляет собой целое число от 1 до 100, и
q представляет собой целое число от 1 до 100, и
В выбран из аминокислоты, нуклеотида, 
где R выбран из Y, водорода и дендрона; и где q равен 1, когда В представляет собой дендрон, и число q В имеет заряд и плотность заряда, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
В одном примере заряд составляет от примерно -100е до примерно +100е. В другом примере плотность заряда составляет от примерно -100е на кубический нанометр до примерно +100е на кубический нанометр. В еще одном другом примере заряд составляет от примерно -200е до примерно +200е. В еще одном другом примере плотность заряда составляет от примерно -200е на кубический нанометр до примерно +200е на кубический нанометр.
В другом примере число q В включает полинуклеотид. В еще одном другом примере полинуклеотид выбран из разветвленного полинуклеотида и одной или более чем одной петли шпильки. В еще одном другом примере полинуклеотид включает от двух до пяти петель шпильки.
В другом примере число q В включает полипептид. В еще одном другом примере полипептид выбран из группы, состоящей из разветвленного полипептида, спирального полипептида и суперспирального полипептида. В еще одном другом примере В включает аминокислоту, и одно или более чем одно число q В включает метиллизин, диметиллизин или триметиллизин.
В другом примере В представляет собой дендрон z поколений, включающий одно или более чем одно составное повторяющееся звено и множество концевых звеньев, где z представляет собой целое число от 1 до 6, причем составные концевые звенья выбраны из:

где
p1 представляет собой целое число от 1 до 3, где любая одна или более чем одна из p1 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-, р2 представляет собой целое число от 1 до 3, где любая одна или более чем одна из р2 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-, и концевые группы выбраны из карбоновой кислоты, сульфоновой кислоты, фосфоновой кислоты, сперминильной группы, аминогруппы и четвертичной аммонийной группы.
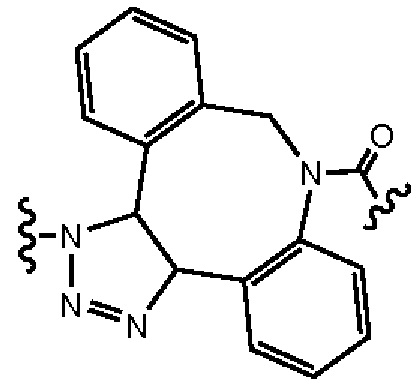
В еще одном другом примере А образовался реакцией, включающей реакцию связывания, и данная реакция связывания выбрана из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол-малеимид.
В еще одном другом примере данный способ дополнительно включает последовательное включение множества меченых нуклеотидов, где заряд каждого из множества меченых нуклеотидов отличается от заряда любого другого из множества меченых нуклеотидов, когда Y каждого и Y любого другого отличаются друг от друга. В другом примере данный способ дополнительно включает идентификацию Y одного или более чем одного меченого поли нуклеотида, включенного в растущую полинуклеотидную нить, на основе заряда, выявленного проводящим каналом.
В еще одном другом примере Х2 представляет собой (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24. В одном примере а равен 24. В другом примере а равен 12. В другом примере а равен 8. В еще одном другом примере а равен 4.
В другом аспекте предложен способ, включающий выявление включения меченого нуклеотида в растущую полинуклеотидную нить, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, где данная полимераза связана с проводящим каналом твердой подложки посредством связки, причем меченый нуклеотид представляет собой соединение Формулы I

в которой n представляет собой целое число от 3 до 10, m представляет собой целое число от 1 до 10, t представляет собой целое число от 0 до 50, X1 представляет собой прямую связь, С1-С10алкил, С1-С10оксаалкил, С1-С10тиаалкил или С1-С10азаалкил, Х2 представляет собой С1-С20алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, Х3 представляет собой прямую связь или олигонуклеотид, где данный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала, F1, выбран из флуорофора и прямой связи, и F2 отсутствует или представляет собой флуорофор.
А представляет собой 
 или амидную связь, и
или амидную связь, и
Y выбран из 
и 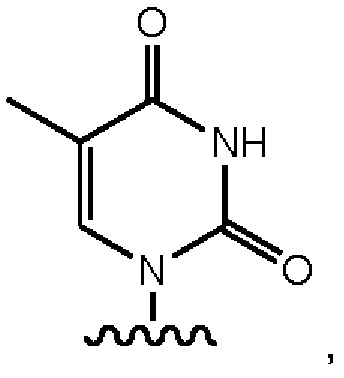 q представляет собой целое число от 1 до 100, и
q представляет собой целое число от 1 до 100, и
В включает аминокислоту, число q В имеет заряд и плотность заряда, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
В одном примере заряд составляет от примерно -100е до примерно +100е. В другом примере плотность заряда составляет от примерно -100е на кубический нанометр до примерно +100е на кубический нанометр. В еще одном другом примере заряд составляет от примерно -200е до примерно +200е. В еще одном другом примере плотность заряда составляет от примерно -200е на кубический нанометр до примерно +200е на кубический нанометр.
В другом примере число q В включает полипептид. В еще одном другом примере полипептид выбран из группы, состоящей из разветвленного полипептида, спирального полипептида и суперспирального полипептида. В еще одном другом примере В включает аминокислоту, и одно или более чем одно число q В включает метиллизин, диметиллизин или триметиллизин.
В еще одном другом примере А образовался реакцией, включающей реакцию связывания, и данная реакция связывания выбрана из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол-малеимид.
В еще одном другом примере данный способ дополнительно включает последовательное включение множества меченных нуклеотидов, где заряд каждого из множества меченых нуклеотидов отличается от заряда любого другого из множества меченых нуклеотидов, когда Y каждого и Y любого другого отличаются друг от друга. В другом примере данный способ дополнительно включает идентификацию Y одного или более чем одного меченого полинуклеотида, включенного в растущую полинуклеотидную нить, на основе заряда, выявленного проводящим каналом.
В еще одном другом примере Х2 представляет собой (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24. В одном примере а равен 24. В другом примере а равен 12. В другом примере а равен 8. В еще одном другом примере а равен 4.
В еще одном другом аспекте предложен способ, включающий выявление включения меченого нуклеотида в растущую полинуклеотидную нить, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, где данная полимераза связана с проводящим каналом твердой подложки посредством связки, причем меченый нуклеотид представляет собой соединение Формулы I

в которой n представляет собой целое число от 3 до 10, m представляет собой целое число от 1 до 10, t представляет собой целое число от 0 до 50, X1 представляет собой прямую связь, С1-С10алкил, С1-С10оксаалкил, С1-С10тиаалкил или С1-С10азаалкил, Х2 представляет собой С1-С20алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, Х3 представляет собой прямую связь или олигонуклеотид, где данный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала, F1, выбран из флуорофора и прямой связи, и F2 отсутствует или представляет собой флуорофор.
A представляет собой 
 или амидную связь, и
или амидную связь, и
Y выбран из 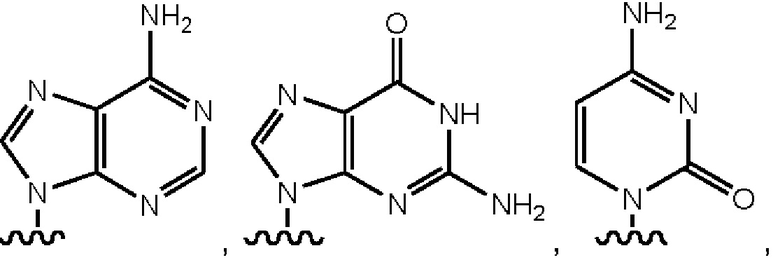
и  q представляет собой целое число от 1 до 100, и
q представляет собой целое число от 1 до 100, и
В выбран из нуклеотида, 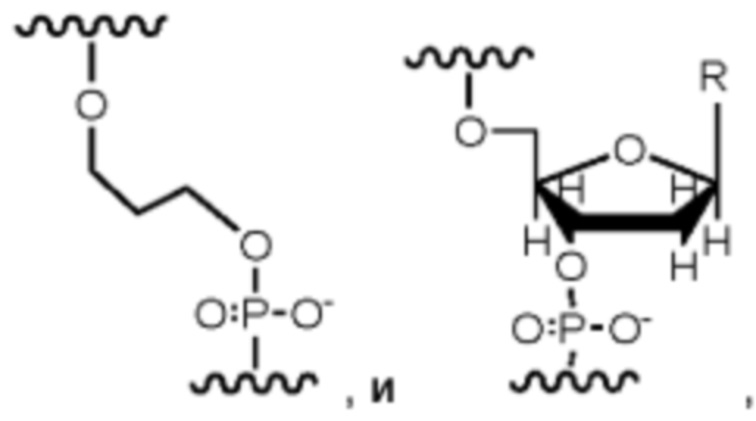 где R выбран из Y и водорода, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
где R выбран из Y и водорода, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
В одном примере заряд составляет от примерно -100е до примерно +100е. В другом примере плотность заряда составляет от примерно -100е на кубический нанометр до примерно +100е на кубический нанометр. В еще одном другом примере заряд составляет от примерно -200е до примерно +200е. В еще одном другом примере плотность заряда составляет от примерно -200е на кубический нанометр до примерно +200е на кубический нанометр.
В другом примере число q В включает полинуклеотид. В еще одном другом примере полинуклеотид выбран из разветвленного полинуклеотида и одной или более чем одной петли шпильки. В еще одном другом примере полинуклеотид включает от двух до пяти петель шпильки.
В еще одном другом примере А образовался реакцией, включающей реакцию связывания, и данная реакция связывания выбрана из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол- малеимид.
В еще одном другом примере данный способ дополнительно включает последовательное включение множества меченых нуклеотидов, где заряд каждого из множества меченых нуклеотидов отличается от заряда любого другого из множества меченых нуклеотидов, когда Y каждого и Y любого другого отличаются друг от друга. В другом примере данный способ дополнительно включает идентификацию Y одного или более чем одного меченого полинуклеотида, включенного в растущую полинуклеотидную нить, на основе заряда, выявленного проводящим каналом.
В еще одном другом примере Х2 представляет собой (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24. В одном примере а равен 24. В другом примере а равен 12. В другом примере а равен 8. В еще одном другом примере а равен 4.
В другом аспекте предложен способ, включающий выявление включения меченого нуклеотида в растущую полинуклеотидную нить, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, где данная полимераза связана с проводящим каналом твердой подложки посредством связки, причем меченый нуклеотид представляет собой соединение Формулы I

в которой n представляет собой целое число от 3 до 10, m представляет собой целое число от 1 до 10, t представляет собой целое число от 0 до 50, X1 представляет собой прямую связь, С1-С10алкил, С1-С10оксаалкил, С1-С10тиаалкил или С1-С10азаалкил, Х2 представляет собой С1-С20алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, Х3 представляет собой прямую связь или олигонуклеотид, где данный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала, F1, выбран из флуорофора и прямой связи, и F2 отсутствует или представляет собой флуорофор.
А представляет собой 
 или амидную связь, и
или амидную связь, и
Y выбран из 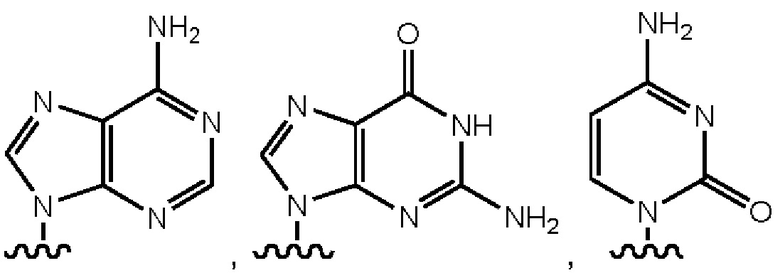
и  q равен 1, В включает дендрон, В имеет заряд и плотность заряда, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
q равен 1, В включает дендрон, В имеет заряд и плотность заряда, и проводящий канал предназначен для выявления меченого нуклеотида во время включения.
В одном примере заряд составляет от примерно -100е до примерно +100е. В другом примере плотность заряда составляет от примерно -100е на кубический нанометр до примерно +100е на кубический нанометр. В еще одном другом примере заряд составляет от примерно -200е до примерно +200е. В еще одном другом примере плотность заряда составляет от примерно -200е на кубический нанометр до примерно +200е на кубический нанометр.
В другом примере В представляет собой дендрон z генераций, включающий одно или более чем одно составное повторяющееся звено и множество концевых звеньев, где z представляет собой целое число от 1 до 6, причем составные концевые звенья выбраны из:

где
p1 представляет собой целое число от 1 до 3, где любая одна или более чем одна из p1 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-, p2 представляет собой целое число от 1 до 3, где любая одна или более чем одна из р2 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-, и концевые группы выбраны из карбоновой кислоты, сульфоновой кислоты, фосфоновой кислоты, сперминильной группы, аминогруппы и четвертичной аммонийной группы.
В еще одном другом примере А образовался реакцией, включающей реакцию связывания, и данная реакция связывания выбрана из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол-малеимид.
В еще одном другом примере данный способ дополнительно включает последовательное включение множества меченых нуклеотидов, где заряд каждого из множества меченых нуклеотидов отличается от заряда любого другого из множества меченых нуклеотидов, когда Y каждого и Y любого другого отличаются друг от друга. В другом примере данный способ дополнительно включает идентификацию Y одного или более чем одного меченого полинуклеотида, включенного в растущую полинуклеотидную нить, на основе заряда, выявленного проводящим каналом.
В еще одном другом примере Х2 представляет собой (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24. В одном примере а равен 24. В другом примере а равен 12. В другом примере а равен 8. В еще одном другом примере а равен 4.
Следует понимать то, что все комбинации вышеупомянутых идей и дополнительных идей, обсуждаемых с большими подробностями ниже (при условии, что такие идеи не являются взаимонесогласующимися), рассматриваются как часть объекта изобретения, раскрытого в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти и другие отличительные признаки, аспекты и преимущества настоящего раскрытия станут понятнее при прочтении следующего подробного описания со ссылкой на сопровождающие графические материалы, в которых:
На ФИГ. 1 в одном примере показана полимераза, присоединенная к проводящему каналу посредством связки.
На ФИГ. 2 в одном примере показаны полимеразы, присоединенные к проводящим каналам посредством связок на основе нуклеиновой кислоты и связанные с нуклеотидами, которые могут быть различены на основе заряда или близости к детектору заряда.
На ФИГ. 3 в одном примере показаны полимеразы, присоединенные к проводящим каналам посредством связок на основе нуклеиновой кислоты и связанные с нуклеотидами, которые могут быть различены на основе заряда.
На ФИГ. 4 в одном примере показана полимераза, присоединенная связкой к проводящему каналу, где данный проводящий канал также присоединен к акцепторной области, включающей в данном примере множество олигонуклеотидов, способных к связыванию (например, к гибридизации) с областью специфичности в пределах линкеров на нуклеотидах.
На ФИГ. 5 показана иллюстрация неограничивающего примера аналога нуклеотида, несущего заряженную метку согласно настоящему раскрытию. Аналог нуклеотида может включать нуклеотидполифосфат (такой как дТгексафосфат, как показано), линкерную область, факультативно содержащую область специфичности, и заряженную метку. В данном неограничивающем примере линкер включает ковалентное присоединение, образованное клик-химией азид-алкин. Как дополнительно описано ниже, в линкер может быть включена область специфичности, и она может способствовать стимуляции близости заряженной метки проводящему каналу во время включения полимеразой.
На ФИГ. 6 в одном примере показана нуклеотидная метка, имеющая отрицательно заряженные кислороды в фосфодиэфирном остове олигонуклеотидной группировки метки.
На ФИГ. 7 в одном примере показаны типичные множительные звенья для построения разветвленных заряженных меток, которые могут быть выявлены с использованием проводящего канала.
На ФИГ. 8 в одном примере показан проводящий канал, который присоединяется к полимеразе (PoI) через связку, имеющую последовательность нуклеиновой кислоты (в общем, представленную как последовательность 10 N). Нуклеотиды N выбирают из универсальных оснований и оснований, которые являются комплементарными нуклеотидам в линкере (например, области специфичности), присоединенном к заряженной метке.
На ФИГ. 9 в одном примере показан проводящий канал, который присоединяется к полимеразе (PoI) через связку, имеющую акцепторную область - в данном примере последовательность нуклеиновой кислоты (в общем, представленную как последовательность 7 N с областью ABC; часть в виде заряженной метки не показана). Полимераза комплексируется с нуклеиновой кислотой-мишенью и меченым аналогом ЦТФ (цитозинтрифосфат). Линкер на аналоге ЦТФ включает область нуклеиновой кислоты, имеющую инозины (I) и область специфичности (А'В'С), которая гибридизуется с акцепторной областью на связке (ABC).
На ФИГ. 10 в одном примере показана полимераза на связке в четырех разных состояниях положения относительно проводящего канала из-за связывания каждого из четырех разных аналогов нуклеотида через область специфичности в каждом линкере с акцепторной областью в связке. Для данного иллюстративного примера аналоги нуклеотидов идентифицируются как АТФ (аденозинтрифосфат), ГТФ (гуанозинтрифосфат), ЦТФ и ТТФ (тимидинтрифосфат), но могли бы быть использованы любые аналоги нуклеотидов (например, могут использоваться аналоги дезоксирибонуклеотидов). Каждый из аналогов нуклеотидов имеет олигонуклеотидную группировку такой же длины, что и другие 3 аналога нуклеотида, но каждый аналог нуклеотида имеет последовательность специфичного связывания, которая связывается с отличной областью акцепторной области в связке по сравнению с областями, где связываются другие линкеры аналогов нуклеотидов. Заряженная метка, представляющая собой в данном примере олигонуклеотид или другую заряженную метку, содержащую фосфодиэфир, в других примерах продолжается за пределы области гибридизации в конце линкера, противоположном нуклеотиду.
На ФИГ. 11 в одном примере показано включение одного нуклеотида заряженных меток на основе фосфодиэфира посредством полимеразы phi29.
На ФИГ. 12А-12D показаны примеры заряженных меток на основе пептидов согласно аспектам настоящего раскрытия.
На ФИГ. 13А, 13B и 13C в одном примере показаны несколько структур модифицированного нуклеотида со структурированным олигонуклеотидом в качестве заряженной метки. Показаны модифицированные нуклеотиды с заряженной меткой, продолжающейся от них, в которых данные заряженные метки включают область специфичности, связанную с акцепторной областью (показанной как «Клей»). На ФИГ. 13А показана заряженная метка в форме стебля и петли, и на ФИГ. 13C показана заряженная метка в форме листа клевера.
На ФИГ. 14А и 14B показан пример крестовидной заряженной метки. На ФИГ. 14А показана крестовидная заряженная метка, содержащая четыре олигонуклеотида, связанных друг с другом в конфигурации, подобной структуре Холлидея, и одноцепочечные олигонуклеотидные липкие концы. На ФИГ. 14B показана структура из ФИГ. 14А с последовательностями пептидных нуклеиновых кислот, связанных с олигонуклеотидными липкими концами, и спиральными полипептидными структурами, простирающимися от концов последовательностей пептидных нуклеиновых кислот. В данном примере полипептидные последовательности имеют положительный заряд.
На ФИГ. 15 показано несколько примеров полипептидных заряженных меток, включающих спиральные полипептиды, и их сборка.
На ФИГ. 16 показан пример заряженной метки, включающей полипептиды, организованные в конфигурации суперспирали.
На ФИГ. 17А и 17B показаны примеры заряженных меток на основе фосфодиэфира, имеющих разветвленную, дендроноподобную структуру.
На ФИГ. 18А и 18B показаны примеры разветвленных заряженных меток на основе пептидов.
На ФИГ. 19А и 19B показаны примеры заряженных меток на основе спермина согласно аспектам настоящего раскрытия.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Примеры настоящего раскрытия, в общем, относятся к композициям и способам для выявления событий включения нуклеотидов в методиках секвенирования нуклеиновых кислот. Существует потребность в улучшенных системах выявления, которые обеспечивают дифференциальное распознавание нуклеотидов на основе различий в зарядах, таким образом, чтобы обеспечивать высокопроизводительное получение длинных считываемых фрагментов секвенирования. Примеры, изложенные в данном документе, могут удовлетворять эту потребность, а также давать другие преимущества.
Как раскрыто в данном документе, имеется дорогая светочувствительная флуоресцентная метка на нуклеотиде с отличной меткой для применения с другой системой выявления. Выявление традиционной флуоресцентной метки может включать дорогое оборудование, такое как лазеры и выявляющая оптика, что увеличивает размер выявляющего прибора. Кроме того, используется более мощное программное обеспечения для декодирования массы генерируемой информации. Важно то, что, как раскрыто в данном документе, дорогие флуорофоры не требуются. Посредством замены флуоресцентной метки заряженной меткой заряд может быть выявлен проводящим каналом, который отслеживает ток в системе. Это обеспечивает осуществление секвенирования в «реальном времени» и имеет потенциал достижения более быстрого времени оборота посредством уменьшения времени цикла включения каждого нуклеотида.
При обеспечении секвенирования «в реальном времени» в одном примере блокирующая группа на 3'-ОН не участвовала бы. Это снижает цену модифицированных нуклеотидов, так как участвует меньше стадий синтеза.
Дополнительным преимуществом является то, что полимеразы лучше приспособлены для включения нуклеотидов с 3'-ОН, что ближе к природной системе по сравнению с химически модифицированной объемной 3' защитной группой.
Проводящий канал для выявления модифицированного нуклеотида, включающего заряд, может реагировать на окружающее электрическое поле. Это поле модулируется расположением модифицированного нуклеотида с зарядом в непосредственной близости к поверхности проводящего канала. Непосредственная близость заряженных меток к поверхности в некоторых случаях может быть важной, как, например, если соль или другие ионы в растворе могут экранировать заряд от выявления проводящим каналом. Характерная длина экранирования называется дебаевским расстоянием, за пределами которого проводящий канал может быть не способен выявлять заряд.
Заряд, включенный в модифицированный нуклеотид, может составлять где-нибудь от -200е до +200е, что может превышать 160 Ангстрем при полном линейном растяжении, тогда как дебаевское расстояние проводящего канала может составлять примерно 1 нм. Таким образом, было бы желательным структурирование несущей заряд модификации нуклеотида для стимуляции его выявления проводящим каналом.
Будет понятно, что термины, используемые в данном документе, принимают их обычное значение, если не определено иначе. Примеры нескольких терминов, использованных в данном документе, и их определения излагаются ниже.
Термин «чип» в том виде, в котором он используется в данном документе, относится к популяции проводящих каналов или молекул, которые присоединяются к одному или более чем одному твердофазному субстрату, таким образом, что данные проводящие каналы или молекулы могут быть различены друг от друга согласно их относительному положению. Чип может включать разные молекулы, каждая из которых располагается в отличном адресуемом месте (например, на разных проводящих каналах) на твердофазном субстрате. В качестве альтернативы, чип может включать отдельные твердофазные субстраты, причем каждый несет отличную молекулу, где разные молекулы-зонды могут быть идентифицированы согласно положениям данных твердофазных субстратов на поверхности, к которой присоединяются данные твердофазные субстраты, или согласно положениям данных твердофазных субстратов в жидкости, такой как ток жидкости. Молекулы чипа могут представлять собой нуклеиновые кислоты-праймеры, нуклеиновые кислоты-зонды, нуклеиновые кислоты-матрицы или ферменты, работающие с нуклеиновыми кислотами, такие как полимеразы и экзонуклеазы.
Термин «присоединенный» в том виде, в котором он используется в данном документе, относится к состоянию двух предметов, которые привязаны, пристегнуты, приклеены, присоединены или связаны друг с другом. Например, компонент реакции, такой как полимераза, может быть присоединен к твердофазному компоненту, такому как проводящий канал, ковалентной или нековалентной связью. Ковалентная связь отличается обобществлением пар электронов между атомами. Нековалентная связь представляет собой химическую связь, которая не включает обобществление пар электронов и может включать, например, водородные связи, ионные связи, вандерваальсовы силы, гидрофильные взаимодействия и гидрофобные взаимодействия.
Подразумевается, что термин «электропроводящий канал» в том виде, в котором он используется в данном документе, означает часть выявляющего устройства, которое преобразует пертурбации на его поверхности или в окружающем его электрическом поле в электрический сигнал. Проводящий канал может представлять собой электропроводящий канал. Например, как показано на Фиг. 1, электропроводящий канал 5 может преобразовывать прибытие или убытие компонента реакции (например, меченого нуклеотида) в электрический сигнал. В примерах, раскрытых в данном документе, электропроводящий канал 5 также может преобразовывать взаимодействия между двумя компонентами реакции (нуклеиновой кислотой-матрицей и нуклеотидом меченого нуклеотида) в выявляемый сигнал через его взаимодействие с редокс-активной заряженной меткой меченого нуклеотида.
Электропроводящий канал 5 может представлять собой канал проводящего канала 2. Проводящий канал 2 может включать электроды истока и стока - S, D - и канал 5, соединяющий электроды S, D. Данный канал может иметь любую подходящую геометрию - например, трубку, проволоку, пластину и т.д.
Подразумевается, что термин «проводящий канал» в том виде, в котором он используется в данном документе, означает выявляющее устройство, которое преобразует пертурбации на его поверхности или в окружающем его электрическом поле в электрический сигнал. Например, проводящий канал может преобразовывать прибытие или убытие компонента реакции в электрический сигнал. Проводящий канал также может преобразовывать взаимодействия между двумя компонентами реакции или конформационные изменения в одном компоненте реакции в электрический сигнал. Типичным проводящим каналом является полевой транзистор (FET), такой как углеродная нанотрубка (CNT), FET на основе односменной углеродной нанотрубки (SWNT), FET на основе кремниевой нанопроволоки (SiNW), FET на основе графеновой наноленты (и родственные FET на основе наноленты, изготовленные из двухмерных материалов, таких как MoS2, силицен, и т.д.), туннельный FET (TFET) и устройства с большой допороговой крутизной (см., например, Swaminathan et al., Proceedings of the 51st Annual Design Automation Conference on Design Automation Conference, pg 1-6, ISBN: 978-1-4503-2730-5 (2014) и lonescu et al., Nature 479, 329-337 (2011); каждая из которых включается посредством ссылки во всей ее полноте). Примеры проводящих каналов на основе FET и SWNT, которые можно использовать в способах и приборе по настоящему раскрытию, излагаются в публикации заявки на патент США №2013/0078622 А1, которая включается в данный документ посредством ссылки во всей ее полноте.
Электроды S, D могут быть из любого подходящего проводящего вещества. Примеры подходящих веществ для истока и стока включают кобальт, силицид кобальта, никель, силицид никеля, алюминий, вольфрам, медь, титан, молибден, оксид индия и олова (ITO), оксид индия и цинка, золото, платину, углерод и т.д.
Проводящий канал 5 может включать любое проводящее или полупроводниковое вещество, которое может окислять или восстанавливать редокс-активную заряженную метку. Данное вещество может содержать органическое вещество, неорганическое вещество или и то, и другое. Некоторые примеры подходящих веществ канала включают кремний, углерод (например, стеклоуглерод, графен и т.п.), полимеры, такие как проводящие полимеры (например, полипиррол, полианилин, политиофен, поли(3,4-этилендиокситиофен) с примесью поли(4-стиролсульфоната) (PEDOT-PSS) и т.д.), металлы, биомолекулы и т.д.
В некоторых примерах проводящий канал 5 также может представлять собой наноструктуру, которая имеет по меньшей мере одно измерение по наношкале (варьирующее от 1 нм до меньше чем 1 мкм). В одном примере данное измерение относится к наибольшему измерению. В качестве примеров, электропроводящий канал 5 может представлять собой полупроводниковую наноструктуру, графеновую наноструктуру, металлическую наноструктуру и наноструктуру на основе проводящего полимера. Наноструктура может представлять собой многостенную или односменную нанотрубку, нанопроволоку, наноленту и т.д.
Термин «разный» в том виде, в котором он используется в данном документе, при применении в связи с нуклеиновыми кислотами, означает то, что нуклеиновые кислоты имеют нуклеотидные последовательности, которые не являются одинаковыми по отношению друг к другу. Две или более чем две разные нуклеиновые кислоты могут иметь нуклеотидные последовательности, которые являются разными по всей их длине. В качестве альтернативы, две или более чем две разные нуклеиновые кислоты могут иметь нуклеотидные последовательности, которые являются разными по существенной части их длины. Например, две или более чем две разные нуклеиновые кислоты могут иметь целевые части нуклеотидной последовательности, которые являются разными для двух или более чем двух молекул, в то время также имея универсальную часть последовательности, которая является одинаковой для двух или более чем двух молекул. Термин «разный» может аналогично применяться к другим молекулам, таким как полимеразы и ферменты, работающие с нуклеиновыми кислотами.
Подразумевается, что термин «каждый» в том виде, в котором он используется в данном документе, при применении в связи с набором элементов, идентифицирует индивидуальный элемент в данном наборе, но не обязательно относится к каждому элементу в данном наборе. Могут встречаться исключения, если прямо сформулированное раскрытие или контекст ясно диктуют иное.
Подразумевается, что термин «метка» в том виде, в котором он используется в данном документе, при применении в связи с компонентом реакции, означает выявляемый компонент реакции или выявляемую группировку компонента реакции. Полезной меткой является заряженная метка (также именуемая зарядовая метка), которая может быть выявлена проводящим каналом. Метка может быть свойственной компоненту реакции, который подлежит выявлению (например, заряженная аминокислота полимеразы), или метка может быть несвойственной компоненту реакции (например, не встречающаяся в природе модификация аминокислоты). В некоторых примерах метка может включать многочисленные группировки, имеющие отдельные функции. Например, метка может включать линкерный компонент (такой как нуклеиновая кислота) и компонент в виде заряженной метки.
Подразумевается, что термин «неприродный» в том виде, в котором он используется в данном документе, при применении в связи с группировкой молекулы, относится к группировке, которая не обнаруживается присоединенной к молекуле в ее природном окружении или в биологической системе, не нарушенной человеческим техническим вмешательством. Типично неприродные группировки представляют собой синтетические модификации молекул, которые делают данные молекулы структурно или химически отличными от немодифицированной молекулы или от молекул, имеющих природные модификации. Подразумевается то, что термин «неприродный» в том виде, в котором он используется в данном документе, при применении в связи с аналогом, используемым для процесса, означает аналог, который не обнаруживается в природном окружении, где происходит данный процесс. Типично неприродные аналоги представляют собой синтетические аналоги, которые являются структурно или химически отличными от других типов молекул в классе, к которому принадлежит данный аналог.
Подразумевается, что термин «нуклеиновая кислота» в том виде, в котором он используется в данном документе, согласуется с его применением в данной области и включает встречающиеся в природе нуклеиновые кислоты или их функциональные аналоги. Особенно полезные функциональные аналоги способны гибридизоваться с нуклеиновой кислотой способом, специфичным в отношении последовательности, или способны к применению в качестве матрицы для репликации конкретной нуклеотидной последовательности. Встречающиеся в природе нуклеиновые кислоты обычно имеют остов, содержащий фосфодиэфирные связи. Структура аналога может иметь альтернативную связь остова, включающую любую из множества связей, известных в данной области, как, например, пептидная нуклеиновая кислота (ПНК) или запертая нуклеиновая кислота (ЗНК). Встречающиеся в природе нуклеиновые кислоты обычно имеют сахар дезоксирибозу (например, находящийся в дезоксирибонуклеиновой кислоте ДНК)) или сахар рибозу (например, находящийся в рибонуклеиновой кислоте РНК)).
Нуклеиновая кислота может содержать любой из множества аналогов данных сахарных группировок, которые известны в данной области. Нуклеиновая кислота может включать природные и неприродные основания. В данном отношении природная дезоксирибонуклеиновая кислота может иметь одно или более чем одно основание, выбранное из группы, состоящей из аденина, тимина, цитозина или гуанина, и рибонуклеиновая кислота может иметь одно или более чем одно основание, выбранное из группы, состоящей из урацила, аденина, цитозина или гуанина. Полезные неприродные основания, которые могут быть включены в нуклеиновую кислоту, известны в данной области.
Подразумевается, что термин «нуклеотид» в том виде, в котором он используется в данном документе, включает природные нуклеотиды, их аналоги, рибонуклеотиды, дезоксирибонуклеотиды, дидезоксирибонуклеотиды и другие молекулы, известные как нуклеотиды. Данный термин может использоваться для названия мономерного звена, которое присутствует в полимере, например, для идентификации субъединицы, присутствующей в нити ДНК или РНК. Данный термин также может использоваться для названия молекулы, которая не обязательно присутствует в полимере, например, молекулы, которая способна к зависимому от матрицы включению в полинуклеотид посредством полимеразы. Данный термин может относиться к нуклеозидному звену, имеющему, например, 0, 1, 2, 3 или более фосфатов на 5'-углероде. Например, особенно полезными могут быть тетрафосфаты нуклеотидов, пентафосфаты нуклеотидов и гексафосфаты нуклеотидов, как и нуклеотиды с больше чем 6 фосфатами, как, например, с 7, 8, 9, 10 или более фосфатами на 5'-углероде. Типичные природные нуклеотиды включают, без ограничения, АТФ, УТФ, ЦТФ и ГТФ (совокупно НТФ), и АДФ, УДФ, ЦДФ и ГДФ (совокупно НДФ) или АМФ, УМФ, ЦМФ и ГМФ (совокупно НМФ), или дАТФ, дТТФ, дЦТФ и дГТФ (совокупно дНТФ), и дАДФ, дТДФ, дЦДФ и дГДФ (совокупно дНДФ), и дАМФ, дТМФ, дЦМФ и дГМФ (совокупно дНМФ). Типичные нуклеотиды могут включать, без исключений, любой НМФ, дНМФ, НДФ, дНДФ, НТФ, дНТФ и другие НХФ и дНХФ, где X представляет число от 2 до 10 (совокупно НПФ (нуклеотидполифосфат)).
Неприродные нуклеотиды, также именуемые в данном документе аналогами нуклеотидов, включают нуклеотиды, которые не присутствуют в природной биологической системе или по существу не включаются в полинуклеотиды полимеразой в ее природном окружении, например, в нерекомбинантной клетке, которая экспрессирует данную полимеразу. Особенно полезные неприродные нуклеотиды включают нуклеотиды, которые включаются в полинуклеотидную нить полимеразой со скоростью, которая существенно быстрее или медленнее, чем скорость, с которой другой нуклеотид, такой как природный нуклеотид, который образует пару с тем же самым комплементарным основанием по Уотсону-Крику, включается в нить полимеразой. Например, неприродный нуклеотид может включаться со скоростью, которая по меньшей мере в 2 раза отличается, в 5 раз отличается, в 10 раз отличается, в 25 раз отличается, в 50 раз отличается, в 100 раз отличается, в 1000 раз отличается, в 10000 раз или более отличается по сравнению со скоростью включения природного нуклеотида. Неприродный нуклеотид может быть способен к дальнейшему удлинению после включения в полинуклеотид. Примеры включают аналоги нуклеотидов, имеющие 3'-гидроксил, или аналоги нуклеотидов, имеющие обратимую терминирующую группировку в 3'- положении, которая может быть удалена для обеспечения дальнейшего удлинения полинуклеотида, который включил аналог нуклеотида. Примеры обратимых терминирующих группировок, которые можно использовать, описываются, например, в патентах США №7427673; 7414116; и 7057026, и публикациях РСТ WO 91/06678 и WO 07/123744, каждая из которых включается в данный документ посредством ссылки во всей ее полноте. Будет понятно то, что в некоторых примерах аналог нуклеотида, имеющий 3'-терминирующую группировку или не имеющий 3'-гидроксила (такой как аналог дидезоксинуклеотида), может использоваться при условиях, когда полинуклеотид, который включил аналог нуклеотида, далее не удлиняется. В некоторых примерах нуклеотид(ды) может(гут) не включать обратимую терминирующую группировку, или нуклеотид(ды) не будет(дут) включать необратимую терминирующую группировку, или нуклеотид(ды) вообще не будет(дут) включать какую-либо терминирующую группировку. Также полезными являются аналоги нуклеотидов с модификациями в 5'-положении.
Подразумевается, что термин «защитная группировка» в том виде, в котором он используется в данном документе, означает соединение или его часть, которое присоединяется к компоненту реакции для предотвращения конкретной реакции данного компонента реакции. Например, молекула нуклеиновой кислоты может связываться с ферментом, работающим с нуклеиновой кислотой, таким образом, что данная молекула нуклеиновой кислоты предотвращает деградацию или модификацию фермента, работающего с нуклеиновой кислотой, посредством обработки, что в противном случае вызвало бы деградацию или модификацию фермента. Антитело также может предназначено для связывания с компонентом реакции для защиты данного компонента реакции от деградации, инактивации или другой реакции.
Подразумевается, что термин «компонент реакции» в том виде, в котором он используется в данном документе, означает молекулу, которая принимает участие в реакции. Примеры включают реагенты, которые расходуются в реакции, продукты, которые создаются реакцией, катализаторы, такие как ферменты, которые облегчают реакцию, растворители, соли, буферы и другие молекулы.
Подразумевается, что термин «репеллентная группировка» в том виде, в котором он используется в данном документе, означает молекулу или ее часть, которая будет занимать пространство для предотвращения или ингибирования занятия данного пространства другой молекулой или для ингибирования смежного расположения другой молекулы около данного пространства. Репеллентная группировка может действовать через стерическое исключение, отталкивание зарядов, гидрофобное-гидрофильное отталкивание или другие силы.
Термин «терминирующая группировка» в том виде, в котором он используется в данном документе, при применении по отношению к нуклеотиду, означает часть нуклеотида, которая ингибирует или предотвращает образование данным нуклеотидом ковалентной связи со вторым нуклеотидом. Например, в случае нуклеотидов, имеющих пентозную группировку, терминирующая группировка может предотвращать образование фосфодиэфирной связи между 3'-кислородом нуклеотида и 5'-фосфатом второго нуклеотида. Терминирующая группировка может быть частью нуклеотида, который представляет собой мономерное звено, присутствующее в полимере нуклеиновой кислоты, или терминирующая группировка может быть частью свободного нуклеотида (например, нуклеотидтрифосфата). Терминирующая группировка, которая является частью нуклеотида, может быть обратимой, таким образом, что данная терминирующая группировка может быть модифицирована для того, чтобы сделать нуклеотид способным образовать ковалентную связь со вторым нуклеотидом. В конкретных примерах терминирующая группировка, такая как обратимая терминирующая группировка, может быть присоединена к 3'-положению или 2'-положению пентозной группировки аналога нуклеотида.
Примеры, изложенные ниже и перечисленные в формуле изобретения, можно понять, принимая во внимание описанные выше определения.
Согласно настоящему раскрытию предложены полезные композиции для, среди прочего, событий включения нуклеотидов, выявляемых в методиках секвенирования нуклеиновой кислоты, способов получения таких композиций и способов их применения в таких методиках. Композиции и способы, изложенные в данном документе, являются особенно полезными, например, в одномолекулярных реакциях секвенирования нуклеиновой кислоты, такого как секвенирование посредством синтеза. Однако будет понятно то, что композиции и способы, изложенные в данном документе, можно использовать для любой другой подходящей схемы выявления, включающей выявление одной молекулы, но не ограничивающейся им. Приборы и способы секвенирования нуклеиновых кислот, в которых можно использовать композиции, как раскрыто в данном документе, раскрываются, например, в заявке на патент США №14/798762, которая включается в данный документ посредством ссылки во всей ее полноте.
Например, способ секвенирования нуклеиновой кислоты может включать следующие стадии: (а) предоставление полимеразы, присоединенной к проводящему каналу твердой подложки; (b) предоставление одного или более чем одного меченого нуклеотида, при этом присутствие метки может быть выявлено проводящим каналом, когда данная метка находится поблизости от проводящего канала; и (в) выявление включения меченого нуклеотида в растущую нить, комплементарную нуклеиновой кислоте-матрице.
В некоторых примерах способа секвенирования нуклеиновой кислоты полимераза удерживается на расстоянии меньше, чем 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нм от проводящего канала.
В некоторых примерах метка или ее часть (например, заряженная метка) может отщепляться от нуклеотида после включения, например, полимеразой.
Один или более чем один меченый нуклеотид в том виде, в котором он предложен в данном документе, может включать множество заряженных меток. Например, один или более чем один меченый нуклеотид может содержать уникальную заряженную метку для каждого типа нуклеотида. Например, нуклеотиды, несущие заряженные метки, могут использоваться в осуществлении синтеза нити ДНК посредством полимеразы согласно последовательности матрицы, причем последовательность матрицы может включать нить нуклеотидов, включающую, например, основания аденин, тимин, гуанин и цитозин. Нуклеотиды, несущие заряженные метки, как раскрыто в данном документе, могут быть включены в нить нуклеотидов, комплементарную последовательности матрицы, посредством фермента-полимеразы. Как раскрыто в данном документе, когда нуклеотид, несущий заряженную метку, включается таким образом, проводящий канал может выявлять заряд данной валентности и значения, специфично и дифференциально ассоциированный с каждым видом нуклеотида, обеспечивая регистрацию идентичности последовательных нуклеотидов, включенных в растущую нить, и, посредством этого, последовательность нуклеотидов, присутствующих в нити матрицы, которой является комплементарной растущая нить. Заряженная метка может представлять собой отрицательно заряженную метку или положительно заряженную метку и может иметь заряд где-нибудь от -200е до +200е, как, например, от -175е до +175е, или от -150е до +150е, или от -125е до +125е, или от -100е до +100е, или от -75е до +75е, или от -50е до +50е.
Проводящий канал, используемый в способе секвенирования нуклеиновой кислоты может включать FET на основе нанопроволоки. Факультативно проводящий канал может включать углеродную нанотрубку. Проводящий канал может быть частью чипа на основе проводящих каналов. Стадия выявления может включать последовательное выявление множества событий включения.
Композиции, устройство и способы, изложенные в данном документе, могут давать длинные считываемые фрагменты нуклеиновой кислоты; быстрые считываемые фрагменты; высокую производительность секвенирования; и масштабируемую платформу для секвенирования. В некоторых примерах любые компромиссы в точности одного считываемого фрагмента могут быть смягчены получением многих перекрывающихся считываемых фрагментов из-за способности способов и прибора, изложенных в данном документе, обеспечивать производительность при параллельном получении множества считываемых фрагментов.
Пример проводящего канала показан на ФИГ. 1. Здесь полимераза 1 создает сайт реакции, где нуклеотиды могут быть включены в ДНК-матрицу 4 со связанным праймером. Полимераза 1 присоединяется к FET2 на основе нанопроволоки посредством связки 3. Данный прибор обеспечивает одномолекулярную чувствительность. Изменения в распределении заряда в реакционном сайте (например, изменения конформации полимеразы, включение нуклеотида, прибытие или убытие заряженных меток, изменения в близости полимеразы к проводящему каналу и т.д.) преобразуются на схеме и могут быть выявлены.
В конкретных примерах в устройстве или способе по настоящему раскрытию в качестве одномолекулярных проводящих каналов могут использоваться глубокомасштабированные транзисторы на основе FinFET. Проводящие каналы на основе FinFET выигрывают от технологии, уже разрабатываемой ведущими производителями полупроводников. Кроме того, можно использовать компоненты, опубликованные ранее, включающие (1) компоненты, использованные для иммобилизации лизоцима на CNT, для наблюдения процессивности фермента в реальном времени, как описано в Choi et al, Science, 335, 319 (2012), (2) компоненты, использованные для иммобилизации фрагмента Кленова Pol 1 на CNT и наблюдения процессивности ДНК в реальном времени, как описано в Olsen et al, J. Amer, Chem. Soc., 135, 7885 (2013), (3) компоненты, использованные для выяснения механизма трансдукции, в виде подвижных заряженных остатков из-за аллостерического движения белка, как описано в Chi et al, NanoLett 13, 625 (2013). В настоящих способах также может использоваться устройство, компоненты устройства и способы, изложенные в публикации заявки на патент США №2013/0078622 А1. Каждая из приведенных выше ссылок включается в данный документ посредством ссылки во всей ее полноте.
Некоторые примеры меченого нуклеотида также могут включать область специфичности. Таким образом, меченый нуклеотид может включать нуклеотид, связывающую молекулу или линкер, присоединенный к фосфатной группе нуклеотида, и заряженную метку, присоединенную к линкеру. Связывающая молекула или линкер может содержать область специфичности, которая может гибридизоваться с акцепторной областью на связке, связанной с проводящим каналом. В качестве примеров, область специфичности может представлять собой любую нуклеотидную последовательность или пептид, которая способна временно присоединяться или связываться с акцепторной областью на связке. Например, область специфичности может включать последовательность нуклеотидов, и акцепторная область может включать такую последовательность нуклеотидов, что образуется связывание пар между нуклеотидами в последовательности области специфичности и акцепторной области. Образование пар в данном случае относится к стандартному связыванию пар между нуклеотидами, как, например, между остатком G и С или между остатком А и Т или U.
Область специфичности может включать последовательность нуклеотидов, и акцепторная область - соответственно комплементарную последовательность нуклеотидов. В одном примере, когда полимераза принимает нуклеотид для включения в растущую полинуклеотидную нить, комплементарную полинуклеотиду-матрице, область специфичности и акцепторная область могут приводиться в достаточную близость друг к другу для образования между ними парной связи. Такая парная связь между областью специфичности и акцепторной областью может способствовать достаточной близости между заряженной меткой и проводящим каналом, стимулируя выявление заряженной метки проводящим каналом во время включения нуклеотида.
В одном примере область специфичности может включать нуклеотидную последовательность, включающую от примерно одного нуклеотида до примерно шести нуклеотидов. В другом примере область специфичности может дополнительно включать инозин(ны), фланкирующий(щие) обе стороны нуклеотидной последовательности. В некоторых примерах область специфичности включается в часть заряженной метки. Например, область специфичности может состоять из отрезков или частей последовательности нуклеотидов или аминокислот, которые отделяются друг от друга вдоль линейной последовательности, как, например, частями заряженной метки, где связывание с акцепторной областью может индуцировать приближение друг к другу отдельных областей области специфичности, при обеспечении принятия заданной трехмерной структуры заряженной меткой.
В одном примере меченого нуклеотида, ассоциированного со связкой, специфичная аффинность связывания между меченым нуклеотидом и связкой объединяется со слабой аффинностью, продуцируемой взаимодействиями неспецифичного связывания. Меченый нуклеотид может включать область специфичности, которая является комплементарной части связки. Специфичное связывание между данными областями может возникать в результате стандартного образования пар оснований по Уотсону-Крику или другого нековалентного связывания. Область специфичности в данном примере также может включать инозины (I), фланкирующие нуклеотидную последовательность. Инозины представляют собой универсальные основания и, таким образом, могут образовать пару со всеми четырьмя природными нуклеотидами ДНК. Дополнительные взаимодействия связывания могут возникать из-за взаимодействий универсальных оснований (например, инозина I) с природными нуклеотидами на связке. Таким образом, при связывании меченого нуклеотида с полимеразой во время включения может происходить синергическое связывание между областью специфичности меченого нуклеотида и акцепторной областью связки, что может значительно увеличивать стабильность взаимодействия между меченым нуклеотидом и связкой.
Взаимодействие между меченым нуклеотидом и полимеразой или полимеразой и связкой может вызвать приведение заряженной метки в пределы чувствительной зоны проводящего канала. Такое(кие) взаимодействие(вия) также может помогать сохранению заряженной метки в пределах чувствительной зоны в течение достаточного времени для эффективного и полного выявления заряда. Такое время может составлять вплоть до десятков миллисекунд. Такое относительно длительное взаимодействие является невероятным для других меченых нуклеотидов, присутствующих в растворе, которые, в теории, могут диффундировать и кратковременно соприкасаться или приближаться к проводящему каналу. Такое краткое взаимодействие может не быть достаточно длительным для того, чтобы происходило достаточное выявление заряда, и, таким образом, в таких случаях заряженная метка не выявляется проводящим каналом.
Как раскрыто в данном документе, заряженная метка может включать полипептиды, олигонуклеотиды, олигомерные пептидные нуклеиновые кислоты, или любую комбинацию двух или более чем двух из вышеописанных. В некоторых примерах заряженная метка может включать множество элементов, выбранных из аминокислот, нуклеотидов и линкеров. Такие молекулы могут принимать трехмерную структуру для обеспечения конденсации зарядов, переносимых сторонами заряженной метки, таким образом, что общий заряд может быть конденсирован в маленькой области. Такая повышенная плотность заряда может увеличивать заряд, выявляемый проводящим каналом во время включения аналога нуклеотида в растущую нить полимеразой, таким образом, что может быть определено присутствие данного вида нуклеотида в таком синтезе. Заряженная метка, которая принимает такую конденсированную конформацию, может минимизировать рассеивание ее заряда от проводящего канала или по большой площади поверхности проводящего канала, или по обоим. Как следствие, проводящий канал может с большей вероятностью выявлять большее количество или долю заряда заряженной метки.
В некоторых примерах, раскрытых в данном документе, используется синергическое связывание меченого нуклеотида с полимеразой, одной или в комбинации со связкой, для того, чтобы приносить и удерживать заряженную метку поблизости от чувствительной зоны проводящего канала. Стабильность комплекса, образованного со связкой, может быть относительно низкой таким образом, что не образуется комплекс в отношении меченых нуклеотидов, которые также не связываются с полимеразой (т.е. меченые нуклеотиды, которые находятся в свободном состоянии в растворе, могут по существу не связываться со связкой). Другими словами, скорость диссоциации такого комплекса может быть достаточно высокой, а время жизни - коротким. Однако при образовании стабильной ассоциации между меченым нуклеотидом и полимеразой локальная концентрация связывающей молекулы вокруг связки может возрастать, приводя, таким образом, к высокой скорости ассоциации. Этим способом общее время ассоциации в состоянии, ассоциированном с полимеразой, может быть значительно увеличено по сравнению с неассоциированным состоянием. Синергический эффект аффинностей меченого нуклеотида в отношении полимеразы, одной или в комбинации со связкой, может складываться с обеспечением существенной общей аффинности связывания. После расщепления полимеразой синергический эффект теряется, и заряженная метка также может диссоциировать от проводящего канала.
В конкретных примерах может использоваться синергическое связывание нуклеотида, меченного гамма-фосфатом, с полимеразой и с меткой. Стабильность комплекса олигонуклеотидная группировка:связка или комплекса область специфичности:акцепторная область может быть относительно низкой, таким образом, что данный комплекс не образуется в отношении нуклеотида, меченного гамма-фосфатом, который также не связывается с полимеразой, таким образом, что нуклеотиды, меченные гамма-фосфатом, которые находятся в свободном состоянии в растворе, по существу не связываются со связкой. Однако синергический эффект аффинностей нуклеотидной группировки в отношении полимеразы и области специфичности, такой как олигонуклеотидная группировка, в отношении акцепторной области связки может складываться для обеспечения существенной общей аффинности связывания. В некоторых примерах в синергическом эффекте может использоваться комбинация аффинности специфичного связывания между нуклеотидной меткой и связкой, наряду со слабой аффинностью, продуцируемой взаимодействиями неспецифичного связывания. Например, как утверждается выше, в некоторых примерах специфичное связывание может возникать в результате стандартного образования пар оснований по Уотсону-Крику и взаимодействий неспецифичного связывания, которые возникают из-за взаимодействий неразборчивых оснований (например, инозина) с природными нуклеотидами. Таким образом, при связывании нуклеотида, меченного гамма-фосфатом, с полимеразой во время включения может происходить синергическое связывание, которое значительно увеличивало бы стабильность взаимодействия между олигонуклеотидной группировкой и связкой. После отщепления гамма-фосфата полимеразой синергический эффект может теряться, и олигонуклеотидная группировка будет диссоциировать от связки. Такому синергическому эффекту могут способствовать другие типы связывания нуклеотидная группировка:связка, как, например, посредством нековалентных взаимодействий между ДНК, РНК, ПНК, аминокислотами или аналогами, или их комбинациями.
Как показано на ФИГ. 2, полимераза может быть иммобилизована на проводящем канале, таком как одностенная углеродная нанотрубка, кремниевая нанопроволока или FinFET. Иммобилизация может осуществляться посредством связок, которые включают ДНК, РНК, ПНК, аминокислоты или их аналоги, или комбинации. Для удобства демонстрации на ФИГ. 2 показаны четыре полимеразы, связанные с проводящим каналом, причем каждая полимераза также связана с отличным типом нуклеотида, меченного гамма-фосфатом. Как показано, нуклеотиды могут иметь олигонуклеотидную группировку, присоединенную к гамма-фосфату. Нуклеотид, меченный бета- или гамма-фосфатом, который правильно соответствует нити матрицы нуклеиновой кислоты-мишени, может удерживаться на месте полимеразой, которая также может быть связана с достаточно длинной матрицей для временной гибридизации с олигонуклеотидной группировкой или другой области специфичности с акцепторной областью связки (например, посредством комплементарности оснований по Уотсону-Крику или другого нековалентного связывания). Гибридизация может вызывать то, что заряженная метка возмущает поле вокруг проводящего канала, который может продуцировать выявляемый сигнал из-за изменения тока транзистора через проводящий канал. На диаграмме показана заряженная метка, входящая в поле, которая находится в пределах 1-2 нм от проводящего канала. Правильно соответствующий нуклеотид, меченный бета- или гамма-фосфатом, может включаться в растущую нить, гибридизованную с нуклеиновой кислотой-матрицей. Это, в свою очередь, разрушило бы связь между бета-фосфатом и вновь включенным нуклеотидом. В результате, заряженная метка (независимо от того, присоединенная ли в бета- или гамма-положении нуклеотида) имела бы свободу для диссоциации от связки и диффундировала бы от проводящего канала, возвращая, посредством этого, поле вокруг проводящего канала в его невозмущенное состояние. Появление и исчезновение сигнала, по мере того как поле вокруг проводящего канала возмущается и возвращается в невозмущенное состояние, соответственно, может коррелировать с включением нуклеотида в растущую нить нуклеиновой кислоты-мишени.
Тип нуклеотида, который включается в растущую нить в каждом положении нити матрицы, может определяться на основе уникальных свойств меток, включенных в каждый тип нуклеотида. Например, четыре типа дНТФ могут быть различены по положению, где область специфичности гибридизуется с областью ассоциации связки, длине области специфичности и/или присутствию заряженной группировки на метке, валентности заряда и величине заряда. Например, данный нуклеотид может иметь заряд данной валентности и величины, которых не имеют другие нуклеотиды, которые имеют заряд другой валентности и/или величины. Проводящий канал может иметь способность выявлять различия валентности и/или величины заряда. Во время включения нуклеотида с заряженной меткой в растущий полинуклеотид полимеразой, прикрепленной связкой к проводящему каналу, данный проводящий канал может выявлять валентность и/или величину заряда метки нуклеотида, включенного в качестве комплемента нуклеотиду нити матрицы. При продвижении полимеразы с включением следующего вида нуклеотида, в свою очередь, комплементарного следующему нуклеотиду матрицы, валентность и/или величина заряда такого следующего вида нуклеотида, включенного в растущую нить, также может быть выявлена проводящим каналом. И так далее, по мере того, как последовательные нуклеотиды с заряженными метками включаются в растущую нить.
По мере того как последовательные заряженные метки выявляются проводящим каналом, могут записываться различия в прохождении тока через проводящий канал, возникающие из-за различий заряженных меток, и сохраняться, как, например, на машиночитаемом информационном носителе, который может быть запрограммирован таким образом, чтобы записывать данный идентифицированный вид нуклеотида для каждого включения, полимеризованный полимеразой, по мере того как синтезируется растущая нить, на основе валентности и/или величины заряда, выявленного проводящим каналом для каждого такого включения.
На ФИГ. 2 предоставлен пример, где достигается различение четырех состояний между основаниями G, А, С и Т с использованием 2 заряженных меток и двух положений гибридизации связки. В частности, дЦТФ уникально метится отрицательно заряженной внешней группировой, дТТФ уникально метится положительно заряженной внешней группировой, дАТФ и дГТФ различаются от двух других типов нуклеотидов на основе отсутствия любой внешней заряженной группировки, и дАТФ различается от дГТФ на основе дифференциальной близости олигонуклеотидных группировок к проводящему каналу, когда они гибридизуются со связкой.
Будет понятно, что разные типы нуклеотидов могут быть различены на основе любой из множества комбинаций положительно заряженных группировок, отрицательно заряженных группировок и/или положений гибридизации связки. Альтернативно или дополнительно, заряженные группировки, используемые для различения разных типов нуклеотидов, могут отличаться по силам зарядов, даже если данные заряды имеют тот же самый знак. В типичной конфигурации, показанной на ФИГ. 3, приводится различение четырех состояний между основаниями G, А, С и Т на основе одного положения гибридизации связки и четырех разных заряженных группировок. В частности, в данном неограничивающем примере и дГТФ, и дЦТФ содержат отрицательно заряженные группировки, которые отличают их от дАТФ и дТТФ, и дГТФ может быть отличена от дЦТФ из-за заряда, который отличительно выше, чем заряд дЦТФ. Аналогичным образом, дАТФ и дТТФ могут быть отличены друг от друга из-за более высокого положительного заряда на группировке дАТФ по сравнению с группировкой дТТФ.
Как отмечено в данном документе ранее, точность размещения метки в конкретных положениях гибридизации вдоль связки может быть увеличена посредством применения связки, имеющей рибонуклеотиды, и нуклеотидной метки, имеющей основания РНК, модифицированные 2'-O-метилом (2'-O-Ме) и 2'-фторо (2'F). В альтернативных конфигурациях может использоваться связка, которая содержит рибонуклеотиды, модифицированные 2'-O-Ме и 2'F, с меткой, имеющей рибонуклеотиды, или и связка, и метка могут включать смесь природных рибонуклеотидов и рибонуклеотидов, модифицированных 2'-O-Ме и 2'F. Хотя применять связку и/или олигонуклеотидную группировку, которые, главным образом, состоят из РНК, необязательно, может быть желательным применение связки и/или олигонуклеотид а на основе ДНК или на основе ПНК, или на основе аминокислот для того, чтобы избегать чувствительности к нуклеазе, которая ассоциирована с РНК. Например, связка на основе ДНК или на основе ПНК, или связка на основе аминокислот, и/или олигонуклеотид могут включать природные рибонуклеотиды или неприродные аналоги рибонуклеотидов для достижения преимуществ связывания, раскрытых в данном документе, при уменьшении риска нежелательного расщепления нуклеазой. В других примерах связка может включать один или более чем один дезоксирибонуклеотид, который является комплементарным дезоксирибонуклеотидам в нуклеотидной метке, или, в качестве альтернативы, данная метка может включать дезоксирибонуклеотиды, которые являются комплементарными дезоксирибонуклеотидам в нуклеотидной метке.
Связка, которая прикрепляет полимеразу к проводящему каналу, может иметь разные положения связывания (например, акцепторные области) в отношении разных нуклеотидных последовательностей, как изложено в нескольких примерах, раскрытых в данном документе. Положения связывания в отношении двух или более нуклеотидных последовательностей могут перекрываться, или они могут быть дискретными без перекрывания. В целях иллюстрации последовательность связки показана на ФИГ. 8 как ряд общих нуклеотидов «N». Любую из множества последовательностей можно использовать согласно правилам комплементарности и желательным силам и специфичностям гибридизации. В зависимости от длины связки, длины акцепторной области и длины области специфичности, некоторые, все или ни один сайт связывания на связке могут перекрываться. В некоторых аспектах комплементарные основания представляют собой стандартные основания ДНК, но мог бы быть использован любой аналог нуклеотида (например, могут быть использованы аналоги дезоксирибонуклеотидов).
Связывающаяся со связкой олигонуклеотидная группировка области специфичности аналога нуклеотида может иметь последовательность нуклеотидов, которая специфично гибридизуется с комплементарной последовательностью на акцепторной области связки. В некоторых примерах связывающаяся со связкой олигонуклеотидная группировка также может включать положения неразборчивых нуклеотидов, которые не специфично связываются со связкой. Такие положения могут обеспечивать слабые взаимодействия между связывающейся со связкой олигонуклеотидной группировкой и связкой, что облегчает образование специфичной гибридной структуры. Например, как показано на ФИГ. 9, олигонуклеотидная группировка может включать несколько инозинов (I), которые, как известно, связываются неразборчиво, хотя и слабо, со всеми четырьмя природными нуклеотидами ДНК. Связывающаяся со связкой олигонуклеотидная группировка (например, область специфичности) и связка (например, акцепторная область) могут образовать слабый комплекс через взаимодействия между инозинами в олигонуклеотидной группировке, связывающейся со связкой, и природными нуклеотидами в связке. Это может обеспечивать более быструю ассоциацию специфических частей последовательности (например, указанных как ABC и ее комплемента А'В'С на Фиг.), чем они ассоциировали бы, если бы требовалась диффузия без образования слабого комплекса. Кроме того, как только образовался специфичный комплекс, инозины могут обеспечивать дополнительную стабильность.
Неограничивающие типичные связывающиеся со связкой олигонуклеотидные группировки на ФИГ. 9 включают положения неразборчивых нуклеотидов, фланкирующие обе стороны специфичной последовательности. Однако будет понятно, что одно или более чем одно положение неразборчивого нуклеотида может быть расположено только на 5'- или 3'-стороне специфичной последовательности. Другие примеры положений неразборчивых нуклеотидов включают положения, образованные посредством синтеза вырожденного олигонуклеотида, или положения, образованные другими аналогами нуклеотидов, которые, как известно в данной области, неразборчиво гибридизуются с 2 или более чем 2 типами нуклеотидов.
Несколько примеров, изложенных в данном документе, проиллюстрировали применение множества разных аналогов нуклеотидов, имеющих области специфичности олигонуклеотидов отличающейся длины. В таких примерах разные типы аналогов нуклеотидов могут различаться на основе разной длины их областей специфичности. В качестве альтернативы, разные аналоги нуклеотидов могут иметь связывающиеся со связкой олигонуклеотидные группировки одинаковой или аналогичной длины, которая может не обеспечивать различение одного от другого. Однако каждый аналог нуклеотида может иметь последовательность специфичности, которая связывается с отличной акцепторной областью связки по сравнению с акцепторной областью или областями, где связываются области специфичности других аналогов нуклеотидов. Типичная конфигурация показана на ФИГ. 10, где связывание полимеразы с отличным аналогом нуклеотида помещает полимеразу в одно из четырех различимых состояний. В неограничивающем примере, показанном на ФИГ. 10, связывающаяся со связкой олигонуклеотидная группировка аналога АТФ связывается в положении на связке, которое является ближайшим к точке присоединения связки к полимеразе, связывающаяся со связкой олигонуклеотидная группировка аналога ТТФ связывается в положении на связке, которое является самым дальним от точки присоединения связки к полимеразе, и связывающаяся со связкой олигонуклеотидная группировка аналогов ГТФ и ЦТФ связывается, соответственно, в отличных положениях на связке, которые находятся на промежуточных расстояниях от сайтов связывания связывающихся со связкой олигонуклеотидных группировок двух других аналогов нуклеотидов. Связывание других аналогов нуклеотида с полимеразой может располагать полимеразу на разных расстояниях от проводящего канала (например, вызывая образование в связке петель разного размера, как показано на Фиг.). В примерах, где один или более чем один аналог нуклеотида включает заряженную метку или другую выявляемую группировку (например, простирающуюся от дистального конца связывающейся со связкой олигонуклеотидной группировки по отношению к концу, который простирается от нуклеотида, подлежащего включению в нуклеотидную последовательность полимеразой), связывание между связывающейся со связкой олигонуклеотидной группировкой и связкой может размещать группировку заряженной метки на разных расстояниях от проводящего канала. В таких случаях разные типы аналогов нуклеотидов могут различаться, по меньшей мере частично, на основе различий в сигналах, производимых для разных расстояний группировок выявляемой заряженной метки от проводящего канала. Для этого иллюстративного примера аналоги нуклеотидов идентифицируются как АТФ, ГТФ, ЦТФ и ТТФ, но мог бы использоваться любой аналог нуклеотида (например, могут быть использованы аналоги дезоксирибонуклеотидов).
В других примерах, таких как проиллюстрированные на ФИГ. 13А и 13В, область специфичности меченого нуклеотида, как раскрыто в данном документе, может включать полинуклеотидные последовательности, каждая из которых гибридизуется с отличным отрезком акцепторной области связки. Между такими последовательностями область специфичности может представлять собой интервал нуклеотидов, которые не гибридизуются с частью акцепторной области. Две последовательности могут, следовательно, гибридизоваться с соответствующими комплементарными частями акцепторной области связки и расположенной между частью области специфичности, причем расположенная между последовательность свободна в гибридизации где-нибудь еще (как, например, две комплементарные части такой расположенной между последовательности области специфичности гибридизуются друг с другом с образованием структуры шпильки, как показано на ФИГ. 13А), или свободна в гибридизации, оставаясь не связанной специфично (как, например, показано на ФИГ. 13B). На ФИГ. 13А и 13C «Клей» обозначает акцепторную часть связки, которая гибридизуется или иным образом кратковременно связывается с областью специфичности меченого нуклеотида. В некоторых примерах такое связывание может увеличивать выявление заряженной метки проводящим каналом (представленным на ФИГ. 13А и 13C проволокой, к которой присоединяется связка/акцепторная область/«Клей»).
Как продемонстрировано примером, представленным в виде диаграммы на ФИГ. 4, связка, которая присоединяет полимеразу к проводящему каналу, не обязательно должна иметь способность гибридизоваться с заряженной меткой или последовательностью специфичности, которая может присутствовать на аналоге нуклеотида. Скорее проводящий канал может быть функционализирован присоединением акцепторной области, отдельной от связки полимеразы, с которой может связываться область специфичности аналога нуклеотида. Различение разных нуклеотидов может достигаться на основе валентности заряда заряженной метки, силы заряда, длины комплекса связывания область специфичности:акцепторная область, или близости, или расположения образования комплекса акцепторная область:область специфичности относительно или в связи с проводящим каналом, или их комбинации, независимо от того, является ли акцепторная область частью связки полимеразы или иным образом присоединенной к проводящему каналу.
Иллюстративный пример аналога нуклеотида, несущего заряженную метку согласно настоящему раскрытию, показан на ФИГ. 5. Это является не единственным из многих примеров аналога нуклеотида, как описано и раскрыто в данном документе, и не ограничивает объем настоящего раскрытия. В данном неограничивающем примере дТ гексафосфат соединяется с заряженной меткой через линкерную область, содержащую область специфичности. Данный линкер в этом неограничивающем примере включает ковалентные связи, образованные клик-реакцией азид-алкин, хотя вместо этого можно применять другую химию, как раскрыто далее в данном документе. Для легкости ссылки, при описании в данном документе частей аналога нуклеотида, область в направлении правой части молекулы, как проиллюстрировано на ФИГ. 5, будет называться 3'-конец согласно соглашению о названии свободной 3'-гидроксильной группы на дезоксирибозе нуклеотида. Соответственно, область в направлении левой части молекулы, как проиллюстрировано на ФИГ. 5, где в данном примере располагается заряженная метка, будет называться 5'-конец в качестве удлинения в виде фосфатной группы, связанной с 5'-углеродом рибозы нуклеотида.
В Таблице I приводится неограничивающий список некоторых полезных модификаций и зарядов, которые можно использовать в качестве меток в приборе или способе, изложенных в данном документе.

В одном аспекте настоящее раскрытие относится к модифицированному нуклеотиду, включающему: нуклеотид; связывающую молекулу, присоединенную к фосфатной группе нуклеотида; и заряженную метку, присоединенную к связывающей молекуле, где данная заряженная метка включает множество элементов, выбранных из группы, состоящей из нуклеотидов и аминокислот, и возможных линкеров между элементами, и где данная заряженная метка содержит внутреннюю свернутую или вторичную структуру. В одном примере заряженная метка содержит одну или более чем одну фосфодиэфирную группу и возможные линкеры между элементами. В некоторых аспектах нуклеотид представляет собой природный нуклеотид или модифицированный нуклеотид. Структуры модифицированных нуклеотидов известны обычному специалисту в данной области и могут включать структурные модификации в отношении основания и сахарной группировки (например, алкилирование, аминогруппы или защитные группы). В некоторых примерах связывающая молекула содержит область специфичности. В некоторых примерах область специфичности содержит нуклеотидную последовательность, включающую от одного до шести нуклеотидов. В некоторых примерах заряженная метка включает от примерно 1 заряда до примерно 100 или примерно 200 зарядов. В некоторых примерах связывающая молекула содержит структуру, как показано ниже в Формуле I от -Х2 до группы (СН2)m. В одном примере заряженная метка не связывается с полимеразой (например, Phi29), использованной в способах в данном документе. В некоторых примерах заряженная метка содержит множество нуклеотидов, содержащих две несмежные области, которые связываются с акцепторной областью в связке полимеразы, образуя, посредством этого, в заряженной метке структуру шпильки.
Пример аналога нуклеотида или меченого нуклеотида представлен соединением следующей Формулы I:

в которой n представляет собой целое число от 3 до 10, m представляет собой целое число от 1 до 10, t представляет собой целое число от 0 до 50, X1 представляет собой прямую связь, С1-С10алкил, С1-С10оксаалкил, С1-С10тиаалкил или С1-С10азаалкил, Х2 представляет собой С1-С20алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, Х3 представляет собой прямую связь или олигонуклеотид, где данный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала, F1 выбран из флуорофора и прямой связи, и F2 отсутствует или представляет собой флуорофор.
А представляет собой 
 или амидную связь, и
или амидную связь, и
Y выбран из  и
и  q представляет собой целое число от 1 до 100, и
q представляет собой целое число от 1 до 100, и
В выбран из аминокислоты, нуклеотида,  где R выбран из Y, водорода и дендрона; и где q равен 1, когда В представляет собой дендрон, и число q В имеет заряд и плотность заряда. В одном примере предложен способ, включающий выявление включения полимеразой меченого нуклеотида в растущую нить полинуклеотида, комплементарную нити полинуклеотида матрицы, где данная полимераза присоединяется к проводящему каналу твердой подложки связкой, меченый нуклеотид представляет собой соединение Формулы I, и проводящий канал предназначен для того, чтобы выявлять меченый нуклеотид во время включения.
где R выбран из Y, водорода и дендрона; и где q равен 1, когда В представляет собой дендрон, и число q В имеет заряд и плотность заряда. В одном примере предложен способ, включающий выявление включения полимеразой меченого нуклеотида в растущую нить полинуклеотида, комплементарную нити полинуклеотида матрицы, где данная полимераза присоединяется к проводящему каналу твердой подложки связкой, меченый нуклеотид представляет собой соединение Формулы I, и проводящий канал предназначен для того, чтобы выявлять меченый нуклеотид во время включения.
В одном примере В содержит заряженную метку, и данная заряженная метка включает нуклеотиды, олигонуклеотиды, аминокислоты, пептидные нуклеиновые кислоты или их комбинации, где заряженная метка имеет внутреннюю свернутую или вторичную структуру.
Как объяснено далее в данном документе, получение соединения Формулы I может включать образование А реакцией, включающей реакцию связывания, и данная реакция связывания выбрана из группы, состоящей из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол-малеимид.
Также предложен способ выявления, с использованием детектора заряда, заряженной метки соединения Формулы I, как, например, во время включения нуклеотидной части соединения Формулы I в растущую нить полинуклеотида. В неограничивающем примере выявление может происходить во время секвенирования нуклеиновой кислоты, включая следующее: (а) предоставление полимеразы, присоединенной к проводящему каналу твердой подложки; (б) предоставление одного или более чем одного соединения Формулы I, при этом присутствие данного соединения может быть выявлено проводящим каналом, когда данная метка находится поблизости от проводящего канала; и (в) выявление включения данного соединения в растущую нить, комплементарную нуклеиновой кислоте-матрице, с использованием проводящего канала.
Также предложено соединение Формулы I, в котором В включает один или более чем один олигонуклеотид с одной или более чем одной формой стебля и петли, одной или более чем одной формой листа клевера, одной или более чем одной трубчатой формой, одной или более чем одной кольцевой формой, одной или более чем одной кубовидной формой, одной или более чем одной крестовидной формой, одной или более чем одной сферической формой, одной или более чем одной прямоугольной формой, одной или более чем одной пирамидальной формой, одной или более чем одной формой ромба, одной или более чем одной слоистой формой, одной или более чем одной колончатой формой, одной или более чем одной сморщенной формой или любой комбинацией двух или более чем двух из вышеупомянутых. В другом примере соединения Формулы I В включает один или более чем один полипептид с одной или более чем одной спиральной формой. Также предложено соединение Формулы I, в котором В включает один или более чем один олигонуклеотид, образующий крестовидную форму, одну или более чем одну молекулу пептидной нуклеиновой кислоты, связанную с одним или более чем одним олигонуклеотидом, и один или более чем один полипептид, связанный с одной или более чем одной молекулой пептидной нуклеиновой кислоты.
Также предложено соединение Формулы I, в котором В имеет заряд от -100е до +100е. Также предложено соединение Формулы I, в котором В имеет заряд от -100е до +100е и плотность заряда от -100е на кубический нанометр до +100е на кубический нанометр. Также предложено соединение Формулы I, в котором В имеет заряд от -200е до +200е. Также предложено соединение Формулы I, в котором В имеет заряд от -200е до +200е и плотность заряда от -200е на кубический нанометр до +200е на кубический нанометр.
В некоторых примерах соединение Формулы I факультативно может включать флуорофор, такой как представленный F1, F2 или обоими. Некоторые неограничивающие примеры флуорофоров включают цианиновые красители (например, Су2, Су3 или Су5), флуоресцеинизотиоцианат, родаминовые флуорофоры (например, тетраметилродамин) или другие. Факультативное присутствие флуорофора в соединении Формулы I может обеспечивать дополнительные применения, как, например, для выявления меченого нуклеотида, включающего флуорофор. Например, присутствие заряженной метки, содержащей флуорофор, может быть выявлено не только посредством выявления присутствия, валентности и величины заряда, который несет метка, но и способами выявления испускания флуоресценции, такими как резонансный перенос энергии флуоресценции.
Также предложен меченый нуклеотид, где заряженная метка включает одну или более чем одну пептидную нуклеиновую кислоту. В некоторых примерах заряженная метка включает одну или более чем одну пептидную нуклеиновую кислоту, и одна или более чем одна пептидная нуклеиновая кислота присоединяется к одной или более чем одной заряженной аминокислоте.
Также предложен способ образования соединения Формулы I, в котором заряженная метка включает олигонуклеотиды и образуется посредством ДНК-оригами. Как было бы понятно специалистам, ДНК-оригами включает сворачивание ДНК при создании непроизвольных форм в наномасштабе. Компактные структуры ДНК-оригами могут обеспечивать высокую плотность заряда, обеспечивая вариации плотности заряда в разных соединениях Формулы I. Более высокий заряд, более высокая плотность заряда и большая гибкость в варьировании заряда и плотности заряда заряженной метки могут увеличивать вероятность выявления заряженной метки проводящим каналом и также обеспечивать различение между разными заряженными метками, выявленными проводящим каналом. Больший интервал зарядов, которые могут переноситься заряженной меткой, обеспечивает большую дифференциацию между зарядами, которые несут разные примеры соединений Формулы I. В некоторых примерах разные нуклеотиды могут быть различены друг от друга посредством заряда, который несет метка, с которой они связаны, как в соединении Формулы I. Проводящий канал может, посредством этого, иметь способность дифференциально выявлять разные нуклеотиды, составляющие часть соединения Формулы I, на основе различий в величине заряда, который несут разные такие нуклеотиды.
В может включать положительно заряженные аминокислоты, такие как аргинин, гистидин и лизин, дающие заряженную метку с положительным зарядом. Вместо этого, В может включать аспарагиновую кислоту и глутаминовую кислоту, дающие заряженную метку с отрицательным зарядом. В некоторых примерах В представляет собой разветвленный полипептид или линейный полипептид, или циклический полипептид. В некоторых примерах В может представлять собой одну аминокислоту или полипептид с где-нибудь от 2 до 10 или от 11 до 20 аминокислот. В некоторых примерах некоторые из аминокислот В могут быть незаряженными, и в других примерах В может содержать некоторые аминокислоты, которые являются противоположно заряженными относительно других аминокислот В, тем не менее, В может сохранять общий положительный или отрицательный заряд.
В данном неограничивающем примере Формулы I нуклеотид, непосредственно связанный с n фосфатными группами, может представлять собой нуклеотид, распознаваемый полимеразой и включенный в синтезированную посредством нее нуклеотидную последовательность, комплементарную последовательности матрицы. В то время как аналог нуклеотида удерживается на месте полимеразой во время добавления к растущей синтезируемой полинуклеотидной последовательности, остальная часть аналога может выходить из нее и, как раскрыто в данном документе, для полимеразы поблизости от проводящего канала, заряженная метка (такая как представленная В в Формуле I и в заряженном пептиде, с которым она непосредственно связывается) может двигаться или приближаться к проводящему каналу таким образом, что данный проводящий канал может воспринимать валентность и величину заряда. Разные аналоги нуклеотида могут содержать разные нуклеотиды на 3'-конце аналога и, соответственно, разные пептидные заряженные метки на 3'-конце аналога таким образом, что проводящий канал, связанный с полимеразой, может выявлять различия в валентности и величине заряда при ассоциации полимеразы с разными аналогами нуклеотидов для включения нуклеотида в синтезируемую нуклеотидную последовательность. В данных примерах полимераза может отщеплять все, кроме одной фосфатной группы, непосредственно связанной с 5'-нуклеотидом аналога нуклеотида, таким образом, что часть в виде дНМФ аналога нуклеотида остается в последовательности синтезированного нуклеотида с 5'-фосфатной группой, свободной для связывания со следующим нуклеотидом, подлежащим включению, а отщепленная остальная часть аналога нуклеотида свободна для диссоциации от комплекса.
Фосфат или серия фосфатных групп, непосредственно связанных с 3'-нуклеотидом, могут включать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 фосфатных групп. Другие примеры могут включать больше, чем 10 фосфатных групп. Эта часть аналога нуклеотида может затем связываться алкильной связью, включающей 1-10 групп -СН2-. Другие примеры могут включать 11-20 таких групп в данном положении. В других примерах одна или более чем одна из этих 1-10 или 11-20 групп -СН2- может быть замещена C1-C20 углеводородом.
Данная часть аналога нуклеотида может быть дополнительно соединена 0-50 оксаалкильными группами, такими как группы -O-СН2-СН2-. В других примерах одна или более чем одна из этих 0-50 групп -O-СН2-СН2- может быть замещена C1-С150 углеводородом. Данная часть аналога нуклеотида может дополнительно соединяться алкильной связью, включающей 0-10 групп -СН2-, как представлено X1. Другие примеры X1 могут включать 11-20 таких групп в данном положении. В других примерах X1 одна или более чем одна из данных 1-10 или 11-20 групп -СН2- может быть замещена С1-С20 углеводородом. X1 также может представлять собой прямую связь, С1-С10 алкил, С1-С10 оксаалкил, C1-C10 тиаалкил или C1-C10 азаалкил.
Как более полно описано ниже, А представляет собой связывающую группу, посредством которой 5'-конец аналога нуклеотида может соединяться с заряженной меткой в направлении 3'-конца аналога нуклеотида. Например, нуклеотидфосфат может иметь функциональные группы, дополненные 5'-фосфатной группой, самой дистальной по отношению к дезоксирибозе (или рибозе), на конце которой функциональные группы могут представлять собой реакционноспособную группу. Реакционноспособная группа представляет собой химическую группу, способную к взаимодействию с другой химической группой, которые вместе представляют собой реакционноспособные группы, с образованием ковалентной связи или связей между ними при контролируемых условиях, как, например, в присутствии специфического реактива или реактивов, или при заданном рН, или температуре и т.д. Например, композиции, имеющие сходство или являющиеся примером частей Формулы I от 3'-нуклеотида вплоть до или до некоторого числа связей, не достигая А, могут иметься в продаже или синтезироваться согласно известным способам. Реакционноспособная группа может затем быть добавлена на конце такого соединения таким образом, что заряженная группа с другой реакционноспособной группой, с которой первая может реагировать с образованием ковалентной связи, могут взаимодействовать друг с другом, ковалентно связывая, посредством этого, заряженную метку с 3'-нуклеотидом с образованием соединения Формулы I.
Присоединенным к А может быть Х2. Х2 может представлять собой С1-С20 алкил, в котором индивидуальные остатки СН2 могут быть независимо заменены одной или более чем одной пептидной связью и (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24. В других примерах Х2 а может представлять собой целое число от 6 до 20. В других примерах одна или более чем одна из 1-20 алкильных групп Х2 может быть замещена C1-C20 углеводородом.
В одном примере В может представлять собой заряженную метку, соединенную с Х2 фосфатной связью. В может включать от 1 до 100 группировок, содержащих фосфодиэфирные группы. В одном примере В может включать от 1 до 200 группировок, содержащих фосфодиэфирные группы. Отрицательные заряды, которые несут атомы кислорода в таких фосфодиэфирных группах, могут придавать отрицательный заряд заряженной метке В со значением, пропорциональным числу группировок. Каждая из q группировок В может представлять собой отличную группировку от любых других группировок В, или они все могут быть одинаковыми по отношению друг к другу. Любая одна или более чем одна группировка В может представлять собой, например, дНМФ с адениновым, тиминовым, цитозиновым или гуанозиновым основанием. Любая одна или более чем одна группировка В может представлять собой:
спейсер С3  или дСпейсер
или дСпейсер  где R представляет собой атом водорода.
где R представляет собой атом водорода.
В некоторых примерах любая группировка В может включать любой НПФ (нуклеотидполифосфат). Заряженные метки, валентность, величина заряда которых или и то, и другое отличаются от валентности и величины заряда других заряженных меток, с которыми связываются другие 3'-нуклеотиды, обеспечивают дифференцированную идентификацию аналогов нуклеотидов проводящим каналом по мере того, как они удерживаются полимеразой, связанной с ним, во время синтеза полинуклеотида. В некоторых примерах некоторые аналоги нуклеотида представляют собой соединение Формулы I или аналогичное соединение, как раскрыто в данном документе. В некоторых примерах все нуклеотиды, используемые в реакции секвенирования посредством синтеза, содержат заряженную метку, которая включает одну или более чем одну фосфодиэфирную группу, как раскрыто в данном документе, такие как примеры соединений Формулы I или родственные соединения. В других примерах некоторые нуклеотиды, используемые в реакции секвенирования посредством синтеза, содержат заряженную метку, которая включает одну или более чем одну фосфодиэфирную группу, как раскрыто в данном документе, такие как примеры соединений Формулы I или родственные соединения, тогда как другие нуклеотиды, используемые в реакции секвенирования посредством синтеза, содержат заряженную метку, которая не включает такие соединения.
В других примерах каждый В может быть независимо выбран из аргинина, гистидина и лизина, давая заряженную метку с положительным зарядом. В другом примере каждый В может быть независимо выбран из аспарагиновой кислоты и глутаминовой кислоты, давая заряженную метку с отрицательным зарядом. В некоторых примерах число q В представляет собой разветвленный полипептид или линейный полипептид, или циклический полипептид. В некоторых примерах число q В может представлять собой одну аминокислоту или полипептид с где-нибудь от 2 до 10 или от 11 до 20 аминокислотами. В некоторых примерах некоторые из аминокислот В могут быть незаряженными, и в других примерах В может содержать некоторые аминокислоты, которые являются противоположно заряженными относительно других аминокислот В, тем не менее, В может сохранять общий положительный или отрицательный заряд. В некоторых примерах В может включать неприродные аминокислоты.
В других примерах В может представлять собой дендрон z генераций, содержащий одно или более чем одно составное повторяющееся звено и множество конечных звеньев, где z представляет собой целое число от 1 до 6, причем составные конечные звенья выбраны из группы, состоящей из:

где p1 представляет собой целое число от 1 до 3, где любая одна или более чем одна из p1 групп -СН2- факультативно заменен 1-3 группами -O-СН2-СН2-, р2 представляет собой целое число от 1 до 3, где любая одна или более чем одна из р2 групп -СН2- факультативно заменен 1-3 группами -O-СН2-СН2-, и концевые группы выбраны из группы, состоящей из карбоновой кислоты, сульфоновой кислоты, фосфоновой кислоты, аминогруппы или четвертичной аммонийной группы.
В может представлять собой заряженную метку в виде дендрона, соединенную с Х2 ее концом со свободной валентностью. В некоторых примерах дендрон, раскрытый в данном документе, может не быть присоединенным к аналогу нуклеотида, таким образом, как он ранее был химически связан с ним. В может включать составное повторяющееся звено с 2 степенями ветвления, такое как представленное следующим:
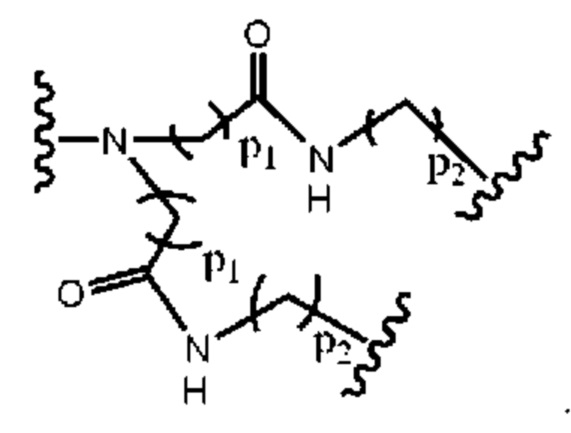
или В может включать составное повторяющееся звено с 3 степенями ветвления, такое как представленное следующим:

Как раскрыто далее в данном документе, заряженные метки на основе дердрона могут составлять где-нибудь от 1 до 6 генераций по размеру. Концевые группы на терминальных составных повторяющихся звеньях могут быть заряженными либо положительно, либо отрицательно. Дендроны с 2 степенями ветвления могут, следовательно, давать заряженную метку с зарядом 2Z, и дендроны с 3 степенями ветвления могут давать заряженную метку с зарядом 3Z (где величина заряда на концевую группу составляет 1).
В примере, где В представляет собой дендрон, концевые группы могут иметь любое число заряженных функциональных групп, таких как, например, группа карбоновой кислоты, сульфоновой кислоты, фосфоновой кислоты, аминогруппа или четвертичная аммонийная группа, или любая другая заряженная функциональная группа. В некоторых примерах составные повторяющиеся звенья дендрона могут включать заряд на атоме, отличном от концевой группы терминальных составных повторяющихся звеньев. Например, в качестве одного неограничивающего примера, составное повторяющееся звено может содержать четвертичную аммонийную группу в точке ветвления, которая могла бы нести положительный заряд. В отличие от заряженной концевой группы, которая присутствовала бы только на концевом составном повторяющемся звене, такой внутренний заряд может присутствовать на каждом образце составного повторяющегося звена в дендроне.
Может присутствовать пептидная связь, такая как факультативно представленная Х2 в Формуле I. В других примерах вместо пептидной связи, показанной в Формуле I, может присутствовать С1-С20 углеводород или прямая связь.
Для А линкер, связывающий нуклеотид с заряженной меткой, может образоваться реакцией связывания между реакционноспособными группами. Например, А может образоваться клик-реакцией азид-алкин с помощью меди между нуклеотидом с азидной (или алкиновой) группой и заряженной меткой с алкиновой (или азидной) группой, давая химическую структуру, такую как следующая, или ее эквивалент:

Или А может образоваться посредством лигирования тетразин (ТЕТ)-транс-циклооктен (ТСО) между нуклеотидом с тетразиновой (или транс-циклооктеновой) группой и заряженной меткой с транс-циклооктеновой (или тетразиновой) группой, давая химическую структуру, такую как следующая или ее эквивалент:

Или А может образоваться посредством клик-реакции группы азид-дибензоциклооктин (DBCO) без участия меди между нуклеотидом с азидной (или дибензоциклооктиновой) группой и заряженной меткой с дибензоциклооктиновой (или азидной) группой, давая химическую структуру, такую как следующая или ее эквивалент:
Или А может образоваться посредством конъюгирования тиол-малеимид между нуклеотидом с тиольной (или малеимидной) группой и заряженной меткой с малеимидной (или тиольной) группой, давая химическую структуру, такую как следующая или ее эквивалент:
Или А может образоваться посредством реакции связывания сложный N-гидроксисукцинимидиловый эфир-амин между нуклеотидом с аминогруппой (или группой N-гидроксисукцинимидилового эфира) и заряженной меткой с группой N-гидроксисукцинимидилового эфира (или аминогруппой), давая амидную связь.
Как было бы понятно специалистам, в настоящее раскрытие могут быть включены другие связывающие группы, образованные другими химиями лигирования между подходящими реакционноспособными группами, с образованием других структур для А, посредством которых 3'-нуклеотид может быть связан с заряженной меткой.
В Формулы I представляет собой заряженную метку. Как раскрыто в данном документе, заряженная метка может включать полипептиды, олигонуклеотиды, олигомерные пептидные нуклеиновые кислоты или дендрон, или комбинации из по меньшей мере двух из вышеупомянутых. Заряды заряженной метки могут нести заряженные функциональные группы таких группировок, такие как фосфодиэфирные связи, амидные группы, группы карбоновых кислот, или другие заряженные функциональные группы, которые могут быть добавлены к таким соединениям, такие как одна или более чем одна сульфоновая кислота, фосфоновая кислота или четвертичные аммонийные группы. Как раскрыто в данном документе, заряженная метка может принимать конкретную трехмерную ориентацию, таким образом, что заряды, которые несут ее элементы, удерживаются вместе, и предотвращается их выступание наружу и от проводящего канала. Такая конденсация заряда посредством увеличения плотности заряда заряженной метки может увеличивать заряд, выявленный проводящим каналом.
Заряженная метка может быть синтезирована таким образом, чтобы иметь подходящую реакционноспособную группу для формирования реакции клик-химии или лигирования согласно вышеизложенному. Например, заряженная метка может иметь азидную или алкиновую группу (как, например, для ковалентного присоединения и включения в аналог нуклеотида в виде заряженной метки посредством клик-реакции азид-алкин с помощью меди), или тетразиновую (ТЕТ) или транс-циклооктеновую группу (как, например, для ковалентного присоединения к и включения в аналог нуклеотида в виде заряженной метки посредством лигирования тетразин (ТЕТ)-транс-циклооктен (ТСО)), или азидную группу или группу DBCO (как, например, для ковалентного присоединения к и включения в аналог нуклеотида в виде заряженной метки посредством клик-реакции азид-группа DBCO без участия меди), или тиольную (например, остаток цистеина) или малеимидную группу (как, например, для ковалентного присоединения к и включения в аналог нуклеотида в виде заряженной метки посредством тиол-малеимидного конъюгирования). Также можно использовать другие известные лигирование, клик-химию или другие химии ковалентного присоединения с соответствующими реакционноспособными группами, присоединенными к заряженной метке, обеспечивая ее ковалентное присоединение к аналогу нуклеотида.
Может присутствовать пептидная связь, как, например, показано между А и 5'-нуклеотидом в Формуле I. В других примерах вместо пептидной связи, показанной в Формуле I, может присутствовать С1-С20 углеводород или прямая связь.
Как также было бы понятно специалистам, некоторые примеры включают модификации или вариации соединения Формулы I, которые включают элементы, обсуждавшиеся выше в связи с тем, как акцепторная область связки (посредством которой полимераза связывается с проводящим каналом) может гибридизоваться или иным образом образовать нековалентные связи с областью специфичности аналогов нуклеотидов. Например, некоторая часть аналога нуклеотида между 3'-нуклеотидом и 5'-заряженной меткой может включать нуклеотиды, остатки PNA или аминокислоты, способные образовать нековалентные связи со связкой, посредством которой полимераза соединяется с проводящим каналом или с частью, функционализированной акцепторной областью, простирающейся от и присоединенной к проводящему каналу, который сам может не быть частью такой связки и также может включать нуклеотиды, остатки PNA или аминокислоты, или их комбинации. Вышеописанным может осуществляться замещение или добавление к областям соединения Формулы I, как раскрыто в данном документе, между 5'-заряженной меткой и 3'-нуклеотидом. Такое замещение или добавление может способствовать синергическому связыванию аналога нуклеотида с полимеразой и со связкой (или с функционализированной частью проводящего канала вне связки с целью связывания с таким замещением или присоединением) для стимуляции ассоциации заряженной метки с выявляющей областью детектора заряда на протяжении подходящим образом длительного времени для обеспечения выявления заряженной метки для регистрации и обозначения включения аналога нуклеотида, несущего такой заряд, как раскрыто в данном документе.
В некоторых примерах принятие заряженной меткой трехмерной структуры может приводить к образованию области специфичности посредством приведения друг к другу в иных отношениях пространственно разрозненных элементов области специфичности, обеспечивая связывание собранной таким образом области специфичности с акцепторной областью. Такое образование области специфичности и связывание с акцепторной областью может не происходить или может с низкой вероятностью происходить, или происходить только очень кратковременно в отсутствие принятия конкретной трехмерной структуры заряженной метки. В другом примере приведение друг к другу в иных отношениях разрозненных элементов области специфичности при связывании с акцепторной областью может индуцировать или стимулировать принятие заряженной меткой данной трехмерной конформации. В некоторых примерах принятие трехмерной конформации заряженной метки и встреча в иных ситуациях пространственно удаленных элементов области специфичности могут быть синергичными таким образом, что каждое стимулирует другое. В некоторых случаях трехмерная конформация, принятая таким образом заряженной меткой, приводит к более высокой плотности заряда, которая в противном случае вероятно образовалась бы, и может усиливать выявление заряженной метки проводящим каналом.
Можно использовать разные конструкции пептидных заряженных меток. С использованием твердофазного пептидного синтеза в заряженную метку может быть включена любая из 21 аминокислоты. Кроме того, модифицированные аминокислоты также имеются в продаже и могут быть добавлены в пептидную заряженную метку для дальнейшей модуляции ее свойств. Кроме применения аминокислот с электрически заряженными боковыми цепями, таких как аргинин, гистидин и лизин (положительно заряженные), и аспарагиновой кислоты и глутаминовой кислоты (отрицательно заряженные), в пептидную заряженную метку могут быть включены другие аминокислоты для корректировки ее гидрофобности, длины и размера.
Как раскрыто выше, в одном примере пептидная заряженная метка может быть представлена в виде линейных (см. ФИГ. 12А), разветвленных (см. ФИГ. 12В и 12С) или циклических цепей (см. ФИГ. 12D).
Посредством применения отличной комбинации аминокислот, такой как KKKKK или ЕЕЕЕЕ (или других комбинаций заряженных аминокислот, с дополнительными незаряженными аминокислотами или без них) разной длины, могут быть различены 4 разных аналога нуклеотидов для секвенирования, или могут быть различены разные аналоги нуклеотидов на основе характерной сигнатуры тока от каждой пептидной заряженной метки. Также возможны другие более сложные трехмерные конформации. Например, пептидная заряженная метка может принимать спиральную конформацию, такую как α-спираль. Такая структура может включать положительно или отрицательно заряженные аминокислоты, но общий положительный или отрицательный заряд. Например, размещение противоположно заряженных аминокислот может индуцировать связывание между ними и принятие α-спиральной или другой структуры, где избыток положительного или избыток отрицательного заряда удерживается поблизости друг от друга, увеличивая плотность заряда. В других примерах аналогичное связывание может стимулировать принятие структуры суперспирали, включающей плотность нетто положительного или отрицательного заряда.
Заряженная метка также может включать олигонуклеотид. Олигонуклеотидная заряженная метка может быть присоединена к аналогу нуклеотида с использованием реакций клик-химии и химии лигирования, описанных выше, для присоединения пептидной заряженной метки к аналогу нуклеотида.
Олигонуклеотидная заряженная метка может принимать разные трехмерные ориентации, которые стимулируют сжатие ее заряда при повышенной плотности заряда. Например, фосфодиэфирные связи между нуклеотидами олигонуклеотида могут иметь отрицательный заряд. Посредством принятия конденсированной трехмерной структуры отрицательные заряды олигонуклеотида могут удерживаться близко друг к другу, увеличивая выявление такой заряженной метки проводящим каналом. Например, олигонуклеотид может принимать хорошо известные структуры, такие как сутруктура стебля и петли, структура листа клевера или крестовидная структура (как, например, структура Холлидея). Для конструирования полинуклеотидных заряженных меток, которые принимают другие конформации, которые увеличивают плотность заряда, также можно использовать методики полинуклеотидной оригами. Полинуклеотидная заряженная метка может принимать трубчатые формы, кольцевидные формы, кубовидные формы или сферическую форму. Такие формы могут приводить к олигонуклеотидной заряженной метке с более высокой плотностью заряда, которую имел бы олигонуклеотид с таким же составом нуклеотидов, но не принимающий трехмерную конформацию, как если бы он был вытянут в линейную конформацию.
Для удобства и ясности определенные термины, используемые в данном описании изобретения, примерах и формуле изобретения, описываются в данном документе.
Если не определено иначе, подразумевается то, что алкил включает линейные или разветвленные насыщенные углеводородные структуры и их комбинации. Термин «алкил» относится к алкильным группам от 1 до 20 атомов углерода - например, от 1 до 10 атомов углерода, как, например, от 1 до 6 атомов углерода и т.д. Примеры алкильных групп включают метильную, этильную, пропильную, изопропильную, н-бутильную, втор-бутильную, трет-бутильную и тому подобные.
Циклоалкил представляет собой поднабор углеводородов и включает циклические углеводородные группы от 3 до 8 атомов углерода. Примеры циклоалкильных групп включают ц-пропил, ц-бутил, ц-пентил, норборнил и тому подобные.
C1-C20 углеводород включает алкил, циклоалкил, полициклоалкил, алкенил, алкинил, арил и их комбинации. Примеры включают бензил, фенэтил, пропаргил, аллил, циклогексил метил, адамантил, камфорил и нафтилэтил. Термин «углеводород» относится к любому заместителю, содержащему водород и углерод в качестве единственных элементарных заместителей.
Если не определено иначе, подразумевается то, что термин «карбоцикл» включает кольцевые системы, в которых все атомы кольца представляют собой углерод, но в любом состоянии окисления. Таким образом, (С3-С12) карбоцикл относится как к неароматическим, так и к аромеическим системам, включающим такие системы как циклопропан, бензол и циклогексан. Термин «карбоцикл», если не ограничивается иначе, относится к моноциклам, бициклам и полициклам. (С8-С12) карбополицикл относится к таким системам, как норборнан, декалин, индан и нафталин.
Термин «алкокси» или «алкоксил» относится к группам из 1-20 атомов углерода, например, от 1 до 10 атомов углерода, как, например, от 1 до 6 атомов углерода и т.д. прямой или разветвленной конфигурации, присоединенным к родительской структуре через кислород. Примеры включают метокси, этокси, пропокси, изопропокси и тому подобные.
Термин «оксаалкил» относится к алкильным остаткам, в которых один или более чем один углерод (и ассоциированные с ними атомы водорода) может быть заменен кислородом. Примеры включают метокси пропокси, 3,6,9-триоксадецил и тому подобные. Термин оксаалкил подразумевается таким, как его понимают в данной области [см. Naming and Indexing of Chemical Substances for Chemical Abstracts, опубликованную Американским химическим обществом, издание 2002 г.,  но без ограничения 127(a) - данная ссылка включается посредством ссылки во всей ее полноте], - он относится к соединениям, в которых кислород связывается посредством одинарной связи с его смежными атомами (образуя простые эфирные связи); он не относится к кислороду, связанному двойной связью, который находился бы в карбонильных группах. Аналогично, тиаалкил и азаалкил относятся к алкильным остаткам, в которых один или более чем один углерод был замещен серой или азотом соответственно. Примеры азаалкила включают этиламиноэтил и аминогексил.
но без ограничения 127(a) - данная ссылка включается посредством ссылки во всей ее полноте], - он относится к соединениям, в которых кислород связывается посредством одинарной связи с его смежными атомами (образуя простые эфирные связи); он не относится к кислороду, связанному двойной связью, который находился бы в карбонильных группах. Аналогично, тиаалкил и азаалкил относятся к алкильным остаткам, в которых один или более чем один углерод был замещен серой или азотом соответственно. Примеры азаалкила включают этиламиноэтил и аминогексил.
Гетероцикл означает циклоалкильный или арильный карбоциклический остаток, в котором от одного до четырех углеродов заменяется гетероатомом, выбранным из группы, состоящей из N, О и S. Гетероарил представляет собой поднабор гетероцикла, в котором гетероцикл является ароматическим. Примеры гетероароматических колец включают: фуран, бензофуран, изобензофуран, пиррол, индол, изоиндол, тиофен, бензотиофен, имидазол, бензимидазол, пурин, пиразол, индазол, оксазол, бензоксазол, изоксазол, бензизоксазол, тиазол, бензотиазол, триазол, тетразол, пиридин, хинолин, изохинолин, пиразин, хиноксалин, акридин, пиримидин, хиназолин, пиридазин, циннолин, фталазин и триазин.
Термин «факультативно замещенный» в том виде, в котором он используется в данном документе, может использоваться взаимозаменяемо с «незамещенный или замещенный». Термин «замещенный» относится к замене одного или более чем одного атома водорода в определенной группе специфическим радикалом. Например, замещенный алкил, арил, циклоалкил, гетероциклил и т.д. относится к алкилу, арилу, циклоалкилу или гетероциклилу, в котором один или более чем один атом Н в каждом остатке заменен галогеном, галогеналкилом, алкилом, ацилом, алкоксиалкилом, гидроксиловералкилом, карбонилом, фенилом, гетероарилом, бензолсульфонилом, гидрокси, низшим алкокси, галогеналкокси, оксаалкилом, карбокси, алкоксикарбонилом [-С(=O)O-алкил], алкоксикарбониламино [HNC(=O)O-алкил], карбоксамидо [-C(=O)NH2], алкиламинокарбонилом [-С(=O)NH-алкил], циано, ацетокси, нитро, амино, алкиламино, диалкиламино, (алкил) (арил)аминоалкилом, алкиламиноалкилом (включая циклоалкиламиноалкил), диалкиламиноалкилом, диалкиламиноалкокси, гетероциклилалкокси, меркапто, алкилтио, сульфоксидом, сульфоном, сульфониламино, алкилсульфинилом, алкилсульфонилом, алкилсульфониламино, арилсульфонилом, арилсульфониламино, ациламиноалкилом, ациламиноалкокси, ациламино, амидино, арилом, бензилом, гетероциклилом, гетероциклилалкилом, фенокси, бензилокси, гетероарилокси, гидроксиимино, алкоксиимино, оксаалкилом, аминосульфонилом, тритилом, амидино, гуанидино, уреидо, бензилоксифенилом и бензилокси. «Оксо» также включается среди данных заместителей, на которые дается ссылка в «факультативно замещенный»; специалистам в данной области будет понятно то, что, поскольку оксо представляет собой двухвалентный радикал, имеются обстоятельства, в которых он не будет подходящим в качестве заместителя (например, на фениле). В одном примере 1, 2 или 3 атома водорода могут быть заменены определенным радикалом. В случае алкила и циклоалкила более чем три атома водорода могут быть заменены фтором; в самом деле, все доступные атомы водорода могли быть заменены фтором. Такие соединения (например, перфторалкил) попадают в класс «фторуглеводородов». Для ясности, общий термин может охватывать более чем один заместитель, то есть, например, термин «галогеналкил» или «галогенфенил» относится к алкилу или фенилу, в котором по меньшей мере один, но факультативно более чем один атом водорода заменен галогеном. В некоторых примерах заместителями являются галоген, галогеналкил, алкил, ацил, гидроксиалкил, гидрокси, алкокси, галогеналкокси, оксаалкил, карбокси, циано, ацетокси, нитро, амино, алкиламино, диалкиламино, алкилтио, алкилсульфинил, алкилсульфонил, алкилсульфониламино, арилсульфонил, арилсульфониламино и бензилокси.
В описании в данном документе соединений используется терминология «замещенный по меньшей мере одним оксигенированным заместителем». Оксигенированный заместитель представляет собой заместитель, который содержит кислород, помимо углерода и водорода; оксигенированный заместитель также может включать дополнительные гетероатомы, такие как азот (например, карбоксамид или метансульфонил). Типичные примеры оксигенированных заместителей включают алкокси, гидрокси, фторалкокси, формил, ацетил и другие С1-С6 ацильные цепи.
НЕОГРАНИЧИВАЮЩИЕ РАБОЧИЕ ПРИМЕРЫ
Следующие примеры предназначены для иллюстрации конкретных примеров настоящего раскрытия, но ни в коей мере не предназначены для того, чтобы ограничивать его объем.
Некоторые примеры заряженных меток для включения в нуклеотид, которые были получены согласно настоящему раскрытию, включают следующее:
 (поли-Т или другой полинуклеотид или комбинация нуклеотидов,
(поли-Т или другой полинуклеотид или комбинация нуклеотидов,  (поли дСпейсер),
(поли дСпейсер),
и  (поли С спейсер), или комбинации любых из вышеизложенных.
(поли С спейсер), или комбинации любых из вышеизложенных.
Заряды таких заряженных меток можно варьировать изменением числа группировок, содержащих фосфатную группу, например, 5, 10, 15, 20, 25, 30, 35, 40 или любое число, или интервал между ними. Можно включать вплоть до 40 или любое число от 1 до 40. Можно включать больше, чем 40. Можно использовать подходящие реакционноспособные группы, отличные от трансциклооктеновой группы, показанные в данных примерах, согласно настоящему раскрытию.
В качестве заряженной метки можно использовать последовательность олигонуклеотида с разными длинами зарядов, которые дают фосфаты в фосфодиэфирных связях. Кроме того, для создания заряженных меток с разной гидрофобностью и размером также можно использовать модифицированные олигонуклеотиды, такие как нуклеотиды дСпейсер и С3 спейсер. Последовательность олигонуклеотида может быть модифицирована с использованием разных оснований и гидрофобных модификаций для модулирования специфичности последовательности, минимизации ингибирования полимераз и оптимизации взаимодействий с поверхностью и линкерами.
Заряженные метки на основе фосфодиэфира могут присоединяться к 5'-концевому фосфату нуклеотида. При включении каждого нуклеотида полимеразой в растущую нить во время синтеза комплемента нити-матрицы заряженная метка может высвобождаться как часть пирофосфатного побочного продукта. Заряд на метке выявляется системой выявления на проводящем канале. На основе характерной сигнатуры тока от каждой метки (например, величины заряда) основания, включенные в синтезируемую нить, могут различаться с использованием дифференциальной величины заряда, который дают метки.
Примеры аналогов нуклеотидов согласно настоящему раскрытию включали следующие, без ограничения:




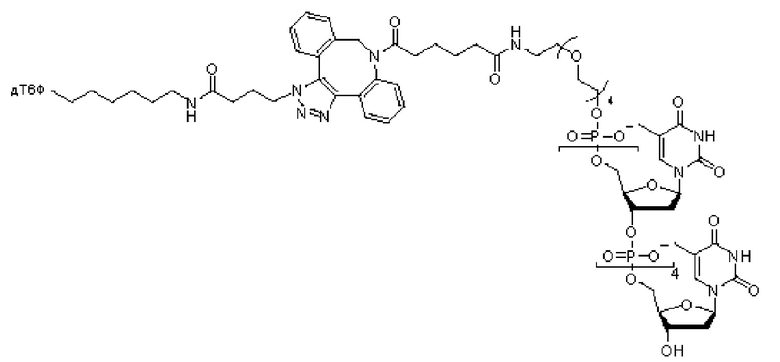
Заряженные метки на основе фосфодиэфира синтезировали с использованием фосфорамидитной химии и автоматического олигонуклеотидного синтеза. Их очищали после синтеза и затем присоединяли к специфическому нуклеотиду посредством способов ортогональной химии. Способы ортогональной химии включали, без ограничения, катализируемое медью связывание алкин-азид, клик-химию с DBCO и азидом без помощи меди, лигирование ТСО-тетразин или тиол-малеимидное лигирование.
В неограничивающих примерах ниже показана модификация 5'-аминонуклеотидгексафосфата разными линкерами для обеспечения химии ортогонального присоединения к фосфодиэфирным заряженным меткам. 5-Амин-дезокситимингексафосфат (дТ6Ф) (или другой НПФ) (1) может быть функционализирован сложным азидо-масляным N-гидроксисукцинимидиловым (NHS) эфиром (2а) или сложным метилтетразин-NHS эфиром (2b) с образованием азид-дТ6Ф (3а) или метилтетразин-дТ6Ф (3b) соответственно (Схема 1).

Азид-дТ6Ф (3а) может быть конъюгирован с линейной нитью поли-Т-олигонуклеотида (4) с 5'-гексинильной группой посредством циклоприсоединения азид-алкин с помощью меди(I) (CuAAC) в присутствии CuSO4, трис-гидроксипропилтриазолилметиламинового (ТНРТА) лиганда и аскорбата натрия с образованием конъюгата олигонуклеотида (5а). Очистку проводили высокоэффективной жидкостной хроматографией (ВЭЖХ) на С18 колонке с обращенной фазой и элюировали 50 мМ ТЕАА (рН 7,5) и ацетонитрилом. Репрезентативный пример реакции CuAAC с поли-Т олигонуклеотидом показан на Схеме 2.

Метилтетразин дТ6Ф (3b) был конъюгирован с линейной нитью поли-Т олигонуклеотида (6) с 5'-трансциклооктеновой (ТСО) группой в 50 мМ фосфатном буфере (рН 7,4) с образованием конъюгата олигонуклеотида (5b). Очистку проводили ВЭЖХ на колонке С18 с обращенной фазой и элюировали 50 мМ ТЕАА (рН 7,5) и ацетонитрилом. Репрезентативный пример лигирования метилтетразин-ТСО показан на Схеме 3.

Азид дТ6Ф (3а) конъюгировали с линейной нитью поли-Т олигонуклеотида (7) с 5'-дибензоциклооктильной (DBCO) группой посредством стимулируемого деформацией циклоприсоединения азид-алкин без участия меди (SPAAC) в 50 мМ фосфатном буфере (рН 7,4) с образованием конъюгата олигонуклеотида (5с). Очистку проводили ВЭЖХ на колонке С18 с обращенной фазой и элюировали 50 мМ ТЕАА (рН 7,5) и ацетонитрилом. Репрезентативный пример реакции SPAAC с поли-Т олигонуклеотидом показан на Схеме 4.
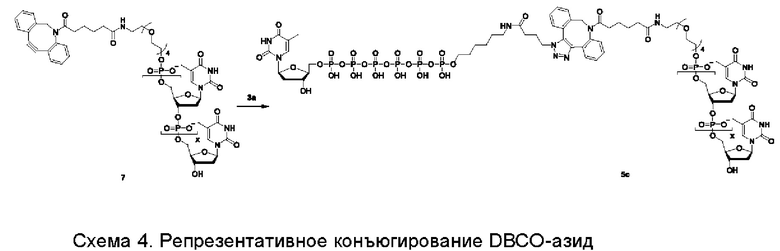
На следующей схеме клик-реакция азид-алкин связывала нуклеотидфосфат с заряженной меткой:

Как было бы понятно специалистам, вышеизложенные примеры могут быть модифицированы как, например, посредством обращения размещения каждой реакционноспособной группы реакции лигирования или реакции клик-химии, с получением вышеизложенных связей, но ориентированных в противоположном направлении по отношению к 5'- и 3'-концам аналогов нуклеотидов.
Реакционноспособные группы и химические структуры линкеров могут быть добавлены к нуклеотидам и заряженным меткам согласно разным применимым химиям согласно настоящему раскрытию. В некоторых неограничивающих примерах к аминированному НПФ может быть добавлен азидный или метилтетразиновый хвост посредством реакции с подходящим остатком NHS, который может включать линкерные части разной длины, как, например, линкер PEG4 или линкер на основе PEG (полиэтиленгликоль) разной длины. Неограничивающие примеры таких схем синтеза включают следующую и ее вариации:

Использовали разные группировки NHS для присоединения азидной или метилтетразиновой реакционноспособной группы с разной длиной линкеров. Неограничивающие примеры включают:

Образовались разные НПФ с разными реакционноспособными группами для реакций клик-химии или лигирования для их ковалентного присоединения к заряженным меткам. Некоторые неограничивающие примеры включали:
 взаимодействовал с алкинсодержащей заряженной меткой с образованием, например, следующего:
взаимодействовал с алкинсодержащей заряженной меткой с образованием, например, следующего:

В качестве альтернативы, НПФ, содержащий метилтетразин, такой как  взаимодействовал с ТСО-содержащей заряженной меткой с образованием следующего:
взаимодействовал с ТСО-содержащей заряженной меткой с образованием следующего:
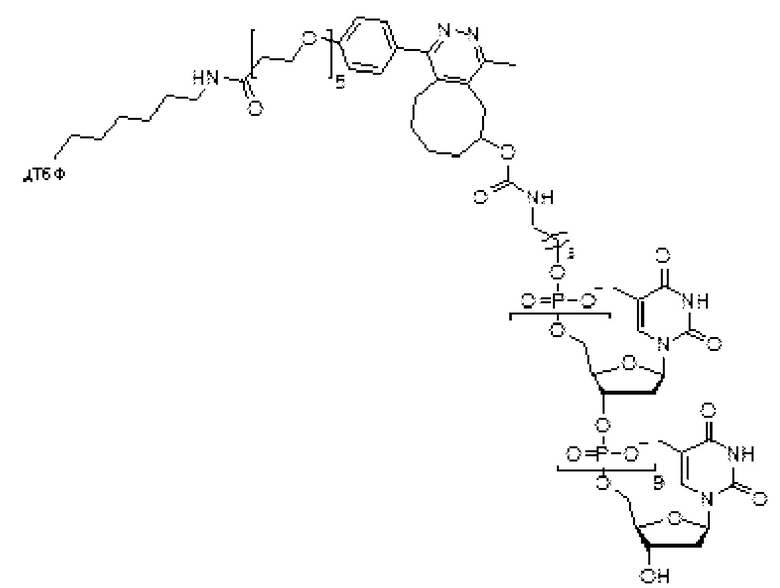
В других примерах использовали клик-химию DBCO-азид между НПФ и заряженной меткой для образования таких соединений, как следующее:

В других примерах малеимидная группа на нуклеотиде или заряженной метке может взаимодействовать с тиольной группой на заряженной метке или нуклеотиде, соответственно, со связыванием двух посредством реакции малеимид-тиол:
НПФ или заряженная метка, содержащая малеимидную группу  взаимодействовала с заряженной меткой или НПФ, содержащим тиолсодержащую группу, соответственно, в присутствии восстановителя, такого как (трис(2-карбоксиэтил)фосфин), приводя к ковалентному связыванию между обоими, например
взаимодействовала с заряженной меткой или НПФ, содержащим тиолсодержащую группу, соответственно, в присутствии восстановителя, такого как (трис(2-карбоксиэтил)фосфин), приводя к ковалентному связыванию между обоими, например 
Как показано в Таблице 2, для разной клик-химии с помощью меди можно использовать разные соли меди, лиганды, добавки, растворители, продолжительности реакции и температуры реакции.

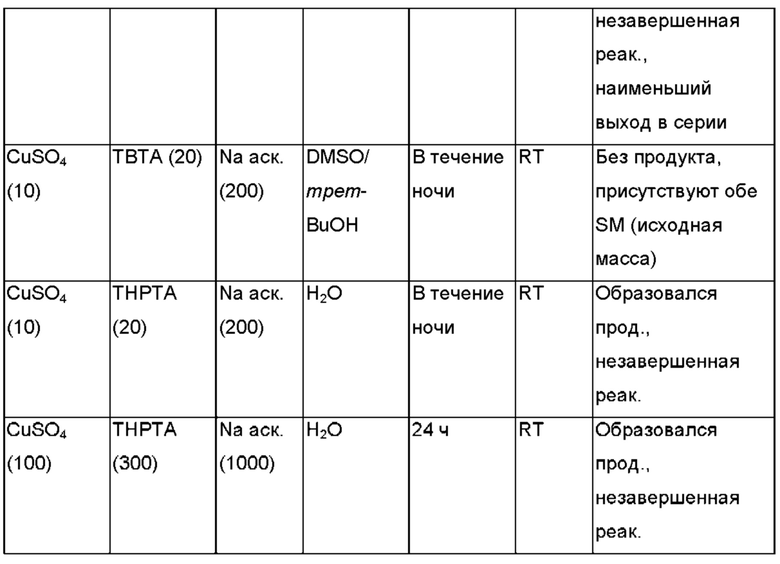
Как можно видеть, в общих терминах, при высокой загрузке Cu реакция может идти до завершения, но с низким выходом. По сравнению с этим при низкой загрузке Cu реакция может не идти до полного завершения, но выход может быть выше. С промежуточной загрузкой Cu реакция может идти до завершения, и продукт реакции может быть выделен с выходом 86% посредством ВЭЖХ.
Было продемонстрировано включение модифицированных нуклеотидов заряженной метки на основе фосфодиэфиров. Включение может осуществляться разными полимеразами, такими как phi29 (и ее вариантами) и фрагмент Кленова или другими, используемыми в способах секвенирования посредством синтеза. Обе полимеразы могут успешно включать заряженные метки. Включение посредством phi29 для данного примера показано на ФИГ. 11. В данном примере полинуклеотидные последовательности одноцепочечной ДНК-матрицы иммобилизовали на полимеризованном субстрате и инкубировали с буферным раствором (50 мМ Tris, рН 7,5; 5 мМ MnCl2, 4 мМ DTT (дитиотрейтол)), содержащим 100 нМ 5'-Су5-меченные ДНК-праймеры (22-меры), комплементарные части последовательностей такой матрицы, 1 мкМ phi29, и 10 мкМ данного нуклеотида для однонуклеотидного включения в праймеры на основе матрицы. После инкубации в течение разных продолжительностей времени при 30 градусах Цельсия для обеспечения 5' включения меченного зарядом тимидина (комплементарного остатку аденозина на нити матрицы непосредственно 5' относительно части, комплементарной праймерам) полимеразную реакцию гасили, праймеры дегибридизировали и разделяли на геле для выявления однонуклеотидного включения. Связи между дезоксирибо-тимидин-5'-гексафосфатом (дТ6Ф) включали Т5, Т10 и Т15, имеющие указанные повторы тимидиновых нуклеотидов в качестве заряженных меток; Т5, Т10 и Т15 присоединяются посредством клик-химии, тогда как T5-Tet присоединяется посредством лигирования тетразин-ТСО. В качестве заряженных меток также использовали олигонуклеотиды С3 спейсер (С3) и дСпейсер, присоединенные посредством лигирования ТСО-тетразин. TMR представляет собой меченный тетраметилродамином дТ6Ф со следующей формулой:

и дТТФ представляет собой дезокситимидинтрифосфат без заряда или метки для того, чтобы предназначень в качестве контроля.
Обращаясь к ФИГ. 11, 1110, 1120 и 1130, каждая индивидуально представляет % включения дТТФ, Т10 или Т5, соответственно (графики которых перекрываются друг с другом и, следовательно, являются почти неразличимыми друг от друга на ФИГ. 11), 1140 представляет включение Т15, 1150 представляет включение T5-Tet, и 1160, 1170 и 1180 каждая индивидуально представляет % включения TMR, д и С3 соответственно (графики которых перекрываются друг с другом и, следовательно, являются почти неразличимыми друг от друга на ФИГ. 11).
Неограничивающий пример схемы синтеза, использованной для синтеза аналога нуклеотида с пептидной заряженной меткой согласно настоящему раскрытию показан ниже:

В другом примере, в отличие от положительно заряженных: остатков лизина, как проиллюстрировано выше, использовали сопоставимую схему для осуществления синтеза заряженной метки с отрицательно заряженными аминокислотами, такой как:
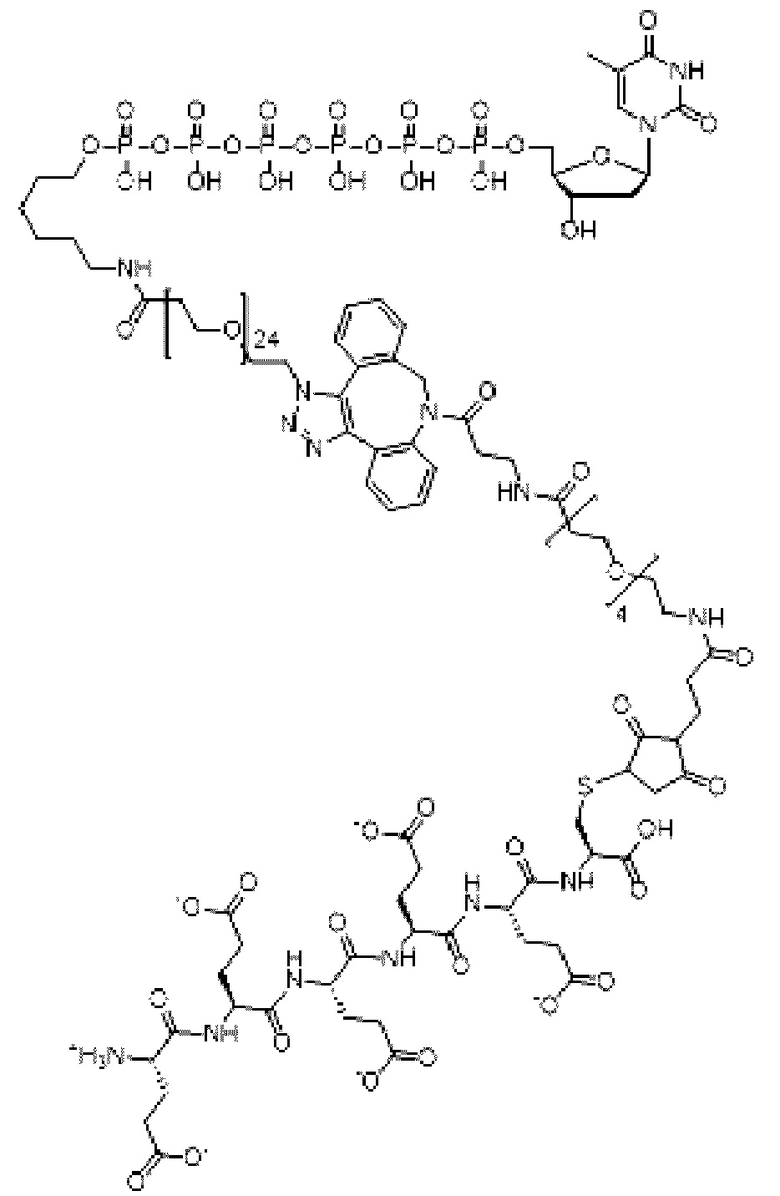
Как было бы очевидно специалистам, были бы возможны многие вариации данной схемы, находящиеся в пределах сохранения идей настоящего раскрытия. Например, можно использовать аминокислоты, отличные от лизина, включая любые заряженные или незаряженные аминокислоты, описанные выше, и их число может быть больше или меньше, чем длина пептидной заряженной метки, показанной в данном примере. Следовательно, можно использовать пептидные заряженные метки с зарядами разных валентностей и величин.
Кроме того, на 5'-конец аналога нуклеотида можно добавлять разные реакционноспособные группы и с разными типами и длинами линкерных частей, как, например, для дополнительных неограничивающих примеров:

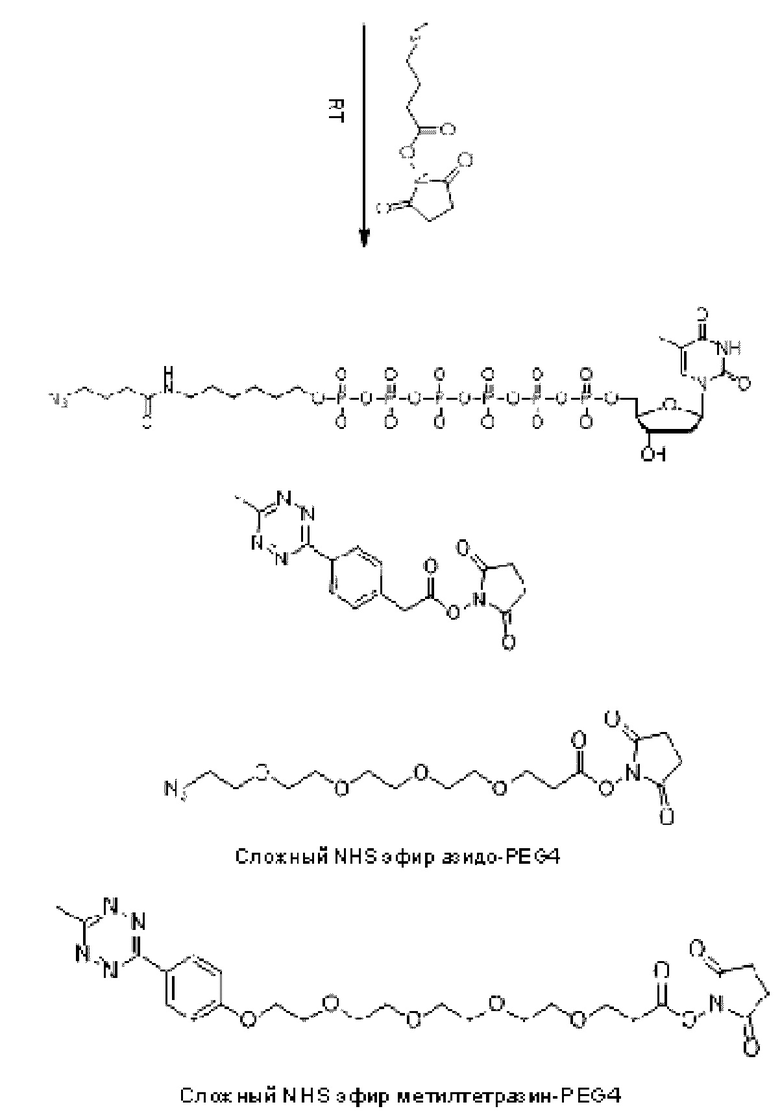
Данные присоединения могут давать аналоги нуклеотидов с разными реакционноспособными группами, включающими азидные или метилтетразиновые реакционноспособные группы с добавлением линкеров разных типов и длины, включая, в качестве неограничивающих примеров:

В других примерах аналогичным образом добавляли алкиновую, ТСО или DBCO группу, или тиольную группу. Соответствующая реакционноспособная группа могла быть затем добавлена к пептидной заряженной метке таким образом, что обе могли быть связаны посредством раскрытых выше клик-химии или химии лигирования, или другими химиями, известными специалистам. Заряженные метки на основе пептида могут быть синтезированы с использованием химии флуоренилметоксикарбонильной (Fmoc) и трет-бутилоксикарбонильной (Вос) защитной группы для твердофазного синтеза пептидов. В синтез пептида на терминальном конце может быть введена реакционноспособная группа в виде ортогональной «ручки» для обеспечения конъюгирования нуклеотида или нуклеиновой кислоты. Способы ортогональной химии включают клик-реакцию азид-алкин с помощью меди, клик-химию с DBCO и азидом без участия меди, и лигирование ТСО-тетразин. Реакционноспособные боковые цепи аминокислот, такие как тиол цистеина, также могут использоваться в химии тиол-малеимид.
Доступность аминокислот, содержащих боковые цепи с разными pKa, также допускает пептидные заряженные метки, которые были бы заряженными при разных рН. Например, гистидин имеет pKa 6,04, тогда как лизин имеет боковую цепь с pKa 10,54. Таким образом, при нейтральном рН только лизин мог бы быть заряженным. Это также обеспечивает дополнительную модуляцию числа зарядов и плотности зарядов посредством модифицирования рН буферного окружения.
Кроме того, пептидные заряженные метки могут быть легко добавлены к олигомерам пептидных нуклеиновых кислот (ПНК), так как и пептиды, и ПНК синтезируются с использованием той же самой твердофазной пептидной химии. Это использовалось бы для дальнейшей модификации свойств пептидной заряженной метки или для добавления ассоциативных свойств заряженной метки линкерам, таким как линкеры на основе нуклеиновой кислоты.
Примеры соединений, используемых в синтезе дендронной заряженной метки, и соответствующие заряды на концевое составное повторяющееся звено включают следующие:

В данных примерах показаны разные реакционноспособные группы на конце дендрона со свободной валентностью, а также разная потенциальная длина стебля между точкой ветвления и свободным терминальным концом индивидуального составного повторяющегося звена, но они являются лишь неограничивающими примерами.
На следующей схеме приводятся иллюстративные примеры возможной структуры заряженной метки на основе дендрона:

Например, показаны дендрон с амидными связями и (А) концевой карбоновой кислотой или (В) аминогруппами; дендрон с поли(пропилениминовыми) (PPI) связями и (С) концевой карбоновой кислотой или (D) аминогруппами; и дендроны со сложноэфирными связями и (Е) концевой карбоновой кислотой или (F) аминогруппами.
В общем, заряженные метки на основе дендрона могут синтезироваться согласно дивергентным или конвергентным способам синтеза, согласно следующим репрезентативным схемам:

При дивергентном синтезе (А) дендрон собирается в серии реакций, расширяясь вовне от ядра, обычно посредством повторяющейся реакции Майкла. При конвергентном синтезе (В) дендрон строится посредством серии реакций построения, направленного внутрь, от периферии и, в конечном счете, присоединения к ядру.
Некоторые примеры схем такого дивергентного синтеза согласно настоящему раскрытию были следующими:

В данных примерах метакрилатную группу добавляли реакцей Майкла к алкиновому стеблю, с последующим либо снятием защиты ацетильных групп с образованием групп карбновой кислоты, либо присоединением этилендиамина с образованием аминогрупп. Повторяющиеся циклы реакции Майкла приводили к последовательному образованию дендронов с удвоенным числом концевых функциональных групп по сравнению с предыдущей генерацией. Могут быть добавлены дополнительные генерации, и могла бы использоваться другая реакционноспособная группа на стебле/конце со свободной валентностью. В некоторых примерах дополнительная генерация или более могут повторно добавляться согласно вышеизложенным схемам синтеза для увеличения заряда, который несет метка. Валентность заряда может изменяться посредством включения положительно или отрицательно заряженной аминокислоты в концевой группе. Примеры показаны на ФИГ. 18А и 18В. В обоих неограничивающих примерах показана заряженная метка, заканчивающаяся остатком цистеина, которая могла бы связываться с линкерным отрезком для придания заряда нуклеотиду, как раскрыто в данном документе, хотя в качестве примеров также подразумеваются другие химические сруктуры, такие как раскрытые в данном документе. На ФИГ. 18А показаны положительно заряженные остатки лизина для концевых групп, с последующими 2, 3 или 4 разветвлениями, дающие разные величины концевого заряда. В качестве альтернативы, как показано на ФИГ. 18B, отрицательно заряженная аминокислота, такая как глутамат, могла бы образовать концевые группы после разных генераций ветвления, вновь давая разные величины концевого заряда.
В другом примере один или более чем один остаток лизина в заряженной метке может быть метилирован (например, триметилирован). В отличие от неметилированного лизина, заряд триметилированного лизина не является зависимым от рН.
Другой пример с DBCO на конце со свободной валентностью является следующим:
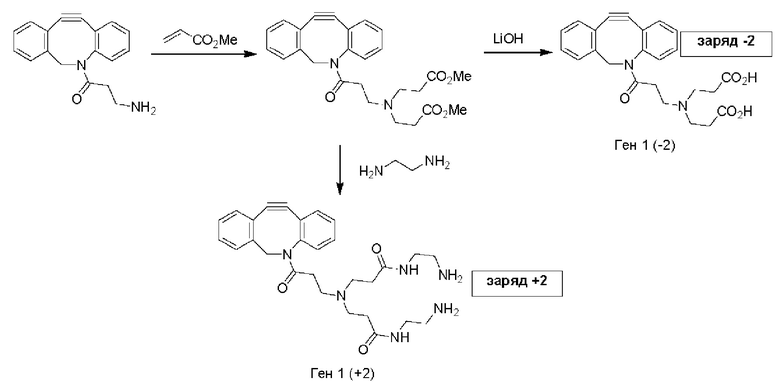
Некоторые примеры конструкций дендронов на основе амидов и PPI для заряженных меток на основе дендрона и их синтез включают следующие:

Некоторыми преимуществами четвертичных аммонийных групп, включенных в примеры С-1 и С-2, является то, что на них может не влиять рН, они могут не координировать металлы и с меньшей вероятностью могут присоединяться к поли(винилфосфоновой кислоте) (PVPA) во время синтеза и обращения.
В другом примере можно использовать составное повторяющееся звено с тремя степенями ветвления. В еще одном другом примере можно использовать конвергентный синтез, а не дивергентный синтез. Преимуществом применения звена с тремя степенями ветвления является то, что можно добавлять больше зарядов на генерацию по сравнению с дендроном со звеньями, имеющими только две степени ветвления, приводя к тому, что требуется меньше генераций для достижения заданного предпочтительного заряда. Пример является следующим:
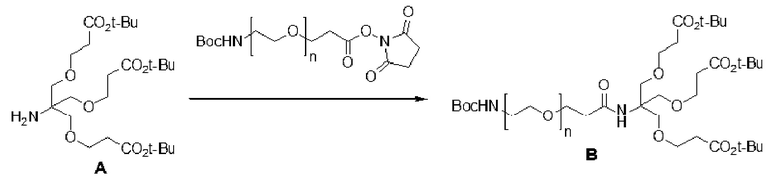
В данном примере составное повторяющееся звено является функционализированным трет-бутилоксикарбонильной (Вос) группой. Затем
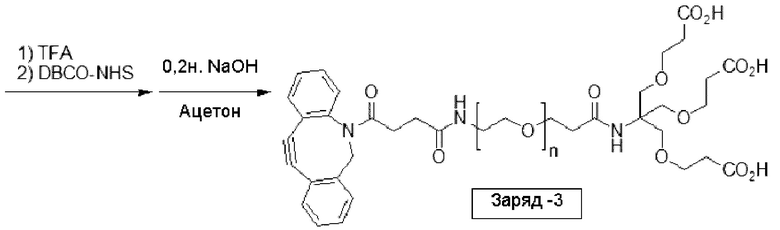
можно добавлять группу DBCO, с образованием групп карбоновой кислоты при снятии защиты с ацетильных групп.Образующееся соединение в данном случае имеет заряд -3. В следующей реакции добавляли соединение А, приведенное выше, во второй генерации дендрона с получением заряда 9 следующим образом:

Посредством поочередного объединения вышеописанных стадий можно объединять три дендрона второй степени с созданием дендрона третьей генерации с зарядом -27 через конвергентный синтез согласно следующему примеру:

Дендрон, несущий отрицательно заряженные группы карбоновой кислоты, превращали до дендрона, несущего положительно заряженые аминогруппы, следующим образом:

В другом примере группы карбоновой кислоты превращали до аминогрупп согласно следующей схеме:

Для второй генерации с зарядом+9 можно использовать следующую схему:
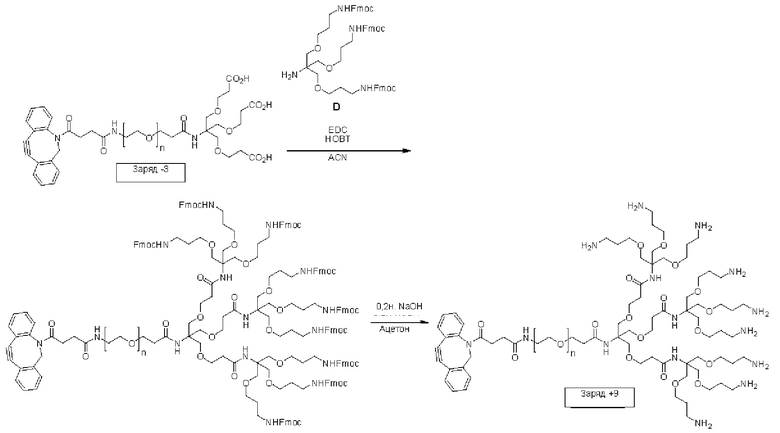
И дендрон третьей генерации можно синтезировать посредством схемы конвергентного синтеза с образованием дендрона с зарядом +27 следующим образом:

В зависимости от реакционноспособных групп на конце со свободной валентностью, синтезировали дендрон согласно настоящему раскрытию, который может включать без ограничения любой из примеров, описанных выше, и соответствующая парная реакционноспособная группа может быть добавлена к аналогу нуклеотида для обеспечения лигирования дендрона заряженной метки с аналогом нуклеотида. Согласно вышеизложенному в аналог нуклеотида может быть включен широкий спектр зарядов, включая -32, -27, -16, -9, -8, -4, -3, -2, +2, +3, +4, +8, +9, +16, +27 и +32. Также можно использовать заряженные функциональные группы, отличные от групп, проиллюстрированных в вышеизложенных неограничивающих типичных схемах синтеза.
В некоторых примерах такую разветвленную структуру можно использовать для добавления к заряженной метке многих зарядов на основе фосфодиэфира. Например, разветвленная структура, такая как согласно структуре дендрона, как здесь показано, а не одиночная линейная нить полинуклеотида или другого содержащего фосфодиэфир заряженного соединения, как раскрыто в данном документе, может включать в качестве концевой группы нуклеотид или полинуклеотид. Посредством основания ветвления таких меток, содержащих фосфодиэфир, в последовательных генерациях согласно структуре дендрона, как раскрыто в данном документе, в одной заряженной метке могут быть объединены многие полинуклеотиды или другие заряды, основанные на фосфодиэфире, например, структуры на основе дендрона, такие как показано на ФИГ. 17А и В. На ФИГ. 17А показан пример метки, объединяющей три последовательности поли-Т в одной метке, которая может быть включена в соединение Формулы I согласно способам, как раскрыто в данном документе. В данном примере метка несла бы заряд -30. На ФИГ. 17В проиллюстрировано несколько способов объединения меток, содержащих фосфодиэфир, с получением заданного заряда (в данном примере -30): линейная последовательность из 30 фосфодиэфирных зарядов, трижды разветвленная структура, заканчивающаяся тремя фосфодиэфирными последовательностями из 10, или структура, дважды разветвленная второе и заканчивающаяся 6 фосфодиэфирными последовательностями из пяти. Преимуществом усиленного ветвления, как, например, в последнем примере по сравнению с первым, может быть более высокая плотность заряда с более высокой концентрацией коротких заряженных последовательностей поблизости друг от друга, в отличие от одной протяженной последовательности, которая могла бы простираться от проводящего канала.
В другом примере заряд может предоставляться компонентом заряженной метки на основе спермина. Например, олигокатионный заряд на основе спермина может быть добавлен к нуклеотиду и может обеспечивать положительный заряд в виде заряженной метки согласно настоящему раскрытию. Олигосперминовый конъюгат имеет приблизительно 2,5 протонированных амина при рН 7. Пример такого нуклеотида, меченного зарядом, показан на ФИГ. 19А и 19В. На ФИГ. 19А показан пример олигосперминового конъюгата согласно одному аспекту настоящего раскрытия, и на ФИГ. 19В показана структурированная дендроном метка с концевыми группами, образующимися из спермина, для увеличения количества заряда, который может располагаться на концевых терминалях заряженной метки. В обоих примерах химии, раскрытые в данном документе для присоединения заряженных меток к нуклеотидам, могли бы быть адаптированы специалистами для присоединения таких заряженных меток, образующихся из спермина, к нуклеотидам согласно аспектам настоящего раскрытия.
Неограничивающие примеры ниже показывают модификацию 5'-аминонуклеотидгексафосфата разными линкерами для обеспечения ортогональной химии присоединения к заряженным меткам на основе дендрона. 5'-Аминодезокситимингексафосфат (дТ6Ф) (или другие НПФ) (1) может быть функционализирован сложным азидо-масляным N-гидроксисукцинимидиловым (NHS) эфиром (2а) или сложным метилтетразин-NHS эфиром (2b) с образованием азид-дТ6Ф (3а) или метилтетразин-дТ6Ф (3b) соответственно (Схема 6).

Азид дТ6Ф (3а) может быть конъюгирован с линейной нитью поли-Т олигонуклеотида (4) с 5'-гексинильной группой посредством циклоприсоединения азид-алкин с помощью меди(I) (CuAAC) в присутствии Си SO4, трис-гидроксипропилтриазолилметиламинового (ТНРТА) лиганда и аскорбата натрия с образованием конъюгата олигонуклеотида (5а). Очистку проводили ВЭЖХ на колонке С18 с обращенной фазой и элюировали 50 мМ ТЕАА (рН 7,5) и ацетонитрилом. Метилтетразин дТ6Ф (3b) можно затем конъюгировать с дендроном с трансциклооктеновой (ТСО) группой в 50 мМ фосфатном буфере (рН 7,4) с образованием аналога нуклеотида с заряженной меткой на основе дендрона.
В качестве альтернативы, азид дТ6Ф (3а) также можно конъюгировать с заряженной меткой на основе дендрона с дибензоциклооктильной (DBCO) группой посредством стимулируемого деформацией циклоп рисоединения азид-ал кин без участия меди (SPAAC) в 50 мМ фосфатном буфере (рН 7,4) с образованием аналога нуклеотида с заряженной меткой на основе дендрона.
На следующей схеме клик-реакция азид-алкин может осуществляться для связывания нуклеотидфосфата с заряженной меткой, такой как заряженная метка на основе дендрона с алкиновой группой на ее конце со свободной валентностью:

Как было бы понятно специалистам, вышеизложенные примеры могут быть модифицированы, как, например, посредством обращения размещения каждой реакционноспособной группы реакции лигирования или реакции клик-химии, с получением вышеизложенных связей, но ориентированных в противоположном направлении по отношению к 5'- и 3'-концам аналогов нуклеотидов.
Реакционноспособные группы и химические структуры линкеров могут быть добавлены к нуклеотидам и заряженным меткам согласно разным применимым химиям согласно настоящему раскрытию. В некоторых неограничивающих примерах к аминированному НПФ может быть добавлен азидный или метилтетразиновый хвост посредством реакции с подходящим остатком NHS, который может включать линкерные части разной длины, как, например, линкер PEG4 или линкер на основе PEG разной длины. Неограничивающие примеры таких схем синтеза включают следующую и ее вариации:

Можно использовать разные группировки NHS для присоединения азидной или метилтетразиновой реакционноспособной группы с разной длиной линкеров. Неограничивающие примеры включают:
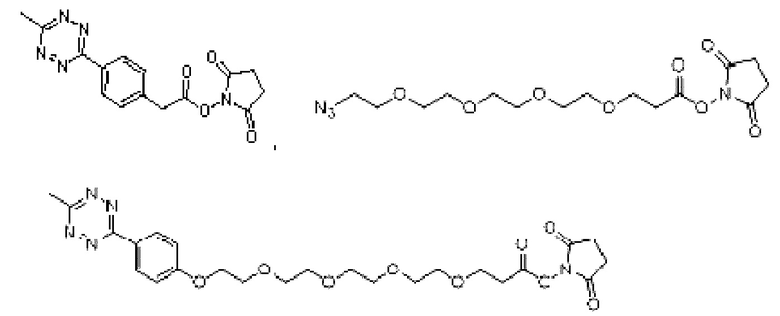 и
и
Могут образоваться разные НПФ с разными реакционноспособными группами для реакций клик-химии или лигирования для их ковалентного соединения с заряженными метками. Некоторые неограничивающие примеры включают
 которым мог бы взаимодействовать с алкинсодержащей заряженной меткой, такой как заряженная метка на основе дендрона с алкиновой группой на ее конце со свободной валентностью.
которым мог бы взаимодействовать с алкинсодержащей заряженной меткой, такой как заряженная метка на основе дендрона с алкиновой группой на ее конце со свободной валентностью.
В качестве альтернативы, НПФ, содержащий метилтетразин, такой как

мог бы взаимодействовать с ТСО-содержащей заряженной меткой, такой как заряженная метка на основе дендрона с ТСО группой на ее конце со свободной валентностью.
В других примерах можно использовать клик-химию DBCO-азид между НПФ и заряженной меткой на основе дендрона. В других примерах малеимидная группа на нуклеотиде или заряженной метке на основе дендрона может взаимодействовать с тиольной группой на заряженной метке или нуклеотиде, соответственно, со связыванием двух посредством реакции малеимид-тиол:
НПФ или заряженная метка, содержащая малеимидную группу  взаимодействовала с заряженной меткой или НПФ, содержащим тиолсодержащую группу, соответственно, в присутствии восстановителя, такого как (трис(2-карбоксиэтил)фосфин), что может приводить к ковалентному связыванию между обоими, например
взаимодействовала с заряженной меткой или НПФ, содержащим тиолсодержащую группу, соответственно, в присутствии восстановителя, такого как (трис(2-карбоксиэтил)фосфин), что может приводить к ковалентному связыванию между обоими, например 
Некоторые неограничивающие иллюстративные примеры заряженных меток с трехмерными конформациями, которые могут вызывать высокую плотность заряда, показаны на ФИГ. 13А-С, 14А, 14В, 15 и 16. На ФИГ. 13С показано три примера аналогов нуклеотидов с олигонуклеотидными заряженными метками. Например, олигонуклеотидная заряженная метка может содержать 5, 10, 15, 20, 25, 30, 35, 40 или более олигонуклеотидов. Также показаны проводящий канал, в данном случае - нанопроволока, и функционализированное присоединение к данному проводящему каналу, в частности акцепторная область. Данная акцепторная область показана как «Клей». Олигонуклеотидные заряженые метки показаны как пунктирные линии, идущие от 5'-конца модифицированного нуклеотида. Показаны три разные конформации, которые могут принимать заряженные метки. ФИГ. 13А, например, иллюстрирует узнаваемую структуру стебля и петли. В такой структуре нуклеотиды вдоль части в виде стебля образуют пары оснований друг с другом, оставляя часть в виде петли между ними, проиллюстрированную в данном примере как ориентированную от акцепторной области. Отрицательные заряды от фосфодиэфирных связей между нуклеотидами олигонуклеотидной заряженной метки могут, посредством этого, сохраняться в непосредственной близости друг к другу, поддерживая более высокую плотность заряда, чем та, которая может быть получена, если они принимали линейную вытянутую конформацию.
На ФИГ. 13В, например, показан другой пример без демонстрации структуры стебля и петли, но с демонстрацией выпяченной области заряженной метки. В данном случае, как и на ФИГ. 13А, заряженная метка включает область специфичности, показанную связанной с акцепторной областью. Здесь область специфичности включает отрезки олигонуклеотида, которые являются пространственно разрозненными друг с другом в обстоятельствах, когда олигонуклеотид растягивается линейно. Но при индукции электростатическим притяжением для ассоциации с акцепторной областью части области специфичности притягиваются ближе друг к другу. Данная конформация согласуется с принятием конформации стебля и петли (ФИГ. 13А) или выпяченной конформации (ФИГ. 13В), в обоих случаях вызывая увеличение плотности заряда заряженной метки.
На ФИГ. 13С показана заряженная метка, принимающая архитектуру листа клевера. Аналогично конформации стебля и петли, стебли, простирающиеся из центрального узелка, образуются нитями нуклеотидов, которые привлекаются друг к другу правилами образования пар по Уотсону-Крику, удерживаются вместе петлей между ними. Между стеблями, расходящимися лучами от центрального узелка находятся соединительные нити олигонуклеотида. Как и с другими примерами, образование пар оснований нуклеотидов в заряженной метке индуцирует принятие меткой конформации, которая вызывает конденсацию вместе отрицательных зарядов фосфодиэфирных связей между нуклеотидами, приводя к увеличению плотности заряда по сравнению с тем, какой могла бы быть плотность, если бы олигонуклеотид был вытянут линейно.
Возможны другие трехмерные конформации олигонуклеотидных заряженных меток. Отрицательные заряды фосфодиэфирных связей между нуклеотидами могут быть индуцированы к приближению друг к другу при высокой плотности заряда из-за образования пар оснований по Уотсону-Крику. Могут приниматься разные трехмерные формы с использованием, например, методологии ДНК оригами, создания олигонуклеотидных заряженных меток в трубчатой, кольцевой, кубовидной, спиральной, конденсированной спиральной, сферической или сфероидной, или других конформациях, давая высокую плотность заряда.
На ФИГ. 14 показан пример двух заряженных меток: одной, включающей олигонуклеотидные последовательности (14А, слева), и другой, включающей такие последовательности, помимо последовательностей пептидной нуклеиновой кислоты и полипептидов (14В, справа). Не показаны соединения между данными заряженными метками и аналогами нуклеотидов, но такое присоединение может осуществляться методиками химического связывания, такими как методики, раскрытые в данном документе, или известные из других источников. Конформация 14А слева представляет собой крестовидную форму. Четыре олигонуклеотидные последовательности связываются друг с другом в конформации, имеющей сходство со структурой Холидей (которая может встречаться во время событий рекомбинации ДНК). Как показано на 14А, части четырех полинуклеотидов связываются друг с другом согласно образованию пар оснований по Уотсону-Крику. Каждый олигонуклеотид также простирается от центральной области, связанной парами, в однонитевые липкие концы. Образование пар поддерживает отрицательные заряды фосфодиэфирных связей в олигонуклеотидах поблизости друг от друга, увеличивая плотность заряда.
Справа на 14В последовательности пептидной нуклеиновой кислоты и полипептида добавляются к заряженной метке, показанной на 14А, приводя к другому неограничиващему примеру заряженной метки. В данном примере каждая из четырех последовательностей пептидных нуклеиновых кислот связывает на ее концах последоватеьности полипептида. Последовательности полипептида образуют спиральные структуры из-за электростатического притяжения между некоторыми аминокислотами в пределах полипептидов. Однако в данных примерах полипептиды имеют нетто положительный заряд (несмотря на включение в них некоторых отрицательно заряженных аминокислот, которые способствуют принятию спиральной конформации). Части последовательностей пептидной нуклеиновой кислоты, соединяющие пары полипептидов, также гибридизуются с однонитевыми частями полинуклеотидов, которые простираются из ядра, образованного парами оснований. Сильные связи между пептидными нуклеиновыми кислотами и укрепленной спиральной конформацией положительно заряженных полипептидов обеспечивают нетто положительный заряд заряженной метки и с высокой плотностью заряда. Другие примеры заряженных меток, принимающих аналогичные архитектуры, могут иметь нетто отрицательный заряд.
На ФИГ. 15 показаны некоторые примеры полипептидных заряженных меток, в которых полипептиды принимают различные трехмерные архитектуры, которые приводят к высокой плотности заряда. Спиральные части полипептида могут соединяться линкерными последовательностями. Когда линкерные последовательности являются довольно короткими, спиральные структуры могут быть способны связываться друг с другом в грубо, в общем, в линейных группах. Такая конформация возможна из-за электростатического притяжения между положительно и отрицательно заряженными аминокислотами в пределах полипептидов. В общем, однако, полипептидные заряженные метки могут иметь нетто положительный или нетто отрицательный заряд. С более длинными линкерами между спиральными частями полипептидов заряженной метки, однако, меньшие стерические препятствия обеспечивают больший изгиб между смежными спиральными частями, обеспечивая принятие более сложных архитектур, таких как показанные в нижней части ФИГ. 15. Данные возможности могут приводить к даже более высокой плотности заряда. Как и с примерами, показанными на ФИГ. 14А и 14В, данные типичные заряженные метки могли бы прикрепляться к аналогам нуклеотидов (не показано).
На ФИГ. 16 показаны примеры полипептидных заряженных меток, принимающих архитектуру суперспирали, где электростатическое притяжение между аминокислотами в пределах спирали и между аминокислотами разных спиралях может индуцировать образование полипептидами конденсированной структуры. Результатом может быть то, что суперспираль может иметь нетто отрицательный или нетто положительный заряд с нетто зарядом, удерживаемым вместе при высокой плотности заряда (по сравнению с тем, какой могла бы быть плотность заряда, если бы последовательности полипептида были линейно вытянуты).
Для присоединения аналога нуклеотида к заряженной метке можно использовать любую клик-химию или химию лигирования, описанную выше, или для образования ковалентных связей для присоединения любой из вышеизложенных заряженных меток к аналогу нуклеотида могут использоваться любые химии.
Заряженные метки, включающие олигонуклеотиды, полипептиды или и те, и другие, с пептидными нуклеиновыми кислотами или без них, могут быть, следовательно, получены для принятия разных трехмерных архитектур с повышенной плотностью заряда по сравнению с линейными заряженными метками, вытянутыми линейно. Заряженная метка может иметь нетто отрицательный заряд, как если бы она содержала избыток фосфодиэфира или отрицательно заряженных аминокислот относительно положительных зарядов, или нетто положительный заряд, как если бы она имела больше положительно заряженных аминокислот, чем отрицательно заряженных групп. Суперспирали могут быть расчетно сконструированы для принятия специфических компактных структур на основе хорошо охарактеризованных молекулярных взаимодействий между аминокислотными компонентами. Пример суперспиралей, которые можно использовать, включает лейциновые молнии, которые могут находиться, например, в димерной или тримерной формах с контролируемой длиной и диаметром. Кроме того, так как взаимодействия, которые управляют компактной структурой суперспирали, локализуются внутри, поверхность может быть независимо сконструирована так, чтобы нести широкий диапазон зарядов.
Заряженная метка, как раскрыто в данном документе, может иметь заряд где-нибудь от -200е до +200е или от -100е до +100е, или от -40е до +40е, или от -20е до +20е, или в любом интервале между ними. В некоторых примерах нетто заряд или частичный нетто заряд заряженной метки может быть упакован в плотности от -200е до +200е на кубический нанометр или от -100е до +100е на кубический нанометр, или от -40е до +40е на кубический нанометр, или от -20е до +20е на кубический нанометр, или в любом интервале между ними.
В некоторых примерах технологии, раскрытой в данном документе, один или более чем один машиночитаемый информационный носитель или хранящиеся в памяти машиночитаемые инструкции при выполнении компьютером вызывают выполнение компьютером по меньшей мере одного из способов, раскрытых в данном документе. В некоторых примерах система сконфигурирована для выполнения по меньшей мере части любого из способов, раскрытых в данном документе. В некоторых примерах система связывается с машиночитаемыми информационными носителями или хранящимися в памяти машиночитаемыми инструкциями, которые, при выполнении, вызывают выполнение данной системой по меньшей мере одного из способов, раскрытых в данном документе.
Вся литература и аналогичный материал, процитированный в данной заявке, включая патенты, патентные заявки, статьи, книги, научные труды и вебстраницы, но не ограничиваясь ими, независимо от формата такой литературы и аналогичного материала, прямо включаются посредством ссылки во всей их полноте. В случае, когда одно или более чем одно из включенной литературы и аналогичных материалов отличается от или противоречит данной заявке, включая определенные термины, применение терминов, описанные методики или тому подобное, но не ограничиваясь ими, данная заявка имеет приоритет.
Следует понимать то, что все комбинации вышеописанных идей и дополнительных идей, обсуждаемых с большими подробностями ниже (при условии, что такие идеи не являются взаимоисключающими), рассматриваются как часть объекта изобретения, раскрытого в данном документе. В частности, все комбинации заявленных объектов изобретения, появляющиеся в конце данного раскрытия, рассматриваются как часть объекта изобретения, раскрытого в данном документе. Также следует понимать то, что терминология, прямо использованная в данном документе, которая также может появиться в любом раскрытии, включенном посредством ссылки, должна предоставлять наиболее согласующееся значение с конкретными идеями, раскрытыми в данном документе.
Ссылка во всем данном описании изобретения на «один пример», «другой пример», «пример» и так далее означает то, что конкретный элемент (например, свойство, структура и/или характеристика), описанный в связи сданным примером, включается в по меньшей мере один пример, описанный в данном документе, и может присутствовать или может не присутствовать в других примерах. Кроме того, следует понимать то, что описанные элементы для любого примера могут объединяться в разных примерах любым подходящим образом, если контекст явно не диктует иное.
В то время как несколько примеров было подробно описано, следует понимать то, что раскрытые примеры могут быть модифицированы. Следовательно, вышеизложеное описание следует рассматривать как неограничивающее. Хотя некоторые примеры и были подробно проиллюстрированы и описаны в данном документе, специалистам в релевантной области будет очевидно то, что могут быть сделаны разные модификации, дополнения, замены и тому подобное без отступления от сущности настоящего раскрытия, и они, следовательно, рассматриваются как находящиеся в пределах объема настоящего раскрытия, как определено в формуле изобретения, которая следует далее.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕНЫЕ НУКЛЕОТИДЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2782056C2 |
| ГЕНЕРАЛИЗОВАННОЕ СТОХАСТИЧЕСКОЕ СЕКВЕНИРОВАНИЕ СВЕРХРАЗРЕШЕНИЯ | 2019 |
|
RU2739571C1 |
| ПОЛИМЕТИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦЕНТНЫХ МЕТОК | 2016 |
|
RU2696562C1 |
| НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ С 3’-ГИДРОКСИ БЛОКИРУЮЩИМИ ГРУППАМИ И ИХ ПРИМЕНЕНИЕ В СПОСОБАХ СЕКВЕНИРОВАНИЯ ПОЛИНУКЛЕОТИДОВ | 2019 |
|
RU2818762C2 |
| СЕНСОР И СЕНСОРНАЯ СИСТЕМА ДЛЯ СЕКВЕНИРОВАНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2019 |
|
RU2747795C1 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| ПОЛЕВОЕ УСТРОЙСТВО И СПОСОБЫ СЕКВЕНИРОВАНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2016 |
|
RU2685953C1 |
| НАБОРЫ ДЛЯ ГЕНОТИПИРОВАНИЯ | 2021 |
|
RU2835967C2 |








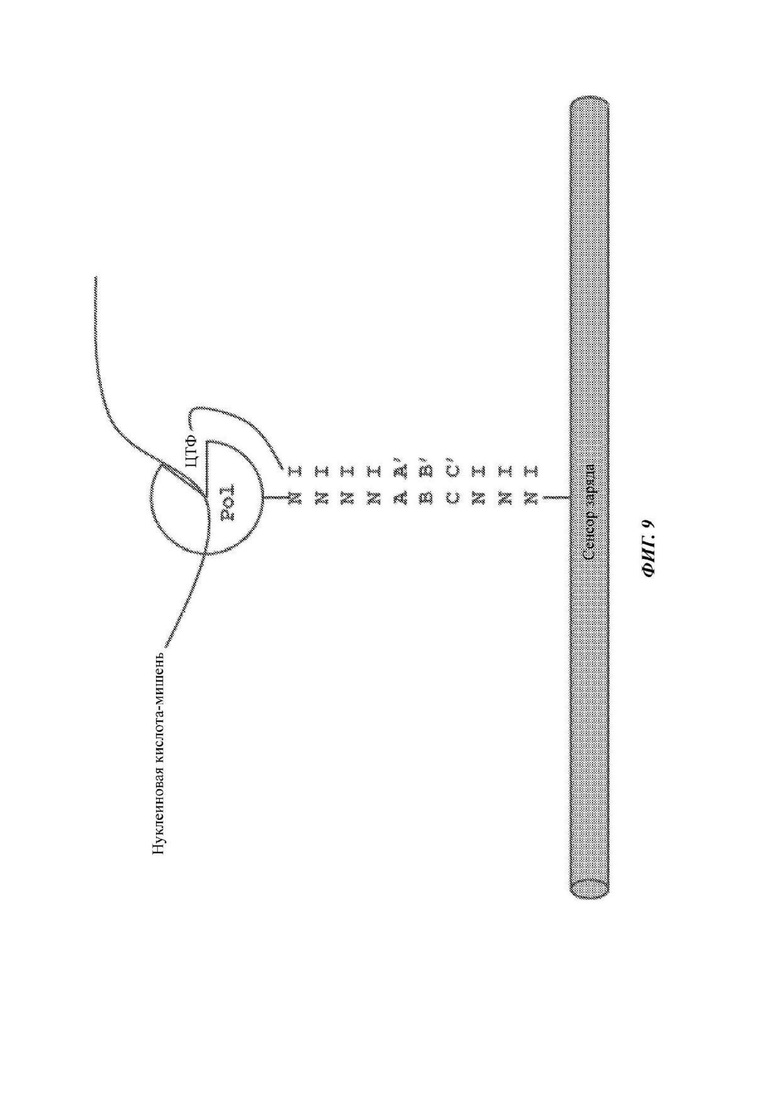














Изобретение относится к области биотехнологии. Описан способ секвенирования нуклеиновых кислот, включающий стадию выявления включения меченого нуклеотида в растущую полинуклеотидную цепь, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, связанной с проводящим каналом твердой подложки посредством связки. Изобретение расширяет арсенал средств для секвенирования нуклеиновых кислот. 14 з.п. ф-лы, 28 ил., 2 табл.
1. Способ секвенирования нуклеиновых кислот, включающий:
выявление включения меченого нуклеотида в растущую полинуклеотидную нить, комплементарную нити полинуклеотида-матрицы, посредством полимеразы, где указанная полимераза связана с проводящим каналом твердой подложки посредством связки,
причем меченый нуклеотид представляет собой соединение формулы I

где n представляет собой целое число от 3 до 10,
m представляет собой целое число от 1 до 10,
t представляет собой целое число от 0 до 50,
X1 представляет собой прямую связь, С1-С10 алкил, С1-С10 оксаалкил, С1-С10 тиаалкил или C1-С10 азаалкил,
Х2 представляет собой С1-С20 алкил, где факультативно один или более чем один индивидуальный остаток СН2 заменен одной или более чем одной пептидной связью и (-О-СН2-СН2-)а, где а представляет собой целое число от 1 до 24,
Х3 представляет собой прямую связь или олигонуклеотид, где указанный олигонуклеотид гибридизуется с акцепторной областью связки, когда метка находится поблизости от проводящего канала,
F1 выбран из флуорофора и прямой связи и F2 отсутствует или представляет собой флуорофор,
А представляет собой 
 или амидную связь,
или амидную связь,
Y представляет собой 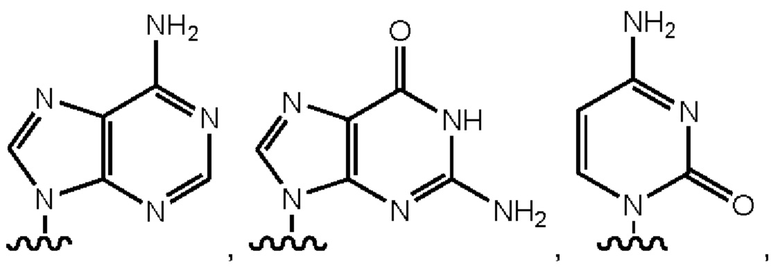
или 
и где
В представляет собой
a) аминокислоту или содержит аминокислоту,
b) нуклеотид,
c)  или
или
d)  где R представляет собой Y или водород,
где R представляет собой Y или водород,
и где q представляет собой целое число от 1 до 100, и проводящий канал предназначен для выявления меченого нуклеотида во время включения; при этом факультативно число q В имеет заряд и плотность заряда;
или
В включает дендрон, причем В имеет заряд и плотность заряда, q равно 1, и сенсор заряда предназначен для выявления меченого нуклеотида во время включения, при этом факультативно проводящий канал предназначен для выявления меченого нуклеотида во время включения.
2. Способ по п. 1, в котором заряд составляет от примерно -100е до примерно +100е.
3. Способ по п. 2, в котором плотность заряда составляет от примерно -100е на кубический нанометр до примерно +100е на кубический нанометр.
4. Способ по п. 1, в котором заряд составляет от примерно -200е до примерно +200е.
5. Способ по п. 4, в котором плотность заряда составляет от примерно -200е на кубический нанометр до примерно +200е на кубический нанометр.
6. Способ по любому из предшествующих пунктов, в котором число q В включает полинуклеотид.
7. Способ по п. 6, в котором полинуклеотид выбран из разветвленного полинуклеотида и одной или более чем одной петли шпильки.
8. Способ по п. 7, в котором полинуклеотид содержит от двух до пяти петель шпильки.
9. Способ по любому из пп. 1-5, в котором число q В включает полипептид.
10. Способ по п. 9, в котором полипептид выбран из разветвленного полипептида, спирального полипептида и суперспирального полипептида.
11. Способ по любому из пп. 1-5, в котором В включает аминокислоту и одно или более чем одно число q В включает метиллизин, диметиллизин или триметиллизин.
12. Способ по любому из пп. 1-5, в котором В представляет собой дендрон z генераций, содержащий одно или более чем одно составное повторяющееся звено и множество концевых звеньев, где z представляет собой целое число от 1 до 6, причем составные концевые звенья выбраны из:
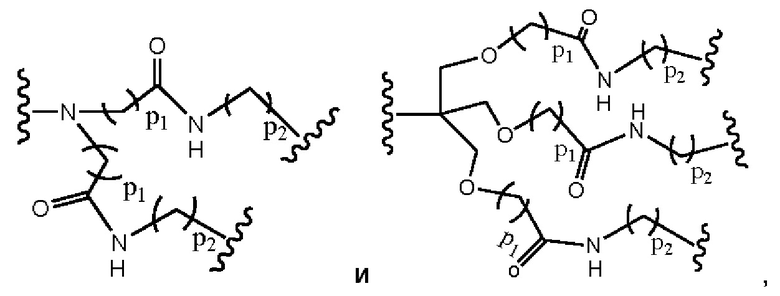
где
p1 представляет собой целое число от 1 до 3, где любая одна или более чем одна из р1 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-,
р2 представляет собой целое число от 1 до 3, где любая одна или более чем одна из р2 групп -СН2- факультативно заменена 1-3 группами -O-СН2-СН2-, и
концевые группы выбраны из карбоновой кислоты, сульфоновой кислоты, фосфоновой кислоты, сперминильной группы, аминогруппы и четвертичной аммонийной группы.
13. Способ по любому из пп. 1-12, в котором А образован реакцией, включающей реакцию связывания, причем данная реакция связывания выбрана из клик-реакции азид-алкин с помощью меди, лигирования тетразин-транс-циклооктен, клик-реакции азид-дибензоциклооктиновая группа без участия меди и конъюгирования тиол-малеимид.
14. Способ по любому из пп. 1-13, дополнительно включающий последовательное включение множества меченых нуклеотидов, где заряд каждого из множества меченых нуклеотидов отличается от заряда любого другого из множества меченых нуклеотидов, когда Y каждого и Y любого другого отличаются друг от друга, факультативно дополнительно включающий идентификацию Y одного или более чем одного меченого полинуклеотида, включенного в растущую полинуклеотидную нить, на основе заряда, выявленного проводящим каналом.
15. Способ по любому из пп. 1-11, в котором Х2 представляет собой (-O-СН2-СН2-)а, где а представляет собой целое число от 1 до 24, при этом факультативно а равно 4, 8, 12, 16 или 24.
| WO 2017203059 A1, 30.11.2017 | |||
| WO 2015148402 A1, 01.10.2015 | |||
| ПОЛЕВОЕ УСТРОЙСТВО И СПОСОБЫ СЕКВЕНИРОВАНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2016 |
|
RU2685953C1 |
Авторы
Даты
2021-07-13—Публикация
2019-02-19—Подача