ОБЛАСТЬ ТЕХНИКИ
[0001] Системы, способы и композиции, предложенные в настоящем документе, относятся к анализам для избирательного контроля ферментативных реакций. В частности аспекты, описанные в настоящем документе, относятся к способам ингибирования, снижения или устранения вторичных секвенирующих чтений ДНК при секвенировании открытого хроматина, секвенировании полного генома или целевом секвенировании.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Ферменты являются полезным инструментом молекулярной биологии и геномики, поскольку они могут выполнять разнообразное число этапов в широком диапазоне областей применения от редактирования геномов, геномных анализов, секвенирования, фармацевтических применений и диагностики. В течение последнего десятка лет наблюдается революция в областях применения и разработках природных и сконструированных ферментов. Большое внимание уделяется специфичности и эффективности с особым акцентом на совершенствовании ферментной системы. Однако ферментативные системы демонстрируют нецелевые эффекты, что затрудняет анализ результатов.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0003] Настоящее изобретение относится к системам, способам и композициям для избирательного контроля ферментативных реакций путем мечения искажающих субстратов, которые нарушают взаимодействие ферментов с субстратом, что позволяет уменьшить или устранить шум или ошибку, которые, как правило, присутствуют в ферментативной реакции.
[0004] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к библиотекам нуклеиновых кислот, содержащим первичные секвенирующие чтения, полученные в результате секвенирования, например, секвенирующие чтения, полученные в результате секвенирования при анализе на доступный для транспозазы хроматин (ATAC-seq) для ядерной ДНК. В некоторых вариантах осуществления библиотеки нуклеиновых кислот включают в себя секвенирующие чтения из анализа, проводимого для секвенирования полного генома или хромосомной ДНК. В некоторых вариантах осуществления библиотеки нуклеиновых кислот не включают в себя или имеют сниженное представление вторичных секвенирующих чтений, например, с митохондриальной ДНК (мтДНА). В некоторых вариантах осуществления библиотеки нуклеиновых кислот относятся к бактериальной ДНК, плазмидам или внехромосомной ДНК.
[0005] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к способам секвенирования нуклеиновой кислоты без секвенирования или со сниженным секвенированием вторичных нуклеиновых кислот. В некоторых вариантах осуществления способы включают в себя получение образца, содержащего нуклеиновую кислоту, приведение образца в контакт с ДНК-связывающей молекулой, приведение образца в контакт с инсерционным ферментным комплексом с получением меченых фрагментов нуклеиновой кислоты и секвенирование меченых фрагментов нуклеиновой кислоты с получением чтений последовательностей.
[0006] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к способам ингибирования, устранения или уменьшения вторичных секвенирующих чтений ДНК, таких как секвенирующие чтения митохондриальной ДНК (мтДНК). В некоторых вариантах осуществления способы включают в себя получение образца, содержащего вторичные нуклеиновые кислоты и первичные нуклеиновые кислоты, приведение образца в контакт с ДНК-связывающей молекулой, которая предпочтительно связывается со вторичными нуклеиновыми кислотами, такими как мтДНК, и выполнение транспонирования ДНК на открытом хроматине, причем вторичные нуклеиновые кислоты не транспонируются или транспонируются со сниженной эффективностью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
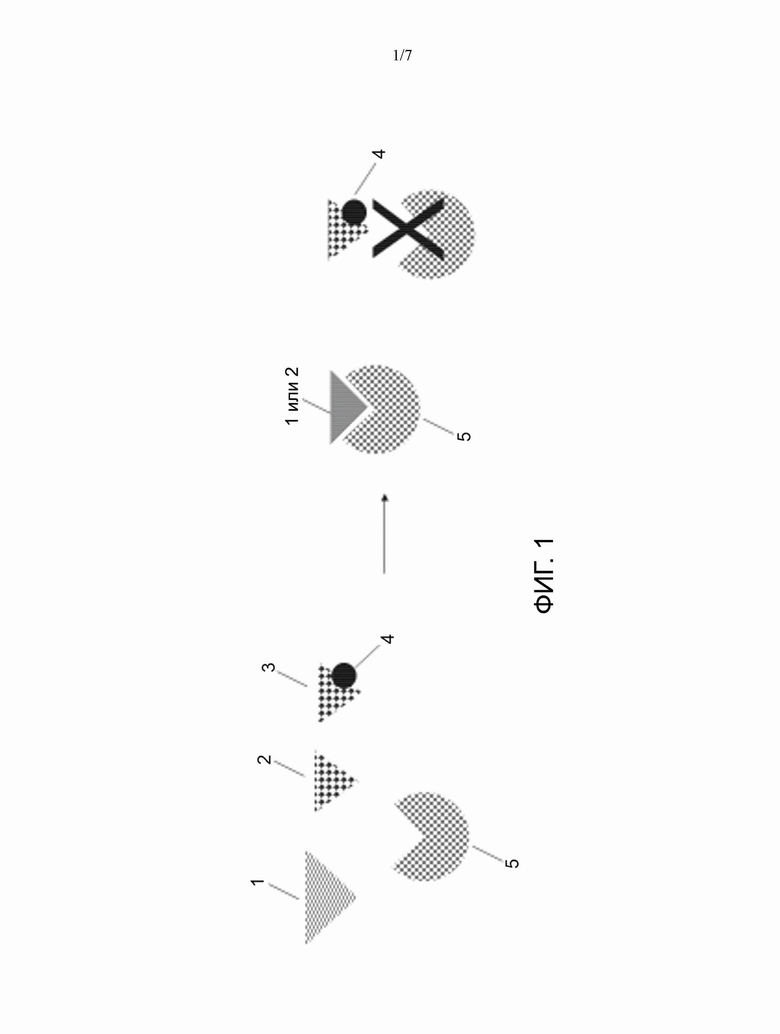
[0007] На ФИГ. 1 представлена схема, иллюстрирующая модификацию мишени для контроля специфичности фермента. Все субстраты (1, 2 или 3) являются субстратами для фермента (5). Субстрат 3, модифицированный посредством 4, не является субстратом для фермента (5) вследствие модификации (4). Модификация (4) может представлять собой окрашивание ДНК, аффинную метку, молекулу, лиганд, фермент, пептид или другую модификацию.
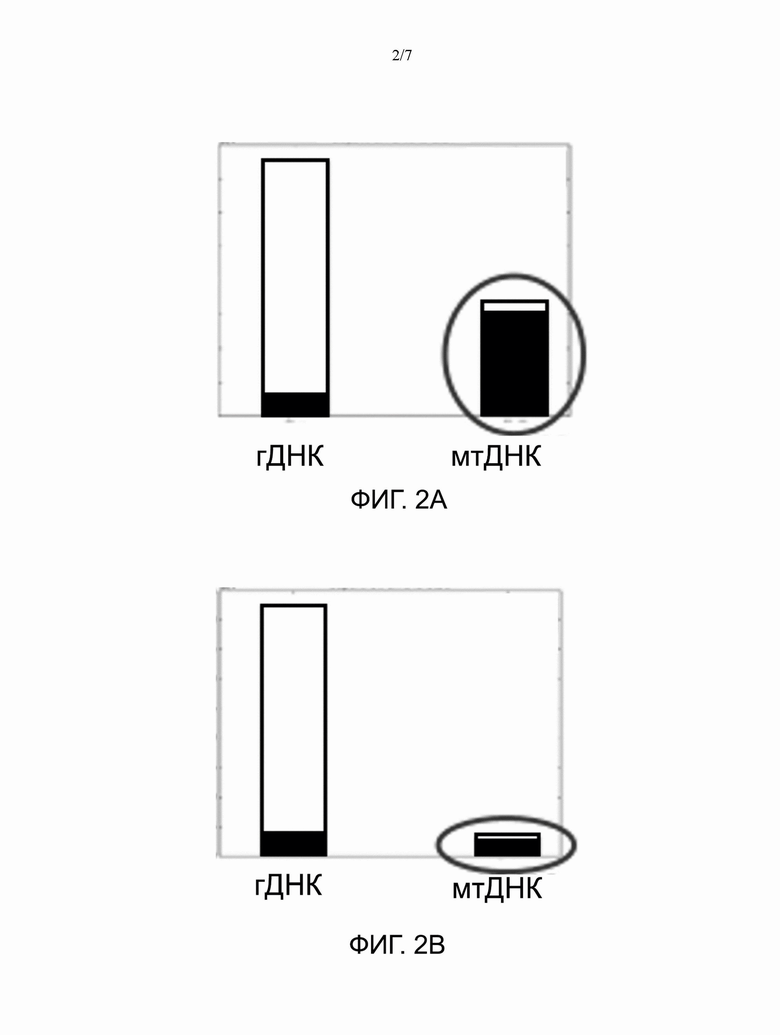
[0008] На ФИГ. 2А-2С представлены гистограммы, показывающие, что растущие количества красителя Hoechst снижают количество чтений мтДНК в экспериментах с транспонированием, таким образом устраняя или уменьшая количество чтений нежелательной мтДНК. Слева направо: концентрация красителя Hoechst составляет 8 мкМ (ФИГ. 2А), 80 мкМ (ФИГ. 2В) и 800 мкМ (ФИГ. 2С).
[0009] На ФИГ. 3А-3С представлены ДНК-гели, демонстрирующие эффективность транспонирования различных ДНК-окрашивающих красителей. На ФИГ. 3А представлено окрашивание красителями Hoechst и SYBR Gold, на ФИГ. 3В представлено окрашивание Sytox Orange и Pico Green, а на ФИГ. 3С представлено окрашивание Qubit или отсутствие окрашивания. Препараты ДНК с высокой молекулярной массой указывают на неэффективное транспонирование. Как для SYBR Gold, так и для Sytox Orange ингибирование наблюдали при концентрациях более 100 мкМ.
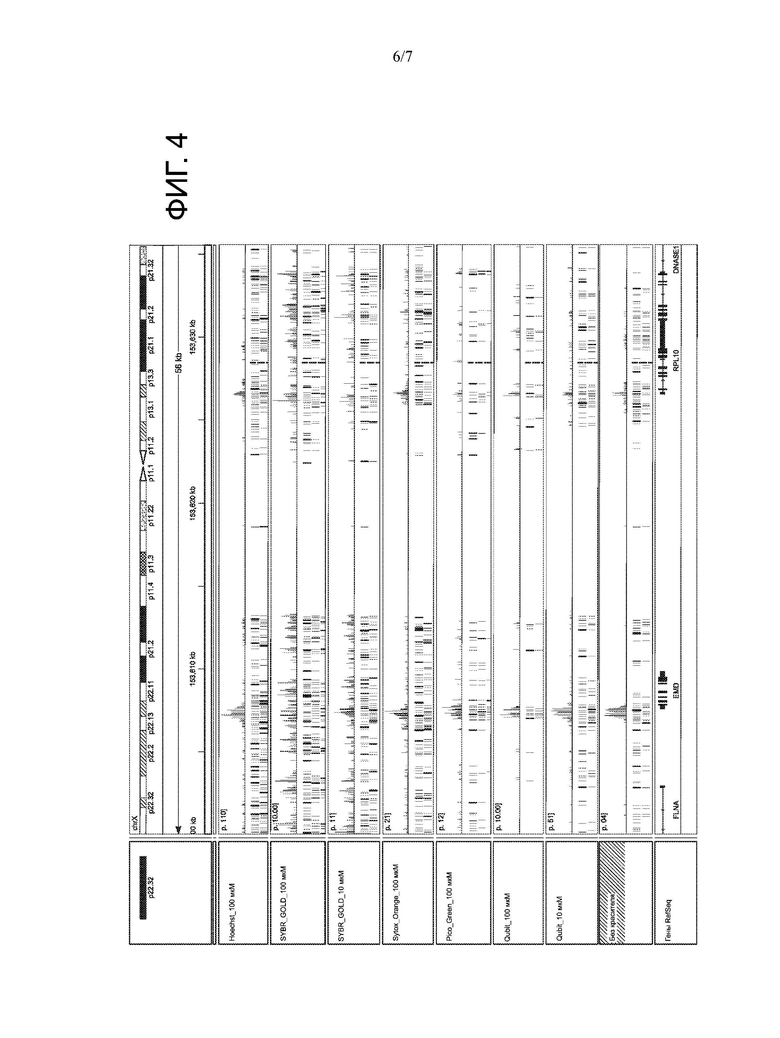
[0010] На ФИГ. 4 представлены результаты различных исследованных красителей, в том числе Hoechst (100 мкМ), SYBR Gold (100 мкМ и 10 мкМ), Sytox Orange (100 мкМ), Pico Green (100 мкМ), Qubit (100 мкМ или 10 мкМ), и при отсутствии красителя. Результаты показывают, что только некоторые красители подходят для снижения или устранения вторичных секвенирующих чтений ДНК.
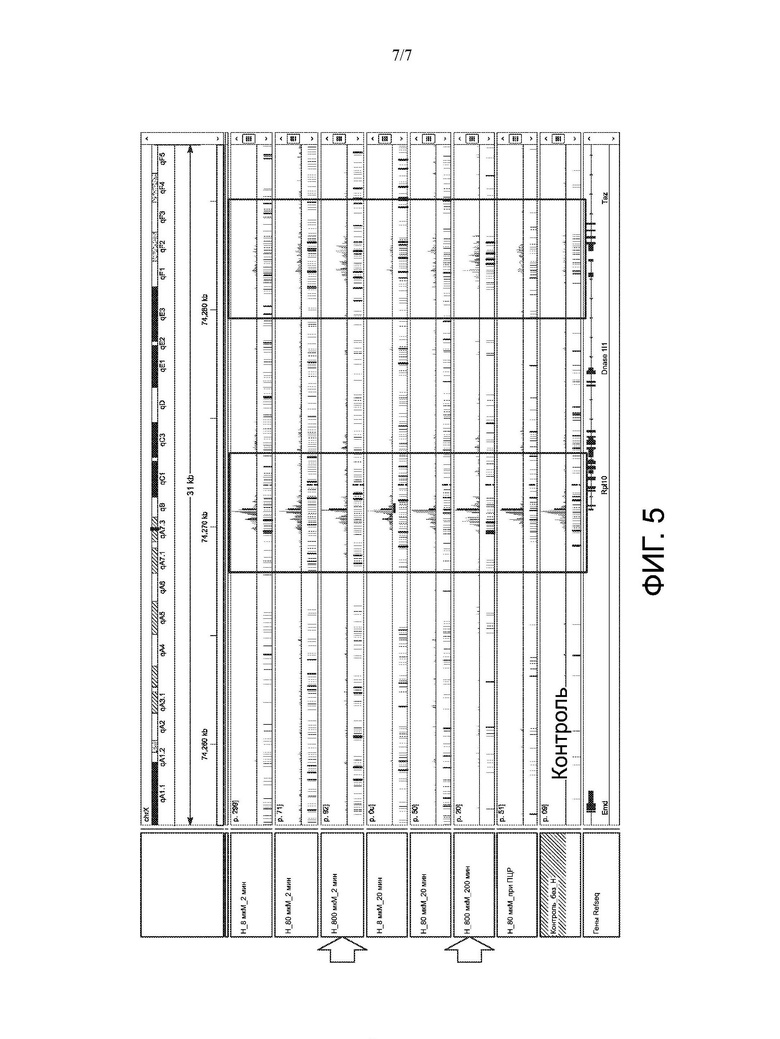
[0011] На ФИГ. 5 представлены результаты окрашивания Hoechst при 8 мкМ, 80 мкМ и 800 мкМ в течение различных периодов времени (2 минуты или 20 минут).
ПОДРОБНОЕ ОПИСАНИЕ
[0012] В приведенном ниже подробном описании содержатся ссылки на соответствующие рисунки, которые являются частью настоящего документа. Если иное не следует из контекста, в графических материалах аналогичные символы, как правило, обозначают аналогичные компоненты. Предполагается, что иллюстративные варианты осуществления, описанные в подробном описании, графических материалах и пунктах формулы изобретения, не имеют ограничительного характера. Допускается использовать другие варианты осуществления и вносить другие изменения без отступления от сущности или объема заявленного объекта изобретения, предложенного в настоящем документе. Следует понимать, что аспекты настоящего описания, как по существу описано в настоящем документе и проиллюстрировано на фигурах, можно перераспределять, заменять, комбинировать, разделять и конструировать в широком спектре разных конфигураций, все из которых явным образом предусмотрены в настоящем описании.
[0013] Варианты осуществления систем, способов и композиций, предложенных в настоящем документе, относятся к контролю ферментативных реакций посредством предотвращения связывания фермента с мешающими субстратами, такими как субстрат, с которым фермент обычно связывается, но который не позволяет провести надлежащий анализ интересующего субстрата.
[0014] Традиционные ферментативные реакции не обладают специфичностью, необходимой для анализа различий между близкородственными субстратами. Например, ферменты к нуклеиновым кислотам плохо различают разные типы нуклеиновых кислот, такие как митохондриальная ДНК (мтДНК) в сравнении с ядерной ДНК. В итоге традиционные ферментативные реакции дают результаты как для целевого аналита, так и для нецелевых аналитов, таким образом спутывая результаты и приводя к временным и финансовым затратам и повышая уровень сложности анализа. Однако во многих сферах применения желательно контролировать избирательность ферментативных реакций.
[0015] Один из вариантов осуществления представляет собой систему и способ уменьшения, ингибирования или устранения нежелательных мишеней, с нацеливанием, таким образом, только на интересующий аналит. На Фиг. 1 схематически представлен принцип связывания фермента с субстратом. На Фиг. 1 фермент 5 способен распознавать и связывать разные субстраты 1, 2 и 3, которые затем ферментативно катализируются ферментом. Однако субстрат 3 модифицируют посредством модификации 4 так, что фермент 5 не распознает и не связывает субстрат 3. На Фиг.1 представлены способы и системы в виде общей схемы. В вариантах осуществления, предложенных в настоящем документе, принцип описан применительно к транспозазе и нуклеиновым кислотам, в частности применительно к первичному секвенирующему чтению ДНК (которое представляет собой секвенирующее чтение интересующей ДНК, включая, например, ядерную ДНК) и ко вторичному секвенирующему чтению ДНК (которое представляет собой секвенирующее чтение нежелательной ДНК, включая, например, митохондриальную ДНК (мтДНК) или внехромосомную ДНК). Однако следует понимать, что общие способы и системы применимы к другим фермент-субстратным системам. Варианты осуществления систем, способов и композиций улучшают специфичность ферментативных реакций, таким образом улучшая ферментативный анализ путем уменьшения нецелевых эффектов.
[0016] Например, данный подход можно применять так, что конкретные красители или ДНК-связывающие молекулы в целом могут доставляться к определенным мишеням с использованием хорошо известных аффинных меток. Эти аффинные метки могут включать в себя антительные конъюгаты и зонды гибридизации ДНК для блокирования нежелательной ферментативной активности. Посредством специфической блокировки определенных типов ДНК, но не других, можно уменьшить нежелательные нецелевые эффекты, которые демонстрируют определенные ферменты. Альтернативно специфические аффинные метки («блокаторы») можно использовать для привлечения ферментов к конкретным мишеням. Такие варианты применения могут включать в себя блокирование нецелевой активности широко используемых белков, таких как CRISPR-ферменты.
[0017] В настоящем документе термин «ДНК-связывающая молекула» относится к молекуле, которая может связываться со всей ДНК, но которая имеет предпочтительный доступ к определенной ДНК вследствие ее доступности, определяемой разнообразными факторами, в том числе, например, размером, зарядом или гидрофобностью ДНК-связывающей молекулы. В результате этого определенные типы ДНК предпочтительно блокируются, тогда как другие доступны для ферментных систем, способных создавать библиотеки секвенирования. Таким образом, в некоторых вариантах осуществления дифференциальный доступ к ДНК допускается в определенных типах ДНК путем связывания с ДНК-связывающей молекулой, в результате чего ДНК становится менее активной в ферментативных реакциях. Например, ДНК-краситель не попадает в ядро, а может попадать в мтДНК, таким образом предпочтительно блокируя мтДНК.
[0018] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к библиотеке нуклеиновых кислот. В некоторых вариантах осуществления библиотека нуклеиновых кислот включает в себя секвенирующие чтения, полученные в ходе анализа с секвенированием доступного для транспозазы хроматина (ATAC-seq), для первичной ДНК (такой как ядерная ДНК), но не включает или включает в себя уменьшенные количества секвенирующих чтений нецелевых нуклеиновых кислот (вторичной ДНК), таких как мтДНК. В некоторых вариантах осуществления секвенирующие чтения вторичной ДНК устраняют, уменьшают или ингибируют благодаря ДНК-связывающим молекулам, которые предпочтительно связываются со вторичной ДНК. В некоторых вариантах осуществления ДНК-связывающая молекула содержит ДНК-краситель, аффинную метку, лиганд, фермент, пептид или биомолекулу. В некоторых вариантах осуществления ДНК-краситель содержит краситель Hoechst, SYBR Gold, Sytox Orange, Pico Green или Qubit. В некоторых вариантах осуществления библиотеку нуклеиновых кислот генерируют из популяции клеток, одиночной клетки, популяции клеточных ядер или ядра одиночной клетки.
[0019] В настоящем документе термин «библиотека нуклеиновых кислот» относится к специально созданному набору нуклеиновых кислот, который можно получить синтетическим или биосинтетическим путем во множестве разных форматов (например, библиотеки растворимых молекул и библиотеки олигонуклеотидов, присоединенных к гранулам из смолы, чипам из кремнезема или другим твердым подложкам). Кроме того, термин «матрица» включает в себя те библиотеки нуклеиновых кислот, которые могут быть получены путем нанесения нуклеиновых кислот по существу любой длины (например, от 1 до около 1000 нуклеотидных мономеров в длину) на субстрат.
[0020] Матрица может относиться к популяции различных микроэлементов, таких как микроэлементы, содержащие полинуклеотиды, которые связаны или прикреплены к поверхности таким образом, что разные микроэлементы можно отличать друг от друга в соответствии с относительным местоположением. Отдельный элемент матрицы может включать в себя одну копию микроэлемента или же может присутствовать множество копий микроэлемента в виде популяции микроэлементов в отдельном элементе матрицы. Популяция микроэлементов в каждом элементе, как правило, является гомогенной и имеет один вид микроэлементов. Таким образом, на элементе может присутствовать множество копий одной нуклеотидной последовательности, например, множество молекул нуклеиновых кислот, имеющих одинаковую последовательность.
[0021] В некоторых вариантах осуществления на элементе может присутствовать гетерогенная популяция микроэлементов. В некоторых вариантах осуществления элемент может включать в себя только один вид микроэлементов. В некоторых вариантах осуществления элемент может включать в себя множество разных видов микроэлементов, таких как смесь нуклеиновых кислот, имеющих разные последовательности. Соседние элементы матрицы могут быть отделены друг от друга. Элементы могут быть расположены рядом друг с другом или разделены зазором. В вариантах осуществления, в которых элементы разнесены друг от друга, соседние участки могут быть разнесены, например, на расстояние менее чем 100 мкм, 50 мкм, 10 мкм, 5 мкм, 1 мкм, 0,5 мкм, 100 нм, 50 нм, 10 нм, 5 нм, 1 нм, 0,5 нм или любое расстояние в пределах диапазона из любых двух из вышеперечисленных расстояний. Расположение элементов на матрице также можно понимать с точки зрения межцентровых расстояний между соседними элементами. Матрица, используемая в изобретении, может иметь соседние элементы с межцентровым расстоянием менее чем около 100 мкм, 50 мкм, 10 мкм, 5 мкм, 1 мкм, 0,5 мкм, 100 нм, 50 нм, 10 нм, 5 нм, 1 нм, 0,5 нм или любым расстоянием в пределах диапазона из любых двух из вышеперечисленных расстояний. В некоторых вариантах осуществления значения расстояний, описанные в настоящем документе, могут представлять собой среднее расстояние между соседними элементами матрицы. Таким образом, не все соседние элементы должны находиться в указанном диапазоне, если иное не указано особо, например, посредством конкретного утверждения о том, что расстояние представляет собой пороговое расстояние между всеми соседними элементами матрицы. Варианты осуществления могут включать в себя матрицы, имеющие элементы с различными плотностями. Например, диапазоны плотностей для определенных вариантов осуществления включают в себя от около 10000000 элементов/см2 до около 2000000000 элементов/см2; от около 100000000 элементов/см2 до около 1000000000 элементов/см2; от около 100000 элементов/см2 до около 10000000 элементов/см2; от около 1000000 элементов/см2 до около 5000000 элементов/см2; от около 10000 элементов/см2 до около 100000 элементов/см2; от около 20000 элементов/см2 до около 50000 элементов/см2; от около 1000 элементов/см2 до около 5000 элементов/см2 или с любой плотностью в пределах диапазона из любых двух из вышеуказанных плотностей.
[0022] В настоящем документе термин «поверхность» может относиться к части субстрата или опорной структуры, которая доступна для контакта с реагентами, гранулами или аналитами. Поверхность может быть по существу ровной или плоской. Альтернативно поверхность может иметь закругленную или контурную форму. Примерами контуров, которые можно использовать на поверхности, являются лунки, выемки, столбики, ребра, каналы или т.п. Примеры материалов, которые можно использовать в качестве субстрата или опорной структуры, включают в себя стекло, такое как модифицированное или функционализированное стекло; пластик, такой как акриловый, полистирольный или из сополимера стирола и другого материала, полипропилен, полиэтилен, полибутилен, полиуретан или TEFLON; полисахариды или поперечно-сшитые полисахариды, такие как агароза или сефароза; нейлон; нитроцеллюлоза; смола; кремнезем или материалы на основе кремнезема, включая кремний и модифицированный кремний; углеродное волокно; металл; неорганическое стекло; пучок оптических волокон или различные другие полимеры. Поверхность, пригодная для использования в рамках изобретения, может быть изготовлена из одного материала или смеси нескольких различных материалов. В некоторых вариантах осуществления поверхность содержит лунки.
[0023] В настоящем документе термин «гранула» может относиться к небольшому телу, изготовленному из жесткого или полужесткого материала. Тело может иметь форму, описываемую, например, как сфера, овал, микросфера, или иную принятую форму частиц с симметричными или несимметричными размерами. Примеры материалов, которые можно использовать в гранулах, включают в себя стекло, такое как модифицированное или функционализированное стекло; пластик, такой как акриловый, полистирольный или из сополимера стирола и другого материала, полипропилен, полиэтилен, полибутилен, полиуретан или TEFLON; полисахариды или поперечносшитые полисахариды, такие как агароза или сефароза; нейлон; нитроцеллюлоза; смола; кремнезем или материалы на основе кремнезема, включая кремний и модифицированный кремний; углеродное волокно; металл; неорганическое стекло; пучок оптических волокон или различные другие полимеры. Примеры гранул включают в себя стеклянные гранулы с контролируемыми порами, парамагнитные гранулы, золь двуокиси тория, гранулы сефарозы, нанокристаллы и другие известные в данной области гранулы. Гранулы могут быть изготовлены из биологических или небиологических материалов. Магнитные гранулы особенно пригодны к использованию из-за простоты манипуляций с магнитными гранулами с помощью магнитов. Гранулы, используемые в определенных вариантах осуществления, могут иметь диаметр, ширину или длину от 0,1 мкм до 100 мкм. Размер гранул можно выбирать таким образом, чтобы она имела уменьшенный размер и, следовательно, повышенную плотность, сохраняя при этом достаточный сигнал для анализа элементов.
[0024] В настоящем документе термин «гибридизация», «гибридизировать» или их грамматический эквивалент может относиться к реакции, в которой один или более полинуклеотидов взаимодействуют с образованием комплекса, который по меньшей мере частично образован посредством водородных связей между основаниями нуклеотидных остатков. Водородные связи могут возникать посредством спаривания оснований по Уотсону - Крику, связывания по Хугстину или любым другим специфичным для последовательности способом. Комплекс может иметь две цепочки, образующие дуплексную структуру, три или более цепочки, образующие многоцепочечный комплекс, одну самогибридизующуюся цепь или любую их комбинацию. Кроме водородного связывания цепочки также могут быть поперечно-сшитыми или соединены иными силами.
[0025] В настоящем документе термины «удлиняющий», «удлинение» или их любые грамматические эквиваленты могут относиться к добавлению дНТФ к праймеру, полинуклеотиду или другой молекуле нуклеиновой кислоты ферментом-удлинителем, таким как полимераза. Например, в некоторых вариантах осуществления, описанных в настоящем документе, полученный удлиненный праймер включает в себя информацию о последовательности нуклеиновой кислоты. Хотя в некоторых вариантах осуществления описано выполнение удлинения с использованием полимеразы, такой как ДНК-полимераза или обратная транскриптаза, удлинение может быть выполнено любым другим способом, хорошо известным в данной области. Например, удлинение можно выполнять путем лигирования олигонуклеотидов друг с другом, например, олигонуклеотидов, которые гибридизовались с интересующей цепью.
[0026] В настоящем документе термины «лигирование», «лигировать» или другие их грамматические эквиваленты могут относиться к соединению двух нуклеотидных цепей фосфодиэфирной связью. Лигирование может включать в себя химическое лигирование. Такая реакция может быть катализирована лигазой. Термин «лигаза» относится к классу ферментов, которые катализируют эту реакцию с гидролизом АТФ или аналогичного трифосфата.
[0027] В настоящем документе термины «полинуклеотид» и «нуклеиновая кислота» могут использоваться взаимозаменяемо и могут относиться к полимерной форме нуклеотидов любой длины, либо рибонуклеотидов, либо дезоксирибонуклеотидов. Таким образом, эти термины включают в себя одно-, двух- или многоцепочечную ДНК или РНК. Примеры полинуклеотидов включают в себя ген или фрагмент гена, цельную геномную ДНК, геномную ДНК, эпигеномную ДНК, фрагмент геномной ДНК, митохондриальную ДНК (мтДНК), ядерную ДНК, рибосомную ДНК, экзон, интрон, матричную РНК (мРНК), регуляторную РНК, транспортную РНК, рибосомную РНК, некодирующую РНК (нкРНК), такую как РНК, взаимодействующую с PIWI (пиРНК), малую интерферирующую РНК (миРНК) и длинную некодирующую РНК (длнкРНК), малую шпильку (мшРНК), малую ядерную РНК (мяРНК), микроРНК (мкрРНК), малую ядрышковую РНК (мяшРНК) и вирусную РНК, рибозим, кДНК, рекомбинантный полинуклеотид, разветвленный полинуклеотид, плазмиду, вектор, изолированную ДНК любой последовательности, изолированную РНК любой последовательности, полинуклеотидный зонд, праймер или амплифицированную копию любого из вышеперечисленных. Полинуклеотид может включать в себя модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, включая нуклеотиды с неприродными основаниями, нуклеотиды с модифицированными природными основаниями, такими как аза- или деазапурины. Полинуклеотид может состоять из конкретной последовательности четырех нуклеотидных оснований: аденина (А), цитозина (Ц), гуанина (Г) и тимина (Т). Также может присутствовать урацил (У), например, в качестве естественной замены тимина, если полинуклеотид представляет собой РНК. Урацил также может использоваться в ДНК. Термин «нуклеотидная последовательность» может относиться к буквенному представлению полинуклеотида или любой молекулы нуклеиновой кислоты, включающей природные и неприродные основания. Кроме того, ДНК может содержать неприродную(-ые) пару(-ы) оснований (UBP). UBP представляет собой сконструированную субъединицу (или нуклеотидное основание) ДНК, которая создана в лаборатории и не встречается в природе.
[0028] В настоящем документе первичная нуклеиновая кислота представляет собой интересующую нуклеиновую кислоту. В некоторых вариантах осуществления первичная нуклеиновая кислота представляет собой ядерную ДНК. Первичной нуклеиновой кислотой может быть любая нуклеиновая кислота, которую требуется проанализировать в образце. В настоящем документе вторичная нуклеиновая кислота представляет собой нуклеиновую кислоту, которая присутствует в образце, но не является интересующей нуклеиновой кислотой и, следовательно, является интерферентом в контексте анализа интересующей нуклеиновой кислоты. В некоторых вариантах осуществления вторичная нуклеиновая кислота представляет собой митохондриальную ДНК (мтДНК) или внехромосомную ДНК. Вторичная нуклеиновая кислота может представлять собой любую нуклеиновую кислоту, которая присутствует в образце, но не является объектом анализа, и которую желательно ингибировать, уменьшить ее содержание или устранить из анализа с целью более эффективного и точного анализа интересующей нуклеиновой кислоты. Внехромосомная ДНК представляет собой любую ДНК, находящуюся за пределами ядра клетки. Ее также называют внеядерной ДНК или цитоплазматической ДНК.
[0029] Нуклеиновая кислота может содержать фосфодиэфирные связи и может иметь другие типы каркасов, включая, например, фосфорамидные, фосфоротиоатные, фосфородитиоатные, О-метилфосфорамидитные и пептидные каркасы и связи нуклеиновых кислот. Нуклеиновая кислота может содержать любую комбинацию дезоксирибо- и рибонуклеотидов и любую комбинацию оснований, включая урацил, аденин, тимин, цитозин, гуанин, инозин, ксантин, гипоксантин, изоцитозин, изогуанин и аналоги оснований, такие как нитропиррол (включая 3-нитропиррол) и нитроиндол (включая 5-нитроиндол). В некоторых вариантах осуществления нуклеиновая кислота может включать в себя по меньшей мере одно универсальное основание. Универсальное основание может спариваться с основаниями более чем одного другого типа оснований и может использоваться, например, при включении в олигонуклеотидные праймеры или вставки, которые используются для случайной гибридизации в образцах сложных нуклеиновых кислот, таких как образцы геномной ДНК. Примером универсального основания является инозин, который может спариваться с аденином, тимином или цитозином. Другие примеры включают в себя гипоксантин, 5-нитроиндол, ациклический 5-нитроиндол, 4-нитропиразол, 4-нитроимидазол и 3-нитропиррол. Можно использовать универсальные основания, которые могут спариваться с основаниями по меньшей мере двух, трех, четырех или более типов.
[0030] Анализ доступного для транспозазы хроматина с использованием секвенирования (ATAC-seq) относится к быстрому и чувствительному способу интегративного эпигеномного анализа. ATAC-seq захватывает открытые сайты хроматина и выявляет взаимосвязь между геномными позициями открытого хроматина, ДНК-связывающими белками, отдельными нуклеосомами и компактизацией более высокого порядка в регуляторных областях с нуклеотидным разрешением. Обнаружены классы ДНК-связывающих факторов, которые строго избегают, способны переносить или склонны перекрываться с нуклеосомами. Используя ATAC-seq, измеряли и оценивали последовательные ежедневные эпигеномы покоящихся человеческих Т-клеток у испытуемого посредством стандартных заборов крови, демонстрируя возможность считывания личных эпигеномов в клинических масштабах времени для контроля состояния здоровья и течения заболевания. Более конкретно, ATAC-seq можно выполнять путем обработки хроматина из одиночной клетки инсерционным ферментным комплексом с получением меченых фрагментов геномной ДНК. На этом этапе хроматин фрагментируют и метят (например, фрагментируют и метят в одной и той же реакции) с использованием инсерционного фермента, такого как Tn5 или MuA, который расщепляет геномную ДНК в открытых областях хроматина и добавляет адаптеры к обоим концам фрагментов. В некоторых вариантах осуществления применение представляет собой секвенирование полного генома или эпигеномное профилирование.
[0031] Секвенированием полного генома (WGS) называется способ многократного чтения генома, например, в форматах 10×, 20× и 40×, в целях секвенирования полного генома с использованием секвенирования следующего поколения. Целевым секвенированием называются способы или анализы, в которых определяют последовательность ДНК в выбранных локусах ДНК или генах в образце, например, секвенирование выбранной группы связанных с раком генов.
[0032] В некоторых случаях условия можно регулировать для получения желаемого уровня вставок в хроматин (например, вставку, которая происходит в среднем каждые 50-200 пар нуклеотидов в открытых областях). Хроматин, используемый в способе, может быть получен любым подходящим способом. В некоторых вариантах осуществления ядра могут быть выделены и лизированы, и хроматин может быть дополнительно очищен, например, от ядерной оболочки. В других вариантах осуществления хроматин может быть выделен путем приведения выделенных ядер в контакт с реакционным буфером. В этих вариантах осуществления выделенные ядра могут лизироваться при контакте с реакционным буфером (который содержит инсерционные ферментные комплексы и другие необходимые реагенты), что обеспечивает доступ инсерционных ферментных комплексов к хроматину. В этих вариантах осуществления способ может включать в себя выделение ядер из популяции клеток и объединение выделенных ядер с транспозазой и адаптерами, причем объединение приводит как к лизису ядер с высвобождением указанного хроматина, так и к получению меченных адаптером фрагментов геномной ДНК. Хроматин не требует поперечного сшивания, как в других способах (например, в способах ChIP-SEQ). В некоторых вариантах осуществления ферментативные реакции протекают непосредственно от клеток.
[0033] После фрагментации и мечения хроматина для получения меченых фрагментов геномной ДНК по меньшей мере некоторые из меченных адаптером фрагментов секвенируют для получения множества чтений последовательностей. Фрагменты можно секвенировать, используя любой подходящий способ. Например, фрагменты можно секвенировать по способу Illumina с обратимым терминатором, способу пиросеквенирования Roche (454), секвенирования Life Technologies путем лигирования (платформа SOLiD) или использования платформы Ion Torrent от Life Technologies. Примеры таких способов описаны в следующих публикациях: Margulies et al. (Nature 2005 437: 376-80); Ronaghi et al. (Analytical Biochemistry 1996 242: 84-9); Shendure et al. (Science 2005 309: 1728-32); Imelfort et al. (Brief Bioinform. 2009 10:609-18); Fox et al. (Methods Mol Biol. 2009;553:79-108); Appleby et al. (Methods Mol Biol. 2009; 513:19-39) и Morozova et al. (Genomics. 2008 92:255-64), которые включены в настоящий документ путем ссылки в целях предоставления общих описаний способов и конкретных этапов способов, включая все исходные продукты, способы получения библиотек, реагенты и конечные продукты для каждого из этапов. Как будет очевидно, сайты праймеров прямого и обратного секвенирования, совместимые с выбранной платформой для секвенирования следующего поколения, можно добавлять к концам фрагментов на этапе амплификации. В определенных вариантах осуществления фрагменты можно амплифицировать с использованием ПЦР-праймеров, которые гибридизуются с метками, добавленными к фрагментам, причем праймер, используемый для ПЦР, имеет 5'-хвосты, совместимые с конкретной платформой секвенирования. Способы выполнения анализа ATAC-seq описаны в заявке на РСТ № PCT/US 2014/038825, которая полностью включена в настоящий документ путем ссылки.
[0034] В настоящем документе термин «хроматин» относится к комплексу молекул, включающему в себя белки и полинуклеотиды (например, ДНК, РНК), такому как обнаруживаемый в ядре эукариотической клетки. Хроматин частично состоит из гистоновых белков, образующих нуклеосомы, геномной ДНК и других ДНК-связывающих белков (например, факторов транскрипции), которые обычно связаны с геномной ДНК.
[0035] В некоторых вариантах осуществления способы, описанные в настоящем документе, дополнительно включают в себя дополнительный анализ интересующей целевой нуклеиновой кислоты. Анализ может включать в себя, например, анализ ДНК, анализ РНК, анализ белков, фрагментацию с мечением, амплификацию нуклеиновых кислот, секвенирование нуклеиновых кислот, получение библиотек нуклеиновых кислот, транспонирование с сохранением смежности (CPT-seq), комбинаторное индексированное секвенирование на одиночной клетке (SCI-seq) или амплификацию генома одиночной клетки, секвенирование полного генома по одиночным клеткам или по популяциям клеток, эпигеномику или любую их комбинацию.
[0036] Анализом ДНК называется любая методика, используемая для амплификации, секвенирования или иного анализа ДНК. Амплификация ДНК может быть выполнена с использованием ПЦР-методик. Анализ ДНК может также содержать методики ненацеленного и не основанного на ПЦР секвенирования ДНК (например, метагеномика). В качестве не имеющего ограничительного характера примера анализ ДНК может включать в себя секвенирование гипервариабельной области 16S рДНК (рибосомной ДНК) и использование секвенирования для идентификации видов по ДНК. В некоторых вариантах осуществления ДНК может включать в себя очищенную ДНК.
[0037] Анализом РНК называется любая методика, используемая для амплификации, секвенирования или иного анализа РНК. Для амплификации и секвенирования РНК можно использовать те же методики, что и для анализа ДНК. РНК, которая менее стабильна, чем ДНК, транслируется с ДНК в ответ на стимулы. Таким образом, анализ РНК может дать более точную картину метаболически активных членов сообщества и может использоваться для получения информации о работе сообщества организмов в образце. Секвенирование нуклеиновых кислот относится к использованию секвенирования для определения порядка нуклеотидов в последовательности молекулы нуклеиновой кислоты, такой как ДНК или РНК. В некоторых вариантах осуществления анализ ДНК также может включать в себя способы, которые не требуют или не используют амплификацию.
[0038] В настоящем документе термин «секвенирование» относится к способу, которым идентифицируют по меньшей мере 10 последовательных нуклеотидов (например, по меньшей мере 20, по меньшей мере 50, по меньшей мере 100 или по меньшей мере 200 или более последовательных нуклеотидов) полинуклеотида.
[0039] Термины «секвенирование следующего поколения», «высокопроизводительное секвенирование» или «NGS» по существу относятся к высокопроизводительным технологиям секвенирования, включая, без ограничений, массивно-параллельное опознавательное секвенирование, высокопроизводительное секвенирование, секвенирование с лигированием (например, секвенирование SOLiD), протон-ионное полупроводниковое секвенирование, секвенирование ДНК на наносферах, секвенирование одиночных молекул и секвенирование через нанопоры, и может относиться к параллелизированным платформам секвенирования путем синтеза или секвенирования путем лигирования, используемым в настоящее время компаниями Illumina, Life Technologies или Roche и т.д. Способы секвенирования следующего поколения могут также включать в себя способы секвенирования через нанопоры или способы электронного обнаружения, такие как технология Ion Torrent, предлагаемая компанией Life Technologies, или способ, основанный на флуоресценции одиночных молекул, предлагаемый компанией Pacific Biosciences и/или BGI Microfluidics.
[0040] Примеры методик секвенирования включают в себя целевое секвенирование, секвенирование отдельных молекул в реальном времени, секвенирование на основе электронной микроскопии, опосредованное транзиторами секвенирование, прямое секвенирование, случайное секвенирование методом «выстрел дробовика», секвенирование с дидезокситерминированием по Сэнгеру, целевое секвенирование, секвенирование экзонов, секвенирование всего генома, секвенирование путем гибридизации (например, на матрице, такой как микроматрица), пиросеквенирование, капиллярный электрофорез, гель-электрофорез, дуплексное секвенирование, цикловое секвенирование, секвенирование с удлинениями на одно основание, твердофазное секвенирование, высокопроизводительное секвенирование, массивное параллельное секвенирование методом «выстрел из дробовика», эмульсионная ПЦР, ко амплификация при пониженной температуре денатурации с ПЦР (COLD-ПЦР), мультиплексная ПЦР, секвенирование посредством обратимого терминатора-красителя, секвенирование спаренных концов, краткосрочное секвенирование, экзонуклеазное секвенирование, секвенирование путем лигирования, секвенирование коротких чтений, секвенирование отдельных молекул, секвенирование путем синтеза, секвенирование в реальном времени, секвенирование с обратным терминатором, ионное полупроводниковое секвенирование, секвенирование с наносферами, секвенирование через нанопоры, секвенирование 454, секвенирование с помощью анализатора Solexa Genome Analyzer, miSeq (Illumina), HiSeq 2000 (Illumina), HiSeq 2500 (Illumina), Illumina Genome Analyzer (Illumina), Ion Torrent PGM™ (Life Technologies), MinlON™ (Oxford Nanopore Technologies), технология реального времени SMRT™ (Pacific Biosciences), Probe-Anchor Ligation (cPAL™) (Complete Genomics/BGI), секвенирование SOLiD®, секвенирование MS-PET, масс-спектрометрия и их комбинация. В некоторых вариантах осуществления секвенирование включает в себя обнаружение продукта секвенирования с помощью прибора, например, без ограничений, ДНК-секвенатора ABI PRISM® 377, ABI PRISM® 310, 3100, 3100-Avant, 3730 или генетического анализатора 373OxI, ДНК-анализатора ABI PRISM® 3700 или системы Applied Biosystems SOLiD™ (все производства Applied Biosystems), системы Genome Sequencer 20 (Roche Applied Science) или масс-спектрометра. В определенных вариантах осуществления секвенирование содержит эмульсионную ПЦР. В определенных вариантах осуществления секвенирование содержит методику высокопроизводительного секвенирования. В определенных вариантах осуществления секвенирование содержит секвенирование полного генома. В определенных вариантах осуществления секвенирование содержит массивно-параллельное секвенирование (например, массивно-параллельное секвенирование методом «выстрел из дробовика»). Альтернативно секвенирование включает в себя целевое секвенирование.
[0041] Анализом белков называется исследование белков, которое может включать в себя протеомный анализ, определение посттрансляционной модификации интересующих белков, определение уровней экспрессии белков или определение взаимодействий белков с другими молекулами, в том числе с другими белками или нуклеиновыми кислотами.
[0042] В настоящем документе термин «тагментация» относится к модификации ДНК транспосомным комплексом, содержащим фермент транспозазу в комплексе с адаптерами, содержащими концевую последовательность транспозона. Фрагментация с мечением приводит к одновременной фрагментации ДНК и лигированию адаптеров к 5'-концам обеих цепей дуплексных фрагментов. После этапа очистки для удаления фермента-транспозазы к концам адаптированных фрагментов можно добавить дополнительные последовательности, например, с помощью ПЦР, лигирования или любой другой приемлемой методики, известной специалистам в данной области.
[0043] Секвенирование с транспозицией с сохранением смежности (СРТ-seq) относится к способу секвенирования при сохранении информации о смежности с использованием транспозазы с целью сохранения связи соседних фрагментов шаблонной нуклеиновой кислоты в целевой нуклеиновой кислоте. Например, СРТ можно проводить на нуклеиновой кислоте, такой как ДНК. СРТ-нуклеиновую кислоту можно захватывать путем гибридизации комплементарных олигонуклеотидов, имеющих уникальные индексы или штрихкоды, и иммобилизовать на твердой подложке. В некоторых вариантах осуществления олигонуклеотид, иммобилизованный на твердой подложке, в дополнение к штрихкодам может также содержать сайты связывания праймеров, уникальные молекулярные индексы. Преимуществом является то, что такое использование транспосом для поддержания физической близости фрагментированных нуклеиновых кислот повышает вероятность того, что фрагментированные нуклеиновые кислоты из той же исходной молекулы, например хромосомы, получат одинаковый уникальный штрихкод и индексную информацию от олигонуклеотидов, иммобилизованных на твердой подложке. В результате этого получается библиотека смежно-связанного секвенирования с уникальными штрихкодами. Библиотеку смежно-связанного секвенирования можно секвенировать для получения информации о смежности последовательности.
[0044] В настоящем документе термин «информация о смежности» относится к пространственным отношениям между двумя или более фрагментами ДНК на основе общей информации. Общий аспект информации может относиться к ближним, компартментным и дистантным пространственным отношениям. Информация об этих отношениях в молекулах облегчает иерархическую сборку или картирование чтений последовательностей, полученных из фрагментов ДНК. Эта информация о смежности повышает эффективность и точность такой сборки или картирования, поскольку традиционные способы сборки или картирования, используемые в связи с традиционными способами секвенирования методом «выстрел из дробовика», не учитывают относительные геномные точки начала или координаты отдельных чтений последовательности применительно к пространственным отношениям между двумя или более фрагментами ДНК, из которых получали отдельные чтения последовательности.
[0045] Таким образом, в соответствии с вариантами осуществления, описанными в настоящем документе, могут быть реализованы способы получения информации о смежности способами определения смежности ближнего диапазона для определения смежных пространственных отношений, способами определения смежности среднего диапазона для определения компартментных пространственных отношений или способами определения смежности дальнего диапазона для определения дистантных пространственных отношений. Эти способы способствуют точности и качеству сборки или картирования последовательности ДНК и могут использоваться с любым способом секвенирования, таким как описанные в настоящем документе.
[0046] Информация о смежности включает в себя относительное геномные точки начала или координаты отдельных чтений последовательности применительно к пространственным отношениям между двумя или более фрагментами ДНК, из которых были получены отдельные чтения последовательности. В некоторых вариантах осуществления информация о смежности включает в себя информацию о последовательности из неперекрывающихся чтений последовательности.
[0047] В некоторых вариантах осуществления информация о смежности для целевой нуклеотидной последовательности указывает на информацию о гаплотипе. В некоторых вариантах осуществления информация о смежности для целевой нуклеотидной последовательности указывает на информацию о геномных вариантах.
[0048] Комбинаторное индексированное секвенирование на одиночной клетке (SCI-seq) представляет собой методику секвенирования для одновременного создания тысяч библиотек одиночных клеток для разнообразных анализов, включая, например, полный геном, метилирование, РНК, одновременно ДНК и РНК, или Hi-C, или другие анализы библиотек, или любую их комбинацию.
[0049] Реакция транспонирования представляет собой реакцию, в которой один или более транспозонов вставляются в целевые нуклеиновые кислоты в случайных сайтах или почти случайных сайтах. Компоненты реакции транспонирования включают в себя транспозазу (или другой фермент, способный к фрагментированию и мечению нуклеиновой кислоты, как описано в настоящем документе, такой как интеграза) и транспозонный элемент, который включает в себя двухцепочечную транспозонную концевую последовательность, связывающуюся с транспозазой (или другим ферментом, как описано в настоящем документе), и адапторную последовательность, присоединенную к одной из двух концевых последовательностей транспозона. Одна цепь двухцепочечной транспозонной концевой последовательности переносится в одну цепь целевой нуклеиновой кислоты, а комплементарная цепь транспозонной концевой последовательности не переносится (непереносящаяся транспозонная последовательность). Адапторная последовательность при необходимости или желании может включать в себя одну или более функциональных последовательностей или компонентов (например, последовательности праймеров, якорные последовательности, универсальные последовательности, спейсерные участки или последовательности индексных меток).
[0050] Технологию на основе транспозонов можно применять для фрагментации ДНК, например, как показано в примере рабочего процесса для наборов подготовки образцов NEXTERA™ XT и FLEX DNA (Illumina, Inc.), в которых целевые нуклеиновые кислоты, такие как геномная ДНК, обрабатывают транспосомными комплексами, которые одновременно фрагментируют и метят (тагментация) мишень, таким образом создавая популяцию фрагментированных молекул нуклеиновой кислоты, меченных уникальными адапторными последовательностями на концах фрагментов.
[0051] В настоящем документе термин «инсерционный ферментный комплекс» относится к комплексу, содержащему инсерционный фермент и две адапторные молекулы («транспозонные метки»), которые объединяют с полинуклеотидами для фрагментирования и добавления адаптеров к полинуклеотидам. Таким образом, инсерционный ферментный комплекс может представлять собой «транспосомный комплекс», состоящий из по меньшей мере одной транспозазы (или другого фермента, описанного в настоящем документе) и последовательности распознавания транспозона. В некоторых таких системах транспозаза связывается с последовательностью распознавания транспозона с образованием функционального комплекса, который способен катализировать реакцию транспонирования. В некоторых аспектах последовательность распознавания транспозона представляет собой двухцепочечную концевую последовательность транспозона. Транспозаза связывается с сайтом распознавания транспозазы в целевой нуклеиновой кислоте и вставляет последовательность распознавания транспозона в целевую нуклеиновую кислоту. В некоторых таких событиях вставки одна цепь последовательности распознавания транспозона (или концевой последовательности) переносится в целевую нуклеиновую кислоту, в результате чего происходит событие расщепления. Примеры процедур и систем транспонирования, которые можно легко адаптировать к использованию с транспозазами по настоящему описанию, описаны, например, в публикациях РСТ № WO10/048605, публикации патента США №2012/0301925, публикации патента США №2012/13470087 или публикации патента США №2013/0143774, каждая из которых полностью включена в настоящий документ путем ссылки.
[0052] Примеры транспозаз, которые можно использовать с определенными вариантами осуществления, предложенными в настоящем документе, включают в себя (или кодируются ими): транспозазу Тп5 (см. Reznikoff et al., Biochem. Biophys. Res. Commun. 1999, 266, 729-734), транспозазу Sleeping Beauty (SB), Vibrio Haryi (транспозаза, охарактеризованная Agilent и используемая в продукте SureSelect QXT), транспозазу MuA и сайт распознавания транспозазы Mu, содержащий концевые последовательности R1 и R2 (Mizuchi, K., Cell, 35: 785, 1983; Savilahti, Η, et al., EMBO J., 14:4893, 1995), Staphylococcus aureus Tn552 (Colegio, O. et al., J. Bacteriol., 183:2384-8, 2001; Kirby, C. et al., Mol. Microbiol., 43:173-86, 2002), Tyl (Devine & Boeke, Nucleic Acids Res., 22:3765-72, 1994 и публикация РСТ № W095/23875), транспозон Tn7 (Craig, N.L., Science, 271:1512, 1996; Craig, N.L., Curr. Top.Microbiol. Immunol., 204:27-48, 1996), Tn/O и IS10 (Kleckner N. et al., Curr. Top.Microbiol. Immunol., 204:49-82, 1996), транспозазу Mariner (Lampe, D.J. et al., EMBO J., 15:5470-9, 1996), Tel (Plasterk, R.H., Curr. Top.Microbiol. Immunol., 204:125-43, 1996), Ρ Element (Gloor, G.B., Methods Mol. Biol., 260:97-114, 2004), Tn3 (Ichikawa & Ohtsubo, J. Biol. Chem., 265:18829-32, 1990), бактериальные инсерционные последовательности (Ohtsubo & Sekine, Curr. Top. Microbiol. Immunol. 204:1-26, 1996), ретровирусы (Brown et al., Proc. Natl. Acad. Sci. USA, 86:2525-9, 1989) и ретротранспозон дрожжей (Boeke & Corces, Ann. Rev. Microbiol. 43:403-34, 1989). Дополнительные примеры включают в себя IS5, Tn10, Tn903, IS911 и сконструированные версии ферментов семейства транспозаз (Zhang et al., (2009) PLoS Genet. 5:el000689. Epub Oct. 16; Wilson C. et al. (2007) J. Microbiol. Methods 71:332-5), причем каждый из источников, процитированных в настоящем документе в отношении транспозазы, полностью включен в настоящий документ путем ссылки. Способы, описанные в настоящем документе, также могут включать в себя комбинации транспозаз, а не только одну транспозазу.
[0053] В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5, MuA или транспозазу Vibrio Haryi либо их активный мутант. В других вариантах осуществления транспозаза представляет собой транспозазу Tn5 или ее активный мутант.В некоторых вариантах осуществления транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5 (см., например, Reznikoff et al., публикацию РСТ № WO2001/009363, патенты США №№5,925,545, 5,965,443, 7,083,980 и 7,608,434 и Goryshin and Reznikoff, J. Biol. Chem. 273:7367, 1998) или ее активный мутант. В некоторых аспектах транспозаза Tn5 представляет собой транспозазу Tn5, как описано в публикации РСТ № WO2015/160895, которая включена в настоящий документ путем ссылки. В некоторых вариантах осуществления транспозаза Tn5 представляет собой гибридный белок. В некоторых вариантах осуществления гибридный белок транспозаза Tn5 содержит слитую метку - фактор элонгации Ts (Tsf). В некоторых вариантах осуществления транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5, содержащую мутации по аминокислотам 54, 56 и 372 относительно последовательности дикого типа. В некоторых вариантах осуществления гиперактивная транспозаза Tn5 представляет собой гибридный белок, причем необязательно слитый белок представляет собой фактор элонгации Ts (Tsf). В некоторых вариантах осуществления сайт распознавания представляет собой сайт распознавания транспозазы типа Tn5 (Goryshin and Reznikoff, J. Biol. Chem., 273:7367, 1998). В одном варианте осуществления используют сайт распознавания транспозазы, образующий комплекс с гиперактивной транспозазой Tn5 (например, транспозазой EZ-Tn5™, Epicentre Biotechnologies, г.Мэдисон, штат Висконсин, США). В некоторых вариантах осуществления транспозаза Tn5 представляет собой транспозазу Tn5 дикого типа.
[0054] В любом из вариантов осуществления способов, композиций или систем, описанных в настоящем документе, транспозон включает в себя концевую последовательность транспозона. В некоторых вариантах осуществления концевая последовательность транспозона представляет собой мозаичную концевую (ME) последовательность. В некоторых вариантах осуществления ДНК помечена с использованием тагментации, причем ДНК помечена меткой и в метку включена транспозон-специфическая последовательность, такая как МЕ-последовательность. Таким образом, ДНК в образце дифференцируется от РНК на основе транспозон-специфической последовательности.
[0055] В любом из вариантов осуществления способов, композиций или систем, описанных в настоящем документе, транспозон включает в себя адапторную последовательность. Адапторные последовательности могут содержать одну или более функциональных последовательностей или компонентов, выбранных из группы, состоящей из последовательностей праймеров, якорных последовательностей, универсальных последовательностей, спейсерных областей, индексных последовательностей, последовательностей захвата, штрихкод-последовательностей, последовательностей расщепления, последовательностей, связанных с секвенированием, и их комбинаций. В некоторых вариантах осуществления адапторная последовательность содержит последовательность праймера. В других вариантах осуществления адапторная последовательность содержит последовательность праймера и индексную последовательность или штрихкод-последовательность. Последовательность праймера также может представлять собой универсальную последовательность. Настоящее описание не ограничено типом допустимых для использования адапторных последовательностей, и специалисту в данной области будут понятны дополнительные последовательности, которые могут использоваться для получения библиотеки и секвенирования следующего поколения. Универсальная последовательность представляет собой область нуклеотидной последовательности, которая является общей для двух или более фрагментов нуклеиновых кислот. Необязательно два или более фрагмента нуклеиновых кислот также имеют области с различиями в последовательности. Универсальная последовательность, которая может присутствовать в разных из множества фрагментов нуклеиновых кислот, может обеспечивать репликацию или амплификацию множества разных последовательностей с использованием одного универсального праймера, комплементарного универсальной последовательности.
[0056] Адаптеры включают в себя нуклеиновые кислоты, такие как одноцепочечные нуклеиновые кислоты. Адаптеры могут включать в себя короткие нуклеиновые кислоты, имеющие длину менее чем, более чем или равную около 5 нуклеотидов, 10 нуклеотидов, 20 нуклеотидов, 30 нуклеотидов, 40 нуклеотидов, 50 нуклеотидов, 60 нуклеотидов, 70 нуклеотидов, 80 нуклеотидов, 90 нуклеотидов, 100 нуклеотидов или находящуюся в диапазоне между любыми двумя из вышеуказанных размеров.
[0057] В любом из вариантов осуществления адапторная последовательность или концевые последовательности транспозона, включая А14-МЕ, ME, В15-МЕ, ME', А14, В15 и ME, представлены ниже:
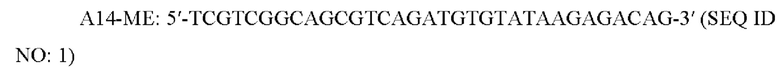



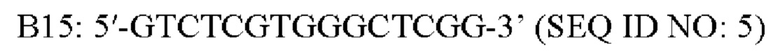

[0058] В некоторых вариантах осуществления включены последовательности праймеров для получения библиотек для секвенирования. В некоторых вариантах осуществления последовательность праймера представляет собой последовательность праймера Р5 или последовательность праймера Р7. Праймеры Р5 и Р7 используют на поверхности коммерческих проточных ячеек, поставляемых компанией Illumina, Inc., для секвенирования на различных платформах Illumina. В патентной публикации США №2011/0059865 А1 описаны последовательности праймеров, которые полностью включены в настоящий документ путем ссылки. К примерам праймеров Р5 и Ρ7, которые могут иметь алкиновую концевую группу на 5'-конце, относятся следующие:


[0059] и их производные или аналоги. В некоторых примерах последовательность Р7 включает в себя модифицированный гуанин в положении G*, например, 8-оксогуанин. В других примерах символ * указывает на то, что связь между G* и смежным 3' А представляет собой фосфоротиоатную связь. В некоторых примерах праймеры Р5 и/или Р7 включают в себя неприродные линкеры. Необязательно один или оба из праймеров Р5 и Р7 могут включать в себя хвост поли-Т. Хвост поли-Т по существу расположен на 5'-конце указанной выше последовательности, например, между 5'-основанием и концевым алкиновым звеном, но в некоторых случаях может быть расположен на 3'-конце. Последовательность поли-Т может включать в себя любое число Т-нуклеотидов, например от 2 до 20. Хотя в качестве примеров приведены праймеры Р5 и Р7, следует понимать, что в примерах, представленных в настоящем документе, можно использовать любые подходящие праймеры. Индексные последовательности, содержащие последовательности праймеров, включая последовательности праймеров Р5 и Р7, служат для добавления Р5 и Р7 в целях активации библиотеки для секвенирования.
[0060] Связывающая нуклеиновую кислоту молекула представляет собой молекулу, которая предпочтительно связывается с нуклеиновой кислотой, например, с ДНК или РНК. Связывающая нуклеиновую кислоту молекула, например ДНК-связывающая молекула, может быть специфичной к определенному типу нуклеиновой кислоты, не связываясь с другими типами нуклеиновых кислот. Например, ДНК-связывающая молекула может предпочтительно связываться с мтДНК, но не связываться или в меньшей степени связываться с другими нуклеиновыми кислотами, такими как ядерная ДНК. Примеры молекул, связывающих нуклеиновую кислоту, включают в себя пигмент или краситель, белок, фермент, биомолекулу, аффинную метку, частицу, флуоресцентную метку, пептид, лиганд или другую молекулу, способную специфически связываться с нуклеиновой кислотой. Таким образом, в некоторых примерах связывающая нуклеиновую кислоту молекула представляет собой краситель Hoechst, цианиновый краситель (включая, например, красители SYBR, такие как SYBR зеленый, SYBR золотой, оксазоловый желтый, тиазоловый оранжевый, Pico Green, Safe зеленый), 4',6-диамидино-2-фенилиндольные (DAPI) красители или красители Sytox (включая, например, Sytox зеленый или Sytox оранжевый). К другим связывающим нуклеиновые кислоты молекулам могут относиться, например, 7-AAD (7-аминоактиномицин D), акридиновый оранжевый, акридиновый красный, Alexa Fluor 594, Alexa Fluor 610 R-фикоэритрин стрептавидин pH 7,2, Alexa Fluor 647 R-фикоэритрин стрептавидин pH 7,2. Alexa Fluor 633, Alexa Fluor 647, Alexa Fluor 660, Alexa Fluor 680, Alexa Fluor 700, Alexa Fluor 750, аллофикоцианин (APC), BOBO-3-DNA, BOBO-3, Bodipy 650/665-X, Cy5.5, Cy5, DDAO, Draq5, бромид этидия, моноазид этидия, гомодимер этидия, гомодимер-1 этидия (EthD-1), гомодимер-1-ДНК этидия, гомодимер-2 этидия, LDS 751, LDS 751 (ДНК), LOLO-1, MitoTracker red, Nile blue-EtOH, OliGreen, реагент для количественного определения дцДНК, POPO-1-DNA, PO-PRO-1-DNA, йодид пропидия (PI), йодид-ДНК пропидия, Ribogreen, SYPRO Ruby, SYTO 60, SYTO 61, SYTO 62, SYTO 63, SYTO 64, Texas Red, TO-PRO-1-DNA, TO-PRO-3, TO-PRO-5, TOTO-1-DNA, TOTO-3, YO-PRO-1-DNA, YO-PRO-3, YOYO-1, YOYO-1-DNAh YOYO-3. Эти связывающие нуклеиновые кислоты молекулы представляют собой примеры пригодных для использования молекул, и специалисту в данной области будет понятно, что можно использовать любую связывающуюся с нуклеиновой кислотой молекулу, которая отличает интересующую целевую нуклеиновую кислоту от нецелевых нуклеиновых кислот.
[0061] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к способу секвенирования нуклеиновой кислоты. В некоторых вариантах осуществления способ включает в себя получение образца, содержащего нуклеиновую кислоту, приведение образца в контакт с ДНК-связывающей молекулой, приведение образца в контакт с инсерционным ферментным комплексом с получением меченых фрагментов нуклеиновой кислоты и секвенирование меченых фрагментов нуклеиновой кислоты с получением чтений последовательности. В некоторых вариантах осуществления образец получен из популяции клеток, одиночной клетки, популяции клеточных ядер или ядра одиночной клетки. В некоторых вариантах осуществления образец содержит мтДНК и ядерную ДНК, причем ДНК-связывающая молекула связывается с мтДНК, но не с ядерной ДНК. В некоторых вариантах осуществления ДНК-связывающая молекула содержит ДНК-краситель, аффинную метку, лиганд, фермент, пептид или биомолекулу. В некоторых вариантах осуществления ДНК-краситель содержит краситель Hoechst, SYBR Gold, Sytox Orange, Pico Green или Qubit. В некоторых вариантах осуществления инсерционный ферментный комплекс представляет собой транспосому, содержащую транспозазу. В некоторых вариантах осуществления секвенирование выполняют с помощью ATAC-seq. В некоторых вариантах осуществления ATAC-seq включает в себя массовый ATAC-seq или ATAC-seq на одиночных клетках. В некоторых вариантах осуществления способ ингибирует, уменьшает или устраняет секвенирующие чтения мтДНК. В некоторых вариантах осуществления связывающая нуклеиновую кислоту молекула предпочтительно связывается со специфической последовательностью или последовательностями ДНК.
[0062] Некоторые варианты осуществления, предложенные в настоящем документе, относятся к способу ингибирования, снижения или устранения секвенирующих чтений мтДНК. В некоторых вариантах осуществления способ включает в себя получение образца, содержащего мтДНК и интересующую нуклеиновую кислоту, приведение образца в контакт со связывающей ДНК молекулой, которая предпочтительно связывается со вторичной ДНК, такой как мтДНК, и выполнение транспонирования ДНК на открытом хроматине, причем вторичная ДНК, такая как мтДНК, не транспонируется. В некоторых вариантах осуществления образец получен из популяции клеток, одиночной клетки, популяции клеточных ядер или ядра одиночной клетки. В некоторых вариантах осуществления ДНК-связывающая молекула содержит ДНК-краситель, аффинную метку, лиганд, фермент, пептид или биомолекулу. В некоторых вариантах осуществления ДНК-краситель содержит краситель Hoechst, SYBR Gold, Sytox Orange, Pico Green или Qubit. В некоторых вариантах осуществления транспонирование ДНК выполняют с использованием ATAC-seq. В некоторых вариантах осуществления ATAC-seq включает в себя массовый ATAC-seq или ATAC-seq на одиночных клетках. В некоторых вариантах осуществления приведение образца в контакт с ДНК-связывающей молекулой блокирует транспонирование в мтДНК. В некоторых вариантах осуществления интересующая нуклеиновая кислота содержит ядерную ДНК. В некоторых вариантах осуществления способ дополнительно включает в себя секвенирование ядерной ДНК.
[0063] В настоящем документе термин «образец» относится к любому образцу, содержащему интересующий аналит. Образец может представлять собой биологический образец, такой как биологический образец, содержащий интересующий аналит, включая, например, цельную кровь, сыворотку, тканевую жидкость, лимфу, спинномозговую жидкость, мокроту, мочу, кал, молоко, пот, слезную жидкость, пуповину, периферическую кровь, костный мозг, клетки или твердую ткань. В некоторых вариантах осуществления образец представляет собой популяцию клеток, клетку, популяцию клеточных ядер или ядро клетки. Образец может быть получен от субъекта, причем у субъекта желательно провести анализ одного или более интересующих аналитов. В настоящем документе термин «субъект» относится к животному, которое является объектом лечения, наблюдения или эксперимента. Термин «животные» включает в себя холоднокровных и теплокровных позвоночных и беспозвоночных, таких как рыбы, моллюски, рептилии, и в частности млекопитающие. Термин «млекопитающие» включает в себя, без ограничений, мышей, крыс, кроликов, морских свинок, собак, кошек, овец, коз, коров, лошадей, приматов, таких как обезьяны, шимпанзе и человекообразные обезьяны, и в частности людей.
[0064] Образец может представлять собой текучую среду или пробу, полученные из источника в окружающей среде. Например, текучая среда или проба, полученные из источника в окружающей среде, могут быть получены или произведены из пищевых продуктов, продуктов питания, птицы, мяса, рыбы, напитков, молочного продукта, воды (включая сточные воды), прудов, рек, резервуаров, плавательных бассейнов, почв, установок по переработке и/или упаковке пищевых продуктов, сельскохозяйственных участков, гидрокультур (включая фермы по гидропонному выращиванию пищевых продуктов), фармацевтических производственных установок, мест с колониями животных или любых их комбинаций. В некоторых вариантах осуществления образец представляет собой текучую среду или пробу, собранную или полученную из клеточной культуры или колонии микроорганизмов.
[0065] В настоящем документе термины «аналит», «целевой аналит», «интересующий аналит» используются взаимозаменяемо и относятся к аналиту, измеряемому в способах и системах, описанных в настоящем документе. В некоторых вариантах осуществления аналит может представлять собой биомолекулу. Не имеющие ограничительного характера примеры биомолекул включают в себя макромолекулы, такие как полинуклеотид (например, ДНК или РНК), белки, липиды и углеводы. В некоторых случаях аналит может представлять собой гормоны, антитела, факторы роста, цитокины, ферменты, рецепторы (например, нейрональные, гормональные, рецепторы к питательным веществам и рецепторы клеточной поверхности) или их лиганды, маркеры рака (например, ПСА, ФНО-альфа), маркеры инфаркта миокарда (например, тропонин, креатинкиназа и т.п.), токсины, лекарственные средства (например, лекарственные средства, вызывающие зависимость), метаболические агенты (например, включая витамины) и т.п.Не имеющие ограничительного характера варианты осуществления белковых аналитов включают в себя пептиды, полипептиды, фрагменты белка, белковые комплексы, гибридные белки, рекомбинантные белки, фосфопротеины, гликопротеины, липопротеины, белки, меченные олигонуклеотидами, и т.п. Целевой аналит может представлять собой нуклеиновую кислоту, такую как ядерная ДНК.
[0066] И наоборот, нецелевой аналит представляет собой аналит, который в норме анализируется с помощью ферментативной реакции, но который не является целевым аналитом, так что анализируются как исследуемый аналит, так и нецелевой аналит, в результате чего снижается точность и достоверность результатов. Нецелевой аналит представляет собой аналит, который было бы предпочтительно не анализировать. Таким образом, предложенные в настоящем документе варианты осуществления относятся к способам и композициям, которые устраняют, уменьшают или ингибируют анализ нецелевого аналита.
[0067] К целевым нуклеиновым кислотам может относиться образец, в котором средний размер нуклеиновой кислоты образца менее чем, более чем или равен около 2 тыс. п.н., 1 тыс. п.н., 500 п.н., 400 п.н., 200 п.н., 100 п.н., 50 п.н. или находится в диапазоне между любыми двумя из вышеуказанных размеров. В некоторых вариантах осуществления средний размер нуклеиновой кислоты в образце менее чем, более чем или равен около 2000 нуклеотидов, 1000 нуклеотидов, 500 нуклеотидов, 400 нуклеотидов, 200 нуклеотидов, 100 нуклеотидов, 50 нуклеотидов или находится в диапазоне из любых двух вышеуказанных размеров.
[0068] В настоящем документе термин «реагент» описывает агент или смесь из двух или более агентов, используемых для реакции с образцом, взаимодействия с образцом, разведения образца или добавления к образцу, и может включать в себя агенты, используемые в анализах, описанных в настоящем документе, включая агенты для лизиса, анализа нуклеиновых кислот, реакций амплификации нуклеиновых кислот, анализа белков, реакций тагментации, реакций АТАС seq, CPT-seq или SCI-seq или других анализов. Таким образом, реагенты могут включать в себя, например, буферы, химические вещества, ферменты, полимеразу, праймеры, имеющие размер менее чем 50 пар нуклеотидов, матричные нуклеиновые кислоты, нуклеотиды, метки, красители или нуклеазы. В некоторых вариантах осуществления реагент включает в себя лизоцим, протеиназу K, случайные гексамеры, полимеразу (например, ДНК-полимеразу Ф29, полимеразу Taq, полимеразу Bsu), транспозазу (например, Tn5), праймеры (например, адапторные последовательности Р5 и Р7), лигазу, катализирующий фермент, дезоксинуклеотидтрифосфаты, буферы или двухвалентные катионы.
[0069] В настоящем документе термины «выделенный», «выделять», «выделение», «очищенный», «очищать», «очистка» и их грамматические эквиваленты, используемые в настоящем документе, если не указано иное, относятся к снижению количества по меньшей мере одного загрязняющего вещества (такого как белковая и/или нуклеотидная последовательность) в образце или источнике (например, клетке), из которого выделяют материал. Таким образом, очистка приводит к «обогащению», например увеличению количества необходимого белка и/или нуклеотидной последовательности в образце.
[0070] Преимущества способов и композиций, описанных в настоящем документе, могут включать в себя, например, специфическое нацеливание на интересующую ДНК посредством секвенирования открытого хроматина (ATAC-seq), снижение, ингибирование, или устранение из анализа нежелательных секвенирующих митохондриальных чтений, снижение или устранение необходимости в разделении нежелательных мишеней для меньшей нагрузки на способы разделения, и снижение затрат, поскольку нежелательная информация не собирается и не анализируется.
[0071] Способы также можно комбинировать путем контроля реакционной способности и селективности фермента. Композиции и способы, описанные в настоящем документе, контролируют активность и специфичность ферментов посредством блокирования специфических мишеней. Как будет понятно специалисту в данной области, аналогичные принципы также могут быть применимы к анализам, относящимся к ДНК, белкам, РНК или любому интересующему аналиту либо комбинации аналитов.
[0072] Варианты осуществления систем и способов, предложенных в настоящем документе, можно использовать в сочетании с капельной системой разделения для использования при выделении образца внутри капли. В настоящем документе термин «разделение» или «разделенный» относится к разделению образца на множество частей или «порций». Порции могут быть твердыми или жидкими. В некоторых вариантах осуществления порция представляет собой твердую порцию, например, микроканал. В некоторых вариантах осуществления раздел представляет собой жидкую порцию, например, каплю. В некоторых вариантах осуществления жидкая порция (например, капля) представляет собой смесь несмешивающихся текучих сред (например, воды и масла) или эмульсию. В некоторых вариантах осуществления жидкая порция (например, капля) представляет собой водную каплю, окруженную несмешивающейся жидкостью-носителем (например, маслом). В других вариантах осуществления жидкая порция представляет собой водную каплю, которая физически или химически отделена от соседних водных капель так, что содержимое одной капли не диффундирует в соседние капли. Например, разделение можно выполнять с помощью каплегенератора (например, системы BioRad, системы Dolomite Microfluidics, системы Micronit Microfluidics, микрофлюидные устройства типа «вода в масле», системы 10Х Genomics или любая другая подходящая система разделения капель) для отдельного разделения, выделения и/или анализа интересующей нуклеиновой кислоты.
[0073] Варианты осуществления систем и способов, предложенные в настоящем документе, включают в себя наборы, содержащие реагенты для транспонирования, а также первый зонд, комплементарный первой метке, и второй зонд, комплементарный второй метке, причем первый и второй зонды иммобилизованы на твердой подложке. В некоторых вариантах осуществления первый зонд и второй зонд содержат штрихкод. В некоторых вариантах осуществления первый зонд и второй зонд представляют собой зонд поли-Т. В некоторых вариантах осуществления твердая подложка представляет собой протравленную поверхность, лунку, матрицу, устройство с проточной ячейкой, микрофлюидный канал, гранулу, магнитную гранулу, колонку, каплю или микрочастицу.
ПРИМЕРЫ
Пример 1. Снижение чтений митохондриальной ДНК
[0074] В следующем примере продемонстрирован вариант осуществления уменьшения чтений мтДНК с использованием ATAC-seq.
[0075] Был получен образец, содержащий как ядерную ДНК, так и мтДНК. Образец разделяли на различные аликвоты и каждую аликвоту приводили в контакт с красителем Hoechst 33258 в различных концентрациях, включая 8 мкМ, 80 мкМ и 800 мкМ. Затем каждую аликвоту подвергали транспонированию и ATAC-seq и анализировали чтения ДНК.
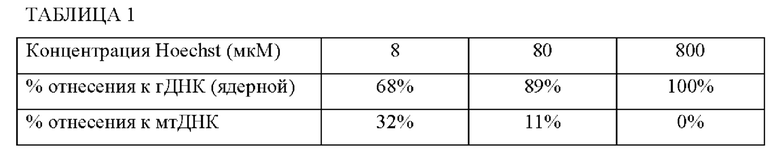
[0076] Как показано на Фиг. 2А-2С, краситель Hoechst избирательно окрашивает мтДНК, предотвращая транспонирование в мтДНК, но допуская транспонирование ядерной ДНК. В таблице 1 представлены сводные данные по чтениям, показанным на Фиг. 2А-2С. Увеличение концентраций красителя Hoechst приводило к уменьшению чтений мтДНК с использованием ATAC-seq. Способы и композиции можно использовать в массовом ATAC-seq или ATAC-seq одиночных клеток для ингибирования, снижения или устранения нежелательных секвенирующих чтений мтДНК.
[0077] В дополнение к выполнению транспонирования и ATAC-seq образцы также окрашивали. Образцы окрашивали DAPI, и происходило окрашивание мтДНК, но не активно транскрибируемых (АТАС) областей ядерной ДНК. DAPI окрашивал ДНК за исключением определенных мест. В местах, где отсутствует окрашивание DAPI, происходит транскрипция РНК. Дифференциальное окрашивание мтДНК и активно не транскрибируемых областей ядерной ДНК эффективно ингибировало транспонирование в мтДНК и таким образом повышало эффективность ATAC-seq ядерной ДНК без нежелательного нецелевого транспонирования.
Пример 2. Эффективность различных ДНК-связывающих молекул
[0078] В следующем примере демонстрируется вариант осуществления уменьшения чтений мтДНК при ATAC-seq с помощью различных ДНК-связывающих молекул.
[0079] Был получен образец, содержащий как ядерную ДНК, так и мтДНК. Образец разделяли на различные аликвоты, и аликвоты приводили в контакт с разными красителями в различных концентрациях. Использовали пять разных красителей, включая Hoechst (в концентрациях 50 мкМ, 25 мкМ, 12 мкМ, 6 мкМ, 3 мкМ и 0,6 мкМ), SYBR Gold (в концентрациях 500 мкМ, 50 мкМ, 5 мкМ, 0,5 мкМ и 0,1 мкМ), Sytox Orange (в концентрациях 500 мкМ, 50 мкМ, 5 мкМ, 0,5 мкМ и 0,1 мкМ), Pico Green (в концентрациях 100 мкМ, 10 мкМ, 1 мкМ, 0,1 мкМ и 0,02 мкМ) и Qubit (в концентрациях 100 мкМ, 10 мкМ, 1 мкМ, 0,1 мкМ и 0,02 мкМ), как показано на Фиг. 3А-3С. Готовили другую аликвоту, которая не подвергалась воздействию какого-либо красителя. Затем каждую аликвоту подвергали транспонированию по технологии Nextera и продукты визуализировали на геле. На Фиг. 3А представлен гель для Hoechst и SYBR Gold. На Фиг. 3В представлен гель для Sytox Orange и Pico Green, а на Фиг. 3С представлен гель для Qubit и при отсутствии красителя. Препараты ДНК с высокой молекулярной массой указывают на неэффективное транспонирование. Ингибирование наблюдали для SYBR Gold и Sytox Orange при концентрациях более чем 100 мкМ.
[0080] Каждую аликвоту подвергали транспонированию и анализировали чтения ДНК, как показано на Фиг. 4 и 5. Как показано на Фиг. 4, Hoechst 33258 не изменяет профили ATAC-seq (расположение нуклеосом) и уменьшает чтения митохондриальной ДНК (это показано также на Фиг. 2А-2С). Hoechst обеспечивает относительно неизменный профиль ATAC-seq, в то же время не изменяя позиционирование нуклеосом. Некоторые красители, такие как SYBR Gold, связывались с ДНК, но изменяли позиционирование нуклеосом (ATAC-seq) по сравнению с контролем без красителей.
[0081] Как показано на Фиг. 5, специфическое блокирование мтДНК повышало специфичность секвенирования ядерной ДНК. Эти результаты показывают, что внедряемые ДНК-связывающие молекулы можно использовать для контроля ферментативной транспонирующей активности на ДНК.
[0082] Такой подход можно применять в более общем смысле, при котором конкретные красители или связывающие молекулы в целом можно доставлять до определенных мишеней с использованием хорошо известных аффинных меток, включая конъюгаты антител и зонды гибридизации ДНК, для блокирования нежелательной ферментативной активности. Альтернативно специфические аффинные метки («блокаторы») можно использовать для привлечения ферментов к конкретным мишеням. Такие области применения могут включать в себя блокирование нецелевой активности ферментов CRISPR.
[0083] В настоящем документе термин «содержащий» является синонимом терминов «включая», «включающий» или «характеризуется» и имеет включающий, а не ограничительный характер, и не исключает дополнительные неуказанные элементы или этапы способа.
[0084] В описании выше приведены несколько способов и материалов настоящего изобретения. Настоящее изобретение может подвергаться модификациям в части способов и материалов, а также изменениям в части способов изготовления и оборудования. Такие модификации будут очевидны специалистам в данной области после изучения настоящего описания или реализации изобретения, описанного в настоящем документе, на практике. Следовательно, не предполагается, что настоящее изобретение ограничено конкретными вариантами осуществления, описанными в настоящем документе, но предполагается, что оно охватывает все модификации и альтернативные варианты в пределах истинного объема и сущности изобретения.
[0085] Все источники, процитированные в настоящем документе, включая, без ограничений, опубликованные и неопубликованные заявки, патенты и ссылки на литературу, полностью включены в настоящий документ путем ссылки и, следовательно, являются частью настоящего описания. В тех случаях, когда публикации, патенты или заявки на патенты, включенные путем ссылки, противоречат изложению, приведенному в настоящем описании, предполагается, что настоящее описание заменяет и/или имеет приоритет над любым таким противоречащим материалом.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Illumina, Inc.
<120> СИСТЕМЫ И СПОСОБЫ УПРАВЛЕНИЯ ФЕРМЕНТАТИВНЫМИ
РЕАКЦИЯМИ
<130> ILLINC.413WO
<150> 62/780,812
<151> 2018-12-17
<160> 8
<170> PatentIn версии 3.5
<210> 1
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 1
tcgtcggcag cgtcagatgt gtataagaga cag 33
<210> 2
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 2
gtctcgtggg ctcggagatg tgtataagag acag 34
<210> 3
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 3
ctgtctctta tacacatct 19
<210> 4
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 4
tcgtcggcag cgtc 14
<210> 5
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 5
gtctcgtggg ctcgg 15
<210> 6
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 6
agatgtgtat aagagacag 19
<210> 7
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 7
aatgatacgg cgaccaccga gauctacac 29
<210> 8
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический олигонуклеотид
<400> 8
caagcagaag acggcatacg agat 24
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838946C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2750567C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2793717C2 |
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ ЯДЕР И ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838545C2 |
| МОДУЛЯЦИЯ ПОЛИМЕРНЫХ ГРАНУЛ ДЛЯ ОБРАБОТКИ ДНК | 2019 |
|
RU2822154C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2709655C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2736728C2 |
| СЛОЖНЫЕ КОМПЛЕКСЫ СВЯЗАННОЙ НА ПОВЕРХНОСТИ ТРАНСПОСОМЫ | 2020 |
|
RU2790295C2 |



Изобретение относится к биотехнологии. Описан способ секвенирования нуклеиновой кислоты, включающий: получение образца, содержащего нуклеиновую кислоту; приведение образца в контакт с ДНК-связывающей молекулой, содержащей ДНК-краситель; приведение образца в контакт с инсерционным ферментным комплексом с получением меченых фрагментов нуклеиновых кислот, причем инсерционный ферментный комплекс ингибируется ДНК-связывающей молекулой; и секвенирование меченых фрагментов нуклеиновых кислот с получением чтений последовательности. Также описан способ ингибирования, снижения или устранения вторичных секвенирующих чтений, включающий: получение образца, содержащего первичные нуклеиновые кислоты и вторичные нуклеиновые кислоты; приведение образца в контакт с ДНК-связывающей молекулой, которая предпочтительно связывает вторичные нуклеиновые кислоты, где ДНК-связывающая молекула содержит ДНК-краситель; и выполнение транспонирования ДНК на открытом хроматине, причем вторичные нуклеиновые кислоты не транспонируются или транспонируются с более низкой эффективностью, чем первичные нуклеиновые кислоты. Кроме того, раскрыта библиотека нуклеиновых кислот для секвенирования, полученная указанными способами, содержащая первичные секвенирующие чтения, полученные путем секвенирования ДНК, причем библиотека нуклеиновых кислот не включает в себя или имеет сниженное представление вторичных секвенирующих чтений благодаря ДНК-связывающим молекулам, которые предпочтительно связываются со вторичной ДНК, где ДНК-связывающая молекула содержит ДНК-краситель. Изобретение расширяет арсенал способов секвенирования. 3 н. и 23 з.п. ф-лы, 5 ил., 1 табл., 2 пр.
1. Способ секвенирования нуклеиновой кислоты, включающий:
получение образца, содержащего нуклеиновую кислоту;
приведение образца в контакт с ДНК-связывающей молекулой, содержащей ДНК-краситель;
приведение образца в контакт с инсерционным ферментным комплексом с получением меченых фрагментов нуклеиновых кислот, причем инсерционный ферментный комплекс ингибируется ДНК-связывающей молекулой; и
секвенирование меченых фрагментов нуклеиновых кислот с получением чтений последовательности.
2. Способ по п. 1, в котором образец представляет собой популяцию клеток, одиночную клетку, популяцию клеточных ядер или ядро одиночной клетки.
3. Способ по любому из пп. 1, 2, в котором образец содержит первичные нуклеиновые кислоты и вторичные нуклеиновые кислоты, причем ДНК-связывающая молекула предпочтительно связывает вторичные нуклеиновые кислоты, а не первичные нуклеиновые кислоты.
4. Способ по п. 3, в котором первичные нуклеиновые кислоты содержат ядерную ДНК.
5. Способ по п. 3, в котором вторичные нуклеиновые кислоты содержат митохондриальную ДНК (мтДНК) или внехромосомную ДНК.
6. Способ по любому из пп. 1-5, в котором ДНК-краситель содержит краситель Hoechst, SYBR Gold, Sytox Orange, Pico Green или Qubit.
7. Способ по любому из пп. 1–6, в котором инсерционный ферментный комплекс представляет собой транспосому, содержащую транспозазу.
8. Способ по любому из пп. 1–7, в котором секвенирование выполняют путем анализа с секвенированием доступного для транспозазы хроматина (ATAC-seq) или путем секвенирования полного генома.
9. Способ по п. 8, в котором ATAC-seq содержит массовый ATAC-seq или ATAC-seq на одиночных клетках.
10. Способ по любому из пп. 1–9, который ингибирует, снижает или устраняет вторичные секвенирующие чтения.
11. Способ ингибирования, снижения или устранения вторичных секвенирующих чтений, включающий:
получение образца, содержащего первичные нуклеиновые кислоты и вторичные нуклеиновые кислоты;
приведение образца в контакт с ДНК-связывающей молекулой, которая предпочтительно связывает вторичные нуклеиновые кислоты, где ДНК-связывающая молекула содержит ДНК-краситель; и
выполнение транспонирования ДНК на открытом хроматине, причем вторичные нуклеиновые кислоты не транспонируются или транспонируются с более низкой эффективностью, чем первичные нуклеиновые кислоты.
12. Способ по п. 11, в котором образец представляет собой популяцию клеток, одиночную клетку, популяцию клеточных ядер или ядро одиночной клетки.
13. Способ по п. 12, в котором ДНК-краситель содержит краситель Hoechst, SYBR Gold, SytoxOrange, PicoGreen или Qubit.
14. Способ по любому из пп. 11–13, в котором транспонирование ДНК выполняют с использованием анализа с секвенированием доступного для транспозазы хроматина (ATAC-seq) или секвенирования полного генома из гДНК или из одиночных клеток.
15. Способ по п. 14, в котором ATAC-seq содержит массовый ATAC-seq или ATAC-seq на одиночных клетках.
16. Способ по любому из пп. 11–15, в котором приведение образца в контакт с ДНК-связывающей молекулой блокирует или снижает транспонирование во вторичные нуклеиновые кислоты.
17. Способ по любому из пп. 11–16, в котором первичные нуклеиновые кислоты содержат ядерную ДНК.
18. Способ по п. 17, дополнительно включающий секвенирование ядерной ДНК.
19. Способ по любому из пп. 11–18, в котором вторичные нуклеиновые кислоты содержат митохондриальную ДНК (мтДНК) или внехромосомную ДНК.
20. Библиотека нуклеиновых кислот для секвенирования, полученная способом по п. 1 или 11, содержащая первичные секвенирующие чтения, полученные путем секвенирования ДНК, причем библиотека нуклеиновых кислот не включает в себя или имеет сниженное представление вторичных секвенирующих чтений благодаря ДНК-связывающим молекулам, которые предпочтительно связываются со вторичной ДНК, где ДНК-связывающая молекула содержит ДНК-краситель.
21. Библиотека нуклеиновых кислот по п. 20, в которой секвенирование ДНК представляет собой анализ с секвенированием доступного для транспозазы хроматина (ATAC-seq) или анализ гДНК с секвенированием полного генома.
22. Библиотека нуклеиновых кислот по любому из пп. 20, 21, в которой первичные секвенирующие чтения представляют собой секвенирующие чтения ядерной ДНК.
23. Библиотека нуклеиновых кислот по любому из пп. 20–22, в которой вторичные секвенирующие чтения представляют собой секвенирующие чтения митохондриальной ДНК (мтДНК) или секвенирующие чтения внехромосомной ДНК.
24. Библиотека нуклеиновых кислот по любому из пп. 20-23, в которой ДНК-связывающая молекула способна связываться со специфической нуклеотидной последовательностью для устранения, снижения или ингибирования секвенирующих чтений или библиотек секвенирования для целевых областей нуклеиновых кислот.
25. Библиотека нуклеиновых кислот по любому из пп. 20-24, в которой ДНК-краситель содержит краситель Hoechst, SYBR Gold, Sytox Orange, Pico Green или Qubit.
26. Библиотека нуклеиновых кислот по любому из пп. 20–25, которая создана из популяции клеток, одиночной клетки, популяции клеточных ядер или ядра одиночной клетки.
| LINDSEY MONTEFIORI et al., "Reducing mitochondrial reads in ATAC-seq using CRISPR/Cas9", SCIENTIFIC REPORTS,Vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO 2018218226 A1, 29.11.2018 | |||
| ГЕНОМНЫЙ ОТБОР И СЕКВЕНИРОВАНИЕ С ПОМОЩЬЮ КОДИРОВАННЫХ МИКРОНОСИТЕЛЕЙ | 2010 |
|
RU2609630C2 |
Авторы
Даты
2024-03-18—Публикация
2019-12-13—Подача