Данное изобретение было сделано с правительственной поддержкой согласно гранту номер 1R01-GM106957, присужденному Национальным институтом общих медицинских наук. Правительство Соединенных Штатов имеет определенные права в данном изобретении.
Предшествующий уровень техники
Данное раскрытие, в общем, относится к обнаружению на основе биосенсора и, более конкретно, к биосенсорам, которые можно использовать для секвенирования нуклеиновых кислот.
Имеющиеся в настоящее время в продаже платформы для секвенирования ДНК являются относительно дорогостоящими. В большинстве из этих платформ используется подход «секвенирования посредством синтеза», который так называется из-за того, что синтезируются полимеры ДНК при одновременном обнаружении присоединения каждого мономера (т.е. нуклеотида) к растущей полимерной структуре. Поскольку нить матричной ДНК строго управляет синтезом нового полимера ДНК, можно вывести последовательность матричной ДНК из серий нуклеотидных мономеров, которые были добавлены к растущей нити во время синтеза. В мониторинге данной реакции используется относительно дорогостоящее оборудование, такое как лазеры, детектирующая оптика и сложные системы доставки жидкости. Для большинства успешных имеющихся в настоящее время в продаже платформ также требуются дорогие реактивы и оборудование для амплификации матриц ДНК перед тем как даже может начаться секвенирование посредством синтеза. Сложность и затраты на эти платформы сдерживали их применение в некоторых клинических и исследовательских контекстах, где существует явная потребность в технологии секвенирования ДНК.
Таким образом, существует потребность в улучшениях платформ секвенирования нуклеиновых кислот для того, чтобы сделать их более рентабельными, быстродействующими и удобными. Настоящее раскрытие удовлетворяет эту потребность и также дает другие преимущества.
Краткое изложение сущности изобретения
Согласно настоящему раскрытию предложен способ секвенирования нуклеиновых кислот. Данный способ может включать следующие стадии: (а)
обеспечение полимеразы, присоединенной к сенсору заряда на твердой подложке;
(б) приведение полимеразы в контакт со смесью нуклеотидтрифосфатов, где данная смесь включает разные типы нуклеотидтрифосфатов, в которой первый тип нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов в смеси, в которой второй тип нуклеотидтрифосфатов не находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов в смеси, и где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты; (в) обнаружение включения нуклеотидов посредством сенсора заряда, где первый тип нуклеотидтрифосфатов дает сигнал, который является уникальным по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами в смеси, получая, посредством этого, первую картину сигнала; (г) повторение стадий (б) и (в) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов, в которой второй тип нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов во второй смеси, и в которой первый тип нуклеотидтрифосфатов не находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов во второй смеси, получая, посредством этого, вторую картину сигнала; и (д) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты.
Также предложен способ секвенирования нуклеиновой кислоты, который включает следующие стадии: (а) обеспечение полимеразы, присоединенной к сенсору заряда на твердой подложке; (б) приведение полимеразы в контакт со смесью нуклеотидтрифосфатов, где данная смесь включает разные типы нуклеотидтрифосфатов, в которой первые два типа нуклеотидтрифосфатов находятся в первом отличимом состоянии по сравнению со вторыми двумя типами нуклеотидтрифосфатов в смеси, и где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты;
(в) обнаружение включения нуклеотидов посредством сенсора заряда, где первые два типа нуклеотидтрифосфатов дают сигнал, который отличается от сигналов, продуцируемых вторыми двумя типами нуклеотидтрифосфатов в смеси, получая, посредством этого, первую картину сигнала; (г) повторение стадий (б) и (в) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов, в которой один из первых двух типов нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другим из первых двух типов нуклеотидтрифосфатов во второй смеси, получая, посредством этого, вторую картину сигнала; и (д) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты.
Краткое описание графических материалов
На ФИГ. 1 показан одиночный фермент, иммобилизованный на полевом транзисторе на основе одностенной нанотрубки (SWNT FET, от англ. single-walled nanotube field effect transistor).
На ФИГ. 2 показана полимераза, присоединенная к сенсору заряда посредством спейсера.
На ФИГ. 3 показаны заряженные остатки фрагмента Кленова ДНК-полимеразы I поблизости от сенсора заряда на основе нанопровода.
На ФИГ. 4А показан каталитический цикл полимеразной активности.
На ФИГ. 4Б показаны типичные сигналы, обнаруживаемые полимеразой, присоединенной к SWNT FET, во время включения нуклеотидов в матричную нуклеиновую кислоту с праймером.
На ФИГ. 5 показан типичный сигнал, обнаруживаемый полимеразой, присоединенной к SWNT FET, во время включения природной и модифицированной по фосфату дАТФ (дезоксиаденозинтрифосфорная кислота) (слева) и; во время включения 2-тио-дТТФ (справа).
На ФИГ. 6А показана химическая структура нуклеотидной модификации γ-ANS.
На ФИГ. 6Б показан сигнал FRET (резонансный перенос энергии флуоресценции) от полимеразы, перерабатывающей смесь природных (дАТФ) и γ-ANS модифицированных нуклеотидов (дТТФ) (дезокситимидинтрифосфорная кислота). Продолжительность закрытого состояния с γ-ANS дТТФ более чем в 10 раз превышает продолжительность с природным нуклеотидом, обеспечивая определение идентичности основания.
На ФИГ. 7А и ФИГ. 7Б показана комбинация параметров, которую можно использовать для уникальной идентификации четырех разных типов нуклеотидов, включенных в нуклеиновую кислоту во время реакции секвенирования с использованием полимеразы, присоединенной к SWNT FET. Как показано, модифицированные нуклеотиды, которые объединяют инвертирование полярности и кинетические модификации, могут кодировать четыре разных основания.
На ФИГ. 8А и ФИГ. 8Б показана схема секвенирования, где в любое время полимераза находится в контакте со смесью трех природных и одного модифицированного дНТФ (дезоксинуклеотидтрифосфат). Выравнивание кривых тока для четырех разных прогонов обеспечивает уникальную идентификацию всех четырех оснований ДНК.
На ФИГ. 9А и ФИГ. 9Б показана схема секвенирования, где в любое время полимераза находится в контакте со смесью двух природных и двух модифицированных дНТФ. Выравнивание кривых тока для двух разных прогонов обеспечивает уникальную идентификацию четырех оснований ДНК.
На ФИГ. 10 показана высокопроцессивная полимераза, сконфигурированная для последовательности кольцевой матрицы, как средство увеличения точности и выравнивания кривых тока для «кругов» вокруг матрицы, осуществляемых со смесями дНТФ, имеющими разные аналоги (например, разные модификации нуклеотидов, присутствующие во время разных кругов).
Подробное описание изобретения
Воплощения настоящего раскрытия, в общем, относятся к установке, композициям и способам, полезным для обнаружения одной молекулы, в таких приложениях, как события включения нуклеотидов, обнаруживаемые в методиках секвенирования нуклеиновых кислот. Имеется потребность в улучшенных системах обнаружения, которые обеспечивают длинные считываемые фрагменты при секвенировании, делая это высокопроизводительно. Изложенные в данном документе воплощения изобретения удовлетворяют эту потребность и также дают другие преимущества.
Согласно настоящему раскрытию предложен способ секвенирования нуклеиновых кислот. В данном способе используется катализируемое полимеразой включение нуклеотидов в образующуюся нить нуклеиновой кислоты относительно матрицы нуклеиновой кислоты. Данная полимераза может быть присоединена к сенсору заряда, который обнаруживает события включения нуклеотидов. Для уникальной идентификации разных нуклеотидов в матричной нуклеиновой кислоте может быть использован один или более чем один тип неприродного нуклеотида, каждый из которых дает уникальные сигнатуры на сенсоре заряда.
В некоторых воплощениях один или более чем один неприродный нуклеотид, который присутствует в смеси, будет давать изменение сигнала, имеющее инвертированную полярность по сравнению с другими нуклеотидами в смеси. Альтернативно или дополнительно, один или более чем один неприродный нуклеотид, который используется в смеси, будет давать задержку во включении нуклеотидов или пониженную скорость включения. Альтернативно или дополнительно, один или более чем один неприродный нуклеотид, который используется в данном способе, будет давать значимо измененную высоту сигнала. Данные параметры сигнала могут обнаруживаться для того, чтобы различать нуклеотиды в матричной нуклеиновой кислоте, которой комплементарны неприродные нуклеотиды, во время полимеразной реакции.
В конкретных воплощениях неприродная группировка или модификация, которая присутствует в неприродном(ных) нуклеотиде(дах), может давать изменение конформации полимеразы (по сравнению с конформацией, производимой нуклеотидом, у которого отсутствует данная группировка или модификация), давая, посредством этого, уникальную сигнатуру в одном или более чем одном параметре сигнала, детектируемого сенсором заряда, к которому присоединена полимераза. Типичные параметры сигнала включают продолжительность сигнала, высоту сигнала, время увеличения сигнала, время уменьшения сигнала, полярность сигнала, шум сигнала и тому подобное, но не ограничиваются ими.
В некоторых воплощениях данного способа используется смесь четырех разных типов нуклеотидтрифосфатов, в которой один тип нуклеотидтрифосфата присутствует в существенно меньшем количестве или концентрации (т.е. нуклеотид «с низким содержанием») по сравнению с другими тремя типами (т.е. нуклеотиды «с высоким содержанием»). В результате, включение нуклеотида с низким содержанием будет обнаруживаться как относительная задержка или пониженная скорость включения. Эту сигнатуру можно использовать для идентификации положения в матрице типа нуклеотида, который является комплементарным нуклеотиду с низким содержанием. Для той же самой матрицы можно завершать несколько прогонов секвенирования, где каждый прогон проводится с отличным нуклеотидом в состоянии нуклеотида «с низким содержанием». Картины сигналов из разных прогонов можно сравнивать для определения последовательности матрицы.
Приведенное выше воплощение иллюстрируется в показателях смеси 3 нуклеотидтрифосфата «с высоким содержанием» - 1 «с низким содержанием». Также можно применять другие смеси, включающие, например, смесь 1 «с высоким содержанием» - 3 «с низким содержанием» или смесь 2 «с высоким содержанием» - 2 «с низким содержанием». Дополнительные полезные конфигурации смесей в отношении использования нуклеотидов, имеющих другие концентрации, излагаются в патенте США №7556922, который включен в данный документ посредством ссылки.
В конкретных воплощениях матричная нуклеиновая кислота является кольцевой. Применение кольцевой матрицы может давать удобный формат для повторных прогонов секвенирования, так как полимераза не должна заменяться и, вместо этого, может делать многочисленные круги вокруг матрицы, причем каждый круг представляет собой, по существу, повторное секвенирование матрицы.
В некоторых воплощениях, в которых используется кольцевая матрица, полимераза может включать 5'-экзонуклеазную активность для отщепления нити нуклеиновой кислоты, которая подлежит вытеснению из кольцевой матрицы при многократном продвижении полимеразы вокруг матрицы.
Независимо от того, является ли матрица линейной или кольцевой, для разных прогонов секвенирования, проводимых на той же самой матрице, можно использовать отличный праймер. Можно конструировать разные праймеры для гибридизации в разных положениях на матрице. Каждый из прогонов, как таковой, будет начинаться в отличном положении на матрице, но может иметь место значительное перекрывание между частями матрицы, которые секвенируются в каждом прогоне. Картины сигналов, полученных в результате каждого прогона, можно выравнивать на основе ожидаемых сайтов начала для каждого прогона для того, чтобы облегчать распознавание последовательности и проверку ошибок.
Сенсор заряда, который используется в способе, изложенном в данном документе, может обнаруживать включение нуклеотида полимеразой посредством полевого эффекта с использованием SWNT FET, FET на основе нанопровода, плавникового полевого транзистора (FinFET, fin-shaped field effect transistor), трехворотного FET, туннельного FET или другого устройства, чувствительного к полю. В некоторых воплощениях сенсор является магнитным, электрохимическим или наноэлектромеханическим.
Будет понятно то, что термины, используемые в данном документе, принимают их обычное значение, если не определено иначе. Примеры нескольких терминов, используемых в данном документе, и их определения изложены ниже.
Термин «чип» в том виде, в котором он используется в данном документе, относится к популяции сенсоров заряда или молекул, которые присоединены к одному или более чем одному твердофазному субстрату, таким образом, что данные сенсоры заряда или молекулы могут быть отличены друг от друга согласно их относительному положению. Чип может включать разные молекулы, каждая из которых расположена в отличном адресуемом положении (например, на разных сенсорах заряда) на твердофазном субстрате. В качестве альтернативы, чип может включать отдельные твердофазные субстраты, каждый из которых несет отличную молекулу, где разные зондовые молекулы могут быть идентифицированы согласно положениям твердофазных субстратов на поверхности, к которой присоединяются твердофазные субстраты. Молекулы чипа могут представлять собой праймеры на основе нуклеиновых кислот, зонды на основе нуклеиновых кислот, матрицы на основе нуклеиновых кислот или ферменты, модифицирующие нуклеиновые кислоты, такие как полимеразы.
Термин «присоединенный» в том виде, в котором он используется в данном документе, относится к состоянию двух предметов, которые сцеплены, пристегнуты, прилипают, соединяются или связываются друг с другом. Например, компонент реакции, такой как полимераза, может быть присоединен к твердофазному компоненту, такому как сенсор заряда, посредством ковалентной или нековалентной связи. Ковалентная связь характеризуется тем, что между атомами обобществляются пары электронов. Нековалентная связь представляет собой химическую связь, которая не включает обобществление пар электронов, и она может включать, например, водородные связи, ионные связи, вандерваальсовы силы, гидрофильные взаимодействия и гидрофобные взаимодействия.
Подразумевается то, что термин «сенсор заряда» в том виде, в котором он используется в данном документе, означает обнаруживающее устройство, которое преобразует пертурбации на его поверхности или в окружающем его электрическом поле в электрический сигнал. Например, сенсор заряда может преобразовать в электрический сигнал прибытие или убытие компонента реакции. Сенсор заряда также может преобразовать в электрический сигнал взаимодействия между двумя компонентами реакции или конформационные изменения в одном компоненте реакции. Типичный сенсор заряда представляет собой полевой транзистор (FET), такой как FET на основе одностенной углеродной нанотрубки (SWNT), FET на основе кремниевого нанопровода (SiNW), FET на основе графеновой наноленты (и родственные FET на основе наноленты, изготовленные из двумерных материалов, таких как MoS2, силицен и т.д.), туннельный FET (TFET) и устройства с использованием эффекта крутого подпорогового наклона (см., например, Swaminathan et al., Proceedings of the 51st Annual Design Automation Conference on Design Automation Conference, pg 1-6, ISBN: 978-1-4503-2730-5 (2014) и lonescu et al., Nature 479, 329-337 (2011)). Примеры сенсоров FET и SWNT, которые можно использовать в способах и приборе по настоящему раскрытию, изложены в публикации заявки на патент США №2013/0078622 А1, которая включена в данный документ посредством ссылки.
Термин «конформационное изменение сигнала» в том виде, в котором он используется в данном документе, означает появление, исчезновение или изменение обнаруживаемого сигнала от молекулы в ответ на изменение структуры, формы или организации частей данной молекулы. Например, изменение сигнала может быть обусловлено изменением во взаимодействии метки с первой частью молекулы с взаимодействием со второй частью молекулы.
Термин «конформационно меченая» при использовании по отношению к молекуле в том виде, в котором он используется в данном документе, означает имеющую по меньшей мере одну метку, которая отвечает на изменение структуры молекулы, изменение формы молекулы или изменение организации частей молекулы. Например, молекула может представлять собой полимеразу, обратную транскриптазу, экзонуклеазу или другой фермент, модифицирующий нуклеиновую кислоту. Части молекулы, например, могут представлять собой атомы, которые меняют относительное расположение из-за вращения около одной или более чем одной химической связи, происходящего в молекулярной структуре между атомами. Части молекулы могут представлять собой домены макромолекулы, такие как общеизвестные домены в релевантной области. Например, полимеразы включают домены, именуемые пальцем, ладонью и большим пальцем. В случае белков данными частями могут быть области вторичной, третичной или четвертичной структуры. Метка(ки) может(гут) быть присоединена(ны) к молекуле, например, посредством ковалентной связи. Однако метка(ки) не обязательно должна(ны) быть присоединена(ны) к молекуле, находясь, например, поблизости от молекулы. В конкретном воплощении метка не присоединяется к реагенту или продукту молекулы, такому как нуклеотид или нуклеиновая кислота.
Термин «отличный» при использовании в отношении нуклеиновых кислот в том виде, в котором он используется в данном документе, означает, что нуклеиновые кислоты имеют нуклеотидные последовательности, которые не являются одинаковыми друг с другом. Две или более чем две отличные нуклеиновые кислоты могут иметь нуклеотидные последовательности, которые отличаются по всей их длине. В качестве альтернативы, две или более чем две отличные нуклеиновые кислоты могут иметь нуклеотидные последовательности, которые отличаются по значительной части их длины. Например, две или более чем две отличные нуклеиновые кислоты могут иметь целевые части нуклеотидной последовательности, которые отличаются для двух или более чем двух молекул, также имея универсальную часть последовательности, которая является одинаковой на двух или более чем двух молекулах. Термин «отличный», аналогичным образом, может применяться к другим молекулам, таким как полимеразы и ферменты, модифицирующие нуклеиновые кислоты.
Подразумевается то, что термин «отличимое состояние» при использовании в отношении конкретного типа нуклеотидтрифосфата в смеси нуклеотидтрифосфатов в том виде, в котором он используется в данном документе, означает то, что конкретный тип нуклеотидтрифосфата имеет характеристику или свойство, которое уникальным образом проявляется при условиях обнаружения по сравнению с другими нуклеотидтрифосфатами. Типичные отличимые состояния включают присутствие в количестве или концентрации, которые существенно меньше, чем количество или концентрация других типов нуклеотидтрифосфатов в смеси, присутствие в количестве или концентрации, которые существенно больше, чем количество или концентрация других типов нуклеотидтрифосфатов в смеси, имеет химическую группировку или модификацию, которая не присутствует на других типах нуклеотидтрифосфатов в смеси, или не имеет химической группировки, или модификации, которая присутствует на других типах нуклеотидтрифосфатов в смеси, но не ограничиваются ими. Отличимое состояние может проявляться, когда тип нуклеотида взаимодействует с полимеразой.
Подразумевается то, что термин «каждый» при использовании в отношении набора предметов в том виде, в котором он используется в данном документе, идентифицирует индивидуальный предмет в наборе, но не обязательно относится к каждому предмету в наборе. Могут иметь место исключения, если прямое раскрытие или контекст явно диктуют иное.
Подразумевается то, что термин «метка» при использовании по отношению к компоненту реакции в том виде, в котором он используется в данном документе, означает обнаруживаемый компонент реакции или обнаруживаемую группировку компонента реакции. Полезной меткой является метка на основе заряда, которая может обнаруживаться сенсором заряда. Метка может быть внутренней по отношению к компоненту реакции, который подлежит обнаружению (например, заряженная аминокислота полимеразы), или метка может быть внешней по отношению к компоненту реакции (например, не встречающаяся в природе модификация аминокислоты).
Подразумевается то, что термин «неприродный» при использовании в отношении группировки молекулы в том виде, в котором он используется в данном документе, относится к группировке, которая не прикрепляется к молекуле в ее природном окружении или в биологической системе без вмешательства человека, технического вмешательства. Типично неприродные группировки представляют собой синтетические модификации молекул, которые делают молекулы структурно или химически отличными от немодифицированной молекулы или от молекул, имеющих природные модификации. Подразумевается то, что термин «неприродный» при использовании в отношении аналога, используемого для процесса, в том виде, в котором он используется в данном документе, означает аналог, который не находится в природном окружении, где происходит процесс. Типично неприродные аналоги представляют собой синтетические аналоги, которые структурно или химически отличаются от других типов молекул в классе, к которому принадлежит аналог. Будет понятно то, что молекула может быть неприродной из-за отсутствия группировки, которая находится в природном аналоге данной молекулы.
Подразумевается то, что термин «нуклеиновая кислота» в том виде, в котором он используется в данном документе, согласуется с его применением в данной области, и он включает встречающиеся в природе нуклеиновые кислоты или их функциональные аналоги. Особенно полезные функциональные аналоги способны гибридизоваться с нуклеиновой кислотой в зависимости от последовательности или могут применяться в качестве матрицы для репликации конкретной нуклеотидной последовательности. Встречающиеся в природе нуклеиновые кислоты обычно имеют остов, содержащий фосфодиэфирные связи. Структура аналога может иметь альтернативную связь в остове, включающую любую из целого ряда связей, известных в данной области, как, например, пептидная нуклеиновая кислота (ПНК) или запертая нуклеиновая кислота (ЗНК). Встречающиеся в природе нуклеиновые кислоты обычно имеют сахар дезоксирибозу (например, находящийся в дезоксирибонуклеиновой кислоте (ДНК)) или сахар рибозу (например, находящийся в рибонуклеиновой кислоте (РНК)).
Нуклеиновая кислота может содержать любую из целого ряда группировок аналогов Сахаров, которые известны в данной области. Нуклеиновая кислота может включать природные или неприродные основания. В данном отношении природная дезоксирибонуклеиновая кислота может иметь одно или более чем одно основание, выбранное из группы, состоящей из аденина, тимина, цитозина или гуанина, и рибонуклеиновая кислота может иметь одно или более чем одно основание, выбранное из группы, состоящей из урацила, аденина, цитозина или гуанина. Полезные неприродные основания, которые могут быть включены в нуклеиновую кислоту, известны в данной области.
Подразумевается то, что термин «нуклеотид» в том виде, в котором он используется в данном докменте, включает природные нуклеотиды, их аналоги, рибонуклеотиды, дезоксирибонуклеотиды, дидезоксирибонуклеотиды и другие молекулы, известные как нуклеотиды. Данный термин может использоваться для названия мономерного звена, которое присутствует в полимере, например, для идентификации субъединицы, присутствующей в нити ДНК или РНК. Данный термин также может использоваться для названия молекулы, которая не обязательно присутствует в полимере, например, молекулы, которая способна к включению в полинуклеотид полимеразой способом, зависимым от матрицы. Данный термин может относиться к нуклеозидному звену, имеющему, например, 0, 1, 2, 3 или более фосфатов на 5'-углероде. Например, особенно полезными могут быть тетрафосфатные нуклеотиды и пентафосфатные нуклеотиды. Типичные природные нуклеотиды включают, без ограничения, АТФ, УТФ, ЦТФ, ГТФ, АДФ, УДФ, ЦДФ, ГДФ, АМФ, УМФ, ЦМФ, ГМФ, дАТФ, дТТФ, дЦТФ, дГТФ, дАДФ, дТДФ, дЦДФ, дГДФ, дАМФ, дТМФ, дЦМФ и дГМФ.
Неприродные нуклеотиды включают нуклеотиды, которые не присутствуют в природной биологической системе или по существу не включаются в полинуклеотиды полимеразой в ее природном окружении, например, в нерекомбинантной клетке, которая экспрессирует данную полимеразу. Особенно полезные неприродные нуклеотиды включают нуклеотиды, которые включаются в полинуклеотидную нить плимеразой со скоростью, которая существенно быстрее или медленнее, чем скорость, с которой другой нуклеотид, такой как природный нуклеотид, который образует пары оснований с таким же комплементарным основанием, что и по правилу Уотсона-Крика, включается в нить полимеразой. Например, неприродный нуклеотид может включаться со скоростью, которая по меньшей мере в 2 раза отличается, в 5 раз отличается, в 10 раз отличается, в 25 раз отличается, в 50 раз отличается, в 100 раз отличается, в 1000 раз отличается, в 10000 раз или более отличается по сравнению со скоростью включения природного нуклеотида. Неприродный нуклеотид может иметь способность дополнительно удлиняться после включения в полинуклеотид. Примеры включают аналоги нуклеотидов, имеющие 3'-гидроксил, или аналоги нуклеотидов, имеющие обратимую терминаторную группировку в положении 3', которая может быть удалена для обеспечения дополнительного удлинения полинуклеотида, который включил аналог нуклеотида. Примеры обратимых терминаторных группировок, которые можно использовать, описываются, например, в патентах США №7427673; 7414116 и 7057026 и в публикациях РСТ WO 91/06678 и WO 07/123744, каждая из которых включена в данный документ посредством ссылки. Будет понятно то, что в некоторых воплощениях аналог нуклеотида, имеющий 3'-терминаторную группировку или не имеющий 3'-гидроксил (такой как дидезоксинуклеотидный аналог), может использоваться при условиях, когда полинуклеотид, который включил аналог нуклеотида, далее не удлиняется. В некоторых воплощениях нуклеотид(ды) не будет(дут) включать обратимую терминаторную группировку, или нуклеотид(ды) не будет(дут) включать необратимую терминаторную группировку, или нуклеотид(ды) вообще не будет(дут) включать какую-либо терминаторную группировку. Аналоги нуклеотидов с модификациями в 5' положении также являются полезными.
Термин «твердая подложка» в том виде, в котором он используется в данном документе, относится к твердому субстрату, который является нерастворимым в водной жидкости. Данный субстрат может быть непористым или пористым. Данный субстрат возможно может иметь способность поглощать жидкость (например, из-за пористости), но типично будет достаточно жестким так, что субстрат по существу не набухает при поглощении жидкости и по существу не сжимается при удалении жидкости посредством сушки. Непористая твердая подложка обычно является непроницаемой для жидкостей или газов. Типичные твердые подложки включают стекло и модифицированное или функционализированное стекло, пластмассы (включающие акриловые соединения, полистирол и сополимеры стирола и других веществ, полипропилен, полиэтилен, полибутилен, полиуретаны, Тефлон™, циклические олефины, полиимиды и т.д.), нейлон, керамические материалы, смолы, Зеонор, диоксид кремния или материалы на основе диоксида кремния, включающие кремний и модифицированный кремний, углерод, металлы, неорганическое стекло, пучки оптических волокон и полимеры, но не ограничиваются ими. Особенно полезные твердые подложки для некоторых воплощений располагаются в пределах устройства проточной ячейки.
Термин «тип» (или «вид») в том виде, в котором он используется в данном документе, используется для идентификации молекул, которые имеют одинаковую химическую структуру. Например, смесь нуклеотидов может включать несколько молекул дЦТФ. Будет понятно то, что молекулы дЦТФ принадлежат к тому же самому типу или виду по отношению друг к другу. Аналогично, индивидуальные молекулы ДНК, которые имеют одинаковую последовательность нуклеотидов, принадлежат к тому же самому типу или виду.
Воплощения, изложенные ниже и процитированные в формуле изобретения, можно понять, принимая во внимание приведенные выше определения.
Способы и устройство, изложенные в данном документе, могут давать длинные считываемые фрагменты при секвенировании нуклеиновой кислоты; быстросчитываемые фрагменты; высокую производительность для секвенирования и масштабируемую платформу для секвенирования. В некоторых воплощениях любые компромиссы в точности одиночных считываемых фрагментов могут быть уменьшены проведением множественного перекрывания считываемых фрагментов из-за способности изложенных в данном документе способов и устройства обеспечивать высокую производительность в числе параллельно осуществляемых считываний.
Согласно настоящему раскрытию предложен способ секвенирования нуклеиновых кислот. Данный способ может включать следующие стадии: (а) обеспечение полимеразы, присоединенной к сенсору заряда на твердой подложке; (б) приведение полимеразы в контакт со смесью нуклеотидтрифосфатов, где данная смесь включает разные типы нуклеотидтрифосфатов, в которой первый тип нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов в смеси, в которой второй тип нуклеотидтрифосфатов не находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов в смеси, и где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты; (в) обнаружение включения нуклеотидов посредством сенсора заряда, где первый тип нуклеотидтрифосфатов дает сигнал, который является уникальным по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами в смеси, получая, посредством этого, первую картину сигнала; (г) повторение стадий (б) и (в) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов, в которой второй тип нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов во второй смеси, и в которой первый тип нуклеотидтрифосфатов не находится в отличимом состоянии по сравнению с другими типами нуклеотидтрифосфатов во второй смеси, получая, посредством этого, вторую картину сигнала; и (д) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты.
Типичный сенсор показан на ФИГ. 1. Здесь полимераза создает реакционный сайт, где нуклеотиды могут включаться в матрицу ДНК с праймером. Данная полимераза присоединена к сенсору заряда (например, к одностенной углеродной нанотрубке (SWNT)). Данное устройство обеспечивает одномолекулярную чувствительность. Изменения распределения заряда в реакционном сайте (например, конформационные изменения полимеразы, включение нуклеотида, прибытие или убытие заряженных меток и т.д.) передаются на затвор и могут обнаруживаться.
Альтернативой конфигурации, показанной на ФИГ. 1, является присоединение полимеразы к сенсору заряда через линкер. Типичное воплощение показано на ФИГ. 2. Вкратце, полимераза 1 иммобилизуется на затворе 5 полевого транзистора (FET) на основе кремниевого нанопровода 2 с использованием линкера 3. Возможно линкер 3 может представлять собой нить проводящего полимера, на что указывает положительный заряд 6 на конце линкера, который является ближним к полимеразе, и отрицательный заряд 7 на конце линкера, который является удаленным от полимеразы и присоединенным к затвору 5. оцДНК (одноцепочечная ДНК), подлежащая секвенированию, связывается с полимеразой 1 после введения в раствор, наряду с нуклеотидами и другими реактивами. По мере синтеза комплементарной нити, генерируются нарушения в распределении заряда поблизости от FET 2 либо в результате конформационных изменений полимеразы 1, либо из-за присутствия нуклеотидов. Данные модификации в распределении заряда воспринимаются FET на основе нанопровода 2 и обнаруживаются в виде модуляции крутизны тока FET.
Несмотря на то, что в приведенных выше примерах описаны сенсоры заряда на основе SWNT и FET, можно использовать любой из целого ряда сенсоров. Полезные сенсоры заряда включают аналитические устройства, которые могут включать компонент реакции в непосредственный пространственный контакт с преобразующим элеметом таким образом, чтобы обеспечивать быстрое и удобное превращение событий реакции в обнаруживаемые сигналы. Устройства, основанные на полевых транзисторах (FET), могут непосредственно преобразовывать взаимодействия между компонентами реакции (например, полимеразами) и поверхностью транзистора в считываемые электрические сигналы. В стандартном FET ток идет по токопроводящей дорожке (каналу), которая соединяется с двумя электродами (источником и стоком). Проводимость канала между источником и стоком включается и выключается третьим электродом (затвором), который может быть емкостно-связанным через тонкий диэлектрический слой.
В конкретных воплощениях FET сконфигурированы для осуществления одномолекулярного обнаружения. Более конкретно, данные сенсоры заряда могут быть сконфигурированы для отслеживания динамики одномолекулярной реакции. В устройстве или способе, изложенных в данном документе, можно использовать любой тип проводящего канала, который обычно находится в полевых транзисторах. Типичные проводящие каналы образуются из металлов, оксидов металлов, полупроводников или проводников нанометрового масштаба, таких как нанопровода, или графена.
Особенно полезными сенсорами заряда для одномолекулярного обнаружения являются одностенные углеродные нанотрубки (SMNT). См., например, Star et al., Nano. Lett. 3, 459 (2003); Star et al., Org. Lett. 6, 2089 (2004); Besterman et al., Nano. Lett. 3, 727 (2003); Gruner, Anal. Biooanal. Chem. 384, 322 (2005); Chen et al. Proc. Natl. Acad. Sci. U.S.A. 100, 4984 (2003) и публикацию заявки на патент США №2013/0078622 А1, каждая из которых вкючена в данный документ посредством ссылки. SWNT представляют собой исключительно маленькие проводники, типично порядка примерно 1 нанометра в диаметре.
SWNT может быть покрыта наночастицами из хемоселективного полимера, металла или оксида металла, или компонентами реакции, подобными белкам, нуклеиновым кислотам или антителам. См., например, Besterman et al., Nano. Lett. 3, 727 (2003) и Chen et al. Proc. Natl. Acad. Sci. U.S.A. 100, 4984 (2003). Одиночные полимеразы могут быть присоединены к данным SWNT и другим сенсорам заряда с использованием способов, изложенных в данном документе.
В некоторых воплощениях одна полимераза может быть присоединена к сенсору заряда посредством создания одного единичного ковалентного дефекта на сенсоре заряда, например, с использованием методик, изложенных в Goldsmith et al. Science 315, 77 (2007), которая включена в данный документ посредством ссылки. Например, может быть произведена SWNT, имеющая единичный дефект таким образом, что можно использовать целый ряд химических способов для селективного связывания одной полимеразы с реакционноспособным сайтом дефета без покрытия остальной части SWNT дополнительными полимеразами. SWNT также могут быть присоединены к полимеразе некрвалентными способами, например, с использованием методик, изложенных в Chen et al, J. Am. Chem. Soc. 123, 3838 (2001), которые включены в данный документ посредством ссылки.
Данные способы могут быть модифицированы, как изложено в данном документе, для надежного нековалентного связывания одной полимеразы с SWNT.
SWNT представляют собой полупроводники с электронными запрещенными зонами, которые могут варьировать от 1 электронвольта до по существу нуля. SWNT являются полезными в качестве проводящих каналов, так как из проводов SWNT любого типа, с затворными электродами или без них и на стеклянных, пластмассовых или кремниевых субстратах, могут быть изготовлены одномолекулярные сенсорные устройства. Полезные SWNT и их конфигурации для обнаружения одной молекулы изложены в публикации заявки на патент США №2013/0078622 А1, которая включена в данный документ посредством ссылки.
Другие сенсоры заряда, которые могут быть модифицированы для применения в устройстве или способе, изложенных в данном документе, включают, без ограничения, FET на основе кремниевого нанопровода (SiNW), FET, сделанные из III-V материалов, кремниевые FinFET, FET на основе графеновой наноленты, а также FET на основе наноленты из других двумерных материалов, таких как MoS2 и силицен, туннельный FET (TFET) и устройства с использованием эффекта крутого подпорогового наклона (см., например, Swaminathan et al., Proceedings of the 51st Annual Design Automation Conference on Design Automation Conference, pg 1-6, ISBN: 978-1-4503-2730-5 (2014) и lonescu et al., Nature 479, 329-337 (2011)).
В конкретных воплощениях в устройстве или способе по настоящему раскрытию в качестве одномолекулярных сенсоров заряда используются FinFET транзисторы с глубоким масштабированием. Сенсоры FinFet выигрывают от технологии, уже разрабатываемой ведущими производителями торцевых полупроводников. Кроме того, можно использовать ранее опубликованные компоненты, включающие: (1) компоненты, используемые для иммобилизации лизоцима на CNT (углеродная нанотрубка) для наблюдения процессивности фермента в реальном времени, как описано в Choi et al, Science, 335, 319 (2012), (2) компоненты, используемые для иммобилизации фрагмента Кленова Pol 1 на CNT и наблюдения процессивности ДНК в реальном времени, как описано в Olsen et al, J. Amer. Chem. Soc., 135, 7885 (2013), (3) компоненты, используемые для выяснения механизма передачи в виде подвижных заряженных остатков из-за аллостерического движения белка, как описано в Chi et al, NanoLett 13, 625 (2013), но не ограничивающиеся ими. В настоящих способах также могут использоваться устройство и способы, изложенные в публикации заявки на патент США №2013/0078622 А1. Каждая из приведенных выше ссылок включается в данный документ посредством ссылки.
Не желая быть ограниченными теорией, считается, что движение заряженных остатков на полимеразе, которая находится поблизости от сенсора заряда, будет создавать внешние электрические поля, которые воспринимаются сенсором заряда. Например, заряженные остатки для фрагмента Кленова ДНК-полимеразы I, которые, как считается, вызывают полевые эффекты при нахождении поблизости от точки присоединения полимеразы к SWNT FET, показаны на ФИГ. 3.
На ФИГ. 4А показана диаграмма каталитического цикла полимеразной активности. По мере того как полимераза проходит через ее каталитический цикл, изменения конформации (например, в остатках, показанных на ФИГ. 3, или в других остатках) могут приводить к зависимому от времени кратковременному сигналу, когда включается каждый нуклеотид. На ФИГ. 4Б показана типичная картина сигнала, обнаруженого полимеразой, присоединенной к SWNT FET, во время включения нуклеотида в матричную нуклеиновую кислоту с праймером.
В некоторых воплощениях сигнал от электронного мониторинга конформационных изменений не способен различать основания, например, когда продолжительность и интенсивность модуляций тока, обнаруженных сенсором заряда, не могут быть дифференцированы на основе типа нуклеотида, который добавляется в каждом цикле полимеразы. В таких воплощениях может быть обнаружено число оснований, которые добавляются полимеразой относительно нити матрицы. Также возможно осуществлять проток одного типа нуклеотида за раз и связывать обнаружение присоединения нуклеоида с типом нуклеотида, для которого известно, что он находится в контакте с полимеразой. Однако в других воплощениях желательно достигать различения оснований для полимераз, которые обнаруживаются сенсорами заряда в присутствии нескольких разных типов нуклеотидов. Преимуществами применения смесей разных типов нуклеотидов, в отличие от одного типа нуклеотидов, являются более быстрый и рентабельный анализ последовательности (например, благодаря меньшему числу жидкостных стадий) и повышенная точность секвенирования (например, из-за меньшей встречаемости ошибок, когда полимераза имеет доступ к более полному репертуару типов нуклеотидов).
Альтернативные воплощения могут быть сконфигурированы для различения разных типов нуклеотидов на основе обнаружения характерных параметров сигнала. Одним таким параметром сигнала является полярность изменений сигнала, обнаруженная при включении конкретного типа нуклеотидтрифосфата в образующуюся нуклеиновую кислоту. Например, первый тип нуклеотида может давать положительное изменение полярности сигнала при включении полимеразой в образующуюся нить нуклеиновой кислоты, и это можно отличать от отрицательного изменения полярности сигнала, которое производится при включении полимеразой второго типа нуклеотида в образующуюся нить нуклеиновой кислоты.
Нуклеотидтрифосфаты могут включать неприродные группировки, которые влияют на наблюдаемую полярность изменения сигнала при их включении в образующуюся нить нуклеиновой кислоты посредством полимеразы, присоединенной к сенсору заряда. В конкретных воплощениях неприродная группировка может давать взаимодействие с полимеразой, которое является отличимым от того взаимодействия, которое полимераза имеет с другими нуклеотидтрифосфатами, у которых отсутствует данная группировка. Например, природные нуклеотиды дезоксиаденозинтрифосфат (дАТФ), дезокситимидинтрифосфат (дТТФ), дезоксицитозинтрифосфат (дЦТФ) и дезоксигуанозинтрифосфат (дГТФ) дают сигналы одинаковой полярности при взаимодействии с полимеразой, присоединенной к сенсору заряда, как и несколько известных аналогов нуклеотидов. Можно использовать смесь, в которой один или более чем один нативный нуклеотидтрифосфат заменяется аналогом, имеющим неприродную группировку, которая изменяет полярность сигнала отличимым способом, не имея вредного влияния на способность аналога формировать пару с его когнатным нуклеотидом в нити матрицы во время секвенирования. Тип когнатного нуклеотида может быть отличен от других типов нуклеотидов в матрице на основе уникальной полярности сигнала, которая обнаруживается при включении аналога нуклеотидтрифосфата.
Пример двух типов нуклеотидтрифосфатов, которые дают сигналы противоположной полярности, показан на ФИГ. 5. В частности, альфа-тио-дАТФ может быть включена в образующуюся нить полимеразой, присоединенной к сенсору заряда, с использованием политиминовой матрицы, и результатом является отрицательное изменение полярности сигнала. В отличие от этого, 2-тио-дТТФ при включении той же самой полимеразой, присоединенной к сенсору, относительно полиаденозиновой матрицы будет давать положительное изменение полярности сигнала. Альфа-тио-дАТФ и 2-тио-дТТФ, как таковые, могут быть использованы для различения положений Т и А в матрице с использованием полимеразы, присоединенной к сенсору заряда, как изложено в данном документе. В способе, изложенном в данном документе, могут быть использованы другие аналоги нуклеотидтрифосфатов, которые могут быть различены на основе отличий в полярности изменений сигнала.
Другим параметром сигнала, который может отличаться на основе типа нуклеотидтрифосфата, который включается в образующуюся нить нуклеиновой кислоты полимеразой, присоединенной к сенсору, является скорость или продолжительность во времени события вкючения. На скорость или продолжительность вкючения во времени могут влиять условия реакции или химическая структура нуклеотидтрифосфатов, используемых в реакции. Примером условия реакции, которым можно манипулировать, является относительная концентрация используемых нуклеотидтрифосфатов. Конкретный тип нуклеотидтрифосфата может присутствовать в относительно малом количестве или концентрации, что будет приводить к пониженной скорости включения данного типа нуклеотида или к более продолжительной задержке в его включении (по сравнению с другими типами нуклеотидов). Данное различие будет типично наблюдаться как различие в средней скорости или средней задержке, но также могут наблюдаться другие меры, такие как пороговое значение, минимальное значение или максимальное значение.
Нуклеотидтрифосфаты могут включать неприродные группировки, которые влияют на скорость включения или продолжительность включения во времени. На ФИГ. 6А показана химическая структура γ-ANS модификации нуклеотида, которую можно включать в 5' положении нуклеотидтрифосфата для увеличение продолжительности времени, которое полимераза проводит в закрытом состоянии относительно того же самого нуклеотидтрифосфата, у которого отсутствует 5' модификация. Как показано на ФИГ. 6Б, оптический сигнал, обнаруженный для полимеразы в присутствии смеси природной дАТФ и дТТФ, модифицированного γ-ANS, показывает то, что продолжительность закрытого состояния при использовании дТТФ γ-ANS более чем в 10 раз больше, чем наблюдаемая с природным нуклеотидом. См. публикацию заявки на патент США №2011/0312529 А1 (которая включена в данный документ посредством ссылки).
Способы, в которых используется основанное на времени или кинетическое различение нуклеотидов, могут быть облегчены применением очень быстрого смешивания реактивов на сенсорах заряда в сочетании с обнаружением в реальном времени. Смешивание может происходить в околомиллисекундном масштабе согласно доступному оборудованию на основе метода остановленной струи. Быстрое смешивание реактивов может достигаться с использованием быстрых жидкостных систем, активного или пассивного смешивания и правильного ограничения (например, нависание смеси) реакции для преодоления ограничений посредством диффузии. Особенно полезной является доставка посредством остановленной струи. Доставка посредством остановленной струи обеспечивает доставку жидкости к месту обнаружения с использованием быстрого тока жидкости, с последующей резкой остановкой тока. Жидкость, которая доставляется, типично вытесняет равный объем жидкости из места обнаружения. Жидкость может смешиваться с твердофазным аналитом, таким как полимераза, присоединенная к сенсору заряда. Время задержки для доставки жидкости посредством остановленной струи может составлять, например, меньше, чем 2 миллисекунды (мс). Соответственно, время задержки может быть не дольше, чем 2 мс, 1,5 мс, 1 мс, 0,8 мс, 0,6 мс, 0,5 мс или 0,4 мс. Относительно полезных жидкостных систем с остановленной струей и быстрым смешиванием, см., например, Chance, В. J. Frank. Inst, 229, 613 (1940) и публикацию заявки на патент США №2013/0165328 А1, каждая из которых включена в данный документ посредством ссылки.
Последовательность основанных на времени или кинетических измерений для полимеразы, присоединенной к сенсору заряда, можно использовать для определения последовательности матричной нуклеиновой кислоты, используемой полимеразой для синтеза комплементарной нити. Будет понятно то, что последовательность нити матрицы может быть выведена из последовательности нуклеотидов, включаемых в нить, которая удлиняется. Будет понятно то, что определение последовательности одной нити, как таковое, включает определение последовательности ее комплементарной нити.
В изложенных в данном документе способе или композиции может быть полезным любой из целого ряда видов нуклеотидов. Например, можно использовать встречающиеся в природе нуклеотиды, такие как АТФ, УТФ, ЦТФ, ГТФ, АДФ, УДФ, ЦДФ, ГДФ, АМФ, УМФ, ЦМФ, ГМФ, дАТФ, дТТФ, дЦТФ, дГТФ, дАДФ, дТДФ, дЦДФ, дГДФ, дАМФ, дТМФ, дЦМФ и дГМФ.
Типично в нить ДНК посредством ДНК-полимераз включаются нуклеотиды дНТФ, а в нить РНК посредством РНК-полимераз включаются нуклеотиды НТФ. В конкретных воплощениях нуклеотиды НТФ или их аналоги могут включаться в ДНК ДНК-полимеразой, например, в случаях, когда НТФ или его аналог способен к включению в ДНК ДНК-полимеразой, и когда скорость или продолжительность во времени для перехода ДНК-полимеразы с использованием НТФ или его аналога могут быть отличены от скорости или продолжительности во времени для перехода ДНК-полимеразы с использованием другого нуклеотида. В качестве альтернативы, нуклеотиды дНТФ или их аналоги могут включаться в РНК РНК-полимеразой, например, в случаях, когда дНТФ или его аналог способен к включению в РНК РНК-полимеразой, и когда скорость или продолжительность во времени для перехода РНК-полимеразы с использованием дНТФ или его аналога могут быть отличены от скорости или продолжительности во времени для перехода РНК-полимеразы с использованием другого нуклеотида. Дополнительно нуклеотиды дНТФ или их аналоги могут включаться в ДНК от РНК матрицы посредством обратной транскриптазы, например, в случаях, когда дНТФ или его аналог способен к включению в ДНК от РНК матрицы обратной транскриптазой, и когда скорость или продолжительность во времени для перехода обратной транскриптазы с использованием дНТФ или его аналога могут быть отличены от скорости или продолжительности во времени для перехода обратной транскриптазы с использованием другого нуклеотида. Относительным различием в скорости или продолжительности во времени могут быть относительное увеличение скорости, относительное увеличение продолжительности, относительное уменьшение скорости или относительное уменьшение продолжительности.
Неприродные аналоги нуклеотидов также являются полезными. Особенно полезные неприродные аналоги нуклеотидов включают аналоги, которые дают обнаруживаемо отличную скорость или продолжительность во времени для перехода полимеразы, которые могут быть отличены от скорости или продолжительности во времени для перехода полимеразы с другим нуклеотидом, но не ограничиваются ими. Например, неприродный аналог нуклеотида может полезным образом давать обнаруживаемо отличную скорость или продолжительность во времени для перехода полимеразы, которые могут быть отличены от скорости или продолжительности во времени для того же самого перехода полимеразы с другим нуклеотидом, таким как встречающийся в природе нуклеотид. Типичные аналоги нуклеотидов, которые можно использовать, включают дНТФаЭ, НТФаБ; нуклеотиды, имеющие неприродные нуклеиновые основания, идентифицированные в Hwang et al,. Nucl. Acids Res. 34:2037-2045 (2006) (включена в данный документ посредством ссылки), такие как ICS, 3MN, 7AI, BEN, DM5, ТМ, 2Br, 3Br, 4Br, 2CN, 3CN, 4CN, 2FB, 3FB, ММ1, ММ2 и ММ3; или нуклеотиды, имеющие другие неприродные нуклеиновые основания, такие как нуклеиновые основания, описанные в Patro et al. Biochem. 48:180-189 (2009) (включена в данный документ посредством ссылки), которые включают 2-амино-1-деазапурин, 1-деазапурин, 2-пиридин, гипоксантин, пурин, 6-CI-пурин, 2-амино-дА, 2-аминопурин или 6-CI-2-аминопурин или нуклеотиды, имеющие неприродные нуклеиновые основания, такие как нуклеиновые основания, описанные в Krueger et al. Chem Biol. 16:242-8 (2009) (включена в данный документ посредством ссылки), которые включают изо-Г, изо-Ц, 5SICS, MMO2, Ds, Pa, Fl, FB, dZ, DNB, изостеры тимина, 5-NI, dP, азолкарбоксамид, хА, Im-No, Im-ON, J, А*, Т*, но не ограничиваются ими.
Неприродные аналоги нуклеотидов, имеющие 5' модификации, являются особенно полезными. Неприродный аналог нуклеотида типично будет иметь трифосфат, но может иметь больше или меньше фосфатов. В конкретных воплощениях один или более чем один альфа-фосфат, бета-фосфат или гамма-фосфат неприродного нуклеотида ковалентно присоединен к группировке, отличной от кислорода. Группировка, которая присоединяется к фосфату или присутствует в 5' положении иным способом, может давать отрицательный заряд, положительный заряд, хелатирующую металл активность или иметь большой стерический объем. Типичные группировки включают аминокислоты в форме L-энантиомера или в форме R-энантиомера, такие как гистидин, аспартат, глутамат, триптофан, фенилаланин, метионин, тирозин, цистеин, глицин, аналин или пролин; аминогруппу; хелатированный металл, такой как магний или марганец; метильную группу; галоген, такой как бром, хлор или йод; тиольную группу; электроноакцепторную группу; электронодонорную группу; ароматический амин или алифатический амин, но не ограничиваются ими. Эти и другие группировки могут быть полезными в воплощениях, где они дают взаимодействие с полимеразой или с другим ферментом, модифицирующим нуклеиновую кислоту, которое отличается от взаимодействия, которое фермент имеет с нуклеотидом, у которого отсутстует данная группировка. Присутствие или отсутствие группировки на соответствующем виде нуклеотида, как таковое, может использоваться для различения видов нуклеотидов в способе секвенирования, например, на основе скорости, продолжительности во времени и/или интенсивности изменения конформационного сигнала в ферменте, модифицирующем нуклеиновую кислоту, действующем на виды нуклеотидов.
Состав реакции или способ могут включать один или более чем один вид нуклеотида. Например, состав реакции или способ, используемые для анализа последовательности, могут включать четыре разных вида нуклеотида, способных образовать пары оснований по Уотсону-Крику с четырьмя соответствующими видами нуклеотидов в синтезируемой матрице нуклеиновой кислоты. Конкретные воплощения могут включать по меньшей мере два разных вида нуклеотида, по меньшей мере три разных вида нуклеотида, по меньшей мере четыре разных вида нуклеотида, или более. По меньшей мере два вида нуклеотидов могут представлять собой неприродные аналоги нуклеотидов, по меньшей мере три вида нуклеотидов могут представлять собой неприродные аналоги нуклеотидов, или по меньшей мере четыре вида нуклеотидов могут представлять собой неприродные аналоги нуклеотидов. Таким образом, состав реакции или способ могут включать смесь природных нуклеотидов и неприродных аналогов нуклеотидов. В качестве альтернативы, в составе реакции могут отсутствовать природные нуклеотиды, которая, вместо этого, имеет только неприродные аналоги нуклеотидов. Реакция может проводиться при условиях, в которых только неприродные аналоги нуклеотидов включаются полимеразой в растущую нуклеиновую кислоту.
В некоторых воплощениях состав реакции или способ могут включать виды нуклеотидов, которые образуют пару оснований с не более чем одним видом нуклеотидов в матрице нуклеиновой кислоты. Например, способ может проводиться при условиях, когда разные виды нуклеотидов приводятся в контакт с полимеразой и нуклеиновой кислотой в отдельных последовательных реакциях. В частности, вид нуклеотида, который образует пару оснований с А, может быть добавлен в первой реакции, вид нуклеотида, который образует пару оснований с Ц, может быть добавлен во второй реакции, вид нуклеотида, который образует пару оснований с Т, может быть добавлен в третьей реакции, и вид нуклеотида, который образует пару оснований с Г, может быть добавлен в четвертой реакции. Данные реакции именуются первой, второй, третьей и четвертой просто для иллюстрации того, что реакции являются отдельными, но это не обязательно ограничивает порядок, в котором данные виды могут быть добавлены в способе, изложенном в данном документе. Скорее виды нуклеотидов, которые образуют пару оснований с А, Ц, Т и Г, могут быть добавлены в любом желательном или подходящем порядке для конкретного воплощения способов. Типично в способе секвенирования виды нуклеотидов, которые образуют пару оснований с четырьмя разными видами нуклеотидов в данной матричной нуклеиновой кислоте, добавляются последовательно для завершения цикла данного способа секвенирования. Однако будет понятно, что в некоторых воплощениях можно использовать добавления меньше, чем четырех нуклеотидов. Кроме того, будет понятно то, что можно использовать смеси нуклеотидов, которые образуют пару оснований с более чем одним, но не более чем 2, 3 или 4 видами нуклеотидов. Аналогично, можно использовать смеси нуклеотидов, которые образуют пару оснований с более чем двумя, но не более чем 3 или 4 видами нуклеотидов, или смеси нуклеотидов, которые образуют пару оснований с более чем тремя, но не более чем 4 видами нуклеотидов.
Согласно настоящему раскрытию предложен способ секвенирования нуклеиновой кислоты, который включает следующие стадии: (а) обеспечение полимеразы, присоединенной к сенсору заряда на твердой подложке; (б) приведение полимеразы в контакт со смесью нуклеотидтрифосфатов, где данная смесь включает разные типы нуклеотидтрифосфатов, в которой первые два типа нуклеотидтрифосфатов находятся в первом отличимом состоянии по сравнению со вторыми двумя типами нуклеотидтрифосфатов в смеси, и где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты; (в) обнаружение включения нуклеотидов посредством сенсора заряда, где первые два типа нуклеотидтрифосфатов дают сигнал, который является отличимым от сигналов, продуцируемых вторыми двумя типами нуклеотидтрифосфатов в смеси, получая, посредством этого, первую картину сигнала; (г) повторение стадий (б) и (в) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов, в которой один из первых двух типов нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другим из первых двух типов нуклеотидтрифосфатов во второй смеси, получая, посредством этого, вторую картину сигнала; и (д) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты.
В некоторых воплощениях может использоваться комбинация описанных выше параметров сигнала для различения многих типов оснований в нуклеиновой кислоте, которая секвенируется. Различия в одном или более чем одном параметре можно использовать для различения по меньшей мере двух, трех или четырех разных типов нуклеотидов. В зависимости от используемого(мых) параметра(ров), в конкретном воплощении могут различаться самое большее два или три разных типа нуклетидов.
Пример комбинаторного применения разных параметров можно понять, принимая во внимание матрицу, показанную на ФИГ. 7А, и таблицу истинности, показанную на ФИГ. 7Б. В данном случае четыре разных типа нуклеотидов различаются по нескольким прогонам секвенирования, осуществляемых для той же самой матрицы и на основе комбинации двух разных состояний в изменении полярности сигнала и двух разных состояний в кинетике включения нуклеотидов.
Комбинаторные способы можно использовать для идентификации целого ряда разных типов нуклеотидов в нуклеиновой кислоте, число которых превышает число разных меток, различаемых в прогоне секвенирования. Типичные комбинации состояний и стадий, которые можно использовать для секвенирования, излагаются в публикации заявки на патент США №2013/0079232 А1, которая включена в данный документ посредством ссылки.
В конкретных воплощениях используется стратегия повторного секвенирования той же самой нуклеиновой кислоты много раз, но каждый раз с использованием отличной смеси нуклеотидтрифосфатов. Например, для секвенирования молекулы нуклеиновой кислоты можно полимеразу, присоединенную к сенсору заряда, с использованием смесей дНТФ, содержащих три природных дНТФ и один неприродный аналог дНТФ, который дает уникальную сигнатуру в кривой тока по сравнению с природными дНТФ. Как показано в матрице ФИГ. 8А и таблице истинности ФИГ. 8Б, в первом прогоне могут использоваться природные дАТФ, дТТФ и дГТФ, наряду с неприродным аналогом дЦТФ, который дает уникальную сигнатуру; во втором прогоне могут использоваться природные дЦТФ, дТТФ и дГТФ, наряду с неприродным аналогом дАТФ, который дает уникальную сигнатуру, и т.д. Выравнивание картин тока из четырех разных прогонов обеспечивает определение нуклеотидной последовательности в нити матрицы посредством распознавания картины, устраняя необходимость осуществлять распознавание индивидуальных оснований.
Хотя комбинаторный способ ФИГ. 8 и проиллюстрирован примером в отношении применения 3 природных нуклеотидов и одного неприродного аналога, будет понятно, что для достижения аналогичного результата можно использовать другие комбинации природных и/или неприродных нуклеотидтрифосфатов. Например, не обязательно использовать неприродные нуклеотидтрифосфаты. Скорее можно использовать четыре разных неприродных аналога.
Кроме того, хотя и можно использовать четыре разных прогона через тот же самый отрезок нуклеиновой кислоты, в каждом из которых используется один из четырех уникально обнаруживаемых аналогов нуклеотидтрифосфатов, как проиллюстрировано примером в отношении ФИГ. 8, положения четырех разных типов нуклеотидов в последовательности также можно определять с использованием меньше, чем четырех прогонов. Например, в альтернативной стратегии, как показано в матрице ФИГ. 9А и таблице истинности ФИГ. 9Б, используются только два разных прогона секвенирования через тот же самый отрезок нуклеиновой кислоты. В данном примере первый прогон дает два типа сигналов, причем первый тип сигнала является вырожденным в отношении Г и Ц, и второй тип сигнала является вырожденным в отношении Т и А. Однако второй прогон можно использовать для получения картины сигналов, которая, по сравнению с картиной из первого прогона, будет различать Г и Ц и будет различать Т от А. В частности, первый тип нуклеотида дает конкретный сигнал, который является одинаковым в обоих прогонах (например, Ц на ФИГ. 9), второй тип нуклеотида дает этот конкретный сигнал в первом прогоне, но не во втором прогоне (например, Г на ФИГ. 9), третий тип нуклеотида дает этот конкретный сигнал во втором прогоне, но не в первом прогоне (например, Т на ФИГ. 9), и четвертый тип нуклеотида не дает этот конкретный сигнал ни в одном прогоне. Соответственно, сравнение обоих прогонов будет недвусмысленно идентифицировать все четыре типа нуклеотидов. В данном примере, конкретный тип сигнала может быть получен, например, благодаря неприродной группировке. Данная группировка, как таковая, может присутствовать в дГТФ и дЦТФ, но отсутствовать в дАТФ и дТТФ в первом прогоне; и данная группировка может присутствовать в дТТФ и дЦТФ, но отсутствовать в дГТФ и дАТФ во втором прогоне. Для достижения аналогичного результата в прогонах могут дифференциально применяться другие условия или химические модификации, которые дают характерные параметры сигнала, такие как условия или химические модификации, проиллюстрированные в данном документе примерами в других местах.
Будет понятно то, что уникальные сигнатуры в картинах сигнала могут быть получены из любого из целого ряда параметров сигнала, включая, например, полярность модуляции тока; продолжительность обнаруживаемого состояния полимеразы (например, продолжительность открытого или закрытого состояния полимеразы); амплитуду модуляции тока или любую другую характеристику сигнала, которая обеспечивает уникальную идентификацию модифицированного нуклеотида, например, шум, время увеличения/падения импульса тока или форму фронта и/или спада импульса.
В некоторых воплощениях повторное секвенирование может достигаться с использованием кольцевой матрицы с высокопроцессивной полимеразой. См. ФИГ. 10. Это обеспечивает консенсусное секвенирование, когда случайные ошибки устраняются посредством увеличенной глубины секвенирования. Другим способом является применение праймера для секвенирования, который служит в качестве маркера положения для выравнивания картины. Многочисленные прогоны можно проводить с уникальными праймерами, которые гибридизуются в разных положениях в матрице. Известные положения гибридизации можно использовать при сравнении многочисленных считываемых фрагментов матрицы. Такие способы можно использовать для достижения покрытия в масштабе генома.
Несмотря на то, что несколько воплощений в данном документе было проиллюстрировано примерами в отношении SWNT FET, для специалистов в данной области будет очевидно то, что для обнаружения движения заряженных остатков, в принципе, подходит любое чувствительное к эффекту поля электронное устройство. Например, все из следующих: Si нановолокна (Yi Cui et al, Nanolett, p.149, 2003), нанотрубки из проводящих полимеров (A.L. Briseno et al, Mater. Today p.28, 2008), Fin-FET и трехзатворные FET (X. Huang et al, IEDM, p.67, 1999), и туннельные FET (D. Sarkar, Appl. Phys. Lett. P. 143108, 2012) являются подходящими сенсорами для данного приложения. Эти ссылки включены в данный документ посредством ссылки. Дополнительно, будет понятно то, что предложенные способы различения оснований могут быть расширены и применяться за пределами полевых сенсоров, и являются равным образом приложимыми к магнитным сенсорам, электрохимическим сенсорам, туннельным сенсорам и наноэлектромеханическим сенсорам (NEMS, nano-electromechanical sensors).
В настоящем раскрытии предложены мультиплексные способы, когда параллельно секвенируются несколько разных молекул нуклеиновой кислоты. Множество сенсоров заряда может быть обеспечено в виде чипа сенсоров заряда. Данный чип может включать по меньшей мере 10, 100, 1×103, 1×104, 1×104, 1×104 или более сенсоров заряда. Каждый индивидуальный сенсор заряда может быть расположен в дискретном положении на чипе, которое отделено от других сенсоров заряда на чипе. Например, каждый сенсор заряда может находиться в лунке или углублении в твердой подложке. Данные положения, даже при отделении друг от друга, возможно, могут находиться в жидкостном контакте с основным объемом раствора. При такой конфигурации на чипе сенсоров заряда могут происходить мультиплексные реакции посредством доставки общих реактивов ко всем сенсорам заряда через объемную доставку жидкости. Беря в качестве примера реакции секвенирования нуклеиновых кислот, нуклеотиды могут доставляться к массиву лунок (или других элементов) через основной объем раствора, причем каждая лунка (или другой элемент) вмещает индивидуальную реакцию секвенирования. Доставка нуклеотидов будет приводить к параллельным реакциям секвенирования в лунках (или других элементах).
Сенсор заряда, такой как нанопровод, может иметь размеры, которые составляют меньше, чем 10 нм в ширину и больше, чем 100 нм в длину.
Нанопровод или другой сенсор заряда может быть помещен в лунку, которая имеет размер 10 нм × 10 нм, 50 нм × 100 нм или больше. Например, лунка в пределах которой находится сенсор заряда, может иметь отверстие на поверхности, которое составляет по меньшей мере 100 нм2, 1000 нм2, 5000 нм2, 1×104 нм2 или больше. Электронная схема для считывания сигнала от элемента, воспринимающего заряд, может занимать площадь твердой подложки, которая составляет 1 мкм × 1 мкм или больше.
Плотность чипа может составлять от 2 до вплоть до миллиарда или более разных сайтов реакции на квадратный см. В данном изобретении полезными являются чипы очень высокой плотности, например, чипы, имеющие по меньшей мере примерно 10000000 сайтов реакции/см2, включающие, например, по меньшей мере примерно 100000000 сайтов реакции/см2, 1000000000 сайтов реакции/см2, вплоть до примерно 2000000000 сайтов реакции/см2 или более. Также можно использовать чипы высокой плотности, например, чипы, имеющие в интервале от примерно 100000 сайтов реакции/см2 до примерно 10000000 сайтов реакции/см2. Полезные в данном изобретении чипы умеренной плотности могут иметь интервал от примерно 10000 сайтов реакции/см2 до примерно 100000 сайтов реакции/см2. Чипы низкой плотности обычно имеют меньше, чем примерно 10000 сайтов реакции/см2.
Мультиплексные воплощения, включающие, например, воплощения, в которых используется чип с сенсорами заряда, могут быть сконфигурированы таким образом, что к каждому сенсору заряда присоединяется одна молекула полимеразы. Например, по существу ко всем сенсорам заряда в мультиплексном воплощении может быть присоединена одна полимераза. Кроме того, тот же самый вид полимеразы может быть присоединен к каждому сенсору заряда. Данная конфигурация может обеспечивать ожидаемый однородный выходной сигнал от каждого сенсора заряда, за исключением различий в других компонентах реакции, которые приводятся в контакт с каждым соответствующим сенсором заряда.
В изложенных в данном документе способе или композиции можно использовать любую из целого ряда полимераз, например, ферменты на основе белков, выделенные из биологических систем, и их функциональные варианты. Будет понятно то, что ссылка на конкретную полимеразу, такую как полимеразы, проллюстрированные примерами ниже, включает ее функциональные варианты, если не указано иное. Особенно полезной функцией полимеразы является катализ полимеризации нити нуклеиновой кислоты с использованием существующей нуклеиновой кислоты в качестве матрицы. Другие функции, которые являются полезными, описываются в данном документе в других местах. Примеры полезных полимераз включают ДНК-полимеразы и РНК-полимеразы. Типичные ДНК-полимеразы включают ДНК-полимеразы, которые были классифицированы по структурной гомологии на семейства, идентифицированные как А, В, С, D, X, Y и RT (обратная транскриптаза). ДНК-полимеразы в семействе А включают, например, ДНК-полимеразу Т7, эукариотическую митохондриальную ДНК-полимеразу γ, ДНК-полимеразу (DNA Pol) I Е. coli, полимеразу (Pol) I Thermus aquaticus и полимеразу I Bacillus stearothermophilus. ДНК-полимеразы в семействе В включают, например, эукариотические ДНК-полимеразы α, β и ε; ДНК-полимеразу ζ, ДНК-полимеразу Т4, ДНК-полимеразу Phi29 и ДНК-полимеразу бактериофага RB69. Семейство С включает, например, альфа-субъединицу ДНК-полимеразы III Е. coli. Семейство D включает, например, полимеразы, происходящие от поддомена Euryarchaeota архей. ДНК-полимеразы в семействе X включают, например, эукариотические полимеразы Pol β, pol σ, Pol λ, Pol μ и Pol4 S. cerevisiae. ДНК-полимеразы в семействе Y включают, например, Pol η, Pol йота, Pol каппа, Pol IV Е. coli (DINB) и Pol V Е. coli (UmuD'2C). Семейство RT (обратная транскриптаза) ДНК-полимераз включает, например, обратные транскриптазы ретровирусов и эукариотические теломеразы. Типичные РНК-полимеразы включают вирусные РНК-полимеразы, такие как РНК-полимераза Т7; эукариотические РНК-полимеразы, такие как РНК-полимераза I, РНК-полимераза II, РНК-полимераза III, РНК-полимераза IV и РНК-полимераза V; и РНК-полимеразу архей, но не ограничиваются ими.
Приведенные выше классификации даются для иллюстративных целей. Будет понятно то, что возможны вариации в системе классификации. Например, в по меньшей мере одной системе классификации полимеразы семейства С были классифицированы как подкатегория семейства X. Кроме того, полимеразы могут классифицироваться согласно другим характеристикам, независимо от того, являются ли они функциональными или структурными, которые могут перекрываться или могут не перекрываться со структурными характеристиками, проиллюстрированными выше. Некоторые типичные характеристики излагаются в больших подробностях ниже.
Для некоторых воплощений может быть полезна полимераза, имеющая собственную 3'-5' экзонуклеазную активность, исправляющую ошибки. Полимеразы, которые по существу лишены 3'-5' экзонуклеазной активности, исправляющей ошибки, также являются полезными в некоторых воплощениях, например, в большинстве воплощений секвенирования. Отсутствие экзонуклеазной активности может быть характеристикой дикого типа или характеристикой, которой наделяет вариант или генетически модифицированная структура полимеразы. Например, экзо минус фрагмент Кленова представляет собой мутировавшую версию фрагмента Кленова, у которой отсутствует 3'-5' экзонуклеазная активность, исправляющая ошибки. Фрагмент Кленова и его экзо минус вариант могут быть полезными в способе или композиции, изложенных в данном документе.
Полимеразы могут быть охарактеризованы согласно их процессивности. Полимераза может иметь среднюю процессивность, которая составляет по меньшей мере примерно 50 нуклеотидов, 100 нуклеотидов, 1000 нуклеотидов, 10000 нуклеотидов, 100000 нуклеотидов или более. Альтернативно или дополнительно, средняя процессивность полимеразы, использованной, как изложено в данном документе, может составлять, например, самое большее 1 миллион нуклеотидов, 100000 нуклеотидов, 10000 нуклеотидов, 1000 нуклеотидов, 100 нуклеотидов или 50 нуклеотидов. Полимеразы также могут быть охарактеризованы согласно их скорости процессивности или включения нуклеотидов. Например, многие природные полимеразы могут включать нуклеотиды со скоростью по меньшей мере 1000 нуклеотидов в секунду. В некоторых воплощениях может быть желательной меньшая скорость. Например, можно использовать подходящую полимеразу и условия реакции для достижения средней скорости самое большее 500 нуклеотидов в секунду, 100 нуклеотидов в секунду, 10 нуклеотидов в секунду, 1 нуклеотид в секунду, 1 нуклеотид в 10 секунд, 1 нуклеотид в минуту или медленнее. Как более подробно изложено в других местах в данном документе, можно использовать аналоги нуклеотидов, которые имеют меньшие или большие скорости включения, чем нуклеотиды, встречающиеся в природе. Будет понятно то, что полимеразы из любого из целого ряда источников можно модифицировать для увеличения или уменьшения их средней процессивности или их средней скорости процессивности (например, средней скорости включения нуклеотидов), или и того, и другого. Соответственно, желательная скорость реакции может достигаться с использованием подходящей(щих) полимеразы(раз), аналога(гов) нуклеотида, матрицы(риц) нуклеиновой кислоты и других условий реакции.
В зависимости от воплощения, которое следует использовать, полимераза может быть либо термофильной, либо инактивируемой нагреванием.
Термофильные полимеразы типично являются полезными для условий высокой температуры или в условиях термоциклирования, таких как условия, используемые для методик полимеразной цепной реакции (ПЦР). Примеры термофильных полимераз включают 9°N ДНК-полимеразу, Taq ДНК-полимеразу, ДНК-полимеразу Phusion®, ДНК-полимеразу Pfu, ДНК-полимеразу RB69, ДНК-полимеразу KOD и ДНК-полимеразу VentR®. Большинство полимераз, выделенных из нетермофильных организмов, инактивируются нагреванием. Примерами являются ДНК-полимеразы из фага. Будет понятно то, что полимеразы из любого из целого ряда источников можно модифицировать для увеличения или уменьшения их устойчивости к условиям высокой температуры. Импульсное нагревание (т.е. короткий период времени с повышенной температурой) можно использовать для инактивации одной или более чем одной инактивируемой нагреванием полимеразы на чипе, оставляя термофильные полимеразы в активном состоянии для последующих реакций или для последующих циклов реакции секвенирования.
Полимераза может быть присоединена к сенсору заряда с использованием любого из целого ряда химических способов, известных в данной области. Например, можно использовать химические линкеры. Во многих воплощениях поверхность сенсора заряда представляет собой одну из SiO2, Al2O3, HfO2, Ta2O5. Также можно использовать другие оксиды, например, из группы лантанидов. Также возможными являются нитриды и оксинитриды. Присоединение можно с удобством осуществлять через поверхностный гидроксил. В конкретных воплощениях полимераза (или молекула линкера, которая присоединяется к полимеразе) включает функциональную группу. Линкер может иметь первую функциональную группу, которая взаимодействует с сенсором заряда, и вторую функциональную группу, которая взаимодействует с полимеразой. Типичные первые функциональные группы включают пирен, бензол, циклогексан и 2,3-дихлор-5,6-дициано-1,4-бензохинон. Типичная вторая функциональная группа представляет собой малеимид. Можно использовать другие химические соединения, для которых известно то, что они ковалентно связывают белки с поверхностями или другими группировками, такие как химические соединения, продаваемые Thermo Fisher (Waltham, MA) или Sigma Aldrich (St. Louis, МО). Химическая группа на полимеразе, присоединенная к линкерам, может представлять собой тиольную, амино или карбоксильную группу.
Полимераза может быть присоединена к сенсору заряда нековалентной связью, такой как связь, образующаяся между рецептором и лигандом. Особенно полезными связями являются связи между стрептавидином (или его вариантами, или аналогами) и биотином (или его аналогами), связи между комплементарными нуклеиновыми кислотами, связи между антителами и эпитопами, и тому подобное.
В некоторых воплощениях для присоединения полимеразы к сенсору заряда используется проводящий линкер. Типичные проводящие линкеры включают линкеры, имеющие структуру, которая включает нанесенные политиофен, поли(3,4-этилендиокситиофен), полиацетилены, полипирролы, полианилины, полифлюорены, полифенилены, полипирены, полиазулены, полинафталины, поликарбазолы, полииндолы или полиазепины. Нанесение заряда на данные линкерные структуры может достигаться посредством окисления полимера. Типичные проводящие линкеры и способы их создания излагаются в Vernitskaya et al. Russ. Chem. Rev. 66:443ff (1997); MacDiarmid, Angew. Chem., Int. Ed. 40:2581-2590 (2001) или McNeill et al., Aust. J. Chem. 16:1056-75 (1963), каждая из которых включена в данный документ посредством ссылки.
В конкретных воплощениях твердая подложка может находиться в пределах или быть частью сосуда, такого как лунка, пробирка, канал, кювета, чашка Петри, бутыль или тому подобное. Особенно полезным сосудом является проточная ячейка, например, как описано в US 2010/0111768 А1 или Bentley et al., Nature 456:53-59 (2008), каждая из которых включена в данный документ посредством ссылки. Типичными проточными ячейками являются проточные ячейки, которые имеются в продаже у Illumina Inc. (Сан-Диего, СА). Проточные ячейки являются удобными для доставки объемных реактивов к чипу сенсоров заряда во время реакций секвенирования, проводимых на сенсорах заряда. Циклические процессы, такие как реакции секвенирования нуклеиновых кислот, особенно хорошо подходят для устройств на основе проточных ячеек. Другим особенно полезным сосудом является лунка в многолуночном планшете или планшете для микротитрования.
Нуклеиновые кислоты, используемые в способе или устройстве по настоящему раскрытию, могут состоять из ДНК, РНК или их аналогов. Источником нуклеиновых кислот может быть геномная ДНК, матричная РНК или другие нуклеиновые кислоты из природных источников. В некоторых случаях нуклеиновые кислоты, которые происходят из таких источников, могут быть амплифицированы до применения в способе или композиции в данном изобретении. Можно использовать любую из целого ряда известных методик амплификации, включая полимеразную цепную реакцию (ПЦР), амплификацию по типу катящегося кольца (RCA), амплификацию с множественным вытеснением цепи (MDA) или амплификацию со случайными праймерами (RPA), Но не ограничиваясь ими. Будет понятно, что амплификация нуклеиновых кислот до применения в способе или устройстве, изложенных в данном документе, является опцией. Нуклеиновые кислоты, как таковые, не будут амплифицироваться до применения в некоторых воплощениях способов и композиций, изложенных в данном документе. Нуклеиновые кислоты возможно могут происходить из синтетических библиотек. Синтетические нуклеиновые кислоты могут иметь природные составы ДНК или РНК, или могут быть их аналогами.
Типичные биологические образцы, из которых могут быть получены нуклеиновые кислоты, включают, например, образцы от млекопитающего, такого как грызун, мышь, крыса, кролик, морская свинка, копытное животное, лошадь, овца, свинья, коза, корова, кошка, собака, примат, человек или примат, не являющийся челвеком; растения, такого как Arabidopsis thaliana, кукуруза, сорго, овес, пшеница, рис, канола или соя; водоросли, такой как Chlamydomonas reinhardtii; нематоды, такой как Caenorhabditis elegans; насекомого, такого как Drosophila melanogaster, комара, плодовой мушки, медоносной пчелы или паука; рыбы, такой как данио; рептилии; амфибии, такой как лягушка или Xenopus laevis; Dictyostelium discoideum; гриба, такого как Pneumocystis cahnii, Takifugu rubripes, дрожжей, Saccharamyces cerevisiae или Schizosaccharomyces pombe; или Plasmodium falciparum. Целевые нуклеиновые кислоты также могут быть получены из прокариота, такого как бактерия, Escherichia coli, стафилококки или Mycoplasma pneumoniae; архей; вируса, такого как вирус гепатита С, вирус эбола или вирус иммунодефицита человека, или вироида. Нуклеиновые кислоты могут быть получены из гомогенной культуры или популяции приведенных выше организмов или, в качестве альтернативы, из набора нескольких разных организмов, например, в сообществе или экосистеме.
Нуклеиновые кислоты не обязательно должны происходить из природных источников и, вместо этого, могут синтезироваться с использованием известных методик. Например, зонды для экспрессии генов или зонды для генотипирования могут быть синтезированы и использованы в способах и устройстве, изложенных в данном документе.
В некоторых воплощениях нуклеиновые кислоты могут быть получены в виде фрагментов одной или более чем одной большей нуклеиновой кислоты. Фрагментация может осуществляться с использованием любой из целого ряда методик, известных в данной области, включающих, например, распыление, обработку ультразвуком, химическое расщепление, ферментативное расщепление или приложение физического усилия сдвига. Фрагментация также может происходить в результате применения конкретной методики амплификации, которая дает ампликоны посредством копирования только части большей нуклеиновой кислоты. Например, ПЦР-амплификация дает фрагменты, имеющие размер, определенный длиной нуклеотидной последовательности на исходной матрице, которая располагается между положениями, где гибридизуются фланкирующие праймеры во время амплификации.
Популяция нуклеиновых кислот или их ампликонов может иметь среднюю длину нити, которая является желательной или подходящей для конкретного применения способов или устройства, изложенных в данном документе. Например, средняя длина нити может составлять меньше, чем примерно 100000 нуклеотидов, 50000 нуклеотидов, 10000 нуклеотидов, 5000 нуклеотидов, 1000 нуклеотидов, 500 нуклеотидов, 100 нуклеотидов или 50 нуклеотидов. Альтернативно или дополнительно, средняя длина нити может быть больше, чем примерно 10 нуклеотидов, 50 нуклеотидов, 100 нуклеотидов, 500 нуклеотидов, 1000 нуклеотидов, 5000 нуклеотидов, 10000 нуклеотидов, 50000 нуклеотидов или 100000 нуклеотидов. Средняя длина нити для популяции нуклеиновых кислот или их ампликонов может находиться в интервале между максимальным и минимальным значением, изложенным выше.
В некоторых случаях популяция нуклеиновых кислот может быть получена при условиях или иным образом сконфигурирована так, чтобы иметь максимальную длину для ее членов. Например, максимальная длина для членов, которые используются на одной или более чем одной стадии способа, изложенного в данном документе, или которые присутствуют в конкретной композиции, может составлять меньше, чем примерно 100000 нуклеотидов, 50000 нуклеотидов, 10000 нуклеотидов, 5000 нуклеотидов, 1000 нуклеотидов, 500 нуклеотидов, 100 нуклеотидов или 50 нуклеотидов. Альтернативно или дополнительно, популяция нуклеиновых кислот или их ампликонов может быть получена при условиях или иным образом сконфигурирована так, чтобы иметь минимальную длину для ее членов. Например, минимальная длина для членов, которые используются на одной или более чем одной стадии способа, изложенного в данном документе, или которые присутствуют в конкретной композиции, может составлять больше, чем примерно 10 нуклеотидов, 50 нуклеотидов, 100 нуклеотидов, 500 нуклеотидов, 1000 нуклеотидов, 5000 нуклеотидов, 10000 нуклеотидов, 50000 нуклеотидов или 100000 нуклеотидов. Максимальная и минимальная длина нити для нуклеиновых кислот в популяции может находиться в интервале между максимальным и минимальным значением, изложенным выше.
Во всей данной заявке были процитированы разные публикации, патенты или патентные заявки. Раскрытия данных публикаций во всей их полноте включены тем самым в данную заявку посредством ссылки для того, чтобы более подробно описать современный уровень техники, к которому относится данное изобретение.
В данном документе подразумевается то, что термин «содержащий» является неограничивающим, включающим не только перечисленные элементы, но дополнительно охватывающим любые дополнительные элементы.
Хотя данное изобретение и было описано со ссылкой на примеры, приведенные выше, следует понимать то, что могут быть сделаны разные модификации без отступления от данного изобретения. Соответственно, данное изобретение ограничивается только формулой изобретения.

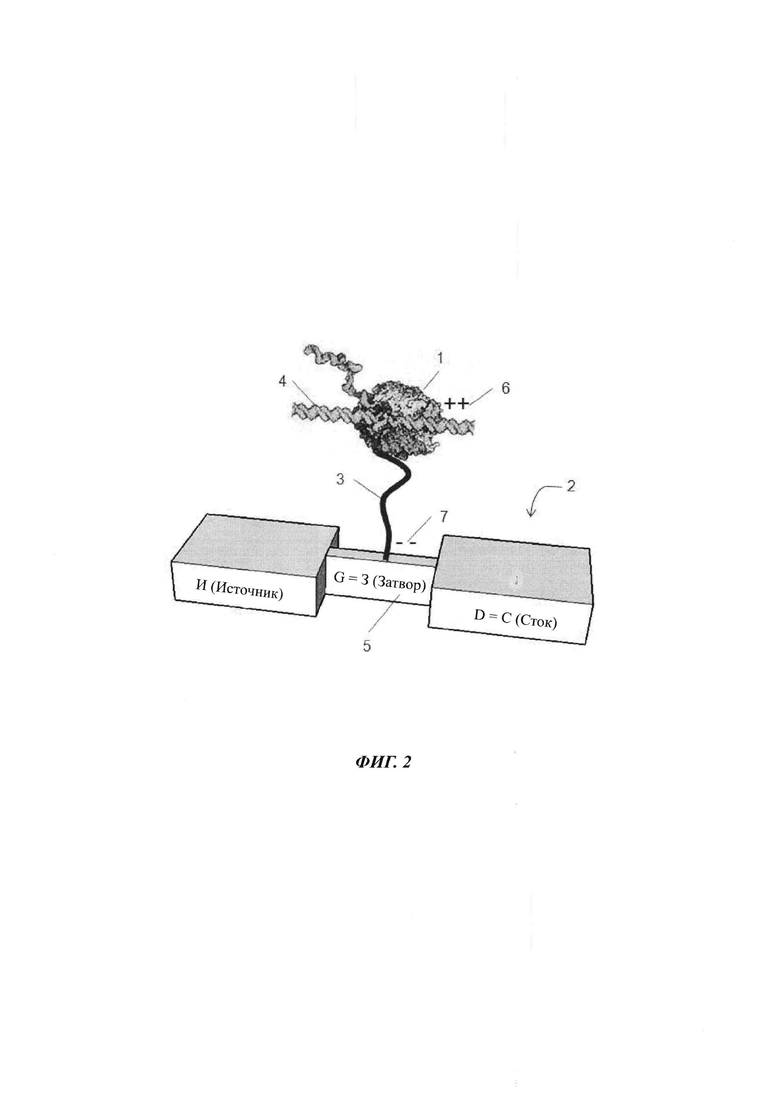
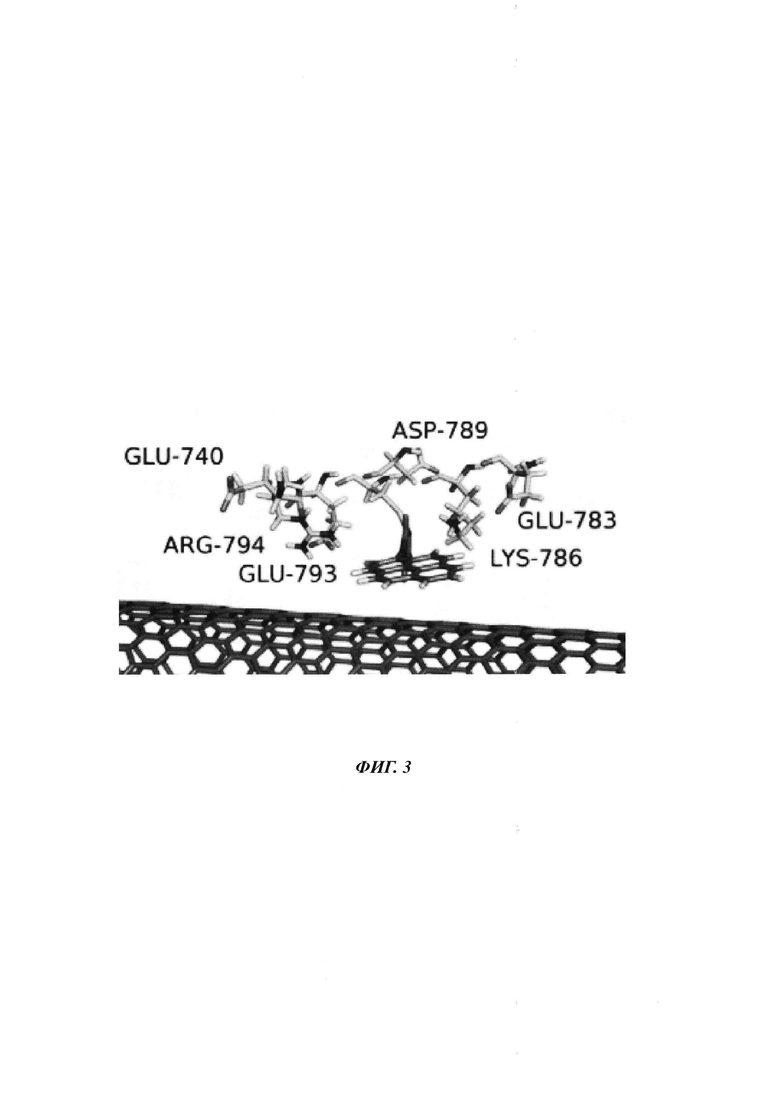
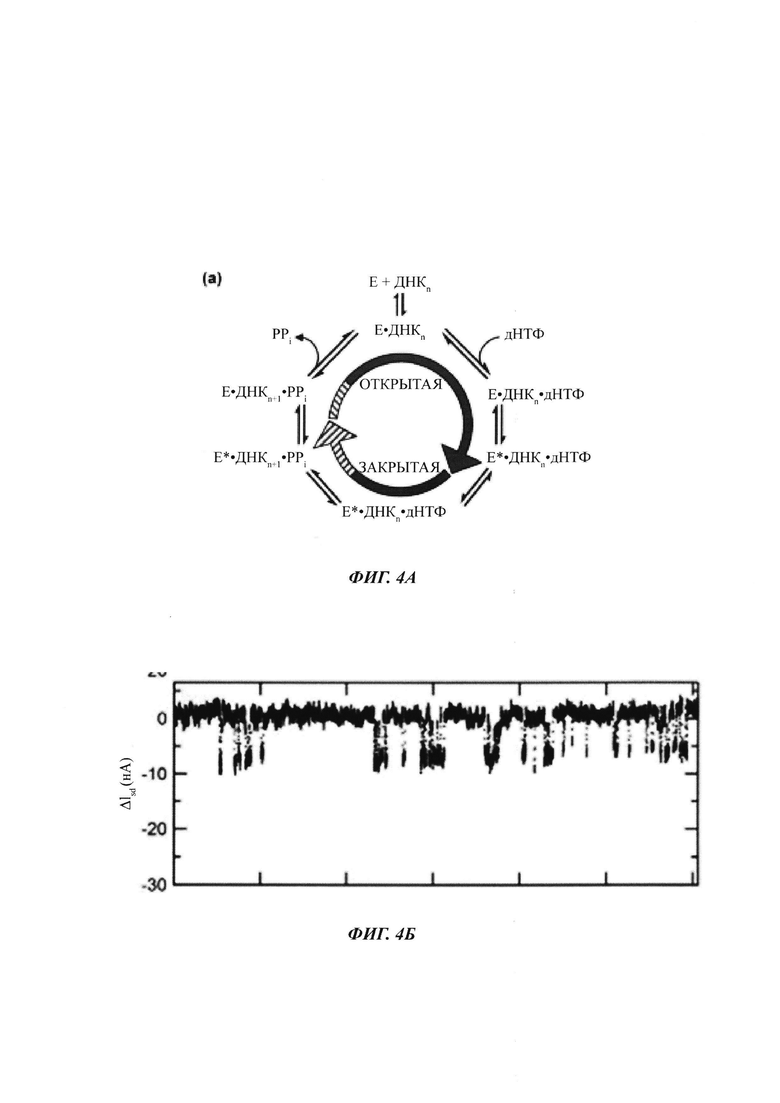
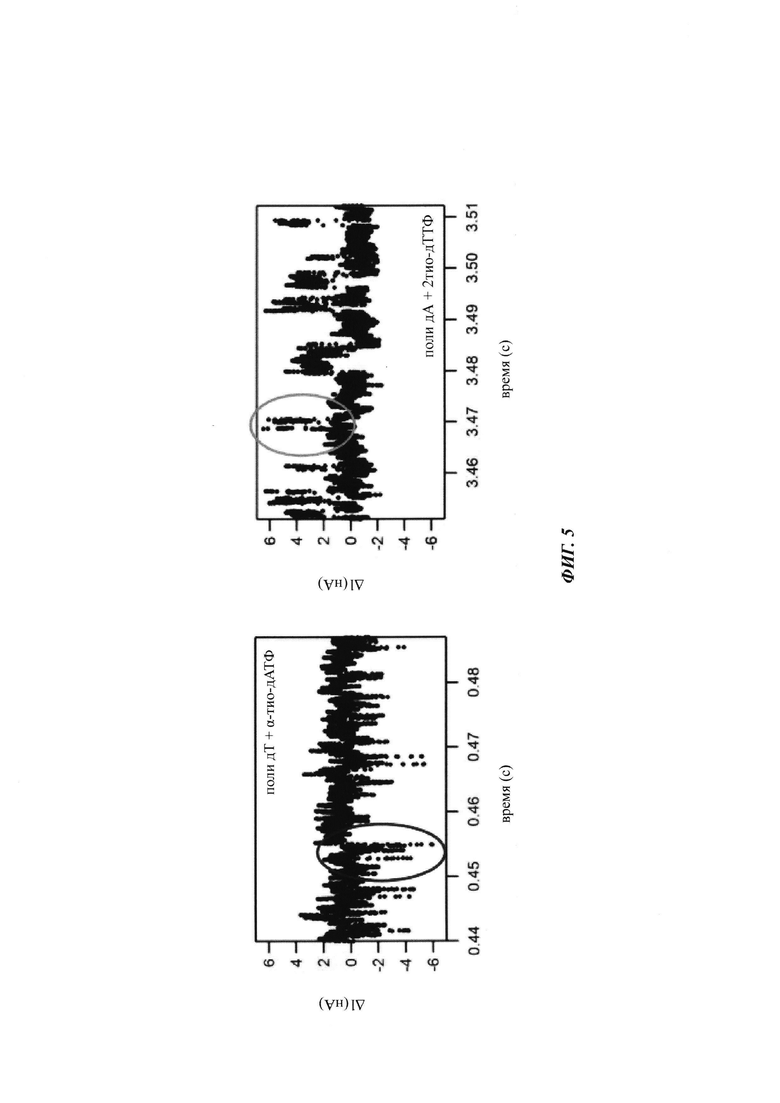
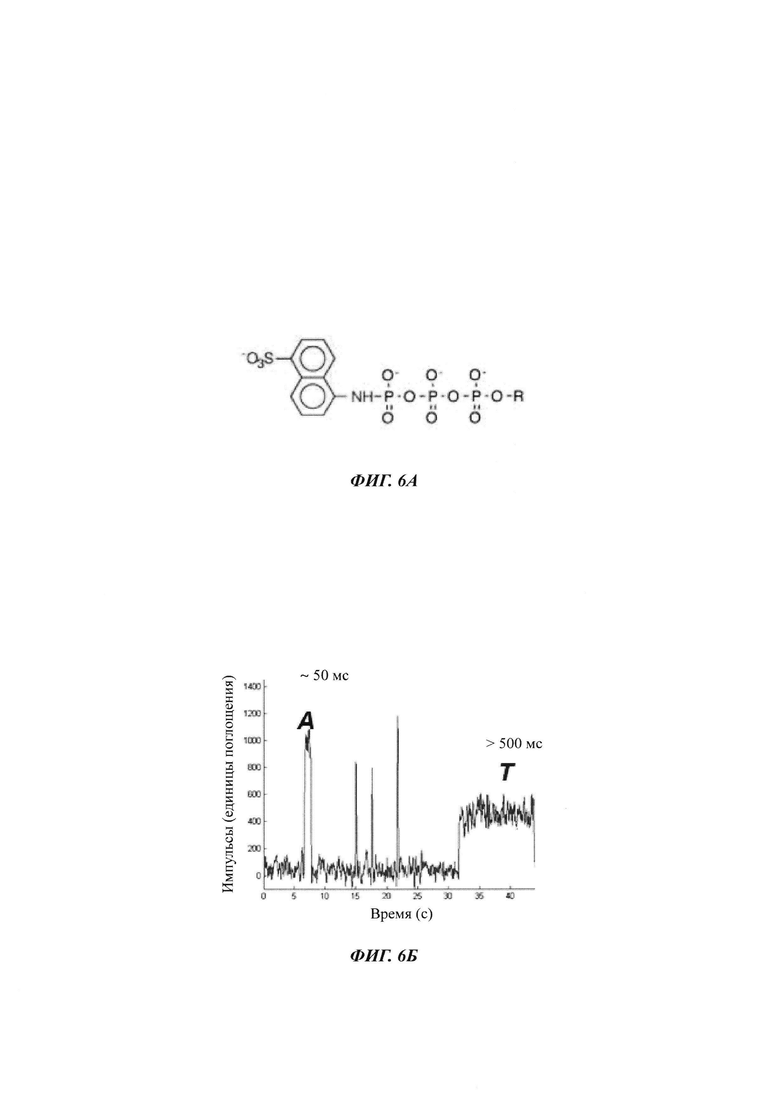
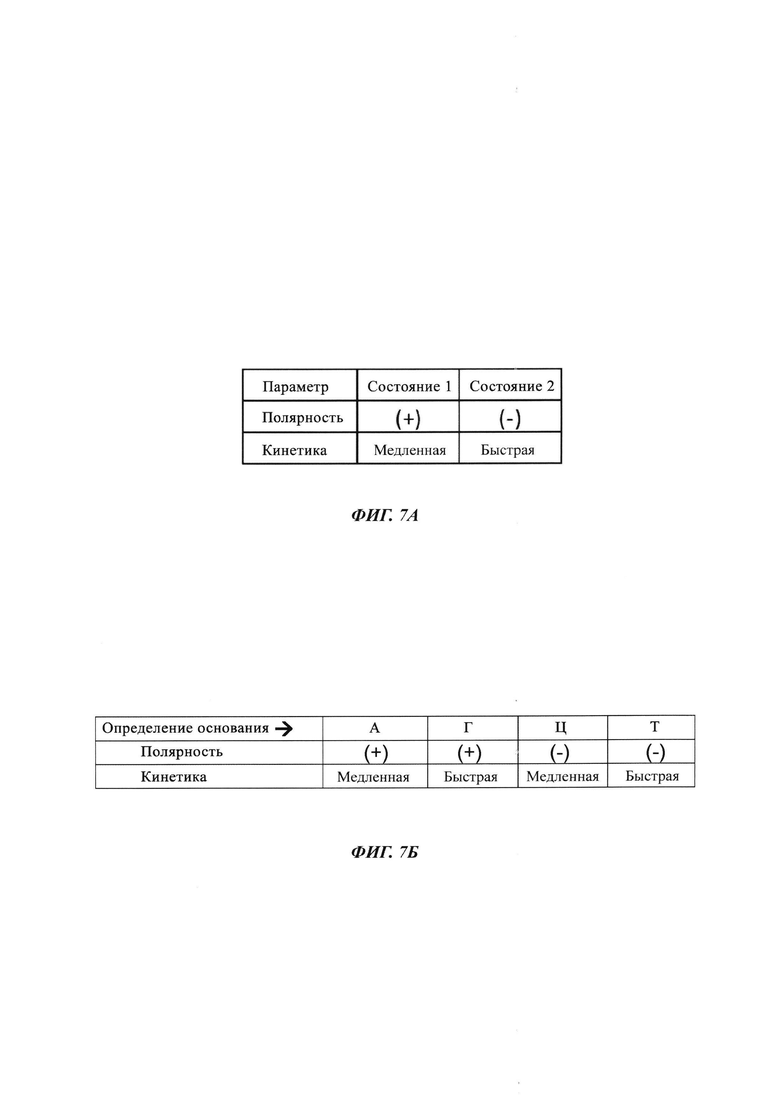



Изобретение относится к области биотехнологии, молекулярной биологии и биохимии. Предложен способ секвенирования нуклеиновых кислот. Данный способ включает катализируемое полимеразой включение нуклеотидов в образующуюся нить нуклеиновой кислоты относительно матрицы нуклеиновой кислоты, где полимераза присоединена к сенсору заряда, который обнаруживает события включения нуклеотидов. Для уникальной идентификации разных нуклеотидов в матричной нуклеиновой кислоте может быть использован один или более чем один тип неприродного нуклеотида, каждый из которых дает уникальные сигнатуры на сенсоре заряда. Изобретение позволяет более эффективно считывать длинные фрагменты нуклеиновых кислот, что может быть использовано в различных научных и прикладных областях. 3 н. и 39 з.п. ф-лы, 10 ил.
1. Способ секвенирования нуклеиновой кислоты, включающий:
(а) обеспечение полимеразы, присоединенной к сенсору заряда на твердой подложке;
(б) приведение полимеразы в контакт со смесью нуклеотидтрифосфатов, где данная смесь содержит разные типы нуклеотидтрифосфатов,
в которой первые два типа нуклеотидтрифосфатов находятся в первом отличимом состоянии по сравнению со вторыми двумя типами нуклеотидтрифосфатов в смеси, и
где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты;
где разные типы нуклеотидтрифосфатов в смеси являются комплементарными четырем разным нуклеотидам в нити матричной нуклеиновой кислоты;
(в) обнаружение включения нуклеотидов посредством сенсора заряда, где первые два типа нуклеотидтрифосфатов дают сигналы, которые отличаются от сигналов, продуцируемых вторыми двумя типами нуклеотидтрифосфатов в смеси,
получая, посредством этого, первую картину сигнала;
(г) повторение стадий (б) и (в) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов,
в которой один из первых двух типов нуклеотидтрифосфатов находится в отличимом состоянии по сравнению с другим из первых двух типов нуклеотидтрифосфатов во второй смеси,
получая посредством этого вторую картину сигнала; и
(д) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты;
где отличимое состояние типа или типов нуклеотидтрифосфатов в смеси нуклеотидтрифосфатов означает, что указанный тип или типы нуклеотидтрифосфатов (i) присутствует в количестве или концентрации, которые отличаются от таковых других типов нуклеотидтрифосфатов в смеси, или (ii) имеет химическую группировку или модификацию, которая не присутствует на других типах нуклеотидтрифосфатов в смеси, или (iii) не имеет химической группировки или модификации, которая присутствует на других типах нуклеотидтрифосфатов в смеси.
2. Способ по п. 1, в котором отличимое состояние на стадии (б) образуется из первых двух типов нуклеотидтрифосфатов, являющихся неприродными нуклеотидами.
3. Способ по п. 2, в котором отличимое состояние на стадии (г) образуется из одного из первых двух типов нуклеотидтрифосфатов, являющихся неприродными нуклеотидами.
4. Способ по п. 2, в котором отличимое состояние включает другой неприродный нуклеотид на стадии (б) по сравнению со стадией (г).
5. Способ по п. 1, в котором отличимое состояние на стадии (б) включает меньшее количество или концентрацию первых двух типов нуклеотидтрифосфатов по сравнению с количеством или концентрацией вторых двух типов нуклеотидтрифосфатов в смеси.
6. Способ по п. 5, в котором отличимое состояние на стадии (г) включает меньшее количество или концентрацию одного из первых двух типов нуклеотидтрифосфатов по сравнению с количеством или концентрацией другого из первых двух типов нуклеотидтрифосфатов во второй смеси.
7. Способ по п. 1, в котором нить матричной нуклеиновой кислоты является кольцевой.
8. Способ по п. 1, в котором сенсор заряда является частью чипа сенсоров заряда, при этом стадия (а) включает обеспечение целого ряда полимераз, каждая из которых присоединена на чипе к сенсору заряда на твердой подложке.
9. Способ по п. 8, в котором стадия (б) включает приведение полимераз в контакт со смесью нуклеотидтрифосфатов и стадия (в) включает обнаружение включения нуклеотидов посредством сенсоров заряда на чипе.
10. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают изменение сигнала, имеющее полярность, которая является противоположной полярности изменения сигнала, продуцируемого вторыми двумя типами нуклеотидтрифосфатов в смеси.
11. Способ по п. 10, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает изменение сигнала, имеющее полярность, которая является противоположной полярности изменения сигнала, продуцируемого другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
12. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают задержку в изменении сигнала по сравнению с изменением сигнала, продуцируемым вторыми двумя типами нуклеотидтрифосфатов в смеси.
13. Способ по п. 12, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает задержку в изменении сигнала по сравнению с изменением сигнала, продуцируемым другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
14. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают ослабленную интенсивность изменения сигнала по сравнению с изменением сигнала, продуцируемым вторыми двумя типами нуклеотидтрифосфатов в смеси.
15. Способ по п. 14, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает ослабленную интенсивность изменения сигнала по сравнению с изменением сигнала, продуцируемым другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
16. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают увеличенную интенсивность изменения сигнала по сравнению с изменением сигнала, продуцируемым вторыми двумя типами нуклеотидтрифосфатов в смеси.
17. Способ по п. 16, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает увеличенную интенсивность изменения сигнала по сравнению с изменением сигнала, продуцируемым другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
18. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают пролонгированное изменение сигнала по сравнению с изменением сигнала, продуцируемым вторыми двумя типами нуклеотидтрифосфатов в смеси.
19. Способ по п. 18, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает пролонгированное изменение сигнала по сравнению с изменением сигнала, продуцируемым другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
20. Способ по п. 1, в котором на протяжении стадии (в) первые два типа нуклеотидтрифосфатов дают более кратковременное изменение сигнала по сравнению с изменением сигнала, продуцируемым вторыми двумя типами нуклеотидтрифосфатов в смеси.
21. Способ по п. 20, в котором на протяжении стадии (г) один из первых двух типов нуклеотидтрифосфатов дает более кратковременное изменение сигнала по сравнению с изменением сигнала, продуцируемым другим из первых двух типов нуклеотидтрифосфатов во второй смеси.
22. Способ по п. 1, в котором сенсор заряда выбран из группы, состоящей из полевого транзистора на основе одностенной нанотрубки (SWNT FET, от англ. single-walled nanotube field effect transistor), FET на основе нанопровода, плавникового полевого транзистора (FinFET), трехзатворного FET, туннельного FET, магнитного сенсора, электрохимического сенсора и наноэлектромеханического сенсора.
23. Способ по п. 22, где сенсор заряда представляет собой FET на основе нанопровода, a FET на основе нанопровода представляет собой FET на основе кремниевого нанопровода.
24. Способ по п. 1, где сенсор заряда на твердой подложке представляет собой полевой транзистор, содержащий проводящий канал, где проводящий канал является полупроводником.
25. Способ секвенирования нуклеиновой кислоты, включающий:
(а) приведение полимеразы, присоединенной к сенсору заряда на твердой подложке, в контакт со смесью нуклеотидтрифосфатов,
где данная смесь содержит разные типы нуклеотидтрифосфатов,
где первый тип нуклеотидтрифосфатов включает неприродный нуклеотид, который дает изменение сигнала, имеющее полярность, которая противоположна полярности изменения сигнала, продуцируемого другими нуклеотидтрифосфатами в смеси, и
где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты;
(б) обнаружение включения нуклеотидов посредством сенсора заряда,
где первый тип нуклеотидтрифосфатов дает сигнал, который является уникальным по полярности по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами в смеси.
26. Способ по п. 25, где на стадии (б) получают первую картину сигнала и
способ дополнительно включает:
(в) повторение стадий (а) и (б) с использованием полимеразы, матричной нуклеиновой кислоты и второй смеси нуклеотидтрифосфатов, получая посредством этого вторую картину сигнала,
где второй тип нуклеотидтрифосфатов во второй смеси включает неприродный нуклеотид, который дает изменение сигнала, имеющее полярность, которая противоположна полярности изменения сигнала, продуцируемого другими нуклеотидтрифосфатами во второй смеси, и
где второй тип нуклеотидтрифосфатов во второй смеси дает сигнал, который является уникальным по полярности по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами во второй смеси; и
(г) сравнение первой и второй картин сигнала для определения последовательности матричной нуклеиновой кислоты.
27. Способ по п. 26, дополнительно включающий:
(д) повторение стадий (а) и (б) с использованием полимеразы, матричной нуклеиновой кислоты и третьей смеси нуклеотидтрифосфатов, получая посредством этого третью картину сигнала,
где третий тип нуклеотидтрифосфатов в третьей смеси включает неприродный нуклеотид, который дает изменение сигнала, имеющее полярность, которая противоположна полярности изменения сигнала, продуцируемого другими нуклеотидтрифосфатами в третьей смеси, и
где третий тип нуклеотидтрифосфатов в третьей смеси дает сигнал, который является уникальным по полярности по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами в третьей смеси; и
где стадия (г) включает сравнение первой, второй и третьей картин сигнала для определения последовательности матричной нуклеиновой кислоты.
28. Способ по п. 27, дополнительно включающий:
(е) повторение стадий (а) и (б) с использованием полимеразы, матричной нуклеиновой кислоты и четвертой смеси нуклеотидтрифосфатов, получая посредством этого четвертую картину сигнала,
где четвертый тип нуклеотидтрифосфатов в четвертой смеси включает неприродный нуклеотид, который дает изменение сигнала, имеющее полярность, которая противоположна полярности изменения сигнала, продуцируемого другими нуклеотидтрифосфатами в четвертой смеси, и
где четвертый тип нуклеотидтрифосфатов в четвертой смеси дает сигнал, который является уникальным по полярности по сравнению с сигналами, продуцируемыми другими нуклеотидтрифосфатами в четвертой смеси; и
где стадия (г) включает сравнение первой, второй, третьей и четвертой картин сигнала для определения последовательности матричной нуклеиновой кислоты.
29. Способ по п. 25, где смесь на стадии (а) содержит меньшее количество или концентрацию первого типа нуклеотидтрифосфатов по сравнению с количеством или концентрацией других типов нуклеотидтрифосфатов в смеси.
30. Способ по п. 29, где на протяжении стадии (б) первый тип нуклеотидтрифосфатов дает задержку в изменении сигнала по сравнению с изменением сигнала, продуцируемым другими нуклеотидтрифосфатами в смеси.
31. Способ по п. 25, где нить матричной нуклеиновой кислоты является кольцевой.
32. Способ по п. 25, в котором разные типы нуклеотидтрифосфатов в смеси являются комплементарными четырем разным нуклеотидам в нити матричной нуклеиновой кислоты.
33. Способ по п. 25, где сенсор заряда является частью чипа сенсоров заряда.
34. Способ по п. 25, где сенсор заряда выбран из группы, состоящей из SWNT FET, FET на основе нанопровода, FinFET, трехзатворного FET, туннельного FET, магнитного сенсора, электрохимического сенсора и наноэлектромеханического сенсора.
35. Способ по п. 34, где сенсор заряда представляет собой FET на основе нанопровода, a FET на основе нанопровода представляет собой FET на основе кремниевого нанопровода.
36. Способ по п. 25, где сенсор заряда на твердой подложке представляет собой полевой транзистор, содержащий проводящий канал, где проводящий канал является полупроводником.
37. Способ по п. 25, где полимераза ковалентно присоединена к сенсору заряда на твердой подложке.
38. Способ секвенирования нуклеиновой кислоты, включающий:
(а) приведение полимеразы, присоединенной к сенсору заряда на твердой подложке, в контакт со смесью нуклеотидтрифосфатов,
где данная смесь содержит разные типы нуклеотидтрифосфатов,
где первый тип нуклеотидтрифосфатов дает изменение сигнала, имеющее первую полярность, и демонстрирует первое состояние в кинетике включения нуклеотидов,
где второй тип нуклеотидтрифосфатов дает изменение сигнала, имеющее первую полярность, и демонстрирует второе состояние в кинетике включения нуклеотидов, которое является более быстрым, чем первое состояние,
где третий тип нуклеотидтрифосфатов дает изменение сигнала, имеющее вторую полярность, которая противоположна первой полярности, и демонстрирует первое состояние в кинетике включения нуклеотидов, и
где четвертый тип нуклеотидтрифосфатов дает изменение сигнала, имеющее вторую полярность, и демонстрирует второе состояние в кинетике включения нуклеотидов, и
где полимераза включает нуклеотиды из данной смеси в образующуюся нить относительно нити матричной нуклеиновой кислоты;
(б) обнаружение включения нуклеотидов посредством сенсора заряда,
где каждый тип нуклеотидтрифосфатов дает уникальный сигнал.
39. Способ по п. 38, где сенсор заряда выбран из группы, состоящей из SWNT FET, FET на основе нанопровода, FinFET, трехзатворного FET, туннельного FET, магнитного сенсора, электрохимического сенсора и наноэлектромеханического сенсора.
40. Способ по п. 39, где сенсор заряда представляет собой FET на основе нанопровода, a FET на основе нанопровода представляет собой FET на основе кремниевого нанопровода.
41. Способ по п. 38, где сенсор заряда на твердой подложке представляет собой полевой транзистор, содержащий проводящий канал, где проводящий канал является полупроводником.
42. Способ по п. 38, где полимераза ковалентно присоединена к сенсору заряда на твердой подложке.
| US2014057339 А1, 27.02.2014 | |||
| US2015065353 A1, 05.03.2015 | |||
| US2013078622 A1, 28.03.2013 | |||
| US6013456 A, 11.01.2000 | |||
| СПОСОБ ВЫПОЛНЕНИЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЬЮ НУКЛЕИНОВОЙ КИСЛОТЫ, УСТРОЙСТВО ДЛЯ ПРОВЕДЕНИЯ МАНИПУЛЯЦИЙ НА ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ, ПРОТОЧНЫЙ СОСУД, ТВЕРДЫЙ НОСИТЕЛЬ ДЛЯ ИММОБИЛИЗАЦИИ ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ, ТВЕРДЫЙ НОСИТЕЛЬ, СПОСОБ ПОЛУЧЕНИЯ НОСИТЕЛЯ ДЛЯ ИММОБИЛИЗАЦИИ ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ | 1992 |
|
RU2186852C2 |
Авторы
Даты
2019-04-23—Публикация
2016-05-11—Подача