Изобретение относится к области биотехнологий и основано на использовании культур живых микроорганизмов, например, для природоохранных технологий очистки природных и техногенных объектов от загрязнений, в том числе – нефтепродуктов. Более конкретно, изобретение может быть применено для стабилизации биопрепаратов, содержащих живые микроорганизмы, с целью продления сроков поддержания высокого титра живых микроорганизмов и высоких технологических свойств соответствующих биопрепаратов.
Для эффективного применения биопрепаратов, содержащих живые микроорганизмы, важно, чтобы концентрация жизнеспособных клеток была на уровне, достаточном для проявления целевых технологических свойств, различающихся для различных биотехнологий. Так, для очистки объектов окружающей среды от нефтепродуктов биопрепараты должны иметь концентрацию углеводородокисляющих бактерий (УОБ) не ниже 108 клеток/г. При этом во всех препаратах, включающих живые клетки, наблюдается отмирание микроорганизмов при хранении и снижение концентрации микроорганизмов. Для замедления этого процесса применяют такие подходы, как высушивание препаратов, хранение при низких температурах (Сидякина, 1985 г.), что наиболее эффективно, но удорожает стоимость и усложняет технологических процесс получения биопрепаратов, что особенно важно для крупномасштабного производства биопрепаратов, применяемых для природоохранных технологий. Более дешевые технологии стабилизации биопрепаратов – иммобилизация микроорганизмов с применением сорбентов и включением в гели (Ефременко, 2018 г.). При этом в некоторых случаях сроки хранения биопрепаратов не должны превышать нескольких недель – от момента изготовления (наработки) биопрепарата до его применения.
Известен способ хранения микроорганизмов, заключающийся в выращивании микроорганизмов с последующим добавлением синтетических волокон, капрона, полипропилена, лавсана или других (Патент РФ №2008348), с целью хранения микроорганизмов. Недостатком такого способа является узкая направленность способа и трудность применения суспензий таких препаратов для обработки больших объектов.
Известен способ увеличение продолжительности хранения культур при сохранении их жизнеспособности с применением енамина А (Патент РФ № 2291193). Недостатком способа является сложность синтеза, малая доступность и стоимость применяемого консерванта-антиоксиданта.
Известно несколько способов стабилизации биопрепаратов для ликвидации разливов/загрязнений нефтепродуктов. Все способы предусматривают первоначальное выращивание культур микроорганизмов с последующими технологическими действиями (отделение или концентрирование биомассы, введение добавок, высушивание и др.). Некоторые способы предусматривают введение нескольких стабилизаторов в жидкую культуру полученных микроорганизмов (патенты РФ RU 2337069 C1, RU 0099120413, RU 2365438 C2).
Некоторые способы предусматривают получение биопрепаратов в твёрдом состоянии – с использованием сыпучих сорбентов-наполнителей (патенты РФ RU 2615464 C1, RU 2193533 C2, RU 2617953 C1).
Такие подходы при доказанной технологической целесообразности и эффективности, характеризуются технологической сложностью и повышенной стоимостью, при том, что на рынке (в сфере) природоохранных технологий существует сектор, ориентированный на применение простых в получении и применении жидких биопрепаратов с минимальной добавленной стоимостью (в дополнение к затратам на выращивание), и сроках хранения не более 1-2 мес.
Наиболее близким к указанным требованиям является способ стабилизации выращенных культур (патент РФ RU 2365438 C2), являющийся прототипом предлагаемого решения. В соответствии со способом в суспензию выращенных на жидкой среде микроорганизмов вводятся добавки, глицерин и минеральные соли. Недостатком способа-прототипа является требование хранения препарата при температуре не выше 10°С, срок хранения не более 1,5 мес, а также отсутствие сравнения с биопрепаратом, полученным и хранившимся без введения стабилизаторов.
Указанных недостатков – многостадийности и сложности производства или повышенной стоимости конечного продукта, требования хранения при пониженных температурах, отсутствие контроля (препарата без стабилизаторов), - лишен предлагаемый способ стабилизации биопрепаратов, содержащих живые микроорганизмы.
Техническим результатом предлагаемого решения является повышение сроков поддержания высокого титра жизнеспособных клеток (сохранности) биопрепаратов, предназначенных для хранения в течение нескольких недель без дополнительного охлаждения, простота получения (без введения дополнительных технологических приёмов типа сушки, прессования), что обеспечивает эффективность применения таких биопрепаратов.
Поставленная задача решается описываемым способом получения препаратов живых микроорганизмов, характеризующимся продленным сроком сохранения высокого титра живых клеток, включающим стадию изготовления микрокапсул как носителя прикрепленного биоценоза, и стадию выращивания микроорганизмов в присутствии микрокапсул.
В соответствии с предлагаемым способом могут быть использованы грамположительные и грамотрицательные бактерии.
В соответствии с предлагаемым способом в качестве носителя прикрепленного биоценоза могут быть использованы микрокапсулы, изготовленные из полимера, характеризующегося способностью к адгезии бактерий.
В соответствии с предлагаемым способом предпочтительно, но не исключительно, микрокапсулы могут быть изготовлены из полимочевины, модифицированной хитозаном, или полимолочной кислоты.
В соответствии с предлагаемым способом микрокапсулы в количестве 1,5-3 г/л добавляют в культуры микроорганизмов одновременно с инокулятом.
Указанная выше совокупность признаков, включённая в два независимых пункта формулы, не известна из уровня техники. В объёме вышеуказанной совокупности признаков достигается заявленный технический результат, подтверждённый ниже. Ни в научно-технической, ни в патентной литературе не обнаружены сведения о возможном влиянии отличительных признаков независимых пунктов формулы (выращивание микроорганизмов в присутствии носителя прикрепленного биоценоза, микрокапсул, и применение в качестве материала для изготовления микрокапсул полимочевины, модифицированной хитозаном, и полимолочной кислоты) на технический результат, достигаемый при осуществлении заявленного способа.
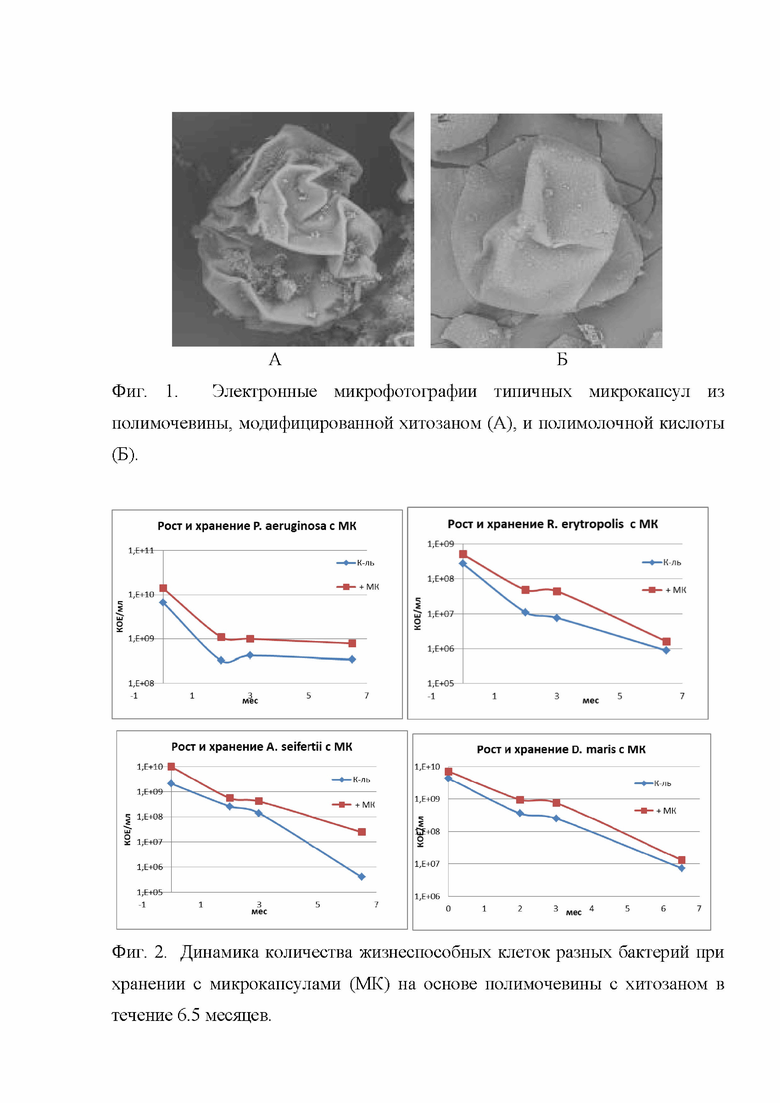
На фиг. 1 приведены электронные микрофотографии типичных микрокапсул из полимочевины, модифицированной хитозаном (А), и полимолочной кислоты (Б).
На фиг. 2 представлена динамика количества жизнеспособных клеток разных бактерий при хранении с микрокапсулами на основе полимочевины с хитозаном в течение 6,5 месяцев.
На фиг. 3 представлены отклики культур P. aeruginosa (А) и R. erytropolis (Б), выращенных в присутствии микрокапсул из полимолочной кислоты (1.5 г/л среды), на добавление глюкозы (по скорости накопления СО2).
На фиг. 4 представлена эффективность деструкции парафинов нефти (%) различными препаратами культуры R. erytropolis, хранившимися 11 мес (А), и эффективность деструкции (окисления) парафинов С10-С34 (%) различными препаратами культуры P. aeruginosa, хранившимися в течение 6 месяцев (Б). Сокращения: к-ль – контрольная культура без стабилизации, МК-ПМХ – микрокапсулы из полимочевины с хитозаном, МК ПМК - микрокапсулы из полимолочной кислоты.
Выбор авторами способа стабилизации биопрепаратов (т.е. длительного поддержания высокого титра жизнеспособных клеток микроорганизмов) основан на необходимости сочетать три научно-технологических подхода: 1) известного свойства микроорганизмов, находящихся в иммобилизованном состоянии, т.е. в виде биопленок, обладать повышенной стрессоустойчивостью и выживаемостью (Ефременко, 2018, Żur et al., 2016); 2) удобства применения жидких биопрепаратов микроорганизмов, т.е. в которых присутствуют растворенные и/или высокодисперсные носители прикрепленного биоценоза, не изменяющие существенно реологические свойства суспензий. Для этих целей подходят микрокапсулы с размерами в доли миллиметра; 3) одностадийность процесса выращивания микроорганизмов, что упрощает и удешевляет производство биопрепаратов, и не было известно до наших работ. Также было принято во внимание, что: 1. Перевод бактерий в состояние пониженного метаболизма позволит на исходно одинаковом количестве субстрата вырасти большему количеству биомассы; 2. Сорбция продуктов метаболизма с ингибирующими и ауторегуляторными свойствами должна способствовать продлению фазы роста микроорганизмов, что также будет способствовать наращиванию большего количества бактерий; 3. При возможности использования материала капсул в качестве пищевого субстрата (полимолочная кислота), это также будет способствовать накоплению большей биомассы микроорганизмов и более длительному сохранению жизнеспособности.
Сущность способа и его техническая реализуемость иллюстрируются следующими примерами.
Пример 1. Получение микрокапсул для использования в качестве носителей прикрепленного биоценоза
При выборе материала микрокапсул исходили из того, поверхность микрокапсул должна быть (полностью или частично) гидрофобной и/или нести положительный заряд, чтобы эффективно адсорбировать на себя клетки микроорганизмов. Были синтезированы два типа микрокапсул: из полимочевины, модифицированной низкомолекулярным хитозаном (МК ПМХ), и из полимолочной кислоты (МК ПМК).
Получение микрокапсул из полимочевины с хитозаном
Оболочка микрокапсул синтезируется по технологии межфазной реакции преполимера полимочевины, содержащейся в органической фазе (галогенуглерод) и водорастворимого полиамина. Технологический процесс получения микрокапсулированного препарата включает четыре этапа:
1. Подготовка раствора преполимера полимочевины
870 г смолы полиизоцианата растворяют в 5 л абсолютного н-гексана, выдерживают 3 часа при комнатной температуре и фильтруют без доступа воздуха. Полученный раствор упаривают в вакууме и сушат при 20°С в вакууме не выше 1⋅10-3 мм рт.ст. в течение 3 часов при перемешивании до полного удаления паров гексана.
2. Подготовка водного раствора эмульгатора
Растворение эмульгатора проводят в реакторе при перемешивании при 90-95°С в течение 1-1,5 час. Затем доводят до рабочей концентрации холодной водой, дополнительно перемешивают 30 минут до полной гомогенизации и охлаждают до рабочей температуры.
3. Приготовление эмульсии
Эмульсию галогенуглерода готовят в эмульгаторе порционно, для получения капель заданного размера. Первичный контроль производят при помощи микроскопа с применением камеры Горяева для определения размера. Время приготовления эмульсии не более 10 минут. При увеличении времени выдержки эмульсия или расслаивается, или набирает вязкость. В обоих случаях выход и качество капсул ухудшается.
4. Отверждение полимера
Реакцию проводят в основном реакторе при перемешивании и нагреве в течение оптимального времени.
Оптимальная температура ввода эмульсии галогенуглерода - +30°С и выдержка при этой температуре 2-3 часа.
Были найдены оптимальные условия получения микрокапсул из полимочевины:
Темплейт (ядро микрокапсул): Дихлорметан / Дихлорфторэтан 2:1
Полиизоцианат: PM-200
Система отверждения: Триэтилентетрамин / Этилендиамин 3:1
Полисахарид: низкомолекулярный хитозан (молекулярная масса в диапазоне от 1 кДа до 30 кДа, степень дезацетилирования 75-95%) - 25% от массы отвердителя.
ПАВ: TWIN 80 / поливиниловый спирт / Лаурилсульфат натрия 1:1:0.2
Режим отверждения: 20-60°С, 6 часов.
Суспензию микрокапсулированного препарата после получения фильтруют на нетканом фильтровальном материале под вакуумом. Остаток на фильтре промывают дистиллированной водой. Микрокапсулированный препарат представляет собой 10-15% водную суспензию капсул размером 50-200 мкм, состоящих из полимочевинной оболочки, галогенуглерода в качестве содержимого и водной фазы в качестве внешнего наполнителя материала. Этот материал вносят в реактор вместе с диспергатором ОП-7 и выдерживают в реакторе при 130°С в течение 5 часов, после чего охлаждают и используют для иммобилизации бактерий.
Полученные препараты имели следующие характеристики: диаметр – 50-200 мкм, в среднем 80-100 мкм, средняя площадь поверхности оболочек микрокапсул (сух.) 0,054 м2/г.
Получение микрокапсул из полимолочной кислоты
Метод включает в себя следующие четыре стадии:
(1) Приготовление растворов ПМК в хлористом метилене и эмульгаторов в воде.
(2) Механическое эмульгирование раствора ПМК в водном растворе эмульгаторов до получения размера микрокапель 0,05-0,5 мм.
(3) Создание повышенного давления воздуха над микроэмульсией (более 300 кПа). Воздух при этом полностью растворяется в каплях и растворе. Последующее уменьшение давления в сосуде до атмосферного давления, приводит к появлению микропузырьков в каплях, и в растворе.
(4) После перехода хлористого метилена в водный раствор ПВС происходит сжатие капель и формирование полых микрокапсул из ПМК.
Оптимальными условиями были следующие:
Раствор полимера – 5% ПМК в дихлорметане, эмульгатор – Твин-80 в поливиниловом спирте 1:1, эмульгирование в течение 10 минут с перемешиванием при 3000 об/мин, основная реакция - в течение 4 ч при 35°С.
Полученный микрокапсулированный препарат представляет собой 10-15% водную суспензию капсул размером 50-200 мкм, состоящих из ПМК (см. фиг. 1).
Полученные препараты имели следующие характеристики:
Диаметр – 25-100 мкм, в среднем 80 мкм.
Микрокапсулы обоих типов представлены сморщенными сферами округлой формы с гладкой поверхностью (фиг. 1). В обоих типах МК встречаются капсулы с трещинами (не более 10%). «Сморщенность» более выражена у капсул из полимочевины.
Приведенный пример доказывает техническую реализуемость предлагаемого способа получения носителей прикрепленного биоценоза и относительную простоту получения микрокапсул.
Пример 2. Выращивание культур микроорганизмов с микрокапсулами
Культуры четырех углеводородокисляющих бактерий: грамотрицательные Pseudomonas aeruginosa и Acinetobacter seifertii и грамположительные Rhodococcus еrytropolis и Dietsia maris, выращивали в 50 мл стерильной среды LB в 250 мл колбах. Вместе с инокулятом одновременно вносили капсулы из полимочевины с хитозаном (1,5-3 г/л). Культуры инкубировали в течение 2 суток при температуре 28°С при перемешивании на орбитальной качалке (100 об/мин) до стационарной фазы, после чего оставляли при комнатной температуре на несколько месяцев. После выращивания поверхность капсул была покрыта слоем адгезированных бактерий (табл. 2). При этом площадь обрастания никогда не достигает 100% поверхности МК. Клетки локализованы, преимущественно, во впадинах между выступающими складками капсул. По форме клеток можно заключить, что они находятся в неактивном состоянии. Через 3 мес хранения культур с капсулами картина существенно не изменилась (таблица 2). Все капсулы были покрыты клетками бактерий, и даже в большей степени, чем 2-суточные культуры.
Обрастание капсул бактериями исследовали с применением сканирующей электронной микроскопии на микроскопе ТМ-3000 («Hitachi», Япония) при ускоряющем напряжении 15 кВ, а также фазово-контрастной микроскопии на световом эпифлуоресцентном микроскопе Axio Imager M2 (Carl Zeiss Microscopy GmbH, Германия). О скорости роста бактерий судили по интенсивности их дыхания, обусловливающей накопление СО2 в замкнутом объеме флакона для инкубации, объемом 500 мл. Концентрацию СО2 определяли на газовом хроматографе (Кристалл 5000, РФ). Объем среды и количество инокулята были рассчитаны таким образом, чтобы не достигалось ингибирования развития культур из-за недостатка кислорода или накопления СО2. Количество жизнеспособных клеток (титр колониеобразующих единиц, КОЕ/мл) определяли методом высева десятичных разведений культур на плотные среды.
Внесение микрокапсул в среду роста не сказалось на скорости роста бактерий, определяемой по дыханию бактерий, что было проверено на культурах P. aeruginosa и R. erytropolis. В обоих вариантах отсутствовала лаг-фаза, культуры росли с одинаковой скоростью и достигали одинакового конечного урожая.
При этом количество выросших клеток в присутствии капсул из полимочевины было в 1.5 раза выше, чем в контрольном варианте (рис. 1), что подтверждает наше предположение о позитивном влиянии выращивания бактерий в присутствии сорбентов.
Выращивание бактерий с микрокапсулами из полимолочной кислоты реализовано с бактериями P. aeruginosa и R. erytropolis (табл. 3). Обе культуры образуют плотные биопленки, покрывающие практически всю поверхность капсул. При этом обнаружено, что электронно-микроскопическое исследование занижает количество адгезированных бактерий по причине наличия пробоподготовки. При просмотре тех же образцов в световом микроскопе видно, что микрокапсулы полностью покрыты толстым слоем бактерий (табл. 4).
Таблица 2. Обрастание микрокапсул из мочевины с хитозаном различными бактериями. Детекция с применением сканирующего электронного микроскопа
инокуляции







Таблица 3. Обрастание микрокапсул из полимолочной кислоты различными бактериями. Детекция с применением сканирующего электронного микроскопа
инокуляции



Таблица 4. Обрастание микрокапсул из полимолочной кислоты различными бактериями. Детекция с применением светового микроскопа
инокуляции

Приведенный пример доказывает техническую реализуемость предлагаемого способа иммобилизации всех испытанных бактерий на носители прикрепленного биоценоза, микрокапсулы разных типов, отсутствие дополнительных операций и затрат на дополнительные технологические процессы.
Пример 3. Выживание бактерий в присутствии микрокапсул в течение длительного времени и сохранение их метаболической активности
На фиг. 2 представлены кривые содержания жизнеспособных клеток четырех бактерий в присутствии микрокапсул из полимочевины с хитозаном. Наличие микрокапсул в среде роста и переход клеток в состояние биопленочного роста положительно сказались на увеличении числа жизнеспособных клеток бактерий в их культурах в ходе длительного хранения относительно контроля (в 2-60 раз). Эффект увеличения титра КОЕ обеспечивается как ростом числа клеток в выросших 2-суточных культурах, так и за счет более успешного выживания клеток, находящихся в состоянии биопленочного фенотипа.
Влияние микрокапсул из полимолочной кислоты на титр жизнеспособных клеток бактерий было трудно оценить по причине чрезвычайно высокой адгезии и методических трудностей десорбции клеток c микрокапсул. Так, для R. erytropolis после 1 мес хранения титр КОЕ в опыте на 3 порядка превосходил этот показатель в контроле, а для P. aeruginosa разницы между контролем и опытом зафиксировано не было.
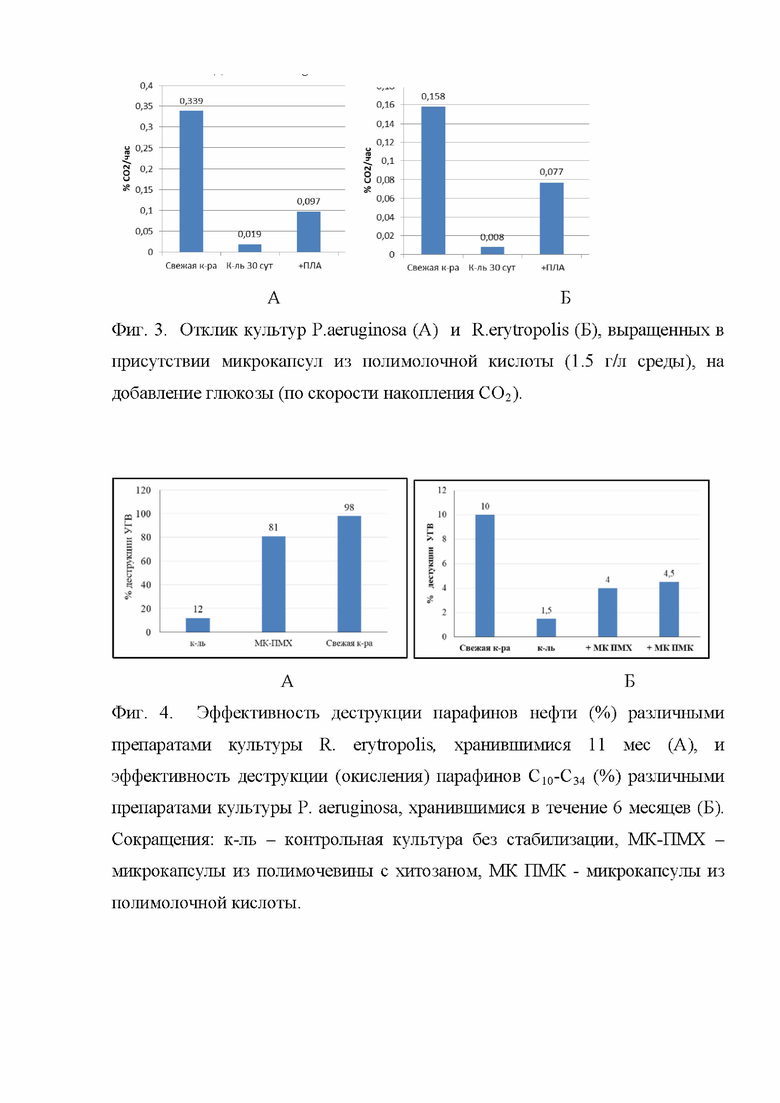
По этой причине дополнительно была исследована метаболическая активность биопрепаратов, хранившихся в течение 1 мес в присутствии микрокапсул относительно контроля. Бактерий культивировали во флаконах объемом 60 мл в среде Раймонда в течение 9 часов (инокулят – культуру стационарной фазы роста, или культуры, хранившиеся в течение 30 сут, вносили в количестве 2% по объему для псевдомонады, и 4% для родококка). После стабилизации уровня СО2 в газовой фазе (через 4 часа инкубации), вносили раствор глюкозы (500 мкл 10% раствора).
На фиг. 3 А, видно, что культура P. aeruginosa, хранившаяся в течение 30 сут в присутствии микрокапсул из полимолочной кислоты (1.5 г/л) в пять раз более активна, чем в контроле. Для R. erytropolis дыхательная активность культуры, хранившейся 30 сут в присутствии микрокапсул и полимолочной кислоты в 10 раз выше, чем контрольной культуры, и всего лишь в 2 раза ниже, чем свежевыращенной культуры.
Приведенный пример показывает эффективность предложенного способа улучшать выживаемость бактерий и их метаболическую активность в ходе длительного хранения в неблагоприятных условиях.
Пример 4. Разложение углеводородов в жидких средах культурами бактерий, стабилизированных с применением микрокапсул
Для подтверждения пригодности разработанного способа поддержания жизнеспособности клеток бактерий и их метаболического потенциала для повышения эффективности использования биопрепаратов по целевому назначению была протестирована эффективность деструкции нефтепродуктов двумя углеводородокисляющими бактериями.
Углеводородокисляющую активность культур R. erytropolis определяли согласно аттестованной методике № 88-16207-054-RA.RU 310657-2017 по деструкции н-алканов алифатической фракции методом ГЖХ на хроматографе Кристалл 5000.1 (Хроматэк, РФ). Степень углеводородокисляющей активности (%) биопрепарата рассчитывали по изменению в суммарном содержании н-алканов с длиной углеродной цепи от 10 до 30 по специальной формуле. Все варианты ставили в колбах, объемом 500 мл, со 100 мл минеральной среды Раймонда с добавлением 3% нефти Московского НПЗ с добавлением 100 мкл биопрепарата (культуры - R. erythropolis). Колбы культивировали на качалке при 120 об/мин в течение 4 суток при 30°С. Для сравнения были взяты биопрепараты на основе R. erytropolis: 1. Культура, выращенная в течение 2 суток на среде LB и хранившаяся 5 суток как положительный контроль, 2. Такая же культура, хранившаяся в течение 11 мес без стабилизации; 3. Такая же культура, выращенная в присутствии микрокапсул из полимочевины с хитозаном, также хранившаяся в течение 11 мес. Результаты испытаний представлены на фиг. 4 А. Культура, хранившаяся в присутствии микрокапсул, показала высокую активность по деградации парафинов – в 7 раз выше, чем контрольная, и лишь на 17% ниже, чем свежевыращенная культура.
Эффективность деструкции смеси парафинов С10-С34 (Энзим, РФ) стабилизированными и нестабилизированными препаратами УОБ P. aeruginosa была тестирована в эксперименте по росту УОБ на жидкой среде Раймонда с добавкой парафинов в качестве единственного источника углерода и детекцией накопления СО2 на газовом хроматографе (Кристалл 5000, РФ). Были использованы культуры: свежевыращенная в течение 2 сут на среде LB; после 6 мес хранения без добавок (к-ль); выращенные в присутствии микрокапсул из полимочевины с хитозаном или из полимолочной кислоты.
Результаты, представленные на фиг. 4Б, демонстрируют, что за 4 суток культивирования свежевыращенная культура конца экспоненциальной фазы роста окислила 1 мг/мл парафинов, что составило 10% от его исходного количества (10 мг/мл). Если среда была инокулирована культурой псевдомонад, первоначально имевшей тот же титр клеток, но хранившихся 6 мес, то за это же время было окислено в 6 раз меньше углеводородов. Стабилизация клеток микрокапсулами обоих типов повышала эффективность деструкции нефтепродукта в 3 раза по сравнению с контрольным, нестабилизированным, вариантом.
Таким образом, лабораторное тестирование подтвердило эффективность разработанных подходов к повышению титра КОЕ препаратов УОБ для реализации целевого процесса – деградации углеводородов.
Цитированные источники
1. Сидякина Т. М. Консервация микроорганизмов, Пущино, 1985.
2. Иммобилизованные клетки: биокатализаторы и процессы. Под ред. Е.Н. Ефременко. М., Риор, 2018.
3. Żur J., Wojcieszyńska D., Guzik U. Metabolic Responses of Bacterial Cells to Immobilization Molecules. 2016 Jul; 21(7): 958.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения биопрепаратов живых микроорганизмов с продленным сроком сохранения высокого титра жизнеспособных клеток путём иммобилизации в гели на основе силанольных производных гуминовых веществ | 2021 |
|
RU2757600C1 |
| БИОПРЕПАРАТ ДЛЯ ОЧИСТКИ ПОЧВЫ И ВОДЫ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ | 1994 |
|
RU2053205C1 |
| БИОПРЕПАРАТ ДЛЯ ОЧИСТКИ ПОЧВЫ И ВОДЫ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ | 2010 |
|
RU2428469C1 |
| МИКРОКОНТЕЙНЕРЫ ДЛЯ ЗАЩИТЫ МИКРООРГАНИЗМОВ, ПРИМЕНЯЕМЫЕ В СЕЛЬСКОМ ХОЗЯЙСТВЕ | 2020 |
|
RU2744839C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО КОМПОНЕНТА ДЛЯ СРЕДСТВА, ПРЕДНАЗНАЧЕННОГО ДЛЯ УХОДА ЗА КОЖЕЙ, И КОМПОНЕНТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2009 |
|
RU2440096C2 |
| КОНСОРЦИУМ ШТАММОВ БИФИДОБАКТЕРИЙ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ЖИДКОГО КОНЦЕНТРАТА БИФИДОБАКТЕРИЙ, КИСЛОМОЛОЧНЫХ, НЕФЕРМЕНТИРОВАННЫХ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ ПРОДУКТОВ, БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВОК И БАКТЕРИЙНЫХ ПРЕПАРАТОВ | 2003 |
|
RU2291194C2 |
| БИОПРЕПАРАТ "ИРИЛИС" НА ОСНОВЕ БАКТЕРИЙ РОДА BACILLUS ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ И ДИСБИОЗА РАЗЛИЧНОЙ ЭТИОЛОГИИ И ШТАММЫ БАКТЕРИЙ BACILLUS SUBTILIS И BACILLUS LICHENIFORMIS, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТА | 2003 |
|
RU2264454C2 |
| БИОПРЕПАРАТ "ИРИЛИС" ВЕТЕРИНАРНОГО НАЗНАЧЕНИЯ | 2003 |
|
RU2264453C2 |
| Микробиологический препарат для повышения урожайности сельскохозяйственных культур в жидкой форме | 2016 |
|
RU2623156C1 |
| ПРЕПАРАТ ДЛЯ БИОДЕГРАДАЦИИ НЕФТЕПРОДУКТОВ "БИОИОНИТ" И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2571219C2 |
Изобретение относится к области биотехнологии. Способ предусматривает стабилизацию биопрепаратов, содержащих живые микроорганизмы, путем совместного выращивания целевых культур микроорганизмов с носителями прикрепленного биоценоза – микрокапсулами, изготовленными из полимочевины, модифицированной хитозаном, или полимолочной кислоты. Изобретение позволяет повысить эффективность применения биопрепаратов на основе живых микроорганизмов для очистки природных и техногенных объектов от загрязнений, в том числе – нефтепродуктов. 3 з.п. ф-лы, 4 ил., 3 табл., 4 пр.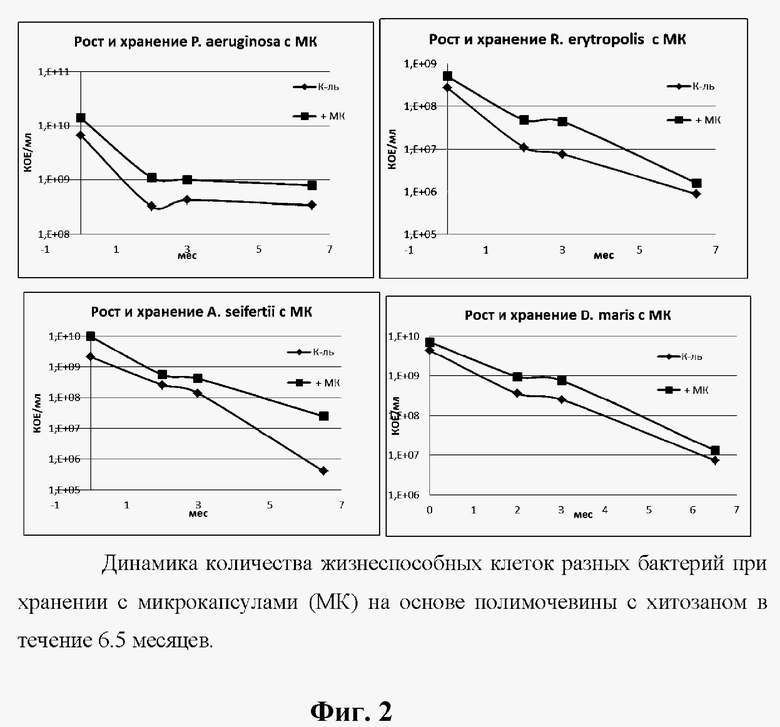
1. Способ получения препаратов живых микроорганизмов, характеризующийся продленным сроком сохранения высокого титра живых клеток, включающий стадию выращивания микроорганизмов в присутствии микрокапсул, полученных из полимочевины, модифицированной низкомолекулярным хитозаном, или из полимолочной кислоты, которые представляют собой 10-15% водную суспензию диаметром 80 мкм и которые добавляют в количестве 1-3 г/л в культуры микроорганизмов одновременно с инокулятом.
2. Способ по п. 1, отличающийся тем, что микроорганизмы могут быть представлены грамположительными бактериями.
3. Способ по п. 1, отличающийся тем, что микроорганизмы могут быть представлены грамотрицательными бактериями.
4. Способ по п. 1, характеризующийся тем, что микрокапсулы изготовлены из полимера, характеризующегося способностью к адгезии бактерий.
| КОНСЕРВАНТ ДЛЯ ХРАНЕНИЯ МИКРООРГАНИЗМОВ | 2005 |
|
RU2291193C2 |
| ŻUR J., WOJCIESZYNSKA D., GUZIK U | |||
| Metabolic Responses of Bacterial Cells to Immobilization Molecules | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| WO 2010070618 A2, 24.06.2010 | |||
| МИКРОКАПСУЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ АЛЬГИНАТА-АЦИЛЬНЫХ ПРОИЗВОДНЫХ ХИТОЗАНА, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2011 |
|
RU2542509C2 |
Авторы
Даты
2021-07-13—Публикация
2020-11-05—Подача