1. Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет в соответствии с 119(e) раздела 35 Свода федеральных законов США на основании предварительной заявки на патент США № 62/342417, поданной 27 мая 2016 года, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
2. Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был предоставлен в электронном виде в формате ASCII и настоящим включен посредством ссылки во всей полноте. Указанная ASCII-копия, созданная 17 мая 2017 года, называется 381493-285WO_SL.txt и имеет размер 108670 байт.
3. Область техники
Настоящая заявка относится, помимо всего прочего, к новым антителам к CD40, композициям, содержащим данные новые антитела, нуклеиновым кислотам, кодирующим данные антитела, а также способам их получения и применения.
4. Уровень техники
Виды терапии рака предусматривают широкий диапазон терапевтических подходов, включая хирургическое вмешательство, облучение и химиотерапию. Несмотря на то, что различные подходы обеспечивают широкий выбор методов для лечения рака, доступных практикующему врачу, существующие терапевтические средства характеризуются целым рядом недостатков, таких как отсутствие избирательности при нацеливания на раковые клетки, а не на нормальные здоровые клетки, а также развитие устойчивости рака к лечению.
Недавно разработанные подходы, основанные на целенаправленно воздействующих терапевтических средствах, которые преимущественно нарушают клеточные процессы в раковых клетках, а не в нормальных клетках, привели к схемам химиотерапии с меньшим количеством побочных эффектов по сравнению с нецеленаправленно воздействующими видами терапии, такими как лучевая терапия.
Иммунотерапия рака, в частности разработка средств, активирующих T-клетки иммунной системы хозяина для предотвращения пролиферации или уничтожения раковых клеток, превратилась в перспективный терапевтический подход, дополняющий существующие стандарты лечения. См., например, Miller, et al. Cancer Cell, 27, 439-449 (2015). Такие иммунотерапевтические подходы включают разработку антител, применяемых для модулирования уничтожения раковых клеток иммунной системой. Например, в США и Европейском союзе были одобрены блокирующие антитела к PD-1, пембролизумаб (Keytruda®) и ниволумаб (Opdivo®), для лечения таких заболеваний, как неоперабельная или метастатическая меланома и метастатический немелкоклеточный рак легкого. Усилия по ингибированию иммуносупрессорных белков, таких как CTLA-4, привели к разработке и клинической оценке антител к CTLA-4, таких как тремелимумаб и ипилимумаб (Yervoy®).
По-прежнему существует потребность в альтернативных подходах и дополнительных методах лечения рака в дополнение к существующим терапевтическим стандартам лечения.
5. Краткое описание изобретения
CD40 человека (SEQ ID NO:40) является представителем суперсемейства рецепторов фактора некроза опухоли (TNF) (представитель 5 суперсемейства TNF), который экспрессируется на антигенпрезентирующих клетках, таких как В-клетки, дендритные клетки (DC) и моноциты, и на неиммунных клетках, включая определенные типы опухолевых клеток. При активации лигандом CD40 человека (SEQ ID NO:41) CD40 человека активирует антигенпрезентирующие клетки и индуцирует ответы как врожденной, так и адаптивной иммунной систем. Агонистические средства для CD40 можно применять для индукции иммунной системы, чтобы предотвратить пролиферацию опухолевых клеток и/или вызвать их уничтожение и, таким образом, обеспечить эффективное терапевтическое лечение солидных опухолей.
В настоящем изобретении представлены антитела к CD40 и их связывающие фрагменты, которые специфически связываются с CD40 человека (SEQ ID NO:40). Аминокислотные последовательности иллюстративных CDR, а также аминокислотные последовательности областей VH и VL тяжелой и легкой цепей иллюстративных антител к CD40 представлены в подробном описании ниже.
Цепи VH и VL антител к CD40, описанных в данном документе, обеспечивают рецепторный ответ с помощью аллостерического агониста, что может активировать CD40 человека при наличии или отсутствии лиганда CD40 (CD40L), не конкурируя со связывающим взаимодействием CD40L-CD40. Более того, антитела к CD40 по настоящему изобретению при взаимодействии с CD40 могут усилить связывание CD40L с CD40.
Антитела к CD40 могут содержать модификации и/или мутации, которые изменяют свойства антител, как, например, увеличивают период полужизни, увеличивают или уменьшают ADCC или увеличивают агонистическую активность, как известно из уровня техники.
В данном документе также представлены нуклеиновые кислоты, содержащие нуклеотидные последовательности, кодирующие антитела к CD40 по настоящему изобретению, а также векторы, содержащие нуклеиновые кислоты. Помимо этого, в данном документе представлены прокариотические и эукариотические клетки-хозяева, трансформированные с помощью вектора, содержащего нуклеотидную последовательность, кодирующую раскрытое антитело к CD40, а также эукариотические клетки-хозяева (например, клетки, полученные от млекопитающих), сконструированные для экспрессии нуклеотидных последовательностей. Также представлены и дополнительно обсуждаются в подробном описании ниже способы получения антител путем культивирования клеток-хозяев и выделения антител.
В другом аспекте настоящего изобретения представлены композиции, содержащие антитела к CD40, описанные в данном документе. Композиции обычно содержат одно или несколько антител к CD40, описываемых в данном документе, и/или их соли, и один или несколько наполнителей, носителей или разбавителей.
В настоящем раскрытии представлены способы лечения субъектов, таких как субъекты-люди, с диагностированной солидной опухолью с помощью антитела к CD40. Способ обычно предусматривает введение субъекту определенного количества антитела к CD40, описанного в данном документе, эффективного для обеспечения терапевтического эффекта. У субъекта может быть диагностирована любая из целого ряда солидных опухолей, которые могут быть впервые диагностированными, рецидивирующими или рецидивирующими и рефрактерными. Антитело к CD40, как правило, вводят в виде внутривенной инфузии или внутриопухолевой инъекции в дозах, варьирующих в диапазоне от приблизительно 0,001 мг/кг до приблизительно 4 мг/кг. Антитело к CD40, как правило, вводят в виде внутривенной инфузии или внутриопухолевой инъекции два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель или один раз каждые восемь недель.
Антитела к CD40 можно вводить в виде отдельных терапевтических средств (монотерапия), или в дополнение, или совместно с другими терапевтическими средствами, которые, как правило, но необязательно, применяют для лечения солидной опухоли. Терапевтические средства, как правило, будут применяться в дозе, посредством пути введения и при частоте введения, которые одобрены для них, но также можно применять и при более низких дозировках.
Антитела к CD40 можно вводить посредством различных путей или способов введения, включая без ограничения внутривенную инфузию и/или инъекцию, подкожную инъекцию и внутриопухолевую инъекцию. Вводимое количество будет зависеть от пути введения, схем дозирования, типа рака, подлежащего лечению, стадии рака, подлежащего лечению, и прочих параметров, таких как возраст и масса пациента, как хорошо известно из уровня техники. Конкретные иллюстративные схемы дозирования, которые, как ожидается, обеспечивают терапевтический эффект, представлены в подробном описании.
На основании данных, представленных в данном документе, ожидается, что антитела к CD40, описанные в данном документе, будут обеспечивать терапевтический эффект у субъектов с диагностированной солидной опухолью.
6. Краткое описание фигур
На ФИГ. 1 показаны аминокислотные последовательности рецептора CD40 человека (SEQ ID NO:40) и лиганда CD40 человека (SEQ ID NO:41).
На ФИГ. 2A-2G представлены аминокислотные последовательности VH и VL иллюстративных мышиных и гуманизированных антител к CD40. На ФИГ. 2A показаны аминокислотные последовательности VH и VL для muAb1 - muAb3; на ФИГ. 2B показаны аминокислотные последовательности VH и VL для muAb4 - muAb7; на ФИГ. 2C показаны аминокислотные последовательности VH и VL для muAb8 - muAb10; на ФИГ. 2D показаны аминокислотные последовательности VH и VL для гуманизированных антител muAb6 и muAb8; на ФИГ. 2E показаны аминокислотные последовательности VH и VL для гуманизированных антител muAb8 и muAb9; на ФИГ. 2F показаны аминокислотные последовательности VH и VL для дополнительно гуманизированного антитела muAb9; а на ФИГ. 2G показаны аминокислотные последовательности VH и VL для дополнительно гуманизированного антитела muAb9.
На ФИГ. 3 представлены результаты экспериментов по конкурентному связыванию CD40 человека между CD40L и иллюстративными антителами к CD40. Вверху слева показаны иллюстративные антитела к CD40, которые конкурируют с CD40L; вверху справа показаны антитела, которые незначительно конкурируют с CD40L; внизу слева показаны антитела, улучшающие взаимодействие CD40-CD40L; внизу справа показаны эффекты антител к CD40, huAb9 A2I и CP-870893. На оси Y изображена оптическая плотность (OD) при 650 нм; на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 4 показано связывание CD40 человека, конъюгированного с флуорохромом, при фиксированной концентрации 1 мкг/мл на клетках Jurkat, экспрессирующих CD40L человека, в присутствии возрастающих количеств антител, huAb9 A2I, CP-870893, изотипического IgG1 человека ("huIgG1") или изотипического IgG2 человека ("huIgG2"). На оси Y изображена средняя интенсивность флуоресценции ("MFI"), описывающая связывание; на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 5A-5B показаны эффекты дозы антител ("Образец"), составляющей 3 мкг/мл, или только среды на сигнал NFκB от клеток HEK293 Blue CD40 с репортерным геном под контролем NFκB, смешанных с клетками Jurkat D1.1 (соотношение 1:1). К индивидуальному образцу добавляли антитела, huAb9 A2I, CP-870893, изотипический IgG1 человека ("huIgG1") или изотипический IgG2 человека ("huIgG2"), или только среду. На ФИГ. 5А изображен сигнал NFκB в культурах, содержащих CD40L-отрицательные ("CD40L-") клетки Jurkat D1.1. На ФИГ. 5В изображен сигнал NFκB в культурах, содержащих CD40L-положительные ("CD40L+") клетки Jurkat D1.1. На оси Y изображена OD при 625 нм; на оси Х изображены результаты обработки антителом или только средой ("Образец").
На ФИГ. 6A-6B показано связывание доз антитела ("Образец") в мкг/мл для huAb9-5 с huIgG1 дикого типа или вариантами V273Y или V273E или CP-870893 в клетках CHO, экспрессирующих CD16F, CD16V, CD32a, CD32b или CD64. На ФИГ. 6А показано связывание антитела к CD40 на клетках СНО, экспрессирующих CD16F (вверху слева), CD16V (вверху справа), CD32a (внизу слева) или CD32b (внизу справа). На ФИГ. 6В показано связывание антитела к CD40 на клетках СНО, экспрессирующих CD64. На оси Y изображена средняя интенсивность флуоресценции (MFI), представляющая связывание; на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 7 показана антителозависимая клеточноопосредованная цитотоксичность (ADCC) под действием вариантов константных областей V273E или V273Y антитела huAb9-5 по сравнению с антителом huAb9-5 с IgG1 дикого типа в клетках RL. На оси Y изображен процент цитотоксичности для клеток RL; на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 8 показан эффект антитела huAb6-1 (вверху слева), huAb9-5 (внизу слева), huAb8-1 (вверху справа) с IgG1 человека дикого типа или вариантами константной области V273E или V273Y на пролиферацию В-клеток. На нижнем правом графике показаны эффекты huAb9 A2I с вариантом V273E IgG1 человека или CP-870893 на пролиферацию В-клеток. На оси Y изображена пролиферация В-клеток в виде числа импульсов в минуту (СРМ); на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 9 показан эффект антитела huAb6-1 (вверху слева), huAb9-5 (внизу слева) и huAb8-1 (вверху справа) с IgG1 человека дикого типа или вариантом константной области V273E или V273Y на активацию дендритных клеток (DC), измеренную по выработке IL-12p70 в пг/мл. На нижнем правом графике показана активация DC под действием huAb9 A2I с вариантом V273E IgG1 человека или CP-870893. На оси Y изображено количество IL-12p70 в пг/мл; на оси Х изображена доза антитела ("Образец") в мкг/мл.
На ФИГ. 10 показан эффект варианта V273Y huAb6-1, huAb8-1 или huAb9-5 на совместно культивируемые DC и T-клетки, измеренный по выработке интерферона-гамма (IFN-γ) в пг/мл.
На ФИГ. 11 показан эффект антител huAb6-1 (вверху), huAb9-5 (посредине) или huAb9 A2I (внизу) на объем опухоли (мм3) у профилактической мышиной модели PC3.
На ФИГ. 12 показаны in vivo эффекты после внутриопухолевой (IT) или внутрибрюшинной (IP) доставки антитела к CD40 1C10 или изотипического mIgG1 в мышиной модели, несущей билатерально приживленные сингенные опухоли CT26. IT введение доз выполняли в одну опухоль на одном боку без инъекции в опухоль на другом боку.
На ФИГ. 13 показаны эффекты в отношении объема опухоли (мм3) у мышиной модели с сингенной опухолью CT26 после введения два раза в неделю доз антитела к CD40 1C10 из расчета 0,6 мг/кг, антитела к PD-1 из расчета 10 мг/кг, или комбинированного лечения с помощью как антитела 1C10, так и антитела к PD-1.
На ФИГ. 14 показаны уровни ALT (вверху слева), TNFα ("TNFa", внизу слева) или IL-6 (внизу справа) через 24 часа после введения доз антитела к CD40 1C10 ("антитело к CD40"), антитела к PD-1 ("антитело к PD-1") или комбинированного лечения ("антитело к CD40+антитело к PD-1") у мышиной модели с сингенной опухолью CT26. На верхнем правом графике показана масса селезенки через 4 дня после введения дозы.
7. Подробное описание
Настоящее изобретение относится к антителам и фрагментам, которые специфически связывают CD40 человека (SEQ ID NO:40), композициям, содержащим данные антитела, полинуклеотидам, кодирующим антитела к CD40, клеткам-хозяевам, способным вырабатывать данные антитела, способам и композициям, применимым для получения данных антител и связывающих фрагментов, и к различным способам применения вышеуказанного.
Как будет понятно специалистам в данной области, антитела являются "модульными" по своей природе. На протяжении настоящего изобретения будут описаны различные конкретные варианты осуществления различных "модулей", составляющих антитела. В качестве конкретных неограничивающих примеров описаны различные конкретные варианты осуществления CDR VH, цепей VH, CDR VL и цепей VL. Предусмотрено, что все конкретные варианты осуществления могут быть объединены друг с другом, как если бы каждая конкретная комбинация была явно описана отдельно.
7.1. Сокращения
Описываемые в данном документе антитела, связывающие фрагменты, ADC и полинуклеотиды во многих вариантах осуществления описаны с помощью их соответствующих полипептидных или полинуклеотидных последовательностей. Если не указано иное, полипептидные последовательности представлены в ориентации N→C; полинуклеотидные последовательности - в ориентации 5'→3'. Для полипептидных последовательностей можно применять традиционные трех- или однобуквенные сокращения кодируемых генетическим кодом аминокислот, которые указаны в таблице 1 ниже.
Сокращения кодируемых аминокислот
Определенные последовательности определяются структурными формулами, указывающими аминокислотные остатки, относящиеся к определенным классам (например, алифатические, гидрофобные и т. д.). Различные классы, к которым относятся кодируемых генетическим кодом аминокислоты, используемые в данном документе, указаны в таблице 2 ниже. Некоторые аминокислоты могут относиться более чем к одному классу. Цистеин, который содержит сульфгидрильную группу, и пролин, который является конформационно ограниченным, не принадлежат ни к одному из классов.
Классы кодируемых аминокислот
Сокращения, используемые для различных иллюстративных антител, раскрытых в данном документе, приведены в таблице 3 ниже:
Сокращения антител
7.2. Определения
Если в данном документе не определено иначе, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понятны специалистами в данной области.
7.3. Антитела к CD40 и связывающие фрагменты
В одном аспекте настоящее изобретение относится к антителам и/или их связывающим фрагментам, которые специфически связывают рецептор CD40 человека (также известный как представитель 5 суперсемейства рецепторов фактора некроза опухоли, TNFRSF5, Bp50 и рецептор CD40L).
Используемый в данном документе термин "антитело" (Ab) относится к молекуле иммуноглобулина, которая специфически связывает конкретный антиген, в данном случае CD40. В некоторых вариантах осуществления антитела к CD40 по настоящему изобретению связываются с CD40 человека и тем самым модулируют, например, активируют иммунную систему. Полученный ответ иммунной системы ингибирует пролиферацию клеток, таких как опухолевые клетки, и в некоторых случаях является цитотоксическим для опухолевых клеток. Антитела к CD40 по настоящему изобретению содержат определяющие комплементарность участки (CDR), также известные как гипервариабельные участки, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркасными участками (FR). Как известно из уровня техники, аминокислотное положение/граница, определяющие гипервариабельный участок антитела, могут варьировать в зависимости от контекста, и из уровня техники известны различные определения. Некоторые положения в пределах вариабельного домена могут рассматривать как гибридные гипервариабельные положения в том смысле, что эти положения можно считать находящимися в пределах гипервариабельного участка по одному набору критериев, и в то же время их можно считать находящимися за пределами гипервариабельного участка по другому набору критериев. Одно или несколько из этих положений также могут находиться в расширенных гипервариабельных участках. В настоящем изобретении представлены антитела, содержащие модификации в таких гибридных гипервариабельных положениях. Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре участка FR, преимущественно принимающих конфигурацию β-складчатой структуры, соединенных тремя CDR, которые образуют петли, соединяющие β-складчатые структуры и в некоторых случаях образующие их часть. CDR в каждой цепи удерживаются в непосредственной близости друг от друга с помощью FR-участков и вместе с CDR из другой цепи участвуют в образовании мишень-связывающего центра антител. См. Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md. 1987). Используемая в данном документе нумерация аминокислотных остатков иммуноглобулина выполняется согласно системе нумерации аминокислотных остатков иммуноглобулина по Kabat et al., если не указано иное.
Антитела по настоящему изобретению могут быть поликлональными, моноклональными, сконструированными с помощью генной инженерии и/или иным образом модифицированными по своей природе, включая без ограничения химерные антитела, гуманизированные антитела, человеческие антитела, приматизированные антитела, одноцепочечные антитела и т. д. В различных вариантах осуществления антитела содержат всю или часть константной области антитела. В некоторых вариантах осуществления константная область представляет собой изотип, выбранный из: IgA (например, IgA1 или IgA2), IgD, IgE, IgG (например, IgG1, IgG2, IgG3 или IgG4) и IgM. В конкретных вариантах осуществления антитела к CD40, описанные в данном документе, содержат IgG1. В других вариантах осуществления антитела к CD40 содержат IgG2. В еще одних вариантах осуществления антитела к CD40 содержат IgG4. Используемая в данном документе "константная область" антитела предусматривает природную константную область, аллотипы или природные варианты, такие как D356E и L358M или A431G в IgG1 человека. См., например, Jefferis and Lefranc, MAbs, 1(4): 332-338 (Jul-Aug 2009).
Константная область легкой цепи антитела к CD40 может представлять собой область легкой каппа-цепи (κ) или лямбда-цепи (λ). Область легкой λ-цепи может принадлежать к любому из известных подтипов, например, λ1, λ2, λ3 или λ4. В некоторых вариантах осуществления антитело к CD40 содержит область легкой каппа-цепи (κ).
Используемый в данном документе термин "моноклональное антитело" не ограничивается антителами, полученными посредством гибридомной технологии. Моноклональное антитело получают из одного клона, включая любой эукариотический, прокариотический или фаговый клон, с помощью любых доступных или известных из уровня техники способов. Моноклональные антитела, применимые в случае настоящего изобретения, можно получать с применением огромного множества методик, известных из уровня техники, включая применение гибридомной технологии, рекомбинантной технологии и технологии фагового дисплея или их комбинации. Во многих путях применения по настоящему изобретению, включая in vivo применение антител к CD40 у людей, подходящим образом могут использоваться химерные, приматизированные, гуманизированные или человеческие антитела.
Используемый в данном документе термин "химерное" антитело относится к антителу, имеющему вариабельные последовательности, полученные из отличного от человеческого иммуноглобулина, такого как крысиное или мышиное антитело, и константные области человеческого иммуноглобулина, как правило, выбранные из матрицы человеческого иммуноглобулина. Способы получения химерных антител известны из уровня техники. См., например, Morrison, 1985, Science 229(4719):1202-7; Oi et al., 1986, BioTechniques 4:214-221; Gillies et al., 1985, J. Immunol. Methods 125:191-202; патенты США №№ 5807715; 4816567 и 4816397.
"Гуманизированные" формы отличных от человеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, которые содержат минимальные последовательности, полученные из отличного от человеческого иммуноглобулина. В целом, большинство гуманизированных антител будет содержать по меньшей мере один и, как правило, два вариабельных домена, в которых все или практически все участки CDR соответствуют таковым из отличного от человеческого иммуноглобулина, а все или практически все участки FR имеют последовательность человеческого иммуноглобулина. Гуманизированное антитело также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, таковую с консенсусной последовательностью человеческого иммуноглобулина. Способы гуманизации антитела известны из уровня техники. См, например, Riechmann et al., 1988, Nature 332:323-7; патенты США №№ 5530101, 5585089, 5693761, 5693762 и 6180370 от Queen et al.; EP239400, публикацию согласно PCT WO 91/09967; патент США № 5225539; EP592106, EP519596, Padlan, 1991, Mol. Immunol., 28:489-498; Studnicka et al., 1994, Prot. Eng. 7:805-814; Roguska et al., 1994, Proc. Natl. Acad. Sci. 91:969-973; и патент США № 5565332.
"Человеческие антитела" предусматривают антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, и они включают антитела, выделенные из библиотек человеческих иммуноглобулинов или из животных, которые являются трансгенными по одному или нескольким человеческим иммуноглобулинам и которые не экспрессируют эндогенные иммуноглобулины. Человеческие антитела можно получать различными способами, известными из уровня техники, включая способы фагового дисплея с применением библиотек антител, полученных из последовательностей человеческих иммуноглобулинов. См. патенты США №№ 4444887 и 4716111; и публикации согласно PCT WO 98/46645; WO 98/50433; WO 98/24893; WO 98/16654; WO 96/34096; WO 96/33735 и WO 91/10741. Человеческие антитела также можно получить с применением трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены человеческого иммуноглобулина. См., например, публикации согласно PCT WO 98/24893; WO 92/01047; WO 96/34096; WO 96/33735; патенты США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 и 5939598. Помимо этого, можно привлечь компании, такие как LakePharma, Inc. (Бельмонт, Калифорния) или Creative BioLabs (Ширли, Нью-Йорк), для получения человеческих антител, направленных на выбранный антиген, с применением технологии, подобной описанной выше. Полностью человеческие антитела, которые распознают выбранный эпитоп, можно создать с применением методики, обозначаемой "управляемый отбор". В данном подходе выбранное не относящееся к человеческому моноклональное антитело, например мышиное антитело, применяют для управления отбором целиком человеческого антитела, распознающего тот же эпитоп (см., Jespers et al., 1988, Biotechnology 12:899-903).
"Приматизированные антитела" содержат вариабельные области обезьян и константные области человека. Способы получения приматизированных антител известны из уровня техники. См., например, патенты США №№ 5658570, 5681722 и 5693780.
Антитела к CD40 по настоящему изобретению предусматривают полноразмерные (интактные) молекулы антитела, которые способны специфически связывать CD40, например, CD40 человека (SEQ ID NO:40).
Также раскрыты связывающие фрагменты антитела к CD40, которые способны специфически связывать CD40 человека. Примеры связывающих фрагментов антитела предусматривают в качестве примера, но без ограничения, Fab, Fab', F(ab')2, Fv-фрагменты, одноцепочечные Fv-фрагменты и однодоменные фрагменты.
Fab-фрагмент содержит константный и вариабельный домены легкой цепи и первый константный домен (CH1), а также вариабельный домен тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбокси-конце домена СН1 тяжелой цепи, включая один или несколько цистеиновых остатков из шарнирной области антитела. F(ab')-фрагменты получают путем расщепления дисульфидной связи в цистеиновых остатках шарнирной области продукта пепсинового расщепления F(ab')2. Рядовым специалистам в данной области известны дополнительные схемы химического связывания фрагментов антител. Fab- и F(ab')2-фрагменты, не содержащие Fc-фрагмент интактного антитела, быстрее выводятся из кровотока животных и могут характеризоваться меньшим неспецифическим связыванием в ткани, чем интактное антитело (см., например, Wahl et al., 1983, J. Nucl. Med. 24:316).
"Fv"-фрагмент представляет собой минимальный фрагмент антитела, который содержит полный центр распознавания и связывания мишени. Эту область составляет димер из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в плотной нековалентной связи (димер VH-VL). Они находятся в такой конфигурации, что три CDR каждого вариабельного домена взаимодействуют с образованием мишень-связывающего центра на поверхности димера VH-VL. Зачастую шесть CDR обеспечивают мишень-связывающую специфичность антитела. Однако в некоторых случаях даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфические в отношении мишени) может обладать способностью распознавать и связывать мишень, хотя и с более низкой аффинностью, чем полный центр связывания.
"Одноцепочечный Fv" или "scFv" связывающие фрагменты антитела содержат домены VH и VL антитела, причем эти домены присутствуют в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовать структуру, необходимую для связывания мишени.
"Однодоменные фрагменты" состоят из одного домена VH или VL, которые проявляют достаточную степень аффинности к CD40 человека. В конкретном варианте осуществления однодоменный фрагмент представляет собой камелизированное антитело (см., например, Riechmann, 1999, Journal of Immunological Methods 231:25-38).
Антитела к CD40 по настоящему изобретению предусматривают дериватизированные антитела. К примеру, но без ограничения, дериватизированные антитела, как правило, модифицированы посредством гликозилирования, ацетилирования, пегилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления и образования связи с клеточным лигандом или другим белком. Любую из многочисленных химических модификаций можно проводить с помощью известных методик, включая без ограничения специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т. д. Помимо этого, производное может содержать одну или несколько неприродных аминокислот, например, с применением технологии Ambryx (см., например, Wolfson, 2006, Chem. Biol. 13(10):1011-2).
Антитела к CD40 или связывающие фрагменты могут представлять собой антитела или фрагменты, последовательности которых были модифицированы для изменения по меньшей мере одной биологической эффекторной функции, опосредуемой константной областью. Например, в некоторых вариантах осуществления антитело к CD40 может быть модифицировано для ослабления по меньшей мере одной биологической эффекторной функции, опосредуемой константной областью, по сравнению с немодифицированным антителом, например, ослабление связывания с одним или несколькими Fc-рецепторами (FcγR), такими как FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и/или FcγRIIIB. Связывание с FcγR может быть ослаблено за счет мутирования сегмента константной области иммуноглобулина антитела в определенных участках, необходимых для взаимодействий с FcγR (см., например, Canfield and Morrison, 1991, J. Exp. Med. 173:1483-1491; и Lund et al., 1991, J. Immunol. 147:2657-2662). При ослаблении способности антитела к связыванию FcγR также могут ослабляться другие эффекторные функции, которые основаны на взаимодействиях с FcγR, таких как опсонизация, фагоцитоз и антигензависимая клеточная цитотоксичность ("ADCC").
Антитело к CD40 или связывающий фрагмент, описанные в данном документе предусматривают антитела, которые были модифицированы для приобретения или улучшения по меньшей мере одной биологической эффекторной функции, опосредуемой константной областью, по сравнению с немодифицированным антителом, например, улучшения взаимодействий с FcγR (см., например, заявку на патент США № 2006/0134709). Например, антитело к CD40 по настоящему изобретению может иметь константную область, которая связывает FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и/или FcγRIIIB с большей аффинностью, чем соответствующая константная область дикого типа.
Таким образом, антитела по настоящему изобретению могут характеризоваться изменениями в биологической активности, которые приводят к увеличению или уменьшению опсонизации, фагоцитоза или ADCC. Такие изменения известны из уровня техники. Например, модификации антител, которые ослабляют активность ADCC, описаны в патенте США № 5834597. Иллюстративный вариант, снижающий ADCC, соответствует "мутанту 3" (также известному как "M3", показанный на ФИГ. 4 патента США № 5834597), в котором остатки 234 и 237 (с использованием нумерации EU) замещены аланиновыми остатками. Разновидность мутант 3 (также известная как "M3") может быть использована в целом ряде изотипов антител, например IgG2.
В некоторых вариантах осуществления антитела к CD40 по настоящему изобретению характеризуются низкими уровнями фукозы или ее отсутствием. Отсутствие фукозы в антителах коррелировало с повышенной активностью ADCC, особенно при низких дозах антитела. См. Shields et al., 2002, J. Biol. Chem. 277:26733-26740; Shinkawa et al., 2003, J. Biol. Chem. 278:3466-73. Способы получения антител, не содержащих фукозу, предусматривают выращивание клеток YB2/0 миеломы крысы (ATCC CRL 1662). Клетки YB2/0 характеризуются низким уровнем экспрессии мРНК FUT8, которая кодирует α-1,6-фукозилтрансферазу, фермент, необходимый для фукозилирования полипептидов.
Антитела к CD40 по настоящему изобретению могут содержать модифицированные (или вариантные) домены CH2 или целые домены Fc, которые включают аминокислотные замены, увеличивающие связывание с FcγRIIB и/или ослабляющие связывание с FcγRIIIA по сравнению со связыванием соответствующего CH2 или области Fc дикого типа. Вариантные домены CH2 или вариантные домены Fc были описаны в заявке на патент США № 2014/0377253. Вариантный домен CH2 или вариантный домен Fc, как правило, включают одну или несколько замен в положении 263, положении 266, положении 273 и положении 305, при этом нумерация остатков в домене Fc приведена согласно EU-индексу по Kabat. В некоторых вариантах осуществления антитела к CD40 содержат одну или несколько замен относительно домена CH2 дикого типа, которые выбраны из V263L, V266L, V273C, V273E, V273F, V273L, V273M, V273S, V273Y, V305K и V305W. В конкретных вариантах осуществления одна или несколько замен в домене CH2 относительно домена CH2 IgG1 человека выбраны из V263L, V273E, V273F, V273M, V273S и V273Y. Например, одна или несколько замен в домене CH2 IgG1может представлять собой V273E. В другом конкретном варианте осуществления антитело к CD40 по настоящему изобретению содержит вариантную область CH2 IgG1, содержащую аминокислотную замену V263L.
Другие примеры вариантных доменов CH2 или вариантных доменов Fc, которые могут обеспечивать усиленное связывание с FcγRIIB и/или ослабленное связывание с FcγRIIIA по сравнению со связыванием соответствующей области CH2 или Fc дикого типа, включают примеры из Vonderheide et al. Clin. Cancer Res., 19 (5), 1035-1043 (2013), такие как S267E или S267E/L328F в IgG1 человека.
В некоторых вариантах осуществления антитела к CD40 или связывающие фрагменты включают модификации, которые увеличивают или уменьшают их аффинность связывания с фетальным Fc-рецептором FcRn, например, за счет мутирования сегмента константной области иммуноглобулина в определенных участках, вовлеченных во взаимодействия FcRn (см., например, WO 2005/123780). В конкретных вариантах осуществления антитело к CD40 класса IgG мутировано таким образом, что по меньшей мере один из аминокислотных остатков 250, 314 и 428 константной области тяжелой цепи замещен сам по себе или в любых их комбинациях, как, например, в положениях 250 и 428, или в положениях 250 и 314, или в положениях 314 и 428, или в положениях 250, 314 и 428, при этом конкретной комбинацией являются положения 250 и 428. В положении 250 замещающим аминокислотным остатком может быть любой аминокислотный остаток, отличный от треонина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, валин, триптофан или тирозин. В положении 314 замещающим аминокислотным остатком может быть любой аминокислотный остаток, отличный от лейцина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. В положении 428 замещающими аминокислотными остатками может быть любой аминокислотный остаток, отличный от метионина, включая без ограничения аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан или тирозин. Иллюстративной заменой, которая, как известно, модифицирует эффекторную функцию Fc, является замена M428L в Fc, которая может встречаться в комбинации с заменой T250Q в Fc. Дополнительные конкретные комбинации подходящих аминокислотных замен определены в таблице 1 патента США № 7217797. Такие мутации увеличивают связывание с FcRn, что защищает антитело от разрушения и увеличивает период его полужизни.
Антитело к CD40 может иметь одну или несколько аминокислот, вставленных в одну или несколько из его CDR, например, как описано в Jung and Plückthun, 1997, Protein Engineering 10: 9, 959-966; Yazaki et al., 2004, Protein Eng. Des Sel. 17(5):481-9. Epub 2004 Aug 17; и заявке на патент США № 2007/0280931.
Антитела к CD40 с аффинностью в отношении CD40 человека могут быть востребованными для терапевтических и диагностических путей применения. Соответственно, в настоящем изобретении рассматриваются антитела, характеризующиеся аффинностью связывания с CD40 человека. В конкретных вариантах осуществления антитела к CD40, которые связывают CD40 человека, характеризуются аффинностью, составляющей по меньшей мере приблизительно 1000 нМ, но могут проявлять более высокую аффинность, например, по меньшей мере приблизительно 900 нМ, 800 нМ, 700 нМ, 600 нМ, 500 нМ, 400 нМ, 300 нМ, 250 нМ, 200 нМ, 150 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,1 нМ, 0,01 нМ или даже выше. В некоторых вариантах осуществления антитела связывают CD40 человека с аффинностью, варьирующей в диапазоне от приблизительно 1 пM до приблизительно 1000 нМ, или аффинностью, варьирующей в диапазоне между любыми из вышеуказанных величин.
Аффинность антител к CD40 в отношении CD40 человека можно определять с применением методик, хорошо известных из уровня техники или описанных в данном документе, таких как, например, но без ограничения, ELISA, изотермическая титрационная калориметрия (ITC), поверхностный плазмонный резонанс или флуоресцентный поляризационный анализ.
Антитела к CD40 обычно содержат тяжелую цепь, содержащую вариабельную область (VH), имеющую три определяющих комплементарность участка ("CDR"), называемые в данном документе (в порядке N→C) CDR№1 VH, CDR№2 VH и CDR№3 VH, и легкую цепь, содержащую вариабельную область (VL), имеющую три определяющие комплементарность участка, называемые в данном документе (в порядке N→C) CDR№1 VL, CDR№2 VL и CDR№3 VL. В данном документе представлены аминокислотные последовательности иллюстративных CDR, а также аминокислотные последовательности областей VH и VL тяжелой и легкой цепей иллюстративных антител к CD40. Конкретные варианты осуществления антител к CD40 предусматривают такие иллюстративные последовательности CDR и/или VH и/или VL, а также антитела, которые конкурируют за связывание CD40 человека с такими антителами.
В некоторых вариантах осуществления аминокислотные последовательности CDR антитела к CD40 выбраны из следующих последовательностей:
GYTFTGYWIQ
GYTFTDYYMN
GFTFSDYYMS
GYSITTNYNWN
GYTFTSYWMH
GYTFTDYYIN
GYSITSNYYWN
GYSISSNYYWN
GYDITSNYYWN
(SEQ ID NO:2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(SEQ ID NO:5)
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
EILPGGDHTKYNEKFRG
DINPNNGGTSYNQKFKG
FIRNKANGYTTEFSASVKG
YIRHDGTNNYNPSLKN
NIDPSNGETHYNQKFKD
WIFPGSGSVYCNEQFKG
YIRYDGSNNYNPSLKN
NIDPSNGETHYAQKFQG
WIFPGSGSVYSNEQFKG
YIRYDGSNNYNPSLKS
YIRYDGSNNYNPSLKG
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
VGGDY
RGGLGRGTYALDY
YGGLRQGWYFDV
LDY
ERIYYSGSTYDGYFDV
SLGKFAY
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:37)
RSSQSLVNSNENTYLH
RASQDISNYLN
RASQDIRNYLN
RSSQSLENSYGNTFLN
SASSSLSYMH
KASQSVVTAVA
RSSQSLENTNGNTFLN
RSSQSLENSNGNTFLN
(SEQ ID NO:52)
(SEQ ID NO:53)
(SEQ ID NO:54)
(SEQ ID NO:55)
(SEQ ID NO:56)
(SEQ ID NO:57)
(SEQ ID NO:58)
(SEQ ID NO:59)
KVFNRYS
YTSRLHL
YTSRLHS
RVSNRFC
DTSKLAS
SASNRYT
RVSNRFS
RISNRFS
(SEQ ID NO:62)
(SEQ ID NO:63)
(SEQ ID NO:64)
(SEQ ID NO:65)
(SEQ ID NO:66)
(SEQ ID NO:67)
(SEQ ID NO:68)
(SEQ ID NO:69)
FQSTHVPWT
QQGNTLPLT
QQGKTLPWT
LQVTHVPYT
QQWSSNPWT
QQYSSYPYT
LQVTHVPFT
(SEQ ID NO:82)
(SEQ ID NO:83)
(SEQ ID NO:84)
(SEQ ID NO:85)
(SEQ ID NO:86)
(SEQ ID NO:87)
(SEQ ID NO:88)
В некоторых вариантах осуществления каждый CDR антитела к CD40 независимо от других выбран таким образом, что его последовательность соответствует соответственному CDR антитела, представленного в таблице 3. В некоторых вариантах осуществления антитело к CD40 представляет собой IgG и имеет VH и VL, последовательность которых соответствует VH и VL антитела, представленного в таблице 3.
В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательности которой соответствует любой из SEQ ID NO:101, 102, 103, 104, 105, 106, 107, 108 или 109; и цепь VL, последовательность которой соответствует любой из SEQ ID NO:151, 152, 153, 154, 155, 156, 157, 158, 159 или 160. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:101, и цепь VL, последовательность которой соответствует SEQ ID NO:151. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:102, и цепь VL, последовательность которой соответствует SEQ ID NO:152. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:103, и цепь VL, последовательность которой соответствует SEQ ID NO:153. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:104, и цепь VL, последовательность которой соответствует SEQ ID NO:154. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:105, и цепь VL, последовательность которой соответствует SEQ ID NO:155. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:106, и цепь VL, последовательность которой соответствует SEQ ID NO:156. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:106, и цепь VL, последовательность которой соответствует SEQ ID NO:157. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:107, и цепь VL, последовательность которой соответствует SEQ ID NO:158. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:108, и цепь VL, последовательность которой соответствует SEQ ID NO:159. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:109, и цепь VL, последовательность которой соответствует SEQ ID NO:160.
Конкретные иллюстративные варианты осуществления антител к CD40 с вышеуказанными CDR описаны в данном документе. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 1, 11, 31, 51, 61 и 81. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 2, 12, 32, 52, 62 и 82. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 3, 13, 33, 53, 63 и 83. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 4, 14, 34, 54, 64 и 84. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 5, 15, 35, 55, 65 и 85. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 6, 16, 36, 56, 66 и 86. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 6, 19, 36, 56, 66 и 86. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 7, 17, 37, 57, 67 и 87. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 7, 20, 37, 57, 67 и 87. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 8, 18, 35, 58, 68 и 88. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 9, 21, 35, 58, 68 и 88. В некоторых вариантах осуществления антитело к CD40 имеет CDR под SEQ ID NO: 10, 22, 35, 58, 68 и 88.
В некоторых вариантах осуществления антитело к CD40 является подходящим для введения человеку. В конкретном варианте осуществления антитело к CD40 является гуманизированным. В другом конкретном варианте осуществления аминокислотные последовательности CDR антитела к CD40 выбраны из:
GYTFTDYYIN
GYSITSNYYWN
GYSISSNYYWN
GYDITSNYYWN
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
YIRYDGSNNYNPSLKN
NIDPSNGETHYAQKFQG
WIFPGSGSVYSNEQFKG
YIRYDGSNNYNPSLKS
YIRYDGSNNYNPSLKG
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
ERIYYSGSTYDGYFDV
SLGKFAY
(SEQ ID NO:36)
(SEQ ID NO:37)
KASQSVVTAVA
RSSQSLENTNGNTFLN
(SEQ ID NO:57)
(SEQ ID NO:58)
SASNRYT
RVSNRFS
(SEQ ID NO:67)
(SEQ ID NO:68)
QQYSSYPYT
LQVTHVPFT
(SEQ ID NO:87)
(SEQ ID NO:88)
В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует любой из SEQ ID NO:110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122 или 123; и цепь VL, последовательность которой соответствует любой из SEQ ID NO:161, 162, 163, 164, 165, 166, 167, 168, 169, 170 или 171. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:110, и цепь VL, последовательность которой соответствует SEQ ID NO:161. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:111, и цепь VL, последовательность которой соответствует SEQ ID NO:161. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:112, и цепь VL, последовательность которой соответствует SEQ ID NO:161. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:113, и цепь VL, последовательность которой соответствует SEQ ID NO:162. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:114, и цепь VL, последовательность которой соответствует SEQ ID NO:162. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:115, и цепь VL, последовательность которой соответствует SEQ ID NO:162. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:116, и цепь VL, последовательность которой соответствует SEQ ID NO:163. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:163. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:118, и цепь VL, последовательность которой соответствует SEQ ID NO:163. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:116, и цепь VL, последовательность которой соответствует SEQ ID NO:164. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:164. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:119, и цепь VL, последовательность которой соответствует SEQ ID NO:165. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:120, и цепь VL, последовательность которой соответствует SEQ ID NO:165. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:121, и цепь VL, последовательность которой соответствует SEQ ID NO:166. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:167. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:168. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:169. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:170. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:117, и цепь VL, последовательность которой соответствует SEQ ID NO:171. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:118, и цепь VL, последовательность которой соответствует SEQ ID NO:164. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:122, и цепь VL, последовательность которой соответствует SEQ ID NO:167. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:122, и цепь VL, последовательность которой соответствует SEQ ID NO:168. В некоторых вариантах осуществления антитело к CD40 содержит цепь VH, последовательность которой соответствует SEQ ID NO:123, и цепь VL, последовательность которой соответствует SEQ ID NO:169.
В некоторых вариантах осуществления антитела к CD40 конкурируют с эталонным антителом за связывание CD40 человека в in vitro анализах. В некоторых вариантах осуществления антитела к CD40 конкурируют за связывание CD40 человека на клетках, экспрессирующих CD40 человека. Эталонное антитело может представлять собой любое из антител к CD40, описанных в данном документе. В некоторых вариантах осуществления эталонное антитело представляет собой антитело, представленное в таблице 3. В конкретных вариантах осуществления эталонное антитело выбрано из антитела AD163.9.3 ("muAb1"); антитела AD166.4.4 ("muAb2"); антитела AD175.14.11 ("muAb3"); антитела AD163.10.7 ("muAb4"); антитела AD165.1.2 ("muAb5"); антитела AD163.162.1 ("muAb6"); антитела AD163.27.12 ("muAb7"); антитела AD163.7.2 ("muAb8"); антитела AD164.14.6 ("muAb9") и антитела AD164.76.2 ("muAb10"). В некоторых вариантах осуществления эталонное антитело представляет собой гуманизированную версию антитела, представленного в таблице 3. В некоторых вариантах осуществления эталонное антитело представляет собой гуманизированную версию muAb6, muAb8 или muAb9. В конкретном варианте осуществления эталонное антитело представляет собой huAb9-2. В другом варианте осуществления эталонное антитело представляет собой huAb9-5. В другом конкретном варианте осуществления эталонное антитело представляет собой huAb9 A2I.
Могут встречаться посттрансляционные модификации последовательностей антитела к CD40, такие как отщепление одного или нескольких (например, 1, 2, 3 и более) аминокислотных остатков на С-конце тяжелой цепи антитела.
В некоторых вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно любой из SEQ ID NO: 130-135 и легкую цепь согласно SEQ ID NO: 140-142. В определенных вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно SEQ ID NO: 130 или 131 и легкую цепь согласно SEQ ID NO: 140. В определенных вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно SEQ ID NO: 132 или 133 и легкую цепь согласно SEQ ID NO: 140. В определенных вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно SEQ ID NO: 134 или 135 и легкую цепь согласно SEQ ID NO: 140. В определенных вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно SEQ ID NO: 132 или 133 и легкую цепь согласно SEQ ID NO: 141. В определенных вариантах осуществления антитело к CD40 содержит тяжелую цепь согласно SEQ ID NO: 132 или 133 и легкую цепь согласно SEQ ID NO: 142.
Антитела к CD40, описанные в данном документе обычно специфически связываются с CD40 человека. Перекрестная реактивность антител при связывании CD40 от других видов, например, обезьяны, например, макака-крабоеда, может обеспечивать такие преимущества, как возможность тестирования биологической активности на животных моделях в виде обезьян. Такое тестирование на животной модели можно использовать для скрининга антител к CD40 для отбора по свойствам, например, благоприятным фармакокинетическим параметрам. В некоторых вариантах осуществления антитела к CD40 связываются с CD40 макака-крабоеда.
Анализы конкурентного связывания включают без ограничения иммунологический анализ с мечением радиоактивным веществом (RIA), твердофазный иммуноферментный анализ (ELISA), сэндвич-ELISA, анализы по методу сортировки клеток с активированной флуоресценцией (FACS) и анализы по методу поверхностного плазмонного резонанса.
При проведении анализа конкурентного связывания антител между эталонным антителом и тестируемым антителом (независимо от вида или изотипа) сначала можно пометить эталонное антитело с помощью детектируемой метки, такой как флуорофор, биотин, или ферментативной (или даже радиоактивной) метки для обеспечения возможности последующей идентификации. В этом случае клетки, экспрессирующие CD40 человека, инкубируют с немеченым тестируемым антителом, добавляют меченое эталонное антитело и измеряют интенсивность связанной метки. Если тестируемое антитело конкурирует с меченым эталонным антителом за счет связывания с частично совпадающим эпитопом, интенсивность будет пониженной по сравнению с контрольной реакцией, проводимой без тестируемого антитела.
В конкретном варианте осуществления данного анализа сначала определяют концентрацию меченого эталонного антитела, которая приводит к 80% от максимального связывания ("конц.80%") в условиях проведения анализа (например, при определенной плотности клеток), и анализ конкурентного связывания проводят с 10X конц.80% немеченого тестируемого антитела и конц.80% меченого эталонного антитела.
Ингибирование можно выразить в виде константы ингибирования или Ki, которую рассчитывают по следующей формуле:
Ki=IC50/ (1+[концентрация эталонного Ab]/Kd),
где IC50 представляет собой концентрацию тестируемого антитела, которая приводит к 50%-ному ослаблению связывания эталонного антитела, а Kd представляет собой константу диссоциации эталонного антитела, показатель его аффинности в отношении CD40 человека. Антитела, которые конкурируют с антителами к CD40, раскрытыми в данном документе, могут характеризоваться Ki, составляющей от 10 пM до 1000 нМ в условиях анализа, описанных в данном документе.
В различных вариантах осуществления считается, что тестируемое антитело конкурирует с эталонным антителом, если оно уменьшает связывание эталонного антитела на по меньшей мере приблизительно 20% или более, например, на по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или даже более, или на процент, варьирующий в диапазоне между любыми из вышеуказанных величин, при концентрации эталонного антитела, которая составляет 80% от максимального связывания при конкретных условиях анализа, а концентрации тестируемого антитела, которая в 10 раз превышает концентрацию эталонного антитела.
Антитела к CD40, описанные в данном документе, могут служить агонистами CD40 человека (SEQ ID NO:40) за счет активации CD40 человека посредством по меньшей мере двух механизмов действия. В некоторых вариантах осуществления антитело к CD40 связывает CD40 человека в отсутствие CD40L (SEQ ID NO:41) и усиливает передачу сигнала от CD40 человека. В некоторых вариантах осуществления антитело к CD40 связывается с комплексом связанных CD40L-CD40 и усиливает передачу сигнала от CD40 человека. В некоторых вариантах осуществления антитело к CD40 конкурирует за связывание CD40 человека (SEQ ID NO:40) с контрольным антителом, выбранным из гуманизированного антитела, перечисленного в таблице 3, и активирует CD40 человека независимо от лиганда CD40 человека (SEQ ID NO:41), т. е. в отсутствие или при наличии CD40L.
Эффект антител CD40 на взаимодействие CD40-CD40L человека можно определить с помощью анализов, известных из уровня техники, таких как анализ конкурентного связывания CD40L, описанный в примере 2. Соотношение OD450, измеренной в образцах, содержащих антитела к CD40, и OD450, измеренной в образцах с антителом изотипического контроля ("соотношение OD450"), можно использовать для определения эффекта антитела к CD40 на связывание CD40L человека с CD40 человека. Отношение OD450, составляющее 1, указывает на отсутствие эффекта; составляющее меньше 1, указывает на конкуренцию с CD40L; составляющее больше 1, указывает на усиление связывания CD40L с CD40. В некоторых вариантах осуществления антитело к CD40 увеличивает (т. е. усиливает) связывание CD40L человека (SEQ ID NO:41) с CD40 человека (SEQ ID NO:40), как определено по соотношению OD450. Усиление связывания CD40L с CD40, определенное с помощью соотношения OD450, составляет по меньшей мере приблизительно 1,2, как, например приблизительно 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,2, 2,4, 2,5, 2,6, 2,8, 3,0 или более.
Конкретный анализ и условия анализа, пригодные для проведения оценки того, конкурирует ли антитело за связывание CD40 человека с эталонным антителом, как описано в данном документе, приведены в примере 2. Конкуренцию антител за связывание можно определять с помощью анализа поверхностного плазмонного резонанса, описываемого в примере 2, или протокола конкурентного связывания, описанного в разделе 8.4.3.
Несмотря на то, что агонистическое антитело к CD40 активирует иммунную систему для обеспечения противоопухолевого действия, широкая активация всех типов клеток иммунной системы может приводить к нежелательным побочным эффектам. Соответственно, в некоторых вариантах осуществления антитело к CD40 приводит к избирательной активации иммунного ответа, опосредуемого дендритного клетками, а не В-клеточного иммунного ответа, в отличие от эталонного антитела к CD40. В некоторых вариантах осуществления эталонное антитело к CD40 представляет собой CP-870893. В некоторых вариантах осуществления антитело к CD40 характеризуется аналогичной активностью при активации дендритных клеток, например, при заданной дозе приводит к выработке IL-12p70 в пределах приблизительно 200%, например, в пределах приблизительно 180%, 150%, 130%, 110%, 100%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 25%, 20%, 15%, 10% или приблизительно 5%, по сравнению с выработкой IL-12p70 при той же дозе эталонного антитела CD40 в анализе, описанном в разделе 8.1.3. В некоторых вариантах осуществления антитело к CD40 характеризуется более низкой эффективностью при активации В-клеток по сравнению с эталонным антителом к CD40. Соотношение EC50 для В-клеток у антитела к CD40 и эталонного антитела к CD40 может составлять больше, чем приблизительно 1,5, как, например приблизительно 2, 3, 4, 5, 6, 8, 10, 15, 20, 30, 40, 50 или больше, в анализе, описанном в разделе 8.5.3. В некоторых вариантах осуществления антитело к CD40 характеризуется аналогичной активностью при активации дендритной клетки и более низкой эффективностью при активации В-клетки по сравнению с эталонным антителом к CD40.
7.4. Полинуклеотиды, кодирующие антитела к CD40, системы экспрессии и способы получения антител
Настоящее изобретение охватывает молекулы нуклеиновой кислоты, кодирующие гены легкой и тяжелой цепи иммуноглобулинов для антител к CD40, векторы, содержащие такие нуклеиновые кислоты, и клетки-хозяева, способные вырабатывать антитела к CD40 по настоящему изобретению.
Антитело к CD40 по настоящему изобретению может быть получено за счет рекомбинантной экспрессии генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или несколькими рекомбинантными векторами экспрессии, несущими фрагменты ДНК, кодирующие легкую и тяжелую цепи иммуноглобулина для антитела, вследствие чего легкая и тяжелая цепи экспрессируются в клетке-хозяине и, необязательно, секретируются в среду, в которой культивируются клетки-хозяева, при этом из данной среды антитела можно выделять. Для получения генов тяжелой и легкой цепей антитела, встраивания данных генов в векторы для рекомбинантной экспрессии и введения векторов в клетки-хозяева применяют стандартные методики рекомбинантной ДНК, такие как описанные в Molecular Cloning; A Laboratory Manual, Second Edition (Sambrook, Fritsch and Maniatis (eds), Cold Spring Harbor, N. Y., 1989), Current Protocols in Molecular Biology (Ausubel, F.M. et al., eds., Greene Publishing Associates, 1989) и в патенте США № 4816397.
Для получения нуклеиновых кислот, кодирующих такие антитела к CD40, сначала получают фрагменты ДНК, кодирующие вариабельные области легкой и тяжелой цепи. Данные ДНК можно получить за счет амплификации и модификации ДНК зародышевого типа или кДНК, кодирующей последовательности вариабельных областей легкой и тяжелой цепей, например, с применением полимеразной цепной реакции (ПЦР). Из уровня техники известны последовательности ДНК зародышевого типа для генов вариабельных областей тяжелой и легкой цепей человека (см., например, базу данных последовательностей зародышевого типа человека "VBASE"; см. также Kabat, E. A. et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., 1992, J. Mol. Biol. 22T:116-198; и Cox et al., 1994, Eur. J. Immunol. 24:827-836; содержание каждой из которых включено в данный документ посредством ссылки).
После получения фрагментов ДНК, кодирующих сегменты VH и VL, связанные с антителом к CD40, такие фрагменты ДНК можно дополнительным подвергнуть манипуляциям с помощью стандартных методик рекомбинантной ДНК, например, для превращения генов вариабельной области в гены полноразмерной цепи антитела, в гены Fab-фрагмента или в ген scFv. В ходе таких манипуляций фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Подразумевается, что термин "функционально связанный", используемый в данном контексте, означает, что два фрагмента ДНК соединены таким образом, что аминокислотные последовательности, кодируемые этими двумя фрагментами ДНК, остаются в пределах рамки считывания.
Выделенную ДНК, кодирующую область VH, можно превратить в ген полноразмерной тяжелой цепи путем функционального связывания ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2, CH3 и необязательно CH4). Последовательности генов константных областей тяжелых цепей человека известны из уровня техники (см., например, Kabat, E.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получить с помощью стандартной ПЦР-амплификации. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но в определенных вариантах осуществления она принадлежит IgG1 или IgG4. Для получения гена тяжелой цепи Fab-фрагмента ДНК, кодирующую VH, можно функционально связывать с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно превратить в ген полноразмерной легкой цепи (а также ген легкой цепи Fab) путем функционального связывания ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности генов константных областей легкой цепи человека известны из уровня техники (см., например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получить с помощью стандартной ПЦР-амплификации. Константная область легкой цепи может представлять собой константную область каппа-цепи или лямбда-цепи, но в определенных вариантах осуществления она представляет собой константную область каппа-цепи. Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, функционально связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4~Ser)3 (SEQ ID NO:200), таким образом, чтобы последовательности VH и VL могли экспрессироваться в виде непрерывного одноцепочечного белка с областями VL и VH, соединенными гибким линкером (см., например, Bird et al., 1988, Science 242:423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., 1990, Nature 348:552-554).
Для экспрессии антител к CD40 по настоящему изобретению ДНК, кодирующие неполные или полноразмерные легкую и тяжелую цепи, полученные, как описано выше, вставляют в векторы экспрессии, вследствие чего гены становятся функционально связанными с последовательностями контроля транскрипции и трансляции. В данном контексте подразумевается, что термин "функционально связанный" означает, что ген антитела лигируют в вектор таким образом, чтобы последовательности контроля транскрипции и трансляции внутри вектора выполняли свою предусматриваемую функцию, заключающуюся в регулировании транскрипции и трансляции гена антитела. Вектор экспрессии и последовательности, контролирующие экспрессию, выбирают так, чтобы они были совместимыми с используемой для экспрессии клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела можно вставить в отдельные векторы или, что более типично, оба гена вставляют в один и тот же вектор экспрессии.
Гены антитела вставляют в вектор экспрессии с помощью стандартных способов (например, путем лигирования комплементарных сайтов рестрикции на фрагменте гена антитела и векторе или путем лигирования "тупых" концов, если сайты рестрикции отсутствуют). До вставки последовательностей легкой или тяжелой цепи, связанных с антителом к CD40, вектор экспрессии уже может нести последовательности константных областей антитела. Например, один подход к превращению последовательностей VH и VL, связанных с моноклональными антителами к CD40, в гены полноразмерного антитела, заключается в том, чтобы вставить их в векторы экспрессии, которые уже кодируют константные области тяжелой и легкой цепи соответственно, вследствие чего сегмент VH функционально связывается с сегментом(сегментами) СН внутри вектора, а сегмент VL функционально связывается с сегментом CL внутри вектора. Дополнительно или альтернативно, вектор для рекомбинантной экспрессии может кодировать сигнальный пептид, который содействует секреции цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор таким образом, чтобы сигнальный пептид был связан в рамке считывания с амино-концом цепи антитела, кодируемой геном. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т. е. сигнальный пептид из отличного от иммуноглобулина белка).
В дополнение к генам цепи антитела векторы для рекомбинантной экспрессии по настоящему изобретению несут регуляторные последовательности, которые контролируют экспрессию генов цепи антитела в клетке-хозяине. Подразумевается, что термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые обеспечивают контроль транскрипции или трансляции генов цепей антитела. Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA, 1990. Специалистам в данной области будет понятно, что конструирование вектора экспрессии, в том числе выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, необходимый уровень экспрессии белка и т. д. Подходящие регуляторные последовательности для экспрессии в клетках-хозяевах, полученных от млекопитающего, включают вирусные элементы, которые приводят к высоким уровням экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и вируса полиомы. Более подробное описание вирусных регуляторных элементов и их последовательностей см., например, в патенте США № 5168062 от Stinski, патенте США № 4510245 от Bell et al. и патенте США № 4968615 от Schaffner et al.
В дополнение к генам цепи антитела и регуляторным последовательностям рекомбинантные векторы экспрессии по настоящему изобретению могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и гены селектируемых маркеров. Ген селектируемого маркера облегчает отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017, все от Axel et al.). Например, как правило, ген селектируемого маркера придает клетке-хозяину, в которую был введен вектор, устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат. Подходящие гены селектируемых маркеров предусматривают ген дигидрофолатредуктазы (DHFR) (для применения в DHFR- клетках-хозяевах с отбором/амплификацией под действием метотрексата) и ген neo (для отбора по G418). Для экспрессии легкой и тяжелой цепей вектор(векторы) экспрессии, кодирующий(кодирующие) тяжелую и легкую цепи, вводят в клетку-хозяина путем трансфекции с помощью стандартных методик. Подразумевается, что различные формы термина "трансфекция" охватывают огромное множество методик, широко применяемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, липофекцию, осаждение с помощью фосфата кальция, трансфекцию, опосредованную DEAE-декстраном, и т. п.
Антитела по настоящему изобретению можно экспрессировать либо в прокариотических, либо в эукариотических клетках-хозяевах. В определенных вариантах осуществления экспрессия антител осуществляется в эукариотических клетках, например клетках-хозяевах, полученных от млекопитающего, с оптимальной секрецией надлежащим образом свернутого и иммунологически активного антитела. Иллюстративные клетки-хозяева, полученные от млекопитающего, для экспрессии рекомбинантных антител по настоящему изобретению включают клетки яичников китайского хомячка (CHO) (включая клетки DHFR CHO, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, применяемые с селектируемым маркером DHFR, например, как описано в Kaufman and Sharp, 1982, Mol. Biol. 159:601-621), клетки миеломы NSO, клетки COS и клетки SP2. Когда векторы для рекомбинантной экспрессии, кодирующие гены антитела, вводятся в клетки-хозяева, полученные от млекопитающего, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения возможности экспрессии антитела в клетках-хозяевах или секреции антитела в культуральную среду, в которой клетки-хозяева выращиваются. Антитела можно выделять из культуральной среды с применением стандартных способов очистки белка. Клетки-хозяева также можно применять для получения частей интактных антител, таких как Fab-фрагменты или молекулы scFv. Понятно, что видоизменения вышеописанной процедуры находятся в пределах объема настоящего изобретения. Например, может потребоваться трансфекция клетки-хозяина с помощью ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела к CD40 по настоящему изобретению.
Технологию рекомбинантной ДНК также можно применять для удаления некоторых или всех ДНК, кодирующих любую одну или обе из легкой и тяжелой цепей, которые не являются необходимыми для связывания CD40 человека. Антитела по настоящему изобретению также охватывают молекулы, экспрессируемые за счет таких усеченных молекул ДНК.
Для рекомбинантной экспрессии антитела к CD40 по настоящему изобретению, можно осуществлять совместную трансфекцию клетки-хозяина двух векторов экспрессии по настоящему изобретению, первого вектора, кодирующего полипептид, полученный из тяжелой цепи, и второго вектора, кодирующего полипептид, полученный из легкой цепи. Два вектора могут содержать идентичные селектируемые маркеры, или каждый из них может содержать отдельный селектируемый маркер. В качестве альтернативы, можно применять один вектор, который кодирует полипептиды как тяжелой, так и легкой цепей.
После получения нуклеиновой кислоты, кодирующей одну или несколько частей антитела к CD40, в кодирующую последовательность могут быть введены дополнительные изменения или мутации, например, для получения нуклеиновых кислот, кодирующих антитела с отличающимися последовательностями CDR, антитела со сниженной аффинностью в отношении Fc-рецептора или антитела других подклассов.
Антитела к CD40 по настоящему изобретению также могут быть получены за счет химического синтеза (например, с помощью способов, описанных в Solid Phase Peptide Synthesis, 2nd ed., 1984 The Pierce Chemical Co., Rockford, Ill.). Вариантные антитела также могут быть получены с применением бесклеточной платформы (см., например, Chu et al., Biochemia No. 2, 2001 (Roche Molecular Biologicals) и Murray et al., 2013, Current Opinion in Chemical Biology, 17: 420-426).
После того как антитело к CD40 по настоящему изобретению было получено за счет рекомбинантной экспрессии, его можно очистить с помощью любого известного из уровня техники способа очистки молекулы иммуноглобулина, например, с помощью хроматографии (например, ионообменной, аффинной и эксклюзионной колоночной хроматографии), центрифугирования, методики, основанной на дифференциальной растворимости, или любой другой стандартной методики для очистки белков. Кроме того, для облегчения очистки антитела к CD40 по настоящему изобретению можно сливать с гетерологичными полипептидными последовательностями, описанными в данном документе или иным образом известными из уровня техники.
После выделения антитела к CD40, при необходимости его можно подвергать дополнительной очистке, например, с помощью высокоэффективной жидкостной хроматографии (см., например, Fisher, Laboratory Techniques In Biochemistry And Molecular Biology, Work and Burdon, eds., Elsevier, 1980) или гель-фильтрационной хроматографии на колонке Superdex™ 75 (Pharmacia Biotech AB, Уппсала, Швеция).
7.5. Фармацевтические композиции
Антитела к CD40, описанные в данном документе, могут быть составлены в виде композиций, содержащих антитело и один или несколько носителей, наполнителей и/или разбавителей. Композиции могут быть составлены для конкретных путей применения, как, например, для путей применения в ветеринарии или для фармацевтических путей применения у человека. Форма композиции (например, сухой порошок, жидкий состав и т. д.) и наполнители, разбавители и/или носители будут зависеть от предполагаемых путей применения антитела и, в случае терапевтических путей применения, способа введения.
В случае терапевтических путей применения композиции могут обеспечиваться как часть стерильной фармацевтической композиции, которая содержит фармацевтически приемлемый носитель. Такая композиция может быть составлена в виде любой приемлемой формы (в зависимости от необходимого способа введения ее субъекту, например, человеку, т. е. пациенту). Фармацевтическую композицию можно вводить субъекту разнообразными путями, такими как пероральный, трансдермальный, подкожный, интраназальный, внутривенный, внутримышечный, внутриопухолевый, интратекальный, местный или локальный. Наиболее подходящий способ введения в любом конкретном случае будет зависеть от конкретного антитела, субъекта, природы и тяжести заболевания и физического состояния субъекта. Фармацевтическую композицию, как правило, вводят внутривенно или подкожно.
В целях удобства фармацевтические композиции могут быть представлены в виде единичных дозированных форм, содержащих заранее определенное количество антитела к CD40, описанного в настоящем документе, на дозу. Количество антитела к CD40, включенного в единичную дозу, будет зависеть от заболевания, подлежащего лечению, а также от других факторов, хорошо известных из уровня техники. Такие единичные дозы могут быть представлены в форме лиофилизированного сухого порошка, содержащего количество антитела, подходящее для одного введения, или в форме жидкости. Единичные лекарственные формы в виде сухого порошка могут быть упакованы в набор, содержащий шприц, подходящее количество разбавителя и/или другие компоненты, применимые для введения. В целях удобства единичные дозы в жидкой форме могут обеспечиваться в форме шприца, предварительно заполненного количеством антитела к CD40, подходящим для одного введения.
Фармацевтические композиции также могут обеспечиваться в нерасфасованной форме, содержащей количества антитела к CD40, подходящие для многократных введений.
Фармацевтические композиции могут быть приготовлены для хранения в виде лиофилизированных составов или водных растворов путем смешивания антитела, имеющего необходимую степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами, как правило, используемыми в данной области техники (все из которых в данном документе называются "носители"), т. е. буферными средствами, стабилизирующими средствами, консервантами, изотонирующими добавками, неионогенными детергентами, антиоксидантами и разными другими добавками. См. Remington's Pharmaceutical Sciences, 16th edition (Osol, ed. 1980). Такие добавки должны быть нетоксичными для получающих их пациентов в используемых дозах и концентрациях.
Буферные средства помогают поддерживать pH в диапазоне, близком к физиологическим условиям. Они могут присутствовать в самых разных концентрациях, но, как правило, они будут присутствовать в концентрациях от приблизительно 2 мМ до приблизительно 50 мМ. Подходящие буферные средства для применения по настоящему изобретению предусматривают как органические, так и неорганические кислоты и их соли, как, например, цитратные буферы (например, смесь цитрата мононатрия и цитрата динатрия, смесь лимонной кислоты и цитрата тринатрия, смесь лимонной кислоты и цитрата мононатрия и т. п.), сукцинатные буферы (например, смесь янтарной кислоты и сукцината мононатрия, смесь янтарной кислоты и гидроксида натрия, смесь янтарной кислоты и сукцината динатрия и т. п.), тартратные буферы (например, смесь винной кислоты и тартрата натрия, смесь винной кислоты и тартрата калия, смесь винной кислоты и гидроксида натрия и т. п.), фосфатные буферы (например, смесь фосфорной кислоты и фосфата мононатрия, смесь фосфорной кислоты и фосфата динатрия, смесь фосфата мононатрия и фосфата динатрия и т. п.), глюконатные буферы (например, смесь глюконовой кислоты и глюконата натрия, смесь глюконовой кислоты и гидроксида натрия, смесь глюконовой кислоты и глюконата калия и т. п.), оксалатный буфер (например, смесь щавелевой кислоты и оксалата натрия, смесь щавелевой кислоты и гидроксида натрия, смесь щавелевой кислоты и оксалата калия и т. п.), лактатные буферы (например, смесь молочной кислоты и лактата натрия, смесь молочной кислоты и гидроксида натрия, смесь молочной кислоты и лактата калия и т. п.) и ацетатные буферы (например, смесь уксусной кислоты и ацетата натрия, смесь уксусной кислоты и гидроксида натрия и т. п.). Помимо этого, можно использовать фумаратные буферы, гистидиновые буферы и соли триметиламина, такие как 2-амино-2-гидроксилметил-пропан-1,3-диол (т. е, Tris, THAM или трис(гидроксиметил)аминометан).
Для обеспечения изотоничности жидких композиций по настоящему изобретению можно добавить изотонирующие добавки, иногда известные как "стабилизаторы", и они включают многоатомные сахароспирты, например трехатомные или высшие сахароспирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Стабилизаторы относятся широкой категории наполнителей, которые могут выполнять функцию от объемообразующего средства до добавки, которая солюбилизирует терапевтическое средство или помогает предотвратить денатурацию или прилипание к стенке контейнера. Типичные стабилизаторы могут представлять собой многоатомные сахароспирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т. д., органические сахара или сахароспирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинозит, галактит, глицерин и т. п., включая циклиты, такие как инозит; полиэтиленгликоль; полимеры аминокислот; серосодержащие восстанавливающие средства, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (например, пептиды из 10 остатков или меньше); гидрофильные полимеры, такие как поливинилпирролидон; моносахариды, такие как ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза и трегалоза; и трисахариды, такие как раффиноза; и полисахариды, такие как декстран. Стабилизаторы могут присутствовать в количествах, варьирующих от 0,5 до 10 мас. % в пересчете на массу антитела к CD40.
Неионогенные поверхностно-активные вещества или детергенты (также известные как "смачивающие средства") можно добавлять для содействия солюбилизации гликопротеина, а также для защиты гликопротеина от агрегации, вызываемой перемешиванием, что также позволяет подвергать состав стрессовому воздействию со сдвигом поверхности без денатурации белка. Подходящие неионогенные поверхностно-активные вещества включают полисорбаты (20, 80 и т. д.), полоксамеры (184, 188 и т. д.) и полиолы-плюроники. Неионогенные поверхностно-активные вещества могут присутствовать в диапазоне от приблизительно 0,05 мг/мл до приблизительно 1,0 мг/мл.
Конкретный иллюстративный вариант осуществления водной композиции, подходящей для введения посредством внутривенной инфузии, предусматривает 10 мг/мл антитела к CD40, 15 мМ гистидинового буфера, рН 6,0, 8,0% (вес/об.) сахарозы и 0,05% (вес/об.) полисорбата 80. В определенных вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, описанных в таблице 3. Композиция может быть представлена в форме лиофилизированного порошка, который при ресуспендировании с помощью 2,0 мл стерильной воды или другого раствора, подходящего для инъекции или инфузии (например, 0,9% солевого раствора, раствора Рингера, раствора Рингера с лактатом и т. д.), приводит к получению вышеуказанной водной композиции. Композиция или другие варианты осуществления композиций также могут быть представлены в форме шприца или другого устройства, подходящего для инъекции и/или инфузии, предварительно заполненного количеством композиции, подходящим для однократного введения антитела к CD40.
7.6. Способы применения
7.6.1. Терапевтический эффект
Данные, представленные в данном документе демонстрируют, что антитела к CD40, описанные в данном документе, которые выступают в роли агониста CD40 в присутствии опухолевых клеток, оказывают сильную противоопухолевую активность в отношении таких солидных опухолей in vivo. Соответственно, антитела к CD40, связывающие фрагменты и/или фармацевтические композиции, содержащие антитела к CD40, могут применяться в терапевтических целях для лечения солидных опухолей.
В целом, способы предусматривают введение пациенту-человеку, имеющему солидную опухоль, эффективного количества антитела к CD40, которое выступает в роли агониста CD40, и уничтожает и/или уменьшает пролиферацию опухолевых клеток с обеспечением терапевтического эффекта. Солидные опухоли, которые можно лечить с помощью антитела к CD40, включают без ограничения формы рака надпочечников, формы рака кости, формы рака головного мозга, формы рака молочной железы, формы колоректального рака, формы рака пищевода, формы рака глаза, формы рака желудка, формы рака головы и шеи, формы рака почки, формы рака печени, формы рака легкого (например, немелкоклеточный рак легкого, мезотелиома), формы рака головы и шеи (например, плоскоклеточный рак головы и шеи), формы лимфомы (например, В-клеточные формы лимфомы), формы меланомы (например, прогрессирующую злокачественную меланому, меланому кожи), формы рака полости рта, формы рака яичника, формы рака полового члена, формы рака предстательной железы, формы рака поджелудочной железы, формы рака кожи, формы рака яичек, формы рака щитовидной железы, формы рака матки и формы рака влагалища. В некоторых вариантах осуществления солидная опухоль представляет собой рак головы и шеи, рак легкого, меланому или рак поджелудочной железы.
Рак может представлять собой впервые диагностированную и ранее не подвергавшуюся лечению форму солидной опухоли или может представлять собой рецидивирующую, рефрактерную, или рецидивирующую и рефрактерную, или метастатическую форму. Действительно, данные, полученные in vivo на профилактических мышиных моделях PC3 (ФИГ. 12), показывают, что антитела к CD40 эффективны в уменьшении размера опухоли по сравнению с введением дозы изотипического антитела.
Не желая ограничиваться теорией, полагают, что антитело к CD40 активирует иммунную систему путем, выступая в роли агониста CD40. Последующий иммунный ответ затем оказывает противоопухолевый эффект на прилегающие опухолевые клетки вне зависимости от уровней экспрессии CD40. Соответственно, ожидается, что антитело к CD40 по настоящему изобретению будет эффективным в отношении CD40-положительных или CD40-отрицательных солидных опухолей.
Антитело к CD40 по настоящему изобретению можно вводить отдельно (монотерапия) или в дополнение или совместно с другими противораковыми видами терапии и/или целенаправленно воздействующими или не оказывающими целенаправленного воздействия противораковыми средствами. Вне зависимости от того, вводят ли антитело к CD40 как монотерапию или в дополнение или совместно с другими видами терапии или средствами, его количество вводят таким образом, что общая схема лечения обеспечивает терапевтический эффект.
Под терапевтическим эффектом подразумевают, что применение антител к CD40 для лечения рака у пациента приводит к любому продемонстрированному клиническому результату по сравнению с отсутствием терапии (когда это необходимо) или с известным стандартом лечения. Клинический результат можно оценить с помощью любого способа, известного рядовому специалисту в данной области. В одном варианте осуществления клинический результат оценивают на основании частоты объективных ответов (ORR) (определяемой с помощью RECIST версии 1.1), продолжительности ответа (DOR), выживаемости без прогрессирования (PFS) и/или общей выживаемости (ОS). В некоторых вариантах осуществления признаком терапевтического эффекта является полный ответ. В некоторых вариантах осуществления признаком терапевтического эффекта является частичный ответ. В некоторых вариантах осуществления признаком терапевтического эффекта является стабилизация заболевания. В некоторых вариантах осуществления признаком терапевтического эффекта является увеличение общей выживаемости. В некоторых вариантах осуществления терапевтический эффект может представлять собой увеличение времени до прогрессирования заболевания и/или уменьшение симптомов или улучшение качества жизни. В других вариантах осуществления терапевтический эффект может не распространяться на увеличение периода контроля заболевания, а скорее заметно снижать тяжесть симптомов, что приводит к улучшению качества жизни. Как будет очевидно специалистам в данной области, терапевтический эффект может наблюдаться при применении антител к CD40 отдельно (монотерапия) или в дополнение или совместно с другими видами противораковой терапии и/или целенаправленно воздействующими или не оказывающими целенаправленного воздействия противораковыми средствами.
Как правило, терапевтический эффект оценивают с применением стандартных клинических тестов, разработанных для измерения ответа на новое средство для лечения рака. Для оценки терапевтического эффекта антител к CD40, описанных в данном документе, можно применять одно или комбинацию из следующих тестов: (1) критерии оценки ответа солидных опухолей (RECIST) версии 1.1, (2) общее состояние согласно критериям Восточной объединенной группы онкологов (ECOG), (3) иммунозависимые критерии ответа (irRC), (4) оценка заболевания путем анализа опухолевых антигенов, (5) валидированные шкалы результатов, сообщаемых пациентом, и/или (6) оценки Каплана-Мейера для общей выживаемости и выживаемости без прогрессирования заболевания.
Оценка изменения опухолевой нагрузки является важной особенностью клинической оценки средств для терапии рака. Как уменьшение размеров опухоли (объективный ответ), так и время до развития прогрессирования заболевания являются важными конечными точками в клинических испытаниях относительно рака. Стандартизированные критерии ответа, известные как RECIST (критерии оценки ответа солидных опухолей), были опубликованы в 2000 году. Обновленная версия (RECIST 1.1) была выпущена в 2009 году. Критерии RECIST, как правило, используют в клинических испытаниях, в которых первичной конечной точкой исследования является объективный ответ, а также в тех испытаниях, в которых проводят оценку стабилизации заболевания, прогрессирования опухоли или времени до прогрессирования, поскольку такие показатели результата основаны на оценке анатомической опухолевой нагрузки и ее изменении в ходе испытания. В таблице 4 представлены определения критериев ответа, используемых для определения объективного ответа опухоли на исследуемое лекарственное средство, такое как антитела к CD40, описанные в данном документе.
(PR)
(SD)
Вторичные показатели результата, которые можно применять для определения терапевтического эффекта антител к CD40, описанных в данном документе, предусматривают: частоту объективного ответа (ORR), выживаемость без прогрессирования (PFS), общую выживаемость (OS), продолжительность полного ответа (DOR) и глубину ответа (DpR). ORR определяют как долю участников, у которых был достигнут полный ответ (CR) или частичный ответ (PR). PFS определяют как время от даты введения первой дозы антитела к CD40 до прогрессирования заболевания или смерти, в зависимости от того, что наступит раньше. OS определяют как период времени либо от даты постановки диагноза, либо от начала лечения заболевания, в течение которого пациенты с диагностированным заболеванием остаются в живых. DOR определяют как время от первоначального CR или PR участника до периода прогрессирования заболевания. DpR определяют как процентное значение уменьшения размеров опухоли, наблюдаемого в момент максимального ответа, по сравнению с исходной опухолевой нагрузкой. Клинические конечные точки как для ORR, так и для PFS можно определить на основании критериев RECIST 1.1, описанных выше.
Шкалу общего состояния согласно ECOG, показанную в таблице 5, используют для описания уровня функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических возможностей. Шкала была разработана Восточной объединенной онкологической группой (ECOG), которая в настоящее время является частью Онкологической исследовательской группы ECOG-ACRIN, и опубликована в 1982 году.
Еще один набор критериев, который можно применять, чтобы полностью охарактеризовать и определить ответ на иммунотерапевтические средства, такие как средства противораковой терапии на основе антител, представляет собой иммуннозависимые критерии ответа (irRC), которые были разработаны для измерения солидных опухолей в 2009 году и обновлены в 2013 году (Wolchok, et al. Clin. Cancer Res. 2009; 15(23): 7412-7420 и Nishino, et al. Clin. Cancer Res. 2013; 19(14): 3936-3943, каждый из которых включен посредством ссылки во всей полноте). Обновленные критерии irRC, как правило, используют для оценки эффекта иммунотерапевтического средства, такого как антитело к CD40, описанное в данном документе, на опухолевую нагрузку, и ответ определяют согласно таблице 6.
(SD)
Одним иллюстративным терапевтическим эффектом в результате применения антител к CD40, описанных в данном документе, для лечения солидных опухолей, независимо от того, вводят их как монотерапию или в дополнение или совместно с другими видами терапии или средствами, является полный ответ. Другим иллюстративным терапевтическим эффектом в результате применения антител к CD40, описанных в данном документе, для лечения солидных опухолей, независимо от того, вводят их как монотерапию или в дополнение или совместно с другими видами терапии или средствами, является частичный ответ.
Для обозначения ответа, предоставляемого каждым пациентом через определенную систему предоставления информации, также можно применять валидированные шкалы результатов, сообщаемых пациентами. Такие шкалы результатов не акцентируют внимание на заболевании, а связаны с сохранением функционирования при лечении хронического состояния. Одним неограничивающим примером валидированной шкалы результатов, сообщаемых пациентами, является PROMIS® (Информационная система для измерения результатов, сообщаемых пациентами) от Национальных институтов здравоохранения Соединенных Штатов Америки. Например, с помощью инструмента для оценки функционального статуса PROMIS® для взрослых пациентов с раком можно оценивать сообщаемые самими пациентами возможности функционирования верхних конечностей (например, точную координацию движений), нижних конечностей (например, ходьбу или подвижность) и центральных частей тела (например, подвижность шеи и спины) и обычные формы повседневной активности, такие как выполнение обычных дел.
Кривые Каплана-Мейера (Kaplan and Meier, J. Am. Stat. Assoc. 1958; 53(282): 457-481) также можно использовать для оценки общей выживаемости и выживаемости без прогрессирования у пациентов с раком, проходящих терапию антителом к CD40, по сравнению со стандартом лечения.
7.6.2. Виды дополнительной терапии
Антитела к CD40 можно использовать в дополнение или совместно с другими средствами или видами лечения, обладающими противораковыми свойствами. При применении в качестве дополнительной терапии антитело к CD40 и другое(другие) средство(средства) могут составляться вместе в одном комбинированном фармацевтическом составе или могут составлять и вводиться отдельно, либо в виде одной координированной схемы введения доз, либо в виде разных схем введения доз. Средства, вводимые в дополнение или совместно с антителами к CD40, как правило, будут характеризоваться взаимодополняющими видами активности для антител к CD40, вследствие чего антитела и другие средства не будут оказывать неблагоприятного воздействия друг на друга.
Средства, которые можно вводить в дополнение или совместно с антителом к CD40, включают без ограничения, алкилирующие средства, ингибиторы ангиогенеза, антитела, антиметаболиты, антимитотические средства, антипролиферативные средства, противовирусные средства, ингибиторы аврора-киназы, факторы, способствующие апоптозу (например, ингибиторы семейства Bcl-2), активаторы пути рецепторов смерти, ингибиторы Bcr-Abl киназы, антитела BiTE (биспецифическое активаторы, привлекающие T-клетки), конъюгаты антител и лекарственных средств, модификаторы биологических ответов, ингибиторы циклинзависимых киназ, ингибиторы клеточного цикла, ингибиторы циклооксигеназы-2, DVD, ингибиторы рецепторов гомолога вирусного онкогена лейкоза (ErbB2), ингибиторы факторов роста, ингибиторы белка теплового шока (HSP)-90, ингибиторы гистондеацетилазы (HDAC), гормональные терапевтические средства, иммунологические препараты, ингибиторы ингибиторов белков апоптоза (IAP), интеркалирующие антибиотики, ингибиторы киназ, ингибиторы кинезинов, ингибиторы Jak2, ингибиторы мишени рапамицина у млекопитающих (mTor), микроРНК, ингибиторы митоген-активируемых киназ, регулируемых внеклеточными сигналами, нестероидные противовоспалительные лекарственные средства (NSAID), ингибиторы поли-АДФ(аденозиндифосфат)-рибозо-полимеразы (PARP), химиотерапевтические препараты на основе платины, ингибиторы тирозинкиназы (BTK) Брутона (например, ибрутиниб, акалабрутиниб), ингибиторы Polo-подобных киназ (Plk), ингибиторы фосфоинозитид-3-киназы (PI3K), ингибиторы протеасом, аналоги пурина, аналоги пиримидина, ингибиторы рецепторных тирозинкиназ, ретиноиды/дельтоиды, растительные алкалоиды, малые ингибирующие рибонуклеиновые кислоты (siRNA), ингибиторы топоизомераз, ингибиторы убиквитинлигазы и т. п., а также комбинации одного или нескольких из этих средств.
Примеры иммунологических препаратов включают без ограничения интерфероны, ингибиторы контрольных точек иммунного ответа и другие иммуностимулирующие средства. Интерфероны включают интерферон альфа, интерферон альфа-2a, интерферон альфа-2b, интерферон бета, интерферон гамма-1a, ACTIMMUNE® (интерферон гамма-1b) или интерферон гамма-n1, их комбинации и т. п. Ингибиторы контрольных точек иммунного ответа включают антитела, которые нацеливаются на PD-1 (например, пембролизумаб и ниволумаб), PD-L1 (например, дурвалумаб, атезолизумаб, авелумаб, MEDI4736, MSB0010718C и MPDL3280A) и CTLA4 (антиген 4 цитотоксических лимфоцитов, например, ипилимумаб, тремелимумаб). Иммуностимулирующие средства включают агонистические антитела к OX40, которые активируют Т-клетки. В определенных вариантах осуществления гуманизированное антитело к CD40, представленное в таблице 3, вводится в дополнение к пембролизумабу. В других определенных вариантах осуществления гуманизированное антитело к CD40, представленное в таблице 3, вводится в дополнение к ниволумабу.
Антитело к CD40 также можно применять для повышения эффективности лучевой терапии. Примеры лучевой терапии включают наружную дистанционную лучевую терапию, внутреннюю лучевую терапию (т. е. брахитерапию) и системную лучевую терапию.
7.7. Дозы и схемы введения
Количество вводимых антител к CD40 будет зависеть от множества факторов, включая без ограничения конкретный тип солидной опухоли, подлежащей лечению, стадию солидной опухоли, подлежащей лечению, способ введения, частоту введения, необходимый терапевтический эффект и другие параметры, такие как возраст, масса и другие характеристики пациента и т. д. Определение доз, эффективных для обеспечения терапевтического эффекта при конкретных путях и частоте введения, находится в пределах возможностей специалистов в данной области.
Дозы, эффективные для обеспечения терапевтического эффекта, можно первоначально оценить на животных моделях in vivo или в клинических условиях. Подходящие животные модели для множества заболеваний известны из уровня техники.
Антитела к CD40, раскрытые в данном документе, можно вводить любым путем, подходящим для состояния, подлежащего лечению. В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40, как правило, будут вводить парентерально, т. е. с помощью инфузии, подкожной, внутримышечной, внутривенной (IV), внутрикожной, интратекальной, болюсной инъекции, внутриопухолевой инъекции (IT) или эпидуральной инъекции ((Shire et al., 2004, J. Pharm. Sciences 93(6):1390-1402)). В одном варианте осуществления антитело к CD40 представлено в виде лиофилизированного порошка во флаконе. Флаконы могут содержать 21 мг антитела к CD40. Перед введением лиофилизированный порошок восстанавливают стерильной водой для инъекций (SWFI) или другой подходящей средой с получением раствора, содержащего 10 мг/мл антитела к CD40. В некоторых вариантах осуществления полученный восстановленный раствор дополнительно разбавляют солевым раствором или другой подходящей средой и вводят посредством IV инфузии два раза в 7 дней, один раз в 7 дней, один раз в 14 дней, один раз в 21 день, один раз в 28 дней, один раз в 35 дней, один раз в 42 дня, один раз в 49 дней или один раз в 56 дней. В некоторых вариантах осуществления в рамках первого цикла инфузию выполняют в течение 90 минут. В некоторых вариантах осуществления последующие инфузии выполняют в течение 60 минут. В других вариантах осуществления полученный восстановленный раствор дополнительно разбавляют солевым раствором или другой подходящей средой и вводят посредством IT инъекции два раза в 7 дней, один раз в 7 дней, один раз в 14 дней, один раз в 21 день, один раз в 28 дней, один раз в 35 дней, один раз в 42 дня, один раз в 49 дней или один раз в 56 дней.
В одном иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 7 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг.
В другом иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 14 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг.
В другом иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 28 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг.
В другом иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 7 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг.
В другом иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 14 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг.
В другом иллюстративном варианте осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 28 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг.
При введении в дополнение или совместно с другими средствами, такими как другие химиотерапевтические средства, антитела к CD40 можно вводить по той же схеме, что и другое(другие) средство(средства), или по другой схеме. При введении по той же схеме антитело к CD40 можно вводить до другого средства, после него или одновременно с ним. В некоторых вариантах осуществления, где антитело к CD40 вводят в дополнение или совместно со стандартами лечения, антитело к CD40 можно начинать вводить до начала приема стандартной терапии, например, за день, за несколько дней, за неделю, за несколько недель, за месяц или даже за несколько месяцев до начала приема средств стандарта лечения.
В одном иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 7 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 14 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 28 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 7 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 14 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к ниволумабу (OPDIVO®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 28 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Ниволумаб вводят посредством внутривенной инфузии в дозе 3 мг/кг в течение 60 минут один раз в две недели. Терапию антителом к CD40 в дополнение к ниволумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 7 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 14 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IV инфузии один раз в 28 дней из расчета 0,005 мг/кг, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,2 мг/кг, 2,4 мг/кг, 2,6 мг/кг, 2,8 мг/кг, 3,0 мг/кг, 3,2 мг/кг, 3,4 мг/кг, 3,6 мг/кг, 3,8 мг/кг или 4,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 7 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 14 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
В другом иллюстративном варианте осуществления антитело к CD40 применяют для лечения немелкоклеточного рака легкого в дополнение к пембролизумабу (Keytruda®). В некоторых вариантах осуществления антитело к CD40 представляет собой любое из гуманизированных антител, перечисленных в таблице 3. Антитело к CD40 вводят посредством IT инъекции один раз в 28 дней из расчета 0,001 мг/кг, 0,002 мг/кг, 0,003 мг/кг, 0,004 мг/кг, 0,005 мг/кг, 0,006 мг/кг, 0,007 мг/кг, 0,008 мг/кг, 0,009 мг/кг, 0,01 мг/кг, 0,015 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,08 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,8 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг или 2,0 мг/кг. Пембролизумаб вводят посредством внутривенной инфузии в дозе 2 мг/кг в течение 30 минут один раз в три недели. Терапию антителом к CD40 в дополнение к пембролизумабу продолжают до момента прогрессирования заболевания или до тех пор, пока пациент переносит лечение.
Как будет понятно специалистам в данной области, рекомендуемые дозы для различных средств, описанных выше, может потребоваться скорректировать для оптимизации ответа пациента и получения максимального терапевтического эффекта.
8. ПРИМЕРЫ
Следующие примеры, которые освещают некоторые признаки и свойства иллюстративных вариантов осуществления антител к CD40, описанных в данном документе, приведены для целей иллюстрации, а не для ограничения.
Пример 1. Получение мышиных антител к CD40 человека
Моноклональные антитела получали путем иммунизации мышей Balb/C или мышей SJL внутрибрюшинно с помощью клеток 3T12 мыши, сверхэкспрессирующих CD40 человека. Селезенки собирали, и спленоциты сливали с линией клеток множественной миеломы NS0. Гибридомы отбирали с использованием аминоптерина. Отобранные гибридомы, экспрессирующие антитела к CD40 с агонистической активностью, подвергали скринингу и субклонировали для выделения отдельных клонов.
Для скрининга в отношении антител с агонистической активностью разработали панель функциональных анализов, предусматривающих стимуляцию пути NFκB, активацию моноцитов, активацию дендритных клеток (DC) и конкуренцию с лигандом CD40 (CD40L). В эти анализы в качестве положительного контроля включали антитело к CD40 человека G28-5 (IgG1 мыши) (Biolegend), а родственное по изотипу мышиное антитело (mIgG1) - в качестве отрицательного контроля.
8.1.1. Анализ с HEK293 Blue CD40 с репортерным геном под контролем NFκB
Линию клеток HEK293 Blue CD40 (InVivogen), стабильно экспрессирующую CD40 человека и репортерный ген под контролем NFκB, поддерживали в DMEM, содержащей 10% термоинактивированной фетальной бычьей сыворотки (FBS), дополненной 30 мкг/мл бластицидина и 100 мкг/мл зеоцина. Активация CD40 на поверхности клеток HEK293 blue CD40 запускает сигнальный каскад, приводящий к активации NFκB и последующей секреции эмбриональной щелочной фосфатазы (SEAP). Инкубация супернатантов культур гибридом, содержащих агонистическое антитело к CD40, с 2,5×105/мл клеток HEK293 blue CD40 стимулировала выработку SEAP, которую измеряли с помощью колориметрического ферментного анализа. Таким образом, уровень SEAP соответствовал активности антитела к CD40 в супернатантах культур гибридом.
8.1.2. Анализ активации моноцитов
Анализ определения активности моноцитов выполняли с применением линии клеток моноцитов THP1-XBlue (InVivogen). Эта линия клеток стабильно экспрессирует NFκB и репортерный ген SEAP, индуцируемый под действием AP-1, и ее поддерживали в RPMI 1640 с 10% термоинактивированной FBS и 200 мкг/мл зеоцина. В ходе анализа 5×105/мл клеток THP1-XBlue сначала примировали с помощью 40 нг/мл IFNγ в течение 24 часов, а затем инкубировали с тестируемыми образцами в течение дополнительных 24 часов. Активность SEAP, индуцируемую агонистическими антителами к CD40, отслеживали посредством ферментного анализа.
8.1.3. Анализ выработки IL-12p70 первичной дендритной клеткой
Клоны антител к CD40 также подвергали скринингу в отношении их способности активировать дендритные клетки моноцитарного происхождения (moDC). Активацию отслеживали по выработке IL-12p70. Вначале с помощью градиента Ficoll выделяли мононуклеарные клетки периферической крови человека (PBMC). Вкратце, цельную кровь от здоровых доноров-людей, разбавленную равным объемом PBS, добавляли в пробирку Leucosep (Greiner Bio One), содержащую Ficoll-Paque Plus ниже фильтра (15 мл). Затем кровь центрифугировали при 1000g в течение 15 минут без торможения. PBMC собирали и промывали однократно с помощью PBS, центрифугировали при 1300 об./мин. в течение 5 минут при комнатной температуре и промывали однократно с помощью RPMI 1640. Клетки ресуспендировали в культуральной среде (RPMI 1640+10% термоинактивированной FBS). Моноциты затем выделяли из PBMC с помощью набора для обогащения от StemCell и культивировали в бессывороточной среде StemSep, дополненной 10 нг/мл GM-CSF и 20 нг/мл IL-4, при 37°C и 5% CO2 в течение 6 дней. Свежие GM-CSF и IL-4 добавляли в культуру в день 3, чтобы помочь поддержанию дифференцировки DC. Спустя 6 дней культивирования незрелые DC моноцитарного происхождения подвергали FACS-анализу для подтверждения фенотипа незрелых DC: Lin-, CD80/CD86+, HLA-DR+ или CD11c+. Незрелые moDC примировали с помощью IFNγ и стимулировали образцами, содержащими антитело к CD40, в течение 48 часов в бессывороточной среде StemSep, дополненной GM-CSF и IL-4. Супернатант культуры собирали и анализировали на выработку IL-12p70 с помощью коммерчески доступного набора для ELISA. Результаты скрининга и типичная активность обобщены в таблице 1-1.
В таблице 1-1 показан диапазон агонистической активности антител к CD40 для всех выделенных гибридом. Все новые клоны продемонстрировали активацию моноцитов, сравнимую с указанной в литературе для антитела к CD40, G28-5 (см., например, Bishop, G. A. Journal of Immunology 188, 4127-4129 (2012)). В случае клонов AD166.4.4 и AD175.14.11 продемонстрирована активация моноцитов, но не показана активация дендритных клеток. В случае остальных клонов проявлялась активация моноцитов, сравнимая с G28-5, а также усиление активации дендритных клеток по сравнению с G28-5.
Сводная информация о скрининге клонов агонистических антител к CD40
(IL-12p70, пг/мл)
Последовательности кДНК, кодирующие вариабельные области тяжелой и легкой цепей, десяти моноклональных антител клонировали из гибридом AD163.9.3, AD166.4.4, AD175.14.11, AD163.10.7, AD165.1.2, AD163.162.1, AD163.27.12, AD163.7.2, AD164.14.6 и AD164.76.3 соответственно, с применением стандартных методик ПЦР и секвенировали с применением стандартных методик секвенирования ДНК. Соответствующие полные аминокислотные последовательности антитела, кодируемые такими ДНК, показаны на ФИГ. 2A-2C.
Пример 2. Эпитопная классификация мышиных антител к CD40 человека
Анализ BIAcore и способ ELISA применяли для классификации агонистических мышиных антител к CD40 человека на основе их способности конкурировать друг с другом или лигандом CD40 (CD40L) за связывание с CD40.
Анализ BIAcore проводили с применением прибора BIAcore T100 при 12°C. Сначала на сенсорном чипе CM5 иммобилизовали козье антитело к Fc мыши (Pierce, № по кат. 31170), а затем осуществляли захват первого тестируемого антитела на поверхности. После блокирования посредством 50 мкг/мл смеси изотипических мышиных антител в проточные кюветы вводили растворимую форму внеклеточного домена CD40 человека (Creative BioMart, № по кат. CD402221H). Следующим шагом вводили второе тестируемое антитело или CD40L (PeproTech, № по кат. 0308145) для измерения их связывания с комплексом CD40 и первым тестируемым антителом. Как показано в таблице 2-1, антитела к CD40 по настоящему изобретению классифицировались на три эпитопные группы. Примерами эпитопной группы 1 выступили AD163.7.2 ("muAb8") и AD175.14.11 ("muAb3"), которые блокировали связывание CD40L с CD40. Эпитопную группу 2 определилась на основании клонов AD163.162.1 ("muAb6") и AD163.27.12 ("muAb7"), которые не конкурировали с CD40L или антителами из эпитопной группы 1. Примерами третьей эпитопной группы выступили клоны AD163.9.3 ("muAb1"), AD166.4.4 ("muAb2") и AD165.1.2 ("muAb5"), которые не конкурировали с CD40L за связывание с CD40, но конкурировали с антителами из эпитопных групп 1 и 2.
Эпитопная классификация с помощью анализа BIAcore
Для определения эффектов антител к CD40 на взаимодействие CD40-CD40L человека был разработан анализ ELISA. Вкратце, слитый белок CD40-Fc человека (huFc) (Creative BioMart) смешивали с антителом к CD40 или антителом изотипического контроля и добавляли в 96-луночные планшеты, покрытые HA-меченным CD40L (R&D Systems). Связывание комплекса CD40-huFc со связанным на планшете CD40L обнаруживали с помощью антитела к Fc человека, конъюгированным с HRP (Jackson ImmunoResearch). После проявления на субстрате TMB (3,3',5,5'-тетраметилбензидин) планшеты считывали при OD450.
Эффект антител к CD40 на взаимодействие CD40-CD40L определяли путем расчета соотношения OD450 в образцах, содержащих антитела к CD40, и OD450 в образце, содержащем антитело изотипического контроля ("соотношение OD450"). Соотношения OD450, составляющие ≤0,1, показывали ингибирование связывания CD40L человека с CD40 человека. Соотношения OD450, составляющие от 0,1 до 1, показывали частичное ингибирование связывания CD40L с CD40. Соотношение OD450, составляющее >1, показывало усиленное связывание CD40L человека с CD40 человека, улучшая тем самым передачу сигнала CD40.
Все данные обобщены в таблице 2-2. Антитела muAb8 и muAb3 блокировали связывание CD40 с CD40L, проявляя соотношение, составляющее меньше 0,1. Для антител muAb6 и muAb7 показано соотношение, составляющее около 0,5, что свидетельствует о незначительном эффекте на взаимодействие CD40-CD40L. Для антител muAb1, muAb2, muAb4, muAb5, muAb9 и muAb10 показано соотношение OD450, составляющее приблизительно 1 или больше 1, что указывает или на отсутствие эффекта, или на эффект, который стимулирует связывание CD40 с CD40L.
Конкуренция с CD40 за связывание с CD40L
Пример 3. Гуманизация мышиных антител к CD40 человека
Гуманизацию области V антитела проводили, как описано Queen, C. et al. (Proc. Natl. Acad. Sci. USA, 1989; 86:10029-10033). Канонические структуры CDR определяли согласно Huang et al. (Methods, 2005; 36:35-42). Идентифицировали последовательности вариабельных областей зародышевого типа человека с одинаковыми или наиболее сходными каноническими структурами CDR, и соответствующие последовательности VH-, VL- и J-сегментов человека выбирали для получения каркасных участков для вариабельной области антитела к CD40. В положениях каркасных областей, в которых компьютерная модель позволяла предположить значительный контакт с CDR, аминокислоты из V-областей мышиных антител к CD40 использовали вместо исходных аминокислот каркасных участков человека (обратные мутации). Если не указано иное, использовали константные области IgG1 человека с природными вариантами D356E и L358M в тяжелой цепи и легкую каппа-цепь. Полные аминокислотные последовательности областей VH и VL гуманизированных антител показаны на ФИГ. 2D-2G.
Клон антитела к CD40, AD163.162.1 ("muAb6"), гуманизировали согласно способу, описанному выше. Гуманизированными версиями muAb6 были huAb6-1, huAb6-2 и huAb6-3. Антитело huAb6-1 содержало VH (SEQ ID NO: 110) с обратными мутациями в каркасных участках: M48I, V67A, I69L и A71V. Антитело huAb6-2 содержало VH (SEQ ID NO: 111) с обратными мутациями M48I и A71V в каркасных участках. Антитело huAb6-3 содержало VH (SEQ ID NO: 112) с обратными мутациями M48I и A71V в каркасных участках, а также изменения N60A, K64Q и D65G в направлении зародышевого типа в CDR VH, чтобы повысить идентичность с последовательностью зародышевой типа человека. Антитела huAb6-1, huAb6-2 и huAb6-3 содержали VL (SEQ ID NO: 161) с обратными мутациями в каркасных участках: A43S, L46R, L47W и F71Y.
Гуманизированными версиями клона антитела к CD40, AD163.7.2 ("muAb8"), были huAb8-1, huAb8-2 и huAb8-3 (ФИГ. 2D-2E). Антитело huAb8-1 содержало VH (SEQ ID NO: 113) с обратными мутациями в каркасных участках: M48I, V67A, I69L, A71V, K73R, Y91F и R94S. Антитело huAb8-2 содержало VH (SEQ ID NO: 114) с обратными мутациями в каркасных участках: M48I, V67A, I69L, A71V, K73R, Y91F и R94S; а также мутацию C59S в CDR VH. Антитело huAb8-3 содержало VH (SEQ ID NO: 115) с обратными мутациями в каркасных участках: M48I, A71V и R94S. Все из антител huAb8-1, huAb8-2 и huAb8-3 содержали VL (SEQ ID NO: 162) с обратными мутациями в каркасных участках: A43S и Y87F.
Клон антитела к CD40, AD164.14.6 ("muAb9"), гуманизировали с получением huAb9-1, huAb9-2, huAb9-3, huAb9-4, huAb9-5 и huAb9-6. Антитела huAb9-1 и huAb9-4 демонстрировали VH (SEQ ID NO: 116) с обратными мутациями в каркасных участках: I48M, V67I и V71R. Антитела huAb9-2 и huAb9-5 содержали VH (SEQ ID NO: 117) с обратными мутациями в каркасных участках: I48M и V71R. Антитела huAb9-3 и huAb9-6 содержали VH (SEQ ID NO: 118) с обратными мутациями в каркасных участках: I48M и V71R, а также два дополнительных изменения в CDR, T30S и N65S, в направлении зародышевого типа, чтобы улучшить идентичность с последовательностью зародышевой типа человека. Антитела huAb9-1, huAb9-2 и huAb9-3 содержали VL (SEQ ID NO: 163) с обратными мутациями в каркасных участках: I2A, Y36F и Y87F. Антитела huAb9-4, huAb9-5 и huAb9-6 содержали VL (SEQ ID NO: 164) с обратной мутацией I2A в каркасном участке. Клон AD164.14.6 дополнительно модифицировали для удаления сайта отщепления сигнального пептида, находящегося во втором положении легкой цепи, путем реверсии обратной мутации I2A в каркасном участке VL. Антитела huAb9 A2I и huAb9 A2V, содержащие VH (SEQ ID NO: 117) и VL с обратными мутациями A2I (SEQ ID NO: 170) и A2V (SEQ ID NO: 171) в каркасном участке соответственно, предотвращали образование нежелательного продукта расщепления.
В настоящем примере гуманизированные антитела получали с константной областью тяжелой цепи и константной областью легкой каппа-цепи IgG1 человека. С-концевой лизин может быть частично отщеплен посредством посттрансляционного процессинга после экспрессии белка тяжелой цепи IgG1 человека. Соответственно, антитело huAb9-5 имело тяжелую цепь согласно SEQ ID NO:130 или 131 и легкую цепь согласно SEQ ID NO:140. Также получали антитело huAb9-5 с аминокислотными мутациями V273E и V273Y в константной области тяжелой цепи, последовательность которой соответствовала тяжелой цепи согласно SEQ ID NO:132 или 133 и SEQ ID NO:134 или 135 соответственно, и легкой цепью согласно SEQ ID NO:140. Антитела huAb9 A2I и huAb9 A2V получали с константной областью тяжелой цепи V273E IgG1 человека. Соответственно, антитело huAb9 A2I имело тяжелую цепь согласно SEQ ID NO:132 или 133 и легкую цепь согласно SEQ ID NO:141. Аналогично, антитело huAb9 A2V имело тяжелую цепь согласно SEQ ID NO:132 или 133 и легкую цепь согласно SEQ ID NO:142.
Пример 4. Определение характеристик гуманизированных антител к CD40 человека
Чтобы убедиться в том, что гуманизированные антитела к CD40 сохраняли агонистические и другие необходимые свойства исходных мышиных антител, осуществляли панель анализов по определению характеристик, чтобы определить активацию NFκB, кинетику связывания CD40, межвидовую перекрестную реактивность и эпитопные классы гуманизированных антител по настоящему изобретению.
8.4.1. Активация NFκB
Активацию NFκB под действием гуманизированного антитела к CD40 по настоящему изобретению оценивали в клетках HEK293 blue CD40 с репортерным геном под контролем NFκB. Активация представлена в виде активности репортерного гена SEAP (секретируемая эмбриональная щелочная фосфатаза), измеренной по OD655. Максимальное измеренное значение OD655 и концентрация полумаксимальной активации (EC50) обобщены в таблице 4-1.
Активация NFκB в клетках HEK293 blue CD40 с репортерным геном под контролем NFκB
8.4.2. Кинетика связывания CD40 и межвидовая перекрестная реактивность
Аффинность связывания раскрытых гуманизированных антител к CD40 анализировали с помощью анализа BIAcore и проточной цитометрии.
Кинетику связывания CD40 анализировали с помощью анализа BIAcore с помощью прибора BIAcore T200. Вкратце, на сенсорном чипе CM5 иммобилизировали козье антитело к Fc мыши (Pierce, № по кат. 31170) или козье антитело к Fc человека (Pierce, № по кат. 31125), а затем осуществляли захват антител CD40 на тестируемой поверхности. Следующим шагом вводили растворимую форму внеклеточного домена CD40 человека (Creative BioMart, № по кат. CD402221H) или CD40 макака-крабоеда (cyno) (Creative BioMart, № по кат. CD40-8824C) и измеряли связывание и диссоциацию.
Данные поверхностного плазмонного резонанса указывали, что гуманизированные антитела huAb8-1, huAb9-5, huAb9 A2I и huAb9 A2V сохраняли показатели аффинности связывания (KD), аналогичные таковым у их исходных клонов AD163.7.2 ("muAb8") или клона AD164.14.6 ("muAb9"), и они показали аналогичное связывание с CD40 человека или макака-крабоеда (таблица 4-2).
Аффинность измеренная с помощью BIAcore*
(1/M с)
(1/с)
(1/M с)
*Числа представлены в виде экспоненциальной записи, например, 3,0E-09=3,0 × 10-9.
Гуманизированные антитела к CD40 также оценивали в отношении связывания с CD40 клеточной поверхности на клетках HEK293, стабильно трансфицированных с помощью CD40 человека или макака-крабоеда, а также B-клетках, полученных из PBMC макака-крабоеда или человека. Гуманизированные антитела к CD40 инкубировали с трансфектантами HEK293 в течение 15 минут на льду, и связывание выявляли с помощью вторичного антитела к иммуноглобулину человека, конъюгированного с флуоресцентной меткой (Jackson ImmunoResearch). FACS-анализ клеток подтвердил, что гуманизированные антитела связывались со стабильными линиями клеток, экспрессирующими CD40 человека и макака-крабоеда. Напротив, связывание не наблюдалось в аналогичных экспериментах, осуществляемых с CD40 мыши, крысы или собаки.
Антитела к CD40 также оценивали в отношении их способности связываться с первичными клетками, экспрессирующими CD40 человека и макака-крабоеда. РВМС, выделенные из крови человека или макака-крабоеда, инкубировали с антителами к CD40, конъюгированными с флуоресцентным красителем CF640R. После FACS-анализа данные анализировали с помощью программного обеспечения FlowJo (FlowJo, LLC). Эти результаты продемонстрировали, что гуманизированные антитела связывались с первичными CD40-положительными клетками, полученными из РВМС как человека, так и макака-крабоеда.
8.4.3. Эпитопная классификация
Анализ проточной цитометрии и способ ELISA применяли для классификации гуманизированных агонистических антител к CD40 на основе их способности конкурировать друг с другом или лигандом CD40 (CD40L) за связывание с CD40.
Разработали анализ проточной цитометрии для оценки того, конкурирует ли антитело за связывание с CD40 человека с другим антителом. В данном анализе в качестве эталонного антитела использовали CP-870893, полученный клона полностью человеческого антитела к CD40 с IgG2, 21.4.1 (см. Gladue, RP et al., Cancer Immunol., Immunother., 2011; 60: 1009-17 и патент США № 7618633). Соответственно тяжелые и легкие цепи CP-870893 представляли собой:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYYMHWVRQAPGQGLEWMGWINPDSGGTNYAQKFQGRVTMTRDTSISTAYMELNRLRSDDTAVYYCARDQPLGYCTNGVCSYFDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 181), и
DIQMTQSPSSVSASVGDRVTITCRASQGIYSWLAWYQQKPGKAPNLLIYTASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANIFPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 182).
Все человеческие антитела или гуманизированные антитела к CD40, включая huAb6-1, huAb8-1, huAb9 A2I и CP-870893, метили с помощью Alexa Fluor (AF)-488. Каждое антитело с флуоресцентной меткой при фиксированной концентрации 1 мкг/мл отдельно смешивали с возрастающими количествами других немеченых антител к CD40, варьирующих в диапазоне от 0,5 нг/мл до 50 мкг/мл, и инкубировали с клетками HEK293, стабильно экспрессирующими CD40 человека. Затем с помощью проточной цитометрии отслеживали связывание флуоресцентно меченых антител.
Конкурирующие антитела, идентифицированные по дозозависимому снижению средней интенсивности флуоресценции (MFI), и неконкурирующие антитела, идентифицированные по постоянной MFI, обобщены в таблице 4-3. Несмотря на то, что huAb6-1 не конкурировал за связывание CD40 человека с huAb8-1, как huAb9 A2I, так и CP-870893 конкурировали с huAb6-1 и huAb8-1. При этом, huAb9 A2I и CP-870893 конкурировали друг с другом.
Эпитопная классификация на основании анализа проточной цитометрии
Эпитопную классификацию гуманизированных антител по настоящему изобретению также подтверждали с помощью анализа ELISA, измеряющего связывание антитела к CD40 и комплекса с CD40 со связанным на планшете CD40L, как описано в примере 2. В данном анализе в качестве эталонного антитела к CD40 использовали CP-870893, подготовленный, как описано выше. Возрастающие количества антител к CD40 или контрольного антитела IgG1 человека (huIgG1) инкубировали с 1 мкг/мл слитого белка CD40-huFc и добавляли в планшет, покрытый CD40L. Как показано на ФИГ. 3, гуманизированные антитела huAb8-1 и huAb8-3 блокировали взаимодействие CD40 и CD40L (вверху слева); huAb6-1 и huAb6-2 показывали минимальный эффект на взаимодействие CD40-CD40L (вверху справа); а huAb9-5 и huAb9-6 стимулировали связывание CD40 с CD40L (внизу слева). Гуманизированное антитело huAb9 A2I также стимулировало связывание CD40 с CD40L по сравнению с CP-870893, которое показало минимальный эффект на взаимодействие CD40-CD40L (внизу справа).
Результаты соответствовали результатам, полученным в анализе на основе проточной цитометрии с клетками, экспрессирующими CD40L (ФИГ. 4). CD40L+ клетки Jurkat инкубировали с растворимым белком CD40 человека, конъюгированным с флуорохромом Alexa Fluor 488, при постоянной концентрации 1 мкг/мл. Связывание конъюгированного с флуорохромом CD40 с CD40L на поверхности клеток Jurkat измеряли с помощью анализа проточной цитометрии в присутствии гуманизированного антитела huAb9 A2I и эталонного антитела к CD40, CP-870893. Усиление интенсивности флуоресценции обнаруживали при увеличении в образце количества huAb9 A2I, но не эталонного антитела CP-870893. Эти результаты свидетельствуют о том, что huAb9 A2I стимулировало связывание CD40 с CD40L+ клетками Jurkat, в то время как эталонное CP-870893 не стимулировало.
Функциональное воздействие huAb9 A2I на передачу сигнала CD40, управляемую CD40L, также определяли в анализе, содержащем как CD40, так и клетки, экспрессирующие CD40L. Клетки, экспрессирующие CD40 (клетки HEK293 blue CD40 с репортерным геном под контролем NFκB, описанные в разделе 8.1.1) смешивали с CD40L- или CD40L+ клетками Jurkat в соотношении 1:1 и инкубировали с одним из huAb9 A2I, CP-870893 или контрольного антитела из расчета 3 мкг/мл. Передачу сигнала CD40 измеряли по активности репортера SEAP с помощью колориметрического анализа, как описано в разделе 8.4.1. При совместном культивировании клеток, содержащих CD40 и репортерный ген, с CD40L- клетками Jurkat (ФИГ. 5A), передача сигнала CD40 значимо увеличивалась только после добавления либо huAb9 A2I, либо CP-870893, но не увеличивалась при обработке контрольным антителом или при отсутствии добавления. Хотя оба антитела активировали CD40, huAb9 A2I не был значительно более активным по сравнению с СР-870893 в отношении стимуляции CD40 в указанных условиях. Когда клетки, содержащие CD40 и репортерный ген, культивировали совместно с CD40L+ клетками Jurkat (ФИГ. 5B), CD40L на поверхности клеток активировал CD40, на что указывала активность репортера SEAP. Обработка с помощью CP-870893 не повышала дополнительно активность передачи сигнала CD40, измеренную по активности репортера SEAP, аналогично обработке изотипическим контролем huIgG1 или huIgG2 или обработке без антител (только среда). Напротив, обработка с помощью huAb9 A2I дополнительно увеличивала передачу сигнала CD40, при этом активность репортера была значимо большей, чем при обработке CP-870893 и контрольной обработке (p<0,001).
Эти данные обозначают, что если CD40 на поверхности клеток был активирован с помощью насыщенного количества CD40L на поверхности клеток, huAb9 A2I дополнительно усиливало активацию CD40 путем осуществления большую последующую передачу сигнала NFκB, по сравнению с эквивалентным количеством известного антитела к CD40, CP-870893.
Пример 5. Варианты области Fc антител к CD40
Большей агонистической активности в отношении CD40 можно достичь посредством модификации области Fc, чтобы усилить связывание с FcγRIIB (Li and Ravetch, Science, 2011; 333:1030-1034; и White, et al., J. Immunol, 2011; 187:1754-1763). В положение 273 константной области IgG1 человека гуманизированных антител к CD40, huAb6-1, huAb8-1, huAb9-5 и huAb9 A2I, вводили две мутации V273E и V273Y. Влияние мутаций в Fc на связывание с Fcγ-рецепторами отслеживали с помощью FACS-анализа и посредством антителозависимой клеточноопосредованной цитотоксичности (ADCC). Агонистическую активность гуманизированного антитела к CD40 с модификацией Fc отслеживали с помощью активации репортерного гена под контролем NF-kB, В-клеток, DC-клеток моноцитарного происхождения и Т-клеток.
8.5.1. Связывание Fcγ-рецептора и функция в ADCC
Возрастающие количества антител IgG1 к CD40 человека и их Fc-вариантов инкубировали с клетками СНО, стабильно экспрессирующими различные Fcγ-рецепторы человека, включая FcγRI (CD64), FcγRIIA (CD32a), FcγRIIB (CD32b) и FcγRIIIA (CD16) с полиморфизмом F или V. Связывание выявляли с помощью вторичного антитела, специфичного к F(ab')2 человека, конъюгированного с флуоресцентной меткой (Jackson ImmunoResearch). Мутации V273E или V273Y снижали связывание с FcγRIIIA (CD16F или V), в то же время сохраняя связывание FcγRI (CD64), и улучшали связывание FcγRIIA (CD32a) или FcγRIIB (CD32b) (ФИГ. 6A-6B).
ADCC под действием Fc-вариантов гуманизированных антител к CD40 измеряли с применением стандартного протокола (Law et al., 2005, Cancer Res., 65:8331-8). В иллюстративном примере ADCC под действием антитела huAb9-5 в клетках RL была снижена в случае вариантов константной области V273E или V273Y по сравнению с IgG1 дикого типа (ФИГ. 7).
8.5.2. Усиление агонистической активности после связывания FcγR
Чтобы оценить влияние связывания Fcγ-рецептора на агонистическую активность антитела к CD40, huAb9 A2I с мутацией V273E в huIgG1 использовали для обработки клеток HEK293 blue CD40 с репортерным геном под контролем NFκB, культивируемых совместно с клетками СНО, стабильно экспрессирующими отличающиеся Fcγ-рецепторы человека, и отслеживали активность NFκB. Как показано в таблице 5-1, агонистическая активность СР-870893 в стимулирующей активации NFκB не зависела от связывания Fcγ-рецептора, в то же время обнаружили, что агонистическая активность huAb9 A2I зависит от связывания Fcγ-рецептора. Эффективность huAb9 A2I в стимулировании активности NFκB была в десять раз выше, если клетки с репортерным геном культивировали совместно с клетками СНО, экспрессирующими CD32a, CD32b или CD64, а не при совместном культивировании с клетками СНО, не экспрессирующими Fcγ-рецептор или экспрессирующими CD16V или CD16F.
Активность NFκB (EC50, нМ)
8.5.3. Влияние Fc-вариантов на пролиферацию B-клеток
Влияние мутации V273E или V273Y в Fc на агонистическую активность антитела к CD40 также оценивали с помощью анализа пролиферации В-клеток. В этом анализе В-клетки человека обогащали с помощью набора для обогащения В-клеток (StemCell Technologies) посредством отрицательного отбора. Очищенные В-клетки высевали в 96-луночные планшеты из расчета 5×105/мл, по 200 мкл на лунку в бессывороточной среде AIM-V (GIBCO). Антитела к CD40 в серийном разведении добавляли и культивировали с В-клетками в течение 6 дней. В течение последних 16 часов культивирования в каждую лунку с культурой добавляли 1 мкКи H3TdR и пролиферацию В-клеток определяли по включению H3TdR. Радиоактивность, связанную с включением H3TdR, регистрировали сцинтилляционным счетчиком в виде числа импульсов в минуту (CPM). По сравнению с соответствующими антителами IgG1 человека дикого типа Fc-варианты IgG1 человека V273E и V273Y антитела к CD40 (huAb6-1, huAb8-1 и huAb9-5) показали усиленную активацию В-клеток (ФИГ. 8). Однако huAb9 A2I (V273E в IgG1человека) показало приблизительно в десять раз меньшую эффективность в стимулировании пролиферации В-клеток по сравнению с CP-870893 (нижний правый график).
8.5.4. Влияние Fc-вариантов на выработку IL-12p70 в DC
Влияние мутаций V273E или V273Y в Fc на агонистическую активность антител к CD40 дополнительно оценивали с помощью анализа активации DC с применением IL-12p70 в качестве регистрируемого показателя. В этом анализе незрелые DC сначала получали из моноцитов, очищенных из PBMC человека и обработанных с помощью IL4 и GM-CSF. Созревание DC и выработку IL-12p70 индуцировали с помощью антител к CD40 после примирования под действием IFNγ. Мутированные версии Fc, V273E или V273Y, повышали эффективность активации DC за счет увеличения выработки IL-12p70. Как проиллюстрировано на ФИГ. 9, huAb6-1 (вверху слева), huAb8-1 (вверху справа) и huAb9-5 (внизу слева) с Fc-вариантами huIgG1, V273E или V273Y, показали увеличение выработки IL-12p70 по сравнению с соответствующими им антителами, имеющими huIgG1 дикого типа. Для huAb6-1 и huAb8-1 вариант с мутацией V273Y в huIgG1 был более эффективен в увеличении выработки IL-12p70 in vitro, чем в случае мутации V273E. Для huAb9-5 варианты с V273E или V273Y в huIgG1 показывали аналогичную эффективность. В случае huAb9 A2I (нижний правый график) вариант с мутацией V273E в huIgG1 продемонстрировал эффективность стимуляции DC, оцениваемую по выработке IL-12p70, аналогичную CP-870893.
8.5.5. Влияние Fc-вариантов на активацию Т-клеток в аллогенной совместной культуре DC и T-клеток
Чтобы продемонстрировать, что антитела к CD40 могут управлять активацией Т-клеток за счет стимулирования антигенпрезентирующих клеток, таких как DC, Fc-варианты антител к CD40 тестировали в аллогенной совместной культуре DC и T-клеток. В этом анализе дендритные клетки (5 × 103) сначала получали из моноцитов с применением способа, описанного выше, затем смешивали с 1 × 105 Т-клеток, очищенных из другого донора. Различные количества антител к CD40, huAb6-1, huAb8-1 или huAb9-5, с константной областью IgG1 человека дикого типа, или Fc-вариантов V273Y добавляли к совместной культуре DC и Т-клеток. После инкубации в течение 4 дней супернатанты собирали и измеряли IFN-γ с помощью ELISA.
На ФИГ. 10 показаны иллюстративные антитела, для которых показано увеличение выработки IFN-γ в совместной культуре с клетками из двух разных донорных пар. В каждом случае варианты V273Y huAb6-1, huAb8-1 и huAb9-5 продемонстрировали активацию Т-клеток, о чем свидетельствует значимое увеличение IFN-γ по сравнению с антителом изотипического контроля huIgG1.
Пример 6. In vivo противоопухолевая активность антител к CD40
Гуманизированные антитела к CD40, huAb6-1, huAb9-5 и huAb9 A2I с IgG1 человека дикого типа или Fc-вариантами, оценивали в отношении их способности ингибировать рост опухоли у мышей NSG, несущих опухоли предстательной железы PC3, в присутствии иммунных клеток человека.
Мышам NSG инокулировали подкожно смесь клеток PC3 (1 × 106), очищенных Т-клеток (5 × 105) и аутологичных DC (1 × 105). Однократную дозу 1 мг/кг антител к CD40 или контрольных антител инъецировали внутрибрюшинно сразу после инокуляции. Объемы опухолей измеряли через день с помощью штангенциркуля. Антитела к CD40, включая huAb6-1, huAb9-5, huAb9 A2I и их Fc-варианты V273E или V273Y, уменьшали рост опухоли по сравнению с антителом изотипического контроля в модели PC3, как показано на ФИГ. 11.
Пример 7. Исследования для подтверждения механизма действия на мышиной модели с сингенной опухолью
Вследствие отсутствия связывания CD40 мыши иллюстративными антителами к CD40 по настоящему изобретению оценку фармакологических эффектов у мышей проводили с применением мышиного агонистичесого антитела к CD40, 1C10 muIgG1. Аналогично описанным выше антителам с Fc-мутацией V273E в huIgG1 1C10, содержащее Fc с IgG1мыши (muIgG1), продемонстрировало сильное связывание с muFcγRIIB и минимальное связывание с muFcγRI и muFcγRIV, функциональным эквивалентом FcγRIII человека. Подобно антителам к CD40 по настоящему изобретению 1C10 muIgG1 продемонстрировало эффективность в стимулировании активации В-клеток селезенки мыши in vitro и in vivo. Таким образом, антитело к CD40 мыши, 1C10, с константной областью IgG1 мыши использовали в качестве молекулы для доказательства механизма действия, чтобы изучить потенциальные пути клинической разработки, что включало применение внутриопухолевой доставки или комбинированной терапии с совместным введением антитела к PD-1.
8.7.1. Внутриопухолевое введение
Для исследования внутриопухолевого введения использовали модель сингенной опухоли CT26, при этом мыши несли подкожные опухоли на двух боках. Жизнеспособные клетки (1 × 105 на мышь) инокулировали подкожно в правую и левую задние боковые стороны самок мышей Balb/c в день 0. Животных рандомизировали в группы по десять мышей на группу в день 12. Средний объем опухоли в правом боку при начале введения доз составлял около 85 мм3. По три животных из каждой группы умерщвляли через 24 часа после введения первой дозы для оценки содержания ALT в сыворотке крови. Оставшихся животных наблюдали в отношении роста обеих опухолей. Объем опухоли измеряли дважды в неделю. Измерения длины (L), ширины (W) и высоты (H) опухоли получали с помощью электронного штангенциркуля, а объем рассчитывали в соответствии со следующим уравнением: L × W × H/2. Введение доз антитела начинали сразу же после рандомизации.
При введении антитела к CD40, 1C10, непосредственно в одну опухоль (3 мг/кг, 2-3 раза в неделю) рост опухолей как в подвергнутом инъекции сайте ("IT введение дозы"), так и в дистальном сайте ("без IT введения дозы") замедлялся, что позволяет предположить развитие системного противоопухолевого иммунитета (ФИГ. 12). Токсичность в отношении печени отслеживали путем измерения фермента печени ALT с помощью VetScan (Abaxis Inc., Юнион-Сити, Калифорния). Внутриопухолевое (IT) введение доз антитела к CD40, 1C10, приводило к меньшему повышению ALT, чем системное внутрибрюшинное (IP) введение доз.
8.7.2. Комбинированная терапия с совместным введением антитела к PD-1
Опухоль CT26 приживляли путем инокуляции 1 × 105 жизнеспособных клеток на мышь подкожно в правый бок самкам BALB/c мышей в день 0. Животных рандомизировали на группы в день 15. Антитело к CD40, 1C10 (0,6 мг/кг), в комбинации с проприетарным антителом к PD1, muIgG2a (10 мг/кг), вводили IP дважды в неделю мышиной модели с сингенной опухолью CT26. Комбинированная схема введения показала значительную противоопухолевую активность (у 7 из 10 мышей наблюдали регрессию опухоли по сравнению с 0 в контроле и 1 из 10 в каждой из групп, обрабатываемых антителом к PD1 или антителом к CD40), что поддерживает разработку данной комбинации (ФИГ. 13).
Обработку антителом к CD40, 1C10, проводили из расчета 0,6 мг/кг, при этом такая доза является субтерапевтической для монотерапии в этой модели. В некоторых случаях сохранение уровня противоопухолевой эффективности при таких дозах каждого моноклонального антитела может обеспечивать снижение токсичности, о чем свидетельствуют, например, уровни фермента печени. В данном эксперименте комбинированное лечение не приводило к увеличению уровней фермента печени, веса селезенки или уровней цитокинов, таких как TNFα или IL-6 (ФИГ. 14). Уровни фермента печени измеряли с помощью VetScan, а уровни цитокинов измеряли с помощью набора для определения цитокинов мыши MILLIPLEX Map (EMD Millipore).
Все публикации, патенты, заявки на патент и другие документы, процитированные в данной заявке, настоящим включены посредством ссылки во всей своей полноте для всех целей в той же степени, как если бы было отдельно указано, что каждая отдельная публикация, патент, заявка на патент или другой документ включены посредством ссылки для всех целей.
Хотя были проиллюстрированы и описаны различные конкретные варианты осуществления, будет понятно, что могут производиться различные изменения без отклонения от сущности и объема изобретения(изобретений).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ABBVIE BIOTHERAPEUTICS INC.
<120> АНТИТЕЛА К CD40 И ПУТИ ИХ ПРИМЕНЕНИЯ
<130> 381493-285WO
<140>
<141>
<150> 62/342,417
<151> 2016-05-27
<160> 200
<170> PatentIn версия 3.5
<210> 1
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 1
Gly Tyr Thr Phe Thr Ser Tyr Trp Ile Thr
1 5 10
<210> 2
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 2
Gly Tyr Thr Phe Thr Gly Tyr Trp Ile Gln
1 5 10
<210> 3
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 3
Gly Tyr Thr Phe Thr Asp Tyr Tyr Met Asn
1 5 10
<210> 4
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 4
Gly Phe Thr Phe Ser Asp Tyr Tyr Met Ser
1 5 10
<210> 5
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 5
Gly Tyr Ser Ile Thr Thr Asn Tyr Asn Trp Asn
1 5 10
<210> 6
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 6
Gly Tyr Thr Phe Thr Ser Tyr Trp Met His
1 5 10
<210> 7
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 7
Gly Tyr Thr Phe Thr Asp Tyr Tyr Ile Asn
1 5 10
<210> 8
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 8
Gly Tyr Ser Ile Thr Ser Asn Tyr Tyr Trp Asn
1 5 10
<210> 9
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 9
Gly Tyr Ser Ile Ser Ser Asn Tyr Tyr Trp Asn
1 5 10
<210> 10
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 10
Gly Tyr Asp Ile Thr Ser Asn Tyr Tyr Trp Asn
1 5 10
<210> 11
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 11
Glu Ile Asn Pro Gly Ser Gly Ser Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 12
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 12
Glu Ile Leu Pro Gly Gly Asp His Thr Lys Tyr Asn Glu Lys Phe Arg
1 5 10 15
Gly
<210> 13
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 13
Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 14
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 14
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Phe Ser Ala Ser
1 5 10 15
Val Lys Gly
<210> 15
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 15
Tyr Ile Arg His Asp Gly Thr Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 16
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 16
Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 17
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 17
Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Cys Asn Glu Gln Phe Lys
1 5 10 15
Gly
<210> 18
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 18
Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 19
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 19
Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 20
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 20
Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Ser Asn Glu Gln Phe Lys
1 5 10 15
Gly
<210> 21
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 21
Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 22
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 22
Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys Gly
1 5 10 15
<210> 23
<400> 23
000
<210> 24
<400> 24
000
<210> 25
<400> 25
000
<210> 26
<400> 26
000
<210> 27
<400> 27
000
<210> 28
<400> 28
000
<210> 29
<400> 29
000
<210> 30
<400> 30
000
<210> 31
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 31
Asn Arg Gly Thr Gly Asp Tyr
1 5
<210> 32
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 32
Val Gly Gly Asp Tyr
1 5
<210> 33
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 33
Arg Gly Gly Leu Gly Arg Gly Thr Tyr Ala Leu Asp Tyr
1 5 10
<210> 34
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 34
Tyr Gly Gly Leu Arg Gln Gly Trp Tyr Phe Asp Val
1 5 10
<210> 35
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 35
Leu Asp Tyr
1
<210> 36
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 36
Glu Arg Ile Tyr Tyr Ser Gly Ser Thr Tyr Asp Gly Tyr Phe Asp Val
1 5 10 15
<210> 37
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 37
Ser Leu Gly Lys Phe Ala Tyr
1 5
<210> 38
<400> 38
000
<210> 39
<400> 39
000
<210> 40
<211> 277
<212> БЕЛОК
<213> Homo sapiens
<400> 40
Met Val Arg Leu Pro Leu Gln Cys Val Leu Trp Gly Cys Leu Leu Thr
1 5 10 15
Ala Val His Pro Glu Pro Pro Thr Ala Cys Arg Glu Lys Gln Tyr Leu
20 25 30
Ile Asn Ser Gln Cys Cys Ser Leu Cys Gln Pro Gly Gln Lys Leu Val
35 40 45
Ser Asp Cys Thr Glu Phe Thr Glu Thr Glu Cys Leu Pro Cys Gly Glu
50 55 60
Ser Glu Phe Leu Asp Thr Trp Asn Arg Glu Thr His Cys His Gln His
65 70 75 80
Lys Tyr Cys Asp Pro Asn Leu Gly Leu Arg Val Gln Gln Lys Gly Thr
85 90 95
Ser Glu Thr Asp Thr Ile Cys Thr Cys Glu Glu Gly Trp His Cys Thr
100 105 110
Ser Glu Ala Cys Glu Ser Cys Val Leu His Arg Ser Cys Ser Pro Gly
115 120 125
Phe Gly Val Lys Gln Ile Ala Thr Gly Val Ser Asp Thr Ile Cys Glu
130 135 140
Pro Cys Pro Val Gly Phe Phe Ser Asn Val Ser Ser Ala Phe Glu Lys
145 150 155 160
Cys His Pro Trp Thr Ser Cys Glu Thr Lys Asp Leu Val Val Gln Gln
165 170 175
Ala Gly Thr Asn Lys Thr Asp Val Val Cys Gly Pro Gln Asp Arg Leu
180 185 190
Arg Ala Leu Val Val Ile Pro Ile Ile Phe Gly Ile Leu Phe Ala Ile
195 200 205
Leu Leu Val Leu Val Phe Ile Lys Lys Val Ala Lys Lys Pro Thr Asn
210 215 220
Lys Ala Pro His Pro Lys Gln Glu Pro Gln Glu Ile Asn Phe Pro Asp
225 230 235 240
Asp Leu Pro Gly Ser Asn Thr Ala Ala Pro Val Gln Glu Thr Leu His
245 250 255
Gly Cys Gln Pro Val Thr Gln Glu Asp Gly Lys Glu Ser Arg Ile Ser
260 265 270
Val Gln Glu Arg Gln
275
<210> 41
<211> 261
<212> БЕЛОК
<213> Homo sapiens
<400> 41
Met Ile Glu Thr Tyr Asn Gln Thr Ser Pro Arg Ser Ala Ala Thr Gly
1 5 10 15
Leu Pro Ile Ser Met Lys Ile Phe Met Tyr Leu Leu Thr Val Phe Leu
20 25 30
Ile Thr Gln Met Ile Gly Ser Ala Leu Phe Ala Val Tyr Leu His Arg
35 40 45
Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val
50 55 60
Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser
65 70 75 80
Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys
85 90 95
Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu
100 105 110
Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser
115 120 125
Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly
130 135 140
Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln
145 150 155 160
Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr
165 170 175
Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser
180 185 190
Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala
195 200 205
Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His
210 215 220
Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn
225 230 235 240
Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe
245 250 255
Gly Leu Leu Lys Leu
260
<210> 42
<400> 42
000
<210> 43
<400> 43
000
<210> 44
<400> 44
000
<210> 45
<400> 45
000
<210> 46
<400> 46
000
<210> 47
<400> 47
000
<210> 48
<400> 48
000
<210> 49
<400> 49
000
<210> 50
<400> 50
000
<210> 51
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 51
Arg Ser Ser Gln Ser Leu Val His Ser Tyr Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 52
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 52
Arg Ser Ser Gln Ser Leu Val Asn Ser Asn Glu Asn Thr Tyr Leu His
1 5 10 15
<210> 53
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 53
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 54
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 54
Arg Ala Ser Gln Asp Ile Arg Asn Tyr Leu Asn
1 5 10
<210> 55
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 55
Arg Ser Ser Gln Ser Leu Glu Asn Ser Tyr Gly Asn Thr Phe Leu Asn
1 5 10 15
<210> 56
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 56
Ser Ala Ser Ser Ser Leu Ser Tyr Met His
1 5 10
<210> 57
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 57
Lys Ala Ser Gln Ser Val Val Thr Ala Val Ala
1 5 10
<210> 58
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 58
Arg Ser Ser Gln Ser Leu Glu Asn Thr Asn Gly Asn Thr Phe Leu Asn
1 5 10 15
<210> 59
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 59
Arg Ser Ser Gln Ser Leu Glu Asn Ser Asn Gly Asn Thr Phe Leu Asn
1 5 10 15
<210> 60
<400> 60
000
<210> 61
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 61
Lys Val Ser Asn Arg Ile Ser
1 5
<210> 62
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 62
Lys Val Phe Asn Arg Tyr Ser
1 5
<210> 63
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 63
Tyr Thr Ser Arg Leu His Leu
1 5
<210> 64
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 64
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 65
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 65
Arg Val Ser Asn Arg Phe Cys
1 5
<210> 66
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 66
Asp Thr Ser Lys Leu Ala Ser
1 5
<210> 67
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 67
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 68
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 68
Arg Val Ser Asn Arg Phe Ser
1 5
<210> 69
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 69
Arg Ile Ser Asn Arg Phe Ser
1 5
<210> 70
<400> 70
000
<210> 71
<400> 71
000
<210> 72
<400> 72
000
<210> 73
<400> 73
000
<210> 74
<400> 74
000
<210> 75
<400> 75
000
<210> 76
<400> 76
000
<210> 77
<400> 77
000
<210> 78
<400> 78
000
<210> 79
<400> 79
000
<210> 80
<400> 80
000
<210> 81
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 81
Ser Gln Ser Thr His Val Pro Tyr Thr
1 5
<210> 82
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 82
Phe Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 83
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 83
Gln Gln Gly Asn Thr Leu Pro Leu Thr
1 5
<210> 84
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 84
Gln Gln Gly Lys Thr Leu Pro Trp Thr
1 5
<210> 85
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 85
Leu Gln Val Thr His Val Pro Tyr Thr
1 5
<210> 86
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 86
Gln Gln Trp Ser Ser Asn Pro Trp Thr
1 5
<210> 87
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 87
Gln Gln Tyr Ser Ser Tyr Pro Tyr Thr
1 5
<210> 88
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 88
Leu Gln Val Thr His Val Pro Phe Thr
1 5
<210> 89
<400> 89
000
<210> 90
<400> 90
000
<210> 91
<400> 91
000
<210> 92
<400> 92
000
<210> 93
<400> 93
000
<210> 94
<400> 94
000
<210> 95
<400> 95
000
<210> 96
<400> 96
000
<210> 97
<400> 97
000
<210> 98
<400> 98
000
<210> 99
<400> 99
000
<210> 100
<400> 100
000
<210> 101
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 101
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Thr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Gly Ser Gly Ser Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Arg Gly Thr Gly Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 102
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 102
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Ala Lys Leu Ser Cys Lys Ala Thr Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Trp Ile Gln Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Gly Asp His Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Arg Gly Lys Ala Thr Phe Thr Ser Asp Thr Ser Ser Asn Thr Val Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Gly Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 103
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 103
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Gly Leu Gly Arg Gly Thr Tyr Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 104
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 104
Leu Val Gln Pro Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly
1 5 10 15
Phe Thr Phe Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly
20 25 30
Lys Ala Leu Glu Trp Leu Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr
35 40 45
Thr Thr Glu Phe Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
50 55 60
Asp Asn Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Ala Leu Arg Ala
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Tyr Gly Gly Leu Arg Gln
85 90 95
Gly Trp Tyr Phe Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser
100 105 110
Ser
<210> 105
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 105
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Glu Pro Ser Gln
1 5 10 15
Ser Leu Phe Leu Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr Thr Asn
20 25 30
Tyr Asn Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg His Asp Gly Thr Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Ile Arg Asp Thr Pro Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Thr Arg Leu Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
100 105 110
<210> 106
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 106
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Ile Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Tyr Tyr Ser Gly Ser Thr Tyr Asp Gly Tyr Phe
100 105 110
Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 107
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 107
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Ser Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Cys Asn Glu Gln Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Val Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Leu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Ser Leu Gly Lys Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 108
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 108
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 109
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 109
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Arg Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 110
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 110
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Tyr Tyr Ser Gly Ser Thr Tyr Asp Gly Tyr Phe
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 111
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 111
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Tyr Tyr Ser Gly Ser Thr Tyr Asp Gly Tyr Phe
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 112
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 112
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Ser Asn Gly Glu Thr His Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Tyr Tyr Ser Gly Ser Thr Tyr Asp Gly Tyr Phe
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 113
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 113
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Cys Asn Glu Gln Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ser Ser Leu Gly Lys Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 114
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 114
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Ser Asn Glu Gln Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ser Ser Leu Gly Lys Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 115
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 115
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Ser Gly Ser Val Tyr Cys Asn Glu Gln Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Ser Leu Gly Lys Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 116
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 116
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 117
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 117
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 118
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 118
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Ser Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 119
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 119
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Tyr
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 120
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 120
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Leu Tyr
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 121
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 121
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Glu
1 5 10 15
Thr Leu Ile Leu Thr Cys Thr Val Ser Gly Tyr Asp Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Tyr
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 122
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 122
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 123
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 123
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Phe Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 124
<400> 124
000
<210> 125
<400> 125
000
<210> 126
<400> 126
000
<210> 127
<400> 127
000
<210> 128
<400> 128
000
<210> 129
<400> 129
000
<210> 130
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 130
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 131
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 131
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 132
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 132
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Glu Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 133
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 133
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Glu Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 134
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 134
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Tyr Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 135
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 135
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asn
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Arg Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Tyr Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 136
<400> 136
000
<210> 137
<400> 137
000
<210> 138
<400> 138
000
<210> 139
<400> 139
000
<210> 140
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 140
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 141
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 141
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 142
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 142
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 143
<400> 143
000
<210> 144
<400> 144
000
<210> 145
<400> 145
000
<210> 146
<400> 146
000
<210> 147
<400> 147
000
<210> 148
<400> 148
000
<210> 149
<400> 149
000
<210> 150
<400> 150
000
<210> 151
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 151
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Tyr Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Ile Ser Gly Val Pro
50 55 60
Asp Arg Leu Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Pro Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 152
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 152
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Asn Ser
20 25 30
Asn Glu Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Phe Asn Arg Tyr Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Phe Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 153
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 153
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Pro Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Leu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 154
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 154
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Arg Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Lys Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Ser Lys Leu Glu Met Lys
100 105
<210> 155
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 155
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Ser
20 25 30
Tyr Gly Asn Thr Phe Leu Asn Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Cys Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Phe Cys Leu Gln Val
85 90 95
Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 156
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 156
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Leu Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 157
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 157
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Leu Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Gly Glu
65 70 75 80
Asp Gly Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 158
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 158
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Thr Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Ser Val Val Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Ala Leu Thr Ile Arg Thr Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 159
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 159
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 160
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 160
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Ser
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 161
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 161
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Leu Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 162
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 162
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Val Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 163
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 163
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 164
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 164
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 165
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 165
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Glu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 166
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 166
Asp Ala Val Met Thr Gln Thr Pro Leu Ser Leu Ala Val Leu Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 167
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 167
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 168
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 168
Asp Ala Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Phe Gln Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 169
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 169
Asp Ala Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Phe Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 170
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 170
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 171
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 171
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Glu Asn Thr
20 25 30
Asn Gly Asn Thr Phe Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Val
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 172
<400> 172
000
<210> 173
<400> 173
000
<210> 174
<400> 174
000
<210> 175
<400> 175
000
<210> 176
<400> 176
000
<210> 177
<400> 177
000
<210> 178
<400> 178
000
<210> 179
<400> 179
000
<210> 180
<400> 180
000
<210> 181
<211> 452
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 181
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asp Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Pro Leu Gly Tyr Cys Thr Asn Gly Val Cys Ser Tyr
100 105 110
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr
130 135 140
Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr
195 200 205
Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val
210 215 220
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
225 230 235 240
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
290 295 300
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 182
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 182
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Tyr Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Thr Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ile Phe Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 183
<400> 183
000
<210> 184
<400> 184
000
<210> 185
<400> 185
000
<210> 186
<400> 186
000
<210> 187
<400> 187
000
<210> 188
<400> 188
000
<210> 189
<400> 189
000
<210> 190
<400> 190
000
<210> 191
<400> 191
000
<210> 192
<400> 192
000
<210> 193
<400> 193
000
<210> 194
<400> 194
000
<210> 195
<400> 195
000
<210> 196
<400> 196
000
<210> 197
<400> 197
000
<210> 198
<400> 198
000
<210> 199
<400> 199
000
<210> 200
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 200
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ АНТИ-FAP КЛОН 212 | 2019 |
|
RU2799429C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| АНТИТЕЛА К CD40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2715597C2 |
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ CSF1R | 2018 |
|
RU2792239C2 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| АНТИ-GDF15 АНТИТЕЛА, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2795457C2 |
| АНТИТЕЛО К CD40, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2779128C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛ К CD40 И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778572C1 |
| ПРИМЕНЕНИЕ АНТИТЕЛ К СКЛЕРОСТИНУ ДЛЯ ЛЕЧЕНИЯ НЕСОВЕРШЕННОГО ОСТЕОГЕНЕЗА | 2017 |
|
RU2789033C2 |








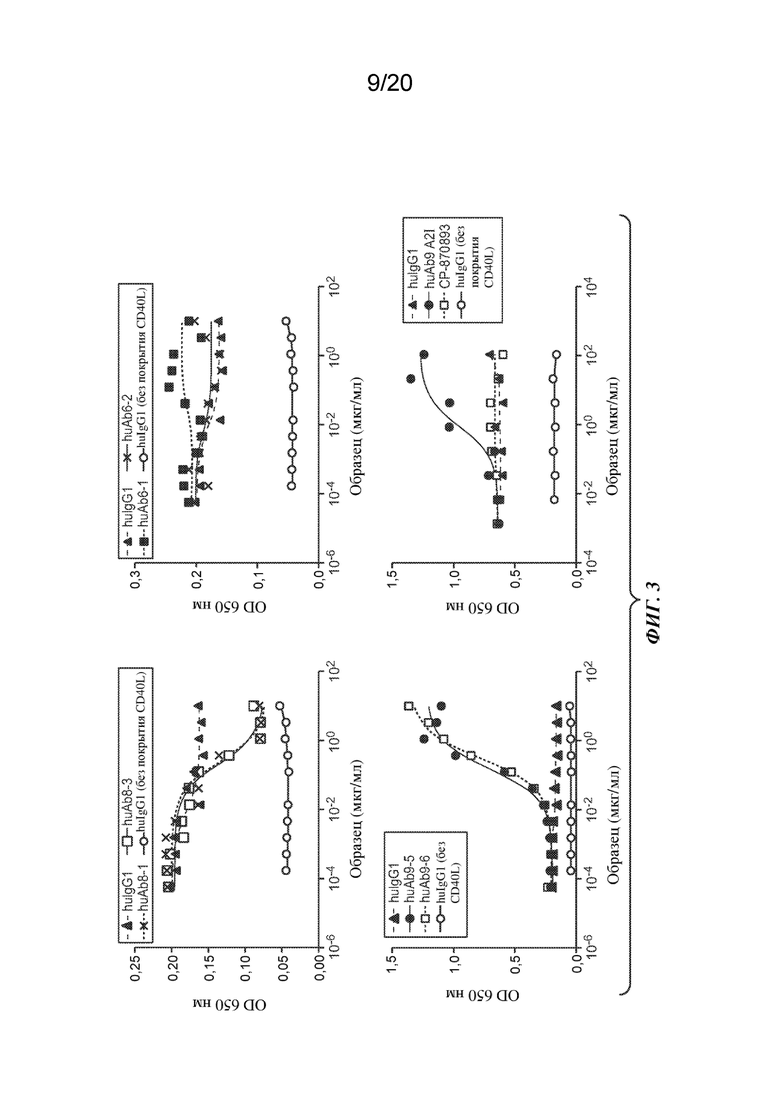
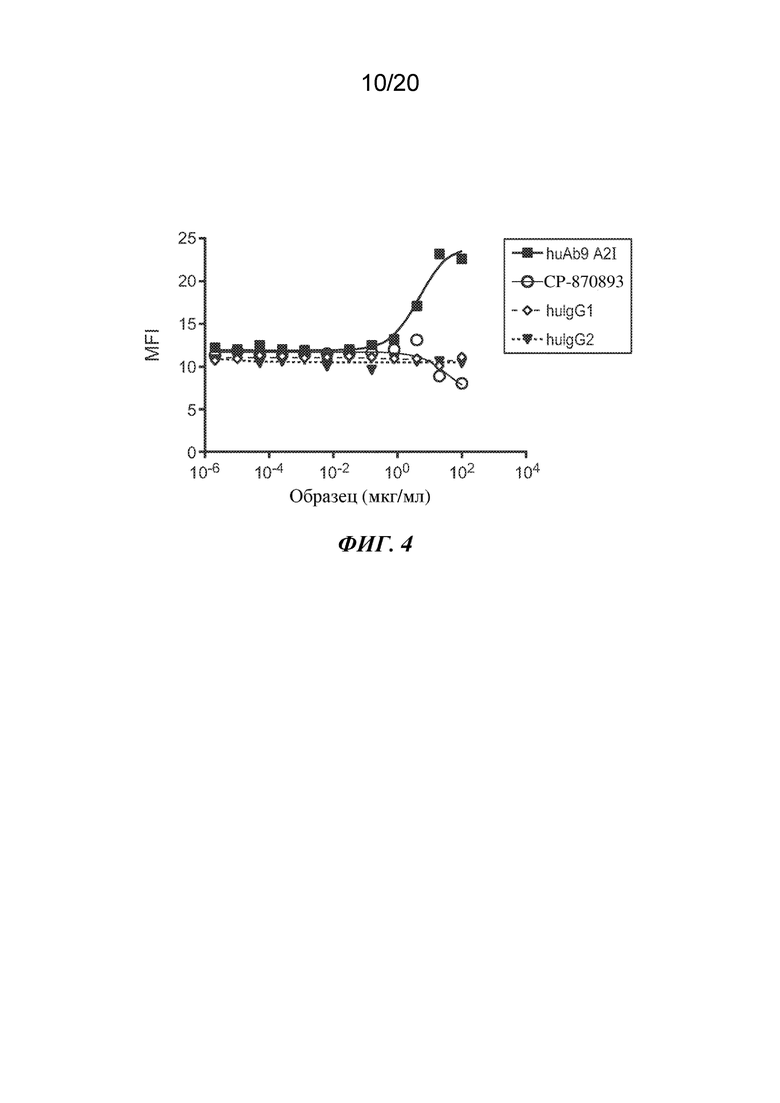
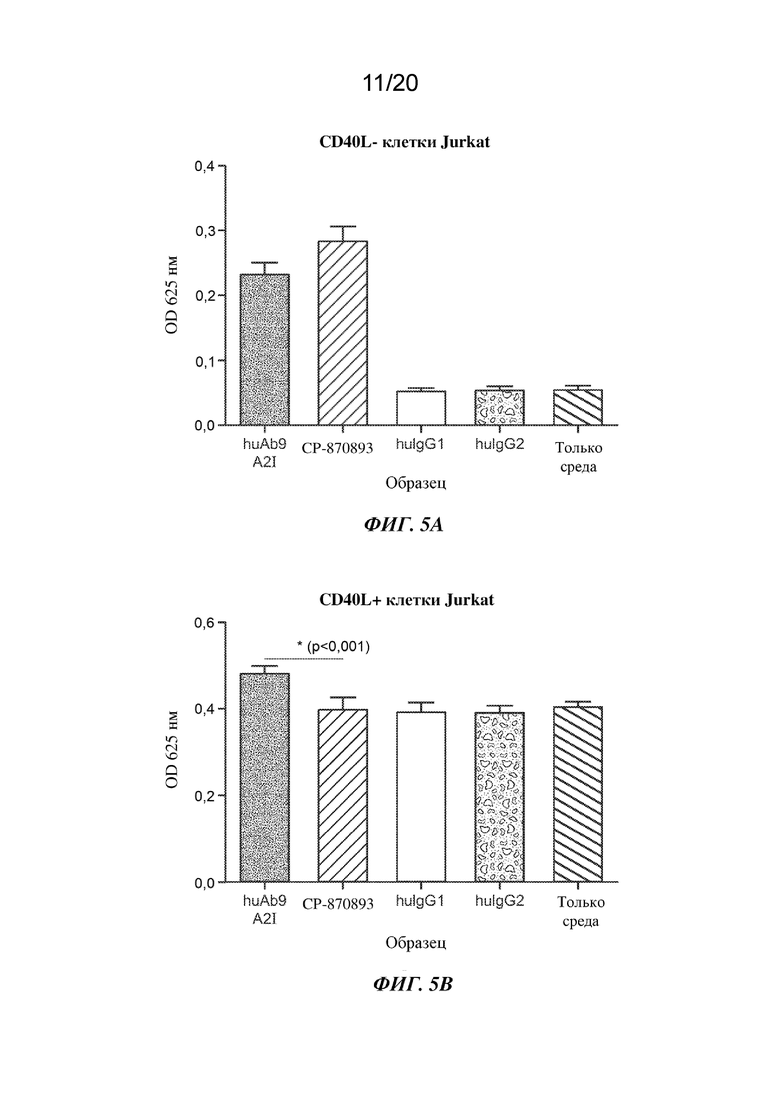
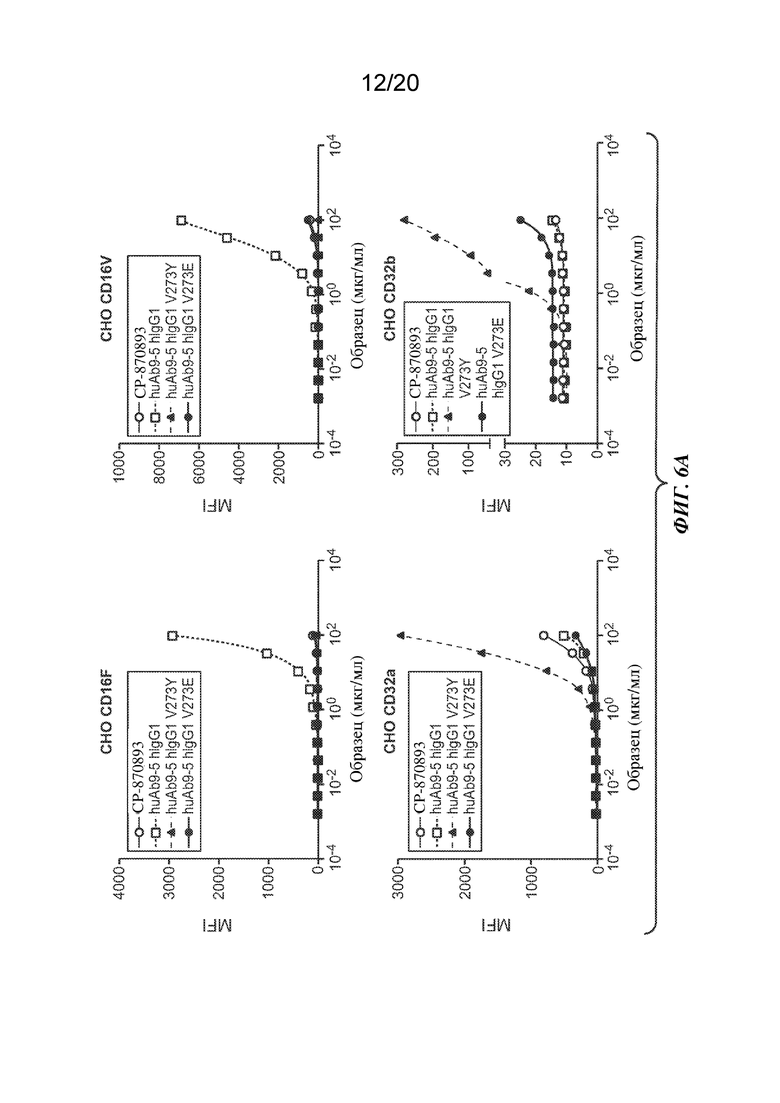
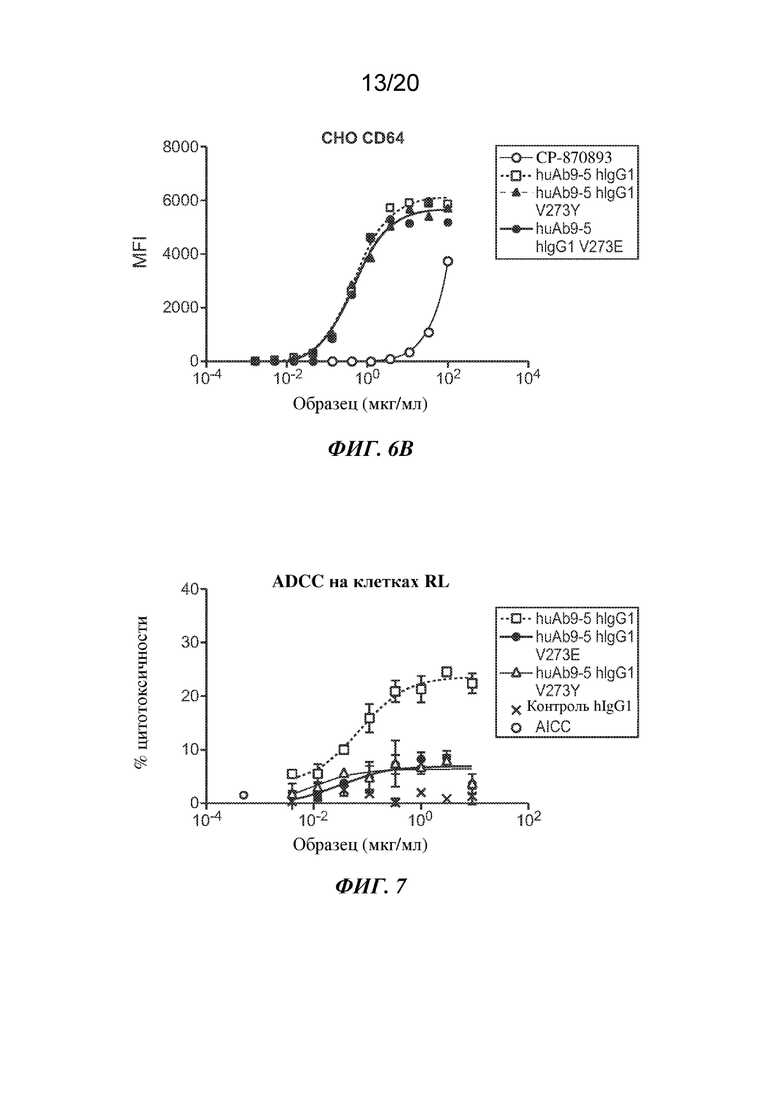
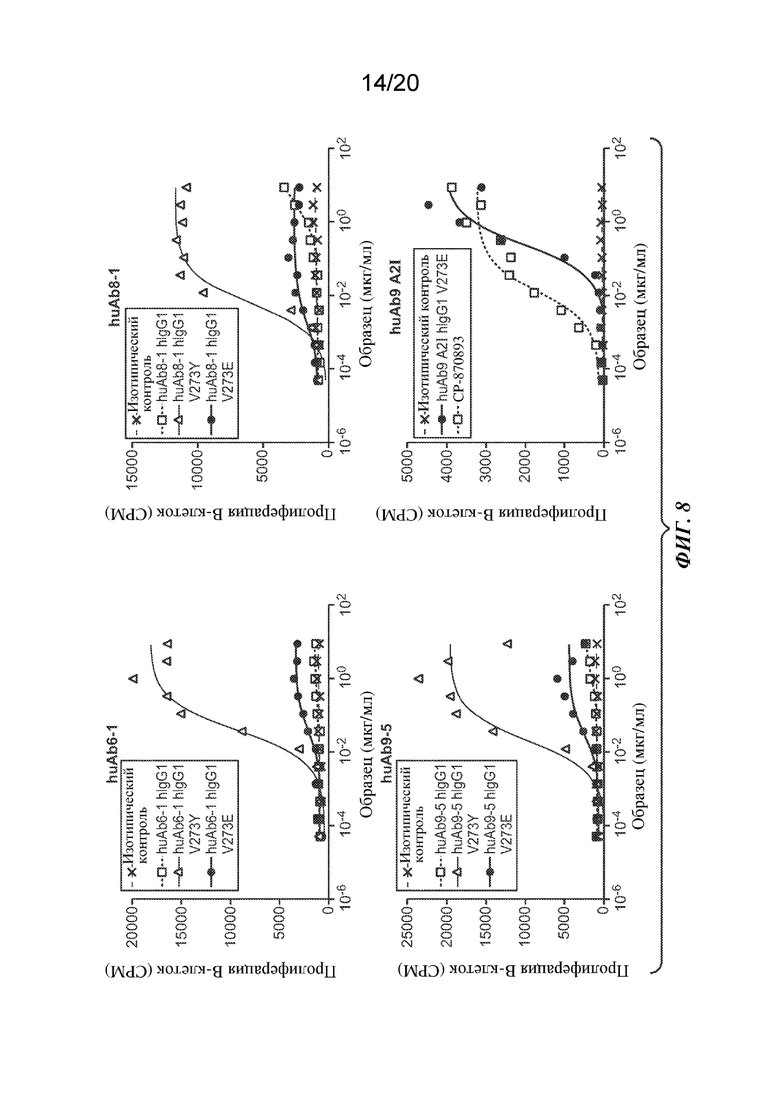
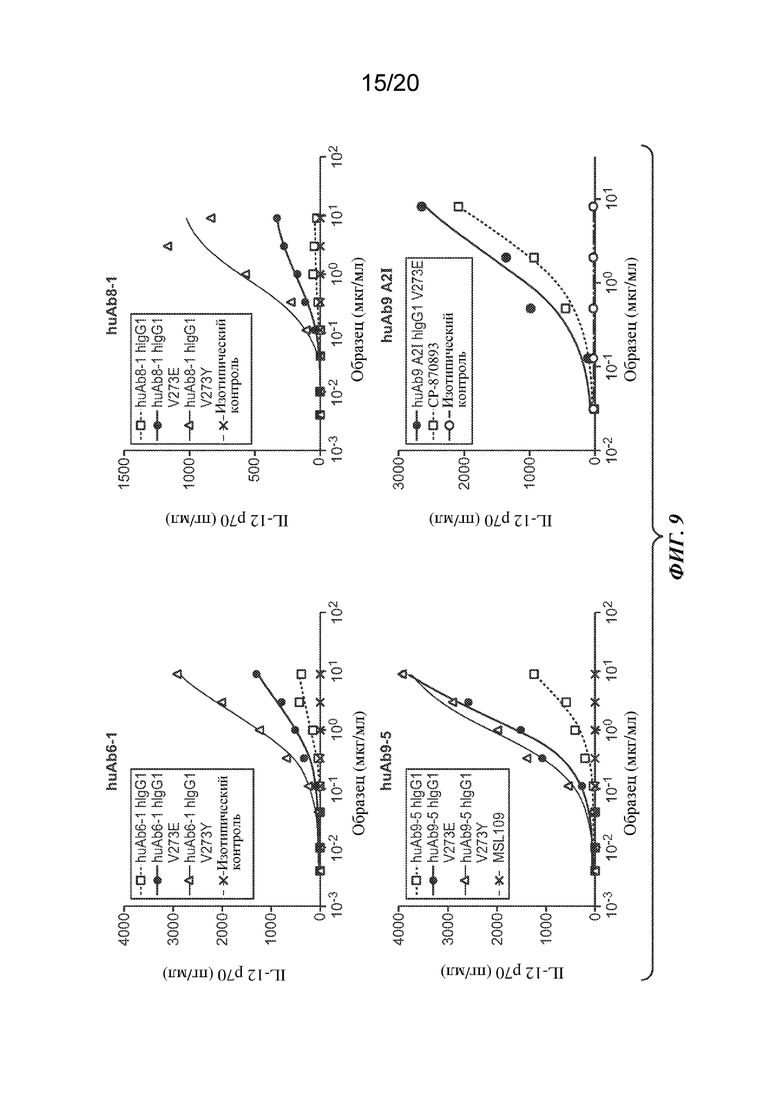
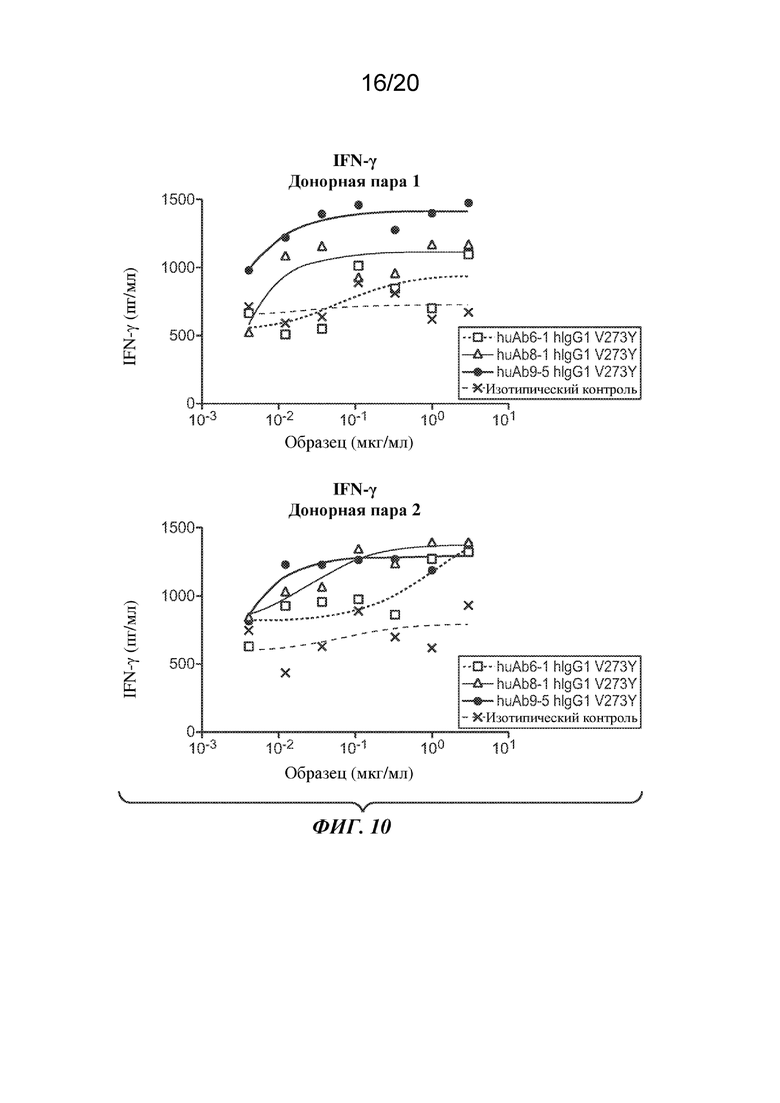
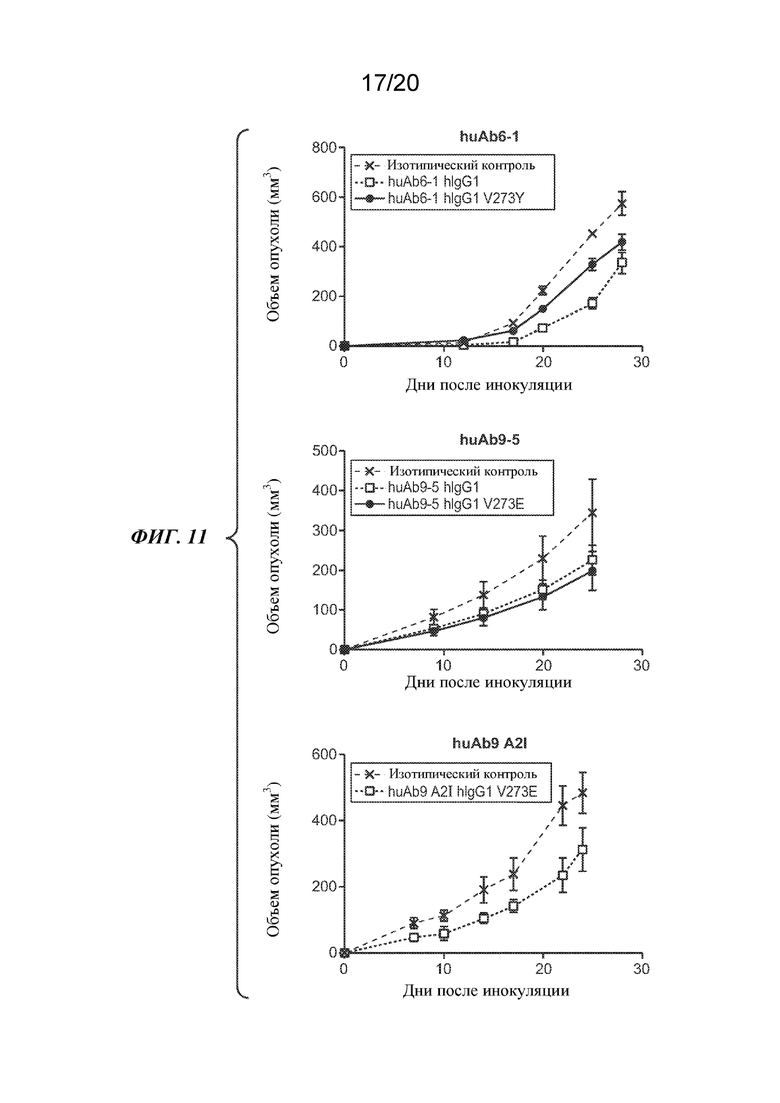

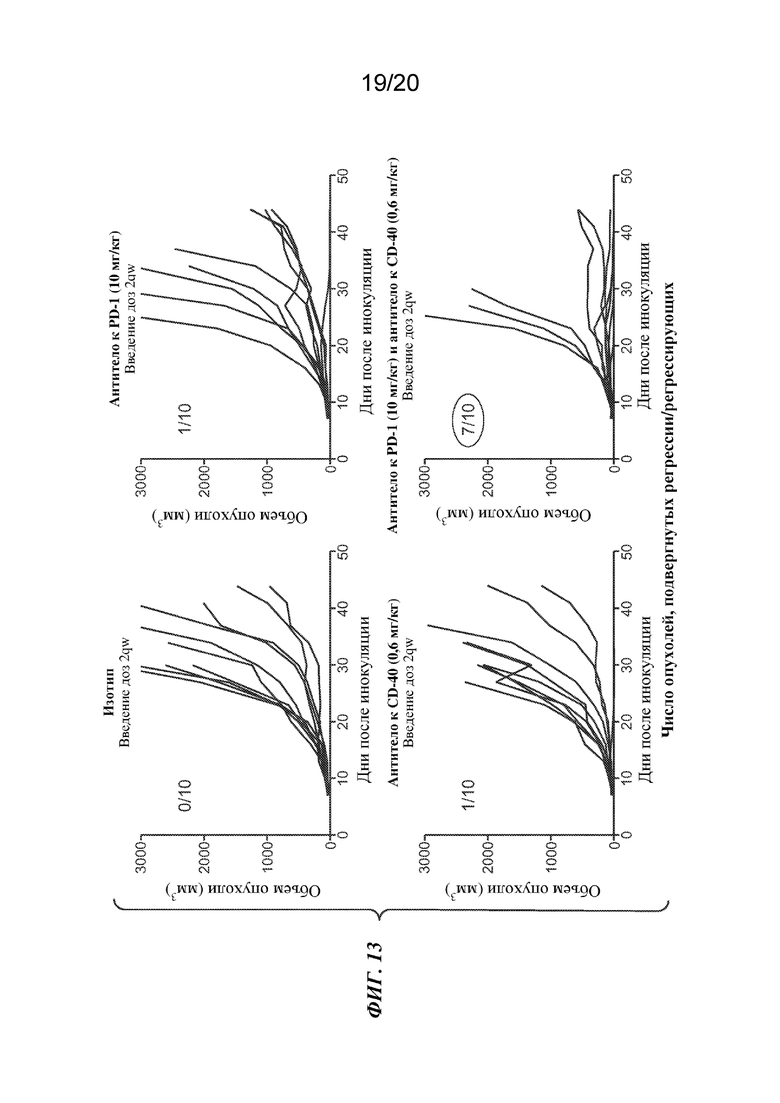
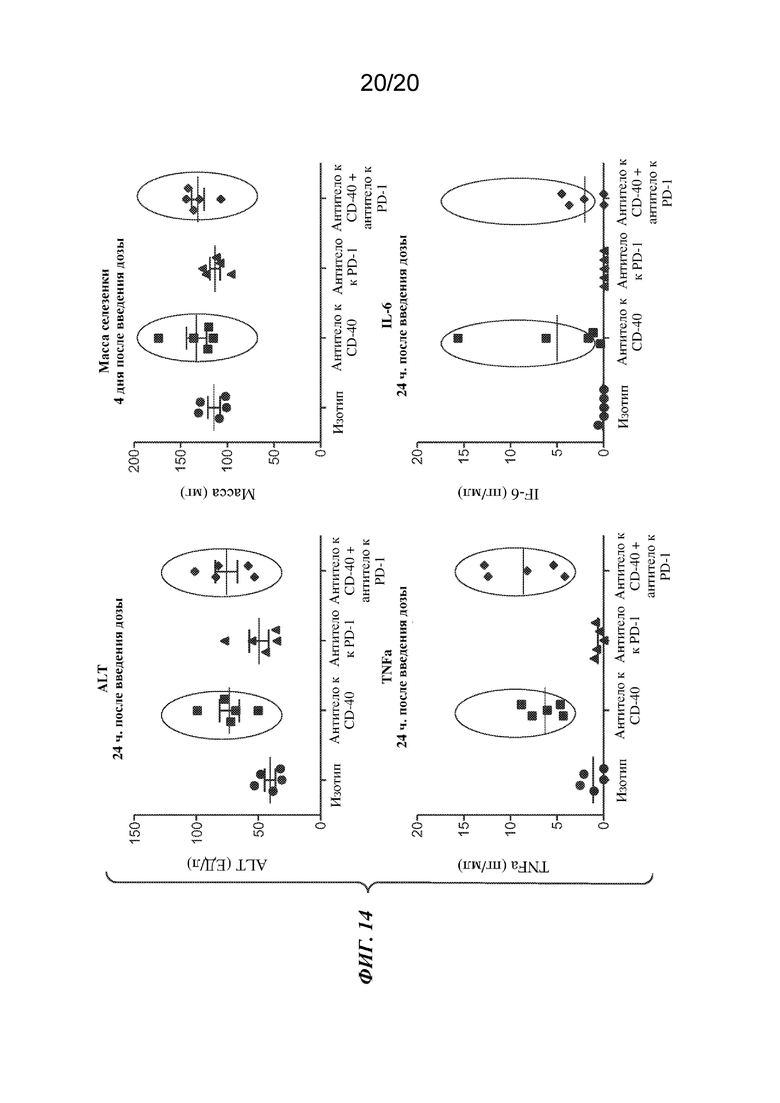
Изобретение относится к области биохимии, в частности к антителу к CD40. Изобретение позволяет эффективно лечить заболевания, ассоциированные с CD40. 9 з.п. ф-лы, 14 ил., 13 табл., 7 пр.
1. Антитело к CD40, которое содержит (i) цепь VH, содержащую три CDR; и (ii) цепь VL, содержащую три CDR, где:
CDR1 VH имеет аминокислотную последовательность:
GYSITSNYYWN (SEQ ID NO:8);
CDR2 VH имеет аминокислотную последовательность:
YIRYDGSNNYNPSLKN (SEQ ID NO:18);
CDR3 VH имеет аминокислотную последовательность:
LDY (SEQ ID NO:35);
CDR1 VL имеет аминокислотную последовательность:
RSSQSLENTNGNTFLN (SEQ ID NO:58);
CDR2 VL имеет аминокислотную последовательность:
RVSNRFS (SEQ ID NO:68);
CDR3 VL имеет аминокислотную последовательность:
LQVTHVPFT (SEQ ID NO:88).
2. Антитело к CD40 по п.1, которое является гуманизированным.
3. Антитело к CD40 по п.1 или 2, которое содержит цепь VH, соответствующую последовательности SEQ ID NO:117, и цепь VL, соответствующую последовательности SEQ ID NO:170.
4. Антитело к CD40 по любому из пп.1-3, которое представляет собой IgG.
5. Антитело к CD40 по п.4, которое представляет собой IgG1 и содержит вариант области CH2, содержащий аминокислотную замену V273E или V273Y.
6. Антитело к CD40 по п.4 или 5, которое представляет собой IgG1 и содержит вариант области Fc, содержащий аминокислотные замены D356E и L358M.
7. Антитело к CD40 по любому из пп.4-6, содержащее константную область каппа легкой цепи.
8. Антитело к CD40 по любому из пп.1, 2, 4, 6, 7, имеющее последовательность тяжелой цепи SEQ ID NO:130 или 131 и последовательность легкой цепи SEQ ID NO:140.
9. Антитело к CD40 по любому из пп.1-7, имеющее последовательность тяжелой цепи SEQ ID NO:132 или 133 и последовательность легкой цепи SEQ ID NO:141.
10. Антитело к CD40 по любому из пп.1, 2 или 4-7, имеющее последовательность тяжелой цепи SEQ ID NO:132 или 133 и последовательность легкой цепи SEQ ID NO:142.
| AU 2005271892 A1, 16.02.2006 | |||
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО, СВЯЗАННОГО С ТРАНСПЛАНТАЦИЕЙ И АУТОИММУННОГО ЗАБОЛЕВАНИЯ | 2007 |
|
RU2495882C2 |
Авторы
Даты
2021-07-22—Публикация
2017-05-26—Подача