ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет по китайской патентной заявке № 201910693957.1, поданной 30 июля 2019 г., под названием “Индикаторная бумага для полуколичественного обнаружения хорионического гонадотропина человека, чашка с реактивом, способ их изготовления и их применение”, содержание которой полностью включено в данную заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области биологического обнаружения и, в частности, относится к индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека, чашке с реактивом, способу их изготовления и их применению.
УРОВЕНЬ ТЕХНИКИ
Хорионический гонадотропин человека (ХГЧ) представляет собой гликопротеиновый гормон, секретируемый трофобластами плаценты при беременности, и он состоит из двух разных субъединиц α- и β-, соединенных нековалентной связью. В процессе выработки, секреции и метаболизма гормонов молекулы ХГЧ будут претерпевать различные изменения, такие как разъединение и диссоциация, поэтому в крови и в моче они существуют в различных молекулярных формах. ХГЧ является единственным плацентарным гормоном, концентрация которого не возрастает по мере увеличения массы плаценты. Референсные значения ХГЧ у беременных женщин описаны в «Китайских методических инструкциях по клиническому исследованию»: референсное значение ХГЧ составляет 5-50 МЕ/мл для 0,2-1 недели беременности, референсное значение ХГЧ составляет 50-500 МЕ/мл для 1-2 недель беременности, референсное значение ХГЧ составляет 100-5000 МЕ/мл для 2-3 недель беременности, референсное значение ХГЧ составляет 500-10000 МЕ/мл для 3-4 недель беременности, референсное значение ХГЧ составляет 1000-50000 МЕ/мл для 4-5 недель беременности, референсное значение ХГЧ составляет 10000-100000 МЕ/мл для 5-6 недель беременности, референсное значение ХГЧ составляет 15000-200000 МЕ/мл для 6-8 недель беременности, референсное значение ХГЧ составляет 10000-100000 МЕ/мл для 8-12 недель беременности, и быстро уменьшается после следующих 1-2 недель, а затем постепенно уменьшается и остается на уровне примерно 1/5-1/10 пикового значения вплоть до родов. Следовательно, оценка цикла беременности может быть проведена путем обнаружения концентрации ХГЧ в крови и моче.
Более того, обнаружение хорионического гонадотропина человека (ХГЧ) также широко использовалось для диагностики и наблюдения эффектов заболеваний, включающих угрожающий аборт, неизбежный аборт, несостоявшийся выкидыш, внематочная беременность, трофобластическая болезнь и так далее. Путем обнаружения концентрации ХГЧ можно диагностировать различные заболевания и можно наблюдать течение заболевания, что имеет большое клиническое значение.
В настоящее время для обнаружения ХГЧ широко используют индикаторную бумагу с коллоидным золотом для раннего определения беременности, но с ее помощью можно проводить только качественное обнаружение и ее диапазон применимости ограничен.
Китайский патент CN108761099A раскрывает индикаторную бумагу для определения цикла ХГЧ, содержащую первую полоску индикаторной бумаги и вторую полоску индикаторной бумаги. Сравнивая степень проявления цвета линий обнаружения на двух полосках индикаторной бумаги, можно определить составляет ли срок беременности первые три недели или более трех недель. Патент также раскрывает индикаторный набор для определения цикла ХГЧ, содержащий индикаторную бумагу для определения цикла ХГЧ. Индикаторная бумага и индикаторный набор просты в обращении и, таким образом, подходят для выполняемого на месте, немедленного и быстрого обнаружения, и подходят для самостоятельного обнаружения нескольких недель беременности. Однако полоска индикаторной бумаги содержит только две полоски индикаторной бумаги, включая первую полоску индикаторной бумаги с минимально обнаруживаемым количеством 25 мМЕ/мл и вторую полоску индикаторной бумаги с минимально обнаруживаемым количеством 100 мМЕ/мл, и может служить только для определения того, составляет ли срок беременности первые три недели или более трех недель. Когда срок беременности больше и концентрация ХГЧ составляет более 100 мМЕ/мл, линия качественного контроля вполне может не дать проявления цвета, поскольку свободное β-антитело, используемое во второй полоске индикаторной бумаги, представляет собой мышиное антитело. Следовательно, невозможно обнаружение диапазона более высоких концентраций ХГЧ, и невозможно диагностирование и обнаружение различных заболеваний, и диапазон обнаружения концентраций узок. Более того, обнаружение с использованием полоски индикаторной бумаги осуществляют путем сравнения степени проявления цвета линий обнаружения двух полосок индикаторной бумаги, таким образом, результаты исследования являются субъективными и недостаточно точными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Из вышеизложенного следует, что техническая проблема, подлежащая решению настоящей заявкой, заключается в том, чтобы устранить недостатки, состоящие в том, что диапазон обнаружения концентраций индикаторной бумаги для обнаружения ХГЧ в предшествующем уровне техники является узким и результаты исследования являются субъективными и недостаточно точными. Следовательно, настоящая заявка предлагает индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека с широким диапазоном обнаружения концентраций, точными результатами исследования и высокой чувствительностью, чашка с реактивом, способ их изготовления и их применение.
В первом аспекте настоящая заявка предлагает индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, содержащую по меньшей мере три полоски индикаторной бумаги, причем каждая включает в себя подложку и прокладку для образца, адсорбирующую прокладку для коллоидного золота, несущую антитело пленку и абсорбирующую прокладку для воды, последовательно приклеенные к подложке; где прокладка для образца, адсорбирующая прокладка для коллоидного золота, несущая антитело пленка и абсорбирующая прокладка для воды частично перекрываются друг с другом и расположены внахлест;
несущая антитело пленка имеет линию обнаружения на конце вблизи адсорбирующей прокладки для коллоидного золота и линию качественного контроля на конце вблизи адсорбирующей прокладки для воды; линия обнаружения покрыта моноклональным антителом к хорионическому гонадотропину человека α-ХГЧ; линия качественного контроля покрыта поликлональным антителом к мышиному IgG;
адсорбирующая прокладка для коллоидного золота одной из по меньшей мере трех полосок индикаторной бумаги имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, и адсорбирующая прокладка для коллоидного золота остальных из по меньшей мере трех полосок индикаторной бумаги имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и свободное β-антитело с разным массовым соотношением; где свободное β-антитело не является мышиным антителом.
В индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека свободное β-антитело представляет собой гуманизированное, лошадиное, кроличье или козье антитело.
Индикаторная бумага для полуколичественного обнаружения хорионического гонадотропина человека содержит шесть полосок индикаторной бумаги в составе первой полоски индикаторной бумаги, второй полоски индикаторной бумаги, третьей полоски индикаторной бумаги, четвертой полоски индикаторной бумаги, пятой полоски индикаторной бумаги и шестой полоски индикаторной бумаги.
В индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека массовые отношения конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом к свободному β-антителу, адсорбированному на адсорбирующей прокладке для коллоидного золота, второй полоски индикаторной бумаги, третьей полоски индикаторной бумаги, четвертой полоски индикаторной бумаги, пятой полоски индикаторной бумаги и шестой полоски индикаторной бумаги составляют 1:1, 1:2, 1:40, 1:80, 1:100, соответственно.
В индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека несущая антитело пленка представляет собой нитроцеллюлозную мембрану с размером пор 3-10 мкм.
В индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека интервал между линией обнаружения и линией качественного контроля составляет 0,3-1,0 см, предпочтительной, 0,5 см.
В индикаторной бумаге для полуколичественного обнаружения хорионического гонадотропина человека защитная пленка размещена как на прокладке для образца, так и на адсорбирующей прокладке для воды.
Во втором аспекте настоящая заявка предлагает способ изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, включающий в себя стадии:
S1: нанесения моноклонального антитела к хорионическому гонадотропину человека α-ХГЧ и поликлонального антитела к мышиному IgG, соответственно, на несущую антитело пленку, чтобы получить линию обнаружения и линию качественного контроля, осуществления уплотняющей обработки в растворе для уплотняющей обработки и сушки для использования;
S2: взятия коллоидного золота и регулирования его pH, добавления к нему моноклонального антитела к хорионическому гонадотропину человека α-ХГЧ, добавления стабилизатора с перемешиванием, центрифугирования и отделения осадка, повторного растворения осадка в комплексном растворе коллоидного золота для получения комплексного раствора конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом;
S3: выливания комплексного раствора конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, полученного на стадии S2, на адсорбирующую прокладку для коллоидного золота одной полоски индикаторной бумаги с последующими сушкой, укупориванием и хранением для использования;
S4: добавления свободного β-антитела к комплексному раствору конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, полученному на стадии S2, и тщательного смешения для получения разных смешанных комплексных растворов с разным массовым отношением конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом к свободному β-антителу, выливания разных смешанных комплексных растворов на адсорбирующие прокладки для коллоидного золота остальных полосок индикаторной бумаги с последующими сушкой, укупориванием и хранением для использования;
S5: взятия прокладки для образца, адсорбирующей прокладки для коллоидного золота, несущей антитело пленки и адсорбирующей прокладки для воды, которые последовательно приклеивают вдоль продольного направления подложки таким образом, что они частично перекрываются, и изготовления полоски индикаторной бумаги, и изготовления по меньшей мере трех полосок индикаторной бумаги таким путем;
где свободное β-антитело не является мышиным антителом.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека имеется шесть полосок индикаторной бумаги в составе первой полоски индикаторной бумаги, второй полоски индикаторной бумаги, третьей полоски индикаторной бумаги, четвертой полоски индикаторной бумаги, пятой полоски индикаторной бумаги и шестой полоски индикаторной бумаги.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека в первой, второй и третьей полосках индикаторной бумаги моноклональное антитело к хорионическому гонадотропину человека β-ХГЧ маркировано коллоидным золотом с концентрацией 4 мкг/мл, и в четвертой, пятой и шестой полосках индикаторной бумаги моноклональное антитело к хорионическому гонадотропину человека β-ХГЧ маркировано коллоидным золотом с концентрацией 5 мкг/мл.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека во второй, третьей, четвертой, пятой и шестой полосках индикаторной бумаги массовые отношения моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ к свободному β- антителу составляют 1:1, 1:2, 1:40, 1:80 и 1:100, соответственно.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека моноклональное антитело к хорионическому гонадотропину человека α-ХГЧ имеет концентрацию 2-3 мг/мл, поликлональное антитело к мышиному IgG имеет концентрацию 1-2 мг/мл.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека раствор для уплотняющей обработки содержит 0,08-0,12 М буферный раствор, 0,3-0,7 масс. % сахара и 0,8-1,2 масс. % уплотняющего белка, и 0,03-0,07 масс. % консерванта, где буферный раствор представляет собой фосфатный буферный раствор, сахар представляет собой сахарозу или трегалозу, консервант представляет собой NaN3 или тимеросал, и блокирующий белок представляет собой казеин или бычий сывороточный альбумин. Предпочтительно, раствор для уплотняющей обработки содержит 0,1 М буферный раствор, 0,5 масс. % сахара, 1 масс. % уплотняющего белка и 0,05 масс. % консерванта.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека на стадии S2 значение pH регулируют до 6,5-7,0.
В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека комплексный раствор конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и смешанный раствор конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и свободного β-антитела выливают на адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, соответственно.
В третьем аспекте настоящая заявка предлагает чашку с реактивом для полуколичественного обнаружения хорионического гонадотропина человека, содержащую индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека или индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, изготовленную данным способом.
Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека дополнительно содержит корпус чашки, картридж, расположенный внутри чашки с реактивом и снабженный параллельными пазами, где один конец паза имеет отверстие для введения в него полоски индикаторной бумаги, прокладка для образца полоски индикаторной бумаги проходит от отверстия до внешней стороны картриджа.
Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека дополнительно содержит крышку чашки, отдельную от чашки и закрывающую корпус чашки.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека картридж расположен вертикально внутри корпуса чашки, и отверстие паза находится вблизи дна корпуса чашки.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека корпус чашки имеет полость обнаружения, полость для хранения жидкости и полость для направления жидкости; где полость для направления жидкости имеет первое сквозное отверстие, взаимно сообщающееся с полостью для хранения жидкости в верхней ее части, и второе сквозное отверстие, взаимно сообщающееся с полостью обнаружения в нижней ее части; поршень, скользящий вдоль полости для направления жидкости, размещен внутри полости для направления жидкости и имеет начальное состояние для обеспечения сообщения полости для направления жидкости с полостью для хранения жидкости и состояние обнаружения для обеспечения сообщения полости для направления жидкости с полостью обнаружения; третье сквозное отверстие размещено на стенке чашки корпуса чашки вдали от полости обнаружения и взаимно сообщается с полостью для направления жидкости; и картридж размещен вертикально внутри полости обнаружения.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека резервуар для хранения жидкости размещен на поршне; когда поршень находится в начальном состоянии, резервуар для хранения жидкости поршня выровнен относительно первого сквозного отверстия, так что полость для направления жидкости взаимно сообщается с полостью для хранения жидкости; когда поршень находится в состоянии обнаружения, резервуар для хранения жидкости поршня выровнен относительно второго сквозного отверстия, так что полость для направления жидкости взаимно сообщается с полостью обнаружения.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека поднимающий элемент для поднятия поршня предусмотрен на крышке чашки, и поднимающий элемент смонтирован на крышке чашки, будучи отделяемым от нее.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека картридж закреплен параллельно внутри крышки чашки.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека опора размещена на внешней кромке крышки чашки для закрепления чашки с реактивом, помещенной на свой бок, и мерная линия расположена на корпусе чашки.
В чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека картридж изготовлен из прозрачного материала.
В четвертом аспекте настоящая заявка предлагает способ полуколичественного обнаружения хорионического гонадотропина человека с использованием чашки с реактивом, который включает в себя сбор образца мочи в корпус чашки и наблюдение того, проявляется ли цвет на линии обнаружения и линии качественного контроля полоски индикаторной бумаги в течение 5 минут от того момента времени, когда полоска индикаторной бумаги адсорбировала образец.
В пятом аспекте настоящая заявка предлагает применение индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, изготовленной способом изобретения, или чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека для обнаружения цикла беременности человека, внематочной беременности, выкидыша и трофобластической болезни.
Предложенные в настоящей заявке технические решения имеют следующие преимущества.
1. Предложенная в настоящей заявке индикаторная бумага для полуколичественного обнаружения хорионического гонадотропина человека содержит по меньшей мере три полоски индикаторной бумаги, причем каждая включает в себя подложку и прокладку для образца, адсорбирующую прокладку для коллоидного золота, несущую антитело пленку и адсорбирующую прокладку для воды, последовательно приклеенные к подложке; где прокладка для образца, адсорбирующая прокладка для коллоидного золота, несущая антитело пленка и адсорбирующая прокладка для воды частично перекрываются друг с другом и расположены внахлест; несущая антитело пленка имеет линию обнаружения на конце вблизи адсорбирующей прокладки для коллоидного золота и линию качественного контроля на конце вблизи адсорбирующей прокладки для воды; линия обнаружения покрыта моноклональным антителом к хорионическому гонадотропину человека α-ХГЧ; линия качественного контроля покрыта поликлональным антителом к мышиному IgG; адсорбирующая прокладка для коллоидного золота одной из по меньшей мере трех полосок индикаторной бумаги имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, и адсорбирующая прокладка для коллоидного золота остальных из по меньшей мере трех полосок индикаторной бумаги имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и свободное β-антитело с разным массовым соотношением; где свободное β-антитело не является мышиным антителом. За счет использования в индикаторной бумаге немышиного свободного β-антитела обнаруживаемое количество индикаторной бумаги может быть адаптировано к более широкому диапазону обнаружения. Если используют мышиное свободное β-антитело, то когда концентрация ХГЧ в анализируемом образце высока, необходимо использовать большое количество свободного β-антитела для адаптации обнаруживаемого количества полоски индикаторной бумаги к более высокой концентрации. Однако поскольку свободное β-антитело представляет собой мышиное антитело, большое количество свободного β-антитела может связываться с поликлональным антителом к мышиному IgG, размещенным на линии качественного контроля, но лишь весьма малое количество маркированного коллоидным золотом ХГЧ может связываться с линией качественного контроля, таким образом, линия качественного контроля не дает проявления цвета, что затрудняет обнаружение более высокой концентрации ХГЧ. Диапазон обнаружения концентраций становится шире при использовании немышиного β-антитела. Кроме того, индикаторная бумага имеет по меньшей мере три полоски индикаторной бумаги, где каждая имеет разные типы и концентрации антител. При обнаружении концентрации ХГЧ проявление цвета каждой полоски индикаторной бумаги является разным. Обнаружением того, дает ли проявление цвета линия обнаружения каждой полоски индикаторной бумаги, полуколичественное определение концентрации в более широком диапазоне может быть произведено без субъективного определения глубины цвета, таким образом, диапазон концентраций определяется более точно.
2. В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, предлагаемом настоящей заявкой, немышиное свободное β- антитело и конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом смешивают и выливают на адсорбирующую прокладку для коллоидного золота, чем может устраняться недостаток, заключающийся в том, что при использовании мышиного свободного β-антитела, когда концентрация ХГЧ в анализируемом образце высока и концентрация мышиного свободного β-антитела высока, линия качественного контроля не дает проявления цвета, что затрудняет обнаружение более высокой концентрации ХГЧ. Диапазон обнаружения концентраций становится шире при использовании немышиного β-антитела. Кроме того, индикаторная бумага имеет по меньшей мере три полоски индикаторной бумаги, где каждая имеет разные типы и концентрации антител. При обнаружении концентрации ХГЧ проявление цвета каждой полоски индикаторной бумаги является разным. Обнаружением того, дает ли проявление цвета линия обнаружения каждой полоски индикаторной бумаги, полуколичественное определение концентрации в более широком диапазоне может быть произведено без субъективного определения глубины цвета, таким образом, диапазон концентраций определяется более точно.
3. В способе изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, предлагаемом настоящей заявкой, массовые отношения конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом к свободному β-антителу, адсорбированному на адсорбирующей прокладке для коллоидного золота, второй полоски индикаторной бумаги, третьей полоски индикаторной бумаги, четвертой полоски индикаторной бумаги, пятой полоски индикаторной бумаги и шестой полоски индикаторной бумаги составляют 1:1, 1:2, 1:40, 1:80, 1:100, соответственно. Установлением вышеописанных градиентов диапазонов, могут быть изготовлены полоски индикаторной бумаги с минимальными обнаруживаемыми количествами 5 мМЕ/мл, 25 мМЕ/мл, 100 мМЕ/мл, 500 мМЕ/мл, 2500 мМЕ/мл и 10000 мМЕ/мл, соответственно, так чтобы получить индикаторную бумагу для полуколичественного обнаружения с высокой чувствительностью, широким диапазоном обнаружения концентраций и точными результатами исследования.
4. Предлагаемая настоящей заявкой чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека содержит индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека или индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, изготовленную данным способом. Чашку с реактивом используют для обнаружения концентрации ХГЧ, и диапазон обнаружения является более широким. Более того, чашку с реактивом можно использовать для полуколичественного установления концентрации путем определения того, дает ли линия обнаружения каждой полоски индикаторной бумаги проявление цвета, без субъективного установления глубины цвета, таким образом, диапазон концентраций определяется более точно.
5. Предлагаемая настоящей заявкой чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека дополнительно содержит корпус чашки и картридж, расположенный внутри чашки с реактивом и снабженный параллельными пазами, где один конец паза имеет отверстие для введения в него полоски индикаторной бумаги, прокладка для образца полоски индикаторной бумаги проходит от отверстия до внешней стороны картриджа. Картридж с пазом выполнен с возможностью закрепления полоски индикаторной бумаги в чашке с реактивом, что удобно для всасывания образца. Прокладка для образца полоски индикаторной бумаги проходит от отверстия до внешней стороны картриджа, что удобно для всасывания образца прокладкой для образца. При использовании чашки с реактивом, при условии, что образец мочи помещен в корпус чашки, исследование может быть выполнено, что просто в использовании и гигиенично.
6. Предлагаемая настоящей заявкой чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека дополнительно содержит крышку чашки, отдельную от чашки и закрывающую корпус чашки. В ходе исследования крышка чашки находится в закрытом состоянии после помещения образца мочи в корпус чашки, что, с одной стороны, может обеспечивать изоляцию образца от внешней среды, гарантируя стабильность исследуемой среды и предотвращая влияние внешней среды на результат исследования, и, с другой стороны, может предотвращать высвобождение запаха и обеспечивать большую гигиеничность.
7. В предлагаемой настоящей заявкой чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека корпус чашки имеет полость обнаружения, полость для хранения жидкости и полость для направления жидкости; где полость для направления жидкости имеет первое сквозное отверстие, взаимно сообщающееся с полостью для хранения жидкости в верхней ее части, и второе сквозное отверстие, взаимно сообщающееся с полостью обнаружения в нижней ее части; поршень, скользящий вдоль полости для направления жидкости, размещен внутри полости для направления жидкости и имеет начальное состояние для обеспечения сообщения полости для направления жидкости с полостью для хранения жидкости и состояние обнаружения для обеспечения сообщения полости для направления жидкости с полостью обнаружения; третье сквозное отверстие размещено на стенке чашки корпуса чашки вдали от полости обнаружения и сообщается с полостью для направления жидкости; и картридж размещен вертикально внутри полости обнаружения. Полость обнаружения, содержащая картридж и индикаторную бумагу, и полость для хранения жидкости для сбора мочи, выполнены с возможностью отделения индикаторной бумаги в полости обнаружения от образца мочи в начальном состоянии. Поршень выполнен с возможностью обеспечения сообщения полости для хранения жидкости с полостью для направления жидкости в начальном состоянии, и моча поступает в полость для направления жидкости из полости для хранения жидкости. Когда поршень скользит в полости для направления жидкости к состоянию обнаружения, моча поступает в полость обнаружения из полости для направления жидкости, таким образом, полоска индикаторной бумаги в картридже полости обнаружения контактирует с образцом мочи, таким образом, выполняя обнаружение. Благодаря вышеописанной структуре время, когда начинается исследование, можно контролировать с большим удобством и исследование можно начинать после завершения сбора образца, так, чтобы предотвратить проблему недостаточной точности результата исследования при сборе образцов с одновременным выполнением исследования, обеспечивая большую точность исследования и удобство в обращении. Полость для направления жидкости взаимно сообщается с третьим сквозным отверстием, так что скольжение поршня можно легко контролировать.
8. В предлагаемой настоящей заявкой чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека резервуар для хранения жидкости размещен на поршне; когда поршень находится в начальном состоянии, резервуар для хранения жидкости поршня выровнен относительно первого сквозного отверстия, так что полость для направления жидкости взаимно сообщается с полостью для хранения жидкости; когда поршень находится в состоянии обнаружения, резервуар для хранения жидкости поршня выровнен относительно второго сквозного отверстия, так что полость для направления жидкости взаимно сообщается с полостью обнаружения. Резервуар для хранения жидкости выполнен с возможностью обеспечения течения образца мочи в резервуар для хранения жидкости из полости для хранения жидкости в начальном состоянии, поршень вдвигают, так что образец мочи может втекать в полость обнаружения из резервуара для хранения жидкости в состоянии обнаружения, и полоска индикаторной бумаги в полости обнаружения может всасывать образцы, тем самым начиная обнаружение. Резервуар для хранения жидкости выполнен с возможностью обеспечения постоянности количества образцов мочи, вводимых в полость обнаружения, тем самым предотвращая поступление избыточных образцов мочи в полость обнаружения и их воздействие на результаты исследования. Гарантируется точность результатов исследования.
9. В предлагаемой настоящей заявкой чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека поднимающий элемент для поднятия поршня предусмотрен на крышке чашки и смонтирован на крышке чашки, будучи отделяемым от нее. Поднимающий элемент выполнен с возможностью обеспечения более легкого продвижения поршня из начального состояния до состояния обнаружения. Когда чашку с реактивом не используют, поднимающий элемент может быть смонтирован на крышке чашки для облегчения хранения и предотвращения его потери.
10. В предлагаемой настоящей заявкой чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека картридж закреплен параллельно внутри крышки чашки. Путем закрепления картриджа на крышке чашки полоску индикаторной бумаги в картридже можно отделить от образца мочи в корпусе чашки, когда исследование не начато. В начале исследования исследование можно начинать уплотнением крышки чашки и помещением чашки с реактивом на ее бок, так, чтобы предотвратить проблему того, что результат исследования недостаточно точен, когда сбор образцов осуществляется одновременно с проведением исследования, что обеспечивает большую точность результата и легкость в обращении.
11. В предлагаемой настоящей заявкой чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека опора размещена на внешней кромке крышки чашки для закрепления чашки с реактивом, помещенной на свой бок, и мерная линия расположена на корпусе чашки. Опора выполнена с возможностью размещения на кромке крышки чашки, чашка с реактивом закреплена, когда ее кладут на ее бок, что предотвращает перекатывание чашки с реактивом. При сборе мочи необходимо гарантировать то, чтобы уровень мочи находился выше мерной линии, что обеспечивает достаточность образцов мочи, когда чашка с реактивом помещена на ее бок, так что полоска индикаторной бумаги может успешно осуществлять обнаружение при адсорбции.
12. При предлагаемом настоящей заявкой применении индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, изготовленной способом изобретения, или чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека для обнаружения цикла беременности человека, внематочной беременности, выкидыша и трофобластической болезни вышеописанные индикаторную бумагу или чашку с реактивом можно использовать для проведения полуколичественного обнаружения концентрации ХГЧ в широком диапазоне. Диапазон обнаружения является широким, чувствительность высока и результат точен, так что цикл беременности человека можно установить точнее, и заболевания, такие как внематочная беременность, выкидыш и трофобластические поражения можно диагностировать и установить по обнаруженному диапазону концентраций.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для более четкой иллюстрации технических решений вариантов осуществления настоящей заявки или предшествующего уровня техники ниже будет приведено краткое описание чертежей, используемых в вариантах осуществления настоящей заявки или предшествующего уровня техники. Очевидно, что чертежи в последующем описании являются лишь некоторыми примерами настоящей заявки, и специалисты в данной области техники, основываясь на этих чертежах, могут получить другие чертежи, не прилагая каких-либо творческих усилий.
На Фигуре 1 представлен схематичный вид индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека в примерах 1-6 настоящей заявки;
На Фигуре 2 представлен схематичный вид индикаторной бумаги и картриджа в чашке с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в примерах 4-6 настоящей заявки;
На Фигуре 3 представлен схематичный вид чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в примере 4 настоящей заявки;
На Фигуре 4 представлен схематичный вид чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в примере 5 настоящей заявки;
На Фигуре 5 представлен схематичный вид чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в начальном состоянии примера 5 настоящей заявки;
На Фигуре 6 представлен схематичный вид чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в состоянии обнаружения в примере 5 настоящей заявки; и
На Фигуре 7 представлен схематичный вид чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в примере 6 настоящей заявки;
Номера ссылочных позиций на фигурах представляют собой:
1-подложка; 2-прокладка для образца; 3-адсорбирующая прокладка для коллоидного золота; 4-несущая антитело пленка; 5-адсорбирующая прокладка для воды; 6-линия обнаружения; 7-линия качественного контроля; 8-защитная пленка; 9-корпус чашки; 10-крышка чашки; 11-первая полоска индикаторной бумаги; 12-вторая полоска индикаторной бумаги; 13-третья полоска индикаторной бумаги; 14-четвертая полоска индикаторной бумаги; 15-пятая полоска индикаторной бумаги; 16-шестая полоска индикаторной бумаги; 17-картридж; 18-паз; 19-полость обнаружения; 20-полость для хранения жидкости; 21-полость для направления жидкости; 211-первое сквозное отверстие; 212-второе сквозное отверстие; 213-третье сквозное отверстие; 22-поршень; 221-резервуар для хранения жидкости; 23-поднимающий элемент; 24- опора; 25- мерная линия; 26-резервуар для направления жидкости.
ПОДРОБНОЕ РАСКРЫТИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Гуманизированное свободное β-антитело от хомяка, лошадиное свободное β-антитело от лошади, кроличье свободное β-антитело от кролика, моноклональное антитело к хорионическому гонадотропину человека α-ХГЧ, поликлональное антитело к мышиному IgG, моноклональное антитело к хорионическому гонадотропину человека β-ХГЧ, использованные в нижеследующих примерах, приобретены у компании Hangzhou Zhengzhi Biotechnology Co., Ltd.
Пример 1
Настоящий пример предлагает индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, которая содержит шесть полосок индикаторной бумаги в составе первой полоски индикаторной бумаги 11, второй полоски индикаторной бумаги 12, третьей полоски индикаторной бумаги 13, четвертой полоски индикаторной бумаги 14, пятой полоски индикаторной бумаги 15 и шестой полоски индикаторной бумаги 16. Структура каждой полоски индикаторной бумаги, как показано на Фигуре 1, включает в себя подложку 1 и прокладку 2 для образца, адсорбирующую прокладку 3 для коллоидного золота, несущую антитело пленку 4 и адсорбирующую прокладку 5 для воды, последовательные приклеенный к подложке. Прокладка 2 для образца, адсорбирующая прокладка 3 для коллоидного золота, несущая антитело пленка 4 и адсорбирующая прокладка 5 для воды частично перекрываются друг с другом и расположены внахлест. Конкретнее, несущая антитело пленка 4 расположена под адсорбирующей прокладкой 3 для коллоидного золота и адсорбирующая прокладка 5 для воды, прокладка 2 для образца расположена над адсорбирующей прокладкой 3 для коллоидного золота, и длинна перекрывающегося участка составляет 1 мм.
Несущая антитело пленка 4 снабжена линией 6 обнаружения на конце вблизи адсорбирующей прокладки 3 для коллоидного золота и линией 7 качественного контроля на конце вблизи адсорбирующей прокладки 5 для воды. Линия 6 обнаружения покрыта моноклональным антителом к хорионическому гонадотропину человека α-ХГЧ (моноклональное антитело анти-α-ХГЧ). Линия 7 качественного контроля покрыта поликлональным антителом к мышиному IgG.
Конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом (конъюгат коллоидного золота-анти-β-ХГЧ моноклонального антитела) адсорбирован на адсорбирующей прокладке 3 для коллоидного золота первой полоски индикаторной бумаги 11. Конъюгат коллоидного золота-анти-β-ХГЧ моноклонального антитела и свободное β-антитело адсорбированы на адсорбирующей прокладке 3 для коллоидного золота во второй полоски индикаторной бумаги 12, третьей полоски индикаторной бумаги 13, четвертой полоски индикаторной бумаги 14, пятой полоски индикаторной бумаги 15 и шестой полоски индикаторной бумаги 16. Массовое отношение конъюгата золота-анти-β-ХГЧ моноклонального антитела к свободному β-антителу во второй полоске индикаторной бумаги 12, третьей полоске индикаторной бумаги 13, четвертой полоске индикаторной бумаги 14, пятой полоске индикаторной бумаги 15 и шестой полоске индикаторной бумаги 16 составляет 1:1, 1:2, 1:40, 1:80 и 1:100, соответственно. Свободное β-антитело не является мышиным антителом. В примере свободное β-антитело представляет собой гуманизированное антитело от хомяка.
Более того, линия 6 обнаружения и линия 7 качественного контроля расположены параллельно с шагом 0,3-1,0 см. В примере шаг составляет 0,5 см.
Более того, защитная пленка 8 размещена как на прокладке 2 для образца, так и на адсорбирующей прокладке 3 для воды.
Более того, несущая антитело пленка 4 представляет собой пленку из нитроцеллюлозы с размером пор 3-10 мкм.
Во втором аспекте настоящая заявка предлагает способ изготовления индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека, включающий в себя стадии.
1. Приготовление несущей антитело пленки:
(1) Отрезают нитроцеллюлозную пленку с размером пор 3-10 мкм с получением пленки, имеющей параметры по ширине 2,0 см и по длине 30,5 см, по необходимости.
(2) Готовят раствор 2-3 мг/мл моноклонального антитела анти-α-ХГЧ в 0,1 M фосфатном буфере для нанесения на линию обнаружения, например, с концентрацией моноклонального антитела анти-α-ХГЧ 2,5 мг/мл. Готовят раствор 1-2,0 мг/мл поликлонального антитела к мышиному IgG в 0,85 масс. % буферном растворе хлорида натрия для нанесения на линию качественного контроля, например, с концентрацией поликлонального антитела к мышиному IgG 1,5 мг/мл.
(3) На нитроцеллюлозной пленке отмечают поверхность нанесения антитела. Раствор антитела для нанесения на линию обнаружения и раствор антитела для нанесения на линию качественного контроля следует равномерно и параллельно наносить на пленку. Линия обнаружения и линия качественного контроля расположены с интервалом 0,3-0,7 см. В данном примере интервал составляет 0,5 см. Для использования нитроцеллюлозную пленку сушат при постоянной температуре 2-30°C .
(4) Готовят пропитывающий раствор для уплотняющей обработки: в смесительный резервуар добавляют фактический технологический объем очищенной воды; и затем отвешивают буферный раствор, сахар, уплотняющий белок и консервант, а затем непосредственно добавляют в смесительный резервуар при перемешивании до полного растворения, добавляют очищенную воду до достижения требуемого объема, после чего тщательно перемешивают в течение не менее 10 минут. Пропитывающий раствор для уплотняющей обработки содержит 0,1 М фосфатный буферный раствор, 0,5 масс. % сахара, 1 масс. % уплотняющего белка и 0,05 масс. % консерванта, где буферный раствор представляет собой фосфатный буферный раствор, сахар представляет собой сахарозу, консервант представляет собой тимеросал и уплотняющей белок представляет собой бычий сывороточный альбумин.
(5) Пленку, с нанесенными линией обнаружения и линией качественного контроля помещают в технологический резервуар и добавляют в него пропитывающий раствор для уплотняющей обработки, приготовленный на стадии (4). Следует убедиться, что каждая пленка полностью погружена в пропитывающий раствор для уплотняющей обработки на 30 минут и пленка не смещается и не образует нахлестов. Пленку извлекают из технологического резервуара и затем пропитывающий раствор для уплотняющей обработки отбрасывают. После этого пленку помещают на марлю с помощью щипцов для ее подсушивания, так что получают несущую антитело пленку.
(6) Наклеивание на подложку и высушивание
Снимают белую бумагу посередине линии отреза на двухсторонней липкой ленте липкой подложки. Оператор помещает пленку в пустое пространство в центре липкой подложки, и необходимо убедится, что лицевая сторона липкой подложки совпадает с лицевой стороной пленки. Во избежание ошибок в технологическом процессе необходимо убедиться, что положение проявления окрашивания является относительно точным. Пленку наклеивают на подложку, выравнивая по верхнему концу линии качественного контроля. После наклеивания пленки на липкую подложку поверхность пленки разглаживают поперек двусторонней липкой ленты во избежание возникновения пузырьков воздуха. Температуру в помещении контролируют в диапазоне 18-28 °C, а относительная влажность составляет ≤40 %. Необходимо также убедиться, что воздух в помещении для сушки может циркулировать, а воздушный поток из осушителя не дует непосредственно на поверхность пленки. Время сушки составляет ≥4 часов.
2. Приготовление адсорбирующей прокладки для коллоидного золота первой полоски индикаторной бумаги
(1) Приготовление комплексного раствора коллоидного золота
Фактический технологический объем очищенной воды добавляют в смесительный резервуар; а затем на электронных аналитических весах взвешивают трегалозу, бычий сывороточный альбумин, тринатрийцитрат, полиэтиленгликоль и NaN3, а затем непосредственно добавляют в смесительный резервуар, перемешивая до полного растворения, очищенную воду до достижения требуемого объема, после чего тщательно перемешивают в течение не менее 30 минут, получая, таким образом, комплексный раствор коллоидного золота, содержащий 5 масс. % трегалозы, 2 масс. % бычьего сывороточного альбумина, 0,5 масс. % тринатрийцитрата, 0,05 масс. % полиэтиленгликоля и 0,05 масс. % NaN3.
(2) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением 0,2 моль/л раствора карбоната калия с 0,53 % по объему коллоидного золота при перемешивании на магнитной мешалке в течение 15 минут, получая, таким образом, отрегулированный раствор коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 4 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(3) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (2) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 50% по объему, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота первой полоски индикаторной бумаги.
3. Приготовление адсорбирующей прокладки для коллоидного золота второй полоски индикаторной бумаги
(1) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением раствора 0,2 моль/л карбоната калия с 0,53 % по объему коллоидного золота, перемешивая на магнитной мешалке в течение 15 минут с получением, таким образом, отрегулированного раствора коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 4 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(2) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (1) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 40% по объему, затем добавляют свободное β-антитело согласно массовому отношению 1:1 моноклонального антитела анти-β-ХГЧ к свободному β-антителу, где свободное β-антитело представляет собой гуманизированное антитело от хомяка, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота второй полоски индикаторной бумаги.
4. Приготовление адсорбирующей прокладки для коллоидного золота третьей полоски индикаторной бумаги
(1) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением раствора 0,2 моль/л карбоната калия с 0,53 % по объему коллоидного золота, перемешивая на магнитной мешалке в течение 15 минут с получением, таким образом, отрегулированного раствора коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 4 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(2) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (1) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 40% по объему, затем добавляют свободное β-антитело согласно массовому отношению 1:2 моноклонального антитела анти-β-ХГЧ к свободному β-антителу, где свободное β-антитело представляет собой гуманизированное антитело от хомяка, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота третьей полоски индикаторной бумаги.
5. Приготовление адсорбирующей прокладки для коллоидного золота четвертой полоски индикаторной бумаги
(1) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением раствора 0,2 моль/л карбоната калия с 0,53 % по объему коллоидного золота, перемешивая на магнитной мешалке в течение 15 минут с получением, таким образом, отрегулированного раствора коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 5 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(2) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (1) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 40% по объему, затем добавляют свободное β-антитело согласно массовому отношению 1:40 моноклонального антитела анти-β-ХГЧ к свободному β-антителу, где свободное β-антитело представляет собой гуманизированное антитело от хомяка, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота четвертой полоски индикаторной бумаги.
6. Приготовление адсорбирующей прокладки для коллоидного золота пятой полоски индикаторной бумаги
(1) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением раствора 0,2 моль/л карбоната калия с 0,53 % по объему коллоидного золота, перемешивая на магнитной мешалке в течение 15 минут с получением, таким образом, отрегулированного раствора коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 5 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(2) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (1) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 40% по объему, затем добавляют свободное β-антитело согласно массовому отношению 1:80 моноклонального антитела анти-β-ХГЧ к свободному β-антителу, где свободное β-антитело представляет собой гуманизированное антитело от хомяка, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота пятой полоски индикаторной бумаги.
7. Приготовление адсорбирующей прокладки для коллоидного золота шестой полоски индикаторной бумаги
(1) С помощью мензурки отмеряют требуемое количество коллоидного золота, регулируют pH до 6,5-7,0 добавлением раствора 0,2 моль/л карбоната калия с 0,53 % по объему коллоидного золота, перемешивая на магнитной мешалке в течение 15 минут с получением, таким образом, отрегулированного раствора коллоидного золота. Моноклональное антитело анти-β-ХГЧ разводят дважды дистиллированной водой и метят коллоидным золотом в концентрации 5 мкг/мл, то есть моноклональное антитело анти-β-ХГЧ добавляют к коллоидному золоту с последующим перемешиванием на магнитной мешалке в течение 30 минут, а затем добавляют 0,5‰ по объему полиэтиленгликоля в качестве стабилизатора с перемешиванием в течение 30 минут, после чего центрифугируют, отделяя маркированный коллоидным золотом осадок, который снова растворяют в комплексном растворе комплекса коллоидного золота с концентрацией 3% по объему, и перемешивают на магнитной мешалке до получения гомогенной смеси, получая, таким образом, 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом.
(2) 3% по объему комплексный раствор конъюгата моноклонального антитела анти-β-ХГЧ с коллоидным золотом из вышеописанной стадии (1) отбирают и снова растворяют в комплексном растворе коллоидного золота с концентрацией 40% по объему, затем добавляют свободное β-антитело согласно массовому отношению 1:100 моноклонального антитела анти-β-ХГЧ к свободному β-антителу, где свободное β-антитело представляет собой гуманизированное антитело от хомяка, после чего смешивают на магнитной мешалке, а затем выливают на приготовленную адсорбирующую прокладку для коллоидного золота в количестве 50 мкл/см2, после чего помещают в камеру для сушки на ≥4 часов, контролируя температуру в камере для сушки в диапазоне 18-28°C и относительную влажность ≤40%. Следует убедиться, что воздух проходит свободно, и что поток воздуха не может дуть непосредственно на адсорбирующую прокладку для коллоидного золота. Высушенную адсорбирующую прокладку для коллоидного золота помещают в пакет из алюминиевой фольги, содержащий осушитель, запечатывают для хранения и маркируют как адсорбирующую прокладку для коллоидного золота шестой полоски индикаторной бумаги.
Примечания: Раствор коллоидного золота наносят путем выливания, поскольку нанесенное путем выливания коллоидное золото можно свободно нарезать, таким образом, легко регулировать интенсивность цвета изделия.
8. Сборка и нарезка:
(1) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота первой полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды первой полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца первой полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота первой полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(2) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как первая полоска индикаторной бумаги.
(3) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота второй полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды второй полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца второй полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота второй полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(4) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как вторая полоска индикаторной бумаги.
(5) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота третьей полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды третьей полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца третьей полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота третьей полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(6) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как третья полоска индикаторной бумаги.
(7) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота четвертой полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды четвертой полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца четвертой полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота четвертой полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(8) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как четвертая полоска индикаторной бумаги.
(9) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота пятой полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды пятой полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца пятой полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота пятой полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(10) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как пятая полоска индикаторной бумаги.
(11) Берут заготовку изделия, представляющую собой прозрачную подложку, на которую была наклеена несущая антитело пленка, и адсорбирующую прокладку для коллоидного золота шестой полоски индикаторной бумаги нарезают на полоску размером 0,5 см × 30 см с шириной 0,5 см, которую наклеивают на прозрачную подложку вблизи линии обнаружения, так что она перекрывается на примерно 1 мм с несущей антитело пленкой. Адсорбирующая прокладка для воды шестой полоски индикаторной бумаги размещена на прозрачной подложке вблизи линии качественного контроля и перекрывается на примерно 1 мм с несущей антитело пленкой. Прокладка для образца шестой полоски индикаторной бумаги размещена на конце адсорбирующей прокладки для коллоидного золота шестой полоски индикаторной бумаги вдали от несущей антитело пленки и перекрывается на примерно 1 мм с ней, обеспечивая маркировку для использования.
(12) Подложку в сборке нарезают на полоску индикаторной бумаги, маркированную как шестая полоска индикаторной бумаги.
Пример 2
Настоящий пример предлагает индикаторную полоску для полуколичественного обнаружения хорионического гонадотропина человека, которая отличается от индикаторной полоски примера 1 тем, что свободное β-антитело представляет собой лошадиное антитело и интервал между линией 6 обнаружения и линией 7 качественного контроля составляет 0,3 см.
Настоящий пример также предлагает способ изготовления вышеупомянутой индикаторной полоски для полуколичественного обнаружения хорионического гонадотропина человека, который отличается от способа изготовления примера 1 тем, что использованное свободное β-антитело представляет собой лошадиное антитело; в ходе процесса получения несущей антитело пленки, концентрация моноклонального антитела анти-α-ХГЧ составляет 2 мг/мл, концентрация поликлонального антитела к мышиному IgG составляет 1 мг/мл и интервал между линией обнаружения и линией качественного контроля составляет 0,3 см; и использованный раствор для уплотняющей обработки включает в себя 0,08 М буферный раствор, 0,3 масс. % сахара, 0,8 масс. % уплотняющего белка и 0,03 масс. % консерванта, где буферный раствор представляет собой фосфатный буферный раствор, сахар представляет собой трегалозу, консервант представляет собой NaN3 и уплотняющей белок представляет собой казеин.
Пример 3
Настоящий пример предлагает индикаторную полоску для полуколичественного обнаружения хорионического гонадотропина человека, которая отличается от индикаторной полоски примера 1 тем, что свободное β-антитело представляет собой кроличье антитело и интервал между линией 6 обнаружения и линией 7 качественного контроля составляет 1,0 см.
Настоящий пример также предлагает способ изготовления вышеупомянутой индикаторной полоски для полуколичественного обнаружения хорионического гонадотропина человека, который отличается от способа изготовления примера 1 тем, что использованное свободное β-антитело представляет собой кроличье антитело; в ходе процесса получения несущей антитело пленки, концентрация моноклонального антитела анти-α-ХГЧ составляет 3 мг/мл, концентрация поликлонального антитела к мышиному IgG составляет 2 мг/мл и интервал между линией обнаружения и линией качественного контроля составляет 0,7 см; и использованный раствор для уплотняющей обработки включает в себя 0,12 М буферный раствор, 0,7 масс. % сахара, 1,2 масс. % уплотняющего белка и 0,07 масс. % консерванта, где буферный раствор представляет собой фосфатный буферный раствор, сахар представляет собой сахарозу, консервант представляет собой тимеросал и уплотняющей белок представляет собой бычий сывороточный белок.
Пример 4
Как показано на Фигуре 3, настоящий пример предлагает чашку с реактивом для полуколичественного обнаружения хорионического гонадотропина человека, которая содержит индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, изготовленную в примере 1, и дополнительно содержит корпус 9 чашки, крышку 10 чашки и картридж 17. Картридж 17 расположен вертикально внутри корпуса 9 чашки и крышка 10 чашки закрывает корпус 9 чашки, будучи отделяемой от него. Как показано на Фигуре 2, картридж 17 снабжен шестью или более параллельными пазами 18, и пазы 18 имеют отверстие вблизи дна корпуса 9 чашки. Первая полоска индикаторной бумаги 11, вторая полоска индикаторной бумаги 12, третья полоска индикаторной бумаги 13, четвертая полоска индикаторной бумаги 14, пятая полоска индикаторной бумаги 15 и шестая полоска индикаторной бумаги 16 последовательно вставлены в шесть слотов 18 через отверстие. Прокладка 2 для образца полоски индикаторной бумаги проходит от отверстия до внешней стороны картриджа 17. Картридж 17 изготовлен из пластмассы, но, конечно, в альтернативном варианте осуществления картридж 17 может быть также изготовлен из других прозрачных материалов.
Конкретнее, структура каждой из первой полоски индикаторной бумаги 11, второй полоски индикаторной бумаги 12, третьей полоски индикаторной бумаги 13, четвертой полоски индикаторной бумаги 14, пятой полоски индикаторной бумаги 15 и шестой полоски индикаторной бумаги 16 показана на Фигуре 1, и структура, соответственно, включает в себя подложку 1 и прокладку 2 для образца, адсорбирующую прокладку 3 для коллоидного золота, несущую антитело пленку 4 и адсорбирующую прокладку 5 для воды, последовательно приклеенные к подложке. Прокладка 2 для образца, адсорбирующая прокладка 3 для коллоидного золота, несущая антитело пленка 4 и адсорбирующая прокладка 5 для воды частично перекрываются друг с другом и расположены внахлест. Конкретнее, несущая антитело пленка 4 расположена под адсорбирующей прокладкой 3 для коллоидного золота и адсорбирующая прокладка 5 для воды, прокладка 2 для образца расположена над адсорбирующей прокладкой 3 для коллоидного золота, и длинна перекрывающегося участка составляет 1 мм.
Несущая антитело пленка 4 снабжена линией 6 обнаружения на конце вблизи адсорбирующей прокладки 3 для коллоидного золота и линией 7 качественного контроля на конце вблизи адсорбирующей прокладки 5 для воды. Линия 6 обнаружения покрыта моноклональным антителом анти-α-ХГЧ. Линия 7 качественного контроля покрыта поликлональным антителом к мышиному IgG.
Конъюгат коллоидного золота-анти-β-ХГЧ-моноклонального антитела адсорбирован на адсорбирующей прокладке 3 для коллоидного золота первой полоски индикаторной бумаги 11. Конъюгат коллоидного золота-анти-β-ХГЧ моноклонального антитела и свободное β-антитело адсорбированы на адсорбирующей прокладке 3 для коллоидного золота во второй полоски индикаторной бумаги 12, третьей полоски индикаторной бумаги 13, четвертой полоски индикаторной бумаги 14, пятой полоски индикаторной бумаги 15 и шестой полоски индикаторной бумаги 16. Свободное β-антитело не является мышиным антителом. В примере свободное β-антитело представляет собой гуманизированное антитело от хомяка.
Более того, линия 6 обнаружения и линия 7 качественного контроля расположены параллельно с шагом 0,3-1,0 см. В примере шаг составляет 0,5 см. Более того, защитная пленка 8 размещена на прокладке 2 для образца и на адсорбирующей прокладке 3 для воды, соответственно. Более того, несущая антитело пленка 4 представляет собой нитроцеллюлозную пленку с размером пор в диапазоне 3-10 мкм.
При использовании крышку 10 чашки открывают, образец мочи собирают в корпус 9 чашки, крышку 10 чашки монтируют на корпусе 9 чашки, корпус 9 чашки ставят вертикально и прокладки 2 для образца шести полосок индикаторной бумаги погружают в образец. Образец всасывается в полоску индикаторной бумаги из прокладки 2 для образца благодаря капиллярным силам и затем последовательно проходит через адсорбирующую прокладку 3 для коллоидного золота и несущую антитело пленку 4, достигая адсорбирующей прокладки 5 для воды, ХГЧ из образца связывается с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела или свободным β-антителом, адсорбированным в адсорбирующей прокладке 3 для коллоидного золота. С током жидкости ХГЧ, связанный с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела, достигает несущей антитело пленки 4 и связывается с моноклональным антителом анти-α-ХГЧ, нанесенным на линию обнаружения, и поликлональным антителом к мышиному IgG, нанесенным на линию качественного контроля, соответственно, и дает проявление цвета на линии обнаружения и линии качественного контроля, поскольку она имеет метку из коллоидного золота. В то же время, ХГЧ, связанный со свободным β-антителом, не дает проявления цвета на линии обнаружения, поскольку она не имеет метки из коллоидного золота, и не связывается с поликлональным антителом к мышиному IgG, нанесенным на линию качественного контроля, поскольку свободное β-антитело не является мышиным антителом. Даже если концентрация ХГЧ в образце высока и большое количество ХГЧ связывается со свободным β-антителом, это не приведет к тому, что большая часть антител линии качественного контроля свяжется с образованием конъюгата ХГЧ-свободное β-антитело, так что линия качественного контроля не даст проявления цвета. В результате, можно проводить измерение образцов с более высокими концентрациями ХГЧ и обнаруживаемое количество может достигать 10000 мМЕ/мл, обеспечивая более широкий диапазон обнаружения концентраций. Поскольку массовые отношения конъюгата коллоидного золота-анти-β-ХГЧ-моноклонального антитела к свободному β- антителу в адсорбирующей прокладке для коллоидного золота шести полосок индикаторной бумаги различаются, линия обнаружения и линия качественного контроля шести полосок индикаторной бумаги будут показывать разное проявление цвета. В соответствии с проявлением цвета можно полуколичественно обнаружить концентрацию ХГЧ в образце.
Пример 5
Как показано на Фигурах 4-6, настоящий пример предлагает чашку с реактивом для полуколичественного обнаружения хорионического гонадотропина человека, которая содержит индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, изготовленную в примере 1, и дополнительно содержит корпус 9 чашки и картридж 17.
Корпус 9 чашки имеет полость 19 обнаружения, полость 20 для хранения жидкости и полость 21 для направления жидкости. Полость 21 для направления жидкости имеет первое сквозное отверстие 211, взаимно сообщающееся с полостью для хранения жидкости в верхней ее части, и второе сквозное отверстие 212, взаимно сообщающееся с полостью 19 обнаружения в нижней ее части. Поршень 22, скользящий вдоль полости для направления жидкости, размещен внутри полости 21 для направления жидкости и имеет начальное состояние для обеспечения сообщения полости 21 для направления жидкости с полостью 20 для хранения жидкости и состояние обнаружения для обеспечения сообщения полости 21 для направления жидкости с полостью 19 обнаружения. Третье сквозное отверстие 213 размещено на стенке чашки корпуса 9 чашки вдали от полости 19 обнаружения и взаимно сообщается с полостью 21 для направления жидкости. Резервуар 221 для хранения жидкости размещен на поршне 22. Как показано на Фигуре 5, когда поршень 22 находится в начальном состоянии, резервуар 221 для хранения жидкости поршня выровнен относительно первого сквозного отверстия 211, так что полость 21 для направления жидкости взаимно сообщается с полостью 20 для хранения жидкости; когда поршень 22 находится в состоянии обнаружения, резервуар 221 для хранения жидкости поршня выровнен относительно второго сквозного отверстия 212, так что полость 21 для направления жидкости взаимно сообщается с полостью 19 обнаружения.
Более того, резервуар 26 для направления жидкости размещен внутри дна корпуса 9 чашки, резервуар 26 для направления жидкости взаимно сообщается с полостью 19 обнаружения, и резервуар 26 для направления жидкости расположен ниже второго сквозного отверстия 212, так что резервуар 26 для направления жидкости взаимно сообщается со вторым сквозным отверстием 212.
Структура и номер картриджа 17 и полоски индикаторной бумаги являются такими же, что и в примере 4, за исключением того, что картридж 17, в который вставлена полоска индикаторной бумаги, вертикально размещен в полости 19 обнаружения.
При установке картриджа 17 чашка с реактивом может фиксировать полоску индикаторной бумаги в полости 19 обнаружения чашки с реактивом. При использовании корпус чашки может оставаться вертикальным, так что полоска индикаторной бумаги может также оставаться вертикальной, что удобно для абсорбции образца. Чашка с реактивом выполнена с возможностью вмещения шести полосок индикаторной бумаги, и концентрацию ХГЧ в моче можно полуколичественно обнаруживать в соответствии с проявлением цвета разных полосок индикаторной бумаги. Диапазон обнаруживаемых концентраций шире, и отсутствует необходимость в установлении концентрации путем сравнения проявления цвета, таким образом, результат исследования является более точным. Полость 19 обнаружения, содержащая картридж и индикаторную бумагу, и полость 20 для хранения жидкости для сбора мочи выполнены с возможностью отделения индикаторной бумаги в полости 19 обнаружения от образца мочи в начальном состоянии. Поршень 22 и резервуар 221 для хранения жидкости, размещенный на поршне, выполнены с возможностью обеспечения поступления мочи в резервуар 221 для хранения жидкости из полости 20 для хранения жидкости через первое сквозное отверстие 211. Когда поршень 22 скользит в полости 21 для направления жидкости к состоянию обнаружения, моча поступает в резервуар 26 для направления жидкости из резервуара 221 для хранения жидкости через второе сквозное отверстие 212, таким образом, полоска индикаторной бумаги в картридже 17 полости 19 обнаружения контактирует с образцом мочи, тем самым выполняя обнаружение. Благодаря вышеописанной структуре время, когда начинается исследование, можно контролировать с большим удобством и исследование можно начинать после завершения сбора образца, так, чтобы предотвратить проблему недостаточной точности результата исследования при сборе образцов с одновременным выполнением исследования, обеспечивая большую точность исследования и удобство в обращении. Полость 21 для направления жидкости взаимно сообщается с третьим сквозным отверстием 213, так что скольжение поршня 22 можно легко контролировать. Резервуар 221 для хранения жидкости выполнен с возможностью обеспечения постоянности количества образцов мочи, вводимых в полость 19 обнаружения, тем самым предотвращая поступление избыточных образцов мочи в полость 19 обнаружения и их воздействие на результаты исследования. Гарантируется точность результатов исследования. При использовании чашки с реактивом пользователю необходимо лишь собрать образец мочи непосредственно в корпус чашки, а затем пользователь вдвигает поршень 22, можно осуществить исследование и считывание результатов, что удобно и гигиенично.
Чашка с реактивом дополнительно включает в себя крышку 10 чашки, отдельную от чашки и закрывающую корпус 9 чашки. Поднимающий элемент 23 для поднятия поршня 22 предусмотрен на крышке 10 чашки, и поднимающий элемент смонтирован на крышке 10 чашки, будучи отделяемым от нее. Поднимающий элемент 23 выполнен с возможностью обеспечения более легкого продвижения поршня 22 из начального состояния до состояния обнаружения. Когда чашку с реактивом не используют, поднимающий элемент 23 может быть смонтирован на крышке 10 чашки для облегчения хранения и предотвращения его потери.
При использовании крышку 10 чашки открывают, образец мочи собирают в полость 20 для хранения жидкости корпуса 9 чашки, крышку 10 чашки монтируют на корпусе 9 чашки, корпус 9 чашки ставят вертикально. В то же время, как показано на Фигуре 5, когда чашка с реактивом находится в начальном состоянии, образец мочи в полости 20 для хранения жидкости поступает в резервуар 221 для хранения жидкости поршня 22 через первое сквозное отверстие 211. Поднимающий элемент 23, смонтированный на крышке 10 чашки, снимают и вставляют в третье сквозное отверстие 213, и поршень 22 продвигают до состояния обнаружения через поднимающий элемент 23. Как показано на Фигуре 6, образец мочи в резервуаре 221 для хранения жидкости втекает в резервуар для направления жидкости 26 на дне через второе сквозное отверстие 212, а затем втекает в область 19 обнаружения, прокладки 2 для образца шести полосок индикаторной бумаги в полости 19 обнаружения погружены в образец. Образец всасывается в полоску индикаторной бумаги из прокладки 2 для образца благодаря капиллярным силам и затем последовательно проходит через адсорбирующую прокладку 3 для коллоидного золота и несущую антитело пленку 4, достигая адсорбирующей прокладки 5 для воды, ХГЧ из образца связывается с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела или свободным β-антителом, адсорбированным в адсорбирующей прокладке 3 для коллоидного золота. С током жидкости ХГЧ, связанный с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела, достигает несущей антитело пленки 4 и связывается с моноклональным антителом анти-α-ХГЧ, нанесенным на линию обнаружения, и поликлональным антителом к мышиному IgG, нанесенным на линию качественного контроля, соответственно, и дает проявление цвета на линии 6 обнаружения и линии 7 качественного контроля, поскольку она имеет метку из коллоидного золота. В то же время, ХГЧ, связанный со свободным β-антителом, не дает проявления цвета на линии 6 обнаружения, поскольку она не имеет метки из коллоидного золота, и не связывается с поликлональным антителом к мышиному IgG, нанесенным на линию 7 качественного контроля, поскольку свободное β-антитело не является мышиным антителом. Поскольку массовые отношения конъюгата коллоидного золота-анти-β-ХГЧ-моноклонального антитела к свободному β- антителу в адсорбирующей прокладке для коллоидного золота шести полосок индикаторной бумаги различаются, линия 6 обнаружения шести полосок индикаторной бумаги будет показывать разное проявление цвета. В соответствии с проявлением цвета можно полуколичественно обнаружить концентрацию ХГЧ в образце. По сравнению с двумя полосками индикаторной бумаги, шесть полосок индикаторной бумаги настоящей заявки имеют более широкий диапазон обнаружения концентраций, и отсутствует необходимость в установлении концентрации путем сравнения проявления цвета, таким образом, результат исследования является более точным. При использовании чашки с реактивом пользователю необходимо лишь собрать образец мочи непосредственно в корпус чашки, а затем пользователь вдвигает поршень 22, можно осуществить исследование и считывание результатов, что удобно и гигиенично.
Пример 6
Как показано на Фигуре 7, настоящий пример предлагает чашку с реактивом для полуколичественного обнаружения хорионического гонадотропина человека, которая содержит корпус 9 чашки, картридж 17 и индикаторную бумагу примера 1, и дополнительно содержит крышку 10 чашки которая смонтирована на корпусе 9 чашки, будучи отделяемой от него. Структура и номер картриджа 17 и полоски индикаторной бумаги являются такими же, что и в примере 4, за исключением того, что картридж 17 закреплен параллельно внутри крышки 10 чашки.
При установке картриджа 17 чашка с реактивом может фиксировать полоску индикаторной бумаги в полости 19 обнаружения чашки с реактивом. При использовании корпус 9 чашки лежит на боку, что удобно для абсорбции образца полоской индикаторной бумаги. Чашка с реактивом выполнена с возможностью вмещения шести полосок индикаторной бумаги, и концентрацию ХГЧ в моче можно полуколичественно обнаруживать в соответствии с проявлением цвета разных полосок индикаторной бумаги. Диапазон обнаруживаемых концентраций шире, и отсутствует необходимость в установлении концентрации путем сравнения проявления цвета, таким образом, результат исследования является более точным. Путем закрепления картриджа 17 на крышке 10 чашки полоску индикаторной бумаги в картридже 17 можно отделить от образца мочи в корпусе 10 чашки, когда исследование не начато. В начале исследования его можно начинать уплотнением крышки 10 чашки и помещением чашки с реактивом на ее бок, так, чтобы предотвратить проблему того, что результат исследования недостаточно точен, когда сбор образцов осуществляется одновременно с проведением исследования, что обеспечивает большую точность результата и легкость в обращении.
Опора 24 размещена на внешней кромке крышки 20 чашки для закрепления чашки с реактивом, помещенной на свой бок, и мерная линия 25 расположена на корпусе 10 чашки. Опора 24 выполнена с возможностью размещения на кромке крышки 10 чашки, чашка с реактивом закреплена, когда ее кладут на ее бок, что предотвращает перекатывание чашки с реактивом. При сборе мочи необходимо гарантировать то, чтобы уровень мочи находился выше мерной линии 25, что обеспечивает достаточность образцов мочи, когда чашка с реактивом помещена на ее бок, так что полоска индикаторной бумаги может успешно осуществлять обнаружение при адсорбции.
При использовании крышка 10 чашки открыта, образец мочи собирают в корпус 9 чашки так, чтобы объем образца мочи превышал мерную линю 25 на корпусе 9 чашки. Крышку 10 чашки монтируют на корпус 9 чашки и уплотняют, чашку с реактивом кладут на ее бок и фиксируют с помощью опоры 24. Прокладки 2 для образцов шести полосок индикаторной бумаги погружены в образец. Образец всасывается в полоску индикаторной бумаги из прокладки 2 для образца благодаря капиллярным силам и затем последовательно проходит через адсорбирующую прокладку 3 для коллоидного золота и несущую антитело пленку 4, достигая адсорбирующей прокладки 5 для воды, ХГЧ из образца связывается с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела или свободным β-антителом, адсорбированным в адсорбирующей прокладке 3 для коллоидного золота. С током жидкости ХГЧ, связанный с конъюгатом коллоидного золота-анти-β-ХГЧ-моноклонального антитела, достигает несущей антитело пленки 4 и связывается с моноклональным антителом анти-α-ХГЧ, нанесенным на линию обнаружения, и поликлональным антителом к мышиному IgG, нанесенным на линию качественного контроля, соответственно, и дает проявление цвета на линии 6 обнаружения и линии 7 качественного контроля, поскольку она имеет метку из коллоидного золота. В то же время, ХГЧ, связанный со свободным β-антителом, не дает проявления цвета на линии 6 обнаружения, поскольку она не имеет метки из коллоидного золота, и не связывается с поликлональным антителом к мышиному IgG, нанесенным на линию 7 качественного контроля, поскольку свободное β-антитело не является мышиным антителом. Поскольку массовые отношения конъюгата коллоидного золота-анти-β-ХГЧ-моноклонального антитела к свободному β- антителу в адсорбирующей прокладке для коллоидного золота шести полосок индикаторной бумаги различаются, линия 6 обнаружения шести полосок индикаторной бумаги будет показывать разное проявление цвета. В соответствии с проявлением цвета можно полуколичественно обнаружить концентрацию ХГЧ в образце. По сравнению с двумя полосками индикаторной бумаги, шесть полосок индикаторной бумаги настоящей заявки имеют более широкий диапазон обнаружения концентраций, и отсутствует необходимость в установлении концентрации путем сравнения проявления цвета, таким образом, результат исследования является более точным. При использовании чашки с реактивом пользователю необходимо лишь собрать образец мочи непосредственно в корпус чашки, а затем пользователь вдвигает поршень 22, можно осуществить исследование и считывание результатов, что удобно и гигиенично.
Пример 7
Настоящий пример предлагает способ применения чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека в примере 4, который включает в себя стадии: выдерживания образца и чашки с реактивом до достижения ими равновесной комнатной температуры; затем открытия крышки 10 чашки и сбора образца мочи в корпус 9 чашки, монтирования крышки 10 чашки на корпусе 9 чашки, размещения корпуса 9 чашки вертикально, погружения прокладки для образца 2 шести полосок индикаторной бумаги в образец и наблюдения того, проявили ли в течение 5 минут цвет линия обнаружения и линия качественного контроля шести полосок индикаторной бумаги. Результаты исследования включают в себя следующие ситуации:
Таблица 1: Интерпретация показанных результатов полосок индикаторной бумаги
Линии обнаружения шести полосок индикаторной бумаги не проявляют сливовый цвет
Менее 5 мМЕ/мл
Линия обнаружения первой полоски индикаторной бумаги проявляет сливовый цвет;
Линии обнаружения остальных полосок индикаторной бумаги не проявляют сливовый цвет
5-25 мМЕ/мл
Линии обнаружения первой и второй полосок индикаторной бумаги проявляют сливовый цвет;
Линии обнаружения остальных полосок индикаторной бумаги не проявляют сливовый цвет
25-100 мМЕ/мл
Линии обнаружения первой, второй и третьей полосок индикаторной бумаги проявляют сливовый цвет;
Линии обнаружения остальных полосок индикаторной бумаги не проявляют сливовый цвет
100-500 мМЕ/мл
Линии обнаружения первой, второй, третьей и четвертой полосок индикаторной бумаги проявляют сливовый цвет;
Линии обнаружения остальных полосок индикаторной бумаги не проявляют сливовый цвет
500-2500 мМЕ/мл
Линии обнаружения первой, второй, третьей, четвертой и пятой полосок индикаторной бумаги проявляют сливовый цвет;
Линия обнаружения шестой полоски индикаторной бумаги не проявляет сливовый цвет
2500-10000 мМЕ/мл
Линии обнаружения шести полосок индикаторной бумаги проявляют сливовый цвет
Больше, либо равно 10000 мМЕ/мл
Исследование начинают в тот день, когда должна была начаться менструация, но не началась. Если исследование начинается заранее, его следует повторить в ожидаемую дату менструации. Если менструация задерживается, исследование следует повторить снова через три дня. Если менструальный период нерегулярный, самый длинный менструальный период в последние месяцы должен быть рассчитан до проведения исследования. Если неизвестно, когда ожидается начало менструации, следует выполнить исследование по крайней мере через девятнадцать дней после последнего полового акта без средств предотвращения беременности.
Пример 8
Настоящий пример предлагает применение индикаторной бумаги для полуколичественного обнаружения хорионического гонадотропина человека в примере 4 для обнаружения цикла беременности человека, внематочной беременности, выкидыша и трофобластической болезни.
Образец мочи исследуют, используя способ применения чашки с реактивом в примере 7, и диапазон концентраций хорионического гонадотропина человека в образце мочи обнаруживают полуколичественно согласно интерпретации в Таблице 1.
Цикл беременности человека устанавливают в соответствии с референсными значениями ХГЧ у беременных женщин, описанными в «Китайских методических инструкциях по клиническому исследованию» ("Chinese Clinical Test Operating Procedures"). Для 0,2-1 недели беременности референсное значение ХГЧ составляет 5-50 МЕ/мл, для 1-2 недель беременности референсное значение ХГЧ составляет 50-500 МЕ/мл, для 2-3 недель беременности референсное значение ХГЧ составляет 100-5000 МЕ/мл, для 3-4 недель беременности референсное значение ХГЧ составляет 500-10000 МЕ/мл, для 4-5 недель беременности референсное значение ХГЧ составляет 1000-50 000 МЕ/мл, для 5-6 недель беременности референсное значение ХГЧ составляет 10 000-100 000 МЕ/мл, для 6-8 недель беременности референсное значение ХГЧ составляет 15 000-200 000 МЕ/мл, для 8-12 недель беременности референсное значение ХГЧ составляет 10 000-100 000 МЕ/мл.
Что касается клинической диагностики, диапазон концентраций хорионического гонадотропина человека в образцах мочи обнаруживают полуколичественно для диагностики внематочной беременности, выкидыша и трофобластической болезни и наблюдения за течением заболевания. Конкретнее, при диагностике внематочной беременности уровень ХГЧ при внематочной беременности часто составляет 312-625 мМЕ/мл, и результат определения ХГЧ может оставаться все еще положительным после трех дней маточного кровотечения, так что исследование ХГЧ можно использовать в качестве способа, позволяющего отличить внематочную беременность от другого типа острого живота. При диагностике выкидыша, если в матке все еще остается плацентарная ткань, результат ХГЧ может оставаться все еще положительным, тогда как при полном аборте или мертворождении результат ХГЧ изменяется с положительного на отрицательный. Следовательно, исследование на ХГЧ можно использовать в качестве референсной основы для защиты плода или аспирации матки. При диагностике угрожающего аборта, если уровень ХГЧ в моче поддерживался на высоком уровне, неизбежного аборта не будет, но если уровень ХГЧ ниже 2500 мМЕ/мл и постепенно снижается, существует вероятность аборта или мертворождения, и когда ХГЧ падает до 600 мМЕ/мл, произойдет неизбежный аборт. Следовательно, при лечении, направленном на сохранение беременности, если ХГЧ продолжает снижаться, это означает, терапия по сохранению беременности неэффективна, тогда как если ХГЧ продолжает расти, это означает, что терапия по сохранению беременности эффективна. Кроме того, уровни ХГЧ в моче у пациентов с пузырным заносом, злокачественным пузырным заносом и хорионэпителиомой значительно повышены и составляют от 100000 до миллионов мМЕ/мл. Уровень ХГЧ в моче пациентов с трофобластической опухолью должен быть менее 50 мМЕ/мл через 3 недели и отрицательным через 8-12 недель после операции. Если уровень ХГЧ не уменьшается или не изменяется на отрицательный, это может указывать на наличие остаточных поражений.
Сравнительный пример 1
Данный сравнительный пример предлагает индикаторную бумагу для полуколичественного обнаружения хорионического гонадотропина человека, аналогичную таковой в примере 1, за исключением того, что использованное свободное β-антитело представляет собой мышиное антитело и стандарт хорионического гонадотропина человека национального уровня получен в виде стандартного раствора с концентрацией 10000 мМЕ/мл. Когда исследование проводят с использованием индикаторной бумаги, результатом является то, что из шести полосок индикаторной бумаги линии качественного контроля четвертой, пятой и шестой полосок индикаторной бумаги не проявляют цвет, таким образом, результат является недействительным.
Сравнительный пример 2
Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартного раствора с концентрацией 5 мМЕ/мл. Когда исследование проводят с использованием индикаторной бумаги на цикл ХГЧ, раскрытой в китайском патенте CN108761099A, и с использованием набора для исследования на цикл ХГЧ, включающего в себя индикаторную бумагу, результатом является то, что линии качественного контроля двух полосок индикаторной бумаги проявляют цвет и линии обнаружения двух полосок индикаторной бумаги не проявляют цвет.
Экспериментальный пример 1
1. Требуются следующие реактивы:
0 мМЕ/мл раствор образца: содержащий белок фосфатный буферный раствор (PBS) представляет собой раствор образца, содержащий 0 мМЕ/мл ХГЧ.
Раствор образца хорионического гонадотропина человека (ХГЧ) с концентрацией 5 мМЕ/мл, 25 мМЕ/мл, 100 мМЕ/мл, 500 мМЕ/мл, 2500 мМЕ/мл и 10000 мМЕ/мл готовили из стандарта хорионического гонадотропина человека (ХГЧ) и содержащего белок фосфатного буферного раствора (0,01 М PBS) до достижения соответствующей надлежащей концентрации.
Лютеинизирующий гормон человека (ЛГЧ) 500 мМЕ/мл: После растворения стандартного образца ЛГЧ в содержащем белок фосфатном буферном растворе (PBS) используют раствор образца ХГЧ с концентрацией 0 мМЕ/мл для приготовления раствора ЛГЧ A с концентрацией 500 мМЕ/мл; используют раствор образца хорионического гонадотропина человека с концентрацией 5 мМЕ/мл для приготовления раствора ЛГЧ B с концентрацией 500 мМЕ/мл.
Фолликулостимулирующий гормон человека (ФСГЧ) 1000 мМЕ/мл: После растворения стандартного образца ФСГЧ в содержащем белок фосфатном буферном растворе (PBS) используют раствор образца ХГЧ с концентрацией 0 мМЕ/мл для приготовления раствора ФСГЧ A с концентрацией 1000 мМЕ/мл; используют раствор образца хорионического гонадотропина человека с концентрацией 5 мМЕ/мл для приготовления раствора ФСГЧ B с концентрацией 1000 мМЕ/мл.
Тиреотропный гормон человека (ТТГЧ) 1000 мкМЕ/мл: После растворения стандартного образца ТТГЧ в содержащем белок фосфатном буферном растворе (PBS) используют раствор образца ХГЧ с концентрацией 0 мМЕ/мл для приготовления раствора ТТГЧ A с концентрацией 1000 мкМЕ/мл; используют раствор образца хорионического гонадотропина человека с концентрацией 5 мМЕ/мл для приготовления раствора ТТГЧ B с концентрацией 1000 мкМЕ/мл; и используют раствор образца хорионического гонадотропина человека с концентрацией 5 мМЕ/мл для приготовления раствора ТТГЧ B с концентрацией 1000 мкМЕ/мл.
2. Испытание физических свойств:
Испытание свойств внешнего вида: Бумажную индикаторную полоску вынимают и проводят ее визуальный осмотр. Бумажная полоска должна быть чистой и целой, не иметь неровностей, повреждений и загрязнений и должна быть прочно прикреплена к материалу.
Ширина пленочной полоски: Берут два из каждых шести видов чувствительных полосок индикаторной бумаги и измеряют ширину пленки на бумажных полосках штангенциркулем, и рассчитывают среднее значение двух результатов измерения.
Хроматографический статус: нормальный, на коллоидном золоте отсутствует слой воды и фон сохраняет исходную чистоту в течение 3-5 минут.
Скорость миграции жидкости: берут две полоски индикаторной бумаги каждой из шести чувствительных полосок индикаторной бумаги и проводят операцию в соответствии со способом, использованным в примере 7. Использованное время регистрируют с помощью секундомера (с точностью 0,01 с) как (t) с момента времени, когда полоску индикаторной бумаги погружают в раствор образца, пока жидкость не достигнет границы между несущей антитело пленкой и адсорбирующей прокладкой для воды. Длину, измеренную штангенциркулем Вернье (точность 0,02 мм), регистрируют как (L) от конца для загрузки образца на прокладке для образца до границы между несущей антитело пленкой и адсорбирующей прокладкой для воды. Рассчитывают скорость миграции, то есть L/t. Берут, соответственно, средние значения повторного измерения двух полосок индикаторной бумаги каждой из шести чувствительных полосок индикаторной бумаги. Результаты соответствуют скорости миграции жидкости не менее 10 мм/мин. Хроматографическое состояние нормальное, коллоидное золото не отслаивается водой, а фон в основном остается прозрачным в течение 5 минут.
3. Минимальное обнаруживаемое количество исследования:
Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 2,5 мМЕ/мл, 5 мМЕ/мл и 10 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, используя чашку с реактивом из примера 4 настоящей заявки, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество первой полоски индикаторной бумаги составляет 5 мМЕ/мл. Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 12,5 мМЕ/мл, 25 мМЕ/мл и 50 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество второй полоски индикаторной бумаги составляет 25 мМЕ/мл. Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 50 мМЕ/мл, 100 мМЕ/мл и 200 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество третьей полоски индикаторной бумаги составляет 100 мМЕ/мл. Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 400 мМЕ/мл, 500 мМЕ/мл и 600 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество четвертой полоски индикаторной бумаги составляет 500 мМЕ/мл. Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 2400 мМЕ/мл, 2500 мМЕ/мл и 2600 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество пятой полоски индикаторной бумаги составляет 2500 мМЕ/мл. Стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 9900 мМЕ/мл, 10000 мМЕ/мл и 10100 мМЕ/мл, соответственно. Стандартный раствор с каждой концентрацией исследуют три раза, и наблюдают результаты в течение 5 минут, и они демонстрируют, что минимальное обнаруживаемое количество шестой полоски индикаторной бумаги составляет 10000 мМЕ/мл.
5. Точность и воспроизводимость исследования:
стандарт хорионического гонадотропина человека национального уровня готовят в виде стандартных растворов с концентрациями 5 мМЕ/мл, 25 мМЕ/мл, 100 мМЕ/мл, 500 мМЕ/мл, 2500 мМЕ/мл и 10000 мМЕ/мл. Стандартный раствор с каждой концентрацией исследуют двадцать раз, получая результат исследования. Правая разность между результатами исследования и маркированным значением соответствующего стандартного раствора не превышает одного порядка величины. Левая разность отсутствует. Положительный стандартный раствор не показывает негативный результат.
5. Специфичность:
Специфичность отрицательного результата: Исследование раствора 500 мМЕ/мл ЛГЧ A, раствора 1000 мМЕ/мл ФСГЧ A, раствора 1000 мкМЕ/мл ТТГЧ A проводят по 3 раза, соответственно. Результаты трехкратного тестирования каждого раствора показывают, что линии обнаружения являются негативными.
Специфичность положительного результата: Исследование раствора 500 мМЕ/мл ЛГЧ B, раствора 1000 мМЕ/мл ФСГЧ B, раствора 1000 мкМЕ/мл ТТГЧ B проводят по 3 раза, соответственно. Результаты трехкратного тестирования каждого раствора показывают, что линии обнаружения являются положительными.
6. Стабильность исследования:
Физические свойства, точность, воспроизводимость и специфичность полоски индикаторной бумаги и чашки с реактивом исследуют через один месяц после истечения срока годности, результаты соответствуют требованиям.
Очевидно, что описанные выше варианты осуществления изобретения являются исключительно примерами для ясности иллюстрации и не предназначены для ограничения вариантов осуществления изобретения. В свете приведенного выше раскрытия специалистами в данной области техники могут быть выполнены другие изменения и модификации в различных формах. Нет необходимости и возможности представить здесь все варианты осуществления изобретения. Вытекающие из них очевидные изменения или модификации все же находятся в объеме защиты настоящей заявки.
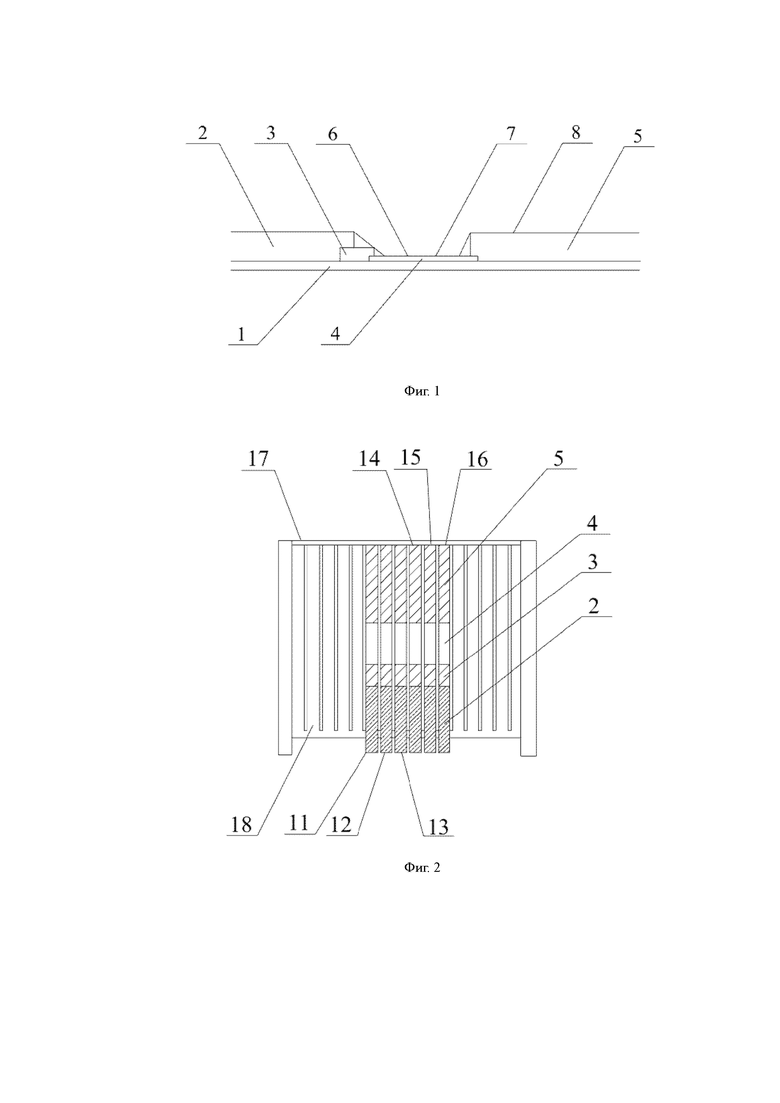
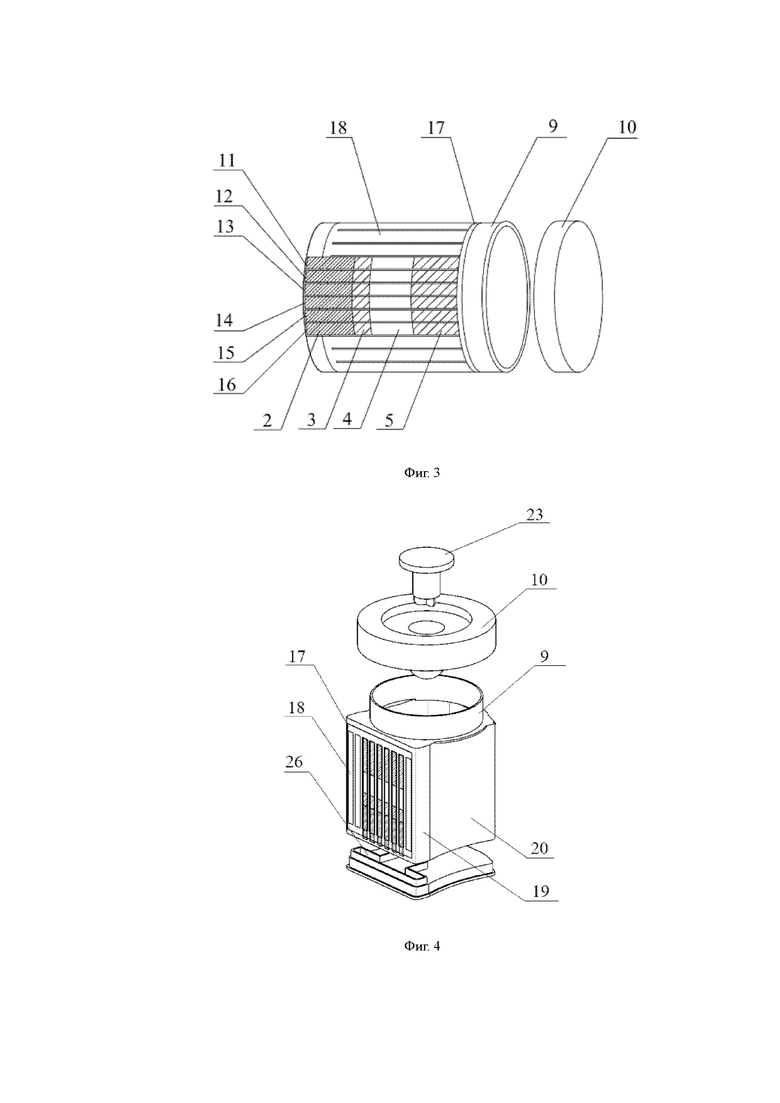

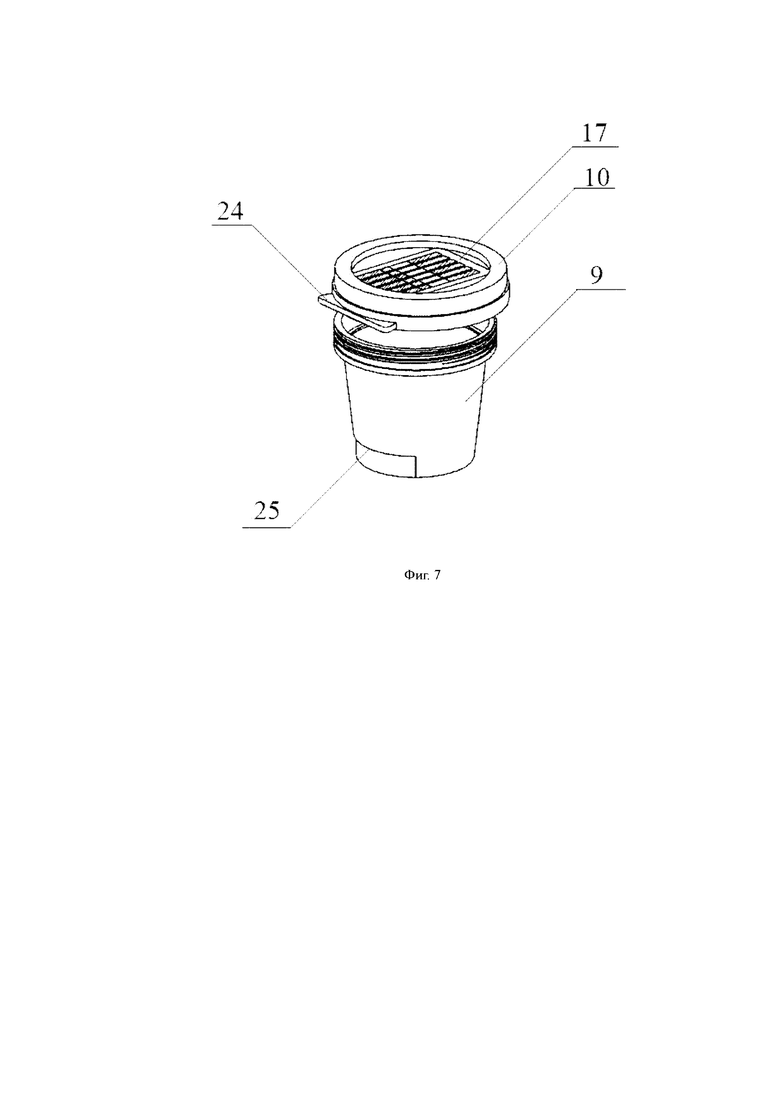
Группа изобретений относится к области биологического обнаружения. Раскрыт картридж для полуколичественного обнаружения хорионического гонадотропина человека, который содержит по меньшей мере первую полоску индикаторной бумаги (11), вторую полоску индикаторной бумаги (12), третью полоску индикаторной бумаги (13), четвертую полоску индикаторной бумаги (14), пятую полоску индикаторной бумаги (15) и шестую полоску индикаторной бумаги (16), причем каждая полоска включает в себя подложку (1) и прокладку для образца (2), адсорбирующую прокладку для коллоидного золота (3), несущую антитело пленку (4) и абсорбирующую прокладку (5) для воды, последовательно приклеенные к подложке (1); несущая антитело пленка (4) имеет линию обнаружения (6) на конце, близком к адсорбирующей прокладке для коллоидного золота (3), и линию контроля качества (7) на конце, близком к адсорбирующей прокладке для воды (5); линия обнаружения (6) покрыта моноклональным антителом к хорионическому гонадотропину человека α-ХГЧ; линия контроля качества (7) покрыта поликлональным антимышиным IgG антителом; адсорбирующая прокладка для коллоидного золота (3) первой полоски индикаторной бумаги (11) имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, и адсорбирующая прокладка для коллоидного золота (3) второй полоски индикаторной бумаги (12), третьей полоски индикаторной бумаги (13), четвертой полоски индикаторной бумаги (14), пятой полоски индикаторной бумаги (15) и шестой полоски индикаторной бумаги (16) имеют адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и свободное β-антитело, с которым связывается ХГЧ из образца, с массовым соотношением 1:1, 1:2, 1:40, 1:80, 1:100 соответственно; где свободное β-антитело является немышиным антителом. Также раскрыты способ изготовления картриджа, чашка с реактивом и применение указанных картриджа или чашки для определения диапазона концентраций хорионического гонадотропина человека в образце мочи. Группа изобретений обеспечивает широкий диапазон определяемых концентраций, высокие точность и чувствительность анализа. 4 н. и 11 з.п. ф-лы, 7 ил., 1 табл., 7 пр.
1. Картридж для полуколичественного обнаружения хорионического гонадотропина человека, отличающийся тем, что он содержит по меньшей мере первую полоску индикаторной бумаги (11), вторую полоску индикаторной бумаги (12), третью полоску индикаторной бумаги (13), четвертую полоску индикаторной бумаги (14), пятую полоску индикаторной бумаги (15) и шестую полоску индикаторной бумаги (16), причем каждая полоска включает в себя
подложку (1) и
прокладку для образца (2), адсорбирующую прокладку для коллоидного золота (3), несущую антитело пленку (4) и абсорбирующую прокладку (5) для воды, последовательно приклеенные к подложке (1);
где прокладка (2) для образца, адсорбирующая прокладка (3) для коллоидного золота, несущая антитело пленка (4) и абсорбирующая прокладка для воды (5) частично перекрываются друг с другом и расположены внахлест;
несущая антитело пленка (4) имеет линию обнаружения (6) на конце, близком к адсорбирующей прокладке для коллоидного золота (3), и линию контроля качества (7) на конце, близком к адсорбирующей прокладке для воды (5); линия обнаружения (6) покрыта моноклональным антителом к хорионическому гонадотропину человека α-ХГЧ; линия контроля качества (7) покрыта поликлональным антимышиным IgG антителом;
адсорбирующая прокладка для коллоидного золота (3) первой полоски индикаторной бумаги (11) имеет адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, и адсорбирующая прокладка для коллоидного золота (3) второй полоски индикаторной бумаги (12), третьей полоски индикаторной бумаги (13), четвертой полоски индикаторной бумаги (14), пятой полоски индикаторной бумаги (15) и шестой полоски индикаторной бумаги (16) имеют адсорбированный конъюгат моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом и свободное β-антитело, с которым связывается ХГЧ из образца, с массовым соотношением 1:1, 1:2, 1:40, 1:80, 1:100 соответственно; где свободное β-антитело является немышиным антителом.
2. Картридж по п. 1, отличающийся тем, что свободное β-антитело представляет собой гуманизированное, лошадиное, кроличье или козье антитело.
3. Способ изготовления картриджа для полуколичественного обнаружения хорионического гонадотропина человека по любому из пп. 1, 2, отличающийся тем, что он включает в себя стадии:
S1: нанесение моноклонального антитела к хорионическому гонадотропину человека α-ХГЧ и поликлонального антимышиного IgG антитела на несущую антитело пленку, чтобы получить линию обнаружения и линию контроля качества, осуществление уплотняющей обработки в изолирующем растворе, содержащем 0,08-0,12 М буферного раствора, 0,3-0,7 масс. % сахара, 0,8-1,2 масс. % уплотняющего белка и 0,03-0,07 масс. % консерванта, и сушки для использования;
S2: взятие коллоидного золота и регулирование его pH, добавление к нему моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ, добавление стабилизатора с перемешиванием, центрифугирование и отделение осадка, повторного растворения осадка в комплексном растворе коллоидного золота для получения комплексного раствора конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом;
S3: выливание комплексного раствора конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, полученного на стадии S2, на адсорбирующую прокладку для коллоидного золота одной полоски индикаторной бумаги с последующими сушкой и хранением для использования;
S4: добавление свободного β-антитела, с которым связывается ХГЧ из образца, к комплексному раствору конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом, полученному на стадии S2, и тщательное смешение для получения разных смешанных комплексных растворов с разным массовым отношением конъюгата моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ с коллоидным золотом к свободному β-антителу, выливание разных смешанных комплексных растворов на адсорбирующие прокладки для коллоидного золота остальных полосок индикаторной бумаги с последующими сушкой и хранением для использования;
S5: взятие прокладки для образца, адсорбирующей прокладки для коллоидного золота, несущей антитело пленки и адсорбирующей прокладки для воды, которые последовательно приклеивают вдоль продольного направления подложки таким образом, что они частично перекрываются, и получения полоски индикаторной бумаги, и изготовления по меньшей мере первой полоски индикаторной бумаги, второй полоски индикаторной бумаги, третьей полоски индикаторной бумаги, четвертой полоски индикаторной бумаги, пятой полоски индикаторной бумаги и шестой полоски индикаторной бумаги таким путем;
при этом во второй, третьей, четвертой, пятой и шестой полосках индикаторной бумаги массовые отношения моноклонального антитела к хорионическому гонадотропину человека β-ХГЧ к свободному β-антителу составляют 1:1, 1:2, 1:40, 1:80 и 1:100 соответственно;
где свободное β-антитело является немышиным антителом;
а картридж снабжен пазами для установки полосок индикаторной бумаги.
4. Способ по п. 3, отличающийся тем, что в первой, второй и третьей полосках индикаторной бумаги моноклональное антитело к хорионическому гонадотропину человека β-ХГЧ маркировано коллоидным золотом с концентрацией 4 мкг/мл, и в четвертой, пятой и шестой полосках индикаторной бумаги моноклональное антитело к хорионическому гонадотропину человека β-ХГЧ маркировано коллоидным золотом с концентрацией 5 мкг/мл.
5. Способ по любому из пп. 3, 4, отличающийся тем, что моноклональное антитело к хорионическому гонадотропину человека α-ХГЧ имеет концентрацию 2-3 мг/мл, поликлональное антимышиное IgG антитело имеет концентрацию 1-2 мг/мл.
6. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека, отличающаяся тем, что она содержит картридж для полуколичественного обнаружения хорионического гонадотропина человека по любому из пп. 1, 2 или картридж для полуколичественного обнаружения хорионического гонадотропина человека, изготовленного способом по любому из пп. 3-5.
7. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 6, отличающаяся тем, что она содержит
корпус чашки (9), а
картридж (17) расположен внутри чашки с реактивом и снабжен параллельными пазами (18), где один конец паза (18) имеет отверстие для введения в него полоски индикаторной бумаги, прокладка для образца (2) полоски индикаторной бумаги проходит от отверстия до внешней стороны картриджа (17).
8. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 7, отличающаяся тем, что она содержит крышку чашки (10), отдельную от чашки и закрывающую корпус чашки (9).
9. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 7 или 8, отличающаяся тем, что картридж (17) расположен вертикально внутри корпуса чашки (9), и отверстие паза (18) находится вблизи дна корпуса чашки (9).
10. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 9, отличающаяся тем, что корпус чашки (9) имеет полость обнаружения (19), полость для хранения жидкости (20) и полость для направления жидкости (21);
где полость для направления жидкости (21) имеет первое сквозное отверстие (211), взаимно сообщающееся с полостью для хранения жидкости в верхней ее части, и второе сквозное отверстие (212), взаимно сообщающееся с полостью обнаружения (19) в нижней ее части;
поршень (22), скользящий вдоль полости для направления жидкости, размещен внутри полости для направления жидкости (21) и имеет начальное состояние для обеспечения сообщения полости для направления жидкости (21) с полостью для хранения жидкости (20) и состояние обнаружения для обеспечения сообщения полости для направления жидкости (21) с полостью обнаружения (19);
третье сквозное отверстие (213) размещено на стенке корпуса чашки (9) вдали от полости обнаружения (19) и взаимно сообщается с полостью для направления жидкости (21); и картридж (17) размещен вертикально внутри полости обнаружения (19).
11. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 10, отличающаяся тем, что на поршне (22) размещен резервуар для хранения жидкости (221); когда поршень (22) находится в начальном состоянии, резервуар для хранения жидкости поршня (221) выровнен относительно первого сквозного отверстия (211), так что полость для направления жидкости (21) взаимно сообщается с полостью для хранения жидкости (20); когда поршень (22) находится в состоянии обнаружения, резервуар для хранения жидкости поршня (221) выровнен относительно второго сквозного отверстия (212), так что полость для направления жидкости (21) взаимно сообщается с полостью обнаружения (19).
12. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 10 или 11, отличающаяся тем, что поднимающий элемент (23) для поднятия поршня предусмотрен на крышке чашки (10), и поднимающий элемент смонтирован на крышке чашки (10), будучи отделяемым от нее.
13. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 8, отличающаяся тем, что картридж (17) закреплен параллельно внутри крышки чашки (10).
14. Чашка с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по п. 13, отличающаяся тем, что на внешней кромке крышки чашки (10) размещена опора (24) для закрепления чашки с реактивом, помещенной на свой бок, и на корпусе чашки (9) расположена мерная линия (25).
15. Применение картриджа для полуколичественного обнаружения хорионического гонадотропина человека по любому из пп. 1, 2, картриджа для полуколичественного обнаружения хорионического гонадотропина человека, изготовленного способом по любому из пп. 3-5, или чашки с реактивом для полуколичественного обнаружения хорионического гонадотропина человека по любому из пп. 6-14 для определения диапазона концентраций хорионического гонадотропина человека в образце мочи, используемого при диагностике цикла беременности человека, внематочной беременности, выкидыша или трофобластической болезни.
| US 5780308 A, 14.07.1998 | |||
| CN 108761099 A, 06.11.2018 | |||
| US 20120083047 A1, 05.04.2012 | |||
| RU 2008145884 A, 27.05.2010 | |||
| CN 105738635 A, 06.07.2016 | |||
| US 9207248 B2, 08.12.2015 | |||
| CN 106932598 A, 07.07.2017. |
Авторы
Даты
2021-07-30—Публикация
2020-01-09—Подача