Изобретение относится к области медицины, биологии, молекулярной иммунологии и может быть использовано в качестве способа обследования при диагностике онкологических заболеваний.
За последние несколько лет были предприняты значительные усилия по открытию и разработке биомаркеров на основе жидкой биопсии, поскольку они являются минимально инвазивными, экономически эффективными и могут быть выполнены во время наблюдения пациентов.
Белки плазмы, такие как растворимый PD-L1, цитокины и протеины, связанные с экзосомами, считаются важным источником информации при открытии и разработке биомаркеров. Группа изобретений относится к способу идентификации индивидуума со злокачественной опухолью, который с большей вероятностью будет отвечать на лечение антагонистом, связывающимся с PD-L1 и предоставление рекомендации по поводу того, что индивидуум вероятно будет отвечать на лечение антагонистом, связывающимся с PD-L1 (например, RU 2701378, G01N 33/574, 2019).Тем не менее, уровень растворимого PD-L1 в плазме может быть повышен вследствие различных физиологических состояний и заболеваний, например беременности или аутоиммунных заболеваний (Yanaba K, Hayashi М, Yoshihara Y, Nakagawa Н. Serum levels of soluble programmed death-1 and programmed death ligand-1 in systemic sclerosis: Association with extent of skin sclerosis. J Dermatol. 2016; 43(8):954-957; Jovanovic D, Roksandic Milenkovic M, Kotur Stevuljevic J, et al. Membrane PD-L1 expression and soluble PD-L1 plasma levels in idiopathic pulmonary fibrosis-a pilot study. J Thorac Dis. 2018; 10(12):6660-6669).Различные образцы тканей, методы обнаружения и критерии оценки могут приводить к противоречивым результатам по оценки роли PD-L1 для пациентов и прогноза течения заболевания. Поскольку иммунотерапия представляет собой многообещающую новую стратегию лечения злокачественных новообразований, то необходимы дополнительные исследования для изучения текущего состояния противоопухолевых Т-клеток у больных злокачественными новообразованиями.
Развитие методов анализа субпопуляционных фенотипов лимфоцитов в периферической крови является основой малоинвазивных методов, позволяющих с высокой вероятностью оценить прогноз течения онкологического заболевания без использования гистологического архивного материала. В европейском патенте (ЕР 3400443, G01N 33/574, 14.11.2018) было исследовано относительное количество (в %) CD8+ Т-клеток, экспрессирующих PD-1 и Tim-3, в образце опухолевой ткани в качестве способа прогнозирования времени выживания субъекта, страдающего от почечно-клеточной карциномы. Данный подход перспективен для ретроспективных исследований, но мало приспособлен для мониторинга состояния конкретного больного в период лечения в связи с инвазивностью процесса и трудозатратами. Предполагается, что именно экспрессия супрессорных костимулирующих молекул на антиген-презентирующих клетках принципиально отличается у здоровых доноров и онкологических больных и позволяет выделить факторы, максимально способствующие сверхэкспрессии супрессорных молекул: растворимые медиаторы, опухоль-ассоциированные антигены или контактное взаимодействие иммунокомпетентных и опухолевых клеток (Сенников С.В., Альшевская А.А., Жукова Ю.В., Беломестнова И.А., Караулов А.В., Лопатникова Ю.А. Плотность экспрессии рецепторов киммунорегуляторным медиаторам как модулирующий компонент биологических эффектов медиаторов на клетку. Часть 1. Медицинская иммунология. 2019. Т. 21. №2. С. 209-220; Сенников С.В., Альшевская А.А., Жукова Ю.В., Беломестнова И.А., Караулов А.В., Лопатникова Ю.А. Плотность экспрессии рецепторов к иммунорегуляторным медиаторам как модулирующий компонент биологических эффектов медиаторов на клетку. Часть 2. Медицинская иммунология. 2019. Т. 21. №3. С. 379-396).
Истощение Т-клеток - это состояние дисфункции, которое обычно происходит во время хронических вирусных инфекций и роста опухоли из-за постоянного присутствия антигена. Истощение также связано с совместной экспрессией высоких уровней множественных ингибиторных рецепторов, включая PD-1, Lag-3, Tim-3, CD160, TIGIT и др. Одним из основных свойств истощения является то, что истощенные Т-клетки возникают из Т-клеток, которые первоначально имели эффекторные функции, но затем становились дисфункциональными при хронической антигенной стимуляции (R.H.McMahan, L. Golden-Mason, M.I. Nishimura, B.J. McMahon, M. Kemper, T.M. Allen, et al., Tim-3 expressionon PD-1+ HCV-specific human CTLs is associated with viral persistence, and its blockade restores hepatocyte-directed in vitro cytotoxicity, J. Clin. Invest. 120 (12) (2010) 4546-4557. Sakuishi К., Apetoh L, Sullivan J.M., Blazar B.R., Kuchroo V.K., Anderson A.C., Targeting Tim-3 and PD-1 pathway store verse T-cell exhaustion and restore antitumor immunity, J. Exp.Med. 207 (10) (2010) 2187-2194).Tim-3 действует как негативная регуляторная молекула и играет критическую роль в иммунной толерантности. В работе (Wu J, Liu С, Qian S, Hou H. The expression of Tim-3 in peripheral blood of ovarian cancer. DNA Cell Biol. 2013; 32 (11):648-653. doi:10.1089/dna.2013.2116) исследовалась экспрессия Tim-3 на периферических CD4 + T и CD8 + Т-клетках при раке яичников. Данные показали, что экспрессия Tim-3 была значительно увеличена как в CD4+, так и в CD8+ Т-клетках при раке яичников. Пациенты с рецидивирующим раком яичников имели более высокое содержание Tim-3+ CD4+ Т-клеток, чем у первично выявленных пациентов. При анализе экспрессии Tim-3 у пациентов с прогрессированием рака показана повышенная экспрессия Tim-3 как в CD4+, так и в CD8+ Т-клетках в случаях с III/IV стадией рака по сравнению с I и II стадиями. Исследование показало, что Tim-3 может участвовать в развитии и прогрессировании рака яичников посредством его негативной регуляции на различных подгруппах Т-клеток, а экспрессия Tim-3 в CD4+ Т-клетках может служить прогностическим маркером противоопухолевой терапии.
В работе (Li Z, Liu X, Guo R, Wang P. TIM-3 plays a more important role than PD-1 in the functional impairments of cytotoxic T cells of malignant Schwannomas. Tumour Biol. 2017; 39(5):1010428317698352. doi:10.1177/1010428317698352) исследовалась возможность использования цитотоксических Т-клеток для лечения злокачественной шванномы, редкой, но агрессивной опухоли нервной оболочки, путем изучения нативного Т-клеточного иммунитета у хозяина. У пациентов со злокачественной опухолью CD8+ Т-клетки были существенно обогащены клетками PD-1-TIM-3+и PD-1+TIM-3+. По сравнению с PD-1-TIM-3- CD8+ Т-клетками, PD-1-TIM-3+и PD-1+TIM-3+CD8+ Т-клетки обладают значительно более низкой пролиферативной способностью, снижением продукции интерлейкина-2 и гамма-интерферона и значительным снижением секреция перфорина и гранзима В, что указывает на иммуносупрессию и снижение цитотоксичности. Экспрессия только TIM-3 была связана с более низкой пролиферацией и меньшей секрецией перфорина и гранзима В, тогда как экспрессия только PD-1 была связана с функциональными нарушениями, поэтому предполагается, что экспрессия TIM-3 является лучшим маркером истощенных CD8+ Т-клеток.
В исследовании (Han S, Feng S, Xu L, et al. Tim-3 on peripheral CD4+ and CD8+ T cells is involved in the development of glioma. DNA Cell Biol. 2014; 33(4):245-250. doi:10.1089/dna.2013.2306) рассмотрена экспрессия TIM-3 на мононуклеарных клетках периферической крови у пациентов с глиомой и анализировалась корреляция между уровнем TIM-3 и развитием глиомы. Наблюдается повышенная экспрессия TIM-3 как на CD4+, так и на CD8+ Т-клетках. Дальнейшее увеличение TIM-3 было идентифицировано только на CD8+ Т-клетках, но не на CD4+ Т-клеток у пациентов при прогрессировании опухоли. Эти результаты показали, что Tim-3-индуцированное истощение Т-клеток может чаще проявляться на CD8+ Т-клетках при глиоме и рассматриваться как новый механизм прогрессирования глиомы. Кроме того, TIM-3+ Т-клетки демонстрируют истощенный фенотип, определяемый по неспособности к пролиферации и продукции IL-2, TNF и IFN-g. Показана отрицательная корреляция между уровнем TNF-a и экспрессией TIM-3+ как на CD4+, так и на CD8+ Т-клетках, что может свидетельствовать о том, что TIM-3 может влиять на болезнь через подавление TNF-a. Данные свидетельствуют о том, что TIM-3 может быть маркером для потенциальной диагностики и прогрессирования глиомы и может быть терапевтической мишенью для лечения этого заболевания.
Известен способ использования поверхностных маркеров лимфоцитов в определении течения онкологического заболевания, в частности колоректального рака (CN 106199005, G01N 33/68, 07.12.2016). В данном патенте использовали CD137, который является членом суперсемейства рецепторов фактора некроза опухоли и необходим для пролиферации и выживания Т-клеток. Использовано два метода: выделение мононуклеарных клеток на градиенте плотности с последующим мечением выделенных лейкоцитов моноклональными антителами и мечение лейкоцитов моноклональными антителами непосредственно в образце крови с последующим лизированием (CN 106199005, G01N 33/68, 07.12.2016).
Недостатком способа является то, что данным способом определяют активность клеток против колоректального рака только по экспрессии маркера CD137, который присутствует на активированных Т-клетках, выраженного в относительных единицах флюоресценции, без проведения функциональных тестов, что не дает полной картины оценки роли этой молекулы в противоопухолевой активности.
Наиболее близким к заявляемому является способ определения качественных параметров иммуносупрессивных клеток у онкологических пациентов, включающий забор периферической крови пациента, мечение лейкоцитов периферической крови моноклональными антителами к поверхностным рецепторам CD3, CD8, TIM-3, PD-1, определение относительного и абсолютного количества клеток, несущих рецепторы TIM-3- и PD-1 в популяциях CD8 Т-клеток, определение противоопухолевой активности лейкоцитов, несущих рецепторы TIM-3- и PD-1. (ЕР 3628322, C12N 5/0783, 01.04.2020). В данном способе после мечения лейкоцитов производится сортировка лейкоцитов по наличию TIM-3- и PD-1, после чего проверяют их количество и противоопухолевую активность.
Недостатком способа является отсутствие анализа лейкоцитов CD4, которые оказывают иммуносупрессивное влияние на процесс, способствующий росту опухоли, данным способом не определяется абсолютное количество рецепторов на клетках, поскольку при превышении определенного уровня рецепторов клетка теряет способность у реализации эффекторных функций.
Задачей изобретения является повышение достоверности определения степени иммуносупрессии у онкологических пациентов.
Поставленная задача решается тем, что в способе определения качественных параметров иммуносупрессивных клеток у онкологических пациентов, включающем забор периферической крови пациента, мечение лейкоцитов периферической крови моноклональными антителами к поверхностным рецепторам CD3, CD8, TIM-3, PD-1, определение относительного и абсолютного количества клеток, несущих рецепторы TIM-3- и PD-1 в популяциях CD8 Т-клеток, определение противоопухолевой активности лйкоцитов, несущих рецепторы TIM-3- и PD-1, мечение лейкоцитов периферической крови включает дополнительное мечение лейкоцитов CD4 соответствующими антителами, затем определяют абсолютное количество рецепторов TIM-3- и PD-1 на поверхности CD4 и CD8 Т-клеток, определяют количество рецепторов на клетку, после чего определяют противоопухолевую активность лейкоцитов, выделенных из другой части периферической крови, по высвобождению внутриклеточного фермента лактатдегидрогеназы из погибших опухолевых клеток, при этом у онкологического пациента наблюдается повышенное количество клеток с меньшим числом рецепторов мечение PD-1- и TIM-3, а снижение цитотоксической активности против опухолевых клеток коррелирует с количеством PD-1- и TIM-3-позитивных клеток и распределением этих рецепторов на поверхности клеток.
Абсолютное количество рецепторов TIM-3- и PD-1 на поверхности CD4 и CD8 Т-клеток определяют с помощью калибровочных частиц.
Изобретение, на наш взгляд, является новым и соответствует критериям "изобретательский уровень" и промышленная применимость. При практическом осуществлении способа сначала производилась запись калибровочных частиц для создания калибровочной кривой и перевода значений интенсивности флуоресценции клеток, экспрессирующих соответствующий маркер, в абсолютные показатели количества рецепторов. Затем в пробы крови здоровых доноров и больных РМЖ добавлялись моноклональные антитела к CD3, CD4, CD8, TIM-3, PD-1. После инкубации с антителами в пробы добавляли калибровочные частицы для определения абсолютного количества клеток. По полученным данным определяли относительное и абсолютное количество TIM-3- и PD-1-позитивных клеток и абсолютное количество молекул TIM-3, PD-1 на клетках. На следующем этапе проводили определение цитотоксической активности мононуклеарных клеток против клеток линии аденокарциномы молочной железы. Исследованные показатели были использованы для проведения статистического корреляционного анализа. Важным результатом изобретения является возможность в лабораторных условиях определить параметры, позволяющие спрогнозировать развитие рака молочной железы.
Изобретение осуществляется следующим образом.
В качестве объекта исследования использовалась венозная кровь 20 пациенток с первичным РМЖ, а также условно-здоровых женщин без клинически и инструментально диагностированной патологии молочных желез (20 человек) после подписания информированного согласия. Забор крови проводился в пробирки с ЭДТА в качестве антикоагулянта. Венозную кровь у пациенток с первично выявленным РМЖ (Т 1-3 N 0-2 М 0) забирали перед операцией (радикальной мастэктомии или радикальной резекции молочной железы). Образец периферической крови делили на две части: для тестирования цитотоксической активности и для определения фенотипических характеристик и количества рецепторов на поверхности клеток.
Мононуклеарные клетки (МНК) периферической крови выделяли в стерильных условиях стандартным методом в градиенте фиколла-урографина (ρ=1,077 г/л). Для этого, 10 мл цельной крови разводили в соотношении 1:1 мл средой RPMI 1640. Далее 20 мл крови наслаивали на 10 мл фиколл-урографина и центрифугировали 45 минут при 1500 об/мин при комнатной температуре. Интерфазное кольцо, содержащее МНК, собирали, дважды отмывали в 15 мл среды RMPI 1640. Для оценки цитотоксической активности МНК против опухолевой линии аденокарциномы молочной железы ZR-75-1 использовали нерадиоактивный цитотоксический тест CytoTox96 (Promega, США), основанный на количественном определении содержания внутриклеточного фермента - лактатдегидрогеназы (ЛДГ), которое увеличивается пропорционально гибели опухолевых клеток. Процедуру осуществляли согласно протоколу фирмы-производителя. Для этого МНК и клетки аденокарциномы молочной железы ZR-75-1 инкубировали в атмосфере 5% CO2 и 37°С в течение 16-18 часов в соотношении 10:1 в питательной среде RPMI-1640 с добавлением 5% эмбриональной телячьей сыворотки, гентамицина 80 мкг/мл, 2 мМ L-глутамина, 5x10-5 меркаптоэтанола. Гибель клеток-мишеней оценивали по высвобождению внутриклеточного фермента (лактатдегидрогеназы). Оптическую плотность измеряли с помощью планшетного ридера Bertold Tecnology при длине волны 490 нм. Уровень цитотоксичности оценивали как отношение оптической плотности в образце со смесью эффекторов и мишеней к оптической плотности в образце с полностью лизированными мишенями, выраженное в процентах. Учитывали поправки на присутствие ЛДГ в среде и спонтанный выход ЛДГ из эффекторов и клеток-мишеней (опухолевые клетки).
Оценка фенотипических характеристик проводилась методом проточной цитометрии (цитофлуориметр FACS Verse (BD, США)) с использованием моноклональных антител: CD 3-PerCp Су 5. (клон ОКТЗ, Cat #317336), CD 4-РЕ-Су7 (клон RPA-T4, Cat #300512), CD 8-FITC (клон RPA-T8, Cat #301006), TIM-3- РЕ (клон F38-2E2, Cat #345006), PD-1- РЕ (клон NAT105, Cat #367404). Все антитела производства Biolegend (USA). Для создания калибровочной кривой и перевода значений интенсивности флуоресценции клеток, экспрессирующих соответствующий маркер, в абсолютные показатели количества рецепторов, использовался набор BD QuantiBRITE РЕ («BD Biosciences)), США), содержащий 4 фракции лиофилизированных бус, каждая из которых несет различный уровень фикоэритрина. Пробирка с бусами разводилась в 500 мкл PBS (137 MMNaCl, 2,68 mMKCl, 10 мМ Na2HPO4 x12H2O, 1,47 мМ KН2Р04, 0,53 мМ EDTA и 0,1% NaN3), перемешивалась в течение 1 минуты и анализировалась на проточном цитометре. На FSC-A/SSC-A дот-плоте гейтировали популяцию бус и записывали 10,000 событий. Далее на гистограмме РЕ флуоресценции выставляли маркеры по четырем пикам калибровочных частиц (Low, Medium Low, Medium High, High). Согласно инструкции фирмы-производителя, по результатам анализа бус был построен график зависимости логарифмических значений числа молекул фикоэритрина от логарифмических значений интенсивности флюоресценции и с помощью построения линии тренда была установлена математическая линейная зависимость (рисунок 3). Полученная зависимость использовалась для составления формулы перевода значений интенсивности флуоресценции по каналу РЕ в число молекул РЕ для каждой из субпопуляций, и были подсчитаны средние значения количества рецепторов на клетке в каждой из субпопуляций. Для определения абсолютного количества клеток были использованы частицы Precision Count Beads (Biolegend (USA). Для наилучшей стабильности и воспроизводимости результатов были подобраны оптимальные условия протокола пробоподготовки и фенотипирования клеток. Для каждого пациента готовили 4 пробирки:
1-я пробирка: Контроль - клетки без окрашивания моноклональными антителами для настройки параметров светорассеяния.
2-я пробирка: FMO -контроль - окрашивание клеток с помощью антител CD 3-PerCp Су 5, CD 4-РЕ-Су7, CD 8-FITC для настройки параметров светорассеяния и напряжения ФЭУ.
3-я пробирка: CD 3-PerCpCy 5/ CD 4-РЕ-Су7/ CD 8-FITC/ TIM-3- РЕ/ Precision Count Beads - для определения количества TIM-3 на поверхности клеток и определения абсолютного количества TIM-3-позитивных клеток.
4- я пробирка: CD 3-PerCpCy 5/ CD 4-РЕ-Су7/ CD 8-FITC/ PD-1- РЕ/ Precision Count Beads - для определения количества PD-1 на поверхности клеток и определения абсолютного количества PD-1-позитивных клеток.
Порядок действий при окрашивании клеток:
1. Клетки с антителами инкубируют 60 минут в темноте при комнатной температуре.
2. Добавление 10-кратный объем лизирующего буфера RBC Lysis Buffer (10Х) (Biolegend).
3. Инкубация 15 минут в темноте при комнатной температуре
4. Центрифугирование в течение 10 минут при 1500 об/мин в 500 мкл PBS, содержащего 0,02% ЭДТА и 1% азида натрия.
5. Удаление жидкости
6. Центрифугирование в течение 10 минут при 1500 об/мин в 500 мкл PBS, содержащего 0,02% ЭДТА и 1% азида натрия.
7. 100 мкл PBS, содержащего 0,02% ЭДТА и 1% азида натрия во все пробирки для анализа
8. Добавление 100 мкл Precision Count Beads в пробирки №3 и №4.
9. Анализ образцов на проточном цитометре BD FACS Verse.
Исследование экспрессии TIM-3 и PD-1 проводилось при тех же параметрах вольтажа фотоэлектронного умножителя по РЕ-детектору, что и при проведении анализа калибровочных бус, что позволило конвертировать значения интенсивности флуоресценции в число РЕ молекул на клетку. Далее, число РЕ молекул на клетку переводилось в число молекул антител на клетку с помощью известного соотношения молекул РЕ на антитело, равное 1:1. Проверка настроек цитометра проводилась еженедельно с помощью Cytometer Setup and Tracking (CS&T) beads (BD Biosciences, США).
Анализ клеточных популяций проводили с помощью проточного цитофлюориметра «BD FACS Verse» и программного обеспечения «BD FACSuite». Для анализа данных использовали параметры относительного количества клеток или средней интенсивности флюоресценции. Результаты представлены в виде медианы и размаха квартилей, а для статистической обработки данных применялись критерии Манна-Уитни (при сравнении показателей здоровых доноров и больных РМЖ). Корреляции между исследуемыми параметрами устанавливались с использованием коэффициента корреляции Спирмана (при р≤0,05). Статистическая обработка данных производилась с использованием программного обеспечения Graph Pad Prism 6.
Для создания калибровочной кривой и перевода значений интенсивности флуоресценции клеток, экспрессирующих соответствующий маркер, в абсолютные показатели количества рецепторов, использовался набор BD QuantiBRITE РЕ («BD Biosciences», США), содержащий 4 фракции лиофилизированных бус, каждая из которых несет различный уровень фикоэритрина. Пробирка с бусами разводилась в 500 мкл PBS (137 MMNaCl, 2,68 mMKCl, 10 мМ Na2HPO4 Х12Н20, 1,47 мМ KH2PO4, 0,53 мМ EDTA и 0,1% №N3), перемешивалась в течение 1 минуты и анализировалась на проточном цитометре. На FSC-A/SSC-A дот-плоте выделяли популяцию бус и записывали 10,000 событий. Далее на гистограмме РЕ флуоресценции выставляли маркеры по четырем пикам калибровочных частиц (Low, Medium Low, Medium High, High). На рис. 1 представлен анализ калибровочных частиц Quanti BRITE РЕ на цитофлуориметре: область калибровочных частиц на дот-плоте FSC-A/SSC-A; калибровочные частицы на гистограмме РЕ флуоресценции (маркеры выставлены по четырем пикам калибровочных частиц - Low, Medium Low, Medium High, High) и показано количество и интенсивность флюоресценции частиц каждого размера.
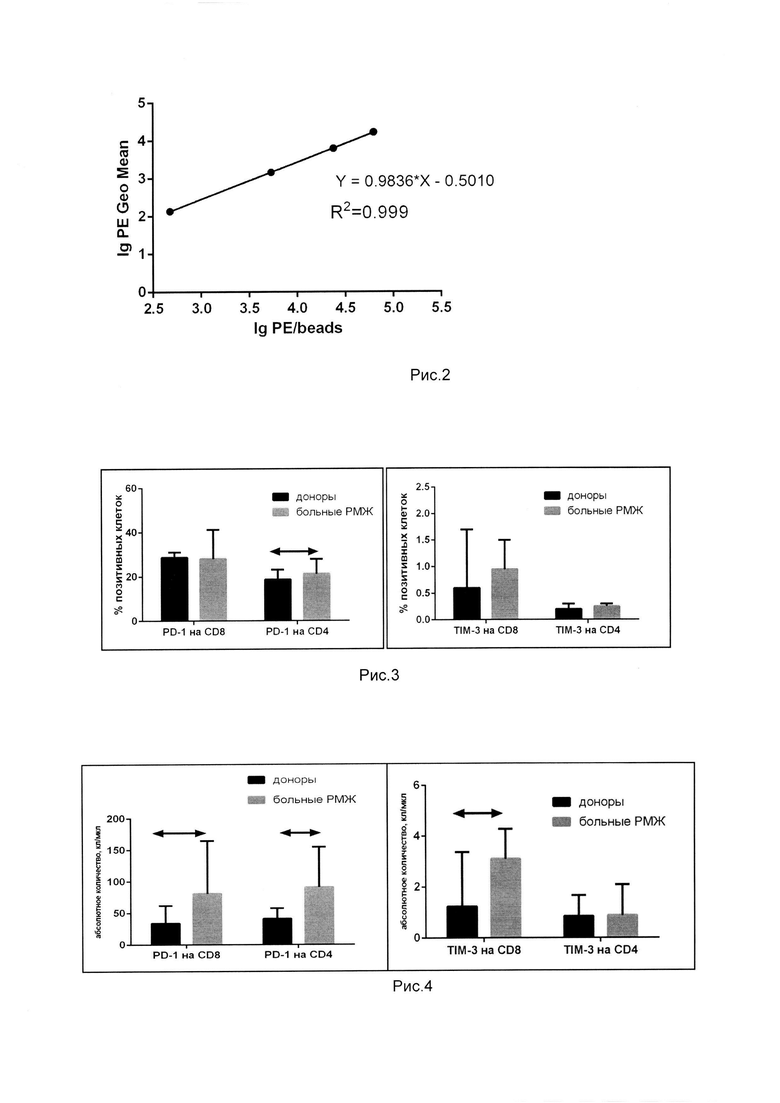
Значения PE/beads являются специфичными для каждого лота калибровочных частиц. Согласно инструкции фирмы-производителя, по результатам анализа калибровочных частиц был построен график линейной регрессии в виде у=mx+с, где y-Ig интенсивности флюоресценции, а х-Ig числа молекул фикоэритрина и с помощью построения линии тренда была установлена математическая линейная зависимость. На рис. 2 представлена калибровочная кривая BD QuantiBRITE РЕ. Зависимость логарифмических значений числа молекул РЕ от интенсивности флюоресценции.
Количество молекул РЕ определялось по формуле:
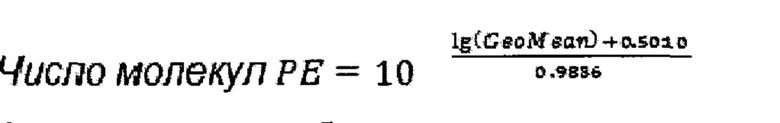
Определение абсолютного количества клеток проводилось по формуле, представленной производителем

Определение содержания PD-1- и TIM-3- позитивных клеток в периферической крови.
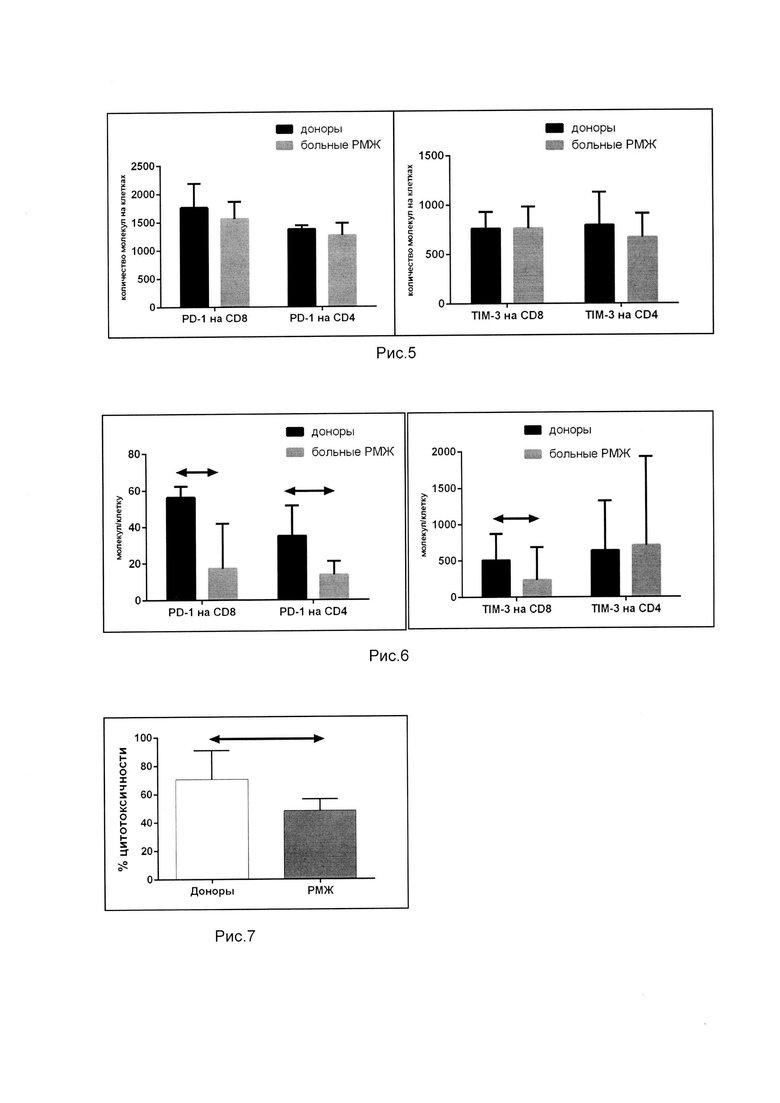
Для определения содержания PD-1- и TIM-3-позитивных клеток из популяции CD 3+ Т-лимфоцитов выделяли популяции CD 4+ и CD 8+ Т-лимфоцитов, в которых определяли относительное и абсолютное количество целевых клеток. Для содержания PD-1-позитивных клеток достоверные отличия получены для CD 4+ Т-лимфоцитов. На рис. 3 представлено относительное количество PD-1- и TIM-3-позитивных клеток у здоровых доноров (n=20) и больных РМЖ (n=20). Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены статистически значимые различия при р<0.05.
При определении абсолютного количества клеток показаны достоверные различия между абсолютным количеством PD-1-позитивных CD 4+ и CD 8+ Т-клеток у здоровых доноров и больных РМЖ. Для TIM-3 достоверные различия по абсолютному количеству клеток показаны для CD 8+ клеток. На рис. 4 показано абсолютное количество PD-1- и TIM-3-позитивных клеток у здоровых доноров (n=20) и больных РМЖ (n=20). Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены статистически значимые различия при р<0.05.
Определение количества молекул PD-1- и TIM-3- в периферической крови. При изучении количества молекул показано, что Т-лимфоциты как здоровых доноров, так и больных РМЖ несут приблизительно равное количество молекул, т.е. достоверных отличий по этим параметрам получено не было. На рис. 5 показано количество молекул PD-1- и TIM-3 на поверхности CD4+ и CD8+ Т-клеток у здоровых доноров (n=20) и больных РМЖ (n=20). Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены статистически значимые различия при р<0.05.
Поскольку нами были получены данные по достоверному отличию абсолютного количества целевых клеток, то для оценки распределения молекул PD-1- и TIM-3 на поверхности CD4+ и CD8+ Т-клеток мы вычислили параметр - количество молекул/клетку. Для PD-1- позитивных клеток оказалось, что количество молекул в пересчете на количество клеток у больных РМЖ достоверно ниже, чем у здоровых доноров, а для TIM-3 такая закономерность наблюдается только для TIM-3-позитивных CD8 Т-клеток. На рис. 6 показано количество PD-1- и TIM-3 молекул/клетку на поверхности CD4+ и CD8+ Т-клеток у здоровых доноров (n=20) и больных РМЖ (n=20). Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены статистически значимые различия при р<0.05.
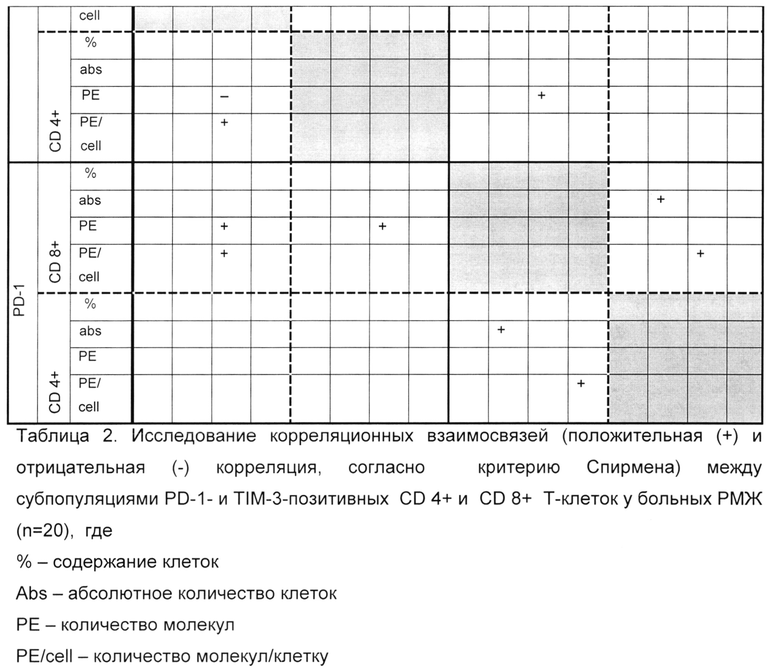
Для выяснения взаимного влияния исследуемых субпопуляций мы провели корреляционный анализ по каждому из исследуемых параметров. Для расчета корреляционных взаимосвязей использовался коэффициент Спирмена и коэффициент р. Наличие связи между величинами считалось достоверным при р<0,05, что соответствовало коэффициенту Спирмена от 0.4 до 1 (умеренная и высокая теснота связи).
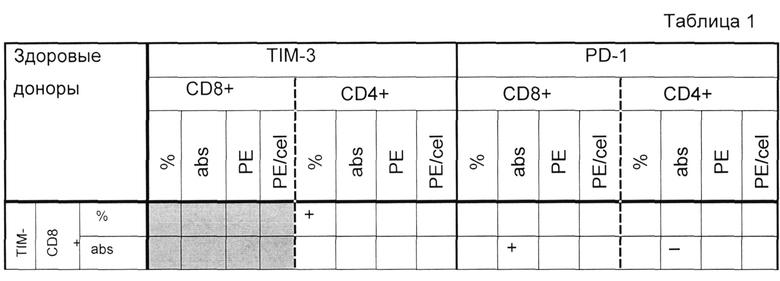
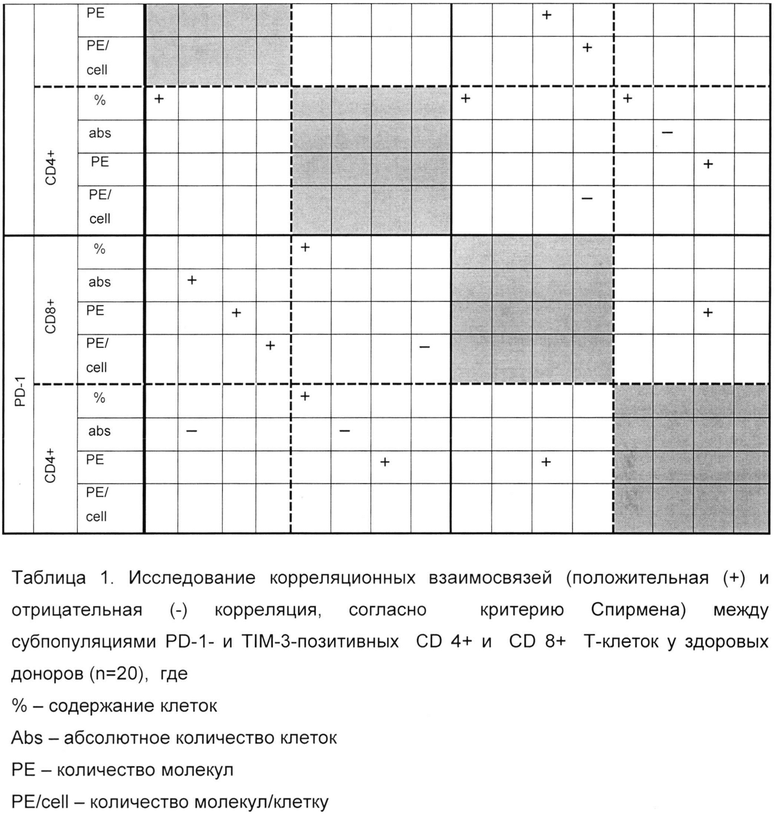
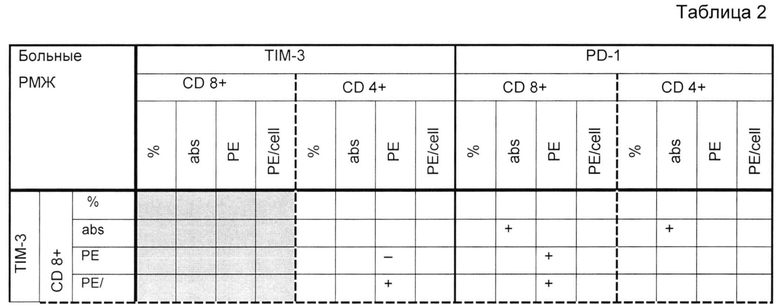
У здоровых донором максимальное количество корреляционных взаимосвязей определяется между PD-1-и TIM-3-позитивными CD4+ Т-клетками и PD-1-и TIM-3-позитивными CD8+ Т-клетками (таблица 1), также наблюдаются корреляционные взаимосвязи между показателями PD-1- и TIM-3 на разных субпопуляциях. У больных РМЖ отмечено меньшее количество корреляционных взаимосвязей (таблица 2).
Оценка цитотоксической активности против клеток линии аденокарциномы молочной железы ZR-75-1 проводилась колориметрическим методом, основанном на высвобождении фермента лактатдегидрогеназы. Показаны достоверные различия между цитотоксической активностью у здоровых доноров и больных РМЖ. На рис. 7 представлена цитотоксическая активность против клеток линии аденокарциномы молочной железы ZR-75-1 у здоровых доноров (n=20) и больных РМЖ (n=20). Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены статистически значимые различия при р<0.05.
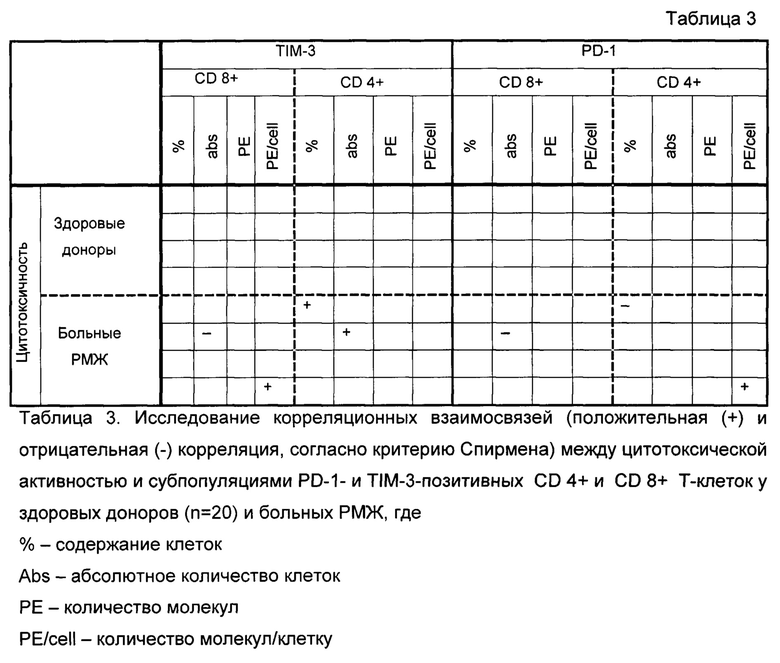
Для выяснения влияния исследуемых субпопуляций на цитотоксическую активность мы провели корреляционный анализ между цитотоксической активностью и параметрами PD-1- и TIM-3-субпопуляций (таблица 3). Показано отсутствие корреляционных связей между цитотоксической активностью и различными параметрами субпопуляций PD-1- и TIM-3-позитивных CD 4+ и CD 8+ Т-клеток. При этом у больных РМЖ цитотоксическая активность коррелирует с относительным количеством PD-1- и TIM-3-позитивных CD 4+и CD 8+ Т-клеток, абсолютным количеством TIM-3-позитивных CD 4+ и CD 8+ Т-клеток, PD-1-позитивных CD 8+ Т-клеток, и количеством молекул на клетку для TIM-3-позитивных CD 8+ Т-клеток и PD-1-позитивных CD 4+ Т-клеток.
Таким образом, показано, что у пациентов, больных раком молочной железы наблюдаются достоверные различия по абсолютному количеству клеток, несущих иммунорегуляторные молекулы PD-1- и TIM-3 и по распределению этих молекул на поверхности клеток, а именно наблюдается повышенное количество клеток с меньшим числом молекул. У больных РМЖ отмечается снижение цитотоксической активности против опухолевых клеток, что коррелирует с количеством PD-1- и TIM-3-позитивных клеток и распределением этих молекул на поверхности клеток. Выявленные закономерности повышают достоверность определения степени иммуносупрессии у онкологических пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики аллергической бронхиальной астмы | 2021 |
|
RU2780687C1 |
| Способ ранней диагностики ревматоидного артрита | 2019 |
|
RU2735738C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК, ОБЛАДАЮЩИХ АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2596920C2 |
| СПОСОБ УЛУЧШЕНИЯ ФУНКЦИИ ИММУННЫХ КЛЕТОК И ОЦЕНКИ МУЛЬТИФУНКЦИОНАЛЬНОСТИ ИММУННЫХ КЛЕТОК | 2015 |
|
RU2731098C2 |
| Способ получения in vitro популяций активированных антигенспецифических противоопухолевых цитотоксических Т-лимфоцитов, специфичных к эпитопам опухоль-ассоциированного антигена | 2016 |
|
RU2619186C1 |
| СПОСОБЫ ИММУНОТЕРАПИИ | 2017 |
|
RU2756276C2 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| Способ терапии метастатического рака с использованием вируса Сендай | 2017 |
|
RU2662916C1 |
| Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток | 2016 |
|
RU2645464C1 |

Изобретение относится к области медицины и предназначено для определения качественных параметров иммуносупрессивных клеток пациентов с раком молочной железы. Осуществляют забор периферической крови пациента. Делят образец периферической крови на две части: для определения фенотипических характеристик и количества рецепторов на поверхности клеток и для тестирования цитотоксической активности. Осуществляют мечение лейкоцитов периферической крови моноклональными антителами к поверхностным рецепторам CD4, CD8, TIM-3, PD-1. В случае увеличенного высвобождения внутриклеточного фермента лактатдегидрогеназы определяют противоопухолевую активность лейкоцитов. Сниженную цитотоксическую активность определяют по увеличению относительного количества PD-1 и TIM-3-позитивных CD4+ и CD8+ Т-клеток, абсолютного количества TIM-3 позитивных CD4+ и CD8+ Т-клеток, увеличению PD-1- позитивных и CD8+ Т-клеток и по увеличению количества молекул на клетку для TIM-3-позитивных CD8+ Т-клеток и PD-1-позитивных CD4+ Т-клеток по сравнению с клетками без окрашивания моноклональными антителами. Изобретение обеспечивает повышение достоверности определения степени иммуносупрессии у онкологических пациентов. 1 з.п. ф-лы, 7 ил., 3 табл.
1. Способ определения качественных параметров иммуносупрессивных клеток пациентов с раком молочной железы, включающий забор периферической крови пациента, деление образца периферической крови на две части: для определения фенотипических характеристик и количества рецепторов на поверхности клеток и для тестирования цитотоксической активности, мечение лейкоцитов периферической крови моноклональными антителами к поверхностным рецепторам CD4, CD8, TIM-3, PD-1, определение относительного и абсолютного количества клеток, несущих рецепторы TIM-3- и PD-1 в популяциях CD8 Т-клеток, определение противоопухолевой активности лейкоцитов, несущих рецепторы TIM-3-и PD-1, в котором мечение лейкоцитов первой части периферической крови включает дополнительное мечение лейкоцитов CD4 моноклональными антителами, определение абсолютного количества рецепторов TIM-3 и PD-1 на поверхности CD4 и CD8 Т-клеток, определение количества рецепторов на клетку, определение противоопухолевой активности лейкоцитов, выделенных из второй части периферической крови, по высвобождению внутриклеточного фермента лактатдегидрогеназы из погибших опухолевых клеток, и в случае увеличенного высвобождения внутриклеточного фермента лактатдегидрогеназы определяют противоопухолевую активность лейкоцитов, а сниженную цитотоксическую активность определяют по увеличению относительного количества PD-1 и TIM-3-позитивных CD4+ и CD8+ Т-клеток, абсолютного количества TIM-3 позитивных CD4+ и CD8+ Т-клеток, увеличению PD-1- позитивных и CD8+ Т-клеток и по увеличению количества молекул на клетку для TIM-3-позитивных CD8+ Т-клеток и PD-1-позитивных CD4+ Т-клеток по сравнению с клетками без окрашивания моноклональными антителами.
2. Способ по п. 1, отличающийся тем, что абсолютное количество рецепторов TIM-3- и PD-1 на поверхности CD4 и CD8 Т-клеток определяют с помощью калибровочных частиц.
| ЕР 3628322 A1, 01.04.2020 | |||
| Патологоанатомическая диагностика опухолей человека / Под ред | |||
| Н | |||
| А | |||
| Краевского, А | |||
| В | |||
| Смольянникова, Д | |||
| С | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| и перераб | |||
| - М.: Медицина, 1993 | |||
| СКЛАДНАЯ НИВЕЛЛИРОВОЧНАЯ РЕЙКА | 1923 |
|
SU560A1 |
| SAKUISHI K | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| J Exp Med | |||
Авторы
Даты
2021-08-11—Публикация
2020-10-12—Подача