Изобретение относится к области медицины, биологии, молекулярной иммунологии и может быть использовано в качестве метода обследования при диагностике аллергической бронхиальной астмы (далее - БА).
Существуют несколько фенотипов бронхиальной астмы, наиболее распространенные из которых, аллергическая и неаллергическая, различающиеся типом воспаления дыхательных путей и основным классом иммунокомпетентных клеток, принимающих участие в развитии данного заболевания (Global strategy for asthma management and prevention: GINA executive summary. E.D. Bateman, S.S. Hurd, P.J. Barnes, J. Bousquet, J.M. Drazen, J.M. FitzGerald, P. Gibson, K. Ohta, P. O'Byrne, S.E. Pedersen, E. Pizzichini, S.D. Sullivan, S.E. Wenzel and H.J. Zar. Eur Respir J 2008; 31: 143-178. Eur Respir J. 2018 Jan 31;51(2):0751387. doi: 10.1183/13993003.51387-2007). Аллергическая БА характеризуется эозинофильным воспалением дыхательных путей и, обычно, хорошим ответом на терапию ингаляционными глюкокортикостероидами (ИГКС)
Причины развития БА неизвестны, однако существуют предрасполагающие факторы, среди которых определенную роль играет генетика. Существуют данные, что генетическая предрасположенность к астме составляет от 35% до 95%. Крупные исследования выявили сотни генетических вариантов, связанных с повышенным риском развития астмы. Другим, не менее важным фактором являются респираторные инфекции, особенно вирусные на ранних этапах жизни, повышающие риск развития астмы, особенно при тяжелом течении, воздействие окружающей среды включая табачный дым, загрязняющие вещества и озон. Атопические состояния и повышенная чувствительность к ингаляционным аллергенам также связаны с развивающейся астмой. Существуют и другие факторы, играющие роль в развитии бронхиальной астмы, такие как: влияние микробиома, витамина D, химические воздействия, изменения в питании, стресс и метаболиты (ChuchalinA.G., KhaltaevN., Antonov N. Chronic respiratory diseases and risk factorsin 12 regions of the Russian Federation // International Journal of COPD 2014:9 963-974).
Состояние иммунной системы и системы цитокинов, в частности, имеет большое значение в развитии бронхиальной астмы, поэтому перспективным является изучение механизмов регуляции цитокинов, что может способствовать пониманию патогенетических механизмов течения данного заболевания и иметь перспективы для новых подходов в терапии.
Известен способ диагностики БА, основанный на определении количества теофиллинрезистентных лимфоцитов, соотношения количества теофиллинрезистентных лимфоцитов к количеству теофиллинчувствительных лимфоцитов в нагрузочном тесте с теофиллином. При данном способе определяют концентрации сывороточных иммуноглобулинов классов М, А и G в реакции радиальной иммунодиффузии по Манчини. После чего вычисляют индекс аллергического воспаления по формуле И=(0,06 ⋅ ТФР+10 ⋅ ИРИ) / (IgG+4 ⋅ IgA+10 ⋅ IgM)2, где И - индекс аллергического воспаления; 0,06, 10, 4, 10 - показатели, нормирующие величины учитываемых признаков; IgG, IgA, IgM - концентрации сывороточных иммуноглобулинов классов G, А, М (г/л); ТФР - абсолютное значение величины теофиллинрезистентных лимфоцитов в 1 мкл венозной крови; ИРИ -соотношение количества теофиллинрезистентных лимфоцитов к количеству теофиллинчувствительных лимфоцитов. При наличии соответствующей клинической картины повторяющихся приступов бронхиальной астмы и превышении индекса аллергического воспаления порогового значения диагностируют тяжелую бронхиальную астму. При этом пороговое значение для атопической бронхиальной астмы устанавливают на уровне 0,130. Для инфекционно-зависимой бронхиальной астмы пороговое значение устанавливают на уровне 0,80. При затруднении дифференциальной диагностики атопической и инфекционно-зависимой бронхиальной астмы пороговое значение устанавливают на уровне 0,10. (RU2120635, G01N 33/53, 1998)
Недостатком данного способа является его неточность, поскольку теофиллинчувствительные лимфоциты могут изменяться и при других патологиях, например при стрессе, а также помимо этих клеток в патогенезе БА участвуют и другие субпопуляции.
Известен способ диагностики бронхиальной астмы, который заключается в том, что проводится обследование легких, других органов дыхания и органов, влияющих на функцию органов дыхания, определяются анатомические размеры каждого органа, а патологические изменения определяются в соответствии с отклонением от номинального размера (UA95699, А61В 9/00, 2011).
Недостатком данного метода является его недостоверность, т.к. размеры легких могут изменяться при многих других заболеваниях.
Известен способ диагностики бронхиальной астмы, основанный на определении уровня экспрессии growth arrest-specific transcript 5 (GAS5). Имеет ли испытуемый тяжелую астму, можно определить по уровню экспрессии GAS5 до и после применения глюкокортикоидных препаратов (CN110205382A, C12Q 1/68, 2019).
Недостатком данного метода является его трудоемкость и необходимость наличия специализированного оборудования, расходных материалов и обученного персонала.
Существует способ диагностики БА, заключающийся в оценке значения резонансной частоты (Fr) методом импульсной осциллометрии. При значении резонансной частоты 15 Гц и более диагностируют бронхиальную астму. Способ позволяет провести раннюю диагностику бронхиальной астмы у лиц старше 18 лет, своевременно провести соответствующую терапию за счет оценки значения резонансной частоты по данным импульсной осциллометрии (RU2646576, А61В 5/00, 2018).
Данный метод также является недостоверным, поскольку резонансная частота может изменяться при других заболеваниях.
Известен способ диагностики бронхиальной астмы, основанный на определения уровня экспрессии гена ENSG00000258698 в образце с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией (RT-PCR), количественной ПЦР в реальном времени, гибридизации in situ, чипа или высокопроизводительной платформы для секвенирования. Он применяется как молекулярный маркер для диагностики тяжелой астмы (CN109439744, А61К 45/00, 2019).
Данный метод сложен и требует наличия специализированного оборудования и подготовленного персонала.
Известен способ скрининговой диагностики хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астмы. Способ включает регистрацию выдыхаемого воздуха пациента и его анализ, для чего проводят регистрацию и анализ спектра поглощения выдыхаемого воздуха пациента, причем предварительно проводят измерения спектра поглощения выдыхаемого воздуха верифицированных групп пациентов с бронхолегочными заболеваниями, представляющими диагностический интерес, вычисляют средние значения квадрата расстояний Махаланобиса от спектра поглощения выдыхаемого воздуха каждого члена группы до спектров поглощения выдыхаемого воздуха остальных членов группы. Затем находят среднее значение от указанных средних значений и доверительный интервал. При значении в интервале от 1,28 до 2,29 диагностируют ХОБЛ, а при значении более 2,29 диагностируют бронхиальную астму (RU 2578445 C1, G01N 33/497, 2016).
Данный способ имеет недостаток, заключающийся в необходимости предварительного проведения измерения спектра поглощения выдыхаемого воздуха верифицированных групп пациентов, а также, спектр выдыхаемого воздуха может изменяться при голодании и сопутствующей патологии, что может влиять на достоверность полученных результатов.
Все вышеперечисленные способы имеют определенные недостатки и не могут с большой долей вероятности диагностировать БА. Поэтому перспективным является поиск и совершенствование методов диагностики данного заболевания.
Одним из перспективных методов может являться иммунодиагностика, основанная на оценке плотности экспрессии рецепторов к цитокинам, в частности к TNF-α. Возможность того, что TNF-α вносит вклад в нарушение регуляции воспалительного ответа, наблюдаемого у пациентов с бронхиальной астмой, подтверждается данными о повышении мРНК TNF-α и самого цитокина в дыхательных путях и периферической крови. Кроме того, вдыхание рекомбинантного TNF-α нормальными субъектами приводило к развитию гиперчувствительности и нейтрофилии дыхательных путей. Введение TNF-α пациентам с астмой также приводит к увеличению гиперреактивности дыхательных путей. (Hurrell BP, Galle-Treger L, Jahani PS, Howard E, Helou DG, Banie H, Soroosh P, Akbari O. TNFR2 Signaling Enhances ILC2 Survival, Function, and Induction of Airway Hyperreactivity. CellRep.2019 Dec 24;29(13):4509-4524.e5. doi: 10.1016/j.celrep.2019.11.102.). Механизм этих явлений полностью не выяснен. Предполагается, что высвобождение медиаторов из тучных клеток, локализованных в гладких мышцах дыхательных путей, играет важную роль в патогенезе гиперреактивности дыхательных путей и бронхоконстрикции при астме. TNF-α непосредственно вызывает высвобождение гистамина из тучных клеток человека и участвует в аутокринной регуляции, которая усиливает секрецию цитокинов тучных клеток человека. TNF-α имеет несколько других действий, которые могут иметь отношение к астме: он является хемоатрактантом для нейтрофилов и эозинофилов; усиливает цитотоксическое действие эозинофилов на эндотелиальные клетки; а также участвует в активации и высвобождении цитокинов Т-клетками; и это увеличивает эпителиальную экспрессию молекул адгезии, таких как молекула межклеточной адгезии-1 и молекула адгезии сосудистых клеток-1, которые играют важную роль в миграции Т-клеток в легкие и в последующем развитии гиперчувствительности дыхательных путей (Athari, S.S. Targeting cell signaling in allergic asthma. Sig Transduct Target Ther 4, 45 (2019). Кроме того, TNF-α обладает рядом свойств, которые могут иметь отношение к рефрактерной астме, включая рекрутирование нейтрофилов, индукцию устойчивости к глюкокортикоидам, пролиферацию миоцитов и стимуляцию роста и созревания фибробластов в миофибробласты путем стимулирования TGF-α (Brightling С, Berry М, Amrani Y. Targeting TNF-alpha: a novel therapeutic approach for asthma. J Allergy Clin Immunol. 2008;121(1):5-12. doi: 10.1016/j.jaci.2007.10.028).
Таким образом, TNF-α, воздействуя на различные субпопуляции иммунокомпетентных клеток, участвует во многих патогенетических механизмах развития бронхиальной астмы, что повышает необходимость изучения роли данного цитокина и его регуляции. Поскольку TNF-α реализует свое действие через два типа мембраносвязанных рецепторов (Aggarwal ВВ. Signalling pathways of the TNF superfamily: a double-edged sword. Nat Rev Immunol. 2003 Sep;3(9):745-56. doi: 10.1038/nri1184. PMID: 12949498.), а характер и тип реагирования иммунокомпетентных клеток зависит от различных параметров экспрессии рецепторов к цитокину. Поэтому перспективным является оценка профиля экспрессии рецепторов TNF-α на различных субпопуляциях клеток в норме и при БА. В настоящее время представлены данные о том, что функциональный ответ клеток на медиатор может меняться, и, при достижении определенного уровня экспрессии рецепторов, цитокины могут оказывать на клетки принципиально различные эффекты (S. Вооу, С.Н. van Eijck, F. Dogan, P.M. van Koetsveld, L.J. Hofland, Influence of type-l Interferon receptor expression level on the response to type-I Interferons in human pancreatic cancer cells, J. Cell. Mol. Med. 18 (3) (2014) 492-502.). Показатели экспрессии рецепторов лежат в основе математического моделирования и могут способствовать поиску и разработке диагностических тестов у пациентов с бронхиальной астмой и прогнозирования ответа на терапию.
Задачей изобретения является создание способа диагностики аллергической БА путем оценки среднего кол-ва рецепторов и процента клеток, экспрессирующих рецепторы 1-го и 2-го типа к TNF-α на субпопуляциях мононуклеарных клеток у пациентов с подозрением на БА.
Поставленная задача решается в способе диагностики аллергической БА тем, что в пробы крови добавляют моноклональные антитела к TNFRI, TNFR2, CD19, CD5, CD4, CD8, CD45RA, производят анализ мононуклеарных клеток периферической крови методом проточной цитометрии, выделяют гейтированием CD19+CD5+ В-лимфоциты, наивные цитотоксические клетки CD8+CD45RA+, Т-хелперные клетки CD4+, определяют показатели экспрессии рецепторов TNFR1 и TNFR2 путем подсчета количества рецепторов на клетках изучаемых субпопуляций, определяют процент клеток, несущих рецепторы TNFRI и TNFR2 в каждой выделенной субпопуляции, после чего рассчитывают на основе параметрической логистической регрессионной модели показатель наличия аллергической бронхиальной астмы по формуле:
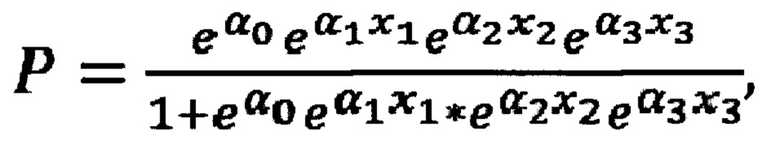
где
е=2,7182818- математическая константа - основание натурального логарифма,
α0 = 12,455816360508 - коэффициент,
α1 = - 0,427698308974449 - коэффициент,
α2 = - 0,006454484262661 - коэффициент,
α3 = - 0,005092094923 - коэффициент,
х1 = процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов
х2 = среднее количество рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах
х3 = среднее кол-во рецепторов 1-го типа на TNFRI-позитивных CD4+ Т-хелперных клетках, при этом если Р более или равно 0,5, то диагностируют наличие аллергической бронхиальной астмы.
Изобретение, на наш взгляд, является новым и соответствует критерию изобретательский уровень.
Предложенный способ основан на следующем. При описанных выше исследованиях, сначала в пробы крови здоровых доноров добавлялись моноклональные антитела к TNFRI, TNFR2, CD19, CD5, CD4, CD8, CD45RA. Далее исследовался уровень экспрессии и ко-экспрессии TNFRI и TNFR2 на субпопуляциях иммунных клеток пациентов с аллергической бронхиальной астмой. Основные субпопуляции Т клеток варьируют по сочетанной экспрессии рецепторов TNFR1 и TNFR2, что может приводить к различному уровню и типу ответа клеток на цитокин TNFα. Таким образом, были установлены все изучаемые показатели у здоровых доноров и пациентов с аллергической бронхиальной астмой.
При создании данного способа брали пробы крови у пациентов заведомо больных аллергической БА, и были выявлены достоверные отличия заведомо больных БА от здоровых доноров по показателям:
- процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов;
- среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах;
- среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках.
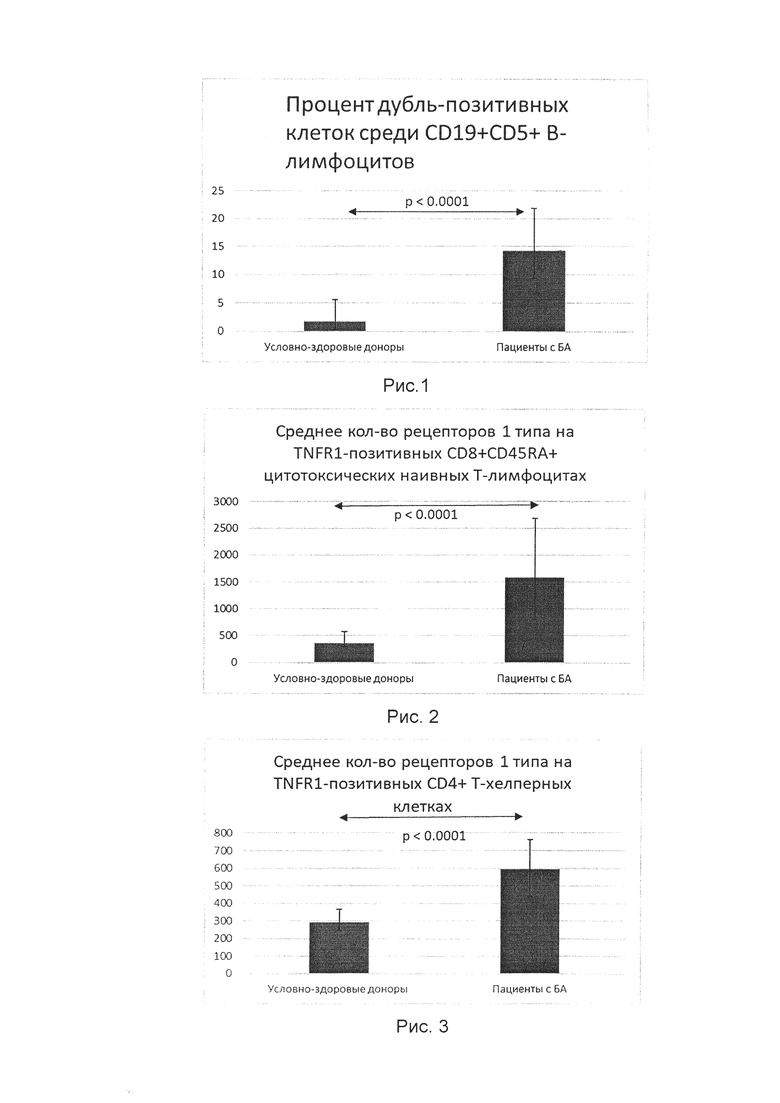
Сравнение экспрессии TNFR1 и TNFR2 больных аллергической БА и здоровых доноров показано на рисунках 1-3. Данные представлены в виде медиан с интерквартильным размахом.
На рис. 1 показан процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов.
На рис. 2 показано среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах.
На рис. 3 показано среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках.
Исследованные показатели были использованы для построения диагностической формулы с использованием однофакторного и многофакторного логистического регрессионного анализа с постепенной редукцией незначимых показателей.
Способ осуществляется следующим образом.
1. Подготовка образцов периферической крови
1.1. Осуществление забора крови производят натощак из локтевой вены в стерильных условиях по 9 мл в вакуумные пробирки с антикоагулянтом. Выполнение общего анализа крови, с подсчетом общего количество лейкоцитов.
1.2. Аликвотирование необходимого объема крови, содержащего 1 млн лейкоцитов, в две цитометрические пробирки.
2. Пробоподготовка образцов:
2.1. Внесение моноклональных антител:
Пробирка 1. Для определения CD19+CD5+ В-лимфоцитов вносятся anti-human CD19 (Ре/Су7 (фикоэритрин-цианин 7), CD5 (аллоцианин-цианин 7), anti-human TNFRI-PE (фикоэритрин), anti-human ТNFRII-РЕ(фикоэритрин), anti-human TNFRI-АРС (Аллофикоцианин), anti-human TNFRII-APC (Аллофикоцианин) (R&D Systems, Minneapolis, MN), в объеме, указанном производителем для окраски 1 млн. кл.
Пробирка 2. Для определения CD4+Т-хелперных клеток и CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах anti-human CD4PerCP-Cy 5.5 (перидинин хлорофилл протеин - цианин 5.5), anti-human CD8APC/Cy7 (Аллофикоцианин-цианин 7), anti-human CD45RA PacificBlue (тихоокеанский синий), anti-human TNFRI-PE (фикоэритрин), anti-human TNFRII-PE (фикоэритрин), anti-human TNFRI-АРС (Аллофикоцианин), anti-human TNFRII-APC (Аллофикоцианин) (R&D Systems, Minneapolis, MN), в объеме, указанном производителем для окраски 1 млн. кл.
2.2. В каждую пробирку внесение десятикратно разведенного в PBS (натрий -фосфатный буфер) лизирующего буфера BDFACSLysingSolution (кат. номер 349202; BD, США) согласно инструкции производителя в десятикратном объеме по отношению к объему пробы. Инкубация в течении 15 минут при комнатной температуре.
2.3. Центрифугирование при 1500 об/мин, 10 минут.
2.4. Удаление надосадочной жидкости, внесение 100 мкл. PBS.
3. Анализ на проточном цитофлуориметре
3.1. Настройка переднего и бокового светорассеивания на пробе №1.
3.2. Настройка вольтажа лазеров и чувствительности ФЭУ (фотоумножительное устройство) всех каналов с использованием контрольных проб №2, 6, 10, 14.
3.3 Гейтирование
CD19+CD5+ В-лимфоцитов гейтировались как CD19+ и CD 5+ клетки из общего пула лимфоцитарных клеток по показателям FSC на SSC (прямого и бокового светорассеивания).
Наивные цитотоксические Т-клетки CD8+CD45RA+, гейтировались как CD8+ и CD45RA+ из общего пула лимфоцитарных клеток по показателям FSC на SSC.
CD4+ Т-лимфоциты гейтировались как CD4+ клетки из общего пула лимфоцитарных клеток по показателям FSC на SSC.
4. Определение процента клеток, несущих рецепторы TNFR1 и TNFR2,
Определение процента клеток, несущих рецепторы TNFR1 и TNFR2 осуществляется при помощи программного обеспечения BDFACSDiva™ Software | BDBiosciences-US.
В результате получаем данные по проценту клеток, несущих как TNFR1, тaк и TNFR2 для субпопуляции CD19+CD5+ В-лимфоцитов.
5. Определение показателей экспрессии рецепторов TNFR1 и TNFR2 осуществляется путем проведения анализа частиц BD QuantiBRITE РЕ (фикоэритрина) (BD, кат. номер 340495) для перевода значений интенсивности флуоресценции по каналу РЕ в число молекул РЕ. В результате мы получаем данные по количеству TNFR1 на СD4+Т-лимфоцитах и TNFR1 на наивных цитотоксических Т-клетках CD8+CD45RA+.
6. Расчет на основе параметрической логистической регрессионной модели наличия аллергической БА по формуле:
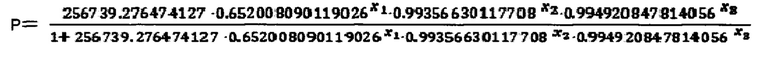
где,
х1 = процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов
х2 = среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах
х3 = среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках.
Если Р более или равно 0,5, то диагностируется аллергическая бронхиальная астма.
Предложенный способ демонстрируется конкретными примерами.
Пример 1. Пациент С., женщина 54 лет, обратилась в клинику с жалобами на периодически возникающее чувство заложенности в груди и кашель, беспокоящий в течение последних 30 дней. Объективно: состояние удовлетворительное, сознание ясное, конституциональный тип - нормостенический, кожные покровы обычной окраски. Периферические лимфоузлы не увеличены, отеков нет. ЧДД 16 в мин, ЧСС 76 в мин, АД 127/74 мм рт.ст. Изменения со стороны дыхательной системы при физикальном обследовании отсутствуют. Показатели спирометрии в норме, бронходилатационный тест отрицательный.
При лабораторно-инструментальном исследовании: гемоглобин 127 г/л, лейкоциты 7,8×103.
При проведении анализа мононуклеарных клеток периферической крови методом проточной цитометрии, были выявлены следующие показатели:
Процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов 13,8 Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах 439
Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках 881.
Используем формулу
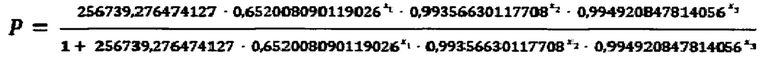
Где X1=13,8
Х2=439
Х3=881
Подставляем данные в формулу:

Р=0,9436
в результате Р=0,9436, что является больше 0,5, следовательно, диагностируется наличие аллергической бронхиальной астмы.
Диагноз аллергической бронхиальной астмы установлен в 2021 году и подтвержден анамнестически, клинически и инструментальными методами: Индекс Тиффно 73% и положительный бронходилятационный тест.
Пример 2. Пациент Т., мужчина 57 года обратился в клинику с жалобами на периодически возникающий кашель, беспокоящий преимущественно в холодное время года. Объективно: состояние удовлетворительное, сознание ясное, конституциональный тип - гиперстенический, кожные покровы обычной окраски. Периферические лимфоузлы не увеличены, отеков нет. Со стороны органов дыхания и пищеварения, а также сердечно-сосудистой системы патологии не выявлено. ЧДД 18 в мин, ЧСС 76 в мин, АД 120/80 мм рт.ст. При лабораторно-инструментальном исследовании: гемоглобин 142 г/л, лейкоциты 6,4×103,
СОЭ 4 мм/ч. Показатели спирометрии в норме, бронходилатационный тест отрицательный.
При проведении анализа мононуклеарных клеток периферической крови методом проточной цитометрии, были выявлены следующие показатели: Процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов 9,8 Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах 776
Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках 661.
Используем формулу
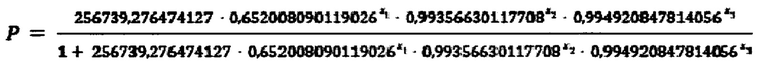
где X1=9,8
Х2=766
Х3=661
Подставляем данные в формулу:

Р=0,8824
в результате Р=0,8824, что является больше 0,5, следовательно, диагностируется наличие аллергической бронхиальной астмы.
Диагноз аллергической бронхиальной астмы установлен в 2021 году и подтвержден анамнестически, клинически и инструментальными методами: Индекс Тиффно 70% и положительный бронходилятационный тест.
Пример 3. Пациент М., женщина 53 года обратился в клинику с жалобами на периодически возникающие приступы удушья, кашель. Объективно: состояние удовлетворительное, сознание ясное, конституциональный тип гиперстенический, кожные покровы обычной окраски. Периферические лимфоузлы не увеличены, отеков нет. Со стороны органов дыхания и пищеварения, а также сердечно-сосудистой системы патологии не выявлено. ЧДД 18 в мин, ЧСС 66 в мин, АД 140/80 мм рт.ст.
При лабораторно-инструментальном исследовании: гемоглобин 124 г/л, лейкоциты 7,7 Х103.
СОЭ 6 мм/ч. Показатели спирометрии в норме, бронходилатационный тест отрицательный.
При проведении анализа мононуклеарных клеток периферической крови методом проточной цитометрии, были выявлены следующие показатели:
Процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов 3,6 Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах 1566
Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках. 1816
Используем формулу
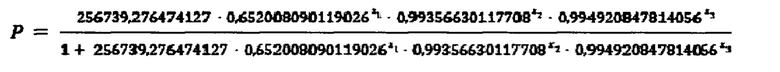
где X1=3,6
Х2=1566
Х3=1816
Подставляем данные в формулу:
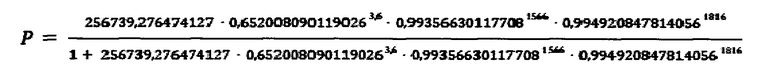
Р=0,0544
в результате Р=0,0544, что является меньше 0,5, следовательно, наличия аллергической бронхиальной астмы нет.
Диагноз аллергической бронхиальной астмы в 2021 году не подтвержден после проведения спирометрии и бронходилатационного теста. Поставлен диагноз: хронический обструктивный бронхит.
Пример 4. Пациент С., мужчина 46 лет обратился в клинику с жалобами на кашель со скудной мокротой, сохраняющийся в течение 2 недель после перенесенного острого обструктивного бронхита. Объективно: состояние удовлетворительное, сознание ясное, конституциональный тип - нормостенический, кожные покровы обычной окраски. Периферические лимфоузлы не увеличены, отеков нет. Со стороны органов дыхания и пищеварения, а также сердечно-сосудистой системы патологии не выявлено. ЧДД 16 в мин, ЧСС 60 в мин, АД 110/70 мм рт.ст. При лабораторно-инструментальном исследовании: гемоглобин 130 г/л, лейкоциты 6,7×103,
СОЭ 2 мм/ч. Показатели спирометрии в норме, бронходилатационный тест отрицательный.
При проведении анализа мононуклеарных клеток периферической крови методом проточной цитометрии, были выявлены следующие показатели:
Процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов 2,7 Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+цитотоксических наивных Т-лимфоцитах 1682.
Среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+Т-хелперных клетках 1288. Используем формулу
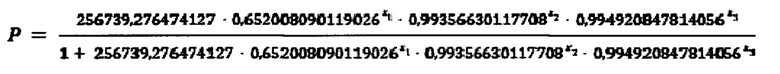
Где X1=2,7
Х2=1682
Х3=1288
Подставляем данные в формулу:

Р=0,0669
в результате Р=0,0669, что является меньше 0,5, следовательно, наличия аллергической бронхиальной нет.
Диагноз аллергической бронхиальной астмы в 2021 году не подтвержден после проведения спирометрии и бронходилатационного теста. Поставлен диагноз: хронический обструктивный бронхит.
Таким образом, предлагаемое изобретение позволяет различать показатели здоровых доноров и больных БА. Формула включает в себя процент клеток, несущих одновременно TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов, среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах, среднее кол-во рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках и позволяет диагностировать аллергическую бронхиальную астму.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ранней диагностики ревматоидного артрита | 2019 |
|
RU2735738C1 |
| Способ оценки вероятности развития и прогрессирования у школьников бронхиальной астмы, связанной с сочетанным комплексным воздействием таких факторов окружающей среды, как никель, марганец, цинк, формальдегид, бензол во вдыхаемом воздухе, а также с наличием негативных факторов образовательной среды, образа жизни и с нарушением структуры питания | 2023 |
|
RU2805820C1 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2012 |
|
RU2688185C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2013 |
|
RU2700765C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2015 |
|
RU2752275C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТВЕТА НА ПРОТИВООПУХОЛЕВУЮ ТЕРАПИЮ У БОЛЬНЫХ ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ | 2023 |
|
RU2814269C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ПРОЯВЛЯЮЩИХ ФЕНОТИПИЧЕСКУЮ ПЛАСТИЧНОСТЬ | 2010 |
|
RU2536941C2 |
| Способ дифференциальной диагностики фенотипов бронхиальной астмы | 2023 |
|
RU2807381C1 |
| Способ определения и оценки местного иммунитета у больных псориазом | 2022 |
|
RU2804243C1 |
| СПОСОБ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ | 2017 |
|
RU2652752C1 |
Изобретение относится к медицине, а именно к молекулярной иммунологии и аллергологии, и может быть использовано для диагностики аллергической бронхиальной астмы. В пробы крови добавляют моноклональные антитела к TNFRI, TNFR2, CD19, CD5, CD4, CD8, CD45RA. Производят анализ мононуклеарных клеток периферической крови методом проточной цитометрии. Выделяют гейтированием CD19+CD5+ В-лимфоциты, наивные цитотоксические клетки CD8+CD45RA+, Т-хелперные клетки CD4+. Определяют показатели экспрессии рецепторов TNFR1 и TNFR2 путем подсчета количества рецепторов на клетках изучаемых субпопуляций. Определяют процент клеток, несущих рецепторы TNFRI и TNFR2 в каждой выделенной субпопуляции. Рассчитывают на основе параметрической логистической регрессионной модели вероятность наличия аллергической бронхиальной астмы по формуле:
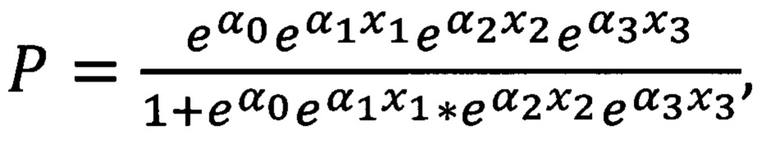 где
где
е=2,7182818 - математическая константа - основание натурального логарифма, α0 = 12,455816360508 - коэффициент, α1 = -0,427698308974449 - коэффициент, α2 = -0,006454484262661- коэффициент, α3 = -0,005092094923 - коэффициент, х1 = процент клеток, несущих одновременно рецепторы TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов, х2 = среднее количество рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах, х3 = среднее количество рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках. Если Р более или равно 0,5, то диагностируют наличие аллергической бронхиальной астмы. Способ обеспечивает возможность диагностики аллергической бронхиальной астмы за счет оценки среднего количества рецепторов и процента клеток, экспрессирующих рецепторы 1-го и 2-го типа к TNF-α на субпопуляциях мононуклеарных клеток у пациентов с подозрением на бронхиальную астму. 3 ил., 4 пр.
Способ диагностики аллергической бронхиальной астмы, заключающийся в том, что в пробы крови добавляют моноклональные антитела к TNFRI, TNFR2, CD19, CD5, CD4, CD8, CD45RA, производят анализ мононуклеарных клеток периферической крови методом проточной цитометрии, выделяют гейтированием CD19+CD5+ В-лимфоциты, наивные цитотоксические клетки CD8+CD45RA+, Т-хелперные клетки CD4+, определяют показатели экспрессии рецепторов TNFR1 и TNFR2 путем подсчета количества рецепторов на клетках изучаемых субпопуляций, определяют процент клеток, несущих рецепторы TNFRI и TNFR2 в каждой выделенной субпопуляции, после чего рассчитывают на основе параметрической логистической регрессионной модели вероятность наличия аллергической бронхиальной астмы по формуле:
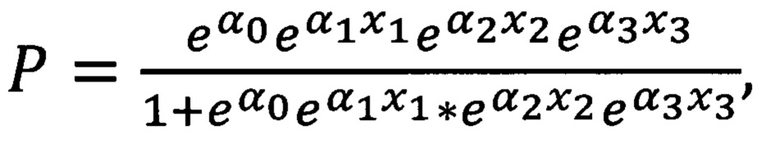
где
е=2,7182818 - математическая константа - основание натурального логарифма,
α0 = 12,455816360508 - коэффициент,
α1 = -0,427698308974449 - коэффициент,
α2 = -0,006454484262661- коэффициент,
α3 = -0,005092094923 - коэффициент,
х1 = процент клеток, несущих одновременно рецепторы TNFR1 и TNFR2 среди CD19+CD5+ В-лимфоцитов,
х2 = среднее количество рецепторов 1-го типа на TNFR1-позитивных CD8+CD45RA+ цитотоксических наивных Т-лимфоцитах,
х3 = среднее количество рецепторов 1-го типа на TNFR1-позитивных CD4+ Т-хелперных клетках, при этом если Р более или равно 0,5, то диагностируют наличие аллергической бронхиальной астмы.
| СПОСОБ ДИАГНОСТИКИ АТОПИЧЕСКОЙ ФОРМЫ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ | 2007 |
|
RU2339951C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БРОНХИАЛЬНОЙ АСТМЫ | 2008 |
|
RU2391663C1 |
| US 2008317673 A1, 25.12.2008 | |||
| ZHENLI HUANG et al., Diagnostic and Therapeutic Value of Hsa_circ_0002594 for T Helper 2-Mediated Allergic Asthma.Int Arch Allergy Immunol | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2022-09-29—Публикация
2021-06-07—Подача