Изобретение относится к лабораторной диагностике, а именно к иммуноцитохимическому (ИЦХ) исследованию белков тканей человека и может быть использовано для качественного выявления экспрессии онкомаркеров Р16/P16INK4a и Ki67 в эпителиальных клетках, природа которых подтверждается по экспрессии маркера EpCAM/clone BerEp4, в качестве вспомогательного средства в диагностике опухолей шейки матки и уточнения степени интраэпителиального поражения.
Рак шейки матки занимает третье место среди всех злокачественных заболеваний у женщин в мире и первое место в структуре онкологической заболеваемости женщин 15-40 лет в Российской Федерации. К факторам риска развития рака шейки матки относится инфицирование вирусом папилломы человека (ВПЧ или HPV) онкогенных серотипов HPV16, HPV18, HPV31, HPV33, HPV35 и другие, а также хронические воспалительные гинекологические заболевания, инфекции, семейный онкологический анамнез, случаи рака шейки матки у родственников, иммунодефициты, курение.
В настоящее время основным методом скрининга рака шейки матки и предраковых состояний является цитологическое исследование мазков (соскобов) с поверхности шейки матки (наружного маточного зева) и цервикального канала по Папаниколау (мазок по Папаниколау, Рар-тест). Несмотря на общедоступность, надежность и широкое применение данный метод имеет ряд недостатков: отсутствие стандартных методов взятия биоматериала для исследования и сложность с его повторным забором, что может привести к ложноотрицательным результатам в 20-30% случаев и ложноположительным результатам в 5-70% случаев. Усовершенствованный метод получения мазков с помощью метода жидкостной цитологии позволяет частично преодолеть недостатки традиционного метода. Кроме того, жидкостная цитология дает возможность выполнять молекулярные виды исследований, одним из которых является иммуноцитохимическое исследование.
Иммуноцитохимический метод - это метод молекулярной иммунологической диагностики, позволяющий идентифицировать клеточные и тканевые молекулы (антигены) в результате их связывания с антителами и формирования комплекса "антиген-антитело". Данный метод позволяет проводить иммунологический анализ цитологического материала в условиях сохранения морфологии клеток.
В современной диагностике рака шейки матки ИЦХ позволяет выявлять белок Р16, а точнее его экспрессию в эпителиальных клетках. Исследованию могут быть подвергнуты отдельные мазки из шеечного канала (эндоцервикса) или с наружной поверхности шейки матки (экзоцервикса), а также смешанный мазок, полученный при нанесении на одно предметное стекло биоматериала из эндоцервикса и экзоцервикса.
Белок Р16 - это клеточный протеин, участвующий в регуляции клеточного цикла и являющийся ингибитором активности циклинзависимой киназы CDK4/6. В норме киназа неактивна и клеточная пролиферация инактивирована за счет наличия прочной связи фактора транскрипции E2F с белком-супрессором pRb. Белок Р16 осуществляет контроль разобщения комплекса E2F-Rb, не допуская пролиферации клетки. В нормально функционирующих клетках синтез Р16 сдерживается по механизму обратной связи и, следовательно, концентрация данного белка в такой клетке чрезвычайно мала, что проявляется в виде негативной иммуноцитохимической реакции. Онкобелок Е7 ВПЧ с высоким онкогенным риском посредством внутриклеточных механизмов приводит к разобщению комплекса E2F-pRb, активации CDK4/6 киназы, а впоследствии стимулирует чрезмерную клеточную пролиферацию. При этом повышается экспрессия белка Р16 что проявляется в виде положительной иммуноцитохимической реакции.
ИЦХ онкобелка Р16 позволяет достоверно дифференцировать опухолевую и неопухолевую дисплазии, а также обладает высокой диагностической чувствительностью [1-10]. Известно, что экспрессия данного белка связана со слабовыраженной (CINI), умеренной (CINII) и резковыраженной дисплазией (CINIII) и внутриэпителиальным раком шейки матки. Р16 практически не обнаруживается в клетках плоского эпителия без признаков дисплазии (0-2% случаев). Таким образом, выявление экспрессии белка Р16 иммуноцитохимическим методом, в дополнение к рутинному методу жидкостной цитологии и окраски мазков по Папаниколау, позволяет повысить чувствительность теста, выявлять персистирующую папилломавирусную инфекцию до появления морфологических изменений, прогнозировать риск развития рака шейки матки, своевременно поставить диагноз и назначить требуемое лечение.
Белок Ki67 - самый широко используемый маркер пролиферации, как в нормальных, так и в опухолевых клетках. Он контролирует работу клеточного цикла, участвуя в биогенезе рибосом, организации гетерохроматина и разделении митотических хромосом. Определение индекса Ki67 является более чувствительным методом оценки пролиферативной активности, чем подсчет фигур митоза, поскольку позволяет выявлять клетки во всех активных фазах клеточного цикла и уменьшает вероятность неверной интерпретации микроскопической картины [4-10, 11, 12,13]. Такая особенность Ki67 служит полезным индикатором прогноза поведения злокачественной опухоли. Определение экспрессии белка Ki67 проводится на образце ткани, полученном из опухоли в результате биопсии или оперативным путем. Экспрессии белка Ki67 не является специфичной для рака молочной железы, детектируется и при других злокачественных заболеваниях. Однако большая доля исследований по определению его значения как маркера опухоли приходится именно на рак молочной железы. Высокие уровни экспрессии Ki67 указывают на агрессивность опухоли и неблагоприятный прогноз течения заболевания.
Эпителиальный антиген EpCAM/clone BerEp4 состоит из двух гликопротеинов, 34 и 39 кДа, иногда обозначаемый как эпителиальный антиген, эпителиальный специфический антиген или эпителиальный гликопротеин. Гликопротеины расположены на поверхности клеточной мембраны и в цитоплазме практически всех эпителиальных клеток за исключением самых плоских эпителиев, гепатоцитов, почечных проксимальных трубчатых клеток, желудочных париетальных клеток и миоэпителиальных клеток. Иммунореактивность с антителом к EpCAM/clone BerEp4 наблюдалась в большинстве эпителиальных новообразований, тогда как большинство неэпителиальных новообразований не демонстрируют экспрессию EpCAM/clone BerEp4.
EpCAM/clone BerEp4 не экспрессируется в мезотелиальных клетках, гепатоцитах и лимфоцитах. EpCAM/clone BerEp4 может использоваться для диагностики новообразований эпителиального происхождения, например, дифференциальной диагностики между аденокарциномой и мезотелиомой [11-18].
Роль описанных ранее клеточных белков в аспекте определения их экспрессии в клетках эпителия шейки матки с целью уточнения степени интраэпителиального поражения отражается в существующих в настоящее время аналогах:
Известен набор диагностический для цитологии CINtec PLUS (CINtec Cytology PLUS Kit), 50 тестов [19], который предназначен для качественного одновременного выявления белков Р16 и Ki67 в цитологическом материале, взятом из цервикального канала (спиртовая фиксация), методом ИЦХ. Данное исследование целесообразно проводить при цитологически установленных интраэпителиальных изменениях плоского эпителия низкой степени (LSIL), при наличии атипичных клеток плоского эпителия неясного значения (ASC-US) и атипичных клеток железистого эпителия неясного значения (AG-US).
Известен набор диагностический CINtec для гистологии (CINtec Histology kit), ), 50 тестов [19], который предназначен для количественного определения белка Р16 формалин-фиксированных залитых в парафин образцов тканей (цервикальных биопсий) методом иммуногистохимии (ИГХ). Применяется для диагностики рака шейки матки и сложных случаев, таких как нетипичная метаплазия, внутриэпителиальная неоплазия шейки матки, случаи, связанные с органами секреции (железами) и наличием вирусов папилломы человека высокого онкогенного риска. Данный метод позволяет визуализировать распространение диспластических клеток в эпителиальном пласте и получить уточняющие данные в сомнительных случаях - промежуточных стадиях (CIN2) и неоднозначных случаях (атрофия, метаплазия, пролиферация).
Применение указанных аналогов имеет некоторые недостатки, к которым относятся большое время для выполнения преаналитических процедур, сложность подготовки материала для исследования (более выражена в гистологической модификации), и высокая стоимость исследования в пересчете на один тест.
Наиболее близкой к заявляемому изобретению, выбранной в качестве прототипа, является срочная флуоресцентная иммуноцитохимическая диагностика метастатического поражения лимфатических узлов, описанная в [20].
Для получения клеточной суспензии материал помещают в питательную среду накопления, состоящую из растворов Хенкса, реополиглюкина и альбумина, смешанных в равных количествах. Хорошо перемешанную клеточную суспензию вносят по 100 мкл на дно каждой пробирки с питательной средой, добавляют 5 мкл моноклонального антитела EpCAM/clone BerEp4 FITC и перемешивают 5 секунд, после этого материал инкубируют 20 минут в холодильнике при температуре 2-8°C. Полученную взвесь клеток распределяют по 50-100 мкл в контейнеры центрифуги и центрифугируют при 1000 об/мин в течение 5 минут. Полученные препараты окрашивают ядерным флуоресцентным красителем и осуществляют флуоресцентную микроскопию
Недостатком известной диагностики является отсутствие возможности оценки коэкспрессии двух аналитов в одном клиническом образце с использованием специфических антител, конъюгированных с флуорофорами разной длины волны, что необходимо, например, для дифференциальной диагностики тяжелой и легкой дисплазии шейки матки.
Используемый аналит EpCAM/clone BerEp4 предназначен для обнаружения метастазов в лимфатических узлах и не приспособлен к диагностике дисплазии шейки матки.
Техническая проблема, решаемая предлагаемым изобретением, - создание быстрого, эффективного способа диагностики тяжелой дисплазии шейки матки с возможностью определения коэкспрессии двух белков одновременно и дополнительным подтверждением эпителиальной природы клеток путем определения экспрессии белка EpCAM/clone BerEp4 на поверхностной мембране исследуемых клеток.
Технический результат от использования изобретения заключается в возможности быстрого параллельного определения коэкспрессии белков Ki67, Р16.
Указанный технический результат достигается тем, что в способе многоцветной иммуноцитохимической диагностики паранеоплазии шейки матки, включающем получение клеточной суспензии клинического материала, окрашивание флуоресцентным красителем с последующей флуоресцентной микроскопией, клеточную суспензию добавляют к смеси антител, специфически направленных к белкам Р16, Ki67 и EpCAM/clone BerEp4 меченых флуоресцентными красителями различной длины волны, включающей антитела к белку Ki67 конъюгированные с флуорофором с длиной волны красного спектра, антитела к белку EpCAM/clone BerEp4 конъюгированные с флуорофором с длиной волны зеленого спектра и антитела к белку Р16 конъюгированные с флуорофором с длиной волны синего спектра, инкубируют в темном месте при комнатной температуре в течение 10-15 минут, и после инкубации осуществляют флуоресцентную микроскопию смеси антител и клеточной суспензии, не дожидаясь высыхания, и при обнаружении в цитологическом материале минимум одной клетки с тройным иммунным окрашиванием на белки Р16/Р16INK4a, Ki67 и EpCAM/clone BerEp4, диагностируют паранеоплазию шейки матки.
Используют смесь антител меченых флуоресцентными красителями различной длины волны (антитела к белку Ki67, конъюгированные с флуорофором длиной волны красного спектра, антитела к белку EpCAM/clone BerEp4, конъюгированные с флуорофором зеленого спектра и антитела к белку Р16 конъюгированные с флуорофором синего спектра), которые инкубируют с исследуемой суспензией клеток от 10 до 15 минут. При более малом времени инкубации отмечается снижение экспрессии исследуемых аналитов, увеличение времени инкубации приводит к появлению ложноположительных результатов. Выбранные длины волны наиболее разнесены по спектру между собой и позволяют идентифицировать разницу в цвете флуоресценции глазом человека без применения специального программного обеспечения
Многоцветную иммуноцитохимическую диагностику паранеоплазии шейки матки осуществляют следующим образом.
1. Клеточный материал соскоба с шейки матки после забора помещают в пластиковую пробирку типа «Эппендорф» объемом 1,5 мл, содержащую 0,8 мл транспортной питательной среды;
2. Исследуемый образец фиксируют в пробирке 70%-м холодным этанолом в течение 5 минут (соотношение 1:1);
3. Смесь антител готовят из отдельных антител к белкам Р16, Ki67, EpCAM/clone BerEp4 в равных пропорциях. Смесь пригодна к использованию в течении 24-72 часа. В промежутках между использованием хранение осуществляют при температуре +4С-+8С. Например, для приготовления смеси антител могут быть использованы антитела производства компании ABCAM (Англия);
4. К суспензии исследуемых клеток добавляют смесь из антител, представленных антителами к белку Ki67. конъюгированными с флуорофором длиной волны 594 нм, антителами к белку EpCAM/clone BerEp4, конъюгированными с флуорофором длиной волны 488 нм и антителами к белку Р16, конъюгированными с флуорофором длиной волны 350 нм;
5. Инкубируют раствор антител и клеточной суспензии в темном месте при комнатной температуре (18-22°С) в течение 10-15 минут;
6. После инкубации весь объем раствора антител и клеточной суспензии из пробирки переносят на одно предметное стекло, накрывают покровным стеклом, избегая образования пузырьков воздуха, и микроскопируют, не дожидаясь высыхания.
При положительной реакции отмечается флуоресцентное окрашивание клеточных структур, содержащих исследуемый белок. При отрицательной реакции флуоресцентное окрашивание отсутствует.
Экспрессия белков Р16 и Ki67 в одних и тех же нормальных эпителиальных клетках взаимно исключающее событие. Одновременное выявление экспрессии белков Р16 и Ki67 в одной клетке является признаком нарушения регуляции клеточного цикла. Обнаружение в цитологическом материале клеток с двойным иммунным окрашиванием на белки Р16 и Ki67 используется в целях дисплазии эпителия и уточнения степени интраэпителиального поражения.
Критерии оценки коэкспрессии:
- одиночные клетки с коэкспрессией: отчетливо просматривается зеленое окрашивание цитоплазмы и красное окрашивание ядра; ядро и цитоплазма находятся в одной плоскости и относятся к одной клетке.
- кластеры клеток с коэкспрессией: выявляется диффузная экспрессия белка Р16 в цитоплазме и четко определяются ядра с экспрессий белка Ki67; ядро и цитоплазма окрашенных клеток находится в одной плоскости.
Положительным считается результат обнаружения минимум одной клетки.
Изобретение поясняется клиническими примерами и иллюстрациями, на которых изображено:
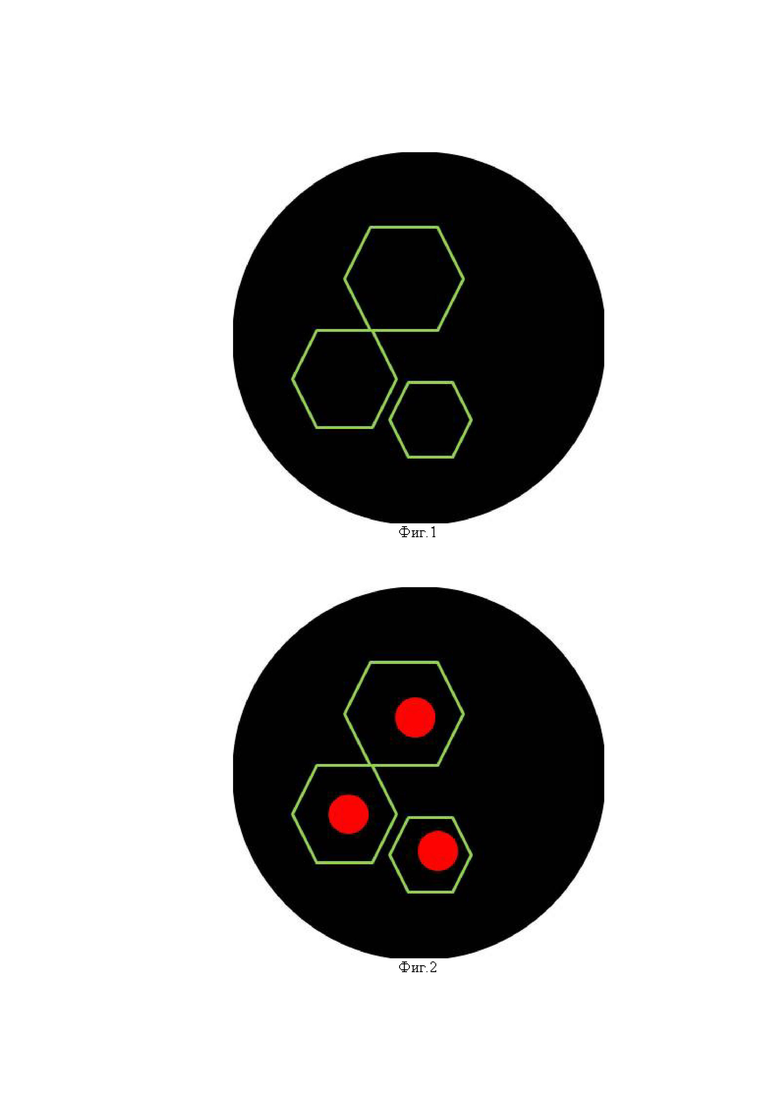
Фиг. 1 - Схематическое изображение: отрицательная реакция на исследуемые белки и положительная реакция на белок EpCAM/clone BerEp4 на мембране клетки;
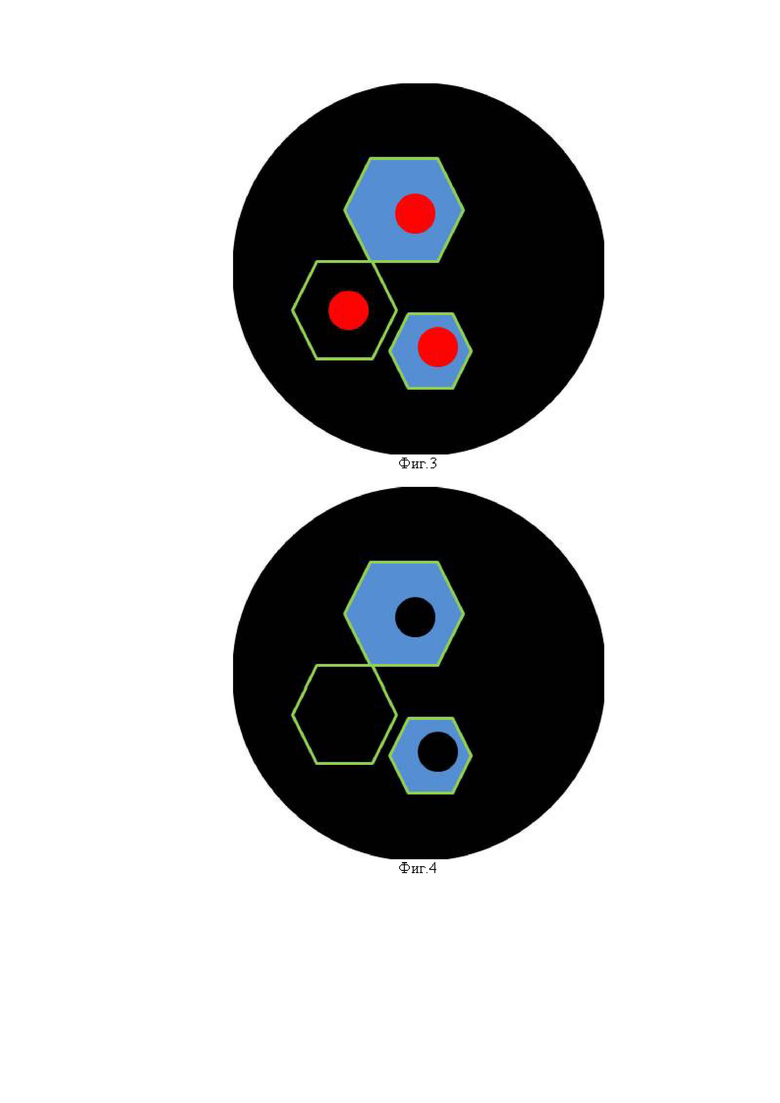
Фиг. 2 - Схематическое изображение: положительная реакция на белок Ki67 (в ядре) и отрицательная реакция на белок Р16 (отсутствие окрашивания цитоплазмы), положительная реакция на белок EpCAM/clone BerEp4 на мембране клетки;
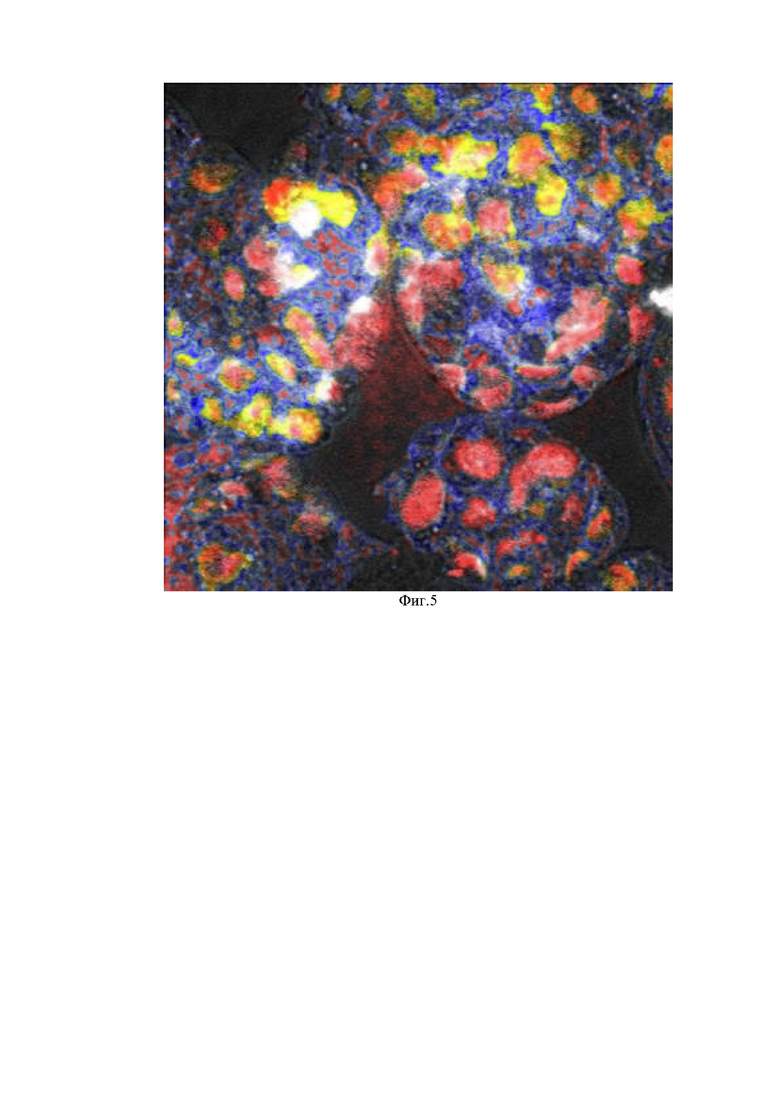
Фиг. 3 - Схематическое изображение: коэкспрессия антигенов на белок Ki67 (в ядре) и белок Р16 (в цитоплазме), положительная реакция на белок EpCAM/clone BerEp4 на мембране клетки;
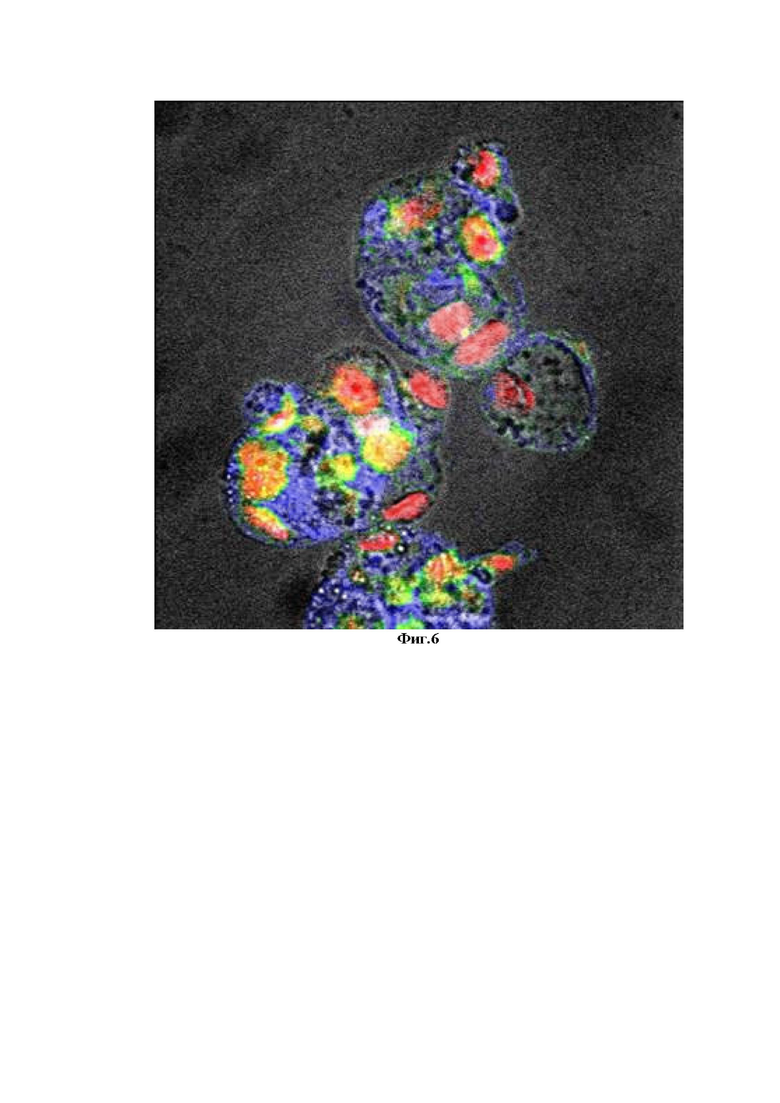
Фиг. 4 - Схематическое изображение: положительной реакци на белок Р16 (в цитоплазме) и отрицательная реакция на белок Ki67 (отсутствие окрашивания ядра), положительная реакция на белок EpCAM/clone BerEp4 на мембране клетки;
Фиг. 5 - Цитологический препарат к примеру 1;
Фиг. 6 - Цитологический препарат к примеру 2;
Фиг. 7 - Цитологический препарат к примеру 7.
Оценку флуоресценции проводили на флуоресцентном микроскопе, имеющем 3 комплементарных длинам волн фильтра, (Leica DM1000, Leica Германия).
На Фиг. 1-4 представлены схематические варианты возможных исходов реакции на коэкспрессию в случае использования смеси из антител, представленных антителами к белку Ki67, конъюгированными с флуорофором красного спектра антителами к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра и антителами к белку Р16 конъюгированными с флуорофором синего спектра
На Фиг. 1 отчетливо просматривается зеленое окрашивание цитоплазмы, что говорит об отсутствии реакций к белку Ki67, конъюгированными с флуорофором красного спектра антителами и антителами к белку Р16, конъюгированными с флуорофором синего спектра; а так же о присутствии экспрессии к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра
На Фиг. 2 отчетливо просматривается зеленое окрашивание цитоплазмы и красное окрашивание ядра, что говорит об наличии реакций к белку Ki67, конъюгированными с флуорофором красного спектра антителами и к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра, а так же об отсутствии реакции с антителами к белку Р16, конъюгированными с флуорофором синего спектра; а так же о присутствии экспрессии.
На Фиг. 3 отчетливо просматривается зеленое окрашивание цитоплазмы и красное окрашивание ядра и синее окрашивание цитоплазы, что говорит о наличии реакций к белку Ki67, конъюгированными с флуорофором красного спектра антителами, к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра, и к белку Р16, конъюгированными с флуорофором синего спектра; а так же о присутствии коэкспрессии белков Ki67 и Р16.
На Фиг. 4 отчетливо просматривается зеленое окрашивание цитоплазмы и синее окрашивание цитоплазы, что говорит об наличии реакций к белку Р16, конъюгированными с флуорофором синего спектра, и к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра, а так же об отсутствии реакции к белку Ki67, конъюгированными с флуорофором красного спектра.
При оценке результатов реакции учитывается количество клеток с коэкспрессией антигенов к белкам Ki67 и Р16. Результат является положительным при обнаружении более 1% раздельно лежащих клеток с наличием коэкспрессии антигенов к белкам Р16, и Ki67 (при подсчете не менее 500 клеток), либо при обнаружении трех и более скоплений по 5 и более клеток с наличием двойного окрашивания. Наличие положительной экспрессии к белку EpCAM/clone BerEp4, конъюгированными с флуорофором зеленого спектра подтверждает эпителиальную природу исследуемых клеток.
Клинические примеры.
Пример 1.
Пациентка М., 43 года, при проведении скрининга рака шейки матки результат ПАП-тест: H-SIL, при определении вирусной нагрузки ВПЧ-тест: 16 тип (7,2 lg). Пациентка приглашена на повторное исследование через 3 недели. На приеме взят соскоб с шейки матки. Клеточный материал соскоба с шейки матки после забора помещают в пробирку типа «Эппендорф» с транспортной питательной средой и доставляют в лабораторию. Исследуемый образец фиксируют в пробирке 70%-м холодным этанолом в течение 5 минут (соотношение 1:1). К суспензии клеток добавляют смесь из антител, представленных антителами к белку Ki67, конъюгированными с флуорофором AlexaFluor-594 нм, антителами к белку EpCAM/clone BerEp4, конъюгированными с флуорофором длиной волны AlexaFluor-488 нм и антителами к белку Р16 конъюгированными с флуорофором AlexaFluor-350 нм и инкубируют в темном месте при комнатной температуре (18-22°С) в течение 10 минут. После инкубации весь объем раствора антител и клеточной суспензии из пробирки переносят на одно предметное стекло, накрывают покровным стеклом, избегая образования пузырьков воздуха, и микроскопируют, не дожидаясь высыхания. При микроскопии определяются кластеры клеток с коэкспрессией белков Р16 и Ki67. В результате исследования подтвержден результат ПАП теста с диагнозом HSIL. Время исследования составило 60 минут. Пациентка отправлена на биопсию шейки матки. Полученный результат гистологического и иммуногистохимического исследования подтвердил данные многоцветовой флуоресцентной иммуноцитохими.
На фиг. 5. Цитологический препарат Пациентки М. Кластеры эпителиальных клеток с коэкспрессией антигенов Р16, Ki67 и EpCAM/clone BerEp4. Используются антитела, конъюгированные с флуоресцентными красителями разной длины волны (Ki67 Alexa Fluor 594, EpCAM/clone BerEp4 Alexa Fluor 488 и Р16 Alexa Fluor 350), специфически детектирующие экспрессию антигенов Р16, Ki67, EpCAM (clone BerEp4), соответственно. Красным цветом окрашено ядро, а синим цветом окрашена цитоплазма
Пример 2.
Пациентка А., 30 лет, при проведении скрининга рака шейки матки результат ПАП-тест: ASC-H (в препарате определяются единичные клетки с атипией;. для убедительного заключения недостаточно диагностического материала). При определении вирусной нагрузки ВПЧ-тест: 16 тип (76,2 lg). Пациентка приглашена на повторное исследование через 3 недели. На приеме взят соскоб с шейки матки. Клеточный материал соскоба с шейки матки после забора помещают в пробирку типа «Эппендорф» с транспортной питательной средой и доставляют в лабораторию. Исследуемый образец фиксируют в пробирке 70%-м холодным этанолом в течение 5 минут (соотношение 1:1). К суспензии клеток добавляют коктейль из антител, представленных антителами к белку Ki67, конъюгированными с флуорофором AlexaFluor-594 нм, антителами к белку EpCAM/clone BerEp4, конъюгированными с флуорофором AlexaFluor-488 нм и антителами к белку Р16, конъюгированными с флуорофором AlexaFluor-350 нм, и инкубируют в темном месте при комнатной температуре (18-22°С) в течение 15 минут. После инкубации весь объем раствора антител и клеточной суспензии из пробирки переносят на одно предметное стекло, накрывают покровным стеклом, избегая образования пузырьков воздуха, и микроскопируют, не дожидаясь высыхания. При микроскопии определяются кластеры клеток с коэкспрессией белков Р16 и Ki67. В результате исследования результат ПАП теста: ASC-H изменен на HSIL. Время исследования составило 60 минут. Пациентка отправлена на биопсию шейки матки. Полученный результат гистологического и иммуногистохимического исследования подтвердил данные многоцветовой флуоресцентной иммуноцитохими.
На фиг. 6 - Цитологический препарат Пациентки А. Кластеры эпителиальных клеток с коэкспрессией антигенов Р16, Ki67 и EpCAM/clone BerEp4. Используются антитела, конъюгированные с флуоресцентными красителями разной длины волны (Ki67 Alexa Fluor 594, EpCAM/clone BerEp4 Alexa Fluor 488 и Р16 Alexa Fluor 350), специфически детектирующие экспрессию антигенов Р16, Ki67, EpCAM/clone BerEp4, соответственно. Красным цветом окрашено ядро, а синим цветом окрашена цитоплазма
Пример 3.
Пациентка Т., 29 лет, при проведении скрининга рака шейки матки результат ПАП-тест: реактивные изменения. При определении вирусной нагрузки ВПЧ-тест: 16 тип (5,9 lg). Пациентка приглашена на повторное исследование через 3 недели. На приеме взят соскоб с шейки матки. Клеточный материал соскоба с шейки матки после забора помещают в пробирку типа «Эппендорф» с транспортной питательной средой и доставляют в лабораторию. Исследуемый образец фиксируют в пробирке 70%-м холодным этанолом в течение 5 минут (соотношение 1:1). К суспензии клеток добавляют смесь из антител, представленных антителами к белку Ki67, конъюгированными с флуорофором AlexaFluor-594 нм, антителами к белку EpCAM/clone BerEp4, конъюгированными с флуорофором AlexaFluor-488 нм и антителами к белку Р16, конъюгированными с флуорофором AlexaFluor-350 нм, и инкубируют в темном месте при комнатной температуре (18-22°С) в течение 15 минут. После инкубации весь объем раствора антител и клеточной суспензии из пробирки переносят на одно предметное стекло, накрывают покровным стеклом, избегая образования пузырьков воздуха, и микроскопируют, не дожидаясь высыхания. При микроскопии клетки с коэкспрессией белков Р16 и Ki67 отсутствуют. В результате исследования подтвержден результат ПАП теста: реактивные изменения. Время исследования составило 60 минут. При полученных результатах многоцветовой флуоресцентной иммуноцитохимии биопсия с гистологическим исследованием пациентке не показана.
Фиг. 7. - Цитологический препарат Пациентки Т. Кластеры эпителиальных клеток с отсутствием коэкспрессии антигенов к белкам Р16, Ki67 и EpCAM/clone BerEp4. Используются антитела, конъюгированные с флуоресцентными красителями разной длины волны (Ki67 Alexa Fluor 594, EpCAM/clone BerEp4 Alexa Fluor 488 и Р16 Alexa Fluor 350), специфически детектирующие экспрессию антигенов к белкам Р16, Ki67, EpCAM/clone BerEp4, соответственно. Красным цветом окрашено ядро, а синим цветом окрашена цитоплазма.
Таким образом, предлагаемая многоцветовая иммуноцитохимическая диагностика паранеоплазии шейки матки позволяет параллельно в течение 60 минут определить коэкспрессию белков Р16/P16INK4a, Ki67 в эпителиальных клетках, что необходимо для дифференциальной диагностики степени дисплазии шейки матки.
Литература:
1. Глузман Д.Ф., Скляренко Л.М, Надгорная В.А., Крячок И.А. Диагностическая иммуноцитохимия опухолей. - Киев, 2003.
2. Климанова З.Ф. Цитоморфологическая характеристика экссудатов при новообразованиях брюшины и плевры: Дис. … канд. мед. наук. - М., 1965.
3. Петров С.В., Райхлин Н.Т. Руководство по иммуногистохи-мической диагностике опухолей человека. - Казань, 2004.
4. Angelis M.D., Buley I.D., Heryet A., Gray W. / Cytopatho-logy. - 2007. - Vol. 3, N 2. - P. 111-127.
5. Carozzi F, Gillio-Tos A, Confortini M, Del Mistro A, Sani C, De Marco L, Girlando S, Rosso S, Naldoni C, Dalla Palma P, Zorzi M, Giorgi-Rossi P, Segnan N, Cuzick J, Ronco G; NTCC working group.Risk of high-grade cervical intraepithelial neoplasia during follow-up in HPV-positive women according to baseline p16-INK4A results: a prospective analysis of a nested substudy of the NTCC randomised controlled trial / Lancet Oncol. 2013 Feb; 14(2):168-76.
6. Cardozo L.L. Atlas of clinical cytology. - Amsterdam, 1975.
7. Cidado J. et al. Ki-67 is required for maintenance of cancer stem cells but not cell proliferation. Oncotarget. 2016; 7(5):6281-6293.
8. Dabbs D.J. Diagnostic immunohistochemistry. - Edinburgh, 2006.
9. Denkert C. et al. Strategies for developing Ki67 as a useful biomarker in breast cancer. Breast.2015; 24 Suppl 2:S67-72.
10. Gerdes J., Schwab U., Lemke H., Stein H. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. Int J Cancer. 1983; 31(1):13-20.
11. Kreipe H. [Ki67: biological intertumor variance versus variance of assay]. Pathologe. 2018; 39(Suppl 2):272-277.
12. Matheson T.D., Kaufman P.D. The p150N domain of chromatin assembly factor-1 regulates Ki-67 accumulation on the mitotic perichromosomal layer. Mol Biol Cell. 2017; 28(1):21-29.
13. Miller I. et al. Ki67 is a Graded Rather than a Binary Marker of Proliferation versus Quiescence. Cell Rep. 2018; 24(5):1105-1112.e5.
14. Risberg B., Davidson B., Dong H. et al. // J. Clin. Pathol. - 2000. - Vol. 53, N 7. - P. 513-517.
15. Roelens J, Reuschenbach M, von Knebel Doeberitz M, Wentzensen N, Bergeron C, Arbyn M. p16INK4a immunocytochemistry versus human papillomavirus testing for triage of women with minor cytologic abnormalities: a systematic review and meta-analysis / Cancer Cytopathol. 2012 Oct 25; 120(5):294-307.
16. Shidham V.B., Atkinson B.F. Cytophathologic diagnosis of serous fluids. - Philadelphia: Saunders Elsevier, 2007.
17. Sun X., Kaufman P.D. Ki-67: more than a proliferation marker. Chromosoma. 2018; 127(2):175-186.
18. Tsoumpou I, Arbyn M, Kyrgiou M, Wentzensen N, Koliopoulos G, Martin-Hirsch P, Malamou-Mitsi V, Paraskevaidis E. p16(INK4a) immunostaining in cytological and histological specimens from the uterine cervix: a systematic review and meta-analysis / Cancer Treat Rev. 2009 May; 35(3):210-20.
19. https://diagnostics.roche.com/ru/ru/products/tests/cintec-plus.html
20. Патент РФ №2582275, G01N 33/50, опубл. 20.04.2016 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ скрининговой дифференциальной диагностики предраковых заболеваний и рака слизистой оболочки рта (СОР) | 2021 |
|
RU2754295C1 |
| СПОСОБ ФОРМИРОВАНИЯ ГРУППЫ РИСКА НЕОПЛАСТИЧЕСКИХ НАРУШЕНИЙ В ЭПИТЕЛИИ ШЕЙКИ МАТКИ | 2010 |
|
RU2437096C1 |
| СПОСОБ ДИАГНОСТИКИ НА ОСНОВЕ РАСТВОРА | 2003 |
|
RU2315312C2 |
| СРОЧНАЯ ФЛЮОРЕСЦЕНТНАЯ ИММУНОЦИТОХИМИЧЕСКАЯ ДИАГНОСТИКА МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ЛИМФАТИЧЕСКИХ УЗЛОВ | 2014 |
|
RU2582275C1 |
| Способы детектирования 5Т4-положительных циркулирующих опухолевых клеток и способы диагностики 5Т4-положительного рака у млекопитающего | 2013 |
|
RU2646498C2 |
| Способ исследования состояния шейки матки | 2023 |
|
RU2833119C1 |
| СПОСОБ СРОЧНОЙ ДИФФЕРЕНЦИАЛЬНОЙ ФЛУОРЕСЦЕНТНОЙ ИММУНОЦИТОХИМИЧЕСКОЙ ДИАГНОСТИКИ МЕТАСТАЗОВ РАКА В ЛИМФАТИЧЕСКИЕ УЗЛЫ И НЕХОДЖКИНСКОЙ ЛИМФОМЫ | 2015 |
|
RU2580612C2 |
| МЕТОД ДИАГНОСТИКИ ЦЕРВИКАЛЬНЫХ ИНТРАЭПИТЕЛИАЛЬНЫХ НЕОПЛАЗИЙ | 2010 |
|
RU2464570C2 |
| МЕТОД ОБНАРУЖЕНИЯ КАНЦЕРОГЕНЕЗА ШЕЙКИ МАТКИ | 2015 |
|
RU2702334C2 |
| Способ диагностики хламидиоза | 2017 |
|
RU2662940C1 |

Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для многоцветной иммуноцитохимической диагностики паранеоплазии шейки матки. Осуществляют получение клеточной суспензии клинического материала, окрашивание флуоресцентным красителем с последующей флуоресцентной микроскопией. Клеточную суспензию добавляют к смеси антител, специфически направленных к белкам Р16/Р16INK4a, Ki67 и EpCAM/clone BerEp4, меченых флуоресцентными красителями различной длины волны. Смесь включает антитела к белку Ki67, конъюгированные с флуорофором с длиной волны красного спектра, антитела к белку EpCAM/clone BerEp4, конъюгированные с флуорофором с длиной волны зеленого спектра, и антитела к белку Р16/Р16INK4a, конъюгированные с флуорофором с длиной волны синего спектра. Инкубируют в темном месте при комнатной температуре в течение 10-15 минут. После инкубации осуществляют флуоресцентную микроскопию смеси антител и клеточной суспензии, не дожидаясь высыхания. При обнаружении в цитологическом материале минимум одной клетки с тройным иммунным окрашиванием на белки Р16/Р16INK4a, Ki67 и EpCAM/clone BerEp4 диагностируют паранеоплазию шейки матки. Способ обеспечивает возможность быстрой, эффективной диагностики тяжелой дисплазии и опухолей шейки матки за счет возможности методом иммуноцитохимии быстрого параллельного определения коэкспрессии белков Ki67, Р16 и дополнительного подтверждения эпителиальной природы клеток путем определения экспрессии белка EpCAM/clone BerEp4 на поверхностной мембране исследуемых клеток. 7 ил., 3 пр.
Способ многоцветной иммуноцитохимической диагностики паранеоплазии шейки матки, включающий получение клеточной суспензии клинического материала, окрашивание флуоресцентным красителем с последующей флуоресцентной микроскопией, отличающийся тем, что клеточную суспензию добавляют к смеси антител, специфически направленных к белкам Р16/Р16INK4a, Ki67 и EpCAM/clone BerEp4, меченых флуоресцентными красителями различной длины волны, включающей антитела к белку Ki67, конъюгированные с флуорофором с длиной волны красного спектра, антитела к белку EpCAM/clone BerEp4, конъюгированные с флуорофором с длиной волны зеленого спектра, и антитела к белку Р16/Р16INK4a, конъюгированные с флуорофором с длиной волны синего спектра, инкубируют в темном месте при комнатной температуре в течение 10-15 минут и после инкубации осуществляют флуоресцентную микроскопию смеси антител и клеточной суспензии, не дожидаясь высыхания, и при обнаружении в цитологическом материале минимум одной клетки с тройным иммунным окрашиванием на белки Р16/Р16INK4a, Ki67 и EpCAM/clone BerEp4 диагностируют паранеоплазию шейки матки.
| ДИМИТРИАДИ Т.А | |||
| и др | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| Исследования и практика в медицине | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| CN 101105496 A, 16.01.2008 | |||
| СРОЧНАЯ ФЛЮОРЕСЦЕНТНАЯ ИММУНОЦИТОХИМИЧЕСКАЯ ДИАГНОСТИКА МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ЛИМФАТИЧЕСКИХ УЗЛОВ | 2014 |
|
RU2582275C1 |
| CN 111089964 A, 01.05.2020 | |||
| ЧУРУКСАЕВА О.Н | |||
| и др | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
Авторы
Даты
2021-08-12—Публикация
2020-11-16—Подача