[Область техники]
Настоящее изобретение относится к применению карбамата формулы 1 с целью предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии, посредством введения фармацевтической композиции, включающей указанный карбамат :
[Формула 1]

где,
R1, R2, A1 и A2 являются, как описано в настоящем описании.
[Предшествующий уровень техники изобретения]
Фибромиалгия, также известная как синдром фибромиалгии, представляет собой комплексный синдром, состоящий из боли, такой как центральная сенсибилизация, гипералгезия и спонтанная боль. Фибромиалгия представляет собой хроническое системное болевое расстройство, которое сопровождается различными симптомами, такими как хроническая усталость, расстройства сна, когнитивные расстройства и депрессия. В частности, она часто включает выраженную боль, скованность и болезненность тканей, связанных со скелетно-мышечной системой, включая мышцы, сухожилия и связки (Bennett RM, Clinical manifestations and diagnosis of fibromyalgia, Rheum Dis Clin North Am., 2009; Clauw DJ, Fibromyalgia and related conditions, Mayo Clin Proc., 2015).
Фибромиалгия имеет частоту распространения 2-8% в соответствии с диагностическими критериями. В соответствии с диагностическими критериями, опубликованными в 1990, фибромиалгию диагностировали по наличию или отсутствию хронической системной боли и определенного количества чувствительных точек (курковые зоны), и по таким критериям фибромиалгия чаще встречалась у женщин, чем у мужчин. В соответствии с вновь предложенными стандартами в 2010 и 2011, количество чувствительных точек (курковых зон) больше не включается в критерии для диагностики фибромиалгии, и вместо этого, различные симптомы, ассоциированные с хронической болью, такие как усталость, расстройства сна, когнитивные расстройства и депрессия, включены в критерии диагностики. В результате, количество пациентов мужчин с диагнозом фибромиалгия, увеличилось и соотношение женщин к мужчинам изменилось с 9:1 в 1990 до 2:1 в новом стандарте.
Почти все пациенты с диагнозом фибромиалгии испытывают хроническую боль множество раз в различных частях тела на протяжении жизни, и болевые ощущения в различных частях организма в конечном счете приводили к хронической системной боли. Фибромиалгия часто начинается в детстве или подростковом возрасте, и пациенты с фибромиалгией предрасположены к развитию головной боли, нарушениям менструального цикла, заболеваниям височно-нижнечелюстного сустава, хронической усталости, воспалительным заболеваниям кишечника и другим типам частичной боли. У таких пациентов хирургическое лечение для устранения частичной боли не приводит к успешному облегчению боли. Фибромиалгия является обычно централизованной болью, болевой ситуацией, которая отчетливо отличается от ноцицептивной боли и нейропатической боли, что врачи могут легко различить.
Патологический механизм фибромиалгии полностью неясен до настоящего времени, но считают, что вовлечены различные факторы окружающей среды, а также генетические факторы. Вероятность развития того же заболевания в семьях пациентов с диагнозом фибромиалгии составляет в 8,5 раз выше, чем таковая в общей популяции. Сообщают, в определенных исследованиях близнецов, что около 50% фибромиалгии вызвано генетическими факторами и около 50% факторами окружающей среды. Основным фактором окружающей среды, который запускает индукцию фибромиалгии, является стресс по различным причинам, такой как таковые, которые индуцируют острую боль в течение нескольких недель. На начало фибромиалгии влияет множество психологических, поведенческих и социальных факторов и такие различные этиологические факторы затрудняют лечение заболевания.
Множество фармакологических и нефармакологических вариантов лечения использовали для лечения фибромиалгии. Лекарственные средства, такие как трициклические соединения, габапентиноиды и ингибиторы обратного захвата серотонина-норэпинефрина использовали для фармакологического лечения, и множество лекарственных средств использовали в комбинации из-за осложненного и многофакторного патогенеза фибромиалгии.
Хотя различные медицинские препараты адаптированы для лечения фибромиалгии, все еще существует ограничение по их использованию из-за неудовлетворительного уровня терапевтического эффекта или побочных явлений из-за комплекса патологий, сопровождаемых симптомами, такими как хроническая утомляемость и депрессия, а также системная скелетно-мышечная боль. Следовательно, все еще существует необходимость в новых лекарственных средствах с улучшенной эффективностью и меньшим количеством побочных эффектов.
[Описание изобретения]
[Проблема решения]
Настоящее изобретение обеспечивает способ предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии.
Настоящее изобретение также обеспечивает применение карбамата следующей формулы 1, или его фармацевтически приемлемой соли, сольвата или гидрата, для профилактики или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии:
[Формула 1]

где,
R1, R2, A1 и A2 являются, как описано в настоящем описании.
[Техническое решение проблемы]
Настоящее изобретение обеспечивает лекарственное средство для предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии, включающий терапевтически эффективное количество карбамата следующей формулы 1, или его фармацевтически приемлемой соли, сольвата или гидрата:
[Формула 1]

где,
R1 и R2 каждый независимо выбирают группы, состоящей из водорода, галогена, C1-C8 алкила, гало-C1-C8 алкила, C1-C8 тиоалкокси и C1-C8 алкокси; и
один из A1 и A2 представляет собой CH, и другой представляет собой N.
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию для предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии, включающую терапевтически эффективное количество карбамата вышеуказанной формулы 1, или его фармацевтически приемлемой соли, сольвата или гидрата, и один или более фармацевтически приемлемых носителей.
Кроме того, настоящее изобретение обеспечивает способ предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии у пациента, включающий соединений карбамата вышеуказанной формулы 1, или его фармацевтически приемлемой соли, сольвата или гидрата пациенту.
Кроме того, настоящее изобретение обеспечивает применение карбаматов вышеуказанной формулы 1, или его фармацевтически приемлемой соли, сольвата или гидрата для предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии.
В одном варианте осуществления настоящего изобретения в вышеуказанной формуле 1, R1 и R2 каждый независимо выбирают из группы, состоящей из водорода, галогена и C1-C8 алкила.
В одном варианте осуществления изобретения гало C1-C8 алкилом является перфторалкил.
В соответствии с другим вариантом осуществления настоящего изобретения карбамат формулы 1 представляет собой (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этиловый эфир карбаминовой кислоты формулы 2:
[Формула 2]
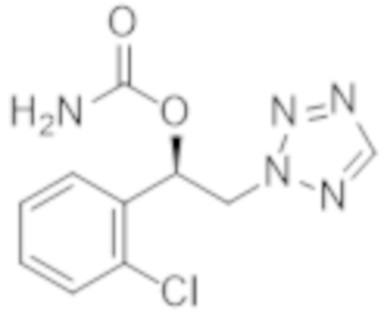 .
.
Обычный специалист в области техники синтеза соединений может легко получить соединения карбаминовой кислоты согласно формулам 1 и 2 с использованием известных соединений или соединений, которые могут быть легко получены из них. В частности, способы получения соединений по вышеуказанной формуле 1 описаны подробно в публикациях PCT No. WO 2006/112685 A1, WO 2010/150946 A1 и WO 2011/046380 A2, содержание которых включено в настоящее описание в виде ссылки. Соединения по настоящему изобретению могут быть химически синтезированы любым из способов, описанных в вышеуказанных документах, но способы являются исключительно примерными, и порядок отдельных операций и подобное могут быть селективно изменены, если необходимо. Следовательно, вышеуказанные способы не предназначены для ограничения рамок изобретения.
Соединения по настоящему изобретению могут быть использованы для профилактики или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии.
В соответствии с одним вариантом осуществления настоящего изобретения фибромиалгия может включать фибромиозит, фиброзит, мышечный ревматизм, скелетно-мышечный болевой синдром, внесуставной ревматизм, боль из-за ревматоидного миозита, миалгию напряжения, гипералгезию, персистирующую боль, ригидность и болезненную чувствительность.
В одном варианте осуществления соединения по настоящему изобретению также могут быть использованы для профилактики или лечения ассоциированных функциональных симптомов фибромиалгии. Ассоциированные функциональные симптомы фибромиалгии могут включать головные боли, бессонницу, когнитивные нарушения, депрессию, нарушения температуры тела, синдром раздраженной кишки, симптомы Сикка, гипергидроз (повышенное потоотделение), головокружение, тремор, одышку, аритмии, парестезии, хроническую усталость и подобные.
Скелетно-мышечная боль является основной характеристикой фибромиалгии и модели на животных, которые связаны со скелетно-мышечной болью у людей, могут быть использованы для оценки эффективности терапевтических средств, способных лечить фибромиалгию. Например, повторные инъекции кислого раствора в икроножную мышцу крыс приводили к механической аллодинии из-за центральной сенсибилизации, которая может хорошо представлять мышечную боль или болезненную чувствительность, наблюдаемую у пациентов с фибромиалгией (Sluka KA et. al., Unilateral intramuscular injections of acidic saline produce a bilateral, long-lasting hyperalgesia, Muscle Nerve. 2001).
Дозировка настоящих соединений для профилактического лечения заболевания может обычно варьироваться в зависимости от тяжести заболевания, массы тела и метаболического статуса пациента. ʺТерапевтически эффективное количествоʺ для отдельного пациента относится к количеству активного соединения или фармацевтической композиции, достаточному для достижения желаемого фармакологического эффекта, т.е. профилактического терапевтического эффекта, как описано выше. Терапевтически эффективное количество соединений по настоящему изобретению составляет от 50 до 500 мг, предпочтительно от 50 до 400 мг, более предпочтительно от 50 до 300 мг, и более предпочтительно от 50 до 200 мг, на основании введения человеку один раз в сутки.
Соединения по настоящему изобретению можно вводить обычным методом, используемым для введения терапевтического средства, таким как пероральное, парентеральное, внутривенное, внутримышечное, подкожное или ректальное введение.
Лекарственное средство или фармацевтическая композиция по одному варианту осуществления настоящего изобретения может включать терапевтически эффективное количество соединения, выбираемого из группы, состоящей из настоящих соединений, их фармацевтически приемлемых солей, сольватов, гидратов и их комбинаций.
Примеры фармацевтически приемлемых солей соединения карбаминовой кислоты вышеуказанной формулы 1 включают независимо ацетат, бензолсульфонат, бензоат, битартрат, ацетат кальция, камзилат, карбонат, цитрат, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глютамат, гликолоил арсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидрокарбонат, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат (эмбонат), пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат или гемисукцинат, сульфат или гемисульфат, таннат, тартрат, оксалат или гемитартрат, теоклат, триэтийодид, бензатин, хлорпрокаин, холин, диэтаноламин, диэтиленамин, меглюмин, прокаин, алюмин, аммоний, тетраметиламмоний, кальция, литий, магний, калий, натрий и цинк.
Лекарственное средство или фармацевтическую композицию по одному варианту осуществления настоящего изобретения можно вводить перорально или парентерально. Парентеральное введение может включать внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию, интраперитонеальную инъекцию, эндотелиальное введение, местное введение, интраназальное введение, интравагинальное введение, интрапульмонарное введение, ректальное введение и подобные. В случае перорального введения фармацевтическая композиция по одному варианту осуществления настоящего изобретения может быть составлена так, что активное средство покрыто оболочкой или защищено от деградации в желудке. Кроме того, композицию можно вводить любым устройством, способным переносить активное вещество в клетки-мишени. Путь введения может варьироваться в зависимости от общего состояния и возраста пациента, которого лечат, природы состояния, которое лечат, и выбранного активного ингредиента.
Подходящая дозировка лекарственного препарата или фармацевтической композиции по одному варианту осуществления настоящего изобретения может варьироваться в зависимости от факторов, таких как способ составления , способ введения, возраст, масса тела и пол пациентов, патологическое состояние, диета, время введения, скорость экскреции и реакции чувствительности, и обычные доктора могут легко определить и назначить дозы, которые являются эффективными для желаемого лечения или профилактики. Лекарственный препарат или фармацевтическую композицию по одному варианту осуществления изобретения можно вводить в одной или более доз, например, от одного до четырех раз в сутки. Фармацевтическая композиция по одному варианту осуществления изобретения может содержать от 50 до 500 мг, предпочтительно от 50 до 400 мг, более предпочтительно от 50 до 300 мг, и более предпочтительно от 50 до 200 мг соединения по формуле 1.
Лекарственное средство или фармацевтическая композиция по одному варианту осуществления настоящего изобретения может быть составлена с использованием фармацевтически приемлемого носителя и/или вспомогательного вещества в соответствии со способом, который обычный специалист в области техники может легко осуществить, посредством чего его получают в стандартной лекарственной форме или в многодозовом контейнере. Вышеуказанная композиция может быть раствором в масле или водной среде, суспензией или эмульсией (эмульгированным раствором), экстрактом, порошком, гранулами, таблеткой или капсулой, и может дополнительно включать диспергирующий или стабилизирующий агент. Кроме того, фармацевтическую композицию можно вводить в форме суппозиториев, спреев, мазей, кремов, гелей, ингаляторов или кожных пластырей. Фармацевтическая композиция также может быть получена для введения млекопитающим, более предпочтительно для введения человеку.
Фармацевтически приемлемые носители могут быть твердыми или жидкими, и могут быть одним или более выбираемых из наполнителей, антиоксидантов, буферов, бактериостатиков, диспергирующих веществ, адсорбентов, поверхностно-активных веществ, вяжущих веществ, консервантов, дезинтегрирующих веществ, подсластителей, ароматизаторов, глидантов, средств, регулирующих высвобождение, увлажняющих средств, стабилизаторов, суспендирующих средств, и смазывающих веществ. Кроме того, фармацевтически приемлемые носители могут быть выбраны из солевого раствора, стерильной воды, раствора Рингера, буферного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и их смесей.
В одном варианте осуществления изобретения подходящие наполнители включают, без ограничения, сахар (например, декстрозу, сахарозу, мальтозу и лактозу), крахмал (например, кукурузный крахмал), сахарный спирт (например, маннит, сорбит, мальтит, эритрит и ксилит), гидролизат крахмала (например, декстрин и мальтодекстрин), целлюлозу или производные целлюлозы (например, микрокристаллическая целлюлоза) или их смеси.
В одном варианте осуществления изобретения подходящие вяжущие вещества включают, без ограничения, повидон, коповидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, желатин, гуммиарабик, сахарозу, крахмал или их смеси.
В одном варианте осуществления изобретения подходящие консерванты включают, без ограничения, бензойную кислоту, бензоат натрия, бензиловый спирт, бутилированный гидроксианизол, бутилированный гидрокситолуол, хлорбутол, галлат, гидроксибензоат, EDTA или их смеси.
В одном варианте осуществления изобретения подходящие дезинтегрирующие вещества включают, без ограничения, гликолат крахмала натрия, сшитый поливинилпирролидон, сшитую карбоксиметилцеллюлозу, крахмал, микрокристаллическую целлюлозу или их смеси.
В одном варианте осуществления изобретения подходящие подсластители включают, без ограничения, сукралозу, сахарин, сахарин натрия, сахарин калия, сахарин кальция, ацесульфам калия или цикламат натрия, маннит, фруктозу, сахарозу, мальтозу или их смеси.
В одном варианте осуществления изобретения подходящие глиданты включают, без ограничения, диоксид кремния, коллоидный диоксид кремния, тальк и подобные.
В одном варианте осуществления изобретения подходящие смазывающие вещества включают, без ограничения, длинноцепочечные кислоты и их соли, такие как стеарат магния и стеариновая кислота, глицериновый воск или их смеси.
Как использовано в настоящем описании термины ʺпредотвращает,ʺ ʺпредотвращаяʺ и ʺпредотвращениеʺ относится к уменьшению или устранению вероятности развития заболевания.
Как используется в настоящем описании термины ʺлечить,ʺ ʺлечениеʺ и ʺлечениеʺ относятся к устранению или облегчению заболевания и/или его сопутствующих симптомов вместе или частично.
[Эффект изобретения]
Лекарственный препарат и фармацевтическая композиция по настоящему изобретению могут эффективно предотвращать или лечить фибромиалгию. Кроме того, лекарственный препарат и фармацевтическая композиция по настоящему изобретению могут эффективно предотвращать или лечить ассоциированные функциональные симптомы фибромиалгии.
[Краткое описание чертежей]
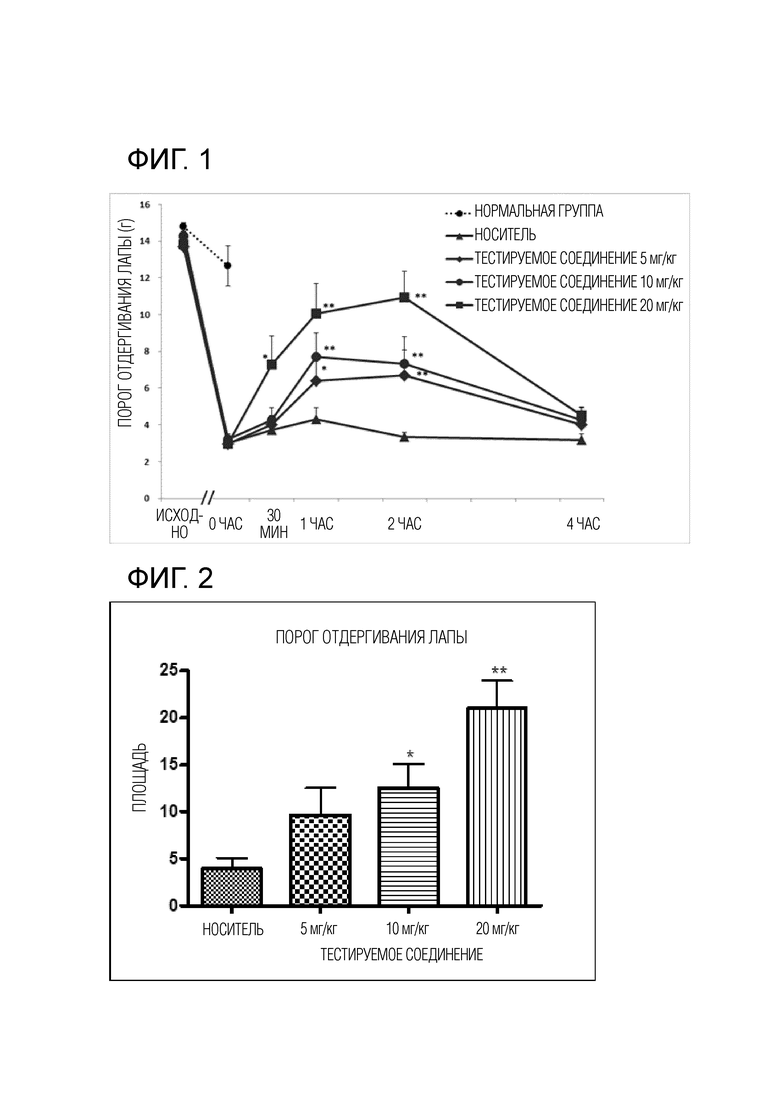
На фиг. 1 показан эффект (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты, полученного в следующем примере синтеза (далее называемого как ʺтестируемое соединениеʺ), в отношении уменьшения порога отдергивания лапы (PWT) в ответ на стимуляцию передней лапы крысы, индуцированную посредством введения кислого солевого раствора (pH 4,0) в правую икроножную мышцу.
Фиг. 2 представляет собой график, показывающий площадь под кривой порога отдергивания лапы для группы, которой вводили тестируемое соединение, по сравнению с группой, которой вводили носитель.
[Специфические варианты осуществления изобретения]
Далее настоящее изобретение будет объяснено более детально посредством рабочих примеров. Однако, следующие рабочие примеры предназначены только для иллюстрации одного или более вариантов осуществления изобретения и не ограничены рамками изобретения.
Пример синтеза: Синтез (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты
(R)-1-(2-хлорфенил)-2-тетразол-2-ил)этиловый эфир карбаминовой кислоты получали в соответствии со способом, описанным в примере синтеза 50 PCT публикации No. WO 2010/150946.
Пример: Изучение эффекта появления боли с использованием модели фибромиалгии на животных
Скелетно-мышечная боль является основной характеристикой фибромиалгии. Модель, которая связана с скелетно-мышечной болью у людей, была разработана Sluka KA, указанная модель характеризуется механической сенсибилизацией, индуцированной повторными внутримышечными инъекциями кислого солевого раствора.
В указанном эксперименте оценивали эффект тестируемого соединения в отношении персистирующей механической аллодинии, которая может представлять мышечную боль или болезненную чувствительность, наблюдаемую у пациентов с фибромиалгией. Повторные инъекции кислого солевого раствора в икроножную мышцу крыс приводили к механической аллодинии из-за центральной сенсибилизации (Sluka KA et. al., Unilateral intramuscular injections of acidic saline produce a bilateral, long-lasting hyperalgesia, Muscle Nerve. 2001).
Экспериментальные животные
Самцов крыс (Sprague-Dawley, 150-200 г, 6 недельного возраста, Orient Bio Co., Ltd.) покупали и подвергали акклиматизации в течение более чем 1 недели в камере для животных. Экспериментальных животных выдерживали в условиях цикла свет-темнота 12 часов, температуры 22-25°C, относительной влажности 40-60%, и свободного доступа к воде и пище.
Оценка механической аллодинии
Механическую аллодинию оценивали посредством измерения порога отдергивания правой передней лапы крыс с использованием метода Диксона ʺвверх и внизʺ (Chaplan et. al., Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods, 1994; Dixon WJ, Efficient analysis of experimental observations, Annu Rev Pharmacol Toxicol. 1980). Сначала крыс помещали в акриловую коробку (13×25×13 см3), расположенную на металлической сетке, встроенной на высоте около 35 см от пола и стабилизировали в течение более чем 20 минут. Использовали восемь (8) филаментов фон Фрея с различными изгибающими силами (0,2, 0,4, 0,6, 1,0, 2,0, 4,0, 6,0, 8,0, 15,0 г). Начиная с филамента 2,0 г, изгибающие силы направляли перпендикулярно к поверхности пола. В случае отсутствия отдергивания (ответ избегания) применяли филамент следующего изгибающего усилия, или, в случае отдергивания (ответ избегания) использовали следующий филамент с более низкой изгибающей силой. С целью получения по меньшей мере шести (6) результатов ответов применение филаментов продолжали еще четыре (4) раза после появления изменения в отдергивании. Начиная с филамента 2,0 г, когда крысы демонстрировали отдергивание (ответ избегания) на филамент четыре раза подряд, устанавливали 0,2 г, и когда крысы не проявляли отдергивания на филаменты пять раз подряд, устанавливали 15,0 г.
Индукция механической аллодинии
Оценивали исходный порог отдергивания (ответ избегания) для механической стимуляции правой передней лапы крыс. 100 мкл кислого солевого раствора без консервантов (0,9% хлорид натрия pH 4,0) вводили внутримышечно в правую икроножную мышцу крыс. Через 5 дней кислый солевой раствор снова вводили внутримышечно в ту же область тем же методом. Через 7 или 8 дней после второго введения кислого солевого раствора индукцию механической аллодинии подтверждали измерением порога отдергивания (ответ избегания) на механическую стимуляцию правой передней лапы, и крыс с порогом механического отдергивания (ответ избегания) менее чем 4,5 г использовали для оценки тестируемого лекарственного средства (Sluka KA et. al., Unilateral intramuscular injections of acidic saline produce a bilateral, long-lasting hyperalgesia, Muscle Nerve. 2001).
Введение
Тестируемое соединение получали в виде раствора с использованием 30% PEG 400 и 70% дистиллированной воды по объему. Каждый раствор вводили интраперитонеально крысам в объеме 3 мл на кг крысы. Порог отдергивания (ответ избегания) на механическую стимуляцию измеряли через 30 минут, 1 час, 2 часа и 4 часа после введения лекарственного средства.
Статистика
Эффект соединений выражали как среднее ± стандартная ошибка и данные анализировали с использованием одностороннего ANOVA и критерия Даннета и сравнивали по ʺ% MPE (процент максимально возможного эффекта).ʺ Статистическую значимость определяли, когда данные имели различие p <0,05.
[% MPE=(порог в течение времени после лечения лекарственным средством- порог в 0 час)/(порог нормальной группы - порог в 0 час)х100]
В результате двух повторных инъекций кислого солевого раствора подтверждали, что порог отдергивания (ответ избегания) на механическую стимуляцию достоверно снижался по сравнению с нормальной группой (при сравнении порогов отдергивания в 0 час в нормальной группе и группе, которой вводили кислый солевой раствор), что было сходно с существующими результатами (Sluka KA et. al., Unilateral intramuscular injections of acidic saline produce a bilateral, long-lasting hyperalgesia, Muscle Nerve. 2001).
Через 7 или 8 дней после второго введения кислого солевого раствора измеряли порог отдергивания на механическую стимуляцию (порог отдергивания в 0 час), и крыс, демонстрирующих порог отдергивания менее чем 4,5 г, использовали для оценки фармакологического эффекта тестируемого соединения. Носитель или тестируемое соединение вводили интраперитонеально в дозах 5, 10 и 20 мг/кг, и порог отдергивания на механическую стимуляцию измеряли через 30 минут, 1 час, 2 часа и 4 часа.
Как может быть видно в таблице 1 и фиг. 1, когда тестируемое соединение вводили в дозах 5, 10 и 20 мг/кг, механическая аллодиния, индуцированная повторными инъекциями кислого солевого раствора, достоверно ингибировалась. Кроме того, в результате расчета и анализа площади под кривой порога отдергивания лапы с течением времени подтверждали, что тестируемое соединение проявляло дозозависимый эффект и группы 10 мг/кг, ип и 20 мг/кг, ип проявляли статистически достоверные эффекты по сравнению с группой носителя.
Полученные результаты подтверждают, что тестируемое соединение достоверно уменьшает мышечную механическую гипералгезию дозозависимым образом в модели хронической миалгии.
[Таблица 1] Порог отдергивания (ответ избегания) на механическую аллодинию, индуцированную инъекцией кислого солевого раствора в икроножную мышцу до и после введения тестируемого соединения
a Порог отдергивания правой передней лапы на механическую стимуляцию, измеренный филаментами фон Фрея (г)
b Исходно измеряли до первой инъекции кислого солевого раствора.
c Тестируемое соединение тестировали через 7 или 8 дней после второго введения кислого солевого раствора.
d p<0,05, значения в 0 час согласно одностороннего ANOVA и критерия Даннетта
e p<0,01, значения в 0 час согласно одностороннего ANOVA и критерия Даннетта
Из вышеуказанных результатов было подтверждено, что тестируемое соединение проявляло достоверный эффект в патологической модели фибромиалгии.
Группа изобретений относится к области медицины, а именно к способу предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии у субъекта, включающему введение терапевтически эффективного количества (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты, или его фармацевтически приемлемой соли субъекту, где ассоциированные функциональные симптомы фибромиалгии выбирают из группы, состоящей из нарушения температуры тела, синдрома раздраженной кишки, симптомов Сикка, гипергидроза (повышенного потоотделения), головокружения, тремора, одышки, аритмий, парестезий и хронической усталости, а также к применению (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты, или его фармацевтически приемлемой соли для предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии. Группа изобретений обеспечивает эффективное предотвращение и лечение фибромиалгии и ассоциированных функциональных симптомов фибромиалгии, где ассоциированные функциональные симптомы фибромиалгии выбирают из группы, состоящей из нарушения температуры тела, синдрома раздраженной кишки, симптомов Сикка, гипергидроза (повышенного потоотделения), головокружения, тремора, одышки, аритмий, парестезий и хронической усталости. 2 н. и 6 з.п. ф-лы, 2 ил., 1 табл., 1 пр.
1. Способ предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии у субъекта, включающий введение терапевтически эффективного количества (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты следующей формулы 2, или его фармацевтически приемлемой соли субъекту:
[формула 2]
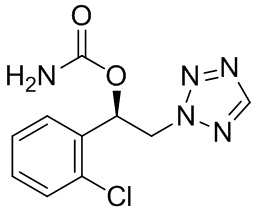
где ассоциированные функциональные симптомы фибромиалгии выбирают из группы, состоящей из нарушения температуры тела, синдрома раздраженной кишки, симптомов Сикка, гипергидроза (повышенного потоотделения), головокружения, тремора, одышки, аритмий, парестезий и хронической усталости.
2. Способ по п. 1, где фибромиалгию выбирают из группы, состоящей из фибромиозита, фиброзита, мышечного ревматизма, скелетно-мышечного болевого синдрома, внесуставного ревматизма, боли из-за равматоидного миозита, миалгии напряжения, гипералгезии, персистирующей боли, скованности и болезненной чувствительности.
3. Способ по п.1 или 2, где субъектом является млекопитающее.
4. Способ по п.3, где млекопитающим является человек.
5. Способ по п.1 или 2, где терапевтически эффективное количество (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты формулы 2 составляет от 50 до 500 мг на основании введения один раз в сутки.
6. Применение (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты формулы 2, или его фармацевтически приемлемой соли для предупреждения или лечения фибромиалгии или ассоциированных функциональных симптомов фибромиалгии:
[формула 2]

где ассоциированные функциональные симптомы фибромиалгии выбирают из группы, состоящей из нарушения температуры тела, синдрома раздраженной кишки, симптомов Сикка, гипергидроза (повышенного потоотделения), головокружения, тремора, одышки, аритмий, парестезий и хронической усталости.
7. Применение по п.6, где фибромиалгию выбирают из группы, состоящей из фибромиозита, фиброзита, мышечного ревматизма, скелетно-мышечного болевого синдрома, внесуставного ревматизма, боли из-за ревматоидного миозита, миалгии напряжения, гипералгезии, персистирующей боли, скованности и болезненной чувствительности.
8. Применение по п.6 или 7, где (R)-1-(2-хлорфенил)-2-тетразол-2-ил)этилового эфира карбаминовой кислоты формулы 2 используют в количестве от 50 до 500 мг на основании введения один раз в сутки.
| WO 2006112685 A1, 26.10.2006 | |||
| СПОСОБ ВЫРАБОТКИ НЕКУРИТЕЛЬНОГО ИЗДЕЛИЯ ИЗ МАХОРКИ | 2010 |
|
RU2445890C1 |
| US 8404461 B2, 26.03.2013 | |||
| КАРБАМАТНЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕВРОПАТИЧЕСКОЙ БОЛИ И БОЛИ, СВЯЗАННОЙ С КЛАСТЕРНОЙ И МИГРЕНЕВОЙ ГОЛОВНОЙ БОЛЬЮ | 2002 |
|
RU2299729C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СИНДРОМА ФИБРОМИАЛГИИ | 2010 |
|
RU2557533C2 |
| Покровский В.И | |||
| Малая медицинская энциклопедия | |||
| - М | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Покровский В.И | |||
| Малая медицинская энциклопедия | |||
| - М | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2021-08-17—Публикация
2017-05-18—Подача