ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-ону (HDM201), являющемуся ингибитором взаимодействия HDM2 с p53, для применения в лечении гематологических опухолей, где лекарственное средство вводится в соответствии со схемой длительного введения низких доз.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
p53 индуцируется и активируется целым рядом потенциально онкогенных процессов, в том числе аберрантными сигналами роста, повреждением ДНК, ультрафиолетовым излучением и ингибиторами протеинкиназ (Millard M, et al. Curr Pharm Design 2011;17:536-559), и регулирует гены, контролирующие остановку клеточного роста, репарацию ДНК, апоптоз и ангиогенез (Bullock AN & Fersht AR. Nat Rev Cancer 2001;1:68-76; Vogelstein B, et al. Nature Education 2010;3(9):6).
Human Double Minute-2 (HDM2) является одним из наиболее важных регуляторов p53. Он связывается непосредственно с p53, ингибируя его трансактивацию и впоследствии приводя к его деградации в цитоплазме (Zhang Y, et al. Nucleic Acids Res 2010;38:6544-6554).
p53 является одним из наиболее часто инактивируемых белков при раке человека, при этом инактивация происходит либо вследствие прямой мутации гена TP53 (обнаруживается примерно в 50% всех случаев рака человека) (Vogelstein, B et al. Nature 2000;408:307-310), либо вследствие супрессорных механизмов, таких как сверхэкспрессия HDM2 (Zhao Y, et al. BioDiscovery 2013;8:4).
В доклинических клеточных моделях и моделях in vivo было показано, что эффективные и селективные ингибиторы взаимодействия HDM2 с p53 (также называемые ингибиторами HDM2 или ингибиторами MDM2), например NVP-HDM201, восстанавливают функцию p53 (Holzer P, et al. Постер, представленный на AACR 2016, тезисы доклада №4855).
Различные схемы введения доз были описаны для ингибиторов HDM2 и протестированы в клинических исследованиях.
Например, в US2013/0245089 раскрыт способ лечения пациента, страдающего от рака, путем введения пациенту 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циано-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойной кислоты в количестве от приблизительно 800 до приблизительно 3000 мг/сутки в течение периода введения, составляющего не более приблизительно 7 дней, дни 1-7, из 28-дневного цикла лечения, за которым следует период отдыха, составляющий от приблизительно 21 до приблизительно 23 дней.
В статье B. Higgins и соавт., опубликованной в Clinical Cancer Research (май 2014), раскрыт график 28-дневного цикла, при котором RG7388 вводится один раз в неделю трижды с последующими 13 днями отдыха (график 28-дневного цикла), или при котором лекарственное средство вводится в течение 5 последовательных дней 28-дневного графика.
Дополнительные схемы введения доз ингибиторов HDM2 раскрыты в WO 2015/198266.
HDM201, являющийся ингибитором HDM2, т. е. (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, и способы его получения были раскрыты, например, в WO2013/111105.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одна из целей при разработке лекарственного средства, представляющего собой ингибитор HDM2, заключается в том, чтобы обнаружить схему введения доз, позволяющую вводить дозу, которая обеспечивает эффективность, но в то же время снижает риск возникновения нежелательных явлений.
Неожиданно было обнаружено, что один тип схемы введения является особенно применимым при лечении гематологических опухолей с помощью HDM201, являющегося ингибитором HDM2.
В частности, в настоящем изобретении предусмотрены следующие аспекты, преимущественные признаки и конкретные варианты осуществления, соответственно отдельно или в комбинации, перечисленные в следующих пунктах.
1. (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), представляющий собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его фармацевтически приемлемое нековалентное производное (включая соль, сольват, гидрат, комплекс, сокристалл)
для применения в лечении гематологических опухолей,
где лекарственное средство вводится в каждый из первых 6-8 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет от 40 мг до 90 мг.
2. HDM201, представляющий собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по пункту 1, где суточная доза лекарственного средства составляет от 40 мг до 60 мг.
3. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по пункту 1, где суточная доза лекарственного средства составляет от 40 мг до 50 мг.
4. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по пункту 1, где суточная доза лекарственного средства составляет 45 мг.
5. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по пункту 1, где лекарственное средство вводится один раз в день в каждый из первых 7 дней (первую неделю) 28-дневного (4-недельного) цикла лечения, а суточная доза лекарственного средства составляет 45 мг.
6. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-5, где лекарственное средство присутствует в виде сокристалла, предпочтительно присутствует в виде сокристалла с янтарной кислотой.
7. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-5, где лекарственное средство присутствует в виде сольвата, предпочтительно присутствует в виде гидрата.
8. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-5, где лекарственное средство присутствует в виде нековалентного производного, предпочтительно присутствует в виде нековалентного производного, содержащего янтарную кислоту или воду, более предпочтительно присутствует в виде нековалентного производного, содержащего янтарную кислоту.
9. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-8, где гематологическая опухоль представляет собой лейкоз.
10. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-9, где гематологическая опухоль выбрана из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL).
11. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-10, где гематологическая опухоль представляет собой гематологическую опухоль с TP53 дикого типа.
12. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-11, где гематологическая опухоль представляет собой рецидивирующую/рефрактерную гематологическую опухоль.
13. HDM201, представляющее собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его нековалентное производное для применения в лечении гематологических опухолей по любому из пунктов 1-8, где гематологическая опухоль представляет собой рецидивирующую/рефрактерную гематологическую опухоль с TP53 дикого типа, выбранную из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL).
Следующие пункты представляют собой особенно предпочтительные варианты осуществления настоящего изобретения.
14. (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), представляющий собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, в виде сокристалла с янтарной кислотой
для применения в лечении рецидивирующих/рефрактерных гематологических опухолей с TP53 дикого типа, выбранных из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL),
где лекарственное средство вводится один раз в день в каждый из первых 7 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет 45 мг.
15. (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), представляющий собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, в виде сокристалла с янтарной кислотой
для применения в лечении рецидивирующего/рефрактерного острого миелоидного лейкоза (AML) с TP53 дикого типа,
где лекарственное средство вводится один раз в день в каждый из первых 7 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет 45 мг.
Схемы введения доз по настоящему изобретению, описанные выше, обеспечивают очень благоприятный терапевтический индекс, низкую частоту возникновения тромбоцитопении 3/4 степени, с одновременным достижением терапевтически значимых значений содержания в плазме крови, активации пути p53 (повышения экспрессии GDF-15) и клинической активности.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Далее настоящее изобретение подробно описано со ссылкой на прилагаемые фигуры, на которых изображено следующее.
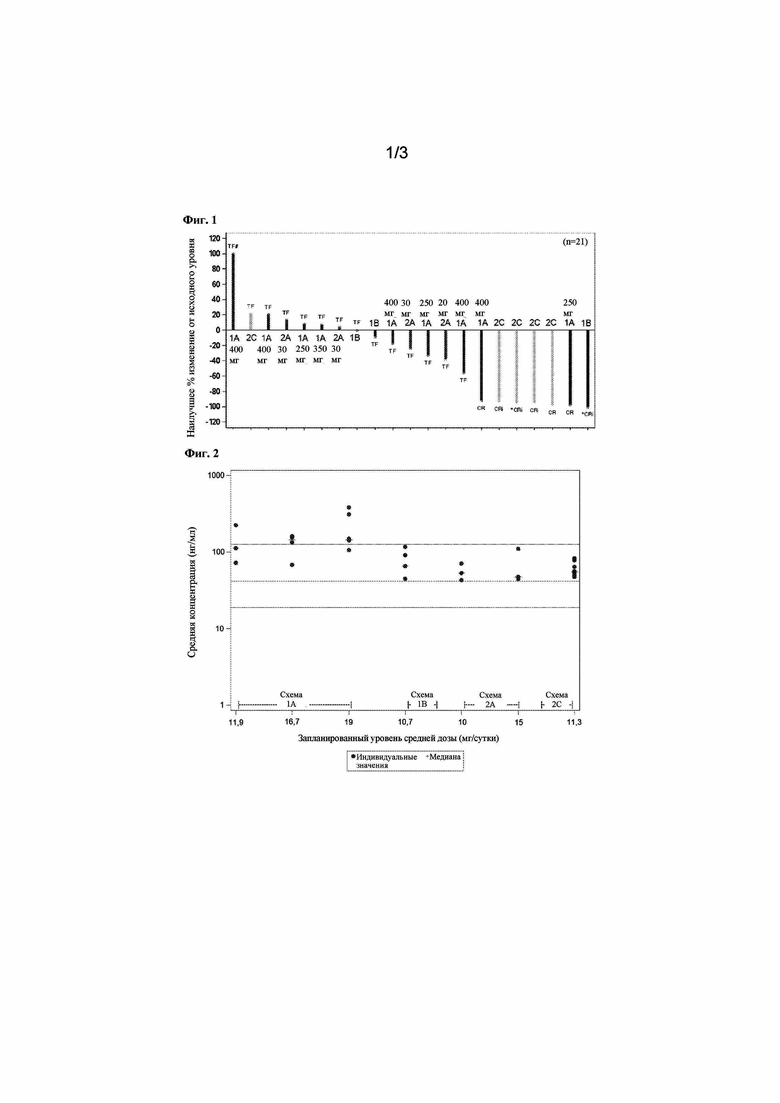
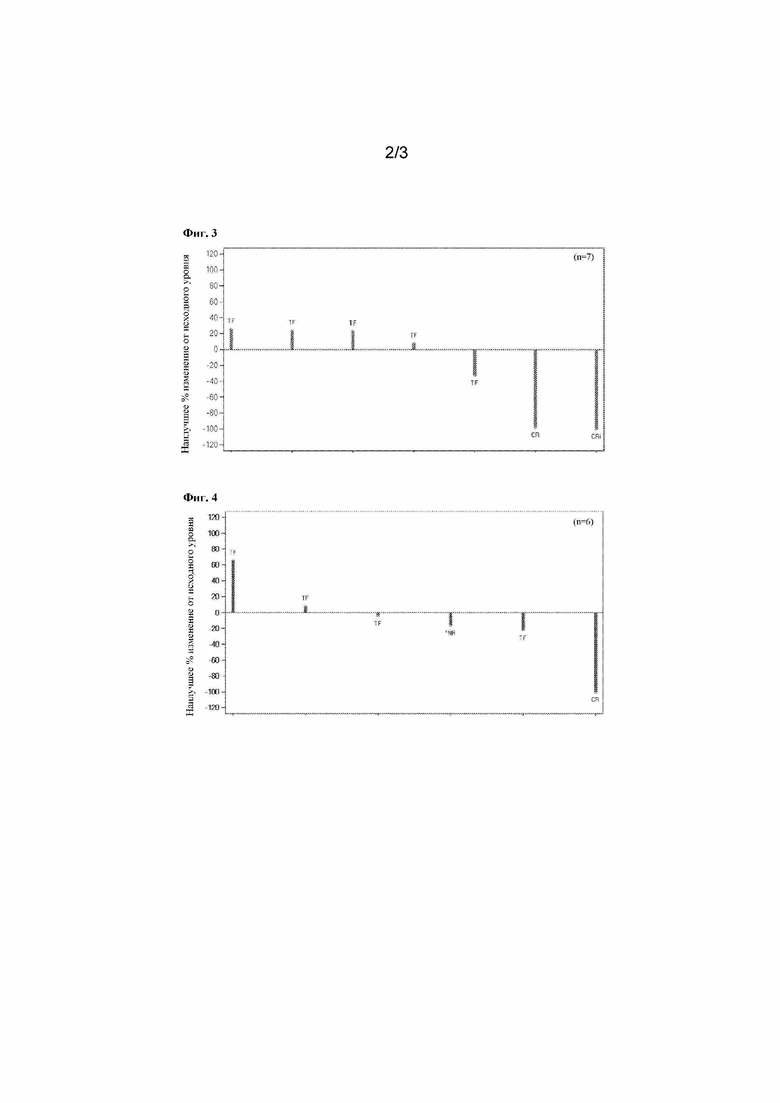
На фигуре 1 проиллюстрировано наилучшее процентное изменение процентной доли бластных клеток в аспирате костного мозга (BM) у пациентов с AML (пациенты с доступным аспиратом костного мозга).
*Продолжающееся лечение; #наилучшее процентное изменение составляет≥100; TF: неэффективное лечение; CR: полный ответ; CRi: морфологический CR с неполным восстановлением формулы крови. Суточные дозы: схема 1A - 250, 350 или 400 мг; схема 1B - 150 мг; схема 2A - 20, 30 мг; схема 2C - 45 мг.
На фигуре 2 показана индивидуальная средняя концентрация в течение первого цикла лечения в зависимости от дозы для каждой схемы у пациентов с гематологическими опухолями.
Линия на уровне 120 нг/мл=регрессия опухоли на 95% у крысы с ксенотрансплантатом SJSA-1 человека. Линия на уровне 41 нг/мл=средняя концентрация для остановки роста опухоли по данным моделирования PK/PD TGI у крысы с ксенотрансплантатом SJSA-1 (остеосаркомы) человека. Линия на уровне 19 нг/мл=средняя концентрация для остановки роста опухоли по данным моделирования PK/PD TGI у крысы с PDX из HSAX2655 (липосаркомы) человека.
Подсчет уровня средней дозы (мг/сутки):
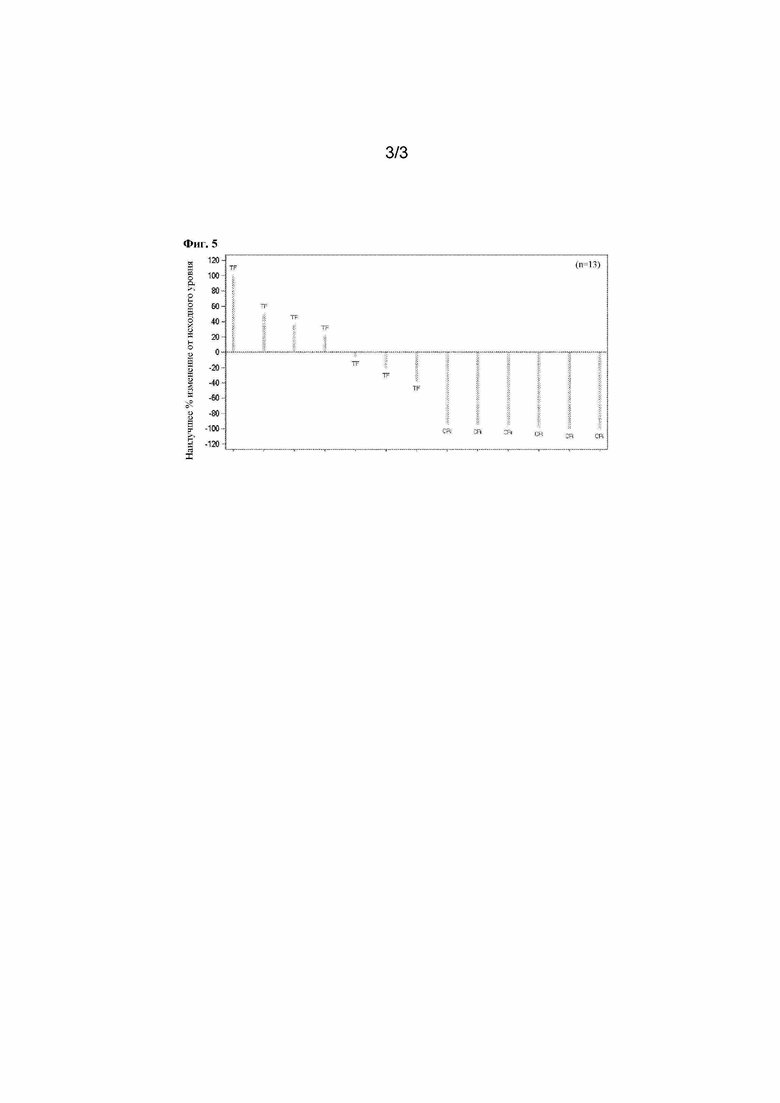
На фигурах 3-5 проиллюстрировано наилучшее процентное изменение процентной доли бластных клеток в аспирате костного мозга (BM) у пациентов с AML (последняя дата сбора данных 15 января 2018 года).
*Продолжающееся лечение; #наилучшее процентное изменение составляет≥100; TF: неэффективное лечение; CR: полный ответ; CRi: морфологический CR с неполным восстановлением формулы крови.
Суточные дозы: Фигура 3. Схема 1A при дозе 250 мг. Фигура 4. Схема 1B при дозе 120 мг. Фигура 5. Схема 2C при дозе 45 мг.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе далее настоящее изобретение описано более подробно и проиллюстрировано в примерах.
В одном аспекте настоящего изобретения предусмотрено следующее.
(S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), представляющий собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его фармацевтически приемлемое нековалентное производное (включая соль, сольват, гидрат, комплекс, сокристалл)
для применения в лечении гематологических опухолей,
где лекарственное средство вводится в каждый из первых 6-8 дней, предпочтительно 7 дней, 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет от 40 мг до 90 мг, предпочтительно 45 мг.
Термин "ингибитор взаимодействия HDM2 с p53" или в сокращенном виде "ингибитор HDM2", также называемый "HDM2i", "Hdm2i", "ингибитор MDM2", "MDM2i", "Mdm2i", обозначает в данном документе любое соединение, ингибирующее взаимодействие HDM-2 с p53 или HDM-4 с p53 с IC50, составляющей менее 10 мкМ, предпочтительно менее 1 мкМ, предпочтительно в диапазоне нМ, измеренной с помощью анализа переноса энергии флуоресценции c временным разрешением (TR-FRET). Ингибирование взаимодействий p53 с Hdm2 и p53 с Hdm4 измеряют с помощью переноса энергии флуоресценции с временным разрешением (TR-FRET). Перенос энергии флуоресценции (или ферстеровский резонансный перенос энергии) описывает перенос энергии между донорной и акцепторной 5 флуоресцентными молекулами. Для этого анализа используют белок MDM2 (аминокислоты 2-188) и белок MDM4 (аминокислоты 2-185), меченные C-концевым биотиновым фрагментом, в комбинации со стрептавидином, меченым европием (Perkin Elmer, Inc., Уолтем, Массачусетс, США), который служит в качестве донорного флуорофора. Меченный Cy5 пептид, полученный из p53, Cy5-TFSDLWKLL (aa 18-26 из p53), является акцептором энергии. При возбуждении донорной 10 молекулы при 340 нм связывающее взаимодействие между MDM2 или MDM4 и пептидом р53 вызывает передачу энергии и усиленный ответ на длине волны излучения акцептора при 665 нм. Нарушение образования комплекса p53-MDM2 или p53-MDM4 вследствие связывания молекулы ингибитора с сайтом связывания p53 в MDM2 или MDM4 приводит к усилению донорного излучения при 615 нм. Логометрические показания FRET-анализа рассчитываются на основании 15 необработанных данных двух отдельных сигналов флуоресценции, измеренных в режиме временного разрешения (интенсивность излучения при 665 нм/интенсивность излучения при 615 нм x 1000). Анализ может быть выполнен в соответствии со следующей процедурой. Испытание проводят в белых титровальных микропланшетах 1536w (Greiner Bio-One GmbH, Фриккенхаузен, Германия) в общем объеме 3,1 мкл путем объединения 100 нл соединений, разбавленных в 90% DMSO/10% Н2О (конечная концентрация DMSO 3,2%), с 2 мкл стрептавидина, меченого европием 20 (конечная концентрация 2,5 нМ), в реакционном буфере (PBS, 125 мМ NaCl, 0,001% Novexin (состоит из углеводных полимеров (полимеры Novexin), разработанных для повышения растворимости и стабильности белков; Novexin Ltd., Кембриджшир, Великобритания), 0,01% желатина, 0,2% плюроника (блок-сополимер этиленоксида и пропиленоксида, BASF, Людвигсхафен, Германия), 1 мМ DTT) с последующим добавлением 0,5 мкл MDM2-Bio или MDM4-Bio, разбавленных в буфере для анализа (конечная концентрация 10 нМ). Раствор оставляют для предварительной инкубации в течение 15 минут при комнатной температуре с последующим добавлением 0,5 мкл Cy5-пептида p53 в буфере для анализа (конечная концентрация 20 нМ). Перед считыванием планшет инкубируют при комнатной температуре в течение 10 минут. Для измерения образцов используют многорежимный ридер для микропланшетов Analyst GT (Molecular Devices) со следующими настройками 30: дихроичное зеркало 380 нм, возбуждение при 330 нм, излучение донора при 615 нм и излучение акцептора при 665 нм. Значения IC50 рассчитываются путем аппроксимации кривой с применением XLfit. Если не указано иное, реагенты приобретают в Sigma Chemical Co, Сент-Луис, Миссури, США.
Ингибитором HDM2 в соответствии с настоящим изобретением является HDM201, т. е. (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметокси-пиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он.
HDM201 может присутствовать в виде свободной молекулы или в виде любого другого нековалентного производного, включая соль, сольват, гидрат, комплекс, сокристалл или их смеси. HDM201 может присутствовать в виде кислотного производного. Кислотное производное может представлять собой соль, образованную HDM201 и кислотой, или кислотный комплекс HDM201, или в виде сокристалла кислоты и HDM201. Предпочтительно HDM201 присутствует в виде сокристалла. Предпочтительно кислота представляет собой янтарную кислоту. Наиболее предпочтительно HDM201 присутствует в виде сокристалла с янтарной кислотой. Нековалентные производные HDM201 описаны в WO2013/111105.
При ссылке на величину дозы HDM201 в данном документе, например, в мг (миллиграммах), подразумевается количество HDM201 в виде свободного основания, а не соли, сольвата, комплекса или сокристалла.
Термин "гематологическая опухоль" относится в данном документе к раку, который начинается в кроветворной ткани, такой как костный мозг, или в клетках иммунной системы. Примерами гематологических опухолей являются лейкоз, лимфома и множественная миелома. Их также часто называют раком крови.
Предпочтительными гематологическими опухолями по настоящему изобретению являются виды лейкоза. Более предпочтительно гематологические опухоли выбраны из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL). Еще более предпочтительно гематологические опухоли представляют собой острый лейкоз, предпочтительно выбранный из острого миелоидного лейкоза (AML) и острого лимфобластного лейкоза (ALL). Еще более предпочтительно гематологическая опухоль представляет собой AML.
Особенно предпочтительные гематологические опухоли по настоящему изобретению представляют собой гематологическую опухоль с TP53 дикого типа. Более предпочтительно гематологические опухоли с TP53 дикого типа по настоящему изобретению представляют собой виды лейкоза с TP53 дикого типа. Еще более предпочтительно гематологические опухоли с TP53 дикого типа выбраны из острого миелоидного лейкоза с TP53 дикого типа (AML), миелодиспластического синдрома с TP53 дикого типа (MDS) и острого лимфобластного лейкоза с TP53 дикого типа (ALL). Еще более предпочтительно гематологические опухоли с TP53 дикого типа представляют собой острый лейкоз с TP53 дикого типа, предпочтительно выбранный из острого миелоидного лейкоза с TP53 дикого типа (AML) и острого лимфобластного лейкоза с TP53 дикого типа (ALL). Еще более предпочтительно гематологическая опухоль с TP53 дикого типа представляет собой AML с TP53 дикого типа.
Согласно настоящему изобретению HDM201, представляющий собой лекарственное средство, вводится в каждый из первых 6-8 дней 28-дневного цикла лечения, предпочтительно в первые семь дней (первую неделю) 28-дневного (4 недели) цикла лечения.
"В первые семь дней 28-дневного цикла лечения" означает, что HDM вводится пациенту в день 1 (d1), d2, d3, d4, d5, d6 и d7 с последующим периодом без введения лекарственного средства (также называемым лекарственными каникулами или периодом отдыха) с дня 8 по день 28. Следующий цикл лечения начинается в день 29, который будет представлять собой d1 такого следующего цикла лечения.
Такую схему введения доз также называют "1 неделя введения/3 недели без введения" или "qd в течение первой недели 4-недельного цикла".
Предпочтительно лекарственное средство вводится приблизительно в одно и то же время в каждый день введения (т. е. d1-d7 28-дневного цикла). Предпочтительно лекарственное средство вводится один раз в день (qd) в каждый день введения. Более предпочтительно лекарственное средство вводится утром.
Предпочтительно лекарственное средство вводится натощак, т. е. по меньшей мере за 1 час до или через 2 часа после приема пищи.
Предпочтительно лекарственное средство принимают со стаканом воды и без разжевывания капсул или таблетки.
Если пациенту назначен уровень дозы, при котором необходимо принимать несколько капсул/таблеток, капсулы/таблетки следует принимать последовательно, в пределах как можно более короткого интервала, например, в пределах 5 мин.
Предпочтительно введение лекарственного средства осуществляется путем пероральной доставки, т. е. перорального введения, перорально (p. o.).
Предпочтительно лекарственное средство предусматривается в виде лекарственной формы для перорального применения, более предпочтительно в виде твердой лекарственной формы для перорального применения, например, капсулы или таблетки.
Когда в данном документе приведены диапазоны доз, например, "суточная доза лекарственного средства составляет от 40 мг до 90 мг", должно подразумеваться, что при этом раскрывается любое целое число мг конечных точек и между этими конечными точками, например, 40 мг, 41 мг, 42 мг, 43 мг, 44 мг, 45 мг, 46 мг, 47 мг,… 88 мг, 89 мг, 90 мг.
В качестве дополнительного аспекта настоящего изобретения предусмотрено следующее.
Комбинация (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она (HDM201), представляющего собой лекарственное средство, являющееся ингибитором взаимодействия HDM2 с p53, или его фармацевтически приемлемого нековалентного производного (включая соль, сольват, гидрат, комплекс, сокристалл) с одним или несколькими другими терапевтически активными средствами для применения в лечении гематологических опухолей,
где лекарственное средство, представляющее собой ингибитор взаимодействия HDM2 с p53, вводится в каждый из первых 6-8 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет от 40 мг до 90 мг.
Другое активное средство можно вводить дозой в тот же день(дни), что и HDM201, или в дни, в которые доза HDM201 не вводится.
Другое терапевтическое активное средство предпочтительно представляет собой противораковое средство, более предпочтительно указанное противораковое средство может быть выбрано из:
ингибиторов FLT3 (например, гилтеритиниба, квизартиниба, мидостаурина),
ингибиторов BCL2 (например, навитоклакса, венетоклакса),
других ингибиторов HDM2 (например, идасанултина, AMG232, DS-3032B, ALRN6924/ATSP7041),
гипометилирующих средств (HMA) (например, Vidaza [азацитидина, 5-азацитидина], Dacogen [децитабина], гуадецитабина),
антрациклинов (например, идарубицина, даунорубицина, доксорубицина, эпирубицина);
антител к CD33 (например, Mylotarg [гемтузумаба], вадастуксимаба)
и других средств (например, AraC [цитарабина, арацитина]).
Преимущественно другое терапевтическое активное средство выбрано из мидостаурина, азацитидина, цитарабина. Предпочтительными комбинациями являются комбинации HDM201 с мидостаурином, HDM201 с цитарабином, HDM201 с азацитидином.
ПРИМЕРЫ
Пример 1. Клинический эффект HDM201, вводимого при схеме введения доз 2С
В этом примере приведен обзор клинических данных в испытании 1 фазы CHDM201X2101 (последняя дата сбора данных 07 декабря 2016 г.), в котором продемонстрировано, что суточная доза 45 мг HDM201 в качестве монотерапии со схемой длительного введения низких доз "2C", т. е. схемой 1 неделя введения/3 недели без введения, пациентам с гематологическими опухолями, получавшим лечение согласно (назначение HDM201 по схеме 1 неделя введения/3 недели без введения), является наиболее эффективной и безопасной дозой/схемой по сравнению с другими схемами длительного введения низких доз или другими схемами прерывистого введения высоких доз. То, что наиболее эффективной схемой введения доз является схема введения доз 2С с HMD201 при дозе 45 мг, было подтверждено данными по эффективности на последнюю дату сбора данных 15 января 2018 года.
В данном документе раскрыты данные, полученные в этом многоцентровом, открытом исследовании I фазы с первым применением на человеке
HDM201 у пациентов с прогрессирующими видами лейкоза с TP53 дикого типа (WT).
Дизайн клинического исследования позволил провести параллельное исследование безопасности, переносимости и клинической активности (эффективности) двух широких стратегий введения доз HDM201 с повышением доз: схем прерывистого введения высоких доз (схема 1A и 1B) и схем длительного введения низких доз (схема 2A и 2C). В таблице 1 обобщены схемы введения доз в каждой категории, оценку которых осуществляли у пациентов с гематологическими опухолями.
Таблица 1. Схемы введения доз HDM201 и уровни дозы, оценку которых осуществляли при гематологических злокачественных новообразованиях
На момент последней даты сбора данных все из 37 пациентов (35 AML и 2 ALL) прошли лечение с применением HDM201 в 4 различных оцениваемых схемах введения доз (см. таблицу 1). При схеме 2C 8 пациентов (7 AML и 1 ALL) прошли лечение с применением HDM201 при уровне однократной дозы 45 мг.
Характеристики этих пациентов представлены в таблице 2.
Таблица 2. Характеристики пациентов
Популяцию пациентов дополнительно характеризовали по следующим критериям включения.
Пациент (мужчина или женщина) в возрасте≥18 лет.
Показатель общего состояния 0-2 по ECOG.
Пациенты с рецидивирующим/рефрактерным AML (как de novo, так и вторичным AML), кроме острого
промиелоцитарного лейкоза (APL) с t(15; 17), или пациенты, ранее не получавшие лечение, которые считаются неподходящими кандидатами для стандартной индукционной терапии.
Только при повышении дозы, пациенты с высоким и очень высоким риском MDS в соответствии с последней редакцией Международной прогностической балльной системы (IPSS-R), у которых предшествующая терапия, такая как терапия с применением азацитидина и децитабина, была неэффективной (пациенты с оценкой IPSS-R > 4,5).
Только при повышении дозы, пациенты с рецидивирующим/рефрактерным острым лимфобластным лейкозом (B-ALL
или T-ALL), включая Ph+ ALL, или пациенты, ранее не получавшие лечение, которые считаются неподходящими кандидатами для стандартной индукционной терапии. Для включения могут рассматриваться пациенты с Ph+ALL, у которых при наблюдении за MRD обнаруживают ранние маркеры рецидива, при условии, что другие виды терапии, такие как TKI, исчерпаны или не могут назначаться.
Опухоль у пациента представляет собой опухоль с TP53wt, характеризующимся как минимум отсутствием мутаций в экзонах 5, 6, 7 и 8, и при этом статус p53 был установлен на основании образца костного мозга, отобранного не
более чем за 3 месяца до подписания основной ICF.
Безопасность и переносимость схемы 2С
При схеме 2C наиболее частыми AE, связанными с лечением (все степени), были тромбоцитопения и анемия (каждое по 5 пациентов, 62,5%), нейтропения и снижение аппетита (каждое по 4 пациента, 50,0%), фебрильная нейтропения и тошнота (каждое по 3 пациента, 37,5%). Пять пациентов (62,5%) испытывали по меньшей мере одно AE, связанное с исследуемым лекарственным средством, характеризующееся 3/4 степенью по CTCAE. Четырьмя наиболее частыми AE, связанными с исследуемым лекарственным средством, характеризующимися 3/4 степенью по CTCAE, были: тромбоцитопения (5 пациентов, 62,5%), анемия, нейтропения и фебрильная нейтропения (каждое по 3 пациента, 37,5%).
Одно явление DLT наблюдалось у одного пациента (12,5%), у которого был синдром лизиса опухоли G4 (таблица 3).
В этом клиническом исследовании использовали модель байесовской логистической регрессии (BLRM) для обоснования увеличения дозы и оценки MTD для HDM201. BLRM позволяет включать доступную предварительную информацию и обновлять параметры модели на основании явлений DLT, наблюдаемых в клиническом исследовании при различных дозах у оцениваемых пациентов. Выбор дозы для следующей когорты основан на принципе EWOC, который допускает только дозы, при которых вероятность превышения токсичности передозировки меньше или равна 25%. Результаты BLRM, основанные на 1 явлении DLT, наблюдаемом в цикле 1 среди 8 оцениваемых пациентов, получающих схему введения 2C при дозе 45 мг, позволили увеличить дозу до 90 мг.
Однако на основе совокупности данных, наблюдаемых во всех циклах, включая безопасность, уровни ответов, PK, PK/PD, доза 45 мг для схемы введения 2C была признана наиболее предпочтительной для фазы применения максимально переносимой дозы клинического исследования.
Таблица 3. Явления DLT в цикле 1 при гематологических опухолях
-Инфекция G3, реактивация GVHd G3, стоматит G3
-Гипофосфатемия G4
-Субарахноидальное кровоизлияние (фатальное)
-Гипофосфатемия G4
- Острая почечная недостаточность G4
Таблица 4. Нежелательные явления всех степеней и степени 3/4, предположительно связанные с исследуемым лекарственным средством, с точки зрения предпочтительных терминов и схем - гематологические опухоли
пониженное количество тромбоцитов
- Пациента с несколькими случаями возникновения AE при одном лечении учитывали только один раз в категории AE
для этого лечения.
- Пациента с несколькими нежелательными явлениями учитывали только один раз в строке "Всего".
- Сообщаются только AE, возникшие в течение лечения или в пределах 30 дней после последнего приема исследуемого лекарственного препарата.
Обновленные данные по безопасности для схем введения 1А (при суточной дозе 250 мг), 1В (при суточной дозе 120 мг) и 2С (при суточной дозе 45 мг), с последней датой сбора данных 15 января 2018 года, представлены в таблице 4А.
Таблица 4А. Нежелательные явления всех степеней и степени 3/4 (≥10%), предположительно связанные с исследуемым лекарственным средством, у пациентов с гематологическими опухолями.
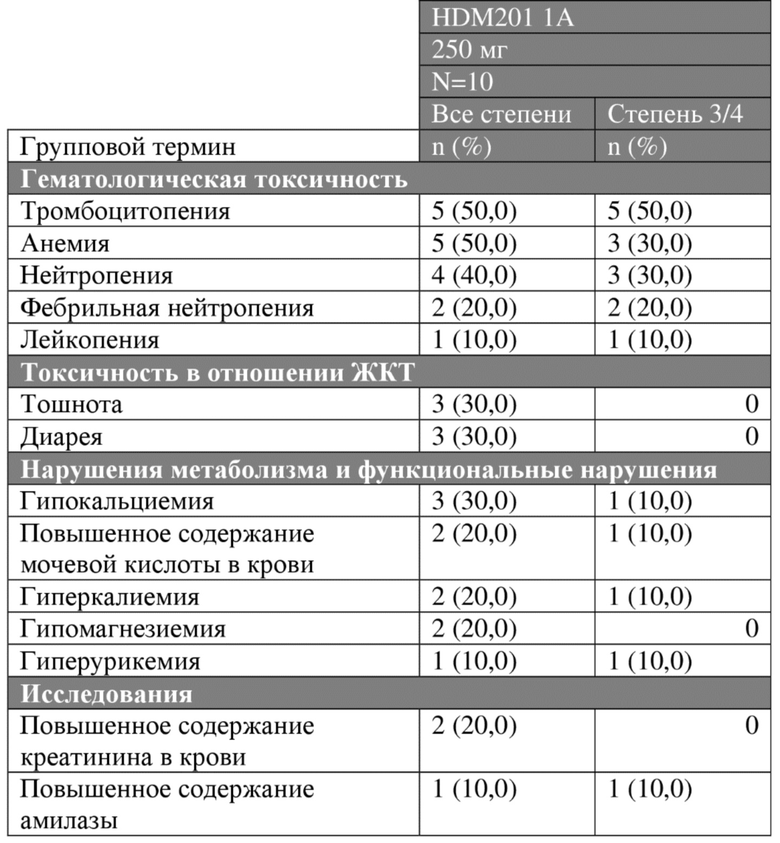
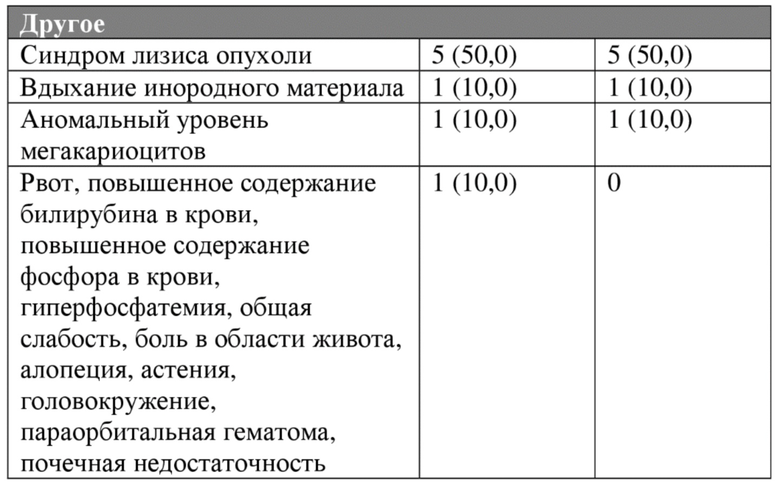
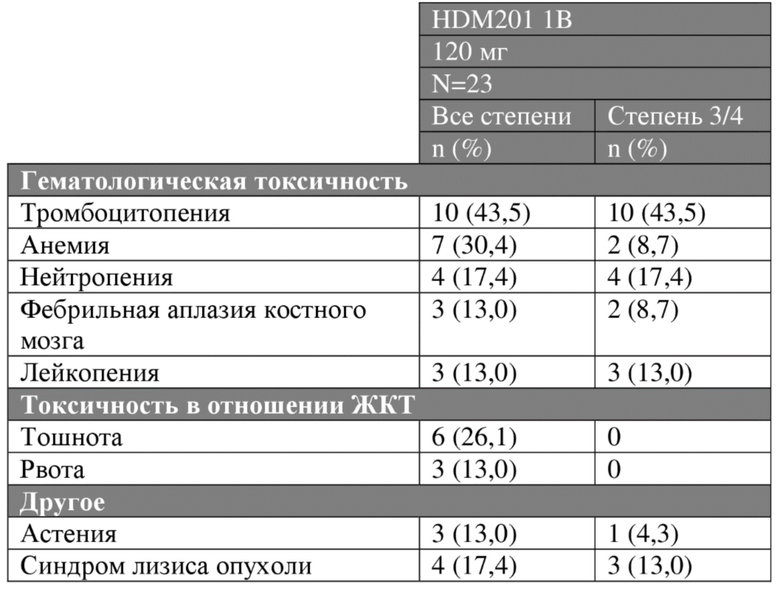

Противоопухолевая активность/эффективность схемы 2С
Из 8 пациентов, получавших лечение с дозой 45 мг по схеме 2C, 7 пациентов имели по меньшей мере одну оценку эффективности после оценки на исходном уровне, и общий уровень ответа составил 57,1% (см. таблицу 5). У одного пациента добились полного ответа, который длился 152 дня, а у трех пациентов добились CRi (морфологический CR с неполным восстановлением формулы крови), который длился 40 дней для одного из них. У другого пациента CRi продолжался на момент последней даты сбора данных (см. таблицу 6).
По сравнению с другими схемами прерывистого введения высоких доз (1А и 1В) и другими схемами длительного введения низких доз (2А) схема 2С, по-видимому, является наиболее эффективной клинически.
Схема 2С также демонстрирует сильную эффективность с точки зрения наилучшего процентного изменения процентной доли бластных клеток в аспирате костного мозга (BM) у пациентов с AML (пациенты с доступным аспиратом костного мозга), см. фигуру 1.
Принимая во внимание то, что дозы до 30 мг оценивали по схеме 2А (2 недели введения/ 2 недели без введения) без подтверждения клинически значимой активности, по-видимому, доза намного ниже 45 мг по схеме 2С (1 неделя введения/ 3 недели без введения) является менее предпочтительной с точки зрения эффективности.
Хотя при дозе 45 мг не наблюдали никакой гематологической токсичности, отвечающей критериям DLT, у пациента с CR время восстановления формулы крови составило 32 дня, а у 3 других пациентов наблюдали CR с неполным восстановлением формулы крови (см. таблицу 6). С учетом повышенного риска продолжительных периодов времени восстановления формулы крови, по-видимому, дозы, значительно превышающие 45 мг, при схеме 2С являются менее предпочтительными с точки зрения переносимости.
Таблица 5. Противоопухолевая активность
(N=35)
BOR - наилучший общий ответ; CR - полный ответ; CRi - морфологический CR с неполным восстановлением формулы крови; ORR - общий уровень ответа.
Таблица 6. Характеристика AML пациентов с CR/CRi
(лет)
(дни)
*Пациент отозвал свое согласие во время CRi
†Пациент, продолжающий лечение на момент последней даты сбора данных
Обновленные данные по эффективности для схем введения 1А (при суточной дозе 250 мг), 1В (при суточной дозе 120 мг) и 2С (при суточной дозе 45 мг) у пациентов с гематологическими опухолями с последней датой сбора данных 15 января 2018 года представлены на фигурах 3-5 и в таблице 7.
Таблица 7. Обновленные данные по противоопухолевой активности (последняя дата сбора данных: 15 января 2018 года)
Клиническая PK
Фармакокинетические данные оценивали в течение всего клинического исследования. Некомпартментный PK-анализ показал, что для всего диапазона доз (2-350 мг) медиана времени, необходимого для достижения максимальных концентраций в плазме крови, находилась в диапазоне от 2,0 до 5,8 ч. Предварительная оценка пропорциональности дозы показала приблизительно дозопропорциональную PK (AUClast и Cmax) по всему исследованному диапазону доз. Для большинства когорт, получавших разные дозы, вариабельность для разных пациентов (CV% геометрического среднего) для AUClast и Cmax была от низкой до умеренной (от 6 до 58,5%). Кроме того, проводили комплексный анализ всех доступных концентраций HDM201 с применением популяционного подхода. PK HDM201 наилучшим образом описывалась с помощью 1-компартментной модели PK с отсроченным процессом абсорбции нулевого и первого порядка и линейным клиренсом. Массу тела идентифицировали в качестве статистически значимой ковариаты, влияющей на кажущийся центральный объем распределения (Vc/F), при этом Vc/F увеличивался с увеличением массы тела.
В рамках дальнейшего обоснования дозы 45 мг для HDM201 для оценки индивидуальной средней концентрации в течение цикла 1 для пациентов с гематологическими опухолями, получавших лечение по 45 мг по схеме 2С, применяли компартментное моделирование PK (фигура 2). Для всех пациентов с измеренной PK оцененные средние концентрации лекарственного средства в течение цикла 1 превышали наиболее консервативную среднюю концентрацию для остановки роста опухоли, составляющую ≈41 нг/мл на цикл, как определено с помощью моделирования PKPD по данным доклинических исследований (крысиная модель с ксенотрансплантатом SJSA-1 человека).
Пример 2. Лекарственный препарат
Лекарственный препарат состоит из лекарственной субстанции, представляющей собой HDM201 и янтарную кислоту, заполненной непосредственно в твердые желатиновые капсулы (HGC), и не содержит каких-либо других вспомогательных веществ. Лекарственный препарат предусмотрен в четырех дозировках: 1 мг, 2,5 мг, 10 мг и 100 мг (в пересчете на вес свободной формы), предназначенных для перорального применения. Капсула с дозировкой 1 мг представляет собой желтую HGC "размера 3", капсула с дозировкой 2,5 мг представляет собой оранжево-красную HGC "размера 3", капсула с дозировкой 10 мг представляет собой серую HGC "размера 1", а с дозировкой 100 мг представляет собой оранжево-красную HGC "размера 0". Лекарственный препарат упакован в бутылки из полиэтилена высокой плотности (HDPE) с индукционной запайкой и защитой от детей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДОЗА И РЕЖИМ ВВЕДЕНИЯ ДЛЯ ИНГИБИТОРОВ ВЗАИМОДЕЙСТВИЯ HDM2 С P53 | 2017 |
|
RU2762573C2 |
| КОМБИНАЦИИ ИНГИБИТОРА ВЗАИМОДЕЙСТВИЯ HDM2-P53 И ИНГИБИТОРА BCL2 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2793123C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ, СВЯЗАННЫХ С LSD1, ИНГИБИТОРАМИ LSD1 | 2020 |
|
RU2826217C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ЛИМФОМЫ | 2019 |
|
RU2784243C2 |
| ПРЕРЫВИСТОЕ ВВЕДЕНИЕ ИНГИБИТОРА MDM2 | 2015 |
|
RU2695228C2 |
| ИНГИБИТОРЫ MDM2 И ИХ КОМБИНАЦИИ | 2016 |
|
RU2740091C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ МОДУЛЯТОРОВ ИЗОФОРМ PI3-КИНАЗЫ | 2013 |
|
RU2702908C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА MCL-1 И МИДОСТАУРИНА, ЕЕ ПРИМЕНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2019 |
|
RU2818453C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S, 4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2592231C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ИМЕЮЩЕГО ГЕМИЗИГОТНУЮ ПОТЕРЮ ТР53 | 2016 |
|
RU2721953C2 |
Изобретение относится к применению лекарственного средства, являющегося ингибитором взаимодействия HDM2 с p53, представляющего собой (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), или его фармацевтически приемлемого нековалентного производного (включая соль, сольват, гидрат, комплекс, сокристалл) для лечения гематологических опухолей, где лекарственное средство вводится в каждый из первых 6-8 дней 28-дневного цикла лечения, где лечение состоит из по меньшей мере двух 28-дневных циклов лечения и где суточная доза лекарственного средства составляет или является эквивалентной 45 мг свободного основания HDM201. Технический результат – разработана эффективная схема лечения пациентов с гематологическими опухолями, где лекарственное средство вводится в соответствии со схемой длительного введения низких доз. 3 н. и 9 з.п. ф-лы, 5 ил., 7 табл., 2 пр.
1. Применение лекарственного средства, являющегося ингибитором взаимодействия HDM2 с p53, представляющего собой (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), или его фармацевтически приемлемого нековалентного производного (включая соль, сольват, гидрат, комплекс, сокристалл)
для лечения гематологических опухолей,
где лекарственное средство вводится в каждый из первых 6-8 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства составляет или является эквивалентной 45 мг свободного основания HDM201.
2. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по п. 1, где лекарственное средство вводится один раз в день в каждый из первых 7 дней (первую неделю) 28-дневного (4-недельного) цикла лечения, а суточная доза лекарственного средства составляет или эквивалентна 45 мг свободного основания HDM201.
3. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1, 2, где лекарственное средство присутствует в виде сокристалла, предпочтительно присутствует в виде сокристалла с янтарной кислотой.
4. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-3, где лекарственное средство присутствует в виде сольвата, предпочтительно присутствует в виде гидрата.
5. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1, 2, где лекарственное средство присутствует в виде нековалентного производного, предпочтительно присутствует в виде нековалентного производного, содержащего янтарную кислоту или воду, более предпочтительно присутствует в виде нековалентного производного, содержащего янтарную кислоту.
6. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-5, где гематологическая опухоль представляет собой лейкоз.
7. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-6, где гематологическая опухоль выбрана из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL).
8. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-7, где гематологическая опухоль представляет собой гематологическую опухоль с TP53 дикого типа.
9. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-8, где гематологическая опухоль представляет собой рецидивирующую/рефрактерную гематологическую опухоль.
10. Применение лекарственного средства HDM201, являющегося ингибитором взаимодействия HDM2 с p53, или его нековалентного производного для лечения гематологических опухолей по любому из пп. 1-5, где гематологическая опухоль представляет собой рецидивирующую/рефрактерную гематологическую опухоль с TP53 дикого типа, выбранную из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL).
11. Применение лекарственного средства, являющегося ингибитором взаимодействия HDM2 с p53, представляющего собой (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201) в виде сокристалла с янтарной кислотой
для лечения рецидивирующих/рефрактерных гематологических опухолей с TP53 дикого типа, выбранных из острого миелоидного лейкоза (AML), миелодиспластического синдрома (MDS) и острого лимфобластного лейкоза (ALL),
где лекарственное средство вводится в каждый из первых 7 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства эквивалентна 45 мг свободного основания HDM201.
12. Применение лекарственного средства, являющегося ингибитором взаимодействия HDM2 с p53, представляющего собой (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (HDM201), в виде сокристалла с янтарной кислотой
для лечения рецидивирующего/рефрактерного острого миелоидного лейкоза (AML) с TP53 дикого типа,
где лекарственное средство вводится в каждый из первых 7 дней 28-дневного цикла лечения,
где лечение состоит из по меньшей мере двух 28-дневных циклов лечения, и
где суточная доза лекарственного средства эквивалентна 45 мг свободного основания HDM201.
| WO 2013111105 A1, 01.08.2013 | |||
| KOJIMA KENSUKE ET AL, Experimental Hematology, vol | |||
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| Зерносушилка | 1921 |
|
SU791A1 |
| WO 2015198266 A1, 30.12.2015 | |||
| WO 2017037579 A1, 09.03.2017 | |||
| EA 201592256 A1, 29.04.2016. | |||
Авторы
Даты
2021-08-17—Публикация
2018-03-29—Подача