УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение относится к способам достижения оптимального лечения гиперкинетических двигательных расстройств у индивидуума, где достигают эффективных концентраций (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) в плазме крови.
Уровень техники
Дисрегуляция дофаминергической системы является неотъемлемой частью некоторых нарушений центральной нервной системы (ЦНС), включая гиперкинетические двигательные расстройства (например, позднюю дискинезию (TD)) и такие состояния, как шизофрения и биполярное расстройство. Белок-транспортер, везикулярный транспортер моноаминов 2 (VMAT2), играет важную роль в пресинаптическом высвобождении дофамина, регулирующем захват моноамина из цитоплазмы в синаптическую везикулу для хранения и высвобождения. Дифференциальная экспрессия VMAT2 в головном мозге человека по сравнению с эндокринной тканью предоставляет возможность использования хорошо переносимого средства, селективно воздействующего на VMAT2, потенциально применимого для лечения нарушений ЦНС (см., например, Weihe and Eiden, The FASEB Journal 2000, 14: 2345-2449).
Поздняя дискинезия (TD) является неврологическим состоянием, отличающимся непроизвольными движениями орофациальной области (т.е. языка, губ, челюстей, лица) и хореоатетоидными движениями конечностей и туловища. Легкие симптомы TD, как правило, не подвергают лечению. Пациенты с легкой TD, как правило, не знают о непроизвольных движениях и не ищут лечения. С повышением тяжести симптомов гиперкинетические движения начинают нарушать нормальную речь, жевание, дыхание, мимику, движения конечностей, походку и баланс. В этот момент потенциальная польза фармакологического лечения перевешивает потенциальный риск связанных с лечением побочных эффектов. В наиболее тяжелых случаях TD может приводить к членовредительству, истираниям, разрывам, неспособности одеваться, есть или пить. Недавний обзор тардивных синдромов см. в Bhidayasiri and Boonyawairoj, Postgrad Med J 2011, 87(1024): 132-141.
TD развивается при длительном приеме нейролептиков и часто сохраняется при прекращении приема нарушающего нормальное функционирование лекарственного средства. У небольшой доли пациентов, которых лечат блокаторами дофаминовых рецепторов, развивается TD; чаще всего у этих пациентов есть шизофрения. Хотя патофизиология TD не в полной мере понятна, наиболее характерной особенностью является постсинаптическая дофаминовая гиперчувствительность в полосатом теле. TD отличается от острых признаков и симптомов дофаминовой блокады, таких как акатизия или паркинсонизм. Эти острые симптомы воздействия часто описывают как "экстрапирамидные побочные эффекты" или EPSE, а не тардивный или замедленный ответ. Хотя есть сообщения об отдельных случаях TD после кратковременного воздействия, чаще всего TD возникает после длительного лечения в течение месяцев или лет. В дополнение к длительности и степени воздействия нейролептиков, другие факторы риска TD, по-видимому, включают старший возраст, шизофрению и когнитивное нарушение (Margolese et al., Can J Psychiatry 2005, 50 (9): 541-47).
В последних литературных источниках, касающихся TD, предполагают коэффициент распространенности TD у приблизительно 15% пациентов с психиатрическими заболеваниями при крайне низком коэффициенте в других популяциях пациентов без психиатрических заболеваний (см., например, Tarsy and Baldessarini, Movement Disorders 2006, 21(5): 589-98). Эта кластеризация TD у пациентов с шизофренией, вероятно, отражает то, что TD, как правило, возникает в условиях хронического воздействия. В отличие от этого, кратковременное использование антагонистов дофамина редко ассоциировано с TD. В большинстве обзоров на тему TD описывают, в среднем, воздействие этих средств в течение более пяти лет. В DSM-IV и критериях клинических исследований в случае TD (например, Критериях Шулера-Кейна 1982 года) отмечают требование о том, что для подтверждения диагноза необходимо документировать воздействие в течение более трех месяцев. Недавние оценки показывают, что частота тардивных гиперкинетических движений у пациентов, которым хронически вводили нейролептики, составляет приблизительно 1-5% на год воздействия (см., например, Tenback et al, J Psychopharmacol 2010, 24: 1031; Woods et al, J Clin Psychiatry 2010, 71(4): 463-74). Сообщают о ремиссии у 30-60% пациентов, не принимающих нарушающий нормальное функционирование фактор в течение нескольких лет.
Ожидали значительного снижения частоты TD после того, как атипичные антипсихотические средства или, так называемые, антипсихотические средства второго поколения стали доступными. Однако в литературе лишь частично подтверждено снижение частоты. В кратковременных исследованиях в течение 12 месяцев или менее сообщают об очень редкой TD, в то время как в более длительных, не спонсируемых промышленностью исследованиях высказывают предположение о распространенности, близкой к 4-6% (см., например, Correll and Schenk, Curr Opin Psychiatry 2008, 21(2): 151-6). Пациентам с биполярным расстройством (BD) также прописывают антипсихотические лекарственные средства, в частности, при рефрактерности к лекарственным средствам первой линии. Для лечения BD, как правило, прописывают атипичные антипсихотические средства второго поколения. Доступны альтернативные терапевтические средства для BD (например, литий, вальпроат и т.д.); таким образом, у пациентов с появляющимися признаками TD часто можно прерывать воздействие нарушающего нормального функционирования фактора и продолжать стандартное лечение, что может вызвать ремиссию TD.
TD может развиваться у пациентов с непсихиатрическими нарушениями, которых лечат воздействием антагонистов дофаминовых рецепторов (например, REGLAN® [метоклопрамид] в случае гастропареза) ограниченного срока действия и, временами, более длительного срока действия. Хотя информированность об ассоциированных с REGLAN® побочных эффектах повышается и становится предметом коллективных исков, метоклопрамид-индуцированная TD, по-видимому, фактически возникает у <1% пациентов, подвергнутых воздействию лекарственного средства (см., например, Rao et al, Aliment Pharmacol Ther 2010, 31(1): 11).
Для лечения TD не доступна ни стандартная схема лечения, ни одобренное лекарственное средство. Первым этапом лечения этого состояния, как правило, является прекращение или минимизация использования нейролептика, предположительно, вызывающего это состояние. Некоторым пациентам может помочь замена нарушающего нормальное функционирование лекарственного средства альтернативным антипсихотическим лекарственным средством, таким как клозапин. Проведены некоторые экспериментальные работы с более агрессивными вмешательствами, такими как глубокая стимуляция головного мозга для тяжелых случаев. Кроме того, показано, что ингибиторы везикулярного транспортера моноаминов 2 (VMAT2) эффективны в лечении различных двигательных расстройств, включая позднюю дискинезию (см., например, Ondo et al, Am J Psychiatry 1999, 156(8): 1279-1281; Jankovic and Beach, Neurology 1997, 48: 359-362). Хорошо переносимое пероральное лекарственное средство для пациентов с умеренной или тяжелой TD может представлять собой важный вариант лечения в случае этого состояния. Таким образом, в этой области существует потребность в терапии, применимой для лечения TD.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к следующим вариантам осуществления.
Вариант осуществления 1. Способ лечения гиперкинетического двигательного расстройства у индивидуума, включающий введение индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, выбранный из (a) тетрабеназина (TBZ); (b) (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты; (c) дейтерированного TBZ; (d) дейтерированного (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты; (e) (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ); и (f) дейтерированного (+)α-HTBZ в количестве, достаточном для обеспечения Cmax от приблизительно 15 нг до приблизительно 60 нг (+)α-HTBZ на мл плазмы и Cmin по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 8 часов.
Вариант осуществления 2. Способ по варианту осуществления 1, где Cmax составляет приблизительно 15 нг, приблизительно 20 нг, приблизительно 25 нг, приблизительно 30 нг, приблизительно 35 нг, приблизительно 40 нг, приблизительно 45 нг, приблизительно 55 нг или приблизительно 60 нг (+)α-HTBZ на мл плазмы.
Вариант осуществления 3. Способ по варианту осуществления 1 или 2, где Cmin составляет по меньшей мере 20 нг, по меньшей мере 25 нг, по меньшей мере 30 нг или по меньшей мере 35 нг (+)α-HTBZ на мл плазмы.
Вариант осуществления 4. Способ по варианту осуществления или 2, где Cmin составляет от приблизительно 15 нг до приблизительно 35 нг (+)α-HTBZ на мл плазмы.
Вариант осуществления 5. Способ по любому из вариантов осуществления 1-4, где Cmin составляет по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 12 часов, 16 часов, 20 часов или 24 часов.
Вариант осуществления 6. Способ лечения гиперкинетического двигательного расстройства у индивидуума, включающий введение индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, выбранный из (a) тетрабеназина (TBZ); (b) (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты; (c) дейтерированного TBZ; (d) дейтерированного (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты; (e) (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ); и (f) дейтерированного (+)α-HTBZ в количестве, достаточном для обеспечения: (i) диапазона терапевтических концентраций от приблизительно 15 нг до приблизительно 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы; и (ii) пороговой концентрации по меньшей мере 15 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы в течение периода от приблизительно 8 часов до приблизительно 24 часов.
Вариант осуществления 7. Способ по варианту осуществления 6, где диапазон терапевтических концентраций (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 35 нг/мл.
Вариант осуществления 8. Способ по варианту осуществления 6, где терапевтическая концентрация (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 40 нг/мл.
Вариант осуществления 9. Способ по варианту осуществления 6, где терапевтическая концентрация (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 45 нг/мл.
Вариант осуществления 10. Способ по варианту осуществления 6, где терапевтическая концентрация (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 50 нг/мл.
Вариант осуществления 11. Способ по варианту осуществления 6, где терапевтическая концентрация (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 55 нг/мл.
Вариант осуществления 12. Способ по любому из вариантов осуществления 6-11, где пороговая концентрация (+)α-HTBZ составляет приблизительно 15 нг/мл
Вариант осуществления 13. Способ по любому из вариантов осуществления 6-11, где пороговая концентрация (+)α-HTBZ составляет приблизительно 20 нг/мл.
Вариант осуществления 14. Способ по любому из вариантов осуществления 6-13, где пороговую концентрацию (+)α-HTBZ поддерживают в течение приблизительно 8 часов.
Вариант осуществления 15. Способ по любому из вариантов осуществления 6-13, где пороговую концентрацию (+)α-HTBZ поддерживают в течение приблизительно 12 часов.
Вариант осуществления 16. Способ по любому из вариантов осуществления 6-13, где пороговую концентрацию (+)α-HTBZ поддерживают в течение приблизительно 16 часов.
Вариант осуществления 17. Способ по любому из вариантов осуществления 6-13, где пороговую концентрацию (+)α-HTBZ поддерживают в течение приблизительно 20 часов.
Вариант осуществления 18. Способ по любому из вариантов осуществления 6-13, где пороговую концентрацию (+)α-HTBZ поддерживают в течение приблизительно 24 часов.
Вариант осуществления 19. Способ по любому из вариантов осуществления 1-18, где гиперкинетическим двигательным расстройством является поздняя дискинезия.
Вариант осуществления 20. Способ по любому из вариантов осуществления 1-18, где гиперкинетическим двигательным расстройством является синдром Туретта.
Вариант осуществления 21. Способ по любому из вариантов осуществления 1-18, где гиперкинетическим двигательным расстройством не является хорея Гентингтона.
Вариант осуществления 22. Способ по любому из вариантов осуществления 1-21, где достаточное количество ингибитора VMAT2 обеспечивает (+)α-HTBZ в концентрации по меньшей мере 50% Cmax в течение по меньшей мере 12 часов в сутки.
Вариант осуществления 23. Способ по любому из вариантов осуществления 1-22, где фармацевтическая композиция содержит состав ингибитора VMAT2 с длительным высвобождением.
Вариант осуществления 24. Способ по любому из вариантов осуществления 1-23, где ингибитором VMAT2 является (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты.
Вариант осуществления 25. Способ по варианту осуществления 24, где (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты вводят в суточной дозе от приблизительно 40 мг до приблизительно 80 мг.
Вариант осуществления 26. Способ по варианту осуществления 25, где (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты вводят в суточной дозе приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг или приблизительно 80 мг.
Вариант осуществления 27. Способ по любому из вариантов осуществления 1-23, где ингибитором VMAT2 является TBZ.
Вариант осуществления 28. Способ по любому из вариантов осуществления 1-23, где ингибитором VMAT2 является (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ол ((+)α-HTBZ).
Вариант осуществления 29. Способ по любому из вариантов осуществления 1-28, где ингибитор VMAT2 является дейтерированным.
Вариант осуществления 30. Способ по варианту осуществления 29, где (+)α-HTBZ, находящийся в плазме индивидуума, является дейтерированным.
Эти и другие варианты осуществления будут очевидны при ссылке на следующее подробное описание. В связи с этим, в настоящем описании приведены различные ссылки, в которых более подробно описывают конкретную информацию об уровне техники, способах, соединения и композициях, и, таким образом, каждая из них включена в настоящее описание в качестве ссылки в полном объеме.
Термины, конкретно не определенные в настоящем описании, должны иметь значения, которые будут даны им специалистом в этой области в свете описания и контекста. Однако, как применяют в настоящем описании, если не указано иначе, термины имеют указанное значение.
На всем протяжении настоящего описания ссылка на "один из вариантов осуществления" или "вариант осуществления" означает, что конкретный признак, структура или характеристика, описываемая в связи с вариантом осуществления, включены по меньшей мере в один из вариантов осуществления. Таким образом, упоминание фраз "в одном из вариантов осуществления" или "в варианте осуществления" в различных местах на всем протяжении настоящего описания не обязательно относятся к одному и тому же варианту осуществления. Кроме того, конкретные признаки, структуры или характеристики можно комбинировать любым соответствующим образом в одном или нескольких вариантах осуществления.
Кроме того, как применяют в настоящем описании и формуле изобретения, формы в единственном числе включают ссылки во множественном числе, если контекст четко не указывает на иное. Таким образом, например, ссылка на "не принадлежащее человеку животное" может относиться к одному или нескольким не принадлежащим человеку животным или множеству таких животных, и ссылка на "клетку" включает ссылку на одну или несколько клеток и их эквиваленты (например, множество клеток), известные специалистам в этой области, и т.д. Если этапы способа представлены в описании или формуле изобретения, и этапы описывают как происходящие в конкретном порядке, описание первого этапа, происходящего (или осуществляемого) "перед" (т.е. до) вторым этапом, имеет то же значение, как если бы было переписано так, что второй этап происходит (или его осуществляют) "после" первого этапа. Термин "приблизительно" в отношении количества или численного диапазона означает, что количество или численный диапазон, на который ссылаются, является приближением в пределах колебания показаний от эксперимента к эксперименту (или в пределах статистической ошибки эксперимента), и таким образом количество или численный диапазон могут варьироваться от 1% до 15% указанного количества или численного диапазона. Также следует отметить, что термин "или", как правило, используют в его значении, включающем "и/или", если контекст четко не указывает на иное. Термин "по меньшей мере один", например, в отношении по меньшей мере одного соединения или по меньшей мере одной композиции имеет то же значение, что и термин "один или несколько".
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
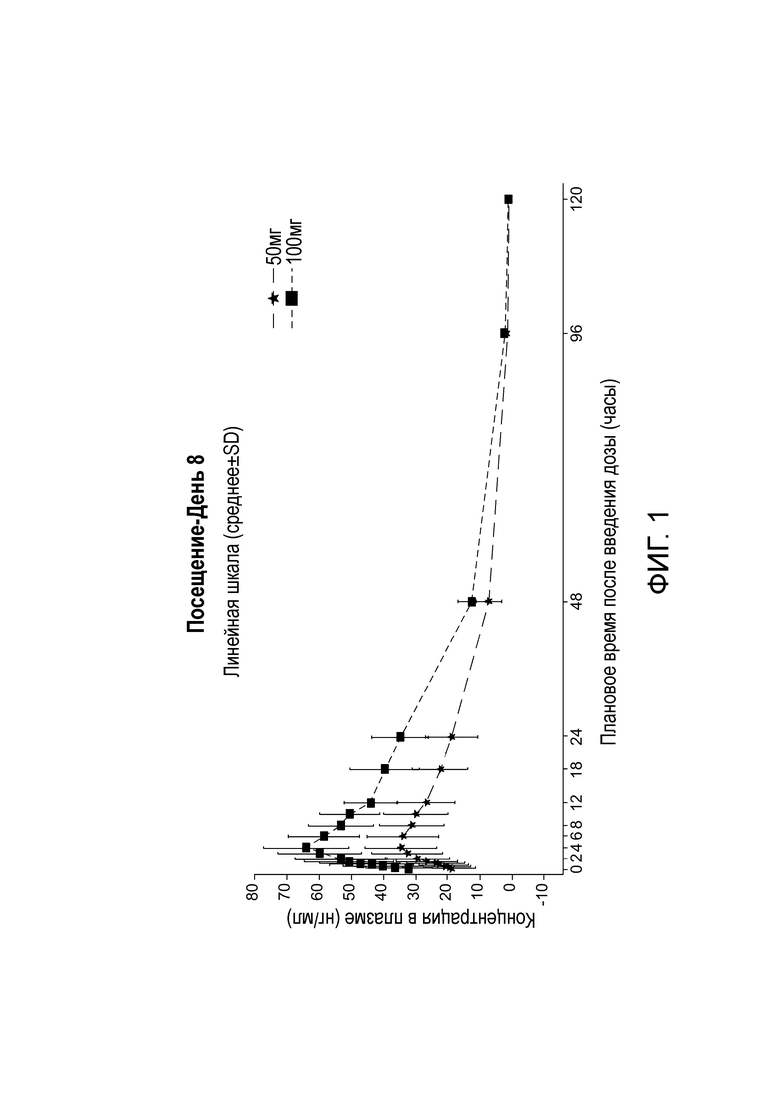
На фигуре 1 показаны данные о средней концентрации в плазме (линейная шкала) активного метаболита (+)α-HTBZ относительно планового времени после введения дозы в день 8 для пациентов в когортном исследовании многократного введения NBI-98854.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к способам достижения или поддержания оптимальной концентрации по меньшей мере одного активного метаболита тетрабеназина (3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-она, TBZ) у индивидуума посредством введения индивидууму соединения TBZ или его аналога в дозе соединения, посредством которой достигают или поддерживают концентрацию активного метаболита (например, (+)α-HTBZ) в течение указанного периода времени, таким образом, оптимизируя клиническую пользу для лечения гиперкинетических двигательных расстройств (например, TD). Перед описанием следует отметить, что дозы TBZ или их аналогов, приводящие к оптимальной клинической пользе для индивидуума, по-видимому, различаются для отдельных подвергаемых лечению индивидуумов.
Тетрабеназин (XENAZINE®) является одобренным средством с VMAT2-ингибиторной активностью, дофамин-истощающим средством, одобренным в 2008 году для лечения хореи, ассоциированной с хореей Гентингтона. Однако ксеназин не одобрен для TD, и тетрабеназин имеет четкую Программу по оценке и снижению риска (REMS), ограничивающую его распространение только среди пациентов с хореей Гентингтона. Описана клиническая польза тетрабеназина при использовании в заявке на регистрацию нового экспериментального лекарственного средства для лечения TD и различных гиперкинетических двигательных расстройств (см., например, Ondo et al, Am J Psychiatry 1999, 156(8): 1279-1281; Jankovic and Beach, Neurology 1997, 48: 359-362). Задокументированы благоприятные фармакологические эффекты тетрабеназина в отношении целевых гиперкинетических непроизвольных движений, а также побочные эффекты, ассоциированные с избыточным истощением моноамина, такие как седативный эффект, депрессия, акатизия и паркинсонизм. Частота этих побочных эффектов при использовании тетрабеназина приводит к потребности в индивидуализированном дозировании, титровании дозы и контроле связанных с лечением побочных эффектов в соответствии с ограничительной программой REMS.
Необходимость титрования дозы при использовании тетрабеназина в клинике может являться результатом его интенсивного и непостоянного метаболизма. TBZ, содержащий два хиральных центра и являющийся рацемической смесью двух стереоизомеров, быстро и интенсивно метаболизируется in vivo до его восстановленной формы, 3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола, также известного как дигидротетрабеназин (HTBZ). Считают, что HTBZ существует в виде четырех отдельных изомеров: (±)α-HTBZ и (±) бета-HTBZ. Считают, что (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ол или (+)α-HTBZ является абсолютной конфигурацией большей части активного метаболита (см., например, Kilbourn Chirality 1997 9:59-62). Т.к. тетрабеназин быстро метаболизируется, и т.к. наблюдают очень низкое воздействие тетрабеназина после его перорального введения, терапевтическая эффективность тетрабеназина, по-видимому, является результатом, главным образом, действия метаболитов (+)α-HTBZ и (+)β-HTBZ (см., например, Kilbourn et al., Eur J Pharmacol 1995, 278: 249-252; Mehvar et al., Drug Metabolism and Disposition 1987, 15(2): 250-255; вкладыш в упаковку ксеназина, Biovail Laboratories International, 2009). Метаболизм тетрабеназина в (±)α-HTBZ и (±)β-HTBZ сильно варьируется между пациентами (см., например, Mehvar et al., Drug Metabolism and Disposition 1987, 15(2): 250-255). Кроме того, эти стереоизомеры HTBZ проявляют различные фармакологические свойства (т.е. связывание с нецелевыми белковыми рецепторами) (см., например, Kilbourn et al., Eur J Pharmacol 1995, 278: 249-252). Это представляет собой источник повышенного риска для пациента и сложность для лечащего врача в терминах активного контроля схемы дозирования у пациента.
Настоящее изобретение относится к способам лечения индивидуума, имеющего гиперкинетическое двигательное расстройство, с использованием [+]α-дигидротетрабеназина или его предшественника в достаточном количестве для достижения соответствующей концентрации [+]α-дигидротетрабеназина в плазме в течение указанного периода времени.
В одном из вариантов осуществления вводят сложный эфир [+]α-дигидротетрабеназина. В варианте осуществления сложный эфир является валиновым сложным эфиром, и соединение является (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловым сложным эфиром (S)-2-амино-3-метил-масляной кислоты (NBI-98854). В более конкретном варианте осуществления (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты или его соль являются дейтерированными.
В другом варианте осуществления вводят тетрабеназин или его фармацевтически приемлемые соли. Тетрабеназин можно вводить множеством способов, включая составы, описываемые в публикациях PCT WO 2010/018408, WO 2011/019956 и WO 2014/047167.
В другом варианте осуществления вводят d6-тетрабеназин, как описывают в патенте США № 8524733, что приводит к получению соответствующей концентрации метаболита (+)α-3-изобутил-9,10-d6-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола (дейтерированного (+)α-HTBZ) или дейтерированного (+)β-HTBZ в плазме в течение указанного периода времени. d6-Тетрабеназин можно вводить множеством способов, включая составы, как описано в публикации PCT WO 2014/047167.
В одном из вариантов осуществления соединения TBZ, используемые в способах, представленных в настоящем описании, заменяют соединениями 3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола и его фармацевтически приемлемыми солями. В другом варианте осуществления соединение является 3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-олом, также известным как дигидротетрабеназин (HTBZ), и включает его отдельные изомеры, (±)альфа-HTBZ и (±)бета-HTBZ, и их фармацевтически приемлемые соли. В другом конкретном варианте осуществления HTBZ является дейтерированным.
В одном из аспектов настоящее изобретение относится к способу лечения гиперкинетических двигательных расстройств, включающему введение нуждающемуся в этом индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, представленный в настоящем описании в количестве, достаточном для достижения максимальной концентрации (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) в плазме крови (Cmax) от приблизительно 15 нг до приблизительно 60 нг на мл плазмы и минимальной концентрации (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) в плазме крови (Cmin) по меньшей мере 15 нг на мл плазмы в течение 8 часов.
В определенных вариантах осуществления ингибитором VMAT2 является тетрабеназин (TBZ); (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты; дейтерированный TBZ; дейтерированный (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты; (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ол ((+)α-HTBZ); или дейтерированный (+)α-HTBZ.
Упоминание концентрации (+)α-HTBZ в плазме в способах, представленных в настоящем описании, включает и дейтерированный (+)α-HTBZ, и недейтерированный (+)α-HTBZ. Специалисту в этой области очевидно, что, если индивидууму вводят дейтерированный ингибитор VMAT2, как представлено в настоящем описании (например, дейтерированный TBZ, дейтерированный (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты или дейтерированный (+)α-HTBZ), то дейтерированный (+)α-HTBZ будет появляться в плазме крови индивидуума и подлежит измерению. Если индивидууму вводят недейтерированный ингибитор VMAT2, как представлено в настоящем описании (например, TBZ, (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты, (+)α-HTBZ), то недейтерированный (+)α-HTBZ будет появляться в плазме крови индивидуума и подлежит измерению. Если индивидууму вводят комбинацию дейтерированных и недейтерированных ингибиторов VMAT2, как представлено в настоящем описании, то дейтерированный и недейтерированный (+)α-HTBZ будут появляться в плазме крови индивидуума и подлежат измерению.
В определенных вариантах осуществления Cmax (+)α-HTBZ составляет приблизительно 15 нг/мл, приблизительно 20 нг/мл, приблизительно 25 нг/мл, приблизительно 30 нг/мл, приблизительно 35 нг/мл, приблизительно 40 нг/мл, приблизительно 45 нг/мл, приблизительно 50 нг/мл, приблизительно 55 нг/мл или приблизительно 60 нг/мл плазмы. В определенных вариантах осуществления Cmin (+)α-HTBZ составляет по меньшей мере 15 нг/мл, по меньшей мере 20 нг/мл, по меньшей мере 25 нг/мл, по меньшей мере 30 нг/мл или по меньшей мере 35 нг/мл плазмы в течение 8 часов, 12 часов, 16 часов, 20 часов, 24 часов, 28 часов или 32 часов. В определенных вариантах осуществления Cmin (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 35 нг/мл.
В определенных вариантах осуществления настоящее изобретение относится к способу лечения гиперкинетических двигательных расстройств, включающих введение нуждающемуся в этом индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, представленный в настоящем описании, в количестве, достаточном для достижения максимальной концентрации (Cmax) (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) в плазме крови от приблизительно 15 нг до приблизительно 60 нг на мл плазмы и минимальной концентрации (Cmin) (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) в плазме крови по меньшей мере 15 нг на мл плазмы в течение 8 часов.
В определенных вариантах осуществления Cmax (+)β-HTBZ составляет приблизительно 15 нг/мл, приблизительно 20 нг/мл, приблизительно 25 нг/мл, приблизительно 30 нг/мл, приблизительно 35 нг/мл, приблизительно 40 нг/мл, приблизительно 45 нг/мл, приблизительно 50 нг/мл, приблизительно 55 нг/мл или приблизительно 60 нг/мл плазмы. В определенных вариантах осуществления Cmin (+)β-HTBZ составляет по меньшей мере 15 нг/мл, по меньшей мере 20 нг/мл, по меньшей мере 25 нг/мл, по меньшей мере 30 нг/мл или по меньшей мере, 35 нг/мл плазмы в течение 8 часов, 12 часов, 16 часов, 20 часов, 24 часов, 28 часов или 32 часов. В определенных вариантах осуществления Cmin (+)β-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 35 нг/мл.
В определенных вариантах осуществления ингибитор VMAT2 вводят в количестве, достаточном для i) достижения Cmax (+)α-HTBZ от приблизительно 15 нг до приблизительно 60 нг на мл плазмы и Cmin (+)α-HTBZ по меньшей мере 15 нг на мл плазмы в течение 8 часов; и/или ii) достижения Cmax (+)β-HTBZ от приблизительно 15 нг до приблизительно 60 нг на мл плазмы и Cmin (+)β-HTBZ по меньшей мере 15 нг на мл плазмы в течение 8 часов.
В варианте осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 33% Cmax в течение 24 часов. В другом варианте осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 50% Cmax в течение 24 часов. В конкретных вариантах осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 33%-50% Cmax в течение 24 часов.
В других конкретных вариантах осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 33% Cmax в течение 12 часов. В другом конкретном варианте осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 50% Cmax в течение 12 часов. В конкретных вариантах осуществления фармацевтическую композицию вводят в количестве, достаточном для обеспечения Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin приблизительно по меньшей мере 33%-50% Cmax в течение 12 часов.
В другом варианте осуществления фармацевтическую композицию вводят нуждающемуся в этом индивидууму в количестве, обеспечивающем Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin от приблизительно 5 нг/мл до приблизительно 30 нг/мл плазмы в течение 24 часов. В еще одном варианте осуществления фармацевтическую композицию вводят нуждающемуся в этом индивидууму в количестве, обеспечивающем Cmax (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) от приблизительно 15 нг/мл до приблизительно 60 нг/мл плазмы и Cmin от приблизительно 7,5 нг/мл до приблизительно 30 нг/мл плазмы в течение 24 часов.
В другом аспекте настоящее изобретение относится к способу лечения гиперкинетических двигательных расстройств, включающему введение нуждающемуся в этом индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, представленный в настоящем описании, в количестве, достаточном для обеспечения: (i) диапазона терапевтических концентраций от приблизительно 15 нг до приблизительно 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы; и (ii) пороговой концентрации по меньшей мере 15 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы в течение периода от приблизительно 8 часов до приблизительно 24 часов.
В определенных вариантах осуществления ингибитором VMAT2 является тетрабеназин (TBZ); (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты; дейтерированный TBZ; дейтерированный (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты; (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ол ((+)α-HTBZ); или дейтерированный (+)α-HTBZ.
В определенных вариантах осуществления диапазон терапевтических концентраций составляет от приблизительно 15 нг до приблизительно 35 нг, до приблизительно 40 нг, до приблизительно 45 нг, до приблизительно 50 нг или до приблизительно 55 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы.
В определенных вариантах осуществления пороговая концентрация (+)α-HTBZ составляет приблизительно 15 нг/мл, приблизительно 20 нг/мл, приблизительно 25 нг/мл, приблизительно 30 нг/мл, приблизительно 35 нг/мл, приблизительно 40 нг/мл, приблизительно 45 нг/мл, приблизительно 50 нг/мл, приблизительно 55 нг/мл или приблизительно 60 нг/мл плазмы в течение приблизительно 8 часов, приблизительно 12 часов, приблизительно 16 часов, приблизительно 20 часов, приблизительно 24 часов, приблизительно 28 часов или приблизительно 32 часов. В конкретном варианте осуществления пороговая концентрация (+)α-HTBZ составляет от приблизительно 15 нг/мл до приблизительно 35 нг/мл в течение периода от приблизительно 8 часов до приблизительно 24 часов.
В другом аспекте настоящее изобретение относится к способу лечения гиперкинетических двигательных расстройств, включающему введение нуждающемуся в этом индивидууму фармацевтической композиции, содержащей ингибитор VMAT2, представленный в настоящем описании, в количестве, достаточном для обеспечения: (i) диапазона терапевтических концентраций от приблизительно 15 нг до приблизительно 60 нг (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) на мл плазмы; и (ii) пороговой концентрации по меньшей мере 15 нг (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) на мл плазмы в течение периода от приблизительно 8 часов до приблизительно 24 часов.
В определенных вариантах осуществления диапазон терапевтических концентраций составляет от приблизительно 15 нг до приблизительно 35 нг, приблизительно 40 нг, приблизительно 45 нг, приблизительно 50 нг или приблизительно 55 нг (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) на мл плазмы.
В определенных вариантах осуществления пороговая концентрация (+)β-HTBZ составляет приблизительно 15 нг/мл, приблизительно 20 нг/мл, приблизительно 25 нг/мл, приблизительно 30 нг/мл, приблизительно 35 нг/мл, приблизительно 40 нг/мл, приблизительно 45 нг/мл, приблизительно 50 нг/мл, приблизительно 55 нг/мл или приблизительно 60 нг/мл плазмы в течение приблизительно 8 часов, приблизительно 12 часов, приблизительно 16 часов, приблизительно 20 часов или приблизительно 24 часов.
В определенных вариантах осуществления ингибитор VMAT2, представленный в настоящем описании, вводят в количестве, достаточном для обеспечения: A) (i) диапазона терапевтических концентраций от приблизительно 15 нг до приблизительно 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы; и (ii) пороговой концентрации по меньшей мере 15 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы в течение периода от приблизительно 8 часов до приблизительно 24 часов; и/или B) (i) диапазона терапевтических концентраций от приблизительно 15 нг до приблизительно 60 нг (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) на мл плазмы; и (ii) пороговой (или минимальной) концентрации по меньшей мере 15 нг (+)β-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)β-HTBZ) на мл плазмы в течение периода от приблизительно 8 часов до приблизительно 24 часов.
В конкретном варианте осуществления фармацевтическая композиция, используемая в способах, представленных в настоящем описании, содержит (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты. В более конкретном варианте осуществления соединение является дигидрохлоридной или дитозилатной солью.
В конкретном варианте осуществления индивидууму вводят суточную дозу от приблизительно 40 мг до приблизительно 80 мг (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты, который может являться дейтерированным или недейтерированным, в способах, представленных в настоящем описании. В более конкретном варианте осуществления индивидууму вводят суточную дозу приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг или приблизительно 80 мг (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты.
В другом варианте осуществления фармацевтическая композиция, используемая в способах, представленных в настоящем описании, содержит (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ол ((+)α-HTBZ), вводимый индивидууму в многократных дозах в течение суток и/или в виде состава с длительным высвобождением.
В другом варианте осуществления фармацевтическая композиция, используемая в способах, представленных в настоящем описании, содержит тетрабеназин (TBZ), вводимый индивидууму в многократных дозах в течение суток и/или в виде состава с длительным высвобождением.
В еще одном варианте осуществления фармацевтическая композиция, используемая в способах, представленных в настоящем описании, содержит d6-тетрабеназин (TBZ), вводимый индивидууму в многократных дозах в течение суток и/или в виде состава с длительным высвобождением.
Концентрации (+)α-HTBZ, (+)β-HTBZ и соединений, представленных в настоящем описании, в плазме можно измерять способами, описываемыми в Derangula et al, Biomedical Chromatography 2013 27(6): 792-801, Mehvar et al, Drug Metabolism and Distribution 1987 15(2): 250-55, и, как правило, посредством тандемной масс-спектроскопии.
Как представлено в настоящем описании, соединения, представленные в настоящем описании, и их соли могут снижать поступление моноаминов в центральную нервную систему посредством ингибирования изоформы 2 транспортера моноамина человека (VMAT2). В связи с этим, эти соединения и их соли могут обладать применимостью в широком диапазоне терапевтического применения, и их можно использовать для лечения множества нарушений, вызываемых или связанных с ингибированием изоформы 2 транспортера моноамина человека. Эти нарушения включают гиперкинетические расстройства. В варианте осуществления состояния, которые можно лечить посредством соединений, представленных в настоящем описании, включают, в качестве неограничивающих примеров, гиперкинетические расстройства, такие как хорея Гентингтона, поздняя дискинезия, синдром Туретта, дистония, гемибализм, хорея и тики. В определенных вариантах осуществления гиперкинетические расстройства, подвергаемые лечению посредством соединений, представленных в настоящем описании, способами, представленными в настоящем описании, не включают хорею Гентингтона.
Соединения, представленные в настоящем описании, можно синтезировать известными способами органического синтеза, описываемыми в этой области. См. например, патент США № 8039627, в котором описывают общие схемы синтеза и способы синтеза конкретных соединений, включающих (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты (называемый "2-1" в патенте США № 8039627).
Соединения, представленные в настоящем описании, как правило, можно использовать в виде свободной кислоты или свободного основания. Альтернативно, соединения можно использовать в форме кислых или основных солей присоединения. Кислые соли присоединения свободных амино-соединений можно получать способами, хорошо известными в этой области, и их можно получать из органических и неорганических кислот. Подходящие органические кислоты включают малеиновую, фумаровую, бензойную, аскорбиновую, янтарную, метансульфоновую, уксусную, трифторуксусную, щавелевую, пропионовую, винную, салициловую, лимонную, глюконовую, молочную, миндальную, коричную, аспарагиновую, стеариновую, пальмитиновую, гликолевую, глутаминовую и бензолсульфоновую кислоты. Подходящие неорганические кислоты включают соляную, бромистоводородную, серную, фосфорную и азотную кислоты. Основные соли присоединения включают соли, образованные с карбоксилатным анионом, и включают соли, образованные с органическими и неорганическими катионами, такими как выбранные из щелочных и щелочноземельных металлов (например, лития, натрия, калия, магния, бария и кальция), а также иона аммония и его замещенных производных (например, дибензиламмония, бензиламмония, 2-гидроксиэтиламмония и т.п.). Таким образом, термин "фармацевтически приемлемая соль" соединений, представленных в настоящем описании, предназначен для включения любых и всех приемлемых форм солей.
Что касается стереоизомеров, соединения, представленные в настоящем описании, могут иметь хиральные центры и могут находиться в виде рацематов, рацемических смесей и отдельных энантиомеров или диастереомеров. Все такие изомерные формы включены в настоящее изобретение, включая их смеси. Кроме того, некоторые из кристаллических форм соединений могут существовать в виде полиморфов, предусмотренных в настоящем описании. Кроме того, некоторые из соединений также могут образовывать сольваты с водой или другими органическими растворителями. Такие сольваты аналогично включены в объем соединений, представленных в настоящем описании.
Как будет понятно специалисту в этой области, любое из указанных выше соединений может включать радиоактивные изотопы. Таким образом, также предусмотрено использование меченых изотопами соединений, идентичных представленным в настоящем описании, где один или несколько атомов заменяют атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, как правило, обнаруживаемого в природе. Примеры изотопов, которые можно включать в эти соединения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, в качестве неограничивающих примеров, такие как, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Конкретные меченые изотопами соединения, например, те, в которые включают радиоактивные изотопы, такие как 3H и 14C, также применимы в анализах распределения лекарственного средства или субстрата в ткани. Изотопы тритированного водорода (3H) и углерода-14 (14C) являются особенно предпочтительными за простоту их получения и выявляемость. Замена более тяжелыми изотопами, такими как дейтерий (2H), может обеспечивать конкретные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например, повышенного времени полужизни in vivo или сниженных требований к дозе, и, таким образом, в некоторых обстоятельствах может являться предпочтительным. Меченые изотопами соединения, как правило, можно получать, осуществляя способы, общепринято практикуемые в этой области.
При введении в соответствии с существующими протоколами тетрабеназин вызывает эффекты, главным образом, в отношении ЦНС (например, сонливость, головокружение, акатизию (беспокойное движение), сонливость, утомляемость, повышенную возбудимость, бессонницу, тревожность, паркинсонизм и депрессию), являющиеся результатом нейрональное истощение моноаминов. Эффекты тетрабеназина являются обратимыми и, таким образом, временными. У людей тетрабеназин быстро метаболизируется до его активного метаболита HTBZ таким образом, что системное воздействие тетрабеназина является практически незначительным. Восстановление тетрабеназина до HTBZ катализируется карбонилредуктазами и является крайне изменчивым, и HTBZ имеет короткое время полужизни. Это приводит к потребности в индивидуализированной схеме дозирования (от 12,5 до 225 мг/сутки, вводимых 1-3 раза в день). Как представлено в настоящем описании, HTBZ, образующийся из тетрабеназина, является смесью четырех стереоизомеров, приводящих к различным фармакологическим свойствам посредством связывания нецелевых рецепторов (см., например, Kilbourn et al., 1995 выше). Однако практическим ограничением является 100 мг/кг/сутки, т.к. FDA требует тестирование CYP2D6 для доз более 50 мг (см. вкладыш в упаковку ксеназина, Biovail Laboratories International, 2009).
NBI-98854 ((2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты) и его фармацевтически приемлемые соли являются перорально активным валиновым сложным эфиром ингибитора везикулярного транспортера моноаминов 2 (VMAT2) ((+) альфа-HTBZ) и созданы для доставки [+]α-HTBZ контролируемым образом со сниженными пиковыми концентрациями в плазме и фармакокинетической (PK) вариабельностью, предназначенной для ограничения нецелевого связывания, и чтобы сделать возможным улучшенный профиль безопасности у людей.
Селективное воздействие на VMAT2 и фармакокинетический профиль активного метаболита [+]α-HTBZ, по-видимому, обеспечивают предпочтительную и дозозависимую модуляцию высвобождения дофамина без доказательств значительного истощения серотонина, норэпинефрина или гистамина. Это должно быть возможным при введении в комбинации с имеющимся антипсихотическим лекарственным средством пациента или независимо у пациентов, прием антипсихотического лекарственного средства которыми был прекращен.
Как понятно специалисту в области медицины, термины "лечить" и "лечение" относятся к медицинскому контролю заболевания, нарушения или состояния индивидуума (т.е. пациента) (см., например, медицинский словарь Стедмана). Термин "лечение" включает превентивное, т.е. профилактическое, или терапевтическое, т.е. радикальное и/или паллиативное, лечение. Таким образом, термин "лечение" включает терапевтическое лечение пациентов, имеющих уже развившееся состояние, в частности, в манифестировавшей форме. Терапевтическое лечение может являться симптоматическим лечением для облегчения симптомов конкретного показания или этиологического лечения для реверсирования или частичного реверсирования состояний показания или для прекращения или замедления прогрессирования заболевания. Таким образом, композиции и способы, представленные в настоящем описании, можно использовать, например, в виде терапевтического лечения в течение периода времени, а также для продолжительной терапии. Кроме того, термин "лечение" включает профилактическое лечение, т.е. лечение пациентов, имеющих риск развития указанного выше состояния, и, таким образом, снижение риска.
Индивидуум, нуждающийся в композициях и способах, представленных в настоящем описании, включает индивидуума, которому диагноз гиперкинетического расстройства (например, поздней дискинезии) поставил специалист в области медицины и психиатрии. Индивидуум (или пациент), подлежащий лечению, может являться млекопитающим, включая человека или не являющегося человеком примата. Млекопитающее может являться одомашненным животным, таким как кошка или собака.
Терапевтическая и/или профилактическая польза включает, например, улучшенный клинический исход, терапевтическое лечение и профилактические меры, где целью является предотвращение, или замедление, или снижение нежелательного физиологического изменения или нарушения, или предотвращение, или замедление, или снижение развития или тяжести такого нарушения. Профилактическое введение композиции по настоящему изобретению можно начинать после первого лечения блокаторами дофаминовых рецепторов, такими как нейролептики. Как представлено в настоящем описании, благоприятные или желаемые клинические результаты лечения индивидуума включают, в качестве неограничивающих примеров, ослабление, снижение или облегчение симптомов, являющихся результатом или ассоциированных с заболеванием, состоянием или нарушением, подлежащим лечению; сниженную частоту симптомов; улучшенное качество жизни; более длительный статус без заболевания (т.е. снижение вероятности или склонности к тому, что у индивидуума будут присутствовать симптомы, на основе которых диагностируют заболевание); уменьшение степени заболевания; стабилизированное (т.е. не ухудшающееся) состояние заболевания; задержку или замедление прогрессирования заболевания; улучшение или облегчение состояния заболевания; и ремиссию (частичную или полную), детектируемую или недетектируемую; и/или общую выживаемость. Термин "лечение" также может означать пролонгированную выживаемость по сравнению с ожидаемой выживаемостью в случае отсутствия лечения индивидуума. Индивидуумы, нуждающиеся в лечении, включают индивидуумов, уже имеющих состояние или нарушение, а также индивидуумов, склонных или имеющих риск развития заболевания, состояния или нарушения (например, TD или других состояний или нарушений, представленных в настоящем описании), и индивидуумов, у которых заболевание, состояние или нарушение подлежит профилактике (т.е. снижению вероятности возникновения заболевания, нарушения или состояния). Терапевтически эффективное количество любого из соединений, представленных в настоящем описании, является количеством соединения, обеспечивающим статистически или клинически значимую терапевтическую и/или профилактическую пользу индивидууму, подвергаемому лечению.
Специалист в области медицины и клинической области рутинно практикует способы определения эффективности терапевтического средства для лечения гиперкинетического расстройства. В качестве примера, индивидуума с гиперкинетическим расстройством можно подвергать диагностике, мониторировать и оценивать по Шкале патологических непроизвольных движений (AIMS). AIMS представляет собой структурированное неврологическое обследование, разработанное в 1976 году, и его широко используют в оценке двигательных нарушений. Она состоит из семи отдельных оценок регионарных непроизвольных движений тела, оцениваемых по шкале от ноля до четырех, где ноль оценивают как отсутствие, а четыре оценивают как тяжелые.
Фармацевтические композиции
Настоящее изобретение дополнительно относится к фармацевтическим композициям, содержащим любое из соединений ингибиторов VMAT2, представленных в настоящем описании, и фармацевтически приемлемый эксципиент для применения в способах лечения гиперкинетического расстройства. Фармацевтически приемлемый эксципиент является физиологически и фармацевтически подходящим нетоксичным и неактивным материалом или ингредиентом, не противодействующим активности активного ингредиента; эксципиент также можно называть носителем. Способы составления и эксципиенты, представленные в настоящем описании, являются примерами и не ограничивают изобретение каким-либо образом. Фармацевтически приемлемые эксципиенты хорошо известны в области фармацевтики, и их описывают, например, в Rowe et al., Handbook of Pharmaceutical Excipients: A Comprehensive Guide to Uses, Properties, and Safety, 5th Ed., 2006, and in Remington: The Science and Practice of Pharmacy (Gennaro, 21st Ed. Mack Pub. Co., Easton, PA (2005)). Примеры фармацевтически приемлемых эксципиентов включают стерильный физиологический раствор и фосфатно-солевой буфер при физиологическом pH. Консерванты, стабилизаторы, красители, буферы и т.п. можно предоставлять в фармацевтической композиции. Кроме того, также можно использовать антиоксиданты и суспендирующие средства.
В случае композиций, составляемых в форме жидких растворов, приемлемые носители и/или растворители включают физиологический раствор и стерильную воду и, необязательно, могут включать антиоксиданты, буферы, бактериостатические средства и другие общепринятые добавки. Композиции также можно составлять в виде пилюль, капсул, гранул или таблеток, содержащих, в дополнение к ингибитору VMAT2, дилюенты, диспергирующие средства и поверхностно-активные средства, связывающие средства и смазочные средства. Специалист в этой области может дополнительно составлять ингибитор VMAT2 подходящим образом и в соответствии с общепринятой практикой, такой, как описывают в Remington, выше.
Другой вариант осуществления относится к способу лечения нарушений центральной или периферической нервной системы. Такие способы включают введение соединения по настоящему изобретению теплокровному животному в количестве, достаточном для лечения состояния. В этом контексте, термин "лечить" включает профилактическое введение. Такие способы включают системное введение ингибитора VMAT2, представленного в настоящем описании, предпочтительно, в форме фармацевтической композиции, как указано выше. Как применяют в настоящем описании, системное введение включает пероральные и парентеральные способы введения. В случае перорального введения подходящие фармацевтические композиции включают порошки, гранулы, пилюли, таблетки и капсулы, а также жидкости, сиропы, суспензии и эмульсии. Эти композиции также могут включать ароматизаторы, консерванты, суспендирующие средства, загустители и эмульгаторы и другие фармацевтически приемлемые добавки. В случае парентерального введения соединения по настоящему изобретению можно получать в водных растворах для инъекций, которые могут содержать, в дополнение к ингибитору VMAT2, буферы, антиоксиданты, бактериостатические средства и другие добавки, общепринято используемые в таких растворах.
Как представлено в настоящем описании, оптимальные дозы, как правило, определяют с использованием экспериментальных моделей и/или клинических испытаний. Оптимальная доза может зависеть от массы тела, объема крови или других индивидуальных характеристик индивидуума. Например, специалист в области медицины может учитывать состояние индивидуума, т.е. стадию заболевания, тяжесть симптомов, вызываемых заболеванием, общее состояние здоровья, а также возраст, пол и массу и другие факторы, очевидные специалисту в области медицины. В основном, количество соединения, представленного в настоящем описании, присутствующего в дозе, находится в диапазоне от приблизительно 0,1 мг до приблизительно 2 мг на кг массы индивидуума. В определенных вариантах осуществления суточная доза составляет приблизительно 10-150 мг. Как правило, предпочтительным является использование минимальной дозы, достаточной для обеспечения эффективной терапии. Как правило, индивидуумов можно мониторировать на предмет терапевтической эффективности посредством клинической оценки и с использованием анализов, подходящих для состояния, подвергаемого лечению или профилактике, где способы (например, оценка AIMS) будут знакомы специалисту в этой области и представлены в настоящем описании. Концентрацию соединения, вводимого индивидууму, можно мониторировать посредством определения концентрации соединения в биологической жидкости, например, в крови, фракции крови (например, плазме, сыворотке) и/или в моче и/или другом биологическом образце от индивидуума. Для измерения концентрации соединения в течение осуществления схемы лечения можно использовать любой способ, практикуемый в этой области для детекции соединения.
В этой области известны составы тетрабеназина и d6-тетрабеназина с длительным высвобождением. Фармацевтические композиции с длительным высвобождением описывают в публикациях PCT №№ WO 2010/018408, WO 2011/019956 и WO2014/047167.
Фармацевтические композиции, представленные в настоящем описании, содержащие по меньшей мере одно из соединений ингибиторов VMAT2, представленных в настоящем описании, можно вводить нуждающемуся в этом индивидууму одним из нескольких путей, посредством которых эффективно доставляют эффективное количество соединения. Такие пути введения включают, например, пероральный, парентеральный, энтеральный, ректальный, интраназальный, буккальный, сублингвальный, внутримышечный и трансдермальный.
ПРИМЕРЫ
ПРИМЕР 1
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ НА ЛЮДЯХ - NBI-98854
Клинические данные об индивидуумах с TD, которым вводили повторные дозы (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты от 12,5 мг до 100 мг в сутки, свидетельствуют о том, что лекарственное средство, как правило, хорошо переносилось. Эффективность связана с концентрациями активного метаболита [+]α-дигидротетрабеназина. Анализ воздействия-ответа показывает, что концентрация 30 нг/мл в плазме является подходящей целью. Воздействие выше 60 нг/мл в плазме делает возможным небольшое увеличение пользы, но повышает риск побочных эффектов, отражающих расширение фармакологических свойств VMAT2. Воздействие ниже 15 нг/мл является субоптимальным в общей популяции пациентов с TD.
Наблюдаемое воздействие и баллы по Шкале патологических непроизвольных движений (AIMS), полученные с помощью оценки видео из клинического исследования фазы 2 (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты, использовали для разработки взаимосвязи воздействие-ответ. Всего 96 пациентов случайным образом распределяли по группам, которым вводили плацебо (N=41) и (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты (25 мг, 50 мг или 75 мг, N=45). Тридцать восемь пациентов, которым вводили (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты, имели доступные данные PK для метаболита [+]α-дигидротетрабеназина. Таким образом, в анализе воздействие-AIMS использовали данные всего 79 (41, которому вводили плацебо, и 38, которым вводили лекарственное средство) пациентов. Баллы AIMS, полученные при оценке видео, были доступны на исходном уровне и на неделе 6 для каждого пациента. Процент изменения на неделе 6 относительно исходного уровня служил в качестве меры ответа. Концентрация [+]α-дигидротетрабеназина на неделе 6, анализируемая приблизительно в момент Tmax, была доступна для каждого пациента и эту равновесную Cmax использовали в качестве меры воздействия.
Пациентов, имевших измеримые концентрации [+]α-дигидротетрабеназина, делили на квартили в зависимости от равновесной Cmax на неделе 6. Для каждой квартили вычисляли снижение средней равновесной Cmax и средних баллов AIMS относительно исходного уровня. Эти квартили сравнивали с пациентами, которым вводили плацебо, как показано в следующей таблице.
(равновесная Cmax, нг/мл [+]α-HTBZ)
(неделя 6 по сравнению с исходным уровнем)
Как можно видеть, AIMS пациентов, которым вводили плацебо, на неделе 6, по существу, была схожей с исходным уровнем. Первая квартиль пациентов (пациенты, демонстрировавшие наименьшую равновесную Cmax [+]α-HTBZ на неделе 6 независимо от вводимой дозы NBI-98854) демонстрировала среднюю равновесную Cmax [+]α-HTBZ приблизительно 15 нг/мл и умеренное снижение AIMS приблизительно 33%. Следующая квартиль пациентов демонстрировала среднюю равновесную Cmax [+]α-HTBZ приблизительно 29 нг/мл и максимальное снижение AIMS приблизительно 70% относительно исходного уровня. Пациенты, достигавшие наибольших концентраций [+]α-HTBZ в следующих 2 квартилях, не достигали какого-либо более значительного снижения симптомов TD, измеряемого по снижению средних баллов AIMS по сравнению с пациентами из 2-ой квартили.
ПРИМЕР 2
ПОДДЕРЖАНИЕ ПОРОГОВОЙ КОНЦЕНТРАЦИИ [+]Α-HTBZ В ПЛАЗМЕ У ПАЦИЕНТОВ, КОТОРЫХ ЛЕЧИЛИ NBI-98854
NBI-98854 вводили перорально один раз в сутки в дозе 50 мг или 100 мг в течение 8 дней пациентам в когорте, которой вводили многократные дозы (n=13 в группе, которой вводили дозу 50 мг; n=4 в группе, которой вводили дозу 100 мг). Данные для отдельных индивидуумов о концентрации (+)α-HTBZ в плазме собирали в запланированные моменты времени после введения дозы (0 часов, 2 часа, 4 часа, 6 часов, 8 часов, 12 часов, 16 часов, 24 часа, 48 часов, 96 часов и 120 часов) в день 8 и представляли в виде данных о средней концентрации в плазме (линейная шкала) (см. фигуру 1). В день 8 медиана времени до Tmax для (+)α-HTBZ составляла приблизительно 4,0 часов для обеих доз. После достижения максимальной концентрации (Cmax) концентрации (+)α-HTBZ в плазме, по-видимому, снижались и демонстрировали кажущееся t1/2 приблизительно 21 часов (доза 50 мг) и приблизительно 19 часов (доза 100 мг). Как показано на фигуре 1, посредством дозы 50 мг NBI-98854, по-видимому, поддерживали желаемый диапазон терапевтических концентраций от приблизительно 15 до приблизительно 60 нг (+)α-HTBZ на мл плазмы выше пороговой концентрации приблизительно 15 нг/мл в течение периода от приблизительно 8 до приблизительно 24 часов.
По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.C. 119(e) по предварительной заявке США № 61/989240, зарегистрированной 6 мая 2014 года, включенной в настоящее описание в качестве ссылки в полном объеме.
Различные варианты осуществления, описываемые выше, можно комбинировать для получения дополнительных вариантов осуществления. Все патенты США, публикации патентных заявок США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, указанные в настоящем описании и/или приведенные в Перечне технических характеристик, включены в настоящее описание в качестве ссылок в полном объеме. Аспекты вариантов осуществления, при необходимости, можно модифицировать для использования концепций различных патентов, заявок и публикаций для получения дополнительных вариантов осуществления.
Можно осуществлять эти и другие изменения вариантов осуществления в свете приведенного выше подробного описания. В целом, в следующей ниже формуле изобретения используемые термины не следует истолковывать как ограничение формулы изобретения конкретными вариантами осуществления, представленными в описании и формуле изобретения, а следует истолковывать их как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, к которым такие пункты формулы изобретения применимы. Таким образом, формула изобретения не ограничена описанием.
Изобретение относится к области медицины и предназначено для лечения поздней дискинезии у индивидуума. Индивидууму вводят соединение (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемую соль в суточной дозе 40 мг или 80 мг в расчете на свободное основание. Изобретение обеспечивает Cmax от 15 нг до 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы в течение 8 часов. 20 з.п. ф-лы, 1 ил., 1 табл., 2 пр.
1. Способ лечения поздней дискинезии у индивидуума, включающий введение индивидууму, нуждающемуся в этом лечении, соединения (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемой соли в суточной дозе 40 мг или 80 мг в расчете на свободное основание,
где введение (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемой соли обеспечивает Cmax от 15 нг до 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы в течение 8 часов.
2. Способ по п.1, в котором указанное введение приводит в результате к снижению баллов у индивидуума по Шкале патологических непроизвольных движений (AIMS) по сравнению с баллами AIMS у индивидуума относительно исходного уровня.
3. Способ по п.2, в котором индивидуум показывал снижение балов по AIMS по меньшей мере 33%.
4. Способ по п.1, в котором (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты вводят в суточной дозе 40 мг в расчете на свободное основание.
5. Способ по п.1, в котором (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-иловый сложный эфир (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемую соль вводят в суточной дозе 80 мг в расчете на свободное основание.
6. Способ по п.1, в котором введение (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемой соли обеспечивает Cmin по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 8 часов.
7. Способ по п.1, в котором введение (2R,3R,11bR)-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-илового сложного эфира (S)-2-амино-3-метил-масляной кислоты или его фармацевтически приемлемой соли обеспечивает Cmax от 15 нг до 60 нг (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) (+)α-3-изобутил-9,10-диметокси-1,3,4,6,7,11b-гексагидро-2H-пиридо[2,1-a]изохинолин-2-ола ((+)α-HTBZ) на мл плазмы и Cmin по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 8 часов.
8. Способ по п.1, в котором Cmin составляет 15 нг, 20 нг, 25 нг, 30 нг, 35 нг, 40 нг, 45 нг, 55 нг или 60 нг (+)α-HTBZ на мл плазмы.
9. Способ по п.6, в котором Cmin составляет по меньшей мере 20 нг (+)α-HTBZ на мл плазмы.
10. Способ по п.6, в котором Cmin составляет по меньшей мере 25 нг (+)α-HTBZ на мл плазмы.
11. Способ по п.6, в котором Cmin составляет по меньшей мере 30 нг (+)α-HTBZ на мл плазмы.
12. Способ по п.6, в котором Cmin составляет по меньшей мере 35 нг (+)α-HTBZ на мл плазмы.
13. Способ по п.6, в котором Cmin составляет от 15 нг до 35 нг (+)α-HTBZ на мл плазмы.
14. Способ по п.6, в котором Cmin составляет по меньшей мере 15 нг/мл на мл плазмы в течение 12 часов.(+)α-HTBZ
15. Способ по п.6, в котором Cmin составляет по меньшей мере 15 нг на мл плазмы (+)α-HTBZ на мл плазмы в течение 16 часов.
16. Способ по п.6, в котором Cmin составляет по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 20 часов.
17. Способ по п.6, в котором Cmin составляет по меньшей мере 15 нг (+)α-HTBZ на мл плазмы в течение 24 часов.
18. Способ по п.6, в котором Cmin составляет от 15 нг до 35 нг (+)α-HTBZ на мл плазмы в течение 12 часов.
19. Способ по п.6, в котором Cmin составляет от 15 нг до 35 нг (+)α-HTBZ на мл плазмы в течение 16 часов.
20. Способ по п.6, в котором Cmin составляет от 15 нг до 35 нг (+)α-HTBZ на мл плазмы в течение 20 часов.
21. Способ по п.6, в котором Cmin составляет от 15 нг до 35 нг (+)α-HTBZ на мл плазмы в течение 24 часов.
| Способ получения продуктов превращения эргостерина | 1927 |
|
SU18378A1 |
| WO 2014047167 A1, 27.03.2014 | |||
| WO 2011153157 A2, 08.11.2011 | |||
| WO 2008058261 A2, 15.05.2008 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
Авторы
Даты
2021-08-23—Публикация
2015-05-06—Подача