ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет предварительной заявки на патент США №62/344347, поданной 1 июня 2016 года, которая полностью включена в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к области фармацевтических и вакцинных составов. Более конкретно, варианты реализации, описанные в настоящем документе, относятся к наноалюмочастицам, композициям, содержащим наноалюмочастицы, и способам получения и применения наноалюмочастиц.
УРОВЕНЬ ТЕХНИКИ
[0003] Соли алюминия (в совокупности называемые алюминиевые квасцы) применяют в вакцинах в течение более чем восьми десятилетий благодаря хорошему профилю безопасности и способности индуцировать усиленный иммунный ответ на адсорбированные вакцинные антигены [1, 2]. Будучи одним из немногих классов адъювантов, одобренных Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA), соли алюминия имеют установленный регуляторный путь в отличие от более новых адъювантных составов [1]. При диспергировании в водном растворе соли алюминия образуют гетерогенные агрегированные частицы с размером ~0,5-10 микрон (мкм), что затрудняет контроль их качества по сравнению с составами с монодисперсным размером совокупности частиц, такими как эмульсии типа «масло-вводе». Эта сложность усугубляется тем фактом, что доступно несколько типов солей алюминия с различными свойствами, включая фосфат алюминия, гидроксифосфат сульфат алюминия и оксигидроксид алюминия.
[0004] В нескольких исследованиях было выдвинуто предположение, что средний размер частиц адъювантного состава является существенным фактором, который может оказывать отрицательное влияние на биологическую активность вакцины (1). В последнее время применяют новые синтетические подходы, основанные на использовании солей алюминия для изготовления de novo новых синтетических составов, содержащих наночастицы алюминиевых квасцов. Сообщалось, что такие синтетические наночастицы вызывают более сильный иммунный ответ, уменьшая при этом воспаление в месте инъекции, по сравнению с микрочастицами [1, 4, 5]. Тем не менее, в каждом из этих исследований для изготовления частиц алюминия применяли синтетический подход с увеличением размеров (bottom-up) и не проводили сравнения с клиническими адъювантами на основе солей алюминия, такими как Alhydrogel®, что затрудняет интерпретацию данных о значимости новых составов по сравнению с клинически одобренным материалом.
[0005] Помимо этого, исходя из требований регуляторных органов, клинические микрочастицы на основе алюминия не поддаются окончательной стерилизации путем фильтрации через фильтры с размером пор 0,45 или 0,20 мкм и могут быть стерилизованы только облучением или в автоклаве, поэтому при их изготовлении невозможно применять этап окончательной стерилизации при комбинировании с антигенами или адъювантами. Существует потребность в обеспечении наночастиц на основе алюминия, которые проявляют сниженную агрегацию или не склоны к агрегации и могут быть окончательно стерилизованы перед внесением во флаконы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к наноалюмочастицам, композициям, содержащим наноалюмочастицы, и способам получения и применения наноалюмочастиц. Наноалюмочастицы можно применять в области фармацевтических и/или вакцинных составов. Настоящее изобретение относится к композициям (включая составы), содержащим множество наноалюмочастиц, содержащих соль алюминия и агент, регулирующий размер, причем размер частиц в композиции составляет менее 1 мкм. В настоящем документе термин «наноалюмочастица» используется для обозначения того, что частица содержит алюминий и имеет размер, измеренный в нанометрах, как правило, от 1 нм до приблизительно 450 нм. Согласно некоторым вариантам реализации настоящего изобретения композиция предназначена для окончательной стерилизации путем фильтрации для продуктов в соответствии с регламентом FDA (например, с применением фильтра с размером пор ≤0,45 микрон). Согласно некоторым вариантам реализации настоящего изобретения размер частиц, присутствующих в композиции, находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции находится в диапазоне от приблизительно 1 до приблизительно 450 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции находится в диапазоне от приблизительно 1 нм до приблизительно 200 нм. Композиции наноалюмочастиц, описанные в настоящем документе, могут быть получены путем обработки или измельчения гидроксида алюминия в присутствии агента, регулирующего размер, с применением стандартных методик, известных в данной области техники, включая, но не ограничиваясь ими, микрофлюидизацию, обработку ультразвуком и смешивание с высоким усилием сдвига. Смешивание с высоким усилием сдвига может быть выполнено с использованием смесителя с высоким усилием сдвига. Одной из компаний, производящих смесители с высоким усилием сдвига, которые можно применять в способах согласно настоящему изобретению, является Silverson.
[0007] Наноалюмочастицы в композициях являются стабильными и не склонны к агрегации, или проявляют незначительную или сниженную агрегацию, и могут быть подвергнуты этапу окончательной стерилизации перед внесением во флаконы. Наноалюмочастицы согласно настоящему изобретению можно применять для доставки индивидууму агента, такого как полипептид или полинуклеотид. Исключительно в качестве примера, наноалюмочастицы согласно настоящему изобретения можно применять для доставки в организм хозяина антигенов и/или адъювантов для того чтобы вызвать иммунный ответ.
[0008] Настоящее изобретение относится к наноалюмочастице, содержащей: (а) соль алюминия; и (b) агент, регулирующий размер; причем размер частицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
[0009] Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц представляет собой Z-среднее значение, определенное методом динамического рассеяния света (ДРС).
[00010] Согласно некоторым вариантам реализации настоящего изобретения соль алюминия выбрана из группы, состоящей из гидроксида алюминия, геля гидроксида алюминия, AlPO4, AlO(ОН), Al(ОН)(PO4) и KAl(SO4)2.
[00011] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, выбран из агентов, регулирующих размер, представленных в таблице 1. Агент, регулирующий размер, может быть выбран из группы, состоящей из полиакриловой кислоты (ПАК), полиэтиленгликоля (ПЭГ) и ПЭГ, соединенного с липидом. Агент, регулирующий размер, может быть выбран из группы, состоящей из хитозана, декстрана (например, сульфата декстрана) или полиаллиламина. Агент, регулирующий размер, может быть выбран из группы, состоящей из ПАК, ПЭГ, ПЭГ, соединенного с липидом, хитозана, сульфата декстрана или полиаллиламина.
[00012] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, соединенный с фосфолипидом. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, соединенный с липидом (необязательно фосфолипидом), и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения липид выбран из группы, состоящей из DSPE, DPPE и DMPE. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПАК, и средняя молекулярная масса ПАК находится в диапазоне от приблизительно 750 дальтон до приблизительно 7000 дальтон.
[00013] В том случае, если агент, регулирующий размер, представляет собой хитозан, он может представлять собой низкомолекулярный хитозан (например, молекулярная масса от приблизительно 15 кДа до приблизительно 190 кДа), среднемолекулярный хитозан (например, молекулярная масса от приблизительно 190 кДа до приблизительно 700 кДа) или высокомолекулярный хитозан (например, молекулярная масса от приблизительно 700 кДа до приблизительно 1000 кДа). Степень деацетилирования хитозана (DDA) будет варьироваться в зависимости от способа очистки и условий реакции. Степень деацетилирования хитозана обычно находится в диапазоне от приблизительно 40% до приблизительно 90%, причем коммерчески доступные хитозаны, как правило, имеют DDA от приблизительно 70% до приблизительно 90%, однако хитозаны с DDA более 90% или ниже 40%, а также хитозаны с DDA от приблизительно 40% до приблизительно 90%, предпочтительно от приблизительно 70% до приблизительно 90% можно применять в способах согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере одну первичную аминогруппу на углероде С2 хитозана можно применять в качестве сайта для ковалентной конъюгации. Соответственно, в настоящем документе термин хитозан включает конъюгаты хитозана, включая, но не ограничиваясь ими, маннозилированный хитозан или флуоресцентномеченый хитозан. Хитозан для применения в способах согласно настоящему изобретению коммерчески доступен из многих источников, включая SIGMA-ALDRICH™.
[00014] В том случае, если агент, регулирующий размер, представляет собой декстран, он может представлять собой любой из декстранов класса 1, 2 или 3, имеющих молекулярную массу равную или превышающую 1000 дальтон. Особенно предпочтительным декстраном для применения в качестве агента, регулирующего размер, является сульфат декстрана. Сульфат декстрана, как правило, продается в виде его натриевой соли, соответственно, в настоящем документе термин «сульфат декстрана» также включает его солевые формы, включая формы его натриевой соли. Как и в случае хитозана, если агент, регулирующий размер, представляет собой сульфат декстрана, он может представлять собой низкомолекулярный (например, от 5000 до 100 кДа), среднемолекулярный (например, от 100 кДа до 500 кДа) или высокомолекулярный сульфат декстрана (например, от 500 кДа до 1000 кДа или даже 2000 кДа). Предпочтительный сульфат декстрана имеет молекулярную массу от приблизительно 20 кДа до приблизительно 80 кДа.
[00015] Полиаллиламин представляет собой водорастворимый катионный полимер со свободными первичными аминогруппами, который можно применять в качестве агента, регулирующего размер, описанного в настоящем документе. Полиаллиламин предпочтительно имеет молекулярную массу от приблизительно 5 кДа до приблизительно 100 кДа, наиболее предпочтительно от приблизительно 5 кДа до приблизительно 50 кДа, наиболее предпочтительно от приблизительно 5 кДа до приблизительно 25 кДа. Можно применять как свободную основную форму полиаллиламина, так и любую из его солевых форм (например, соль соляной кислоты). Специалист в данной области техники поймет, что полимеры полиаллиламина с молекулярными массами более 100 кДа можно применять в способах, описанных в настоящем документе, и помимо этого при использовании солевой формы полиаллиламина ее молекулярная масса будет увеличиваться.
[00016] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица находится в жидком составе, который стерилизован фильтрованием. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица стабильна в жидком составе при температуре от 0°С до 8°С в течение по меньшей мере приблизительно 1 месяца, по меньшей мере приблизительно 6 месяцев или по меньшей мере приблизительно 1 года. Согласно некоторым вариантам реализации настоящего изобретения наночастица стабильна в жидком составе при температуре приблизительно 37°С в течение по меньшей мере приблизительно 1 месяца. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, ассоциирован с солью алюминия.
[00017] Настоящее изобретение относится к способу получения наноалюмочастицы, включающему воздействие на соль алюминия источником высокой энергии в присутствии агента, регулирующего размер, что приводит к получению наноалюмочастицы, причем размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
[00018] Специалист в данной области техники поймет, что наноалюмочастицы согласно настоящему изобретению могут быть получены из более крупных частиц микронного размера. Соответственно, настоящее изобретение относится к способу получения описанных наноалюмочастиц из частиц-предшественников солей алюминия, размер которых составляет от 0,5 мкм до 20 мкм или от 0,5 мкм до 10 мкм.
[00019] Настоящее изобретение относится к способу получения наноалюмочастицы, включающему (а) воздействие на соль алюминия источником высокой энергии с получением наноалюмочастицы, размер которой находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм, и (b) смешивание агента, регулирующего размер, с указанной наноалюмочастицей в течение приблизительно 30 минут после этапа (а).
[00020] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии получают с применением микрофлюидизатора, экструдера, соникатора, смесителя с высоким усилием сдвига (например, смесителя Silverson) или гомогенизатора. Можно применять два или более источников высокой энергии. Например, источник высокой энергии может быть создан из микрофлюидизатора и смесителя с высоким усилием сдвига, и смесь, содержащая соль алюминия и агент, регулирующий размер, может быть пропущена через микрофлюидизатор один или более раз (например, от одного раза до примерно 30 или более раз). Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии получают с применением микрофлюидизатора, и смесь, содержащая соль алюминия и агент, регулирующий размер, пропускают через микрофлюидизатор от одного раза до примерно 15 раз. Согласно некоторым вариантам реализации настоящего изобретения соль алюминия выбрана из группы, состоящей из гидроксида алюминия, геля гидроксида алюминия, AlPO4, AlO(ОН), Al(ОН)(PO4) и KAl(SO4)2. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, выбран из группы, состоящей из ПАК, ПЭГ и ПЭГ, соединенного с липидом. Согласно другому варианту агент, регулирующий размер, может быть выбран из агента, регулирующего размер, указанного в таблице 1, или из хитозана, декстрана или полиаллиламина. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, соединенный с липидом (необязательно фосфолипидом), и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения липид выбран из группы, состоящей из DSPE, DPPE и DMPE. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой ПАК, и средняя молекулярная масса ПАК находится в диапазоне от приблизительно 750 дальтон до приблизительно 7000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения способ дополнительно включает стерилизацию наноалюмочастицы путем фильтрации. Согласно некоторым вариантам реализации настоящего изобретения соотношение соли алюминия и ПЭГ составляет от приблизительно 2:1 до приблизительно 7,5:1. В вариантах реализации, в которых агент, регулирующий размер, представляет собой хитозан или полиаллиламин, соль алюминия подвергнется модификации поверхности посредством обмена фосфатного лиганда.
[00021] Настоящее изобретение относится к наноалюмочастице, которая может быть получена или которая получена способом, описанного в настоящем документе, причем размер наноалюмочастицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
[00022] Настоящее изобретение относится к композиции, содержащей наноалюмочастицу, описанную в настоящем документе.
[00023] Согласно некоторым вариантам реализации настоящего изобретения композиция дополнительно содержит биоактивный агент. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент ассоциирован с наноалюмочастицей в композиции. Согласно некоторым вариантам реализации настоящего изобретения более чем приблизительно 75% биоактивного агента ассоциировано с наноалюмочастицей в композиции, согласно результатам определения методом гель-электрофореза. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой полипептид, полинуклеотид, антиген, адъювант, диагностический агент, терапевтический агент или организм. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой полипептид. Согласно некоторым вариантам реализации настоящего изобретения полипептид представляет собой антиген, гибридный белок, полноразмерный белок, пептид или пептидный миметик. Согласно некоторым вариантам реализации настоящего изобретения антиген представляет собой агонист Rig I. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой полинуклеотид. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой ДНК. Согласно некоторым вариантам реализации настоящего изобретения ДНК содержит последовательность, кодирующую полипептид. Согласно некоторым вариантам реализации настоящего изобретения ДНК представляет собой олигонуклеотид. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой РНК. Согласно некоторым вариантам реализации настоящего изобретения РНК выбрана из группы, состоящей из РНК-репликона, иРНК, тРНК, киРНК, кшРНК и микроРНК. Согласно некоторым вариантам реализации настоящего изобретения РНК содержит последовательность, кодирующую полипептид. Согласно некоторым вариантам реализации настоящего изобретения композиция дополнительно содержит адъювант. Согласно некоторым вариантам реализации настоящего изобретения адъювант выбран из группы, состоящей из AS-2, монофосфориллипида А, 3-де-О-ацилированного монофосфориллипида A, IFA, QS21, CWS, ТОМ, AGP, CpG-содержащих олигонуклеотидов, агонистов Toll-подобного рецептора (TLR), Leif, сапонинов, миметиков сапонинов, биологического и синтетического липида А, имиквимода, гардиквимода, резиквимода, полиI:С, флагеллина, GLA, SLA, STING и их комбинаций.
[00024] Согласно некоторым вариантам реализации настоящего изобретения композиция представляет собой жидкий состав. Согласно некоторым вариантам реализации настоящего изобретения композиция может быть профильтрована через фильтр с размером пор 0,20 мкм или фильтр с размером пор 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения композиция поддается окончательной стерилизации перед внесением во флаконы. Согласно некоторым вариантам реализации настоящего изобретения композиция является стабильной при температуре от приблизительно 0°С до приблизительно 8°С в течение по меньшей мере приблизительно 1 месяца, по меньшей мере приблизительно 6 месяцев или по меньшей мере приблизительно 1 года. Согласно некоторым вариантам реализации настоящего изобретения композиция является стабильной при температуре приблизительно 37°С в течение по меньшей мере приблизительно 1 месяца. Согласно некоторым вариантам реализации настоящего изобретения композиция дополнительно содержит липосому. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции составляет от приблизительно 1 нм до приблизительно 450 нм.
[00025] Настоящее изобретение относится к набору, содержащему первый флакон, содержащий композицию, описанную в настоящем документе. Согласно некоторым вариантам реализации настоящего изобретения набор дополнительно содержит второй флакон, содержащий другой агент.
[00026] Настоящее изобретение относится к способу стимуляции иммунного ответа у субъекта, включающему введение субъекту композиции, раскрытой в настоящем документе, что приводит к стимуляции иммунного ответа у субъекта.
[00027] Согласно некоторым вариантам реализации настоящего изобретения иммунный ответ представляет собой неспецифический иммунный ответ. Согласно некоторым вариантам реализации настоящего изобретения иммунный ответ представляет собой антигенспецифический иммунный ответ. Согласно некоторым вариантам реализации настоящего изобретения иммунный ответ включает активацию В-клеток, активацию Т-клеток, выработку антител или высвобождение цитокинов. Согласно некоторым вариантам реализации настоящего изобретения композицию применяют для монотерапии. Согласно некоторым вариантам реализации настоящего изобретения композицию применяют для лечения аллергии, зависимости, рака или аутоиммунного заболевания. Согласно некоторым вариантам реализации настоящего изобретения путь введения композиции представляет собой пероральный, внутривенный, внутрикожный, трансдермальный, назальный, подкожный или анальный путь введения. Согласно некоторым вариантам реализации настоящего изобретения субъект представляет собой человека. Согласно некоторым вариантам реализации настоящего изобретения субъект представляет собой млекопитающее, отличное от человека. Согласно некоторым вариантам реализации настоящего изобретения млекопитающее, не относящееся к человеку, представляет собой собаку, кошку, корову или лошадь.
[00028] Настоящее изобретение относится к способу доставки биоактивного агента в клетку в организме субъекта, включающему введение субъекту композиции, содержащей (а) наноалюмочастицу, содержащую соль алюминия и агент, регулирующий размер, причем размер частицы находится в пределах от приблизительно 1 нм до приблизительно 450 нм, и (b) биоактивный агент, что обеспечивает доставку биоактивного агента в клетку в организме субъекта.
[00029] Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент доставляют в клетку. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой РНК, содержащую последовательность, кодирующую полипептид, и полипептид экспрессируется клеткой. Согласно некоторым вариантам реализации настоящего изобретения композиция вызывает иммунный ответ у субъекта.
[00030] Настоящее изобретение относится к способу получения композиции, включающему смешивание наноалюмочастицы, раскрытой в настоящем документе, с биоактивным агентом.
[00031] Настоящее изобретение относится к способу получения композиции, включающему этапы: (а) воздействия на соль алюминия источника высокой энергии в присутствии агента, регулирующего размер, для получения наноалюмочастицы, причем размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм; и (b) смешивание наноалюмочастицы, полученной на этапе (а), с биоактивным агентом.
[00032] Настоящее изобретение относится к способу получения композиции, включающему следующие этапы: (а) воздействие на соль алюминия источником высокой энергии с получением наноалюмочастицы, размер которой находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм; (b) смешивание агента, регулирующего размер, с указанной наноалюмочастицей в течение приблизительно 30 минут после этапа (а); и (с) смешивание указанной наноалюмочастицы с биоактивным агентом во время или после этапа (b).
[00033] Перечисленные и другие аспекты настоящего изобретения будут очевидны при обращении к нижеследующему подробному описанию и прилагаемым чертежам. Помимо этого, в настоящем документе указаны различные источника, которые более подробно описывают некоторые аспекты настоящего изобретения и поэтому полностью включены в настоящий документ посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00034] ФИГ. 1A-F: составы наноалюмочастиц с агентами, регулирующими размер, ПАК и ПЭГ и результаты исследований стабильности составов наноалюмочастиц. На ФИГ. 1А показано, что составы наноалюмочастиц, обработанные или измельченные в присутствии ПАК2000 в качестве агента, регулирующего размер, подвергнутые 3-6 раундам при 30000 фунтов на кв. дюйм, имеют средний размер частиц приблизительно 100 нм, при этом полидисперсность составляет приблизительно 0,25-0,3. Увеличение количества этапов измельчения до 10-15 раз приводило к получению составов наноалюмочастиц с размером частиц приблизительно 78-87 нм без увеличения полидисперсности. На ФИГ. 1В-С приведены данные об изменении диаметра частиц с течением времени для составов наноалюмочастиц с ПЭГ-фосфолипидом (ПЭГ 5000-DSPE в соотношении с алюминиевыми квасцами 2:1) или ПАК в качестве агента, регулирующего размер. Составы, имеющие первоначальные размеры частиц приблизительно 78 нм, хранили при 4°С до одного года и исследовали в указанные моменты времени для оценки размера частиц и полидисперсности. Образцы отбирали с тремя повторами. ФИГ. 1D-F: термостабильность составов наноалюмочастиц. Термостабильность составов наноалюмочастиц с размером частиц менее 100 нм, приготовленных с пегилированными липидами с различной длиной цепей ПЭГ (5000, 2000 и 750) и/или различной длиной ацильных цепей (18, 16 или 14 атомов углерода), оценивали при 25°С, 37°С или 60°С в течение 0, 2 или 4 недель. QG194 представляет собой ПЭГ5000-DSPE; QG195 представляет собой ПЭГ2000-DMPE; QG196 представляет собой ПЭГ2000-DMPE; QG197 представляет собой ПЭГ750-DSPE; QG198 представляет собой ПЭГ2000-DSPE.
[00035] ФИГ. 2: составы наноалюмочастиц, содержащие разный агент, регулирующий размер, имеют предсказанное содержание алюминиевых квасцов. Составы наноалюмочастиц, полученные с применением в качестве агентов, регулирующих размер, ПЭГ с различной длиной цепей, соединенных с фосфолипидами с различной длиной ацильных цепей, имеют предсказанное содержание алюминиевых квасцов. Составы наноалюмочастиц, состоящие из агентов, регулирующих размер, содержащих фосфолипид 18С (DSPE) и ПЭГ с различной длиной цепей, составляющей 5000 (образец 1), 2000 (образец 4) и 750 (образец 5), содержат примерно эквивалентные количества от предсказанного исходного содержания алюминиевых квасцов 4 мг/мл, согласно результатам измерения методом оптической эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-OES), которые находятся в диапазоне от 3,9 мг/мл для ПЭГ750-DSPE (образец 5) до 4,5 мг/мл для ПЭГ2000-DPPE (образец 3).
[00036] ФИГ. 3A-D: мышей иммунизировали 2,5 мкг ID97 по отдельности или с добавлением адъюванта, такого как алюминиевые квасцы, ПАК, наноалюмочастицы с ПАК, наноалюмочастицы с ПЭГ или агонист TLR4, GLA-SE. Через 1 неделю после иммунизации спленоциты выделяли и либо оставляли без стимуляции, либо стимулировали белком ID97 в присутствии брефелдина А в течение 8 ч при 37°С. Затем клетки окрашивали для оценки поверхностной экспрессии CD4, CD8 и CD44, а также внутриклеточной экспрессии CD 154, ИФН-γ, ФНО-α, ИЛ-2, ГМ-КСФ, ИЛ-5 и ИЛ-17А. Антигенспецифические ответы рассчитывали как частоту CD4+ Т-клеток, опосредующих ответ в образцах, стимулированных ID97, за вычетом этого показателя в нестимулированных образцах. На ФИГ. 3А представлены результаты оценки частоты CD4+ Т-клеток, которые опосредуют специфичность ответа в отношении ID97 в каждом случае. Сыворотку собирали у иммунизированных животных через неделю после иммунизации, и оценивали титры ID97-связывающего антитела с помощью ИФА для изотипа IgG (3В) и подклассов IgG1 (3С) и IgG2 (3D). Данные указывают на то, что состав наноалюмочастиц с ПАК усиливает Th1 ответы. Пояснительная надпись для Фигуры 3В аналогична таковой для 3А, и пояснительная надпись для 3С аналогична таковой для 3D.
[00037] ФИГ. 4А-С: самок мышей иммунизировали внутримышечно солевым раствором, алюминиевыми квасцами, составом наноалюмочастиц с ПАК или составом наноалюмочастиц с ПЭГ. Через один день дренирующие лимфатические узлы были удалены, и уровни секретированных цитокинов и хемокинов количественно исследовали с помощью Luminex. Данные указывают на то, что состав наноалюмочастиц с ПАК усиливает выработку цитокинов, смещающих ответ в сторону Th1, в дренирующих лимфатических узлах мышей.
[00038] ФИГ. 5: мышей дикого типа и мышей IL-18R-/- иммунизировали 2,5 мкг ID97 и 1 мкг РЕ-рекомбинантных антигенов, содержащих в качестве адъюванта наноалюмочастицы с ПАК. Через одну неделю после иммунизации спленоциты выделяли и либо оставляли без стимуляции, либо стимулировали белком ID97 в присутствии брефелдина А в течение 8 часов при температуре 37°С. Затем клетки окрашивали для оценки поверхностной экспрессии CD4, CD8 и CD44, а также внутриклеточной экспрессии CD154, ИФН-γ, ФИО, ИЛ-2, ГМ-КСФ, ИЛ-5 и ИЛ-17А. Антигенспецифические ответы рассчитывали как частоту CD4 Т-клеток, опосредующих ответ в образцах, стимулированных ID97, за вычетом этого показателя в нестимулированных образцах. Данные указывают на то, что состав наноалюмочастиц с ПАК усиливает Th1 ответы посредством ИЛ-18R-зависимого механизма.
[00039] ФИГ. 6А-С: Мышей иммунизировали вектором экспрессии РНК-репликона, приготовленным с наночастицами алюминия. Данные указывают на то, что через 24 часа после инъекции уровни экспрессии РНК-репликона, смешанного с катионной эмульсией в дозах в 30 и 300 раз (1 или 0,1 мкг) ниже, чем дозы РНК в чистом виде (30 мкг), были эквивалентны уровням экспрессии РНК в чистом виде, тогда как состав наноалюмочастиц с ПАК продемонстрировал более низкую экспрессию (ФИГ. 6А). Однако к 4 дню и 7 дню после инъекции уровни экспрессии РНК, смешанной с контрольной катионной эмульсией или наночастицами алюминия с ПАК, были приблизительно эквивалентны уровням экспрессии при обеих дозах 1 мкг (мкг) и 0,1 мкг (мкг) (ФИГ. 6В и 6С).
[00040] ФИГ. 7A-D: экспрессия векторов, несущих РНК-репликон, приготовленных с наночастицами алюминия-РНК, не обусловлена агентом, регулирующим размер, в составе наноалюмочастиц. На ФИГ. 7A-D представлены данные, сгруппированные в соответствии с составом и дозой доставленного вектора для экспрессии репликона (мкг, в чистом виде, обозначенного как +) 1 мкг (мкг) и 0,1 мкг (мкг), соответственно) через 24 часа, свидетельствующие о том, что ПАК по отдельности (верхняя правая панель) не доставляет и/или не индуцирует экспрессируемый уровень РНК-репликона в дозах 0,1 или 1,0 мкг, тогда как аналогичные дозы РНК-репликона, приготовленного или смешанного либо с контрольной катионной эмульсией, либо с наночастицами алюминия с ПАК, приводят к детектируемой экспрессии люциферазы.
[00041] ФИГ. 8А-С: мыши, иммунизированные иРНК, приготовленной с наночастицами алюминия, экспрессируют генные продукты, кодируемые РНК, в условиях in vivo. Данные указывают на то, что составы наноалюмочастиц способны доставлять и обеспечивать экспрессию иРНК, и обладают свойствами, направленными на уменьшение дозы, по сравнению с иРНК в чистом виде. На ФИГ. 8А представлены относительные единицы интенсивности люминесценции, наблюдаемые у животных, которым путем инъекции вводили иРНК, кодирующую люциферазу, и подвергали визуализирующим способам исследований для оценки экспрессии гена люциферазы. иРНК в чистом виде демонстрирует детектируемую экспрессию в дозе 10 мкг и 1 мкг, но не в дозе 0,1 мкг, при оценке через 24 часа после инъекции (левая группа). Однако, как контрольный катионный состав, так и состав наноалюмочастиц с ПАК (средняя и крайняя правая группы) не только экспрессируют эквивалентные уровни гена, кодируемого иРНК, при всех дозах (10 мкг, 1 мкг и 0,1 мкг), при сопоставлении друг с другом, но также демонстрируют повышенный уровень экспрессии (>30 раз) при дозе 1 мкг, по сравнению с иРНК в чистом виде, и имеют детектируемые уровни экспрессии при дозе 0,1 мкг, что указывает на их свойства уменьшать дозу состава наноалюмочастиц. На ФИГ. 8 В представлены относительные значения интенсивности иммунофлуоресценции у животных, которых подвергали визуализирующим способам исследований для оценки экспрессии иРНК, через 5 дней после инъекции. иРНК в чистом виде демонстрирует детектируемую экспрессию гена, кодируемого иРНК, в дозе 10 мкг, но не в более низких дозах (1 мкг и 0,1 мкг), и иРНК, приготовленная в контрольном катионном составе, не имела детектируемой экспрессии в любой из доставленных доз (10 мкг, 1 мкг, 0,1 мкг), при оценке через 5 дней после инъекции (левая и средняя группы). Состав наноалюмочастиц с ПАК (крайние правые группы) экспрессирует в >10 раз более высокие уровни люциферазы, кодируемой иРНК в дозе 10 мкг, и показывает детектируемую экспрессию при дозе 1 мкг, что приблизительно эквивалентно уровням, наблюдаемым при 10 мкг дозе иРНК в чистом виде, это указывает на свойства состава наноалюмочастиц уменьшать дозу даже через 5 дней после доставки иРНК. На ФИГ. 8С представлены результаты исследования относительной экспрессии гена люциферазы, кодируемого иРНК, в условиях in vivo через 6 часов, 24 часа и 5 дней после смешивания в виде чистой формы, составов контрольных катионных эмульсий или наноалюмочастиц с ПАК и введения путем инъекции в условиях in vivo. Данные указывают на то, что животные, которые были иммунизированы иРНК, приготовленной с составами наноалюмочастиц, имели повышенные и относительно устойчивые уровни экспрессии гена люциферазы, кодируемого иРНК, в течение пяти дней  по сравнению с иРНК в чистом виде (•) или иРНК, приготовленной с контрольной катионной эмульсией
по сравнению с иРНК в чистом виде (•) или иРНК, приготовленной с контрольной катионной эмульсией  , экспрессия которой быстро снижалась.
, экспрессия которой быстро снижалась.
[00042] ФИГ. 9А-Е: составы наноалюмочастиц стабилизируют РНК. На этой фигуре показано, что, в том случае, когда составы наноалюмочастиц (средняя группа, наноалюмочастицы с ПАК) смешаны с РНК, хранятся в виде единого препарата в одном флаконе при 4°С в течение 1 часа, 4 часов или 24 часов и затем применяются для иммунизации мышей, смешанные составы способны доставлять конструкцию РНК-репликона так, что уровень экспрессии люциферазы из реплицирующейся РНК эквивалентен или превышает уровень для составов, смешанных и немедленно введенных в нулевое время при исследовании в 1 день (ФИГ. 9А средняя группа) или 5 день (ФИГ. 9 В средняя группа). РНК-репликоны в чистом виде не демонстрируют детектируемую экспрессию после хранения в течение 4 часов или 24 часов, когда экспрессию гена измеряют через 24 часа или 5 дней после введения, однако демонстрируют детектируемую экспрессию при немедленном введении или введении через 1 час после смешивания. Аналогичным образом, контрольный катионный состав демонстрирует защиту РНК-репликона при смешивании и хранении при 4°С в течение 1, 4 или 24 часов, при этом экспрессию гена измеряли в 1 день или 5 день после инъекции. На ФИГ. 9С-Е представлены диаграммы разброса данных, на которых представлены результаты непосредственного сравнения контрольного катионного состава, наноалюмочастиц с ПАК и РНК-репликона в чистом виде, соответственно, при введении непосредственно после смешивания с РНК-репликоном (Т=0, левая панель 9С), при введении через 4 часа после смешивания и хранения при 4°С (Т=1 час, средняя панель 9D) или после смешивания и хранения в течение 24 часов (Т=24 ч, правая панель 9Е) при 4°С. Экспрессия гена измерена на 5 день после введения животным с помощью относительных единиц люминесценции. Уровни экспрессии люциферазы свидетельствуют о том, что РНК, приготовленная с наночастицами алюминия, стабильна при смешивании в виде состава для хранения в одном флаконе при 4°С до 24 часов, по сравнению с РНК в чистом виде.
[00043] ФИГ. 10А-Е: мыши, иммунизированные вектором для экспрессии РНК-репликона, кодирующим гибридный белок лейшманиоза, приготовленным с наночастицами, экспрессируют РНК в условиях in vivo, и у них вызываются антигенспецифичные иммунные ответы, характеризуемые уменьшением вводимой дозы. На этой фигуре показано, что у мышей, иммунизированных вектором для экспрессии РНК-репликона, кодирующим гибридный полинуклеотид лейшманиоза, ЕМСН, развиваются антигенспецифические ответы. На ФИГ. 10A-D показано, что иммунизация с применением 100-кратно более низких доз РНК ЕМСН, приготовленной с контрольной катионной эмульсией или наночастицами алюминия с ПАК, приводит к выработке приблизительно эквивалентных количеств CD4+CD44highCD154 Т-клеток, вырабатывающих ИФН-γ, ИЛ-2 или ФНО-α, как и при введении 10 мкг РНК в чистом виде, по сравнению с незначительной или отсутствующей индукцией цитокинов после введения 0,1 мкг РНК-репликона в чистом виде. ФИГ. 10Е: отличительная черта защитного иммунного ответа против лейшманиоза включает присутствие полифункциональных антигенспецифических Т-клеток, которые секретируют несколько цитокинов. CD4+CD44high Т-клетки дополнительно исследовали для оценки ответов полифункциональных Т-клеток. Данные указывают на то, что мыши, иммунизированные 100 нг РНК-репликона ЕМСН, приготовленного с наночастицами алюминия с ПАК (заштрихованный столбик) или приготовленного с контрольной катионной эмульсией (заштрихованный по диагонали столбик), имели эквивалентные количества тройных положительных CD44highИФH-γ+ИЛ-2+ФНО-α+ CD4+ Т-клеток по сравнению с животными, иммунизированными 10 мкг РНК в чистом виде (закрашенный черный столбик). Также присутствовали двойные положительные клетки, экспрессирующие ИФН-γ и ИЛ-2 или ИЛ-2 и ФНО-α. Данные указывают на то, что составы наноалюмочастиц с ПАК способны доставлять РНК, которая экспрессируется на уровне, достаточном для того чтобы вызвать соответствующие антигенспецифические иммунные ответы.
[00044] На ФИГ. 11А-В показано, что у мышей, иммунизированных составами наноалюмочастиц, размер частиц в которых составляет 400 нм, 130 нм или 75 нм, абсорбированными в гибридный белок ТВ, ID93, вызываются антигенспецифические иммунные ответы. На Фигуре 11А показано, что составы наноалюмочастиц вызывают титры антигенспецифических антител IgG1, которые являются характерными для смещения в сторону Th2 ответов. На Фигуре 11В показано, что составы наноалюмочастиц плюс агонист TLR4, SLA, вызывают титры антигенспецифических антител IgG2c, которые являются характерными для смещения в сторону Th1 ответа.
[00045] На ФИГ. 12А-С показано, что у мышей, иммунизированных составами наноалюмочастиц с ПЭГ, содержащими либо пегилированные фосфолипидные агенты, регулирующие размер, с различной длинной цепей ПЭГ, либо ПЭГ с одинаковой длинной цепей, соединенный с фосфолипидами с различной длинной ацильных цепей, и смешанными с гибридным белком ТВ, ID93, плюс агонист TLR4, SLA, вызываются антигенспецифичные иммунные ответы.
[00046] ФИГ. 13А-В. На Фигуре 13А представлены результаты исследования эффекта количества раундов микрофлюидизации при 30000 фунтов на кв. дюйм на гидродинамический размер наноалюмочастиц, синтезированных с использованием предшественника AdjuPhos® и хитозана массой 120 кДа с 75-85% DD. На Фигуре 13 В представлены результаты определения диаметра и PDI наноалюмочастиц, изготовленных с применением адъюванта AdjuPhos® в качестве предшественника и различных количеств хитозана массой 120 кДа с 75-85% DD. Образцы подвергали микрофлюидизации при 30000 фунтов на кв. дюйм в 22 отдельных раундах.
[00047] ФИГ. 14-В. На Фигуре 14А представлены результаты определения размера наноалюмочастиц, полученных из Alhydrogel® (0,2% масс/об. А1), стабилизированных с применением сульфата декстрана массой 40 кДа. Микрофлюидизацию проводили при давлении 30000 фунтов на кв. дюйм. На Фигуре 14В представлены данные по стабильности размера частиц для партии наноалюмочастицы-декстран QG774 (0,2% масс/об. алюминия +0,22% сульфата декстрана массой 40 кДа), хранившейся при 5°С, 25°С и 37°С.
[00048] ФИГ. 15А-В: На Фигуре 15А представлены значения дзета-потенциала исходного адъюванта Alhydrogel® до и после обработки фосфатно-солевым буфером (ФСБ), содержащим 67 мМ фосфата. На Фигуре 15 В представлены значения диаметра частиц (Z-среднее) и распределение по размерам наноалюмочастиц, полученных из Alhydrogel® (0,2% масс/об. А1 или 2 мг А1/мл), стабилизированных с применением различных количеств хитозана. Данные о размерах собирали сразу после микрофлюидизации и перед стерилизацией путем фильтрации.
[00049] На ФИГ. 16 представлены результаты исследования эффекта фракции полиаллиламина (РАН) на размер частиц и распределение по размеру наноалюмочастиц, синтезированных из PE-Alhydrogel®.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00050] Настоящее изобретение, описанное в настоящем документе, относится к наноалюмочастицам, композициям, содержащим наноалюмочастицы, и способам получения и применения наноалюмочастиц.
I Определения
[00051] Приведенные ниже термины имеют следующие значения, если не указано иное. Любые термины, которым не дано определение, имеют значения, признанные в соответствующей области.
[00052] В настоящем описании термины «приблизительно» и «состоящий по существу из» означают ±20% от указанного диапазона, значения или структуры, если не указано иное. Согласно некоторым вариантам реализации настоящего изобретения термины «приблизительно» и «состоящий по существу из» означают ±15%; ±10%; или ±5% от указанного диапазона, значения или структуры, если не указано иное.
[00053] Следует понимать, что использование альтернативы (например, «или») означает одну, обе или любую комбинацию указанных альтернатив.
[00054] В настоящем документе термины «включать», «иметь» и «содержать» используются как синонимы, эти термины и их варианты следует истолковывать как неограничивающие.
[00055] В настоящем документе и в прилагаемой формуле изобретения формы единственного числа («а», «an» и «the» в исходном тексте на английском языке) включают указание на множественное число, если из контекста явно не следует иное.
[00056] В настоящем документе термин «биоактивный агент» относится к любому материалу, который должен быть доставлен с помощью составов (препаратов) наноалюмочастиц согласно настоящему изобретению, и включает, но не ограничивается ими, макромолекулы, пептиды, белки, пептидомиметики, нуклеиновые кислоты, олигонуклеотиды, дезоксирибонуклеотиды, рибонуклеотиды, иРНК, РНК-и, RigI, РНК-репликон, адъюванты, включая агонисты TLR (например, агонисты TLR2, TLR3, TLR4, TLR7, TLR8 и TLR9), сапонины, целые вирусные частицы, вирусные фрагменты, клеточные фрагменты. Также термин «биоактивный агент» включает, например, аптамеры, углеводы, конъюгированные углеводы и вирусоподобные частицы.
[00057] В настоящем документе термин «макромолекула» относится к большим молекулам, примерами которых являются, но не ограничиваясь ими, пептиды, белки, олигонуклеотиды и полинуклеотиды биологического или синтетического происхождения. Также термин «макромолекула» включает, например, углеводы.
[00058] Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и может быть прерван неаминокислотами. Термины также включают полимер из аминокислот, который был модифицирован естественным путем или путем вмешательства; например, за счет образования дисульфидных связей, гликозилирования, липидирования, ацетилирования, фосфорилирования или любых других манипуляций или модификаций, таких как конъюгация с помечающим компонентом. Также в определение включены, например, полипептиды, содержащие один или более аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области техники, которые включают соединения пептидомиметиков, которые получают из пептидов и белков путем структурной модификации с использованием неприродных аминокислот.
[00059] Термин «выделенный» означает, что молекула была извлечена из ее природного окружения.
[00060] «Очищенный» означает, что чистота молекулы была повышена так, что она существует в более чистой форме, чем она существует в ее природном окружении и/или при первоначальном синтезе и/или амплификации в лабораторных условиях. Чистота - это относительный термин и не обязательно означает абсолютную чистоту. Согласно некоторым вариантам реализации настоящего изобретения очистка может означать на 99%, 98%, 97%, 96%, 95%, 90%, 85% или 80% более чистую молекулу, чем она существует в ее природном окружении и/или при первоначальном синтезе и/или амплификации в лабораторных условиях.
[00061] Термины «полинуклеотид» или «нуклеиновая кислота» используются в настоящем документе взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть встроен в полимер ДНК- или РНК-полимеразой или с помощью синтетической реакции. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификация нуклеотидной структуры, если она присутствует, может быть внедрена до или после сборки полимера. Полинуклеотиды согласно настоящему изобретению включают рибонуклеотиды (например, РНК, РНК- и, тРНК и иРНК, как термины, хорошо известные в данной области техники.) и дезоксирибонуклеотиды (ДНК), известные в данной области техники, которые могут представлять собой одно- или двухцепочечные молекулы.
[00062] В настоящем документе термин «олигонуклеотид» обычно относится к коротким, обычно одноцепочечным, обычно синтетическим полинуклеотидам, которые обычно, но не обязательно, имеют менее 200 нуклеотидов в длину. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Приведенное выше описание для полинуклеотидов в равной степени и полностью применимо к олигонуклеотидам. Примеры включают агонисты Rig I.
[00063] В настоящем документе термин «репликон» включает любой генетический элемент, например, плазмиду, космиду, бакмиду, фаг или вирус, способный к репликации в значительной степени под своим собственным контролем. Репликон может представлять собой РНК или ДНК и может быть одно- или двухцепочечным.
[00064] «Индивидуум» или «субъект» представляет собой любое млекопитающее. Млекопитающие включают, но не ограничиваются ими, человека, приматов, сельскохозяйственных животных, спортивных животных, домашних животных (таких как кошки, собаки, лошади) и грызунов.
[00065] «Алкил» представляет собой линейный или разветвленный насыщенный углеводород. Например, алкильная группа может содержать от 1 до 30 атомов углерода (т.е. (C1-С30) алкил) или от 1 до 20 атомов углерода (т.е. (С1-С20 алкил) или от 1 до 10 атомов углерода (т.е., (C1-С10) алкил) или от 1 до 8 атомов углерода (т.е. (C1-C8) алкил) или от 1 до 6 атомов углерода (т.е. (C1-С6) алкил) или от 1 до 4 (например, С1-С4) алкил). Этот термин включает, например, линейные и разветвленные гидрокарбильные группы, такие как метил (СН3-), этил (СН3СН2-), н-пропил (СН3СН2СН2-), изопропил ((СН3)2СН-), н-бутил (СН3СН2СН2СН2-), изобутил ((СН3)2СНСН2-), втор-бутил ((СН3)(СН3СН2)СН-), трет-бутил ((СН3)3С-), н-пентил (СН3СН2СН2СН2СН2-), неопентил ((СН3)3ССН2-) и н-гексил (СН3(СН2)5-).
[00066] «Гало» или «галоген» относится к фтору, хлору, бром и йоду.
[00067] «Гидрокси» или «гидроксил» относится к группе -ОН.
[00068] «Алкокси» относится к группе -О-алкил, где алкил представляет собой тот, который определен в настоящем документе. Алкокси включает, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси и тому подобное.
[00069] «Карбоксиловый эфир» или «карбоксиэфир» относится к группам -С(0)0-алкил и -С(O)O-замещенный алкил, где алкил и замещенный алкил представляют собой те, которые определены в настоящем документе.
II Общие методики
[00070] При реализации настоящего изобретения будут применены, если не указано иное, обычные методики молекулярной биологии, рекомбинантной ДНК, биохимии и химии, которые находятся в пределах компетенции специалистов в данной области техники. Такие методики полностью объяснены в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., Sambrook et al., ed., Cold Spring Harbor Laboratory Press: (1989); DNA Cloning, Volumes I and II (D.N. Glover ed., 1985); Oligonucleotide Synthesis (M.J. Gait ed., 1984); Mullis et al., U.S. Pat. No: 4,683,195; Nucleic Acid Hybridization (B. D. Hames & S. J. Higgins eds. 1984); B. Perbal, A Practical Guide To Molecular Cloning (1984); сборник трудов Methods In Enzymology (Academic Press, Inc., N.Y.); и в Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989).
III Наноалюмочастицы
[00071] Наноалюмочастицы согласно настоящему изобретению содержат соль алюминия (взаимозаменяемо называемую алюминиевые квасцы) и агент, регулирующий размер, причем размер частицы находится в диапазоне от приблизительно 1 до 450 нм. Обсуждение солей алюминия и агентов, регулирующих размер, приведено ниже.
А Соли алюминия
[00072] Композиции, описанные в настоящем документе, могут содержать соль алюминия, которая может назваться в настоящем документе алюминиевые квасцы. Подходящие соли алюминия включают гидроксид алюминия, тригидрат алюминия, оксигидроксид алюминия, фосфат алюминия, гидроксифосфат алюминия, гидроксифосфат сульфат алюминия и сульфат алюминия-калия. Соли алюминия также могут упоминаться с помощью формулы: Al(ОН)3, AlH3O3, AlH6O3, AlO(ОН), Al(ОН)(PO4) и KAl(SO4)2. Специалист в данной области техники поймет, что гидроксифосфат алюминия является нестехиометрическим, и, несмотря на то, что он представлен в настоящем документе как Al(ОН)(PO4), соотношение поверхностных гидроксилов и фосфатов изменяется в зависимости от условий производства и как таковое более точно представлено формулой: Al(ОН)х(PO4)у.
[00073] Соли алюминия, применяемые в качестве коадъювантов, являются предпочтительными, поскольку они имеют хорошие показатели безопасности, усиливают гуморальный ответ, стабилизируют антигены и являются относительно простыми для крупномасштабного изготовления (Edelman 2002 Mol. Biotechnol. 21:129-148; Edelman, R. 1980 Rev. Infect. Dis. 2:370-383).
[00074] Согласно некоторым вариантам реализации настоящего изобретения соль алюминия представляет собой Alhydrogel®, гидроксид алюминия или оксигидроксид алюминия. Alhydrogel® имеет общий положительный заряд и может легко адсорбировать отрицательно заряженные фрагменты. Alhydrogel® также может называться амфогель; гель гидроксида алюминия; гидрат окиси алюминия; тригидроксид алюминия; или Alugelibye.
[00075] Согласно некоторым вариантам реализации настоящего изобретения соль алюминия представляет собой AdjuPhos®, фосфат алюминия. AdjuPhos® имеет общий отрицательный заряд и может легко адсорбировать положительно заряженные фрагменты.
[00076] Специалист в данной области техники поймет, что в вариантах реализации, в которых соль алюминия и агент, регулирующий размер, которые будут применены, имеют одинаковый поверхностный заряд, желательно подвергнуть соль алюминия модификации поверхности так, чтобы ее заряд можно было поменять на противоположный, обеспечивая тем самым притяжение между агентом, регулирующим размер, и солью алюминия. В качестве примера, если соль алюминия имеет катионный поверхностный заряд (например, AlO(ОН)), и агент, регулирующий размер, имеет катионный поверхностный заряд (например, хитозан, полиаллиламин), обмен лигандами (например, обмен фосфатного лиганда) позволяет изменить поверхностный заряд соли алюминия на анионный, что обеспечивает взаимодействие агента, регулирующего размер, с солью алюминия.
В. Агенты, регулирующие размер
[00077] Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы поддерживается за счет того, что агент, регулирующий размер, снижает, блокирует или замедляет агрегацию обработанной или измельченной соли алюминия, по сравнению с наночастицами алюминия, содержащими соль алюминия в отсутствие агента, регулирующего размер.
[00078] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, добавляют во время обработки соли алюминия путем подведения высокого уровня энергии, такого как обработка ультразвуком или микрофлюидизация, чтобы достичь желательного размера наноалюмочастиц. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, добавляют после обработки соли алюминия путем подведения высокого уровня энергии, такого как обработка ультразвуком или микрофлюидизация, чтобы достичь желательного размера наноалюмочастиц. Согласно некоторым вариантам реализации настоящего изобретения, в случае если агент, регулирующий размер, добавляют после обработки соли алюминия путем подведения высокого уровня энергии, такого как обработка ультразвуком или микрофлюидизация, чтобы достичь желательного размера наноалюмочастиц, агент, регулирующий размер, добавляют сразу же после обработки или приблизительно через 0,5 минуты, 0,5-1,0 минуту, 1,0-1,5 минуты, 1,5-2,0 минуты, 2,0-2,5 минуты, 2,5-3,0 минуты, 3,0-3,5 минуты, 3,5-4,0 минуты, 4,0-4,5 минуты, 4,5-5,0 минут, 5,05-5,5 минуты, 5,5-6,0 минут, 6,0-6,5 минуты, 6,5-7,0 минут, 7,0-7,5 минуты, 7,5-8,0 минут, 8,0-8,5 минуты, 8,5-9,0 минут, приблизительно 10 минут, приблизительно 12 минут, приблизительно 14 минут, приблизительно 16 минут, приблизительно 18 минут, приблизительно 20 минут, приблизительно 22 минуты, приблизительно 24 минуты, приблизительно 26 минут, приблизительно 28 минут, приблизительно 30 минут после обработки соли алюминия, чтобы достичь желательного размера наноалюмочастиц.
[00079] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой агент, который изменяет поверхностные свойства соли алюминия. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой агент, который стабилизирует размер соли алюминия.
[00080] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой агент, который стабилизирует или защищает биоактивный агент. Примеры биоактивных агентов включают, но не ограничиваются ими, антиген, адъювант, агонист TLR, пептидомиметик, пептид, полипептид, белок, нуклеотид, полинуклеотид, РНК, ДНК, целый вирусный геном и целый вирус. Биоактивный агент может быть доставлен с помощью состава наноалюмочастиц согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, защищает или ограждает биоактивный агент от окисления. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, защищает или ограждает биоактивный агент от теплового стресса, который может включать факторы высокой температуры и времени. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, защищает или ограждает биоактивный агент от холодового стресса, который может включать факторы низкой температуры и времени. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, защищает или ограждает биоактивный агент от разрушения. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой тот, который защищает или ограждает биоактивный агент, который должен быть доставлен с помощью составов наноалюмочастиц согласно настоящему изобретению, от разрушения или инактивации под воздействием сыворотки крови или компонентов крови. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, защищает или ограждает биоактивный агент так, что агент может быть приготовлен с наночастицами в виде стабильного состава, помещенного в один флакон.
[00081] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, снижает, блокирует или замедляет агрегацию или повторную агрегацию соли алюминия по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90% или даже блокирует агрегацию или повторную агрегацию соли алюминия практически на 100% по сравнению с наноалюмочастицей, образованной в отсутствие агента, регулирующего размер.
[00082] В наночастицах алюминия согласно настоящему изобретению агент, регулирующий размер, ассоциирован с солью алюминия. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, непосредственно связан с солью алюминия. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, адсорбирован в наноалюмочастицу. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, ассоциирован с солью алюминия с помощью обмена лигандами. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, ассоциирован с солью алюминия за счет взаимодействия зарядов/электростатических взаимодействий. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, ассоциирован с солью алюминия за счет концевой фосфатной группы, обнаруженной на агенте, регулирующие размер. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, дополнительно соединен с липидом. Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, дополнительно соединен с фосфолипидом.
[00083] В таблице 1 представлен неограничивающий перечень агентов, регулирующих размер, для встраивания в наноалюмочастицы согласно настоящему изобретению.

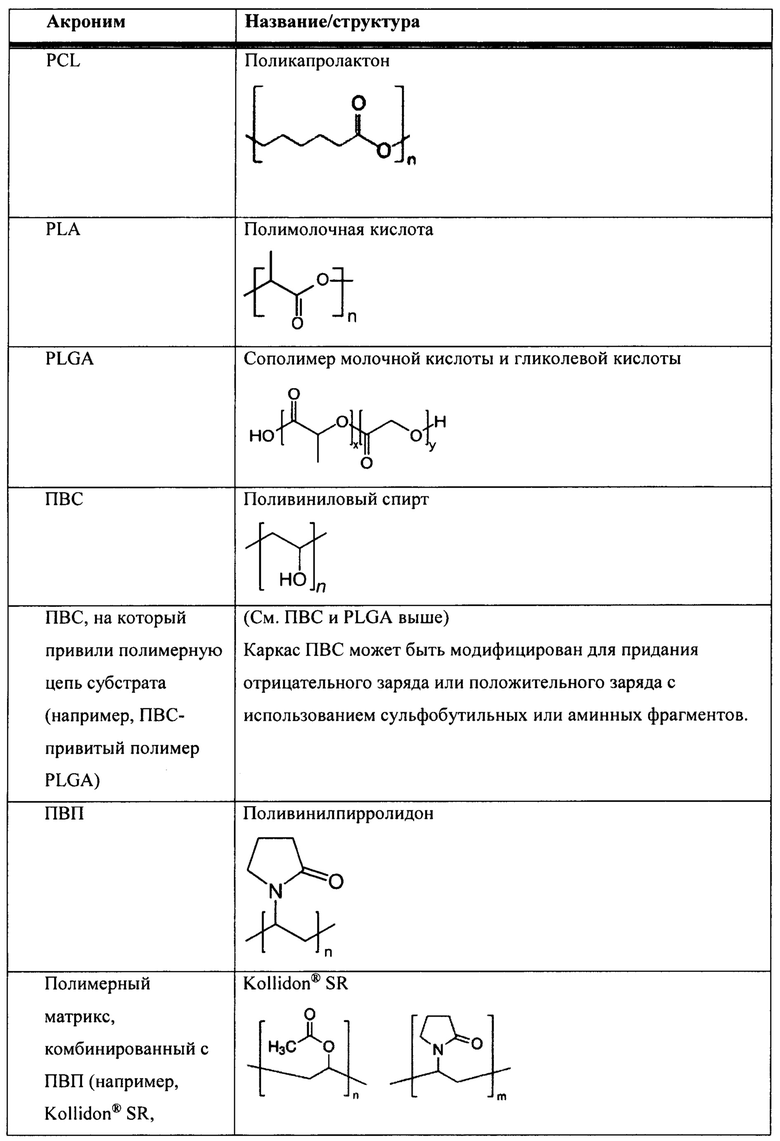
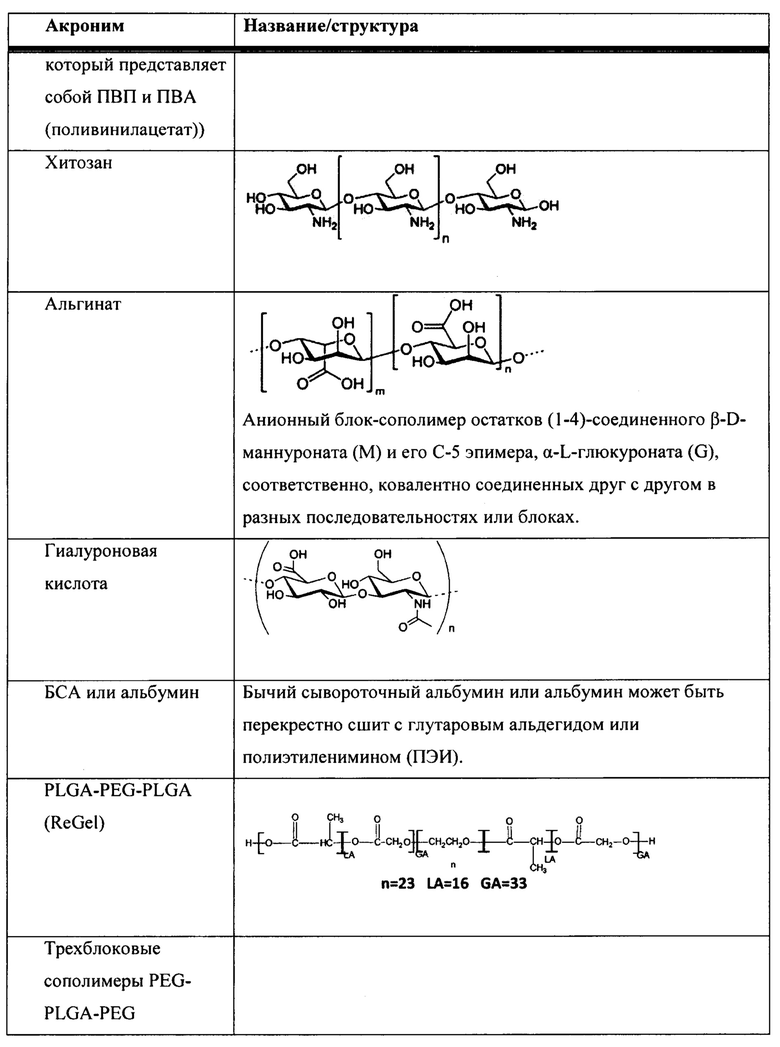
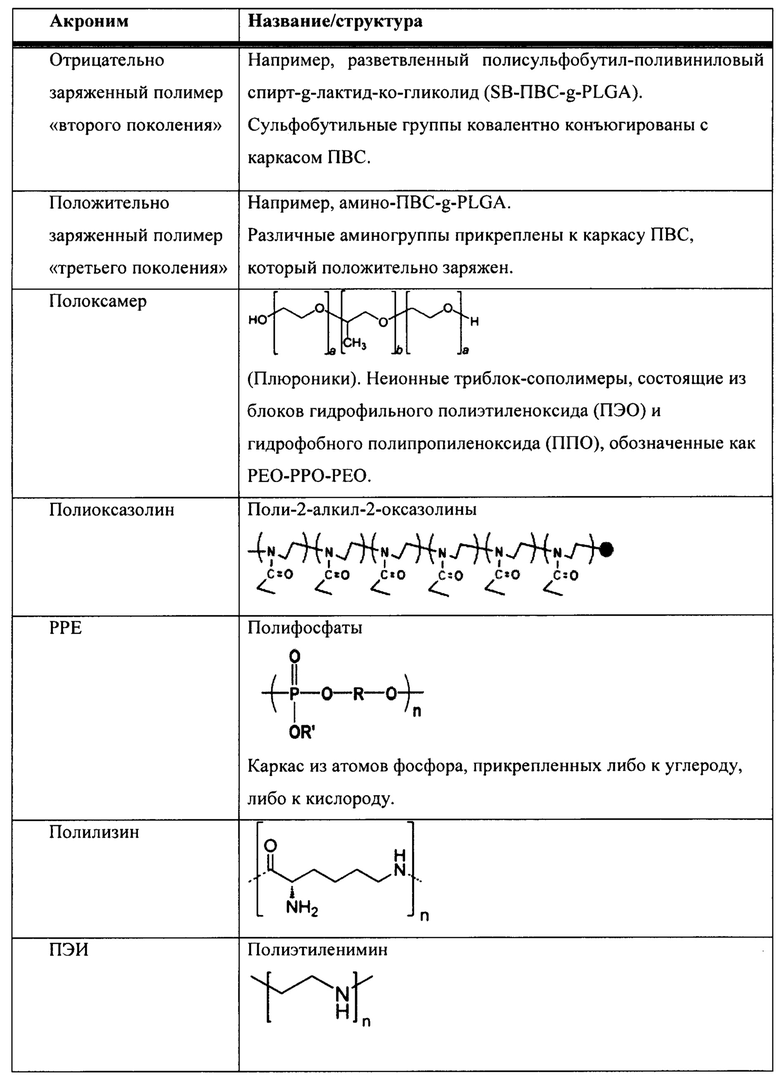
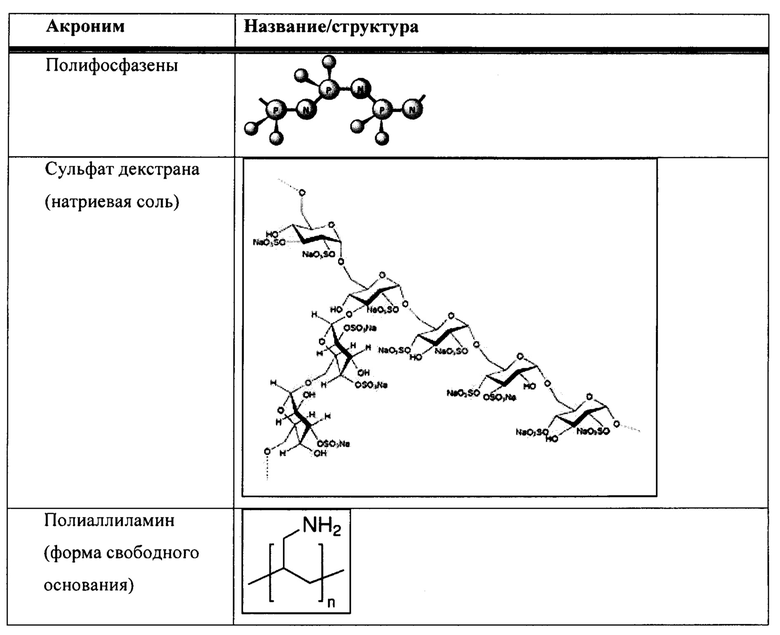
[00084] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой полиакриловую кислоту (ПАК). Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК находится в диапазоне от приблизительно 500 до 7000; от 1000 до 7000; от 1500 до 7000; от 2000 до 7000; от 2500 до 7000; от 3000 до 7000; от 3500 до 7000; от 4000 до 7000; от 4500 до 7000; от 5000 до 7000; от 5500 до 7000; от 6000 до 7000; или от 6500 до 7000. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК находится в диапазоне от приблизительно 500 до 1000; от 500 до 1500; от 500 до 2000; от 500 до 2500; от 500 до 3000; от 500 до 3500; от 500 до 4000; от 500 до 4500; от 500 до 5000; от 500 до 5500; от 500 до 6000; от 500 до 6500; или от 500 до 7000. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК находится в диапазоне от приблизительно 1000 до 3000 или от 1500 до 2500. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК составляет приблизительно 7000, 6500, 6000, 5500, 5000, 4500, 4000, 3500, 3000, 2500, 2400, 2300, 2200, 2100, 2000, 1900, 1800, 1700, 1600, 1500, 1400, 1300, 1250, 1200, 1100, 1000 или 500. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК составляет приблизительно 5000, 2000, 1250, 1200 или 1000. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПАК составляет приблизительно 2000.
[00085] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, представляет собой полиэтиленгликоль (ПЭГ). Согласно некоторым конкретным вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от приблизительно 500 дальтон до приблизительно 6000 дальтон. Согласно некоторым конкретным вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от 750 до 1000; от 750 до 1500; от 750 до 2000; от 750 до 2500; от 750 до 3000; от 750 до 3500; от 750 до 4000; от 750 до 4500; или от 750 до 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от приблизительно 4500 до 5000; от 4000 до 5000; от 3500 до 5000; от 3000 до 5000; от 2500 до 5000; от 2000 до 5000; от 1500 до 5000; от 1000 до 5000; или от 750 до 5000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от приблизительно 500 до 1000; от 500 до 750; или от 750 до 1000 дальтон. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от 1500 до 2500; от 1500 до 2000; или от 2000 до 2500 дальтон. Согласно некоторым вариантам реализации настоящего изобретения средняя молекулярная масса ПЭГ или длина ПЭГ находится в диапазоне от приблизительно 4500 до 5500; от 4500 до 5000; или от 5000 до 5500 дальтон. Согласно одному примерному варианту реализации агент, регулирующий размер, представляет собой ПЭГ750. Согласно одному примерному варианту реализации агент, регулирующий размер, представляет собой ПЭГ2000. Согласно одному примерному варианту реализации агент, регулирующий размер, представляет собой ПЭГ5000.
С. Липиды, соединенные с агентом, регулирующим размер
[00086] Согласно некоторым вариантам реализации настоящего изобретения агент, регулирующий размер, дополнительно соединен с липидом или фосфолипидом. В таблице 2 представлен неограничивающий перечень липидов, которые могут быть соединены с агентом, регулирующим размер. Согласно одному примерному варианту реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, и ПЭГ соединен с DSPE. Согласно некоторому варианту реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, и ПЭГ соединен с DPPE. Согласно некоторому варианту реализации настоящего изобретения агент, регулирующий размер, представляет собой ПЭГ, и ПЭГ соединен с DMPE.
[00087] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой фосфолипид или липид, содержащий соль четвертичного аммония. Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой фосфолипид, который представляет собой фосфатидилхолин или фосфоглицерид. Согласно некоторым вариантам реализации настоящего изобретения липид содержит любой из следующих фрагментов:
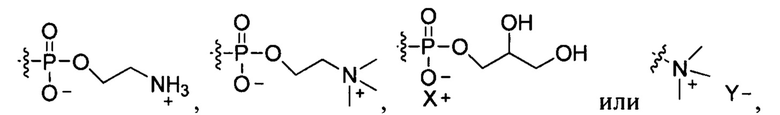
где X- представляет собой противоион щелочного металла, и Y+ представляет собой противоион галогена.
[00088] Согласно некоторым вариантам реализации настоящего изобретения поверхностно-активное вещество представляет собой полоксамер:
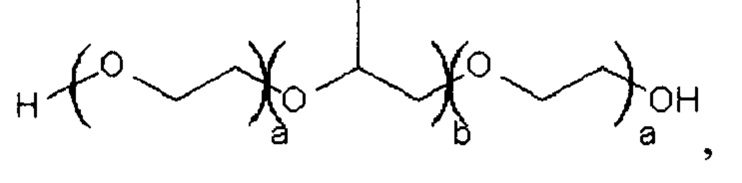
где а составляет 2-130, и b составляет 15-67.
[00089] Согласно некоторым вариантам реализации настоящего изобретения липид содержит С10-20 алкильную цепь. Согласно некоторым вариантам реализации настоящего изобретения липид содержит С12-18 алкильную цепь.
[00090] Согласно некоторым вариантам реализации настоящего изобретения липид является анионным. Согласно некоторым вариантам реализации настоящего изобретения липид является катионным. Согласно некоторым вариантам реализации настоящего изобретения липид в целом заряжен нейтрально. Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой цвиттерион.
[00091] Согласно некоторым вариантам реализации настоящего изобретения подходящие липиды приведены в таблице 2.
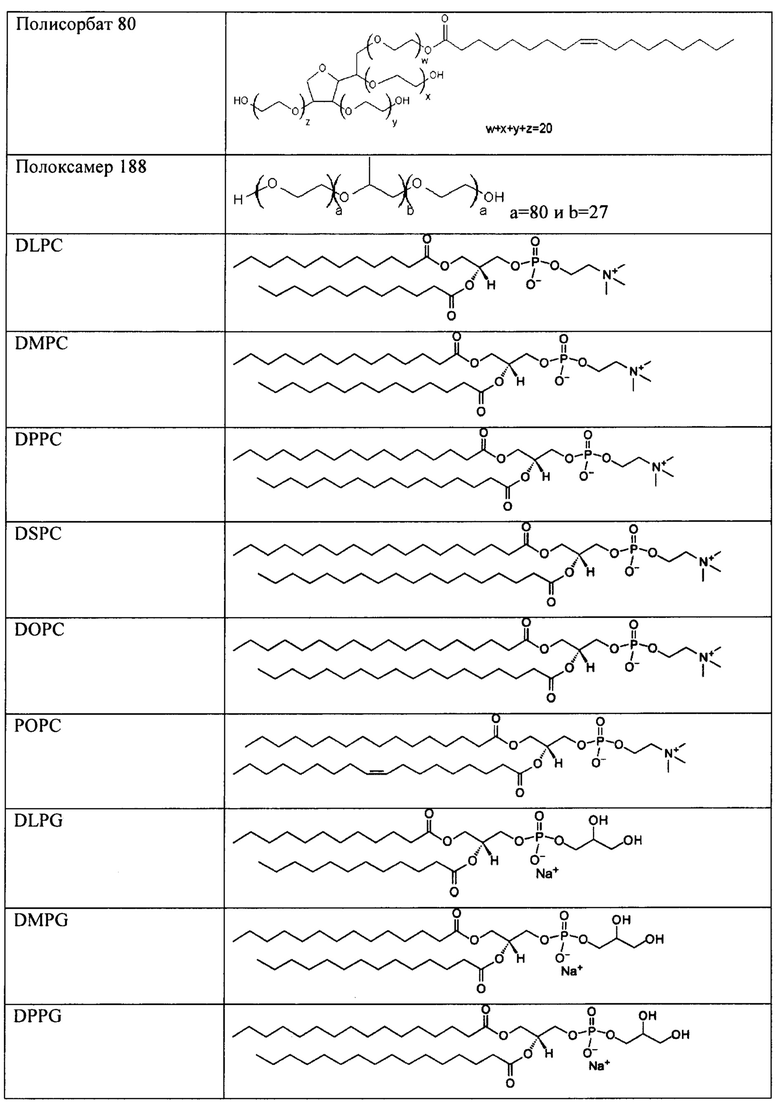
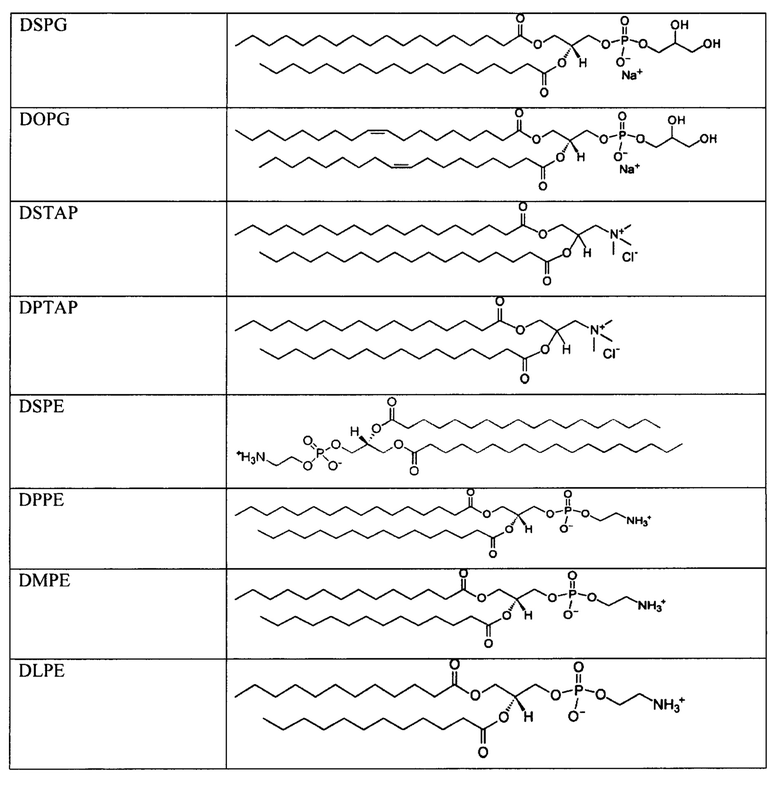
[00092] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой полоксамер 188.
[00093] Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DLPG, DMPG, DPPG, DSPG, DOPG, DSTAP и DPTAP. Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DLPG, DMPG, DPPG, DSPG и DOPG. Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DSTAP и DPTAP.
[00094] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DSPG. Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DSTAP. Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DPTAP.
[00095] Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DSPG, DSTAP и полоксамера 188.
[00096] Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DLPC, DMPC, DPPC, DSPC, POPG и POPG. Согласно некоторым вариантам реализации настоящего изобретения липид выбран из DLPC, DSPC и POPC.
[00097] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DSPE. Согласно примерному варианту реализации настоящего изобретения агент, регулирующий размер, ПЭГ, соединен с DSPE в наноалюмочастице.
[00098] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DPPE. Согласно примерному варианту реализации настоящего изобретения агент, регулирующий размер, ПЭГ, соединен с DPPE в наноалюмочастице.
[00099] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DMPE. Согласно примерному варианту реализации настоящего изобретения агент, регулирующий размер, ПЭГ, соединен с DMPE в наноалюмочастице.
[000100] Согласно некоторым вариантам реализации настоящего изобретения липид представляет собой DLPE. Согласно примерному варианту реализации настоящего изобретения агент, регулирующий размер, ПЭГ, соединен с DLPE в наноалюмочастице.
D. Способы получения наноалюмочастицы
[000101] Настоящее изобретение относится к наноалюмочастице, содержащей соль алюминия и агент, регулирующий размер, причем размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до 450 нм. Настоящее изобретение относится к способам получения таких наноалюмочастиц.
[000102] Способ получения наноалюмочастицы включает воздействие на соль алюминия источником высокой энергии или высокоэнергетического усилия сдвига в присутствии агента, регулирующего размер, что приводит к уменьшению размера соли алюминия и образованию наноалюмочастицы, причем размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до 450 нм.
[000103] Согласно некоторым вариантам реализации настоящего изобретения алюминиевые квасцы обрабатывают или измельчают в присутствии агента, регулирующего размер, или агент, регулирующий размер, добавляют к измельченным алюминиевым квасцам спустя по меньшей мере секунды, минуты или часы после обработки. Согласно некоторым вариантам реализации настоящего изобретения алюминиевые квасцы обрабатывают и сразу же лиофилизируют или высушивают, а агент, регулирующий размер, добавляют при восстановлении или в течение нескольких секунд, минут, часов после восстановления. Обработку или измельчение осуществляют с использованием стандартных методик, известных в данной области техники, включая обработку ультразвуком, смешивание с высоким усилием сдвига (например, смешивание Silverson) и микрофлюидизацию. Другой стандартной методикой, известной в данной области техники, которую можно применять в способах согласно настоящему изобретению, является гомогенизация под высоким давлением.
[000104] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии обеспечивает по меньшей мере 5000 фунтов на кв. дюйм, по меньшей мере 10000 фунтов на кв. дюйм, по меньшей мере 15000 фунтов на кв. дюйм, по меньшей мере 20000 фунтов на кв. дюйм, по меньшей мере 25000 фунтов на кв. дюйм, по меньшей мере 30000 фунтов на кв. дюйм, по меньшей мере 35000 фунтов на кв. дюйм, по меньшей мере 40000 фунтов на кв. дюйм, по меньшей мере 45000 фунтов на кв. дюйм или по меньшей мере 50000 фунтов на кв. дюйм. Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии обеспечивает приблизительно от 5000 до 50000; от 5000 до 10000; от 5000 до 15000; от 5000 до 20000; от 5000 до 25000; от 5000 до 30000; от 5000 до 35000; от 5000 до 40000; от 5000 до 45000; или от 5000 до 50000 фунтов на кв. дюйм. Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии обеспечивает приблизительно от 45000 до 50000; от 40000 до 50000; от 35000 до 50000; от 30000 до 50000; от 25000 до 50000; от 20000 до 50000; от 15000 до 50000; от 10000 до 50000; или от 5000 до 50000 фунтов на кв. дюйм. Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии обеспечивает приблизительно от 25000 до 35000; от 25000 до 30000; или от 30000 до 35000 фунтов на кв. дюйм. Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии обеспечивает приблизительно 30000 фунтов на кв. дюйм.
[000105] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии представляет собой источник с высоким усилием сдвига.
[000106] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии представляет собой микрофлюидизатор. Микрофлюидизация используется для описания способа, при котором композиции подвергают воздействию высокого усилия сдвига. Согласно некоторым вариантам реализации настоящего изобретения композиции обрабатывают с помощью прибора или устройства, известного как MICROFLUIDIZER®.
[000107] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии представляет собой экструдер.
[000108] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии представляет собой соникатор.
[000109] Согласно некоторым вариантам реализации настоящего изобретения источник высокой энергии представляет собой гомогенизатор.
[000110] Согласно некоторым вариантам реализации настоящего изобретения соль алюминия и агент, регулирующий размер, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 50 или 100 раз обрабатывают высоким усилием сдвига. Согласно некоторым вариантам реализации настоящего изобретения соль алюминия и агент, регулирующий размер, обрабатывают 1-5, 6-10, 11-15, 16-20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-80, 81-90 или 91-100 раз обрабатывают с высоким усилием сдвига. Согласно некоторым вариантам реализации настоящего изобретения соль алюминия и агент, регулирующий размер, 3, 6 или 10 раз обрабатывают с высоким усилием сдвига.
[000111] Согласно некоторым вариантам реализации настоящего изобретения способ получения наноалюмочастиц согласно настоящему изобретению выполняют при 0°С, при 4°С, при 25°С, при 30°С, при 50°С или при 60°С. Согласно некоторым вариантам реализации настоящего изобретения способ получения наноалюмочастиц согласно настоящему изобретению выполняют при 0-4, 5-10, 11-15, 16-20, 21-25, 26-30, 31-35, 36-40, 41-45, 46-50, 51-55 или 56-60°С. Согласно некоторым вариантам реализации настоящего изобретения способ получения наноалюмочастиц согласно настоящему изобретению выполняют при 4°С.
[000112] Согласно некоторым вариантам реализации настоящего изобретения начальная концентрация соли алюминия составляет 10 мг/мл. Согласно некоторым вариантам реализации настоящего изобретения начальная концентрация соли алюминия составляет 4 мг/мл. Согласно некоторым вариантам реализации настоящего изобретения начальная концентрация соли алюминия составляет 2 мг/мл. Согласно некоторым вариантам реализации настоящего изобретения начальная концентрация соли алюминия составляет от 0,5 до 10 мг/мл, от 1 до 10 мг/мл, от 0,5 до 5 мг/мл; от 1 до 5 мг/мл; от 0,5 до 4 мг/мл; от 0,5 до 3 мг/мл; или от 0,5 до 3 мг/мл.
[000113] Согласно некоторым вариантам реализации настоящего изобретения исходный размер соли алюминия составляет 1 мкм. Согласно некоторым вариантам реализации настоящего изобретения исходный размер соли алюминия составляет от 0,5 до 5 мкм; от 0,5 до 4 мкм; от 0,5 до 3 мкм; от 0,5 до 2 мкм; или от 0,5 до 1 мкм.
[000114] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица, описанная в настоящем документе, получена путем измельчения или обработки в соответствии со способами, описанными в настоящем документе, в присутствии агента, регулирующего размер, и имеет средний размер частиц 1-450 нм. Согласно некоторым вариантам реализации настоящего изобретения синтетическая наноалюмочастица может содержать синтетические алюминиевые квасцы, описанные в данной области техники, которые синтезируют de novo для получения частиц алюминия соответствующего размера, к которым добавлен агент, регулирующий размер, согласно настоящему изобретению, чтобы создать стабильный водный состав наноалюмочастиц. Наноалюмочастицы из состава могут быть смешаны с фармацевтически приемлемыми вспомогательными веществами, известными в данной области техники, чтобы получить композиции или составы наноалюмочастиц.
[000115] В настоящем документе термины «измельчение», «регулирование размера» или «обработка» относятся к способу обработки раствора алюминиевых квасцов с целью достичь размера частиц в нанометровом диапазоне. Способ включает обработку композиции алюминиевых квасцов (включая состав) с помощью источника высокой энергии или подведения высокого уровня энергии для снижения агрегации частиц алюминиевых квасцов, измеренной на основании уменьшения среднего размера частиц менее 0,5-10 мкм. Подходящие примеры подводимой энергии с получением композиций наноалюмочастиц включают, но не ограничиваются ими, смешивание с высоким усилием сдвига (такое как обработка ультразвуком или смешивание с высоким усилием сдвига с помощью смесителя Silverson с высоким усилием сдвига), экструзию, гомогенизацию и микрофлюидизацию. Согласно некоторым вариантам реализации настоящего изобретения смешивание с высоким усилием сдвига выполняют при 1000, 2000, 5000 или 10000 об./мин в течение 1 минуты, 2 минут, 5 минут или 10 минут. Согласно некоторым вариантам реализации настоящего изобретения микрофлюидизатор представляет собой Microfluidics M110P (Ньютон, Массачусетс, США), оснащенный камерой для взаимодействия F12Y с внутренним алмазным покрытием с последующим керамическим вспомогательным модулем H30Z. Согласно некоторым вариантам реализации настоящего изобретения композиции алюминиевых квасцов подвергают микрофлюидизации при величинах давления 3000 фунтов на кв. дюйм, 5000 фунтов на кв. дюйм, 10000 фунтов на кв. дюйм, 15000 фунтов на кв. дюйм или 30000 фунтов на кв. дюйм. Согласно некоторым вариантам реализации настоящего изобретения раствор алюминиевых квасцов обрабатывают с помощью микрофлюидизатора, в котором температура рециркулирующей воды составляет 60°С, 40°С, 20°С или 4°С, чтобы получить композиции наноалюмочастиц. Согласно некоторым вариантам реализации настоящего изобретения раствор алюминиевых квасцов измельчают или обрабатывают по меньшей мере приблизительно 1, 3, 6, 10, 15, 20 или 30 раз, чтобы воспроизводимо получить наночастицы согласно настоящему изобретению, средний размер которых составляет 1-450 нм. Согласно некоторым вариантам реализации настоящего изобретения раствор алюминиевых квасцов подвергают микрофлюидизации до 10 раз при 30000 фунтов на кв. дюйм, при этом температура рециркулирующей воды составляет 4°С, чтобы предотвратить повышение температуры во время обработки. Согласно некоторым вариантам реализации настоящего изобретения раствор алюминиевых квасцов обрабатывают в присутствии агента, регулирующего размер. Согласно некоторым вариантам реализации настоящего изобретения соотношение агента, регулирующего размер, и алюминиевых квасцов составляет 30:1, 20:1, 15:1, 10:1, 7,5:1, 4:1, 3:1, 2:1, 1,5:1, 0,5:1 или 0,25:1. Согласно некоторым вариантам реализации настоящего изобретения соотношение агента, регулирующего размер, и алюминиевых квасцов составляет 7,5:1, 4:1,3:1,2:1 или 1:1.
[000116] Следует понимать, что в способе получения наноалюмочастицы согласно вариантам реализации можно контролировать некоторые переменные. Некоторые переменные включают, но не ограничиваются ими, агент, регулирующий размер, тип источника высокой энергии, давление, оказываемое источником высокой энергии, количество раундов (раз) обработки смеси источником высокой энергии, температуру, при которой осуществляют способ, концентрацию агента, регулирующего размер, временную точку в способе, когда агент, регулирующий размер, добавляют к алюминию, и соотношение соли алюминия и агента, регулирующего размер, по массе.
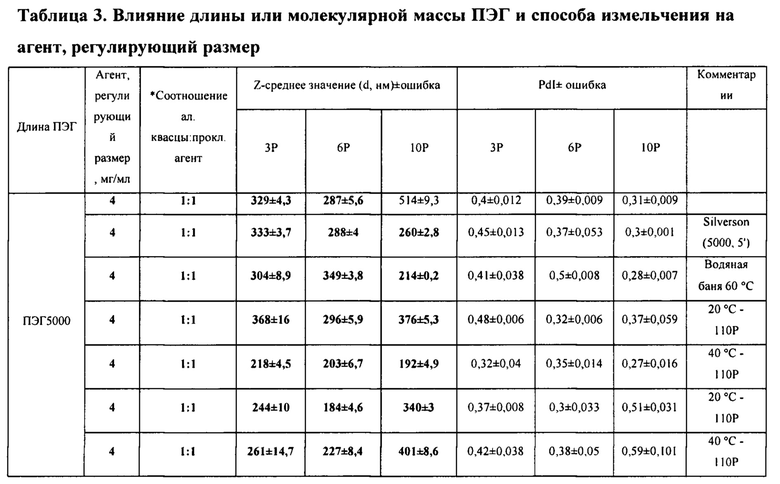
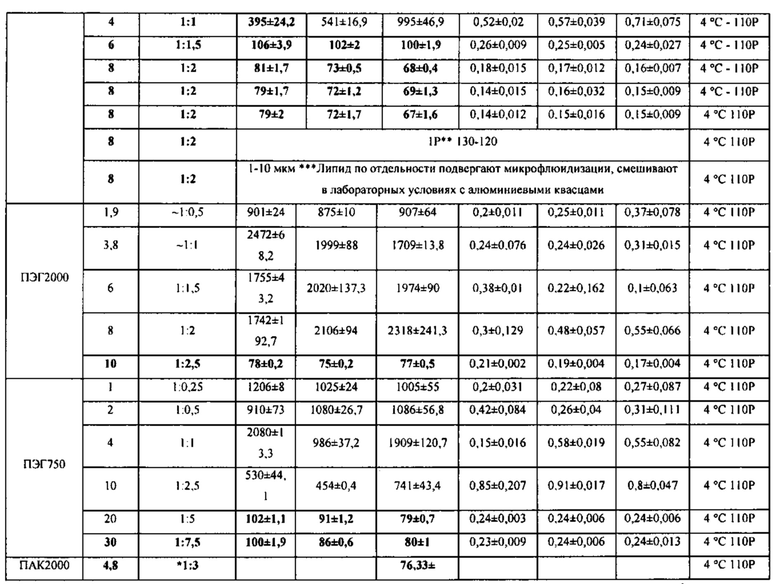
*Алюминиевые квасцы представляют собой раствор с концентрацией 4 мг/мл, за исключением состава с ПАК, где концентрация алюминиевых квасцов составляет 1,6 мг/мл.
Агент, регулирующий размер, выделен жирным шрифтом, концентрация представлена в мг/мл, Соотношение алюминиевые квасцы : агент, регулирующий размер, и значения Z-среднего (d, нм) ± ошибка в таблице 3 представляют условия, которые обеспечивают получение наноалюмочастиц согласно настоящему изобретению.
[000117] Следует понимать, что некоторые переменные и их комбинации могут быть задействованы в способе получения наноалюмочастиц согласно вариантам реализации, такие как те, которые представлены в таблице 3.
[000118] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ5000, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10 раз;
d) температура, при которой осуществляют способ, составляет приблизительно 4°С;
e) концентрация алюминиевых квасцов составляет приблизительно 4 мг/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 8 мг/мл; и
g) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:2.
[000119] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (a)-(g). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (a)-(g). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (е). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (f). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (g).
[000120] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ2000, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) температура, при которой осуществляют способ, составляет приблизительно 4°С;
e) концентрация алюминиевых квасцов составляет приблизительно 4 мг/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 10 мг/мл; и
g) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:2,5.
[000121] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (a)-(g). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (a)-(g). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (a), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (е). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (f). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (g).
[000122] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ750, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) температура, при которой осуществляют способ, составляет приблизительно 4°С;
e) концентрация алюминиевых квасцов составляет приблизительно 4 мг/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 30 мг/мл; и
g) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:7,5.
[000123] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (a)-(g). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (a)-(g). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (е). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (f). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (g).
[000124] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ750, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) температура, при которой осуществляют способ, составляет приблизительно 4°С;
e) концентрация алюминиевых квасцов составляет приблизительно 4 мг/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 20 мг/мл; и
g) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:5.
[000125] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (a)-(f). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (a)-(f). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (е). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (f). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (g).
[000126] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПАК, указанный способ может иметь один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) температура, при которой осуществляют способ, составляет приблизительно 4°С;
e) концентрация алюминиевых квасцов составляет приблизительно 1,6 мг/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 4,8 мг/мл; и
g) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:3.
[000127] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (a)-(f). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (a)-(f). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (a), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (е). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (f). Согласно другому варианту способ соответствует признакам (а), (b), (с), (d) и (g).
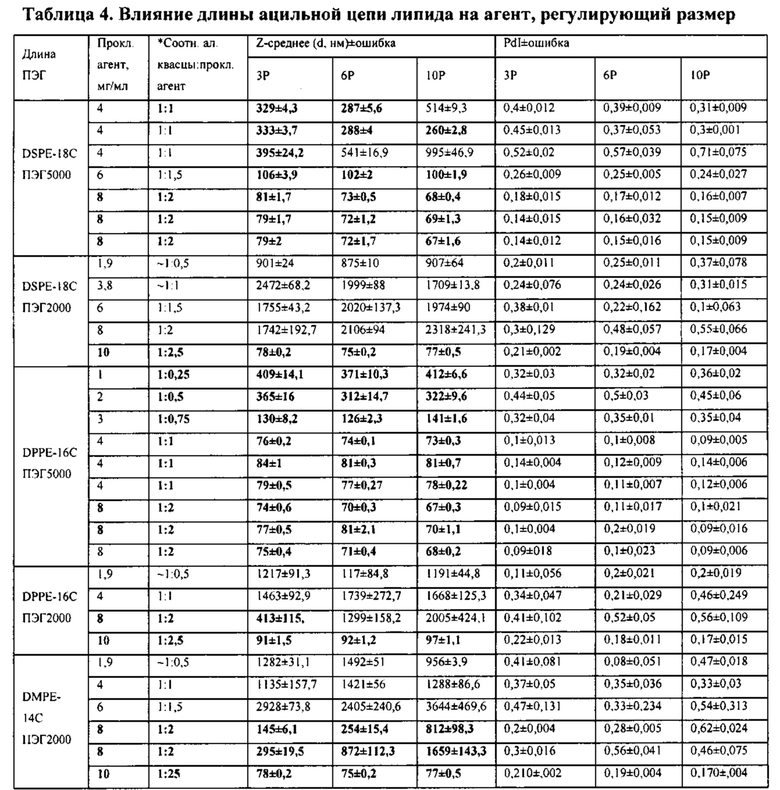
Алюминиевые квасцы представляют собой раствор с концентрацией 4 мг/мл. Агент, регулирующий размер, выделен жирным шрифтом, концентрация представлена в мг/мл, Соотношение алюминиевые квасцы:агент, регулирующий размер, и значения Z-среднего (d, нм) ± ошибка в таблице 4 представляют условия, которые обеспечивают получение наноалюмочастиц согласно настоящему изобретению.
[000128] Следует понимать, что некоторые переменные и их комбинации могут быть задействованы в способе получения наноалюмочастицы согласно вариантам реализации, такие как те, которые представлены в таблице 4.
[000129] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ5000 с DSPE-18C, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) концентрация агента, регулирующего размер, составляет приблизительно 8 мг/мл; и
e) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:2.
[000130] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (а)-(е). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (а)-(е). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (е).
[000131] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ2000 с DSPE-18C, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) концентрация агента, регулирующего размер, составляет приблизительно 10 мг/мл; и
e) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:2,5.
[000132] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (а)-(е). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (а)-(е). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (е).
[000133] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ5000 с DPPE-16C, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) концентрация агента, регулирующего размер, составляет от приблизительно 1 мг/мл до приблизительно 8 мг/мл, например, 4 или 8 мг/мл; и
e) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:1 или 1:2.
[000134] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (а)-(е). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (а)-(е). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (е).
[000135] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ2000 с DPPE-16C, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) концентрация агента, регулирующего размер, составляет приблизительно 10 мг/мл; и
e) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:2,5.
[000136] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (а)-(е). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (а)-(е). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (е).
[000137] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой ПЭГ2000 с DMPE-14C, указанный способ может иметь любой один или более из следующих признаков:
a) типом источника высокой энергии является микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет от 1 до 10, например, 3, 6 или 10;
d) концентрация агента, регулирующего размер, составляет приблизительно 10 мг/мл; и
e) соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:25.
[000138] Согласно одному варианту способ соответствует по меньшей мере одному из признаков (а)-(е). Согласно другому варианту способ соответствует двум или более (и в некоторых вариантах всем) признакам (а)-(е). Согласно конкретному варианту способ соответствует признаку (а). Согласно другому варианту способ соответствует признакам (а), (b) и (с). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (d). Согласно другому варианту способ соответствует признакам (а), (b), (с) и (е).
[000139] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой хитозан и соль алюминия представляет собой Al(ОН)(PO4) (например, AdjuPhos®), указанный способ может иметь любую комбинацию следующих признаков:
a) типом источника высокой энергии является смеситель с высоким усилием сдвига, после которого применяют микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет 1-30, предпочтительно от 10 до 30;
d) смеситель с высоким усилием сдвига осуществляет смешивание при 5000 об./мин;
e) концентрация алюминиевых квасцов составляет приблизительно 2 мг алюминия/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 2 мг/мл; и
g) массовое соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 1:1;
h) агент, регулирующий размер, представляет собой низкомолекулярный хитозан.
[000140] Согласно некоторым вариантам реализации настоящего изобретения,
применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой декстран (например, натриевую соль сульфата декстрана) и соль алюминия представляет собой AlO(ОН) (например, Alhydrogel®), указанный способ может иметь любую комбинацию следующих признаков:
a) типом источника высокой энергии является смеситель с высоким усилием сдвига, после которого применяют микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет 1-30, предпочтительно от 10 до 30;
d) смеситель с высоким усилием сдвига осуществляет смешивание при 5000 об./мин;
e) концентрация алюминиевых квасцов составляет приблизительно 2 мг алюминия/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 0,5 мг/мл (например, 0,44 мг/мл); и
g) массовое соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 4,5:1;
h) агент, регулирующий размер, представляет собой натриевую соль сульфата низкомолекулярного хитозана.
[000141] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой хитозан и соль алюминия представляет собой AlO(ОН) (например, Alhydrogel®), указанный способ может иметь любую комбинацию следующих признаков:
a) типом источника высокой энергии является смеситель с высоким усилием сдвига, после которого применяют микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет 1-30, предпочтительно от 10 до 30;
d) смеситель с высоким усилием сдвига осуществляет смешивание при 5000 об./мин;
e) концентрация алюминиевых квасцов составляет приблизительно 2 мг алюминия/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 1 мг/мл; и
g) массовое соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 2:1;
h) агент, регулирующий размер, представляет собой низкомолекулярный хитозан;
i) перед смешиванием соли алюминия и агента, регулирующего размер, соль алюминия подвергают обмену лигандами (например, обмену фосфатного лиганда).
[000142] Согласно некоторым вариантам реализации настоящего изобретения, применительно к способу получения наноалюмочастицы, в котором агент, регулирующий размер, представляет собой полиаллиламин и соль алюминия представляет собой AlO(ОН) (например, Alhydrogel®), указанный способ может иметь любую комбинацию следующих признаков:
a) типом источника высокой энергии является смеситель с высоким усилием сдвига, после которого применяют микрофлюидизатор;
b) давление, оказываемое источником высокой энергии, составляет приблизительно 30000 фунтов на кв. дюйм;
c) количество раундов обработки смеси источником высокой энергии составляет 1-30, предпочтительно от 10 до 30;
d) смеситель с высоким усилием сдвига осуществляет смешивание при 5000 об./мин;
e) концентрация алюминиевых квасцов составляет приблизительно 2 мг алюминия/мл;
f) концентрация агента, регулирующего размер, составляет приблизительно 0,5 мг/мл; и
g) массовое соотношение соли алюминия и агента, регулирующего размер, составляет приблизительно 4:1;
h) масса агента, регулирующего размер, составляет 15 кДа;
i) перед смешиванием соли алюминия и агента, регулирующего размер, соль алюминия подвергают обмену лигандами (например, обмену фосфатного лиганда).
Е. Размер наноалюмочастиц
[000143] Согласно настоящему изобретению размер наноалюмочастицы, содержащей соль алюминия и агент, регулирующий размер, находится в диапазоне от приблизительно 1 нм до 450 нм.
[000144] Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 50 нм до 75 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 50 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 5 нм до 150 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 5 нм до 200 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 50 нм до 300 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 50 нм до 400 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 50 нм до 450 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 20 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 20 нм до 50 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 10 нм до 200 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 10 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы находится в диапазоне от приблизительно 10 нм до 50 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы составляет приблизительно 1 нм, составляет приблизительно 5 нм, составляет приблизительно 10 нм, составляет приблизительно 15 нм, составляет приблизительно 20 нм, составляет приблизительно 25 нм, составляет приблизительно 30 нм, составляет приблизительно 35 нм, составляет приблизительно 40 нм, составляет приблизительно 45 нм, составляет приблизительно 50 нм, составляет приблизительно 55 нм, составляет приблизительно 60 нм, составляет приблизительно 65 нм, составляет приблизительно 70 нм, составляет приблизительно 75 нм, составляет приблизительно 80 нм, составляет приблизительно 85 нм, составляет приблизительно 90 нм, составляет приблизительно 95 нм, составляет приблизительно 100 нм, составляет приблизительно 105 нм, составляет приблизительно 110 нм, составляет приблизительно 115 нм, составляет приблизительно 120 нм, составляет приблизительно 125 нм, составляет приблизительно 130 нм, составляет приблизительно 135 нм, составляет приблизительно 140 нм, составляет приблизительно 145 нм, составляет приблизительно 150 нм, составляет приблизительно 155 нм, составляет приблизительно 160 нм, составляет приблизительно 165 нм, составляет приблизительно 170 нм, составляет приблизительно 175 нм, составляет приблизительно 180 нм, составляет приблизительно 185 нм, составляет приблизительно 190 нм, составляет приблизительно 195 нм, составляет приблизительно 200 нм, составляет приблизительно 210 нм, составляет приблизительно 220 нм, составляет приблизительно 240 нм, составляет приблизительно 250 нм, составляет приблизительно 260 нм, составляет приблизительно 280 нм, составляет приблизительно 200 нм, составляет приблизительно 300 нм, составляет приблизительно 320 нм, составляет приблизительно 340 нм, составляет приблизительно 350 нм, составляет приблизительно 360 нм, составляет приблизительно 380 нм, составляет приблизительно 400 нм, составляет приблизительно 420 нм, составляет приблизительно 440 нм или составляет приблизительно 450 нм. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастицы не более приблизительно 1 нм, не более приблизительно 5 нм, не более приблизительно 10 нм, не более приблизительно 15 нм, не более приблизительно 20 нм, не более приблизительно 25 нм, не более приблизительно 30 нм, не более приблизительно 35 нм, не более приблизительно 40 нм, не более приблизительно 45 нм, не более приблизительно 50 нм, не более приблизительно 55 нм, не более приблизительно 60 нм, не более приблизительно 65 нм, не более приблизительно 70 нм, не более приблизительно 75 нм, не более приблизительно 80 нм, не более приблизительно 85 нм, не более приблизительно 90 нм, не более приблизительно 95 нм, не более приблизительно 100 нм, не более приблизительно 100 нм, не более приблизительно 105 нм, не более приблизительно 110 нм, не более приблизительно 115 нм, не более приблизительно 120 нм, не более приблизительно 125 нм, не более приблизительно 130 нм, не более приблизительно 135 нм, не более приблизительно 140 нм, не более приблизительно 145 нм, не более приблизительно 150 нм, не более приблизительно 155 нм, не более приблизительно 160 нм, не более приблизительно 165 нм, не более приблизительно 170 нм, не более приблизительно 175 нм, не более приблизительно 180 нм, не более приблизительно 185 нм, не более приблизительно 190 нм, не более приблизительно 195 нм, не более приблизительно 199 нм, не более приблизительно 210 нм, не более приблизительно 230 нм, не более приблизительно 250 нм, не более приблизительно 270 нм, не более приблизительно 290 нм, не более приблизительно 310 нм, не более приблизительно 330 нм, не более приблизительно 350 нм, не более приблизительно 370 нм, не более приблизительно 390 нм, не более приблизительно 410 нм, не более приблизительно 430 нм, не более приблизительно 440 нм, не более приблизительно 449 нм или не более приблизительно 450 нм.
[000145] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица может быть профильтрована через фильтр с размером пор по меньшей мере 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица может быть профильтрована через фильтр с размером пор 0,45 мкм или менее. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица может быть профильтрована через фильтр с размером пор 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица может быть профильтрована через фильтр с размером пор 0,20 мкм. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица может быть профильтрована через фильтр с размером пор 0,22 мкм.
F. Стабильность
[000146] Согласно некоторым вариантам реализации настоящего изобретения, предусмотренным в настоящем документе, размер 1-450 нм наноалюмочастицы, содержащей соль алюминия и агент, регулирующий размер, является стабильным, это означает, что размер наноалюмочастицы поддерживается менее 450 нм и что соль алюминия проявляет сниженную агрегацию или не склонна к агрегации по сравнению с солью алюминия в отсутствие агента, регулирующего размер.
[000147] Согласно некоторым вариантам реализации настоящего изобретения «стабильный» относится к составу или композиции наноалюмочастиц, состоящей из наноалюмочастиц, которые не «агрегируют», проявляют незначительную агрегацию или отсутствие агрегации, или проявляют сниженную агрегацию, и/или демонстрируют незначительное или отсутствующее общее увеличение среднего размера частиц или полидисперсности состава с течением времени по сравнению с начальным размером частиц.
[000148] Стабильность наноалюмочастицы может быть измерена с помощью методик, хорошо известных специалистам в данной области техники. Согласно некоторым вариантам реализации настоящего изобретения стабильность наблюдают визуально. Визуальная проверка может включать проверку на присутствие микрочастиц, хлопьевидности или агрегатов. Согласно некоторым вариантам реализации настоящего изобретения стабильность определяют по размеру наноалюмочастиц. Например, размер можно оценить с помощью известных методик в данной области техники, включая, но не ограничиваясь ими, рентгеновскую и лазерную дифракцию, динамическое рассеяние света (ДРС), крио-ЭМ, или Malvern Zetasize. Согласно некоторым вариантам реализации настоящего изобретения размер наноалюмочастиц относится к Z-среднему диаметру. Согласно некоторым вариантам реализации настоящего изобретения стабильность определяют путем оценки процента (%) агрегации солей алюминия в наноалюмочастице. Согласно некоторым вариантам реализации настоящего изобретения стабильность оценивают по способности наноалюмочастицы пройти через фильтр определенного размера, например, через фильтр с размером пор 0,20, 0,22 или 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения стабильность определяют на основании рН. Согласно некоторым вариантам реализации настоящего изобретения стабильность определяют на основании измерения индекса полидисперсности (PdI), например, с использованием метода динамического рассеяния света (ДРС).
[000149] Согласно некоторым вариантам реализации настоящего изобретения Z-средний диаметр наночастицы увеличивается менее чем на 50%, менее чем на 40%, менее чем на 30%, менее чем на 25%, менее чем на 20%, менее чем на 15%, менее чем на 12%, менее чем на 10%, менее чем на 7%, менее чем на 5%, менее чем на 3%, менее чем на 1% в течение исследованного периода времени. Согласно некоторым вариантам реализации настоящего изобретения индекс полидисперсности (PdI) наночастицы увеличивается менее чем на 50%, менее чем на 40%, менее чем на 30%, менее чем на 25%, менее чем на 20%, менее чем на 15%, менее чем на 12%, менее чем на 10%, менее чем на 7%, менее чем на 5%, менее чем на 3%, менее чем на 1% в течение исследованного периода времени.
[000150] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 0-8°С. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 0°С, 1°С, 2°С, 3°С, 4°С, 5°С, 6°С, 7°С или 8°С в течение по меньшей мере 1 минуты, в течение по меньшей мере 5 минут, в течение по меньшей мере 10 минут, в течение по меньшей мере 15 минут, в течение по меньшей мере 20 минут, в течение по меньшей мере 25 минут, в течение по меньшей мере 30 минут, в течение по меньшей мере 35 минут, в течение по меньшей мере 40 минут, в течение по меньшей мере 45 минут, в течение по меньшей мере 50 минут, в течение по меньшей мере 55 минут, в течение по меньшей мере 1 часа, в течение по меньшей мере 2 часов, в течение по меньшей мере 6 часов, в течение по меньшей мере 12 часов, в течение по меньшей мере 18 часов, в течение по меньшей мере 24 часов, в течение по меньшей мере 48 часов, в течение по меньшей мере 72 часов, в течение по меньшей мере 1 недели, в течение по меньшей мере 2 недель, в течение по меньшей мере 3 месяцев, в течение по меньшей мере 1 месяца, в течение по меньшей мере 2 месяцев, в течение по меньшей мере 3 месяцев, в течение по меньшей мере 4 месяцев, в течение по меньшей мере 5 месяцев, в течение по меньшей мере 6 месяцев, в течение по меньшей мере 7 месяцев, в течение по меньшей мере 8 месяцев, в течение по меньшей мере 9 месяцев, в течение по меньшей мере 10 месяцев, в течение по меньшей мере 11 месяцев, в течение по меньшей мере 1 года, в течение по меньшей мере 2 лет или в течение по меньшей мере 5 лет.
[000151] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 20-30°С. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 25°С в течение по меньшей мере 1 минуты, в течение по меньшей мере 5 минут, в течение по меньшей мере 10 минут, в течение по меньшей мере 15 минут, в течение по меньшей мере 20 минут, в течение по меньшей мере 25 минут, в течение по меньшей мере 30 минут, в течение по меньшей мере 35 минут, в течение по меньшей мере 40 минут, в течение по меньшей мере 50 минут, в течение по меньшей мере 55 минут, в течение по меньшей мере 1 часа, в течение по меньшей мере 2 часов, в течение по меньшей мере 6 часов, в течение по меньшей мере 12 часов, в течение по меньшей мере 18 часов, в течение по меньшей мере 24 часов, в течение по меньшей мере 48 часов, в течение по меньшей мере 72 часов, в течение по меньшей мере 1 недели, в течение по меньшей мере 2 недель, в течение по меньшей мере 3 недель, в течение по меньшей мере 1 месяца, в течение по меньшей мере 2 месяцев, в течение по меньшей мере 3 месяцев, в течение по меньшей мере 4 месяцев, в течение по меньшей мере 5 месяцев, в течение по меньшей мере 6 месяцев, в течение по меньшей мере 7 месяцев, в течение по меньшей мере 8 месяцев, в течение по меньшей мере 9 месяцев, в течение по меньшей мере 10 месяцев, в течение по меньшей мере 11 месяцев, в течение по меньшей мере 1 года, в течение по меньшей мере 2 лет или в течение по меньшей мере 5 лет.
[000152] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 35-40°С. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 35°С, 36°С, 37°С, 38°С, 39°С, или 40°С в течение по меньшей мере 1 минуты, в течение по меньшей мере 5 минут, в течение по меньшей мере 10 минут, в течение по меньшей мере 15 минут, в течение по меньшей мере 20 минут, в течение по меньшей мере 25 минут, в течение по меньшей мере 30 минут, в течение по меньшей мере 35 минут, в течение по меньшей мере 40 минут, в течение по меньшей мере 45 минут, в течение по меньшей мере 50 минут, в течение по меньшей мере 55 минут, в течение по меньшей мере 1 часа, в течение по меньшей мере 2 часов, в течение по меньшей мере 6 часов, в течение по меньшей мере 12 часов, в течение по меньшей мере 18 часов, в течение по меньшей мере 24 часов, в течение по меньшей мере 48 часов, в течение по меньшей мере 72 часов, в течение по меньшей мере 1 недели, в течение по меньшей мере 2 недель, в течение по меньшей мере 3 недель, в течение по меньшей мере 1 месяца, в течение по меньшей мере 2 месяцев, в течение по меньшей мере 3 месяцев, в течение по меньшей мере 4 месяцев, в течение по меньшей мере 5 месяцев, в течение по меньшей мере 6 месяцев, в течение по меньшей мере 7 месяцев, в течение по меньшей мере 8 месяцев, в течение по меньшей мере 9 месяцев, в течение по меньшей мере 10 месяцев, в течение по меньшей мере 11 месяцев, в течение по меньшей мере 1 года, в течение по меньшей мере 2 лет или в течение по меньшей мере 5 лет.
[000153] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 57-62°С. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной при 57°С, 58°С, 59°С, 60°С, 61°С, или 62°С в течение по меньшей мере 1 минуты, в течение по меньшей мере 5 минут, в течение по меньшей мере 10 минут, в течение по меньшей мере 15 минут, в течение по меньшей мере 20 минут, в течение по меньшей мере 25 минут, в течение по меньшей мере 30 минут, в течение по меньшей мере 35 минут, в течение по меньшей мере 40 минут, в течение по меньшей мере 50 минут, в течение по меньшей мере 50 минут, в течение по меньшей мере 55 минут, в течение по меньшей мере 1 часа, в течение по меньшей мере 2 часов, в течение по меньшей мере 6 часов, в течение по меньшей мере 12 часов, в течение по меньшей мере 18 часов, в течение по меньшей мере 24 часов, в течение по меньшей мере 48 часов, в течение по меньшей мере 72 часов, в течение по меньшей мере 1 недели, в течение по меньшей мере 2 недель, в течение по меньшей мере 3 недель и в течение по меньшей мере 1 месяца.
[000154] Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 4°С в течение по меньшей мере 2 лет. Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 4°С в течение по меньшей мере 4 лет. Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 4°С в течение по меньшей мере 5 лет. Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 25°С в течение по меньшей мере одного месяца. Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 37°С в течение по меньшей мере двух недель. Согласно одному примерному варианту реализации настоящего изобретения наноалюмочастица является стабильной при 60°С в течение по меньшей мере двух недель.
[000155] Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной после 1-4 циклов замораживания/оттаивания. Согласно некоторым вариантам реализации настоящего изобретения наноалюмочастица является стабильной после 1, после 2, после 3 или после 4 циклов замораживания/оттаивания.
IV. Композиции наноалюмочастиц
[000156] Настоящее изобретение относится к композициям, содержащим наноалюмочастицы, причем указанные наноалюмочастицы содержат соль алюминия и агент, регулирующий размер, при этом размер наноалюмочастиц составляет приблизительно 1 нм-450 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 75 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 150 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 200 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 300 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 до 400 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 50 нм до 450 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 20 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 20 нм до 50 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 10 нм до 200 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 10 нм до 100 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц находится в диапазоне от приблизительно 10 нм до 50 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц составляет приблизительно 1 нм, составляет приблизительно 5 нм, составляет приблизительно 10 нм, составляет приблизительно 15 нм, составляет приблизительно 20 нм, составляет приблизительно 25 нм, составляет приблизительно 30 нм, составляет приблизительно 35 нм, составляет приблизительно 40 нм, составляет приблизительно 45 нм, составляет приблизительно 50 нм, составляет приблизительно 55 нм, составляет приблизительно 60 нм, составляет приблизительно 65 нм, составляет приблизительно 70 нм, составляет приблизительно 75 нм, составляет приблизительно 80 нм, составляет приблизительно 85 нм, составляет приблизительно 90 нм, составляет приблизительно 95 нм, составляет приблизительно 100 нм, составляет приблизительно 105 нм, составляет приблизительно 110 нм, составляет приблизительно 115 нм, составляет приблизительно 120 нм, составляет приблизительно 125 нм, составляет приблизительно 130 нм, составляет приблизительно 135 нм, составляет приблизительно 140 нм, составляет приблизительно 145 нм, составляет приблизительно 150 нм, составляет приблизительно 155 нм, составляет приблизительно 160 нм, составляет приблизительно 165 нм, составляет приблизительно 170 нм, составляет приблизительно 175 нм, составляет приблизительно 180 нм, составляет приблизительно 185 нм, составляет приблизительно 190 нм, составляет приблизительно 195 нм, составляет приблизительно 200 нм, составляет приблизительно 210 нм, составляет приблизительно 220 нм, составляет приблизительно 240 нм, составляет приблизительно 250 нм, составляет приблизительно 260 нм, составляет приблизительно 280 нм, составляет приблизительно 200 нм, составляет приблизительно 300 нм, составляет приблизительно 320 нм, составляет приблизительно 340 нм, составляет приблизительно 350 нм, составляет приблизительно 360 нм, составляет приблизительно 380 нм, составляет приблизительно 400 нм, составляет приблизительно 420 нм, составляет приблизительно 440 нм или составляет приблизительно 450 нм. Согласно некоторым вариантам реализации настоящего изобретения средний размер частиц в композиции наноалюмочастиц составляет не более приблизительно 1 нм, не более приблизительно 5 нм, не более приблизительно 10 нм, не более приблизительно 15 нм, не более приблизительно 20 нм, не более приблизительно 25 нм, не более приблизительно 30 нм, не более приблизительно 35 нм, не более приблизительно 40 нм, не более приблизительно 45 нм, не более приблизительно 50 нм, не более приблизительно 55 нм, не более приблизительно 60 нм, не более приблизительно 65 нм, не более приблизительно 70 нм, не более приблизительно 75 нм, не более приблизительно 80 нм, не более приблизительно 85 нм, не более приблизительно 90 нм, не более приблизительно 95 нм, не более приблизительно 100 нм, не более приблизительно 105 нм, не более приблизительно 110 нм, не более приблизительно 115 нм, не более приблизительно 120 нм, не более приблизительно 125 нм, не более приблизительно 130 нм, не более приблизительно 135 нм, не более приблизительно 140 нм, не более приблизительно 145 нм, не более приблизительно 150 нм, не более приблизительно 155 нм, не более приблизительно 160 нм, не более приблизительно 165 нм, не более приблизительно 170 нм, не более приблизительно 175 нм, не более приблизительно 180 нм, не более приблизительно 185 нм, не более приблизительно 190 нм, не более приблизительно 195 нм, не более приблизительно 199 нм, не более приблизительно 210 нм, не более приблизительно 230 нм, не более приблизительно 250 нм, не более приблизительно 270 нм, не более приблизительно 290 нм, не более приблизительно 310 нм, не более приблизительно 330 нм, не более приблизительно 350 нм, не более приблизительно 370 нм, не более приблизительно 390 нм, не более приблизительно 410 нм, не более приблизительно 430 нм, не более приблизительно 440 нм или не более приблизительно 449 нм, согласно результатам измерения методом ДРС.
[000157] Согласно некоторым вариантам реализации настоящего изобретения композиции могут быть профильтрованы и окончательно стерилизованы перед внесением во флаконы. Согласно некоторым вариантам реализации настоящего изобретения композиция может быть профильтрована через фильтр с размером пор 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения композиция может быть профильтрована через фильтр с размером пор 0,20 мкм. Согласно некоторым вариантам реализации настоящего изобретения композиция может быть профильтрована через фильтр с размером пор 0,22 мкм.
[000158] Согласно некоторым вариантам реализации настоящего изобретения композиции сохраняют в виде водных составов. Согласно некоторым вариантам реализации настоящего изобретения композиции сохраняют в виде лиофилизированных составов. Согласно некоторым вариантам реализации настоящего изобретения композиции сохраняют в виде высушенных распылением составов.
[000159] Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и эмульсию. Согласно некоторым вариантам реализации настоящего изобретения эмульсия композиции представляет собой эмульсию типа «вода-в-масле». Согласно некоторым вариантам реализации настоящего изобретения эмульсия композиции представляет собой эмульсию Пикеринга. Согласно некоторым вариантам реализации настоящего изобретения эмульсия композиции представляет собой эмульсию типа «масло-в-воде». Согласно некоторым вариантам реализации настоящего изобретения масло эмульсии является биоразлагаемым маслом. Согласно дополнительным вариантам реализации настоящего изобретения масло представляет собой сквален. Согласно другому варианту реализации настоящего изобретения масло представляет собой синтетическое биоразлагаемое масло.
[000160] Липосомы и нановезикулы, полученные из липосом, известны в данной области техники [8] и могут применяться с наночастицами алюминия согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит липосому, содержащую наноалюмочастицы. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и липосому, причем липосома представляет собой катионную липосому. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и липосому, причем липосома представляет собой анионную липосому. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и липосому, причем липосома представляет собой нейтральную липосому. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и липосому, причем липосома представляет собой археосому. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и липосому, причем липосома представляет собой виросому.
А. Биоактивные агенты
[000161] Согласно некоторым вариантам реализации настоящего изобретения композиция дополнительно содержит один или более биоактивных агентов, например, биоактивный агент может представлять собой полипептид, полинуклеотид, антиген, адъювант, диагностический агент, терапевтический агент, организм, вирус, вирусный геном. Согласно некоторым вариантам реализации настоящего изобретения композиция содержит два или более биоактивных агентов. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент ассоциирован с наноалюмочастицей. Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент ассоциирован с наноалюмочастицей за счет обмена лигандами и/или электростатического (на основе зарядов) взаимодействия. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере 25%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% и по меньшей мере 99% биоактивного агента, присутствующего в композиции, ассоциировано с наночастицами алюминия. Согласно некоторым вариантам реализации настоящего изобретения процент ассоциации биоактивного агента с наноалюмочастицей определен с помощью гель-электрофореза или УФ-спектроскопии. Один примерный способ определения процента ассоциации приведен в примерах.
I. Макромолекулы
[000162] Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой макромолекулу. Макромолекула может включать, но не ограничивается ими, полинуклеотид, полипептид или антиген. Согласно некоторым вариантам реализации настоящего изобретения макромолекула является природной. Согласно некоторым вариантам реализации настоящего изобретения макромолекула является синтетической. Согласно некоторым вариантам реализации настоящего изобретения макромолекула помечена или маркирована,
а. Полинуклеотиды
[000163] Белки, субъединицы белков и инактивированный патоген являются эффективными стимуляторами антительных ответов (гуморального иммунитета) и успешно разработаны как эффективные вакцины для ряда инфекционных заболеваний, при которых имеется сильная корреляция гуморального иммунитета со степенью защиты. Однако для некоторых хронических инфекционных заболеваний или рака помимо гуморального ответа может потребоваться классический клеточный ответ или ответ цитолитических Т-клеток. Классический путь выработки клеточных иммунных ответов включает эндогенное или внутриклеточное представление антигенов в комплексе с молекулами главного комплекса гистосовместимости. В этой связи исследователи предположили, что доставка нуклеиновых кислот для кодирования внутриклеточных антигенов может привести к более успешным стратегиям вакцинации при хронической инфекции и раке. РНК-вакцины являются особенно привлекательными для доставки нуклеиновой кислоты, теоретически, на основании способности белка, транскрибируемого РНК, к более эффективному представлению в комплексе с молекулами главного комплекса гистосовместимости хозяина. В данной области техники доставка РНК-вакцин включает, например, доставку иРНК и реплицирующихся РНК-конструкций, экспрессируемых с конструкций альфавируса, оба этих подхода основаны на доставке и экспрессии в клетке белка, кодируемого РНК. Несмотря на то, что данный подход является многообещающим в теории, на сегодняшний день практическая разработка РНК-вакцин была ограничена стоимостью получения РНК, относительно неэффективной доставкой РНК в условиях in vivo, нестабильностью «оголенной» РНК, а также относительного уровня экспрессии РНК в условиях in vivo. В простейшем случае все упомянутые ограничения могут быть связаны с отсутствием эффективной доставки РНК в условиях in vivo. В последнее время для устранения этих ограничений применяли многочисленные стратегии, включая встраивание химически модифицированных нуклеотидов, модификацию структуры РНК, включая ARCA-кэп и удлиненные полиА-хвосты, а также оценку стратегий доставки РНК, начиная от «оголенной» РНК и заканчивая катионными липидами и полимерами (1-5). Возможно, наиболее хорошо изученными составами для доставки РНК являются катионные эмульсии, состоящие из катионного липида, DOTAP, DOTAP, триолеата сорбитана, полисорбата и сквалена (5). Было продемонстрировано, что такие катионные липосомы способны к самостоятельной сборке в синтетические липидные наночастицы с РНК, инкапсулированными в ядро частицы. Несмотря на то, что такие катионные липосомы были способны доставлять РНК-вакцины и индуцировать иммунные ответы, изготовление таких составов является довольно сложным и дорогим. В данной области техники необходим состав для доставки полинуклеотидов, включая РНК и ДНК, который является стабильным, недорогим и пригодным для крупномасштабного изготовления, включая окончательную стерилизацию.
[000164] Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой полинуклеотид. Полинуклеотид включает, но не ограничивается ими, ДНК, РНК, аптамер и олигонуклеотид. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой ДНК. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой РНК. Согласно некоторым вариантам реализации настоящего изобретения ДНК или РНК являются одноцепочечными или двухцепочечными. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой некодирующую РНК. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой кодирующую РНК. Согласно некоторым вариантам реализации настоящего изобретения РНК выбрана из группы, состоящей из РНК-репликона, иРНК, тРНК, киРНК, кшРНК, Rig I и микроРНК.
[000165] Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид кодирует полипептид. Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид кодирует полипептид, который является антигеном или содержит антиген, дополнительно описанный ниже. Согласно некоторым вариантам реализации настоящего изобретения полипептид, кодируемый полинуклеотидом, представляет собой гибридный белок. Согласно некоторым вариантам реализации настоящего изобретения полипептид, кодируемый полинуклеотидом, представляет собой ID93.
[000166] Согласно одному конкретному варианту реализации настоящего изобретения наночастица содержит агент, регулирующий размер, ПЭГ, и агент представляет собой РНК.
[000167] Согласно одному конкретному варианту реализации настоящего изобретения наночастица содержит агент, регулирующий размер, ПАК, и агент представляет собой РНК.
1. Рекомбинантные конструкции для экспрессии
[000168] В соответствии с некоторыми раскрытыми вариантами реализации композиции, описанные в настоящем документе, могут содержать по меньшей мере одну рекомбинантную конструкцию для экспрессии, которая содержит промотор, функционально соединенный с последовательностью нуклеиновой кислоты, кодирующей полипептид. Согласно некоторым другим вариантам реализации настоящего изобретения рекомбинантная конструкция для экспрессии присутствует в вирусном векторе, таком как аденовирусный вектор, вектор на основе аденоассоциированного вируса, вектор на основе вируса герпеса, лентивирусный вектор, поксвирусный вектор или ретровирусный вектор. Композиции и способы получения и применения указанных конструкций для экспрессии и векторов известны в данной области техники для экспрессии полипептидных антигенов, описанных в настоящем документе, например, в соответствии с Ausubel et al. (Eds.), Current Protocols in Molecular Biology, 2006 John Wiley & Sons, NY. Неограничивающие примеры рекомбинантных конструкций для экспрессии обычно можно найти, например, в патентах США №№6844192; 7037712; 7052904; 7001770; 6106824; 5693531; 6613892; 6875610; 7067310; 6218186; 6783981; 7052904; 6783981; 6734172; 6713068; 5795577 и 6770445 и в других местах, при этом принципы изобретений могут быть адаптированы для экспрессии полипептидных антигенов, предусмотренных в настоящем документе, для применения в некоторых вариантах реализации, раскрытых в настоящем документе.
2. Альтернативные межнуклеозидные связи и аналоги нуклеиновых кислот
[000169] Согласно некоторым вариантам реализации настоящего изобретения полинуклеотиды содержат альтернативные межнуклеозидные связи или аналоги нуклеиновых кислот. Например, согласно одному варианту реализации настоящего изобретения полинуклеотид содержит фосфодитиоатные или фосфотиоатные связи, хотя фосфодиэфирные и другие межнуклеотидные связи включены в объем настоящего изобретения, включая олигонуклеотиды со смешанными межнуклеотидными связями. Способы получения фосфотиоатных олигонуклеотидов или фосфодитиоата описаны в патентах США №№5666153, 5278302 и WO95/26204.
3. Репликоны
[000170] Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид представляет собой репликон. Согласно некоторым вариантам реализации настоящего изобретения репликон представляет собой плазмиду, космиду, бакмиду, фаг или вирус, способный к репликации в значительной степени под собственным контролем. Согласно некоторым вариантам реализации настоящего изобретения репликон представляет собой РНК или ДНК. Согласно некоторым вариантам реализации настоящего изобретения репликон является одноцепочечным или двухцепочечным. Согласно некоторым вариантам реализации настоящего изобретения репликон происходит из РНК-вируса.
b. Полипептиды
[000171] Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой полипептид. Соответственно, в таких вариантах реализации описанные композиции содержат наноалюмочастицы согласно настоящему изобретению и дополнительно содержат полипептид. Согласно некоторым вариантам реализации настоящего изобретения полипептид представляет собой полноразмерный белок или его фрагмент. Согласно некоторым вариантам реализации настоящего изобретения полипептид представляет собой пептид. Согласно некоторым вариантам реализации настоящего изобретения такой полипептид представляет собой гибридный белок. Согласно некоторым конкретным вариантам реализации настоящего изобретения такой гибридный белок способен вызывать иммунный ответ при введении индивидууму. Согласно некоторым вариантам реализации настоящего изобретения полипептид представляет собой антиген, подробно описанный ниже.
с. Антигены
[000172] Согласно некоторым вариантам реализации настоящего изобретения биоактивный агент представляет собой антиген. Согласно некоторым вариантам реализации настоящего изобретения антиген представляет собой полипептид, кодируемый полинуклеотидом. Согласно некоторым вариантам реализации настоящего изобретения антиген представляет собой полипептид, кодируемый полинуклеотидом. Согласно некоторым вариантам реализации настоящего изобретения антиген представляет собой ДНК-полинуклеотид, доставленный составами наноалюмочастиц согласно настоящему изобретению, который кодирует полипептид. Согласно некоторым вариантам реализации настоящего изобретения антиген представляет собой РНК-полинуклеотид, доставленный составами наноалюмочастиц согласно настоящему изобретению, который кодирует полипептид. Соответственно, согласно некоторым вариантам реализации настоящего изобретения описанные композиции содержат любую из наноалюмочастиц согласно настоящему изобретению, а также дополнительно содержат антиген, причем антиген наноалюмочастицы обеспечен в виде полипептида или полинуклеотида.
[000173] Согласно некоторым вариантам реализации настоящего изобретения антиген вовлечен в патофизиологию аллергии, рака или инфекционного заболевания, или происходит из них.
[000174] Согласно некоторым вариантам реализации настоящего изобретения композиции, описанные в настоящем документе, пригодны для целей вакцинации и обеспечены в виде вакцинных составов (вакцинных композиций).
[000175] Антиген может представлять собой любой целевой эпитоп, молекулу (включая биомолекулу), молекулярный комплекс (включая молекулярные комплексы, содержащие биомолекулы), субклеточный агрегат, клетку или ткань, против которых желательно вызвать или усилить иммунореактивность у субъекта. Часто термин «антиген» будет относиться к представляющему интерес полипептидному антигену. Однако в настоящем документе «антиген» также может относиться к рекомбинантной конструкции, которая кодирует представляющий интерес полипептидный антиген (например, конструкции для экспрессии). Согласно некоторым вариантам реализации настоящего изобретения антиген может представлять собой, или может происходить из него или может быть иммунологически перекрестно-реактивным с ним, инфекционный патоген и/или эпитоп, биомолекулу, клетку или ткань, которая ассоциирована с инфекцией, раком, аутоиммунным заболеванием, аллергией, астмой или любым другим состоянием, при котором стимуляция антигенспецифического иммунного ответа будет желательной или благоприятной.
[000176] Соответственно, согласно некоторым вариантам реализации настоящего изобретения предусмотрен антиген, который происходит из по меньшей мере одного инфекционного патогена, такого как бактерия, вирус или грибок, включая Actinobacterium, такую как М. tuberculosis или М. leprae, или другую микобактерию; бактерию, такую как член рода Salmonella, Neisseria, Borrelia, Chlamydia или Bordetella; вирус, такой как вирус простого герпеса, вирус иммунодефицита человека (ВИЧ), вирус кошачьего иммунодефицита (FIV), цитомегаловирус, вирус ветряной оспы, вирус гепатита, вирус Эпштейна-Барр (EBV), респираторно-синцитиальный вирус, вирус папилломы человека (ВПЧ) и цитомегаловирус; ВИЧ, например ВИЧ-1 или ВИЧ-2; грибок, такой как Aspergillus, Blastomyces, Coccidioides и Pneumocysti, или дрожжи, включая виды Candida, такие как С. albicans, С. glabrata, С. krusei, С. lusitaniae, С. tropicalis и С. parapsilosis; паразита, такого как простейший, например, виды Plasmodium, включая P. falciparum, Р. vivax, P. malariae и P. ovale; или другого паразита, такого как один или более из Acanthamoeba, Entamoeba histolytica, Angiostrongylus, Schistosoma mansonii, Schistosoma haematobium, Schistosoma japonicum, Cryptosporidium, Ancylostoma, Entamoeba histolytica, Entamoeba coli, Entamoeba dispar, Entamoeba hartmanni, Entamoeba polecki, Wuchereria bancrofti, Giardia и Leishmania.
[000177] Например, согласно некоторым вариантам реализации настоящего изобретения антигены происходят из Borrelia sp., антигены могут включать нуклеиновую кислоту, антиген или антигенные препараты, происходящие из возбудителя, рекомбинантно полученный белок или пептиды и химерные гибридные белки. Одним из таких антигенов является OspA. OspA может представлять собой полноразмерный зрелый белок в липидированной форме вследствие его биосинтеза в клетке-хозяине (Lipo-OspA) или согласно другому варианту может представлять собой нелипидированное производное. Такие нелипидированные производные включают нелипидированный гибридный белок NS1-OspA, который содержит 81 первую N-концевую аминокислоту неструктурного белка (NS1) вируса гриппа, и полноразмерный белок OspA, и другое производное, MDP-OspA, которое представляет собой нелипидированную форму OspA, несущую 3 дополнительные N-концевые аминокислоты.
[000178] Согласно некоторым вариантам реализации настоящего изобретения антиген происходит из вируса, такого как ВИЧ-1 (например, tat, nef, gp120 или gp160), вирусов герпеса человека, например, gD или его производные, или немедленный ранний белок, такой как ICP27 из HSV1 или HSV2, цитомегаловируса (особенно человека) (например, gB или его производные), ротавирусов (включая живые ослабленные вирусы), вируса Эпштейна-Барр (такой как gp350 или его производные), вируса ветряной оспы (например, gpI, II и IE63) или вируса гепатита, такого как вирус гепатита В (например, поверхностный антиген гепатита В или его производное), вируса гепатита А, вируса гепатита С и вируса гепатита Е, или из других вирусных патогенов, таких как парамиксовирусы: респираторного синцитиального вируса (например, белки F и G или их производные), вируса парагриппа, вируса кори, вируса эпидемического паротита, вирусов папилломы человека (например, HPV6, 11, 16, 18 и т.д.), флавивирусов (например, вируса желтой лихорадки, вируса денге, вируса клещевого энцефалита, вируса японского энцефалита, вируса Западного Нила, вируса Зика, вируса Пауссана) или вируса гриппа (целый живой или инактивированный вирус, расщепленный вирус гриппа, выращенный в яйцах или клетках MDCK, или виросомы целого вируса (как описано Gluck, Vaccine, 1992, 10, 915-920) или их очищенные или рекомбинантные белки, такие как белки НА, NP, NA или М или их комбинации.
[000179] Согласно некоторым другим вариантам реализации настоящего изобретения антиген происходит из одного или более бактериальных патогенов, таких как Neisseria spp., включая N. gonorrhea и N. meningitidis (например, капсулярные полисахариды и их конъюгаты, трансферринсвязывающие белки, лактоферринсвязывающие белки, PilC, адгезины); S. pyogenes (например, М-белки или их фрагменты, протеаза С5А, липотейхоевые кислоты), S. agalactiae, S. mutans: Н. ducreyi; Moraxella spp., включая M. catarrhalis, также известную как Branhamella catarrhalis (например, высокомолекулярные и низкомолекулярные адгезины и инвазины); Bordetella spp., включая В. pertussis (например, пертактин, токсин коклюша или его производные, филаментный гемагглютинин, аденилатциклазу, фимбрии), В. parapertussis и В. bronchiseptica; Mycobacterium spp., включая М. tuberculosis (например, ESAT6, антиген 85А, -В или -С), М. bovis, М. leprae, М. avium, М. paratuberculosis, М. smegmatis; Legionella spp., включая L. pneumophila; Escherichia spp., включая энтеротоксическую E. coli (например, факторы колонизации, термолабильный токсин или его производные, термостойкий токсин или его производные), энтерогеморрагическую Е. coli, энтеропатогенную Е. coli (например, токсин, сходный с шига-токсином или его производные); Vibrio spp., включая V. cholera (например, холерный токсин или его производные); Shigella spp., включая S. sonnei, S. dysenteriae, S. flexnerii; Yersinia spp., включая Y. enterocolitica (например, Yop-белок), Y. pestis, Y. pseudotuberculosis; Campylobacter spp., включая С. jejuni (например, токсины, адгезины и инвазины) и С. coli; Salmonella spp., включая S. typhi, S. paratyphi, S. choleraesuis, S. enteritidis; Listeria spp., включая L. monocytogenes; Helicobacter spp., включая Н. pylori (например, уреазу, каталазу, вакуолирующий токсин); Pseudomonas spp., включая P. aeruginosa; Staphylococcus spp., включая S. aureus, S. epidermidis; Enterococcus spp., включая E. faecalis, E. faecium; Clostridium spp., включая С. tetani (например, столбнячный токсин и его производное), С. botulinum (например, ботулинический токсин и его производное), С. difficile (например, токсины клостридий А или В и их производные); Bacillus spp., включая В. anthracis (например, сибиреязвенный токсин и его производные); Corynebacterium spp., включая С. diphtheriae (например, дифтерийный токсин и его производные); Borrelia spp., включая В. burgdorferi (например, OspA, OspC, DbpA, DbpB), В. garinii (например, OspA, OspC, DbpA, DbpB), B. afzelii (например, OspA, OspC, DbpA, DbpB), B. andersonii (например, OspA, OspC, DbpA, DbpB), B. hermsii; Ehrlichia spp., включая E. equi и агент гранулоцитарного эрлихиоза человека; Rickettsia spp., включая R. rickettsii; Chlamydia spp., включая С. trachomatis (например, MOMP, связывающие гепарин белки), С. pneumoniae (например, МОМР, гепаринсвязывающие белки), С. psittaci; Leptospira spp., включая L. interrogans; Treponema spp., включая Т. pallidum (например, редкие белки наружной мембраны), Т. denticola, Т. hyodysenteriae; или других бактериальных патогенов.
[000180] Согласно некоторым другим вариантам реализации настоящего изобретения антиген происходит из одного или более паразитов (см, например, John, D.T. and Petri, W.A., Markell and Voge's Medical Parasitology-9th Ed., 2006, WB Saunders, Philadelphia; Bowman, D.D., Georgis' Parasitology for Veterinarians-8th Ed., 2002, WB Saunders, Philadelphia), таких как Plasmodium spp., включая P. falciparum; Toxoplasma spp., включая Т. gondii (например, SAG2, SAG3, Tg34); Entamoeba spp., включая E. histolytica; Babesia spp., включая В. microti; Trypanosoma spp., включая Т. cruzi; Giardia spp., включая G. lamblia; Leshmania spp., включая L. major; Pneumocystis spp., включая P. carinii; Trichomonas spp., включая Т. vaginalis; или гельминтов, способных инфицировать млекопитающее, таких как: (i) нематодные инфекции (включая, но не ограничиваясь ими, Enterobius vermicularis, Ascaris lumbricoides, Trichuris trichuria, Necator americanus, Ancylostoma duodenale, Wuchereria bancrofti, Brugia malayi, Onchocerca volvulus, Dracanculus medinensis, Trichinella spiralis и Strongyloides stercoralis); (ii) трематодные инфекции (включая, но не ограничиваясь ими, Schistosoma mansoni, Schistosoma haematobium, Schistosoma japonicum, Schistosoma mekongi, Opisthorchis sinensis, Paragonimus sp, Fasciola hepatica, Fasciola magna, Fasciola gigantica); и (iii) цестодные инфекции (включая, но не ограничиваясь ими, Taenia saginata и Taenia solium). Согласно некоторым другим вариантам реализации настоящего изобретения антиген происходит из Schisostoma spp., Schistosoma mansonii, Schistosoma haematobium и/или Schistosoma japonicum, или происходит из дрожжей, таких как Candida spp., включая С. albicans; Cryptococcus spp., включая С. neoformans.
[000181] Другие специфические антигены происходят из М. tuberculosis, например Th Ra12, Tb Н9, Tb Ra35, Tb38-1, Erd 14, DPV, MTI, MSL, mTTC2 и hTCC1 (WO 99/51748). Белки M. tuberculosis также включают гибридные белки и их варианты, в которых по меньшей мере два, три или четыре или более полипептидов М. tuberculosis гибридизованы в более крупный белок. Некоторые гибридные белки включают Ra12-TbH9-Ra35, Erd14-DPV-MTI, DPV-MTI-MSL, Erd14DPV-MTI-MSL-mTCC2, Erd14-DPV-MTI-MSL, DPV-MTI-MSL-mTCC2, TbH9-DPV-MTI (WO 99151748). Другие антигены, которые можно применять, включают антигены, комбинацию антигенов и гибридные белки, описанные в US 2010/0129391 и WO 2008/124647. Согласно одному примерному варианту реализации настоящего изобретения гибридный белок представляет собой ID93. Согласно одному примерному варианту реализации настоящего изобретения гибридный белок представляет собой ID91.
[000182] Другие специфические антигены происходят из Leishmania, например полипептиды и полинуклеотиды Leishmania согласно настоящему изобретению могут быть получены или выделены с использованием любой из множества процедур и с использованием любого из множества видов Leishmania, включая, но не ограничиваясь ими, L. donovani, L. chagasi, L. infantum, L. major, L. amazonensis, L. braziliensis, L. panamensis, L. mexicana, L. Tropics и L. guyanensis. Такие виды доступны, например, из Американской коллекции типовых культур (АТСС), Роквилл, Мэриленд, США. Белки Leishmania также включают гибридные белки и их варианты, в которых по меньшей мере два, три или четыре или более полипептидов Leishmania гибридизованы в более крупный белок, как описано в WO2009/012166, WO 2014/160987, WO 2014/160985. Согласно одному примерному варианту реализации настоящего изобретения гибридный белок представляет собой ЕМСН, как описано в настоящем документе.
[000183] Другие специфические антигены происходят из Chlamydia и включают, например, высокомолекулярный белок (HWMP) (WO 99/17741), ORF3 (ЕР 366412) и предполагаемые мембранные белки (Pmp). Другие антигены Chlamydia могут быть выбраны из группы, описанной в WO 99128475. Некоторые антигены могут происходить из Streptococcus spp., включая S. pneumoniae (например, капсулярные полисахариды и их конъюгаты, PsaA, PspA, стрептолизин, связывающие холин белки) и белковый антиген пневмолизин (Biochem Biophys Acta, 1989, 67, 1007; Rubins et al., Microbial Pathogenesis, 25, 337-342) и их мутированные детоксифицированные производные (WO 90/06951; WO 99/03884). Другие бактериальные вакцины включают антигены, происходящие из Haemophilus spp., включая H. influenzae типа В (например, PRP и его конъюгаты), нетипируемый штамм Н. influenzae, например, ОМР26, высокомолекулярные адгезины, Р5, Р6, белок D и липопротеин D, а также фимбрин и пептиды, происходящие из фимбрина (патент США №5843464), или варианты, содержащие множественные копии, или их гибридные белки.
[000184] Другие специфические антигены происходят из вируса гепатита В. Производные поверхностного антигена гепатита В хорошо известны в данной области техники и включают, среди прочего, PreS1, Pars2 S-антигены, описанные в заявках на европейский патент ЕР-А414 374; ЕР-А-0304 578 и ЕР 198474. Согласно одному аспекту антиген представляет собой gp120 HIV-1, в частности, при экспрессии в клетках СНО. Согласно другому варианту реализации настоящего изобретения антиген представляет собой gD2t.
[000185] Согласно другим вариантам реализации настоящего изобретения антиген происходит из вируса папилломы человека (ВПЧ), который, как предполагают, вызывает генитальные бородавки (HPV6 или HPV11 и другие), а также вирусов ВПЧ, вызывающих рак шейки матки (HPV16, HPV18 и других). Конкретные антигены включают частицы L1 или капсомеры, а также гибридные белки, содержащие один или более антигенов, выбранных из белков Е6, Е7, L1 и L2 из HPV 6 и HPV 11. Некоторые формы гибридного белка включают L2E7, описанный в WO 96/26277, и белок D(1/3)-E7, описанный в GB 9717953.5 (РСТ/ЕР98/05285). Дополнительные возможные антигены включают антигены ВПЧ 16 или 18. Например, мономеры антигена L1 или L2 или антигены L1 или L2, представленные вместе как вирусоподобная частица (VLP), или только белок L1, представленный отдельно в VLP или капсомерной структуре. Такие антигены, вирусоподобные частицы и капсомер известны сами по себе. См., например, WO94/00152, WO94/20137, WO94/05792 и WO93/02184.
[000186] Согласно другим вариантам реализации настоящего изобретения антиген представляет собой гибридный белок. Гибридные белки могут быть включены по отдельности или в виде гибридных белков, таких как Е7, Е2 или F5, например; конкретные варианты реализации включают VLP, содержащую гибридные белки L1E7 (WO 96/11272). Конкретные антигены ВПЧ 16 включают ранние белки Е6 или F7, гибридизованные с белком-носителем D с образованием гибридов белок D-E6 или Е7 из HPV 16 или их комбинаций; или комбинации Е6 или Е7 с L2 (WO 96/26277). Согласно другому варианту ранние белки Е6 и Е7 HPV 16 или 18 могут быть представлены в виде отдельной молекулы, например, гибрида белок D-E6/E7. Композиции могут необязательно содержать любой из белков Е6 и Е7 или оба указанных белка из HPV 18, например, в виде гибридов белок D-E6 или белок D-E7 или гибрида белок D-E6/E7. Композиции могут дополнительно содержать антигены из других штаммов ВПЧ, например, из штаммов ВПЧ 31 или 33.
[000187] Антигены также могут происходить из паразитов, которые вызывают малярию. Например, антигены Plasmodia falciparum включают RTS,S и TRAP. RTS представляет собой гибридный белок, содержащий по существу всю С-концевую часть белка спорозоита (CS) P. falciparum, соединенного посредством четырех аминокислот части preS2 поверхностного антигена гепатита В с поверхностным (S) антигеном вируса гепатита В. Его полная структура описана в международной заявке на патент РСТ/ЕР92/02591, опубликованной как WO 93/10152, испрашивающей приоритет согласно заявке на патент Великобритании №9124390.7. При экспрессии в дрожжах RTS вырабатывается как липопротеиновая частица, и при его совместной экспрессии с S-антигеном ВГВ он вырабатывается в виде смешанной частицы, известной как RTS,S.
[000188] Антигены TRAP описаны в международной заявке на патент PCT/GB89/008 95, опубликованной как WO 90/01496. В одном варианте реализации настоящего изобретения описана вакцина против малярии, в которой антигенный препарат содержит комбинацию RTS,S и антигены TRAP. Другие антигены плазмодиев, которые являются потенциальными кандидатами для включения в качестве компонентов многоступенчатой вакцины против малярии, представляют собой MSP1, АМА1, MSP3, ЕВА, GLURP, RAP1, RAP2, секвестрин, PfEMP1, Pf332, LSA1, LSA3, STARP, SALSA, PfEXP1, Pfs25, Pfs28, PFS27125, Pfs16, Pfs48/45, Pfs230 из P. faciparum и их аналоги в Plasmodium spp.
[000189] Согласно одному варианту реализации настоящего изобретения антиген происходит из раковой клетки, это можно применять для иммунотерапевтического лечения различных видов рака. Например, антиген может представлять собой антиген отторжения опухоли, такой как антигены рака предстательной железы, рака молочной железы, колоректального рака, рака легких, рака поджелудочной железы, рака почек или меланомы. Примерные антигены, происходящие из рака или раковых клеток, включают антигены MAGE 1, 3 и MAGE 4 или другие антигены MAGE, такие как те, которые описаны в WO99/40188, PRAME, BAGE, Lage (также известный как NY Eos 1), SAGE и HAGE (WO 99/53061) или GAGE (Robbins and Kawakami, 1996 Current Opinions in Immunology 8, pps 628-636; Van den Eynde et al., International Journal of Clinical & Laboratory Research (1997 & 1998); Correale et al. (1997), Journal of the National Cancer Institute 89, p. 293). Такие неограничивающие примеры раковых антигенов экспрессируются в широком диапазоне типов опухолей, таких как меланома, карцинома легких, саркома и карцинома мочевого пузыря. См., например, патент США №6544518.
[000190] Другие опухолеспецифические антигены включают, но не ограничиваются ими, опухолеспецифические или опухолеассоциированные ганглиозиды, такие как GM2 и GM3 или их конъюгаты с белками-носителями; или аутологичный пептидный гормон, такой как полноразмерный гонадотропин-рилизинг-гормон (GnRH, WO 95/20600), короткий пептид из 10 аминокислот, который можно применять для лечения многих видов рака. В другом варианте применяют простатические антигены, такие как простатический специфический антиген (PSA), PAP, PSCA (например, Proc. Nat. Acad. Sci. USA 95(4) 1735-1740 1998), PSMA или согласно одному варианту реализации настоящего изобретения антиген, известный как простаза. (например, Nelson, et al., Proc. Natl. Acad. Sci. USA (1999) 96: 3114-3119; Ferguson, et al. Proc. Natl. Acad. Sci. USA 1999. 96, 3114-3119; WO 98/12302; патент США №5955306; WO 98/20117; патенты США №№5840871 и 5786148; WO 00/04149). Другие простатические специфические антигены известны из WO 98/137418 и WO/004149. Другой антиген представляет собой STEAP (PNAS 96 14523 14528 7-12 1999).
[000191] Другие ассоциированные с опухолью антигены, подходящие применительно к настоящему изобретению, включают: Plu-1 (J Biol. Chem 274 (22) 15633-15645, 1999), HASH-1, HasH-2, Cripto (Salomon et al Bioessays 199, 21:61-70, патент США №5654140) и криптин (патент США №5981215). Помимо этого антигены, особенно подходящие для вакцин в терапии рака, также включают тирозиназу и сурвивин.
[000192] Согласно другим вариантам реализации настоящего изобретения агенты, применяемые в композициях согласно настоящему изобретению, включают антигены, связанные с респираторными заболеваниями, такими как заболевания, вызванные или усугубляемые бактериальной инфекцией (например, пневмококковой), для профилактики и терапии таких состояний как хроническая обструктивная болезнь легких (ХОБЛ). ХОБЛ определяется физиологически как присутствие необратимой или частично обратимой обструкции дыхательных путей у пациентов с хроническим бронхитом и/или эмфиземой (Am J Respir Crit Care Med. 1995 Nov; 152(5 Pt 2):S77-121). Обострения ХОБЛ часто вызваны бактериальной (например, пневмококковой) инфекцией (Clin Microbiol Rev. 2001 Apr; 14(2):336-63).
II. Адъюванты
[000193] Согласно некоторым вариантам реализации настоящего изобретения агент представляет собой адъювант, и, соответственно, композиции, содержащие любую из наноалюмочастиц, описанных в настоящем документе, содержат адъювант в присутствии антигена или в его отсутствие.
[000194] Согласно некоторым вариантам реализации настоящего изобретения адъювант выбран из группы, состоящей из AS-2, монофосфориллипида А, 3-де-О-ацилированного монофосфориллипида A, IFA, QS21, CWS, ТОМ, AGP, CpG-содержащих олигонуклеотидов, агонистов Toll-подобного рецептора (TLR), Leif, сапонинов, миметиков сапонинов, биологического и синтетического липида А, имиквимода, гардиквимода, резиквимода, полиI:С, флагеллина, GLA, SLA, STING и их комбинаций.
[000195] Согласно одному примерному варианту реализации адъювант представляет собой GLA. Согласно одному примерному варианту реализации настоящего изобретения адъювант представляет собой SLA.
а. Агонисты TLR
[000196] Как описано в настоящем документе, согласно некоторым вариантам реализации настоящего изобретения предусмотрено включение наноалюмочастиц, описанных в настоящем документе, а также дополнительно включение одного или более агонистов Toll-подобного рецептора (агонистов TLR). Toll-подобные рецепторы (TLR) включают трансмембранные поверхностные рецепторы клеток врожденной иммунной системы, которые придают клеткам хозяина способность распознавать на ранних фазах множество консервативных микробных молекулярных структур, таких как те, которые могут присутствовать у большого количества инфекционных патогенов или на них. (например, Armant et al., 2002 Genome Biol. 3(8):reviews3011.1-3011.6; Fearon et al., 1996 Science 272:50; Medzhitov et al., 1997 Curr. Opin. Immunol. 9:4; Luster 2002 Curr. Opin. Immunol. 14:129; Lien et al. 2003 Nat. Immunol. 4:1162; Medzhitov, 2001 Nat. Rev. Immunol. 1:135; Takeda et al., 2003 Ann Rev Immunol. 21:335; Takeda et al. 2005 Int. Immunol. 17:1; Kaisho et al., 2004 Microbes Infect. 6:1388; Datta et al., 2003 J. Immunol. 170:4102).
[000197] Индукция TLR-опосредуемой передачи сигнала для усиления инициации иммунных ответов врожденной иммунной системой может быть осуществлена с помощью агонистов TLR, которые связываются с TLR на поверхности клеток. Например, липополисахарид (LPS) может быть агонистом TLR посредством TLR2 или TLR4 (Tsan et al., 2004 J. Leuk. Biol. 76:514; Tsan et al., 2004 Am. J. Physiol. Cell Phsiol. 286:C739; Lin et al., 2005 Shock 24:206); полиинозин-цитидин (полиI:С) может быть агонистом TLR посредством TLR3 (Salem et al., 2006 Vaccine 24:5119); CpG-последовательности (олигодезоксинуклеотиды, содержащие мотивы неметилированного цитозина-гуанозина или «CpG»-динуклеотида, например, CpG 7909, Cooper et al., 2005 AIDS 19:1473; CpG 10101, Bayes et al. Methods Find Exp Clin Pharmacol 27:193; Vollmer et al. Expert Opinion on Biological Therapy 5:673; Vollmer et al., 2004 Antimicrob. Agents Chemother. 48:2314; Deng et al., 2004 J. Immunol. 173:5148) могут быть агонистами TLR посредством TLR9 (Andaloussi et a., 2006 Glia 54:526; Chen et al., 2006 J. Immunol. 177:2373); пептидогликаны могут быть агонистами TLR2 и/или TLR6 (Soboll et al., 2006 Biol. Reprod. 75:131; Nakao et al., 2005 J. Immunol. 174:1566); 3M003 (4-амино-2-этоксиметил-α,α-диметил-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-этанолгидрат, мол. масса 318 Да от 3М Pharmaceuticals, Сент-Пол, Миннесота, США, который также является источником родственных соединений 3М001 и 3М002; Gorden et al., 2005 J. Immunol. 174:1259) может быть агонистом TLR7 (Johansen 2005 Clin. Exp. Allerg. 35:1591) и/или агонистом TLR8 (Johansen 2005); флагеллин может быть агонистом TLR5 (Feuillet et al., 2006 Proc. Nat. Acad. Sci. USA 103:12487); и антигены гепатита С могут действовать как агонисты TLR посредством TLR7 и/или TLR9 (Lee et al., 2006 Proc. Nat. Acad. Sci. USA 103:1828; Horsmans et al., 2005 Hepatol. 42:724). Другие агонисты TLR (например, Schirmbeck et al., 2003 J. Immunol. 171:5198) известны и могут применяться в соответствии с некоторыми из вариантов, описанных в настоящем документе.
b. Агонисты TLR7/8
[000198] Настоящее изобретение относится к агонистам TLR7/8, которые можно применять в композициях, описанных в настоящем документе. В настоящем документе «агонист TLR7/8» относится к агонисту, который осуществляет свою биологическую активность за счет взаимодействия с TLR7, TLR8, или ими обоими. Виды такой биологической активности включают, но не ограничиваются ими, индукцию TLR7- и/или TLR8-опосредуемой передачи сигналов, чтобы усилить ингибирование иммунных ответов врожденной иммунной системой.
c. Агонисты TLR4
[000199] Настоящее изобретение относится к агонистам TLR4, которые можно применять в композициях, описанных в настоящем документе. Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4, применяемый в композициях согласно настоящему изобретению, содержит адъювант глюкопиранозил-липид A (GLA), такой как те, которые описаны в публикациях патентов США US2007/021017, US2009/045033, US2010/037466 и US 2010/0310602, содержание которых полностью включено в настоящий документ посредством ссылки.
[000200] Например, согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру формулы (IV):
или ее фармацевтически приемлемую соль, где:
L1, L2, L3, L4, L5 и L6 являются одинаковыми или различными и независимо представляют собой -О-, -NH- или -(СН2)-;
L7, L8, L9, и L10 являются одинаковыми или различными и независимо отсутствуют или представляют собой -С(=O)-;
Y1 представляет собой кислотную функциональную группу;
Y2 и Y3 являются одинаковыми или различными и независимо представляют собой -ОН, -SH или кислотную функциональную группу;
Y4 представляет собой -ОН или -SH;
R1, R3, R5 и R6 являются одинаковыми или различными и независимо представляют собой С8-13 алкил; и
R2 и R4 являются одинаковыми или различными и независимо представляют собой С6-11 алкил.
[000201] Согласно некоторым вариантам реализации структуры синтетического GLA R1, R3, R5 и R6 представляют собой С10 алкил; и R2 и R4 представляют собой C8 алкил. Согласно некоторым вариантам реализации настоящего изобретения R1, R3, R5 и R6 представляют собой С11 алкил; и R2 и R4 представляют собой С9 алкил.
[000202] Например, согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру формулы (V):
[000203] Согласно конкретному варианту реализации настоящего изобретения R1, R3, R5 и R6 представляют собой C11-С20 алкил; и R2 и R4 представляют собой С12-С20 алкил.
[000204] Согласно другому конкретному варианту реализации настоящего изобретения GLA имеет формулу, указанную выше, где R1, R3, R5 и R6 представляют собой C11 алкил; и R2 и R4 представляют собой С13 алкил.
[000205] Согласно другому конкретному варианту реализации настоящего изобретения GLA имеет формулу, указанную выше, где R1, R3, R5 и R6 представляют собой С10 алкил; и R2 и R4 представляют собой С8 алкил.
[000206] Согласно другому конкретному варианту реализации настоящего изобретения GLA имеет формулу, указанную выше, где R1, R3, R5 и R6 представляют собой С11-С20 алкил; и R2 и R4 представляют собой С9-С20 алкил. Согласно некоторым вариантам реализации настоящего изобретения R1, R3, R5 и R6 представляют собой С11 алкил; и R2 и R4 представляют собой С9 алкил.
[000207] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру формулы (V):
[000208] Согласно некоторым вариантам реализации приведенной выше структуры GLA R1, R3, R5 и R6 представляют собой C11-С20 алкил; и R2 и R4 представляют собой С9-С20 алкил. Согласно некоторым вариантам реализации настоящего изобретения R1, R3, R5 и R6 представляют собой C11 алкил; и R2 и R4 представляют собой С9 алкил.
[000209] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру формулы (VI):

[000210] Согласно некоторым вариантам реализации представленной выше структуры GLA R1, R3, R5 и R6 представляют собой С11-С20 алкил; и R2 и R4 представляют собой С9-С20 алкил. Согласно некоторым вариантам реализации настоящего изобретения R1, R3, R5 и R6 представляют собой С11 алкил; и R2 и R4 представляют собой С9 алкил.
[000211] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру формулы (VII):
[000212] Согласно некоторым вариантам реализации представленной выше структуры GLA R1, R3, R5 и R6 представляют собой С11-С20 алкил; и R2 и R4 представляют собой С9-С20 алкил. Согласно некоторым вариантам реализации настоящего изобретения R1, R3, R5 и R6 представляют собой С11 алкил; и R2 и R4 представляют собой С9 алкил.
[000213] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру (SLA):
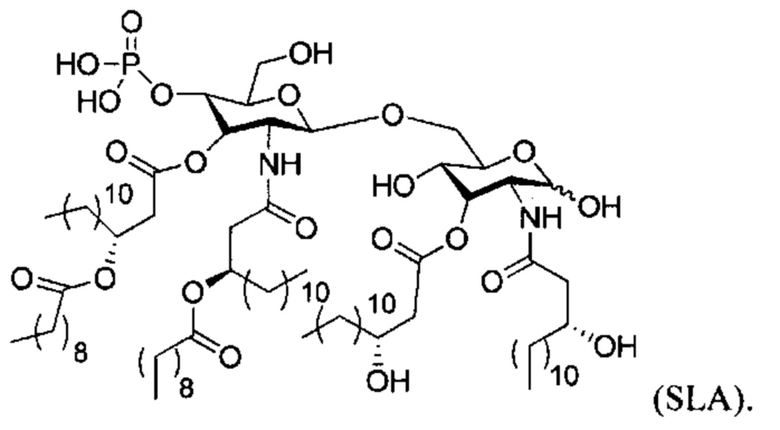
[000214] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру:
[000215] Согласно некоторым вариантам реализации настоящего изобретения агонист TLR4 представляет собой синтетический адъювант GLA, имеющий следующую структуру:
[000216] Согласно другому варианту реализации настоящего изобретения аттенуированное производное липида A (ALD) встраивают в композиции, описанные в настоящем документе. ALD представляют собой липид А-подобные молекулы, которые были изменены или сконструированы так, что молекула проявляет менее выраженное или другое действие в сравнении с нежелательными эффектами липида А. Такие нежелательные эффекты включают пирогенность, местную реактивность Шварцмана и токсичность, которые количественно оценивали в курином эмбрионе с использованием 50% летальной дозы (CELD50). ALD, которые можно применять в соответствии с настоящим изобретением, включают монофосфориллипид A (MLA) и 3-деацилированный монофосфориллипид A (3D-MLA). MLA и 3D-MLA известны и не нуждаются в подробном описании в настоящем документе. См., например, патент США №4436727, выданный 13 марта 1984 года, закрепленный за Ribi ImmunoChem Research, Inc., в котором описан монофосфориллипид А и его получение. Патент США №4912094 и свидетельство о пересмотре В1 патента США №4912094, выданного Myers, et al., также закрепленного за Ribi ImmunoChem Research, Inc., в котором реализован 3-деацилированный монофосфориллипид А и способ его изготовления. Содержание каждого из этих патентов в отношении MLA и 3D-MLA включено в настоящий документ посредством ссылки.
[000217] В вышеупомянутых соединениях агонистов TLR4 общий заряд может быть определен в соответствии с функциональными группами в молекуле. Например, фосфатная группа может быть отрицательно заряженной или нейтральной в зависимости от состояния ионизации фосфатной группы.
d. CpG-нуклеотиды
[000218] Согласно одному варианту реализации настоящего изобретения адъювант представляет собой иммуностимулирующий олигонуклеотид, содержащий неметилированные CpG-динуклеотиды (например, патент США №6554518). Иммуностимулирующие олигонуклеотиды, содержащие неметилированные CpG-динуклеотиды («CpG»), известны как адъюванты. Согласно некоторым вариантам реализации настоящего изобретения CpG-олигонуклеотиды согласно настоящему изобретению могут содержать два или более динуклеотидных мотивов CpG, разделенных по меньшей мере тремя, по меньшей мере четырьмя, по меньшей мере пятью или по меньшей мере шестью или более нуклеотидами.
[000219] Примеры последовательностей CpG-олигонуклеотидов раскрыты в следующих публикациях; согласно некоторым вариантам реализации, раскрытым в настоящем документе, последовательности могут содержать межнуклеотидные связи, модифицированные фосфотиоатом:
CPG 7909: Cooper et al., "CPG 7909 adjuvant improves hepatitis В virus vaccine seroprotection in antiretroviral-treated HIV-infected adults." AIDS, 2005 Sep 23; 19(14): 1473-9.
CpG 10101: Bayes et al., "Gateways to clinical trials." Methods Find. Exp. Clin. Pharmacol. 2005 Apr; 27(3): 193-219.
Vollmer J., "Progress in drug development of immunostimulatory CpG oligodeoxynucleotide ligands for TLR9." Expert Opinion on Biological Therapy. 2005 May; 5(5): 673-682
[000220] Альтернативные CpG-олигонуклеотиды могут содержать варианты последовательностей, описанные в процитированных выше публикациях, которые характеризуются тем, что они содержат несущественные замены, вставки, делеции и/или добавления к нуклеотидной последовательности. CpG-олигонуклеотиды, применяемые в некоторых вариантах реализации настоящего изобретения, могут быть синтезированы любым способом, известным в данной области техники (например, ЕР 468520). Такие олигонуклеотиды могут быть удобно синтезированы с использованием автоматизированного синтезатора. Олигонуклеотиды обычно являются дезоксинуклеотидами. Согласно одному варианту реализации настоящего изобретения межнуклеотидная связь в олигонуклеотиде представляет собой фосфодитиоатную или фосфотиоатную связь, хотя фосфодиэфиры также включены в объем вариантов реализации, предусмотренных в настоящем документе. Олигонуклеотиды, содержащие различные межнуклеотидные связи, также включены в объем настоящего изобретения, например, смешанные фосфотиоатные фосфодиэфиры. Также можно применять другие межнуклеотидные связи, которые стабилизируют олигонуклеотид.
III. Организмы и вирусы
[000221] Согласно некоторым вариантам реализации настоящего изобретения агент представляет собой организм. Соответственно, в данных вариантах реализации описанные композиции содержат наноалюмочастицы согласно настоящему изобретению и дополнительно содержат организм.
[000222] Например, бактерия Mycobacterium tuberculosis вызывает туберкулез (ТБ). В настоящее время вакцинация живыми бактериями является наиболее эффективным способом индукции защитного иммунитета против туберкулеза. Наиболее распространенной микобактерией, используемой для этой цели, является бацилла Кальмета-Герена (BCG), авирулентный штамм Mycobacterium bovis. Соответственно, согласно некоторым вариантам реализации настоящего изобретения композиция содержит наноалюмочастицу и Mycobacterium.
[000223] Согласно некоторым вариантам реализации настоящего изобретения агент представляет собой вирус или вирусный геном. Соответственно, в данных вариантах реализации описанные композиции содержат наноалюмочастицы согласно настоящему изобретению и дополнительно содержат вирусную частицу, выделенную оболочку вируса или вирусный геном.
В. Ассоциация с наноалюмочастицей
[000224] Согласно вариантам реализации, предусмотренным в настоящем документе, агенты композиций согласно настоящему изобретению ассоциированы с наноалюмочастицей. Согласно некоторым вариантам реализации настоящего изобретения агенты композиций согласно настоящему изобретению связывают наноалюмочастицу. Согласно некоторым вариантам реализации настоящего изобретения агенты композиций согласно настоящему изобретению адсорбированы в наноалюмочастицу. Такое связывание или адсорбция относится к взаимодействию между молекулами или их частями, которые проявляют взаимную аффинность или связывающую способность, как правило, за счет специфического или неспецифического связывания или взаимодействия, включая, но не ограничиваясь ими, биохимические, физиологические и/или химические взаимодействия. Согласно некоторым вариантам реализации настоящего изобретения связывание с наноалюмочастицей может быть определено с помощью УФ-спектроскопии или гель-электрофореза.
[000225] Адсорбция на наноалюмочастицу обычно может происходить, но не ограничиваясь ими, с помощью следующих механизмов: электростатическое взаимодействие и обмен лигандами. Электростатическое взаимодействие основано на присутствии противоположных зарядов на компонентах при определенных условиях раствора. При обмене лигандами фосфатная группа в одном из компонентов обменивается на гидроксильную группу другого компонента. Для обмена лигандами используются доступные фосфатные группы и гидроксильные группы в компонентах. Согласно некоторым вариантам реализации настоящего изобретения для получения композиции с агентом, антигеном или адъювантом следует учитывать заряд и присутствие фосфатных групп и гидроксильных групп на агенте.
i. Обмен лигандами
[000226] Согласно некоторым вариантам реализации настоящего изобретения механизм обмена лигандами может включать обмен лигандами между агентом и солью алюминия.
[000227] Согласно некоторым вариантам реализации настоящего изобретения обмен лигандами может происходить между адъювантным агентом и солью алюминия. Некоторые компоненты в адъювантной композиции содержат фосфатные группы, тогда как некоторые другие компоненты содержат гидроксильные группы, что обеспечивает обмен лигандами. Например, некоторые агонисты TLR4 содержат фосфатные группы. AdjuPhos® содержит фосфатные группы. Гидроксильные группы присутствуют по меньшей мере в следующих компонентах: антигены, агонисты TLR, липид/сурфактант и Alhydrogel®.
II. Электростатическое взаимодействие
[000228] Согласно некоторым вариантам реализации настоящего изобретения, применительно к механизму электростатического взаимодействия, обмен лигандами может происходить между агентом и солью алюминия.
[000229] Согласно некоторым примерным вариантам реализации настоящего изобретения, применительно к механизму электростатического взаимодействия, вакцинная композиция по существу нейтрально заряжена при физиологическом рН. Если антиген для вакцинной композиции заряжен, то компоненты для адъювантной композиции могут быть выбраны так, чтобы нейтрализовать заряд антигена с получением по существу нейтрально заряженной вакцинной композиции. Если антиген для вакцинной композиции по существу нейтрально заряжен, то компоненты для адъювантной композиции могут быть выбраны так, чтобы поддержать по существу нейтральный заряд антигена с получением по существу нейтрально заряженной вакцинной композиции.
[000230] Как отмечено выше, каждый из компонентов в композиции может быть охарактеризован как отрицательно заряженный, положительно заряженный или нейтрально заряженный.
С. Уменьшение дозы
[000231] Согласно некоторым вариантам реализации настоящего изобретения композиция, содержащая наноалюмочастицы согласно настоящему изобретению и дополнительно содержащая агент, проявляет эффект уменьшения дозы и/или высокие уровни экспрессии в условиях in vivo. Согласно одному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять по меньшей мере на 5% меньше, по меньшей мере на 10% меньше, по меньшей мере на 20% меньше, по меньшей мере на 25% меньше, по меньшей мере на 30% меньше, по меньшей мере на 40% меньше, по меньшей мере на 50% меньше, по меньшей мере на 60% меньше, по меньшей мере на 75% меньше, по меньшей мере на 80% меньше, по меньшей мере на 90% меньше, по меньшей мере на 95% меньше или даже по меньшей мере на 99% меньше агента, по сравнению с количеством агента, которое применяли бы для достижения аналогичного биологического и/или физиологического эффекта, когда для доставки не применяли композицию, содержащую любую из наноалюмочастиц согласно настоящему изобретению. Согласно одному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу агента приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг для достижения биологического и/или физиологического эффекта. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу полипептида приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг или 10 нг, 1 нг агента для достижения желательного биологического и/или физиологического эффекта. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу полипептида приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг агента для достижения иммунного ответа. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу полинуклеотида приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг агента для достижения желательного биологического и/или физиологического эффекта. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу полинуклеотида приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг или 10 нг, 1 нг агента для достижения иммунного ответа. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу полинуклеотида РНК приблизительно 100 нг, 50 нг, 30 нг, 10 нг или 1 нг РНК-агента для достижения иммунного ответа. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу векторного полинуклеотида, несущего РНК-репликон, приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг агента для достижения иммунного ответа. Согласно одному конкретному варианту реализации настоящего изобретения применение композиции, содержащей любую из наноалюмочастиц согласно настоящему изобретению, позволяет применять дозу векторного полинуклеотида, несущего иРНК, приблизительно 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг агента для достижения иммунного ответа.
[000232] Согласно одному варианту реализации настоящего изобретения эффект уменьшения дозы достигается при применении в 300 раз меньшего количества РНК, необходимого для доставки полинуклеотида РНК, чтобы достичь экспрессии полипептидного антигена для получения иммунного ответа, по сравнению с РНК в чистом виде. Согласно одному варианту реализации настоящего изобретения эффект уменьшения дозы достигается при применении в 100 раз меньшего количества РНК, необходимого для доставки полинуклеотида РНК, чтобы достичь экспрессии полипептидного антигена для получения иммунного ответа, по сравнению с РНК в чистом виде. Согласно одному варианту реализации настоящего изобретения эффект уменьшения дозы достигается при применении в 50 раз меньшего количества РНК, необходимого для доставки полинуклеотида РНК, чтобы достичь экспрессии полипептидного антигена для получения иммунного ответа, по сравнению с РНК в чистом виде. Согласно одному варианту реализации настоящего изобретения эффект уменьшения дозы достигается при применении в 30 раз меньшего количества РНК, необходимого для доставки полинуклеотида РНК, чтобы достичь экспрессии полипептидного антигена для получения иммунного ответа, по сравнению с РНК в чистом виде. Согласно одному варианту реализации настоящего изобретения эффект уменьшения дозы достигается при применении в 10 раз меньшего количества РНК, необходимого для доставки полинуклеотида РНК, чтобы достичь экспрессии полипептидного антигена для получения иммунного ответа, по сравнению с РНК в чистом виде.
D. Фармацевтические композиции
[000233] Настоящее изобретение относится к фармацевтическим композициям, содержащим наноалюмочастицы, и композициям, описанным в настоящем документе. Согласно некоторым вариантам реализации настоящего изобретения композиция, содержащая наноалюмочастицу, дополнительно содержит фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция представляет собой вакцинную композицию. Композиции, описанные в настоящем документе, могут быть введены субъекту для любой терапевтической или диагностической цели. Согласно некоторым вариантам реализации настоящего изобретения композиции, описанные в настоящем документе, применяют для стимуляции иммунного ответа у субъекта (включая неспецифический ответ и антигенспецифический ответ). В вариантах реализации, предусмотренных в настоящем документе, субъект представляет собой млекопитающее (например, животное, включая сельскохозяйственных животных (коров, свиней, коз, лошадей и т.д.), домашних животных (кошек, собак и т.д.) и грызунов (крыс, мышей и т.д.)), или человека). В частности, составы и композиции согласно настоящему изобретению, которые стимулируют Th1 иммунный ответ, можно применять для стимуляции такого ответа у субъекта.
[000234] Фармацевтические композиции обычно содержат композиции, описанные в настоящем документе, и могут дополнительно содержать один или более компонентов, предусмотренных в настоящем документе, которые выбраны из антигена, дополнительных агонистов или рекомбинантной конструкции для экспрессии, в комбинации с фармацевтически приемлемым носителем, вспомогательным веществом или разбавителем.
[000235] В вариантах реализации, предусмотренных в настоящем документе, фармацевтическая композиция может быть профильтрована через фильтр с размером пор 0,45 мкм. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может быть профильтрована через фильтр с размером пор 0,20 мкм. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция может быть профильтрована через фильтр с размером пор 0,22 мкм.
[000236] Согласно одному варианту реализации настоящего изобретения предложена фармацевтическая композиция, содержащая наноалюмочастицу и содержащая агонист TLR7/8 или агонист TLR4. Такую композицию можно применять для «монотерапии», причем агонист TLR7/8 или агонист TLR4, описанные в настоящем документе, готовят в виде композиции, и композиция по существу не содержит других антигенов и вводится субъекту для того чтобы стимулировать иммунный ответ, например, неспецифический иммунный ответ или антигенспецифический иммунный ответ, с целью диагностики, лечения или предотвращения заболевания или другого состояния, такого как инфекция организмом.
[000237] Согласно другим вариантам реализации настоящего изобретения фармацевтическая композиция представляет собой вакцинную композицию, которая содержит обе композиции, описанные в настоящем документе, и антиген и может дополнительно содержать один или более компонентов, предусмотренных в настоящем документе, в комбинации с фармацевтически приемлемым носителем, вспомогательным веществом или разбавителем. Иллюстративные носители будут нетоксичны для реципиентов в применяемых дозах и концентрациях.
[000238] Иллюстративные носители будут нетоксичны для реципиентов в применяемых дозах и концентрациях.
[000239] Согласно вариантам реализации, предусмотренным в настоящем документе, вводят дозу фармацевтической композиции от приблизительно 1 нг/кг до приблизительно 1 мг/кг. Согласно вариантам реализации, предусмотренным в настоящем документе, вводят дозу фармацевтической композиции от приблизительно 1 нг до приблизительно 1 мг. Согласно некоторым вариантам реализации настоящего изобретения вводят дозу фармацевтической композиции приблизительно 500 мкг, 200 мкг, 100 мкг, 50 мкг, 25 мкг, 20 мкг, 15 мкг, 10 мкг, 5 мкг, 2 мкг, 1 мкг, 10 нг или 1 нг. Специалисты в данной области техники поймут, что количество и частота введений будут зависеть от ответа субъекта. «Фармацевтически приемлемые носители» для терапевтического применения хорошо известны в фармацевтической области и описаны, например, в Remingtons Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985). Например, можно применять стерильный солевой раствор и забуференный фосфатом солевой раствор при физиологическом рН. В фармацевтической композиции могут быть предусмотрены консерванты, стабилизаторы, красители и даже ароматизаторы. Например, в качестве консервантов могут быть добавлены бензоат натрия, сорбиновая кислота и сложные эфиры п-гидроксибензойной кислоты. Id. at 1449. Помимо этого можно применять антиоксиданты и суспендирующие агенты. Id.
[000240] «Фармацевтически приемлемая соль» относится к солям соединений согласно настоящему изобретению, полученным из комбинации таких соединений и органической или неорганической кислоты (кислотно-аддитивные соли), или органического или неорганического основания (основно-аддитивные соли). Композиции согласно настоящему изобретению можно применять в форме свободного основания или соли, причем обе формы включены в объем настоящего изобретения.
[000241] Фармацевтические композиции могут быть в любой форме, которая позволяет вводить композицию пациенту. Например, композиция может быть в виде твердого вещества, жидкости или газа (аэрозоля). Типичные пути введения включают, но не ограничиваются ими, оральный, местный, парентеральный (например, сублингвальный или буккальный), сублингвальный, ректальный, вагинальный и интраназальный (например, в виде спрея) пути введения. В настоящем документе термин «парентеральный» включает ионтофоретический (например, US 7033598, 7018345, 6970739), сонофоретический (например, US 4780212, 4767402, 4948587, 5618275, 5656016, 5723997, 6322532, 6018678), термический (например, US 5885211, 6685699), пассивный трансдермальный способ введения (например, US 3598122, 3598123, 4286592, 4314557, 4379454, 4568343, 5464387, описание патента Великобритании №2232892, US 6871477, 6974588, 6676961), введение с помощью микроиглы (например, US 6908453, 5457041, 5591139, 6033928) и струйной инъекции, а также с помощью подкожных инъекций, методик внутривенной, внутримышечной, интрастернальной, внутрикавернозной, интратекальной, интрамеатальной, интрауретральной инъекции или инфузии. Согласно конкретному варианту реализации настоящего изобретения композицию, описанную в настоящем документе (включая вакцинные и фармацевтические композиции), вводят внутрикожно с помощью методики, выбранной из ионтофореза, микрокавитации, сонофореза или введения с помощью микроигл.
[000242] Фармацевтическая композиция может быть приготовлена так, что активные ингредиенты, содержащиеся в ней, являются биологически доступными при введении композиции субъекту. Композиции, которые будут введены субъекту, принимают форму одной или более стандартных лекарственных форм, в которых, например, таблетка может быть единичной стандартной лекарственной формой, и контейнер, содержащий одно или более соединений согласно настоящему изобретению в форме аэрозоля, может содержать множество стандартных лекарственных форм.
[000243] В форме для введения пероральным путем может присутствовать вспомогательное вещество и/или связующий агент. Примеры включают сахарозу, каолин, глицерин, декстрины крахмала, альгинат натрия, карбоксиметилцеллюлозу и этилцеллюлозу. Могут присутствовать красители и/или ароматизаторы. Можно применять покрывающую оболочку.
[000244] Композиция может быть в форме жидкости, например, эликсира, сиропа, раствора, эмульсии или суспензии. Жидкость может быть предназначена для перорального введения или для доставки путем инъекции, в качестве двух примеров. Композиции, предназначенные для перорального введения, могут содержать один или более подсластителей, консервантов, красителей/окрашивающих веществ и усилителей вкуса. В композицию, предназначенную для введения путем инъекции, может быть включен один или более из сурфактанта, консерванта, смачивающего агента, диспергирующего агента, суспендирующего агента, буфера, стабилизатора и изотонического агента.
[000245] В настоящем документе жидкая фармацевтическая композиция, будь то в форме раствора, суспензии или в другой подобной форме, может включать один или более из следующих носителей или вспомогательных веществ: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический солевой раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как сквален, сквален, минеральное масло, моноолеат маннита, холестерин и/или синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для корректировки тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или многодозные флаконы из стекла или пластика. Фармацевтическая композиция для инъекций предпочтительно является стерильной.
[000246] Согласно другому варианту реализации композиция согласно настоящему изобретению приготовлена так, чтобы она могла быть переведена в аэрозольное состояние.
[000247] Желательным также может включение в фармацевтическую композицию других компонентов, таких как носители для доставки, включая, но не ограничиваясь ими, соли алюминия, эмульсии типа «вода-в-масле», биоразлагаемые масляные носители, эмульсии типа «масло-в-воде», биоразлагаемые микрокапсулы и липосомы. Примеры дополнительных иммуностимулирующих веществ (коадъювантов) для применения в таких носителях также описаны выше и могут включать N-ацетилмурамил-L-аланин-D-изоглутамин (MDP), глюкан, ИЛ-12, ГМ-КСФ, гамма-интерферон и ИЛ-12.
[000248] Несмотря на то, что в фармацевтических композициях согласно настоящему изобретению можно применять любой подходящий носитель, известный специалистам в данной области техники, тип носителя будет изменяться в зависимости от способа введения и от того, является ли желательным пролонгированное высвобождение. Для парентерального введения, такого как подкожная инъекция, носитель может содержать воду, солевой раствор, спирт, жир, воск или буфер. Для перорального введения можно применять любой из вышеуказанных носителей или твердый носитель, такой как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, тальк, целлюлоза, глюкоза, сахароза и карбонат магния. Биоразлагаемые микросферы (например, галактид полимера молочной кислоты) также можно применять в качестве носителей для фармацевтических композиций согласно настоящему изобретению. Подходящие биоразлагаемые микросферы описаны, например, в патентах США №№4892668 и 5075109. В этом отношении предпочтительно размер микросферы превышает приблизительно 25 микрон.
[000249] Фармацевтические композиции также могут содержать разбавители, такие как буферы, антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные полипептиды (менее 10 остатков), белки, аминокислоты, углеводы, включая глюкозу, сахарозу или декстрины, хелатирующие агенты, такие как ЭДТА, глутатион и другие стабилизаторы и вспомогательные вещества. Нейтральный забуференный солевой раствор или солевой раствор, смешанный с неспецифическим сывороточным альбумином, являются примерными подходящими разбавителями. Например, продукт может быть приготовлен в виде лиофилизата с использованием подходящих растворов вспомогательных веществ (например, сахарозы) в качестве разбавителей.
[000250] Как описано выше, согласно некоторым вариантам реализации настоящего изобретения предложены композиции, способные доставлять молекулы нуклеиновых кислот, кодирующие желательные антигены. Такие композиции включают рекомбинантные вирусные векторы (например, ретровирусы (см. WO 90/07936, WO 91/02805, WO 93/25234, WO 93/25698 и WO 94/03622), аденовирус (см. Berkner, Biotechniques 6: 616-627, 1988; Li et al., Hum. Gene Ther. 4: 403-409, 1993; Vincent et al., Nat. Genet. 5: 130-134, 1993; и Kolls et al., Proc. Natl. Acad. Sci. USA 91: 215-219, 1994), поксвирус (см. патент США №4769330, патент США №5017487 и WO 89/01973)), молекулы нуклеиновых кислот рекомбинантной конструкции для экспрессии, входящей в состав комплекса с поликатионной молекулой (см. WO 93/03709), и нуклеиновые кислоты, связанные с липосомами (см. Wang et al., Proc. Natl. Acad. Sci. USA 84: 7851, 1987). Согласно некоторым вариантам реализации настоящего изобретения ДНК может быть соединена с убитым или инактивированным аденовирусом (см. Curiel et al., Hum. Gene Ther. 3: 147-154, 1992; Cotton et al., Proc. Natl. Acad. Sci. USA 89: 6094, 1992). Другие подходящие композиции включают ДНК-лиганд (см. Wu et al., J. Biol. Chem. 264: 16985-16987, 1989) и комбинации липид-ДНК (см. Feigner et al., Proc. Natl. Acad. Sci. USA 84: 7413-7417, 1989).
[000251] Согласно некоторым вариантам реализации настоящего изобретения жидкая композиция, предназначенная как для парентерального, так и для перорального введения, должна содержать количество вакцинной композиции, достаточное для получения подходящей дозы. Как правило, такое количество составляет по меньшей мере 0,01% масс/об. антигена в композиции. В композиции для перорального введения такое количество может варьироваться от 0,1% до 70% по массе композиции. Композиции для перорального введения могут содержать от приблизительно 4% до приблизительно 50% антигена. Композиции и препараты могут быть приготовлены так, что стандартная лекарственная форма для парентерального введения содержит от 0,01% до 1% по массе активной композиции.
[000252] Фармацевтическая композиция может быть предназначена для местного введения, и в этом случае носитель может подходящим образом содержать раствор, эмульсию, мазь или гель. Основание, например, может содержать одно или более из следующих: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, а также эмульгаторы и стабилизаторы. В фармацевтической композиции для местного введения могут присутствовать сгущающие агенты. Композиция, предназначенная для чрескожного введения, может включать трансдермальный пластырь или устройство для ионтофореза. Составы для местного введения могут содержать антиген (например, GLA-антиген-вакцинную композицию) или GLA (например, иммунологическую адъювантную композицию, GLA доступен от Avanti Polar Lipids, Inc., Алабастер, Алабама, США, например, номер продукта 699800) в концентрации от приблизительно 0,1% до приблизительно 10% масс./об. (масса на единицу объема).
[000253] Композиция может быть предназначена для ректального введения в форме, например, суппозитория, который будет плавиться в прямой кишке и высвобождать лекарственный препарат. Композиция для ректального введения может содержать маслянистое основание в качестве подходящего нераздражающего вспомогательного вещества. Такие основания включают, но не ограничиваются ими, ланолин, масло какао и полиэтиленгликоль. В способах согласно настоящему изобретению вакцинные композиции/адъюванты могут быть введены путем использования вставки (вставок), гранулы (гранул), состава (составов) с замедленным высвобождением, пластыря (пластырей) или состава (составов) с быстрым высвобождением.
V. Применение наноалюмочастиц и композиций
А. Терапевтические средства
[000254] Согласно некоторым вариантам реализации настоящего изобретения агент можно применять для терапевтических целей. Соответственно, согласно некоторым вариантам реализации настоящего изобретения описанные композиции содержат наноалюмочастицы согласно настоящему изобретению и дополнительно содержат агент для лечения заболевания, состояния или расстройства.
[000255] Согласно некоторым вариантам реализации настоящего изобретения агент можно применять для лечения или предотвращения аллергии, рака, инфекционных заболеваний, аутоиммунных заболеваний или зависимости.
[000256] В вариантах реализации, раскрытых в настоящем документе, композиции содержат раковые антигены. Согласно некоторым вариантам реализации настоящего изобретения вакцинная композиция содержит раковый антиген, который можно применять против любого вида рака, характеризующегося экспрессией связанного с опухолью антигена, такого как HER-2/neu или других специфических для рака или ассоциированных с раком антигенов.
[000257] Композиции и способы в соответствии с некоторыми вариантами реализации настоящего изобретения также можно применять для профилактики или лечения аутоиммунных заболеваний, которые включают заболевания, состояния или расстройства, при которых иммунная система хозяина или субъекта пагубно опосредует иммунный ответ, направленный против «аутологичных» тканей, клеток, биомолекул (например, пептидов, полипептидов, белков, гликопротеинов, липопротеинов, протеолипидов, липидов, гликолипидов, нуклеиновых кислот, таких как РНК и ДНК, олигосахаридов, полисахаридов, протеогликанов, гликозаминогликанов или т.п. и других молекулярных компонентов клеток и тканей субъекта) или эпитопов (например, специфических иммунологически определенных структур распознавания, таких как те, которые распознаются гипервариабельным участком (CDR) вариабельной области антитела или CDR рецептора Т-клеток.
[000258] Таким образом, аутоиммунные заболевания характеризуются патологическим иммунным ответом, вовлекающим как клетки, так и антитела, которые в любом случае направлены против нормальных аутологичных тканей. Аутоиммунные заболевания у млекопитающих обычно можно классифицировать в одну из двух различных категорий: опосредуемое клетками заболевание (т.е. Т-клетками) или опосредуемые антителами расстройства. Неограничивающие примеры опосредуемых клетками аутоиммунных заболеваний включают рассеянный склероз, ревматоидный артрит, тиреоидит Хашимото, сахарный диабет I типа (сахарный диабет у подростков) и аутоиммунный уворетинит. Опосредуемые антителами аутоиммунные нарушения включают, но не ограничиваются ими, наследственную миастению, системную красную волчанку (или СКВ), болезнь Грейвса, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению, аутоиммунную астму, криоглобулинемию, тромботическую тромбоцитопеническую пурпуру, первичный билиарный склероз и пернициозную анемию. Антиген (ы), ассоциированный (е) с системной красной волчанкой, представляет (ют) собой малые ядерные рибонуклеопротеины (snRNP); связанные с болезнью Грейвса антигены включают рецептор тиреотропина, тиреоглобулин и другие компоненты тиреоидных эпителиальных клеток (Akamizu et al., 1996; Kellerman et al., 1995; Raju et al., 1997; и Texier et al., 1992); связанные с обыкновенной пузырчаткой антигены включают кадгериноподобные антигены пемфигуса, такие как десмоглеин 3 и другие молекулы адгезии (Memar et al., 1996: Stanley, 1995; Plott et al., 1994; и Hashimoto, 1993); и антигены, связанные с тромботической тромбоцитопенической пурпурой, включают антигены тромбоцитов. (См., например, патент США №6929796, Gorski et al. (Eds.), Autoimmunity, 2001, Kluwer Academic Publishers, Norwell, MA; Radbruch and Lipsky, P.E. (Eds.) Current Concepts in Autoimmunity and Chronic Inflammation (Curr. Top. Microbiol. and Immunol.) 2001, Springer, NY.)
[000259] Аутоиммунитет играет определенную роль более чем в 80 различных заболеваниях, включая диабет 1 типа, рассеянный склероз, волчанку, ревматоидный артрит, склеродермию и заболевания щитовидной железы. Активные количественные оценки заболеваемости для большинства аутоиммунных заболеваний отсутствуют. Результаты наиболее недавних исследований, проведенных в конце 1990-х годов, выявили, что аутоиммунные заболевания являются третьим по распространенности основным заболеванием в Соединенных Штатах; и наиболее распространенные аутоиммунные заболевания поражают более 8,5 миллионов американцев. Современные оценки распространенности заболевания колеблются от 5 до 8 процентов населения Соединенных Штатов. Большинство аутоиммунных заболеваний непропорционально поражают женщин. Женщины в 2,7 раза чаще, чем мужчины, приобретают аутоиммунное заболевание. Женщины более восприимчивы к аутоиммунным заболеваниям; мужчины, по-видимому, имеют более высокий уровень активности природных клеток-киллеров, чем женщины. (Jacobsen et al, Clinical Immunology and Immunopathology, 84: 223-243, 1997)
[000260] Композиции согласно настоящему изобретению могут применяться для индукции защитного иммунитета, например, против туберкулеза, и включают применение полипептидов, которые содержат по меньшей мере одну иммуногенную часть одного или более белков Mycobacterium, и молекул ДНК и РНК, кодирующих такие полипептиды. Помимо этого такие соединения могут быть приготовлены в виде вакцин и/или фармацевтических композиций для иммунизации против инфекции Mycobacterium. (патент США №№6949246 и 6555653).
[000261] Согласно некоторым вариантам реализации настоящего изобретения композиции согласно настоящему изобретению будут особенно пригодны при лечении пожилых индивидуумов и/или индивидуумов с подавленным иммунитетом, включая субъектов, проходящих диализ почек, субъектов, получающих химиотерапию и/или лучевую терапию, реципиентов трансплантата и т.п. Такие индивидуумы обычно проявляют уменьшенные иммунные ответы на вакцины, и поэтому применение композиций согласно настоящему изобретению может усилить иммунные ответы, достигнутые у таких субъектов.
[000262] Согласно другим вариантам реализации настоящего изобретения композиции согласно настоящему изобретению включают антигены, связанные с респираторными заболеваниями, такими как те, которые вызваны или усугубляются бактериальной инфекцией (например, пневмококковой), для профилактики и лечения таких состояний как хроническая обструктивная болезнь легких (ХОБЛ).
[000263] Помимо этого для того чтобы направить процедуры в условиях in vivo, можно применять процедуры в условиях ex vivo, при которых клетки извлекают из хозяина, модифицируют и помещают в то же или другое животное-хозяина. Очевидно, что для введения молекул нуклеиновых кислот, кодирующих антиген, в тканевые клетки в условиях ex vivo можно применять любую из вышеперечисленных композиций. Протоколы для вирусных, физических и химических способов поглощения хорошо известны в данной области техники.
[000264] Таким образом, настоящее изобретение можно применять для того чтобы усилить или вызвать иммунный ответ у хозяина, пациента или в клеточной культуре. В настоящем документе термин «субъект» относится к любому млекопитающему. Пациент может быть болен инфекционным заболеванием, раком, таким как рак молочной железы, или аутоиммунным заболеванием, или может быть нормальным (т.е., без детектируемого заболевания и/или инфекции). «Культура клеток» представляет собой любой препарат, содержащий иммунокомпетентные клетки или выделенные клетки иммунной системы (включая, но не ограничиваясь ими, Т-клетки, макрофаги, моноциты, В-клетки и дендритные клетки). Такие клетки могут быть выделены с помощью любого из множества способов, хорошо известных специалистам в данной области техники (например, центрифугирование в градиенте плотности Ficoll-hypaque). Клетки могут быть выделены (но не обязательно) у пациента, страдающего раком, и могут быть повторно введены пациенту после лечения.
В. Вакцина
[000265] Таким образом, настоящее изобретение относится к композиции для изменения (т.е. статистически значимого увеличения или уменьшения, например, относительно соответствующего контроля, как будет хорошо известно специалистам в данной области техники) иммунных ответов у хозяина, способного вырабатывать иммунный ответ. Как известно специалистам в данной области техники, иммунный ответ может представлять собой любое активное изменение иммунного статуса хозяина, которое может включать любое изменение структуры или функции одной или более тканей, органов, клеток или молекул, которые участвуют в поддержании и/или регуляции иммунного статуса хозяина. Как правило, иммунные ответы можно детектировать с помощью любого из множества хорошо известных параметров, включая, но не ограничиваясь ими, определение в условиях in vivo или in vitro: растворимых иммуноглобулинов или антител; растворимых медиаторов, таких как цитокины, лимфокины, хемокины, гормоны, факторы роста и тому подобное, а также других растворимых малых пептидных, углеводных, нуклеотидных и/или липидных медиаторов; изменения статуса активации клетки, на основании определения измененных функциональных или структурных свойств клеток иммунной системы, например, пролиферации клеток, измененной подвижности, индукции специализированных видов активности, таких как специфическая экспрессия генов или цитолитическое поведение; клеточной дифференцировки клетками иммунной системы, включая измененные профили экспрессии поверхностных антигенов или начало апоптоза (запрограммированной гибели клеток); или любого другого критерия, с помощью которого может быть детектировано присутствие иммунного ответа.
[000266] Определение индукции иммунного ответа под действием композиций согласно настоящему изобретению может быть установлено с помощью любого из ряда хорошо известных иммунологических количественных исследований, с которыми могут быть полностью знакомы специалисты в данной области техники. Такие количественные исследования включают, но не ограничиваются ими, определение в условиях in vivo или in vitro: растворимых антител; растворимых медиаторов, таких как цитокины, лимфокины, хемокины, гормоны, факторы роста и тому подобное, а также других растворимых малых пептидных, углеводных, нуклеотидных и/или липидных медиаторов; изменения статуса активации клетки, на основании определения измененных функциональных или структурных свойств клеток иммунной системы, например, пролиферации клеток, измененной подвижности, индукции специализированных видов активности, таких как специфическая экспрессия генов или цитолитическое поведение; клеточной дифференцировки клетками иммунной системы, включая измененные профили экспрессии поверхностных антигенов или начало апоптоза (запрограммированной гибели клеток). Процедуры для проведения этих и подобных количественных исследований широко известны и могут быть найдены, например, в Lefkovits (Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, 1998; см. также Current Protocols in Immunology; см. также, например, Weir, Handbook of Experimental Immunology, 1986 Blackwell Scientific, Boston, MA; Mishell and Shigii (eds.) Selected Methods in Cellular Immunology, 1979 Freeman Publishing, San Francisco, CA; Green and Reed, 1998 Science 281:1309 и ссылки, цитируемые в них).
[000267] Детектирование пролиферации антигенреактивных Т-клеток можно осуществлять с помощью множества известных методик. Например, пролиферацию Т-клеток можно детектировать путем измерения скорости синтеза ДНК, и антигенную специфичность можно определить путем контроля стимулов (таких как, например, антиген-презентирующие клетки, в которые введен специфический желательный антиген или контрольный антиген), воздействию которых подвергаются Т-клетки, реактивные в отношении антигена-кандидата. Т-клетки, пролиферация которых была стимулирована, проявляют повышенную скорость синтеза ДНК. Типичный способ измерения скорости синтеза ДНК включает, например, импульсно-меченые культуры Т-клеток с меченым тритием тимидином, предшественником нуклеозидов, который включается во вновь синтезированную ДНК. Количество включенного меченого тритием тимидина может быть определено с использованием жидкостного сцинтилляционного спектрофотометра. Другие способы детектирования пролиферации Т-клеток включают измерение увеличения выработки интерлейкина-2 (ИЛ-2), потоков Са2+ или поглощения красителя, такого как 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий. Согласно другому варианту может быть измерен синтез лимфокинов (таких как интерферон-гамма) или может быть количественно определено относительное количество Т-клеток, которые могут реагировать на определенный антиген.
[000268] Детектирование выработки антигенспецифического антитела может быть достигнуто, например, путем количественного исследования образца (например, образца, содержащего иммуноглобулин, такого как сыворотка, плазма или кровь) от хозяина, получавшего вакцину в соответствии с настоящим изобретением, с использованием методик в условиях in vitro, таких как радиоиммуноанализ (RIA), твердофазный иммуноферментный анализ (ИФА), равновесный диализ или твердофазный иммуноблоттинг, включая Вестерн-блоттинг. В вариантах реализации количественные исследования методом ИФА могут дополнительно включать иммобилизацию с захватом антигена, когда антиген-мишень захватывается моноклональным антителом, специфичным в отношении данного антигена, закрепленным на твердой подложке, например, для повышения чувствительности количественного исследования. Выработка растворимых медиаторов (например, цитокинов, хемокинов, лимфокинов, простагландинов и т.д.) также может быть легко определена с помощью твердофазного иммуноферментного анализа (ИФА), например, с использованием способов, аппаратов и реагентов, которые легко доступны из коммерческих источников (например, Sigma, Сент-Луис, Миссури, США, см. также каталог за 2006 г. R&D Systems, R&D Systems, Миннеаполис, Миннесота, США).
[000269] Любое количество других иммунологических параметров можно контролировать с помощью обычных количественных исследований, которые хорошо известны в данной области техники. Они могут включать, например, количественные исследования антителозависимой клеточной цитотоксичности (АЗКЦ), исследования вторичных антительных ответов в условиях in vitro, проточный иммуноцитофлуориметрический анализ различных субпопуляций мононуклеарных клеток периферической крови или лимфоидных мононуклеарных клеток с использованием хорошо установленных маркерных антигенных систем, иммуногистохимии или других соответствующих количественных исследований. Перечисленные и другие количественные исследования можно найти, например, в Rose et al. (Eds.), Manual of Clinical Laboratory Immunolog, 5th Ed., 1997 American Society of Microbiology, Washington, DC.
[000270] Соответственно, согласно настоящему изобретению предусмотрено, что композиции согласно настоящему изобретению будут способны вызывать или усиливать у хозяина по меньшей мере один тип иммунного ответа, который выбран из ответа Т-лимфоцитов Th1, ответа Т-лимфоцитов Th2, ответа цитотоксических Т-лимфоцитов (ЦТЛ), гуморального ответа, ответа цитокинов, ответа лимфокинов, ответа хемокинов и воспалительного ответа. Согласно некоторым вариантам реализации настоящего изобретения иммунный ответ может включать по меньшей мере одно из выработки одного или множества цитокинов, при этом цитокин выбран из интерферона-гамма (ИФН-γ), фактора некроза опухоли-альфа (ФНО-α), выработки одного или множества интерлейкинов, при этом интерлейкин выбран из ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-13, ИЛ-16, ИЛ-18 и ИЛ-23, выработки одного или множества хемокинов, при этом хемокин выбран из MIP-1α, MIP-1β, RANTES, CCL4 и CCL5, и ответа лимфоцитов, который выбран из ответа Т-клеток памяти, ответа В-клеток памяти, ответа эффекторных Т-клеток, ответа цитотоксических Т-клеток и ответа эффекторных В-клеток. См., например, WO 94/00153; WO 95/17209; WO 96/02555; U.S. 6692752; U.S. 7084256; U.S. 6977073; U.S. 6749856; U.S. 6733763; U.S. 6797276; U.S. 6752995; U.S. 6057427; U.S. 6472515; U.S. 6309847; U.S. 6969704; U.S. 6120769; U.S. 5993800; U.S. 5595888; Smith et al., 1987 J Biol Chem. 262:6951; Kriegler et al., 1988 Cell 53:45 53; Beutler et al., 1986 Nature 320:584; U.S. 6991791; U.S. 6654462; U.S. 6375944.
[000271] Составы наноалюмочастиц согласно настоящему изобретению можно применять для лечения или предотвращения заболеваний, таких как коклюш, туберкулез, проказа, малярия, ВИЧ, лейшманиоз и грипп. В частности, способность составов наноалюмочастиц стимулировать Тh1 иммунитет делает их особенно подходящими в этом отношении.
С. Диагностические агенты
[000272] Согласно некоторым вариантам реализации настоящего изобретения агент представляет собой диагностический агент. Таким образом, в этих вариантах реализации описанные композиции содержат наноалюмочастицы согласно настоящему изобретению и дополнительно содержат диагностический агент, и могут применяться для диагностики любого заболевания, состояния или расстройства.
[000273] Согласно некоторым вариантам реализации настоящего изобретения диагностические агенты можно применять для детектирования рака. В данной области техники известны композиции и способы выявления субъектов, которые имеют рак или у которых подозревают риск развития рака, как описано в настоящем документе. Диагностику рака у субъекта, имеющего или у которого подозревают риск развития рака, можно осуществлять с помощью любого из широкого спектра общепринятых в данной области техники методик, которые могут варьироваться в зависимости от целого ряда факторов, включая клиническую картину, степень прогрессирования рака, тип рака и другие факторы. Примеры диагностики рака включают гистопатологическое, гистоцитохимическое, иммуногистоцитохимическое и иммуногистопатологическое исследование образцов пациентов (например, крови, биопсии кожи, биопсии другой ткани, хирургических образцов и т.д.), ПЦР-тесты для определенных генетических (например, нуклеиновая кислота) маркеров, серологические тесты для определения циркулирующих ассоциированных с раком антигенов или клеток, несущих такие антигены, или для определения антител с определенной специфичностью, или другие методики, с которыми будут знакомы специалисты в данной области техники. См., например, патенты США №№6734172; 6770445; 6893820; 6979730; 7060802; 7030232; 6933123; 6682901; 6587792; 6512102; 7078180; 7070931; JP5-328975; Waslylyk et al., 1993 Eur. J Bioch. 211 (7): 18. Любой один или более из этих диагностических агентов может быть включен в композиции, содержащие наноалюмочастицы, описанные в настоящем документе.
[000274] Согласно некоторым вариантам реализации настоящего изобретения диагностические агенты можно применять для детектирования аутоиммунного заболевания. Детектирование аутоантитела, соответственно, обеспечивает раннее выявление или распознавание присутствия или риска развития аутоиммунного заболевания. На основании этих данных были обнаружены различные аутоантитела против аутоантигенов, и аутоантитела против аутоантигенов были измерены в клинических исследованиях (например, патенты США №№6919210, 6596501, 7012134, 6919078), в то время как другие аутоиммунные диагностические способы могут включать детектирование соответствующего метаболита (например, патент США №4659659) или иммунологической реактивности (например, патенты США №№4614722 и 5147785, 4420558, 5298396, 5162990, 4420461, 4595654, 5846758, 6660487). Таким образом, согласно некоторым вариантам реализации настоящего изобретения композиции, содержащие любую из описанных в настоящем документе наноалюмочастиц, дополнительно содержат аутоантитело, пригодное для детектирования аутоантигена.
[000275] Согласно одному варианту реализации настоящего изобретения диагностические агенты можно применять для детектирования инфекционных заболеваний. В данной области техники известны композиции и способы выявления субъектов, имеющих или у которых подозревают риск заражения инфекционным патогеном, описанным в настоящем документе.
[000276] Например, бактерия Mycobacterium tuberculosis вызывает туберкулез (ТБ). Таким образом, согласно некоторым вариантам реализации настоящего изобретения композиции, содержащие любую из описанных в настоящем документе наноалюмочастиц, дополнительно содержат агент для диагностики туберкулеза. Диагностические наборы, содержащие такие полипептиды или последовательности ДНК и подходящий реагент для детектирования, можно применять для детектирования инфекции Mycobacterium у пациентов и в биологических образцах. Настоящее изобретение также относится к антителам, направленным против таких полипептидов.
[000277] Согласно некоторым вариантам реализации настоящего изобретения композиции, содержащие любую из описанных в настоящем документе наноалюмочастиц, дополнительно содержат агент для диагностики малярии с применением любого из диагностических агентов, описанных ниже. Известен способ диагностики малярии у индивидуума в условиях in vitro, включающий приведение ткани или биологической жидкости, взятой у индивидуума, в контакт с молекулой или полипептидной композицией, причем указанная молекула или полипептидная композиция содержит одну или более пептидных последовательностей, несущих весь или часть одного или более Т-клеточных эпитопов белков, которые вырабатываются в результате инфекционной активности P. falciparum, в условиях, обеспечивающих протекание иммунологической реакции in vitro между указанной композицией и антителами, которые могут присутствовать в ткани или биологической жидкости, и детектирование образованных комплексов антиген-антитело в условиях in vitro (см., например, патент США №7087231).
[000278] Описана экспрессия и очистка рекомбинантного эктодомена АМА-1 Plasmodium falciparum (3D7). При использовании более ранних способов получали высокоочищенный белок, который сохраняет структуру сворачивания и дисульфидные мостики нативной молекулы. Рекомбинантный АМА-1 можно применять в качестве диагностических реагентов, а также при получении антител и в качестве белка для применения по отдельности или как часть вакцины для предотвращения малярии, (патент США №7029685)
[000279] В данной области техники были описаны полинуклеотиды, которые кодируют видоспецифические малярийные пептидные антигены P. vivax, которые представляют собой белки или фрагменты белков, секретируемые в плазму восприимчивого млекопитающего-хозяина после заражения, а также моноклональные или поликлональные антитела, направленные против этих антигенов. Пептидные антигены, моноклональные антитела и/или поликлональные антитела применяют в количественных исследованиях, используемых для диагностики малярии, а также для определения того, является ли Plasmodium vivax видом, ответственным за инфекцию, (патент США №6706872). Также сообщалось о видоспецифических малярийных пептидных антигенах Р. vivax, которые представляют собой белки или фрагменты белков, секретируемые в плазму восприимчивого млекопитающего-хозяина после заражения, а также о моноклональных или поликлональных антителах, направленных против этих антигенов. Пептидные антигены, моноклональные антитела и/или поликлональные антитела применяют в количественных исследованиях, используемых для диагностики малярии, а также для определения того, является ли Plasmodium vivax видом, ответственным за инфекцию (см., например, патент США №6231861).
[000280] Рекомбинантный эктодомен АМА-1 Plasmodium falciparum (3D7) также экспрессировали с помощью способа, который позволяет получить высокоочищенный белок, который сохраняет структуру складывания и дисульфидные мостики нативной молекулы. Рекомбинантный АМА-1 можно применять в качестве диагностического реагента, для получения антител и в качестве вакцины, (патент США 7060276). Также известны способы экспрессии и очистки рекомбинантного MSP-142 Plasmodium falciparum (3D7), который сохраняет структуру складывания и дисульфидные мостики нативной молекулы. Рекомбинантный MSP-142 можно применять в качестве диагностического реагента, для получения антител и в качестве вакцины, (патент США 6855322)
[000281] Диагностические способы детектирования заражения человека малярией для выявления субъекта, который имеет или у которого подозревают риск заражения инфекционным возбудителем малярии, известны в соответствии с упомянутыми и родственными изобретениями. В частности, например, образцы крови комбинируют с реагентом, содержащим 3-ацетилпиридинадениндинуклеотид (APAD), субстрат (например, соль молочной кислоты или молочную кислоту) и буфер. Реагент предназначен для детектирования присутствия уникального гликолитического фермента, вырабатываемого малярийным паразитом. Этот фермент известен как паразитарная лактатдегидрогеназа (пЛДГ). пЛДГ легко отличить от ЛДГ хозяина с использованием реагента, описанного выше. Комбинация реагента с образцом крови, зараженным паразитами, приводит к восстановлению APAD. Однако APAD не восстанавливается ЛДГ хозяина. Затем восстановленный APAD можно детектировать с помощью различных методик, включая спектральный, флуориметрический, электрофоретический или колориметрический анализ. Детектирование восстановленного APAD с помощью упомянутого выше способа обеспечивает положительный признак заражения малярией (например, патент США №5124141). В другом способе диагностики малярии полипептид, содержащий характерную аминокислотную последовательность, происходящий из антигена GLURP Plasmodium falciparum, распознается в исследуемом образце конкретным антителом, которое вырабатывается против полипептида или является реактивным в отношении полипептида, (патент США №5231168).
[000282] Согласно некоторым вариантам реализации настоящего изобретения композиции, содержащие любую из описанных в настоящем документе наноалюмочастиц, дополнительно содержат агент, который можно применять для диагностики лейшманиоза с использованием любого из диагностических агентов, описанных ниже. Лейшманиоз это широко распространенная паразитарная болезнь с частыми эпидемиями на индийском субконтиненте, в Африке и Латинской Америке, которая является приоритетной для Всемирной организации здравоохранения в отношении разработки вакцин. Это комплекс различных заболеваний, поскольку паразиты Leishmania вызывают смертельные инфекции внутренних органов, а также серьезные заболевания кожи. Одной из самых изнуряющих форм лейшманиоза является обезображивающая инфекция носа и рта. Число случаев лейшманиоза увеличивается и в настоящее время не поддается контролю во многих областях. Число случаев лейшманиоза также растет в некоторых развитых странах, особенно в Южной Европе в результате ВИЧ-инфекции. Доступные лекарственные препараты являются токсичными, дорогими и требуют длительных ежедневных инъекций.
[000283] Лейшмании это простейшие паразиты, населяющие макрофаги или лейкоциты иммунной системы. Паразиты передаются с укусом мелких кровососущих насекомых (песчаных мух), которых трудно контролировать, поскольку они обитают в обширных районах планеты.
[000284] Висцеральный лейшманиоз является самым опасным из трех проявлений заболевания. По оценкам ежегодно возникает приблизительно 500000 новых случаев висцеральной формы (кала-азар или «убивающая болезнь»). В настоящее время более 200 миллионов человек подвержены риску заражения висцеральным лейшманиозом. Более 90% случаев висцерального лейшманиоза приходятся на Индию, Бангладеш, Судан, Бразилию и Непал. Большинство смертей приходятся на детей. Индивидуумы с кожными формами заболевания часто остаются обезображенными.
[000285] Заражения лейшманиями трудно поддаются диагностике и, как правило, включают гистопатологический анализ образцов биопсии ткани. Однако было разработано несколько серологических и иммунологических диагностических количественных исследований, (патент США №7008774, Senaldi et al., (1996) J. Immunol. Methods 193:9 5; Zijlstra, et al., (1997) Trans. R. Soc. Trop. Med. Hyg. 91:671 673; Badaro, et al., (1996) J. Inf. Dis. 173:758 761; Choudhary, S., et al., (1992) J. Comm. Dis. 24:32 36; Badaro, R., et al., (1986) Am. J. Trop. Med. Hyg. 35:72 78; Choudhary, A., et al., (1990) Trans. R. Soc. Trop. Med. Hyg. 84:363 366; и Reed, S.G., et al., (1990) Am. J. Trop. Med. Hyg. 43:632 639). Промастиготы высвобождают метаболические продукты в культуральную среду для создания кондиционированной среды. Эти метаболические продукты являются иммуногенными для хозяина. (См. Schnur, L.F., et al., (1972) lsrl. J. Med. Sci. 8:932 942; Sergeiev, V.P., et al., (1969) Med. Parasitol. 38:208 212; El-On, J., et al., (1979) Exper. Parasitol. 47:254 269; и Bray, R.S., et al., (1966) Trans. R. Soc. Trop. Med. Hyg. 60:605 609; патент США №6846648, патент США №5912166; патент США №5719263; патент США №5411865).
[000286] Согласно некоторым вариантам реализации настоящего изобретения композиции, содержащие любую из описанных в настоящем документе наноалюмочастиц, дополнительно содержат агент, который можно применять для диагностики ВИЧ с использованием любого из диагностических агентов, описанных ниже. Известны способы диагностики ВИЧ-инфекции, включая культивирование вируса, ПЦР определенных последовательностей нуклеиновых кислот из образцов пациентов и исследования антител для определения присутствия антител к ВИЧ в сыворотках крови пациентов (см., например, патенты США №№6979535, 6544728, 6316183, 6261762, 4743540).
VI. Наборы
[000287] Согласно некоторым вариантам реализации настоящего изобретения также предложены наборы, содержащие описанные в настоящем документе композиции, содержащие наноалюмочастицы, которые могут быть обеспечены в одном или более контейнерах. Согласно одному варианту реализации настоящего изобретения все компоненты композиций присутствуют вместе в одном контейнере, однако варианты реализации не ограничиваются только указанными и также включают два или более контейнеров, в которых, например, иммунологическая адъювантная композиция отделена от антигенного компонента и не вступает с ним в контакт. В качестве неограничивающей теории полагают, что в некоторых случаях введение только иммунологической адъювантной композиции может быть благоприятным, в то время как в других случаях такое введение может быть благоприятно отделено по времени и/или пространственно (например, в другом анатомическом месте) от введения антигена, в то время как в некоторых других случаях введение субъекту благоприятно проводят с использованием вакцинной композиции, описанной в настоящем документе и содержащей как антиген, так и адъювантную композицию, и необязательно другие компоненты, описанные в настоящем документе.
[000288] Согласно некоторым вариантам реализации настоящего изобретения флакон набора содержит композицию, содержащую наноалюмочастицы.
[000289] Согласно некоторым вариантам реализации настоящего изобретения один флакон набора содержит композицию, содержащую наноалюмочастицы, и второй флакон набора содержит биоактивный агент. Согласно некоторым вариантам реализации настоящего изобретения набор содержит третий флакон, содержащий адъювант.
[000290] Согласно некоторым вариантам реализации настоящего изобретения один флакон набора содержит композицию, содержащую наноалюмочастицы, и второй флакон набора содержит адъювант. Согласно некоторым вариантам реализации настоящего изобретения набор содержит третий флакон, содержащий биоактивный агент.
[000291] Наборы согласно настоящему изобретению могут дополнительно содержать инструкции по применению, как описано в настоящем документе, или инструкции для смешивания материалов, содержащихся во флаконах. Согласно некоторым вариантам реализации настоящего изобретения материал во флаконе является сухим или лиофилизованным. Согласно некоторым вариантам реализации настоящего изобретения материал во флаконе является жидким.
[000292] Контейнер в соответствии с такими вариантами реализации набора может представлять собой любой подходящий контейнер, сосуд, флакон, ампулу, пробирку, чашку, коробку, бутылку, колбу, банку, планшет, лунку однолуночного или многолуночного аппарата, резервуар, цистерну или т.п. или другое устройство, в котором композиции, описанные в настоящем документе, могут размещаться, храниться и/или транспортироваться и могут быть доступны для извлечения содержимого. Как правило, такой контейнер может быть изготовлен из материала, который совместим с предполагаемым применением и из которого можно легко извлечь содержимое. Неограничивающие примеры таких контейнеров включают стеклянные и/или пластиковые герметизированные или повторно герметизированные пробирки и ампулы, включая те, которые имеют резиновую перегородку или другие уплотнительные средства, которые совместимы с извлечением содержимого с помощью иглы и шприца. Такие контейнеры могут быть изготовлены, например, из стекла или химически совместимого пластика или смолы, могут быть изготовлены из вещества или могут быть покрыты веществом, которое обеспечивает эффективное извлечение материала из контейнера и/или защищает материал, например, от разрушающих условий, таких как ультрафиолетовый свет или экстремальные значения температуры, или от внесения нежелательных загрязнителей, включая микробные загрязнители. Контейнеры предпочтительно являются стерильными или стерилизуемыми и изготовлены из материалов, которые будут совместимы с любым носителем, вспомогательным веществом, растворителем, наполнителем или т.п., например, такими как те, которые можно применять для суспендирования или растворения вакцинных композиций и/или иммунологических адъювантных композиций, и/или антигенов, и/или рекомбинантных конструкций для экспрессии и т.д., описанных в настоящем документе.
[000293] Следующие примеры приведены в качестве иллюстрации и не являются ограничивающими.
ПРИМЕРЫ
Пример 1. Получение составов наноалюмочастиц с ПЭГ и ПАК
[000294] Получение составов наноалюмочастиц. 2% Гидроксид алюминия или Al(ОН)3, гидроксид алюминия, оксигидроксид алюминия 2% (Alhydrogel® 85) приобретали у ЕМ Sargeant в виде влажных гелевых суспензий. Следующие липиды приобретали у Corden Pharma (Liestal, Switzerland): дистеароилглицерофосфоэтаноламин (DSPE), N-карбонилметоксиполиэтиленгликоль-750)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (мПЭГ750-DSPE), N-карбонилметоксиполиэтиленгликоль-2000-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (мПЭГ2000-DSPE), N-карбонилметоксиполиэтиленгликоль-5000-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (мПЭГ5000-DSPE), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-[метоксиполиэтиленгликоль-2000] (мПЭГ2000-DPPE), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-[метоксиполиэтиленгликоль-5000] (мПЭГ5000-DPPE), N-карбонилметоксиполиэтиленгликоль-2000-1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин (мПЭГ2000-DMPE) и N-карбонилметоксиполиэтиленгликоль-5000-1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин (мПЭГ5000-DMPE). Alhydrogel® «85» приобретали у ЕМ Sergeant Pulp and Chemical Company (Клифтон, Нью-Джерси, США) и производили в Brenntag (Mulheim an der Ruhr, Германия). Полиакриловую кислоту (ПАК) приобретали у Sigma Aldrich.
[000295] Получение составов наноалюмочастиц. В общих чертах, составы наноалюмочастиц с ПЭГ изготавливали путем разведения 40 мл Alhydrogel® (10 мг/мл алюминия) в 60 мл воды и нагревания в водяной бане Crest Powersonic CP230D (Трентон, Нью-Джерси, США) при температуре ~60°С в течение 2 часов. DSPE или пегилированный фосфолипид DSPE добавляли к нагретому раствору Alhydrogel® в указанных концентрациях, варьирующихся от 0,5 до 30 мг/мл фосфолипида (таблица 3). Все составы возвращали на водяную баню с температурой ~60°С для растворения видимых фосфолипидных агрегатов. Microfluidics M110P (Ньютон, Массачусетс, США), оборудованный камерой для взаимодействий с внутренним алмазным покрытием F12Y с последующей обработкой в керамическом вспомогательном модуле H30Z, использовали для обработки составов при давлении 30000 фунтов на кв. дюйм до 10 раз с рециркулирующей охлажденной водой, чтобы предотвратить повышение температуры во время обработки. Аликвоты по 50 мкл извлекали между выбранными раундами обработки для характеристики размера частиц методом динамического рассеяния света. Оставшийся состав собирали после 10-го раунда и включали в план исследований стабильности для контроля размера частиц. Отобранные составы, изготовленные на микрофлюидизаторе 110Р, фильтровали через мембрану Supor с размером пор 0,2 мкм перед оценкой биологической активности в условиях in vivo. Отобранные составы обрабатывали с использованием смесителя с высоким усилием сдвига Silverson (Восточный Лонгмидоу, Массачусетс, США) в течение 5 минут при 5000 об./мин вместо микрофлюидизации.
[000296] Для получения составов наноалюмочастиц с ПАК, ПАК со средней молекулярной массой 2000 приобретали у Sigma Aldrich. 50% масс./об. исходный водный раствор разбавляли водой, чтобы получить 30% масс./об. в воде. 16 г 30% масс./об. ПАК комбинировали с 160 г исходного 10 мг/мл раствора Alhydrogel®, и рН доводили до 6,6 с помощью 10 М NaOH. Составы обрабатывали с использованием микрофлюидизатора 110Р при давлении 30000 фунтов на кв. дюйм и 4°С 1, 3, 6, 10, 15 или 20 раз.
[000297] Исследование частиц в составах наноалюмочастиц. Размер частиц в составах характеризовали с помощью динамического рассеяния света (ДРС) с использованием Zetasizer Nano-S или Nano-ZS от Malvern Instruments (Вустершир, Великобритания) и путем оценки размера частиц с помощью лазерной дифракции с использованием Beckman Coulter LS230 (Бри, Калифорния, США). Информацию о размерах частиц также получали с помощью количественного исследования седиментации и крио-ПЭМ (описано ниже). Для исследования методом ДРС составы алюминиевых квасцов разбавляли водой в соотношении 1:100 в одноразовой полистироловой кювете объемом 1,5 мл. Измерения ДРС проводили с тремя повторами, и значения представляли как средний диаметр частиц на основании рассеяния, Z-среднее. Образцы, исследуемые методом ДРС, измеряли против полистироловых стандартов (показатель преломления полистирола = 1,55-1,59) с размером частиц 60 нм и 200 нм; алюминий имеет показатель преломления 1,24. Для измерений методом лазерной дифракции образцы алюминиевых квасцов помещали непосредственно в заполненную водой камеру для образцов. Было достигнуто значение дифференциальной интенсивности рассеянного поляризованного света (PIDS) между 50% ± 5%. Поправки на смещение (устанавливает исходный уровень электрического шума при измерении напряжения цепи при выключенном лазере) устанавливали на 60 секунд, измерение фонового сигнала - 90 секунд, длительность анализа - 90 секунд и скорость насоса - 50%. Перед проведением исследования образцов и в перерывах между исследованиями в LS230 три раза удаляли пузырьки.
[000298] Седиментационный анализ. Определение оптического профиля лазерного рассеяния проводили с использованием LUMiReader (LUM GmbH, Боулдер, Колорадо, США), оснащенного тремя лазерами с длиной волны 470 нм, 630 нм и 870 нм. Скорость осаждения частиц определяли на основании изменений профиля пропускания лазерного излучения в вертикальном поперечном сечении кюветы с образцом. По 4 мл неразбавленного состава добавляли непосредственно в цилиндрическую стеклянную ячейку для количественного исследования. Образцы измеряли при 25°С в течение 2-4 часов при максимальном угле наклона 30°С со сканированиями для измерения каждые 60 секунд. Помимо этого, на основании метода многоволнового анализа (2), скорость осаждения частиц может быть использована для расчета распределения частиц по размерам на основании их объема для частиц с размером более ~0,5 мкм.
[000299] Адсорбция антигена. Связывание антигена с составами наноалюмочастиц исследовали методом гель-электрофореза в ДСН-ПААГ с окрашиванием серебром. Перед центрифугированием образцы смешивали в следующем порядке: состав алюминиевых квасцов, лиганд TLR, антиген и разбавитель (солевой раствор или глицерин). Образцы затем центрифугировали на ультрацентрифуге Optima Мах-ХР Beckman Coulter (Бри, Калифорния, США) в течение 30 минут при 35000 g при 4°С. По 30 мкл образца смешивали с 10 мкл 4× восстановленного буфера для образцов с ДСЛ, затем 20 мкл смеси загружали в ДСН-ПААГ с 12 дорожками с 8 мкл предварительно окрашенного стандарта SeeBlue2. Каждый гель анализировали в течение 55 минут при 190 В и затем помещали в фиксирующий раствор EtOH:СН3СООН:Н2О в соотношении 50:40:10 по меньшей мере на 2 часа или в течение ночи. Затем гель окрашивали в соответствии с указаниями, предоставленными для набора для окрашивания серебром ProteoSilver Plus (Sigma-Aldrich, Сент-Луис, Миссури, США).
[000300] Адсорбция лиганда TLR. Связывание лиганда TLR-9 с составами наноалюмочастиц исследовали методом гель-электрофореза в ДСН-ПААГ с окрашиванием серебром с использованием аналогичного метода центрифугирования и приготовления разведений, условий для геля и набора для окрашивания. Присутствие темно-коричневой полосы в диапазоне 3-6 кДа указывало на то, что лиганд TLR-9 присутствует в геле. Связывание лиганда TLR-4 с составами наноалюмочастиц количественно исследовали с помощью центрифугирования лиганда TLR-4 с составами наноалюмочастиц и исследования супернатанта для определения присутствия несвязанного лиганда TLR-4, разбавленного в соотношении 1:5 подвижной фазой А (75:15:10 [об.:об.:об.] метанол : хлороформ : вода с добавлением 20 мМ ацетата аммония и 1% уксусной кислоты). Каждый образец супернатанта вводили в объеме 50 мкл на колонку Xbridge ВЕН Shielf RP18 (Waters Co., Милфорд, Массачусетс, США), подсоединенную к Agilent Model 1100 ВЭЖХ (Санта Клара, Калифорния, США). Градиент, состоящий из подвижных фаз А и В (1:1 [об.:об.] метанол : хлороформ с добавлением 20 мМ ацетата аммония и 1% уксусной кислоты), анализировали в течение 25 минут. Детектирование проводили с помощью аэрозольного детектора Coronoa Charged (CAD) (ESA Biosciences, Челмсфорд, Массачусетс, США). Количественное определение выполняли с использованием стандарта GLA, впрыснутого в разных объемах в подвижную фазу В для получения стандартной кривой.
[000301] XRD. Рентгеновский порошковый дифракционный анализ выполняли на четырех образцах, отправленных в Triclinic Labs (Вест Лафайет, Индиана, США), чтобы определить влияние различных вариантов обработки на одну и ту же композицию пегилированный липид/Alhydrogel®. Образцы подвергали ультрацентрифугированию, и влажные твердые вещества и супернатантные жидкости исследовали методом рентгеновской порошковой дифракции (XRPD). Рентгеновскую дифракционную систему Rigaku Smart-Lab (The Woodlands, Техас, США) конфигурировали на отражение на основании геометрии Брэгга-Брентано с использованием линейного источника рентгеновского излучения. Источник рентгеновского излучения представлял собой длинную медную точно фокусирующую трубку, функционирующую при 40 кВ и 444 мА. Этот источник обеспечивает профиль падающего луча в образце, который изменяется от узкой линии под большими углами до широкого прямоугольника под малыми углами. На линейном источнике рентгеновских лучей применяли щели для обработки луча, которые позволяют обеспечить максимальную ширину луча менее 10 мм как вдоль по линии, так и по нормали к линии. Геометрия Брэгга-Брентано представляет собой парафокусирующую геометрию, контролируемую пассивной дивергенцией и принимающими щелями, причем сам образец действует как фокусирующий компонент для оптики. Собственное разрешение геометрии Брэгга-Брентано частично определяется радиусом дифрактометра и шириной используемой приемной щели. Как правило, Rigaku Smart-Lab функционирует так, чтобы обеспечить ширину пика 0,1 °2 или менее. Осевая дивергенция пучка рентгеновских лучей контролируется щелями Soller 5,0° на пути как падающего, так и дифрагированного пучка. Образцы помещали в кремниевые держатели с низким фоном, прикладывая незначительное ручное давление, чтобы удержать поверхность образцов плоской и уравнять с эталонной поверхностью держателя. Каждый образец исследовали при 2-40 °2
или менее. Осевая дивергенция пучка рентгеновских лучей контролируется щелями Soller 5,0° на пути как падающего, так и дифрагированного пучка. Образцы помещали в кремниевые держатели с низким фоном, прикладывая незначительное ручное давление, чтобы удержать поверхность образцов плоской и уравнять с эталонной поверхностью держателя. Каждый образец исследовали при 2-40 °2 с использованием непрерывного сканирования 6 °2
с использованием непрерывного сканирования 6 °2 в минуту с постоянным размером шага 0.02 °2
в минуту с постоянным размером шага 0.02 °2 . Каждый набор данных подвергали цифровой фильтрации для удаления низкочастотных ответов. Изучение полученных профилей позволило идентифицировать два совершенно разных ответа кристаллов: пики, сходные с гауссиановскими, и пики, сходные с лоренциановскими. Пики, сходные с гауссиановскими, обычно ассоциированы с микрокристаллическим материалом и используются для обозначения материалов, содержащих как кристаллические, так и аморфные области. Пики, сходные с лоренциановскими, обычно ассоциированы с нанокристаллическими материалами и содержат кристаллиты нанометровых размеров.
. Каждый набор данных подвергали цифровой фильтрации для удаления низкочастотных ответов. Изучение полученных профилей позволило идентифицировать два совершенно разных ответа кристаллов: пики, сходные с гауссиановскими, и пики, сходные с лоренциановскими. Пики, сходные с гауссиановскими, обычно ассоциированы с микрокристаллическим материалом и используются для обозначения материалов, содержащих как кристаллические, так и аморфные области. Пики, сходные с лоренциановскими, обычно ассоциированы с нанокристаллическими материалами и содержат кристаллиты нанометровых размеров.
Исследование составов наноалюмочастиц методом крио-ЭМ
[000302] Исследование методом крио-ЭМ выполняли в Nanolmaging Services. В общих чертах, образцы для исследования методом ЭМ консервировали в бесструктурном льду, поддерживаемом перфорированной углеродной пленкой на медных решетках 400 меш. Каждый образец получали путем нанесения капли суспензии образца объемом 3 мкл на очищенную решетку, осушали с помощью фильтровальной бумаги и сразу же переводили в бесструктурное состояние в жидком этане. Решетки хранили в жидком азоте до перенесения к электронному микроскопу для визуализации. Электронную микроскопию выполняли с использованием электронного микроскопа FEI Tecnai Т12, функционирующего при 120 КэВ, оборудованного камерой FEI Eagle 4k × 4k CCD. Решетки с бесструктурным льдом переносили в электронный микроскоп с использованием криоплатформы, которая поддерживает решетки при температуре ниже - 170°С. Изображения каждой решетки получали в нескольких масштабах для оценки общего распределения образца. После выявления потенциально подходящих целевых областей для визуализации при более низком увеличении, изображения с высоким увеличением регистрировали при значениях номинального увеличения 110000 × (0,10 нм/пиксель), 52000 × (0,21 нм/пиксель) и 21000 × (0,50 нм/пиксель). Изображения регистрировали при номинальной недофокусировке -2 мкм (110000×), от -3 мкм до -2 мкм (52000×) и -5 мкм (21000×) и интенсивности пучка электронов ~9-42 
Получение составов наноалюмочастиц - разработка агентов, регулирующих размер.
Составы наноалюмочастиц с ПЭГ - агент, регулирующий размер, на основе пегилированного фосфолипида
[000303] Оксигидроксид алюминия (алюминиевые квасцы) в растворе обычно агрегирует с образованием более крупных типичных кристаллических массивов или листов. Необработанный Alhydrogel® образует более крупные типичные кристаллические массивы или листы из молекул гидроксида алюминия размером 1 микрон или более в необработанных составах алюминиевых квасцов. Чтобы определить, приведет ли измельчение или обработка путем микрофлюидизации только растворов гидроксида алюминия в различных условиях к образованию составов наноалюмочастиц, выполняли эксперименты, данные которых не представлены; однако не удалось определить условие, при котором микрофлюидизация только гидроксида алюминия может привести к получению стабильного состава наноалюмочастиц.
[000304] Не желая быть связанными соответствием какой-либо теории, авторы настоящего изобретения полагают, что добавление агента, регулирующего размер, или стабилизирующего агента может быть необходимым для предотвращения или нарушения агрегации молекул гидроксида алюминия. Фосфолипиды обычно добавляют в качестве эмульгаторов и стабилизаторов микросфер в водных растворах, и они первоначально были выбраны в качестве агентов, регулирующих размер,. Первоначальные эксперименты выполняли, чтобы исследовать возможность получения составов наноалюмочастиц при включении агентов, регулирующих размер, таких как фосфолипиды, во время измельчения или обработки растворов алюминиевых квасцов. Выполняли эксперименты по включению одного типа фосфолипида, DSPE, DPPE и DMPE, с различной длиной ацильной цепи, содержащей 18, 16 и 14 атомов углерода, соответственно. Было обнаружено, что исследованные фосфолипиды не являлись эффективными агентами, регулирующими размер, и не предотвращали агрегацию молекул алюминиевых квасцов (данные не представлены).
[000305] Чтобы определить, может ли добавление фрагмента полиэтиленгликоля, соединенного с фосфолипидом, создать эффективный агент, регулирующий размер, выполняли дополнительные эксперименты. Для того чтобы оценить, может ли включение агента, регулирующего размер, нарушить агрегацию молекул алюминиевых квасцов для получения состава наноалюмочастиц, исходный раствор ПЭГ5000-DSPE измельчали с помощью микрофлюидизации при 30000 фунтов на кв. дюйм 10 раз и сразу же смешивали в лабораторных условиях с исходным раствором гидроксида алюминия, чтобы получить состав 8 мг/мл ПЭГ5000-DSPE:4 мг/мл Alhydrogel®. Результаты исследования методом крио-ЭМ смешанного состава микрофлюидизированного пегилированного фосфолипидатидроксида алюминия выявили, что смешивание гидроксида алюминия с микрофлюидизированным пегилированным липидом не нарушало образование более крупных кристаллических агрегатов из алюминиевых квасцов и не приводило к получению состава наноалюмочастиц.
[000306] Последующие эксперименты выполняли для того чтобы определить, можно ли получить составы наноалюмочастиц путем добавления агента, регулирующего размер, во время измельчения или обработки исходного состава алюминиевых квасцов. Чтобы определить, может ли добавление агента, регулирующего размер, во время измельчения или обработки алюминиевых квасцов привести к получению состава наноалюмочастиц, выполняли серию экспериментов для оценки пегилированных фосфолипидов DSPE, DPPE и DMPE с фрагментами полиэтиленгликоля, имеющими различную молекулярную массу (варьирующуюся от 750 до 5000 Да), соединенными с разными фосфолипидами с варьирующейся длиной ацильной цепи (DSPE, DPPE, DMPE с длиной ацильной цепи 18 атомов углерода, 16 атомов углерода и 14 атомов углерода, соответственно), смешанных с исходными составами алюминиевых квасцов в процессе измельчения или регулировки размера в различных условиях. Составы исследовали для определения размера частиц с помощью анализа на оборудовании от Malvern Instruments и крио-ЭМ. Измельчение или обработка алюминиевых квасцов в присутствии агента, регулирующего размер, такого как пегилированный фосфолипид, обеспечивали получение составов наноалюмочастиц с размерами частиц от приблизительно 400 нм до 70 нм (таблица 4, и не представленные данные).
[000307] Анализ представленных данных указывал на то, что способ или условия, использованные для измельчения алюминиевых квасцов в присутствии агента, регулирующего размер, могут обеспечить получение состава наноалюмочастиц с различными установленными размерами частиц. Необработанные алюминиевые квасцы имеют размер приблизительно 1000-10000 нм (таблица 4). Смешивание алюминиевых квасцов в присутствии ПЭГ-DSPE с молекулярной массой 5000 кДа в качестве агента, регулирующего размер, (например, при соотношении агент, регулирующий размер:квасцы 8 мг:4 мг) с помощью смесителя Silverson при скорости 5000 об./мин в течение 5 минут позволило получить состав наноалюмочастиц со средним размером частиц приблизительно 400 нм (таблица 3, и не представленные данные). Микрофлюидизация ПЭГ-DSPE с молекулярной массой 5000 кДа, смешанного с алюминиевыми квасцами (например, при соотношении агент, регулирующий размер:алюминиевые квасцы 8 мг: 4 мг), при давлении 10000 фунтов на кв. дюйм 1 раз, приводила к получению состава наноалюмочастиц со средним размером частиц приблизительно 120-130 нм. Обработка смешанного раствора ПЭГ-DSPE, имеющего молекулярную массу 5000 кДа, с алюминиевыми квасцами 6, 10, 15 или до 20 раз, приводила к получению составов наноалюмочастиц со средним размером частиц 70 нм (таблица 3, и не представленные данные). Данные в таблице 4, а также не представленные данные, указывали на то, что изменение обработки алюминиевых квасцов в присутствии агента, регулирующего размер, путем либо изменения оборудования для измельчения или регулировки размера (например, смесителя Silverson или микрофлюидизатора), либо условий измельчения (например, для микрофлюидизатора за счет изменения давления (фунтов на кв. дюйм) или количества раундов обработки) приводило к получению состава наноалюмочастиц с диапазоном размеров наночастиц (400 нм, 120 нм, 70 нм). На основании представленных данных специалист в данной области техники может измельчить или обработать алюминиевые квасцы в присутствии агента, регулирующего размер, такого как пегилированный липид, с использованием хорошо известных способов и оборудования, таких как источник высокой энергии или подведение высокой энергии, чтобы получить наноалюмочастицы с желательным диапазоном размеров.
[000308] Дополнительный анализ данных в таблице 4 и не представленных данных указывал на то, что широкий диапазон молекулярных масс фрагментов ПЭГ, соединенных с фосфолипидом DSPE, позволил получить эффективные агенты, регулирующие размер,. Как показано в таблице 4 и следует из не представленных данных, изменение длины ПЭГ от 750 до 2000 или до 5000 кДа (таблица 3, и не представленные данные) не влияло на размер частиц в составе наноалюмочастиц при измельчении в условиях измельчения, определенных для получения частиц с размером 70 нм в составе наноалюмочастиц. Соответственно, агенты, регулирующие размер, на основе пегилированных фосфолипидов согласно настоящему изобретению могут содержать фрагменты полиэтиленгликоля с широким диапазоном молекулярной массы.
[000309] Чтобы определить, можно ли контролировать размер частиц в составе наноалюмочастиц путем изменения соотношения алюминиевых квасцов и агентов, регулирующих размер, на основе пегилированных фосфолипидов, выполняли эксперименты.
[000310] Данные, представленные в таблице 4, указывали на то, что изменение соотношения агента, регулирующего размер, и алюминиевых квасцов может быть использовано для воздействия на размер частиц в составе наноалюмочастиц. Например, наноалюмочастицы со средними размерами частиц приблизительно 300-400 нм для агента, регулирующего размер, DSPE-ПЭГ5000 могут быть воспроизводимо получены при соотношении алюминиевых квасцов и агента, регулирующего размер, равном 1:1, тогда как увеличение доли агента, регулирующего размер, до 1:1,5 или 1:2 позволило воспроизводимо получать наноалюмочастицы с размером частиц приблизительно 100 нм или 70-80 нм, соответственно. Результаты сравнения агента, регулирующего размер, DSPE-ПЭГ2000, агентов, регулирующих размер, DPPE-ПЭГ-5000 или ПАК200 указывали на то, что оптимальные соотношения алюминиевых квасцов и агента, регулирующего размер, которые находятся в диапазоне 1:2-1:3, обеспечивали воспроизводимое получение наноалюмочастиц с размером частиц 70-80 нм. Помимо этого данные в таблице 4 и не представленные данные указывали на то, что длина ацильной цепи пегилированного фосфолипида не влияла на способность агента, регулирующего размер, обеспечивать получение наноалюмочастиц с желательным диапазоном размеров. Изменение длины ацильной цепи, состоящей из 18 атомов углерода (18С DSPE), 16 атомов углерода (16С DPPE) и 14 атомов углерода (14С DMPE), пегилированного фосфолипида при смешивании с составом алюминиевых квасцов и измельчении с помощью аналогичного способа во всех случаях приводило к получению составов наноалюмочастиц с одинаковым размером частиц (Таблица 4 и не представленные данные). Соответственно, агенты, регулирующие размер, на основе пегилированных фосфолипидов согласно настоящему изобретению могут содержать фосфолипиды с различной длиной ацильной цепи.
Снижение рН с помощью концентрированной HCl, HNO3 и пропионовой кислоты
[000311] Существенное снижение рН алюминиевых квасцов с помощью концентрированной кислоты при измельчении путем ультразвуковой обработки в течение пяти минут приводило к получению составов наноалюмочастиц согласно настоящему изобретению. Исследовали возможность достижения конечного значения рН=1,0 с помощью концентрированной хлористоводородной и азотной кислот, и обе кислоты приводили к получению составов наноалюмочастиц с размером частиц 324 нм (данные не представлены) с высокой полидисперсностью. Соответственно, концентрированные растворы кислот могут быть пригодны в качестве агентов, регулирующих размер, для получения составов наноалюмочастиц для определенных аспектов настоящего изобретения. Однако, поскольку конечное значение рН=1,0 для составов наноалюмочастиц может не быть предпочтительным для всех аспектов настоящего изобретения, включая доставку белков, пептидов и нуклеиновых кислот, также оценивали дополнительные кислоты с более низким общим рН-профилем.
[000312] В общих чертах, 4 мМ олеиновую кислоту смешивали с водой для получения 30 мл эмульсии. Эту смесь обрабатывали ультразвуковым зондом (при 40% мощности) в течение 10 мин. Равные объемы 1,6% об./масс. Alhydrogel® смешивали с равным объемом раствора эмульгированной олеиновой кислоты с получением состава Alhydrogel® : олеиновая кислота, содержащего 0,8% (об./масс.) Alhydrogel® : 2 мМ олеиновой кислоты, который дополнительно обрабатывали ультразвуком в течение 10 минут, используя ультразвуковой зонд при 40% мощности. Полученный состав наноалюмочастиц имел размер частиц 194 нм и конечное значение рН=2,4. Соответственно, для некоторых аспектов олеиновая кислота является подходящим агентом, регулирующим размер, для составов наноалюмочастиц.
[000313] Алюминиевые квасцы обрабатывали ультразвуком, как описано выше, при перемешивании и добавлении 5% уксусной кислоты до достижения рН=6,1, 5,1 или 4,5. Уксусная кислота в качестве агента, регулирующего размер, позволила получить эффективные составы наноалюмочастиц со средними размерами частиц приблизительно 100-130 нм. Помимо этого наночастицы состава были положительно заряжены, согласно результатам измерения дзета-потенциала. Соответственно, для некоторых аспектов настоящего изобретения уксусная кислота может быть эффективным агентом, регулирующим размер, для получения составов наноалюмочастиц согласно настоящему изобретению.
Составы наноалюмочастиц с ПАК - полиакриловая кислота (ПАК) в качестве агента, регулирующего размер
[000314] Для первоначальных экспериментов применение ПАК в качестве агента, регулирующего размер, для получения наноалюмочастиц оценивали путем смешивания при сильном перемешивании 40 г 0,4% (масс./об.) алюминиевых квасцов с 20% (масс./об.) раствора ПАК, и рН доводили до рН=6,0 с помощью концентрированного гидроксида аммония с получением наноалюмочастиц с размером частиц приблизительно 140 нм и с отрицательным поверхностным зарядом, согласно результатам измерения дзета-потенциала.
[000315] Для последующих экспериментов, в общих чертах, 20% (масс./об.) ПАК смешивали с исходным раствором алюминиевых квасцов, рН доводили до 6,6 с помощью гидроксида натрия и измельчали с использованием Microfluidizer 110Р. На основании данных, полученных в ходе разработки составов наноалюмочастиц с ПЭГ, состав измельчали путем микрофлюидизации при температуре рециркулирующей воды 4°С, и оценивали при давлении 30000 фунтов на кв. дюйм с количеством раундов 3, 6, 10 и 15 соответственно. 3 или 6 раундов позволили получить наноалюмочастицы с размером частиц приблизительно 100 нм без заметного влияния на размер частиц, наблюдаемый между 3 и 6 раундами. Увеличение количества раундов с 10 до 15 во всех случаях приводило к получению наноалюмочастиц с размером приблизительно 70-85 нм и хорошей полидисперсностью. Для последующих экспериментов использовали 10 раундов (обработки). Данные указывали на то, что ПАК является эффективным агентом, регулирующим размер, для составов наноалюмочастиц.
Стабильность и характеристика составов наноалюмочастиц
[000316] Данные указывали на то, что состав наноалюмочастиц может быть получен путем измельчения в присутствии подходящих веществ, регулирующих размер, таких как пегилированные липиды и полиакриловая кислота. Однако для коммерческого применения в качестве состава для доставки лекарственных препаратов или биологических препаратов желательной характеристикой состава является стабильность размера частиц с течением времени. Выполняли эксперименты для определения стабильности водных составов наноалюмочастиц с ПЭГ или составов наноалюмочастиц с ПАК и поддержания начального размера частиц или отсутствия увеличения размера или агрегации свыше среднего размера частиц 200 нм, при измельчении до начального размера частиц 70 нм. В общих чертах, составы наноалюмочастиц с ПЭГ и составы наноалюмочастиц с ПАК получали, как описано выше, и хранили при 4°С, как указано. Образцы, взятые с тремя повторами, извлекали через 1 неделю, 2 недели и 1, 3, 6, 9 и 12 месяцев после получения, и размер частиц и полидисперсность оценивали, как описано в настоящем документе. Данные на Фигуре 1В для составов наноалюмочастиц с ПАК указывали на то, что составы наноалюмочастиц с ПАК были чрезвычайно стабильны и сохраняли средний размер частиц приблизительно 75 нм в течение исследованных 1, 3 и 6 месяцев и более 12 месяцев (данные не представлены). Аналогичным образом, составы наноалюмочастиц с ПЭГ, данные для которых представлены на Фигуре 1С, также были чрезвычайно стабильны и сохраняли средний размер частиц приблизительно 75 нм в течение 1, 3, 6, 9 и до 12 месяцев при измерении методом динамического рассеяния света с помощью Malvern Zetasizer.
[000317] Долгосрочная стабильность при 2-8°С является важной характеристикой для вакцинных составов, но поддержание холодовой цепи может быть ограничивающим фактором для доставки вакцин для международного здравоохранения. Исследовали термостабильность составов наноалюмочастиц согласно настоящему изобретению в диапазоне температур (25°С, 37°С и 65°С) в течение 4 недель. В общих чертах, образцы, взятые с тремя повторами, хранили при желательной температуре и количественно исследовали изменение среднего размера частиц и полидисперсности, согласно результатам измерения методом динамического рассеяния света с помощью Malvern zetasizer. Далее исследовали влияние длины ПЭГ и длины ацильной цепи на термостабильность водных составов наноалюмочастиц путем оценки ПЭГ5000-DSPE (длина ацильной цепи 18 атомов углерода), ПЭГ2000-DMPE (длина ацильной цепи 14 атомов углерода), ПЭГ2000-DPPE (длина ацильной цепи 16 атомов углерода) ПЭГ750-DSPE (длина ацильной цепи 18 атомов углерода) и ПЭГ200-DSPE (длина ацильной цепи 18 атомов углерода). Данные на ФИГ. 1D-F указывали на то, что ПЭГ2000-DSPE был чрезвычайно стабилен при температурах до 25°С и 37°С с незначительной агрегацией или без агрегации или изменения размера частиц в течение 0, 2 или 4 недель, и даже при 60°С состав был стабилен до 2 недель. Даже через 4 недели при 60°С состав наноалюмочастиц с ПЭГ2000-DSPE проявлял лишь незначительное увеличение размера частиц и по-прежнему имел средний размер частиц 114 нм, это указывало на то, что наноалюмочастицы, содержащие агенты, регулирующие размер, могут не нуждаться в хранении в холодовой цепи. Составы наноалюмочастиц с ПЭГ5000-DSPE (длина ПЭГ 5000 и длина ацильной цепи 18С), ПЭГ2000-DPPE (длина ПЭГ 2000 и длина ацильной цепи 16С) и ПЭГ750-DSPE (длина ПЭГ 750 и длина ацильной цепи 18С) проявили термостабильность при 25°С и 37°С в течение 0, 2 и 4 недель, однако при 60°С они были термолабильными и проявили агрегацию частиц через 2 и 4 недели со средними размерами частиц более 2000 нм. Следует отметить, что состав наноалюмочастиц с ПЭГ2000-ВМРЕ (длина ПЭГ 2000 и длина ацильной цепи 14С) был стабильным при 25°С до 4 недель и при температуре 37°С в течение 2 недель, но при температуре 37°С и 60°С не был стабильным и проявлял агрегацию частиц со средними размерами частиц более 2000 нм. Следовательно, составы наноалюмочастиц согласно настоящему изобретению проявляли повышенную термостабильность. Термостабильность составов наноалюмочастиц может не только обеспечить более широкий международный доступ к областям без специального хранения в холодовой цепи, но также может снизить общую стоимость состава. В пояснительных подписях к фигурам QG194 представляет собой ПЭГ5000-DSPE; QG195 представляет собой ПЭГ2000-DMPE; QG196 представляет собой ПЭГ2000-DPPE; QG197 представляет собой ПЭГ750-DSPE; QG198 представляет собой ПЭГ200-DSPE.
[000318] Для дальнейшей оценки стабильности наноалюмочастиц оценивали влияние циклов замораживания-оттаивания на коллоидную стабильность алюминиевых квасцов и составов наноалюмочастиц. Размер частиц составов до замораживания определяли с помощью Horiba LA-960 для составов алюминиевых квасцов и с помощью Malvern Zetasizer для составов наноалюмочастиц. Препараты замораживали в бане со смесью сухой лед/ацетон и затем оттаивали на водяной бане при 37°С. Размеры частиц измеряли и сравнивали до и после цикла замораживания-оттаивания. Средний размер частиц Alhydrogel® 85 (алюминиевые квасцы) увеличился на 160% после одного цикла замораживания-оттаивания, это указывало на отсутствие коллоидной стабильности. Средний размер частиц состава (наноалюмочастицы-полиакриловая кислота) не проявил значительного изменения размера частиц после трех циклов замораживания-оттаивания. Средний размер наноалюмочастиц с ПЭГ увеличился на 273% после 1 цикла замораживания-оттаивания, это указывало на отсутствие коллоидной стабильности. Адъювант Alhydrogel® 85 проявлял коллоидную нестабильность после одного цикла замораживания-оттаивания, это свидетельствовало о низкой устойчивости к дестабилизирующим эффектам замораживания. С другой стороны, наноалюмочастицы, стабилизированные полиакриловой кислотой, проявляли отличную стабильность после повторных циклов замораживания-оттаивания, что может усилить долговременную криоконсервацию составов наноалюмочастиц с ПАК.
[000319] Алюминий является привлекательным адъювантом, который, как описано, связывает или адсорбирует белковые антигены за счет электростатических взаимодействий (с участием иона Al3+ или отрицательно заряженного противоиона) [11], координации ионов металлов и водородной связи с молекулами воды и гидроксильными группами [9], [10] и [12]; и в некоторых случаях гидрофобных взаимодействий [13] В данной области техники продолжаются споры относительно того, в какой степени, если вообще имеет место, адсорбция белка необходима для адъювантного свойства алюминиевых квасцов. Исследовали способность наноалюмочастиц согласно настоящему изобретению с гораздо меньшей площадью поверхности и размером частиц, по сравнению с алюминиевыми квасцами, эффективно адсорбировать антигены. В общих чертах, перед центрифугированием образцы смешивали в следующем порядке: состав алюминиевых квасцов, лиганд TLR (GLA или CpG 5 мкг), антиген (гибридный белок ТБ ID93 (0,5 мкг)) и разбавитель (солевой раствор или раствор глицерина). Образцы центрифугировали 30 минут при 350000×g и при 4°С, и 30 мкл образца из неосажденного супернатанта смешивали с 10 мкл 4× восстановленного буфера для образцов с ДСЛ. По 20 мкл загружали в ДСН-ПААГ с 12 дорожками с 8 мкл заранее окрашенного стандарта SeeBlue2. Каждый гель анализировали в течение 55 минут при 190 В и затем помещали в фиксирующий раствор EtOH:CH3COOH:H2O в соотношении 50:40:10 по меньшей мере на 2 ч или в течение ночи. Затем гель окрашивали с использованием набора для окрашивания серебром ProteoSilver Plus, чтобы определить, присутствует ли ID93 в супернатанте или осажден за счет адсорбции в алюминиевые квасцы. Данные указывали на то (данные не представлены), что агенты, регулирующие размер, присутствующие в составах наноалюмочастиц, не препятствовали связыванию или ассоциации антигена или адъювантов и пригодны в качестве носителей для доставки биологически активных агентов согласно настоящему изобретению. Для того чтобы подтвердить, что агент, регулирующий размер, ПЭГ-5000 DSPE не будет препятствовать адсорбции белка в алюминиевые квасцы или в целом не будет препятствовать количественному исследованию, гибридный белок ID93 смешивали с адъювантом TLR4, GLA, и алюминиевыми квасцами. Отсутствие полосы 62Kd ID93 на геле подтверждало, что DSPE-ПЭГ5000 не блокировал адсорбцию антигена частицами алюминиевых квасцов микронного (0,5-1,0 микрон) размера. Составы наноалюмочастиц согласно настоящему изобретению с размерами частиц менее 100 нм, содержащие агент, регулирующий размер, ПЭГ-DSPE с различной длиной ПЭГ 5000, 2000 или 750 или ПЭГ с фиксированной длиной 2000, соединенный с фосфолипидами с различной длиной ацильной цепи, состоящей из 18 атомов углерода (DSPE), 16 атомов углерода (DPPE) или 14 атомов углерода (DMPE), в равной степени были способы адсорбировать гибридный белок ID93, что подтверждалось отсутствием полосы 62Kd ID93 на геле (данные не представлены). Соответственно, уменьшение средней площади поверхности или размера частиц составов наноалюмочастиц не приводило к уменьшению адсорбции белковых антигенов, что делает их особенно полезными составами для вакцин.
[000320] Затем охарактеризовали концентрацию гидроксида алюминия, присутствующего в наночастицах алюминия согласно настоящему изобретению. В общих чертах, составы наноалюмочастиц, содержащие агенты, регулирующие размер, с ПЭГ различной длины (5000, 2000, 750) или фосфолипиды с различной длиной ацильной цепи (18 C-DSPE, 16C-DPPE или 14С DMPE), обрабатывали, как описано в настоящем документе, и содержание алюминия оценивали методом ICP-OES (ФИГ. 2). Данные на ФИГ. 2 указывали на то, что составы наноалюмочастиц, содержащие агенты, регулирующие размер, различного размера, имели предсказанное содержание алюминия при приготовлении с ПЭГ-содержащими агентами, регулирующими размер, с различной длиной ПЭГ, соединенного с фосфолипидами с различной длиной ацильной цепи. Составы наноалюмочастиц, состоящие из агентов, регулирующих размер, с фосфолипидами 18С (DSPE) и ПЭГ различной длины 5000 (образец 1), 2000 (образцы 2-4) и 750 (образец 5), полученные из исходного 4 мг/мл состава алюминиевых квасцов и указанных агентов, регулирующих размер, измельченных с помощью микрофлюидизации при давлении 30000 фунтов на кв. дюйм 10 раз при 4°С, содержали приблизительно эквивалентные количества предсказанного исходного количества 4 мг/мл, согласно результатам измерения методом ICP-OES, которые находились в диапазоне от 3,9 мг/мл для ПЭГ750-DSPE (образец 5) до 4,5 мг/мл для ПЭГ2000-DPPE (образец 3). Следует отметить, что как алюминиевые квасцы, измельченные в отсутствие агента, регулирующего размер, так и необработанные алюминиевые квасцы, имели пониженное содержание алюминия (3,2 мг/мл для образца 6 и 3,4 мг/мл для образца 7 соответственно).
[000321] Данные указывали на то, что обработка или измельчение гидроксида алюминия (Alhydrogel®) в присутствии подходящего агента, регулирующего размер, может привести к получению стабильного состава наноалюмочастиц, подходящего для доставки агентов согласно настоящему изобретению. Агенты, регулирующие размер, согласно настоящему изобретению включают, но не ограничиваются ими, пегилированные фосфолипиды и ПАК.
Пример 2. Применение составов наноалюмочастиц с ПЭГ5000 и составов наноалюмочастиц с ПАК для доставки белков или пептидов (например, ID97) для стимуляции иммунного ответа
[000322] Чтобы оценить потенциальную применимость модификаций гидроксида алюминия (Alhydrogel®), которые приводят к уменьшению размера частиц алюминиевых квасцов в масштабе 100 нм, для стимуляции иммунного ответа, смещенного в сторону Th1, создавали два адъювантных состава наноалюмочастиц, один на основе полиакриловой кислоты (ПАК) и один на основе ПЭГ5000. Чтобы исследовать возможность применения этих кандидатов в качестве адъювантов, 8-недельных самцов мышей линии С57В1/6 (по 5 на группу), приобретенных в The Jackson Laboratory, иммунизировали рекомбинантным антигеном, ID97, который является рекомбинантным гибридным белком из четырех белков Mycobacterium tuberculosis: Rv1886, Rv3478, Rv3619 и Rv2875. ID97 доставляли по отдельности или с использованием в качестве адъюванта алюминиевых квасцов (100 мкг), ПАК, наноалюмочастиц с ПАК в соотношении 1:1 (100 мкг алюминиевых квасцов, размер частиц 70 нм), наноалюмочастиц с ПЭГ (100 мкг алюминиевых квасцов, размер частиц 70 нм) или адъюванта GLA-SE, агониста TLA4, в качестве положительного контроля индукции Th1 ответов. Мышей иммунизировали один раз внутримышечно. Через семь дней после иммунизации ответы ID97-специфических CD4+ Т-клеток оценивали путем стимуляции спленоцитов с помощью ID97 в присутствии ингибитора аппарата Гольджи, брефелдина А, или оставляли клетки без стимуляции. Затем клетки окрашивали для оценки поверхностной экспрессии CD4, CD8 и CD44, а также внутриклеточной экспрессии CD154, ИФН-γ, ФНО, ИЛ-2, ГМ-КСФ, ИЛ-5 и ИЛ-17A. Антигенспецифичные ответы рассчитывали как частоту CD4+ Т-клеток, которые опосредовали ответ в ID97-стимулированных образцах, за вычетом сигнала в нестимулированных образцах. На Фигуре 3А представлены результаты для Th1 ответов в каждой группе. Как и ожидалось, группы, стимулированные без адъювантов, стимулированные алюминиевыми квасцами в качестве адъювантов и стимулированные ПАК в качестве адъюванта, имели низкую частоту ID97-специфических CD4+ Т-клеток на основании повторной экспрессии CD154 (маркер антигенной специфичности, но неспецифический для детерминации Th1, Th2 или Th17). Неожиданным фактом явилось то, что состав наноалюмочастиц на основе ПАК, индуцировал устойчивый ответ CD4+ Т-клеток, который характеризовался выработкой цитокинов ИФН-γ, ФНО и ИЛ-2, типичных для Th1. Уровень ответа был аналогичен уровню, достигнутому с помощью адъюванта для положительного контроля GLA-SE. Качество гуморального ответа также оценивали через 7 дней после иммунизации. Только состав наноалюмочастиц на основе ПАК и положительный контроль GLA-SE усиливали титры ID97-специфических IgG2c и IgG (Фигура 3B-D). Переключение класса на IgG2c зависит от индукции ИФН-γ-вырабатывающих Th1-клеток, соответственно, такое смещение подтверждает данные о том, что состав наноалюмочастиц на основе ПАК усиливал Th1 ответы. Неожиданным фактом явилось то, что состав наноалюмочастиц на основе ПАК также повышал титры антител IgG1, в отличие от GLA-SE, это указывало на то, что он может иметь уникальный способ действия. Состав наноалюмочастиц на основе ПАК обладает уникальными и неожиданными адъювантными свойствами для программирования Th1 ответов. Помимо этого такие ответы являются свойством не только компонента ПАК, так как он не обладал адъювантной активностью в отношении Th1 ответов сам по себе.
[000323] Чтобы выяснить механизм, за счет которого состав наноалюмочастиц на основе ПАК усиливал Th1-иммунитет к вакцинным антигенам, оценивали концентрацию ключевых Th1-усиливающих цитокинов в дренирующих лимфатических узлах иммунизированных мышей через 1 день после внутримышечной иммунизации (Фигура 4А-С). ИЛ-12р70 и ИЛ-18 имеют решающее значение для индукции ИФН-γ, и IP-10 является ранним ИФН-γ-индуцибельным цитокином. По сравнению с иммунизацией солевым раствором или алюминиевыми квасцами состав наноалюмочастиц на основе ПАК усиливал экспрессию обоих ИЛ-18 и ИЛ-12р70 на 1 день после иммунизации. Это, вероятно, усилило раннюю экспрессию ИФН-γ, поскольку экспрессия IP-10 также была повышена у животных, получавших состав наноалюмочастиц на основе ПАК. Состав наноалюмочастиц на основе ПЭГ также увеличивал экспрессию ИЛ-18, но не ИЛ-12р70 или IP-10, что также указывало на уникальные свойства состава наноалюмочастиц на основе ПАК. Чтобы определить значимость ранней индукции ИЛ-18 для Th1-программирования, определяли профиль Th1CD4+ Т-клеток у мышей линии С57В1/6 дикого типа и мышей ИЛ-18R-/-, которые нечувствительны к ИЛ-18. По сравнению с мышами дикого типа состав наноалюмочастиц на основе ПАК не индуцировал Th1 ответ на антиген ID97 (Фигура 5).
[000324] В совокупности эти данные подтверждали вывод о том, что адъювантные составы наноалюмочастиц на основе ПАК и потенциально другие адъювантные составы на основе наноалюмочастиц обладают уникальными адъювантными свойствами по сравнению с алюминиевыми квасцами. Такие свойства конкретно включают индукцию врожденных цитокинов, которые программируют Th1 иммунитет, включая ИЛ-18 и ИЛ-12р70, а также ИФН-γ-восприимчивых цитокинов, таких как IP-10. Помимо этого по сравнению с алюминиевыми квасцами состав наноалюмочастиц на основе ПАК и потенциально другие составы наноалюмочастиц усиливали индукцию CD4+ Т-клеток с профилем Th1-типа (секреция ИФН-γ, ФНО и ИЛ-2 при стимуляции антигенами) и усиливали переключение класса на IgG2c и выработку титров антигенспецифических антител. Эти процессы зависят от активации сигнальной оси ИЛ-18:ИЛ-18R. Усиление Th1 ответов на вакцинные антигены главным образом было основано на включении известных агонистов Toll-подобного рецептора (TLR), таких как MPL, GLA, SLA, CpG, полиIС:LC или Pam2CSK4. На основании имеющихся данных это первый адъювант, не содержащий агонист TLR, который может надежно стимулировать Th1 иммунитет. Он имеет много возможных вариантов применения в качестве вакцинного адъюванта, включая вакцины против таких заболеваний, как коклюш, туберкулез, проказа, малярия, ВИЧ, лейшманиоз и грипп.
[000325] Составы наноалюмочастиц на основе ПАК с антигеном из вакцины против туберкулеза, ID93, также проявили повышенную адъювантную активность в отношении Th1 ответов по сравнению с необработанными алюминиевыми квасцами (данные не представлены).
Пример 3. Применение составов наноалюмочастиц на основе ПАК для доставки нуклеиновых кислот.
[000326] На основании улучшенной стабильности наноалюмочастиц согласно настоящему изобретению, недорогого и пригодного для окончательной стерилизации способа крупномасштабного изготовления, оценивали способность составов наноалюмочастиц эффективно осуществлять доставку РНК. Сравнивали эффективность составов наноалюмочастиц и катионной эмульсии, описанной в данной области техники. В общих чертах, катионную эмульсию получали, как описано в данной области техники (5), полученная эмульсия содержала 0,5% масс./об. Span 85, 5,0% об./об. сквалена, 0,4% масс./об. DOTAP и 0,5% масс./об. твин-80. РНК-репликон получали из модифицированного альфавирусного генома, в котором структурные белки, включая капсид и Е-гликопротеин (С-Е3-Е2-6K-Е1), удалены и заменены геном люциферазы. В общих чертах, вектор экспрессии РНК представлял собой вектор для РНК-репликона, экспрессирующий люциферазу под контролем субгеномного промотора, сконструированный из модифицированного альфавирусного генома с удаленными структурными белками, включая капсид и Е-гликопротеин (С-Е3-Е2-6K-Е1), но содержащий все неструктурные гены (ns1-ns5), необходимые для репликации и экспрессии РНК в клетке. Для исследования люциферазы в условиях in vivo, доставленной РНК-репликоном и составом наноалюмочастиц на основе ПАК, мышей линии C57/BL6 анестезировали, выбривали и иммунизировали внутримышечно (в/м) в бедро с использованием 250 мкл указанного состава плюс и минус РНК в указанных дозах. Дозу (концентрацию) РНК подтверждали перед инъекцией путем измерения с помощью спектрофотометра Nanodrop. Иммунизированных мышей подвергали анестезии, выбривали, и экспрессию РНК оценивали с использованием визуализирующей системы IVIS Illumina II в течение шестидесяти секунд через 24 часа, 4 дня и 7 дней после инъекции. Животных исследовали с помощью визуализирующих способов, и получали относительные единицы люминесценции, представленные на логарифмической шкале. В приведенных в настоящем документе примерах применяли составы наноалюмочастиц на основе ПАК, однако это не следует рассматривать как ограничение объема в отношении наноалюмочастиц, описанных в настоящем документе.
[000327] Мыши, иммунизированные векторами экспрессии РНК-репликона, приготовленными с наночастицами алюминия, экспрессировали РНК в условиях in vivo. Для оценки способности наноалюмочастиц доставлять РНК, мышам вводили путем инъекции (по 3 мыши на группу), как описано в настоящем документе, 250 мкл состава наноалюмочастиц на основе ПАК или контрольного состава катионной эмульсии, описанной в настоящем документе, и РНК-репликон в дозе 1 мкг или 0,1 мкг в соотношении 1:3. Контроли включали солевой раствор, катионную эмульсию, состав наноалюмочастиц на основе ПАК или «оголенный» РНК-репликон в дозе 30 мкг, 1 мкг или 0,1 мкг. Экспрессия РНК-репликона в чистом виде не поддавалась детектированию в течение 24 часов, за исключением одного животного, которое получило самую высокую дозу 30 мкг люциферазы-РНК-репликона (данные не представлены). Однако к 4 и 7 дням все животные, иммунизированные 30 мкг рекомбинантного вектора в чистом виде, несущего репликон и люциферазу, имели детектируемую экспрессию по сравнению с контрольными носителями (солевой раствор) (данные не представлены). Ни одно из животных, которые получили 1 мкг или 0,1 мкг «оголенного» РНК-репликона, не имело детектируемой экспрессии. При использовании в 30 раз более низкой дозы РНК (1 мкг РНК-репликона), смешанной с контрольным составом катионной эмульсии, все трое животных через 24 часа, 4 дней или 7 дней после доставки имели детектируемую экспрессию люциферазы (данные не представлены), это указывало на то, что катионная эмульсия улучшала доставку РНК-репликона, что привело к уменьшению дозы, о котором свидетельствовала эквивалентная или более высокая экспрессия РНК-репликона по сравнению с материалом в чистом виде. Аналогичная в 30 раз более низкая доза РНК (1 мкг РНК-репликона), смешанная с составом наноалюмочастиц на основе ПАК, также вызывала экспрессию люциферазы у одного из трех животных через 24 часа, и у всех иммунизированных животных через 4 и 7 дней, соответственно (данные не представлены). При использовании в 300 раз более низкой дозы РНК (100 нг РНК-репликона), смешанной с контрольным катионным составом, 3 из 3 животных через 24 часа и 2 из 3 животных на 4 или 7 день экспрессировали детектируемые уровни люциферазы (данные не представлены). При использовании в 300 раз более низкой дозы РНК (100 нг РНК-репликона), смешанной с составом наноалюмочастиц на основе ПАК, 1 из 3 животных через 24 часа и 2 из 3 животных на 4 день или 7 день экспрессировали детектируемые уровни люциферазы (данные не представлены).
[000328] Данные визуализации, описанные выше, количественно оценивали с использованием круговых областей, представляющих интерес (ОИ), программного обеспечения Living Image и представляли графически на ФИГ. 6А-С. Данные относительной люминесценции выражали на логарифмической шкале, группировали в соответствии с составом (в чистом виде, контрольная катионная эмульсия и состав наноалюмочастиц на основе ПАК на левой, средней и крайней панели, соответственно) и доставленной дозой репликонного вектора 0 мкг (мкг), 1 мкг (мкг) и 0,1 мкг (мкг), соответственно) через 24 ч (ФИГ. 6А), 4 дня (ФИГ. 6В) и 7 дней (ФИГ. 6С). Полученные данные указывали на то, что через 24 ч после инъекции уровни экспрессии РНК-репликона, смешанного с катионной эмульсией в дозах в 30 раз и 300 раз (1 или 0,1 мкг) ниже, чем доза РНК в чистом виде (30 мкг), были эквивалентны уровням для РНК в чистом виде. Через 24 часа уровни экспрессии РНК-репликона, приготовленного с составом наноалюмочастиц на основе ПАК в дозах в 30 раз и 300 раз (1 или 0,1 мкг) ниже, чем доза РНК в чистом виде (30 мкг), были ниже (ФИГ. 6А) по сравнению с уровнями экспрессии для катионной эмульсии, но к 4 и 7 дням после инъекции уровни экспрессии РНК, смешанной с контрольной катионной эмульсией или составом наноалюмочастиц на основе ПАК, были приблизительно эквивалентны (ФИГ. 6В и С) уровням для доз 1 мкг (мкг)) и 0,1 мкг (мкг). Полученные данные указывали на то, что составы наноалюмочастиц на основе ПАК способны доставлять и экспрессировать векторы, несущие РНК-репликон, и обладают способностью уменьшать дозу по сравнению с РНК в чистом виде.
[000329] Затем исследовали влияние агента, регулирующего размер, ПАК в составе наноалюмочастиц на доставку или экспрессию векторов, несущих РНК-репликон (Фигура 7). Чтобы определить, была ли экспрессия люциферазы из вектора, несущего РНК-репликон, обусловлена только ПАК, мышей иммунизировали РНК-репликоном в чистом виде (7А), только ПАК с добавлением РНК-репликона (7В), контрольной катионной эмульсией с добавлением РНК-репликона (7С) или составом наноалюмочастиц с ПАК с добавлением РНК-репликона (7D) в дозе 30 мкг для репликона в чистом виде или 1 мкг и 100 нг для РНК-репликонов в виде компонента составов. Экспрессию люциферазы оценивали с использованием визуализирующей системы IVIS Illumina II, и данные визуализирующего исследования количественно оценивали с помощью круговой ОИ, как было описано, через 24 часа после инъекции. Данные указывали на то, что ПАК (7В) по отдельности не обеспечивает доставку и/или индукцию экспрессируемого уровня РНК-репликона в дозах 0,1 или 1,0 мкг, тогда как те же дозы РНК-репликона, приготовленного или смешанного с контрольной катионной эмульсией или составом наноалюмочастиц с ПАК, приводили к детектируемой экспрессии люциферазы на уровне, который был примерно эквивалентен уровню, обеспеченному в 30-300 раз более высокой дозой РНК-репликона в чистом виде. Полученные данные указывали на то, что агент, регулирующий размер, ПАК по отдельности не способен доставлять и/или индуцировать экспрессируемые уровни белка из РНК-репликона.
[000330] Предыдущие эксперименты продемонстрировали, что составы наноалюмочастиц согласно настоящему изобретению способны доставлять РНК-репликон, который может быть экспрессирован, и были способны уменьшать дозу, по сравнению с РНК-репликоном в чистом виде. Затем определяли способность состава наноалюмочастиц эффективно доставлять информационную РНК (Фигура 8). Для проведения данного исследования у Trilink Biotechnologies приобрели кэпированную (Сар 0) и полиаденилированную FLuc иРНК, оптимизированную для систем млекопитающих и модифицированную с использованием псевдоуридина и 5-метилцитидина, который имитирует полностью процессированную зрелую иРНК (Luc mRNA). иРНК экспрессирует белок люциферазы, первоначально выделенный из светлячка Photinus pyralis. В общих чертах, мышей (по 3 на группу) иммунизировали, как описано, с применением РНК в чистом виде, иРНК, приготовленной с составами наноалюмочастиц с ПАК, или иРНК, приготовленной с контрольной катионной эмульсией, при этом дозы РНК составили 10 мкг, 1 мкг или 0,1 мкг. Экспрессию РНК оценивали с использованием визуализирующей системы IVIS Illumina II в течение 6 часов, 24 часов (ФИГ. 8А) и 5 дней (ФИГ. 8В), и данные визуализации количественно оценивали с помощью круговой ОИ. Данные, представленные на ФИГ. 8А, полученные через 24 часа после инъекции, указывали на то, что у животных, которые получили иРНК в чистом виде (левая группа), люцифераза экспрессировалась как при уровне дозы РНК 10 мкг, так и при уровне дозы иРНК 1 мкг, но не 0,1 мкг. Тем не менее, как контрольный катионный состав, так и состав наноалюмочастиц с ПАК (ФИГ. 8А, средняя и крайняя правая группы) не только экспрессировали эквивалентные уровни иРНК при всех дозах (10 мкг, 1 мкг и 0,1 мкг), при сопоставлении друг с другом, но также проявляли повышенный уровень экспрессии (>30 раз) при дозе РНК 1 мкг, по сравнению с иРНК в чистом виде, и имели детектируемые уровни экспрессии при дозе РНК 0,1 мкг, что указывало на способность состава наноалюмочастиц уменьшать дозу. Через 5 дней после инъекции (ФИГ. 8В) иРНК в чистом виде проявляла детектируемую экспрессию LUC при дозе РНК 10 мкг, хотя и на более низких уровнях, однако экспрессия люциферазы из иРНК не поддавалась детектированию при более низких дозах 1 мкг и 0,1 мкг. Следует отметить, что через 5 дней после инъекции мыши, получившие иРНК, приготовленную с контрольным катионным составом, не имели детектируемой экспрессии иРНК при любой из доставленных доз 10 мкг, 1 мкг, 0,1 мкг (левая и средняя группы). Однако мыши, получившие иРНК, приготовленную с составом наноалюмочастиц с ПАК (крайние правые группы), не только экспрессировали >10-кратно более высокие уровни иРНК при дозе 10 мкг, но также имели детектируемую экспрессию при дозе 1 мкг, что указывало на способность состава наноалюмочастиц уменьшать дозу даже через 5 дней после доставки иРНК. Затем сравнивали кинетику экспрессии у животных, получавших иРНК в чистом виде, иРНК, приготовленную с катионной эмульсией, или иРНК, приготовленную с составом наноалюмочастиц с ПАК, при дозе иРНК 10 мкг (ФИГ. 8С) через 6 часов, 24 часа и 5 дней после доставки в условиях in vivo. Данные указывали на то, что животные, которых иммунизировали иРНК, приготовленной с составом наноалюмочастиц, имели повышенные и относительно устойчивые уровни экспрессии иРНК в течение пяти дней  по сравнению с иРНК в чистом виде (•) или иРНК, приготовленной с контрольной катионной эмульсией (Δ), экспрессия которой быстро снижалась.
по сравнению с иРНК в чистом виде (•) или иРНК, приготовленной с контрольной катионной эмульсией (Δ), экспрессия которой быстро снижалась.
[000331] Снижение экспрессии иРНК на 5 день при доставке с помощью контрольных катионных липосом было описано в литературе и не было неожиданным, однако устойчивая экспрессия иРНК в чистом виде или иРНК, приготовленной с наночастицами алюминия, была неожиданным и интересным фактом, через 5 дней все еще наблюдали эффект 10-кратного уменьшения дозы. Относительный уровень экспрессии для дозы 10 мкг был приблизительно эквивалентен уровню для дозы РНК 1 мкг для иРНК, приготовленной с наночастицами алюминия. Не желая быть связанными соответствием какой-либо теории, авторы настоящего изобретения предположили, что составы наноалюмочастиц согласно настоящему изобретению могут стабилизировать конструкцию иРНК.
[000332] Исходя из неожиданной стабильности экспрессии в условиях in vivo иРНК, приготовленной с составами наноалюмочастиц согласно настоящему изобретению, дополнительно исследовали способность наноалюмочастиц согласно настоящему изобретению стабилизировать РНК в условиях in vitro. Для того чтобы проверить это, смешивали 1 мкг РНК-репликона с контрольным катионным составом или составом с ПАК и хранили эту смесь как единый препарат в одном флаконе при 4°С в течение 1 часа, 4 часов или 24 часов. РНК-репликон в чистом виде, который хранили при 4°С в течение 1 часа, 4 часов или 24 часов, использовали в качестве контроля. Такие смешанные составы, которые хранили как единый препарат в одном флаконе, затем использовали для иммунизации мышей (по 3 на группу), экспрессию РНК оценивали с использованием визуализирующей системы IVIS Illumina II, и полученные данные количественно оценивали с использованием круговой ОИ на 1 день (ФИГ. 9А) и 5 день (ФИГ. 9В) после доставки в условиях in vivo. Данные указывали на то, что РНК-репликоны в чистом виде не имели детектируемой экспрессии при хранении при 4°С в течение 4 ч или 24 ч после смешивания, вне зависимости от количественного исследования через 24 часа или 5 дней после доставки в условиях in vivo. Однако детектируемую экспрессию наблюдали при введении РНК-репликона непосредственно (время 0) или через 1 час после хранения при 4°С при оценке через 24 часа или 5 дней после доставки в условиях in vivo, будь то в чистом виде, приготовленный с катионными липосомами или приготовленный с составом наноалюмочастиц с ПАК. РНК в чистом виде не имела детектируемой экспрессии при хранении при 4°С в течение 4 часов или 24 часов вследствие относительной нестабильности РНК, как сообщалось в литературе. Результаты сравнения данных для РНК-репликона в чистом виде с данными для РНК-репликона, приготовленного с контрольным катионным составом, или РНК-репликона, приготовленного с составом наноалюмочастиц, когда РНК-репликон смешивали и хранили в виде единого препарата в одном флаконе при 4°С в течение 1, 4 или 24 часов до введения в условиях in vivo, указывали на приблизительно эквивалентные уровни экспрессии, измеренные в 1 день (ФИГ. 9А) или 5 день (ФИГ. 9В). Данные дополнительно анализировали путем анализа диаграмм разброса (ФИГ. 9С-Е), непосредственно сравнивая данные для контрольного катионного состава, состава наноалюмочастиц с ПАК и РНК-репликона в чистом виде, соответственно. Уровни экспрессии РНК, которую вводили сразу же после смешивания РНК-репликона (Т=0, 9С), или через 4 часа после смешивания и хранения при 4°С (Т=1 ч, 9D), или смешивания и хранения в течение 24 часов (Т=24 ч, 9Е) при 4°С, были сопоставимы на 5 день после введения, это указывало на то, что РНК, приготовленная с наночастицами алюминия, является стабильной при смешивании в виде состава, который хранили как единый препарат в одном флаконе при 4°С до 24 часов.
[000333] В примерах, приведенных в настоящем документе, с помощью кодируемых РНК репортерных генов было продемонстрировано, что наноалюмочастицы согласно настоящему изобретению: (1) способны доставлять экспрессируемую в условиях in vivo форму полинуклеотидного агента и, в частности, РНК-агента, вне зависимости от того, представляет собой доставляемая форма РНК информационную РНК или конструкцию вектора экспрессии РНК; (2) составы наноалюмочастиц обеспечивают доставку с уменьшением дозы РНК-векторов, это означает, что эквивалентная экспрессия РНК достигается для составов наноалюмочастиц при дозах РНК по меньшей мере в 30-300 раз ниже, чем дозы РНК в чистом виде; и (3) составы наноалюмочастиц согласно настоящему изобретению усиливают стабильность РНК-агента как в условиях in vivo, так и в условиях in vitro. После разработки и описания свойств доставки РНК с помощью составов наноалюмочастиц, оценивали способность составов наноалюмочастиц доставлять РНК, которая приводит к стимуляции иммунного ответа у хозяина.
[000334] Для того чтобы оценить способность РНК-антигена, доставленного с помощью состава наноалюмочастиц согласно предусмотренным вариантам реализации, исследовали иммунный ответ у мышей, иммунизированных РНК-репликоном, экспрессирующим гибридный полипептид ЕМСН, приготовленным с наночастицами алюминия согласно настоящему изобретению.
[000335] Конструкция гибридного полипептида ЕМСН. Гибридный полипептид, обозначенный ЕМСН, получали с помощью тандемного соединения открытой рамки считывания полинуклеотидов, кодирующих метиониновый старт-кодон (ATG), добавленный к 5'-концу фрагмента карбокси-конца предполагаемого митохондриального полипептида HSP70 (8Е или 8), карбокси-концевого фрагмента открытой рамки считывания полинуклеотидов, кодирующих полипептид малатдегидрогеназы, карбокси-концевого фрагмента полипептида цистеиновой протеазы В (СрВ, СРВ или С), и открытой рамки считывания полинуклеотидов, кодирующих фрагмент амино-конца полипептида гистона H2BN (H2BN, h2Bn или Н). ЕМСН содержит полинуклеотидную последовательность из 2631 п.о., которая кодирует аминокислоты с 509 по 660 карбокси-конца предполагаемого митохондриального полипептида HSP70 (8Е или 8) из полинуклеотида L. infantum, полинуклеотиды с 460 по 1425, которые кодируют аминокислоты с 1 по 322 карбокси-конца гена малатдегидрогеназы из полинуклеотида L. infantum, полинуклеотиды с 1426 по 2295, которые кодируют аминокислоты 154-443 карбокси-конца фрагмента полипептида цистеиновой протеазы В (В), и полинуклеотиды с 2297 по 2631, которые кодируют аминокислоты с 1 по 111 амино-конца полипептида гистона H2BN (Н) из L infantum. Гибридный полипептид, состоящий из 877 аминокислот, экспрессировали в E. coli и очищали с помощью колоночной хроматографии. Компоненты нуклеиновых кислот и способы их получения и применения более подробно описаны в WO 2014/160985, который полностью включен в настоящий документ посредством ссылки для всех целей.
[000336] В общих чертах, мышей иммунизировали 10 мкг или 0,1 мкг альфавирусного вектора, несущего РНК-репликон, кодирующего гибридный полинуклеотид РНК из Leishmania, ЕМСН, в виде «оголенной» контрольной РНК или в виде РНК-репликона, смешанного с контрольными катионными липосомами, или РНК-репликона, смешанного с составом наноалюмочастиц с ПАК, в момент времени 0, и все группы повторно иммунизировали через три недели. Спленоциты собирали и исследовали для определения повторных антигенспецифичных ответов Т-клеток, согласно результатам определения с помощью окрашивания внутриклеточных цитокинов после стимуляции полипептидом ЕМСН в условиях in vivo через четыре недели после последней иммунизации. Выработку цитокинов из спленоцитов иммунизированных мышей исследовали для определения ЕМСН-специфичных CD44highCD4+ Т-клеток памяти, согласно результатам измерения методом проточной цитометрии. Стимулированные антигеном спленоциты идентифицировали с помощью окрашивания внутриклеточных цитокинов на основании экспрессии CD3 и CD4 и далее пропускали для выявления популяции CD44high клеток. CD44highCD4+ Т-клетки дополнительно окрашивали для оценки внутриклеточных CD154, ИФН-γ, ИЛ-2, ФНО-α; ГМ-КСФ, ИЛ-17 и ИЛ-5. ЕМСН-специфические CD44highCD4+ Т-клетки проявляли полифункциональные Т-клеточные ответы, положительные в отношении ИФН-γ, ФНО-α и ИЛ-2, типичные для ответов, специфичных в отношении антигена Leishmania. Данные (10A-D) указывали на то, что иммунизация с применением в 100 раз более низких доз РНК ЕМСН, 0,1 мкг, приготовленной с контрольными катионными липосомами или с составом наноалюмочастиц с ПАК, приводила к выработке приблизительно равных процентных долей CD4+CD44highCD154 Т-клеток с положительным окрашиванием отдельных цитокинов, ИФН-γ, ИЛ-2 или ФНО-α, как и 10 мкг РНК в чистом виде. При введении 0,1 мкг дозы РНК-репликона в чистом виде окрашивание было незначительным или не поддавалось детектированию. Соответственно, составы наноалюмочастиц согласно настоящему изобретению способны доставлять РНК, кодирующую антиген патогена, в виде вакцинного состава, который стимулирует иммунный ответ у вакцинированного хозяина.
[000337] Также описывали качество иммунного ответа на полипептид Leishmania, экспрессируемый РНК-вектором, при доставке вектора, приготовленного с составом наноалюмочастиц согласно настоящему изобретению. Отличительной чертой защитного иммунного ответа против лейшманиоза является присутствие полифункциональных антигенспецифических Т-клеток, которые секретируют несколько цитокинов. CD4+CD44high Т-клетки исследовали для определения ответов полифункциональных Т-клеток. Данные (ФИГ. 10Е) указывали на то, что мыши, иммунизированные 100 нг РНК-репликона-ЕМСН, приготовленного с составом наноалюмочастиц с ПАК (заштрихованный столбик) или приготовленного с контрольной катионной эмульсией (столбик с диагональной штриховкой), имели эквивалентное количество тройных положительных ИФН-γ, ИЛ-2 и ФНО-α CD4+ CD44high Т-клеток по сравнению с животными, иммунизированными 10 мкг РНК в чистом виде (столбик со сплошным черным закрашиванием). Также присутствовали двойные положительные клетки, экспрессирующие ИФН-γ и ИЛ-2 или ИЛ-2 и ФНО-α. Данные указывали на то, что составы наноалюмочастиц с ПАК способны доставлять РНК, уровни экспрессии которой достаточны для того чтобы вызвать соответствующие антигенспецифические иммунные ответы, характерные для вакцин.
Пример 4. Применение составов наноалюмочастиц с ПЭГ (ПЭГ различной длины) для доставки белков или пептидов (ID93) для стимуляции иммунного ответа
[000338] Выполняли эксперименты для исследования способности составов наноалюмочастиц согласно настоящему изобретению доставлять белок или полипептидный агент по отдельности или в комбинации с другими агентами (в частности, агонистами TLR) для стимуляции иммунного ответа у хозяина.
[000339] Модели на животных. В общих чертах, экспериментальных животных и самок мышей линии CB57BL/6 в возрасте 6-8 недель приобретали в The Jackson Laboratory или Charles River и содержали в условиях, обеспечивающих отсутствие специфической патогенной микрофлоры.
[000340] ID93 представляет собой гибридный белок, который включает четыре пептида М. tuberculosis, Rv1813, Rv2620 и Rv2608 и Rv3619, полученный, как описано ранее [14]
[000341] Спленоциты выделяли у четырех-пяти животных на одну схему лечения. Эритроциты лизировали с использованием буфера для лизиса эритроцитов (eBioscience) и ресуспендировали в RPMI 1640, дополненной 10% ФБС. Общее количество жизнеспособных клеток подсчитывали с использованием количественного исследования ViaCount с помощью системы РСА (Guava Technologies), высевали при плотности 2×106 клеток/лунку в 96-луночные планшеты и стимулировали в течение 2 часов с использованием сред или ID93 (10 мкг/мл) при 37°С. Добавляли GolgiPlug (BD Biosciences), и клетки инкубировали еще в течение 8 часов при 37°С. Клетки промывали и окрашивали с помощью меченых флуорохромом антител к CD4 (клон GK1.5), CD44 (клон IM7) и CD8 (клон 53-6.7) (BioLegend и eBioscience) в присутствии антитела к CD16/32 мыши в течение 20 минут при 4°С. Клетки промывали и пермеабилизировали с использованием Cytofix/Cytoperm (BD Biosciences) в течение 20 минут при комнатной температуре. Клетки дважды промывали смесью Perm/Wash (BD Biosciences) и окрашивали внутриклеточно с использованием меченых флуорохромом антител к CD154 (клон MR1), ИФН-γ (клон XMG-1.2), ФНО (МР6-ХТ22), ГМ-КСФ (МР1-22Е9), ИЛ-17А (клон ТС11-18Н10) и ИЛ-5 (TRFK5) (BioLegend и eBioscience) в течение 20 минут при комнатной температуре. Клетки промывали и ресуспендировали в ФСБ. Собирали до 106 событий на четырехканальном проточном цитометре LSRFortessa (BD Biosciences). Клетки пропускали как синглеты>лимфоциты>CD4+CD8->CD44hign>цитокин-положительные популяции. Частоту ID93-специфичных ответов определяли путем вычитания частоты положительных ответов нестимулированных клеток от частоты ID93-стимулированных клеток в сопоставленных образцах.
Гуморальные ответы
[000342] Сыворотки мышей получали путем сбора крови из ретро-орбитальной области в пробирки для сбора сыворотки Microtainer® (VWR International, Вест Честер, Пенсильвания, США) с последующим центрифугированием при 10000 об./мин в течение 5 минут. Затем каждый образец сыворотки исследовали методом ИФА с захватом антителами. В общих чертах, планшеты для ИФА (Nunc, Рочестер, Нью-Йорк, США) покрывали 2 мкг/мл рекомбинантного антигена ID93 в 0,1 М бикарбонатном буфере и блокировали 1% ФСБ-БСА. Затем, в последовательном порядке и после промывок в ФСБ/твин-20, в планшеты добавляли последовательно разведенные образцы сыворотки, анти-IgG1 мыши или IgG2c-ПХ (все от Southern Biotech, Бирмингем, Алабама, США) и ABTS-H2O2 (Kirkegaard and Perry Laboratories, Гейтесберг, Мэриленд, США). Планшеты исследовали при 405 нм (ELX808, Bio-Tek Instruments Inc, Уинуски, Вермонт, США). Промежуточные титры рассчитывали с использованием программного обеспечения Prism (GraphPad Software, Inc.) для определения сигмоидальной кривой дозовой зависимости методом наименьших квадратов.
[000343] Ранее опубликованные данные, полученные на модели Mycobacterium tuberculosis, продемонстрировали, что у мышей, иммунизированных гибридным полипептидом ID93, приготовленным с GLA/SE, наблюдали индукцию более сильных ответов ID93-специфического IgG2c, это указывало на смещение в сторону Th1 ответа (Baldwin 2012). Опубликованные данные также указывают на то, что составы алюминиевых квасцов, тем не менее, обычно индуцируют более сильный Th2 ответ, о чем свидетельствуют более сильные ответы антител IgG1. Оценивали влияние изменения среднего размера частиц состава наноалюмочастиц на качество иммунного ответа, вызванного против гибридного полипептида ID93. Для оценки этого показателя животных иммунизировали на 0 день путем внутримышечной инъекции в четырехглавую мышцу 0,5 мкг ID93, смешанного с 100 мкг алюминиевых квасцов с микронным размером частиц (например, необработанные алюминиевые квасцы, которые коммерчески доступны), которые использовали в качестве контрольного состава, или 0,5 мкг ID93, смешанного с 100 мкг состава наноалюмочастиц с ПЭГ (ПЭГ 5000-DSPE в качестве агента, регулирующего размер, измельченного так, чтобы полученные составы имели средний размер частиц 400 нм, 130 нм или 75 нм) плюс или минус 5 мкг агониста TLR, SLA4, на нулевой день. На 21 день после иммунизации у животных брали образцы крови, и сыворотку собирали и исследовали для определения ответов ID93-специфических антител, как описано. Промежуточные титры антител для ID93-специфического IgG1 на 21 день (ФИГ. 11А) и для IgG2c (ФИГ. 11В) указывали на то, что у животных, иммунизированных ID93, смешанным с составом SLA-SE, вырабатывались как титры ID93-специфических антител IgG1, так и IgG2c, причем незначительное увеличение титра IgG2c указывало на Th1 ответ, как было описано ранее. Иммунизация мышей ID93-гибридным полипептидом не приводила к выработке измеримых титров антител IgG1 или IgG2c, как и ожидалось. Иммунизация составами алюминиевых квасцов с размером частиц 1-10 микрон привела к выраженному смещению в сторону Th2 ответа, о котором свидетельствовали высокие титры антител IgG1 и низкие титры IgG2c, как было предсказано в литературе. Эти контрольные образцы сравнивали с составами наноалюмочастиц с ПЭГ, содержащими ПЭГ-5000 DSPE в качестве агента, регулирующего размер, измельченного или проклеенного путем варьирования способов (смешивание на смесителе Silverson при скорости 5000 об./мин в течение 5 минут, микрофлюидизация при 10000 фунтов на кв. дюйм один раз или 10 раз при 30000 фунтов на кв. дюйм), как описано в примере 1, чтобы получить наночастицы с размером 400 нм, 130 нм или 75 нм, соответственно. Данные указывали на то (ФИГ. 11А), что составы наноалюмочастиц с ПЭГ с размером частиц 400 нм индуцировали конечный титр IgG1, который был близок титру для составов необработанных алюминиевых квасцов. Составы наноалюмочастиц с ПЭГ с размером частиц 130 нм и 75 нм также приводили к высоким промежуточным титрам IgG1 на 21 день, хотя они были снижены приблизительно вдвое по сравнению с титрами, вызванными квасцами или составами наноалюмочастиц с ПЭГ с размером частиц 400 нм. Данные указывали на то, что ни один из испытываемых составов наноалюмочастиц с ПЭГ не привел к выработке измеримых титров ID93-специфичных антител IgG2c у иммунизированных мышей. Для того чтобы определить, может ли добавление агониста TLR4 к смешанному составу наноалюмочастиц смещать ответ в сторону Th1, на основании измерения IgG2c, мышей также иммунизировали агонистом TLR4, SLA, плюс антиген ID93 и составы наноалюмочастиц с ПЭГ. Данные указывали на то, что смешивание агониста TLR4, SLA, с составом алюминиевых квасцов или составом наноалюмочастиц с ПЭГ с размером частиц 400 нм оказывало незначительный эффект на промежуточный титр ID93-специфического IgG1, но смешивание SLA с составом наноалюмочастиц с ПЭГ с размером частиц 130 нм или 75 нм, как правило, вызывало увеличение промежуточных титров ID93-специфического IgG1. Аналогичным образом, представленные на Фигуре 11В данные исследования промежуточных титров IgG2c, специфического в отношении антигена ID93, на 21 день указывали на то, что титры ID93-специфического IgG2c были индуцированы при добавлении SLA к составам наноалюмочастиц с ПЭГ с размером частиц 400 нм, 130 нм или 75 нм, по сравнению с недетектируемыми титрами у животных, иммунизированных наноалюмочастицы ID93/ПЭГ в отсутствие SLA. Данные указывали на то, что составы наноалюмочастиц с ПЭГ способны вызывать иммунный ответ, смещенный в сторону Th2, однако составы наноалюмочастиц с ПЭГ с размером частиц 130 нм или менее вызывали титры ID93-специфического IgG1, которые были снижены приблизительно наполовину по сравнению с титрами, вызванными алюминиевыми квасцами или составом наноалюмочастиц с ПЭГ с размером частиц 400 нм. Следует отметить, что добавление агониста TLR4, SLA, практически восстанавливало величину смещенного Th2 ответа до величины, характерной для общепринятых составов алюминиевых квасцов. Помимо этого, несмотря на то, что у мышей, иммунизированных составами наноалюмочастиц с ID93/ПЭГ, не детектировали ID93-специфические титры антител IgG2c, добавление агониста TLR4, SLA, к вакцинным композициям на основе составов наноалюмочастиц с ID93/ПЭГ приводило к выработке IgG2c, что указывало на некоторое смещение ответа к Th1-типу под действием SLA.
[000344] Иммунизация мышей составами наноалюмочастиц с ПЭГ, содержащими в качестве агентов, регулирующих размер, пегилированные фосфолипиды с различной длиной ПЭГ или ПЭГ одинаковой длины, соединенный с фосфолипидами с различной длиной ацильных цепей, и смешанными с гибридным пептидом ТБ, ID93, плюс агонист TLR4, SLA4, вызывала выработку антигенспецифических иммунных ответов. В таблице 5 представлены экспериментальные группы, в которых сравнивали адсорбцию 0,5 мкг гибридного белка ID93 в 100 мкг стандартных составов алюминиевых квасцов с размером частиц 1-10 мкм, смешанных в лабораторных условиях с ПЭГ-5000 DSPE (без измельчения или обработки), плюс 5 мкг агониста TLR4, SLA, с адсорбцией 0,5 мкг гибридного белка ID93 в обработанные методом микрофлюидизации составы наноалюмочастиц, содержащие агент, регулирующий размер, ПЭГ-DSPE с ПЭГ различной длины 5000, 2000 или 750, плюс 5 мкг SLA, и в составы наноалюмочастиц, содержащие в качестве агента, регулирующего размер, пегилированный фосфолипид, имеющий определенную длину ПЭГ 2000, и фосфолипиды с различной длиной ацильных цепей, состоящих из 18 атомов углерода (DSPE), 16 атомов углерода (DPPE) и 14 атомов углерода (DMPE).
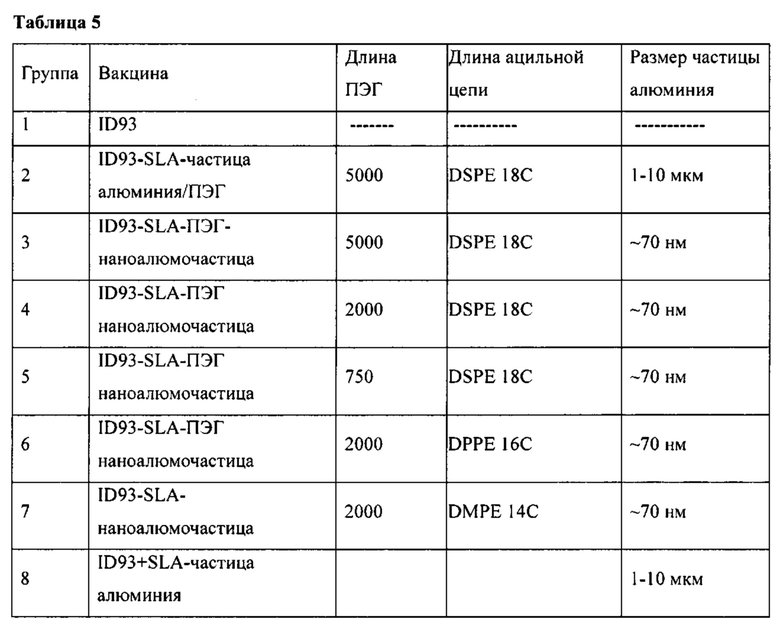
[000345] Иммунизация мышей 5 мкг агониста TLR, SLA, и 0,5 мкг гибридного белка ID93, адсорбированного в 100 мкг состава наноалюмочастиц с ПЭГ (ПЭГ-DSPE в качестве агента, регулирующего размер) длиной 5000, 2000 или 750 и размером частиц приблизительно 70 нм, вызывала выработку титров ID93-специфических IgG1, измеренных как промежуточные титры на 21 день. На ФИГ. 12А показано, что иммунизация мышей общепринятыми составами алюминиевых квасцов с размером частиц 1-10 мкм и составами наноалюмочастиц с размером частиц 70 нм, содержащими агент, регулирующий размер, ПЭГ-DSPE с ПЭГ длиной 5000, 2000 или 750 или ПЭГ длиной 2000, соединенный с фосфолипидом с длиной ацильной цепи, составляющей 18 (DSPE) или 16 (DPPE) атомов углерода, вызывала выработку эквивалентных титров IgG1. Составы наноалюмочастиц, содержащие фосфолипид с длиной ацильной цепи 14 атомов углерода (DMPE) и ПЭГ длиной 2000, вызывали титры IgG1, которые были снижены приблизительно наполовину, по сравнению с титрами, вызванными другими составами наноалюмочастиц. На ФИГ. 12В показано, что 100 мкг доза состава наноалюмочастиц с размером частиц 70 нм, содержащего агент, регулирующий размер, ПЭГ-DSPE с ПЭГ длиной 5000, 2000 или 750 или ПЭГ длиной 2000, соединенный с фосфолипидом с длиной ацильной цепи 18 (DSPE) или 16 (DPPE) атомов углерода, с адсорбированными 0,5 мкг антигена ID93 плюс 5 мкг агониста TLR4, SLA, вызывала выработку титров антигенспецифических антител IgG2c, что указывало на смещение в сторону Th1 ответа, несмотря на то, что величина ответа составляла приблизительно половину от величины ответа, наблюдаемого для состава алюминиевых квасцов с размером частиц 1-10 мкм. Составы наноалюмочастиц, содержащие фосфолипид с длиной ацильной цепи 14 атомов углерода (DMPE) и ПЭГ длиной 2000, не вызывали детектируемые титры ID93-специфических IgG2c. На Фигуре 12С показано, что составы наночастиц с ID93 индуцировали антигенспецифические CD4+ Т-клетки. Выработку цитокинов у иммунизированных мышей исследовали для выявления ID93-специфических CD44highCD4+ Т-клеток памяти, измеренных методом проточной цитометрии. Спленоциты от вакцинированных мышей, стимулированные ID93 в течение 12 часов в присутствии GolgiStop, и ID93-стимулированные спленоциты выявляли с помощью окрашивания внутриклеточных цитокинов на основании экспрессии CD3 и CD4 и далее пропускали для выявления CD44high клеток. CD44highCD4+ Т-клетки дополнительно окрашивали для выявления внутриклеточных CD154, ИФН-γ, ФНО, ГМ-КСФ, ИЛ-17 и ИЛ-5. ID93-специфические CD44highCD4+ Т-клетки проявляли полифункциональные ответы Т-клеток, положительные в отношении ФНО-α и ИЛ-5, которые типичны для ответов, специфических в отношении антигена ID93, это указывало на то, что такие наноалюмочастицы могут быть эффективным носителем агониста TLR4, SLA, для индукции Th1 иммунитета к антигену ID93.
Пример 4. Получение хитозан-, декстран- и полиаллиламин-содержащих составов наноалюмочастиц
[000346] Содержащие алюминий адъюванты вводили человеку и животным с середины 1920-х годов. Термин алюминиевые квасцы широко используется для общей классификации любого адъюванта на основе алюминия, используемого в вакцинах, но химически это в основном оксигидроксид алюминия (AlO(OH)) или фосфат алюминия (AlPO4, также называемый Al(ОН)х(PO4)у). AlO(OH) слабо кристалличен, о чем свидетельствует характер рентгеновской дифракции (XRD), кристаллическая структура представляет собой псевдобемит, который является одной из многих метастабильных фаз стабильной корундной фазы (α-Al2O3). Поверхность AlO(OH) является катионной и, соответственно, наиболее подходящей для адсорбции анионных антигенов. Изображения, полученные методом просвечивающей электронной микроскопии (ПЭМ), показывают волокнистые наночастицы с расчетными средними размерами 4,5×2,2×10 нм, которые образуют в суспензии агрегаты с широким распределением по размеру от 5 до 10 микрон. Фосфат алюминия, вопреки его названию, состоит из противоионов фосфата и гидроксида в нестехиометрических количествах, имеет общий отрицательный (анионный) поверхностный заряд и, соответственно, наиболее подходит для адсорбции катионных антигенов. В отличие от AlO(OH) фосфат алюминия является безводным для рентгеновских лучей и состоит из частиц размером 50 нм, образующих рыхлые агрегаты с медианой диаметра приблизительно 4 мкм. В настоящем документе описаны примеры адъювантов на основе наноалюмочастиц (наноалюминий), изготовленных с применением коммерчески доступных алюминиевых квасцов микронного размера (например, Alhydrogel® или AdjuPhos®) в качестве исходного материала и их микрофлюидизации в присутствии стабилизирующих агентов.
[000347] Получение наноалюмочастиц с хитозаном с использованием адъюванта AdjuPhos® (Al(ОН)х(PO4)у). Ниже описан общий способ синтеза составов наноалюмочастиц с использованием AdjuPhos® в качестве предшественника алюминиевых квасцов и низкомолекулярного хитозана (50000-190000 Да на основании вязкости 20-300 сП 1% масс./об. раствора в 1% уксусной кислоте при 25°С) с 75-85% степенью деацетилирования (DD) в качестве стабилизирующего агента.

[000348] Концентрацию адъюванта AdjuPhos® (10 мл при 5 мг Al/мл, 50 мг Al) поддерживали постоянной и стабилизировали с использованием различных количеств хитозана. Перед смешиванием заранее определенное количество хитозана растворяли в 40 мл слабокислого 0,12 М ацетата натрия/0,02 М ацетатном буфере, рН=5,4. После полного растворения раствор хитозана (40 мл) смешивали с 10 мл AdjuPhos® (50 мг алюминия), перемешивали в течение 5 минут в смесителе с высоким усилием сдвига Silverson при 5000 об./мин, и затем подвергали микрофлюидизации при 30000 фунтов на кв. дюйм в течение 22 дискретных раундов в микрофлюидизаторе с высоким усилием сдвига LM20 (Microfluidics). Микрофлюидизированный материал визуально был мутным, но прозрачным. Композиция различных составов наноалюмочастиц, полученных из Adjuphos®, стабилизированных хитозаном, приведена в таблице 6 ниже. Гидродинамический диаметр снижался при увеличении количества раундов обработки, как показано на Фигуре 13А. Для аналогичного процесса гомогенизации гидродинамический диаметр снижался при увеличении доли хитозана (13В). В среднем дзета-потенциал состава наноалюмочастиц с хитозаном составил +20 мВ.
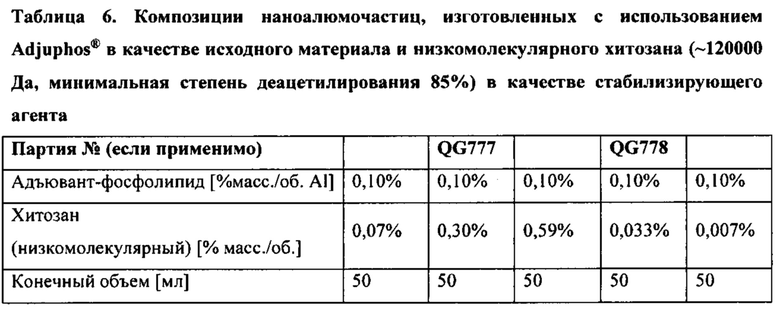
[000349] Получение составов наноалюмочастиц с декстраном с использованием адъюванта Alhydrogel® (AlO(OH)). Ниже описан общий способ синтеза составов наноалюмочастиц с использованием Alhydrogel® в качестве предшественника алюминиевых квасцов и сульфата декстрана (40000 Да) в качестве стабилизирующего агента.
[000350] Концентрацию адъюванта Alhydrogel® (10 мл при 10 мг Al/мл, 100 мг алюминия) поддерживали постоянной и стабилизировали с использованием различных количеств сульфата декстрана. Перед смешиванием заранее определенное количество сульфата декстрана растворяли в 40 мл дистиллированной воды. 10 мл Alhydrogel® (100 мг Al) добавляли к 40 мл раствора сульфат декстрана, перемешивали в течение 5 минут в смесителе с высоким усилием сдвига Silverson при скорости 5000 об./мин и затем подвергали микрофлюидизации при 30000 фунтов на кв. дюйм 15 дискретных раундов в микрофлюидизаторе с высоким усилием сдвига LM20 (Microfluidics), Микрофлюидизированный материал очищали до прозрачности и стерилизовали путем фильтрации через ПЭС-мембрану с размером пор 200 нм. Композиция различных составов наноалюмочастиц, полученных из Alhydrogel®, стабилизированных сульфатом декстрана, представлена в таблице 7 ниже. Гидродинамический диаметр снижался при увеличении количества раундов, как показано на Фигуре 14А. В среднем дзета-потенциал составов наноалюмочастиц с декстраном составил -40 мВ. Данные о стабильности частиц, имеющиеся к моменту составления данного отчета, указывали на отсутствие значительного изменения размера наноалюмочастиц-декстрана (партия QG774, представленная в качестве примера) до 3 месяцев после даты изготовления (Фигура 14В).
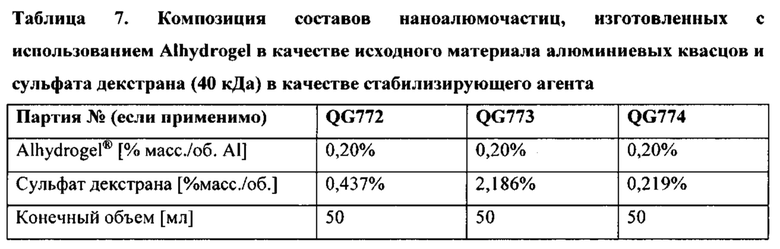
[000351] Получение составов наноалюмочастиц с хитозаном с использованием адъюванта Alhydrogel® (AlO(OH)). Ниже описан общий способ синтеза составов наноалюмочастиц с использованием Alhydrogel® в качестве предшественника алюминиевых квасцов и хитозана (15000 Да, минимальная степень деацетилирования 85) в качестве стабилизирующего агента.
[000352] Исходный Alhydrogel® (AlO(OH)) имеет катионный поверхностный заряд и, соответственно, электростатически отталкивает хитозан, который также является катионным. Для того чтобы адсорбировать хитозан в Alhydrogel®, последний должен подвергнуться модификации поверхности путем обмена фосфатного лиганда. Для обмена фосфата Alhydrogel® (10 мг Al/мл) смешивали с 10× ФСБ в объемном соотношении 1:2 и оставляли на орбитальном шейкере на 24-48 часов при 37°С для протекания реакции. Alhydrogel® после обмена фосфата (PE-Alhydrogel®) центрифугировали при 2500 об./мин в течение 15 минут, и прозрачный супернатант декантировали. Осажденный PE-Alhydrogel® затем диспергировали в дистиллированной воде и операцию центрифугирования-декантирования повторяли 3 раза для вымывания фосфатного буфера. Конечный промытый осадок PE-Alhydrogel® диспергировали в дистиллированной воде до концентрации 10 мг Al/мл и хранили при комнатной температуре. Измерение дзета-потенциала Alhydrogel® до и после фосфатного обмена подтвердило, что катионный поверхностный заряд был успешно трансформирован в анионный (Фигура 15А). Раствор 2% масс./об. хитозана в 1% об./об. уксусной кислоте получали в качестве исходного раствора для смешивания с PE-Alhydrogel®. 10 мл PE-Alhydrogel® (100 мг Al) смешивали с различными количествами хитозана, полученными путем разбавления 2% раствора хитозана дистиллированной водой. Примеры условий смешивания приведены в таблице 8.

[000353] По 50 мл смеси PE-Alhydrogel® и хитозана гомогенизировали с помощью смесителя с высоким усилием сдвига Silverson при 5000 об./мин в течение 5 минут, затем подвергали микрофлюидизации при 30000 фунтов на кв. дюйм в непрерывном режиме в течение 5 минут при 110 мл/мин с использованием микрофлюидизатора М110Р (Microfluidics). Микрофлюидизированный материал был белым, опалесцирующим и практически прозрачным. Композиция примерных синтезированных партий представлена в таблице 9. Размер частиц предварительно фильтрованного материала наноалюмочастиц с хитозаном согласно данным ДРС представлен на Фигуре 15В. В целом, Z-средний диаметр положительно коррелировал с количеством использованного хитозана. Композиции фильтровали через ПЭС-мембрану с размером пор 200 нм, в тех случаях, когда фильтрация была возможной, и хранили при 4°С. В среднем дзета-потенциал составов наноалюмочастиц с хитозаном составил +20 мВ.
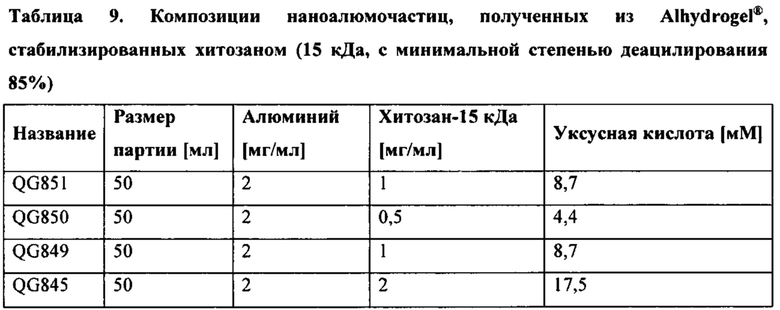
[000354] Z-средний гидродинамический диаметр увеличивается с течением времени, но, в зависимости от количества использованного хитозана, плато было достигнуто при приблизительно 300-500 нм. Во-вторых, скорость увеличения размера частиц зависит от температуры, размер увеличивается быстрее при более высоких температурах, это указывает на то, что увеличение размера является эндотермическим процессом и потенциально обусловлено увеличением энтропии.
[000355] Получение составов наноалюмочастиц с полиаллиламином с использованием адъюванта Alhydrogel® (AlO(OH)). Далее описан общий способ синтеза наноалюмочастиц с использованием Alhydrogel® в качестве предшественника алюминиевых квасцов и полиаллиламина (15000 Да) в качестве стабилизирующего агента.
[000356] Исходный Alhydrogel® (AlO(OH)) имеет катионный поверхностный заряд и, соответственно, электростатически отталкивает полиаллиламин, который также является катионным. Для того чтобы адсорбировать полиаллиламин в Alhydrogel®, последний должен быть подвергнут модификации поверхности путем обмена фосфатного лиганда. Для обмена фосфата Alhydrogel® (10 мг Al/мл) смешивали с 10× ФСБ в объемном соотношении 1:2 и оставляли на орбитальном шейкере на 24-48 часов при 37°С для протекания реакции. Alhydrogel® после обмена фосфата (PE-Alhydrogel®) центрифугировали при 2500 об./мин в течение 15 минут, и прозрачный супернатант декантировали. Осажденный PE-Alhydrogel® затем диспергировали в дистиллированной воде, и этап центрифугирования-декантирования повторяли 3 раза для вымывания фосфатного буфера. Конечный промытый осадок PE-Alhydrogel® диспергировали в дистиллированной воде до концентрации 10 мг Al/мл и хранили при комнатной температуре. Измерение дзета-потенциала Alhydrogel® до и после обмена фосфата подтвердило, что катионный поверхностный заряд был успешно трансформирован в анионный. Для синтеза составов наноалюмочастиц, стабилизированных полиаллиламином, по 10 мл PE-Alhydrogel® (100 мг Al) смешивали с различными количествами 15% масс./об. полиаллиламина; примерные соотношения смешивания приведены в таблице 10. Поскольку полиаллиламин использовали в форме свободного основания, значение рН смеси PE-Alhydrogel® и полиаллиламина составило от 8 до 11, и, следовательно, требовалась корректировка до рН=7 с использованием 6 М HCl.
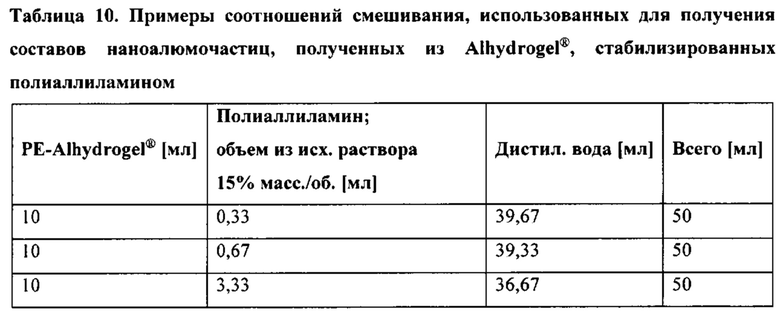
[000357] Для получения стабильных наноалюмочастиц смесь PE-Alhydrogel® и полиаллиламина смешивали в течение 5 минут с использованием смесителя с высоким усилием сдвига Silverson при скорости 5000 об./мин и затем подвергали микрофлюидизации при 30000 фунтов на кв. дюйм в течение 5 минут при 110 мл/мин с использованием микрофлюидизатора М110Р (Microfluidics). Микрофлюидизированный материал был почти прозрачным и был стерилизован путем фильтрации через ПЭС-мембрану с размером пор 200 нм. Размер наноалюмочастиц, приведенный на Фигуре 16, увеличивается при повышении содержания полиаллиламина. В среднем дзета-потенциал составов наноалюмочастиц с полиаллиламином составил приблизительно +20 мВ.
Композиция полученных примерных составов наноалюмочастиц с полиаллиламином приведена в таблице 11.
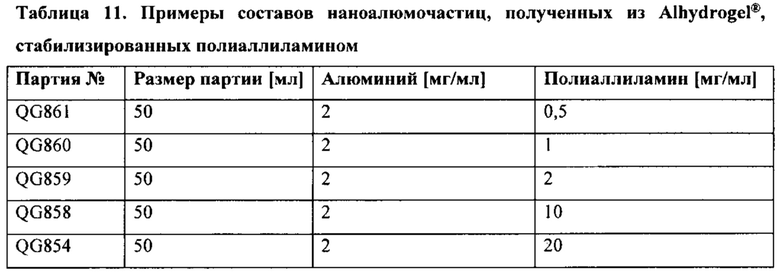
[000358] Получение составов наноалюмочастиц с полиаллиламином для приготовления вакцин на основе РНК. Для оценки совместимости составов наноалюмочастиц с полиаллиламином для образования комплекса с РНК смешивали 1 мкг самореплицирующей РНК, содержащей 10 тыс. п.о., кодирующей антиген вируса Зика, с разбавленными составами наноалюмочастиц с полиаллиламином, содержащими 1 мг/мл (партия QG860), 2 мг/мл (партия QG859) или 20 мг/мл (много QG854) полиаллиламина. Образцы наноалюмочастиц, образовавшие комплекс с РНК, наряду с «оголенными» контрольными РНК, количественно исследовали для определения замедления подвижности в геле (GRA), чтобы оценить способность каждого состава связывать РНК и загрузочную способность. QG859 (2 мл/мл неразбавленного полиаллиламина) связывал 100% РНК при разбавлении в соотношении 1/200 (0,01 мг/мл полиаллиламина). Аналогичным образом, QG860 (1 мл/мл неразбавленного полиаллиламина) связывал 100% РНК при разбавлении в соотношении 1/100 (0,01 мг/мл полиаллиламина). Оба состава показали сходные характеристики связывания, которые коррелировали с количеством полиаллиламина. С другой стороны, QG854 (20 мл/мл неразбавленного полиаллиламина) связывал практически 100% РНК даже при разбавлении в соотношении 1/4000 (0,005 мг/мл полиаллиламина).
ЛИТЕРАТУРА
1. Shah RR, Dodd S, Schaefer M, Ugozzoli M, Singh M, Otten GR, Amiji MM,  DT, Brito LA. The Development of Self-Emulsifying Oil-in-Water Emulsion Adjuvant and an Evaluation of the Impact of Droplet Size on Performance. Journal of Pharmaceutical Sciences. 2015.
DT, Brito LA. The Development of Self-Emulsifying Oil-in-Water Emulsion Adjuvant and an Evaluation of the Impact of Droplet Size on Performance. Journal of Pharmaceutical Sciences. 2015.
2. Weichert R, editor. Determination of Extinction Efficiency and Particle Size Distribution by Photosedimentation using Light of Different Wavelengths. Particle Size Analysis 1981 Proc 4 th Conf held at Loughborough Univ of Technology, 21-24 Sept, 1981 Edited by N G Stanley-Wood and T Allen Chichester, Wiley, 1982; 1981.
4. Xiang SD, Scholzen A, Minigo G, David C, Aspostolopoulos v, Mottram PL, Plebanski M. Pathogen Recognition and Development of Particulate Vaccines: Does Size Matter? Methods. 2006:1-9.
5. Kalkanidis M, Pietersiz GA, Ziang SD, Mottram PL, Crimeen-Irwin B, Ardipradja K, Plebanski M. Methods for Nano-Particle Based Vaccine Formulation and Evaluation of their Immunogenicity. Methods. 2006: 20-29
6. Fung HWM, Mikasa TJT, Vergara J, Sivananthan SJ, Guderian JA, Duthie MS, Vedvick TS, Fox CB. Optimizing Manufacturing and Composition of a TLR4 Nanosuspension: Physicochemical Stability and Vaccine Adjuvant Activity. Journal of Nanobiotechnology. 2013: 11-43.
7. Weichert R, editor. Determination of Extinction Efficiency and Particle Size Distribution by Photosedimentation using Light of Different Wavelengths. Particle Size Analysis 1981 Proc 4 th Conf held at Loughborough Univ of Technology, 21-24 Sept, 1981 Edited by N G Stanley-Wood and T Allen Chichester, Wiley, 1982; 1981.
8. Schwendener RA. Liposomes as vaccine delivery systems: a review of the recent advances Ther Adv Vaccines. 2014 Nov; 2(6): 159-182.
9. A.L. Nail, J.L. White, S.L. Hem, Structure of aluminum hydroxide I: initial precipitate. J Pharm Sci, 65 (1976), pp. 1188-1191.
10. E.B. Lindblad. Aluminium adjuvants D.E.S. Stewart-Tull (Ed.), The theory and practical application of adjuvants, John Wiley & Sons, Ltd, New York (1995), pp. 21-35.
11. S.J. Seeber, J.L. White, S.L. Hem. Predicting the adsorption of proteins by aluminum-containing adjuvants Vaccine, 9 (1991), pp. 201-203.
12. S. Iyer, R.S. Robin Robinett, H. HogenEsch, S.L. Hem. Mechanism of adsorption of hepatitis В surface antigen by aluminum hydroxide adjuvant Vaccine, 22 (2004), pp. 1475-1479.
13. J.V. Rinella Jr., R.F. Workman, M.A. Hermondson, J.L. White, S.L. Hem. Elutability of proteins from aluminum-containing vaccine adjuvants by treatment with surfactants J Colloid Interface Sci, 197 (1998), pp. 48-56.
14. Baldwin, et. al., 2009, Bertholet, et. al., A Defined Tuberculosis Vaccine Candidate Boosts BCG and Protects Against Multidrug-Resistant Mycobacterium tuberculosis 2010Sci Transl Med 2, 53ra74 (2010)); Baldwin, et. al. The Importance of Adjuvant Formulation in the Development of a Tuberculosis Vaccine. The Journal of Immunology, 2012, 188: 000-000.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВ, СОДЕРЖАЩИЙ АГОНИСТ TLR, И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2761870C2 |
| ПЕГИЛИРОВАННЫЕ ЛИПОСОМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2796539C2 |
| НАНОСТРУКТУРИРОВАННЫЕ ЛИПИДНЫЕ НОСИТЕЛИ И СТАБИЛЬНЫЕ ЭМУЛЬСИИ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2816240C2 |
| ЭМУЛЬСИИ ТИПА "МАСЛО В ВОДЕ", КОТОРЫЕ СОДЕРЖАТ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2012 |
|
RU2606846C2 |
| КАТИОННЫЕ ЭМУЛЬСИИ МАСЛО-В-ВОДЕ | 2012 |
|
RU2649133C2 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2021 |
|
RU2837542C1 |
| МАЛЕНЬКИЕ ЛИПОСОМЫ ДЛЯ ДОСТАВКИ КОДИРУЮЩЕЙ ИММУНОГЕН РНК | 2011 |
|
RU2671482C2 |
| ПРОТИВОРАКОВЫЕ РНК-ВАКЦИНЫ | 2017 |
|
RU2768829C2 |
| ПЕГИЛИРОВАННЫЕ ЛИПОСОМЫ ДЛЯ ДОСТАВКИ КОДИРУЮЩЕЙ ИММУНОГЕН РНК | 2012 |
|
RU2628705C2 |
| СТИМУЛИРУЮЩАЯ ИММУННУЮ СИСТЕМУ МИЦЕЛЛЯРНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2832220C1 |
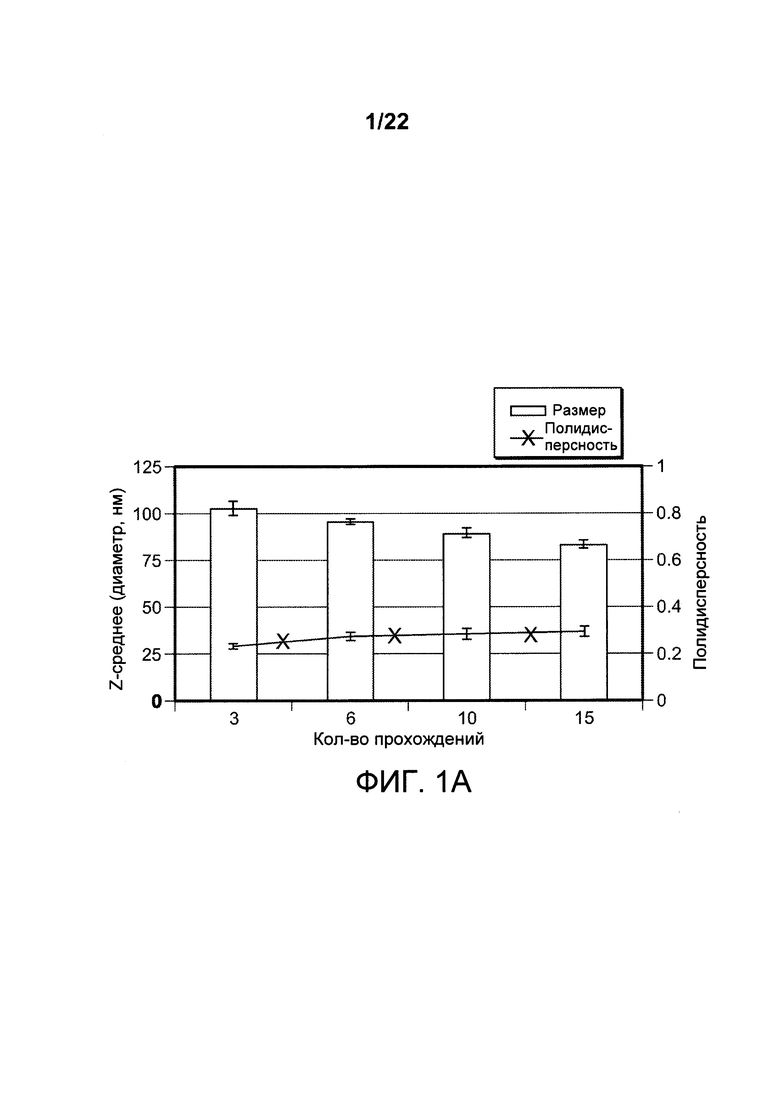
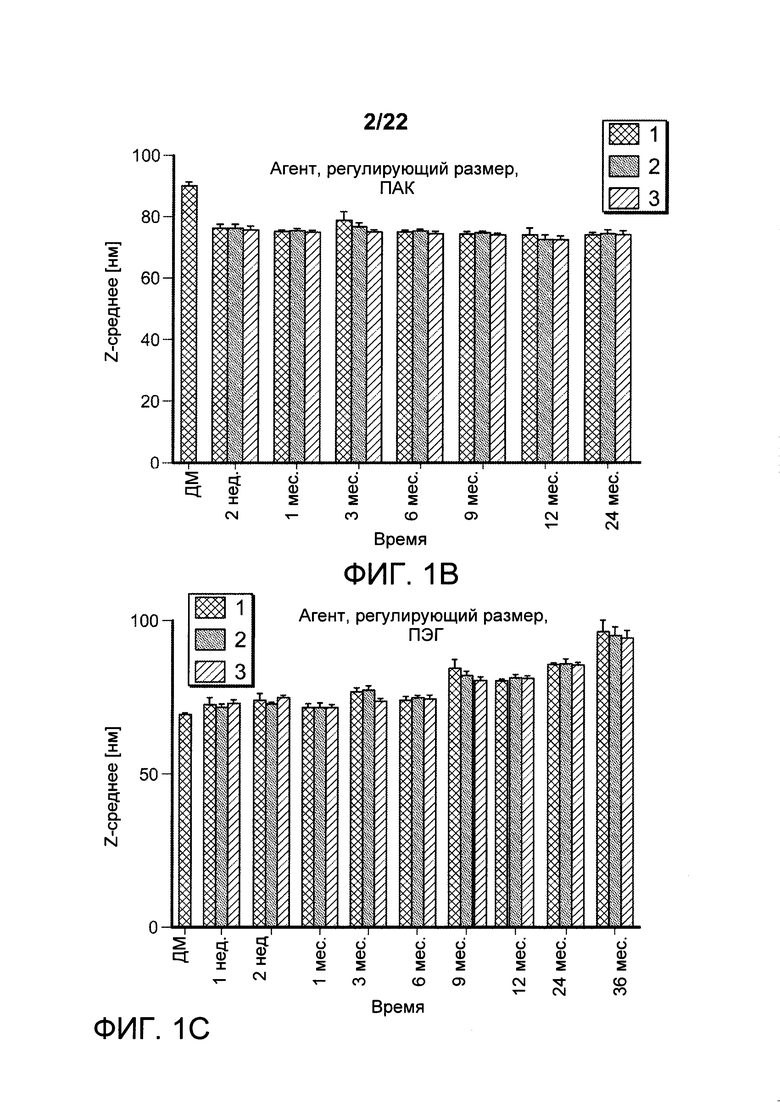

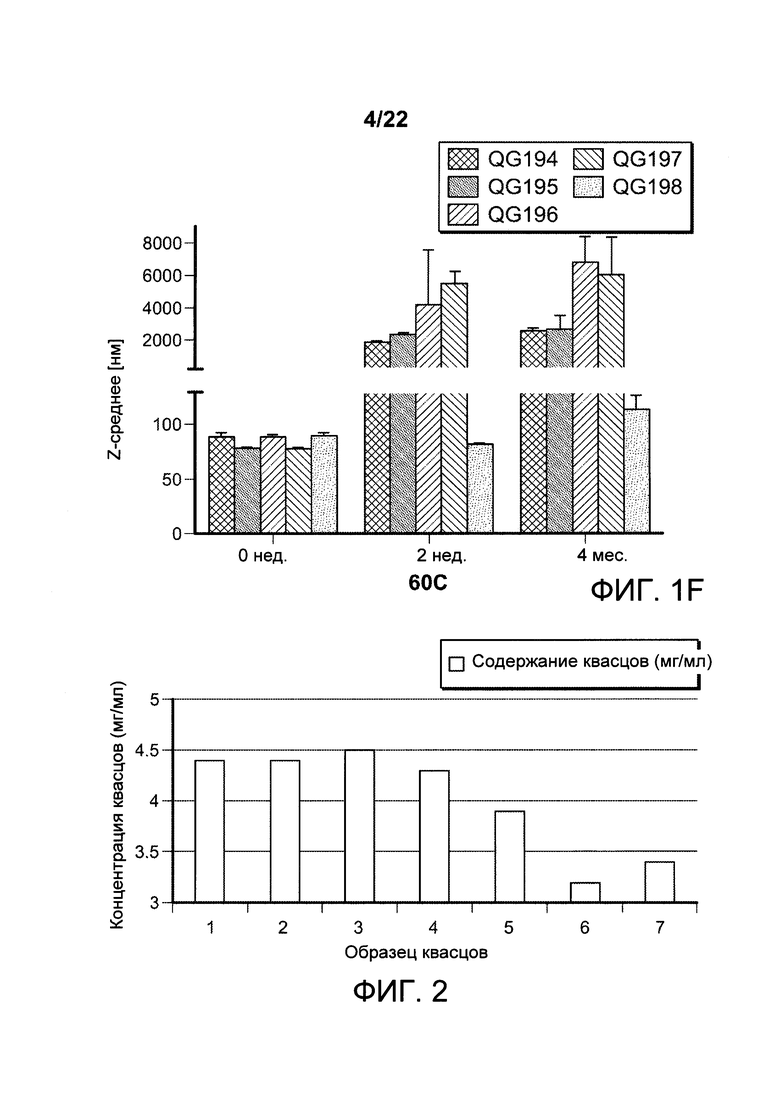
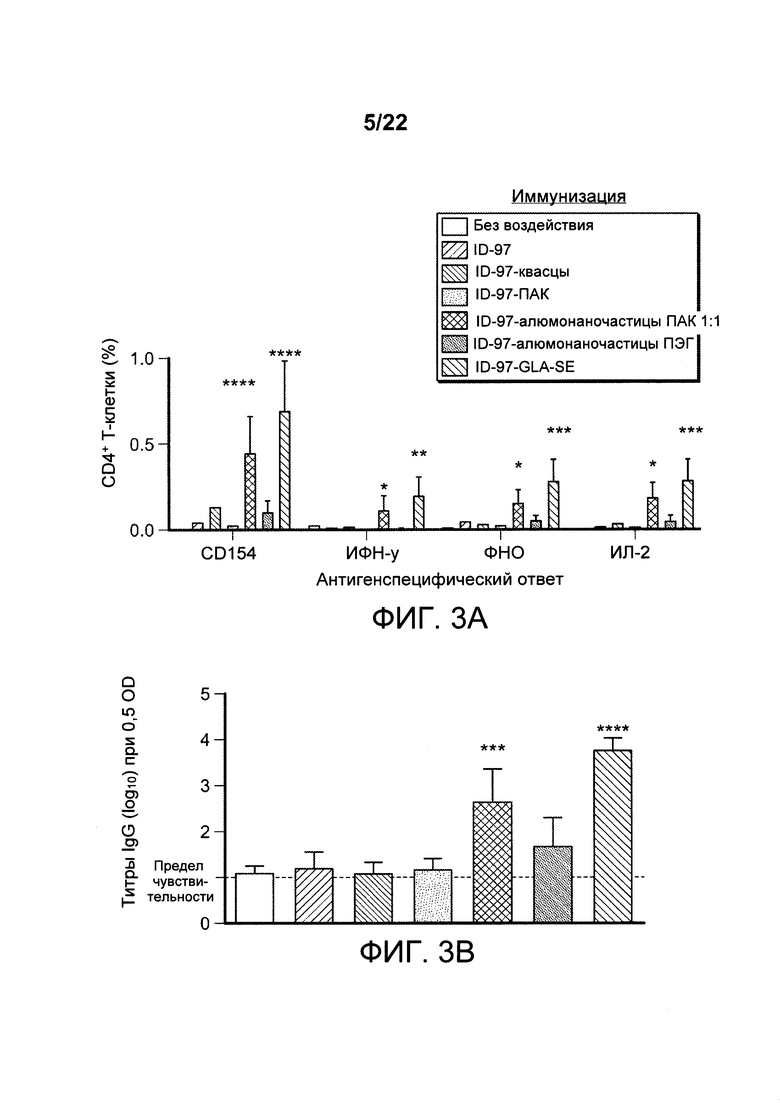
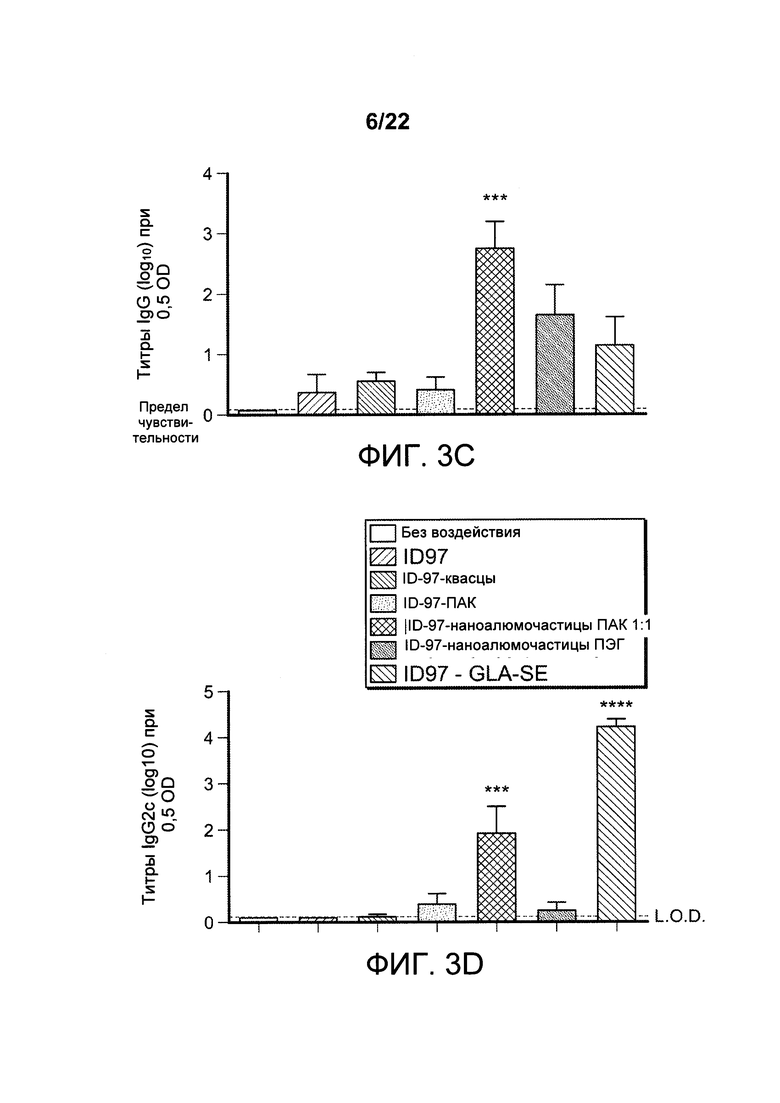
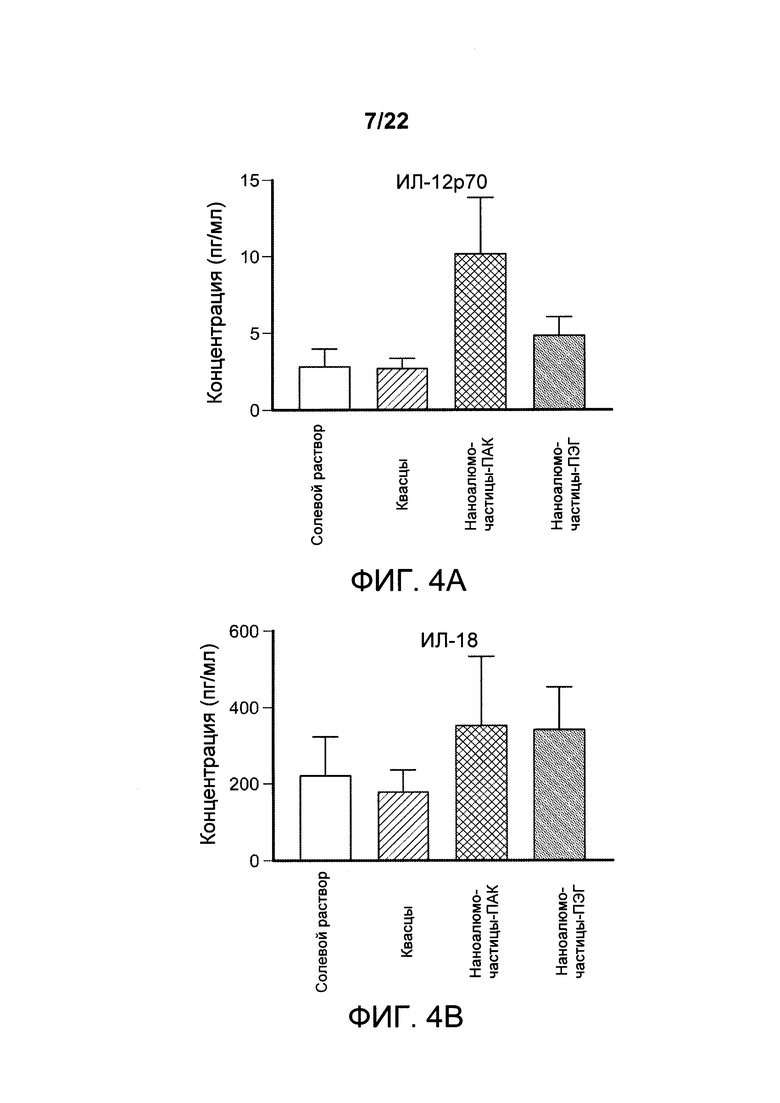
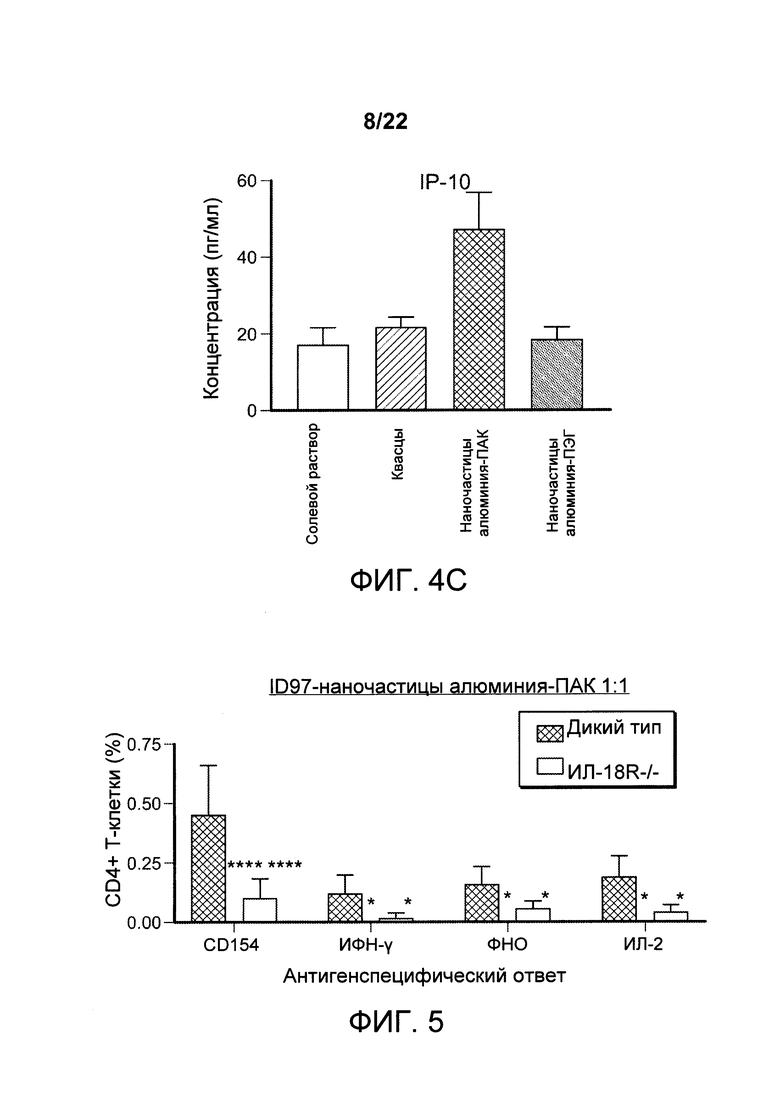
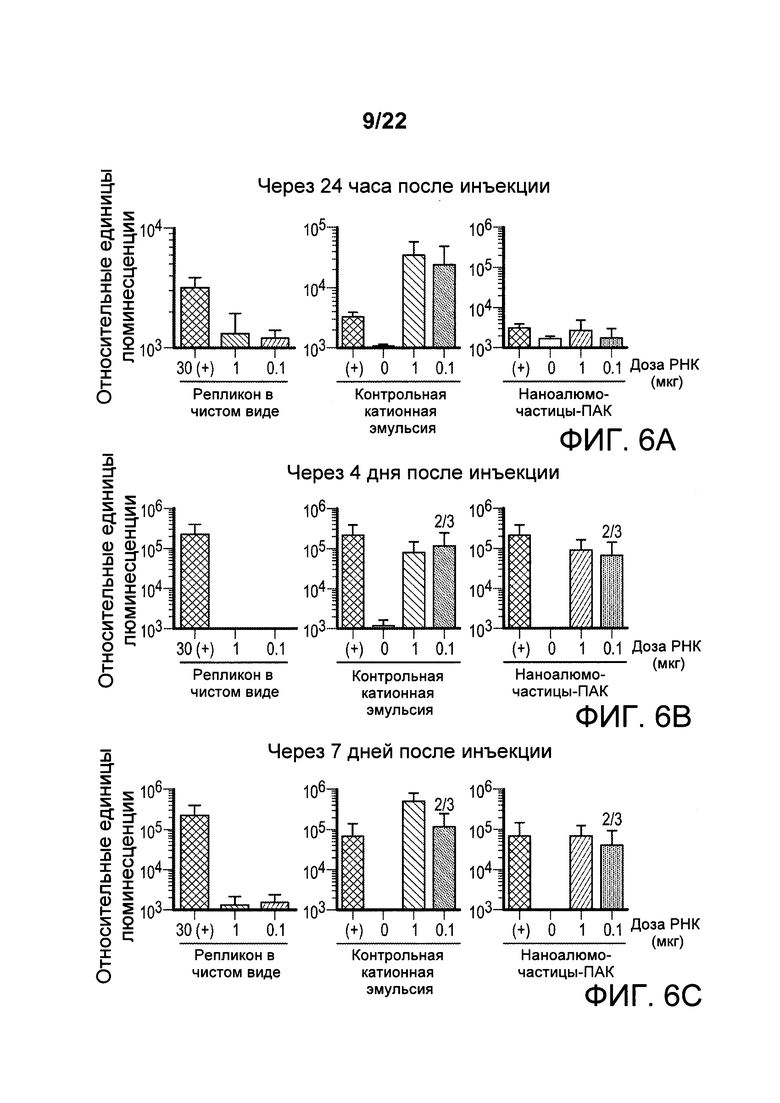
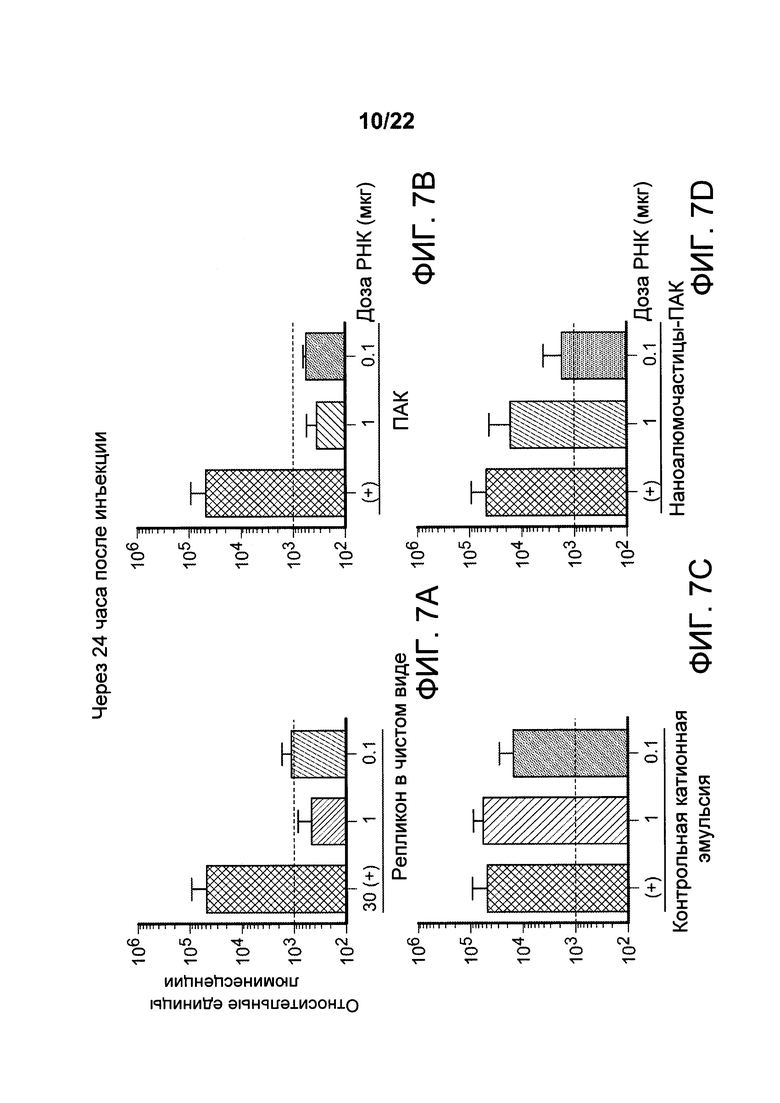
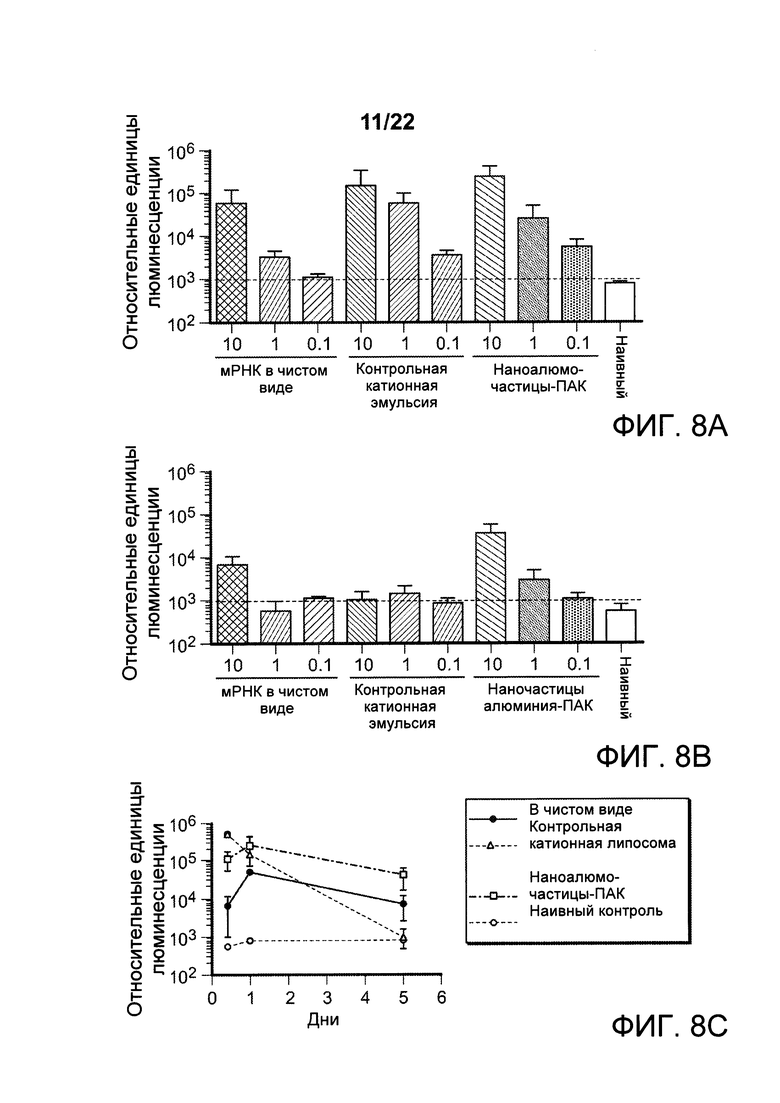
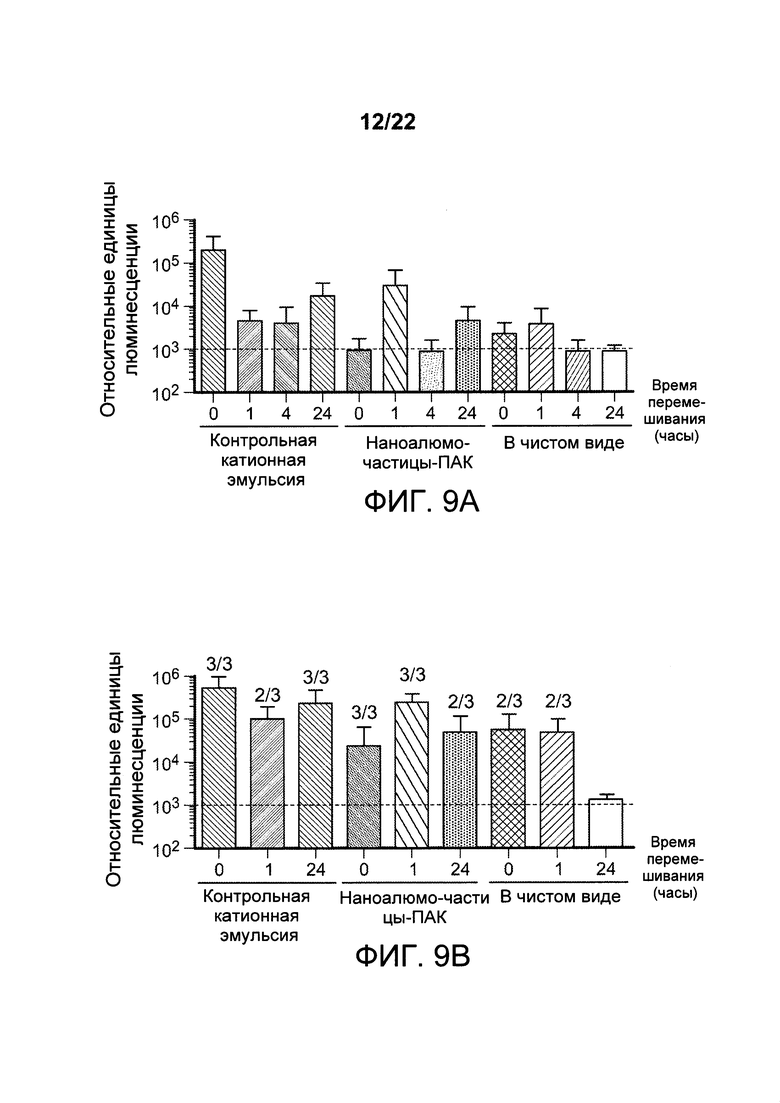
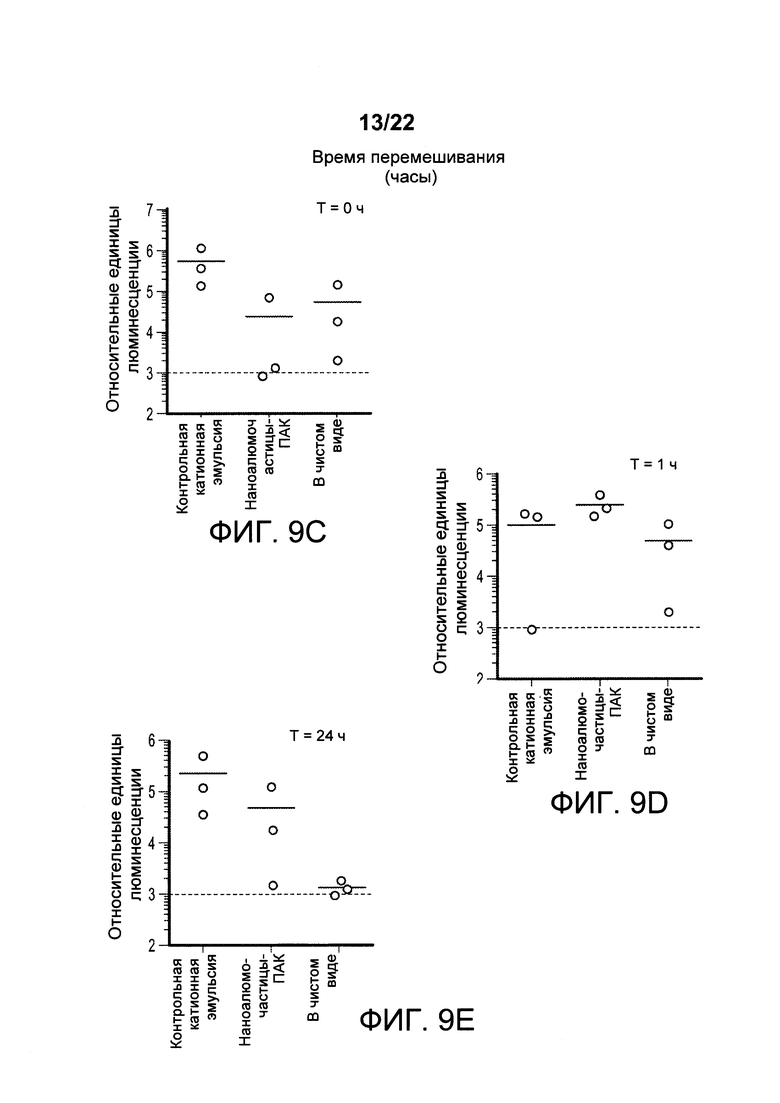

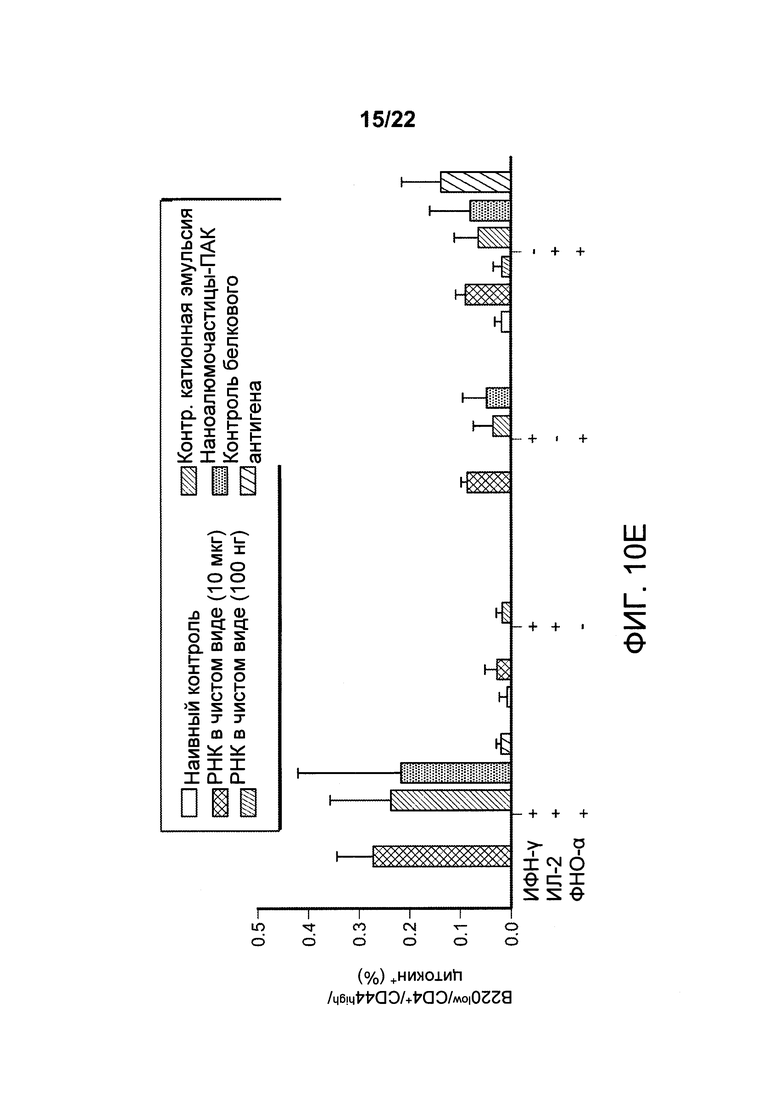
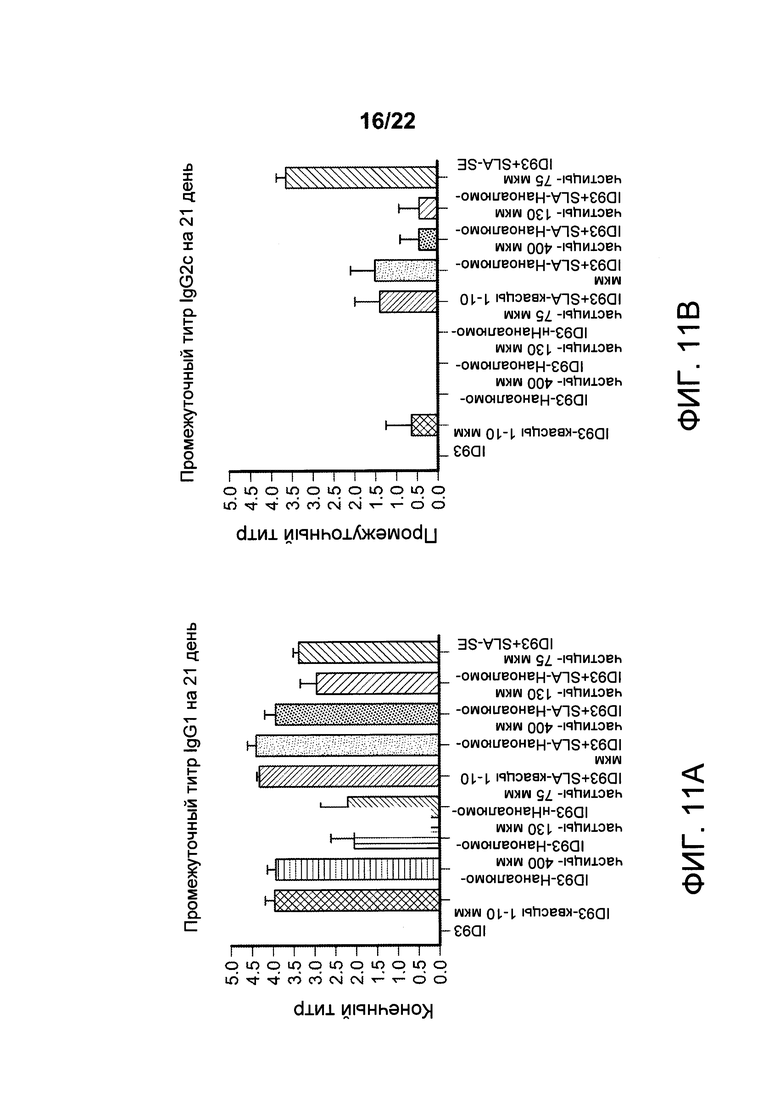
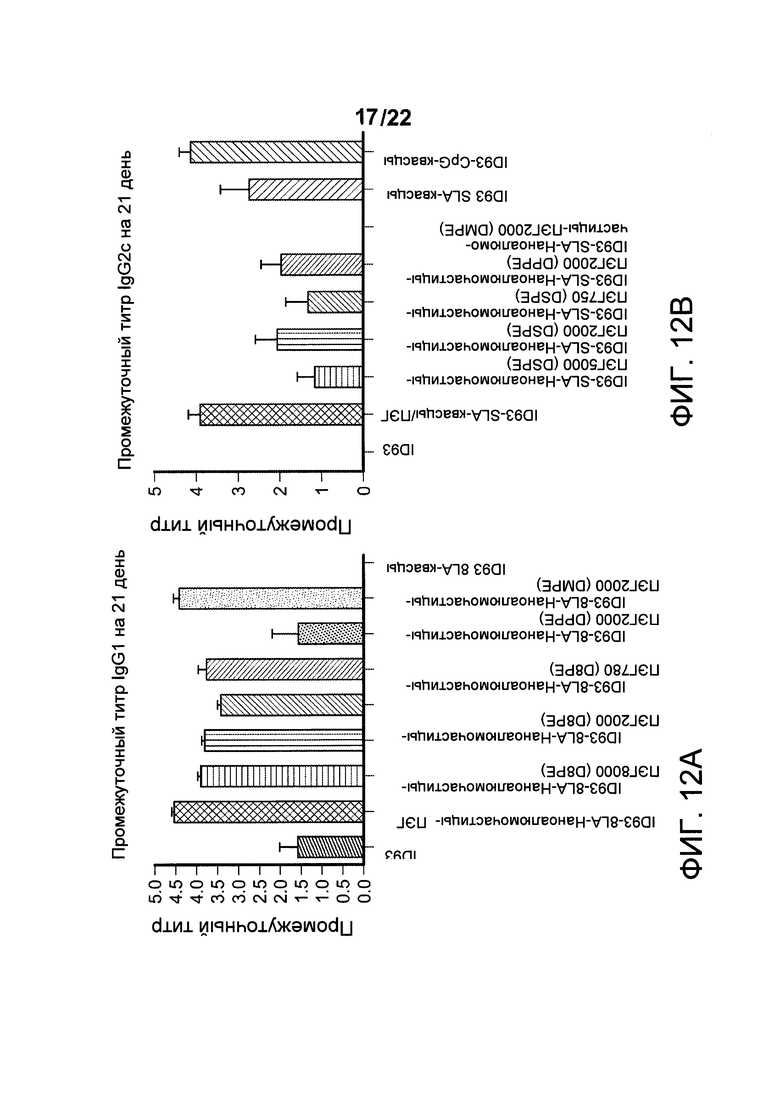
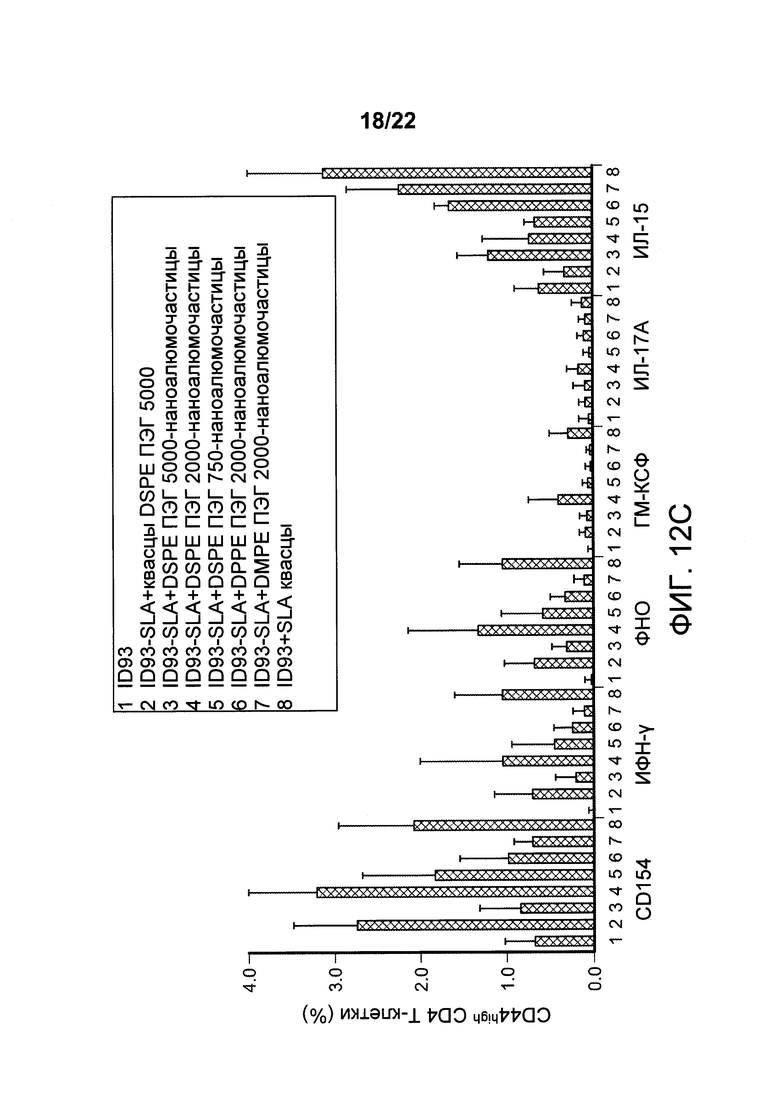
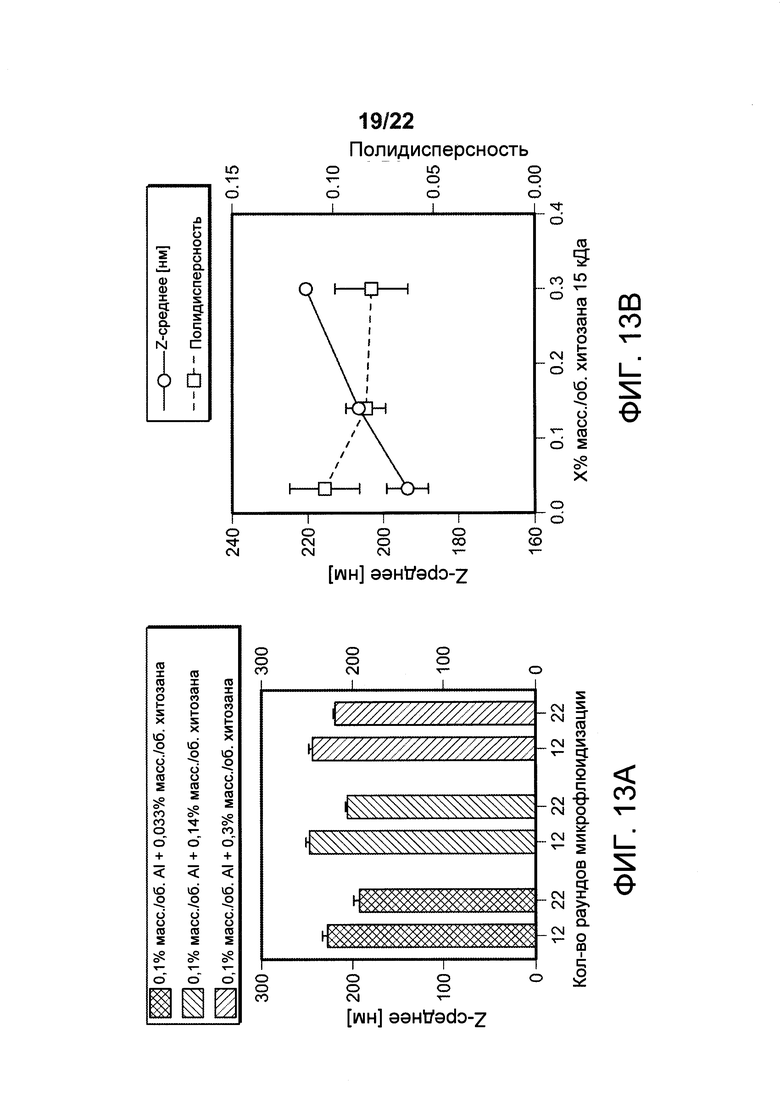
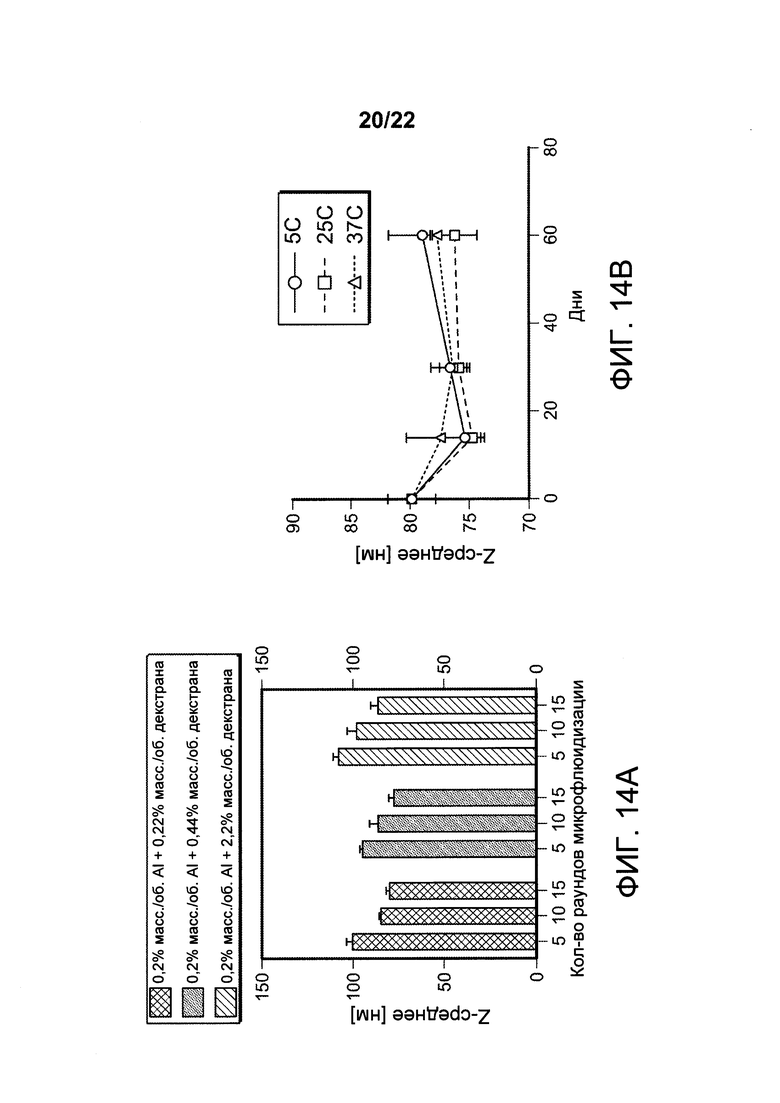
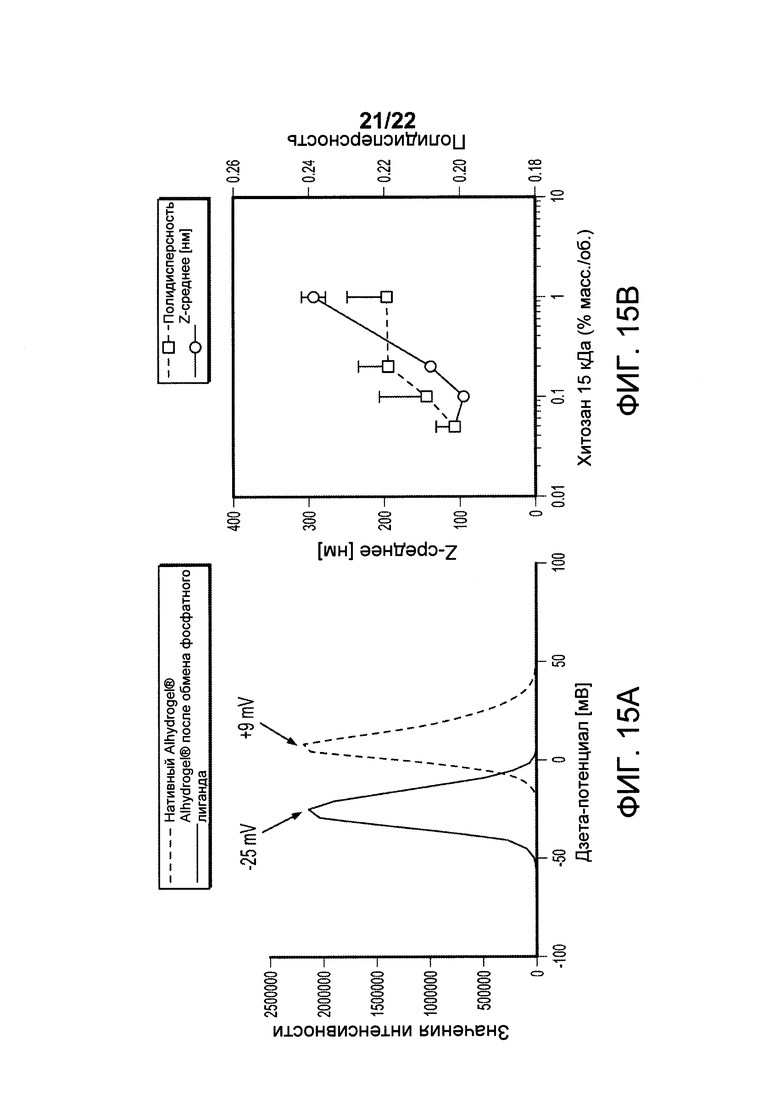

Настоящее изобретение относится к наноалюмочастице для применения в вакцинном составе. Наноалюмочастица содержит: (a) подходящую соль алюминия, где соль алюминия выбрана из группы, состоящей из гидроксида алюминия, геля гидроксида алюминия, AlPO4, AlO(OH), Al(OH)(PO4) и KAl(SO4)2; и (b) подходящий агент, регулирующий размер, где агент, регулирующий размер, выбран из группы, включающей полиакриловую кислоту (ПАК), ПЭГ, ПЭГ, соединенный с липидом, хитозан, декстран или полиаллиламин; причем размер указанной частицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм. Также предложены способ изготовления наноалюмочастицы, композиция для применения в вакцинном составе, способ стимуляции иммунного ответа у субъекта. Предложенные наноалюмочастицы стабильны и поддаются этапу окончательной стерилизации перед внесением во флаконы. 5 н. и 20 з.п. ф-лы, 47 ил., 15 табл., 5 пр.
1. Наноалюмочастица для применения в вакцинном составе, содержащая:
(a) подходящую соль алюминия, где соль алюминия выбрана из группы, состоящей из гидроксида алюминия, геля гидроксида алюминия, AlPO4, AlO(OH), Al(OH)(PO4) и KAl(SO4)2; и
(b) подходящий агент, регулирующий размер, где агент, регулирующий размер, выбран из группы, включающей полиакриловую кислоту (ПАК), ПЭГ, ПЭГ, соединенный с липидом, хитозан, декстран или полиаллиламин;
причем размер указанной частицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
2. Наноалюмочастица по п. 1, характеризующаяся тем, что указанный агент, регулирующий размер, представляет собой ПАК, необязательно ПАК, имеющую среднюю молекулярную массу приблизительно 2000 дальтон.
3. Наноалюмочастица по п. 2, характеризующаяся тем, что массовое отношение соли алюминия к агенту, регулирующему размер, составляет приблизительно 1:2-1:3.
4. Наноалюмочастица по п. 1, характеризующаяся тем, что
(a) указанный агент, регулирующий размер, представляет собой ПЭГ и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон; или
(b) указанный агент, регулирующий размер, представляет собой ПЭГ, соединенный с липидом (необязательно фосфолипидом), причем указанный липид необязательно выбран из группы, состоящей из DSPE, DPPE, DMPE и DLPE.
5. Наноалюмочастица по любому из пп. 1-4, характеризующаяся тем, что указанная наноалюмочастица находится в жидком составе, стерилизованном путем фильтрации; причем необязательно указанная наноалюмочастица стабильна в жидком составе при температуре от приблизительно 0°C до приблизительно 8°C по меньшей мере приблизительно 1 месяц, по меньшей мере приблизительно 6 месяцев или по меньшей мере приблизительно 1 год или указанная наноалюмочастица стабильна в жидком составе при температуре приблизительно 37°C в течение по меньшей мере приблизительно 1 месяца.
6. Способ изготовления наноалюмочастицы, включающий воздействие источником высокой энергии на соль алюминия, выбранную из группы, состоящей из гидроксида алюминия, геля гидроксида алюминия, AlPO4, AlO(OH), Al(OH)(PO4) и KAl(SO4)2, в присутствии подходящего агента, регулирующего размер, выбранного из группы, включающей полиакриловую кислоту (ПАК), ПЭГ, ПЭГ, соединенный с липидом, хитозан, декстран или полиаллиламин, с получением наноалюмочастицы, содержащей (a) указанную соль алюминия и (b) указанный агент, регулирующий размер; причем размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
7. Способ по п. 6, характеризующийся тем, что указанный источник высокой энергии получают с применением одного, двух или более из микрофлюидизатора, экструдера, соникатора, смесителя с высоким усилием сдвига (например, смесителя Silverson) или гомогенизатора.
8. Способ по п. 6, характеризующийся тем, что указанный источник высокой энергии получают с применением микрофлюидизатора и смесителя с высоким усилием сдвига и указанную смесь, содержащую соль алюминия и агент, регулирующий размер, пропускают через микрофлюидизатор от одного раза до приблизительно 30 раз, или указанный источник высокой энергии получают с применением микрофлюидизатора и указанную смесь, содержащую соль алюминия и агент, регулирующий размер, пропускают через микрофлюидизатор от одного раза до приблизительно 15 раз.
9. Способ по любому из пп. 6-8, характеризующийся тем, что указанный агент, регулирующий размер, представляет собой ПАК, необязательно, ПАК, имеющую среднюю молекулярную массу приблизительно 2000 дальтон.
10. Способ по п. 9, характеризующийся тем, что массовое отношение соли алюминия к агенту, регулирующему размер, составляет приблизительно 1:2-1:3.
11. Способ по любому из пп. 6-8, характеризующийся тем, что указанный агент, регулирующий размер, выбран из группы, состоящей из ПЭГ, ПЭГ, соединенного с липидом, хитозана, декстрана или полиаллиламина.
12. Способ по любому из пп. 6-8, характеризующийся тем, что указанный агент, регулирующий размер, представляет собой хитозан или полиаллиламин и указанную соль алюминия подвергают модификации поверхности путем обмена фосфатного лиганда перед воздействием на нее источником высокой энергии в присутствии агента, регулирующего размер.
13. Способ по любому из пп. 6-8, характеризующийся тем, что указанный агент, регулирующий размер, представляет собой ПЭГ и средняя молекулярная масса ПЭГ находится в диапазоне от приблизительно 750 дальтон до приблизительно 5000 дальтон, или указанный агент, регулирующий размер, представляет собой ПЭГ, соединенный с липидом (необязательно фосфолипидом), при этом необязательно указанный липид выбран из группы, состоящей из DSPE, DPPE, DMPE и DLPE.
14. Наноалюмочастица для применения в вакцинном составе, которая может быть получена или которая получена способом в соответствии с любым из пп. 6-13, характеризующаяся тем, что размер указанной наноалюмочастицы находится в диапазоне от приблизительно 1 нм до приблизительно 450 нм.
15. Композиция для применения в вакцинном составе, содержащая наноалюмочастицу по любому из пп. 1-5 и 14.
16. Композиция по п. 15, дополнительно содержащая подходящий биоактивный агент, при этом необязательно указанный биоактивный агент ассоциирован с указанной наноалюмочастицей в композиции согласно результатам определения методом гель-электрофореза.
17. Композиция по п. 16, характеризующаяся тем, что указанный биоактивный агент представляет собой полипептид, полинуклеотид, антиген, адъювант, диагностический агент, терапевтический агент или организм; причем указанный полипептид необязательно представляет собой гибридный белок, полноразмерный белок, пептид или пептидный миметик; при этом полинуклеотид необязательно представляет собой ДНК или РНК, которая необязательно кодирует полипептид; при этом указанный антиген представляет собой агонист Rig-I или ID97.
18. Композиция по любому ил пп. 15-17, характеризующаяся тем, что указанная композиция дополнительно содержит адъювант, причем указанный адъювант выбран из группы, состоящей из AS-2, монофосфориллипида A, 3-де-О-ацилированного монофосфориллипида A, IFA, QS21, CWS, TOM, AGP, CpG-содержащих олигонуклеотидов, агонистов Toll-подобных рецепторов (TLR), Leif, сапонинов, миметиков сапонинов, биологического и синтетического липида A, имиквимода, гардиквимода, резиквимода, полиI:C, флагеллина, GLA, SLA, STING и их комбинаций.
19. Композиция по любому из пп. 15-18, причем указанная композиция:
(a) представляет собой жидкий состав, который необязательно может быть профильтрован через фильтр с размером пор 0,45 мкм или фильтр с размером пор 0,20 мкм; и/или
(b) может быть окончательно стерилизована перед внесением во флаконы;
(c) стабильна при температуре от приблизительно 0°C до приблизительно 8°C в течение по меньшей мере приблизительно 1 месяца, по меньшей мере приблизительно 6 месяцев или по меньшей мере приблизительно 1 года; и/или
(d) стабильна при температуре приблизительно 37°C в течение по меньшей мере приблизительно 1 месяца.
20. Способ стимуляции иммунного ответа у субъекта, включающий введение субъекту композиции по любому из пп. 15-19, что приводит к стимуляции иммунного ответа у указанного субъекта.
21. Способ по п. 20, характеризующийся тем, что указанный иммунный ответ представляет собой неспецифический иммунный ответ или антигенспецифический иммунный ответ.
22. Способ по п. 21, характеризующийся тем, что указанный иммунный ответ представляет собой преимущественно TH1 иммунный ответ, или указанный иммунный ответ представляет собой преимущественно TH2 иммунный ответ, или указанный иммунный ответ представляет собой как TH1, так и TH2 иммунный ответ.
23. Способ по п. 22, характеризующийся тем, что указанный иммунный ответ включает активацию В-клеток, активацию T-клеток, выработку антител или высвобождение цитокинов.
24. Способ по любому из пп. 20-23, характеризующийся тем, что указанную композицию применяют для лечения аллергии, зависимости, рака или аутоиммунного заболевания.
25. Способ по любому из пп. 19-24, характеризующийся тем, что указанный субъект представляет собой человека или млекопитающее, отличное от человека, причем млекопитающее, отличное от человека, представляет собой собаку, кошку, корову или лошадь.
| WO 2007098186 A2, 30.08.2007 | |||
| BERKOVICH Y | |||
| et al, Preparation of Amorphous Aluminum Oxide-Hydroxide Nanoparticles in Amphiphilic Silicone-Based Copolymer Microemulsions, Journal of Colloid and Interface Science, 2002, v | |||
| Льночесальная машина | 1923 |
|
SU245A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| US 6093406 A, 25.07.2000 | |||
| WO 2015044616 A1, 02.04.2015 | |||
| WO 2008028956 A1, 13.03.2008 | |||
| WO 2009146523 A1, | |||
Авторы
Даты
2021-08-24—Публикация
2017-05-31—Подача