Данные о родственных заявках
По настоящей заявке испрашивается приоритет по предварительной заявки США № 62/468595, поданной 8 марта 2017, которая настоящим включена в настоящее описание посредством ссылки во всей своей полноте для всех целей.
Заявление о государственных интересах
Это изобретение было сделано при государственной поддержке в соответствии с 5DP1CA186693 от Национального института здравоохранения. Правительство имеет определенные права на изобретение.
Предшествующий уровень техники
Область техники, к которой относится изобретение
Варианты осуществления настоящего изобретения в целом относятся к способам и композициям для амплификации ДНК, такой как ДНК из одной клетки, или внеклеточной ДНК, с целью сохранения информации о метилировании или статусе метилирования.
Описание области техники, к которой относится изобретение
Конверсия геномной ДНК бисульфитом натрия является золотым стандартом анализа метилирования ДНК. Обработка ДНК бисульфитом превращает цитозиновые остатки в урацил, но оставляет 5-метилцитозиновые остатки без изменений. Этот способ дает возможность дифференцировать неметилированные и метилированные цитозины и обеспечивает карту статуса метилирования ДНК с однонуклеотидным разрешением.
Основная проблема бисульфитной конверсии заключается в деградации и фрагментации ДНК, которая происходит одновременно с конверсией. Условия, необходимые для полной конверсии, такие как длительное время инкубации, повышенная температура и высокая концентрация бисульфита, могут привести к деградации и фрагментации до 90% инкубированной ДНК. Деградация происходит в виде депуринизации ДНК, что приводит к случайным разрывам цепей. Обширная деградация является проблемой, и тем более, например, когда речь идет об ограниченном количестве исходной ДНК или даже ДНК на уровне отдельных клеток. Бисульфитное секвенирование в единичной клетке с низким охватом достигается прямым осуществлением бисульфитной конверсии в одной клетке с последующей амплификацией ДНК. Guo, H., et al. (2013). «Single-cell methylome landscapes of mouse embryonic stem cells and early embryos analyzed using reduced representation bisulfite sequencing». Genome Res 23(12): 2126-2135; Smallwood, S. A., et al. (2014) «Single-cell genome-wide bisulfite sequencing for assessing epigenetic heterogeneity». Nat Methods 11(8): 817-820.
Способность проводить исследования метилирования генома с высоким охватом ДНК на уровне отдельных клеток важна в исследованиях, где межклеточная вариация и гетерогенность популяции играют ключевую роль, таких как исследование роста опухоли, перепрограммирования стволовых клеток, формирования памяти, эмбрионального развития и т.д. Это также важно, когда образцы клеток, подлежащие анализу, являются ценными или редкими, или имеются в незначительных количествах, например, когда образец представляет собой одну клетку или геном, полностью или частично, из отдельной клетки или внеклеточной ДНК.
Различные известные способы амплификации, такие как способы амплификации всего генома, приводят к амплификации ДНК, где информация о метилировании или статус метилирования исходной матрицы утрачены. Такие способы амплификации всего генома включают амплификацию с множественным вытеснением цепи (MDA), которая является распространенным способом, используемым в данной области техники в отношении геномной ДНК из одной клетки перед секвенированием и другими анализами. В этом способе случайный отжиг праймера сопровождается удлинением с использованием ДНК-полимеразы с высокой активностью замещения цепей. Исходная геномная ДНК из одной клетки амплифицируется экспоненциально каскадным образом с образованием гиперразветвленных структур ДНК. Другой способ амплификации геномной ДНК из одной клетки описан в Zong, C., Lu, S., Chapman, A.R., and Xie, X.S. (2012), «Genome-wide detection of single-nucleotide and copy-number variations of a single human cell», Science 338, 1622-1626, где описаны циклы амплификации на основе множественного отжига и выпетливания (MALBAC). Другим известным в данной области способом является ПЦР с вырожденными олигонуклеотидными праймерами или DOP-ПЦР. Несколько других способов, используемых с одноклеточной геномной ДНК, включают способы, описанные в Cheung, V.G. and S.F. Nelson, «Whole genome amplification using a degenerate oligonucleotide primer allows hundreds of genotypes to be performed on less than one nanogram of genomic DNA», Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(25): p.14676-9; Telenius, H., et al., «Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer», Genomics, 1992. 13(3): p. 718-25; Zhang, L., et al., «Whole genome amplification from a single cell: implications for genetic analysis». Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(13): p. 5847-51; Lao, K., N.L. Xu, and N.A. Straus, «Whole genome amplification using single-primer PCR», Biotechnology Journal, 2008, 3(3): p.378-82; Dean, F.B., et al., «Comprehensive human genome amplification using multiple displacement amplification», Proceedings of the National Academy of Sciences of the United States of America, 2002. 99(8): p.5261-6; Lage, J.M., et al., «Whole genome analysis of genetic alterations in small DNA samples using hyperbranched strand displacement amplification and array-CGH», Genome Research, 2003, 13(2): p. 294-307; Spits, C., et al., «Optimization and evaluation of single-cell whole-genome multiple displacement amplification», Human Mutation, 2006, 27(5): p. 496-503; Gole, J., et al., «Massively parallel polymerase cloning and genome sequencing of single cells using nanoliter microwells», Nature Biotechnology, 2013. 31(12): p.1126-32; Jiang, Z., et al., «Genome amplification of single sperm using multiple displacement amplification», Nucleic Acids Research, 2005, 33(10): p.e91; Wang, J., et al., «Genome-wide Single-Cell Analysis of Recombination Activity and De Novo Mutation Rates in Human Sperm», Cell, 2012. 150(2): p.402-12; Ni, X., «Reproducible copy number variation patterns among single circulating tumor cells of lung cancer patients», PNAS, 2013, 110, 21082-21088; Navin, N., «Tumor evolution inferred by single cell sequencing», Nature, 2011, 472(7341):90-94; Evrony, G.D., et al., «Single-neuron sequencing analysis of l1 retrotransposition and somatic mutation in the human brain», Cell, 2012. 151(3): p. 483-96; и McLean, J.S., et al., «Genome of the pathogen Porphyromonas gingivalis recovered from a biofilm in a hospital sink using a high-throughput single-cell genomics platform», Genome Research, 2013. 23(5): p.867-77. Способы, направленные на аспекты амплификации полного генома, описаны в WO 2012/166425, US 7718403, US 2003/0108870 и US 7402386.
Однако существует потребность в дополнительных способах амплификации небольших количеств геномной ДНК или фрагментов ДНК, таких как из ДНК одной клетки или небольшой группы клеток, или внеклеточной ДНК, где ампликоны сохраняют информацию о метилировании исходной матрицы.
Краткое изложение сущности изобретения
Настоящее изобретение обеспечивает способ получения или использования фрагментов ДНК, которые затем могут быть подвергнуты денатурации и удлинению праймера, например, удлинению одного праймера, например, с использованием условий ПЦР для получения двух копий полуметилированных двухцепочечных матриц или фрагментов. Две копии полуметилированных двухцепочечных матриц или фрагментов обрабатывают метилтрансферазой для метилирования цитозина во вновь синтезированных участках цепи, где исходный матричный двухцепочечный фрагмент был метилирован, т.е. где метильные группы могли быть удалены в результате реакции удлинения. Процесс удлинения праймера с образованием полуметилированной двухцепочечной ДНК и обработки метилтрансферазой может быть повторен для получения амплифицированных двухцепочечных фрагментов ДНК, имеющих паттерн метилирования исходных матричных фрагментов двухцепочечной ДНК. Популяция амплифицированных фрагментов ДНК, имеющих характеристики метилирования исходных матричных фрагментов, может быть проанализирована для определения характеристик метилирования.
Способы фрагментации включают способы, известные в данной области техники, и включают фрагментацию с транспозазой, где транспозазу или транспосому используют для фрагментации оригинальной или исходной последовательности нуклеиновых кислот, такой как геномная ДНК, ее фрагменты, внеклеточная ДНК и т.д., и для прикрепления штрихкодовой последовательности к каждому концу разреза или участка фрагментации, чтобы облегчить последующее компьютерное объединение последовательностей фрагментов в качестве части сборки de novo всего или целого метилома, если это необходимо.
Дополнительные признаки и преимущества некоторых вариантов осуществления настоящего изобретения станут более очевидными из последующего описания вариантов осуществления и их чертежей, а также из формулы изобретения.
Краткое описание чертежей
Документы патента или заявки содержит как минимум один чертеж, выполненный в цвете. Копии этого патента или публикации патентной заявки с цветными чертежами будут предоставлены Ведомством по запросу и уплате необходимой пошлины. Вышеизложенные и другие признаки и преимущества настоящего изобретения будут более понятны из следующего подробного описания иллюстративных вариантов осуществления, взятых вместе с прилагаемыми чертежами, на которых:
Фиг.1 схематически изображает способ фрагментации образца геномной нуклеиновой кислоты с последующей денатурацией и удлинением праймера и обработкой метилирующим агентом. Цикл повторяют от 2 до 4 раз, чтобы получить амплифицированный метилом, который затем подвергают обработке бисульфитом или ферментом, таким как член семейства ABOPEC, или другим реагентом для превращения цитозина в урацил.
Фиг.2 представляет собой график, показывающий процент метилированного цитозина в выровненных один раз чтениях результатов бисульфитного секвенирования с использованием набора 2x150bp Miseq v2 (1 000 000 чтений).
Фиг.3 представляет собой график, показывающий эффективность метилтрансферазы DNMT1.
Фиг.4 является схематическим изображением, демонстрирующим способ диагностики рака с использованием способов амплификации и метилирования, описанных в настоящем документе.
Фиг.5 изображает данные, анализирующие эффективность с использованием синтетических олигонуклеотидов для чувствительного к метилированию рестрикционного фермента Clai in vitro для разработки оптимального реакционного буфера для реакций амплификации и метилирования, описанных в настоящем документе.
Фиг.6 представляет данные, оценивающие эффективность переноса метила DNMT1 в определенных буферных условиях.
Фиг.7 изображает данные, оценивающие эффективность переноса метила DNMT1 для первого и второго раунда денатурации и удлинения праймера и обработки метилирующим агентом в определенных буферных условиях.
Подробное описание изобретения
Практика определенных вариантов осуществления или признаки определенных вариантов осуществления могут использовать, если не указано иное, общепринятые методы молекулярной биологии, микробиологии, рекомбинантной ДНК и так далее, которые известны специалистам в данной области техники. Такие приемы подробно описаны в литературе. См., например, Sambrook, Fritsch, and Maniatis, «MOLECULAR CLONING: A LABORATORY MANUAL, Second Edition» (1989), «OLIGONUCLEOTIDE SYNTHESIS» (M. J. Gait Ed., 1984), «ANIMAL CELL CULTURE» (R. I. Freshney, Ed., 1987), серию «METHODS IN ENZYMOLOGY» (Academic Press, Inc.); «GENE TRANSFER VECTORS FOR MAMMALIAN CELLS» (J. M. Miller and M. P. Calos eds. 1987), «HANDBOOK OF EXPERIMENTAL IMMUNOLOGY», (D. M. Weir and C. C. Blackwell, Eds.), «CURRENT PROTOCOLS IN MOLECULAR BIOLOGY» (F. M. Ausubel, R. Brent, R. E. Kingston, D. D. Moore, J. G. Siedman, J. A. Smith, and K. Struhl, eds., 1987), «CURRENT PROTOCOLS IN IMMUNOLOGY» (J. E. coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach and W. Strober, eds., 1991); «ANNUAL REVIEW OF IMMUNOLOGY»; а также монографии в журналах, таких как «ADVANCES IN IMMUNOLOGY». Все патенты, патентные заявки и публикации, упомянутые в настоящем документе, как выше, так и ниже, тем самым включены в настоящий документ посредством ссылки.
Термины и символы химии нуклеиновых кислот, биохимии, генетики и молекулярной биологии, используемые в настоящем документе, соответствуют терминам стандартных трактатов и текстов в данной области техники, например, Kornberg and Baker, «DNA Replication, Second Edition» (W.H. Freeman, New York, 1992); Lehninger, «Biochemistry, Second Edition» (Worth Publishers, New York, 1975); Strachan and Read, «Human Molecular Genetics, Second Edition» (Wiley-Liss, New York, 1999); Eckstein, editor, «Oligonucleotides and Analogs: A Practical Approach» (Oxford University Press, New York, 1991); Gait, editor, «Oligonucleotide Synthesis: A Practical Approach» (IRL Press, Oxford, 1984); и тому подобных.
Участки CpG или участки CG представляют собой области ДНК, где за цитозиновым нуклеотидом следует гуаниновый нуклеотид в линейной последовательности оснований в направлении 5'→3'. У млекопитающих цитозины в динуклеотидах CpG могут метилироваться с образованием 5-метилцитозина. Метилирование цитозина в гене может изменить его экспрессию, обычно приводит к сайленсингу или супрессии транскрипции. У млекопитающих от 70 до 80% цитозинов CpG метилированы, а у человека существует 28 миллионов участков CpG. Обнаружено, что метилирование цитозинов ДНК у млекопитающих в контексте динуклеотида CpG связано с рядом ключевых процессов, включая эмбриогенез, геномный импринтинг, инактивацию Х-хромосомы, старение и канцерогенез. В эмбриогенезе паттерны метилирования ДНК в значительной степени стираются, а затем восстанавливаются между поколениями у млекопитающих. Почти все метилирования от родителей стираются, сначала во время гаметогенеза, и снова в раннем эмбриогенезе, причем деметилирование и реметилирование происходят каждый раз. При многих патологических процессах, таких как рак, CpG островки промотеров генов приобретают аномальное гиперметилирование, что приводит к транскрипционному сайленсингу, который может наследоваться дочерними клетками после деления клеток.
Настоящее изобретение основано на признании того, что точный анализ метилирования генома зависит от сохранения информации о метилировании во время процессинга ДНК, такой как ДНК в незначительных количествах или ДНК из одной клетки или внеклеточная ДНК. Настоящее изобретение обеспечивает способ амплификации ДНК из одной клетки или небольшого количества ДНК для получения ампликонов, имеющих информацию о метилировании или статус метилирования исходной матричной ДНК. В соответствии с одним аспектом способы, описанные в настоящем документе для обеспечения изучения метилирования ДНК, обеспечивают дополнительные способы диагностики рака путем сравнения статуса метилирования образца ДНК от индивидуума, такого как образец внеклеточной ДНК, полученный из крови, со статусом метилирования ДНК, характерным для рака, то есть со стандартом. Если статус метилирования образца ДНК коррелирует со статусом метилирования стандарта, указывающего на рак, то у индивидуума диагностируют рак. Паттерны метилирования для раковой ДНК, которые могут служить стандартом в описанных здесь способах, известны специалистам в данной области техники, как описано в Vadakedath S., Kandi V. (2016) «DNA Methylation and Its Effect on Various Cancers: An Overview». J Mol Biomark Diagn S2:017. doi: 10.4172/2155-9929.S2-017 и «A DataBase of Methylation Analysis on different type of cancers: MethHC: a database of DNA methylation and gene expression in human cancer». W.Y. Huang, S.D. Hsu, H.Y. Huang, Y.M. Sun, C.H. Chou, S.L. Weng, H.D. Huang* Nucleic Acids Res. 2015 Jan; 43 (Database issue): D856-61, каждый из которых включен в настоящее описание посредством ссылки во всей полноте.
Согласно одному аспекту, фрагменты двухцепочечной ДНК, такой как внеклеточная ДНК, или фрагменты ДНК, полученные из более крупной ДНК, такой как геномная ДНК, денатурируют в первую матричную одноцепочечную ДНК и вторую матричную одноцепочечную ДНК с последующим удлинением праймера, таким как одиночное удлинение праймера, каждой из первой матричной одноцепочечной ДНК и второй матричной одноцепочечной ДНК с образованием первой полуметилированной двухцепочечной ДНК и второй полуметилированной двухцепочечной ДНК. Двухцепочечная ДНК является полуметилированной, поскольку комплементарная цепь, созданная удлинением праймера, не имеет статуса метилирования исходной цепи, которую она заменила. Затем полуметилированную двухцепочечную ДНК обрабатывают метилирующим агентом, таким как метилтрансфераза, такая как DNMT1, для получения фрагментов метилированной двухцепочечной ДНК, что приводит к репликации статуса метилирования или информации о метилировании исходной матрицы. Если метилирование приводит к исходному статусу метилирования исходной матрицы, метилирование полуметилированной двухцепочечной ДНК считается полным. Этот процесс денатурации, удлинения праймера с образованием полуметилированной двухцепочечной ДНК и обработки метилирующим агентом для восстановления метилирования можно повторять множество раз, например, от 1 до 3 раз, от 1 до 4 раз или от 1 до 5 раз, т.е. процесс можно проводить от 2 до 4 раз, от 2 до 5 раз или от 2 до 6 раз, чтобы получить амплифицированные фрагменты, имеющие статус метилирования или информацию о метилировании исходных матричных фрагментов. Амплифицированные фрагменты, имеющие статус метилирования или информацию о метилировании исходных матричных фрагментов, можно затем обрабатывать реагентом, который превращает цитозин в урацил, как известно в данной области техники, а обработанные амплифицированные фрагменты можно затем секвенировать, как известно в данной области техники, например, с использованием высокопроизводительных методик секвенирования, для определения природы и степени метилирования, паттернов метилирования, наличия или отсутствия метилирования и т.д. Согласно одному аспекту процесс амплификации обеспечивает достаточное количество ампликонов с исходным статусом метилирования исходной матрицы, так чтобы компенсировать потерю ДНК из-за деградации путем обработки реагентом, который превращает цитозин в урацил, такой как деградация из-за обработки бисульфитом, или выпадения аллеля при проведении реакций ПЦР, при этом все еще имея достаточно ДНК для анализа метилирования.
Метилирующие агенты известны специалистам в данной области техники и станут очевидными из настоящего раскрытия. Метилирующие агенты могут представлять собой метилтрансферазу. Одним из примеров метилирующего агента является DNMT1. DNMT1 является наиболее распространенной ДНК-метилтрансферазой в клетках млекопитающих и считается ключевой поддерживающей метилтрансферазой благодаря своей способности преимущественно метилировать полуметилированные CpG динуклеотиды в геноме млекопитающих. Этот фермент в 7-100 раз более активен в отношении полуметилированной ДНК по сравнению с неметилированным субстратом in vitro. Путем комбинирования одного раунда реакции ПЦР и инкубации DNMT1 на геномной ДНК можно добиться репликации статуса метилирования геномной ДНК. Кроме того, петли репликации метилирования можно выполнять многократно, что приводит к 32-кратному увеличению исходной ДНК для бисульфитной конверсии или ферментативной конверсии, такой как с APOBEC или другим агентом, который превращает цитозин в урацил. Дополнительные полезные метилирующие агенты включают DNMT3a и DNMT3b, которые представляют собой метилтрансферазы млекопитающих. Дополнительные полезные метилирующие агенты включают DRM2, MET1 и CMT3, которые представляют собой метилтрансферазы растений. Дополнительные полезные метилирующие агенты включают Dam, который представляет собой бактериальную метилтрансферазу. Согласно одному аспекту следует понимать, что DNMT1 или другие подходящие метилтрансферазы используются с источником метила и могут использоваться с кофактором или без кофакторов, известных специалистам в данной области техники. DNMT1 работает in vitro с эффективностью 95% без кофактора, однако DNMT1 можно использовать с кофактором, таким как NP95 (Uhrf1), как описано в Bashtrykov P1, Jankevicius G, Jurkowska RZ, Ragozin S, Jeltsch A. «The UHRF1 protein stimulates the activity and specificity of the maintenance DNA methyltransferase DNMT1 by an allosteric mechanism». J Biol Chem. 2014, настоящим включенном посредством ссылки во всей полноте.
Согласно одному аспекту, для метилтрансферазы, такой как DNMT1, могут потребоваться условия, такие как буферные условия, которые не включают ионы (такие как катионы), такие как ионы магния или ионы марганца, которые могут быть компонентом или условием ПЦР реакции, используемой для удлинения праймера. Специалист в данной области техники легко поймет природу и объем ионов, таких как катионы, которые используются для удлинения праймера или реакций ПЦР. В соответствии с одним аспектом, хелатирующий агент, такой как ЭДТА, используют после стадии удлинения праймера для хелатирования ионов, таких как ионы магния, для проведения стадии метилирования. Специалист в данной области техники поймет, что стадия хелатирования предназначена для хелатирования ионов, которые используются на стадии удлинения праймера, но которые могут ингибировать стадию метилирования. Следует понимать, что в некоторых условиях ионы магния могут присутствовать в реакционной среде на стадии метилирования. Однако в определенном варианте осуществления, где стадию удлинения праймера и стадию метилирования проводят в одном сосуде с одной и той же средой, стадия очистки не требуется, поскольку хелатирующий агент, такой как ЭДТА, используется для хелатирования магния в эквимолярном отношении, чтобы обеспечить не содержащий магния буфер для реакции переноса метила. Магний пополняют обратно в реакции для следующей стадии удлинения праймера в условиях ПЦР после завершения реакций переноса метила. Типичные хелатообразующие агенты включают иминодиянтарную кислоту (IDS), полиаспарагиновую кислоту, этилендиамин-N, N'-диянтарную кислоту (EDDS), метилглициндиуксусную кислоту, хелаты на основе аминополикарбоксилата, N-диуксусную кислоту или тетранатриевую соль.
Реагенты для превращения цитозина в урацил известны специалистам в данной области техники и включают бисульфитные реагенты, такие как бисульфит натрия, бисульфит калия, бисульфит аммония, бисульфит магния, метабисульфит натрия, метабисульфит калия, метабисульфит аммония, метабисульфит магния и тому подобное. Ферментативные реагенты для превращения цитозина в урацил, то есть цитозин-деаминазы, включают представители семейства ABOPEC, такие как APOBEC-seq или APOBEC3A. Члены семейства APOBEC представляют собой цитидин-дезаминазы, которые превращают цитозин в урацил, сохраняя при этом 5-метилцитозин, т.е. не изменяя 5-метилцитозин. Такие ферменты описаны в US 2013/0244237 и могут быть получены от New England Biolabs. Другие ферментативные реагенты станут очевидными для специалистов в данной области на основании настоящего раскрытия.
Образец ДНК, обработанный бисульфитным реагентом, таким как бисульфит натрия, может преобразовать цитозин в урацил и оставить 5-метилцитозин (mC) без изменений. Таким образом, после обработки бисульфитом 5-mC в ДНК остается в виде цитозина, а немодифицированный цитозин будет заменен на урацил. Обработку бисульфитом моно выполнять с помощью коммерческих наборов, таких как Imprint DNA Modification Kit (Sigma), EZ DNA Methylation-Direct™ Kit (ZYMO) и т.д. После завершения бисульфитной конверсии ДНК одноцепочечную ДНК захватывают, десульфонируют и очищают. Обработанная бисульфитом ДНК может быть захвачена колоннами очистки или магнитными гранулами. Обработанную бисульфитом ДНК дополнительно десульфонируют щелочным раствором, предпочтительно гидроксидом натрия. Затем ДНК элюируют и собирают в пробирку для ПЦР. Обработанную бисульфитом одноцепочечную ДНК можно превратить в дцДНК посредством ферментативно-катализируемого синтеза цепи ДНК с соответствующими праймерами. Подходящие ферменты включают Bst ДНК-полимеразу, экзонуклеазо-дефицитный большой фрагмент ДНК-полимеразы Кленова, phi29 ДНК-полимеразу, Т4 ДНК-полимеразу, Т7 ДНК-полимеразу, обратную транскриптазу ВИЧ-1, обратную транскриптазу M-MLV, обратную транскриптазу AMV и тому подобное. Эти ферменты распознают урацил в матрице оцДНК как тимин и добавляют аденин к комплементарной цепи. Дальнейшее удлинение полимеразы на комплементарной цепи приведет к репликации исходной матрицы оцДНК, обработанной бисульфитом, за исключением замены урацила тимином. Таким образом, путем идентификации превращения всего цитозина в тимин и превращения гуанина в аденин (комплементарная цепь) посредством сравнения с эталонным геномом можно идентифицировать весь немодифицированный цитозин, в то время как оставшийся цитозин считается метилированным.
Для анализа целого метилома одной клетки используют случайные праймеры, предпочтительно 6-8 меры и наиболее предпочтительно гексамеры. Для диагностики рака используют набор (20+) выбранных бисульфитных ПЦР-праймеров (предназначенных для амплификации ДНК, обработанной бисульфитом), которые нацелены на различные метилированные гены для дифференцировки рака (гены, которые метилированы или неметилированы только при определенном типе рака). Типичные гены, связанные с раком, включают ген SEPT9, TMEM106A, NCS1, UXS1, HORMAD2, REC8, DOCK8, CDKL5 и тому подобное. Другие связанные с раком гены станут очевидными для специалистов в данной области техники на основе настоящего раскрытия. Выбор праймеров основан на стандартных данных метилирования для рака. Различные комбинации статуса метилирования целевых генов идентифицируют определенный тип рака, присутствующий у индивидуума.
Соответственно, способы, описанные в настоящем документе, могут быть применены на образце нуклеиновой кислоты, таком как небольшое количество геномной ДНК или ограниченное количество ДНК, такой как внеклеточная ДНК, такой как геномная последовательность или геномные последовательности, полученные из одной клетки или множества клеток одного и того же клеточного типа или из эмбриона, образца ткани, жидкости или крови, полученного от индивидуума или субстрата. В соответствии с некоторыми аспектами настоящего изобретения образец нуклеиновой кислоты может находиться в неочищенном или необработанном лизате из одной клетки. Согласно некоторым аспектам настоящего раскрытия, образец нуклеиновой кислоты может представлять собой внеклеточную ДНК, такую как присутствующая в жидком биологическом образце, таком как кровь. Нуклеиновые кислоты, которые должны подвергаться способам, раскрытым в данном документе, не нуждаются в очистке, такой как очистка на колонке, перед контактированием с различными реагентами и в различных условиях, как описано в настоящем документе.
В соответствии с определенным аспектом способ, описанный в настоящем документе, может называться способом амплификации метилирования или циклами репликации метилома с помощью метилтрансферазы (MERLOT). Способы, описанные в настоящем документе, обеспечивают предварительную амплификацию геномной ДНК на уровне отдельных клеток или небольших количеств ДНК, в то же время сохраняя информацию о метилировании или статус метилирования исходной последовательности матричной дцДНК. Согласно одному иллюстративному аспекту способ объединяет один раунд реакции ПЦР и инкубацию метилтрансферазы DNMT1 человека на ДНК для достижения репликации статуса метилирования ДНК. Согласно одному аспекту, увеличение количества исходной ДНК для бисульфитной конверсии в 2-32 раза, увеличение в 2-19 раз, увеличение в 2-18 раз, увеличение в 2-17 раз, увеличение в 2-16 раз, увеличение в 2-8 раз, увеличение в 2-4 раза достигается путем многократного выполнения цикла репликации метилома. Такая амплифицированная ДНК может компенсировать потерю ДНК во время бисульфитной конверсии или амплификации всего генома и приводит к большей эффективности в характеристике статуса метилирования ДНК, такой как ДНК на уровне отдельных клеток или небольшие количества ДНК.
Варианты осуществления настоящего изобретения используют способы получения фрагментов ДНК, например, фрагментов ДНК из целого генома отдельной клетки или небольшого количества ДНК, или ДНК из эмбриона, которые затем могут быть подвергнуты описанному здесь способу амплификации для сохранения информации о метилировании, сопровождаемому способами секвенирования, известными специалистам в данной области техники и описанными в настоящем документе.
Способы получения фрагментов ДНК из исходного образца ДНК известны специалистам в данной области техники. Один подход включает обработку ультразвуком с последующим восстановлением конца и лигированием адаптерной последовательности. Для диагностики рака набор (20+) выбранных целевых праймеров для ПЦР (для нормальной ДНК) используют для создания ампликонов ДНК с сайтами праймирования на обоих концах. Гены-мишени включают ген SEPT9, TMEM106A, NCS1, UXS1, HORMAD2, REC8, DOCK8, CDKL5 и тому подобные.
Согласно одному иллюстративному аспекту описаны способы получения фрагментов нуклеиновой кислоты с использованием фермента, такого как Tn5. Такие способы известны в данной области техники и включают способы, осуществляемые с использованием набора Illumina Nextera. В соответствии с одним примерным аспектом способы, описанные в данном документе, используют библиотеку транспосом и способ, называемый «тагментацией», в той степени, в которой фрагменты создаются из большей последовательности дцДНК, где фрагменты помечены праймерами для использования в удлинении и амплификации одного праймера. В целом, транспозаза как часть транспосомы используется для создания набора фрагментов двухцепочечной геномной ДНК. Согласно определенным аспектам, транспозазы обладают способностью связываться с ДНК транспозона и обеспечивать димеризацию при совместном контакте, например, когда их помещают в реакционный сосуд или реакционный объем, образуя комплексный димер транспозазы/ ДНК транспозона, называемый транспосомой. Каждая ДНК транспозона из транспосомы включает двухцепочечный сайт связывания транспозазы и первую последовательность нуклеиновых кислот, включающую последовательность, стимулирующую амплификацию, такую как специфический участок праймирования («участок связывания праймера») или участок промотора транскрипции. Первая последовательность нуклеиновых кислот может быть в форме одноцепочечного удлинения.
Транспосомы обладают способностью случайным образом связываться с участками-мишенями вдоль двухцепочечных нуклеиновых кислот, таких как двухцепочечная геномная ДНК, образуя комплекс, включающий транспосому и двухцепочечную геномную ДНК. Транспозазы в транспосоме расщепляют двухцепочечную геномную ДНК, причем одна транспозаза расщепляет верхнюю цепь, и одна транспозаза расщепляет нижнюю цепь. Каждая из ДНК транспозона в транспосоме прикреплена к двухцепочечной геномной ДНК на каждом конце участка разреза, т.е. одна ДНК транспозона из транспосомы прикреплена к левостороннему участку разреза, а другая ДНК транспозона из транспосомы прикреплена к правостороннему участку разреза. Таким образом, левосторонний участок разреза и правосторонний участок разреза обеспечивают участок связывания праймера.
Согласно некоторым аспектам множество комплексных димеров транспозазы/ ДНК транспозона, т.е. транспосомы, связываются с соответствующим множеством целевых участков, например, вдоль двухцепочечной геномной ДНК, а затем расщепляют двухцепочечную геномную ДНК на множество фрагментов двухцепочечной геномной ДНК, где каждый фрагмент имеет ДНК транспозона с участком связывания праймера, присоединенным на каждом конце двухцепочечного фрагмента. Таким образом, участки связывания праймеров можно использовать в реакции удлинения одного праймера.
Согласно одному аспекту, ДНК транспозона присоединена к двухцепочечной геномной ДНК, и существует одноцепочечный гэп между одной цепью геномной ДНК и одной цепью ДНК транспозона. Согласно одному аспекту, удлинение гэпа выполняют, чтобы заполнить гэп и создать двухцепочечное соединение между двухцепочечной геномной ДНК и двухцепочечной ДНК транспозона. В соответствии с одним аспектом последовательность нуклеиновых кислот, включающая участок связывания транспозазы и последовательность, стимулирующую амплификацию ДНК транспозона, присоединена на каждом конце двухцепочечного фрагмента. Согласно определенным аспектам, транспозаза присоединяется к ДНК транспозона, которая присоединена на каждом конце двухцепочечного фрагмента. Согласно одному аспекту транспозазы удаляют из ДНК транспозона, которая присоединена на каждом конце фрагментов двухцепочечной геномной ДНК.
Согласно одному аспекту настоящего изобретения фрагменты двухцепочечной геномной ДНК, продуцируемые транспозазами, которые имеют ДНК транспозона, присоединенную на каждом конце фрагментов двухцепочечной геномной ДНК, затем заполняют гэп и удлиняют посредством участка связывания с праймером, используя ДНК транспозона как матрицу. Соответственно, получают продукт удлинения двухцепочечной нуклеиновой кислоты, который включает фрагмент двухцепочечной геномной ДНК и двухцепочечную ДНК транспозона, включающую последовательность, стимулирующую амплификацию, то есть последовательность удлинения праймера, на каждом конце двухцепочечной геномной ДНК.
На этой стадии продукт удлинения двухцепочечной нуклеиновой кислоты, включающий фрагмент геномной ДНК и последовательность, стимулирующую амплификацию, может быть подвергнут удлинению праймера с использованием способов, известных специалистам в данной области техники, для получения пары полуметилированной двухцепочечной ДНК. Затем пару полуметилированной двухцепочечной ДНК инкубируют с метилирующим агентом, таким как метилтрансфераза, такая как DNMT1, и источником метильных групп для размещения метильных групп на цепи, которая была создана путем удлинения праймера, чтобы соответствовать метилированию исходной матричной цепи. Таким образом, можно сказать, что способ добавляет метильные группы или восстанавливает метильные группы, или восстанавливает информацию о метилировании или статус метилирования исходной матричной цепи, который был утрачен из-за реакции удлинения одного праймера для создания комплементарной цепи.
Удлинение праймера включает использование удлинения одного или нескольких праймеров. Удлинение одного праймера включает использование промоторной последовательности, которая может представлять собой специфический участок связывания праймера на каждом конце двухцепочечной геномной ДНК. Ссылка на «специфический» участок связывания праймера указывает, что два участка связывания праймера имеют одинаковую последовательность, и поэтому праймер с общей последовательностью можно использовать для удлинения всех фрагментов. Последовательности и реагенты для праймеров ПЦР можно использовать для удлинения. Способ удлинения может быть выполнен любое количество раз по необходимости, чтобы максимизировать создание ампликонов, имеющих информацию о метилировании исходного матричного фрагмента.
Затем ампликоны могут быть собраны и/или очищены перед дальнейшим анализом. Ампликоны могут быть амплифицированы и/или секвенированы с использованием способов, известных специалистам в данной области техники. После секвенирования информацию о метилировании фрагментов можно анализировать с использованием способов, известных специалистам в данной области техники, и затем их можно сравнивать со стандартами метилирования, соответствующими определенным заболеваниям, например, в качестве способа диагностики индивидуума с определенным заболеванием.
Варианты осуществления настоящего изобретения направлены на способ получения ампликонов ДНК, имеющих статус метилирования или информацию о метилировании исходной матрицы ДНК, которая может быть утрачена в результате реакций амплификации и/или удлинения праймера для создания комплементарной цепи. ДНК может представлять собой небольшое количество геномной ДНК или ограниченное количество ДНК, такое как геномная последовательность или геномные последовательности, полученные из одной клетки или множества клеток одного типа клеток или из образца ткани, жидкости или крови, т.е. циркулирующую ДНК, полученную от индивидуума или субстрата. В соответствии с определенными аспектами настоящего изобретения в способах, описанных в настоящем документе, используются способы тагментации фрагментированной ДНК с использованием транспозазы, включающей праймер для удлинения, для получения дцДНК, которая включает участки удлинения праймера, или использование направленной ПЦР для получения ампликонов целевых генов. Эти фрагменты могут быть денатурированы в отдельные цепи и удлинены, а информация о метилировании восстановлена. Этот процесс может быть повторен много раз, чтобы получить усиленный метилом, который можно подвергнуть бисульфитной конверсии или обработке ABOPEC. Подвергнутый бисульфитной конверсии амплифицированный метилом затем может быть подвергнут амплификации и/или секвенированию, например, с использованием высокопроизводительных платформ секвенирования, известных специалистам в данной области техники. Статус метилирования может быть проанализирован в соответствии со способами, известными в данной области техники, такими как анализ информации о секвенировании.
Способы, описанные в настоящем документе, имеют конкретное применение в биологических системах или образцах тканей, характеризующихся высоко гетерогенными клеточными популяциями, таких как опухолевые и нервные образования. Способы, описанные в настоящем документе, могут использовать различные источники материалов ДНК, включая генетически гетерогенные ткани (например, рак), редкие и ценные образцы (например, эмбриональные стволовые клетки) и неделящиеся клетки (например, нейроны) и тому подобное, а также платформы секвенирования и методы генотипирования, известные специалистам в данной области техники.
Согласно одному аспекту получают ДНК, такую как геномная нуклеиновая кислота, полученная из лизированной отдельной клетки. Используют множество транспосом или библиотеку транспосом для разрезания ДНК на двухцепочечные фрагменты. Каждая транспосома из множества или библиотеки представляет собой димер транспозазы, связанной с ДНК транспозона, то есть каждая транспосома включает две отдельных ДНК транспозона. Каждая ДНК транспозона из транспосомы включает участок связывания транспозазы и последовательность, облегчающую амплификацию или удлинение, такой как участок связывания специфического праймера, например, для способов удлинения одного праймера.
ДНК транспозона становится прикрепленной к верхней и нижней цепям каждого двухцепочечного фрагмента в каждом участке разреза или фрагментации. Затем двухцепочечные фрагменты обрабатывают для заполнения гэпов. Затем фрагменты подвергают удлинению по одному праймеру для получения полуметилированной дцДНК, которую затем подвергают обработке метилтрансферазой для добавления метильной группы в различных местах для репликации статуса метилирования исходной матрицы дцДНК. Этот процесс повторяют для получения популяции амплифицированных матричных фрагментов, имеющих характеристики метилирования исходных матричных фрагментов. Могут быть определены характеристики метилирования. Согласно одному аспекту фрагменты могут быть амплифицированы и/или секвенированы, и могут быть определены характеристики метилирования.
В определенных аспектах амплификация удлинения праймера достигается в условиях ПЦР. ПЦР представляет собой реакцию, в которой реплицированные копии получают из целевого полинуклеотида с использованием пары праймеров или набора праймеров, состоящих из прямого праймера и обратного праймера, и катализатора полимеризации, такого как ДНК полимераза, и обычно термически стабильного полимеразного фермента. Способы ПЦР хорошо известны в данной области техники и описаны, например, в MacPherson et al. (1991) «PCR 1: A Practical Approach» (IRL Press at Oxford University Press). Термин «полимеразная цепная реакция» («ПЦР») Mullis (патенты США №№ 4,683,195, 4,683,202 и 4,965,188) относится к способу увеличения концентрации сегмента целевой последовательности без клонирования или очистки. Этот процесс амплификации целевой последовательности включает обеспечение олигонуклеотидных праймеров с необходимой целевой последовательностью и реагентов для амплификации с последующей точной последовательностью термоциклирования в присутствии полимеразы (например, ДНК-полимеразы). Праймеры являются комплементарными их соответствующим цепям («последовательности связывания праймеров») двухцепочечной целевой последовательности. Для осуществления амплификации двухцепочечную целевую последовательность денатурируют, а затем праймеры отжигают с их комплементарными последовательностями в целевой молекуле. После отжига праймеры удлиняют с помощью полимеразы, чтобы образовать новую пару комплементарных цепей. При необходимости стадии денатурации, отжига праймера и полимеразного удлинения могут повторяться много раз (т.е. денатурация, отжиг и удлинение составляют один «цикл»; может быть множество «циклов») для получения высокой концентрации амплифицированного сегмента необходимой целевой последовательности. Согласно настоящему изобретению после одного цикла полученные ампликоны обрабатывают реагентом, добавляющим метил, или ферментом, таким как метилтрансфераза, такая как DNMT1, для добавления метильных групп к фрагментам двухцепочечной нуклеиновой кислоты. Длина амплифицированного сегмента необходимой целевой последовательности определяется относительными положениями праймеров по отношению друг к другу, и следовательно, эта длина является контролируемым параметром. В силу повторяющегося аспекта процесса этот способ называется «полимеразной цепной реакцией» (далее «ПЦР»), а целевая последовательность называется «ПЦР-амплифицированной». ПЦР-амплификация достигает насыщения, когда двухцепочечный продукт амплификации ДНК накапливается до такого количества, что активность ДНК-полимеразы ингибируется. После насыщения амплификации ПЦР достигает плато, где продукт амплификации не увеличивается с повышением количества циклов ПЦР.
С помощью ПЦР можно амплифицировать единственную копию специфической целевой последовательности в геномной ДНК до уровня, определяемого несколькими различными методологиями (например, гибридизацией с меченым зондом; включением биотинилированных праймеров с последующим обнаружением с конъюгатом авидин-фермент; включением 32Р-меченых дезоксинуклеотидтрифосфатов, таких как дЦТФ или дАТФ, в амплифицированный сегмент). В дополнение к геномной ДНК любая олигонуклеотидная или полинуклеотидная последовательность может быть амплифицирована с соответствующим набором молекул праймеров. В частности, амплифицированные сегменты, созданные процессом ПЦР как таковым, сами по себе являются эффективными матрицами для последующей амплификации ПЦР. Способы и наборы для проведения ПЦР хорошо известны в данной области техники. Все процессы получения реплицированных копий полинуклеотида, такие как ПЦР или клонирование генов, вместе упоминаются в настоящем документе как репликация. Праймер также можно использовать в качестве зонда в реакциях гибридизации, таких как Саузерн- или Нозерн-блоттинг.
Выражение «амплификация» или «амплифицирование» относится к процессу, посредством которого получают дополнительные или множественные копии конкретного полинуклеотида. Амплификация включает такие способы, как ПЦР, лигазно-зависимая амплификация (или лигазная цепная реакция, ЛЦР) и другие способы амплификации. Эти способы известны и широко применяются в данной области техники. См., нпример, патенты США № 4683195 и 4683202 и Innis et al., «PCR protocols: a guide to method and applications» Academic Press, Incorporated (1990) (для ПЦР); и Wu et al. (1989) Genomics 4:560-56 (для LCR). В общем, процедура ПЦР описывает способ амплификации генов, который включает (i) специфичную для последовательности гибридизацию праймеров со специфическими генами в образце (или библиотеке) ДНК; (ii) последующую амплификацию, включающую множественные циклы отжига, удлинения и денатурации с использованием ДНК-полимеразы; и (iii) скрининг продуктов ПЦР с определением полосы правильного размера. Используемые праймеры представляют собой олигонуклеотиды достаточной длины и подходящей последовательности для обеспечения инициации полимеризации, то есть каждый праймер специально сконструирован так, чтобы быть комплементарным каждой цепи геномного локуса, подлежащего амплификации.
Реагенты и оборудование для проведения реакций амплификации доступны в продаже. Праймеры, подходящие для амплификации последовательностей из определенной области гена, предпочтительно являются комплементарными и специфически гибридизуются с последовательностями в целевой области или во фланкирующих областях и могут быть получены с использованием способов, известных специалистам в данной области техники. Последовательности нуклеиновых кислот, полученные амплификацией, могут быть секвенированы напрямую.
Когда гибридизация происходит в антипараллельной конфигурации между двумя одноцепочечными полинуклеотидами, реакцию называют «отжигом», и эти полинуклеотиды описываются как «комплементарные». Двухцепочечный полинуклеотид может быть комплементарен или гомологичен другому полинуклеотиду, если может происходить гибридизация между одной из цепей первого и второго полинуклеотида. Комплементарность или гомология (степень, в которой один полинуклеотид комплементарен другому) количественно определяется с точки зрения доли оснований в противоположных цепях, которые, как ожидается, образуют водородные связи друг с другом, в соответствии с общепринятыми правилами спаривания оснований.
Термины «продукт ПЦР», «фрагмент ПЦР» и «продукт амплификации» относятся к полученной смеси соединений после завершения одного или нескольких циклов стадий денатурации, отжига и удлинения ПЦР. Эти термины охватывают случай, когда произошла амплификация одного или нескольких сегментов одной или нескольких целевых последовательностей.
Термин «реагенты для амплификации» может относиться к тем реагентам (дезоксирибонуклеотид трифосфатам, буферу и т.д.), которые необходимы для амплификации, за исключением праймеров, матрицы нуклеиновых кислот и фермента амплификации. Обычно реагенты для амплификации вместе с другими компонентами реакции помещают и содержат в реакционном сосуде (пробирке, микролунке и т.д.). Методы амплификации включают методы ПЦР, известные специалистам в данной области техники, и также включают амплификацию по типу катящегося кольца (Blanco et al., J. Biol. Chem., 264, 8935-8940, 1989), гиперразветвленную амплификацию по типу катящегося кольца (Lizard et al., Nat. Genetics, 19, 225-232, 1998), и изотермическую амплификацию с формированием петель (Notomi et al., Nuc. Acids Res., 28, e63, 2000), каждая из которых включена в настоящее описание посредством ссылки во всей полноте.
В соответствии с одним аспектом предложен способ получения амплифицированного метилома для бисульфитной обработки или обработки APOBEC, который включает обеспечение контакта двухцепочечной геномной ДНК из одной клетки с Tn5 транспозазами, каждая из которых связана с ДНК транспозона, где ДНК транспозона включает двухцепочечный участок связывания транспозазы (Tnp) длиной 19 п.н. и первую последовательность нуклеиновых кислот, включающую участок связывания праймера для образования комплексного димера транспозазы/ ДНК транспозона, называемого транспосомой. Первая последовательность нуклеиновых кислот может быть в форме одноцепочечного удлинения. Согласно одному аспекту первая последовательность нуклеиновых кислот может представлять собой липкий конец, такой как 5' липкий конец, где липкий конец включает участок праймирования. Липкий конец может быть любой длины, подходящей для включения участка праймирования по необходимости. Транспосома связывается с целевыми точками вдоль двухцепочечной геномной ДНК и расщепляет двухцепочечную геномную ДНК на множество двухцепочечных фрагментов, причем каждый двухцепочечный фрагмент имеет первый комплекс, присоединенный к верхней цепи посредством участка связывания Tnp, и второй комплекс, присоединенный к нижней цепи посредством участка связывания Tnp. Участок связывания транспозона и, следовательно, ДНК транспозона прикрепляется к каждому 5'-концу двухцепочечного фрагмента. Согласно одному аспекту, транспозазы Tn5 удаляют из комплекса. Двухцепочечные фрагменты удлиняют вдоль ДНК транспозона, чтобы получить двухцепочечный продукт удлинения, имеющий специфические участки связывания праймера на каждом конце двухцепочечного продукта удлинения. Согласно одному аспекту может быть заполнен гэп, который может возникнуть в результате присоединения участка связывания Tn5-транспозазы к двухцепочечному фрагменту геномной ДНК. Двухцепочечный продукт удлинения с заполненным гэпом денатурируют на отдельные цепи, каждую из которых подвергают удлинению с одним праймером для получения полуметилированной дцДНК с последующей обработкой метилтрансферазой, такой как DNMT1, с целью добавления метильных групп к полуметилированной дцДНК. Стадии денатурации, удлинения праймера и метилирования повторяют множество раз для создания ампликонов исходной матричной дцДНК с исходным статусом метилирования. Затем ампликоны могут быть обработаны бисульфитом или APOBEC или другим реагентом, который превращает цитозин в урацил, но без изменения 5-метилцитозина. Затем обработанную ДНК ампликона можно подвергать множественным раундам амплификации со случайным праймированием, например, с использованием экзогенных фрагментов Кленова exo- или больших фрагментов Bst, с последующими примерно 13-18 раундами реакции ПЦР с адаптерами, такими как адаптеры Illumina. Подходящий протокол амплификации описан Stephen J Clark, Sébastien A Smallwood, Heather J Lee, Felix Krueger, Wolf Reik & Gavin Kelsey. «Genome-wide base-resolution mapping of DNA methylation in single cells using single-cell bisulfite sequencing (scBS-seq)», Nature Protocols (2017), включенном посредством ссылки во всей полноте. Также можно использовать комплект для подготовки библиотеки Pico Methyl-SeqTM от ZYMO.
В соответствии с некоторыми аспектами примерная система транспозонов включает транспозазу Tn5, транспозазу Mu, транспозазу Tn7 или транспозазу IS5 и тому подобное. Другие полезные системы транспозонов известны специалистам в данной области техники и включают систему транспозонов Tn3 (см. Maekawa T., Yanagihara K. и Ohtsubo E. (1996), «A cell-free system of Tn3 transposition and transposition immunity», Genes Cells 1, 1007-1016), систему транспозонов Tn7 (см. Craig, N.L. (1991), «Tn7: a target site-specific transposon», Mol. Microbiol. 5, 2569-2573), систему транспозонов Tn10 (см. Chalmers, R., Sewitz S., Lipkow K. и Crellin P. (2000), «Complete nucleotide sequence of Tn10», J. Bacteriol 182, 2970-2972), систему транспозонов Piggybac (см. Li, X., Burnight, E.R., Cooney, A.L., Malani, N., Brady, T., Sander, J.D., Staber, J., Wheelan, S.J., Joung, J.K., McCray, P.B., Jr., et al. (2013), «PiggyBac transposase tools for genome engineering», Proc. Natl. Acad. Sci. USA 110, E2279-2287), систему транспозонов «спящая красавица» (см. Ivics, Z., Hackett, P.B., Plasterk, R.H., and Izsvak, Z. (1997), «Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells», Cell 91, 501-510), систему транспозонов Tol2 (см. Kawakami, K. (2007), «Tol2: a versatile gene transfer vector in vertebrates», Genome Biol. 8 Suppl. 1, S7).
ДНК может быть получена из биологического образца. Используемый в настоящем документе термин «биологический образец» предназначен для включения тканей, клеток, биологических жидкостей и их изолятов, выделенных у субъекта, а также тканей, клеток и жидкостей, присутствующих у субъекта, но не ограничивается ими.
ДНК может быть получена из одной клетки или небольшой популяции клеток. ДНК может быть из любого вида или организма, включая ДНК человека, животных, растений, дрожжей, вирусов, эукариот и прокариот, но не ограничиваясь этим. В конкретном аспекте варианты осуществления относятся к способам амплификации по существу всего генома без потери представления специфических участков и, как следствие, к амплификации метилома (в настоящем документе определяемой как «амплификация всего генома»). В конкретном варианте осуществления амплификация всего генома включает амплификацию практически всех фрагментов или всех фрагментов геномной библиотеки. В еще одном конкретном варианте осуществления «по существу полный» или «по существу весь» относится к примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 97% или около 99% всех последовательностей в геноме.
В соответствии с одним аспектом образец ДНК представляет собой геномную ДНК, ДНК от хромосом с микродиссекцией, ДНК дрожжевой искусственной хромосомы (YAC), плазмидную ДНК, космидную ДНК, ДНК фага, ДНК искусственной хромосомы бактериофага Р1 (PAC), или ДНК бактериальной искусственной хромосомы (BAC), митохондриальную ДНК, хлоропластную ДНК, ДНК криминалистического образца или другую ДНК из природных или искусственных источников, подлежащую анализу. В другом предпочтительном варианте осуществления образец ДНК представляет собой ДНК млекопитающего, растительную ДНК, дрожжевую ДНК, вирусную ДНК или прокариотическую ДНК. В еще одном предпочтительном варианте осуществления образец ДНК получают от человека, коровы, свиньи, овцы, лошади, грызуна, птицы, рыбы, креветки, растения, дрожжей, вируса или бактерий. Предпочтительно образец ДНК представляет собой геномную ДНК.
В соответствии с некоторыми примерными аспектами система транспозиции используется для получения фрагментов нуклеиновой кислоты для множественного удлинения праймера и реакций метилирования для получения амплифицированного метилома для бисульфитной обработки, например, в одном реакционном сосуде. В соответствии с иллюстративным вариантом осуществления, показанным на фиг.1, одна клетка сначала захватывается в буфер для лизиса в пробирке для ПЦР для высвобождения гДНК. Затем геномную ДНК подвергают Tn5 тагментации и фрагментируют в дцДНК размером приблизительно 1 т.п.н. с комплементарными участками праймирования ПЦР на обоих концах. Полученные фрагменты дцДНК подвергают тепловой денатуризации в оцДНК с последующим удлинением праймера с образованием полуметилированной дцДНК. Полуметилированную дцДНК инкубируют с DNMT1 и SAM в течение 3 часов для получения полностью метилированной дцДНК, что приводит к воспроизведению статуса метилирования исходной матрицы. Полностью метилированная дцДНК снова денатурируется под действием тепла, и петля репликации повторяется. Петля репликации может повторяться от 1 до 20 раз, от 1 до 10 раз или от 1 до 5 раз. Продукт амплификации обработан бисульфитом натрия и готов для последующего анализа.
Конкретные системы транспозиции Tn5 описаны и доступны специалистам в данной области техники. См. Goryshin, I.Y. and W.S. Reznikoff, «Tn5 in vitro transposition». The Journal of biological chemistry, 1998. 273(13): p. 7367-74; Davies, D.R., et al., «Three-dimensional structure of the Tn5 synaptic complex transposition intermediate». Science, 2000. 289(5476): p.77-85; Goryshin, I.Y., et al., «Insertional transposon mutagenesis by electroporation of released Tn5 transposition complexes». Nature biotechnology, 2000. 18(1): p. 97-100; и Steiniger-White, M., I. Rayment, and W.S. Reznikoff, «Structure/function insights into Tn5 transposition». Current opinion in structural biology, 2004. 14(1): p. 50-7, каждый из которых включен в настоящее описание посредством ссылки во всей полноте для всех целей. Известны наборы, использующие систему транспозиции Tn5 для приготовления библиотеки ДНК и других применений. См. Adey, A., et al., «Rapid, low-input, low-bias construction of shotgun fragment libraries by high-density in vitro transposition». Genome biology, 2010. 11(12): p. R119; Marine, R., et al., «Evaluation of a transposase protocol for rapid generation of shotgun high-throughput sequencing libraries from nanogram quantities of DNA. Applied and environmental microbiology», 2011. 77(22): p. 8071-9; Parkinson, N.J., et al., «Preparation of high-quality next-generation sequencing libraries from picogram quantities of target DNA». Genome research, 2012. 22(1): p. 125-33; Adey, A. and J. Shendure, «Ultra-low-input, tagmentation-based whole-genome bisulfite sequencing». Genome research, 2012. 22(6): p. 1139-43; Picelli, S., et al., «Full-length RNA-seq from single cells using Smart-seq2». Nature protocols, 2014. 9(1): p.171-81 и Buenrostro, J.D., et al., «Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position». Nature methods, 2013, каждый из которых включен в настоящее описание посредством ссылки во всей полноте для любых целей. См. также WO 98/10077, EP 2527438 и EP 2376517, каждый из которых включен в настоящее описание посредством ссылки во всей полноте. Коммерчески доступный набор для транспозиции продается под названием NEXTERA и доступен от Illumina.
Используемый в настоящем документе термин «геном» определяется как совокупный набор генов, который несет индивидуум, клетка или органелла. Используемый в настоящем документе термин «геномная ДНК» определяется как материал ДНК, содержащий частичный или полный совокупный набор генов, который несет индивидуум, клетка или органелла. Аспекты настоящего изобретения включают использование внеклеточной ДНК.
Используемый в настоящем документе термин «нуклеозид» относится к молекуле, имеющей пуриновое или пиримидиновое основание, ковалентно связанное с рибозным или дезоксирибозным сахаром. Типичные нуклеозиды включают аденозин, гуанозин, цитидин, уридин и тимидин. Дополнительные примерные нуклеозиды включают инозин, 1-метилинозин, псевдоуридин, 5,6-дигидроуридин, риботимидин, 2N-метилгуанозин и 2,2N,N-диметилгуанозин (также называемые «редкими» нуклеозидами). Термин «нуклеотид» относится к нуклеозиду, имеющему одну или несколько фосфатных групп, связанных сложноэфирными связями с сахарным фрагментом. Типичные нуклеотиды включают нуклеозидмонофосфаты, дифосфаты и трифосфаты. Термины «полинуклеотид», «олигонуклеотид» и «молекула нуклеиновой кислоты» используются в настоящем документе взаимозаменяемо и относятся к полимеру из нуклеотидов, дезоксирибонуклеотидов или рибонуклеотидов любой длины, соединенных вместе фосфодиэфирной связью между 5 'и 3' атомами углерода. Полинуклеотиды могут иметь любую трехмерную структуру и могут выполнять любую функцию, известную или неизвестную. Ниже приведены неограничивающие примеры полинуклеотидов: ген или фрагмент гена (например, зонд, праймер, метка EST или SAGE), экзоны, интроны, информационная РНК (иРНК), транспортная РНК, рибосомная РНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонды из нуклеиновых кислот и праймеры. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Термин также относится как к двухцепочечным, так и к одноцепочечным молекулам. Если иное не указано или не требуется, любой вариант осуществления этого изобретения, который включает полинуклеотид, охватывает как двухцепочечную форму, так и каждую из двух комплементарных одноцепочечных форм, известных или прогнозированных для составления двухцепочечной формы. Полинуклеотид состоит из определенной последовательности из четырех нуклеотидных оснований: аденин (А); цитозин (С); гуанин (G); тимин (T); и урацил (U) для тимина, когда полинуклеотид представляет собой РНК. Таким образом, термин полинуклеотидная последовательность представляет собой алфавитное представление полинуклеотидной молекулы. Это алфавитное представление может быть введено в базы данных на компьютере, имеющем центральный процессор, и использовано для приложений биоинформатики, таких как функциональная геномика и поиск гомологии.
Термины «ДНК», «молекула ДНК» и «молекула дезоксирибонуклеиновой кислоты» относятся к полимеру из дезоксирибонуклеотидов. ДНК может быть синтезирована естественным путем (например, путем репликации ДНК). РНК может быть посттранскрипционно модифицированной. ДНК также может быть химически синтезирована. ДНК может быть одноцепочечной (то есть оцДНК) или многоцепочечной (например, двухцепочечной, то есть дцДНК).
Термины «нуклеотидный аналог», «измененный нуклеотид» и «модифицированный нуклеотид» относятся к нестандартному нуклеотиду, включая не встречающиеся в природе рибонуклеотиды или дезоксирибонуклеотиды. В некоторых примерных вариантах осуществления нуклеотидные аналоги модифицированы в любом положении так, чтобы изменять определенные химические свойства нуклеотида, но сохранять способность нуклеотидного аналога выполнять назначенную функцию. Примеры положений нуклеотида, который может быть дериватизирован, включают положение 5, например, 5-(2-амино)пропилуридин, 5-бромуридин, 5-пропинуридин, 5-пропенилуридин и т.д.; положение 6, например 6-(2-амино)пропилуридин; положение 8 для аденозина и/или гуанозина, например, 8-бромгуанозин, 8-хлоргуанозин, 8-фторгуанозин и т.д. Нуклеотидные аналоги также включают деаза-нуклеотиды, например, 7-деаза-аденозин; O- и N-модифицированные (например, алкилированные, например, N6-метиладенозин или другие известные в данной области техники) нуклеотиды; и другие гетероциклически модифицированные нуклеотидные аналоги, такие как те, которые описаны в Herdewijn, Antisense Nucleic Acid Drug Dev., 2000 Aug. 10 (4): 297-310.
Нуклеотидные аналоги могут также содержать модификации сахарной части нуклеотидов. Например, 2'OH-группа может быть заменена группой, выбранной из H, OR, R, F, Cl, Br, I, SH, SR, NH2, NHR, NR2, COOR или OR, где R представляет собой замещенный или незамещенный C1-C6 алкил, алкенил, алкинил, арил и т.д. Другие возможные модификации включают модификации, описанные в патентах США №№ 5,858,988 и 6,291,438.
Фосфатная группа нуклеотида также может быть модифицирована, например, путем замены одного или нескольких атомов кислорода фосфатной группы серой (например, фосфоротиоатами) или путем осуществления других замен, которые позволяют нуклеотиду выполнять его намеченную функцию, как описано, например, в Eckstein, Antisense Nucleic Acid Drug Dev. 2000 Apr. 10(2):117-21; Rusckowski et al. Antisense Nucleic Acid Drug Dev. 2000 Oct. 10(5):333-45; Stein, Antisense Nucleic Acid Drug Dev. 2001 Oct. 11(5): 317-25; Vorobjev et al. Antisense Nucleic Acid Drug Dev. 2001 Apr. 11(2):77-85; и патенте США № 5,684,143. Некоторые из указанных выше модификаций (например, модификации фосфатных групп) снижают скорость гидролиза, например, полинуклеотидов, содержащих указанные аналоги, in vivo или in vitro.
Термин «in vitro» имеет общепризнанное в данной области значение, например, включающее очищенные реагенты или экстракты, например, клеточные экстракты. Термин «in vivo» также имеет общепризнанное в данной области значение, например, включающее живые клетки, например, иммортализованные клетки, первичные клетки, клеточные линии и/или клетки в организме.
Используемые в настоящем документе термины «комплементарный» и «комплементарность» используются в отношении нуклеотидных последовательностей, связанных правилами спаривания оснований. Например, последовательность 5'-AGT-3' комплементарна последовательности 5'-ACT-3'. Комплементарность может быть частичной или полной. Частичная комплементарность возникает, когда одно или несколько оснований нуклеиновых кислот не сопоставлены в соответствии с правилами спаривания оснований. Полная комплементарность между нуклеиновыми кислотами наблюдается, когда каждое основание нуклеиновой кислоты сопоставляется с другим основанием в соответствии с правилами спаривания оснований. Степень комплементарности между цепями нуклеиновых кислот оказывает существенное влияние на эффективность и силу гибридизации между цепями нуклеиновых кислот.
Термин «гибридизация» относится к спариванию комплементарных нуклеиновых кислот. На гибридизацию и силу гибридизации (то есть на силу ассоциации между нуклеиновыми кислотами) влияют такие факторы, как степень комплементарности между нуклеиновыми кислотами, жесткость условий процесса, Тп образовавшегося гибрида и отношение G:C в нуклеиновых кислотах. Одна молекула, которая содержит пары комплементарных нуклеиновых кислот в своей структуре, называется «самогибридизированной».
Термин «Тп» относится к температуре плавления нуклеиновой кислоты. Температура плавления - это температура, при которой популяция двухцепочечных молекул нуклеиновой кислоты наполовину диссоциирует на отдельные нити. Уравнение для расчета Тп нуклеиновых кислот хорошо известно в данной области техники. Как указано в стандартных ссылках, простая оценка значения Тп может быть рассчитана по уравнению: Тп = 81,5 + 0,41 (% G+C), когда нуклеиновая кислота находится в водном растворе с 1 М NaCl (см., например, Anderson and Young, «Quantitative Filter Hybridization», в Nucleic Acid Hybridization (1985)). Другие ссылки включают более сложные вычисления, которые принимают во внимание структурные характеристики и характеристики последовательности для расчета Тп.
Термин «жесткость» относится к условиям температуры, ионной силы и присутствия других соединений, таких как органические растворители, при которых проводят гибридизации нуклеиновых кислот.
«Условия низкой жесткости» при использовании в отношении гибридизации нуклеиновых кислот включают условия, эквивалентные связыванию или гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl; 6,9 г/л NaH2PO4 (H2O) и 1,85 г/л ЭДТА, рН 7,4 с доведением с помощью NaOH), 0,1% ДСН, 5х реагент Денхардта (50 х реагент Денхардта содержит на 500 мл: 5 г фиколла (тип 400, Pharmacia), 5 г БСА (фракция V плазмы крови; Sigma)) и 100 мг/мл денатурированной ДНК спермы лосося, с последующим промыванием в растворе, содержащем 5x SSPE, 0,1% ДСН при 42°C, когда используют зонд длиной около 500 нуклеотидов.
«Условия средней жесткости» при использовании в отношении гибридизации нуклеиновых кислот включают условия, эквивалентные связыванию или гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl; 6,9 г/л NaH2PO4 (H2O) и 1,85 г/л ЭДТА, pH 7,4 при доведении с помощью NaOH), 0,5% ДСН, 5x реагент Денхардта и 100 мг/мл денатурированной ДНК спермы лосося, с последующим промыванием в растворе, содержащем 1,0x SSPE, 1,0% ДСН при 42°C, когда используют зонд длиной примерно 500 нуклеотидов.
«Условия высокой жесткости» при использовании в отношении гибридизации нуклеиновых кислот включают условия, эквивалентные связыванию или гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl; 6,9 г/л NaH2PO4 (H2O) и 1,85 г/л ЭДТА, pH 7,4 при доведении с помощью NaOH), 0,5% ДСН, 5x реагент Денхардта и 100 мг/мл денатурированной ДНК спермы лосося, с последующим промыванием в растворе, содержащем 0,1x SSPE; 1,0% ДСН при 42°C, когда используют зонд длиной примерно 500 нуклеотидов.
В некоторых примерных вариантах осуществления идентифицируют клетки, а затем выделяют одну или несколько клеток. Клетки в объеме настоящего изобретения включают клетки любого типа, для которых специалистами в данной области техники считается целесообразным определить содержание ДНК. Клетка по настоящему изобретению включает раковую клетку любого типа, гепатоцит, ооцит, эмбриоцит, стволовую клетку, индуцированную плюрипотентную стволовую клетку, эмбриональную стволовую клетку, нейрон, эритроцит, меланоцит, астроцит, зародышевую клетку, олигодендроцит, клетку почки и тому подобное. Согласно одному аспекту способы по настоящему изобретению осуществляют с клеточной ДНК из одной клетки. Множество клеток включает примерно от 2 до 1 000 000 клеток, примерно от 2 до 10 клеток, примерно от 2 до 100 клеток, примерно от 2 до 1000 клеток, примерно от 2 до 10 000 клеток, примерно от 2 до 100 000 клеток, примерно от 2 до 10 клеток или примерно от 2 до 5 клеток.
Нуклеиновые кислоты, обработанные описанными в настоящем документе способами, могут представлять собой ДНК, и они могут быть получены из любого полезного источника, такого как, например, человеческий образец. В конкретных вариантах осуществления двухцепочечная молекула ДНК дополнительно определяется как содержащая геном, такой как, например, геном, полученный из образца от человека. Образец может быть любым образцом от человека, таким как кровь, сыворотка, плазма, спинномозговая жидкость, соскобы щеки, аспират из соска, биоптат, сперма (которая может называться эякулятом), моча, кал, волосяной фолликул, слюна, пот, иммунопреципитированный или физически изолированный хроматин, и т.д. В конкретных вариантах осуществления образец содержит одну клетку. В конкретных вариантах осуществления образец включает только одну клетку.
Нуклеиновая кислота, используемая в изобретении, также может включать нативные или ненативные основания. В этом отношении нативная дезоксирибонуклеиновая кислота может иметь одно или несколько оснований, выбранных из группы, состоящей из аденина, тимина, цитозина или гуанина, а рибонуклеиновая кислота может иметь одно или несколько оснований, выбранных из группы, состоящей из урацила, аденина, цитозина или гуанина. Типичные ненативные основания, которые могут быть включены в нуклеиновую кислоту, независимо от того, имеет ли она нативный каркас или аналоговую структуру, включают инозин, ксатанин, гипоксатанин, изоцитозин, изогуанин, 5-метилцитозин, 5-гидроксиметилцитозин, 2-аминоаденин, 6-метиладенин, 6-метилгуанин, 2-пропилгуанин, 2-пропиладенин, 2-тиоурацил, 2-тиотимин, 2-тиоцитозин, 15-галоурацил, 15-галоцитозин, 5-пропинилурацил, 5-пропинилцитозин, 6-азоурацил, 6-азоцитозин, 6-азотимин, 5-урацил, 4-тиоурацил, 8-галоаденин или гуанин, 8-аминоаденин или гуанин, 8-тиоладенин или гуанин, 8-тиоалкиладенин или гуанин, 8-гидроксиладенин или гуанин, 5-галогензамещенный урацил или цитозин, 7-метилгуанин, 7-метиладенин, 8-азагуанин, 8-азааденин, 7-деазагуанин, 7-деазааденин, 3-деазагуанин, 3-деазааденин или тому поодобные, но не ограничиваются ими. Конкретный вариант осуществления может использовать изоцитозин и изогуанин в нуклеиновой кислоте для уменьшения неспецифической гибридизации, как описано в целом в патенте США № 5,681,702.
В конкретных вариантах осуществления амплифицированный метилом, который был обработан бисульфитом или APOBEC или другим реагентом, который превращает цитозин в урацил, и проанализирован на метилирование, обеспечивает диагностическую или прогностическую информацию. Например, амплифицированный метилом, который был обработан бисульфитом или APOBEC или другим реагентом, который превращает цитозин в урацил, и проанализирован на метилирование, может обеспечить информацию о числе копий генома и/или последовательности, информацию о геномном импринтинге, информацию об аллельных вариациях, диагностику рака, пренатальную диагностику, информацию об отцовстве, информацию о диагностике, обнаружении, мониторинге и/или лечении заболевания, информацию о последовательности и т.д.
Используемый в настоящем документе термин «отдельная клетка» относится к одной клетке. Отдельные клетки, используемые в описанных здесь способах, можно получить из интересующей ткани или из биоптата, образца крови или клеточной культуры. Кроме того, клетки из конкретных органов, тканей, опухолей, новообразований или тому подобного могут быть получены и использованы в описанных здесь способах. Кроме того, в целом, клетки из любой популяции могут быть использованы в этих способах, такие как популяция прокариотических или эукариотических одноклеточных организмов, включая бактерии или дрожжи. Суспензия отдельных клеток может быть получена с использованием стандартных способов, известных в данной области техники, включая, например, ферментативный способ с использованием трипсина или папаина для расщепления белков, связывающих клетки в образцах ткани, или высвобождения прилипших клеток в культуре, или механического разделения клеток в образце. Отдельные клетки могут быть помещены в любой подходящий реакционный сосуд, в котором отдельные клетки могут обрабатываться индивидуально. Например, можно применять 96-луночный планшет, так что каждая отдельная клетка помещается в одну лунку.
Способы манипулирования отдельными клетками известны в данной области техники и включают флуоресцентную сортировку клеток (FACS), проточную цитометрию (Herzenberg., PNAS USA 76: 1453-55 1979), микроманипуляции и использование полуавтоматических сборщиков клеток (например, системы переноса клеток Quixell™ от Stoelting Co.). Отдельные клетки, например, могут быть индивидуально выбраны на основе признаков, обнаруживаемых при микроскопическом наблюдении, таких как местоположение, морфология или экспрессия репортерного гена. Кроме того, комбинация градиентного центрифугирования и проточной цитометрии также может быть использована для повышения эффективности выделения или сортировки.
Как только желаемая клетка идентифицирована, клетку лизируют для высвобождения клеточного содержимого, включая ДНК, с использованием методов, известных специалистам в данной области техники. Содержимое клетки содержится в сосуде или объеме для сбора. В некоторых аспектах изобретения клеточное содержимое, такое как геномная ДНК, можно высвобождать из клеток путем лизиса клеток. Лизис может быть достигнут, например, путем нагревания клеток, или с использованием детергентов или других химических методов, или с помощью их комбинации. Однако может быть использован любой подходящий метод лизиса, известный в данной области техники. Например, нагревание клеток при 72°С в течение 2 минут в присутствии Твин-20 достаточно для лизиса клеток. Альтернативно, клетки можно нагревать до 65°С в течение 10 минут в воде (Esumi et al., Neurosci Res 60(4): 439-51 (2008)); или 70°C в течение 90 секунд в буфере для ПЦР II (Applied Biosystems) с добавлением 0,5% NP-40 (Kurimoto et al., Nucleic Acids Res 34(5): e42 (2006)); или лизис может быть достигнут с помощью протеазы, такой как протеиназа К, или с помощью хаотропных солей, таких как изотиоцианат гуанидина (патентная публикация США № 2007/0281313). Амплификация геномной ДНК в соответствии со способами, описанными в настоящем докменте, может быть выполнена непосредственно на клеточных лизатах, так что реакционная смесь может быть добавлена к клеточным лизатам. Альтернативно, клеточный лизат может быть разделен на два или более объема, таких как два или более контейнеров, пробирок или областей, с использованием способов, известных специалистам в данной области техники, с частью клеточного лизата, содержащейся в каждом объемном контейнере, пробирке или области. Геномная ДНК, содержащаяся в каждом контейнере, пробирке или области, может быть затем амплифицирована способами, описанными в данном документе, или способами, известными специалистам в данной области техники.
Используемый в настоящем документе термин «праймер» обычно включает олигонуклеотид, природный или синтетический, который способен при образовании дуплекса с полинуклеотидной матрицей действовать в качестве точки инициации синтеза нуклеиновой кислоты, такой как праймер для секвенирования, и удлиняться от его 3' конца вдоль матрицы, так что образуется расширенный дуплекс. Последовательность нуклеотидов, добавленных в процессе удлинения, определяется последовательностью матричного полинуклеотида. Обычно праймеры удлиняются ДНК-полимеразой. Праймеры обычно имеют длину в диапазоне от 3 до 36 нуклеотидов, также от 5 до 24 нуклеотидов, также от 14 до 36 нуклеотидов. Праймеры в объеме изобретения включают ортогональные праймеры, амплификационные праймеры, конструкционные праймеры и тому подобное. Пары праймеров могут фланкировать интересующую последовательность или набор интересующих последовательностей. Праймеры и зонды могут быть вырожденными или квази-вырожденными в последовательности. Праймеры в объеме настоящего изобретения связываются рядом с целевой последовательностью. «Праймером» можно считать короткий полинуклеотид, обычно со свободной 3'-ОН группой, которая связывается с мишенью или матрицей, потенциально присутствующей в интересующем образце, путем гибридизации с мишенью, и после этого способствует полимеризации полинуклеотида комплементарно мишени. Праймеры по настоящему изобретению состоят из нуклеотидов в диапазоне от 17 до 30 нуклеотидов. В одном аспекте праймер представляет собой по меньшей мере 17 нуклеотидов или альтернативно, по меньшей мере 18 нуклеотидов, или альтернативно, по меньшей мере 19 нуклеотидов, или альтернативно, по меньшей мере 20 нуклеотидов, или альтернативно, по меньшей мере 21 нуклеотид, или альтернативно, по меньшей мере 22 нуклеотида, или альтернативно, по меньшей мере 23 нуклеотида, или альтернативно, по меньшей мере 24 нуклеотида, или альтернативно, по меньшей мере 25 нуклеотидов, или альтернативно, по меньшей мере 26 нуклеотидов, или альтернативно, по меньшей мере 27 нуклеотидов, или альтернативно, по меньшей мере 28 нуклеотидов, или альтернативно, по меньшей мере 29 нуклеотидов, или альтернативно, по меньшей мере 30 нуклеотидов, или альтернативно, по меньшей мере 50 нуклеотидов, или альтернативно, по меньшей мере 75 нуклеотидов, или альтернативно, по меньшей мере 100 нуклеотидов.
Праймеры включают те праймеры, которые специфичны для выбранных целевых локусов, например, ДНК, ассоциированной с заболеванием, таким как рак, и могут упоминаться как праймеры, специфичные для локусов-мишеней, праймеры, специфичные для заболевания, или онкоспецифические праймеры. Использование таких праймеров, специфичных для локусов-мишеней, праймеров, специфичных для заболевания, или онкоспецифических праймеров позволяет амплифицировать локусы-мишени, такие как ДНК, специфичная для заболевания, или онкоспецифическая ДНК, тем самым позволяя идентифицировать ДНК, специфичную для заболевания, или онкоспецифическую ДНК, чтобы диагностировать индивидуума с заболеванием или раком.
Выражение «амплификация» или «амплифицирование» относится к процессу, посредством которого образуются дополнительные или множественные копии конкретного полинуклеотида.
Амплифицированный метилом, который был обработан бисульфитом или APOBEC или другим реагентом, который превращает цитозин в урацил, может быть амплифицирован, секвенирован и проанализирован с использованием методов, известных специалистам в данной области техники. Определение представляющей интерес последовательности нуклеиновой кислоты может быть выполнено с использованием различных методов секвенирования, известных в данной области техники, включая секвенирование путем гибридизации (SBH), секвенирование путем лигирования (SBL) (Shendure et al. (2005) Science 309: 1728), количественное последовательное добавление флуоресцентных нуклеотидов (QIFNAS), ступенчатое лигирование и расщепление, резонансный перенос энергии флуоресценции (FRET), молекулярные маяки, расщепление репортерным зондом TaqMan, пиросеквенирование, флуоресцентное секвенирование in situ (FISSEQ), FISSEQ гранулы (патент США № 7,425,431), wobble-секвенирование (PCT/US 05/27695), мультиплексное секвенирование (заявка США № 12/027,039, поданная 6 февраля 2008; Porreca et al. (2007) Nat. Methods 4:931), секвенирование полимеризованной колонии (POLONY) (патенты США № 6432360, 6485944 и 6511803 и PCT/US05/06425); секвенирование по типу катящегося кольца с использованием нанорешеток (ROLONY) (заявка США № 12/120,541, поданная 14 мая 2008), аллель-специфические анализы лигирования олигонуклеотидов (например, анализ лигирования олигонуклеотидов (OLA)), OLA с одной матричной молекулой с использованием лигированного линейного зонда и амплификации по типу катящегося кольца (RCA), лигированные замыкающие кольцо зонды и/или OLA с одной матричной молекулой с использованием лигированного кольцевого замыкающего кольцо зонда и амплификацией по типу катящегося кольца (RCA) и т.д. Могут также использоваться способы высокопроизводительного секвенирования, например, с использованием платформ, таких как Roche 454, Illumina Solexa, AB-SOLiD, Helicos, платформы Polonator и т.д. В данной области техники известно множество технологий секвенирования на основе света (Landegren et al. (1998) Genome Res. 8: 769-76; Kwok (2000) Pharmacogenomics 1: 95-100; Shi (2001) Clin. Chem. 47: 164-172).
Другие методы секвенирования включают высокопроизводительные методы скрининга, такие как технология секвенирования SOLID компании Applied Biosystems или анализатор генома Illumina. В одном аспекте изобретения ДНК может быть секвенирована методом дробовика. Количество чтений может составлять по меньшей мере 10000, по меньшей мере 1 млн, по меньшей мере 10 млн, по меньшей мере 100 млн или по меньшей мере 1000 млн. В другом аспекте число чтений может составлять от 10 000 до 100 000, или альтернативно, от 100 000 до 1 миллиона, или альтернативно, от 1 миллиона до 10 миллионов, или альтернативно, от 10 миллионов до 100 миллионов, или альтернативно, от 100 миллионов до 1000 миллионов. «Чтение» - это длина непрерывной последовательности нуклеиновой кислоты, полученной в результате реакции секвенирования.
«Секвенирование методом дробовика» относится к методу, используемому для секвенирования очень большого количества ДНК (такого как весь геном). В этом методе ДНК, подлежащую секвенированию, сначала измельчают на более мелкие фрагменты, которые можно секвенировать по отдельности. Последовательности этих фрагментов затем повторно собирают в их первоначальном порядке на основе их перекрывающихся последовательностей, получая, таким образом, полную последовательность. «Измельчение» ДНК может быть выполнено с использованием ряда различных методик, включая расщепление рестриктазой или механической фрагментацией. Перекрывающиеся последовательности обычно выравнивают с помощью компьютера, запрограммированного соответствующим образом. Методы и программы для секвенирования библиотеки кДНК методом дробовика хорошо известны в данной области техники.
Описанные в настоящем документе способы полезны в области прогностической медицины, в которой диагностические анализы, прогностические анализы, фармакогеномика и мониторинг клинических испытаний используются в прогностических (предиктивных) целях, чтобы таким образом лечить человека с профилактической целью. Соответственно, один аспект настоящего изобретения относится к диагностическим анализам для определения геномной ДНК, чтобы определить, подвержен ли индивидуум риску развития расстройства и/или заболевания. Такие анализы могут быть использованы в прогностических или предиктивных целях, чтобы таким образом профилактически лечить человека до развития расстройства и/или заболевания. Соответственно, в некоторых примерных вариантах осуществления предлагаются способы диагностики и/или прогнозирования одного или нескольких заболеваний и/или расстройств с использованием одного или нескольких описанных в настоящем документе способов профилирования экспрессии.
В некоторых примерных вариантах осуществления обеспечен читаемый электронным устройством носитель, содержащий одну или несколько последовательностей геномной ДНК, описанных в данном документе. Используемый здесь термин «читаемый электронным устройством носитель» относится к любому подходящему носителю для хранения, выдержки или содержания данных или информации, которые могут быть считаны и доступны непосредственно с помощью электронного устройства. Такие носители могут включать магнитные носители данных, такие как гибкие диски, жесткие диски и магнитные ленты; оптические носители информации, такие как компакт-диск; электронные носители, такие как RAM, ROM, EPROM, EEPROM и т.п.; обычные жесткие диски и гибриды этих категорий, такие как магнитные/оптические носители данных, но не ограничиваются ими. Носитель адаптирован или сконфигурирован для записи на нем одного или нескольких описанных в настоящем документе профилей экспрессии.
Используемый в настоящем документе термин «электронное устройство» предназначен для включения любого подходящего вычислительного или обрабатывающего устройства или другого устройства, сконфигурированного или приспособленного для хранения данных или информации. Примеры электронных устройств, подходящих для использования с настоящим изобретением, включают автономное вычислительное устройство; сети, включая локальную сеть (LAN), глобальную сеть (WAN), Интернет, Интранет и Экстранет; электронные приборы, такие как карманные персональные компьютеры (КПК), сотовый телефон, пейджер и т.п.; и локальные и распределенные системы обработки.
Как используется в данном документе, «записанный» относится к процессу хранения или кодирования информации на считываемом электронным устройством носителе. Специалисты в данной области техники могут легко принять любой из известных в настоящее время способов записи информации на известные носители для создания производств, содержащих один или несколько описанных здесь профилей экспрессии, описанных в данном документе.
Для хранения информации о геномной ДНК по настоящему изобретению на считываемом электронным устройством носителе можно применять множество программ и форматов. Например, последовательность нуклеиновых кислот может быть представлена в файле обработки текста, отформатированном в коммерческом программном обеспечении, таком как WordPerfect и MicroSoft Word, или представлена в форме файла ASCII, сохраненного в приложении базы данных, таком как DB2, Sybase, Oracle или тому подобное, а также в других формах. Любое количество форматов структурирования процессора данных (например, текстовый файл или база данных) может использоваться для получения или создания носителя, на котором записаны один или несколько описанных в настоящем документе профилей экспрессии.
Следует понимать, что варианты осуществления настоящего изобретения, которые были описаны, являются просто иллюстрацией некоторых применений принципов настоящего изобретения. Специалистами в данной области техники могут быть сделаны многочисленные модификации на основе представленных здесь идей без отклонения от истинной сущности и объема изобретения. Содержание всех ссылок, патентов и опубликованных патентных заявок, процитированных в настоящем документе, включено посредством ссылки во всей полноте для всех целей.
Следующие примеры приведены в качестве иллюстративных для настоящего изобретения. Эти примеры не должны рассматриваться как ограничивающие объем изобретения, поскольку эти и другие эквивалентные варианты осуществления будут очевидны с точки зрения настоящего раскрытия, чертежей и прилагаемой формулы изобретения.
ПРИМЕР I
Протокол
Следующий общий протокол полезен для амплификации целого метилома одной клетки. Выделение отдельных клеток может быть выполнено путем пипетирования, лазерной диссекции, микрофлюидных устройств, проточной цитометрии и тому подобного.
В целом, отдельную клетку лизируют в литическом буфере. Транспосому с последовательностью участка связывания праймера и буфером транспозиции добавляют к лизату клеток. Протеазу добавляют после транспозиции для удаления транспозазы от связывания с геномной ДНК одной клетки. К реакционной смеси добавляют экзо-ДНК-полимеразу Deep Vent®, dNTP, реакционный буфер для ПЦР и праймеры, чтобы заполнить гэп, образованный после вставки транспозона. После восстановления гэпа фрагменты ДНК денатурируют. Полученная в результате оцДНК с комплементарными концами, таким образом, будет формировать структуру «стебель-петля». Для амплификации структур «стебель-петля» проводят реакцию ПЦР с одним праймером при постепенном снижении температуры отжига. Полученные продукты удлинения затем инкубируют с реагентом метилирования, таким как DNMT1. После инкубации, в зависимости от того, сколько раундов повторения метилирования необходимо, реакцию ПЦР DeepVent и инкубацию DNMT1 можно проводить несколько раз. Продукт может быть непосредственно обработан реагентом для бисульфитной конверсии с использованием набора Zymo EZ-Direct Bisulfite Kit.
Ниже приведен более конкретный протокол амплификации целого метилома в одной клетке.
Лизис отдельной клетки
Отдельную клетку выделяют с помощью флуоресцентного сортинга или пипетки в 2,5 мкл литического буфера. Буфер для лизиса содержит: 1,825 мкл Н2О; 0,05 мкл 1 М ТЕ-буфера с рН 8,0; 0,05 мкл 1 М KCl; 0,375 мкл 0,1 М DTT; 0,075 мкл 10% Triton Х-100; 0,125 мкл 20 мг/мл протеазы Q (Qiagen). Реакцию лизиса осуществляют в следующем термоцикле: 50°C в течение 20 минут, 75°C в течение 20 минут, 80°C в течение 5 минут. После лизиса дцДНК высвобождается из одной клетки.
Tn5 тагментация
Транспозонный комплекс Tn5 готовят для тагментации следующим образом. Смешивают 1 мкл очищенного 5 мкМ белка Tn5 с 1 мкл 5 мкМ дцДНК Tn5. Инкубируют при 25°С в течение 45 минут. Добавляют 98 мкл буфера для разведения Tn5 к 2 мкл транспозонной смеси для получения 0,05 мкМ комплекса Tn5. Буфер для разведения Tn5 включает 10 мкл 1 М TE буфера с рН 8,0; 4 мкл 0,5 М NaCl и 84 мкл H2O. дцDNA Tn5 включает верхнюю цепь 5'-CAT TAC GAG CGA GAT GTG TAT AAG AGA CAG-3' и нижнюю цепь 5'-Phos-CTG TCT CTT ATA CAC ATC invdT-3'. К 2,5 мкл клеточного лизата добавляют 1,5 мкл 0,05 мкМ транспозонного комплекса Tn5 и 1 мкл 5х буфера для вставки Tn5. Условия 1x буфера для Буфера для вставки Tn5 включают 10 мМ Трис-HCl, 5 мМ MgCl2 при рН 7,8 при 25°С. Инкубируют 5 мкл реакции при 50°С в течение 10 минут. Добавляют 1 мкл 1 мг/мкл протеазы Q (Qiagen) к реакционной смеси и инкубируют при следующем термоцикле: 50°C в течение 20 минут и 70°C в течение 30 минут. Полученная дцДНК должна иметь длину 500-1000 п.н. с участками праймирования ДНК по 30 п.н., добавленными на обоих концах, оставляя гэп в 9 п.н. на 3'-конце.
Восстановление гэпа и 1-й раунд реакции ПЦР
Чтобы заполнить гэп в 9 п.н., для восстановления гэпа используют экзополимеразу Deep Vent® с активностью замещения цепи. После восстановления гэпа фрагменты ДНК денатурируют под воздействием нагревания. Полученная в результате оцДНК с комплементарными концами образует структуру «стебель-петля». Для амплификации структур стебель-петля проводят реакцию ПЦР с одним праймером при постепенно снижающейся температуре отжига. К 6 мкл реакции добавляют 1 мкл 10-х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ 30 п.н. оцДНК праймера, имеющего последовательность 5'-CAT TAC GAG CGA GAT GTG TAT AAG AGA CAG-3'; 0,2 мкл 100 мМ MgSO4 и 2,3 мкл H2O. Условия 1x ПЦР-буфера включают 20 мМ Трис-HCl; 10 мМ KCl; 0,1% Trition X-100 с pH 7,8 при 25°C. При 10 мкл реакции проводят следующий термоцикл: 72°C в течение 10 минут, 95°C в течение 3 минут, 68°C в течение 60 секунд, 67°C в течение 60 секунд, 66°C в течение 60 секунд, 65°C в течение 60 секунд, 64°C в течение 60 секунд, 63°C в течение 60 секунд, 62°C в течение 60 секунд, 61°C в течение 60 секунд, 60°C в течение 60 секунд, 59°C в течение 60 секунд, 58°C в течение 60 секунд и 72°С в течение 3 минут. Это приводит к получению полуметилированных фрагментов дцДНК.
1-й раунд реакции переноса метила DNMT1
Полученные продукты удлинения затем инкубируют с DNMT. ЭДТА добавляют для хелатирования Mg2+. К 10 мкл реакции добавляют 1,5 мкл 10-х буфера для переноса метила (МТ); 0,15 мкл 160 мкМ SAM; 0,15 мкл 100 мкг/мл БСА; 0,3 мкл 200 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,9 мкл H2O. Условия 1х буфера для MERLOT MT буфера включают 20 мМ Трис-HCl, 1 мМ DTT, 5% глицерина, pH 7,8 при 25°C. Реакцию 15 мкл инкубируют при 37°С в течение 3 часов. Это приводит к метилированным фрагментам дцДНК и полному циклу амплификации, т.е. удлинению одного праймера и метилированию.
Множество раундов амплификации и метилирования по требованию
Дополнительные 1–20, 1–10 или 1–5 циклов амплификации и метилирования могут быть выполнены при необходимости. Термоцикл является таким же, как 1-й раунд амплификации и метилирования. Следующие реагенты должны быть добавлены для 2-го, 3-го, 4-го, 5-го и т.д. раундов амплификации и метилирования, соответственно.
2-й раунд амплификации, ПЦР
К 15 мкл реакции добавляют 1 мкл 10-х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 мкл/мкл экзополимеразы DeepVent; 0,2 мкл 1 мкл 30 п.н. оцДНК праймера; 0,55 мкл 100 мМ MgSO4 и 2,95 мкл H2O.
2-й раунд DNMT1 реакции переноса метила
К 20 мкл реакции добавляют 1 мкл 10-х буфера для переноса метила (МТ); 0,25 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,325 мкл 100 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,15 мкл 100 мМ DTT и 1,175 мкл H2O.
3-й раунд амплификации, ПЦР
К 25 мкл реакции добавляют 1 мкл 10х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкл 30 п.н. оцДНК праймера; 0,85 мкл 100 мМ MgSO4 и 2,65 мкл H2O.
3-й раунд реакции переноса метила DNMT1
К 30 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (MT) MERLOT; 0,35 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,475 мкл 200 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,25 мкл 100 мМ DTT и 0,825 мкл H2O.
4-й раунд ПЦР
К 35 мкл реакции добавляют 1 мкл 10х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ 30 п.н. оцДНК праймера; 1,15 мкл 100 мМ MgSO4 и 2,35 мкл H2O.
4-й раунд реакции переноса метила DNMT1
К 40 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (MT); 0,45 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,625 мкл 200 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,35 мкл 100 мМ DTT и 0,475 мкл H2O.
5-й раунд ПЦР
К 45 мкл реакции добавляют 1 мкл 10х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкл 30 п.н. оцДНК праймера; 1,45 мкл 100 мМ MgSO4 и 2,05 мкл H2O.
5-й раунд реакции переноса метила DNMT1
К 50 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (MT); 0,55 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,775 мкл 100 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,45 мкл 100 мМ DTT и 0,125 мкл H2O.
Амплифицированную дцДНК, которая была полностью метилирована, можно непосредственно обработать бисульфитом натрия с использованием коммерческих наборов, таких как Zymo EZ-Direct Bisulfite Kit. Подвергнутая бисульфитной конверсии ДНК готова для последующего анализа, такого как бисульфитное секвенирование целого генома.
ПРИМЕР II
Наборы
Материалы и реагенты, необходимые для раскрытых способов, могут быть собраны вместе в набор. Наборы для секвенирования целого генома отдельной клетки по настоящему изобретению, как правило, будут включать по меньшей мере транспосому (состоящую из фермента транспозазы и ДНК транспозона), нуклеотиды и ДНК-полимеразу, необходимые для осуществления заявленного способа, а также наборы праймеров по мере необходимости. Набор также будет включать DNMT1 и любые необходимые буферы, включая те, которые содержат катионы, как описано в настоящем документе. Набор может также содержать хелатирующий агент для хелатирования таких катионов во время стадии метилирования, и может также включать катионы для пополнения реакционной среды, когда выполняется удлинение праймера. Набор также будет содержать инструкции по созданию амплифицированного метилома из образцов ДНК. Наборы для ранней диагностики рака по настоящему изобретению в целом будут включать по меньшей мере выбранные наборы праймеров, нуклеотидов и ДНК-полимеразы, необходимые для осуществления заявленного способа. В комплект также войдет DNMT1 и все необходимые буферы. Набор также будет содержать инструкции по амплификации целевых областей ДНК из образцов внеклеточной ДНК. В каждом случае наборы предпочтительно будут иметь отдельные контейнеры для каждого отдельного реагента, фермента или реактанта. Каждый агент, как правило, будет соответствующим образом аликвотирован в соответствующих контейнерах. Контейнерные средства наборов обычно включают по меньшей мере один флакон или пробирку. Также возможны колбы, бутылки и другие контейнерные средства, в которые помещают реагенты и делят их на аликвоты. Отдельные контейнеры из набора предпочтительно должны содержаться в герметичной упаковке для коммерческой продажи. Подходящие большие контейнеры могут включать пластмассовые контейнеры, полученные литьем под давлением или выдувным формованием, в которые помещаются необходимые флаконы. Предпочтительно с набором обепечиваются инструкции.
ПРИМЕР III
Эффективность переноса метила
Чтобы определить эффективность переноса метила способами, описанными в настоящем документе, бисульфитное секвенирование (химический набор Miseq v2, чтение спаренных концов 2x150 пар оснований, общее количество чтений 1 000 000) было впервые выполнено на 10 пг полностью метилированной гДНК HeLa и амплифицированной ДНК, полученной в результате 1 раунда удлинения одного праймера и инкубации DNMT1, как описано в настоящем документе, из 10 пг полностью метилированной гДНК HeLa. Среди всех считываний, которые однозначно выровнены с геномом человека, 98,7% цитозина в контексте CpG метилировано для полностью метилированной гДНК HeLa, в то время как 93,60% цитозина в контексте CpG метилировано для амплифицированной ДНК, полученной в результате 1 раунда удлинения одного праймера и DNMT1 инкубациии, как описано в настоящем документе, из 10 пг полностью метилированной гДНК HeLa. См. Фигуру 2. Это указывает на эффективность переноса метила 95,1% во время инкубации DNMT1. Смотрите Фигуру 3.
Также известно, что DNMT1 обладает метилирующей активностью de-novo. Чтобы определить скорость метилирования de-novo описанных в настоящем документе способов, было проведено бисульфитное секвенирование (химический набор Miseq v2, чтение спаренных концов 2x150 пар оснований, общее количество чтений 1 000 000) на 10 пг продукта ПЦР гДНК одной клетки SM480 и амплифицированной ДНК в результате 1 раунда удлинения одного праймера и инкубации DNMT1, как описано в настоящем документе, 10 пг продукта ПЦР гДНК одной клетки SM480. См. Фигуру 2. Результат указывает на допустимую степень метилирования de-novo, равную 1,7%. Смотрите Фигуру 3.
Для секвенирования целого метилома отдельных клеток и без проведения предварительной амплификации метилома, как описано в настоящем документе, перед бисульфитной конверсией отдельную клетку можно непосредственно обработать бисульфитом натрия с последующей амплификацией и секвенированием после бисульфитной обработки. В этом случае охват метилома является низким из-за потери ДНК во время бисульфитной конверсии. Достигнутый репрезентативный охват составляет в среднем около 20% для метилома мыши. См. Smallwood, S.A., et al. (2014). «Single-cell genome-wide bisulfite sequencing for assessing epigenetic heterogeneity». Nat Methods 11(8): 817-820, настоящим включенный в настоящее описание посредством ссылки во всей полноте. Также достигается уменьшенная репрезентативная версия со средним 4% охватом метилома. См. Guo, H., et al. (2013). «Single-cell methylome landscapes of mouse embryonic stem cells and early embryos analyzed using reduced representation bisulfite sequencing». Genome Res 23(12): 2126-2135, настоящим включеный посредством ссылки во всей полноте. При таком низком охвате необходимо проанализировать большое количество клеток для достижения достаточной статистической достоверности (поскольку для охвата 20% необходимо секвенировать около 15 клеток, чтобы воспроизвести статус метилирования конкретного участка CpG не менее 3 раз), что дает возможность эффективно решать проблему гетерогенности метилирования среди клеточной популяции или анализа редких образцов, таких как человеческий эмбрион. Способы, описанные в данном документе, которые включают удлинение одного праймера и инкубацию с агентом, добавляющим метил, улучшают охват метилома в 3-4 раза, что значительно улучшает способность анализировать редкие образцы и гетерогенность клеток.
В соответствии с одним вариантом осуществления, направленным на диагностику рака, количество внеклеточной ДНК, высвобождаемой из опухоли, по сравнению с плазменной ДНК является чрезвычайно низким. Для извлечения информации о метилировании внеклеточной ДНК опухоли из основной фоновой (плазматической) ДНК современные методы требуют высокочувствительного метода детекции метилирования, например, специфичной в отношении метилирования кПЦР, которая зависит от средней или поздней стадии рака, когда количество внеклеточной ДНК от опухоли значительно выше по сравнению с ранней стадией рака. Кроме того, такие методы имеют низкую чувствительность, то есть около 50% для ранней диагностики рака. Вместо оптимизации метода детекции метилирования описанные в настоящем документе способы амплифицируют внеклеточную ДНК, сохраняя статус метилирования с использованием агента метилирования и с выбранным набором праймеров, нацеленных на дифференциально метилированные гены. Амплификация при сохранении информации о метилировании или статуса метилирования обеспечивает больше исходного материала для методов детекции и повышенную чувствительность.
В соответствии с одним аспектом эффективность переноса метила и скорость метилирования de novo используют для максимизации эффективности получения амплифицированного метилома. Эффективность переноса метила относится к проценту полуметилированных CpG, которые становятся полностью метилированными после инкубации с метилирующим агентом, таким как DNMT1. Уровень метилирования de novo относится к проценту неметилированных CpG, которые становятся полностью метилированными после инкубации.
100% эффективность переноса метила означает идеальную репликацию статуса метилирования исходных полуметилированных участков CpG матрицы. Эффективность переноса метила 95% означает, что в 1 цикле инкубации DNMT1 5% статуса метилирования будет случайным образом потеряно и введено 5% ложноотрицательных данных для анализа статуса метилирования. Для 3 раундов амплификации, то есть 3 раундов удлинения одного праймера и инкубации с метилирующим агентом, уровень ложноотрицательных результатов увеличивается экспоненциально, как 1-0,953 = 14,3%. Хотя при расчете метилирования конкретного гена принимается во внимание статус метилирования нескольких участков CpG, чтобы снизить уровень ложноотрицательных результатов, и эффективность переноса метила предпочтительно составляет по меньшей мере 95%.
0% уровень метионилирования de novo означает, что метильная группа не добавляется к неметилированным участкам CpG исходной матрицы. 2% уровень метилирования de novo означает в 1 раунде инкубации DNMT1, что 2% участков CpG, которые не были метилированы, будут случайным образом метилированы, и вводится 2% ложноположительных показателей для анализа статуса метилирования. Для 3 раундов амплификации, то есть 3 раундов удлинения одного праймера и инкубации с агентом метилирования, частота ложноположительных результатов увеличивается линейно, так как 3 × 0,02 = 6%. Хотя при расчете метилирования конкретного гена принимается во внимание статус метилирования нескольких участков CpG, чтобы снизить частоту ложноположительных результатов, и метилирование de novo предпочтительно составляет не более 2%.
ПРИМЕР IV
Способы диагностики на основе анализа метилирования
Аспекты настоящего изобретения основаны на диагностике или прогнозе состояния, такого как рак. Согласно одному аспекту образец крови, включающий внеклеточную ДНК, получают от индивидуума. Внеклеточную ДНК обрабатывают в соответствии со способами, описанными в настоящем документе, и анализируют для определения присутствия ДНК раковых клеток на основе идентификации паттерна метилирования, соответствующего ДНК раковых клеток. Путем амплификации статуса метилирования целевых дифференциально метилированных локусов, чувствительность захвата малораспространенной внеклеточной опухолевой ДНК увеличивается. Способ включает (а) фрагментацию последовательности двухцепочечной ДНК, полученной из образца крови от индивидуума, где последовательность двухцепочечной ДНК имеет паттерн метилирования, для получения фрагментных матричных последовательностей двухцепочечной ДНК, имеющих паттерн метилирования и включающих участок связывания праймера на каждом 5'-конце фрагментных матричных последовательностей двухцепочечной ДНК; (b) разделение фрагментных матричных последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи; (c) удлинение верхней и нижней матричных цепей с использованием праймера, полимеразы и нуклеотидов для получения неметилированных комплементарных цепей, приводящих к полуметилированным последовательностям двухцепочечной ДНК, соответствующим фрагментным матричным последовательностям двухцепочечной ДНК, имеющим паттерн метилирования; (d) обработку полуметилированных последовательностей двухцепочечной ДНК для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих фрагментных матричных последовательностях двухцепочечной ДНК для получения полностью метилированных фрагментных матричных последовательности двухцепочечной ДНК; повторение стадий (b)-(d) от 1 до 5 раз для получения полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК; обработку полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК реагентом для превращения остатков цитозина в урацил; определение паттерна метилированного цитозина; сравнение паттерна метилированного цитозина со стандартным паттерном метилированного цитозина для раковой ДНК; и диагностику индивидуума, страдающего раком, когда определенный паттерн метилированного цитозина соответствует стандартному паттерну метилированного цитозина для раковой ДНК.
Согласно одному аспекту описаны способы, которые включают (а) экстракцию внеклеточной ДНК или геномной ДНК, которая может содержать внеклеточную опухолевую ДНК, из жидкого биоптата от отдельного пациента, где последовательность внеклеточной опухолевой ДНК имеет иной паттерн метилирования по сравнению с нормальными соматическими клетками; (b) разделение последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи; (c) удлинение верхней и нижней матричных цепей с использованием полимеразы, нуклеотидов и избранных наборов праймеров, нацеленных на дифференциально метилированные локусы, для получения неметилированных комплементарных цепей, с получением полуметилированных последовательностей двухцепочечной ДНК для избранных дифференциально метилированных локусов; (d) добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания условий не содержащего магния буфера; (е) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих последовательностях двухцепочечной ДНК, для получения полностью метилированных последовательностей двухцепочечной ДНК из выбранных дифференциально метилированных локусов; (f) после такой обработки добавление иона магния до идеальной концентрации для последующей реакции удлинения праймера, такой как, при необходимости, с использованием условий ПЦР; и (g) повторение стадий для получения полностью метилированных ампликонов избранных дифференциально метилированных локусов. Затем полностью метилированные ампликоны могут быть обработаны реагентом для превращения остатков цитозина в урацил при сохранении остатков метилированного цитозина без изменений. Может быть определен паттерн метилированного цитозина. Наличие в образце внеклеточной опухолевой ДНК определяют путем сравнения паттерна метилированного цитозина внеклеточной ДНК с паттерном метилированного цитозина различных раковых тканей. Индивидуум может быть диагностирован как страдающий определенным типом рака, когда определенный паттерн метилированного цитозина содержит стандартный паттерн метилированного цитозина для определенного типа рака.
Согласно одному аспекту плазматическую ДНК извлекают из образца крови. Избранный набор связанных с биотином праймеров для ПЦР, которые нацелены на локусы-мишени дифференциально метилированных генов при раке, используют для выполнения 1 раунда удлинения праймера ПЦР и инкубации с метилирующим агентом для создания полуметилированных ампликонов целевых локусов. DNMT1 можно использовать для реакции переноса метила для создания метилированных ампликонов целевых генных локусов. Стадия удлинения праймера и инкубации может быть повторена по желанию для получения амплифицированного метилома выбранных целевых локусов. Стадию удлинения праймера и инкубации можно повторять от 1 до 20 раз или более, если необходимо получить амплифицированный метилом из выбранных целевых локусов. Ампликоны, меченные биотином, выделяют или «вытягивают», используя, например, партнер связывания авидина, прикрепленный к субстрату. Выделенные ампликоны обрабатывают бисульфитом натрия. Подвергнутую бисульфитной конверсии версию того же набора праймеров для ПЦР используют для амплификации подвергнутых бисульфитной конверсии ампликонов. Те же самые праймеры ПЦР не могут амплифицировать ампликоны, обработанные бисульфитом, поскольку все немодифицированные цитозины превращаются в урацил, и поэтому необходимо слегка изменить праймеры, чтобы соответствовать конверсии C-U. Эта стадия сопровождается подготовкой библиотеки и секвенированием. Альтернативно, за этой стадией следует специфическая для метилирования кПЦР для определения статуса метилирования ампликонов, обработанных бисульфитом, в одном варианте осуществления, по одному гену за раз. Типичным геном является ген рака, такой как SEPT9. Подходящие для метилирования специфические кПЦР описаны в Jorja D Warren et al. «Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer». BMC Medicine 2011, 9:133, настоящим включенном посредством ссылки во всей полноте. В соответствии с одним аспектом, амплификация для поддержания статуса метилирования, как описано в настоящем документе, для получения амплифицированного метилома улучшает чувствительность по сравнению с известными методиками кПЦР для прямого исследования статуса метилирования раковых генов внеклеточной ДНК, как, например, выполняется EpiProColon.
Более конкретно, способы амплификации и метилирования могут быть выполнены для анализа метилирования внеклеточной опухолевой ДНК, как показано на схеме на фиг.4. Экстракцию внеклеточной ДНК из плазмы крови осуществляют следующим образом. 10 мл крови собирали в пробирку с ЭДТА (этилендиаминтетрауксусной кислотой). Каждую пробирку центрифугировали в течение 12 минут при 1350±150 g при комнатной температуре. Плазму переносили, не нарушая лейкоцитарный слой, в чистую коническую пробирку объемом 15 мл. Образец центрифугировали второй раз в течение 12 минут при 1350±150 g. Плазму переносили, не нарушая осадок, в пробирку объемом 4 мл. Внеклеточную ДНК экстрагировали из 4 мл плазмы с использованием набора для циркулирующей нуклеиновой кислоты QIAamp (QIAGEN) и элюировали в 50 мкл буфера для элюции. Экстракция внеклеточной ДНК также может быть выполнена с помощью набора Quick-cfDNA™ для сыворотки и плазмы (ZYMO), набора Chamagic cfDNA 5k (Chemagen), NucleoSpin Plasma XS (TaKaRa) и т.д. 50 мкл элюированной ДНК далее концентрировали посредством набора для концентрирования и очистки ДНК (ZYMO) и элюировали в 6 мкл буфера для элюции в пробирку для ПЦР.
Удлинение праймера и метилирование, приводящее к амплифицированному метилому, проводят на экстрагированной внеклеточной ДНК с использованием набора праймеров ПЦР, нацеленных на дифференциально метилированные генные локусы. Дифференциально метилированные гены, которые представляют собой гены, которые имеют иной статус метилирования в раковой клетке по сравнению с нормальной соматической клеткой, отбирают на основе стандартных данных метилирования для рака. Дифференциально метилированные гены включают SEPT9; TMEM106A; NCS1; UXS1; HORMAD2; REC8; DOCK8; CDKL5; SNRPN; SNURF; ABCC6; CA10; DBC2; HEPACAM; KRT13; MYO3A; NKX6-2; PMF1; POU4F2; SYNPO2/миоподин; ZNF154; 3OST3B; ACADL; ATOH1/hATH; BECN1; C14; CBFA2T3; COL7A1; CREBBP; CXCL1; EDN3; ETS1; FAM110A/c20; FAM19A4/FLJ25161; FAT4; FGFR4; FOXC1; FOXF1; GHSR; GJB2/CX26; GPR180/ITR; HDAC1; HSD17B1; HSD17B2; HSD17B4; IPF1; ISL1; ITIH5; LEBREL1/P3H2; LEBREL2/P3H3; LRRC49; MGA; miR-124; miR-196a-2; miR-335; ADAMTS5; MYBL2; NFIX; NRN1; OGG1; PCDHGB6; PPP2R2B; PRDM12; PTRF; RNF20; ST18; STK36; STMN1; SULT1A1; SYNM; THAP10; TOX; TSC1; UAP1L1; UGT3A1; ZBTB8A; ZNF432; ADAMTS12; ADHFE1; BARX1; BEND4; CASR; CD109; CDX1; CNR1/CB(1) рецептор; CNRIP1; CNTFR; DEXI; DUSP26; EDIL3; ELMO1; EXTL3; EYA2; FLT1; GJC1; GLP1R; GPR101; GRIN2/NMDAR2A; GSPT2; HOMER2; INA; KCNK12; LAMA1; LRP2/мегалин; KISS1; MBD4/MED1; MCC; miR-342; miR-345; NDRG4; NGFR; NR3C1/GR; PIK3CG; PPARG; PTGIS; PTPRR; QKI; RGMA; SEPT9; SPG20; STARD8; STOX2; TBX5; THBS4/TSP4; TMEM8B/NGX6; VSX2/HOX10; ANGTL2; AXIN1; CCBE1; CTGF/IGFBP8; DNAJC15; FBXO32; FILIP1L; FZD4; GPR150; GUCY2C; HOXB5; ITGA8; LRP5; miR-130b; NFATX; PTPRN; RUNX1T1; TERC/hTR; TES; TMCO5; IFFO1; ALK; CHGA; CSMD2; DES; DUSP6; ELOVL4; FANCG; FGF2; FGF3; FGF5; FGF8; FGFR1; FLT3; FLT4; GAS1; GEMIN2/SIP1; HIC2; HSD17B12; IGFBP5; ITPR2; LMO1/RBTN1; I-mfa; miR-132; NEFL; NKX2-8; NTRK3/TRKC; NTSR1; PRG2; PTCH2; SLC32A1; TRH; TUBB3; ZNF415; CLSTN1; HIST1H4K; HIST2H2BF; INHA/ингибин-альфа; KCNMA1; NKX3.1; NPBWR1/GPR7; NSMCE1/NSE1; PXMP4/PMP24; RGS2; S100A6; SLC18A2; SPRY4; SVIL; TFAP2E; TGFB2; ZNF132; NFATC; CST6; MDFI; ADAM23; ALDH1A3; APC; BNC1; BRCA1; CADM1/TSLC1/IGSF4; CASB; CAV1; CCNA1; CCND2; CD2/SRBC; CD44; CDH1/E-кадгерин; CDH13/H-кадгерин; CDKN1C/KIP2/p57; CDKN2A/ARF/p14; CDKN2B/INK4B/p15; CHFR; CIDEA; CLSTN1; COL1A2; CYP1A1; DAB2IP; DAPK1; DBC1; DIRAS(3)/ARHI; DKK3; DLC1; DLEC1; DPYS; EOMES; EPHA5; ESR1/ER-альфа; ESR2/ER-бета; FHIT; FHL1; GAS7; GATA5; GSTP1; HIC1; HIST1H4K; HIST2H2Bf; HOXA11; HOXA9; HS3ST2/30ST2; ID4; IGF2; IGFBP3; KCNMA1; LAMA3; LAMC2; MAL; MARVELD1; MDFI; MGMT; MINT1/APBA1; MINT2/APBA2; MINT31; miR-34a; miR-34b; miR-34c; miR-9-1; MLH1; MMP2; MSH2; MSX1; MYOD1/MYF-3; NID2; NKX3-1; NPBWR1; NSMCE1/NSE1; OPCML; p14; PCDH17; PDLIM4/RIL; PENK; PGR; PITX2; PLAU/uPA; PRDM2/RIZ1; PTEN/MMAC1; PTGS2/COX2; PXMP4/PMP24; PYCARD/ASC/TMS1; RARB; RARB2; RARRES1/TIG1; RASSF1; RASSF1A; RASSF2; RB1; RBP1/CRBP1; RGS2; RPIA; RPRM/Reprimo; RUNX3; S100A6; SCGB3A1/HIN1; SERPINB5/маспин; SFN/14-3-3 сигма; SFRP1/SARP2; SFRP2; SFRP4; SFRP5; SLC18A2; SLC5A8; SLIT2; SOCS1; SOX11; SOX17; SPARC; SPOCK2; SPRY4; STK11/LKB1; SVIL; SYK; TCF21; TERT; TFAP2E; TFPI2; TGFB2; THBS1; TIMP3; TMEFF2/HPP1/TPEF; TNFRSF10C/DcR1; TNFRSF10D/DcR2; TNFRSF25/DR3; TWIST1; UCHL1/PGP9.5; VIM; WIF1; WWOX; XAF1; ZNF132, но не ограничиваются ими.
Согласно одному примерному варианту осуществления, смесь праймеров представляет собой равную смесь из 21 пары модифицированных биотином праймеров, каждый из которых нацелен на один дифференциально метилированный ген, включая SEPT9; TMEM106A; NCS1; UXS1; HORMAD2; REC8; dock8; CDKL5; SNRPN; SNURF; ABCC6; CA10; DBC2; HEPACAM; KRT13; MYO3A; NKX6-2; PMF1; POU4F2; SYNPO2/миоподин; и CDH1/E-кадгерин. Комбинация выбрана потому, что другая комбинация статуса метилирования 21 целевого гена охватывает диагностику 6 типов распространенного рака, включая: brca - инвазивную карциному молочной железы; coad - аденокарциному толстой кишки; lihc - печеночно-клеточную карциному; prad - аденокарциному простаты; stad - аденокарциному желудка; и ucec - карциному эндометрия. Специалист в данной области поймет, что другие виды рака могут быть диагностированы с использованием комбинаций других раковых генов и их статуса или характеристик метилирования. Дополнительные способы могут включать большее количество праймеров или изменить состав смеси праймеров, чтобы охватить больше видов рака или повысить чувствительность и специфичность диагностики рака. Способы могут быть осуществлены следующим образом.
1-й раунд реакции ПЦР с использованием смеси праймеров
К 6 мкл элюата добавляют 1 мкл 10х буфера для ПЦР; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ смеси биотина-праймера MERLOT; 0,2 мкл 100 мМ MgSO4 и 2,3 мкл H2O. Условия 1x буфера ПЦР MERLOT включают 20 мМ Трис-HCl, 10 мМ KCl; 0,1% Trition X-100, pH 7,8 при 25°C. В реакции 10 мкл выполняют следующий термоцикл для охвата всех температур отжига для 21 праймера (от 58 до 64°C): 94°C в течение 2 минут, 64°C в течение 60 секунд, 63°C в течение 60 секунд, 62°C в течение 60 секунд, 61°C в течение 60 секунд, 60°C в течение 60 секунд, 59°C в течение 60 секунд, 58°C в течение 60 секунд и 72°C в течение 3 минут. Это приводит к получению полуметилированных фрагментов дцДНК, где одна цепь связана с биотином.
1-й раунд реакции переноса метила DNMT1
К 10 мкл реакции добавляют 1,5 мкл 10х буфера переноса метила (MT) MERLOT; 0,15 мкл 160 мкМ SAM; 0,15 мкл 100 мкг/мл БСА; 0,3 мкл 200 мМ ЭДТА, 2 мкл 2 Ед./мкл DNMT1 и 0,9 мкл H2O. Условия 1x буфера для MT буфера включают 20 мМ Трис-HCl, 1 мМ DTT, 5% глицерин, pH 7,8 при 25°C. Реакцию 15 мкл инкубируют при 37°С в течение 3 часов. Это приводит к метилированным фрагментам дцДНК и завершенному одиночному раунду амплификации и метилирования.
Несколько раундов MERLOT при необходимости
Дальнейшие от 1 до 4 раундов амплификации и метилирования могут быть выполнены при необходимости. Термоцикл такой же, как в 1-м раунде амплификации и метилирования. Следующие реагенты должны быть добавлены для 2-го, 3-го, 4-го, 5-го раунда амплификации и метилирования, соответственно.
2-й раунд ПЦР
К 15 мкл реакции добавляют 1 мкл 10х буфера для ПЦР; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ смеси биотина-праймера MERLOT; 0,55 мкл 100 мМ MgSO4 и 2,95 мкл H2O.
2-й раунд реакции переноса метила DNMT1
К 20 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (МТ); 0,25 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,325 мкл 100 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,15 мкл 100 мМ DTT и 1,175 мкл H2O.
3-й раунд ПЦР
К 25 мкл реакции добавляют 1 мкл 10х буфера для ПЦР MERLOT; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл раствора экзополимеразы DeepVent; 0,2 мкл 1 мкМ смеси биотина-праймера MERLOT; 0,85 мкл 100 мМ MgSO4; 2,65 мкл H2O.
3-й раунд реакции переноса метила DNMT1
К 30 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (MT); 0,35 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,475 мкл 200 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,25 мкл 100 мМ DTT и 0,825 мкл H2O.
4-й раунд ПЦР
К 35 мкл реакции добавляют 1 мкл 10х буфера ПЦР; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ смеси биотина-праймера MERLOT; 1,15 мкл 100 мМ MgSO4 и 2,35 мкл H2O.
4-й раунд реакции переноса метила DNMT1
К 40 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (МТ); 0,45 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,625 мкл 200 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,35 мкл 100 мМ DTT и 0,475 мкл H2O.
5-й раунд ПЦР
К 45 мкл реакции добавляют 1 мкл 10х ПЦР-буфера; 0,2 мкл dNTP; 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent; 0,2 мкл 1 мкМ смеси биотина-праймера MERLOT; 1,45 мкл 100 мМ MgSO4 и 2,05 мкл H2O.
5-й раунд реакции переноса метила DNMT1
К 50 мкл реакции добавляют 1 мкл 10х буфера для переноса метила (МТ); 0,55 мкл 160 мкМ SAM; 0,1 мкл 100 мкг/мл БСА; 0,775 мкл 100 мМ ЭДТА; 2 мкл 2 Ед./мкл DNMT1; 0,45 мкл 100 мМ DTT; 0,125 мкл H2O.
Обогащение с использованием гранул Dynabeads и бисульфитной конверсии
Амплифицированная и метилированная дцДНК содержит молекулу биотина, присоединенную к обоим концам ампликонов ДНК. Ампликоны обогащают стандартным промыванием стрептавидином Dynabeads M-280 и элюируют в 20 мкл буфера для элюции. Ампликоны амплифицированных дифференциально метилированных генов обрабатывают бисульфитом натрия, следуя указаниям набора Zymo EZ-Direct Bisulfite. Подвергнутая бисульфитной конверсии ДНК готова для последующего анализа, такого как специфическая для метилирования кПЦР, секвенирование NGS, пиросеквенирование, секвенирование Sanger и т.д. Статус метилирования генных ампликонов сравнивают с известным статусом метилирования раковых генов, то есть стандартом, чтобы определить через совпадение, то есть статус метилирования, сходный с известным статусом метилирования ДНК раковой клетки, присутствуют ли нуклеиновые кислоты из раковой клетки в исходном испытуемом образце.
ПРИМЕР V
Амплификация и метилирование в синтетических матрицах
Для проверки эффективности DNMT1 in vitro и для разработки оптимального реакционного буфера для реакций амплификации и метилирования, описанных в настоящем документе, используют синтетическую дцДНК, которая содержит чувствительный к метилированию сайт рестрикции, как показано на Фиг.5. ДцДНК размером 87 п.н. содержит мотив ClaI размером 6 п.н., 5'-ATCGAT-3'. ДцДНК размером 87 п.н. будет расщеплена на два фрагмента после инкубации с Clai, если сайт CpG неметилирован. Если сайт CpG метилирован, дцДНК не будет расщеплена. Когда только одна цепь дцДНК содержит метилированный цитозин, скорость расщепления Clai в значительной степени снижается, но все равно приводит к фрагментации, если время реакции достаточно велико до насыщения. При проведении электрофореза на биоанализаторе после инкубации Clai в течение 3 часов (насыщение) вычисляют точный процент интактной матрицы дцДНК, который указывает процент метилированной матрицы в образце.
Матрица дцДНК 87 п.н.:
Верхняя цепь: 5'-ACC TGT GAC TGA GAC ATC TGA AGG TGC AAT CAG GTG TCA GTC TTA AAG GAT CGA TAA GGA AGC GGA AGT AGT GGT CTC GTC GTA GTG-3'
Нижняя цепь: 5'-CAC TAC GAC GAC ACC ACT ACT TCC GCT TCC TCA ATC CTT TAA GAC TGA CAC CTT ATT GCA CCT TCA GAT GTC TCA GTC ACA GGT-3'.
Чтобы оценить эффективность переноса метила DNMT1 в определенных буферных условиях, матрицу полуметилированной дцДНК инкубируют с DNMT1 в буфере собственного изготовления с последующим расщеплением Clai и электрофорезом, как показано на Фиг.6. DNMT1 может достигать почти 100% эффективности переноса метила в 15 мкл реакции, содержащей 2 мкл 2 Ед./мкл DNMT1 (NEB). Условия реакционного буфера: 1x МТ-буфер, с добавлением 0,15 мкл 160 мкМ SAM; 0,15 мкл 100 мкг/мл БСА.
Для оценки скорости метилирования de novo DNMT1 в определенных буферных условиях матрицу неметилированной дцДНК инкубировали с DNMT1 в буфере собственного изготовления с последующим расщеплением Clai и электрофорезом, как показано на Фигуре 7. DNMT1 показывает около 0,1% скорость метилирования de novo в реакции 15 мкл при инкубации с 2 мкл 2 Ед./мкл DNMT1 (NEB) в течение 3 часов. Условия реакционного буфера: 1x МТ-буфер с добавлением 0,15 мкл 160 мкМ SAM; 0,15 мкл 100 мкг/мл БСА; 0,3 мкл 200 мМ ЭДТА. Буферные условия для 1х MT Буфера включают 20 мМ Трис-HCl, 1 мМ DTT, 5% глицерина, pH 7,8 при 25°C. Надежная производительность DNMT1 может быть достигнута при реакции в буфере MT, но для усиления статуса метилирования также необходима надежная реакция полимеразного удлинения. Идеальные буферные условия для полимеразного удлинения не должны конфликтовать с буфером MT, и переключение между буфером РПЦР и буфером MT не должно быть сложным. В настоящее время описанные в настоящем документе реакции амплификации и метилирования осуществляют полимеразное удлинение с использованием 0,1 мкл 2 Ед./мкл экзополимеразы DeepVent в 10 мкл реакционного объема. Буферные условия представляют собой 1x ПЦР-буфер с добавлением 0,2 мкл dNTP и 0,2 мкл 100 мМ MgSO4. Переключение буфера осуществляют путем хелатирования Mg2+ с помощью ЭДТА. Условие 1x ПЦР-буфера включает 20 мМ Трис-HCl, 1 мМ DTT, 5% глицерина, рН 7,8 при 25°С. Термоцикл для полимеразного удлинения матрицы дцДНК размером 87 п.н. составляет 94°С в течение 2 минут, 58°С в течение 60 секунд и 72°С в течение 3 минут. Прямой праймер - 5'-ACC TGT GAC TGA GAC ATC TG-3'. Обратный праймер 5'-CAC TAC GAC GAG ACC ACT AC-3'.
Комбинируя полимеразное удлинение и реакцию переноса метила DNMT1 (метод MERLOT), можно добиться репликации статуса метилирования исходной матрицы. 1 раунд метода MERLOT на метилированной матрице 87 п.н. с последующим расщеплением Clai и электрофорезом приводит к получению 96,6% полноразмерной матрицы, что указывает на 96,6% эффективность переноса метила DNMT1. 2 раунда MERLOT на метилированной матрице размером 87 п.н. с последующим расщеплением Clai и электрофорезом дают 95,4% полноразмерной матрицы, что указывает на успешное переключение буфера с использованием реакции хелатирования.
ПРИМЕР VI
Варианты осуществления
Настоящее изобретение обеспечивает способ получения амплифицированного метилома, включающий (а) фрагментацию последовательности двухцепочечной ДНК, имеющей паттерн метилирования, для получения фрагментных матричных последовательностей двухцепочечной ДНК, имеющих паттерн метилирования и включающих участок связывания праймера на каждом 5' конце и 3' конце фрагментных матричных последовательностей двухцепочечной ДНК; (b) разделение фрагментных матричных последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи; (c) удлинение верхней и нижней матричных цепей с использованием праймеров, полимеразы и нуклеотидов для получения неметилированных комплементарных цепей, приводящих к полуметилированным последовательностям двухцепочечной ДНК, соответствующим фрагментным матричным последовательностям двухцепочечной ДНК, имеющим паттерн метилирования; (d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой и источником метильных групп для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих фрагментных матричных последовательностях двухцепочечной ДНК для получения полностью метилированных фрагментных матричных последовательностей двухцепочечной ДНК; и (e) повторение стадий (b) - (d) для получения полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК. Согласно одному аспекту способ дополнительно включает обработку полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК реагентом для преобразования остатков цитозина в урацил и анализ паттерна метилированного цитозина. Согласно одному аспекту, фрагментация на стадии (а) является результатом контакта последовательности двухцепочечной ДНК с библиотекой транспосом, где каждая транспосома из библиотеки имеет свою собственную уникальную ассоциированную штрихкодовую последовательность, где каждая транспосома из библиотеки включает транспозазу и гомодимер ДНК транспозона, где каждая ДНК транспозона из гомодимера включает участок связывания транспозазы, уникальную штрихкодовую последовательность и участок связывания праймера, где библиотека транспосом связывается с целевыми местоположениями вдоль последовательности двухцепочечной ДНК, а транспозаза расщепляет последовательность двухцепочечной ДНК на фрагментные матричные последовательности двухцепочечной ДНК, причем каждая фрагментная матричная последовательность двухцепочечной ДНК включает один член уникальной пары штрихкодовых последовательностей на каждом конце фрагментной матричной последовательности двухцепочечной ДНК; заполнение гэпа между ДНК транспозона и фрагментной матричной последовательностью двухцепочечной ДНК для формирования библиотеки фрагментных матричных последовательности двухцепочечной ДНК, имеющих участки связывания праймеров на каждом конце. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния в эквимолярной форме для создания идеальных буферных условий для метилтрансферазы. Согласно одному аспекту стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий буфера для удлинения праймера с целью удлинения праймера. Согласно одному аспекту метилтрансфераза представляет собой DNMT1. Согласно одному аспекту транспозаза представляет собой Tn5-транспозазу, Mu-транспозазу, Tn7-транспозазу или IS5 транспозазу. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является бисульфит натрия. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой геномную ДНК. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки, или представляет собой внеклеточную ДНК. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой геномную ДНК из пренатальной клетки, раковой клетки или циркулирующей опухолевой клетки. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой внеклеточную геномную ДНК опухолевых клеток, полученную из образца крови индивидуума. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 20 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 10 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 5 раз. Согласно одному аспекту полностью метилированные ампликоны фрагментных матричных последовательностей двухцепочечной ДНК обрабатывают реагентом для превращения остатков цитозина в урацил. Согласно одному аспекту реагент для превращения остатков цитозина в урацил представляет собой фермент семейства APOBEC. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является APOBEC3A. Согласно одному аспекту праймеры являются локус-специфичными праймерами. Согласно одному аспекту, праймеры являются специфичными для заболевания праймерами. Согласно одному аспекту праймеры представляют собой онкоспецифические праймеры.
Настоящее изобретение обеспечивает способ диагностики индивидуума, страдающего раком, включающий (а) фрагментацию последовательности двухцепочечной ДНК, полученной из жидкого образца от биопсии индивидуума, где последовательность двухцепочечной ДНК имеет паттерн метилирования, для получения фрагментных матричных последовательностей двухцепочечной ДНК, имеющих паттерн метилирования и включающих участок связывания праймера на каждом 5'-конце и 3'-конце фрагментных матричных последовательностей двухцепочечной ДНК; (b) разделение фрагментных матричных последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи; (c) удлинение верхней и нижней матричных цепей с использованием онкоспецифических праймеров, полимеразы и нуклеотидов для обеспечения неметилированных комплементарных цепей, с получением полуметилированных последовательностей двухцепочечной ДНК, соответствующих фрагментным матричным последовательностям двухцепочечной ДНК, имеющим паттерн метилирования; (d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой и источником метильных групп для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих фрагментных матричных последовательностях двухцепочечной ДНК, для получения полностью метилированных фрагментных матричных последовательностей двухцепочечной ДНК; (e) повторение стадий (b) - (d) для получения полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК; обработку полностью метилированных ампликонов фрагментных матричных последовательностей двухцепочечной ДНК реагентом для превращения остатков цитозина в урацил; определение паттерна метилированного цитозина; сравнение паттерна метилированного цитозина со стандартным паттерном метилированного цитозина для раковой ДНК; определение различий между паттерном метилированного цитозина и стандартным паттерном метилированного цитозина для раковой ДНК; и диагностирование индивидуума, страдающего раком, когда определенный паттерн метилированного цитозина соответствует стандартному паттерну метилированного цитозина для раковой ДНК. Согласно одному аспекту жидкий образец от биопсии представляет собой образец крови, образец спинномозговой жидкости или образец мочи. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания идеальных буферных условий для метилтрансферазы. Согласно одному аспекту стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий для буфера для удлинения праймера с целью удлинения праймера. Согласно одному аспекту метилтрансфераза представляет собой DNMT1. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является бисульфит натрия. Согласно одному аспекту реагент для превращения остатков цитозина в урацил представляет собой фермент семейства APOBEC. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является APOBEC3A. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой геномную ДНК из раковой клетки или циркулирующей опухолевой клетки. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой внеклеточную геномную ДНК опухолевых клеток, полученную из образца крови индивидуума. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 20 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 10 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 5 раз. Согласно одному аспекту праймеры представляют собой онкоспецифические праймеры. В соответствии с одним аспектом определение паттернов метилированного цитозина включает секвенирование следующего поколения, специфическую для метилирования кПЦР или выявляющую метилирование микроматрицу. В соответствии с одним аспектом рак представляет собой заболевание, выбранное из группы, состоящей из инвазивной карциномы молочной железы, аденокарциномы толстой кишки, гепатоцеллюлярной карциномы печени, аденокарциномы предстательной железы, аденокарциномы желудка и карциномы эндометрия.
Изобретение обеспечивает способ ранней диагностики рака для индивидуума, включающий (а) экстракцию внеклеточной ДНК или геномной ДНК, которая может содержать внеклеточную ДНК опухоли, из жидкого биоптата индивидуума, где последовательность внеклеточной ДНК опухоли имеет иной паттерн метилирования, по сравнению с нормальными соматическими клетками; (b) разделение последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи; (c) удлинение верхней и нижней матричных цепей с использованием полимеразы, нуклеотидов и избранных наборов праймеров, которые нацелены на области генома, где раковая клетка и нормальная клетка имеют различные паттерны метилирования, с получением полуметилированных последовательностей двухцепочечной ДНК для избранных дифференциально метилированных локусов; (d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой с целью добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих последовательностях двухцепочечной ДНК для получения полностью метилированных последовательностей двухцепочечной ДНК из избранных дифференциально метилированных локусов; (e) повторение стадий (b) - (d) для получения полностью метилированных ампликонов из выбранных дифференциально метилированных локусов; (f) обработку полностью метилированных ампликонов реагентом для превращения остатков цитозина в урацил с сохранением метилированных цитозиновых остатков без изменений; (g) определение паттерна метилированного цитозина; (h) определение наличия в образце внеклеточной ДНК опухоли путем сравнения паттерна метилированного цитозина внеклеточной ДНК с паттерном метилированного цитозина в различных раковых тканях; определение различий между паттерном метилированного цитозина образца внеклеточной ДНК и паттерном метилированного цитозина различных раковых тканей; определение наличия в образце внеклеточной ДНК опухоли; и (i) диагностирование индивидуума с определенным типом рака, когда определенный паттерн метилированного цитозина содержит онкоспецифический паттерн метилирования. Согласно одному аспекту жидкий образец от биопсии представляет собой образец крови, образец спинномозговой жидкости или образец мочи. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния. Согласно одному аспекту стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания идеальных буферных условий для метилтрансферазы. Согласно одному аспекту стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий для буфера для удлинения праймера с целью удлинения праймера. Согласно одному аспекту метилтрансфераза представляет собой DNMT1. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является бисульфит натрия. Согласно одному аспекту реагент для превращения остатков цитозина в урацил представляет собой фермент семейства APOBEC. Согласно одному аспекту реагентом для превращения остатков цитозина в урацил является APOBEC3A. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой геномную ДНК из раковой клетки или циркулирующей опухолевой клетки. Согласно одному аспекту последовательность двухцепочечной ДНК представляет собой внеклеточноую геномную ДНК опухолевых клеток, полученную из образца крови индивидуума. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 20 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 10 раз. Согласно одному аспекту стадии (b) - (d) повторяют от 1 до 5 раз. Согласно одному аспекту праймеры представляют собой онкоспецифические праймеры. В соответствии с одним аспектом определение паттернов метилированного цитозина включает секвенирование следующего поколения, специфическую для метилирования кПЦР или выявляющую метилирование микроматрицу. В соответствии с одним аспектом рак представляет собой заболевание, выбранное из группы, состоящей из инвазивной карциномы молочной железы, аденокарциномы толстой кишки, гепатоцеллюлярной карциномы печени, аденокарциномы предстательной железы, аденокарциномы желудка и карциномы эндометрия.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PRESIDENT AND FELLOWS OF HARVARD COLLEGE
<120> METHODS OF AMPLIFYING DNA TO MAINTAIN METHYLATION STATUS
<130> 010498.01058/WO
<140> PCT/US2018/021453
<141> 2018-03-08
<150> 62/468,595
<151> 2017-03-08
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 1
cattacgagc gagatgtgta taagagacag 30
<210> 2
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 2
ctgtctctta tacacatct 19
<210> 3
<211> 87
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 3
acctgtgact gagacatctg aaggtgcaat caggtgtcag tcttaaagga tcgataagga 60
agcggaagta gtggtctcgt cgtagtg 87
<210> 4
<211> 87
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 4
cactacgacg agaccactac ttccgcttcc ttatcgatcc tttaagactg acacctgatt 60
gcaccttcag atgtctcagt cacaggt 87
<210> 5
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 5
acctgtgact gagacatctg 20
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 6
cactacgacg agaccactac 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |
| ПОЛНОГЕНОМНЫЕ БИБЛИОТЕКИ ОТДЕЛЬНЫХ КЛЕТОК ДЛЯ БИСУЛЬФИТНОГО СЕКВЕНИРОВАНИЯ | 2018 |
|
RU2770879C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ БИБЛИОТЕК ДВУХЦЕПОЧЕЧНЫХ ДНК И СПОСОБЫ СЕКВЕНИРОВАНИЯ ДЛЯ ИДЕНТИФИКАЦИИ МЕТИЛИРОВАННЫХ ЦИТОЗИНОВ | 2015 |
|
RU2688485C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2709655C2 |
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2736728C2 |
| СПОСОБ АНАЛИЗА НАРУШЕНИЙ, СВЯЗАННЫХ С РАКОМ ЯИЧНИКОВ | 2008 |
|
RU2511408C2 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2744175C1 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2833615C2 |

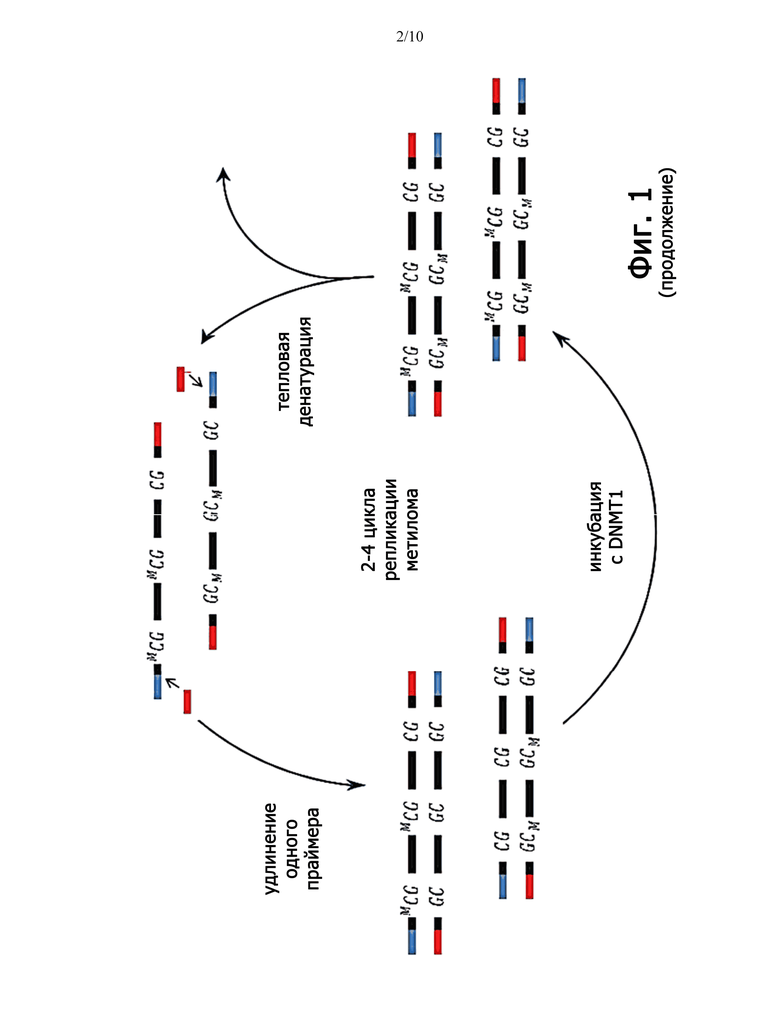

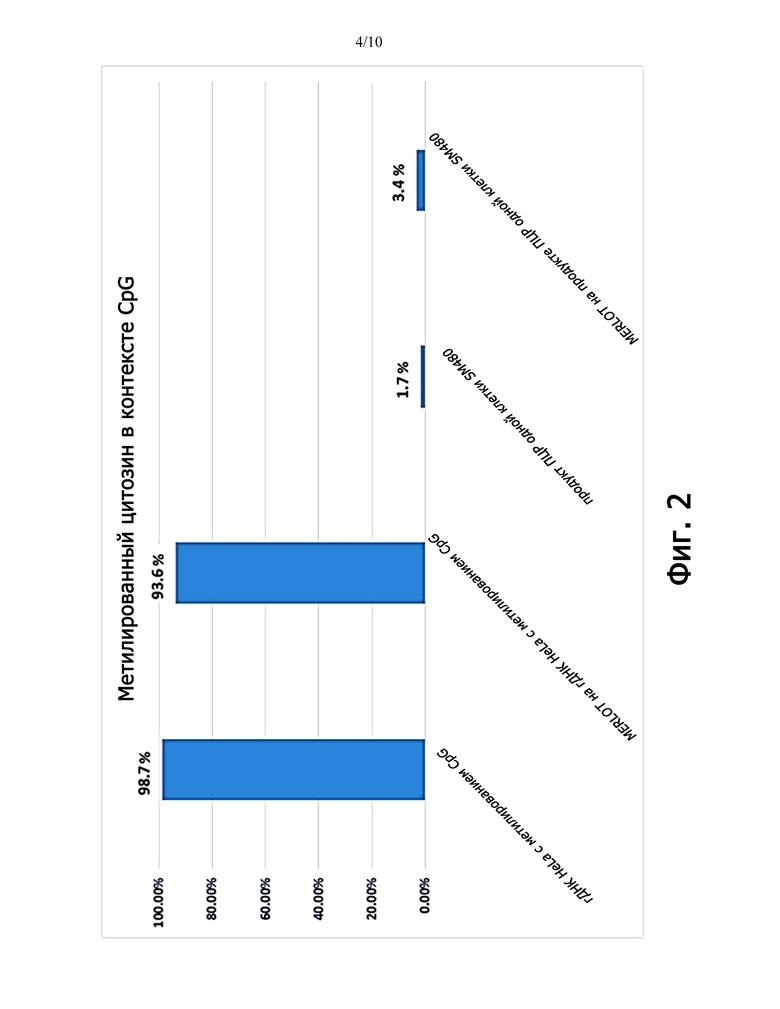
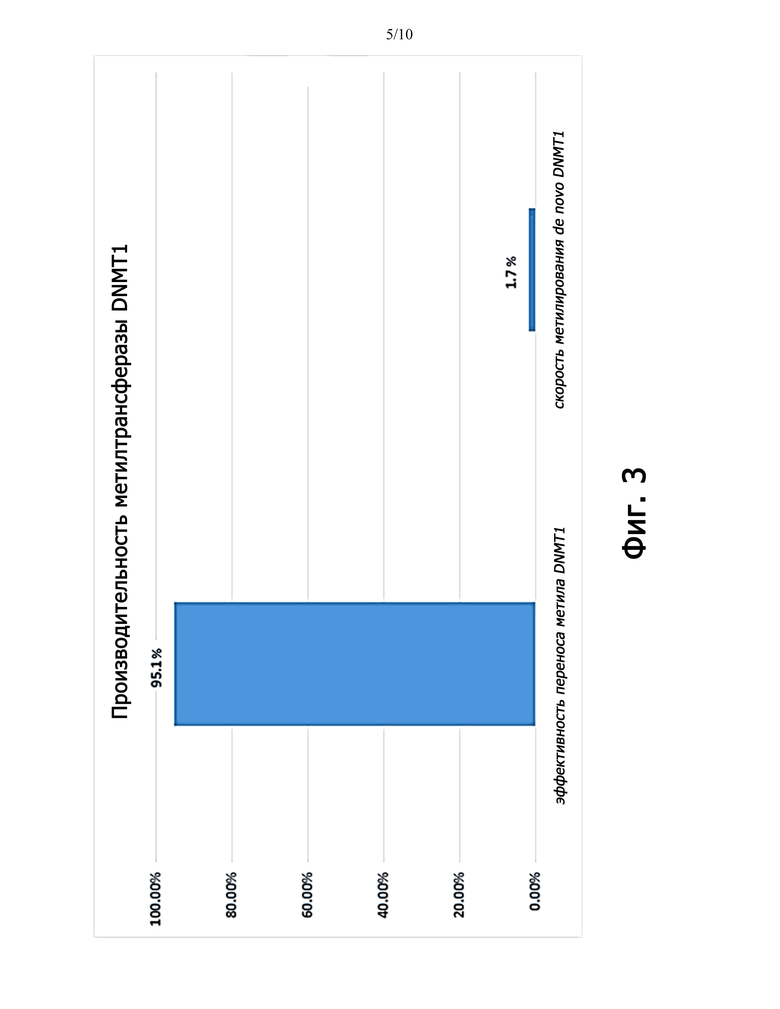

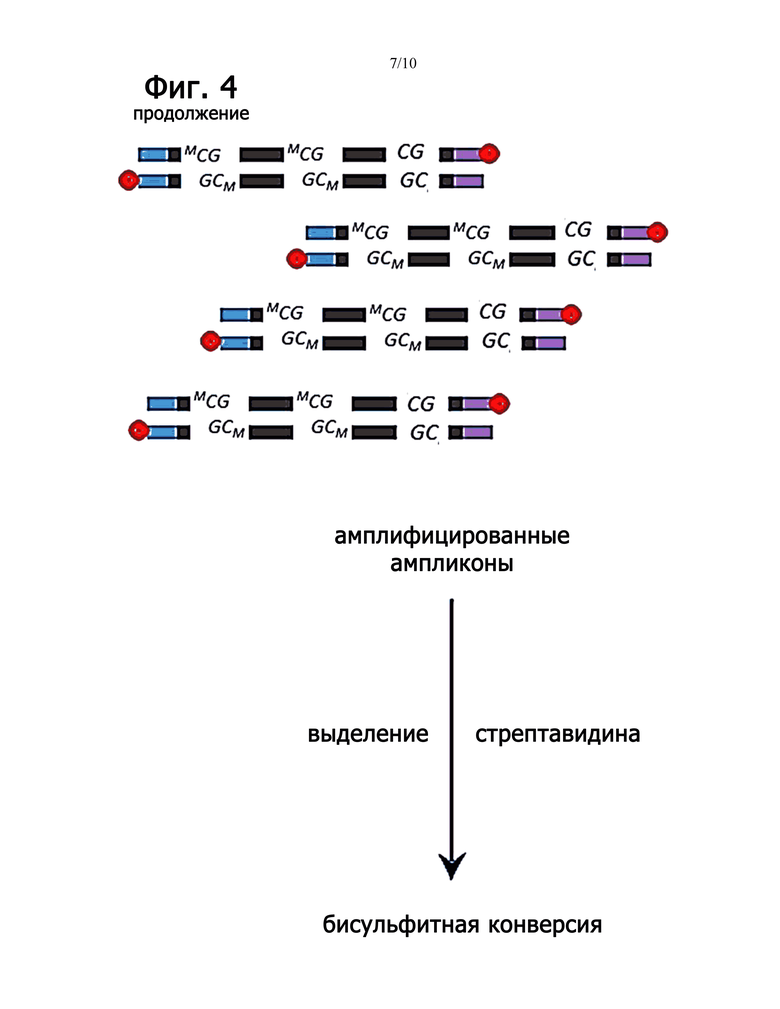


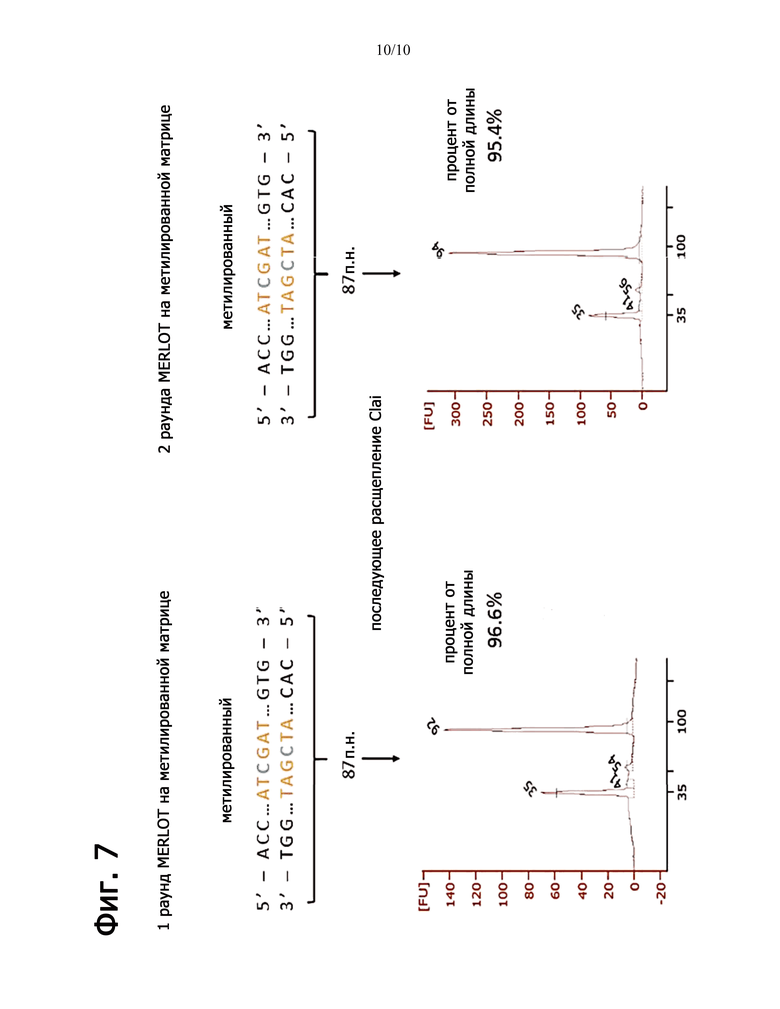
Изобретение относится к биотехнологии, в частности, изобретение обеспечивает способ получения амплифицированного метилома путем удлинения фрагментов и обработки удлиненных фрагментов метилтрансферазой и источником метильных групп для трансформации полуметилированной двухцепочечной ДНК в полностью метилированную двухцепочечную ДНК. 3 н. и 58 з.п. ф-лы, 7 ил., 6 пр.
1. Способ получения амплифицированного метилома, включающий:
(а) фрагментирование последовательности двухцепочечной ДНК, имеющей паттерн метилирования, для получения матричных последовательностей-фрагментов двухцепочечной ДНК, имеющих паттерн метилирования и включающих участок связывания праймера на каждом 5'-конце и 3'-конце матричных последовательностей-фрагментов двухцепочечной ДНК;
(b) разделение матричных последовательностей-фрагментов двухцепочечной ДНК на верхнюю и нижнюю матричные цепи;
(c) удлинение верхней и нижней матричных цепей с использованием праймеров, полимеразы и нуклеотидов для получения неметилированных комплементарных цепей, с получением полуметилированных последовательностей двухцепочечной ДНК, соответствующих матричным последовательностям-фрагментам двухцепочечной ДНК, имеющим паттерн метилирования;
(d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой и источником метильных групп для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих матричных последовательностях-фрагментах двухцепочечной ДНК, для получения полностью метилированных матричных последовательностей-фрагментов двухцепочечной ДНК; и
(e) повторение стадий (b)-(d) для получения полностью метилированных ампликонов матричных последовательностей-фрагментов двухцепочечной ДНК.
2. Способ по п. 1, дополнительно включающий обработку полностью метилированных ампликонов матричных последовательностей-фрагментов двухцепочечной ДНК реагентом для превращения остатков цитозина в урацил и анализ паттерна метилированного цитозина.
3. Способ по п. 1, в котором фрагментация на стадии (а) происходит в результате контакта последовательности двухцепочечной ДНК с библиотекой транспосом, причем каждая транспосома из библиотеки имеет свою собственную уникальную ассоциированную штрихкодовую последовательность, причем каждая транспосома из библиотеки включает транспозазу и гомодимер ДНК транспозона, где каждая ДНК транспозона из гомодимера включает участок связывания транспозазы, уникальную штрихкодовую последовательность и участок связывания праймера, где библиотека транспосом связывается с целевыми местоположениями в последовательности двухцепочечной ДНК, а транспозаза расщепляет последовательность двухцепочечной ДНК на матричные последовательности-фрагменты двухцепочечной ДНК, причем каждая матричная последовательность-фрагмент двухцепочечной ДНК включает по одному члену пары уникальных штрихкодовых последовательностей на каждом конце матричной последовательности-фрагмента двухцепочечной ДНК; заполнение гэпа между ДНК транспозона и матричной последовательностью-фрагментом двухцепочечной ДНК с образованием библиотеки из матричных последовательностей-фрагментов двухцепочечной ДНК, имеющих участки связывания праймеров на каждом конце.
4. Способ по п. 1, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния.
5. Способ по п. 1, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния.
6. Способ по п. 1, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания идеальных буферных условий для метилтрансферазы.
7. Способ по п. 1, в котором стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий буфера для удлинения праймера с целью удлинения праймера.
8. Способ по п. 1, в котором метилтрансферазой является DNMT1.
9. Способ по п. 3, в котором транспозаза представляет собой Tn5 транспозазу, Mu транспозазу, Tn7 транспозазу или IS5 транспозазу.
10. Способ по п. 2, в котором реагентом для превращения остатков цитозина в урацил является бисульфит натрия.
11. Способ по п. 1, в котором последовательность двухцепочечной ДНК представляет собой геномную ДНК.
12. Способ по п. 1, в котором последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки, или представляет собой внеклеточную ДНК.
13. Способ по п. 1, в котором последовательность двухцепочечной ДНК представляет собой геномную ДНК пренатальной клетки, раковой клетки или циркулирующей опухолевой клетки.
14. Способ по п. 1, в котором последовательность двухцепочечной ДНК представляет собой внеклеточную геномную ДНК опухолевой клетки, полученную из образца крови индивидуума.
15. Способ по п. 1, в котором стадии (b)-(d) повторяют от 1 до 20 раз.
16. Способ по п. 1, в котором стадии (b)-(d) повторяют от 1 до 10 раз.
17. Способ по п. 1, в котором стадии (b)-(d) повторяют от 1 до 5 раз.
18. Способ по п. 1, в котором полностью метилированные ампликоны матричных последовательностей-фрагментов двухцепочечной ДНК обрабатывают реагентом для превращения остатков цитозина в урацил.
19. Способ по п. 2, в котором реагент для превращения остатков цитозина в урацил представляет собой фермент семейства APOBEC.
20. Способ по п. 2, в котором реагентом для превращения остатков цитозина в урацил является APOBEC3A.
21. Способ по п. 1, в котором праймеры представляют собой локус-специфические праймеры.
22. Способ по п. 1, в котором праймеры представляют собой специфические для заболевания праймеры.
23. Способ по п. 1, в котором праймеры представляют собой онкоспецифические праймеры.
24. Способ диагностики индивидуума, страдающего раком, включающий:
(а) фрагментирование последовательности двухцепочечной ДНК, полученной из жидкого образца биопсии от индивидуума, где последовательность двухцепочечной ДНК имеет паттерн метилирования, для получения матричных последовательностей-фрагментов двухцепочечной ДНК, имеющих паттерн метилирования и включающих участок связывания праймера на каждом 5'-конце и 3'-конце матричных последовательностей-фрагментов двухцепочечной ДНК;
(b) разделение матричных последовательностей-фрагментов двухцепочечной ДНК на верхнюю и нижнюю матричные цепи;
(c) удлинение верхней и нижней матричных цепей с использованием онкоспецифических праймеров, полимеразы и нуклеотидов для получения неметилированных комплементарных цепей, с получением полуметилированных последовательностей двухцепочечной ДНК, соответствующих матричным последовательностям-фрагментам двухцепочечной ДНК, имеющим паттерн метилирования;
(d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой и источником метильных групп для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих матричных последовательностях-фрагментах двухцепочечной ДНК, для получения полностью метилированных матричных последовательностей-фрагментов двухцепочечной ДНК;
(e) повторение стадий (b)-(d) для получения полностью метилированных ампликонов матричных последовательностей-фрагментов двухцепочечной ДНК;
обработку полностью метилированных ампликонов матричных последовательностей-фрагментов двухцепочечной ДНК реагентом для превращения остатков цитозина в урацил;
определение паттерна метилированного цитозина;
сравнение паттерна метилированного цитозина со стандартным паттерном метилированного цитозина для раковой ДНК;
определение различий между паттерном метилированного цитозина и стандартным паттерном метилированного цитозина для раковой ДНК; и
диагностирование у человека рака, когда определенный паттерн метилированного цитозина соответствует стандартному паттерну метилированного цитозина для раковой ДНК.
25. Способ по п. 24, в котором жидкий образец от биопсии представляет собой образец крови, образец спинномозговой жидкости или образец мочи.
26. Способ по п. 24, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния.
27. Способ по п. 24, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния.
28. Способ по п. 24, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания идеальных буферных условий для метилтрансферазы.
29. Способ по п. 24, в котором стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий буфера для удлинения праймера с целью удлинения праймера.
30. Способ по п. 24, где метилтрансферазой является DNMT1.
31. Способ по п. 24, в котором реагентом для превращения остатков цитозина в урацил является бисульфит натрия.
32. Способ по п. 24, в котором реагент для превращения остатков цитозина в урацил представляет собой фермент семейства APOBEC.
33. Способ по п. 24, где реагентом для превращения остатков цитозина в урацил является APOBEC3A.
34. Способ по п. 24, в котором последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки.
35. Способ по п. 24, в котором последовательность двухцепочечной ДНК представляет собой геномную ДНК из раковой клетки или циркулирующей опухолевой клетки.
36. Способ по п. 24, в котором последовательность двухцепочечной ДНК представляет собой внеклеточную геномную ДНК опухолевой клетки, полученную из образца крови индивидуума.
37. Способ по п. 24, в котором стадии (b)-(d) повторяют от 1 до 20 раз.
38. Способ по п. 24, в котором стадии (b)-(d) повторяют от 1 до 10 раз.
39. Способ по п. 24, в котором стадии (b)-(d) повторяют от 1 до 5 раз.
40. Способ по п. 24, в котором праймеры представляют собой онкоспецифические праймеры.
41. Способ по п. 24, в котором определение паттернов метилированного цитозина включает секвенирование следующего поколения, специфическую для метилирования кПЦР или выявляющую метилирование микроматрицу.
42. Способ по п. 24, в котором рак представляет собой заболевание, выбранное из группы, состоящей из инвазивной карциномы молочной железы, аденокарциномы толстой кишки, гепатоцеллюлярной карциномы печени, аденокарциномы простаты, аденокарциномы желудка и карциномы эндометрия.
43. Способ ранней диагностики рака для индивидуума, включающий:
(а) извлечение внеклеточной ДНК или геномной ДНК, которая может содержать внеклеточную ДНК опухоли, из жидкого биоптата от индивидуума, где последовательность внеклеточной ДНК опухоли имеет иной паттерн метилирования по сравнению с нормальными соматическими клетками;
(b) разделение последовательностей двухцепочечной ДНК на верхнюю и нижнюю матричные цепи;
(c) удлинение верхней и нижней матричных цепей с использованием полимеразы, нуклеотидов и избранных наборов праймеров, которые нацелены на области генома, в которых раковая клетка и нормальная клетка имеют различные паттерны метилирования, с получением полуметилированных последовательностей двухцепочечной ДНК для избранных дифференциально метилированных локусов;
(d) обработку полуметилированных последовательностей двухцепочечной ДНК метилтрансферазой для добавления метильных групп в положениях, соответствующих метилированному цитозину в соответствующих последовательностях двухцепочечной ДНК, с получением полностью метилированных последовательностей двухцепочечной ДНК из выбранных дифференциально метилированных локусов;
(e) повторение стадий (b)-(d) для получения полностью метилированных ампликонов избранных дифференциально метилированных локусов;
(f) обработку полностью метилированных ампликонов реагентом для превращения остатков цитозина в урацил при сохранении остатков метилированного цитозина без изменений;
(g) определение паттерна метилированного цитозина;
(h) определение наличия в образце внеклеточной ДНК опухоли путем сравнения паттерна метилированного цитозина внеклеточной ДНК с паттерном метилированного цитозина различных раковых тканей, определения различий между паттерном метилированного цитозина внеклеточной ДНК и паттерном метилированного цитозина различных раковых тканей, определение наличия в образце внеклеточной ДНК опухоли; и
(i) диагностирование индивидуума с определенным типом рака, когда определенный паттерн метилированного цитозина содержит онкоспецифический паттерн метилирования.
44. Способ по п. 43, в котором жидкий образец от биопсии представляет собой образец крови, образец спинномозговой жидкости или образец мочи.
45. Способ по п. 43, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление хелатирующего агента для хелатирования ионов магния.
46. Способ по п. 43, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния.
47. Способ по п. 43, в котором стадия (с) включает ионы магния, а обработка на стадии (d) включает добавление ЭДТА для хелатирования ионов магния эквимолярным способом для создания идеальных буферных условий для метилтрансферазы.
48. Способ по п. 43, в котором стадия (е) включает добавление иона магния на повторяющейся стадии (с) для создания идеальных условий буфера для удлинения праймера с целью удлинения праймера.
49. Способ по п. 43, где метилтрансферазой является DNMT1.
50. Способ по п. 43, где реагентом для превращения цитозиновых остатков в урацил является бисульфит натрия.
51. Способ по п. 43, в котором реагент для превращения цитозиновых остатков в урацил представляет собой фермент семейства APOBEC.
52. Способ по п. 43, где реагентом для превращения цитозиновых остатков в урацил является APOBEC3A.
53. Способ по п. 43, где последовательность двухцепочечной ДНК представляет собой ДНК целого генома, полученную из одной клетки.
54. Способ по п. 43, где последовательность двухцепочечной ДНК представляет собой геномную ДНК из раковой клетки или циркулирующей опухолевой клетки.
55. Способ по п. 43, где последовательностью двухцепочечной ДНК является внеклеточная геномная ДНК опухолевых клеток, полученная из образца крови индивидуума.
56. Способ по п. 43, в котором стадии (b)-(d) повторяют от 1 до 20 раз.
57. Способ по п. 43, в котором стадии (b)-(d) повторяют от 1 до 10 раз.
58. Способ по п. 43, в котором стадии (b)-(d) повторяют от 1 до 5 раз.
59. Способ по п. 43, где праймеры представляют собой онкоспецифические праймеры.
60. Способ по п. 43, в котором определение паттернов метилированного цитозина включает секвенирование следующего поколения, специфическую для метилирования кПЦР или выявляющую метилирование микроматрицу.
61. Способ по п. 43, где рак представляет собой заболевание, выбранное из группы, состоящей из инвазивной карциномы молочной железы, аденокарциномы толстой кишки, гепатоцеллюлярной карциномы печени, аденокарциномы предстательной железы, аденокарциномы желудка и карциномы эндометрия.
| Wiench M | |||
| et al | |||
| DNA methylation status predicts cell type‐specific enhancer activity, The EMBO journal, 2011, Т | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| ПРИСПОСОБЛЕНИЕ К БАНКАБРОШУ ДЛЯ РЕГУЛИРОВАНИЯ НАТЯЖЕНИЯ РОВНИЦЫ | 1925 |
|
SU3028A1 |
| Hashimoto K | |||
| et al | |||
| Improved quantification of DNA methylation using methylation-sensitive restriction enzymes and real-time PCR, Epigenetics, 2007, Т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Кузнецова Е | |||
| Б., Стрельников В | |||
| В | |||
Авторы
Даты
2021-08-25—Публикация
2018-03-08—Подача