ПРЕДПОСЫЛКИ
[1] Обнаружение нуклеиновых кислот и белков в биологических образцах можно использовать для идентификации и классификации микроорганизмов, диагностирования инфекционных заболеваний, обнаружения и определения характеристик генетических аномалий, идентификации генетических изменений, ассоциированных с началом или прогрессированием заболевания, изучения генетической подверженности заболеванию и измерения ответа на лечение заболевания.
[2] Анализ отдельных клеток или отдельных ядер или предоставление дискретного анализа цитоплазматических и ядерных компартментов дает свободу в оценке типа клеток, дифференцировки клетки, состояния клетки, белкового синтеза и регуляции, эволюции, прогрессирования и диагностирования заболевания и ответов на лечение заболевания. В частности, анализ ДНК и РНК, а также гистонов и других ядерных белков, на уровне ядра можно использовать для проведения секвенирования полного генома, для обнаружения информации о состояниях покоя клетки и состояниях открытого хроматина или для предоставления в реальном времени информации о белковой регуляции. Такую информацию можно использовать для таких приложений, как редактирование генов, превращение типов клеток, анализ белковой регуляции и терапия заболевания.
[3] В существующих приемах доступа к нуклеиновым кислотам и белкам, содержащимся в клетке, для последующего анализа в целом используют способы лизиса клеток, которые разрушают клеточные компартменты. В некоторых способах используют литические среды, такие как ионные детергенты, которые дают смеси цитоплазматического и ядерного содержимого и препятствуют разрешению молекулярной информации между компартментами (например, из-за перекрестной контаминации между цитоплазматической митохондриальной ДНК и ядерной ДНК). В альтернативных способах лизиса используют мягкие неионные детергенты для того, чтобы разрушать клеточную мембрану, при этом оставляя ядра интактными. В другом подходе, выделенные ядра можно разрушать с использованием расщепляющих ферментов, таких как протеазы.
[4] В приемах секвенирования нового поколения (NGS) обычно используют стадию получения образца или библиотеки, на которой геномную ДНК или РНК превращают в библиотеку фрагментированных секвенируемых матриц. Фрагментирование геномной ДНК является ключевой стадией при получении образца ДНК для высокопропускного секвенирования. В одном подходе транспосомные комплексы используют для того, чтобы фрагментировать и метить целевые нуклеиновые кислоты. Транспозазы опосредуют фрагментирование двухцепочечной ДНК и лигируют синтетические олигонуклеотиды по обоим концам. Добавленные олигонуклеотиды делают возможной последующие стадии амплификации и секвенирования. Рассмотренные выше способы лизиса клеток и ядер несовместимы с такими подходами, поскольку они разрушают ферменты (например, ионные детергенты, расщепляющие ферменты) или потому, что ферменты неспособны достаточно проникать в интактные ядра. Например, транспосомные комплексы, такие как Nextera Tn5 (димер ~106 кДа), который используют в существующих протоколах тагментации, неспособны эффективно осуществлять доступ к ядерному материалу из-за комплексности ядерной оболочки (см. фиг. 1). Ядерная оболочка состоит из внешней ядерной мембраны и внутренней ядерной мембраны, которые вместе образуют липидный бислой, который ограничивает диффузию биомолекул из цитоплазмы в ядро. Ядерные поровые комплексы (NPC) пронизывают ядерную мембрану и строго регулируют транспорт биомолекул в ядро и из него, обычно позволяя проходить только молекулам размером меньше 40 кДа. Смежно с внутренней ядерной мембраной в ядерной пластинке, которая содержит белковые филаменты, такие как элементы прикрепления к каркасу/матриксу, клатрин и другие белки, которые создают поддерживающий остов для того, чтобы поддерживать ядерную жесткость и управлять избирательным по размеру проникновением молекул в ядро. В связи с этими проблемами ферментативного разрушения и ограниченной диффузии через ядерную мембрану, способы лизиса клеток требуют дополнительных стадий очистки и выделения для того, чтобы выделять целевые нуклеиновые кислоты или белки прежде чем можно будет осуществлять получение образца.
[5] Анализ содержимого отдельной клетки можно выполнять посредством выделения отдельных клеток в дискретные компартменты. В одном приеме клетки распределяют в водные капельки в масляной среде. Однако масло затрудняет перенос материалов и ферментов для получения образца в водные капельки и из них, так что все такие реактивы должны присутствовать в начальной водной среде. Кроме того, можно сохранять информацию о близости, используя способы компартментализации, например, сохраняющие близость элементы (CE), как описано в публикации PCT № WO2016/013704. Однако, такие приемы не направлены на рассмотренные выше ограничения, касающиеся дискретного доступа к ядерным и цитоплазматическим элементам.
[6] Существует необходимость в способах получения образца для анализа клеточных компонентов, например, посредством секвенирования нового поколения, которые обеспечивают эффективный доступ к ядерному генетическому материалу, делают возможным независимое обнаружение ядерного и цитоплазматического содержимого и создают подходящие библиотеки фрагментированной ДНК или РНК для секвенирования, при этом сохраняя цитоплазматический и ядерный компартмент и/или ядерную близость. В настоящем описании рассмотрены способы, которые предусматривают способы получения образца, подлежащие осуществлению в интактном ядре, в сущности используя ядерную оболочку в качестве CE.
КРАТКОЕ ИЗЛОЖЕНИЕ
[7] Настоящее раскрытие направлено на способы доставки аналитической биомолекулы в ядро клетки и проведения реакции аналитической биомолекулы с информационной молекулой ядра клетки (такой как нуклеиновая кислота или белок) посредством контакта клетки и/или ядра клетки с усилителем ядерной проницаемости. В некоторых аспектах способы включают проведение реакции второй аналитической биомолекулы с цитоплазматической информационной молекулой (такой как нуклеиновая кислота или белок). В некоторых аспектах способы включают стадии, которые облегчают анализ индивидуальных клеток и/или индивидуальных ядер. В некоторых аспектах содержимое отдельной клетки и/или ядра локализуют в сохраняющем близость элемент. В некоторых аспектах используют несколько сохраняющих близость элементов, что допускает независимый анализ анализируемых веществ из различных клеточных компартментов. В некоторых аспектах ядерная мембрана служит в качестве сохраняющего близость элемента или в качестве одного из множества сохраняющих близость элементов. Такая обработка также допускает удаление крупных биомолекул, таких как аналитические комплексы, из ядра для того, чтобы содействовать выделению и/или анализу.
[8] В настоящем описании описаны способы проведения реакций информационной молекулы ядра клетки с аналитической биомолекулой, которые включают приведение в контакт ядра клетки с усилителем ядерной проницаемости и проведение реакции информационной молекулы с аналитической биомолекулой.
[9] В настоящем описании описаны способы анализа информационной молекулы ядра клетки, включающие:
(a) приведение в контакт ядра клетки, содержащего информационную молекулу ядра клетки, с усилителем ядерной проницаемости и аналитической биомолекулой;
(b) проведение реакции аналитической биомолекулы с информационной молекулой ядра клетки для того, чтобы предоставлять аналитический комплекс; и
(c) анализ аналитического комплекса, тем самым обнаруживая информационную молекулу ядра клетки.
[10] Такие способы могут включать анализ цитоплазматической информационной молекулы. Таким образом, раскрытие направлено на способы анализа ядерной информационной молекулы и цитоплазматической информационной молекулы, включающие:
(a) приведение в контакт клетки, содержащей информационную молекулу ядра клетки и цитоплазматическую информационную молекулу, с усилителем ядерной проницаемости, первой аналитической биомолекулой и второй аналитической биомолекулой;
(b) проведение реакции первой аналитической биомолекулы с информационной молекулой ядра клетки для того, чтобы предоставлять первый аналитический комплекс, и проведение реакции второй аналитической биомолекулы с цитоплазматической информационной молекулой для того, чтобы предоставлять второй аналитический комплекс;
(c) анализ первого аналитического комплекса, тем самым обнаруживая информационную молекулу ядра клетки; и, необязательно,
(d) анализ второго аналитического комплекса, тем самым обнаруживая цитоплазматическую информационную молекулу.
[11] Способы, описанные в настоящем описании, позволяют использовать сохраняющие близость элементы. Следовательно, раскрытие направлено на способы анализа информационной молекулы ядра клетки, включающие:
(a) предоставление сохраняющего близость элемента, содержащего ядро, где ядро содержит информационную молекулу ядра клетки;
(b) приведение в контакт сохраняющего близость элемента с усилителем ядерной проницаемости и аналитической биомолекулой; и
(c) проведение реакции аналитической биомолекулы с информационной молекулой ядра клетки для того, чтобы предоставлять аналитический комплекс; и
(d) анализ аналитического комплекса, тем самым обнаруживая информационную молекулу ядра клетки.
[12] Кроме того, раскрытие направлено на способы анализа информационной молекулы ядра клетки и цитоплазматической информационной молекулы, включающие:
(a) предоставление сохраняющего близость элемента, содержащего клетку, где клетка содержит информационную молекулу ядра клетки и цитоплазматическую информационную молекулу;
(b) приведение в контакт сохраняющего близость элемента с усилителем ядерной проницаемости, первой аналитической биомолекулой и второй аналитической биомолекулой;
(c) проведение реакции первой аналитической биомолекулы с информационной молекулой ядра клетки для того, чтобы предоставлять первый аналитический комплекс, и проведение реакции второй аналитической биомолекулы с цитоплазматической информационной молекулой для того, чтобы предоставлять второй аналитический комплекс;
(d) анализ первого аналитического комплекса, тем самым обнаруживая информационную молекулу ядра клетки; и, необязательно,
(e) анализ второго аналитического комплекса, тем самым обнаруживая цитоплазматическую информационную молекулу.
[13] В вышеуказанных способах аналитические биомолекулы могут представлять собой транспосомные комплексы. Таким образом, в настоящем описании описаны способы фрагментирования и мечения целевых нуклеиновых кислот в ядре с использованием транспосомных комплексов и усилителя ядерной проницаемости. Направленное воздействие на клетки или ядра клеток усилителем ядерной проницаемости делает возможной эффективную доставку транспосомных комплексов в ядерное пространство. Раскрытие направлено на способы доставки транспозаз или транспосомных комплексов в ядра клеток посредством обработки клеток или ядер усилителем проницаемости ядра клетки. Таким образом, транспозицию ядерного генетического материала можно осуществлять в ядре.
[14] В настоящем описании описаны способы получения библиотеки меченых фрагментов нуклеиновой кислоты из клеточной ядерной целевой нуклеиновой кислоты, включающие:
(a) приведение в контакт ядра клетки, содержащего целевую нуклеиновую кислоту, с усилителем ядерной проницаемости и множеством транспосомных комплексов, где каждый транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности;
(b) проведение реакции целевой нуклеиновой кислоты с множеством транспосомных комплексов, в соответствии с чем целевую нуклеиновую кислоту фрагментируют на двухцепочечные фрагменты нуклеиновой кислоты и метят перенесенными нитями из транспозонных концевых композиций для того, чтобы формировать меченые аналитические комплексы; и
(c) анализ меченых аналитических комплексов, тем самым обнаруживая меченые фрагменты нуклеиновой кислоты.
[15] Также в настоящем описании описаны способы получения библиотеки меченых фрагментов нуклеиновой кислоты из клеточной ядерной целевой нуклеиновой кислоты:
(a) предоставление сохраняющего близость элемента, содержащего отдельное ядро, где отдельное ядро содержит целевую нуклеиновую кислоту;
(b) приведение в контакт сохраняющего близость элемента и отдельного ядра с усилителем ядерной проницаемости и аналитической биомолекулой; и
(c) проведение реакции аналитической биомолекулы с информационной молекулой ядра клетки для того, чтобы предоставлять аналитический комплекс; и
(d) анализ аналитического комплекса, тем самым обнаруживая информационную молекулу ядра клетки.
[16] В некоторых способах сохраняющий близость элемент содержит ядро клетки (выделенное или внутри клетки) с целевой нуклеиновой кислотой. Способы дополнительно могут включать получение и анализ цитоплазматической информационной молекулы, как рассмотрено выше.
[17] В некоторых вариантах осуществления дифференциальный доступ к клеточным, цитоплазматическим и ядерным компонентам клетки делает возможным анализ РНК, ДНК, белка или любого их сочетания из одной или более клеток или одного или более цитоплазматических и ядерных компонентов клетки.
[18] В некоторых способах соединения или биомолекулы (например, блокаторы ядерных пор) используют для того, чтобы блокировать доступ к определенным цитоплазматическим и ядерным компартментам.
[19] Способы, описанные в настоящем описании, можно использовать в анализе нескольких анализируемых веществ (ДНК, РНК, белок и т. д.) из одной и той же отдельной клетки.
[20] Также в настоящем описании описаны композиции, содержащие клетки и/или ядра клеток, усилитель ядерной проницаемости и транспозазу или транспосомный комплекс.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[21] На фиг. 1A и 1B представлена архитектура клетки (фиг. 1A) и ядра (фиг. 1B). У цитоплазме сливаются белки, РНК, митохондриальная ДНК и другие биомолекулы. В ядре клетки сливается ДНК. РНК, ядерные белки и другие биомолекулы.
[22] На фиг. 2A, 2B и 2C представлены различные режимы доступа к клеточным и ядерным компонентам. На фиг. 2A показан доступ к цитоплазматическим компонентам клетки отдельно посредством блокирования ядерных пор. На фиг. 2B представлен доступ к ядру посредством усиления проницаемости клеточной мембраны с использованием проницаемых биомолекул клетки и/или усиления проницаемости ядерной мембраны. На фиг. 2C показано выделенное ядро, сохраняемое индивидуально в качестве элемента близости с использованием усилителя ядерной проницаемости.
[23] На фиг. 3 представлена визуализация выделенных ядер, обработанных FAM-мечеными транспосомными комплексами в присутствии различных концентраций Pitstop-2, как описано в примере 3.
[24] На фиг. 4A, 4B и 4C представлены результаты секвенирования для библиотек ATAC-seq, генерируемых при обработке с использованием Pitstop-2 и без нее, как описано в примере 5. На фиг. 4A представлен профиль ATAC-seq поверх части Chr 12. На фиг. 4B приведены результаты по разнообразию и уникальности для покрытия секвенированием полного генома. На фиг. 4C представлено нормализованное покрытие на промоторных и кодирующих областях генома человека.
[25] На фиг. 5 представлено изображение агарозного геля для библиотек транспозиционной ДНК, полученных в присутствии и отсутствии Pitstop-2.
[26] На фиг. 6 представлено изображение агарозного геля при создании библиотеки ATAC-seq с использованием неочищенных, тагментированных ядер после обработки полимеразой с замещением цепи, как описано в примере 7.
[27] На фиг. 7A и 7B представлены результаты, описанные в примере 8. На фиг. 7A приведена концентрация библиотек ATAC-seq на основе данных BioAnalyzer. На фиг. 7B представлен профиль ATAC-seq для двух библиотек над частью Chr 6.
[28] На фиг. 8A и 8B показано создание индексного праймера, как рассмотрено в примере 11. На фиг. 8A приведено схематическое представление связанного с гранулой затравочного олигонуклеотида с областью, комплементарной праймеру для индексной ПЦР. На фиг. 8B приведена эффективность амплификации, которой достигают с использованием подхода с затравочным олигонуклеотидом.
[29] На фиг. 9 представлены данные агарозного геля для экспериментов с полимеразами с замещением цепи Bst и Phi29, как описано в примере 13.
[30] На фиг. 10 представлена схема использования ядерной мембраны в качестве CE для транспозиции, наряду с дополнительными способами, в которых экспонируют транспозиционные ядра деионизированной воде или условиям высокой соли.
[31] На фиг. 11 представлены данные секвенирования отдельной клетки для библиотек ATAC-seq мыши (3T3), полученных с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2, добавляемого в ходе клеточного лизиса и транспозиции ядер. На фиг. 11A показан эффект концентрации Pitstop-2, оказываемый на общее число уникальных прочтений для трех наборов штриховых кодов, сгруппированных по различному числу (>1 тыс., >10 тыс. и >100 тыс.) уникальных прочтений. На фиг. 11B представлена процентная доля фрагментов для образцов ATAC seq с использованием 0 мкМ, 30 мкМ или 60 мкМ Pitstop-2 в пределах 1 т. о. сайтов инициации транскрипции. На фиг. 11C представлены перекрытия пиков ATAC-seq, которые определяли с помощью программы поиска пиков MACS-2, для образцов, обработанных с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2.
ПОДРОБНОЕ ОПИСАНИЕ
[32] В некоторых вариантах осуществления информационная молекула ядра клетки представляет собой ДНК, РНК или белок. В некоторых вариантах осуществления она представляет собой ДНК или мРНК. В некоторых аспектах она представляет собой ДНК. В некоторых вариантах осуществления она представляет собой РНК. В некоторых вариантах осуществления она представляет собой ДНК и РНК. В некоторых вариантах осуществления она представляет собой кДНК или кДНК и ДНК. В некоторых вариантах осуществления ДНК может представлять состояние открытого хроматина ДНК. В некоторых вариантах осуществления ДНК может представлять полногеномную ДНК или фракцию полногеномной ДНК или митохондриальной ДНК.
[33] В некоторых вариантах осуществления цитоплазматическая информационная молекула представляет собой мРНК, ДНК или белок. В некоторых вариантах осуществления она представляет собой мРНК или ДНК.
[34] В некоторых вариантах осуществления аналитическая биомолекула представляет собой транспозазу или транспосомный комплекс, или антитело, или олигонуклеотид, или нуклеотид, или праймер обратной транскрипции или фермент. В некоторых примерах олигонуклеотид или нуклеотид содержит по меньшей мере один меченый нуклеотид. В некоторых примерах фермент представляет собой фермент амплификации, полимеразу, ДНК полимеразу, лигазу, РНК полимеразу, ПЦР фермент, ДНК полимеразу Taq, ДНК полимеразу Pfu, фермент, который опосредует транскрипцию in vitro, интегразу или никирующий фермент.
[35] В некоторых вариантах осуществления аналитическую биомолекулу индексируют или метят штриховым кодом. В некоторых вариантах осуществления аналитическая биомолекула представляет собой транспозазу. В других вариантах осуществления она представляет собой транспосомный комплекс. В некоторых вариантах осуществления транспосомный комплекс содержит транспозазу и две транспозонных концевых композиции, содержащие транспозонные концевые последовательности. Подходящие способы транспозиции известны в данной области и описаны, например, в публикациях США №№ 2010/0120098 и 2014/0194324 и публикации PCT № WO2016/130704.
[36] В некоторых вариантах осуществления транспозонные концевые композиции содержат концевые последовательности и олигонуклеотид адаптеры. В некоторых вариантах осуществления конкретные транспозонные концевые последовательности содержат двухцепочечную область, которая связывается с участком распознавания транспозазы.
[37] В некоторых вариантах осуществления аналитическая биомолекула представляет собой антитело, в частности, антитело, которое связывается специфически с целевой информационной молекулой, которая представляет собой белок, фрагмент белка или пептид. Необязательно антитело также содержит свисающий олигонуклеотид или другую метку, которая делает возможным последующее выделение и/или анализ. Связывание антитела с целевым белком образует аналитический комплекс.
[38] «Аналитический комплекс» представляет собой продукт реакции аналитической биомолекулы и целевой информационной молекулы. Такие комплексы можно формировать через ковалентное или нековалентное связывание или как ковалентное, так и нековалентное связывание. Например, транспозазный комплекс может фрагментировать и метить целевую нуклеиновую кислоту перенесенной нитью, давая комплекс меченой нуклеиновой кислоты, транспозазы и неперенесенной нити. Получаемый аналитический комплекс формируют через ковалентную связь и гибридизацию. В другом примере, аналитический комплекс может представлять собой комплекс антитела и целевого белка или антитела и целевого пептида.
[39] Описаны способы и композиции для усовершенствования доступности транспосом для ДНК в ядре. Текущие использования не ограничены транспосомами, поскольку различные другие молекулы можно избирательно вставлять в ядро или удалять. Например, захватывающие зонды поли(T) можно вносить в ядра для захвата РНК и последующего исследования (например, секвенирования) и анализа. Альтернативно, другие поры, например, NPC, можно нацеливать на транспортировку молекул в ядра и из них.
[40] Примеры цитоплазматических и ядерных компартментов представляют собой, но не ограничиваясь этим, митохондрии, ядра, хлоропласты, пероксисомы, эндоплазматический ретикулум, микротрубочки, аппарат Гольджи, карбоксисомы и метаболосомы.
Усилитель ядерной проницаемости
[41] В некоторых аспектах, усилитель ядерной проницаемости представляет собой соединение (например, низкомолекулярное соединение или пептид), которое увеличивает проницаемость ядерной оболочки без разрушения ядерной мембраны. В таких вариантах осуществления, ядерную мембрану не удаляют, и она становится более пористой. Такая обработка усовершенствует доступ аналитических биомолекул, таких как транспосомные комплексы или антитела, к ядерному генетическому материалу. Таким образом, в некоторых вариантах осуществления доступ аналитической биомолекулы, такой как транспосомный комплекс, к ядерному генетическому материалу увеличивают посредством контакта ядер с усилителем ядерной проницаемости. Подходящие усилители включают соединения, которые разрушают NPC гидрофобные взаимодействия, соединения, которые связываются с и/или ингибируют белки ядерных филаментов, такие как клатрин, и пептиды сигналов ядерной локализации.
[42] В некоторых вариантах осуществления усилителем является ингибитор клатрина. Показано, что ингибиторы сборки клатриновой оболочки ингибируют захват классических субстратов клатрин-опосредованного эндоцитоза. (См. Liashkovich, I. et al., «Clathrin inhibitor Pitstop-2 disrupts the nuclear pore complex permeability barrier», Sci. Rep. 2015, 5, 9994.) Такие соединения могут функционировать для того, чтобы создавать сквозные полости и/или увеличивать размер ядерных поровых комплексов. Подходящие ингибиторы клатрина включают Pitstop-2 (также известный как N-[5-(4-бромбензилиден)-4-оксо-4,5-дигидро-1,3-тиазол-2-ил]нафталин-1-сульфонамид), метил-β-циклодекстрин, фенотиазины, монодансилкадаверин, хлорохин, монензин, гиперосмотическую сахарозу и динасор, а также их синтетические аналоги. (См. Chen, C.-L. et al., «Inhibitors of clathrin-dependent endocytosis enhance TGFβ signaling and responses» J. Cell. Sci. 2009, 122, 1863-1871, и цитируемые в них ссылки). Как показано в данных, представленных в настоящем описании, обнаружено, что ингибитор клатрина осуществляет транспорт транспосомных комплексов в ядра, тем самым усовершенствуя доступ транспосомных комплексов к ядерному генетическому материалу и усовершенствуя эффективность транспозиции для этого материала.
[43] Образцовые усилители также включают нарушители гидрофобности, такие как алифатические спирты, включая C4-10-алкилдиолы, циклические диолы, циклоалкандиолы или вицинальные диолы (например, транс-1,2-циклогександиол, н-гексан-1,2-диол, 1,6-гександиол; см. Ribbeck, K. et al., «The permeability barrier of nuclear pore complexes appears to operate via hydrophobic exclusion», The EMBO J. 2002, 21(11), 2664-2671). В некоторых вариантах осуществления усилитель ядерной проницаемости представляет собой циклогександиол или 1,2-циклогександиол или транс-1,2-циклогександиол. Кроме того, нарушители гидрофобности включают поверхностно-активные средства, такие как дигитонин (см., например, Hagstrom et al., J. Cell Sci. 1997, 110, 2323-2331; Tissera et al., «Nuclear envelopes show cell-type specific sensitivity for permeabilization with digitonin», Nature (Protocol Exchange), 2010 (доступно по адресу https://www.nature.com/protocolexchange/protocols/1994).
[44] Образцовые усилители также включают сигналы ядерной локализации (NLS), которые представляют собой аминокислотные последовательности, обычно используемые для того, чтобы метить белки для импорта в ядро клетки посредством ядерного транспорта. В некоторых вариантах осуществления NLS ковалентно или нековалентно связывают с аналитической биомолекулой (например, примеряют в виде комплекса или формируют в виде комплекса in situ). В некоторых способах, NLS не связывают ковалентно с аналитической биомолекулой (например, транспозазой или транспосомным комплексом), но используют в качестве добавки к смеси аналитической биомолекулы и клетки или ядра клетки (например, реакция транспозиции). В некоторых вариантах осуществления NLS представляет собой большой T-антиген SV40 (PKKKRKV; Creative Peptides, Shirley, NY, № по каталогу GR1405), NLS нуклеоплазмина (KR[PAATKKAGQA]KKKK или AVKRPAATKKAGQAKKKLD) (см. Rotello et al., Bioconj. Chem. 26(6), 1004-7), K-K/R-X-K/R (см. Chelsky et al., Mol. Cell Biol. 1989, 9(6), 2487-2492; Dingwall et al., J. Cell. Biol. 1988, 107(3), 841), EGL-13 (MSRRRKANPTKLSENAKKLAKEVEN), c-Myc (PAAKRVKLD), TUS-белок (KLKIKRPVK), кислый домен M9 из hnRNP A1, KIPIK из репрессора транскрипции дрожжей Matα2, последовательности PY-NLS (Lee et al., Cell 126(3), 543-58) и ингибиторы импортина β2. В некоторых вариантах осуществления NLS представляет собой большой T-антиген SV40.
Получение матричных нуклеиновых кислот
[45] Некоторые варианты осуществления включают способы получения матричных нуклеиновых кислот. Как используют в настоящем описании, «матричная нуклеиновая кислота» может относиться к субстрату для получения информации о последовательности. Некоторые способы получения матричных нуклеиновых кислот включают инсерцию транспозонной последовательности в целевую нуклеиновую кислоту, тем самым получая матричную нуклеиновую кислоту. Некоторые способы инсерции включают приведение в контакт транспозонной последовательности, предусмотренной в настоящем описании, с целевой нуклеиновой кислотой в присутствии фермента, такого как транспозаза или интеграза, в условиях, достаточных для встраивания транспозонной последовательности или последовательностей в целевую нуклеиновую кислоту. В некоторых вариантах осуществления матричная нуклеиновая кислота может включать целевую нуклеиновую кислоту, ее фрагмент или любую ее копию, содержащую по меньшей мере одну транспозонную последовательность, ее фрагмент или любую ее копию. В некоторых вариантах осуществления матричная нуклеиновая кислота может включать целевую нуклеиновую кислоту, содержащую адаптер, содержащий метку, подходящую для секвенирования, такую как участок праймера.
[46] В некоторых вариантах осуществления клетки можно фиксировать. В некоторых вариантах осуществления в способах описанных в настоящем описании, используют интактные клетки, и фиксируют клетки посредством обработки поверхностно-активным средством. В таких способах аналитические биомолекулы могут проникать в клетки без разрушения клеточной мембраны. В образцовых способах клетки обрабатывают поверхностно-активным средством (например, NP-40, SDS и т. д.), усилителем ядерной проницаемости и аналитической биомолекулой.
[47] В некоторых вариантах осуществления аналитические биомолекулы разрабатывают для конкретных целевых ДНК, мРНК, кДНК, ДНК или любого их сочетания (например, ДНК и кДНК). Например, определенные аналитические биомолекулы могут включать индексные зонды, разработанные для того, чтобы различать ДНК и мРНК. В некоторых вариантах осуществления используют первую аналитическую молекулу и вторую аналитическую биомолекулу, например, первый транспосомный комплекс и второй транспосомный комплекс, где первый транспосомный комплекс содержит транспозонную концевую последовательность для мечения ДНК (например, последовательности праймеров A14/B15) и второй транспосомный комплекс содержит транспозонную концевую последовательность для мечения мРНК (например, которая содержит адаптер, содержащий область поли(T), которая обладает специфичностью к хвосту поли(A) в мРНК).
[48] В некоторых вариантах осуществления искусственные поры можно вставлять в клеточные или ядерные компартменты для того, чтобы содействовать переносу аналитических биомолекул в компартмент или из него.
[49] В некоторых вариантах осуществления способы включают выделение ядер клеток. Выделение ядер клеток можно выполнять с использованием стандартных известных в данной области способов, при условии, что способы сохраняют целостность ядер клеток. В некоторых случаях можно использовать способы лизиса клеток. Ядра клеток можно выделять или очищать от цитоплазматических компонентов перед экспонированием для усилителя ядерной проницаемости. В некоторых вариантах осуществления цитоплазматическую фракцию сохраняют и анализируют отдельно.
[50] Для анализа нуклеиновых кислот получение образца обычно включает фрагментирование геномных нуклеиновых кислот на секвенируемые отрезки и лигирование адаптеров с фрагментами для того, чтобы получать матрицы для последующей очистки и, если необходимо, амплификации. Матрицы превращают с использованием праймеров в «затравочные» матрицы, которые амплифицируют и подвергают протоколам секвенирования.
[51] Число стадий, необходимых для того, чтобы трансформировать ДНК и/или РНК в модифицированные адаптером матрицы в растворе, готовом для амплификации и секвенирования, можно минимизировать с помощью опосредованного транспозазой фрагментирования и мечения. Этот процесс, обозначаемый в настоящем описании как «тагментация», часто включает модификацию ДНК или мРНК с помощью транспосомного комплекса, содержащего фермент транспозазу в комплексе с адаптерами, содержащими транспозонную концевую последовательность. Тагментация ведет к одновременному фрагментированию ДНК и лигированию адаптеров с 5'-концами обеих нитей дуплексных фрагментов. Стадию очистки можно использовать для того, чтобы удалять фермент транспозазу. Можно заполнять любые пропуски в двухцепочечном продукте и можно добавлять дополнительные последовательности на концы адаптированных фрагментов посредством ПЦР.
[52] В некоторых вариантах осуществления множество транспозонных последовательностей, предусмотренных в настоящем описании, вставляют в целевую нуклеиновую кислоту. Некоторые варианты осуществления включают выбор условий, достаточных для того, чтобы достигать встраивания множества транспозонных последовательностей в целевую нуклеиновую кислоту так, что усредненное расстояние между каждой встроенной транспозонной последовательностью содержит определенное число последовательных нуклеотидов в целевой нуклеиновой кислоте.
[53] Некоторые варианты осуществления получения матричной нуклеиновой кислоты могут включать копирование последовательностей, содержащих целевую нуклеиновую кислоту. Например, некоторые варианты осуществления включают гибридизацию праймера с участком праймера в транспозонной последовательности, встроенной в целевую нуклеиновую кислоту. В некоторых таких вариантах осуществления праймер можно гибридизировать с участком праймера и достраивать. Копируемые последовательности могут включать по меньшей мере одну последовательность штрихового кода и по меньшей мере часть целевой нуклеиновой кислоты. В некоторых вариантах осуществления копируемые последовательности могут содержать первую последовательность штрихового кода, вторую последовательность штрихового кода и по меньшей мере часть целевой нуклеиновой кислоты, расположенную между ними. В некоторых вариантах осуществления по меньшей мере одна копируемая нуклеиновая кислота может содержать по меньшей мере первую последовательность штрихового кода первой копируемой нуклеиновой кислоты, которую можно идентифицировать или предназначать для образования пары со второй последовательностью штрихового кода второй копируемой нуклеиновой кислоты. В некоторых вариантах осуществления праймер может включать праймер секвенирования. В некоторых вариантах осуществления данные секвенирования получают с использованием праймера секвенирования. В дополнительных вариантах осуществления адаптеры, содержащие участки праймера, можно лигировать с каждым концом нуклеиновой кислоты, и нуклеиновый амплифицированный с таких участков праймера.
[54] Некоторые варианты осуществления получения матричной нуклеиновой кислоты могут включать амплификацию последовательностей, содержащих по меньшей мере часть одной или более транспозонных последовательностей и по меньшей мере часть целевой нуклеиновой кислоты. В некоторых вариантах осуществления по меньшей мере часть целевой нуклеиновой кислоты можно амплифицировать с использованием праймеров, которые гибридизируются с участками праймера встроенных транспозонных последовательностей, встроенных в целевую нуклеиновую кислоту. В некоторых таких вариантах осуществления, амплифицируемая нуклеиновая кислота может содержать первую последовательность штрихового кода и вторую последовательность штрихового кода, имеющие по меньшей мере часть целевой нуклеиновой кислоты, расположенную между ними. В некоторых вариантах осуществления по меньшей мере одна амплифицируемая нуклеиновая кислота может содержать по меньшей мере первую последовательность штрихового кода первой амплифицируемой нуклеиновой кислоты, которую можно идентифицировать, для образования пары со второй последовательностью штрихового кода второй амплифицируемой последовательности.
[55] В некоторых вариантах осуществления может быть благоприятно для каждой матричной нуклеиновой кислоты встраивать по меньшей мере один универсальный участок праймера. Например, матричная нуклеиновая кислота может содержать первые концевые последовательности, которые содержат первый универсальный участок праймера, и вторые концевые последовательности, которые содержат второй универсальный участок праймера. Универсальные участки праймера могут иметь различные применения, такие как использование в амплификации, секвенировании и/или идентификации одной или более матричных нуклеиновых кислот. Первый и второй универсальные участки праймера могут представлять собой одно и то же, по существу схожее, схожее или различное. Универсальные участки праймера можно вводить в нуклеиновые кислоты с помощью различных способов, хорошо известных в данной области, например, лигирования участков праймера с нуклеиновыми кислотами, амплификации нуклеиновых кислот с использованием хвостатых праймеров и инсерции транспозонной последовательности, содержащей универсальный участок праймера.
Транспосомы
[56] Как используют в настоящем описании, термин «транспосомный комплекс» относится обычно к ферменту транспозиции (например, интегразе или транспозазе) и двухцепочечной нуклеиновой кислоте, содержащей интеграционный участок распознавания, такой как участок распознавания транспозазы. В вариантах осуществления, предусмотренных в настоящем описании, транспозаза может формировать функциональный комплекс с участком распознавания транспозазы, который способен катализировать реакцию транспозиции. Транспозаза может связываться с участком распознавания транспозазы и вставлять участок распознавания транспозазы в целевую нуклеиновую кислоту через «тагментацию». В некоторых таких событиях инсерции одну нить участка распознавания транспозазы можно передавать в целевую нуклеиновую кислоту. В одном из примеров транспосома содержит димерную транспозазу, содержащую две субъединицы и две не примыкающих транспозонных последовательности. В другом примере транспозаза содержит димерную транспозазу, содержащую две субъединицы, и примыкающую транспозонную последовательность. В некоторых вариантах осуществления комплекс формируют посредством инкубации транспозазы с двухцепочечной транспозонной ДНК в условиях, которые способствуют формированию нековалентного комплекса.
[57] Двухцепочечная транспозонная ДНК может включать, без ограничения, ДНК Tn5, часть ДНК Tn5, транспозонную концевую композицию, смесь транспозонных концевых композиций или другую двухцепочечную ДНК, способную взаимодействовать с транспозазой, такой как гиперактивная транспозаза Tn5.
[58] «Транспозаза» обозначает фермент, который способен формировать функциональный комплекс с содержащей транспозонный конец композицией (например, транспозоны, транспозонные концы, транспозонные концевые композиции) и катализировать инсерцию или транспозицию содержащей транспозонный конец композиции в двухцепочечную целевую ДНК, с которой ее инкубируют, например, в реакции транспозиции in vitro. Транспозаза, как представлено в настоящем описании, также может включать интегразы из ретротранспозонов и ретровирусов.
[59] Транспозазы, транспосомы и транспосомные комплексы в целом известны специалистам в данной области, как показано на примере раскрытием публикации США № 2010/0120098 и публикации PCT № 2016/130704, которые включены в настоящее описание посредством ссылки. Ферменты транспозазы включают, но не ограничиваясь этим, транспозазу Tn5, транспозазу Mu и транспозазу Vibrio harveyi, а также их варианты, такие как гиперактивная транспозаза Tn5. Ферменты транспозазы могут представлять собой мультимеры, такие как димеры, тримеры или тетрамеры, такие как димер Tn5. Любую транспозиционную систему, которая способна вставлять транспозонный конец с достаточной эффективностью для того, чтобы метить и фрагментировать целевую ДНК для ее предполагаемой цели, можно использовать в способах, описанных в настоящем описании. В конкретных вариантах осуществления предпочтительная транспозиционная система способна вставлять транспозонный конец случайным или почти случайным образом в 5'-метку и фрагментировать целевую ДНК. В конкретных вариантах осуществления имеют место гиперактивная транспозаза Tn5 и участок распознавания транспозазы типа Tn5 (Goryshin and Reznikoff, J. Biol. Chem. 1983, 273:7367), или транспозаза MuA и участок распознавания транспозазы Mu, содержащий концевые последовательности R1 и R2 (Mizuuchi, K., Cell 1983, 35:785; Savilahti, H. et al., EMBO J. 1995, 14:4893). Мозаичные концевые (ME) последовательности также можно использовать, как оптимизировано специалистом в данной области. Вышеуказанные источники включены в настоящее описание посредством ссылки. Дополнительные образцовые транспозиционные системы описаны в WO2016/130704, например, Tn552 S. aureus, Ty1, транспозон Tn7, Tn/O и IS10, транспозаза Mariner, Tc1, элемент P, Tn3, бактериальные вставочные последовательности, ретровирусы, ретровирусные интегразы (такие как интегразы HIV-1, HIV-2, SIV, PFV-1 и RSV), ретротранспозоны дрожжей, IS5, Tn10, Tn903 или IS911, а также из сконструированные варианты.
[60] В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5, транспозазу Mu или транспозазу Vibrio (например, Vibrio harveyi). В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5. В некоторых вариантах осуществления транспозаза представляет собой гиперактивную транспозазу Tn5. В некоторых вариантах осуществления транспозаза представляет собой димер. В некоторых вариантах осуществления транспозаза представляет собой димер Tn5. В некоторых вариантах осуществления димер Tn5 является гиперактивным.
Транспозонные последовательности
[61] Термин «транспозонный конец» относится к двухцепочечной нуклеиновой кислоте ДНК включает по меньшей мере один транспозиционный участок распознавания («транспозонные концевые последовательности»), который образует комплекс с ферментом транспозазой или интегразой для того, чтобы предоставлять транспосомный комплекс для реакции транспозиции in vitro. Транспозонные последовательности, которые можно использовать в способах и композициях, предусмотренных в настоящем описании, предоставлены в публикациях США №№ 2012/0208705 и 2012/0208724 и публикации PCT № WO 2012/061832, каждая из которых включена по ссылке в полном объеме. В некоторых вариантах осуществления транспозонный конец способен формировать функциональный комплекс с транспозазой в реакции транспозиции. В качестве неограничивающих примеров, транспозонные концы могут включать транспозонный конец внешнего конца («OE») из 19 п. о., транспозонный конец внутреннего конца («IE») или транспозонный конец «мозаичного конца» («ME»), распознаваемый транспозазой Tn5 дикого или мутантного типа, или транспозонный конец R1 и R2, как описано в публикации США № 2010/0120098. Транспозонные концы могут содержать любую нуклеиновую кислоту или аналог нуклеиновой кислоты, подходящий для формирования функционального комплекса с ферментом транспозазой или интегразой в реакции транспозиции in vitro. Например, транспозонный конец может содержать ДНК, РНК, модифицированные основания, неприродные основания и/или модифицированный остов и может содержать однонитевые разрывы в одной или обеих нитях. Несмотря на то, что термин «ДНК» используют на всем протяжении настоящего раскрытия в связи с композицией транспозонных концов, следует понимать, что любую подходящую нуклеиновую кислоту или аналог нуклеиновой кислоты можно использовать в транспозонном конце.
[62] Термин «перенесенная нить» относится к перенесенной части обоих транспозонных концов. Аналогичным образом, термин «неперенесенная нить» относится к неперенесенной части обоих «транспозонных концов». 3'-конец перенесенной нити соединяют или переносят на целевую ДНК в реакции транспозиции in vitro. Неперенесенную нить, которая демонстрирует транспозонную концевую последовательность, которая комплементарна перенесенной транспозонной концевой последовательности, не соединяют или не переносят на целевую ДНК в реакции транспозиции in vitro.
[63] Термин «адаптер», как используют в настоящем описании, относится к полинуклеотидной области, содержащей по меньшей мере одну метку. Некоторые варианты осуществления включают транспосомный комплекс, содержащий полинуклеотид, имеющий 3'-часть, содержащую транспозонную концевую последовательность, и адаптерную область, содержащую по меньшей мере одну метку. Адаптерные последовательности могут содержать линкерные области.
[64] Термин «метка», как используют в настоящем описании, относится к олигонуклеотидной области с последовательностью, подходящей для желаемой планируемой цели или применения. Метка может содержать одну или более последовательностей, которые можно использовать, когда вставляют в целевую нуклеиновую кислоту, например, участки фрагментирования (последовательность, которую можно расщеплять химически, биохимически или фотохимически в определенное время), участки праймера, штриховые коды (используемые для того, чтобы идентифицировать одно или более конкретных анализируемых веществ), аффинные метки, участки распознавания и/или репортерные фрагменты (фрагмент, который может испускать сигнал, например, флуоресцентный, хемилюминесцентный, биолюминесцентный, фосфоресцентный, радиоактивный, калориметрический, электронный или другой сигнал). Следует принимать во внимание, что любой другой подходящий признак можно встраивать в метку. В некоторых вариантах осуществления метка содержит последовательность, имеющую длину между 5 и 200 п. о., или между 10 и 100 п. о., или между 20 и 50 п. о., или имеющую длину приблизительно 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 или 200 п. о.
[65] В некоторых вариантах осуществления метка содержит один или более участков праймера, подходящих для гибридизации с праймером (который можно связывать с твердой поверхностью, такой как гранула или проточная кювета) для реакции амплификации, такой как кластерная амплификация и/или реакция секвенирования. Образцовые последовательности сайтов связывания праймеров включают, но не ограничиваясь этим:
AATGATACGGCGACCACCGAGATCTACAC (последовательность P5)
и
CAAGCAGAAGACGGCATACGAGAT (последовательность P7)
и их комплементы. В некоторых случаях, последовательность праймера содержит модифицированные основания для того, чтобы сделать возможным последующее ферментативное или химическое расщепление, например, вицинальный диол или 8-оксогуанин.
В некоторых вариантах осуществления метки содержат штриховые коды, которые используют при получении матричных нуклеиновых кислот. Как будет ясно, большое число доступных штриховых кодов позволяет каждой молекуле матричной нуклеиновой кислоты содержать уникальную идентификацию. Уникальную идентификацию каждой молекулы в смеси матричных нуклеиновых кислот можно использовать в нескольких применениях. Например, уникально идентифицируемые молекулы можно применять для того, чтобы идентифицировать индивидуальные молекулы нуклеиновой кислоты в образцах, содержащих несколько хромосом, в геномах, в клетках, в клетках определенных типов, в состояниях заболеваний клеток и в биологических видах, например, при секвенировании гаплотипа, при определении родительского аллеля, при метагеномном секвенировании и при секвенировании образца генома. Образцовые последовательности штрихового кода включают, но не ограничиваясь этим, TATAGCCT, ATAGAGGC, CCTATCCT, GGCTCTGA, AGGCGAAG, TAATCTTA, CAGGACGT и GTACTGAC.
[66] Способы получения транспозонных концевых последовательностей, транспозонов и транспосомных комплексов известны в данной области.
[67] Как используют в настоящем описании, термины «нуклеиновая кислота» и «олигонуклеотид» относятся к по меньшей мере двум нуклеотидным мономерам, ковалентно связанным вместе. Нуклеиновая кислота в целом содержит сложные фосфодиэфирные связи и природные основания, но в некоторых вариантах осуществления может содержать не природные остовы и/или основания, как описано, например, в публикации PCT № WO2016/130704. Нуклеиновая кислота может представлять собой ДНК, например, геномную или кДНК, РНК или гибрид, из отдельных клеток, отдельных ядер, нескольких клеток, нескольких ядер или от нескольких биологических видов, как и в случае метагеномных образцов, например, из образцов окружающей среды, а также из смешанных образцов, например, смешенных образцов тканей или смешанных образцов для различных индивидуумов одного и того же вида, патологических образцов, таких как нуклеиновые кислоты, связанные со злокачественными опухолями, и т. п. Нуклеиновая кислота может содержать любую комбинацию дезоксирибо- и рибонуклеотидов и любую комбинацию оснований, включающую природные основания или не природные аналоги или синтетические основания.
[68] Как используют в настоящем описании, термин «обнаруживать» и/или его грамматические эквиваленты может относиться к идентификации присутствия или существования анализируемого вещества, идентификации индивидуальных компонентов анализируемого вещества, например, информации о последовательности, и/или определению количества такого анализируемого вещества. В некоторых вариантах осуществления обнаружение включает обнаружение последовательностей меченых информационных молекул или ампликонов, получаемых способами, описанными в настоящем описании.
[69] В некоторых вариантах осуществления целевые информационные молекулы, клетки и/или ядра можно получать из любого биологического образца, содержащего ДНК и/или мРНК, включая в качестве неограничивающих примеров биологический образец или образец пациента. Источник клеток и/или ядер клеток может представлять собой, например, бактерии, растения, паразитов, насекомых, животных или млекопитающих (например, крысу, мышь, обезьяну, не являющегося человеком примата, человека) или их смесь. Термин «биологический образец» или «образец пациента», как используют в настоящем описании, включает такие образцы, как одна или более клеток, тканей или текучих веществ организма. Образцы могут включать природные или обработанные образцы, такие как мацерированная ткань или лизаты. «Текучие вещества организма» могут включать, но не ограничиваясь этим, кровь, сыворотку, плазму, слюну, цереброспинальную жидкость, бронхиальный аспират, плевральную жидкость, жидкость сумки, синовиальную жидкость, слезы, текучее вещество молочного протока, лимфу, слизь, мокроту, мочу, кал, амниотическую жидкость или семя или их смеси. Ткани могут включать образцы биопсии, опухолевые образцы или кожу. Образец может содержать текучее вещество организма, которое содержит меньше чем приблизительно 1% (масс./масс.) цельноклеточного материала, например, плазму или сыворотку. Образец может включать образец природного или синтетического происхождения (т. е. клеточный образец, сделанный бесклеточным).
[70] В некоторых вариантах осуществления способы дополнительно включают обработку тагментированной нуклеиновой кислоты полимеразой, такой как полимераза с замещением цепи (например, полимераза Bst или полимераза Phi29) для того, чтобы удалять транспозазу из тагментированного материала. В таких вариантах осуществления тагментированные нуклеиновые кислоты в ядрах можно обрабатывать полимеразой (например, полимеразой с замещением цепи) и додецилсульфатом натрия для того, чтобы сделать возможной ПЦР амплификацию. В других вариантах осуществления меченые информационные молекулы можно обрабатывать полимеразой, такой как полимераза с замещением цепи, чтобы сделать возможной ПЦР амплификацию.
[71] В некоторых вариантах осуществления способы дополнительно включают приведение в контакт транспозиционных ядер клеток с деионизированной водой. Таким образом, способы дополнительно могут включать удаление аналитических комплексов, таких как меченые нуклеиновые кислоты или комплексы антитела и белка/пептида, из обработанных клеток или ядер посредством обработки клеток или ядер деионизированной водой. Такая обработка создает осмотический приток воды и, тем самым, набухание ядерного тельца. В некоторых вариантах осуществления обработка клеток или ядер усилителем ядерной проницаемости включает обработку деионизированной водой. Такое набухание служит для дополнительного увеличения размера ядерных пор, чтобы сделать возможным дальнейший приток транспосомных комплексов в ядерное пространство. (См. фиг. 10.)
[72] В некоторых вариантах осуществления обработка усилителем ядерной проницаемости происходит в присутствии высокосолевого буфера. Буфере создает осмотический дифференциал на ядерной мембране с тем, чтобы вытеснять ядерный материал из ядерного тельца. Такая обработка делает возможным временной контроль за разрушением ядерной мембраны (см. фиг. 10).
[73] Без обработки ядер усилителем проницаемости к ядерному материалу получают доступ небольшие количества транспосомных комплексов. Таким образом, в некоторых вариантах осуществления способы включают реакцию цитоплазматической информационной молекулы с первой аналитической биомолекулой в присутствии блокатора ядерных пор и в отсутствие усилителя ядерной проницаемости. На последующей стадии блокатор ядерных пор и/или цитоплазматический материал необязательно удаляют и остающийся клеточный материал обрабатывают второй аналитической биомолекулой в присутствии усилителя ядерной проницаемости. Таким образом, цитоплазматические и ядерные компоненты метят ортогонально. Подходящие блокаторы ядерных пор включают такие средства, как агглютинин зародышей пшеницы, лептомицин B, антитела со специфичностью к NPC (см., например, Adam, S.A. et al., J. Cell Biol. 1990, 111(3), 807-816; Moore et al., Cell 1992, 69(6), 939-950) или другие лиганды, ферменты или биомолекулы, которые связываются с NPC или зависимыми ионными каналами.
Сохраняющие близость элементы
[74] В некоторых вариантах осуществления сохраняющие близость элементы (CE) используют сохранения информации отдельных клеток и/или отдельных ядер. В некоторых вариантах осуществления информацию о близости для отдельных ядер сохраняют посредством компартментализации индивидуальных ядер или индивидуальных клеток. В некоторых вариантах осуществления такую компартментализацию выполняют посредством локализации отдельных ядер или клеток в физических компартментах, таких как микролунки, микрокапельки или микрокапсулы, или посредством иммобилизации генетического материала с использованием гидрогелей или на или в микрогранулах. Такие процессы эффективно поддерживают клеточную и/или ядерную близость в течение транспозиции, при этом давая больше прямого доступа к ядерному материалу. Такие подходы также снижают перекрестную контаминацию ядерного материала из отдельных ядер. В некоторых вариантах осуществления CE может содержать целевую нуклеиновую кислоту.
[75] В некоторых вариантах осуществления способы включают секвенирование нуклеиновых кислот, сохраненных, встроенных или содержащихся в сохраняющих близость элементах. В частности, варианты осуществления способов и композиций, предусмотренных в настоящем описании, относятся к получению матриц нуклеиновых кислот и получению данных последовательностей из них. Способы и композиции, предусмотренные в настоящем описании, связаны со способами и композициями, предусмотренными в публикациях США №№ 2012/0208705 и 2012/0208724 и публикации PCT № WO 2012/061832, каждая из которых включена по ссылке в полном объеме. Некоторые варианты осуществления, представленные в настоящем описании, относятся к получению ДНК в сохраняющем близость элементе(ах), чтобы получать фазирование и информацию о сборке последовательности из целевой нуклеиновой кислоты, и получению фазирования и информации о сборке последовательности из таких матриц. Конкретные варианты осуществления, предусмотренные в настоящем описании, относятся к использованию интеграз, например, транспозаз, чтобы поддерживать физическую близость ассоциированных концов фрагментированных нуклеиновых кислот; и к использованию комбинаторной индексации для того, чтобы создавать библиотеки индивидуумов из каждого сохраняющего близость элемента. Получение информации о гаплотипе включает различение различных аллелей (например, SNP, генетические аномалии и т. д.) в целевой нуклеиновой кислоте. Такие способы можно использовать для того, чтобы определять характеристики различных аллелей в целевой нуклеиновой кислоте и снижать частоту ошибок в информации о последовательности.
[76] В некоторых вариантах осуществления CE содержит клетки или отдельную клетку. В некоторых вариантах осуществления CE содержит нуклеиновые кислоты из клеток или из отдельной клетки, например, ДНК, мРНК или кДНК; макромолекулы клеток или отдельной клетки, включая белки, полисахариды, липиды и нуклеиновые кислоты, а также низкомолекулярные соединения, такие как первичные метаболиты, вторичные метаболиты и естественные продукты клеток или отдельной клетки. В некоторых вариантах осуществления нуклеиновую кислоту подвергают амплификации, такой как ПЦР или амплификация полного генома, перед формированием CE, содержащего нуклеиновую кислоту. В некоторых вариантах осуществления анализ ДНК и мРНК можно осуществлять параллельно. В некоторых вариантах осуществления клеточная мембрана представляет собой CE.
[77] В некоторых вариантах осуществления CE содержит ядра или отдельное ядро. В некоторых вариантах осуществления CE содержит нуклеиновую кислоту из ядер или отдельного ядра. В некоторых вариантах осуществления ядерная мембрана представляет собой CE.
[78] Как показано на фиг. 2, в настоящем раскрытии рассматривают различные режимы доступа к клеточным и ядерным компартментам, которые сохраняют информацию о близости. В некоторых вариантах осуществления клетка представляет собой CE элемент, в котором ядро (например, ядерные поровые комплексы) блокируют для входа аналитических биомолекул или реактивов, необходимых для того, чтобы сделать возможным взаимодействие ядерных информационных молекул с аналитическими биомолекулами (фиг. 2A). Следовательно, ядерная мембрана представляет собой CE, который делает возможной дифференциальную реакцию с цитоплазматическим содержимым в сравнении с ядерным. В таких случаях клеточную мембрану можно использовать в качестве второго CE, или клетку можно компартментализировать на дополнительный CE. В некоторых вариантах осуществления доступ к ядерному содержимому осуществляют посредством усиления проницаемости клеточной мембраны, используя биомолекулы клеточной проницаемости, и/или усиливая проницаемость ядерной мембраны (фиг. 2B). В других вариантах осуществления ядерная мембрана выделенных ядер может служить в качестве CE (фиг. 2C), когда обрабатывают усилителем ядерной проницаемости. Все эти способы можно использовать в сочетании с дополнительными CE, такими как микрокапельки, микрогранулы (гидрогели), микролунки и компартменты других типов, чтобы поддерживать информационную близость.
[79] В некоторых вариантах осуществления предусмотрены способы получения библиотек из РНК, ДНК или их смесей и получения данные об отдельных клетках по РНК, ДНК или как РНК, так и ДНК. В некоторых вариантах осуществления предусмотрены способы получения библиотек из РНК, ДНК, белков или любого их сочетания.
[80] В некоторых вариантах осуществления клетки лизируют в CE так, что множество целевых информационных молекул в отдельной клетке высвобождают в CE. В некоторых случаях клетку лизируют, но ядро не лизируют, так что цитоплазматические компоненты высвобождают в CE, а ядра остаются интактными.
[81] В некоторых вариантах осуществления несколько CE используют в сочетании с подходом комбинаторного мечения с тем, чтобы нуклеиновые кислоты или другие информационные молекулы физически разделять и/или ортогонально метить.
[82] В одном из вариантов осуществления мишени можно разводить в CE, таком как капельки. Можно использовать необязательную амплификацию полного генома и можно получать информацию о последовательности из количества матричной нуклеиновой кислоты, эквивалентной приблизительно гаплоидному эквиваленту целевой нуклеиновой кислоты.
[83] В некоторых вариантах осуществления схему множественного комбинаторного мечения можно применять к компонентам в отдельной клетке в дополнение к нуклеиновой кислоте, например, белкам, органеллам, липидам или клеточным мембранам так, что компоненты в отдельной клетке или ядре можно идентифицировать относительно компонентов из другой отдельной клетки или ядра. В некоторых вариантах осуществления CE может содержать компоненты в отдельной клетке или отдельном ядре. В некоторых вариантах осуществления идентифицируемую уникальную метку(и) в CE будут иметь компоненты отдельной клетки и/или отдельного ядра, которые отличаются от компонентов отдельной клетки и/или ядра в другом CE.
[84] В некоторых вариантах осуществления можно использовать несколько схем комбинаторного мечения штриховыми кодами. В некоторых вариантах осуществления такое комбинаторное мечение штриховыми кодами и комбинаторное мечение можно осуществлять в CE, содержащем отдельную клетку. В некоторых вариантах осуществления такое комбинаторное мечение штриховыми кодами и комбинаторное мечение можно параллельно осуществлять для нескольких CE, содержащих отдельные клетки или ядра.
[85] Сохраняющий близость элемент (CE) представляет собой физический объект, которых сохраняет по меньшей мере два или больше или все анализируемые вещества в непосредственной близости (или близости) через одну или более стадий анализа и предоставляет доступ для реактивов анализа и может быть объединен и разделен несколько раз без утраты близости анализируемых веществ.
[86] В некоторых вариантах осуществления CE может представлять собой твердый носитель. В одном из вариантов осуществления CE может представлять собой эмульсию или капельку. В некоторых вариантах осуществления CE представляет собой гель, гидрогель или гелевую гранулу. В некоторых вариантах осуществления CE может содержать твердый носитель, такой как гранулы. В некоторых вариантах осуществления гранулы дополнительно могут содержать антитела, олигонуклеотиды и/или штриховые коды. В другом варианте осуществления CE может составлять ДНК-наношар, создаваемый посредством WGA, RCA или конденсации любого реактива нуклеиновой кислоты.
[87] В некоторых вариантах осуществления CE можно создавать посредством встраивания нуклеиновой кислоты из клеток или из отдельной клетки или продукта ее амплификации (из WGA и т. д.) в полимерную матрицу, такую как агароза, полиакриламид, альгинат и т. д. В некоторых вариантах осуществления близость содержимого клеток или отдельной клетки в CE поддерживают посредством сохранения физической близости компонентов друг с другом через инкапсулирование (например, в полимерной матрице), иммобилизацию на грануле или захват, эффективно сохраняя информацию о близости внутри CE через повторные раунды объединения и перераспределения. Тот признак, что совокупность CE можно независимо объединять и разделять, вводить в реакцию с реактивами анализа, объединять и разделять снова и т. д., при этом сохраняя близость анализируемых веществ, составляющих индивидуальный CE, делает возможной комбинаторную индексацию через различные стадии разделения и объединения.
[88] В некоторых вариантах осуществления анализируемые вещества в сохраняющем близость элементе доступны для реактивов анализа, включая водные растворы, ферменты (например, фрагментазы, полимеразы, лигазы, транспозазы, киназы, рестрикционные эндонуклеазы, протеазы, фосфатазы или липазы), адаптеры нуклеиновой кислоты, штриховые коды нуклеиновой кислоты и/или метки.
[89] В некоторых вариантах осуществления одно или более анализируемых веществ в CE метят одной или более метками. Образцовые метки включают, но не ограничиваясь этим, штриховые коды или индексы ДНК, флуоресцентные метки, хемилюминесцентные метки, штриховые коды или индексы РНК, радиоактивные метки, антитело, содержащее метку, гранулы, содержащие метку.
[90] В некоторых вариантах осуществления способ может включать стадии: (a) компартментализации CE, содержащего целевую нуклеиновую кислоту, на множество первых сосудов; (b) предоставления первого индекса для целевой нуклеиновой кислоты каждого первого сосуда, тем самым получая первую индексированную нуклеиновую кислоту; (c) объединения первых индексированных нуклеиновых кислот; (d) компартментализации первых индексированных матричных нуклеиновых кислот на множество вторых сосудов; (e) предоставления второго индекса для первой индексированной матричной нуклеиновой кислоты каждого второго сосуда, тем самым получая вторую индексированную нуклеиновую кислоту. Стадии a-e можно продолжать дополнительными циклами из одной или более стадий из серии a-e, чтобы получать дополнительные виртуальные компартменты. Этот способ комбинаторной индексации можно использовать для того, чтобы эффективно создавать большое число виртуальных компартментов из ограниченного числа физических компартментов.
[91] В некоторых вариантах осуществления способ может включать стадии: (a) предоставлении CE, содержащего анализируемые вещества не нуклеиновых кислот (например, белки) с присоединенными репортерами нуклеиновой кислоты; (b) компартментализации CE на множество первых сосудов; (c) предоставления первого индекса для целевых репортеров нуклеиновой кислоты каждого первого сосуда, тем самым получая первый индексированный репортер целевой нуклеиновой кислоты; (d) объединения первых индексированных репортеров нуклеиновой кислоты; (e) компартментализации первых индексированных CE на множество вторых сосудов; (f) предоставления второго индекса для первых индексированных репортеров нуклеиновой кислоты каждого второго сосуда, тем самым получая второй индексированный репортер нуклеиновой кислоты. Стадии a-f можно продолжать дополнительными циклами из одной или более стадий из серии a-f, для того, чтобы получать дополнительные виртуальные компартменты. Стадия компартментализации дополнительно может включать амплификацию нуклеиновой кислоты или стадию захвата, например, PLA, PEA или другой прием, которым захватывают или амплифицируют нуклеиновые кислоты.
[92] В некоторых вариантах осуществления нуклеиновую кислоту или нуклеиновые кислоты можно встраивать в матрицу, которая ограничивает нуклеиновые кислоты определенным пространством, но дает реактиву доступ для того, чтобы осуществлять стадии, включая в качестве неограничивающих примеров, амплификацию (ПЦР, полногеномная амплификация, случайная достройка праймера и т. д.), лигирование, транспозицию, гибридизацию, рестрикционное расщепление и мутагенез ДНК. Примеры мутагенеза включают, но не ограничиваясь этим, достраивание с внесением ошибок, алкилирование, бисульфитное превращение и индуцированные активацией (цитидин) дезаминазы и т. д.
[93] В некоторых вариантах осуществления анализируемое вещество, представляющей интерес, в CE представляет собой белок. Белки можно метить штриховыми кодами или альтернативными метками. Штриховой код или метки можно считывать с использованием традиционных чипов или способов, основанных на последовательности. Подходы лигирования близости и последовательности индексов антител можно использовать для того, чтобы обнаруживать белки (Fredriksson et al., Nature Biotechnology 20, 473-477 (2002), включен в настоящее описание посредством ссылки) вместе с обнаружением последовательностей штрихового кода, чтобы устанавливать идентичность и относительное содержание белков в каждой индивидуальной клетке. Белки можно метить различными способами (www.piercenet.com/cat/protein-antibody-labeling), которые известны квалифицированному работнику, включая сайт-специфические стратегии химического мечения in vivo и in vitro.
[94] В некоторых вариантах осуществления сохраняющие близость элементы могут содержать отдельную клетку и можно амплифицировать нуклеиновую кислоту из клетки. Впоследствии, каждый сохраняющий близость элемент можно уникально индексировать по схеме комбинаторной индексации. В некоторых вариантах осуществления можно использовать подход комбинаторной индексации. Например, начальные индексы прикрепляют к геномной ДНК или кДНК с помощью стандартных приемов получения библиотек с использованием фрагментирования (ферментативного) и лигирования адаптера или через тагментацию с использованием транспозазных комплексов. Последующие индексы прикрепляют к библиотеке через лигирование или ПЦР. Лигирование является предпочтительным, поскольку легко добавлять индексированные адаптеры последовательным образом. конечная стадия может включать только индексную ПЦР или лигирование и ПЦР.
[95] Дифференциальная индексация клеточных биомолекул: клеточные и субклеточные компартменты, содержащие биомолекулы, такие как ДНК, РНК, митохондриальная ДНК, белки и т. д., можно специфически и ортогонально индексировать для геномного анализа посредством сохранения клеточной близости. Этого можно достичь посредством дифференциального направленного воздействия на мембранные белки субклеточных компартментов (клеточная мембрана, ядерная мембрана и митохондриальная мембрана) для того, чтобы сделать возможным избирательный транспорт ионов или других белков в определенные компартменты, но не в другие. Например, ядерные мембранные белки или митохондриальные белки можно блокировать молекулами блокатора, такими как агглютинин зародышей пшеницы, лептомицин B и антитела со специфичностью к NPC, тогда как циклоспорин A, олигомицин и другие соединения блокируют митохондриальные мембранные белки. Этот подход делает возможной индексацию генетического материала (без ограничения транспозицией, сплайсированным лигированием и т. д.) в субклеточных компартментах клетки, что дает более хорошие уточненные прочтения секвенирования, направленные конкретно внутрь клетки.
[96] В некоторых аспектах в настоящем описании описаны способы дифференциальной индексации информационных молекул из различных компартментов клетки. В некоторых аспектах такие способы включают:
избирательную доставку первой аналитической биомолекулы, содержащей первую метку, в первый клеточный компартмент, выбранный из группы, состоящей из ядра клетки, цитоплазмы и митохондрий, где первый клеточный компартмент содержит первую информационную биомолекулу;
реакцию первой аналитической биомолекулы с первой информационной молекулой для того, чтобы предоставлять меченую первую информационную молекулу;
избирательную доставку второй аналитической биомолекулы, содержащей вторую метку, во второй клеточный компартмент, выбранный из группы, состоящей из ядра клетки, цитоплазмы и митохондрий, где второй клеточный компартмент содержит вторую информационную молекулу и отличается от первого клеточного компартмента; и
реакцию второй аналитической биомолекулы со второй информационной молекулой, чтобы предоставлять меченую вторую информационную молекулу, где первая и вторая метки отличаются.
[97] В некоторых вариантах осуществления предоставлен способ дифференциальной индексации цитоплазматических и ядерных информационных молекул, который включает: (a) доставку первой аналитической биомолекулы, содержащей первую метку, в цитоплазму клетки без существенной доставки первой аналитической биомолекулы в ядро клетки; (b) проведение реакции первой аналитической биомолекулы с цитоплазматической информационной молекулой, тем самым добавляя первую метку или ее комплемент к цитоплазматической информационной молекуле, чтобы предоставлять меченую цитоплазматическую информационную молекулу; (c) обработку клетки усилителем ядерной проницаемости и второй аналитической биомолекулой, содержащей вторую метку, тем самым доставляя вторую аналитическую биомолекулу в ядро клетки; и (d) реакцию второй аналитической биомолекулы с информационной молекулой ядра клетки, тем самым добавляя вторую метку или ее комплемент к информационной молекуле ядра клетки, чтобы предоставлять меченую информационную молекулу ядра клетки. В некоторых вариантах осуществления доставка в цитоплазму дополнительно включает обработку клетки блокатором ядерных пор и/или блокатором митохондриальных пор. В некоторых вариантах осуществления способ дополнительно включает лизис клеток для высвобождения меченых молекул. В некоторых вариантах осуществления первая и вторая метки являются ортогональными, так что они поддаются различению при обнаружении или могут быть отдельно подвержены направленному воздействию на последующих стадиях манипуляции, таких как амплификация. В некоторых вариантах осуществления цитоплазматическая информационная молекула представляет собой РНК. В некоторых вариантах осуществления информационная молекула ядра клетки представляет собой ДНК или геномную ДНК (гДНК). В некоторых вариантах осуществления аналитические биомолекулы представляют собой транспосомы. В некоторых вариантах осуществления способ дополнительно включает обнаружение меченых молекул или их ампликонов. В некоторых вариантах осуществления способ дополнительно включает избирательную амплификацию меченых молекул (например, первой меченой относительно второй меченой или наоборот).
[98] В других аспектах способ включает: (a) проведение реакции первой аналитической биомолекулы, содержащей первую метку, с митохондриальной информационной молекулой для получения меченой митохондриальной информационной молекулы; (b) проведение реакции второй аналитической биомолекулы, содержащей вторую метку, с информационной молекулой ядра клетки для получения меченой информационной молекулы ядра клетки. В некоторых вариантах осуществления способ дополнительно включает: доставку первой аналитической биомолекулы в митохондрии посредством обработки клетки усилителем проницаемости митохондриальной мембраны и первой аналитической биомолекулой. В некоторых вариантах осуществления доставка в митохондрии дополнительно включает обработку клетки блокатором ядерных пор. В некоторых вариантах осуществления доставка в митохондрии не включает существенную доставку первой аналитической биомолекулы в ядро клетки. В некоторых аспектах митохондриальная информационная молекула представляет собой ДНК. В некоторых аспектах информационная молекула ядра клетки представляет собой ДНК или представляет собой геномную ДНК (гДНК). В некоторых вариантах осуществления первая и втора метки являются ортогональными, так что они поддаются различению при обнаружении или могут быть отдельно подвержены направленному воздействию на последующих стадиях манипуляции, таких как амплификация. В некоторых вариантах осуществления аналитические биомолекулы представляют собой транспосомы. В некоторых вариантах осуществления способ дополнительно включает обнаружение меченых молекул или их ампликонов.
[99] В некоторых аспектах избирательная доставка первой аналитической биомолекулы в первый клеточный компартмент включает обработку клетки усилителем проницаемости для первого клеточного компартмента. В некоторых вариантах осуществления избирательная доставка первой аналитической биомолекулы в первый клеточный компартмент включает обработку клетки блокатором проницаемости для второго клеточного компартмента. В некоторых вариантах осуществления избирательная доставка второй аналитической биомолекулы во второй клеточный компартмент включает обработку клетки усилителем проницаемости для второго клеточного компартмента. В некоторых вариантах осуществления избирательная доставка первой аналитической биомолекулы происходит без существенной доставки первой аналитической биомолекулы во второй клеточный компартмент.
[100] В некоторых вариантах осуществления первый клеточный компартмент представляет собой цитоплазму и первая информационная молекула представляет собой цитоплазматическую информационную молекулу и (a) второй клеточный компартмент представляет собой ядро клетки и вторая информационная молекула представляет собой информационную молекулу ядра клетки или (b) второй клеточный компартмент представляет собой митохондрии и вторая информационная молекула представляет собой митохондриальную информационную молекулу. В некоторых вариантах осуществления избирательную доставку первой аналитической биомолекулы в цитоплазму выполняют в присутствии блокатора ядерных пор и/или блокатора митохондриальных пор. В некоторых вариантах осуществления доставку второй аналитической биомолекулы выполняют в присутствии усилителя ядерной проницаемости или митохондриального усилителя проницаемости.
[101] Как используют в настоящем описании, «митохондриальный усилитель проницаемости» усиливает проницаемость митохондрий для реактивов, таких как ферменты. Такие усилители не лизируют митохондрии. Образцовые митохондриальные усилители проницаемости включают средства, которые увеличивают поток через митохондриальные поры. Примеры включают неорганический полифосфат (см., например, Seidlmayer et al., J. Gen. Physiol. 2012, 139(5), 321-331).
[102] Как используют в настоящем описании, термин «избирательная доставка» или его грамматические вариации относятся к усиленной доставке средства в один клеточный компартмент относительно другого. Избирательную доставку можно выполнять посредством усиления проницаемости одного компартмента или блокирования проницаемости одного компартмента относительно проницаемости компартментов без обработки. Избирательная доставка не обязательно должна быть на 100% избирательной, но может включать увеличение относительных фракций меченых информационных молекул из различных компартментов в получаемой библиотеке.
Анализ и секвенирование
[103] Некоторые из способов, предусмотренных в настоящем описании, включают способы анализа нуклеиновых кислот. Такие способы включают получение библиотеки матричных нуклеиновых кислот для целевой нуклеиновой кислоты, получение данных последовательностей из библиотеки матричных нуклеиновых кислот и сборку представления последовательности целевой нуклеиновой кислоты из таких данных последовательностей.
[104] Целевые нуклеиновые кислоты и матричные нуклеиновые кислоты можно обогащать по определенным последовательностям, представляющим интерес, используя различные способы, хорошо известные в данной области. Примеры таких способов предоставлены в публикации PCT № WO2012/108864, которая включена в настоящее описание посредством ссылки в полном объеме. В некоторых вариантах осуществления нуклеиновые кислоты дополнительно можно обогащать в ходе способов получения библиотек матриц. Например, нуклеиновые кислоты можно обогащать по определенным последовательностям, перед тагментацией, после тагментации и/или после амплификации нуклеиновых кислот.
[105] Некоторые варианты осуществления технологии, описанные в настоящем описании, включают способы анализа матричных нуклеиновых кислот. В таких вариантах осуществления, информацию о секвенировании можно получать из матричных нуклеиновых кислот, и эту информацию можно использовать для того, чтобы генерировать представление последовательности для одной или более целевых нуклеиновых кислот.
[106] В некоторых вариантах осуществления способов секвенирования, описанных в настоящем описании, можно использовать стратегию сцепленного прочтения. Стратегия сцепленного прочтения может включать идентификацию данных секвенирования, которые связывают по меньшей мере два прочтения секвенирования. Например, первое прочтение секвенирования может содержать первый маркер, а второе прочтение секвенирования может содержать второй маркер. Первый и второй маркеры позволяют идентифицировать данные секвенирования из каждого прочтения секвенирования, которое должно быть смежным в представлении последовательности целевой нуклеиновой кислоты. В некоторых вариантах осуществления композиций и способов, описанных в настоящем описании, маркеры могут содержать первую последовательность штрихового кода и вторую последовательность штрихового кода, где первая последовательность штрихового кода может образовывать пару со второй последовательностью штрихового кода. В других вариантах осуществления маркеры могут содержать первую метку хозяина и вторую метку хозяина. В дополнительных вариантах осуществления маркеры могут содержать первую последовательность штрихового кода с первой меткой хозяина и вторую последовательность штрихового кода со второй меткой хозяина.
[107] Образцовый вариант осуществления способа секвенирования матричной нуклеиновой кислоты может включать следующие стадии: (a) секвенирования первой последовательности штрихового кода с использованием гибридизации праймера секвенирования с первым участком праймера; и (b) секвенирования второй последовательности штрихового кода с использованием гибридизации праймера секвенирования со вторым праймером. Результатом являются два прочтения последовательности, которые помогают связывать матричную нуклеиновую кислоту с ее геномными соседями. Имея достаточно длинные прочтения и достаточно короткие фрагменты библиотеки, эти два прочтения можно сливать информационно, чтобы получать одно длинное прочтение, которое покрывает весь фрагмент. Используя прочтение последовательности штрихового кода и 9-нуклеотидную дублированную последовательность, представленную из инсерции, теперь прочтения можно связывать с их геномными соседями для того, чтобы формировать значительно более длинные «сцепленные прочтения» in silico.
[108] Как будет ясно, библиотека, содержащая матричные нуклеиновые кислоты, может включать дублирующие фрагменты нуклеиновой кислоты. Секвенирование дублирующих фрагментов нуклеиновой кислоты является благоприятным в способах, которые включают создание консенсусной последовательности для дублирующих фрагментов. Такие способы могут повышать точность для предоставления консенсусной последовательности для матричной нуклеиновой кислоты и/или библиотеки матричных нуклеиновых кислот.
[109] В некоторых вариантах осуществления анализ может включать ДНК или РНК или белок или любое их сочетание, из отдельной клетки или из одного или более клеточных и/или ядерных компартментов. В некоторых вариантах осуществления анализ проводят среди 10, 100, 1000, 10000, 100000, 1000000, 10000000, 100000000, 1000000000 или больше клеток или клеточных и/или ядерных компартментов.
[110] В некоторых вариантах осуществления технологии секвенирования, описанной в настоящем описании, анализ последовательности осуществляют в реальном времени. Например, секвенирование в реальном времени можно осуществлять посредством одновременного получения и анализа данных секвенирования. В некоторых вариантах осуществления процесс секвенирования для получения данных секвенирования можно прерывать в различные моменты, в том числе после получения по меньшей мере части данных последовательности целевой нуклеиновой кислоты или перед тем как секвенируют полное прочтение нуклеиновой кислоты. Образцовые способы, системы и дополнительные варианты осуществления предоставлены в публикации международного патента № WO 2010/062913, описание которого включено в настоящее описание посредством ссылки в полном объеме.
[111] В образцовом варианте осуществления способа сборки коротких прочтений секвенирования с использованием стратегии сцепленного прочтения, транспозонные последовательности, содержащие штриховые коды, вставляют в геномную ДНК, получают библиотеку и получают данные секвенирования для библиотеки матричных нуклеиновых кислот. Блоки матриц можно собирать посредством идентификации парных штриховых кодов и затем собирают более длинные контиги. В одном из вариантов осуществления собранные прочтения можно собирать в более длинные контиги через пары кодов, используя перекрывающиеся прочтения.
[112] Некоторые варианты осуществления технологии секвенирования, описанные в настоящем описании, включают обнаружение ошибок и коррекционные признаки. Примеры ошибок могут включать ошибки в вызовах значений в ходе процесса секвенирования, и ошибки при сборке фрагментов в более длинные контиги. Как будет понятно, обнаружение ошибок может включать обнаружение присутствия или вероятности ошибок в наборе данных и по существу обнаружение местоположения ошибки или множества ошибок может не требоваться. Для коррекции ошибки можно использовать информацию о местоположении ошибки и/или множества ошибок в наборе данных. Способы коррекции ошибки хорошо известны в данной области. Примеры включают использование хемминговских расстояний и использование алгоритма контрольной суммы (См., например, публикацию патентной заявки США № 2010/0323348; патент США № 7,574,305; и патент США № 6,654,696, раскрытия которых включены в настоящее описание посредством ссылки во всей их полноте).
[113] В некоторых вариантах осуществления клеточные и/или ядерные белки можно анализировать, обнаруживать и/или секвенировать. В некоторых вариантах осуществления такие белки являются уникально мечеными. В некоторых вариантах осуществления белки сохраняют, встраивают, иммобилизуют или содержатся в одном или более CE. Идентификацию и секвенирование можно осуществлять с использованием известных в данной области способов. В некоторых вариантах осуществления идентификацию и или секвенирование белка можно осуществлять вместе со сбором информации о последовательности нуклеиновых кислот.
[114] В некоторых вариантах осуществления индексацию можно осуществлять посредством создания индексных праймеров из олигонуклеотидов на гранулах, которые содержат обратные комплементарные последовательности адаптеров общих библиотек в PCT (см. пример 3 далее). В PCT праймер P7, например, образует гибрид с его комплементарной последовательностью на 3'-конце олигонуклеотида на грануле, и его достраивание ведет к созданию полностью функционального индексного олигонуклеотида. Количество индексного олигонуклеотида, в частности, можно контролировать с помощью числа циклов ПЦР при подходящих температурах отжига. Затем синтезированный праймер ПЦР образует гибрид с областью B15 фрагмента библиотеки, которую вводили посредством транспозиции, что позволяет амплификации проходить. Праймер P7 можно биотинилировать для того, чтобы обогащать фрагменты ATAC-seq после ПЦР для секвенирования.
Твердый носитель
[115] Твердые носители, как раскрыто в настоящем описании, можно использовать для секвенирования и анализа. Твердые носители также можно использовать в качестве сохраняющих близость элементов. Твердый носитель может быть двух- или трехмерным и может иметь плоскую поверхность (например, стеклянная пластина) или может быть фигурным. Твердый носитель может включать стекло (например, стекло с контролируемым размером пор (CPG)), кварц, пластмассу (такую как полистирол (слабо сшитый и сильно сшитый полистирол), поликарбонат, полипропилен и поли(метилметакрилат)), акриловый сополимер, полиамид, кремний, металл (например, дериватизированное алкантиолатом золото), целлюлозу, нейлон, латекс, декстран, гелевую матрицу (например, силикагель), полиакролеин или композиты.
[116] Подходящие трехмерные твердые носители включают, например, сферы, микрочастицы, гранулы, наночастицы, полимерные матрицы, такие как агароза, полиакриламид, альгинат, мембраны, пластинки, пластины, полученные микрообработкой кристаллы, трубки (например, капиллярные трубки), микролунки, микрожидкостные устройства, каналы, фильтры, проточные кюветы, структуры, подходящие для иммобилизации нуклеиновой кислоты, белков или клеток. Твердый носитель может включать плоские массивы или матрицы, которые могут иметь области, которые содержат популяции матричных нуклеиновых кислот или праймеров. Примеры включают дериватизированные нуклеозидами CPG и полистироловые пластинки; дериватизированные магнитные пластинки; полистирол с привитым полиэтиленгликолем и т. п.
[117] В некоторых вариантах осуществления твердый носитель содержит микросферы или гранулы. Под «микросферами» или «гранулами» или «частицами» или грамматическими эквивалентами в настоящем описании понимают небольшие дискретные частицы, которые могут иметь сферическую, несферическую или неправильную геометрическую форму. Подходящие композиции гранул включают, но не ограничиваясь этим, пластмассы, керамику, стекло, полистирол, метилстирол, акриловые полимеры, парамагнитные материалы, золь диоксида тория, угольный графит, диоксид титана, латекс или сшитые декстраны, такие как сефароза, целлюлоза, нейлон, сшитые мицеллы и тефлон, а также можно использовать все любые другие материалы, описанные в настоящем описании для твердых носителей. В определенных вариантах осуществления микросферы или гранулы имеют магнитное и/или цветовое кодирование для того, чтобы сделать возможным разделение и манипуляции. Гранулы или микросферы могут быть сплошными или полыми, а также могут быть пористыми. Пористость гранул или микросфер адаптировать при необходимости посредством выбора подходящего материала и способа формирования. Размеры гранул варьируют от нанометров, т. е. 100 нм, до миллиметров, т. е. 1 мм, причем гранулы приблизительно от 0,2 мкм приблизительно до 200 мкм предпочтительны, и приблизительно от 0,5 приблизительно до 5 мкм особенно предпочтительны, несмотря на то, что в некоторых вариантах осуществления можно использовать более мелкие или более крупные гранулы.
[118] В некоторых вариантах осуществления гранулы могут содержать антитела или другие аффинные зонды (типичные протоколы прикрепления см. в Immobilized Biomolecules in Analysis. A Practical Approach. Cass T, Ligler F S, ред., Oxford University Press, New York, 1998. стр. 1-14, включенный в настоящее описание посредством ссылки). В некоторых вариантах осуществления антитела могут быть моноклональными и в других вариантах осуществления антитела могут быть поликлональными. В некоторых вариантах осуществления антитела могут обладать специфичностью к эпитопу клеточной поверхности. В некоторых вариантах осуществления антитела могут обладать специфичностью к белку внутри клетки.
[119] В некоторых вариантах осуществления матрицу нуклеиновой кислоты, предусмотренную в настоящем описании, можно прикреплять к твердому носителю. Различные способы, хорошо известные в данной области, можно использовать для того. Чтобы прикреплять, заякоривать или иммобилизовать нуклеиновые кислоты на поверхности твердого носителя.
[120] В некоторых вариантах осуществления твердый носитель может инкапсулировать клетку, клетку и клеточные и ядерные компартменты клетки, клеточные и ядерные компартменты клетки или ядерные компартменты клетки.
Примеры
[121] Следующие примеры служат для того, чтобы описывать, но не ограничивать раскрытие, предусмотренное в настоящем описании.
Пример 1: тагментация ядерной ДНК с использованием проникающего в клетку ингибитора клатрина
[122] Используя стандартный протокол клеточной культуры, 1×106 клеток K562 (клеточная линия лимфомы человека) собирали из флакона для тканевых культур для реакции тагментации. Все стадии осаждения/центрифугирования клеток осуществляли при 300×g в течение 3 мин при 4°C. Свежие выделенные клетки центрифугировали и ресуспендировали в ледяном PBS (фосфатно-солевой буфер). Клетки снова осаждали и инкубировали на льду при суспендировании в 200 мкл ледяного лизирующего клетки буфера (Tris/NaCl/октилфеноксиполиэтоксиэтанол (детергент IGEPAL CA-630)) в течение 5 мин. После этого ядра центрифугировали в течение 3 мин при 300×g, промывали один раз в 200 мкл лизирующего буфера и осажденные ядра подвергали транспозиции с использованием транспозазы Nextera Tn5 (TDE1) в течение 30 мин при 55°C в 1× ДНК буфере Tagment (PN:15027866) с добавлением (a) Pitstop-2 в DMSO, чтобы получать конечную концентрацию Pitstop-2 30 мкМ (тестовые ядра) или (b) 2% DMSO (контрольные ядра). Ядра из каждого образца осаждали и основную часть супернатанта аккуратно удаляли.
Пример 2. Удаление транспозазы из тагментированной ДНК с использованием полимеразы с замещением цепи
[123] Тагментированные ядра из предыдущего примера (тествовый и контрольный объединенные образцы) ресуспендировали в реакционной смеси Phi29, содержащей 50 мМ Tris-HCl pH 7,5, 10 мМ MgCl2, 10 мМ (NH4)2SO4, 4 мМ DTT, 0,005% SDS, 200 мкМ каждого dNTP и 10 Ед. ДНК полимеразы Phi29 (New England BioLabs), и получаемую смесь инкубировали в течение 30 мин при 30°C в термоциклере. Затем ядра осаждали посредством мягкого центрифугирования в центрифуге для настольной пробирок на полоске и ресуспендировали в 30% Optiprep (Sigma-Aldrich) в буфере Tris при конечном объеме 30 мкл.
Пример 3. Визуализация доступа транспосом к ядрам с использованием FAM-меченых комплексов
[124] Способ из примера 1 использовали для того, чтобы импортировать FAM-меченые транспосомные комплексы в ядерные компартменты. Ядра выделяли и обрабатывали, как описано в примере 1, используя транспозазу Nextera Tn5 в комплексе с транспозонной последовательностью, меченой в ходе синтеза олигонуклеотида на 5'-конце с использованием FAM (6-FAM, Integrated DNA Technologies), и используя контроль 2% DMSO, и варьируя концентрации Pitstop-2 (10 мкМ, 30 мкМ и 60 мкМ). Как показано на фиг. 3, обработка Pitstop-2 увеличивала приток FAM-меченых транспосом в ядерное пространство, в частности, на периферию ядер (показано стрелками).
Пример 4. Эффект обработки Pitstop-2, оказываемый на создание библиотеки ДНК
[125] Выделенные ядра (50000) подвергали транспозиции с использованием набора Nextera Tn5, как описано в предшествующих примерах, в присутствии различных концентраций Pitstop-2 (от 0 до 80 мкМ). Избыток транспосом удаляли посредством короткого центрифугирования и получаемые осадки ядер обрабатывали протеазой Qiagen (ID
19155) в течение 1 ч при 50°C, после чего следовало 10 мин при 80°C. Получаемый лизат анализировали с использованием 25 cy qPCR, выполняемой в термоциклере Bio-Rad с мастер-смесью KAPA SYBR Fast и праймерами, отжигаемыми к части мозаичного конца (ME) транспозонов. Значения Cq, соответствующие различным концентрациям Pitstop-2, и ΔCq между образцами Pitstop-2 и контрольными образцами (не Pitstop-2) приведены в таблице 1. Единица значения Cq грубо соответствует двукратной разнице в ДНК на входе. Как показано в таблице, обработка интактных ядер с использованием Pitstop-2 увеличивает выход библиотеки по сравнению с необработанным контролем. Единица значения Cq грубо соответствует двукратной разнице в ДНК на входе.
Таблица 1A. Pitstop-2 увеличивает выход библиотеки из транспозиционных ядер
[126] Дополнительные эксперименты проводили с использованием различных концентраций Pitstop-2 и транспозаз Tn5 и TsTn5. Данные для этих экспериментов представлены в таблице 1B.
Таблица 1B
Пример 5. Секвенирование транспозиционных библиотек
[127] Библиотеки ДНК создавали из ядерного содержимого K562 (клеточная линия лимфомы человека) с использованием способов, как описано в предшествующих примерах. Библиотеки секвенировали, и результаты показывали, что обработка Pitstop-2 увеличивает доступ к доступным для транспозаз межгенным областям и областям открытого хроматина. Как показано на фиг. 4A для профиля ATAC-seq на части Chr 12, библиотеки имели направленность на в основном межгенные области при всех концентрациях Pitstop-2. Как показано на фиг. 4B, более подробный анализ данных секвенирования, показывающий основную метрику покрытия секвенирования полного генома, указывал на более хорошее разнообразие и уникальность для обработанных Pitstop-2 образцов относительной контролей, в соответствии с усовершенствованными выходами библиотек с использованием Pitstop-2. На фиг. 4C представлено нормализованное покрытие на промоторных и кодирующих областях генома человек, и данные показывают, что обработка с использованием 30 и 60 мкМ Pitstop-2 усовершенствовала профиль ATAC-seq относительно контролей, что указывает на увеличенное покрытие по межгенной области. Эти результаты демонстрируют, что обработка Pitstop-2 увеличивает доступ транспосомных комплексов в ядра и усовершенствует эффективность ядерной транспозиции.
Пример 6. Индексация транспозиционной ядерной ДНК в присутствии Pitstop-2
[128] Геномную ДНК, которую подвергали транспозиции с использованием набора Nextera Tn5 в присутствии Pitstop-2 (в концентрациях 0, 10, 30 и 60 мкМ), как описано выше, высвобождали из ядер и захватывали на индексных гранулах, содержащих олигонуклеотидные захватывающие последовательности. ДНК, захваченную гранулами, дополнительно подвергали лигированию с заполнением пропусков для того, чтобы ковалентно связывать обе нити геномной ДНК с общими последовательностями (включающими уникальные индексы), и амплифицировали посредством ПЦР. При анализе с помощью электрофореза в агарозном геле амплифицированные библиотеки показывали явное увеличение выхода транспозиции с использованием Pitstop-2 (фиг. 5). Увеличения интенсивности полос коррелировали с увеличением концентрации Pitsthop-2. Соответствующие фрагменты ДНК, покрываемые определенным числом нуклеосом в получаемых библиотеках, содержали «нуклеосомную исчерченность», указывающую на успешную тагментацию ATAC-seq в областях, не содержащих нуклеосомы.
[129] В отдельном эксперименте FAM-меченый транспозиционный ядерный материал получали обработкой с использованием Pitstop-2 (в концентрациях 0, 10, 30 и 60 мкМ), используя способы, описанные выше, и проводили обогащение на гранулах с захватывающими олигонуклеотидами, а гранулы анализировали посредством проточной цитометрии для того, чтобы оценивать эффективность захвата. В соответствии с предыдущими результатами, FAM-меченые транспозиционные библиотеки, полученные при обработке Pitstop-2, демонстрировали увеличенные уровни захвата гранулами относительно контрольных объединенных образцов (таблица 2).
Таблица 2
Пример 7. Удаление транспозазы с помощью полимеразы с замещением цепи
[130] В определенных способах получения транспозиционной библиотеки удаление транспозазы из ДНК вызывает дополнительное фрагментирование тагментированной ДНК. В отличие от этого, удаление транспозазы с использованием амплификации с замещением цепи сохраняет близость транспозиционных ядер и все индивидуальные библиотеки ядер, связанные с отдельными клетками.
[131] В качестве альтернативы очистке гДНК после стадии тагментации и перед амплификацией, полимеразу с замещением цепи можно использовать для того, чтобы вызывать удаление транспозазы и амплификацию за одну стадию. Неочищенный продукт ядерной тагментации в интактных ядрах (24 нг), полученный как описано в предшествующих примерах в присутствии 30 мкМ Pitstop-2, обрабатывали мастер-смесью для ПЦР Illumina NPM, полимеразой с замещением цепи (Bst) и низкой концентрацией SDS (0,0025% - 0,04%). Как показано на фиг. 6, добавление Bst усовершенствовало эффективность амплификации тагментированной ДНК.
[132] В дальнейших экспериментах создавали библиотеки секвенирования из подверженных транспозиции осажденных ядер с использованием полимеразы с замещением цепи для того, чтобы удалять транспозазу из тагментированной ДНК. В супернатанте после амплификации с замещением цепи не наблюдали библиотеки секвенирования, что показывает, что фрагменты ДНК не «утекали» в супернатант из ядер. Ядра можно использовать в качестве «компартментов» для того, чтобы осуществлять реакции и стадии анализа без потери информации о близости для пограничного состояния или в непосредственном контакте компонентов отдельной клетки.
Пример 8. Выход библиотеки ATAC-seq для неочищенных ядер
[133] Обработка ядер с использованием Pitstop-2 (10 и 100 мкМ), как описано в предшествующих примерах, увеличивала выход библиотеки ATAC-seq, создаваемой из образцов неочищенных ядер, как показано в анализе 1 мкл каждой библиотеки ATAC-seq на высокочувствительном чипе в приборе BioAnalyzer. Концентрацию каждой библиотеки определяли в BioAnalyzer между диапазоном библиотек 150-1000 п. о., что показано на графике для каждой концентрации Pitstop-2 (фиг. 7A). Дополнительные эксперименты, которые проводили при различных концентрациях Pitstop-2 (5, 10, 30, 50, 100 и 200 мкМ), показывали увеличенный выход библиотеки относительно библиотек, получаемых в отсутствие Pitstop-2, как показано в спектрофотометрическом анализе (таблица 3).
Таблица 3
[134] На фиг. 7B представлен профиль ATAC-seq части Chr 6 для исследований с использованием 0 и 100 мкМ Pitstop-2.
Пример 9. Выдача РНК их ядер
[135] Обработка Pitstop-2 увеличивает выдачу РНК посредством усовершенствования синтеза кДНК из ядерной мРНК. Клетки K562 лизировали с использованием 0,1% NP40. Ядра и цитоплазму разделяли, и ядра промывали два раза, затем осуществляли протокол обратной транскрипции/количественной ПЦР (набор ThermoFisher Maxima HT RT, набор Kapa qPCR, ПЦР праймер RPLP0) (a) без добавок, (b) с 0,1% SDS или (c) с 30 мкМ Pitstop-2. ΔCt между отсутствием обратной транскрипции и обратной транскрипцией использовали в качестве метрики, говорящей об относительной эффективности синтеза кДНК. Обработка Pitstop-2 усиливала синтез кДНК из ядер в 4-5 раз относительно необработанных ядер (таблица 4).
Таблица 4
Пример 10: получение индексных гранул
[136] Гранулы с функционализированной поверхностью, позволяющей сопряжение олигонуклеотидов (например, гидразин-альдегид, эпоксид-амин и т. д.), диаметром 30 мкм и плотностью гранул 1×107 промывали в деионизированной H2O. Промытые гранулы добавляли в каждую лунку 96-луночного планшета в концентрации 1×105 гранул/50 мкл. После этого в каждую лунку добавляли 500 пмоль уникального 5' альдегидного индексного олиго_1 (/5FormInd/CCGAGCCCACGAGAC INDEX1 GACTTGTC), соответственно, до конечного объема 50 мкл реакционной смеси на лунку. Планшет запечатывали для того, чтобы избегать испарения и инкубировали в течение ночи при 37°C во вращающемся инкубаторе. Гранулы объединяли и промывали три раза в 0,1× TE/0,1% Tween-20. Промытые гранулы распределяли тем же путем, как описано ранее, в индивидуальные лунки 96-луночного планшета, в которые уникальный 5' фосфорилированный индексный олиго_2 (/5Phos/TAGAGCAT INDEX2 ATCTCGTATGCCGTCTTCTGCTTG), олигонуклеотидный шунт добавляли наряду с ДНК лигазой T4, суспендированной в буфере ДНК лигазы T4. Реакцию лигирования оставляли протекать в течение ночи при комнатной температуре. Затем гранулы наконец объединяли вместе из всех лунок и промывали три раза в 0,1× TE/0,1% Tween-20.
Пример 11. Создание индексных праймеров «на лету»
[137] Выполнение индексации в течение ПЦР со смесью ядер или в капельках требует панели индивидуальных праймеров для индексной ПЦР, представленной на комбинаторно синтезированных гранулах. Эти праймеры можно или отщеплять от гранул перед использованием в ПЦР, или они могут представлять собой олигонуклеотид («затравочный олиго») с обратной комплементарной последовательностью для фактических ПЦР праймеров. В последнем случае общий праймер (например, P5 или P7) в ПЦР смеси будет гибридизоваться с индексным «затравочным олиго» на грануле и образовывать индексный праймер, используемый в ПЦР. Плотность «затравочного олиго» можно корректировать для того, чтобы оптимизировать ПЦР, и каждый раунд ПЦР будет создавать дополнительное количество праймера для индексной ПЦР. Как показано на фиг. 8A, затравочный олиго с обратной комплементарной последовательностью для праймера для индексной ПЦР сопрягают с гранулой. В ПЦР смесь добавляют общий праймер, который отжигают с «затравочным олиго» и, при достраивании в каждом цикле ПЦР, генерируют праймер, используемый для амплификации библиотеки.
[138] В одном эксперименте конъюгированные гранулы, содержание индексный олиго (B15', индекс ядер, P7'), который имеет обратную комплементарную последовательность для P7 на его 3'-конце, добавляли в мастер-смесь ПЦР по 250 гранул/мкл. Мастер-смесь, состоящую из Nextera PCR Master Mix (NPM), 0,01% SDS, 0,5 мкМ индексного праймера образца (P5, индекс образца и A14'), 0,5 мкМ праймера P7 и 30% Optiprep добавляли в лунку 1 на чип капельного генератора. Ядра (6×104) добавляли в лунку 2 наряду с 250 гранулами/мкл, суспендированными в 30% Optiprep. Индексные праймеры создавали из олиго на грануле в ходе ПЦР при гибридизации P7 с его 3'-концом, достраивании и денатурации от гранулы. Праймер P7 также можно биотинилировать для того, чтобы обогащать фрагменты ATAC-seq после ПЦР для секвенирования. Затем синтезированный ПЦР праймер образует гибрид с областью B15 фрагмента библиотеки, полученной посредством транспозиции, таким образом позволяя протекать амплификации. Придерживались следующих параметров ПЦР: начальное достраивание при 73°C в течение 3 мин, 98°C в течение 30 с, 25 циклов 98°C в течение 10 с, 56°C в течение 30 с и 73°C в течение 30 с.
[139] В других экспериментах затравочных олигонуклеотиды прикреплять в различных концентрациях к гранулам, и эти гранулы использовали в ПЦР в качестве источника одного из ПЦР праймеров, бок о бок с положительным контролем, содержащим обща ПЦР праймера, и отрицательным контролем только с одним ПЦР праймером. Как представлено на фиг. 8B, библиотеки, созданные с использованием гранул с сопряженным «затравочным олиго», обеспечивают достаточное количество второго ПЦР праймера, чтобы поддерживать эффективную амплификацию. На фиг. 6B показана амплификация библиотек с двумя ПЦР олигонуклеотидами (+ контроль) или одним ПЦР олигонуклеотидом и гранулами с затравочным олигонуклеотидом (5, 50 и 500 пмоль гранул) и реактивами, используемыми в экспериментах.
Пример 12. Создание капелек
[140] Капельки создавали с использованием капельного генератора QX200 Bio-Rad, содержащего впуски для клеток, гранул и масла. В кратком изложении, 10 мкл стартового раствора (такого как водный буфер или клеточные среды) добавляли во впуск для клеток и впуск для гранул и позволяли ему заполнять каналы в течение 1 мин и затем удаляли. Растворы ядер и гранул (30 мкл каждого) добавляли в соответствующие лунки. Приблизительно 70 мкл масла добавляли в каждый впуск для масла перед установкой картриджа в капельный генератор. После создания капелек, капельки объединяли вместе из обоих выпусков и осуществляли ПЦР. После ПЦР эмульсию «вода-в-масле» разрушали обработкой эмульсификатором и использовали водную фазу для секвенирования.
Пример 13. Ядра в качестве физических Компартментов для ферментативных реакций
[141] Живые клетки имеют множество органелл, в которых находятся различные механизмы для того, чтобы осуществлять отдельные ферментативные реакции, такие как поддержание генома в ядре, получение энергии в митохондриях, катаболические процессы в лизосоме и т. д. Чтобы использовать естественную компартментализацию, предусмотренную живыми клетками, осуществляли эксперименты, которые показывают, что ядра могут обеспечивать физический барьер для изолированных реакций геномной ДНК in vitro.
[142] Ядра (150000) извлекали с использованием стандартного буфера для выделения ядер, содержащего 0,1% IGEPAL CA-630, и ядерные осадки подвергали транспозиции с использованием транспосомы Tn5 с 30 мкМ Pitstop-2 и без него в течение 30 мин при 55°C. Осуществляли мониторинг целостности ядер по завершении этой стадии с помощью световой микроскопии (данные не приведены). Ядра осаждали мягким центрифугированием и удаляли избыток неиспользованных транспосом. Ядра ресуспендировали в реакционной смеси, содержащей сильную ДНК полимеразу с замещением цепи (Bst или Phi29), и инкубировали при подходящих температурах (65°C, Bst; 30°C, Phi29) в течение 30 мин для того, чтобы удалять Tn5 из тагментированного хроматина и делать фрагменты ДНК доступным для ПЦР амплификации. После завершения реакции, ядра отделяли от супернатанта посредством мягким центрифугированием и ресуспендировали в мастер-смеси для ПЦР.
[143] И ядра и супернатант амплифицировали (25 циклов) с использованием набора индексных праймеров Nextera и анализировали продукты реакций посредством электрофореза в агарозном геле, как показано на фиг. 9. Из супернатанта не создавали библиотеку при любом наборе условий, что подсказывает, что фрагменты ДНК не диффундируют из ядер в ходе тагментации и реакций замещения Tn5.
[144] Данные показывают, что ядра используют успешно в качестве физических компартментов для тагментации и других ферментативных процессов (см. фиг. 1, 2 и 10). Таким образом, данные способы обеспечивают амплификацию специфических компартментов для продуктов, прошедших транспозицию в ядрах. Ферменты, такие как транспосомный комплекс Tn5 и полимеразы, а также другие компоненты реакционной смеси, способны проникать и функционировать в ядрах, обработанных Pitstop-2. ДНК и элементы библиотек остаются в ядрах в ходе и после реакции. Следовательно, множество ферментативных реакций можно выполнять в ядрах без нарушения целостности ядерной мембраны, и ядра можно подвергать нескольким заменам реактивов, нескольким процессам и/или различным манипуляциям (например, ферментативные реакции, окрашивание, сортировка и т. д.) без утечки ДНК из ядерного пространства.
Пример 14. Эффект Pitstop-2, оказываемый на метрику ATAC-seq отдельной клетки в капельках
[145] Ядра мыши (3T3) обрабатывали с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2 в ходе клеточного лизиса и транспозиции ядер. Pitstop-2 использовали для раскрытия ядерных пор и для того, чтобы сделать возможной увеличенную транспозицию открытого хроматина. Определенное число транспозиционных ядер, заданное для того, чтобы обеспечивать заполнение отдельными ядрами, загружали в капельный генератор QX200 Bio-Rad с индексными гранулами, разработанными для получения библиотек отдельных клеток ATAC-seq. Библиотеки отдельных клеток подвергали ПЦР амплификации в капельках и затем очистке и секвенированию в NextSeq® 550 Sequencing System. На фиг. 11 представлены данные секвенирования отдельной клетки для каждого набора обработанных клеток (0 мкМ, 30 мкМ и 60 мкМ Pitstop-2). Как показано на фиг. 11A, увеличение концентрации Pitstop-2 вело к увеличению общего числа уникальных прочтений для всех трех наборов штриховых кодов, сгруппированных по различному числу (>1 тыс., >10 тыс. и >100 тыс.) уникальных считываний.
[146] Обработка ядер с использованием Pitstop-2 делает возможными более эффективную транспозицию и увеличенное уникальное покрытие открытого хроматина. В присутствии Pitstop-2, транспозазы направленно воздействуют на дополнительные области открытого хроматина вне сайтов инициации транскрипции (TSS) (см. фиг. 11B). На фиг. 11B показана процентная доля фрагментов для образцов ATAC seq с 0 мкМ, 30 мкМ или 60 мкМ Pitstop-2 в пределах 1 т. о. от сайтов инициации транскрипции. Подробное исследование выравнивания прочтений в двух геномных местоположениях (гены GAPDH и RPL10) указывало на создание библиотек в областях с потенциально открытой структурой хроматина, таких как энхансеры и открытые рамки считывания, что говорит о более высокой чувствительности анализа (данные не показаны). На фиг. 11C показаны перекрытия пиков ATAC-seq, которые определяли с помощью более консервативной программы поиска пиков MACS-2 программного обеспечения для образцов, обработанных с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2. Очень сильное перекрытие пиков обнаруживали для образцов с использованием Pitstop-2 и без него, что указывает на то, что Pitstop-2 не меняет общую целостность анализа (см. фиг. 11C). Также наблюдали выравнивание объединенных прочтений ATAC-seq, созданных с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2, около гена GAPDH на хромосоме 6, и выравнивание объединенных прочтений ATAC-seq, созданных с использованием 0 мкМ, 30 мкМ и 60 мкМ Pitstop-2, около гена RPL10 на хромосоме X (данные не представлены).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838946C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ ЯДЕР И ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838545C2 |
| ПОЛНОГЕНОМНЫЕ БИБЛИОТЕКИ ОТДЕЛЬНЫХ КЛЕТОК ДЛЯ БИСУЛЬФИТНОГО СЕКВЕНИРОВАНИЯ | 2018 |
|
RU2770879C2 |
| КРУПНОМАСШТАБНЫЕ МОНОКЛЕТОЧНЫЕ БИБЛИОТЕКИ ТРАНСКРИПТОМОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2773318C2 |
| ПОЛУЧЕНИЕ БИБЛИОТЕКИ НУКЛЕИНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ ЭЛЕКТРОФОРЕЗА | 2020 |
|
RU2798952C2 |
| МОДУЛЯЦИЯ ПОЛИМЕРНЫХ ГРАНУЛ ДЛЯ ОБРАБОТКИ ДНК | 2019 |
|
RU2822154C2 |
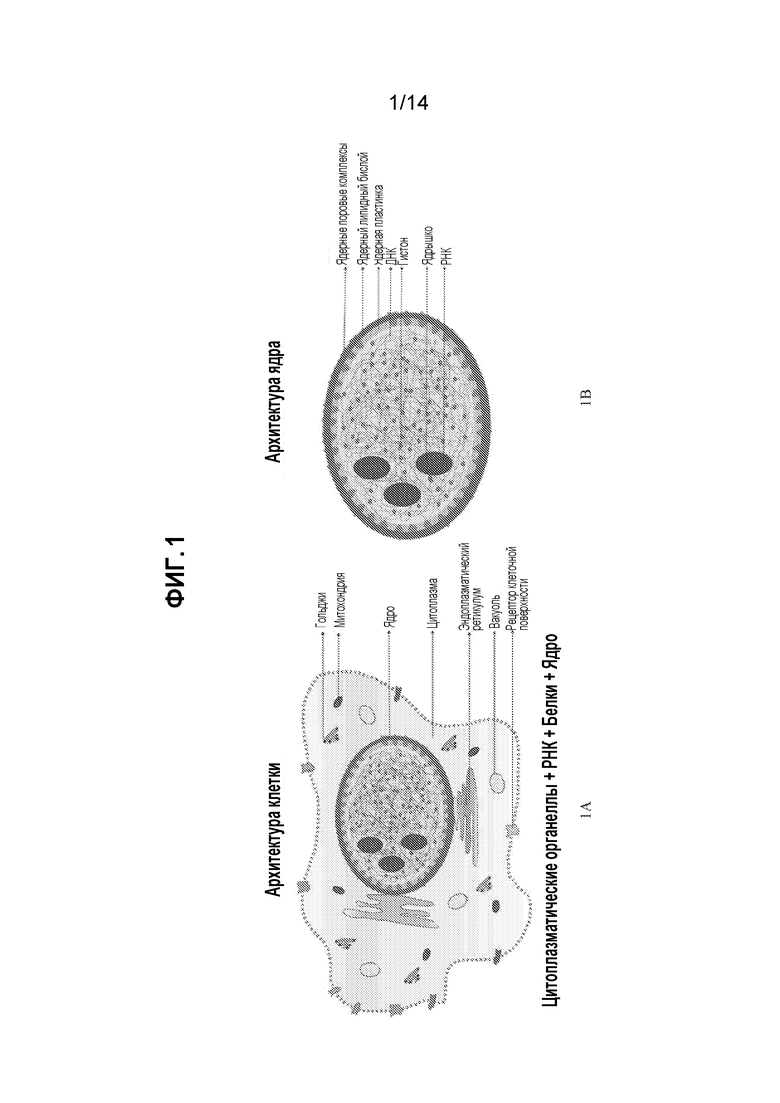
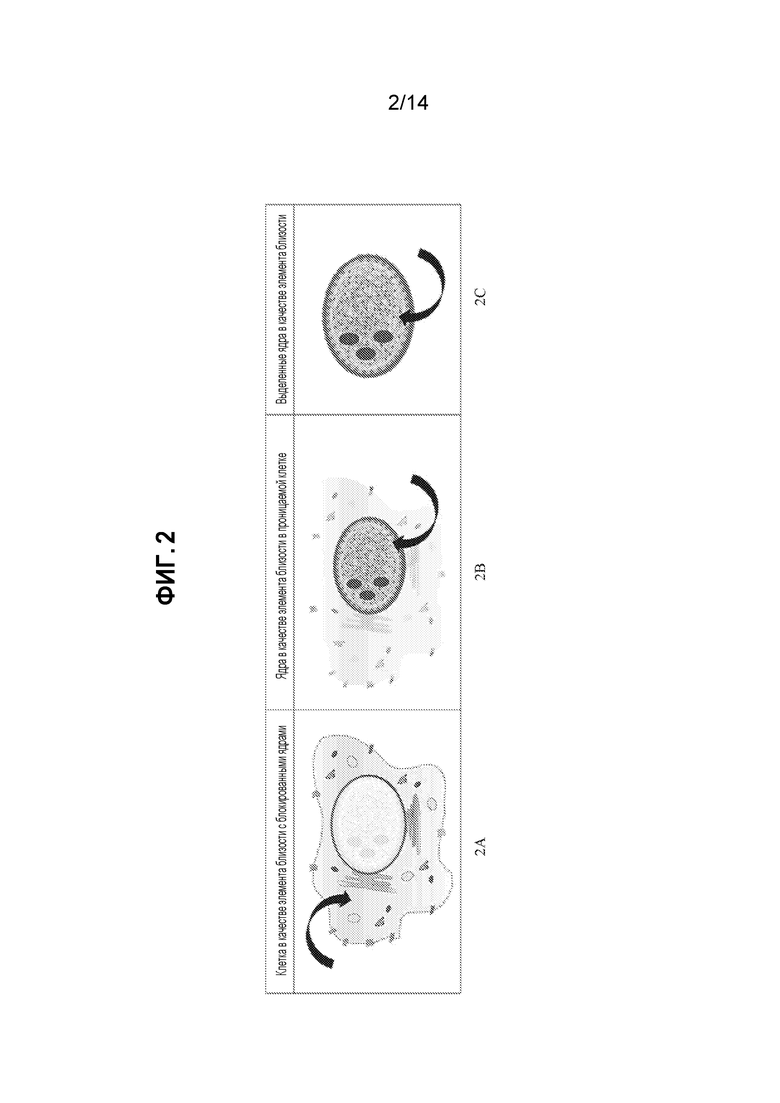
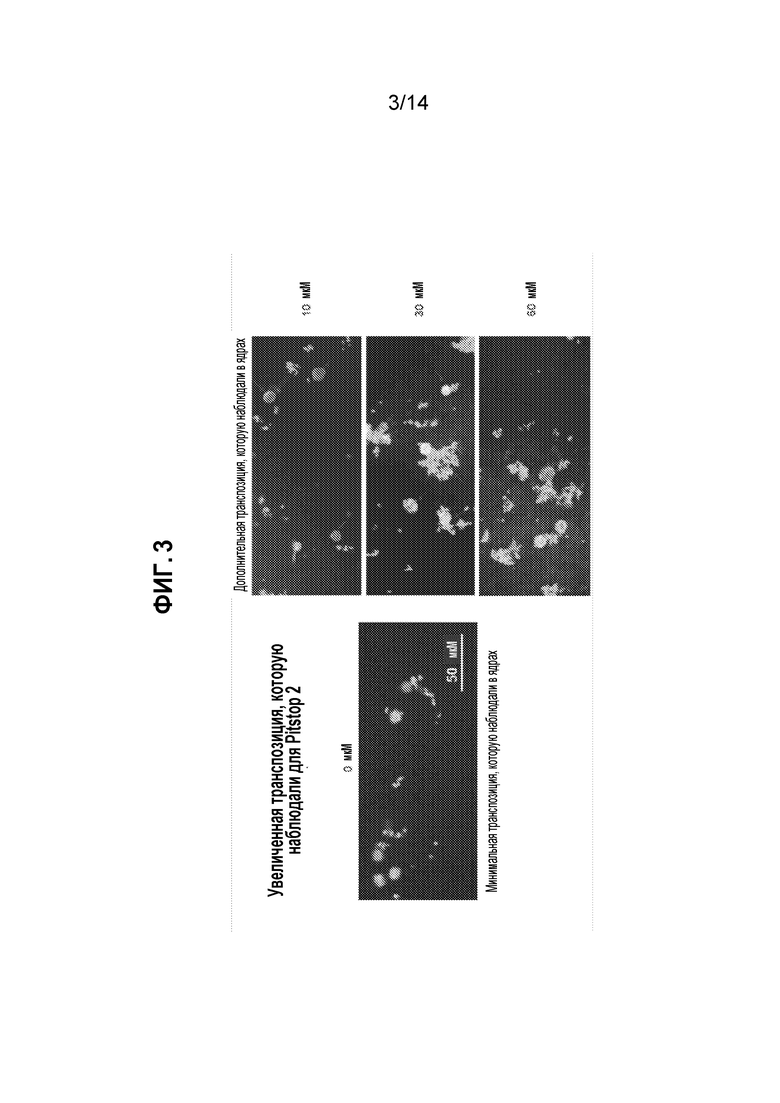
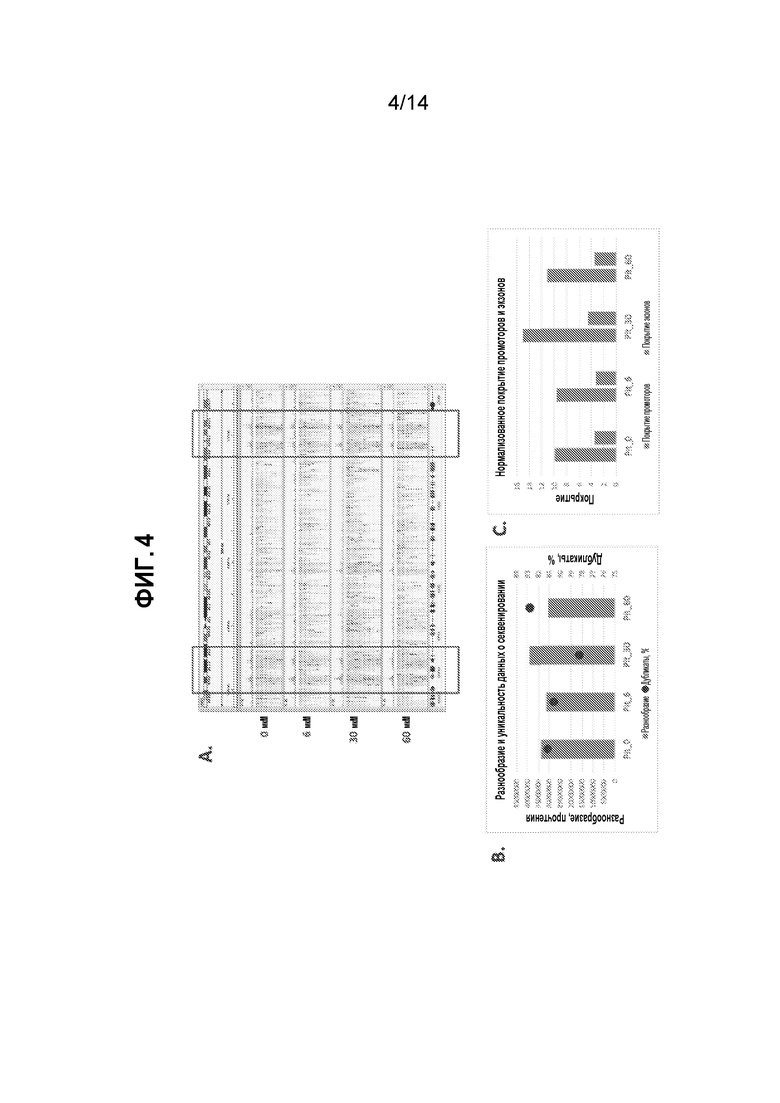
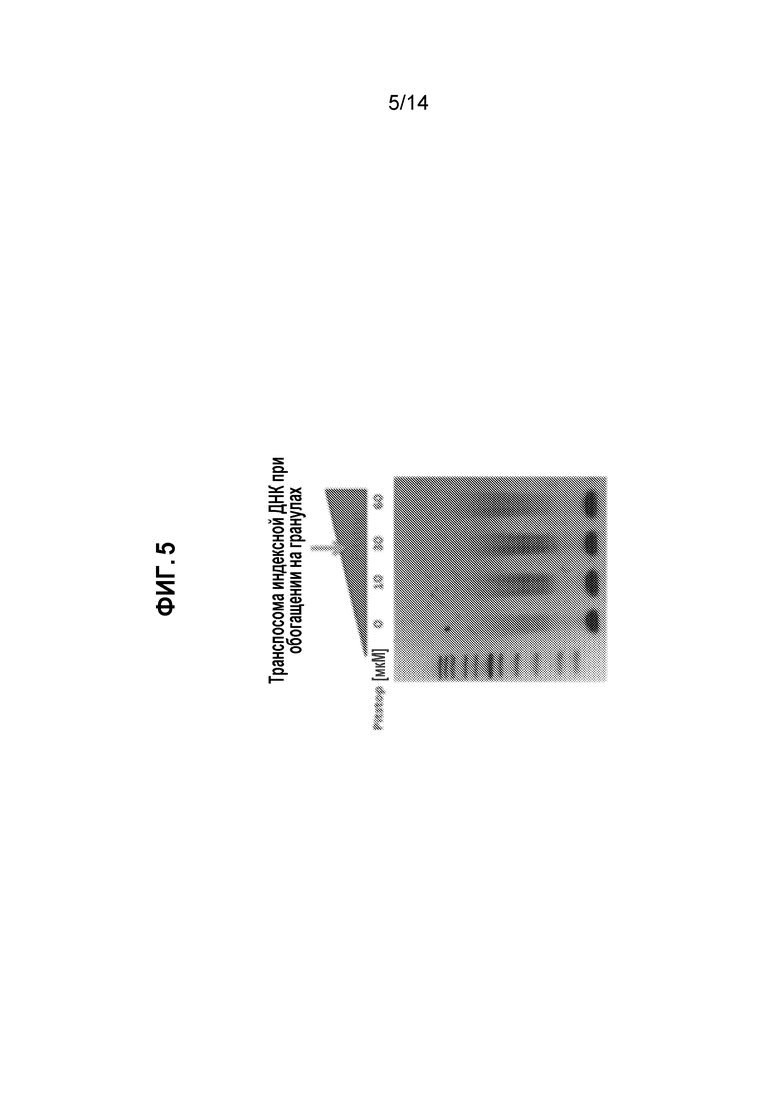
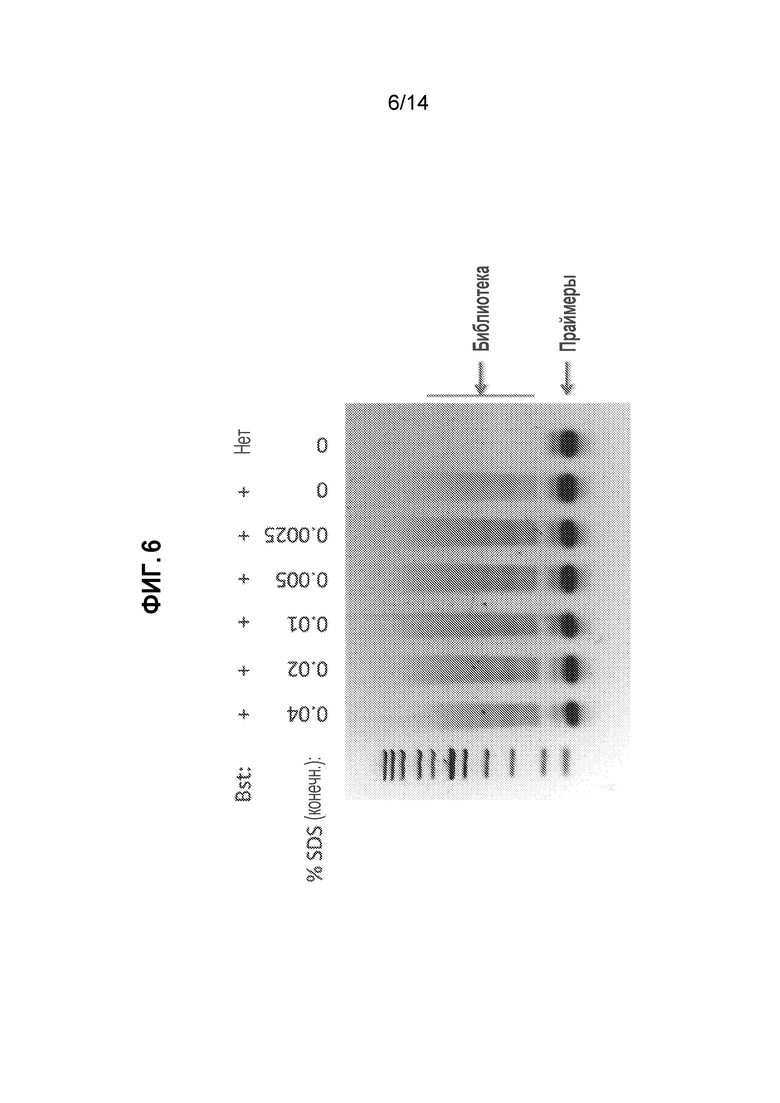


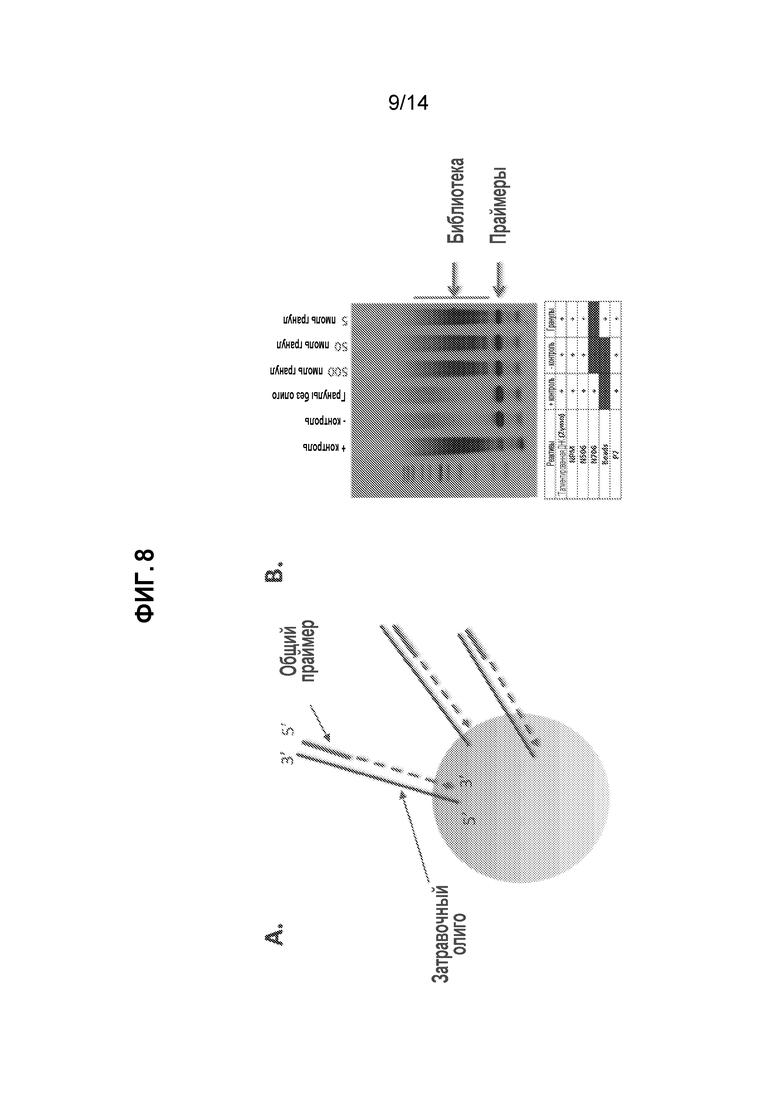
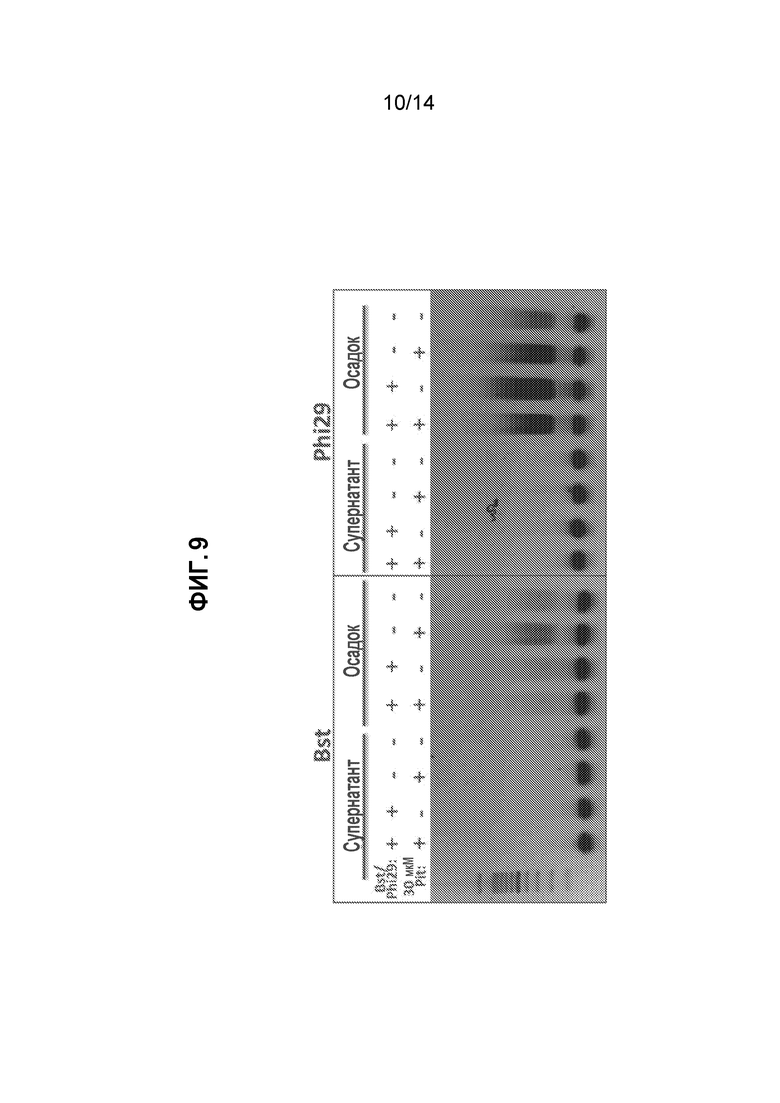
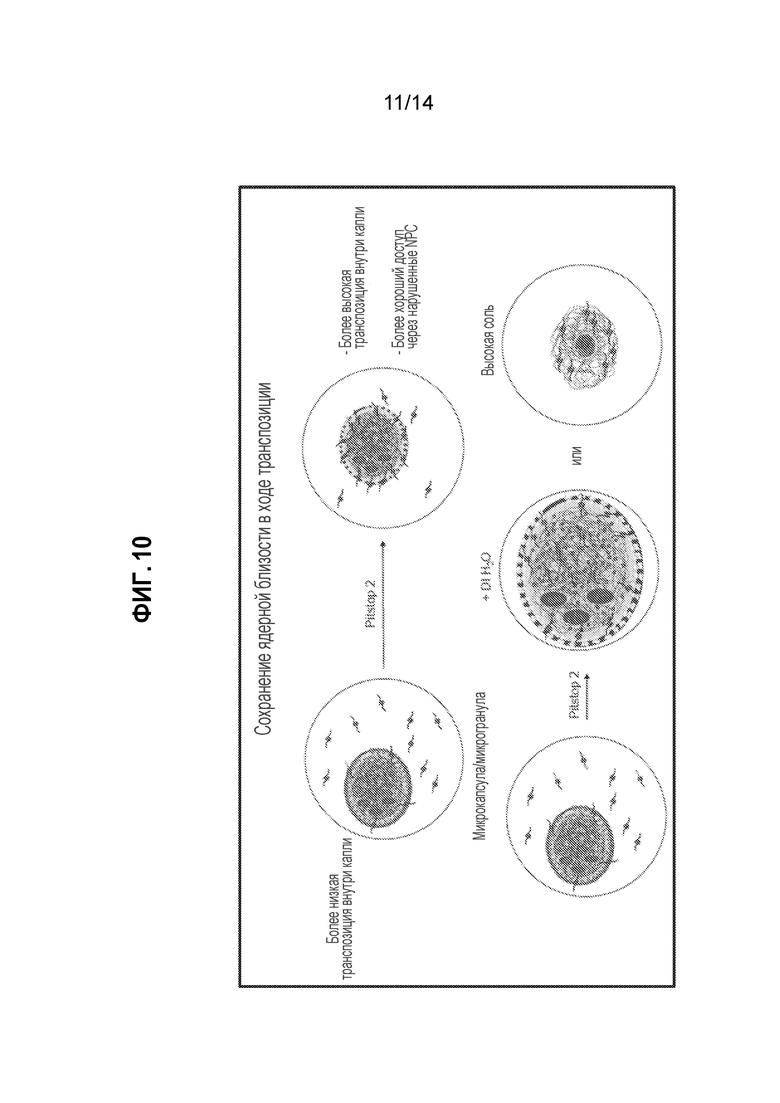
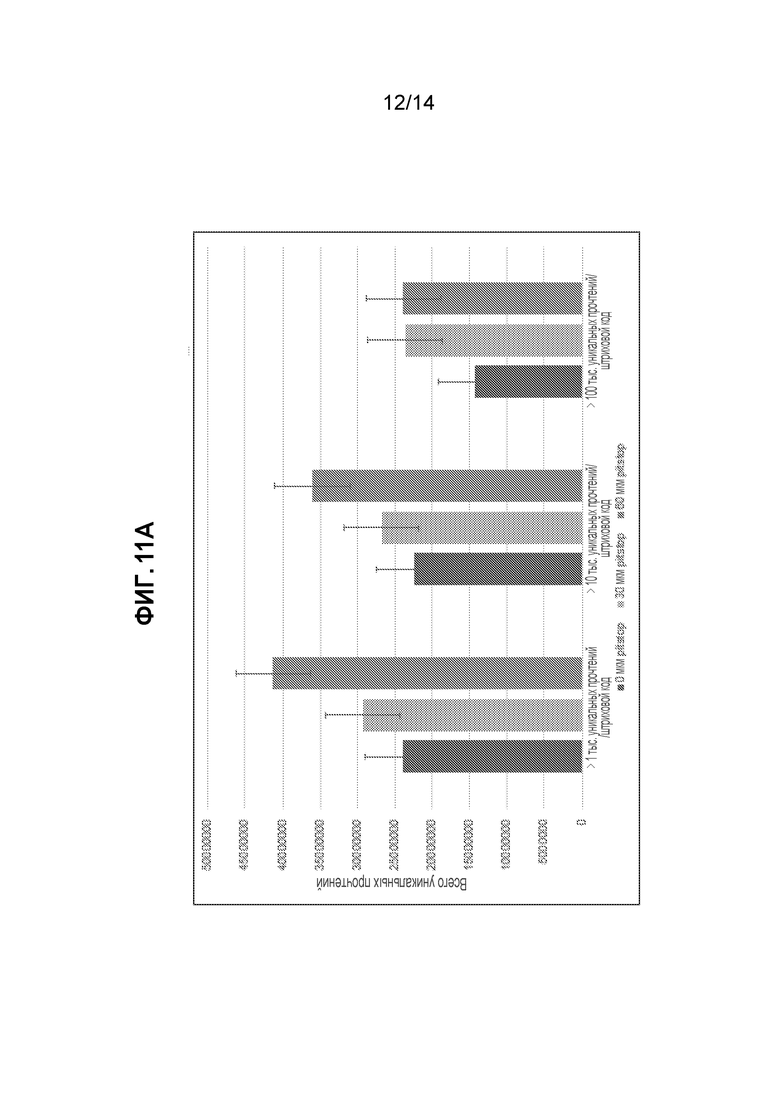
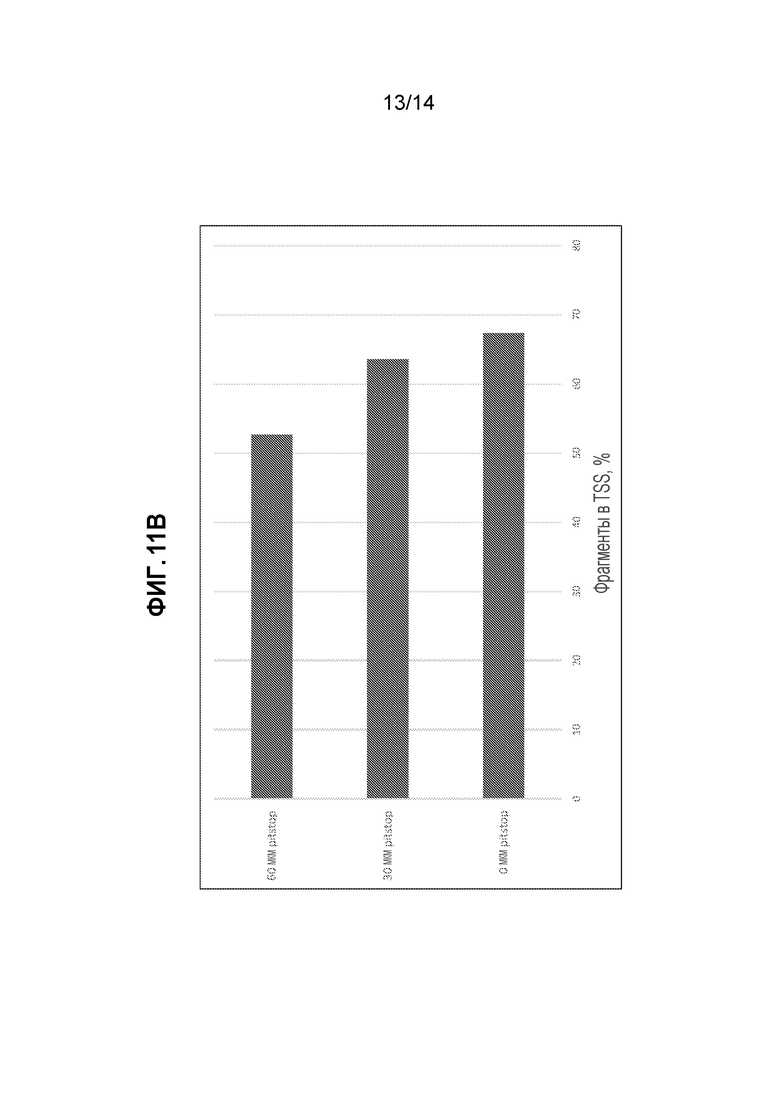

Изобретение относится к биотехнологии, в частности, к системе и способам усиления доступа к ядерным информационным молекулам, таким как ДНК, РНК и белки, с помощью аналитических биомолекул, таких как транспосомные комплексы, посредством обработки ядер усилителем ядерной проницаемости, а также к способам использования ядерной мембраны, клеточной мембраны и подходов внешней компартментализации в качестве сохраняющих близость элементов. 5 н. и 28 з.п. ф-лы, 11 ил., 5 табл., 13 пр.
1. Способ проведения реакции клеточной ядерной целевой нуклеиновой кислоты с транспосомным комплексом, где указанный транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности, где указанный способ включает приведение ядра клетки, содержащего клеточную ядерную целевую нуклеиновую кислоту, в контакт с усилителем ядерной проницаемости и реакцию транспосомного комплекса с целевой нуклеиновой кислотой, где указанная реакция включает фрагментирование целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием меченых двухцепочечных фрагментов нуклеиновой кислоты, и дополнительно где усилитель ядерной проницаемости повышает проницаемость ядерной оболочки без нарушения ядерной мембраны.
2. Способ анализа клеточной ядерной целевой нуклеиновой кислоты, включающий:
(a) приведение клеточной ядерной целевой нуклеиновой кислоты в контакт с усилителем ядерной проницаемости и транспосомным комплексом, где указанный транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности;
(b) проведение реакции транспосомного комплекса с целевой нуклеиновой кислотой с обеспечением аналитического комплекса, где указанная реакция включает фрагментирование целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием меченых двухцепочечных фрагментов нуклеиновой кислоты; и
(c) анализ аналитического комплекса, тем самым обнаруживая меченые двухцепочечные фрагменты нуклеиновой кислоты, и дополнительно где усилитель ядерной проницаемости повышает проницаемость ядерной оболочки без нарушения ядерной мембраны;
необязательно где клетка содержит сохраняющий близость элемент, содержащий ядро клетки.
3. Способ по п. 1 или 2, в котором клеточная ядерная целевая нуклеиновая кислота представляет собой ДНК или РНК.
4. Способ по п. 3, в котором клеточная ядерная целевая нуклеиновая кислота представляет собой ДНК.
5. Способ получения библиотеки меченых фрагментов нуклеиновой кислоты из клеточной ядерной целевой нуклеиновой кислоты, включающий:
(a) предоставление сохраняющего близость элемента, содержащего отдельное ядро клетки, где отдельное ядро клетки содержит клеточную ядерную целевую нуклеиновую кислоту;
(b) приведение сохраняющего близость элемента и отдельного ядра клетки в контакт с усилителем ядерной проницаемости и транспосомным комплексом, содержащим транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности; и
(c) проведение реакции транспосомного комплекса с клеточной ядерной целевой нуклеиновой кислотой с предоставлением аналитического комплекса, где указанная реакция включает фрагментирование целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием меченых двухцепочечных фрагментов нуклеиновой кислоты; и
(d) анализ аналитического комплекса, тем самым обнаруживая меченые двухцепочечные фрагменты нуклеиновой кислоты, и дополнительно где усилитель ядерной проницаемости повышает проницаемость ядерной оболочки без нарушения ядерной мембраны.
6. Способ по любому из предшествующих пунктов, дополнительно включающий, перед приведением в контакт, проведение реакции цитоплазматической целевой нуклеиновой кислоты со вторым транспосомным комплексом, содержащим транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности, в присутствии блокатора ядерных пор и в отсутствие усилителя ядерной проницаемости, где указанные стадии реакции вводят первую метку в цитоплазматическую целевую нуклеиновую кислоту и вторую метку – в клеточную ядерную целевую нуклеиновую кислоту.
7. Способ по п. 5 или 6, где сохраняющий близость элемент содержит ядерную мембрану, необязательно где указанный способ дополнительно включает встраивание нуклеиновой кислоты из отдельной клетки в полимерную матрицу, необязательно где полимерная матрица представляет собой агарозу, полиакриламид или альгинат.
8. Способ по любому из предшествующих пунктов, дополнительно включающий анализ цитоплазматической целевой нуклеиновой кислоты путем приведения клетки в контакт со вторым транспосомным комплексом, содержащим транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности, проведение реакции второго транспосомного комплекса с цитоплазматической целевой нуклеиновой кислотой с образованием второго аналитического комплекса, где указанная реакция включает фрагментирование целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием меченых двухцепочечных фрагментов нуклеиновой кислоты, и необязательно анализ второго аналитического комплекса, посредством чего осуществляется детекция меченых двухцепочечных фрагментов цитоплазматической нуклеиновой кислоты.
9. Способ по любому из предшествующих пунктов, дополнительно включающий обработку меченых двухцепочечных фрагментов нуклеиновой кислоты полимеразой, где полимераза представляет собой необязательно полимеразу с замещением цепи.
10. Способ по любому из пп. 2-9, в котором анализ включает секвенирование двухцепочечных фрагментов нуклеиновой кислоты или их ампликонов или их копий.
11. Способ по любому из предшествующих пунктов, в котором усилитель ядерной проницаемости выбирают из соединений, которые нарушают гидрофобные взаимодействия комплекса ядерных пор (NPC), соединения, которые связываются с белками ядерных филаментов и/или ингибируют их, соединения, которые связываются с клатрином и/или ингибируют его, и пептиды сигналов ядерной локализации (NLS).
12. Способ по любому из пп. 1-10, в котором усилитель ядерной проницаемости представляет собой ингибитор клатрина или представляет собой Pitstop-2, метил-b-циклодекстрин, фенотиазины, монодансилкадаверин, хлорохин, монензин, гиперосмотическую сахарозу или динасор или его синтетический аналог или представляет собой Pitstop-2.
13. Способ по любому из пп. 1-10, в котором усилитель ядерной проницаемости представляет собой нарушитель гидрофобности, алифатический спирт, C4-10-алкилдиол, циклический диол, циклоалкандиол, вицинальный диол, транс-1,2-циклогександиол, н-гексан-1,2-диол или 1,6-гександиол.
14. Способ по любому из пп. 1-10, в котором усилитель ядерной проницаемости представляет собой NLS, большой T-антиген SV40 (PKKKRKV), NLS нуклеоплазмина (KR[PAATKKAGQA]KKKK или AVKRPAATKKAGQAKKKLD), K-K/R-X-K/R, EGL-13 (MSRRRKANPTKLSENAKKLAKEVEN), c-Myc (PAAKRVKLD), TUS-белок (KLKIKRPVK), кислый домен M9 из hnRNP A1, KIPIK из репрессора транскрипции дрожжей Matα2, последовательность PY-NLS, ингибитор импортина β2 или большой T-антиген SV40.
15. Способ по п. 11 или 14, в котором NLS ковалентно связывают с транспосомным комплексом.
16. Способ по п. 11 или 14, в котором NLS нековалентно связывают с транспосомным комплексом.
17. Композиция для проведения реакции клеточной ядерной целевой нуклеиновой кислоты с транспосомным комплексом, содержащая одну или более клеток и/или одно или более ядер клеток, усилитель ядерной проницаемости и транспосомный комплекс,
a) где усилитель ядерной проницаемости повышает проницаемость ядерной оболочки без нарушения ядерной мембраны, и
b) где транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности.
18. Композиция по п. 17, в которой усилитель ядерной проницаемости представляет собой Pitstop-2, алифатический спирт, C4-10-алкилдиол, циклический диол, циклоалкандиол, вицинальный диол, транс-1,2-циклогександиол, н-гексан-1,2-диол, 1,6-гександиол или дигитонин.
19. Композиция по п. 18, в которой усилитель ядерной проницаемости представляет собой Pitstop-2, циклогександиол или дигитонин.
20. Способ дифференциального целевых нуклеиновых кислот в клетках, включающий:
избирательную доставку первого транспосомного комплекса, где транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности, содержащего первую метку, в первый клеточный компартмент, выбранный из цитоплазмы и митохондрий, где первый клеточный компартмент содержит первую целевую нуклеиновую кислоту;
проведение реакции первого транспосомного комплекса с первой целевой нуклеиновой кислотой, где указанная реакция включает фрагментирование первой целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием первых меченых двухцепочечных фрагментов нуклеиновой кислоты;
обработку клеточного ядра, содержащего клеточную ядерную целевую нуклеиновую кислоту, усилителем ядерной проницаемости, который повышает проницаемость ядерной оболочки без нарушения ядерной мембраны, и избирательную доставку второго транспосомного комплекса, где транспосомный комплекс содержит транспозазу и две транспозонные концевые композиции, содержащие транспозонные концевые последовательности, содержащего вторую метку, в ядро клетки, где ядро клетки содержит целевую нуклеиновую кислоту; и
проведение реакции второго транспосомного комплекса со второй целевой нуклеиновой кислотой, где указанная реакция включает фрагментирование второй целевой нуклеиновой кислоты на двухцепочечные фрагменты нуклеиновой кислоты и мечение перенесенными нитями из транспозонных концевых композиций с образованием вторых меченых двухцепочечных фрагментов нуклеиновой кислоты; и
необязательно детекцию двухцепочечных фрагментов нуклеиновой кислоты или их ампликонов, где указанная детекция необязательно включает детекцию последовательностей указанных двухцепочечных фрагментов нуклеиновой кислоты или ампликонов.
21. Способ по п. 20, в котором избирательная доставка первой аналитической биомолекулы в первый клеточный компартмент включает обработку клетки усилителем проницаемости для первого клеточного компартмента.
22. Способ по п. 20 или 21, в котором избирательная доставка первого транспосомного комплекса в первый клеточный компартмент включает обработку клетки блокатором ядерных пор.
23. Способ по любому из пп. 20-22, в котором избирательная доставка первого транспосомного комплекса происходит без существенной доставки первого транспосомного комплекса в ядро клетки.
24. Способ по любому из пп. 20-23, в котором первый клеточный компартмент представляет собой цитоплазму и первая целевая нуклеиновая кислота представляет собой цитоплазматическую целевую нуклеиновую кислоту.
25. Способ по п. 24, в котором избирательную доставку первого транспосомного комплекса в цитоплазму выполняют в присутствии блокатора ядерных пор.
26. Способ по любому из пп. 21-23, в котором избирательную доставку первого транспосомного комплекса выполняют в присутствии митохондриального усилителя проницаемости.
27. Способ по п. 24 или 25, в котором цитоплазматическая целевая нуклеиновая кислота представляет собой РНК.
28. Способ по любому из пп. 24-27, в котором клеточная ядерная целевая нуклеиновая кислота представляет собой ДНК или геномную ДНК (гДНК).
29. Способ по любому из пп. 20-23, 26 или 28, в котором:
избирательная доставка первого транспосомного комплекса включает реакцию первого транспосомного комплекса с митохондриальной целевой нуклеиновой кислотой с получением меченого митохондриального двухцепочечного фрагмента нуклеиновой кислоты; и
избирательная доставка второго транспосомного комплекса включает реакцию второго транспосомного комплекса с клеточной ядерной целевой нуклеиновой кислотой с получением меченого ядерного двухцепочечного фрагмента нуклеиновой кислоты.
30. Способ по п. 29, в котором митохондриальная целевая нуклеиновая кислота представляет собой ДНК.
31. Способ по п. 29 или 30, в котором клеточная ядерная целевая нуклеиновая кислота представляет собой ДНК или гДНК.
32. Способ по любому из пп. 20-31, который дополнительно включает лизирование клеток для высвобождения меченых двухцепочечных фрагментов нуклеиновой кислоты.
33. Способ или композиция по любому из предшествующих пунктов, где усилителем ядерной проницаемости является дигитонин.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ГЕНЕТИЧЕСКИ ЗАПРОГРАММИРОВАННАЯ ЭКСПРЕССИЯ БЕЛКОВ, СОДЕРЖАЩИХ НЕ ВСТРЕЧАЮЩУЮСЯ В ПРИРОДЕ АМИНОКИСЛОТУ ФЕНИЛСЕЛЕНОЦИСТЕИН | 2007 |
|
RU2464315C2 |
Авторы
Даты
2022-05-13—Публикация
2017-12-28—Подача