ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка испрашивает приоритет и преимущество на основании предварительных заявок США под серийными номерами: 62/199,661, поданной 31.07.2015, 62/196,839, поданной 24.07.2015, 62/102,244, поданной 12.01.2015, и 62/096,374, поданной 23.12.2014, содержание которых полностью включено в настоящий документ путем ссылки.
УРОВЕНЬ ТЕХНИКИ
[2] В норме в клетках поддерживается баланс между синтезом, скручиванием (фолдингом), транспортом, агрегацией и разрушением белка, называемый белковым гомеостазисом; в поддержании этого баланса участвуют чувствительные элементы и сети каскадов (Sitia с соавт., Nature426:891-894,2003; Ron с соавт., Nat Rev Mol Cell Biol 8:519-529,2007). Поддержание в клетке белкового гомеостазиса, или протеостазиса, относится к контролю конформации, взаимодействий связывания, локализации и концентрации отдельных белков, составляющих протеом. Скручивание белков in vivo осуществляется посредством взаимодействий между скручивающейся полипептидной цепью и макромолекулярными компонентами клетки, включая многие классы шаперонов и ферментов скручивания, которые минимизируют агрегацию (Wiseman с соавт., Cell 131: 809-821, 2007). Будет ли происходить скручивание данного белка в определенной клетке, зависит от распределения, концентрации и субклеточной локализации шаперонов, ферментов скручивания, метаболитов и т.п. (Wiseman с соавт.). Муковисцидоз и другие болезни, связанные с неправильным скручиванием белков, возникают в результате дисбаланса в способности среды белкового гомеостазиса (протеостазиса) справляться со сниженной энергетической стабильностью неправильно скрученных, мутантных белков, имеющих критическое значение для нормальной физиологии (Balch с соавт., Science 319, 916-9 (2008); Powers, с соавт., Annu Rev Biochem 78, 959-91 (2009); Hutt с соавт., FEBS Lett 583, 2639-46 (2009)).
[3] Муковисцидоз (МВ) вызывают мутации в гене регулятора трансмембранной проводимости при муковисцидозе (CFTR), который кодирует многократно пронизывающий мембрану хлоридный канал (Riordan с соавт., Annu Rev Biochem 77, 701-26 (2008)). Приблизительно у девяноста процентов пациентов присутствует делеция фенилаланина (Phe) 508 (ΔF508) в по меньшей мере одной аллели. Эта мутация вызывает нарушение энергетических характеристик скрученного белка, что ведет к разрушению CFTR в эндоплазматическом ретикулуме (ЭР). Соответственно, мутацию ΔF508 связывают с усиленным разрушением мутантного белка CFTR (Qu с соавт., J Biol Chem 272, 15739-44 (1997)). Потеря функционального канала CFTR в плазматической мембране нарушает ионный гомеостазис (Cl-, Na+, HCO3-) и увлажнение поверхности дыхательных путей, приводя к снижению функции легких (Riordan с соавт.). Снижение объема жидкости вокруг ресничек и повышенная вязкость слизи замедляют мукоцилиарный клиренс, что приводит к хронической инфекции и воспалению, которые являются отличительными фенотипическими признаками муковисцидоза (Boucher, J Intern Med 261, 5-16 (2007)). Помимо респираторной дисфункции ΔF508 CFTR влияет также на нормальное функционирование других органов (поджелудочной железы, кишечника, желчного пузыря), что позволяет предположить, что потеря функции затрагивает многие нижележащие каскады, которые необходимо будет восстановить.
[4] Помимо муковисцидоза, мутации гена CFTR и/или активность CFTR также задействованы в других состояниях, включая, например, врожденное двустороннее отсутствие семявыносящего протока (ВДОСП), острый, рецидивирующий или хронический панкреатит, распространенный бронхоэктаз, астму, аллергический легочный аспергиллез, заболевания легких, связанные с курением, такие как хроническая обструктивная болезнь легких (ХОБЛ), синдром сухого глаза, синдром Шегрена и хронический синусит (Sloane с соавт. (2012), PLoS ONE 7(6): e39809.doi:10,1371/journal. pone,0039809; Bombieri с соавт. (2011), J Cyst Fibros. 2011 июнь;10 Suppl 2:S86-102; (Albert с соавт. (2008), Clinical Respiratory Medicine, 3е изд., Mosby Inc.; Levin с соавт. (2005), Invest Ophthalmol Vis Sci., 46(4):1428-34; Froussard (2007), Pancreas 35(1): 94-5).
[5] В данной области сохраняется потребность в соединениях, композициях и способах для повышения активности CFTR, а также в способах лечения МВ, других заболеваний, связанных с CFTR, и других болезней, связанных с неправильным скручиванием белка.
КРАТКОЕ ОПИСАНИЕ
[6] Раскрытые объекты основаны, частично, на обнаружении того, что раскрытые соединения, такие как соединения, имеющие раскрытые формулы, могут повышать активность регулятора трансмембранной проводимости при муковисцидозе (CFTR), измеряемую в клетках эпителия бронхов человека ((hBE).
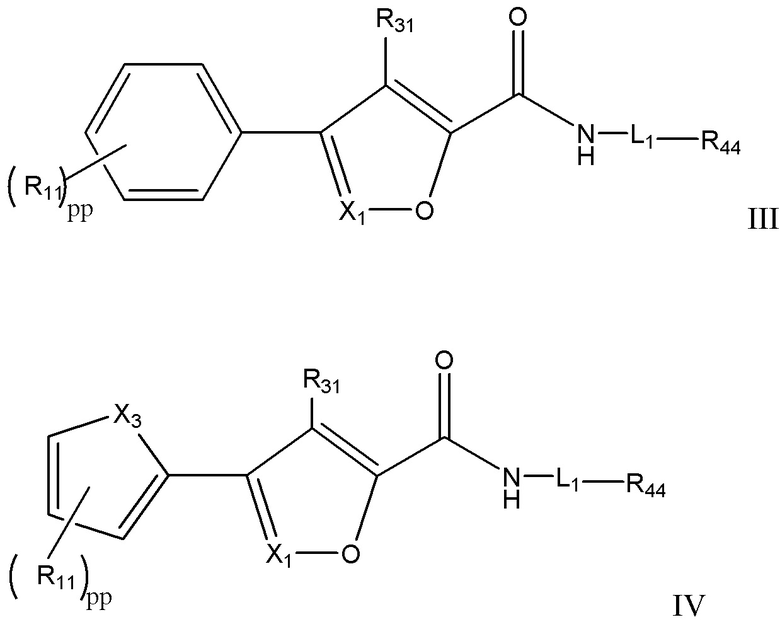
[7] Например, в настоящем документе раскрыты соединения, имеющие формулы:

и их фармацевтически приемлемые соли, стереоизомеры и пролекарства, где:
X1 представляет собой CR33 или N;
X3 выбран из группы, состоящей из O, S и NRhh;
pp представляет собой 1, 2 или 3;
R11 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, галогена, C1-4 алкила (необязательно замещенного одним, двумя или тремя галогенами);
R31 выбран из группы, состоящей из водорода, галогена и C1-4 алкила;
R33 выбран из группы, состоящей из H, галогена, C1-4 алкила и -NR'R''
L1 выбран из группы, состоящей из C1-6 алкилена, C3-6 циклоалкилена, C3-6 циклоалкилен-C1-4 алкилена, C1-3 алкилен-NRhh-S(O)w-, - C1-3 алкилен-S(O)w-NRhh-, C3-6 циклоалкилен-C0-2 алкилен-S(O)w-NRhh и C3-6 циклоалкилен- C0-2 алкилен-NRhh-S(O)w-, причем L1 может необязательно содержать один, два или три заместителя, выбранные из группы, состоящей из галогена, гидроксила и C1-3 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из Rff);
R44 выбран из группы, состоящей из H, галогена, гидроксила, C1-3 алкокси, гетероцикла и 5-6-членного или 8-10-членного бициклического гетероарила, содержащего один, два или три гетероатома, каждый из которых выбран из O, N и S; причем гетероцикл и гетероарил могут быть необязательно замещены одним или двумя заместителями, каждый из которых независимо выбран из Rgg;
Rff выбран в каждом случае, когда он присутствует, из группы, состоящей из галогена, гидроксила, C1-4 алкила, C1-4 алкилокси, C2-4 алкенила, C3-6 циклоалкила, -NR'R'', -NR'-S(O)w-C1-3 алкила, S(O)w-NR'R'' и -S(O)w-C1-3 алкила, где w равен 0, 1 или 2, причем C1-4 алкил, C1-4 алкилокси, C2-4 алкенил и C3-6 циклоалкил могут быть необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, гидроксила, -NR'R'', -NR'-S(O)w-C1-3 алкила, S(O)w-NR'R'' и -S(O)w-C1-3 алкила, Rgg для каждого случая, когда он присутствует, выбран из группы, состоящей из: галогена, гидроксила, -NR'R'', -NR'R'', -NR'-S(O)w-C1-3 алкила, -S(O)w-NR'R'' и -S(O)w-C1-3 алкила, где w равен 0, 1 или 2; C1-6 алкила, C3-6 циклоалкила и C1-6 алкенила, причем C1-6 алкил, C3-6 циклоалкил и C1-6 алкенил могут быть необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rjj; и гетероцикла, необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rll;
Rjj для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C3-6 циклоалкила, C1-6 алкокси (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rkk), гетероцикла, C(O)OH, -C(O)OC1-6 алкила, -NR'R'', -NR'-S(O)w-C1-3 алкила, -S(O)w-NR'R'' и -S(O)w-C1-3 алкил, где w равен 0, 1 или 2;
Rkk для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила, C3-6 циклоалкила и гетероцикла (необязательно замещенного C1-6 алкилом)), C3-6 циклоалкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила и C1-6 алкила), фенила, гетероцикла (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена, гидроксила и C1-6 алкила) и гетероарила;
Rll для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила и C3-6 циклоалкила) и гетероцикла (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена, гидроксила и C1-6 алкила);
R' и R'' каждый независимо выбран, для каждого случая, когда он присутствует, из H и C1-4 алкила, или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо;
w равен 0, 1 или 2; и
Rhh для каждого случая, когда он присутствует, выбран из группы, состоящей из H, C1-6 алкила и C3-6 циклоалкила.
[8] Также в настоящем документе предусмотрены фармацевтические композиции, которые включают раскрытое соединение (такое как соединения, имеющие раскрытые формулы, такие как формула (Ia), (IIa), (Ib), (IIb), (III) и (IV)) фармацевтически приемлемый носитель или вспомогательное вещество. В некоторых вариантах реализации композиции могут включать по меньшей мере один дополнительный модулятор CFTR, описанный в любой другом месте настоящего документа, или по меньшей мере два дополнительных модулятора CFTR, каждый из которых независимо раскрыт в любой другом месте настоящего документа.
[9] В дополнительных вариантах реализации предложен способ повышения (например, увеличения) активности регулятора трансмембранной проводимости при муковисцидозе (CFTR) у субъекта, нуждающегося в этом, включающий введение указанному субъекту эффективного количества раскрытого соединения например, имеющего формулу (Ia), (IIa), (Ib), (IIb), (III) или (IV).
[10] В некоторых из этих вариантов реализации повышают активность одного или более (например, одного или дух) мутантных CFTR (например, ΔF508, S549N, G542X, G551D, R117H, N1303K, W1282X, R553X, 621+1G>T, 1717-1G>A, 3849+10kbC>T, 2789+5G>A, 3120+1G>A, I507del, R1162X, 1898+1G>A, 3659delC, G85E, D1152H, R560T, R347P, 2184insA, A455E, R334W, Q493X и 2184delA CFTR) (например, увеличивают). В некоторых вариантах реализации повышают активность CFTR ΔF508 (например, увеличивают). В других вариантах реализации повышают активности двух мутантных CFTR (например, ΔF508 и G551D; ΔF508 и A455E; или G542X; Δ508F) (например, увеличивают).
[11] В некоторых из этих вариантов реализации субъект (например, пациент-человек) страдает заболеванием, связанным с пониженной активностью CFTR, (например, муковисцидозом, врожденным двустороннем отсутствием семявыносящего протока (ВДОСП), острым, рецидивирующим или хроническим панкреатитом, распространенным бронхоэктазом, астмой, аллергическим легочным аспергиллезом, хронической обструктивной болезнью легких (ХОБЛ), хроническим синуситом, синдромом сухого глаза, дефицитом белка C, A-β-липопротеинемией, лизосомными болезнями накопления, хиломикронемией 1 типа, болезнью легких средней тяжести, дефектами процессинга липидов, наследственным ангионеврологическим отеком 1 типа, нарушениями свертывания крови-фибринолиза, наследственным гемохроматозом, связанным с CFTR метаболическим синдромом, хроническим бронхитом, запором, недостаточностью поджелудочной железы, наследственной эмфиземой, синдромом Шегрена, семейной гиперхолестеринемией, болезнями клеточных включений/псевдо-синдромом Хюрлера, мукополисахаридозами, болезнью Сандхоффа/Тея-Сакса, синдромом Криглера-Найяра II типа, полиэндокринопатией/гиперинсулинемией, сахарным диабетом, карликовостью Ларона, дефицитом милеопероксидазы, первичным гипопаратиреоидизмом, меланомой, гликанозом, относящимся к врожденным заболеваниям гликозилирования 1 типа, врожденным гипертироидизмом, несовершенным остеогенезом, наследственной гипофибриногенемой, дефицитом ACT, несахарным диабетом (НД), нейрофизиологическим НД, нефрогенным НД, синдромом Шарко-Мари-тута, болезнью Пелицеуса-Мерцбахера, болезнью Альцгеймера, болезнью Паркинсона, боковым амиотрофическим склерозом, прогрессирующим супрануклеарным параличом, болезнью Пика, болезнью Хантингтона, спинномозговой атаксией I типа, спинально-бульбарной мышечной атрофией, дентато-рубро-паллидо-льюисовой атрофией, миотонической дистрофией, наследственной болезнью Крейтцфельдта-Якоба (вызванной дефектом процессинга прионного белка), болезнью Фабри и синдрома Штрауслера-Шейнкера). В некоторых вариантах реализации заболевание представляет собой муковисцидоз.
[12] Также в настоящем документе предусмотрен способ лечения пациента, страдающего муковисцидозом, включающий введение указанному пациенту эффективного количества раскрытого соединения.
[13] В некоторых вариантах реализации способы, описанные в настоящем документе, могут дополнительно включать введение дополнительного модулятора CFTR или введение по меньшей мере двух дополнительных модуляторов CFTR. В некоторых вариантах реализации по меньшей мере один модулятор CFTR представляет собой корректор CFTR (например, VX-809, VX-661, VX-983, VX-152, VX-440, GLPG2222 и GLPG2665) или потенциатор (например, ивакафтор и генистеин). В некоторых из этих вариантов реализации один из по меньшей мере двух дополнительных терапевтических агентов представляет собой корректор CFTR (например, VX-809, VX-661, VX-983, VX-152, VX-440, GLPG2222 т GLPG2665), а другой представляет собой потенциатор CFTR (например, ивакафтор т генистеин).
[14] В другом аспекте предложен способ идентификации потенциального агента, который повышает активность CFTR, который включает: (i) осуществление контакта клетки, которая экспрессирует белок CFTR с потенциальным агентом и раскрытым соединением; (ii) измерение активности CFTR в клетке в присутствии потенциального агента и раскрытого соединение; и (iii) сравнение активности CFTR с активностью в отсутствие исследуемого агента, причем повышение активности CFTR в присутствии исследуемого агента указывает на то, что этот агент повышает активность CFTR. В некоторых вариантах реализации клетка экспрессирует мутантный белок CFTR. В некоторых вариантах реализации активность CFTR измеряют путем измерения активности хлоридного канала CFTR, и/или активности транспорта другого иона. В некоторых из этих вариантов реализации способ представляет собой способ с высокой пропускной способностью. В некоторых из этих вариантов реализации потенциальный агент представляет собой корректор CFTR или потенциатор CFTR.
ПОДРОБНОЕ ОПИСАНИЕ
[15] В настоящем тексте слова в единственном числе (соотв. английским артиклям «a» и «an») включают один или более, если не указано иное. Например, термин «агент» включает как единственный агент, так и комбинацию двух или более агентов.
[16] Как обсуждалось выше, раскрытые объекты частично относятся к соединениям, описанным в настоящем документе, или их фармацевтически приемлемым солям, пролекарствам или сольватам, фармацевтическим композициям, способам увеличения активности CFTR и способам лечения муковисцидоза.
[17] Например, в настоящем документе раскрыты соединения, имеющие формулы:
и их фармацевтически приемлемые соли, стереоизомеры и пролекарства, где:
X1 представляет собой CR33 или N;
X3 выбран из группы, состоящей из O, S, и NRhh;
pp представляет собой 1, 2 или 3;
R11 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, галогена, C1-4 алкила (необязательно замещенного одним, двумя или тремя галогенами);
R31 выбран из группы, состоящей из водорода, галогена и C1-4 алкила;
R33 выбран из группы, состоящей из H, галогена, C1-4 алкила и -NR'R'', причем R' и R'' каждый независимо выбран, для каждого случая, когда он присутствует, из H и C1-4 алкила, или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо;
L1 выбран из группы, состоящей из C1-6 алкилена, C3-6 циклоалкилена, C3-6 циклоалкилен-C1-4 алкилена, C1-3 алкилен-NRhh-S(O)w-, - C1-3 алкилен-S(O)w-NRhh-, C3-6 циклоалкилен-C0-2 алкилен-S(O)w-NRhh и C3-6 циклоалкилен- C0-2 алкилен-NRhh-S(O)w-, где L1 может необязательно содержать один, два или три заместителя, выбранные из группы, состоящей из галогена, гидроксила и C1-3 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из Rff);
R44 выбран из группы, состоящей из H, галогена, гидроксила, C1-3 алкокси, фенила, -O-фенила, -NR'-фенила, гетероцикла и 5-6-членного или 8-10-членного бициклического гетероарила, содержащего один, два или три гетероатома, каждый из которых выбран из O, N и S; причем фенил, -O-фенил, -NR'-фенил, гетероцикл и гетероарил могут быть необязательно замещены одним или двумя заместителями, каждый из которых независимо выбран из Rgg;
Rff выбран в каждом случае, когда он присутствует, из группы, состоящей из галогена, гидроксила, C1-4 алкила, C1-4 алкилокси, C2-4 алкенила C3-6 циклоалкила, -NR'R'', -NR'-S(O)w-C1-3 алкила S(O)w-NR'R'' и -S(O)w-C1-3 алкила, где w равен 0, 1 или 2, причем C1-4 алкил, C1-4 алкилокси, C2-4 алкенил и C3-6 циклоалкил могут быть необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, гидроксила, -NR'R'', -NR'-S(O)w-C1-3 алкила, S(O)w-NR'R'' и -S(O)w-C1-3 алкила;
Rgg для каждого случая, когда он присутствует, выбран из группы, состоящей из:
a) галогена, гидроксила, циано, -NR'R'', -NR'-S(O)w-C1-3 алкила, -S(O)w-NR'R'' и -S(O)w-C1-3 алкила, где w равен 0, 1 или 2;
b) C1-6 алкила, C3-6 циклоалкила и C1-6 алкенила, где C1-6 алкил, C3-6 циклоалкил и C1-6 алкенил могут быть необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rjj; и
c) гетероцикла, необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rll;
Rjj для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C3-6 циклоалкила, C3-6 циклоалкокси, C1-6 алкокси (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из Rkk), гетероцикла, C(O)OH, -C(O)OC1-6 алкила, -NR'R'', -NR'-S(O)w-C1-3 алкила, -S(O)w-NR'R'' и -S(O)w-C1-3 алкила, где w равен 0, 1 или 2;
Rkk для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила, C3-6 циклоалкила и гетероцикла (необязательно замещенного C1-6 алкилом)), C3-6 циклоалкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила и C1-6 алкила), фенила, гетероцикла (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена, гидроксила и C1-6 алкила) и гетероарила;
Rll для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, гидроксила, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена, гидроксила и C3-6 циклоалкила) и гетероцикла (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена, гидроксила и C1-6 алкила);
R' и R'' каждый независимо выбран, для каждого случая, когда он присутствует, из H и C1-4 алкила;
w равен 0, 1 или 2; и
Rhh для каждого случая, когда он присутствует, выбран из группы, состоящей из H, C1-6 алкила и C3-6 циклоалкила.
[18] Например, в некоторых из этих вариантов реализации L1 в одной или более из приведенных выше формул представляет собой C1-3 алкилен, C3-5 циклоалкилен или C3-6 циклоалкилен-C1-4 алкилен и/или R31 представляет собой H или F.
[19] В некоторых вариантах реализации Rgg выбран из группы, состоящей из:
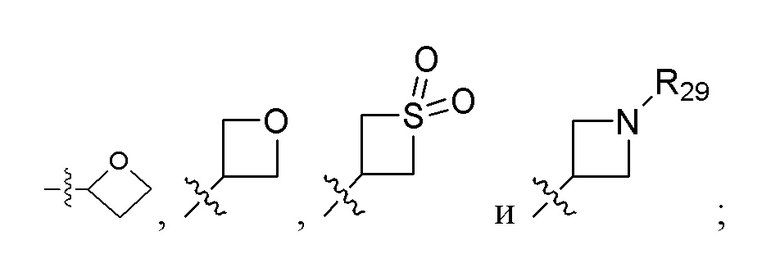
где R29 выбран из C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, гидроксила, C1-6 алкокси и циклоалкила) и гетероцикла (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, гидроксила, C1-6 алкила и C1-6 алкокси). Например, R29 может быть выбран из группы, состоящей из:
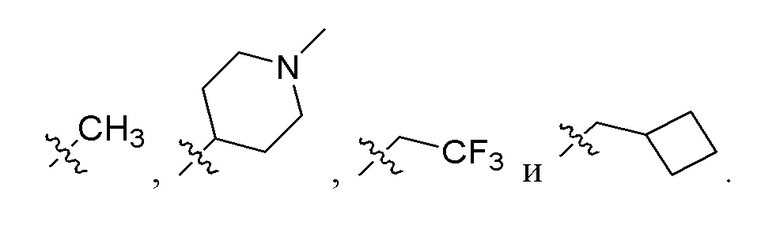
[20] В одном из вариантов реализации раскрытое соединение имеет формулу:
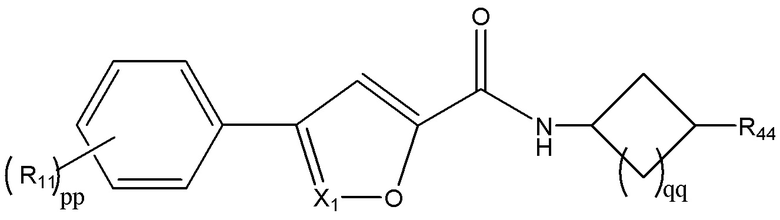 ; где qq равен 0 или 1. Например, в некоторых вариантах реализации раскрытое изобретение может иметь следующую формулу:
; где qq равен 0 или 1. Например, в некоторых вариантах реализации раскрытое изобретение может иметь следующую формулу:
 .
.
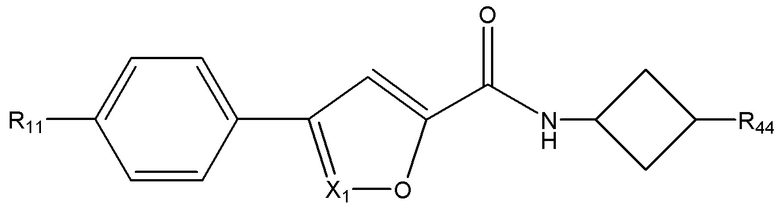
[21] Например, R44 в приведенных выше формулах может быть выбран из группы, состоящей из: пирролидинила, пиперидинила, тетрагидропиранила и тетрагидрофуранила. В других вариантах реализации R44 выбран из группы, состоящей из:
 ,
, ,
,  ,
, ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
, ,
,  ,
,  ,
,  и
и 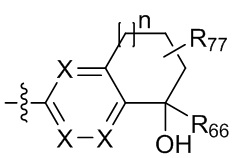 ;
;
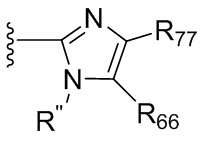
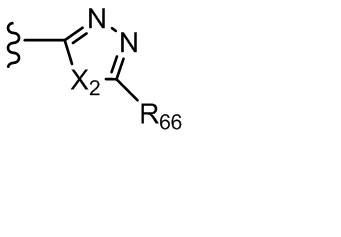
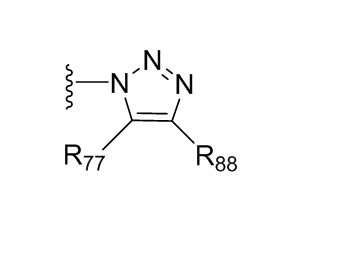
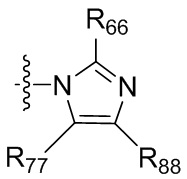
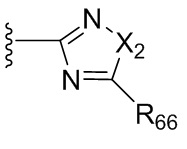
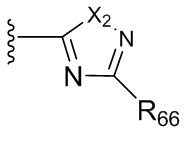
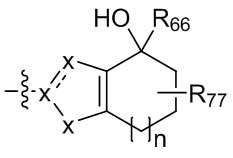
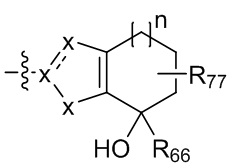
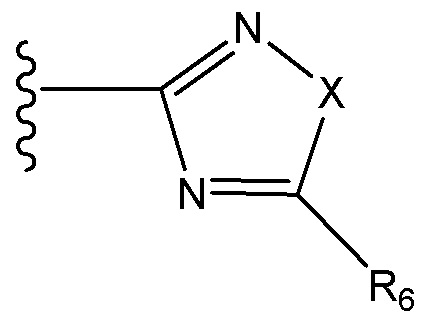
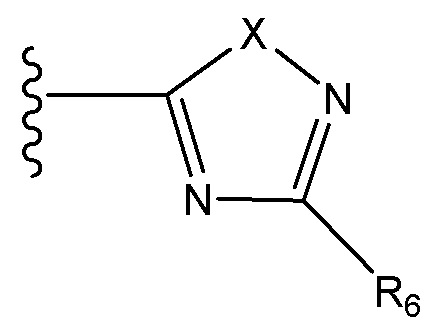
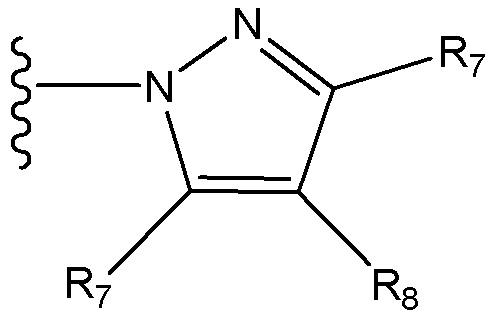
где X независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из O, S, NRhh, C, C(R88) и C(R88)(R99); X2 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из O, S и NRhh; R'' представляет собой H или C1-4алкил, каждый R66, R77, R88 и R99 независимо выбран для каждого случая, когда он присутствует, из H и Rgg, и n равен 0, 1, 2 или 3.
[22] В некоторых вариантах реализации каждый из R66, R77, R88 и R99 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, галогена, гидроксила, C1-6 алкила, C3-6 циклоалкила и гетероцикла, причем C1-6 алкил, C3-6 циклоалкил и гетероцикл необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из гидроксила, C1-6 алкила, C1-6 алкокси, -S(O)w-C1-3 алкила (w равен 0,1 или 2) и -NR'S(O)2C1-6 алкила. В некоторых вариантах реализации R' представляет собой H или C1-4 алкил. В некоторых вариантах реализации R66, R77 и R88 могут быть выбраны из группы, состоящей из H, галогена, метила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), этила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), пропила ((необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), изопропила ((необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), н-бутила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), трет-бутила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси), сек-бутила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси) и изобутила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых выбран из галогена, гидроксила, метокси и этокси).
[23] В некоторых вариантах реализации pp равен 0, 1 или 2, и R11 выбран из H, F, или метила.
[24] Например, в настоящем документе предложено соединение, представленное формулой:
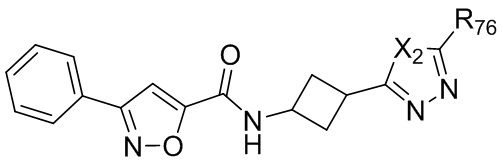 ,
,
где X2 выбран из группы, состоящей из O, S или NRhh (определенного выше);
R76 выбран из группы, состоящей из C1-6алкила (необязательно содержащего внутри цепи один или более атомов кислорода или NR''и необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, S(O)w-C1-3 алкила (w равен 0,1 или 2), C3-6циклоалкила (необязательно замещенного одним или более заместителями, выбранными из гетероцикла, C1-6алкила и галогена) и гетероцикла (необязательно замещенного одним или более заместителями, выбранными из гетероцикла, C1-6алкила и галогена)); и гетероцикла (необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, S(O)w-C1-3 алкила (w равен 0,1 или 2), C3-6циклоалкила (необязательно замещенного одним или более заместителями, выбранными из гетероцикла, C1-6алкила и галогена) и гетероцикла (необязательно замещенного одним или более заместителями, выбранными из гетероцикла, C1-6алкила и галогена).
[25] Также в настоящем документе раскрыты соединения, имеющие формулу (Ia) или формулу (IIa):
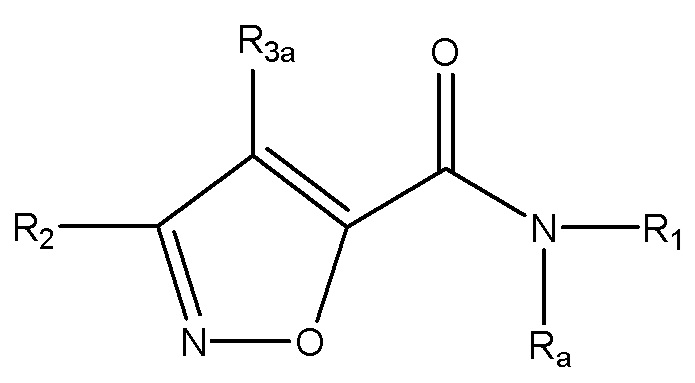
(Ia);
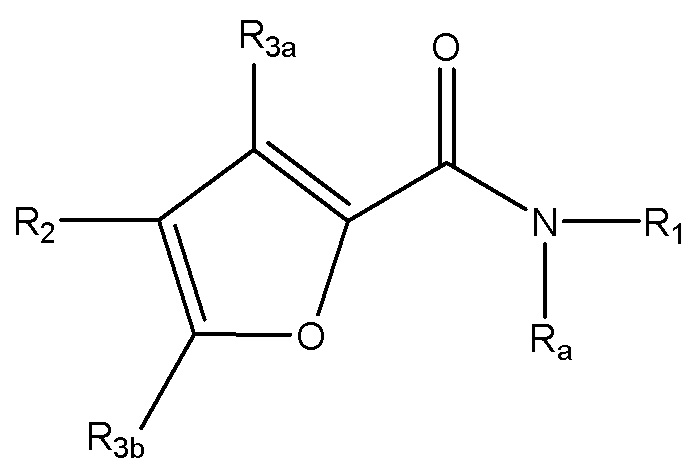
(IIa);
или их фармацевтически приемлемые соли, пролекарства или сольваты, где:
R1 выбран из группы, состоящей из:
 и
и 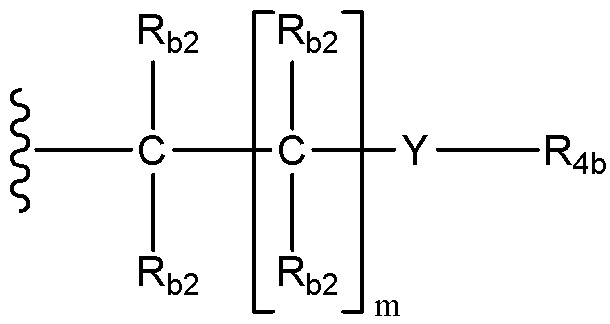 ;
;
R2 выбран из группы, состоящей из необязательно замещенного арила и необязательно замещенного гетероарила;
R3a и R3b каждый независимо выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного арила, галогена, ORc, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)nRc, N(Rd)(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nNRdRd, NRdS(O)nRc, S(O)nRc, S(O)nNRdRd, OC(O)ORc, (C=NRd)Rc, необязательно замещенного гетероцикла и необязательно замещенного гетероарила;
R4a выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного арила, галогена, ORc, S(O)nRc, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)Rc, N(Rd)(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nRdRd, NRdS(O)nRc, S(O)NRdRd, OC(O)ORc, (C=NRd)Rc, необязательно замещенного гетероцикла и необязательно замещенного гетероарила;
R4b выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного арила, необязательно замещенного гетероцикла и необязательно замещенного гетероарила;
Ra выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного гетероцикла, необязательно замещенного арила, необязательно замещенного гетероарила, C(O)ORc, C(O)Rc, C(O)C(O)Rc и S(O)nRc;
или, в качестве альтернативы, Ra и атом азота, к которому он присоединен, совместно с соседним C(Rb1)(Rb1) или C(Rb2)(Rb2) образуют необязательно замещенное 4- 12-членное гетероциклическое кольцо, содержащее один или больше атомов азота в кольце, причем указанное гетероциклическое кольцо необязательно содержит один или больше гетероатомов кольца, выбранных из кислорода и серы;
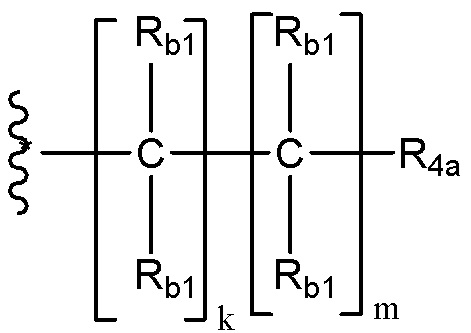
каждый Rb1 и Rb2 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного гетероцикла, необязательно замещенного арила, необязательно замещенного гетероарила, галогена, ORc, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)nRc, N(Rd)(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nNRdRd, NRdS(O)nRc, S(O)nRc, S(O)nNRdRd, OC(O)ORc и (C=NRd)Rc; или в альтернативном варианте, две присоединенные к одному атому группы Rb1 или две присоединенные к одному атому группы Rb2 и атом углерода, к которому они присоединены, вместе образуют группу C(O), или, в качестве еще одной альтернативы, две присоединенные к одному атому группы Rb1 или две присоединенные к одному атому группы Rb2 вместе с атомом углерода, к которому они присоединены, образуют C3-C12 спироциклоалкил, C3-C12 спироциклоалкенил, спирогетероцикл, спироарил или спирогетероарил, каждый из которых необязательно замещен;
Y выбран из группы, состоящей из S(O)n, NRd, NRdS(O)n, NRdS(O)nNRd, NRdC(O), NRdC(O)O, NRdC(O)C(O), NRdC(O)NRd, S(O)nNRd и O;
каждый Rc независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного гетероцикла, необязательно замещенного арила и необязательно замещенного гетероарила;
каждый Rd независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C1-C10 алкокси, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного гетероцикла, необязательно замещенного арила и необязательно замещенного гетероарила; или две присоединенные к одному атому группы Rd вместе с атомом азота, к которому они присоединены, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил;
k равен 0 или 1;
m равен 0, 1, 2, 3, 4 или 5;
каждый n независимо равен 0, 1 или 2.
[26] В некоторых вариантах реализации m равен 0, 1 или 2. В некоторых вариантах реализации k равен 0. В некоторых вариантах реализации m равен 0, 1 или 2, k равен 0.
[27] В некоторых вариантах реализации каждый из R3a и R3b представляет собой водород.
[28] В некоторых вариантах реализации Ra представляет собой водород или C1-C4 алкил (необязательно замещенный 1, 2 или 3 галогенами).
[29] В некоторых вариантах реализации Rb1 и Rb2 каждый независимо выбран из группы, состоящей из водорода, гидроксила, C1-4 алкокси (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена и гидроксила) и C1-C4 алкила (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена и гидроксила). В некоторых вариантах реализации Rb1 и Rb2 в каждом случае представляют собой водород.
[30] В некоторых вариантах реализации R2 выбран из группы, состоящей из фенила и 5-6-членного гетероарила, содержащего один или два гетероатома, каждый из которых выбран из N, S, и O, причем R2 необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена и C1-C4 алкила (необязательно замещенного одним, двумя или тремя галогенами).
[31] В некоторых вариантах реализации R2 представляет собой фенил.
[32] В других вариантах реализации R2 выбран из группы, состоящей из: необязательно замещенного тиенила, необязательно замещенного фуранила и необязательно замещенного пиридинила.
[33] В некоторых вариантах реализации, R4a выбран из группы, состоящей из необязательно замещенного C1-C6 алкила, необязательно замещенного C3-C7 циклоалкила, фенила,ORc, C(O)ORc, C(O)Rc, необязательно замещенного гетероцикла и необязательно замещенного гетероарила, причем Rc выбран, независимо для каждого случая, когда он присутствует, из группы, состоящей из H и C1-6 алкила.
[34] В некоторых вариантах реализации R4a представляет собой гетероцикл, или 5-6-членный моноциклический или 8-10-членный бициклический гетероарил, содержащий один, два или три гетероатома, выбранные из N, S или O, причем гетероцикл или гетероарил необязательно замещены одним, двумя или тремя заместителями, независимо выбранными, для каждого случая, когда они присутствуют, из группы, состоящей из галогена, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена и гидроксила), C1-6 алкокси (необязательно замещенный одним, двумя или тремя галогенами), гидроксила, и NRdRd, причем Rd независимо для каждого случая, когда он присутствует, выбран из H и C1-4 алкила, или два Rd вместе с N, к которому они присоединены, образуют гетероциклическое кольцо). Например, R4a может быть выбран из группы, состоящей из тетрагидропиранила, тиадиазолила, тетрагидрофуранила и морфолинила. В качестве другого примера R4a может представлять собой моноциклический гетероарил, содержащий один, два или три атома азота. В другом примере R4a может быть выбран из группы, состоящей из фуранила, пиридинила, пиразинила, пиразолила, имидазолила, изоксазолила, триазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, пиперазинила и бензимидазолила, каждый из которых необязательно замещен.
[35] В некоторых вариантах реализации R4a выбран из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
, и
и 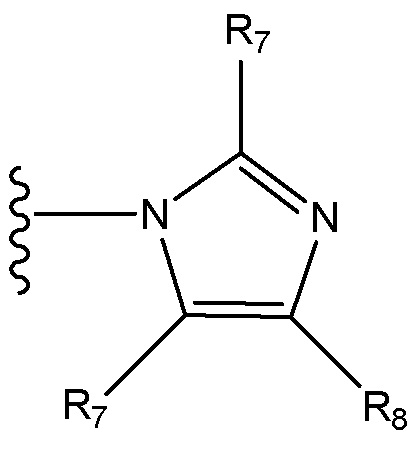 ;
;
причем каждый X независимо представляет собой O, S или NRg;
каждый Rg независимо выбран из группы, состоящей из водорода, C1-C4 алкила, C3-C6 циклоалкила, и
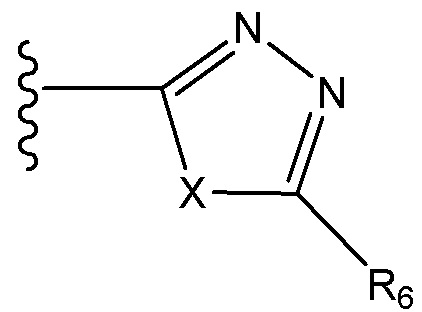
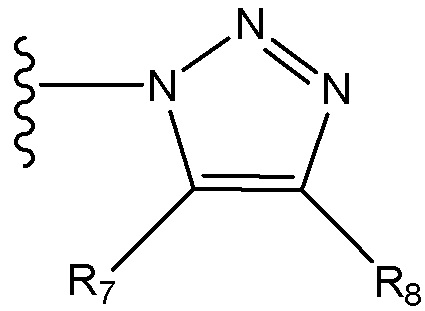
каждый R6, R7 и R8 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, C1-C6 алкила, C2-C6 алкенила, C2-C16 алкинила, C3-C7 циклоалкила, C3-C7 циклоалкенила, фенила, гетероцикла, гетероарила, галогена, гидроксила, карбоксила, ORc, NRdRd, C(O)ORc,, CN, C(O)Rc, причем C1-6 алкил, C2-C6 алкенил, C2-C16 алкинил, C3-C7 циклоалкил, C3-C7 циклоалкенил, фенил, гетероцикл и гетероарил в R6, R7 и R8 каждый может быть независимо замещен одним, двумя или тремя заместителями, выбранными из галогена, гидроксила, C1-6 алкила и C1-6 алкокси;
Rc представляет собой C1-4 алкил; и
Rd независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из H и C1-4 алкила, или два Rd вместе с N, к которому они присоединены, образуют гетероциклическое кольцо.
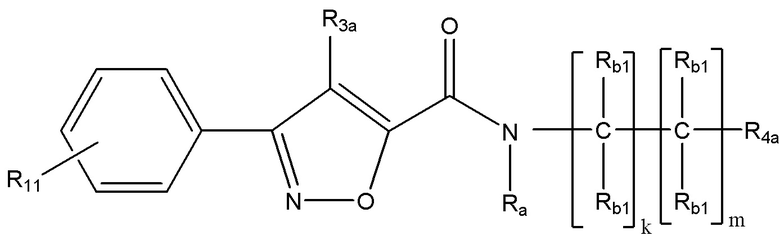
[36] В некоторых вариантах реализации раскрытое соединение имеет формулу (Ib) или формулу (IIb):
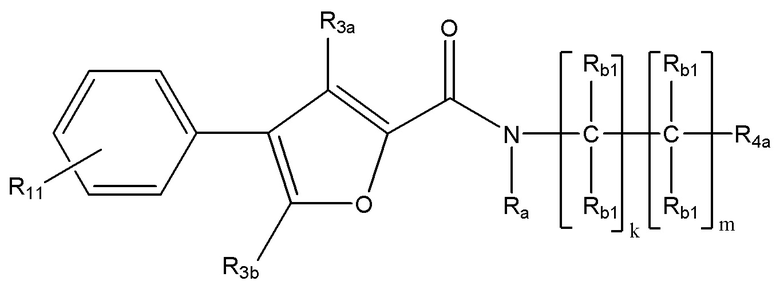
(Ib);
(IIb);
где R11 выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила и галогена. В некоторых вариантах реализации R4a представляет собой необязательно замещенный C3-C7 циклоалкил (например, необязательно замещенный циклопропил или необязательно замещенный циклобутил).
[37] В некоторых из этих вариантов реализации R4a замещен заместителем, имеющим формулу:
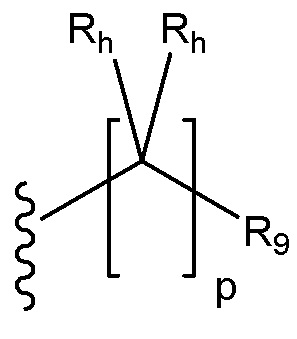
Причем каждый Rh независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, галогена, гидроксила, C1-C6 алкила и C3-C6 циклоалкила, или две присоединенные к одному атому группы Rh вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный карбоцикл или гетероцикл;
R9 выбран из группы, состоящей из водорода, галогена, CN, гидроксила, метила (необязательно замещенного одним, двумя или тремя заместителями, выбранными из галогена и гидроксила), C2-C4 алкенила, C2-C4 алкинила, C3-C6 циклоалкила, C1-6 алкокси, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)nRc, NRd(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nNRdRd, NRdS(O)nRc, S(O)nRc, S(O)nNRdRd, OC(O)ORc, (C=NRd)Rc ;
Rc независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из H, C1-C6 алкила, C3-6 циклоалкила, гетероцикла и гетероарила;
Rd независимо для каждого случая, когда он присутствует, выбран из H и C1-4 алкила, или два Rd вместе с N, к которому они присоединены, образуют гетероциклическое кольцо; и p равен 0, 1 или 2.
[38] Например, R4a может быть выбран из группы, состоящей из:
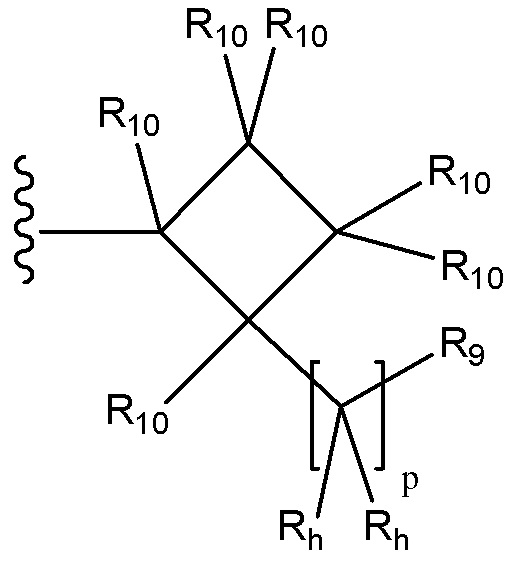 и
и 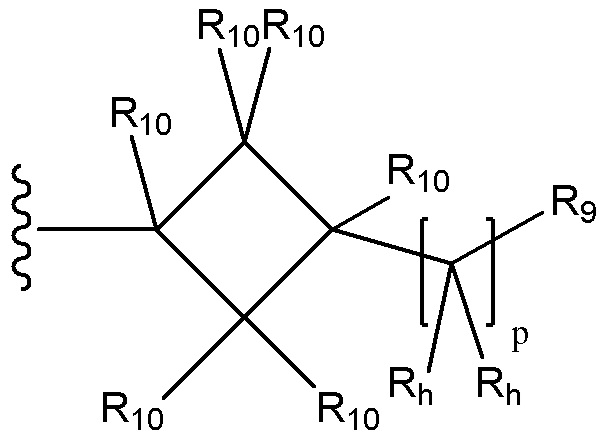 ; где
; где
каждый R10 независимо выбран из группы, состоящей из водорода, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила необязательно замещенного C3-C6 циклоалкила, необязательно замещенного C3-C6 циклоалкенила, необязательно замещенного арила, галогена, ORc, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)nRc, NRd(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nNRdRd, NRdS(O)nRc, S(O)nRc, S(O)nNRdRd, OC(O)ORc, (C=NRd)Rc, необязательно замещенного гетероцикла и необязательно замещенного гетероарила; в качестве альтернативы, две присоединенные к одному атому группы R10 вместе с атомом углерода, к которому они присоединены, образуют C3-C7 спироциклоалкил, C3-C7 спироциклоалкенил, спирогетероцикл, спироарил или спирогетероарил, каждый из которых необязательно замещен; или в качестве еще одной альтернативы, две присоединенные к соседним атомам группы R10 вместе с атомами углерода, к которым они присоединены, образуют конденсированную, необязательно замещенную циклическую группу, выбранную из группы, состоящей из C4-C8 циклоалкила, C4-C8 циклоалкенила, 4- 8-членного гетероцикла, арила и гетероарила, каждый из которых необязательно замещен; или в качестве еще одной альтернативы два R10, присоединенные к несоседним атомам углерода, вместе с атомами углерода, к которым они присоединены, образуют мостиковую циклическую группу, выбранную из группы, состоящей из C3-C8 циклоалкила, C3-C8 циклоалкенила и 4- 8-членного гетероцикла, каждый из которых необязательно замещен;
каждый Rh независимо выбран из группы, состоящей из водорода, галогена, необязательно замещенного C1-C10 алкила и необязательно замещенного C3-C6 циклоалкила, или две присоединенные к одному атому группы Rb вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил;
R9 выбран из группы, состоящей из водорода, необязательно замещенного C1-C10 алкила, необязательно замещенного C2-C10 алкенила, необязательно замещенного C2-C10 алкинила, необязательно замещенного C3-C12 циклоалкила, необязательно замещенного C3-C12 циклоалкенила, необязательно замещенного арила, галогена, ORc, NRdRd, C(O)ORc, NO2, CN, C(O)Rc, C(O)C(O)Rc, C(O)NRdRd, NRdC(O)Rc, NRdS(O)nRc, NRd(COORc), NRdC(O)C(O)Rc, NRdC(O)NRdRd, NRdS(O)nNRdRd, NRdS(O)nRc, S(O)nRc, S(O)nNRdRd, OC(O)ORc, (C=NRd)Rc, необязательно замещенного гетероцикла и необязательно замещенного гетероарила; и p равен 0, 1 или 2.
[39] В некоторых вариантах реализации Y представляет собой S, S(O)2 или S(O)2NRd.
[40] В некоторых вариантах реализации R4b представляет собой гетероцикл или 5-6-членный моноциклический или 8-10-членный бициклический гетероарил, содержащий один, два или три гетероатома, выбранные из N, S или O, причем гетероцикл или гетероарил необязательно замещены одним, двумя или тремя заместителями, независимо выбранными, для каждого случая, когда они присутствуют, из группы, состоящей из галогена, C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена и гидроксила), C1-6 алкокси (необязательно замещенный одним, двумя или тремя галогенами), гидроксила, и NRdRd, причем Rd независимо для каждого случая, когда он присутствует, выбран из H и C1-4 алкила, или два Rd вместе с N, к которому они присоединены, образуют гетероциклическое кольцо). Например,R4b может быть выбран из группы, состоящей из фуранила, пиридинила, пиразинила, пиразолила, имидазолила, изоксазолила, триазолила, тиазолила, оксадиазолила, тиадиазолила, тиенила, пиперазинила и бензимидазолила, каждый из которых необязательно замещен.
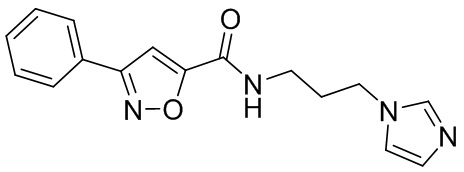
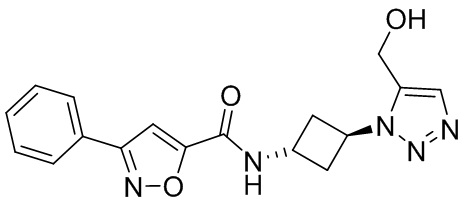
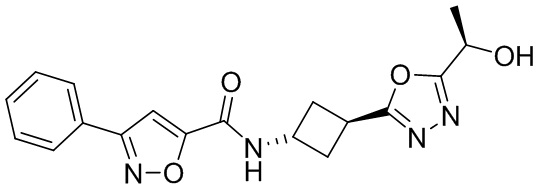
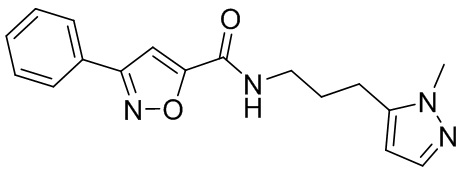
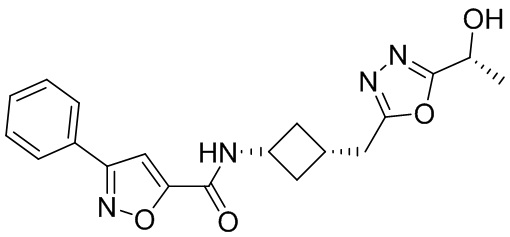
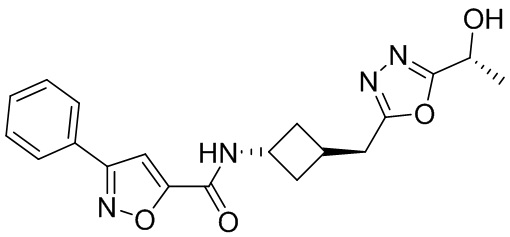
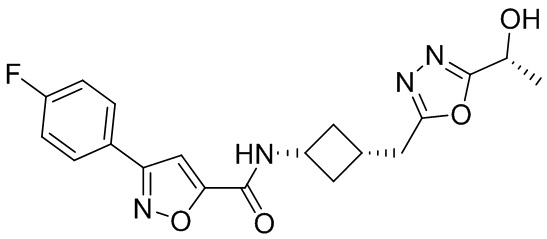
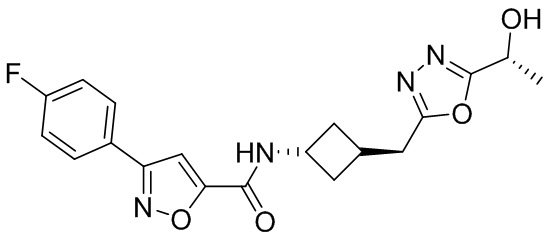
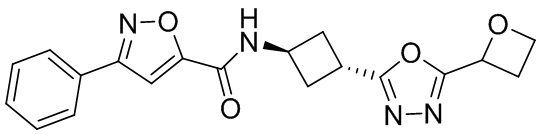
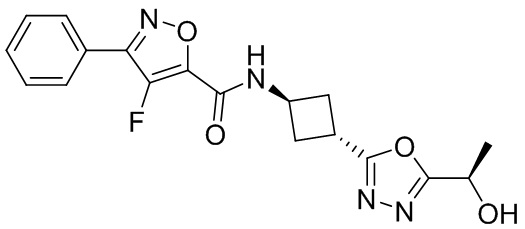
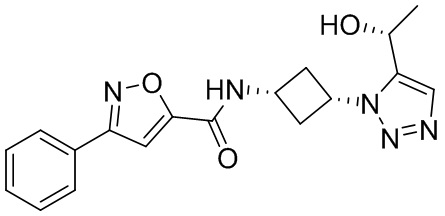
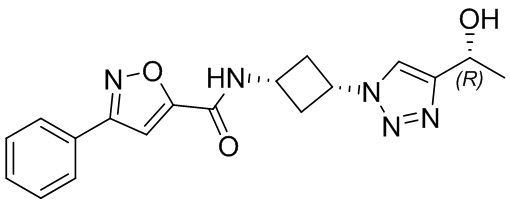
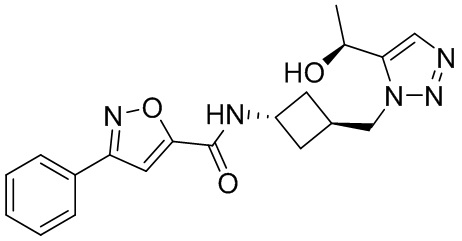
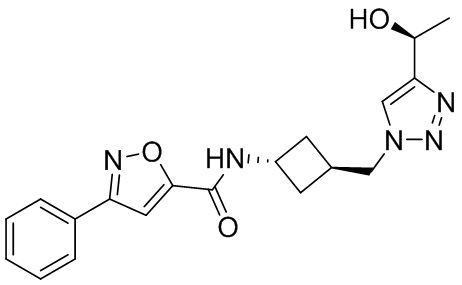
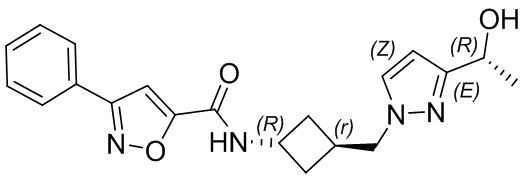
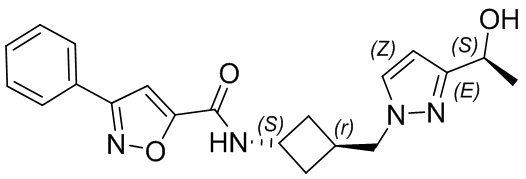
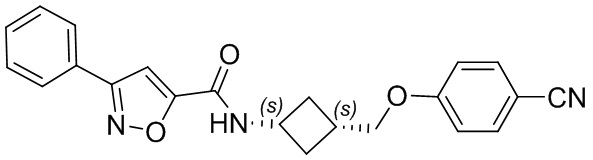
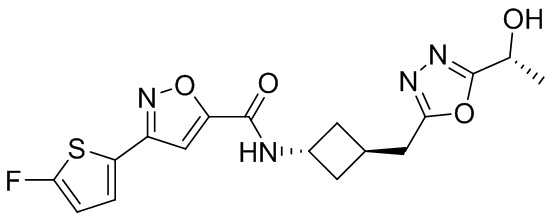
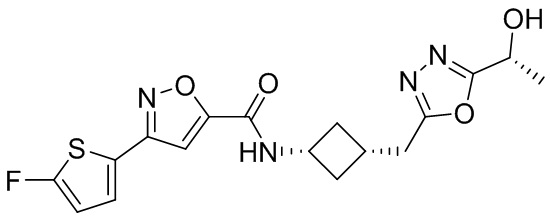
[41] Примеры соединений показаны ниже в Таблице 1:
Таблица 1
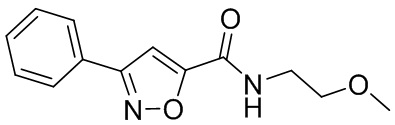
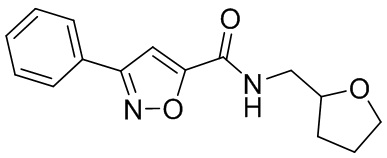
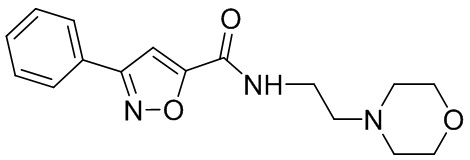
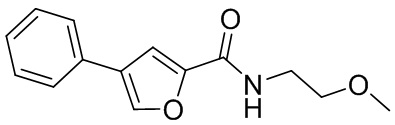
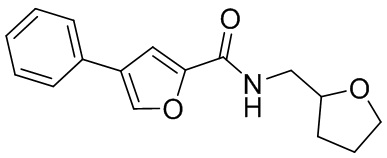
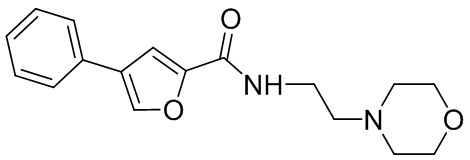
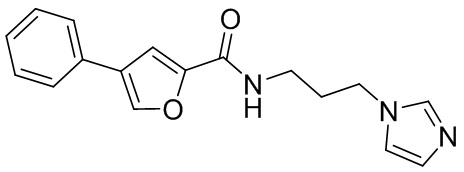
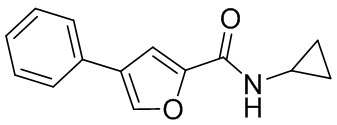
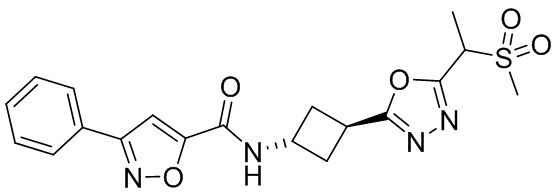
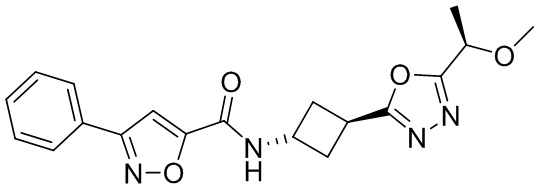
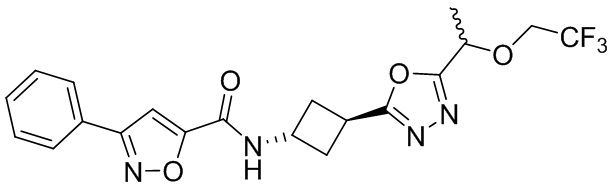
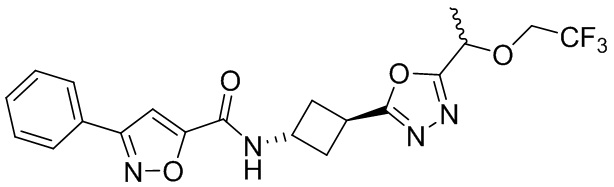
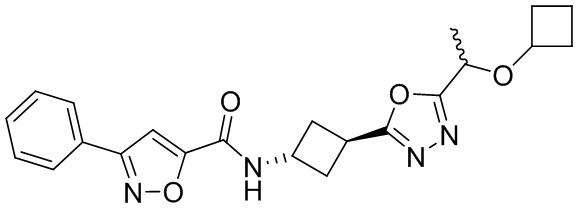
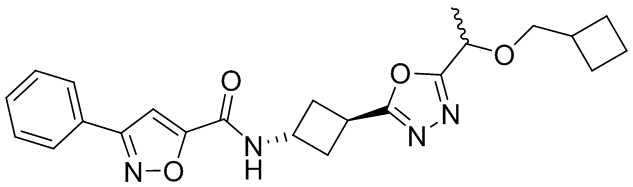
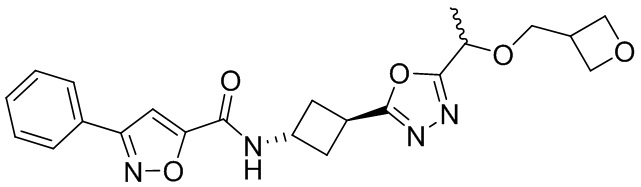
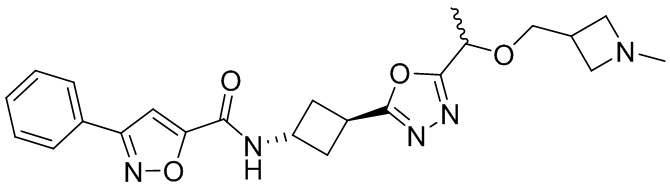
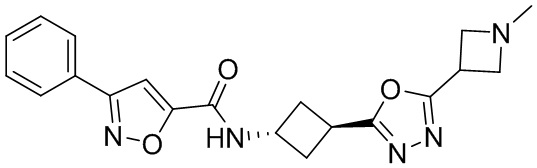
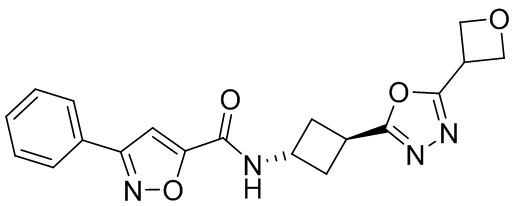
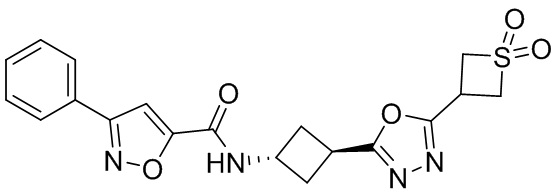
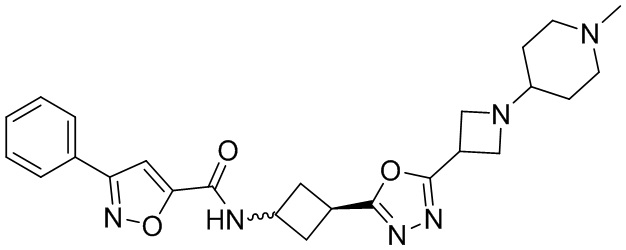
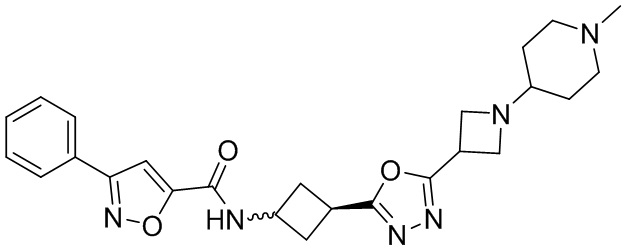
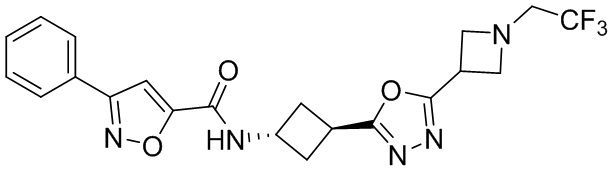
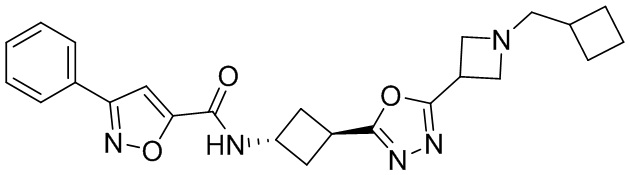
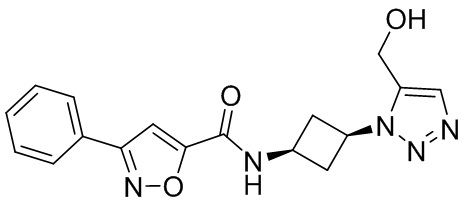
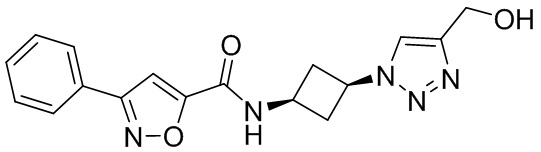
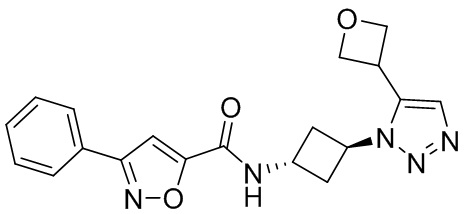
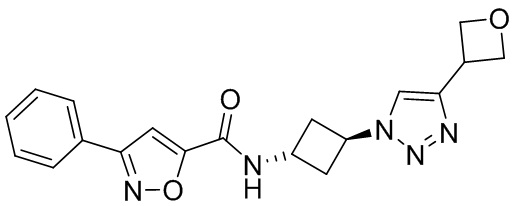
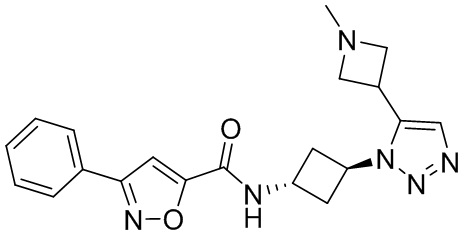

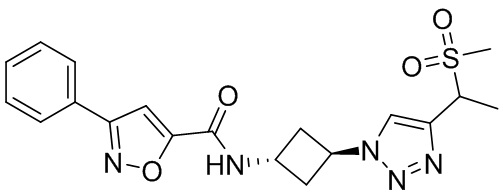
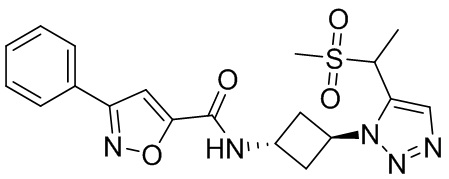
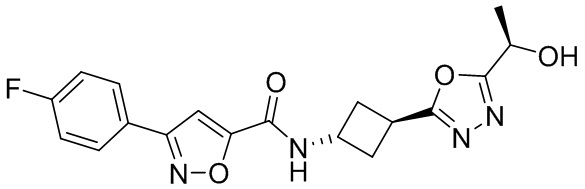
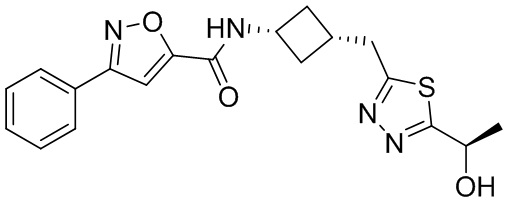
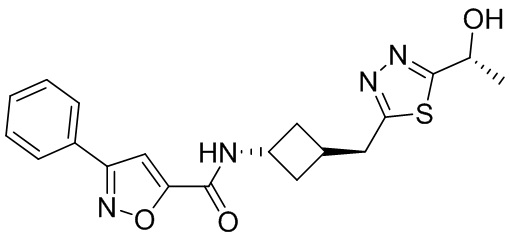
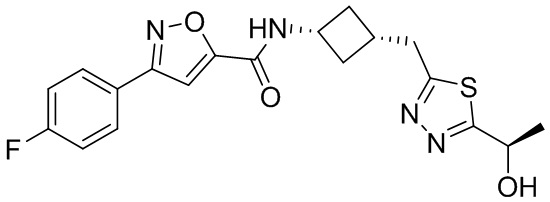
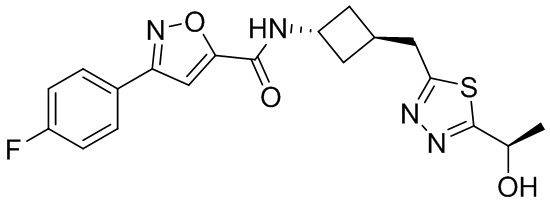
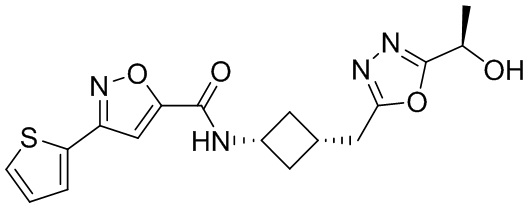
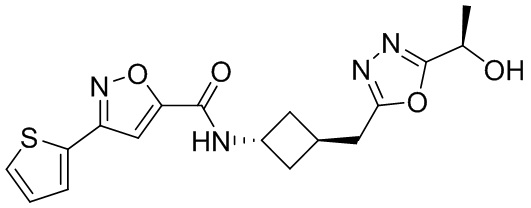
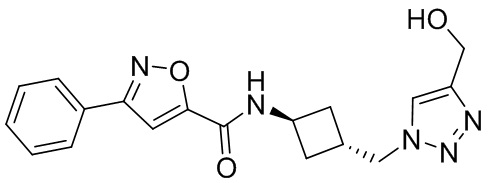
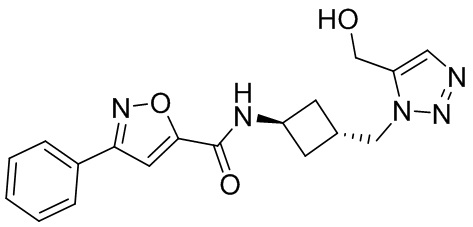
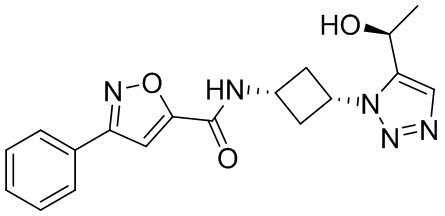
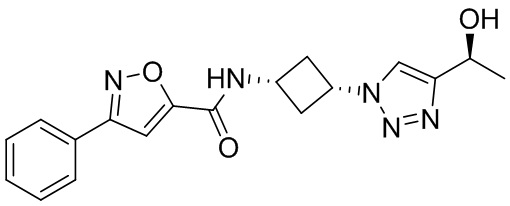
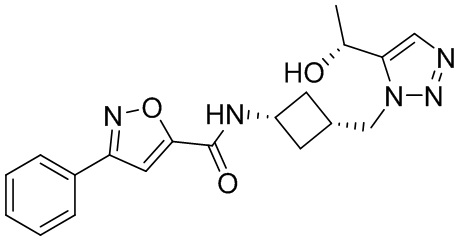
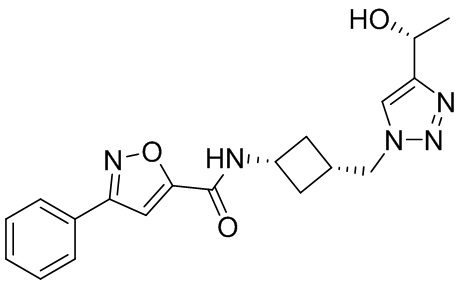
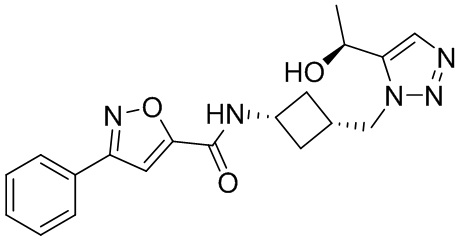
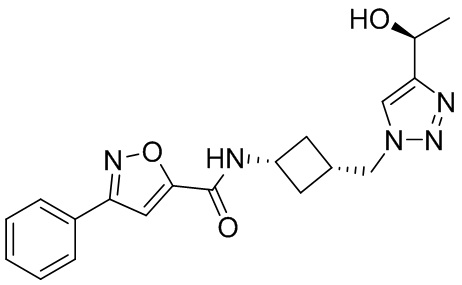
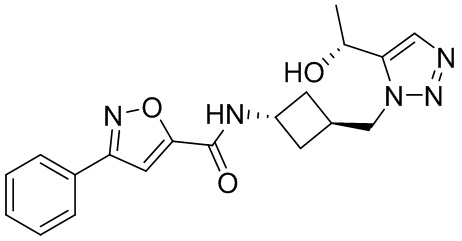
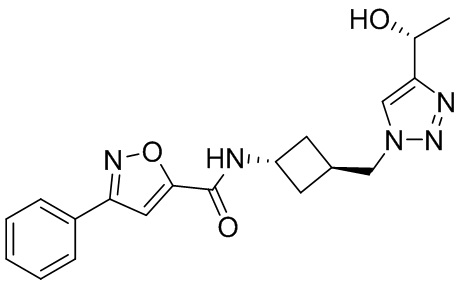
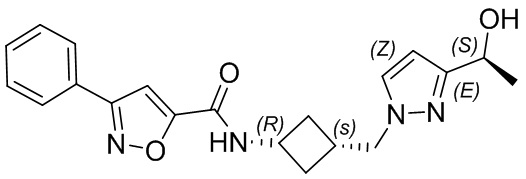
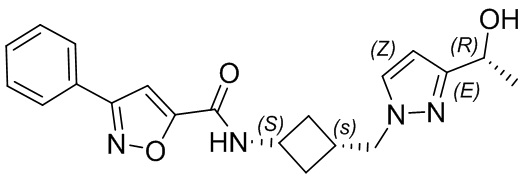
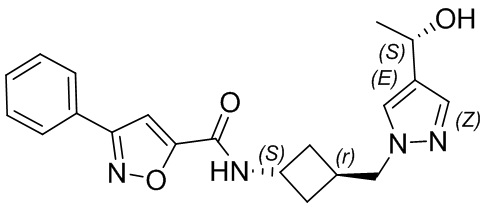
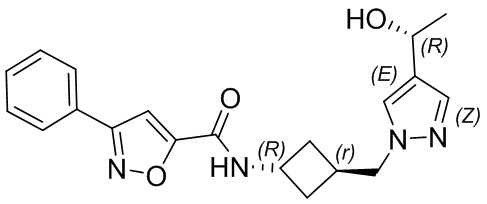
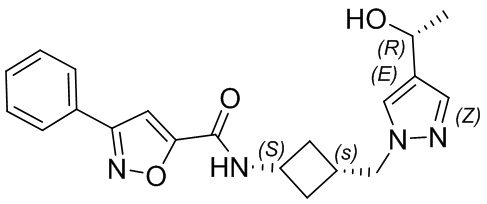
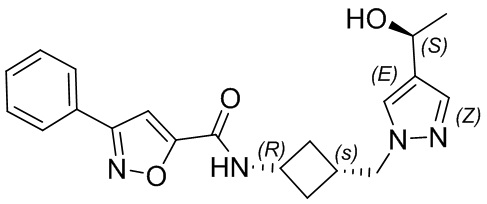
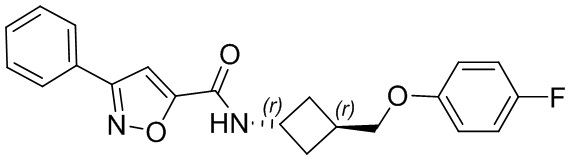
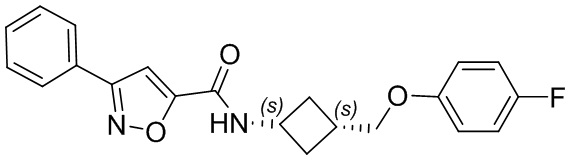

[42] Также в настоящем документе предусмотрены фармацевтические композиции, которые включают раскрытое соединение, такое как соединения, имеющие формулу (Ia), (IIa), (Ib), (IIb), (III) или (IV), и фармацевтически приемлемый носитель или вспомогательное вещество. В некоторых вариантах реализации композиции могут включать по меньшей мере один дополнительный модулятор CFTR, раскрытый в любом другом месте настоящего документа, или по меньшей мере два дополнительных модулятора CFTR, каждый из которых независимо раскрыт в любой другом месте настоящего документа.
[43] Следует понимать, что конкретные варианты реализации, описанные в настоящем документе, можно комбинировать с другими вариантами реализации, описанными в настоящем документе. Например, как обсуждается выше, в некоторых вариантах реализации R2a представляет собой фтор, и в некоторых вариантах реализации, описанных выше, A представляет собой необязательно замещенный имидазолил или пиразолил. Например, предусмотрены раскрытые соединения Формулы (Ia), (IIa), (Ib), (IIb), (III) или (IV), где R2a представляет собой фтор, и A представляет собой необязательно замещенный имидазолил или пиразолил.
[44] Ниже будут более подробно описаны признаки и другие детали раскрытия. Перед дальнейшим описанием настоящего изобретения здесь собраны некоторые термины, использующиеся в описании, примерах и прилагаемой формуле изобретения. Эти определения следует рассматривать в свете остального описания и понимания специалиста в данной области. Если не указано иное, все технические и научные термины, использующиеся в настоящем описании, имеют значения, придаваемые им обычно средними специалистами в данной области.
[45] Понятно, что описание настоящего изобретения следует толковать в соответствии с законами и принципами образования химических связей.
[46] Термин «алкил» в настоящем тексте, если не указано иное, относится как к разветвленным, так и к линейным насыщенным алифатическим углеводородным группам, содержащим указанное число атомов углерода: например, «C1-C10 алкил» обозначает алкил, содержащий от 1 до 10 атомов углерода, и линейные или разветвленные углеводороды, содержащие 1 6, 1 4 или 1-3 атома углерода, обозначаемые в настоящем документе как C1-6 алкил, C1-4 алкил и C1-3 алкил, соответственно. Примеры алкила включают следующие, но не ограничиваются ими: метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, сек-бутил, трет-бутил, н-пентил, н-гексил, 2-метилбутил, 2-метилпентил, 2-этилбутил, 3-метилпентил и 4-метилпентил.
[47] Термин «алкенил» в настоящем тексте относится как к группам как с разветвленной, так и с линейной цепью, содержащим указанное число атомов углерода и содержащим по меньшей мере одну двойную углерод-углеродную связь. Примеры алкенильных групп включают следующие линейные или разветвленные группы из 2 6 или 3-4 атома углерода, обозначаемые в настоящем документе как C2 6 алкенил, и C3-4 алкенил, соответственно, но не ограничиваются ими. Примеры алкенильных групп включают следующие, но не ограничиваются ими: винил, аллил, бутенил, пентенил и т.д., но не ограничиваются перечисленными.
[48] Термин «алкинил» в настоящем тексте относится как к группам как с разветвленной, так и с линейной цепью, содержащим указанное число атомов углерода и содержащим по меньшей мере одну тройную углерод-углеродную связь.
[49] Термин «циклоалкил» в настоящем тексте относится к насыщенным циклическим алкильный группам, содержащим 3 или больше атомов углерода, например, 3-10, 3-6 или 4-6 атомов углерода, обозначаемым в настоящем документе как C3-10 циклоалкил, C3-6 циклоалкил или C4-6 циклоалкил, соответственно, например. Примеры циклоалкилов включают следующие, но не ограничиваются ими: циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил.
[50] Термин «циклоалкокси» в настоящем документе относится к циклоалкильной группе, присоединенной к кислороду (циклоалкил-O-). Примеры циклоалкокси-групп включают следующие, без ограничения, циклоалкокси-группы, содержащие 3-6 атомов углерода, называемые в настоящем документе C3-6циклоалкокси-группами. Примеры циклоалкокси-групп, включают циклопропокси, циклобутокси, циклогексилокси и т.д., но не ограничиваются перечисленными.
[51] Термин «циклоалкенил» в настоящем тексте относится к циклическим алкенильный группам, содержащим 3 или больше атомов углерода.
[52] Термин «циклоалкинил» в настоящем тексте относится к циклическим алкинильным группам, содержащим 5 или больше атомов углерода.
[53] «Алкилен» обозначает линейный или разветвленный насыщенный алифатический двухвалентный радикал, содержащий указанное количество атомов углерода. «Циклоалкилен» относится к двухвалентному радикалу карбоциклической насыщенной углеводородной группы, содержащему указанное число атомов углерода.
[54] Термин «алкокси» в настоящем документе относится к линейной или разветвленной алкильной группе, присоединенной к кислороду (алкил-O-). Примеры алкокси-групп включают следующие, но не ограничиваются ими: алкоксигруппы, содержащие 1-6 или 2-6 атомов углерода, обозначаемые в настоящем документе как C1-6 алкокси, и C2-6 алкокси, соответственно. Примеры алкокси-групп включают метокси, этокси, изопропокси и т.д., но не ограничиваются перечисленными.
[55] Термин «гетероциклический» или «гетероцикл» охватывают гетероциклоалкил, гетероциклоалкенил, гетеробициклоалкил, гетеробициклоалкенил, гетерополициклоалкил, гетерополициклоалкенил и п.т., если не указано иное. Гетероциклоалкил относится к циклоалкильным группам, содержащим один или более гетероатомов (O, S или N) в кольце. Гетероциклоалкенил в настоящем документе относится к циклоалкенильным группам, содержащим один или более гетероатомов (O, S или N) в кольце. Гетеробициклоалкил относится к бициклоалкильным группам, содержащим один или больше гетероатомов (O, S или N) в кольце. Гетеробициклоалкенил в настоящем документе относится к бициклоалкенильным группам, содержащим один или больше гетероатомов (O, S или N) в кольце, и гетероцикл относится к, например, насыщенной или частично ненасыщенной 4-12- или 4-10-членной кольцевой структуре, включая соединенные мостиками или конденсированные кольца, в которых структуры колец включают от одного до трех гетероатомов, таких как азот, кислород и сера. В тех случаях, когда это возможно, гетероциклильные кольца могут быть соединены с соседними радикалами через углерод или азот. Примеры гетероциклильных групп включают следующие, но не ограничиваются ими: пирролидин, пиперидин, морфолин, тиоморфолин, пиперазин, оксетан, азетидин, тетрагидрофуран или дигидрофуран и т.д.
[56] Циклоалкильные, циклоалкенильные и гетероциклические группы также включают группы, аналогичные описанным выше для каждой из соответствующих категорий, но содержащие одну или более групп-заместителей.
[57] Термин «арил» в настоящем тексте относится к моноциклической или полициклической ароматической карбоциклической системе колец. Полициклический арил представляет собой полициклическую систему колец, которая содержит по меньшей мере одно ароматические кольцо. Полициклические арилы содержат конденсированные кольца, ковалентно соединенные кольца или их комбинации. Термин «арил» охватывает ароматические радикалы, такие как фенил, нафтил, инденил, тетрагидронафтил и инданил. Арильная группа может быть замещенной или незамещенной. В некоторых вариантах реализации арил представляет собой C4-C10 арил. Примерами необязательно замещенного арила являются фенил, замещенный фенил, нафтил и замещенный нафтил.
[58] Термин «гетероарил» в настоящем тексте относится к ароматическим карбоциклическим группами, содержащим один или больше гетероатомов (O, S или N) в кольце. Гетероарильная группа, если не указано другое, может быть моноциклической или полициклической. Гетероарильная группа может дополнительно быть замещенной или незамещенной. Предусмотренные гетероарильные группы включают системы колец, замещенные одной или более оксо-группами. Полициклический гетероарил может содержать конденсированные кольца, ковалентно связанные кольца или их комбинацию. Полициклический гетероарил представляет собой полициклическую систему колец, которая содержит по меньшей мере одно ароматические кольцо, содержащее один или больше гетероатомов в кольце. Примеры гетероарильных групп включают следующие, но не ограничиваются ими: пиридинил, пиридазинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, хинолил, изохинолил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фтализинил, триазинил, изоиндолил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотриазолил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтидинил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил, бензофурил, фуропиридинил, пиролопиримидинил, тиазолопиридинил, оксазолопиридинил и азаиндолил. Вышеперечисленные гетероарильные группы могут быть связаны с остальной частью молекулы через атом углерода или гетероатом (где это возможно). Например, группа, образованная из пиррола, может представлять собой пиррол-1-ил (N-связанный) или пиррол-3-ил (C-связанный). В некоторых вариантах реализации гетероарил представляет собой 4-12-членный гетероарил. В других вариантах реализации гетероарил представляет собой моно- или бициклический 4- 10-членный гетероарил.
[59] Термин «замещенный» относится к замещению путем независимой замены одного, двух, трех или более атомов водорода заместителями, включая перечисленные, но не ограничиваясь ими: и, если не указано другое, -C1-C12 алкил, -C2-C12 алкенил, -C2-C12 алкинил, -C3-C12 циклоалкил, -C3-C12 циклоалкенил, C3-C12 циклоалкинил, -гетероцикл, -F, -Cl, -Br, -I, -OH, -NO2, -N3, -CN, -NH2, оксо, тиооксо, -NHRx, -NRxRx, диалкиламино, -диариламино, -дигетероариламино, -ORx, -C(O)Ry, -C(O)C(O)Ry, -OCO2Ry, -OC(O)Ry, OC(O)C(O)Ry, -NHC(O)Ry, -NHCO2Ry, -NHC(O)C(O)Ry, NHC(S)NH2, -NHC(S)NHRx, -NHC(NH)NH2, -NHC(NH)NHRx, -NHC(NH)Rx, -C(NH)NHRx и (C=NRx)Rx; -NRxC(O)Rx, -NRxC(O)N(Rx)2, -NRxCO2Ry, -NRxC(O)C(O)Ry, -NRxC(S)NH2, -NRxC(S)NHRx, -NRxC(NH)NH2, -NRxC(NH)NHRx, -NRxC(NH)Rx, -C(NRx)NHRx -S(O)Ry, -NHSO2Rx, -CH2NH2, -CH2SO2CH3, -арил, -арилалкил, -гетероарил, -гетероарилалкил, -гетероциклоалкил, -C3-C12-циклоалкил, -полиалкоксиалкил, -полиалкокси, -метоксиметокси, -метоксиэтокси, -SH, -S-Rx, или -метилтиометил, где Rx выбран из группы, состоящей из водорода, -C1-C12 алкила, -C2-C12 алкенила, -C2-C12 алкинила, -C3-C12 циклоалкила, -арила, -гетероарила и -гетероцикл, и -Ry выбран из группы, состоящей из водорода, -C1-C12 алкила, -C2-C12 алкенила, -C2-C12 алкинила, -C3-C12 циклоалкила, -арила, -гетероарила, -гетероцикла, -NH2, -NH-C1-C12 алкила, -NH-C2-C12 алкенила, -NH-C2-C12-алкинила, -NH-C3-C12 циклоалкила, -NH-арила, -NH-гетероарил и -NH-гетероцикла. Понятно, что арилы, гетероарилы, алкилы и п. т. могут также содержать заместители.
[60] Термины «гало» или «галоген» в настоящем документе относятся к F, Cl, Br или I.
[61] Термин «галогеналкил» в настоящем документе относится к алкильной группе, содержащей от 1 до (2n+1) заместителей, независимо выбранных из F, Cl, Br или I, где n представляет собой максимальный номер атома углерода в данной алкильной группе. Понятно, что галогеналкил представляет собой частный случай необязательно замещенного алкила.
[62] Термины «гидрокси» и «гидроксил» в настоящем документе относится к радикалу OH.
[63] Для специалиста понятно, что «H» является символом для обозначения водорода, «N» является символом для обозначения азота, «S» является символом для обозначения серы, «O является символом для обозначения кислорода. «Me» представляет собой сокращение для метила.
[64] Раскрытые в настоящем документе соединения могут содержать один или более хиральных центров и, соответственно, существовать в форме стереоизомеров. Термин «стереоизомеры» с настоящем документе включает все энантиомеры или диастереомеры. Эти соединения могут быть обозначены символами «(+)», «(-)», «R» или «S», в зависимости от конфигурации заместителей вокруг стереогенного атома углерода, но специалист понимает, что структура может косвенным образом указывать на хиральный центр. Настоящее описание охватывает различные стереоизомеры раскрытых соединений и их смеси. Смеси энантиомеров или диастереомеров могут обозначаться в номенклатуре«(±)», но специалист понимает, что структура может косвенным образом указывать на хиральный центр.
[65] Раскрытые в настоящем документе соединения могут содержать одну или более двойных связей и, соответственно, существуют в форме геометрических изомеров, существование которых обусловлено расположением заместителей вокруг двойной углерод-углеродной связи. Символ обозначает связь, которая может представлять собой одинарную, двойную или тройную связь, описанную в настоящем документе. Заместители вокруг двойной углерод-углеродной связи обозначаются как имеющие конфигурацию «Z» или «E», где термины «Z» и «E» применяются в соответствии со стандартами IUPAC. Если не указано иное, структуры, в которых показаны двойные связи, включают оба изомера «E» и «Z». В качестве альтернативы, заместители вокруг двойной углерод-углеродной связи могут обозначаться как «цис-» или «транс-», где «цис-» относится к заместителям по одну сторону от двойной связи, и «транс-» обозначает заместители на противоположных сторонах двойной связи.
[66] Раскрытые в настоящем документе соединения могут содержать карбоциклическое или гетероциклическое кольцо и, соответственно, существовать в виде геометрических изомеров, существование которых обусловлено расположением заместителей вокруг кольца. Расположение заместителей вокруг карбоциклического или гетероциклического кольца обозначается как конфигурация «Z» или «E», где термины «Z» и «E» используются в соответствии со стандартами IUPAC. Если не указано иное, структуры, содержащие изображение карбоциклических или гетероциклических колец, включают оба изомера «Z» и «E». Заместители вокруг карбоциклического кольца или гетероциклического кольца могут также обозначаться как «цис-» или «транс-», где термин «цис-» обозначает заместители с одной стороны плоскости кольца, а термин «транс-» обозначает заместители на противоположных сторонах плоскости кольца. Смеси соединений согласно настоящему изобретению, в которых заместители расположены как на одной, так и на противоположных сторонах от плоскости кольца, обозначаются «цис/транс».
[67] Отдельные энантиомеры и диастереомеры раскрытых соединений могут быть получены синтетическим путем из доступных для приобретения исходным материалов, которые содержат асимметричные или стереогенные центры, или путем получения рацемических смесей с последующим разделением способами, известными среднему специалисту в данной области. Примеры таких способов разделения включают (1) связывание смеси энантиомеров со вспомогательными хиральными материалами, разделение полученной смеси диастереомеров путем перекристаллизации или хроматографии и отсоединение оптически чистого продукта от вспомогательного материала, (2) получение солей с применением оптически активного разделяющего реагента, (3) прямое разделение смеси оптических энантиомеров на колонках для хиральной жидкостной хроматографии или (4) кинетическое разделение с использованием стереоселективных химических реагентов или ферментативных реагентов. Рацемические смеси могут быть разделены на составляющие их энантиомеры хорошо известными способами, такими как жидкостная хроматография с хиральной фазой или кристаллизация соединения в хиральном растворителе. Стереоселективные пути синтеза, химические или ферментативные реакции, в которых один реагент образует неравномерную смесь стереоизомеров в процессе образования нового стереоцентра или в процессе преобразования уже существующего центра, хорошо известны в данной области. Стереоселективные пути синтеза охватывают как энантио-, так и диастереоселективные преобразование, и могут включать применение вспомогательных хиральных материалов. Например, см. Carreira и Kvaerno, Classics in Stereoselective Synthesis, Wiley-VCH: Weinheim, 2009. В тех случаях, когда описаны или изображены конкретные соединения, предполагается, что такое описание или изображение включает саму химическую структуру, а также таутомеры этой структуры.
[68] Термин «энантиомерно чистый» обозначает стереомерно чистый состав соединения. Например, стереомерно чистый состав представляет собой состав, не содержащий или по существу не содержащий других стереоизомеров данного соединения. В другом примере, для соединения, имеющего хиральный центр, энантиомерно чистый состав соединения не содержит или по существу не содержит другой энантиомер. В еще одном примере, в случае, когда соединение содержит два хиральных центра, энантиомерно чистый состав не содержит или почти не содержит других диастереомеров.
[69] В тех случаях, когда описана или изображена конкретная стереохимическая структура, подразумевается, что она обозначает, что конкретный энантиомер присутствует в избытке по отношению к другому энантиомеру. Соединение имеет R-конфигурацию по какому-либо положению, если оно присутствует в избытке по отношению к соединению, имеющему S-конфигурацию по этому положению. Соединение имеет S-конфигурацию по какому-либо конкретному положению, если оно присутствует в избытке по отношению к соединению, имеющему R-конфигурацию по этому положению.
[70] Раскрытые в настоящем документе соединения могут существовать в сольватированных и несольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и п. т., и подразумевается, что раскрытые соединения включают как сольватированные, так и несольватированные формы. В одном варианте реализации раскрытое соединение является аморфным, а в другом варианте реализации представляет собой отдельный полиморф. В другом варианте реализации раскрытое соединение представляет собой смесь полиморфов. В другом варианте реализации раскрытое соединение имеет кристаллическую форму.
[71] Также в настоящем документе предусмотрены меченные изотопами соединения, которые идентичны описанным в настоящем документе, за тем исключением, что один или более атомов заменены на атом, атомная масса или массовое число которого отличаются от атомной массы или массового числа, обычно присутствующих в природных условиях. Примеры изотопов, которые можно включать в соединения согласно настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Например, в раскрытом соединении один или более атомов H могут быть заменены дейтерием.
[72] Некоторые меченые изотопами соединения, раскрытые в настоящем описании (например, соединения, меченные изотопами 3H и 14C) можно применять в исследованиях распределения соединений и/или субстрата в ткани. Содержащие тритий (т.е., 3H) и углерод-14 (т.е., 14C) изотопы особенно предпочтительны благодаря легкости их получения и детектирования. Далее, замещение более тяжелыми изотопами, такими как дейтерий (т.е., 2H) может давать определенные терапевтические преимущества, обусловленные более высокой метаболической стабильностью (например, увеличенное время жизни in vivo или более низкие необходимые дозировки) и, соответственно, могут быть предпочтительными в некоторых обстоятельствах. Меченные изотопами соединения могут быть получены в соответствии с процедурами, аналогичными раскрытым в примерах, содержащихся в настоящем документе, путем использования меченного изотопом реагента вместо реагента, не меченного изотопом.
[73] В некоторых вариантах реализации один или больше атомов азота раскрытого соединения, если они присутствуют, окислены до N-оксида.
[74] Репрезентативные примеры путей синтеза для получения соединений, раскрытых в настоящем документе, приведены в разделе «Примеры». Как это понятно специалисту в данной области, диастереомеры можно выделять из реакционной смеси с использованием колоночной хроматографии.
[75] Раскрытые соединения также могут быть получены способами, описанными в литературе, включая следующие источники, но не ограничиваясь ими: J. Med. Chem. 2011, 54(13), 4350-64; Russian Journal of Organic Chemistry, 2011, 47(8), 1199-1203; публикация заявки на патент США 2009/0036451 A1, WO2008/046072 A2 и патент США № 4,336,264, содержание каждого из которых в явном виде включено в настоящее описание путем ссылки.
[76] Как обсуждалось выше, в одном из вариантов реализации настоящего изобретения предусмотрен способ увеличения активности CFTR у субъекта включающий введение эффективного количества раскрытого соединения. Также в настоящем документе предусмотрен способ лечения пациента, страдающего состоянием, связанным с активностью CFTR, включающий введение указанному пациенту эффективного количества соединения, описанного в настоящем документе.
[77] «Лечить» или «лечение» включает предотвращение или замедление возникновения симптомов, осложнений или биохимических показателей заболевания, облегчение или снижение выраженности симптомов или прекращение или подавление дальнейшего развития заболевания, состояния или нарушения. «Субъект» представляет собой животное, которое будут лечить, или животное, нуждающееся в лечении. «Пациент» представляет собой субъекта-человека, нуждающегося в лечении.
[78] «Эффективное количество» относится к такому количеству агента, которое является достаточным для достижения желаемого и/или указанного эффекта. В контексте способа лечения «эффективное количество» терапевтического агента - это количества, достаточное для облегчения одного или более симптомов и/или предотвращения прогрессирования нарушения, обеспечения обратного развития нарушения и/или достижения желаемого эффекта.
[79] Термин «модуляция» включает увеличение, повышение, ингибирование, снижение, подавление и т.д. Термины «увеличение» и «повышение» значат непосредственно или опосредованно вызывать общий прирост. В настоящем тексте термины «ингибирование» и «уменьшение» включают непосредственно или опосредованно вызываемое общее снижение.
[80] В некоторых примерах активность CFTR повышается после введения соединения, описанного в настоящем документе, когда имеет место увеличение активности CFTR по сравнению с активностью в отсутствие введения соединения. Активность CFTR, например, активность CFTR в качестве хлоридного канала и/или активность транспорта другого иона (например, транспорта HCO3-). В некоторых из этих вариантов реализации повышают (например, увеличивают) активность одного или больше (например, одного или двух) мутантных CFTR (например, CFTR с мутациями ΔF508, S549N, G542X, G551D, R117H, N1303K, W1282X, R553X, 621+1G>T, 1717-1G>A, 3849+10kbC>T, 2789+5G>A, 3120+1G>A, I507del, R1162X, 1898+1G>A, 3659delC, G85E, D1152H, R560T, R347P, 2184insA, A455E, R334W, Q493X и 2184delA). Предполагаемые пациенты имеют мутацию (мутации) CFTR из одного или более классов, такие как, без ограничения, мутации CFTR класса I, мутации CFTR класса II, мутации CFTR класса III, мутации CFTR класса IV, мутации CFTR класса V и мутации CFTR класса VI. Генотипы предполагаемого субъекта (например, субъекта-человека) CFTR включают, без ограничения: гомозиготные мутации (например, ΔF508/ΔF508 и R117H/R117H) и сложные гетерозиготные мутации (например, ΔF508/G551D; ΔF508/A455E; ΔF508/G542X; Δ508F/W1204X; R553X/W1316X; W1282X/N1303K, 591Δ18/E831X, F508del/R117H/ N1303K/ 3849+10kbC>T; Δ303K/ 384; и DF508/G178R).
[81] В некоторых вариантах реализации мутация представляет собой мутацию класса I, мутацию класса II/ I например, G542X; например, сложную гетерозиготную мутацию ΔF508/G542X. В других вариантах реализации мутация представляет собой мутацию класса III, например, G551D, мутацию класса II/ класса III, например, сложную гетерозиготную мутацию ΔF508/G551D. В дальнейших вариантах реализации мутация представляет собой мутацию класса V, например, A455E; мутацию класса II/ класса V, например, сложную гетерозиготную мутацию ΔF508 /A455E. Среди более чем 1000 известных мутаций гена CFTR, ΔF508 представляет собой наиболее распространенную мутацию CFTR, приводящую к неправильному скручиванию и нарушению перемещения белка из эндоплазматического ретикулума к апикальной мембране (Dormer с соавт. (2001). J Cell Sci 114, 4073-4081; http://www.genet.sickkids.on.ca/app). В некоторых вариантах реализации повышают (например, увеличивают) активность ΔF508 CFTR. В некоторых вариантах реализации повышают (например, увеличивают) активность ΔF508 CFTR и/или активность G542X CFTR и/или активность G551D CFTR и/или активность A455E CFTR. Повышение активности CFTR можно измерять, например, с использованием описанных в литературе способов, например, анализа в камере Уссинга, пэтч-кламп анализа, анализа эквивалентного тока на клетках hBE I. (2000), Am J Physiol Cell Physiol 279(2): C461-79; Dousmanis с соавт. (2002), J Gen Physiol 119(6): 545-59; Bruscia с соавт. (2005), PNAS 103(8): 2965-2971).
[82] Как обсуждалось выше, настоящее изобретение охватывает также способ лечения муковисцидоза. Также в настоящем документе предложены способы лечения других заболеваний, связанных с активностью CFTR, включая состояния, связанные с дефицитом активности CFTR, включающие введение эффективного количества раскрытого соединения.
[83] Например, в настоящем документе предложено лечение состояния, связанного с недостаточной или пониженной активностью CFTR, включающее введение эффективного количества раскрытого соединения, которое повышает активность CFTR. Неограничивающими примерами состояний, связанных с недостаточной активностью CFTR, являются муковисцидоз, врожденное двустороннее отсутствие семявыносящего протока (ВДОСП), острый, рецидивирующий или хронический панкреатит, распространенный бронхоэктаз, астма, аллергический легочный аспергиллез, связанные с курением легочные заболевания, такие как хроническая обструктивная болезнь легких (ХОБЛ), хронический синусит, синдром сухого глаза, дефицит белка C, Aβ-липопротеинемия, лизосомные болезни накопления, хиломикронемия 1 типа, болезни легких средней тяжести, дефекты процессинга липидов, наследственный ангионеврологический отек 1 типа, нарушения свертывания крови-фибринолиза, наследственный гемохроматоз, связанный с CFTR метаболический синдром, хронический бронхит, запор, недостаточность поджелудочной железы, наследственная эмфизема и синдрома Шегрена.
[84] В некоторых вариантах реализации раскрытые способы лечения дополнительно включают введение дополнительного терапевтического агента. Например, в одном из вариантов реализации предложен способ введения раскрытого соединения и по меньшей мере одного дополнительного терапевтического агента. В некоторых аспектах раскрытый способ лечения включает введение раскрытого соединения и по меньшей мере двух дополнительных терапевтических агентов. Дополнительные терапевтические агенты включают, например, муколитические агенты, бронхорасширяющие средства, антибиотики, противоинфекционные агенты, противовоспалительные агенты, модуляторы ионных каналов, терапевтические агенты, применяемые в генной терапии, корректоры CFTR и потенциаторы CFTR, или другие агенты, которые модулируют активность CFTR. В некоторых вариантах реализации по меньшей мере один дополнительный терапевтический агент выбран из группы, состоящей из корректора CFTR и потенциатора CFTRа. Неограничивающие примеры корректоров и потенциаторов CFTR включают VX-770 (ивакафтор), VX-809 (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту, VX-661 (1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[1-[(2R)-2,3-дигидроксипропил]-6-фтор-2-(2-гидрокси-1,1-диметилэтил)-1H-индол-5-ил]- циклопропанкарбоксамид), VX-983, VX-152, VX-440 и аталурен (PTC124) (3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойная кислота), FDL169, GLPG1837/ABBV-974 (например, потенциатор CFTR), GLPG 2665, GLPG2222 (например, корректор CFTR), и соединения, описанные в, например, WO2014/144860 и 2014/176553, которые включены в настоящий документ путем ссылки. Неограничивающие примеры модуляторов QBW-251, QR-010, NB-124 и соединения, описанные в, например, WO2014/045283; WO2014/081821, WO2014/081820, WO2014/152213; WO2014/160440, WO2014/160478, US2014027933; WO2014/0228376, WO2013/038390, WO2011/113894, WO2013/038386 и WO2014/180562, причем раскрытые в этих публикациях модуляторы предусмотрены в качестве дополнительных терапевтических агентов и включены путем ссылки. Неограничивающие примеры противовоспалительных агентов включают N6022 (3-(5-(4-(1H-имидазол-1-ил) фенил)-1-(4-карбамоил-2-метилфенил)-1H-пиррол-2-ил) пропановую кислоту), CTX-4430, N1861, N1785 и N91115.
[85] В некоторых вариантах реализации способы, описанные в настоящем документе, могут дополнительно включать введение дополнительного терапевтического агента или введение по меньшей мере двух дополнительных терапевтических агентов CFTR. В некоторых вариантах реализации способы, описанные в настоящем документе, могут дополнительно включать введение дополнительного модулятора CFTR или введение по меньшей мере двух дополнительных модуляторов CFTR. В некоторых вариантах реализации по меньшей мере один модулятор CFTR представляет собой корректор CFTR (например, VX-809, VX-661, VX-983, VX-152, VX-440, GLPG2222 и GLPG2665) или потенциатор (например, ивакафтор, генистеин и GLPG1837). В некоторых из этих вариантов реализации один из по меньшей мере двух дополнительных терапевтических агентов представляет собой корректор CFTR (например, VX-809, VX-661, VX-983, VX-152 и VX-440), а другой представляет собой потенциатор CFTR (например, ивакафтор и генистеин). В некоторых из этих вариантов реализации один из по меньшей мере двух дополнительных терапевтических агентов представляет собой корректор CFTR (например, GLPG2222 или GLPG2665), а другой представляет собой потенциатор CFTR (например, GLPG1837). В некоторых из этих вариантов реализации один из по меньшей мере двух дополнительных терапевтических агентов представляет собой корректор CFTR (например, VX-809 или VX-661), а другой представляет собой потенциатор CFTR (например, ивакафтор). В некоторых из этих вариантов реализации по меньшей мере один модулятор CFTR представляет собой агент, который повышает сквозное прохождение стоп-кодонов (например, NB124 или аталурен).
[86] Соответственно, в другом аспекте настоящего документа предложен способ лечения состояния, связанного с недостаточной или пониженной активностью CFTR (например, муковисцидоза), который включает введение нуждающемуся в этом субъекту (например, пациенту-человеку, нуждающемуся в этом) эффективного количества раскрытого соединения и по меньшей мере одного или двух дополнительных терапевтических агентов CFTR (например, по меньшей мере одного или двух дополнительных терапевтических агентов CFTR, например, где один из двух из указанных по меньшей мере одного или двух дополнительных терапевтических агентов необязательно представляет собой корректор или модулятор CFTR (например, VX-809, VX-661, VX-983, VX-152, VX-440, GLPG2222, GLPG2665, NB124, аталурен) и/или другой представляет собой потенциатор CFTR (например, ивакафтор, генистеин и GLPG1837); например, один из по меньшей мере двух дополнительных терапевтических агентов представляет собой GLPG2222 или GLPG2665, а другой представляет собой GLPG1837; или один из по меньшей мере двух дополнительных терапевтических агентов представляет собой VX-809 или VX-661, а другой представляет собой ивакафтор). В некоторых вариантах реализации генотип CFTR субъекта включает, без ограничений, одну или более мутаций CFTR класса I, одну или более мутаций CFTR класса II, одну или более мутаций CFTR класса III, одну или более мутаций CFTR класса IV или одну или более мутаций CFTR класса V, или одну или более мутаций CFTR класса VI. В некоторых вариантах реализации генотип CFTR субъекта включает, без ограничения, одну или более гемозиготных мутаций (например, ΔF508/ΔF508 или R117H/R117H) и/или одну или более сложных гетерозиготных мутаций (например, ΔF508/G551D; ΔF508/A455E; ΔF508/G542X; Δ508F/W1204X; R553X/W1316X; W1282X/N1303K; F508del/R117H; N1303K/ 3849+10kbC>T; ΔF508/R334W; DF508/G178R и 591Δ18/E831X). В некоторых вариантах реализации генотип CFTR субъекта включает мутацию класса I, например, мутацию класса I G542X, например, сложную гетерозиготную мутацию ΔF508/G542X. В других вариантах реализации генотип CFTR субъекта включает мутацию класса III, например, мутацию класса G551D, например, сложную гетерозиготную мутацию ΔF508/G551D. В дальнейших вариантах реализации генотип CFTR субъекта включает мутацию класса V, например, мутацию класса V A455E, например, сложную гетерозиготную мутацию ΔF508/A455E. В некоторых вариантах реализации активность ΔF508 CFTR и/или активность G542X CFTR и/или активность G551D CFTR и/или активность A455E повышают (например, увеличивают). В некоторых вариантах реализации повышение активности (например, увеличение активности), обеспечиваемое комбинацией раскрытого соединения и одного или двух дополнительных терапевтических агентов, выше, чем повышение активности, обеспечиваемое каждым терапевтическим компонентом отдельно.
Без заболеваний легких или поджелудочной железы
[87] Например, в настоящем документе предложен способ лечения пациента с одной или большим количеством мутаций в гене CFTR: G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N, S549R, G970R или R117H, и/или, например, пациента с одной или двумя копиями мутации F508del или одной копией мутации ΔF508 и второй мутацией, которая приводит к открытию (gating) канала белка CFTR (например, пациента, который гетерозиготен по мутации ΔF508 и G551D), пациента с одной копией мутации ΔF508 и второй мутацией, которая вызывает остаточную активность CFTR, или пациента с одной копией мутации ΔF508 и второй мутацией, которая вызывает остаточную активность CFTR, включающий введение эффективного количества раскрытого соединения. Как описано в настоящем документе, примеры таких способов (например, для пациентов с одной или более мутациями, такими как описаны выше) могут включать, например, применение для таких пациентов комбинированной терапии, например, введения (одновременно или последовательно) указанному пациенту эффективного количества ивакафтора и эффективного количества раскрытого соединения, которое может действовать как усилитель. Такое введение может обеспечить, например, повышения транспорта хлорид-ионов в клетках эпителия бронхов человека с, например, одной или двумя копиями мутации, например, мутации ΔF508, по сравнению с введением только ивакафтора. Другая комбинированная терапия, которая включает раскрытое соединение, может также включать эффективное количество агента сквозного прохождения (например, аталурена, NB124) и эффективное количество раскрытого соединения, которое может действовать как усилитель.
[88] Выражение «комбинированная терапия» в настоящем тексте относится к варианту реализации, в котором пациенту совместно вводят раскрытое соединение, агент- потенциатор CFTR (например, ивакафтор ) и необязательно один или более агентов-корректоров CFTR (например, VX-661 и/или лумакафтор) в рамках специального режима лечения, направленного на обеспечение полезного эффекта от совместного действия этих терапевтических агентов. Например, полезный эффект комбинированной терапии может включать, без ограничения: совместное фармакокинетическое или фармакодинамическое действие комбинации фармацевтических агентов. Например, введение раскрытого соединения только с ивакафтором или с агентом-корректором CFTR (например, лумакафтором или VX-661) может давать такой уровень действия (например, измеренный по хлоридной активности в клетках HBE или у пациентов с мутацией ΔF508, который обеспечивает клиническое улучшение (или лучший эффект) по сравнению с уровнем хлоридной активность в клетках или у пациентов с мутацией G551D, получающих только ивакафтор или ивакафтор и агент-корректор (лумакафтор или VX-661; или, например, введение раскрытого соединения только с ивакафтором или с агентом-корректором CFTR (например, лумакафтором или VX-661) может давать такой уровень действия (например, измеренный по хлоридной активности в клетках HBE или у пациентов с мутацией A455E, который обеспечивает клиническое улучшение (или лучший эффект) по сравнению с уровнем хлоридной активности, например, в 50% или более клеток дикого типа; или после введения раскрытого соединения и ивакафтора пациенту (например, с мутацией G551D класса III) может демонстрировать например, двукратное или большее усиление активности ивакафтора по сравнению с введением только ивакафтора. Введение раскрытых терапевтических агентов в комбинации обычно осуществляют в течение определенного периода времени (продолжительность которого обычно исчисляется днями, неделями, месяцами или годами в зависимости от выбранной комбинации). Подразумевается, что комбинированная терапия включает последовательное введение нескольких терапевтических агентов, т.е. такой случай, в котором каждый терапевтический агент вводят в свое время, а также по существу одновременное введение этих терапевтических агентов или по меньшей мере двух из терапевтических агентов. По существу одновременное введение можно осуществить, например, путем введения субъекту единственной таблетки или капсулы, содержащей фиксированное соотношение всех терапевтических агентов или в форме набора отдельных капсул для каждого терапевтического агента. Последовательное или по существу одновременное введение каждого терапевтического агента можно осуществлять с использованием подходящего пути, включая перечисленные, но не ограничиваясь ими: пероральные пути, ингаляционные пути, внутривенные пути, внутримышечные пути и прямое всасывание через структуры слизистой оболочки. Терапевтические агенты возможно вводить одним и тем же путем или различными путями. Например, в некоторых случаях первый терапевтический агент выбранной комбинации вводят путем внутривенной инъекции, ингаляции или при помощи небулайзера, а другие терапевтические агенты комбинации вводят перорально. В альтернативном варианте, например, возможно все терапевтические агенты вводят перорально или возможно все терапевтические агенты вводят путем внутривенной инъекции, ингаляции или распыления.
[89] Комбинированная терапия также может включать введение терапевтических агентов, описанных выше, в комбинации с дополнительными другими биологически активными ингредиентами и другими нелекарственными средствами терапии. В тех случаях, когда комбинированная терапия дополнительно содержит нелекарственное лечение, указанное нелекарственное лечение может осуществляться в любое подходящее время, при условии, что будет достигаться полезный эффект от совместного действия комбинации терапевтических агентов и нелекарственного лечения. Например, в соответствующих случаях, полезный эффект достигается даже в случае временного прекращения применения нелекарственного лечения при применении терапевтических агентов, возможно, на день, несколько дней или даже недель.
[90] Компоненты раскрытых комбинаций можно вводить пациенту одновременно или последовательно. Понятно, что компоненты могут присутствовать в одном фармацевтически приемлемом носителе, и, соответственно, будут вводиться одновременно. В альтернативном варианте, активные ингредиенты могут быть представлены в отдельных фармацевтических носителях, таких как обычные пероральные лекарственные формы, которые можно вводить одновременно или последовательно.
[91] В другом аспекте предложен способ идентификации потенциального агента, который повышает активность CFTR, который включает: (i) осуществление контакта клетки, которая экспрессирует белок CFTR, с потенциальным агентом и раскрытым соединением; (ii) измерение активности CFTR в клетке в присутствии потенциального агента и раскрытого соеднения; и (iii) сравнение активности CFTR с активностью в отсутствие исследуемого агента, причем повышение активности CFTR в присутствии исследуемого агента указывает на то, что этот агент повышает активность CFTR. В некоторых вариантах реализации клетка экспрессирует мутантный белок CFTR. В некоторых вариантах реализации активность CFTR измеряют путем измерения активности хлоридного канала CFTR, и/или активности транспорта другого иона. В некоторых из этих вариантов реализации способ представляет собой способ с высокой пропускной способностью. В некоторых из этих вариантов реализации потенциальный агент представляет собой корректор CFTR или потенциатор CFTR.
[92] Термин «фармацевтически приемлемая соль(соли)» в настоящем документе относится к солям кислотных или основных групп, которые могут присутствовать в раскрытых соединениях, применяемых в раскрытых композициях. Соединения, включаемые в настоящие композиции, которые основны по своей природе, могут образовывать разнообразные соли с различными органическими и неорганическими кислотами. Кислоты, которые можно применять для получения фармацевтически приемлемых солей таких основных соединений, включают кислоты, образующие нетоксические соли присоединения, т.е., соли, содержащие фармацевтически приемлемые анионы, включая перечисленные, но не ограничиваясь ими: малат, оксалат, хлорид, бромид, йодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, олеат, таннат, пантотенат, биатртрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, p-толуолсульфонат и памоат (т.е., 1,1'-метилен-бис-(2-гидрокси-3-нафтoат)). Соединения, включаемые в настоящие композиции, которые являются кислотыми по своей природе, могут образовывать разнообразные соли с различными фармацевтически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов и соли щелочноземельных металлов, в частности, соли кальция, магния, натрия, лития, цинка, калия и железа. Соединения, включаемые в настоящие композиции, которые включают кислотный или основной фрагмент, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Раскрытые в настоящем документе соединения могут содержать как кислотные, так и основные группы, например, одну аминогруппу и одну группу карбоновой кислоты. В таком случае соединение может существовать в форме соли присоединения кислоты, цвиттериаона или соли присоединения основания.
[93] В одном из вариантов реализации предусмотренные способы могут включать например, введение пролекарств соединений, описанных в настоящем тексте, например, пролекарств соединений Формулы (Ia), (IIa), (Ib), (IIb), (III) или (IV) или содержащей их фармацевтической композиции.
[94] Термин «пролекарство» относится к соединениям, которые in vivo преобразуются в раскрытом соединение или фармацевтически приемлемую соль, гидрат или сольваты соединения. Механизмы преобразования могут быть различными (таких как метаболизм под действием эстераз, амидаз, фосфатаз или восстановительный метаболизм), они могут протекать в различных местах (например, в просвете кишечника, после прохождения кишечник, в крови или печени). Пролекарства хорошо известны в данной области (см., например, Rautio, Kumpulainen, с соавт., Nature Reviews Drug Discovery 2008, 7, 255). Например, если соединение согласно настоящему изобретению или фармацевтически приемлемая соль, гидрат или сольват соединения содержит функциональную группу карбоновой кислоты, пролекарство может включать сложный эфир, образованный путем замены атома водорода в кислотой группу такой группой как (C1-8)алкил, (C2-12)алкилкарбонилоксиметил, 1-(алкилкарбонилокси)этил, содержащий от 4 до 9 атомов углерода, 1-метил-1-(алкилкарбонилокси)-этил, содержащий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, содержащий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил, содержащий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил, содержащий от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометил, содержащий от 3 до 9 атомов углерода, 1 (N (алкоксикарбонил)амино)этил, содержащий от 4 до 10 атомов углерода, 3-фталидил, 4 кротонолактонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-2)алкиламино-(C2-3)алкил (такой как β-диметиламиноэтил), карбамоил-(C1-2)алкил, N,N-ди(C1-2)алкилкарбамоил-(C1-2)алкил и пиперидино-, пирролидино- или морфолинo(C2-3)алкил.
[95] Аналогично, если соединение, раскрытое в настоящем документе, содержит спиртовую функциональную группу, пролекарство может быть образовано путем замены атома водорода спиртовой группы такой группой как (C1-6)алкилкарбонилоксиметил, 1-((C1-6)алкилкарбонилокси)этил, 1 метил 1 ((C1-6)алкилкарбонилокси)этил (C1-6)алкоксикарбонилокси)метил, N (C1-6)алкоксикарбониламинометил, сукциноил, (C1-6)алкилкарбонил, α-амино(C1-4)алкилкарбонил, арилалкилкарбонил и α-аминоалкилкарбонил или α-аминоалкилкарбонил-α-аминоалкилкарбонил, где каждыая α-аминоалкилкарбонильная группа независимо выбрана из природных L-аминокислот, P(O)(OH)2, P(O)(O(C1-6)алкил)2 или гликозила (радикала, образующегося в результате удаления гидроксильной группы из гемиацетальной формы углеводорода).
[96] Если соединение согласно настоящему описанию включает функциональную амино-группу, пролекарство может быть получено, например, путем создания амида или карбамата, N-алкилкарбонилоксиалкильного производного, (оксодиоксоленил)метильного производного N-основания Манниха, имина или енамина. Дополнительно, в результате метаболического расщепления вторичного амина может образовываться биологически активный первичный амин, а в результате метаболического расщепления третичного амина может образовываться биологически активный первичный или третичный амин. Примеры можно найти в публикации Simplício, с соавт., Molecules 2008, 13, 519 и в источниках, на которые она ссылается.
[97] Также в некоторых вариантах реализации предусмотрено применение клатратов соединений, описанных в настоящем документе, фармацевтических композиций, содержащих клатраты, и способы применения клатратов. В настоящем документе также предусмотрены клатраты раскрытого соединения или содержащие их фармацевтические композиции.
[98] Как обсуждалось выше, настоящий документ также предусматривает введение фармацевтических композиций, содержащих фармацевтически приемлемый носитель или вспомогательное вещество и соединение, описанное в настоящем документе. Раскрытое соединение или его фармацевтически приемлемая соль, сольват, клатрат или пролекарство можно вводить в фармацевтических композициях, содержащих фармацевтически приемлемый носитель или вспомогательное вещество. Вспомогательное вещество может быть выбрано на основании ожидаемого пути введения композиции при терапевтическом применении. Путь введения композиции зависит от состояния, которое лечат. Например, внутривенная инъекция может быть предпочтительна для лечения системного нарушения, а пероральное введение может быть предпочтительным для лечения желудочно-кишечного нарушения. Специалист в данной области сможет определить путь введения и дозировку композиции для введения без чрезмерно большого количества экспериментов в комбинации со стандартными исследованиями зависимости доза-ответ. Значимые обстоятельства, которые нужно при этом принимать во внимание, включают состояние или состояния, которые лечат, выбор композиции для введения, возраст, массу и реакцию конкретного пациента, а также тяжесть симптомов у пациента. Фармацевтическую композицию, содержащую раскрытое соединение или фармацевтически приемлемую соль, сольват, клатрат или пролекарство, можно вводить различными путями, включая перечисленные, но не ограничиваясь ими: парентеральное, пероральное введение, введение через легкие, введение в глаза, назальное, ректальное, вагинальное введение, введение в ухо, топическое, буккальное, трансдермальное, внутривенное, внутримышечное, подкожное, внутрикожное, внутриглазное, внутримозговое, интралимфатическое, внутрисуставное, интратекальное и интраперитонеальное введение. Композиции также могут включать, в зависимости от желаемой лекарственной формы, фармацевтически приемлемые нетоксичные носители или разбавители, которые определяются как основы, обычно применяемые для получения лекарственных форм фармацевтических композиций для введения человеку или животному. Разбавитель выбирают таким образом, чтобы он не нарушал биологическую активность фармакологического агента или композиции. Примерами таких разбавителей являются дистиллированная вода, физиологический фосфатный буферный раствор, растворы Рингера, раствор декстрозы и раствор Хэнка. Дополнительно фармацевтическая композиция или лекарственная форма может также включать другие носители, адъюванты или нетоксичные, нетерапевтические и неиммуногенные стабилизаторы и т. п. Фармацевтические композиции могут также включать большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (таких как функционализированная латексом SEPHAROSE™, агароза, целлюлоза и т. п.), полимерные аминокислоты, сополимеры аминокислот и липидные агрегаты (такие как масляные капельки или липосомы).
[99] Раскрытые композиции можно вводить парентеральным путем, таким как, например, путем внутривенной, внутримышечной, интратекальной или подкожной инъекции. Парентеральное введение можно осуществлять путем введения композиции в раствор или суспензию. Такие растворы или суспензии могут также включать стерильные разбавители, такие как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители. Лекарственные формы для парентерального введения могут также включать антибактериальные агенты, такие как, например, бензиловый спирт или метилпарабены, антиоксиданты, такие как, например, аскорбиновая кислота или бисульфит натрия, и хелатирующие агенты, такие как ЭДТА. Также можно добавлять буферы, такие как ацетаты, цитраты или фосфаты и вещества для модификации тоничности, такие как хлорид натрия или декстроза. Препараты для парентерального введения могут быть заключены в ампулы, одноразовые шприцы или многодозовые сосуды, выполненные из стекла или пластика.
[100] Дополнительно, в композициях могут присутствовать вспомогательные вещества, такие как смачивающие вещества или эмульгаторы, поверхностно-активные вещества, pH-буферные вещества и т. п. Другими компонентами фармацевтических композиций являются компоненты нефти, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло и минеральное масло. В целом, предпочтительными жидкими носителями, особенно для инъекционных растворов, являются пропиленгликоль или полиэтиленгликоль.
[101] Также могут быть приготовлены инъецируемые лекарственные формы в форме жидких растворов или суспензий, твердых форм, подходящих для растворения в или суспендирования в жидких носителях перед инъекцией. Препарат также может быть эмульгирован или инкапсулирован в липосомы или микрочастицы, такие как полилактид, поликликолид или cополимер, для достижения повышенного адъювантного эффекта, как обсуждается выше [Langer, Science 249: 1527, 1990 и Hanes, Advanced Drug Delivery Reviews 28: 97-119, 1997]. Композиции ифармакологические агенты, описанные в настоящем тексте, можно вводить в форме инъекционных депо или имплантирумых препаратов, которые могут быть выполнены с обеспечением возможности замедленного или импульсного высвобождения активного ингредиента.
[102] Дополнительные лекарственные формы, подходящие для других путей введения, включают лекарственные формы для перорального интраназального и легочного введения, суппозитории, трансдермальное применение и введение в глаза. Для суппозиториев связующие и носители включают, например, полиалкиленгликоли или триглицериды; такие суппозитории могут быть получены из смесей, содержащих активный ингредиент в диапазоне от приблизительно 0,5% до приблизительно 10%, предпочтительно от приблизительно 1% до приблизительно 2%. Формы для перорального введения включают вспомогательные вещества, такие как маннитол, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлозу и карбонат магния фармацевтического класса. Топическое применение может обеспечивать трансдермальную или внутрикожную доставку. Трансдермальную доставку можно осуществлять с использованием накожных пластырей или с использованием трансферосом. [Paul с соавт., Eur. J. Immunol. 25: 3521-24, 1995; Cevc с соавт., Biochem. Biophys. Acta 1368: 201-15, 1998].
[103] Для целей терапевтического перорального введения фармацевтические композиции можно объединять со вспомогательными веществами и применять в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток, жевательных резинок и т.п. Таблетки, пилюли, капсулы, лепешки и т.п. могут также содержать связующие, вспомогательные вещества, дезинтегранты, смазывающие вещества, скользящие вещества, подсластители и вкусоароматические вещества. Некоторые примеры связующих включают микрокристаллическую целлюлозу, трагакантовую камедь или желатин. Примеры вспомогательных веществ включают крахмал или лактозу. Некоторые примеры разрыхлителей включают альгиновую кислоту, кукурузный крахмал и т.п. Примеры смазывающих веществ включают стеарат магния или стеарат кальция. Примером скользящего вещества является коллоидный диоксид кремния. Некоторые примеры подсластителей включают сахарозу, сахарин и т. п. Примеры вкусоароматических веществ включают переччную мяту, метилсалицилат, апельсиновый ароматизатор и т. п. Материалы, применяемые в изготовлении этих различных композиций, должны иметь фармацевтическую степень чистоты и быть нетоксичными в применяемых количествах. В другом варианте реализации композицию вводят в форме таблетки или капсулы.
[104] Различные другие материалы могут присутствовать в качестве покрытий или для модификации физической формы дозированного препарата. Например, таблетки могут быть покрыты шеллаком, сахаром, или и тем, и другим одновременно. Сироп или эликсир могут содержать в дополнение в активному ингредиенту сахарозу в качестве подслащивающего средства, метил- и пропилпарабены в качестве консервантов, краситель и ароматизирующие вещества, такие как вишневый или апельсиновый ароматизатор. Для вагинального введения фармацевтические композиции может быть представлены в форме пессариев, тампонов, кремов, гелей, паст, пенок или спрея.
[105] Фармацевтическую композицию также можно вводить назальным путем. В настоящем тексте введение назальным путем или назальное введение включает введение композиции в слизистую оболочку носового хода или носовой полости пациента. В настоящем тексте фармацевтические композиции для назального введения композиции включают терапевтически эффективные количества соединений, приготовленные хорошо известными способами, для введения, например, в форме назального спрея, назальных капель, суспензии, геля, мази, крема или порошка. Введение композиции можно осуществлять с использованием носового тампона или носовой губки.
[106] Подходящие препараты для топического введения могут включать биосовместимое масло, воск, гель, порошок, полимер или другие жидкие или твердые носители. Такие препараты можно применять, нанося непосредственно на пораженные ткани, например, жидкий препарат для лечения ткани конъюнктивы можно вводить по каплям в глаз субъекта, а препарат в форме крема можно наносить на кожу.
[107] Ректальное введение включает введение фармацевтических композиций в прямую кишку или толстый кишечник. Это можно осуществить с применением суппозиториев или клизм. Препараты в форме суппозиториев можно легко изготовить с применением способов, известных в данной области. Например, лекарственная форма суппозиториев может быть получена путем нагревания глицерина до приблизительно 120 °C, растворения фармацевтической композиции в глицерине, перемешивания нагретого глицерина, после чего может быть добавлена очищенная вода, и заливки горячей смеси в форму для суппозиториев.
[108] Трансдермальное введение включает впитывание композиции через кожу. Трансдермальные лекарственные формы включают пластыри, мази, кремы, гели, бальзамы и т. п.
[109] Для целей настоящего изобретения подразумевается, что в дополнение к обычному значению введения лекарственных форм, описанных в настоящем тексте, в любую часть, ткань или орган, основной функцией которых является газообмен с окружающей средой, «пульмональный» («легочный», «в легкие») охватывает также ткани или полости, связанные с дыхательными путями, в частности, синусы. Для пульмонального введения предусмотрены аэрозольные лекарственные формы, содержащие активный агент, формы спрея с ручным насосом, небулайзеры или дозированные аэрозольные ингаляторы, а также сухой порошок. Подходящие лекарственные формы этого типа могут также включать другие агенты, такие как антистатические агенты, для сохранения эффективной аэрозольной формы раскрытых соединений.
[110] Устройство доставки лекарственного средства для доставки аэрозолей включает подходящий контейнер для аэрозоля с клапаном-дозатором, содержащий описанный фармацевтический препарат в форме аэрозоля и корпус с клапаном, удерживающий контейнер, обеспечивающий доставку лекарственного средства. Контейнер в устройстве для доставки лекарственного средства имеет свободное пространство, составляющее более приблизительно 15% общего объема контейнера. Часто соединение, предназначенное для пульмонального введения, растворяют, суспендируют или эмульгируют в смеси растворителя, поверхностно-активного соединения и пропеллента. Эта смесь находится в контейнере под давлением в контейнере, закрытым дозирующим клапаном.
[111] Настоящий документ также предусматривает лечение состояния, связанного с нарушением протеостазиса, у субъекта, включающее введение указанному субъекту эффективного количества раскрытого соединения, которое повышает, улучшает или восстанавливает протеостазис белка. Протеостазисом называется белковый гомеостазис. Дисфункция в белковом гомеостазисе представляет собой результат неправильного скручивания белка, образования агрегатов белка, неправильный транспорт белка или разрушение белка. Например, в настоящем описании рассматривается введение описанного соединения, например, Формулы (Ia), (IIa), (Ib), (IIb), (III), или (IV), которое корректирует неправильное скручивание белка, снижает образование агрегатов белка, корректирует или восстанавливает транспорт белка и/или влияет на процесс разрушения белка для лечения состояния, связанного с нарушением протеостазиса. В некоторых аспектах, вводят раскрытое соединение, например, Формулы (Ia), (IIa), (Ib), (IIb), (III), или (IV), которое корректирует неправильное скручивание белка и/или корректирует или восстанавливает транспорт белка. При муковисцидозе мутантным или дефектным ферментом является регулятор трансмембранной проводимости при муковисцидозе (CFTR). Одной из наиболее распространенных мутаций этого белка является ΔF508, которая представляет собой делецию (Δ) трех нуклеозидов, приводящую к потере аминокислоты фенилаланина (F) в 508-м положении (508) белка. Как описано выше, мутантный регулятор трансмембранной проводимости при муковисцидозе существует в неправильно свернутом состоянии и характеризуется измененным транспортом по сравнению с CFTR дикого типа. Дополнительными примерами белков, у которых может быть нарушен протеостазис, например, которые могут находиться в неправильно свернутом состоянии, включают следующие: гликоцереброзидаза, гексозамин A, аспартилглюкозаминидаза, α-галактозидаза A, транспортный белок цистеина, кислая церемидаза, кислая α-L-фукозидаза, защитный белок, катепсин A, кислая β-гликозидаза, кислая β-галактозидаза, идуронат-2-сульфатаза, α-L-идуронидаза, галактоцереброзадаза, кислая α-маннозидаза, кислая β-маннозидаза, арилсульфатаза B, арилсульфатаза A, N-ацетилгалактозамин-6-сульфат сульфатаза, кислая β-галактозидаза, N-ацетилглюкозамин-1-фосфотрансфераза, кислая сфингмиелиназа, NPC-1, кислая α-глюкозидаза, β-гексозамин B, гепарин N-сульфатаза, α-N-ацетилглюкозаминидаза, α -глюкозаминид N-ацетилтрансфераза, N-ацетилглюкозамин-6-сульфатсульфатаза, α-N-ацетилгалактозаминидаза, α-нейрамидаза, β-глюкуронидаза, β-гексозамин A и кислая липаза, полиглутамин, α-синуклеин, TDP-43, супероксиддисмутаза (SOD), пептид Aβ, тау белок, транстиретини инсулин, но не ограничиваются ими. Соединения формулы (Ia), (IIa), (Ib), (IIb), (III), или (IV) могут быть использованы для восстановления протеостазиса (например, для правильного скручивания и/или изменения транспорта) белков, описанных выше.
[112] Заболевания, связанные с конформацией белков, включают нарушения, связанные с усилением функции, и нарушения, связанные с утратой функции. В одном варианте реализации заболевание, связанное с конформацией белка, представляет собой нарушение, связанное с усилением функции. Термин «нарушение, связанное с усилением функции», «заболевание, связанное с усилением функции», «нарушение, связанное с усилением токсичной функции» и «заболевание, связанное с усилением токсичной функции» используются в настоящем описании взаимозаменяемо. Нарушение, связанное с усилением функции представляет собой заболевание, характеризующееся повышенной токсичностью белков, ассоциированной с агрегацией. В этих заболеваниях, накопление внутри и/или снаружи клетки превосходит клиренс. Заболевания, связанные с усилением функции, включают следующие: нейродегенеративные заболевания, ассоциированные с образованием агрегатов полиглутамина, заболевания, связанные с тельцами Леви, боковой амиотрофический склероз, заболевания, ассоциированные с образованием агрегатов, обусловленных транстиретином, Болезнь Альцгеймера, болезнь Мачадо-Джозефа, церебральную B-амилоидную ангиопатию, дегенерацию ганглиозных клеток сетчатки, таупатии (прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация, дегенерация лобной и височной долей), внутримозговое кровоизлияние с амилоидозом, болезнь Александера, серпинопатии, семейную амилоидную нейропатию, старческие системные амилоидозы, амилоидоз ApoAI, амилоидоз ApoAII, амилоидоз ApoAIV, семейные амилоидозы финского типа, амилоидоз, связанный с активностью лизоцима, диализный амилоидоз, миозит/миопатия с тельцами включений, катаракта, карцинома мозгового вещества щитовидной железы, предсердный амилоидоз сердца, пролактинома гипофиза, наследственная решетчатая дистрофия роговицы, амилоидоз кожи на фоне лишая, амилоидоз роговицы, связанный с активностью лактоферрина, альвеолярный протеиноз легких, одонтогенная амилоидная опухоль, амилоидоз семенных пузырьков, серповидноклеточная анемия, миопатия критических состояний, болезнь фон Гиппеля - Линдау, спиноцеребреллярная атаксия 1, синдром Ангельмана, нейропатии гигантского аксона, миопатия с тельцами включения и болезнь Педжета костей, лобно-височная деменция (IBMPFD) и прионные болезни, но не ограничиваются ими. Нейродегенеративные заболевания, связанные с агрегацией полиглютамина, включают следующие: болезнь Хантингтона, дентато-рубро-паллидо-льюисову атрофию, некоторые формы спино-церебреллярной атаксии и спинально-бульбарную мышечную атрофию. Болезнь Альцгеймера характеризуется образованием двух типов агрегатов: внеклеточных агрегатов Aβ-пептида и внутриклеточных агрегатов ассоциированного с микротрубочками белка тау, но не ограничиваются ими. Ассоциированные с транстиретином болезни накопления включают, например, старческие системные амилоидозы и семейную амилоидную нейропатию. Заболевания с тельцами Леви характеризуются агрегацией белка α-синуклеина и включают, например, болезнь Паркинсона, деменцию с тельцами Леви (LBD) и множественную системную атрофию (SMA, МСА). Прионные болезни (также известные как трансмиссивные губчатые энцефалопатии или TSE(ТГЭ)) характеризуются агрегацией прионных белков. Примеры прионных заболеваний человека включают болезнь Крейтцфельда-Якоба (БКЯ, CJD), варианты болезни Крейтцфельда-Якоба, синдром Герстманна-Штраусслера-Шейнкера, фатальную семейную бессонницу и Куру. В другом варианте реализации неправильно скручивающимся белком является альфа-1 антитрипсин.
[113] В другом варианте реализации болезнь, связанная с конформацией белков, представляет собой нарушение, связанное с потерей функции. Термины «заболевание, связанное с потерей функции» и «нарушение, связанное с потерей функции» в настоящем тексте используются взаимозаменяемо. Заболевания, связанные с потерей функции, представляют собой группу заболеваний, характеризующихся неэффективным скручиванием белка, приводящим к избыточному разрушению белка. Заболевания, связанные с потерей функции, включают, например, лизосомные болезни накопления. Лизосомные болезни накопления представляют собой группу заболеваний, характеризующихся дефицитом какого-либо конкретного лизосомного фермента, который может возникать в различных тканях и приводить к накоплению молекул, в норме разрушаемых дефицитным ферментом. Дефицит лизосомного фермента может затрагивать гидролазу лизосом или какой-либо белок, участвующий в лизосомном транспорте. Лизосомные болезни накопления включают следующие, но не ограничиваются ими: аспартилглюкозаминурия, болезнь Фабри, болезнь Баттена, цистиноз, Фарбера, фукозидоз, галактозидосиалидоз, болезнь Гоше (включая типы 1, 2 и 3), ганглиозидоз Гоше подтип М1 (Gm1), болезнь Хантера, болезь Гурлер-Шейе, болезнь Краббе, α- -маннозидоз, β- -маннозидоз, болезнь Марото-Лами, метахроматическая лейкодистрофия, синдром Моркио типа A, синдром Моркио типа B, муколипидоз II, муколипидоз III, болезнь Нимана-Пика (включая типы A, B и C), болезнь Помпе, болезнь Сендхоффа, синдром Санфилиппо (включая типы A, B, C и D), болезнь Шиндлера, болезнь Шиндлера-Канзаки, сиалидоз, синдром Слая, болезнь Тея-Сакса и болезнь Вольмана.
[114] В другом варианте реализации заболевание, связанное с нарушением протеостазиса, представляет собой сердечно-сосудистое заболевание. Сердечно-сосудистые заболевания включают следующие, но не ограничиваются ими: ишемическая болезнь сердца, инфаркт миокарда, инсульт, рестеноз и атеросклероз. Состояния, связанные с нарушением протеостазиса, также включают ишемические состояния, такие как ишемически-реперфузионное повреждение, ишемия миокарда, стабильная стенокардия, нестабильная стенокардия, инсульт, ишемическая болезнь сердца и церебральная ишемия.
[115] В еще одном варианте реализации предусмотрено лечение заболевания, связанного с нарушением протеостазиса, которое представляет собой диабет и/или осложнения диабета, включая перечисленные, но не ограничиваясь ими: диабетическая ретинопатия, кардиомиопатия, нейропатия, нефропатия и нарушение заживления ран.
[116] В другом варианте реализации предусмотрено лечение заболевания, связанного с нарушением протеостазиса, которое представляет собой глазное заболевание, включая перечисленные, но не ограничиваясь ими: возрастную дегенерацию желтого пятна (AMD), диабетический макулярный отек (DME), диабетическую ретинопатию, глаукому, катаракту, пигментный ретинит (RP, ПР) и сухую дегенерацию желтого пятна.
[117] В других дополнительных вариантах реализации раскрытый способ направлен на лечения заболевания, связанного с нарушением протеостазиса, причем указанное заболевание, поражающее дыхательную систему или поджелудочную железу. В некоторых дополнительных вариантах реализации предусмотренный способ включает лечение состояния, выбранного из группы, состоящей из полиэндокринопатии/гиперинсулинемии, сахарного диабета, синдрома Шарко-Мари-тута, болезни Пелицеуса-Мерцбахера и синдрома Горхема.
[118] Дополнительные состояния, связанные с нарушением протеостазиса, включают гемоглобинопатии, воспалительные заболевания, болезни промежуточных филаментов, вызванные лекарствами нарушения и потеря слуха. Например, в настоящем документе предусмотрены способы для лечения гемоглобинопатий (таких как серповидноклеточноя анемия), воспалительных заболеваний (таких как воспалительное заболевание кишечника, колит, анкилозирующий спондилит), болезней промежуточных филаментов (таких как неалкогольный и алкогольный стеатоз печени) и вызванное лекарствами поражение легких (таких как вызванное метотрексатом повреждение легких). В другом варианте реализации предложены способы лечения потери слуха, такой как шумовая потеря шума, индуцированная аминогликозидами потеря слуха и индуцированная цисплатином потеря слуха, включающие введение раскрытого соединения.
[119] Дополнительные состояния включают состояния, связанные с нарушением транспорта белков, которые можно лечить в соответствии с раскрытыми способами, включают: мутации P-гликопротеина (PGP), изменения транспорта hERG, ассоциированные с нефрогенным несахарным диабетом мутации аргинин-вазопрессинового рецептора 2, связанные с персистирующей гиперинсулинемической гипогликемии новорожденных (PHH1) мутации рецептора сульфонилмочевины 1 и α1AT.
[120] Настоящее изобретение проиллюстрировано следующими примерами, которые никоим образом не ограничивают изобретение.
ПРИМЕРЫ
[121] Описанные в настоящем документе соединения можно получать различными способами, основанными на содержащихся здесь концепциях и процедурах синтеза, известных в данной области. Следует понимать, что все условия реакции, приведенные в описании способов синтеза ниже, включая выбор растворителя, атмосферу, в которой проходит реакция, продолжительность экспериментальных процедур и процедур обработки, могут быть выбраны из стандартных условий для этих реакций, если не указано обратное. Для специалиста в области органического синтеза понятно, что функциональные группы, присутствующие в различных частях молекулы, должны быть совместимы с реагентами и предложенными реакциями. Заместители, не совместимые с условиями реакции, будут очевидны для специалиста в данной области, и, соответственно, указаны альтернативные способы. Исходные материалы для примеров либо доступны для приобретения, либо могут быть легко получены стандартными способами из известных материалов. По меньшей мере некоторые из соединений, идентифицированных в настоящем документе как «промежуточные соединения» рассматриваются как соединения согласно настоящему изобретению.
[122] Получение трет-бутил-(транс-3-азидоциклобутил)-карбамата
[123] Этап 1: 3-Амино-циклобутен-1-он: SOCl2 (15,6 г, 131,46 ммоль) добавляли по каплям к охлажденному льдом раствору 3-оксоциклобутанкарбоновой кислоты (5,0 г, 43,82 ммоль) в сухом ДХМ (30 мл) и нагревали реакционную смесь с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и удаляли летучие вещества при пониженном давлении, в результате чего получали неочищенное соединение, которое подвергали азеотропной дистилляции с толуолом (20 мл x 2) для удаления следов кислоты. Неочищенное соединение растворяли в сухом ацетоне (15 мл) и добавляли к полученному раствору раствор NaN3 (5,69 г, 87,64 ммоль) в воде (20 мл) при 0°C в течение 30 мин. Реакционную смесь перемешивали в течение 1 ч при 0°C и добавляли к реакционной смеси колотый лед. Водную фазу экстрагировали эфиром (3×50 мл), сушили над сульфатом натрия и концентрировали до ~1/4 объема. Затем реакционную смесь добавляли в толуол (70 мл) и нагревали до 90°C до прекращения выделения N2 (~30 мин). К полученной реакционной смеси добавляли 20% HCl (50 мл) при 0°C и аккуратно нагревали реакционную смесь до 90°C в течение 16 ч. Органический слой отделяли и промывали водой (50 мл). Водный слой концентрировали под вакуумом, в результате чего получали продукт (5 г, неочищенного) в виде коричневого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 8,75 (br, 3H), 3,92-3,86 (m, с помехами, вызванными сигналом растворителя, 2H), 3,38-3,31 (m, 3H).
[124] Этап 2: трет-бутил (3-оксоциклобутил) карбамат: триэтаноламин (29,72 г, 293,73 ммоль) добавляли по каплям к раствору 3-аминоциклобутен-1-она (5,0 г, 58,74 ммоль) и Boc2O (25,64 г, 117,49 ммоль) в ДМФА (80 мл) и перемешивали реакционную смесь при комнатной температуре в течение 2 ч. После полного поглощения исходного материала, определенного тонкослойной хроматографией, реакционную смесь разбавляли водой (100 мл) и экстрагировали диэтиловым эфиром (6×70 мл). Объединенный органический слой промывали солевым раствором (2×100 мл) и сушили на Na2SO4. Растворитель удаляли при пониженном давлении, в результате чего получали неочищенное соединение, которое очищали хроматографией на колонке с силикагелем (100-200) с использованием 30% этилацетата в н-гексане, в результате чего получали продукт (5,3 г, 65% после двух этапов) в виде беловатого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,91 (br, 1H), 4,25 (br, 1H), 3,41-3,34 (m, 2H), 3,07-3,00 (m, 2H), 1,44 (s, 9H).
[125] Этап 3: трет-бутил-цис-3-гидроксициклобутил)карбамат: раствор L-селектрида (1M раствор в ТГФ) (8,053 мл, 8,05 ммоль) добавляли по каплям в течение периода продолжительностью 20 мин к раствору трет-бутил-(3-оксоциклобутил)карбамата (1,0 г, 5,40 ммоль) в ТГФ (25 мл) в атмосфере N2 при -78°C и перемешивали реакционную смесь в течение 1ч при -78 oC. К полученной реакционной смеси добавляли раствор NaOH (3,25 г) в воде (4 мл) в течение периода продолжительностью 10 мин, затем 30% водный раствор H2O2 (3 мл) в течение периода продолжительностью 20 мин. Реакционной смеси давали нагреться до комнатной температуры и разбавляли этилацетатом (100 мл). Отделяли органический слой и промывали 10% водным раствором Na2SO3 (40 мл), а затем солевым раствором (40 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении, в результате чего получали неочищенное соединение, которое дополнительно очищали хроматографией на колонке с нейтральным оксидом алюминия с использованием 50% этилацетат в н-гексане в качестве элюента, в результате чего получали целевое соединение. Соединение промывали н-гексаном, в результате чего получали продукт (0,750 г, 74%) в виде белого твердого вещества. Температура плавления 119°C (известное из литературы значение - 117 oC); 1H-ЯМР (400 МГц, CDCl3) δ 4,63 (br, 1H), 4,03-3,96 (m, 1H), 3,66-3,64 (m, 1H), 2,76-2,72 (m, 2H), 1,91 (br, 1H), 1,79-1,76 (m, 2H), 1,42 (s, 9H).
[126] Этап 4: цис-3-((трет-бутоксикарбонил)амино)циклобутилметансульфонат: триэтиламин (1,0 г, 9,93 ммоль) добавляли к холодному (-10°C ) раствору трет-бутил(цис-3-гидроксициклобутил)карбамата (0,62 г, 3,31 ммоль) в ДХМ (30 мл), после чего по каплям добавляли метансульфонилхлорид (0,45 г, 3,97 ммоль) и перемешивали реакционную смесь при -10°C в течение 2 ч. Реакционную смесь разбавляли дихлорметаном (100 мл) и промывали водой (5 мл), а затем разбавленной лимонной кислотой (30 мл) и солевым раствором (30 мл). Органический слой сушили на Na2SO4, концентрировали при пониженном давлении, в результате чего получали продукт (0,800 г, неочищенного) в виде белого твердого вещества, которое использовали как есть на следующем этапе без дальнейшей очистки. 1H-ЯМР (400 МГц, CDCl3) δ 4,73-4,66 (m, 2H), 3,85-3,80 (m, 1H), 2,98 (s, 3H), 2,93-2,86 (m, 2H), 2,20-2,13 (m, 2H), 1,42 (s, 9H).
[127] Этап 5: трет-бутил (транс-3-азидоциклобутил)карбамат: NaN3 (0,49 г, 7,54 ммоль) добавляли к раствору цис-3-((трет-бутоксикарбонил)амино)циклобутилметансульфоната (0,8 г, 3,01 ммоль) в сухом ДМФА (20 мл) и нагревали смесь при 85°C в течение 16 ч. Реакционную смесь разбавляли водой (40 мл) и экстрагировали водную фазу этилацетатом (50 мл x 3). Объединенный органический слой промывали солевым раствором (50 мл x 4) и сушили на Na2SO4. Растворитель удаляли при пониженном давлении, в результате чего получали неочищенный продукт (0,73 г) в виде беловатого твердого вещества.
Получение трет-бутил (цис-3-азидоциклобутил) карбамат
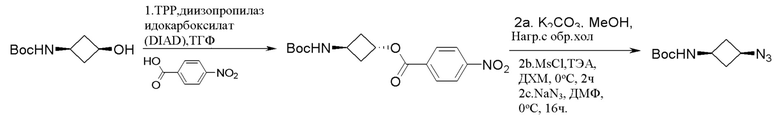
[128] Этап 1: Транс-3-((трет-бутоксикарбонил)амино)циклобутил-4-нитробензоат: К охлажденному льдом раствору трет-бутил-(цис-3-гидроксициклобутил)карбамата (1,5 г, 80,11 ммоль) и 4-нитробензойной кислоты (1,47 г, 88,12 ммоль) в сухом ТГФ (60 мл) добавляли трифенилфосфин (3,15 г, 12,01 ммоль), после чего по каплям добавляли диизопропилазидокарбоксилат (DIAD) (8,09 г, 40,05 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 2 дней. Растворитель удаляли при пониженном давлении, в результате чего получали неочищенное соединение, которое очищали колоночной хроматографией на силикагеле (100-200 меш). Элюирование 50% этилацетатом в н-гексане с последующей промывкой диэтиловым эфиром (4 мл x 2) давало продукт (2,3 г, 85%) в форме белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 8,29-8,27 (q, 2H, J=8,92 Гц), 8,21-8,19 (q, 2H, J=8,92 Гц), 5,37-5,32 (m, 1H), 4,77 (br, 1H), 4,41-4,38 (m, 1H), 2,64-2,58 (m, 2H), 2,47-2,40 (m, 2H), 1,44 (s, 9H); ЖХ-МС (электроспрей, M/Z): [M+H]+=336,8.
[129] Этап 2a: Транс-трет-бутил-3-гидроксициклобутил карбамат: Транс-3-((трет-бутоксикарбонил) амино) циклобутил-4-нитробензоат добавляли (2,3 г, 68,38 ммоль) к суспензии K2CO3 (1,41 г, 10,25 ммоль) в MeOH (50 мл) и воде (10 мл) и нагревали реакционную смесь с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали и фильтровали через слой целита. Фильтрат концентрировали при пониженном давлении, в результате чего получали неочищенный продукт (4,2 г, неочищенного) в виде беловатого твердого вещества, которое использовали как есть без дальнейшей очистки.
[130] Этап 2b: Транс-3-((трет-бутоксикарбонил)амино)циклобутилметансульфонат: триэтиламин (6,8 г, 67,29 ммоль) добавляли к суспензии транс-трет-бутил-3-гидроксициклобутилкарбамата (4,2 г, 22,43 ммоль) в ДХМ (100 мл), после чего по каплям добавляли метансульфонилхлорид (3,08 г, 26,91 ммоль) при -10°C и перемешивали реакционную смесь при -10°C в течение 2 ч. Реакционную смесь разбавляли дихлорметаном (100 мл) и промывали водой (50 мл), а затем солевым раствором (30 мл). Органический слой сушили на сульфате натрия и концентрировали при пониженном давлении, в результате чего получали неочищенный продукт (3,4 г, неочищенного) в виде желтого твердого вещества, которое использовали как есть на следующем этапе без очистки.
[131] Этап 2c: цис-трет-бутил (3-азидоциклобутил)карбамат: азид натрия (2,08 г, 32,035 ммоль) добавляли к раствору транс-3-((трет-бутоксикарбонил)амино)циклобутилметансульфоната (3,4 г, 12,81 ммоль) в сухом ДМФА (20 мл) при комнатной температуре и нагревали реакционную смесь при 85°C в течение 16ч. Неочищенную реакционную смесь разбавляли водой (50 мл) и экстрагировали водную фазу этилацетатом (50 мл x 3). Объединенный органический слой промывали солевым раствором (50 мл x 4) и сушили на Na2SO4. Растворитель удаляли при пониженном давлении, в результате чего получали неочищенное соединение, которое очищали хроматографией на колонке с нейтральным оксидом алюминия с использованием 10% MeOH в ДХМ в качестве элюента, в результате чего получали продукт (1,0 г, 68% после двух этапов) в форме белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,66 (br, 1H), 3,86-3,84 (m, 1H), 3,57-3,53 (m, 1H), 2,76-2,69 (m, 2H), 1,92-1,85 (m, 2H), 1,42 (s, 9H).
Получение Транс-3-(3-фенилизоксазол-5-карбоксамидо)циклобутан-1-карбоновая кислота
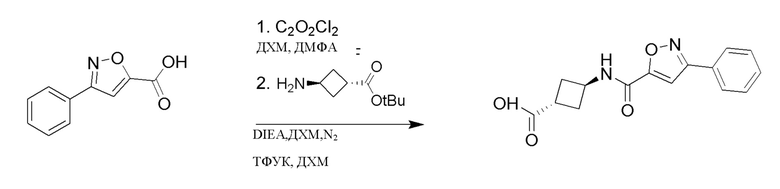
[132] Этап 1: 3-фенилизоксазол-5-карбонил хлорид: ДМФА (0,5 мл) добавляли к раствору 3-фенилизоксазол-5-карбоновой кислоты (10 г, 52,86 ммоль, 1,00 экв.) и оксалилхлорида (8,74 г, 68,86 ммоль, 1,30 экв.) в дихлорметане (200 мл) и перемешивали раствор в течение 1 ч при 0 °C. Полученную смесь концентрировали под вакуумом, в результате чего получали 11,265 г (неочищенного) 3-фенилизоксазол-5-карбонилхлорида в виде желтого твердого вещества.
[133] Этап 2: трет-бутил-3-транс-(3-фенилизоксазол-5-амидо)циклобутан-1-карбоксилат: раствор 3-фенилизоксазол-5-карбонилхлорида (8,21 г, 39,54 ммоль, 1,50 экв.) в дихлорметане (60 мл) добавляли по каплям к раствору трет-бутил-3-транс-аминоциклобутан-1-карбоксилата (4,5 г, 26,28 ммоль, 1,00 экв.) и DIEA (диизопропиленамин) (6,79 г, 52,54 ммоль, 2,00 экв.) в дихлорметане (30 мл) в атмосфере N2. Полученный раствор перемешивали в течение 2 ч при 0 °C, а затем гасили с использованием 100 мл 5% водного раствора K2CO3. Полученный раствор экстрагировали дихлорметаном, органические слои объединяли, сушили и концентрировали под вакуумом, в результате чего получали 9,7 г (неочищенного) трет-бутил-3-(3-фенилизоксазол-5-амидо)циклобутан-1-карбоксилата в форме светло-желтого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=343,1.
[134] Этап 3: -3-транс-(3-фенилизоксазол-5-амидо)циклобутан-1-карбоновая кислота: раствор трет-бутил-3-транс-(3-фенилизоксазол-5-амидо)циклобутан-1-карбоксилата (9,7 г, 28,33 ммоль, 1,00 экв.) и трифторуксусной кислоты (30 мл) в дихлорметане (100 мл) перемешивали в течение 6 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом, растворяли в 20 мл толуола и собирали твердые вещества фильтрацией, в результате чего получали 5,116 г (63%) 3-транс-(3-фенилизоксазол-5-амидо)циклобутан-1-карбоновой кислоты в форме светло-желтого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=287,0.
Получение (R)-2-метоксипропангидразид
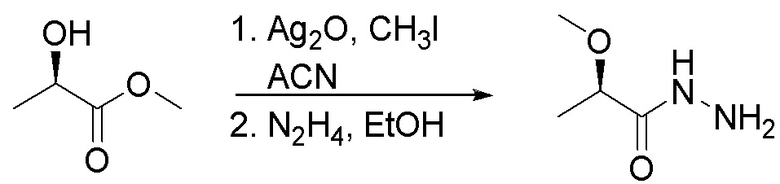
[135] Этап 1: метил (2R)-2-метоксипропаноат: Ag2O (6,1 г, 26,4 ммоль, 1,10 экв.) добавляли к раствору йодометана (27,3 г, 192 ммоль, 8,00 экв.) и метил-(2R)-2-гидроксипропаноата (2,5 г, 24 ммоль, 1,00 экв.) в ацетонитриле (30 мл) и перемешивали раствор в течение 16 ч при 85°C в масляной ванне. Твердые вещества фильтровали и разбавляли смесь дихлорметаном (100 мл). Полученную смесь промывали водой (3×50 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали2 г (70%) метил-(2R)-2-метоксипропаноат в виде бесцветного масла. 1H-ЯМР (400 МГц, CDCl3): δ 3,92-3,87 (m, 1H), 3,76 (s, 3H), 3,40 (s, 3H), 1,42-1,40 (d, J=6,8 Гц, 3H).
[136] Этап 2: (2R)-2-метоксипропангидразид: раствор метил-(2R)-2-метоксипропаноата (2 г, 16,93 ммоль, 1,00 экв.) и гидразина гидрата (5,3 г, 84,70 ммоль, 5,00 экв.) в этаноле (50 мл) перемешивали в течение 16 ч при 70°C в масляной ванне. Полученную смесь концентрировали под вакуумом, в результате чего получали 2 г (неочищенного) (2R)-2-метоксипропангидразида в виде светло-желтого масла. ЖХ-МС (электроспрей, m/z): [M+1]+=119.

[137] Общая процедура (1) для реакции сочетания амидов: N-(3-диметиламинопропил)-N′-этилкарбодиимид гидрохлорид (1,98 ммоль), HOBt.H2O (1,32 ммоль) и соответствующий амин (1,45 ммоль) добавляли к раствору 3-фенилизоксазол-5-карбоновой кислоты (1,32 ммоль) в ТГФ (10 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 15 ч при комнатной температуре и концентрировали реакционную смесь досуха. Неочищенное твердое вещество экстрагировали этилацетатом (3×10 мл) и промывали водой. Объединенные органические слои сушили на Na2SO4 и концентрировали. Неочищенное соединение очищали комбифлэш-хроматографией, в результате чего получали соответствующий амид.
Пример 1: N-(2-метоксиэтил)-3-фенилизоксазол-5-карбоксамид:
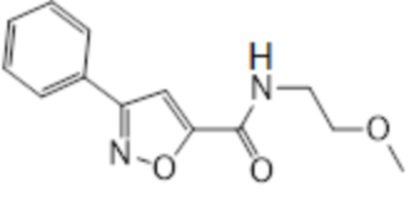
[138] Соединение 1 получали в виде беловатого твердого вещества с использованием общей процедуры 1 (0,120 г, 37,0%); 1H-ЯМР (400 МГц, CDCl3) δ 7,82-7,79 (m, 2H), 7,50-7,45 (m, 3H), 7,21 (s, 1H), 6,98-6,97 (br, 1H), 3,68-3,64 (m, 2H), 3,57-3,55 (t, 2H), 3,40 (s, 3H); ЖХ-МС (электроспрей, m/z): [M+H]+=247,2; чистота, определенная методом ВЭЖХ: 99,76% при 220 нм и 99,64% при 254 нм.
Пример 2: 3-фенил-N-((тетрагидрофуран-2-ил)метил)изоксазол-5-карбоксамид:
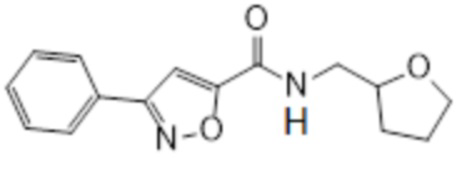
[139] Соединение 2 получали в форме белого твердого вещества с использованием общей процедуры 1 (0,110 г, 30,6%); 1H-ЯМР (400 МГц, CDCl3) δ 7,82-7,80 (m, 2H), 7,49-7,45 (m, 3H), 7,25-7,21 (d, J=14,9Гц, 1H), 6,95 (br, 1H), 4,08-4,06 (m, 1H), 3,92-3,89 (m, 1H), 3,81-3,71 (m, 2H), 3,44-3,39 (m, 1H), 2,06-1,99 (m, 1H), 1,96-1,91 (m, 2H), 1,63-1,58 (m, 1H); ЖХ-МС (электроспрей, m/z): [M+H]+=273,2; чистота, определенная методом ВЭЖХ: 99,78% при 220 нм и 99,79% при 254 нм.
Пример 3: N-(2-морфолиноэтил)-3-фенилизоксазол-5-карбоксамид
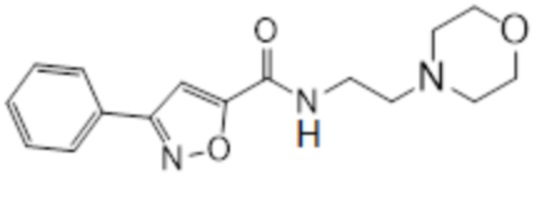
[140] Соединение 3 получали в форме белого твердого вещества с использованием общей процедуры 1 (0,125 г, 31,5%); 1H-ЯМР (400 МГц, CDCl3) δ 7,82-7,80 (m, 2H), 7,49-7,46 (m, 3H), 7,21 (s, 2H), 3,75-3,72 (t, 4H), 3,58-3,53 (q, 2H), 2,61-2,58 (t, 2H), 2,51-2,50 (m, 4H); ЖХ-МС (электроспрей, m/z): [M+H]+=302,1; чистота, определенная методом ВЭЖХ: 99,81% при 220 нм и 99,87% при 254 нм.
Пример 4: N-(3-(1H-имидазол-1-ил)пропил)-3-фенилизоксазол-5-карбоксамид

[141] Соединение 4 получали в форме белого твердого вещества с использованием общей процедуры 1 (0,127 г, 32,6%); 1H-ЯМР (400 МГц, CDCl3) δ 7,82-7,79 (m, 2H), 7,52 (s, 1H), 7,50-7,46 (m, 3H), 7,22 (s, 1H),7,08 (s, 1H), 6,98-6,97 (m, 1H), 6,79-6,76 (m, 1H), 4,08-4,04 (t, 2H), 3,52-3,47 (m, 2H), 2,18-2,11 (m, 2H); ЖХ-МС (электроспрей, m/z): [M+H]+=297,2; чистота, определенная методом ВЭЖХ: 98,05% при 220 нм и 97,78% при 254 нм.
Пример 5: N-транс-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид

[142] Этап 1: трет-бутил (3-оксоциклобутил)карбамат: DPPA (дифенилфосфорилазид) (4,0 г, 1,1 экв.) добавляли по каплям к холодному (-5~5 °C) раствору 3-оксоциклобутанкарбоновой кислоты (1,5 г, 1,0 экв.) и триэтаноламина (1,5 г, 1,1 экв.) в толуоле (30 мл) и перемешивали смесь при -5~0 °C в течение 16 ч. Реакционную смесь промывали NaHCO3 (2×9 мл), водой (1×9 мл) и NaCl вод. (1×4,5 мл) при 0~10 °C. Объединенный органический слой сушили на Na2SO4, фильтровали и добавляли к фильтрату трет-BuOH (7,5 мл). Реакционную смесь нагревали при 90~100 °C в течение 16 ч. Эту смесь концентрировали под вакуумом при 60~70 °C, суспендировали в TMBE (4,5 мл), фильтровали, и сушили твердое вещество на воздухе, в результате чего получали 1,15 г (чистота: 98,5%, Выход: 47,2%) продукта в форме белого твердого вещества.
[143] Этап 2: трет-бутил (цис-3-гидроксициклобутил)карбамат: раствор трет-бутил (3-оксоциклобутил)карбамата (200 мг, 1,0 экв.) в ТГФ (1 мл) добавляли по каплям к холодному (ниже -70 °C) раствору NaBH4 (20,4 мг, 0,5 экв.) в ТГФ (1,8 мл) и воде (2 мл), поддерживая температуру на уровне -80~-70 °C (около в течение 2 ч до завершения добавления). Эту смесь перемешивали при -60~-50 °C в течение 3 ч, к реакционной смеси добавляли воду (2 мл) и давали нагреться до 15 °C. Реакционную смесь затем экстрагировали этилацетатом (2 мл, 2×1 мл) и промывали объединенные органические слои солевым раствором (1 мл). Органический слой концентрировали под вакуумом при 35~40 °C, растворяли твердое вещество в толуоле (1 мл, 80~90 °C) и постепенно охлаждали до 25-30 °C в течение 2,5 ч. Эту смесь перемешивали в течение 2 ч при 25-30 °C, фильтровали, и сушили твердое вещество на воздухе, в результате чего получали продукт (177 мг с отношением цис:транс (96,4:3,6), выход: 87,6%) в виде беловатого твердого вещества.
[144] Этап 3: трет-бутил-(транс-3-азидоциклобутил)карбамат: раствор PPh3 (315 мг) и диизопропилазидокарбоксилата (DIAD) (243 мг) в ТГФ (3 мл) перемешивали в течение 20 мин при 0-10 °C. Добавляли по каплям раствор трет-бутил-(цис-3-гидроксициклобутил)карбамата (150 мг, 1,0 экв.) и DPPA (дифенилфосфорилазид) (265 мг, 1,2 экв.) в ТГФ (1 мл) и после этого нагревали смесь до 25-30 °C и перемешивали в течение 2 ч. Добавляли к реакционной смеси солевой раствор (3 мл), экстрагировали этилацетатом (3 мл), а затем концентрировали под вакуумом, в результате чего получали неочищенное масло. Эту смесь очищали хроматографией на колонке сSiO2 и элюировали градиентом этилацетат/петролейный эфир (0%~10%). Продукт суспендировали в н-гептане (0,3 мл) и перемешивали в течение 0,5 ч при 20~25 °C. Эту смесь фильтровали и сушили твердое вещество на воздухе, в результате чего получали продукт с 85% выходом и отношением цис/транс=4:96, определенным методом 1H-ЯМР.
[145] Этап 4: трет-бутил-(транс-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)карбамат: раствор трет-бутил-(транс-3-азидоциклобутил)карбамата (246 мг, 1,0 экв.) и проп-2-ин-1-ола (326 мг, 5,0 экв.) в ДМФА (1,2 мл) нагревали при 90~ 95 °C в течение 20 ч. Эту смесь концентрировали под вакуумом при 65 °C, в результате чего получали a смесь региоизомеров 4 и 5 в соотношении ~1:1 (353 мг). Эту смесь очищали сверхкритической жидкостной хроматографией (SFC), в результате чего получали трет-бутил (транс-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)карбамат (101 мг 32% выход, чистота: 99,9% (205 нм)) в форме твердого вещества.
[146] Этап 5: (1-(транс-3-аминоциклобутил)-1H-1,2,3-триазол-5-ил)метанол гидрохлорид: трет-бутил-(транс-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)карбамат (101 мг, 1,0 экв.) медленно добавляли (5 порциями) к раствору HCl/диоксан (3,5 моль/л, 2 мл) при 20~30 °C, а затем перемешивали в течение 18 ч при 20~30 °C. Реакционную смесь концентрировали под вакуумом при 55 °C, в результате чего получали продукт (93,4 мг, аналитич. 67% в пересчете на свободное основание, Y: 100%) в форме твердого вещества.
[147] Этап 6: N-(транс-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид: DIPEA (388 мг, 3,00 ммоль, 3,00 экв.) добавляли по каплям к имеющему температуру 0°C раствору литий-3-фенилизоксазол-5-карбоксилата (190 мг, 0,97 ммоль, 1,00 экв.), [1-[транс-3-аминоциклобутил]-1H-1,2,3-триазол-5-ил]метанола гидрохлорида (204 мг, 1,00 ммоль, 1,00 экв.) и HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (684 мг, 1,80 ммоль, 1,80 экв.) в ДМФА (5 мл). Полученный раствор перемешивали в течение 1 ч при комнатной температуре, а затем разбавляли 50 мл смеси воды/лед. Полученный раствор экстрагировали этилацетатом (3×50 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×30 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ со следующими условиями (IntelFlash-1): Колонке, C18; подвижная фаза, H2O/CH3CN=100:1 с повышением до H2O/CH3CN=1:100 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 100 мг (30%) 3-фенил-N-[транс-3-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=340; 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,54-9,52 (d, J=7,2 Гц, 1H), 7,96-7,94 (m, 2H), 7,69-7,63 (m, 2H), 7,56-7,54 (m, 3H), 5,45-5,42 (t, J=5,6 Гц, 1H), 5,27-5,20 (m, 1H), 4,80-4,71 (m, 1H), 4,56-4,55 (d, J=5,6 Гц, 2H), 2,93-2,87 (m, 2H), 2,81-2,75 (m, 2H).
[148] Пример 6: N-транс-3-(5-((R)-1-гидроксиэтил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
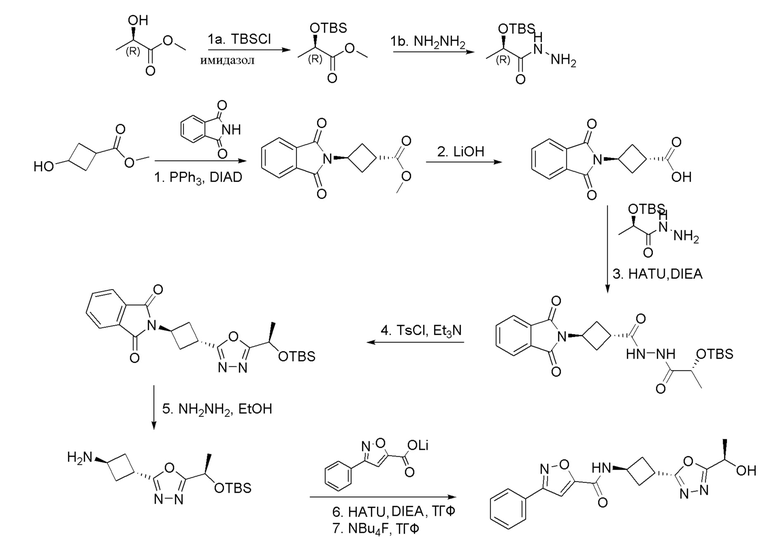
[149] Этап 1a: метил-(2R)-2-[(трет-бутилдиметилсилил)окси]пропаноат: В круглодонную колбу объемом 250 мл помещали раствор метил-(2R)-2-гидроксипропаноата (5 г, 48,03 ммоль, 1,00 экв.) и имидазола (6,5 г, 95,59 ммоль, 2,00 экв.) в дихлорметане (100 мл), после чего по каплям добавляли раствор трет-бутил(хлор)диметилсилана (8,7 г, 57,72 ммоль, 1,20 экв.) в дихлорметане (50 мл) при 0 °C. Полученный раствор перемешивали в течение 2 ч при комнатной температуре. Реакцию гасили путем добавления 100 мл смеси вода/лед. Полученный раствор экстрагировали дихлорметаном (3×100 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (3×50 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 7 г (67%) метил-(2R)-2-[(трет-бутилдиметилсилил)окси]пропаноата в виде бесцветного масла.
[150] Этап 1b: (2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразид: В круглодонную колбу объемом 250 мл помещали раствор метил (2R)-2-[(трет-бутилдиметилсилил)окси]пропаноата (7 г, 32,06 ммоль, 1,00 экв.) в этаноле (100 мл). К раствору добавляли гидразин (10 г, 159,81 ммоль, 5,00 экв., 80%). Полученный раствор перемешивали в течение 15 ч при 90°C в масляной ванне. Полученный раствор нейтрализовали путем добавления смеси вода/лед. Полученный раствор экстрагировали этилацетатом (3×100 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×100 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 6,5 г (93%) (2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразида в виде бесцветного масла. ЖХ-МС (электроспрей, m/z): [M+1]+=219.
[151] Этап 1: метил(транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоксилат: В круглодонную колбу объемом 250 мл,в атмосфере азота помещали раствор метил-3-цис-гидроксициклобутан-1-карбоксилата (8 г, 61,47 ммоль, 1,00 экв.), 2,3-дигидро-1H-изоиндол-1,3-диона (18,1 г, 123,02 ммоль, 2,00 экв.) и трифенилфосфина (32,3 г, 123,15 ммоль, 2,00 экв.) в ТГФ (100 мл), после чего по каплям добавляли диизопропилазидокарбоксилат (DIAD) (24,9 г, 123,14 ммоль, 2,00 экв.) при перемешивании при 0 °C. Полученный раствор перемешивали в течение 2,5 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и смесью этилацетат/петролейный эфир (1:5). Неочищенный продукт перекристаллизовывали из смеси петролейный эфир/этилацетат в соотношении 10:1, в результате чего получали 7,2 г (45%) метил-транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоксилата в форме белого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=260. 1H-ЯМР (400 МГц, CDCl3): δ 7,85-7,82 (m, 2H), 7,74-7,71 (m, 2H), 5,08-5,04 (m, 1H), 3,75 (s, 3H), 3,34-3,32 (m, 1H), 3,20-3,12 (m, 2H), 2,66-2,60 (m, 2H).
[152] Этап 2: Транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоновая кислота: В круглодонную колбу объемом 100 мл помещали раствор метил-транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоксилата (7,2 г, 27,77 ммоль, 1,00 экв.) в 1,4-диоксане (100 мл). К раствору добавляли 5M водный раствор хлороводородной кислоты (10 мл). Полученный раствор перемешивали в течение 4 ч при 80°C в масляной ванне. Полученную смесь концентрировали под вакуумом, в результате чего получали 6,2 г (91%) транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоновой кислоты в форме белого твердого вещества. ЖХ-МС (электроспрей, m/z): [M-1]-=244.
[153] Этап 3: (2R)-2-[(трет-бутилдиметилсилил)окси]-N-[транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутил]карбонил]пропангидразид: В круглодонную колбу объемом 250 мл помещали раствор транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутан-1-карбоновой кислоты (6,2 г, 25,28 ммоль, 1,00 экв.), (2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразида (6,61 г, 30,27 ммоль, 1,20 экв.) и HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (14,4 г, 37,89 ммоль, 1,50 экв.) в ТГФ (100 мл), после чего по каплям при перемешивании добавляли DIEA (диизопропиленамин) (9,81 г, 75,91 ммоль, 3,00 экв.) при 0 oC. Полученный раствор перемешивали в течение 1 ч при комнатной температуре. Затем реакцию гасили путем добавления 100 мл смеси вода/лед. Полученный раствор экстрагировали этилацетатом (3×50 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×50 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и смесью этилацетат/петролейный эфир (1:4), в результате чего получали 7 г (62%) (2R)-2-[(трет-бутилдиметилсилил)окси]-N-[транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутил]карбонил]пропангидразида в виде бесцветного масла. ЖХ-МС (электроспрей, m/z): [M+1]+=446.
[154] Этап 4: 2-[транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-2,3-дигидро-1H-изоиндол-1,3-дион: В круглодонную колбу объемом 250 мл помещали раствор (2R)-2-[(трет-бутилдиметилсилил)окси]-N-[[ транс-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циклобутил]карбонил]пропангидразида (6,95 г, 15,60 ммоль, 1,00 экв.) и триэтаноламина (7,89 г, 77,97 ммоль, 5,00 экв.) в дихлорметане (100 мл), после чего по каплям при перемешивании добавляли раствор 4-метилбензол-1-сульфонилхлорида (8,92 г, 46,79 ммоль, 3,00 экв.) в дихлорметане (50 мл) при 0 °C. Полученный раствор перемешивали в течение 15 ч при комнатной температуре. Затем реакцию гасили путем добавления 100 мл смеси вода/лед. Полученный раствор экстрагировали дихлорметаном (2×50 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×50 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка, C18; подвижная фаза, H2O/CH3CN=100:1 с повышением до H2O/CH3CN=1:100 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 3,28 г (49%) 2-[транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-2,3-дигидро-1H-изоиндол-1,3-диона в виде бесцветного масла. ЖХ-МС (электроспрей, m/z): [M+1]+=428. 1H-ЯМР (400 МГц, CDCl3): δ 7,72-7,70 (m, 2H), 7,60-7,58 (m, 2H), 5,04-4,96 (m, 2H), 3,83-3,78 (m, 1H), 3,26-3,24 (m, 2H), 2,67-2,62 (m, 2H), 1,49-1,48 (d, J=6,8Гц, 3H), 0,76 (s, 9H), 0,01 (s, 3H), 0,00 (s, 3H).
[155] Этап 5: транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутен-1-амин: В круглодонную колбу объемом 250 мл, помещали раствор 2-[транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-2,3-дигидро-1H-изоиндол-1,3-диона (1,18 г, 2,76 ммоль, 1,00 экв.) в этаноле (100 мл). К раствору добавляли гидразина гидрат (3,45 г, 55,13 ммоль, 20,00 экв., 80%). Полученный раствор перемешивали в течение 3 ч при комнатной температуре. Твердые вещества фильтровали. Полученную смесь концентрировали под вакуумом, в результате чего получали 760 мг (неочищенного) транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутен-1-амина в виде бесцветного масла. ЖХ-МС (электроспрей, m/z): [M+1]+=298.
[156] Этап 6: N-(транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: В круглодонную колбу объемом 100 мл, помещали раствор литий-3-фенилизоксазол-5-карбоксилата (300 мг, 1,54 ммоль, 1,20 экв.), 3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутен-1-амина (380 мг, 1,28 ммоль, 1,00 экв.) и HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиния 3-оксид гексафторфосфат) (728 мг, 1,92 ммоль, 1,50 экв.) в ТГФ (50 мл). После этого по каплям при перемешивании добавляли DIEA (диизопропиленамин) (500 мг, 3,87 ммоль, 3,00 экв.) при 0 °C. Полученный раствор перемешивали в течение 1 ч при комнатной температуре. Полученный раствор разбавляли 50 мл смеси вода/лед. Полученный раствор экстрагировали этилацетатом (3×50 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×30 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 300 мг (50%) N-(транс-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в виде беловатого неочищенного твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=469.
[157] Этап 7: N-(транс-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: В круглодонную колбу объемом 50 мл помещали раствор N-(3-[транс-5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида (300 мг, 0,64 ммоль, 1,00 экв.) и TBAF (1 моль/л в тетрагидрофуране, 1 мл) в ТГФ (5 мл). Полученный раствор перемешивали в течение 3 ч при комнатной температуре и разбавляли 20 миллилитрами воды. Полученный раствор экстрагировали этилацетатом (3×30 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×10 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем дихлорметаном/метанол (20:1). Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка, C18; подвижная фаза, H2O/CH3CN=100:1 с повышением до H2O/CH3CN=1:100 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 149,2 мг (66%) N-(транс-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=355; 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,48-9,46 (d, J=7,6 Гц, 1H), 7,96-7,93 (m, 2H), 7,67 (s, 1H), 7,56-7,54 (m, 3H), 5,95-5,94 (d, J=5,6Гц, 1H), 4,95-4,89 (m, 1H), 4,73-4,63 (m, 1H), 3,77-3,71 (m, 1H), 2,73-2,50 (m, 4H), 1,50-1,48 (d, J=6,8Гц, 3H).
Пример 7: N-(3-(1-метил-1H-пиразол-5-ил)пропил)-3-фенилизоксазол-5-карбоксамид
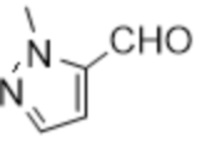
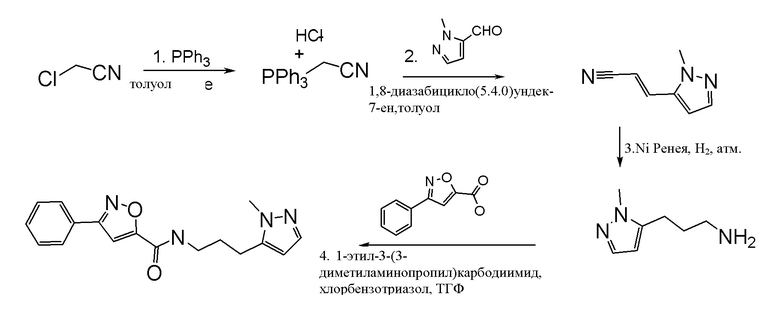
[158] Этап 1: Цианометилтрифенилфосфония хлорид: хлорацетонитрил (10 г, 0,132моль) добавляли по каплям к раствору трифенилфосфина (23,5г, 0,0895моль) в толуоле (120 мл) и нагревали с обратным холодильником в течение 6ч. Реакционную смесь охлаждали до комнатной температуры, твердые вещества фильтровали и промывали диэтиловым эфиром (2×20 мл). Получали соединение (15 г, 49,58%) в форме белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО) δ 8,02-7,97 (m, 3H), 7,90-7,79 (m, 12H), 5,94 (s, 1H), 5,90 (s, 1H); ЖХ-МС (электроспрей, m/z): [M+H]+=301,7
[159] Этап 2: 3-(2-метил-2H-пиразол-3-ил)-акрилонитрил (4): К перемешиваемому раствору 2-метил-2H-пиразол-3-карбальдегида 3 (3,8 г, 0,0345 моль) в толуоле (50 мл) добавляли цианометилтрифенилфосфония хлорид (12,8 г, 0,0389 моль) при комнатной температуре. Затем по каплям добавляли 1,8-диазабицикло(5,4,0)ундек-7-ен (DBU) (1,52 мл, 0,0099 моль) и нагревали с обратным холодильником в течение 3 ч. После завершения реакции толуол полностью удаляли под вакуумом. Полученный неочищенный продукт очищали на колонке для комби-флэш хроматографии, элюируя целевой продукт в смеси 15% EtOAc:гексан, в результате чего получали продукт (1,1 г, 24,01% выход) в форме белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,46-7,45 (d, J=176Гц, 1H), 7,3-7,25 (m, 1H), 6,56 (s, 1H), 5,79-5,75 (d, J=16,34Гц, 1H), 3,93 (s, 3H). ЖХ-МС (электроспрей, m/z): [M+H]+=134,1.
[160] Этап 3: 3-(1-метил-1H-пиразол-5-ил)пропан-1-амин: Ni Ренея (1 г, 50% суспензия в воде) добавляли к раствору 3-(2-метил-2H-пиразол-3-ил)-акрилонитрила (1,0 г, 0,0075 моль) в этаноле (10 мл) при комнатной температуре. Реакционную смесь затем перемешивали в атмосфере водорода в течение 16 ч, фильтровали через слой целита и промывали этанолом (2×10 мл). Фильтрат выпаривали под вакуумом, в результате чего получали соединение (0,9 г, 86,53% выход) в виде желтого масла. Неочищенный продукт использовали без дополнительной обработки для реакции амидного сочетания.
[161] Этап 4: N-(3-(1-метил-1H-пиразол-5-ил)пропил)-3-фенилизоксазол-5-карбоксамид: EDC⋅HCl (0,220г, 0,00115 моль) и HOBt.H2O (0,129 г, 0,00084 моль) добавляли к раствору 3-фенилизоксазол-5-карбоновой кислоты (0,150 г, 0,00076 моль) в ТГФ (5 мл) и перемешивали при комнатной температуре в течение 20 минут. К этой реакционной смеси добавляли 3-(1-метил-1H-пиразол-5-ил)пропан-1-амин (0,16 г, 0,00115моль) и DIPEA (0,590 мл, 0,0023 моль) и перемешивали в течение 16 ч. Реакционную смесь концентрировали на роторном испарителе и очищали смеси с использованием комбифлэш-хроматографии, целевой продукт элюировали в 35% растворе EtOAc:гексан (0,115г, 47,23%) в виде беловатого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,54-7,53 (m, 1H), 7,50-7,48 (m, 1H), 7,38-7,37 (d, J=1,84Гц, 1H), 7,15-7,14 (m, 1H), 6,88 (br, 1H), 6,81 (s, 1H), 3,79 (s, 3H), 3,56-3,51 (q, 2H), 2,71-2,67 (t, 2H), 2,02-1,95 (m, 2H); ЖХ-МС (электроспрей, m/z): [M+H]+=316,9; чистота, определенная методом ВЭЖХ: 95,83% при 220 нм и 98,85% при 254 нм.
Пример 8: N-(2-метоксиэтил)-4-фенилфуран-2-карбоксамид:
[162] Соединение 8 получали в виде беловатого твердого вещества с использованием общей процедуры 1. Выход: 57%; 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,42 (br, 1H), 8,35 (s, 1H), 7,66 (d, J=7,6 Гц, 2H), 7,57 (s, 1H), 7,42 (t, J=7,6 Гц, 2H), 7,31 (t, J=7,3 Гц, 1H), 3,44-3,39 (m, 4H), 3,26 (s, 3H); ЖХ-МС (электроспрей, m/z): [M+H]+=246,0; чистота, определенная методом ВЭЖХ: 99,32% при 220 нм и 99,35% при 254 нм.
Пример 9: 4-фенил-N-((тетрагидрофуран-2-ил)метил)фуран-2-карбоксамид:
[163] Соединение 9 получали в виде беловатого твердого вещества с использованием общей процедуры 1. Выход: 46%; 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,42 (br, 1H), 8,35 (s, 1H), 7,66 (d, J=7,6 Гц, 2H), 7,59 (s, 1H), 7,42 (t, J=7,2 Гц, 2H), 7,31 (t, J=7,2 Гц, 1H), 3,97 (m, 1H), 3,79 (m, 1H), 3,64 (m, 1H), 3,27 (s, 2H), 1,90-1,78 (m, 3H), 1,61 (m, 1H); ЖХ-МС (электроспрей, m/z): [M+H]+=271,9; чистота, определенная методом ВЭЖХ: 98,21% при 220 нм и 98,35% при 254 нм.
Пример 10: N-(2-морфолинoэтил)-4-фенилфуран-2-карбоксамид
[164] Соединение 10 получали в виде беловатого твердого вещества с использованием общей процедуры 1. Выход: 42%; 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,35 (m, 2H), 7,67 (d, J=7,6 Гц, 2H), 7,54 (s, 1H), 7,42 (t, J=7,2 Гц, 2H), 7,31 (t, J=7,2 Гц, 1H), 3,56 (s, 4H), 3,36 (s, 2H), 2,46-2,40 (m, 6H); ЖХ-МС (электроспрей, m/z): [M+H]+=300,7; чистота, определенная методом ВЭЖХ: 99,42% при 220 нм и 99,36% при 254 нм.
Пример 11: N-(3-(1H-имидазол-1-ил)пропил)-4-фенилфуран-2-карбоксамид:
[165] Соединение 11 получали в виде беловатого твердого вещества с использованием общей процедуры 1. Выход: 33%; 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,54 (t, J=5,6 Гц, 1H), 8,36 (s, 1H), 7,67 (d, J=7,2 Гц, 2H), 7,56 (s, 1H), 7,43 (t, J=7,2 Гц, 2H), 7,31 (t, J=7,2 Гц, 1H), 7,21 (s, 1H), 6,89 (s, 1H), 4,02 (t, J=6,8 Гц, 2H), 3,23 (q, J=6,8 Гц, 2H), 1,97 (квинтет, J=6,8 Гц, 2H); ЖХ-МС (электроспрей, m/z): [M+H]+=296,1; чистота, определенная методом ВЭЖХ: 99,51% при 220 нм и 99,21% при 254 нм.
Пример 12: N-циклопропил-4-фенилфуран-2-карбоксамид:
[166] Соединение 12 получали в виде беловатого твердого вещества с использованием общей процедуры 1 (0,032 г, 19,04%); 1H-ЯМР (400 МГц, CDCl3) δ 7,66 (s, 1H), 7,48-7,46 (m, 2H), 7,41-7,36 (m, 3H), 7,31-7,24 (m, 1H), 6,44 (s, 1H), 2,89-2,85 (m, 1H), 0,89-0,84 (m, 2H), 0,65-0,61 (m, 2H); ЖХ-МС (электроспрей, m/z): [M+H]+=228,1; чистота, определенная методом ВЭЖХ: 99,57% при 220 нм и 99,02% при 254 нм.
Пример 13: N-(транс-3-(5-(1-(метилсульфонил)этил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
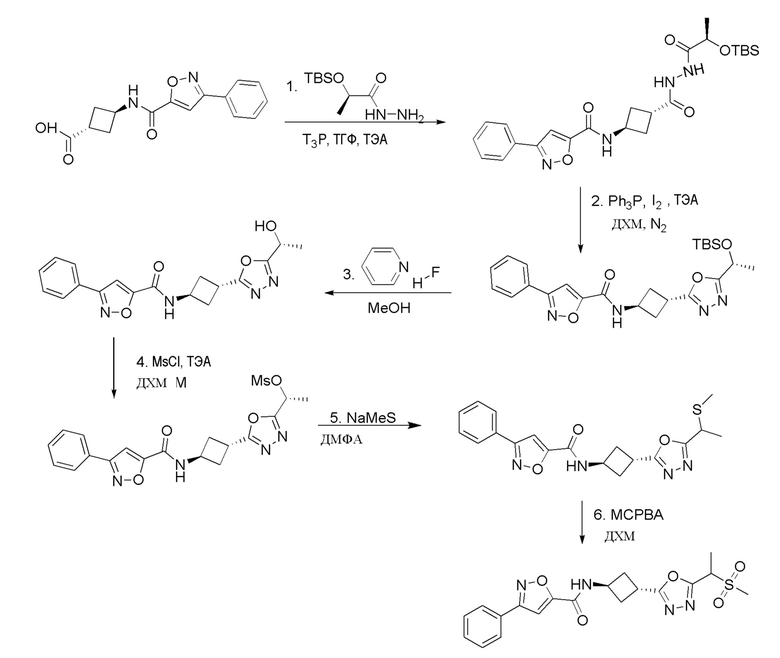
[167] Этап 1: N-транс-(3-[[(2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразидо]карбонил]циклобутил)-3-фенилизоксазол-5-карбоксамид: T3P (50%) (55,6 г, 5,00 экв.), триэтаноламин (8,83 г, 87,26 ммоль, 5,00 экв.) и (2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразид (4,95 г, 22,67 ммоль, 1,30 экв.) добавляли к раствору 3-(3-фенилизоксазол-5-амидо)циколбутан-1-карбоновойя кислоты (5 г, 17,47 ммоль, 1,00 экв.) в тетрагидрофуране (50 мл) и перемешивали раствор в течение 1,5 ч при 30 °C. Затем реакцию гасили путем добавления воды, экстрагировали дихлорметаном, органические слои объединяли, сушили и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем со смесью этилацетат/петролейный эфир (1:1), в результате чего получали 8,45 г (неочищенного) N-транс-(3-[[(2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразидо]карбонил]циклобутил)-3-фенилизоксазол-5-карбоксамид в форме светло-желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=487,1.
[168] Этап 2: N-транс-(3-[5-[(R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: I2 (20,74 г, 5,00 экв.) и триэтаноламин (9,98 г, 98,63 ммоль, 6,00 экв.) добавляли к раствору Ph3P (21,56 г, 5,00 экв.) в дихлорметане (50 мл), после чего по каплям добавляли раствор N-транс-(3-[[(2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразидо]карбонил]циклобутил)-3-фенилизоксазол-5-карбоксамида (8 г, 16,44 ммоль, 1,00 экв.) в дихлорметане (50 мл). Полученный раствор перемешивали в течение 2,5 ч при 0 °C, затем нейтрализовали путем добавления воды, и экстрагировали раствор дихлорметаном, органические слои объединяли, сушили и концентрировали под вакуумом, в результате чего получали 3,19 г (41%) N-транс-(3-[5-[(R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в виде коричневого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=469,1.
[169] Этап 3: N-транс-(3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор N-транс-(3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида (25,3 г, 53,99 ммоль, 1,00 экв.) и пиридина гидрофторида (15 г, 151,35 ммоль, 2,80 экв.) в метаноле (50 мл) перемешивали в течение 5 ч при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали дихлорметаном, органические слои объединяли, сушили и концентрировали под вакуумом. Остаток растворяли в 50 мл толуола и собирали твердые вещества фильтрацией, в результате чего получали 1,85 г (10%) N-транс-(3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=355,0.
[170] Этап 4: (R)-1-[5-транс-[3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этил метансульфонат: триэтаноламин (1,28 г, 12,65 ммоль, 3,00 экв.) и MsCl (0,725 г, 1,50 экв.) добавляли к раствору N-транс-(3-[5-[(R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида (1,5 г, 4,23 ммоль, 1,00 экв.) в дихлорметане (50 мл) и перемешивали раствор в течение 3 ч при 0 °C. Затем реакцию гасили путем добавления 200 миллилитров насыщенного NH4Cl, экстрагировали дихлорметаном, органические слои объединяли, сушили и концентрировали под вакуумом, в результате чего получали 1,72 г (94%) (R)-1-[5-транс-[3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этил метансульфоната в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=433,0.
[171] Этап 5: N-транс-(3-[5-[1-(метилсульфанил)этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор (R)-1-[5-транс-[3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этил метансульфоната (400 мг, 0,92 ммоль, 1,00 экв.) и NaMeS (132 мг, 2,00 экв.) в ДМФА (3 мл) перемешивали в течение 5 ч при 100 °C. Полученную смесь концентрировали под вакуумом и наносили остаток на колонку с силикагелем этилацетатом/петролейный эфир (4:5), в результате чего получали 254 мг (71%) N-транс-(3-[5-[1-(метилсульфанил)этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=385,0.
[172] Этап 6: N-(3-[5-транс-[1-метансульфонилэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор N-(3-[5-транс-[1-(метилсульфанил)этил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида (230 мг, 0,60 ммоль, 1,00 экв.) и MCPBA (0,42 г, 4,00 экв.) в дихлорметане (5 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом и наносили остаток на колонку с силикагелем с дихлорметаном/метанолом (25:1), в результате чего получали 80 мг (32%) рацемической смеси N-(3-[5-транс-[1-метансульфонилэтил]-1,3,4-оксадиазол-2-ил]циклобутил)-3-фенилизоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=417,0 1H-ЯМР (ДМСО-d6, 400 МГц, ppm): δ 9,44 (s, 1H), 7,93-7,91 (m, 2H), 7,65 (s,1H), 7,54-7,52 (m, 3H), 5,16-5,11 (m, 1H), 4,69-4,63 (m, 1H), 3,78-3,75 (m, 1H), 3,14 (s, 3H), 2,72-2,65 (m, 4H), 1,74-1,70 (m, 3H); чистота, определенная методом ВЭЖХ: 97,1% при 254 нм.
Пример 14: N-(транс-3-(5-((R)-1-метоксиэтил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
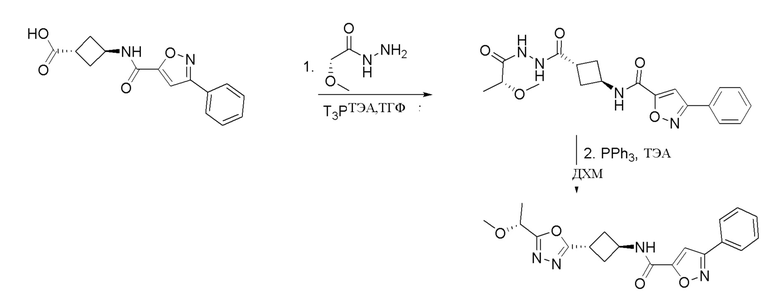
[173] Этап 1: 3-фенил-N-[транс-3-[N-[(2R)-2-метоксипропаноил]гидразинкарбонил]циклобутил]-1,2-оксазол-5-карбоксамид: триэтаноламин (315 мг, 3,11 ммоль, 2,97 экв.) и T3P (667 мг)добавляли к раствору транс-3-(3-фенилизоксазол-5-амидо)циколбутан-1-карбоновой кислоты (300 мг, 1,05 ммоль, 1,00 экв.) и (2R)-2-метоксипропангидразида (185 мг, 1,57 ммоль, 1,49 экв.) в тетрагидрофуране (5 мл) и перемешивали смесь в течение 2 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом, разбавляли 5 миллилитрами метанола. Твердые вещества собирали фильтрацией и сушили в сушильном шкафу при пониженном давлении, в результате чего получали 200 мг (49%) 3-фенил-N-[транс-3-[N-[(2R)-2-метоксипропаноил]гидразинкарбонил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=387,2.
[174] Этап 2: 3-фенил-N-[транс-3-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид: 3-фенил-N-[транс-3-[N-[(2R)-2-метоксипропаноил]гидразинкарбонил]циклобутил]-1,2-оксазол-5-карбоксамид (150 мг, 0,39 ммоль, 1,00 экв.) добавляли к раствору PPh3 (150 мг, 0,57 ммоль, 1,47 экв.), I2 (150 мг) и триэтаноламина (120 мг, 1,19 ммоль, 3,05 экв.) в дихлорметане (5 мл) и перемешивали смесь в течение 2 ч при 0 °C. Полученную смесь промывали водой (2×5 мл) и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ВЭЖХ, с использованием следующих условий: (Waters): колонка: препаративная колонка XBridge C18 OBD 10 мкм, 19 мм X 250 мм; подвижная фаза, вода (0,5% NH4HCO3) и CH3CN; градиент: 40% CH3CN др 45% CH3CN в течение 10 мин; детектор УФ 254 нм, в результате чего получали 101,8 мг (71%) 3-фенил-N-[транс-3-[5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+1]+=369,0; 1H-ЯМР (ДМСО-d6, 300 МГц, ppm): δ 9,46-9,44 (d, J=7,2 Гц, 1H), 7,94-7,93 (m, 2H), 7,66 (s, 1H), 7,55-7,54 (m, 3H), 4,72-4,64 (m, 2H), 3,78-3,73 (m, 1H), 3,29 (s, 3H), 2,73-2,61 (m, 4H), 1,51-1,49 (d, J=6,8 Гц, 3H); чистота, определенная методом ВЭЖХ: 99,1% при 254 нм.
[175] Пример 15 и 16: 3-фенил-N-(транс-3-(5-((S)-1-(2,2,2-трифторэтокси)этил)-1,3,4-оксадиазол-2-ил)циклобутил)изоксазол-5-карбоксамид и 3-фенил-N-(транс-3-(5-((R)-1-(2,2,2-трифторэтокси)этил)-1,3,4-оксадиазол-2-ил)циклобутил)изоксазол-5-карбоксамид
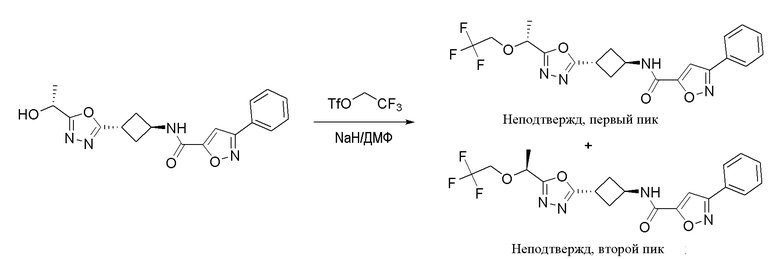
[176] 2,2,2-трифторэтилтрифторметансульфонат (491 мг, 2,12 ммоль, 1,50 экв.) добавляли к раствору 3-фенил-N-[транс-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамида (500 мг, 1,41 ммоль, 1,00 экв.) и гидрида натрия (85 мг, 2,12 ммоль, 1,50 экв.) в ДМФА (10 мл) и перемешивали раствор в течение 2 ч при комнатной температуре. Реакционную смесь разбавляли водой (30 мл), экстрагировали этилацетатом (3×30 мл), органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (Waters): колонка: препаративная колонка XBridge C18 OBD 10 мкм, 19 мм X 250 мм; подвижная фаза A: вода (10 ммоль/л NH4HCO3), подвижная фаза B: ацетонитрил; Скорость потока: 25 мл/мин; градиент: 15% B до 65% B в течение 8 мин; 254/220 нм. Изомеры очищали хиральной препаративной ВЭЖХ, с использованием следующих условий: колонка: Chiralpak IA 2*25см, 5мкм; подвижная фаза A: гексан; ВЭЖХ, подвижная фаза B: EtOH, ВЭЖХ Скорость потока: 18 мл/мин; градиент: 40 B до 40 B в течение 15 мин; 254/220 нм; время удерживания 1: 9,505; время удерживания 2: 11,208. В результате получали 19,1 мг (3%) переднего пика в форме белого твердого вещества и 16,8 мг второго пика в форме белого твердого вещества.
[177] Передний пик: ЖХ-МС (электроспрей, m/z): [M+1]+=437,1. 1H-ЯМР (ДМСО-d6, 300 МГц, ppm): δ 7,87-7,86 (m, 2H), 7,49-7,47 (m, 3H), 7,37 (s, 1H), 5,00-4,94 (m, 1H), 4,11-4,02 (m, 2H), 3,81-3,74 (m, 1H), 2,78-2,68 (m, 4H), 1,64-1,62 (d, J=6,6 Гц, 3H); чистота, определенная методом ВЭЖХ: 98,6% при 254 нм.
[178] Второй пик: ЖХ-МС (электроспрей, m/z): [M+1]+=437,1; 1H-ЯМР (ДМСО-d6, 300 МГц, ppm): δ 7,86 (br, 2H), 7,48 (br, 3H), 7,37 (s, 1H), 5,00-4,94 (m, 1H), 4,10-4,02 (m, 2H), 3,79-3,77 (m, 1H), 2,78-2,69 (m, 4H), 1,64-1,62 (d, J=6,6 Гц, 3H); чистота, определенная методом ВЭЖХ: 98,9% при 254 нм.
Пример 17: N-(транс-3-(5-(1-циколбутоксиэтил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
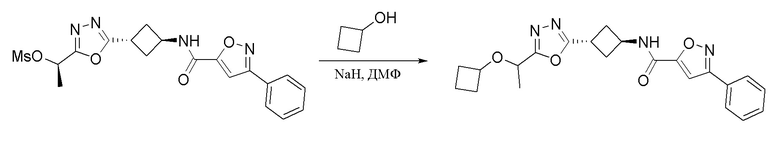
[179] Гидрид натрия (84 мг, 2,10 ммоль, 3,00 экв.) добавляли порциями к холодному (0 °C) раствору циколбутанола (150 мг, 2,08 ммоль, 3,00 экв.) в ДМФА (10 мл) и перемешивали полученный раствор в течение 30 мин при 0 °C. К этой смеси добавляли (R)-1-[5-транс-[3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этилметансульфонат (300 мг, 0,69 ммоль, 1,00 экв.) и перемешивали в течение еще 2 ч при 25 °C. Затем реакцию гасили путем добавления 100 мл воды, экстрагировали этилацетатом (2×100 мл), объединяли органические слои. Полученную смесь промывали солевым раствором (2×100 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ТСХ (петролейный эфиир:этилацетат=1:1), в результате чего получали 50,2 мг (18%) 3-фенил-N-[транс-3-[5-(1-циколбутоксиэтил)-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=409,4; 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,46-9,43 (d, J=7,2 Гц, 1H), 7,95-7,92 (m, 2H), 7,65 (s, 1H), 7,56-7,54 (m, 3H), 4,78-4,64 (m, 2H), 4,04-3,99 (m, 1H), 3,77-3,74 (m, 1H), 2,71-2,50 (m, 4H), 2,18-2,14 (m, 1H), 1,97-1,85 (m, 2H), 1,75-1,57 (m, 2H), 1,49-1,47 (d, J=6,6 Гц, 3H), 1,47-1,40 (m, 1H); чистота, определенная методом ВЭЖХ: 98,0% при 254 нм.
Пример 18: N-(транс-3-(5-(1-(циклобутилметокси)этил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
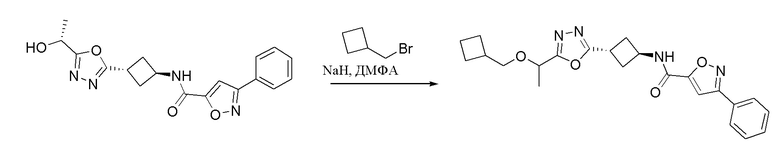
[180] (Бромметил)циколбутан (83 мг, 0,56 ммоль, 2,00 экв.) добавляли к раствору 3-фенил-N-[транс-3-[5-(1-гидроксиэтил)-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида (100 мг, 0,28 ммоль, 1,00 экв.) и гидрида натрия (17 мг, 0,42 ммоль, 1,50 экв.) в ДМФА (2 мл). Полученный раствор перемешивали в течение 2 ч при комнатной температуре, реакционную смесь нейтрализовали путем добавления воды (20 мл) и экстрагировали раствор этилацетатом (3×10 мл). Органические слои объединяли и сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (Waters): колонка: колонка XBridge Prep C18 OBD 19×150 мм, 5 мкм; подвижная фаза A: вода (10 ммоль/л NH4HCO3), подвижная фаза B: ацетонитрил; скорость потока: 20 мл/мин; градиент: от 40% B до 80% B в течение 8 мин; 254 нм, в результате чего получали 21,2 мг (18%) 3-фенил-N-[транс-3-[5-[1-(циклобутилметокси)этил]-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=421,0; 1H-ЯМР (ДМСО-d6, 300 МГц, ppm): δ 9,46-9,43 (d, J=7,2 Гц, 1H), 7,94-7,93 (m, 2H), 7,66 (s, 1H), 7,57-7,54 (m, 3H), 4,81-4,74 (m, 1H), 4,72-4,64 (m, 1H), 3,77-3,74 (m, 1H), 3,49-3,36 (m, 2H), 2,70-2,65 (m, 4H), 1,96-1,91 (m, 2H), 1,88-1,80 (m, 2H), 1,75-1,67 (m, 2H), 1,50-1,48 (d, J=6,6Гц, 3H); чистота, определенная методом ВЭЖХ: 99,8% при 254 нм.
Пример 19: N-(транс-3-(5-(1-(оксетан-3-илметокси)этил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
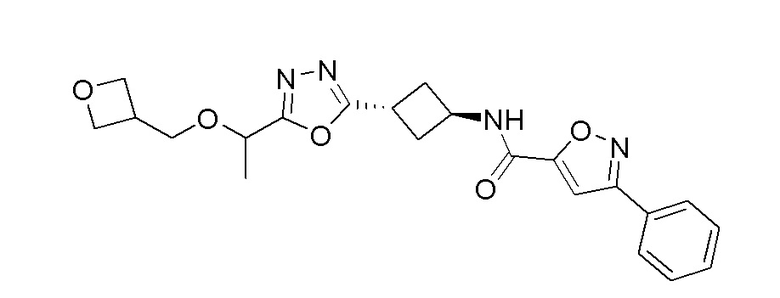
[181] Указанное в заголовке соединение получали с применением способа, показанного в примере 18.
Пример 20: N-(транс-3-(5-((R)-1-((1-метилазетидин-3-ил)метокси)этил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
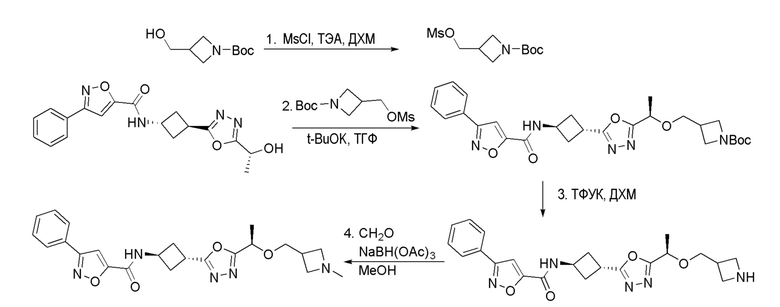
[182] Этап 1: трет-бутил-3-[(метансульфонилокси)метил]азетидин-1-карбоксилат: MsCl (549 мг, 4,82 ммоль, 1,20 экв.) и триэтаноламин (606 мг, 6,00 ммоль, 1,50 экв.) добавляли к раствору трет-бутил-3-(гидроксиметил)азетидин-1-карбоксилата (750 мг, 4,01 ммоль, 1,00 экв.) в дихлорметане (20 мл) и перемешивали раствор в течение 3 ч при комнатной температуре. Полученный раствор разбавляли этилацетатом (50 мл), промывали насыщенным водным раствором карбоната натрия (1×30 мл), водой (1×30 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 980 мг (92%) трет-бутил-3-[(метансульфонилокси)метил]азетидин-1-карбоксилата в виде бесцветного масла.
[183] Этап 2: трет-бутил-3-[(1-[5-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этокси)метил]азетидин-1-карбоксилат: трет-бутил-3-[(метансульфонилокси)метил]азетидин-1-карбоксилат (670 мг, 2,53 ммоль, 1,50 экв.) добавляли к раствору 3-фенил-N-[транс-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамида (600 мг, 1,69 ммоль, 1,00 экв.) и трет-BuOK (570 мг, 5,08 ммоль, 3,00 экв.) в ТГФ (15 мл). Реакционную смесь перемешивали в течение 16 ч при 80°C на масляной бане, затем разбавляли этилацетатом (100 мл). Полученный раствор промывали водой (2×30 мл), солевым раствором (1×30 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем этилацетатом/петролейный эфир (1:10 до 1:2), в результате чего получали 287 мг (32%) трет-бутил-3-[(1-[5-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этокси)метил]азетидин-1-карбоксилата в форме светло-желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=524,2.
[184] Этап 3: 3-фенил-N-[транс-3-[5-[1-(азетидин-3-илметокси)этил]-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамид: раствор трет-бутил-3-[(1-[5-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1,3,4-оксадиазол-2-ил]этокси)метил]азетидин-1-карбоксилата (237 мг, 0,45 ммоль, 1,00 экв.) и ТФУК (1,5 мл) в ДХМ (4 мл) перемешивали в течение 2 ч при комнатной температуре. Реакцию гасили добавлением 20 мл насыщенного водного раствора карбоната натрия и экстрагировали этилацетатом (2×50 мл). Объединенный органический слой промывали водой (1×10 мл), солевым раствором (1×10 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 150 мг (78%) 3-фенил-N-[транс-3-[5-[1-(азетидин-3-илметокси)этил]-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=424,2.
[185] Этап 4: 3-фенил-N-[транс3-(5-[1-[(1-метилазетидин-3-ил)метокси]этил]-1,3,4-оксадиазол-2-ил)циклобутил]-изоксазол-5-карбоксамид: HCHO (57 мг, 0,70 ммоль, 1,50 экв.) добавляли к раствору 3-фенил-N-[транс-3-[5-[1-(азетидин-3-илметокси)этил]-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида (150 мг, 0,35 ммоль, 1,00 экв.) в метаноле (3 мл) и перемешивали в течение 30 мин. К реакционной смеси добавляли NaBH(OAc)3 (150 мг, 0,71 ммоль, 2,00 экв.) и перемешивали 16 ч при комнатной температуре. После удаления твердого вещества фильтрацией неочищенный продукт (3 мл) очищали препаративной ВЭЖХ с использованием следующих условий: (Waters): колонка: препаративная колонка XBridge C18 OBD 10 мкм, 19 мм X 250 мм; подвижная фаза A: вода (10 ммоль/л NH4HCO3), подвижная фаза B: ацетонитрил; Скорость потока: 20 мл/мин; градиент: 15% B до 45% B в течение 8 мин; 220/254 нм, в результате чего получали 68,6 мг (44%) 3-фенил-N-[транс-3-(5-[1-[(1-метилазетидин-3-ил)метокси]этил]-1,3,4-оксадиазол-2-ил)циклобутил]-изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=438,2; 1H-ЯМР (CDOD, 400 МГц): δ 7,89-7,87 (m, 2H), 7,51-7,50 (m, 3H), 7,39 (s, 1H), 4,85-4,78 (m, 2H), 3,85-3,59 (m, 3H), 3,48-3,43 (m, 2H), 3,16-3,11 (m, 2H), 2,87-2,73 (m, 4H), 2,60-2,57 (m, 1H), 2,35-2,33 (m, 3H), 1,61-1,58 (m, 3H); чистота, определенная методом ВЭЖХ: 97% при 254 нм.
Пример 21: N-(транс-3-(5-(1-метилазетидин-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид трифторацетат
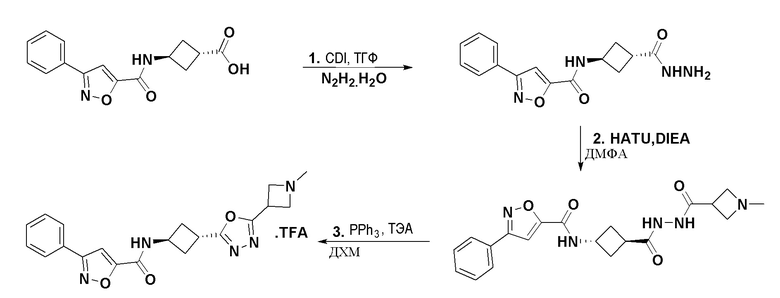
[186] Этап 1: 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]изоксазол-5-карбоксамид: раствор транс-3-(3-фенилизоксазол-5-амидо)циколбутан-1-карбоновой кислоты (1,706 г, 5,96 ммоль, 1,00 экв.) и карбодиимидазола (1,933 г, 11,92 ммоль, 2,00 экв.) в тетрагидрофуране (30 мл) перемешивали в течение 0,5 ч при комнатной температуре. К реакционной смеси добавляли гидразин гидрат (1,118 г, 22,33 ммоль, 3,75 экв.) и перемешивали в течение 2 ч при комнатной температуре. Продукт осаждали путем добавления воды и собирали фильтрацией, в результате чего получали 780 мг (44%) 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=301,2.
[187] Этап 2: 3-фенил-N-[транс-3-[[(1-метилазетидин-3-ил)формогидразидо]карбонил]циклобутил]-изоксазол-5-карбоксамид: 1-метилазетидин-3-карбоновую кислоту (172,5 мг, 1,50 ммоль, 1,50 экв.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (570 мг, 1,50 ммоль, 1,50 экв.) и DIEA (диизопропиленамин) (387 мг, 2,99 ммоль, 3,00 экв.) добавляли к раствору 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]-изоксазол-5-карбоксамида (300 мг, 1,00 ммоль, 1,00 экв.) в ДМФА (10 мл), а затем перемешивали в течение 2 ч при комнатной температуре. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка C18; подвижная фаза, MeCN/H2O=5:95 с повышением до MeCN/H2O=95:5 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 200 мг (50%) 3-фенил-N-[транс-3-[[(1-метилазетидин-3-ил)формогидразидо]карбонил]циклобутил]-изоксазол-5-карбоксамида в виде беловатого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=398,0.
[188] Этап 3: 3-фенил-N-[транс-3-[5-(1-метилазетидин-3-ил)-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамид: I2 (232 мг) и триэтаноламин (276 мг, 2,73 ммоль, 5,99 экв.) добавляли к холодному (0 °C) раствору PPh3 (239 мг, 0,91 ммоль, 2,00 экв.) в ДХМ (20 мл). К этой смеси добавляли 3-фенил-N-[транс-3-[[(1-метилазетидин-3-ил)формогидразидо]карбонил]циклобутил]-изоксазол-5-карбоксамид (181 мг, 0,46 ммоль, 1,00 экв.) при 0 °C. Полученный раствор перемешивали в течение 3 ч при комнатной температуре, разбавляли 50 миллилитрами ДХМ, промывали водным раствором NaHSO3 (2×50 мл) и концентрировали под вакуумом. Остаток обрабатывали преп-ТСХ с использованием смеси этилацетатом/петролейный эфир (1:1). Полученный неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (ВЭЖХ-10): колонка: препаративная колонка XBridge C18 OBD 100Å, 10 мкм, 19 мм X 250 мм; подвижная фаза A: вода (10 ммоль/л NH4HCO3), подвижная фаза B: ацетонитрил; Скорость потока: 20 мл/мин; градиент: 20% B до 30% B в течение 10 мин; 254&220 нм, в результате чего получали 50 мг (29%) 3-фенил-N-[транс-3-[5-(1-метилазетидин-3-ил)-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M-ТФУК+H]+=380,1; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 10,19-10,12 (m, 1H), 9,49-9,47 (d, J=7,5 Гц, 1H), 7,95-7,92 (m, 2H), 7,66-7,64 (d, J=8,1 Гц, 1H), 7,56-7,54 (t, J=3,3 Гц, 3H), 4,75-4,62 (m, 6H), 3,78-3,69 (m, 1H), 2,94 (s, 3H), 2,44-2,72 (m, 4H); чистота, определенная методом ВЭЖХ: 97,1% при 254 нм.
Пример 22: N-транс-3-(5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид

[189] Этап 1: 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]изоксазол-5-карбоксамид: карбодиимидазол (2,26 г, 13,94 ммоль, 2,00 экв.) добавляли к раствору N-транс-3-(3-фенилизоксазол-5-амидо)циколбутан-1-карбоновой кислоты (приготовленному в соответствии с процедурой, показанной в примере 13 ( 2 г, 6,99 ммоль 1,00 экв.) в ТГФ (3 мл)) и перемешивали раствор в течение 1 ч при комнатной температуре, после чего добавляли гидразина гидрат (1,33 г, 21,25 ммоль, 3,00 экв., 80%). Полученный раствор перемешивали в течение еще 1 ч при комнатной температуре, а затем нейтрализовали водой. После удаления твердых веществ фильтрацией полученную смесь концентрировали под вакуумом и промывали остаток 10 миллилитрами метанола, в результате чего получали 960 мг (46%) 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=301,1.
[190] Этап 2: 3-фенил-N-[транс-3-[(оксетан-3-илформогидразидо)карбонил]циклобутил]изоксазол-5-карбоксамид: оксетан-3-карбоновую кислоту (170 мг, 1,67 ммоль, 1,00 экв.), T3P (5,3 г, 8,33 ммоль, 5,00 экв., 50%) и триэтаноламин (838 мг, 8,3 ммоль, 5,00 экв.) добавляли к раствору 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]изоксазол-5-карбоксамида (500 мг, 1,66 ммоль, 1,00 экв.) в ТГФ (50 мл). Полученный раствор перемешивали в течение 20 мин при комнатной температуре, затем нейтрализовали путем добавления 200 мл воды. Полученный раствор экстрагировали дихлорметаном (3×200 мл), органические слои объединяли. Полученную смесь промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Твердый остаток промывали 2 миллилитрами метанола, в результате чего получали 420 мг (66%) 3-фенил-N-[транс-3-[(оксетан-3-илформогидразидо)карбонил]циклобутил]изоксазол-5-карбоксамида в виде беловатого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=385,0.
[191] Этап 3: 3-фенил-N-[транс-3-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамид: I2 (579 мг, 2,28 ммоль, 2,50 экв.), триэтаноламин (598 мг, 5,91 ммоль, 6,50 экв.) и 3-фенил-N-[транс-3-[(оксетан-3-илформогидразидо)карбонил]циклобутил]изоксазол-5-карбоксамид (350 мг, 0,91 ммоль, 1,00 экв.) добавляли к холодному раствору PPh3 (597 мг, 2,28 ммоль, 2,50 экв.) в дихлорметане (30 мл) при 0 °C. Полученный раствор перемешивали в течение 1 ч при комнатной температуре, затем нейтрализовали путем добавления воды. Полученный раствор экстрагировали этилацетатом, органические слои объединяли. Полученную смесь промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на силикагелиевую колонку со смесью дихлорметан/метанол (10:1), в результате чего получали 100,4 мг (30%) 3-фенил-N-[транс-3-[5-(оксетан-3-ил)-1,3,4-оксадиазол-2-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=367,1; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 9,46-9,44 (d, 1H, J=7,5 Гц), 7,95-7,92 (m, 2H), 7,66 (s, 1H), 7,56-7,54 (m, 3H), 4,95-4,90 (m, 2H), 4,83-4,79 (m, 2H), 4,75-4,51 (m, 2H), 3,78-3,71 (m, 1H), 2,70-2,65 (m, 4H); чистота, определенная методом ВЭЖХ: 96,5% при 254 нм.
Пример 23: N-(транс-3-(5-(1,1-диоксидотиэтан-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
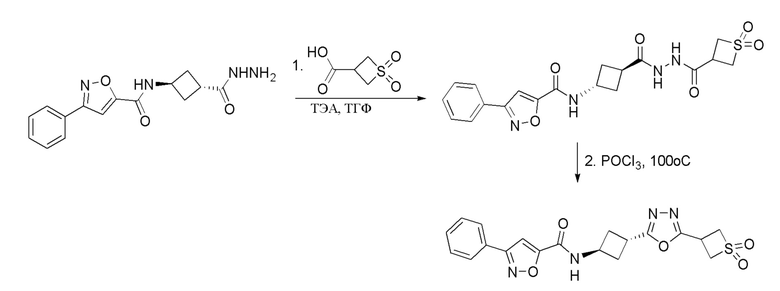
[192] Этап 1: N-(транс-3-(2-(1,1-диоксидотиетан-3-карбонил)гидразин-1-карбонил)циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор 1,1-диоксида тиетан-3-карбоновой кислоты (500 мг, 3,4 ммоль, 1,00 экв.), 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]-изоксазол-5-карбоксамида (1,0 г, 3,4 ммоль, 1,00 экв.), T3P (10 мл) и триэтаноламина (4 мл) в тетрагидрофуране (20 мл) перемешивали в течение 1 ч при комнатной температуре. Затем реакцию гасили путем добавления воды и собирали твердые вещества фильтрацией, в результате чего получали 30 мг (42%) N-(транс-3-(2-(1,1-диоксидотиетан-3-карбонил)гидразин-1-карбонил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме светло-желтого твердого вещества. ЖХ-МС (электроспрей, m/z): [M+H]+=433,1.
[193] Этап 2: N-(транс-3-(5-(1,1-диоксидотиэтан-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор N-(транс-3-(2-(1,1-диоксидотиетан-3-карбонил)гидразин-1-карбонил)циклобутил)-3-фенилизоксазол-5-карбоксамида (400 мг, 0,92 ммоль, 1,00 экв.) в POCl3 (8 мл) перемешивали в течение 3 ч при 100°C в масляной ванне. Затем реакцию гасили путем добавления смеси водный раство бикарбоната натрия/лед, экстрагировали этилацетатом, органические слои объединяли. Полученную смесь промывали водой, сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 105,8 мг (28%) N-(транс-3-(5-(1,1-диоксидотиэтан-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=415,2; 1H-ЯМР (ДМСО-d6, 400 МГц): δ 9,46-9,42 (m, 1H), 7,95-7,91 (m, 2H), 7,66-7,65 (m, 1H), 7,55-7,54 (m, 3H), 4,75-4,57 (m, 5H), 4,23-4,14 (m, 1H), 3,73-3,52 (m, 1H), 2,70-2,66 (m, 4H); чистота, определенная методом ВЭЖХ: 99,2% при 254 нм.
Пример 24 и 25: N-цис-(3-(5-(1-(1-метилпиперидин-4-ил)азетидин-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-транс-(3-(5-(1-(1-метилпиперидин-4-ил)азетидин-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
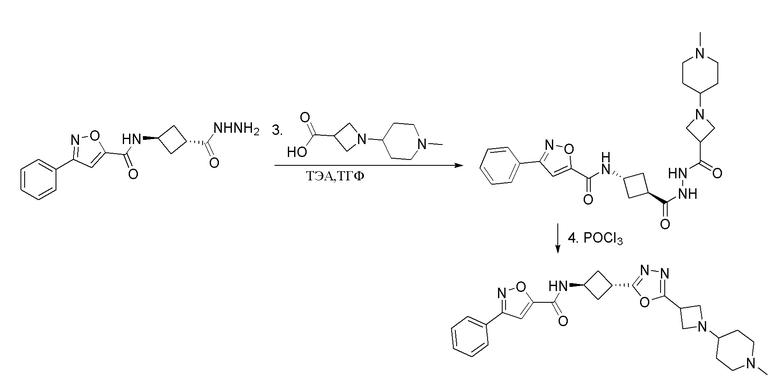
[194] Этап 1: бензил-1-(1-метилпиперидин-4-ил)азетидин-3-карбоксилат: раствор бензилазетидин-3-карбоксилата трифторуксусной кислоты (1,3 г, 4,26 ммоль, 1,00 экв.), 1-метилпиперидин-4-она (482 мг, 4,26 ммоль, 1,10 экв.) и уксусной кислоты (255 мг, 4,25 ммоль, 1,00 экв.) в ДХЭ (20 мл) перемешивали в течение 30 мин, после чего добавляли NaBH(OAc)3 (1,44 г, 6,79 ммоль, 1,60 экв.). Полученный раствор перемешивали в течение 16 ч при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали дихлорметаном, органические слои объединяли. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем дихлорметаном/MeOH (10:1), в результате чего получали 830 мг (68%) --(1-метилпиперидин-4-ил)азетидин-3-карбоксилата в виде желтого масла; ЖХ-МС (электроспрей, m/z): [M+H]+=289,2.
[195] Этап 2: 1-(1-метилпиперидин-4-ил)азетидин-3-карбоновая кислота: Палладий на угле (100 мг) добавляли к раствору бензил-1-(1-метилпиперидин-4-ил)азетидин-3-карбоксилата (830 мг, 2,88 ммоль, 1,00 экв.) в метаноле (20 мл), раствор дегазировали и снова насыщали водородом. Полученный раствор перемешивали в течение 2 ч при комнатной температуре и отфильтровывали твердые вещества. Полученную смесь концентрировали под вакуумом, в результате чего получали 570 мг (неочищенного) 1-(1-метилпиперидин-4-ил)азетидин-3-карбоновой кислоты в виде светло-желтого масла; ЖХ-МС (электроспрей, m/z): [M+H]+=199,1.
[196] Этап 3: 3-фенил-N-[транс-3-([[1-(1-метилпиперидин-4-ил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамида: раствор 3-фенил-N-[транс-3-(гидразинкарбонил)циклобутил]-изоксазол-5-карбоксамида (409 мг, 1,36 ммоль, 1,00 экв.), 1-(1-метилпиперидин-4-ил)азетидин-3-карбоновой кислоты (270 мг, 1,36 ммоль, 1,00 экв.), T3P (4,3 г, 6,76 ммоль, 5,00 экв., 50%) и триэтаноламина (688 мг, 6,80 ммоль, 5,00 экв.) в тетрагидрофуране (10 мл) перемешивали в течение 30 мин при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали этилацетатом, объединяли водные слои и концентрировали под вакуумом. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка, C18; подвижная фаза, метанол/H2O=5:95 с повышением до метанол/H2O=95:5 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 220 мг (34%) 3-фенил-N-[транс-3-([[1-(1-метилпиперидин-4-ил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамида в форме светло-желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=481,2.
[197] Этап 4: раствор 3-фенил-N-[транс-3-([[1-(1-метилпиперидин-4-ил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамида (160 мг, 0,33 ммоль, 1,00 экв.) в POCl3 (8 мл) перемешивали в течение 1 ч при 100 oC. Затем реакцию гасили путем добавления смеси вода/лед, значение pH раствора доводили до 8 водным раствором бикарбоната натрия. Полученный раствор экстрагировали дихлорметаном, органические слои объединяли, промывали солевым раствором, сушили и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (ВЭЖХ-10): колонка, XBridge Shield RP18 OBD, 5мкм, 19*150мм; подвижная фаза, вода (0,05% NH4HCO3) и ацетонитрил (27,0% ацетонитрил до 37,0% в течение 8 мин); детектор УФ 254/220 нм, в результате чего получали 19,6 мг (13%) переднего пика в форме белого твердого вещества и 4,2 мг (3%) второго пика в виде беловатого твердого вещества.
[198] Передний пик: ЖХ-МС (электроспрей, m/z): [M+H]+=463,2; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 9,45-9,43 (d, 1H, J=7,5Гц), 7,95-7,92 (m, 2H), 7,66 (s, 1H), 7,56-7,53 (m, 3H), 4,67-4,64 (m, 1H), 3,85-3,80 (m, 1H), 3,73-3,69(m, 1H), 3,60-3,55 (m, 2H), 3,29-3,24 (m, 3H), 2,68-2,62 (m, 5H), 2,12 (s, 3H), 2,04-1,98 (m, 1H), 1,91-1,84 (m, 2H), 1,62-1,58 (m, 2H), 1,21-1,11 (m, 2H); чистота, определенная методом ВЭЖХ: 97,8% при 254 нм.
[199] Второй пик: ЖХ-МС (электроспрей, m/z): [M+H]+=463,2; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 9,47-9,44 (d, 1H, J=7,8Гц), 7,95-7,92 (m, 2H), 7,66 (s, 1H), 7,56-7,54 (m, 3H), 4,72-4,64 (m, 1H), 3,77-3,74 (m, 1H), 3,62 (s, 2H), 3,29 (s, 3H), 2,71-2,66 (m, 6H), 2,40-2,30 (m, 1H), 2,12 (s, 3H), 1,89-1,75 (m, 4H), 1,29-1,25 (m, 2H); чистота, определенная методом ВЭЖХ: 95,1% при 254 нм.
Пример 26: 3-фенил-N-(транс-3-(5-(1-(2,2,2-трифторэтил)азетидин-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)изоксазол-5-карбоксамид
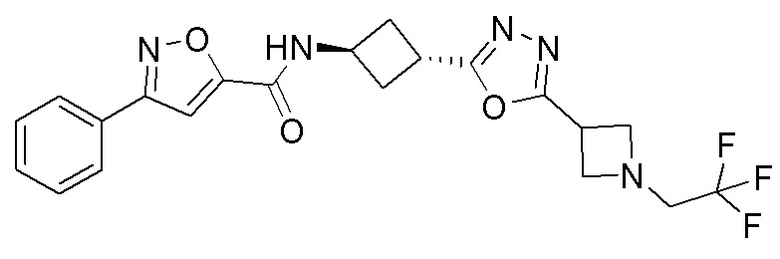
[200] Указанное в заголовке соединение получали с использованием способа, аналогичного показанному в примере 20.
Пример 27: N-(транс-3-(5-(1-(циклобутилметил)азетидин-3-ил)-1,3,4-оксадиазол-2-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
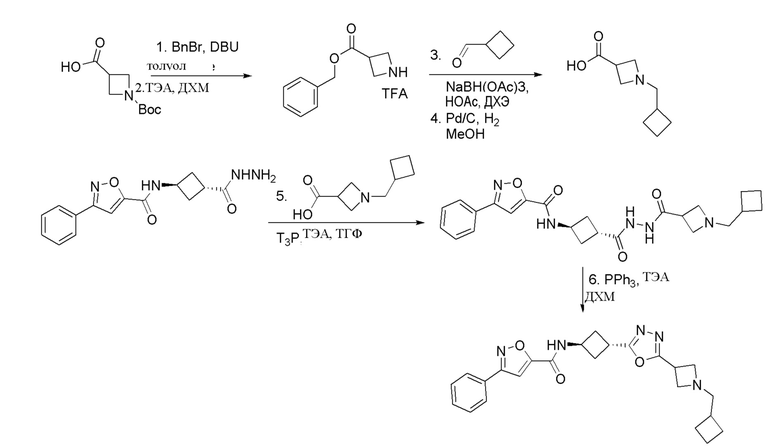
[201] Этап 1: 3-бензил-1-трет-бутилазетидин-1,3-дикарбоксилат: раствор 1-[(трет-бутокси)карбонил]азетидин-3-карбоновой кислоты (5 г, 24,85 ммоль, 1,00 экв.), BnBr (4,65 г, 27,19 ммоль, 1,10 экв.) и 1,8-диазабицикло(5,4,0)ундек-7-ена (DBU) (5,67 г, 37,24 ммоль, 1,50 экв.) в толуоле (80 мл) перемешивали в течение 4 ч при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали этилацетатом, органические слои объединяли. Полученную смесь промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на силикагелевую колонку со смесью этилацетат/петролейный эфир (1:6), в результате чего получали 5,4 г (75%) 3-бензил-1-трет-бутил азетидин-1,3-дикарбоксилата в виде бесцветного масла; ЖХ-МС (электроспрей, m/z): [M+H-Boc]+=192,0.
[202] Этап 2: 2,2,2-трифторуксусной кислоты бензилазетидин-3-карбоксилат: раствор 3-бензил-1-трет-бутил азетидин-1,3-дикарбоксилата (5,4 г, 18,53 ммоль, 1,00 экв.)) и трифторуксусной кислоты (7 мл).в дихлорметане (50 мл) перемешивали в течение ночи при комнатной температуре. Полученную смесь концентрировали под вакуумом, в результате чего получали 7 г (неочищенного) 2,2,2-трифторуксусной кислоты в виде светло-желтого масла; ЖХ-МС (электроспрей, m/z): [M+H-ТФУК]+=191,8.
[203] Этап 3: бензил-1-(циклобутилметил)азетидин-3-карбоксилат: раствор 2,2,2-трифторуксусной кислоты циклогексилметилазетидин-3-карбоксилата (1,3 г, 4,18 ммоль, 1,00 экв.), циколбутанкарбоксальдегида (358 мг, 4,26 ммоль, 1,00 экв.) и уксусной кислоты (255 мг, 4,25 ммоль, 1,00 экв.) в ДХЭ (20 мл) перемешивали в течение 30 мин, а затем добавляли NaBH(OAc)3 (1,44 г, 6,79 ммоль, 1,60 экв.). Полученный раствор перемешивали в течение 2 ч при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали дихлорметаном, органические слои объединяли. Полученную смесь промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем дихлорметаном/метанол (20:1), в результате чего получали 650 мг (59%) бензил-1-(циклобутилметил)азетидин-3-карбоксилата в виде бесцветного масла; ЖХ-МС (электроспрей, m/z): [M+H]+=260,1.
[204] Этап 4: 1-(циклобутилметил)азетидин-3-карбоновая кислота: К раствору бензил-1-(циклобутилметил)азетидин-3-карбоксилата (650 мг, 2,51 ммоль, 1,00 экв.) в метаноле (10 мл) добавляли палладий на угле (65 мг), раствор дегазировали и снова насыщали водородом. Полученный раствор перемешивали в течение 2 ч при комнатной температуре. Твердые вещества отфильтровали и концентрировали под вакуумом, в результате чего получали 425 мг (99%) 1-(циклобутилметил)азетидин-3-карбоновой кислоты в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=170,1.
[205] Этап 5: 3-фенил-N-[транс-3-([[1-(циклобутилметил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамид: раствор 3-фенил-N-[(транс-3-(гидразинкарбонил)циклобутил]-изоксазол-5-карбоксамида (300 мг, 1,00 ммоль, 1,00 экв.), 1-(циклобутилметил)азетидин-3-карбоновой кислоты (200 мг, 1,20 ммоль, 1,20 экв.), T3P (3,18 г, 5,00 ммоль, 5,00 экв., 50%) и триэтаноламина (505 мг, 4,99 ммоль, 5,00 экв.) в тетрагидрофуране (10 мл) перемешивали в течение 30 мин при комнатной температуре. Затем реакцию гасили путем добавления воды, экстрагировали этилацетатом, объединяли водные слои и концентрировали под вакуумом. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка, C18; подвижная фаза, MeCN/H2O=5:95 с повышением до MeCN/H2O=95:5 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 210 мг (47%) 3-фенил-N-[транс-3-([[1-(циклобутилметил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамида в форме светло-желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=452,1.
[206] Этап 6: 3-фенил-N-[транс-3-[5-[1-(циклобутилметил)азетидин-3-ил]-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамид: I2 (401 мг, 1,58 ммоль, 2,50 экв.), триэтаноламин (415 мг, 4,10 ммоль, 6,50 экв.) и 3-фенил-N-[транс-3-([[1-(циклобутилметил)азетидин-3-ил]формогидразидо]карбонил)циклобутил]-изоксазол-5-карбоксамид (285 мг, 0,63 ммоль, 1,00 экв.) добавляли к раствору Ph3P (414 мг, 1,58 ммоль, 2,50 экв.) в дихлорметане (20 мл) в атмосфере N2. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, нейтрализовали водой, а затем экстрагировали этилацетатом, органические слои объединяли. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем дихлорметаном/MeOH (25:1). Полученный неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (ВЭЖХ-10): колонка, X Bridge Prep C18 OBD, 19*150мм, 5мкм; подвижная фаза, вода (0,05% NH4HCO3) и ацетонитрил (30% ацетонитрил до 80% в течение 8 мин); детектор УФ 254 нм, в результате чего получали 125,6 мг (46%) 3-фенил-N-[транс-3-[5-[1-(циклобутилметил)азетидин-3-ил]-1,3,4-оксадиазол-2-ил]циклобутил]-изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=434,3; 1H-ЯМР (400 МГц, ДМСО-d6, ppm): δ 9,45-9,43 (d, 1H, J=7,6 Гц), 7,95-7,93 (m, 2H), 7,65 (s, 1H), 7,55-7,54 (m, 2H), 4,71-4,63 (m, 1H), 3,88-3,81 (m, 1H), 3,74-3,67 (m, 1H), 3,59-3,55 (t, 2H, J=7,2 Гц), 3,31 (s, 1H), 3,29-3,26 (d, 1H, J=6,8 Гц), 2,70-2,63 (m, 4H), 2,45-2,43 (m, 2H), 2,32-2,24 (m, 1H), 1,99-1,95 (m, 2H), 1,88-1,73 (m, 2H), 1,67-1,59 (m, 2H); чистота, определенная методом ВЭЖХ: 99,3% при 254 нм.
Примеры 28 и 29: N-(цис-3-(5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-(цис-3-(4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
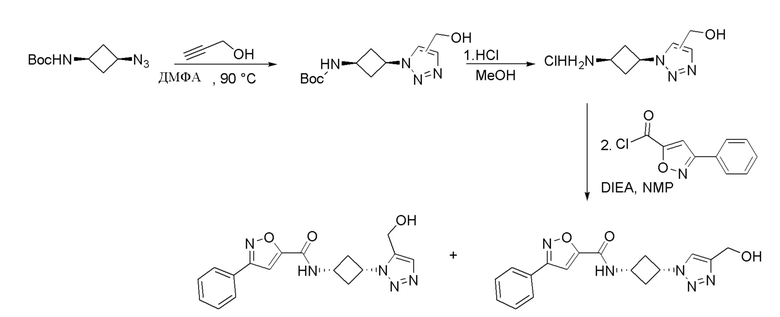
[207] Этап 1: 1-[цис-3-аминоциклобутил]-1H-1,2,3-триазол-5-ил]метанол гидрохлорид: раствор трет-бутил N-[цис-3-[4/5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]карбамата (приготовленный в соответствии с процедурой, аналогичной примеру 36; 400 мг, 1,49 ммоль, 1,00 экв.) в смеси хлороводород/MeOH (5 мл) перемешивали в течение 18 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом и разбавляли 3 миллилитрами диоксана. Твердые вещества собирали фильтрацией и сушили в сушильном шкафу при пониженном давлении, в результате чего получали 301 мг (неочищенного) 1-[цис-3-аминоциклобутил]-1H-1,2,3-триазол-5-ил]метанола гидрохлорида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=167,1.
[208] Этап 2: 3-фенил-N-[цис-3-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид и 3-фенил-N-[цис-3-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид: DIEA (диизопропиленамин) (787 мг, 6,09 ммоль, 3,00 экв.) добавляли по каплям к холодному раствору (10 °C) [1-[цис-3-аминоциклобутил]-1H-1,2,3-триазол-4/5-ил]метанол гидрохлорида (410 мг, 2,00 ммоль, 1,00 экв.) в N-метил-2-пирролидоне (NMP) (4 мл) и перемешивали в течение 30 мин при 25°C, после чего по каплям при перемешивании добавляли раствор 3-фенилизоксазол-5-карбонилхлорида (310 мг, 1,64 ммоль, 1,00 экв.) в N-метил-2-пирролидоне (NMP) (1 мл) при температуре от 0 до 10 °C. Реакционную смесь перемешивали в течение 30 мин, а затем нейтрализовали путем добавления 0,5 мл метанола. Эту смесь перемешивали при 25°C в течение 30 мин, затем добавляли 40 мл воды. Неочищенное твердое вещество собирали фильтрацией и очищали препаративной ВЭЖХ: колонка: XBridge BEH130 Prep C18 OBD 19*150 мм, 5мк, 13нм; подвижная фаза A: вода (10 ммоль/л NH4HCO3), подвижная фаза B: ацетонитрил; Скорость потока: 20 мл/мин; градиент: 22% B до 47% B в течение 8 мин; 254 нм, в результате чего получали 152 мг (22%) 3-фенил-N-[цис-3-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества и 143,15 мг (28%) 3-фенил-N-[цис-3-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества.
[209] 3-фенил-N-[цис-3-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид: ЖХ-МС (электроспрей, m/z): [M+1]+=340,0; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 9,48-9,45 (d, J=7,5 Гц, 1H), 7,94-7,91 (m, 2H), 7,66-7,62 (m, 2H), 7,56-7,54 (m, 3H), 5,46-5,42 (m, 1H), 4,89-4,80 (m, 1H), 4,58-4,57 (d, J=5,4 Гц, 2H), 4,45-4,35 (m, 1H), 2,92-2,80 (m, 4H); чистота, определенная методом ВЭЖХ: 99,2% при 254 нм.
[210] 3-фенил-N-[цис-3-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид: ЖХ-МС (электроспрей, m/z): [M+1]+=340,0; 1H-ЯМР (300 МГц, ДМСО-d6, ppm): δ 9,41-9,39 (d, J=8,4 Гц, 1H), 8,16 (s, 1H), 7,96-7,93 (m, 2H), 7,67 (s, 1H), 7,56-7,54 (m, 3H), 5,23-5,19 (t, J=5,6 Гц, 1H), 4,98-4,92 (m, 1H), 4,55-4,53 (d, J=5,4 Гц, 2H), 4,45-4,37 (m, 1H), 2,98-2,90 (m, 2H), 2,75-2,65 (m, 2H); чистота, определенная методом ВЭЖХ: 99,3% при 254 нм.
Примеры 30 и 31: N-(транс-3-(5-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-5-фенилизоксазол-3-карбоксамид и N-(транс-3-(4-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-5-фенилизоксазол-3-карбоксамид
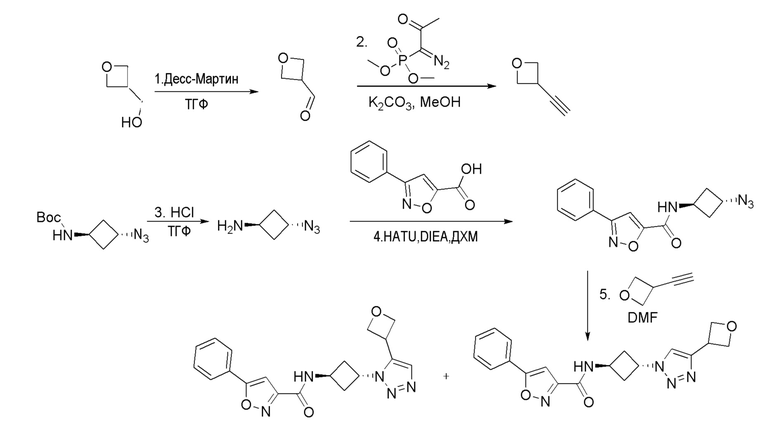
[211] Этап 1: оксетан-3-карбальдегид: раствор оксетан-3-илметанола (2 г, 22,70 ммоль, 1,00 экв.) в дихлорметане (20 мл) и 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он (11,7 г, 27,59 ммоль, 1,00 экв.) перемешивали в течение 2 ч при 25 °C. Твердые вещества отфильтровывали и концентрировали смесь под вакуумом, в результате чего получали 2,1 г (неочищенного) оксетан-3-карбальдегида в виде желтого масла.
[212] Этап 2: 3-этинилоксетан: раствор оксетан-3-карбальдегида (2,1 г, 24,39 ммоль, 1,00 экв.), карбоната калия (6,6 г, 47,75 ммоль, 2,00 экв.) и диметил-(1-диазо-2-оксопропил)фосфоната (7 г, 36,44 ммоль, 1,50 экв.) в метаноле (30 мл) перемешивали в течение 3 ч при 25 °C. Полученный раствор разбавляли 150 миллилитрами воды, экстрагировали этилацетатом (2×100 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×100 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 820 мг (41%) 3-этинилоксетана в виде бесцветного масла.
[213] Этап 3: Транс-3-азидоциколбутен-1-амин: раствор трет-бутил N-[транс-3-азидоциклобутил]карбамата (1 г, 4,71 ммоль, 1,00 экв.) в тетрагидрофуране (20 мл)/конц. вод. HCl (5 мл) перемешивали в течение 2 ч при 25°C. Полученную смесь концентрировали под вакуумом, в результате чего получали 800 мг (неочищенного) цис-3-азидоциколбутен-1-амина в виде желтого масла.
[214] Этап 4: 3-фенил-N-[транс-3-азидоциклобутил]-изоксазол-5-карбоксамид: HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний-3-оксид гексафторфосфат) (1,37 г, 3,60 ммоль, 1,50 экв.), DIEA (диизопропиленамин) (928 мг, 7,18 ммоль, 3,00 экв.) и 3-фенил-изоксазол-5-карбоновую кислоту (453 мг, 2,39 ммоль, 1,00 экв.) добавляли к раствору транс-3-азидоциколбутен-1-амина (800 мг, 7,13 ммоль, 1,00 экв.) в дихлорметане (15 мл) и перемешивали смесь в течение 2 ч при 25 °C. Полученный раствор разбавляли 150 миллилитрами воды, экстрагировали этилацетатом (2 x100 мл), органические слои объединяли. Органический слой промывали солевым раствором (2×100 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и элюировали смесью петролейный эфиир:этилацетат (10:1), в результате чего получали 390 мг (19%) 3-фенил-N-[транс-3-азидоциклобутил]-изоксазол-5-карбоксамида в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=284,1.
[215] Этап 5: 5-фенил-N-[транс-3-[4-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-3-карбоксамид и 5-фенил-N-[транс-3-[5-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-3-карбоксамид: раствор 3-фенил-N-[(транс-3-азидоциклобутил]изоксазол-5-карбоксамида (283 мг, 1,00 ммоль, 1,00 экв.) и 3-этинилоксетана (410 мг, 4,99 ммоль, 5,00 экв.) в ДМФА (10 мл) перемешивали в течение 16 ч при 100 °C. Полученный раствор разбавляли 100 миллилитрами воды, экстрагировали этилацетатом (2×100 мл), объединенные органические слои сушили на безводном сульфате натрия и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ТСХ (петролейный эфиир:этилацетат=1:5). Полученные изомеры разделяли хиральной препаративной ВЭЖХ с использованием следующих условий: (Prep-HPLC-032): колонка, Phenomenex Lux 5мк, заполненная целлюлозой Cellulose -4 AXIA, 250*21,2 мм, 5мкм; подвижная фаза, гексан и этанол (поддерживали 50,0% этанола в течение 20 мин); детектор УФ 254/220 нм, в результате чего получали 16,8 мг (5%) 5-фенил-N-[транс-3-[5-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-3-карбоксамида в форме белого твердого вещества и 29,1 мг (8%) 3-фенил-N-[транс-3-[4-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида в форме белого твердого вещества.
[216] 5-фенил-N-[транс-3-[5-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-3-карбоксамид: ЖХ-МС (электроспрей, m/z): [M+H]+=366,1; 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,51-9,49 (d, J=7,2 Гц, 1H), 7,96-7,94 (m, 3H), 7,68 (s, 1H), 7,57-7,56 (m, 3H), 4,97-4,93 (m, 3H), 4,75-4,70 (m, 1H), 4,66-4,62 (m, 2H), 4,48-4,42 (m, 1H), 2,86-2,74 (m, 4H); чистота, определенная методом ВЭЖХ: 99,5% при 254 нм.
[217] 5-фенил-N-[транс-3-[4-(оксетан-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-3-карбоксамид: ЖХ-МС (электроспрей, m/z): [M+H]+=366,1; 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,52-9,50 (d, J=6,9 Гц, 1H), 8,33 (s, 1H), 7,96-7,93 (m, 2H), 7,68 (s, 1H), 7,56-7,54 (m, 3H), 5,34-5,24 (m, 1H), 4,92-4,88 (m, 2H), 4,76-4,65 (m, 3H), 4,42-4,32 (m, 1H), 2,91-2,75 (m, 4H); чистота, определенная методом ВЭЖХ: 98% при 254 нм.
Пример 32 и 33: N-(транс-3-(4-(1-метилазетидин-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-(транс-3-(5-(1-метилазетидин-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
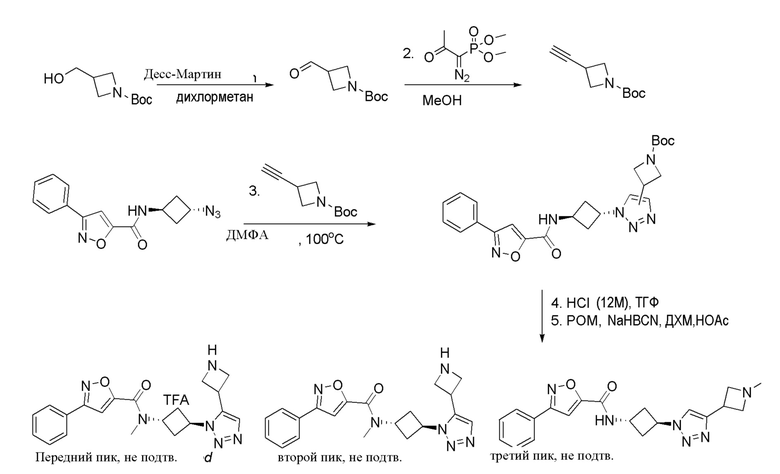
[218] Этап 1: трет-бутил-3-формилазетидин-1-карбоксилат: раствор трет-бутил-3-(гидроксиметил)азетидин-1-карбоксилата (3,74 г, 19,97 ммоль, 1,00 эквив.) и реагент Десса-Мартина(12,72 г, 30,00 ммоль, 1,50 экв.) в дихлорметане (100 мл) перемешивали в течение 2 ч при комнатной температуре. Твердые вещества отфильтровывали, полученную смесь концентрировали под вакуумом, в результате чего получали 3,8 г (неочищенного) трет-бутил-3-формилазетидин-1-карбоксилата в форме белого твердого вещества.
[219] Этап 2: трет-бутил-3-этинилазетидин-1-карбоксилат: раствор трет-бутил-3-формилазетидин-1-карбоксилата (3,7 г, 19,98 ммоль, 1,00 экв.), карбоната калия (8,28 г, 59,91 ммоль, 3,00 экв.) и диметил(1-диазо-2-оксопропил)фосфоната (5,76 г, 29,98 ммоль, 1,50 экв.) в метаноле (50 мл) перемешивали в течение 3 ч при комнатной температуре. Полученный раствор разбавляли 200 миллилитрами эфира, промывали насыщенным водным раствором бикарбоната натрия (2×200 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом, в результате чего получали 3,282 г (неочищенного) трет-бутил-3-этинилазетидин-1-карбоксилата в виде желтого масла.
[220] Этап 3: трет-бутил-3-[1-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1H-1,2,3-триазол-4/5-ил]азетидин-1-карбоксилат: раствор 3-фенил-N-[транс-3-азидоциклобутил]изоксазол-5-карбоксамида (327 мг, 1,15 ммоль, 1,00 экв.) и трет-бутил-3-этинилазетидин-1-карбоксилата (627 мг, 3,46 ммоль, 3,00 экв.) в ДМФА (4 мл) помещали в микроволновый реактор на 6 ч при 140 °C. Полученную смесь концентрировали под вакуумом и наносили остаток на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:1), в результате чего получали 553 мг (неочищенной) смеси трет-бутил-3-[1-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1H-1,2,3-триазол-5-ил]азетидин-1-карбоксилата и трет-бутил-3-[1-[транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1H-1,2,3-триазол-4-ил]азетидин-1-карбоксилата в виде желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=465,3.
[221] Этап 4: 3-фенил-N-[транс-3-[4/5-(азетидин-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид гидрохлорид: раствор смеси трет-бутил-3-[1-транс-3-(3-фенилизоксазол-5-амидо)циклобутил]-1H-1,2,3-триазол-4/5-ил]азетидин-1-карбоксилата (553 мг, 1,19 ммоль, 1,00 экв.) в тетрагидрофуране (10 мл)/водный раствор хлороводородной кислоты (6н., 6 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом, в результате чего получали 551 мг (неочищенной) смеси 3-фенил-N-[транс-3-[4/5-(азетидин-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамид гидрохлорида в виде коричневого твердого вещества; ЖХ-МС (электроспрей, m/z): [M-HCl+H]+=365,3.
[222] Этап 5: N-(транс-3-(4-(1-метилазетидин-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-(транс-3-(5-(1-метилазетидин-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид: раствор смеси 3-фенил-N-[транс-3-[4/5-(азетидин-3-ил)-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида гидрохлорида, РОМ (302 мг, 6,86 ммоль, 4,99 экв.) и уксусной кислоты (165 мг, 2,75 ммоль, 2,00 экв.) в ДХМ (20 мл) перемешивали в течение 30 мин при комнатной температуре. К реакционной смеси добавляли NaBHCN (346 мг, 5,49 ммоль, 4,00 экв.) и перемешивали ее в течение 3 ч при комнатной температуре. Эту смесь концентрировали под вакуумом и очищали неочищенный продукт препаративной ВЭЖХ с использованием следующих условий: (ВЭЖХ-10): колонке, XBridge C18 OBD Prep, 19 мм X 250 мм; подвижная фаза, вода (10 ммоль/л NH4HCO3) и ацетонитрил (40,0% ацетонитрил до 90,0% в течение 8 мин); детектор УФ 254/220 нм. В результате получали 50 мг неочищенного первого пика, 20 мг (4%) второго пика в форме белого твердого вещества и 75 мг (15%) третьего пика) в форме белого твердого вещества. Затем первый неочищенный пик очищали препаративной ВЭЖХ с использованием следующих условий: (ВЭЖХ-10): колонка - XBridge C18 OBD Prep, 19 мм X 250 мм; подвижная фаза, вода (0,05% ТФУК) и ацетонитрил (20,0% ацетонитрил до 50,0% в течение 10 мин); детектор УФ 254/220 нм, в результате чего получали 30 мг продукта в виде желтого масла.
[223] Первый пик (предполагаемая структура):
[224] Второй пик (предполагаемая структура): ЖХ-МС (электроспрей, m/z): [M+H]+=379,2; 1H-ЯМР (400 МГц, CD3OD, ppm): 8,05(s, 1H), 7,89-7,88 (d, J=2,8 Гц, 2H), 7,52-7,51 (m, 3H ), 7,43 (s, 1H), 5,11 (br, 1H), 4,90-4,88 (m, 1H), 4,74-7,54 (m, 1H), 4,54-4,46 (m, 2H), 4,36-4,25 (m, 2H), 3,10-2,91 (m, 5H), 2,89-2,88 (m, 2H); чистота, определенная методом ВЭЖХ: 99,4% при 254 нм.
[225] Третий пик: N-(транс-3-(4-(1-метилазетидин-3-ил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид: ЖХ-МС [M+H]+=379,3; 1H-ЯМР (400 МГц, ДМСО-d6, ppm): δ 9,53-9,51 (d, J=6,8 Гц, 1H), 8,23 (s, 1H), 7,96-7,74 (m, 2H), 7,69 (s, 1H), 7,56-7,54 (m, 3H), 5,28-5,24 (m, 1H), 4,72-4,67 (m, 1H), 3,64-3,56 (m, 3H), 3,12-3,09 (m, 2H), 2,88-2,75 (m, 4H), 2,08 (s, 3H); числота, измеренная методом ВЭЖХ; 98,7% при 254 нм.
Примеры 34: N-(транс-3-(5-(1-(метилсульфонил)этил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
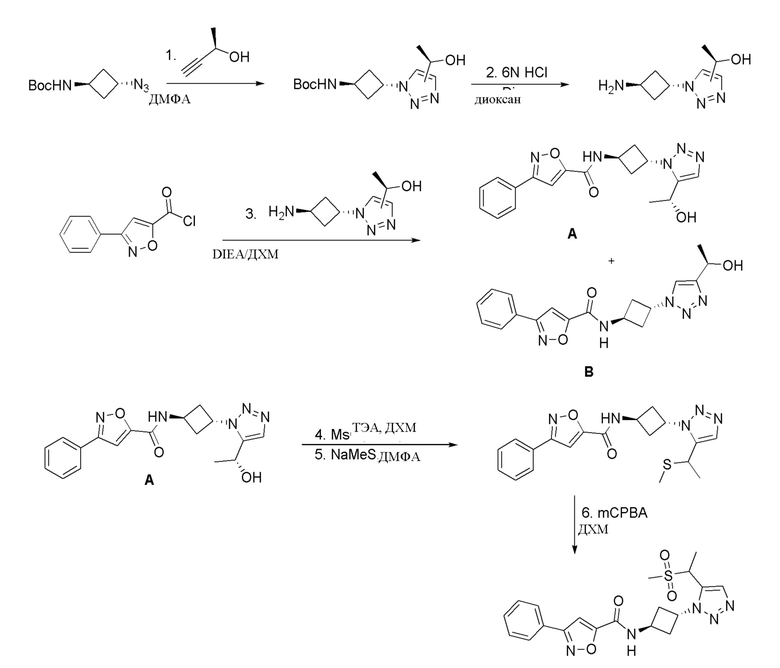
Получение промежуточных соединений A и B:
[226] Этап 1: N-[транс-3-[4/5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]карбамат: раствор трет-бутил N-[транс-3-азидоциклобутил]карбамата (2 г, 9,42 ммоль, 1,00 экв.) и (2R)-бут-3-ин-2-ола (3,3 г, 47,08 ммоль, 5,00 экв.) в ДМФА (5 мл) перемешивали в течение ночи при 100°C в масляной ванне. Полученную смесь концентрировали под вакуумом. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетатом/петролейный эфир (3:1), в результате чего получали 2,1 г (79%) смеси трет-бутил N-[транс-3-[4/5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]карбамата в форме светло-желтого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=283,2.
[227] Этап 2: (1R)-1-[1-[транс-3-аминоциклобутил]-1H-1,2,3-триазол-4/5-ил]этанол: раствор смеси трет-бутил N-[транс-3-[4/5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]карбамата в диоксане (10 мл)/ водный раствор хлороводородной кислоты (6н., 3 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом, в результате чего получали 1,45 г (неочищенной) смеси (1R)-1-[1-[транс-3-аминоциклобутил]-1H-1,2,3-триазол-4/5-ил]этанола в форме светло-желтого твердого вещества; ЖХ-МС-PH (электроспрей, m/z): [M+H]+=183,1.
[228] Этап 3: N-(транс-3-(5-((R)-1-гидроксиэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид (A) и N-(транс-3-(4-((R)-1-гидроксиэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид (B): DIEA (диизопропиленамин) (2,55 г, 3,00 экв.) и 3-фенилизоксазол-5-карбонил хлорид (1,77 г, 8,53 ммоль, 1,30 экв.) добавляли по каплям к холодному (0 °C) раствору смеси (1R)-1-[1-[транс-3-аминоциклобутил]-1H-1,2,3-триазол-4/5-ил]этанола в дихлорметане (20 мл) и перемешивали смесь в течение 2 ч при 0 °C. Полученную смесь промывали водным раствором хлороводородной кислоты (2N) (1×50 мл) и карбонатом калия (5%) (1×100 мл), концентрировали под вакуумом, неочищенный продукт очищали препаративной ВЭЖХ, в результате чего получали 0,236 г (10%) N-(транс-3-(5-((R)-1-гидроксиэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамида и 0,333 г (14%) N-(транс-3-(4-((R)-1-гидроксиэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=354,2.
Получение N-(транс-3-(5-(1-(метилсульфонил)этил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид:
[229] Этап 4: N-(транс-3-(5-((R)-1-хлорэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид: MsCl (81,3 мг, 2,00 экв.) добавляли по каплям к имеющему температуру 0°C раствору 3-фенил-N-[(транс-3-[5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида (126 мг, 0,36 ммоль, 1,00 экв.) и триэтаноламина (108 мг, 3,00 экв.) в дихлорметане (20 мл) и перемешивали раствор в течение 5 ч при комнатной температуре. Эту смесь разбавляли 30 миллилитрами дихлорметана, промывали водным раствором CuSO4 (2×30 мл) и концентрировали под вакуумом, в результате чего получали 151 мг (неочищенного) N-(транс-3-(5-((R)-1-хлорэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамида в виде коричневого масла; ЖХ-МС (электроспрей, m/z): [M+H]+=372,1.
[230] Этап 5: раствор N-(транс-3-(5-((R)-1-хлорэтил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамида (151 мг, 0,41 ммоль, 1,00 экв.) и NaSMe (50 мг, 2,00 экв.) в ДМФА (5 мл) перемешивали в течение 5 ч при 100°C в масляной ванне. Затем реакцию гасили путем добавления 20 миллилитров воды, экстрагировали этилацетатом (3×20 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×10 мл) и концентрировали под вакуумом, в результате чего получали 189 мг (неочищенного) 3-фенил-N-[транс-3-[5-[1-(метилсульфанил)этил]-1H-1,2,3-триазол-1-ил]циклобутил]-изоксазол-5-карбоксамида в виде коричневого масла; ЖХ-МС (электроспрей, m/z): [M+H]+=384,4.
[231] Этап 6: mCPBA (338 мг, 1,96 ммоль, 4,00 экв.) добавляли несколькими порциями к имеющему температуру 0°C раствору 3-фенил-N-[транс-3-[5-[1-(метилсульфанил)этил]-1H-1,2,3-триазол-1-ил]циклобутил]изоксазол-5-карбоксамида (189 мг, 0,49 ммоль, 1,00 экв.) в дихлорметане (10 мл) и перемешивали смесь в течение 5 ч при комнатной температуре. Реакционную смесь разбавляли 50 миллилитрами дихлорметана, промывали водным раствором Na2S2O3 (1×50 мл) и концентрировали под вакуумом. Неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (Water): колонка - Xbridge Prep C18, 5 мк,19*150 мм; подвижная фаза, вода с 0,08% NH4HCO3 и CH3CN (30% CH3CN до 70% CH3CN в течение 10 мин, до 95% в течение 2 мин и вниз до 30% в течение 2 мин); детектор УФ 254 нм и 220 нм, в результате чего получали 23,3 мг (11%) 3-фенил-N-[транс-3-[5-[1-метансульфонилэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=416,2; 1H-ЯМР (ДМСО-d6, 400 МГц): δ 9,52-9,49 (d, J=12,0 Гц, 1H), 7,95-7,93 (m, 3H), 7,69 (s, 1H), 7,56-7,54 (m, 3H), 5,36-5,29 (m, 1H), 4,93-4,87 (m, 1H), 4,85-4,76 (m, 1H), 3,01 (s, 3H), 2,92-2,78 (m, 4H), 1,69-1,67 (d, J=7,2 Гц, 3H); чистота, определенная методом ВЭЖХ: 99,2% при 254 нм.
Пример 35: N-(транс-3-(4-(1-(метилсульфонил)этил)-1H-1,2,3-триазол-1-ил)циклобутил)-3-фенилизоксазол-5-карбоксамид
[232] Указанное в заголовке соединение получали с использованием процедуры, аналогичной показанной в примере 34, с использованием промежуточного соединения B в качестве исходного материала. Неочищенный продукт очищали препаративной ВЭЖХ с использованием следующих условий: (Water): колонка, Xbridge Prep C18, 5 мкм,19*150 мм; подвижная фаза, вода с 0,08% NH4HCO3 и CH3CN (30% CH3CN до 75% CH3CN в течение 10 мин, до 95% в течение 2 мин с понижение до 30% в течение 2 мин); детектор УФ 254 нм и 220 нм, в результате чего получали 54,5 мг (17,6%) 3-фенил-N-[транс-3-[5-[1-метансульфонилэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-изоксазол-5-карбоксамида в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+H]+=416,2; 1H-ЯМР (ДМСО-d6, 400 МГц): δ 9,54-9,52 (d, J=7,2 Гц, 1H), 8,43 (s, 1H), 7,96-7,94 (m, 2H), 7,68 (s, 1H), 7,56-7,54 (m, 3H), 5,37-5,29 (m, 1H), 4,72-4,68 (m, 2H), 2,95 (s, 3H), 2,88-2,81 (m, 4H), 1,68-1,66 (d, J=7,2 Гц, 3H); чистота, определенная методом ВЭЖХ: 98,4% при 254 нм.
Пример 36: 3-(4-фторфенил)-N-(транс-3-(5-((R)-1-гидроксиэтил)-1,3,4-оксадиазол-2-ил)циклобутил)изоксазол-5-карбоксамид
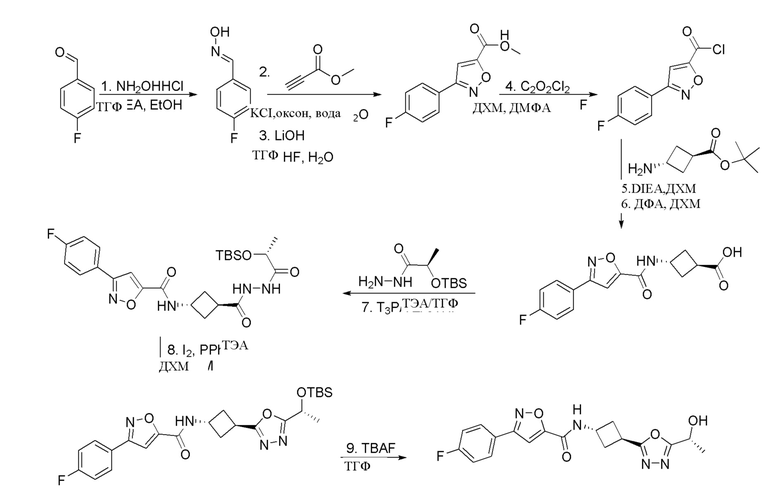
[233] Указанное в заголовке соединение получали с использованием процедуры, аналогичной показанной в примере 13, и очищали методом препаративной флэш-ВЭЖХ с использованием следующих условий: (IntelFlash-1): колонка C18; подвижная фаза, H2O/CH3CN=100:1 с повышением до H2O/CH3CN=1:100 в течение 30 мин; детектор УФ 254 нм, в результате чего получали 37,7 мг (25%) в форме белого твердого вещества; ЖХ-МС (электроспрей, m/z): [M+1]+=373,0; 1H-ЯМР (400 МГц, ДМСО-d6): δ9,49-9,47 (d, J=7,6 Гц, 1H), 8,03-7,98 (m, 2H), 7,68 (s, 1H), 7,42-7,37 (m, 2H), 5,97-5,95 (d, J=6 Гц, 1H), 7,96-4,89 (m, 1H), 4,71-4,65 (m, 1H), 3,76-3,72 (m, 1H), 2,73-2,60 (m, 4H), 1,50-1,48 (d, J=6,4 Гц, 3H); чистота, определенная методом ВЭЖХ: 99,8% при 254 нм.
Примеры 37 и 38: N-((1S,3s)-3-((5-((R)-1-гидроксиэтил)-1,3,4-оксадиазол-2-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-((1R,3r)-3-((5-((R)-1-гидроксиэтил)-1,3,4-оксадиазол-2-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид

[234] Этап 1: Этил 2-(3-((трет-бутоксикарбонил)амино)циклобутилиден)ацетат. В круглодонную колбу объемом 250 мл помещали раствор трет-бутил N-(3-оксоциклобутил)карбамат (13 г, 70,19 ммоль, 1,00 эквив.) в толуоле (100 мл), затем (карбэтоксиметилен)трифенилфосфоран (CEMTPP) (25,7 г, 73,77 ммоль, 1,05 эквив.) добавляли. Полученный раствор перемешивали в течение 2 ч при 100oC. Полученную смесь концентрировали под вакуумом, затем остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:5), в результате чего получали 16,7 г (93%) этил-2-(3-[[(трет-бутокси)карбонил]амино]циклобутилиден)ацетата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=256,2.
[235] Этап 2: Этил-2-(3-((трет-бутоксикарбонил)амино)циклобутил)ацетат. В круглодонную колбу объемом 250 мл помещали раствор этил-2-(3-[[(трет-бутокси)карбонил]амино]циклобутилиден)ацетата (16,7 г, 65,41 ммоль, 1,00 эквив., приготовленный выше) в MeOH (100 мл), затем Pd на угле (1 г) добавляли. Раствор дегазировали и снова насыщали водородом. Полученный раствор перемешивали в течение 3 ч при к.т. Твердые вещества удаляли фильтрацией, затем полученный раствор концентрировали при пониженном давлении, в результате чего получали 15,5 г (92%) этил-2-(3-[[(трет-бутокси)карбонил]амино]циклобутил)ацетата в виде бесцветного масла. ЖХМС (электроспрей, m/z): [M+H]+=258,2.
[236] Этап 3: 2-(3-[[(трет-Бутокси)карбонил]амино]циклобутил)уксусная кислоты. В круглодонную колбу объемом 500 мл помещали раствор этил-2-(3-[[(трет-бутокси)карбонил]амино]циклобутил)ацетата (15,5 г, 60,23 ммоль, 1,00 эквив.) в ТГФ/H2O (150/50 мл) и LiOH (2,16 г, 90,20 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при к.т., затем полученную смесь концентрировали при пониженном давлении. Полученный раствор разбавляли 200 миллилитрами водного раствора NaHSO4, экстрагировали 3×150 мл EtOAc, а затем органические экстракты объединяли. Раствор промывали 2×100 мл солевого раствора, сушили и концентрировали при пониженном давлении, в результате чего получали 13,8 г (неочищенной) 2-(3-[[(трет-бутокси)карбонил]амино]циклобутил)уксусной кислоты в виде бесцветного масла. ЖХМС (электроспрей, m/z): [M+H]+=230,1.
[237] Этап 4: трет-бутил-N-(3-[2-[(2R)-2-[(трет-бутилдиметилсилил)окси] пропангидразидо]-2-оксоэтил]циклобутил)карбамат. В круглодонную колбу объемом 500 мл помещали раствор 2-(3-[[(трет-бутокси)карбонил]амино]циклобутил)уксусной кислоты (13 г, 56,70 ммоль, 1,00 эквив.) в ТГФ (250 мл). К этому раствору добавляли (2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразид (18,6 г, 85,18 ммоль, 1,50 эквив.), триэтаноламин (28,9 г, 285,60 ммоль, 5,00 эквив.) и T3P (72 г, 113,21 ммоль, 2,00 эквив.). Реакционную смесь перемешивали в течение 2 ч при к.т., затем разбавляли 400 миллилитрами воды и экстрагировали этилацетатом (3×300 мл). Органические экстракты объединяли, промывали солевым раствором (2×300 мл), сушили на Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью петролейный эфир/EtOAc (2:1), в результате чего получали 14,5 г (60%) трет-бутил-N-(3-[2-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразидо]-2-оксоэтил]циклобутил)карбамата в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=430,3.
[238] Этап 5: трет-бутил-N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]карбамат. В трехгорлую круглодонную колбу объемом 250 мл, продутую и заполненную азотом, помещали раствор PPh3 (2,84 г, 10,83 ммоль, 2,00 эквив.) в ДХМ (100 мл). К этому раствору добавляли I2 (2,75 г, 10,83 ммоль, 2,00 эквив.), триэтаноламин (3,7 г, 36,56 ммоль, 5,00 эквив.) и трет-бутил-N-[3-([N-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропаноил]гидразинкарбонил]метил)циклобутил]карбамат (3,1 г, 7,22 ммоль, 1,00 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., затем разбавляли 150 миллилитрами воды и экстрагировали этилацетатом (2×150 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью петролейный эфир/EtOAc (5:1), в результате чего получали 2 г (67%) трет-бутил-N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]карбамата в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=412,3. 1H-ЯМР (400 МГц, CDCl3): δ 5,11-5,02 (m, 1H), 4,15-4,08 (m, 1H), 3,02-2,92 (m, 2H), 2,59-2,52 (m, 1H), 2,26-2,19 (m, 1H), 2,14-2,08 (m, 1H), 1,70-1,62 (m, 2H), 1,58-1,56 (d, J=7,6 Гц, 2H), 1,43 (s, 9H), 0,88 (s, 9H), 0,11 (s, 3H), 0,04 (s, 3H).
[239] Этап 6: 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циколбутен-1-амин. В круглодонную колбу объемом 100 мл помещали раствор трет-бутил N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]карбамата (2 г, 4,86 ммоль, 1,00 эквив.) в ДХМ (50 мл), затем добавляли ТФУК (3 мл, 8,00 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., затем концентрировали при пониженном давлении, в результате чего получали 2,5 г (неочищенного) 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циколбутен-1-амина в виде желтого неочищенного масла. ЖХМС (электроспрей, m/z): [M+H]+=312,2.
[240] Этап 7: N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циколбутен-1-амина (1 г, неочищенного) в ДХМ (50 мл), затем добавляли 3-фенил-1,2-оксазол-5-карбоновую кислоту (468 мг, 2,47 ммоль, 1,00 эквив.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (1,28 г, 3,37 ммоль, 1,20 эквив.) и DIEA (диизопропиленамин) (1,1 мл, 2,80 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., промывали водой (3x 50 мл), а затем концентрировали при пониженном давлении, в результате чего получали 680 мг (неочищенного) N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамида в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=483,2.
[241] Этап 8: N-[3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу помещали раствор N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамида (1 г, 2,07 ммоль, 1,00 эквив.) в ТГФ (20 мл), затем добавляли Py.HF (2,5 мл, 8,00 эквив.). Полученный раствор перемешивали в течение 2 ч при 0°C, затем нейтрализовали путем добавления 100 мл солевого раствора. Полученную смесь экстрагировали этилацетатом (3×100 мл), затем органические экстракты объединяли, промывали NaHCO3 (2×100 мл), солевым раствором (2x 100 мл) и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью петролейный эфир/EtOAc (1:3), в результате чего получали 460 мг N-[3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамида в виде светло-желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=369,2.
[242] N-[3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамид (520 мг, 1,41 ммоль, 1,00 эквив.) очищали препаративной сверхкритической жидкостной хроматографией, с использованием следующих условий: колонка: Phenomenex Lux 5мк с целлюлозой Cellulose-4, 250*50 мм; подвижная фаза A:CO2:50, подвижная фаза B: MeOH-преп.:50; Скорость потока: 150 мл/мин; 220 нм; время удерживания 1:6,38; время удерживания 2:7,33, в результате чего получали 98,6 мг (19%) 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 78,7 мг (15%) 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[243] 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=369,0. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,23-9,20 (d, J=7,8 Гц, 1H), 7,94-7,91 (m, 2H), 7,62 (s, 1H), 7,55-7,53 (m, 3H), 5,92 (s, 1H), 4,92-4,85 (q, J=6,6 Гц, 1H), 4,35-4,27 (m, 1H), 2,99-2,97 (d, J=6,6 Гц, 2H), 2,45-2,35 (m, 3H), 1,98-1,92 (m, 2H), 1,47-1,44 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,0%.
[244] 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=369,0. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,23-9,20 (d, J=8,4 Гц, 1H), 7,94-7,91 (m, 2H), 7,62 (s, 1H), 7,55-7,53 (m, 3H), 5,92 (s, 1H), 4,92-4,85 (q, J=6,6 Гц, 1H), 4,35-4,28 (m, 1H), 2,99-2,97 (d, J=6,6 Гц, 2H), 2,45-2,35 (m, 3H), 1,98-1,92 (m, 2H), 1,47-1,44 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,3%.
Пример 39 и 40: 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
[245] Указанные в заголовке соединения получали с использованием методики, аналогичной показанной в Примере 37. Эту смесь разделяли хоральной препаративной ВЭЖХ, с использованием следующих условий: колонка: Repaired IA, 21,2*150 мм, 5 мкм; подвижная фаза A:гекс-ВЭЖХ, подвижная фаза B: EtOH-ВЭЖХ; Скорость потока: 20 мл/мин; градиент: 50 B до 50 B в течение 11,5 мин; 254/220 нм; время удерживания 1:7,21; время удерживания 2:8,75. В результате получали 95 мг (34%) 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 79,6 мг (28%) 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[246] 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=386,9. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,23-9,20 (d, J=7,8 Гц, 1H), 8,02-7,97 (m, 2H), 7,63 (s, 1H), 7,42-7,36 (m, 2H), 5,92-5,90 (d, J=5,4 Гц 1H), 4,91-4,87 (m, 1H), 4,35-4,28 (m, 1H), 2,99-2,97 (d, J=6,9 Гц, 2H), 2,45-2,40 (m, 3H), 1,97-1,92 (m, 2H), 1,47-1,44 (d, J=6,9 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,3%.
[247] 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=386. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,31-9,29 (d, J=7,2 Гц, 1H), 8,01-7,96 (m, 2H), 7,64 (s, 1H), 7,41-7,35 (m, 2H), 5,92-5,90 (d, J=5,7 Гц 1H), 4,93-4,84 (m, 1H), 4,58-4,51 (q, J=7,5 Гц, 1H), 3,10-3,07 (d, J=7,8 Гц, 2H), 2,70-2,64 (s, 1H), 2,38-2,29 (m, 2H), 2,18-2,09 (m, 2H), 1,46-1,44 (d, J=6,6 Гц, 3H ). Чистота (ВЭЖХ, 254 нм): 98,0%.
Примеры 41 и 42: 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
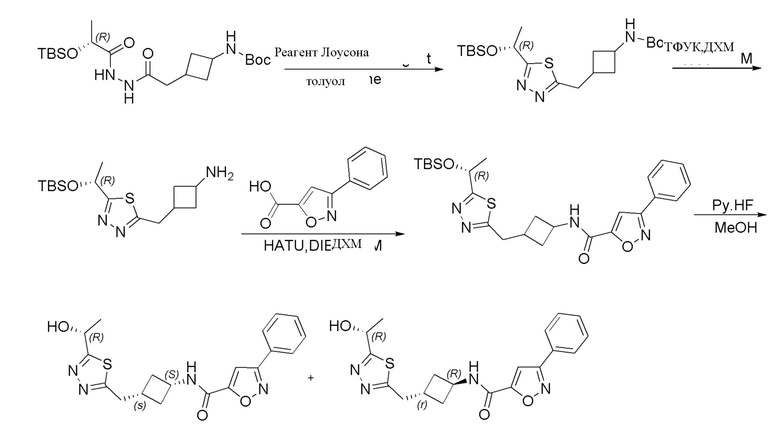
[248] Этап 1: трет-бутил-N-[3-([5-[(1R)-1-[(трет-Бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]карбамат. В круглодонную колбу объемом 250 мл помещали раствор трет-бутил-N-(3-[2-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропангидразидо]-2-оксоэтил]циклобутил)карбамата (6 г, 13,97 ммоль, 1,00 эквив.) в толуоле (100 мл), затем добавляли реагент Лоусона (8,5 г, 21,02 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 1,5 ч при 80°C, затем концентрировали при пониженном давлении. Полученный раствор разбавляли 200 миллилитрами H2O, а затем экстрагировали этилацетатом (3×200 мл). Органические экстракты объединяли, промывали солевым раствором (2×200 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ (CombiFlash-1: колонка, C18; подвижная фаза, X:H2O (0,5% NH4HCO3), Y:CAN, X/Y=80/20 с повышением до X/Y=5/95 в течение 40 мин; детектор УФ 254 нм), в результате чего получали 2,2 г (37%) трет-бутил-N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]карбамата в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H-BOC]+=328,0.
[249] Этап 2: 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циколбутен-1-амин. В круглодонную колбу объемом 50 мл помещали раствор трет-бутил-N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]карбамата (2,2 г, 5,14 ммоль, 1,00 эквив.) в ДХМ (20 мл) и ТФУК (4 мл). Полученный раствор перемешивали в течение 1 ч при к.т., затем концентрировали при пониженном давлении, в результате чего получали 3 г (неочищенного) 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циколбутен-1-амина в виде желтого масла.
[250] Этап 3: N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циколбутен-1-амина (500 мг, 1,53 ммоль, 1,00 эквив.) в ДХМ (20 мл), затем добавляли HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (753 мг, 1,98 ммоль, 1,30 эквив.), 3-фенил-1,2-оксазол-5-карбоновую кислоту (317 мг, 1,68 ммоль, 1,10 эквив.) и DIEA (диизопропиленамин) (589 мг, 4,56 ммоль, 3,00 эквив.). Полученную смесь перемешивали в течение 2 ч при к.т., затем разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:5), в результате чего получали 320 мг (42%) N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамида в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=499,1.
[251] Этап 4: 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 10 мл помещали раствор N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-3-фенил-1,2-оксазол-5-карбоксамида (320 мг, 0,64 ммоль, 1,00 эквив.) в MeOH (3 мл), затем добавляли Py.HF (1 мл). Полученный раствор перемешивали в течение 2 ч при к.т., разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:1). Полученные изомеры разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-004: колонка Phenomenex Lux 5u, заполненная целлюлозой Cellulose -4 AXIA, 250*21,2мм, 5мкм; подвижная фаза, гексан и изопропиловый спирт (поддерживали 50,0% изопропиловый спирт в течение 18 мин); детектор УФ 254/220 нм), в результате чего получали 88,7 мг (36%) 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 57,8 мг (23%) 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[252] 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=385,0. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,23-9,20 (d, J=7,5 Гц, 1H), 7,94-7,91 (m, 2H), 7,62 (s, 1H), 7,55-7,53 (m, 3H), 6,26-6,24 (d, J=5,1 Гц, 1H), 5,09-5,03 (m, 1H), 4,35-4,28 (m, 1H), 3,19-3,16 (d, J=7,2 Гц, 2H), 2,43-2,34 (m, 3H), 1,98-1,92 (m, 2H), 1,49-1,47 (d, J=6,3 Гц, 3H). ). Чистота (ВЭЖХ, 254 нм): 97,9%.
[253] 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=385. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,31-9,29 (d, J=7,2 Гц, 1H), 7,94-7,91 (m, 2H), 7,64 (s, 1H), 7,55-7,53 (m, 3H), 6,25-6,24 (d, J=5,1 Гц, 1H), 5,09-5,01 (m, 1H), 4,60-4,52 (m, 1H), 3,29-3,26 (m, 2H), 2,66-2,62 (m, 1H), 2,37-2,27 (m, 2H), 2,18-2,12 (m, 2H), 1,49-1,47 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,4%.
Примеры 43 и 44: 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
[254] Указанные в заголовке соединения получали с использованием методики, аналогичной показанной в Примере 41. Полученные изомеры разделяли препаративной сверхкритической жидкостной хроматографией (Prep SFC100: колонка, Phenomenex Lux 5мк, заполненная целлюлозой Cellulose -4 AXIA, 250*21,2мм, 5мкм; подвижная фаза, CO2(60%), ETOH(0,2%DEA(диэтаноламин))--(40%); детектор УФ 220 нм), в результате чего получали 125 мг (22%) 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 110,8 мг (20%) 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[255] 3-(4-фторфенил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=403. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,24-9,22 (d, J=8,0 Гц, 1H), 8,01-7,98 (m, 2H), 7,63 (s, 1H), 7,41-7,37 (m, 2H), 6,25 (s, 1H), 5,05-5,04 (m, 1H), 4,34-4,28 (m, 1H), 3,18-3,16 (d, J=6,8 Гц, 2H), 2,45-2,36 (m, 3H), 1,94-1,92 (m, 2H), 1,48-1,47 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,4%.
[256] 3-(4-фторфенил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-тиадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=403,0. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,32-9,29 (d, J=7,5 Гц, 1H), 8,02-7,97 (m, 2H), 7,65 (s, 1H), 7,42-7,36 (m, 2H), 6,25-6,24 (d, J=5,1 Гц, 1H), 5,09-5,01 (m, 1H), 4,62-4,50 (m, 1H), 3,29-3,26 (d, J=8,1 Гц, 2H), 2,69-2,60 (m, 1H), 2,37-2,27 (m, 2H), 2,19-2,10 (m, 2H), 1,49-1,47 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 96,3%.
Примеры 45 и 46: N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид и N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид
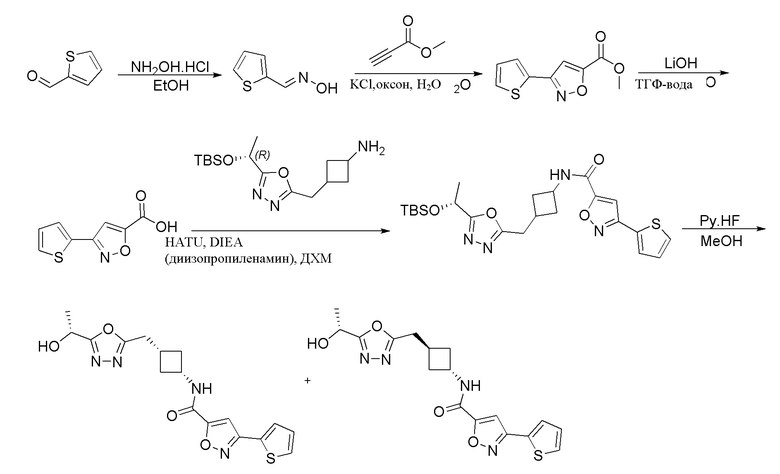
[257] Этап 1: N-(тиофен-2-илметилиден)гидроксиламин. В круглодонную колбу объемом 100 мл помещали раствор тиофен-2-карбальдегида (5 г, 44,58 ммоль, 1,00 эквив.) в EtOH (50 мл), затем добавляли NH2OH.HCl (3,7 г, 1,20 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., затем реакционную смесь экстрагировали этилацетатом. Органические экстракты объединяли, сушили и концентрировали при пониженном давлении, в результате чего получали 4,5 г (79%) N-(тиофен-2-илметилиден)гидроксиламина в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=128,0.
[258] Этап 2: Метил-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксилат. В круглодонную колбу объемом 100 мл помещали раствор N-(тиофен-2-илметилиден)гидроксиламина (4,5 г, 35,39 ммоль, 1,00 эквив.) в H2O (50 мл), затем добавляли метилпроп-2-иноат (8 мл, 2,50 эквив.), KCl (2,6 г, 1,00 эквив.) и оксон (14,4 г, 1,50 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., затем реакционную смесь экстрагировали этилацетатом (3×100 мл). Органические экстракты объединяли, сушили и концентрировали при пониженном давлении, в результате чего получали 5,4 г (73%) метил-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксилата в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=210,0.
[259] Этап 3: 3-(тиофен-2-ил)-1,2-оксазол-5-карбоновая кислота. В круглодонную колбу объемом 250 мл помещали раствор метил-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксилата (5,4 г, 25,81 ммоль, 1,00 эквив.) в ТГФ и H2O (30 мл/10 мл), затем добавляли LiOH (1,33 г, 55,53 ммоль, 2,00 эквив.). Полученный раствор перемешивали в течение 1 ч при к.т. После концентрирования при пониженном давлении остаток разбавляли 100 миллилитрами воды, затем полученный раствор промывали этилацетатом (2x 30 мл). Значение pH водного слоя доводили до 3 соляной кислотой HCl, затем экстрагировали раствор этилацетатом (3x 100 мл). Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 3,2 г (64%) 3-(тиофен-2-ил)-1,2-оксазол-5-карбоновой кислоты в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=196,1.
[260] Этап 4: N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу помещали раствор 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циколбутен-1-амина (1,25 г, 4,02 ммоль, 1,00 эквив.) в ДХМ (30 мл), затем добавляли 3-(тиофен-2-ил)-1,2-оксазол-5-карбоновую кислоту (800 мг, 4,10 ммоль, 1,02 эквив.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний-3-оксид гексафторфосфат) (2,3 г, 6,05 ммоль, 1,50 эквив.) и DIEA (диизопропиленамин) (3,1 г, 24,01 ммоль, 6,00 эквив.). Полученный раствор перемешивали в течение 3 ч при к.т., затем промывали солевым раствором (2×60 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:8, в результате чего получали 2,3 г (неочищенного) N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамида в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=489,2.
[261] Этап 5: N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид и N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу помещали раствор N-[3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамида (1,1 г, 2,25 ммоль, 1,00 эквив.) в MeOH (50 мл), затем добавляли Py.HF (6 мл). Полученный раствор перемешивали в течение 1 ч при к.т., затем концентрировали при пониженном давлении. Остаток растворяли в EtOAc (60 мл), промывали раствором NaHCO3 (2×50 мл) и солевым раствором (2×50 мл), затем сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:3), в результате чего получали 150 мг смеси PH-PTS-005-0005 и PH-PTS-005-0017. Эту смесь разделяли хиральной препаративной ВЭЖХ (колонка: Phenomenex Lux 5мкм, заполненная целлюлозой Cellulose -4 AXIA, 250*21,2 мм, 5 мкм; подвижная фаза A:гексан, подвижная фаза B: EtOH; Скорость потока: 20 мл/мин; градиент: 30 B до 30 B в течение 27 мин; 254/220 нм; время удерживания 1:19,83; время удерживания 2:23,28), в результате чего получали 52,6 мг N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 51,3 мг N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[262] N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид: ЖХ-МС-PH-PTS-005-0005-0: (электроспрей, m/z): [M+H]+=375,0. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,24-9,20 (d, J=7,5 Гц, 1H), 7,80-7,78 (m, 2H), 7,59 (s, 1H), 7,26-7,23 (m, 1H), 5,92-5,90 (d, J=5,7 Гц, 1H), 4,93-4,84 (m, 1H), 4,35-4,27 (m, 1H), 2,99-2,96 (d, J=6,6 Гц, 2H), 2,47-2,37 (m, 3H), 1,97-1,91 (m, 2H), 1,46-1,44 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 95,9%.
[263] N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-3-(тиофен-2-ил)-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=375,0. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,32-9,30 (d, J=7,2 Гц, 1H), 7,80-7,78 (d, J=4,5 Гц, 2H), 7,60 (s, 1H), 7,26-7,23 (m, 1H), 5,93-5,91(d, J=5,4 Гц, 1H), 4,93-4,85 (m, 1H), 4,58-4,51 (m, 1H), 3,10-3,08 (d, J=7,8 Гц, 2H), 2,72-2,65 (m, 1H), 2,83-2,29 (m, 2H), 2,18-2,11 (m, 2H), 1,47-1,44 (d, J=6,9 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,7%.
Примеры 47 и 48: N-((1r,3r)-3-((5-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-((1r,3r)-3-((4-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид
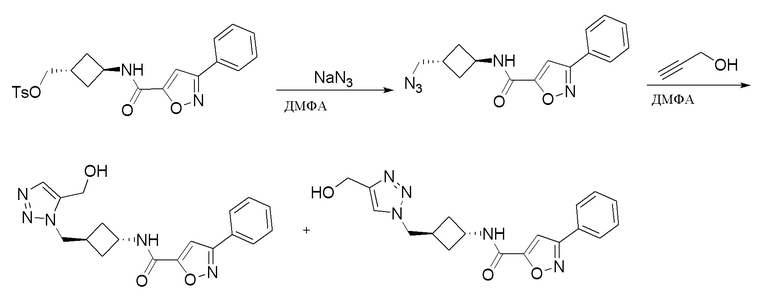
[264] Этап 1: N-((1r,3r)-3-(азидометил)циклобутил)-3-фенилизоксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор ((1r,3r)-3-(3-фенилизоксазол-5-карбоксамидо)циклобутил)метил-4-метилбензолсульфоната (1,5 г, 3,52 ммоль, 1,00 эквив.) в ДМФА (15 мл), затем добавляли NaN3 (390 мг, 6,00 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 5 ч при 80°C, нейтрализовали путем добавления 20 мл смеси лед/вода, и экстрагировали дихлорметаном (2×30 мл). Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:20), в результате чего получали 0,9 г (86%) N-((1r,3r)-3-(азидометил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС: (электроспрей, m/z): [M+H]+=298,1.
[265] Этап 2: N-((1r,3r)-3-((5-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид и N-((1r,3r)-3-((4-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор N-((1r,3r)-3-(азидометил)циклобутил)-3-фенилизоксазол-5-карбоксамида (700 мг, 2,35 ммоль, 1,00 эквив.) в ДМФА (5 мл), затем добавляли проп-2-ин-1-ол (660 мг, 11,77 ммоль, 5,00 эквив.). Полученный раствор перемешивали в течение 24 ч при 80°C, затем удаляли растворитель при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:5). Полученную смесь разделяли препаративной сверхкритической жидкостной хроматографией (колонка: Lux 5мк, заполненная целлюлозой Cellulose -3, AXIA, 250*21,2мм; подвижная фаза A:CO2:70, подвижная фаза B: MeOH:30; Скорость потока: 40 мл/мин; 220 нм; время удерживания 1:4,47; время удерживания 2:5,32), в результате чего получали 120 мг (27%) N-((1r,3r)-3-((5-(гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества и 119,8 мг (27%) N-((1r,3r)-3-((4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамида в форме белого твердого вещества.
[266] N-((1r,3r)-3-((5-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,29-9,27 (d, J=7,2 Гц, 1H), 8,00 (s, 1H), 7,93-7,90 (m, 2H), 7,63 (s, 1H), 7,55-7,52 (m, 3H), 5,17-5,13 (t, J=5,7 Гц, 1H), 4,60-4,49 (m, 5H), 2,74-2,70 (m, 1H), 2,31-2,12 (m, 4H). Чистота (ВЭЖХ, 254 нм): 98,8%.
[267] N-((1r,3r)-3-((4-(Гидроксиметил)-1H-1,2,3-триазол-1-ил)метил)циклобутил)-3-фенилизоксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,30-9,27 (d, J=7,5 Гц, 1H), 7,93-7,90 (m, 2H), 7,63-7,60 (m, 2H), 7,57-7,52 (m, 5H), 5,51-5,47 (t, J=5,7 Гц, 1H), 4,66-4,60 (m, 3H), 4,53-4,47(m, 2H), 2,86-2,78 (m, 1H), 2,30-2,15 (m, 4H). Чистота (ВЭЖХ, 254 нм): 96,9%.
Пример 49: 3-фенил-N-[(1r,3r)-3-[5-(оксетан-2-ил)-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид

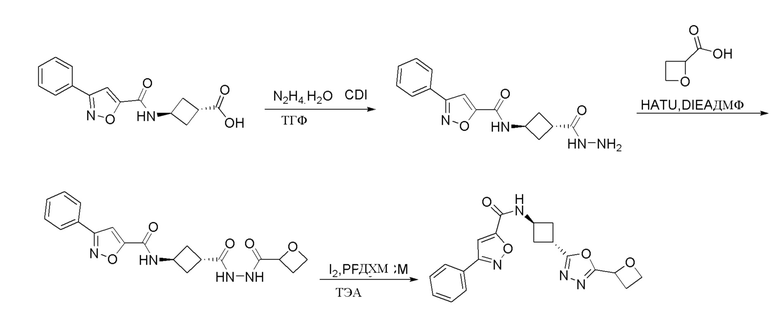
[268] Этап 1: 3-фенил-N-[(1r,3r)-3-(гидразинкарбонил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор (1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты (2,87 г, 10,03 ммоль, 1,00 эквив.) в ТГФ (50 мл), затем добавляли карбодиимидазол (3,24 г, 20,00 ммоль, 2,00 эквив.). Полученный раствор перемешивали в течение 1 ч при 25°C, и затем добавляли N2H4.H2O (2,1 г, 30,00 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 16 ч при к.т., затем разбавляли 300 миллилитрами H2O. Твердые вещества собирали фильтрацией и сушили в сушильном шкафу при пониженном давлении, в результате чего получали 487 мг (16%) 3-фенил-N-[(1r,3r)-3-(гидразинкарбонил)циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=301,1.
[269] Этап 2: 3-фенил-N-[(1r,3r)-3-[(оксетан-2-илформогидразидо)карбонил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор 3-фенил-N-[(1r,3r)-3-(гидразинкарбонил)циклобутил]-1,2-оксазол-5-карбоксамида (280 мг, 0,93 ммоль, 1,00 эквив.) в ДМФА (5 мл), затем добавляли HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (570 мг, 1,50 ммоль, 1,50 эквив.), DIEA (диизопропиленамин) (361 мг, 2,79 ммоль, 3,00 эквив.) и оксетан-2-карбоновая кислота (143 мг, 1,40 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., затем разбавляли 10 миллилитрами воды и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/этилацетат=1:2), в результате чего получали 220 мг (61%) 3-фенил-N-[(1r,3r)-3-[(оксетан-2-илформогидразидо)карбонил]циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=385,1.
[270] Этап 3: 3-фенил-N-[(1r,3r)-3-[5-(оксетан-2-ил)-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу помещали раствор PPh3 (299 мг, 1,14 ммоль, 2,00 эквив.) в ДХМ (20 мл), затем добавляли I2 (290 мг, 1,14 ммоль, 2,00 эквив.) и триэтаноламин (230 мг, 2,27 ммоль, 4,00 эквив.). Полученный раствор перемешивали в течение 10 мин при к.т., затем добавляли 3-фенил-N-[(1r,3r)-3-[(оксетан-2-илформогидразидо)карбонил]циклобутил]-1,2-оксазол-5-карбоксамид (220 мг, 0,57 ммоль, 1,00 эквив.) и перемешивали в течение 1 ч при к.т. Реакционную смесь разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (2:1), в результате чего получали 174,8 мг (83%) 3-фенил-N-[(1r,3r)-3-[5-(оксетан-2-ил)-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамида в виде беловатого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=367,3. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,45 (d, J=7,2 Гц, 1H), 7,93-7,91 (m, 2H), 7,65 (s, 1H), 7,54-7,52 (m, 3H), 5,88-5,84 (t, J=7,6 Гц, 1H), 4,72-4,62 (m, 3H), 3,81-3,74 (m, 1H), 3,12-2,96 (m, 2H), 2,73-2,66 (m, 4H). Чистота (ВЭЖХ, 254 нм): 99,5%.
Пример 50: 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид
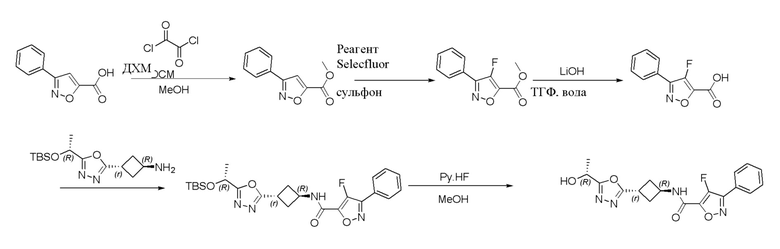
[271] Этап 1: Метил-3-фенил-1,2-оксазол-5-карбоксилат. В круглодонную колбу объемом 50 мл помещали раствор 3-фенил-1,2-оксазол-5-карбоновой кислоты (1,89 г, 9,99 ммоль, 1,00 эквив.) в ДХМ (20 мл), затем оксалилхлорид (1,9 г, 14,97 ммоль, 1,50 эквив.) и добавляли каплю диметилформамида. Полученный раствор перемешивали в течение 1 ч при к.т., затем добавляли MeOH (5 мл). Реакционную смесь перемешивали в течение 1 ч при к.т., затем концентрировали при пониженном давлении, в результате чего получали 1,9 г (94%) метил 3-фенил-1,2-оксазол-5-карбоксилата в виде желтого твердого вещества.
[272] Этап 2: Метил-4-фтор-3-фенил-1,2-оксазол-5-карбоксилат. В круглодонную колбу объемом 25 мл помещали раствор метил 3-фенил-1,2-оксазол-5-карбоксилата (1 г, 4,92 ммоль, 1,00 эквив.) в сульфоне (10 мл), затем добавляли реагент Selectfluor (3,54 г, 10,00 ммоль, 2,00 эквив.). Полученный раствор перемешивали в течение 16 ч при 120oC, разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/этилацетат=10:1), в результате чего получали 250 мг (25%) метил-4-фтор-3-фенил-1,2-оксазол-5-карбоксилата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=222,0.
[273] Этап 3: 4-фтор-3-фенил-1,2-оксазол-5-карбоновая кислота. В круглодонную колбу объемом 25 мл помещали раствор метил-4-фтор-3-фенил-1,2-оксазол-5-карбоксилата (250 мг, 1,13 ммоль, 1,00 эквив.) в ТГФ/H2O (10/3 мл), затем добавляли LiOH (82 мг, 3,42 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 2 ч при к.т., а затем разбавляли 50 миллилитрами H2O. РН раствора доводили до 4-5 с использованием концентрированного 12M раствора HCl, затем экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 210 мг (90%) 4-фтор-3-фенил-1,2-оксазол-5-карбоновой кислоты в форме белого твердого вещества.
[274] Этап 3: 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1S)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор 4-фтор-3-фенил-1,2-оксазол-5-карбоновой кислоты (210 мг, 1,01 ммоль, 1,00 эквив.) в ДХМ (10 мл), затем добавляли HATU ((1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (570 мг, 1,50 ммоль, 1,50 эквив.), (1r,3r)-3-5-[(1S)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-илциколбутен-1-амин (300 мг, 1,01 ммоль, 1,00 эквив.) и DIEA (диизопропиленамин) (387 мг, 2,99 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 1 ч при к.т., разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:5), в результате чего получали 360 мг (73%) 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1S)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=487,3.
[275] Этап 4: 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамида (360 мг, 0,74 ммоль, 1,00 эквив.) в метаноле (6 мл), затем добавляли Py.HF (2 мл). Полученный раствор перемешивали в течение 1 ч при к.т., затем разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (3×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ (ВЭЖХ-10: колонка X Bridge C18 OBD Prep, 19 мм X 250 мм; подвижная фаза, вода (0,5% NH4HCO3) и ацетонитрил (30,0% ацетонитрил до 50,0% в течение 8 мин); детектор УФ 254/220 нм), в результате чего получали 133,3 мг (48%) 4-фтор-3-фенил-N-[(1r,3r)-3-[5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=372,9. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,49-9,47 (d, J=7,2 Гц, 1H), 7,99-7,94 (m, 1H), 7,65-7,60 (m, 1H), 7,52 (s, 1H), 7,48-7,37 (m, 2H), 5,96-5,95 (d, J=6,4 Гц, 1H), 4,95-4,89 (m, 1H), 4,70-4,64 (m, 1H), 3,78-3,72 (m, 1H), 2,72-2,63 (m, 4H), 1,49-1,48 (d, J=6,8 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,7%.
Примеры 51 и 52: 3-фенил-N-[(1s,3s)-3-[5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-[4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид
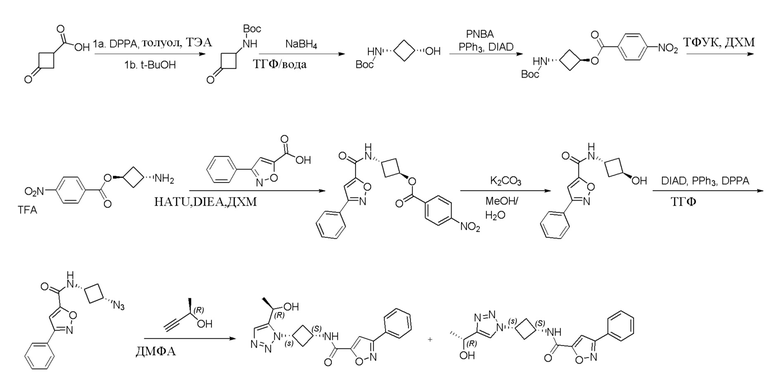
[276] Этап 1: трет-бутил-N-(3-Оксоциклобутил)карбамат. В трехгорлую круглодонную колбу объемом 1000 мл помещали раствор 3-оксоциколбутан-1-карбоновой кислоты (20 г, 175,29 ммоль, 1,00 эквив.) в толуоле (400 мл), затем добавляли триэтаноламин (19,5 г, 192,71 ммоль, 1,10 эквив.) DPPA (дифенилфосфорилазид) (53 г, 192,73 ммоль, 1,10 эквив.). Полученный раствор перемешивали в течение ночи при 0°C, затем промывали насыщенным водным раствором бикарбоната натрия (2×120 мл), H2O (1×120 мл) и солевым раствором (1×60 мл) при 0~10°C. Раствор сушили на безводном Na2SO4 и фильтровали. К этому раствору добавляли трет-BuOH (100 мл), а затем перемешивали реакционную смесь в течение 16 ч при 100°C. Растворитель удаляли при пониженном давлении, затем остаток промывали трет-бутилметиловым эфиром (TBME) (60 мл), в результате чего получали 8,3 г (26%) трет-бутил N-(3-оксоциклобутил)карбамата в виде ярко-белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,94 (brs, 1H), 4,29 (brs, 1H), 3,48-3,36 (m, 2H), 3,13-3,01 (m, 2H), 1,48 (s, 9H).
[277] Этап 2: трет-бутил-N-[(1s,3s)-3-гидроксициклобутил]карбамат. В круглодонную колбу объемом 250 мл помещали раствор трет-бутил N-(3-оксоциклобутил)карбамат (8,3 г, 44,81 ммоль, 1,00 эквив.) в ТГФ/H2O=9:1 (100 мл), затем добавляли порциями NaBH4 (830 мг, 22,54 ммоль, 0,50 эквив.) при -70°C. Полученный раствор перемешивали в течение 1 ч при -50°C, затем реакцию гасили путем добавления воды. Эту смесь экстрагировали этилацетатом, органические экстракты объединяли и удаляли растворитель при пониженном давлении. Остаток растворяли в 20 мл толуола при 80°C, затем раствор охлаждали до к.т. и перемешивали в течение 1 ч. Твердые вещества собирали фильтрацией, в результате чего получали 7,56 г (90%) трет-бутил-N-[(1s,3s)-3-гидроксициклобутил]карбамата в форме белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,67 (brs, 1H), 4,08-4,01 (m, 1H), 3,69-3,66 (m, 1H), 2,82-2,76 (m, 2H), 2,00 (brs, 1H), 1,88-1,75 (m, 2H), 1,46 (s, 9H).
[278] Этап 3: (1r,3r)-3-[[(трет-Бутокси)карбонил]амино]циклобутил-4-нитробензоат. В трехгорлую круглодонную колбу объемом 250 мл, которую предварительно продули и в которой поддерживали инертную атмосферу азота, помещали раствор трет-бутил-N-[(1s,3s)-3-гидроксициклобутил]карбамата (7,56 г, 40,38 ммоль, 1,00 эквив.) в ТГФ (100 мл), затем добавляли PPh3 (15,89 г, 60,58 ммоль, 1,50 эквив.) и PNBA (7,43 г, 1,10 эквив.). После этого по каплям при перемешивании добавляли диизопропилазидокарбоксилат (DIAD) (12,25 г, 60,58 ммоль, 1,50 эквив.) при 0°C. Полученный раствор перемешивали в течение ночи при к.т., затем реакцию гасили путем добавления воды и экстрагировали этилацетатом. Органические экстракты объединяли, а затем концентрировали при пониженном давлении. Остаток растворяли в 10 мл EtOH и перемешивали в течение 2 ч при к.т. Твердые вещества собирали фильтрацией, в результате чего получали 10,8 г (80%) (1r,3r)-3-[[(трет-бутокси)карбонил]амино]циклобутил 4-нитробензоат в форме белого твердого вещества. 1H-ЯМР (300 МГц, CDCl3) δ 8,28-8,17 (m, 4H), 5,36-5,32 (m, 1H), 4,77 (brs, 1H), 4,36 (brs, 1H), 2,65-2,56 (m, 2H), 2,47-2,38 (m, 2H), 1,43 (s, 9H).
[279] Этап 4: соль (1r,3r)-3-аминоциклобутил-4-нитробензоата с трифторуксусной кислотой. В круглодонную колбу объемом 100 мл помещали раствор (1r,3r)-3-[[(трет-бутокси)карбонил]амино]циклобутил-4-нитробензоата (10,8 г, 32,11 ммоль, 1,00 эквив.) в ДХМ (25 мл) и ТФУК (7 мл). Полученный раствор перемешивали в течение ночи при к.т., затем удаляли растворитель при пониженном давлении, в результате чего получали 10,3 г (92%) соли (1r,3r)-3-аминоциклобутил 4-нитробензоата с трифторуксусной кислотой в форме белого твердого вещества. 1H-ЯМР (300 МГц, CD3OD) δ 8,28-8,25 (m, 4H), 5,52-5,44 (m, 1H), 4,09-4,00 (m, 1H), 2,85-2,62 (m, 4H).
[280] Этап 5: (1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил 4-нитробензоат. В круглодонную колбу объемом 250 мл помещали раствор соли (1r,3r)-3-аминоциклобутил-4-нитробензоата с трифторуксусной кислотой (4 г, 11,42 ммоль, 1,00 эквив.), DIEA (диизопропиленамин) (7,4 г, 57,26 ммоль, 5,00 эквив.) и 3-фенил-1,2-оксазол-5-карбоновой кислоты (2,6 г, 13,74 ммоль, 1,20 эквив.) в ДХМ (100 мл). К этому раствору добавляли HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (6,5 г, 17,09 ммоль, 1,50 эквив.), затем реакционную смесь перемешивали в течение 30 мин при к.т. Реакцию гасили водой и экстрагировали этилацетатом. Органические экстракты объединяли, промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:5), в результате чего получали 4,57 г (98%) (1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил-4-нитробензоата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=408,1.
[281] Этап 6: 3-фенил-N-[(1r,3r)-3-гидроксициклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор (1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил-4-нитробензоат (4,4 г, 10,80 ммоль, 1,00 эквив.) в MeOH/H2O=2:1 (30 мл), затем добавляли K2CO3 (4,4 г, 31,83 ммоль, 3,00 эквив.). Полученную смесь перемешивали в течение ночи при 40°C. Реакцию гасили водой, а затем экстрагировали этилацетатом. Органические экстракты объединяли, промывали солевым раствором, сушили на Na2SO4, а затем концентрировали при пониженном давлении, в результате чего получали 2,2 г (79%) 3-фенил-N-[(1r,3r)-3-гидроксициклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=259,1.
[282] Этап 7: 3-фенил-N-[(1s,3s)-3-азидоциклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор 3-фенил-N-[(1r,3r)-3-гидроксициклобутил]-1,2-оксазол-5-карбоксамида (2,2 г, 8,52 ммоль, 1,00 эквив.), DPPA (дифенилфосфорилазид) (2,8 г, 10,17 ммоль, 1,20 эквив.) b PPh3 (3,3 г, 12,58 ммоль, 1,50 эквив.) в ТГФ (40 мл), затем по каплям добавляли диизопропилазидокарбоксилат (DIAD) (2,6 г, 12,86 ммоль, 1,50 эквив.). Реакционную смесь перемешивали в течение 1 ч при 30°C, нейтрализовали путем добавления солевого раствора и экстрагировали этилацетатом. Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:10), в результате чего получали 860 мг (36%) 3-фенил-N-[(1s,3s)-3-азидоциклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[283] Этап 8: 3-фенил-N-[(1s,3s)-3-[5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-[4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид. В запаянную пробирку объемом 10 мл помещали раствор 3-фенил-N-[(1s,3s)-3-азидоциклобутил]-1,2-оксазол-5-карбоксамида (550 мг, 1,94 ммоль, 1,00 эквив.) в ДМФА (2,5 мл), затем добавляли (2R)-бут-3-ин-2-ол (680 мг, 9,70 ммоль, 5,00 эквив.). Полученный раствор перемешивали в течение ночи при 100°C. После удаления растворителя при пониженном давлении остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:3). Полученную смесь разделяли препаративной сверхкритической жидкостной хроматографией (преп SFC80-1: колонка Chiralpak AD-H, 2*25см; подвижная фаза, CO2 (50%) и этанол (50%); детектор УФ 220 нм), в результате чего получали 170,0 мг (25%) 3-фенил-N-[(1s,3s)-3-[5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 222 мг (32%) 3-фенил-N-[(1s,3s)-3-[4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[284] 3-фенил-N-[(1s,3s)-3-[5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,50-9,47 (d, J=7,2 Гц, 1H), 7,94-7,90 (m, 2H), 7,66 (s, 1H), 7,61 (s, 1H), 7,56-7,54 (m, 3H), 5,52-5,50 (d, J=6,0 Гц, 1H), 4,95-4,85 (m, 2H), 4,45-4,31 (m, 1H), 2,94-2,80 (m, 4H), 1,45-1,43 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,4%.
[285] 3-фенил-N-[(1s,3s)-3-[4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,41-9,39 (d, J=8,4 Гц, 1H), 8,13 (s, 1H), 7,96-7,93 (m, 2H), 7,68 (s, 1H), 7,56-7,54 (m, 3H), 5,30-5,28 (d, J=4,8 Гц, 1H), 5,00-4,80 (m, 2H), 4,48-4,35 (m, 1H), 2,98-2,89 (m, 2H), 2,74-2,64 (m, 2H), 1,43-1,41 (d, J=6,6 Гц, 3H).
Примеры 53 и 54: 3-фенил-N-[(1s,3s)-3-[5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-[4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид
[286] Этап 1: 3-фенил-N-[(1s,3s)-3-[5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-[4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид. В запечатанную пробирку объемом 10 мл помещали раствор 3-фенил-N-[(1s,3s)-3-азидоциклобутил]-1,2-оксазол-5-карбоксамида (500 мг, 1,77 ммоль, 1,00 эквив.) в ДМФА (2,5 мл), затем добавляли (2S)-бут-3-ин-2-ол (618 мг, 8,82 ммоль, 5,00 эквив.). Реакционную смесь перемешивали в течение ночи при 100°C, затем концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетатом/петролейный эфир (1:3). Полученную смесь разделяли препаративной сверхкритической жидкостной хроматографией (преп. SFC80-1: колонка, Chiralpak AD-H, 2*25см; подвижная фаза, CO2(55%) и метанол (45%); детектор УФ 220nm), в результате чего получали 106,1 мг (17%) 3-фенил-N-[(1s,3s)-3-[5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 192,2 мг (31%) 3-фенил-N-[(1s,3s)-3-[4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[287] 3-фенил-N-[(1s,3s)-3-[5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,50-9,47 (d, J=7,5 Гц, 1H), 7,94-7,90 (m, 2H), 7,66 (s, 1H), 7,61 (s, 1H), 7,56-7,54 (m, 3H), 5,52-5,50 (d, J=6,0 Гц, 1H), 4,95-4,85 (m, 2H), 4,45-4,31 (m, 1H), 2,94-2,80 (m, 4H), 1,45-1,43 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 96,0%.
[288] 3-фенил-N-[(1s,3s)-3-[4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=354. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,41-9,39 (d, J=8,1 Гц, 1H), 8,13 (s, 1H), 7,96-7,93 (m, 2H), 7,68 (s, 1H), 7,56-7,54 (m, 3H), 5,30-5,28 (d, J=4,5 Гц, 1H), 5,00-4,92 (m, 1H), 4,88-4,80 (m, 1H), 4,48-4,35 (m, 1H), 2,98-2,89 (m, 2H), 2,74-2,50 (m, 2H), 1,43-1,41 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 97,7%.
Примеры 55 и 56: 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
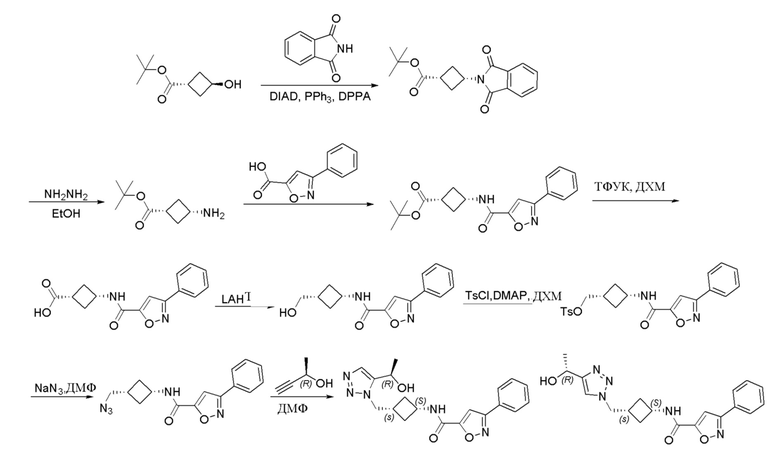
[289] Этап 1: трет-бутил-(1s,3s)-3-(1,3-Диоксо-2,3-дигидро-1H-изоиндол-2-ил)циколбутан-1-карбоксилат. В трехгорлую круглодонную колбу объемом 250 мл помещали раствор трет-бутил-(1r,3r)-3-гидроксициколбутан-1-карбоксилата (1,1 г, 5,87 ммоль, 1,00 эквив.), 2,3-дигидро-1H-изоиндол-1,3-дион (1,04 г, 7,07 ммоль, 1,19 эквив.), и PPh3 (2,5 г) в ТГФ (60 мл). После этого добавляли по каплям диизопропилазидокарбоксилат (DIAD) (300 мг) при перемешивании при 0°C. Полученный раствор перемешивали в течение 1 ч при к.т., затем реакцию гасили путем добавления 50 мл воды. Полученный раствор экстрагировали этилацетатом (3×50 мл), органические слои объединяли. Полученную смесь промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:40), в результате чего получали 810 мг трет-бутил-(1s,3s)-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циколбутан-1-карбоксилата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=302,2.
[290] Этап 2: трет-бутил-(1s,3s)-3-аминоциколбутан-1-карбоксилат. В круглодонную колбу объемом 2000 мл помещали раствор трет-бутил-(1s,3s)-3-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)циколбутан-1-карбоксилата (810 мг, 2,64 ммоль, 1,00 эквив.) в EtOH (50 мл), а затем добавляли N2H4.H2O (400 мг, 3,00 эквив.). Полученный раствор перемешивали в течение 4 ч при к.т., затем удаляли твердые вещества фильтрацией. Фильтрат концентрировали при пониженном давлении, в результате чего получали 500 мг неочищенного трет-бутил-(1s,3s)-3-аминоциколбутан-1-карбоксилата в виде светло-желтого масла. ЖХМС [M+H]+=172,1
[291] Этап 3: трет-бутил-(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилат. В круглодонную колбу объемом 100 мл помещали раствор трет-бутил (1s,3s)-3-аминоциколбутан-1-карбоксилата (1,7 г, 9,93 ммоль, 1,00 эквив.) в ДХМ (50 мл), затем добавляли 3-фенил-1,2-оксазол-5-карбоновая кислота (1,9 г, 10,04 ммоль, 1,00 эквив.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (5,7 г, 14,99 ммоль, 1,50 эквив.) и DIEA (диизопропиленамин) (3,9 г, 30,18 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 1 ч при к.т., затем нейтрализовали путем добавления воды и экстрагировали этилацетатом. Органические экстракты объединяли, промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:7), в результате чего получали 2 г (59%) трет-бутил-(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=343,2.
[292] Этап 4: (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновая кислота. В круглодонную колбу объемом 25 мл помещали раствор трет-бутил-(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилата (830 мг, 2,42 ммоль, 1,00 эквив.) в ДХМ (10 мл) и ТФУК (3 мл). Полученный раствор перемешивали в течение 2 ч при к.т., затем реакционную смесь концентрировали при пониженном давлении, в результате чего получали 680 мг (98%) (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты в форме светло-желтого твердого вещества.
[293] Этап 5: 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу помещали раствор (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты (1,2 г, 4,19 ммоль, 1,00 эквив.) в ТГФ (50 мл), а затем порциями добавляли LiAlH4 (319 мг, 8,41 ммоль, 2,00 эквив.) при 0°C в течение 5 мин. Полученный раствор перемешивали в течение 2 ч при к.т., затем нейтрализовали путем добавления 100 миллилитров 2н. HCl и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 860 мг (75%) 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=273,1.
[294] Этап 6: [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфонат. В круглодонную колбу объемом 50 мл помещали раствор 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида (860 мг, 3,16 ммоль, 1,00 эквив.) в ДХМ (20 мл), затем добавляли диметиламинопиридин (DMAP) (781 мг, 6,39 ммоль, 2,00 эквив.) и TsCl (779 мг, 4,09 ммоль, 1,30 эквив.). Полученный раствор перемешивали в течение 16 ч при к.т., разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 1,1 г (82%) [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил-4-метилбензол-1-сульфоната в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=427,2.
[295] Этап 7: 3-фенил-N-[(1s,3s)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил-4-метилбензол-1-сульфоната (1,1 г, 2,58 ммоль, 1,00 эквив.) в ДМФА (10 мл), затем добавляли NaN3 (254 мг, 3,91 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 1 ч при 80°C, разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (5×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 750 мг (98%) 3-фенил-N-[(1s,3s)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества.
[296] Этап 8: 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор 3-фенил-N-[(1s,3s)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида (350 мг, 1,18 ммоль, 1,00 эквив.) в ДМФА (5 мл), затем добавляли (2R)-бут-3-ин-2-ол (420 мг, 5,99 ммоль, 5,00 эквив.). Полученный раствор перемешивали в течение 16 ч при 80°C, затем разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (3×50 мл). Органические экстракты объединяли, промывали солевым раствором (3×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (5:1). Чистые изомеры разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-009: колонка, Chiralpak IB, 2*25см, 5мкм; подвижная фаза, гексан и этанол (поддерживали 15,0% этанола в течение 29 мин); детектор УФ 254/220 нм), в результате чего получали 29,4 мг (7%) 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества и 31,6 мг (7%) 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[297] 3-фенил-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,25-9,22 (d, J=7,8 Гц, 1H), 7,94-7,91 (m, 2H), 7,63-7,60 (d, J=6,9 Гц, 2H), 7,55-7,53 (m, 3H), 5,53-7,51 (d, J=6,0 Гц, 1H), 4,93-4,85 (m, 1H), 4,43-4,40 (d, J=7,2 Гц, 2H), 4,35-4,27 (m, 1H), 2,64-2,55 (m, 1H), 2,39-2,30 (m, 2H), 2,03-1,94 (m, 2H), 1,48-1,46 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 95,2%.
[298] 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,22-9,19 (d, J=7,8 Гц, 1H), 7,90-7,76 (m, 2H), 7,84 (s, 1H), 7,59 (s, 1H), 7,55-7,46 (m, 3H), 5,19-5,18 (d, J=4,5 Гц, 1H), 4,80-4,76 (m, 1H), 4,35-4,24 (m, 3H), 2,60-2,50 (m, 1H), 2,33-2,25 (m, 2H), 1,95-1,88 (m, 2H), 1,37-1,35 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 95,0%.
Примеры 57 и 58: 3-фенил-N-[(1s,3s)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид.
[299] В круглодонную колбу объемом 25 мл помещали раствор 3-фенил-N-[(1s,3s)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида (270 мг, 0,91 ммоль, 1,00 эквив.) в толуоле (5 мл), затем добавляли (2S)-бут-3-ин-2-ол (315 мг, 4,49 ммоль, 5,00 эквив.). Полученный раствор перемешивали в течение 16 ч при 100°C, а затем концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/EtOAc=1:5). Полученную смесь разделяли хиральной препаративной ВЭЖХ (2#-Gilson Gx 281(ВЭЖХ-09): колонка: Chiralpak IB, 2*25см, 5мкм; подвижная фаза A: гексан, подвижная фаза B: EtOH; Скорость потока: 20 мл/мин; градиент: 30 B до 30 B в течение 15 мин; 254/220 нм; время удерживания 1:7,642; время удерживания 2:10,588), в результате чего получали 32,8 мг (10%) 3-фенил-N-[(1s,3s)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 68,5 мг (21%) 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[300] 3-фенил-N-[(1s,3s)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,24-9,22 (d, J=7,6 Гц, 1H), 7,94-7,92 (m, 2H), 7,62-7,60 (d, J=8,4 Гц, 1H), 7,55-7,53 (m, 3H), 5,52-5,50 (d, J=6,0 Гц, 1H), 4,95-4,83 (m, 1H), 4,43-4,40 (m, 2H), 4,35-4,31 (m, 3H), 2,54-2,52 (m, 1H), 2,36-2,33 (m, 2H), 2,05-1,98 (m, 2H), 1,48-1,46 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 93,1%.
[301] 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,24-9,22 (d, J=7,6 Гц, 1H), 7,94-7,92 (m, 2H), 7,87 (s, 1H), 7,62 (s, 1H), 7,55-7,53 (m, 3H), 5,22-5,21 (d, J=4,8 Гц, 1H), 4,85-4,79 (m, 1H), 4,38-4,37 (d, J=7,2 Гц, 2H), 4,34-4,28 (m, 1H), 2,54-2,46 (m, 1H), 2,39-2,32 (m, 2H), 2,01-1,93 (m, 2H), 1,41-1,39 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,6%.
Примеры 59 и 60: 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
[302] Этап 1: 3-фенил-N-[(1r,3r)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 25 мл помещали раствор [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната (920 мг, 2,16 ммоль, 1,00 эквив.) в ДМФА (10 мл), затем добавляли NaN3 (169 мг, 2,60 ммоль, 1,20 эквив.). Полученный раствор перемешивали в течение 2 ч при 80°C, затем разбавляли 100 миллилитрами воды и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 600 мг (94%) 3-фенил-N-[(1r,3r)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества.
[303] Этап 2: 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 5 мл помещали раствор 3-фенил-N-[(1r,3r)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида (300 мг, 1,01 ммоль, 1,00 эквив.) в ДМФА (5 мл), затем добавляли (2R)-бут-3-ин-2-ол (210 мг, 3,00 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 16 ч при 100°C, затем разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/этилацетат=1:5). Полученную смесь разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-004: колонка Chiralpak IA, 2*25см, 5мк; подвижная фаза, гексан м изопропиловый спирт (удерживали 30,0% изопропилового спирта в течение 15 мин); детектор УФ 254/220 нм), в результате чего получали 103,5 мг (28%) 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 127,1 мг (38%) 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме светло-желтого твердого вещества.
[304] 3-фенил-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,29-9,27 (d, J=7,2 Гц, 1H), 7,92-7,90 (m, 2H), 7,62-7,59 (m, 2H), 7,53-7,52 (m, 3H), 5,53-5,52 (d, J=6,0 Гц, 1H), 4,92-4,89 (m, 1H), 4,62-4,58 (m, 1H), 4,56-4,48 (m, 2H), 2,85-2,81 (m, 1H), 2,27-2,17 (m, 4H), 1,46-1,44 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 95,0%.
[305] 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,27-9,25 (d, J=7,2 Гц, 1H), 7,94 (s, 1H), 7,93-7,89 (m, 2H), 7,62 (s, 1H), 7,53-7,51 (m, 3H), 5,21-5,20 (d, J=4,8 Гц, 1H), 4,83-4,80 (m, 1H), 4,59-4,51 (m, 1H), 4,48-4,46 (d, J=7,6 Гц, 2H), 2,74-2,66 (m, 1H), 2,28-2,21 (m, 2H), 2,17-2,11 (m, 2H), 1,39-1,37 (d, J=6,8 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 96,9%.
Примеры 61 и 62: 3-фенил-N-[(1r,3r)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
[306] В круглодонную колбу объемом 25 мл помещали раствор 3-фенил-N-[(1r,3r)-3-(азидометил)циклобутил]-1,2-оксазол-5-карбоксамида (210 мг, 0,71 ммоль, 1,00 эквив.) в толуоле (5 мл), затем добавляли (2S)-бут-3-ин-2-ол (245 мг, 3,50 ммоль, 5,00 эквив.). Полученный раствор перемешивали в течение 16 ч при 100°C, затем концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/EtOAc=1:5). Полученную смесь разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-004: колонка, Chiralpak IC, 2*25см, 5мк; подвижная фаза, гексан и этанол (поддерживали 50,0% этанол в течение 15 мин); детектор УФ 254/220 нм), в результате чего получали 44,2 мг (17%) 3-фенил-N-[(1r,3r)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 78,5 мг (30%) 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[307] 3-фенил-N-[(1r,3r)-3-([5-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,31-9,29 (d, J=7,2 Гц, 1H), 7,94-7,91 (m, 2H), 7,64-7,60 (m, 2H), 7,55-7,52 (m, 3H), 5,55-5,53 (d, J=6,0 Гц, 1H), 4,95-4,89 (m, 1H), 4,64-4,47 (m, 3H), 2,88-2,82 (m, 1H), 2,30-2,19 (m, 4H), 1,48-1,46 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 97,5%.
[308] 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-1,2,3-триазол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=368,2. 1H-ЯМР (400 МГц, ДМСО-d6) δ 9,30-9,28 (d, J=7,6 Гц, 1H), 7,96 (s, 1H), 7,94-7,91 (m, 2H), 7,64 (s, 1H), 7,55-7,53 (m, 3H), 5,23-5,21 (d, J=4,8 Гц, 1H), 4,85-4,79 (m, 1H), 4,58-4,53 (m, 1H), 4,50-4,48 (d, J=7,6 Гц, 2H), 2,75-2,71 (m, 1H), 2,30-2,23 (m, 2H), 2,18-2,12 (m, 2H), 1,41-1,39 (d, J=6,4 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,2%.
Примеры 63 и 64: 3-фенил-N-[(1r,3r)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-фенил-N-[(1r,3r)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
Неподтвержденный
первый пик
Неподтвержденный
второй пик
ДМФА
ТГФ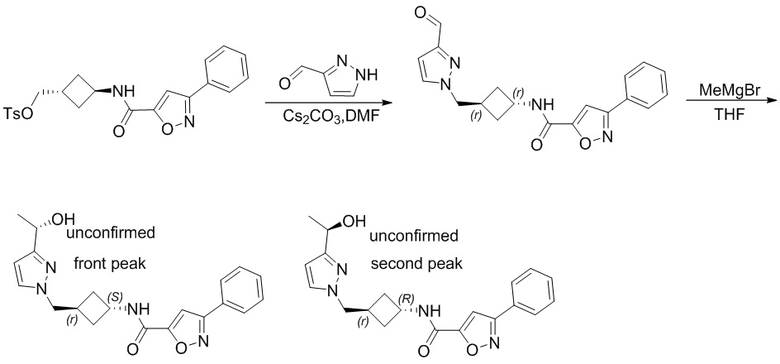
[309] Этап 1: 3-фенил-N-[(1r,3r)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната (1,28 г, 3,00 ммоль, 1,00 эквив.) в ДМФА (20 мл), затем добавляли Cs2CO3 (1,95 г, 5,98 ммоль, 2,00 эквив.) и 1H-пиразол-3-карбальдегид (432 мг, 4,50 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 100°C, затем удаляли твердые вещества фильтрацией. Фильтрат очищали методом препаративной флэш-ВЭЖХ (CombiFlash-1: колонка, C18; подвижная фаза, X: H2O (0,5% NH4HCO3), Y: CAN, X/Y=90/10 с повышением до X/Y=5/95 в течение 40 мин; детектор УФ 254 нм), в результате чего получали 450 мг (43%) 3-фенил-N-[(1r,3r)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=351,2.
[310] Этап 2: 3-фенил-N-[(1r,3r)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1r,3r)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик). В трехгорлую круглодонную колбу объемом 50 мл помещали раствор 3-фенил-N-[(1r,3r)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида (450 мг, 1,28 ммоль, 1,00 эквив.) в ТГФ (20 мл). Раствор охлаждали до 0°C, затем добавляли по каплям MeMgBr (1,3 мл, 3,00 эквив., 3 моль/L) при перемешивании при 0°C в течение 10 мин. Реакционную смесь перемешивали в течение 2 ч при к.т., затем нейтрализовали путем добавления 10 миллилитров 2н. HCl и 50 миллилитров H2O и экстрагировали этилацетатом (3×50 мл). Органические экстракты объединяли, промывали солевым раствором (3×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (2:1). Полученную смесь разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-004: колонка Chiralpak IC, 2*25см, 5мкм; подвижная фаза, гексан и этанол (поддерживали 50,0% этанол в течение 13 мин); детектор УФ 254/220 нм), в результате чего получали 126,1 мг (27%) 3-фенил-N-[(1r,3r)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (передний пик) в форме светло-желтого твердого вещества и 136,9 мг (29%) 3-фенил-N-[(1r,3r)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (второй пик) в форме белого твердого вещества.
[311] 3-фенил-N-[(1r,3r)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=367,0. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,28-9,25 (d, J=7,2 Гц, 1H), 7,94-7,91 (m, 2H), 7,65-7,63 (m, 2H), 7,55-7,53 (m, 3H), 6,15-6,14 (d, J=1,8 Гц, 1H), 4,95-4,93 (d, J=4,8 Гц, 1H), 4,72-4,64 (m, 1H), 4,58-4,45 (m, 1H), 4,19-4,16 (d, J=7,8 Гц, 2H), 2,72-2,64 (m, 1H), 2,27-2,12 (m, 4H), 1,34-1,32 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,9%.
[312] 3-фенил-N-[(1r,3r)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=367,0. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,28-9,25 (d, J=7,5 Гц, 1H), 7,94-7,91 (m, 2H), 7,65-7,63 (m, 2H), 7,55-7,53 (m, 3H), 6,15-6,14 (d, J=2,1 Гц, 1H), 4,95-4,93 (d, J=5,1 Гц, 1H), 4,72-4,63 (m, 1H), 4,55-4,48 (m, 1H), 4,19-4,16 (d, J=7,5 Гц, 2H), 2,69-2,64 (m, 1H), 2,27-2,11 (m, 4H), 1,34-1,32 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,3%.
Примеры 65 и 66: 3-фенил-N-[(1s,3s)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1s,3s)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик)
Неподтвержденный второй пик
Неподтвержденный первый пик
ДМФА
ТГФ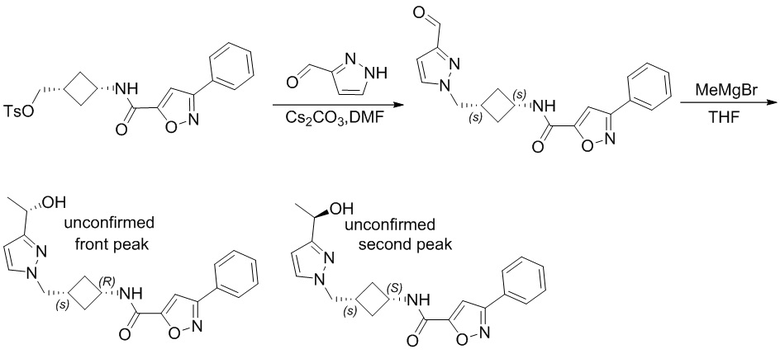
[313] Этап 1: 3-фенил-N-[(1s,3s)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил-4-метилбензол-1-сульфоната (1,3 г, 3,05 ммоль, 1,00 эквив.) в ДМФА (15 мл), затем добавляли Cs2CO3 (1,96 г, 6,02 ммоль, 2,00 эквив.) и 1H-пиразол-3-карбальдегид (432 мг, 4,50 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 100°C, затем удаляли твердые вещества фильтрацией. Фильтрат очищали методом препаративной флэш-ВЭЖХ (CombiFlash-1: колонка C18; подвижная фаза, X: H2O (0,5% NH4HCO3), Y: ацетонитрил, X/Y=90/10 с повышением до X/ацетонитрил=5/95 в течение 40 мин; детектор УФ 254 нм), в результате чего получали 430 мг (40%) 3-фенил-N-[(1s,3s)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=351,2.
[314] Этап 2: 3-фенил-N-[(1s,3s)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1s,3s)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик). В круглодонную трехгорлую колбу помещали раствор 3-фенил-N-[(1s,3s)-3-[(3-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида (430 мг, 1,23 ммоль, 1,00 эквив.) в ТГФ (30 мл), охлаждали до 0°C и затем добавляли по каплям раствор MeMgBr (1,2 мл, 3 моль/л, 3,00 эквив.) при перемешивании при 0°C на протяжении 5 мин. Реакционную смесь перемешивали в течение 3 ч при к.т., затем нейтрализовали путем добавления 2н. раствора HCl (10 мл) и 50 миллилитров H2O и экстрагировали этилацетатом (3×50 мл). Органические экстракты объединяли, промывали солевым раствором (3×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (2:1). Чистые изомеры разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-009: колонка Phenomenex Lux 5мк с целлюлозой Cellulose-3, 5*25см, 5 мкм; подвижная фаза, гексан и изопропиловый спирт (поддерживали 50,0% изопропилового спирта в течение 17 мин); детектор УФ 220/254 нм), в результате чего получали 89,5 мг (20%) 3-фенил-N-[(1s,3s)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (передний пик) в форме белого твердого вещества и 65,5 мг (15%) 3-фенил-N-[(1s,3s)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (второй пик) в форме белого твердого вещества.
[315] 3-фенил-N-[(1s,3s)-3-([3-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик): ЖХМС (электроспрей, m/z): [M+H]+=367,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,21-9,18 (d, J=7,5 Гц, 1H), 7,94-7,92 (m, 2H), 7,62 (s, 1H), 7,55-7,53 (m, 4H), 6,15 (d, J=2,1 Гц, 1H), 4,94-4,92 (d, J=4,8 Гц, 1H), 4,71-4,63 (m, 1H), 4,34-4,26 (m, 1H), 4,09-4,06 (d, J=6,9 Гц, 2H), 2,48-2,29 (m, 3H), 1,98-1,89 (m, 2H), 1,34-1,32 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,2%.
[316] 3-фенил-N-[(1s,3s)-3-([3-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик): ЖХМС (электроспрей, m/z): [M+H]+=367,2. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,21-9,18 (d, J=7,5 Гц, 1H), 7,93-7,90 (m, 2H), 7,61 (s, 1H), 7,54-7,52 (m, 4H), 6,14 (d, J=2,1 Гц, 1H), 4,94-4,93 (d, J=4,8 Гц, 1H), 4,70-4,62 (m, 1H), 4,35-4,22 (m, 1H), 4,08-4,05 (d, J=6,9 Гц, 2H), 2,46-2,28 (m, 3H), 1,97-1,88 (m, 2H), 1,33-1,31 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 97,9%.
Примеры 67 и 68: 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) м 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик)
неподтвержденный
неподтвержденный
Преп. СКЖХ
второй пик
первый пик
ДМФА
ТГФ
ТГФ
ДХМ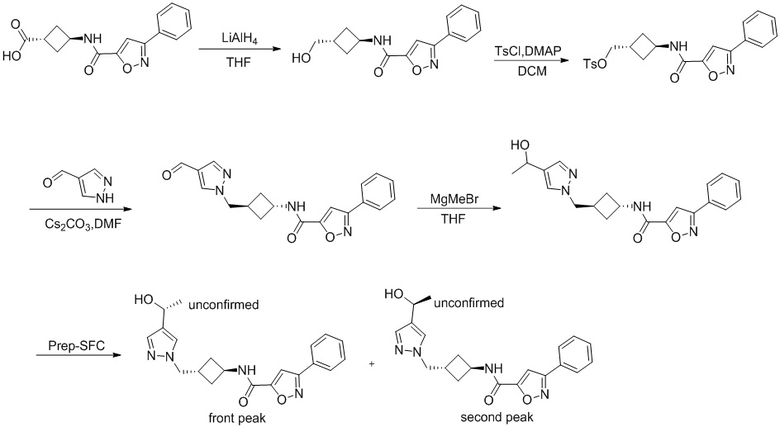
[317] Этап 1: 3-фенил-N-[(1r,3r)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамид. В трехгорлую круглодонную колбу объемом 250 мл помещали раствор (1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты (2 г, 6,99 ммоль, 1,00 эквив.) в ТГФ (40 мл), затем раствор охлаждали до 0°C и добавляли LiAlH4 (800 мг, 21,08 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 2 ч при 5°C, затем нейтрализовали путем добавления Na2SO4,10H2O. Твердые вещества удаляли фильтрацией, затем фильтрат концентрировали при пониженном давлении, в результате чего получали 850 мг (45%) 3-фенил-N-[(1r,3r)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого масла. ЖХМС (электроспрей, m/z): [M+H]+=273,1.
[318] Этап 2: [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфонат. В круглодонную колбу объемом 50 мл помещали раствор 3-фенил-N-[(1r,3r)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида (850 мг, 3,12 ммоль, 1,00 эквив.) и диметиламинопиридин (DMAP) (762 мг, 6,24 ммоль, 1,20 эквив.) в ДХМ (20 мл). К этому раствору добавляли TsCl (712 мг, 3,73 ммоль, 1,20 эквив.), затем смесь перемешивали в течение 24 ч при к.т. Реакционную смесь разбавляли 50 миллилитрами смеси вода/лед и экстрагировали дихлорметаном. Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 980 мг (неочищенного) [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната в форме светло-желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=427,1.
[319] Этап 3: 3-фенил-N-[(1r,3r)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил добавляли 4-метилбензол-1-сульфоната (980 мг, 2,30 ммоль, 1,00 эквив.) в ДМФА (20 мл), затем 1H-пиразол-4-карбальдегид (331 мг, 3,44 ммоль, 1,50 эквив.) и Cs2CO3 (1,1 г, 3,37 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 70°C, разбавляли 50 миллилитрами H2O, фильтровали, а затем экстрагировали этилацетатом. Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:3), в результате чего получали 400 мг (50%) 3-фенил-N-[(1r,3r)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=351,1.
[320] Этап 4: 3-фенил-N-[(1r,3r)-3-[[4-(1-гидроксиэтил)-1H-пиразол-1-ил]метил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 150 мл помещали раствор 3-фенил-N-[(1r,3r)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксадзол-5-карбоксамида (600 мг, 1,71 ммоль, 1,00 эквив.) в ТГФ (20 мл), затем раствор охлаждали до 5°C. К этому раствору добавляли MeMgBr (1M в гексане, 1,79 мл, 1,79 ммоль, 4,00 эквив.) при 5°C в атмосфере азота. Полученный раствор перемешивали в течение 3 ч при 5°C. Значение pH раствора доводили до 3 с использованием 1M HCl, затем полученный раствор экстрагировали этилацетатом. Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:3), в результате чего получали 440 мг (70%) 3-фенил-N-[(1r,3r)-3-[[4-(1-гидроксиэтил)-1H-пиразол-1-ил]метил]циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=367,2.
[321] Этап 5: 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик). Неочищенный N-(3-[[4-(1-гидроксиэтил)-1H-пиразол-1-ил]метил]циклобутил)-3-фенил-1,2-оксазол-5-карбоксамид (440 мг, 1,20 ммоль, 1,00 эквив.) отделяли препаративной сверхкритической жидкостной хроматографией (колонка: Phenomenex Lux 5u, заполненная целлюлозой Cellulose-4 AXIA, 250*21,2мм, 5мкм; подвижная фаза A: CO2: 60, подвижная фаза B: гексан: 40; Скорость потока: 40 мл/мин; 220 нм; время удерживания 1:5,12; время удерживания 2:6,06), в результате чего получали 141,7 мг (32%) 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (передний пик) в форме белого твердого вещества и 146,5 мг (33%) 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (второй пик) в виде красного твердого вещества.
[322] 3-фенил-N-[(1r,3r)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик): ЖХМС (электроспрей, m/z): [M+H-H2O]+=349,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,26-9,23 (d, J=7,5 Гц, 1H), 7,93-7,90 (m, 2H), 7,62-7,60 (m, 2H), 7,54-7,52 (m, 3H), 7,32 (s, 1H), 4,85-4,83 (d, J=4,8 Гц, 1H), 4,71-4,63 (m, 1H), 4,55-4,47 (m, 1H), 4,20-4,17 (d, J=7,8 Гц, 2H), 2,68-2,64 (m, 1H), 2,27-2,10 (m, 4H), 1,33-1,31 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,2%.
[323] 3-фенил-N-[(1r,3r)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик): ЖХМС (электроспрей, m/z): [M+H-H2O]+=349,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,26-9,24 (d, J=7,2 Гц, 1H), 7,93-7,90 (m, 2H), 7,64-7,60 (m, 2H), 7,54-7,52 (m, 3H), 7,32 (s, 1H), 4,85-4,84 (d, J=4,8 Гц, 1H), 4,71-4,63 (m, 1H), 4,58-4,45 (m, 1H), 4,20-4,17 (d, J=7,8 Гц, 2H), 2,68-2,64 (m, 1H), 2,27-2,10 (m, 4H), 1,33-1,31 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 97,0%.
Примеры 69 и 70: 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик)
Неподтвержденный
второй пик
Неподтвержденный
первый пик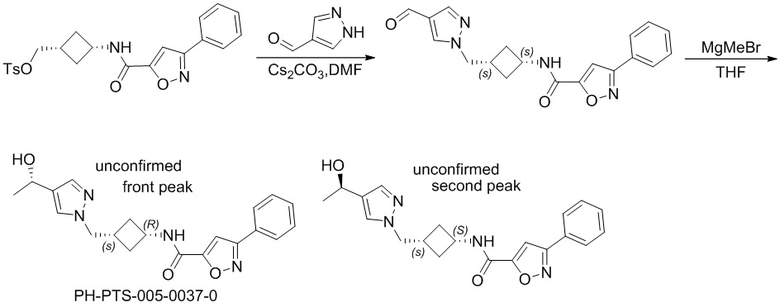
[324] Этап 1: 3-фенил-N-[(1s,3s)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил-4-метилбензол-1-сульфоната (1 г, 2,34 ммоль, 1,00 эквив.) в ДМФА (15 мл), затем добавляли Cs2CO3 (1,5 г, 4,60 ммоль, 2,00 эквив.) и 1H-пиразол-4-карбальдегид (338 мг, 3,52 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 100°C, затем удаляли твердые вещества фильтрацией. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ (CombiFlash-1: колонка, силикагель C18; подвижная фаза, X: H2O (0,5% NH4HCO3), Y: ацетонитрил, X/Y=90/10 с повышением до X/Y=5/95 в течение 40 мин; детектор УФ 254 нм), в результате чего получали 460 мг (56%) 3-фенил-N-[(1s,3s)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=351,1.
[325] Этап 2: 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик) и 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик). В круглодонную трехгорлую колбу помещали раствор 3-фенил-N-[(1s,3s)-3-[(4-формил-1H-пиразол-1-ил)метил]циклобутил]-1,2-оксазол-5-карбоксамида (460 мг, 1,31 ммоль, 1,00 эквив.) в ТГФ (30 мл), затем раствор охлаждали до 0°C. К этому раствору добавляли по каплям при перемешивании MeMgBr (1,3 мл, 3,00 эквив.) при 0°C в течение 10 мин. Полученный раствор перемешивали в течение 3 ч при к.т., нейтрализовали 2н. раствором HCl (10 мл) и 50 миллилитрами H2O и экстрагировали этилацетатом (3×50 мл). Органические экстракты объединяли, промывали солевым раствором (3×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (2:1). Продукт очищали хиральной препаративной ВЭЖХ (Prep-HPLC-004: колонка Chiralpak IB, 2*25см, 5мкм; подвижная фаза, гексан и этанол (поддерживали 10,0% этанол в течение 41 мин); Детектор УФ 254/220 нм), в результате чего получали 132,3 мг (28%) 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (первый пик) в виде беловатого твердого вещества и 139,4 мг (29%) 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида (второй пик) в виде беловатого твердого вещества.
[326] 3-фенил-N-[(1s,3s)-3-([4-[(1R)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (передний пик): ЖХМС (электроспрей, m/z): [M+H]+=367,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,21-9,18 (d, J=7,5 Гц, 1H), 7,94-7,91 (m, 2H), 7,62 (s, 1H), 7,55-7,51 (m, 3H), 7,48 (s, 1H), 7,32 (s, 1H), 4,85 (brs, 1H), 4,70-4,64 (q, J=6,6 Гц, 1H), 4,36-4,23 (m, 1H), 4,10-4,07 (d, J=6,9 Гц, 2H), 2,46-2,29 (m, 3H), 1,99-1,89 (m, 2H), 1,33-1,31 (d, J=6,3 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 96,4%.
[327] 3-фенил-N-[(1s,3s)-3-([4-[(1S)-1-гидроксиэтил]-1H-пиразол-1-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид (второй пик): ЖХМС (электроспрей, m/z): [M+H]+=367,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,21-9,18 (d, J=7,5 Гц, 1H), 7,92-7,87 (m, 2H), 7,68 (s, 1H), 7,61-7,48 (m, 4H), 7,31 (s, 1H), 4,85 (brs, 1H), 4,73-4,65 (m, 1H), 4,36-4,28 (m, 1H), 4,09-4,07 (d, J=6,6 Гц, 2H), 2,43-2,32 (m, 3H), 1,95-1,85 (m, 2H), 1,32-1,31 (d, J=5,1 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 96,0%.
Пример 71: 3-фенил-N-[(1r,3r)-3-(4-фторфеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамид.
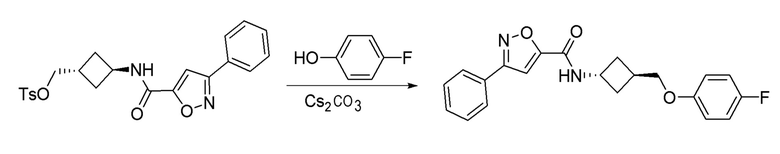
[328] В круглодонную колбу объемом 50 мл помещали раствор [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната (550 мг, 1,29 ммоль, 1,00 эквив.) в ДМФА (10 мл), затем 4-фторфенол (217 мг, 1,94 ммоль, 1,50 эквив.) и добавляли Cs2CO3 (631 мг, 1,93 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 70°C, затем разбавляли водой и экстрагировали этилацетатом. Органические экстракты объединяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:4). Затем полученный неочищенный продукт очищали препаративной ВЭЖХ (Waters: колонка X Bridge Shield RP18 OBD, 5 мкм, 19*150 мм; подвижная фаза, вода с 0,03%ТФУК и CH3CN (10,0% CH3CN до 30% CH3CN в течение 8 мин, до 100% в течение 4 мин и понижение до 10% в течение 3 мин); детектор УФ 254 нм и 220 нм), в результате чего получали 152,3 мг (53%) 3-фенил-N-[(1r,3r)-3-(4-фторфеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=367,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,31-9,29 (d, J=7,2 Гц, 1H), 7,92-7,91 (m, 2H), 7,63 (s, 1H), 7,55-7,54 (m, 3H), 7,15-7,09 (m, 2H), 6,99-6,95 (m, 2H), 4,61-4,53 (m, 1H), 4,05-4,03 (d, J=6,9 Гц, 2H), 2,69-2,63 (m, 1H), 2,38-2,29 (m, 2H), 2,23-2,17 (m, 2H). Чистота (ВЭЖХ, 254 нм): 97,4%.
Пример 72: 3-фенил-N-[(1s,3s)-3-(4-фторфеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамид
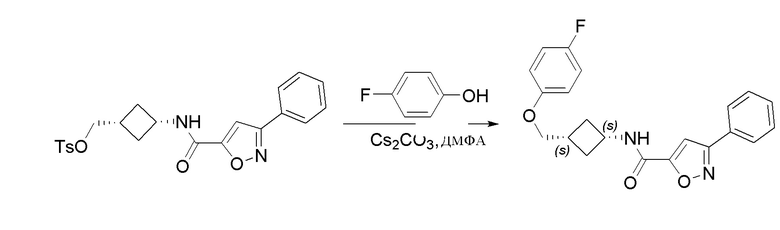
[329] В круглодонную колбу объемом 25 мл помещали раствор [(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната (213 мг, 0,50 ммоль, 1,00 эквив.) в ДМФА (5 мл), затем Cs2CO3 (326 мг, 1,00 ммоль, 2,00 эквив.) и добавляли 4-фторфенол (84 мг, 0,75 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 3 ч при 100°C, затем разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (2×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (петролейный эфир/этилацетат=1:2), в результате чего получали 56,9 мг (31%) 3-фенил-N-[(1s,3s)-3-(4-фторфеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=367,1. 1H-ЯМР (300 МГц, ДМСО-d6) δ 9,23-9,21 (d, J=7,5 Гц, 1H), 7,94-7,90 (m, 2H), 7,62 (s, 1H), 7,55-7,48 (m, 3H), 7,14-7,07 (m, 2H), 6,97-6,93 (m, 2H), 4,40-4,32 (m, 1H), 3,94-3,92 (d, J=5,1 Гц, 2H), 2,43-2,39 (m, 3H), 2,00-1,94 (m, 2H). Чистота (ВЭЖХ, 254 нм): 99,5%.
Пример 73: 3-фенил-N-[(1r,3r)-3-(4-цианофеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамид
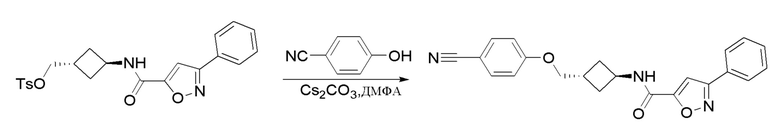
[330] В круглодонную колбу объемом 50 мл помещали раствор [(1r,3r)-3-(3-фенил-1,2-оксазол-5-амидо)циклобутил]метил 4-метилбензол-1-сульфоната (560 мг, 1,31 ммоль, 1,00 эквив.) в ДМФА (10 мл), добавляли затем 4-гидроксибензонитрил (235 мг, 1,97 ммоль, 1,50 эквив.) и Cs2CO3 (643 мг, 1,97 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 2 ч при 110°C, затем разбавляли путем добавления воды и экстрагировали этилацетатом. Органические экстракты объединяли, промывали водой, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Этот остаток очищали препаративной ВЭЖХ (Waters: колонка X Bridge Prep C18 5мкм, 19*150 мм; подвижная фаза, вода с 0,03% ТФУК и CH3CN (10,0% CH3CN до 30% CH3CN в течение 6 мин, до 100% в течение 5 мин с последующим снижением до 10% в течение 2 мин); Детектор УФ 254 нм и 220 нм), в результате чего получали 129,9 мг (87%) 3-фенил-N-[(1r,3r)-3-(4-цианофеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС-PH-PTS (электроспрей, m/z): [M+H]+=374,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,32-9,30 (d, J=7,5 Гц, 1H), 7,94-7,91(m, 2H), 7,78-7,76 (d, J=8,7 Гц, 2H), 7,63 (s, 1H), 7,55-7,54 (m, 3H), 7,15-7,12 (m, J=8,7 Гц, 2H), 4,63-4,55 (m, 1H), 4,19-4,17 (d, J=6,9 Гц, 2H), 2,72-2,66 (m, 1H), 2,40-2,30 (m, 2H), 2,24-2,18 (m, 2H). Чистота (ВЭЖХ, 254 нм): 97,3%.
Пример 74: 3-фенил-N-[(1s,3s)-3-(4-цианофеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамид
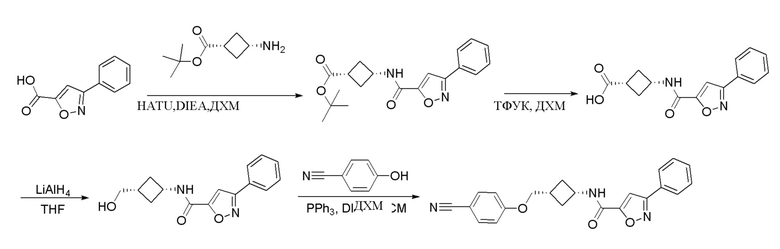
[331] Этап 1: трет-бутил (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилат. В круглодонную колбу объемом 100 мл помещали раствор трет-бутил (1s,3s)-3-аминоциколбутан-1-карбоксилата (1,7 г, 9,93 ммоль, 1,00 эквив.) в ДХМ (50 мл), затем добавляли 3-фенил-1,2-оксазол-5-карбоновую кислоту (1,9 г, 10,04 ммоль, 1,00 эквив.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (5,7 г, 14,99 ммоль, 1,50 эквив.) и DIEA (диизопропиленамин) (3,9 г, 30,18 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 1 ч при к.т., затем нейтрализовали путем добавления воды и экстрагировали этилацетатом. Органические экстракты объединяли, промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:7), в результате чего получали 2 г (59%) трет-бутил-(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилата в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+Na]+=365,1.
[332] Этап 2: (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновая кислота. В круглодонную колбу объемом 100 мл помещали раствор трет-бутил-(1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоксилата (2 г, 5,84 ммоль, 1,00 эквив.) в ДХМ (20 мл) и ТФУК (7 мл). Полученный раствор перемешивали в течение 4 ч при к.т., затем удаляли растворитель при пониженном давлении, в результате чего получали 1,8 г (неочищенной) (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты в виде беловатого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=286,8.
[333] Этап 3: 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор (1s,3s)-3-(3-фенил-1,2-оксазол-5-амидо)циколбутан-1-карбоновой кислоты (1 г, 2,79 ммоль, 1,00 эквив., 80%) в ТГФ (25 мл), затем раствор охлаждали до 0°C. К этому раствору порциями добавляли LiAlH4 (425 мг, 11,18 ммоль, 4,00 эквив.) при 0°C, затем полученный раствор перемешивали в течение 1 ч при 10°C. Реакцию гасили путем добавления Na2SO4.10H2O, затем твердые вещества удаляли фильтрацией, а фильтрат концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:2), в результате чего получали 420 мг (55%) 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=273,1.
[334] Этап 4: 3-фенил-N-[(1s,3s)-3-(4-цианофеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную трехгорлую колбу, которую продували и затем поддерживали в ней нейтральную атмосферу азота, помещали раствор 3-фенил-N-[(1s,3s)-3-(гидроксиметил)циклобутил]-1,2-оксазол-5-карбоксамида (420 мг, 1,31 ммоль, 1,00 эквив., 85%), 4-гидроксибензонитрила (320 мг, 2,69 ммоль, 2,00 эквив.) и PPh3 (1,08 г, 4,12 ммоль, 3,00 эквив.) в ТГФ (10 мл). После этого по каплям добавляли диизопропилазидокарбоксилат (DIAD) (840 мг, 4,15 ммоль, 3,00 эквив.) при перемешивании при 0°C. Полученный раствор перемешивали в течение 2 ч при к.т. Реакцию гасили путем добавления воды, затем экстрагировали этилацетатом. Органические экстракты объединяли, промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали методом препаративной флэш-ВЭЖХ (IntelFlash-1: колонка C18; подвижная фаза, MeCN/H2O=5:95 с повышением до MeCN/H2O=50:50 в течение 20 мин; детектор УФ 254 нм), в результате чего получали 148,5 мг (30%) 3-фенил-N-[(1s,3s)-3-(4-цианофеноксиметил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=374,2. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,25-9,24 (d, J=7,6 Гц, 1H), 7,94-7,92 (m, 2H), 7,79-7,76 (m, 2H), 7,64 (s, 1H), 7,55-7,53 (m, 3H), 7,16-7,12 (m, 2H), 4,43-4,35 (p, J=8,0 Гц, 1H), 4,08-4,06 (d, J=6,0 Гц, 2H), 2,45-2,40 (m, 3H), 2,02-1,97 (m, 2H). Чистота (ВЭЖХ, 254 нм): 98,2%.
Пример 75 и 76: 3-(5-фтортиофен-2-ил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-(5-фтортио фен-2-ил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид
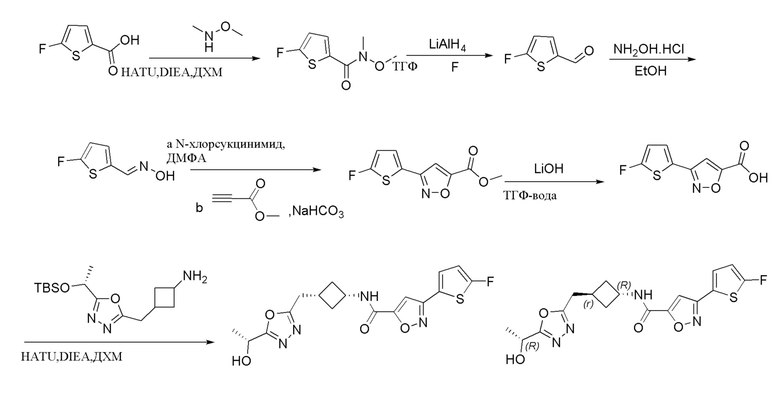
[335] Этап 1: 5-фтор-N-метокси-N-метилтиофен-2-карбоксамид. В круглодонную колбу объемом 100 мл помещали раствор 5-фтортиофен-2-карбоновой кислоты (1 г, 6,84 ммоль, 1,00 эквив.) в ДХМ (50 мл), затем добавляли метокси(метил)амина гидрохлорид (730 мг, 7,53 ммоль, 1,10 эквив.), HATU ( (1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (3,9 г, 10,26 ммоль, 1,50 эквив.) и DIEA (диизопропиленамин) (2,82 мл, 3,00 эквив.). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре, разбавляли водой и экстрагировали дихлорметаном (2×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток наносили на колонку с силикагелем и элюировали смесью этилацетат/петролейный эфир (1:4), в результате чего получали 1,14 г (88%) 5-фтор-N-метокси-N-метилтиофен-2-карбоксамида в виде желтой жидкости. ЖХМС (электроспрей, m/z): [M+H]+=190,0.
[336] Этап 2: (E)-N-[(5-фтортиофен-2-ил)метилиден]гидроксиламин. В круглодонную колбу объемом 50 мл помещали раствор 5-фтор-N-метокси-N-метилтиофен-2-карбоксамида (1,14 г, 6,03 ммоль, 1,00 эквив.) в ТГФ (20 мл), затем добавляли LiAlH4 (342 мг, 9,01 ммоль, 1,20 эквив.). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, затем нейтрализовали путем добавления 20 мл смеси H2O/лед и экстрагировали этилацетатом (2×20 мл). Органические экстракты сушили и использовали непосредственно на следующем этапе.
[337] В круглодонную колбу объемом 250 мл помещали раствор 5-фтортиофен-2-карбальдегида (780 мг, 5,99 ммоль, 1,00 эквив.) в EtOH/EtOAc (120 мл), затем добавляли NH2OH.HCl (0,5 г, 1,20 эквив.). Полученный раствор перемешивали в течение 3 ч при комнатной температуре, затем удаляли растворитель при пониженном давлении. Остаток растворяли в H2O (50 мл), затем полученный раствор экстрагировали этилацетатом (3×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 650 мг (75%) (E)-N-[(5-фтортиофен-2-ил)метилиден]гидроксиламина в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=146,0.
[338] Этап 3: Метил-3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоксилат. В круглодонную колбу объемом 25 мл помещали раствор (E)-N-[(5-фтортиофен-2-ил)метилиден]гидроксиламина (300 мг, 2,07 ммоль, 1,00 эквив.) ДМФА (5 мл), затем добавляли маленькими порциями N-хлорсукцинимид (NCS) (414 мг, 3,11 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 1 ч при комнатной температуре, затем добавляли метил-проп-2-иноат (0,27 мл, 2,00 эквив.), а затем маленькими порциями Na2CO3 (260 мг, 3,09 ммоль, 1,50 эквив.). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, разбавляли 50 миллилитрами H2O и экстрагировали этилацетатом (3×100 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали препаративной ТСХ (этилацетат /петролейный эфир=1/3), в результате чего получали 200 мг (43%) метил 3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоксилата в виде желтого твердого вещества.
[339] Этап 4: 3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоновая кислота. В круглодонную колбу объемом 50 мл помещали раствор метил 3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоксилат (254 мг, 1,12 ммоль, 1,00 эквив.) в ТГФ-H2O (3:1, 10 мл), затем доавляли LiOH (52 мг, 2,17 ммоль, 2,00 эквив.). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, разбавляли водой (20 мл) и промывали этилацетатом (2×50 мл). pH водного слоя доводили до 3 при помощи 1M HCl, затем полученный раствор экстрагировали этилацетатом (3×50 мл). Органические экстракты объединяли, промывали солевым раствором (2×50 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, в результате чего получали 170 мг (71%) 3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоновой кислоты в виде желтого твердого вещества. ЖХМС (электроспрей, m/z): [M+H]+=214,1.
[340] Этап 5: 3-(5-фтортиофен-2-ил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид и 3-(5-фтортиофен-2-ил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид. В круглодонную колбу объемом 50 мл помещали раствор 3-(5-фтортиофен-2-ил)-1,2-оксазол-5-карбоновой кислоты (170 мг, 0,80 ммоль, 1,00 эквив.) в ДХМ (20 мл), затем добавляли 3-([5-[(1R)-1-[(трет-бутилдиметилсилил)окси]этил]-1,3,4-оксадиазол-2-ил]метил)циколбутен-1-амин (273 мг, 0,88 ммоль, 1,10 эквив.), HATU ((1-[бис(диметиламино)метилен]-1H-1,2,3-триазол[4,5-b]пиридиний 3-оксид гексафторфосфат) (455 мг, 1,20 ммоль, 1,50 эквив.) и DIEA (диизопропиленамин) (0,33 мл, 3,00 эквив.). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре, разбавляли водой и экстрагировали дихлорметаном. Органические экстракты объединяли, промывали солевым раствором (2 x30 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (EtOAc/петролейный эфир=1/4), затем полученные чистые изомеры разделяли хиральной препаративной ВЭЖХ (Prep-HPLC-032: колонка, Lux 5мк, заполненная целлюлозой Cellulose -4, AXIA,, 250*21,2мм; подвижная фаза, гексан и изопропиловый спирт (поддерживали 30,0% изопропиловый спирт в течение 21 мин); детектор УФ 254/220 нм), в результате чего получили 37,2 мг (19%) 3-(5-фтортиофен-2-ил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества и 9,4 мг (5%) 3-(5-фтортиофен-2-ил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамида в форме белого твердого вещества.
[341] 3-(5-фтортиофен-2-ил)-N-[(1s,3s)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=393,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,23-9,20 (d, J=7,8 Гц, 1H), 7,61 (s, 1H), 7,57-7,55 (t, J=3,9 Гц, 2H), 6,94-6,92 (m, 1H), 5,91-5,89 (d, J=5,7 Гц, 1H), 4,92-4,83 (m, 1H), 4,33-4,23 (m, 1H), 2,97-2,95 (d, J=6,3 Гц, 2H), 2,46-2,33 (m, 3H), 1,96-1,90 (m, 2H), 1,45-1,43 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 98,8%.
[342] 3-(5-фтортиофен-2-ил)-N-[(1r,3r)-3-([5-[(1R)-1-гидроксиэтил]-1,3,4-оксадиазол-2-ил]метил)циклобутил]-1,2-оксазол-5-карбоксамид: ЖХМС (электроспрей, m/z): [M+H]+=393,1. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,33-9,31 (d, J=7,2 Гц, 1H), 7,62 (s, 1H), 7,57-7,54 (t, J=4,2 Гц, 1H), 6,94-6,92 (m, 1H), 5,92-5,90 (d, J=5,7 Гц, 1H), 4,92-4,84 (m, 1H), 4,57-4,49 (m, 1H), 3,09-3,06 (d, J=7,8 Гц, 2H), 2,72-2,64 (m, 1H), 2,37-2,27 (m, 2H), 2,17-2,12 (m, 2H), 1,46-1,43 (d, J=6,6 Гц, 3H). Чистота (ВЭЖХ, 254 нм): 99,3%.
Пример 77: Тесты на активность CFTR
i. Измерения по Уссингу
[343] Как обсуждалось выше, для измерения активности CFTR использовали измерения по Уссингу. В этом методе первичные клетки эпителия легких (hBE), гомозиготные по вызывающей муковисцидозмутации ΔF508, дифференцируют в течение по меньшей мере 4 недель перед проведением измерений по Уссингу на границе воздух/жидкость в фильтровальных планшетах SnapWell. Клетки промывают от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляют и заменяют средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубируют при 37°C и 5% CO2 в течение 24 ч. В конце периода обработки клетки на фильтрах переносят в камеру Уссинга и уравновешивают в течение 30 минут. Ток короткого замыкания измеряют в режиме регистрации напряжения (вольткламп) (Vhold=0 мМ), весь эксперимент проводят при температуре 36°C -36,5 °C. После стабилизации напряжений снимают показания с камеры, регистрируя данные в импульсном режиме с интервалом 5 секунд. После стабилизации исходного уровня напряжения можно добавлять следующие соединения и отслеживать изменения в токе и сопротивлении клеток:
1. Бензамил в апикальную камеру для ингибирования натриевого канала ENaC.
2. Формколин в обе камеры для активации ΔF508-CFTR за счет фосфорилирования.
3. Генистеин в обе камеры для стимуляции открытия канала ΔF508-CFTR.
4. CFTRinh-172 в апикальную камеру для подавления проводимости ΔF508-CFTR для Cl.
[344] Поддающийся ингибированию ток (т.е. ток, блокируемый ингибитором CFTRinh-172) измеряют в качестве меры удельной активности канала ΔF508-CFTR, и повышение в ответ на соединение этой активности по сравнению с наблюдаемой в образцах, обработанных нейтральной средой, определяют как коррекцию ΔF508-CFTR, обеспечиваемую исследуемым соединением.
ii. Исследование эквивалентного тока hBE (Iэкв.)
[345] Первичные клетки эпителия легких, гомозиготные по вызывающей муковисцидоз мутации ΔF508, дифференцировали в течение по меньшей мере 4 недель на границе воздух/жидкость в 24-луночных фильтровальных планшетах Costar HTS перед измерениями эквивалентного тока (Iэкв.). Клетки промывали от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляли и заменяли средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубировали при 37°C и 5% CO2 в течение 24 ч. В конце периода обработки среду меняли на раствор для проведения экспериментов по измерению Iэкв, за 30 минут до проведения эксперимента и в течение этого периода клетки находятся в инкубаторе без CO2. Планшеты, содержащие клетки, затем помещали в предварительно нагретые термостаты с температурой 36 °C±0,5 на 15 минут перед снятием измерений. Измеряли трансэпителиальное напряжение (VT) и проводимость (GT) с использованием специального 24-канального измерителя тока (TECC-24) с блоком электродов на 24 лунки. Экспериментальные измерения Iэкв проводили после внесения добавок со стандартными интервалами:
1. Исходные значения VT и GT измеряли в течение приблизительно 20 минут.
2. Бензамил добавляли для блокирования ENaC в течение 15 минут.
3. Форсколин плюс VX-770 добавляли для максимальной активации ΔF508-CFTR в течение 27 минут.
4. Буметанид добавляли для ингибирования со-транспортера NaK2Cl перекрывания секреции хлорида.
[346] В качестве параметров активности регистрировали площадь под кривой (AUC), отражающую следы эквивалентного тока хлорид-ионов. AUC регистрировали от времени добавления формколина/VX-770 до добавления ингибирующего буметанида. Коррекцию в ответ на обработку соединением определяли как повышение AUC для соединений, обработанных соединением по сравнению с образцами, обработанными нейтральной средой.
[347] Результаты показаны ниже в Таблице 2. ++ обозначает активность >25%, определенную при 10 мкМ VX-809 при 1 мкМ,+обозначает активность от 10 до < 25%, определенную при 10 мкМ VX-809 при 1 мкМ, ** обозначает активность >200% для VX-809 (1 мкМ) с соединением в концентрации 10 мкм и VX-809 в концентрации 1 мкМ; * обозначает активность 100-200% для VX-809 (1 мкМ) с соединением в концентрации 10 мкМ и VX-809 в концентрации 1 мкМ. ## обозначает активность >200% для VX-809 (3 мкМ) с соединением в концентрации 10 мкМ и VX-809 в концентрации 3 мкМ; # обозначает активность 100-200% для VX-809 (3 мкМ) с соединением в концентрации 10 мкМ и VX-809 при 3 мкМ.
Таблица 2:






































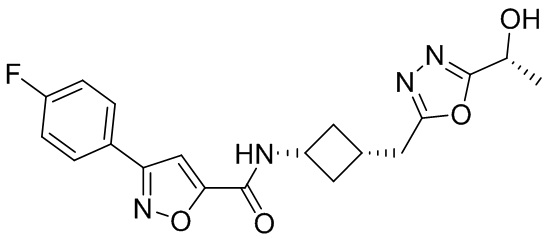





































Пример 78
i. Измерения по Уссингу
[348] Как обсуждалось выше, для измерения активности CFTR использовали измерения по Уссингу. В этом методе первичные клетки эпителия легких (hBE) c вызывающей муковисцидоз мутациией класса I дифференцируют в течение по меньшей мере 4 недель перед проведением измерений по Уссингу на границе воздух/жидкость в фильтровальных планшетах SnapWell™. Клетки промывают от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляют и заменяют средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубируют при 37°C и 5% CO2 в течение 24 ч. В конце периода обработки клетки на фильтрах переносят в камеру Уссинга и уравновешивали в течение 30 минут. Ток короткого замыкания измеряют в режиме регистрации напряжения (вольткламп) (Vhold=0 мМ), весь эксперимент проводят при температуре 36°C -36,5 °C. После стабилизации напряжений снимают показания с камеры, регистрируя данные в импульсном режиме с интервалом 5 секунд. После стабилизации исходного уровня напряжения добавляют следующие соединения и отслеживают изменения в токе и сопротивлении клеток:
1. Бензамил в апикальную камеру для ингибирования натриевого канала ENaC.
2. Формколин в обе камеры для активации ΔF508-CFTR за счет фосфорилирования.
3. Генистеин в обе камеры для стимуляции открытия канала ΔF508-CFTR.
4. CFTRinh-172 в апикальную камеру для подавления проводимости ΔF508-CFTR для Cl.
[349] Поддающийся ингибированию ток (т.е. ток, блокируемый ингибитором CFTRinh-172) измеряют в качестве меры удельной активности канала ΔF508-CFTR, и повышение в ответ на соединение этой активности по сравнению с наблюдаемой в образцах, обработанных нейтральной средой, определяют как коррекцию ΔF508-CFTR, обеспечиваемую исследуемым соединением.
Пример 79
i. Измерения по Уссингу
[350] Как обсуждалось выше, для измерения активности CFTR можно использовать измерения по Уссингу. В этом методе первичные клетки эпителия легких (hBE) c вызывающей муковисцидоз мутацией класса III дифференцируют в течение по меньшей мере 4 недель перед проведением измерений по Уссингу на границе воздух/жидкость в фильтровальных планшетах SnapWell™. Клетки промывают от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляют и заменяют средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубируют при 37°C и 5% CO2 в течение 24 ч. В конце периода обработки клетки на фильтрах переносят в камеру Уссинга и уравновешивают в течение 30 минут. Ток короткого замыкания измеряют в режиме регистрации напряжения (вольткламп) (Vhold=0 мМ), весь эксперимент проводят при температуре 36°C -36,5 °C. После стабилизации напряжений снимают показания с камеры, регистрируя данные в импульсном режиме с интервалом 5 секунд. После стабилизации исходного уровня напряжения добавляют следующие соединения и отслеживают изменения в токе и сопротивлении клеток:
1. Бензамил в апикальную камеру для ингибирования натриевого канала ENaC.
2. Формколин в обе камеры для активации ΔF508-CFTR за счет фосфорилирования.
3. Генистеин в обе камеры для стимуляции открытия канала ΔF508-CFTR.
4. CFTRinh-172 в апикальную камеру для подавления проводимости ΔF508-CFTR для Cl.
[351] Чувствительный к форсколину ток и поддающийся ингибированию ток (т.е. ток, блокируемый ингибитором CFTRinh-172) измеряют в качестве меры удельной активности канала ΔF508-CFTR, и повышение в ответ на соединение этой активности по сравнению с наблюдаемой в образцах, обработанных нейтральной средой, определяют как коррекцию ΔF508-CFTR, обеспечиваемую исследуемым соединением.
Пример 80
i. Измерения по Уссингу
[352] Как обсуждалось выше, для измерения активности CFTR можно использовать измерения по Уссингу. В этом методе первичные клетки эпителия легких (hBE) c вызывающей муковисцидоз мутациией класса V дифференцируют в течение по меньшей мере 4 недель перед проведением измерений по Уссингу на границе воздух/жидкость в фильтровальных планшетах SnapWell™. Клетки промывают от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляют и заменяют средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубируют при 37°C и 5% CO2 в течение 24 ч. В конце периода обработки клетки на фильтрах переносят в камеру Уссинга и уравновешивали в течение 30 минут. Ток короткого замыкания измеряют в режиме регистрации напряжения (вольткламп) (Vhold=0 мМ), весь эксперимент проводят при температуре 36°C -36,5 °C. После стабилизации напряжений снимают показания с камеры, регистрируя данные в импульсном режиме с интервалом 5 секунд. После стабилизации исходного уровня напряжения добавляют следующие соединения и отслеживают изменения в токе и сопротивлении клеток:
1. Бензамил в апикальную камеру для ингибирования натриевого канала ENaC.
2. Формколин в обе камеры для активации ΔF508-CFTR за счет фосфорилирования.
3. Генистеин в обе камеры для стимуляции открытия канала ΔF508-CFTR.
4. CFTRinh-172 в апикальную камеру для подавления проводимости ΔF508-CFTR для Cl.
[353] Чувствительный к форсколину ток и поддающийся ингибированию ток (т.е. ток, блокируемый ингибитором CFTRinh-172) измеряют в качестве меры удельной активности канала ΔF508-CFTR, и повышение в ответ на соединение этой активности по сравнению с наблюдаемой в образцах, обработанных нейтральной средой, определяют как коррекцию ΔF508-CFTR, обеспечиваемую исследуемым соединением.
ii. Измерение эквивалентного тока в hBE (Iэкв.)
[354] Первичные клетки эпителия легких, гомозиготные по вызывающей муковисцидозмутации ΔF508, дифференцировали в течение по меньшей мере 4 недель на границе воздух/жидкость в 24-луночных фильтровальных планшетах Costar HTS перед измерениями эквивалентного тока (Iэкв.). Клетки промывали от апикальной слизи в течение 30 минут перед обработкой соединениями. Базолатеральную среду удаляют и заменяют средой, содержащей исследуемые соединения, полученные путем разбавления до конечных концентраций из исходных растворов в ДМСО. Обработанные клетки инкубируют при 37°C т 5% CO2 в течение 24 ч. В конце периода обработки среду меняют на раствор для проведения экспериментов по измерению Iэкв, за 30 минут до проведения эксперимента и в течение этого периода клетки находятся в инкубаторе без CO2. Планшеты, содержащие клетки, затем помещают в предварительно нагретые термостаты с температурой 36 °C±0,5 на 15 минут перед снятием измерений. Измеряют трансэпителиальное напряжение (VT) и проводимость (GT) с использованием специального 24-канального измерителя тока (TECC-24) с блоком электродов на 24 лунки. Экспериментальные измерения Iэкв проводили после внесения добавок со стандартными интервалами:
1. Исходные значения VT и GT измеряли в течение приблизительно 20 минут.
2. Бензамил добавляли для блокирования ENaC в течение 15 минут.
3. Форсколин плюс VX-770 добавляли для максимальной активации ΔF508-CFTR в течение 27 минут.
4. Буметанид добавляли для ингибирования со-транспортера NaK2Cl перекрывания секреции хлорида.
[355] В качестве параметров активности регистрируют площадь под кривой (AUC), отражающая следы эквивалентного тока хлорид-ионов. AUC регистрируют от времени добавления формколина/VX-770 до добавления ингибирующего буметанида. Корреацию в ответ на обработку соединением определяли как повышение AUC для соединений, обработанных соединением по сравнению с образцами, обработанными нейтральной средой.
[356] Хотя данное изобретение было показано в деталях и описано с указанием предпочтительных результатов его реализации, специалисты в данной области поймут, что в изобретение можно внести различные изменения формы и деталей, не выходя за пределы объема изобретения, охватываемые прилагаемой формулой изобретения.
ВКЛЮЧЕНИЕ ПУТЕМ ССЫЛКИ
[357] Все публикации и патенты, упоминаемые в настоящем документе, включая перечисленные ниже документы, полностью включены в настоящий документ посредством ссылки для любых целей так как если бы каждое из них было отдельно включено посредством ссылки. В случае противоречия приоритетное значение имеет настоящая заявка, включая любые содержащиеся в ней определения.
ЭКВИВАЛЕНТЫ
[358] Хотя обсуждались варианты реализации и объект изобретения, описание выше является иллюстративным, а не ограничивающим. Полный объем изобретения определяется формулой изобретения, а также полным объемом эквивалентов формулы изобретения, а также описанием с такими вариациями.
[359] Если не указано иное, все численные значения, характеризующие количества ингредиентов, условия реакции и т.д., используемые в описании и формуле изобретения, следует во всех случаях понимать как модифицированные термином «примерно». Соответственно, если не указано обратное, численные параметры, приведенные в этом описании и прилагаемой формуле изобретения, являются приблизительными значениями, которые могут варьировать в зависимости от желаемых свойств, которые хотят получить при осуществлении настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОАРОМАТИЧЕСКИЕ МОДУЛЯТОРЫ РЕТИНОЛ-СВЯЗАННОГО ОРФАННОГО РЕЦЕПТОРА ГАММА | 2017 |
|
RU2771280C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ПРОИЗВОДНЫЕ 5-(7Н-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)-5-АЗАСПИРО[2.5]ОКТАН-8-КАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ НОВЫХ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2018 |
|
RU2761626C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| АНИЛИДЫ АМИНОКИСЛОТ В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ МОДУЛЯТОРОВ IL-17 | 2019 |
|
RU2815505C2 |
| БЕНЗОТИАЗОЛЬНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ РАССТРОЙСТВ | 2018 |
|
RU2778370C2 |
| НЕСТЕРОИДНЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИОДИДНЫХ РЕЦЕПТОРОВ ДЛЯ МЕСТНОЙ ДОСТАВКИ ЛЕКАРСТВ | 2016 |
|
RU2731618C2 |
| НОВЫЕ СОЕДИНЕНИЯ - АНТАГОНИСТЫ РЕЦЕПТОРА НЕЙРОКИНИНА 1 | 2013 |
|
RU2631319C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ KDM5, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840256C1 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОАРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ СТИМУЛЯТОРОВ CFTR | 2017 |
|
RU2753056C2 |
Изобретение относится к соединению, представленному формулой III или IV, и к его фармацевтически приемлемой соли, где X1 представляет собой N; X3 представляет собой S; pp представляет собой 1; R11 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода и галогена; R31 выбран из группы, состоящей из водорода и галогена; L1 представляет собой C3-6 циклоалкилен или C3-6циклоалкилен-C1-4алкилен; R44 представляет собой 5-членный гетероарил, содержащий один, два или три гетероатома, каждый из которых выбран из O, N и S; причем гетероарил может быть необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из Rgg; Rgg для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, циано, гетероцикла, выбранного из азетидинила, оксетанила и диоксидотиетанила, C1-6 алкила, причем C1-6 алкил может быть необязательно замещены одним заместителем, выбранным из Rjj; и гетероцикл необязательно замещен одним заместителем, выбранным из Rll; Rjj для каждого случая, когда он присутствует, выбран из группы, состоящей из гидроксила, C1-6 алкокси (необязательно замещенного одним заместителем, выбранным из Rkk), C3-6 циклоалкокси и -S(O)w-C1-3 алкила, где w равен 2; Rkk для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, C3-6 циклоалкила, оксетанила и азетидинила (необязательно замещенного C1-6 алкилом); Rll для каждого случая, когда он присутствует, выбран из группы, состоящей из C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена и C3-6 циклоалкила) и пиперидинила (необязательно замещенного одним заместителем, выбранным из C1-6 алкила). Изобретение также относится к фармацевтической композиции для повышения активности регулятора трансмембранной проводимости при муковисцидозе (CFTR) на основе указанных соединений. Технический результат – получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения муковисцидоза. 5 н. и 11 з.п. ф-лы, 2 табл., 79 пр.
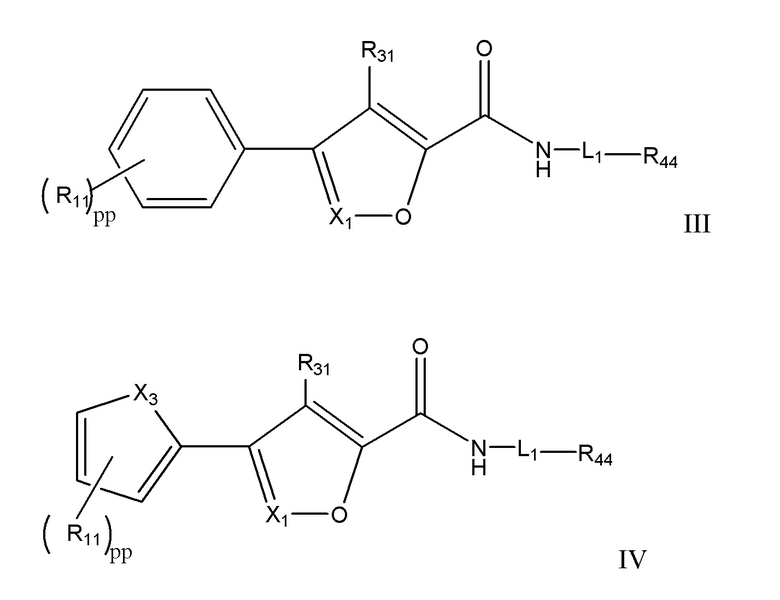
1. Соединение, представленное формулой III или IV:
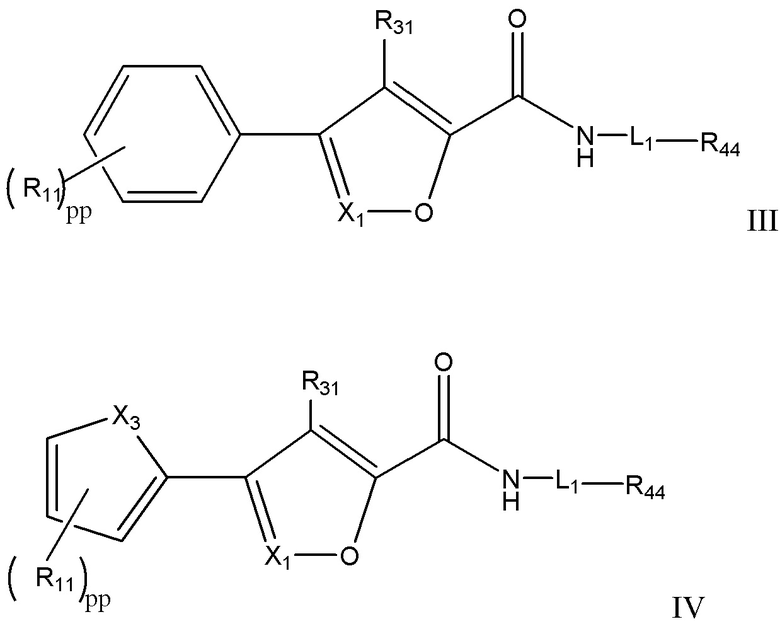
и его фармацевтически приемлемые соли, где:
X1 представляет собой N;
X3 представляет собой S;
pp представляет собой 1;
R11 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода и галогена;
R31 выбран из группы, состоящей из водорода и галогена;
L1 представляет собой C3-6 циклоалкилен или C3-6циклоалкилен-C1-4алкилен;
R44 представляет собой 5-членный гетероарил, содержащий один, два или три гетероатома, каждый из которых выбран из O, N и S; причем гетероарил может быть необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из Rgg;
Rgg для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, циано, гетероцикла, выбранного из азетидинила, оксетанила и диоксидотиетанила, C1-6 алкила, причем C1-6 алкил может быть необязательно замещены одним заместителем, выбранным из Rjj; и гетероцикл необязательно замещен одним заместителем, выбранным из Rll;
Rjj для каждого случая, когда он присутствует, выбран из группы, состоящей из гидроксила, C1-6 алкокси (необязательно замещенного одним заместителем, выбранным из Rkk), C3-6 циклоалкокси и -S(O)w-C1-3 алкила, где w равен 2;
Rkk для каждого случая, когда он присутствует, выбран из группы, состоящей из галогена, C3-6 циклоалкила, оксетанила и азетидинила (необязательно замещенного C1-6 алкилом);
Rll для каждого случая, когда он присутствует, выбран из группы, состоящей из C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из галогена и C3-6 циклоалкила) и пиперидинила (необязательно замещенного одним заместителем, выбранным из C1-6 алкила).
2. Соединение по п. 1, в котором R31 представляет собой H или F.
3. Соединение по любому из пп. 1 или 2, в котором Rgg выбран из группы, состоящей из:
в котором R29 выбран из C1-6 алкила (необязательно замещенного одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена и циклоалкила) и пиперидинила (необязательно замещенного одним заместителем, выбранным из C1-6 алкила).
4. Соединение по п. 3, в котором R29 выбран из группы, состоящей из:
5. Соединение по любому из пп. 1-4, представленное формулой:

где qq равен 0 или 1.
6. Соединение по любому из пп. 1-5, представленное формулой:
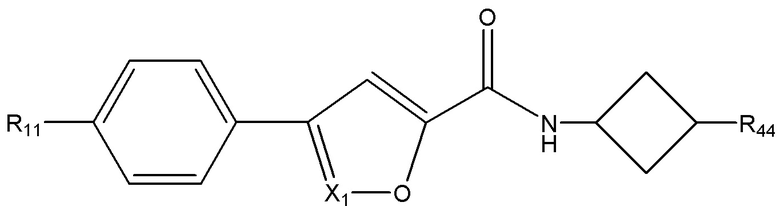 .
.
7. Соединение по любому из пп. 1-6, в котором R44 выбран из группы, состоящей из:
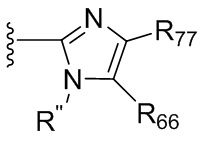 ,
,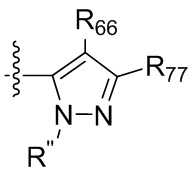 ,
, 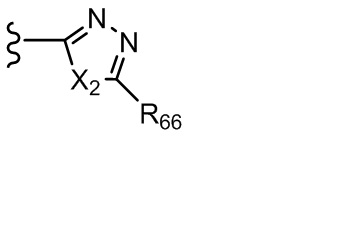 ,
,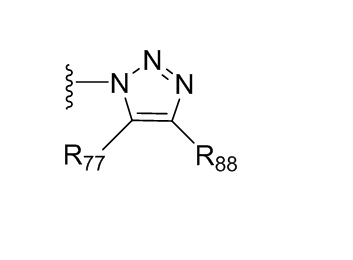 ,
, 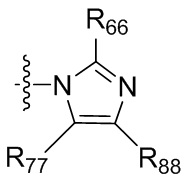 ,
, 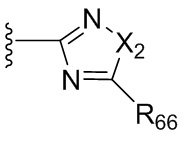 ,
, 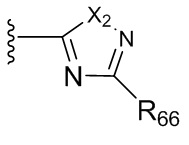 и
и 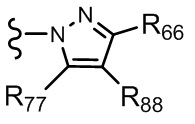 ;
;
где X2 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из O, S и NRhh; R'' представляет собой H или C1-4алкил; и каждый R66, R77 и R88 независимо выбран для каждого случая, когда он присутствует, из H и Rgg, и Rhh выбран из Rgg.
8. Соединение по п. 7, в котором каждый R66, R77 и R88 независимо для каждого случая, когда он присутствует, выбран из группы, состоящей из водорода, галогена, C1-6 алкила и гетероцикла, причем C1-6 алкил и гетероцикл необязательно замещены одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из гидроксила, C1-6 алкила, C1-6 алкокси (необязательно замещенного C3-6циклоалкилом, гетероциклом и C1-2алкил-C3-6циклоалкилом), -S(O)w-C1-3 алкила (w равен 2).
9. Соединение по любому из пп. 1-8, в котором pp равен 0, 1 или 2, и R11 выбран из H или F.
10. Соединение, выбранное из группы, состоящей из:
 ,
, ,
, ,
, ,
, ,
,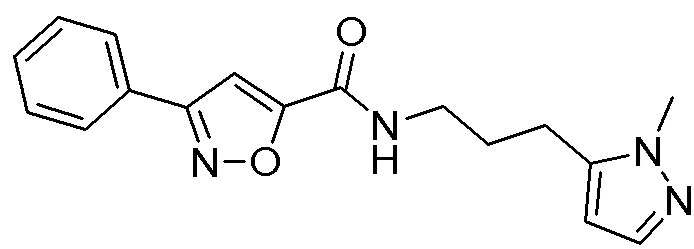 ,
,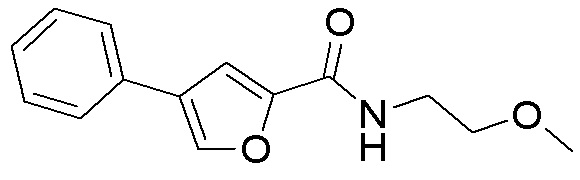 ,
,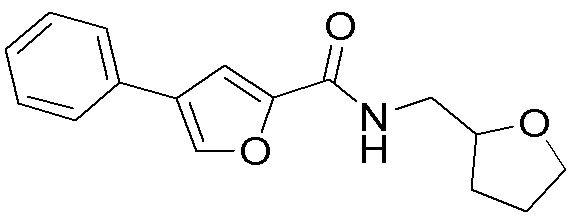 ,
,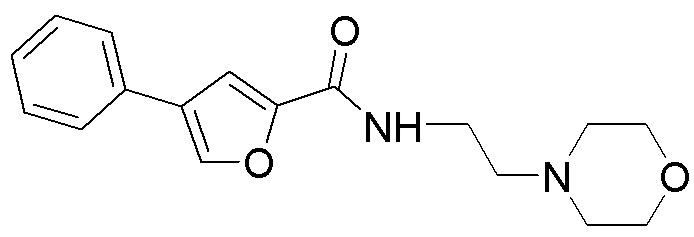 ,
,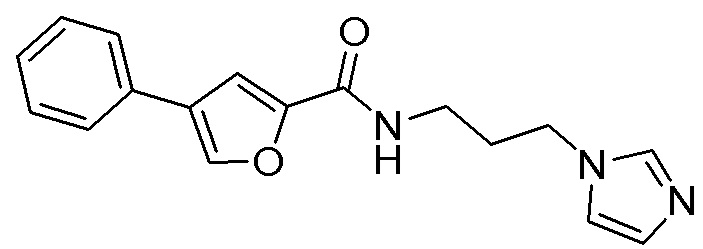 ,
,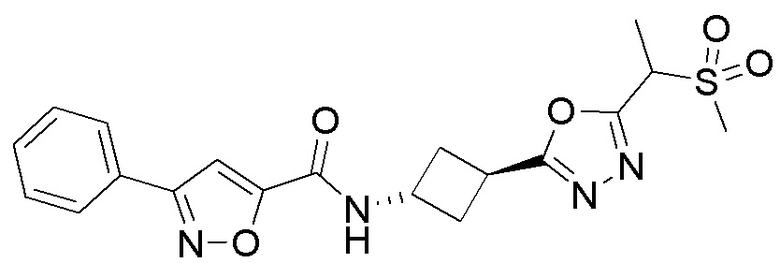 ,
,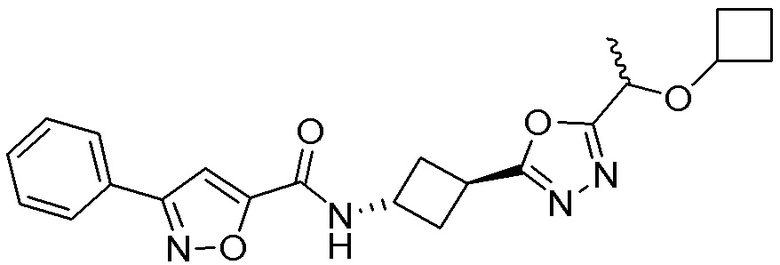 ,
,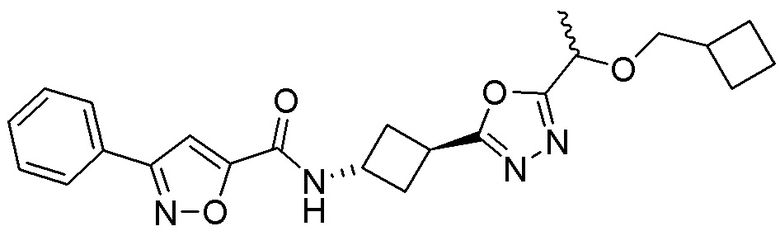 ,
,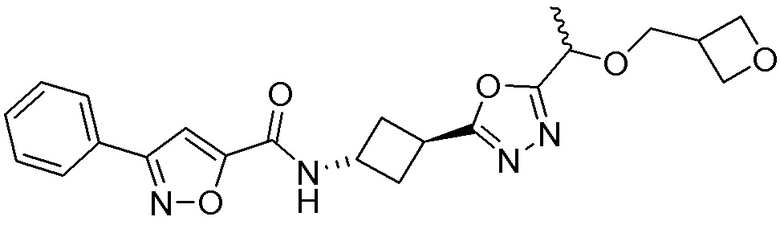 ,
,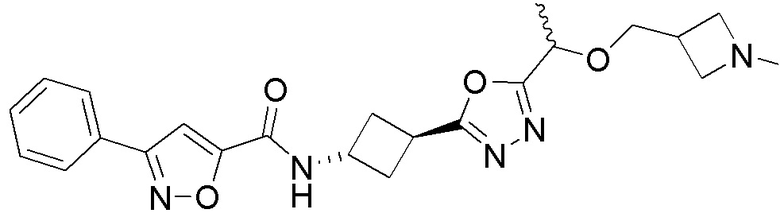 ,
,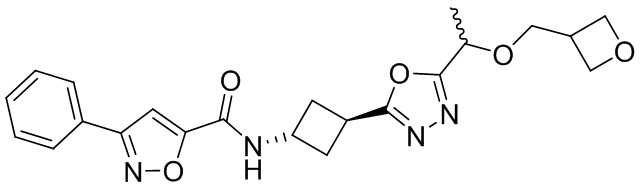 ,
,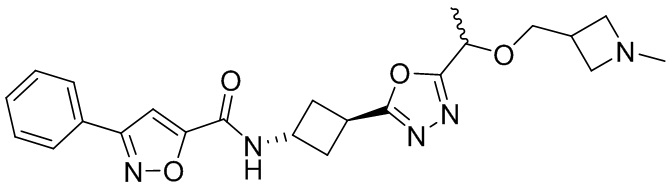 '
'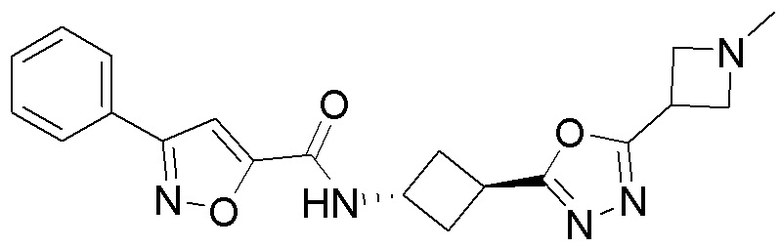 ,
,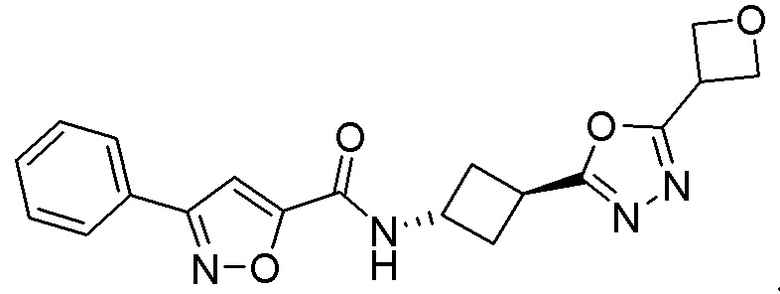 ,
,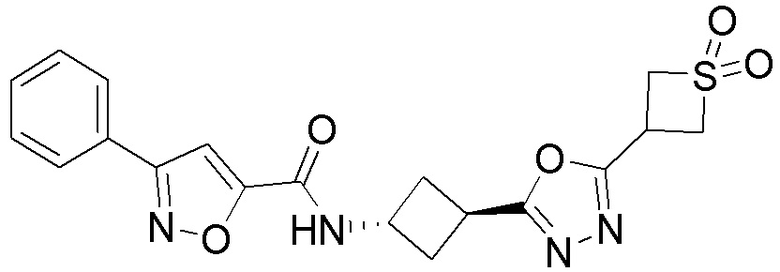 '
'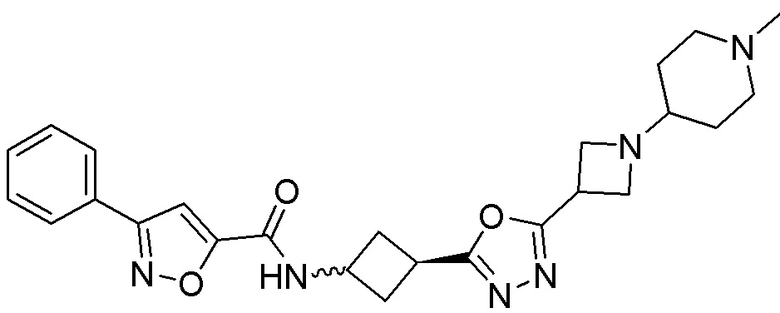 ,
,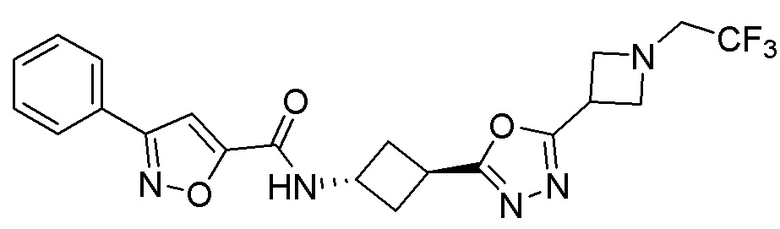 ,
,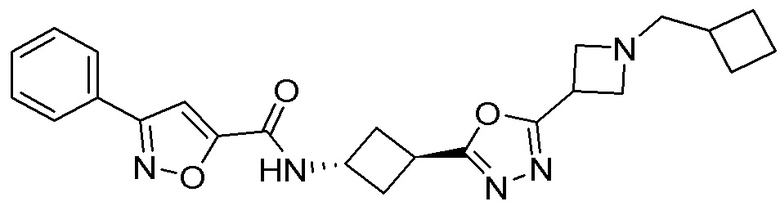 ,
,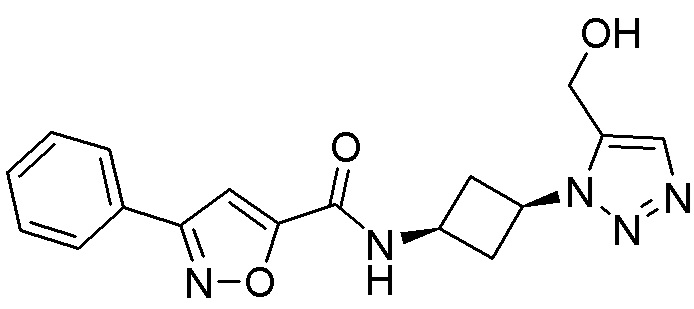 ,
,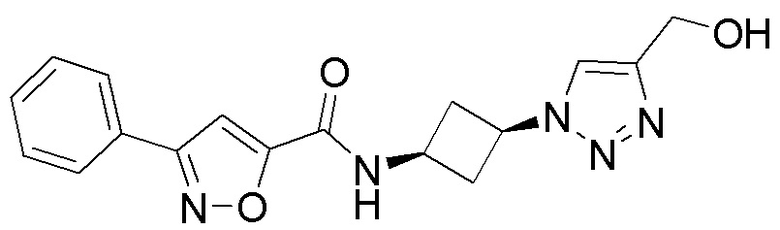 ,
,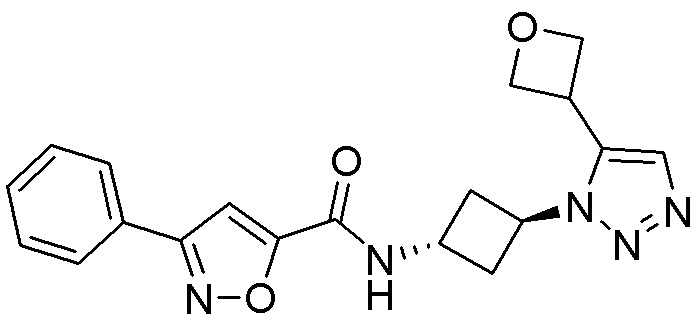 ,
,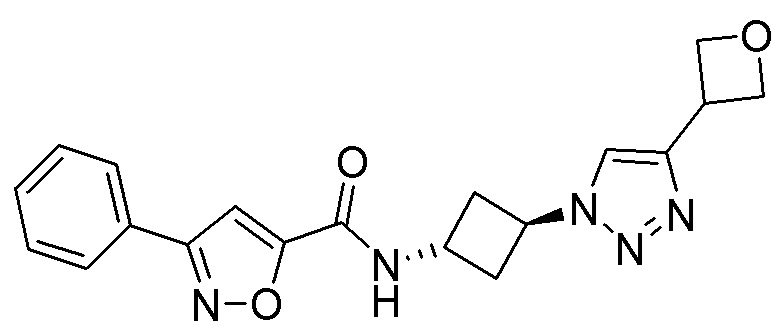 ,
,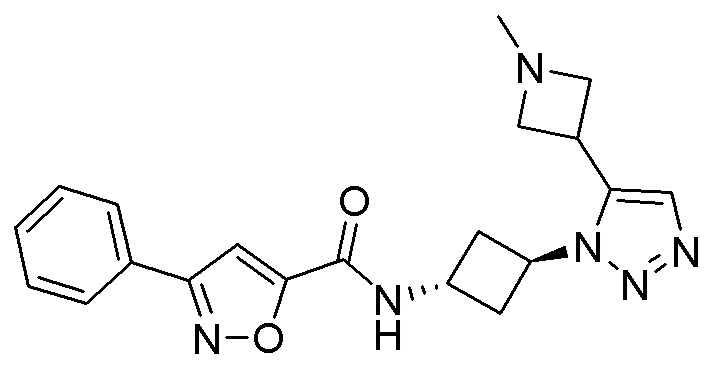 ,
,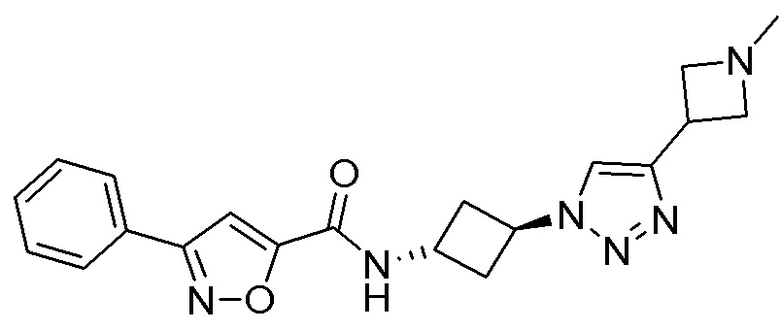 ,
,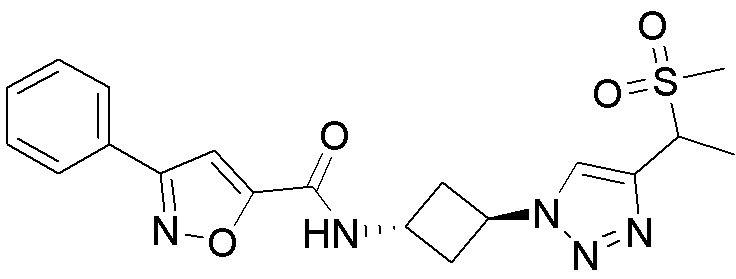 ,
,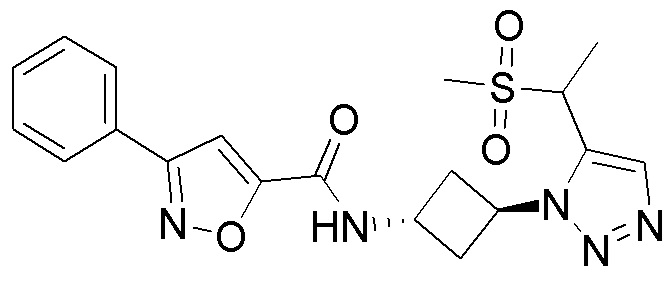 ,
,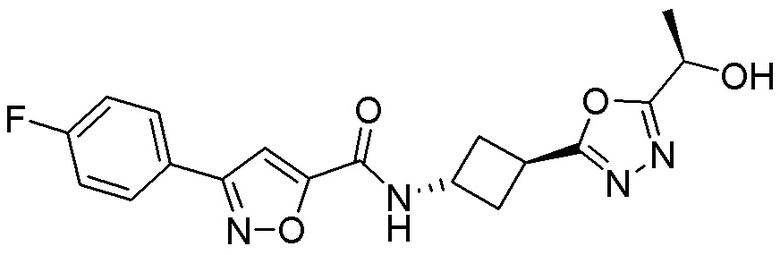 ,
,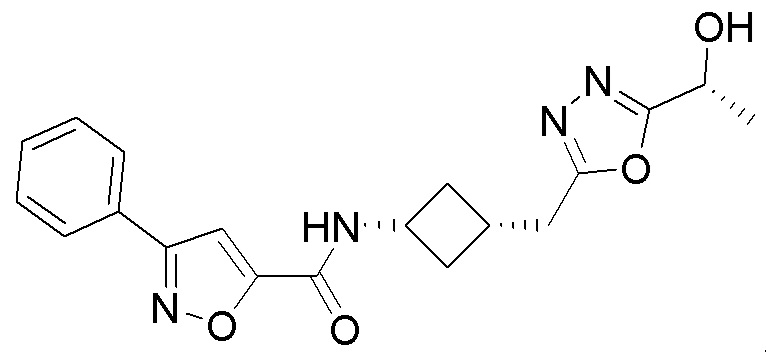 ,
,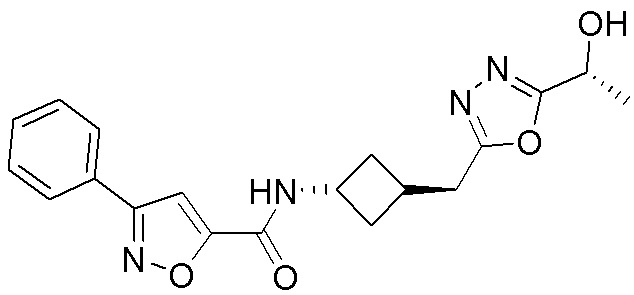 ,
,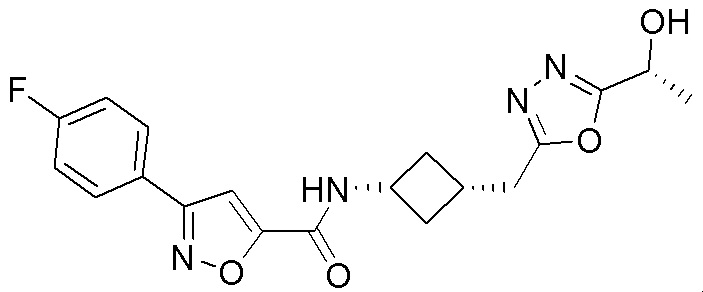 ,
,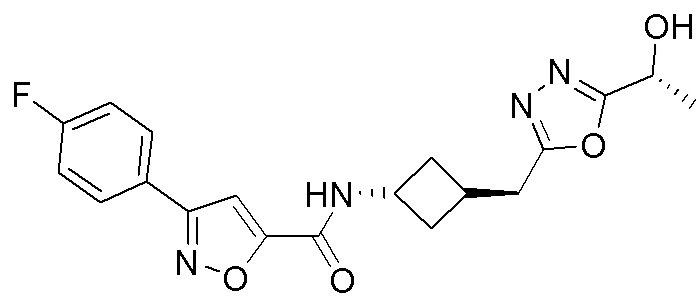 ,
,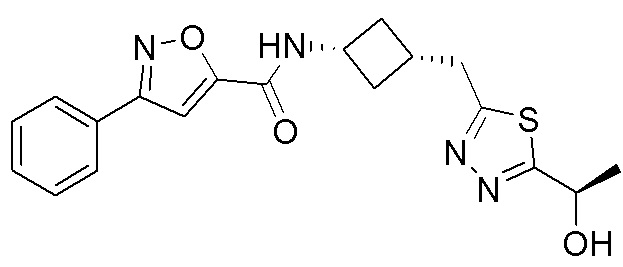 ,
,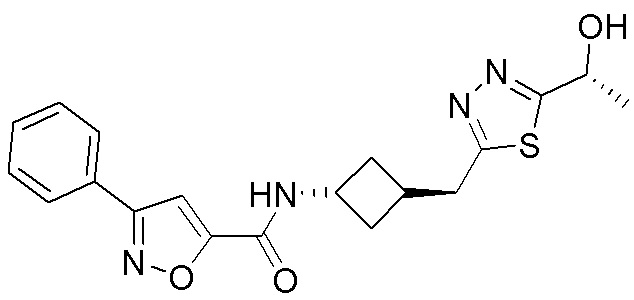 ,
,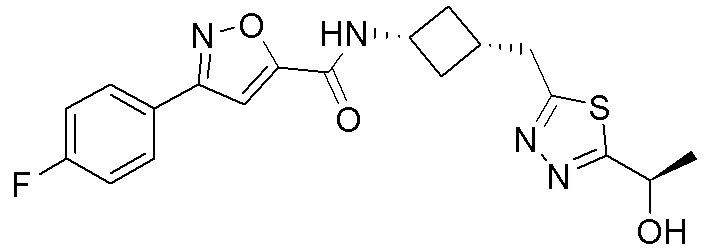 ,
, ,
,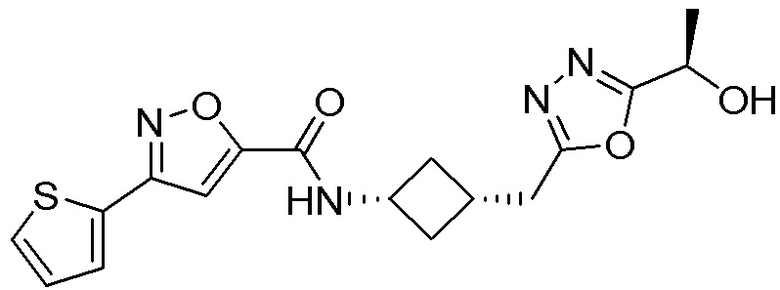 ,
,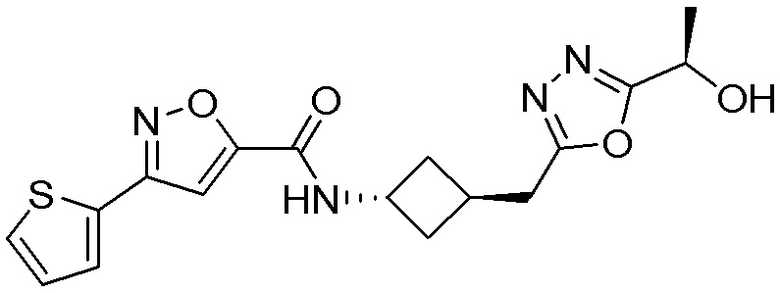 ,
,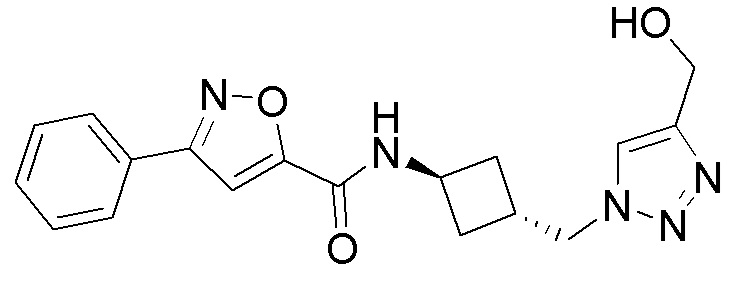 ,
,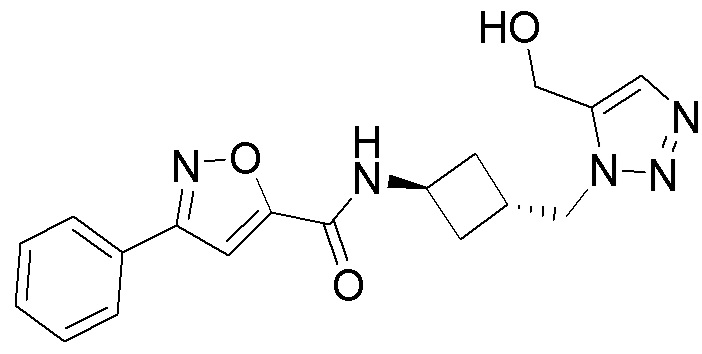 ,
,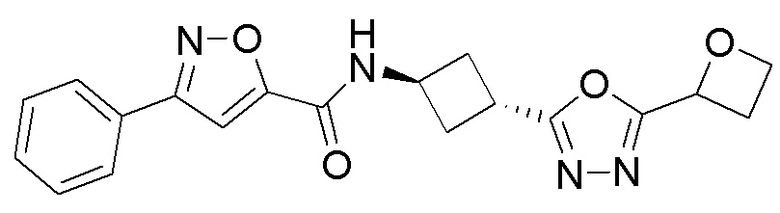 ,
,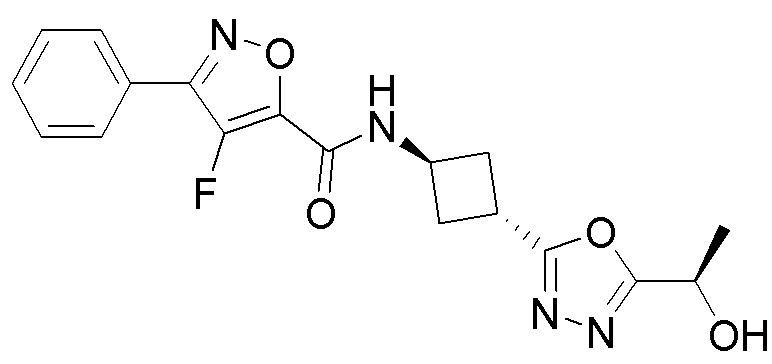 ,
, ,
,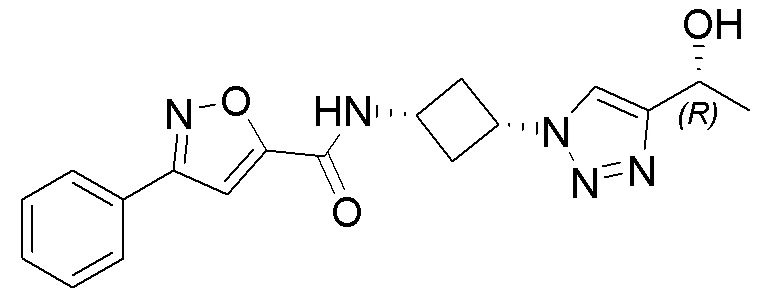 ,
,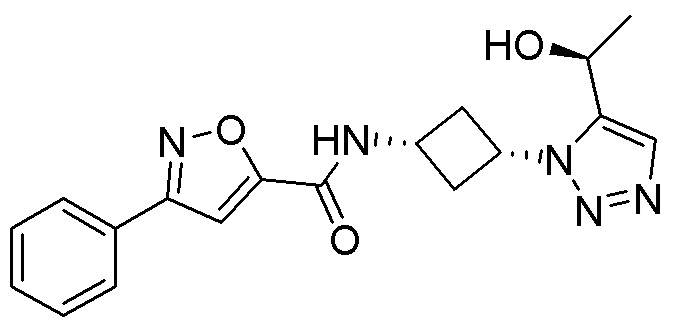 ,
,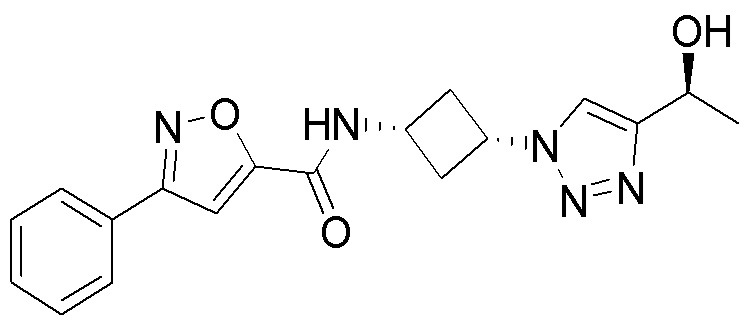 ,
,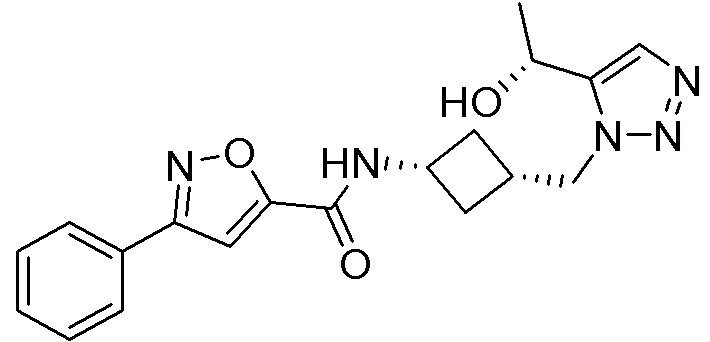 ,
,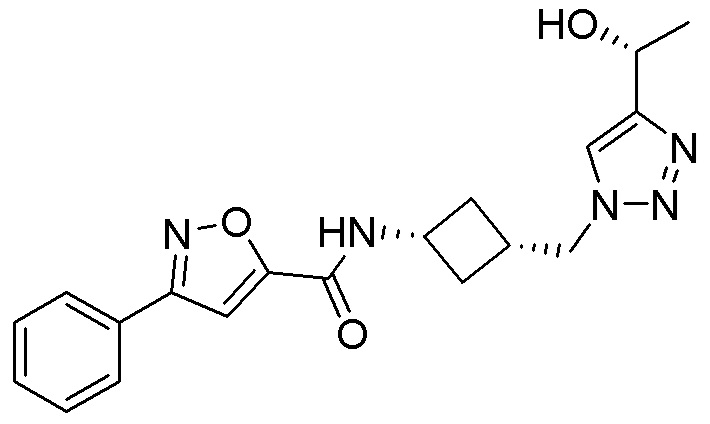 ,
,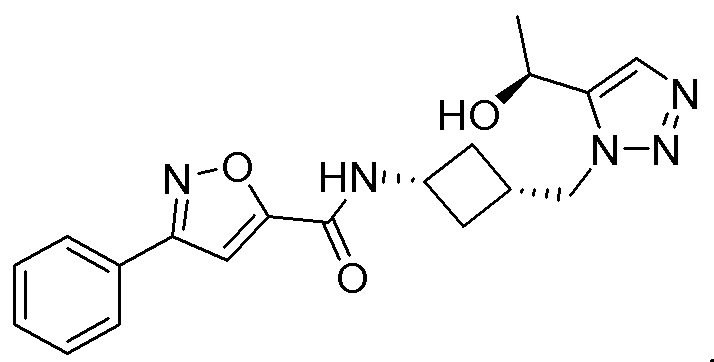 ,
,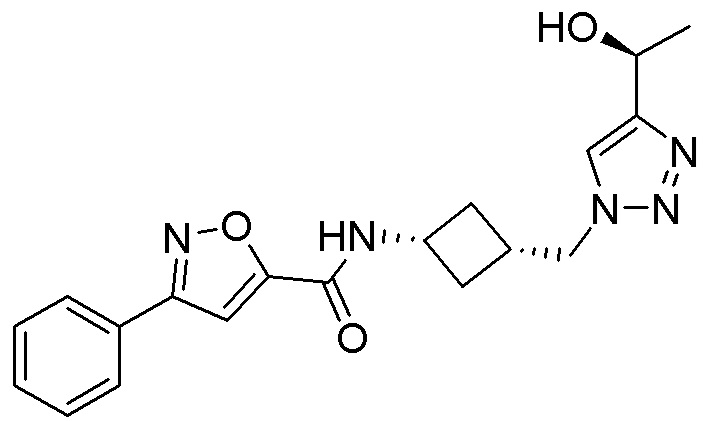 ,
,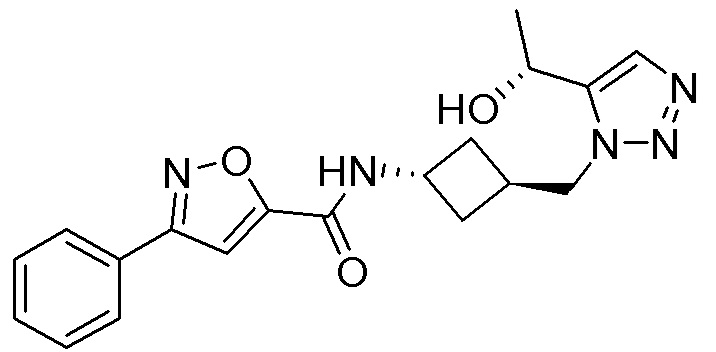 ,
,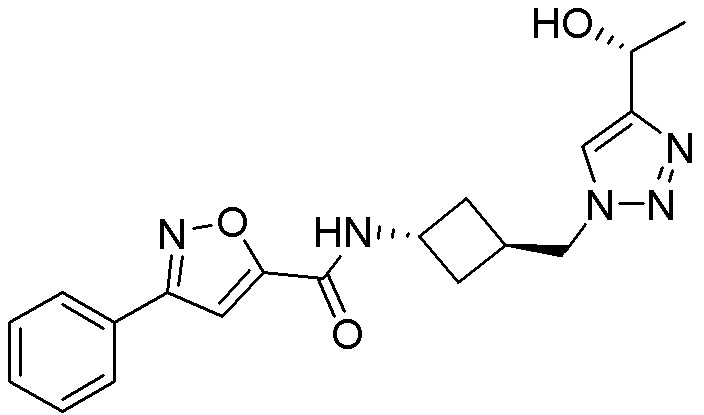 ,
,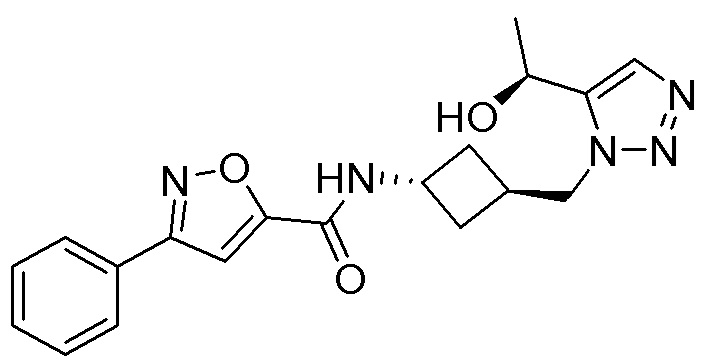 ,
,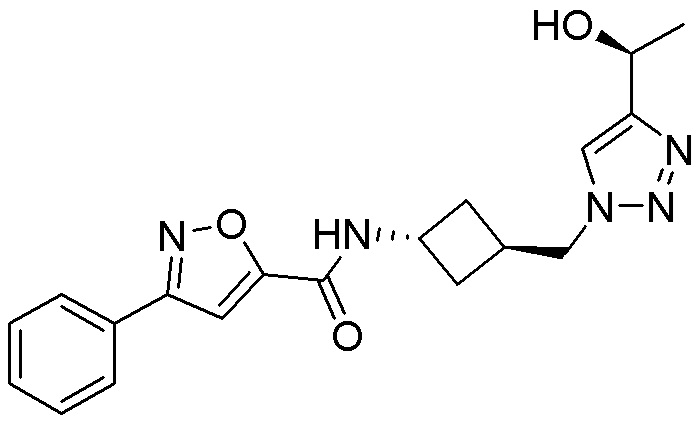 ,
,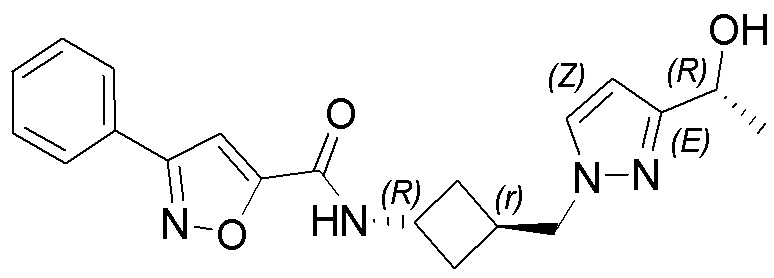 ,
,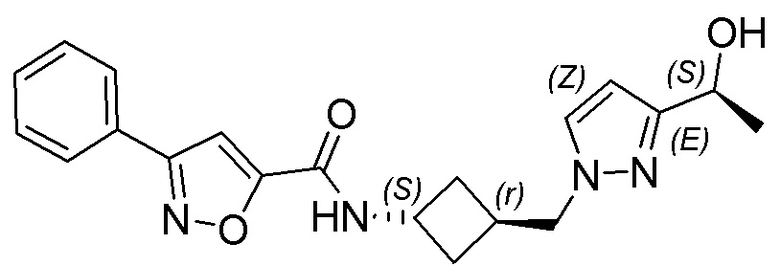 ,
,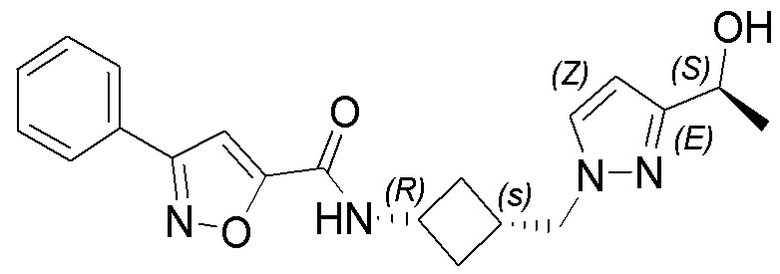 ,
,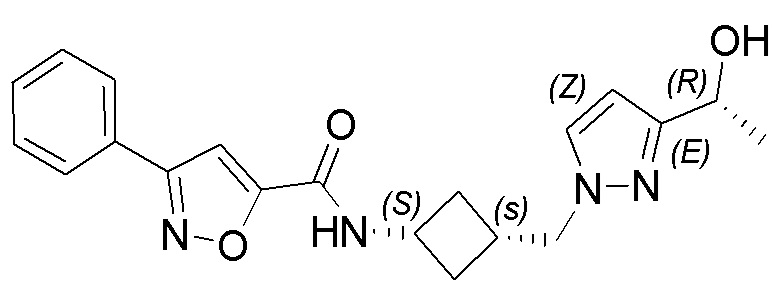 ,
,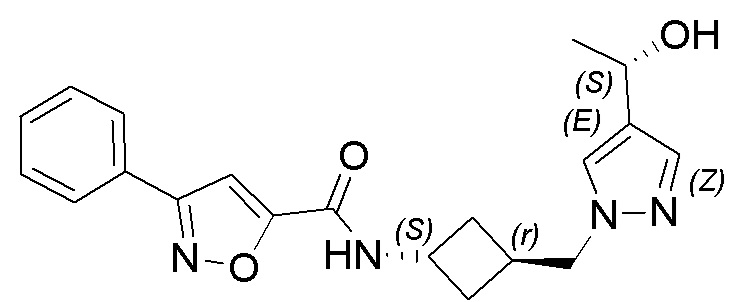 ,
,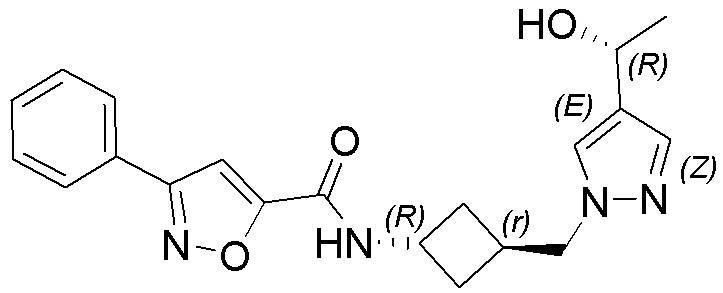 ,
,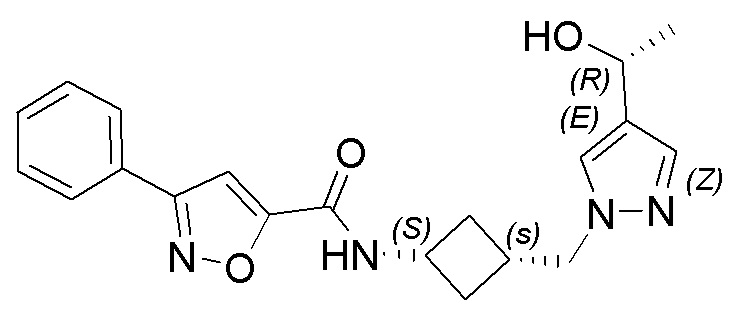 ,
, ,
,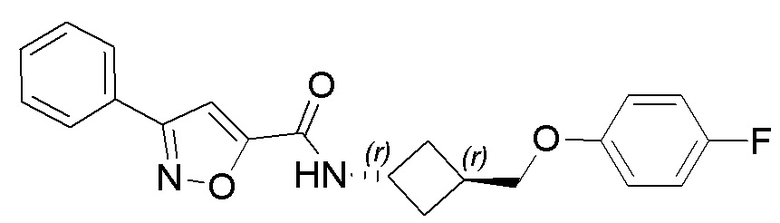 ,
,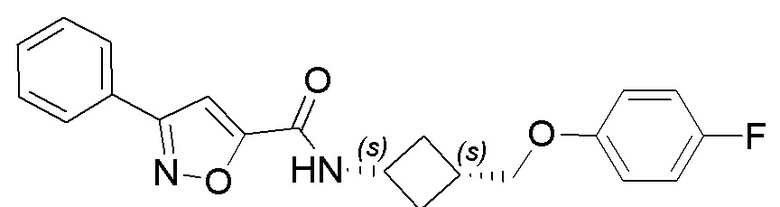 ,
,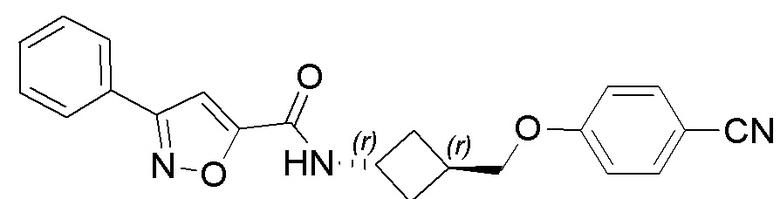 ,
,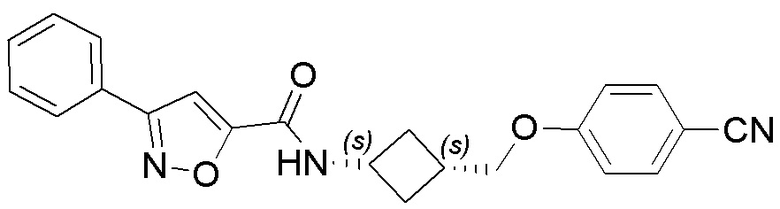 ,
,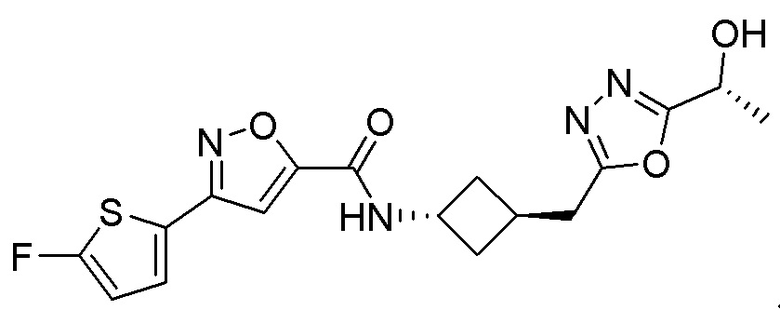 ,
, ,
,
и их фармацевтически приемлемы солей.
11. Фармацевтическая композиция для повышения активности регулятора трансмембранной проводимости при муковисцидозе (CFTR), содержащая эффективное количество соединения по любому из пп. 1-10 и фармацевтически приемлемый носитель или вспомогательное вещество.
12. Способ повышения активности регулятора трансмембранной проводимости при муковисцидозе (CFTR) у субъекта, нуждающегося в этом, включающий введение указанному субъекту эффективного количества соединения по любому из пп. 1-10 или фармацевтической композиции по п.11, где повышают активность мутантного CFTR и где мутантный CFTR представляет собой ΔF508.
13. Способ по п. 12, в котором субъект страдает заболеванием, связанным с активностью CFTR.
14. Способ по п. 13, в котором заболевание представляет собой муковисцидоз.
15. Способ по п. 14, в котором субъект представляет собой пациента-человека.
16. Способ лечения муковисцидоза у нуждающегося в этом пациента, включающий введение эффективного количества соединения по любому из пп. 1-10 или фармацевтической композиции по п.11.
| WO 2009011850 A2, 22.01.2009 | |||
| WO 2003093297 A2, 13.11.2003 | |||
| Способ ультразвукового контроля качества материалов и устройство для его осуществления | 1981 |
|
SU957099A1 |
| WO 2006014134 A1, 09.02.2006 | |||
| WO 2010089297 A1, 12.08.2010 | |||
| WO 2010142801 A1, 16.12.2010 | |||
| Штамм дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу из Bacillus pumilus и бета-глюканазу из Paenibacillus jamilae | 2019 |
|
RU2736441C1 |
Авторы
Даты
2022-03-17—Публикация
2015-12-23—Подача