Способ относится к области биотехнологии, в частности к молекулярной биотехнологии, и представляет собой метод, основанный на принципиально новом подходе к методике проведения полимеразной цепной реакции, исключающем этап экстрагирования ДНК.
На сегодняшний день серьезной угрозой здоровью норки является алеутская болезнь, вызываемая парвовирусом Carnivore amdoparvovirus рода Amdovirus. Алеутская болезнь первоначально наблюдалась в США в конце 1940-х годов у алеутской норки (разновидность серо-коричневого цвета, похожая по цвету на алеутских лис). Данное заболевание относится к плазмоцитозам, поскольку при нем обнаруживается большое количество плазматических клеток в тканях или экссудатах (Canuti et al, 2015). Классическая форма данной болезни встречается у взрослых норок и характеризуется гипергаммаглобулинемией, вызывающей гломерулонефрит, приводящий к острой почечной недостаточности, артриту и снижению репродуктивной функции (Prieto et al, 2018). Острая форма заболевания, как правило, характеризуется летальной интерстициальной пневмонией у детенышей норок. Эффективного лечения и вакцины против алеутской болезни норок не существует.
Алеутская болезнь может протекать временно бессимптомно, но течение заболевания в основном определяется вирулентностью вирусного штамма. Известные штаммы имеют различную патогенность, от непатогенного штамма AMDV G, низковирулентного штамма SL-3, выделенного в Германии, штамма Пуллмана, который является летальным для алеутской разновидности норки и высоко смертельного штамма Юты. Алеутской болезни подвержены американская норка (Neovison visori), европейский хорек (Mustela putorius), европейская куница (Martes martes), обыкновенная генетта (Genetta genetta), енотовидная собака (Nyctereutes procyonoides) и скунс (Mephitis mephitis), которые могут являться переносчиками.
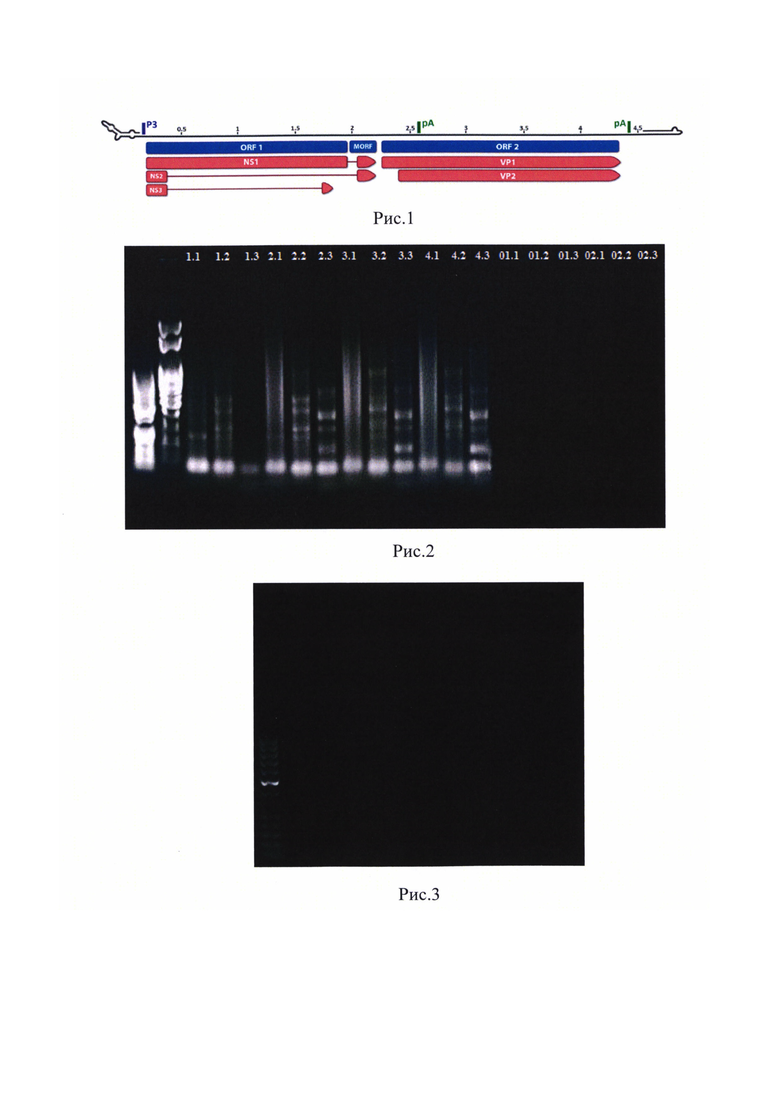
Геном вируса состоит из одиночной цепи ДНК длиной до 4,8 тн, содержащей информацию о трех неструктурных белках (NS1, NS2 и NS3) и двух структурных (VP1 и VP2). На Рисунке 1 представлена схема генома вируса алеутской болезни норок Неструктурные белки обслуживают экспрессию вирусного материала, в то время как структурные определяют антигенные свойства. Было показано, что ингибиторы каспаз у взрослых норок могут ограничить размножение вируса, поскольку каспазы участвуют в регуляции репликации NS1 вируса. Особое значение представляет собой белок VP2, содержащий участок с высоким полиморфизмом аминокислот, комбинация которых специфична для определенных штаммов. Высокий полиморфизм этого участка обусловлен его участием в формировании и локализацией в третичной структуре капсидных белков и позволяет дифференцировать штаммы.
В лабораторных условиях контроль заболевания осуществляется на основании анализа патологоанатомических ицитоморфологических данных, результатов лабораторных исследований сыворотки крови зверей с помощью йодной пробы по методу Меллони, которая не является специфическим методом для выявления возбудителя и позволяет выявить не более 40% инфицированных зверей, и реакции иммуноэлектроосмофореза (РИОЭФ), иммуноферментного анализа (ИФА). Животных с подтвержденным диагнозом выбраковывают.
Необходимо отметить, что на определенной стадии течения болезни уровень специфических антител к белкам вируса крайне низок, поэтому используемые в диагностике методы ИФА большинстве случаев дают ложноотрицательные результаты.
Тем не менее, наблюдается регулярное реинфицирование ферм, несмотря на значительные усилия по искоренению болезни. Происходит это в силу устойчивости вирусных частиц к физическим и химическим агентам, быстрого распространения вируса насекомыми и человеком.
С помощью методов ПЦР, для проведения которых требуется этап выделения ДНК, невозможно выявить вирус при хроническом течении алеутской болезни норок, так как у таких животных репликации вируса не происходит и количество ДНК патогена очень низко в биопробах.
ПЦР, как правило, не используется в хозяйствах для обследования основного стада в связи с высокой стоимостью анализа, которая частично обусловлена необходимостью выделения ДНК. Методики выделения ДНК предполагают использование коммерческих наборов, не всегда отвечающих стандартам качества, что приводит к неполному устранению некоторых ингибиторов и, следовательно, к потере ДНК, при этом вероятность перекрестного заражения образцов повышается.
Известен метод ПЦР диагностики вируса алеутской болезни норок «АБН» (организация-производитель - ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва) для выявления ДНК вируса алеутской болезни норок (Aleutian mink disease virus (AMDV)) в биологическом материале методом полимеразной цепной реакции (ПЦР) с электрофоретической детекцией продуктов амплификации в агарозном геле. Метод основан на амплификации специфического участка ДНК из биологического материала за счет многократного повторения циклов денатурации ДНК в исследуемой пробе, отжига специфических олигонуклеотидных затравок (праймеров) и синтеза комплементарных цепей ДНК с помощью фермента Taq-полимеразы.
Недостатком данного метода является то, что разработчики предлагают выявление AMDV, основанное на амплификации фрагментов вирусной ДНК, гомологичных одному синтетическому олигонуклеотиду, при этом, в случае возникновения мутаций в ДНК вируса, амплификация невозможна, что по результатам электрофоретического разделения ампликонов выявляет ложноотрицательный результат анализа. Еще одним недостатком этого метода является то, что для проведения ПЦР необходимо использовать этап экстрагирования ДНК, при котором вероятность утраты вирусной ДНК ввиду малой длины генома AMDV крайне высока, возможность контаминации образцов также повышается. Кроме перечисленных недостатков имеющийся метод характеризуется сложностью постановки ПЦР, включающей необходимость применения специальной восковой пластины, предупреждающей смешивание реактивов до воздействия определенных температур. Время проведения анализа без учета специальной подготовки образцов, выделения ДНК и ее обработки - не менее 2 ч 30 мин.
Известен метод ПЦР диагностики вируса алеутской болезни норок, предложенный М.В. Мартыненко (Мартыненко М.В. Использование полимеразной цепной реакции для тетекции вируса алеутской болезни норок // Сельскохозяйственная биология. - 2004.- №6. - С. 120-122). Метод предполагает проведение ПЦР по стандартной методике с этапом экстрагирования ДНК, использование Taq-полимеразы и одну пару праймеров к геному AMDV. Преимущество метода в том, что по сравнению с РИЭОФ, данный метод обладает чувствительность в 5,5 раза выше. Авторы подтверждают необходимость дальнейшего совершенствования методов диагностики, в том числе, для исключения из методики постановки реакции этапа экстрагирования ДНК, но достигнуть этого авторам не удалось. Более того, авторы предлагают к использованию одну пару праймеров. Таким образом, представленный метод не исключает возможности утраты генома AMDV на этапе выделения ДНК, возможности перекрытий искомых нуклеотидных последовательностей вируса малой длины ДНК норки, что говорит о высоком риске получения ложноотрицательных результатов. Также использование одной пары праймеров повышает вероятность комплементарности последовательностей олигонуклеотидов с геномом норки и, следовательно, получение ложноположительных результатов анализа.
Патентуемый способ предполагает выявление возбудителя алеутской болезни норок проведением ПЦР с использованием рекомбинантной полимеразы, в районе N-конца которой содержится меньшее количество аминокислот, а глутаминовая кислота замещена лизином в кодоне 708, который обеспечивает устойчивость к нескольким типам ингибиторов ПЦР, и, соответственно, увеличение выхода целевой ДНК из образцов цельной крови, плазмы и сыворотки не менее чем на 25%, что позволяет исключить этап экстрагирования ДНК. Также, патентуемый способ основан на амплификации фрагментов ДНК с тремя парами специфических праймеров, гомологичных последовательностям консервативных участков ДНК генома AMDV, что исключает возможность получения ложноотрицательных и ложноположительных результатов по итогам электрофоретического разделения фрагментов ДНК. Праймеры, используемые для диагностики AMDV по патентуемому способу: RP2 F ТСТ AGA AGC AAC GCT TGG GGT GTA TG RGT TGT GTC ACT CCA CTG ТСТ RP3 F ТСТ AGA TTG GGC СТА CCT CCT СТС TG R ATA CAG GAC CAA CGT TGT CT NS F TTG GTT GCT TTA СТС С R СТА CTT TTA CAT CAC CAC
Заявленный способ не требует специальной подготовки образца, экстрагирования ДНК и каких-либо дополнительных инструментов и предполагает использование нативных тканей для прямой амплификации в ходе ПЦР.
Для подтверждения эффективности заявленного способа был проведен сравнительный анализ результатов применения для выявления AMDV патентуемого способа и стандартного метода ПЦР (с этапом выделения ДНК и PFU-полимеразой) в 50 образцах цельной крови норок. Из 50 норок, у которых были взяты биопробы, 10 животных ранее иными методами были идентифицированы как свободные от инфекции AMDV, 19 - как носители, 21 животное - не тестировались.
ПЦР с использованием PFU-полимеразы с выделением ДНК из биопроб норок со всеми тремя парами праймеров к различным участкам генома патогена AMDV, не привела к получению продуктов амплификации и, таким образом, свидетельствовала об отсутствии патогена в анализируемом материале. В то же время, в биообразцах тех же норок при использовании методов прямой амплификации без выделения ДНК с применением рекомбинантной полимеразы обнаруживались соответствующие фрагменты генома патогена одновременно в продуктах амплификации, полученных с использованием в ПЦР каждого из трех праймеров, которые отсутствовали в контрольных образцах.
По результатам анализа электрофореграмм продуктов амплификации ПЦР, проводимой без выделения суммарной ДНК с использованием трех пар праймеров к участкам генома патогена AMDV, получено подтверждение, что 10 условно отрицательных образцов не продуцируют продукты амплификации с использованием всех трех праймеров к геному патогена, в 19 условно положительных образцах подтверждается наличие продуктов амплификации, в 21 образцах крови ранее неисследованных норок также обнаруживаются продукты амплификации геномной ДНК AMDV при использовании в ПЦР всех трех пар праймеров.
Пример 1. Были исследованы образцы крови норки, которые отбирались, в том числе, от животных, ранее иными методами идентифицированных как носители инфекции AMDV.
Для проведения ПЦР-анализа использовалась ПЦР-смесь общим объемом 25 мкл, полученная с использованием коммерческого набора реагентов для проведения ПЦР (Синтол) и термостабильной рекомбинантной полимеразы:
Цел. кровь - 2,5 мкл
dNTP - 2,5 мкл
Buffer - 2,5 мкл
MgCl2 - 2,5 мкл
ddH2O -9,75 мкл
Pr. F. - 2,5 мкл
Pr. R. - 2,5 мкл
Pol. rec - 0,25 мкл
где праймеры: RP2 F ТСТ AGA AGC AAC GCT TGG GGT GTA TG R GTT GTG ТСА СТС CAC TGT СТ RP3 F ТСТ AGA TTG GGC СТА CCT ССТ СТС TG R ATA CAG GAC САА CGT TGT СТ NS F TTG GTT GCT ТТА СТС С R ТСТ ACT ТТТ АСА ТСА ССА С
Программа амплификации включала этапы:
1 цикл - первичная денатурации 95°С 5 мин
40 циклов - денатурация 94°С 30 сек
- отжиг 55°С 1 мин
- элонгация 68°С 30 сек
1 цикл - финальная элонгация 68°С 2 мин
В качестве контрольных образцов использовалась цельная кровь от норок, в последствии павших от подтвержденного диагноза алеутской болезни норок (положительный контроль), а также ПЦР-смесь без содержания образца крови или с содержанием образца крови кролика.
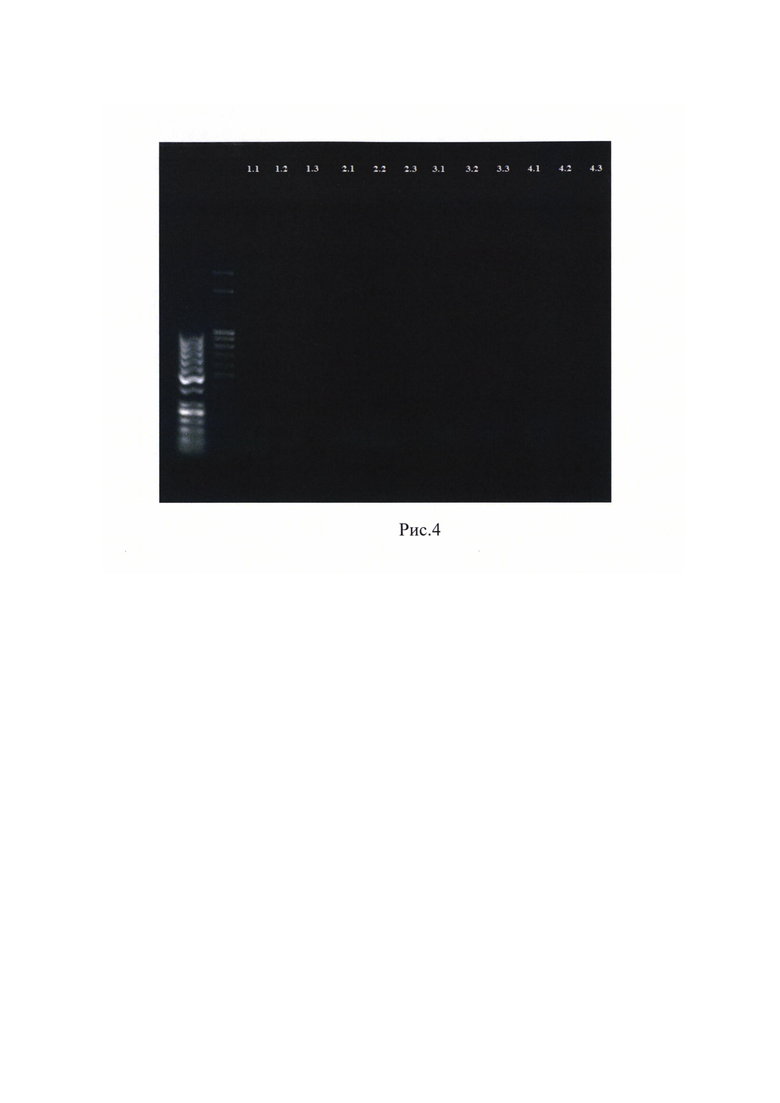
По результатам анализа электрофореграмм продуктов амплификации ПЦР, проводимой без выделения суммарной ДНК с использованием трех пар праймеров к участкам генома патогена AMDV, выявлены положительные по содержанию генома вируса алеутской болезни норок, а также получено подтверждение, что во всех условно положительных образцах выявляется наличие продуктов амплификации. На рисунке 2 представлена электрофореграмма ампликонов, полученных в результате ПЦР с рекомбинантной полимеразой без выделения ДНК. В образцах 1.1-4.3 в номере дорожки первая цифра означает номер образца крови животного. Образцы 01.1-01.3 - отрицательный контроль (кровь кролика), 02.1-02.3 - отрицательный контроль (без содержания образца крови в ПЦР-смеси). Вторая цифра в номере дорожки означает номер праймера (№1 - RP2, №2 - RP3, №3 - NS).
Пример 2. По патентуемому методу были исследованы образцы крови норки, которые отбирались от животных, ранее иными методами идентифицированных как свободные от инфекции AMDV.
Для проведения ПЦР-анализа использовалась ПЦР-смесь общим объемом 25 мкл, полученная с использованием коммерческого набора реагентов для проведения ПЦР (Синтол) и термостабильной рекомбинантной полимеразы:
Цел.кровь - 2,5 мкл
dNTP -2,5 мкл
Buffer - 2,5 мкл
MgCl2 - 2,5 мкл
ddH2O - 9,75 мкл
Pr. F. - 2,5 мкл
Pr. R. - 2,5 мкл
Pol. rec - 0,25 мкл
где праймеры: RP2 F ТСТ AGA AGC AAC GCT TGG GGT GTA TG R GTT GTG ТСА СТС CAC TGT СТ RP3 F ТСТ AGA TTG GGC СТА CCT ССТ СТС TG R ATA CAG GAC САА CGT TGT СТ NS F TTG GTT GCT ТТА СТС С R ТСТ ACT ТТТ АСА ТСА ССА С
Программа амплификации включала этапы:
1 цикл - первичная денатурации 95°С 5 мин
40 циклов - денатурация 94°С 30 сек
- отжиг 55°С 1 мин
- элонгация 68°С 30 сек
1 цикл - финальная элонгация 68°С 2 мин
В качестве контрольных образцов использовалась цельная кровь от норок, в последствии павших от подтвержденного диагноза алеутской болезни норок (положительный конроль), а также ПЦР-смесь без содержания образца крови или с содержанием образца крови кролика (отрицательный контроль).
По результатам анализа электрофореграмм продуктов амплификации ПЦР, проводимой без выделения суммарной ДНК с использованием трех пар праймеров к участкам генома патогена AMDV, получено подтверждение, что во всех условно отрицательных образцах наличие продуктов амплификации не выявляется. На рисунке 3 представлены результаты электрофореграммы ампликонов, полученных в результате ПЦР с рекомбинантной полимеразой без выделения ДНК с использованием трех пар праймеров к участкам генома AMDV, в образцах норок условно свободных от инфекции. Первая дорожка -маркер молекулярных масс.
Пример 3. ПЦР с использованием PFU-полимеразы с выделением ДНК из биопроб норок, данные исследования которых приведены в примере 1 и 2, со всеми тремя парами праймеров к различным участкам генома патогена AMDV, не привела к получению продуктов амплификации и, таким образом, свидетельствовала об отсутствии патогена в анализируемом материале. На рисунке 4 представлены результаты электрофореграммы ампликонов, полученных в результате ПЦР с ДНК из крови норок с применением PFU-полимеразы, где в номере дорожки первая цифра означает номер образца крови животного, а вторая - номер праймера (праймер №1 RP2, №2 -RP3, №3 - NS). Первые две дорожки - маркер молекулярных масс.
Для проведения ПЦР-анализа сначала экстрагировали ДНК с использованием коммерческого набора «М-Сорб» согласно рекомендациям производителя.
ПЦР-смесь общим объемом 25 мкл получали с использованием коммерческого набора реагентов для проведения ПЦР (Синтол) и PFU-полимеразы 5ед./мкл (Силекс):
ДНК -2 мкл
dNTP - 2 мкл
Buffer - 2 мкл
MgCl2 - 2 мкл
ddH2O -14,8 мкл
Pr. F. - 2 мкл
Pr. R. -2 мкл
PFU-Pol - 0,2 мкл
Программа амплификации включала этапы:
1 цикл - первичная Денатурации 95°С 2 мин
40 циклов - денатурация 94°С 15 сек
- отжиг 55°С 15 сек
- элонгация 72°С 2 мин
Технический результат. Патентуемый метод исключает этап экстрагирования ДНК, позволяет проводить ПЦР с образцами нативных тканей, снижает риски перекрестного заражения образцов и время проведения исследования, исключает возможность перекрытия с геномом хозяина во время амплификации, исключает возможность получения как ложноположительных, так и ложноотрицательных результатов, включает диагностику по трем маркерам, предполагает диагностику, основанную на выявлении консервативных участков генома патогенна. Принцип предлагаемого к патентованию способа может быть использован для выявления иных вирусов с малыми геномами, как в ветеринарии, так и в медицине.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ ДНК ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ С ПОМОЩЬЮ СПЕЦИФИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2007 |
|
RU2360971C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ПРОВИРУСА ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА | 2013 |
|
RU2558252C2 |
| Способ пробоподготовки образцов изолятов коронавируса SARS-CoV-2 и олигонуклеотидные праймеры для его реализации | 2021 |
|
RU2762759C1 |
| СПОСОБ ДИАГНОСТИКИ ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2445370C1 |
| Способ получения линии гуманизированных мышей, трансгенных по hACE2 | 2020 |
|
RU2757114C1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ - ЗОНД И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ ГЕНОМОВ 1-ГО, 4-ГО, 16-ГО СЕРОТИПОВ ВИРУСА БЛЮТАНГА МЕТОДОМ ОТ-ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2011 |
|
RU2481404C1 |
| Способ получения аттенуированного бесплазмидного штамма F.tularensis 15 CMSA, синтезирующего микобактериальный антиген супероксиддисмутазу А | 2019 |
|
RU2745161C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ВИДОВОГО СОСТАВА ПРОПИОНОВЫХ БАКТЕРИЙ, ОБИТАЮЩИХ НА КОЖЕ ЧЕЛОВЕКА | 2013 |
|
RU2542477C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ СЕЛЕКЦИОННОЙ РАБОТЫ НА ОСНОВЕ ПОЛИЛОКУСНОГО ГЕНОТИПИРОВАНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2020 |
|
RU2756922C2 |
| Рекомбинатные плазмиды- @ - @ ,кодирующие синтез лейкоцитарного интерферона типа @ - @ человека, и штаммы @ @ / @ - @ - @ -продуценты лейкоцитарного интерферона типа @ -F человека | 1983 |
|
SU1144376A1 |
Изобретение относится к биотехнологии, в частности к молекулярной биотехнологии, и представляет собой метод, основанный на принципиально новом подходе к методике проведения полимеразной цепной реакции, исключающем этап экстрагирования ДНК. Способ проведения полимеразной цепной реакции исключает этап экстрагирования ДНК и позволяет проводить ПЦР-анализ с использованием нативной крови без дополнительной обработки. Способ позволяет избежать потери геномной ДНК вируса алеутской болезни норок, происходящей на этапе экстрагирования ДНК, а также вероятности получения ложноположительных и ложноотрицательных результатов. 4 ил., 3 пр.
Способ ПЦР-диагностики вируса алеутской болезни норок Carnivore amdoparvovirus, характеризующийся использованием в ПЦР-смеси образца нативной крови норки, термостабильной рекомбинантной полимеразы, в районе N-конца которой содержится меньшее количество аминокислот, а глутаминовая кислота замещена лизином в кодоне 708, а также трех пар праймеров RP2 F ТСТ AGA AGC ААС GCT TGG GGT GTA TG RGT TGT GTC ACT CCA CTG ТСТ RP3 F ТСТ AGA TTG GGC СТА CCT CCT CTC TG R ATA CAG GAC CAA CGT TGT CT NS F TTG GTT GCT TTA CTC С R СТА CTT TTA CAT САС СAC, проведением амплификации, включающей «горячий старт» и 40 циклов денатурации, отжига и элонгации - наличие или отсутствие вируса алеутской болезни норок подтверждается результатами электрофореграммы: наличием или отсутствием бэндов соответственно.
| Мартыненко М | |||
| В | |||
| Использование полимеразной цепной реакции для детекции вируса алеутской болезни норок, Сельскохоз | |||
| Биол., 2005, номер 6 | |||
| стр | |||
| Способ получения камфоры | 1921 |
|
SU119A1 |
| Jensen T | |||
| H | |||
| et al., Implementation and validation of a sensitive PCR detection method in the eradication campaign against Aleutian mink disease virus, Journal of virological methods, 2011 | |||
| Т | |||
| Аппарат для передачи изображений на расстояние | 1920 |
|
SU171A1 |
Авторы
Даты
2021-10-07—Публикация
2020-04-03—Подача