Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, которые разрушают, ингибируют или предотвращают рост или распространение в окружающие ткани клеток, в особенности, злокачественных клеток, участвующих в различных заболеваниях человека и животных.
В частности, изобретение относится к соединениям, которые применимы для лечения заболеваний, связанных с пролиферацией клеток, таких как гемопоэтические раковые заболевания, включая лимфому, лейкоз и множественную миелому, солидные раковые образования, включая рак головы и шеи, меланому, карциному почек, карциному желудка, карциному печени, колоректальную карциному, карциному поджелудочной железы, карциному легкого, нейрональную карциному, костную карциному, карциному молочной железы, карциному яичника и карциному предстательной железы.
Предшествующий уровень техники
Общим термином "рак" обозначают большую группу заболеваний, которые могут поражать любую часть тела. Одной из определяющих особенностей рака является быстрое появление аномальных клеток, которые разрастаются сверх своих обычных пределов и могут затем вторгаться в прилегающие части тела и распространяться на другие органы, что известно как метастазирование. Метастазы являются основной причиной смерти от рака.
Рак входит в число основных причин заболеваемости и смертности во всем мире, при этом в 2012 году зарегистрировано около 14 миллионов новых случаев заболевания и 8,2 миллиона случаев смерти от рака. Наиболее распространенными причинами смерти от рака являются раковые заболевания легкого (1,59 миллиона смертей), печени (745000 смертей), желудка (723000 смертей), толстой и прямой кишки (694000 смертей), молочной железы (521000 смертей), пищевода (400000 смертей). Пятью наиболее распространенными типами рака, диагностированными в 2012 году у мужчин, являются рак легкого, предстательной железы, толстой и прямой кишки, желудка и печени. Пятью наиболее распространенными типами рака, диагностированными у женщин, являются рак молочной железы, толстой и прямой кишки, легкого, шейки матки и желудка.
Ожидается, что в ближайшие два десятилетия число новых случаев возрастет примерно на 70% (Всемирный доклад ВОЗ 2014 года о борьбе с раком).
Несмотря на необычайные успехи в том, что касается нашего понимания биологии, которая лежит в основе возникновения и развития рака, а также потенциальных молекулярных мишеней для его лечения, более 90% всех новых противораковых препаратов, которые достигают стадии клинической разработки, не получают разрешения на их продажу. Со многими лекарствами это происходит на поздних стадиях разработки в ходе испытаний фазы III по причине их недостаточной активности, отсутствия стратегий борьбы с резистентностью к этим препаратам, неожиданных проблем безопасности или трудностей в определении эффективности по причинам, которые включают смешение результатов клинических испытаний. Более того, улучшенное понимание биологии рака показало, что раковые заболевания являются гетерогенными заболеваниями, что говорит о высокой вероятности того, что эффективные методы лечения рака потребуют решения специфических для пациента проблем молекулярных дефектов и особенностей микроокружения опухоли.
Широкое распространение рака и высокая степень гетерогенности этого заболевания подчеркивают необходимость усовершенствования схем лечения злокачественных новообразований. Большая группа средств на основе линий раковых клеток, применяемая с недавнего времени, становится важным инструментом обнаружения и оценки потенциального нового противоракового лекарства. Действительно, большая группа выделенный из опухолей линий клеток может повторять зависимость генотип-ответ новых терапевтических средств и представлять наибольший интерес.
В настоящем изобретении предложены новые соединения формулы (I) для лечения заболеваний, связанных с пролиферацией клеток, таких как гемопоэтические раковые образования или солидные раковые образования. Соединения согласно изобретению обладают противоопухолевой активностью в отношении очень большой группы линий раковых клеток.
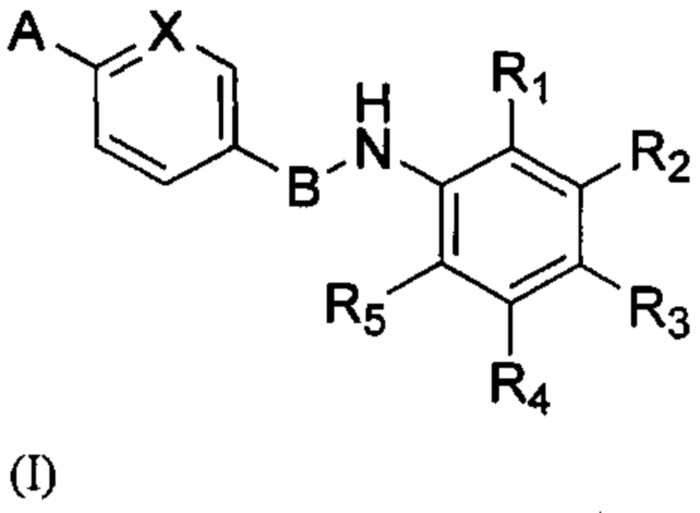
Соединения формулы (I) содержит 6-членный арильный или гетероарильный фрагмент, паразамещенный группами А и В. В WO 2013/014170 описаны соединения, содержащие 6-членный арильный или гетероарильный фрагмент, метазамещенный гетероарильной и гетероциклической группами. Соединения согласно WO 2013/014170 являются ингибиторами тирозинкиназ и могут применяться для лечения пролиферативных заболеваний. Как ни удивительно, соединения формулы (I) изобретения не являются ингибиторами тирозинкиназы, но обладают антипролиферативными свойствами. Соответственно, соединения согласно изобретению обеспечивают новый способ лечения заболеваний, связанных с пролиферацией клеток.
Краткое изложение сущности изобретения
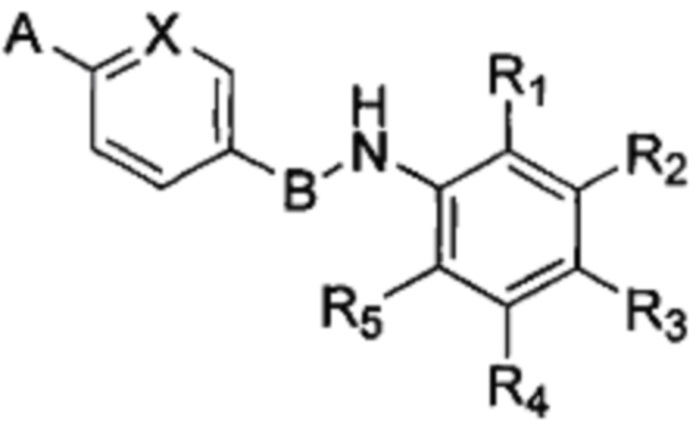
В настоящем изобретении предложено соединение формулы (I):
 ,
,
в которой А, В, X, R1, R2, R3, R4 и R5 имеют значения, определения которых приведены далее.
Согласно одному из вариантов осуществления В в соединении формулы (I) означает 5-членную гетероарильную группу.
Согласно одному из вариантов осуществления В не выбирают из 1,2-диазинила, триазолопиридинила или триазолила. Если В означает оксазолил, согласно одному из вариантов осуществления А не является тетразолилом или тетрагидропиридинилом. Если В означает тиазолил, согласно одному из вариантов осуществления А не является имидазолилом, триазолилом, пиперазинилом, пирролидинилом, пиперидинилом или 1,4-оксазинилом.
Согласно одному из вариантов осуществления X в соединении формулы (I) означает СН, а А означает 2-оксоимидазолидильную или пиразолильную группу.
Согласно одному из вариантов осуществления R3 в соединении по изобретению означает водород.
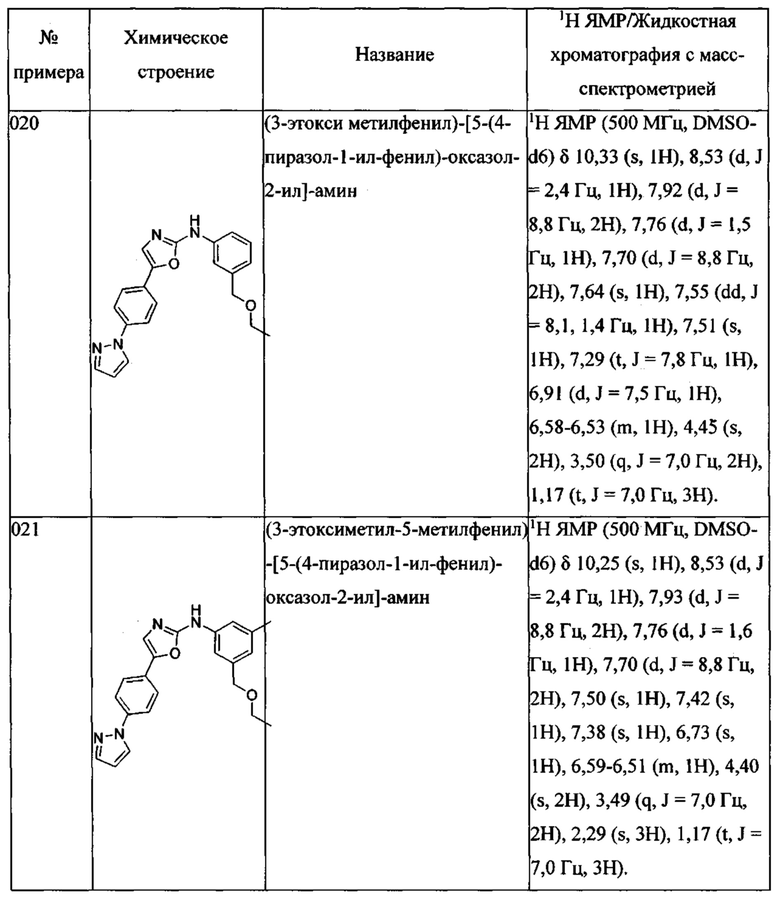
Согласно одному из вариантов осуществления соединение формулы (I) имеет формулу (II), определение которой приведено далее.
Согласно одному из вариантов осуществления соединение формулы (I) имеет формулу (III), определение которой приведено далее.
Согласно одному из вариантов осуществления R1 в соединении по изобретению означает метил, R2, R3 и R5 означают водород, a R4 означает -СН2ОС2Н5.
Согласно одному из вариантов осуществления соединение согласно изобретению выбрано из:
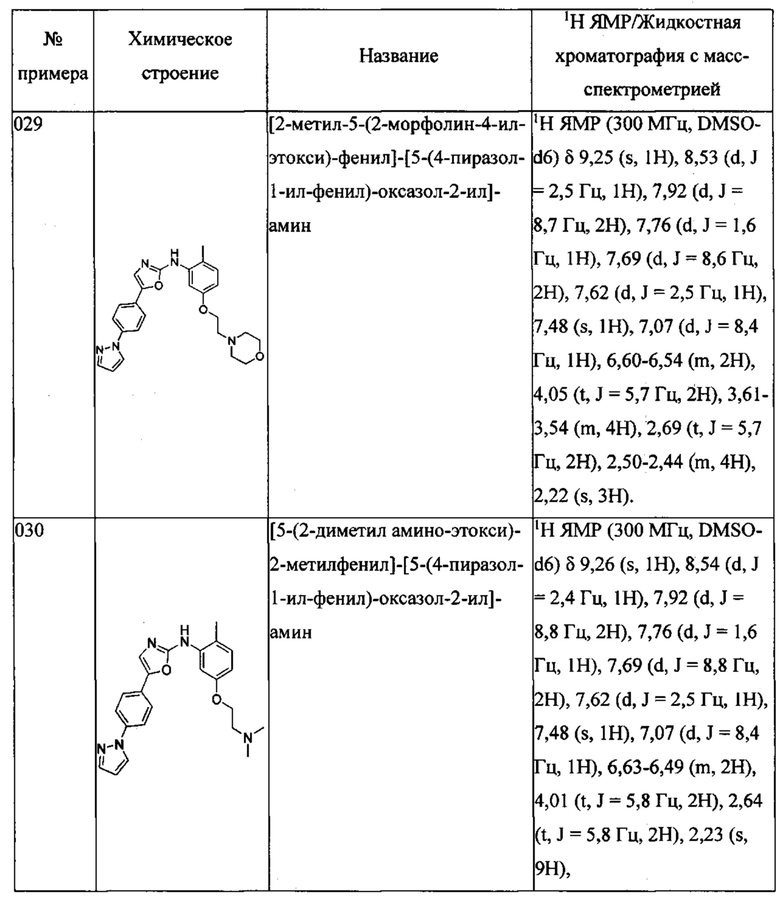
(5-метокси-2-метилфенил)-[5-(6-пиразол-1-ил-пиридин-3-ил)-оксазол-2-ил] амина;
(5-этоксиметил-2-метилфенил)-[5-(3-метокси-4-пиразол-1-илфенил)оксазол-2-ил] амина;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))тиазол-4-ил]фенил}имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
4-метил-N-(2-морфолин-4-ил-этил)-3-[5-(4-пиразол-1-илфенил)-оксазол-2-иламино]бензамида;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]фенил}имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(6-пиразол-1-ил-пиридин-3-ил)-оксазол-2-ил]-амина;
1-{4-[5-(5-этоксиметил-(2-метилфениламино))-[1,3,4]оксадиазол-2-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-[1,3,4]оксадиазол-2-ил]-амина;
1-{4-[5-(5-этоксиметил-(2-метилфениламино))-[1,2,4]тиадиазол-3-ил]-фенил}-имидазолидин-2-она;
(5-метокси-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
1-{4-[2-(5-метокси-2-металфениламино)-тиазол-5-ил]-фенил}-имидазолидин-2-она;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-таазол-5-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[4-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
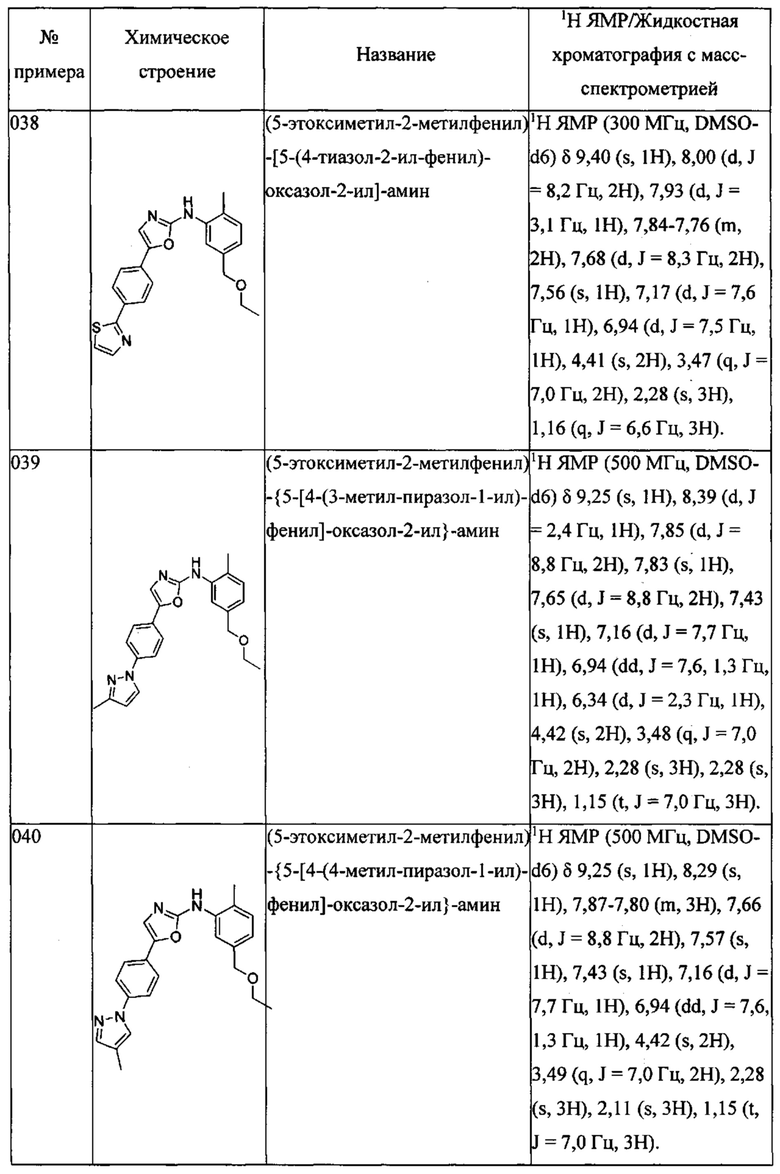
{4-метил-3-[4-(4-пиразол-1-ил-фенил)-тиазол-2-иламино]-фенил}-метанола;
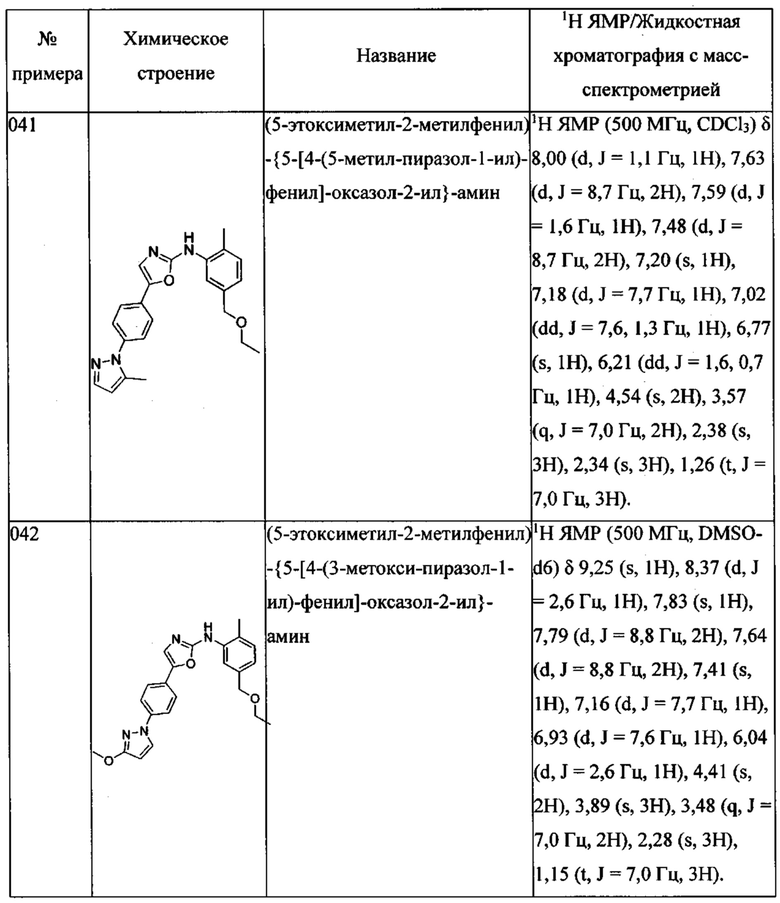
1-{4-[2-(3-этоксиметил-(5-метилфениламино))-тиазол-4-ил]-фенил}-имидазолидин-2-она;
1-{4-[2-(3-этоксиметил-(5-метилфениламино))-оксазол-5-ил]-фенил}-имидазолидин-2-она;
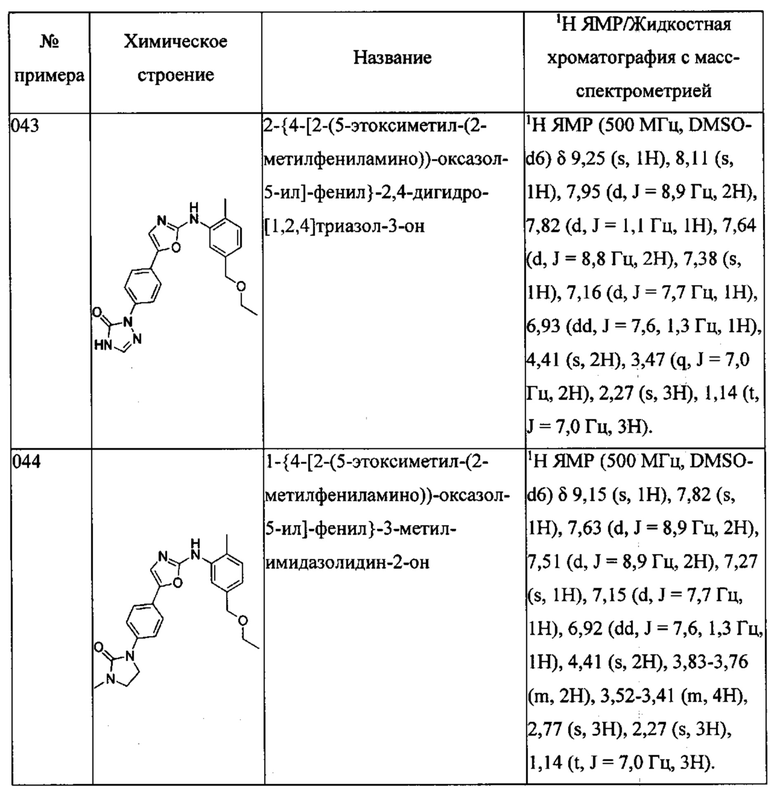
(3-этоксиметилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(3-этоксиметил-5-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
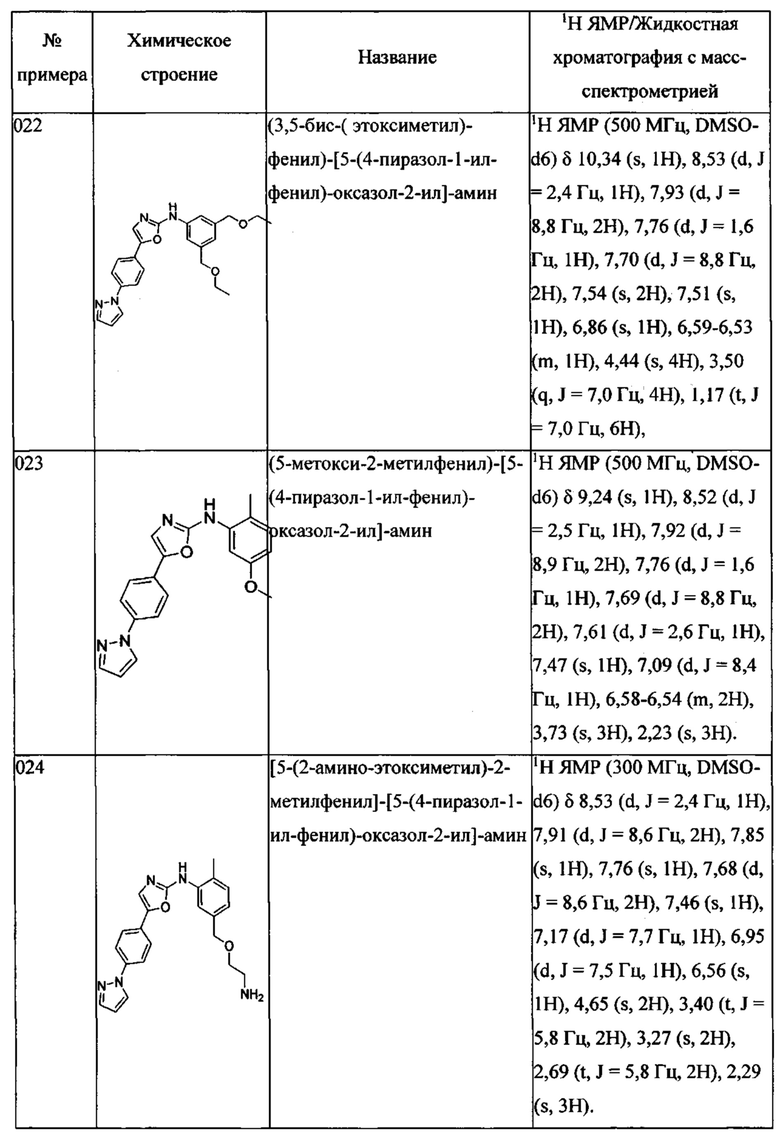
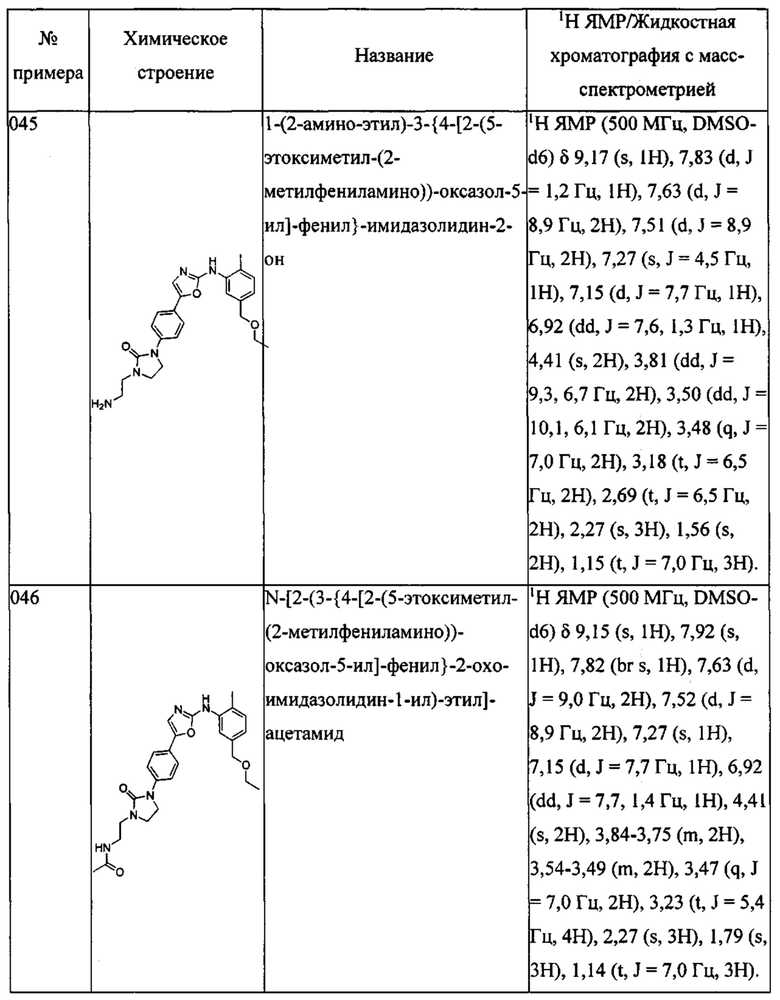
(3,5-бис-(этоксиметил)-фенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-метокси-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
[5-(2-амино-этоксиметил)-2-метилфенил]-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
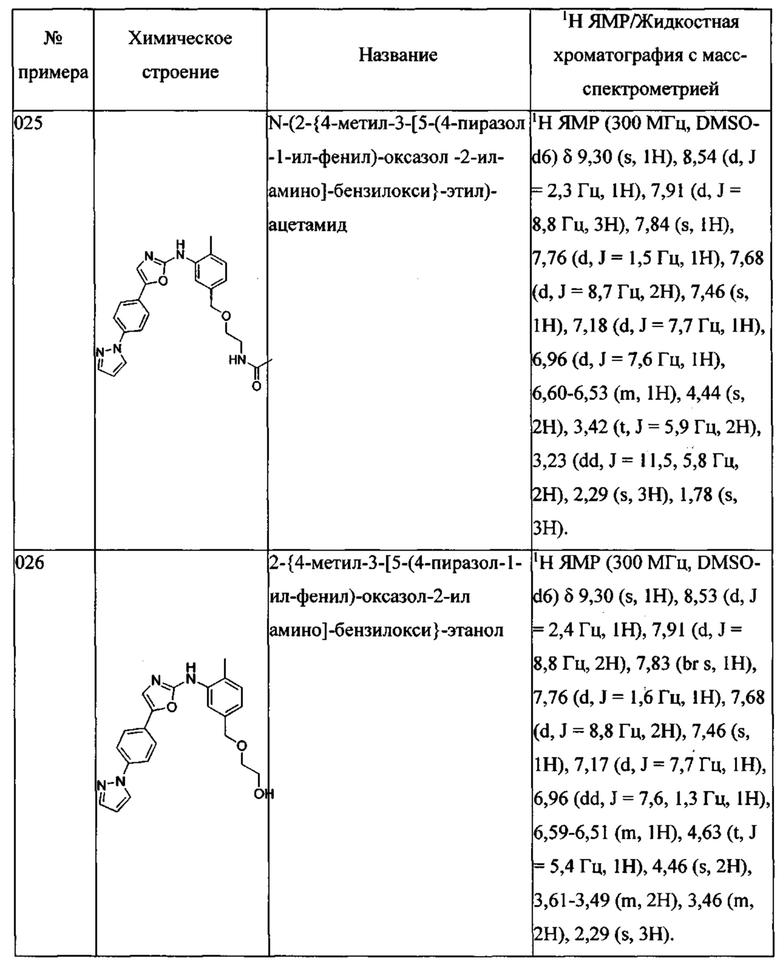
N-(2-{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензилокси}-этил)-ацетамида;
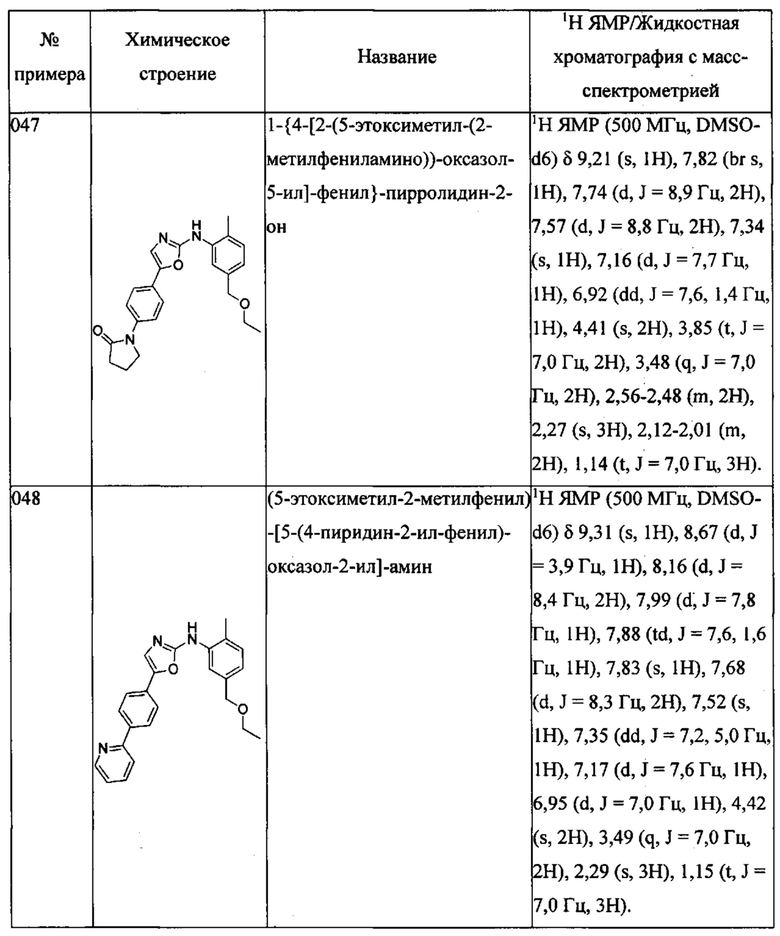
2-{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензилокси}-этанола;
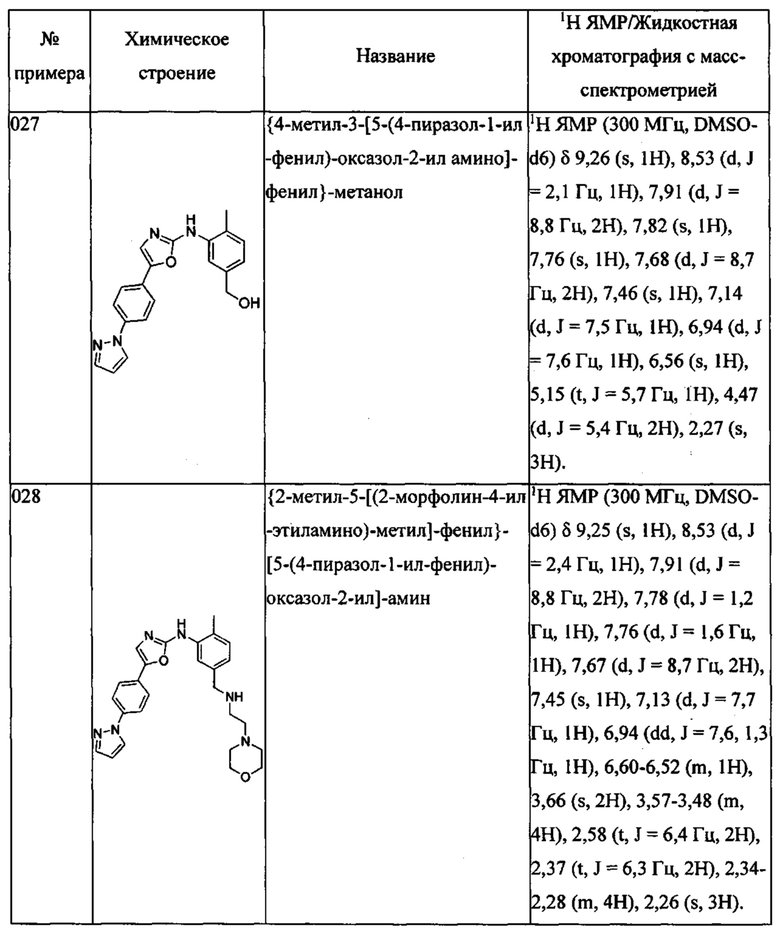
{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-фенил}-метанола;
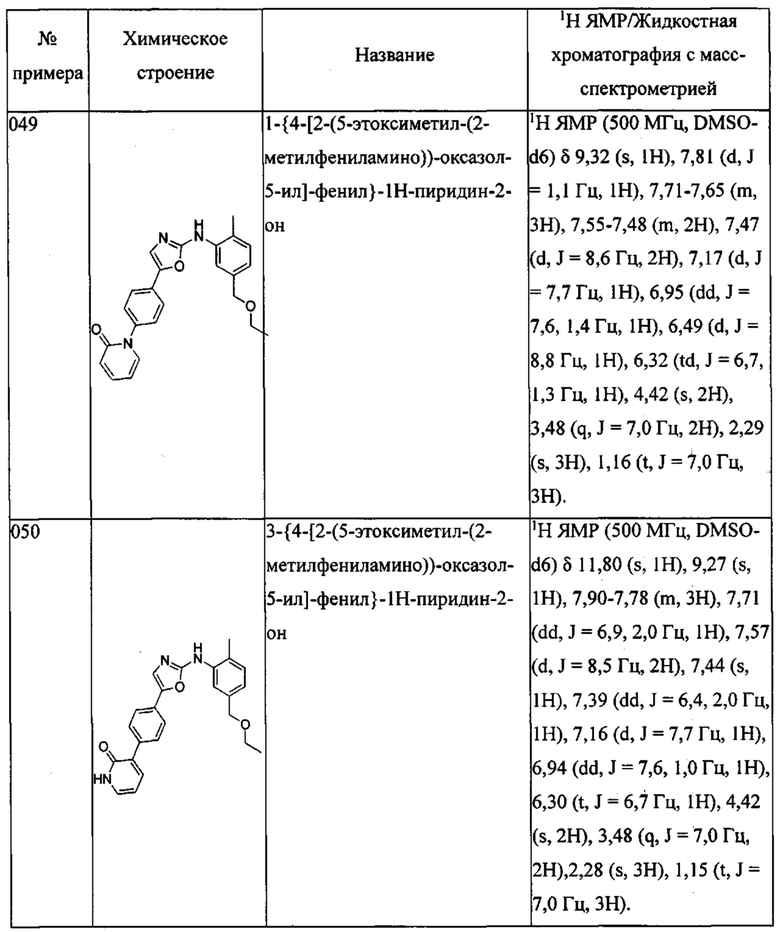
{2-метил-5-[(2-морфолин-4-ил-этиламино)-метил]-фенил}-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
[2-метил-5-(2-морфолин-4-ил-этокси)-фенил]-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
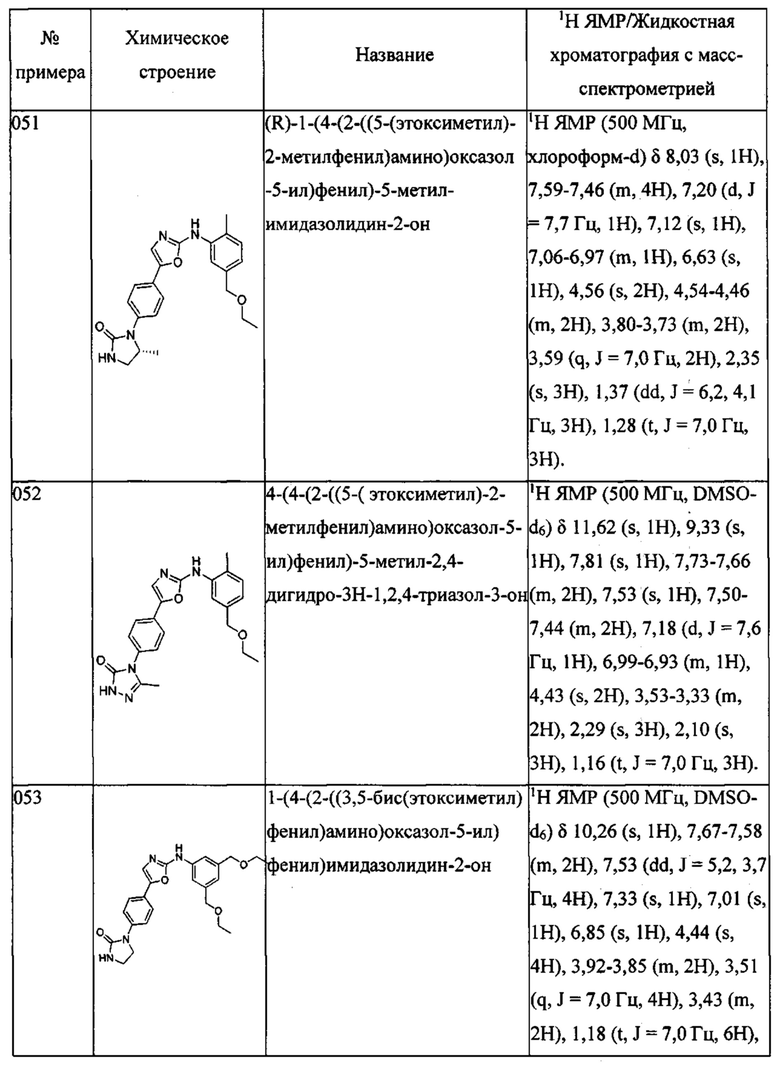
[5-(2-диметиламино-этокси)-2-метилфенил]-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
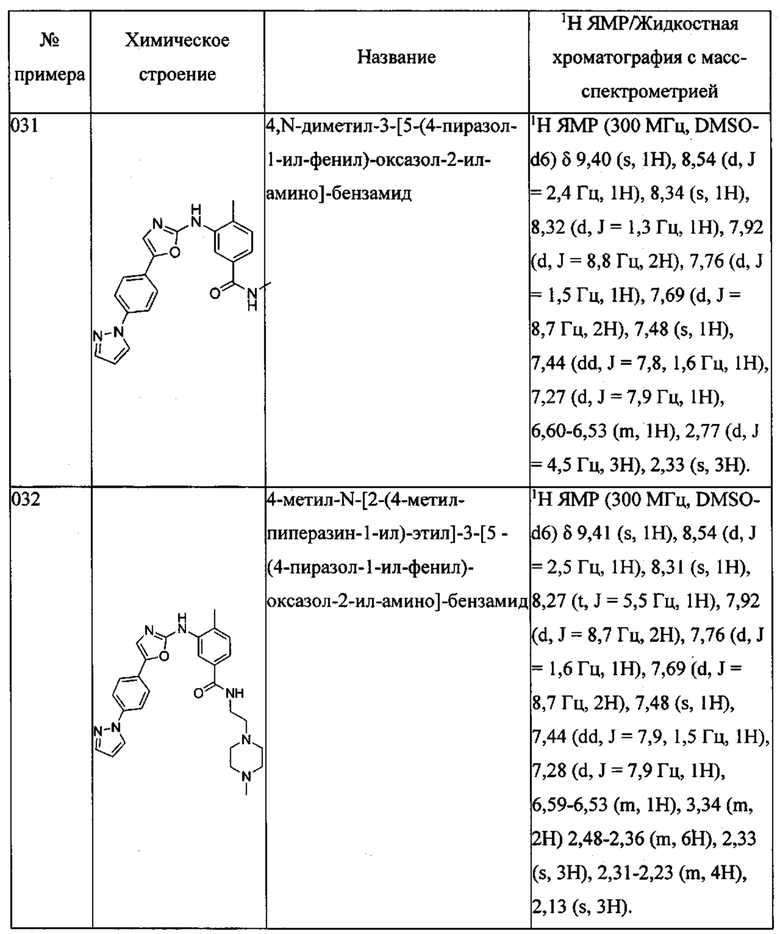
4,N-диметил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензамида;
4-метил-N-[2-(4-металпиперазин-1-ил)-этил]-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензамида;
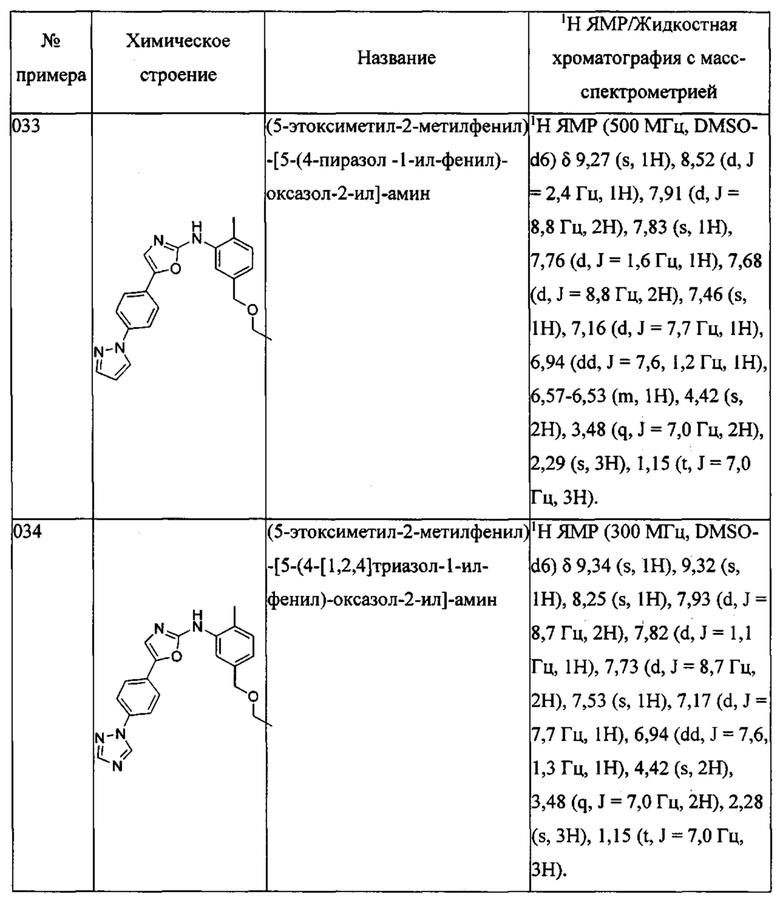
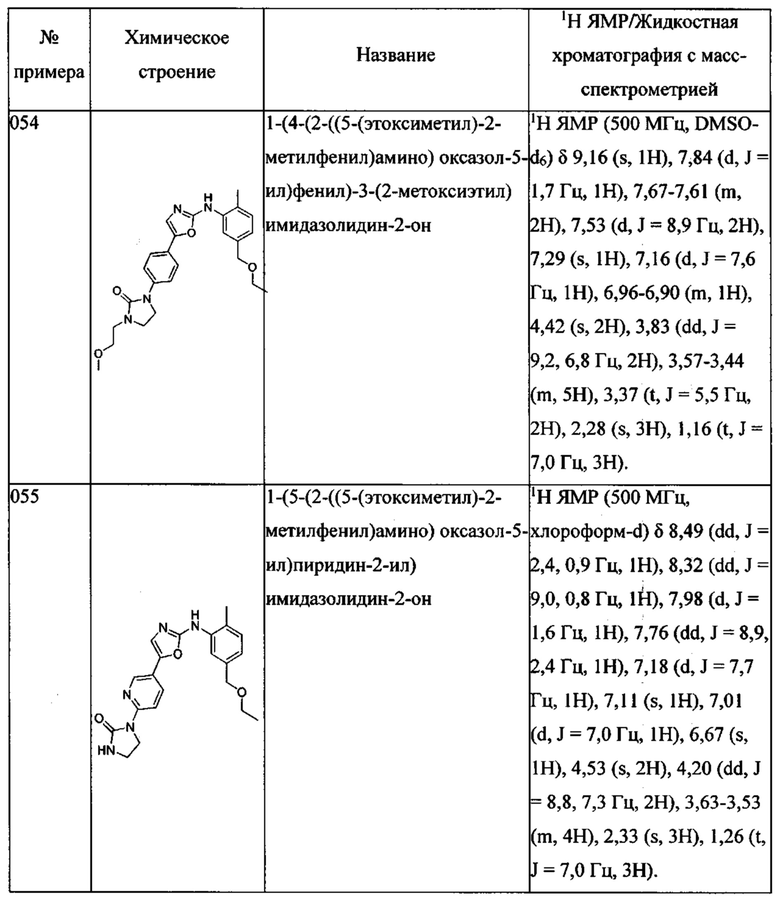
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,4]триазол-1-ил-фенил)-оксазол-2-ил]-амина;
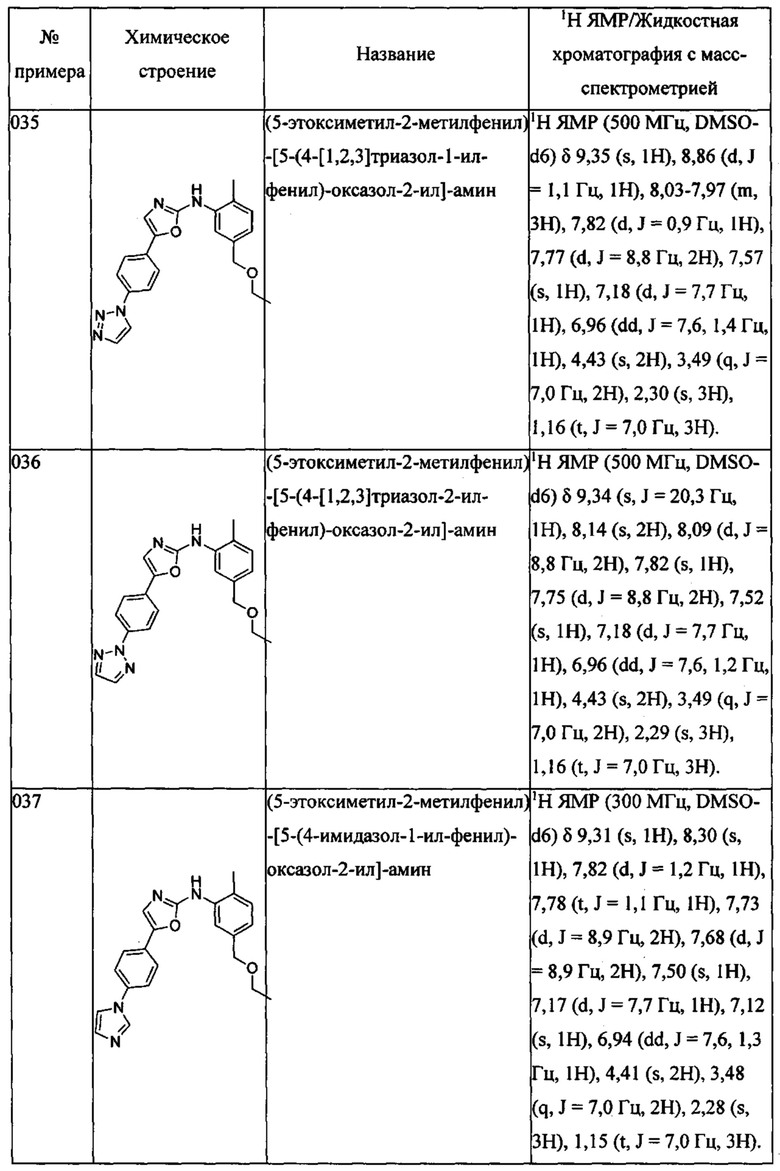
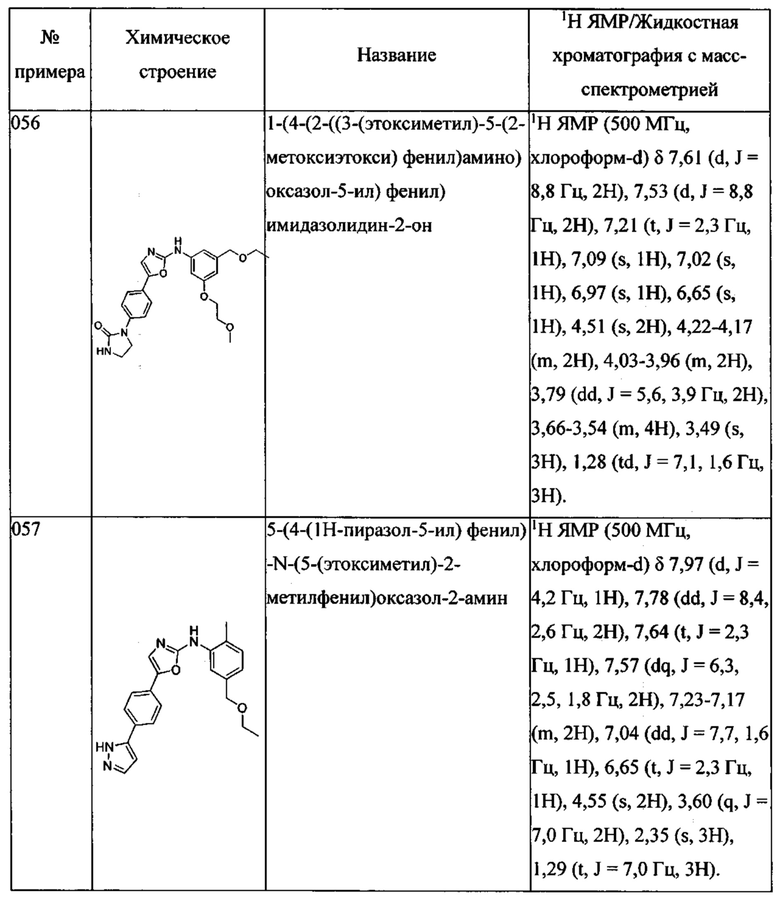
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,3]триазол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,3]триазол-2-ил-фенил)-оксазол-2-ил]-амина;
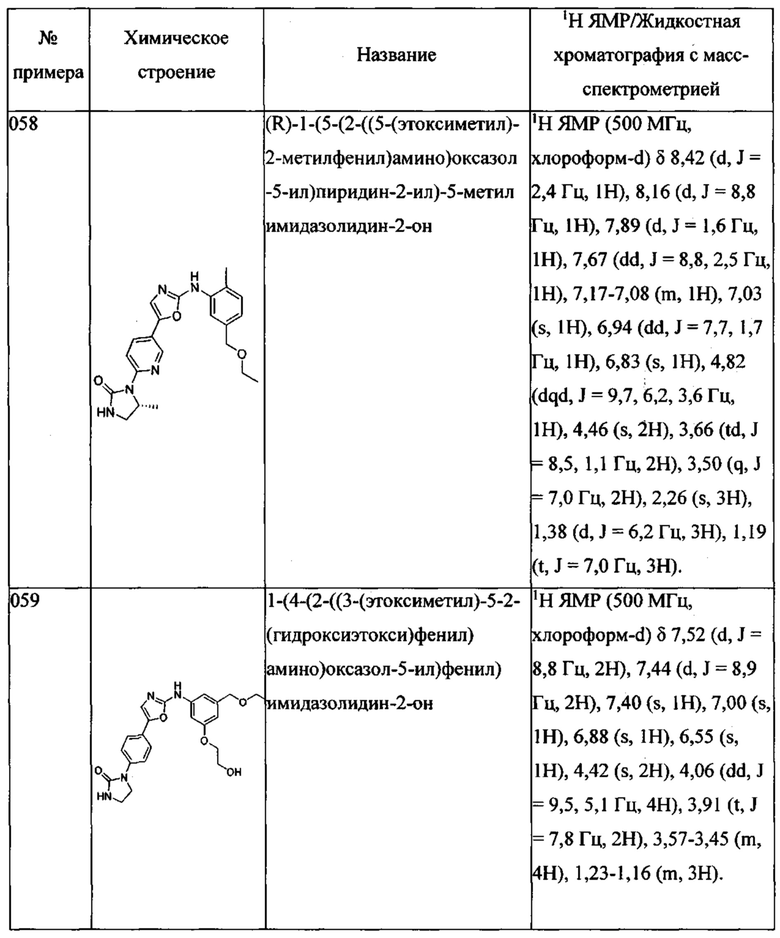
(5-этоксиметил-2-метилфенил)-[5-(4-имидазол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-тиазол-2-ил-фенил)-оксазол-2-ил]-амина;
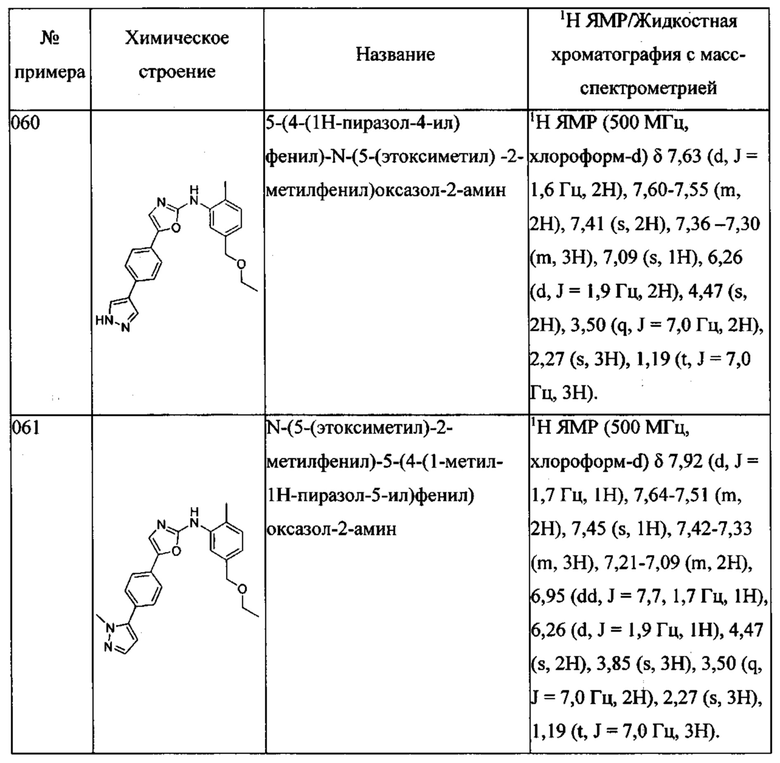
(5-этоксиметил-2-метилфенил)-{5-[4-(3-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(4-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
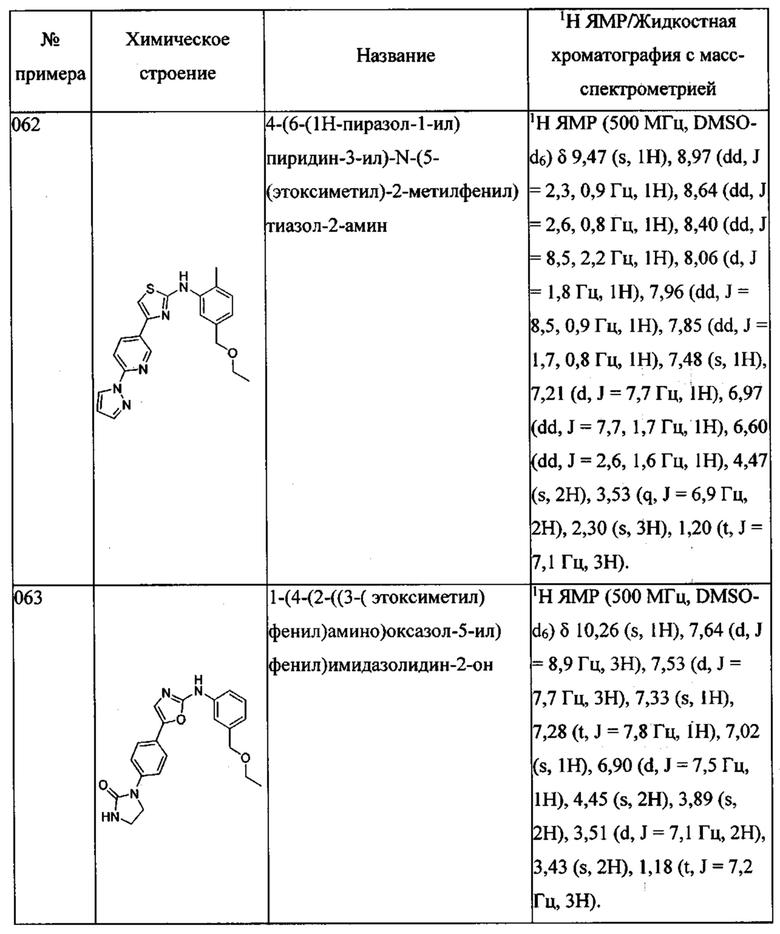
(5-этоксиметил-2-метилфенил)-{5-[4-(5-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(3-метокси-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
2-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-2,4-дигидро-[1,2,4]триазол-3-она;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-3-метил-имидазолидин-2-она;
1-(2-амино-этил)-3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-имидазолидин-2-она;
N-[2-(3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-2-охо-имидазолидин-1-ил)-этил]-ацетамида;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-пирролидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиридин-2-ил-фенил)-оксазол-2-ил]-амина;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-1Н-пиридин-2-она;
3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-1Н-пиридин-2-она;
(R)-1-(4-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)фенил)-5-метилимидазолидин-2-она;
4-(4-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)фенил)-5-метил-2,4-дигидро-3Н-1,2,4-триазол-3-она;
1-(4-(2-((3,5-бис(этоксиметил)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
1-(4-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)фенил)-3-(2-метоксиэтил)имидазолидин-2-она;
1-(5-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)пиридин-2-ил)имидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)-5-(2-метоксиэтокси)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
5-(4-(1Н-пиразол-5-ил)фенил)-N-(5-(этоксиметил)-2-метилфенил)оксазол-2-амина;
(R)-1-(5-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)пиридин-2-ил)-5-метилимидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)-5-(2-гидроксиэтокси)фенил)амино)оксазол-5-ил)фенил) имидазолидин-2-она;
5-(4-(1Н-пиразол-4-ил)фенил)-N-(5-(этоксиметил)-2-метилфенил)оксазол-2-амина;
N-(5-(этоксиметил)-2-метилфенил)-5-(4-(1-метил-1Н-пиразол-5-ил)фенил)оксазол-2-амина;
4-(6-(1Н-пиразол-1-ил)пиридин-3-ил)-N-(5-(этоксиметил)-2-метилфенил)тиазол-2-амина;
1-(4-(2-((3-(этоксиметил)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)фенил)амино)тиазол-4-ил)фенил)имидазолидин-2-она.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение согласно изобретению или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый наполнитель и/или носитель.
Согласно одному из вариантов осуществления фармацевтическая композиция содержит соединение согласно изобретению или его фармацевтически приемлемую соль в качестве единственного активного фармацевтического ингредиента.
Согласно одному из вариантов осуществления фармацевтическая композиция согласно изобретению дополнительно содержит другой активный фармацевтический агент.
Изобретение также относится к лекарственному средству, содержащему соединение согласно изобретению или его фармацевтически приемлемую соль.
Изобретение также относится к соединению согласно изобретению или его фармацевтически приемлемой соли для применения при лечении гематологических и/или пролиферативных нарушений.
Согласно одному из вариантов осуществления гематологическое нарушение выбрано из лимфомы; лейкоза, такого как острый миелоидный лейкоз (ОМЛ), острый лимфобластный лейкоз (ОЛЛ), хронический лимфоидный лейкоз (ХЛЛ) или хронический миелоидный лейкоз (ХМЛ); множественной миеломы (ММ); миелодиспластического синдрома (МДС); и миелодисплазии с миелофиброзом.
Согласно одному из вариантов осуществления пролиферативным нарушением является рак, такой как рак головы и шеи, меланома, карцинома почек, карцинома желудка, карцинома печени, колоректальная карцинома, карцинома поджелудочной железы, карцинома легкого, нейрональная карцинома, мультиформная глиобластома, остеосаркома, саркома Юинга, карцинома молочной железы, карцинома яичника или карцинома предстательной железы.
Изобретение также относится к фармацевтической композиции, содержащей соединение согласно изобретению или его фармацевтически приемлемую соль и другой активный фармацевтический ингредиент в качестве комбинированного препарата для последовательного, одновременного или раздельного применения при лечении нарушения, выбранного из группы, включающей гематологические и пролиферативные нарушения.
Определения
Если не указано иное, указанные далее термины имеют следующие значения.
Если не указано иное, для обозначения заместителей, которые в прямой форме не определены в описании, указывается название оконечной части функциональной группы, за которой следуют смежная функциональная группа в направлении точки присоединения. Так, заместитель "арилалкил" относится к группе (арил)-(алкил)-.
Используемый термин "заместитель" или "замещенный" означает, что водородный радикал в соединении или группе замещен любой желаемой группой, которая преимущественно стабильна в условиях реакции в незащищенной форме или, когда она защищена с использованием защитной группы. Примерами предпочтительных заместителей являются заместители, которые указаны в примерах соединений и в вариантах осуществления, а также галогенные, алкильные или арильные группы согласно данным выше определениям, гидроксильная группа, алкоксигруппа согласно данному выше определению, нитрогруппы, тиоловые группы, гетероциклоалкильные группы, гетероарильные группы, цианогруппы, циклоалкильные группы согласно данным выше определениям, а также солюбилизирующая группа, группы -NRR', -NR-CO-R', -CONRR', -SO2NRR', в которых R и R' в каждом случае независимо выбраны из водорода, алкила, циклоалкила, арила, гетероциклоалкильных или гетероарильных групп согласно данным выше определениям.
Используемый термин "галоген" означает фтор, хлор, бром или йод.
Используемый термин "алкил" означает насыщенный неразветвленный или разветвленный нециклический углеводород, содержащий от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода. Типичные насыщенные алкилы с прямой цепью включают метил, этил, n-пропил, n-бутил, n-пентил, n-гексил, n-гептил, n-октил, n-нонил и n-децил; а насыщенные алкилы с разветвленной цепью включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и т.п. Алкильные группы, включенные в соединения согласно настоящему изобретению, могут быть необязательно замещены одним или несколькими заместителями. Алкильные группы, включенные в соединения согласно настоящему изобретению, могут быть необязательно замещены солюбилизирующей группой.
Используемый термин "алкокси" означает алкильную группу согласно данному выше определению, которая присоединена к другому фрагменту атомом кислорода. Примеры алкоксигрупп включают метокси, изопропокси, этокси, трет-бутокси и т.п. Алкоксигруппы могут быть необязательно замещены одним или несколькими заместителями. Алкоксигруппы, входящие в соединения согласно настоящему изобретению, могут быть необязательно замещены солюбилизирующей группой.
Используемый термин "гетероцикл" собирательно обозначает гетероциклоалкильные и гетероарильные группы.
Используемый термин "гетероциклоалкил" означает моноциклическую или полициклическую группу, которая имеет, по меньшей мере, один гетероатом, выбранный из О, N или S, и от 2 до 11 атомов углерода, и которая может являться насыщенной или ненасыщенной, но не является ароматической. Примеры гетероциклоалкильных групп включают (без ограничения): пиперидинил, пиперазинил, N-метилпиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 4-пиперидонил, пирролидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидропиранил, тетрагидротиопиранил, 2-оксоимидазолидинил, тетрагидропиримидинил-2-он, 2-оксопирролидинил, тетрагидропириндинил, тетрагидропиринилдинил, тетрагидротиопиранилсульфон, тетрагидротиопиранилсульфоксид, морфолинил, тиоморфолинил, тиоморфолинилсульфоксид, тиоморфолинилсульфон, 1,3-диоксолан, тетрагидрофуранил, дигидрофуранил-2-тетрагидротиенил и тетрагидро-1-ил-диоксотиенил. Обычно моноциклические гетероциклоалкильные группы имеют от 3 до 7 членов. Предпочтительными 3-7-членными моноциклическими гетероциклоалкильными группами являются группы, имеющие 5 или 6 атомов в кольце. Гетероатом может быть замещен защитной группой, известной специалистам в данной области техники, например, водород в азоте может быть замещен трет-бутоксикарбонильной группой. Кроме того, гетероциклоалкильные группы могут быть необязательно замещены одним или несколькими заместителями. Помимо этого, точкой присоединения гетероциклического кольца к другой группе может являться атом углерода или гетероатом гетероциклического кольца. Под данное определение подпадают только стабильные изомеры таких замещенных гетероциклических групп.
Используемый термин "гетероарил" или подобные термины означают моноциклическое или полициклическое гетероароматическое кольцо, содержащее атомы углерода в качестве членов кольца и один или несколько гетероатомов в качестве членов кольца (таких как, например, атомы кислорода, серы или азота). Как правило, гетероарильная группа имеет от 1 до 5 гетероатомов в качестве членов кольца и от 1 до примерно 14 атомов углерода в качестве членов кольца. Типичные гетероарильные группы включают пиридил, 1-оксопиридил, фуранил, бензо [1,3] диоксолил, бензо [1,4] диоксинил, тиенил, пирролил, оксазолил, оксадиазолил, имидазолил, тиазолил, тиадиазолил, изоксазолил, хинолинил, пиразолил, Изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, триазолил, тиадиазолил, изохинолинил, индазолил, бензоксазолил, бензофурил, индолизинил, имидазопиридил, тетразолил, бензимидазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, индолил, тетрагидроиндолил, азанддолил, имидазопиридил, хиназолинил, пуринил, пирроло [2,3] пиримидинил, пиразоло [3,4] пиримидинил, имидазо [1,2-а] пиридил и бензо(b)тиенил. Гетероатом может быть замещен защитной группой, известной специалистам в данной области, например, водород в азоте может быть замещен трет-бутоксикарбонильной группой. Кроме того, гетероатомы азота или серы в качестве членов кольца могут быть окислены. В одном из вариантов осуществления гетероароматическое кольцо выбрано из 5-8-членных моноциклических гетероарильных колец. В одном из конкретных вариантов осуществления гетероарильная группа представляет собой 5-членную гетероарильную группу. Точкой присоединения гетероароматического или гетероарильного кольца к другой группе может являться атом углерода или гетероатомом гетероароматических или гетероарильных колец.
Используемый термин "арил" означает моноциклический или полициклический ароматический радикал, содержащий атомы углерода и водорода. Примеры применимых арильных групп включают без ограничения фенил, толил, антраценил, флуоренил, инденил, азуленил и нафтил, а также бензоконденсированные карбоциклические фрагменты, такие как 5,6,7,8-тетрагидронафтил.
Термин "циклоалкильная группа" означает насыщенный или частично ненасыщенный моноциклический, конденсированный бициклический или мостиковый полициклический кольцевой узел, содержащий указанное количество атомов в кольце. Он включает замещенные или незамещенные циклоалкоксильные группы. Например, циклоалкильная группа может представлять собой С3-С10-алкильную группу, такую как С3 или С4, в частности циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную или циклооктильную группу и т.д.
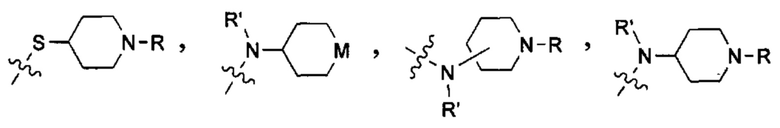
Используемый термин "солюбилизирующая группа" означает группу, которая улучшает растворимость соединения в воде или водном растворе по сравнению с аналогичным соединением, которое не включает такую группу. Неограничивающими примерами таких солюбилизирующих групп являются группы, которые ионизируются в условиях применения с образованием заряженных фрагментов (например, карбоновых кислот, сульфоновых кислот, фосфорных кислот, аминов и т.д.); группы, которые имеют постоянные заряды (например, четвертичные аммониевые группы); и/или гетероатомы или гетероатомные группы, такие как О, S, N, NH, N-(CH2)zR, N-(CH2)z-C(O)R, N-(CH2)z-C(O)OR, N-(CH2)z-S(O)2R, N-(CH2)z-S(O)2OR, N-(CH2)z-C(O)NRR', где z означает число от 0 до 6, a R и R' в каждом случае независимо выбраны из водорода, алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или несколькими гетероатомами, такими как гетероатомы галогена (выбранного из F, Cl, Br или I), кислорода и азота; алкоксигруппы, содержащей от 1 до 10 атомов углерода; а также арильной группы и гетероарильной группы.
В некоторых вариантах осуществления солюбилизирующей группой является гетероциклоалкил, который необязательно включает от 1 до 5 заместителей, которые сами могут являться солюбилизирующими группами.
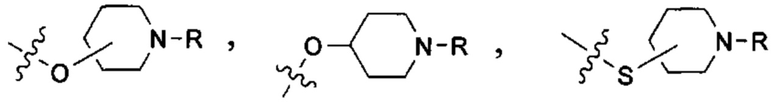
В одном из конкретных вариантов осуществления солюбилизирующая группа имеет формулу:
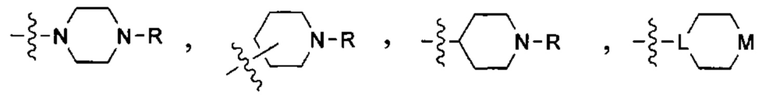 ,
,
 ,
,
 ,
,
в которой L выбран из группы, включающей СН и N; М выбран из группы, включающей -CH(R)-, -СН2-, -О-, -S-, -NH-, -N(-(CH2)z-R)-, -N(-(CH2)z-C(O)R)-, -N(-(CH2)z-C(O)OR)-,-N(-(CH2)z-S(O)2R)-,-N(-(CH2)z-S(O)2OR)-and-N(-(CH2)z-C(O)NRR')-, где z означает целое число от 0 до 6, a R и R' в каждом случае независимо выбраны из водорода, алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или несколькими гетероатомами, такими как гетероатомы галогена (выбранного из F, CI, Br или I), кислорода и азота; а также алкоксигруппы, содержащей от 1 до 10 атомов углерода, группы NRR', в которой R и R' в каждом случае независимо выбраны из водорода, алкильной группы согласно данному выше определению, необязательно замещенной, по меньшей мере, одним гетероатомом, в особенности, кислорода или азота, необязательно замещенным алкильной группой, содержащей от 1 до 10 необязательно замещенных атомов углерода; а также арильной и гетероарильной группы, при условии, что L и М одновременно не означают СН и СН2, соответственно.
В другом конкретном варианте осуществления солюбилизирующая группа выбрана из группы, включающей морфолинил, пиперидинил, пирролидинил, N- (C1-С6) алкилпиперидинил, в частности N-метилпиперидинил и N-этилпиперидинил, N-(4-пиперидинил)пиперидинил, 4-(1-пиперидинил)пиперидинил, 1-пирролидинилпиперидинил, 4-морфолинопиперидинил, 4-(N-метил-1-пиперазинил) пиперидинил, пиперазинил, N-(C1-С6) алкилпиперазинил, в частности N-метилпиперазинил и N-этилпиперазинил, N-(C3-С6) циклоалкилпиперазинил, в частности N-циклогексилпиперазинил, пирролидинил, N-(C1-С6)алкилпирролидинил, в частности, N-метилпирролидинил и N-этилпирролидинил, диазепинил, N-(C1-С6) алкилзамединил, в частности N-метилазепинил и N-этилазепинил, гомопиперазинил, N-метилгомопиперазинил, N-этилгомопиперазинил, имидазолил и т.п.
Термин "сольват" используется для описания молекулярного комплекса, содержащего соединение согласно изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например этанола. Термин "гидрат" используется, когда упомянутым растворителем является вода.
Термин "изомеры сольвата" используется для описания двух или более молекулярных комплексов, содержащих соединение согласно изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например, этанола, при этом упомянутые комплексы различаются числом молекул растворителя на молекулу соединения согласно изобретению. Термин "гидрат" используется, когда упомянутым растворителем является вода.
Термин "метаболит" используется для описания соединения, получаемого в результате биохимической трансформации исходного соединения путем метаболизма.
Подробное описание изобретения
Соединения
Настоящее изобретение относится к соединениям, способным проявлять антипролиферативную активность в отношении большой группы линий опухолевых клеток в качестве единственного средства или в сочетании с другими цитотоксическими средствами.
В первом варианте осуществления изобретения предложены соединения формулы (I) в форме свободных оснований:
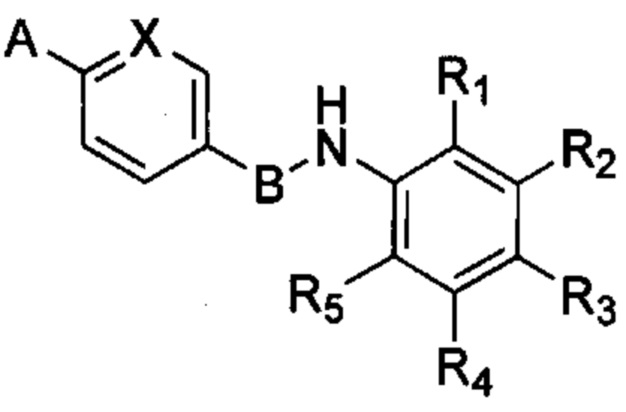
или их фармацевтически приемлемые соли, где:
R1, R2, R3, R4 и R5 в каждом случае независимо выбраны из:
водорода;
гетероцикла;
циано;
-CF3;
-NRR';
-ОН;
галогена, выбранного предпочтительно из F, CI, Br и I;
алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы;
алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы;
-CO-NRR';
-SO2-NRR';
-NR-CO-R' и
-NR-SO2R';
при этом R и R' в каждом случае независимо выбраны из водорода, циклоалкила, гетероцикла, солюбилизирующей группы и алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из OR'', NR''R''', NR''COR''' и солюбилизирующей группы; a R'' и R''' в каждом случае независимо выбраны из водорода, алкила или циклоалкила;
А означает необязательно замещенную гетероциклическую группу, А предпочтительно означает гетероциклическую группу, необязательно замещенную одной или несколькими группами, выбранными из галогена, алкила, арила, гидроксила, алкокси, нитро, тиола, гетероциклоалкила, гетероарила, циано, циклоалкила, солюбилизирующей группы, -NRR', -алкил-NRR'; -NR-CO-R', -алкил-NR-CO-R', -ONRR' и -SO2NRR'; где R и R' в каждом случае независимо выбраны из водорода, алкильных, циклоалкильных, арильных, гетероциклоалкильных и гетероарильных групп;
В означает арильную или гетероарильную группу;
X означает N или C-R6, при этом R6 выбран из водорода, циано, CF3, алкила и алкокси.
Согласно одному из вариантов осуществления в числе соединений формулы (I) настоящее изобретение относится к соединениям, в которых R3 означает водород.
Согласно другому варианту осуществления в число соединений формулы (I) согласно настоящему изобретению входят соединения следующей формулы (II):
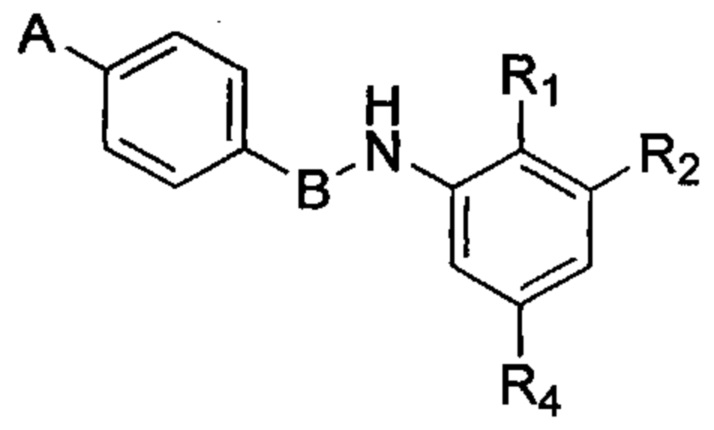
или их фармацевтически приемлемая соль, где:
R1, R2 и R4 в каждом случае независимо выбраны из водорода; гетероцикла; циано; -CF3; -NRR'; -ОН; галогена, предпочтительно выбранного из F, CI, Br и I; алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы; алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы; -CO-NRR'; -SO2-NRR'; -NR-CO-R' и -NR-SO2R';
при этом R и R' в каждом случае независимо выбраны из водорода, циклоалкила, гетероцикла, солюбилизирующей группы и алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из OR'', NR''R''', NR''COR''' и солюбилизирующей группы; a R'' и R''' в каждом случае независимо выбраны из водорода, алкила или циклоалкила;
значение А выбрано из необязательно замещенной гетероциклической группы, А предпочтительно означает гетероциклическую группу, необязательно замещенную одной или несколькими группами, выбранными из галогена, алкила, арила, гидроксила, алкокси, нитро, тиола, гетероциклоалкила, гетероарила, циано, циклоалкила, солюбилизирующей группы, -NRR', -алкил-NRR'; -NR-CO-R', -алкил-NR-CO-R', -CONRR' и -SO2NRR'; при этом R и R' в каждом случае независимо выбраны из водорода, алкильных, циклоалкильных, арильных, гетероциклоалкильных и гетероарильных групп;
В означает пятичленную гетероарильную группу.
Согласно другому варианту осуществления в число соединений формулы (I) согласно настоящему изобретению входят соединения следующей формулы (III):
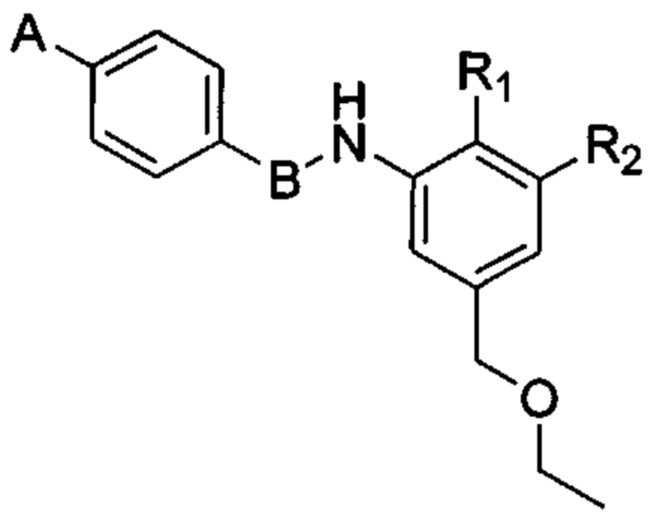
или их фармацевтически приемлемая соль, где:
R1 и R2 в каждом случае независимо выбраны из водорода; гетероцикла; циано; -CF3; -NRR; -ОН; галогена, предпочтительно выбранного из F, CI, Br и I; алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы; алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из гетероцикла, NRR', OR и солюбилизирующей группы; -CO-NRR'; -SO2-NRR'; -NR-CO-R' и -NR-SO2R';
при этом R и R' в каждом случае независимо выбраны из водорода, циклоалкила, гетероцикла, солюбилизирующей группы и алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из OR'', NR''R''', NR''COR''' и солюбилизирующей группы; a R'' и R''' в каждом случае независимо выбраны из водорода, алкила или циклоалкила;
значение А выбрано из необязательно замещенной гетероциклической группы, А предпочтительно означает гетероциклическую группу, необязательно замещенную одной или несколькими группами, выбранными из галогена, алкила, арила, гидроксила, алкокси, нитро, тиола, гетероциклоалкила, гетероарила, циано, циклоалкила, солюбилизирующей группы, -NRR', -алкил-NRR'; -NR-CO-R', -алкил-NR-CO-R', -CONRR' и -SO2NRR';
при этом R и R' в каждом случае независимо выбраны из водорода, алкильных, циклоалкильных, арильных, гетероциклоалкильных и гетероарильных групп;
В означает пятичленную гетероарильную группу.
В соответствии с одним из конкретных вариантов осуществления R1 в соединениях согласно изобретению означает водород или алкильную группу, R1 предпочтительно означает водород или С1-С3-алкил, R1 более предпочтительно означает водород, метил, этил или пропил, R1 еще более предпочтительно означает водорода или метил. Согласно другому конкретному варианту осуществления R1 в соединениях согласно изобретению означает алкильную группу, R1 предпочтительно означает С1-С3 алкил, R1 более предпочтительно означает метил, этил или пропил, R1 еще более предпочтительно означает метил.
В соответствии с одним из конкретных вариантов осуществления R2 в соединениях согласно изобретению означает водород или алкильную группу, необязательно замещенную алкоксигруппой, R2 предпочтительно означает водород, метил или -СН2-O-С2Н5. Согласно другому конкретному варианту осуществления R2 в соединениях согласно изобретению означает водород.
В соответствии с одним из конкретных вариантов осуществления R3 в соединениях согласно изобретению означает водород.
В соответствии с одним из конкретных вариантов осуществления R4 в соединениях согласно изобретению означает алкильную группу, необязательно замещенную одной или несколькими группами, выбранными из NRR' и OR; алкоксигруппу, необязательно замещенную одной или несколькими группами, выбранными из NRR 'и солюбилизирующей группы; или -CO-NRR'; где R и R' в каждом случае независимо выбраны из водорода и алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из OR'', NR''R''', NR''COR''' и солюбилизирующей группы, a R'' и R''' в каждом случае независимо выбраны из водорода или алкила.
В соответствии с одним из конкретных вариантов осуществления R4 в соединениях согласно изобретению означает алкильную группу, замещенную OR, где R означает алкильную группу; или R4 означает алкоксигруппу; предпочтительно R4 означает -СН2-О-С2Н5 или -О-СН3.
В соответствии с одним из конкретных вариантов осуществления R5 в соединениях согласно изобретению означает водород.
В соответствии с одним из конкретных вариантов осуществления R1 в соединениях согласно изобретению означает алкильную группу, R2 означает водород, R3 означает водород, R4 означает алкильную группу, замещенную OR, где R означает алкильную группу; или R4 означает алкоксигруппу; и R5 означает водород. В соответствии с одним из конкретных вариантов осуществления R1 в соединениях согласно изобретению означает метил, R2 означает водород, R3 означает водород, R4 означает -СН2-О-С2Н5 или -О-СН3; и R5 означает водород. В соответствии с одним из конкретных вариантов осуществления R1 в соединениях согласно изобретению означает метил, R2, R3 и R5 означают водород, и R4 означает -СН2ОС2Н5.
В соответствии с одним из конкретных вариантов осуществления X в соединениях согласно изобретению означает N или С-R6, где R6 выбран из водорода и алкоксигруппы. В соответствии с одним из конкретных вариантов осуществления X в соединениях согласно изобретению означает N, СН или С(ОСН3). В соответствии с предпочтительным вариантом осуществления X в соединениях согласно изобретению означает СН.
В соответствии с одним из конкретных вариантов осуществления А в соединениях согласно изобретению означает гетероциклоалкильную группу. В качестве альтернативы, А в соединениях согласно изобретению означает гетероарильную группу. В соответствии с одним из конкретных вариантов осуществления А в соединениях согласно изобретению означает триазолил, оксотриазолил, имидазолил, оксоимидазолидинил, пиразолил, пиридил, оксопиридил, тиазолил или оксопирролидинил. В соответствии с одним из конкретных вариантов осуществления А в соединениях согласно изобретению означает 2-оксоимидазолидинил или пиразолил, более предпочтительно А означает 2-оксоимидазолидинил.
В соответствии с одним из конкретных вариантов осуществления А в соединениях согласно изобретению означает гетероциклическую группу, замещенную одной или несколькими группами, выбранными из галогена, алкила, арила, гидроксила, алкокси, нитро, тиола, гетероциклоалкила, гетероарила, циано, циклоалкила, солюбилизирующей группы, -NRR', -алкил-NRR'; -NR-CO-R', -алкил-NR-CO-R', -CONRR' и -SO2NRR'; где R и R' в каждом случае независимо выбраны из водорода, алкильных, циклоалкильных, арильных, гетероциклоалкильных и гетероарильных групп. В соответствии с одним из конкретных вариантов осуществления А в соединениях согласно изобретению означает гетероциклическую группу, замещенную алкилом, алкокси, -алкил-NRR' или -алкил-NR-CO-R', А более предпочтительно замещена метилом, метокси, -CH2-CH2-NH2 или -CH2-CH2-NHCO-CH3.
В соответствии с одним из конкретных вариантов осуществления В в соединениях согласно изобретению означает арильную группу. В качестве альтернативы, В означает гетероарильную группу. Согласно одному из конкретных вариантов осуществления В в соединениях согласно изобретению означает пятичленный кольцевой гетероарил. Согласно одному из конкретных вариантов осуществления В в соединениях согласно изобретению означает оксадиазолил, оксазолил, тиадиазолил или тиазолил, предпочтительно В означает оксадиазолил, оксазолил или тиазолил. В соответствии с одним из конкретных вариантов осуществления В не выбран из 1,2-диазинила, триазолопиридинила или триазолила.
В соответствии с одним из конкретных вариантов осуществления В в соединениях согласно изобретению означает оксазолил или тиазолил. В соответствии с одним из конкретных вариантов осуществления, если В означает оксазолил, А не является тетразолилом или тетрагидропиридинилом. В соответствии с одним из конкретных вариантов осуществления, если В означает тиазолил, А не является имидазолилом, триазолилом, пиперазинилом, пирролидинилом, пиперидинилом или 1,4-оксазинилом.
В соответствии с одним из конкретных вариантов осуществления X в соединениях согласно изобретению означает СН и А означает 2-оксоимидазолидинильную или пиразолильную группу.
Согласно одному из вариантов осуществления R1 и R2 в соединениях формулы (III) в каждом случае независимо означают водород или алкильную группу (предпочтительно С1-С3 алкил, более предпочтительно метил, этил или пропил), А означает 2-оксоимидазолидинил, и В означает гетероарильную группу.
Согласно одному из конкретных вариантов осуществления R1 в соединениях формулы (III) означает метил, R2 означает водород, А означает 2-оксоимидазолидинил или пиразолил и В означает оксазол, тиазол или оксадиазольное кольцо.
Согласно одному из вариантов осуществления в число соединений формулы (I) согласно настоящему изобретению входят соединения следующей формулы (IVa) или (IVb):
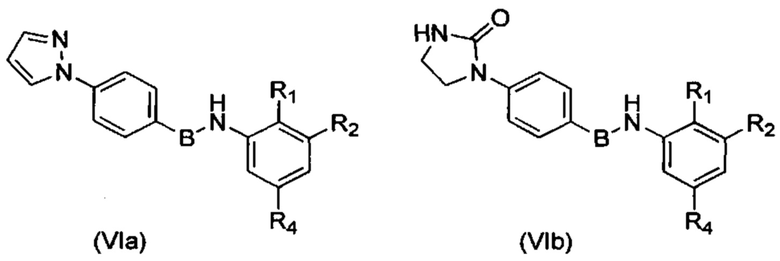
где В, R1, R2 и R4 имеют указанные выше значения.
Согласно одному из вариантов осуществления в число соединений формулы (I) согласно настоящему изобретению входят соединения следующей формулы (Va) или (Vb):
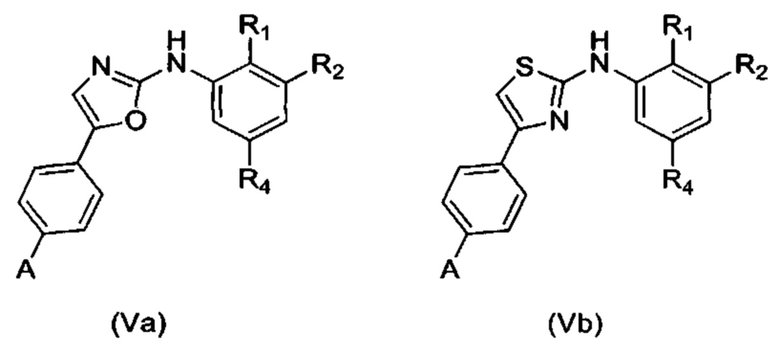
где A, R1, R2 и R4 имеют указанные выше значения.
Согласно одному из вариантов осуществления в число соединений формулы (I) согласно настоящему изобретению входят соединения следующей формулы (VIa), (VIb), (VIc) или (VId):
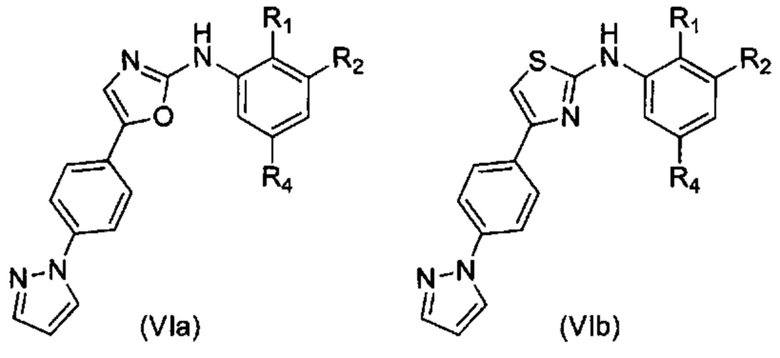
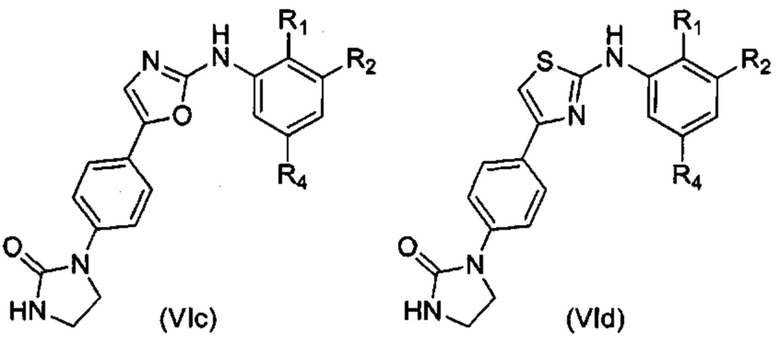
где R1, R2 и R4 имеют указанные выше значения.
Далее в Таблице 1 представлены примеры предпочтительных соединений указанных выше формул.
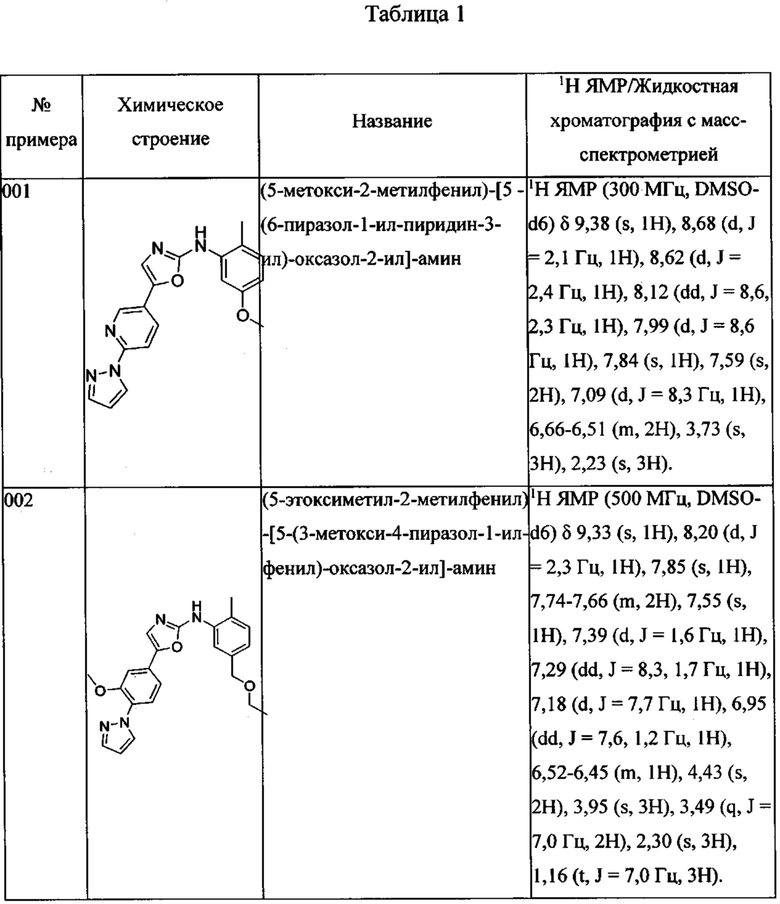
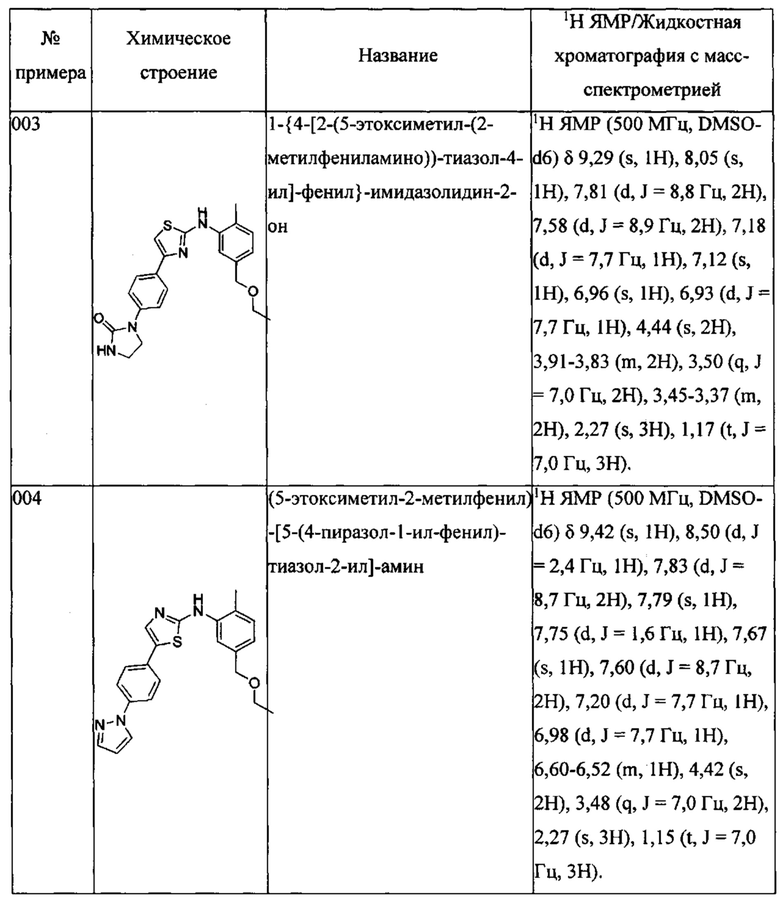
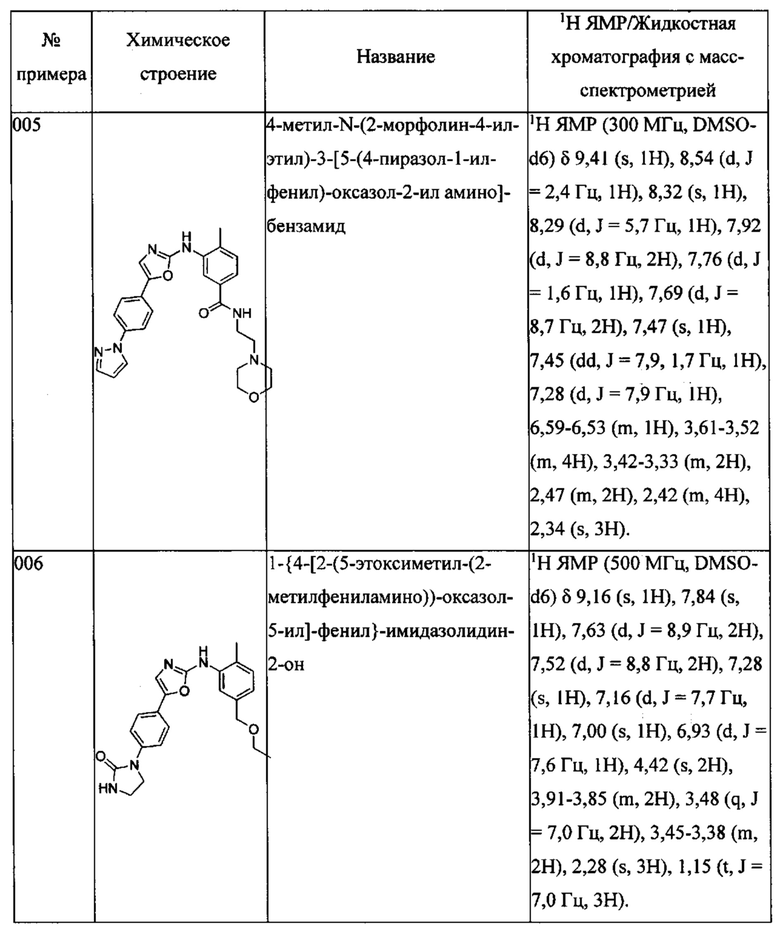
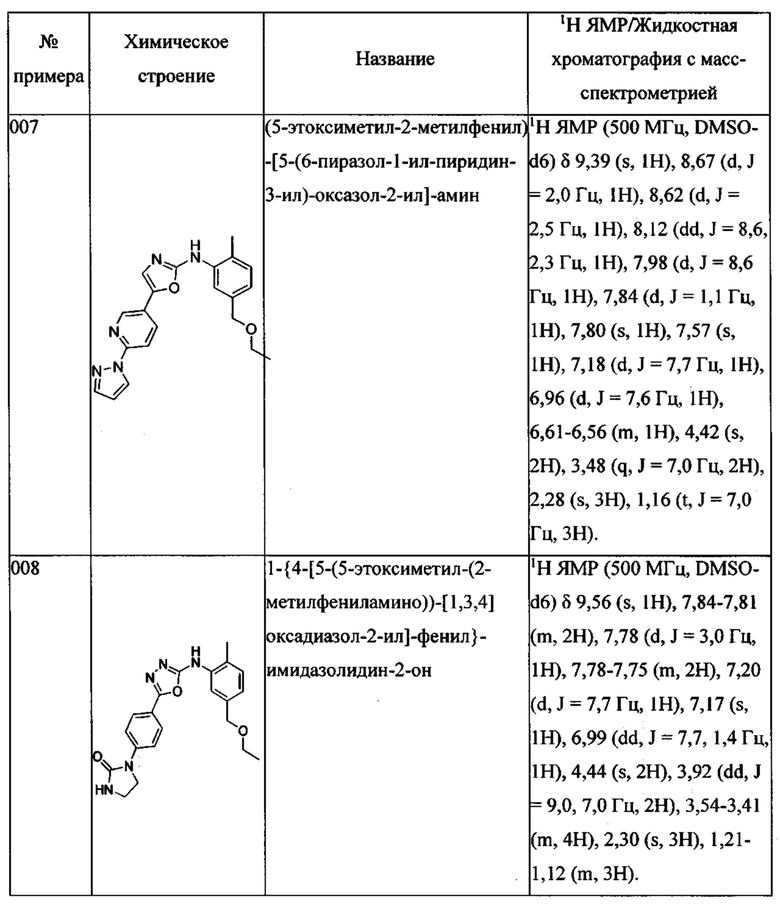
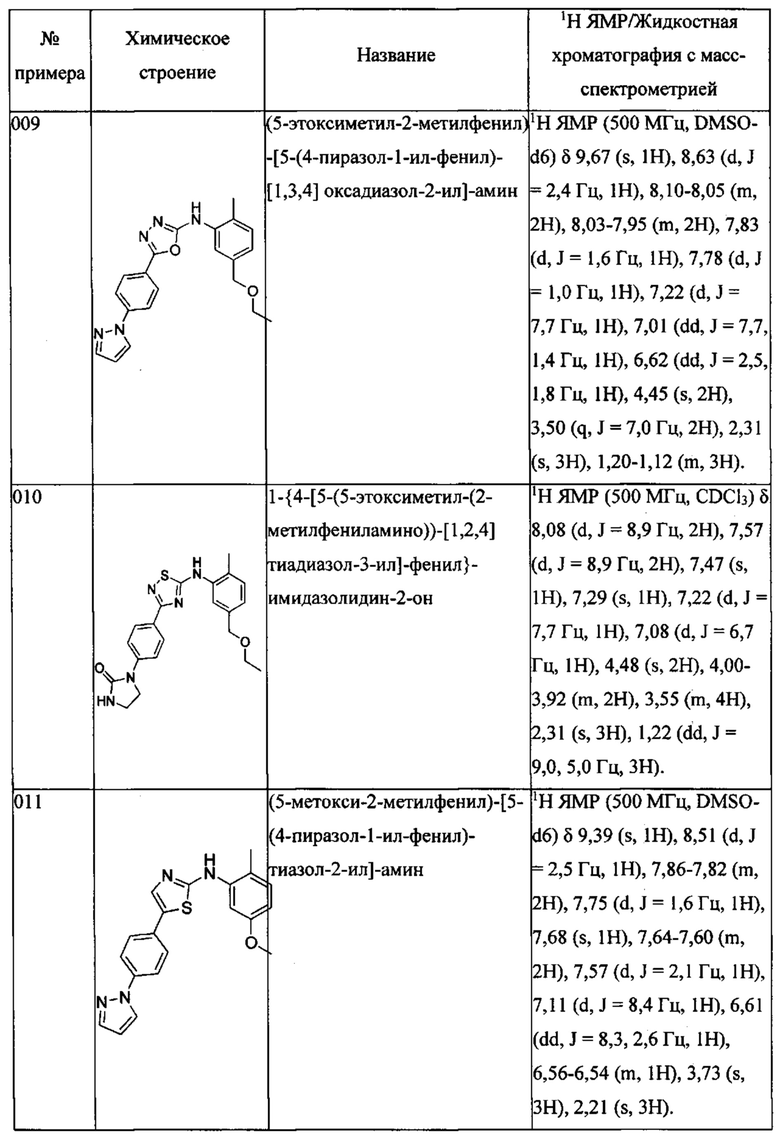
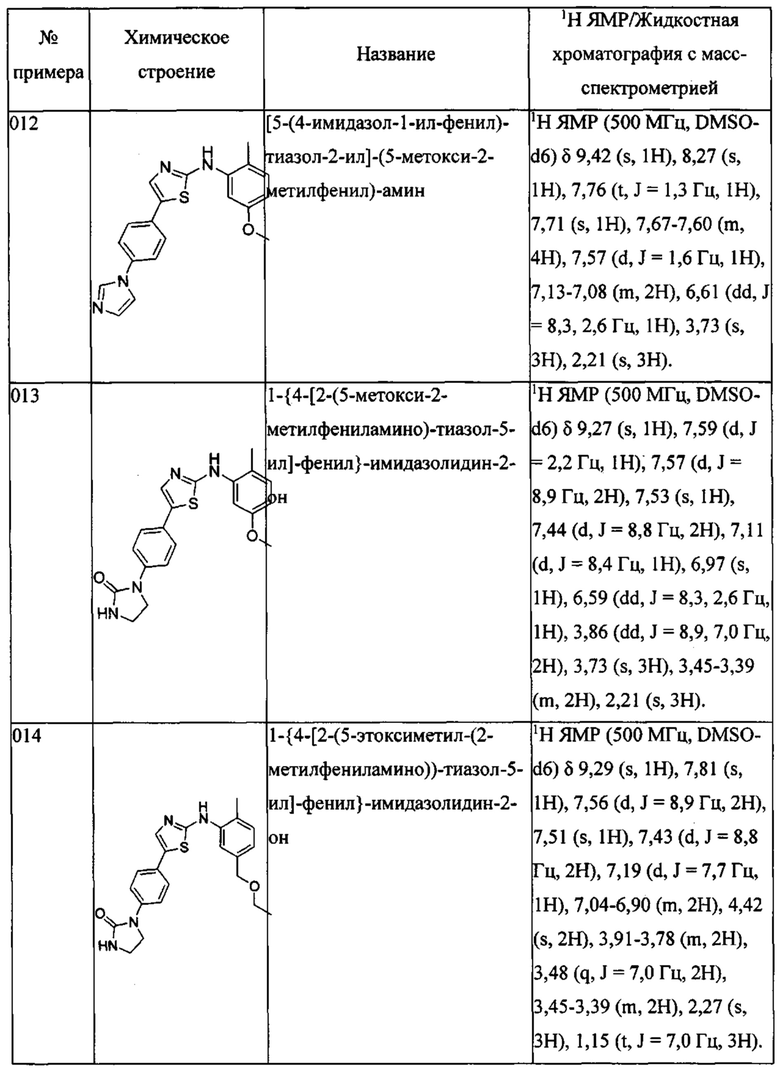
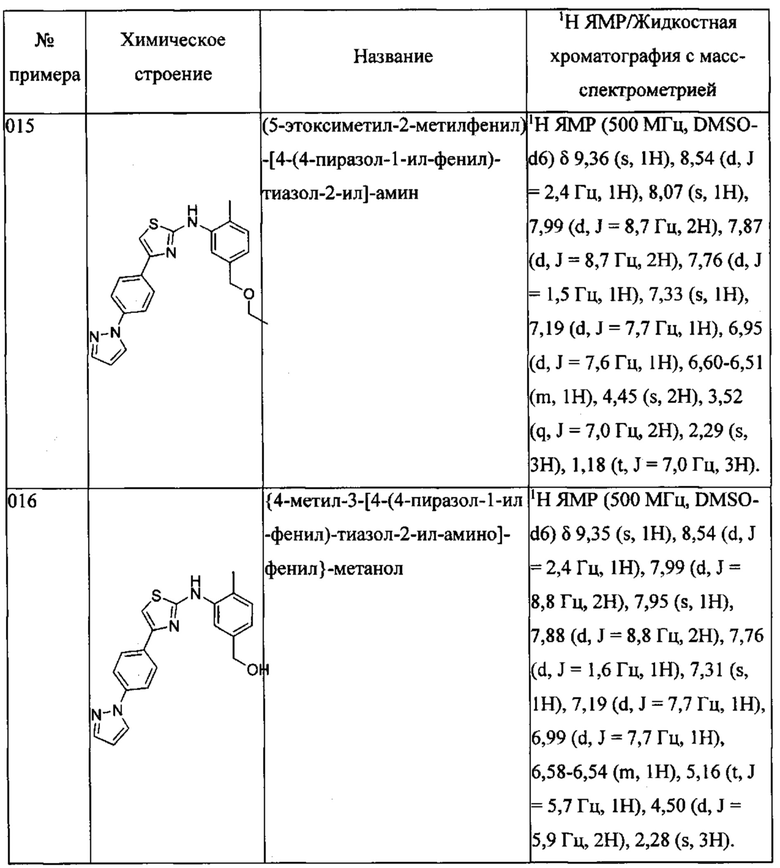
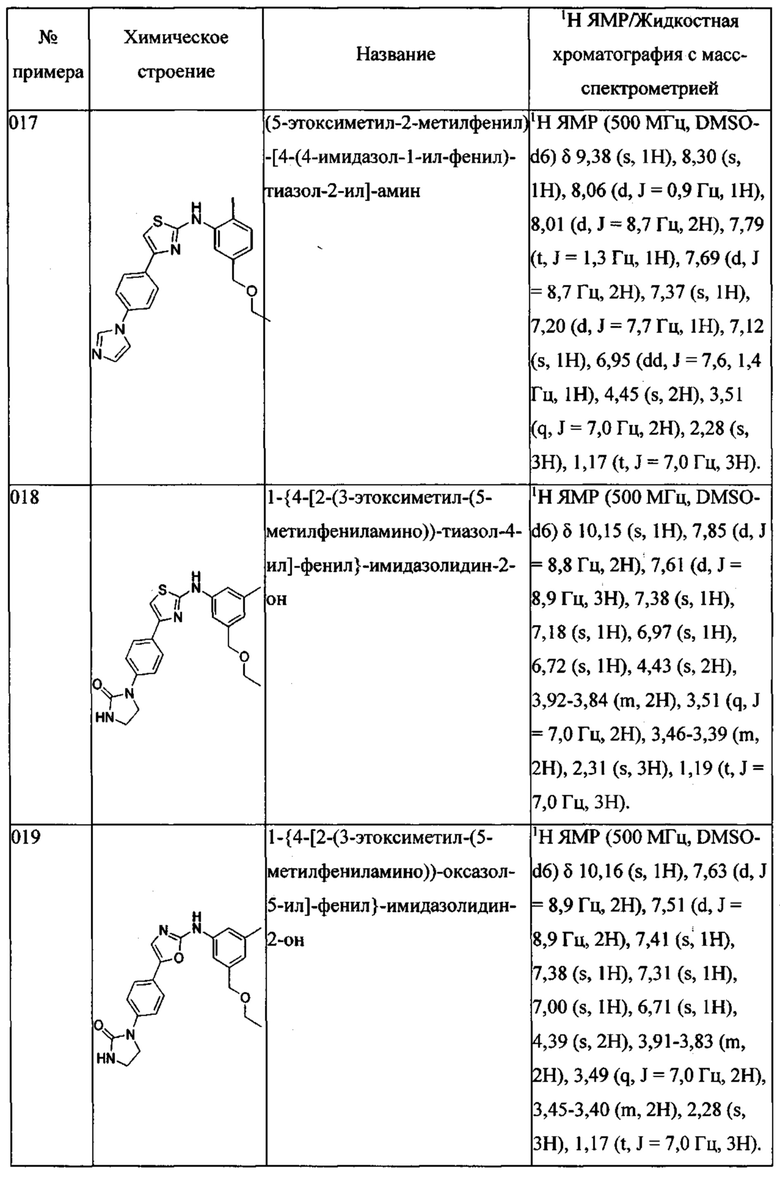
Когда в соединении имеется один или несколько хиральных центров, могут присутствовать смеси энантиомеров или диастереомеров. Такие соединения могут использоваться в качестве фармацевтических препаратов в форме чистых энантиомеров или диастереоизомеров в виде рацемических смесей или смесей, обогащенных одним или несколькими стереоизомерами. В заявленный объем настоящего изобретения входят рацемические формы таких соединений, а также отдельные энантиомеры, диастереомеры и обогащенные стереоизомерами смеси.
Отдельный стереоизомер хирального соединения обычно получают из оптически чистого предшественника или путем разделения энантиомеров методом хроматографии, например, хиральной жидкостной хроматографии высокого давления (ЖХВД). Рацемические смеси также могут преобразовываться в разделимые диастереомеры путем введения в реакцию с соответствующим реакционноспособным хиральным соединением с целью выделения методом хроматографии. В качестве альтернативы, разделение может достигаться путем преобразования в хиральную соль. Например, рацемическое хиральное соединение, содержащее основную группу, может образовывать диастереомерную соль с хиральной кислотой, такой как яблочная кислота. Смесь полученных таким способом диастереомерных солей затем может разделяться методом фракционной кристаллизации. Чистые синтетические диастереомеры, полученные этими способами, затем могут преобразовываться в желаемый стереоизомер классическими химическими средствами, известными специалистам в данной области техники. В настоящем изобретении хиральные рацемические соединения могут разделяться методом хиральной ЖХВД в применимой хиральной стационарной фазе путем элюирования смесью гептана и этанола или чистым спиртом (метанолом или этанолом). Стереоизомерные конгломераты могут разделяться традиционными способами, известными специалистам в данной области техники. Смотри, например, работу Ernest L. Eliel под названием "Stereochemistry of Organic Compounds" (издательство Wiley, Нью-Йорк, 1994 г.).
Соединения формулы (I) могут использоваться в форме солей, полученных из фармацевтически приемлемых неорганических или органических кислот. Если не указано иное, термин "фармацевтически приемлемая соль" означает соль, полученную путем объединения соединения формулы (I) с кислотой, чей анион, или основанием, чей катион обычно считаются применимыми для употребления человеком. Фармацевтически приемлемые соли особо применимы в качестве продуктов в способах согласно настоящему изобретению за счет их большей растворимости в воде, чем у исходного соединения. Солями соединений согласно настоящему изобретению для применения в медицине являются нетоксичные "фармацевтически приемлемые соли". Соли, подпадающие под термин "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений согласно настоящему изобретению, которые обычно получают путем введения свободного основания в реакцию с применимой органической или неорганической кислотой. Применимые фармацевтически приемлемые кислотно-аддитивные соли соединений согласно настоящему изобретению, когда это возможно, включают соединения, полученные из неорганических кислот, таких как хлористоводородная, бромистоводородная, фтористоводородная, борная, фторборная, фосфорная, метафосфорная, азотная, карбоновая, сульфоновая и серная кислоты, и из органических кислоты, таких как уксусная, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изотоническая, молочная, лактобионная, малеиновая, яблочная, метансульфоновая, трифторметансульфоновая, янтарная, толуолсульфоновая, винная и трифторуксусная кислоты. Применимые органические кислоты обычно включают, например, органические кислоты алифатического, циклоалифатического, ароматического, аралифатического, гетероциклического, карбонового и сульфонового классов. Конкретные примеры применимых органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолят, глюконат, диглюконат, лактат, малат, винная кислота, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат, глутамат, бензоат, антраниловая кислота, стеарат, салицилат, р-гидроксибензоат, фенилацетат, манделат, эмбонат (памоат), метансульфонат, этансульфонат, бензолсульфонат, пантотенат, толуолсульфонат, 2-гидроксиэтансульфонат, суфанилат, циклогексиламиносульфонат, β-гидроксибутират, галактарат, галактуронат, адипат, альгинат, камфарат, камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гептаноат, гексаноат, никотинат, 2-нафталсульфонат, оксалат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат, тиоцианат и ундеканоат. Кроме того, когда соединения по изобретению содержат кислотный остаток, применимые фармацевтически приемлемые соли могут включать соли щелочных металлов, то есть соли натрия или калия; соли щелочноземельных металлов, например, соли кальция или магния; и соли, получаемые с применимыми органическими лигандами, например, соли четвертичного аммония. В другом варианте осуществления основные соли получают из оснований, которые образуют нетоксичные соли, включая соли алюминия, аргинина, бензатина, холина, диэтиламина, диоламина, глицина, лизина, меглумина, оламина, трометамина и цинка. Органические соли могут быть получены из вторичных, третичных или четвертичных аминных солей, таких как трометамин, диэтиламин, N,N'-дибензил-этилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Основные азотсодержащие группы могут быть кватернизированы такими агентами, как галогениды низших алкилов (CrCe) (например, метил, этил, пропил и бутилхлориды, бромиды и йодиды), диалкилсульфаты (т.е. диметил, диэтил, дибутил и диамилсульфаты), длинноцепочечные галогениды (например, децил, лаурил, миристил и стеарилхлориды, бромиды и йодиды), арилалкилгалогениды (например, бензил и фенетилбромиды) и другие. Также могут быть получены гемисоли кислот и оснований, например, гемисульфатные и гемикальциевые соли.
Термин "соединения формулы (I)" включает все подформулы и конкретные варианты осуществления, раскрытые в описании. Кроме того, если не указано иначе, термин "соединения формулы (I)" включает все формы соединения формулы (I), включая гидраты, изомеры сольватов, кристаллические и некристаллические формы, изоморфы, полиморфы и их метаболиты. Например, соединения формулы (I) или их фармацевтически приемлемые соли могут существовать в несольватированных и сольватированных формах. Когда растворитель или вода прочно связаны, комплекс имеет четко определенную стехиометрию независимо от влажности. Однако когда растворитель или вода слабо связаны, как в сольватах и гигроскопических соединениях, содержание воды/растворителя зависит от влажности и условий сушки. В таких случаях нормой является нестехиометрия. Стереоизомеры соединений формулы (I) включают цис- и транс-изомеры, оптические изомеры, такие как R и S энантиомеры, диастереомеры, геометрические изомеры, вращательные изомеры, конформационные изомеры и таутомеры соединений согласно изобретению, включая соединения, проявляющие изомерию нескольких типов; и их смеси (такие как рацематы и диастереомерные пары). Если не указано иное, термин "соединения формулы (I)" включает таутомерные формы соединений. Там, где структурные изомеры способны к взаимному превращению через низкоэнергетический барьер, может возникать таутомерная изомерия ("таутомерия"). Она может приобретать форму протонной таутомерии в соединениях согласно изобретению, содержащих, например, иминогруппу, кетогруппу или оксимную группу, или так называемой валентной таутомерии в соединениях, которые содержат ароматический фрагмент. Из этого следует, что одно соединение может проявлять изомерию нескольких типов. Различные соотношения таутомеров в твердой и жидкой форме зависят от различных заместителей в молекуле, а также от конкретного метода кристаллизации, используемого для выделения соединения.
Фармацевтическая композиция, лекарственное средство и применение
Изобретение также относится к фармацевтической композиции, содержащей описанное выше соединение.
Соответственно, изобретение относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение согласно изобретению и приемлемый фармацевтический наполнитель.
Согласно одному из вариантов осуществления изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый носитель и/или наполнитель.
Как известно специалистам в данной области техники, могут использоваться различные формы наполнителей, адаптированные к способу введения, и некоторые из них могут способствовать повышению эффективности активной молекулы, например, обеспечивая профиль высвобождения, делающий эту активную молекулу более эффективной для желаемого лечения.
Таким образом, фармацевтические композиции согласно изобретению могут вводиться в различных формах, например, в виде форм для инъекций, распыления или приема внутрь, например, путем внутримышечного, внутривенного, подкожного, внутрикожного, перорального, местного, ректального, вагинального, офтальмического, назального, трансдермального или парентерального введения. Настоящее изобретение, в частности, относится к применению соединения согласно настоящему изобретению с целью изготовления композиции, в частности, фармацевтической композиции.
Такому лекарственному препарату может быть придана форма фармацевтической композиции, приспособленной для перорального введения, которая может быть составлена с использованием хорошо известных из техники фармацевтически приемлемых носителей в применимых дозах. Такие носители позволяют составлять фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, суспензий, суспензий и т.п. для приема внутрь пациентом. В дополнение к действующим ингредиентам эти фармацевтические композиции могут содержать применимые фармацевтически приемлемые носители, представляющие собой наполнители и вспомогательные вещества, которые облегчают переработку активных соединений в препараты, которые могут использоваться в фармацевтических целях. Более подробную информацию о методах составления и введения можно найти в последнем издании Remington's Pharmaceutical Sciences (издательство Maack Publishing Co, Истон, штат Пенсильвания, США).
Композиции согласно изобретению также может быть придана форма фармацевтической или косметической композиции для местного введения.
Такие композиции могут быть составлены в виде геля, пасты, мази, крема, лосьона, жидкой суспензии, водно-спиртовых или масляных растворов или дисперсий типа лосьона или сыворотки или безводных или липофильных гелей или эмульсий жидкой или полутвердой консистенции молочного типа, полученных диспергированием жирной фазы в водной фазе или наоборот, или суспензий или эмульсий мягкой, полутвердой консистенции типа крема или геля или в качестве альтернативы, микроэмульсий, микрокапсул, микрочастиц или везикулярных дисперсий ионного и/или неионного типа. Эти композиции получают стандартными методами.
Композиция согласно изобретению может содержать любой ингредиент, обычно используемый в дерматологии и косметике. Она может содержать, по меньшей мере, один ингредиент, выбранный из гидрофильных или липофильных гелеобразующих агентов, гидрофильных или липофильных действующих веществ, консервантов, смягчающих веществ, улучшающих вязкость полимеров, увлажнителей, поверхностно-активных веществ, консервантов, антиоксидантов, растворителей, отдушек, наполнителей, просеивающих агентов, бактерицидов, поглотителей запахов и окрашивающего вещества.
В качестве масел, которые могут использоваться в изобретении, можно упомянуть минеральные масла (жидкий парафин), растительные масла (жидкую фракцию масла ши, подсолнечное масло), масла для животных, синтетические масла, силиконовые масла (циклометикон) и фторированные масла. В качестве жирных веществ также могут использоваться жирные спирты, жирные кислоты (стеариновая кислота) и воски (парафин, карнауба, пчелиный воск).
Эмульгаторы, которые могут использоваться в изобретении, включают, например, стеарат глицерина, полисорбат 60 и смесь ПЭГ-6/ПЭГ-32/стеарата гликоля.
Гидрофильные гелеобразующие агенты, которые могут использоваться в изобретении, включают, например, карбоксивиниловые полимеры (карбомер), акриловые сополимеры, такие как акрилатные/алкилакрилатные сополимеры, полиакриламиды, полисахариды, такие как гидроксипропилцеллюлоза, глины и природные смолы. Липофильные гелеобразующие агенты, которые могут использоваться в изобретении, включают, например, модифицированные глины, такие как бентоны, соли металлов жирных кислот, такие как стеараты алюминия и гидрофобный диоксид кремния, или качестве альтернативы этилцеллюлозу и полиэтилен.
В качестве гидрофильных действующих веществ могут использоваться белки или белковые гидролизаты, аминокислоты, полиолы, мочевина, аллантоин, сахара и производные сахаров, витамины, крахмал и растительные экстракты, в частности, алоэ вера.
В качестве липофильного действующего вещества может использоваться ретинол (витамин А) и его производные, токоферол (витамин Е) и его производные, незаменимые жирные кислоты, церамиды и эфирные масла. Эти вещества придают дополнительные увлажняющие или смягчающие кожу свойства при их использовании.
Кроме того, в композицию может быть включено поверхностно-активное вещество, чтобы обеспечить более глубокое проникновение соединения, способного проявлять антипролиферативную активность в отношении большой группы линий опухолевых клеток в качестве единственного средства агента или в сочетании с другими цитотоксическими средствами.
В число предусмотренных в изобретении ингредиентов входят усиливающие проникновение средства, выбранные, например, из группы, включающей минеральное масло, воду, этанол, триацетин, глицерин и пропиленгликоль; средства когезии, выбранные, например, из группы, включающей полиизобутилен, поливинилацетат и поливиниловый спирт, и загустителей.
Химические способы усиления местной абсорбции лекарств хорошо известны из техники. Например, соединения с улучшающими проникновение свойствами включают лаурилсульфат натрия (Dugard, Р.Н. и Sheuplein, R.J, "Effects of Ionic Surfactants on the Permeability of Human Epidermis: An Electrometric Study", J. Ivest. Dermatol, том 60, стр. 263-69, 1973 г.), оксид лауриламина (Johnson и др., патент US 4411893), азон (Rajadhyaksha, патенты US 4405616 и US 3989816) и децилметилсульфоксид (Sekura, DL и Scala, J, "The Percutaneous Absorption of Аlkylmethyl Sulfides," Pharmacology of the Skin, Advances In Biology of Skin, издательство Appleton-Century Craft, том. 12, стр. 257-69, 1972 г.). При увеличении полярности головной группы в амфотерных молекулах наблюдается усиление их проникающих свойств, но за счет усиления их раздражающих кожу свойств (Cooper, ER и Berner, В, "Interaction of Surfactants with Epidermal Tissues: Physiochemical Aspects", Surfactant Science Series, том 16, под редакцией Reiger, MM, издательство Marcel Dekker, Inc, стр. 195-210, 1987 г).
Второй класс химических усилителей обычно называют сорастворителями. Эти материалы относительно легко абсорбируются местно и посредством различных механизмов обеспечивают повышение проницаемости некоторых лекарств. Несколько примеров соединений, которые продемонстрировали способность усиливать абсорбцию различных соединений, включают этанол (Gale и др., патент US 4615699 и Campbell и др., патенты US 4460372 и US 4379454), диметилсульфоксид (патенты US 3740420, US 3743727 и US 4575515) и производные глицерина (патент US 3223433).
Фармацевтические композиции согласно изобретению также могут быть предназначены для доставки в составе аэрозоля до целевых областей дыхательных путей пациента.
Устройства и методики доставки распыляемых порций лекарственного средства описаны в патенте US 5906202. Составы предпочтительно означают растворы, например, водные растворы, растворы в этаноле, водные растворы в этаноле, солевые растворы, коллоидные суспензии и микрокристаллические суспензии. Например, распыляемые частицы содержат упомянутый выше действующий ингредиент и носитель (например, фармацевтически активный респираторный препарат и носитель) и образуются при распылении состава через сопло, которое предпочтительно имеет форму гибкой пористой мембраны. Поскольку размер частиц достаточно мал, при их образовании они остаются взвешенными в воздухе в течение достаточного времени, чтобы пациент мог вдыхать их в легкие.
В изобретение входит описанная в патенте US 5556611 система, содержащая:
системы сжиженного газа (в качестве носителя используется сжиженный газ, например, FCHC с низкой температурой кипения или пропан, бутан в емкости под давлением),
суспензионный аэрозоль (частицы активного вещества в твердой форме суспендированы в жидкой фазе носителя),
система сжатого газа (используется сжатый газ, такой как азот, диоксид углерода, монооксид азота или воздух).
Таким образом, в соответствии с изобретением получают фармацевтический препарат путем растворения или диспергирования действующего вещества в применимой нетоксичной среде, распыляют полученный раствор или дисперсию в виде аэрозоля, т.е. получают его тонкую дисперсия в газообразном носителе. Это технически осуществимо, например, в форме аэрозольных баллонов с газом-носителем, аэрозолей для нагнетания или других известных как таковых устройств для распыления жидкостей и тонкого измельчения твердых веществ, которые, в частности, позволяют осуществлять точную индивидуальную дозировку.
Следовательно, изобретение также относится к аэрозольным устройствам, содержащим описанное выше соединение и такой состав, предпочтительно с дозирующими клапанами.
Фармацевтические композиции согласно изобретению также могут быть предназначены для интраназального введения.
При этом, специалистам хорошо известные фармацевтически приемлемые носители для доставки соединения до поверхностей слизистой оболочки носа. Эти носители описаны в Remington's Pharmaceutical Sciences, 16-е издание, 1980 г, под редакцией Arthur Osol.
Выбор применимых носителей зависит от предполагаемого конкретного типа введения. Для введения композиции через верхние дыхательные может быть составлен раствор, например, воды или забуференного или незабуференного изотонического солевого раствора или суспензия для интраназального введения в виде капель или спрея. Такие растворы или суспензии предпочтительно являются изотоническими по отношению к носовым выделениям и имеют примерно одинаковые значения рН, например, от около 4,0 до около 7,4 или от 6,0 до 7,0. Буферы должны быть физиологически совместимыми и включать, например, фосфатные буферы. Например, известно, что типичный назальный противозастойный препарат забуферен до рН около 6,2 (Remington's, стр. 1445). Разумеется, что специалист в данной области техники может легко определить соответствующее содержание солевого раствора и значение рН у безвредного водного носителя для введения через нос и/или верхние дыхательные пути.
Для обеспечения более устойчивого контакта с поверхностями слизистой оболочки носа также могут использоваться обычные интраназальные носители включают назальные гели, кремы, пасты или мази с вязкостью, например, от около 10 до около 3000 сПз или от около 2500 до 6500 сПз или более. Лишь в качестве примера такие несущие вязкие составы могут быть основаны на алкилцеллюлозах и/или других биосовместимых носителях с высокой вязкостью, хорошо известных из техники (смотри, процитированный выше Remington's). Предпочтительной алкилцеллюлозой является, например, метилцеллюлоза в концентрации от около 5 до около 1000 или более мг на 100 мл носителя. Лишь в качестве примера более предпочтительная концентрация метилцеллюлозы составляет, например, от около 25 до около 150 мг на 100 мл носителя.
Для обеспечения дополнительной вязкости, удержания влаги и придания приятной текстуры и запаха составу также могут включаться другие ингредиенты, такие как известные консерванты, красители, смазочные или вязкие минеральные или растительные масла, отдушки, природные или синтетические растительные экстракты, такие как ароматические масла, и увлажнители и усилители вязкости. Из техники известны различные устройства получения капель, капелек и спреев для назального введения растворов или суспензий согласно изобретению.
Другим аспектом изобретения является создание диспенсера заданных стандартных доз с пипеткой или распылительным устройством, содержащим раствор или суспензию для доставки в виде капель или спрея, который содержит одну или несколько доз вводимого лекарственного средства. В изобретении также предложен комплект, содержащий одну или несколько стандартных обезвоженных доз соединения вместе с любыми необходимыми солями и/или буферами, консервантами, красителями и т.п., готовый для приготовления раствора или суспензии путем добавления соответствующего количества воды.
Еще одним аспектом изобретения относится к применению упомянутого соединения для изготовления лекарственного средства. В частности» изобретение относится к лекарственному средству, содержащему соединение согласно изобретению или его фармацевтически приемлемую соль. Таким образом, в изобретении предложен способ лечения заболевания путем ингибирования пролиферации опухолевых клеток, включающий введение эффективного количества, по меньшей мере, одного описанного выше соединения субъекту, нуждающемуся в таком лечении.
Соединения согласно изобретению могут преимущественно использоваться в эффективном количестве. Эти количества обычно составляют от 0,1 мг до 2 г соединения согласно изобретению в сутки на килограмм массы тела.
Согласно еще одному аспекту настоящее изобретение относится к способу модулирования, регулирования и/или ингибирования пролиферации клеток. Способ включает введение в клетки, по меньшей мере, одного описанного выше соединения формулы (I), такого как соединение формулы (II) или (III), или его фармацевтически приемлемой соли.
Описанные способы могут быть предназначены для лечения гематологического и/или пролиферативного заболевания или нарушения у субъекта. В одном из конкретных вариантов осуществления заболеванием или нарушением является пролиферативное заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием или нарушением является гематологическое заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием или нарушением является пролиферативное гематологическое заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием является рак.
В одном из вариантов осуществления у субъекта диагностировано пролиферативное заболевание или нарушение. В одном из вариантов осуществления у субъекта диагностировано гематологическое заболевание или нарушение.
В одном из вариантов осуществления описанные способы не вызывают ингибирования протеинкиназ и не приводят к нему.
Заболевания и нарушения, которые, как известно, связаны с этими гематологическими и пролиферативными заболеваниями, включают, например:
гематологические нарушения, такие как лимфомы и лейкозы, включая неходжкинскую лимфому, диффузную В-крупноклеточную лимфому (ДВККЛ), фолликулярную лимфому (ФЛ), мантийноклеточную лимфому (МКЛ), В клеточный хронический лимфоцитарный лейкоз (ВХЛЛ)/лимфому из малых лимфоцитов (ЛМЛ), макроглобулинемию Вальденстрема (MB), лимфому маргинальной зоны (ЛМЗ), лимфому Беркитта и периферические Т-клеточные лимфомы (ПТКЛ); а также множественную миелому (ММ), миелодиспластический синдром (МДС), миелодисплазию с миелофиброзом;
пролиферативные заболевания, такие как мастоцитоз, включая пигментную крапивницу (ПК), макулярную эруптивную персистирующую телеангиэктазию (МЭПТ), индолентный системный мастоцитоз, агрессивный системный мастоцитоз и лейкозный системный мастоцитоз;
пролиферативные заболевания, такие как солидные опухоли, включая рак головы и шеи, меланому, карциному желудка, карциному печени, колоректальную карциному кишки, карциному поджелудочной железы, карциному легкого, нейрональную карциному, мультиформную глиобластому, костную карциному, остеосаркому, саркому Юинга, карциному молочной железы, карциному яичника, карциному предстательной железы.
Одно из соединений формулы (I), такое как соединение формулы (II) или (III), или его фармацевтически приемлемая соль может применяться для указанного выше лечения заболевания или нарушения, такого как гематологические нарушения и/или пролиферативные нарушения. Пролиферативным нарушением может являться рак.
В одном из вариантов осуществления из соединений формулы (I), такое как соединение формулы (II) или (III), или его фармацевтически приемлемая соль, предназначено для применения при лечении указанного выше заболевания или нарушения, такого как гематологические и/или пролиферативные заболевания или нарушения. В одном из конкретных вариантов осуществления заболеванием или нарушением является пролиферативное заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием или нарушением является гематологическое заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием или нарушением является пролиферативное гематологическое заболевание или нарушение. В одном из конкретных вариантов осуществления заболеванием является рак.
В одном из конкретных вариантов осуществления соединения формулы (I) предназначены для применения при модулировании, регулировании и/или ингибировании пролиферации линий кроветворных опухолевых клеток. В одном из конкретных вариантов осуществления соединения формулы (I) предназначены для применения при модулировании, регулировании и/или ингибировании пролиферации линий клеток солидных опухолей.
В описанных в изобретении способах соединение формулы (I) или его фармацевтически приемлемая соль могут использоваться в качестве единственного действующего фармацевтического ингредиента или в сочетании с другим действующим фармацевтическим ингредиентом. В одном из вариантов осуществления соединение формулы (I) или его фармацевтически приемлемая соль используется в качестве единственного действующего фармацевтического ингредиента. В одном из вариантов осуществления соединение формулы (I) или его фармацевтически приемлемая соль используется в сочетании с другим действующим фармацевтическим ингредиентом.
Настоящее изобретение относится к способу профилактики или лечения заболевания или нарушения, выбранного из гематологических и пролиферативных нарушений, включающему одновременное или последовательное введение нуждающемуся в этом человеку или животному, по меньшей мере, одного соединения формулы (I) или его фармацевтически приемлемой соли в сочетании с другим действующим фармацевтическим ингредиентом в достаточных количествах для обеспечения терапевтического эффекта.
Настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), такое как соединение формулы (II) или (III), или его фармацевтически приемлемую соль, и другое действующее лекарственное вещество, в качестве комбинированного препарата для последовательного, одновременного или отдельного применения при лечении заболевания или нарушения, выбранного из группы, включающей гематологические и пролиферативные нарушения.
Настоящее изобретение относится к применению соединения формулы (I), такого как соединение формулы (II) или (III), или его фармацевтически приемлемой соли, необязательно в сочетании с другим действующим лекарственным веществом для изготовления лекарственного средства для лечения заболевания или нарушения, выбранного из группы, включающей гематологическое нарушение и пролиферативное нарушение.
Хотя описанные выше способы и применения относятся к одному из соединений формулы (I), такому, как одно из соединений формулы (II) или (III), или его фармацевтически приемлемой соли, когда это технически осуществимо, подразумевается, что они в равной мере относятся к фармацевтическим композициям, содержащим те же самые соединения.
Общие процедуры синтеза
Соединения согласно изобретению могут быть получены несколькими способами, включая способы, представленные на Схемах 1-2, при этом заместителями являются заместители согласно приведенной выше формуле (I), если отсутствуют дополнительные указания. Описанные далее способы синтеза являются лишь иллюстративными, а соединения согласно изобретению могут быть синтезированы альтернативными путями, известными специалистам в данной области техники.
Соответственно, осуществили синтез производных V аминооксазола, для чего сначала ввели ароматические альдегиды I в реакцию с р-толуолсульфонилметил изоцианидом (TosMIC) и получили соответствующие производные II оксазола методом Van Leusen и др. (Tetrahedron Lett, 1972, 23, 2369) (Схема 1). Известными из литературы способами получили некоммерческие альдегиды, чтобы ввести альдегидную группу из соответствующего бромированного ароматического соединения с использованием металлоорганического реагента и DMF или из продукта окисления соответствующего толуола методом Frey и др. (Tetrahedron Lett, 2001, 39, 6815) или из продукта реакции дибромирования бромопиколинов с последующим гидролизом с использованием водного раствора карбоната кальция методом Bombrun и др. (Tetrahedron Lett, 2005, 36, 6033). Затем дополнительно функционализировали эти соединения II путем депротонирования оксазольного фрагмента применимым органическим основанием, и путем последующего электрофильного хлорирования получили соединения III 2-хлороксазола. Конечные целевые соединения V обычно должны являться продуктом прямой реакция нуклеофильного замещения соединениями IV анилина (где R' означает водород) в присутствии применимого растворителя, такого как спирт, с нагревом до повышенной температуры. Соединения V также могут быть получены в результате реакции соединений IV (где R' означает ацетильную группу) и соединений III в присутствии гидрида натрия и в применимом растворителе, таком как тетрагидрофуран или диметилформамид (WO/2007/131953).
Осуществили синтез производных VIII аминотиазола, для чего сначала ввели ароматические альдегиды I в реакцию с (метоксиметил)трифенилфосфоний хлоридом и получили соответствующие производные VI энольных эфиров с использованием реакции Виттига, описанной Iwao и др. (J. Org. Chem. 2009, 74, 8143). Затем осуществили циклизацию производным VI энольного эфира I, производными VII тиомочевины и N-бромсукцинимидом (NBS) с использованием метода Zhao и др. (Tetrahedron Lett, 2001, 42, 2101). Синтезировали производные VII тиомочевины путем введения анилина IX в реакцию с тиоцианатом аммония.
Схема 1
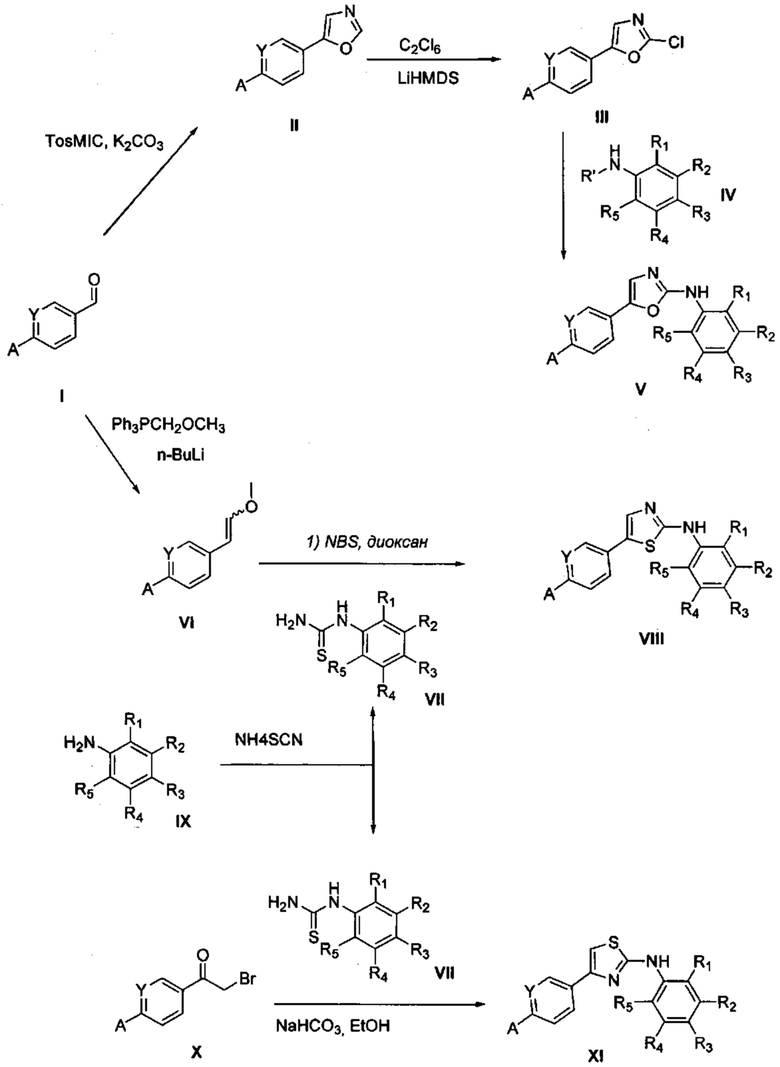
Осуществили синтез производных XI аминотиазола с использованием реакции Ханча путем циклизации с производными X 2-бромкетона и производными VII тиомочевины в основных условиях в присутствии применимого растворителя, такого как спирт, и с нагревом до повышенной температуры
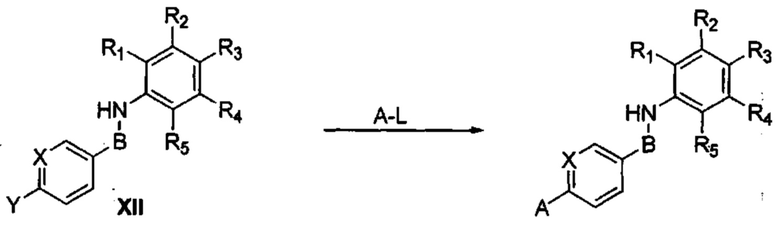
В качестве альтернативы, соединения формулы (I) могут быть получены посредством реакции связывания с медью или палладием согласно приведенной далее Схеме 2, путем введения соединения XII в реакцию с необязательно замещенным гетероциклом A-L, где Y может означать I, Br или Cl, a L означает водород, борную кислоту, сложный борный эфир или триалкилстанил. Специалисты в данной области техники поймут, что соединения XII могут быть в качестве альтернативы получены по протоколу, показанному выше на Схеме 1.
Схема 2
Примеры
Далее изобретение проиллюстрировано Примерами, представляющими собой предпочтительные варианты осуществления, которые являются частью изобретения, но никоим образом не ограничивающие объем прирязаний.
А. Синтез соединений
Изобретение будет более полно понято со ссылкой на следующие примеры получения, которые не должны толковаться как ограничивающие объем изобретения.
Общие сведения
Все использованные химические вещества являлись реактивами товарного сорта. Растворители являлись безводными растворителями товарного сорта, которые использовали без дальнейшей очистки. Протекание реакций контролировали методом тонкослойной хроматографии с использованием пластин ТРК Merck из предварительно обработанного силикагеля 60F 254, которые визуализировали в ультрафиолетовом свете. Мультиплетность 1Н ЯМР спектров обозначена как синглет(ы), широкий синглет (br s), дублет (d), триплет (t), квадруплет (q) и мультиплет (m), а для получения ЯМР спектров использовали спектрометр Bruker с рабочей частотой 300 МГц или 500 МГц.
Аббревиатуры
n-Buli n-бутиллитий
t-BuOH Трет-бутиловый спирт
СаСО3 Карбонат кальция
CCl4 Четыреххлористый углерод
C2Cl6 Гексахлорэтан
CDCl3 Дейтерохлороформ
Cs2CO3 Карбонат цезия
CuI Йодид меди
DCC Дициклогексилкарбодиимид
DCM Дихлорметан
DMAP 4-Диметиламинопиридин
DMF Диметилформамид
DMSO-d6 Гексадейтеродиметилсульфоксид
EDCI 1-этил-3-(3-диметиламинопропил) карбодиимид
EtOAc Этилацетат
EtOH Этанол
Et2O Простой диэтиловый эфир
Et3N Триэтиламин
ч Час(ы)
H2O Вода
H4N2 Моногидрат гидразина
HCl Соляная кислота
Conc. HCl Концентрированная соляная кислота (37%)
HOBt Гидроксибензотриазол
iPrOH 2-пропанол
K2CO3 Карбонат калия
KHCO3 Гидрокарбонат калия
LiHMDS Бис(триметилсилил)амид лития
МеОН Метанол
MgSO4 Сульфат магния
Мин. Минуты
NaCl Хлорид натрия
NaH Гидрид натрия
NaHCO3 Гидрокарбонат натрия
NaNO2 Нитрит натрия
NaOEt Этоксид натрия
NaOH Гидроксид натрия
NBS N-бромсукцинимид
NH4Cl Хлорид аммония
NH4SCN Тиоцианат аммония
Pd/C Палладий на углероде 10% по весу
Pd2(dba)3 Трис(дибензилиденацетон)дипалладий(0)
РЕ Петролейный эфир
(PhCO)2O2 Бензоилпероксид
SnCl2⋅2H2O Дигидрат хлорида олова(II)
КТ Комнатная температура
TFA Трифторуксусная кислота
THF Тетрагидрофуран
TosMIC р-толуолсульфонилметил изоцианид
Ксантфос 4,5-Бис(дифенилфосфино)-9,9-диметилксантен
А.1. Соединение 001
Метод синтеза соединения 001
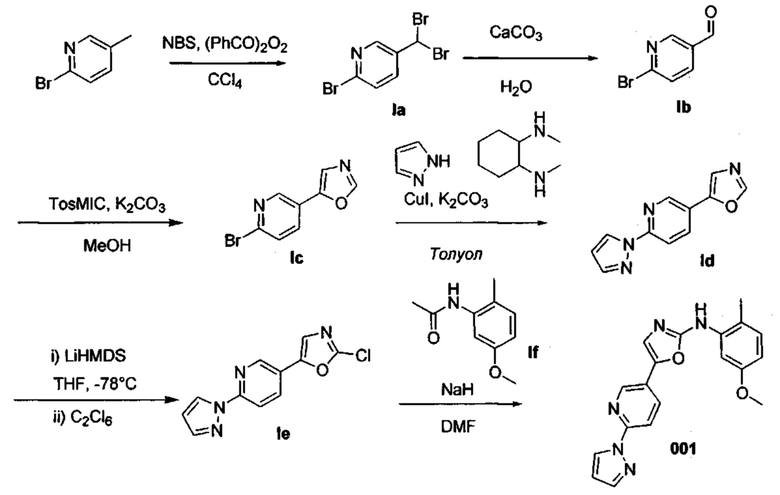
1. Получение 2-бром-5-(дибромметил)пиридина (Ia)
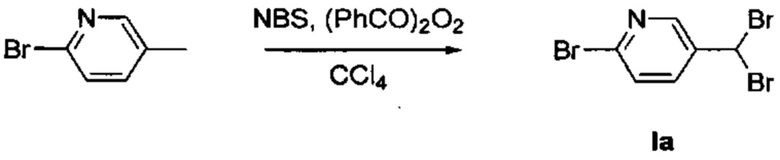
2. Добавили N-бромсукцинимид (6,829 г, 38,36 ммоль) и бензоилпероксид (506 мг, 2,09 ммоль) в раствор 2-бром-5-метилпиридина (3,000 г, 17,44 ммоль) в CCl4 (30 мл). Перемешивали реакционную смесь при 90°С в течение 16 часов в условиях темноты. Охладили реакционную смесь и добавили РЕ. Отфильтровали полученное твердое вещество и промыли большим количеством РЕ. Испарили досуха охлажденную смесь, разбавили водой и экстрагировали с помощью EtOAc. Высушили объединенные органические вещества над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 10% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Ia (4,6 г, 80%). 1Н ЯМР (500 МГц, CDCl3) δ 8,46 (d, J=2,6 Гц, 1Н), 7,87 (dd, J=8,4, 2,7 Гц, 1Н), 7,55 (d, J=8,4 Гц, 1H), 6,61 (s, 1H).
Получение 6-бромникотинальдегида (Ib)
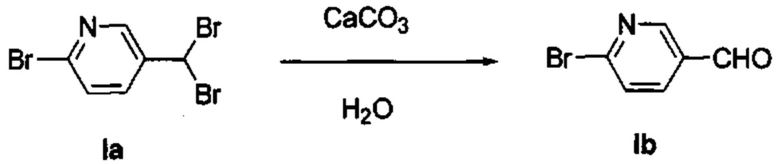
В течение 16 часов перемешивали раствор промежуточного соединения Ia (3,650 г, 11,07 ммоль), карбоната кальци (2,437 г, 24,35 ммоль) в воде (80 мл) при 105°С. Разбавили охлажденную смесь водой и дважды экстрагировали EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали, испарили и получили промежуточное соединение Ib (1,890 г, 92%). 1H ЯМР (500 МГц, CDCl3) δ 10,05 (s, 1Н), 8,78 (d, J=2,2 Гц, 1H), 7,98 (dd, J=8,2, 2,4 Гц, 1H), 7,65 (d, J=8,2 Гц, 1H).
Получение 5-(6-бромпиридин-3-ил)оксазола (Ic)
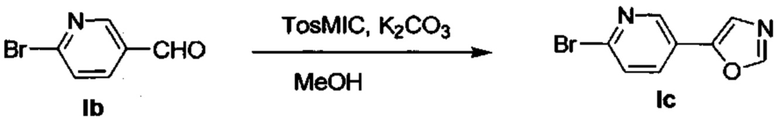
Добавили K2CO3 (3,567 г, 25,80 ммоль) и TosMIC (2,015 г, 10,32 ммоль) в раствор промежуточного соединения 1,6 г (8,60 ммоль) в МеОН (35 мл). В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Испарили досуха охлажденную смесь, разбавили водой и дважды экстрагировали EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Ic (1,371 г, 71%). 1Н ЯМР (500 МГц, CDCl3) δ 8,68 (d, J=2,4 Гц, 1Н), 7,98 (s, 1H), 7,78 (dd, J=8,3, 2,5 Гц, 1H), 7,56 (d, J=8,3 Гц, 1H), 7,46 (s, 1H).
Получение 5-(6-(1Н-пиразол-1-ил)пиридин-3-ил)оксазола (Id)
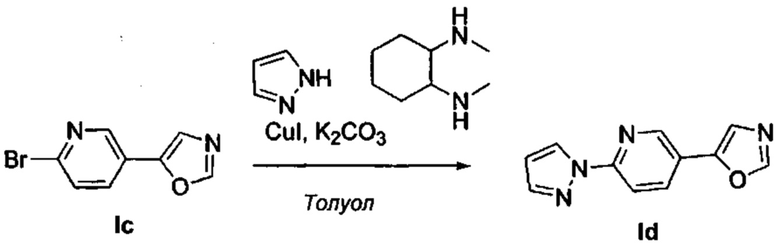
Последовательно добавили пиразол (454 мг, 6,66 ммоль), карбонат калия (1,288 г, 8,88 ммоль), рац-транс-N,N'-диметилциклогексан-1,2-диамин (137 мкл, 0,89 ммоль) и йодид меди (42 мг, 0,22 ммоль) в герметичную пробирку с раствором промежуточного соединения Ic (1,000 г, 4,44 ммоль) в сухом толуоле (6 мл). Перемешивали реакционную смесь при 110°С в течение 3 дней. Разбавили охлажденную смесь водой и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Id (817 мг, 87%). 1Н ЯМР (300 МГц, DMSO-d6) δ 8,85 (d, J=2,3 Гц, 1Н), 8,65 (dd, J=2,6, 0,5 Гц, 1H), 8,55 (s, 1H), 8,31 (dd, J=8,6, 2,3 Гц, 1H), 8,02 (dd, J=8,6, 0,7 Гц, 1H), 7,87 (d, J=1,6 Гц, 1H), 7,84 (s, 1H), 6,61 (dd, J=2,6, 1,7 Гц, 1H).
Получение 5-(6-(1Н-пиразол-1-ил)пиридин-3-ил)-2-хлороксазола (Ie)
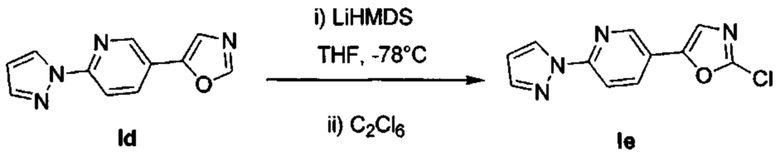
В течение 10 мин по каплям добавили раствор LiHMДC в сухом THF (4,23 мл, 4,23 ммоль) при температуре -78°С в перемешиваемый раствор промежуточного соединения Id (817 мг, 3,85 ммоль) в сухом THF (26 мл). В течение 30 минут перемешивали реакционную смесь при -78°С. Затем добавили C2Cl6 (1,094 г, 4,62 ммоль), и в течение 16 часов перемешивали реакционную смесь при комнатной температуре. Разбавили смесь водой и дважды экстрагировали с помощью ЕtOAс. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Ie (736 мг, 78%). 1H ЯМР (300 МГц, DMSO-d6) δ 8,81 (d, J=2,2 Гц, 1Н), 8,65 (d, J=2,6 Гц, 1H), 8,27 (dd, J=8,6, 2,3 Гц, 1H), 8,02 (d, J=8,7 Гц, 1H), 7,92 (s, 1H), 7,87 (d, J=0,8 Гц, 1H), 6,72-6,55 (m, 1H).
Получение N-(5-метокси-2-метилфенил)ацетамида (If)
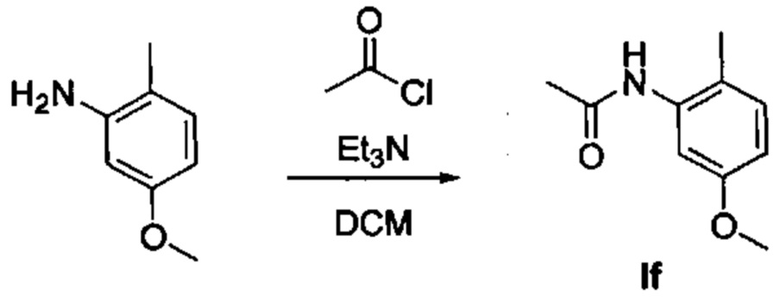
По каплям последовательно добавили Et3N (12,2 мл, 87,48 ммоль) и ацетилхлорид (4,2 мл, 58,32 ммоль) при 0°С в раствор 5-метокси-2-метилфениламина (4000 г, 29,16 ммоль) в сухом DCM (60 мл). В течение 2 часов перемешивали реакционную смесь при комнатной температуре. Разбавили смесь водой и дважды экстрагировали с помощью DCM. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием от 40 до 60% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение If (4,952 г, 95%). 1Н ЯМР (300 МГц, CDCl3) δ 7,49 (d, J=2,2 Гц, 1Н), 7,05 (d, J=8,4 Гц, 2H), 6,63 (dd, J=8,3, 2,3 Гц, 1H), 3,77 (s, 3H), 2,18 (s, 3H), 2,17 (s, 3H).
Получение 5-(6-(1Н-пиразол-1-ил)пиридин-3-ил)-N-(5-метокси-2-метилфенил)оксазол-2-амина (001)
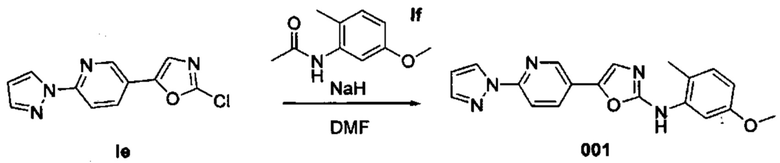
По каплям добавили раствор промежуточного соединения If (363 мг, 2,03 ммоль) в сухом DMF (5 мл) при 0°С в раствор 60% дисперсии гидрида натрия в минеральном масле (162 мг, 4,06 ммоль) в сухом DMF (5 мл). В течение 1 часа перемешивали реакционную смесь при комнатной температуре, и по каплям добавили раствор промежуточного соединения Ie (500 мг, 2,03 ммоль) в сухом DMF (5 мл) при 0°С. В течение 3 часов перемешивали реакционную смесь при 0°С.Разбавили смесь водой, и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества насыщенным раствором NaHCCb (3 раза), водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием от 10 до 30% EtOAc/циклогексана в качестве элюента, и получили соединение 001 (480 мг, 68%).
1Н ЯМР (300 МГц, DMSO-d6) δ 9,38 (s, 1Н), 8,68 (d, J=2,1 Гц, 1H), 8,62 (d, J=2,4 Гц, 1H), 8,12 (dd, J=8,6, 2,3 Гц, 1H), 7,99 (d, J=8,6 Гц, 1H), 7,84 (s, 1H), 7,59 (s, 2H), 7,09 (d, J=8,3 Гц, 1H), 6,66-6,51 (m, 2H), 3,73 (s, 3H), 2,23 (s, 3H).
3. A.2. Соединение 002
Метод синтеза соединения 002
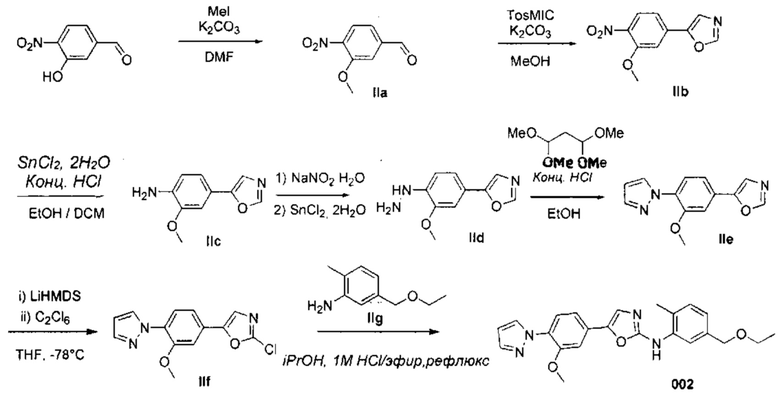
Получение 3-метокси-4-нитробензальдегида (IIa)
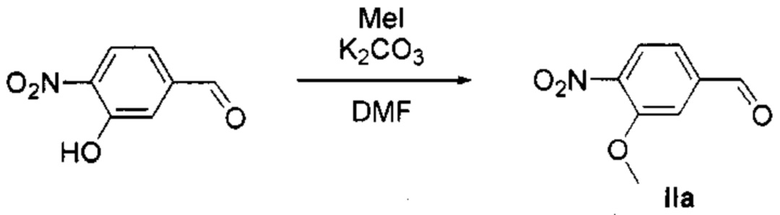
Добавили K2CO3 (1,687 г, 12,22 ммоль) и йодметан (1,52 мл, 24,44 ммоль) в раствор 3-гидрокси-4-нитробензальдегида (2,000 г, 11,98 ммоль) в DMF (24 мл). В течение 4 часов перемешивали реакционную смесь при комнатной температуре. Разбавили смесь водой и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества насыщенным раствором NaHCO3 (3 раза), водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали, испарили и получили промежуточное соединение IIa (2,137 г, 98%). 1Н ЯМР (500 МГц, CDCl3) δ 10,06 (s, 1Н), 7,93 (d, J=8,1 Гц, 1H), 7,60 (s, 1H), 7,54 (dd, J=8,1, 1,4 Гц, 1H), 4,04 (s, 3H).
Получение 5-(3-метокси-4-нитрофенил)оксазола (IIb)
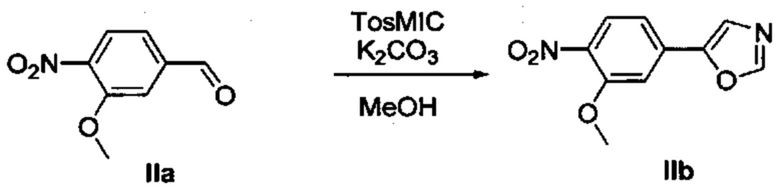
Использовали описанный выше способ получения промежуточного соединения Ic, и получили из промежуточного соединения IIa промежуточное соединение IIb (2,708 г, 100%). 1Н ЯМР (500 МГц, CDCl3) δ 8,00 (s, 1Н), 7,95 (d, J=8,4 Гц, 1H), 7,52 (s, 1H), 7,35 (d, J=1,5 Гц, 1H), 7,31 (dd, J=8,4, 1,7 Гц, 1H), 4,05 (s, 3H).
Получение 2 тметокси-4-(оксазол-5-ил)анилина (IIc)
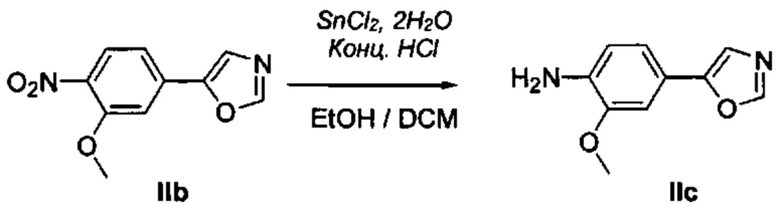
Добавили SnCl2⋅2H2O (13,875 г, 61,50 ммоль) и концентрированную HCl (10 мл) в раствор промежуточного соединения (2,708 г, 12,30 ммоль) в EtOH/DCM (104/46 мл). В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Добавили воду и добавляли водный раствор NaOH (2,5 М) до получения основного рН. Дважды экстрагировали неочищенный продукт с помощью DCM. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-40% EtOAc/циклогексана в качестве элюента, и получили промежуточный продукт IIc (1,972 г, 84%). 1Н ЯМР (500 МГц, DMSO-d6) δ 8,26 (s, 1Н), 7,37 (s, 1H), 7,10 (d, J=1,8 Гц, 1H), 7,06 (dd, J=8,0,1,8 Гц, 1H), 6,68 (d, J=8,1 Гц, 1H), 5,07 (s, 2H), 3,83 (s, 3H).
Получение 5-(4-гидразинил-3-метоксифенил) оксазола (IId)
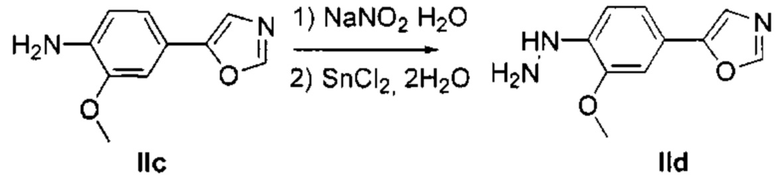
По каплям добавили раствор NaNO2 (787 мг, 11,47 ммоль) в воде (10 мл) при 0°С в суспензию промежуточного соединения IIc (1,972 г, 10,37 ммоль) в HCl 6N (25 мл). Перемешивали реакционную смесь при 0°С в течение 15 мин. Затем добавили SnCl2⋅2H2O (6,778 г, 30,07 ммоль) и в течение 2 часов перемешивали реакционную смесь при 0°С. Добавили раствор NaOH 2,5N до получения основного рН, и дважды экстрагировали неочищенный продукт с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали, испарили и получили промежуточное соединение I1d (1,834 г, 86%). 1Н ЯМР (500 МГц, DMSO-d6) δ 8,27 (s, 1Н), 7,41 (s, 1H), 7,20 (dd, J=8,2, 1,7 Гц, 1H), 7,10 (d, J=1,7 Гц, 1H), 7,05 (d, J=8,2 Гц, 1H), 6,29 (s, 1H), 4,05 (s, 2H), 3,31 (s, 3H).
Получение 5-(3-метокси-4-(1Н-пиразол-1-ил)фенил)оксазола (IIe)
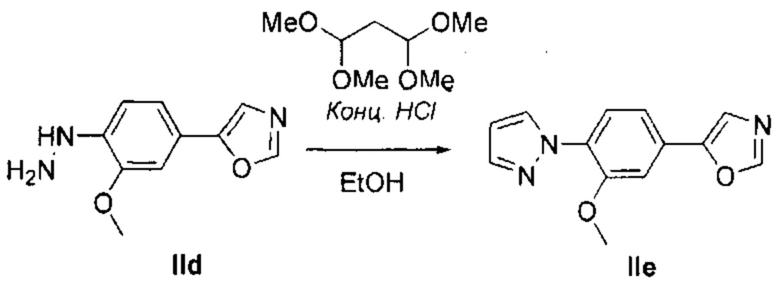
Добавили бис(диметилацеталь)малональдегид (1,63 мл, 9,84 ммоль) и концентрированную HCl (1 мл) в суспензию промежуточного соединения IId (1,834 г, 8,94 ммоль) в EtOH (30 мл). В течение 2 часов перемешивали реакционную смесь при 70°С. Испарили досуха охлажденную смесь, разбавили насыщенным раствором NaHCO3 и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение IIe (1,380 г, 64%). 1Н ЯМР (500 МГц, CDCl3) δ 8,12 (d, J=2,1 Гц, 1Н), 7,94 (s, 1H), 7,85 (d, J=8,3 Гц, 1H), 7,72 (d, J=1,4 Гц, 1H), 7,40 (s, 1H), 7,36 (dd, J=8,3, 1,8 Гц, 1H), 7,32 (d, J=1,7 Гц, 1H), 6,46-6,43 (m, 1H), 3,97 (s, 3H).
Получение 2-хлор-5-(3-метокси-4-(1Н-пиразол-1-ил)фенил)оксазола (IIf)
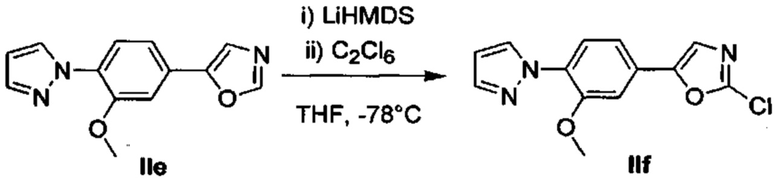
Использовали описанный выше способ получения промежуточного соединения IIe из промежуточного соединения Ie с последующей хроматографией на силикагеле с использованием 0-20% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение IIf (1,380 г, 88%). 1Н ЯМР (500 МГц, CDCl3) δ 8,13 (d, J=2,5 Гц, 1Н), 7,86 (d, J=8,3 Гц, 1H), 7,72 (d, J=1,6 Гц, 1H), 7,33 (s, 1H), 7,30 (dd, J=8,3, 1,8 Гц, 1H), 7,24 (d, J=1,7 Гц, 1H), 6,48-6,42 (m, 1H), 3,98 (s, 3H).
Получение N-(5-(этоксиметил)-2-метилфенил)-5-(3-метокси-4-(1H-пиразол-1-ил)фенил)оксазол-2-амина (002)
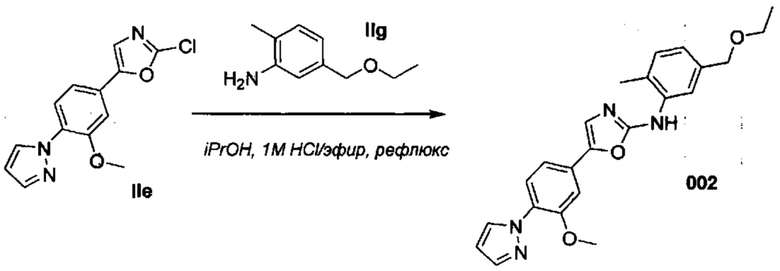
Добавили промежуточное соединение IIg (171 мг, 1,04 ммоль) и раствор HCl в эфире (220 мкл, 0,22 ммоль) в раствор промежуточного соединения IIe (300 мг, 1,09 ммоль) в сухом iPrOH (2 мл). Перемешивали реакционную смесь при 90°С в течение 16 часов. Испарили досуха охлажденную смесь, разбавили водой и дважды экстрагировали с помощью EtOAc. Высушили объединенные органические вещества над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-40% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение 002 (230 мг, 55%). 1Н ЯМР (500 МГц, DMSO-d6) δ 9,33 (s, 1Н), 8,20 (d, J=2,3 Гц, 1H), 7,85 (s, 1H), 7,74-7,66 (m, 2H), 7,55 (s, 1H), 7,39 (d, J=1,6 Гц, 1H), 7,29 (dd, J=8,3,1,7 Гц, 1H), 7,18 (d, J=7,7 Гц, 1H), 6,95 (dd, J=7,6,1,2 Гц, 1H), 6,52-6,45 (m, 1H), 4,43 (s, 2H), 3,95 (s, 3H), 3,49 (q, J=7,0 Гц, 2H), 2,30 (s, 3H), 1,16 (t, J=7,0 Гц, 3H).
Метод синтеза соединения (IIg)
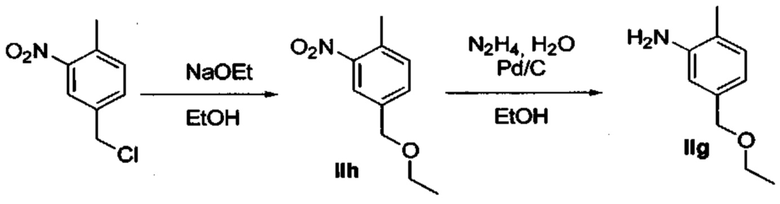
Получение 4-этоксиметил-1-метил-2-нитро-бензола (IIh)
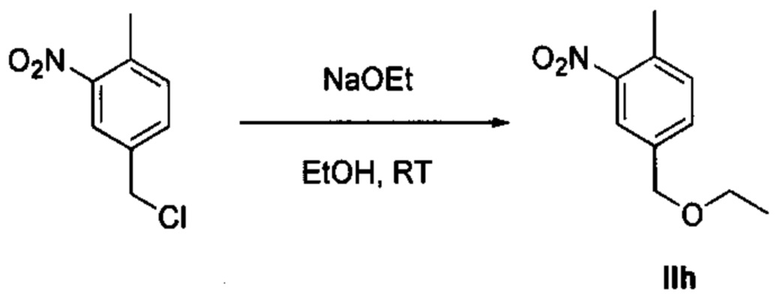
Добавили 4-хлорметил-1-метил-2-нитробензол (15000 г, 82,14 ммоль) в раствор этилата натрия (75 мл, 246,42 ммоль) в сухом этаноле. В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Добавили воду и удалили этанол при пониженном давлении. Дважды экстрагировали неочищенный продукт с помощью DCM. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение IIh (15,364 г, 96%). 1Н ЯМР (300 МГц, CDCl3) δ 7,95 (d, J=1,0 Гц, 1Н), 7,48 (dd, J=7,8, 1,5 Гц, 1H), 7,31 (d, J=7,9 Гц, 1H), 4,52 (s, 2H), 3,56 (q, J=7,0 Гц, 2H), 2,58 (s, 3H), 1,26 (t, J=7,0 Гц, 3H).
Получение 5-этоксиметил-2-метилфениламина (IIg)
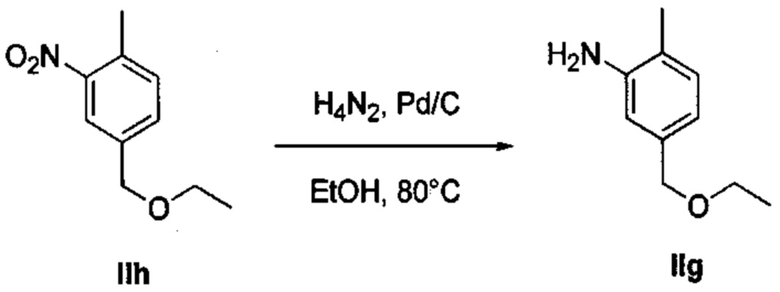
По каплям последовательно добавили Pd/C (5,405 г, 0,33% по весу) и гидразин моногидрат (10,7 мл, 212,49 ммоль) при 0°С в раствор промежуточного соединения IIh (15,364 г, 78,70 ммоль) в этаноле (500 мл). В течение 2 часов перемешивали реакционную смесь при 80°С. Затем профильтровали горячую смесь через слой целита® и промыли этанолом. Концентрировали фильтрат, и получили промежуточное соединение IIg (13,779 г, 100%). 1Н ЯМР (500 МГц, CDCl3) δ 7,01 (d, J=7,4 Гц, 1Н), 6,68 (s, 1H), 6,67 (d, J=7,6 Гц, 1H), 4,41 (s, 2H), 3,59 (s, 2H), 3,51 (q, J=7,0 Гц, 2H), 2,15 (s, 3H), 1,23 (t, J=7,0 Гц, 3H).
4. А.3. Соединение 003
Метод синтеза соединения 003
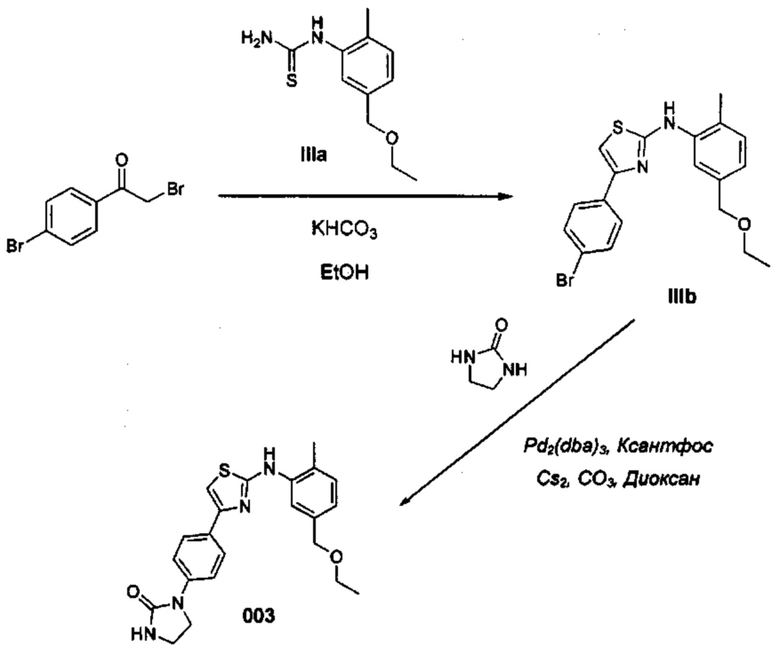
Получение 1-(5-(этоксиметил)-2-метилфенил)тиомочевины (IIIa)
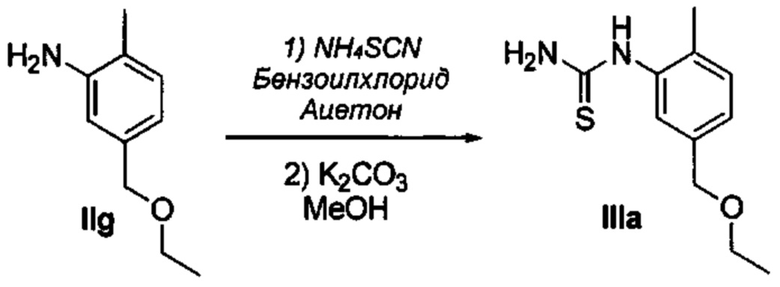
По каплям добавили при комнатной температуре раствор бензоилхлорида (3,5 мл, 30,26 ммоль) в раствор тиоцианата калия (2,534 г, 33,29 ммоль) в ацетоне (35 мл). В течение 15 минут перемешивали реакционную смесь при 50°С. Затем добавили раствор промежуточного соединения IIg (5000 г, 30,26 ммоль) в ацетоне (15 мл), и перемешивали реакционную смесь при 50°С в течение 15 минут. Добавили воду, и профильтровали твердое вещество, промыли большим количеством воды и эфира, и получили белое твердое вещество. В течение 3 часов перемешивали его раствор с карбонатом калия (7,946 г, 57,49 ммоль) в МеОН (27 мл) при комнатной температуре. Удалили метанол при пониженном давлении, промыли твердое вещество водой и эфиром, и получили промежуточное соединение IIIa (5,800 г, 78%). 1Н ЯМР (500 МГц, DMSO-d6) δ 9,20 (s, 1Н), 7,21 (d, J=7,7 Гц, 1H), 7,14 (s, 1H), 7,10 (d, J=7,7 Гц, 1H), 4,40 (s, 2H), 3,47 (q, J=7,0 Гц, 2H), 2,17 (s, 3H), 1,14 (t, J=7,0 Гц, 3H).
Получение 4-(4-бромфенил)-N-(5-(этоксиметил)-2-метилфенил)тиазол-2-амина (IIIb)
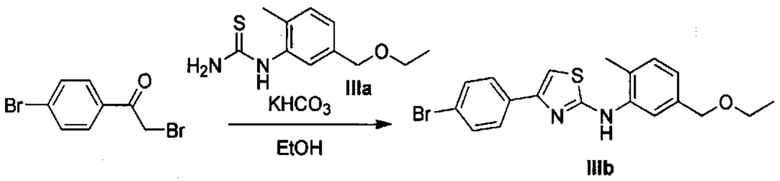
Добавили промежуточное соединение IIIa (1,211 г, 5,39 ммоль) и гидрокарбонат калия (1621 г, 16,02 ммоль) в раствор 2,4'-дибромацетофенона (1,500 г, 5,39 ммоль) в EtOH (54 мл). В течение 16 часов перемешивали реакционную смесь при 80°С. Испарили досуха охлажденную смесь, разбавили водой и дважды экстрагировали с помощью EtOAc. Высушили объединенные органические вещества над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение IIIb (2,000 г, 92%). 1H ЯМР (500 МГц, DMSO-d6) δ 9,37 (s, 1Н), 8,01 (s, 1H), 7,82 (d, J=8,6 Гц, 2H), 7,58 (d, J=8,6 Гц, 2H), 7,35 (s, 1H), 7,18 (d, J=7,7 Гц, 1H), 6,95 (d, J=7,7 Гц, 1H), 4,44 (s, 2H), 3,50 (q, J=7,0 Гц, 2H), 2,27 (s, 3H), 1,16 (t, J=7,0 Гц, 3H).
Получение 1-{4-[2-(5-этоксиметил-2-метилфениламино)-тиазол-4-ил]-фенил}-имидазолидин-2-она (003)
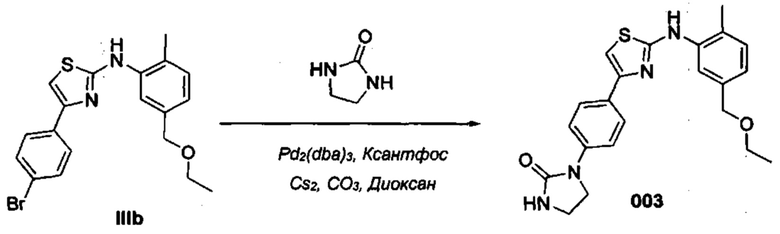
Последовательно добавили 2-имидазолидинон (556 мг, 6,45 ммоль), карбонат цезия (1,052 г, 3,23 ммоль), Ксантфос (75 мг, 0,13 ммоль) в герметичную пробирку с раствором соединения IIIb (500 мг, 1,29 ммоль) в сухом диоксане (7 мл). В течение 20 минут дегазировали реакционную смесь азотом перед добавлением Pd2(dba)3 (35 мг, 0,04 ммоль). Затем в течение 16 часов перемешивали реакционную смесь при 110°С. Разбавили охлажденную смесь водой и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 60-90% EtOAc/циклогексан в качестве элюента, и получили промежуточное соединение 003 (260 мг, 52%). 1Н ЯМР (500 МГц, DMSO-d6) δ 9,29 (s, 1H), 8,05 (s, 1H), 7,81 (d, J=8,8 Гц, 2H), 7,58 (d, J=8,9 Гц, 2H), 7,18 (d, J=7,7 Гц, 1H), 7,12 (s, 1H), 6,96 (s, 1H), 6,93 (d, J=7,7 Гц, 1H), 4,44 (s, 2H), 3,91-3,83 (m, 2H), 3,50 (q, J=7,0 Гц, 2H), 3,45-3,37 (m, 2H), 2,27 (s, 3H), 1,17 (t, J=7,0 Гц, 3H).
5. A.4. Соединение 004
Метод синтеза соединения 004
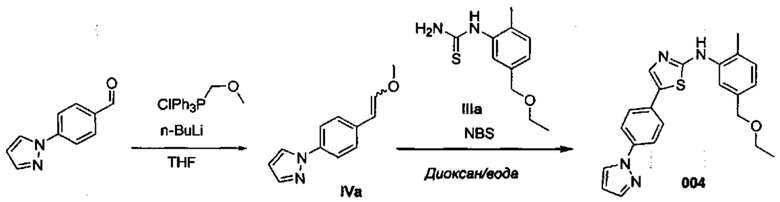
Получение (Е/Z)-1-(4-(2-метоксивинил)фенил)-1Н-пиразола (IVa)
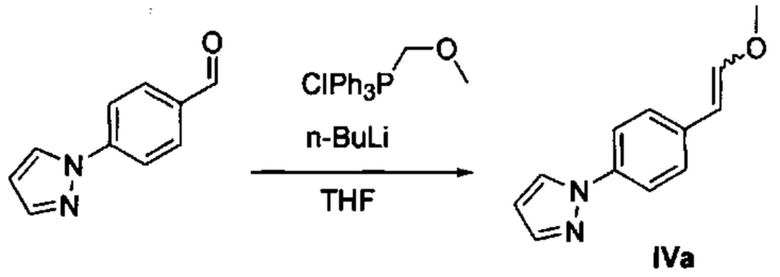
По каплям добавили раствор n-BuLi в сухом THF (4,7 мл, 11,62 ммоль) при 0°С в раствор (метоксиметил) трифосфонийхлорида (5,93 г, 17,43 ммоль) в сухом THF (40 мл). В течение 1 часа перемешивали реакционную смесь при комнатной температуре. Затем по каплям добавили раствор 4-(1Н-пиразол-1-ил)бензальдегида (1,000 г, 5,81 ммоль) в сухом THF (20 мл) при 0°С. В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Разбавили охлажденную смесь насыщенным раствором NH4Cl и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-20% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение (E/Z) 50/50 IVa (758 мг, 65%). 1Н ЯМР (500 МГц, CDCl3) δ 7,90 (d, J=2,4 Гц, 1Н), 7,88 (d, J=2,4 Гц, 1Н), 7,71 (s, 2Н), 7,65 (d, J=8,8 Гц, 2Н), 7,62-7,56 (m, 4Н), 7,30 (d, J=8,5 Гц, 2Н), 7,07 (d, J=13,0 Гц, 1Н), 6,47-6,43 (m, 2Н), 6,17 (d, J=7,0 Гц, 1Н), 5,83 (d, J=13,0 Гц, 1Н), 5,24 (d, J=7,0 Гц, 1Н), 3,80 (s, 3Н), 3,70 (s, 3Н).
Получение 5-(4-(1Н-пиразол-1-ил)фенил)-N-(5-(этоксиметил)-2-метилфенил) тиазол-2-амина (004)
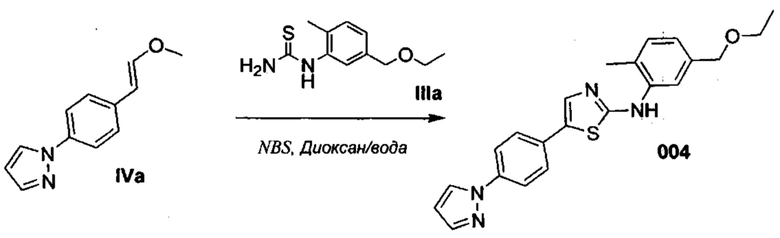
Добавили N-бромсукцинимид (196 мг, 1,10 ммоль) в раствор промежуточного соединения IVa (200 мг, 1,00 ммоль) в диоксане/воде (1/1 мл). В течение 1 часа перемешивали реакционную смесь при комнатной температуре. Затем добавили промежуточное соединение IIIa (224 мг, 1,00 ммоль), и в течение 16 часов перемешивали реакционную смесь при 80°С. Разбавили охлажденную смесь насыщенным раствором NH4Cl и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение 004 (270 мг, 69%). 1Н ЯМР (500 МГц, DMSO-d6) δ 9,42 (s, 1Н), 8,50 (d, J=2,4 Гц, 1H), 7,83 (d, J=8,7 Гц, 2H), 7,79 (s, 1H), 7,75 (d, J=1,6 Гц, 1H), 7,67 (s, 1H), 7,60 (d, J=8,7 Гц, 2H), 7,20 (d, J=7,7 Гц, 1H), 6,98 (d, J=7,7 Гц, 1H), 6,60-6,52 (m, 1H), 4,42 (s, 2H), 3,48 (q, J=7,0 Гц, 2H), 2,27 (s, 3H), 1,15 (t, J=7,0 Гц, 3H).
6. A.5. Соединение 005:
Метод синтеза соединения 005
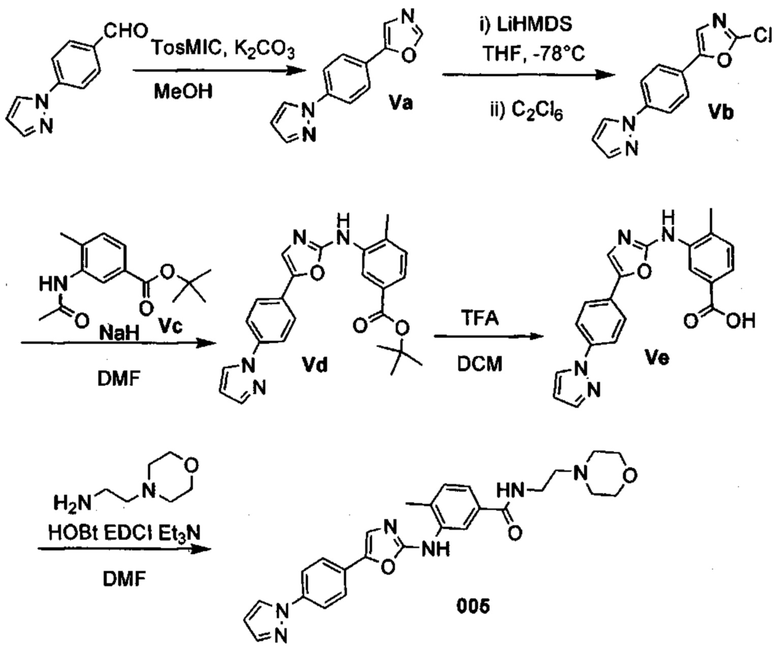
Получение 5-(4-(1Н-пиразол-1-ил)фенил)оксазола (Va)
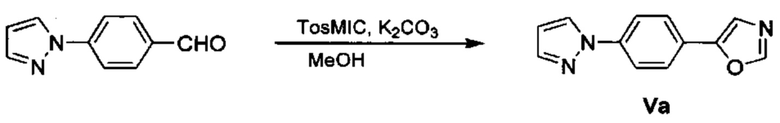
Использовали способ получения промежуточного соединения Ic из 4-(1Н-пиразол-1-ил)бензальдегида с последующей хроматографией на силикагеле с использованием 40% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Va (23,637 г, 96%). 1Н ЯМР (500 МГц, CDCl3) δ 7,97 (d, J=2,5 Гц, 1Н), 7,93 (s, 1H), 7,78 (d, J=8,9 Гц, 2H), 7,76-7,72 (m, 3H), 7,38 (s, 1H), 7,26 (s, 1H), 6,54-6,47 (m, 1H).
Получение 5-(4-(1 Н-пиразол-1-ил)фенил)-2-хлороксазола (Vb)
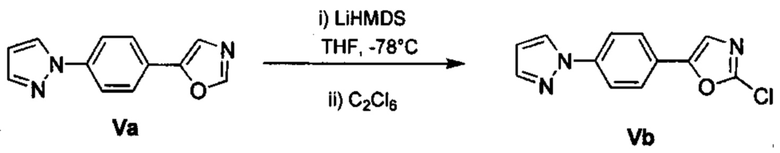
Использовали описанный выше способ получения промежуточного соединения Ie из промежуточного соединения Va с последующей хроматографией на силикагеле с использованием 30% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Vb (7 г, 100%). 1Н ЯМР (500 МГц, CDC3) δ 7,97 (d, J=2,5 Гц, 1Н), 7,78 (d, J=8,9 Гц, 2Н), 7,75 (d, J=1,5 Гц, 1Н), 7,68 (d, J=8,8 Гц, 2Н), 7,31 (s, 1Н), 6,53-6,46 (m, 1Н).
Метод синтеза соединения (Vc)
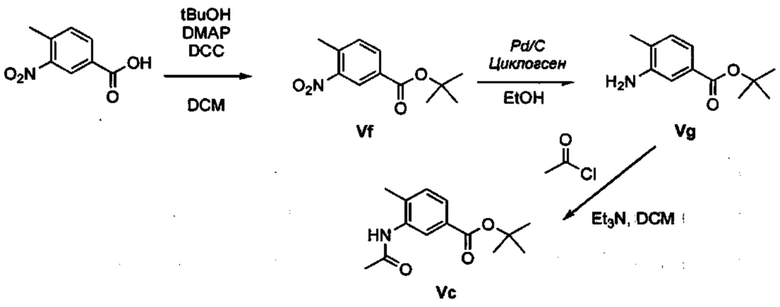
Получение трет-бутил-4-метил-3-нитробензоата (Vf)
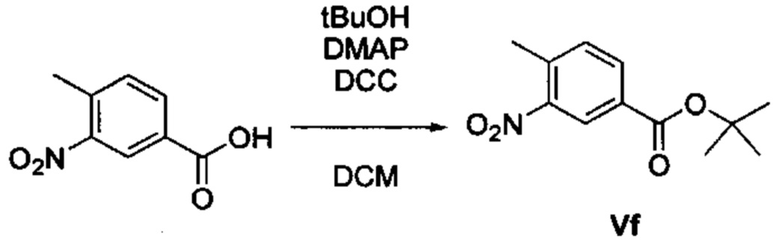
Последовательно добавили DMAP (404 мг, 3,312 ммоль), t-BuOH (2,946 г, 27602 ммоль) и DCC (8,200 г, 27,602 ммоль) при 0°С в раствор 4-метил-3-нитробензойной кислоты (6000 г, 33,12 ммоль) в сухом DCM. В течение 48 часов перемешивали реакционную смесь при комнатной температуре. Затем отфильтровали реакционную смесь, промыли дополнительным количеством DCM, и концентрировали фильтрат. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-20% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Vf (6,793 г, 86%). 1Н ЯМР (300 МГц, CDCl3) δ 8,51 (d, J=1,6 Гц, 1Н), 8,08 (dd, J=8,0, 1,7 Гц, 1Н), 7,40 (d, J=8,0 Гц, 1Н), 2,64 (s, 3Н), 1,60 (s, 9Н).
Получение трет-бутил-3-амино-4-метилбензоата (Vg)
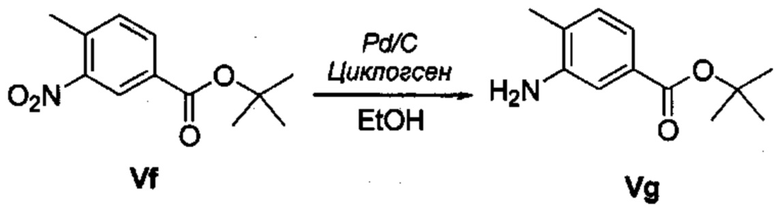
Добавили Pd/C (1,200 г) и циклогексен (60 мл) в дегазированный азотом раствор промежуточного соединения Vf (6,793 г, 28,64 ммоль) в EtOH (60 мл). В течение 16 часов перемешивали реакционную смесь при 80°С. Отфильтровали реакционную смесь на подушке из Celite®, промыли дополнительным количеством EtOH, концентрировали фильтрат, и получили промежуточное соединение Vg (6,200 г, 100%).
1H ЯМР (300 МГц, CDCl3) δ 7,32 (d, J=7,8 Гц, 1H), 7,29 (s, 1Н), 7,07 (d, J=7,8 Гц, 1Н), 3,68 (s, 2Н), 2,20 (s, 3Н), 1,57 (s, 9Н).
Получение трет-бутил 3-ацетамидо-4-метилбензоата (Vc)
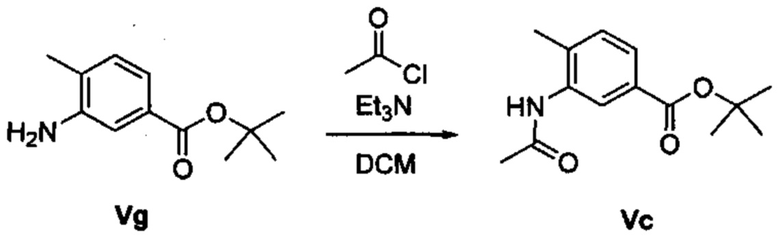
Использовали описанный выше способ получения промежуточного соединения If из промежуточного соединения Vg с последующей очисткой методом хроматографии на силикагеле с использованием 25-40% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Vc (6,296 г, 84%). 1Н ЯМР (300 МГц, CDCl3) δ 8,17 (s, 1Н), 7,71 (d, J=7,7 Гц, 1H), 7,21 (d, J=8,0 Гц, 2H), 2,27 (s, 3H), 2,19 (s, 3H), 1,57 (s, 9H).
Получение трет-бутил 3-(5-(4-(1Н-пиразол-1-ил)фенил)оксазол-2-иламино)-4-метилбензоата (Vd)
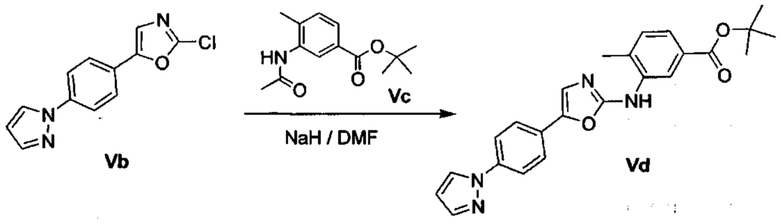
Использовали описанный выше способ получения соединения 001 из промежуточных соединений Vb и Vc с последующей очисткой методом хроматографии на силикагеле с использованием 10-40% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение Vf (1,100 г, 65%). 1Н ЯМР (300 МГц, DMSO-d6) δ 9,47 (s, 1Н), 8,54 (d, J=2,3 Гц, 1H), 8,51 (d, J=1,5 Гц, 1H), 7,92 (d, J=8,8 Гц, 2H), 7,76 (d, J=1,5 Гц, 1H), 7,70 (d, J=8,8 Гц, 2H), 7,53 (d, J=1,6 Гц, 1H), 7,50 (s, 1H), 7,32 (d, J=7,9 Гц, 1H), 6,59-6,52 (m, 1H), 2,36 (s, 3H), 1,54 (s, 9H).
Получение 3-(5-(4-(1Н-пиразол-1-ил)фенил)оксазол-2-иламино)-4-метилбензойной кислоты (Ve)
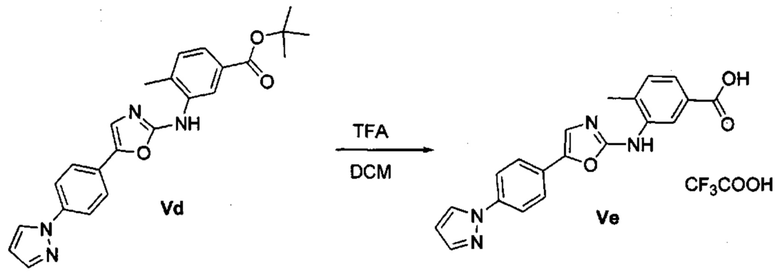
По каплям добавили TFA (2,7 мл) в раствор промежуточного соединения Vd (1,00 г, 2,64 ммоль) в DCM (13 мл). В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Концентрировали реакционную смесь, растерли твердое вещество в порошок в Et2O, отфильтровали, и получили промежуточное соединение Ve (1,200 г, 96%). 1Н ЯМР (300 МГц, DMSO-d6) δ 9,55 (s, 1Н), 8,57 (d, J=1,3 Гц, 1H), 8,54 (d, J=2,4 Гц, 1H), 7,93 (d, J=8,7 Гц, 2H), 7,76 (d, J=1,6 Гц, 1H), 7,71 (d, J=8,7 Гц, 2H), 7,57 (dd, J=7,8, 1,5 Гц, 1H), 7,53 (s, 1H), 7,33 (d, J=7,9 Гц, 1H), 6,62-6,48 (m, 1H), 2,37 (s, 3H).
Получение 3-(5-(4-(1Н-пиразол-1-ил)фенил)оксазол-2-иламино)-4-метил-N-(2-морфолиноэтил)бензамида (005)
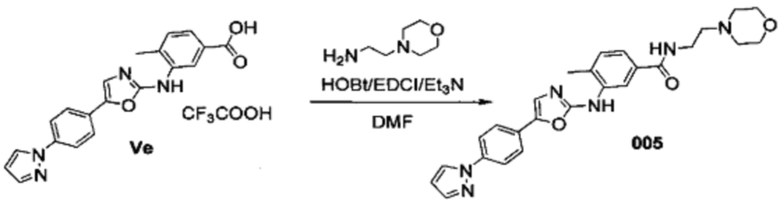
Последовательно добавили HOBt (83 мг, 0,61 ммоль), EDCI (159 мг, 0,83 ммоль), Et3N (464 мкг, 6,32 ммоль) и 2-морфолиноэтанамин (72 мкл, 0,55 ммоль) в раствор промежуточного соединения Ve (200 мг, 0,42 ммоль) в сухом DMF (2 мл). В течение 16 часов перемешивали реакционную смесь при комнатной температуре. Разбавили смесь водой и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества насыщенным раствором NaHCO3 (3 раза) водой с насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 0-20% MeOH/EtOAc в качестве элюента, и получили соединение 005 (165 мг, 83%). 1Н ЯМР (300 МГц, DMSO-d6) δ 9,41 (s, 1Н), 8,54 (d, J=2,4 Гц, 1H), 8,32 (s, 1H), 8,29 (d, J=5,7 Гц, 1H), 7,92 (d, J=8,8 Гц, 2H), 7,76 (d, J=1,6 Гц, 1H), 7,69 (d, J=8,7 Гц, 2H), 7,47 (s, 1H), 7,45 (dd, J=7,9, 1,7 Гц, 1H), 7,28 (d, J=7,9 Гц, 1H), 6,59-6,53 (m, 1H), 3,61-3,52 (m, 4H), 3,42-3,33 (m, 2H), 2,47 (m, 2H), 2,42 (m, 4H), 2,34 (s, 3H).
7. A.6. Соединение 006
Метод синтеза соединения 006
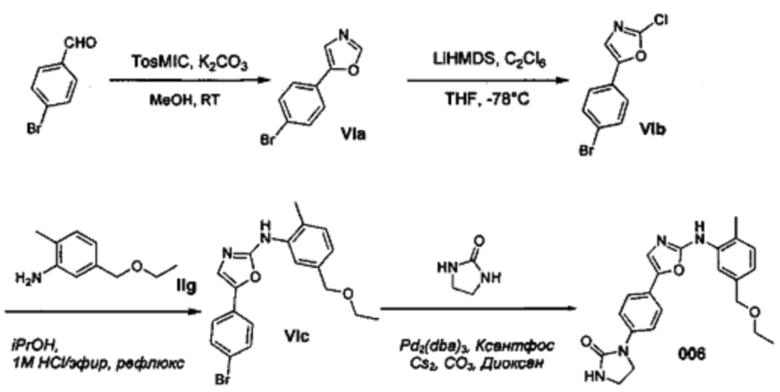
Получение 5-(4-бромфенил)оксазола (VIa)
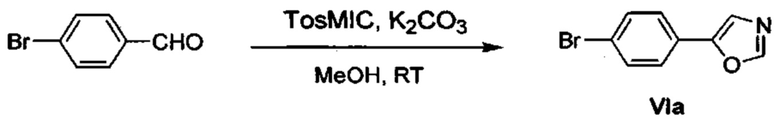
Использовали описанный выше способ получения промежуточного соединения Ic из 4-бромбензилальдегида, и получили промежуточное соединение VIa (15,000 г, 95%). 1Н ЯМР (300 МГц, CDCl3) δ 7,92 (s, 1Н), 7,56 (d, J=8,8 Гц, 2H), 7,51 (d, J=8,8 Гц, 2H), 7,36 (s, 1H).
Получение 5-(4-бромфенил)-2-хлороксазола (VIb)
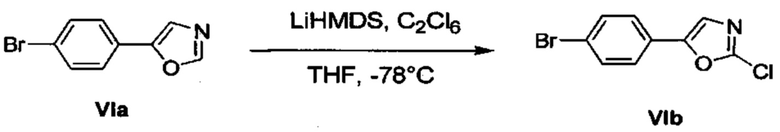
Использовали описанный выше способ получения промежуточного соединения Ie из промежуточного соединения VIa с последующей хроматографией на силикагеле с использованием 5% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение VIb (9,000 г, 98%). 1Н ЯМР (300 МГц, CDCl3) δ 7,57 (d, J=8,6 Гц, 2Н), 7,46 (d, J=8,6 Гц, 2Н), 7,29 (s, 1Н).
Получение 5-(4-бромфенил)-N-(5-(этоксиметал)-2-метилфенил)оксазол-2-амина (VIc)
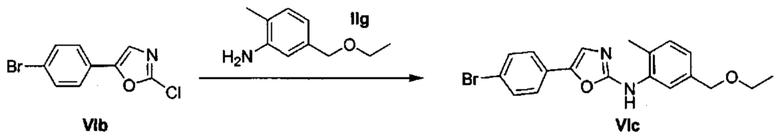
Использовали описанный выше способ получения соединения 002 из промежуточных соединений VIb и IIg с последующей хроматографией на силикагеле с использованием 0-20% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение VIc (4,234 г, 68%). 1H ЯМР (300 МГц, DMSO-d6) δ 9,32 (s, 1H), 7,79 (s, 1H), 7,61 (d, J=8,6 Гц, 2H), 7,50 (d, J=9,9 Гц, 3Н), 7,16 (d, J=7,7 Гц, 1H), 6,93 (d, J=7,6 Гц, 1H), 4,40 (s, 2H), 3,47 (q, J=7,0 Гц, 2H), 2,27 (s, 3H), 1,14 (t, J=7.0 Гц, 3Н).
Получение 1-{4-[2-(5-этоксиметил-2-метилфениламино)-оксазол-5-ил]-фенил}-имидазолидин-2-она (006)
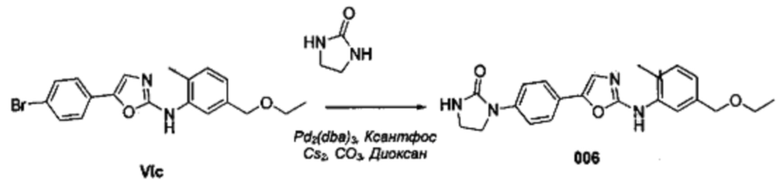
Последовательно добавили 2-имидазолидинон (556 мг, 6,45 ммоль), карбонат цезия (1,052 г, 3,23 ммоль), сантфос (75 мг, 0,13 ммоль) в герметичную пробирку с раствором промежуточного соединения VIc (500 мг, 1,29 ммоль) в сухом диоксане (7 мл). В течение 20 минут дегазировали реакционную смесь азотом перед добавлением Pd2(dba)3 (35 мг, 0,04 ммоль). Затем в течение 16 часов перемешивали реакционную смесь при 110°С. Разбавили охлажденную смесь водой и дважды экстрагировали с помощью EtOAc. Промыли объединенные органические вещества водой, насыщенным раствором NaCl, высушили над MgSO4, отфильтровали и испарили. Очистили конечный продукт методом хроматографии на силикагеле с использованием 10-50% EtOAc/циклогексана в качестве элюента, и получили промежуточное соединение 006 (260 мг, 52%). 1Н ЯМР (500 МГц, DMSO-d6) δ 9,16 (s, 1H), 7,84 (s, 1H), 7,63 (d, J=8,9 Гц, 2H), 7,52 (d, J=8,8 Гц, 2H), 7,28 (s, 1H), 7,16 (d, J=7,7 Гц, 1H), 7,00 (s, 1H), 6,93 (d, J=7,6 Гц, 1H), 4,42 (s, 2H), 3,91-3,85 (m, 2H), 3,48 (q, J=7,0 Гц, 2H), 3,45-3,38 (m, 2H), 2,28 (s, 3H), 1,15 (t, J=7,0 Гц, 3Н).
8. A.7. Соединения 007-064
Синтезировали соединения 007-050 из Таблицы согласно описанным способам и общим процедурам синтеза
B. Пример фармакологической противоопухолевой активности
9. В.1. Вводная часть
К середине 1980-х годов во всем мире было известно множество линий опухолевых клеток, многие из них были депонированы, например, в: Американской коллекции типовых культур. В конце 1980-х годов в качестве средства отбора соединений с ингибирующей рост активностью Национальным институтом раковых заболеваний США была разработан метод анализа противораковых лекарств на основе 60 линий опухолевых клеток человека (NCI60). В NCI60 включено 60 линий опухолевых клеток человека, которые относятся к раку девяти типов, и он служит средством оценки соединений для исследовательского сообщества (Sharma и др., Nature Reviews, 2010, 10, 241, Shoemaker, Nature Reviews, 2006, 6, 813).
Этот высокоэффективный подход к анализу клеток имел решающее значение для открытия нескольких средств, которые, как было впоследствии обнаружено, обладают терапевтической активностью. Возможно, самым значительным вкладом NCI60 в современную химиотерапию стала разработка ингибитора протеасом бортезомиба, который в 2003 году был одобрен Управлением США по санитарному надзору за качеством пищевых продуктов и медикаментов.
Хотя физиологическая обоснованность и применимость этого подхода для оценки эффективности лекарственных средств остаются спорными, большинство исследователей согласны с тем, что он остается лучшим имеющимся средством идентификации и определения характеристик лекарственных средств, которые потенциально могут принести клиническую пользу больным раком.
Соединения формулы (I) были испытаны на группе из 34 линий опухолевых клеток человека, представляющих рак 17 типов, а именно лейкоз (представлен 1 линией клеток), лимфому (4 линиями клеток), миелому (1 линией клеток), колоректальный рак (2 линиями клеток), рак головы и шея (3 линиями клеток), рак легкого (3 линиями клеток), меланому (2 линиями клеток), рак поджелудочной железы (2 линиями клеток), рак предстательной железы (2 линиями клеток), рак яичников (2 линиями клеток), рак почки (2 линиями клеток), рак желудка (2 линиями клеток), рак печени (2 линиями клеток), глиобластому (2 линиями клеток), остеосаркому (1 клеточной линией), саркому Юинга (1 линией клеток).
10. В.2. Методы
Анализ соединений на основе пролиферации клеток Было проведено исследование CellTiter-Blue (Promega G8080) выживаемости/пролиферации линий опухолевых клеток. Высеяли на 96-луночный планшет в общей сложности 1,104 клеток/лунку/50 мкл. Инициировали лечение путем добавления 2-кратного раствора лекарства в последовательных разведениях 1/10 от 0 до 10 мкМ. Выращивали клетки в течение 48 ч при 37°С и затем в течение 4 ч инкубировали с 10 мкл/лунку реагента Promega CellTiter-Bleue при 37°С. Определили количество образовавшегося резорюнинового красителя на основании его флуоресцентного излучения на волне 590 нм с использованием сканирующего многолуночного спектрофотометра (OPTIMA производства компании BMG labtech, Франция). В качестве исходного контроля для спектрофотометра использовалась пустая лунка без клеток.
Примеры протестированных клеточных линий
А375, А4513, А498, А549, ACHN, AGS, BT20, BXPC3, CALU6, CLS354, DLD1, DU145, H1299, HCT116, HEP2, HEPG2, HGC27, HL60, HUT78, KARPAS299, MDAMB231, MELWO, MESSA, OPM2, PANC1, PC3, PLCPRF5, REC1, RL, SW579, TOV112D, U118, U2OS, U87MG.
11. В.3. Результаты
Противоопухолевая активность соединений формулы (I)
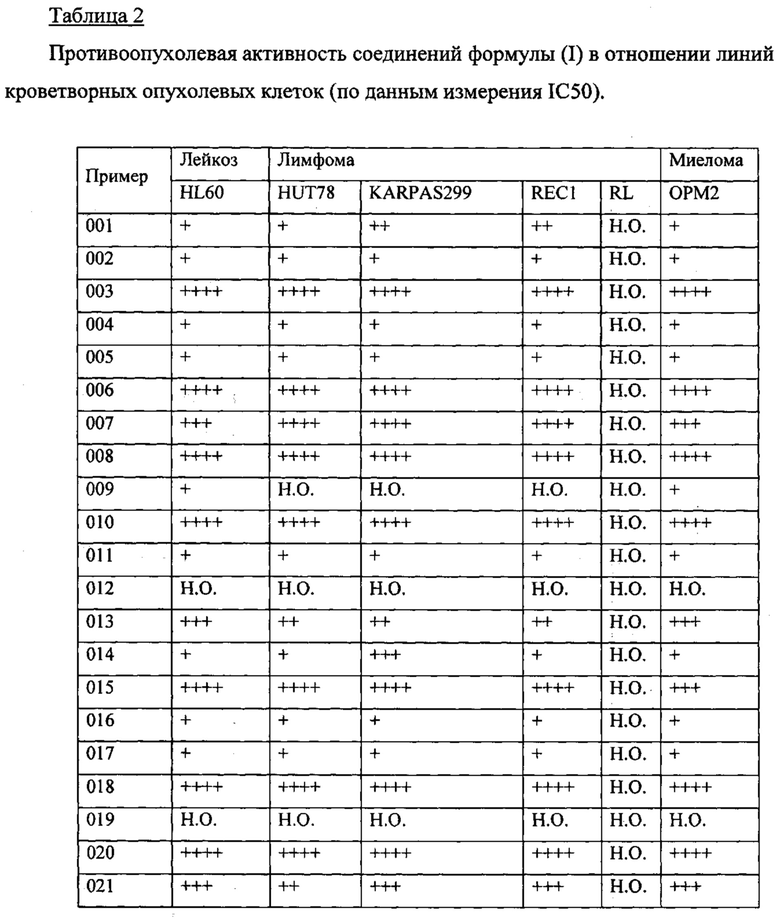
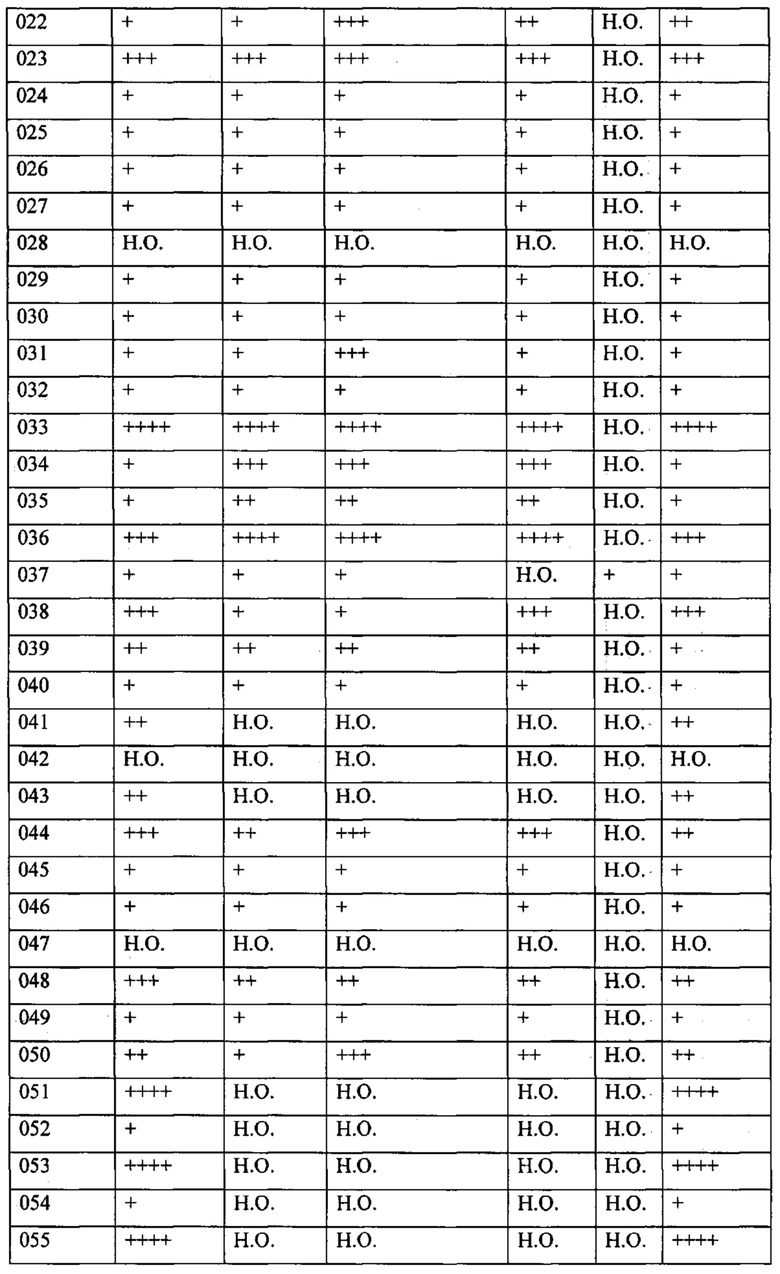

Показатели IC50 в Таблице 2 представлены следующим образом:
++++: IC50≤100 нМ
+++: 100<IC50≤500нМ
++: 500<IC50≤1000 нМ
+: IC50>1000нМ
Н.О.: не определен
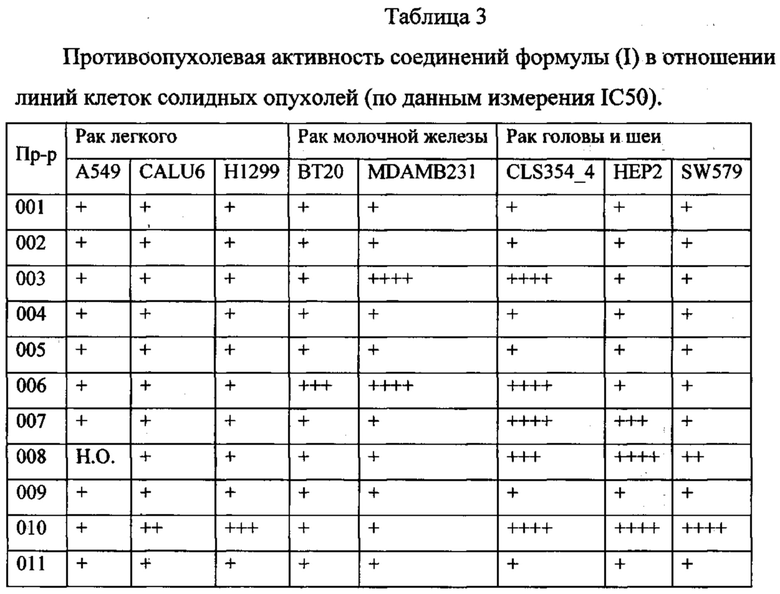
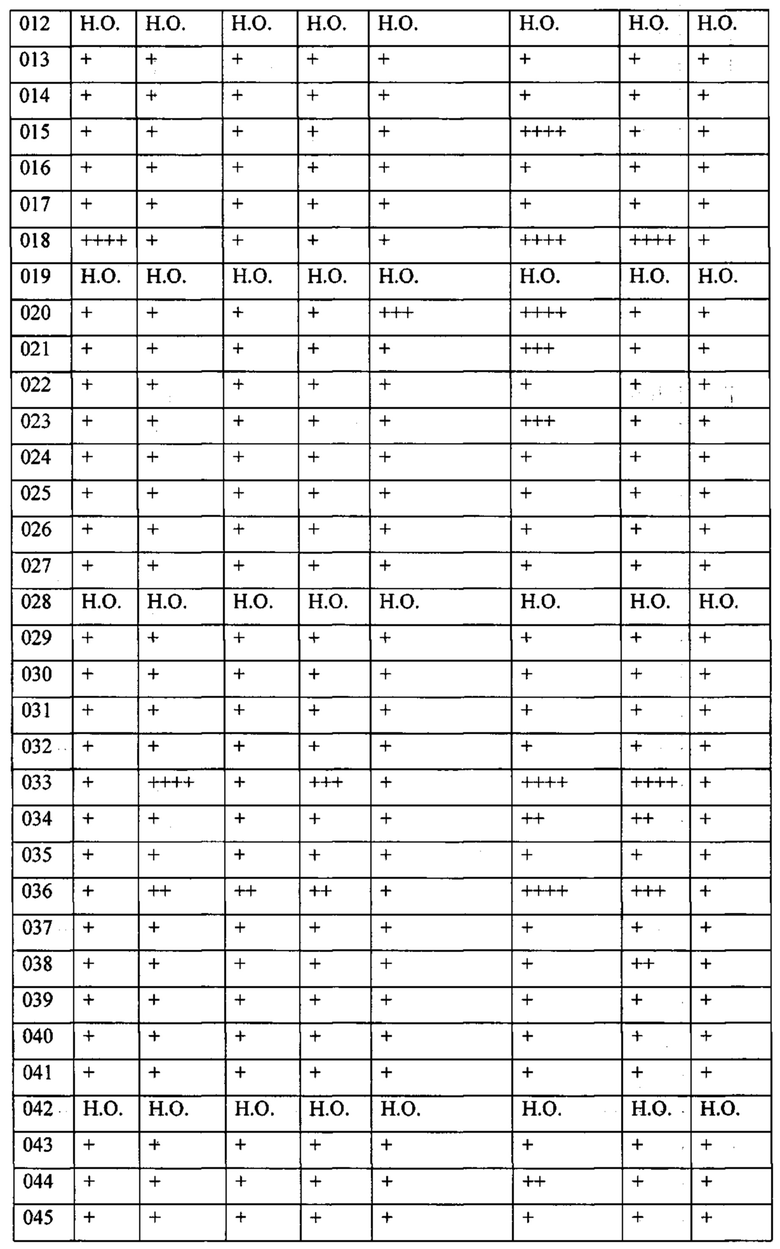
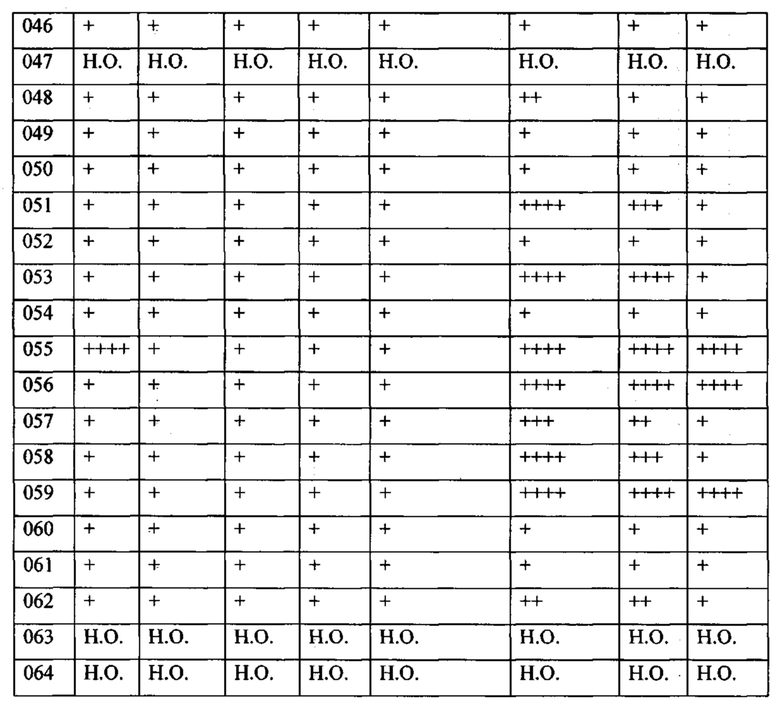
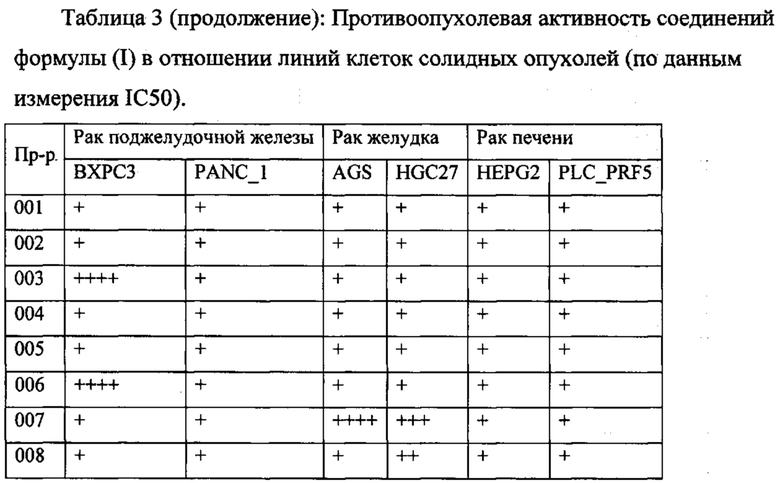
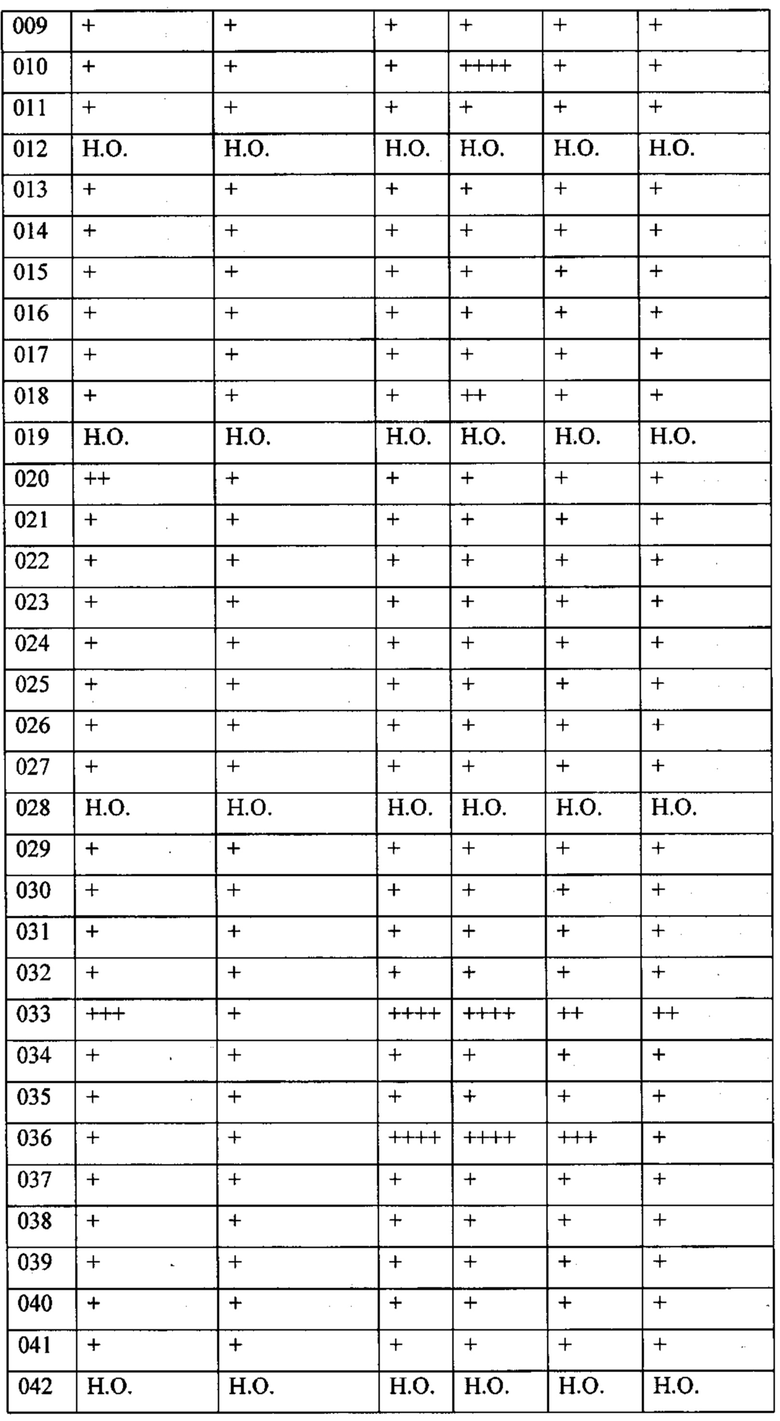
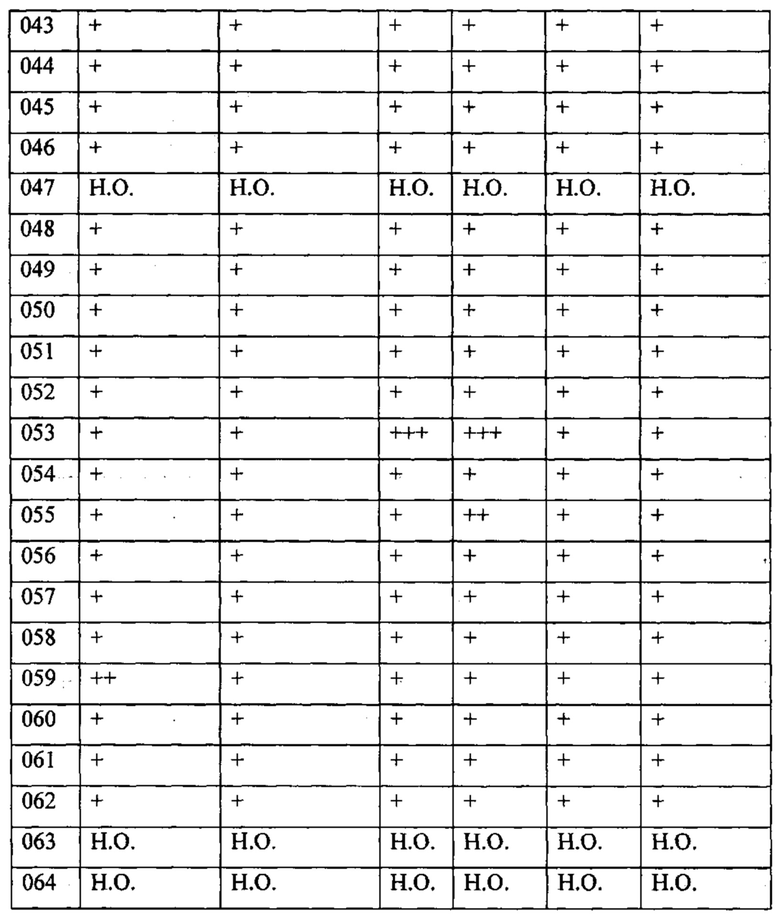
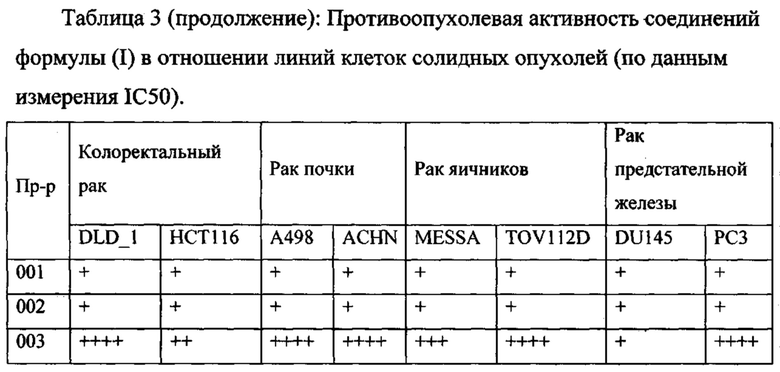
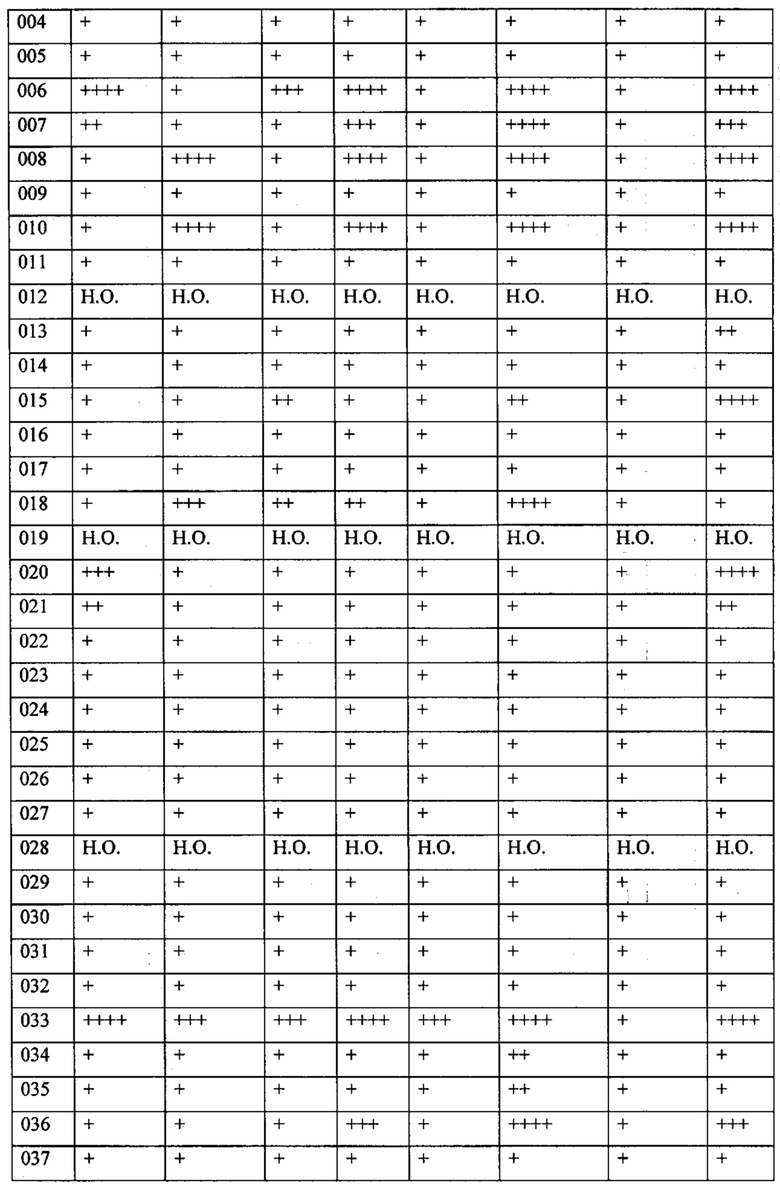
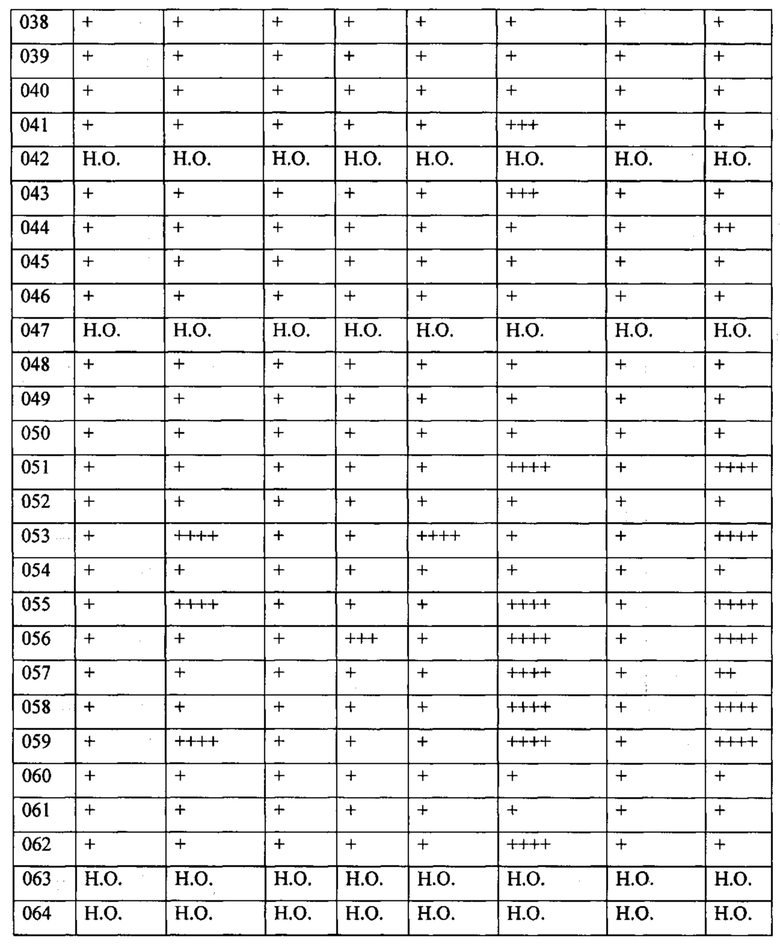

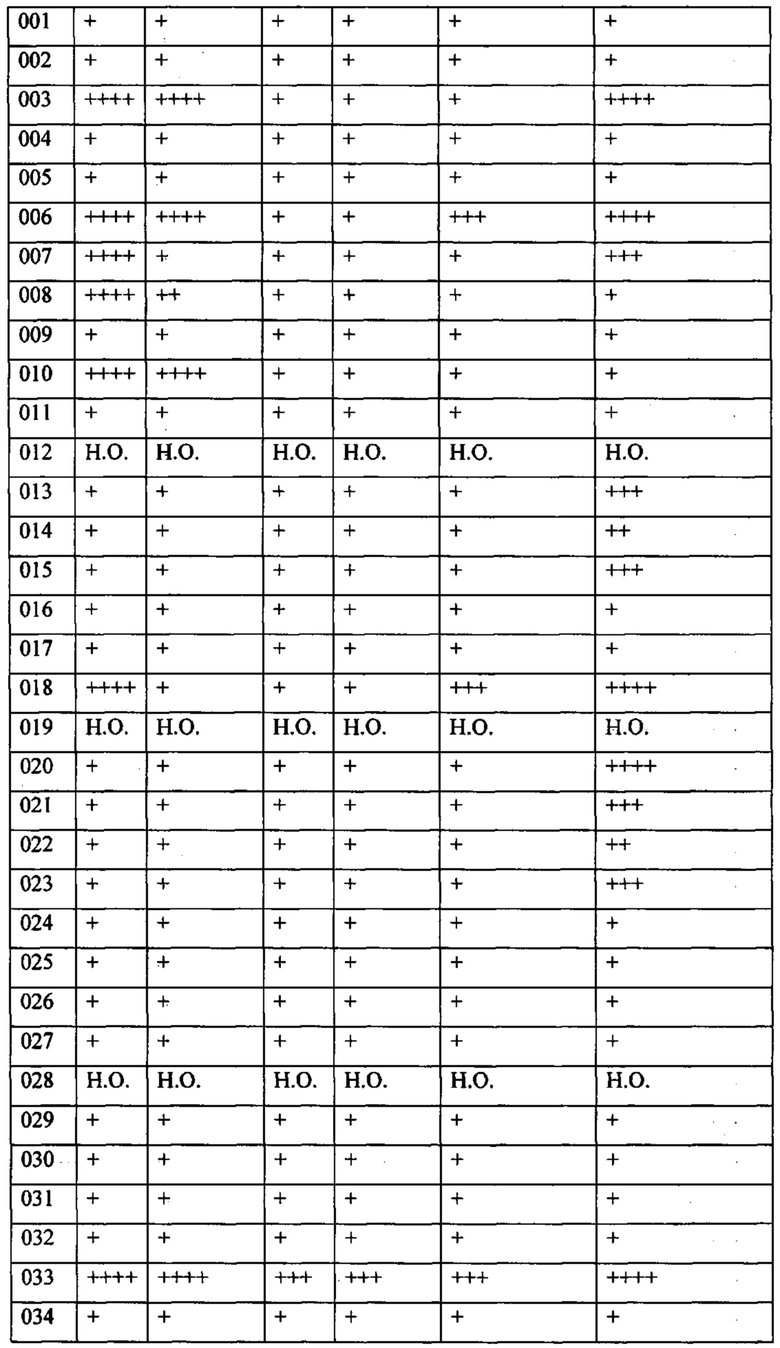
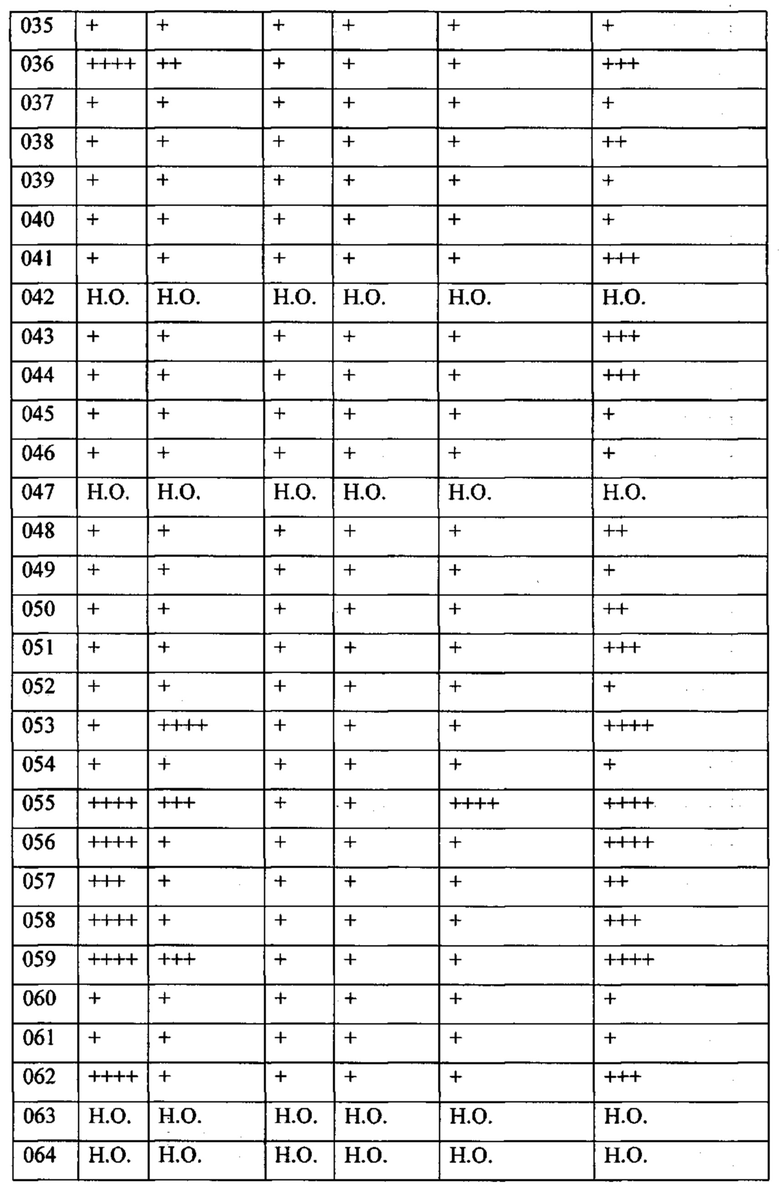
Показатели IC50 в Таблице 2 представлены следующим образом:
++++: IC50≤100 нМ
+++: 100<IC50≤500нМ
++: 500<IC50≤1000 нМ
+:IC50>1000 нМ
H.O.: не определен
Авторы изобретения наблюдали весьма действенный антипролиферативный эффект со стороны класса соединений формулы (I) согласно изобретению в отношении перечисленных выше клеточных линий.
Класс соединений формулы (I) представлен соединениями из Таблиц 2 и 3.
С. Отсутствие ингибирования протеинканаз
Подвергли киназы анализу in vitro с целью подтверждения отсутствия ингибирования протеинкиназ соединениями согласно изобретению.
Компания DiscoveRx (Ambit Biosciences) разработала высокопроизводительную систему (KINOMEscan™) скрининга соединений с использованием большого числа киназ человека (456 киназ).
С этой целью использовали соединения согласно изобретению в концентрации 1 мкМ, а результаты первичных связующих взаимодействий были представлены в процентах по отношению к контролю (% Ctrl), при этом меньшие показатели означают более сильные взаимодействия. В качестве отрицательного контроля (100% Ctrl) использовали DMSO, в качестве положительного контроля (0% Ctrl) использовали высокоаффинное соединение. % Ctrl рассчитывался следующим образом:
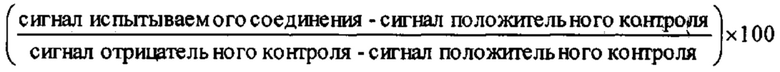
Показатель избирательности или показатель S является количественным показателем избирательности соединения. Он рассчитывается путем деления числа киназ, которые связывает соединение, на общее число отдельных тестируемых киназ, исключая варианты мутаций. S(10)=(число киназ с % Ctrl<10)/(число протестированных киназ), S(1)=(число киназ с % Ctrl<1)/(число протестированных киназ).
Далее в Таблице в качестве примера приведены показатели S соединений 003, 006 и 033.
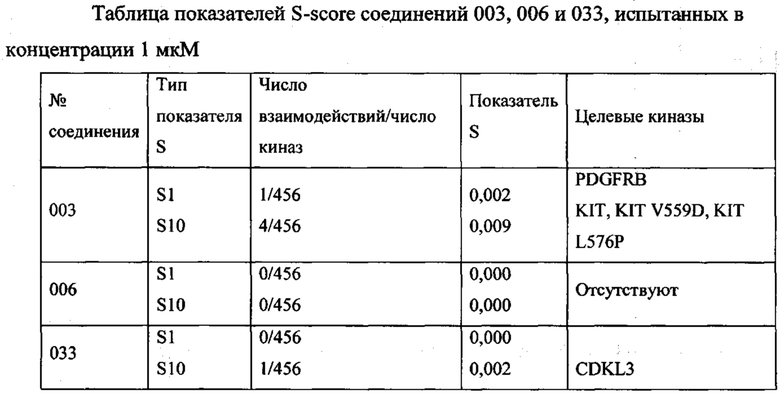
У соединений согласно изобретению, в особенности, у соединений 003, 006 и 033, как показано выше, отсутствует эффективное взаимодействие с тестируемыми 456 киназами. Наблюдаемое антипролиферативное действие не может объясняться сохраняющимся незначительным ингибированием киназ, поскольку соединения не имеют общих ферментов целевых киназ (соединения 003 и 033) и по-прежнему демонстрируют антипролиферативную активность без ингибирования киназ (соединения 006).
| название | год | авторы | номер документа |
|---|---|---|---|
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2012 |
|
RU2612972C2 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| МУЛЬТИЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ТРОМБИНА | 2011 |
|
RU2639876C2 |
| ПРОИЗВОДНЫЕ 5-ЧЛЕННЫХ ГЕТЕРОЦИКЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ p38 | 2004 |
|
RU2381219C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2019 |
|
RU2806758C2 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ОПОСРЕДОВАННОГО КИНАЗОЙ RAF, ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ МОЧЕВИНЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 1998 |
|
RU2232015C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2840815C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ МИМЕТИКОВ ТРО | 2006 |
|
RU2385865C2 |
| Гетероциклические соединения в качестве ингибиторов киназы RET | 2017 |
|
RU2742115C2 |
Изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, которые разрушают, ингибируют или предотвращают рост или распространение в окружающие ткани клеток, в особенности злокачественных клеток, участвующих в различных заболеваниях человека и животных. Предложено соединение формулы (I) или его фармацевтически приемлемая соль, где R1 и R5 в каждом случае независимо выбраны из водорода, С1-С10 алкильной группы; R2 выбран из водорода и С1-С10 алкильной группы, необязательно замещенной одной или более -OR группой, и С1-С10 алкоксигруппы, необязательно замещенной одной или более -OR группой, при этом R выбран из водорода и С1-С10 алкильной группы; R3 означает водород; R4 выбран из С1-С10 алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, С1-С10 алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, и -CONRR', при этом R и R' в каждом случае независимо выбраны из водорода, С1-С10 алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из ОН, NH2, NHCOH и водной солюбилизурующей группы; А означает гетероциклическую группу, выбранную из триазолила, оксотриазолила, имидазолила, оксоимидазолидинила, пиразолила, пиридила, оксопиридила, тиазолила и оксопирролидинила, необязательно замещенную одной или несколькими группами, выбранными из С1-С10 алкила, С1-С10 алкокси, -С1-С10 алкил-NRR', -С1-С10 алкил-NR-CO-R', где R и R' в каждом случае независимо выбраны из водорода, С1-С10 алкильных групп; В означает пятичленную гетероарильную группу, выбранную из оксодиазолила, оксазолила, тиадиазолила и тиазолила; X означает N или CН; и каждая солюбилизирующая группа независимо выбрана из структуры (а), где L выбран из N, M выбран из -О- и -S- и R представляет С1-С10 алкил; при условии, если В является тиазолилом, А не является имидазолилом или триазолилом. Соединения по изобретению предназначены лечения гематологических и/или пролиферативных нарушений. 3 н. и 8 з.п. ф-лы, 4 табл.
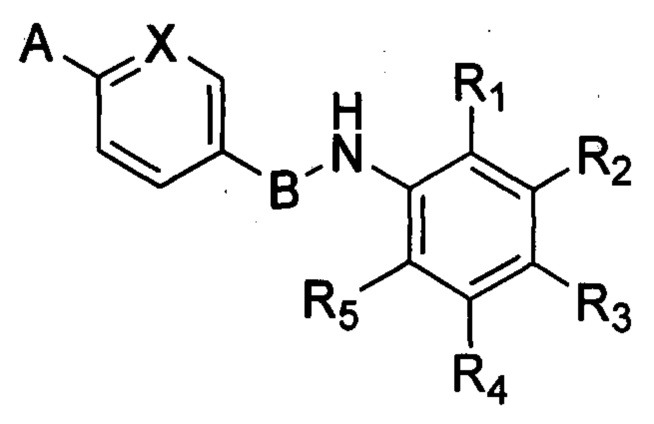 (I),
(I),
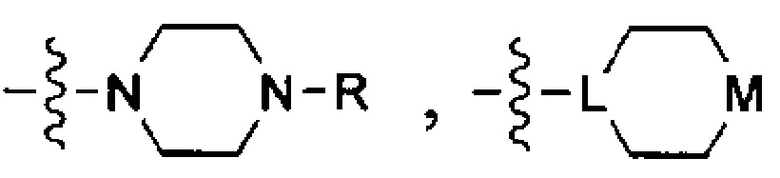 (а)
(а)
1. Соединение формулы (I)
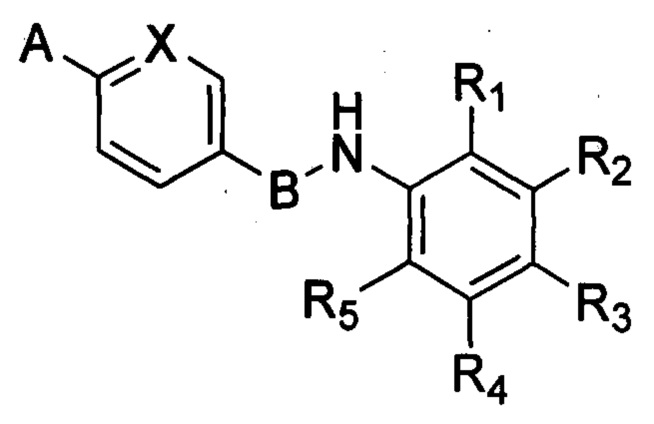
или его фармацевтически приемлемая соль, где
R1 и R5 в каждом случае независимо выбраны из водорода, С1-С10 алкильной группы;
R2 выбран из водорода и С1-С10 алкильной группы, необязательно замещенной одной или более -OR группой, и С1-С10 алкоксигруппы, необязательно замещенной одной или более -OR группой, при этом R выбран из водорода и С1-С10 алкильной группы;
R3 означает водород;
R4 выбран из С1-С10 алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, С1-С10 алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, и -CONRR', при этом R и R' в каждом случае независимо выбраны из водорода, С1-С10 алкильной группы, необязательно замещенной одной или несколькими группами, выбранными из ОН, NH2, NHCOH и водной солюбилизирующей группы;
А означает гетероциклическую группу, выбранную из триазолила, оксотриазолила, имидазолила, оксоимидазолидинила, пиразолила, пиридила, оксопиридила, тиазолила и оксопирролидинила, необязательно замещенную одной или несколькими группами, выбранными из С1-С10 алкила, С1-С10 алкокси, -С1-С10 алкил-NRR', -С1-С10 алкил-NR-CO-R', где R и R' в каждом случае независимо выбраны из водорода, С1-С10 алкильных групп;
В означает пятичленную гетероарильную группу, выбранную из оксодиазолила, оксазолила, тиадиазолила и тиазолила;
X означает N или CН;
и каждая солюбилизирующая группа независимо выбрана из
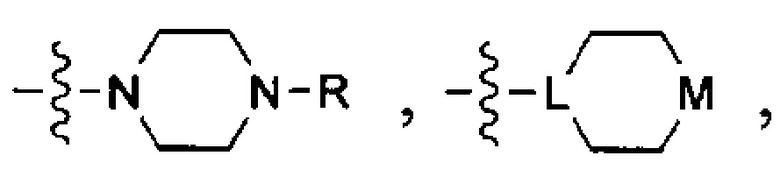
где L выбран из N;
M выбран из -О- и -S- и
R представляет С1-С10 алкил;
при условии, если В является тиазолилом, А не является имидазолилом или триазолилом.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где X означает СН, а А означает 2-оксоимидазолидильную или пиразолильную группу.
3. Соединение по любому из пп.1, 2 формулы (II)
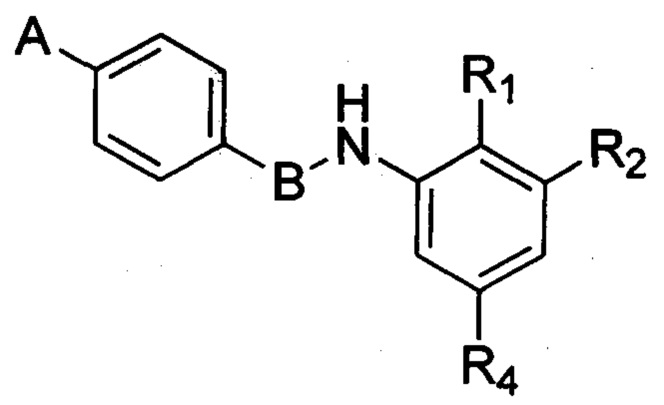
или его фармацевтически приемлемая соль, где
R1 выбран из водорода и С1-С4 алкильной группы;
R2 выбран из водорода, С1-С4 алкильной группы, необязательно замещенной одной или несколькими OR группами, и С1-С4 алкоксигруппы, необязательно замещенной одной или несколькими OR группами, где R выбран из водорода и С1-С4 алкильной группы;
R4 выбран из С1-С4 алкильной группы, замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, С1-С4 алкоксигруппы, необязательно замещенной одной или несколькими группами, выбранными из -NRR' и -ОR групп, и -CONRR';
где R и R' в каждом случае независимо выбраны из водорода и С1-С4 алкильной группы, необязательно замещенной одной или более группой, выбранной из ОН, NH2, NHCOH и водной солюбилизирующей группы;
А означает гетероциклическую группу, выбранную из триазолила, оксотриазолила, имидазолила, оксоимидазолидинила, пиразолила, пиридила, оксопиридила, тиазолила и оксопирролидинила, необязательно замещенную одной или несколькими группами, выбранными из С1-С4 алкила, С1-С4 алкокси, -С1-С4 алкил-NRR', -С1-С4 алкил-NR-CO-R', где R и R' в каждом случае независимо выбраны из водорода, С1-С4 алкильных групп;
В означает пятичленную гетероарильную группу, выбранную из оксодиазолила, оксазолила, тиадиазолила и тиазолила, где каждая водная солюбилизирующая группа независимо определена, как описано в п. 1;
при условии, что, если В означает тиазолил, А не означает имидазолил или триазолил.
4. Соединение по любому из пп. 1-3 формулы (III)
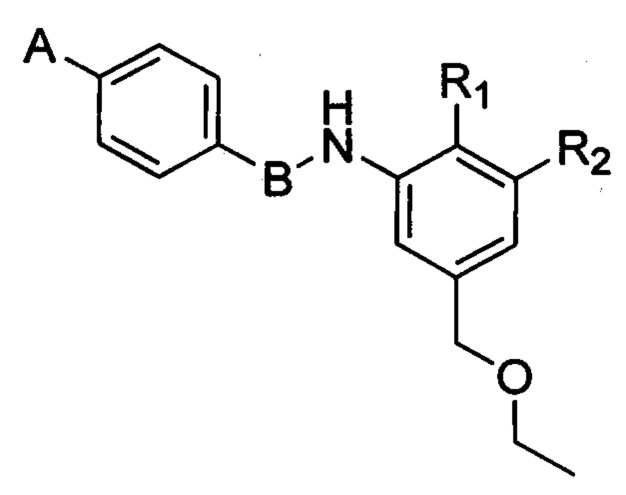 ,
,
где R1 и R2 в каждом случае независимо выбраны из водорода и С1-С4 алкильной группы;
А означает гетероциклическую группу, выбранную из триазолила, оксотриазолила, имидазолила, оксоимидазолидинила, пиразолила, пиридила, оксопиридила, тиазолила и оксопирролидинила, необязательно замещенную одной или несколькими группами, выбранными из С1-С4 алкила, С1-С4 алкокси, -С1-С4 алкил-NRR', -С1-С4 алкил-NR-CO-R', где R и R' в каждом случае независимо выбраны из водорода, С1-С4 алкильных групп;
В означает пятичленную гетероарильную группу, выбранную из оксодиазолила, оксазолила, тиадиазолила и тиазолила, где каждая водная солюбилизирующая группа независимо определена, как описано в п. 1;
при условии, что, если В означает тиазолил, А не означает имидазолил или триазолил.
5. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, где R1 означает метил, R2, R3 и R5 означают водород, a R4 означает -СН2ОС2Н5.
6. Соединение по п. 1 или его фармацевтически приемлемая соль, выбранное из группы, включающей:
(5-метокси-2-метилфенил)-[5-(6-пиразол-1-ил-пиридин-3-ил)-оксазол-2-ил]-амина;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-тиазол-4-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
4-метил-N-(2-морфолин-4-ил-этил)-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензамида;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(6-пиразол-1-ил-пиридин-3-ил)-оксазол-2-ил]-амина;
1-{4-[5-(5-этоксиметил-(2-метилфениламино))-[1,3,4]оксадиазол-2-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-[1,3,4]оксадиазол-2-ил]-амина;
1-{4-[5-(5-этоксиметил-(2-метилфениламино))-[1,2,4]тиадиазол-3-ил]-фенил}-имидазолидин-2-она;
(5-метокси-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
1-{4-[2-(5-метокси-2-метилфениламино)-тиазол-5-ил]-фенил}-имидазолидин-2-она;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-таазол-5-ил]-фенил}-имидазолидин-2-она;
(5-этоксиметил-2-метилфенил)-[4-(4-пиразол-1-ил-фенил)-тиазол-2-ил]-амина;
{4-метил-3-[4-(4-пиразол-1-ил-фенил)-тиазол-2-иламино]-фенил}-метанола;
1-{4-[2-(3-этоксиметил-(5-метилфениламино))-тиазол-4-ил]-фенил}-имидазолидин-2-она;
1-{4-[2-(3-этоксиметил-(5-метилфениламино))-оксазол-5-ил]-фенил}-имидазолидин-2-она;
(3-этоксиметилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(3-этоксиметил-5-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(3,5-бис-(этоксиметил)-фенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-метокси-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
[5-(2-амино-этоксиметил)-2-метилфенил]-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
N-(2-{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензилокси}-этил)-ацетамида;
2-{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензилокси}-этанола;
{4-метил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-фенил}-метанола;
{2-метил-5-[(2-морфолин-4-ил-этиламино)-метил]-фенил}-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
[5-(2-диметиламино-этокси)-2-метилфенил]-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
4,N-диметил-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензамида;
4-метил-N-[2-(4-метил-пиперазин-1-ил)-этил]-3-[5-(4-пиразол-1-ил-фенил)-оксазол-2-иламино]-бензамида;
(5-этоксиметил-2-метилфенил)-[5-(4-пиразол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,4]триазол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,3]триазол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-[1,2,3]триазол-2-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-имидазол-1-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-[5-(4-тиазол-2-ил-фенил)-оксазол-2-ил]-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(3-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(4-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(5-метил-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
(5-этоксиметил-2-метилфенил)-{5-[4-(3-метокси-пиразол-1-ил)-фенил]-оксазол-2-ил}-амина;
2-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-2,4-дигидро-[1,2,4]триазол-3-она;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-3-метил-имидазолидин-2-она;
1-(2-амино-этил)-3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-имидазолидин-2-она;
N-[2-(3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-2-оксо-имидазолидин-1-ил)-этил]-ацетамида;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-пирролидин-2-она;
(5-этоксиметил-2-метилфенил)-[5-(4-пиридин-2-ил-фенил)-оксазол-2-ил]-амина;
1-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-1Н-пиридин-2-она;
3-{4-[2-(5-этоксиметил-(2-метилфениламино))-оксазол-5-ил]-фенил}-1Н-пиридин-2-она;
(R)-1-(4-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)фенил)-5-метилимидазолидин-2-она;
4-(4-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)фенил)(-5-метил-2,4-дигидро-3Н-1,2,4-триазол-3-она;
1-(4-(2-((3,5-бис(этоксиметил)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
1-(5-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)пиридин-2-ил)имидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)-5-(2-метоксиэтокси)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
5-(4-(1H-пиразол-5-ил)фенил)-N-(5-(этоксиметил)-2-метилфенил)оксазол-2-амина;
(R)-1-(5-(2-((5-(этоксиметил)-2-метилфенил)амино)оксазол-5-ил)пиридин-2-ил)-5-метилимидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)-5-(2-гидроксиэтокси)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
5-(4-(1Н-пиразол-4-ил)фенил)-N-(5-(этоксиметил)-2-металфенил)оксазол-2-амина;
N-(5-(этоксиметил)-2-метилфенил)-5-(4-(1-метил-1Н-пиразол-5-ил)фенил)оксазол-2-амина;
4-(6-(1Н-пиразол-1-ил)пиридин-3-ил)-N-(5-(этоксиметил)-2-метилфенил)тиазол-2-амина;
1-(4-(2-((3-(этоксиметил)фенил)амино)оксазол-5-ил)фенил)имидазолидин-2-она;
1-(4-(2-((3-(этоксиметил)фенил)амино)тиазол-4-ил)фенил)имидазолидин-2-она.
7. Фармацевтическая композиция для лечения гематологических и/или пролиферативных нарушений, содержащая эффективное количество соединения по любому из пп. 1-6 или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый наполнитель и/или носитель.
8. Фармацевтическая композиция по п. 7, содержащая соединение по любому из пп. 1-6 или его фармацевтически приемлемую соль в качестве единственного действующего фармацевтического ингредиента.
9. Применение соединения по любому из пп. 1-6 в эффективном количестве для лечения гематологических и/или пролиферативных нарушений, при этом гематологическое нарушение выбрано из лимфомы, лейкоза, множественной миеломы (ММ), миелодиспластического синдрома (МДС) и миелодисплазии с миелофиброзом и пролиферативное нарушение представляет собой рак.
10. Применение по п. 9, где лейкоз представляет собой острый миелоидный лейкоз (ОМЛ), острый лимфобластный лейкоз (ОЛЛ), хронический лимфоидный лейкоз (ХЛЛ) или хронический миелоидный лейкоз (ХМЛ).
11. Применение по п. 9, где рак представляет собой рак головы и шеи, меланому, карциному почек, карциному желудка, карциному печени, колоректальную карциному, карциному поджелудочной железы, карциному легкого, нейрональную карциному, мультиформную глиобластому, остеосаркому, саркому Юинга, карциному молочной железы, карциному яичников или карциному предстательной железы.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| MANE R.A | |||
| and INGLE D.B.: "Synthesis of | |||
Авторы
Даты
2021-10-27—Публикация
2016-02-05—Подача