ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет временной заявки на патент США 61/319175, поданной 30 марта 2010 г., все содержание которой тем самым включено в настоящее описание путем ссылки и во всех целях.
УРОВЕНЬ ТЕХНИКИ
Настоящее раскрытие относится к соединениям, например, мультизамещенным ароматическим соединениям, которые показывают биологическую активность, например, ингибирующее действие, против тромбина (активированный фактор свертывания крови II; EC 3.4.21.5).
В системах млекопитающих повреждения кровеносных сосудов приводят к событиям кровотечения, которые связаны с каскадом коагуляции крови. Этот каскад включает внешние и внутренние пути, включая активацию по меньшей мере 13 связанных друг с другом факторов и разнообразные совместно действующие факторы и другие регулирующие белки. После повреждения сосудов плазматический фактор VII взаимодействует с экспонируемым тканевым фактором (TF), и возникающий в результате комплекс TF-fVIIa инициирует сложный ряд событий. Фактор fXa продуцируется на непосредственно следующей стадии из комплекса TF-fVIIa и множественно амплифицируется через внутренний путь. FXa затем служит катализатором для формирования тромбина (fIIa), который в свою очередь является прямым предшественником фибринолиза. Результатом является фибринолитический сгусток, который останавливает кровотечение. Фибринолиз полимерного сгустка на мономеры фибрина приводит к растворению и возвращению системы к состоянию предсгустка. Этот каскад представляет собой сложный баланс факторов и совместно действующих факторов и сильно зарегулирован.
При болезненных состояниях нежелательная положительная или отрицательная регуляция любого фактора приводит к таким состояниям как кровотечение или тромбоз. Исторически, антикоагулирующие средства использовались у пациентов с риском тромботических осложнений, таких как стенокардия, инсульт и сердечный приступ. Варфарин доминировал в качестве терапевтического антикоагулирующего средства первой линии. Разработанный в 1940-ых годах, он представляет собой антагонист витамина К и ингибирует, среди прочих, факторы VII, IX и X. Его вводят перорально, но его простота использования компенсируется другими эффектами: он имеет очень длинный период полужизни (>2 дней) и показывает серьезное межлекарственное взаимодействие. Важно, так как витамин К является повсеместным совместно действующим фактором в рамках каскада коагуляции, что антагонизм приводит к одновременному ингибированию многих факторов системы свертывания крови и таким образом может привести к значительным осложнениям, связанным с кровотечением.
Большое внимание было сосредоточено на гепарине, натуральном полисахариде, который активирует AT III, эндогенный ингибитор многих из факторов в каскаде коагуляции. Потребность в парентеральном введении терапевтических средств, являющихся производными гепарина, и неудобные требования пристального наблюдения для перорально доступного варфарина привели к необходимости обнаружить и разработать перорально доступные лекарственные средства с широкими терапевтическими окнами для безопасности и эффективности.
Действительно, положение тромбина в каскаде коагуляции сделало его популярной мишенью для открытия лекарственных средств. Вне связи с какой-либо теорией, считается, что окончательная разработка прямых ингибиторов тромбина (DTI) должна предпочтительно основываться на классическом звене D-Phe-Pro-Arg, последовательности, которая миметирует фибриноген, который является естественным субстратом тромбина. Также вне связи с какой-либо теорией, считается, что использование DTI имеет очень хорошие прецеденты, такие как антикоагулирующие средства на основе гирудина, и, таким образом, существует сильный интерес в открытии и разработке новых DTI.
Полное обсуждение тромбина и его ролей в процессе коагуляции может быть найдено в различных библиографических источниках, включая следующие, которые полностью включены в настоящее описание путем ссылки во всех целях: Wieland, H. A., et al., 2003, Curr Opin Investig Drugs, 4:264-71; Gross, P. L. & Weitz, J. I., 2008, Arterioscler Thromb Vase Biol, 28:380-6; Hirsh, J., et al., 2005, Blood, 105:453-63; Prezelj, A., et al., 2007, Curr Pharm Des, 13:287-312.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к соединению со структурой формулы (Ia)
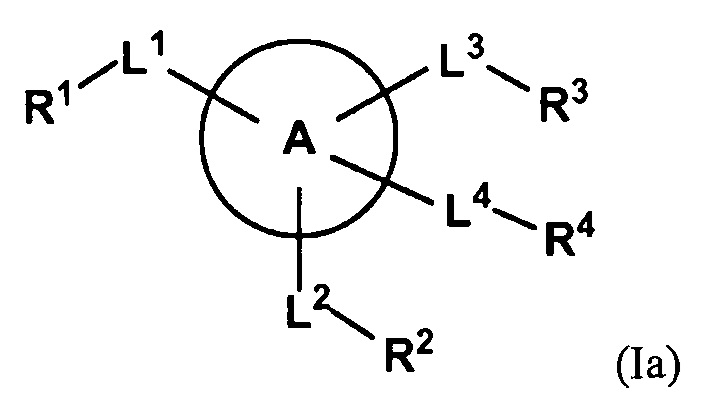
или к его фармацевтически приемлемой соли, сложному эфиру, сольвату или пролекарству. Кольцо A представляет собой замещенный или незамещенный пиразолил, или замещенный или незамещенный триазолил. L1, L2 и L3 независимо обозначают связь, замещенный или незамещенный алкилен, замещенный или незамещенный гетероалкилен, -S-, -SO-, -SO2-, -О-, -NHSO2- или -NR5-. L4 отсутствует, обозначает связь, замещенный или незамещенный алкилен, замещенный или незамещенный гетероалкилен, -S-, -SO-, -SO2-, -О-, -NHSO2- или -NR5-. R1, R2 и R3 независимо обозначают водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил. R4 отсутствует, обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, при условии, что, когда L4 отсутствует, тогда R4 отсутствует. R5 независимо обозначает водород или замещенный или незамещенный алкил. Было обнаружено, что соединения, описанные здесь, являются пригодными для ингибирования тромбина.
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение, раскрытое здесь, и фармацевтически приемлемый эксципиент. Соединение представляет собой соединение любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, или соединения, как представлено здесь в любой из таблиц A, B или C, или их фармацевтически приемлемую соль, сложный эфир, сольват или пролекарство.
В еще одном аспекте изобретение относится к способу лечения заболевания или нарушения у пациента. Способ включает введение соединения любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, соединения, как представлено здесь в любой из таблиц A, B или C, их фармацевтически приемлемой соли, сложного эфира, сольвата или пролекарства, или фармацевтической композиции, пациенту в количестве, эффективном для лечения заболевания или нарушения.
В другом аспекте изобретение относится к способу профилактики заболевания или нарушения у пациента. Способ включает введение соединения любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, соединения, как представлено здесь в любой из таблиц A, B или C, их фармацевтически приемлемой соли, сложного эфира, сольвата или пролекарства, или фармацевтической композиции, пациенту в количестве, эффективном для профилактики заболевания или нарушения.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Не применимо.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Сокращения, используемые здесь, имеют их обычное значение в рамках химической и биологической областей техники. Химические структуры и формулы, приведенные здесь, созданы согласно стандартным правилам химической валентности, известным в химических областях техники.
Если группы заместителей определены их обычными химическими формулами, написанными слева направо, они одновременно охватывают химически идентичные заместители, которые следовали бы из написания структуры справа налево, например, -CH2O- эквивалентно -OCH2-.
В рамках изобретения термин "присоединенный" означает стабильную ковалентную связь, причем некоторые предпочтительные точки присоединения являются очевидными для специалиста.
Термин "галоген" включает фтор, хлор, бром и йод. Дополнительно, такие термины как "галогеналкил" включают моногалогеналкил и полигалогеналкил. Например, термин "галоген(C1-C4)алкил" включает, но не ограничен ими, фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п.
Термин "алкил", отдельно или как часть другого заместителя, означает, если не указано иное, прямую (то есть, неразветвленную) или разветвленную цепь, или их комбинацию, которая может быть полностью насыщенной, моно- или полиненасыщенной и может включать ди- и поливалентные радикалы, имеющие указанное число атомов углерода (то есть, C1-C10 означает один-десять атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничены ими, такие группы как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, (циклогексил)метил, гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и т.п. Ненасыщенная алкильная группа представляет собой группу, имеющую одну или более двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничены ими, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил, и высшие гомологи и изомеры. Соответственно, термин "алкил" может относиться к насыщенным алифатическим углеводородным группам с насыщенной нормальной C1-C16 цепью, насыщенной разветвленной C1-C16, насыщенной циклической C3-C8 и нормальной или разветвленной C1-C16, замещенным циклическими насыщенными алифатическими углеводородными C3-C8 группами, имеющими указанное число атомов углерода. Например, это определение должно включать, но не ограничено ими, метил (Ме), этил (Et), пропил (Pr), бутил (Bu), пентил, гексил, гептил, октил, нонил, децил, ундецил, изопропил (i-Pr), изобутил (i-Bu), трет-бутил (t-Bu), втор-бутил (s-Bu), изопентил, неопентил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопропилметил и т.п.
Термин "алкилен", отдельно или как часть другого заместителя, означает, если не указано иное, двухвалентный радикал, полученный из алкила, как иллюстрируется, но не ограничено, -CH2CH2CH2CH2-. Как правило, алкильная (или алкиленовая) группа имеет от 1 до 24 атомов углерода, причем группы, имеющие 10 или менее атомов углерода, являются предпочтительными в соединениях, раскрытых здесь. "Низший алкил" или "низший алкилен" являются алкильной или алкиленовой группой с более короткой цепью, обычно имеющей восемь или менее атомов углерода.
Термин "гетероалкил", отдельно или в комбинации с другим термином, означает, если не указано иное, стабильную прямую или разветвленную цепь, или их комбинации, состоящую по меньшей мере из одного атома углерода и по меньшей мере одного гетероатома, выбранного из группы, состоящей из O, N, P, Si и S, и в которой атомы азота и серы могут быть окислены, и гетероатом азота может быть кватернизован. Гетероатом(ы) O, N, P, S и Si может быть помещен в любое внутреннее положение гетероалкильной группы или в положение, в котором алкильная группа привязана к остатку молекулы. Примеры включают, но не ограничены ими: -CH2-CH2-О-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-О-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -О-CH3, -О-CH2-CH3 и -CN. До двух гетероатомов могут быть последовательными, как, например, -CH2-NH-OCH3.
Точно так же термин "гетероалкилен", отдельно или как часть другого заместителя, означает, если не указано иное, двухвалентный радикал, полученный из гетероалкила, как иллюстрируется, но не ограничено, -CH2-CH2-S-CH2-CH2- и -CH2-S-CH2-CH2-NH-CH2-. В случае гетероалкиленовых групп, гетероатомы могут также занимать любой или оба из концов цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и т.п.). Кроме того, для алкилен- и гетероалкилен-связывающих групп, никакая ориентация связывающей группы не подразумевается направлением, в котором написана формула связывающей группы. Например, формула -C(O)2R’- означает как -C(O)2R’-, так и -R’C(O)2-. Как описано выше, гетероалкильные группы, в рамках изобретения, включают группы, которые присоединены к остатку молекулы через гетероатом, такие как -C(O)R’, -C(O)NR’, -NR’R’’, -OR’, -SR’ и/или -SO2R’. Когда указан "гетероалкил", сопровождаемый указанием определенных гетероалкильных групп, таких как -NR’R’’ и т.п., следует понимать, что термины гетероалкил и -NR’R’’ не дублируют и взаимно не исключают друг друга. Скорее определенные гетероалкильные группы указаны для большей ясности. Таким образом, термин "гетероалкил" не должен интерпретироваться здесь как исключающий определенные гетероалкильные группы, такие как -NR’R’’ и т.п.
Термины "циклоалкил" и "гетероциклоалкил", сами по себе или в комбинации с другими терминами, означают, если не указано иное, циклические версии "алкила" и "гетероалкила", соответственно. Дополнительно, для гетероциклоалкила, гетероатом может занимать положение, в котором гетероцикл присоединен к остатку молекулы. Примеры циклоалкила включают, но не ограничены ими, циклопропил, циклобутил, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают, но не ограничены ими, 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п. "Циклоалкилен" и "гетероциклоалкилен", одни или как часть другого заместителя, означают двухвалентный радикал, полученный из циклоалкила и гетероциклоалкила, соответственно.
Термин "алкенил" включает ненасыщенные алифатические углеводородные группы с ненасыщенной нормальной C2-C16 цепью, разветвленной ненасыщенной C2-C11, ненасыщенной циклической С5-С8 и нормальной или разветвленной C2-C16 цепью, замещенные циклическими насыщенными и ненасыщенными алифатическими углеводородными C3-C8 группами, имеющими указанное число атомов углерода. Двойные связи могут находиться в любом стабильном месте цепи, и углерод-углеродные двойные связи могут иметь конфигурацию транс или цис. Например, это определение должно включать, но не ограничено ими, этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил, ундеценил, 1,5-октадиенил, 1,4,7-нонатриенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, этилциклогексенил, бутенилциклопентил, 1-пентенил-3-циклогексенил и т.п. Точно так же "гетероалкенил" относится к гетероалкилу, имеющему одну или более двойных связей.
Термин "алкинил" относится в общепринятом смысле к алкилу, дополнительно включающему одну или более тройных связей. Термин "циклоалкенил" относится к циклоалкилу, дополнительно имеющему одну или более двойных связей. Термин "гетероциклоалкенил" относится к гетероциклоалкилу, дополнительно имеющему одну или более двойных связей.
Термин "ацил", если не указано иное, означает -C(O)R, где R обозначает замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
Каждый из вышеупомянутых терминов (например, "алкил," "гетероалкил", "арил" и "гетероарил") включает как замещенные, так и незамещенные формы обозначенного радикала. Предпочтительные заместители для каждого типа радикалов приведены здесь.
Заместители для алкильных и гетероалкильных радикалов (включая группы, часто называемые алкиленом, алкенилом, гетероалкиленом, гетероалкенилом, алкинилом, циклоалкилом, гетероциклоалкилом, циклоалкенилом и гетероциклоалкенилом) могут представлять собой одну или более из разнообразных групп, выбранных из, но не ограничиваясь ими, -OR’, =О, =NR’, =N-OR’, -NR’R’’, -SR’, -галоген, -SiR’R’’R’’’, -OC(O)R’, -C(O)R’, -CO2R’, -CONR’R’’, -OC(O)NR’R’’, -NR’’C(O)R’, -NR’-C(O)NR’’R’’’, -NR’’C(O)2R’, -NR-C(NR’R’’R’’’)=NR’’’’, -NR-C(NR’R’’)=NR’’’, -S(O)R’, -S(O)2R’, -S(O)2NR’R’’, -NRSO2R’, -CN и -NO2 в количестве в пределах от нуля до (2m’+1), где m’ является общим числом атомов углерода в таком радикале. R’, R’’, R’’’ и R’’’’, каждый, предпочтительно независимо относится к водороду, замещенному или незамещенному гетероалкилу, замещенному или незамещенному циклоалкилу, замещенному или незамещенному гетероциклоалкилу, замещенному или незамещенному арилу (например, арилу, замещенному 1-3 галогенами), замещенному или незамещенному алкилу, алкокси или тиоалкокси, или арилалкилу. Когда соединение, раскрытое здесь, включает более чем одну группу R, например, каждая из групп R независимо выбрана, как каждая из групп R’, R’’, R’’’ и R’’’’, когда присутствует более чем одна из этих групп. Когда R’ и R’’ присоединены к одному и тому же атому азота, они могут вместе с атомом азота образовывать 4-, 5-, 6- или 7-членное кольцо. Например, -NR’R’’ включает, но не ограничен ими, 1-пирролидинил и 4-морфолинил. Из приведенного выше обсуждения заместителей специалист поймет, что термин "алкил" включает группы, включающие атомы углерода, связанные с группами, отличными от водородных групп, такими как галогеналкил (например, -CF3 и -CH2CF3) и ацил (например, -C(O)CH3, -C(O)CF3, -C(O)CH2OCH3 и т.п.).
Подобно заместителям, описанным для алкильного радикала, заместители для арила и гетероарила различны и могут быть выбраны из, например: -OR’, -NR’R’’, -SR’, -галогена, -SiR’R’’R’’’, -OC(O)R’, -C(O)R’, -CO2R’, -CONR’R’’, -OC(O)NR’R’’, -NR’’C(O)R’, -NR’-C(O)NR’’R’’’, -NR’’C(O)2R’, -NR-C(NR’R’’R’’’)=NR’’’’, -NR-C(NR’R’’)=NR’’’, -S(O)R’, -S(O)2R’, -S(O)2NR’R’’, -NRSO2R’, -CN, -NO2, -R’, -N3, -CH(Ph)2, фтор(C1-C4)алкокси и фтор(C1-C4)алкила, в количестве в пределах от нуля до общего количества открытых валентностей на ароматической кольцевой системе; и где R’, R’’, R’’’ и R’’’’ предпочтительно независимо выбраны из водорода, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. Когда соединение, раскрытое здесь, включает более чем одну группу R, например, каждая из групп R выбрана независимо, как каждая из групп R’, R’’, R’’’ и R’’’’, когда присутствует более чем одна из этих групп.
Два или более заместителей могут быть соединены, образуя арил, гетероарил, циклоалкил или гетероциклоалкил. Такие так называемые образующие кольцо заместители обычно, хотя не обязательно, присоединены к структуре циклического основания. В одном варианте осуществления образующие кольцо заместители присоединены к смежным членам структуры основания. Например, два образующих кольцо заместителя, присоединенные к смежным членам структуры циклического основания, создают конденсированную кольцевую структуру. В другом варианте осуществления образующие кольцо заместители присоединены к единственному члену структуры основания. Например, два образующих кольцо заместителя, присоединенные к единственному члену структуры циклического основания, создают спироциклическую структуру. В еще одном варианте осуществления образующие кольцо заместители присоединены к несмежным членам структуры основания.
Два из заместителей на смежных атомах арильного или гетероарильного кольца могут образовывать кольцо формулы -T-C(O)-(CRR’)q-U-, в котором T и U независимо обозначают -NR-, -О-, -CRR’- или простую связь, и q означает целое число от 0 до 3. Альтернативно, два из заместителей на смежных атомах арильного или гетероарильного кольца могут быть заменены заместителем формулы -A-(CH2)r-B-, в котором A и B независимо обозначают -CRR’-, -О-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR’- или простую связь, и r означает целое число от 1 до 4. Одна из простых связей сформированного таким образом нового кольца может быть заменена двойной связью. Альтернативно, два из заместителей на смежных атомах арильного или гетероарильного кольца могут быть заменены заместителем формулы -(CRR’)s-X’-(C’’R’’’)d-, где s и d независимо означают целые числа от 0 до 3, и X’ обозначает -О-, -NR’-, -S-, -S(O)-, -S(O)2- или -S(O)2NR’-. Заместители R, R’, R’’ и R’’’ предпочтительно независимо выбраны из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила.
В рамках изобретения термины "гетероатом" или "кольцевой гетероатом" включают кислород (O), азот (N), серу (S), фосфор (P) и кремний (Si).
Термин "алкилокси" (например, метокси, этокси, пропилокси, аллилокси, циклогексилокси) обозначает алкильную группу, определенную выше, имеющую обозначенное число атомов углерода, присоединенных через кислородный мостик (-О-).
Термин "алкилтио" (например, метилтио, этилтио, пропилтио, циклогексилтио и т.п.) обозначает алкильную группу, определенную выше, имеющую обозначенное число атомов углерода, присоединенных через серный мостик (-S-).
Термин "алкиламино" обозначает одну или две алкильные группы, как определено выше, имеющие обозначенное число атомов углерода, присоединенных через мостик амина. Две алкильные группы могут вместе с азотом, к которому они присоединены, образовывать циклическую систему, содержащую от 3 до 8 атомов углерода с или без одного C1-C16алкильного, арилC0-C16алкильного, или C0-C16алкиларильного заместителя.
Термин "алкиламиноалкил" обозначает алкиламино группу, присоединенную через алкильную группу, определенную выше, имеющую обозначенное число атомов углерода.
Термин "алкилокси(алкил)амино" (например, метокси(метил)амин, этокси(пропил)амин) обозначает алкилокси группу, определенную выше, присоединенную через аминогруппу, причем эта аминогруппа сама имеет алкильный заместитель.
Термин "алкилкарбонил" (например, циклооктилкарбонил, пентилкарбонил, 3-гексилкарбонил) обозначает алкильную группу, определенную выше, имеющую обозначенное число атомов углерода, присоединенную через карбонильную группу.
Термин "алкилкарбокси" (например, гептилкарбокси, циклопропилкарбокси, 3-пентенилкарбокси) обозначает алкилкарбонильную группу, определенную выше, в которой карбонил, в свою очередь, присоединен через кислород.
Термин "алкилкарбоксиалкил" обозначает алкилкарбоксигруппу, присоединенную через алкильную группу, определенную выше, имеющую обозначенное число атомов углерода.
Термин "алкилкарбониламино" (например, гексилкарбониламино, циклопентилкарбониламинометил, метилкарбониламинофенил) обозначает алкилкарбонильную группу, определенную выше, в которой карбонил, в свою очередь, присоединен через атом азота аминогруппы.
Азотная группа может сама быть замещена алкильной или арильной группой.
Термин "арил" обозначает, если не указано иное, полиненасыщенный ароматический углеводородный заместитель, который может представляеть собой единственное кольцо или множество колец (предпочтительно от 1 до 3 колец), которые конденсированы вместе (то есть, конденсированный арил) или связаны ковалентно. Конденсированный арил относится к множеству колец, конденсированных вместе, причем по меньшей мере одно из конденсированных колец представляет собой арильное кольцо. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от одного до четырех гетероатомов, выбранных из N, O и S, причем атомы азота и серы могут быть окислены, и атом(ы) азота могут быть кватернизованы. Таким образом, термин "гетероарил" включает конденсированные гетероарильные группы (то есть, множество колец, соединенных вместе, причем по меньшей мере одно из конденсированных колец представляет собой гетероароматическое кольцо). 5,6-конденсированный гетероарилен относится к двум кольцам, конденсированным вместе, причем одно кольцо имеет 5 членов, и другое кольцо имеет 6 членов, и причем по меньшей мере одно кольцо представляет собой гетероарильное кольцо. Аналогично, 6,6-конденсированный гетероарилен относится к двум кольцам, конденсированным вместе, причем одно кольцо имеет 6 членов, и другое кольцо имеет 6 членов, и причем по меньшей мере одно кольцо представляет собой гетероарильное кольцо. И 6,5-конденсированный гетероарилен относится к двум кольцам, конденсированным вместе, причем одно кольцо имеет 6 членов, и другое кольцо имеет 5 членов, и причем по меньшей мере одно кольцо представляет собой гетероарильное кольцо. Гетероарильная группа может быть связана с остатком молекулы через углерод или гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой из вышеупомянутых известных арильных и гетероарильных кольцевых систем выбраны из группы приемлемых заместителей, описанных ниже. "Арилен" и "гетероарилен", отдельно или как часть другого заместителя, означают двухвалентный радикал, полученный из арила и гетероарила, соответственно. Соответственно, термин "арил" может обозначать незамещенные, моно-, ди- или тризамещенные моноциклические, полициклические биарильные и гетероциклические ароматические радикалы, ковалентно присоединенные в любом положении кольца, способном к образованию стабильной ковалентной связи, причем некоторые предпочтительные точки присоединения являются очевидными для специалиста (например, 3-индолил, 4-имидазолил). Заместители арила независимо выбраны из группы, состоящей из галогена, нитро, циано, тригалогенметила, C1-16алкила, арилC1-16алкила, C0-16алкилоксиC0-16алкила, арилC0-16алкилоксиC0-16алкила, C0-16алкилтиоC0-16алкила, арилC0-16алкилтиоC0-16алкила, C0-16алкиламиноC0-16алкила, арилC0-16алкиламиноC0-16алкила, ди(арилC1-16алкил)аминоC0-16алкила, C1-16алкилкарбонилC0-16алкила, арилC1-16алкилкарбонилC0-16алкила, C1-16алкилкарбоксиC0-16алкила, арилC1-16алкилкарбоксиC0-16алкила, C1-16алкилкарбониламиноC0-16алкила, арилC1-16алкилкарбониламиноC0-16алкила, -C0-16алкилCOOR4, -C0-16алкилCONR5R6, причем R4, R5 и R6 независимо выбраны из водорода, C1-C11алкила, арилC0-C11алкила, или R5 и R6 вместе с азотом, к которому они присоединены, образуют циклическую систему, содержащую от 3 до 8 атомов углерода с или без одного C1-16алкильного, арилC0-C16алкильного или C0-C16алкиларильного заместителя. Арил включает, но не ограничен ими, пиразолил и триазолил.
Для краткости, термин "арил", когда он используется в комбинации с другими терминами (например, арилокси, арилтиокси, арилалкил) включает как арильные, так и гетероарильные кольца, как определено выше. Таким образом, термины "арилалкил", "аралкил" и т.п. включают радикалы, в которых арильная группа связана с алкильной группой (например, бензил, фенетил, пиридилметил и т.п.), включая алкильные группы, в которых атом углерода (например, метиленовая группа) был заменен, например, атомом кислорода (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.) или атомом серы. Соответственно, термины "арилалкил" и т.п. (например, (4-гидроксифенил)этил, (2-аминонафтил)гексил, пиридилциклопентил) обозначают арильные группы, определенные выше, присоединенные через алкильную группу, определенную выше, имеющую обозначенное число атомов углерода.
Термин "оксо", в рамках изобретения, означает кислород, который присоединен двойной связью к атому углерода.
Термин "алкилсульфонил", в рамках изобретения, означает группу, имеющую формулу -S(O2)-R’, где R’ обозначает алкильную группу, определенную выше. R’ может иметь указанное число атомов углерода (например, "C1-C4алкилсульфонил").
Термин "карбонилокси" обозначает карбонильную группу, присоединенную через кислородный мостик.
В приведенных выше определениях термины "алкил" и "алкенил" могут использоваться взаимозаменяемо, при условии, что образуется стабильный химический объект, как очевидно для специалиста.
Термин "линкер" относится к присоединенным группам, встроенным между заместителями, например, R1, R2, R3 или R4, описанными здесь, например, в формуле (Ia), и в общем названными Rn, и группой, которая замещена, например, "кольцом А", например, в формуле (Ia). В некоторых вариантах осуществления линкер включает амидо (-CONH-Rn или -NHCO-Rn), тиоамидо (-CSNH-Rn или -NHCS-Rn), карбоксильную группу (-CO2-Rn или -OCORn), карбонил (-СО-Rn), мочевину (-NHCONH-Rn), тиомочевину (-NHCSNH-Rn), сульфонамидо (-NHSO2-Rn или -SO2NH-Rn), простой эфир (-О-Rn), сульфонил (-SO2-Rn), сульфоксил (-SO-Rn), карбамоил (-NHCO2-Rn или -OCONH-Rn) или амино (-NHRn) связывающие группы.
"Группа заместителя" в рамках изобретения означает группу, выбранную из следующих групп:
(A) -OH, -NH2, -SH, -CN, -CF3, -NO2, оксо, галоген, -COOH, незамещенный алкил, незамещенный гетероалкил, незамещенный циклоалкил, незамещенный гетероциклоалкил, незамещенный арил, незамещенный гетероарил, и
(B) алкил, гетероалкил, циклоалкил, гетероциклоалкил, арил и гетероарил, замещенный по меньшей мере одним заместителем, выбранным из:
(i) оксо, -OH, -NH2, -SH, -CN, -CF3, -NO2, галогена, -COOH, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила, незамещенного гетероарила, и
(ii) алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила и гетероарила, замещенных по меньшей мере одним заместителем, выбранным из:
(a) оксо, -OH, -NH2, -SH, -CN, -CF3, -NO2, галогена, -COOH, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила, незамещенного гетероарила, и
(b) алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила или гетероарила, замещенных по меньшей мере одним заместителем, выбранным из: оксо, -OH, -NH2, -SH, -CN, -CF3, -NO2, галогена, -COOH, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила и незамещенного гетероарила.
"Ограниченный размером заместитель" или "ограниченная размером группа заместителя" в рамках изобретения означает группу, выбранную из всех заместителей, описанных выше для "группы заместителя", причем каждый замещенный или незамещенный алкил представляет собой замещенный или незамещенный C1-C20 алкил, каждый замещенный или незамещенный гетероалкил представляет собой замещенный или незамещенный 2-20-членный гетероалкил, каждый замещенный или незамещенный циклоалкил представляет собой замещенный или незамещенный C4-C8 циклоалкил, и каждый замещенный или незамещенный гетероциклоалкил представляет собой замещенный или незамещенный 4-8-членный гетероциклоалкил.
"Низший заместитель" или "низшая группа заместителя" в рамках изобретения означает группу, выбранную из всех заместителей, описанных выше для "группы заместителя", причем каждый замещенный или незамещенный алкил представляет собой замещенный или незамещенный C1-C8 алкил, каждый замещенный или незамещенный гетероалкил представляет собой замещенный или незамещенный 2-8-членный гетероалкил, каждый замещенный или незамещенный циклоалкил представляет собой замещенный или незамещенный C5-C7 циклоалкил, и каждый замещенный или незамещенный гетероциклоалкил представляет собой замещенный или незамещенный 5-7-членный гетероциклоалкил.
Термин "приблизительно", используемый в контексте числового значения, указывает диапазон +/-10% от этого числового значения, если явно не указано иное.
II. Соединения
В одном аспекте изобретение относится к соединению со структурой формулы (Ia):

или к его фармацевтически приемлемой соли, сложному эфиру, сольвату или пролекарству. Кольцо A представляет собой замещенный или незамещенный пиразолил, или замещенный или незамещенный триазолил. L1, L2 и L3 независимо обозначают связь, замещенный или незамещенный алкилен, замещенный или незамещенный гетероалкилен, -S-, -SO-, -SO2-, -О-, -NHSO2- или -NR5-. L4 отсутствует, обозначает связь, замещенный или незамещенный алкилен, замещенный или незамещенный гетероалкилен, -S-, -SO-, -SO2-, -О-, -NHSO2- или -NR5-. R1, R2 и R3 независимо обозначают водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил. R4 отсутствует, обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, при условии, что, когда L4 отсутствует, тогда R4 отсутствует. R5 независимо обозначает водород или замещенный или незамещенный алкил.
В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль, сложный эфир, сольват или пролекарство соединения формулы (Ia). В некоторых вариантах осуществления соединение не является сложным эфиром, не является сольватом и не является пролекарством.
В некоторых вариантах осуществления L4 и R4 отсутствуют, что приводит к соединению со следующей структурой формулы (Ib).

В некоторых вариантах осуществления изобретение относится к соединению согласно формуле (Ib) со следующими структурами формул (IIa) или (IIb).

В некоторых вариантах осуществления соединение имеет структуру формулы (IIa), в которой L3 обозначает связь, и R3 обозначает замещенный или незамещенный арил, или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления гетероарил R3 представляет собой замещенный или незамещенный пиридил, тиенил или фурил. В некоторых вариантах осуществления R3 обозначает незамещенный пиридил, тиенил или фурил. В некоторых вариантах осуществления R3 обозначает незамещенный арил, предпочтительно фенил. В некоторых вариантах осуществления R3 обозначает замещенный арил, предпочтительно замещенный галогеном фенил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIa), в которой L3 обозначает связь, замещенный или незамещенный алкилен, и R3 обозначает замещенный или незамещенный арил, или замещенный или незамещенный гетероциклоалкил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIa), в которой L3 обозначает -C(O)О-, и R3 обозначает замещенный или незамещенный алкил, предпочтительно незамещенный алкил, более предпочтительно незамещенный низший алкил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIa), в которой L3 обозначает -C(O)NR5-, R5 обозначает водород или алкил, и R3 обозначает замещенный или незамещенный алкил, или замещенный или незамещенный арил.
В дополнение к любому варианту осуществления, описанному выше, в некоторых вариантах осуществления L1 обозначает -S-, -NR5-, замещенный или незамещенный алкилен, или замещенный или незамещенный гетероалкилен, и R1 обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероциклоалкил. В некоторых вариантах осуществления L1 обозначает -NC(O)-. В некоторых вариантах осуществления R3 обозначает замещенный или незамещенный арил. В некоторых вариантах осуществления R3 обозначает незамещенный арил. В некоторых вариантах осуществления L2 обозначает связь. В некоторых вариантах осуществления L2 обозначает связь, и R2 обозначает водород.
В дополнение к любому варианту осуществления, описанному выше, в некоторых вариантах осуществления L2 обозначает замещенный или незамещенный алкилен или -C(O)-, и R2 обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероциклоалкил.
В некоторых вариантах осуществления соединение формулы (IIa) имеет структуру следующей формулы (IIc), в которой L1 обозначает -NH-(CH2)n-, n = от 0 до 6, предпочтительно 1, и R1 обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероциклоалкил.

В некоторых вариантах соединения формулы (IIc) L1 обозначает -NHCH2- или -NH(CH2)2-, и R1 обозначает замещенный или незамещенный арил. В некоторых вариантах осуществления R1 обозначает незамещенный арил. В некоторых вариантах осуществления R1 обозначает арил, предпочтительно фенил, замещенный галогеном, -CN или алкилокси, предпочтительно метокси. В некоторых вариантах осуществления R1 обозначает незамещенный алкил, предпочтительно низший алкил, более предпочтительно метил или этил. В некоторых вариантах осуществления n=0, и R1 обозначает водород.
В некоторых вариантах осуществления соединение формулы (IIa) имеет структуру следующей формулы (IId), в которой L1 обозначает связь, и R1 обозначает незамещенный алкил, или замещенный или незамещенный арил. В некоторых вариантах осуществления R1 обозначает незамещенный алкил, предпочтительно низший алкил. В некоторых вариантах осуществления R1 обозначает замещенный арил, предпочтительно замещенный галогеном фенил.
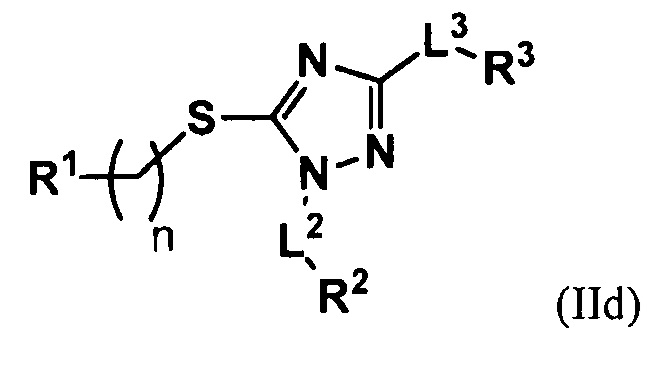
В некоторых вариантах осуществления изобретение относится к соединению со структурой формулы (IIb). В некоторых вариантах осуществления L2 обозначает связь или замещенный или незамещенный алкилен. В некоторых вариантах осуществления L2 обозначает связь, и R2 обозначает алкил, предпочтительно низший алкил. В некоторых вариантах осуществления L2 обозначает замещенный алкилен. В некоторых вариантах осуществления L2 обозначает незамещенный алкилен, предпочтительно метилен или этилен. В некоторых вариантах осуществления L2 обозначает незамещенный алкилен, и R2 обозначает незамещенный арил, предпочтительно фенил. В некоторых вариантах осуществления R2 обозначает замещенный или незамещенный алкил, или замещенный или незамещенный арил.
В некоторых вариантах осуществления изобретение относится к соединению согласно формуле (Ib) со структурой следующих формул (IIIa) или (IIIb).
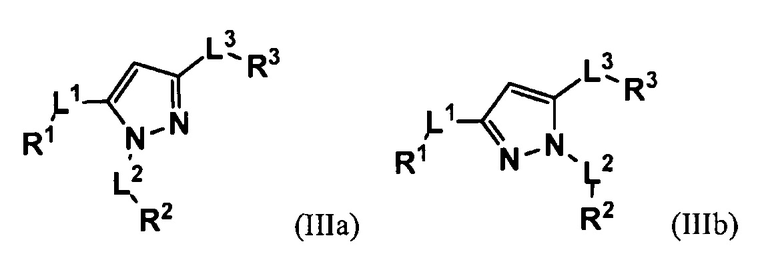
В некоторых вариантах осуществления соединение имеет структуру формулы (IIIa). В некоторых вариантах осуществления L3 обозначает связь или замещенный или незамещенный алкилен, и R3 обозначает замещенный или незамещенный арил, или замещенный или незамещенный гетероциклоалкил. В некоторых вариантах осуществления R3 обозначает замещенный или незамещенный фенил, или замещенный или незамещенный пиридил. В некоторых вариантах осуществления R3 обозначает незамещенный фенил. В некоторых вариантах осуществления R3 обозначает незамещенный пиридил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIIa), в которой L3 обозначает -C(O)О-, и R3 обозначает замещенный или незамещенный алкил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIIa), в которой L3 обозначает -C(O)NR6, R6 обозначает водород или алкил, и R3 обозначает замещенный или незамещенный алкил, или замещенный или незамещенный арил.
В дополнение к любому варианту осуществления, описанному выше, в котором соединение имеет структуру формулы (IIIa), в некоторых вариантах осуществления L1 обозначает -S-, -NR4-, замещенный или незамещенный алкилен, или замещенный или незамещенный гетероалкилен, и R1 обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероциклоалкил. В некоторых вариантах осуществления L2 обозначает связь. В некоторых вариантах осуществления R2 обозначает водород. В некоторых вариантах осуществления L2 обозначает замещенный или незамещенный алкилен или -C(O)-, и R2 обозначает водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероциклоалкил.
В некоторых вариантах осуществления соединение имеет структуру формулы (IIIb). В некоторых вариантах осуществления L2 обозначает связь или замещенный или незамещенный алкилен. В некоторых вариантах осуществления L2 обозначает связь. В некоторых вариантах осуществления L2 обозначает незамещенный алкилен. В некоторых вариантах осуществления L2 обозначает замещенный алкилен. В некоторых вариантах осуществления R2 обозначает замещенный или незамещенный алкил, или замещенный или незамещенный арил. В дополнение к любому частному значению L2, в некоторых вариантах осуществления R2 обозначает замещенный или незамещенный алкил, или замещенный или незамещенный арил. В некоторых вариантах осуществления R2 обозначает незамещенный алкил. В некоторых вариантах осуществления R2 обозначает незамещенный арил. В некоторых вариантах осуществления R2 обозначает замещенный алкил. В некоторых вариантах осуществления R2 обозначает замещенный арил.
В некоторых вариантах осуществления изобретение относится к соединению согласно формуле (Ib) со структурой следующей формулы (IV).
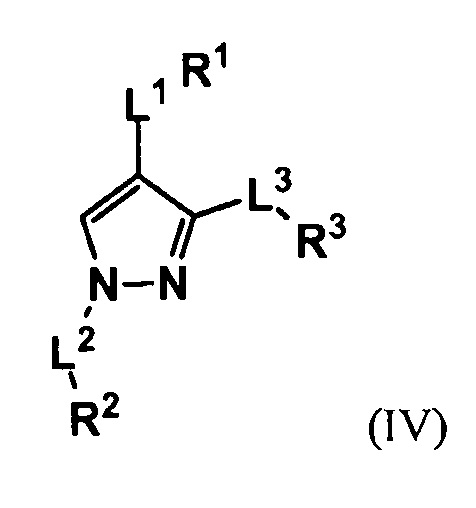
В некоторых вариантах осуществления изобретение относится к соединению с формулой (IV), в которой L3 обозначает связь, замещенный или незамещенный алкилен, или замещенный или незамещенный гетероалкилен, и R3 обозначает замещенный или незамещенный арил, или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления L3 обозначает связь, -NH-, -NHCH2- или -NH(CH2)2-.
В дополнение к любому варианту соединения со структурой формулы (IV), в некоторых вариантах осуществления L1 обозначает связь, замещенный или незамещенный алкилен, замещенный или незамещенный гетероалкилен, -C(O)-, -C(O)-NR6-. В некоторых вариантах осуществления R1 обозначает водород, -COOH, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил; замещенный или незамещенный гетероциклоалкил. В некоторых вариантах осуществления R6 обозначает водород или замещенный или незамещенный алкил.
В некоторых вариантах осуществления изобретение относится к соединению согласно формуле (Ia) со структурой следующей формулы (V).

В некоторых вариантах осуществления изобретение относится к соединению с формулой (V), в которой L4 обозначает связь; и R4 обозначает водород, замещенный или незамещенный алкил, или замещенный или незамещенный гетероалкил. В некоторых вариантах осуществления R4 обозначает незамещенный алкил.
Примеры соединений, например, мультизамещенных ароматических соединений, в соответствии с настоящим раскрытием, приведены здесь. В следующей таблице А раскрыты номер соединения (Соед), химическое название (то есть, название согласно International Union of Pure and Applied Chemistry [IUPAC]), молекулярная масса (ММрассчит., рассчитанная масса и ММизмер., измеренная масса) и биологическая активность (то есть, активность ингибирования в тромбиновом тесте).
Относительно экспериментальных молекулярных масс, полученных масс-спектрометрическим анализом, как описано здесь, включая таблицу A, если не указано иное, следует понимать, что взвешенные химические разновидности могут быть протонированным соединением, например, [М+Н]+, в соответствии с чем взвешенная масса на 1 атомную единицу больше, чем расчетная масса соединения, что известно в данной области техники.
Для следующей таблицы А, раскрытые соединения были протестированы в отношении ингибирования протеазной активности тромбина, как описано здесь. В таблице A, уровень ингибирования в тромбиновом тесте обозначен следующим образом: a: IC50 ≤0,1 мкМ; b: 0,1 мкМ < IC50 < 1 мкМ; c: IC50 ≥1 мкМ. Соответственно, в некоторых вариантах осуществления изобретение относится к соединению как явно сформулировано в следующей таблице А.
сульфанил-1-[(2-метоксифенил)
карбонил]-1H-1,2,4-триазол-3-ил)пиридин
В некоторых вариантах осуществления изобретение относится к соединению, как явно представлено в следующей таблице B.
Соединения, раскрытые здесь, также включают рацемические смеси, стереоизомеры и смеси соединений, включая изотопно меченные и радиоактивно меченные соединения. См. например, Goding, 1986, MONOCLONAL ANTIBODIES PRINCIPLES AND PRACTICE; Academic Press, p. 104. Такие изомеры могут быть выделены стандартными методиками разделения, включая, например, фракционную кристаллизацию, хиральную хроматографию и т.п. См. например, Eliel, E. L. & Wilen S. H., 1993, STEREOCHEMISTRY IN ORGANIC COТ.пл.OUNDS; John Wiley & Sons, New York.
В некоторых вариантах осуществления соединения, раскрытые здесь, имеют центры асимметрии и могут существовать как рацематы, рацемические смеси и как индивидуальные энантиомеры или диастереоизомеры, причем все изомерные формы, а также их смеси, рассматриваются как пригодные для использования в соединениях и способах, описанных здесь. Соединения, рассмотренные для использования в соединениях и способах, описанных здесь, не включают соединения, которые, как известно в данной области техники, являются слишком нестабильными для синтеза и/или выделения.
Соединения, раскрытые здесь, могут также содержать неестественные соотношения атомных изотопов в отношении одного или более атомов, которые составляют такие соединения. Например, соединения могут быть радиоактивно мечены радиоактивными изотопами, такими как, например, тритий (3H), йод 125 (125I) или углерод 14 (14C). Все изотопные вариации соединений, раскрытых здесь, радиоактивные или нет, входят в объем изобретения.
В некоторых вариантах осуществления метаболиты соединений, раскрытых здесь, могут использоваться в способах, раскрытых здесь.
В некоторых вариантах осуществления соединения, рассмотренные здесь, находятся в форме пролекарства. Термин "пролекарство" относится к соединению, которое может быть превращено в соединение (например, биологически активное соединение), описанное здесь, in vivo. Пролекарства могут быть полезными в силу разнообразных причин, известных в данной области техники, включая, например, легкость введения вследствие, например, увеличенной биодоступности при пероральном введении, и т.п. Пролекарство может также иметь улучшенную растворимость в фармацевтических композициях по сравнению с биологически активным соединениям. Неограничивающим примером пролекарства является соединение, которое вводят как сложный эфир (то есть, "пролекарство"), чтобы облегчить прохождение через клеточные мембраны, где водорастворимость вредна с точки зрения обеспечения мобильности, но которое затем метаболически гидролизуется до карбоновой кислоты, активного соединения, после попадания в клетку, где водорастворимость полезна. Обычные процедуры выбора и получения подходящих производных пролекарства описаны, например, в DESIGN OF PRODRUGS, (ed. H. Bundgaard, Elsevier, 1985), который ,тем самым, включен в настоящее описание путем ссылки для ограниченной цели описания процедур и получения подходящих производных пролекарства.
Соответственно, в некоторых вариантах осуществления соединения, рассмотренные здесь, находятся в форме сложного эфира пролекарства. Термин "сложный эфир пролекарства" относится к производным соединений, раскрытых здесь, образованным присоединением любой из разнообразных образующих сложные эфиры групп, например, групп, известных в данной области техники, которые гидролизуются в физиологических условиях. Примеры сложноэфирных групп пролекарства включают пивалоилоксиметил, ацетоксиметил, фталидил, инданил и метоксиметил, а также другие такие группы, известные в данной области техники, включая (5-R-2-оксо-1,3-диоксолен-4-ил)метильную группу. Другие примеры сложноэфирных групп пролекарства могут быть найдены, например, в T. Higuchi and V. Stella, in "Pro-drugs as Novel Delivery Systems", Vol. 14, A.C.S. SyТ.пл.osium Series, American Chemical Society (1975); и BIOREVERSIBLE CARRIERS IN DRUG DESIGN: THEORY AND APPLICATION, E. B. Roche, Pergamon Press: New York, 14-21 (1987) (включает примеры сложных эфиров, пригодных в качестве пролекарств соединений, содержащих карбоксильные группы). Каждый из приведенных библиографических источников включен в настоящее описание путем ссылки с ограниченной целью раскрытия образующих сложный эфир групп, которые могут образовывать сложные эфиры пролекарства.
В некоторых вариантах осуществления пролекарства могут медленно превращаться в соединения, описанные здесь, пригодные для способов, описанных здесь, при помещении в резервуар трансдермального пластыря с подходящим ферментом или химическим реагентом.
Некоторые соединения, раскрытые здесь, могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В общем, сольватированные формы эквивалентны несольватированным формам и входят в рамки рассматриваемых соединений. Некоторые соединения согласно настоящему изобретению могут существовать в множестве кристаллических или аморфных форм. В общем, все физические формы эквивалентны для соединений и способов, рассмотренных здесь, и входят в объем изобретения, раскрытого здесь.
III. Биологические активности
В некоторых вариантах осуществления соединения, описанные здесь, демонстрируют ингибирующую активность против тромбина с активностями ≥1 мкМ, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 мкМ или более. В некоторых вариантах осуществления соединения показывают ингибирующую активность против тромбина с активностями от 0,1 мкМ до 1 мкМ, например, приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 мкМ. В некоторых вариантах осуществления соединения, описанные здесь, демонстрируют ингибирующую активность против тромбина с активностями ≤0,1 мкМ, например, приблизительно 1, 2, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мкМ. Диапазоны значений с использованием комбинаций любых из значений, указанных здесь, в качестве верхних и/или нижних пределов, также входят в рамки изобретения, например, но не ограничиваясь ими, 1-10 мкМ, 10-100 мкМ, 0,1-1 мкМ, 1-10 мкМ, 10-100 мкМ, 100-200 мкМ, 200-500 мкМ или 500-1000 мкМ. В некоторых вариантах осуществления ингибирующая активность находится в диапазоне приблизительно 1-10 мкМ, 10-100 мкМ, 0,1-1 мкМ, 1-10 мкМ, 10-100 мкМ, 100-200 мкМ, 200-500 мкМ или 500-1000 мкМ. Следует понимать, что в целях количественного анализа, термины "активность", "ингибирующая активность", "биологическая активность", "активность тромбина" и т.п. в контексте ингибирующего соединения, раскрытого здесь, может быть определена количественно различными путями, известными в данной области техники. Если не указано иное, в рамках изобретения такие термины относятся к IC50 в общепринятом смысле (то есть, концентрация, необходимая для достижения полумаксимального ингибирования).
Ингибирующая активность против тромбина в свою очередь ингибирует процесс коагуляции крови. Соответственно, соединения, раскрытые здесь, показаны для лечения или борьбы с тромботическими нарушениями. В некоторых вариантах осуществления доза или терапевтически эффективная доза соединения, раскрытого здесь, является достаточной для достижения плазменной концентрации соединения или его активного метаболита(ов) в пределах диапазона, сформулированного здесь, например, приблизительно 1-10 нМ, 10-100 нМ, 0,1-1 мкМ, 1-10 мкМ, 10-100 мкМ, 100-200 мкМ, 200-500 мкМ или 500-1000 мкМ, предпочтительно приблизительно 1-10 нМ, 10-100 нМ или 0,1-1 мкМ. Вне связи с какой-либо теорией, считается, что такие соединения показаны для лечения или борьбы с тромботическими нарушениями.
IV. Способы лечения и профилактики заболевания
Тромбоз. Тромботические заболевания являются первичными показаниями для ингибирования тромбина из-за местоположения тромбина в каскаде коагуляции и, в свою очередь, важности каскада коагуляции в прогрессии процессов свертывания крови. Однако, вне связи с какой-либо теорией, считается, что каскад коагуляции в общем и тромбин в частности, являются важными в различных других болезненных состояниях.
Было обнаружено, что соединения, описанные здесь, например, мультизамещенные ароматические соединения, показывают ингибирующую активность против тромбина (активированный фактор свертывания крови II; EC 3.4.21.5). Это, в свою очередь, ингибирует процесс коагуляции крови.
Это ингибирующее действие является полезным в лечении различных тромботических нарушений, таких как, но не ограничиваясь ими, острые сосудистые заболевания, такие как острые коронарные синдромы; венозные, артериальные и кардиогенные тромбоэмболии; профилактике других состояний, таких как диссеминированное внутрисосудистое свертывание или другие состояния, которые включают наличие или потенциальное формирование тромба. Другие показания для способов, описанных здесь, включают следующее.
Рак. Давно известно, что прогрессия рака сопровождается венозным тромбозом, но не было понятно, как каждое заболевание с ним связано. На основании нескольких клинических испытаний, в которых изучали лечение VTE, метаанализы показали, что низкомолекулярные гепарины (LMWH) улучшают общее выживание в подгруппах больных раком. См., например, Zacharski, L. R. & Lee, A. Y., 2008, Expert Opin Investig Drugs, 17: 1029-1037; Falanga, A. & Piccioli, A., 2005, Current Opinion in Pulmonary Medicine, 11:403-407; Smorenburg, S. M., et al., 1999, Thromb Haemost, 82: 1600-1604; Hettiarachchi, R. J., et al., 1999, Thromb Haemost, 82:947-952. Это открытие было обосновано в более поздних клинических испытаниях, в которых измеряли специфично выживание больных раком. См. например, Lee, A. Y. et al., 2005, J Clin Oncol, 23:2123-2129; Klerk, C. P.et al., J Clin Oncol 2005, 23:2130-2135; Kakkar, A. K., et al., 2004, J Clin Oncol, 22:1944-1948; Altinbas, M., et al., 2004, J Thromb Haemost, 2: 1266-1271.
Позднее исследователи сосредоточились на специфическом противораковом эффекте DTI. Например, показано, что гепарин значительно продлевал выживание пациентов с ограниченным мелкоклеточным раком легкого. См. например, Akl, E. A., et al., 2008, J Exp Clin Cancer Res, 27:4. Другие исследователи обнаружили, что системное использование аргатробана уменьшало массу опухоли и продлевало время выживания в крысиных моделях глиомы, вынуждая прийти к заключению, что аргатробан нужно рассматривать как новое терапевтическое средство для лечения глиомы, общеизвестно трудноизлечимого типа рака. См. например, Hua, Y., et al., 2005, Acta Neurochir, Suppl 2005, 95:403-406; Hua, Y., et al., 2005, J Thromb Haemost, 3: 1917-1923. Совсем недавно было продемонстрировано, что дабигатран этексилат, DTI, недавно апробированный FDA (см. например, Hughes, B., 2010, Nat Rev Drug Discov, 9,:903-906) для показаний DVT, ингибировал как инвазию, так и метастаз злокачественных опухолей молочной железы. См. например, DeFeo, K. et al., 2010, Thrombosis Research, 125 (Supplement 2): S188-S188; Defeo, K., et al., 2010, Cancer Biol Ther, 10: 1001-1008. Таким образом, лечение дабигатран этексилатом приводило к 50%-му сокращению объема опухоли за 4 недели без снижения массы тела у получавших лечение мышей. Дабигатран этексилат также уменьшал опухолевые клетки в микрометастазах крови и печени на 50-60%. Эти исследователи пришли к заключению, что дабигатран этексилат может быть полезным не только для профилактики тромботических событий у больных раком, но также и в качестве дополнительной терапии для лечения злокачественных опухолей.
Далее, гирудин и LMWH надропарин резко уменьшали количество метастазов легкого при введении до инокуляции раковыми клетками. См. например, Hu, L., et al., 2004, Blood, 104:2746-51.
Было обнаружено, что ингибитор тромбина de novo d-Arg-Oic-Pro-d-Ala-Phe(p-Me) блокирует стимулируемую тромбином инвазию линии раковых клеток предстательной железы РС-3 зависимым от концентрации образом. См. например, Nieman, M. T., et al., 2008, J Thromb Haemost, 6:837-845. Сниженная скорость роста опухоли наблюдалась у мышей, которым через питьевую воду вводили пентапептид. Мыши также показали кратно уменьшенный размер опухоли и уменьшенную в целом массу опухоли по сравнению с необработанными мышами. Микроскопическое исследование излеченных опухолей показало уменьшенное количество больших кровеносных сосудов, таким образом позволяя сделать заключение, что пентапептид препятсвовал ангиогенезу опухоли. Nieman, M. T., et al., Thromb Haemost, 104: 1044-8.
Ввиду этих и связанных исследований было сделано предположение, что антикоагулирующие средства воздействуют на метастазирование опухоли; то есть, процессы ангиогенеза, адгезии раковых клеток, миграции и инвазии. См. например, Van Noorden, C. J., et al., 2010, Thromb Res, 125 Suppl 2:S77-79.
Фиброз. Несколько исследований показали полезность терапии антикоагулирующими средствами при фиброзных нарушениях. Например, в крысиной модели CCl4-индуцированного хронического повреждения печени, DTI SSR182289 значительно уменьшил фиброгенез печени после 7 недель введения (источник 24). Подобные наблюдения были сделаны в других исследованиях с использованием LMWH надропарина (источник 25), тинзапарина (источник 25), эноксапарина (источник 26) и далтепарина натрия (источник 27). См. например, Duplantier, J. G., et al., 2004, Gut, 53: 1682-1687; Abdel-Salam, O. M., et al., 2005, Pharmacol Res, 51:59-67; Assy, N., et al., 2007, Dig Dis Sci, 52:1187-1193; Abe, W., et al., 2007, J Hepatol, 46:286-294.
В другом примере DTI мелагатран значительно уменьшал повреждение ишемии-реперфузии в почечной модели трансплантата у больших белых свиней. Это приводило к решительному улучшению приживания почечного трансплантата в 3 месяца. См. например, Favreau, F., et al., 2010, Am J Transplant, 10:30-39.
Недавние исследования показали, что в блеомицин-индуцированной модели легочного фиброза мыши лечение дабигатран этексилатом уменьшало важные профиброзные события в фибробластах легкого, включая продукцию фактора роста соединительной ткани и коллагена. См. например, Silver, R. M., et al., 2010, Am. J. Respir. Crit. Care Med., 181:A6780; Bogatkevich, G. S., et al., 2009, Arthritis Rheum, 60:3455-3464.
Приведенные выше экспериментальные доказательства указывают на близкую зависимость между тромбином и фиброзом (источник 31) и предлагают новые терапевтические возможности фиброза с использованием ингибиторов тромбина (источники 32-34). См. например, Calvaruso, V., et al., 2008, Gut, 57: 1722-1727; Chambers, R. C, 2008, Br J Pharmacol, 153 Suppl l :S367-378; Chambers, R. C. & Laurent, G. J., 2002, Biochem Soc Trans, 30: 194-200; Howell, D. C, et al., 2001, Am J Pathol, 159: 1383-1395.
Болезнь Альцгеймера. Очень недавние эксперименты подтверждают более высокие уровни тромбина в мозговых эндотелиальных клетках пациентов с болезнью Альцгеймера. В то время как ‘нормальные’ уровни тромбина связаны с регуляторными функциями ЦНС, аккумуляция тромбина в мозге является токсичной. Также было обнаружено, что количество неврального ингибитора тромбина Протеазы Nexin 1 (PN-1) значительно уменьшалось в мозге при болезни Альцгеймера, несмотря на то, что уровни мРНК PN-1 были неизменными. Эти наблюдения привели некоторых исследователей к предположению, что сокращение ЦНС-резидентского тромбина окажется полезным при лечении болезни Альцгеймера (AD). См. например, Vaughan, P. J., et al., 1994, Brain Res, 668: 160-170; Yin, X., et al., 2010, Am J Pathol, 176:1600-1606; Akiyama, H., et al., 1992, Neurosci Lett, 146:152-154.
Рассеянный склероз. Исследователи обнаружили, что лечение гирудином в модели рассеянного склероза на животных (MS) показало резкое уменьшение серьезности заболевания (источник 38). См. например, Han, M. H., et al., 2008, Nature, 451: 1076-1081. Подобные результаты были получены после лечения гепарином (источник 39) (DTI) и дерматан сульфатом (источник 40), другим ингибитором коагуляции. См. например, Chelmicka-Szorc, E. & Arnason, B. G., 1972, Arch Neurol, 27: 153-158; Inaba, Y., et al., 1999, Cell Immunol, 198:96-102. Другие данные показывают, что природный антитромбин III имеет противовоспалительные эффекты при таких заболеваниях как эндотоксемия и другие связанные с сепсисом состояния. См. например, Wiedermann, C. J. & Romisch, J., 2002, Acta Med Austriaca, 29:89-92. Природные ингибиторы тромбина, по-видимому, синтезируются in situ и играют защитную роль в воспалении ЦНС. Поэтому терапевтическое ингибирование тромбина было предложено как потенциальное лечение MS. См. например, Luo, W., et al., 2009, In: THROMBIN, Maragoudakis, M. E.; Tsopanoglou, N. E., Eds. Springer New York: 2009; pp 133-159.
Боль. В крысиной модели боли с частичным поражением седалищного нерва внутриоболочковый гирудин предотвращал развитие нейропатической боли и сокращал болевые ответы в течение 7 дней. Исследователи обнаружили, что после повреждения нейропатическая боль опосредуется генерацией тромбина, который, в свою очередь, активировал рецептор PAR-1 в спинном мозге. Гирудин ингибировал генерацию тромбина и в конечном счете приводил к уменьшению боли (источники 43, 44). См. например, Garcia, P. S., et al., 2010, Thromb Haemost, 103:1145-1151; Narita, M., et al., 2005, J Neurosci, 25: 10000-10009. Исследователи выдвинули гипотезу, что тромбин и PAR участвуют не как часть каскада коагуляции, но в воспалении, ноцицепции и развитии мозга. Развитие DTI в рамках неразработанной до сих пор фармакологии приведет к средствам для терапии боли, отличным от опиоидов и NSAID, недостатки которых хорошо задокументированы. См. например, Garcia 2010, Id.
Соответственно, в следующем аспекте изобретение относится к способу лечения заболевания или нарушения у пациента. Способ включает введение соединения любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, соединения, представленного в любой из таблиц A, B или C, его фармацевтически приемлемой соли, сложного эфира, сольвата или пролекарства, или его фармацевтической композиции, пациенту в количестве, эффективном для лечения заболевания или нарушения. Термины "терапевтически эффективное количество", "количество, эффективное для лечения", "количество, эффективное для профилактики" и т.п. относятся к такому количеству лекарственного средства или фармацевтического средства (например, соединения или фармацевтической композиции, раскрытых здесь), которое вызывает биологический или медицинский ответ ткани, системы, организма животного или человека, который изыскивается исследователем, ветеринаром, врачом или другим клиническим специалистом.
Соединения, пригодные для способов, раскрытых здесь, включают соединения, сформулированные для формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) и (V), и соединения, сформулированные выше в таблицах A и B. Дополнительно, соединения, пригодные для способов, раскрытых здесь, включают соединения, приведенные далее в таблице C. Для таблицы C, соединения тестировали в отношении ингибирования протеазной активности тромбина, как описано для таблицы A.
В некоторых вариантах осуществления заболевание или нарушение представляет собой тромботическое заболевание или нарушение. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой острый коронарный синдром, венозную тромбоэмболию, артериальную тромбоэмболию или кардиогенную тромбоэмболию. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой острый коронарный синдром. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой венозную тромбоэмболию. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой артериальную тромбоэмболию. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой кардиогенную тромбоэмболию.
В некоторых вариантах осуществления заболевание или нарушение представляет собой фиброз, болезнь Альцгеймера, рассеянный склероз, боль или рак. В некоторых вариантах осуществления заболевание или нарушение представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления заболевание или нарушение представляет собой рассеянный склероз.
В некоторых вариантах осуществления заболевание или нарушение представляет собой фиброз. В некоторых вариантах осуществления, в которых рассматривается фиброз, способ направлен на лечение хронического повреждения печени. В некоторых вариантах осуществления заболевание или нарушение представляет собой повреждение ишемии-реперфузии. В некоторых вариантах осуществления заболевание или нарушение представляет собой легочный фиброз.
В некоторых вариантах осуществления заболевание или нарушение представляет собой боль. В некоторых вариантах осуществления боль представляет собой нейропатическую боль.
В некоторых вариантах осуществления заболевание или нарушение представляет собой рак. В некоторых вариантах осуществления рак представляет собой ограниченный мелкоклеточный рак легкого. В некоторых вариантах осуществления рак представляет собой глиому. В некоторых вариантах осуществления рак представляет собой злокачественный рак молочной железы. В некоторых вариантах осуществления рак представляет собой микрометастаз. В некоторых вариантах осуществления микрометастаз является метастазом в кровь или печень. В некоторых вариантах осуществления рак представляет собой метастаз легкого. В некоторых вариантах осуществления рак представляет собой рак предстательной железы.
В другом аспекте изобретение относится к способу профилактики заболевания или нарушения у пациента. Способ включает введение соединения любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, соединения, представленного в любой из таблиц A, B или C, его фармацевтически приемлемой соли, сложного эфира, сольвата или пролекарства или его фармацевтической композиции, пациенту в количестве, эффективном для профилактики заболевания или нарушения.
В некоторых вариантах осуществления заболевание или нарушение представляет собой тромботическое нарушение. В некоторых вариантах осуществления тромботическое нарушение представляет собой острый коронарный синдром, венозную тромбоэмболию, артериальную тромбоэмболию или кардиогенную тромбоэмболию. В некоторых вариантах осуществления тромботическое заболевание или нарушение представляет собой диссеминированное внутрисосудистое свертывание. В некоторых вариантах осуществления тромботическое нарушение включает наличие или потенциальное формирование тромба.
В дополнение к этому аспекту, в некоторых вариантах осуществления заболевание или нарушение представляет собой фиброз, болезнь Альцгеймера, рассеянный склероз, боль или рак. В некоторых вариантах осуществления заболевание или нарушение представляет собой фиброз. В некоторых вариантах осуществления заболевание или нарушение представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления заболевание или нарушение представляет собой рассеянный склероз. В некоторых вариантах осуществления заболевание или нарушение представляет собой боль. В некоторых вариантах осуществления заболевание или нарушение представляет собой рак.
V. Тесты
Соединения, описанные здесь, могут быть протестированы различными способами, известными в данной области техники и описанными здесь, для ингибирования биологической активности, например, протеазной активности, различных белков, например, тромбина. Например, протеазная активность таких белков, например, тромбина, может быть проверена с использованием хромофорного субстрата, например, п-нитроанилидного пептидного субстрата, который в результате гидролиза высвобождает п-нитроанилид, который в свою очередь дает начало изменению цвета, которое может быть определено спектрофотометрически. См. например, Lottenberg, R, et al., 1983, Biochemica et Biophysica Acta, 752:539-557. Соответственно, изменение в цвете может быть проверено спектрофотометром при, например, 405 нм, чтобы обеспечить сигнал, который является прямо пропорциональным протеолитической активности фермента.
Активность тромбина, приведенная здесь (например, в таблице A), была получена следующим образом. Человеческий тромбин был получен от Haematologic Technologies Inc. Хромогенный субстрат S-2238 был получен от DiaPharma. Тромбин тестировали в буфере, содержащем 0,05 M Tris (pH 7,4), 0,015 M NaCl и 0,01% PEG-8000. Конечная концентрация используемого фермента составляла 3 нМ тромбина. Конечная концентрация используемого субстрата составляла 125 мкМ S-2238 для тромбина. Все тесты осуществляли в планшетах для микротитратора с 96 лунками при комнатной температуре (RT). Фермент и ингибитор преинкубировали в течение 10 минут, затем добавляли субстрат и считывали при 405 нм в спектрофотометре SpectraMax Plus (Molecular Devices). Ингибиторные значения IC50 определяли, добавляя тестируемое соединение как тройные серийные разведения для десяти концентраций в буферном растворе, как известно в данной области техники. Планшет считывали через 10 минут после добавления субстрата. IC50 вычисляли, изображая процент (%) ингибирования против концентрации соединения и приспосабливая данные к сигмовидной кривой с принужденными четырьмя параметрами, как известно в данной области техники.
VI. Фармацевтические композиции
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение, раскрытое здесь, и фармацевтически приемлемый эксципиент. Соединение представляет собой соединение любой из формул (Ia), (Ib), (IIa), (IIb), (IIIa), (IIIb), (IV) или (V), как раскрыто здесь, соединения, представленного в любой из таблиц A, B или C, или его фармацевтически приемлемой соли, сложного эфира, сольвата или пролекарства. В некоторых вариантах осуществления соединение представлено в таблице А. В некоторых вариантах осуществления соединение представлено в таблице B. В некоторых вариантах осуществления соединение представлено в таблице C.
Термин "фармацевтически приемлемые соли" включает соли активных соединений, полученные с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, находящихся на соединениях, описанных здесь. Когда соединения, раскрытые здесь, содержат относительно кислые функциональные группы, соли присоединения с основанием могут быть получены введением в контакт нейтральной формы таких соединений с достаточным количеством желаемого основания, в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения с основанием включают соль натрия, калия, кальция, аммония, органического амино или магния, или подобную соль. Когда соединения, раскрытые здесь, содержат относительно основные функциональные группы, соли присоединения с кислотой могут быть получены введением в контакт нейтральной формы таких соединений с достаточным количеством желаемой кислоты, в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения с кислотой включают полученные из неорганических кислот, таких как хлористоводородная, бромистоводородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодистоводородная или фосфористая кислоты и т.п., а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая, фумаровая, молочная, миндальная, фталевая, бензолсульфоновая, п-толилсульфоновая, лимонная, винная, щавелевая, метансульфоновая и т.п. Также в рамки изобретения включены соли аминокислот, такие как аргинат и т.п., и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и т.п. (см., например, Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые специфические соединения, раскрытые здесь, содержат как основные, так и кислые функциональные группы, которые позволяют соединениям превращаться в соли присоединения как с основанием, так и с кислотой.
Соединения, раскрытые здесь, могут существовать как соли, такие как соли с фармацевтически приемлемыми кислотами. Соответственно, соединения, рассмотренные здесь, включают такие соли. Примеры таких солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты (например, (+)-тартраты, (-)-тартраты или их смеси, включая рацемические смеси), сукцинаты, бензоаты, и соли с аминокислотами, такими как глутаминовая кислота. Эти соли могут быть получены способами, известными специалисту.
Нейтральные формы соединений предпочтительно восстанавливают путем введения в контакт соли с основанием или кислотой и выделением родительского соединения обычным образом. Родительская форма соединения отличается от различных форм соли некоторыми физическими свойствами, такими как растворимость в полярных растворителях.
Фармацевтически приемлемые соли соединений, описанных выше, где основная или кислая группа присутствует в структуре, также включены в рамки соединений, рассмотренных здесь. Когда присутствует кислый заместитель, такой как -NHSO3H, -COOH и -P(O)(ОН)2, можно образовать соль аммония, натрия, калия, кальция и т.п., для использования в виде лекарственной формы. Основные группы, такие как амино или основные гетероарильные радикалы, или пиридил и кислые соли, такие как гидрохлорид, гидробромид, ацетат, малеат, пальмоат, метансульфонат, п-толуолсульфонат, и т.п., могут использоваться в виде лекарственной формы.
Кроме того, в вариантах осуществления, в которых присутствует R-COOH, могут использоваться фармацевтически приемлемые сложные эфиры, например, метиловый, этиловый, трет-бутиловый, пивалоилоксиметиловый и т.п., и сложные эфиры, известные в данной области техники для модификации растворимости или характеристик гидролиз для использования в форме составов замедленного высвобождения или пролекарства.
A. Составы
Соединения, раскрытые здесь, могут быть получены и введены в широкой разновидности пероральных, парентеральных и топических лекарственных форм. Так, соединения могут вводиться инъекцией (например, внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно). Кроме того, соединения, описанные здесь, могут вводиться ингаляцией, например, интраназально. Дополнительно, соединения, раскрытые здесь, могут вводиться чрескожно. Также предполагается, что для введения соединений, раскрытых здесь, могут использоваться множественные пути введения (например, внутримышечный, пероральный, чрескожный). В некоторых вариантах осуществления соединения, раскрытые здесь, могут вводиться перорально как таблетки, водные или масляные суспензии, таблетки для рассасывания, пастилки, порошки, гранулы, эмульсии, капсулы, сиропы или эликсиры. Композиция для перорального использования может содержать одно или более средств, выбранных из группы подсластителей, ароматизаторов, красителей и консервантов, для получения фармацевтически элегантных и приемлемых препаратов. Соответственно, изобретение также относится к фармацевтическим композициям, включающим фармацевтически приемлемый носитель или эксципиент и одно или более соединений, раскрытых здесь.
В некоторых вариантах осуществления таблетки содержат действующий ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые являются подходящими для производства таблеток. Этими эксципиентами могут быть, например, (1) инертные разбавители, такие как карбонат кальция, лактоза, фосфат кальция, карбоксиметилцеллюлоза или фосфат натрия; (2) гранулирующие и дезинтегрирующие средств, такие как кукурузный крахмал или альгиновая кислота; (3) связующие, такие как крахмал, желатин или гуммиарабик; и (4) лубриканты, такие как стеарат магния, стеариновая кислота или тальк. Эти таблетки могут быть без покрытия или быть покрыты известными методиками для задержки разложения и абсорбции в желудочно-кишечном тракте и таким образом обеспечения пролонгированного действия за более длительный период. Например, может использоваться материал для задержки времени, такой как глицерил моностеарат или глицерил дистеарат. Покрытие можно также сформировать, используя методики, описанные в патентах США.
Для получения фармацевтических композиций из соединений, раскрытых здесь, фармацевтически приемлемые носители могут быть твердыми или жидкими. Твердые формы препаратов включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и дисперсивные гранулы. Твердый носитель может быть одним или более веществами, которые могут также действовать как разбавители, ароматизаторы, связующие, консерванты, дезинтеграторы таблеток или инкапсулирующий материал.
Соединение, раскрытое здесь, в форме свободного соединения или фармацевтически приемлемого пролекарства, метаболита, аналога, производного, сольвата или соли, может вводиться, для применения in vivo, парентерально инъекцией или постепенной перфузией в течение времени. Введение может быть внутривенным, внутрибрюшинным, внутримышечным, подкожным, внутриполостным или чрескожным. Для исследований in vitro соединения могут быть добавлены или растворены в подходящем биологически приемлемом буфере и добавлено к клетке или ткани.
В порошках носитель представляет собой тонкодисперсное твердое вещество в смеси с тонкодисперсным активным компонентом. В таблетках активный компонент смешан с носителем, имеющим необходимые связующие способности, в подходящих соотношениях и спрессован в желаемые форму и размер.
Порошки и таблетки предпочтительно содержат от 5% до 70% активного соединения. Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натрий карбоксиметилцеллюлоза, воск с низкой температурой плавления, масло какао и т.п. Термин "препарат" включает состав активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивающим получение капсулы, в которой активный компонент, с другими носителями или без других носителей, окружен носителем, который, таким образом, находится с ним в ассоциации. Точно так же включены облатки и таблетки. Таблетки, порошки, капсулы, пилюли, облатки и таблетки могут использоваться как твердые лекарственные формы, подходящие для перорального введения.
Для получения суппозиториев сначала расплавляют воск с низкой температурой плавления, такой как смесь глицеридов жирной кислоты или масла какао, и активный компонент гомогенно диспергируют в нем при перемешивании. Расплавленную гомогенную смесь затем льют в формы подходящего размера, дают охладиться и таким образом затвердеть.
Жидкие формы препаратов включают растворы, суспензии и эмульсии, например, водные растворы или растворы в смеси вода/пропиленгликоль. Для парентеральной инъекции жидкие препараты могут быть составлены в растворе в водном растворе полиэтиленгликоля.
Когда необходимо или желаемо парентеральное применение, особенно подходящие смеси для соединений, раскрытых здесь, представляет собой инъецируемые стерильные растворы, предпочтительно масляные или водные растворы, а также суспензии, эмульсии или имплантаты, включая суппозитории. В частности, носители для парентерального введения включают водные растворы декстрозы, солевой раствор, чистую воду, этанол, глицерин, пропиленгликоль, арахисовое масло, кунжутное масло, блок-полимеры полиоксиэтилена и т.п. Ампулы являются удобными стандартными лекарственными формами. Соединения, раскрытые здесь, могут также быть включены в липосомы или вводиться через трансдермальные насосы или пластыри. Фармацевтические смеси, подходящие для использования в композициях фармацевтических препаратов и способах, раскрытых здесь, включают описанные, например, в PHARMACEUTICAL SCIENCES (17th Ed., Mack Pub. Co., Easton, PA) и WO 96/05309, содержание которых тем самым включены путем ссылки.
В некоторых вариантах осуществления препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, водно-спиртовые растворы, эмульсии или суспензии, включая солевой раствор и буферизованную среду. Парентеральные носители включают раствор хлорида натрия, декстрозы Рингера, декстрозы и хлорида натрия, лактатсодержащий раствор Рингера. Внутривенные носители включают жидкие и питательные добавки, электролитные добавки (такие как основанные на декстрозе Рингера) и т.п. Могут также присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, агенты для образованию хелатных соединений, факторы роста и инертные газы и т.п.
Водные растворы, подходящие для перорального использования, могут быть получены растворением активного компонента в воде и добавлением подходящих красителей, ароматизаторов, стабилизаторов и загустителей, если желательно. Водные суспензии, подходящие для перорального использования, могут быть получены диспергированием тонкодисперсного активного компонента в воде с вязкими материалами, такими как натуральные или синтетические каучуки, смолы, метилцеллюлоза, натрий карбоксиметилцеллюлоза, и другими известными суспендирующими агентами.
Также в рамки изобретения включены твердые формы препаратов, которые предназначены для превращения, незадолго до использования, в жидкие формы препаратов для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, красители, ароматизаторы, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергирующие агенты, загущающие агенты, солюбилизирующие агенты и т.п.
Фармацевтический препарат находится предпочтительно в стандартной лекарственной форме. В такой форме препарат подразделен на унифицированные дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может быть упакованным препаратом, причем упаковка содержит дискретные количества препарата, таким как упакованные таблетки, капсулы и порошки в пузырьках или ампулах. Кроме того, стандартная лекарственная форма может быть непосредственно капсулой, таблеткой, облаткой или таблеткой для рассасывания, или она может представлять собой подходящее количество любой из них в упакованной форме.
Количество активного компонента в препарате унифицированной дозы может варьировать или быть отрегулировано от 0,1 мг до 10000 мг, более предпочтительно от 1,0 мг до 1000 мг, наиболее предпочтительно от 10 мг до 500 мг, в зависимости от конкретного применения и потенциала активного компонента. Композиция может, если желательно, также содержать другие совместимые терапевтические средства.
Некоторые соединения могут иметь ограниченную растворимость в воде и поэтому могут требовать поверхностно-активного вещества или другого подходящего совместного растворителя в композиции. Такие совместные растворители включают: Полисорбат 20, 60 и 80; Pluronic F-68, F-84 и P-103; циклодекстрин; и касторовое масло polyoxyl 35. Такие совместные растворители обычно используются на уровне от приблизительно 0,01% до приблизительно 2% по весу.
Вязкость больше вязкости простых водных растворов может быть желательной для уменьшения вариабельности распределения составов, уменьшения физического разделения компонентов суспензии или эмульсии состава, и/или другого улучшения состава. Такие усиливающие вязкость агенты включают, например, поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, карбоксилметилцеллюлозу, гидроксипропилцеллюлозу, хондроитин сульфат и его соли, гиалуроновую кислоту и ее соли, и комбинации перечисленных средств. Такие средства обычно используют на уровне от приблизительно 0,01% до приблизительно 2% по весу.
Композиции, раскрытые здесь, могут дополнительно включать компоненты для обеспечения замедленного высвобождения и/или комфорта. Такие компоненты включают высокомолекулярные анионные мукомиметические полимеры, желирующие полисахариды и тонкодисперсные субстраты носителя лекарственного средства. Эти компоненты обсуждаются в больших подробностях в патентах США 4911920; 5403841; 5212162; и 4861760. Все содержание этих патентов полностью включено в настоящее описание путем ссылки во всех целях.
Настоящее изобретение относится к способам улучшения заживления ран и для опосредования восстановления тканей (включая, но не ограничиваясь ими, лечение заболевания периферических и коронарных сосудов). Согласно этим способам, пациента, имеющего рану или потребность в восстановлении ткани, обрабатывают на участке раны или поврежденной ткани или обрабатывают системно соединением, раскрытым здесь, в форме свободного соединения или фармацевтически приемлемого пролекарства, метаболита, аналога, производного, сольвата или соли.
Вообще, термины "лечение" и т.п. используются здесь для обозначения воздействия на пациента, ткань или клетку для получения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим в терминах полного или частичного предотвращения заболевания или нарушения, или его признака или симптома, и/или может быть терапевтическим в терминах частичного или полного излечения нарушения и/или неблагоприятного эффекта, относящегося к этому нарушению. "Лечение" в рамках изобретения покрывает любое лечение или профилактику заболевания или нарушения у позвоночного, млекопитающего, особенно человека, и включает: (a) препятствование возникновения заболевания или нарушения у пациента, который может быть предрасположен к этому заболеванию или нарушению, но у которого еще не было диагностировано его наличие; (b) ингибирование заболевания или нарушения, то есть, остановку его развития; или (c) выздоровление или облегчение заболевания или нарушения, то есть, индукцию регрессии заболевания или нарушения.
Изобретение относится к различным фармацевтическим композициям, пригодным для облегчения заболеваний и нарушений, включая тромбоз. В некоторых вариантах осуществления заболевание или нарушение представляет собой тромботическое нарушение. В некоторых вариантах осуществления заболевание или нарушение представляет собой острый коронарный синдром, венозную тромбоэмболию, артериальную тромбоэмболию или кардиогенную тромбоэмболию. В некоторых вариантах осуществления заболевание или нарушение представляет собой фиброз. В некоторых вариантах осуществления заболевание или нарушение представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления заболевание или нарушение представляет собой рассеянный склероз. В некоторых вариантах осуществления заболевание или нарушение представляет собой боль. В некоторых вариантах осуществления заболевание или нарушение представляет собой рак. Фармацевтические композиции согласно одному варианту осуществления получают, составляя соединение, раскрытое здесь, в форме свободного соединения или фармацевтически приемлемого пролекарства, метаболита, аналога, производного, сольвата или соли, индивидуально или вместе с другими фармацевтическими средствами, подходящими для введения пациенту с использованием носителей, эксципиентов и добавок или вспомогательных средств. Часто используемые носители или вспомогательные средства включают карбонат магния, диоксид титана, лактозу, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, витамины, целлюлозу и ее производные, животные и растительные масла, полиэтиленгликоли и растворители, такие как стерилизованная вода, спирты, глицерин и многоатомные спирты. Внутривенные носители включают жидкие и питательные добавки.
Консерванты включают противомикробные средства, антиоксиданты, агенты для образования хелатных соединений и инертные газы. Другие фармацевтически приемлемые носители включают водные растворы, нетоксичные эксципиенты, включая соли, консерванты, буферы и т.п., как описано, например, в Remington’s Pharmaceutical Sciences, 15th ed. Easton: Mack Publishing Co., 1405-1412, 1461-1487 (1975) и The National Formulary XIV., 14th ed. Washington: American Pharmaceutical Association (1975), содержание которых тем самым включено путем ссылки. рН и точную концентрацию различных компонентов фармацевтической композиции регулируют согласно обычным знаниям специалиста. См. например, Goodman and Gilman (eds.), 1990, THE PHARMACOLOGICAL BASIS FOR THERAPEUTICS (7th ed.).
Фармацевтические композиции предпочтительно получают и вводят в лекарственных формах. Твердыми лекарственными формами являются таблетки, капсулы и суппозитории. Для лечения пациента, в зависимости от активности соединения, способа введения, природы и серьезности заболевания или нарушения, возраста и массы тела пациента, могут использоваться различные суточные дозы.
При некоторых обстоятельствах, однако, могут быть адекватными более высокие или более низкие суточные дозы. Введение суточной дозы может быть осуществлено как единственным введением в форме индивидуальной разовой дозы или нескольких меньших доз, так и многократными введениями подразделенных доз через определенные интервалы.
Фармацевтические композиции, рассмотренные здесь, могут вводиться местно или системно в терапевтически эффективной дозе. Количества, эффективные для этого использования, будут, конечно, зависеть от серьезности заболевания или нарушения и массы тела и общего состояния пациента. Как правило, дозировки, используемые in vitro, могут обеспечить полезное руководство в количествах, полезных для введения in situ фармацевтической композиции, и модели животных могут использоваться для определения эффективных доз для лечения конкретных нарушений.
Различные аспекты описаны, например, в Langer, 1990, Science, 249: 1527; Goodman and Gilman’s (eds.), 1990, Id., каждый из которых включен в настоящее описание путем ссылки и во всех целях. Дозировки для парентерального введения активных фармацевтических средств могут быть преобразованы в соответствующие дозировки для перорального введения путем умножения парентеральных дозировок на подходящие переводные коэффициенты. Относительно общих применений, парентеральная дозировка в мг/м2×1,8 = соответствующая пероральная дозировка в миллиграммах ("мг"). Относительно применений в онкологии, парентеральная дозировка в мг/м2×1,6 = соответствующая пероральная дозировка в мг. Средний взрослый человек весит приблизительно 70 кг. См. например, Miller-Keane, 1992, ENCYCLOPEDIA & DICTIONARY OF MEDICINE, NURSING & ALLIED HEALTH, 5th Ed., (W. B. Saunders Co.), pp. 1708 and 1651.
Способ, которым соединение, раскрытое здесь, может вводиться для перорального использования, может заключаться, например, в твердой желатиновой капсуле, в которой активный ингредиент смешан с инертным твердым разбавителем, или мягкой желатиновой капсуле, в которой активный ингредиент смешан со смесью совместного растворителя, такого как ПЭГ 400, содержащего Tween 20. Соединение, раскрытое здесь, может также вводиться в форме стерильного инъецируемого водного или масляного раствора или суспензии. Соединение может вообще вводиться внутривенно или в форме пероральной дозы от 0,1 мкг до 20 мг/кг, например, каждые 3-12 часов.
Составы для перорального использования могут быть в форме твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином. Они могут также быть в форме мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, такой как арахисовое масло, жидкий парафин или оливковое масло.
Водные суспензии обычно содержат активные вещества в смеси с эксципиентами, подходящими для получения водной суспензии. Такими эксципиентами могут быть (1) суспендирующий агент, такой как натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакант и гуммиарабик; (2) диспергирующие или смачивающие вещества, которые могут быть (a) натуральным фосфатидом, таким как лецитин; (b) продуктом конденсации эпоксида с жирной кислотой, например, полиоксиэтилен стеаратом; (c) продуктом конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например, гептадекаэтиленоксицетанолом; (d) продуктом конденсации этиленоксида с неполным эфиром многоатомного спирта, полученным из жирной кислоты и гексита, таким как полиоксиэтилен сорбит моноолеатом, или (e) продуктом конденсации этиленоксида с неполным эфиром многоатомного спирта, полученным из жирных кислот и ангидридов гексита, например, полиоксиэтилен сорбитан моноолеатом.
Фармацевтические композиции могут быть в форме стерильной инъецируемой водной или масляной суспензии. Эта суспензия может быть составлена согласно известным способам с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих агентов, которые были упомянуты выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут использоваться, можно назвать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используются как растворитель или суспендирующая среда. С этой целью может использоваться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят использование в получении инъецируемых составов.
Соединение, раскрытое здесь, может также вводиться в форме суппозиториев для ректального введения лекарственного средства. Эти композиции могут быть получены смешиванием лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычной температуре, но жидким при температуре прямой кишки, и поэтому будет плавиться в прямой кишке, высвобождая лекарственное средство. Такие материалы включают масло какао и полиэтиленгликоли.
Соединения, раскрытые здесь, которые используются в способах, раскрытых здесь, могут также вводиться в форме липосомных систем доставки, таких как малые униламеллярные везикулы, большие униламеллярные везикулы и мультиламеллярные везикулы. Липосомы можно сформировать из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолин.
Для топического использования используются кремы, мази, гели, растворы или суспензии, и т.д., содержащие соединения, раскрытые здесь.
Кроме того, некоторые из соединений, раскрытых здесь, могут образовывать сольваты с водными или обычными органическими растворителями. Такие сольваты используют в рамках способов, рассмотренных здесь.
B. Эффективные дозировки
Фармацевтические композиции по изобретению включают композиции, в которых активный ингредиент содержится в терапевтически эффективном количестве, то есть, в количестве, эффективном для достижения его намеченной цели. Фактическое количество, эффективное для конкретного применения, зависит, среди прочего, от подвергаемого лечению состояния. Например, при использовании в способах лечения тромбоза такие композиции содержат количество активного ингредиента, эффективное для достижения желаемого результата (например, уменьшение степени тромбоза).
Дозировка и частота введения (единственные или многократные введения) вводимого соединения могут варьировать в зависимости от различных факторов, включая путь введения; рост, возраст, пол, состояние здоровья, массу тела, индекс массы тела и диету реципиента; природу и степень выраженности симптомов подвергаемого лечению заболевания (например, заболевания, чувствительного к ингибированию тромбина); наличие других заболеваний или других связанных со здоровьем проблем; вид параллельного лечения; и осложнения любого заболевания или режима лечения. Другие терапевтические режимы или средства могут использоваться в сочетании со способами и соединениями, раскрытыми здесь.
Для любого соединения, описанного здесь, терапевтически эффективное количество может быть первоначально определено различными методиками, известными в данной области техники, например, биохимическим исследованием ингибирования тромбина, тестов клеточной культуры и т.п. Целевые концентрации представляют собой такие концентрации активного соединения(й), которые способны уменьшать ферментативную активность тромбина при измерении, например, с использованием описанных способов.
Терапевтически эффективные количества для использования у человека могут быть определены на моделях животных. Например, доза для человека может быть составлена для достижения концентрации, которая была эффективна у животных. Дозировка у человека может быть отрегулирована путем контроля ингибирования тромбина и увеличения или уменьшения дозировки, как описано выше.
Дозировки могут быть различными в зависимости от требований пациента и используемого соединения. Доза, вводимая пациенту, в контексте способов, раскрытых здесь, должна быть достаточной, чтобы вызвать полезный терапевтический ответ у пациента на долгое время. Размер дозы также определяется наличием, природой и степенью проявления любых неблагоприятных побочных эффектов. Вообще, лечение инициируют с небольшими дозировками, которые являются меньшими, чем оптимальная доза соединения. После этого дозировку увеличивают небольшими приращениями, пока не будет достигнут оптимальный эффект при данных обстоятельствах. В некоторых вариантах осуществления способа, раскрытого здесь, диапазон дозировки составляет от 0,001% до 10% вес./об. В некоторых вариантах осуществления диапазон дозировки составляет от 0,1% до 5% вес./об.
Количества дозировки и интервалы введения могут быть отрегулированы индивидуально, чтобы обеспечить уровни вводимого соединения, эффективные для конкретного подвергаемого лечению клинического показания. Это обеспечит терапевтический режим, который является соразмерным с серьезностью болезненного состояния у человека.
Используя приведенное здесь раскрытие, можно спланировать эффективный профилактический или терапевтический режим лечения, который не вызывает существенной токсичности и все же остается полностью эффективным для лечения клинических симптомов, демонстрируемых конкретным пациентом. Это планирование должно включать тщательный выбор активного соединения с рассмотрением таких факторов как потенциал соединения, относительная биодоступность, масса тела пациента, наличие и серьезность неблагоприятных побочных эффектов, предпочтительный способ введения и профиль токсичности выбранного средства.
Соответственно, в некоторых вариантах осуществления уровни дозировки соединений, раскрытых здесь, используемые в способах по изобретению, имеют порядок, например, от приблизительно 0,1 мг до приблизительно 1 мг, от приблизительно 1 мг до приблизительно 10 мг, от приблизительно 0,5 мг до приблизительно 20 мг на килограмм массы тела, причем средний взрослый человек весит 70 килограммов, причем предпочтительным является диапазон дозировок от приблизительно 0,1 мг до приблизительно 20 мг на килограмм массы тела в сутки (от приблизительно 0,7 мг до приблизительно 1,4 граммов на пациента в сутки). Количество соединения, раскрытого здесь, которое может быть скомбинировано с материалами-носителями с получением единственной лекарственной формы, варьирует в зависимости от получающего лечение хозяина и конкретного способа введения. Например, состав, предназначенный для перорального введения человеку, может содержать приблизительно от 5 мкг до 1 г соединения, раскрытого здесь, с подходящим и удобным количеством материала-носителя, которое может варьировать приблизительно от 5 до 95 процентов от общей массы композиции. Стандартные лекарственные формы обычно содержат приблизительно от 0,1 мг до 500 мг соединения, раскрытого здесь.
Понятно, однако, что конкретный уровень дозы для любого конкретного пациента зависит от различных факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость экскреции, комбинации лекарственных средств и серьезность конкретного заболевания, подвергаемого терапии.
C. Токсичность
Отношение между токсичностью и терапевтическим эффектом для конкретного соединения составляет его терапевтический индекс и может быть выражено как отношение между LD50 (количество соединения, летального у 50% популяции) и ED50 (количество соединения, эффективного у 50% популяции). Соединения, которые показывают высокие терапевтические индексы, являются предпочтительными. Данные терапевтических индексов, полученные в тестах in vitro, тестов клеточной культуры и/или исследований нак животных, могут использоваться в формулировке диапазона дозировок для использования у человека. Дозировка таких соединений предпочтительно находится в пределах диапазона плазменных концентраций, которые включают ED50 с небольшим или отсутствующим показателем токсичности. Дозировка может варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. См., например, Fingl et al., In: THE PHARMACOLOGICAL BASIS OF THERAPEUTICS, Ch.1, p.1, 1975. Точный состав, путь введения и дозировки могут быть выбраны индивидуальным практиком ввиду состояния пациента и конкретного способа, в котором используется соединение. Для составов in vitro точный состав и дозировка могут быть выбраны индивидуальным практиком ввиду состояния пациента и конкретного способа, в котором используется соединение.
VII. Примеры
Примеры ниже предназначаются для иллюстрации некоторых вариантов осуществления изобретения, а не для ограничения объема изобретения. Аббревиатуры, используемые здесь, имеют их обычное значение в данной области техники, если не указано иное. Особые аббревиатуры включают следующее: Å=Ангстрем; AC2O=уксусный ангидрид; AcOH=уксусная кислота; водн.=водный; Bt=бензотриазол; DOC=N-трет-бутоксикарбонил; br=уширенный; t-BuOH=трет-бутанол; °C=градус Цельсия; d=дублет; DABCO=1,4-диазабицикло[2.2.2]октан; DCE=1,2-дихлорэтан; DCM=дихлорметан; dd=дублет дублетов; DIEA=диэтилизопропиламин; DMAP=4-диметиламинопиридин; DMF=N,N-диметилформамид; ДМСО=диметилсульфоксид; δ=химический сдвиг (в ppm, если не указано иное); EDCI=1-этил-3-(3-диметиламинопропил)карбодиимид; экв.=эквивалент; Et2O=простой диэтиловый эфир; Et3N=триэтиламин; EtOAc=этилацетат; EtOH=этанол; г=грамм; ч=час; HOBt=гидроксибензотриазол; ВЭЖХ=высокоэффективная жидкостная хроматография; Гц=Герц; IC50=ингибирующая концентрация с 50% ингибирования; J=константа спаривания (в Гц, если не указано иное); LC=жидкостная хроматография; LHMDS=литий гексаметилдисилазид; м=мультиплет; М=моль; [M+H]+=пик масс-спектра родительской молекулы плюс Н+; MS=масс-спектр; ms=молекулярные сита; Т.пл.=температура плавления; Me2NH=диметиламин; MeOH=метанол; мг=миллиграмм; мл=миллилитр; мМ=миллимоль; ммоль=ммоль; мин.=минута; мкл=микролитр; мкМ=микромоль; нг=нанограмм; нМ=наномоль; ЯМР=ядерный магнитный резонанс; ppm=частей на миллион; q=квартет; Rf=удерживающий фактор; RT=комнатная температура; s=синглет; t=триплет; TFA=трифторуксусная кислота; THF=тетрагидрофуран; TLC=тонкослойная хроматография слоя.
Пример 1 - Получение соединения 1
Общая схема I. Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта далее в общей схеме I, в которой термин "Ar" в общей схеме I относится к замещенному или незамещенному арилу, или замещенному или незамещенному гетероарилу, и термины "R1" и "R2" имеют значения, определенные выше.
Общая схема I

Синтез соединения 1 согласно следующей общей процедуре 1.
Общая процедура 1

Раствор никотиновой кислоты (9,9 г, 80,9 ммоль) в воде (30 мл) добавляли медленно частями к предварительно перемешанной смеси аминогуанидин сульфата (10 г, 73,5 ммоль) в концентрированной H2SO4 (8,8 мл, 162 ммоль), и реакционную смесь перемешивали при 140°C в течение 72 часов. Реакционную смесь разбавляли водой (50 мл) и нейтрализовали насыщенным водным раствором K2CO3 (30 мл), и полученное твердое вещество отфильтровывали. Остаток промывали водой (2×30 мл), Et2O (2×30 мл) и высушивали под вакуумом, получая соединение 1 (4,6 г, 39%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 12,23 (с, 1H), 9,05 (с, 1H), 8,54 (д, J=2,8 Гц, 1H), 8,17 (д, J=7,4 Гц, 1H), 7,42-7,52 (м, 1H), 6,19 (с, 2H); MS: 162 [M+H]+; Т.пл.: 234-236°C; TLC: 20% MeOH/NH3 в CHCl3: Rf: 0,40.
Пример 2 - Получение соединения 2

Следовали общей процедуре 1, получая соединение 2 (8,5 г, 46%). 1H ЯМР: (ДМСО-d6) δ 8,60 (д, J=4,4 Гц, 1H), 7,86-7,91 (м, 2H), 7,37 (уш.с, 1H), 5,79 (уш.с, 2H); MS: 162 [M+H]+; Т.пл.: 218-220°C; TLC: 20% McOH/NH3 в CHCl3: Rf: 0,40.
Пример 3 - Получение соединения 3
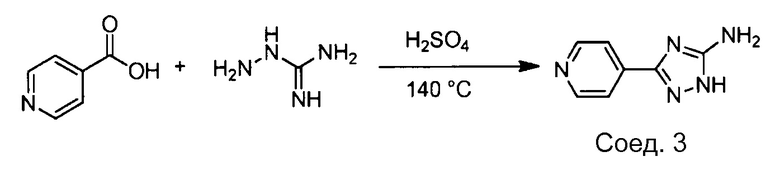
Следовали общей процедуре 1, получая соединение 3 (12 г, 67%). 1H ЯМР: (ДМСО-d6) δ 12,35 (уш.с, 1H), 8,59 (д, J=5,5 Гц, 2H), 7,76-7,78 (м, 2H), 6,23 (с, 2H); MS: 162 [M+H]+; TLC: 20% MeOH/NH3 в CHCl3: Rf: 0,40.
Пример 4 - Получение соединения 4
Синтез соединения 4 осуществляли согласно следующей общей процедуре 2.
Общая процедура 2

4-Фторбензальдегид (3,1 г, 24,8 ммоль, 2 экв.) и молекулярные сита (4Å порошок) добавляли к раствору соединения 1 (2 г, 12,4 ммоль) в EtOH (20 мл) при комнатной температуре и нагревали с обратным холодильником в течение 8 часов. Затем при 0°C добавляли каталитическое количество AcOH, NaCNBH3 (1,6 г, 24,8 ммоль, 2 экв.) и с перемешиванием в течение 15 часов при комнатной температуре. Растворитель отгоняли, и остаток растворяли в EtOAc (200 мл) и фильтровали через слой Celite®, чтобы удалить неорганические материалы. Фильтрат промывали насыщенным водным раствором NaHCO3 (2×20 мл), водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Полученное соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента растворителя MeOH-CHCl3 0-10% в качестве элюента, получая соединение 4 (1,7 г, 51%). 1H ЯМР: (ДМСО-d6) δ 12,50 (с, 1H), 9,06 (д, J=1,4 Гц, 1H), 8,53-8,55 (м, 1H), 8,17-8,20 (м, 1H), 7,33-7,45 (м, 4H), 7,12-7,19 (м, 2H), 4,40 (д, J=6,4 Гц, 2H); MS: 270 [M+H]+; Т.пл.: 185-186°C; TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 5 - Получение промежуточного соединения 1

Следовали общей процедуре 2, получая промежуточное соединение 1 (80 мг). 1H ЯМР: (ДМСО-d6) δ 12,53 (с, 1H), 9,05 (д, J=1,3 Гц, 1H), 8,50-8,54 (м, 1H), 8,18-8,20 (м, 1H), 7,01-7,62 (м, 6H), 4,44 (д, J=6,2 Гц, 2H); TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 6 - Получение промежуточного соединения 2
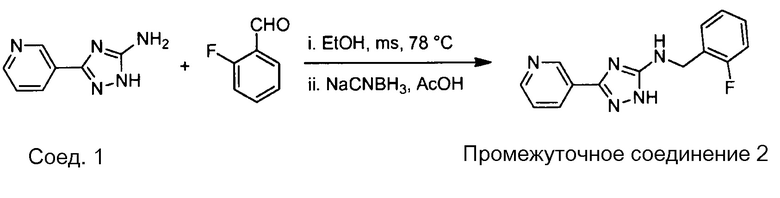
Следовали общей процедуре 2, получая промежуточное соединение 2 (75 мг). 1H ЯМР: (ДМСО-d6) δ 12,51 (с, 1Н), 9,06 (д, J=1,8 Гц, 1H), 8,54-8,55 (м, 1H), 8,17-8,20 (м, 1H), 7,15-7,45 (м, 6H), 4,49 (д, J=6,2 Гц, 2H); TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 7 - Получение промежуточного соединения 3

Следовали общей процедуре 2, получая промежуточное соединение 3 (180 мг). 1H ЯМР: (ДМСО-d6) δ 12,57 (с, 1Н), 9,05 (с, 1Н), 8,54-8,55 (м, 1Н), 8,16-8,18 (м, 1Н), 7,41-7,95 (м, 6H), 4,52 (д,J=6,6 Гц, 2H); TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 8 - Получение соединения 5
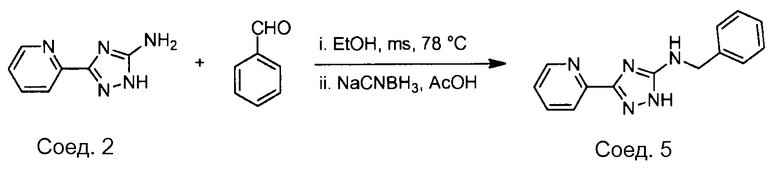
Следовали общей процедуре 2, получая соединение 5 (2,8 г, 60%). MS: 252 [М+Н]+; Т.пл.: 226-228°C; TLC: 10% MeOH в CHCl3: Rf: 0,30.
Пример 9 - Получение соединения 6

Следовали общей процедуре 2, получая соединение 6 (1,6 г, 48%). 1H ЯМР: (ДМСО-d6) δ 13,15 (уш.с, 1H), 8,60 (д, J=4,0 Гц, 1H), 7,86-7,93 (м, 2H), 7,30-7,42 (м, 3H), 7,02-7,15 (м, 2H), 6,84 (уш.с, 1H), 4,37 (д, J=6,2 Гц, 2H); MS: 270 [M+H]+; Т.пл.: 219-220°C; TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 10 - Получение промежуточного соединения 4

Следовали общей процедуре 2, получая промежуточное соединение 4 (1,4 г, 42%). MS: 270 [М+Н]+; TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 11 - Получение промежуточного соединения 5

Следовали общей процедуре 2, получая промежуточное соединение 5 (1,3 г, 38%). MS: 282 [М+Н]+; TLC: 10% MeOH в CHCl3: Rf: 0,30.
Пример 12- Получение соединения 7
Синтез соединения 7 согласно следующей общей процедуре 3.
Общая процедура 3

Пропионил хлорид (39 мкл, 0,44 ммоль, 1,2 экв.) добавляли при комнатной температуре к раствору соединения 4 (100 мг, 0,37 ммоль) в триэтиламине (3 мл) и перемешивали в течение 5 часов. Реакционную смесь разбавляли водой (5 мл) и экстрагировали EtOAc (20 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (5 мл), солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонке с силикагелем (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-30% в качестве элюента, получая соединение 7 (40 мг, 33%). 1H ЯМР: (ДМСО-d6) δ 9,14 (д, J=1,8 Гц, 1Н), 8,66-8,67 (м, 1Н), 8,28-8,34 (м, 2H), 7,47-7,53 (м, 3H), 7,13-7,17 (м, 2H), 4,63 (д, J=6,2 Гц, 2H), 3,05 (кв, J=7,5 Гц, 2H), 1,16 (т, J=7,5 Гц, 3H); MS: 326 [M+H]+; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 13 - Получение соединения 8
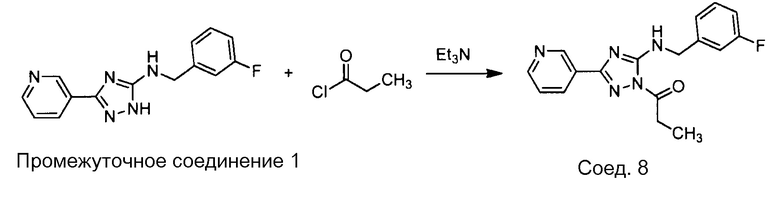
Следовали общей процедуре 3, получая соединение 8 (50 мг, 51%). 1H ЯМР: (ДМСО-d6) δ 9,13 (д, J=1,8 Гц, 1H), 8,65-8,67 (м, 1H), 8,42 (т, J=6,4 Гц, 1H), 8,27-8,29 (м, 1H), 7,50-7,53 (м, 1H), 7,24-7,41 (м, 3H), 7,06-7,10 (м, 1H), 4,67 (д, J=6,6 Гц, 2H), 3,06 (кв, J=7,3 Гц, 2H), 1,16 (т, J=7,3 Гц, 3H); MS: 326 [M+H]+; Т.пл.: 140-142°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 14 - Получение соединения 9

Следовали общей процедуре 3, получая соединение 9 (35 мг, 38%). 1H ЯМР: (ДМСО-d6) δ 9,12 (д, J=1,3 Гц, 1Н), 8,65-8,67 (м, 1Н), 8,26-8,32 (м, 2H), 7,45-7,52 (м, 2H), 7,15-7,33 (м, 3H), 4,73 (д, J=6,2 Гц, 2H), 3,07 (кв, J=7,5 Гц, 2H), 1,16 (т, J=7,3 Гц, 3H); MS: 326 [M+H]+; Т.пл.: 142-144°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 15 - Получение соединения 10

Следовали общей процедуре 3, получая соединение 10 (25 мг, 20%). 1H ЯМР: (ДМСО-d6) δ 9,11 (с, 1Н), 8,50-8,67 (м, 2H), 8,26 (д, J=7,8 Гц, 1Н), 7,81 (д, J=7,8 Гц, 2H), 7,49-7,62 (м, 3H), 4,73 (д, J=6,3 Гц, 2H), 3,06 (кв, J=7,1 Гц, 2H), 1,16 (т, J=7,3 Гц, 3H); MS: 333 [M+H]+; Т.пл.: 143-145°C; TLC: 50% EtOAc в гексане: Rf: 0,65.
Пример 16 - Получение соединения 11

Следовали общей процедуре 3, получая соединение 11 (48 мг, 35%). 1H ЯМР: (ДМСО-d6) δ 8,71 (д, J=4,0 Гц, 1H), 8,46 (уш.с, 1H), 8,13-8,23 (м, 3H), 7,92-7,96 (м, 1H), 7,24-7,52 (м, 6H), 6,88-6,89 (м, 1Н), 4,74 (д, J=6,2 Гц, 2H); MS: 346 [M+H]+; Т.пл.: 143-145°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 17 - Получение соединения 12
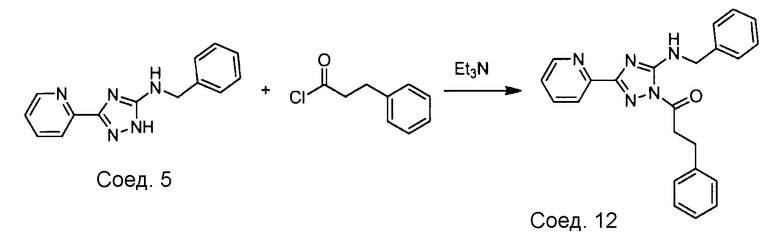
Следовали общей процедуре 3, получая соединение 12 (25 мг, 16%). 1H ЯМР: (ДМСО-d6) δ 8,65 (д, J=4,0 Гц, 1H), 8,26 (уш.с, 1H), 8,03 (д, J=8,1 Гц, 1Н), 7,90 (т, J=7,7 Гц, 1Н), 7,19-7,48 (м, 11Н), 4,67 (д, J=6,0 Гц, 2H), 3,30-3,41 (м, 2H), 2,99-3,03 (м, 2H); MS: 384 [M+H]+; Т.пл.: 118-120°C; TLC: 50% EtOAc в гексане: Rf: 0,40.
Пример 18 - Получение соединения 13

Следовали общей процедуре 3, получая соединение 13 (40 мг, 28%). 1H ЯМР: (ДМСО-d6) δ 8,72 (д, J=4,6 Гц, 1Н), 8,47-8,54 (м, 2H), 8,12-8,23 (м, 2Н), 7,94-7,98 (м, 1Н), 7,48-7,52 (м, 3H), 7,34-7,36 (м, 1Н), 7,16 (т, J=9,0 Гц, 2H), 4,71 (д, J=6,1 Гц, 2H); MS: 380 [M+H]+; Т.пл.: 159-160°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 19 - Получение соединения 14

Следовали общей процедуре 3, получая соединение 14 (48 мг, 46%). 1H ЯМР: (ДМСО-d6) δ 8,68-8,70 (м, 3Н), 8,14-8,16 (м, 2H), 7,85-7,87 (м, 2H), 7,53-7,73 (м, 5H), 7,18 (т, J=8,9 Гц, 2H), 4,70 (д, J=6,2 Гц, 2H); MS: 374 [M+H]+; Т.пл.: 174-178°C; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 20 - Получение соединения 15
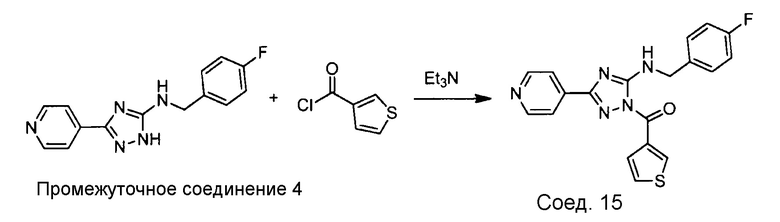
Следовали общей процедуре 3, получая соединение 15 (20 мг, 14%). 1H ЯМР: (ДМСО-d6) δ 9,19 (д, J=1,3 Гц, 1Н), 8,63-8,73 (м, 3Н), 8,00 (д, J=5,7 Гц, 2H), 7,72-7,88 (м, 2H), 7,50-7,54 (м, 2H), 7,17 (т, J=8,8 Гц, 2H), 4,70 (д, J=6,2 Гц, 2H); MS: 380 [M+H]+; Т.пл.: 187-188°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 21 - Получение соединения 16

Следовали общей процедуре 3, получая соединение 16 (35 мг, 36%). 1H ЯМР: (ДМСО-d6) δ 8,71 (д, J=6,2 Гц, 2H), 8,38 (т, J=6,2 Гц, 1Н), 7,90 (д, J=5,7 Гц, 2H), 7,38 (д, J=8,3 Гц, 2H), 6,90 (д, J=8,8 Гц, 2H), 4,58 (д, J=6,2 Гц, 2H), 3,72 (с, 3H), 1,46 (с, 9H); MS: 366 [M+H]+; Т.пл.: 143-146°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 22 - Получение соединения 17
Синтез соединения 17 осуществляли согласно следующей общей процедуре 4.
Общая процедура 4

Раствор соединения 4 (100 мг, 0,37 ммоль) в сухом DMF (2 мл) добавляли к раствору морфолинкарбонил хлорида (86 мкл, 0,74 ммоль, 2 экв.), DABCO (124 мг, 1,11 ммоль, 3 экв.) в DMF (3 мл) при комнатной температуре и перемешивали в течение 2 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (2×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырой остаток. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента 0-50% смеси EtOAc-гексан в качестве элюента, получая соединение 17 (33 мг, 23%). 1H ЯМР: (ДМСО-d6) δ 9,11 (с, 1Н), 8,64 (д, J=4,8 Гц, 1Н), 8,25 (д, J=7,9 Гц, 1H), 7,90 (с, 1H), 7,46-7,52 (м, 3H), 7,16 (т, J=8,8, 2H), 4,59 (д, J=6,2 Гц, 2H), 3,70-3,99 (м, 8H); MS: 383 [M+H]+; TLC: 50% EtOAc в гексане: Rf: 0,40.
Пример 23 - Получение соединения 18 [общая процедура 5]
Синтез соединения 18 осуществляли согласно следующей общей процедуре 5.
Общая процедура 5
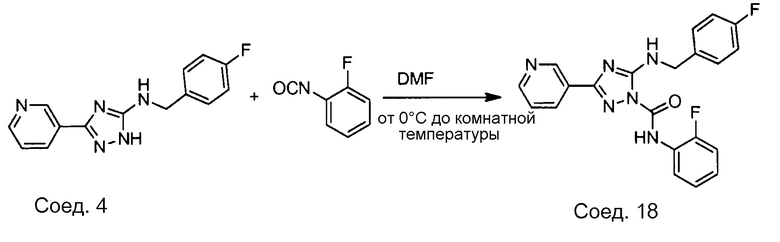
2-Фторфенил изоцианат (29 мкл, 0,26 ммоль, 0,7 экв.) добавляли к раствору соединения 4 (100 мг, 0,37 ммоль) в DMF (5 мл) при 0°C и перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (2×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырой остаток. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-30% в качестве элюента, получая соединение 18 (60 мг, 39%). 1H ЯМР: (ДМСО-d6) δ 9,94 (с, 1Н), 9,23 (с, 1Н), 8,68 (д, J=4,4 Гц, 1H), 8,34-8,36 (м, 1H), 8,11-8,14 (м, 1H), 7,48-7,67 (м, 4H), 7,14-7,38 (м, 5H), 4,64 (д, 7=5,7 Гц, 2H); MS: 407 [M+H]+; Т.пл.: 157-159°C; TLC: 40% EtOAc в гексане: Rf: 0,50.
Пример 24 - Получение соединения 19
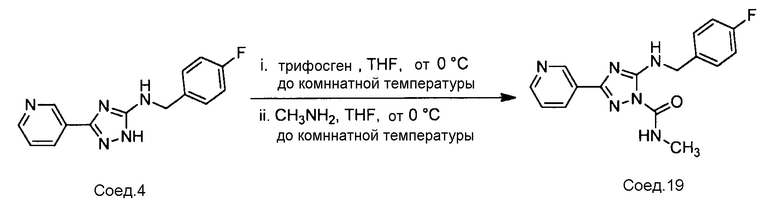
Раствор соединения 4 (200 мг, 0,74 ммоль) в сухом THF (5 мл) добавляли к раствору трифосгена (100 мг, 0,37 ммоль, 0,5 экв.) в THF (3 мл) при 0°C и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь повторно охлаждали до 0°C, добавляли метиламин (2,47 мл, 3M раствор в THF, 7,43 ммоль, 10 экв.), реактор закрывали и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли водой (30 мл) и экстрагировали EtOAc (2×30 мл). Объединенный органический слой промывали водой (2×30 мл), насыщенным водным раствором NaHCO3 (20 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-50% в качестве элюента, получая соединение 19 (70 мг, 34%). 1H ЯМР: (ДМСО-d6) δ 9,16 (д, J=1,3 Гц, 1H), 8,64-8,66 (м, 1H), 8,24-8,29 (м, 2H), 8,01 (т, J=6,2 Гц, 1H), 7,46-7,54 (м, 3H), 7,16 (т, J=9,0 Гц, 2H), 4,61 (д, J=6,2 Гц, 2H), 2,81 (д, J=4,4 Гц, 3H); MS: 327 [M+H]+; Т.пл.: 154-158°C; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 25 - Получение соединения 20

Следовали общей процедуре 3, получая соединение 20 (44 мг, 40%). 1H ЯМР: (ДМСО-d6) δ 9,14 (д, J=1,3 Гц, 1H), 8,65-8,67 (м, 1H), 8,26-8,29 (м, 1H), 8,13 (т, J=6,2, 1H), 7,47-7,52 (м, 3H), 7,14-7,18 (м, 2H), 4,63 (д, J=6,2 Гц, 2H), 3,99 (с, 3H); MS: 328 [M+H]+; Т.пл.: 134-137°C; TLC: 60% EtOAc в гексане: Rf: 0,50.
Пример 26 - Получение соединения 21
Общая схема II. Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта ниже в общей схеме II, в где термин "X" в общей схеме II относится к галогену, например, Cl, Br, "основание" представляет собой основание, известное в данной области техники, например, K2CO3, Et3N и т.п., и “R” обозначает заместитель, как раскрыто здесь, например, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил.
Общая схема II

X=Cl, Br основание=K2CO3 или Et3N
Синтез соединения 21 осуществляли согласно следующей общей процедуре 6.
Общая процедура 6
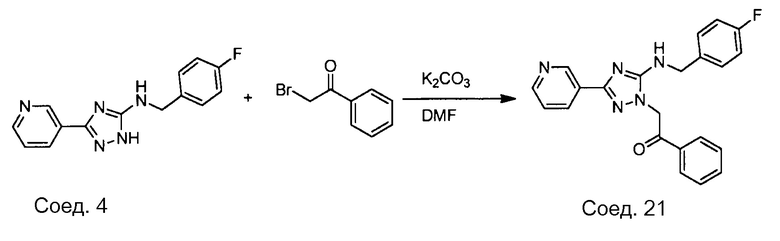
2-Бромацетофенон (44 мг, 0,22 ммоль) добавляли к раствору Соединения 4 (100 мг, 0,37 ммоль), K2CO3 (102 мг, 0,74 ммоль) в DMF (4 мл) при комнатной температуре и перемешивали в течение 5 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (5 мл), солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси MeOH/CHCl3 0-5% в качестве элюента, получая соединение 21 (25 мг, 17%). 1H ЯМР: (ДМСО-d6) δ 9,06 (д, J=1,3 Гц, 1H), 8,55-8,57 (м, 1H), 8,19 (д, J=7,9 Гц, 1H), 8,06 (д, J=7,0, 2H), 7,59-7,75 (м, 3H), 7,41-7,46 (м, 3H), 7,15-7,29 (м, 3H), 5,74 (с, 2H), 4,52 (д, J=5,7, 2H); MS: 388 [M+H]+; TLC: 10% MeOH в CHCl3: Rf: 0,50.
Пример 27 - Получение соединения 22
Схема, пригодная для получения соединений типа соединения 22, приведена в следующей схеме 1.
Схема 1

Подробное описание получения промежуточного соединения 6 и соединения 22 приведено далее.
Получение промежуточного соединения 6

Фенилацетальдегид (0,29 мл, 2,48 ммоль, 2 экв.), молекулярные сита (4Å порошок), AcOH (0,1 мл, 2,48 ммоль, 2 экв.) и Na(OAc)3BH (655 мг, 7,71 ммоль, 6,2 экв.) при 0°C добавляли к раствору соединения 1 (200 мг, 1,24 ммоль) в DCE (10 мл) и перемешивали при комнатной температуре в течение 18 часов. Растворитель отгоняли, и остаток разбавляли EtOAc (150 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (50 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырое промежуточное соединение 6 (220 мг), которое использовали без дополнительной очистки. TLC: 10% MeOH в CHCl3: Rf: 0,40.
Получение соединения 22

Следовали общей процедуре 3, получая соединение 22 (13 мг, 5%). 1H ЯМР: (ДМСО-d6) δ 9,17 (с, 1H), 8,68 (д, J=4,4 Гц, 1H), 8,33 (д, J=7,9 Гц, 1H), 7,83 (т, J=5,7 Гц, 1H), 7,52-7,55 (м, 1H), 7,21-7,34 (м, 5H), 3,70 (кв, J=6,6 Гц, 2H), 2,95-3,07 (м, 4H), 1,14 (т, J=7,3 Гц, 3H); MS: 322 [M+H]+; Т.пл.: 98-100°C; TLC: 60% EtOAc в гексане: Rf: 0,60.
Пример 28 - Получение соединения 23
Схема, пригодная для получения соединений типа соединения 23, приведена в следующей схеме 2.
Схема 2

Подробное описание получения промежуточных соединений 7-9 и соединения 23 приведено далее.
Получение промежуточного соединения 7
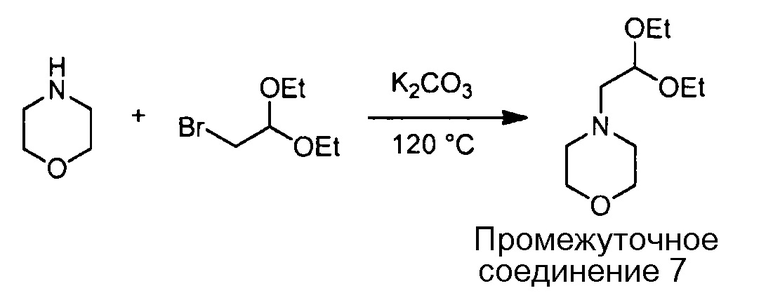
Смесь 2-бромацетальдегид диэтилацеталя (4,5 г, 22,9 ммоль), морфолина (2,0 г, 22,9 ммоль) и K2CO3 (6,34 г, 45,9 ммоль, 2 экв.) перемешивали при 120°C в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой (50 мл) и экстрагировали DCM (3×50 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (50 мл), солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и концентрировали, получая сырой остаток. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексана 0-50% в качестве элюента, получая промежуточное соединение 7 (2,6 г, 56%) в форме светло-желтой жидкости. 1H ЯМР: (CDCl3) δ 4,64 (т, J=5,3 Гц, 1H), 3,63-3,70 (м, 6H), 3,50-3,58 (м, 2H), 2,52-2,55 (м, 6H), 1,20 (т, J=7,0 Гц, 6H); TLC: 60% EtOAc в гексане: Rf: 0,50.
Получение промежуточного соединения 8

Раствор промежуточного соединения 7 (600 мг, 2,95 ммоль), растворенного в концентрированном водном растворе HCl (4 мл) перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, подщелачивали (рН~10) насыщенным водным раствором NaHCO3 (20 мл), и полученный раствор экстрагировали DCM (3×50 мл). Объединенные органические слои промывали водой (50 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырое промежуточное соединение 8 (340 мг) в форме бесцветного масла, которое использовали без дополнительной очистки. TLC: 60% EtOAc в гексане: Rf: 0,30.
Получение промежуточного соединения 9

Промежуточное соединение 8 (320 мг, 2,48 ммоль, 2 экв.) и молекулярные сита (4Å порошок) добавляли к раствору соединения 1 (200 мг, 1,24 ммоль) в MeOH (10 мл) при -20°C, и полученный раствор перемешивали при комнатной температуре. Через 16 часов при 0°C добавляли AcOH (1 мл) и NaCNBH3 (156 мг, 2,48 ммоль, 2 экв.), и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Растворитель выпаривали, и остаток растворяли в EtOAc (75 мл) и фильтровали через слой Целита, чтобы удалить неорганические материалы. Фильтрат промывали насыщенным водным раствором NaHCO3 (2×10 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента растворителя EtOAc-гексан 0-80% в качестве элюента, получая промежуточное соединение 9 (210 мг). TLC: 10% MeOH в CHCl3: Rf: 0,40.
Получение соединения 23
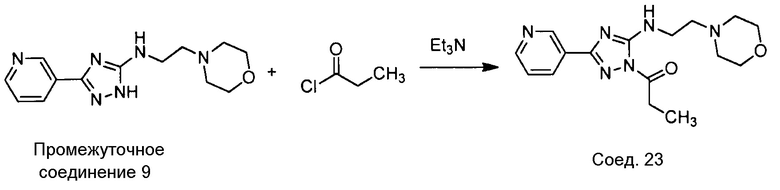
Следовали общей процедуре 3, получая соединение 23 (10 мг, 4%). 1H ЯМР: (ДМСО-d6) δ 9,15 (с, 1H), 8,67 (д, J=4,8 Гц, 1H), 8,30 (д, J=7,9 Гц, 1H), 7,83 (уш.с, 1H), 7,51-7,54 (м, 1H), 3,58 (д, J=4,4 Гц, 6H), 3,02-3,08 (м, 2H), 2,44-2,59 (м, 6H), 1,15 (т, J=7,3 Гц, 3H); MS: 331 [M+H]+; TLC: 50% EtOAc в гексане: Rf 0,50.
Пример 29 - Получение соединения 24
Схема, пригодная для получения соединений типа соединения 24, приведена в следующей схеме 3.
Схема 3
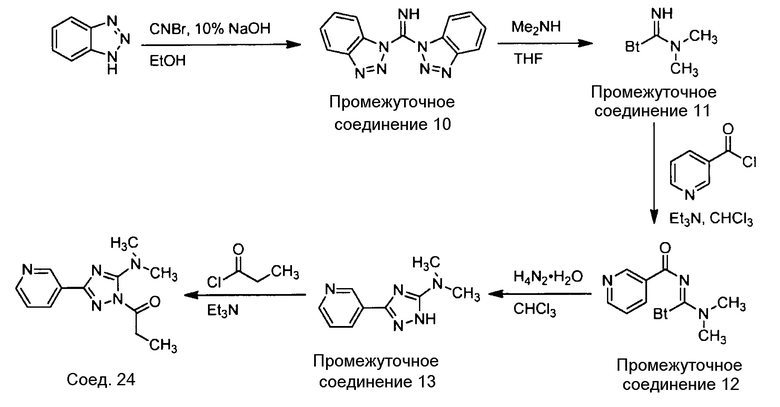
Подробное описание получения промежуточных соединений 10-13 и соединения 24
Получение промежуточного соединения 10
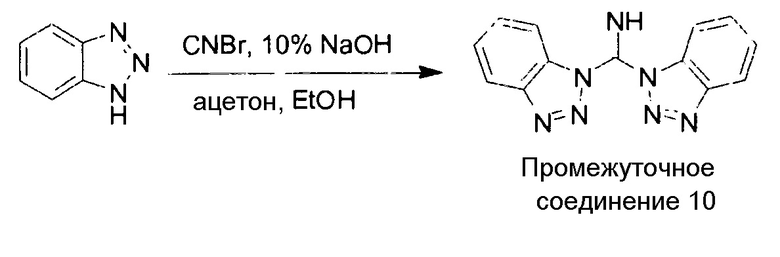
Раствор циано бромида (1,3 г, 12,6 ммоль) в ацетоне (5 мл) добавляли медленно частями к смеси бензотриазола (3 г, 25,2 ммоль, 2 экв.) в EtOH (50 мл) с последующим добавлением при 0°C 10% водного раствора NaOH (6 мл, 12,6 ммоль, 1 экв.). Реакционную смесь затем перемешивали при комнатной температуре в течение 30 мин. Наблюдали образование твердого вещества. Это твердое вещество отфильтровывали и промывали холодным EtOH. Полученный материал перекристаллизовывали из бензола, получая промежуточное соединение 10 (2,2 г, 33%) в форме твердого вещества белого цвета. 1H ЯМР: (ДМСО-d6) δ 11,76 (с, 1H), 8,29-8,39 (м, 2H), 7,86-8,09 (м, 2H), 7,44-7,72 (м, 4H), MS: 264 [M+H]+; TLC: 30% EtOAc в гексане: Rf: 0,50.
Получение промежуточного соединения 11

Диметиламин (1,59 мл, 7,60 ммоль, 1 экв.) добавляли к промежуточному соединению 10 (2 г, 7,60 ммоль) в THF (30 мл) при комнатной температуре, и полученную смесь оставляли для перемешивания в течение 24 часов. Растворитель выпаривали, и остаток растворяли в DCM (100 мл). Органический слой промывали 10% Na2CO3 (3×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая промежуточное соединение 11 (1,2 г, 71%) в форме светло-желтой жидкости, которую использовали без дополнительной очистки. 1H ЯМР: (ДМСО-d6) δ 8,17 (д, J=8,4 Гц, 1H), 7,65-7,80 (м, 3H), 7,49-7,53 (м, 1H), 2,87 (с, 6H); MS: 190 [M+H]+; TLC: 30% EtOAc в гексане: Rf: 0,30.
Получение промежуточного соединения 12
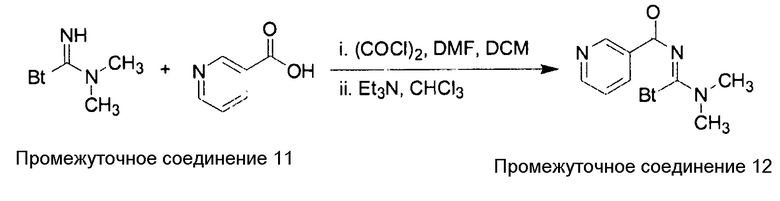
Оксалил хлорид (2 мл, 23,3 ммоль, 1,4 экв.) добавляли к раствору никотиновой кислоты (2 г, 16,3 ммоль) в DCM, с последующим добавлением каталитического количества DMF (0,5 мл) при 0°C и перемешивали в течение 5 часов при комнатной температуре. Растворитель затем выпаривали, получая хлорангидрид никотиновой кислоты в форме твердого вещества желтого цвета. Хлорангидрид никотиновой кислоты (1,1 г, 7,93 ммоль, 1,5 экв.) затем добавляли к раствору промежуточного соединения 11 (1 г, 5,29 ммоль) в CHCl3 (30 мл) с последующим добавлением при 0°C Et3N (0,7 мл, 5,29 ммоль, 1 экв.). Реакционной смеси давали нагреться до комнатной температуры при перемешивании в течение 18 часов. Смесь затем разбавляли CHCl3 (20 мл). Органический слой промывали водой (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Полученное соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-50% в качестве элюента, получая промежуточное соединение 12 (900 мг, 60%) в форме твердого вещества белого цвета. MS: 295 [М+Н]+; TLC: 50% EtOAc в DCM: Rf: 0,40.
Получение промежуточного соединения 13

К гидразин гидрату (5 мл) при комнатной температуре добавляли раствор промежуточного соединения 12 (900 мг, 25,2 ммоль) в хлороформе (20 мл), и полученную смесь оставляли для перемешивания в течение 24 часов. Смесь разбавляли избытком CHCl3 (20 мл). Органический слой затем промывали водой (15 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток частично очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-50% в качестве элюента, получая промежуточное соединение 13 (150 мг) в форме густой коричневой массы. MS: 190 [М+Н]+; TLC: 10% MeOH в CHCl3: Rf: 0,30.
Получение соединения 24

Следовали общей процедуре 3, получая соединение 24 (13 мг, 6%). 1H ЯМР: (ДМСО-d6) δ 9,15 (с, 1H), 8,68 (д, J=3,5 Гц, 1H), 8,31 (д, J=7,9 Гц, 1H), 7,53 (дд, J=7,9, 4,8 Гц, 1H), 3,04-3,14 (м, 8H), 1,15 (т, J=7,3 Гц, 3H); MS: 246 [M+H]+; TLC: 50% EtOAc в DCM: Rf: 0,50.
Пример 30 - образование кольца триазолила
Общая химическая схема, которая включает формирование триазолильного кольца, приведена в следующей общей схеме III, в которой "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема III

Пример 31 - Получение соединения 25
Синтез соединения 25 согласно следующей общей процедуре 7.
Общая процедура 7

2-фуроил хлорид (7,9 мл, 75,2 ммоль) добавляли при 0°C к раствору аминогуанидин сульфата (10 г, 75,2 ммоль, 1 экв.) в пиридине (50 мл). Реакционную смесь затем оставляли для перемешивания при комнатной температуре в течение 14 часов, после чего нейтрализовали насыщенным водным раствором NaHCO3 (20 мл), экстрагировали t-BuOH (3×100 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток затем растворяли в воде (150 мл) и перемешивали при 100°C в течение 6 часов. Реакционную смесь охлаждали до 0°C и экстрагировали EtOAc (5×100 мл), высушивали над Na2SO4, фильтровали и концентрировали, получая соединение 25 (3,5 г, 31%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 12,17 (уш.с, 1H), 7,69 (с, 1H), 6,69 (д, J=2,5 Гц, 1H), 6,55 (дд, J=2,9, 1,8 Гц, 1H), 6,05 (уш.с, 2H); MS: 151 [M+H]+; Т.пл.: 202-204°C; TLC: 20% MeOH/NH3 в CHCl3: Rf: 0,40.
Пример 32 - Получение промежуточного соединения 14

Следовали общей процедуре 7, получая сырое промежуточное соединение 14 (2,2 г). 1H ЯМР: (ДМСО-d6) δ 12,07 (уш.с, 1H), 7,39-7,46 (м, 2H), 7,07 (с, 1Н), 6,09 (уш.с, 2H); MS: 167 [M+H]+; Т.пл.: 206-208°C; TLC: 20% MeOH/NH3 в CHCl3: Rf: 0,40.
Пример 33 - Получение промежуточного соединения 15

Следовали общей процедуре 2, получая промежуточное соединение 15 (350 мг, 25%). MS: 259 [М+Н]+; TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 34 - Получение промежуточного соединения 16
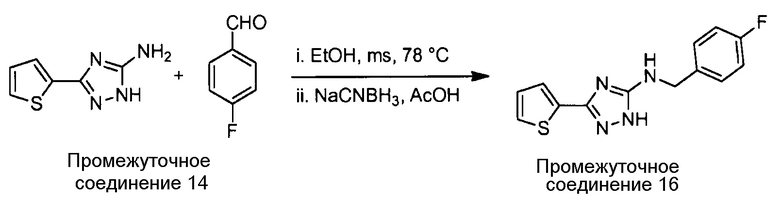
Следовали общей процедуре 2, получая промежуточное соединение 16 (500 мг, 38%). 1H ЯМР: (ДМСО-d6) δ 12,27 (с, 1H), 7,38-7,47 (м, 4H), 7,07-22 (м, 4Н), 4,37 (д, J=6,2 Гц, 2H); MS: 275 [M+H]+; TLC: 10% MeOH в CHCl3: Rf: 0,25.
Пример 35 - Получение соединения 26

Следовали общей процедуре 3, получая соединение 26 (20 мг, 17%). 1H ЯМР: (ДМСО-d6) δ 8,51 (т, J=6,2 Гц, 1H), 7,76 (с, 1H), 7,49-7,57 (м, 4H), 7,06-7,21 (м, 4Н), 6,94 (д, J=3,5 Гц, 1H), 6,59 (м, 1H), 4,64 (д, J=6,2 Гц, 2H), 3,77 (с, 3H); MS: 393 [M+H]+; Т.пл.: 150-152°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 36 - Получение соединения 27

Следовали общей процедуре 3, получая соединение 27 (25 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,47 (т, J=6,2 Гц, 1H), 7,50-7,63 (м, 6H), 7,06-7,22 (м, 5H), 4,65 (д, J=6,2 Гц, 2H), 3,77 (с, 3H); MS: 409 [M+H]+; Т.пл.: 151-152°C; TLC: 50% EtOAc в гексане: Rf: 0,60.
Пример 37 - Получение соединения 28
Общая химическая схема формирования соединений типа соединения 28 приведена в следующей общей схеме IV, в которой "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема IV
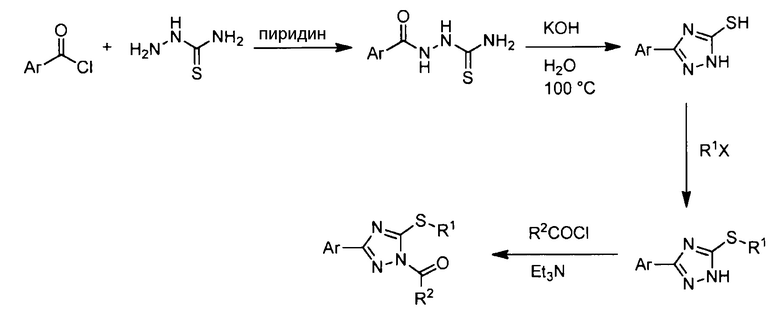
Подробное описание получения промежуточных соединений 17, 18 и соединения 28
Получение промежуточного соединения 17
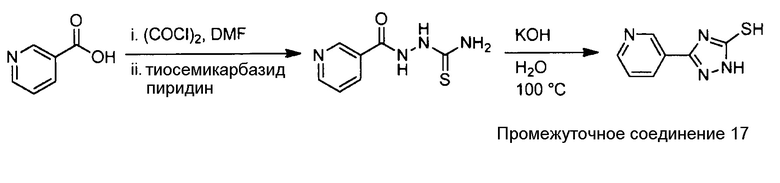
Оксалил хлорид (5,4 мл, 61,0 ммоль, 1,5 экв.) и DMF (3 мл) добавляли последовательно при комнатной температуре к раствору никотиновой кислоты (5 г, 40,7 ммоль) в сухом DCM (300 мл). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение 2 часов. Растворитель удаляли и перегоняли совместно с сухим толуолом (2×50 мл), получая 5 г сырого хлорангидрида никотиновой кислоты (5 г, 35,5 ммоль). Этот материал добавляли медленно частями к раствору тиосемикарбазида (5 г, 54,9 ммоль, 1,5 экв.) в пиридине (50 мл) при 0°C в течение 1 часа и затем оставляли для перемешивания при комнатной температуре в течение 14 часов. Реакционную смесь нейтрализовали насыщенным водным раствором NaHCO3 (30 мл) и экстрагировали t-BuOH (3×100 мл), и высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток растворяли в воде (20 мл) наряду с 10%-ым водным раствором KOH (50 мл), и полученную смесь оставляли для перемешивания при 100°C в течение 3 часов. Реакционную смесь затем охлаждали до 0°C и нейтрализовали 10%-ым водным раствором AcOH (60 мл), экстрагировали EtOAc (2×150 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырое промежуточное соединение 17 (1,2 г) в форме твердого вещества грязно-белого цвета. MS: 179 [М+Н]+; TLC: 20% MeOH/NH3 в CHCl3: Rf: 0,30.
Получение промежуточного соединения 18
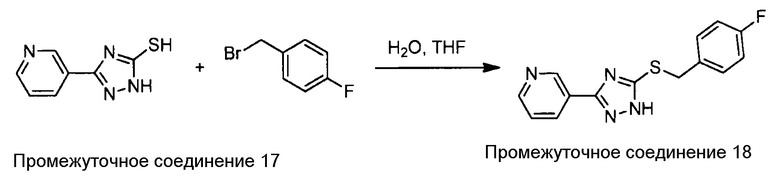
4-фторбензил бромид (0,12 мл, 1,01 ммоль, 0,6 экв.) добавляли при -10°C к раствору промежуточного соединения 17 (300 мг, 1,68 ммоль) в воде (5 мл) и THF (15 мл), и реакционную смесь оставляли для перемешивания при -10°C в течение 8 часов. Растворитель удаляли, и остаток разбавляли водой (10 мл) и экстрагировали EtOAc (50 мл). Органический слой промывали водой (15 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси растворителей MeOH-CHCl3 0-10% в качестве элюента, получая промежуточное соединение 18 (110 мг, 23%) в форме твердого вещества грязно-белого цвета. MS: 287 [М+Н]+; TLC: EtOAc: Rf: 0,40.
Получение соединения 28

Следовали общей процедуре 3, получая соединение 28 (20 мг, 30%). 1H ЯМР: (ДМСО-d6) δ 9,13 (с, 1H), 8,71 (д, J=4,0 Гц, 1H), 8,26 (д, J=7,9 Гц, 1H), 7,53-7,67 (м, 5H), 7,09-7,25 (м, 4H), 4,64 (с, 2H), 3,75 (с, 3H); MS: 421 [M+H]+; Т.пл.: 108-112°C; TLC: 30% EtOAc в гексане: Rf: 0,40.
Пример 38 - Получение промежуточного соединения 19
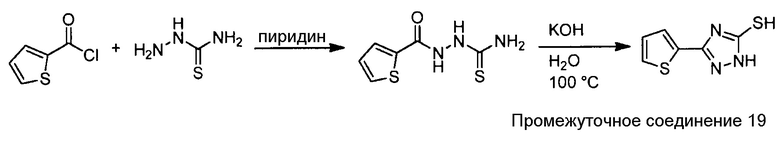
Хлорангидрид 2-тиофенкарбоновой кислоты (6,5 мл, 60,4 ммоль) добавляли медленно частями к раствору тиосемикарбазида (5 г, 54,9 ммоль, 1,1 экв.) в пиридине (50 мл) при 0°C в течение 1 часа и затем оставляли для перемешивания при комнатной температуре в течение 14 часов. Реакционную смесь нейтрализовали насыщенным водным раствором NaHCO3 (50 мл) и экстрагировали t-BuOH (3×100 мл), и высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток растворяли в воде (30 мл) наряду с 10% водным раствором KOH (60 мл), и полученную смесь оставляли для перемешивания при 100°C в течение 3 часов. Реакционную смесь затем охлаждали до 0°C и нейтрализовали 10% водным раствором AcOH, экстрагировали EtOAc (2×150 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая сырое промежуточное соединение 19 (1,2 г) в форме твердого вещества грязно-белого цвета. MS: 184 [М+Н]+; TLC: 10% MeOH/NH3 в CHCl3: Rf: 0,60.
Пример 39 - Получение промежуточного соединения 20
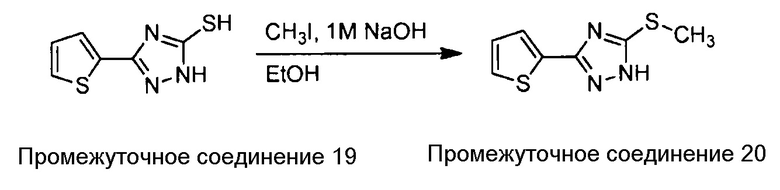
Раствор метил йодида (65 мкл, 1,04 ммоль, 1,6 экв.) в EtOH (2 мл) добавляли при комнатной температуре к раствору промежуточного соединения 19 (120 мг, 0,66 ммоль) в 1M водном растворе NaOH (3 мл), и полученную смесь оставляли для перемешивания в течение 3 часов. Реакционную смесь затем нейтрализовали 10%-ым водным раствором AcOH (5 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (10 мл), насыщенным водным раствором NaHCO3 (5 мл), солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси растворителей MeOH-CHCl3 0-10% в качестве элюента, получая промежуточное соединение 20 (90 мг, 70%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 14,19 (уш.с, 1H), 7,62-7,67 (м, 2H), 7,16-7,18 (м, 1H), 2,60 (с, 3H); MS: 198 [M+H]+; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 40 - Получение соединения 29
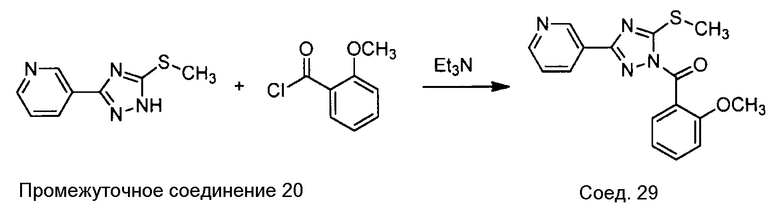
Следовали общей процедуре 3, получая соединение 29 (30 мг, 29%). 1H ЯМР: (ДМСО-d6) δ 7,72 (д, J=4,8 Гц, 1H), 7,56-7,65 (м, 3H), 7,25 (д, J=8,8 Гц, 1H), 7,09-7,24 (м, 2H), 3,77 (с, 3H), 2,73 (с, 3H); MS: 332 [M+H]+; Т.пл.: 165-167°C; TLC: 30% EtOAc в гексане: Rf: 0,40.
Пример 41 - Получение соединения 30
Общая химическая схема формирования соединений типа соединения 30 приведена в следующей общей схеме V, в которой "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема V

Подробное описание получения промежуточных соединений 21, 22 и соединения 30 приведено далее.
Получение промежуточного соединения 21

Тионил хлорид (5,43 мл, 74,9 ммоль, 3,2 экв.) добавляли при комнатной температуре к холодному раствору 5-амино-[1,2,4]триазол-3-карбоновой кислоты (3 г, 23,4 ммоль) в MeOH (21 мл), и полученную смесь оставляли для перемешивания в течение 24 часов. Растворитель затем удаляли, и сырой остаток перекристаллизовывали из смеси MeOH-Et2O, получая промежуточное соединение 21 (3,5 г, 98%) в форме соли HCl. 1H ЯМР: (ДМСО-d6) δ 12,62 (с, 1H), 6,23 (с, 2H), 3,76 (с, 3H); MS: 143 [M+H]+; Т.пл.: 240-241°С; TLC: 15% MeOH в CHCl3: Rf: 0,50.
Получение промежуточного соединения 22

Бензальдегид (0,7 мл, 6,74 ммоль, 2 экв.) добавляли к раствору промежуточного соединения 21 (600 мг, 3,37 ммоль) в EtOH (10 мл), и полученный раствор оставляли для перемешивания в течение 6 часов при 75°C. Затем добавляли NaCNBH3 (424 мг, 6,74 ммоль, 2 экв.), и смесь оставляли для перемешивания в течение 16 часов при комнатной температуре. Реакционную смесь затем разбавляли водой (20 мл) и экстрагировали EtOAc (2×100 мл). Объединенный органический слой промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали хроматографией на колонках на силикагеле (100-200 меш) с использованием градиента смеси 10-40% EtOAc-гексан в качестве элюента, получая промежуточное соединение 22 (120 мг, 15%) в форме твердого вещества желтого цвета. 1H ЯМР: (ДМСО-d6) δ 12,87 (с, 1H), 7,23-7,38 (м, 7H), 4,39 (д, J=6,6 Гц, 2H), 3,76 (с, 3H), 3,08-3,10 (м, 1H); MS: 233 [M+H]+; TLC: EtOAc: Rf: 0,70.
Получение соединения 30

Следовали общей процедуре 3, получая соединение 30 (25 мг, 47%). 1H ЯМР: (ДМСО-d6) δ 8,56 (т, J=6,4 Гц, 1H), 8,06 (д, J=8,3 Гц, 2H), 7,67 (д, J=8,8 Гц, 2H), 7,24-7,41 (м, 5H), 4,67 (д, 6,2 Гц, 2H), 3,82 (с, 3H); MS: 371 [M+H]+; TLC: 20% EtOAc в гексане: Rf: 0,50.
Пример 42- Получение соединения 31
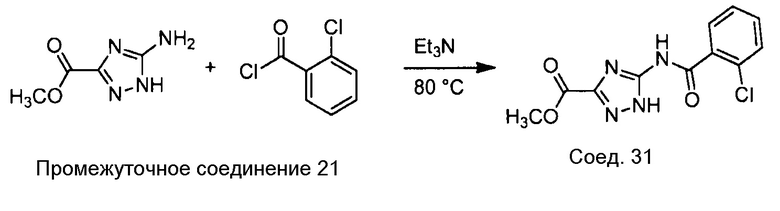
2-Хлорбензоил хлорид (0,33 мл, 2,46 ммоль, 1,1 экв.) добавляли при 0°C к раствору промежуточного соединения 21 (400 мг, 2,24 ммоль) в Et3N (6 мл). Полученную смесь нагревали до 80°C и оставляли для перемешивания в течение 4 часов. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали DCM (3×40 мл). Объединенные органические слои промывали водой (40 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали хроматографией на колонках на силикагеле (100-200 меш) с использованием градиента смеси MeOH-CHCl3 0-6% в качестве элюента, получая соединение 31 (80 мг, 12%). 1H ЯМР: (ДМСО-d6) δ 14,36 (с, 1H), 12,37 (с, 1H), 7,46-7,67 (м, 4H), 3,84 (с, 3H); MS: 281 [M+H]+; Т.пл.: 100-101°C; TLC: 10% MeOH в CHCl3: Rf: 0,60.
Пример 43 - Получение соединения 32

2-Хлорбензоил хлорид (0,24 мл, 1,80 ммоль, 1,1 экв.) добавляли при 0°C к раствору промежуточного соединения 21 (300 мг, 1,68 ммоль) в пиридине (6 мл). Полученный раствор нагревали до комнатной температуры и оставляли для перемешивания в течение 2 часов. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали CHCl3 (3×40 мл). Объединенные органические слои промывали водой (40 мл), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой остаток очищали хроматографией на колонках на силикагеле (100-200 меш) с использованием градиента смеси MeOH-CHCl3 0-6% в качестве элюента, получая соединение 32 (99 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,00 (с, 2H), 7,73 (д, J=7,5 Гц, 1H), 7,49-7,64 (м, 3H), 3,77 (с, 3H); MS: 281 [M+H]+; TLC: 10% MeOH в CHCl3: Rf: 0,60.
Пример 44 - Получение соединения 33
Общая схема VI. Схема синтеза, пригодная для синтеза соединений, описанных здесь, включая соединение 33, раскрыта в следующей общей схеме VI, в которой термины "Ar", "R1" и "R2" определены в примере 1.
Общая схема VI

Описание синтеза промежуточных соединений 23-28 и соединения 33 приведено далее.
Синтез промежуточного соединения 23 согласно следующей общей процедуре 8.
Получение промежуточного соединения 23 [общая процедура 8]
Следовали общей процедуре 8 в получении промежуточного соединения 23.
Общая процедура 8
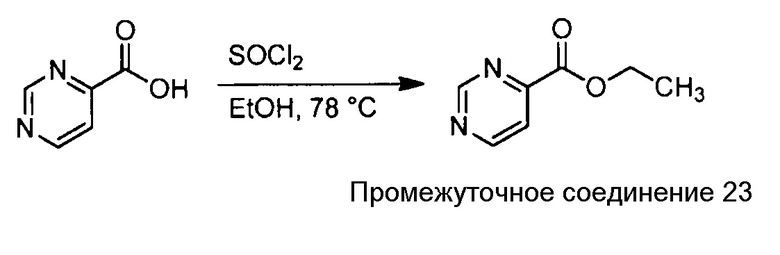
Тионил хлорид (3,55 мл, 48,4 ммоль, 3 экв.) добавляли по каплям к раствору пиримидин-4-карбоновой кислоты (2 г, 16,1 ммоль) в EtOH (15 мл), и полученную смесь нагревали с обратным холодильником в течение 14 часов. Смесь затем охлаждали до комнатной температуры и подщелачивали насыщенным водным раствором NaHCO3 до рН 8. Основной раствор затем экстрагировали EtOAc (4×50 мл). Объединенные органические слои промывали солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая промежуточное соединение 23 (1,7 г, 77%). 1H ЯМР: (ДМСО-d6) δ 9,40 (д, J=1,0 Гц, 1H), 9,10 (д, J=5,1 Гц, 1H), 8,05 (дд, J=5,1, 1,3 Гц, 1H), 4,39 (кв, J=7,1 Гц, 2H), 1,35 (т, J=7,1 Гц, 3H); MS: 153 [M+H]+; TLC: 40% гексан в EtOAc: Rf: 0,40.
Получение промежуточного соединения 24

Следовали общей процедуре 8, получая сырое промежуточное соединение 24 (950 мг, 86%). 1H ЯМР: (ДМСО-d6) δ 9,43 (с, 1H), 9,26 (с, 2H), 4,39 (кв, J=7,1 Гц, 2H), 1,35 (т, J=7,1 Гц, 3H); TLC: 40% EtOAc в гексане: Rf: 0,50.
Получение промежуточного соединения 25 [общая процедура 9]
Следовали общей процедуре 9 в получении промежуточного соединения 25.
Общая процедура 9

Промежуточное соединение 23 (1,6 г, 10,5 ммоль) добавляли по каплям при 0°C к энергично перемешиваемой смеси аминогуанидин сульфата (10,3 г, 42,1 ммоль, 4 экв.) в свежеполученном NaOMe (используя 968 мг, 42,1 ммоль Na в 28 мл сухого MeOH). Полученную смесь нагревали с обратным холодильником в течение 20 часов. Смесь затем охлаждали до комнатной температуры, аккуратно лили на ледяную воду (20 мл) и концентрировали в вакууме. Сырой остаток очищали на нейтральном оксиде алюминия, используя MeOH-CHCl3 4-10% в качестве элюента, получая промежуточное соединение 25 (500 мг, 26%). MS: 163 [М+Н]+; TLC: 20% MeOH в CHCl3: Rf: 0,20.
Получение промежуточного соединения 26

Следовали общей процедуре 9, получая промежуточное соединение 26 (500 мг, 45%). 1H ЯМР: (ДМСО-d6) δ 12,44 (уш.с, 1H), 9,17-9,18 (м, 3H), 6,32 (с, 2H); TLC: 20% MeOH в CHCl3: Rf: 0,20.
Получение промежуточного соединения 27

Следовали общей процедуре 2, получая промежуточное соединение 27 (210 мг, 34%). 1H ЯМР: (ДМСО-d6) δ 12,80 (с, 1H), 9,18 (с, 1H), 8,83 (с, 1H), 7,92 (д, J=4,4 Гц, 1H), 7,25-7,40 (м, 5H), 4,44 (д, J=5,7 Гц, 2H); TLC: EtOAc: Rf: 0,30.
Получение промежуточного соединения 28
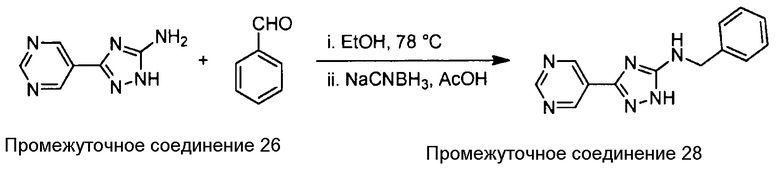
Следовали общей процедуре 2, получая промежуточное соединение 28 (160 мг, 20%). MS: 253 [М+Н]+; TLC: EtOAc: Rf: 0,30.
Получение соединения 33 [общая процедура 10]
[0252] Следовали общей процедуре 10 в получении соединения 33.
Общая процедура 10

2-Метоксибензоил хлорид (72 мкл, 0,54 ммоль, 2 экв.) добавляли при 0°C к раствору промежуточного соединения 27 (70 мг, 0,27 ммоль) в Et3N (0,18 мл, 1,35 ммоль) и DCM (3 мл). Полученную смесь оставляли для перемешивания при комнатной температуре в течение 2 часов. Реакционную смесь затем разбавляли водой (5 мл) и экстрагировали DCM (3×15 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (10 мл), водой (2×5 мл), солевым раствором (15 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) с использованием градиента смеси EtOAc-гексан 0-70% в качестве элюента, получая соединение 33 (45 мг, 29%). 1H ЯМР: (ДМСО-d6) δ 9,21 (с, 1H), 8,90 (д, J=5,1 Гц, 1H), 8,59 (т, J=6,0 Гц, 1H), 7,93 (д, J=5,1 Гц, 1H), 7,08-7,60 (м, 10H), 4,72 (д, J=5,7 Гц, 2H), 3,77 (с, 3H); MS: 387 [M+H]+; Т.пл.: 192-195°C; TLC: 40% гексан в EtOAc: Rf: 0,30,
Пример 45 - Получение соединения 34

Следовали общей процедуре 10 с последующей очисткой препаративной ВЭЖХ, получая соединение 34 (30 мг, 16%). 1H ЯМР: (ДМСО-d6) δ 9,26 (с, 1H), 9,11 (с, 2H), 8,64 (т, J=6,3 Гц, 1H), 7,07-7,60 (м, 9H), 4,71 (д, J=6,3 Гц, 2H), 3,78 (с, 3H); MS: 387 [M+H]+; Т.пл.: 154-157°C; TLC: 40% EtOAc в гексане: Rf: 0,20.
Пример 46 - Получение соединения 35
Общая схема VII. Схема синтеза, пригодная для синтеза соединений, описанных здесь, включая соединение 35, раскрыта в следующей общей схеме VII, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема VII

Описание синтеза промежуточных соединений 29, 30 и соединения 35 приведено далее.
Получение промежуточного соединения 29
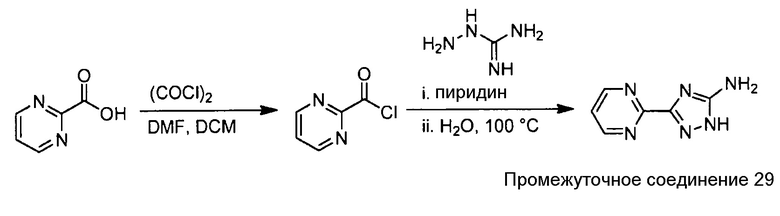
Оксалил хлорид (2,36 мл, 24,2 ммоль, 1,5 экв.) и каталитическое количество DMF добавляли при 0°C к раствору пиримидин-2-карбоновой кислоты (2 г, 16,1 ммоль) в сухом DCM (30 мл). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 3 часов. Летучие компоненты удаляли в вакууме, и остаток полностью высушивали, получая хлорангидрид пиримидин-2-карбоновой кислоты (2,1 г, 14,8 ммоль) в форме твердого вещества черного цвета. Сырой материал добавляли частями при 0°C к раствору аминогуанидин сульфата (5,5 г, 22,2 ммоль, 1,5 экв.) в пиридине (20 мл). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 14 часов. Смесь затем нейтрализовали насыщенным водным раствором NaHCO3, экстрагировали t-BuOH (5×50 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал растворяли в воде (45 мл), и полученный раствор нагревали до 100°C в течение 24 часов. Реакционную смесь затем охлаждали до комнатной температуры, экстрагировали t-BuOH (5×30 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме, получая промежуточное соединение 29 (650 мг, 25%) в форме твердого вещества грязно-белого цвета. TLC: 30% MeOH в CHCl3: Rf: 0,20.
Получение промежуточного соединения 30

Следовали общей процедуре 2, получая промежуточное соединение 30 (120 мг, 17%). MS: 253 [М+Н]+; TLC: EtOAc: Rf: 0,30.
Получение соединения 35

Следовали общей процедуре 10, получая соединение 35 (32 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,86 (д, J=5,1 Гц, 2H), 8,44 (т, J=6,0 Гц, 1H), 7,08-7,59 (м, 10H), 4,73 (д, J=6,3 Гц, 2H), 3,77 (с, 3H); MS: 387 [M+H]+; Т.пл.: 203-205°C; TLC: 40% гексан в EtOAc: Rf: 0,40.
Пример 47 - Получение соединения 36
Общая схема VIII. Схема синтеза, пригодная для синтеза соединений, описанных здесь, включая соединение 36, раскрыта в следующей общей схеме VIII, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема VIII.
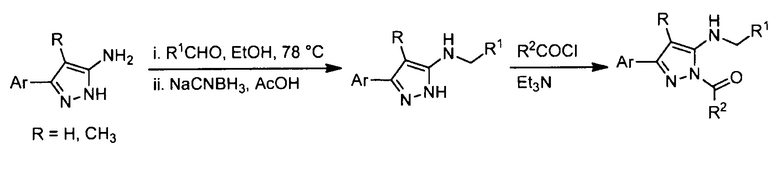
R=Н, CH3
Получение промежуточного соединения 31
Следовали общей процедуре 11 в получении промежуточного соединения 31.
Общая процедура 11

4-Фторбензальдегид (0,54 мл, 5,03 ммоль, 2 экв.) и молекулярные сита (4Å порошок) добавляли при комнатной температуре к раствору 3-амино-5-фенилпиразола (400 мг, 2,51 ммоль) в EtOH (20 мл), и полученную смесь нагревали с обратным холодильником. Через 8 часов реакционную смесь охлаждали до 0°C и добавляли AcOH (0,4 мл) и NaCNBH3 (316 мг, 5,03 ммоль, 2 экв.). Смеси затем давали нагреться до комнатной температуры и перемешивали в течение 15 часов. Растворитель выпаривали, и остаток растворяли в EtOAc (100 мл) и фильтровали через слой Целита, чтобы удалить неорганические материалы. Фильтрат затем промывали насыщенным водным раствором NaHCO3 (2×20 мл), водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента растворителей EtOAc-петролейный эфир 0-50% в качестве элюента, получая промежуточное соединение 31 (240 мг, 36%) в форме твердого вещества грязно-белого цвета. MS: 268 [М+Н]+; TLC: EtOAc: Rf: 0,60.
Получение соединения 36
Следовали общей процедуре 12 в получении соединения 36.
Общая процедура 12
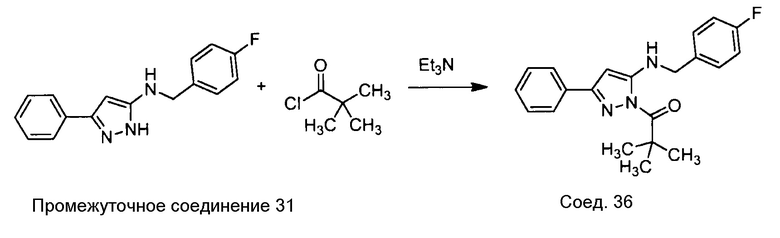
Пивалоил хлорид (32 мкл, 0,26 ммоль, 1,2 экв.) добавляли при комнатной температуре к раствору промежуточного соединения 31 (60 мг, 0,22 ммоль) в триэтиламине (3 мл) и перемешивали в течение 3 часов. Реакционную смесь разбавляли водой (5 мл) и экстрагировали EtOAc (20 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (5 мл), солевым раствором (5 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырое соединение очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-10% в качестве элюента, получая соединение 36 (23 мг, 29%). 1H ЯМР: (ДМСО-d6) δ 7,79-7,84 (м, 3Н), 7,37-7,49 (м, 5H), 7,17 (т, J=8,8 Гц, 2H), 5,89 (с, 1H), 4,38 (д, J=6,2 Гц, 2H), 1,49 (с, 9H); MS: 352 [M+H]+; TLC: 20% EtOAc в гексане: Rf: 0,60.
Пример 48 - Получение промежуточного соединения 32
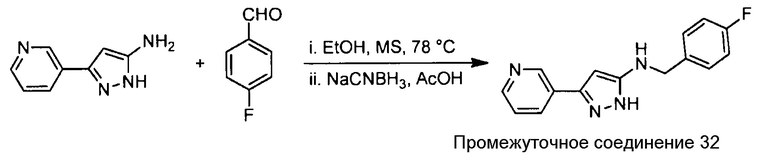
Следовали общей процедуре 11, получая промежуточное соединение 32 (200 мг, 24%). MS: 269 [М+Н]+; TLC: EtOAc: Rf: 0,40.
Пример 49 - Получение соединения 37
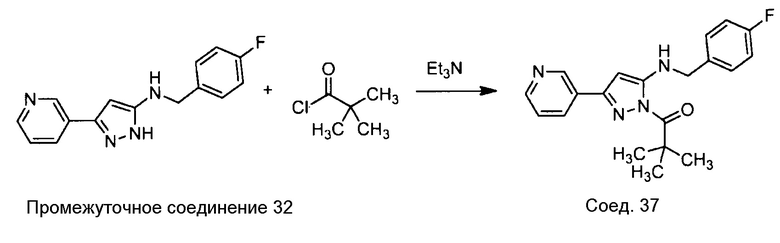
Следовали общей процедуре 12, получая соединение 37 (10 мг, 15%). 1H ЯМР: (ДМСО-d6) δ 8,99 (д, J=1,5 Гц, 1H), 8,58 (дд, J=4,9, 1,3 Гц, 1H), 8,14-8,16 (м, 1H), 7,83 (т, J=6,4 Гц, 1H), 7,45-7,48 (м, 3H), 7,16 (т, J=8,7 Гц, 2H), 6,01 (с, 1H), 4,38 (д, J=6,1 Гц, 2H), 1,49 (с, 9H); MS: 353 [M+H]+; TLC: 30% EtOAc в гексане: Rf: 0,60.
Пример 50 - Получение промежуточного соединения 33

Следовали общей процедуре 11, получая промежуточное соединение 33 (35 мг, 44%). MS: 282 [М+Н]+; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 51 - Получение соединения 38

Следовали общей процедуре 12, получая соединение 38 (6 мг, 7%). 1H ЯМР: (ДМСО-d6) δ 7,56-7,59 (м, 2H), 7,34-7,49 (м, 6H), 7,18 (т, J=9,0 Гц, 2H), 4,52 (д, J=6,8 Гц, 2H), 2,04 (с, 3H), 1,43 (с, 9H); MS: 366 [M+H]+; TLC: 20% EtOAc в гексане: Rf: 0,70.
Пример 52 - Получение соединения 39
Общая схема IX. Схема синтеза, пригодная для синтеза соединений, описанных здесь, включая соединение 39, раскрыта в следующей общей схеме IX, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема IX

Описание синтезов промежуточных соединений 34-37 и соединения 39 приведено далее.
Получение промежуточного соединения 34 [общая процедура 13]
Следовали общей процедуре 13 в получении промежуточного соединения 34.
Общая процедура 13
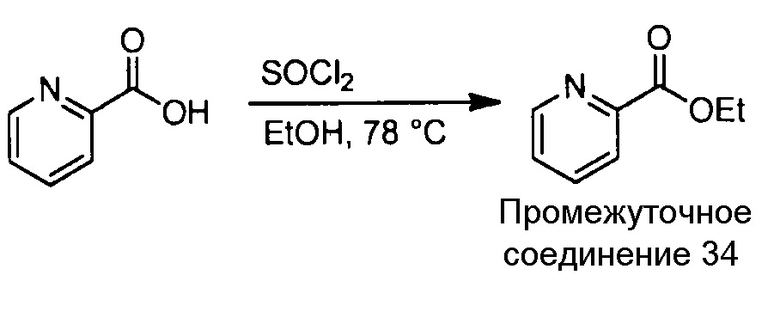
Тионил хлорид (5,4 мл, 73,2 ммоль, 3 экв.) добавляли при 0°C к раствору пиколиновой кислоты (3 г, 24,4 ммоль) в EtOH (50 мл). Полученную смесь нагревали с обратным холодильником и оставляли для перемешивания в течение 2 часов. Смесь затем охлаждали, и растворитель выпаривали. Полученный остаток лили в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc (2×50 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании DCM в качестве элюента, получая промежуточное соединение 34 (3 г, 81%) в форме бесцветной жидкости. MS: 152 [М+Н]+; TLC: 10% MeOH/NH3 в CHCl3: Rf: 0,70.
Получение промежуточного соединения 35 [общая процедура 14]
Следовали общей процедуре 14 в получении промежуточного соединения 35.
Общая процедура 14
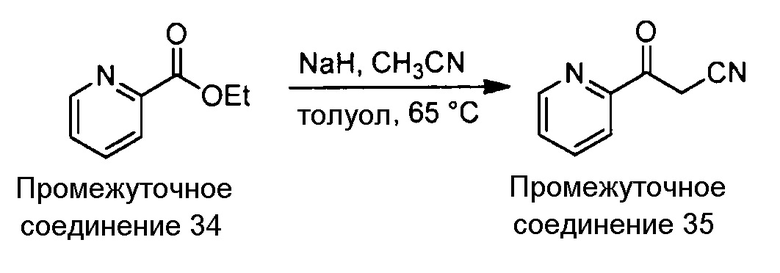
Раствор промежуточного соединения 34 (3 г, 19,6 ммоль) и CH3CN (0,8 мл, 19,6 ммоль, 1 экв.) в сухом толуоле (10 мл) медленно добавляли к смеси NaH (784 мг, 19,6 ммоль, 1 экв., 60% в минеральном масле) в толуоле (50 мл) при 65°C. Полученную смесь оставляли для перемешивания при 65°C в течение 16 часов. Реакционную смесь затем охлаждали до комнатной температуры и гасили ледяной водой (20 мл). Полученное твердое вещество отфильтровывали, получая промежуточное соединение 35 (1,5 г, 53%) в форме твердого вещества коричневого цвета. 1H ЯМР: (CDCl3) δ 8,70 (д, J=4,8 Гц, 1H), 8,12 (д, J=7,5 Гц, 1H), 7,90-7,94 (м, 1H), 7,56-7,60 (м, 1H), 4,41 (с, 2H); MS: 147 [M+H]+; TLC: EtOAc: Rf: 0,40.
Получение промежуточного соединения 36 [общая процедура 15]
Следовали общей процедуре 15 в получении промежуточного соединения 36.
Общая процедура 15
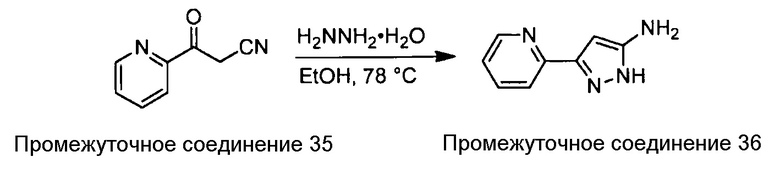
Гидразин гидрат (0,34 мл, 6,8 ммоль, 1 экв.) добавляли при комнатной температуре к раствору промежуточного соединения 35 (1 г, 6,8 ммоль) в EtOH (30 мл). Смесь затем нагревали с обратным холодильником и оставляли для перемешивания в течение 20 часов. Растворитель затем выпаривали. Полученный сырой материал растирали с Et2O (2×20 мл) и высушивали под вакуумом, получая промежуточное соединение 36 (700 мг, 64%) в форме коричневой жидкости. 1H ЯМР: (ДМСО-d6) δ 8,53 (д, J=4,4 Гц, 1H), 7,78 (д, J=4,4 Гц, 2H), 7,23-7,26 (м, 1H), 5,95 (с, 1H), 4,84 (уш.с, 2H); MS: 161 [M+H]+; TLC: EtOAc: Rf: 0,20.
Получение промежуточного соединения 37
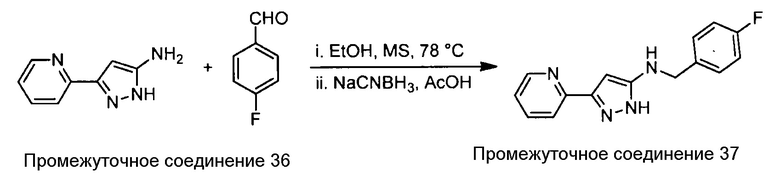
Следовали общей процедуре 11, получая промежуточное соединение 37 (450 мг). MS: 269 [М+Н]+; TLC: EtOAc: Rf: 0,40.
Получение соединения 39

Следовали общей процедуре 12, получая соединение 39 (40 мг, 30%). 1H ЯМР: (ДМСО-d6) δ 8,58 (д, J=4,4 Гц, 1H), 7,86-7,98 (м, 3H), 7,38-7,46 (м, 3H), 7,18 (т, J=8,8 Гц, 2H), 5,84 (с, 1H), 4,40 (д, J=6,2 Гц, 2H), 1,50 (с, 9H); MS: 353 [M+H]+; Т.пл.: 102-103°C; TLC: 20% EtOAc в гексане: Rf: 0,60.
Пример 53 - Получение соединения 40

Следовали общей процедуре 12, получая соединение 40 (38 мг, 29%). 1H ЯМР: (ДМСО-d6) δ 8,58 (д, J=4,4 Гц, 1H), 7,97 (д, J=7,9 Гц, 1H), 7,79-7,88 (м, 2H), 7,37-7,46 (м, 3H), 7,17 (т, J=8,8 Гц, 2H), 5,87 (с, 1H), 4,42 (д, J=6,2 Гц, 2H), 3,13 (кв, J=7,3 Гц, 2H), 1,17 (т, J=7,3 Гц, 3H); MS: 325 [M+H]+; Т.пл.: 106-108°C; TLC: 20% EtOAc в гексане: Rf: 0,50.
Пример 54 - Получение соединения 41

Следовали общей процедуре 12, получая соединение 41 (30 мг, 20%). 1H ЯМР: (ДМСО-d6) δ 8,55 (д, J=4,4 Гц, 1H), 7,97 (т, J=5,9 Гц, 1H), 7,71-7,78 (м, 2H), 7,49-7,63 (м, 6H), 7,34-7,37 (м, 1H), 7,20 (т, J=8,8 Гц, 2H), 5,94 (с, 1H), 4,49 (д, J=6,2 Гц, 2H); MS: 407 [M+H]+, 409 [M+2+H]+; Т.пл.: 137-136°C; TLC: 20% EtOAc в гексане: Rf: 30.
Пример 55 - общая схема X
Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта в следующей общей схеме X, в которой термин "R” в каждом случае независимо обозначает "R1" и "R2", как определено в примере 1, и "AR1" и "AR2" определены как "Ar" в примере 1.
Общая схема X

Пример 56 - Получение соединения 42 [общая процедура 16]
Следовали общей процедуре 16 в получении соединения 42.
Общая процедура 16
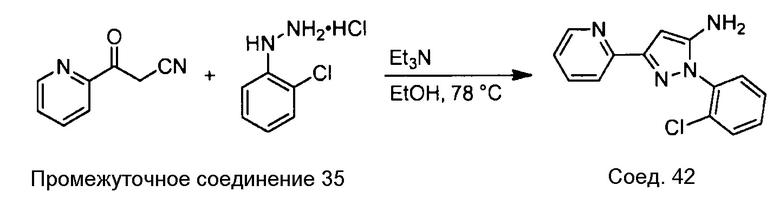
2-Хлорфенилгидразин гидрохлорид (122 мг, 0,68 ммоль, 1 экв.) и Et3N (95 мкл, 0,68 ммоль, 1 экв.) добавляли к раствору промежуточного соединения 35 (100 мг, 0,68 ммоль) в EtOH (3 мл). Полученный раствор нагревали с обратным холодильником и оставляли для перемешивания в течение 2 часов. Растворитель затем выпаривали. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-70% в качестве элюента, получая соединение 42 (70 мг, 37%). 1H ЯМР: (ДМСО-d6) δ 8,56 (д, J=4,4 Гц, 1Н), 7,64-7,84 (м, 3H), 7,28-7,29 (м, 1Н), 6,00 (с, 1Н), 5,31 (с, 2H); MS: 271 [M+H]+, 273 [M+2+H]+; Т.пл.: 134-137°C; TLC: EtOAc: Rf: 0,20.
Пример 57 - Получение соединения 43 [общая процедура 17]
Следовали общей процедуре 17 в получении соединения 43.
Общая процедура 17
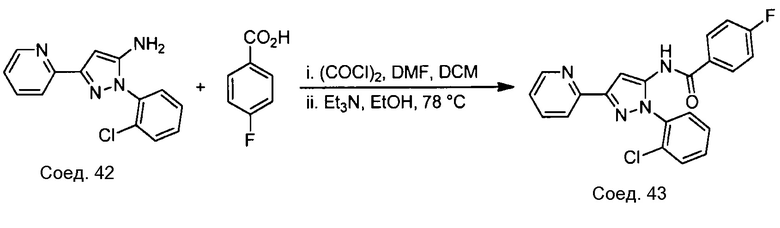
Оксалил хлорид (7,2 мл, 5,37 ммоль, 1,5 экв.) и DMF (0,5 мл) добавляли при 0°C к раствору 4-фторбензойной кислоты в DCM (20 мл). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа. Летучие компоненты выпаривали, и смесь перегоняли совместно с толуолом (30 мл). Полученный материал высушивали под вакуумом, получая сырой 4-фторбензоил хлорид (500 мг) в форме бесцветной жидкости, которую использовали без дополнительной очистки. 4-Фторбензоил хлорид (49 мг, 0,31 ммоль, 1,2 экв.) и Et3N (0,36 мл, 2,59 ммоль, 10 экв.) добавляли при комнатной температуре к раствору соединения 42 (70 мг, 0,26 ммоль) в DCM (4 мл), и полученную смесь оставляли для перемешивания в течение 3 часов. Смесь разбавляли водой (10 мл) и экстрагировали в EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (2×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-60% в качестве элюента, получая соединение 43 (25 мг, 25%). 1H ЯМР: (ДМСО-d6) δ 10,57 (с, 1Н), 8,64 (д, J=4,4 Гц, 1Н), 7,97 (д, J=7,9 Гц, 1Н), 7,82-7,88 (м, 3H), 7,49-7,68 (м, 4H), 7,31-7,39 (м, 3H), 7,06 (с, 1Н); MS: 393 [M+H]+, 395 [M+2+H]+; Т.пл.: 186-188°C; TLC: EtOAc: Rf: 0,40.
Пример 58 - Получение соединения 44 [общая процедура 18]
Следовали общей процедуре 18 в получении соединения 44.
Общая процедура 18

Гидрид натрия (17,7 мг, 0,37 ммоль, 1 экв., 60% в минеральном масле) добавляли при 0°C к раствору соединения 42 (100 мг, 0,37 ммоль) и 4-фторбензил бромида (30 мкл, 0,22 ммоль, 0,6 экв.) в DMF (4 мл). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа. Смесь разбавляли водой (10 мл) и экстрагировали в EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (2×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-20% в качестве элюента, получая соединение 44 (25 мг, 13%). 1H ЯМР: (ДМСО-d6) δ 8,57 (д, J=4,4 Гц, 1Н), 7,73-7,88 (м, 3H), 7,49-7,62 (м, 3H), 7,30-7,33 (м, 1Н), 7,06-7,15 (м, 8H), 6,63 (с, 1Н), 3,96 (с, 4H); MS: 487 [M+H]+, 489 [M+2+H]+; Т.пл.: 113-117°C; TLC: EtOAc: Rf: 0,60.
Пример 59 - Получение соединения 45 [общая процедура 19]
Следовали общей процедуре 19 в получении соединения 45.
Общая процедура 19
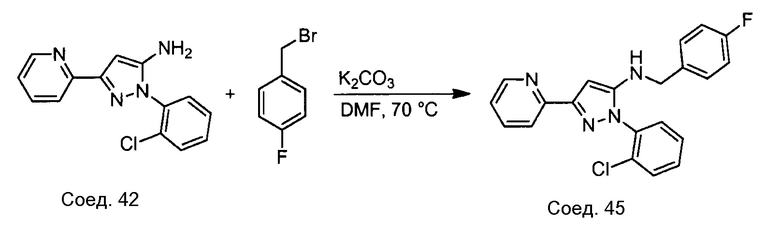
4-Фторбензил бромид (126 мг, 0,67 ммоль, 0,6 экв.) и K2CO3 (310 мг, 2,24 ммоль, 2 экв.) добавляли при комнатной температуре к раствору соединения 42 (300 мг, 1,11 ммоль) в DMF (8 мл). Полученную смесь нагревали до 70°C и оставляли для перемешивания в течение 8 часов. Смесь разбавляли водой (10 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (2×5 мл), насыщенным водным раствором NaHCO3 (2×5 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал частично очищали препаративной TLC с использованием смеси 40% EtOAc-гексан и затем препаративной ВЭЖХ, получая соединение 45 (16 мг, 4%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 8,51 (д, J=4,4 Гц, 1Н), 7,70-7,83 (м, 3H), 7,54-7,60 (м, 3H), 7,40-7,43 (м, 2H), 7,12-7,27 (м, 3H), 6,13 (т, J=5,7 Гц, 1Н), 5,87 (с, 1Н), 4,24 (д, J=5,7 Гц, 2H); MS: 379 [M+H]+, 381 [M+2+H]+; Т.пл.: 159-162°C; TLC: EtOAc: Rf: 0,30.
Пример 60 - общая схема XI
Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта в следующей общей схеме XI, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема XI

Пример 61 - Получение промежуточного соединения 38
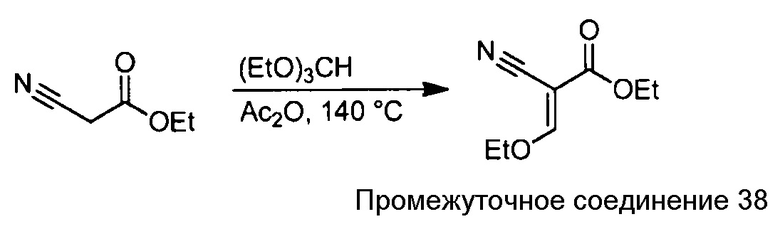
Раствор этил цианоацетата (20 г, 176,8 ммоль) и триэтил ортоформиата (29,4 мл, 176,8 ммоль) в уксусном ангидриде (100 мл) нагревали до 140°C и оставляли для перемешивания в течение 5 часов. Растворитель затем выпаривали, получая сырое промежуточное соединение 38 (23 г, 76%) в форме низкоплавкого твердого вещества. MS: 170 [М+Н]+; TLC: 30% EtOAc в гексане: Rf: 0,40.
Пример 62- Получение промежуточного соединения 39
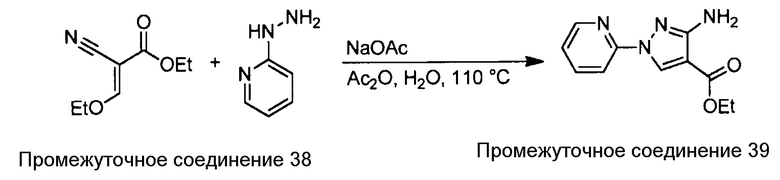
Ацетат натрия (8,2 г, 100 ммоль, 2 экв.) добавляли к раствору промежуточного соединения 38 (8,45 г, 50,0 ммоль) и 2-гидразинопиридина (5 г, 45,5 ммоль, 0,9 экв.) в AcOH (100 мл) и воде (20 мл). Полученную смесь нагревали при 110°C и оставляли для перемешивания в течение 16 часов. Смеси затем давали охладиться и добавляли ледяную воду. Осадок собирали фильтрацией и промывали Et2O, и высушивали под вакуумом, получая промежуточное соединение 39 (4 г, 38%) в форме твердого вещества светло-желтого цвета. 1H ЯМР: (ДМСО-d6) δ 8,48-8,49 (м, 1Н), 8,00-8,04 (м, 1Н), 7,87 (д, J=8,3 Гц, 1Н), 7,79 (с, 1Н), 7,65 (уш.с, 2H), 7,33-7,36 (м, 1Н), 4,22 (кв, J=7,0 Гц, 2H), 1,28 (т, J=7,0 Гц, 3H); MS: 233 [M+H]+; TLC: 15% EtOAc в гексане: Rf: 0,50.
Пример 63 - Получение соединения 46

Гидрид натрия (603 мг, 15,1 ммоль, 1 экв., 60% в минеральном масле) добавляли при 0°C к раствору промежуточного соединения 39 (3,5 г, 15,1 ммоль) в DMF (300 мл). Через 30 минут добавляли раствор 4-фторбензил бромида (2,85 г, 15,1 ммоль, 1 экв.) в DMF (50 мл), и полученной смеси давали нагреться до комнатной температуры. Через 5 часов реакционную смесь разбавляли водой (100 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (5×50 мл), солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-5% в качестве элюента, получая частично чистый продукт. Этот материал затем перекристаллизовывали из Et2O и пентана, получая соединение 46 (2,8 г, 55%) в форме твердого вещества светло-желтого цвета. 1H ЯМР: (ДМСО-d6) δ 9,50 (т, J=6,6 Гц, 1Н), 8,45-8,46 (м, 1Н), 8,00-8,05 (м, 1Н), 7,82-7,89 (м, 2H), 7,24-7,38 (м, 3H), 7,11 (т, J=8,8 Гц, 2H), 4,88 (д, J=6,6 Гц, 2H), 4,17 (кв, J=7,0 Гц, 2H), 1,24 (т, J=7,0 Гц, 3H); MS: 341 [M+H]+; Т.пл.: 99-100°C; TLC: 15% EtOAc в гексане: Rf: 0,40.
Пример 64 - Получение соединения 47

Гидроксид калия (922 мг, 16,5 ммоль) добавляли к раствору соединения 46 (2,8 г, 8,23 ммоль) в THF (10 мл) и MeOH (10 мл). Полученную смесь нагревали до 70°C и оставляли для перемешивания в течение 16 часов. Реакционную смесь затем нейтрализовали водным раствором HCl (2н.), и полученный осадок собирали фильтрацией, промывали водой (50 мл) и высушивали, получая соединение 47 (2,1 г, 84%) в форме твердого вещества грязно-белого цвета. MS: 313 [М+Н]+; TLC: 50% EtOAc в гексане: Rf: 0,30.
Пример 65 - Получение соединения 48 [общая процедура 20]
Следовали общей процедуре 20 в получении соединения 48.
Общая процедура 20

N,О-диметилгидроксиламин гидрохлорид (979 мг, 10,1 ммоль, 1,5 экв.) добавляли к смеси EDCI (2,0 г, 10,1 ммоль, 1,5 экв.), HOBt (3,1 г, 21,2 ммоль, 3,2 экв.), DIEA (3,5 мл, 20,2 ммоль, 3 экв.) и соединения 47 (2,1 г, 6,73 ммоль) в DMF (30 мл). Полученную смесь оставляли для перемешивания при комнатной температуре в течение 16 часов. Смесь затем разбавляли водой (50 мл) и экстрагировали EtOAc (100 мл). Органический слой промывали водой (2×50 мл), насыщенным водным раствором NaHCO3 (50 мл), солевым раствором (50 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-30% в качестве элюента, получая соединение 48 (1,5 г, 65%). 1H ЯМР: (ДМСО-d6) δ 9,29 (т, J=6,6 Гц, 1Н), 8,49 (д, J=4,9 Гц, 1Н), 7,98-8,04 (м, 1Н), 7,82-7,85 (м, 1Н), 7,69 (с, 1Н), 7,34-7,38 (м, 1Н), 7,06-7,19 (м, 4H), 4,54 (д, J=7,0 Гц, 2H), 3,28 (с, 3Н), 3,14 (с, 3H); MS: 356 [M+H]+; Т.пл.: 88-99°С; TLC: 50% EtOAc в гексане: Rf: 0,30.
Пример 66 - Получение соединения 49
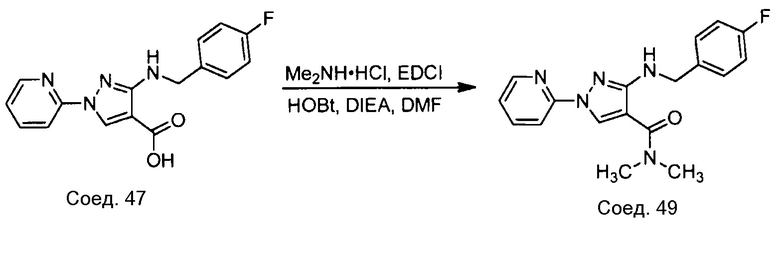
Следовали общей процедуре 20, получая соединение 49 (31 мг, 32%). 1H ЯМР: (ДМСО-d6) δ 9,23 (т, J=6,6 Гц, 1Н), 8,48 (д, J=3,5 Гц, 1Н), 7,99-8,03 (м, 1Н), 7,88-7,91 (м, 1Н), 7,49 (с, 1Н), 7,32-7,35 (м, 1Н), 7,09-7,20 (м, 4H), 4,50 (д, J=6,6 Гц, 2H), 2,57-2,89 (м, 6H); MS: 340 [M+H]+; Т.пл.: 107-109°C; TLC: 50% EtOAc в гексане: Rf: 0,30.
Пример 67 - Получение промежуточного соединения 40
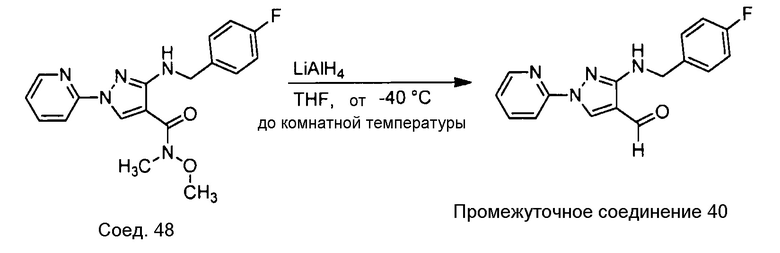
Литий-алюминийгидрид (642 мг, 16,9 ммоль) добавляли при -40°C к раствору соединения 48 (1,5 г, 4,22 ммоль) в THF (20 мл). Полученной смеси давали нагреться до 0°C и перемешивали в течение 5 часов. Смесь затем гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (2×50 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-10% в качестве элюента, получая промежуточное соединение 40 (1 г, 80%). 1H ЯМР: (ДМСО-d6) δ 10,09 (с, 1H), 9,53 (с, 1H), 8,47 (д, J=5,1 Гц, 1Н), 8,05 (т, J=7,9 Гц, 1Н), 7,99 (с, 1Н), 7,92 (д, J=8,2 Гц, 1Н), 7,34-7,37 (м, 3H), 7,15-7,20 (м, 2H), 4,96 (д, J=6,3 Гц, 2H); MS: 297 [M+H]+; TLC: 20% EtOAc в гексане: Rf: 0,30.
Пример 68 - Получение промежуточного соединения 41

Триэтиламин (4,6 мл, 33,7 ммоль, 10 экв.), DMAP (410 мг, 3,36 ммоль, 1 экв.) и (ВОС)2О (5 мл, 20,5 ммоль, 6,1 экв.) добавляли к раствору промежуточного соединения 40 (1 г, 3,36 ммоль) в THF (3 мл). Полученную смесь оставляли для перемешивания при комнатной температуре в течение 16 часов. Смесь затем разбавляли водой (75 мл) и экстрагировали EtOAc (150 мл). Органический слой промывали водой (2×75 мл), солевым раствором (75 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-15% в качестве элюента, получая промежуточное соединение 41 (1 г, 76%) в форме светло-желтой жидкости. MS: 397 [М+Н]+; TLC: 30% EtOAc в гексане: Rf: 0,50.
Пример 69 - Получение промежуточного соединения 42

Этилмагний хлорид (0,75 мл, 1,5 ммоль, 3 экв., 2M в THF) добавляли при -78°C к раствору промежуточного соединения 41 (200 мг, 0,50 ммоль) в THF (10 мл). Полученную смесь нагревали до 0°C и оставляли для перемешивания в течение 4 часов. Реакционную смесь затем гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (10 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси 0-30% EtOAc-гексан в качестве элюента, получая промежуточное соединение 42 (140 мг, 65%) в форме твердого вещества желтого цвета. MS: 427 [М+Н]+; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 70 - Получение промежуточного соединения 43

Диоксид марганца (245 мг, 2,81 ммоль) добавляли к раствору промежуточного соединения 42 (120 мг, 0,28 ммоль) в THF (10 мл), и полученную смесь оставляли для перемешивания при комнатной температуре в течение 48 часов. Смесь затем фильтровали через Целит и промывали EtOAc (20 мл). Органическую фазу промывали водой (10 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-30% в качестве элюента, получая промежуточное соединение 43 (90 мг, 75%). MS: 425 [М+Н]+; TLC: 40% EtOAc в гексане: Rf: 0,50.
Пример 71 - Получение соединения 50
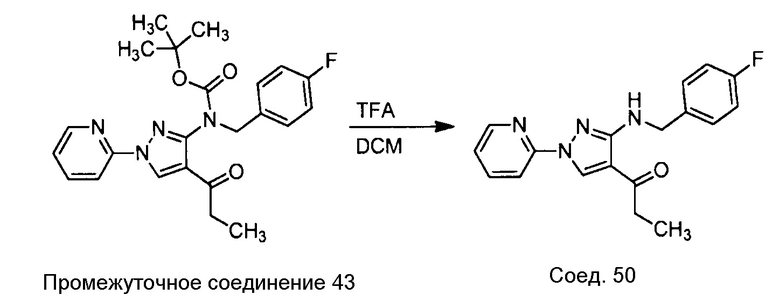
Трифторуксусную кислоту (2 мл) добавляли при 0°C к раствору промежуточного соединения 43 (90 мг, 0,21 ммоль) в DCM (2 мл). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь затем нейтрализовали насыщенным водным раствором NaHCO3 и экстрагировали EtOAc (30 мл). Органический слой промывали водой (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-20% в качестве элюента, получая соединение 50 (50 мг, 73%). 1H ЯМР: (ДМСО-d6) δ 9,40-9,43 (м, 1Н), 8,46 (д, J=3,2 Гц, 1Н), 7,97-8,08 (м, 2H), 7,79 (д, J=8,2 Гц, 1Н), 7,35-7,38 (м, 1Н), 7,03-7,14 (м, 4H), 4,72 (д, J=6,7 Гц, 2H), 2,70 (кв, J=7,3 Гц, 2H), 1,00 (т, J=7,5 Гц, 3H); MS: 325 [M+H]+; Т.пл.: 108-110°C; TLC: 50% EtOAc в гексане: Rf: 0,40.
Пример 72 - общая схема XII
Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта в следующей общей схеме XII, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1, и термин "X" относится к галогену, например, Cl, Br.
Общая схема XII

Пример 73 - Получение промежуточного соединения 44

Литий гексаметилдисилазид (24,8 мл, 24,8 ммоль, 1 экв., 1M в THF) разбавляли безводным Et2O (100 мл) и охлаждали до -78°C под атмосферой аргона. Через 15 минут к холодной смеси добавляли 2-ацетилпиридин (3 г, 24,8 ммоль) в Et2O (20 мл). После 30 минут при -78°C, диэтил оксалат (3,61 г, 24,8 ммоль, 1 экв.) в Et2O (25 мл) добавляли одной порцией, и полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 20 часов. Полученный осадок собирали фильтрацией и высушивали, получая промежуточное соединение 44 (4 г, 74%) в форме соли лития. MS: 222 [М+Н]+; TLC: EtOAc: Rf: 0,10.
Пример 74 - Получение промежуточного соединения 45
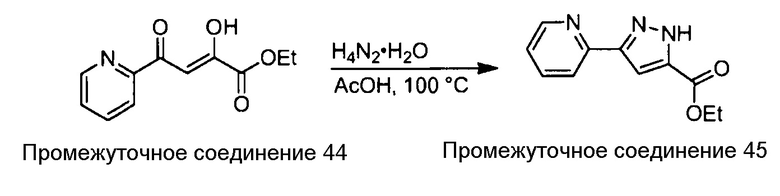
Гидразин гидрат (602 мг, 13,3 ммоль, 15 экв.) добавляли к раствору промежуточного соединения 44 (200 мг, 0,90 ммоль) в AcOH (5 мл). Полученную смесь нагревали до 100°C и оставляли для перемешивания в течение 12 часов. Реакционную смесь затем нейтрализовали насыщенным водным раствором NaHCO3 (20 мл) и экстрагировали EtOAc (40 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (2×10 мл), водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал промывали пентаном (2×10 мл) и высушивали под вакуумом, получая промежуточное соединение 45 (120 мг, 66%) в форме вязкой жидкости. MS: 218 [М+Н]+; TLC: EtOAc: Rf: 0,40.
Пример 75 - Получение соединения 51

Безводный K2CO3 (1,27 г, 9,21 ммоль, 2,5 экв.) и 4-фторфенетил бромид (1 г, 4,61 ммоль, 1,25 экв.) добавляли к раствору промежуточного соединения 45 (744 мг, 3,68 ммоль) в DMF (30 мл), и полученную смесь оставляли для перемешивания при комнатной температуре в течение 8 часов. Смесь затем разбавляли водой (30 мл) и экстрагировали EtOAc (100 мл). Органический слой промывали водой (2×10 мл), насыщенным водным раствором NaHCO3 (2×15 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-10% в качестве элюента, получая соединение 51 (700 мг, 58%). 1H ЯМР: (ДМСО-d6) δ 8,61 (д, J=4,3 Гц, 1H), 7,85-7,96 (м, 2H), 7,31-7,38 (м, 2H), 7,07-7,19 (м, 4H), 4,78 (т, J=7,2 Гц, 2H), 4,27 (кв, J=7,2 Гц, 2H), 3,12 (т, J=7,2 Гц, 2H), 1,29 (т, J=7,0 Гц, 3H); MS: 340 [M+H]+; Т.пл.: 94-95°C; TLC: 30% EtOAc в гексане: Rf: 0,40.
Пример 76 - Получение соединения 52 [общая процедура 21]
Следовали общей процедуре 21 в получении соединения 52.
Общая процедура 21

К раствору соединения 51 (300 мг, 0,88 ммоль) в THF (3 мл) добавляли LiOH•H2O (185 мг, 4,42 ммоль, 5 экв.) в воде (3 мл) и MeOH (3 мл). Смесь нагревали до 50°C и оставляли для перемешивания в течение 3 часов. Реакционную смесь затем нейтрализовали водным раствором HCl (2н.), и осадок собирали фильтрацией, промывали водой (20 мл) и высушивали, получая соединение 52 (220 мг, 83%) в форме твердого вещества светло-розового цвета. 1H ЯМР: (ДМСО-d6) δ 8,74 (д, J=4,5 Гц, 1H), 8,29-8,33 (м, 2H), 7,72 (уш.с, 2H), 7,08-7,19 (м, 4H), 4,84 (т, J=6,7 Гц, 2H), 3,16 (т, J=7,0 Гц, 2H); MS: 312 [M+H]+; Т.пл.: 256-258°C; TLC: EtOAc: Rf: 0,10.
Пример 77 - Получение соединения 53

Следовали общей процедуре 20, получая соединение 53 (190 мг, 55%). 1H ЯМР: (ДМСО-d6) δ 8,60 (д, J=4,4 Гц, 1H), 7,95 (д, J=7,9 Гц, 1H), 7,86-7,88 (м, 1H), 7,34-7,37 (м, 1H), 7,07-7,21 (м, 5H), 4,67 (т, J=7,1 Гц, 2H), 3,57 (с, 3H), 3,25 (с, 3H), 3,12 (т, J=7,1 Гц, 2H); MS: 355 [M+H]+; Т.пл.: 110-111°C; TLC: 50% EtOAc в гексане: Rf: 0,30.
Пример 78 - Получение соединения 54
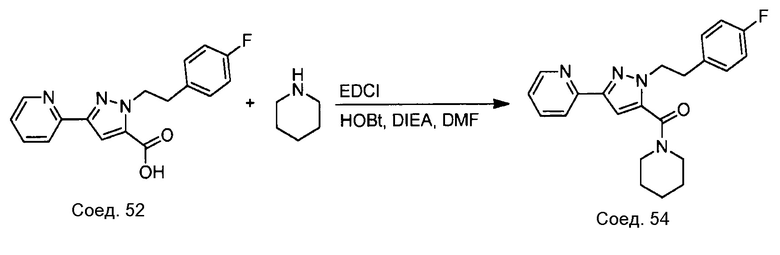
Следовали общей процедуре 20, получая соединение 54 (25 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,57 (д, J=4,4 Гц, 1H), 7,82-7,94 (м, 2H), 7,31-7,34 (м, 1H), 7,04-7,14 (м, 4H), 6,84 (с, 1H), 4,56 (т, J=7,0 Гц, 2H), 3,52 (уш.с, 2H), 3,25 (уш.с, 2H), 3,10 (т, J=7,0 Гц, 2H), 1,41-1,58 (м, 6H); MS: 379 [M+H]+; Т.пл.: 88-90°C; TLC: EtOAc: Rf: 0,50.
Пример 79 - Получение промежуточного соединения 46
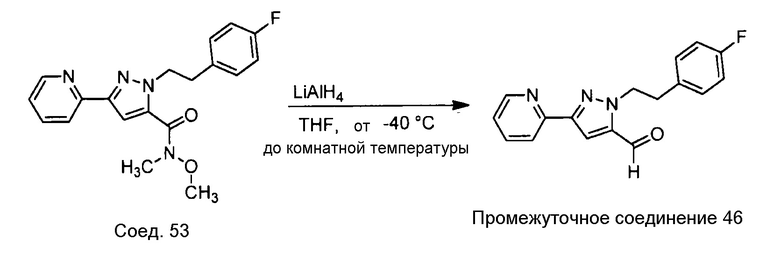
Литий-алюминийгидрид (11 мг, 0,28 ммоль) добавляли при -40°C к раствору соединения 53 (100 мг, 0,28 ммоль) в THF (4 мл). Полученной смеси давали медленно нагреться до 0°C и перемешивали в течение 2 часов. Смесь затем гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (10 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал промывали пентаном (2×5 мл) и высушивали под вакуумом, получая промежуточное соединение 46 (65 мг, 79%). 1H ЯМР: (ДМСО-d6) δ 9,82 (с, 1H), 8,63 (д, J=3,5 Гц, 1H), 7,86-7,97 (м, 2H), 7,54 (с, 1H), 7,36-7,39 (м, 1H), 7,07-7,19 (м, 4H), 4,75-4,78 (м, 2H), 3,11-3,14 (м, 2H); TLC: 30% EtOAc в гексане: Rf: 0,50.
Пример 80 - Получение соединения 55
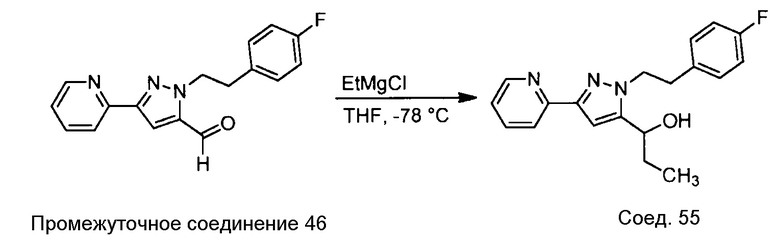
Этилмагний хлорид (0,33 мл, 0,66 ммоль, 3 экв., 2M в THF) добавляли при -78°C к раствору промежуточного соединения 46 (65 мг, 0,22 ммоль) в THF (4 мл). Полученную смесь нагревали до 0°C и оставляли для перемешивания в течение 4 часов. Реакционную смесь затем гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали EtOAc (30 мл). Органический слой промывали водой (10 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси 0-30% EtOAc-гексан в качестве элюента, получая соединение 55 (60 мг, 84%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 8,55 (д, J=3,8 Гц, 1H), 7,79-7,93 (м, 2H), 7,10-7,30 (м, 5Н), 6,65 (с, 1Н), 5,31 (д, J=6,0 Гц, 1H), 4,25-4,39 (м, 3H), 3,14-3,16 (м, 2H), 1,58-1,69 (м, 2H), 0,81 (т, J=7,3 Гц, 3Н); MS: 326 [M+H]+; Т.пл.: 91-96°C; TLC: 50% EtOAc в гексане: Rf: 0,20.
Пример 81 - Получение соединения 56

Диоксид марганца (83 мг, 0,96 ммоль, 3 экв.) добавляли к раствору соединения 55 (100 мг, 0,32 ммоль) в THF (4 мл), и полученную смесь оставляли для перемешивания при комнатной температуре в течение 14 часов. Смесь затем фильтровали через Целит и промывали EtOAc (20 мл). Органическую фазу промывали водой (10 мл), насыщенным водным раствором NaHCO3 (10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента смеси EtOAc-гексан 0-30% в качестве элюента, получая соединение 56 (22 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,61 (д, J=5,1 Гц, 1H), 7,85-7,95 (м, 2H), 7,60 (с, 1H), 7,35-7,38 (м, 1H), 7,08-7,21 (м, 4H), 4,74 (т, J=7,6 Гц, 2H), 3,06 (т, J=7,3 Гц, 2H), 2,94 (кв, J=12 Гц, 2H), 1,03 (т, J=7,3 Гц, 3H); MS: 324 [M+H]+; Т.пл.: 129-130°C; TLC: 50% EtOAc в гексане: Rf: 0,50.
Пример 82 - общая схема XIII
Схема синтеза, пригодная для синтеза соединений, описанных здесь, раскрыта в следующей общей схеме XIII, в которой термины "Ar", "R1" и "R2" имеют значения, определенные в примере 1.
Общая схема XIII

Пример 83 - Получение соединения 57
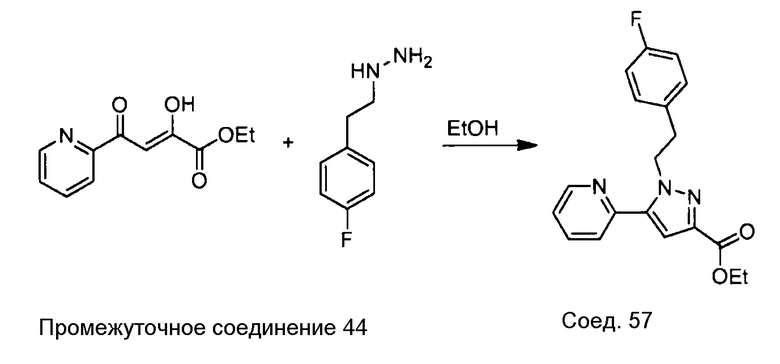
[2-(4-Фторфенил)-этил]-гидразин (348 мг, 2,26 ммоль, 2 экв.) добавляли к раствору промежуточного соединения 44 (500 мг, 2,26 ммоль) в EtOH (30 мл), и полученную смесь оставляли для перемешивания в течение 12 часов. Растворитель выпаривали, и остаток растворяли в EtOAc (100 мл) и фильтровали через Целит, чтобы удалить весь остаточный неорганический материал. Фильтрат промывали насыщенным водным раствором NaHCO3 (2×10 мл), водой (20 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках на силикагеле (100-200 меш) при использовании градиента растворителя EtOAc-гексан 0-15% в качестве элюента, получая соединение 57 (400 мг, 52%). 1H ЯМР: (ДМСО-d6) δ 8,72-8,73 (м, 1H), 7,87-7,91 (м, 1H), 7,75-7,77 (м, 1H), 7,41-7,44 (м, 1H), 7,29 (с, 1H), 6,99-7,15 (м, 4H), 4,91 (т, J=7,6 Гц, 2H), 4,31 (кв, J=7,1 Гц, 2H), 3,06 (т, J=7,6 Гц, 2H), 1,3 (т, J=7,0 Гц, 3H); MS: 340 [M+H]+; Т.пл.: 91-92°C; TLC: 30% EtOAc в гексане: Rf: 0,30.
Пример 84 - Получение соединения 58

Следовали общей процедуре 21, получая соединение 58 (230 мг, 84%) в форме твердого вещества грязно-белого цвета. 1H ЯМР: (ДМСО-d6) δ 12,84 (с, 1H), 8,71 (д, J=4,4 Гц, 1H), 7,73-7,90 (м, 2H), 7,40-7,43 (м, 1H), 6,99-7,22 (м, 5H), 4,88 (т, J=7,3 Гц, 2H), 3,06 (т, J=7,6 Гц, 2H); MS: 312 [M+H]+; Т.пл.: 132-134°C; TLC: EtOAc: Rf: 0,10.
Пример 85 - Получение соединения 59
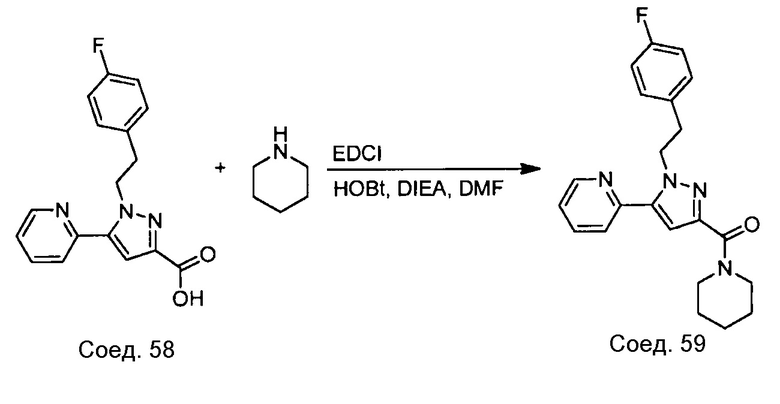
Следовали общей процедуре 20, получая соединение 59 (25 мг, 21%). 1H ЯМР: (ДМСО-d6) δ 8,69 (д, J=4,4 Гц, 1H), 7,85-7,89 (м, 1H), 7,73 (д, J=7,6 Гц, 1H), 7,38-7,41 (м, 1H), 6,95-7,06 (м, 5H), 4,86 (т, J=7,0 Гц, 2H), 3,54-3,95 (м, 4H), 3,01 (т, J=7,0 Гц, 2H), 1,42-1,60 (м, 6H); MS: 379 [M+H]+; TLC: EtOAc: Rf: 0,50.
Содержание всех ссылок, патентов и опубликованных заявок, процитированных здесь, тем самым полностью включено путем ссылки и во всех целях.
Хотя изобретение было описано подробно в отношении некоторых его предпочтительных вариантов осуществления, следует понимать, что его модификации и изменения находятся в рамках духа и объема того, что описано и заявлено.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕРИНОВЫХ ПРОТЕАЗ | 2014 |
|
RU2678830C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-7-ИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE2 | 2015 |
|
RU2659070C9 |
| УЛУЧШЕННЫЕ АГОНИСТЫ АПЕЛИНОВОГО РЕЦЕПТОРА (APJ) И ИХ ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2766148C1 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ДИГИДРОНАФТИРИДИНОНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2809869C1 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| ПРОИЗВОДНЫЕ 5-ЧЛЕННЫХ ГЕТЕРОЦИКЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ p38 | 2004 |
|
RU2381219C2 |
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗ ДЛЯ УСИЛЕНИЯ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ СНИЖЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2019 |
|
RU2822216C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ KDM5, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840256C1 |
Изобретение относится к соединению формулы:
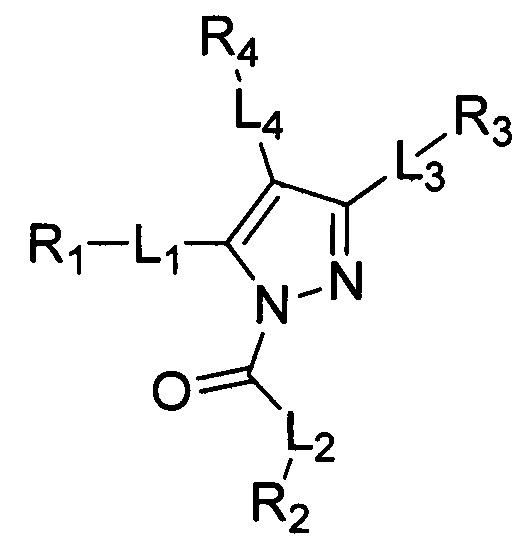 , а также к фармацевтическим композициям и способам лечения и профилактики заболевания, такого как тромботическое. Технический результат: получены новые соединения, способные ингибировать протеазную активность тромбина. 4 н. и 11 з.п. ф-лы, 3 табл., 85 пр.
, а также к фармацевтическим композициям и способам лечения и профилактики заболевания, такого как тромботическое. Технический результат: получены новые соединения, способные ингибировать протеазную активность тромбина. 4 н. и 11 з.п. ф-лы, 3 табл., 85 пр.
1. Соединение со следующей структурой формулы

или его фармацевтически приемлемая соль, сложный эфир, сольват или пролекарство;
в которой
L1 представляет собой -NR5-;
L2 представляет собой связь;
L3 представляет собой связь;
L4 представляет собой связь;
R1 представляет собой замещенный или незамещенный C1-С4 алкил, где замещенный алкил имеет одну группу заместителей, выбранных из группы, состоящей из замещенного или незамещенного фенила и незамещенного гетероарила, причем гетероарил выбран из группы, состоящей из фурила, тиенила и пиридила, и причем группа заместителя для замещенного фенила выбрана из группы, состоящей из: галогена, незамещенного C1-С4 гетероалкила, содержащего О или N в качестве гетероатома, незамещенного C1-С4 алкила и CN;
R2 представляет собой незамещенное нафтильное ядро или незамещенный 5-6-членный гетероарил, имеющий в качестве гетероатома один атом N, О или S;
R3 представляет собой замещенный или незамещенный фенил или незамещенный 6-членный гетероарил, имеющий в качестве гетероатома один атом N, причем замещенный фенил замещен галогеном;
R4 представляет собой водород или незамещенный C1-С4 алкил; и
R5 представляет собой водород.
2. Соединение по п. 1, в котором R3 обозначает замещенный или незамещенный фенил.
3. Соединение по п. 1, в котором R3 обозначает замещенный или незамещенный фенил или незамещенный пиридил.
4. Соединение по п. 1, в котором R4 обозначает водород.
5. Соединение по п. 1, в котором R4 обозначает незамещенный C1-С4 алкил.
6. Соединение по любому из пп. 1-5, выбранное из группы, состоящей из следующих соединений:
соединение 270 N-бензил-1-[(нафталин-1-ил)карбонил]-3-(пиридин-2-ил)-1Н-пиразол-5-амин;
соединение 272 N-бензил-1-[(нафталин-2-ил)карбонил]-3-(пиридин-2-ил)-1Н-пиразол-5-амин;
соединение 279 N-бензил-3-(2-фторфенил)-1-[(тиофен-3-ил)карбонил]-1Н-пиразол-5-амин;
соединение 284 N-бензил-3-(пиридин-2-ил)-1-[(тиофен-3-ил)карбонил]-1Н-пиразол-5-амин.
7. Фармацевтическая композиция, имеющая тромбинингибирующую активность, включающая соединение по любому из пп. 1-6 и фармацевтически приемлемый эксципиент.
8. Способ лечения заболевания или нарушения у пациента, включающий введение пациенту соединения по любому из пп. 1-6 или фармацевтической композиции по п. 7 в количестве, эффективном для лечения указанного заболевания или нарушения, причем указанное заболевание или нарушение включает по меньшей мере одно заболевание или нарушение из числа тромботического нарушения, фиброза, болезни Альцгеймера, рассеянного склероза, боли или рака.
9. Способ по п. 8, в котором указанное тромботическое нарушение представляет собой острый коронарный синдром, венозную тромбоэмболию, артериальную тромбоэмболию или кардиогенную тромбоэмболию.
10. Способ профилактики заболевания или нарушения у пациента, включающий введение пациенту соединения по любому из пп. 1-6 или фармацевтической композиции по п. 7 в количестве, эффективном для профилактики указанного заболевания или нарушения, причем указанное заболевание или нарушение включает тромботическое нарушение.
11. Способ по п. 10, в котором указанное тромботическое нарушение представляет собой острый коронарный синдром, венозную тромбоэмболию, артериальную тромбоэмболию или кардиогенную тромбоэмболию.
12. Способ по п. 10, в котором указанное тромботическое нарушение представляет собой диссеминированное внутрисосудистое свертывание.
13. Способ по п. 10, в котором указанное тромботическое нарушение включает наличие или потенциальное формирование тромба из кровяных сгустков.
14. Соединение по п. 2, в котором R3 обозначает незамещенный 6-членный гетероарил, имеющий в качестве гетероатома один атом N.
15. Соединение по п. 1, в котором R1 представляет собой замещенный C1-С4 алкил, имеющий одну группу заместителей, выбранных из группы, состоящей из замещенного или незамещенного фенила и незамещенного 5-6-членного гетероарила, имеющего в качестве гетероатома один атом N, О или S, и в котором указанный фенил замещен одним или более галогенами.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 5739083 A, 14.04.1998 | |||
| US 3250761 A, 10.05.1966 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 4008249 A, 15.02.1977 | |||
| ИНГИБИТОРЫ ТРОМБИНА | 1999 |
|
RU2221808C2 |
Авторы
Даты
2017-12-25—Публикация
2011-03-30—Подача