Область техники, к которой относится изобретение
Изобретение относится к моноклональному антителу, которое специфически распознает уникальную структуру O-антигена на основе галактана, которая связана с большинством эпидемических мультирезистентных Klebsiella pneumoniae ST258.
Предшествующий уровень техники
Klebsiella pneumoniae является важным энтеробактериальным возбудителем, ответственным за инфекции мочевых путей, пневмонию и сепсис, который вызывает значительную заболеваемость и смертность. В последнее время появились и распространились мультирезистентные штаммы (англ. Multi-drug resistant, MDR), против которых ограничены терапевтические возможности.
Липополисахарид (LPS) является основной составной частью внешнего листа наружной мембраны грамотрицательных бактерий, таких как Klebsiella pneumoniae. LPS имеет три основные структурно и функционально разнообразные части: i) липид A, который также известен как эндотоксин, ii) внутренний олигосахарид и iii) O-антиген, который образован повторяющимися единицами олигосахаридных блоков.
O-антигены K. pneumoniae являются поверхностными антигенами различной структуры, определяющими различные O-типы. Наиболее распространенными серотипами среди признанных в настоящее время 7 O-типов являются O1 и O2, которые, как сообщается, экспрессируются большинством (т.е.> 50%) всех изолятов (1; 2). Оба антигена O1 и O2 состоят из галактозных полимеров, т.е. галактанов. О2-антиген (также известный как O2a или O2ab для того, чтобы отличать от O2ac, описанного ниже) состоит из повторов так называемого дисахарида галактана-I (см. фиг. 3). Напротив, антигены O1 и O2ac содержат следующие дополнительные особые структуры, кроме галактана-I: проксимальная часть LPS-ядра состоит из повторов галактана-I, который ограничен галактаном-II (другим гомополимером галактозы в случае O1) или не-галактановой повторяющейся единицей (в случае O2ac).
Серотипы, несущие O-субъединицу с галактаном-I, имеют очень сходный rfb- локус, кодирующий синтез и экспорт этой структуры. Определена нуклеотидная последовательность оперона галактана-I (3). Было описано, что локус имеет длину 7,3 тыс. п.о. и содержит 6 генов. Комплементация шероховатых мутантов K. pneumoniae O1, E. coli K-12 или Salmonella enterica serovar Typhimurium клонированным rfb-локусом восстанавливала производство гладких LPS, состоящих из повторов галактан-I О-антигена. Это говорит о том, что эти 6 генов являются существенными и достаточными для продуцирования боковых цепей галактан-I О-антигена (3). Структурная модификация D-галактана-I в разных штаммах O2 Klebsiella была опубликована Kelly et al. (5). Тем не менее, генетический фон для этих модификаций еще предстоит выяснить. Недавно были описаны генетические детерминанты, кодирующие повторяющиеся единицы галактана-II (т.е. те, которые кэпированы либо галактаном-I, либо галактаном-III, представленными в данном документе) (4). Важно отметить, что эти гены не связаны с генетическими детерминантами, ответственными за превращение единиц галактана-I в галактан-III. Следовательно, штаммы серотипа O1, помимо экспрессии серотипа, определяющего повторяющиеся единицы галактана-II, расположенные на поверхности, могут экспрессировать повторяющиеся единицы галактана-I или галактана-III, соединяющие Липид А-ядро и повторы галактана-II.
Мультирезистентные (MDR) штаммы K. pneumoniae, которые появились недавно, вызывают значительную долю инфекций K. pneumoniae. Варианты лечения против штаммов MDR становятся очень ограниченными, поскольку эти штаммы развили устойчивость к большинству классов клинически значимых антибиотиков. Поэтому альтернативный вариант лечения, например, пассивная иммунизация моноклональными антителами (mAb), дает большие перспективы на будущее.
Необходимы новые мишени на Klebsiella pneumoniae. В частности, необходимо определить мишени, которые являются иммунорецептивными и могут использоваться для разработки методов лечения и диагностики.
Сущность изобретения
Целью настоящего изобретения является предоставление антитела, направленного против K. pneumoniae, в частности против штаммов MDR, с улучшенной релевантностью нацеливания на патоген, которое должно использоваться для профилактики или терапии инфекций K. pneumoniae. Кроме того, целью является предоставление средств и способов, способных быстро и надежно диагностировать бактерии K. pneumoniae, такие как штаммы MDR.
Задача решается объектом настоящего изобретения.
В соответствии с изобретением предлагается выделенное антитело, которое специфически распознает эпитоп галактана-III (gal-III) структуры липополисахарида (LPS) O-антигена из Klebsiella pneumoniae, где эпитоп включен в повторяющиеся единицы галактана-III, где повторяющаяся единица галактана-III представляет собой гомополимер разветвленной галактозы формулы (I)
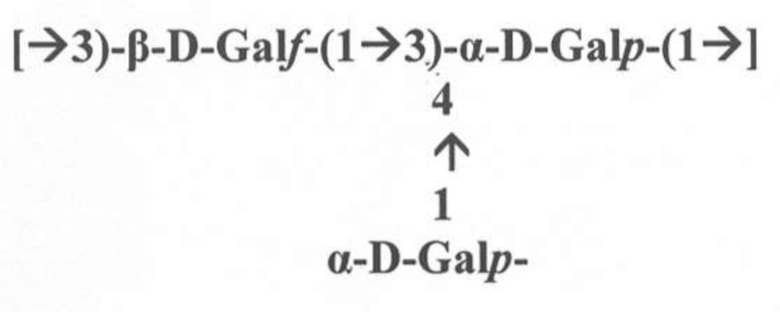 Формула (I).
Формула (I).
В частности, эпитоп галактана-III включен в структуру O-антигена, включающую, по меньшей мере, 2 повторяющиеся единицы gal-III или, по меньшей мере, 3, 4 или 5.
В соответствии с конкретным аспектом антитело предпочтительно связывается с эпитопом галактана-III относительно эпитопа галактана-I или которое не реагирует перекрестно с эпитопом галактана-I, где эпитоп галактана-I (gal-I) включен в повторяющиеся единицы галактана-I структуры LPS O2a-антигена Klebsiella pneumoniae и где повторяющаяся единица галактана-I представляет собой линейный гомополимер галактозы формулы (II)
[→3)-β-D-Galf-(1→3)-α-D-Galp-(1→]
Формула (II).
Например, антитело по изобретению представляет собой специфическое антитело к gal-III, которое специфически распознает или связывает структуру O-антигена, включающую антиген gal-III. Примерные антитела или варианты таких антител перечислены на фиг. 1 и 2. В целях обеспечения вариантов, антитела в данном документе упоминаются как исходные антитела, а CDR или каркасные последовательности в данном документе упоминаются как исходные CDR или исходные каркасные последовательности.
В соответствии с конкретным аспектом антитело содержит рекомбинантные CDR и каркасные последовательности, например, различного происхождения, где, по меньшей мере, одна из CDR и каркасных последовательностей включает человеческие, гуманизированные, химерные, мышиные последовательности или последовательности с созревшей аффинностью, предпочтительно, где каркасные последовательности представляют собой любой изотип иммуноглобулина и, в частности, антитело IgG.
В частности, антитело по изобретению является перекрестно-специфичным для связывания эпитопов gal-III и gal-I и предпочтительно связывается с антигенной структурой gal-III по сравнению с антигенной структурой gal-I антигена O2 K. pneumoniae, например, с аффинностью, которая в случае связывания gal-III выше по сравнению со связыванием с антигеном gal-I. В соответствии с конкретным воплощением антитело имеет, по меньшей мере, в два раза большую аффинность связывания антигена gal-III по сравнению с антигеном gal-I, в частности, по меньшей мере, 2-кратную разницу или, по меньшей мере, в 3-кратную, по меньшей мере, в 4-кратную, по меньшей мере, в 5-кратную или даже, по меньшей мере, 10-кратную, например, в аффинности и/или авидности. Например, разница Kd для преимущественного связывания антигена gal-III по сравнению с gal-I антигеном составляет, по меньшей мере, 0,5 или 1 log или даже, по меньшей мере, 2 log или, по меньшей мере, 3 log, что определено иммуноанализом, предпочтительно иммуноблоттингом, ELISA или другими иммунологическими способами.
Антитело по изобретению дополнительно характеризуется тем, что оно не реагирует перекрестно с любым другим антигеном K. pneumoniae и/или антитело связывается с любым другим антигеном K. pneumoniae с более низкой аффинностью, например, где разница Kd предпочтительного связывания антигена gal-III по сравнению с другими антигенами K. pneumoniae (кроме антигенов gal-III или gal-I) составляет, по меньшей мере, 2 log, предпочтительно, по меньшей мере, 3 log.
В частности, функционально активный вариант представляет собой функционально активный CDR-вариант, который содержит, по меньшей мере, одну точечную мутацию в исходной последовательности CDR и включает или состоит из аминокислотной последовательности, которая, по меньшей мере, на 60% идентична исходной последовательности CDR, предпочтительно идентична последовательности, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%.
Конкретный вариант представляет собой, например, гуманизированный вариант исходного антитела, где исходные последовательности CDR включены в человеческие или гуманизированные каркасные последовательности, где необязательно 1, 2, 3 или 4 аминокислотных остатка каждой из исходных последовательностей CDR могут быть дополнительно мутированы путем введения точечных мутаций для улучшения стабильности, специфичности и аффинности исходного или гуманизированного антитела.
В частности, последовательности VH или тяжелой цепи (HC) таких вариантов могут быть заменены на последовательности VH и HC другого варианта, соответственно, где другой вариант конкретно представляет собой любой другой вариант того же исходного антитела.
В частности, последовательности VL или легкой цепи (LC) таких вариантов могут быть заменены последовательностями VL и LC другого варианта, соответственно, где другой вариант конкретно представляет собой любой другой вариант того же исходного антитела.
В частности, эпитоп галактана-III экспрессируется мультирезистентными (MDR) Klebsiella pneumoniae, более конкретно клоном MDR ST258. В частности, эпитоп галактана-III содержится в мультирезистентных (MDR) Klebsiella pneumoniae.
В соответствии с конкретным воплощением антитело имеет аффинность связывания эпитопа галактана-III с Kd менее 10-7 М, предпочтительно менее 10-8 М, еще более предпочтительно менее 10-9 М.
Варианты исходных антител, которые получают путем созревания аффинности, называемые в данном документе вариантами с созревшей аффинностью, могут иметь увеличенную аффинность связывания с разницей Kd, по меньшей мере, 1 log или 2 log или 3 log по сравнению с родительским антителом. Варианты с созревшей аффинностью обычно имеют аффинность связывания антигена gal-III с Kd менее 10-8 М или менее 10-9 М. Если исходное антитело имеет аффинность с Kd менее 10-8 М, или менее 10-9 М, и исходное антитело подвергается созреванию аффинности, вариант с созревшей аффинностью может иметь еще более высокую аффинность с Kd менее 10-9 М и менее
10-10 М, соответственно.
В соответствии с конкретным аспектом антитело является нейтрализующим антителом. В частности, антитело нейтрализует эндотоксин (т.е. LPS) штаммов Klebsiella pneumoniae, экспрессирующих эпитоп галактана-III, определяемый способом обнаружения in vitro или in vivo. В частности, антитело нейтрализует эндотоксическое действие специфических молекул LPS in vitro.
В частности, антитело нейтрализует эндотоксин штаммов Klebsiella pneumoniae, экспрессирующих эпитоп галактана-III, где эффективность нейтрализации представляет собой, по меньшей мере, эффективность эталонного антитела (например, эталонного антитела 2D8-A10), которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 10; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 11; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 12; и
d) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
е) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
f) CDR6, состоящую из аминокислотной последовательности SEQ ID 18,
согласно номенклатуре Кабат. Такие последовательности CDR обозначаются в соответствии с системой нумерации Кабат.
В дальнейшем, если не указано иное, дается ссылка на последовательности CDR, пронумерованные в соответствии с Кабат, то есть определенные в соответствии с номенклатурой Кабат (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, U.S. Department of Health and Human Services. (1991)), и, в частности, те последовательности CDR, которые перечислены в таблице 1. Понятно, что изобретение и объем формулы изобретения также охватывают те же самые антитела и CDR, но с другой нумерацией и обозначенной CDR-областью, где области CDR определены в соответствии с системой IMGT (The international ImMunoGeneTics, Lefranc et al., 1999, Nucleic Acids Res. 27: 209-212).
В частности, штамм Klebsiella pneumoniae, на который нацелено антитело по изобретению, характеризуется локусом rfbgal-I, включающим дополнительные гены гликозилтрансферазы (gtr).
В соответствии с конкретным аспектом антитело распознает клон ST258 Klebsiella pneumoniae MDR, в частности штамм, экспрессирующий эпитоп галактана-III.
Конкретный вариант осуществления относится к антителу, которое является любым из числа полноразмерного моноклонального антитела, его фрагмента, содержащего, по меньшей мере, один домен антитела, включающий участок связывания, или химерного белка, содержащего, по меньшей мере, один домен антитела, включающего участок связывания, в частности, где антитело является неприродным антителом, которое содержит рандомизированную или искусственную аминокислотную последовательность.
В частности, антитело представляет собой антитело, выбранное из группы, состоящей из антител мыши, ламы, кролика, козы, коровы, химерных, гуманизированных или человеческих антител, антител тяжелой цепи, Fab, Fd, scFv и однодоменных антител, таких как VH, VHH или VL, предпочтительно человеческого IgG-антитела или мышиного IgG-антитела.
В частности, антитело представляет собой моноклональное антитело.
В соответствии с конкретным воплощением антитело содержит, по меньшей мере, вариабельный участок или домен тяжелой цепи антитела (VH), который характеризуется любой из последовательностей CDR1-CDR3, перечисленных в таблице 1, которые обозначены в соответствии с системой нумерации Kabat, или функционально активными вариантами этих CDR.
В соответствии с конкретным аспектом изобретение предусматривает примерные (исходные) антитела, как подробно описано на приведенных в данном документе чертежах, а другие варианты антител таких исходных антител, в частности, включая варианты, связывающиеся по существу с одним и тем же эпитопом, что и исходное антитело, которое характеризуется участком специфического связывания, образованным аминокислотными последовательностями VH и VL фиг. 2, или с помощью соответствующих последовательностей CDR из таблицы 1. Такие антитела могут быть, например, функционально активными вариантными антителами, полученными путем модификации соответствующей CDR или антительной последовательности исходного антитела. Понятно, что любая антительная последовательность, в соответствии с описанием в данном документе, считается «исходной» последовательностью, которая может быть изменена, например, путем точечных мутаций.
Антитела, описанные в примерах, имеют мышиное происхождение или являются их гуманизированными формами. Варианты, которые получают путем гуманизации и, возможно, созревания аффинности, могут быть сконструированы с использованием хорошо известных методов. Эти варианты антител связываются с целевым антигеном, поэтому они считаются функционально активными. Возможно, что также могут быть использованы варианты VH или VL-доменов, например, с модификациями в соответствующих FR или CDR-последовательностях, которые являются функционально активными, например, связываются с одним и тем же эпитопом или содержат один и тот же участок связывания или имеют те же характеристики связывания, что и родительское антитело. Также возможно, что некоторые из FR или последовательностей CDR описанных в данном документе антител могут быть заменены такими же последовательностями других антител, например, антител, перечисленных в таблице 1.
В частности, антитело по изобретению содержит любую из последовательностей CDR вариабельной области тяжелой цепи антитела, как показано на фиг. 1 (таблица 1), или функционально активные варианты этих CDR и/или аминокислотную последовательность VH, выбранную из любой из последовательностей VH, отображенных на фиг. 2, или их функционально-активных вариантов, например, аминокислотную последовательность тяжелой цепи (HC) или VH антитела, которая содержит CDR 1, 2 и 3, где любая из последовательностей CDR1 представляет собой 1, 4, 7 или 10; и/или любая из CDR2 последовательностей представляет собой 2, 5, 8 или 11; и/или любая из последовательностей CDR3 представляет собой 3, 6, 9 или 12; или содержит любую из VH-последовательностей 19, 21, 23 или 25.
В частности, антитело
A)
выбранное из группы, состоящей из представителей группы i) - iv), где
i)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 1; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 2; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 3;
ii)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 4; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 5; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 6;
iii)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 7; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 8; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 9;
iv)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 10; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 11; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 12;
или
B) антитело, которое является функционально активным вариантом исходного антитела, которое представляет собой любое из представителей группы A, которое содержит, по меньшей мере, один функционально активный вариант CDR любого из CDR1, CDR2 или CDR3 исходного антитела.
В частности, функционально активный вариант представляет собой функционально активный вариант CDR, который содержит, по меньшей мере, одну точечную мутацию в исходной последовательности CDR и включает или состоит из аминокислотной последовательности, которая идентична, по меньшей мере, на 60% последовательности с исходной последовательностью CDR, предпочтительно идентична этой последовательности, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%.
В частности, антитело содержит аминокислотную последовательность VH, выбранную из любой из последовательностей VH, отображенных на фиг. 2.
Согласно конкретному воплощению антитело дополнительно включает вариабельный участок или домен (VL) легкой цепи антитела, который включает любую из последовательностей CDR4-CDR6, перечисленных в таблице 1, которые обозначены в соответствии с системой нумерации Кабат или функционально активные варианты этих CDR.
В частности, антитело по изобретению включает любую из последовательностей CDR вариабельной области легкой цепи антитела, представленных на фиг. 1 (таблица 1), или функционально активные варианты этих CDR и/или аминокислотную последовательность VL, выбранную из любой из последовательностей VL, представленных на фиг. 2, или их функционально-активные варианты, например, аминокислотную последовательность антитела (LC) или VL, которая содержит CDR4, 5 и 6, где любая из CDR4-последовательностей представляет собой 13, 16 или 19; и/или любая из последовательностей CDR5 представляет собой 14, 17 или 20; и/или любая из последовательностей CDR6 представляет собой 3, 6, 9 или 12; или включает любую из последовательностей VH 15 или 18, или содержит любую из последовательностей VL 20, 22, 24 или 26.
В частности, антитело
A)
выбрано из группы, состоящей из представителей группы i) - iv), где
i)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 13; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 14; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 15;
ii)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 16; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
iii)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 20; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
iv)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
или
B) антитело, которое является функционально активным вариантом исходного антитела, которое представляет собой любого из представителей группы A, который содержит, по меньшей мере, один функционально активный вариант CDR любой из CDR4, CDR5 или CDR6 исходного антитела.
В частности, функционально активный вариант представляет собой функционально активный вариант CDR, который содержит, по меньшей мере, одну точечную мутацию в исходной последовательности CDR и включает или состоит из аминокислотной последовательности, которая идентична, по меньшей мере, на 60% исходной последовательности CDR, предпочтительно идентична последовательности, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%.
В частности, антитело содержит домен VL, характеризующийся
а) CDR4, состоящей из аминокислотной последовательности SEQ ID 19 или функционально активного CDR-варианта CDR4; и
b) CDR5, состоящей из аминокислотной последовательности SEQ ID 20 или функционально активного CDR-варианта CDR5; и
с) CDR6, состоящей из аминокислотной последовательности SEQ ID 18 или функционально активного CDR-варианта CDR6;
предпочтительно в комбинации с любой из последовательностей VH, в соответствии с описанием в данном документе.
В частности, антитело содержит аминокислотную последовательность VL, выбранную из любой из последовательностей VL, показанных на фиг. 2.
В частности, антитело содержит как аминокислотные последовательности как VH, так и VL и необязательно дополнительные каркасные последовательности полноразмерного антитела или фрагмента антитела, в частности любого из полноразмерных антител или фрагментов Fab.
В частности, антитело включает
а) последовательности CDR1-CDR6 любого из антител, перечисленных в таблице 1; или
b) последовательности VH и VL любого из антител, как показано на фиг. 2; или
с) которое является функционально активным вариантом исходного антитела, которое характеризуется последовательностями а) - с),
предпочтительно, где
- функционально активный вариант включает, по меньшей мере, один функционально активный вариант CDR любого из CDR1-CDR6 исходного антитела; и/или
- функционально активный вариант включает, по меньшей мере, одну точечную мутацию в каркасной области любой из последовательностей VH и VL;
и дополнительно где
- функционально активный вариант имеет специфичность связывания того же эпитопа, что и исходное антитело; и/или
- функционально активным вариантом является человеческий, гуманизированный, химерный или мышиный вариант и/или вариант с созревшей аффинностью исходного антитела.
В частности, антитело выбрано из группы, состоящей из
а) антитела, включающего
- последовательность CDR1 из SEQ ID 1; и
- последовательность CDR2 из SEQ ID 2; и
- последовательность CDR3 из SEQ ID 3; и
- последовательность CDR4 из SEQ ID 13; и
- последовательность CDR5 из SEQ ID 14; и
- последовательность CDR6 из SEQ ID 15;
b) антитела, включающего
- последовательность CDR1 из SEQ ID 4; и
- последовательность CDR2 из SEQ ID 5; и
- последовательность CDR3 из SEQ ID 6; и
- последовательность CDR4 из SEQ ID 16; и
- последовательность CDR5 из SEQ ID 17; и
- последовательность CDR6 из SEQ ID 18;
с) антитела, включающего
- последовательность CDR1 из SEQ ID 7; и
- последовательность CDR2 из SEQ ID 8; и
- последовательность CDR3 из SEQ ID 9; и
- последовательность CDR4 из SEQ ID 19; и
- последовательность CDR5 из SEQ ID 20; и
- последовательность CDR6 из SEQ ID 18;
d) антитела, включающего
- последовательность CDR1 из SEQ ID 10; и
- последовательность CDR2 из SEQ ID 11; и
- последовательность CDR3 из SEQ ID 12; и
- последовательность CDR4 из SEQ ID 19; и
- последовательность CDR5 из SEQ ID 17; и
- последовательность CDR6 из SEQ ID 18;
е) антитела, включающего
- последовательность CDR1 из SEQ ID 4; и
- последовательность CDR2 из SEQ ID 5; и
- последовательность CDR3 из SEQ ID 6; и
- последовательность CDR4 из SEQ ID 19; и
- последовательность CDR5 из SEQ ID 20; и
- последовательность CDR6 из SEQ ID 18;
и
f) антитела, включающего
- последовательность CDR1 из SEQ ID 10; и
- последовательность CDR2 из SEQ ID 11; и
- последовательность CDR3 из SEQ ID 12; и
- последовательность CDR4 из SEQ ID 19; и
- последовательность CDR5 из SEQ ID 20; и
- последовательность CDR6 из SEQ ID 18;
или функционально активный CDR-вариант любого из вышеперечисленных, который имеет аффинность связывания антигена gal-III с Kd менее 10-8 М, предпочтительно менее 10-9 М, предпочтительно менее 10-10 М, предпочтительно менее 10-11 М, например, с аффинностью в пикомолярном диапазоне.
В частности, антитело содержит функционально активный CDR-вариант любой из последовательностей CDR, указанных в таблице 1, где функционально активный CDR-вариант включает, по меньшей мере, одно из
a) 1, 2 или 3 точечные мутации в исходной последовательности CDR; и/или
b) 1 или 2 точечные мутации в любом из четырех C-концевых или четырех N-концевых или четырех центровых аминокислотных положений исходной последовательности CDR; и/или
c) по меньшей мере, 60% идентичности последовательности с исходной последовательностью CDR;
предпочтительно, где функционально активный CDR-вариант включает 1 или 2 точечные мутации в любой последовательности CDR, состоящей из менее чем 4 или 5 аминокислот.
В частности, функционально активный вариант антитела включает, по меньшей мере, один из функционально активных вариантов CDR по изобретению. В частности, функционально активный вариант антитела, содержащий один или несколько функционально активных CDR-вариантов, обладает специфичностью связывания того же эпитопа, что и исходное антитело.
В частности, функционально активный вариант представляет собой вариант CDR, например, который включает CDR, более конкретно, петлевую последовательность CDR, с аминокислотной последовательностью, идентичной последовательности, по меньшей мере, на 60%, предпочтительно, по меньшей мере, на 70%, 80% или 90%.
В соответствии с конкретным аспектом, по меньшей мере, одна точечная мутация представляет собой любую аминокислотную замену, делецию и/или вставку одной или нескольких аминокислот.
В частности, функционально активный вариант отличается от исходного антитела, по меньшей мере, одной точечной мутацией в аминокислотной последовательности, предпочтительно в CDR, где число точечных мутаций в каждой из аминокислотных последовательностей CDR составляет 0, 1, 2 или 3.
В частности, антитело получают из таких антител с использованием соответствующих последовательностей CDR или CDR-мутантов, включая функционально активные CDR-варианты, например, с 1, 2 или 3 точечными мутациями в пределах одной петли CDR, например, внутри CDR длиной 5-18 аминокислот, например, в области CDR 5-15 аминокислот или 5-10 аминокислот. В ином случае, могут быть от 1 до 2 точечных мутаций в пределах одной петли CDR, например, в пределах длины CDR менее 5 аминокислот, для обеспечения антитела, содержащего функционально активный CDR-вариант. Специфические последовательности CDR могут быть короткими, например, CDR2 или CDR5. В соответствии с конкретным воплощением функционально активный CDR-вариант содержит 1 или 2 точечные мутации в любой последовательности CDR, состоящей из менее 4 или 5 аминокислот.
В соответствии с конкретным аспектом антитело по изобретению содержит CDR и каркасные последовательности, где, по меньшей мере, одна из CDR и каркасных последовательностей включает человеческие, гуманизированные, химерные, мышиные последовательности или последовательности с созревшей аффинностью, предпочтительно, где каркасные последовательности происходят из IgG-антитела, например, IgG1, IgG2, IgG3 или IgG4 подтипа, или IgA1, IgA2, IgD, IgE или IgM антитела.
Специфические антитела представлены в виде каркасных мутированных антител, например, для улучшения технологичности или переносимости исходного антитела, например, для обеспечения улучшенного (мутированного) антитела с низким иммуногенным потенциалом, такого как гуманизированные антитела с мутациями в любой из последовательностей CDR и/или каркасных последовательностей по сравнению с исходным антителом.
Дополнительные специфические антитела представлены в виде мутированных в CDR антител, например, для улучшения аффинности антитела и/или для нацеливания на тот же эпитоп или эпитопы вблизи эпитопа, на который нацелено исходное антитело (эпитопный сдвиг).
Соответственно, любое из антител, перечисленных в таблице 1 или на фиг. 2, может быть использовано в качестве исходных антител для разработки улучшенных версий.
В соответствии с конкретным аспектом антитело по изобретению содержит комбинации CDR, перечисленные на фиг. 1 (таблица 1), при условии, что антитело по-прежнему функционально активно.
В частности, антитело по изобретению содержит CDR1-6 любого из антител, перечисленных в таблице 1. Однако в соответствии с альтернативным воплощением, антитело может содержать различные комбинации CDR, например, где антитело, указанное в таблице 1, содержит, по меньшей мере, одну последовательность CDR, такую как 1, 2, 3, 4, 5 или 6 последовательностей CDR одного антитела и, по меньшей мере, одну дополнительную последовательность CDR другого антитела из любых антител, перечисленных в таблице 1. В соответствии с конкретным примером антитело содержит 1, 2, 3, 4, 5 или 6 последовательности CDR, где последовательности CDR представляют собой комбинации CDR из более чем 1 антитела, например, 2, 3, 4, 5 или 6 различных антител. Например, последовательности CDR могут быть объединены, чтобы предпочтительно содержать 1, 2 или все 3 из CDR1-3 любого из антител, перечисленных в таблице 1, и 1, 2 или все 3 из CDR4-6 того же или любого другого антитела, перечисленного в таблице 1.
Например, последовательности CDR могут быть объединены, чтобы предпочтительно содержать, по меньшей мере, CDR1-3 любого из антител, перечисленных в таблице 1, например, любого из антител, обозначенных как 8E3-E5, 9H9-H7, 5A4-A7 или 2D8-A10 и/или, по меньшей мере, CDR4-6 любых (других) антител, перечисленных в таблице 1, например, антитела, обозначенного как 5A4-A7, или, по меньшей мере, его последовательности CDR4 и CDR6 в комбинации с функционально активным вариантом CDR его CDR5. В соответствии с конкретным воплощением антитело по изобретению содержит CDR1-6 любого из антител, перечисленных в таблице 1, например, любого из антител, обозначенных как 8E3-E5, 9H9-H7, 5A4-A7 или 2D8-A10. Однако в соответствии с еще одним конкретным аспектом антитело может содержать различные комбинации CDR, например, где антитело, указанное в таблице 1, например, любое из антител, обозначенных как 8E3-E5, 9H9-H7, 5A4-A7 или 2D8-A10, включает, по меньшей мере, одну последовательность CDR, такую как 1, 2, 3, 4, 5 или 6 последовательности CDR, другого антитела, например, последовательность CDR любого другого антитела из любых антител, перечисленных в таблице 1. Например, антитело содержит 1, 2, 3, 4, 5 или 6 последовательностей CDR, где последовательности CDR представляют собой комбинации CDR из более чем 1 антитела, например, 2, 3, 4, 5 или 6 различных антител. Примерные антитела, содержащие последовательности CDR различных антител, представлены на фиг. 2.
В частности,
- антитело G3-77 содержит последовательности VH-CDR (CDR1, 2 и 3) антитела 9H9-H7; и последовательности VL-CDR (CDR4, 5 и 6) антитела 5A4-A7;
- антитело G3-78 содержит последовательности VH-CDR (CDR1, 2 и 3) антитела 9H9-H7; и последовательности VL-CDR (CDR4, 5 и 6) антитела 5A4-A7;
- антитело G3-97 содержит последовательности VH-CDR (CDR1, 2 и 3) антитела 2D8-A10; и последовательности VL-CDR (CDR4, 5 и 6) антитела 5A4-A7.
Согласно конкретному воплощению антитело содержит только домен VH в качестве антигенсвязывающего фрагмента, таким образом, содержит CDR1-3 без соответствующего домена VL.
Здесь в частности понятно, что CDR с номерами CDR1, 2 и 3 представляют собой область связывания домена VH, а CDR4, 5 и 6 представляют собой область связывания домена VL.
В соответствии с конкретным аспектом антитело по изобретению содержит любую комбинацию аминокислотной последовательности VH и VL, как показано на фиг. 2, или участок связывания, образованный такой комбинацией аминокислотных последовательностей VH и VL. В ином случае, могут быть использованы комбинации доменов иммуноглобулина двух разных антител, при условии, что антитело все еще функционально активно. Например, последовательность VH одного антитела может быть объединена с последовательностью VL другого антитела. В соответствии с дополнительными конкретными воплощениями любая из каркасных областей, представленных на фиг. 2, может быть использована в качестве основы для любой из последовательностей CDR и/или комбинаций VH/VL, в соответствии с описанием в данном документе.
В соответствии с конкретным аспектом антитело по изобретению содержит любую комбинацию аминокислотной последовательности VH и VL, как показано на фиг. 2, или участок связывания, образованный такой комбинацией аминокислотных последовательностей VH и VL.
Понятно, что антитело по изобретению необязательно включает такие аминокислотные последовательности, показанные на фиг. 2, с или без подходящей сигнальной или лидерной последовательности.
В соответствии с конкретным аспектом каждая из последовательностей на фиг. 2 может быть окончательно расширена или удалена в константной области, например, делецией одной или нескольких С-концевых аминокислот.
На фиг. 2 показаны различные последовательности VH и различные последовательности VL исходных антител, называемых 8E3-E5, 9H9-H7, 5A4-A7, 2D8-A10, G3-43, G3-46, G3-77, G3-78 и G3 -97, и поддержаны любые комбинации VH/VL, соответственно, ряд различных комбинаций VH/VL для каждого из родительских антител, например, так, как изображено на фиг. 9. Поэтому конкретные варианты исходного антитела могут включать последовательность VH одного исходного антитела и последовательность VL другого исходного антитела или комбинацию функционально активных вариантов таких последовательностей VH и VL, например, функционально активных вариантов, которые происходят из одного и того же исходного антитела.
В частности, на фиг. 2 показаны различные последовательности VH и различные последовательности VL исходных антител, называемых 8E3-E5, 9H9-H7, 5A4-A7, 2D8-A10, G3-43, G3-46, G3-77, G3- 78 и G3-97. Например, возможны 81 различные комбинации VH/VL, объединяющие последовательность VH одного исходного антитела и последовательность VL другого исходного антитела, и возможны многие другие варианты, если любая из последовательностей VH или VL является функционально активным вариантом исходной последовательности, например, вариантом, который включает любую мутацию CDR и/или мутацию каркаса.
Последовательности CDR, включенные в последовательности VH и VL на фиг. 2, идентичны последовательностям CDR, перечисленным на фиг. 1.
Изобретение также относится к способу получения функционально активных вариантов антител исходного антитела, которое представляет собой любое из антител по изобретению, например, антитело, указанное в таблице 1, или включающее любую комбинацию аминокислотных последовательностей VH или VL, как показано на фиг. 2, или включающее участок связывания, образованный такой комбинацией аминокислотных последовательностей VH и VL, причем этот способ включает сконструированную, по меньшей мере, одну точечную мутацию в любой из каркасных областей (FR) или константных доменов или областей, определяющих комплементарность (CDR1-CDR6) для получения варианта антитела и определения функциональной активности варианта антитела, в частности, аффинности связывания эпитопа gal-III с Kd менее 10-6 М, предпочтительно менее 10-7 М или менее 10-8 М или менее 10-9 М, даже менее 10-10 М или менее 10-11 М, например, с аффинностью в пикомолярном диапазоне. При определении функциональной активности функционально активные варианты выбирают для дальнейшего применения и необязательно для получения способом рекомбинантного продуцирования.
В соответствии с конкретным аспектом вариантное антитело связывает тот же эпитоп, что и исходное антитело.
В соответствии с еще одним конкретным аспектом вариантное антитело содержит тот же участок связывания, что и исходное антитело.
Функционально активные варианты антител могут различаться в любой последовательности VH или VL или иметь общие последовательности VH и VL и включать модификации в соответствующем FR. Вариантное антитело, полученное из исходного антитела путем мутагенеза, может быть получено способами, хорошо известными в данной области.
Примерные исходные антитела описаны в разделе примеров ниже и на фиг. 1 (таблица 1) и на фиг. 2. В частности, антитело является функционально активным производным исходного антитела, которое характеризуется последовательностями, перечисленными в таблице 1 или на фиг. 2. Могут быть спроектированы варианты с одной или несколькими модифицированными последовательностями CDR и/или с одной или несколькими модифицированными FR-последовательностями, такими как последовательности FR1, FR2, FR3 или FR4, или модифицированной последовательностью константного домена.
Например, функционально активные варианты антител могут быть получены путем мутагенеза, в частности, созреванием аффинности и/или гуманизацией. Хотя альтернативные антитела могут по-прежнему иметь общие последовательности CDR CDR1-6 или общие последовательности VH и VL исходного антитела, возможно, что также продуцируются варианты антител или доменов антител, например, с модификациями в соответствующих FR или CDR-последовательностях, которые являются функционально активными.
Примерные варианты антител исходного антитела содержат, по меньшей мере, одну точечную мутацию в любой из CDR1-CDR6 и/или, по меньшей мере, одну точечную мутацию в любой из последовательностей FR, предпочтительно, когда антитело имеет специфичность связывания того же эпитопа, что и исходное антитело.
В некоторых аспектах изобретение предусматривает такие функционально активные варианты антител, предпочтительно моноклональные антитела, наиболее предпочтительно гуманизированные или человеческие антитела, содержащие тяжелую цепь и легкую цепь, где любая из вариабельной области легкой цепи или VL или соответствующих CDR содержит аминокислотную последовательность, полученную из исходного антитела, которое представляет собой антитело, обозначенное как 8D5-1G10 или 4D5-D4, или любое другое антитело, указанное в таблице 1 или на фиг. 2, путем модификации, по меньшей мере, одной последовательности FR или CDR.
Изобретение дополнительно предусматривает антитело по изобретению для применения при лечении объекта, подверженного риску инфицирования или колонизации Klebsiella pneumoniae или страдающего от этого, включающего введение объекту эффективного количества антитела для ограничения инфекции у объекта или для облегчения заболевания, вызванного указанной инфекцией, предпочтительно для лечения или профилактики любой первичной и вторичной бактериемии, пневмонии, инфекции мочевых путей, абсцесса печени, перитонита или менингита.
Соответственно, изобретение далее относится к способу лечения объекта, подверженного риску инфицирования или колонизации Klebsiella pneumoniae или страдающего от этого, включая введение объекту эффективного количества антитела для подавления инфекции у объекта или для облегчения болезненного состояния, вызванного указанной инфекцией, предпочтительно для лечения или профилактики любой первичной и вторичной бактериемии, пневмонии, инфекции мочевых путей, абсцесса печени, перитонита или менингита.
Антитело в частности способно нейтрализовать летальную эндотоксемию. Такая функциональная активность может быть определена в соответствующей модели in vivo (заражение очищенным LPS).
В частности, антитело может обеспечивать бактерицидную активность против Klebsiella pneumoniae gal-III O-типа, в частности MDR Klebsiella pneumoniae, предпочтительно MDR Klebsiella pneumoniae ST258.
В соответствии с конкретным аспектом иммунотерапия с использованием антитела по изобретению может эффективно защищать от заражения живыми бактериями, например, как определено на различных моделях животных.
Антитело может быть особенно эффективным против Klebsiella pneumoniae gal-III O-типа путем опосредованного комплементом уничтожения, например, как определено бактерицидным сывороточным анализом in vitro (SBA), например, по меньшей мере, с 20% уничтожением бактерий по сравнению с контрольными образцами (не было добавлено антитело или было добавлено нерелевантное контрольное mAb).
Антитело может быть особенно эффективным против Klebsiella pneumoniae типа gal-III O-типа из-за опосредованного антителом фагоцитоза, например, определенного методом опсонофагоцитотического убийства in vitro (OPK), например, по меньшей мере, с 20% поглощением входных бактерий или на на 20% более низким пределом подсчета CFU по сравнению с контрольными образцами (не добавлено антитело или иррелевантное контрольное mAb).
Антитело особенно эффективно против Klebsiella pneumoniae gal-III O-типа из-за нейтрализующих эндотоксин функций, например, как определено с помощью анализа LAL in vitro, или с помощью репортерного анализа Толл-подобного рецептора 4 (TLR4), например, с уменьшением, по меньшей мере, на 20% активности эндотоксина по сравнению с контрольными образцами (не добавлено антитело или иррелевантное контрольное mAb).
В соответствии с еще одним конкретным аспектом антитело нейтрализует целевой патоген у животных, включая как людей, так и животных, не являющихся людьми, и ингибирует патогенез in vivo, предпочтительно любые модели первичной и вторичной бактериемии, пневмонии, инфекции мочевых путей, абсцесса печени, перитонита или менингита.
В качестве эталона (положительного контроля) для определения силы нейтрализации может быть использовано любое из антител, описанных в разделе примеров. Предпочтительно, эффективность нейтрализации антитела по изобретению равна или выше, чем антитела, характеризуемого последовательностями CDR1-6 антитела, обозначаемого в данном документе как 2D8-A10, в частности химерного антитела IgG1, как описано в примерах.
Изобретение также относится к фармацевтическому препарату, содержащему антитело по изобретению, предпочтительно содержащее парентеральный или слизистый состав, необязательно содержащий фармацевтически приемлемый носитель или эксципиент.
Такая фармацевтическая композиция может содержать антитело в качестве единственного активного вещества или в комбинации с другими активными веществами или коктейлем активных веществ, например, комбинация или коктейль, по меньшей мере, двух или трех разных антител.
Согласно изобретению антитело по изобретению специально предназначено для медицинского, диагностического или аналитического применения.
Изобретение далее предусматривает применение антитела по изобретению для диагностических целей, в частности, для диагностики инфекции или колонизации Klebsiella pneumoniae (особенно ST258) или связанного с ней заболевания, такого как первичная и вторичная бактериемия, пневмония, инфекция мочевых путей, абсцесс печени, перитонит или менингит у объекта.
В частности, объектом является человек, в частности пациент с ослабленным иммунитетом или иммунодефицитом, или контактирующий с ним.
В частности, антитело предоставляется для применения в соответствии с изобретением, где системная инфекция или колонизация Klebsiella pneumoniae gal-III O-типа у объекта определяется ex vivo путем контакта биологического образца указанного объекта с антителом, где специфическая иммунная реакция антитела определяет инфекцию или колонизацию.
В частности, биологические образцы представляют собой образец биологической жидкости или ткани организма, предпочтительно образец, выбранный из группы, состоящей из образца крови, образца стула, образца кожи, образца мочи, спинномозговой жидкости и образца респираторного тракта, такого как эндотрахеальные аспираты, плевральная жидкость, легочный пунктат, назальный тампон или мокрота, или изолят Klebsiella pneumoniae, происходящий из любого из вышеперечисленного. В частности, испытывают образец жидкости организма для конкретной иммунной реакции, образец которой выбирают из группы, состоящей из мочи, крови, изолятов крови или культуры крови, аспирата, мокроты, лаважной жидкости интубированных объектов и стула.
В частности, биологический образец обрабатывают для получения изолята Klebsiella pneumoniae, происходящего из биологического образца, изолят которого может быть дополнительно описан по его генотипу или фенотипу gal-III и/или уровню экспрессии антигена gal-III. Предпочтительные способы приготовления образцов для получения бактериальных изолятов используют стадии бактериального обогащения и культивирования.
В частности, биологический образец обрабатывают для определения уровня gal-III непосредственно в образце, необязательно после подготовительных стадий обогащения или очистки для уменьшения эффектов матрицы и повышения специфичности и чувствительности теста. Подготовительные стадии включают культивирование биологического образца в соответствии со стандартными процедурами культивирования, такими как, но не исключительно, гемокультуры в стандартных ростовых средах, а также культивирование образцов на твердом агаре (включая фенотипирование, то есть антибиограмму), как это делается в обычных микробиологических лабораториях. Бактерии могут быть субкультивированы для экспансии КОЕ в различных ростовых средах (стандартные среды и/или химически определенные среды, высокая концентрация питательных веществ, низкая концентрация питательных веществ, ограниченная ростовая среда) для усиления экспрессии факторов вирулентности. Бактериальные суспензии могут быть получены и промыты стандартными буферными растворами для устранения потенциальных матричных эффектов.
В частности, антиген gal-III определяют, по меньшей мере, одним из числа иммуноанализа, предпочтительно любого из ELISA, CIA, RIA, IRMA, анализа агглютинации, иммунохроматографии, анализа с тест-полосками и вестерн-блоттинга или масс-спектрометрии, ядерного магнитного резонанса (ЯМР), или способа определения соответствующей ДНК или РНК, указывающей на экспрессию gal-III, в частности, определение последовательности нуклеиновой кислоты, специфичной к генам gtr, предпочтительно с использованием анализа гибридизации нуклеиновой кислоты или анализа амплификации нуклеиновой кислоты.
В частности, диагностическое применение в соответствии с изобретением относится к определению серотипа Klebsiella pneumoniae in vitro из чистой культуры Klebsiella pneumoniae, извлеченной из клинического образца, для определения того, является ли бактерия gal-III О-типа или нет.
Кроме того, настоящее изобретение относится к диагностическому препарату антитела по изобретению, содержащему антитело и дополнительный диагностический реагент в композиции или набор, содержащий компоненты
а) антитело; и
b) дополнительный диагностический реагент;
с) и необязательно твердую фазу для иммобилизации, по меньшей мере, одного из числа антитела и диагностического реагента.
Диагностический препарат необязательно включает антитело по изобретению и дополнительный диагностический реагент в композиции или наборе.
Диагностический набор предпочтительно включает все основные компоненты для определения экспрессии gal-III в биологическом образце, необязательно без обычных или неспецифических веществ или компонентов, таких как вода, буфер или эксципиенты. Устойчивый к хранению набор может храниться предпочтительно не менее 6 месяцев, более предпочтительно, по меньшей мере, 1 или 2 года. Он может состоять из сухих (например, лиофилизированных) компонентов и/или включать консерванты.
Предпочтительный диагностический набор предоставляется в виде упакованной или предварительно упакованной единицы, например, где компоненты содержатся только в одной упаковке, что облегчает обычные эксперименты. Такая упаковка может включать реагенты, необходимые для одного или нескольких тестов, например, подходящие для проведения тестов серии биологических образцов. Набор может дополнительно подходящим образом содержать антигенный препарат gal III в качестве стандартного или эталонного контроля.
Диагностическая композиция может быть реагентом, готовым к употреблению в реакционной смеси с биологическим образцом или консервированной формой такого реагента, например, устойчивой к хранению формой, например. лиофилизированной; быстрозамороженной (например, в жидком азоте), для ультранизкотемпературного хранения (-70°C и -80°C), холодного хранения (-20°C и 5°C) и контролируемого при комнатной температуре (15°C-27°C); стандартным хранилищем образцов, например, глицериновые стоки, тканевые парафиновые блоки, (буккальные) мазки и другие стандартные способы хранения биологических образцов, которые сохраняют форму реагента, могут быть восстановлены или подготовлены для получения готового к употреблению реагента. Такой готовый к употреблению реагент обычно представляет собой водный раствор, в частности (физиологический) буферный раствор (например, буферный буфер EDTA, фосфатный буфер, HBSS, цитратный буфер и т.д.).
В частности, дополнительный диагностический реагент представляет собой реагент, специфически реагирующий с антителом и/или продукт реакции связывания антитела с его антигеном. Соответствующий диагностический реагент целесообразно использовать для проведения иммуноанализа для диагностики или мониторинга у объекта инфекции или колонизации Klebsiella pneumoniae. Соответствующим диагностическим реагентом может быть растворитель, буфер, краситель, антикоагулянт, лиганд, который специфически связывается с антителом по изобретению и/или иммунокомплексом антитело-антиген.
В частности, изобретение предусматривает диагностический препарат антитела по изобретению, необязательно содержащий антитело с меткой и/или дополнительный диагностический реагент с меткой, такой как реагент, специфически распознающий антитело или иммунный комплекс антитела с соответствующим целевым антигеном и/или твердую фазу для иммобилизации, по меньшей мере, одного из антител и диагностического реагента.
Антитело или диагностический реагент могут быть прямо или косвенно помечены. Косвенная метка может содержать меченый связывающий агент, который образует комплекс антитела или диагностического реагента с антигеном gal-III.
Метка обычно представляет собой молекулу или часть молекулы, которая может быть обнаружена в аналитическом тесте. Примерными метками являются хромофоры, флуорохромы или радиоактивные молекулы. В некоторых воплощениях антитело или диагностический реагент конъюгируют с детектируемой меткой, которая может включать молекулы, которые обнаруживаются сами (например, флуоресцентные фрагменты, электрохимические метки, хелаты металлов и т.д.), а также молекулы, которые могут быть косвенно обнаружены при выработке детектируемого продукта (например, ферменты, такие как пероксидаза хрена, щелочная фосфатаза и т.д.) или с помощью специфической связывающей молекулы, которая сама может быть детектируемой (например, биотин, дигоксигенин, мальтоза, олигогистидин, 2,4-динтробензол, фениларсенат, оцДНК, дцДНК и т.д.).
Предпочтительные диагностические препараты или тесты включают антитело по изобретению, иммобилизованное на твердой фазе, например, латексных шариках, частицах золота и т.д., например, для проверки агглютинации антителом бактерий типа gal-III, полученных из образца, подлежащего тестированию.
Изобретение дополнительно предусматривает способ диагностики у объекта инфекции или колонизации Klebsiella pneumoniae, вызванного штаммом Klebsiella pneumoniae, включающий
а) предоставление антитела согласно изобретению и
b) детекцию того, что антитело специфически иммунореакционно реагирует с эпитопом галактана-III в биологическом образце испытуемого, тем самым диагностируя инфекцию или колонизацию Klebsiella pneumoniae.
Такой диагноз конкретно указывается в случае инфекции колонизации MDR Klebsiella pneumoniae, в частности, для лечения MDR Klebsiella pneumoniae типа gal-III. Необязательно, диагностический анализ может включать два разных антитела с различной специфичностью и/или аффинностью для связывания gal-III и/или gal-I, чтобы, возможно, провести различие между антигенами gal-III и gal-I.
В соответствии с конкретным аспектом изобретение обеспечивает сопутствующую диагностику для определения инфекции объекта Klebsiella pneumoniae, в частности с MDR Klebsiella pneumoniae, посредством диагностики изобретения или диагностического способа по изобретению для того, чтобы обеспечить основу для лечения терапевтическим средством против такой инфекции, например, с помощью иммунотерапии, такой как обработка антителом по изобретению.
В соответствии с конкретным аспектом изобретение предусматривает чувствительную экспресс-диагностику для диагностики инфекции объекта Klebsiella pneumoniae, в частности MDR Klebsiella pneumoniae, путем определения свободного LPS, например, из клинического образца, где количество живых бактерий ограничено. Чувствительность такого анализа составляет в частности менее 100 нг, предпочтительно менее 10 нг LPS.
Изобретение также предусматривает выделенную нуклеиновую кислоту, кодирующую антитело по любому изобретению.
Кроме того, изобретение предусматривает экспрессирующую кассету или плазмиду, содержащую кодирующую последовательность, для экспрессии белка, содержащего VH и/или VL антитела по изобретению.
Изобретение также относится к клетке-хозяину, содержащей экспрессирующую кассету или плазмиду по изобретению.
Изобретение также относится к способу получения антитела по изобретению, в котором клетку-хозяин по изобретению культивируют или поддерживают в условиях получения указанного антитела.
В частности, предпочтительной является клетка-хозяин и способ получения, использующий такую клетку-хозяина, которая включает
- плазмиду или экспрессирующую кассету по изобретению, которая включает кодирующую последовательность для экспрессии легкой цепи антитела; и
- плазмиду или экспрессирующую кассету по изобретению, которая включает кодирующую последовательность для экспрессии тяжелой цепи антитела.
В соответствии с еще одним аспектом изобретение предусматривает способ получения антитела по изобретению, включающий
а) иммунизацию животного, не являющегося человеком, антигеном gal-III из Klebsiella pneumoniae и выделение B-клеток, продуцирующих антитела;
b) формирование иммортализованных клеточных линий из выделенных В-клеток;
с) скрининг клеточных линий для идентификации клеточной линии, продуцирующей моноклональное антитело, которое специфически связывается с антигеном gal-III и, возможно, с антигеном gal-I, например, где определено предпочтительное связывание с gal-III по сравнению с gal-I; и
d) продуцирование моноклонального антитела или гуманизированной или человеческой формы антитела или его производного с той же специфичностью связывания эпитопа, что и моноклональное антитело.
Изобретение также относится к способу идентификации антитела-кандидата, включающему:
а) предоставление образца, содержащего антитело или антителообразующую клетку; и
b) оценку связывания антитела в образце, или продуцируемого образцом с эпитопом галактана-III, где положительная реакция между антителом и эпитопом идентифицирует антитело в качестве антитела-кандидата.
Изобретение также относится к способу идентификации антитела-кандидата, включающему:
а) предоставление образца, содержащего антитело или антителообразующую клетку; и
b) оценку связывания антитела в образце или продуцируемого образцом с эпитопом галактана-III, где специфическая положительная реакция между антителом и эпитопом галактана-III относительно эпитопа галактана-I идентифицирует антитело в качестве антитела-кандидата.
Изобретение также относится к способу получения антитела по изобретению, включающему
а) предоставление антитела-кандидата, идентифицированного в соответствии с изобретением; и
b) получение моноклонального антитела или гуманизированной или человеческой формы антитела-кандидата или его производного с той же специфичностью связывания эпитопа, что и антитело-кандидат.
Чертежи
Фиг. 1. Таблица 1: последовательности CDR (номенклатура Кабат) антител, обозначенных как 8E3-E5, 9H9-H7, 5A4-A7 и 2D8-A10.
Номенклатура, используемая на фиг. 1, имеет следующее значение:
VH CDR1 = CDR1
VH CDR2 = CDR2
VH CDR3 = CDR3
VL CDR4 = CDR4 = VL CDR1
VL CDR5 = CDR5 = VL CDR2
VL CDR6 = CDR6 = VL CDR3
Фиг. 2. Последовательности VH и VL
- Химерных антител (с вариабельными доменами мыши) 8E3-E5, 9H9-H7, 5A4-A7 и 2D8-A10, включая последовательности CDR из таблицы 1 и каркасные последовательности.
- Гуманизированных антител G3-43, G3-46, G3-77, G3-78, G3-97
G3-43 VH: (включая последовательности CDR VH 5A4-A7)
G3-43 VL: (включая последовательности CDR VL 5A4-A7)
G3-46 VH: (включая последовательности CDR VH 5A4-A7)
G3-46 VL: (включая последовательности CDR VL 5A4-A7)
G3-77 VH: (включая последовательности CDR VH 9H9-H7)
G3-77 VL: (включая последовательности CDR VL 5A4-A7)
G3-78 VH: (включая последовательности CDR VH 9H9-H7)
G3-78 VL: (включая последовательности CDR VL 5A4-A7)
G3-97 VH: (включая последовательности CDR VH 2D8-A10)
G3-97 VL: (включая последовательности CDR VL 5A4-A7)
Последовательности FR из VH: FR1 (расположенные на N-конце относительно CDR1), FR2 (расположенные между CDR1 и CDR2), FR3 (расположенные между CDR2 и CDR3) и FR4 (расположены на C-конце относительно CDR3).
FR-последовательности VL: FR1 (расположенные на N-конце относительно CDR4), FR2 (расположенные между CDR4 и CDR5), FR3 (расположенные между CDR5 и CDR6) и FR4 (расположены на C-конце относительно CDR6).
Фиг. 3. Схематическая структура и сахарный состав боковых цепей О-антигена K. pneumoniae O1, O2ab и O2ac. На основании настоящего изобретения субъединицы галактана-I могут быть заменены субъединицами галактана-III во всех случаях.
Фиг. 4. Длина оперона rfb (wb) в последовательности штаммов K. pneumoniae (A) и схематическое сравнение генетической организации разных локусов rfb (wb), кодирующих галактан-I (B). Гены, отображенные черным, обозначают те, которые описаны Clarke et al. (3). Пустые стрелки представляют gtr-подобные гены, тогда как серые стрелки между двумя вариантами rfb (wb) обозначают неконсервативные гипотетические гены гликозилтрансферазы.
Фиг. 5. Структура модифицированных повторяющихся звеньев галактана-I (называемых в данном документе как галактан-III) (5).
Фиг. 6. Результат реакции ПЦР детектирующей gtr-подобных гены в rfb (wb) -опероне O1, O2 и O2ac. Ампликон с размером ~ 2 тыс. п.о. подтверждает утрату gtr-подобных генов, однако ампликон с ~ 5 тыс п.о. предполагает наличие gtr-подобных генов между wbbO и hisI.
Фиг. 7. Иммуноблот с mAb 9H9-H7, распознающий молекулы D-галактана III.
Фиг. 8. Иммуноблот, использующий LPS, очищенный из изогенной группы штаммов, подтверждает реактивность mAb в присутствие генов gtr.
Фиг. 9. Композиция VH и VL тестируемых гуманизированных mAb. Области CDR гуманизированных mAb происходят из указанных химерных родителей. Указанные области CDR были привиты в каркасные последовательности человека. Сохраненные характеристики связывания гуманизированных mAb были подтверждены поверхностным окрашиванием gal-III, экспрессируемых K. pneumoniae, измеренных проточной цитометрией (последние столбцы).
Фиг. 10. Защита, вызванная химерными (панель А) или гуманизированными (панель B) специфическими к галактану-III mAb (1 или 2 мкг/мышиных доз, соответственно) против последующего летального заражения живыми K. pneumoniae в GalN-сенсибилизированной мышиной модели бактериемии. График показывает комбинированные результаты двух отдельных экспериментов с группами по 5 мышей каждая.
Фиг. 11. Потенциал нейтрализации эндотоксинов гуманизированных gal-III-специфических mAb при концентрации 1 мкг/мл. Подробнее см. в тексте.
Фиг. 12. Титрование дозы потенциала нейтрализации эндотоксина, проявляемого отдельными гуманизированными и исходными химерными gal-III-специфическими mAb. В качестве эталонной нейтрализации использовали полимиксин В.
Подробное описание изобретения
Используемый в данном документе термин «антитело» относится к полипептидам или белкам, которые состоят из или содержат домены антител, которые понимаются как константные и/или вариабельные домены тяжелых и/или легких цепей иммуноглобулинов с или без линкерной последовательности. Полипептиды понимаются как домены антител, если они содержат структуру бета-бочки, состоящую, по меньшей мере, из двух бета-цепей структуры домена антитела, связанных петлевой последовательностью. Домены антител могут иметь нативную структуру или модифицированы путем мутагенеза или дериватизации, например, для модификации антигенсвязывающих свойств или любого другого свойства, такого как стабильность или функциональные свойства, такие как связывание с Fc-рецепторами FcRn и/или рецептором Fcgamma.
Используемое в данном документе антитело имеет специфический участок связывания для связывания одного или нескольких антигенов или одного или нескольких эпитопов таких антигенов, в частности, содержащий участок связывания CDR одного вариабельного домена антитела, такой как VH, VL или VHH, или участок связывания пар вариабельных доменов антитела, таких как пара VL/VH, антитело, содержащее пару доменов VL/VH и константные домены антитела, такие как Fab, F (ab'), (Fab) 2, scFv, Fv или полноразмерное антитело.
Используемый в данном документе термин «антитело» в особенности относится к форматам антител, содержащим или состоящим из одного домена вариабельного антитела, такого как VH, VL или VHH, или комбинации варибельных и/или константных доменов с или без связующей последовательности или шарнирной области, включая пары доменов с переменным антителом, такие как пара VL/VH, антителу, содержащему или состоящему из пары домена VL/VH и константных доменов антитела, таких как тяжелой цепи, Fab, F (ab'), (Fab)2, scFv, Fd, Fv антитела, или полноразмерному антителу, например, типа IgG (например, подтипа IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM. Термин «полноразмерное антитело» можно использовать для обозначения любой молекулы антитела, содержащей, по меньшей мере, большую часть домена Fc и других доменов, обычно встречающихся в природном мономере антитела. Эта фраза используется в данном документе для того, чтобы подчеркнуть, что конкретная молекула антитела не является фрагментом антитела.
Термин «антитело» должен конкретно включать антитела в выделенной форме, которые по существу не содержат других антител, направленных против различных антигенов-мишеней или содержащих другое структурное расположение доменов антител. Тем не менее, выделенное антитело может быть включено в комбинированный препарат, содержащий комбинацию выделенного антитела, например, по меньшей мере, с одним другим антителом, таким как моноклональные антитела или фрагменты антител, имеющие разные специфические особенности.
Термин «антитело» применяется к антителам животного происхождения, включая человека, таких как млекопитающие, включая человека, мышь, кролика, козу, ламу, корову и лошадь или птицы, такие как курица, причем этот термин должен включать, в частности, рекомбинантные антитела, которые основаны на последовательности животного происхождения, например, на человеческих последовательностях.
Термин «антитело», кроме того, применим к химерным антителам с последовательностями, происходящими из разных видов, таким как последовательности мышиного и человеческого происхождения.
Термин «химерный», используемый в отношении антитела, относится к тем антителам, в которых одна часть каждой из аминокислотных последовательностей тяжелых и легких цепей гомологична соответствующим последовательностям в антителах, полученных из определенного вида или принадлежащих к определенному классу, а оставшийся сегмент цепи гомологичен соответствующим последовательностям у другого вида или класса. Обычно вариабельная область как легкой, так и тяжелой цепей имитирует вариабельные области антител, полученных от одного вида млекопитающих, тогда как константные части гомологичны последовательностям антител, полученных из другого организма. Например, вариабельная область может быть получена из известных в настоящее время источников с использованием легкодоступных В-клеток или гибридом от организмов-хозяев, не являющихся человеком, в комбинации с константными участками, полученными, например, из клеточных препаратов человека.
Термин «антитело» может, кроме того, применяться к гуманизированным антителам.
Термин «гуманизированный», используемый в отношении антитела, относится к молекуле, имеющей участок связывания антигена, который по существу получен из иммуноглобулина из видов, не являющихся человеком, где оставшаяся структура иммуноглобулина молекулы основана на структуре и/или последовательности человеческого иммуноглобулина. Участок связывания антигена может либо содержать полные вариабельные домены, слитые с константными доменами, либо только участки, определяющие комплементарность (CDR), привитые в соответствующие каркасные области в вариабельных доменах. Антигенсвязывающие сайты могут быть дикого типа или модифицированными, например, одной или несколькими аминокислотными заменами, предпочтительно модифицированы так, чтобы более точно напоминать человеческие иммуноглобулины. Некоторые формы гуманизированных антител сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиного антитела). Другие формы имеют одну или несколько CDR, которые изменяются относительно исходного антитела.
Термин «антитело» кроме того применим к человеческим антителам.
Под термином «человеческое», используемым в отношении антитела, понимают антитела, имеющие вариабельные и постоянные области, полученные из последовательностей иммуноглобулинов зародышевой линии человека. Антитело человека по изобретению может включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные случайным или сайтспецифическим мутагенезом in vitro или соматической мутацией in vivo), например, в CDR. Антитела человека включают антитела, выделенные из библиотек иммуноглобулинов человека или животных, трансгенных по одному или нескольким человеческим иммуноглобулинам.
Термин «антитело», как правило, относится к антителам любого класса или подкласса. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей антитела могут быть отнесены к основным классам антител IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин, кроме того, применим к моноклональным или поликлональным антителам, в частности к рекомбинантному антителу, который включает все антитела и структуры антител, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, такие как антитела, происходящие из животных, например, млекопитающих, включая человека, которые включают гены или последовательности разного происхождения, например, мышиные, химерные, гуманизированные антитела или антитела, полученные из гибридомы. Другие примеры относятся к антителам, выделенным из клетки-хозяина, трансформированной для экспрессии антитела или антител, выделенных из рекомбинантной комбинаторной библиотеки антител или доменов антител, или антител, полученных, экспрессированных, созданных или выделенных любыми другими способами, которые включают сплайсинг последовательности гена антитела с другими последовательностями ДНК.
Понятно, что термин «антитело» также относится к производным антитела, в частности к функционально активным производным. Под производным антитела понимают любую комбинацию одного или нескольких доменов антител или антител и/или химерного белка, в котором любой домен антитела может быть слит в любом положении с одним или несколькими другими белками, такими как другие антитела, например, связывающей структурой, содержащей петли CDR, рецепторный полипептид, но также лиганды, каркасные белки, ферменты, токсины и т.п. Производное антитела может быть получено путем ассоциации или связывания с другими веществами различными химическими методами, такими как ковалентная связь, электростатическое взаимодействие, дисульфидная связь и т.д. Другими веществами, связанными с антителом, могут быть липиды, углеводы, нуклеиновые кислоты, органические и неорганические молекулы или любая их комбинация (например, ПЭГ, пролекарства или лекарственные средства). В конкретном воплощении антитело представляет собой производное, содержащее дополнительную метку, позволяющую осуществить специфическое взаимодействие с биологически приемлемым соединением. Какое-либо конкретное ограничение по отношению к метке, используемой в настоящем изобретении, отсутствует, поскольку она не имеет или не допускает отрицательного влияния на связывание антитела с его мишенью. Примеры подходящих меток включают His-метку, Myc-метку, FLAG-метку, Strep-метку, кальмодулин-метку, GST-метку, MBP-метку и S-метку. В другом конкретном воплощении антитело представляет собой производное, содержащее метку. Используемый в данном документе термин «метка» относится к детектируемому соединению или композиции, которое прямо или косвенно конъюгировано с антителом, с получением «меченного» антитела. Метка может обнаруживаться сама по себе, например, радиоизотопные метки или флуоресцентные метки, или, в случае ферментативной метки, может катализировать химическое изменение субстратного соединения или композиции, которые могут быть обнаружены.
Предпочтительные производные, в соответствии с описанием в данном документе, являются функционально активными в отношении связывания антигена, предпочтительно, которые обладают способностью бороться с K. pneumonia, например, определенных при анализе SBA, OPK или LAL, или для защиты от бактериального заражения или для нейтрализации эндотоксемии.
В частности, антитело, полученное из антитела по изобретению, может содержать, по меньшей мере, одну или несколько CDR-областей или их CDR-вариантов, функционально активных в отношении дифференциального связывания с антигеном gal-III, например, специфически или селективно связывающим антиген gal-III.
Антитела, полученные из исходного антитела или антительной последовательности, такой как исходная CDR или FR-последовательность, в данном документе в особенности понимаются как мутанты или варианты, полученные, например, in silico или рекомбинантной техникой, а также путем химической дериватизации или синтеза.
Понятно, что термин «антитело» также относится к вариантам антитела, включая антитела с функционально активными вариантами CDR исходной последовательности CDR и функционально-активными вариантными антителами исходного антитела.
В частности, антитело, полученное из антитела по изобретению, может содержать, по меньшей мере, одну или несколько из числа CDR-областей или их CDR-вариантов, например, по меньшей мере, 3 области CDR тяжелой цепи и/или, по меньшей мере, 3 области CDR легкой цепи, по меньшей мере, с одной точечной мутацией, по меньшей мере, в одной из областей CDR или FR или в константной области HC или LC, функционально активной, например, специфически связывающей антиген gal-III.
Термин «вариант», в частности, относится к антителам, таким как мутантные антитела или фрагменты антител, например, полученные методами мутагенеза, в частности для удаления, обмена, введения вставок в определенную аминокислотную последовательность или область антитела или химическую дериватизацию аминокислотной последовательности, например, в константных доменах, чтобы сконструировать стабильность антитела, эффекторную функцию или период полужизни, или в вариабельных доменах для улучшения антигенсвязывающих свойств, например, с помощью методов созревания аффинности, доступных в данной области. Можно использовать любой из известных способов мутагенеза, включая точечные мутации в искомых положениях, например, полученных методами рандомизации. В некоторых случаях положения выбираются случайным образом, например, в любой из возможных аминокислот или в выборке предпочтительных аминокислот для рандомизации последовательностей антител. Термин «мутагенез» относится к любому признанному в данной области методу для изменения полинуклеотидной или полипептидной последовательности. Предпочтительные типы мутагенеза включают мутагенез с помощью ПЦР пониженной точности, мутагенез насыщения или другой сайтнаправленный мутагенез.
Термин «вариант» должен конкретно включать функционально активные варианты.
Термин «функционально активный вариант» последовательности CDR, при использовании в данном документе, понимается как «функционально активный вариант CDR», и «функционально активный вариант» антитела, при использовании в данном документе, понимается как «функционально активный вариант антитела». Функционально активный вариант означает последовательность, полученную в результате модификации этой последовательности (исходного антитела или исходной последовательности) путем введения, делеции или замещения одной или нескольких аминокислот или химической дериватизации одного или нескольких аминокислотных остатков в аминокислотной последовательности, или нуклеотидов в нуклеотидной последовательности, или на любом из обоих дистальных концов последовательности, например, в последовательности CDR, N-концевых и/или C-концевых 1, 2, 3 или 4 аминокислотах и / или центральных 1, 2, 3 или 4 аминокислотах (т.е. в середине последовательности CDR), и эта модификация не влияет, в частности, на ухудшение активности этой последовательности. В случае участка связывания, имеющего специфичность к выбранному целевому антигену, функционально активный вариант антитела будет по-прежнему иметь заданную специфичность связывания, хотя это можно изменить, например, для того, чтобы изменить тонкую специфичность на конкретный эпитоп, аффинность, авидность, скорость Kon или Koff и т.д. Например, антитело, с созревшей аффинностью конкретно понимается как функционально-активное вариантное антитело. Следовательно, модифицированная последовательность CDR в антителе с созревшей аффинностью понимается как функционально активный вариант CDR.
В частности, функционально активные варианты антитела по изобретению обладают способностью связывать антиген gal III и специфичностью или селективностью для того, чтобы предпочтительно связываться с антигеном gal-III по сравнению с другими антигенами K. pneumoniae, например, связываться с gal-III и не связываться с антигеном gal-I K. pneumoniae, или не значительно связываться с антигеном gal-I и/или не связывается с другими антигенами K. pneumoniae.
Функционально активные варианты могут быть получены, например, путем изменения последовательности исходного антитела, например, антитела, содержащего тот же участок связывания, что и любое из антител, перечисленных в таблице 1 и на фиг. 2, но с модификациями внутри области антитела, кроме участка связывания, или получены из такого исходного антитела путем модификации внутри участка связывания, которая не нарушает связывание антигена и предпочтительно будет иметь по существу такую же биологическую активность, что и исходное антитело или даже улучшенную активность, включая способность специфически или избирательно связывать gal-III, например, связывать gal-III и не связывать антиген gal-I K. pneumoniae, или же не связывать антиген gal-I и/или не связывать другие антигены K. pneumoniae. Необязательно функционально активные варианты могут дополнительно включать нейтрализующую активность и/или эффективность опосредованного комплементом уничтожения в анализе SBA и/или необязательно дополнительно включать активность опосредованного антителом фагоцитоза в анализе OPK и/или необязательно дополнительно включать функцию нейтрализации эндотоксина в анализе LAL, например, по существу, с той же биологической активностью, что определяется анализом специфического связывания или функциональным тестом, нацеленным на (MDR) K. pneumoniae.
Термин «по существу такая же биологическая активность», при использовании в данном документе, относится к активности указанной как по существу такая же биологическая активность, и составляющей, по меньшей мере, 20%, по меньшей мере, 50%, по меньшей мере, 75%, по меньшей мере, 90%, например, по меньшей мере, 100%, или, по меньшей мере, 125% или, по меньшей мере, 150% или, по меньшей мере, 175% или, например, вплоть до 200%, или даже более высокую активность, определенную для сопоставимого или исходного антитела.
Предпочтительные варианты или производные, в соответствии с описанием в данном документе, являются функционально активными в отношении связывания антигена, предпочтительно, которые обладают способностью специфически связывать антиген gal III и не связывать другие антигены K. pneumoniae, например, связывать gal-III, и не связывать антиген gal-I K. pneumoniae или не связывать антиген gal-I в значительной степени, или преимущественно связывать антиген gal-III относительно gal-I, или связывать gal-III с более высокой аффинностью по сравнению с текущей поликлональной типирующей сывороткой, полученной против штаммов с gal-I. Предпочтительные варианты не связываются с другими антигенами K. pneumoniae с разницей значений Kd, по меньшей мере, 2 log, предпочтительно, по меньшей мере, 3 log, и необязательно дополнительно включают активность опосредованного комплементом убийства в анализе SBA, например, для достижения значительного снижения количества бактерий по сравнению с контрольными образцами, не содержащими антитела, и/или необязательно дополнительно включающие активность опосредованного антителом фагоцитоза в анализе OPK, например, для достижения значительного снижения количества бактерий по сравнению с контрольными образцами, не содержащими антитело, и/или, необязательно, дополнительно включающую функцию нейтрализации эндотоксина в анализе сигнализации LAL или TLR4, например, для достижения значительного снижения активности эндотоксина по сравнению с контрольными образцами, не содержащими антитела, например, по существу, с той же биологической активностью, которые определены с помощью анализа специфического связывания или функционального теста, нацеленного на K. pneumoniae. Существенное снижение активности в различных анализах обычно означает уменьшение, по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 60%, 70%, 80%, 90%, 95% или 98% до полного снижения около 100% (+/- 1%).
В предпочтительном воплощении функционально активный вариант исходного антитела
а) представляет собой биологически активный фрагмент антитела, причем фрагмент содержит, по меньшей мере, 50% последовательности молекулы, предпочтительно, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90% или, по меньшей мере, 95% и наиболее предпочтительно, по меньшей мере, 97%, 98% или 99%;
b) получают из антитела, по меньшей мере, одной аминокислотной заменой, добавлением, или делецией, где функционально активный вариант идентичен молекуле или ее части, такой как антитело, с идентичностью, по меньшей мере, 50%, предпочтительно, по меньшей мере, 60%, более предпочтительно, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 90%, еще более предпочтительно, по меньшей мере, 95% и наиболее предпочтительно, по меньшей мере, 97%, 98% или 99%; и/или
c) состоит из антитела или его функционально активного варианта и дополнительно, по меньшей мере, одной аминокислоты или нуклеотида, гетерологичного полипептиду или нуклеотидной последовательности.
В одном предпочтительном воплощении изобретения функционально активный вариант антитела в соответствии с изобретением по существу идентичен варианту, описанному выше, но отличается от его полипептида или нуклеотидной последовательности, соответственно, тем, что он получен из гомологичной последовательности другого вида. Они называются естественными вариантами или аналогами.
Термин «функционально активный вариант» также включает встречающиеся в природе аллельные варианты, а также мутанты или любые другие не встречающиеся в природе варианты. Как известно в данной области, аллельный вариант представляет собой альтернативную форму (поли)пептида, который характеризуется замещением, делецией или добавлением одной или нескольких аминокислот, которые по существу не изменяют биологическую функцию полипептида.
Функционально активные варианты могут быть получены путем изменения последовательности в полипептидной или нуклеотидной последовательности, например, одной или несколькими точечными мутациями, где изменения последовательности сохраняют или улучшают функцию неизмененного полипептида или нуклеотидной последовательности при использовании в комбинации по изобретению. Такие изменения последовательности могут включать без ограничения перечисленным (консервативные) замены, добавления, делеции, мутации и вставки.
Специфическими функционально активными вариантами являются варианты CDR. Вариант CDR включает аминокислотную последовательность, модифицированную, по меньшей мере, одной аминокислотой в области CDR, где указанная модификация может представлять собой химическое или частичное изменение аминокислотной последовательности, причем эта модификация позволяет варианту сохранить биологические характеристики немодифицированной последовательности. Частичное изменение аминокислотной последовательности CDR может быть осуществлено путем делеции или замены одной-нескольких аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или путем добавления или введения одной-нескольких аминокислот, например, 1, 2, 3, 4 или 5 аминокислот или путем химической дериватизации от одной до нескольких аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или их комбинацией. Замены в аминокислотных остатках могут быть консервативными заменами, например, замещением одной гидрофобной аминокислоты на альтернативную гидрофобную аминокислоту.
Консервативные замены - это те, которые происходят в семействе аминокислот, которые родственны по их боковым цепям и химическим свойствам. Примерами таких семей являются аминокислоты с основными боковыми цепями, с кислотными боковыми цепями, с неполярными алифатическими боковыми цепями, с неполярными ароматическими боковыми цепями, с незаряженными полярными боковыми цепями, с небольшими боковыми цепями, с большими боковыми цепями и т.д.
Точечная мутация, в частности, понимается как конструирование полинуклеотида, которое приводит к экспрессии аминокислотной последовательности, которая отличается от несконструированной аминокислотной последовательности замещением или заменой, делецией или вставкой одной или нескольких одиночных (не последовательных) или дублетов аминокислот для различных аминокислот.
Предпочтительные точечные мутации относятся к обмену аминокислот с одинаковой полярностью и/или зарядом. В связи с этим аминокислоты относятся к 20 встречающимся в природе аминокислотам, кодированным 64 триплетными кодонами. Эти 20 аминокислот можно разделить на те, которые имеют нейтральные заряды, положительные заряды и отрицательные заряды:
Ниже приведены «нейтральные» аминокислоты вместе с их трехбуквенным и однобуквенным кодом и полярностью:
Аланин: (Ala, A) неполярный, нейтральный;
Аспарагин: (Asn, N) полярный, нейтральный;
Цистеин: (Cys, C) неполярный, нейтральный;
Глутамин: (Gln, Q) полярный, нейтральный;
Глицин: (Gly, G) неполярный, нейтральный;
Изолейцин: (Ile, I) неполярный, нейтральный;
Лейцин: (Leu, L) неполярный, нейтральный;
Метионин: (Met, M) неполярный, нейтральный;
Фенилаланин: (Phe, F) неполярный, нейтральный;
Пролин: (Pro, P) неполярный, нейтральный;
Серин: (Ser, S) полярный, нейтральный;
Треонин: (Thr, T) полярный, нейтральный;
Триптофан: (Trp, W) неполярный, нейтральный;
Тирозин: (Tyr, Y) полярный, нейтральный;
Валин: (Val, V) неполярный, нейтральный; и
Гистидин: (His, H) полярный, положительный (10%) нейтральный (90%).
«Положительно» заряженными аминокислотами являются:
Аргинин: (Arg, R) полярный, положительный; и
Лизин: (Lys, K) полярный, положительный.
«Отрицательно» заряженными аминокислотами являются:
Аспарагиновая кислота: (Asp, D) полярная, отрицательная; и
Глутаминовая кислота: (Glu, E) полярная, отрицательная.
«Идентичность аминокислотной последовательности в процентах (%)» в отношении последовательностей антител и гомологов, описанных в данном документе, определяется как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной полипептидной последовательности после выравнивания последовательностей и введения разрывов, если необходимо, для достижения максимальной идентичности последовательностей и без учета каких-либо консервативных замен как части идентичности последовательности. Специалисты в данной области могут определить соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
Особо понимается вариант антитела, включающий гомологи, аналоги, фрагменты, модификации или варианты со специфической картиной гликозилирования, например, полученные гликоинжинирингом, которые являются функциональными и могут служить в качестве функциональных эквивалентов, например, связываясь с конкретными мишенями и с функциональными свойствами.
Антитело по настоящему изобретению может иметь или не проявлять эффекторную функцию Fc. Хотя способ действия в основном опосредуется нейтрализующими антителами без Fc-эффекторных функций, Fc может рекрутировать комплемент и устранять целевые антигены, такие как токсин, из кровообращения путем образования иммунных комплексов.
Специфические антитела могут быть лишены активного фрагмента Fc, таким образом, либо состоят из доменов антитела, которые не содержат Fc-части антитела или которые не содержат участок связывания с гамма-рецептором Fc, или содержат домены антител, лишенные функции Fc-эффектора, например, путем модификации для уменьшения эффекторных функций Fc, в частности для отмены или уменьшения активности ADCC и/или CDC. Альтернативные антитела могут быть сконструированы так, чтобы включать модификации для увеличения эффекторных функций Fc, в частности для повышения активности ADCC и/или CDC.
Такие модификации могут быть осуществлены путем мутагенеза, например, мутаций в участке связывания Fc-гамма-рецептора или с помощью производных или агентов для того, чтобы препятствовать активности ADCC и/или CDC в формате антител, таким образом, достигая уменьшения или увеличения эффекторной функции Fc.
Как правило, значительное снижение эффекторной функции Fc понимается как относящееся к функции Fc-эффектора менее 10% от немодифицированного (дикого типа) формата, предпочтительно менее 5%, измеренной по активности ADCC и/или CDC. Как правило, значительное увеличение эффекторной функции Fc относится к увеличению эффекторной функции Fc, по меньшей мере, на 10% от немодифицированного (дикого типа) формата, предпочтительно, по меньшей мере, на 20%, 30%, 40% или 50%, что измерено по активности ADCC и/или CDC.
Термин «подвергнутые гликоинженирингу» варианты по отношению к последовательностям антител относится к вариантам гликозилирования, имеющим модифицированные иммуногенные или иммуномодулирующие (например, противовоспалительные) свойства, ADCC и/или CDC, которые являются результатом гликоинжиниринга. Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелой цепи, причем каждый изотип обладает определенным набором N-связанных углеводных структур, которые изменяют влияние на сборку белка, секрецию или функциональную активность. IgG1-антитела являются гликопротеинами, имеющими консервативный N-связанный сайт гликозилирования в Asn297 в каждом домене CH2. Два комплексных биантеннарных олигосахарида, присоединенных к Asn297, погруженных между доменами CH2, образуют обширные контакты с полипептидной основой, и их присутствие имеет важное значение для того, чтобы антитело опосредовало эффекторные функции, такие как зависимая от антител клеточная цитотоксичность (ADCC). Удаление N-гликана на N297, например, путем мутации N297, например, на A или T299, обычно приводит к формам агликозилированных антител с уменьшенным ADCC. В частности, антитело по изобретению может быть гликозилированным или подвергнутым гликоинжинирингу или агликозилированным антителом.
Основные различия в гликозилировании антител происходят между клеточными линиями, и даже небольшие различия наблюдаются для данной линии клеток, выращенной в разных условиях культивирования. Экспрессия в бактериальных клетках обычно дает агликозилированное антитело. Сообщалось, что клетки CHO с регулируемой тетрациклином экспрессией β (1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансфераза, катализирующая образование биссекторного GIcNAc, имели улучшенную активность ADCC (Umana et al., 1999, Nature Biotech. 17:176-180). В дополнение к выбору клеток-хозяев факторы, которые влияют на гликозилирование при рекомбинантном продуцировании антител, включают режим роста, состав среды, плотность культуры, оксигенацию, рН, схемы очистки и т.п.
Термин «участок связывания антигена» или «участок связывания» относится к части антитела, которое участвует в связывании антигена. Участок связывания антигена образован аминокислотными остатками N-концевых вариабельных («V») участков тяжелой («H») и/или легкой («L») цепей или их вариабельных доменов. Три сильно дивергирующих отрезка в V-областях тяжелой и легкой цепей, называемых «гипервариабельными областями», включены между более консервативными фланкирующими отрезками, известными как каркасные участки. Участок связывания антигена обеспечивает поверхность, которая комплементарна трехмерной поверхности связанного эпитопа или антигена, а гипервариабельные области называются «областями, определяющими комплементарность», или «CDR». Участок связывания, включенный в CDR, в данном документе также называют «участком связывания CDR».
Используемый в данном документе термин «антиген» взаимозаменяем с терминами «мишень» или «целевой антиген» и относится к целой молекуле-мишени или фрагменту такой молекулы, распознаваемому участком связывания антитела. В частности, такой участок связывания может распознаваться подструктурами антигена, например, полипептидной или углеводной структурой, обычно называемой «эпитопами», например, эпитопами B-клеток или эпитопом Т-клеток, которые являются иммунологически релевантными. Конкретные антигены, такие как антигены gal-III или gal-I, представляют собой углеводные структуры и могут быть предоставлены в виде выделенных антигенов, необязательно предоставленных на искусственном носителе, или же в виде клеток K. pneumoniae, экспрессирующих антигены или их клеточные фракции.
Используемый в данном документе термин «эпитоп», в частности, относится к молекулярной структуре, которая может полностью составлять специфический связывающий партнер или быть частью специфического связывающего партнера с участком связывания антитела. Эпитоп может либо состоять из углевода, пептидной структуры, жирной кислоты, органического, биохимического или неорганического вещества или его производных и любых их комбинаций. Если эпитоп содержится в пептидной структуре, такой как пептид, полипептид или белок, он обычно будет включать, по меньшей мере, 3 аминокислоты, предпочтительно от 5 до 40 аминокислот и более предпочтительно от около 10 до 20 аминокислот. Эпитопы могут быть либо линейными, либо конформационными эпитопами. Линейный эпитоп состоит из одного сегмента первичной последовательности полипептидной или углеводной цепи. Линейные эпитопы могут быть смежными или перекрывающимися.
Конформационные эпитопы состоят из аминокислот или углеводов, объединенных путем сгибания полипептида с образованием третичной структуры, и аминокислоты не обязательно смежны друг с другом в линейной последовательности. В частности, и в отношении полипептидных антигенов конформационный или прерывистый эпитоп характеризуется наличием двух или более дискретных аминокислотных остатков, разделенных в первичной последовательности, но собирающихся в устойчивую структуру на поверхности молекулы, когда полипептид складывается в нативный белок/антиген.
В данном документе термин «эпитоп» должен, в частности, относиться к одному эпитопу, распознаваемому антителом, или к перекрестно-реактивному эпитопу, который является общим, по меньшей мере, для двух различных антигенов и, необязательно, распознаваемым перекрестно-реактивным антителом.
Термин «экспрессия» понимается следующим образом. Молекулы нуклеиновой кислоты, содержащие искомую кодирующую последовательность экспрессируемого продукта, такую как, например, антитело, в соответствии с описанием в данном документе, и контролирующие последовательности, такие как, например, промотор в функциональной связи, могут использоваться для целей экспрессии. Хозяева, трансформированные или трансфицированные этими последовательностями, способны продуцировать кодируемые белки. Для осуществления трансформации система экспрессии может быть включена в вектор; однако соответствующая ДНК также может быть интегрирована в хромосому хозяина. В частности, термин относится к клетке-хозяину и совместимому вектору в подходящих условиях, например, для экспрессии белка, закодированного посторонней ДНК, переносимой вектором и введенной в клетку-хозяина.
Кодирующая ДНК представляет собой последовательность ДНК, которая кодирует определенную аминокислотную последовательность для конкретного полипептида или белка, такого как, например, антитело. Промоторная ДНК представляет собой последовательность ДНК, которая инициирует, регулирует или иным образом опосредует или контролирует экспрессию кодирующей ДНК. Промоторная ДНК и кодирующая ДНК могут быть из одного и того же гена или из разных генов и могут быть от одних и тех же или разных организмов. Рекомбинантные клонирующие векторы часто включают одну или несколько систем репликации для клонирования или экспрессии, один или несколько маркеров для отбора в хозяине, например, устойчивость к антибиотикам, и одну или несколько экспрессирующих кассет.
«Векторы», используемые в данном документе, определяются как последовательности ДНК, которые необходимы для транскрипции клонированных рекомбинантных нуклеотидных последовательностей, то есть рекомбинантных генов и трансляции их мРНК в подходящем организме-хозяине.
«Экспрессирующая кассета» относится к кодирующей ДНК последовательности или сегменту ДНК, которые кодируют продукт экспрессии, и которые могут быть вставлены в вектор по определенным сайтам рестрикции. Сайты рестрикции кассеты предназначены для обеспечения вставки кассеты в правильную рамку считывания. Как правило, чужеродную ДНК вставляют в один или несколько сайтов рестрикции векторной ДНК и затем переносят вектором в клетку-хозяин вместе с трансмиссивной векторной ДНК. Сегмент или последовательность ДНК, имеющая вставленную или добавленную ДНК, такую как экспрессирующий вектор, также можно назвать «ДНК-конструктом».
Экспрессирующие векторы содержат экспрессирующую кассету и дополнительно обычно включают точку начала автономной репликации в клетках-хозяевах или сайт интеграции в геном, один или несколько селектируемых маркеров (например, ген синтеза аминокислоты или ген, придающий устойчивость к антибиотикам, таким как цеоцин, канамицин, G418 или гигромицин), ряд участков расщепления рестрикционными ферментами, подходящую промоторную последовательность и терминатор транскрипции, причем эти компоненты функционально связаны друг с другом. Используемый в данном документе термин «вектор» включает автономно реплицирующиеся нуклеотидные последовательности, а также последовательности для интеграции в геном. Общим типом вектора является «плазмида», которая обычно представляет собой автономную молекулу двухцепочечной ДНК, которая может легко принимать дополнительную (чуждую) ДНК и которая может быть легко введена в подходящую клетку-хозяина. Плазмидный вектор часто содержит кодирующую ДНК и промоторную ДНК и имеет один или несколько сайтов рестрикции, подходящих для введения чужеродной ДНК. В частности, термин «вектор» или «плазмида» относится к носителю, посредством которого последовательность ДНК или РНК (например, чужеродный ген) может быть введена в клетку-хозяина, чтобы трансформировать хозяин и стимулировать экспрессию (например, транскрипцию и трансляцию) введенной последовательности.
Используемый в данном документе термин «клетка-хозяин» относится к клеткам первичного объекта, образованным для получения конкретного рекомбинантного белка, такого как антитело, в соответствии с описанием в данном документе, и любому ее потомству. Следует понимать, что не все потомство в точности идентично исходной клетке (из-за преднамеренных или непреднамеренных мутаций или различий в окружающей среде), однако такое измененное потомство включено в эти термины, при условии, что потомство сохраняет ту же функциональность, что и первоначально трансформированная клетка. Термин «линия клеток-хозяев» относится к клеточной линии клеток-хозяев, которая используется для экспрессии рекомбинантного гена для получения рекомбинантных полипептидов, таких как рекомбинантные антитела. Используемый в данном документе термин «клеточная линия» относится к выведенному клону определенного типа клетки, который приобрел способность размножаться в течение длительного периода времени. Такую клетку-хозяина или линию клеток-хозяев можно поддерживать в культуре клеток и/или культивировать с получением рекомбинантного полипептида.
Термин «выделенный» или «выделение», используемый в данном документе в отношении нуклеиновой кислоты, антитела или другого соединения, относится к такому соединению, которое было достаточно отделено от среды, с которой оно, в природе было связано так, чтобы оно существовал в «по существу чистой» форме. «Выделенный» не обязательно означает исключение искусственных или синтетических смесей с другими соединениями или материалами или наличие примесей, которые не влияют на основную активность и которые могут присутствовать, например, из-за неполной очистки. В частности, выделенные молекулы нуклеиновых кислот по настоящему изобретению также включают те, которые не встречаются в природе, например, нуклеиновые кислоты, оптимизированные по кодонам или кДНК, или химически синтезированные.
Подобным же образом выделенное антитело по изобретению конкретно не встречается в природе, например, предоставляемое в комбинированном препарате с другим антителом или активным агентом, причем эта комбинация не встречается в природе, или оптимизированный вариант или вариант с созревшей аффинностью антитела, встречающегося в природе, или антитело с каркасной областью, которая разработана для улучшения технологичности антитела. Благодаря такой оптимизации или разработке антитело включает одну или несколько синтетических последовательностей или характеристик, которые не были бы обнаружены в контексте антитела в природе.
В отношении нуклеиновых кислот по изобретению иногда используется термин «выделенная нуклеиновая кислота». Этот термин, при применении к ДНК, относится к молекуле ДНК, которая отделена от последовательностей, с которыми она непосредственно соседствует в естественном геноме организма, из которого она происходит. Например, «выделенная нуклеиновая кислота» может содержать молекулу ДНК, вставленную в вектор, такую как плазмиду или вирусный вектор, или интегрированную в геномную ДНК прокариотической или эукариотической клетки или организма-хозяина. При применении к РНК, термин «выделенная нуклеиновая кислота» относится в основном к молекуле РНК, кодируемой выделенной молекулой ДНК, как определено выше. В ином случае, этот термин может относиться к молекуле РНК, которая была достаточно отделена от других нуклеиновых кислот, с которыми она была бы связана в своем естественном состоянии (т.е. в клетках или тканях). «Выделенная нуклеиновая кислота» (или ДНК или РНК) может также представлять собой молекулу, полученную непосредственно биологическими или синтетическими средствами и отделенную от других компонентов, присутствующих во время ее получения.
Что касается полипептидов или белков, таких как выделенные антитела или эпитопы по изобретению, термин «выделенный» должен конкретно относиться к соединениям, которые свободны или практически не содержат вещества, с которым они естественно связаны, например, с другими соединениями, с которыми они обнаруживаются в их природной среде или в среде, в которой их получают (например, клеточная культура), когда такое получение осуществляется по технологии рекомбинантной ДНК, применяемой in vitro или in vivo. Выделенные соединения могут быть включены в состав вместе с разбавителями или адъювантами и все же для практических целей могут быть выделенными - например, полипептиды или полинуклеотиды могут быть смешаны с фармацевтически приемлемыми носителями или эксципиентами при использовании в диагностике или терапии. В частности, выделенное антитело по изобретению отличается от препаратов поликлональной сыворотки, выращенных против штаммов K. pneumoniae, поскольку оно предоставляется в выделенной и очищенной форме, предпочтительно в препарате, включающем выделенное антитело в качестве единственного активного вещества. Это не исключает, однако, что выделенное антитело предоставляется в комбинированном продукте, включающем ограниченное количество других хорошо определенных (выделенных) антител. Выделенные антитела также могут быть представлены на твердом, полужидком или жидком носителе, таком как гранулы.
Термин «нейтрализующий» или «нейтрализация» используется в данном документе в самом широком смысле и относится к любой молекуле, которая ингибирует способность возбудителя, такого как K. pneumoniae, заражать объект или препятствует возбуждению инфекции возбудителем путем продуцирования эндотоксинов или ингибирует биологическую активность эндотоксинов, независимо от механизма, с помощью которого достигается нейтрализация. Нейтрализация может быть достигнута, например, антителом, которое ингибирует колонизацию K. pneumoniae поверхностей слизистой оболочки, вторжение в стерильные участки тела и вызов неблагоприятных биологических сигналов (в худшем случае, вызывающих септический шок) у хозяина.
В строгом смысле нейтрализация означает, ингибирование связывания специфических LPS с его узнающим рецептором (например, комплексом Толл-подобного рецептора-4) и, следовательно, вызова биологической активности. Эту нейтрализационную активность обычно определяют в стандартном анализе, например, в анализе нейтрализации in vitro или in vivo, например, в тестах LAL или на основе TLR-4, где измеряется ингибирование биологической активности эндотоксина, например, путем колориметрии.
Антитела, которые борются или нейтрализуют K. pneumoniae, мешают патогенам и патогенным реакциям, что позволяет ограничить или предотвратить инфекцию и/или облегчить болезненное состояние, возникающее в результате такой инфекции, или ингибировать патогенез K. pneumoniae, в частности, распространение и репликацию в или в пределах стерильных отделов/участков организма хозяина. В этом отношении нейтрализующее антитело также понимается как «защитное антитело», что означает, что антитело отвечает за иммунитет к инфекционному агенту, наблюдаемый при активном или пассивном иммунитете. В частности, нейтрализующие или защитные антитела в соответствии с описанием в данном документе, возможно, используются для терапевтических целей, например, для профилактики или терапии, для предотвращения, улучшения, лечения или, по меньшей мере, частичной остановки симптомов болезни, побочных эффектов или прогрессирования заболевания, вызванного патогеном. В частности, защитные антитела способны убивать или препятствовать репликации живых клеток K. pneumoniae, например, индуцируя бактерицидную или опсонофагоцитарную активность в сыворотке или удалять целые бактериальные клетки или молекулы LPS из стерильных участков тела после терапевтических применений (т.е. полученных при развитой инфекции). В качестве альтернативы профилактически применяемые защитные антитела ингибируют развитие инфекции (т.е. распространение K. pneumoniae из нестерильных участков в стерильные отделы организма) одним из вышеупомянутых или других механизмов.
Используемый в данном документе термин «биологический образец» относится к любому материалу, полученному от объекта, такого как человек, который содержит, или потенциально содержит, биологический материал, который может содержать K. pneumoniae. Биологический образец может быть образцом ткани, жидкости или клеточной культуры. Примеры образцов для применения в соответствии с изобретением включают, без ограничения указанным, образцы пациентов, например, ткани или биологические жидкости организма, в частности образцы дыхательных путей, такие как эндотрахеальные аспираты, плевральная жидкость, пунктат легкого, назальный тампон или мокрота, образец крови, образец стула, образец кожи и мочи или цереброспинальная жидкость.
Биологический образец обычно включает сложную биологическую матрицу, такую как сложные вязкие биологические жидкости, содержащие несколько типов биологических и малых органических молекул, например, слизистые экссудаты, богатые белковым веществом. Подходящие добавки или способы экстракции могут быть использованы для уменьшения неспецифического связывания, которое может быть ассоциировано с матрицей в образце и/или для понижения вязкости матрицы путем солюбилизации и/или разрушения вязких или твердых компонентов матрицы образца. Можно использовать способы подготовки образцов, которые высвобождают маркеры из организмов и/или разрушают и/или разжижают биологические матрицы. Биологические матрицы, которые могут быть проанализированы, включают образцы, содержащие слизь, такие как назальные выделения, мокроту, флегму, глоточные экссудаты, уретральные или вагинальные выделения и промывки таких мембранных поверхностей.
Подходящие способы получения образцов включают стадии способа для снижения действия биологической матрицы при анализе. Такие стадии способа могут включать, без ограничения указанным, например, захват, хроматографию, центрифугирование и диализ.
Материал, полученный от объекта, также может быть в форме бактериальных изолятов, например, в форме клеточной культуры для культивирования выделенных K. pneumoniae, или продукта клеточной культуры. Культуральные среды могут быть селективными, для обогащения исключительно популяции K. pneumoniae или неселективными.
Приготовление бактериального изолята обычно включает стадию инкубации для поддержания образца в условиях, которые усиливают пролиферацию K. pneumoniae, тем самым обогащая популяцию K. pneumoniae в образце.
После получения изолята бактерию можно дополнительно исследовать с помощью биохимических и/или серологических тестов, например, для определения O-типа и уровня gal-III. Для изучения штаммов K. pneumoniae доступны несколько способов типирования. Эти способы обычно включают серотипирование, стандартную типизацию для генетической взаимосвязи/филогении, включая типизацию множественных локусов (MLST), или электрофорез в пульсирующем поле (PFGE).
Термин «галактан-III», также упоминаемый как «gal-III», используемый в данном документе, относится к углеводной структуре O-антигена LPS K. pneumoniae, содержащей галактозный полимер, и структуру, содержащую, по меньшей мере, одну повторяющуюся единицу Формулы (I). Такая повторяющаяся единица включает разветвленный галактозный полимер, см. фиг. 5. Структура подобна, но отличается от структуры антигена gal-I. Gal-III в данном документе понимается как новая детерминанта серотипа, которая подобна, но отличается от серотипа O2a, который характеризуется наличием антигена gal-I и отсутствием структуры gal-III.
Соответствующий O-антиген, включающий структуру gal-III, в дальнейшем упоминается как «антиген gal-III», который включает «gal-III-эпитоп», распознаваемый гало-III-специфическим антителом по изобретению. Антиген gal-III понимается как внешняя часть LPS K. pneumoniae gal-III O-типа, которая является поверхностно доступной антигенной углеводной структурой, содержащей один или несколько специфических эпитопов gal-III, включенных в нее.
Генотип K. pneumoniae gal-III O-типа специфически характеризуется локусом rfb gal-I, дополненным генами gtr (фиг. 4B), т.е. локусом rfb, который удлинен дополнительными gtr-генами, который отвечает за экспрессию разветвленной тригалактозной повторяющейся единицей, которая отличается от линейной формы gal-I типа.
Любая K. pneumoniae, которая характеризуется O-антигеном LPS, содержащим, по меньшей мере, одну структуру gal-III, в данном документе упоминается как K. pneumoniae типа gal-III O-типа. LPS K. pneumoniae gal-III O-типа может содержать исключительно структуру gal-III или обе структуры, gal-III и gal-I.
Термин «галактан-I», также упоминаемый как «gal-I», используемый в данном документе, относится к углеводной структуре О-антигена LPS K. pneumoniae, содержащему галактозный полимер, и структуру, содержащую, по меньшей мере, одну повторяющуюся единицу Формулы (II), но не повторяющуюся единицу Формулы (I). Такая повторяющаяся единица включает линейный галактозный полимер. Gal-I характерен для серотипа O2a, который не содержит какого-либо антигена gal-III.
Соответствующий O-антиген, включающий gal-I-структуру, в дальнейшем упоминается как «антиген gal-I», который включает «gal-I-эпитоп», распознаваемый gal-I-специфическим антителом по изобретению. Генотип K. pneumoniae gal-I O-типа специфически характеризуется локусом rfb gal-I, который не включает гены gtr, которые отвечают за экспрессию линейной тригалактозной повторяющейся единицы, которая отличается от разветвленной единицы gal-III-типа.
Антиген gal-I понимается как внешняя часть LPS K. pneumoniae gal-I O-типа, который представляет собой поверхностно доступную антигенную углеводную структуру, содержащую один или несколько специфических эпитопов gal-I, включенных в нее, и которая не включает любую структуру gal-III.
«Специфическое» связывание, распознавание или нацеливание, при использовании в данном документе, означает, что связующее, например, антитело или его антигенсвязывающая часть, проявляет заметную аффинность к целевому антигену или соответствующему эпитопу в гетерогенной популяции молекул. Таким образом, при определенных условиях (например, иммуноанализе) связующее специфически связывается с целевым антигеном gal-III и не связывается в значительном количестве с другими молекулами, присутствующими в образце. Специфическое связывание означает, что связывание является избирательным по показателю идентичности мишени, высокой, средней или низкой аффинности связывания или авидности, по выбору. Селективное связывание обычно достигается, если константа связывания или динамика связывания, по меньшей мере, в 10 раз различаются (понимается как разница, по меньшей мере, в 1 log), предпочтительно разница составляет, по меньшей мере, 100 раз (понимается как разница, по меньшей мере, в 2 log), а более предпочтительно, по меньшей мере, в 1000 раз (понимается как разница, по меньшей мере, в 3 log) по сравнению с другой мишенью.
Под термином «специфичность» понимается также применение связующих, которые связываются с одной или несколькими молекулами, например, перекрестно-специфические связующие. Предпочтительные перекрестно-специфические (также называемые полиспецифическими или перекрестно-реактивными) связующие, нацеленные, по меньшей мере, на две разные мишени или эпитопа или нуклеотидных последовательности таких мишеней или нацеленные на перекрестно-реактивный эпитоп или нуклеотидную последовательность, по меньшей мере, на двух разных мишенях, специфически связывают мишени по существу со сходной аффинностью связывания, например, меньше чем со 100-кратной разницей, или дале меньше, чем с 10-кратной разницей, или, по существу, с различной аффинностью связывания, например, с разностью, по меньшей мере, в 10 раз или, по меньшей мере, в 100 раз. Перекрестно-специфическое связующее, которое распознает как первую (например, gal-III), так и вторую (например, gal-I) мишень, которое предпочтительно связывает первую мишень по сравнению со второй мишенью, обычно характеризуется одинаковой аффинностью или более высокой аффинностью к первой мишени относительно второй, в частности, где дифференцированная аффинность связывания предпочтительно связывать первый антиген относительно второго антигена, в частности, по меньшей мере, равна или более чем равна, например, выше, по меньшей мере, в 1,5 раза или, по меньшей мере, в 2 раза или, по меньшей мере, в 3 раза или, по меньшей мере, в 4 раза или, по меньшей мере, в 5 раз или, по меньшей мере, в 6 раз или, по меньшей мере, в 7 раз или, по меньшей мере, в 8 раз или, по меньшей мере, в 9 раз или, по меньшей мере, в 10 раз. Такое дифференциальное связывание может быть определено иммуноанализом, предпочтительно иммуноблоттингом, ELISA или другими иммунологическими способами.
Предпочтительные антитела по изобретению связывают антиген gal-III (только gal-III или предпочтительно связывают gal-III относительно антигена gal-I) с высокой аффинностью, в частности с высокой скоростью ассоциации и/или низкой скоростью диссоциации, или с высокой авидностью связывания. Аффинность связывания антитела обычно характеризуется с точки зрения концентрации антитела, в которой занята половина сайтов связывания антигена, известная как константа диссоциации (Kd или KD). Обычно связующее вещество считается связующим с высокой аффинностью с Kd <10-7 М, в некоторых случаях, например, в терапевтических целях с более высокой аффинностью, например, с Kd <10-8 M, предпочтительно Kd <10-9 М, еще более предпочтительным является Kd <10-10 М.
Однако в особенно предпочтительном воплощении индивидуальные аффинности связывания антигена имеют среднюю аффинность, например, с Kd менее 10-6 и до 10-8 М, например, при связывании, по меньшей мере, с двумя антигенами.
В соответствии с изобретением могут быть предусмотрены связующие со средней аффинностью, предпочтительно в сочетании с процессом созревания аффинности, если это необходимо.
Созревание аффинности представляет собой процесс, с помощью которого получают антитела с повышенной аффинностью к целевому антигену. Любой один или несколько способов получения и/или применения библиотек созревания аффинности, доступных в данной области, могут быть использованы для получения аффинно созревших антител в соответствии с различными воплощениями изобретения, раскрытыми в данном документе. Примерные способы и применения созревания аффинности, такие как случайный мутагенез, пассирование штаммов бактериальных мутаторов, сайт-направленный мутагенез, таргетинг мутационных горячих точек, экономный мутагенез, шаффлинг антител, шаффлинг легкой цепи, шаффлинг тяжелой цепи, CDR1 и/или мутагенез CDR1, и способы получения и применения библиотек созревания аффинности, пригодных для реализации способов и применений в соответствии с различными воплощениями изобретения, которые раскрыты в данном документе, включают, например, те, которые раскрыты в: Prassler et al. (2009); Immunotherapy, Vol. 1(4), pp. 571-583; Sheedy et al. (2007), Biotechnol. Adv., Vol. 25(4), pp. 333-352; WO2012/009568; WO2009/036379; WO2010/105256; US2002/0177170; WO2003/074679.
При структурных изменениях антитела, включая мутагенез аминокислот или, как следствие, соматической мутации в сегментах гена иммуноглобулина, для большей аффинности продуцируются и выбираются варианты участка связывания с антигеном. Антитела с созревшей аффинностью могут демонстрировать аффинность, большую на несколько log, чем родительское антитело. Одиночные родительские антитела могут подвергаться созреванию аффинности. В ином случае пулы антител со сходной аффинностью связывания с целевым антигеном можно рассматривать как родительские структуры, которые варьируют для получения одиночных антител с созревшей аффинностью или пулы с созревшей аффинностью таких антител.
Предпочтительный вариант антитела с созревшей аффинностью согласно изобретению проявляет, по меньшей мере, 2-кратное увеличение аффинности связывания, предпочтительно, по меньшей мере, 5-кратное, предпочтительно, по меньшей мере, 10-кратное, предпочтительно, по меньшей мере, 50-кратное или, предпочтительно, по меньшей мере, 100-кратное увеличение. Созревание аффинности может быть использовано в ходе кампаний отбора, в которых используются соответствующие библиотеки исходных молекул, либо с антителами, имеющими среднюю аффинность связывания для получения антитела по изобретению, имеющему свойство специфического связывания с мишенью с аффинностью связывания с Kd <10-8 M. В ином случае, аффинность может быть еще более увеличена за счет созревания аффинности антитела в соответствии с изобретением для получения высоких значений, соответствующих Kd менее 10-9 М, предпочтительно менее 10 -10 М или даже менее 10 - 11 М, наиболее предпочтительно в пикомолярном диапазоне.
В некоторых воплощениях аффинность связывания определяют с помощью аффинного анализа ELISA. В некоторых воплощениях аффинность связывания определяют с помощью анализов BIAcore, ForteBio или MSD. В некоторых воплощениях аффинность связывания определяется кинетическим методом. В некоторых вариантах аффинность связывания определяется способом равновесия/раствора.
Использование термина «с той же специфичностью», «с тем же самым участком связывания» или «связывание одного и того же эпитопа» указывает на то, что эквивалентные моноклональные антитела имеют одинаковые или, по существу, одни и те же, то есть аналогичные иммунореакционные (связывающие) характеристики и конкурируют за связывание с предварительно выбранной целевой последовательностью связывания. Относительная специфичность молекулы антитела для конкретной мишени может быть относительно определена с помощью конкурентных анализов, например, как описано в Harlow, et al., ANTIBODIES: LABORATORY MANUAL, Cold Spring Harbor Press Press, Cold Spring Harbor, NY, 1988).
Термин «конкурировать», используемый в данном документе в отношении антитела, означает, что первое антитело или его антигенсвязывающая часть связывается с эпитопом способом, достаточно похожим на связывание второго антитела или его антигенсвязывающей части, так что результат связывания первого антитела с узнаваемым им эпитопом, детектируемо снижается в присутствие второго антитела, по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернатива, когда связывание второго антитела с его эпитопом также заметно снижается в присутствии первого антитела, может иметь место, но не является обязательной. То есть, первое антитело может ингибировать связывание второго антитела с его эпитопом без ингибирования этим вторым антителом связывания первого антитела с его соответствующим эпитопом. Однако, когда каждое антитело детектируемо ингибирует связывание другого антитела с узнаваемым им эпитопом, будь то в той же, большей или меньшей степени, то говорят, что антитела «конкурируют» друг с другом за связывание с их соответствующим эпитопом(ами). Антитела, которые конкурируют с любым из приведенных в качестве примера антител для связывания с антигеном gal-III, в частности, охватываются настоящим изобретением.
Конкуренция в данном документе означает большее относительное ингибирование, чем около 30%, определенное в анализе конкурентного ELISA или анализе ForteBio. Возможно, было бы желательно установить более высокий порог относительного ингибирования в качестве критериев того, что является подходящим уровнем конкуренции в конкретном контексте, например, когда конкурентный анализ используется для выбора или скрининга новых антител, спроектированных с предполагаемой функцией связывания антигена. Таким образом, например, можно установить критерии конкурентного связывания, в которых обнаруживается, по меньшей мере, 40% относительного ингибирования или, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90 % или даже не менее 100%, прежде чем антитело будет считаться достаточно конкурентным.
Используемый в данном документе термин «диагностический набор» относится к набору или комплекту частей, которые в комбинации или смеси могут использоваться для проведения измерения/детекции одного или нескольких аналитов или маркеров для определения заболевания или состояния заболевания или для прогноза заболевания или прогрессии заболевания. В частности, набор содержит, по меньшей мере, молекулу для детекции и/или связующее, где молекула для детекции и/или связующее специфически распознает аналит или маркер или продукт реакции такого аналита или маркера. Кроме того, в набор могут быть включены различные реагенты или инструменты. Диагностический набор может содержать любые полезные реагенты для проведения предметных способов, включая субстраты, такие как микрогранулы или плоские биочипы или лунки, реагенты для выделения биомаркеров, молекулы для детекции, направленные на конкретные мишени, реагенты, такие как праймеры для секвенирования или амплификации нуклеиновых кислот, биочипы для гибридизации нуклеиновых кислот, детектируемые метки, растворители или буферы и т.п., различные линкеры, различные аналитические компоненты, блокаторы и тому подобное.
В набор могут также входить инструкции для применения диагностического способа. Такие инструкции могут быть, например, предусмотрены для устройства, включенного в набор, например, инструменты или устройство для подготовки биологического образца для диагностических целей, таких как отделение фракции, содержащей клетку и/или белок, перед определением маркера. Набор может удобно поставляться в стабильной форме хранения, такой как коммерческий набор со сроком годности не менее 6 месяцев.
Специфические диагностические наборы также содержат твердую подложку, содержащую детектирующую молекулу, или имеющую иммобилизованный структурированный биочип детектирующих молекул, направленный против маркеров, представляющих интерес, предпочтительно включающий первую область, содержащую первый связывающий реагент, направленный против первого маркера, и вторую область, содержащую второй связывающий реагент, направленный против второго маркера.
В частности, можно использовать формат сэндвич. Например, одно или несколько связующих веществ конъюгируют с субстратом перед контактом с биологическим образцом. Одно или несколько связующих могут быть конъюгированы с детектируемой меткой, чтобы служить в качестве детектирующей молекулы. В других воплощениях одно или несколько связующих конъюгируют с детектируемой меткой. В этой конфигурации один или несколько связующих могут быть конъюгированы с субстратом перед контактом с биологическим образцом, чтобы служить агентом для захвата. Кроме того, одно или несколько связующих могут быть конъюгированы с субстратом перед контактом с биологическим образцом и/или одно или несколько связующих конъюгируют с детектируемой меткой. В таких случаях одно или несколько связующих могут действовать либо как агент захвата, либо как агент детекции, либо и тем, и другим.
Диагностический набор специально предназначен для применения в иммунологическом анализе, где детектирующая молекула представляет собой специфическое связующее, которое связывается с аналитом или маркером с помощью иммунореакции. Такое связующее может быть антителами или фрагментами антител или антителоподобными каркасами, связывающимися с целевым антигеном.
Подходящими иммунологическими анализами являются любые из числа ELISA, CIA, RIA, IRMA, агглютинационного анализа, иммунохроматографии, анализа с тест-полосками и вестерн-блоттинга.
Термин «инфекция K. pneumoniae» и «колонизация K. pneumoniae» понимается следующим образом: Klebsiella pneumoniae является грамотрицательной бактерией, которая является членом семейства Enterobacteriaceae. Она является повсеместно встречающейся бактерией, которая также может колонизировать хозяина-человека, как правило, в кишечнике или в верхних дыхательных путях. Будучи оппортунистическим патогеном, с этих участков она может вторгнуться в стерильные участки тела в случае, если она не будет надлежащим образом контролироваться иммунной системой. Неконтролируемая репликация бактерий в этих стерильных участках, в противном случае, вызывает воспаление, в значительной степени опосредованное молекулами эндотоксина (т.е. LPS), высвобождаемых из K. pneumoniae. В случае бактериемии молекулы эндотоксинов могут вызывать септический шок.
Колонизация K. pneumoniae означает, что объект имеет достаточно высокую концентрацию бактерий K. pneumoniae на участке, в котором они могут быть обнаружены, но бактерии не вызывают никаких признаков или симптомов. Колонизация может сохраняться в течение длительного периода времени, при этом разрешение зависит от иммунного ответа организма, конкуренции на участке с другими организмами и, иногда, от применения противомикробных препаратов.
В общем, бактериемии, вызванные K. pneumoniae, можно успешно лечить с помощью известной традиционной антибактериальной терапии, такой как лечение антибиотиками, стероидные и нестероидные ингибиторы воспаления. Настоящее изобретение предусматривает новую иммунотерапию с использованием антител, специфически распознающих K. pneumoniae, которая необязательно комбинируется с антибактериальной или противовоспалительной терапией. Примерами антибиотиков, используемых для лечения пациентов с инфекцией K. pneumoniae, являются аминогликозиды, цефалоспорины, аминопенициллины, карбапенемы, фторхинолоны, тигециклин, колистин и т.д.
Следует понимать мультирезистентные (MDR) K. pneumoniae как штаммы, демонстрирующие устойчивость к трем или более классам антибиотиков, например, следующим агентам/группам: пенициллины, цефалоспорины, карбапенемы, аминогликозиды, тетрациклины, фторхинолоны, нитрофурантоин, триметоприм (и его комбинации), фосфомицин, полимиксины, хлорамфеникол, азтреонам или тигециклин.
С недавним появлением устойчивых к антибиотикам штаммов лечение бактерий этой природы стало значительно сложнее. Пациенты, у которых развивается заболевание, опосредованное K. pneumoniae с множественной лекарственной устойчивостью, имеют больший срок пребывания в больнице и ОИТ, высокую смертность и большие затраты на здравоохранение, чем пациенты без заболевания с K. pneumoniae. Уход за пациентами может быть улучшен, а внутрибольничные инфекции могут быть уменьшены путем предотвращения, а не лечения, профилактики заболевания с K. pneumoniae, когда пациент сильно колонизирован K. pneumoniae с множественной лекарственной устойчивостью.
Заболевание с K. pneumoniae конкретно понимается как заболевание, вызванное инфекцией K. pneumoniae. Такие заболевания включают местное и системное заболевание. Тяжелыми случаями заболевания являются, например, первичная и вторичная бактериемия, пневмония, инфекция мочевых путей, абсцесс печени, перитонит или менингит.
Термин «рекомбинантный», при использовании в данном документе, означает «полученный с помощью или в результате генной инженерии». Рекомбинантный хозяин, в частности, содержит экспрессирующий вектор или вектор клонирования, или он генетически модифицирован так, чтобы содержать рекомбинантную последовательность нуклеиновой кислоты, в частности, используя нуклеотидную последовательность, чуждую хозяину. Рекомбинантный белок получают путем экспрессии соответствующей рекомбинантной нуклеиновой кислоты в хозяине. Используемый в данном документе термин «рекомбинантное антитело» включает антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, такие как (а) антител, выделенных из животного (например, мыши), которые являются трансгенными или трансхромосомными для генов человеческого иммуноглобулина, или полученных из них гибридом, (b) антител, выделенных из клетки-хозяина, трансформированной для экспрессии антитела, например, из трансфектомы, (с) антител, выделенных из комбинаторной библиотеки рекомбинантных человеческих антител или библиотеки антигенсвязывающих последовательностей антитела и (d) антитела, полученные, экспрессированные, созданные или выделенные с помощью любых других средств, которые включают сплайсинг последовательностей генов человеческого иммуноглобулина с другими последовательностями ДНК. Такие рекомбинантные антитела содержат антитела, сконструированные для включения реаранжировок и мутаций, которые возникают, например, во время созревания антител. В соответствии с настоящим изобретением могут быть использованы обычные методы молекулярной биологии, микробиологии и рекомбинантной ДНК в пределах компетентности в данной области. Такие методы подробно описаны в литературе. См., например, Maniatis, Fritsch & Sambrook, "Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, (1982).
Селективное связывание может быть дополнительно улучшено с помощью способов оптимизации рекомбинантных антител, известных в данной области техники. Например, определенные области вариабельных областей цепей иммуноглобулина, описанных в данном документе, могут быть подвергнуты одной или нескольким стратегиям оптимизации, включая шаффлинг легкой цепи, дистанционный мутагенез, слияние CDR и направленный мутагенез выбранных CDR и/или каркасных областей.
Используемый в данном документе термин «объект» относится к теплокровному млекопитающему, в частности человеку или животному, не относящемуся к человеку. K. pneumoniae - критически важный патоген человека, который также вызывает беспокойство в области ветеринарии. Он присутствует в широком диапазоне видов животных, не относящихся к человеку. Таким образом, термин «объект» может также, в частности, относиться к животным, включая собак, кошек, кроликов, лошадей, коров, свиней и домашнюю птицу. В частности, медицинское применение изобретения или соответствующий способ лечения относится к объекту, нуждающемуся в профилактике или лечении заболевания, связанного с инфекцией K. pneumoniae. Объектом может быть пациент, подверженный риску заражения K. pneumoniae или страдающий от болезни, включая раннюю стадию или позднюю стадию заболевания. Термин «пациент» включает людей и других объектов-млекопитающих, которые получают либо профилактическое, либо терапевтическое лечение. Таким образом, термин «лечение» включает как профилактическое, так и терапевтическое лечение.
Объект, например, обрабатывается для профилактики или лечения состояний, связанных с заболеванием K. pneumoniae. В частности, обрабатывают объект, который либо подвергается риску заражения, либо у которого развивается такое заболевание или рецидив заболевания, либо объект, страдающий такой инфекцией и/или заболеванием, связанным с такой инфекцией.
В частности, термин «профилактика» относится к превентивным мерам, который призваны охватить возникновение патогенеза или профилактические меры для снижения риска патогенеза.
В частности, лечение может мешать патогенезу K. pneumoniae, как возбудителя состояния.
Используемый в данном документе термин «по существу чистый» или «очищенный» относится к препарату, включающему, по меньшей мере, 50% (масс./масс.), предпочтительно, по меньшей мере, 60%, 70%, 80%, 90% или 95% соединения, такого как молекула нуклеиновой кислоты или антитело. Чистоту измеряют способами, подходящими для соединения (например, хроматографические методы, электрофорез в полиакриламидном геле, анализ ВЭЖХ и тому подобное).
Термин «терапевтически эффективное количество», используемый в данном документе, взаимозаменяемо с любым из терминов «эффективное количество» или «достаточное количество» соединения, например, антитела по настоящему изобретению, представляет собой количество или активность, достаточную, при введении объекту, для получения благоприятных или желаемых результатов, включая клинические результаты, и, таким образом, эффективное количество или его синоним зависят от контекста, в котором термин применяется.
Эффективное количество означает количество соединения, которое является достаточным для лечения, профилактики или ингибирования таких заболеваний или расстройств. В контексте заболевания терапевтически эффективные количества антитела, в соответствии с описанием в данном документе, специально используются для лечения, модуляции, ослабления, реверсии или воздействия на заболевание или состояние, которое благоприятствует ингибированию патогенеза K. pneumoniae, например, адгезии и колонизации поверхностей слизистой оболочки, неконтролируемой репликации в стерильных участках тела и токсикоза клеток-хозяев бактериальными продуктами.
Количество соединения, которое будет соответствовать такому эффективному количеству, будет варьировать в зависимости от различных факторов, таких как данное лекарственное средство или соединение, фармацевтическая композиция, способ введения, тип заболевания или расстройства, особенности объекта или хозяина, подвергаемого лечению, и тому подобное, но, тем не менее, оно может быть определено специалистом в данной области.
Терапевтически эффективное количество антитела, в соответствии с описанием в данном документе, например, предоставленное нуждающемуся пациенту-человеку, может в частности находиться в пределах 0,5-50 мг/кг, предпочтительно 5-40 мг/кг, еще более предпочтительно вплоть до 20 мг/кг, вплоть до 10 мг/кг, вплоть до 5 мг/кг, хотя более высокие дозы могут быть указаны, например, для лечения острых состояний заболевания. Доза может быть значительно ниже, если используется сильнодействующее антитело. В этом случае эффективное количество может находиться в диапазоне от 0,005 до 5 мг/кг, предпочтительно от 0,05 до 1 мг/кг.
Кроме того, режим лечения или профилактики объекта терапевтически эффективным количеством антитела по настоящему изобретению может состоять из одного введения или в ином случае содержать ряд применений. Например, антитело можно вводить не реже одного раза в год, по меньшей мере, один раз в полгода или, по меньшей мере, один раз в месяц. Однако в другом воплощении антитело для данного лечения может вводиться объекту примерно от одного раза в неделю до примерно ежедневного введения. Продолжительность периода лечения зависит от целого ряда факторов, таких как тяжесть заболевания, острое или хроническое заболевание, возраст пациента, концентрация и активность формата антител. Также будет понятно, что эффективная доза, используемая для лечения или профилактики, может увеличиваться или уменьшаться в течение конкретного режима лечения или профилактики. Изменения в дозировке могут возникать и становиться очевидными с помощью стандартных диагностических анализов, известных в данной области. В некоторых случаях может потребоваться постоянное введение.
Моноклональные антитела (mAb) с высокой специфичностью к gal-III, обладают большим потенциалом в качестве диагностических реагентов для идентификации MDR Klebsiella pneumoniae, в частности штаммов MDR, относящихся к линии ST258. Кроме того, в частности, при гуманизации эти mAb подходят для профилактики (например, для групп высокого риска) и лечения инфекций K. pneumoniae, вызванных штаммами ST258-gal-III.
Считалось, что углеводные структуры gal-III и gal-I очень похожи и не имеют разных антигенов. Генетический фон синтеза O-антигена в штаммах MDR Klebsiella pneumoniae, ST258 не был полностью выяснен. Удивительно, но оказалось, что специфический ген, соседствующий с кластером rfb (wb) (кодирующим гликозилтрансферазы, gtr-s), составляет основу для идентификации на основе ПЦР штаммов gal-III O-типа.
Имеются данные о гетерогенности в кластерах гена rfb, кодирующих фактор O-антигена галактан-I. Разница в размерах, наблюдаемая между вариантами, происходит из-за присутствия или отсутствия фрагмента 3 тыс. п.о., несущего gtr (гликозилтрансфераза) -подобные гены. Реакция ПЦР, разработанная для различения вариантов, показала, что более 50% всех клинических изолятов O1 и O2 Klebsiella и более 80% всех штаммов ST258 имеют gtr- подобный локус.
К удивлению оказалось, что антитело по изобретению может специфически связывать антиген gal-III. Было установлено, что иммунизация мышей gtr + O2 штаммом приводит к возникновению антигалактановых антител, которые исключительно распознают молекулы галактана-I, отделанные локусом gtr (т.е. антигенами галактана-III). Хотя характер этой модификации был идентифицирован, как та же самая ветвящаяся галактановая структура, описанная ранее как повторяющаяся единица серотипа O2 (2a, 2f, 2g), структуры не были выявлены как антигенно различимые. В настоящем изобретении предложены первые mAb, специфичные к галактану-III, генерируемые стандартной методикой гибридом. Наблюдалась способность этих mAb связаться с поверхностью живых O2 gtr + изолятов Klebsiella (включая штаммы ST258). Было удивительно, что защитная эффективность галактан-III специфических mAb может быть показана в мышиных моделях бактериемии и эндотоксемии. Предполагаемым режимом действия для защиты является нейтрализация эндотоксина, что подтверждается функциональным анализом in vitro.
С целью разработки терапевтических моноклональных антител для профилактики и лечения инфекций, вызванных штаммами MDR Klebsiella, молекулярная мишень специфических mAb соответственно представляет собой O-антиген LPS, который демонстрирует ограниченную гетерогенность в Klebsiella. Такая O-боковая цепь считается иммунорелевантной, поскольку она не полностью маскируется крупным капсулярным полисахаридом.
После идентификации антител с искомыми связывающими свойствами, такие антитела, включая фрагменты антител, могут быть получены способами, хорошо известными в данной области, включая, например, гибридомные методы или технологию рекомбинантной ДНК.
Рекомбинантные моноклональные антитела могут быть получены, например, путем выделения ДНК, кодирующей требуемые цепи антител, и трансфекции рекомбинантной клетки-хозяина кодирующими последовательностями для экспрессии с использованием хорошо известных рекомбинантных экспрессирующих векторов, например, плазмид по изобретению или экспрессирующей кассеты (кассет), включающих нуклеотидные последовательности, кодирующие последовательности антитела. Рекомбинантные клетки-хозяева могут быть прокариотическими и эукариотическими клетками, такими как описанные выше.
В соответствии с конкретным аспектом нуклеотидная последовательность может использоваться для генетической манипуляции с тем, чтобы гуманизировать антитело или для улучшения аффинности или других характеристик антитела. Например, константная область может быть сконструирована так, чтобы больше напоминать константные области человека, чтобы избежать иммунного ответа, если антитело используется в клинических испытаниях и при лечении у людей. Желательной может быть генетическая манипуляция с последовательностью антитела с тем, чтобы получить большую аффинность к мишени gal-III и большую эффективность против Klebsiella pneumoniae, в частности клона MDR ST258. Специалисту в данной области техники будет очевидно, что одно или несколько изменений полинуклеотида могут быть проведены в антителе с сохранением при этом его способности связывания с целевым антигеном gal-III.
Как правило, продуцирование молекул антител различными способами хорошо известно. В патенте США 6331415 (Cabilly et al.), например, описан способ рекомбинантного продуцирования антител, где тяжелая и легкая цепи экспрессируются одновременно из одного вектора или из двух отдельных векторов в одной клетке. Wibbenmeyer et al., (1999, Biochim Biophys Acta 1430 (2): 191 -202) и Lee and K wak (2003, J. Biotechnology 101: 189-198) описывают получение моноклональных антител из отдельно продуцируемых тяжелых и легких цепей, с использованием плазмид, экспрессируемых в отдельных культурах клеток-хозяев. Различные другие методы, относящиеся к выработке антител, представлены, например, в Harlow, et al., ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988).
При желании антитело по изобретению, например, любое из антител фиг. 1 или фиг. 2, может быть секвенировано, и полинуклеотидная последовательность затем может быть клонирована в вектор для экспрессии или размножения. Последовательность, кодирующая антитело, может поддерживаться в векторе в клетке-хозяине, и затем клетка-хозяин может быть размножена и заморожена для будущего использования. Получение рекомбинантных моноклональных антител в клеточной культуре может быть осуществлено путем клонирования генов антител из В-клеток с помощью способов, известных в данной области.
В другом аспекте изобретение относится к выделенной нуклеиновой кислоте, содержащей последовательность, которая кодирует получение рекомбинантного антитела по настоящему изобретению.
Нуклеиновая кислота, кодирующая антитело, может иметь любые подходящие характеристики и иметь любые подходящие признаки или их комбинации. Так, например, кодирующая антитело нуклеиновая кислота может быть в форме ДНК, РНК или их гибрида и может включать не встречающиеся в природе основания, модифицированную основную цепь, например, фосфоротиоатную цепь, которая способствует стабильности нуклеиновой кислоты, или и то, и другое. Нуклеиновая кислота преимущественно может быть включена в экспрессирующую кассету, вектор или плазмиду по изобретению, содержащую признаки, которые способствуют искомой экспрессии, репликации и/или отбору в целевой клетке (клетках)-хозяине. Примеры таких признаков включают компонент начала репликации, компонент селективного гена, промоторный компонент, компонент энхансерного элемента, компонент последовательности полиаденилирования, компонент терминации и тому подобное, многочисленные подходящие примеры которых известны.
В настоящем описании далее представлены конструкции рекомбинантной ДНК, содержащие одну или несколько нуклеотидных последовательностей, описанных в данном документе. Эти рекомбинантные конструкции используются в связи с вектором, таким как плазмида, фагемида, фаг или вирусный вектор, в который вводится молекула ДНК, кодирующая любое раскрытое антитело.
Моноклональные антитела получают с помощью любого способа, который позволяет продуцировать молекулы антител клеточными линиями в культуре, например, культивированием рекомбинантных эукариотических (из млекопитающих или насекомых) или прокариотических (бактериальных) клеток-хозяев. Примеры подходящих способов получения моноклональных антител включают гибридомные способы Kohler et al. (1975, Nature 256: 495-497) и способ с гибридомами В-клеток человека (Kozbor, 1984, J. Immunol. 133:3001; and Brodeur et al., 1987, Monoclonal Antibody Production Techniques and Applications, (Marcel Dekker, Inc., New York), pp. 51-63).
Антитела по настоящему изобретению могут быть идентифицированы или получены с использованием гибридомного способа. В таком способе мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируется для того, чтобы стимулировать лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с белком, используемым для иммунизации. В ином случае, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с использованием подходящего агента для слияния, такого как полиэтиленгликоль, с образованием клетки гибридомы.
Культуральную среду, в которой растут клетки гибридомы, анализируют на предмет выработки моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяется иммунопреципитацией или анализом связывания in vitro, таким как радиоиммунологический анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
mAb затем могут быть очищены из надосадочных жидкостей гибридомы для дальнейшего тестирования их специфического связывания с антигеном gal-III и, возможно, для тестирования их дифференциальной аффинности связывания с преимущественным связыванием антигена gal-III относительно антигена gal-I и конструирования антител, например, для различных диагностических или терапевтических целей.
Gal-III-специфические антитела, в некоторых случаях, выявляют скринингом против одиночного антигена gal-III. Чтобы увеличить вероятность выделения дифференциально связывающихся клонов, можно применять множественные селективные давления путем последовательного скрининга с различными антигенами. Специальные стратегии отбора mAb используют чередующиеся компоненты gal-III и gal-I или другие антигены K. pneumoniae.
Способы скрининга для идентификации антител с искомыми свойствами селективного связывания могут быть выполнены с помощью технологий экспозиции с использованием библиотеки, экспонирующей последовательности антител или их антигенсвязывающие последовательности (например, с использованием фаговых, бактериальных, дрожжевых клеток или клеток млекопитающих клеток или систем экспонирования in vitro, транслирующих информацию о нуклеиновой кислоте в соответствующие (поли)пептиды). Реакционная способность может быть оценена на основе ELISA, вестерн-блоттинга или поверхностного окрашивания с проточной цитометрией, например, с использованием стандартных анализов.
Выделенный антиген(ы) можно, например, использовать для отбора антител из библиотеки антител, например, библиотеки антител, экспонированных дрожжами.
Например, изобретение конкретно предусматривает антитела, специфичные к gal-III, которые получают путем идентификации антител со специфичностью связывания с антигеном gal-III, например, с помощью конкретной исследовательской схемы отбора. Соответственно, для реактивности с мишенью может быть выбрана библиотека антител, включающая антитела, демонстрирующие реакционную способность по отношению к мишени gal-III.
Кроме того, изобретение предлагает фармацевтические композиции, которые содержат антитело, в соответствии с описанием в данном документе, и фармацевтически приемлемый носитель или эксципиент. Эти фармацевтические композиции можно вводить в соответствии с настоящим изобретением в виде болюсной инъекции или инфузии или путем непрерывной инфузии. Фармацевтические носители, подходящие для облегчения таких способов введения, хорошо известны в данной области.
Фармацевтически приемлемые носители обычно включают любые и все подходящие растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и агенты задержки абсорбции и т.п., которые физиологически совместимы с антителом или родственной композицией или комбинацией, обеспечиваемой изобретением. Другие примеры фармацевтически приемлемых носителей включают стерильную воду, физиологический раствор, забуференный фосфатом физиологический раствор, декстрозу, глицерин, этанол и тому подобное, а также их комбинации.
В одном таком аспекте антитело может быть объединено с одним или несколькими носителями, подходящими для искомого способа введения, антитела могут быть, например, смешаны с любым из числа лактозы, сахарозы, крахмала, сложных эфиров целлюлозы и алкановых кислот, стеариновой кислоты, талька, стеарата магния, оксида магния, натриевых и кальциевых солей фосфорной и серной кислот, аравийской камеди, желатина, альгината натрия, поливинилпирролидина, поливинилового спирта и, необязательно, дополнительно таблетированы или инкапсулированы для обычного введения. В ином случае, антитело может быть растворено в физиологическом растворе, воде, полиэтиленгликоле, пропиленгликоле, коллоидных растворах карбоксиметилцеллюлозы, этаноле, кукурузном масле, арахисовом масле, хлопковом масле, кунжутном масле, трагакантовой камеди, и/или различных буферах. Другие носители, адъюванты и способы введения хорошо известны в фармацевтической области. Носитель может включать материал с контролируемым высвобождением или материал с временной задержкой, такой как глицерилмоностеарат или глицерилдистеарат в отдельности или с воском, или другие материалы, хорошо известные в данной области.
Дополнительные фармацевтически приемлемые носители известны в данной области и описаны, например, в REMINGTON'S PHARMACEUTICAL SCIENCES. Жидкие составы могут быть растворами, эмульсиями или суспензиями и могут включать эксципиенты, такие как суспендирующие агенты, солюбилизаторы, поверхностно-активные вещества, консерванты и хелатирующие агенты.
Рассматриваются фармацевтические композиции, в которые включены антитело по настоящему изобретению и один или несколько терапевтически активных агентов. Стабильные композиции антитела по настоящему изобретению готовят для хранения путем смешивания указанного иммуноглобулина с требуемой степенью чистоты с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами в форме лиофилизированных составов или водных растворов. Композиции, которые следует использовать для in vivo введения, являются, в частности, стерильными, предпочтительно в виде стерильного водного раствора. Это легко достигается путем фильтрации через стерильные фильтрующие мембраны или другими способами. Антитело и другие терапевтически активные агенты, описанные в данном документе, также могут быть составлены в виде иммунолипосом и/или захвачены в микрокапсулы.
Введение фармацевтической композиции, содержащей антитело по настоящему изобретению, может быть осуществлено различными способами, включая пероральное, подкожное, внутривенное, интраназальное, внутриматочное, трансдермальное, слизистое, местное, например, с помощью гелей, мазей, лосьонов, кремов и т.д., внутрибрюшинно, внутримышечно, внутрилегочно, например, с использованием технологии ингаляции или легочных систем доставки, вагинально, парентерально, ректально или внутриглазно.
Примерные составы, используемые для парентерального введения, включают составы, которые подходят для подкожной, внутримышечной или внутривенной инъекции, такие как, например, стерильный раствор, эмульсия или суспензия.
В одном воплощении антитело по настоящему изобретению является единственным терапевтически активным средством, вводимым объекту, например, в виде модифицирующей или предотвращающей заболевание монотерапии.
В другом воплощении антитело по настоящему изобретению объединяют с дополнительными антителами в коктейле, например, объединяют в смеси или наборе, для нацеливания на Klebsiella pneumoniae, в частности штаммы MDR, принадлежащие к линии ST258, так что коктейль содержит больше, чем один терапевтически активный агент, вводимый объекту, например, в виде модифицирующей или предотвращающей заболевание монотерапии.
Кроме того, антитело по настоящему изобретению можно вводить в комбинации с одним или несколькими другими терапевтическими или профилактическими средствами, включая, без ограничения указанным, стандартное лечение, например, антибиотики, стероидные и нестероидные ингибиторы воспаления и/или другие антительные терапии, например, с применением антибактериальных или противовоспалительных средств.
Комбинированная терапия в том числе использует стандартный режим, например, используемый для лечения инфекции Klebsiella pneumoniae, в частности клона MDR ST258. Такая терапия может включать антибиотики, например, тигециклин, колистин, полимиксин В и бета-лактамы в сочетании с не-бета-лактамными ингибиторами.
В комбинированной терапии антитело можно вводить в виде смеси или одновременно с одним или несколькими другими терапевтическими режимами, например, до, одновременно или после сопутствующей терапии.
Биологические свойства антитела или соответствующих фармацевтических препаратов по изобретению могут быть охарактеризованы ex vivo в экспериментах на клетках, тканях и целых организмах. Как известно в данной области, лекарственные средства часто тестируются in vivo на животных, включая, без ограничения указанным, мышей, крыс, кроликов, собак, кошек, свиней и обезьян для того, чтобы измерить эффективность лекарственного средства против заболевания или на модели заболевания, или для измерения фармакокинетики, фармакодинамики, токсичности и других свойств лекарственного средства. Животные могут упоминаться как модели болезней. Терапевтические средства часто тестируют на мышах, включая, без ограничения указанным, голых мышей, мышей SCID, мышей-ксенотрансплантатов и трансгенных мышей (включая нокин и нокаут). Проведение таких экспериментов может дать осмысленные данные для определения потенциала антитела, которое будет использоваться в качестве терапевтического или профилактического с соответствующим периодом полужизни, эффекторной функцией, (перекрестной) нейтрализующей активностью и/или иммунным ответом при активной или пассивной иммунотерапии. Любой организм, предпочтительно млекопитающие, может быть использован для тестирования. Например, из-за их генетического сходства с людьми приматы, обезьяны могут быть подходящими терапевтическими моделями и, таким образом, могут быть использованы для проверки эффективности, токсичности, фармакокинетики, фармакодинамики, периода полужизни или другого свойства или композиции. Тесты на людях в конечном счете необходимы для утверждения в качестве лекарственных средств, и, следовательно, такие эксперименты предполагаются. Таким образом, антитело и соответствующие фармацевтические композиции по настоящему изобретению могут быть испытаны на людях для определения их терапевтической или профилактической эффективности, токсичности, иммуногенности, фармакокинетики и/или других клинических свойств.
Объект изобретения следующих определений считаются воплощениями настоящего изобретения:
1. Выделенное антитело, которое специфически распознает эпитоп галактана-III структуры O-антигена липополисахарида (LPS) Klebsiella pneumoniae, где эпитоп включен в повторяющиеся единицы галактана-III, где повторяющаяся единица галактана-III представляет собой разветвленный гомополимер галактозы формулы (I)
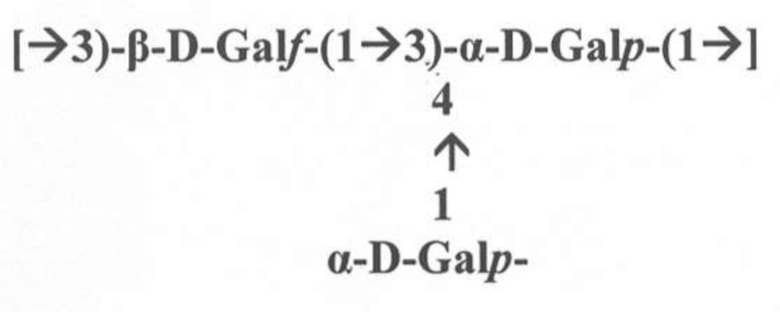 Формула (I).
Формула (I).
2. Антитело по определению 1, которое предпочтительно связывается с эпитопом галактана-III относительно эпитопа галактана-I или которое не реагирует перекрестно с эпитопом галактана-I, где эпитоп галактана-I включен в повторяющиеся единицы галактана-I из структуры LPS O2a-антигена Klebsiella pneumoniae и где повторяющаяся единица галактана-I представляет собой линейный гомополимер галактозы Формулы (II)
[→3)-β-D-Galf-(1→3)-α-D-Galp-(1→]
Формула (II).
3. Антитело по определению 1 или 2, где эпитоп галактана-III содержится в мультирезистентных (MDR) Klebsiella pneumoniae, в частности в клоне MDR ST258.
4. Антитело по любому из определений 1-3, которое имеет аффинность связывания эпитопа галактана-III с Kd менее 10-7 М, предпочтительно менее 10-8 М, еще более предпочтительно менее 10-9 М.
5. Антитело по любому из определений 1-4, которое нейтрализует эндотоксин штаммов Klebsiella pneumoniae, экспрессирующих эпитоп галактана-III.
6. Антитело по любому из определений от 1 до 5, которое нейтрализует эндотоксин штаммов Klebsiella pneumoniae, экспрессирующих эпитоп галактана-III, где сила нейтрализации представляет собой, по меньшей мере, эффективность эталонного антитела, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 10; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 11; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 12; и
d) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
е) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
f) CDR6, состоящую из аминокислотной последовательности SEQ ID 18,
cогласно номенклатуре Кабат.
7. Антитело по определению 5 или 6, где штамм характеризуется локусом rfb gal-I, включающим гены gtr.
8. Антитело по любому из определений 5-7, которое распознает клон ST258 Klebsiella pneumoniae.
9. Антитело по любому из определений 1-8, которое представляет собой полноразмерное моноклональное антитело, его фрагмент, содержащий, по меньшей мере, один домен антитела, включающий участок связывания, или слитый белок, содержащий, по меньшей мере, один домен антитела, включающий участок связывания, в частности, где антитело представляет собой неприродное антитело, которое содержит рандомизированную или искусственную аминокислотную последовательность.
10. Антитело по любому из определений 1-9, которое имеет человеческое, гуманизированное, химерное или мышиное происхождение.
11. Антитело по любому из определений 1-10, которое является моноклональным антителом.
12. Антитело по любому из определений 1-11, которое содержит, по меньшей мере, вариабельный участок тяжелой цепи антитела (VH), который характеризуется любой из последовательностей CDR1-CDR3, перечисленных в таблице 1, которые обозначены в соответствии с системой нумерации Kabat, или функционально активные варианты CDR.
13. Антитело по определению 12, которое
A)
выбирают из группы, состоящей из представителей группы i) - iv), где
i)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 1; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 2; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 3;
ii)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 4; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 5; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 6;
iii)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 7; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 8; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 9;
iv)
представляет собой антитело, которое включает
а) CDR1, состоящую из аминокислотной последовательности SEQ ID 10; и
b) CDR2, состоящую из аминокислотной последовательности SEQ ID 11; и
с) CDR3, состоящую из аминокислотной последовательности SEQ ID 12;
или
B) антитело, которое является функционально активным вариантом исходного антитела, которое представляет собой любое из представителей группы A, которое содержит, по меньшей мере, один функционально активный CDR-вариант любого из CDR1, CDR2 или CDR3 исходного антитела.
14. Антитело по определению 12 или 13, включающее аминокислотную последовательность VH, выбранную из любой из последовательностей VH, показанных на фиг. 2.
15. Антитело по любому из определений 12-14, которое дополнительно включает вариабельный участок легкой цепи антитела (VL), который содержит любую из последовательностей CDR4-CDR6, перечисленных в таблице 1, которые обозначены в соответствии с системой нумерации Кабат, или их функционально активные варианты CDR.
16. Антитело по определению 15, которое
A)
выбирают из группы, состоящей из представителей группы i) - iv), где
i)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 13; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 14; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 15;
ii)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 16; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
iii)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 20; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
iv)
представляет собой антитело, которое включает
а) CDR4, состоящую из аминокислотной последовательности SEQ ID 19; и
b) CDR5, состоящую из аминокислотной последовательности SEQ ID 17; и
с) CDR6, состоящую из аминокислотной последовательности SEQ ID 18;
или
B) антитело, которое является функционально активным вариантом исходного антитела, которое представляет собой любое из представителей группы A, которое включает по меньшей мере один функционально активный CDR-вариант любого из CDR4, CDR5 или CDR6 исходного антитела.
17. Антитело по определению 16, включающее аминокислотную последовательность VL, выбранную из любой из последовательностей VL, показанных на фиг. 2.
18. Антитело по любому из определений 12-17, которое включает
а) последовательности CDR1-CDR6 любого из антител, перечисленных в таблице 1; или
b) последовательности VH и VL любого из антител, показанных на фиг. 2; или
с) которое является функционально активным вариантом исходного антитела, которое характеризуется последовательностями а) - с),
предпочтительно, где
- функционально активный вариант включает, по меньшей мере, один функционально активный CDR-вариант любого из CDR1-CDR6 исходного антитела; и/или
- функционально активный вариант включает, по меньшей мере, одну точечную мутацию в каркасной области любой из последовательностей VH и VL;
и где дополнительно
- функционально активный вариант имеет специфичность связывания того же эпитопа, что и исходное антитело; и/или
- функционально активным вариантом является человеческий, гуманизированный, химерный или мышиный вариант и/или вариант с созревшей аффинностью исходного антитела.
19. Антитело по любому из определений 1-18, содержащее функционально активный CDR-вариант любой из последовательностей CDR, перечисленных в таблице 1, где функционально активный CDR-вариант включает, по меньшей мере, одно из
а) 1, 2 или 3 точечные мутации в исходной последовательности CDR; и/или
b) 1 или 2 точечные мутации в любом из четырех C-концевых или четырех N-концевых или четырех центральных аминокислотных положений исходной последовательности CDR; и/или
с) идентичен, по меньшей мере, на 60% исходной последовательности CDR;
предпочтительно, где функционально активный CDR-вариант включает 1 или 2 точечные мутации в любой последовательности CDR, состоящей из менее 4 или 5 аминокислот.
20. Антитело по любому из определений 1-19 для применения при лечении объекта, подверженного риску заражения или колонизации Klebsiella pneumoniae или страдающего от неё, включающему введение объекту эффективного количества антитела для ограничения инфекции у объекта или для облегчения заболевания указанной инфекцией, предпочтительно для лечения или профилактики любой первичной и вторичной бактериемии, пневмонии, инфекции мочевых путей, абсцесса печени, перитонита или менингита.
21. Фармацевтический состав, содержащий антитело по любому из определений 1-19, предпочтительно содержащее парентеральную или слизистую формулу, необязательно содержащую фармацевтически приемлемый носитель или эксципиент.
22. Применение антитела любого из определений 1-19 для диагностики инфекции или колонизации Klebsiella pneumoniae или связанного с ней заболевания, такого как первичная и вторичная бактериемия, пневмония, инфекция мочевых путей, абсцесс печени, перитонит или менингит у объекта.
23. Применение по определению 22, где объект представляет собой пациента с ослабленным иммунитетом или пациента с подавленным иммунитетом или его контакт.
24. Диагностический состав антитела любого из определений 1-19, содержащий антитело и дополнительный диагностический реагент в композиции или наборе, включающий компоненты
а) антитело; и
b) дополнительный диагностический реагент;
с) и необязательно твердую фазу для иммобилизации, по меньшей мере, одного из числа антитела и диагностического реагента.
25. Диагностический состав определения 24, где дополнительный диагностический реагент представляет собой диагностическую метку или реагент, специфически реагирующий с антителом и/или продукт реакции связывания антитела с его антигеном.
26. Способ диагностики инфекции или колонизации Klebsiella pneumoniae у объекта, вызванного штаммом Klebsiella pneumoniae, включающий
а) обеспечение антитела по любому из определений 1-19, и
b) детекцию специфической иммунореакции антитела с эпитопом галактана-III в биологическом образце испытуемого, посредством чего диагностируется инфекция или колонизация Klebsiella pneumoniae.
27. Способ по определению 26, где биологические образцы представляют собой образец жидкости организма или ткани, предпочтительно образец, выбранный из группы, состоящей из образца крови, образца стула, образца кожи, образца мочи, спинномозговой жидкости и образца из дыхательных путей, такого как эндотрахеальные аспираты, плевральная жидкость, легочный пунктат, назальный тампон или мокрота или изолят Klebsiella pneumoniae, происходящий из любого из вышеперечисленных источников.
28. Выделенная нуклеиновая кислота, кодирующая антитело по любому из определений 1-19.
29. Экспрессирующая кассета или плазмида, содержащая кодирующую последовательность для экспрессии белковой конструкции или белка, которая содержит VH и/или VL антитела любого из определений 1-19.
30. Клетка-хозяин, содержащая экспрессирующую кассету или плазмиду по определению 29.
31. Способ получения антитела по любому из определений с 1 по 19, где клетка-хозяин определения 30 культивируется или поддерживается в условиях для получения указанного антитела.
32. Способ идентификации антитела-кандидата, включающий:
а) обеспечение образца, содержащего антитело или антителообразующую клетку; и
b) оценку связывания антитела в образце или продуцируемого образцом с эпитопом галактана-III, как определено в определении 1, где положительная реакция между антителом и эпитопом идентифицирует антитело в качестве кандидата-антитела.
33. Способ идентификации антитела-кандидата, включающий:
а) обеспечение образца, содержащего антитело или антителообразующую клетку; и
b) оценку связывания антитела в образце или продуцируемого образцом с эпитопом галактана-III, как определено в определении 1, где специфическая положительная реакция между антителом и эпитопом галактана-III относительно эпитопа галактана-I идентифицирует антитело в качестве антитела-кандидата.
34. Способ получения антитела по любому из определений 1-19, включающий
а) обеспечение антитела-кандидата, идентифицированного согласно определению 32 или 33; и
b) получение моноклонального антитела или гуманизированной или человеческой формы антитела-кандидата или его производного с той же специфичностью связывания эпитопа, что и антитело-кандидат.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, но не ограничивается ими.
Примеры
Пример 1. Идентификация генетического фона новой галактановой структуры:
Со времени исходного описания (3) галактан-I-специфического rfb (также известного как wb) кластера стали доступными несколько полных последовательностей генома. Поскольку rfb кластер всегда интегрируется между двумя консервативными генами (uge и hisI), точный размер локусов rfb может быть определен. In silico анализ выявил две альтернативные длины оперона rfb (фиг. 4A). Детальный анализ этих последовательностей (фиг. 4B) показал, что в кластере rfb имеются дополнительные гены, не идентифицированные Clarke et al (3).
Даже более короткий полноразмерный оперон rfb длиннее на ок. 2 тыс. п.о., чем описано Clarke et al. и содержит дополнительный ген, аннотированный как гипотетический белок семейства гликозилтрансфераз. Этот ген демонстрирует плохую гомологию между длинными и короткими оперонами rfb. Учитывая, что клонированный кластер, лишенный этого гена, восстанавливает синтез галактана-I (5), этот ген, по-видимому, не применим для экспрессии галактана-I.
В более длинной форме локуса rfb имеется дополнительная область 3 тыс. п.о., содержащая 3 гена, организованных в один оперон на противоположной нити ДНК. Эти гены демонстрируют высокое сходство по последовательности с семейством гликозилтрансферазы, которое часто переносится мобильными генетическими элементами у различных членов Enterobacteriaceae. Считается, что этот вид горизонтально приобретенных гликозилтрансфераз играет роль в конверсии серотипов (6) или увеличивает фенотипическое разнообразие внутри и между штаммами. Интересно отметить, что в случае Klebsiella oxytoca идентичный кластер gtr был обнаружен на хромосомном участке, не связанном с кластером rfb (неопубликованная находка). Таким образом, возможно, что определенные штаммы K. pneumoniae получили этот кластер путем горизонтального переноса из K. oxytoca.
Структура субъединиц O-антигена, очищенных из O2-штамма, несущего более длинный локус rfb (т.е. включение генов gtr), показала разветвляющуюся тригалактозную повторяющуюся единицу (фиг. 5), которая отличается от структуры галактана-I. Ранее эта структура была идентифицирована Kelly et al. (5) как подсеротип O2, обозначенный как O2 (2a, 2f, 2g). Структурный анализ штамма O2, несущего короткий оперон на хромосоме, транс-дополненной либо пустым вектором, либо генами gtr, клонированными в векторе, доказал, что добавление разветвленной галактозы в 1-4-связи кодируется генами gtr (см. Пример 3, ниже).
В отличие от того, что было опубликовано ранее (5), биохимический анализ показал, что эта модификация повторяющихся единиц галактана-I не является полностью стехиометрической, хотя подавляющее большинство единиц представляют собой галактан-III. Стехиометрия модификации, тем не менее, может быть зависимой от штамма, а также находиться под влиянием экспрессионной регуляции и, следовательно, нуждается в дальнейшем исследовании.
Пример 2. Эпидемиология галактана-III
Для того чтобы обнаружить gtr-подобные гены в rfb кластере в клинических изолятах К. pneumoniae, разработали отжиг праймеров с консервативными генами wbbO и hisI (см. фиг. 4В) (таблица 2, ниже).
Таблица 2: Праймеры, используемые для обнаружения gtr + и gtr- штаммов
O1, O2 и O2ac прототипные штаммы K. pneumoniae были протестированы на наличие gtr- подобных генов с описанными выше праймерами. Геномную ДНК очищали из штаммов с помощью набора Wizard® Genomic DNA purification kit (Promega) в соответствии с инструкцией производителя. Реакцию ПЦР проводили с помощью смеси для ПЦР Phusion® High-Fidelity PCR Master Mix (Thermo) в 20 мкл смеси с 20 ммоль прямого и обратного праймеров и 0,2 мкл очищенной гДНК. ПЦР проводили в термоциклире TProfessional TRIO Thermocycler (Biometra) со следующей программой:
Реакционную смесь загружали на 1% агарозный гель, визуализировали с помощью GelRed™ (Biotium), и получали изображение с помощью ImageQuant ™ LAS 4000 (GE Healthcare) (фиг. 6).
ПЦР подтвердила, что gtr + и gtr- изоляты могут быть обнаружены как среди штаммов O1, так и O2. Чтобы выявить частоту gtr + и gtr- изолятов среди клинических изолятов, отобранные клинические изоляты 45 клинических изолятов O1 и 47 клинических изолятов O2 были отобраны из разных географических мест. Среди изолятов O1 выделили 27 (60%) gtr - и 18 (40%) gtr + изолятов, среди штаммов O2 идентифицировали 15 (32%) gtr - и 32 (68%) gtr+.
Интересно, что было обнаружено, что большинство штаммов, относящихся к KPC (карбапенемаза Klebsiella pneumoniae)-продуцирующему эндемическому мультирезистентному клону ST258, несут оперон, кодирующий галактан-III (то есть длинный rfb gal-I локус, включающий гены gtr). 27 изолятов ST258 анализировали с помощью ПЦР и дополнительно 224 геномных последовательности, доступных в базах данных, анализировали in silico. В общей сложности 210 (83,6%) этих штаммов несли интактный оперон rfb, включающий гены gtr (т.е. ожидаемо экспрессирующих антиген галактан-III). Однако, не ожидается, что геномы многих оставшихся штаммов, содержащих, по меньшей мере, части генов gtr, будут экспрессировать интактный галактан-III из-за делеций или вставок транспозонов.
Поскольку недавно был описан генетический фон синтеза галактана-II (4), штаммы O1 и 2 можно было отличить только путем анализа геномных последовательностей. Однако ни один из изолятов ST258 не нес эти специфические детерминанты O1. Более того, ни один из доступных изолятов ST258 не реагировал на галактан-II-специфичные mAb, подтверждая, что эти изоляты не относятся к группе серогруппы O2.
Эти данные свидетельствуют о том, что клональная линия ST258 сильно связана с экспрессией галактан-III O-антигенов и, по-видимому, в большинстве штаммов ST258 галактан-III является единственным детерминантой O-боковой цепи (т.е. антигены галактана-III не кэпированы галактаном-II). Это делает галактан-III привлекательной мишенью для антител для диагностики и/или терапевтических средств на иммунной основе.
Пример 3. Получение моноклональных антител, специфичных к галактану-III
Мышиные моноклональные mAb получали стандартным методом гибридом с использованием мышей, иммунизированных штаммом gtr + O2 (т.е. gal-III). Было выбрано четыре mAb, которые проявляли специфичность к антигенам галактана-III. Чтобы исследовать, влияет ли связывание этих mAb на gtr- опосредованное оснащение молекул галактана-I, с помощью иммуноблотов исследовалась панель молекул LPS, очищенных из штаммов gtr-, а также gtr + O1 и O2. Антитела разводили до концентрации 1 мкг/мл, вторичное антитело против мышиных IgG разводили 1: 20000.
Все 4 mAb показали идентичный паттерн связывания. Полученные результаты с одним представительным mAb (9H9-H7), показаны на фиг. 7. За исключением одного штамма (Kp67, дорожка 8) все O-антигены, полученные из gtr+ штаммов, сильно окрашивались, в то время как ни одна из молекул gtr- LPS не была распознана этим mAb (как и другими тремя). Хотя штамм Kp67 был признан ПЦР положительным по gtr-локусу, он, по-видимому, является фенотипически отрицательным по предполагаемой gtr-опосредованной модификации. Причина противоречия, скорее всего, происходит из мутаций внутри оперона rfb, что подтверждалось шероховатым фенотипом LPS (т.е. отсутствием каких-либо детектируемых O-антигенов) на окрашенных серебром гелях (данные не показаны).
Для того чтобы дополнительно подтвердить специфичность этих моноклональных антител, иммунная реактивность была исследована на панели изогенных производных (фиг. 8). Как и следовало ожидать, отсутствие связывания наблюдалось с LPS, экстрагированным из O2 gtr- штамма (фиг. 8 дорожка 2). После комплементации плазмидой, несущей гены gtr, было обнаружено сильное связывание (фиг. 8 дорожки 5 и 6).
Пример 4. Измерение биослойной интерферометрии (BLI)
Характеристики связывания антитела исследовали с помощью бислойной интерферометрии (BLI). Связывание антитела измеряли путем иммобилизации биотинилированного D-галактан III полисахаридного антигена (очищенного из O2 gtr + K. pneumoniae) на датчиках стрептавидина (ForteBio, Pall Life Sciences) и путем отслеживания ассоциации химерных mAb (10 мкг/мл) с предварительно нагруженными датчиками в течение 10 минут в DPBS, содержащем 1% бычьего сывороточного альбумина (BSA) и 0,05% Tween-20 с последующей диссоциацией (1 час) в том же буфере. Значения Kd, kon и koff определялись с использованием программного обеспечения Data Analysis 7 (ForteBio, Pall Life Sciences). Значения откликов ниже 0,05 нм считались отрицательными.
Значения Kd, kon и koff приведены в таблице 3. Все моноклональные антитела показали сильное авидное связывание с очищенным антигеном (KD-0,1 нМ-10 нМ), с аналогичными значениями kon (только 3-кратное различие между самым низким и самым высоким значением kon). Напротив, значения koff для mAb 5A4 и 9H9 на ~ 2 порядка ниже, чем у 2D8 и 8E3. Отсутствие связывания с антигеном в случае отрицательного контроля наблюдалось с любым из mAb.
Таблица 3. K d, Kon и Koff значения химерных D-галактан III-специфических mAb
Пример 5: Окрашивание поверхности живых клеток Klebsiella
Связывание поверхности одного представителя mAb (9H9-H7) тестировали с помощью проточной цитометрии на нескольких клинических изолятах Klebsiella с различными O-типами (таблица 4).
Выдержанные в течение ночи бактерии разводили и выращивали до средней логарифмической фазы (OD600 = 0,5), промывали в PBS и использовали для поверхностного окрашивания. 2x106 бактерий повторно суспендировали в PBS, содержащем 0,5% BSA + 0,0,1% азида натрия, и окрашивали mAb 9H9-H7 в концентрации 40 мкг/мл в течение 30 минут на льду. Образцы дважды промывали в PBS-буфере, содержащем BSA и азид натрия, повторно суспендировали в PBS, содержащем 4 мкг/мл конъюгированных с AlexaFluor 488 козьих вторичных антител против мышиных IgG и инкубировали в течение 30 минут на льду. После промывания образцы повторно суспендировали в PBS, содержащем 5 нМ краситель SYTO-62, и инкубировали в течение 10 минут на льду перед анализом на проточном цитометре i-Cyt Eclipse.
Результаты проточной цитометрии (таблица 4) подтверждают, что исследованные mAb обладают специфичностью по отношению к галактану-III (т.е. gtr- положительным штаммам) на основании результатов, полученных с использованием клинических gtr + и gtr- штаммов.
Таблица 4. Поверхностное окрашивание галактан-III специфическими mAb штаммов O1 и O2 с различным gtr- статусом. Значения представляют интенсивность флуоресценции (FL-1)/1000
Кроме того, связывание с коллекцией штаммов ST258 также определяли с помощью проточной цитометрии, как описано выше (таблица 5). 8/11 исследуемых штаммов сильно окрашивались всеми четырьмя mAb, один штамм окрашивался грубо, а два оставшихся штамма показали нетипируемую структуру LPS (данные не показаны). Ни один из этих штаммов не реагировал на галактан-II-специфическое mAb (см. выше).
Таблица 5. Поверхностное окрашивание галактан-III-специфическими mAb изолятов ST258. Значения представляют собой интенсивность флуоресценции (FL-1).
Пример 6. Сравнение функциональной эффективности различных галактан-III-специфичных mAb.
Получали химерные mAb, в которых мышиные вариабельные области (VH и VL, для тяжелых и легких цепей, соответственно) были генетически слиты с константными областями человеческих IgG1 и каппа. После тестирования в различных функциональных анализах in vitro и in vivo (см. ниже) лучшие химерные mAb были подвергнуты гуманизации. Гуманизация была достигнута путем прививки последовательностей CDR как тяжелых, так и легких цепей из каркасных областей мыши в соответствующие (спрогнозированные in silico) человеческие каркасы. Следовательно, в этих гуманизированных mAb единственные мышиные последовательности представляют собой области CDR, остальная часть mAb содержит последовательности человека.
Кроме того, гуманизированные легкие цепи спаривались с различными гуманизированными тяжелыми цепями (шаффлинг легкой цепи, см. фиг. 9). Интересно, что mAb, состоящие из гуманизированных легких цепей, полученных из 5A4, по-видимому, демонстрируют значительно более высокую эффективность, что указывает на то, что специфические CDR-области легкой цепи могут способствовать повышению эффективности некоторых mAb. Связывание гуманизированных mAb было подтверждено окрашиванием поверхности специфических бактерий, оцененное с помощью проточной цитометрии (фиг. 9).
Пример 7. Защитная эффективность gal-III-специфических mAb in vivo
Группы из 5 мышей пассивно иммунизировали внутрибрюшинно химерными (фиг. 10А) или гуманизированными (фиг. 10В) галактан-III-специфическими mAb или изотипическими нерелевантными mAb в качестве контроля. Спустя 24 ч мышей сенсибилизировали к эндотоксину путем внутрибрюшинного введения 20 мг GalN и одновременно вводили смертельную дозу штамма K. pneumoniae #79. Смертность контролировалась ежедневно.
Все протестированные химерные mAb показали значительную защиту при дозах до 1 мкг/мышь (фиг. 10А), соответствующих дозе ок. 50 мкг/кг. MAb 5A4 показал превосходную защитную эффективность, которая находится в хорошей корреляции с его более высокой аффинностью (Пример 4) и эффективностью нейтрализации LPS in vitro (Пример 8 ниже).
Наиболее эффективные гуманизированные mAb по потенциалу нейтрализации эндотоксина (см. ниже в примере 8) были испытаны в той же модели. Так как все гуманизированные mAb несли 5A4-производные CDR легкой цепи, то защитную эффективность сравнивали с химерным mAb 5A4. Как показано на фиг. 10B, была сохранена превосходная защитная эффективность большинства гуманизированных mAb. Учитывая, что эти гуманизированные mAb содержат различные CDR тяжелой цепи (но имеют общие CDR легкой цепи), можно сделать вывод, что области легкой цепи значимо способствуют сильной защитной эффективности.
Пример 8. Нейтрализация эндотоксина in vitro
Учитывая высокую сывороточную восприимчивость штаммов K. pneumoniae O2, мы предположили, что нейтрализация эндотоксина, а не бактерицидная активность может быть основным режимом действия защиты, описанной выше (Пример 7). Чтобы подтвердить это экспериментально, исследовали эффективность нейтрализации эндотоксина галактан-III-специфическими mAb in vitro.
Коммерческая репортерная клеточная линия (HEK-Blue™ TLR4, Invivogen) использовалась для обнаружения сигнала Толл-подобного рецептора 4 (TLR-4), инициированного очищенным LPS в соответствии с инструкциями производителя. Тридцать пять мкл mAb (разбавленного в среде HEK Blue™) смешивали с 25 мкл свежеразмороженного очищенного LPS. O2 gtr + LPS получали из штамма PCM-27 (O2 gtr +: K27 Польская коллекция микробов, Польша). Исходные растворы готовили с концентрацией 0,4 нг/мл в среде HEK Blue™. Смесь переносили в прозрачные 96-луночные планшеты с половинной зоной и инкубировали при комнатной температуре в течение 30 минут. Добавляли 50 мкл суспензии клеток HEK-Blue™ (~ 50 000 клеток/лунку). Планшеты обертывали алюминиевой фольгой и инкубировали в течение ночи (16-18 часов) при 37°С с 5% СО2. На следующий день оптическую плотность измеряли при 630 нм и рассчитывали уровень репортерного белка (секретированная эмбриональная щелочная фосфатаза - SEAP) по сравнению с контролем. Процент ингибирования индукции SEAP относительно контроля без антитела рассчитывали и наносили на диаграмму при различной концентрации mAb. 50% -ную ингибирующую концентрацию (IC50) рассчитывали с помощью GraphPad Prism 5.0 с использованием log (ингибитора) против ответа - нелинейного регрессионного анализа с вариабельным наклоном. В качестве положительного контроля использовали полимиксин B (PMB-сульфат, FLUKA Cat. # 81334), аналогично тестируемым mAb. В качестве отрицательного контроля включили нерелевантное mAb.
Потенциал нейтрализации гуманизированных mAb сравнивали с их родительскими (по отношению к тяжелой цепи, поскольку гуманизированные легкие цепи подвергались шаффлингу) химерными mAb при дозе 1 мкг/мл mAb (фиг. 11). При этой дозе химерное mAb 5A4 показало превосходную нейтрализующую способность к другим химерным mAb, что хорошо коррелирует с аффинностью, измеренной BLI (пример 4). Интересно, что некоторые гуманизированные производные каждой из линий тяжелой цепи показали сравнительно хорошую нейтрализацию к химерному 5А4, когда они были соединены с полученной из 5А4 гуманизированной легкой цепью. Это наблюдение, опять же, предполагает, что последовательности CDR легкой цепи 5A4 могут придать улучшенную эффективность нейтрализации и, следовательно, защиту in vivo, описанную выше (пример 7).
Для дальнейшего подтверждения этого открытия наилучшие гуманизированные mAb каждой линии, а также их родительские химерные mAb титровали в том же анализе нейтрализации in vitro. Как показано на фиг. 12. Все mAb, несущие CDR-цепи легкой цепи 5A4, демонстрировали эффективность нейтрализации, превосходящую эффективность полимиксина B (низкомолекулярный антибиотик с известными характеристиками связывания эндотоксинов), тогда как остальные mAb показали нейтрализацию только в более высоких дозах.
Список литературы
(1) Hansen DS, Mestre F, Alberti S, et al. Klebsiella pneumoniae lipopolysaccharide O typing: revision of prototype strains and O-group distribution among clinical isolates from different sources and countries. J Clin Microbiol 1999 Jan;37(1):56-62.
(2) Trautmann M, Ruhnke M, Rukavina T, et al. O-antigen seroepidemiology of Klebsiella clinical isolates and implications for immunoprophylaxis of Klebsiella infections. Clin Diagn Lab Immunol 1997 Sep;4(5):550-5.
(3) Clarke BR, Whitfield C. Molecular cloning of the rfb region of Klebsiella pneumoniae serotype O1:K20: the rfb gene cluster is responsible for synthesis of the D-galactan I O polysaccharide. J Bacteriol 1992 Jul;174(14):4614-21.
(4) Hsieh PF, Wu MC, Yang FL, et al. D-galactan II is an immunodominant antigen in O1 lipopolysaccharide and affects virulence in Klebsiella pneumoniae: implication in vaccine design. Front Microbiol 2014;5:608.
(5) R.F.Kelly, M.B.Perry, L.L.MacLean, C.Whitfield. Structures of the O-antigens of Klebsiella serotypes 02 (2a,2e), 02 (2a,2e,2h), and 02 (2a,2f,2g) members of a family of related D-galactan O-antigens in Klebsiella spp. Journal of Endotoxin Research 1995;2:131-40.
(6) Allison GE, Verma NK. Serotype-converting bacteriophages and O-antigen modification in Shigella flexneri. Trends Microbiol 2000 Jan;8(1):17-23
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ARSANIS Biosciences GmbH
<120> ANTIBODIES TARGETING A GALACTAN-BASED O-ANTIGEN OF K. PNEUMONIAE
<130> AR013P
<160> 40
<170> BiSSAP 1.3
<210> 1
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 1
Phe Thr Phe Ser Asn Tyr Trp Ile Asn
1 5
<210> 2
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 2
Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Val Glu Ser
1 5 10 15
Val Lys Gly
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 3
Thr Lys Glu Tyr Gly Gly Phe Ala Asn
1 5
<210> 4
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 4
Leu Ala Phe Ser Asn Tyr Trp Met Asn
1 5
<210> 5
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 5
Glu Ile Arg Leu Lys Ser Asn Ser Tyr Ser Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 6
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 6
Thr Pro Glu Phe Gly Gly Phe Pro Tyr
1 5
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 7
Phe Thr Phe Ser Asp Tyr Trp Met Asn
1 5
<210> 8
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 8
Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 9
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 9
Leu Pro Glu Phe Gly Gly Phe Phe Tyr
1 5
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 10
Phe Thr Phe Ser Asn Tyr Trp Met Asn
1 5
<210> 11
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 11
Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 12
Thr Pro Glu Phe Gly Gly Phe Phe Tyr
1 5
<210> 13
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 13
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Ser Asn Gln Lys Asn Cys Leu
1 5 10 15
Ala
<210> 14
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 14
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 15
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 15
His Gln Tyr Leu Ser Ser Tyr Thr
1 5
<210> 16
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 16
Arg Ser Ser Gln Ser Leu Val His Ser Asp Gly Ser Thr Tyr Leu His
1 5 10 15
<210> 17
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 17
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 18
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 19
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 19
Arg Ser Ser Gln Ser Leu Val His Ser Asp Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 20
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 20
Leu Val Ser Asn Arg Phe Ser
1 5
<210> 21
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 21
Glu Val Lys Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Val Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Lys Glu Tyr Gly Gly Phe Ala Asn Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 22
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 22
Asn Ile Met Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Cys Leu Ala Trp Tyr Gln Arg Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Ser Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys His Gln
85 90 95
Tyr Leu Ser Ser Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 23
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 23
Glu Val Lys Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Leu Ala Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Ser Tyr Ser Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Gly
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Pro Glu Phe Gly Gly Phe Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 24
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 24
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp His Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Ser Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 25
Glu Val Asn Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Arg Ser
65 70 75 80
Val Tyr Leu Arg Val Asn Asn Leu Arg Val Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Leu Pro Glu Phe Gly Gly Phe Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 26
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 26
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Arg Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 27
Glu Val Lys Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Pro Glu Phe Gly Gly Phe Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 28
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 28
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 29
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 29
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Leu Pro Glu Phe Gly Gly Phe Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 30
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 30
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 31
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 31
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Arg Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Leu Pro Glu Phe Gly Gly Phe Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 32
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 32
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 33
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Leu Ala Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Ser Tyr Ser Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Glu Phe Gly Gly Phe Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 34
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 34
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 35
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Leu Ala Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Ser Tyr Ser Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Glu Phe Gly Gly Phe Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 36
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 36
Asp Val Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ser
35 40 45
Pro Lys Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 37
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH Sequence
<400> 37
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Glu Phe Gly Gly Phe Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 38
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> VL Sequence
<400> 38
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 39
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer
<400> 39
tgttgtggag taaaggactg ggcg 24
<210> 40
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer
<400> 40
accgcttcga gctgaagaat gag 23
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2795485C2 |
| АНТИТЕЛО ПРОТИВ MUC1 | 2019 |
|
RU2792347C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РАКОВЫМИ КЛЕТКАМИ И ОБЕСПЕЧИВАЮТ НАПРАВЛЕННЫЙ ПЕРЕНОС РАДИОНУКЛИДОВ К УКАЗАННЫМ КЛЕТКАМ | 2020 |
|
RU2833191C2 |
| БИСПЕЦИФИЧНЫЕ МОЛЕКУЛЫ, ИММУНОРЕАКТИВНЫЕ С ИММУННЫМИ ЭФФЕКТОРНЫМИ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ АКТИВИРУЮЩИЙ РЕЦЕПТОР | 2014 |
|
RU2721707C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| Антитела против ингибитора пути тканевого фактора и их применения | 2016 |
|
RU2815681C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CCL2 | 2020 |
|
RU2819613C1 |
| АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ | 2015 |
|
RU2832918C2 |
| АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ | 2015 |
|
RU2722562C2 |
| АНТИТЕЛО К ЦИТОМЕГАЛОВИРУСУ ЧЕЛОВЕКА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2817217C1 |


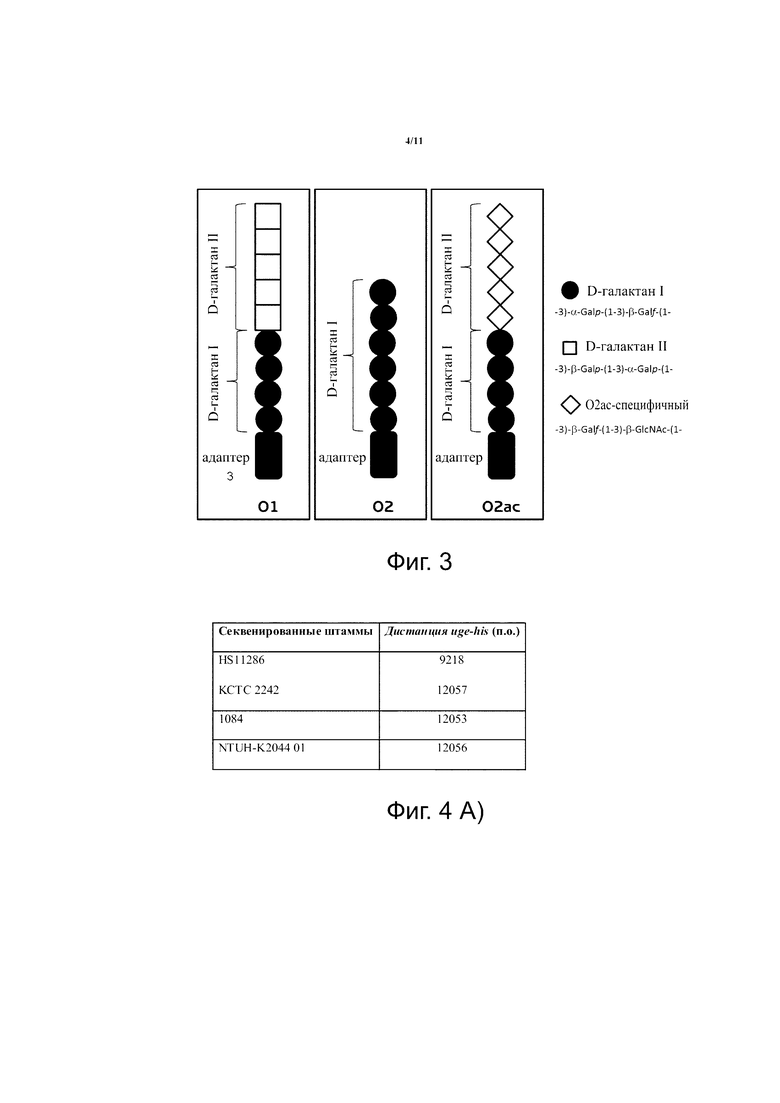
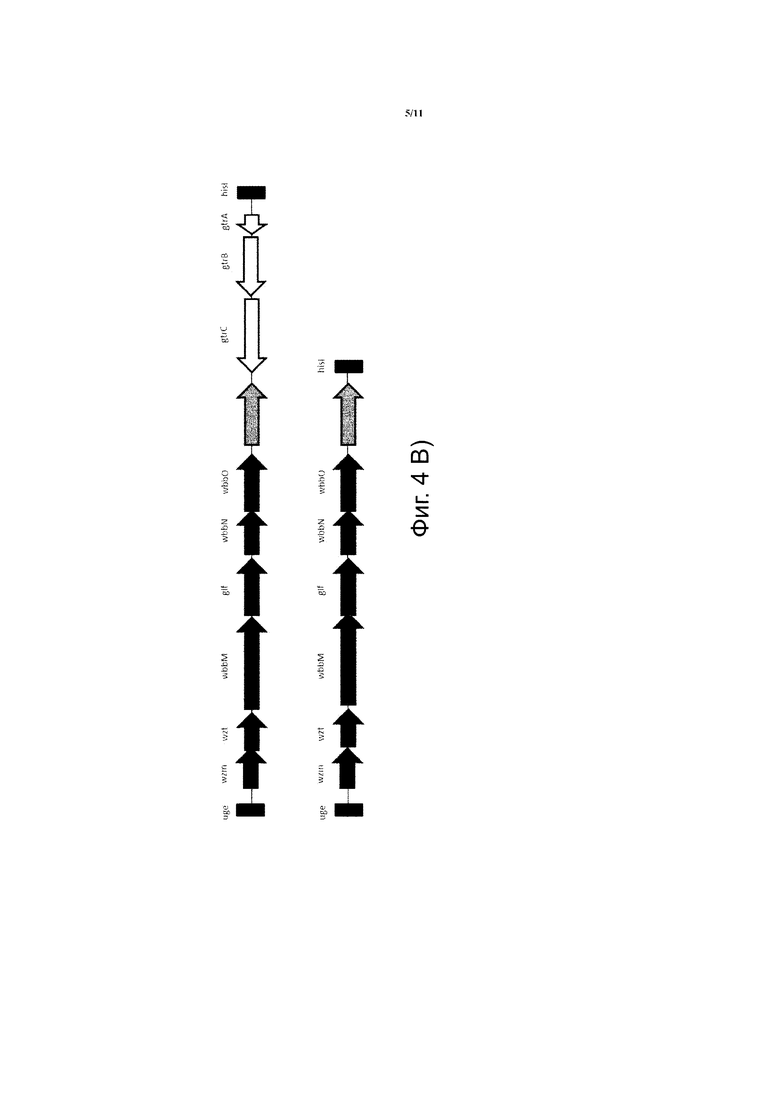
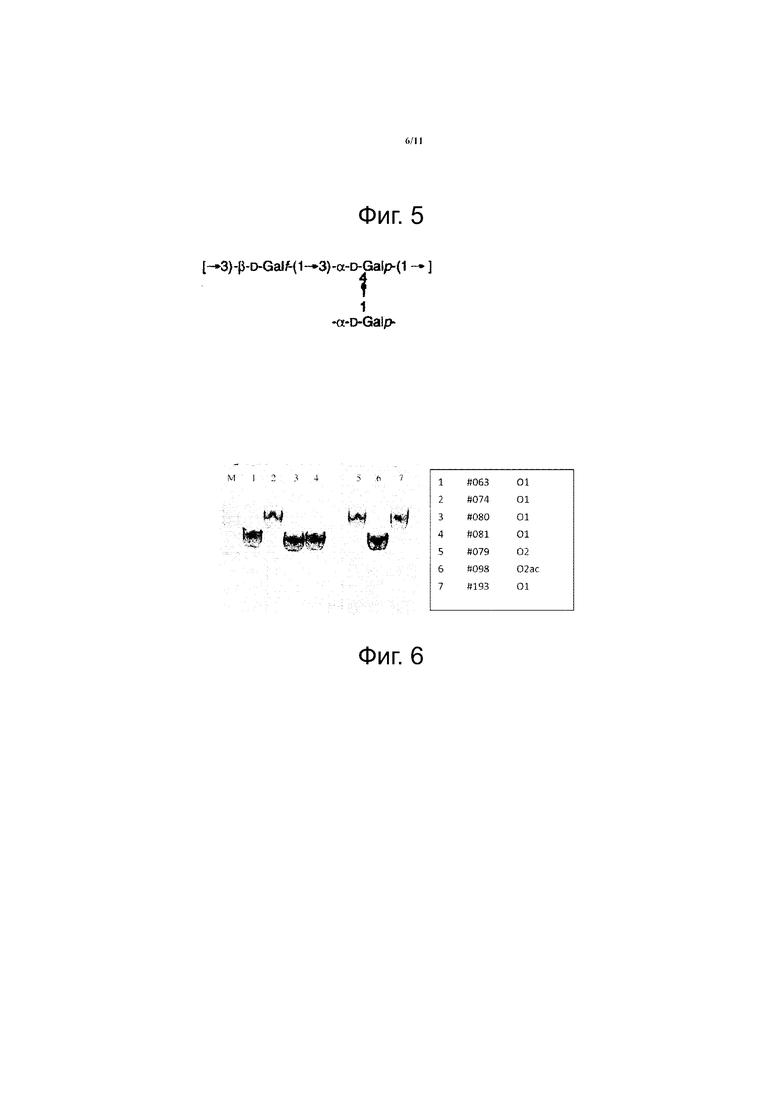
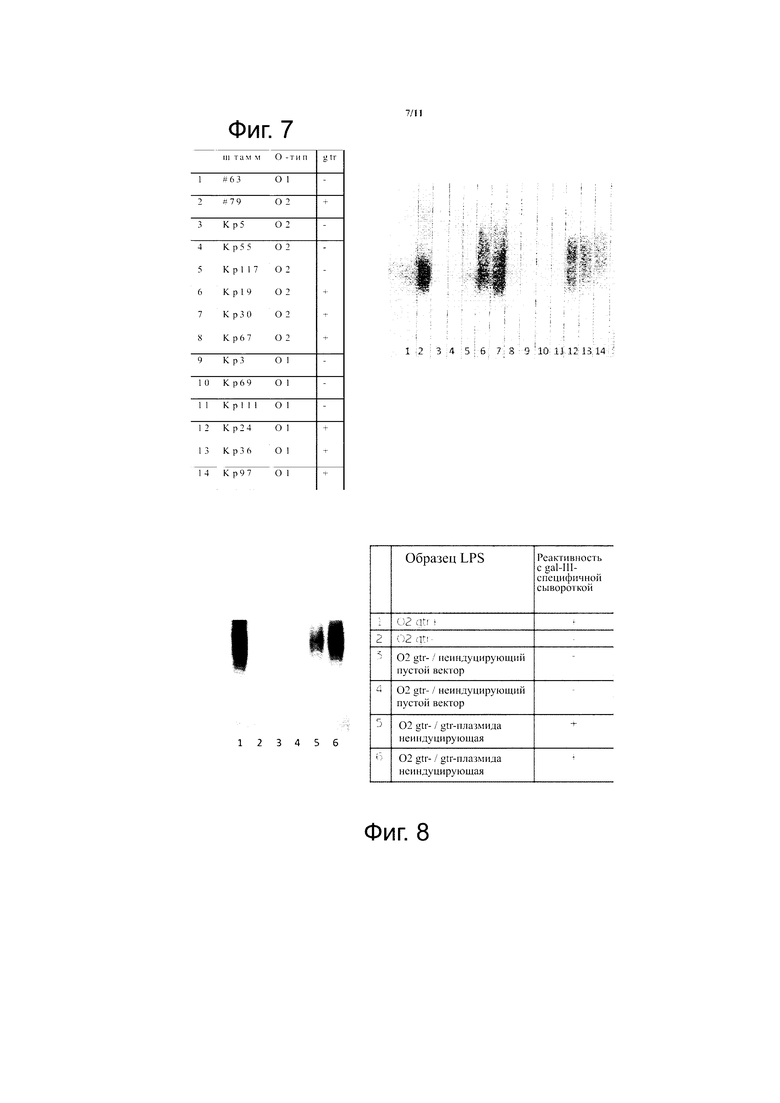
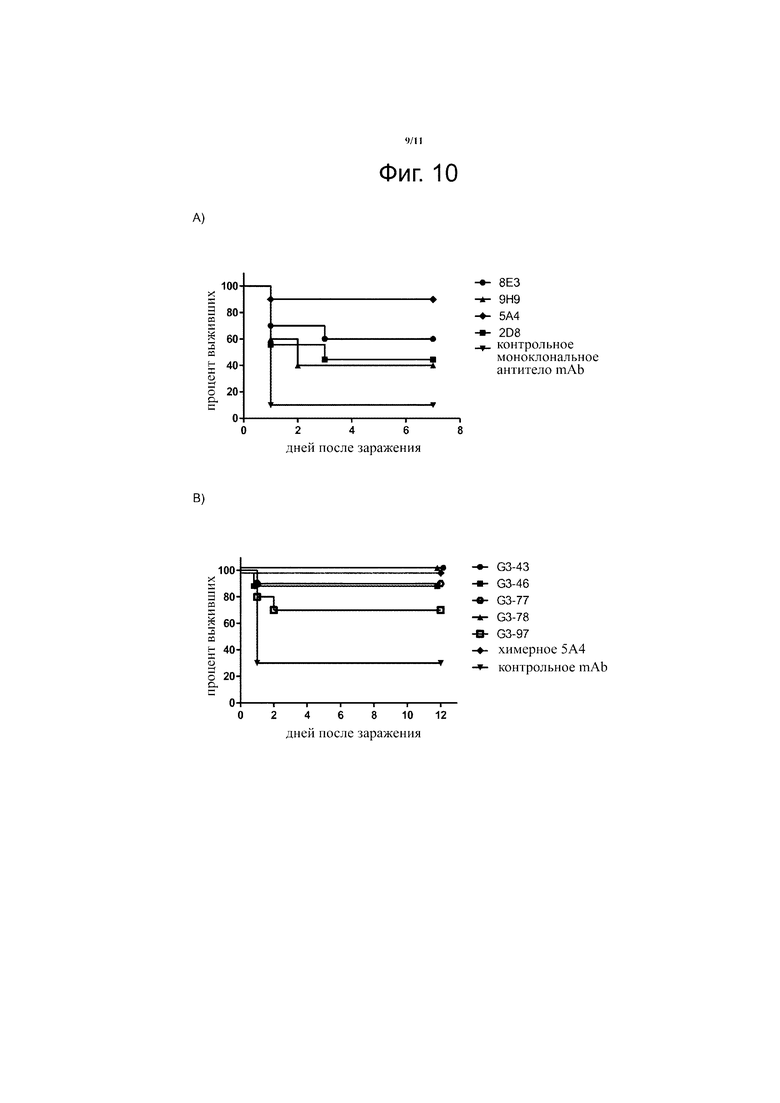
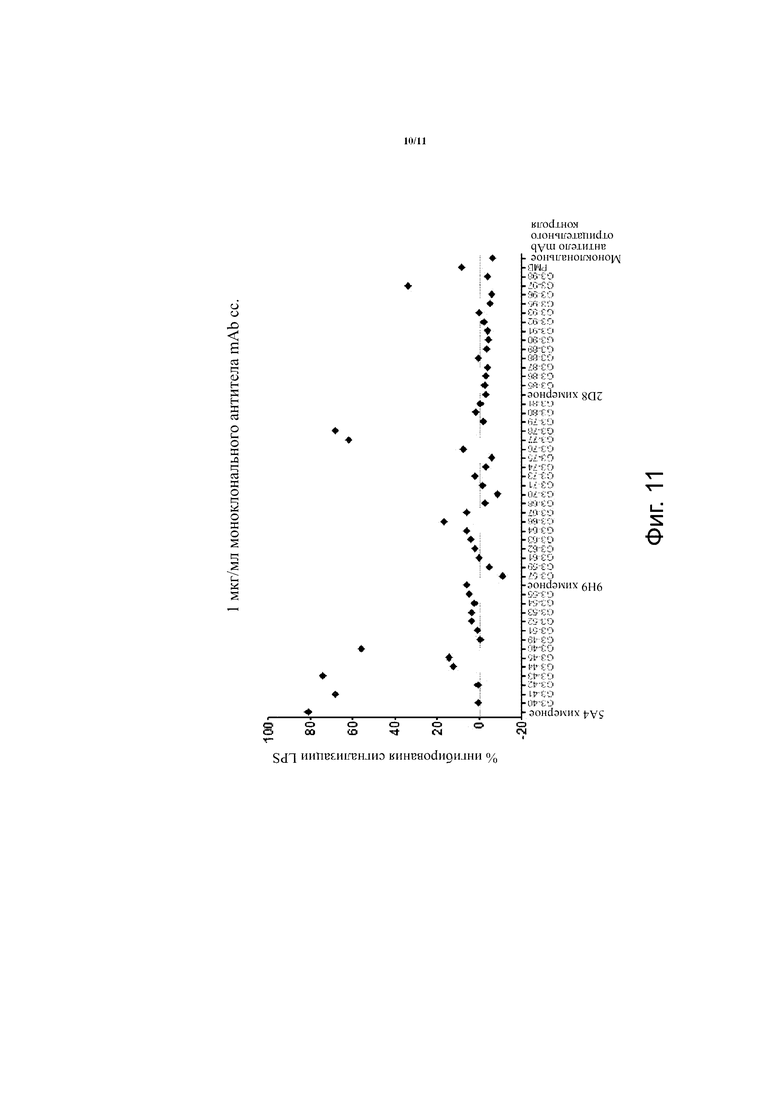
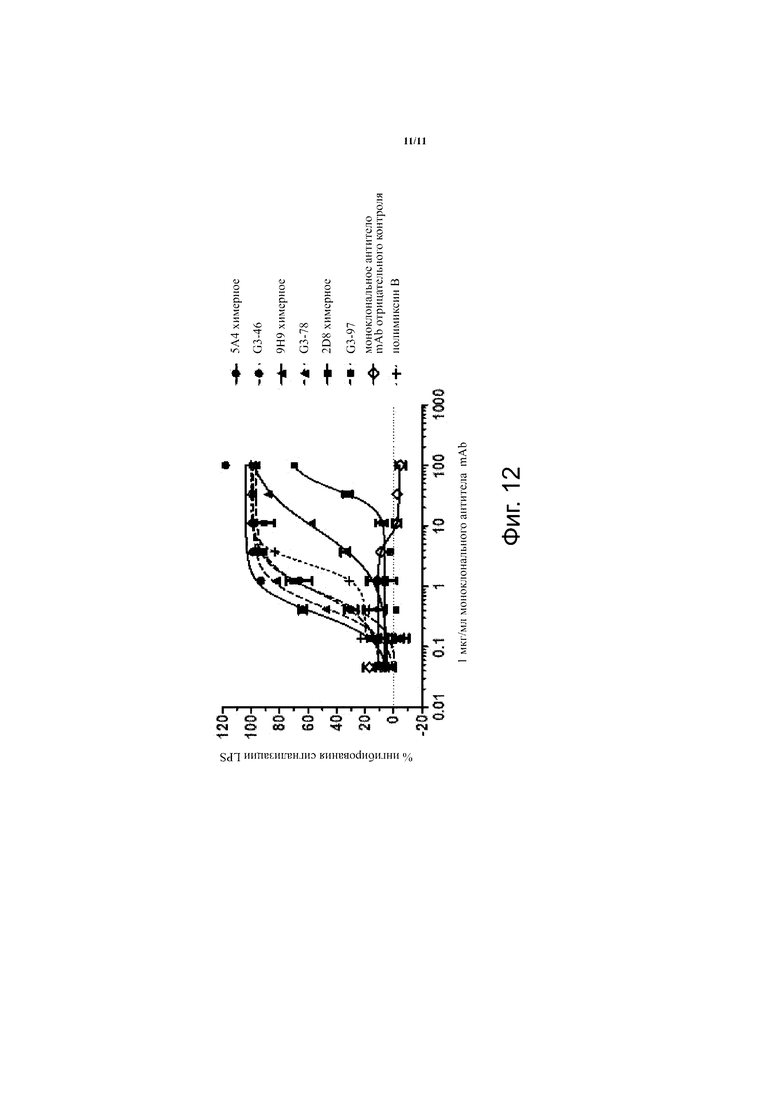
Настоящее изобретение относится к области иммунологии. Предложено выделенное антитело, которое специфически распознает эпитоп галактана-III структуры O-антигена липополисахарида (LPS) из Klebsiella pneumoniae, и не вступает в перекрестную реакцию с эпитопом галактана-I. Кроме того, предложены фармацевтический препарат, применение антитела, диагностические препараты, способ диагностики инфекции или колонизации Klebsiella pneumoniae. Также предложена выделенная нуклеиновая кислоты, экспрессирующая кассета или плазмида, клетка-хозяин, способ получения антитела. Данное изобретение может найти применение в терапии или диагностике инфекции Klebsiella pneumoniae. 10 н. и 7 з.п. ф-лы, 12 ил., 6 табл., 8 пр.
1. Выделенное антитело, которое специфически распознает эпитоп галактана-III структуры O-антигена липополисахарида (LPS) из Klebsiella pneumoniae и не вступает в перекрестную реакцию с эпитопом галактана-I, где эпитоп галактана-III находится в повторяющихся единицах галактана-III, где повторяющаяся единица галактана-III представляет собой разветвленный гомополимер галактозы формулы (I)
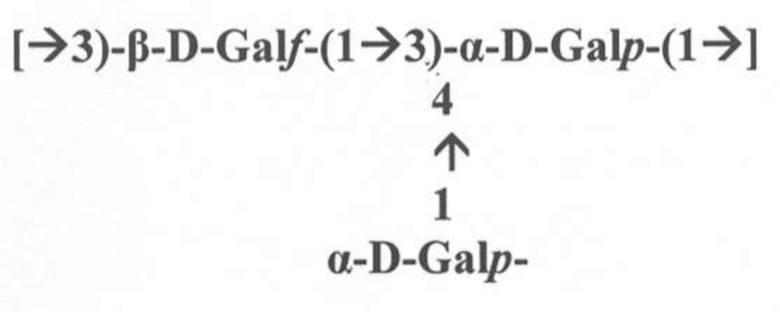 формула (I),
формула (I),
и где повторяющаяся единица галактана-I представляет собой галактозный гомополимер формулы (II)
[→3)-β-D-Galf-(1→3)-α-D-Galp-(1→] формула (II),
где антитело содержит последовательности VH-CDR, обозначаемые как CDR1, CDR2 и CDR3, и последовательности VL-CDR, обозначаемые как CDR4, CDR5 и CDR6,
где антитело выбрано из группы, состоящей из
а) антитела, содержащего
а. последовательность CDR1 SEQ ID 1; и
б. последовательность CDR2 SEQ ID 2; и
c. последовательность CDR3 SEQ ID 3; и
d. последовательность CDR4 SEQ ID 13; и
е. последовательность CDR5 SEQ ID 14; и
f. последовательность CDR6 SEQ ID 15;
б) антитела, содержащего
а. последовательность CDR1 SEQ ID 4; и
б. последовательность CDR2 SEQ ID 5; и
c. последовательность CDR3 SEQ ID 6; и
d. последовательность CDR4 SEQ ID 16; и
е. последовательность CDR5 SEQ ID 17; и
f. последовательность CDR6 SEQ ID 18;
в) антитела, содержащего
а. последовательность CDR1 SEQ ID 7; и
б. последовательность CDR2 SEQ ID 8; и
c. последовательность CDR3 SEQ ID 9; и
d. последовательность CDR4 SEQ ID 19; и
е. последовательность CDR5 SEQ ID 20; и
f. последовательность CDR6 SEQ ID 18;
г) антитела, содержащего
а. последовательность CDR1 SEQ ID 10; и
б. последовательность CDR2 SEQ ID 11; и
c. последовательность CDR3 SEQ ID 12; и
d. последовательность CDR4 SEQ ID 19; и
е. последовательность CDR5 SEQ ID 17; и
f. последовательность CDR6 SEQ ID 18;
д) антитела, содержащего
а. последовательность CDR1 SEQ ID 4; и
б. последовательность CDR2 SEQ ID 5; и
c. последовательность CDR3 SEQ ID 6; и
d. последовательность CDR4 SEQ ID 19; и
е. последовательность CDR5 SEQ ID 20; и
f. последовательность CDR6 SEQ ID 18;
и
e) антитела, содержащего
а. последовательность CDR1 SEQ ID 10; и
б. последовательность CDR2 SEQ ID 11; и
c. последовательность CDR3 SEQ ID 12; и
d. последовательность CDR4 SEQ ID 19; и
е. последовательность CDR5 SEQ ID 20; и
f. последовательность CDR6 SEQ ID 18.
2. Антитело по п. 1, в котором эпитоп галактана-III содержится в мультирезистентных (MDR) Klebsiella pneumoniae, в частности, в клоне MDR ST258.
3. Антитело по любому из пп. 1 или 2, которое нейтрализует эндотоксин штаммов Klebsiella pneumoniae, экспрессирующих эпитоп галактана-III и имеет аффинность связывания эпитопа галактана-III с Kd менее 10-7 М, предпочтительно менее 10-8 М, еще более предпочтительно менее 10-9 М.
4. Антитело по любому из пп. 1-3, которое представляет собой полноразмерное моноклональное антитело, его фрагмент, содержащий, по меньшей мере, один домен антитела, включающий участок связывания, или слитый белок, содержащий по меньшей мере один домен антитела, включающий участок связывания, в частности, где антитело представляет собой неприродное антитело, которое содержит рандомизированную или искусственную аминокислотную последовательность.
5. Антитело по любому из пп. 1-4, предназначенное для лечения субъекта с риском инфицирования или колонизации Klebsiella pneumoniae или страдающего от указанного, включающего введение субъекту эффективного количества антитела для ограничения инфекции у субъекта или для облегчения заболевания, вызванного указанной инфекцией, предпочтительно для лечения или профилактики любой первичной и вторичной бактериемии, пневмонии, инфекции мочевых путей, абсцесса печени, перитонита или менингита.
6. Фармацевтический препарат, предназначенный для использовании в лечении субъекта с риском инфицирования или колонизации Klebsiella pneumoniae или страдающего от указанного, включающий эффективное количество антитела по любому из пп. 1-5, чтобы ограничить инфекцию у указанного субъекта или облегчить состояние заболевания, являющегося следствием указанной инфекции, в виде парентерального или мукозального состава, содержащего фармацевтически приемлемый носитель или эксципиент.
7. Применение антитела по любому из пп. 1-5 для диагностики инфекции или колонизации Klebsiella pneumoniae или связанного с ней заболевания, такого как первичная и вторичная бактериемия, пневмония, инфекция мочевых путей, абсцесс печени, перитонит или менингит у субъекта.
8. Применение по п. 7, где субъект представляет собой пациента с ослабленным иммунитетом или пациента с подавленным иммунитетом или его контакт.
9. Диагностический препарат для использования при диагностировании у субъекта риска развития или колонизации Klebsiella pneumoniae или наличия указанного, включающий антитело по любому из пп. 1-5, дополнительный диагностический реагент и необязательно твердую фазу для иммобилизации по меньшей мере одного из антитела и диагностического реагента.
10. Диагностический препарат по п. 9, в котором дополнительный диагностический реагент представляет собой диагностическую метку или реагент, специфически реагирующий с антителом и/или продуктом реакции связывания антитела с его антигеном.
11. Способ диагностики инфекции или колонизации Klebsiella pneumoniae у субъекта, вызванного штаммом Klebsiella pneumoniae, включающий
а) обеспечение антитела по любому из пп. 1-5 и
b) детекцию специфической иммунореакции антитела с эпитопом галактана-III в биологическом образце испытуемого, посредством чего диагностируется инфекция или колонизация Klebsiella pneumoniae.
12. Способ по п. 11, где биологические образцы представляют собой образец жидкости организма или ткани, предпочтительно образец, выбранный из группы, состоящей из образца крови, образца стула, образца кожи, образца мочи, спинномозговой жидкости и образца из дыхательных путей, такого как эндотрахеальные аспираты, плевральная жидкость, легочный пунктат, назальный тампон или мокрота, или изолят Klebsiella pneumoniae, происходящий из любого из вышеперечисленных источников.
13. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп. 1-5.
14. Экспрессирующая кассета или плазмида, содержащая кодирующую последовательность для экспрессии белка, содержащего VH и VL антитела по любому из пп. 1-5.
15. Клетка-хозяин для использования при получении антитела, включающая экспрессирующую кассету или плазмиду по п. 14, где указанная клетка продуцирует антитело по любому из пп. 1-5.
16. Способ получения антитела по любому из пп. 1-5, в котором клетку-хозяин по п. 15 культивируют или поддерживают в условиях получения указанного антитела.
17. Диагностический препарат, предназначенный для использования при диагностировании у субъекта риска развития или колонизации Klebsiella pneumoniae или наличия указанного, включающий антитело по любому из пп. 1-5 и дополнительный диагностический реагент, в виде набора реагентов, причем препарат необязательно включает твердую фазу для иммобилизации по меньшей мере одного из антитела и диагностического реагента.
| HANSEN DS et | |||
| al | |||
| "Klebsiella pneumoniae Lipopolysaccharide O typing: Revision of Prototype Strains and O-Group Distribution among Clinical Isolates from Different Sources and Countries", Journal of Clinical Microbiology, 1999, Vol | |||
| Пишущая машина | 1922 |
|
SU37A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| KELLY RF et | |||
| al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2021-11-19—Публикация
2015-11-03—Подача