ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, озаглавленный "160163WO02_ST25", составляет 198 килобайт и был создан 30 января 2018 года и включен в данный документ посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
У пациентов с коагулопатией, таких как люди с гемофилией А и В, различные этапы коагуляционного каскада оказываются дисфункциональными, например из-за отсутствия или недостаточного присутствующего количества функционального фактора свертывания крови. Такая дисфункция одной части коагуляционного каскада приводит к недостаточному свертыванию крови и потенциально опасному для жизни кровотечению или повреждению внутренних органов, таких как суставы.
Дефицит фактора свертывания крови VIII (FVIII), обычно называемый гемофилией А, представляет собой врожденное нарушение свертываемости крови, поражающее примерно 420000 человек во всем мире, из которых около 105000 в настоящее время имеют поставленный диагноз.
Пациенты с гемофилией А могут получать заместительную терапию фактором свертывания крови, такую как экзогенный FVIII. Традиционное лечение состоит из заместительной терапии, предоставляемой в качестве профилактики или по требованию для лечения эпизодов кровотечения. До недавнего времени профилактическое лечение пациента с тяжелой гемофилией А представляло собой до трех внутривенных инъекций в неделю либо полученного из плазмы крови FVIII, либо рекомбинантного FVIII, либо его вариантов длительного действия.
Однако такие пациенты подвергаются риску развития нейтрализующих антител, так называемых ингибиторов, к таким экзогенным факторам, что делает ранее эффективную терапию неэффективной. Гемофилия А у пациентов с ингибиторами является неограничивающим примером коагулопатии, которая является частично врожденной и частично приобретенной. Пациентов, у которых развились ингибиторы FVTII, нельзя лечить традиционной заместительной терапией. Недавно было одобрено новое лекарственное средство, гемлибра, для подкожного профилактического лечения гемофилии А при наличии ингибиторов. Экзогенные факторы свертывания крови можно вводить только внутривенно, что создает значительные неудобства и дискомфорт для пациентов. Например, младенцам и детям младшего возраста может потребоваться хирургическое введение внутривенных катетеров в грудную вену, чтобы гарантировать венозный доступ. Это обуславливает большой риск развития у них бактериальных инфекций. Таким образом, даже с появлением гемлибры существует необходимость в альтернативном подкожном лечении гемофилии при наличии ингибиторов.
У индивидуума с кровотечением коагуляция инициируется образованием комплекса тканевый фактор/фактор VIIa (TF/FVIIa), когда внесосудистый TF подвергается воздействию активированного FVII (FVIIa) в крови. Образование комплекса TF/FVIIa приводит к активации фактора свертывания крови X (FX) до активированного фактора свертывания крови Ха (FXa), который вместе с активированным фактором свертывания крови V (FVa) приводит к образованию ограниченного количества тромбина, который, в свою очередь, активирует тромбоциты. Активированные тромбоциты поддерживают сборку теназного комплекса, состоящего из активированного фактора VIII (FVIIIa) и активированного фактора свертывания крови IX (FIXa). Теназный комплекс является очень эффективным катализатором активации FX, и FXa, генерируемый на этой второй стадии, служит активной протеазой в протромбиназном комплексе FVa/FXa, который отвечает за окончательный тромбиновый «взрыв». Тромбин расщепляет фибриноген с образованием фибриновых мономеров, которые полимеризуются с образованием фибриновой сети, герметизирующей протекающий сосуд и останавливающей кровотечение. Быстрый и обширный тромбиновый «взрыв» является необходимым условием для образования твердого и стабильного фибринового сгустка.
Неадекватное образование FXa и снижение выработки тромбина, вызванное снижением или отсутствием активности FVIII, является причиной, лежащей в основе геморрагического диатеза у пациентов с гемофилией А.
Как уже упоминалось, протеолитическое превращение FX в его ферментативно активную форму FXa может быть достигнуто с помощью собственного FX-активирующего комплекса, содержащего FIXa и его кофактор FVIIIa. Связывание кофактора увеличивает ферментативную активность FIXa на приблизительно пять порядков, и, как полагают, это происходит благодаря множеству механизмов, описанных Scheiflinger et al. (2008) J Thromb Haemost, 6:315-322. Примечательно, что было обнаружено, что FVIIIa стабилизирует конформацию FIXa, которая обладает повышенной протеолитической активностью по отношению к FX (Kolkman JA, Mertens K (2000) Biochemistry, 39:7398-7405,  Brandstetter H (2009) Biol Chem, 390:391-400). Основываясь на этом наблюдении и осознавая, что антитела являются универсальными связывающими белками, способными имитировать различные белок-белковые взаимодействия, Scheiflinger et al. провели скрининг на агонистические антитела к FIXa, характеризующиеся способностью усиливать активацию FX с помощью FIXa в присутствии фосфолипидной поверхности и кальция, но в отсутствие природного кофактора FVIIIa. При скрининге супернатантов 5280 гибридом было обнаружено, что 88 вырабатывают антитела, проявляющие различные степени агонистической активности в отношении FIXa, см. ЕР 1220923 В1 и ЕР 1660536 В1. Что касается кинетики активации FX и способности стимулировать образование тромбина в плазме крови человека с дефицитом FVIII, в ЕР 1660536 В1 постоянно указывается 224F3 как наиболее эффективное антитело (см., например, параграфы 0060 и 0062).
Brandstetter H (2009) Biol Chem, 390:391-400). Основываясь на этом наблюдении и осознавая, что антитела являются универсальными связывающими белками, способными имитировать различные белок-белковые взаимодействия, Scheiflinger et al. провели скрининг на агонистические антитела к FIXa, характеризующиеся способностью усиливать активацию FX с помощью FIXa в присутствии фосфолипидной поверхности и кальция, но в отсутствие природного кофактора FVIIIa. При скрининге супернатантов 5280 гибридом было обнаружено, что 88 вырабатывают антитела, проявляющие различные степени агонистической активности в отношении FIXa, см. ЕР 1220923 В1 и ЕР 1660536 В1. Что касается кинетики активации FX и способности стимулировать образование тромбина в плазме крови человека с дефицитом FVIII, в ЕР 1660536 В1 постоянно указывается 224F3 как наиболее эффективное антитело (см., например, параграфы 0060 и 0062).
АСЕ910 или эмицизумаб (торговое название Hemlibra®) представляет собой гуманизированное биспецифическое моноклональное антитело к FIX(a)/FX(a), разработанное Chugai Pharmaceutical для лечения гемофилии А. АСЕ910 предназначено для имитации функции кофактора FVIII (см. Sampei et al.: (2013) PLoS One, 8, e57479 и WO 2012067176).
По-прежнему существует много неудовлетворенных медицинских потребностей у лиц с гемофилией, в частности, и у субъектов с типами коагулопатии в целом, и настоящее изобретение относится к усовершенствованным соединениям, способным заменить FVIII и, таким образом, пригодным для лечения коагулопатии, такой как гемофилия А.
КРАТКОЕ ОПИСАНИЕ
Настоящее изобретение относится к соединениям, которые служат заменой фактора свертывания крови VIII (FVIII) у пациентов, страдающих коагулопатией, и, в частности, у пациентов, у которых отсутствует функциональный FVIII, таких как пациенты с гемофилией А, включая пациентов с гемофилией А с ингибиторами.
Следовательно, один аспект настоящего изобретения относится к соединениям, способным усиливать выработку FXa и, таким образом, частично или полностью восстанавливать коагуляцию у пациентов, не имеющих FVIII.
В одном аспекте соединение представляет собой антитело. В одном таком аспекте соединение представляет собой полиспецифическое антитело, такое как биспецифическое антитело.
В одном конкретном аспекте настоящее изобретение относится к прокоагулянтным антителам, которые служат заменой FVIII у пациентов, не имеющих FVIII, таких как пациенты с гемофилией А.
В одном таком аспекте антитело связывается с FIXa и увеличивает его ферментативную активность по отношению к FX, необязательно также связывая FX.
В одном аспекте настоящее изобретение относится к прокоагулянтному антителу, которое связывает FX, включая биспецифические прокоагулянтные антитела, которые повышают ферментативную активность FIXa по отношению к FX и степень связывания FX.
В одном аспекте настоящее изобретение относится к прокоагулянтному биспецифическому антителу, которое способно связываться с факторами свертывания крови FIX/FIXa и FX/FXa.
В одном аспекте антитело является человеческим или гуманизированным.
Дополнительный аспект настоящего изобретения относится к отдельным антителам или их антигенсвязывающим фрагментам, которые являются частью прокоагулянтного антитела, таким как конкретное антитело к FIX или к FIXa или его антигенсвязывающий фрагмент. Дополнительный аспект настоящего изобретения относится к отдельным антителам или их антигенсвязывающим фрагментам, которые являются частью прокоагулянтного антитела, таким как конкретное антитело к FX или к FXa или его антигенсвязывающий фрагмент.
Дополнительный аспект настоящего изобретения относится к изготовлению антител и их промежуточных соединений, раскрытых в данном документе.
Дополнительный аспект настоящего изобретения относится к антителу, которое конкурирует с прокоагулянтным антителом или его антигенсвязывающим фрагментом, раскрытыми в данном документе, за связывание с FIX/FIXa.
Дополнительный аспект настоящего изобретения относится к прокоагулянтному антителу, которое конкурирует с антителом или его антигенсвязывающим фрагментом, раскрытыми в данном документе, за связывание с FX/FXa.
Еще один дополнительный аспект настоящего изобретения относится к фармацевтической композиции, содержащей прокоагулянтное антитело, раскрытое в данном документе, составленной для доставки указанного антитела для предупреждения и/или лечения коагулопатии.
Дополнительный аспект настоящего изобретения направлен на прокоагулянтные антитела, раскрытые в данном документе, для предупреждения и/или лечения коагулопатии, заболевания, сопровождающего коагулопатию, или заболевания, вызванного коагулопатией.
Настоящее изобретение также может решить дополнительные проблемы, которые будут очевидны из раскрытия иллюстративных вариантов осуществления.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показаны выровненные последовательности с SEQ ID NO: 3-188, в которых определяющие комплементарность области 1, 2 и 3 (CDR1, CDR2 и CDR3) вариабельных доменов тяжелой цепи и легкой цепи были выделены последовательно в прямоугольниках.
На фигуре 2 показаны данные теста тромбинообразования (TGT) для биспецифических антител mAb4-7761, mAb4-7762, mAb4-7789, mAb5-0057, mAb5-1409 и АСЕ910 в активированной тканевым фактором обедненной тромбоцитами плазме крови человека при гемофилии А (НА-РРР). Эксперимент проводили, как описано в примере 17. Точечные и пунктирные линии показывают пиковый уровень (нМ) тромбина, наблюдаемый в отсутствие антитела к FVIII в НА-РРР и нормальной РРР соответственно, и их стандартное отклонение, обозначенное точечными линиями. Профили mAb4-7761, mAb4-7762, mAb4-7789, mAb5-0057 и mAb5-1409 обозначены направленными вверх треугольниками, тогда как профиль АСЕ910 обозначен направленными вниз треугольниками. Эксп. А - D относятся к независимым экспериментам; в каждом из этих экспериментов пиковый уровень тромбина при каждой концентрации антител представляет собой среднее значение ± стандартное отклонение по меньшей мере трех независимых прогонов.
На фигуре 3 показаны данные теста тромбинообразования (TGT) для биспецифических антител mAb5-0057, mAb5-1409 и АСЕ910 в активированной тканевым фактором обогащенной тромбоцитами плазме крови человека при гемофилии A (HA-PRP). Эксперимент проводили, как описано в примере 17. Точечные и пунктирные линии показывают пиковый уровень (нМ) тромбина, наблюдаемый в отсутствие антитела к FVIII в HA-PRP и нормальной PRP соответственно, и их стандартное отклонение, обозначенное точечными линиями. Профили mAb5-0057 и mAb5-1409 обозначены направленными вверх треугольниками, тогда как профиль АСЕ910 обозначен направленными вниз треугольниками. Результаты представлены в виде среднего значения ± стандартное отклонение из четырех независимых экспериментов.
На фигуре 4 показаны данные теста тромбинообразования (TGT) для моновалентных неполных (OA) антител mAb1-9016 и 224F3 в обедненной тромбоцитами плазме крови человека, активированной фактором XIa. Эксперимент проводили, как описано в примере 18. Пунктирными линии показывают средний пиковый уровень (нМ) тромбина, наблюдаемый в отсутствие антитела, и его стандартное отклонение (±1 SD), обозначенное точечными линиями. Профили ОА-вариантов mAb1-9016 и 224F3 (mAb1-1582) обозначены треугольниками, направленными вверх и вниз соответственно.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 представляет собой аминокислотную последовательность фактора свертывания крови IX человека.
SEQ ID NO: 2 представляет собой аминокислотную последовательность фактора свертывания крови X человека.
SEQ ID NO: 3-188 представляют собой последовательности вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) моноклональных антител (mAb) к FIX и к FX, описанных в данном документе. ID для соответствующих неполных (OA) антител, а также некоторых биспецифических антител также приведены в таблице. Последовательности CDR1-3 выделены прямоугольниками на фигуре 1.
Обзор сокращений для антител, мишеней и SEQ ID NO для соответствующих последовательностей VH и VL.
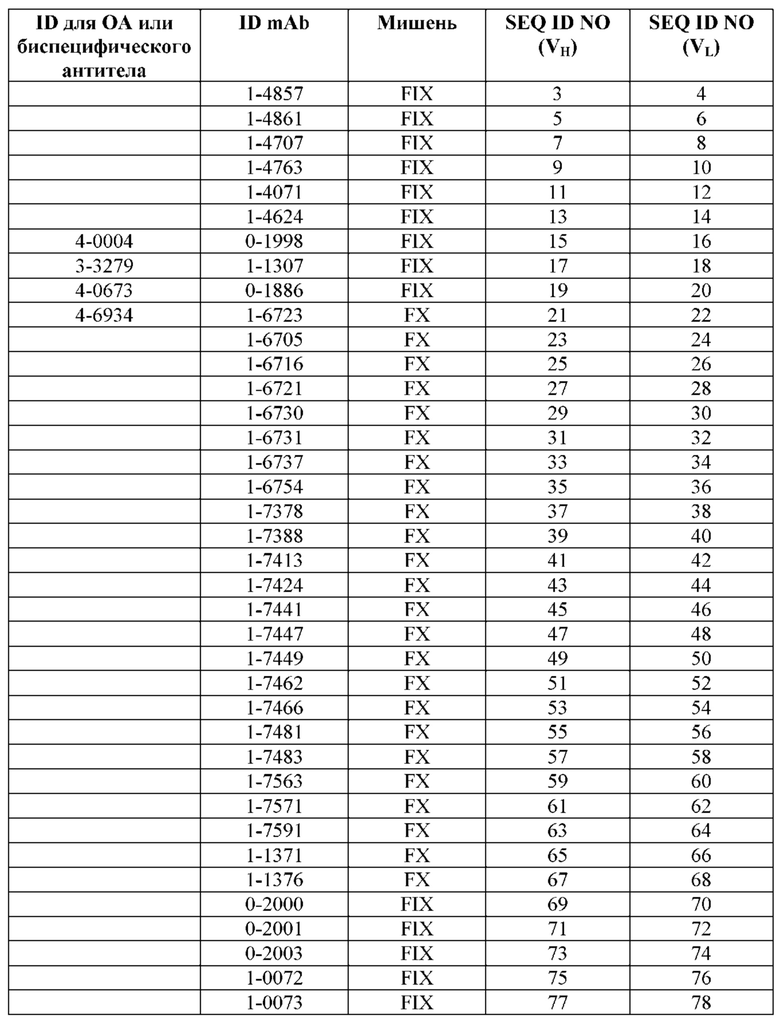
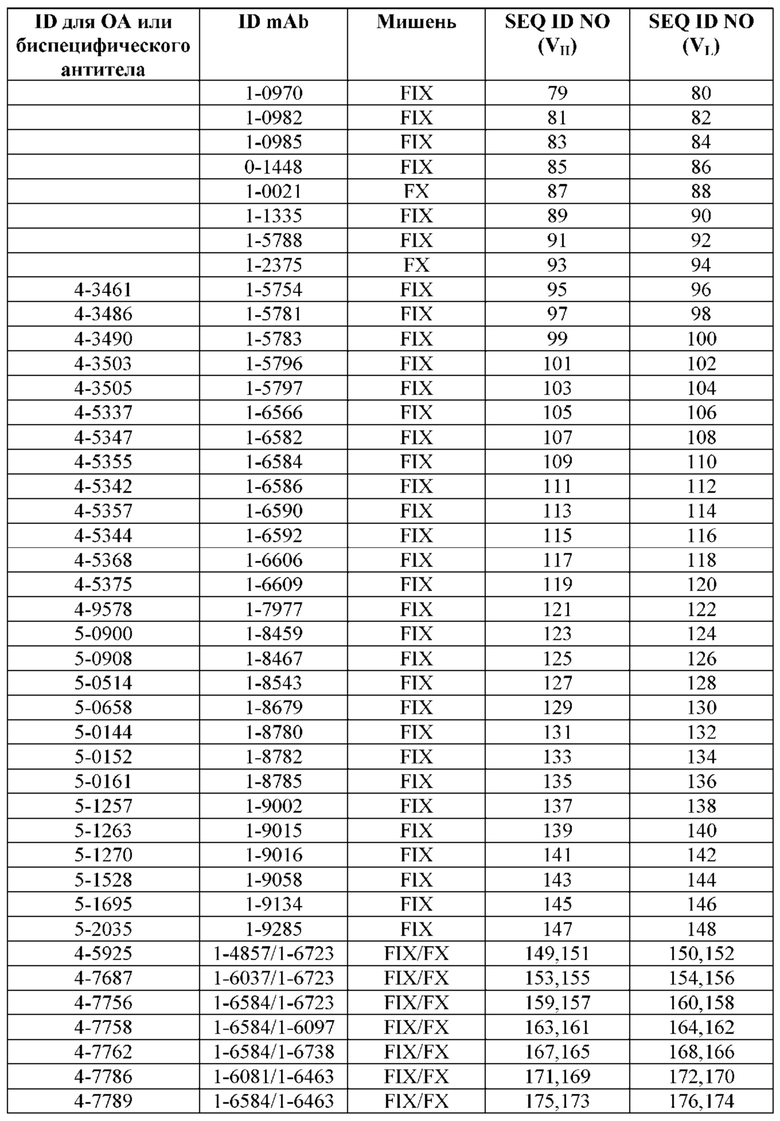
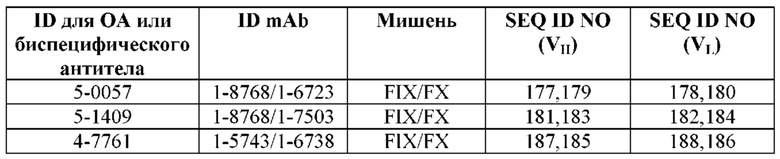
Первый столбец («ID для OA или биспецифического антитела») содержит сокращения для моновалентных неполных (OA) антител и/или биспецифических антител. Во втором столбце («ID mAb») представлены сокращения для соответствующих составных антител (для биспецифических антител первое упомянутое антитело во втором столбце является антителом к FIX/FIXa, а второе - антителом к FX/FXa). Четвертый («SEQ ID NO (VH)») и пятый («SEQ ID NO (VL)») столбцы представляют SEQ ID NO для последовательностей VH и VL, соответственно, причем первый SEQ ID NO в каждом столбце представляет антитело к FIX/FIXa, а второй - антитело к FX/FXa.
ОПИСАНИЕ
У субъектов с коагулопатией, таких как люди с гемофилией А, коагуляционный каскад оказывается дисфункциональным из-за отсутствия или недостаточного присутствующего количества функционального FVIII. Такая дисфункция одной части коагуляционного каскада приводит к недостаточному свертыванию крови и потенциально опасному для жизни кровотечению или повреждению внутренних органов, таких как суставы. Настоящее изобретение относится к соединениям, которые служат заменой фактора свертывания крови VIII (FVIII) у пациентов, страдающих коагулопатией, и, в частности, у пациентов, у которых отсутствует функциональный FVIII, таких как пациенты с гемофилией А, включая пациентов с гемофилией А с ингибиторами. В одном аспекте такое соединение представляет собой антитело.
В частности, авторы настоящего изобретения неожиданно идентифицировали антитела, которые имитируют активность кофактора FVIII с высокой действенностью и эффективностью.
В одном конкретном аспекте настоящее изобретение относится к прокоагулянтным антителам, которые служат заменой FVIII у пациентов, не имеющих функционального FVIII, таких как пациенты с гемофилией А.
В одном таком аспекте прокоагулянтные антитела связываются с фактором свертывания крови IXa (FIXa) и увеличивают его ферментативную активность по отношению к фактору свертывания крови X (FX), необязательно также связывая FX. В одном таком аспекте антитела по настоящему изобретению представляют собой биспецифические антитела, способные связываться с FIX/FIXa и FX.
Фактор свертывания крови IX
FIX является витамин К-зависимым фактором свертывания крови со структурными сходствами с фактором VII, протромбином, фактором X и С-белком. Циркулирующая форма зимогена состоит из 415 аминокислот, разделенных на четыре отдельных домена, включая N-концевой домен, обогащенный γ-карбоксиглутаминовой кислотой, (Gla), два EGF-домена и С-концевой домен со свойствами трипсиноподобной сериновой протеазы. FIX циркулирует в плазме крови в виде одноцепочечного зимогена (SEQ ID NO: 1). Активация FIX происходит путем ограниченного протеолиза в Arg145 и Arg180 с высвобождением активационного пептида (остатки со 146 по 180 из SEQ ID NO: 1). Таким образом, активированный FIX (FIXa) состоит из остатков 1-145 из SEQ ID NO: 1 (легкая цепь) и остатков 181-415 из SEQ ID NO: 1 (тяжелая цепь).
Циркулирующие молекулы FIX, таким образом, включают в себя зимоген FIX и активированную форму FIX, которые в данном документе в целом обозначаются как FIX и FIXa со ссылкой на SEQ ID NO: 1.
Активированный фактор IX упоминается как фактор IXa или FIXa. Термин «FIX (SEQ ID NO: 1) и/или его активированная форма (FIXa)» также может упоминаться как «FIX/FIXa» или «FIX(a)».
FIXa представляет собой трипсиноподобную сериновую протеазу, которая играет ключевую роль в гемостазе, генерируя в составе теназного комплекса большую часть фактора Ха, необходимого для поддержания правильного образования тромбина во время коагуляции.
FIX представлен в данном документе последовательностью с SEQ ID NO: 1, соответствующей аллельной форме Ala148 FIX человека (Anson et al. EMBO J. 1984 3:1053-1060; McGraw et al, Proc Natl Acad Sci USA. 1985 82:2847-2851; Graham et al. Am. J. Hum. Genet. 1988 42:573-580). В настоящем изобретении FIX предназначен для охвата всех природных вариантов FIX, таких как вариант Т148 (ID Р00740 в Uniprot).
Фактор свертывания крови X
FX является витамин К-зависимым фактором свертывания крови со структурными сходствами с фактором VII, протромбином, FIX и С-белком. Зимоген FX человека содержит четыре отдельных домена, включая N-концевой домен, обогащенный гамма-карбоксиглутаминовой кислотой (Gla), два EGF-домена и С-концевой домен с со свойствами трипсиноподобной сериновой протеазы. FX циркулирует в плазме крови в виде двухцепочечного зимогена, включающего остатки 1-139 из SEQ ID NO: 2 (легкая цепь) и остатки 143-448 из SEQ ID NO: 2 (тяжелая цепь). Активация FX происходит путем ограниченного протеолиза в Arg194, что приводит к высвобождению активационного пептида (а.к. 143-194). Таким образом, активированный FX (FXa) состоит из остатков 1-139 из SEQ ID NO: 2 (легкая цепь) и остатков 195-448 из SEQ ID NO: 2 (активированная тяжелая цепь). Циркулирующие молекулы FX, таким образом, включают в себя зимоген FX и активированную форму FX, которые в данном документе обозначаются как FX и FXa соответственно, со ссылкой на SEQ ID NO: 2. В настоящем изобретении FX предназначен для охвата всех природных вариантов FX. Термин «FX (SEQ ID NO: 2) и/или его активированная форма (FXa)» также может упоминаться как «FX/FXa» или «FX(a)».
Антитела
Термин «антитело» в данном документе относится к белку, полученному из последовательности иммуноглобулина, который способен связываться с антигеном или его частью. Термин антитело включает, без ограничения, полноразмерные антитела любого класса (или изотипа), то есть IgA, IgD, IgE, IgG, IgM и/или IgY. Термин антитело включает в себя, без ограничения, антитела, которые являются бивалентными, такие как биспецифические антитела.
Природные полноразмерные антитела содержат по меньшей мере четыре полипептидные цепи: две тяжелые цепи (НС) и две легкие цепи (LC), которые связаны дисульфидными связями. В некоторых случаях природные антитела содержат менее четырех цепей, как в случае IgNAR, обнаруженных у Chondrichthyes. Одним классом иммуноглобулинов, представляющим особый фармацевтический интерес, является IgG. У людей класс IgG можно разделить на четыре подкласса IgG1, IgG2, IgG3 и IgG4 на основании последовательности их константных областей тяжелой цепи. Легкие цепи можно разделить на два типа: каппа- и лямбда-цепи, на основании различий в их составах последовательностей. Молекулы IgG состоят из двух тяжелых цепей, связанных двумя или более дисульфидными связями, и двух легких цепей, каждая из которых прикреплена к тяжелой цепи дисульфидной связью. Тяжелая цепь IgG может содержать вариабельный домен тяжелой цепи (VH) и до трех константных доменов тяжелой цепи (CH): CH1, CH2 и CH3. Легкая цепь может содержать вариабельный домен легкой цепи (VL) и константный домен легкой цепи (CL). Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR) или гипервариабельными областями (HvR), чередующиеся с более консервативными областями, называемыми каркасными областями (FR). Домены VH и VL обычно состоят из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные домены тяжелой и легкой цепей, содержащие гипервариабельные области (CDR), образуют структуру, которая способна взаимодействовать с антигеном, в то время как константная область антитела может опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе, без ограничения, с различным клеткам иммунной системы (эффекторными клетками), Fc-рецепторами и первым компонентом, C1q, из комплекса С1 классической системы комплемента.
Антитела по настоящему изобретению могут быть моноклональными антителами (mAb) в том смысле, что они представляют собой набор уникальных последовательностей вариабельных доменов тяжелой и легкой цепей, экспрессируемый одной В-клеткой или клональной популяцией В-клеток. Антитела по настоящему изобретению можно получать и очищать с использованием различных способов, которые известны специалисту в данной области. Например, антитела можно получать из клеток гибридомы. Антитела можно получать путем размножения В-клеток. Антитела или их фрагменты можно рекомбинантно экспрессировать в системах экспрессии млекопитающих или микробов или при трансляции in vitro. Антитела или их фрагменты также можно рекомбинантно экспрессировать в виде молекул, связанных с поверхностью клетки, например, с помощью фагового дисплея, бактериального дисплея, дрожжевого дисплея, дисплея клеток млекопитающих или рибосомального или mRNA-дисплея.
Антитела по настоящему изобретению могут быть выделенными. Термин «выделенное антитело» относится к антителу, которое было отделено от и/или извлечено из другого(-их) компонента(-ов) в среде, в которой оно было произведено, и/или которое было очищено от смеси компонентов, присутствующих в среде, в которой оно было произведено.
Определенные антигенсвязывающие фрагменты антител могут быть подходящими в контексте настоящего изобретения, поскольку было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Термин «антигенсвязывающий фрагмент» антитела относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связывать или распознавать антиген, такой как FIX/FIXa, FX/FXa или другая целевая молекула, как описано в данном документе. Примеры антигенсвязывающих фрагментов включают (без ограничения) Fab, Fab', Fab2, Fab'2, Fv (как правило, комбинацию доменов VL и VH из одного плеча антитела), одноцепочечный Fv (scFv); см., например, Bird et al. Science 1988; 242:423-426 и Huston et al. PNAS 1988; 85:5879-5883), dsFv, Fd (как правило, домен VH и CH1), моновалентные молекулы, содержащие как один VH-, так и один VL-домен; минитела, диатела, триотела, тетратела и каппа-тела (см., например Ill et al (1997) Protein Eng 10:949-57); а также один или более выделенных CDR или функциональных паратопов, где выделенные CDR или антигенсвязывающие остатки или полипептиды могут быть связаны или соединены друг с другом с образованием функционального фрагмента антитела. Эти фрагменты антител можно получать с использованием общепринятых методик, известных специалистам в данной области, и фрагменты можно подвергать скринингу в отношении полезности таким же образом, как и интактные антитела.
«Fab-фрагменты» антитела, включая фрагменты «Fab» и «Fab'2», можно получать из антитела путем расщепления тяжелой цепи в шарнирной области на N-концевой или С-концевой стороне соответственно шарнирных остатков цистеина, соединяющих тяжелые цепи антитела. «Fab»-фрагмент предусматривает вариабельный и константный домены легкой цепи и вариабельный домен и CH1-домен тяжелой цепи. «Fab'2»-фрагменты содержат пару «Fab'»-фрагментов, которые, как правило, ковалентно соединены своими цистеинами шарнира. Fab' обычно получают из Fab'2-фрагмента путем расщепления шарнирных дисульфидных связей, соединяющих тяжелые цепи в Fab'2. Другие химические связи, кроме дисульфидных связей фрагментов антител, также известны из уровня техники. Fab-фрагмент сохраняет способность родительского антитела связываться со своим антигеном, потенциально с более низкой аффинностью. Fab'2-фрагменты способны к бивалентному связыванию, тогда как фрагменты Fab и Fab' могут связываться только моновалентно. Как правило, у Fab-фрагментов отсутствуют константные домены CH2 и CH3, т.е. Fc-часть, где может происходить взаимодействие с Fc-рецепторами и C1q. Таким образом, Fab-фрагменты вообще лишены эффекторных функций. Fab-фрагменты можно получать способами, известными из уровня техники, либо путем ферментативного расщепления антитела, например, с использованием папаина для получения Fab или пепсина для получения Fab'2, или Fab-фрагменты, в том числе Fab, Fab', Fab'2, можно получать рекомбинантно с использованием методик, которые хорошо известны специалисту в данной области.
Фрагмент «Fv» (вариабельный фрагмент) представляет собой фрагмент антитела, который содержит полный участок распознавания и связывания антигена и обычно содержит один вариабельный домен тяжелой и один вариабельный домен легкой цепи в ассоциации, которая может быть ковалентной по природе, например в одноцепочечном фрагменте вариабельных доменов (scFv). Именно в этой конфигурации три гипервариабельных области каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего участка на поверхности димера VH-VL. В совокупности шесть гипервариабельных областей или их подмножество придают антителу специфичность связывания антигена.
«Одноцепочечный Fv» или антитело «scFv» содержат VH- и VL-домены антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv формировать необходимую структуру для связывания антигена. Для обзора в отношении scFv см. Pluckthun, 1994, в: The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315.
«Одноцепочечный Fab» или антитело «scFab» содержит VH, CH1, VL и CL-домены антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид Fab дополнительно содержит полипептидный линкер между доменами VH и CL или VL и CH1, который позволяет scFab формировать необходимую структуру для связывания антигена (Koerber et al. (2015) J Mol Biol. 427:576-86).
Термин «диатела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, причем фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH и VL). При использовании линкера, слишком короткого, чтобы обеспечить спаривание между двумя вариабельными доменами в одной и той же цепи, вариабельные домены вынуждены образовывать пары с комплементарными доменами другой цепи, создавая два антигенсвязывающих участка.
Выражение «линейные антитела» относится к антителам, описываемым в Zapata et al. (1995) Protein Eng. 8:1057-1062. Вкратце, эти антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифичными.
Фрагменты антител можно получать с использованием общепринятых методик рекомбинантной или белковой инженерии, и фрагменты можно подвергать скринингу в отношении связывания с FIX и его активированной формой, FX или другим функциональным элементом таким же образом, как и интактные антитела.
Фрагменты антител по настоящему изобретению можно получать путем усечения, например путем удаления одной или нескольких аминокислот с N- и/или С-конца полипептида. Фрагменты также можно получать при помощи одной или нескольких внутренних делеций.
Антитело по настоящему изобретению может представлять собой или может содержать фрагмент антитела или вариант любого из антител, раскрытых в данном документе. Антитело по настоящему изобретению может представлять собой или может содержать антигенсвязывающую часть одного из этих антител или их вариантов. Например, антитело по настоящему изобретению может представлять собой Fab-фрагмент одного из этих антител или его вариантов или это может быть одноцепочечное антитело, полученное из одного из этих антител или его варианта. Также антитело по настоящему изобретению может представлять собой комбинацию антитела полной длины и его фрагмента.
Используемый в данном документе термин «неполное» относится к моновалентному антителу определенного типа, состоящему из тяжелой цепи антитела, усеченной тяжелой цепи, лишенной Fab-области, и одной легкой цепи.
Используемый в данном документе термин «моноспецифическое» антитело относится к антителу, которое способно связываться с одним конкретным эпитопом (включая, без ограничения, бивалентные антитела).
Используемый в данном документе термин «биспецифическое» антитело относится к антителу, которое способно связываться с двумя разными антигенами или двумя разными эпитопами на одном и том же антигене.
Используемый в данном документе термин «триспецифическое» антитело относится к антителу, которое способно связываться с тремя разными антигенами или тремя разными эпитопами на одном и том же антигене, или тремя разными эпитопами, присутствующими на двух разных антигенах.
Используемый в данном документе термин «полиспецифическое» антитело относится к антителу, которое способно связываться с двумя или более разными антигенами или двумя или более разными эпитопами на одном и том же антигене. Таким образом, полиспецифические антитела включают би- и триспецифические антитела.
Биспецифические антитела в формате IgG полной длины можно получать путем слияния двух отдельных гибридом с образованием гибридной квадромы, которая вырабатывает смесь антител, включающую фракцию биспецифических гетеродимеризующихся антител (Chelius D. et al.; MAbs. 2010 May-Jun; 2(3):309-319). Биспецифические гетеродимеризующиеся антитела можно альтернативно получать с использованием рекомбинантных методик. Гетеродимеризации также можно достичь путем конструирования поверхности контакта для димеризации в Fc-области, чтобы способствовать гетеродимеризации. Одним из примеров этого являются так называемые мутации «выступ-во-впадину», когда стерически громоздкие боковые цепи (выступы) вводят в один Fc, совпадающий со стерически небольшими боковыми цепями (впадины) на противоположном Fc, создавая тем самым стерическую комплементарность, способствующую гетеродимеризации. Другими способами конструирования поверхностей контакта на Fc для гетеродимеризации являются электростатическая комплементарность, слияние с доменами гетеродимеризации, отличными от IgG, или использование природного феномена обмена Fab-плеча IgG4 человека для контроля гетеродимеризации. Примеры гетеродимеризованных биспецифических антител хорошо описаны в литературе, например (Klein С, et al.; MAbs. 2012 Nov-Dec; 4(6):653-663). Особое внимание следует уделить легким цепям в гетеродимерных антителах. Правильного спаривания LC и НС можно достичь путем применения общей легкой цепи. Опять же, конструирование поверхности контакта LC/HC можно использовать для стимуляции гетеродимеризации или конструирования перекреста легкой цепи, как в CrossMabs. Повторную сборку антител in vitro в мягких восстанавливающих условиях из двух отдельных IgG, содержащих соответствующие мутации, также можно использовать для получения биспецифических антител (например, Labrijn et al., PNAS, 110, 5145-5150 (2013)). Также сообщается, что природный способ обмена Fab-плеча обеспечивает правильное спаривание легких цепей.
Молекулы на основе полиспецифических антител также можно экспрессировать рекомбинантно в виде слитых белков, объединяющих природные модули IgG с образованием полиспецифических и поливалентных производных антител, как описано в литературе. Примерами слитых антител являются DVD-Ig, IgG-scFV, диатела, DART и т.д. В слитые белки можно вводить специфические метки для обнаружения или очистки, фрагменты для удлинения времени полужизни или другие компоненты. Дополнительные, не относящиеся к IgG, атрибуты также можно вводить в слитые белки. Биспецифические антитела полной длины, основанные на гетеродимеризации Fc, обычно называют асимметричными IgG, независимо от методологии спаривания LC.
Как правило, биспецифические антитела можно получать в различных молекулярных форматах, как описано Brinkmann et al. (Brinkmann et al. The making of bispecific antibodies. Mabs 9, 182-212 (2017)).
Молекулы на основе полиспецифических антител также можно получать путем химической конъюгации или сопряжения отдельных IgG полной длины или сопряжения фрагментов IgG с образованием полиспецифических и поливалентных производных антител, как описано в литературе. Примерами являются химически сопряженные Fab-фрагменты, димер IgG и т.д. В конъюгированные белки можно вводить специфические метки для обнаружения или очистки, молекулы для удлинения времени полужизни или другие компоненты. Дополнительные не относящиеся к IgG полипептиды также можно вводить в слитые белки. Полиспецифические молекулы также можно получать путем объединения рекомбинантных и химических способов, в том числе описанных выше.
В одном аспекте антитело по настоящему изобретению представляет собой химерное антитело, человеческое антитело или гуманизированное антитело. Такое антитело можно получать с использованием, например, подходящих платформ для дисплея антител или иммунизации или других подходящих платформ или способов, известных из уровня техники. Используемый в данном документе термин «человеческое антитело» предназначен для обозначения антител, имеющих вариабельные домены, в которых по меньшей мере часть каркасной области и/или по меньшей мере часть области CDR получены из последовательностей иммуноглобулина зародышевой линии человека. Например, человеческое антитело может иметь вариабельные домены, в которых как каркасные, так и CDR-области получены из последовательностей иммуноглобулина зародышевой линии человека. Кроме того, если антитело содержит константную область, то константная область или ее часть также получены из последовательностей иммуноглобулина зародышевой линии человека. Человеческие антитела по настоящему изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, вводимые случайным или сайт-специфичным мутагенезом in vitro или соматической мутацией in vivo).
Такое человеческое антитело может быть человеческим моноклональным антителом. Такое человеческое моноклональное антитело может вырабатываться гибридомой, которая включает В-клетку, полученную от трансгенного животного, отличного от человека, например трансгенной мыши, имеющей геном, включающий репертуары генных сегментов тяжелой и легкой цепей иммуноглобулина человека, слитую с иммортализованной клеткой.
Человеческие антитела можно выделять из библиотек последовательностей, построенных на выборках последовательностей зародышевой линии человека, дополнительно модифицированных с помощью введения природного и синтетического разнообразия последовательностей.
Человеческие антитела можно получать путем иммунизации человеческих лимфоцитов in vitro с последующей трансформацией лимфоцитов вирусом Эпштейна-Барра.
Человеческие антитела можно получать рекомбинантными способами, известными из уровня техники.
Термин «производное человеческого антитела» относится к любой модифицированной форме человеческого антитела, такой как конъюгат антитела и другого средства или антитела.
Используемый в данном документе термин «гуманизированное антитело» относится к человеческому/отличному от человеческого антителу, которое содержит последовательность (области CDR или их части), полученную из иммуноглобулина, отличного от человеческого. Таким образом, гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное антитело), в котором остатки из по меньшей мере гипервариабельной области реципиента заменены остатками из гипервариабельной области антитела вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат, отличный от человека, которое обладает необходимой специфичностью, аффинностью, составом и функциональностью последовательности. В некоторых случаях каркасные (FR) остатки человеческого иммуноглобулина заменяют соответствующими остатками, отличными от человеческих. Примером такой модификации является введение одной или нескольких так называемых обратных мутаций, которые обычно представляют собой аминокислотные остатки, полученные из донорского антитела. Гуманизацию антитела можно осуществлять с использованием рекомбинантных методик, известных специалисту в данной области (см., например, Antibody Engineering, Methods in Molecular Biology, vol. 248, edited by Benny K. Lo). Подходящий человеческий реципиентный каркас для вариабельного домена как легкой, так и тяжелой цепи, можно идентифицировать, например, по гомологии последовательности или структуры. В качестве альтернативы, можно использовать установленные реципиентные каркасы, например на основе знания структуры, биофизических и биохимических свойств. Реципиентные каркасы можно получать из зародышевой линии или получать из последовательности зрелого антитела. Области CDR от донорского антитела можно перенести с помощью прививки CDR. CDR-привитое гуманизированное антитело можно дополнительно оптимизировать, например, в отношении аффинности, функциональности и биофизических свойств, путем идентификации существенно важных каркасных положений, где повторное введение (обратная мутация) аминокислотного остатка из донорского антитела оказывает благотворное влияние на свойства гуманизированного антитела. В дополнение к обратным мутациям, полученным из донорских антител, гуманизированное антитело можно сконструировать путем введения остатков зародышевой линии в CDR или каркасные области, удаления иммуногенных эпитопов, сайт-направленного мутагенеза, созревания аффинности и т.д.
Более того, гуманизированные антитела могут содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в донорском антителе. Эти модификации делают для дополнительного улучшения характеристик антитела. В целом, гуманизированное антитело будет содержать по меньшей мере один, как правило два, вариабельных домена, в которых все или по сути все области CDR соответствуют областям иммуноглобулина, отличного от человеческого, и в которых все или по сути все остатки FR представляют собой остатки из последовательности иммуноглобулина человека. Гуманизированное антитело может, необязательно, также содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека.
Термин «производное гуманизированного антитела» относится к любой модифицированной форме гуманизированного антитела, такой как конъюгат антитела и химического средства или конъюгат антитела с другим антителом.
Используемый в данном документе термин «химерное антитело» относится к антителу, содержащему части антител, полученные от двух или более видов. Например, гены, кодирующие такое антитело, включают в себя гены, кодирующие вариабельные домены, и гены, кодирующие константные домены, происходящие от двух разных видов. Например, гены, кодирующие вариабельные домены мышиного моноклонального антитела, можно присоединять к генам, кодирующим константные домены антитела человеческого происхождения.
Кристаллизующийся фрагмент («Fc-участок»/«Fc-домен») антитела представляет собой С-концевую область антитела, которая содержит шарнир и константные домены CH2 и CH3. Fc-домен может взаимодействовать с рецепторами клеточной поверхности, называемыми Fc-рецепторами, а также с некоторыми белками системы комплемента. Fc-область позволяет антителам взаимодействовать с иммунной системой. В одном аспекте настоящего изобретения антитела можно сконструировать с включением модификаций в Fc-области, обычно для изменения одного или нескольких ее функциональных свойств, таких как время полужизни в сыворотке крови, связывание комплемента, связывание с Fc-рецептором, стабильность белка и/или антиген-зависимая клеточная цитотоксичность или ее отсутствие, среди прочего. Кроме того, антитело по настоящему изобретению можно химически модифицировать (например, к антителу можно присоединять одну или более химических групп) или модифицировать для изменения его гликозилирования, опять же, для изменения одного или нескольких функциональных свойств антитела. Антитело IgG1 может нести модифицированный Fc-домен, содержащий одну или более и, возможно, все следующие мутации, которые приведут к снижению аффинности к определенным Fc-гамма-рецепторам (L234A, L235E и G237A) и к уменьшению опосредованного C1q связывания комплемента (A330S и P331S), соответственно (нумерация остатков в соответствии с индексом EU). В качестве альтернативы, можно использовать другие аминокислотные замены и их комбинации и комбинации с вышеупомянутым, известные из уровня техники, чтобы получить измененное (уменьшенное или увеличенное) связывание Fc-гамма-рецептора.
Изотип антитела по настоящему изобретению может представлять собой IgG, такой как IgG1, такой как IgG2, такой как IgG4. При желании класс антитела можно «переключить» известными методиками. Например, у антитела, которое первоначально было получено в виде молекулы IgM, можно переключать класс на антитело IgG. Методики переключения классов также можно использовать для преобразования одного подкласса IgG в другой, например: из IgG1 в IgG2 или IgG4; из IgG2 в IgG1 или IgG4; или из IgG4 в IgG1 или IgG2. Можно также выполнять конструирование антител с получением химерных по константной области молекул путем объединения областей из разных подклассов IgG.
В одном варианте осуществления шарнирную область антитела модифицируют таким образом, что количество остатков цистеина в шарнирной области изменяется, например увеличивается или уменьшается. Этот подход дополнительно описан, например, в патенте США №5677425 от Bodmer et al.
Константную область можно модифицировать для стабилизации антитела, например для снижения риска разделения бивалентного антитела на полуантитела. Например, в константной области lgG4 остаток S228 (согласно индексу нумерации по EU и S241 по Kabat) можно мутировать в остаток пролина (Р) для стабилизации образования дисульфидного мостика между тяжелыми цепями в шарнире (см., например, Angal etal. Mol Immunol. 1993; 30:105-8).
Антитела или их фрагменты можно определить с точки зрения их определяющих комплементарность областей (CDR). Термин «определяющая комплементарность область» или «гипервариабельная область» при применении в данном документе относится к областям антитела, в которых находятся аминокислотные остатки, участвующие в связывании антигена. Область гипервариабельности или CDR можно идентифицировать как области с самой высокой вариабельностью при аминокислотном выравнивании вариабельных доменов антител. Можно использовать базы данных для идентификации CDR, такие как база данных Kabat, где CDR, например, определяются как содержащие аминокислотные остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельного домена легкой цепи и 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; (Kabat et al. 1991; Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В качестве альтернативы, CDR можно определить как те остатки из «гипервариабельной петли» (остатки 26-33 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol. 1987; 196:901-917). Как правило, нумерацию аминокислотных остатков в этой области выполняют способом, описанным в Kabat et al. выше. Такие фразы, как «положение по Kabat», «остаток по Kabat» и «в соответствии с Kabat» в данном документе, относятся к этой системе нумерации для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи. При применении системы нумерации по Kabat, фактическая линейная аминокислотная последовательность пептида может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению или вставке в каркас (FR) или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать аминокислотные вставки (остатки 52а, 52b и 52с в соответствии с Kabat) после остатка 52 из CDR Н2 и вставленные остатки (например, остатки 82а, 82b и 82с и т.д. в соответствии с Kabat) после остатка 82 из FR тяжелой цепи. Нумерацию остатков по Kabat можно определить для данного антитела путем выравнивания по областям гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Kabat.
Термин остатки «каркасной области» или «FR» относятся к тем аминокислотным остаткам VH или VL, которые не находятся в CDR, как определено в данном документе.
Антитело по настоящему изобретению может содержать область CDR из одного или нескольких специфичных антител, раскрытых в данном документе.
Термин «прокоагулянтное антитело» относится к антителу, которое усиливает свертывание крови, например, путем ускорения процесса свертывания крови и/или увеличения ферментативной активности одного или нескольких факторов свертывания крови.
Термин «прокоагулянтная активность» относится к способности соединения, такого как антитело, усиливать свертывание крови, например, путем ускорения процесса свертывания крови и/или увеличения ферментативной активности одного или нескольких факторов свертывания крови.
Термин «антиген» (Ag) относится к молекулярному объекту, используемому для иммунизации иммунокомпетентного позвоночного животного с образованием антитела (Ab), которое распознает Ag. В данном документе Ag определяется более широко и обычно предназначен для включения целевых молекул, которые специфически распознаются Ab, таким образом, включая фрагменты или имитаторы молекулы, используемой в процессе иммунизации или в другом процессе, например фаговом дисплее, используемом для выработки Ab.
Термин «эпитоп», используемый в данном документе, определен в контексте молекулярного взаимодействия между «антигенсвязывающим полипептидом», таким как антитело (Ab), и его соответствующим антигеном (Ag). Обычно «эпитоп» относится к области или участку на Ag, с которым связывается Ab, т.е. к области или участку физического контакта с Ab. Физический контакт можно определить с использованием различных критериев (например, расстояние отсечения 2-6  , такое как 3
, такое как 3 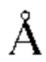 , такое как 3,5
, такое как 3,5 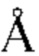 , такое как 4
, такое как 4 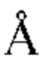 , такое как 4,5
, такое как 4,5 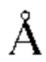 , такое как 5
, такое как 5 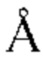 , или доступность для растворителя) для атомов в молекулах Ab и Ag.
, или доступность для растворителя) для атомов в молекулах Ab и Ag.
FIX/FIXa и FX/FXa могут содержать ряд различных эпитопов, которые могут включать, без ограничения, (1) линейные пептидные эпитопы, (2) конформационные эпитопы, которые состоят из одной или нескольких несмежных аминокислот, расположенных рядом друг с другом в зрелой конформации FIX/FIXa или FX/FXa; и (3) эпитопы, которые состоят, полностью или частично, из молекулярных структур, ковалентно присоединенных к FIX/FIXa или FX/FXa, таких как углеводные группы.
Эпитоп для данной пары антитело (Ab)/антиген (Ag) можно описать и охарактеризовать на разных уровнях детализации с использованием различных экспериментальных и вычислительных способов картирования эпитопов. Экспериментальные способы включают мутагенез, рентгеновскую кристаллографию, ядерную магнитно-резонансную (ЯМР) спектроскопию, масс-спектрометрию водородно-дейтериевого обмена (HDX-MS) и различные способы конкурентного связывания; способы, которые известны из уровня техники. Поскольку каждый способ основан на уникальном принципе, описание эпитопа тесно связано со способом, с помощью которого он был определен. Таким образом, в зависимости от используемого способа картирования эпитопа, эпитоп для данной пары Ab/Ag можно описать по-разному.
В контексте полученной с помощью рентгеновских лучей кристаллической структуры, определяемой пространственными координатами комплекса между Ab, например Fab-фрагментом, и его Ag, термин эпитоп в данном документе, если иное не указано или не противоречит контексту, конкретно определен как остатки FIX/FIXa или FX, характеризующиеся наличием тяжелого атома (т.е. атома, отличного от водорода) на расстоянии 3,5 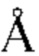 от тяжелого атома в Ab.
от тяжелого атома в Ab.
Эпитопы, описанные на уровне аминокислот, например, определенные по рентгеновской структуре, считаются идентичными, если они содержат одинаковый набор аминокислотных остатков. Считается, что эпитопы перекрываются, если по меньшей мере один аминокислотный остаток является общим для эпитопов. Считается, что эпитопы являются отдельными (уникальными), если нет аминокислотных остатков, которые являются общими для эпитопов.
Определение термина «паратоп» получено из приведенного выше определения «эпитоп» путем изменения перспективы. Таким образом, термин «паратоп» относится к области или участку на Ab, с которым связывается Ag, т.е. с помощью которого оно вступает в физический контакт с Ag.
В контексте полученной с помощью рентгеновских лучей кристаллической структуры, определяемой пространственными координатами комплекса между Ab, таким как Fab-фрагмент, и его Ag, термин паратоп в данном документе, если иное не указано или не противоречит контексту, конкретно определен как остатки Ab, характеризующиеся наличием тяжелого атома (т.е. атома, отличного от водорода) на расстоянии 3,5 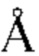 от тяжелого атома в FIX/FIXa или FX.
от тяжелого атома в FIX/FIXa или FX.
Эпитоп и паратоп для данной пары антитело (Ab)/антиген (Ag) можно идентифицировать обычными способами. Например, общее местоположение эпитопа можно определить путем оценки способности антитела связываться с различными фрагментами или вариантами FIX/FIXa или FX. Специфичные аминокислоты в FIX/FIXa или FX, которые вступают в контакт с антителом (эпитоп), и специфичные аминокислоты в антителе, которые вступают в контакт с FIX/FIXa или FX (паратоп), также можно определять обычными способами. Например, можно объединять антитело и целевую молекулу и можно кристаллизовать комплекс Ab:Ag. Кристаллическую структуру комплекса можно определять и использовать для идентификации конкретных участков взаимодействия между антителом и его мишенью.
Эпитопы на антигене могут содержать один или более остатков «горячей точки», т.е. остатков, которые особенно важны для взаимодействия с родственным антителом, и где взаимодействия, опосредованные боковой цепью указанного остатка «горячей точки», вносят значительный вклад в энергию связывания для взаимодействия антитело/антиген (Peng et al. (2014) PNAS 111, E2656-E2665). Остатки «горячей точки» можно идентифицировать путем тестирования вариантов антигена (в данном документе FIX/FIXa и FX), в которых отдельные остатки эпитопа были заменены, например аланином, в отношении связывания с родственным антителом. Если замена остатка эпитопа аланином оказывает сильное влияние на связывание с антителом, то указанный остаток эпитопа считается остатком «горячей точки» и, следовательно, имеет особое значение для связывания антитела с антигеном.
Антитела, которые связываются с одним и тем же антигеном, можно охарактеризовать с точки зрения их способности связываться с их общим антигеном одновременно и можно подвергать «конкурентному связыванию»/«категоризации». В контексте настоящего изобретения термин «категоризация» относится к способу группировки антител, которые связываются с одним и тем же антигеном. «Категоризация» антител может быть основана на конкурентном связывании двух антител с их общим антигеном в анализах на основании стандартных методик.
«Категорию» антитела определяют с использованием эталонного антитела. Если второе антитело не способно связываться с антигеном в то же время, что и эталонное антитело, то говорят, что второе антитело относится к той же «категории», что и эталонное антитело. В этом случае эталон и второе антитело конкурентно связывают одну и ту же часть антигена и представляют собой «конкурирующие антитела». Если второе антитело способно связываться с антигеном одновременно с эталонным антителом, то говорят, что второе антитело относится к отдельной «категории». В этом случае эталон и второе антитело не связывают конкурентно одну и ту же часть антигена и представляют собой «не конкурирующие антитела».
«Категоризация» антител не дает прямой информации об эпитопе.
Конкурирующие антитела, т.е. антитела, принадлежащие к одной и той же «категории», могут иметь идентичные эпитопы, перекрывающиеся эпитопы или даже отдельные эпитопы. Последнее имеет место, если эталонное антитело, связанное со своим эпитопом на антигене, занимает пространство, необходимое для того, чтобы второе антитело вошло в контакт со своим эпитопом на антигене («стерическое затруднение»). Не конкурирующие антитела обычно имеют отдельные эпитопы. Таким образом, в некоторых вариантах осуществления антитела по настоящему изобретению будут связываться с тем же эпитопом, что и по меньшей мере одно из антител, конкретно раскрытых в данном документе.
Конкурентные анализы для определения того, конкурирует ли антитело за связывание с антителом к FIX/FIXa или антителом к X, раскрытыми в данном документе, известны из уровня техники. Иллюстративные конкурентные анализы включают иммунологические анализы (например, анализы ELISA, анализы RIA), анализ с использованием поверхностного плазмонного резонанса (например, с использованием прибора BIAcore™), интерферометрию биослоев (ForteBio®) и проточную питометрию.
Как правило, конкурентный анализ предусматривает применение антигена, связанного с твердой поверхностью или экспрессируемого на клеточной поверхности, тестируемого FIX- или FIXa-связывающего антитела и эталонного антитела. Эталонное антитело метят, а тестируемое антитело не метят. Конкурентное ингибирование измеряют путем определения количества меченого эталонного антитела, связанного с твердой поверхностью или клетками в присутствии тестируемого антитела. Обычно тестируемое антитело присутствует в избытке (например, в 1, 5, 10, 20, 100, 1000, 10000 или 100000 раз). Антитела, идентифицированные как конкурировавшие в конкурентном анализе (т.е. конкурирующие антитела), включают в себя антитела, связывающиеся с тем же эпитопом или с перекрывающимися эпитопами, что и эталонное антитело, и антитела, связывающиеся с соседним эпитопом, достаточно проксимальным к эпитопу, связанному с эталонным антителом, для возникновения стерических помех.
В иллюстративном конкурентном анализе эталонное антитело к FIX или к FIXa биотинилируют с использованием коммерчески доступных реагентов. Биотинилированное эталонное антитело смешивают с серийными разведениями тестируемого антитела или немеченого эталонного антитела (контроль самоконкуренции), что приводит к смеси различных молярных соотношений (например, в 1, 5, 10, 20, 100, 1000, 10000 или 100000 раз) тестируемого антитела (или немеченого эталонного антитела) с меченым эталонным антителом. Смесь антител добавляют в планшет для ELISA, покрытый полипептидом FIX или FIXa. Затем планшет промывают и добавляют в планшет пероксидазу хрена (HRP)-стрептавидин в качестве реагента для обнаружения. Количество меченого эталонного антитела, связанного с целевым антигеном, определяют после добавления хромогенного субстрата (например, ТМВ (3,3',5,5'-тетраметилбензидин) или ABTS (2,2''-азино-ди-(3-этилбензтиазолин-6-сульфонат)), которые известны из уровня техники. Показания оптической плотности (единицы OD) получают с помощью спектрометра (например, спектрометр SpectraMax® М2 (Molecular Devices)). Ответ (единицы OD), соответствующий нулевому проценту ингибирования, определяют по лункам без какого-либо конкурирующего антитела. Ответ (единицы OD), соответствующий 100% ингибированию, т.е. фону анализа, определяют по лункам без какого-либо меченого эталонного антитела или тестируемого антитела. Процент ингибирования меченого эталонного антитела к FIX или FIXa тестируемым антителом (или немеченым эталонным антителом) в каждой концентрации рассчитывают следующим образом: % ингибирования = (1 - (единицы OD - 100% ингибирования) / (0% ингибирования - 100% ингибирования))* 100.
Специалисту в данной области будет понятно, что аналогичные анализы можно выполнить для определения того, имеют ли два или более антитела к FX/FXa общую область связывания, категорию и/или конкурентно связывают антиген. Специалисты в данной области также признают, что конкурентный анализ можно проводить с использованием различных систем обнаружения, известных из уровня техники.
Тестируемое антитело конкурирует с эталонным антителом за связывание с антигеном, если избыток одного антитела (например, в 1, 5, 10, 20, 100, 1000, 10000 или 100000 раз) ингибирует связывание другого антитела, например на по меньшей мере 50%, 75%, 90%, 95% или 99%, как измерено в анализе конкурентного связывания.
Если не указано иное, конкуренцию определяют с помощью конкурентного анализа ELISA, как описано выше.
Термин «аффинность связывания» используется в данном документе как мера силы нековалентного взаимодействия между двумя молекулами, например антителом или его фрагментом и антигеном. Термин «аффинность связывания» используется для описания моновалентных взаимодействий.
Аффинность связывания между двумя молекулами, например антителом или его фрагментом и антигеном, посредством моновалентного взаимодействия можно количественно определить путем определения равновесной константы диссоциации (KD). KD можно определить путем измерения кинетики образования и диссоциации комплекса, например способом поверхностного плазмонного резонанса (SPR) или способом изотермической титрационной калориметрии (ITC). Константы скорости, соответствующие ассоциации и диссоциации моновалентного комплекса, упоминаются как константа скорости ассоциации ka (или kon) и константа скорости диссоциации kd (или koff) соответственно. KD соотносится с ka и kd через уравнение KD=kd / ka.
Следуя приведенному выше определению, аффинности связывания, ассоциированные с различными молекулярными взаимодействиями, такие как сравнение аффинности связывания различных антител для данного антигена, можно сравнивать путем сравнения значений KD для отдельных комплексов антитело/антиген.
Значение константы диссоциации можно определить напрямую хорошо известными способами. Стандартные анализы для оценки способности связывания лигандов, таких как антитела, с мишенями известны из уровня техники и включают, например, ELISA, вестерн-блоты, RIA и анализ способом проточной цитометрии. Кинетику связывания и аффинность связывания антитела также можно оценить с помощью стандартных анализов, известных из уровня техники, таких как SPR. Однако предпочтительно, чтобы можно было использовать изотермическую титрационную калориметрию (ITC) для измерения аффинности взаимодействия антитело/мишень, а также для получения термодинамических параметров взаимодействия.
Можно провести анализ конкурентного связывания, в котором связывание антитела с мишенью сравнивают со связыванием мишени другим лигандом этой мишени, таким как другое антитело.
Антитело по настоящему изобретению может иметь KD для своей мишени 1×10-4 М или менее, 1×10-5 М или менее, 1×10-6 М или менее, 1×10-7 М или менее, 1×10-8 М или менее, или 1×10-9 М или менее, или 1×10-10 М или менее, 1×10-11 М или менее, 1×10-12 М или менее, 1×10-13 М или менее или 1×10-14 М или менее.
KD антитела по настоящему изобретению может составлять менее чем 100 мкМ, как, например, менее чем 10 мкМ, как, например, менее чем 1 мкМ, как, например, менее чем 0,9 мкМ, как, например, менее чем 0,8 мкМ, как, например, менее чем 0,7 мкМ, как, например, менее чем 0,6 мкМ, как, например, менее чем 0,5 мкМ, как, например, менее чем 0,4 мкМ, как, например, менее чем 0,3 мкМ, как, например, менее чем 0,2 мкМ, как, например, менее чем 0,1 мкМ.
В одном таком варианте осуществления антитело представляет собой биспецифическое антитело, содержащее плечо к FX с KD в отношении FX менее чем 100 мкМ, как, например, менее чем 10 мкМ, как, например, менее чем 1 мкМ, как, например, менее чем 0,9 мкМ, как, например, менее чем 0,8 мкМ, как, например, менее чем 0,7 мкМ, как, например, менее чем 0,6 мкМ, как, например, менее чем 0,5 мкМ, как, например, менее чем 0,4 мкМ, как, например, менее чем 0,3 мкМ, как, например, менее чем 0,2 мкМ, как, например, менее чем 0,1 мкМ, как, например, менее чем 0,09 мкМ, как, например, менее чем 0,08 мкМ, как, например, менее чем 0,07 мкМ, как, например, менее чем 0,06 мкМ, как, например, менее чем 0,05 мкМ, как, например, менее чем 0,04 мкМ, как, например, менее чем 0,03 мкМ, как, например, менее чем 0,02 мкМ, как, например, менее чем 0,01 мкМ, как, например, менее чем 9 нМ, как, например, менее чем 8 нМ, как, например, менее чем 7 нМ, как, например, менее чем 6 нМ, как, например, менее чем 5 нМ, как, например, менее чем 4 нМ, как, например, менее чем 3 нМ, как, например, менее чем 2 нМ, как, например, менее чем 1 нМ, как, например, менее чем 0,5 нМ.
Антитела и их фрагменты антител, описанные в данном документе, можно объединять с другими антителами и фрагментами антител, известными из уровня техники, с образованием молекул биспецифических, триспецифических или полиспецифических антител. Соединения, имитирующие функцию кофактора FVIII, ранее были созданы с использованием других доменов, связывающих FIX/IXa и FX/Xa, каждое из которых потенциально может заменять описанные в данном документе домены, связывающие FIX/IXa и/или FX/Xa. Таким образом, ясно, что связывающие FIX/IXa и FX/Xa домены по настоящему изобретению представляют отдельный интерес в качестве индивидуальных молекул, а также в качестве «промежуточных соединений» как части би-, три- или полиспецифического антитела, содержащего по меньшей мере один домен, связывающий FIX/IXa и/или FX/Xa.
Активность прокоагулянтных антител, включая би-, три- и полиспецифические антитела, можно определять способами, известными из уровня техники. Стандартные анализы включают тест тромбинообразования (TGT) в цельной крови, измерение времени свертывания с помощью тромбоэластографии (TEG) и анализы с образованием FXa.
Идентичность
Термин «идентичность», как известно в данной области, относится к взаимосвязи между последовательностями двух или более полипептидов, определяемой путем сравнения последовательностей. В данной области «идентичность» также означает степень родства последовательностей между полипептидами, определяемую по количеству совпадений между цепочками двух или более аминокислотных остатков. «Идентичность» измеряется в процентах идентичных совпадений между меньшей из двух или более последовательностями с выравниваниями гэпов (если они есть) с применением конкретной математической модели или компьютерной программы (т.е. «алгоритмов»). Идентичность родственных полипептидов можно легко рассчитать известными способами. Такие способы включают, без ограничения, способы, описанные в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991 и Carillo et al. SIAM J. Applied Math. 1988; 48:1073.
Предпочтительные способы определения идентичности предназначены для обеспечения наибольшего совпадения между протестированными последовательностями. Способы определения идентичности описаны в общедоступных компьютерных программах. Предпочтительные способы с применением компьютерных программ для определения идентичности между двумя последовательностями включают в себя пакет программ GCG, включая GAP (Devereux et al. Nucl. Acid. Res. 1984; 12:387); Genetics Computer Group, Висконсинский университет, Мэдисон, Висконсин), BLASTP, BLASTN и FASTA (Altschul et al. J. Mol. Biol. 1990; 215:403-410). Программа BLASTX общедоступна от Национального центра биотехнологической информации (NCBI) и из других источников (BLAST Manual, Altschul et al. NCB/NLM/NIH Бетесда, Мэриленд 20894; Altschul et al. выше). Хорошо известный алгоритм Смита-Уотермана также можно использовать для определения идентичности.
Например, используя компьютерный алгоритм GAP (Genetics Computer Group, Висконсинский университет, Мэдисон, Висконсин), два полипептида, для которых определяется процентная идентичность последовательности, выравнивают для оптимального совпадения их соответствующих аминокислот («длина совпадения», как определено алгоритмом). Штраф за введение гэпа (который рассчитывается как 3-кратная средняя диагональ; «средняя диагональ» - это среднее значение диагонали используемой матрицы сравнений; «диагональ» - это оценка или число, присвоенное каждому идеальному совпадению аминокислот конкретной матрицей сравнений) и штраф за продолжение гэпа (который обычно равен {доле (1/10)} от штрафа за введение гэпа), а также матрицу сравнений, такую как РАМ 250 или BLOSUM 62, используют в сочетании с алгоритмом. Стандартную матрицу сравнений (см. Dayhoff et al. 1978; Atlas of Protein Sequence and Structure, vol. 5, supp. 3 в отношении матрицы сравнений РАМ 250; Henikoff et al. PNAS 1992; 89:10915-10919 в отношении матрицы сравнений BLOSUM 62) также используют в алгоритме.
Предпочтительные параметры для сравнения пептидных последовательностей включают следующее: алгоритм: Needleman et al. J. Mol. Biol. 1970; 48:443-453; матрица сравнений: BLOSUM 62 из Henikoff et al. PNAS 1992; 89:10915-10919; штраф за введение гэпа: 12, штраф за продолжение гэпа: 4, порог сходства: 0.
Программа GAP полезна с указанными выше параметрами. Вышеупомянутые параметры являются параметрами по умолчанию для сравнения пептидов (наряду с отсутствием штрафа за закрытие гэпа) с использованием алгоритма GAP.
Термин «сходство» является родственным понятием, но в отличие от «идентичности» относится к взаимосвязи последовательностей, которая включает в себя как идентичные совпадения, так и совпадения консервативных замен. Если две полипептидные последовательности имеют, например, (долю (10/20)) идентичных аминокислот, а все остальные являются неконсервативными заменами, то процент идентичности и сходства будет равен 50%. Если в том же примере есть еще 5 положений с консервативными заменами, то процент идентичности составляет 25%, а процент сходства будет равен 75% ((доля (15/20))). Следовательно, в случаях, когда имеются консервативные замены, степень сходства между двумя полипептидами будет выше, чем процент идентичности между этими двумя полипептидами.
Фармацевтические составы
В другом аспекте настоящее изобретение относится к композициям и составам, содержащим соединения по настоящему изобретению, такие как антитела, описанные в данном документе. Например, в настоящем изобретении предусмотрена фармацевтическая композиция, которая содержит одно или более антител по настоящему изобретению, составленных вместе с фармацевтически приемлемым носителем.
Соответственно, одна цель настоящего изобретения состоит в том, чтобы предложить фармацевтический состав, содержащий такое антитело, которое присутствует в концентрации от 0,25 мг/мл до 250 мг/мл, и где указанный состав имеет рН от 2,0 до 10,0. Состав может дополнительно содержать одно или более из буферной системы, консерванта, средства регуляции тоничности, хелатообразующего средства, стабилизатора или поверхностно-активного вещества, а также различных их комбинаций. Применение консервантов, изотонических средств, хелатообразующих средств, стабилизаторов и поверхностно-активных веществ в фармацевтических композициях хорошо известно специалисту. Можно сослаться на Remington: The Science and Practice of Pharmacy, 19th edition, 1995.
В одном варианте осуществления фармацевтический состав представляет собой водный состав. Такой состав, как правило, представляет собой раствор или суспензию, но также может включать коллоиды, дисперсии, эмульсии и многофазные материалы. Термин «водный состав» определяется как состав, содержащий по меньшей мере 50% вес/вес воды. Аналогично, термин «водный раствор» определяется как раствор, содержащий по меньшей мере 50% вес/вес воды, а термин «водная суспензия» определяется как суспензия, содержащая по меньшей мере 50% вес/вес воды.
В другом варианте осуществления фармацевтический состав представляет собой лиофилизированный состав, к которому врач или пациент добавляет растворители и/или разбавители перед применением.
В дополнительном аспекте фармацевтический состав содержит водный раствор такого антитела и буфер, где антитело присутствует в концентрации от 1 мг/мл или выше, и где указанный состав имеет рН от приблизительно 2,0 до приблизительно 10,0.
Введение
Соединение по настоящему изобретению, такое как антитело, можно вводить парентерально, например внутривенно, например внутримышечно, например подкожно. В качестве альтернативы, антитело по настоящему изобретению можно вводить не парентеральным путем, например периорально или местно. Антитело по настоящему изобретению можно вводить профилактически. Антитело по настоящему изобретению можно вводить терапевтически (по требованию).
Дозы
Доза подлежащих доставке соединений может составлять от приблизительно 0,01 мг до 500 мг соединения в день, предпочтительно от приблизительно 0,1 мг до 250 мг в день и более предпочтительно от приблизительно 0,5 мг до приблизительно 250 мг в день, в неделю, в две недели или в месяц в качестве нагрузочных и поддерживающих доз в зависимости от тяжести состояния. Подходящую дозу также можно отрегулировать для конкретного соединения на основе свойств этого соединения, включая его время полужизни in vivo или среднее время удержания и его биологическую активность. Например, подлежащие доставке соединения можно вводить в одном варианте осуществления один раз в неделю, или в другом варианте осуществления один раз в две недели, или в другом варианте осуществления один раз в месяц и в любом из указанных вариантов осуществления в дозе, например, 0,25, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или 10 мг на кг массы тела.
Композиции, содержащие соединения, раскрытые в данном документе, можно вводить для профилактического и/или в некоторых вариантах осуществления терапевтического лечения. В терапевтических применениях композиции вводят субъекту, уже страдающему от заболевания, такого как любое нарушение свертываемости крови, как описано выше, в количестве, достаточном для излечения, облегчения или частичной задержки заболевания и его осложнений. Количество, достаточное для достижения подобного, определяется как «терапевтически эффективное количество». Как будет понятно специалисту в данной области, количества, эффективные для этой цели, будут зависеть от тяжести заболевания или повреждения, а также от веса и общего состояния субъекта.
Варианты осуществления
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Н256 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Н257 из FIX (SEQ ID NO: 1) или его активированной формы FIXa.
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток N258 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток K293 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток K301 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток D332 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток R333 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток A334 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Т335 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток L337 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток R338 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток S339 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Т340 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток K341 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Т343 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток N346 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток R403 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Y404 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток N406 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток W407 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток Е410 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остаток K411 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остатки L337, R338, S339, Т340, K341 и Т343 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остатки K301, D332, R333, А334, Т335, R338 и N346 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать эпитоп, содержащий остатки Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из FIX (SEQ ID NO: 1) или его активированной формы (FIXa).
В одном варианте осуществления антитело по настоящему изобретению способно связывать FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело конкурирует с Fab7236 за связывание с FIX.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело конкурирует с Fab7237 за связывание с FIX.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело конкурирует с Fab7238 за связывание с FIX.
В одном варианте осуществления антитело по настоящему изобретению связывает FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело принадлежит к той же «категории», что и Fab7236.
В одном варианте осуществления антитело по настоящему изобретению связывает FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело принадлежит к той же «категории», что и Fab7237.
В одном варианте осуществления антитело по настоящему изобретению связывает FIX (SEQ ID NO: 1) или его активированную форму (FIXa), где антитело принадлежит к той же «категории», что и Fab7238.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX (SEQ ID NO: 2) или его активированную форму FXa, где антитело конкурирует с антителом, содержащим CDR из mAb1-6723.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит вариабельные домены из mAb1-6723 в соответствии с SEQ ID NO: 21 и SEQ ID NO: 22.
В одном варианте осуществления антитело по настоящему изобретению способно специфически связывать FX/FXa, где антитело содержит CDR из mAb1-6723 в соответствии с SEQ ID NO: 21 и SEQ ID NO: 22.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и Fab, содержащий вариабельные домены из mAb1-6723 в соответствии с SEQ ID NO: 21 и SEQ ID NO: 22.
В одном варианте осуществления антитело по настоящему изобретению способно специфически связывать FX/FXa, где антитело принадлежит к той же «категории», что и mAb1-6723 в соответствии с SEQ ID NO: 21 и SEQ ID NO: 22.
В одном варианте осуществления антитело по настоящему изобретению способно специфически связывать FX/FXa, где антитело принадлежит к той же «категории», что и антитело или Fab, содержащий антигенсвязывающий домен в соответствии с SEQ ID NO: 21 и SEQ ID NO: 22.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело конкурирует с антителом, содержащим CDR из mAb1-1371.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит вариабельные домены из mAb1-1371 в соответствии с SEQ ID NO: 65 и SEQ ID NO: 66.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит CDR из mAb1-1371 в соответствии с SEQ ID NO: 65 и SEQ ID NO: 66.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», упомянутой в данном документе как «категория А», что и Fab, содержащий вариабельные домены из mAb1-1371 в соответствии с SEQ ID NO: 65 и SEQ ID NO: 66.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и mAb1-1371 в соответствии с SEQ ID NO: 65 и SEQ ID NO: 66.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и антитело или Fab, содержащий антигенсвязывающий домен в соответствии с SEQ ID NO: 65 и SEQ ID NO: 66.
В одном варианте осуществления антитело по настоящему изобретению способно специфически связывать FX/FXa, где данное антитело конкурирует с антителом, содержащим CDR из mAb1-1376, mAb1-6705, mAb1-7388 или mAb1-7563. Такие антитела в данном документе упоминаются как принадлежащие к категории В.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит вариабельные домены из mAb1-1376, mAb1-6705, mAb1-7388 или mAb1-7563, определяемые согласно SEQ ID NO: 67 и 68, SEQ ID NO: 23 и 24, SEQ ID NO: 39 и 40 и SEQ ID NO: 59 и 60 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит CDR из mAb1-1376, mAb1-6705, mAb1-7388 или mAb1-7563, определяемые согласно SEQ ID NO: 67 и 68, SEQ ID NO: 23 и 24, SEQ ID NO: 39 и 40 и SEQ ID NO: 59 и 60 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и Fab, содержащий вариабельные домены из mAb1-1376, mAb1-6705, mAb1-7388 или mAb1-7563, определяемые согласно SEQ ID NO: 67 и 68, SEQ ID NO: 23 и 24, SEQ ID NO: 39 и 40 и SEQ ID NO: 59 и 60 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и mAb1-1376, mAb1-6705, mAb1-7388 или mAb1-7563, определяемым согласно SEQ ID NO: 67 и 68, SEQ ID NO: 23 и 24, SEQ ID NO: 39 и 40 и SEQ ID NO: 59 и 60 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и антитело или Fab, содержащий антигенсвязывающий домен в соответствии с SEQ ID NO: 67 и 68, SEQ ID NO: 23 и 24, SEQ ID NO: 39 и 40 или SEQ ID NO: 59 и 60.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит CDR или вариабельные домены из антитела, выбранного из группы, состоящей из: mAb1-6723, 1-6716, 1-6721, 1-6730, 1-6731, 1-6737, 1-6754, 1-7378, 1-7413, 1-7424, 1-7466, 1-7481, 1-7483 и mAb1-7591.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит CDR или вариабельные домены из антитела, выбранного из группы, состоящей из: mAb1-6723, 1-6716, 1-6721, 1-6730, 1-6731, 1-6737, 1-6754, 1-7378, 1-7413, 1-7424, 1-7466, 1-7481, 1-7483, 1-7591, 1-7388, 1-7563, 1-7462 и mAb1-7571.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и mAb, выбранное из группы mAb, содержащих вариабельные последовательности или их CDR, выбранные из: SEQ ID NO: 21 и 22, SEQ ID NO: 25 и 26, SEQ ID NO: 27 и 28, SEQ ID NO: 29 и 30, SEQ ID NO: 31 и 32, SEQ ID NO: 33 и 34, SEQ ID NO: 35 и 36, SEQ ID NO: 37 и 38, SEQ ID NO: 39 и 40, SEQ ID NO: 41 и 42, SEQ ID NO: 43 и 44, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 52, SEQ ID NO: 53 и 54, SEQ ID NO: 55 и 56, SEQ ID NO: 57 и 58, SEQ ID NO: 59 и 60, SEQ ID NO: 61 и 62 и SEQ ID NO: 63 и 64. Эта «категория» антител упомянута в данном документе как категория С и иллюстрируется большим количеством отдельных антител, таких как mAb1-6723, 1-6716, 1-6721, 1-6730, 1-6731, 1-6737, 1-6754, 1-7378, 1-7413, 1-7424, 1-7466, 1-7481, 1-7483, 1-7591, 1-7388, 1-7563, 1-7462 и mAb1-7571.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело конкурирует за связывание с FX, зимогеном FX или FXa с эталонным антителом, выбранным из группы антител, состоящей из mAb, содержащих вариабельные последовательности или их CDR, выбранные из: SEQ ID NO: 21 и 22, SEQ ID NO: 25 и 26, SEQ ID NO: 27 и 28, SEQ ID NO: 29 и 30, SEQ ID NO: 31 и 32, SEQ ID NO: 33 и 34, SEQ ID NO: 35 и 36, SEQ ID NO: 37 и 38, SEQ ID NO: 41 и 42, SEQ ID NO: 43 и 44, SEQ ID NO: 53 и 54, SEQ ID NO: 55 и 56, SEQ ID NO: 57 и 58 и SEQ ID NO: 63 и 64.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением конкурирует за связывание с FX/FXa с антигенсвязывающим фрагментом, содержащим CDR из SEQ ID NO: 21 и 22, SEQ ID NO: 25 и 26, SEQ ID NO: 27 и 28, SEQ ID NO: 29 и 30, SEQ ID NO: 31 и 32, SEQ ID NO: 33 и 34, SEQ ID NO: 35 и 36, SEQ ID NO: 37 и 38, SEQ ID NO: 41 и 42, SEQ ID NO: 43 и 44, SEQ ID NO: 53 и 54, SEQ ID NO: 55 и 56, SEQ ID NO: 57 и 58 или SEQ ID NO: 63 и 64.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело конкурирует с антителом, содержащим CDR из mAb 1-7447, 1-7441, 1-7571 или 1-7462. Они в данном документе упомянуты как антитела категории D.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит вариабельные домены из mAb1-7447, 1-7441, 1-7571 или 1-7462 в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 53 или SEQ ID NO: 61 и 62 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит вариабельные домены из mAb1-7447 или 1-7441 в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело содержит CDR из mAb1-7447,1-7441, 1-7571 или 1-7462 в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 53 или SEQ ID NO: 61 и 62 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa в соответствии с SEQ ID NO: 2, где антитело принадлежит к той же «категории», что и Fab, содержащий вариабельные домены из mAb1-7447, 1-7441, 1-7571 или mAb1-7462 в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 53 или SEQ ID NO: 61 и 62 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и mAb1-7447, 1-7441, 1-7571 или mAb1-7462 в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 53 или SEQ ID NO: 61 и 62 соответственно.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FX/FXa, где антитело принадлежит к той же «категории», что и антитело или Fab, содержащий антигенсвязывающий домен в соответствии с SEQ ID NO: 47 и 48, SEQ ID NO: 45 и 46, SEQ ID NO: 51 и 53 или SEQ ID NO: 61 и 62.
В одном варианте осуществления антитело по настоящему изобретению представляет собой антитело по любому из предшествующих вариантов осуществления, где антитело специфически связывает зимоген FX.
В таком варианте осуществления антитело специфически связывает зимоген FX в соответствии с аминокислотными остатками 1-139, 143-448 из SEQ ID NO: 2.
В одном варианте осуществления антитело по настоящему изобретению представляет собой антитело по любому из предшествующих вариантов осуществления, где антитело связывает FX.
В одном варианте осуществления антитело по настоящему изобретению представляет собой антитело по любому из предшествующих вариантов осуществления, где антитело связывает FXa.
В одном таком варианте осуществления антитело специфически связывает FXa в соответствии с аминокислотными остатками 1-139, 195-448 из SEQ ID NO: 2.
В одном варианте осуществления антитело представляет собой моноспецифическое антитело. В одном варианте осуществления антитело представляет собой полиспецифическое антитело. В одном таком варианте осуществления антитело представляет собой биспецифическое антитело. В одном таком варианте осуществления биспецифическое антитело способно связываться с FIX или его активированной формой (FIXa) и FX/FXa. В одном таком варианте осуществления биспецифическое антитело способно специфически связываться с FIX/FIXa и FX/FXa.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, способное связывать FIX/FIXa и FX/FXa, где домен связывания FIX/FIXa получен из антитела категории 1, а домен связывания FX/FXa получен из антитела категории А.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, связывающее FIX/FIXa и FX/FXa, где домен связывания FIX/FIXa получен из антитела категории 2, а домен связывания FX/FXa получен из антитела категории А.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, связывающее FIX/FIXa и FX/FXa, где домен связывания FIX/FIXa получен из антитела категории 2, а домен связывания FX/FXa получен из антитела категории В.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, связывающее FIX/FIXa и FX/FXa, где домен связывания FIX/FIXa получен из антитела категории 2, а домен связывания FX/FXa получен из антитела категории В.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, связывающее FIX/FIXa и FX/FXa, где домен связывания FIX/FIXa получен из антитела категории 1, а домен связывания FX/FXa получен из антитела категории С или D.
В одном варианте осуществления антитело представляет собой биспецифическое антитело, связывающее FIX/FIXa и FX/FXa, где домены связывания получены из пар mAb, состоящих из: mAb1-1371/mAb1-1307, mAb1-6705/mAb1-1307, mAb1-1371/mAb0-1886, mAb1-7441/mAb0-1886, mAb1-7447/mAb0-1886, mAb1-7481/mAb0-1886, mAb1-1371/mAb0-1998, mAb1-6716/mAb0-1998, mAb1-6723/mAb0-1998, mAb1-6730/mAb0-1998, mAb1-6731/mAb0-1998, mAb1-6737/mAb0-1998, mAb1-6754/mAb0-1998, mAb1-7378/mAb0-1998, mAb1-7441/mAb0-1998, mAb1-7447/mAb0-1998, mAb1-7481/mAb0-1998, mAb1-1371/mAb1-4707, mAb1-6705/mAb1-4707, mAb1-1371/mAb1-4071, mAb1-7441/mAb1-5788, mAb1-7447/mAb1-5788, mAb1-7481/mAb1-5788, mAb1-1371/mAb1-4857, mAb1-6716/mAb1-4857, mAb1-6723/mAb1-4857, mAb1-6730/mAb1-4857, mAb1-6731/mAb1-4857, mAb1-6737/mAb1-4857, mAb1-6754/mAb1-4857, mAb1-7378/mAb1-4857, mAb1-7441/mAb1-4857, mAb1-7447/mAb1-4857 или mAb1-7481/mAb1-4857.
В одном варианте осуществления биспецифическое антитело по настоящему изобретению содержит плечо антитела, связывающееся с FX, и плечо антитела, связывающееся с FIX/FIXa. В одном таком варианте осуществления плечо антитела, связывающееся с FX, связывается с эпитопом, содержащим один или более остатков из активационного пептида FX, и плечо антитела, связывающее FIX/FIXa, связывается с эпитопом, содержащим один или более остатков из протеазного домена FIX.
В одном варианте осуществления антитело по настоящему изобретению представляет собой полиспецифическое антитело, такое как би- или триспецифическое антитело.
В одном варианте осуществления антитело по настоящему изобретению имеет формат IgG, такой как IgG4 полной длины.
В одном варианте осуществления антитело по настоящему изобретению представляет собой химический конъюгат из двух фрагментов антитела, такой как конъюгат из двух Fab-фрагментов или фрагментов scFv или их комбинаций.
В одном варианте осуществления антитело по настоящему изобретению представляет собой человеческое или гуманизированное антитело.
В одном варианте осуществления антитела, раскрытые в данном документе, являются промежуточными соединениями для применения при изготовлении биспецифического антитела.
В одном варианте осуществления настоящее изобретение включает антитела, конкурирующие за связывание с FIX/FIXa с антителами, раскрытыми в данном документе.
Антитело по настоящему изобретению можно использовать для лечения субъекта с коагулопатией и, в частности, с гемофилией А. Таким образом, настоящее изобретение также относится к применению моноклонального антитела, которое способно связывать протеазный домен FIX/FIXa, для лечения субъекта, нуждающегося в этом; а также к применению указанного антитела для изготовления лекарственного препарата для лечения субъекта, нуждающегося в этом. Кроме того, настоящее изобретение включает способ лечения субъекта, нуждающегося в этом, с помощью моноклонального антитела, которое способно связываться с протеазным доменом FIX/FIXa.
В одном варианте осуществления антитело по настоящему изобретению способно связывать FIXa с более высокой аффинностью, чем та, с которой оно связывает FIX.
В одном варианте осуществления антитело по настоящему изобретению способно увеличивать ферментативную активность FIXa по отношению к FX.
В одном таком варианте осуществления антитело по настоящему изобретению способно увеличивать ферментативную активность FIXa по отношению к FX, измеряемую в анализе с образованием FXa с использованием моновалентных неполных антител, описанных в данном документе.
В одном варианте осуществления антитело по настоящему изобретению способно увеличивать ферментативную активность FIXa по отношению к FX, измеряемую в анализе с образованием FXa с использованием бивалентных антител, описанных в данном документе.
В одном варианте осуществления антитело по настоящему изобретению не является антителом к FIX CLB-FIX 13, которое описано в Rohlena et al. (2003) J. Biol. Chem. 278(11):9394-9401. В одном варианте осуществления антитело по настоящему изобретению не является антителом к FIX HIX-1 (мышиный IgG1) (Merck KGaA, SigmaAldrich). В одном варианте осуществления антитело по настоящему изобретению не является антителом к FIX AHIX-5041 (IgG1) (Haematologic Technologies, Inc.).
В одном варианте осуществления антитело по настоящему изобретению обладает пониженной иммуногенностью по сравнению с прокоагулянтными антителами из уровня техники.
В одном варианте осуществления биспецифическое антитело или его антигенсвязывающий фрагмент содержит первый антигенсвязывающий участок, распознающий FIX (SEQ ID NO: 1) или его активированную форму (FIXa), и второй антигенсвязывающий участок, распознающий FX (SEQ ID NO: 2) или его активированную форму (FXa), где
a) первый антигенсвязывающий участок содержит следующие последовательности CDR:
VH-CDR1: DYAMH
VH-CDR2: GISWRGDIIGYVDSVKG
VH-CDR3: SYGSGSFYNAFDS
VL-CDR1: RASQSISSWLA
VL-CDR2: KASRLDR
VL-CDR3: LEYSSYIRT
и
b) второй антигенсвязывающий участок содержит следующие последовательности CDR:
VH-CDR1: TSWIV
VH-CDR2: MIDPSDSFTSYSPSFQG
VH-CDR3: LHYYHSEEFDV
VL-CDR1: RASQSVSSSYLA
VL-CDR2: GASSRAR
VL-CDR3: QQFGSSRLFT
В одном варианте осуществления биспецифическое антитело или его антигенсвязывающий фрагмент содержит первый антигенсвязывающий участок, распознающий FIX (SEQ ID NO: 1) или его активированную форму (FIXa), и второй антигенсвязывающий участок, распознающий FX (SEQ ID NO: 2) или его активированную форму (FXa), где
a) первый антигенсвязывающий участок содержит следующие последовательности CDR:
VH-CDR1: DYAMH
VH-CDR2: GISWRGDIIGYVDSVKG
VH-CDR3: SYGSGSFYNAFDS
VL-CDR1: RASQSISSWLA
VL-CDR2: KASRLDR
VL-CDR3: LEYSSYIRT
и
b) второй антигенсвязывающий участок содержит следующие последовательности CDR:
VH-CDRI: TSWIV
VH-CDR2: MIDPSDSFTSYSPSFQG
VH-CDR3: LHYYHSEEFDV
VL-CDR1: RASQSVSSSYLA
VL-CDR2: GASSRTR
VL-CDR3: QQFGSSRLFT
Настоящее изобретение дополнительно описывается следующими вариантами осуществления.
1. Антитело или его антигенсвязывающий фрагмент, способные связываться с фактором IX (FIX) в соответствии с SEQ ID NO: 1 или его активированной формой (FIXa).
2. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент является частью «категории 1».
3. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит
a. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 15, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 16, или
b. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 19, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 20.
4. Антитело по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
5. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 15, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 16,
b. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 19, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 20,
c. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 69, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 70,
d. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 71, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 72,
e. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 73, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 74,
f. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 83, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 84,
g. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 81, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 82,
h. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 75, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 76,
i. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 77, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 78, или
j. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 177, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 178.
6. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 5, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
7. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 5, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
8. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 6 и 7, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
9. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 15, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 16,
b.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 19, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 20,
с.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 69, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 70,
d.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 71, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 72,
е.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 73, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 74,
f.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 83, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 84,
g.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 81, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 82,
h.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 75, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 76, или
i.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 77, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 78, или
j
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 177, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 178.
10. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 9, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
11. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 9, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
12. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 9, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
13. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 9, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
14. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 15, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 16, или
b. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 19, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 20, или
c. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 3, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 4, или
d. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 109, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 110, или
e. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 153, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 154, или
f. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 171, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 172, или
g. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 177, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 178, или
h. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 187, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 188.
15. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 15, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 16, или
b. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 19, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 20, или
c. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 3, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 4, или
d. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 109, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 110, или
e. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 153, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 154, или
f. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 171, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 172, или
g. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 177, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 178, или
h. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 187, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 188.
16. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий один или более аминокислотных остатков из L337, R338, S339, Т340, K341 и Т343 из SEQ ID NO: 1.
17. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотный остаток R338 из SEQ ID NO: 1.
18. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки R338 и K341 из SEQ ID NO: 1.
19. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий два или три аминокислотных остатка из L337, R338, S339, Т340, K341 и Т343 из SEQ ID NO: 1.
20. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий четыре или пять аминокислотных остатков из L337, R338, S339, Т340, K341 и Т343 из SEQ ID NO: 1.
21. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий
a. R338, S339, Т340, K341 и Т343,
b. L337, S339, Т340, K341 и Т343,
c. L337, R338, Т340, K341 и Т343,
d. L337, R338, S339, K341 и Т343,
e. L337, R338, S339, Т340 и Т343 или
f. L337, R338, S339, Т340 и K341
из SEQ ID NO: 1.
22. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки L337, R338, S339, Т340, K341 и Т343 из SEQ ID NO: 1.
23. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий один или более аминокислотных остатков из K301, D332, R333, A334, Т335, R338 и N346 из SEQ ID NO: 1.
24. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки L337, R338, S339, Т340, K341 и Т343 из SEQ ID NO: 1.
25. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий два или три аминокислотных остатка из K301, D332, R333, A334, Т335, R338 и N346 из SEQ ID NO: 1.
26. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий четыре или пять аминокислотных остатков из K301, D332, R333, A334, Т335, R338 и N346 из SEQ ID NO: 1.
27. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий пять или шесть аминокислотных остатков из K301, D332, R333, A334, Т335, R338 и N346 из SEQ ID NO: 1.
28. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий
a. D332, R333, А334, Т335, R338 и N346,
b. K301, R333, А334, Т335, R338 и N346,
c. K301, D332, А334, Т335, R338 и N346,
d. K301, D332, R333, Т335, R338 и N346,
e. K301, D332, R333, А334, R338 и N346,
f. K301, D332, R333, А334, Т335 и N346 или
g. K301, D332, R333, А334, T335 hR338
из SEQ ID NO: 1.
29. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки D332, R333, L337 и R338 из SEQ ID NO: 1.
30. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки K301, D332, R333, А334, Т335, R338 и N346 из SEQ ID NO: 1.
31. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент принадлежит к «категории 2».
32. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный согласно последовательности под SEQ ID NO: 17, и вариабельный домен легкой цепи, идентифицированный согласно последовательности под SEQ ID NO: 18.
33. Антитело по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
34. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 17, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 18,
b. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 85, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 86, или
c. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 79, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 80.
35. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 34, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
36. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 34, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
37. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 35 и 36, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
38. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 17, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 18,
b.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 85, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 86, или
с.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 79, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 80.
39. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 38, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
40. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 38, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
41. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 38, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
42. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 38, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
43. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 17, и
последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 18.
44. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 17, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 18.
45. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий один или более аминокислотных остатков из Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
46. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
47. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий два, три или четыре аминокислотных остатка из Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
48. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий пять, шесть или семь аминокислотных остатков из Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
49. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий восемь, девять или десять аминокислотных остатков из Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
50. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки
a. Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411,
b. Н256, N258, K293, R403, Y404, N406, W407, Е410 и K411,
c. Н256, Н257, K293, R403, Y404, N406, W407, Е410 и K411,
d. Н256, Н257, N258, R403, Y404, N406, W407, Е410 и K411,
e. Н256, Н257, N258, K293, Y404, N406, W407, Е410 и K411,
f. Н256, Н257, N258, K293, R403, N406, W407, Е410 и K411,
g. Н256, Н257, N258, K293, R403, Y404, W407, Е410 и K411,
h. Н256, Н257, N258, K293, R403, Y404, N406, Е410 и K411,
i. Н256, Н257, N258, K293, R403, Y404, N406, W407 и K411 или
j. Н256, Н257, N258, K293, R403, Y404, N406, W407 и Е410 из SEQ ID NO: 1.
51. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411 из SEQ ID NO: 1.
52. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки Н257, K293 и N406 из SEQ ID NO: 1.
53. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело представляет собой прокоагулянтное антитело.
54. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны увеличивать прокоагулянтную активность FIXa.
55. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело способно увеличивать ферментативную активность FIXa по отношению к FX.
56. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело способно функционально замещать FVIII и/или FVIIIa.
57. Антитело или его антигенсвязывающий фрагмент, способные связываться с FX (SEQ ID NO: 2) или его активированной формой (FXa).
58. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент является частью «категории А».
59. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 65, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 66.
60. Антитело по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
61. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий один или более аминокислотных остатков из Н101, Е103, R113, Т116, L117, А118, Т127, S227, Е228, F229, Y230, Е266, R287, L303, Р304, Е305, L419, K420, D423, R424, М426, K427 и Т428 из FX/FXa.
62. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки Н101, Е103, R113, Т116, L117, А118, Т127, S227, Е228, F229, Y230, Е266, R287, Р304, L303, Р304, Е305, L419, K420, D423, R424, М426, K427 и Т428 из FX/FXa.
63. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий один или более аминокислотных остатков из R113, Y230, K420 D423, R424 и K427 из FX/FXa.
64. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент способны связывать эпитоп, содержащий аминокислотные остатки R113, Y230, K420, D423, R424 и K427 из FX/FXa.
65. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 65, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 66.
66. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 65, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
67. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 65, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
68. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 66 и 67, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
69. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 65, и
b. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 66.
70. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 69, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
71. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 69, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
72. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 69, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
73. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 69, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
74. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 65, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 66.
75. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 65, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 66.
76. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент является частью «категории В».
77. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 67, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 68.
78. Антитело или его антигенсвязывающий фрагмент по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
79. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 67, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 68,
b. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 23, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 24,
c. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 39, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 40, или
d. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 59, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 60.
80. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 79, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
81. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 79, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
82. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 80 и 81, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
83. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 67, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 68,
b.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 23, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 24,
с.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 39, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 40, или d.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 59, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 60.
84. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 83, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
85. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 83, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
86. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 83, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
87. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 83, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
88. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 67, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 68,
b. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 23, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 24,
c. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 39, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 40, или
d. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 59, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 60.
89. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 67, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 68,
b. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 23, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 24,
c. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 39, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 40, или
d. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 59, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 60.
90. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент является частью «категории С».
91. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 21, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 22.
92. Антитело или его антигенсвязывающий фрагмент по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
93. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 21, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 22,
b. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 25, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 26,
c. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 27, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 28,
d. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 29, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 30,
e. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 31, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 32,
f. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 33, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 34,
g. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 35, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 36,
h. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 37, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 38,
i. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 39, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 40,
j. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 41, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 42,
k. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 43, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 44,
l. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 51, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 52,
m. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 53, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 54,
n. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 55, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 56,
о. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 57, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 58,
р. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 59, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 60,
q. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 61, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 62, или
r. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 63, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 64.
94. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 93, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
95. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 93, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
96. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 94 и 95, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
97. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 21, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 22,
b.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 25, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 26,
с.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 27, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 28, или
d.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 29, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 30,
е.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 31, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 32,
f.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 33, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 34,
g.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 35, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 36, или
h.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 37, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 38,
i.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 39, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 40,
j.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 41, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 42,
k.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 43, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 44, или
l.
m.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 51, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 52, или
n.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 53, и
три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 54,
о.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 55, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 56,
p.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 57, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 58,
q.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 59, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 60,
r.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 61, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 62, или
s.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 63, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 64.
98. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 97, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
99. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 97, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
100. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 97, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
101. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 97, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
102. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 21, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 22,
b. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 25, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 26,
c. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 27, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 28,
d. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 29, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 30,
e. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 31, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 32,
f. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 33, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 34,
g. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 35, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 36,
h. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 37, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 38,
i. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 39, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 40,
j. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 41, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 42,
k. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 43, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 44,
l. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 51, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 52,
m. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 53, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 54,
n. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 55, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 56,
о. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 57, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 58,
р. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 59, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 60,
q. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 61, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 62, или
r. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 63, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 64,
103. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, идентифицированные под
a. SEQ ID NO: 21 и 22,
b. SEQ ID NO: 25 и 26,
c. SEQ ID NO: 27 и 28,
d. SEQ ID NO: 29 и 30,
e. SEQ ID NO: 31 и 32,
f. SEQ ID NO: 33 и 34,
g. SEQ ID NO: 35 и 36,
h. SEQ ID NO: 37 и 38,
i. SEQ ID NO: 39 и 40,
j. SEQ ID NO: 41 и 42,
k. SEQ ID NO: 43 и 44,
l. SEQ ID NO: 51 и 52,
m. SEQ ID NO: 53 и 54,
n. SEQ ID NO: 55 и 56,
о. SEQ ID NO: 57 и 58,
p. SEQ ID NO: 59 и 60,
q. SEQ ID NO: 61 и 62 или
r. SEQ ID NO: 63 и 64 соответственно.
104. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент принадлежит к «категории D».
105. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 47, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 48.
106. Антитело по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
107. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 47, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 48,
b. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 45, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 46,
c. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 51, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 52,
или
d. вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 61, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 62.
108. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 107, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
109. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 107, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
110. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 108 и 109, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
111. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
а.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 47, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 48,
b.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 45, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 46,
с.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 51, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 52, или
d.
i. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 61, и
ii. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 62.
112. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 111, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
113. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 111, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
114. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 111, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
115. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 111, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
116. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 47, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 48,
b. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 45, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 46,
c. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 51, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 52,
или
d. последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 61, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 62.
117. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 47, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 48,
b. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 45, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 46,
c. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 51, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 52,
или
d. вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 61, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 62.
118. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент принадлежит к «категории Е».
119. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 57, где антитело или его антигенсвязывающий фрагмент конкурирует с эталонным антителом, где эталонное антитело содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 49, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 50.
120. Антитело по предшествующему варианту осуществления, где эталонное антитело представляет собой Fab.
121. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 49, и вариабельный домен легкой цепи, по меньшей мере на 90% идентичный последовательности, идентифицированной под SEQ ID NO: 50.
122. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 121, где вариабельный домен тяжелой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированной SEQ ID.
123. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 121, где вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированной SEQ ID.
124. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 122 и 123, где как вариабельный домен тяжелой цепи, так и вариабельный домен легкой цепи по меньшей мере на 92, 94, 96 или 98% идентичен идентифицированным SEQ ID.
125. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит
a. три последовательности CDR тяжелой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 49, и
b. три последовательности CDR легкой цепи не более чем с 10 аминокислотными заменами по сравнению с последовательностями CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 50.
126. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 125, где три последовательности CDR тяжелой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
127. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 125, где три последовательности CDR тяжелой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
128. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 125, где три последовательности CDR легкой цепи имеют не более чем 9, как, например, 8, как, например, 7 или как, например, 6, аминокислотных замен по сравнению с CDR из идентифицированных SEQ ID.
129. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 125, где три последовательности CDR легкой цепи имеют не более чем 5, как, например, 4, как, например, 3, как, например, 2, или не более чем 1 аминокислотную замену по сравнению с CDR из идентифицированных SEQ ID.
130. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит последовательности CDR вариабельного домена тяжелой цепи, идентифицированного под SEQ ID NO: 49, и последовательности CDR вариабельного домена легкой цепи, идентифицированного под SEQ ID NO: 50.
131. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления, где антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, идентифицированный под SEQ ID NO: 49, и вариабельный домен легкой цепи, идентифицированный под SEQ ID NO: 50.
132. Полиспецифическое антитело или его антигенсвязывающий фрагмент, способные связываться с FIX/FIXa и FX/FXa.
133. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 1-131.
134. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 2-30.
135. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 31-52.
136. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 57-131.
137. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 58-75.
138. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 76-89.
139. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 90-103.
140. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 104-117.
141. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 118-131
142. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 1-56 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 57-131.
143. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 2-30 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 58-75.
144. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 2-30 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 76-89.
145. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 2-30 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 90-103.
146. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 31-52, антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 58-75.
147. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 31-52 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 76-89.
148. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело содержит антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 31-52 и антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления 90-103.
149. Полиспецифическое антитело или его антигенсвязывающий фрагмент по варианту осуществления 132, где антитело представляет собой биспецифическое антитело, способное специфически связывать FIX/FIXa и FX/FXa, где домены связывания являются производными пар mAb, состоящих из: mAb1-1371/mAb1-1307, mAb1-6705/mAb1-1307, mAb1-1371/mAb0-1886, mAb1-7441/mAb0-1886, mAb1-7447/mAb0-1886, mAb1-7481/mAb0-1886, mAb1-1371/mAb0-1998, mAb1-6716/mAb0-1998, mAb1-6723/mAb0-1998, mAb1-6730/mAb0-1998, mAb1-6731/mAb0-1998, mAb1-6737/mAb0-1998, mAb1-6754/mAb0-1998, mAb1-7378/mAb0-1998, mAb1-7441/mAb0-1998, mAb1-7447/mAb0-1998, mAb/mAb0-1998, mAb1-6723/mAb1-1307, mAb1-6723/mAb0-1886, mAb1-6705/mAb0-1886, mAb1-7481/mAb0-1998 и mAb1-6705/mAb0-1998.
150. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 132-149, где антитело представляет собой прокоагулянтное биспецифическое антитело.
151. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 132-149, где антитело представляет собой биспецифическое антитело, способное усиливать прокоагулянтную активность FIXa.
152. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 132-149, где антитело представляет собой биспецифическое антитело, способное увеличивать ферментативную активность FIXa по отношению к FX.
153. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 132-149, где антитело представляет собой биспецифическое антитело, способное функционально замещать FVIII и/или FVIIIa.
154. Полиспецифическое антитело, способное стимулировать ферментативную активность FIXa по отношению к FX, содержащее первый антигенсвязывающий участок, распознающий FIX (SEQ ID NO: 1) или его активированную форму (FIXa), и второй антигенсвязывающий участок, распознающий FX (SEQ ID NO: 2) или его активированную форму (FXa), где
а) первый антигенсвязывающий участок содержит CDR из антитела, выбранного из группы, состоящей из: mAb1-5743, mAb1-6584, mAb1-8768, mAb1-6037, mAb1-6081, mAb1-4857, mAb1-8780, mAb1-9016, mAb1-9015, mAb1-8467, mAb1-5783 или mAb1-5781, и
b) второй антигенсвязывающий участок содержит CDR из антитела, выбранного из группы, состоящей из: mAb1-6738, mAb1-6463, mAb1-6723, mAb1-7503 или mAb1-6097.
155. Полиспецифическое антитело, способное стимулировать ферментативную активность FIXa по отношению к FX, содержащее
первый полипептид, распознающий FIX/FIXa, и
второй полипептид, распознающий FX/FXa, где
a) первый полипептид содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи из mAb1-5743, mAb1-6584, mAb1-8768, mAb1-6037, mAb1-6081, mAb1-4857, mAb1-8780, mAb1-9016, mAb1-9015, mAb1-8467, mAb1-5783 или mAb1-5781, и
b) второй полипептид содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи из mAb1-6738, mAb1-6463, mAb1-6723, mAb1-7503 или mAb1-6097.
156. Антитело по любому из вариантов осуществления 154 или 155, где антитело представляет собой биспецифическое антитело.
157. Антитело по любому из вариантов осуществления 150-156, где стимуляцию ферментативной активности FIXa по отношению к FX определяют в анализе с образованием FXa, описанном в данном документе, с использованием моновалентного неполного антитела к FIX/FIXa, где индекс стимуляции является по меньшей мере 94, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 3000, 4000 или 5000-кратным при измерении с использованием концентрации неполного антитела, приводящей к насыщению FIXa по меньшей мере на 80%.
158. Полиспецифическое антитело, способное стимулировать ферментативную активность FIXa по отношению к FX, содержащее
первый антигенсвязывающий участок, распознающий FIX (SEQ ID NO: 1) или его активированную форму (FIXa), и второй антигенсвязывающий участок, распознающий FX (SEQ ID NO: 2) или его активированную форму (FXa), где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотный остаток R338 из FIX/FIXa, и
где второй антигенсвязывающий участок способен связываться с доменом EGF-2 и/или каталитической субъединицей FX/FXa.
159. Полиспецифическое антитело по варианту осуществления 158, где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотные остатки R338 и K341 из FIX/FIXa.
160. Полиспецифическое антитело по варианту осуществления 159, где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотные остатки L337, R338, S339, Т340, K341 и Т343 из FIX/FIXa.
161. Полиспецифическое антитело, способное стимулировать ферментативную активность FIXa по отношению к FX, содержащее первый антигенсвязывающий участок, распознающий FIX (SEQ ID NO: 1) или его активированную форму FIXa, и второй антигенсвязывающий участок, распознающий FX (SEQ ID NO: 2) или его активированную форму (FXa),
где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотные остатки D332, R333, L337 и R338 из FIX/FIXa, и
где второй антигенсвязывающий участок способен связываться с доменом EGF-2 и/или каталитической субъединицей FX/FXa.
162. Полиспецифическое антитело по варианту осуществления 161, где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотные остатки K301, D332, R333, A334, Т335, R338, N346 из FIX/FIXa.
163. Полиспецифическое антитело, способное стимулировать ферментативную активность FIXa по отношению к FX, содержащее
первый антигенсвязывающий участок, распознающий FIX/FIXa, и
второй антигенсвязывающий участок, распознающий FX/FXa, где
первый антигенсвязывающий участок способен специфически связывать эпитоп, содержащий аминокислотные остатки Н257, K293 и N406 из FIX/FIXa, и
где второй антигенсвязывающий участок способен связываться с доменом EGF-2 и/или каталитической субъединицей FX/FXa.
164. Антитело по любому из вариантов осуществления 1-56 и 132-156, где стимуляцию ферментативной активности FIXa по отношению к FX измеряют в анализе с образованием FXa, описанном в данном документе, с использованием моновалентного неполного антитела к FIX/FIXa, где индекс стимуляции является по меньшей мере 94, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 3000, 4000 или 5000-кратным при измерении с использованием концентрации неполного антитела, приводящей к насыщению FIXa по меньшей мере на 80%.
165. Антитело по любому из вариантов осуществления 1-56 и 132-156, где стимуляцию ферментативной активности FIXa по отношению к FX измеряют в анализе с образованием FXa, описанном в данном документе, с использованием моновалентного неполного антитела к FIX/FIXa, где индекс стимуляции является 50-5000-кратным, как, например, 94-2500-кратным, как, например, 100-2500-кратным, как, например, 200-2500-кратным, как, например, 300-2500-кратным, как, например, 400-2500-кратным, как, например, 500-2500-кратным, как, например, 600-2500-кратным, как, например, 700-2500-кратным, как, например, 800-2500-кратным, как, например, 500-2500-кратным, как, например, 600-2500-кратным, как, например, 700-2500-кратным, как, например, 800-2500-кратным, как, например, 900-2500-кратным, как, например, 1000-2500-кратным, как, например, 1500-2500-кратным, при измерении с использованием концентрации неполного антитела, приводящей к насыщению FIXa по меньшей мере на 80%.
166. Антитело по любому из предшествующих вариантов осуществления, где антитело представляет собой прокоагулянтное антитело.
167. Антитело по любому из предшествующих вариантов осуществления, где указанное антитело функционально замещает FVIII и/или FVIIIa.
168. Антитело по любому из предшествующих вариантов осуществления, где антитело представляет собой биспецифическое антитело.
169. Антитело по любому из предшествующих вариантов осуществления, где изотипом антитела является IgG1, IgG2, IgG3 или IgG4 или их комбинация.
170. Антитело по любому из вариантов осуществления 57-131, где вариабельный домен легкой цепи указанного антитела или его антигенсвязывающего фрагмента содержит аминокислотные остатки R57, R96 (SEQ ID NO: 22) и где вариабельный домен тяжелой цепи указанного антитела содержит аминокислотные остатки W33, D52, D55, Н100, Y101, Y102, Н103 (SEQ ID NO: 21).
171. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления для применения в способе лечения коагулопатии или нарушения свертываемости крови.
172. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент по любому из предшествующих вариантов осуществления для лечения коагулопатии или нарушения свертываемости крови.
173. Способ лечения субъекта, страдающего коагулопатией или нарушением свертываемости крови, включающий введение указанному субъекту антитела или его антигенсвязывающего фрагмента по любому из предшествующих вариантов осуществления.
174. Способ по варианту осуществления 173, где коагулопатия или нарушение свертываемости крови представляет собой гемофилию А или гемофилию А при наличии ингибиторов.
ПРИМЕРЫ


Пример 1. Разработка плазмид экспрессии для Fab и mAb к фактору IX/FIXa
FIX/FIXa-связывающие антитела, раскрытые в данном документе, идентифицировали с использованием различных способов разработки антител. Для создания разнообразного набора антител, целенаправленно воздействующих на FIXa и FX, выполняли процедуры иммунизации мышей и кроликов, а также отбора из фагового дисплея и дрожжевого дисплея Adimab.
Дрожжевой дисплей Adimab
Платформа Adimab представляет собой систему дрожжевого дисплея, содержащую полностью человеческую библиотеку не подвергавшихся воздействию IgG1/каппа с разнообразием 1010 и охватывающую 20 из 42 семейств VH. Используемая платформа фагового дисплея антител представляет собой запатентованную полностью человеческую библиотеку Fab-дисплея. Библиотека имеет размер 1010 и была создана при помощи комбинационного подхода с использованием химического синтеза легкой цепи, а также CDR1 и CDR2 тяжелой цепи, дополненных ПЦР-амплификацией CDR3 тяжелой цепи из мононуклеарных клеток периферической крови человека. Процесс отбора антител управляется с использованием способов на основе MACS и FACS, которые позволяют отслеживать применяемые критерии отбора в режиме реального времени. Поскольку процедуры отбора основаны на MACS и FACS, необходимы меченые антигены (например, биотином). Операции по отбору проводили с использованием меченного биотином hFIXa с ингибированным активным сайтом (FIXa-EGR-биотин) или опосредованной антителами иммобилизации hFIXa. «Хиты» оценивали в отношении связывания с использованием биослойной интерферометрии (системы ForteBio Octet).
Фаговый дисплей
Чтобы довести до максимума охват разнообразия эпитопов, исследовали различные стратегии пэннинга, включая пэннинг с использованием биотинилированного FIXa-EGR, FX, FXa с ингибированным активным сайтом или захват антигена с использованием антител к FIXa. Исходные «хиты» идентифицировали при помощи фагового ELISA. После анализа последовательностей уникальные «хиты» клонировали, экспрессировали как IgG1 и ранжировали с использованием SPR (Biacore) или биослойной интерферометрии (системы ForteBio Octet).
Платформы in vivo
Для получения полностью человеческих антител у мышей использовали мышей Kymouse™ HK и HL 1.0 (продуцирующих каппа- и лямбда-цепи соответственно). Дополнительные процедуры иммунизации проводили на мышах и кроликах дикого типа, чтобы довести до максимума разнообразие антител.
Получение антител к FIXa
Мышей или кроликов иммунизировали с помощью FIXa, FIXa-EGR или FX с использованием стандартных протоколов. Антитела, полученные на мышах или кроликах, подвергали скринингу с использованием ELISA. FIXa-связывающие В-клетки кролика сортировали с помощью FACS с использованием случайным образом биотинилированного FIXa-EGR. «Хиты» антител от кроликов и мышей либо рекомбинантно экспрессировали (mAb кролика), либо размножали (гибридомы мыши) и антитела впоследствии очищали в небольшом масштабе.
Получение антител к FX
Мышей Kymouse и кроликов иммунизировали с помощью FX с использованием стандартных протоколов или протоколов повторной иммунизации в нескольких участках (RIMMS). В-клетки кролика выделяли с помощью сортировки, предусматривающей FACS, с использованием случайным образом биотинилированного FX. mAb к FX из слияний и сортировок подвергали скринингу с использованием ELISA и систем ForteBio Octet.
Секвенирование антител, полученных от мышей Kymouse и мышей wt
Антитела к FIXa и к FX, вырабатываемые гибридомами, полученными от мышей Kymouse или мышей wt, секвенировали и экспрессировали в клетках HEK293 с использованием стандартных методик. Экспрессированные антитела оценивали на связывание с использованием систем ForteBio Octet.
Полученные последовательности ДНК, кодирующие вариабельные домены (VH и VL) отобранных антител, вводили в вектор экспрессии млекопитающих на основе рТТ (Durocher et al (2002) Nucleic Acid Res. 30: E9) или в вектор экспрессии млекопитающих pcDNA3.4 (Invitrogen), содержащий последовательности ДНК, кодирующие константные области антитела. Для векторов экспрессии mAb pTT/pcDNA3.4 последовательности ДНК для VH и VL вводили в рамку считывания с последовательностями ДНК, кодирующими константные области IgG1 или IgG4 S228P человека (СН1СН2СН3) или CL каппа-цепи человека соответственно. Для соответствующих векторов экспрессии Fab pTT/pcDNA3.4 последовательности ДНК для VH вводили в рамку считывания с последовательностями ДНК, кодирующими IgG1 СН1 человека.
Для эталонного соединения 224F3, использованного в примерах 6, 8 и 18 ниже, последовательности VH и VL 224F3 получали согласно ЕР 1660536 B1 (SEQ ID NO: 1 и 2 соответственно). Последовательности ДНК, кодирующие VH и VL 224F3, вводили в вектор экспрессии млекопитающих на основе pTT5/pcDNA3.4 в рамку считывания с последовательностями ДНК, кодирующими константную область IgG1 (СН1СН2СН3) человека или CL каппа-цепи человека соответственно.
Все векторы экспрессии включали в себя 5'-концевую последовательность ДНК, содержащую последовательность kozak и последовательность ДНК, кодирующую сигнальный пептид, в рамке считывания с последовательностями ДНК, кодирующими антитело.
Пример 2. Рекомбинантная экспрессия антител и Fab-фрагментов антител
Антитела и Fab-фрагменты антител экспрессировали с использованием временной трансфекции суспензии клеток HEK293 (293Expi, Invitrogen), в основном следуя инструкциям производителя. Клетки 293Expi обычно пересевали каждые 3-4 дня в среде для экспрессии Expi293F (Invitrogen, номер по каталогу А1435104) с добавлением 1% P/S (GIBCO, номер по каталогу 15140-122). Клетки Expi293F трансфицировали при плотности клеток 2,5-3 млн./мл, используя Expifectamine. Для каждого литра клеток Expi293F трансфекцию осуществляли путем разведения в общей сложности 1 мг плазмидной ДНК (VH-CH1 (для Fab) или VH-CH1-CH2-CH3 (для mAb) и LC-плазмид в соотношении 1:1) в 50 мл Optimem (GIBCO, номер по каталогу 51985-026, разведение А) и путем разведения 2,7 мл Expifectamine в 50 мл Optimem (разведение В). Для совместных трансфекции с выработкой Fab и mAb использовали VH-CH1 и LC-плазмиды (Fab) и VH-CH1-CH2-CH3 и LC-плазмиды (mAb), соответственно, в соотношении 1:1. Разведения А и В смешивали и инкубировали при комнатной температуре в течение 10-20 минут. После этого смесь для трансфекции добавляли к клеткам Expi293F и клетки инкубировали при 37°С в увлажненном инкубаторе с эпициклическим вращением (85-125 об./мин.). Через день после трансфекции к трансфицированным клеткам добавляли 5 мл усилителя 1 трансфекции ExpiFectamine 293 и 50 мл усилителя 2 трансфекции ExpiFectamine 293. Супернатанты клеточных культур обычно собирали через 4-5 дней после трансфекции при центрифугировании с последующей фильтрацией.
Пример 3. Очистка и определение характеристик Fab и антител
Очистка и определение характеристик Fab
Очистку молекул Fab проводили в виде 2-стадийного процесса, состоящего из аффинной хроматографии с использованием смолы kappaSelect (GE Healthcare, номер по каталогу 17-5458-11) и эксклюзионной хроматографии с использованием смолы Superdex200 (GE Healthcare, номер по каталогу 17-1043-04). Процедуры очистки проводили с использованием хроматографической системы  (GE Healthcare, номер по каталогу 18-1112-41). Буферными системами, используемыми для стадии аффинной очистки, были уравновешивающий буфер, состоящий из 20 мМ фосфата Na, рН 7,2, 150 мМ NaCl, и элюирующий буфер, состоящий из 10 мМ муравьиной кислоты, рН 3,5, и буфер для регулирования рН, состоящий из 0,4 М фосфата Na, рН 9,0. Супернатанты клеток наносили непосредственно без каких-либо корректировок на предварительно уравновешенную колонку kappaSelect SuRe. Колонку промывали 10 объемами колонки уравновешивающего буфера и молекулы Fab элюировали изократически в примерно 5 объемах колонки элюирующего буфера. Значение рН собранных фракций доводили до нейтрального с помощью описанного буфера для регулирования рН сразу после элюирования. Молекулы Fab дополнительно очищали и заменяли буфер с использованием указанной гель-фильтрационной смолы, предварительно упакованной в колонку. Рабочий буфер, используемый для эксклюзионной хроматографии, представлял собой 25 мМ HEPES и 150 мМ NaCl, рН 7,4. Молекулы Fab элюировались в виде отдельных пиков при примерно 0,5 объема колонки. Фракции, образующие пик, анализировали с применением постановки способа эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC) в системе Agilent LC 1100/1200 с использованием колонки BIOSep-SEC-S3000 300×7,8 мм (Phenomenex, номер по каталогу 00Н-2146-K0) и рабочего буфера, состоящего из 200 мМ фосфата Na, рН 6,9, 300 мМ NaCl и 10% изопропанола. На основании этого анализа фракции объединяли с получением гомогенного белкового препарата. Конечный препарат элюировали в виде единого симметричного пика со временем удержания примерно 10 мин. при скорости потока 1 мл/мин.
(GE Healthcare, номер по каталогу 18-1112-41). Буферными системами, используемыми для стадии аффинной очистки, были уравновешивающий буфер, состоящий из 20 мМ фосфата Na, рН 7,2, 150 мМ NaCl, и элюирующий буфер, состоящий из 10 мМ муравьиной кислоты, рН 3,5, и буфер для регулирования рН, состоящий из 0,4 М фосфата Na, рН 9,0. Супернатанты клеток наносили непосредственно без каких-либо корректировок на предварительно уравновешенную колонку kappaSelect SuRe. Колонку промывали 10 объемами колонки уравновешивающего буфера и молекулы Fab элюировали изократически в примерно 5 объемах колонки элюирующего буфера. Значение рН собранных фракций доводили до нейтрального с помощью описанного буфера для регулирования рН сразу после элюирования. Молекулы Fab дополнительно очищали и заменяли буфер с использованием указанной гель-фильтрационной смолы, предварительно упакованной в колонку. Рабочий буфер, используемый для эксклюзионной хроматографии, представлял собой 25 мМ HEPES и 150 мМ NaCl, рН 7,4. Молекулы Fab элюировались в виде отдельных пиков при примерно 0,5 объема колонки. Фракции, образующие пик, анализировали с применением постановки способа эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC) в системе Agilent LC 1100/1200 с использованием колонки BIOSep-SEC-S3000 300×7,8 мм (Phenomenex, номер по каталогу 00Н-2146-K0) и рабочего буфера, состоящего из 200 мМ фосфата Na, рН 6,9, 300 мМ NaCl и 10% изопропанола. На основании этого анализа фракции объединяли с получением гомогенного белкового препарата. Конечный препарат элюировали в виде единого симметричного пика со временем удержания примерно 10 мин. при скорости потока 1 мл/мин.
Очищенные молекулы Fab дополнительно характеризовали с использованием анализов SDS-PAGE/кумасси и жидкостной хроматографии - масс-спектрометрии. Анализ SDS-PAGE/кумасси проводили с использованием 4-12% бис-трис-гелей NuPage (Invitrogen, номер по каталогу NP0321BOX). Все молекулы Fab показали ожидаемые компоненты легкой цепи и тяжелой цепи. Процедуры определения интактной молекулярной массы проводили с использованием постановки способа жидкостной хроматографии - времяпролетной масс-спектрометрии с ионизацией электрораспылением на приборе Agilent 6210 и колонке для обессоливания MassPREP (Waters, номер по каталогу USRM10008656). Используемая буферная система представляла собой уравновешивающий буфер, состоящий из 0,1% муравьиной кислоты в H2O со степенью чистоты для LC-MS, и элюирующий буфер, состоящий из 0,1% муравьиной кислоты в ACN со степенью чистоты для LC-MS. Все молекулы Fab показали ожидаемые значения интактной молекулярной массы в соответствии с последовательностью. Конечную чистоту определяли на основании анализа SE-HPLC. Все оценки чистоты были между 95-99% для различных Fab-фрагментов. Для определения конечных концентраций белка проводили измерение оптической плотности при 280 нм с использованием спектрофотометра NanoDrop (Thermo Scientific) и рассчитывали концентрации, используя конкретные коэффициенты экстинкции для каждой из молекул Fab.
Очистка и определение характеристик антител
Очистку антител проводили при помощи аффинной хроматографии с использованием смолы с белком A MabSelect SuRe (GE Healthcare, номер по каталогу 17-5438-01). Процедуры очистки проводили с использованием хроматографической системы  (GE Healthcare, номер по каталогу 18-1112-41). Буферными системами, используемыми для стадии аффинной очистки, были уравновешивающий буфер, который состоял из 20 мМ фосфата Na, рН 7,2, 150 мМ NaCl, и элюирующий буфер, состоящий из 10 мМ муравьиной кислоты, рН 3,5, и буфер для регулирования рН, состоящий из 0,4 М фосфата Na, рН 9,0. Супернатанты клеток наносили непосредственно без каких-либо корректировок на предварительно уравновешенную колонку MabSelect SuRe. Колонку промывали 10 объемами колонки уравновешивающего буфера и антитела элюировали изократически в приблизительно 2-5 объемах колонки элюирующего буфера. Значение рН собранных фракций доводили до нейтрального с помощью описанного буфера для регулирования рН сразу после элюирования.
(GE Healthcare, номер по каталогу 18-1112-41). Буферными системами, используемыми для стадии аффинной очистки, были уравновешивающий буфер, который состоял из 20 мМ фосфата Na, рН 7,2, 150 мМ NaCl, и элюирующий буфер, состоящий из 10 мМ муравьиной кислоты, рН 3,5, и буфер для регулирования рН, состоящий из 0,4 М фосфата Na, рН 9,0. Супернатанты клеток наносили непосредственно без каких-либо корректировок на предварительно уравновешенную колонку MabSelect SuRe. Колонку промывали 10 объемами колонки уравновешивающего буфера и антитела элюировали изократически в приблизительно 2-5 объемах колонки элюирующего буфера. Значение рН собранных фракций доводили до нейтрального с помощью описанного буфера для регулирования рН сразу после элюирования.
Очищенные антитела характеризовали с использованием анализов SDS-PAGE/кумасси, эксклюзионной жидкостной хроматографии высокого давления (SE-HPLC) и жидкостной хроматографии - масс-спектрометрии (LC-MS). Анализ SDS-PAGE/кумасси проводили с использованием 4-12% бис-трис-гелей NuPage (Invitrogen, номер по каталогу NP0321BOX). В данном случае все антитела показали ожидаемые компоненты легкой цепи и тяжелой цепи. Процедуры определения интактной молекулярной массы проводили с использованием постановки способа жидкостной хроматографии - времяпролетной масс-спектрометрии с ионизацией электрораспылением на приборе Agilent 6210 и колонке для обессоливания MassPREP (Waters, номер по каталогу USRM10008656). Используемая буферная система представляла собой уравновешивающий буфер, состоящий из 0,1% муравьиной кислоты в H2O со степенью чистоты для LC-MS, и элюирующий буфер, состоящий из 0,1% муравьиной кислоты в ACN со степенью чистоты для LC-MS. Анализы выполняли с N-гликозидазой F (Roche Diagnostics, номер по каталогу 11365177001) и восстановителем (т.е. меркаптоэтанолом или DTT) и без них. Все антитела показали ожидаемые значения интактной молекулярной массы в соответствии с последовательностью и одним N-гликаном тяжелой цепи. Чистоту определяли на основании SE-HPLC. Конечную чистоту белка анализировали на основании постановки способа SE-HPLC в системе Agilent LC 1100/1200 и с использованием колонки BIOSep-SEC-S3000 300×7,8 мм (Phenomenex, номер по каталогу 00Н-2146-K0) и рабочего буфера, состоящего из 200 мМ фосфата Na, рН 6,9, 300 мМ NaCl и 10% изопропанола. Для обнаружения использовали детекторы UV280 и флуоресценции (возб. 280 нм/излуч. 354 им). Антитела элюировались в виде единичных симметричных пиков со временем удержания, отражающим размер антител. Все оценки чистоты были между 95-99% для разных антител. Для измерения конечных концентраций белка использовали спектрофотометр NanoDrop (Thermo Scientific) вместе с конкретными коэффициентами экстинкции для каждого из антител.
Пример 4. Категоризация стимулирующих антител к FIXa
Антитела, выбранные как способные стимулировать ферментативную активность FIXa по отношению к FX, анализировали в экспериментах по категоризации для определения характеристик связывания идентифицированных антител с использованием способа, описанного ниже.
Способ категоризации антител
Эксперименты по категоризации проводили с использованием систем ForteBio Octet (НТХ, Red384), оснащенных сенсорами-антителами к IgG человека (Pall Life Sciences, Менло Парк, Калифорния), и с использованием 8- или 32-канального режима (Red384 и НТХ). Анализы для категоризации проводили с использованием классической установки для категоризации сэндвич-эпитопов. Кратко, (1) первое антитело захватывали наконечниками АНС к антителам человека (наконечники для захвата с Fc к IgG человека (АНС, номер по каталогу 18-5064), (2) неблокированные участки связывания IgG на наконечниках АНС блокировали человеческим поликлональным IgG (14506 SIGMA), (3) FIXa связывали с первым антителом, (4) конкурирующее антитело предлагали комплексу антитело-антиген на наконечниках, и если связывание вторичного антитела не могли обнаружить, то антитела оценивали как принадлежащие к одной и той же категории.
В результате анализа идентифицировали две разных категории, категорию 1 и 2, определяемые антителами mAb0-1886 и mAb1-1307 соответственно.
Категоризация антител к FIX.
Отобранные антитела к FIX подвергали категоризации друг против друга и идентифицировали две разных категории (категорию 1 и 2). Номера относятся к ID mAb, например 0-1998 обозначает mAb0-1998.
Обзор показывает, что несколько антител были отнесены к категории 1, включая mAb0-1886 и mAb0-1998. Было обнаружено, что категория 2 включает четыре антитела в дополнение к mAb1-1307. Два антитела, mAb1-0072 и mAb1-0073, были общими для категории 1 и 2.
Варианты родительских антител (линии происхождения), раскрытые в данном документе, относятся к одинаковым категориям и имеют общие остатки эпитопа (горячие точки) с родительскими антителами.
Поскольку варианты антител, данные для которых приведены в настоящем примере, не содержат аминокислотных замен в положениях, которые имеют решающее значение для распознавания эпитопов, как показано на основе кристаллических структур комплексов родительское антитело-FIXa, представленных в примере 5, специалисту в данной области должно быть понятно, что варианты в качестве отправной точки будут принадлежать одной и той же категории, конкурировать за связывание и распознавать по меньшей мере те же остатки «горячей точки» в эпитопе FIX/FIXa, что и антитело, от которого они происходят, т.е. mAb0-1998, mAb0-1886 или mAb1-1307.
Пример 5. Кристаллизация и картирование эпитопов антител к FIX/FIXa с использованием рентгеновской кристаллографии
Белок FIXa, используемый для кристаллизации (Cambridge ProteinWorks, код продукта 10316), состоит из усеченной легкой цепи (остатки 85-142 из SEQ ID NO: 1) с неприродным остатком метионина, присоединенным на N-конце в результате бактериальной экспрессии, и тяжелой цепи, содержащей остатки 181-415 из SEQ ID NO: 1. Активный сайт протеазы блокируют EGR-хлорметилкетоном.
Кристаллизация
Fab0-7237:FIXa
Кристаллы Fab0-7237 (Fab-фрагмент, соответствующий mAb0-1886), смешанные в молярном соотношении 1:1 с белком FIXa, выращивали с использованием методики диффузии паров в варианте висящей капли при 18°С. Раствор белка 0,8 мкл 7,5 мг/мл в 20 мМ трис-HCl, рН 7,4, 50 мМ NaCl и 2,5 мМ CaCl2 смешивали с равным объемом 4 М формиата натрия в качестве осадителя и инкубировали на 1 мл осадителя.
Fab0-7238:FIXa
Кристаллы Fab0-7238 (Fab-фрагмент, соответствующий mAb0-1998), смешанные в молярном соотношении 1:1 с белком FIXa, выращивали с использованием методики диффузии паров в варианте сидящей капли при 18°С. Раствор белка 0,1 мкл 6,2 мг/мл в 20 мМ трис-HCl, рН 7,4, 50 мМ NaCl и 2,5 мМ CaCl2 смешивали с 0,1 мкл 100 мМ какодилата натрия, рН 6,5, и 1 М тринатрия цитрата в качестве осадителя и инкубировали на 60 мкл осадителя.
Fab0-7236:FIXa
Кристаллы Fab0-7236 (Fab-фрагмент, соответствующий mAb 1-1307), смешанные в молярном соотношении 1:1 с белком FIXa, выращивали с использованием методики диффузии паров в варианте сидящей капли при 18°С. Раствор белка 0,1 мкл 6,4 мг/мл в 20 мМ трис-HCl, рН 7,4, 50 мМ NaCl и 2,5 мМ CaCl2 смешивали с равным объемом 0,2 М сульфата лития, 40% (об./об.) PEG400 и 0,1 М трис, рН 8,5, в качестве осадителя и инкубировали на 1 мл осадителя.
Сбор данных дифракции
Fab0-7237:FIXa
Кристалл подвергали криозащите в растворе, состоящем из 3 М формиата натрия, 4% глицерина, 4% этиленгликоля, 4,5% сахарозы и 1% глюкозы перед мгновенным охлаждением в жидком азоте. Данные дифракции собирали при 100K в пучке синхротронного излучения X06DA от Swiss Light Source (длина волны 1,0000  ) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
Fab0-7238:FIXa
Кристалл подвергали криозащите в растворе, состоящем из 75 мМ какодилата натрия, рН 6,5, и 0,75 М тринатрия цитрата, 4% глицерина, 4% этиленгликоля, 4,5% сахарозы и 1% глюкозы перед мгновенным охлаждением в жидком азоте. Данные дифракции собирали при 100K в пучке синхротронного излучения X06DA от Swiss Light Source (длина волны 1,0000  ) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
Fab0-7236:FIXa
Три кристалла подвергали криозащите в растворе, состоящем из 0,15 М сульфата лития, 30% (об./об.) PEG400 и 0,075 М трис, рН 8,5, 4% глицерина, 4% этиленгликоля, 4,5% сахарозы и 1% глюкозы перед мгновенным охлаждением в жидком азоте. Данные дифракции собирали при 100K в пучке синхротронного излучения X06DA от Swiss Light Source (длина волны 1,0000  ) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию, объединение и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию, объединение и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 1).
Определение и уточнение структуры
Fab0-7237:FIXa
Структуру определяли путем молекулярной замены с использованием Phaser, реализованного в наборе программ Phenix, цепями Н и L из записи 4NP4 базы данных структуры белков и цепями Н и L из записи 3KCG базы данных структуры белков. Асимметричная единица содержит два комплекса Fab:FIXa. Модель уточняли с использованием этапов уточнения в Phenix и неавтоматизированной перестройки в COOT. Статистические характеристики уточнения приведены в таблице 1.
Fab0-7238:FIXa
Структуру определяли путем молекулярной замены с использованием Phaser, реализованного в наборе программ Phenix, цепями Н и L из записи 4PUB базы данных структуры белков и цепями Н и L из записи 3KCG базы данных структуры белков. Асимметричная единица содержит два комплекса Fab:FIXa. Модель уточняли с использованием этапов уточнения в Phenix и неавтоматизированной перестройки в COOT. Статистические характеристики уточнения приведены в таблице 1.
Fab0-7236:FIXa
Структуру определяли путем молекулярной замены с использованием Phaser, реализованного в наборе программ Phenix, частью, представляющей собой Fab, сложной структуры комплекса Fab0-7238:FIXa, описанного выше, и цепями Н и L из записи 3KCG базы данных структуры белков. Асимметричная единица содержит один комплекс Fab:FIXa. Модель уточняли с использованием этапов уточнения в Phenix и неавтоматизированной перестройки в COOT. Статистические характеристики уточнения приведены в таблице 1.
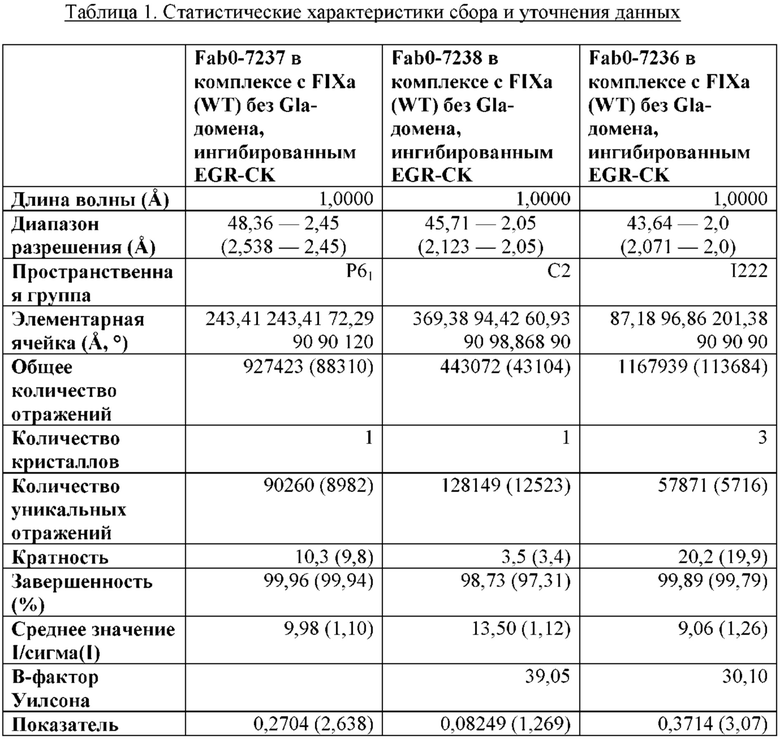
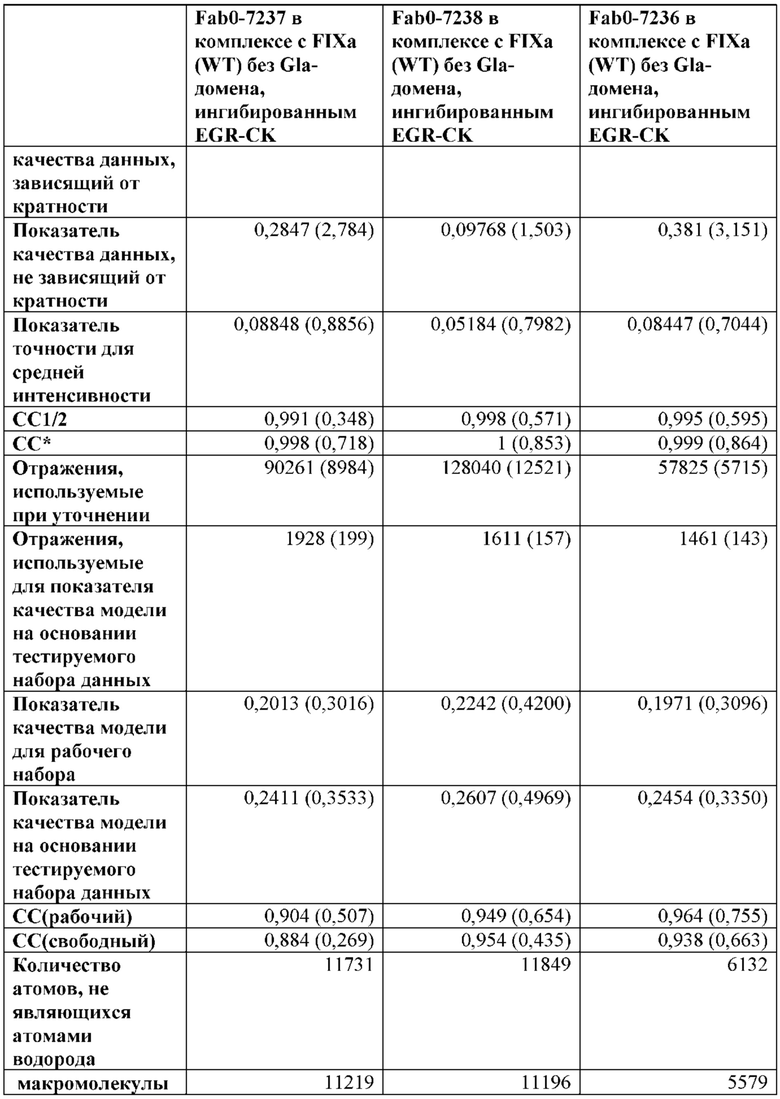
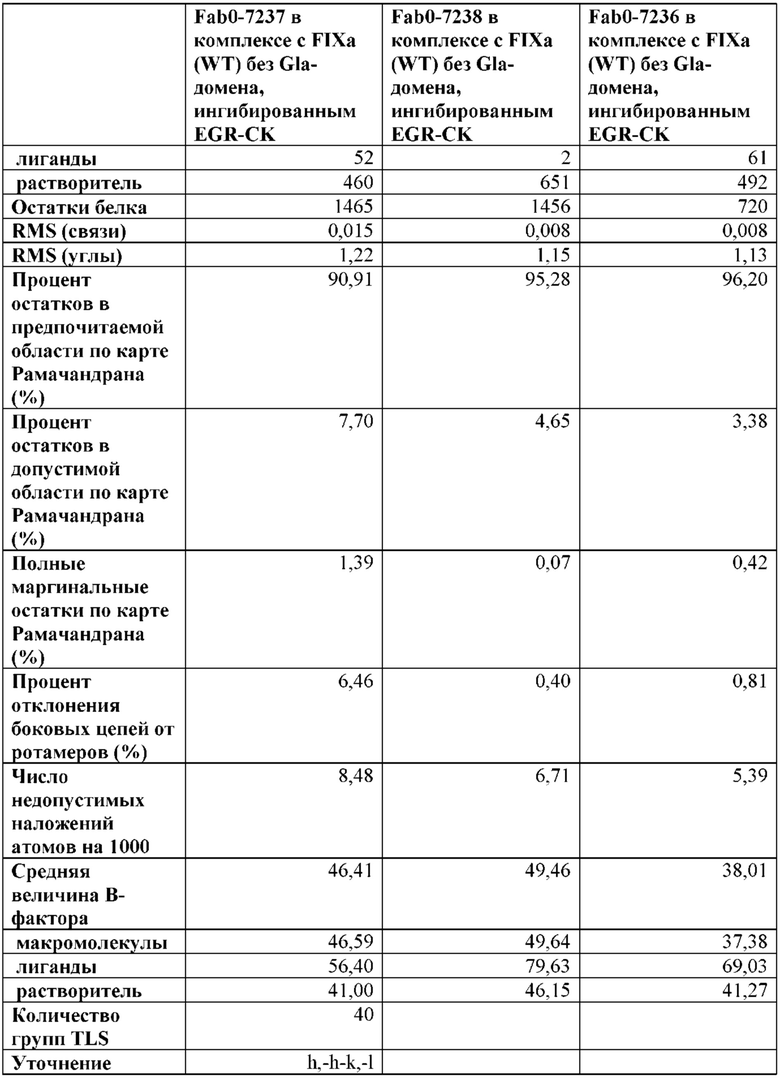

Статистические характеристики для оболочки с самым высоким разрешением показаны в скобках.
Определение эпитопов
На основании вышеуказанного mAb0-1998 было обнаружено, что mAb1-1307 и mAb0-1886 связываются с различными эпитопами на FIXa, где эпитоп определяется как остатки, имеющие по меньшей мере один тяжелый атом на расстоянии ≤ 3,5  от тяжелого атома в антителе.
от тяжелого атома в антителе.
Эпитоп mAb0-1998 расположен в 170-петле и содержит следующие остатки протеазного домена: L337, R338, S339, Т340, K341 и Т343.
Эпитоп mAb1-1307 содержит следующие остатки: Н256, Н257, N258, K293, R403, Y404, N406, W407, Е410 и K411.
Эпитоп mAb0-1886 расположен в 170-спирали и содержит следующие остатки протеазного домена: K301, D332, R333, А334, Т335, R338 и N346.
Было обнаружено, что эпитопы mAb0-1998 и mAb0-1886 перекрываются, что хорошо согласуется с наблюдением того, что эти два антитела конкурируют за связывание с FIX/FIXa (пример 4).
Варианты родительских антител (линии происхождения), раскрытые в данном документе, относятся к одинаковым категориям и имеют общие остатки эпитопа (горячие точки) с родительскими антителами.
Поскольку варианты антител, данные для которых приведены в примере 4 выше и в определенных примерах ниже, не содержат аминокислотных замен в положениях, которые имеют решающее значение для распознавания эпитопов, как показано на основе кристаллических структур комплексов родительское антитело-FIXa, представленных в настоящем примере, специалисту в данной области должно быть понятно, что варианты в качестве отправной точки будут принадлежать одной и той же категории, конкурировать за связывание и распознавать по меньшей мере те же остатки «горячей точки» в эпитопе FIX/FIXa, что и антитело, от которого они происходят, т.е. mAb0-1998, mAb0-1886 или mAb1-1307.
Пример 6. Активность бивалентных антител к FIX/FIXa в анализе с образованием FXa
Стимулирующее действие бивалентных антител к FIX/FIXa на ферментативную активность FIXa в отношении FX определяли по их способности стимулировать активацию FX при помощи FIXa в присутствии прокоагулянтной фосфолипидной мембраны в соответствии с принципами, описанными в Scheiflinger et al. (2008) J Thromb Haemost, 6:315-322. Учитывая высокую активность антитела 224F3 к FIXa среди антител, идентифицированных Scheiflinger et al., 224F3 выбрали в качестве эталона в следующих экспериментах (см. пример 1 для получения информации о конструкции 224F3).
Стимулирующее действие антител к FIXa на опосредованную FIXa активацию FX в FXa измеряли в автоматизированном высокопроизводительном биохимическом анализе в 384-луночных планшетах. Кратко, FIXa смешивали с очищенным антителом при четырехточечном 5-кратном разведении для зависимости ответа от дозы. Добавляли смесь FX/фосфолипид (PL) и измеряли степень образования FXa при добавлении субстрата для FXa (Pefaflour) и скорости гидролиза субстрата определяли путем выявления флуоресценции в течение пяти минут на считывающем устройстве с несколькими метками (PheraSTAR). Относительную стимулирующую активность FIXa рассчитывали как скорость образования FXa с комплексом FIXa-антитело по сравнению с одним FIXa.
Каждое антитело тестировали в диапазоне концентраций 0-200 нМ путем предварительной инкубации с 3 нМ FIXa, полученного из плазмы крови человека (Haematologic Technologies Inc, США), и 10 мкМ фосфолипидных везикул смеси 25:75 фосфатидилсерин : фосфатидилхолин (Haematologic Technologies Inc, США) в буфере для анализа (50 мМ HEPES, 100 мМ NaCl, 5 мМ CaCl2, 0,1% (вес/объем) PEG8000, рН 7,3, +1 мг/мл BSA) в течение 10 мин. перед добавлением FX, полученного из плазмы крови человека (Haematologic Technologies Inc, США), до концентрации 150 нМ. После 10-минутной активации при комнатной температуре реакцию (50 мкл) гасили добавлением 25 мкл буфера для гашения (50 мМ HEPES, 100 мМ NaCl, 60 мМ EDTA, 0,1% PEG8000, рН 7,3, +1 мг/мл BSA). Затем определяли количество образованного FXa при добавлении 25 мкл 2 мМ хромогенного субстрата S-2765 (Chromogenix, Швеция) и измерении конверсии хромогенного субстрата путем измерения оптической плотности при 405 им (ΔOD/мин.) в считывающем устройстве для микропланшетов. Скорость образования FXa при каждой концентрации антител определяли по стандартной кривой, построенной с известными количествами FXa, полученного из плазмы крови человека (Haematologic Technologies Inc, США).
В таблице 2 приведены измеренные скорости образования FXa для каждого антитела при тестируемых концентрациях. Исходя из этого, пиковые значения стимулирующей активности рассчитывали для каждого антитела как наблюдаемую максимальную скорость образования FXa по сравнению со скоростью образования с 224F3. Эти данные представлены в таблице 3, в которой показано, что антитела, принадлежащие к каждому из трех семейств (0-1886, 0-1998 и 1-1307 соответственно), обладают активностями, которые в 10-67 раз выше, чем активность, наблюдаемая для 224F3 (Scheiflinger et al.).
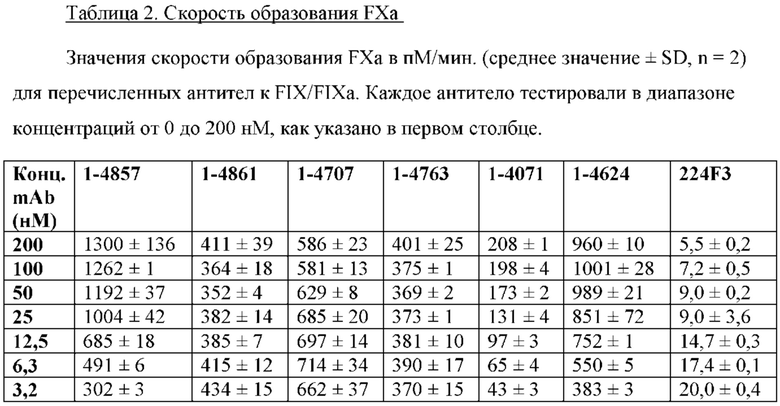
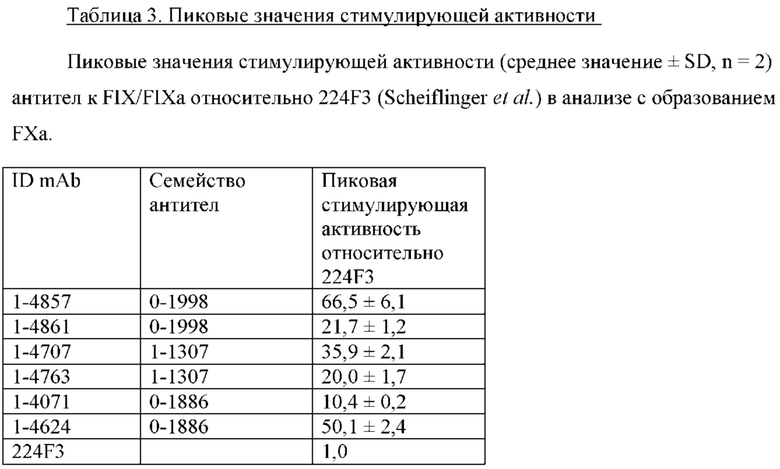
Пример 7. Получение моновалентных (неполных) антител
Чтобы избежать любых возможных эффектов авидности, ассоциированных с обычными моноспецифическими и бивалентными антителами, например в анализах с образованием FXa (пример 8) и в определенных экспериментах SPR (примеры 14 и 15), использовали формат моновалентного неполного (OA) антитела, как описано Martens et al.: A Novel One-Armed Anti-c-Met Antibody Inhibits Glioblastoma Growth In vivo. Clin. Cancer Res. 12, 6144-6152 (2006), где полную тяжелую цепь, усеченную тяжелую цепь (без Fab-области) и легкую цепь экспрессируют совместно. Вместо совместной экспрессии трех цепей, описанной Martens et al., в настоящем изобретении получали моновалентные антитела с использованием принципа Duobody®, как описано для биспецифических антител (пример 10). Таким образом, моновалентные антитела получали смешением полного моноспецифического и бивалентного антитела и димера усеченной тяжелой цепи (формально полученного из полного антитела путем удаления Fab-области) и давали возможность проходить обмену цепями в тех же экспериментальных условиях, которые описаны в примере 10. Для образования моновалентного антитела требуется, чтобы антитело и димер усеченной тяжелой цепи несли соответствующие комплементарные мутации для стимуляции гетеродимеризации, т.е. F405L/K409R для IgG1 и F405L+R409K/WT для IgG4, как описано в примере 10.
В случае моновалентных антител подтипа IgG1 усечение тяжелой цепи может происходить от N-конца до положения между Cys 220 и верхним шарнирным Cys 226 (нумерация по EU). Конкретным примером усеченной тяжелой цепи IgG1 является та, где усечены остатки 1-220.
В случае моновалентных антител подтипа IgG4 усечение тяжелой цепи может происходить от N-конца до положения между Cys 200 и верхним шарнирным Cys 226 (нумерация по EU). Конкретным примером усеченной тяжелой цепи IgG4 является та, где усечены остатки 1-214.
Пример 8. Активность моновалентных антител к FIX/FIXa в анализе с образованием FXa
Чтобы избежать любых возможных эффектов авидности, возникающих вследствие бивалентности стандартного формата антител, стимулирующую активность антител к FIX/FIXa относительно ферментативной активности FIXa в отношении FX определяли после преобразования в формат моновалентного неполного (OA) антитела (см. пример 8). Протестированные антитела перечислены в таблице 4 ниже. Моновалентный OA-вариант антитела 224F3 к FIXa (обозначенный mAb1-1582), также упоминаемый в примере 7, включили для сравнения.
Стимулирующую активность OA-антител измеряли в буфере для анализа (50 мМ HEPES, 100 мМ NaCl, 5 мМ CaCl2, 0,1% (вес/объем) PEG8000, рН 7,3, +1 мг/мл BSA) при фиксированных концентрациях фосфолипидных везикул смеси фосфатидилсерин (PS):фосфатидилхолин (PC) (конечная концентрация 500 мкМ; Haematologic Technologies Inc, США) и полученного из плазмы крови FIXa (конечные концентрации 0,17, 0,5 или 1 нМ; Haematologic Technologies Inc, США). Концентрацию FIXa выбирали для обеспечения того, чтобы менее 15% субстрата FX превращалось в FXa. После предварительной инкубации в присутствии моновалентного OA-антитела (конечные концентрации указаны в таблице 1) добавляли 150 нМ полученного из плазмы крови FX с получением конечного объема реакционной смеси 50 мкл и давали активации возможность проходить в течение 20 мин. при комнатной температуре. Затем реакцию гасили добавлением 25 мкл буфера для гашения (50 мМ HEPES, 100 мМ NaCl, 60 мМ EDTA, 0,1% PEG8000, рН 7,3, +1 мг/мл BSA) и определяли количество образованного FXa при дальнейшем добавлении 25 мкл 2 мМ хромогенного субстрата S-2765 (Chromogenix, Швеция) и измерении конверсии хромогенного субстрата путем измерения оптической плотности при 405 нм (ΔOD/мин.) в считывающем устройстве для микропланшетов. Измеренную активность корректировали на фоновую активность путем вычитания сигнала, измеренного в том же анализе, но с заменой FIXa и антитела буфером для анализа, а затем нормализовали в соответствии с концентрацией FIXa, присутствующего в анализе ([FIXa]общий). Разделив это число на аналогично нормализованную скорость образования FXa в отсутствие антитела (AFIXa,норм.), рассчитывали индекс стимуляции антитела, обеспечивающий кратную стимуляцию активности FIXa антителом в использованной концентрации. Из-за низкой скорости образования FXa свободным FIXa реакции активации в отсутствие антитела проводили, как описано выше, но в присутствии 5, 10 или 20 нМ FIXa. Из измеренных значений активности затем вычитали фон и нормализовали в соответствии с концентрацией FIXa в анализе. Для расчета индекса стимуляции использовали среднее значение трех нормализованных значений активности свободного FIXa.
Определение индекса стимуляции
Таким образом, расчет индекса стимуляции можно описать следующим образом.
Индекс стимуляции = ((AFIXa+OA - Афон) / FIXa]общий) / AFIXa,норм.,
где AFIXa+OA представляет собой активность, измеренную в присутствии ОА-антитела, Афон представляет собой фоновую активность, измеренную в отсутствие FIXa и моновалентного антитела, [FIXa]общий представляет собой концентрацию FIXa в анализе, и AFIXa,норм. представляет собой среднее значение нормализованной активности свободного FIXa.
Определение насыщения FIXa
Долю FIXa, насыщенного OA-антителом в анализе, определяют по концентрациям FIXa и OA-антитела и равновесной константе диссоциации (Kd), обуславливающей их взаимодействие. Последнее можно измерить с помощью методик, известных из уровня техники, таких как изотермическая титрапионная калориметрия (ITC).
Поскольку индекс стимуляции будет увеличиваться по мере увеличения концентрации OA-антитела до тех пор, пока не будет достигнуто насыщение FIXa, концентрацию OA-антитела в анализе следует выбирать так, чтобы гарантировать по меньшей мере 80% насыщение FIXa в анализе для обеспечения надлежащей оценки индекса стимуляции при полном насыщении FIXa.
Долю FIXa, связанного с OA-антителом в равновесном состоянии (fFIXa+OA), можно рассчитать из общих концентраций FIXa ([FIXa]общий) и OA ([ОА]общее) в анализе и равновесной константы диссоциации (Kd) для их взаимодействия с использованием квадратного уравнения связывания, как описано Krishnaswamy et al. (1992) J. Biol. Chem., 267:23696-23706 и детализировано в уравнениях 1 и 2 ниже, где
[FIXa+OA]анализа представляет рассчитанную концентрацию комплекса FIXa-ОА-антитело в равновесном состоянии в анализе,
fFIXa+OA представляет рассчитанную долю (в процентах) FIXa, которая связана с OA-антителом в равновесном состоянии в анализе.
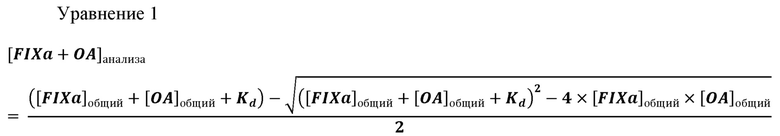
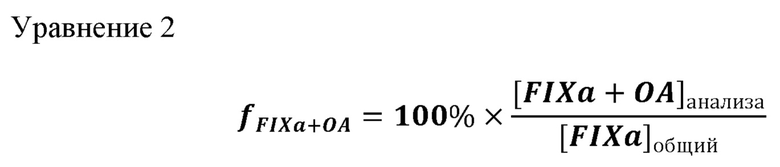
Индекс стимуляции для каждого моновалентного OA-антитела приведен в таблице 4. Было обнаружено, что для всех протестированных антител измеренный индекс стимуляции выше, чем индекс стимуляции, измеренный для моновалентного неполного антитела 224F3 (mAb1-1582).
При концентрации неполного антитела 224F3 в анализе 3260 нМ и Kd для взаимодействия с FIXa 0,477 нМ, как сообщается у Kerschbaumer et al. (US7297336-В2), более 95% FIXa было связано с неполным антителом 224F3 в анализе.
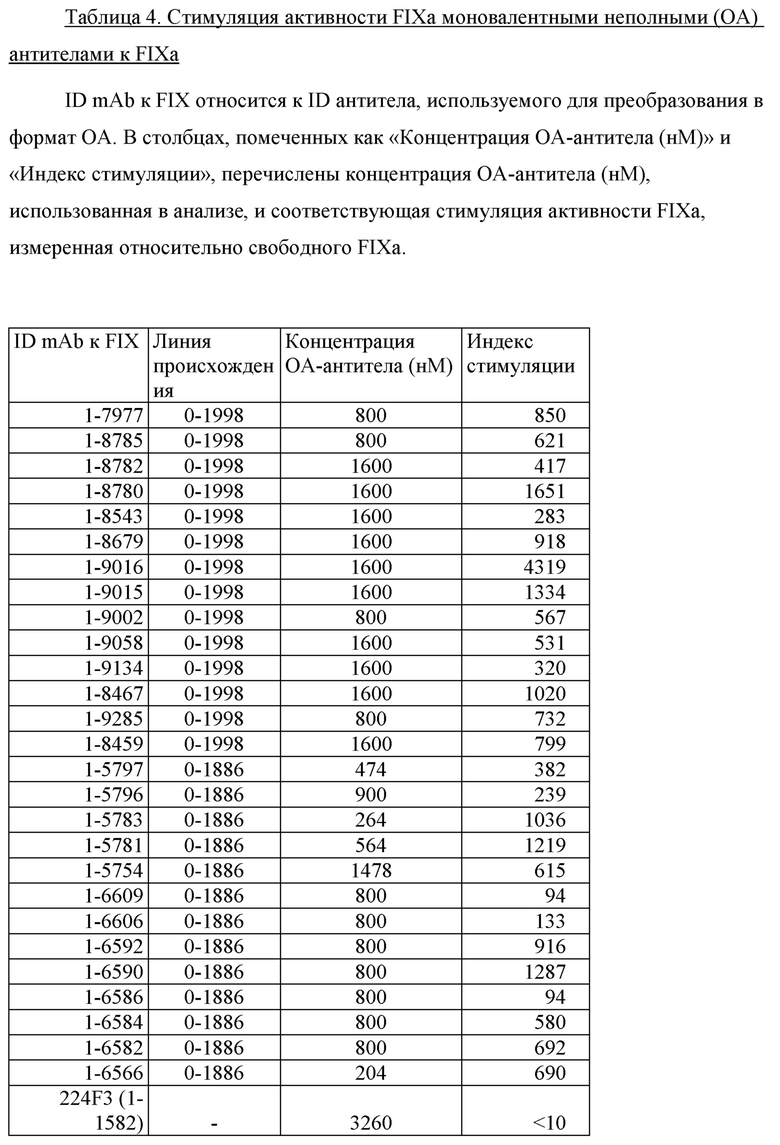
Пример 9. Разработка плазмид экспрессии для Fab и mAb к FX/FXa
Антитела к FX/FXa, раскрытые в данном документе, разрабатывали с использованием стандартных способов разработки антител и плазмиды экспрессии получали, как описано в примере 1 в отношении плазмид экспрессии для Fab и mAb к FIX/FIXa. Экспрессию, очистку и определение характеристик антител к FX/Xa также проводили, как описано для антител к FIX/FIXa в примерах 2 и 3.
Пример 10. Биспецифические антитела, полученные при сборке in vitro
Биспецифические антитела получают при сборке in vitro первого и второго антител способом Duobody® (Genmab), описанным (Labrijn et al. PNAS 2013, vol. 110, pp. 5145-5150) для биспецифических антител IgG1, и с использованием несколько модифицированного варианта для биспецифических антител IgG4, как подробно описано ниже.
Для IgG1 константная область тяжелой цепи первого антитела представляет собой K409R IgG1 (к FIX/FIXa), а константная область тяжелой цепи второго антитела представляет собой F405L IgG1 (к FX/FXa). IgG1 может представлять собой вариант IgG1 со сниженными эффекторными функциями, как упоминалось ранее.
Для IgG4 константная область тяжелой цепи первого антитела представляет собой S228P IgG4 (к FIX/FIXa), а константная область тяжелой цепи второго антитела представляет собой S228P F405L R409K IgG4 (к FX). Два родительских антитела получают, как описано в примерах 1-3. Реакцию обмена Fab-плеча проводят в буфере HEPES (рН 7,4) в восстанавливающих условиях с использованием 75 мМ 2-меркаптоэтиламина (2-МЕА) и инкубации при 30°С в течение 3 часов.
Пример 11. Прокоагулянтная активность биспецифических антител
Пары антител к FIXa и к hFX превращали в биспецифические антитела с помощью технологии Duobody®, как описано выше (пример 10). Биспецифические антитела тестировали на прокоагулянтную активность в различных анализах, таких как анализы с образованием FXa, описанные выше (пример 6), и в тесте тромбинообразования (TGT), описанном в следующем абзаце.
Анализ теста тромбинообразования (TGT)
TGT проводили в автоматизированной 384-луночной установке НТР с использованием стимуляции каолином (Haemonetics Corporation, номер по каталогу 6300). Кратко, антитела добавляли в концентрации 111 нМ (за исключением mAb1-1371, которое добавляли при 55 нМ, и mAb1-0021, которое добавляли при 166 нМ) к плазме крови с гемофилией А (НА) (George King). Затем добавляли каолин, смешанный с фосфолипидами (Rossix, номер по каталогу PL604T), с последующим добавлением субстрата FIIa (FluCa, Thrombinoscope, номер по каталогу TS50.00). Флуоресценцию измеряли на считывающем устройстве для планшетов с несколькими метками En Vision Perkin Elmer с интервалами в 1 минуту в течение 2 часов. Высоту пика рассчитывали как максимальное значение, наблюдаемое на тромбограмме, а затем нормализовали к высоте пика, наблюдаемой для эталонного антитела к FIXa и к FX. Эталон всегда включал домен связывания из антитела к FX mAb1-2375 (идентифицированного под SEQ ID NO: 93 и 94) в комбинации с доменами FIX из каждого из трех семейств, представленных mAb1-4707, mAb1-5788 и mAb1-4857. Антитела группировали по их относительной активности в TGT как низкой (0-24%), + (24-50%), ++ (50-75%) и +++ (>75%), где + является предпочтительным, ++ является более предпочтительным, и +++ является наиболее предпочтительным.
Выбор предпочтительных комбинаций биспецифических антител к FIXa/к FX
Большое количество антител к FX протестировали в виде биспецифических антител в комбинации с вариантами антител к FIXa, принадлежащих к трем линиям происхождения, mAb1-1307, mAb0-1886 и mAb0-1998. Выбранные комбинации пар антитело к FIXa/антитело к FX, демонстрирующие значительную активность в анализе TGT, показаны в таблице 5.
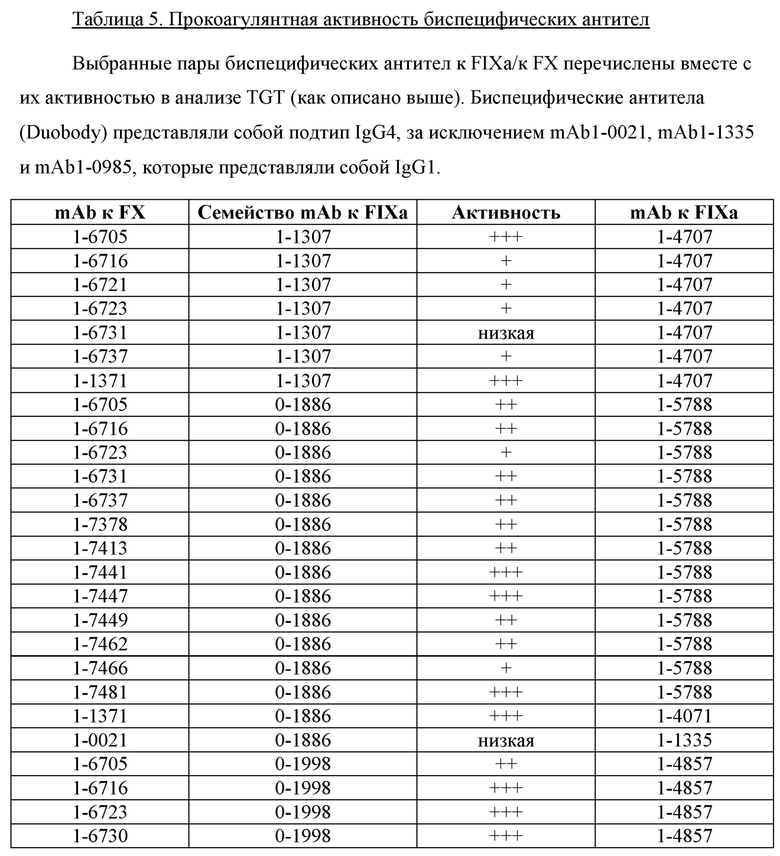
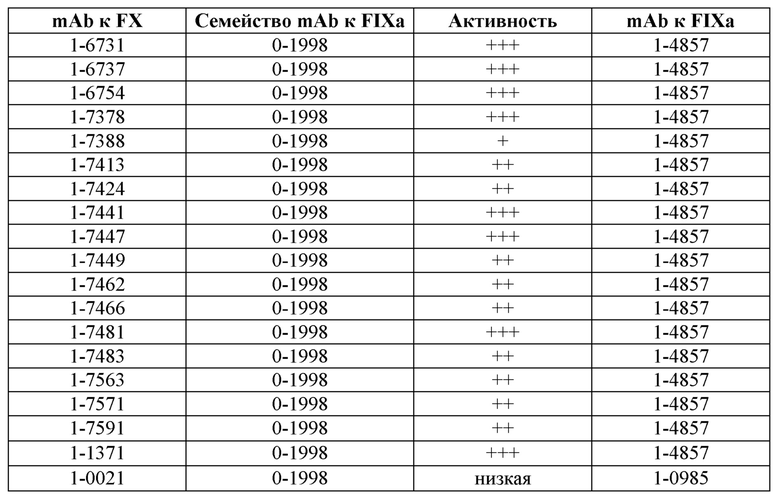
Как видно из таблицы 5, уровень активности, проявляемой биспецифическим антителом, зависит от конкретной комбинации антитело к FIXa/антитело к FX. Например, антитело к FX mAb1-6723 в комбинации с антителом к FIXa mAb0-1998 проявляет сильную активность (+++), тогда как активность mAb1-6723 в комбинации с mAb0-1886 (+) и mAb1-1307 (+) ниже.
Пример 12. Категоризация антител к FX
Некоторые антитела к FX, проявляющие значительную активность в TGT в формате биспецифических антител в комбинации с антителом к hFIXa (пример 11), подвергали категоризации друг против друга с использованием систем ForteBio Octet согласно той же постановке, которая описана для антител к FIXa (пример 4), за исключением замены FIXa на FX.
В результате анализа идентифицировали пять различных категорий, категории А-Е, определяемые антителами mAb1-1371, mAb1-1376, mAb1-6723, mAb1-7447 и mAb1-7449 соответственно. Две категории, категория А и категория Е, представлены только одним антителом к FX (см. таблицу 6).
Большое количество клонов идентифицировали в категории С как конкурирующие с mAb1-6723.
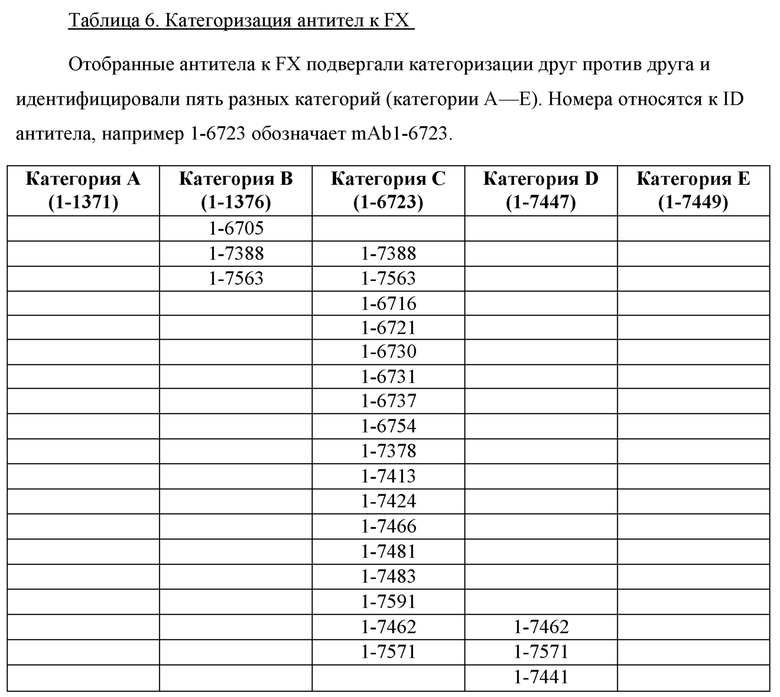
Пример 13. Кристаллизация и картирование эпитопов антитела к FX с использованием рентгеновской кристаллографии
Кристаллизация
Попытки кристаллизовать Fab0-8954 (Fab-фрагмент, соответствующий mAb1-6723) в комплексе с FX были безуспешными, тогда как получили кристаллы хорошего качества с FXa при ингибировании активного центра. Таким образом, кристаллы Fab0-8954, смешанные в молярном соотношении 1:1 с FXa без gla с ингибированным активным сайтом (бактериально экспрессированный фактор Ха человека без домена gla (дикого типа), ингибированный EGR, партия №hGDFXAEGR-022, Cambridge Protein Works), выращивали с использованием методики диффузии паров в варианте сидящей капли при 18°С. 150 нл белкового раствора 6,7 мг/мл комплекса в 20 мМ трис-HCl, рН 7,4, 50 мМ NaCl и 2,5 мМ CaCl2 смешивали с 50 нл 0,2 М ацетата магния, 0,1 М какодилата натрия, рН 6,5, 20% (вес/объем) PEG 8000 в качестве осадителя и инкубировали на 60 мкл осадителя.
Сбор данных дифракции
Кристалл подвергали криозащите путем добавления 1 мкл осадителя с добавлением 20% этиленгликоля к капле кристаллизации перед мгновенным охлаждением в жидком азоте. Данные дифракции собирали при 100K в пучке синхротронного излучения X06DA от Swiss Light Source (длина волны 1,0000  ) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 7).
) с использованием пиксельного детектора Pilatus2M от Dectris. Автоиндексирование, интеграцию и масштабирование данных выполняли с помощью программ из пакета XDS (статистические характеристики данных по дифракции обобщены в таблице 7).
Определение и уточнение структуры
Асимметричная единица содержит четыре комплекса Fab:FXa, как заключили из анализа коэффициента Мэтьюса. Структуру определяли путем молекулярной замены. Phaser, реализованный в наборе программ Phenix, использовали с цепями Н и L из записи 5I1K базы данных структуры белков в качестве поисковой модели, локализующей четыре Fab. Их моделировали с использованием правильной аминокислотной последовательности при помощи COOT, а затем уточняли, используя уточнение в Phenix. Уточненную модель Fab доработали с применением молекулярной замены в Molrep из набора ССР4 с цепями А и В из записи 1G2L базы данных структуры белков в качестве поисковой модели. Обнаружили четыре фрагмента FXa. Модель уточняли с использованием этапов уточнения в Phenix и неавтоматизированной перестройки в COOT. Статистические характеристики уточнения приведены в таблице 7.
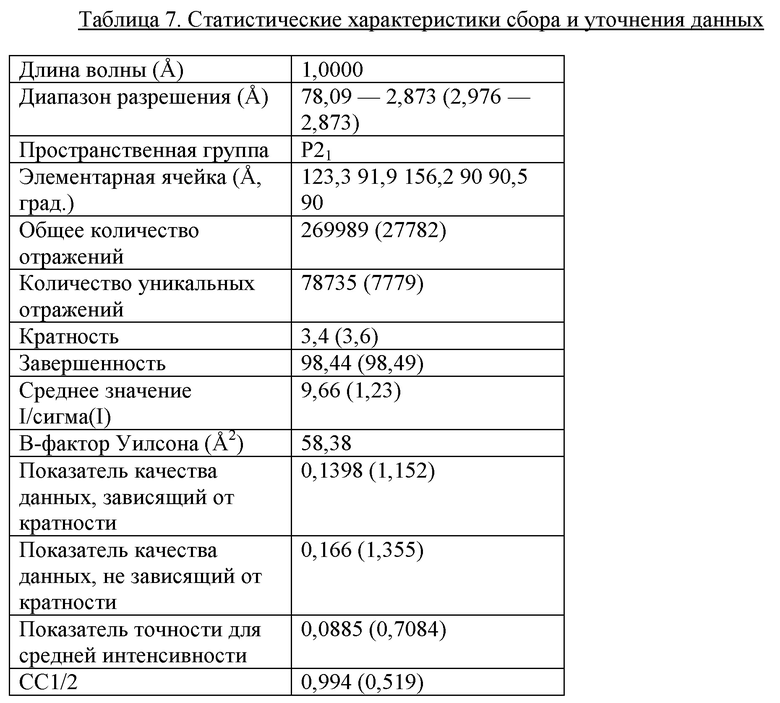
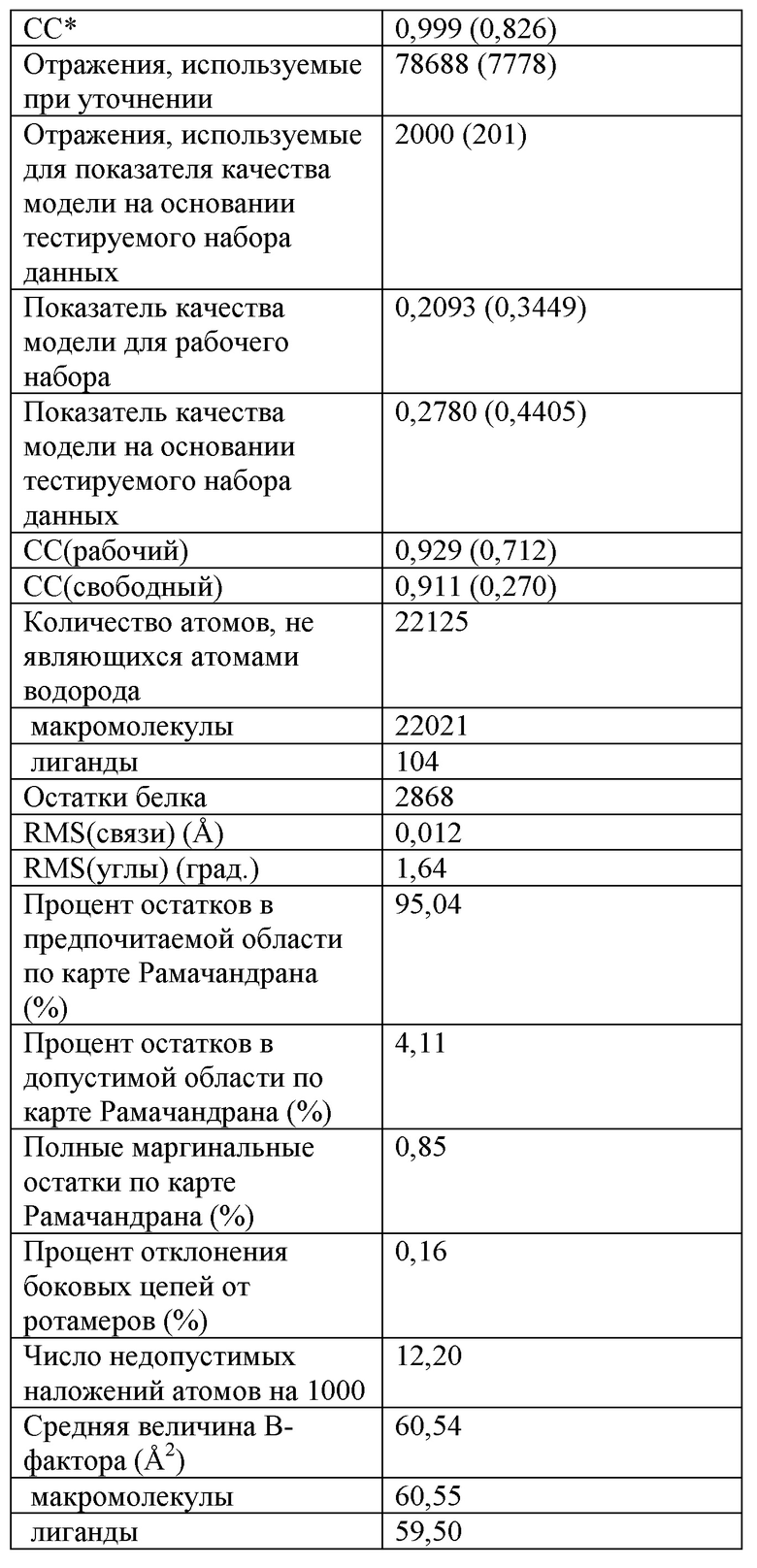
Статистические характеристики для оболочки с самым высоким разрешением показаны в скобках.
Определение эпитопа
Кристаллическая структура комплекса Fab0-8954:FXa содержит четыре копии комплекса в асимметричной единице, и их проанализировали отдельно для идентификации эпитопа и паратопа с использованием расстояния отсечения 3,5  .
.
Остатки включают в эпитоп для mAb1-6723, если они удовлетворяют критерию расстояния 3,5  по меньшей мере в одной из четырех копий комплекса Fab0-8954:FXa в элементарной ячейке. Остатки эпитопа и паратопа для mAb1-6723 перечислены в таблице 8.
по меньшей мере в одной из четырех копий комплекса Fab0-8954:FXa в элементарной ячейке. Остатки эпитопа и паратопа для mAb1-6723 перечислены в таблице 8.
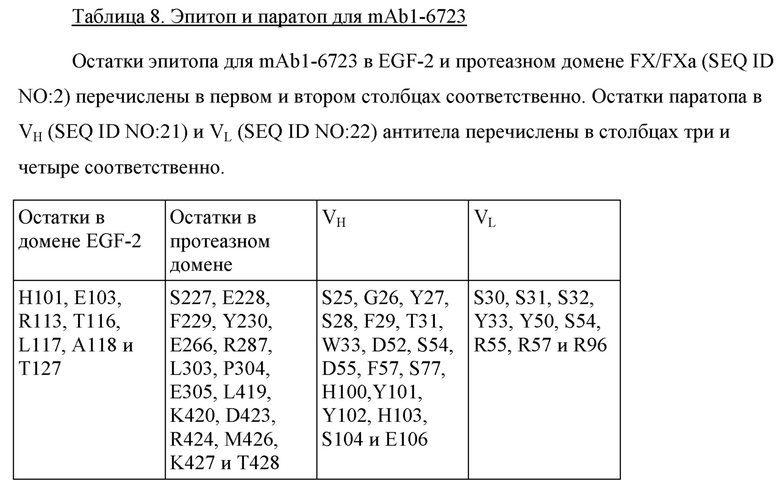
Варианты родительских антител (линии происхождения), раскрытые в данном документе, относятся к одинаковым категориям и имеют общие остатки эпитопа (горячие точки) с родительскими антителами.
Поскольку варианты антител, данные для которых приведены в примерах в данном документе, не содержат аминокислотных замен в положениях, которые имеют решающее значение для распознавания эпитопов, как показано на основе кристаллических структур комплексов родительское антитело-FXa, представленных в настоящем примере, специалисту в данной области должно быть понятно, что варианты в качестве отправной точки будут принадлежать одной и той же категории, конкурировать за связывание и распознавать по меньшей мере те же остатки «горячей точки» в эпитопе FX/FXa, что и антитело, от которого они происходят, т.е. mAb1-6723.
Пример 14. Идентификация остатков «горячей точки» на FX
Подобно картированию остатков «горячей точки» эпитопа на FIX для mAb1-1307, mAb0-1886 и mAb0-1998, как описано в примере 15, данные, представленные в настоящем примере, определяют остатки «горячей точки» эпитопа на FX для mAb1-6723. Используемыми вариантами FX были варианты FX без Gla-без EGF1 с аланином в одном участке (за исключением положения 118, которое представляет собой аланин у дикого типа, где вводили замену аланина на серии), соответствующие остаткам 86-448 из SEQ ID NO: 2 с N-концевой His-меткой (НННННН, для аффинной очистки), присоединенной посредством короткого GS-линкера (GGGGSGGGGS). Варианты, охватывающие остатки эпитопа, как определено в примере 13, перечислены в таблице 9.
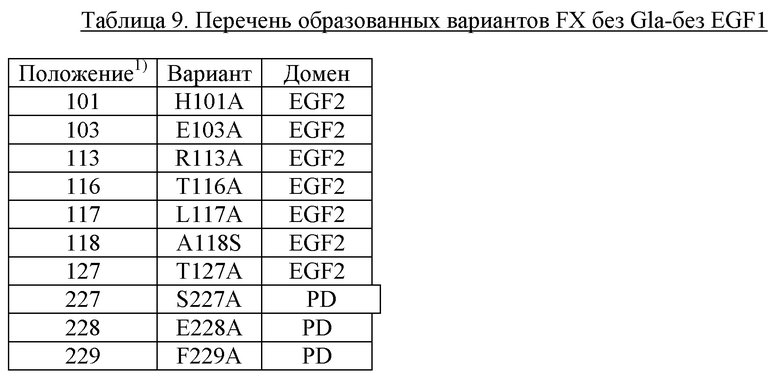

1) Согласно SEQ ID NO: 2.
2) EGF2 и PD относятся ко второму подобному эпидермальному фактору роста домену и протеазному домену соответственно.
FX без Gla-без EGF1 дикого типа и его варианты, перечисленные в таблице 9, экспрессировали в системе HEK293 и очищали с помощью аффинной хроматографии. Никакой экспрессии или плохой чистоты не наблюдали для вариантов L117A, L303A, Р304А и М426А, и оценка связывания для этих четырех вариантов была невозможна.
Идентификацию остатков «горячей точки» эпитопа проводили с использованием прибора Biacore Т200 при 25°С. Fc-антитело к hIgG из набора для захвата антител человека (GE Healthcare, номер по каталогу BR100839) в концентрации 2 мкг/мл иммобилизовали на сенсорном чипе серии S СМ5 (GE Healthcare, номер по каталогу BR100530) с использованием стандартной химии иммобилизации по аминогруппе. Антитело к FX mAb4-6934 (моновалентный вариант mAb1-6723) вводили при скорости потока 5 мкл/мин. в течение 30 с и захватывали иммобилизованным Fc-антителом к hIgG. Впоследствии 5 мкМ (с 2- или 3-кратными серийными разведениями) вариантов Т116А, A118S, Т127А, F229A и Е226А, 10 мкМ (с 5-кратными серийными разведениями) варианта Y230A и 10 мкМ (с 2- или 3-кратными серийными разведениями) WT и вариантов Н101А, Е103А, R113A, S227A, Е228А, R287A, Е305А, L419A, K420A, D423A, R424A, K427A и Т428А вводили при скорости потока 5 мкл/мин. в течение 90 с, позволяя связаться с захваченным антителом к FX, с последующей 90-секундной инъекцией буфера для обеспечения возможности диссоциации вариантов FX без GLA-без EGF1. Рабочий буфер (также используемый для разбавления антитела к FX и вариантов hFX без GLA-без EGF1) содержал 10 мМ HEPES, 150 мМ NaCl, 1 мг/мл BSA и 5 мМ CaCl2 (рН 7,4). Регенерацию сенсорного чипа проводили с использованием 1 М муравьиной кислоты. Данные по связыванию анализировали с использованием аппроксимации в равновесном состоянии в соответствии с моделью 1:1 в программном обеспечении Biacore Evaluation 2.0, поставляемом GE Healthcare. Данные по связыванию представлены как % связывания вариантов FX с антителом к FX (моновалентным mAb1-6723) относительно связывания FX дикого типа с антителом к FX при введении 5 или 10 мкМ вариантов FX и рассчитываются согласно формуле:
Связывание (%)=100% × [(Rmax_FXvar,Ab)/(Rmax_Ab)] / [(Rmax_FXwt,Ab)/(Rmax_Ab)],
где Rmax_Ab представляет уровень захвата (RU) антитела к FX, и Rmax_FXvar,Ab и Rmax_FXwt,Ab представляют связывание (RU) вариантов FX и FX дикого типа в одинаковой концентрации (5 мкМ для всех, кроме варианта Y230A, концентрация которого составляла 10 мкМ) с захваченным антителом к FX соответственно. Результаты показаны в таблице 10.
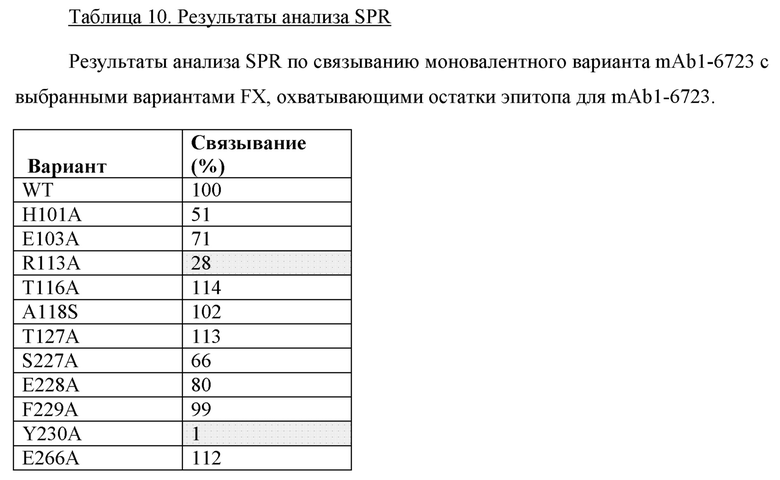
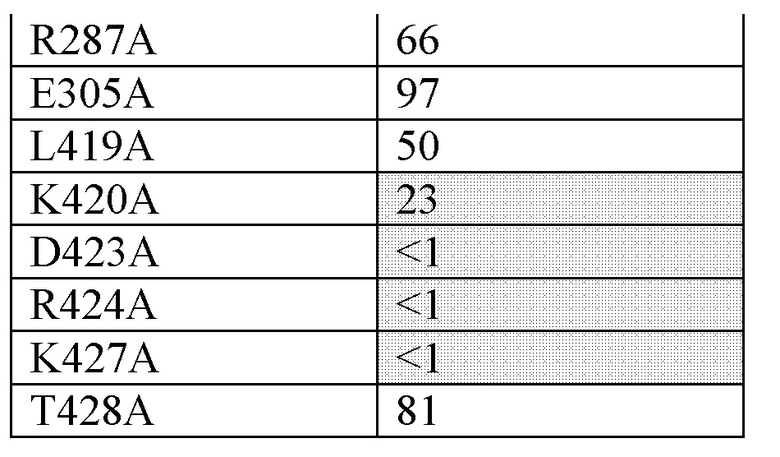
Остатки «горячей точки» для mAb1-6723
Остатки «горячей точки» для mAb1-6723 определяют как положения, в которых замена остатка дикого типа аланином (или замена в положении 118 аланина серином) снижает связывание антитела до 30% или менее относительно связывания антитела с FX дикого типа в концентрации 5 мкМ WT (или варианта) FX без GLA-без EGF1.
Остатки «горячей точки» для mAb1-6723 (экспериментально представленного его моновалентным аналогом, mAb4-6934):
R113, Y230, K420, D423, R424 и K427.
Пример 15. Идентификация остатков «горячей точки» на FIX/FIXa
Для определения остатков, критических для взаимодействия (называемых «горячей точкой») между Ab к FIX/FIXa mAb0-1886, mAb0-1998 и mAb1-1307 и FIX, выбрали набор вариантов FIX на основе кристаллической структуры FIXa в комплексе с соответствующими Fab-фрагментами (Fab7237, Fab7238 и Fab7236, соответственно). Как подробно описано ниже, выбранные варианты FIX временно экспрессировали в клетках млекопитающих, очищали и определяли характеристики в отношении их связывания с моновалентными вариантами mAb0-1886, mAb0-1998 и mAb1-1307 с использованием поверхностного плазмонного резонанса (SPR).
Получение мутантов FIX
ДНК-плазмиду, подходящую для временной экспрессии у млекопитающих, конструировали с использованием кассеты экспрессии, кодирующей аминокислотные остатки 1-461 FIX человека (UNIPROT Р00740, за исключением мутации Т194А по нумерации UNIPROT, соответствующей Т148А из SEQ ID NO: 1), за которыми непосредственно следуют шесть остатков гистидина (6×His-метка, для аффинной очистки). Секретированная зрелая белковая цепь FIX, полученная с использованием этой конструкции, идентична аллельной форме А148 FIX человека (Anson et al. EMBO J. 1984 3:1053-1060, McGrawetal, Proc Natl Acad Sci USA. 1985 82:2847-2851) за исключением добавления С-концевой His-метки.
Используя конструкцию в качестве матрицы, выбранные мутации вводили с помощью ПЦР. Для каждой точечной мутации, указанной в таблице 11, создавали прямой праймер, содержащий необходимую аминокислотную замену, и обратный праймер без аминокислотных мутаций. Эти праймеры использовали в стандартной реакции ПЦР с вектором, описанным выше в качестве матрицы для амплификации полной последовательности вектора. Клонирование без лигирования использовали для соединения концов полученного фрагмента амплифицированной ДНК в кольцевую плазмиду экспрессии с использованием перекрывающихся последовательностей, введенных прямым и обратным праймерами.
Закольцованные плазмиды трансформировали в клетки Е. coli, выращивали на чашках с селективным агаром для образования колоний и использовали колонии для запуска культур Е. coli в жидкой питательной среде. После роста культур Е. coli в течение ночи получали плазмидные препараты и мутантов идентифицировали секвенированием ДНК.
Выработку рекомбинантного белка осуществляли путем трансфекции клеток expi293F, растущих в суспензионной культуре в среде Expi293 Expression™ (ThermoFisher Scientific, номер по каталогу А1435101), с использованием набора для трансфекции ExpiFectamine™ 293 (ThermoFisher Scientific, номер по каталогу А14525) и плазмидной ДНК, кодирующей каждый из необходимых вариантов FIX, а также FIX дикого типа (соответствует SEQ ID NO: 1 с С-концевой His-меткой). Витамин К добавляли до конечной концентрации 5 мг/мл во время трансфекции. Усилители 1 и 2 трансфекции из набора для трансфекции ExpiFectamine™ 293 добавляли на следующий день после трансфекции. Культуры клеток собирали через 5 дней после трансфекции центрифугированием.
С-концевую His-метку в каждом варианте FIX использовали для очистки белка в многолуночной роботизированной установке периодического действия. Кратко, собранные супернатанты клеточных культур приводили к условиям связывания, смешивали со смолой для аффинной очистки Ni Sepharose 6 Fast Flow (GE Healthcare, номер по каталогу 17-5318-02, 50 мкл осажденной смолы/мл среды для культивирования клеток) и инкубировали при встряхивании в течение 20 минут. Затем смеси смола/супернатант переносили на фильтровальный планшет и жидкость пропускали через фильтровальный планшет с применением вакуума. Смолу, оставшуюся на фильтровальном планшете, трижды промывали перед элюированием в буфере с высоким содержанием имидазола.
Определение концентрации очищенных белковых растворов проводили с помощью ELISA, используя антитело к FIX для обнаружения и высокочистый рекомбинантный FIX дикого типа для стандартных кривых.
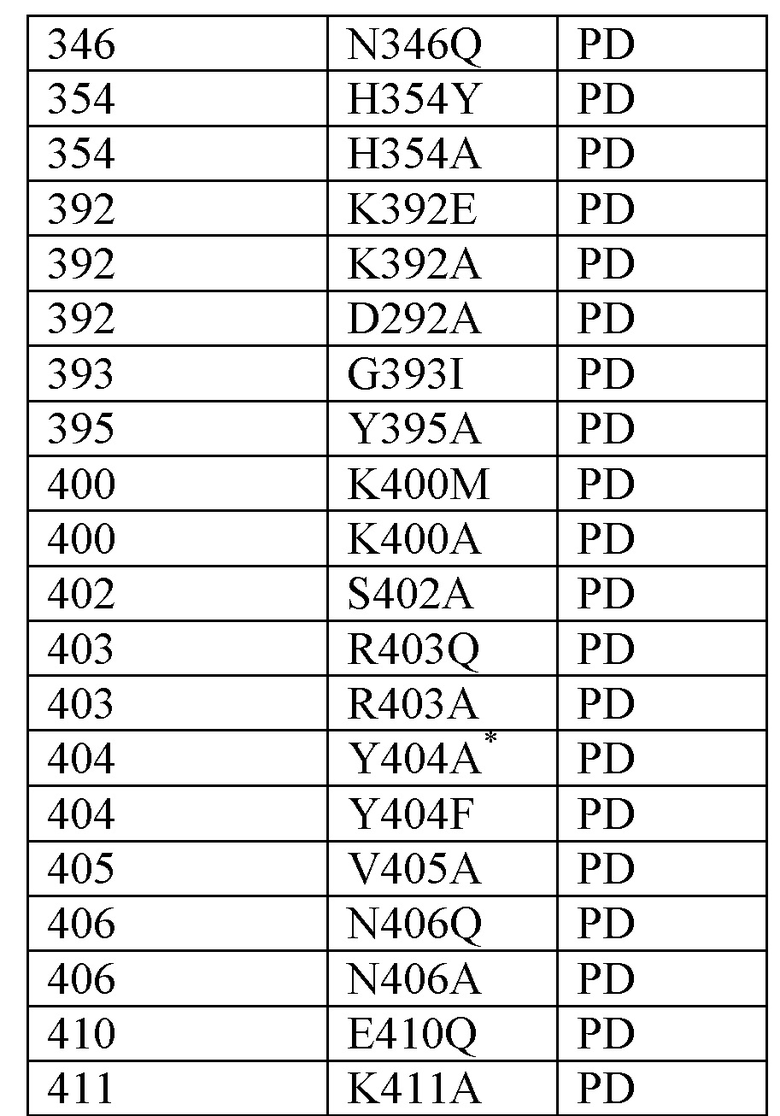
3) Согласно SEQ ID NO: 1.
4) EGF2 и PD относятся ко второму подобному эпидермальному фактору роста домену и протеазному домену соответственно.
* Варианты, отмеченные звездочкой, демонстрируют очень низкие уровни экспрессии и не могут быть оценены в исследованиях связывания.
Термостабильность вариантов FIX
Чтобы проверить, приводит ли введение аминокислотных замен в варианты FIX к дестабилизации и неправильному сворачиванию, для вариантов определяли среднюю точку (Tm) термического конформационного перехода с разворачиванием.
Очищенные варианты FIX загружали в стандартные капилляры (стандартные капилляры Prometheus NT.48 nanoDSF Grade, Nanotemper Technologies GmbH, Мюнхен) и вводили в Prometheus NT.48 (Nanotemper Technologies GmbH, Мюнхен). Интенсивность возбуждения составляла 70%, а термическое разворачивание следовало при 20-90°С с темпом нагревания 1,5°С/мин. Флуоресценцию триптофана измеряли путем возбуждения при 280 нм и регистрации излучения при 330 нм и 350 нм. Можно определить Tm вариантов FIX (кроме случаев, когда концентрация белка была ниже 20 мкг/мл, что имело место для FIX N101D, Н256А, L330A, S339A, G393I, Y404A и N406Q) по соотношению флуоресценции, измеренной при 350 нм и 330 нм (F350/F330). Во всех случаях программа PR.ThermControl v2.0.4 (NanoTemper Technologies GmbH, Мюнхен) могла автоматически подбирать Tm, определяя максимум первой производной кривой разворачивания F350/F330. Обнаружено, что Tm для FIX дикого типа составляет 51°С, и Tm для вариантов находится в диапазоне от 47 до 54°С, свидетельствуя о том, что аминокислотные замены не вызывают значительной дестабилизации.
Анализ SPR
Варианты FIX характеризовали в отношении их связывания с mAb0-1886, mAb0-1998 и mAb1-1307 с использованием поверхностного плазмонного резонанса (SPR) при захвате варианта FIX посредством С-концевой His-метки. Чтобы избежать потенциальных эффектов авидности, связанных с традиционным бивалентным антителом, т.е. обеспечить взаимодействие 1:1, в качестве анализируемых веществ использовали моновалентные варианты mAb0-1886, mAb0-1998 и mAb1-1307, обозначенные mAb4-0673, mAb4-0004 и mAb3-3279 соответственно (получены, как описано в примере 7).
Анализы SPR проводили на приборах Biacore 4000 или Biacore Т200 (Biacore АВ, Упсала, Швеция). Для экспериментов на приборе Т200 применяли следующие условия: измерения проводили при температуре 25°С. Антитело к His в концентрации 25 мкг/мл (R&D Systems, номер по каталогу МАВ050) иммобилизовали на сенсорном чипе СМ5 с использованием стандартной химии иммобилизации по аминогруппе. Варианты антител к FIX при 25 нМ вводили при скорости потока 10 мкл/мин. в течение 1 мин. и захватывали посредством их His-метки иммобилизованным антителом к His. Впоследствии 200 нМ (с 4-кратными серийными разведениями), 1600 нМ (с 3-кратными серийными разведениями) и 2000 нМ (с 3-кратным серийным разведением) mAb4-0004, mAb3-3279 и mAb4-0673 соответственно вводили при скорости потока 50 мкл/мин. в течение 5 минут, позволяя связаться с захваченным вариантом FIX, с последующей 10-минутной инъекцией буфера для обеспечения возможности диссоциации моновалентных антител к FIX. В качестве рабочего буфера использовали 20 мМ трис, 150 мМ NaCl, 5 мМ CaCl2, 0,05% Tween-20, 1 мг/мл BSA, рН 7,4. Его также использовали для разведения образцов антитела к FIX и образцов FIX. Регенерацию чипа проводили с использованием 10 мМ глицина, рН 2,0. Данные по связыванию анализировали в соответствии с моделью 1:1, используя BiaEvaluation 4.1, предоставленный производителем (Biacore АВ, Упсала, Швеция). Аналогичную экспериментальную схему использовали для прибора Biacore 4000.
Первоначально все варианты FIX, перечисленные в таблице 11, подвергали скринингу с использованием прибора Biacore 4000 в отношении связывания со всеми тремя моновалентными антителами, mAb4-0004, mAb3-3279 и mAb4-0673. Связывание антител с вариантами FIX, содержащими мутации в положениях, отвечающих их соответствующим остаткам эпитопа (определяемым критерием расстояния, как указано в примере 6), как и ожидалось, в различной степени нарушалось. Не наблюдали значительного влияния на связывание антител для вариантов FIX, содержащих мутации в положении, не отвечающем их соответствующим остаткам эпитопа. В частности, ни одна из замен, сделанных в домене EGF2, не оказала какого-либо влияния на связывание с каким-либо антителом (данные не показаны).
Более подробный анализ связывания проводили для остатков, определенных как остатки эпитопа (см. пример 6), с использованием прибора Biacore Т200. Результаты приведены в таблице 12.
Данные по связыванию представлены как % связывания антитела с вариантом FIX относительно связывания антитела с FIX дикого типа, рассчитанный по формуле:
Связывание (%) = 100% × [(Rmax_Ab,FIX_var)/(Rmax_FIXvar)] / [(Rmax_Ab,FIX_wt)/(Rmax_FIXwt)],
где Rmax_FIXvar и Rmax_FIXwt представляют уровень захвата (RU) варианта FIX и FIX дикого типа соответственно, и где Rmax_Ab,FIX_var и Rmax_Ab,FIX_wt представляют связывание (RU) антитела с захваченным вариантом FIX и FIX дикого типа соответственно. Результаты показаны в таблице 12.
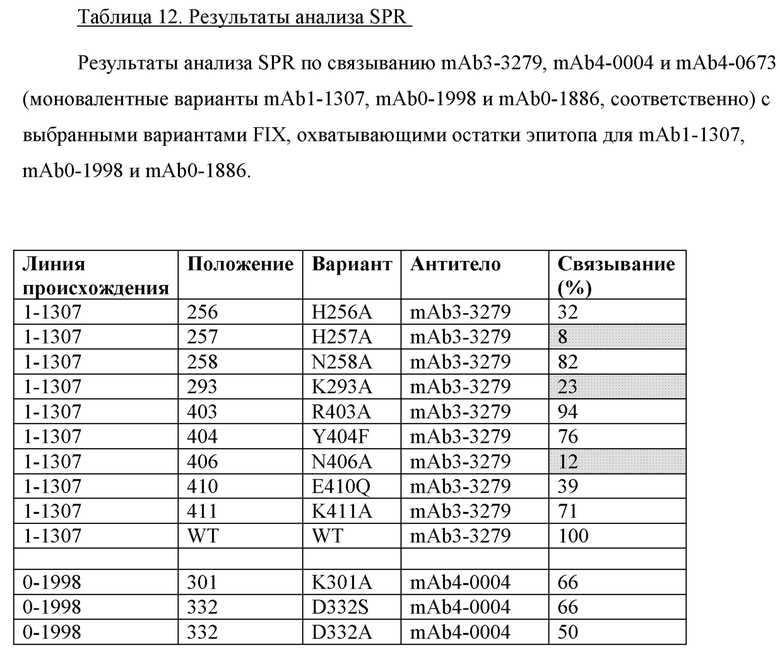
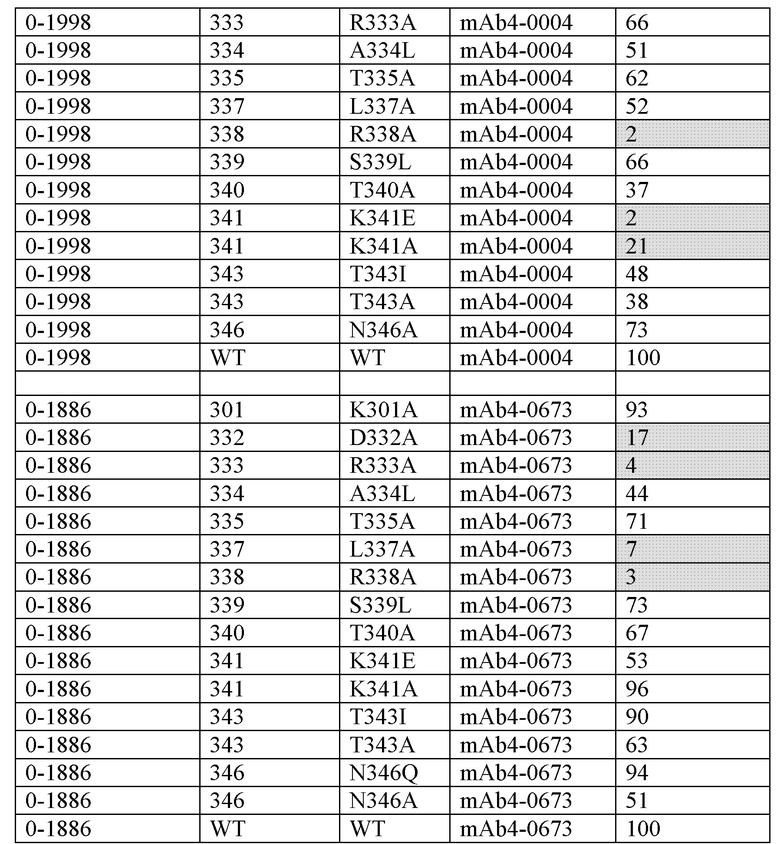
1) Положение согласно SEQ ID NO: 1.
2) 100% × [(Rmax_Ab,FIX_var) / (Rmax_FIXvar)] / [(Rmax_Ab,FIX_wt) / (Rmax_FIXwt)].
Остатки «горячей точки» для mAb1-1307, mAb0-1998 и mAb0-1886
Остатки «горячей точки» для mAb1-1307, mAb0-1998 и mAb0-1886 определены как положения, в которых замена остатка дикого типа аланином снижает связывание антитела до 30% или менее относительно связывания антитела с FIX дикого типа.
Остатки «горячей точки» для mAb1-1307 (экспериментально представленного как mAb3-3279):
Н257, K293 и N406.
Остатки «горячей точки» для mAb0-1998 (экспериментально представленного как mAb4-0004):
R338 и K341.
Остатки «горячей точки» для mAb0-1886 (экспериментально представленного как mAb4-0673):
D332, R333, L337 и R338.
Как для mAb0-1998, так и для mAb0-1886 остаток, наиболее способствующий связыванию, представляет собой R338; замена R338 аланином (R338A) в FIX показала наибольшее влияние на связывание антител, которое было значительно снижено до 2% и 3% для mAb0-1998 и mAb0-1886 соответственно относительно связывания антител с FIX дикого типа.
Пример 16. Активность биспецифических антител к FIX(a)/FX(a) в анализе с образованием FXa
Прокоагулянтную активность биспецифических антител к FIXa/FX определяли на основании их способности стимулировать активацию FX с помощью FIXa в присутствии прокоагулянтной фосфолипидной мембраны. Протестированные биспецифические антитела (BiAb) перечислены в таблице 13, и для сравнения включили АСЕ910.
Прокоагулянтную активность каждого биспецифического антитела описывают как кратность стимуляции по сравнению с активацией FX свободным FIXa при данной концентрации антитела. Биспецифические антитела тестировали в 8 концентрациях (полученных серийными трехкратными разведениями в буфере для анализа) путем предварительной инкубации с 125 пМ FIXa, полученного из плазмы крови человека (Haematologic Technologies Inc., США), и 500 мкМ фосфолипидных везикул смеси 25:75 фосфатидилсерин:фосфатидилхолин (Haematologic Technologies Inc, США) в буфере для анализа (50 мМ HEPES, 100 мМ NaCl, 5 мМ CaCl2, 0,1% (вес/объем) PEG8000, рН 7,3,+1 мг/мл BSA) в течение 10 мин. Затем инициировали активацию путем добавления FX, полученного из плазмы крови человека (Haematologic Technologies Inc, США), до концентрации 25 нМ. После 15-минутной активации при комнатной температуре реакцию (50 мкл) гасили добавлением 25 мкл буфера для гашения (50 мМ HEPES, 100 мМ NaCl, 60 мМ EDTA, 0,1% PEG8000, рН 7,3,+1 мг/мл BSA). Определяли количество образованного FXa при добавлении 25 мкл 2 мМ хромогенного субстрата S-2765 (Chromogenix, Швеция) и измерении конверсии хромогенного субстрата путем измерения оптической плотности при 405 нм (ΔOD/мин.) в считывающем устройстве для микропланшетов. Аналогично, активацию FX свободным FIXa определяли при концентрации FIXa 25 нМ и времени реакции 60 мин.
Измеренную активность нормализовали в соответствии с концентрацией FIXa, присутствующей в анализе, и временем реакции. Путем деления этого числа на аналогично нормализованную скорость образования FXa в отсутствие антитела рассчитывали кратность стимуляции антителом при данной концентрации.
Таким образом, расчет стимуляции biAb можно описать следующим образом:
стимуляция biAb = (AFIXa+biAb / ([FIXa]анализа × tреакции)) / AFIXa,норм.,
где AFIXa+biAb представляет активность, измеренную в присутствии биспецифического антитела, [FIXa]анализа представляет концентрацию FIXa в анализе, tреакции представляет время реакции, и AFIXa,норм. представляет нормализованную активность свободного FIXa.
В таблице 13 перечислены максимальная стимуляция, определенная для каждого биспецифического антитела среди 8 протестированных концентраций антитела, а также концентрация, при которой наблюдалась максимальная стимуляция. Было обнаружено, что для всех протестированных биспецифических антител максимальная стимуляция была выше, чем измеренная для АСЕ910, которое было протестировано в интервале концентраций от 0 до 15300 нМ.
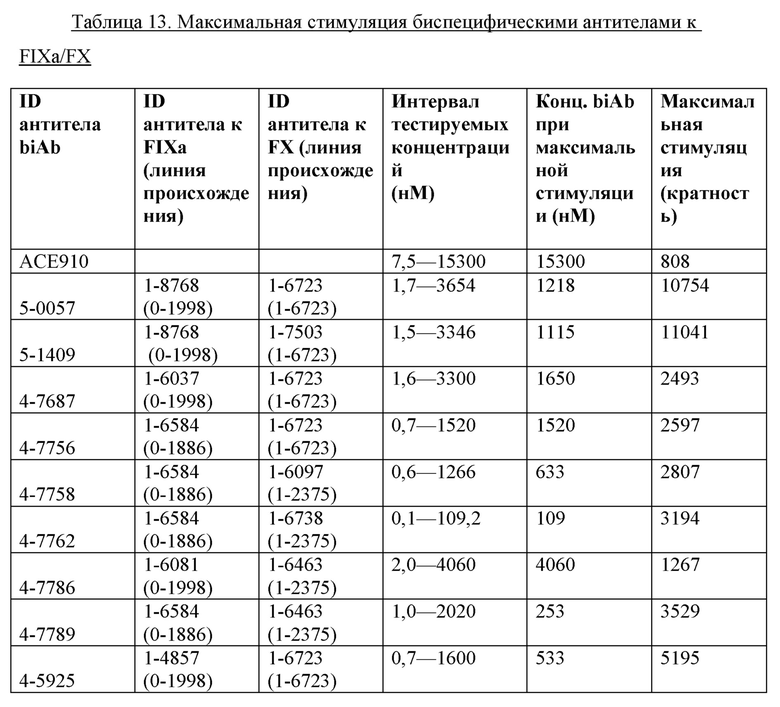
Пример 17. Активность биспецифических антител к FIX(a)/FX(a) в тесте тромбинообразования (TGT) в обедненной тромбоцитами или обогащенной тромбоцитами плазме крови человека с имитацией гемофилии А
Прокоагулянтную активность биспецифических антител mAb4-7761, mAb4-7762, mAb4-7789, mAb5-0057 и mAb5-1409 (см. таблицу 14) определяли на основе их способности стимулировать тромбинообразование в присутствии либо прокоагулянтной синтетической фосфолипидной мембраны, либо тромбоцитов в соответствии с принципами, описанными Hemker et al. (Pathophysiol Haemost Thromb, 2002; 32:249-253). ACE910 включили для сравнения. Каждое антитело (тестируемое соединение) испытывали в тесте тромбинообразования (TGT) в объединенной плазме крови пациентов с гемофилией А (НА), обедненной тромбоцитами (НА-РРР), и/или в плазме крови человека, обогащенной тромбоцитами, с индуцированной НА (НА-PRP).
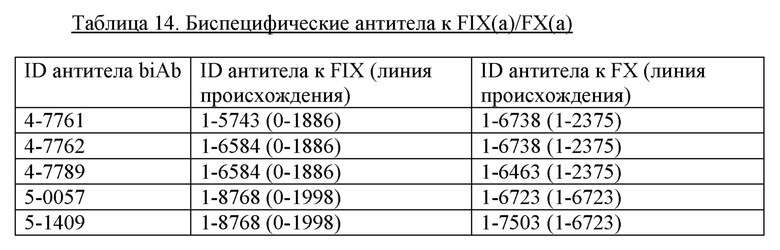
Обогащенная тромбоцитами плазма крови человека с индуцированной гемофилией A (HA-PRP)
Кровь получали от здоровых, давших согласие доноров путем венепункции. Шесть объемов крови собирали с 1 объемом кислой цитратной декстрозы (ACD; 85 мМ цитрата натрия, 110 мМ декстрозы и 62,3 мМ лимонной кислоты, рН 4,9), конечное значение рН 6,5, и центрифугировали в течение 20 мин. при 220 g при комнатной температуре (RT). Обогащенную тромбоцитами плазму крови (PRP) собирали и определяли концентрации тромбоцитов с помощью гематологического анализатора Medonic СА 620 (Boule Diagnostics АВ, Спонга, Швеция). Часть плазмы крови, содержащую эритроциты, центрифугировали еще 10 мин. при 600 g при RT. Обедненную тромбоцитами плазму крови (РРР) собирали и использовали для разбавления PRP до 300000 тромбоцитов/мкл. Условия НА индуцировали добавлением FVIII-нейтрализующего антитела к FVIII человека (овечье антитело к фактору VIII человека - 5 мг, Haematologic Technologies, Вермонт, США) до конечной концентрации 0,1 мг/мл и осторожно перемешивали при 2 об./мин. в течение 30 минут при RT.
Тест тромбинообразования
Тесты тромбинообразования (TGT) в HA-PRP и НА-РРР (George King Bio-Medical Inc, Канзас, США) выполняли с помощью откалиброванной стандартом автоматической тромбографии с использованием флуориметра для 96-луночных планшетов (Fluoroscan Ascent FL, Thermolabsystems, Хельсинки, Финляндия). Реакционные смеси содержали 70 мкл HA-PRP (300000 тромбоцитов/мкл) или НА-РРР, 10 мкл разведения тестируемого соединения (разведенного в 20 мМ HEPES, 140 мМ NaCl, рН 7,4, 2% BSA), 20 мкл реагентов CAT, содержащих тканевый фактор (TF) (реагент PRP; TF без синтетических фосфолипидов, реагент РРР LOW; TF с синтетическими фосфолипидами, 1 пМ итогового TF, Thrombinoscope BV, Маастрихт, Нидерланды) или калибратор тромбина (Thrombinoscope BV), и 20 мкл смеси, содержащей флуоресцентно меченный субстрат для тромбина z-Gly-Gly-Arg-AMC (3 мМ) и CaCl2. (90 мМ) (Thrombinoscope BV). TGT проводили при восьми концентрациях тестируемого соединения (0,3, 1,0, 3, 10, 30, 100, 300 и 900 нМ, конечная концентрация в плазме крови) или только при добавлении буфера (20 мМ HEPES, 140 мМ NaCl, рН 7,4, 2% BSA) (представляет контроль НА). Диапазоны концентраций тестировали по меньшей мере в трех независимых экспериментах в НА-РРР из того же запаса или в крови от четырех разных доноров. Нормальные контрольные уровни в TGT измеряли, используя необработанную PRP человека или объединенную нормальную плазму крови человека РРР CRYOcheck™ (Precision Biologic Inc., Дартмут, Канада) с добавлением только буфера (20 мМ HEPES, 140 мМ NaCl, рН 7,4, 2% BSA). В целом TGT проводили в течение 90 минут и параметр TGT пиковой высоты тромбина (нМ) анализировали с помощью программного обеспечения Thrombinoscope (Thrombinoscope BV).
На фигуре 2/в таблице 15 показаны измеренные пиковые скорости тромбинообразования для каждого биспецифического антитела при концентрациях, протестированных в НА-РРР. Данные показывают, что все тестируемые соединения увеличивают пик образования тромбина выше уровня, наблюдаемого в отсутствие антитела, т.е. проявляют прокоагулянтную активность. Кроме того, уровни тромбинообразования от 30 до 300 нМ для mAb4-7761, mAb4-7762, mAb4-7789, mAb5-0057 и mAb5-1409 выше, чем уровни, наблюдаемые для АСЕ910, что демонстрирует превосходную действенность. Кроме того, уровни тромбинообразования при 300-900 нМ mAb5-0057 и mAb5-1409 выше, чем уровни, наблюдаемые при 900 нМ АСЕ910, что демонстрирует более высокие значения действенности и эффективности этих соединений по сравнению с АСЕ910.
На фигуре 3/в таблице 16 показаны измеренные пиковые уровни тромбинообразования для mAb5-0057 и mAb5-1409 при концентрациях, протестированных в HA-PRP. В этих условиях mAb5-0057 и mAb5-1409 также демонстрируют лучшие значения действенности и эффективности по сравнению с АСЕ910.
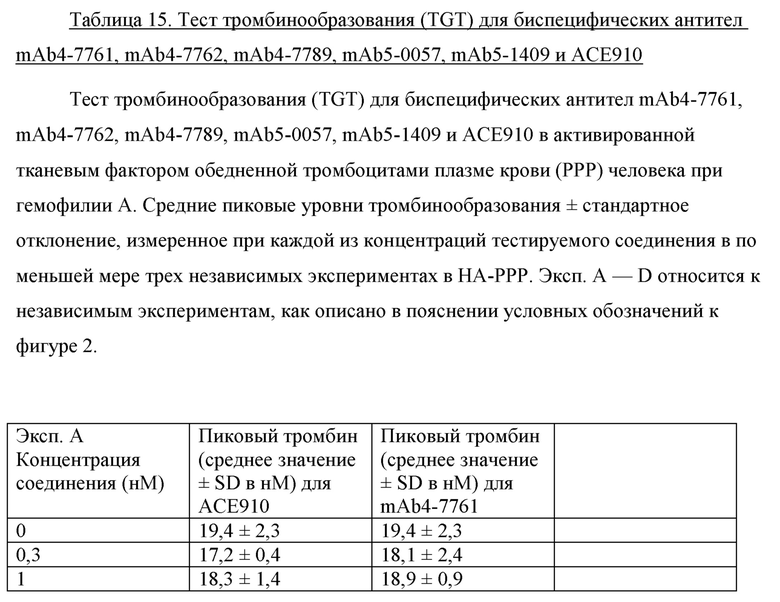
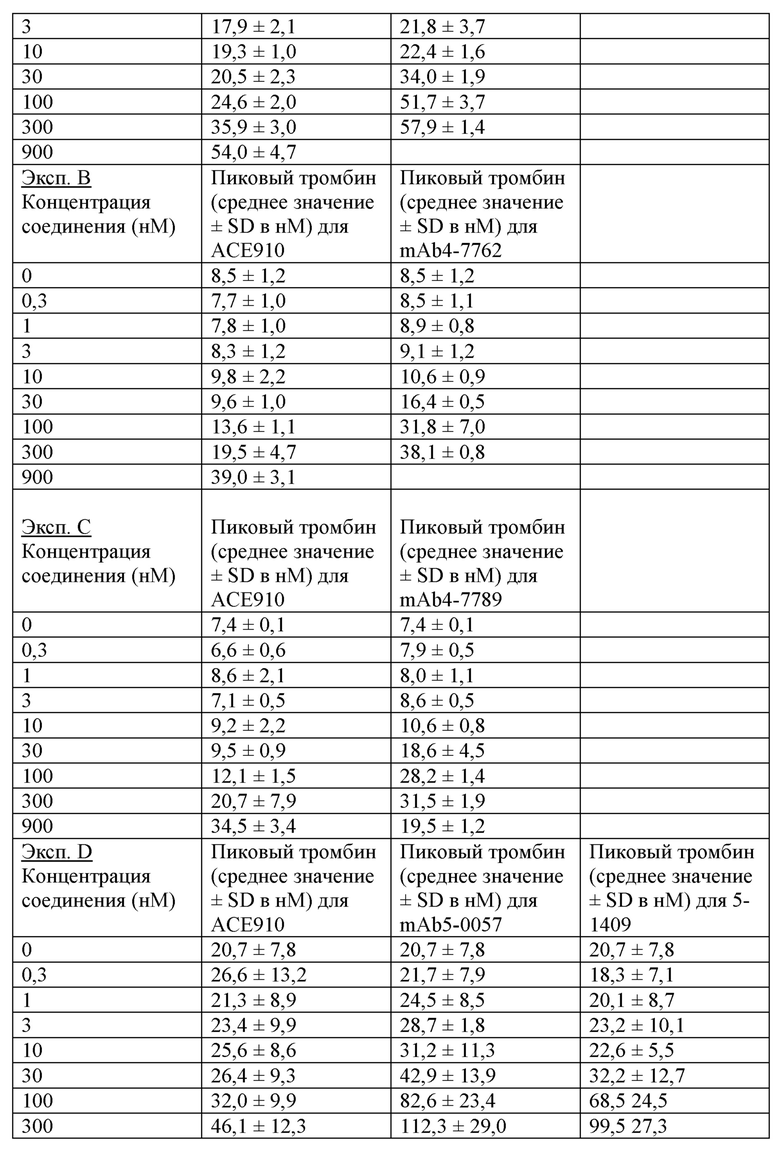

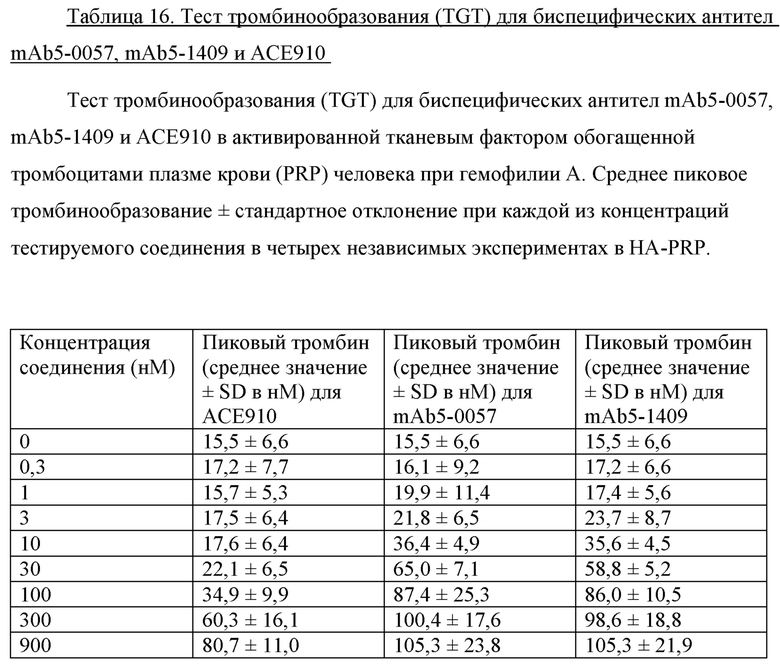
Пример 18. Активность моновалентных неполных (OA) антител к FIX/FIXa в тесте тромбинообразования (ТГТ) в обедненной тромбоцитами плазме крови человека при гемофилии А
Прокоагулянтную активность моновалентного неполного (OA) варианта mAb1-9016 определяли на основе его способности стимулировать тромбинообразование в присутствии прокоагулянтной фосфолипидной мембраны в соответствии с принципами, описанными Hemker et al. (2002) Pathophysiol Haemost Thromb, 32:249-253. Неполный вариант антитела 224F3 (mAb1-1582) включили для сравнения. Каждое антитело (тестируемое соединение) испытывали в тесте тромбинообразования (TGT) в объединенной плазме крови пациентов с гемофилией А (НА), обедненной тромбоцитами (НА-РРР) (George King Bio-Medical Inc., Канзас, США), с помощью откалиброванной стандартом автоматической тромбографии с использованием флуориметра для 96-луночных планшетов (Fluoroscan Ascent FL, Thermolabsystems, Хельсинки, Финляндия). Реакционные смеси содержали 70 мкл НА-РРР, 10 мкл тестируемого соединения (разведенного в 20 мМ HEPES, 140 мМ NaCl, рН 7,4, 2% BSA), 20 мкл реагентов PRP (синтетические фосфолипиды, Thrombinoscope BV, Маастрихт, Нидерланды), содержащих активированный полученный из плазмы крови человека фактор XI (hFXIa, 8,3 мЕд./мл в итоге) (Enzyme Research Laboratories, Индиана, США) или калибратор тромбина (Thrombinoscope BV), и 20 мкл смеси, содержащей флуоресцентно меченный субстрат для тромбина Z-Gly-Gly-Arg-AMC (3 мМ) и CaCl2 (90 мМ) (Thrombinoscope BV). TGT проводили при пяти концентрациях тестируемого соединения (30, 100, 300, 600 и 900 нМ, конечная концентрация в плазме крови) или только при добавлении буфера (20 мМ HEPES, 140 мМ NaCl, рН 7,4, 2% BSA) (представляет контроль НА). Диапазон концентраций тестировали в двух независимых экспериментах в НА-РРР из одного и того же запаса. В целом TGT проводили в течение 90 минут и параметр TGT пиковой высоты тромбина (нМ) анализировали с помощью программного обеспечения Thrombinoscope (Thrombinoscope BV). На фигуре 4 и в таблице 17 показаны/перечислены измеренные пиковые скорости тромбинообразования для каждого моновалентного неполного антитела при протестированных концентрациях. Данные показывают, что OA-вариант антитела mAb1-9016 увеличивает пик образования тромбина выше уровня, наблюдаемого в отсутствие антитела, т.е. проявляет прокоагулянтную активность. Кроме того, тромбинообразование, индуцированное OA-вариантом антитела mAb1-9016, выше, чем тромбинообразование, наблюдаемое для моновалентного OA-варианта антитела 224F3 (mAb1-1582).
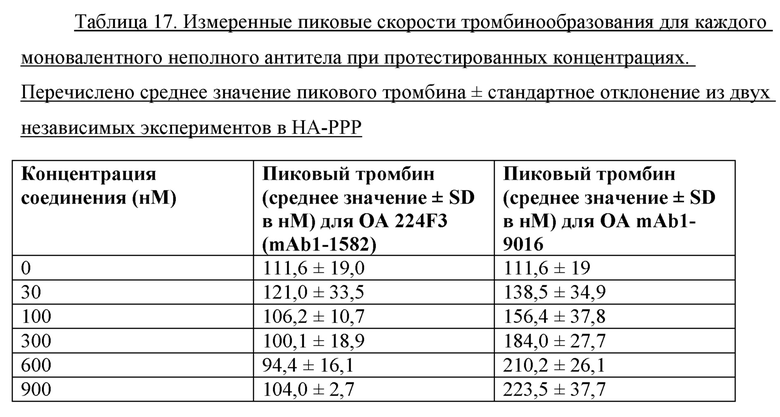
Пример 19. Значения аффинности связывания, определенные при помощи изотермической титрационной калориметрии (ITC)
Значения аффинности связывания для антител к FIX/FIXa и антител к FX/FXa, связывающихся с FIX/FIXa и FX/FXa соответственно, измеряют с помощью изотермической титрационной калориметрии (ITC) с использованием калориметра PEAQ-ITC (Малверн, Великобритания). Эксперименты проводят при 37°С и рН 7,4 с использованием 25 мМ трис, 150 мМ NaCl, 5 мМ CaCl2 (трис-буфер). Ячейка для образца (200 мкл) содержит либо FIX, FIXa, FX либо FXa, и антитела к FIX/FIXa и к FX/FXa вводят через шприц. Все белки подвергают интенсивному диализу в трис-буфере перед измерениями для обеспечения подходящих буферных условий. За стадией термического уравновешивания следовала 60-секундная задержка и затем начальная инъекция 0,2 мкл антитела с последующими 14 инъекциями по 2,5 мкл антитела с интервалом в 120 с. Скорость перемешивания поддерживают на уровне 750 об./мин., а эталонную мощность поддерживают постоянной на уровне 5-10 мккал/с. Тепло, ассоциированное с каждой инъекцией антитела, интегрируют и наносят на график в зависимости от молярного отношения лиганда к макромолекуле. Полученную изотерму аппроксимируют к модели связывания в одном участке для получения аффинности (KD), стехиометрии (n) и энтальпии взаимодействия (ΔН) с использованием программного обеспечения, предоставленного производителем. Эксперименты проводили в двух или трех повторах.
Хотя определенные признаки настоящего изобретения были проиллюстрированы и описаны в данном документе, многие модификации, замены, изменения и эквиваленты в то же время будут очевидны для специалистов в данной области. Следовательно, следует понимать, что прилагаемая формула изобретения предназначена для охвата всех таких модификаций и изменений, которые соответствуют истинному духу настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Novo Nordisk A/S
<120> ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА
<130> 160163WO02
<160> 188
<170> PatentIn версия 3.5
<210> 1
<211> 415
<212> Белок
<213> Homo sapiens
<400> 1
Tyr Asn Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg
1 5 10 15
Glu Cys Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe
20 25 30
Glu Asn Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly
35 40 45
Asp Gln Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp
50 55 60
Asp Ile Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys
65 70 75 80
Asn Cys Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu
85 90 95
Gln Phe Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr
100 105 110
Glu Gly Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val
115 120 125
Pro Phe Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr
130 135 140
Arg Ala Glu Ala Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu
145 150 155 160
Ala Glu Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn
165 170 175
Asp Phe Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe
180 185 190
Pro Trp Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly
195 200 205
Ser Ile Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu
210 215 220
Thr Gly Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu
225 230 235 240
Thr Glu His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His
245 250 255
His Asn Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu
260 265 270
Leu Glu Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile
275 280 285
Cys Ile Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser
290 295 300
Gly Tyr Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala
305 310 315 320
Leu Val Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys
325 330 335
Leu Arg Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly
340 345 350
Phe His Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro
355 360 365
His Val Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser
370 375 380
Trp Gly Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys
385 390 395 400
Val Ser Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr
405 410 415
<210> 2
<211> 448
<212> Белок
<213> Homo sapiens
<400> 2
Ala Asn Ser Phe Leu Glu Glu Met Lys Lys Gly His Leu Glu Arg Glu
1 5 10 15
Cys Met Glu Glu Thr Cys Ser Tyr Glu Glu Ala Arg Glu Val Phe Glu
20 25 30
Asp Ser Asp Lys Thr Asn Glu Phe Trp Asn Lys Tyr Lys Asp Gly Asp
35 40 45
Gln Cys Glu Thr Ser Pro Cys Gln Asn Gln Gly Lys Cys Lys Asp Gly
50 55 60
Leu Gly Glu Tyr Thr Cys Thr Cys Leu Glu Gly Phe Glu Gly Lys Asn
65 70 75 80
Cys Glu Leu Phe Thr Arg Lys Leu Cys Ser Leu Asp Asn Gly Asp Cys
85 90 95
Asp Gln Phe Cys His Glu Glu Gln Asn Ser Val Val Cys Ser Cys Ala
100 105 110
Arg Gly Tyr Thr Leu Ala Asp Asn Gly Lys Ala Cys Ile Pro Thr Gly
115 120 125
Pro Tyr Pro Cys Gly Lys Gln Thr Leu Glu Arg Arg Lys Arg Ser Val
130 135 140
Ala Gln Ala Thr Ser Ser Ser Gly Glu Ala Pro Asp Ser Ile Thr Trp
145 150 155 160
Lys Pro Tyr Asp Ala Ala Asp Leu Asp Pro Thr Glu Asn Pro Phe Asp
165 170 175
Leu Leu Asp Phe Asn Gln Thr Gln Pro Glu Arg Gly Asp Asn Asn Leu
180 185 190
Thr Arg Ile Val Gly Gly Gln Glu Cys Lys Asp Gly Glu Cys Pro Trp
195 200 205
Gln Ala Leu Leu Ile Asn Glu Glu Asn Glu Gly Phe Cys Gly Gly Thr
210 215 220
Ile Leu Ser Glu Phe Tyr Ile Leu Thr Ala Ala His Cys Leu Tyr Gln
225 230 235 240
Ala Lys Arg Phe Lys Val Arg Val Gly Asp Arg Asn Thr Glu Gln Glu
245 250 255
Glu Gly Gly Glu Ala Val His Glu Val Glu Val Val Ile Lys His Asn
260 265 270
Arg Phe Thr Lys Glu Thr Tyr Asp Phe Asp Ile Ala Val Leu Arg Leu
275 280 285
Lys Thr Pro Ile Thr Phe Arg Met Asn Val Ala Pro Ala Cys Leu Pro
290 295 300
Glu Arg Asp Trp Ala Glu Ser Thr Leu Met Thr Gln Lys Thr Gly Ile
305 310 315 320
Val Ser Gly Phe Gly Arg Thr His Glu Lys Gly Arg Gln Ser Thr Arg
325 330 335
Leu Lys Met Leu Glu Val Pro Tyr Val Asp Arg Asn Ser Cys Lys Leu
340 345 350
Ser Ser Ser Phe Ile Ile Thr Gln Asn Met Phe Cys Ala Gly Tyr Asp
355 360 365
Thr Lys Gln Glu Asp Ala Cys Gln Gly Asp Ser Gly Gly Pro His Val
370 375 380
Thr Arg Phe Lys Asp Thr Tyr Phe Val Thr Gly Ile Val Ser Trp Gly
385 390 395 400
Glu Gly Cys Ala Arg Lys Gly Lys Tyr Gly Ile Tyr Thr Lys Val Thr
405 410 415
Ala Phe Leu Lys Trp Ile Asp Arg Ser Met Lys Thr Arg Gly Leu Pro
420 425 430
Lys Ala Lys Ser His Ala Pro Glu Val Ile Thr Ser Ser Pro Leu Lys
435 440 445
<210> 3
<211> 122
<212> Белок
<213> Homo sapiens
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 107
<212> Белок
<213> Homo sapiens
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 122
<212> Белок
<213> Homo sapiens
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Gly Asp Asn Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 107
<212> Белок
<213> Homo sapiens
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 120
<212> Белок
<213> Homo sapiens
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Val Ser Gly Ser Ile Gly Tyr Ala Arg Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Gly Gln Tyr Asp Glu Asp Ala Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 106
<212> Белок
<213> Homo sapiens
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Arg Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Pro Thr Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 120
<212> Белок
<213> Homo sapiens
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Lys Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Gly Gln Tyr Asp Glu Asp Ala Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 10
<211> 106
<212> Белок
<213> Homo sapiens
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Pro Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Pro Thr Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 119
<212> Белок
<213> Homo sapiens
<400> 11
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Glu Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 12
<211> 112
<212> Белок
<213> Homo sapiens
<400> 12
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Arg Leu Leu His Ser
20 25 30
Thr Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 13
<211> 119
<212> Белок
<213> Homo sapiens
<400> 13
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Arg Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Thr Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Met Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 14
<211> 112
<212> Белок
<213> Homo sapiens
<400> 14
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 15
<211> 122
<212> Белок
<213> Homo sapiens
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Gly Asp Asn Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 107
<212> Белок
<213> Homo sapiens
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 120
<212> Белок
<213> Homo sapiens
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Gly Gln Tyr Asp Glu Asp Ala Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 18
<211> 106
<212> Белок
<213> Homo sapiens
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Pro Thr Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 119
<212> Белок
<213> Homo sapiens
<400> 19
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Met Glu Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 20
<211> 112
<212> Белок
<213> Homo sapiens
<400> 20
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 21
<211> 120
<212> Белок
<213> Homo sapiens
<400> 21
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 109
<212> Белок
<213> Homo sapiens
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 23
<211> 120
<212> Белок
<213> Homo sapiens
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Leu Tyr Thr Gly Gly Ser Thr His Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Ala Thr Trp Glu Leu Leu Ser Ile Val Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 24
<211> 112
<212> Белок
<213> Homo sapiens
<400> 24
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asp Gly Tyr Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 121
<212> Белок
<213> Homo sapiens
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Gly Ser Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Trp Gly Phe Gly Trp Tyr Phe Asp Leu Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 109
<212> Белок
<213> Homo sapiens
<400> 26
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Gly Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Thr Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gln Tyr Gly Thr Ser
85 90 95
Pro Gly Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 122
<212> Белок
<213> Homo sapiens
<400> 27
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Pro His Asn Gly Asn Thr His Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Leu Trp Phe Gly Glu Leu Leu Pro Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 108
<212> Белок
<213> Homo sapiens
<400> 28
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Ala Val Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Gly Ser Ser Pro
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 29
<211> 120
<212> Белок
<213> Homo sapiens
<400> 29
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Lys Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Thr Asp Ser Tyr Thr Thr Tyr Ser Pro Ser Leu
50 55 60
His Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Gln Leu Trp Leu Arg Asp Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 30
<211> 107
<212> Белок
<213> Homo sapiens
<400> 30
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Gly Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Tyr Trp Pro Ala
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 31
<211> 121
<212> Белок
<213> Homo sapiens
<400> 31
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Ser Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Ser Gln Arg Arg Gly Tyr Leu Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 32
<211> 108
<212> Белок
<213> Homo sapiens
<400> 32
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Gly Ile Gly Thr Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ala Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Leu
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 33
<211> 118
<212> Белок
<213> Homo sapiens
<400> 33
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Thr Tyr Ser Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Pro Ser Phe Thr Asp His Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 34
<211> 106
<212> Белок
<213> Homo sapiens
<400> 34
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ser Ala Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Asn Trp Pro Ala Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 121
<212> Белок
<213> Homo sapiens
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Asp Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala His Ser Glu Asp Tyr Tyr Asp Ser Ser Gly Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 36
<211> 108
<212> Белок
<213> Homo sapiens
<400> 36
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ala Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Asn Trp Pro Pro
85 90 95
Val Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 37
<211> 126
<212> Белок
<213> Homo sapiens
<400> 37
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Leu Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Ser
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Glu Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Gly Phe Ala Ser Ser Ser Gly Arg Tyr Tyr Tyr Tyr Ala
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 38
<211> 107
<212> Белок
<213> Homo sapiens
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 121
<212> Белок
<213> Homo sapiens
<400> 39
Gln Ala Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Tyr Asp Gly Ser Asn Glu Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Gln Trp Leu Val Pro Asp Asp Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 40
<211> 113
<212> Белок
<213> Homo sapiens
<400> 40
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Lys Asn Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Ile Ile Tyr Trp Ala Ser Asn Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys His Gln
85 90 95
Tyr Tyr Asn Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 41
<211> 123
<212> Белок
<213> Homo sapiens
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Leu Arg Ser Tyr
20 25 30
Gly Ile Ser Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asp Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Thr Glu Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asp Ile Ser Ser Arg Trp Ser Pro Asp Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 42
<211> 107
<212> Белок
<213> Homo sapiens
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn His Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 43
<211> 124
<212> Белок
<213> Homo sapiens
<400> 43
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Asn
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Trp Ala Met Val Arg Gly Val Ile Thr Asn Ala Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 44
<211> 106
<212> Белок
<213> Homo sapiens
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Arg Tyr Ser Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 120
<212> Белок
<213> Homo sapiens
<400> 45
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Asn
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Thr Pro Gly Lys Arg Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Ile Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Thr Leu Ser Phe Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Ala Glu Arg His Asp Ser Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 46
<211> 107
<212> Белок
<213> Homo sapiens
<400> 46
Glu Ile Val Met Thr Gln Ser Pro Val Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Tyr Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Phe Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Val Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 47
<211> 120
<212> Белок
<213> Homo sapiens
<400> 47
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Thr Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Ile Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Thr Leu Ser Phe Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Ala Glu Arg His Asp Ser Phe Asp Leu Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 48
<211> 107
<212> Белок
<213> Homo sapiens
<400> 48
Glu Ile Val Met Thr Gln Ser Pro Val Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Tyr Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Val Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 49
<211> 116
<212> Белок
<213> Homo sapiens
<400> 49
Gln Glu Gln Leu Val Glu Ser Gly Gly Asp Val Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Thr Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Ser Ile Ser Tyr Asp Gly Thr Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Gly Thr Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ser Arg Gly Met Ala Val Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 50
<211> 112
<212> Белок
<213> Homo sapiens
<400> 50
Asp Val Leu Met Thr Gln Ser Pro Leu Phe Leu Pro Val Thr Phe Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Val Asn Trp Phe His Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 51
<211> 120
<212> Белок
<213> Homo sapiens
<400> 51
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Tyr Tyr Tyr Trp Gly Trp Ile Arg Gln Thr Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn His Phe
65 70 75 80
Ser Leu Asn Leu Ser Phe Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Ala Glu Arg His Asp Thr Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 52
<211> 107
<212> Белок
<213> Homo sapiens
<400> 52
Glu Ile Val Met Thr Gln Ser Pro Val Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Ile Ser Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 53
<211> 119
<212> Белок
<213> Homo sapiens
<400> 53
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Leu Gly Ser Tyr Glu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 54
<211> 112
<212> Белок
<213> Homo sapiens
<400> 54
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Ser Tyr Leu Asp Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 55
<211> 117
<212> Белок
<213> Homo sapiens
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Ser Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Trp Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Ala Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Tyr Asp Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 107
<212> Белок
<213> Homo sapiens
<400> 56
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Thr Ile Gly Asn Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Glu Tyr Ala Ser Gln Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ile Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Arg Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 57
<211> 124
<212> Белок
<213> Homo sapiens
<400> 57
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Phe Gly Tyr Arg Phe Thr Asp Tyr
20 25 30
Trp Ile Gly Trp Ile Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Asp Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Arg Ser Val Lys Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Gly Ile Ile Gly Thr Arg Asp Tyr Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 58
<211> 107
<212> Белок
<213> Homo sapiens
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Ile Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Tyr Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Ile Ala Thr Tyr Tyr Cys Gln His Tyr Asp Asn Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 59
<211> 124
<212> Белок
<213> Homo sapiens
<400> 59
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Leu Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Gly Gly Ser Lys Glu Tyr Ala Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Phe Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Trp Ala Met Val Arg Gly Val Ile Thr Asn Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 60
<211> 106
<212> Белок
<213> Homo sapiens
<400> 60
Ala Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Thr Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Ser Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 61
<211> 119
<212> Белок
<213> Homo sapiens
<400> 61
Gln Glu Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Asn Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Val Ile Ser Phe Asp Ser Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Lys Gly Arg Ser Tyr Tyr Trp Tyr Phe Asp Leu Trp Gly Arg Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 62
<211> 112
<212> Белок
<213> Homo sapiens
<400> 62
Asn Ile Ile Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Thr Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Lys Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ala
85 90 95
Thr His Phe Pro His Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 63
<211> 121
<212> Белок
<213> Homo sapiens
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Tyr Trp Val
35 40 45
Ser Ala Ile Ser Gly Asn Gly Asp Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Glu Glu Gly Ile Val Val Ala His Asp Ala Phe Glu Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 64
<211> 113
<212> Белок
<213> Homo sapiens
<400> 64
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Ile Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Gly Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
100 105 110
Lys
<210> 65
<211> 109
<212> Белок
<213> Oryctolagus cuniculus
<400> 65
Gln Glu Arg Leu Lys Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr
1 5 10 15
Pro Leu Thr Leu Thr Cys Thr Ala Gly Gly Ser Asp Ile Ser Val Tyr
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Gly Ala Gly Gly His Ala Tyr Tyr Ala Arg Trp Ala Val
50 55 60
Gly Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Ser Ala
85 90 95
Gly Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105
<210> 66
<211> 112
<212> Белок
<213> Oryctolagus cuniculus
<400> 66
Gln Val Leu Thr Gln Thr Glu Ser Pro Val Ser Ala Ala Ile Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ser Ser Gln Ser Val Val Asn Asp Asn
20 25 30
Arg Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg Leu
35 40 45
Ile Tyr Asp Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Asp Cys Ser
85 90 95
Leu Asn Asp Cys Asn Gly Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 67
<211> 119
<212> Белок
<213> Oryctolagus cuniculus
<400> 67
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Thr Tyr Thr
20 25 30
Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Ile Gly
35 40 45
Ile Ile Ala Ser Ser Gly His Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Ala Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Val Arg Ala
85 90 95
Leu Tyr Ser Gly Gly Gly Tyr Trp Pro Gly Gly Phe Trp Gly Pro Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 68
<211> 111
<212> Белок
<213> Oryctolagus cuniculus
<400> 68
Ile Val Met Thr Gln Thr Pro Ser Ser Lys Ser Val Pro Val Gly Asp
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Lys Ser Val Tyr Ser Asn Asn
20 25 30
Arg Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Arg
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Val
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Tyr Glu Glu Ser Ile
85 90 95
Asp Asp Asp Thr Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 69
<211> 122
<212> Белок
<213> Homo sapiens
<400> 69
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Gly Asp Asn Ile Gly Tyr Val Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Asp Lys Asn Ser Leu His
65 70 75 80
Leu Glu Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Lys Ser Tyr Gly Ser Gly Ser Tyr Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 70
<211> 107
<212> Белок
<213> Homo sapiens
<400> 70
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 71
<211> 122
<212> Белок
<213> Homo sapiens
<400> 71
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Arg Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Asp Asn Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Ala Phe Gly Ser Gly Ser Tyr Tyr Asn Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 72
<211> 107
<212> Белок
<213> Homo sapiens
<400> 72
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Glu Tyr Asn Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 73
<211> 122
<212> Белок
<213> Homo sapiens
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Asp Asn Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ile Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Ala Phe Gly Ser Gly Ser Tyr Tyr Asn Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 74
<211> 107
<212> Белок
<213> Homo sapiens
<400> 74
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Glu Tyr Asn Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 75
<211> 121
<212> Белок
<213> Mus musculus
<400> 75
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Ala Tyr Glu Phe Ser Lys His
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Arg Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Tyr Gly Tyr Asp Glu Glu Tyr Tyr Gly Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 76
<211> 107
<212> Белок
<213> Mus musculus
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Ala Val Thr Ile Thr Cys Arg Val Asn Glu Asn Ile Asp Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ala Ala Thr Leu Leu Ala Asp Gly Val Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Val Ala Arg Tyr Phe Cys Gln His Tyr Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 77
<211> 121
<212> Белок
<213> Mus musculus
<400> 77
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Lys His
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Ile Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Tyr Gly Tyr Asn Glu Glu Tyr Tyr Gly Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 78
<211> 107
<212> Белок
<213> Mus musculus
<400> 78
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ile Ser Glu Asn Ile Asp Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ala Ala Thr Leu Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Val Ala Arg Tyr Phe Cys Gln His Tyr Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 79
<211> 117
<212> Белок
<213> Oryctolagus cuniculus
<400> 79
Gln Ser Leu Ala Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Pro Gly Phe Thr Ile Gly Gly Tyr His
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Leu Ile Asn Asn Gly Gly Ser Thr Ala Tyr Ala Asn Trp Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Leu Thr
65 70 75 80
Ser Leu Thr Ser Glu Gly Thr Ala Thr Tyr Phe Cys Ala Arg Trp Thr
85 90 95
Gly Tyr Ala Gly Asp Gly Tyr Gly Asp Ile Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 80
<211> 111
<212> Белок
<213> Oryctolagus cuniculus
<400> 80
Ala Asp Ile Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val
1 5 10 15
Gly Gly Thr Val Thr Phe Lys Cys Gln Ala Ser Glu Asn Ile Tyr Asn
20 25 30
Leu Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Ala Phe Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu
65 70 75 80
Ser Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Ser Tyr Tyr Tyr Ala Ser
85 90 95
Ser Ser Ser Tyr Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 81
<211> 122
<212> Белок
<213> Homo sapiens
<400> 81
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Asp Asn Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ile Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Ala Phe Gly Ser Gly Ser Tyr Tyr Asn Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 82
<211> 107
<212> Белок
<213> Homo sapiens
<400> 82
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gly Gln Tyr Arg Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 83
<211> 122
<212> Белок
<213> Homo sapiens
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Gly Asp Asn Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 84
<211> 107
<212> Белок
<213> Homo sapiens
<400> 84
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Arg Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 85
<211> 120
<212> Белок
<213> Oryctolagus cuniculus
<400> 85
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ala Tyr Ala
20 25 30
Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ile Val Ser Ser Ser Asp Phe Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Glu Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asp Leu
85 90 95
Asn Tyr Asp Asp Tyr Glu Asn Tyr Tyr Gly Met Asp Pro Trp Gly Pro
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 86
<211> 113
<212> Белок
<213> Oryctolagus cuniculus
<400> 86
Asp Val Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ser Ser Gln Ser Val Tyr Asn Tyr
20 25 30
Asn Leu Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Ala Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Ser Phe Asp Asp
85 90 95
Asp Val Asp Tyr Glu Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val
100 105 110
Lys
<210> 87
<211> 119
<212> Белок
<213> Oryctolagus cuniculus
<400> 87
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Thr Tyr Thr
20 25 30
Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Ile Gly
35 40 45
Ile Ile Ala Ser Ser Gly His Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Ala Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Val Arg Ala
85 90 95
Leu Tyr Ser Gly Gly Gly Tyr Trp Pro Gly Gly Phe Trp Gly Pro Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 88
<211> 110
<212> Белок
<213> Oryctolagus cuniculus
<400> 88
Val Met Thr Gln Thr Pro Ser Ser Lys Ser Val Pro Val Gly Asp Thr
1 5 10 15
Val Thr Ile Asn Cys Gln Ala Ser Lys Ser Val Tyr Ser Asn Asn Arg
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Arg Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Val Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Ala Gly Tyr Glu Glu Ser Ile Asp
85 90 95
Asp Asp Thr Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 89
<211> 119
<212> Белок
<213> Homo sapiens
<400> 89
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Glu Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 90
<211> 112
<212> Белок
<213> Homo sapiens
<400> 90
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Arg Leu Leu His Ser
20 25 30
Thr Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 91
<211> 119
<212> Белок
<213> Homo sapiens
<400> 91
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 92
<211> 112
<212> Белок
<213> Homo sapiens
<400> 92
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
20 25 30
Thr Tyr Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 93
<211> 123
<212> Белок
<213> Homo sapiens
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Arg Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asn Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 94
<211> 113
<212> Белок
<213> Homo sapiens
<400> 94
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 95
<211> 119
<212> Белок
<213> Homo sapiens
<400> 95
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 96
<211> 112
<212> Белок
<213> Homo sapiens
<400> 96
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Arg Leu Leu His Ser
20 25 30
Thr Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 97
<211> 119
<212> Белок
<213> Homo sapiens
<400> 97
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Lys Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 98
<211> 112
<212> Белок
<213> Homo sapiens
<400> 98
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Arg Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 99
<211> 119
<212> Белок
<213> Homo sapiens
<400> 99
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 100
<211> 112
<212> Белок
<213> Homo sapiens
<400> 100
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Arg Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 101
<211> 119
<212> Белок
<213> Homo sapiens
<400> 101
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
His Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Met Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 102
<211> 112
<212> Белок
<213> Homo sapiens
<400> 102
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 103
<211> 119
<212> Белок
<213> Homo sapiens
<400> 103
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Arg Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Thr Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
His Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Met Arg Ile Met Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 104
<211> 112
<212> Белок
<213> Homo sapiens
<400> 104
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 105
<211> 119
<212> Белок
<213> Homo sapiens
<400> 105
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 106
<211> 112
<212> Белок
<213> Homo sapiens
<400> 106
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Arg Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 107
<211> 119
<212> Белок
<213> Homo sapiens
<400> 107
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 108
<211> 112
<212> Белок
<213> Homo sapiens
<400> 108
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 109
<211> 119
<212> Белок
<213> Homo sapiens
<400> 109
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 110
<211> 112
<212> Белок
<213> Homo sapiens
<400> 110
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 111
<211> 119
<212> Белок
<213> Homo sapiens
<400> 111
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Arg Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Thr Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
His Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Met Arg Ile Met Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 112
<211> 112
<212> Белок
<213> Homo sapiens
<400> 112
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 113
<211> 119
<212> Белок
<213> Homo sapiens
<400> 113
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 114
<211> 112
<212> Белок
<213> Homo sapiens
<400> 114
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 115
<211> 119
<212> Белок
<213> Homo sapiens
<400> 115
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 116
<211> 112
<212> Белок
<213> Homo sapiens
<400> 116
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 117
<211> 119
<212> Белок
<213> Homo sapiens
<400> 117
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 118
<211> 112
<212> Белок
<213> Homo sapiens
<400> 118
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 119
<211> 119
<212> Белок
<213> Homo sapiens
<400> 119
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Arg Phe Thr Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Thr Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 120
<211> 112
<212> Белок
<213> Homo sapiens
<400> 120
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 121
<211> 122
<212> Белок
<213> Homo sapiens
<400> 121
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Ala Gln Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 122
<211> 107
<212> Белок
<213> Homo sapiens
<400> 122
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Lys Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Arg Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 123
<211> 122
<212> Белок
<213> Homo sapiens
<400> 123
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Lys Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ile Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 124
<211> 107
<212> Белок
<213> Homo sapiens
<400> 124
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Glu Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 125
<211> 122
<212> Белок
<213> Homo sapiens
<400> 125
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Lys Phe Arg Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Glu Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 126
<211> 107
<212> Белок
<213> Homo sapiens
<400> 126
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 127
<211> 122
<212> Белок
<213> Homo sapiens
<400> 127
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Lys Phe Arg Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Glu Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 128
<211> 107
<212> Белок
<213> Homo sapiens
<400> 128
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Asp Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Arg Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 129
<211> 122
<212> Белок
<213> Homo sapiens
<400> 129
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Lys Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 130
<211> 107
<212> Белок
<213> Homo sapiens
<400> 130
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Lys Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 131
<211> 122
<212> Белок
<213> Homo sapiens
<400> 131
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Lys Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 132
<211> 107
<212> Белок
<213> Homo sapiens
<400> 132
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 133
<211> 122
<212> Белок
<213> Homo sapiens
<400> 133
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Thr Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 134
<211> 107
<212> Белок
<213> Homo sapiens
<400> 134
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 135
<211> 122
<212> Белок
<213> Homo sapiens
<400> 135
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Lys Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 136
<211> 107
<212> Белок
<213> Homo sapiens
<400> 136
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 137
<211> 122
<212> Белок
<213> Homo sapiens
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Lys Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 138
<211> 107
<212> Белок
<213> Homo sapiens
<400> 138
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 139
<211> 122
<212> Белок
<213> Homo sapiens
<400> 139
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Lys Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 140
<211> 107
<212> Белок
<213> Homo sapiens
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 141
<211> 122
<212> Белок
<213> Homo sapiens
<400> 141
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Gly Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 142
<211> 107
<212> Белок
<213> Homo sapiens
<400> 142
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 143
<211> 122
<212> Белок
<213> Homo sapiens
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 144
<211> 107
<212> Белок
<213> Homo sapiens
<400> 144
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Asn Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 145
<211> 122
<212> Белок
<213> Homo sapiens
<400> 145
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Lys Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 146
<211> 107
<212> Белок
<213> Homo sapiens
<400> 146
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Glu Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 147
<211> 122
<212> Белок
<213> Homo sapiens
<400> 147
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Lys Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ile Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 148
<211> 107
<212> Белок
<213> Homo sapiens
<400> 148
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 149
<211> 122
<212> Белок
<213> Homo sapiens
<400> 149
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 150
<211> 107
<212> Белок
<213> Homo sapiens
<400> 150
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 151
<211> 120
<212> Белок
<213> Homo sapiens
<400> 151
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 152
<211> 109
<212> Белок
<213> Homo sapiens
<400> 152
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 153
<211> 122
<212> Белок
<213> Homo sapiens
<400> 153
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 154
<211> 107
<212> Белок
<213> Homo sapiens
<400> 154
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Glu Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 155
<211> 120
<212> Белок
<213> Homo sapiens
<400> 155
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 156
<211> 109
<212> Белок
<213> Homo sapiens
<400> 156
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 157
<211> 120
<212> Белок
<213> Homo sapiens
<400> 157
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 158
<211> 109
<212> Белок
<213> Homo sapiens
<400> 158
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 159
<211> 119
<212> Белок
<213> Homo sapiens
<400> 159
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 160
<211> 112
<212> Белок
<213> Homo sapiens
<400> 160
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 161
<211> 123
<212> Белок
<213> Homo sapiens
<400> 161
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
His Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Arg Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 162
<211> 113
<212> Белок
<213> Homo sapiens
<400> 162
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 163
<211> 119
<212> Белок
<213> Homo sapiens
<400> 163
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 164
<211> 112
<212> Белок
<213> Homo sapiens
<400> 164
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 165
<211> 123
<212> Белок
<213> Homo sapiens
<400> 165
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Arg Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asp Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 166
<211> 113
<212> Белок
<213> Homo sapiens
<400> 166
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 167
<211> 119
<212> Белок
<213> Homo sapiens
<400> 167
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 168
<211> 112
<212> Белок
<213> Homo sapiens
<400> 168
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 169
<211> 123
<212> Белок
<213> Homo sapiens
<400> 169
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 170
<211> 113
<212> Белок
<213> Homo sapiens
<400> 170
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Gly Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 171
<211> 122
<212> Белок
<213> Homo sapiens
<400> 171
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 172
<211> 107
<212> Белок
<213> Homo sapiens
<400> 172
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 173
<211> 123
<212> Белок
<213> Homo sapiens
<400> 173
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 174
<211> 113
<212> Белок
<213> Homo sapiens
<400> 174
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Gly Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 175
<211> 119
<212> Белок
<213> Homo sapiens
<400> 175
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Arg Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ala Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 176
<211> 112
<212> Белок
<213> Homo sapiens
<400> 176
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Thr Trp Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Lys Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 177
<211> 122
<212> Белок
<213> Homo sapiens
<400> 177
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 178
<211> 107
<212> Белок
<213> Homo sapiens
<400> 178
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Thr Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 179
<211> 120
<212> Белок
<213> Homo sapiens
<400> 179
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 180
<211> 109
<212> Белок
<213> Homo sapiens
<400> 180
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 181
<211> 122
<212> Белок
<213> Homo sapiens
<400> 181
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Arg Gly Asp Ile Ile Gly Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Ser Tyr Gly Ser Gly Ser Phe Tyr Asn Ala Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 182
<211> 107
<212> Белок
<213> Homo sapiens
<400> 182
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Lys Ala Ser Arg Leu Asp Arg Gly Thr Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Glu Tyr Ser Ser Tyr Ile Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 183
<211> 120
<212> Белок
<213> Homo sapiens
<400> 183
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Ser
20 25 30
Trp Ile Val Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Phe Thr Ser Tyr Ser Pro Ser Phe
50 55 60
Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Tyr Tyr His Ser Glu Glu Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 184
<211> 109
<212> Белок
<213> Homo sapiens
<400> 184
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Thr Arg Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Gly Ser Ser Arg
85 90 95
Leu Phe Thr Phe Gly Glu Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 185
<211> 123
<212> Белок
<213> Homo sapiens
<400> 185
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Arg Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asp Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Asp Gly Ile Ala Val Ala Gly Pro Leu Arg Val Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 186
<211> 113
<212> Белок
<213> Homo sapiens
<400> 186
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 187
<211> 119
<212> Белок
<213> Homo sapiens
<400> 187
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Arg Pro Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Tyr Thr Asp Tyr Gly Pro Ser Phe
50 55 60
Glu Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Arg Ile Arg Ser Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 188
<211> 112
<212> Белок
<213> Homo sapiens
<400> 188
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Arg Leu Leu His Arg
20 25 30
Thr Gly Tyr Asn Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Arg Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Val
85 90 95
Leu His Ile Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УСОВЕРШЕНСТВОВАННЫЕ ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2019 |
|
RU2810748C2 |
| АНТИТЕЛО, КОТОРОЕ ОБЛАДАЕТ СПОСОБНОСТЬЮ НЕЙТРАЛИЗОВАТЬ СУБСТАНЦИЮ, ОБЛАДАЮЩУЮ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ ФАКТОРА СВЕРТЫВАНИЯ VIII (FVIII) | 2015 |
|
RU2737145C2 |
| СПОСОБ ИЗМЕРЕНИЯ РЕАКТИВНОСТИ FVIII | 2015 |
|
RU2752595C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО, ОБЛАДАЮЩЕЕ ПОВЫШЕННОЙ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ КОФАКТОРА FVIII | 2017 |
|
RU2821642C2 |
| АНТИТЕЛО ПРОТИВ LILRB1 И ЕГО ПРИМЕНЕНИЯ | 2021 |
|
RU2813373C1 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА СВЕРТЫВАНИЯ XI | 2017 |
|
RU2757314C2 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
| АНТИ-LILRB1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2801535C1 |







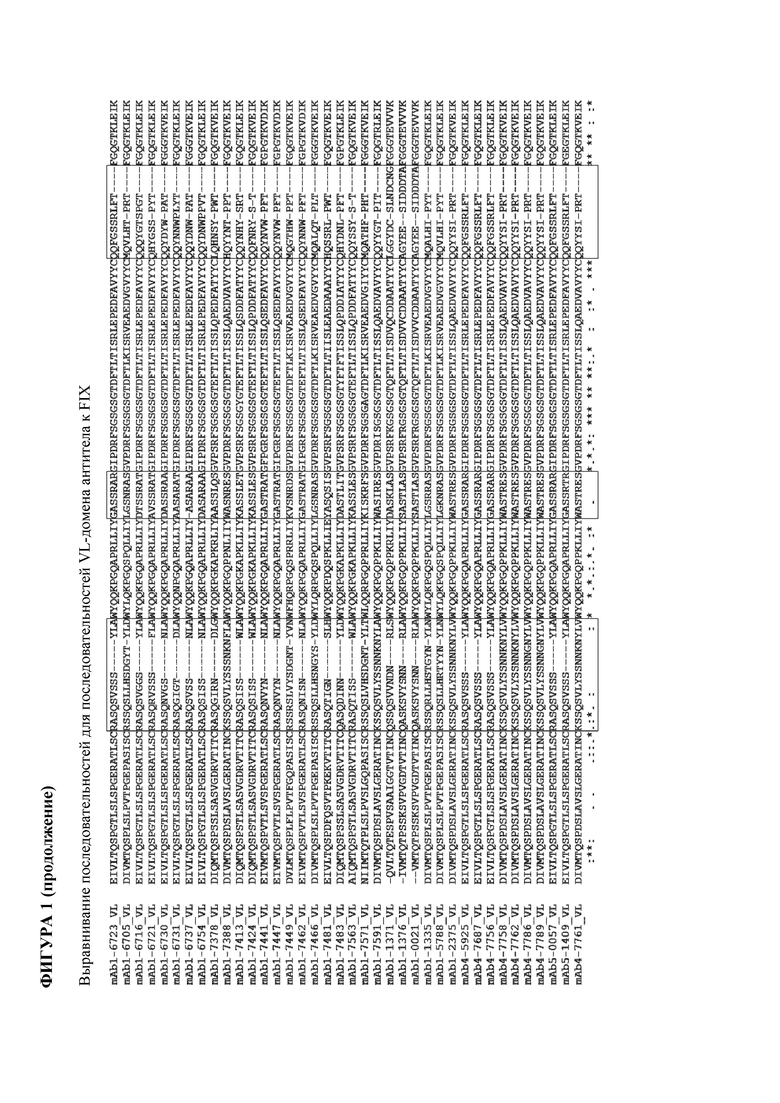
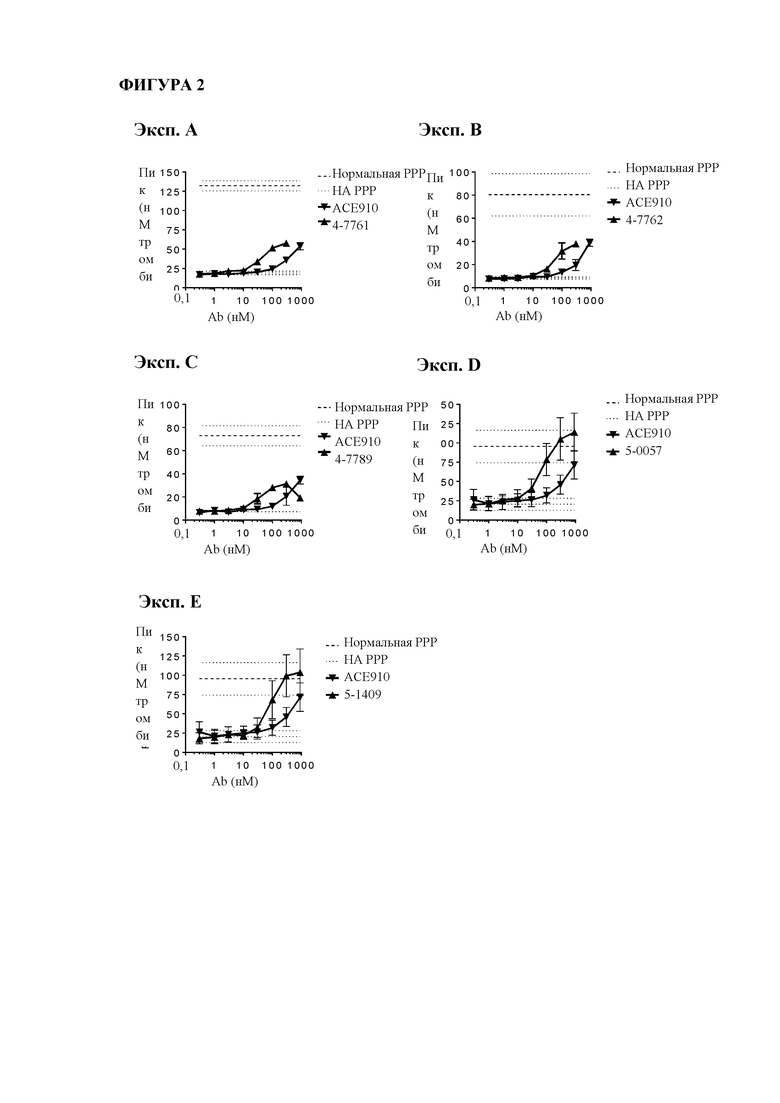
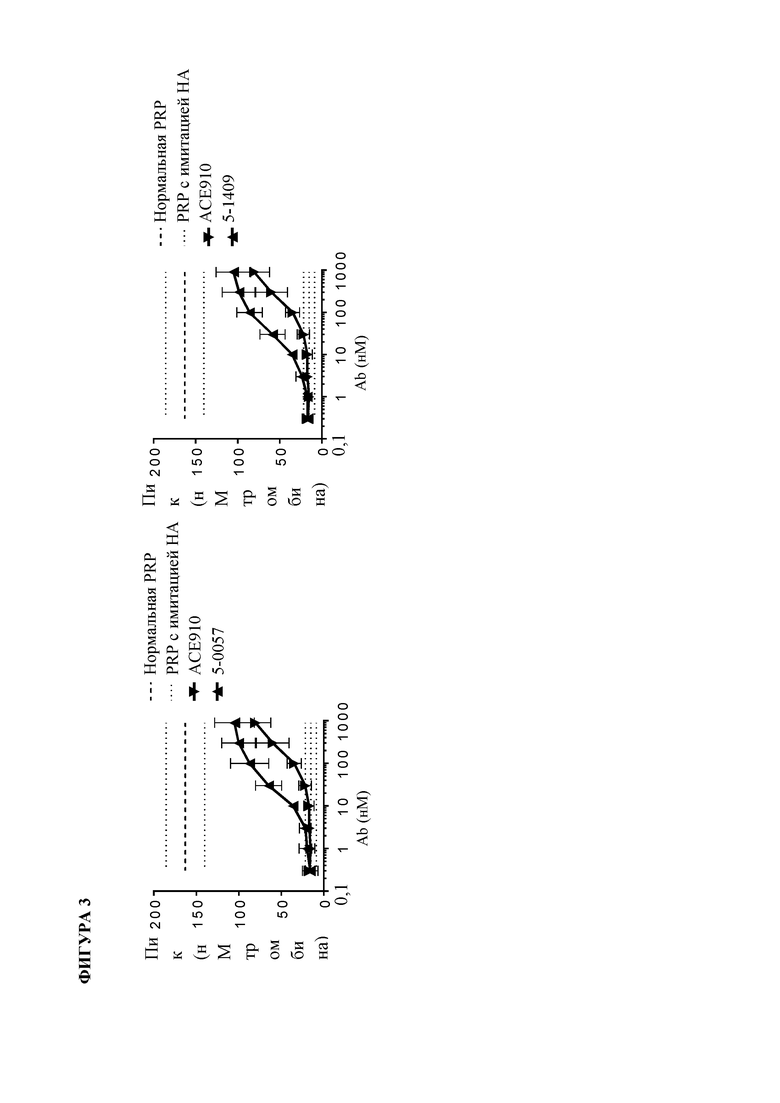

Изобретение относится к области биохимии, в частности к прокоагулянтному биспецифическому антителу, которое специфически связывает FIX и FX. Также раскрыты фармацевтическая композиция и лекарственное средство, содержащее указанное антитело, для лечения гемофилии А. Изобретение позволяет эффективно лечить гемофилию А. 3 н. и 9 з.п. ф-лы, 4 ил., 17 табл., 19 пр.
1. Прокоагулянтное биспецифическое антитело или его антигенсвязывающий фрагмент, содержащее первый антигенсвязывающий участок, способный связываться с FIX, описанным SEQ ID NO: 1, и/или его активированной формой FIXa, и второй антигенсвязывающий участок, способный связываться с FX, описанным SEQ ID NO: 2, и/или его активированной формой FXa, где
а) первый антигенсвязывающий участок содержит вариабельный домен тяжелой цепи, который по меньшей мере на 96% идентичен последовательности SEQ ID NO: 177, и вариабельный домен легкой цепи, который по меньшей мере, на 96% идентичен последовательности SEQ ID NO: 178,
и где
б) второй антигенсвязывающий участок содержит вариабельный домен тяжелой цепи, который по меньшей мере на 96% идентичен последовательности SEQ ID NO: 21, и вариабельный домен легкой цепи, который, по меньшей мере, на 96% идентичен последовательности SEQ ID NO: 22.
2. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотный остаток R338 из FIX/FIXa, и
второй антигенсвязывающий участок способен связываться с доменом EGF-2 и/или каталитической субъединицей FX/FXa.
3. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотные остатки R338 и К341 из FIX/FIXa.
4. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотные остатки L337, R338, S339, T340, K341 и T343 из FIX/FIXa.
5. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотные остатки D332, R333, L337 и R338 FIX/FIXa, и второй антигенсвязывающий участок способен связываться с доменом EGF-2 и/или каталитической субъединицей FX/FXa.
6. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотные остатки K301, D332, R333, A334, T335, R338 и N346 из FIX/FIXa.
7. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где первый антигенсвязывающий участок способен связывать эпитоп, содержащий аминокислотные остатки R113, Y230, K420, D423, R424 и K427 из FX/FXa.
8. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где второй антигенсвязывающий участок способен связывать эпитоп, содержащий один или более аминокислотных остатков из H101, E103, R113, T116, L117, A118, T127, S227, E228, F229, Y230, E266, R287, L303, P304, E305, L419, K420, D423, R424, M426, K427 и T428 из FX/FXa.
9. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где изотип антитела представляет собой IgG4.
10. Биспецифическое антитело или его антигенсвязывающий фрагмент по п. 1, где указанное биспецифическое антитело или его антигенсвязывающий фрагмент способно стимулировать ферментативную активность FIXa по отношению к FX.
11. Фармацевтическая композиция для лечения гемофилии А при наличии ингибиторов или гемофилии А, при которой отсутствуют ингибиторы, содержащая биспецифическое антитело или его антигенсвязывающий фрагмент по любому из предыдущих пунктов и фармацевтически приемлемый носитель.
12. Лекарственное средство для лечения гемофилии А при наличии ингибиторов или гемофилии А, при которой отсутствуют ингибиторы, содержащее биспецифическое антитело или его антигенсвязывающий фрагмент по любому из пп. 1-10.
| Naoki Uchida et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
| Насос | 1917 |
|
SU13A1 |
| Микрофонно-телефонный усилитель | 1923 |
|
SU1633A1 |
| RU 2013118448 А, 27.10.2014 | |||
| WO 2016166014 A1, 20.10.2016 | |||
| ZENJIRO SAMPEI et al | |||
| "Identification and | |||
Авторы
Даты
2023-12-21—Публикация
2018-02-01—Подача