[0001] По настоящей заявке испрашивается приоритет по международной заявке PCT/US2017/023788, поданной 23 марта 2017 года, и по предварительной заявке США № 62/463,543, поданной 24 февраля 2017 года, каждая из которых включена в настоящее описание во всей своей полноте в виде ссылки для любых целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к выделенным анти–IL31–антителам, например, связывающимся с собачьим IL31, и способам их применения, например, для лечения IL31–индуцированных состояний или снижения сигнальной функции IL31 в клетках, например, у животных-компаньонов, таких как собаки, кошки и лошади.
УРОВЕНЬ ТЕХНИКИ
[0003] Интерлейкин 31 (IL31) представляет собой цитокин, вырабатываемый в основном Th2–клетками, и считается, что он участвует в развитии кожных заболеваний, таких как зуд и другие формы аллергических заболеваний (например, атопический дерматит). IL31 функционирует через связывание со своим рецептором и активацию нижележащих сигнальных молекул, например активацию JAK1, и предполагается, что он является причиной многих клинических проблем, связанных с дерматитом и другими расстройствами.
[0004] Животные-компаньоны, такие как кошки, собаки и лошади, страдают от многочисленных кожных заболеваний, аналогичных кожным заболеваниям человека, включая атопический дерматит. Однако последовательности IL31 у человека, кошки, собаки и лошади отличаются. Таким образом, остается потребность в способах и соединениях, которые можно использовать исключительно для связывания IL31 животного-компаньона, для лечения IL31–индуцированных состояний и для снижения передачи сигналов IL31.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] В некоторых вариантах осуществления предоставляется выделенное антитело, которое связывается с собачьим IL31. В некоторых вариантах осуществления антитело связывается с эпитопом, содержащим аминокислоты 34–50 SEQ ID NO:22. В некоторых вариантах осуществления антитело связывается с эпитопом, содержащим аминокислотную последовательность SEQ ID NO:23. В некоторых вариантах осуществления антитело связывается с эпитопом, содержащим аминокислотную последовательность PSDX1X2KI (SEQ ID NO:45), в которой X представляет собой любой аминокислотный остаток. В некоторых вариантах осуществления X1 представляет собой гидрофобную аминокислоту. В некоторых вариантах осуществления X1 выбран из A, V, I и L. В некоторых вариантах осуществления X1 выбран из V и I. В некоторых вариантах осуществления X2 представляет собой гидрофильную аминокислоту. В некоторых вариантах осуществления X2 выбран из A, R, K, Q и N. В некоторых вариантах осуществления X2 выбран из R и Q. В некоторых вариантах осуществления X1 представляет собой V, и X2 представляет собой R. В некоторых вариантах осуществления X1 представляет собой I, и X2 представляет собой Q. В некоторых вариантах осуществления антитело связывается с эпитопом, содержащим аминокислотную последовательность SEQ ID NO:88.
[0006] В некоторых вариантах осуществления антитело связывается с собачьим IL31 с константой диссоциации (Kd) менее чем 5×10–6 М, менее чем 1×10–6 М, менее чем 5×10–7 М, менее чем 1×10–7 М, менее чем 5×10–8 М, менее чем 1×10–8 М, менее чем 5×10–9 М, менее чем 1×10–9 М, менее чем 5×10–10 М, менее чем 1×10–10 М, менее чем 5×10–11 М, менее чем 1×10–11 М, менее чем 5×10–12 М или менее чем 1×10–12 М, измеренной методом бислойной интерферометрии.
[0007] В некоторых вариантах осуществления антитело снижает сигнальную функцию IL31 у вида животного-компаньона, измеренную по снижению фосфорилирования STAT–3. В некоторых вариантах осуществления вид животного-компаньона представляет собой вид псовых, кошачьих или лошадиных.
[0008] В некоторых вариантах осуществления антитело связывается с кошачьим IL31 или лошадиным IL31, согласно результатам анализа иммуноблотинга и/или бислойной интерферометрии. В некоторых вариантах осуществления антитело конкурирует с моноклональным антителом М14 за связывание с собачьим IL31. В некоторых вариантах осуществления антитело конкурирует с моноклональным антителом М14 за связывание с кошачьим IL31. В некоторых вариантах осуществления антитело не связывается с человеческим IL31, согласно результатам анализа иммуноблотинга и/или бислойной интерферометрии.
[0009] В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой собачье, канинизированное, кошачье, фелинизированное, лошадиное, эквинизированное или химерное антитело. В некоторых вариантах осуществления антитело представляет собой химерное антитело, содержащее мышиные каркасные участки вариабельной тяжелой цепи или мышиные каркасные участки вариабельной легкой цепи.
[0010] В некоторых вариантах осуществления антитело содержит тяжелую цепь и легкую цепь, где:
а. тяжелая цепь содержит последовательность CDR–H1, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:1; последовательность CDR–H2, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:2, 62, 89 или 87; и последовательность CDR–H3, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:3, и
b. легкая цепь содержит последовательность CDR–L1, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:8 или SEQ ID NO:63; последовательность CDR–L2, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:9; и последовательность CDR–L3, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:10.
[0011] В некоторых вариантах осуществления антитело содержит тяжелую цепь, содержащую (а) CDR–H1, содержащую аминокислотную последовательность SEQ ID NO:1, (b) CDR–H2, содержащую аминокислотную последовательность SEQ ID NO:2 или 89, и (c) CDR–H3, содержащую аминокислотную последовательность SEQ ID NO:3.
[0012] В некоторых вариантах осуществления антитело содержит тяжелую цепь, содержащую (а) CDR–H1, содержащую аминокислотную последовательность SEQ ID NO:1, (b) CDR–H2, содержащую аминокислотную последовательность SEQ ID NO:62 или 87, и (c) CDR–H3, содержащую аминокислотную последовательность SEQ ID NO:3.
[0013] В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую (а) CDR–L1, содержащую аминокислотную последовательность SEQ ID NO:8, (b) CDR–L2, содержащую аминокислотную последовательность SEQ ID NO:9, и (c) CDR–L3, содержащий аминокислотную последовательность SEQ ID NO:10.
[0014] В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую (а) CDR–L1, содержащую аминокислотную последовательность SEQ ID NO:63, (b) CDR–L2, содержащую аминокислотную последовательность SEQ ID NO:9, и (c) CDR–L3, содержащий аминокислотную последовательность SEQ ID NO:10.
[0015] В некоторых вариантах осуществления антитело содержит одну или более из: (а) последовательности каркасного участка 1 вариабельной области тяжелой цепи (HC–FR1) SEQ ID NO:4, 70 или 79, (b) последовательности HC–FR2 SEQ ID NO:5, 71 или 80, (c) последовательности HC–FR3 SEQ ID NO:6, 72, 73 или 81, (d) последовательности HC–FR4 SEQ ID NO:7, 74, или 82, (e) последовательности каркасного участка 1 вариабельной области легкой цепи (LC–FR1) SEQ ID NO:11, 75 или 83, (f) последовательности LC–FR2 SEQ ID NO:12, 76 или 84, (g) последовательности LC–FR3 SEQ ID NO:13, 77 или 85 или (h) последовательности LC–FR4 SEQ ID NO:14, 78 или 86.
[0016] В некоторых вариантах осуществления антитело содержит:
а. (i) последовательность вариабельной легкой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:24; (ii) последовательность вариабельной тяжелой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:25; или (iii) последовательность вариабельной легкой цепи, определенную в (i), и последовательность вариабельной тяжелой цепи, определенную в (ii); или
b. (i) последовательность вариабельной легкой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:16; (ii) последовательность вариабельной тяжелой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:15; или (iii) последовательность вариабельной легкой цепи, определенную в (i), и последовательность вариабельной тяжелой цепи, определенную в (ii); или
с. (i) последовательность вариабельной легкой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:32; (ii) последовательность вариабельной тяжелой цепи, имеющую по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:33; или (iii) последовательность вариабельной легкой цепи, определенную в (i), и последовательность вариабельной тяжелой цепи, определенную в (ii).
[0017] В некоторых вариантах осуществления антитело содержит последовательность вариабельной легкой цепи SEQ ID NO:24; SEQ ID NO:16; или SEQ ID NO:32. В некоторых вариантах осуществления антитело содержит последовательность вариабельной тяжелой цепи SEQ ID NO:25; SEQ ID NO:15; или SEQ ID NO:33. В некоторых вариантах осуществления антитело содержит: последовательность вариабельной легкой цепи SEQ ID NO:24 и последовательность вариабельной тяжелой цепи SEQ ID NO:25; последовательность вариабельной легкой цепи SEQ ID NO:16 и последовательность вариабельной тяжелой цепи SEQ ID NO:15; или последовательность вариабельной легкой цепи SEQ ID NO:32 и последовательность вариабельной тяжелой цепи SEQ ID NO:33.
[0018] В некоторых вариантах осуществления антитело представляет собой химерное антитело, содержащее константную область тяжелой цепи или константную область легкой цепи, полученную от животного-компаньона.
[0019] В некоторых вариантах осуществления антитело содержит (а) собачью константную область тяжелой цепи, выбранную из константных областей IgG–A, IgG–B, IgG–C и IgG–D; (b) кошачью константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2a и IgG2b; или (c) лошадиную константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 и IgG7.
[0020] В некоторых вариантах осуществления антитело содержит:
а. (i) аминокислотную последовательность легкой цепи SEQ ID NO:26; (ii) аминокислотную последовательность тяжелой цепи SEQ ID NO:27; или (iii) аминокислотную последовательность легкой цепи, определенную в (i), и аминокислотную последовательность тяжелой цепи, определенную в (ii); или
b. (i) аминокислотную последовательность легкой цепи SEQ ID NO:30; (ii) аминокислотную последовательность тяжелой цепи SEQ ID NO:31; или (iii) аминокислотную последовательность легкой цепи, определенную в (i), и аминокислотную последовательность тяжелой цепи, определенную в (ii); или
с. (i) аминокислотную последовательность легкой цепи SEQ ID NO:34; (ii) аминокислотную последовательность тяжелой цепи SEQ ID NO:35; или (iii) аминокислотную последовательность легкой цепи, определенную в (i), и аминокислотную последовательность тяжелой цепи, определенную в (ii).
[0021] В некоторых вариантах осуществления антитело содержит аминокислотную последовательность легкой цепи SEQ ID NO:21. В некоторых вариантах осуществления антитело содержит аминокислотную последовательность тяжелой цепи SEQ ID NO:17; SEQ ID NO:18; SEQ ID NO:19; или SEQ ID NO:20.
[0022] В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, выбранный из Fv, scFv, Fab, Fab', F(ab')2 и Fab’–SH.
[0023] В некоторых вариантах осуществления антитело является биспецифическим, при этом антитело связывается с IL31 и одним или более антигенами, выбранными из IL17, TNFα, CD20, CD19, CD25, IL4, IL13, IL23, IgE, CD11α, IL6R, α4–интегрина, IL12, IL1β или BlyS.
[0024] В некоторых вариантах осуществления предоставляется выделенная нуклеиновая кислота, которая кодирует анти–IL31 антитело, раскрытое в настоящем описании выше. В некоторых вариантах осуществления предоставляется клетка–хозяин, которая содержит нуклеиновую кислоту, кодирующую анти–IL–31 антитело, раскрытое в настоящем описании выше. В некоторых вариантах осуществления предлагается способ получения анти–IL31 антитела, который включает культивирование такой клетки–хозяина, которая содержит нуклеиновую кислоту, кодирующую анти–IL31 антитело, раскрытое в настоящем описании выше, и выделение антитела.
[0025] В некоторых вариантах осуществления предлагается фармацевтическая композиция, которая содержит анти–IL31 антитело, раскрытое в настоящем описании, и фармацевтически приемлемый носитель. В некоторых вариантах осуществления предложена фармацевтическая композиция, которая содержит анти–IL–31 антитело, раскрытое в настоящем описании, и фармацевтически приемлемый носитель, причем фармацевтически приемлемый носитель содержит L–гистидин, хлорид натрия и полисорбат 80.
[0026] В некоторых вариантах осуществления фармацевтическая композиция имеет рН в диапазоне от 5,0 до 6,2. В некоторых вариантах осуществления фармацевтическая композиция имеет рН в диапазоне от 5,0 до 6,0 или от 5,3 до 5,7 или равный 5,5.
[0027] В некоторых вариантах осуществления фармацевтическая композиция содержит L–гистидин в концентрации от 5 мМ до 100 мМ, от 10 мМ до 50 мМ, от 20 мМ до 30 мМ, от 10 мМ до 30 мМ или 20 мМ.
[0028] В некоторых вариантах осуществления фармацевтическая композиция содержит хлорид натрия в концентрации от 80 до 200 мМ, от 100 до 175 мМ, от 120 до 150 мМ или 140 мМ.
[0029] В некоторых вариантах осуществления фармацевтическая композиция содержит полисорбат 80 в концентрации от 0,005 мг/мл до 0,5 мг/мл, от 0,01 мг/мл до 0,1 мг/мл или 0,05 мг/мл.
[0030] В некоторых вариантах осуществления фармацевтически приемлемый носитель содержит по меньшей мере один сахар. В некоторых вариантах осуществления фармацевтическая композиция содержит по меньшей мере один сахар в концентрации от 0,5% до 20%, от 1% до 10%, от 1% до 5% или от 1% до 3%. В некоторых вариантах осуществления фармацевтически приемлемый носитель содержит сахарозу, трегалозу, D–маннит, мальтозу и/или сорбит.
[0031] В некоторых вариантах осуществления фармацевтически приемлемый носитель содержит антибактериальный агент. В некоторых вариантах осуществления фармацевтическая композиция содержит крезол или метилпарабен. В некоторых вариантах осуществления фармацевтическая композиция содержит 0,2% м–крезола и/или 0,9% метилпарабена.
Применение антител и фармацевтических композиций
[0032] В некоторых вариантах осуществления предлагаются способы лечения вида животного-компаньона, имеющего IL31–индуцированное состояние, включающие введение виду животного-компаньона терапевтически эффективного количества анти–Il31 антитела, раскрытого в настоящем описании, или фармацевтической композиции, содержащей антитело, раскрытое в настоящем описании. В некоторых вариантах осуществления вид животного-компаньона представляет собой вид псовых, кошачьих или лошадиных. В некоторых вариантах осуществления IL31–индуцированное состояние представляет собой зудящее или аллергическое состояние. В некоторых вариантах осуществления IL31–индуцированное состояние выбран из атопического дерматита, зуда, астмы, псориаза, склеродермии и экземы.
[0033] В некоторых вариантах осуществления анти–IL31 антитело или фармацевтическую композицию вводят парентерально. В некоторых вариантах осуществления анти–IL31 антитело или фармацевтическую композицию вводят внутримышечно, внутрибрюшинно, интрацереброспинально, подкожно, внутриартериально, интрасиновиально, интратекально или путем ингаляции.
[0034] В некоторых вариантах осуществления способ включает введение анти–IL31–антитела или фармацевтической композиции в комбинации с ингибитором Jak, ингибитором PI3K, ингибитором AKT или ингибитором MAPK. В некоторых вариантах осуществления способ включает введение анти–IL31–антитела или фармацевтической композиции в комбинации с одним или более антителами, выбранными из анти–IL17 антитела, анти–TNFα антитела, анти–CD20 антитела, анти–CD19 антитела, анти–CD25 антитела, анти–IL4 антитела, анти–IL13 антитела, анти–IL23 антитела, анти–IgE антитела, анти–CD11α антитела, анти–IL6R антитела, антитела к α4–интегрину, анти–IL12 антитела, анти–IL1β антитела и анти–BlyS антитела.
[0035] В некоторых вариантах осуществления предлагаются способы снижения сигнальной функции IL31 в клетке, включающие в воздействие на клетку анти–IL31–антитела, фармацевтической композиции, раскрытых в настоящем описании, в условиях, допускающих связывание антитела с внеклеточным IL31, тем самым уменьшая связывание с рецептором IL31 и/или снижая сигнальную функцию IL31 в клетке. В некоторых вариантах осуществления клетка подвергается воздействию антитела или фармацевтической композиции ex vivo. В некоторых вариантах осуществления клетка подвергается воздействию антитела или фармацевтической композиции in vivo. В некоторых вариантах осуществления клетка представляет собой клетку собаки, клетку кошки или клетку лошади.
[0036] В некоторых вариантах осуществления предлагается способ детектирования IL31 в образце, полученного от вида животного-компаньона, включающий приведение в контакт образца с анти–IL31 антителом или фармацевтической композицией, раскрытой в настоящем описании, в условиях, позволяющих связывание антитела с IL31, и детектирование в образце образования комплекса антитела с IL31. В некоторых вариантах осуществления образец представляет собой биологический образец, полученный от собаки, кошки или лошади.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0037] На фиг. 1А показано выравнивание последовательностей вариабельных легких цепей клонов М14, М18, М19 и М87 мышиных моноклональных антител. На фиг. 1B показано выравнивание последовательностей вариабельных тяжелых цепей клонов M14, M18, M19 и M87 мышиных моноклональных антител.
[0038] На фиг. 2А и фиг. 2B показаны графики, построенные по результатам анализа связывания собачьего IL31 с химерным антителом M14 в различных концентрациях.
[0039] На фиг. 3А и фиг. 3В показаны графики, построенные по результатам анализа связывания собачьего IL31 с канинизированным антителом М14 в различных концентрациях.
[0040] На фиг. 4 показаны иммуноблоты, демонстрирующие подавленную передачу сигналов собачьего IL31 при различных концентрациях канинизированного антитела М14.
[0041] На фиг. 5А и 5В показаны иммуноблоты для делеций в GST–собачий IL31, зондированных антителом М14 и анти–GST антителом, соответственно.
[0042] На фиг. 6А и 6В показаны иммуноблоты для делеций в GST–собачий IL31, зондированных антителом М14 и анти–GST антителом, соответственно.
[0043] На фиг. 7А и 7В показаны иммуноблоты кошачьих и лошадиных белков IL–31, слитых с человеческим Fc, зондированных антителом М14 и анти–FC антителом, соответственно.
[0044] На фиг. 8 показаны результаты анализа иммуноблотинга для детального картирования эпитопа и аланинового сканирования зрелого собачьего эпитопа IL31 с помощью антитела к собачьему IL31 (верхняя панель) и анти–GST антитела (нижняя панель).
[0045] На фиг. 9 показаны результаты анализа иммуноблотинга по детального картированию эпитопа и аланинового сканирования зрелого собачьего эпитопа IL31 с помощью антитела к собачьему IL31 (верхняя панель) и анти–GST антитела (нижняя панель).
[0046] На фиг. 10 показаны результаты анализа иммуноблотинга по детального картированию эпитопа и аланинового сканирования зрелого собачьего эпитопа IL31 с помощью антитела к собачьему IL31 (верхняя панель) и анти–GST антитела (нижняя панель).
[0047] На фиг. 11 показаны результаты анализа иммуноблотинга по детального картированию эпитопа и аланинового сканирования зрелого собачьего эпитопа IL31 с помощью антитела к собачьему IL31 (верхняя панель) и анти–GST антитела (нижняя панель).
[0048] На фиг. 12 показаны результаты анализа иммуноблотинга по детального картированию эпитопа и аланинового сканирования зрелого собачьего эпитопа IL31 с помощью антитела к собачьему IL31 (верхняя панель) и анти–GST антитела (нижняя панель).
[0049] На фиг. 13 показан иммуноблот, демонстрирующий перекрестную реактивность антитела М14 к собачьему IL31 с IL31 моржа.
ОПИСАНИЕ НЕКОТОРЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0050] В таблице 1 приведен список некоторых последовательностей, упоминаемых в настоящем описании.
NCBI №: XP_011286140.1
[felis catus]
NCBI №: NP_001014358.1
NCBI №: XP_004395998.1
[odobenus rosmarus divergens]
NCBI №: XP_003907358.1
[papio anubis]
NCBI №: XP_008687166.1
[ursus maritimus]
NCBI №: XP_006746595.1
[leptonychotes weddellii]
NCBI №: XP_007079636.1
[panthera tigris altaica]
NCBI №: XP_014919275.1
[acinonyx jubatus]
GenBank №: EHH66805.1
[macaca fascicularis]
GenBank №: EHH21279.1
[macaca mulatta]
NCBI №: XP_011819882.1
[mandrillus leucophaeus]
NCBI №: XP_008003211.1
[chlorocebus sabaeus]
NCBI №: XP_011926625.1
[cercocebus atys]
NCBI №: XP_010366647.1
[rhinopithecus roxellana]
NCBI №: NP_083870
[mus musculus]
ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0051] Предоставляются антитела, которые связываются с собачьим IL31, кошачьим IL31 или лошадиным IL31. Также предоставляются тяжелые цепи и легкие цепи антител, которые способны формировать антитела, связывающиеся с IL31. Кроме того, предоставляются антитела, тяжелые цепи и легкие цепи, содержащие одну или более конкретных определяющих комплементарность областей (CDR). Предоставляются полинуклеотиды, кодирующие антитела к собачьему IL31. Также предоставляются способы получения или очистки антител к собачьему IL31. Предоставляются способы лечения с помощью антител к собачьему IL31. Такие способы включают, без ограничения, способы лечения IL31–индуцированных состояний у вида животного-компаньона. Предоставляются способы детектирования IL31 в образце, полученном от вида животного-компаньона.
[0052] Для облегчения понимания в настоящем описании ниже приведены определения используемых в настоящем описании терминов.
[0053] Как используется в настоящем описании, числовые термины, такие как Kd, вычисляют на основании научных измерений и, следовательно, они подвержены соответствующей ошибке измерения. В некоторых случаях числовой термин может включать числовые значения, округленные до ближайшего значащего числа.
[0054] Используемое в настоящем описании единственное число означает «по меньшей мере один» или «один или более», если не указано иное. Используемый в настоящем описании термин «или» означает «и/или», если не указано иное. В контексте пункта формулы изобретения с множественной зависимостью использование «или» при ссылке на другой пункт формулы изобретения относится только к этим пунктам формулы изобретения.
Анти–IL31 антитела
[0055] Предоставляются новые антитела, направленные против IL31, например антитела, которые связываются с собачьим IL31, кошачьим IL31 и/или лошадиным IL31. Анти–IL31 антитела, представленные в настоящей заявке, включают, без ограничения, моноклональные антитела, мышиные антитела, химерные антитела, канинизированные антитела, фелинизированные антитела и эквинизированные антитела. В некоторых вариантах осуществления анти–IL31 антитело представляет собой выделенное мышиное моноклональное антитело, такое как М14, М18, М19 и М87.
[0056] Моноклональные антитела М14, М18, М19 и М87 выделяли следующим образом. Вкратце, мышей иммунизировали собачьим IL31, и клоны мышиных моноклональных антител получали с помощью стандартной технологии гибридомы. Для скрининга гибридомных клонов, продуцирующих антитела, связывающиеся с IL31, использовали твердофазный иммуноферментный анализ (ИФА). На основании сродства связывания и клеточного функционального анализа, описанного в настоящем описании, для дальнейшего исследования отбирали клоны гибридомы, продуцирующие моноклональные антитела M14, M18, M19 и M87. Вариабельную тяжелую цепь (VH) и вариабельную легкую цепь (VL) каждого из четырех клонов секвенировали и анализировали путем выравнивания последовательностей (фиг.1).
[0057] В настоящем документе также представлены аминокислотные последовательности моноклонального антитела M14. Например, для моноклонального антитела M14 представлены CDR вариабельной тяжелой цепи (SEQ ID NO:1–3; SEQ ID NO:89 является альтернативным определением CDR–H2), CDR вариабельной области легкой цепи (SEQ ID NO:8–10), последовательности каркасных участков вариабельной области тяжелой цепи (SEQ ID NO:4–7) и последовательности каркасных участков вариабельной области легкой цепи (SEQ ID NO:11–14). Представлены аминокислотные последовательности вариабельной легкой цепи, легкой цепи, вариабельной тяжелой цепи и вариабельной и шарнирной областей тяжелой цепи моноклонального антитела М14 (SEQ ID NO:24, 36, 25 и 40, соответственно).
[0058] Кроме того, предоставлены аминокислотные последовательности CDR, последовательности каркасных участков, вариабельной легкой цепи, вариабельной тяжелой цепи моноклональных антител М18, М19 и М87 (см., например, фиг.1). Предоставлены CDR вариабельной легкой цепи (SEQ ID NO:1–3; SEQ ID NO:89 является альтернативным определением CDR–H2), CDR вариабельной легкой цепи (SEQ ID NO:8–10), вариабельная легкая цепь (SEQ ID NO 65), легкая цепь (SEQ ID NO:38), вариабельная и шарнирная области тяжелой цепи (SEQ ID NO:42) и вариабельная тяжелая цепь (SEQ ID NO:68) моноклонального антитела M19. Предоставлены CDR вариабельной тяжелой цепи (SEQ ID NO:1, 62 и 3; SEQ ID NO:87 является альтернативным определением CDR–H2), CDR вариабельной легкой цепи (SEQ ID NO:63, 9 и 10), вариабельная легкая цепь (SEQ ID NO:64), легкая цепь (SEQ ID NO:37), вариабельная и шарнирные области тяжелой цепи (SEQ ID NO:41) и вариабельная тяжелая цепь (SEQ ID NO:67) моноклонального антитела М18. Предоставлены вариабельная легкая цепь (SEQ ID NO:66), легкая цепь (SEQ ID NO:39), вариабельная и шарнирная области тяжелой цепи (SEQ ID NO:43) и вариабельная тяжелая цепь (SEQ ID NO:69) моноклонального антитела M87.
[0059] В настоящей заявке также представлены химерные, канинизированные, фелинизированные и эквинизированные антитела, полученные из моноклональных антител М14, М18, М19 и М87. В некоторых вариантах осуществления представлены аминокислотные последовательности канинизированного моноклонального антитела M14, такие как SEQ ID NO:15–21 и 70–78. В некоторых вариантах осуществления представлены аминокислотные последовательности фелинизированных антител, полученных из моноклонального антитела M14, такие как SEQ ID NO:32–35 и 79–86. В некоторых вариантах осуществления представлены аминокислотные последовательности химерных антител, полученных из моноклонального антитела M14, такие как SEQ ID NO:26, 27, 30 и 31.
[0060] Термин «антитело» в настоящем описании используется в самом широком смысле и охватывает различные структуры антител, включая, без ограничения, моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические (такие как биспецифические рекрутеры Т–клеток) и триспецифические антитела) и фрагменты антител (такие как Fab, F(ab')2, ScFv, мини–тело, диатело, триатело и тетратело) при условии, что они проявляют требуемую антигенсвязывающую активность. Виды собачьих, кошачьих и лошадиных имеют разные разновидности (классы) антител, которые являются общими для многих млекопитающих.
[0061] Термин «антитело» включает, без ограничения, фрагменты, которые способны связываться с антигеном, таким как Fv, одноцепочечный Fv (scFv), Fab, Fab', ди–scFv, sdAb (однодоменное антитело) и (Fab')2 (включая химически связанный F(ab')2). При расщеплении антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых «Fab» –фрагментами, каждый из которых имеет один антигенсвязывающий участок, и оставшийся «Fc»–фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих участка и который все еще способен к перекрестному связыванию антигена. Термин антитело также включает, без ограничения, химерные антитела, гуманизированные антитела и антитела различных видов, таких как мышь, человек, яванский макак, собака, кошка, лошадь и тому подобное. Кроме того, для всех конструкций антител, представленных в настоящем описании, также предполагаются варианты, имеющие последовательности из других организмов. Таким образом, если раскрыт мышиный вариант антитела, специалист в данной области поймет, как преобразовать антитело на основе мышиной последовательности в антитело с последовательностью кошки, собаки, лошади и тому подобное. Фрагменты антител также включают любую ориентацию одноцепочечных scFv, тандемного ди–scFv, диатела, тандемного три–sdcFv, мини–тела и тому подобное. Фрагменты антител также включают нанотела (sdAb, антитело, имеющее единственный мономерный домен, например пару вариабельных доменов тяжелых цепей, без легкой цепи). В некоторых вариантах осуществления фрагмент антитела может упоминаться как являющийся специфическим для вида (например, мышиный scFv или собачий scFv). В этом случае имеются ввиду последовательности по меньшей мере части областей, не относящихся к CDR, а не источник конструкции. В некоторых вариантах осуществления антитела содержат метку или конъюгированы со вторым фрагментом.
[0062] Термины «метка» и «детектируемая метка» означают фрагмент, присоединенный к антителу или его аналиту, что позволяет детектировать реакцию (например, связывание) между членами пары специфического связывания. Меченый член пары специфического связывания называется «детектируемо меченым». Таким образом, термин «меченый связывающий белок» относится к белку со встроенной меткой, которая обеспечивает идентификацию связывающего белка. В некоторых вариантах осуществления метка представляет собой обнаруживаемый маркер, который может продуцировать сигнал, обнаруживаемый с помощью визуальных или инструментальных средств, например, включение радиоактивно меченной аминокислоты или присоединение к полипептиду биотинилированных фрагментов, которые могут быть обнаружены с помощью меченного авидина (например, стрептавидина, содержащего флуоресцентную метку или имеющего ферментативную активность, которая может быть обнаружена оптическими или колориметрическими методами). Примеры меток для полипептидов включают, без ограничения, следующие: радиоизотопы или радионуклиды (например, 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm); хромогены, флуоресцентные метки (например, FITC, родамин, лантаноидные люминофоры), ферментативные метки (например, пероксидаза хрена, люцифераза, щелочная фосфатаза); хемилюминесцентные маркеры; биотинилированные группы; заданные полипептидные эпитопы, распознаваемые вторичным репортером (например, последовательности пары лейциновой молнии, сайты связывания для вторичных антител, домены связывания металлов, метки эпитопов); и магнитные агенты, такие как хелаты гадолиния. Типичные примеры меток, обычно используемых для иммуноанализов, включают фрагменты, которые генерируют свет, например, соединения акридиния, и фрагменты, которые генерируют флуоресценцию, например флуоресцеин. В связи с этим сам фрагмент может иметь недетектируемую метку, но может стать детектируемым при реакции с еще одним фрагментом.
[0063] Термин «моноклональное антитело» относится к антителу по существу гомогенной популяции антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифическими и направлены против одного антигенного участка. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Таким образом, образец моноклонального антитела может связываться с одним и тем же эпитопом на антигене. Модификатор «моноклональный» указывает на характер антитела, получаемого из по существу гомогенной популяции антител, и его не следует истолковывать как требующий получения антитела каким–либо конкретным способом. Например, моноклональные антитела могут быть получены методом гибридомы, впервые описанным Kohler and Milstein, 1975, Nature 256:495, или могут быть получены методами рекомбинантной ДНК, такими как описано в патенте США № 4,816,567. Моноклональные антитела также могут быть выделены из фаговых библиотек, полученных методами, описанными, например, McCafferty et al., 1990, Nature 348: 552–554.
[0064] В некоторых вариантах осуществления моноклональное антитело представляет собой выделенное мышиное антитело, выбранное из клонов М14, М18, М19 и М87.
[0065] «Аминокислотная последовательность» означает последовательность аминокислотных остатков в пептиде или белке. Термины «полипептид» и «белок» используются взаимозаменяемо для обозначения полимера, состоящего из аминокислотных остатков, и не ограничены минимальной длиной. Такие полимеры аминокислотных остатков могут содержать природные или неприродные аминокислотные остатки и включают, без ограничения, пептиды, олигопептиды, димеры, тримеры и мультимеры аминокислотных остатков. Это определение охватывает как полноразмерные белки, так и их фрагменты. Эти термины также включают модификации полипептида после экспрессии, например, гликозилирование, сиалилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения термин «полипептид» относится к белку, который включает модификации, такие как делеции, добавления и замены (обычно консервативные по природе), в нативной последовательности при условии, что белок сохраняет требуемую активность. Эти модификации могут быть преднамеренными, например полученными в результате сайт–направленного мутагенеза, или могут быть случайными, например возникшими в результате мутаций хозяев, которые продуцируют белки, или ошибок вследствие амплификации ПЦР.
[0066] Используемый в настоящем описании термин «IL31» относится к любому нативному IL31, который является результатом экспрессии и процессинга IL31 в клетке. Термин включает IL31 из любого источника позвоночных, включая млекопитающих, таких как приматы (например, люди и яванский макак), грызуны (например, мыши и крысы), и животные-компаньоны (например, собаки, кошки и лошади), если не указано иное. Термин также включает встречающиеся в природе варианты IL31, например сплайс–варианты или аллельные варианты.
[0067] В некоторых вариантах осуществления собачий IL31 содержит аминокислотную последовательность SEQ ID NO:22 или SEQ ID NO:44. В некоторых вариантах осуществления кошачий IL31 содержит аминокислотную последовательность SEQ ID NO:28. В некоторых вариантах осуществления лошадиный IL31 содержит аминокислотную последовательность SEQ ID NO:29. В некоторых вариантах осуществления человеческий IL31 содержит аминокислотную последовательность SEQ ID NO:46. В некоторых вариантах осуществления IL31 моржа содержит аминокислотную последовательность SEQ ID. NO: 47. В некоторых вариантах осуществления мышиный IL31 содержит аминокислотную последовательность SEQ ID NO:61. В других вариантах осуществления IL31 содержит аминокислотную последовательность SEQ ID NO:49, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59 или SEQ ID NO:60.
[0068] Термин «IL31–связывающий домен» антитела означает связывающий домен, образованный легкой цепью и тяжелой цепью антитела к IL31, который связывается с IL31.
[0069] В некоторых вариантах осуществления IL31–связывающий домен связывается c собачьим IL31 с более высоким сродством, чем он связывается с человеческим IL31. В некоторых вариантах осуществления IL31–связывающий домен связывается с IL31 других животных-компаньонов, таких как кошачий IL31 или лошадиный IL31. В некоторых вариантах осуществления IL31–связывающий домен не связывается с человеческим IL31.
[0070] Используемый в настоящем описании термин «эпитоп» относится к участку на молекуле–мишени (например, антигене, таком как белок, нуклеиновая кислота, углевод или липид), с которым связывается антигенсвязывающая молекула (например, антитело, фрагмент антитела или каркасный белок, содержащий участки связывания антител). Эпитопы часто включают химически активную поверхность, группирующую молекулы, такие как аминокислоты, полипептиды или боковые углеводные цепи, и имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Эпитопы могут быть образованы как из смежных, так и соседних несмежных остатков (например, аминокислот, нуклеотидов, сахаров, липидного фрагмента) молекулы–мишени. Эпитопы, образованные из смежных остатков (например, аминокислот, нуклеотидов, сахаров, липидного фрагмента), обычно сохраняются под воздействием денатурирующих растворителей, тогда как эпитопы, сформированные в результате пространственной укладки, обычно «теряются» при обработке денатурирующими растворителями. Эпитоп может включать, без ограничения, по меньшей мере 3, по меньшей мере 5 или 8–10 остатков (например, аминокислот или нуклеотидов). В некоторых примерах эпитоп имеет длину менее 20 остатков (например, аминокислот или нуклеотидов), менее 15 остатков или менее 12 остатков. Два антитела могут связываться с одним и тем же эпитопом в антигене, если они демонстрируют конкурентное связывание с антигеном. В некоторых вариантах осуществления эпитоп может быть идентифицирован по определенному минимальному расстоянию до остатка в CDR на антигенсвязывающей молекуле. В некоторых вариантах осуществления эпитоп может быть идентифицирован по указанному выше расстоянию и дополнительно ограничен теми остатками, которые задействованы в связи (например, водородной связи) между остатком в антителе и остатком в антигене. Эпитоп также может быть идентифицирован с помощью различных видов сканирования, например сканирования аланином или аргинином может указывать на один или более остатков, с которыми может взаимодействовать антигенсвязывающая молекула. Если не указано в явном виде, набор остатков в качестве эпитопа не исключает того, что другие остатки также могут быть частью эпитопа для конкретного антитела. Скорее присутствие такого набора означает минимальный репертуар (или набор видов) эпитопов. Таким образом, в некоторых вариантах осуществления набор остатков, идентифицированных как эпитоп, обозначает минимальный значимый эпитоп для антигена, а не список исключения остатков для эпитопа на антигене.
[0071] В некоторых вариантах осуществления эпитоп содержит аминокислотную последовательность PSDX1X2KI (SEQ ID NO:45), где X представляет собой любой аминокислотный остаток. В некоторых вариантах осуществления X1 представляет собой гидрофобную аминокислоту. В некоторых вариантах осуществления X1 выбран из A, V, I и L. В некоторых вариантах осуществления X1 выбран из V и I. В некоторых вариантах осуществления X2 представляет собой гидрофильную аминокислоту. В некоторых вариантах осуществления X2 выбран из A, R, K, Q и N. В некоторых вариантах осуществления X2 выбран из R и Q. В некоторых вариантах осуществления X1 представляет собой V, и X2 представляет собой R. В некоторых вариантах осуществления X1 представляет собой I, и X2 представляет собой Q. В некоторых вариантах осуществления эпитоп содержит аминокислотную последовательность SEQ ID NO:88. В некоторых вариантах осуществления эпитоп содержит аминокислотную последовательность SEQ ID NO:23. В некоторых вариантах осуществления эпитоп находится в пределах аминокислот 34–50 SEQ ID NO:22. В некоторых вариантах осуществления эпитоп содержит аминокислоты 34–50 SEQ ID NO:22.
[0072] Термин «CDR» означает определяющую комплементарность область, определенную по меньшей мере одним способом идентификации, известным специалисту в данной области. В некоторых вариантах осуществления CDR могут быть определены в соответствии с любой из схем нумерации по Чотиа (Chothia), схемы нумерации по Кабат (Kabat), комбинации Кабат и Чотиа, определения AbM, определения контакта или комбинации Кабат, Чотиа, AbM или определения контактов. Различные CDR в антителе могут быть обозначены соответствующим номером и типом цепи, включая, без ограничения, CDR–H1, CDR–H2, CDR–H3, CDR–L1, CDR–L2 и CDR–L3. Используемый в настоящем описании термин «CDR» также охватывает «гипервариабельную область» или HVR, включая гипервариабельные петли.
[0073] В некоторых вариантах осуществления анти–IL31 антитело содержит тяжелую цепь, содержащую (а) CDR–H1, содержащую аминокислотную последовательность SEQ ID NO:1; (b) CDR–H2, содержащую аминокислотную последовательность SEQ ID NO:2, SEQ ID NO:62, SEQ ID NO:89 или SEQ ID NO:87; или (c) CDR–H3, содержащую аминокислотную последовательность SEQ ID NO:3. В некоторых вариантах осуществления анти–IL31 антитело содержит легкую цепь, содержащую (a) CDR–L1, содержащую аминокислотную последовательность SEQ ID NO:8 или SEQ ID NO:63; (b) CDR–L2, содержащую аминокислотную последовательность SEQ ID NO:9; или (c) CDR–L3, содержащую аминокислотную последовательность SEQ ID NO:10.
[0074] В некоторых вариантах осуществления анти–IL31 антитело содержит тяжелую цепь, содержащую (а) CDR–H1, содержащую аминокислотную последовательность SEQ ID NO:1, (b) CDR–H2, содержащую аминокислотную последовательность SEQ ID NO:2 или 89 и (c) CDR–H3, содержащую аминокислотную последовательность SEQ ID NO:3; и легкую цепь, содержащую (а) CDR–L1, содержащую аминокислотную последовательность SEQ ID NO:8 или 63, (b) CDR–L2, содержащую аминокислотную последовательность SEQ ID NO:9, и (с) CDR–L3, содержащую аминокислотную последовательность SEQ ID NO:10.
[0075] В некоторых вариантах осуществления анти–IL31 антитело содержит тяжелую цепь, содержащую (а) CDR–H1, содержащую аминокислотную последовательность SEQ ID NO:1, (b) CDR–H2, содержащую аминокислотную последовательность SEQ ID NO:62 или 87, и (c) CDR–H3, содержащую аминокислотную последовательность SEQ ID NO:3; и легкую цепь, содержащую (а) CDR–L1, содержащую аминокислотную последовательность SEQ ID NO:8 или 63, (b) CDR–L2, содержащую аминокислотную последовательность SEQ ID NO:9, и (с) CDR–L3, содержащую аминокислотную последовательность SEQ ID NO:10.
[0076] Используемый в настоящем описании термин «вариабельная область» относится к области, содержащей по меньшей мере три CDR. В некоторых вариантах осуществления вариабельная область включает три CDR и по меньшей мере один каркасный участок («FR»). Термины «вариабельная область тяжелой цепи» или «вариабельная тяжелая цепь» используются взаимозаменяемо для обозначения области, содержащей по меньшей мере три CDR тяжелой цепи. Термины «вариабельная область легкой цепи» или «вариабельная легкая цепь» используются взаимозаменяемо для обозначения области, содержащей по меньшей мере три CDR легкой цепи. В некоторых вариантах осуществления вариабельная тяжелая цепь или вариабельная легкая цепь содержит по меньшей мере один каркасный участок. В некоторых вариантах осуществления антитело содержит по меньшей мере один каркасный участок тяжелой цепи, выбранный из HC–FR1, HC–FR2, HC–FR3 и HC–FR4. В некоторых вариантах осуществления антитело содержит по меньшей мере один каркасный участок легкой цепи, выбранный из LC–FR1, LC–FR2, LC–FR3 и LC–FR4. Каркасные участки могут быть расположены между CDR легкой цепи или между CDR тяжелой цепи. Например, антитело может содержать вариабельную тяжелую цепь, имеющую следующую структуру: (HC–FR1)–(CDR–H1)–(HC–FR2)–(CDR–H2)–(HC–FR3)–(CDR–H3)–(HC–FR4). Антитело может содержать вариабельную тяжелую цепь, имеющую следующую структуру: (CDR–H1)–(HC–FR2)–(CDR–H2)–(HC–FR3)–(CDR–H3). Антитело также может содержать вариабельную легкую цепь, имеющую следующую структуру: (LC–FR1)–(CDR–L1)–(LC–FR2)–(CDR–L2)–(LC–FR3)–(CDR–L3)–(LC–FR4). Антитело также может содержать вариабельную легкую цепь, имеющую следующую структуру: (CDR–L1)–(LC–FR2)–(CDR–L2)–(LC–FR3)–(CDR–L3).
[0077] В некоторых вариантах осуществления анти–IL31 антитело содержит одну или более из: (а) последовательности каркасного участка 1 вариабельной области тяжелой цепи (HC–FR1) SEQ ID NO:4, (b) последовательности HC–FR2 SEQ ID NO:5, (c) последовательности HC–FR3 SEQ ID NO:6, (d) последовательности HC–FR4 SEQ ID NO:7, (e) последовательности каркасного участка 1 вариабельной области легкой цепи (LC–FR1) SEQ ID NO:11, (f) последовательности LC–FR2 SEQ ID NO:12, (g) последовательности LC–FR3 SEQ ID NO:13 или (h) последовательности LC–FR4 SEQ ID NO:14. В некоторых вариантах осуществления анти–IL31 антитело содержит последовательность вариабельной легкой цепи (а) SEQ ID NO:16, (b) SEQ ID NO:24 или (c) SEQ ID NO:32. В некоторых вариантах осуществления анти–IL31 антитело содержит последовательность вариабельной тяжелой цепи (а) SEQ ID NO:15; (b) SEQ ID NO:25; или (c) SEQ ID NO:33. В некоторых вариантах осуществления анти–IL31 антитело содержит (a) последовательность вариабельной легкой цепи SEQ ID NO:16 и последовательность вариабельной тяжелой цепи SEQ ID NO:15; (b) последовательность вариабельной легкой цепи SEQ ID NO:24 и последовательность вариабельной тяжелой цепи SEQ ID NO:25; или (c) последовательность вариабельной легкой цепи SEQ ID NO:32 и последовательность вариабельной тяжелой цепи SEQ ID NO:33.
[0078] Используемый в настоящем описании термин «константная область» относится к области, содержащей по меньшей мере три константных домена. Термины «константная область тяжелой цепи» или «константная тяжелая цепь» используются взаимозаменяемо для обозначения области, содержащей по меньшей мере три константных домена тяжелой цепи, CH1, CH2 и CH3. Неограничивающие примеры константных областей тяжелой цепи включают γ, δ, α, ε и μ. Каждая константная область тяжелой цепи соответствует изотипу антитела. Например, антитело, содержащее константную область γ, представляет собой антитело IgG, антитело, содержащее константную область δ, представляет собой антитело IgD, антитело, содержащее константную область α, представляет собой антитело IgA, антитело, содержащее константную область μ, представляет собой антитело IgM, и антитело, содержащее константную область ε, представляет собой антитело IgE. Определенные изотипы могут быть далее подразделены на подклассы. Например, IgG антитела включают, без ограничения, антитела IgG1 (содержащие константную область γ1), IgG2 (содержащие константную область γ2), IgG3 (содержащие константную область γ3) и IgG4 (содержащие константную область γ4); IgA антитела включают, без ограничения, антитела IgA1 (содержащие константную область α1) и антитела IgA2 (содержащие константную область α2); и IgM антитела включают, без ограничения, IgM1 и IgM2. Термины «константная область легкой цепи» или «константная легкая цепь» используются взаимозаменяемо для обозначения области, содержащей константный домен легкой цепи, CL. Неограничивающие примеры константных областей легкой цепи включают λ и κ. В объем термина «константная область» включены делеции и замены внутри доменов, не изменяющие функцию, если не указано иное. Собаки, кошки и лошади имеют классы антител, такие как IgG, IgA, IgD, IgE и IgM. Класс собачьих IgG–антител включает IgG–A, IgG–B, IgG–C и IgG–D. Класс кошачьих IgG–антител включает IgG1a, IgG1b и IgG2. Класс лошадиных IgG–антител включает IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 и IgG7.
[0079] Термин «химерное антитело» или «химерный» относится к антителу, в котором часть тяжелой цепи или легкой цепи происходит от конкретного источника или вида, в то время как по меньшей мере часть оставшейся тяжелой цепи или легкой цепи происходит от другого источника или вида. В некоторых вариантах осуществления химерное антитело относится к антителу, содержащему, по меньшей мере, одну вариабельную область от первого вида (такого как мышь, крыса, яванский макак и тому подобное.) и по меньшей мере одну константную область от второго вида (такого как человек, собака, кошка, лошадь и тому подобное.). В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну мышиную вариабельную область и по меньшей мере одну собачью константную область. В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну мышиную вариабельную область и по меньшей мере одну кошачью константную область. В некоторых вариантах осуществления все вариабельные области химерного антитела относятся к первому виду, а все константные области химерного антитела относятся ко второму виду. В некоторых вариантах осуществления химерное антитело содержит константную область тяжелой цепи или константную область легкой цепи животного-компаньона. В некоторых вариантах осуществления химерное антитело содержит мышиные вариабельные тяжелые и легкие цепи и константные тяжелые и легкие цепи животного-компаньона. Например, химерное антитело может содержать мышиные вариабельные тяжелую и легкую цепи и собачьи константные тяжелую и легкую цепи; химерное антитело может содержать мышиные вариабельные тяжелую и легкую цепи и кошачьи константные тяжелую и легкую цепи; или химерное антитело может содержать мышиные вариабельные тяжелую и легкую цепи и лошадиные константные тяжелую и легкую цепи.
[0080] В некоторых вариантах осуществления анти–IL31 антитело содержит химерное антитело, содержащее:
а. (i) аминокислотную последовательность легкой цепи SEQ ID NO:26; (ii) аминокислотную последовательность тяжелой цепи SEQ ID NO:27; или (iii) аминокислотную последовательность легкой цепи, определенную в (i), и последовательность тяжелой цепи, определенную в (ii); или
b. (i) аминокислотную последовательность легкой цепи SEQ ID NO:30; (ii) аминокислотную последовательность тяжелой цепи SEQ ID NO:31; или (iii) аминокислотную последовательность легкой цепи, определенную в (i), и последовательность тяжелой цепи, определенную в (ii).
[0081] «Собачья химера» или «собачье химерное антитело» относится к химерному антителу, имеющему по меньшей мере часть тяжелой цепи или часть легкой цепи, полученную от собаки. «Кошачья химера» или «кошачье химерное антитело» относится к химерному антителу, имеющему по меньшей мере часть тяжелой цепи или часть легкой цепи, полученную от кошки. «Лошадиная химера» или «лошадиное химерное антитело» относится к химерному антителу, имеющему по меньшей мере часть тяжелой цепи или часть легкой цепи, полученную от лошади. В некоторых вариантах осуществления собачье химерное антитело содержит мышиные вариабельные тяжелую и легкую цепи и собачьи константные тяжелую и легкую цепи. В некоторых вариантах осуществления кошачье химерное антитело содержит мышиные вариабельные тяжелую и легкую цепи и кошачьи константные тяжелую и легкую цепи. В некоторых вариантах осуществления лошадиное химерное антитело содержит мышиные вариабельные тяжелую и легкую цепи и лошадиные константные тяжелую и легкую цепи. В некоторых вариантах осуществления антитело представляет собой химерное антитело, содержащее мышиные каркасные участки вариабельной тяжелой цепи или мышиные каркасные участки вариабельной легкой цепи.
[0082] Используемое в настоящем описании «собачье антитело» охватывает антитела, продуцируемые у собак; антитела, продуцируемые у животных, не относящихся к собачьим, которые содержат гены собачьего иммуноглобулина или содержат пептиды собачьего иммуноглобулина; или антитела, выбранные in vitro методами, такими как фаговый дисплей, где репертуар антител основан на последовательности собачьего иммуноглобулина. Термин «собачье антитело» обозначает род последовательностей, которые представляют собой собачьи последовательности. Таким образом, этот термин обозначает не процесс, с помощью которого было создано антитело, а род соответствующих последовательностей.
[0083] В некоторых вариантах осуществления анти–IL31 антитело содержит собачью константную область тяжелой цепи, выбранную из константных областей IgG–A, IgG–B, IgG–C и IgG–D. В некоторых вариантах осуществления анти–IL31 антитело представляет собой собачье IgG–A, IgG–B, IgG–C или IgG–D антитело. В некоторых вариантах осуществления анти–IL31 антитело представляет собой (а) собачье IgG–A антитело, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO:17; (b) собачье IgG–B антитело, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO:18; (c) собачье IgG–C антитело, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO:19; или (d) собачье IgG–D антитело, содержащее аминокислотную последовательность тяжелой цепи SEQ ID NO:20.
[0084] Термин «кошачье антитело», используемый в настоящем описании, охватывает антитела, продуцируемые у кошки; антитела, продуцируемые у животных, не относящихся к кошачьим, которые содержат гены кошачьих иммуноглобулинов или содержат пептиды кошачьих иммуноглобулинов; или антитела, выбранные in vitro методами, такими как фаговый дисплей, где репертуар антител основан на последовательности кошачьего иммуноглобулина. Термин «кошачье антитело» обозначает род последовательностей, которые представляют собой кошачьи последовательности. Таким образом, этот термин обозначает не процесс, с помощью которого было создано антитело, а род соответствующих последовательностей.
[0085] В некоторых вариантах осуществления анти–IL31 антитело содержит кошачью константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2a и IgG2b. В некоторых вариантах осуществления анти–IL31 антитело представляет собой кошачье антитело IgG1, IgG2a или IgG2b.
[0086] Используемое в настоящем описании «лошадиное антитело» включает антитела, полученные у лошадей; антитела, продуцируемые у животных, не относящихся к лошадиным, которые содержат гены лошадиного иммуноглобулина или содержат пептиды лошадиного иммуноглобулина; или антитела, выбранные in vitro методами, такими как фаговый дисплей, где репертуар антител основан на последовательности лошадиного иммуноглобулина. Термин «лошадиное антитело» обозначает род последовательностей, которые представляют собой лошадиные последовательности. Таким образом, этот термин обозначает не процесс, с помощью которого было создано антитело, а род соответствующих последовательностей.
[0087] В некоторых вариантах осуществления анти–IL31 антитело содержит лошадиную константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 и IgG7. В некоторых вариантах осуществления анти–IL31 антитело представляет собой лошадиное антитело IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 или IgG7.
[0088] «Канинизированное антитело» означает антитело, в котором по меньшей мере одна аминокислота в части не относящейся к собачьим вариабельной области заменена соответствующей аминокислотой из собачьей вариабельной области. В некоторых вариантах осуществления канинизированное антитело содержит по меньшей мере одну собачью константную область (например, константную область γ, константную область α, константную область δ, константную область ε, константную область μ и тому подобное.) или ее фрагмент. В некоторых вариантах осуществления канинизированное антитело представляет собой фрагмент антитела, такой как Fab, scFv, (Fab')2 и тому подобное. Термин «канинизированный» также обозначает формы не относящихся к собачьим (например, мышиные) антител, которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность не относящегося к собачьему иммуноглобулина. Канинизированные антитела могут включать собачьи иммуноглобулины (реципиентное антитело), в которых остатки из CDR реципиента замещены остатками из CDR не относящегося к собачьим вида (донорское антитело), такого как мышь, крыса или кролик, имеющие требуемую специфичность, сродство и эффективность. В некоторых случаях остатки каркасного участка (FR) Fv собачьего иммуноглобулина замещены соответствующими не относящимися к собачьим остатками. Кроме того, канинизированное антитело может содержать остатки, которые не найдены ни в антителе–реципиенте, ни в последовательностях импортированных CDR или каркасных участков, но которые включены для дальнейшей очистки и оптимизации характеристик антитела.
[0089] В некоторых вариантах осуществления, по меньшей мере один аминокислотный остаток в части мышиной вариабельной тяжелой цепи или мышиной вариабельной легкой цепи заменен соответствующей аминокислотой из собачьей вариабельной области. В некоторых вариантах осуществления модифицированная цепь слита с собачьей константной тяжелой цепью или собачьей константной легкой цепью. В некоторых вариантах осуществления анти–IL31 антитело представляет собой канинизированное антитело, содержащее (а) последовательность тяжелой цепи SEQ ID NO:15, (b) последовательность тяжелой цепи SEQ ID NO:17, (c) последовательность тяжелой цепи SEQ ID NO:18, (d) последовательность тяжелой цепи SEQ ID NO:19, (e) последовательность тяжелой цепи SEQ ID NO:20, (f) последовательность легкой цепи SEQ ID NO:16 или (g) последовательность легкой цепи SEQ ID NO:21.
[0090] Термин «фелинизированное антитело» означает антитело, в котором по меньшей мере одна аминокислота в части не относящейся к кошачьим вариабельной области заменена соответствующей аминокислотой из кошачьей вариабельной области. В некоторых вариантах осуществления фелинизированное антитело содержит по меньшей мере одну кошачью константную область (например, константную область γ, константную область α, константную область δ, константную область ε, константную область μ и тому подобное.) или ее фрагмент. В некоторых вариантах осуществления фелинизированное антитело представляет собой фрагмент антитела, такой как Fab, scFv, (Fab')2 и тому подобное. Термин «фелинизированный» также обозначает формы не относящиеся к кошачьим (например, мышиные) антител, которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность не относящегося к кошачьим иммуноглобулина. Фелинизированные антитела могут включать кошачьи иммуноглобулины (реципиентное антитело), в которых остатки из CDR реципиента замещены остатками из CDR не относящегося к кошачьим вида (донорское антитело), такого как мышь, крыса или кролик, имеющие требуемую специфичность, сродство и эффективность. В некоторых случаях остатки каркасного участка (FR) Fv кошачего иммуноглобулина заменены соответствующими не относящимися к кошачьим остатками. Кроме того, фелинизированное антитело может содержать остатки, которые не найдены ни в реципиентном антителе, ни в последовательностях импортированных CDR или каркасных участков, но которые включены для дальнейшей очистки и оптимизации характеристик антитела.
[0091] В некоторых вариантах осуществления по меньшей мере один аминокислотный остаток в части мышиной вариабельной тяжелой цепи или мышиной вариабельной легкой цепи заменен соответствующей аминокислотой из кошачьей вариабельной области. В некоторых вариантах осуществления модифицированная цепь слита с кошачьей константной тяжелой цепью или собачьей константной легкой цепью. В некоторых вариантах осуществления анти–IL31 антитело представляет собой фелинизированное антитело, содержащее (а) последовательность легкой цепи SEQ ID NO:32, (b) последовательность легкой цепи SEQ ID NO:34, (c) последовательность тяжелой цепи SEQ ID NO:33 или (d) последовательность тяжелой цепи SEQ ID NO:35.
[0092] «Эквинизированное антитело» означает антитело, в котором по меньшей мере одна аминокислота в части не относящейся к лошадиной вариабельной области заменена соответствующей лошадиной аминокислотой из вариабельной области. В некоторых вариантах осуществления эквинизированное антитело содержит по меньшей мере одну лошадиную константную область (например, константную область γ, константную область α, константную область δ, константную область ε, константную область μ и тому подобное.) или ее фрагмент. В некоторых вариантах осуществления эквинизированное антитело представляет собой фрагмент антитела, такой как Fab, scFv, (Fab')2 и тому подобное. Термин «эквинизированный» также обозначает формы не относящихся к лошадиным (например, мышиные) антител, которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность не относящегося к лошадиному иммуноглобулина. Эквинизированные антитела могут включать лошадиные иммуноглобулины (реципиентное антитело), в которых остатки из CDR реципиента замещены остатками из CDR не относящегося к лошадиным вида (донорское антитело), такого как мышь, крыса или кролик, имеющие требуемую специфичность, сродство и эффективность. В некоторых случаях остатки каркасного участка (FR) Fv лошадиного иммуноглобулина заменены соответствующими не относящимися к лошадиным остатками. Кроме того, лошадиное антитело может содержать остатки, которые не найдены ни в реципиентном антителе, ни в последовательностях импортированных CDR или каркасных участках, но которые включены для дальнейшей очистки и оптимизации характеристик антитела.
[0093] В некоторых вариантах осуществления по меньшей мере один аминокислотный остаток в части мышиной вариабельной тяжелой цепи или мышиной вариабельной легкой цепи заменен соответствующей аминокислотой из лошадиной вариабельной области. В некоторых вариантах осуществления модифицированная цепь слита с лошадиной константной тяжелой цепью или собачьей константной легкой цепью.
[0094] Термин «IgX Fc» означает, что Fc–область получена из конкретного изотипа антитела (например, IgG, IgA, IgD, IgE, IgM и тому подобное.), где «Х» означает изотип антитела. Таким образом, «IgG Fc» обозначает Fc–область γ–цепи, «IgA Fc» обозначает Fc–область α–цепи, «IgD Fc» обозначает Fc–область δ–цепи, «IgE Fc» обозначает Fc–область ε–цепи, «IgM Fc» обозначает Fc–область μ–цепи и тому подобное. В некоторых вариантах осуществления Fc–область IgG включает СН1, шарнирную область, СН2, СН3 и CL1. «IgX–N–Fc» означает, что область Fc происходит из определенного подкласса изотипа антитела (такого как подкласс A, B, C или D собачьего IgG; подкласс 1, 2a или 2b кошачьего IgG; или подкласс IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 или IgG7 и тому подобное. лошадиного IgG), где «N» обозначает подкласс. В некоторых вариантах осуществления области IgX Fc или IgX–N–Fc получены от животного-компаньона, такого как собака, кошка или лошадь. В некоторых вариантах осуществления Fc–области IgG выделяют из собачьих тяжелых γ–цепей, таких как IgG–A, IgG–B, IgG–C или IgG–D. В некоторых случаях Fc–области IgG выделяют из кошачьих тяжелых γ–цепей, таких как IgG1, IgG2a или IgG2b. Антитела, содержащие Fc–область IgG–A, IgG–B, IgG–C или IgG–D, могут обеспечивать более высокие уровни экспрессии в рекомбинантных системах продуцирования.
[0095] Термин «сродство» означает силу суммы нековалентных взаимодействий между единичным сайтом связывания молекулы (например, антителом) и его партнером по связыванию (например, антигеном). Сродство молекулы X к ее партнеру Y, как правило, может быть представлено константой диссоциации (KD). Сродство может быть измерено обычными методами, известными в данной области, такими как, например, анализ иммуноблотинга, ИФА KD, KinEx A, бислойная интерферометрия (BLI) или с помощью устройств поверхностного плазмонного резонанса.
[0096] Термины «KD», «Kd», «Kd» или «значение Kd» используются взаимозаменяемо для обозначения равновесной константы диссоциации взаимодействия антитело–антиген. В некоторых вариантах осуществления Kd антитела измеряют методом бислойной интерферометрии с помощью биосенсора, такого как система Octet® (Pall ForteBio LLC, Fremont, CA), в соответствии с инструкциями производителя. Вкратце, биотинилированный антиген иммобилизуют на наконечнике сенсора, и ассоциацию антитела отслеживают в течение девяноста секунд, а диссоциацию отслеживают в течение 600 секунд. Буфер для разведений и стадий связывания представляет собой 20 мМ фосфат, 150 мМ NaCl, рН 7,2. Фоновую кривую, соответствующую только буферу, вычитают для корректировки любого отклонения. Данные фитируют к модели связывания 2:1 с помощью программного обеспечения для анализа данных ForteBio для определения константы скорости ассоциации (kon), константы скорости диссоциации (koff) и Kd. Равновесную константу диссоциации (Kd) вычисляют как отношение koff/kon. Термин «kon» относится к константе скорости ассоциации антитела с антигеном, а термин «koff» относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
[0097] Термин «связывается» с антигеном или эпитопом является термином, который хорошо известен в данной области, и способы определения такого связывания также хорошо известны в данной области. Говорят, что молекула демонстрирует «связывание», если она реагирует, ассоциирует или имеет сродство к конкретной клетке или веществу, а реакцию, ассоциацию или сродство можно детектировать одним или более методами, известными в данной области, такими как, например, анализ иммуноблотинга, ИФА KD, KinEx A, бислойная интерферометрия (BLI), с помощью устройства поверхностного плазмонного резонанса или др.
[0098] «Поверхностный плазмонный резонанс» означает оптическое явление, которое позволяет анализировать биоспецифические взаимодействия в режиме реального времени путем детектирования изменений в концентрации белка в матрице биосенсора, например, с помощью системы BIAcoreTM (BIAcore International AB, компания GE Healthcare, Uppsala, Sweden and Piscataway, N.J.). Дополнительное описание см. Jonsson et al. (1993) Ann. Biol. Clin. 51:19–26.
[0099] Термин «бислойная интерферометрия» относится к оптическому аналитическому методу, которым анализируют интерференционную картину света, отраженного от слоя иммобилизованного белка на наконечнике биосенсора и внутреннем эталонном слое. Изменения в количестве молекул, связанных с наконечником биосенсора, вызывают сдвиги в интерференционной картине, которые можно измерять в режиме реального времени. Неограничивающим примером устройства для бислойной интерферометрии является система Octet® (Pall ForteBio LLC). см., например, Abdiche et al., 2008, Anal. Biochem. 377:209–277.
[00100] В некоторых вариантах осуществления анти–IL31 антитело связывается с собачьим IL31, кошачьим IL31 или лошадиным IL31 с константой диссоциации (Kd) менее чем 5×10–6 М, менее чем 1×10–6 М, менее чем 5×10–7 М, менее чем 1×10–7 М, менее чем 5×10–8 М, менее чем 1×10–8 М, менее чем 5×10–9 М, менее чем 1×10–9 М, менее чем 5×10–10 М, менее чем 1×10–10 М, менее чем 5×10–11 М, менее чем 1×10–11 М, менее чем 5×10–12 М или менее чем 1×10–12 М согласно результатам измерения методом бислойной интерферометрии. В некоторых вариантах осуществления анти–IL31 антитело связывается с собачьим IL31, кошачьим IL31 или лошадиным IL31 с Kd от 5×10–6 M до 1×10–6 M, от 5×10–6 M до 5×10–7 M, от 5×10–6 M до 1×10–7 M, от 5×10–6 M до 5×10–8 M, от 5×10–6 M до 1×10–8 M, от 5×10–6 M до 5×10–9 M, от 5×10–6 M до 1×10–9 M, от 5×10–6 M до 5×10–10 M, от 5×10–6 M до 1×10–10 M, от 5×10–6 M до 5×10–11 M, от 5×10–6 M до 1×10–11 M, от 5×10–6 M до 5×10–12 M, от 5×10–6 M до 1×10–12 M, от 1×10–6 M до 5×10–7 M, от 1×10–6 M до 1×10–7 M, от 1×10–6 M до 5×10–8 M, от 1×10–6 M до 1×10–8 M, от 1×10–6 M до 5×10–9 M, от 1×10–6 M до 1×10–9 M, от 1×10–6 M до 5×10–10 M, от 1×10–6 M до 1×10–10 M, от 1×10–6 M до 5×10–11 M, от 1×10–6 M до 1×10–11 M, от 1×10–6 M до 5×10–12 M, от 1×10–6 M до 1×10–12 M, от 5×10–7 M до 1×10–7 M, от 5×10–7 M до 5×10–8 M, от 5×10–7 M до 1×10–8 M, от 5×10–7 M до 5×10–9 M, от 5×10–7 M до 1×10–9 M, от 5×10–7 M до 5×10–10 M, от 5×10–7 M до 1×10–10 M, от 5×10–7 M до 5×10–11 M, от 5×10–7 M до 1×10–11 M, от 5×10–7 M до 5×10–12 M, от 5×10–7 M до 1×10–12 M, от 1×10–7 M до 5×10–8 M, от 1×10–7 M до 1×10–8 M, от 1×10–7 M до 5×10–9 M, от 1×10–7 M до 1×10–9 M, от 1×10–7 M до 5×10–10 M, от 1×10–7 M до 1×10–10 M, от 1×10–7 M до 5×10–11 M, от 1×10–7 M до 1×10–11 M, от 1×10–7 M до 5×10–12 M, от 1×10–7 M до 1×10–12 M, от 5×10–8 M до 1×10–8 M, от 5×10–8 M до 5×10–9 M, от 5×10–8 M до 1×10–9 M, от 5×10–8 M до 5×10–10 M, от 5×10–8 M до 1×10–10 M, от 5×10–8 M до 5×10–11 M, от 5×10–8 M до 1×10–11 M, от 5×10–8 M до 5×10–12 M, от 5×10–8 M до 1×10–12 M, от 1×10–8 M до 5×10–9 M, от 1×10–8 M до 1×10–9 M, от 1×10–8 M до 5×10–10 M, от 1×10–8 M до 1×10–10 M, от 1×10–8 M до 5×10–11 M, от 1×10–8 M до 1×10–11 M, от 1×10–8 M до 5×10–12 M, от 1×10–8 M до 1×10–12 M, от 5×10–9 M до 1×10–9 M, от 5×10–9 M до 5×10–10 M, от 5×10–9 M до 1×10–10 M, от 5×10–9 M до 5×10–11 M, от 5×10–9 M до 1×10–11 M, от 5×10–9 M до 5×10–12 M, от 5×10–9 M до 1×10–12 M, от 1×10–9 M до 5×10–10 M, от 1×10–9 M до 1×10–10 M, от 1×10–9 M до 5×10–11 M, от 1×10–9 M до 1×10–11 M, от 1×10–9 M до 5×10–12 M, от 1×10–9 M до 1×10–12 M, от 5×10–10 M до 1×10–10 M, от 5×10–10 M до 5×10–11 M, от 1×10–10 M до 5×10–11 M, от 1×10–10 M до 1×10–11 M, от 1×10–10 M до 5×10–12 M, от 1×10–10 M до 1×10–12 M, от 5×10–11 M до 1×10–12 M, от 5×10–11 M до 5×10–12 M, от 5×10–11 M до 1×10–12 M, от 1×10–11 M до 5×10–12 M или от 1×10–11 M до 1×10–12 M, согласно результатам измерения методом бислойной интерферометрии. В некоторых вариантах осуществления анти–IL31 антитело связывается с собачьим IL31, кошачьим IL31 или лошадиным IL31, согласно результатам анализа иммуноблотинга.
[00101] В некоторых вариантах осуществления анти–IL31 антитело не связывается с человеческим IL31, согласно результатам анализа иммуноблотинга и/или бислойной интерферометрии.
[00102] В некоторых вариантах осуществления предоставляется анти–IL31 антитело, которое конкурирует с анти–IL31 антителом, описанным в настоящем описании (таким как М14, М18, М19 или М87), за связывание с IL31. В некоторых вариантах осуществления может быть получено или использовано антитело, которое конкурирует за связывание с любым из антител, представленных в настоящем описании. В некоторых вариантах осуществления предоставляется анти–IL31 антитело, которое конкурирует с моноклональным антителом M14 за связывание с собачьим IL31 или кошачьим IL31.
[00103] «Вариант» означает биологически активный полипептид, имеющий по меньшей мере примерно 50% идентичности аминокислотной последовательности с полипептидом нативной последовательности после выравнивания последовательностей и, если необходимо, введения гэпов (пропусков) для достижения максимального процента идентичности последовательностей и без учета каких–либо консервативных замен как части идентичности последовательностей. Такие варианты включают, например, полипептиды, в которых один или более аминокислотных остатков добавлены, удалены на N или C–конце полипептида.
[00104] В некоторых вариантах осуществления вариант имеет по меньшей мере примерно 50% идентичности аминокислотной последовательности, по меньшей мере примерно 60% идентичности аминокислотной последовательности, по меньшей мере примерно 65% идентичности аминокислотной последовательности, по меньшей мере примерно 70% идентичности аминокислотной последовательности, по меньшей мере примерно 75% идентичности аминокислотной последовательности, по меньшей мере примерно 80% идентичности аминокислотной последовательности, по меньшей мере примерно 85% идентичности аминокислотной последовательности, по меньшей мере примерно 90% идентичности аминокислотной последовательности, по меньшей мере примерно 95% идентичности аминокислотной последовательности с полипептидом нативной последовательности.
[00105] Используемый в настоящем описании «процент (%) идентичности аминокислотной последовательности» и «гомология» по отношению к последовательности пептида, полипептида или антитела определяют как процент аминокислотных остатков в последовательности–кандидате, которые идентичны аминокислотным остаткам в конкретной пептидной или полипептидной последовательности после выравнивания последовательностей и введения гэпов, если это необходимо для достижения максимального процента идентичности последовательности, и без учета каких–либо консервативных замен как части идентичности последовательностей. Выравнивание в целях определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые известны специалисту в данной области, например, с помощью общедоступного программного обеспечения, такого как программное обеспечение BLAST, BLAST–2, ALIGN или MEGALINETM (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
[00106] Аминокислотная замена может включать, без ограничения, замену одной аминокислоты в полипептиде другой аминокислотой. Примеры замен показаны в таблице 2. Аминокислотные замены могут быть введены в представляющее интерес антитело, и продукты могут быть подвергнуты скринингу в отношении требуемой активности, например, сохраненного/улучшенного связывания антигена, пониженной иммуногенности или улучшенной ADCC или CDC.
[00107] Таблица 2
[00108] Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
[00109] Неконсервативные замены повлекут за собой замену члена одного из этих классов другим классом.
[00110] В некоторых вариантах осуществления анти–IL31 антитело содержит тяжелую цепь и легкую цепь, где:
а. тяжелая цепь содержит последовательность CDR–H1, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:1; последовательность CDR–H2, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:2, SEQ ID NO:62, SEQ ID NO:89 или SEQ ID NO:87; и последовательность CDR–H3, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:3, и
b. легкая цепь содержит последовательность CDR–L1, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:8 или SEQ ID NO:63; последовательность CDR–L2, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или, по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:9; и последовательность CDR–L3, имеющую по меньшей мере 85% идентичности последовательности, по меньшей мере 90% идентичности последовательности, по меньшей мере 95% идентичности последовательности или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:10.
[00111] В некоторых вариантах осуществления анти–IL31 антитело содержит тяжелую цепь и легкую цепь, где:
а. (i) последовательность вариабельной легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:24; (ii) последовательность вариабельной тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:25; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи, определена в (ii); или
b. (i) вариабельная последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:16; (ii) вариабельная последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:15; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи определена в (ii); или
с. (i) вариабельная последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:32; (ii) вариабельная последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:33; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи определена в (ii); или
d. (i) вариабельная последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:64; (ii) вариабельная последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:67; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи определена в (ii); или
е. (i) вариабельная последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:65; (ii) вариабельная последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:68; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи определена в (ii); или
f. (i) вариабельная последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:66; (ii) вариабельная последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичности последовательности с аминокислотной последовательностью SEQ ID NO:69; или (iii) последовательность вариабельной легкой цепи определена в (i), и последовательность вариабельной тяжелой цепи определена в (ii).
[00112] Термин «вектор» используется для описания полинуклеотида, который может быть сконструирован таким образом, чтобы он содержал клонированный полинуклеотид или полинуклеотиды, которые могут размножаться в клетке–хозяине. Вектор может включать один или более следующих элементов: точку начала репликации, одну или более регуляторных последовательностей (таких как, например, промоторы или энхансеры), которые регулируют экспрессию представляющего интерес полипептида, или один или более селектируемых маркерных генов (таких как, например, гены устойчивости к антибиотикам и гены, которые можно использовать в колориметрических анализах, например, β–галактозидазы). Термин «вектор экспрессии» относится к вектору, который используется для экспрессии представляющего интерес полипептида в клетке–хозяине.
[00113] «Клетка–хозяин» относится к клетке, которая может быть или была реципиентом вектора или выделенного полинуклеотида. Клетки–хозяева могут быть прокариотическими клетками или эукариотическими клетками. Типичные эукариотические клетки включают клетки млекопитающих, такие как клетки животных–приматов или неприматов; клетки грибов, таких как дрожжи; растительные клетки; и клетки насекомых. Неограничивающие типичные клетки млекопитающих включают, без ограничения, клетки NS0, клетки PER.C6® (Crucell), клетки 293 и клетки CHO и их производные, такие как клетки 293–6E, DG44, CHO–S и CHO–К. Клетки–хозяева включают потомство одной клетки–хозяина, и потомство необязательно может быть полностью идентичным (по морфологии или комплементарности геномной ДНК) исходной родительской клетке из–за естественной, случайной или преднамеренной мутации. Клетка–хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами), кодирующим(и) аминокислотную последовательность(и), представленную в настоящем описании.
[00114] Используемый в настоящем описании термин «выделенный» относится к молекуле, которая была отделена от по меньшей мере некоторых компонентов, с которыми она обычно встречается в природе или продуцируется. Например, полипептид называется «выделенным», когда он отделен, по меньшей мере, от некоторых компонентов клетки, в которой он был продуцирован. Если полипептид секретируется клеткой, то полипептид считается «выделенным» после экспрессии, физического отделения содержащего полипептид супернатанта от клетки, которая его продуцирует. Аналогично, полинуклеотид называют «выделенным», когда он не является частью более крупного полинуклеотида (такого как, например, геномная ДНК или митохондриальная ДНК, в случае ДНК–полинуклеотида), в котором он обычно находится в природе, или отделен по меньшей мере от некоторых компонентов клетки, в которой он был продуцирован, например, в случае РНК–полинуклеотида. Таким образом, ДНК–полинуклеотид, который содержится в векторе внутри клетки–хозяина, может называться «выделенным». В некоторых вариантах осуществления анти–IL31 антитело очищают с помощью хроматографии, такой как эксклюзионная хроматография, ионообменная хроматография, колоночная хроматография с белком А, хроматография гидрофобного взаимодействия и хроматография на CHT.
[00115] Термин «вид животного-компаньона» относится к животному, подходящему для того, чтобы быть компаньоном для человека. В некоторых вариантах осуществления вид животного-компаньона представляет собой мелких млекопитающих, таких как собачьи, кошачьи, собаки, кошки, лошади, кролики, хорьки, морские свинки, грызуны и тому подобное. В некоторых вариантах осуществления вид животного-компаньона представляет собой сельскохозяйственных животных, таких как лошадь, корова, свинья и тому подобное.
[00116] Термин «сигнальная функция IL31» относится к любой последующей активности или их комбинации, которые возникают, когда IL31 связывается со своим рецептором или рецепторным комплексом. В некоторых вариантах осуществления сигнальная функция IL31 включает активацию сигнальных молекул Янус–киназы (Janus kinase, Jak) 1 или Jak 2. В некоторых вариантах осуществления сигнальная функция IL31 включает фосфорилирование белков STAT–3 или STAT–5. В некоторых вариантах осуществления сигнальная функция IL31 содержит активацию сигнального пути MAP–киназы ERK1/2. В некоторых вариантах осуществления сигнальная функция IL31 включает активацию сигнального пути PI3K/AKT. В некоторых вариантах осуществления сигнальная функция IL31 включает активацию сигнального пути Jak1/2.
[00117] «Фосфорилирование STAT» означает модификацию белка STAT после экспрессии путем фосфорилирования. Например, «фосфорилирование STAT–3» относится к фосфорилированию STAT–3, а «фосфорилирование STAT–5» относится к фосфорилированию STAT–5. В некоторых вариантах осуществления фосфорилирование STAT–3 измеряют с помощью анализа иммуноблотинга. Например, клетки (например, собачьи моноцитарные клетки DH82) высевают в 96–луночный планшет для культивирования клеток с плотностью 1×105 клеток на лунку в питательной среде (например, MEM, Life Technologies®), содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л пирувата натрия и 10 нм/мл собачьего интерферона–c (R&D Systems, Миннеаполис, Миннесота, США) в течение 24 часов при 37°C в присутствии анти–IL31 антитела, описанного в настоящем описании. Анализ иммуноблотинга клеточного лизата с использованием анти–фосфо STAT–3 и анти–STAT–3 антител (R&D Systems) использовали для определения концентраций фосфорилированного STAT–3 и нефосфорилированного STAT–3 относительно друг друга и сравнивали с бета–актиновым контролем. Методы качественного или количественного определения концентрации белков с помощью иммуноблота известны специалистам в данной области. В некоторых вариантах осуществления используют методы качественного определения относительной концентрации путем визуального осмотра иммуноблота. В некоторых вариантах осуществления используют методы количественного определения концентраций фосфорилированного STAT 3 и нефосфорилированного STAT 3 с помощью цифровой визуализации иммуноблота, определения интенсивности полос и использования линейной стандартной кривой известных концентраций белка STAT–3 для обратного расчета концентраций фосфорилированного или нефосфорилированного STAT–3 в образце.
[00118] «Уменьшать» или «ингибировать» означает уменьшать, снижать или блокировать активность, функцию или количество по сравнению с эталоном. В некоторых вариантах осуществления «уменьшать» или «ингибировать» означает способность вызывать общее снижение на 20% или более. В некоторых вариантах осуществления «уменьшать» или «ингибировать» означает способность вызывать общее снижение на 50% или более. В некоторых вариантах осуществления «уменьшать» или «ингибировать» означает способность вызывать общее снижение на 75%, 85%, 90%, 95% или более. В некоторых вариантах осуществления количество, указанное выше, ингибируется или уменьшается в течение некоторого периода времени относительно контрольной дозы (такой как плацебо) в течение такого же периода времени. Термин «эталон», используемый в настоящей заявке, относится к любому образцу, стандарту или уровню, которые используются для целей сравнения. Эталон может быть получен из здорового образца или образца без заболеваний. В некоторых примерах, эталон получают из образца без заболеваний или необработанного образца животного-компаньона. В некоторых примерах, эталон получают от одного или более здоровых животных конкретного вида, которые не подлежат тестированию или лечению.
[00119] Термин «существенно уменьшенный», используемый в настоящем описании, обозначает достаточно сильное уменьшение числового значения относительно эталонного числового значения, настолько, что специалист в данной области техники станет рассматривать разницу между этими двумя значениями как статистически значимую в контексте биологической характеристики, измеряемой указанными значениями. В некоторых вариантах осуществления существенно уменьшенные числовые значения уменьшаются по сравнению с контрольным значением более чем примерно на любое из: 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100%.
[00120] В некоторых вариантах осуществления анти–IL31 антитело может снижать сигнальную функцию IL31 у видов животных-компаньонов по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40% по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или 100% по сравнению с сигнальной функцией IL31 в отсутствие антитела, по результатам измерения уменьшения уровня фосфорилирования STAT–3. В некоторых вариантах осуществления снижение сигнальной функции IL31 или снижение фосфорилирования STAT–3 составляет от 10% до 15%, от 10% до 20%, от 10% до 25%, от 10% до 30%, от 10% до 35%, от 10% до 40%, от 10% до 45%, от 10% до 50%, от 10% до 60%, от 10% до 70%, от 10% до 80%, от 10% до 90%, от 10% до 100%, от 15% до 20%, от 15% до 25%, от 15% до 30%, от 15% до 35%, от 15% до 40%, от 15% до 45%, от 15% до 50%, от 15% до 60%, от 15% до 70%, от 15% до 80%, от 15% до 90%, от 15% до 100%, от 20% до 25%, от 20% до 30%, от 20% до 35%, от 20% до 40%, от 20% до 45%, от 20% до 50%, от 20% до 60%, от 20% до 70%, от 20% до 80%, от 20% до 90%, от 20% до 100%, от 25% до 30%, от 25% до 35%, от 25% до 40%, от 25% до 45%, от 25% до 50%, от 25% до 60%, от 25% до 70%, от 25% до 80%, от 25% до 90%, от 25% до 100%, от 30% до 35%, от 30% до 40%, от 30% до 45%, от 30% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 100%, от 35% до 40%, от 35% до 45%, от 35% до 50%, от 35% до 60%, от 35% до 70%, от 35% до 80%, от 35% до 90%, от 35% до 100%, от 40% до 45%, от 40% до 50%, от 40% до 60%, от 40% до 70%, от 40% до 80%, от 40% до 90%, от 40% до 100%, от 45% до 50%, от 45% до 60%, от 45% до 70%, от 45% до 80%, от 45% до 90%, от 45% до 100%, от 50% до 60%, от 50% до 70%, от 50% до 80%, от 50% до 90%, от 50% до 100%, от 60% до 70%, от 60% до 80%, от 60% до 90%, от 60% до 100%, от 70% до 80%, от 70% до 90%, от 70% до 100%, от 80% до 90%, от 80% до 100% или от 90% до 100%.
Фармацевтические композиции
[00121] Термины «фармацевтический состав» и «фармацевтическая композиция» относятся к препарату, который находится в такой форме, которая обеспечивает эффективную биологическую активность активного(ых) ингредиента(ов), и которая не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому вводят состав.
[00122] «Фармацевтически приемлемый носитель» относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, инкапсулирующему материалу, вспомогательному составу или носителю, общепринятому в данной области техники для применения с терапевтическим агентом, которые вместе составляют «фармацевтическую композицию», предназначенную для введения субъекту. Фармацевтически приемлемый носитель является не токсичным для реципиентов в используемых дозировках и концентрациях и совместимым с другими ингредиентами состава. Фармацевтически приемлемый носитель подходит для используемого состава. Примеры фармацевтически приемлемых носителей включают оксид алюминия; стеарат алюминия; лецитин; сывороточные белки, такие как человеческий сывороточный альбумин, альбумин собаки или другого животного; буферы, такие как фосфатный, цитратный, трометаминовый или HEPES–буферы; глицин; сорбиновую кислоту; сорбат калия; смеси парциальных глицеридов насыщенных растительных жирных кислот; воду; соли или электролиты, такие как протаминсульфат, динатрия гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния или трисиликат магния; поливинилпирролидон, вещества на основе целлюлозы; полиэтиленгликоль; сахарозу; маннит; или аминокислоты, включая, без ограничения, аргинин.
[00123] Фармацевтическая композиция может храниться в лиофилизированной форме. Таким образом, в некоторых вариантах осуществления способ получения включает стадию лиофилизации. Затем, перед введением собаке, кошке или лошади, лиофилизированная композиция может быть восстановлена, как правило, в виде водной композиции, подходящей для парентерального введения. В других вариантах, в частности, когда антитело является высоко стабильным к термической и окислительной денатурации, фармацевтическая композиция может храниться в виде жидкости, т.е. в виде водной композиции, которую можно вводить собаке, кошке или лошади непосредственно или после соответствующего разведения. Лиофилизированная композиция может быть восстановлена стерильной водой для инъекций (WFI). Могут быть включены антибактериальные агенты (например, бактериостатические реагенты, такие как бензиловый спирт). Таким образом, изобретение предлагает фармацевтические композиции в твердой или жидкой форме.
[00124] Величина рН фармацевтических композиций при введении может находиться в диапазоне от примерно 5 до примерно 8. Композиции по изобретению являются стерильными, если предназначены для использования в терапевтических целях. Стерильность может быть достигнута любым из нескольких способов, известных в данной области, включая фильтрацию через стерильные фильтрующие мембраны (например, 0,2 микронные мембраны). Стерильность может поддерживаться с помощью антибактериальных агентов или без них.
[00125] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция имеет рН от 5,0 до 6,2, от 5,0 до 6,0 или от 5,3 до 5,7. В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция имеет рН, равный 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1 или 6,2.
[00126] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит L–гистидин, хлорид натрия и полисорбат 80.
[00127] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит хлорид натрия в концентрации от 80 нМ до 200 нМ, от 100 нМ до 180 нМ, от 100 нМ до 175 нМ, от 110 нМ до 170 нМ, от 120 нМ до 160 нМ, от 120 нМ до 150 нМ, от 130 нМ до 150 нМ, от 130 нМ до 160 нМ, 100 нМ, 80 нМ, 110 нМ, 120 нМ, 130 нМ, 140 нМ, 150 нМ, 160 нМ, 170 нМ, 180 нМ или 200 нМ.
[00128] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит полисорбат 80 в концентрации от 0,005 мг/мл до 0,5 мг/мл, от 0,01 мг/мл до 0,1 мг/мл, от 0,1 мг/мл до 0,5 мг/мл, от 0,005 мг/мл до 0,01 мг/мл, 0,1 мг/мл, 0,2 мг/мл, 0,3 мг/мл, 0,4 мг/мл, 0,05 мг/мл, 0,06 мг/мл, 0,07 мг/мл, 0,08 мг/мл, 0,09 мг/мл или 0,1 мг/мл.
[00129] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит L–гистидин в концентрации от 5 мМ до 100 мМ, от 10 мМ до 50 мМ, от 20 мМ до 30 мМ, от 10 мМ до 30 мМ, от 20 мМ до 80 мМ, от 30 мМ до 70 мМ, от 40 мМ до 60 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 40 или 50 мМ.
[00130] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит м–крезол или бензиловый спирт. В некоторых вариантах осуществления концентрация м–крезола составляет примерно 0,2%, от примерно 0,1% до примерно 0,3%, от примерно 0,08% до примерно 0,25% или от примерно 0,05% до примерно 0,25%. В некоторых вариантах осуществления концентрация бензилового спирта составляет примерно 1%, от примерно 0,5% до примерно 2%, от примерно 0,2% до примерно 2,5%, от примерно 1% до примерно 5%, от примерно 0,5% до примерно 5% или от примерно 1% до примерно 3%.
[00131] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит сахар. В некоторых вариантах осуществления сахар представляет собой сахарозу, трегалозу, D–маннит, мальтозу и/или сорбит. В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит сахар в концентрации от 0,5% до 20%, от 1% до 10%, от 1% до 5%, от 1% до 3%, 0,5%, 1%, 2%, 3%, 4%, 5% или 10%.
[00132] В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит антибактериальный агент. В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит м–крезол или метилпарабен. В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит 0,2% м–крезола. В некоторых вариантах осуществления фармацевтически приемлемый носитель или фармацевтическая композиция содержит 0,9% метилпарабена.
Применение антител и фармацевтических композиций
[00133] Антитела или фармацевтические композиции, содержащие антитела по изобретению, могут быть полезными для лечения IL–31–индуцированного состояния. Используемый в настоящем описании термин «IL31–индуцированное состояние» означает заболевание, связанное, вызванное или характеризуемое повышенными уровнями или измененными градиентами концентрации IL31. Такие IL31–индуцированные состояния включают, без ограничения, зуд или аллергическое заболевание. В некоторых вариантах осуществления IL31–индуцированным состоянием является атопический дерматит, зуд, астма, псориаз, склеродермия или экзема. IL31–индуцированное состояние может проявляться у животного-компаньона, включая, без ограничения, собак, кошек или лошадей.
[00134] Используемый в настоящем описании термин «лечение» представляет собой подход для получения полезных или требуемых клинических результатов. Термин «лечение», используемый в настоящем описании, охватывает любое введение или применение терапевтического средства для лечения заболевания у млекопитающего, включая животных-компаньонов. Для целей настоящего раскрытия полезные или требуемые клинические результаты включают, без ограничения, любое одно или более из следующего: ослабление одного или более симптомов, уменьшение тяжести заболевания, предотвращение или задержку распространения заболевания, предотвращение или задержку рецидива заболевания, задержку или замедление прогрессирования заболевания, купирование болезненного состояния, ингибирование заболевания или прогрессирования заболевания, ингибирование или замедление заболевания или его прогрессирования, остановку его развития и ремиссию (частичную или полную). Термин «лечение» также включает уменьшение патологических последствий пролиферативного заболевания. Способы, представленные в настоящем описании, предусматривают любой один или более из этих аспектов лечения. В соответствии с вышеизложенным, термин «лечение» не требует стопроцентного устранения всех аспектов расстройства.
[00135] В некоторых вариантах осуществления анти–IL31 антитело или фармацевтические композиции, содержащие его, могут быть использованы в соответствии с описанными в настоящем описании способами для лечения IL31–индуцированных состояний. В некоторых вариантах осуществления анти–IL31 антитело или фармацевтические композиции вводят животному-компаньону, такому как собака, кошка или лошадь, для лечения IL31–индуцированного состояния.
[00136] «Терапевтически эффективное количество» вещества/молекулы, агониста или антагониста может варьировать в зависимости от таких факторов, как тип подлежащего лечению заболевания, состояние заболевания, тяжесть и течение заболевания, тип терапевтического назначения любой предшествующей терапии, истории болезни, реакции на предшествующее лечение, усмотрение лечащего ветеринара, возраст, пол и вес животного и способность вещества/молекулы, агониста или антагониста вызывать требуемый ответ у животного. Терапевтически эффективное количество также представляет собой количество, при котором терапевтически полезные эффекты перевешивают любые токсические или вредные эффекты вещества/молекулы, агониста или антагониста. Терапевтически эффективное количество может быть доставлено с помощью одного или более введений. Терапевтически эффективное количество относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата.
[00137] В некоторых вариантах осуществления анти–IL31 антитело или фармацевтическую композицию, содержащую анти–IL31 антитело, вводят парентерально, подкожно, путем внутривенной инфузии или внутримышечной инъекции. В некоторых вариантах осуществления анти–IL31 антитело или фармацевтическую композицию, содержащую анти–IL31 антитело, вводят в виде болюсной инъекции или путем непрерывной инфузии в течение некоторого периода времени. В некоторых вариантах осуществления анти–IL31 антитело или фармацевтическую композицию, содержащую анти–IL31 антитело, вводят внутримышечно, внутрибрюшинно, интрацереброспинально, подкожно, внутриартериально, интрасиновиально, интратекально или путем ингаляции.
[00138] Анти–IL31 антитела, описанные в настоящем описании, можно вводить в количестве от 0,1 мг/кг массы тела до 100 мг/кг массы тела на дозу. В некоторых вариантах осуществления анти–IL31 антитела можно вводить в количестве от 0,5 мг/кг массы тела до 50 мг/кг массы тела на дозу. В некоторых вариантах осуществления анти–IL31 антитела можно вводить в количестве от 1 мг/кг массы тела до 10 мг/кг массы тела на дозу. В некоторых вариантах осуществления анти–IL31 антитела можно вводить в количестве от 0,5 мг/кг массы тела до 100 мг/кг массы тела, от 1 мг/кг массы тела до 100 мг/кг массы тела, от 5 мг/кг массы тела до 100 мг/кг массы тела, от 10 мг/кг массы тела до 100 мг/кг массы тела, от 20 мг/кг массы тела до 100 мг/кг масса тела, от 50 мг/кг массы тела до 100 мг/кг массы тела, от 1 мг/кг массы тела до 10 мг/кг массы тела, от 5 мг/кг массы тела до 10 мг/кг массы тела, от 0,5 мг/кг массы тела до 10 мг/кг массы тела или от 5 мг/кг массы тела до 50 мг/кг массы тела.
[00139] Анти–IL3 антитело или фармацевтическую композицию, содержащую анти–IL31 антитело, можно вводить животному-компаньону один раз или в виде нескольких введений. Например, анти–IL31 антитело или фармацевтическая композицию, содержащую анти–IL31 антитело, можно вводить по меньшей мере один раз, более одного раза, по меньшей мере два раза, по меньшей мере три раза, по меньшей мере четыре раза или по меньшей мере пять раз.
[00140] В некоторых вариантах осуществления дозу вводят один раз в неделю в течение по меньшей мере двух или трех последовательных недель, и в некоторых вариантах осуществления этот цикл лечения повторяют два или более раз, необязательно чередуя с одной или более неделями без лечения. В других вариантах осуществления терапевтически эффективную дозу вводят один раз в сутки в течение двух–пяти последовательных дней, и в некоторых вариантах осуществления этот цикл лечения повторяют два или более раз, необязательно, с одним или более днями или неделями без лечения.
[00141] Введение «в комбинации с» одним или более дополнительными терапевтическими агентами включает одновременное (параллельное) и последовательное введение в любом порядке. Термин «одновременно» используется в настоящем описании для обозначения введения двух или более терапевтических агентов, когда введения по меньшей мере частично перекрываются по времени или когда введение одного терапевтического агента происходит в течение короткого периода времени относительно введения другого терапевтического средства. Например, два или более терапевтических агента вводят с временным интервалом не более примерно определенного количества минут. Термин «последовательно» используется в настоящем описании для обозначения введения двух или более терапевтических агентов, когда введение одного или более агентов продолжается после прекращения введения одного или более других агентов, или когда введение одного или более агентов начинается до введения одного или более других агентов. Например, введение двух или более терапевтических агентов происходит с разницей во времени, превышающей определенное количество минут. Используемый в настоящем описании термин «в комбинации с» относится к применению одного способа лечения дополнительно к другому способу лечения. Таким образом, «в комбинации с» относится к получению животным одного вида лечения до, во время или после получения другого вида лечения.
[00142] В некоторых вариантах осуществления способ включает введение анти–IL31 антитела или фармацевтической композиции, содержащей анти–IL31 антитело, в комбинации с ингибитором Jak, ингибитором PI3K, ингибитором AKT или ингибитором MAPK. В некоторых вариантах осуществления способ включает введение анти–IL31 антитела или фармацевтической композиции, содержащей анти–IL31 антитело, в комбинации с анти–IL17 антителом, анти–TNFα антителом, анти–CD20 антителом, анти–CD19 антителом, анти–CD25 антителом, анти–IL4 антителом, анти–IL13 антителом, анти–IL23 антителом, анти–IgE антителом, анти–CD11α антителом, анти–IL6R антителом, антителом к α4–интегрину, анти–IL12 антителом, анти–IL1β антителом или анти–BlyS антителом.
[00143] В настоящем документе представлены способы воздействия анти–IL31 антитела или фармацевтической композиции, содержащей анти–IL31–антитело, на клетку в условиях, благоприятных для связывания антитела с IL31. В некоторых вариантах осуществления клетка подвергается воздействию антитела или фармацевтической композиции ex vivo. В некоторых вариантах осуществления клетка подвергается воздействию антитела или фармацевтической композиции in vivo. В некоторых вариантах осуществления изобретения клетка подвергается воздействию анти–IL31 антитела или фармацевтической композиции в условиях, благоприятных для связывания антитела с внутриклеточным IL31. В некоторых вариантах осуществления изобретения клетка подвергается воздействию анти–IL31 антитела или фармацевтической композиции в условиях, благоприятных для связывания антитела с внеклеточным IL31. В некоторых вариантах осуществления клетка может подвергаться in vivo воздействию анти–IL31 антитела или фармацевтической композиции при введении любым одним или более способами, описанными в настоящей заявке, включая, без ограничения, внутрибрюшинную, внутримышечную, внутривенную инъекцию субъекту. В некоторых вариантах осуществления клетка может подвергаться ex vivo воздействию анти–IL31 антитела или фармацевтической композиции через воздействие на клетку культуральной среды, содержащей антитело или фармацевтическую композицию. В некоторых вариантах осуществления, перед воздействием на клетку культуральной среды, содержащей антитело или фармацевтическую композицию может быть оказано воздействие на проницаемость клеточной мембраны любым количеством методов, известных специалисту в данной области (таких как электропорация клеток или воздействие на клетки раствором, содержащим хлорид кальция).
[00144] В некоторых вариантах осуществления связывание приводит к уменьшению сигнальной функции IL31 в клетке. В некоторых вариантах осуществления анти–IL31 антитело может снижать сигнальную функцию IL31 в клетке по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или 100% по сравнению с сигнальной функцией IL31 в отсутствие антитела, по результатам измерения уменьшения уровня фосфорилирования STAT–3. В некоторых вариантах осуществления снижение сигнальной функции IL31 или уменьшение уровня фосфорилирования STAT–3 составляет от 10% до 15%, от 10% до 20%, от 10% до 25%, от 10% до 30%, от 10% и 35%, от 10% до 40%, от 10% до 45%, от 10% до 50%, от 10% до 60%, от 10% до 70%, от 10% до 80%, от 10% до 90%, от 10% до 100%, от 15% до 20%, от 15% до 25%, от 15% до 30%, от 15% до 35%, от 15% до 40%, от 15% до 45%, от 15% до 50%, от 15% до 60%, от 15% до 70%, от 15% до 80%, от 15% до 90%, от 15% до 100%, от 20% до 25% от 20% до 30%, от 20% до 35%, от 20% до 40%, от 20% до 45%, от 20% до 50%, от 20% до 60%, от 20% до 70%, от 20% до 80%, от 20% до 90%, от 20% до 100%, от 25% до 30%, от 25% до 35%, от 25% до 40%, от 25% до 45%, от 25% до 50%, от 25% до 60%, от 25% до 70%, от 25% до 80%, от 25% до 90%, от 25% до 100%, от 30% до 35%, от 30% до 40%, от 30% до 45%, от 30% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 100%, от 35% до 40%, от 35% и 45%, от 35% до 50%, от 35% до 60%, от 35% до 70%, от 35% до 80%, от 35% до 90%, от 35% до 100%, от 40% до 45%, от 40% до 50%, от 40% до 60%, от 40% до 70%, от 40% до 80%, от 40% до 90%, от 40% до 100%, от 45% до 50%, от 45% до 60%, от 45% до 70%, от 45% до 80%, от 45% до 90%, от 45% до 100%, от 50% до 60%, от 50% до 70% от 50% до 80%, от 50% до 90%, от 50% до 100%, от 60% до 70%, от 60% до 80%, от 60% до 90%, от 60% до 100%, от 70% до 80%, от 70% до 90%, от 70% до 100%, от 80% до 90%, от 80% до 100% или от 90% до 100%.
[00145] В настоящей заявке представлены способы применения анти–IL31 антител, полипептидов и полинуклеотидов для детектирования, диагностики и мониторинга IL31–индуцированного состояния. В настоящем описании представлены способы определения того, будет ли животное-компаньон отвечать на терапию анти–IL31 антителами. В некоторых вариантах осуществления способ включает определение с помощью анти–IL31 антитела наличия у животного клеток, которые экспрессируют IL31. В некоторых вариантах осуществления способ детектирования включает приведение образца в контакт с антителом, полипептидом или полинуклеотидом и определение того, отличается ли уровень связывания от уровня связывания эталонного образца или образца сравнения (такого как контроль). В некоторых вариантах осуществления способ может быть полезен для определения, являются ли антитела или полипептиды, описанные в настоящем описании, подходящими для лечения животного–субъекта.
[00146] В некоторых вариантах осуществления образец представляет собой биологический образец. Термин «биологический образец» означает количество вещества, полученного из живого существа или бывшего ранее живым существа. В некоторых вариантах осуществления биологический образец представляет собой клеточный или клеточный/тканевый лизат. В некоторых вариантах осуществления биологический образец включает, без ограничения, кровь (например, цельную кровь), плазму, сыворотку, мочу, синовиальную жидкость и эпителиальные клетки.
[00147] В некоторых вариантах осуществления клетки или клеточный/тканевый лизат приводят в контакт с анти–IL31 антителом, и определяют связывание между антителом и клеткой. Когда тестируемые клетки демонстрируют активность связывания по сравнению с контрольной клеткой того же типа ткани, это может указывать на то, что субъект получит пользу от лечения анти–IL31 антителом. В некоторых вариантах осуществления тестируемые клетки берут из ткани животного-компаньона.
[00148] Для детектирования антитело–антиген специфического связывания могут быть использованы различные способы, известные в данной области. Типичные иммуноанализы, которые могут быть проведены, включают поляризационный флуоресцентный иммуноанализ (FPIA), флуоресцентный иммуноанализ (FIA), ферментный иммуноанализ (EIA), нефелометрический иммуноанализ ингибирования (NIA), твердофазный иммуноферментный анализ (ИФА) и радиоиммуноанализ (RIA). Индикаторный фрагмент или группа меток могут быть присоединены к исследуемым антителам и выбраны таким образом, чтобы они удовлетворяли требованиям, предъявляемым к различным применениям способа, которые часто определяются наличием оборудования для анализа и совместимыми процедурами иммуноанализа. Подходящие метки включают, без ограничения, радионуклиды (например, 125I, 131I, 35S, 3H или 32P), ферменты (например, щелочную фосфатазу, пероксидазу хрена, люциферазу или β–глактозидазу), флуоресцирующие фрагменты или белки (например, флуоресцеин, родамин, фикоэритрин, GFP или BFP) или люминесцирующие фрагменты (например, наночастицы QdotТМ, поставляемые корпорацией Quantum Dot, Пало–Альто, Калифорния). Общие методы, применяемые при осуществлении различных видов иммуноанализа, указанных выше, известны специалистам в данной области.
[00149] Для целей диагностики полипептид, включая антитела, может быть помечен детектируемым фрагментом, включая, без ограничения, радиоизотопы, флуоресцентные метки и различные фермент–субстратные метки, известные в данной области. Способы конъюгирования меток с антителами известны в данной области. В некоторых вариантах осуществления анти–IL31 антитела не нужно метить, и их присутствие можно детектировать с помощью второго меченого антитела, которое связывается с первым анти–IL31 антителом. В некоторых вариантах осуществления анти–IL31 антитело можно использовать в любом известном методе анализа, таком как анализы конкурентного связывания, прямой и непрямой сэндвич–анализы и анализы иммунопреципитации. Zola, Monoclonal antibodies: A Manual of Techniques, pp. 147–158 (CRC Press, Inc. 1987). Анти–IL31 антитела и полипептиды также можно использовать в in vivo диагностических анализах, таких как in vivo визуализация. Как правило, антитело или полипептид метят радионуклидом (таким как 111In, 99Tc, 14C, 131I, 125I, 3H или любой другой радионуклидной меткой, включая те, что указаны в настоящем описании) с тем, чтобы обеспечить возможность локализации интересующих клеток или тканей с помощью иммуносцинтиграфии. Антитело также можно использовать в качестве окрашивающего реагента при патологии, используя методы, хорошо известные в данной области.
[00150] В некоторых вариантах осуществления первое антитело используется для диагностики, а второе антитело используется в качестве терапевтического. В некоторых вариантах осуществления первое и второе антитела являются разными. В некоторых вариантах осуществления первое и второе антитела могут одновременно связываться с антигеном за счет связывания с отдельными эпитопами.
[00151] Приведенные ниже примеры иллюстрируют конкретные аспекты изобретения и никоим образом не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Пример 1. Идентификация мышиных моноклональных антител, которые связываются с собачьим IL31.
[00152] Собачий ген IL31, кодирующий белок IL31 (SEQ ID NO:22), синтезировали с поли–His–меткой на С–конце и клонировали в вектор экспрессии млекопитающего. Плазмиду, несущую ген собачьего IL31, трансфицировали в клетки 293.
[00153] Супернатант, содержащий собачий белок IL31, собирали и фильтровали. Собачий IL31 подвергали аффинной очистке на колонке Ni–NTA (CaptivA® Protein A Affinity Resin, Repligen).
[00154] Мышиные моноклональные антитела идентифицировали с помощью стандартной иммунизации, используя в качестве иммуногена собачий IL31, продуцированный клетками 293. Во время иммунизации использовали два разных адъюванта (Antibody Solutions, Саннивейл, Калифорния), и стандартным методом гибридомы получали моноклональные антитела. Для скрининга клонов, продуцирующих антитела, связывающиеся с IL31, разработали твердофазный иммуноферментный анализ (ИФА). Сначала собачий IL31 биотинилировали, а затем его вводили в лунки, покрытые стрептавидином. Затем в лунки добавляли иммунизированную сыворотку с последующей промывкой и детектированием анти–мышиными антителами, конъюгированными с HRP. Присутствие собачьего IL31–связывающего антитела давало положительный сигнал. Из тысяч клонов, протестированных методом ИФА, 170 клонов с наибольшим сродством связывания отбирали для дальнейшего тестирования с помощью биосенсорного анализа (Forte Bio Octet), исходя из интенсивности сигнала. Биотинилированный собачий IL31 иммобилизовали на наконечнике сенсора, и супернатанты клонов гибридом, содержащие антитела к собачьему IL31, отбирали по медленной скорости диссоциации (скорости диссоциации между антителом и лигандом). Сродство связывания лучших 19 кандидатов измеряли при одной концентрации и выражали в виде равновесной константы диссоциации (Kd) после измерения концентрации антител с помощью анализа титра, основанного на связывании с белком A, на Biosensor Octet. Значения Kd лучших 19 кандидатов составляли менее 10 нМ.
[00155] Кроме того, каждый из 170 клонов с высокой активностью связывания, согласно результатам ИФА, тестировали на нейтрализующую активность. Для оценки активности лучших кандидатов по снижению передачи сигналов pSTAT, опосредованной собачьим IL31, выполняли клеточный функциональный анализ, описанный ниже в примере 4, используя клетки DH82 собаки. Для дальнейшего исследования отбирали четыре лучших клона (M14, M18, M19 и M87). Примечательно, что большинство клонов с высоким сродством связывания, выявленных методом ИФА, оказались нефункциональными.
Пример 2. Идентификация ДНК–последовательностей, кодирующих VH и VL моноклональных антител.
[00156] Клетки гибридомы, продуцирующие М14, М18, М19 и М87, осаждали центрифугированием. РНК экстрагировали, и для получения кДНК стандартными методами использовали олигонуклеотидные праймеры для амплификации вариабельных доменов мышиного иммуноглобулина (Ig). Вариабельную тяжелую цепь (VH) и вариабельную легкую цепь (VL) каждого из четырех клонов секвенировали и анализировали путем выравнивания последовательностей (фиг. 1; SEQ ID NO:36–43). Примечательным оказалось то, что у трех из четырех активных антител (М14, М18 и М19) шесть CDR имели одинаковые последовательности, за исключением того, что у CDR–L1 М18 находился изолейцин в положении 14 (SEQ ID NO:63), в то время как у М14 и М19 в положении 14 находился метионин (SEQ ID NO:8), а также того, что у CDR–H2 M18 в положении 9 находился тирозин (SEQ ID NO:62 и SEQ ID NO:87), в то время как у M14 и M19 в положении 14 находилась аспарагиновая кислота (SEQ ID NO:2 и SEQ ID NO:89). Сходство последовательностей CDR предполагает, что М14, М18 и М19 имеют общий эпитоп.
Пример 3: Экспрессия и очистка мышино–собачьего химерного и канинизированного IL31–mAb M14 из клеток СНО
[00157] Конструировали последовательности ДНК, кодирующие химерное антитело, для слияния мышиного VH (SEQ ID NO:25) и мышиного VL (SEQ ID NO:24) M14 с собачьей константной тяжелой цепью и собачьей константной легкой цепью. Нуклеотидные последовательности синтезировали химическим способом и вставляли в вектор экспрессии, подходящий для трансфекции в клетку–хозяина СНО. После трансфекции в клетки СНО из клетки секретировались белок с легкой цепью или тяжелой цепью или оба белка. Например, химерный М14, в котором используется собачий IgG–B, очищали с помощью одностадийной хроматографии на колонке с белком А.
[00158] Мышиные VH и VL M14 канинизировали посредством поиска и отбора надлежащих последовательностей собачьих антител зародышевой линии в качестве матрицы для прививки CDR с последующим моделированием белка. Канинизированный IgG–B M14 (SEQ ID NO:18 и SEQ ID NO:21) легко экспрессировался и был подвергнут одностадийной очистке на колонке с белком A или другими хроматографическими методами, такими как ионообменная колоночная хроматография, колоночная хроматография гидрофобного взаимодействия, колоночная хроматография со смешанным режимом, например на CHT, или колоночная хроматография с мультимодальным режимом, такая как CaptoMMC. Можно применять этапы с низким pH или другие этапы инактивации и удаления вирусов. Очищенный белок смешивали с наполнителями и стерилизовали фильтрацией для приготовления фармацевтической композиции по изобретению. Фармацевтическую композицию вводили собаке с атопическим дерматитом в количестве, достаточном для связывания, чтобы ингибировать IL31.
[00159] Затем использовали векторы для осуществления пилотной трансфекции в клетки CHO–S с помощью реагента для трансфекции FreestyleMaxТМ (Life Technologies). Супернатант собирали путем осветления кондиционированной среды. Белок очищали с помощью одностадийной хроматографии с белком А и использовали для дальнейшего исследования.
Пример 4: Демонстрация активности связывания IL31
[00160] В этом примере показано, что антитела по изобретению, на примере химерных M14 (SEQ ID NO:26 и SEQ ID NO:27) и канинизированных M14 (SEQ ID NO:18 и SEQ ID NO:21), связываются с собачьим IL31 с кинетикой, необходимой для терапевтической активности.
[00161] Анализ связывания выполняли с помощью биосенсора Octet следующим образом. Вкратце, собачий IL31 биотинилировали по первичным аминным группам, используя EZ–LinkTM NHS–LC–биотин (Thermo Scientific, № по каталогу: 21336), или по гликановым группам, используя EZ–LinkTM биотин–LC–гидразид (ThermoFisher Scientific, № по каталогу: 21340), в соответствии с инструкциями производителя. Свободный непрореагировавший биотин удаляли из биотинилированного IL31 путем экстенсивного диализа. Биотинилированный собачий IL31 иммобилизовали на наконечнике сенсора, покрытого стрептавидином. Ассоциацию при четырех различных концентраций (400, 200, 66,6 и 33 нМ) химерного и канинизированного антитела М14 и IL31 человека и собаки (амин–конъюгированный биотин) и ассоциацию 100 нМ канинизированного антитела М14 и собачьего IL31 (гликан–конъюгированный–биотин) отслеживали в течение девяноста секунд. Диссоциацию отслеживали в течение 600 секунд. Вычитали кривую, содержащую только буфер, для коррекции любого отклонения. Данные фитировали к модели связывания 2:1 с помощью программного обеспечения для анализа данных ForteBioТМ для определения kon, koff и Kd. Буфер для разведений и всех стадий связывания: 20 мМ фосфат, 150 мМ NaCl, рН 7,2.
[00162] Собачий IL31 с C–концевой поли–His–меткой экспрессировали и очищали от клеток CHO–S. Человеческий IL31 получали из биосенсоров Sino Biological, и стрептавидин получали от ForteBio (кат. № 18–509). Кинетика связывания была следующей: в случае лиганда собачьего IL31 (амин–конъюгированный биотин) величина Kd(M) химерного M14 была <1,0×10–11 (фиг.2), а величина Kd(M) канинизированного M14 была <1,0×10–11 (фиг.3). В случае лиганда собачьего IL31 (гликан–конъюгированный биотин) величина Kd(M) канинизированного M14 была <1,0×10–12, а величина koff (1/с) была <1,0×10–7.
[00163] Химерное М14 и канинизированное М14 не давали видимого сигнала связывания с человеческим IL31. Таким образом, Kd не был измерен.
Пример 5. Демонстрация того, что M14 ингибирует передачу сигналов собачьего IL31.
[00164] После связывания с рецептором IL–31 происходит активация сигнальных молекул Janus–киназы (Jak) 1 и Jak2, индуцированная IL–31. В свою очередь, активированные Jak стимулируют фосфорилирование расположенных ниже сигнальных молекул STAT–3 и STAT–5. Детектирование анти–IL31 активности из фракции бесклеточной культуральной среды очищенной с помощью белка А осуществляли с помощью анализа анти–фосфо–Stat3 методом иммуноблотинга (Gonzales et. Al. Vet Dermatol 2013; 24:48–e12). Вкратце, собачьи моноцитарные клетки DH82 (Американская коллекция типовых культур, Манассас, Вирджиния, США) высевали в 96–луночные плоскодонные планшеты для культивирования клеток с плотностью посева 1×105 клеток на лунку в питательной среде MEM (Life Technologies), содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л пирувата натрия и 10 нг/мл собачьего интерферона–c (R&D Systems, Миннеаполис, Миннесота, США) в течение 24 ч при 37°С. В этом эксперименте концентрация собачьего IL31–Fc составляла 5 нг/мл (8 нМ). Анти–фосфо–STAT–3 и анти–STAT–3 антитела приобретали у компании в R&D Systems. Антитела к бета–актину приобретали у компании Sigma–Aldrich. Как показано на фиг.4, передача сигналов собачьего IL31 снижается (о чем свидетельствует снижение фосфорилирования STAT–3) по мере увеличения воздействующей на клетки концентрации канинизированного M14 (дорожка 1: анти–IL31–антитело отсутствует; дорожка 2: 3,3 нМ; дорожка 3: 6,6 нМ, дорожка 4: 9,9 нМ и дорожка 5: 13,2 нМ).
Пример 6. Идентификация эпитопа собачьего IL31, связывающегося с M14.
[00165] Для идентификации эпитопа собачьего IL31, распознаваемого M14, создавали множество рекомбинантных молекул GST–фрагмент собачьего IL31, и белки экспрессировали внутриклеточно в E.coli. После переноса GST–рекомбинантных белков на мембрану использовали химерное М14 для зондирования мембраны. Положительный сигнал возникал в том случае, если фрагмент IL31 содержал эпитоп.
[00166] На фиг.5 в комбинации с фиг.6 продемонстрировано, что М14 может распознавать минимальный фрагмент (SEQ ID NO:23).
Пример 7. Демонстрация перекрестной реакции М14 с кошачьим IL31.
[00167] Для оценки, распознает ли антитело М14 кошачий IL31 (SEQ ID NO:28) или лошадиный IL31 (SEQ ID NO:29), выполняли слияние каждого белка с человеческим Fc и экспрессировали в клетках 293 млекопитающих. Частично очищенные белки подвергали блоттингу и зондировали антителом М14. Иммуноблот на фиг.1 демонстрирует, что М14 связывается с кошачьим IL31. Анализ иммуноблотинга не выявил связывание между M14 и лошадиным IL31. Однако анализ бислойной интерферометрии показал, что антитело М14 связывается с лошадиным IL31, но с меньшим сродством. Предварительное измерение Kd с помощью биотинилированного лошадиного IL31, иммобилизованного на сенсоре, показало, что сродство (Kd) находится в диапазоне примерно от 10 до 50 нМ.
Пример 8: Фелинизированное М14
[00168] Вариабельную легкую цепь М14 фелинизировали в виде (SEQ ID NO:32), и вариабельную тяжелую цепь М14 фелинизировали в виде (SEQ ID NO:33). Сначала, мышиные вариабельные последовательности тяжелой цепи и легкой цепи использовали для поиска подходящих вариантов кошачьих VH и VL. Подходящие кошачьи рамки считывания отбирали для прививки CDR. Их дополнительно оптимизировали с помощью структурного моделирования. Фелинизированные VH и VL подвергали слиянию с кошачьими константными доменами тяжелой цепи IgG (CH1, CH2 и CH3) и кошачьим константным доменом легкой цепи (CL1).
[00169] Кошачье химерное антитело М14 (SEQ ID NO:30 и SEQ ID NO:31) или фелинизированное антитело М14 (SEQ ID NO:34 и SEQ ID NO:35) можно вводить кошкам для лечения IL31–индуцированного состояние.
Пример 9. Идентификация эпитопа связывания собачьего IL31 с M14.
[00170] Для дальнейшей идентификации аминокислотных остатков эпитопа собачьего IL31, распознаваемого M14, в E.coli экспрессировали множество рекомбинантных молекул GST–фрагмент эпитопа собачьего IL31, несущих мутации аланина. На фиг. 8–12 показаны иммуноблоты детального картирования эпитопов гибридных белков GST–собачий IL31, зондированных анти–собачьим IL31–mAb (M14) или канинизированным M14 (верхние панели) и контролем антител к GST (нижние панели). Фрагмент эпитопа, тестируемый на каждой дорожке, указан под иммуноблотом. Название фрагмента указывает диапазон аминокислот тестированного зрелого собачьего IL31 (SEQ ID NO:44) и положение мутации аланина, если таковая имеется. Положительный сигнал возникал в случае, когда фрагмент IL31 содержал эпитоп дикого типа, тогда как отрицательный сигнал возникал, когда фрагмент IL31 содержал замену аланина в остатке, важном для взаимодействия антитело–лиганд.
[00171] Результаты картирования эпитопов приведены в Таблице 3 ниже. Результаты показывают, что P12, S13, D14 и K17 зрелого собачьего IL31 (SEQ ID NO:44) участвуют в связывании антитела M14, и что R16 и I18 частично участвуют в распознавании M14. В целом, результаты этого исследования предполагают, что мотив полипептида IL31, который связывает CDR антитела M14, представляет собой: PSDX1X2KI, где X1 и X2 являются переменными (SEQ ID NO:45).
[00172] Таблица 3
Пример 10: М14 специфически связывается с IL31 других видов, содержащих в эпитопе мотив PSDX1X2KI
[00173] Мотив эпитопа IL31, распознаваемый M14 (PSDX1X2KI; SEQ ID NO:45), отсутствует в аминокислотных последовательностях IL31 человека (SEQ ID NO:46) или мыши (SEQ ID NO:61). Тем не менее, этот мотив был идентифицирован у нескольких других видов, включая кошачьих:
Felis catus (XP_011286140.1; SEQ ID NO:28)
Odobenus rosmarus divergens (XP_004395998.1; SEQ ID NO:47)
Papio Anubis (XP_003907358.1; SEQ ID NO:49)
Ursus maritimus (XP_008687166.1; SEQ ID NO:51)
Leptonychotes weddellii (XP_006746595.1; SEQ ID NO:52)
Panthera tigris altaica (XP_007079636.1; SEQ ID NO:53)
Acinonyx jubatus (XP_014919275.1; SEQ ID NO:54)
Macaca flavicularis (EHH66805.1; SEQ ID NO:55)
Macaca mulatta (EHH21279.1; SEQ ID NO:56)
Mandrillus leucophaeus (XP_011819882.1; SEQ ID NO:57)
Chlorocebus sabaeus (XP_008003211.1; SEQ ID NO:58)
Cercocebus atys (XP_011926625.1; SEQ ID NO:59)
Rhinopithecus roxellana (XP_010366647.1; SEQ ID NO:60)
[00174] IL31 моржа (SEQ ID NO:47) и IL31 оливкового бабуина (SEQ ID NO:49) имеют эпитоп PSDX1X2KI (SEQ ID NO:45), который может распознаваться антителом M14. Для облегчения очистки белка добавляли С–концевую His–метку к IL31 моржа (SEQ ID NO:48) и IL31 оливкового бабуина (SEQ ID NO:50). Вестерн–блот анализ подтвердил, что М14 связывается с IL31 моржа (фиг. 13). Антитело М14 или его производные могут быть использованы в качестве терапевтических и диагностических агентов для IL31–индуцированного заболевания у любого из перечисленных выше видов.
Пример 11. Термостабильность канинизированного антитела М14.
[00175] Термостабильность канинизированного антитела М14 сравнивали с коммерчески доступным анти–IL31 антителом Zoetis' CYTOPOINTТМ в широком диапазоне рН с использованием дифференциальной сканирующей флуоресценции (DSF). Температура плавления (Tm) каждого антитела при различных значениях pH приведена ниже в таблице 4. Выполняли замену буфера как для CYTOPOINTТМ, так и для канинизированных антител M14 на буфер для анализа, указанный в таблице 4, с помощью колонки PD MinitrapTM G–25 (GE Healthcare). Tm каждого антитела оценивали, используя один и тот же буфер и концентрацию белка. Канинизированное M14 антитело показало улучшенную термостабильность по сравнению с CYTOPOINTТМ в широком диапазоне pH. Кроме того, в условиях стресса, таких как содержание при 55°C в течение 2 дней при концентрации антитела 0,22 мг/мл, CYTOPOINTТМ выпадал в осадок, в то время как в случае канинизированного антитела M14 не наблюдалось никаких осадков.
[00176] Таблица 4
Пример 12. Буферные составы для канинизированных антител M14.
[00177] Анализировали термостабильность канинизированного антитела М14 в различных буферных составах. Рассматривали буферы, содержащие фосфат натрия, ацетат натрия или L–гистидин. Другие переменные состава включали: различные значения pH (pH 5,2, 5,5, 6,0, 6,5 и 7,0), различные концентрации хлорида натрия (50 мМ и 140 мМ), различные полисорбаты (полисорбат 20 и полисорбат 80) и различные антибактериальные агенты (м–крезол и метилпарабен). Температуру плавления (Tm) канинизированного антитела М14 в каждом буфере измеряли методом дифференциальной сканирующей флуоресценции (DSF) при температуре от 20 до 95°С. В таблице 5 приведены значения Tm для канинизированного антитела М14 в различных протестированных буферах.
[00178] Таблица 5
(Tm °C)
140 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 6,0
м–крезол (0,2%)
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 6,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 6,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 6,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 7,0
м–крезол (0,2%)
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 7,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 7,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 7,0
0,2% м–крезол
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 5,2
м–крезол (0,2%)
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 5,2
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 5,2
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 5,2
0,2% м–крезол
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 5,5
м–крезол (0,2%)
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 5,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 5,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 5,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 6,5
м–крезол (0,2%)
Метилпарабен 0,9 мг/мл
140 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 6,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 80 (0,05 мг/мл)
pH 6,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
50 мМ хлорид натрия
Полисорбат 20 (0,05 мг/мл)
pH 6,5
0,2% м–крезол
Метилпарабен 0,9 мг/мл
* Отсутствие пика указывает на то, что четкой точки плавления не наблюдалось.
[00179] Методом DSF также протестировали Tm составов D1, D2, D3, D4, D5 и D6 в присутствии одного из следующих сахаров (1%): сахароза, трегалоза, D–маннит, мальтоза и сорбит.
[00180] Составы с сахарами и без сахаров также испытывали в условиях стресса: 1 день при 40°C, затем 1 день при 45°C, затем 4 дня при 55°C. Для выявления и количественного определения мономерной и агрегированной форм антител в различных составах после воздействия стрессовых условий использовали метод эксклюзионной ВЭЖХ. Образец загружали на колонку SHODEXTM KW803 (8 мм х 300 мм) и прикрепляли к защитной колонке KW–G. Хроматографическую систему Agilent 1100 использовали с 2X PBS (270 мМ NaCl, 5,4 мМ KCl, 8,6 мМ Na2PO4), pH 7,2 в качестве рабочего буфера при постоянной скорости потока 0,5 мл/мин. Колонку калибровали с помощью стандарта для гель–фильтрации BIORAD (№ по каталогу 151–1901), состоящего из тироглобулина, бычьего γ–глобулина, куриного овальбумина, миоглобина лошади и витамина B12 (молекулярная масса 1350–670,000). Количество мономерного антитела, оставшегося в растворе, определяли путем измерения УФ–поглощения при 214 или 280 нм и вычисления площади пика под кривой.
[00181] Согласно результатам анализа DSF и ВЭЖХ, составы, содержащие L–гистидин, хлорид натрия, полисорбат 80 и имеющие рН от 5,0 до 6,2, такие как составы D1, D2, D3, D4, D6, D7, D10 и D12, оказались более предпочтительными. Например, составы, предпочтительные для однократного дозирования, представляют собой: 20 мМ L–гистидин; 140 мМ хлорид натрия; полисорбат 80 (0,05 мг/мл); рН 5,5. Составы, предпочтительные для многократного введения (в присутствии консервантов) являются следующими:
1. 20 мМ L–гистидин; 140 мМ хлорид натрия; Полисорбат 80 (0,05 мг/мл); сахароза (1–3%); м–крезол (0,2%); рН 5,5; и
2. 20 мМ L–гистидин; 140 мМ хлорид натрия; Полисорбат 80 (0,05 мг/мл); трегалоза (1–3%); метилпарабен (0,9%); рН 5,5.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КИНДРЕД БАЙОСАЙЕНСИЗ, ИНК.
<120> АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ
<130> 01157-0007-01PCT
<140> PCT/US18/17623
<141> 2018-02-09
<150> US 62/463,543
<151> 2017-02-24
<150> PCT/US2017/023788
<151> 2017-03-23
<160> 89
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(9)
<223> Аминокислотная последовательность CDR-H1 вариабельной тяжелой цепи
клонов M14, M18 и M19 мышиного антитела
<400> 1
Gly Asp Ser Ile Thr Ser Gly Tyr Trp
1 5
<210> 2
<211> 16
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(16)
<223> Аминокислотная последовательность CDR-H2 вариабельной тяжелой цепи
клонов M14 и M19 мышиного антитела
<400> 2
Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 3
<211> 12
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(12)
<223> Аминокислотная последовательность CDR-H3 вариабельной тяжелой цепи
клонов M14, M18 и M19 мышиного антитела
<400> 3
Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr
1 5 10
<210> 4
<211> 25
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(25)
<223> Аминокислотная последовательность HC-FR1 каркасного участка
вариабельной области тяжелой цепи клона M14 мышиного антитела
<400> 4
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr
20 25
<210> 5
<211> 15
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(15)
<223> Аминокислотная последовательность HC-FR2 каркасного участка
вариабельной области тяжелой цепи клона M14 мышиного антитела
<400> 5
Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met Gly
1 5 10 15
<210> 6
<211> 30
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(30)
<223> Аминокислотная последовательность HC-FR3 каркасного участка
вариабельной области тяжелой цепи клона M14 мышиного антитела
<400> 6
Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu Gln
1 5 10 15
Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
20 25 30
<210> 7
<211> 11
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(11)
<223> Аминокислотная последовательность HC-FR4 каркасного участка
вариабельной области тяжелой цепи клона M14 мышиного антитела
<400> 7
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
1 5 10
<210> 8
<211> 15
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(15)
<223> Аминокислотная последовательность CDR-L1 вариабельной тяжелой цепи
клонов M14 и M19 мышиного антитела
<400> 8
Arg Ala Ser Glu Ser Val Asp Thr Tyr Gly Asn Ser Phe Met His
1 5 10 15
<210> 9
<211> 7
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(7)
<223> Аминокислотная последовательность CDR-L2 вариабельной тяжелой цепи
клонов M14, М18 и M19 мышиного антитела
<400> 9
Arg Ala Ser Asn Leu Glu Ser
1 5
<210> 10
<211> 9
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(9)
<223> Аминокислотная последовательность CDR-L3 вариабельной тяжелой цепи
клонов M14, М18 и M19 мышиного антитела
<400> 10
Gln Gln Ser Tyr Glu Asp Pro Trp Thr
1 5
<210> 11
<211> 23
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(23)
<223> Аминокислотная последовательность LC-FR1 каркасного участка
вариабельной области легкой цепи клона M14 мышиного антитела
<400> 11
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys
20
<210> 12
<211> 15
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(15)
<223> Аминокислотная последовательность LC-FR2 каркасного участка
вариабельной области легкой цепи клона M14 мышиного антитела
<400> 12
Trp Tyr Gln Gln Lys Ser Gly Gln Ser Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 13
<211> 32
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(32)
<223> Аминокислотная последовательность LC-FR3 каркасного участка
вариабельной области легкой цепи клона M14 мышиного антитела
<400> 13
Gly Ile Pro Ala Arg Phe Gly Gly Ser Gly Ser Arg Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Asp Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys
20 25 30
<210> 14
<211> 10
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(10)
<223> Аминокислотная последовательность LC-FR4 каркасного участка
вариабельной области легкой цепи клона M14 мышиного антитела
<400> 14
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 15
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная аминокислотная последовательность
вариабельной тяжелой цепи клона M14 мышиного антитела
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 16
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная аминокислотная последовательность
вариабельной легкой цепи клона M14 мышиного антитела
<400> 16
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Gly Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Gln Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 17
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная последовательность тяжелой цепи из
клона M14 мышиного антитела и собачьего IgG-A
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu His Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Phe Asn Glu Cys Arg Cys Thr Asp
210 215 220
Thr Pro Cys Pro Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln
260 265 270
Ile Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln
275 280 285
Ser Arg Glu Gln Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Pro Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg
305 310 315 320
Val Asn His Ile Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys
325 330 335
Ala Arg Gly Arg Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser
340 345 350
Pro Lys Glu Leu Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile
355 360 365
Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly
370 375 380
Gln Gln Glu Pro Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp
385 390 395 400
Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr
420 425 430
Leu Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 18
<211> 453
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная последовательность тяжелой цепи из
клона M14 мышиного антитела и собачьего IgG-B
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Lys Thr Lys Val Asp Lys Pro Val Pro Lys Arg Glu Asn Gly Arg Val
210 215 220
Pro Arg Pro Pro Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu
245 250 255
Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Leu Asp Pro
260 265 270
Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met
275 280 285
Gln Thr Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Asn Gly Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly
305 310 315 320
Lys Gln Phe Thr Cys Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile
325 330 335
Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val
340 345 350
Tyr Val Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser
355 360 365
Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp Val Glu
370 375 380
Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr
385 390 395 400
Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu
405 410 415
Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser
435 440 445
His Ser Pro Gly Lys
450
<210> 19
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная последовательность тяжелой цепи из
клона M14 мышиного антитела и собачьего IgG-C
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Gln Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Ile Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Val Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Thr
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Ala Lys Glu Cys Glu Cys Lys Cys
210 215 220
Asn Cys Asn Asn Cys Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala
245 250 255
Arg Thr Pro Thr Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asn
260 265 270
Pro Glu Val Gln Ile Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr
275 280 285
Ala Asn Thr Gln Pro Arg Glu Glu Gln Ser Asn Gly Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln
305 310 315 320
Phe Lys Cys Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Glu
325 330 335
Ile Ile Ser Lys Thr Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr
355 360 365
Cys Leu Val Lys Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln
370 375 380
Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro
385 390 395 400
Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val
405 410 415
Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser
435 440 445
Pro Gly Lys
450
<210> 20
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная последовательность тяжелой цепи из
клона M14 мышиного антитела и собачьего IgG-D
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Thr Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Pro Lys Glu Ser Thr Cys Lys Cys
210 215 220
Ile Ser Pro Cys Pro Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro
245 250 255
Glu Ile Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val
260 265 270
Gln Ile Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr
275 280 285
Gln Pro Arg Glu Gln Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Pro Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn His Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro
340 345 350
Ser Pro Lys Glu Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu
355 360 365
Ile Lys Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn
370 375 380
Gly Gln Pro Glu Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu
385 390 395 400
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu
420 425 430
Ala Leu Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly
435 440 445
Lys
<210> 21
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: канинизированная последовательность легкой цепи из
клона M14 мышиного антитела и собачьей константной области легкой цепи
<400> 21
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Gly Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Gln Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Asn Asp Ala Gln Pro Ala Val Tyr Leu Phe Gln Pro Ser Pro Asp Gln
115 120 125
Leu His Thr Gly Ser Ala Ser Val Val Cys Leu Leu Asn Ser Phe Tyr
130 135 140
Pro Lys Asp Ile Asn Val Lys Trp Lys Val Asp Gly Val Ile Gln Asp
145 150 155 160
Thr Gly Ile Gln Glu Ser Val Thr Glu Gln Asp Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Leu Ser His
180 185 190
Glu Leu Tyr Ser Cys Glu Ile Thr His Lys Ser Leu Pro Ser Thr Leu
195 200 205
Ile Lys Ser Phe Gln Arg Ser Glu Cys Gln Arg Val Asp
210 215 220
<210> 22
<211> 159
<212> Белок
<213> Неизвестный
<220>
<223> Canidae sp.
<220>
<221> misc_feature
<222> (1)..(159)
<223> Аминокислотная последовательность собачьего IL31
<400> 22
Met Leu Ser His Thr Gly Pro Ser Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Ser Met Glu Thr Leu Leu Ser Ser His Met Ala Pro Thr His Gln Leu
20 25 30
Pro Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Arg Gly Leu Leu Glu Asp Tyr Gln Lys Lys Glu Thr Gly Val Pro Glu
50 55 60
Ser Asn Arg Thr Leu Leu Leu Cys Leu Thr Ser Asp Ser Gln Pro Pro
65 70 75 80
Arg Leu Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu Ser Val Phe Lys Ser Leu Asn Ser Gly Pro Gln
145 150 155
<210> 23
<211> 17
<212> Белок
<213> Неизвестный
<220>
<223> Canidae sp.
<220>
<221> misc_feature
<222> (1)..(17)
<223> Эпитоп собачьего IL31
<400> 23
Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser Arg
1 5 10 15
Gly
<210> 24
<211> 111
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(111)
<223> Аминокислотная последовательность вариабельной легкой цепи клона M14
мышиного антитела
<400> 24
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Ser Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Gly Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 118
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> misc_feature
<222> (1)..(118)
<223> Аминокислотная последовательность вариабельной тяжелой цепи клона M14
мышиного антитела
<400> 25
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 26
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: химерная вариабельная легкая цепь клона М14 мышиного
антитела и собачья константная область легкой цепи
<400> 26
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Ser Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Gly Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Asn Asp Ala Gln Pro Ala Val Tyr Leu Phe Gln Pro Ser Pro Asp Gln
115 120 125
Leu His Thr Gly Ser Ala Ser Val Val Cys Leu Leu Asn Ser Phe Tyr
130 135 140
Pro Lys Asp Ile Asn Val Lys Trp Lys Val Asp Gly Val Ile Gln Asp
145 150 155 160
Thr Gly Ile Gln Glu Ser Val Thr Glu Gln Asp Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Leu Ser His
180 185 190
Glu Leu Tyr Ser Cys Glu Ile Thr His Lys Ser Leu Pro Ser Thr Leu
195 200 205
Ile Lys Ser Phe Gln Arg Ser Glu Cys Gln Arg Val Asp
210 215 220
<210> 27
<211> 453
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: химерная вариабельная тяжелая цепь клона М14 мышиного
антитела и собачьего IgG-B
<400> 27
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Lys Thr Lys Val Asp Lys Pro Val Pro Lys Arg Glu Asn Gly Arg Val
210 215 220
Pro Arg Pro Pro Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu
245 250 255
Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Leu Asp Pro
260 265 270
Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met
275 280 285
Gln Thr Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Asn Gly Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly
305 310 315 320
Lys Gln Phe Thr Cys Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile
325 330 335
Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val
340 345 350
Tyr Val Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser
355 360 365
Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp Val Glu
370 375 380
Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr
385 390 395 400
Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu
405 410 415
Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser
435 440 445
His Ser Pro Gly Lys
450
<210> 28
<211> 159
<212> Белок
<213> Felis catus
<220>
<221> misc_feature
<222> (1)..(159)
<223> Аминокислотная последовательность кошачьего IL31 NCBI ref:
XP_011286140.1 [felis catus]
<400> 28
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Cys Met Glu Thr Leu Leu Pro Ser His Met Ala Pro Ala His Arg Leu
20 25 30
Gln Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Arg Pro Met Ser
35 40 45
Lys Gly Leu Leu Gln Asp Tyr Leu Lys Lys Glu Ile Gly Leu Pro Glu
50 55 60
Ser Asn His Ser Ser Leu Pro Cys Leu Ser Ser Asp Ser Gln Leu Pro
65 70 75 80
His Ile Asn Gly Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Thr Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln Arg Glu Pro Glu Ala Lys Val Ser Met Pro Ala Asp
115 120 125
Asn Phe Glu Arg Lys Asn Phe Ile Leu Ala Val Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu His Val Leu Gln Ser Leu Asn Ser Gly Pro Gln
145 150 155
<210> 29
<211> 209
<212> Белок
<213> Equus caballus
<220>
<221> misc_feature
<222> (1)..(209)
<223> Аминокислотная последовательность лошадиного IL31
<400> 29
Met Val Ser His Ile Gly Ser Thr Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Thr Leu Met Phe Ser His Thr Gly Pro Ile Tyr Gln Leu
20 25 30
Gln Pro Lys Glu Ile Gln Ala Ile Ile Val Glu Leu Gln Asn Leu Ser
35 40 45
Lys Lys Leu Leu Asp Asp Tyr Leu Asn Lys Glu Lys Gly Val Gln Lys
50 55 60
Phe Asp Ser Asp Leu Pro Ser Cys Phe Thr Ser Asp Ser Gln Ala Pro
65 70 75 80
Gly Asn Ile Asn Ser Ser Ala Ile Leu Pro Tyr Phe Lys Ala Ile Ser
85 90 95
Pro Ser Leu Asn Asn Asp Lys Ser Leu Tyr Ile Ile Glu Gln Leu Asp
100 105 110
Lys Leu Asn Phe Gln Asn Ala Pro Glu Thr Glu Val Ser Met Pro Thr
115 120 125
Asp Asn Phe Glu Arg Lys Arg Phe Ile Leu Thr Ile Leu Arg Trp Phe
130 135 140
Ser Asn Cys Leu Glu Leu Ala Met Lys Thr Leu Thr Thr Ala Glu Gln
145 150 155 160
Ala Leu Pro Pro Leu Asp Pro Ser Thr Pro His Ala Gly Ala Val Ala
165 170 175
Leu Thr His His Gln Gln Asp Arg Thr Ala Leu Asp Arg Ala Val Phe
180 185 190
Pro Phe Val Trp Ala Ala Pro Arg Gly Gly Glu Val Gly Asp Gly Gly
195 200 205
His
<210> 30
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: химерная вариабельная легкая цепь клона М14 мышиного
антитела и кошачья константная область легкой цепи
<400> 30
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Ser Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Gly Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Ser Asp Ala Gln Pro Ser Val Phe Leu Phe Gln Pro Ser Leu Asp Glu
115 120 125
Leu His Thr Gly Ser Ala Ser Ile Val Cys Ile Leu Asn Asp Phe Tyr
130 135 140
Pro Lys Glu Val Asn Val Lys Trp Lys Val Asp Gly Val Val Gln Asn
145 150 155 160
Lys Gly Ile Gln Glu Ser Thr Thr Glu Gln Asn Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Gln Ser
180 185 190
His Glu Lys Phe Ser Cys Glu Val Thr His Lys Ser Leu Ala Ser Thr
195 200 205
Leu Val Lys Ser Phe Asn Arg Ser Glu Cys Gln Arg Glu
210 215 220
<210> 31
<211> 453
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: химерная вариабельная тяжелая цепь клона М14 мышиного
антитела и кошачья константная область тяжелойцепи
<400> 31
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Thr Thr Ser Gly Ala Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Leu Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ala Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Leu Ser Asp Thr Phe Thr Cys Asn Val Ala His Pro Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Arg Lys Thr Asp His Pro Pro Gly
210 215 220
Pro Lys Pro Cys Asp Cys Pro Lys Cys Pro Pro Pro Glu Met Leu Gly
225 230 235 240
Gly Pro Ser Ile Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Ser
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Leu Val Val Asp Leu Gly Pro
260 265 270
Asp Asp Ser Asp Val Gln Ile Thr Trp Phe Val Asp Asn Thr Gln Val
275 280 285
Tyr Thr Ala Lys Thr Ser Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Pro Ile Leu His Gln Asp Trp Leu Lys Gly
305 310 315 320
Lys Glu Phe Lys Cys Lys Val Asn Ser Lys Ser Leu Pro Ser Pro Ile
325 330 335
Glu Arg Thr Ile Ser Lys Ala Lys Gly Gln Pro His Glu Pro Gln Val
340 345 350
Tyr Val Leu Pro Pro Ala Gln Glu Glu Leu Ser Arg Asn Lys Val Ser
355 360 365
Val Thr Cys Leu Ile Lys Ser Phe His Pro Pro Asp Ile Ala Val Glu
370 375 380
Trp Glu Ile Thr Gly Gln Pro Glu Pro Glu Asn Asn Tyr Arg Thr Thr
385 390 395 400
Pro Pro Gln Leu Asp Ser Asp Gly Thr Tyr Phe Val Tyr Ser Lys Leu
405 410 415
Ser Val Asp Arg Ser His Trp Gln Arg Gly Asn Thr Tyr Thr Cys Ser
420 425 430
Val Ser His Glu Ala Leu His Ser His His Thr Gln Lys Ser Leu Thr
435 440 445
Gln Ser Pro Gly Lys
450
<210> 32
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: кошачья последовательность вариабельной легкой цепи
клона M14 мышиного антитела
<400> 32
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Pro Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 33
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: фелинизированная последовательность вариабельной
тяжелой цепи клона M14 мышиного антитела
<400> 33
Asp Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Val
35 40 45
Ala Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Leu Asn Asn Leu Lys Ala Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 34
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: фелинизированная последовательность легкой цепи клона
M14 мышиного антитела
<400> 34
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Pro Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Ser Asp Ala Gln Pro Ser Val Phe Leu Phe Gln Pro Ser Leu Asp Glu
115 120 125
Leu His Thr Gly Ser Ala Ser Ile Val Cys Ile Leu Asn Asp Phe Tyr
130 135 140
Pro Lys Glu Val Asn Val Lys Trp Lys Val Asp Gly Val Val Gln Asn
145 150 155 160
Lys Gly Ile Gln Glu Ser Thr Thr Glu Gln Asn Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Gln Ser
180 185 190
His Glu Lys Phe Ser Cys Glu Val Thr His Lys Ser Leu Ala Ser Thr
195 200 205
Leu Val Lys Ser Phe Asn Arg Ser Glu Cys Gln Arg Glu
210 215 220
<210> 35
<211> 453
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая: фелинизированная последовательность тяжелой цепи клона
M14 мышиного антитела
<400> 35
Asp Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Val
35 40 45
Ala Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Leu Asn Asn Leu Lys Ala Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Thr Thr Ser Gly Ala Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Leu Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ala Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Leu Ser Asp Thr Phe Thr Cys Asn Val Ala His Pro Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Arg Lys Thr Asp His Pro Pro Gly
210 215 220
Pro Lys Pro Cys Asp Cys Pro Lys Cys Pro Pro Pro Glu Met Leu Gly
225 230 235 240
Gly Pro Ser Ile Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Ser
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Leu Val Val Asp Leu Gly Pro
260 265 270
Asp Asp Ser Asp Val Gln Ile Thr Trp Phe Val Asp Asn Thr Gln Val
275 280 285
Tyr Thr Ala Lys Thr Ser Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Pro Ile Leu His Gln Asp Trp Leu Lys Gly
305 310 315 320
Lys Glu Phe Lys Cys Lys Val Asn Ser Lys Ser Leu Pro Ser Pro Ile
325 330 335
Glu Arg Thr Ile Ser Lys Ala Lys Gly Gln Pro His Glu Pro Gln Val
340 345 350
Tyr Val Leu Pro Pro Ala Gln Glu Glu Leu Ser Arg Asn Lys Val Ser
355 360 365
Val Thr Cys Leu Ile Lys Ser Phe His Pro Pro Asp Ile Ala Val Glu
370 375 380
Trp Glu Ile Thr Gly Gln Pro Glu Pro Glu Asn Asn Tyr Arg Thr Thr
385 390 395 400
Pro Pro Gln Leu Asp Ser Asp Gly Thr Tyr Phe Val Tyr Ser Lys Leu
405 410 415
Ser Val Asp Arg Ser His Trp Gln Arg Gly Asn Thr Tyr Thr Cys Ser
420 425 430
Val Ser His Glu Ala Leu His Ser His His Thr Gln Lys Ser Leu Thr
435 440 445
Gln Ser Pro Gly Lys
450
<210> 36
<211> 238
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(238)
<223> Аминокислотная последовательность легкой цепи клона М14 мышиного
антитела
<400> 36
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
35 40 45
Val Asp Thr Tyr Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Ser
50 55 60
Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Gly Gly Ser Gly Ser Arg Thr Asp Phe Thr
85 90 95
Leu Thr Ile Asp Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Tyr Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
165 170 175
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp
195 200 205
Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr
210 215 220
Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 37
<211> 238
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(238)
<223> Аминокислотная последовательность легкой цепи клона М18 мышиного
антитела
<400> 37
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Pro Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
35 40 45
Val Asp Thr Tyr Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
85 90 95
Leu Thr Ile Asn Pro Val Glu Thr Asp Asp Val Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Tyr Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
165 170 175
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp
195 200 205
Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr
210 215 220
Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 38
<211> 238
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(238)
<223> Аминокислотная последовательность легкой цепи клона М19 мышиного
антитела
<400> 38
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
35 40 45
Val Asp Thr Tyr Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
85 90 95
Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Ile Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Tyr Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
165 170 175
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp
195 200 205
Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr
210 215 220
Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 39
<211> 238
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(238)
<223> Аминокислотная последовательность легкой цепи клона М87 мышиного
антитела
<400> 39
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Tyr Arg Ala Ser Lys Ser
35 40 45
Val Ser Thr Ser Gly Tyr Ser Tyr Met His Trp Asn Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Arg Leu Leu Ile Tyr Leu Val Ser Asn Leu Glu Ser
65 70 75 80
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys
100 105 110
Gln His Ile Arg Glu Leu Thr Arg Ser Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
165 170 175
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp
195 200 205
Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr
210 215 220
Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 40
<211> 152
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(152)
<223> Аминокислотная последовательность вариабельной и шарнирной областей
тяжелой цепи клона M14 мышиного антитела
<400> 40
Met Ala Val Leu Gly Leu Leu Leu Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile
35 40 45
Thr Ser Gly Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu
50 55 60
Glu Tyr Met Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala Pro Gly Ser
145 150
<210> 41
<211> 152
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(152)
<223> Аминокислотная последовательность вариабельной и шарнирной областей
тяжелой цепи клона M18 мышиного антитела
<400> 41
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile
35 40 45
Thr Ser Gly Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu
50 55 60
Glu Tyr Met Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala Pro Gly Ser
145 150
<210> 42
<211> 152
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(152)
<223> Аминокислотная последовательность вариабельной и шарнирной областей
тяжелой цепи клона M19 мышиного антитела
<400> 42
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile
35 40 45
Thr Ser Gly Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Glu Leu
50 55 60
Glu Tyr Met Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Tyr Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Phe Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala Pro Gly Ser
145 150
<210> 43
<211> 154
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(154)
<223> Аминокислотная последовательность вариабельной и шарнирной областей
тяжелой цепи клона M87 мышиного антитела
<400> 43
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Asn Trp Val Arg Gln Pro Pro Gly Lys Ala Leu
50 55 60
Glu Trp Leu Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu
65 70 75 80
Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Gln Ser Ile Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Ser
100 105 110
Ala Thr Tyr Tyr Cys Ala Arg Asp Tyr Tyr Gly Ser Cys Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro
130 135 140
Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
145 150
<210> 44
<211> 137
<212> Белок
<213> Неизвестный
<220>
<223> Canidae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(137)
<223> Аминокислотная последовательность зрелого собачьего IL31
<400> 44
Ser Ser His Met Ala Pro Thr His Gln Leu Pro Pro Ser Asp Val Arg
1 5 10 15
Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser Arg Gly Leu Leu Glu Asp
20 25 30
Tyr Gln Lys Lys Glu Thr Gly Val Pro Glu Ser Asn Arg Thr Leu Leu
35 40 45
Leu Cys Leu Thr Ser Asp Ser Gln Pro Pro Arg Leu Asn Ser Ser Ala
50 55 60
Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile
65 70 75 80
Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu
85 90 95
Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser
100 105 110
Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Cys Leu Glu Ser Val
115 120 125
Phe Lys Ser Leu Asn Ser Gly Pro Gln
130 135
<210> 45
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> IL31 epitope
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X является любой аминокислотой; или X является гидрофобной
аминокислотой, или X выбран из A, V, I и L, или X выбран из V и I
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X является любой аминокислотой; или X является гидрофобной
аминокислотой, или X выбран из A, R, K, Q и N; или X выбран из R и Q
<400> 45
Pro Ser Asp Xaa Xaa Lys Ile
1 5
<210> 46
<211> 164
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(164)
<223> Аминокислотная последовательность предшественника человеческого IL31
NCBI ref: NP_001014358.1
<400> 46
Met Ala Ser His Ser Gly Pro Ser Thr Ser Val Leu Phe Leu Phe Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Ala Ser His Thr Leu Pro Val Arg Leu Leu
20 25 30
Arg Pro Ser Asp Asp Val Gln Lys Ile Val Glu Glu Leu Gln Ser Leu
35 40 45
Ser Lys Met Leu Leu Lys Asp Val Glu Glu Glu Lys Gly Val Leu Val
50 55 60
Ser Gln Asn Tyr Thr Leu Pro Cys Leu Ser Pro Asp Ala Gln Pro Pro
65 70 75 80
Asn Asn Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg
85 90 95
Gln Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp
100 105 110
Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr
115 120 125
Asp Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe
130 135 140
Ser Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln
145 150 155 160
Gln Ala Thr Thr
<210> 47
<211> 177
<212> Белок
<213> Odobenus rosmarus divergens
<220>
<221> MISC_FEATURE
<222> (1)..(177)
<223> Предсказанная аминокислотная последовательность IL31 моржа NCBI ref:
XP_004395998.1 [odobeus rosmarus divergens]
<400> 47
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Phe Met Gly Thr Ser Leu Thr Ser Gln Thr Ala Pro Ile His Gln Leu
20 25 30
His Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Lys Gly Leu Leu Glu Asp Tyr Leu Lys Lys Glu Met Gly Val Pro Glu
50 55 60
Ser Asn His Phe Leu Leu Pro Cys Leu Thr Ser Asp Ser Gln Pro Pro
65 70 75 80
Arg Ile Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Thr Ile Asn Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Val Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Ser Lys Ser Phe Ile Leu Ala Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Asp His Val Phe Lys Ser Leu Asn Pro Gly Pro Gln Gln
145 150 155 160
Val Met Gln Gly His Leu Ile Glu Pro Ile Pro Ser Gly Thr Ala Asp
165 170 175
Val
<210> 48
<211> 187
<212> Белок
<213> Odobenus rosmarus divergens
<220>
<221> MISC_FEATURE
<222> (1)..(187)
<223> Walrus_IL31_His6
<400> 48
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Phe Met Gly Thr Ser Leu Thr Ser Gln Thr Ala Pro Ile His Gln Leu
20 25 30
His Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Lys Gly Leu Leu Glu Asp Tyr Leu Lys Lys Glu Met Gly Val Pro Glu
50 55 60
Ser Asn His Phe Leu Leu Pro Cys Leu Thr Ser Asp Ser Gln Pro Pro
65 70 75 80
Arg Ile Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Thr Ile Asn Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Val Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Ser Lys Ser Phe Ile Leu Ala Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Asp His Val Phe Lys Ser Leu Asn Pro Gly Pro Gln Gln
145 150 155 160
Val Met Gln Gly His Leu Ile Glu Pro Ile Pro Ser Gly Thr Ala Asp
165 170 175
Val Gly Ser Gly Ser His His His His His His
180 185
<210> 49
<211> 163
<212> Белок
<213> Papio anubis
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 оливкового
бабуина NCBI ref: XP_003907358.1 [papio anubis]
<400> 49
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Glu
85 90 95
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 50
<211> 173
<212> Белок
<213> Papio anubis
<220>
<221> MISC_FEATURE
<222> (1)..(173)
<223> Olive baboon_IL31_His6
<400> 50
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Glu
85 90 95
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr Gly Ser Gly Ser His His His His His His
165 170
<210> 51
<211> 159
<212> Белок
<213> Ursus maritimus
<220>
<221> MISC_FEATURE
<222> (1)..(159)
<223> Предсказанная аминокислотная последовательность IL31 полярного медведя
NCBI ref: XP_008687166.1 [ursus maritimus]
<400> 51
Met Leu Ser Arg Ala Val Pro Ala Gly Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Tyr Met Glu Thr Leu Leu Thr Ser His Thr Ala Pro Thr His Arg Leu
20 25 30
Pro Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Lys Gly Leu Leu Glu Asp Tyr Leu Lys Lys Glu Thr Gly Leu Pro Glu
50 55 60
Ser Asn His Ser Leu Val Pro Cys Leu Thr Ser Asp Ser Glu Ala Pro
65 70 75 80
His Ile Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Val Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Val Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Gly Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu Arg Val Phe Lys Ser Leu Asn Pro Gly Ala Gln
145 150 155
<210> 52
<211> 185
<212> Белок
<213> Ursus maritimus
<220>
<221> MISC_FEATURE
<222> (1)..(185)
<223> Предсказанная аминокислотная последовательность IL31 тюленя Уэддела
NCBI ref: XP_006746595.1 [leptonychotes weddellii]
<400> 52
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Phe Met Glu Thr Ser Leu Thr Ser Gln Thr Val Pro Ile His Gln Leu
20 25 30
Gln Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Lys Gly Leu Leu Glu Asp Tyr Leu Lys Lys Glu Met Gly Val Pro Glu
50 55 60
Ser Asn His Phe Leu Leu Pro Cys Leu Thr Ser Asp Ser Gln Pro Pro
65 70 75 80
Arg Ile Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Ile Ile Asn Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Val Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Ser Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Gly His Val Leu Lys Ser Leu Asn Pro Gly Pro Gln Gln
145 150 155 160
Val Met Gln Gly His Leu Ala Lys Pro Ile Pro Ser Gly Thr Ala Asp
165 170 175
Met Tyr Glu Thr Leu Arg His His His
180 185
<210> 53
<211> 159
<212> Белок
<213> Panthera tigris altaica
<220>
<221> MISC_FEATURE
<222> (1)..(159)
<223> Предсказанная аминокислотная последовательность IL31 амурского тигра
NCBI ref: XP_007079636.1 [panther tigris altaica]
<400> 53
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Cys Met Glu Thr Leu Leu Pro Ser His Met Ala Pro Thr His Arg Leu
20 25 30
Gln Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Arg Pro Met Ser
35 40 45
Lys Gly Leu Leu Gln Asp Tyr Leu Lys Lys Glu Met Gly Leu Pro Glu
50 55 60
Ser Asn His Ser Ser Leu Pro Cys Leu Ser Ser Asp Ser Gln Leu Pro
65 70 75 80
His Ile Asn Gly Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Thr Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln Arg Glu Pro Glu Ala Glu Val Ser Met Pro Ala Asp
115 120 125
Asn Phe Glu Arg Lys Asn Phe Ile Leu Ala Val Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu His Val Leu Gln Ser Leu Asn Ser Gly Pro Gln
145 150 155
<210> 54
<211> 159
<212> Белок
<213> Acinonyx jubatus
<220>
<221> MISC_FEATURE
<222> (1)..(159)
<223> Предсказанная аминокислотная последовательность IL31 гепарда NCBI ref:
XP_014919275.1 [acinonyx jubatus]
<400> 54
Met Leu Ser His Ala Gly Pro Ala Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Cys Met Glu Thr Leu Leu Pro Ser His Met Ala Pro Thr His Arg Leu
20 25 30
Gln Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Arg Pro Met Ser
35 40 45
Lys Gly Leu Leu Gln Asp Tyr Leu Lys Lys Glu Met Gly Leu Pro Glu
50 55 60
Ser Asn His Ser Ser Leu Pro Cys Leu Ser Ser Asp Ser Gln Leu Pro
65 70 75 80
His Ile Asn Gly Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Thr Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln Arg Glu Pro Glu Ala Glu Val Ser Met Pro Ala Asp
115 120 125
Asn Phe Glu Arg Lys Asn Phe Ile Leu Ala Val Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu His Val Leu Gln Ser Leu Asn Ser Gly Ser Gln
145 150 155
<210> 55
<211> 163
<212> Белок
<213> Macaca fascicularis
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 макака крабоеда
GenBank ref: EHH66805.1 [macaca fascicularis]
<400> 55
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln
85 90 95
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 56
<211> 158
<212> Белок
<213> Macaca mulatta
<220>
<221> MISC_FEATURE
<222> (1)..(158)
<223> Предсказанная аминокислотная последовательность IL31 макака резус
(частичная) GenBank ref: EHH21279.1 [macaca mulatta]
<400> 56
Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys Cys Leu Gly Gly Trp
1 5 10 15
Leu Thr Ser His Thr Leu Pro Val His Phe Leu Gln Pro Ser Asp Ile
20 25 30
Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser Lys Met Leu Leu Lys
35 40 45
Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser Gln Asn Tyr Thr Leu
50 55 60
Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn Ile Ile His Ser Pro
65 70 75 80
Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln Leu Asp Asn Lys Ser
85 90 95
Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys Leu Ile Phe Gln Asp
100 105 110
Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp Thr His Glu Cys Lys
115 120 125
Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser Glu Cys Met Asp Leu
130 135 140
Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln Ala Thr Thr
145 150 155
<210> 57
<211> 163
<212> Белок
<213> Mandrillus leucophaeus
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 дрила NCBI ref:
XP_011819882.1 [mandrillus leucophaeus]
<400> 57
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Lys Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln
85 90 95
Leu Asp Asn Arg Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 58
<211> 163
<212> Белок
<213> Chlorocebus sabaeus
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 зеленой мартышки
NCBI ref: XP_008003211.1 [chlorocebus sabaeus]
<400> 58
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Lys Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln
85 90 95
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 59
<211> 163
<212> Белок
<213> Cercocebus atys
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 дымчатого
альбатроса NCBI ref: XP_011926625.1 [cercocebus atys]
<400> 59
Met Ala Ser His Ser Gly Pro Ala Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Gln Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Lys Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln
85 90 95
Leu Asp Asn Arg Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 60
<211> 163
<212> Белок
<213> Rhinopithecus roxellana
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Предсказанная аминокислотная последовательность IL31 золотистой
курносой обезьяны NCBI ref: XP_010366647.1 [rhinopithecus roxellana]
<400> 60
Met Ala Ser His Ser Gly Pro Thr Thr Ser Val Leu Phe Leu Leu Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Thr Ser His Thr Leu Pro Val His Phe Leu
20 25 30
Arg Pro Ser Asp Ile Gln Lys Ile Val Glu Glu Leu Gln Ser Leu Ser
35 40 45
Lys Met Leu Leu Lys Asp Val Glu Glu Asp Lys Gly Val Leu Val Ser
50 55 60
Gln Asn Tyr Thr Leu Pro Cys Leu Thr Pro Asp Ala Gln Pro Pro Asn
65 70 75 80
Ile Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln
85 90 95
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
100 105 110
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
115 120 125
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
130 135 140
Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln Gln
145 150 155 160
Ala Thr Thr
<210> 61
<211> 163
<212> Белок
<213> Mus musculus
<220>
<221> MISC_FEATURE
<222> (1)..(163)
<223> Аминоксилотная последовательность предшественника IL31 мышиного NCBI
ref: NP_083870 [mus musculus]
<400> 61
Met Ile Phe His Thr Gly Thr Thr Lys Pro Thr Leu Val Leu Leu Cys
1 5 10 15
Cys Ile Gly Thr Trp Leu Ala Thr Cys Ser Leu Ser Phe Gly Ala Pro
20 25 30
Ile Ser Lys Glu Asp Leu Arg Thr Thr Ile Asp Leu Leu Lys Gln Glu
35 40 45
Ser Gln Asp Leu Tyr Asn Asn Tyr Ser Ile Lys Gln Ala Ser Gly Met
50 55 60
Ser Ala Asp Glu Ser Ile Gln Leu Pro Cys Phe Ser Leu Asp Arg Glu
65 70 75 80
Ala Leu Thr Asn Ile Ser Val Ile Ile Ala His Leu Glu Lys Val Lys
85 90 95
Val Leu Ser Glu Asn Thr Val Asp Thr Ser Trp Val Ile Arg Trp Leu
100 105 110
Thr Asn Ile Ser Cys Phe Asn Pro Leu Asn Leu Asn Ile Ser Val Pro
115 120 125
Gly Asn Thr Asp Glu Ser Tyr Asp Cys Lys Val Phe Val Leu Thr Val
130 135 140
Leu Lys Gln Phe Ser Asn Cys Met Ala Glu Leu Gln Ala Lys Asp Asn
145 150 155 160
Thr Thr Cys
<210> 62
<211> 16
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> Аминоксилотная последовательность CDR-H2 вариабельной тяжелой цепи
клона M18 мышиного антитела
<400> 62
Tyr Ile Ser Tyr Ser Gly Ile Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 63
<211> 15
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(15)
<223> Аминоксилотная последовательность CDR-L1 вариабельной легкой цепи
клона M18 мышиного антитела
<400> 63
Arg Ala Ser Glu Ser Val Asp Thr Tyr Gly Asn Ser Phe Ile His
1 5 10 15
<210> 64
<211> 131
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(131)
<223> Аминоксилотная последовательность вариабельной легкой цепи клона M18
мышиного антитела
<400> 64
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Pro Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
35 40 45
Val Asp Thr Tyr Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Ser Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
85 90 95
Leu Thr Ile Asn Pro Val Glu Thr Asp Asp Val Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Tyr Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys
130
<210> 65
<211> 131
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(131)
<223> Аминоксилотная последовательность вариабельной легкой цепи клона M19
мышиного антитела
<400> 65
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser
35 40 45
Val Asp Thr Tyr Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser
65 70 75 80
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr
85 90 95
Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Ile Ala Thr Tyr Tyr Cys
100 105 110
Gln Gln Ser Tyr Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys
130
<210> 66
<211> 131
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(131)
<223> Аминоксилотная последовательность вариабельной легкой цепи клона M87
мышиного антитела
<400> 66
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala
20 25 30
Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Tyr Arg Ala Ser Lys Ser
35 40 45
Val Ser Thr Ser Gly Tyr Ser Tyr Met His Trp Asn Gln Gln Lys Pro
50 55 60
Gly Gln Pro Pro Arg Leu Leu Ile Tyr Leu Val Ser Asn Leu Glu Ser
65 70 75 80
Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys
100 105 110
Gln His Ile Arg Glu Leu Thr Arg Ser Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys
130
<210> 67
<211> 137
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(137)
<223> Аминоксилотная последовательность вариабельной тяжелой цепи клона M18
мышиного антитела
<400> 67
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile
35 40 45
Thr Ser Gly Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu
50 55 60
Glu Tyr Met Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser
130 135
<210> 68
<211> 137
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(137)
<223> Аминоксилотная последовательность вариабельной тяжелой цепи клона M19
мышиного антитела
<400> 68
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile
35 40 45
Thr Ser Gly Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Glu Leu
50 55 60
Glu Tyr Met Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Tyr Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Phe Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Arg Tyr Gly Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser
130 135
<210> 69
<211> 139
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(139)
<223> Аминоксилотная последовательность вариабельной тяжелой цепи клона M87
мышиного антитела
<400> 69
Met Ala Val Leu Gly Leu Leu Phe Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Asn Trp Val Arg Gln Pro Pro Gly Lys Ala Leu
50 55 60
Glu Trp Leu Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu
65 70 75 80
Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Gln Ser Ile Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Ser
100 105 110
Ala Thr Tyr Tyr Cys Ala Arg Asp Tyr Tyr Gly Ser Cys Phe Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
130 135
<210> 70
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный HC-FR1 M14
<400> 70
Glu Val Gln Leu Val Glu Ser Gly Pro Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr
20 25
<210> 71
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный HC-FR2 M14
<400> 71
Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met Gly
1 5 10 15
<210> 72
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный HC-FR3 M14
<400> 72
Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu Gln
1 5 10 15
Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
20 25 30
<210> 73
<211> 36
<212> Белок
<213> Искусственная последовательность
<220>
<223> Альтернативный канинизированный HC-FR3 M14
<400> 73
Asn Pro Ser Leu Lys Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys
1 5 10 15
Asn Gln Tyr Tyr Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala
20 25 30
Thr Tyr Tyr Cys
35
<210> 74
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный HC-FR4 M14
<400> 74
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 75
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный LC-FR1 M14
<400> 75
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys
20
<210> 76
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный LC-FR2 M14
<400> 76
Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 77
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный LC-FR3 M14
<400> 77
Gly Ile Pro Ala Arg Phe Gly Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Asp Pro Val Gln Ala Asp Asp Val Ala Thr Tyr Tyr Cys
20 25 30
<210> 78
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Канинизированный LC-FR4 M14
<400> 78
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 79
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный HC-FR1 M14
<400> 79
Asp Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Thr Cys Ser Val Thr
20 25
<210> 80
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный HC-FR2 M14
<400> 80
Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Val Ala
1 5 10 15
<210> 81
<211> 37
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный HC-FR3 M14
<400> 81
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys
1 5 10 15
Asn Thr Leu Tyr Leu Gln Leu Asn Asn Leu Lys Ala Glu Asp Thr Ala
20 25 30
Thr Tyr Tyr Cys Ala
35
<210> 82
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный HC-FR4 M14
<400> 82
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 83
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный LC-FR1 M14
<400> 83
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Pro Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys
20
<210> 84
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный LC-FR2 M14
<400> 84
Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 85
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный LC-FR3 M14
<400> 85
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 86
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Фелинизированный LC-FR4 M14
<400> 86
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 87
<211> 10
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> Альтернативная аминокислотная последовательность CDR-H2 вариабельной
тяжелой цепи клона M18 мышиного антитела
<400> 87
Tyr Ile Ser Tyr Ser Gly Ile Thr Tyr Tyr
1 5 10
<210> 88
<211> 7
<212> Белок
<213> Неизвестный
<220>
<223> Canidae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> Альтернативный эпитоп собачьего IL31
<400> 88
Pro Ser Asp Val Arg Lys Ile
1 5
<210> 89
<211> 10
<212> Белок
<213> Неизвестный
<220>
<223> Murinae sp.
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> Альтернативная аминокислотная последовательность CDR-H2 вариабельной
тяжелой цепи клонов M14 и M19 мышиного антитела
<400> 89
Tyr Ile Ser Tyr Ser Gly Ile Thr Asp Tyr
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С НЕОНАТАЛЬНЫМ FC-РЕЦЕПТОРОМ (FCRN) ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2830231C2 |
| МОДИФИЦИРОВАННАЯ КОНСТАНТНАЯ ОБЛАСТЬ АНТИТЕЛА | 2023 |
|
RU2837820C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2743464C2 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
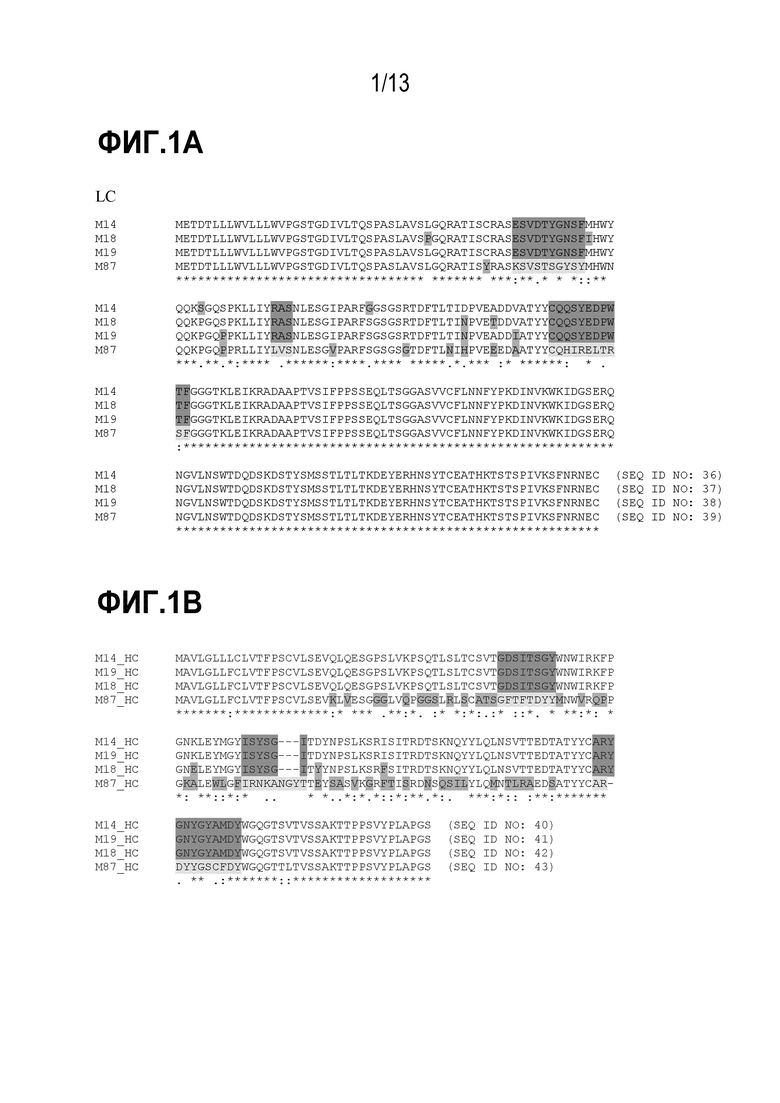
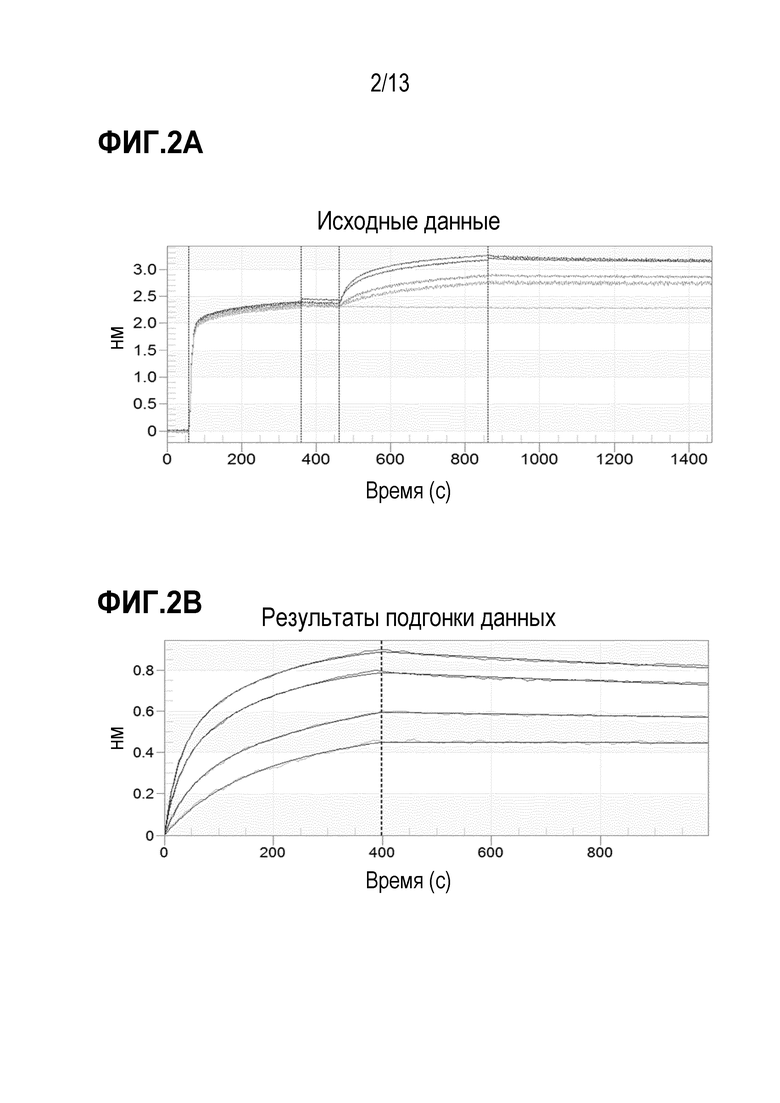
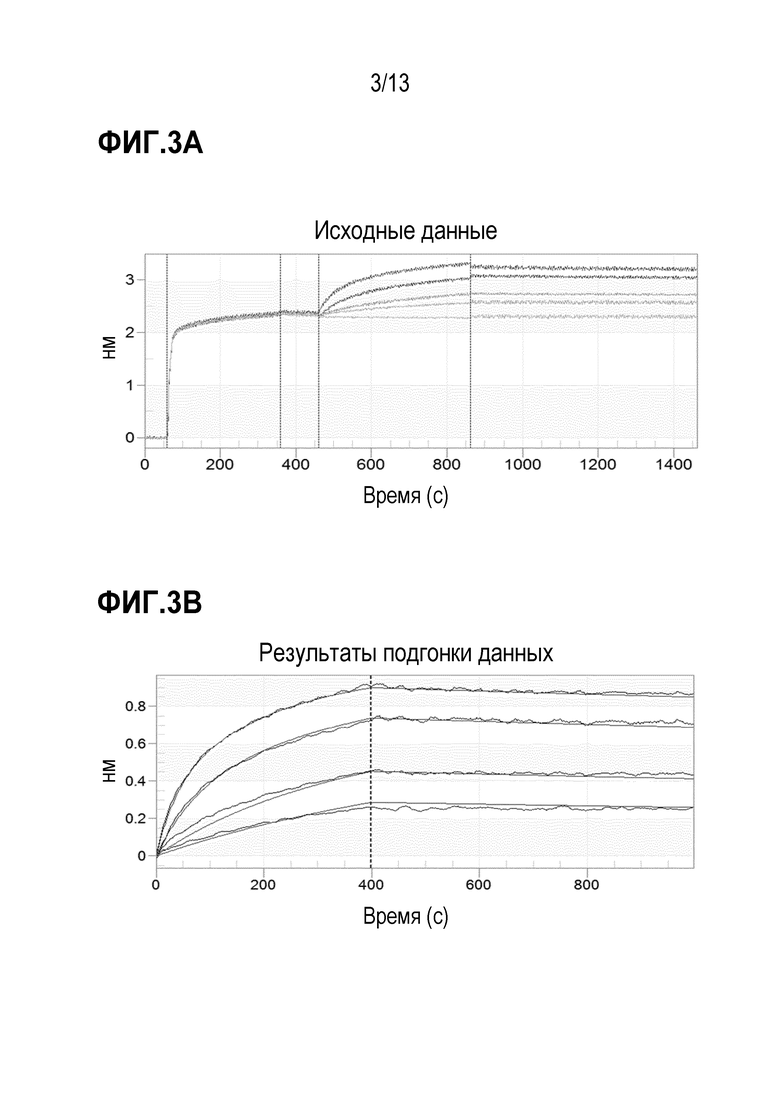

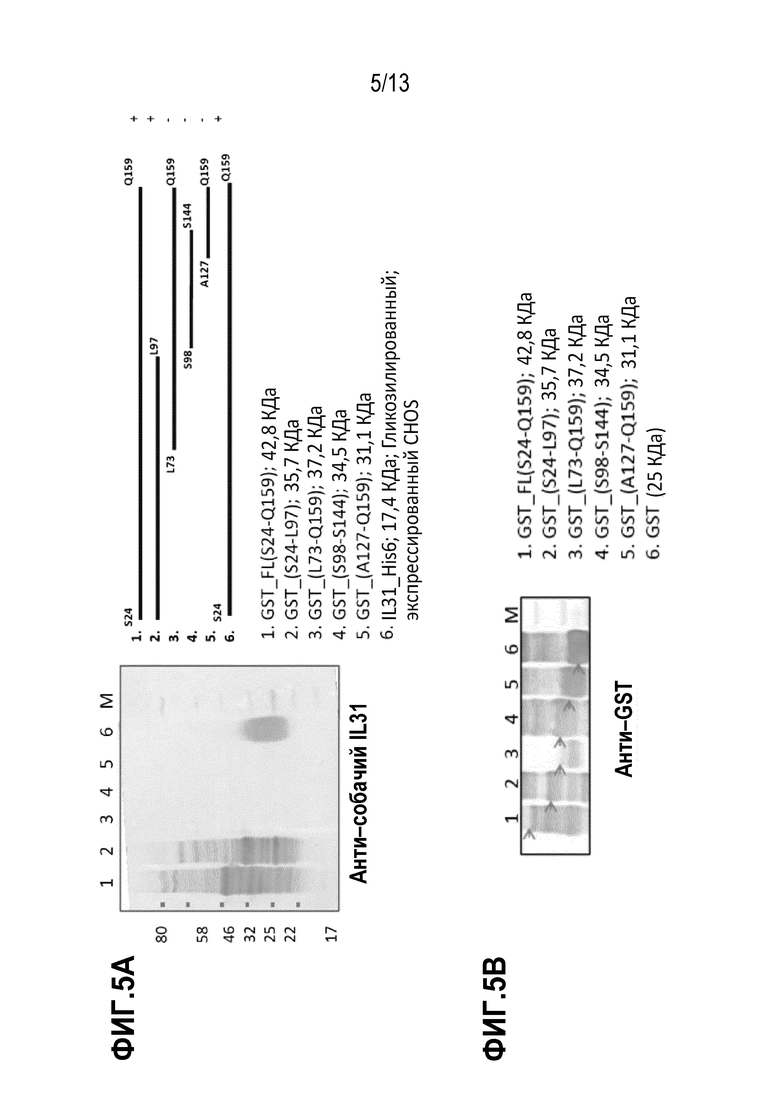
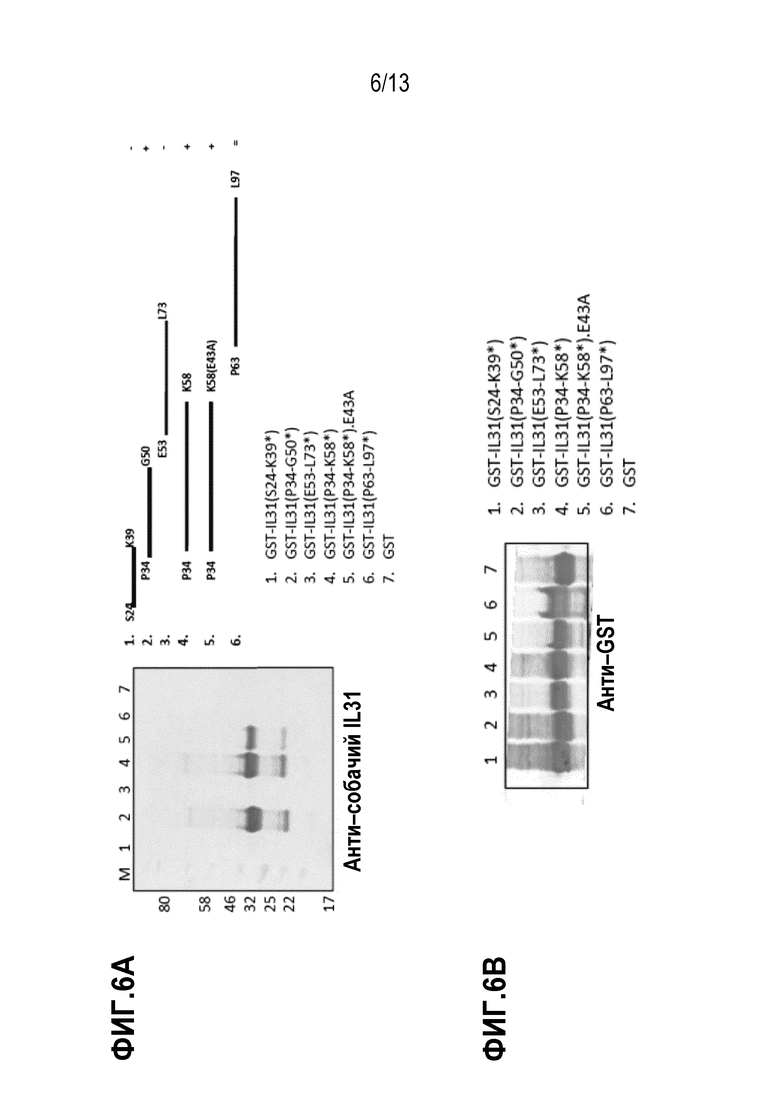
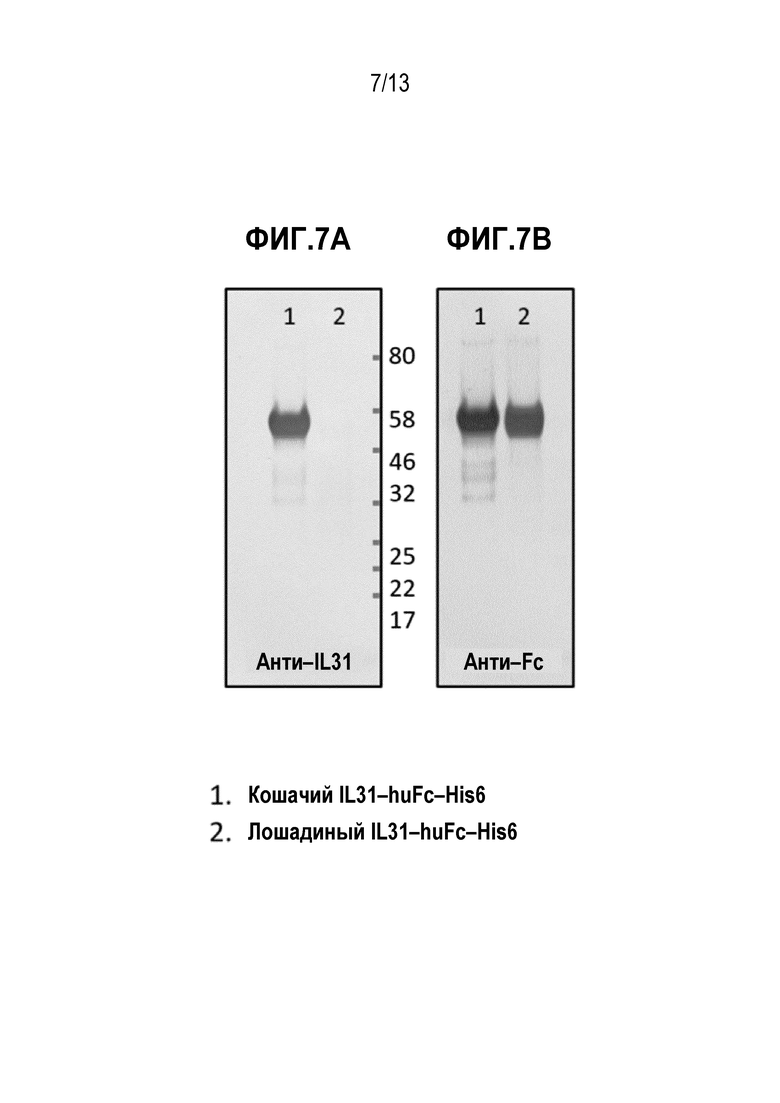
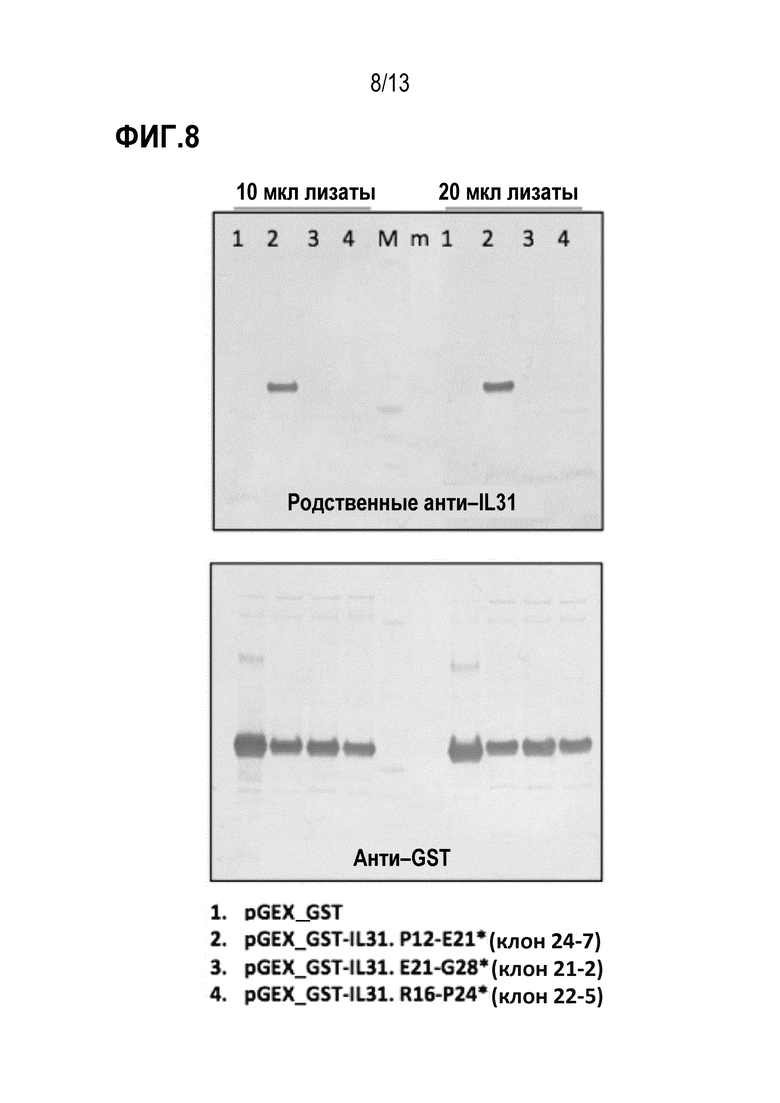
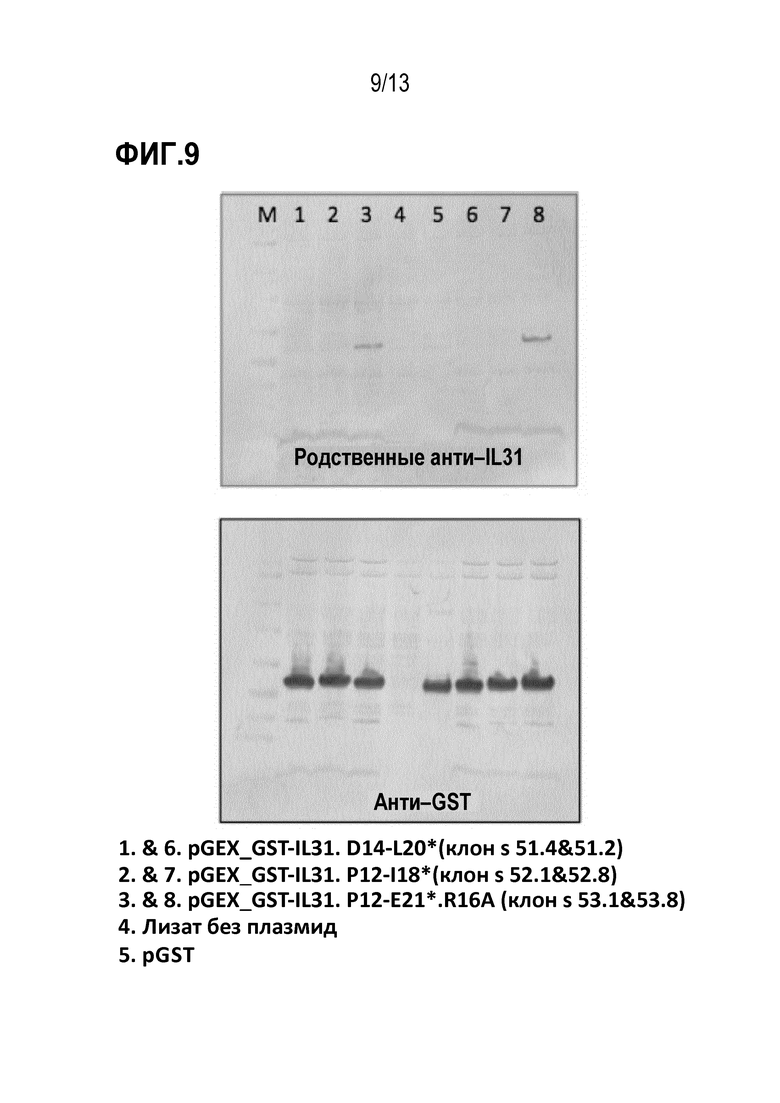
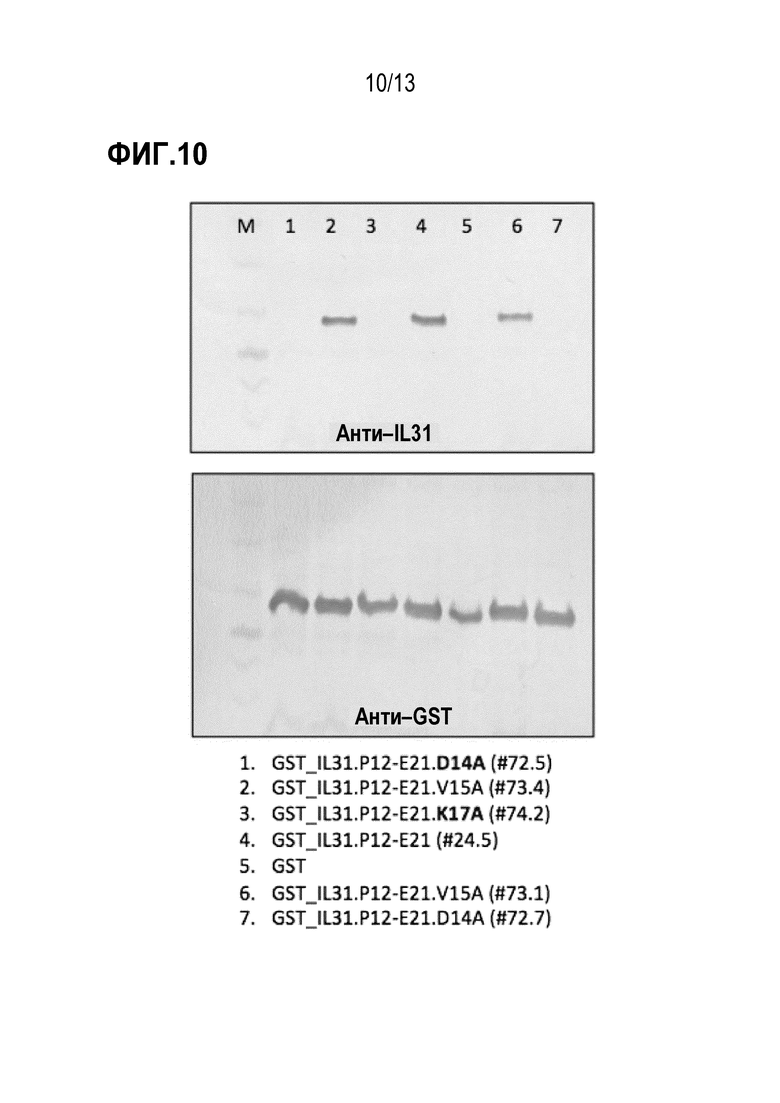
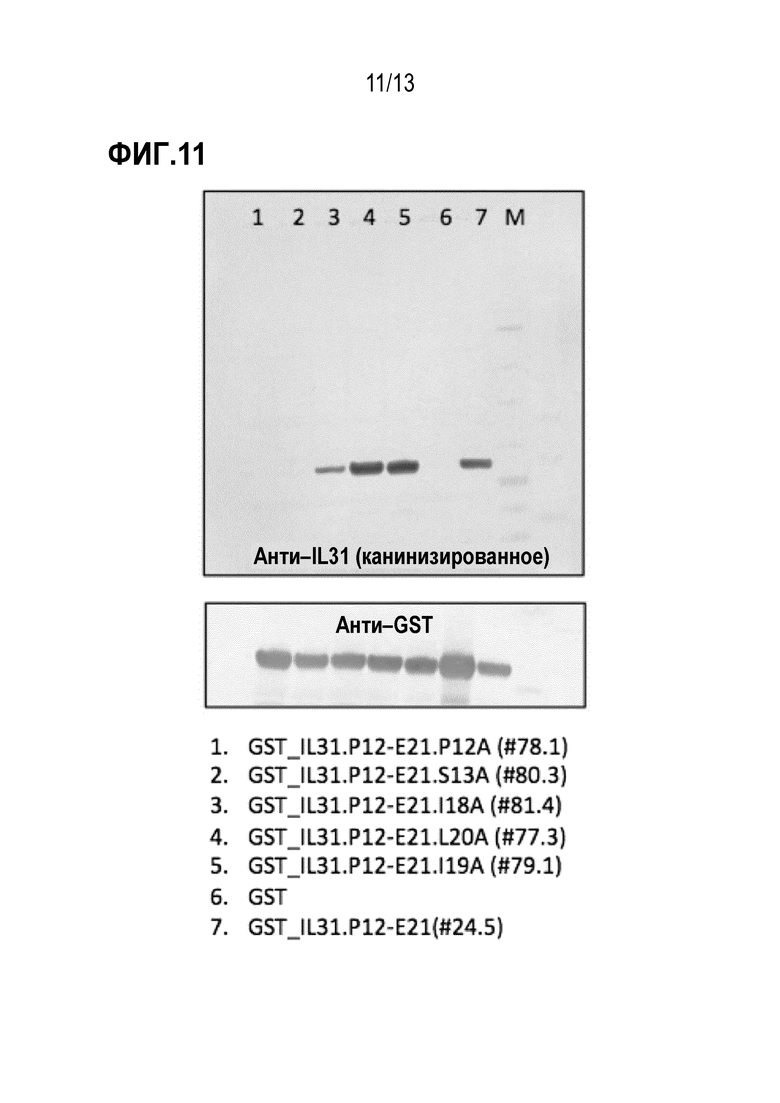
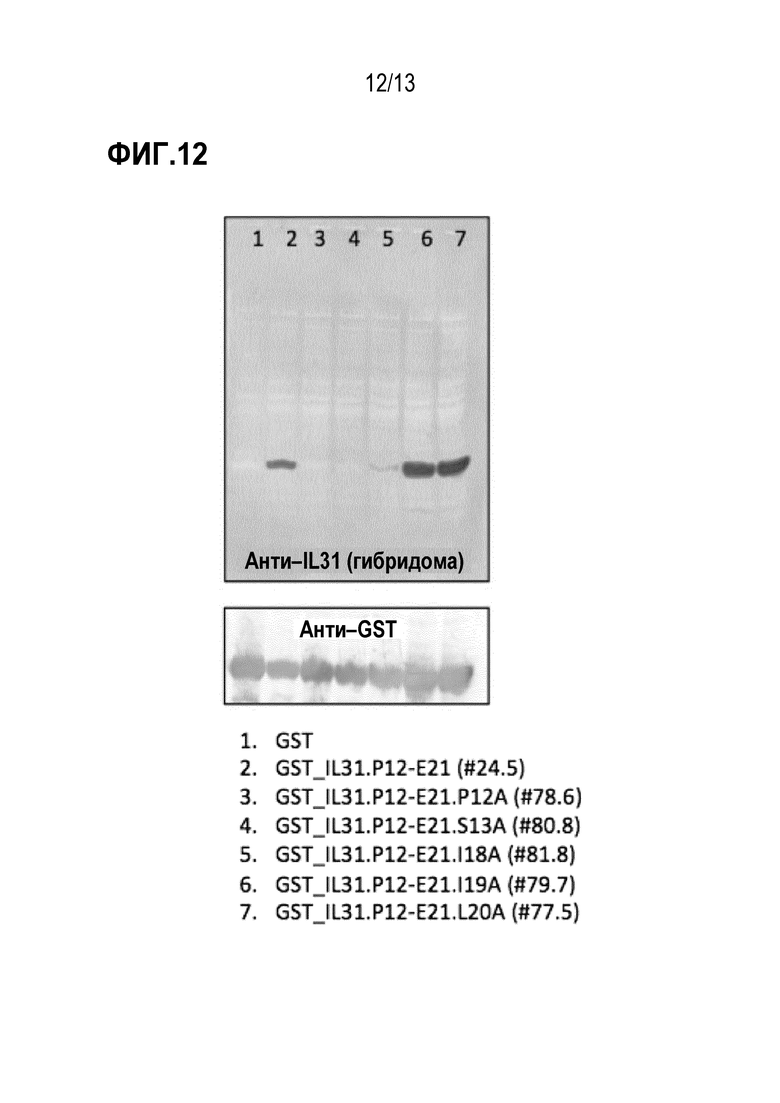
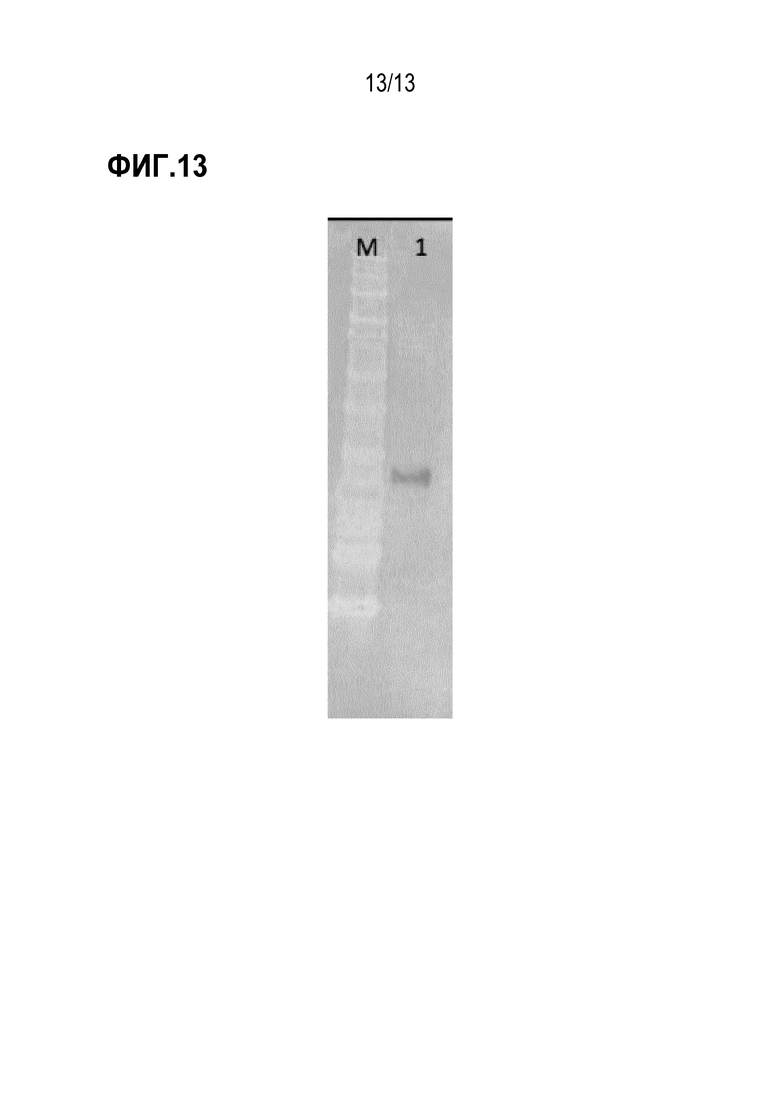
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению антитела или выделенного фрагмента антитела, которые связываются с собачьим IL31, и может быть использовано в ветеринарии для лечения IL31-индуцированного состояния. Изобретение позволяет получить антитело или выделенный фрагмент антитела, способный связываться с IL31 и снижать сигнальную функцию IL31 в клетках. 8 н. и 45 з.п. ф-лы, 13 ил., 5 табл., 12 пр.
1. Выделенное антитело или выделенный фрагмент антитела, которые связываются с собачьим IL31, содержащие:
а) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1;
CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; и
CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3, и
b) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 8;
CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 9; и
CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 10.
2. Антитело или фрагмент антитела по п.1, где антитело или фрагмент антитела связываются с аминокислотной последовательностью PSDX1X2KI (SEQ ID NO: 45), где X представляет собой любой аминокислотный остаток.
3. Антитело или фрагмент антитела по п.1 или 2, где антитело или фрагмент антитела связываются с собачьим IL31 с константой диссоциации (Kd), равной менее 5×10–6 М, менее 1×10–6 М, менее 5×10–7 М, менее 1×10–7 М, менее 5×10–8 М, менее 1×10–8 М, менее 5×10–9 М, менее 1×10–9 М, менее 5×10–10 М, менее 1×10–10 М, менее 5×10–11 М, менее 1×10–11 М, менее 5×10–12 М или менее 1×10–12 М, как измерено методом бислойной интерферометрии.
4. Антитело или фрагмент антитела по любому из предыдущих пунктов, где антитело или фрагмент антитела снижает сигнальную функцию IL31 у вида, относящегося к животному-компаньону, как измерено по снижению фосфорилирования STAT–3.
5. Антитело или фрагмент антитела по п.4, где видом, относящимся к животному-компаньону, является вид псовых, кошачьих или лошадиных.
6. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела связывают с кошачьим IL31 или лошадиным IL31, как определено анализом иммуноблот и/или бислойной интерферометрией.
7. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела конкурируют с моноклональным антителом М14 за связывание с собачьим IL31.
8. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела конкурируют с моноклональным антителом М14 за связывание с кошачьим IL31.
9. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела не связываются с IL31 человека, как определено анализом иммуноблота и/или бислойной интерферометрией.
10. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело представляет собой моноклональное антитело.
11. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела являются канинизированными, фелинизированными, эквинизированными или химерными.
12. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело представляет собой химерное антитело, содержащее мышиные каркасные участки вариабельной тяжелой цепи или мышиные каркасные участки вариабельной легкой цепи.
13. Антитело или фрагмент антитела по любому из предшествующих пунктов, дополнительно содержащие одну или более из:
(а) последовательности каркасного участка 1 вариабельной области тяжелой цепи (HC–FR1) SEQ ID NO: 4, 70 или 79;
(b) последовательности HC–FR2 SEQ ID NO: 5, 71 или 80;
(c) последовательности HC–FR3 SEQ ID NO: 6, 73 или 81;
(d) последовательности HC–FR4 SEQ ID NO: 7, 74 или 82;
(e) последовательности каркасного участка 1 вариабельной области легкой цепи (LC–FR1) SEQ ID NO: 11, 75 или 83;
(f) последовательности LC–FR2 SEQ ID NO: 12, 76 или 84;
(g) последовательности LC–FR3 SEQ ID NO: 13, 77 или 85; или
(h) последовательности LC–FR4 SEQ ID NO: 14, 78 или 86.
14. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие:
a) (i) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 24;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 25; или
(iii) вариабельную область легкой цепи, определенную в (i), и вариабельную область тяжелой цепи, определенную в (ii); или
b) (i) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 16;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 15; или
(iii) вариабельную область легкой цепи, определенную в (i), и вариабельную область тяжелой цепи, определенную в (ii); или
c)(i) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 32;
(ii) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 33; или
(iii) вариабельную область легкой цепи, определенную в (i), и вариабельную область тяжелой цепи, определенную в (ii).
15. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 24; SEQ ID NO: 16; или SEQ ID NO: 32.
16. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 25; SEQ ID NO: 15; или SEQ ID NO: 33.
17. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:24, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 25;
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 16, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 15; или
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:32, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 33.
18. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие константную область тяжелой цепи или константную область легкой цепи, полученную от животного-компаньона.
19. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие
(а) собачью константную область тяжелой цепи, выбранную из константных областей IgG–A, IgG–B, IgG–C и IgG–D;
(b) кошачью константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2a и IgG2b; или
(c) лошадиную константную область тяжелой цепи, выбранную из константных областей IgG1, IgG2, IgG3, IgG4, IgG5, IgG6 и IgG7.
20. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие:
а)(i) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 26;
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 27; или
(iii) легкую цепь, определенную в (i), и тяжелую цепь, определенную в (ii); или
b)(i) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 30;
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31; или
(iii) легкую цепь, определенную в (i), и тяжелую цепь, определенную в (ii); или
c) (i) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 34;
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 35; или
(iii) легкую цепь, определенную в (i), и тяжелую цепь, определенную в (ii).
21. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 21.
22. Антитело или фрагмент антитела по любому из предшествующих пунктов, содержащие тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; или SEQ ID NO: 20.
23. Антитело или фрагмент антитела по любому из предшествующих пунктов, где фрагмент антитела выбран из Fv, scFv, Fab, Fab', F(ab')2 и Fab’–SH.
24. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела является биспецифическим,
где антитело или фрагмент антитела связывается с IL31 и c одним или более антигенами, выбранными из IL17, TNFα, CD20, CD19, CD25, IL4, IL13, IL23, IgE, CD11α, IL6R, α4–интегрина, IL12, IL1β или BlyS.
25. Выделенная нуклеиновая кислота, кодирующая антитело или фрагмент антитела по любому из пп.1–24.
26. Клетка–хозяин для получения анти-IL31 антитела или фрагмента антитела, где клетка содержит нуклеиновую кислоту по п.25.
27. Способ получения антитела или фрагмента антитела, включающий культивирование клетки–хозяина по п.26 и выделение антитела или фрагмента антитела.
28. Фармацевтическая композиция для лечения IL31-опосредованного состояния, где композиция содержит антитело или фрагмент антитела по любому из пп.1–24 и фармацевтически приемлемый носитель.
29. Фармацевтическая композиция по п.28,
где фармацевтически приемлемый носитель включает L–гистидин, хлорид натрия и полисорбат 80 и
где фармацевтическая композиция имеет рН от 5,0 до 6,2.
30. Фармацевтическая композиция по п.29, где рН фармацевтической композиции составляет от 5,0 до 6,0, или от 5,3 до 5,7, или равно 5,5.
31. Фармацевтическая композиция по п.29 или 30, где в фармацевтической композиции находится L–гистидин в концентрации от 5 до 100 мМ, от 10 до 50 мМ, от 20 до 30 мМ, от 10 до 30 мМ или 20 мМ.
32. Фармацевтическая композиция по любому из пп.29–31, где в фармацевтической композиции находится хлорид натрия в концентрации от 80 до 200 мМ, от 100 до 175 мМ, от 120 до 150 мМ или 140 мМ.
33. Фармацевтическая композиция по любому из пп.29–32, где в фармацевтической композиции находится полисорбат 80 в концентрации от 0,005 до 0,5 мг/мл, от 0,01 до 0,1 мг/мл или равна 0,05 мг/мл.
34. Фармацевтическая композиция по любому из пп.29–33, где фармацевтически приемлемый носитель включает по меньшей мере один сахар.
35. Фармацевтическая композиция по п.34, где в фармацевтической композиции находится сахар в концентрации от 0,5 до 20%, от 1 до 10%, от 1 до 5% или от 1 до 3%.
36. Фармацевтическая композиция по любому из пп.29–35, где фармацевтически приемлемый носитель включает сахарозу, трегалозу, D–маннит, мальтозу и/или сорбит.
37. Фармацевтическая композиция по любому из пп.29–36, где фармацевтическая композиция содержит антибактериальный агент.
38. Фармацевтическая композиция по любому из пп.29–37, где фармацевтическая композиция содержит м–крезол или метилпарабен.
39. Фармацевтическая композиция по любому из пп.29–38, где фармацевтическая композиция содержит 0,2% м–крезол и/или 0,9% метилпарабен.
40. Способ лечения IL31–индуцированного состояния у вида, относящегося к животному-компаньону,
где способ включает введение виду, относящемуся к животному-компаньону, терапевтически эффективного количества антитела или фрагмента антитела по любому из пп.1–24 или фармацевтической композиции по любому из пп.28-39.
41. Способ по п.40, где вид, относящийся к животному-компаньону, представляет собой вид псовых, кошачьих или лошадиных.
42. Способ по п.40 или 41, где IL31–индуцированное состояние представляет собой зуд или аллергическое состояние.
43. Способ по любому из пп.40-42, где IL31–индуцированное состояние выбрано из атопического дерматита, зуда, астмы, псориаза, склеродермии и экземы.
44. Способ по любому из пп.40-43, где антитело или фрагмент антитела или фармацевтическую композицию вводят парентерально.
45. Способ по любому из пп.40-44, где антитело или фрагмент антитела или фармацевтическую композицию вводят внутримышечным, внутрибрюшинным, интрацереброспинальным, подкожным, внутриартериальным, интрасиновиальным, интратекальным путем или путем ингаляции.
46. Способ по любому из пп.40–45, где способ включает введение антитела или фрагмента антитела или фармацевтической композиции в комбинации с ингибитором Jak, ингибитором PI3K, ингибитором AKT или ингибитором MAPK.
47. Способ по любому из пп.40–46, где способ включает введение антитела или фрагмента антитела или фармацевтической композиции в комбинации с одним или более антителами, выбранными из анти–IL17 антитела, анти–TNFα антитела, анти–CD20 антитела, анти–CD19 антитела, анти–CD25 антитела, анти–IL4 антитела, анти–IL13 антитела, анти–IL23 антитела, анти–IgE антитела, анти–CD11α антитела, анти–IL6R антитела, антитела к α4–интегрину, анти–IL12 антитела, анти–IL1β антитела и анти–BlyS антитела.
48. Способ снижения сигнальной функции IL31 в клетке, включающий воздействие на клетку антителом или фрагментом антитела по любому из пп.1–24 или фармацевтической композицией по любому из пп.28–39 в условиях, при которых возможно связывание антитела или фрагмента антитела с внеклеточным IL31, тем самым снижая связывание с рецептором IL31 и/или снижая сигнальную функцию IL31 в клетке.
49. Способ по п.48, где клетка подвергается воздействию антитела или фрагмента антитела или фармацевтической композиции ex vivo.
50. Способ по п.48, где клетка подвергается воздействию антитела или фрагмента антитела или фармацевтической композиции in vivo.
51. Способ по любому из пп.48–50, где клетка представляет собой клетку собаки, клетку кошки или клетку лошади.
52. Способ детекции IL31 в образце, полученном из вида, относящего к животному-компаньону, включающий
приведение в контакт образца с антителом или фрагментом антитела по любому из пп.1–24 или фармацевтической композицией по любому из пп.28–39 в условиях, при которых возможно связывание анти–IL31 антитела или фрагмента антитела, и
детекцию образования комплекса антитела или фрагмента антитела и IL31 в образце.
53. Способ по п.52, где образец представляет собой биологический образец, полученный от собаки, кошки или лошади.
| US 2013022616 A1, 24.01.2013 | |||
| MICHELS G.M | |||
| et al., A blinded, randomized, placebo-controlled, dosedetermination trial of lokivetmab (ZTS-00103289),a caninized, anti-canine IL-31 monoclonal antibody inclient owned dogs with atopic dermatitis, Vet Dermatol, 2016, V | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| GONZALES A.J | |||
| et al | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
Авторы
Даты
2023-05-04—Публикация
2018-02-09—Подача