Перекрестная ссылка на родственные заявки
Настоящая заявка имеет приоритет и привилегии предварительной патентной заявкой США № 63/173,752, поданной 12 апреля 2021 г., и предварительной патентной заявки США № 63/63/190,199, поданной 18 мая 2021 г., содержание которых настоящим включено по ссылки во всей своей полноте.
Предпосылки настоящего раскрытия
Вспышка Covid-19 унесла жизни более трех миллионов человек во всем мире с момента первого случая, зарегистрированного в декабре 2019 года. В настоящее время несколько вакцин против COVID-19 для профилактики SARS-CoV-2 находятся на стадии клинических исследований, и некоторые вакцины были одобрены для медицинского применения. Хотя ряд одобренных вакцин продемонстрировали высокую эффективность, на протяжении всей пандемии COVID-19 появляются и циркулируют по всему миру генетические варианты SARS-CoV-2.
Таким образом, существует острая необходимость в усовершенствованных вакцинах против COVID-19 для лучшей профилактики новых коронавирусных инфекций и (или) для снижения тяжести опасных для жизни коронавирусных инфекций.
Краткое описание сущности настоящего раскрытия
Шиповидный белок SARS-CoV-2 в высокой степени гликозилирован. Настоящее изобретение основано на признании того факта, что иммунизация модифицированным шиповидным белком SARS-CoV-2, без гликановых экранов или менее экранированным гликанами, вызывала усиленный иммунный ответ против SARS-CoV-2 и его вызывающих беспокойство вариантов (например, альфа, гамма, дельта и омикрон) по сравнению с нативным шиповидным белком SARS-CoV-2 или его вариантом. 12 высококонсервативных эпитопов (SEQ ID: 1-12), расположенных в рецептор-связывающем домене (RBD) и в субъединице 2 (S2), включая домен гептадного повтора 2 (HR2), были идентифицированы на основе выравнивания более 6 миллионов последовательностей S белка из GISAID. Удаление гликановых экранов путем удаления N-гликанов для лучшей экспозиции этих высококонсервативных эпитопов предлагает эффективный подход к разработке защитных вакцин против SARS-CoV-2 и его вариантов широкого спектра. Удаление N-гликанов шиповидного белка может быть осуществлено методами гликоинженерии in vitro. Таким образом, сконструированный с помощью гликоинженерии шиповидный белок открывает высококонсервативные эпитопы, скрытые гликанами, и в то же время сохраняет третичную структуру шиповидного белка. Таким образом, в настоящем раскрытии предлагаются улучшенные иммуногены, вакцины и способы для более эффективной профилактики и лечения новых коронавирусных (например, SARS-CoV-2) инфекций.
Соответственно, в настоящем изобретении предлагается иммуноген, содержащий сконструированный с помощью гликоинженерии шиповидный белок коронавируса, содержащий множество усеченных N-гликанов и немодифицированных O-гликанов (например, О-связанных олигосахаридов). В соответствии с некоторыми воплощениями множество усеченных N-гликанов локализуются в рецептор-связывающем домене (RBD), тем самым открывая большое количество высококонсервативных эпитопов, имеющих аминокислотные последовательности TESIVRFPNITNL (SEQ ID NO.: 41), NITNLCPFGEVFNATR (SEQ ID NO: 42), LYNSASFSTFK (SEQ ID NO: 43), LDSKVGGNYN (SEQ ID NO: 44), KSNLKPFERDIST (SEQ ID NO: 45), KPFERDISTEIYQAG (SEQ ID NO: 46) и/или GPKKSTNLVKNKC (SEQ ID NO: 47). В соответствии с некоторыми воплощениями, множество усеченных N-гликанов локализуются в домене гептадного повтора 2 (HR2), тем самым открывая большое количество высококонсервативных эпитопов, имеющих аминокислотные последовательности NCDVVIGIVNNTVY (SEQ ID NO: 48), PELDSFKEELDKYFKNHTS (SEQ ID NO: 49), VNIQKEIDRLNEVA (SEQ ID NO: 50), NLNESLIDLQ (SEQ ID NO: 51) и/или LGKYEQYIKWP (SEQ ID NO: 52).
В соответствии с некоторыми воплощениями, множество усеченных N-гликанов локализуются в рецептор-связывающем домене (RBD) и домене гептадного повтора 2 (HR2), тем самым открывая большое количество высококонсервативных эпитопов, имеющих аминокислотные последовательности) TESIVRFPNITNL (SEQ ID NO.: 41), NITNLCPF GEVFNATR (SEQ ID NO: 42), LYNSASFSTFK (SEQ ID NO: 43), LDSKVGGNYN (SEQ ID NO: 44), KSNLKPFERDIST (SEQ ID NO: 45), KPFERDISTEIYQAG (SEQ ID NO: 46), GPKKSTNLVKNKC (SEQ ID NO: 47), NCDVVIGIVNNTVY (SEQ ID NO: 48), PELDSFKEELDKYFKNHTS (SEQ ID NO: 49), VNIQKEIDRLNEVA (SEQ ID NO: 50), NLNESLIDLQ (SEQ ID: 51) и/или LGKYEQYIKWP (SEQ ID NO: 52).
Сконструированный с помощью гликоинженерии шиповидный белок коронавируса, описанный в настоящем документе, содержит аминокислотную последовательность SEQ ID NO: 1 или ее вариант, обладающий по меньшей мере 90% идентичностью с аминокислотной последовательностью SEQ ID NO: 1, или иммунологически активный фрагмент аминокислотной последовательность или варианта.
В соответствии с некоторыми воплощениями сконструированный с помощью гликоинженерии шиповидный белок коронавируса содержит полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1, где полипептид состоит из 22 усеченных N-гликанов, каждый из которых содержит фрагмент GlcNAc.
В соответствии с некоторыми воплощениями сконструированный с помощью гликоинженерии шиповидный белок коронавируса содержит полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 2, где полипептид состоит из 21 усеченного N-гликана, каждый из которых содержит фрагмент GlcNAc.
В соответствии с некоторыми воплощениями усеченные N-гликаны представляют собой моносахариды, дисахариды или трисахариды. В соответствии с некоторыми воплощениями усеченные N-гликаны представляют собой моносахариды. В соответствии с предпочтительными воплощениями моносахариды представляют собой N-ацетилглюкозамины (GlcNAc).
В соответствии с предпочтительными воплощениями описанные здесь усеченные N-гликаны являются практически гомогенными. Термин «гомогенный» предназначен для обозначения профиля гликозилирования, представленного одним желательным видом гликанов. Используемый здесь термин «практически гомогенный» означает, что по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или по меньшей мере 99% гликопротеина, присутствующего в композиции, представлено одной желательной гликоформой (например, GlcNAc-декорированной) со следовыми количествами нежелательных гликоформ в составе композиции. Под «следовыми количествами» подразумевается, что любая данная нежелательная гликоформа, которая присутствует в композиции гликопротеина, присутствует в количестве менее 5%, предпочтительно менее 4%, менее 3%, менее 2%, менее 1% и даже менее 0,5% или даже менее 0,1% от общего количества гликопротеина.
Как описано в настоящем документе, термины «шиповидный белок», «шиповидный гликопротеин» и «шиповидный белок коронавируса» используются взаимозаменяемо. Сконструированный с помощью гликоинженерии шиповидный белок, описанный в настоящем документе, может быть получен из нативного шиповидного белка коронавируса с помощью гликоинженерии (например, гликоинженерия in vitro или in vivo). В соответствии с некоторыми воплощениями сконструированный с помощью гликоинженерии шиповидный белок получают с использованием одного или нескольких химических или ферментативных способов. В соответствии с некоторыми воплощениями сконструированный с помощью гликоинженерии шиповидный белок создается с использованием эндогликозидазы H (Endo H).
В соответствии с некоторыми воплощениями нативный шиповидный белок коронавируса, описанный в настоящем документе, представляет собой шиповидный белок коронавируса тяжелого острого респираторного синдрома 2 (SAR-CoV-2) или его вариантов. SARS-CoV-2, описанный в настоящем документе, представляет собой уханьский штамм SARS-CoV-2 (hCoV/Wuhan/WHO 1/2019). Варианты SARS-CoV-2, описанные в настоящем документе, включают, но не ограничиваются, D614G, альфа (линии B.1.1.7 и Q), бета (линии B.1.351 и потомки), гамма (линии P.1 и потомки), эпсилон (В. 1.427 и В. 1.429), эта (В. 1.525), йота (В. 1.526), каппа (В. 1.617.1), 1.617.3, мю (В. 1.621, В. 1.621.1), дзета (P.2), дельта (линии B. 1.617.2 и AY) и омикрон (линии B. 1.1.529 и BA). В соответствии с некоторыми воплощениями нативный шиповидный белок коронавируса представляет собой шиповидный белок коронавируса летучей мыши RaTG13 или его варианты.
Как описано в настоящем документе, термины «нативный шиповидный белок коронавируса», «нативный шиповидный гликопротеин коронавируса», «нативный шиповидный гликопротеин» и «нативный шиповидный белок» являются взаимозаменяемыми.
В соответствии с некоторыми воплощениями сконструированный с помощью гликоинженерии шиповидный белок, описанный в настоящем документе, присутствует в виде тримера (например, тримера в растворе). Сконструированный с помощью гликоинженерии шиповидный белок, описанный в настоящем документе, может сохранять ту же третичную структуру, что и его нативный шиповидный белок коронавируса.
Как описано в настоящем документе, сконструированный с помощью гликоинженерии шиповидный белок способен индуцировать усиленный иммунный ответ по сравнению со своим нативным шиповидным белком коронавируса. Усиленный иммунный ответ представляет собой повышенный титр IgG, повышенный титр IgM, повышенный клеточный ответ, опосредованный CD4 Т-клетками, повышенный клеточный ответ, опосредованный CD8 Т-клетками, повышенный титр нейтрализации или их сочетание.
В соответствии с другим аспектом настоящее изобретение обеспечивает иммуногенную композицию, содержащую: (а) иммуноген по настоящему раскрытию и (b) необязательно адъювант.
Как описано в настоящем документе, адъювант может включать, помимо прочего, гидроксид алюминия, фосфат алюминия, неполный адъювант Фрейнда (IFA), сквален, квасцы, алгидрогель, MF59, QS-21, CpG 1018, AS03, AS37, Matrix-M или их сочетание.
Описанный здесь коронавирус может включать SARS-CoV-2 и его варианты, а также может включать коронавирус летучих мышей RaTG13 или его варианты. В соответствии с предпочтительными воплощениями коронавирусная инфекция вызывается SARS-CoV-2 и его вариантами.
Как описано в настоящем документе, иммуногенная композиция способна вызывать усиленный иммунный ответ по сравнению с вакциной, использующей нативный шиповидный белок SAR-CoV-2, тем самым выступая в качестве улучшенной вакцины против COVID-19 для профилактики коронавирусных инфекций, вызванных SAR-CoV-2 или его вариантом.
В соответствии с другим аспектом в настоящем изобретении предлагается способ индукции иммунного ответа против SAR-CoV-2 или его вариантов у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества иммуногенной композиции по настоящему изобретению.
В соответствии с другим аспектом в настоящем изобретении предлагается способ защиты нуждающегося в этом субъекта от заражения SAR-CoV-2 или его вариантами, содержащий введение субъекту эффективного количества иммуногенной композиции по настоящему изобретению.
В соответствии с другим аспектом в настоящем изобретении предлагается способ предотвращения заражения СОVID-19 у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества иммуногенной композиции по настоящему изобретению.
В соответствии с другим аспектом в настоящем изобретении предлагается применение иммуногенной композиции по настоящему изобретению для индукции иммунного ответа против SARS-CoV-2 у нуждающегося в этом субъекта.
В соответствии с другим аспектом в настоящем изобретении предлагается применение иммуногенной композиции по настоящему изобретению для защиты нуждающегося в этом субъекта от инфекции SARS-CoV-2.
В соответствии с другим аспектом в настоящем изобретении предлагается применение иммуногенной композиции по настоящему изобретению для предотвращения заражения COVID-19 нуждающегося в этом субъекта.
Эти и другие аспекты станут очевидными из следующего описания предпочтительных воплощений, используемых совместно со следующими чертежами, хотя возможны изменения и модификации, не отступающие от духа и области применения новых концепций изобретения.
Краткое описание чертежей
Следующие чертежи составляют часть настоящей спецификации и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения, изобретение можно лучше понять, обратившись к одному или нескольким из этих чертежей в сочетании с подробным описанием конкретных воплощений, представленных в настоящем документе.
Фиг. 1 (а)-(f). Дизайн и характеристика гликоинженерного шиповидного белка с белковой вакциной, декорированной моно-GlcNAc (SMG). (а) Схематическое представление рекомбинантного конструкта гликопротеина шипа SARS-CoV-2. Белковые домены показаны как N-концевой домен (NTD), рецептор-связывающий домен (RBD), слитый пептид (FP), гептадный повтор 1 (HR1), гептадный повтор 2 (HR2), центральная спираль (CH) и соединительный домен (CD). С-конец растворимого шиповидного белка связан со складкой последовательности и His-меткой (His6). Сайт расщепления фурином был заменен остатками GSAG, а две мутации пролина (K986P и V987P) фиксируют шиповидный белок в состоянии, предшествующем слиянию. Положения N-связанных последовательностей гликозилирования (N-X-S/T, где X ≠ P) представлены в виде ответвлений (N, Asn; X, любой остаток; S, Ser; T, Thr; P, Pro). «Утопленный» сайт представляет собой сайт расщепления тромбином, (b) схематический обзор производства вакцины с шиповидным белком с моно-GlcNAc; SHM, шип с N-гликанами типа, характеризующимся высоким содержанием маннозы; SMG, шип с GlcNAc в сайтах N-гликозилирования, (c) Эксклюзионная хроматография очищенного SMG. Черная кривая представляет SMG, а серая кривая показывает маркеры молекулярной массы белка, (d) ДСН-ПААГ анализ SFG (пика с N-гликанами обычного сложного типа), SHM и SMG, (e) структурная модель SMG. Модели были созданы на основании белка с ID-кодом 7CN9 банка данных белков (PDB) путем добавления гликана с помощью Wincootmand и отображены с помощью программы ChimeraX. (f) Масс-спектрометрический анализ композиций N-гликанов SFG и SMG.
Фиг. 2 (А)-(S). Вакцинация SMG обеспечивает улучшенную защиту от инфекции SARS-CoV-2 in vivo. (A) Показан график иммунизации сирийских хомяков. SFG (синий), SMG (красный) и контроль (серый). (B) Изменение массы тела измерили у сирийских хомяков после заражения WT SARS-CoV-2. (C) Показаны титры легочных вирусов зараженных хомяков. Пунктирная линия указывает нижний предел обнаружения. (D) Репрезентативные изображения, демонстрирующие гистопатологию, иммуногистохимию и иммунофлуоресценцию легких инфицированного хомяка (3 точки на дюйм). Первый ряд: окраска гематоксилином и эозином (H&E); масштабная линейка, 50 мкм. Второй ряд: иммуногистохимическое (IHC) окрашивание; масштабная линейка, 50 мкм. Третий ряд: иммунофлуоресцентное (IF) окрашивание; масштабная линейка, 100 мкм. N-специфичные поликлональные антитела к SARS-CoV-2 использовали для обнаружения вируса, что показано коричневыми точками при IHC и зелеными точками при окрашивании IF. Синий цвет: 4,6-диамидино-2-фенилиндол (DAPI). (E) Показан график иммунизации трансгенных мышей CAG-hACE2 или K18-hACE2. (F - I) Показаны титры анти-S IgG (F), титры микронейтрализации SARS-CoV-2 WT (G) и анализ подтипа IgG, включая IgG1, IgG2c (H) и отношение IgG2c:IgGl (I) для образцов сыворотки, собранных у иммунизированных трансгенных мышей CAG-hACE2 (n = 7). (J) Показаны типичные гистопатология, иммуногистохимия и иммунофлуоресценция легких инфицированных мышей (7 точек на дюйм). Масштабные линейки такие же, как в (D). (K) Титры вируса в легких инфицированных мышей CAG-hACE2 (n = 3). Пунктирная линия обозначает нижний предел обнаружения. (L и M) Изменение массы тела (L) и анализ выживаемости (M) представлены для трансгенных мышей CAG-hACE2, зараженных WT-SARS-CoV-2 (n = 4). (N и O) Изменение массы тела (N) и анализ выживаемости (O) представлены для трансгенных мышей CAG-hACE2, зараженных альфа-вариантом SARS-CoV-2 (n = 5). (P и Q) Изменение массы тела (P) и анализ выживаемости (Q) представлены для трансгенных мышей CAG-hACE2, зараженных гамма-вариантом SARS-CoV-2 (n = 5). (R и S) Изменение массы тела (R) и анализ выживаемости (S) представлены для трансгенных мышей K18-hACE2, зараженных дельта-вариантом SARS-CoV-2 (n = 4). Данные представлены как среднее значение ± SEM и проанализированы с использованием двусторонних U-тестов Манна-Уитни для сравнения двух экспериментальных групп, ns, незначимо; *Р<0,05.
Фиг. 3 (a) - (e). Вакцинация SMG обеспечивает лучшую защиту от смертельной дозы инфекции SARS-CoV-2 у трансгенных мышей hACE2. (а) Схема иммунизации и заражения трансгенных мышей, (b) Сыворотки, собранные через 28 дней и 42 дня после первоначальной вакцинации, исследовали на наличие специфических IgG против шиповидного белка. (c) Сыворотки, собранные через 42 дня после первоначальной вакцинации, исследовали на титр нейтрализующих антител с помощью анализа CPE. (d) Изменение массы тела трансгенных мышей после заражения. (n = 3) (e) Коэффициент выживаемости трансгенных мышей после заражения. (n = 3). Данные представляют собой среднее ± SEM (стандартная ошибка среднего). Сравнения проводили по t-критерию Стьюдента (непарный, двусторонний). Повышение кратности связывания и нейтрализации антител, индуцированных вакцинами SMG, по сравнению с вакцинами SFG обозначены цифрами над столбиками. Синие квадраты - трансгенные мыши, иммунизированные SFG; красные треугольники - трансгенные мыши, иммунизированные SMG; серые точки, животные контрольной группы (группа, получавшая только квасцы).
Фиг. 4 (а) - (f). Антитела, индуцированные вакциной SMG у мышей, для усиления ширины связывания и нейтрализации и эффективности против вариантов SARS-CoV-2. (а) Проиллюстрированы схематические изображения структуры шиповидного белка SARS-CoV-2 и ландшафта мутаций вариантов, использованных в этом исследовании. RBD, домен связывания рецептора. На карте мутаций точка (.) обозначает такую же аминокислоту в этом положении, что и дикий тип, а тире (-) обозначает делецию. (b) Титр антител IgG, специфичных для SARS-CoV-2, определяли с помощью ELISA. Кратность связывания антител, индуцированных вакцинами SMG, по сравнению с вакцинами SFG обозначена цифрами над столбиками. (c) Показаны кривые нейтрализации псевдовируса вариантов SARS-CoV-2. (d) На графике показаны титры, которые достигают 50% нейтрализации псевдовируса (pNT50) вариантов SARS-CoV-2. Кратность нейтрализации антител, индуцированных вакцинами SMG, по сравнению с вакцинами SFG обозначена цифрами над столбиками. (e) Показаны кривые нейтрализации инфекционных вариантов SARS-CoV-2, определенные с помощью теста нейтрализации уменьшения бляшек (PRNT). (f) Показаны на графике титры, достигающие 50% нейтрализации (PRNT50) вариантов SARS-CoV-2. Данные представляют собой средние значения ± SEM (стандартная ошибка среднего). Кривые были подобраны с помощью нелинейной регрессии с использованием GraphPrism 9.0, а сравнения были выполнены с помощью множественного t-критерия (парный, двусторонний). Сравнение титров проводили с помощью t-критерия Стьюдента (непарный, двусторонний). Увеличение кратности нейтрализации антител, индуцированных вакцинами SMG, по сравнению с вакцинами SFG, указано цифрами над столбиками. Синие квадраты - трансгенные мыши, иммунизированные SFG; красные треугольники - трансгенные мыши, иммунизированные SMG; серые точки, животные контрольной группы (группа, получившая фосфатно-солевой буферный раствор, группа ФСБ).
Фиг. 5 (А)-(G). Гликозилирование S-белка влияет на связывание рецептора ACE2 и инфекцию SARS-CoV-2. (А-С) Авидность связывания ACE2 измерили для гликозилированных по-разному эктодоменов S-белка (SFG; исходный полностью гликозилированный, синий; deS, несиалилированный, светло-голубой; SHM, с высоким содержанием маннозы, желтый; и SMG, моно-GlcNAc-декорированный, красный) из клеток BEAS-2B (A), HEK293T (B) и HEK293S (GnTI) без расщепления Endo H (C) или с таким расщеплением. (С). Данные трех технических повторов показаны как среднее значение ± SD, а кривые соответствуют нелинейной регрессии для значений EC50. (D) Заражающая способность вируса была измерена для псевдовирусов, несущих по-разному гликозилированный S-белок с тем же входным количеством (0,3 мкг/мл эквивалента p24), окрашенных соответственно, как в (C). RLU, относительная единица люминесценции. Данные шести технических повторов показаны как среднее значение ± SD и проанализированы с помощью обычного одностороннего теста ANOVA с последующим тестом множественных сравнений Тьюки, ns, не значимо. **** P < 0,0001. (E) Схематическое изображение S-белка SARS-CoV-2 [дикого типа (WT)] показано окрашенным доменом, включая N-концевой домен (NTD; 14-306; оранжевый), домен связывания рецептора (RBD; 319- 541; красный), два субдомена (SD1/2; 542-685; желтый), проксимальная область слитого пептида (FPPR; 816-856; зеленый), гептадный повтор 1 (HR1; 912-984; бирюзовый), соединительный домен (CD; 1063-1162; синий), гептадный повтор 2 (HR2; 1163-1211; фиолетовый) и трансмембранный домен (ТМ; 1214-1234; белый). Сайты N-гликанов (обозначены ветвями) и O-гликанов (кружки) отмечены номерами остатков. Домены SI и S2 показаны выше. (F) Показаны титры вирусов для псевдовирусов, несущих белок S WT или мутантов с удаленными гликанами в каждом показанном сайте гликозилирования, нормализованными с помощью количественного определения p24 и окрашенными соответственно, как в (E). (G) Инфекционность той же панели псевдовирусов, что и в (F), протестирована на пяти клеточных линиях, экспрессирующих hACE2. Значения в (F) и (G) нормированы по отношению к значениям WT (определены как 100%, окрашены в темно-серый цвет) со средним значением ± SD трех независимых экспериментов.
Фиг. 6 (А)-(Е). Профили гликана S-белка демонстрируют различия в двух клеточных линиях и коррелируют со степенью консервативности последовательности. (A и B) Показано сравнение профиля N-гликозилирования рекомбинантного S-белка, экспрессируемого эпителиальными клетками легкого BEAS-2B (A) и эпителиальными клетками почек HEK293T (B). Гликаны сгруппированы и окрашены соответственно: комплекс-S (сиалилированный комплексный тип; темно-синий), комплекс (несиалилированный комплексный тип; светло-голубой), гибрид-S (сиалированный гибридный тип; темно-желтый) и гибрид (несиалированный гибридный тип; светло-желтый), с высоким содержанием маннозы (зеленый) и незанятый (серый). Процент каждой группы для каждого гликосайта показан на круговой диаграмме, а доля каждой гликоформы (№ 1-27) - на гистограмме. Гистограммы представляют собой среднее значение ± SD для трех биологических повторов. F-гибрид означает фукозилированные гликаны гибридного типа. (C) Профили гликанов из (A) и (B) были сопоставлены с трехмерной структурой эктодомена S (смоделированной из 6VSB). Гликаны окрашены по группе с самым высоким содержанием для данных BEAS-2B (слева) или HEK293T (справа) в соответствии с пометкой (комплексный тип - синий; гибридный тип - желтый; и с высоким содержанием маннозы - зеленый). N-гликосайты некомплексного типа помечены номером остатка. (D) Показано картирование относительной доступности поверхности (RSA) на смоделированном белке S-структуры, где закрытые остатки окрашены темно-желтым цветом, гликаны желтым цветом, а открытые участки - светло-желтым цветом. (E) Показано картирование вариации последовательности на смоделированной структуре S-белка, оно окрашено в по принципу тепловую карты, причем более глубокий темно-красный цвет указывает на более высокую скорость мутаций. Выделены несколько высококонсервативных областей, экранированных гликанами. Дополнительную информацию для (D) и (E) можно найти на фиг. S9 и в файле данных SI.
Фиг. 7 (А)-(S). Вакцинация SMG вызывает более сильный гуморальный и клеточный иммунный ответ, чем SFG, у мышей BALB/c. (A) Показаны структурные модели белковых вакцин SFG и SMG (согласно фиг. 2C). Синий: гликаны; серый: белок. SFG экспрессировался HEK293E без дополнительной модификации. SMG получен путем ферментативного расщепления, чтобы укоротить все N-гликаны SHM, экспрессированные HEK293S GnTI, до одного GlcNAc, тогда как O-гликаны были немодифицированными. (B) Схема иммунизации с использованием белков, как в (A), в качестве иммуногенов у мышей BALB/c (n = 5 в каждом эксперименте). SFG (синий), SHM (желтый), SMG (красный) и контроль (серый). Квасцы, гидроксид алюминия. (C) Титры IgG к белку S в образцах сыворотки анализировали с помощью ELISA. (D) Титры нейтрализации образцов сыворотки измеряли с использованием псевдовируса с белком S дикого типа. (E-G) Анализ сыворотки на подтип IgG, включая IgG1 (E), IgG2a (F) и соотношение IgG2a:IgG1 (G). (H - K) Процентное содержание Tfh в активированных нерегуляторных CD4 T-клетках (H) и процентное содержание IFN-γ (I)-, IL-4 (J)- и IL-21 (K)-экспрессирующих Tfh-клеток (СD4+СD19-СD44hiРохр3-РD-1+СХСВ5+) в лимфатических узлах (LN) мышей BALB/c методом проточной цитометрии. (L) Процент гранзим В-продуцирующих CD8+ Т-клеток (CD3+B220-CD8+CD49b-) в LN мышей BALB/c, проанализированных методом проточной цитометрии. (М) Показано соотношение В-клеток, специфичных к S-белку (CD3-CD19+S-белок+) (в процентах), нормализованное по флуоресценции минус один (FMO) контрольного окрашивания (окрашенного без S-белка) (в процентах) в селезенке. (N) Показано использование легких цепей каппа и лямбда. (О и Р) Распределение тяжелых (О) и каппа (P) цепей анализа репертуара В-клеток. Использование менее чем на 5% выделено белым цветом. (Q - S) Титры анти-S белка IgG (Q), титры нейтрализации псевдовируса (R) и титры нейтрализации аутентичного вируса (S) показаны для сыворотки, выделенной из мышей BALB/c после введения трех доз указанных вакцин против SARS-CoV-2 WT (или D614G) и вариантов (числа над каждой полосой указывают на кратность увеличения SMG по сравнению с группой SFG). pNT50 представляет обратное разведение, достигающее 50% нейтрализации. Пунктирная линия на гистограмме представляет нижний предел обнаружения. Данные представлены как среднее значение ± SEM и проанализированы с помощью двустороннего U-критерия Манна-Уитни для сравнения двух экспериментальных групп, за исключением (N), где пять образцов были объединены вместе и использовался критерий хи-квадрат. Значения P показаны над каждым столбцом. *Р < 0,05; **Р < 0,01.
Фиг. 8 (А)-(L). Функциональная, профилактическая и структурная характеристика антитела m31A7, полученного при вакцинации SMG, указывает на способность к перекрестной нейтрализации. (A) Твердофазный иммуноферментный анализ (ELISA) связывания m31A7 с SI, S2, RBD или всем эктодоменом S. (B) Анализ методом проточной цитометрии связывания m31A7 с клетками HEK293T, экспрессирующими S-белок SARS-CoV-2 WT, и вариантов. (C) Нейтрализующая активность m31A7 против псевдовирусов, несущих белки WT или варианты S. Данные трех технических повторов для (A), (B) и (C) показаны как среднее значение ± среднеквадратическое отклонение (SD), а кривые соответствуют нелинейной регрессии для значений EC50. (D) Показан график проведения инъекций антител и контрольного заражения для трансгенных мышей K18-hACE2 (n = 3). (E и F) Изменение массы тела (E) и изменение температуры тела (F) показаны для мышей, получавших m31A7 или ФСБ. Данные представлены как среднее значение ± стандартная погрешность средней величины (SEM). (G) Представлена кинетика связывания m31A7 IgG и Fab с белком S с константами диссоциации (Kd), показанными выше. (H) Картирование эпитопа m31A7 с помощью HDX-MS показано в зависимости от времени, что позволяет выявить два пептида-кандидата, 419-433 и 471-482, с более чем 10% AHDX через 15 с. Данные представлены как среднее значение ± SD и проанализированы с помощью нескольких t-тестов в каждый момент времени. *Р < 0,05; **Р < 0,01; ***Р < 0,001; ****Р < 0,0001. (I) Показана карта, полученная с помощью криоэлектронной микроскопии (cryo-EM), соответствующая структуре белкового комплекса m31A7-Fab/S. Тяжелая цепь, темно-зеленая; легкая цепь, светло-зеленая; RED, красная; NTD, оранжевая; остальные SI светло-серые; S2, темно-серая; и N-гликаны, синяя. (J) Показан увеличенный вид интерфейса RBD-m31A7. Звездочка отмечает близость между легкой цепью m31A7 и N165-гликаном. (K) Наложение ранее зарегистрированных mAb S2E12 (пурпурный), COV253 (розовый) и Bl-182.1 (голубой) (PDB 7BEN, 7K4N и 7MLZ) на RBD, связанное с m31A7 (серый). Мотив связывания рецептора и кончик RBD выделены. (L) Сравнение изображений COV253 (розовый) и m31A7 (зеленый) на RBD (серый) показывает подобие, остатки VOC помечены и нарисованы в виде красных сфер.
Фиг. 9 (А)-(С). Вакцинация Дельта SMG выявила больше нейтрализующих антител против псевдовируса варианта SARS-CoV-2. (А) Схема вакцинации. Мышей BALB/c (n=5) дважды иммунизировали на неделе 0 и неделе 2 вакциной Дельта SFG или SMG. Сыворотки собирали на 6-й неделе и впоследствии определяли способность к нейтрализации с использованием анализа на псевдовирусы. (B) 50-процентный титр обратной нейтрализации (pNT50) сыворотки против варианта псевдовируса SARS-CoV-2, включая дикий тип (WH01) и вызывающие озабоченность варианты (VOC), включая альфа, бета, гамма, дельта и омикрон. Данные были показаны как среднее (указано над каждым столбцом) ± SEM и проанализированы с помощью двустороннего U-критерия Манна-Уитни для сравнения двух экспериментальных групп. *Р < 0,05. (C) Ингибирование (%) инфекции клеток псевдовирусом варианта SARS-CoV-2, обеспечиваемое по-разному разбавленной сывороткой. Данные представлены как среднее значение ± SEM, а кривые подогнаны методом нелинейной регрессии с использованием Graph Prism 9.0.
Фиг. 10 (А) и (В). Вакцинация Дельта или WT SMG вызывала больше нейтрализующих антител против псевдовируса варианта SAR.S-CoV-2 Омикрон. (А) Схема вакцинации. Мышей BALB/c (n=5) дважды иммунизировали на неделе 0 и неделе 2 вакциной Дельта/WT SFG или SMG. Сыворотки собирали на 6-й неделе и впоследствии изучали способность к нейтрализации с использованием анализа на псевдовирусы. (B) Ингибирование (%) клеточной инфекции псевдовируса варианта SARS-CoV-2, обеспечиваемое разбавленной по-разному сывороткой. Данные представлены как среднее значение ± SEM, а кривые подобраны с помощью нелинейной регрессии с использованием Graph Prism 9.0.
Фиг. 11 (А)-(С). Белок Дельта SMG можно хранить при комнатной температуре в растворе или в виде порошка. (A и B) Белок Дельта SMG в фосфатно-солевом буфере с добавлением двух аминокислот (pbs-aa), 50 мМ L-аргинина и 50 мМ L-глутамата профильтровали через фильтр 0,22 мкм и хранили при комнатной температуре (КТ) или при 4°С. Белки собирали в разные моменты времени, включая 3, 7, 14, 21 день и 3 месяца. Собранные образцы смешивали с 5X ДСН-ПААГ Loading Dye, нагревали при 100°C в течение 5 минут и хранили при 4°C до появления геля. (C) Тест на хранение белка Дельта SMG в различных буферах и условиях лиофилизации. ФСБ с 50 мМ L-аргинина и 50 мМ L-глутамата или без них исследовали на хранение дельта SHM или SMG (первые 3 дорожки) при 4°C. Дельта-SMG исследовали на лиофилизацию со вспомогательным веществом или без него и хранили при комнатной температуре более 2 недель (последние 2 полосы).
На фиг. 12 показано схематическое изображение высококонсервативных эпитопов (E1, E2, E3, E4, E5, E6 и E7) (SEQ ID NO: 41-47), присутствующих в рецептор-связывающем домене (RBD) шиповидного белка SARS-CoV-2, содержащего N-концевой домен (NTD), рецептор-связывающий домен (RBD), слитый пептид (FP), последовательность гептапептидных повторов 1 (HR1), последовательность гептапептидных повторов 2 (HR2), трансмембранный домен (TM), цитоплазматический домен (CD) и субъединицу S2.
На фиг. 13 показано схематическое изображение высококонсервативных эпитопов (E8, E9, E10, E11, E12) (SEQ ID NO: 48-52), присутствующих в последовательности гептапептидных повторов 2 (HR2) шиповидного белка SARS-CoV-2.
Подробное описание
В следующем далее подробном описании воплощений настоящего изобретения делается ссылка на прилагаемые чертежи, где одинаковые ссылки указывают на аналогичные элементы и где в качестве иллюстрации показаны конкретные воплощения, в которых настоящее изобретение может быть реализовано на практике. Эти воплощения описаны достаточно подробно, чтобы специалисты в данной области техники могли применять настоящее изобретение на практике, и следует понимать, что могут использоваться другие воплощения и что логические, структурные, функциональные и другие изменения могут быть сделаны, не отступая от области настоящего изобретения. Таким образом, следующее подробное описание не следует понимать в ограничительном смысле.
Все технические и научные термины, используемые здесь, если иное не определено ниже, имеют то же значение, которое обычно понимается специалистом в данной области техники. Ссылки на методики, используемые в данном документе, предназначены для обозначения методик, как они обычно понимаются в уровне техники, включая вариации этих методик или замены эквивалентных или разработанных позднее методик, которые будут очевидны специалисту в данной области. Кроме того, для более ясного и краткого описания предмета изобретения, для некоторых терминов, которые используются в описании и прилагаемой формуле изобретения, даны следующие определения.
Используемые здесь и в прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылка на «белок» может относиться к одному белку или к смеси таких белков, а ссылка на «способ» включает ссылку на эквивалентные стадии и/или способы, известные специалистам в данной области, и т.д.
В настоящем документе термин «мутация» относится к единичному изменению генома вируса (генетического кода). Мутации случаются часто, но лишь иногда изменяют характеристики вируса.
Используемый здесь термин «линия» относится к группе близкородственных вирусов с общим предком. SARS-CoV-2 имеет много линий; все вызывают COVID-19.
В настоящем документе термин «вариант» относится к вирусному геному (генетическому коду), который может содержать одну или несколько мутаций. Иногда группа вариантов со сходными генетическими изменениями, например линия или группа линий, может быть отмечена организациями общественного здравоохранения как вариант, вызывающий озабоченность (VOC), или вариант, представляющий интерес (VOI), из-за общих признаков и характеристик, которые могут потребовать действий общественного здравоохранения.
В настоящем документе термин «адъювант» относится к соединению, которое при использовании в комбинации с иммуногеном усиливает или иным образом изменяет или модифицирует иммунный ответ, индуцированный против иммуногена. Модификация иммунного ответа может включать усиление или расширение специфичности одного или обоих антител и клеточного иммунного ответа.
В настоящем документе термин «около» или «приблизительно» перед числовым значением обозначает значение плюс или минус в диапазоне 10%. Например, «около 100» включает в себя 90 и 110.
В настоящем документе термин «иммуногенная композиция» представляет собой композицию, содержащую антиген, где введение композиции субъекту приводит к развитию у субъекта гуморального и/или клеточного иммунного ответа на антиген.
Как описано в настоящем документе, термины «шиповидный белок», «шиповидный гликопротеин» и «шиповидный белок коронавируса» используются взаимозаменяемо.
В настоящем документе термин «практически гомогенный» означает, что по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или по меньшей мере 99% гликопротеина, присутствующего в композиции, представлено одной желаемой гликоформой (например, моно-GlcNAc-декорированной) со следовым количеством нежелательных гликоформ, присутствующих в композиции. Под «следовым количеством» подразумевается, что любая данная нежелательная гликоформа, которая присутствует в гликопротеиновой композиции, присутствует в количестве менее 5%, предпочтительно менее 4%, менее 3%, менее 2%, менее 1% и даже менее 0,5% или даже менее 0,1% от общего количества гликопротеина.
Здесь термины «лечить», «лечение» и «проводить лечение» означает подход, позволяющий получить полезные или желаемые результаты, например, клинические результаты. Для целей настоящего изобретения благоприятные или желаемые результаты могут включать ингибирование или подавление начала или прогрессирования инфекции или заболевания; облегчение или уменьшение развития симптомов инфекции или заболевания; или комбинация вышеуказанного.
Здесь термины «предупреждение» и «предотвращение» используются взаимозаменяемо с термином «профилактика» и могут означать полное предотвращение инфекции или предотвращение развития симптомов этой инфекции; задержку начала инфекции или ее симптомов; или уменьшение тяжести впоследствии развившейся инфекции или ее симптомов
В настоящем документе термин «эффективное количество» означает количество иммуногена, достаточное для индукции иммунного ответа, который уменьшает по меньшей мере один симптом патогенной инфекции. Эффективную дозу или эффективное количество можно определить, например, путем измерения количества нейтрализующих секреторных и/или сывороточных антител, например, путем нейтрализации бляшек, фиксации комплемента, твердофазного иммуноферментного анализа (ELISA) или анализа микронейтрализации.
В настоящем документе термин «вакцина» означает иммуногенную композицию (с адъювантом или без него), такую как иммуноген, полученный из коронавируса, который используется для индукции иммунного ответа против коронавируса, обеспечивающего защитный иммунитет (например, иммунитет который защищает субъекта от заражения коронавирусом и/или снижает тяжесть состояния, вызванного заражением коронавирусом). Защитный иммунный ответ может включать образование антител и/или клеточно-опосредованный ответ. В зависимости от контекста термин «вакцина» может также относиться к суспензии или раствору иммуногена, который вводят субъекту для выработки защитного иммунитета.
В настоящем документе термин «субъект» включает людей и других животных. Как правило, субъектом является человек. Например, субъектом может быть взрослый, подросток, ребенок (от 2 до 14 лет), младенец (от рождения до 2 лет) или новорожденный (до 2 месяцев). В соответствии с конкретными аспектами возраст субъекта составляет до 4 месяцев или до 6 месяцев. В соответствии с некоторыми аспектами взрослые являются пожилыми людьми в возрасте около 65 лет или старше или около 60 лет или старше. В соответствии с конкретными аспектами субъект представляет собой беременную женщину или женщину, намеревающуюся забеременеть. В соответствии с другими аспектами субъект не является человеком; например, это может быть примат, не являющийся человеком; например, павиан, шимпанзе, горилла или макака. В соответствии с некоторыми аспектами субъект может быть домашним животным, таким как собака или кошка.
В настоящем документе термин «фармацевтически приемлемый» означает, одобренный регуляторным органом федерального правительства США или правительства штата или указанный в Фармакопее США, Европейской фармакопее или другой общепризнанной фармакопее для применения у млекопитающих и, более конкретно, у людей. Эти композиции могут быть использованы в качестве вакцин и/или антигенных композиций для индукции защитного иммунного ответа у позвоночных.
Коронавирус, вызывающий тяжелый острый респираторный синдром 2, (SARS-CoV-2) представляет собой оболочечный положительно-полярный одноцепочечный РНК-вирус, вызывающий коронавирусную болезнь 2019 (СОVID-19). Вирусные частицы включают генетический материал РНК и структурные белки, необходимые для инвазии в клетки-хозяева. Оказавшись внутри клетки, инфицирующая РНК используется для кодирования структурных белков, из которых состоят вирусные частицы, неструктурных белков, управляющих сборкой вируса, его транскрипцией, репликацией и контролем хозяина, а также вспомогательных белков, функция которых не установлена. Структурные белки SARS-CoV-2 включают белок оболочки (E), шиповидный гликопротеин или гликопротеин поверхности (S), мембранный белок (M) и нуклеокапсидный белок (N). Шиповидный гликопротеин находится снаружи вирусной частицы и придает коронавирусным вирусам их коронообразный вид. Этот гликопротеин обеспечивает прикрепление вирусной частицы и ее проникновение в клетку-хозяина.
S-белок, генерируемый эпителиальными клетками легких, имеет гликоформы, связанные с повышенной инфекционностью. По сравнению с полностью гликозилированным S-белком, иммунизация S-белка, покрытого N-гликанами, усеченными до моно-GlcNAc (SMG), вызывала более сильные иммунные ответы и лучшую защиту трансгенных мышей, несущих ангиотензинпревращающий фермент 2 (hACE2) человека, от вызывающих беспокойство вариантов (VOC). Кроме того, у мышей, иммунизированных SMG, было идентифицировано широко нейтрализующее моноклональное антитело, которое могло нейтрализовать SARS-CoV-2 дикого типа и VOC в субпикомолярной активности.
Сконструированный с помощью гликоинженерии шиповидный белок по настоящему раскрытию содержит полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, или его вариант, последовательность которого по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 1, или иммунологически активный фрагмент аминокислотной последовательности или варианта. Аминокислотная последовательность SEQ ID NO: 1 показана ниже.
SEQ ID NO: 1
QCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIVNNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLEGKQGNFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETKCTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNR KRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDIS TEIYQAGSTPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVWLSFELLHAPATVCG PKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLE ILDITPCSFGGVSVITPGTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGS NVFQTRAGCLIGAEHVNNSYECDIPIGAGICASYQTQTNSPRRARSVASQSIIAYTM SLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLL QYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTPPIKDFGGFNFSQILPDPSK PSKRSFIEDLLFNKVTLADAGFIKQYGDCLGDIAARDLICAQKFNGLTVLPPLLTDE MIAQYTSALLAGTITSGWTFGAGAALQIPFAMQMAYRFNGIGVTQNVLYENQKLIAN QFNSAIGKIQDSLSSTASALGKLQDWNQNAQALNTLVKQLSSNFGAISSVLNDILS RLDKVEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSECVLGQSKR VDFCGKGYHLMSFPQSAPHGWFLHVTYVPAQEKNFTTAPAICHDGKAHFPREGVFV SNGTHWFVTQRNFYEPQIITTDNTFVSGNCDWIGIVNNTVYDPLQPELDSFKEELD KYFKNHTSPDVDLGDISGINASWNIQKEIDRLNEVAKNLNESLIDLQELGKYEQY
В соответствии с одним воплощением сконструированный с помощью гликоинженерии шиповидный белок по настоящему раскрытию содержит полипептид, содержащий аминокислоты, указанные в SEQ ID NO: 2 ниже.
SEQ ID NO: 2
QCVNLRTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIVNNATNWIKVCEFQFCNDPFLDVYYHKNNKSWMESGVYSSANNCTFEYVSQPFLMDLEGKQGNFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETKCTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYRYRLFRKSNLKPFERDISTEIYQAGSKPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVWLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVSVITPGTNTSNQVAVLYQGVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSYECDIPIGAGICASYQTQTNSRGSAGSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDCLGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAMQMAYRFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQNWNQNAQALNTLVKQLSSNFGAISSVLNDILSRLDPPEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGWFLHVTYVPAQEKNFTTAPAICHDGKAHFPREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDWIGIVNNTVYDPLQPELDSFKEELDKYFKNHTSPDVDLG DISGINASWNIQKEIDRLNEVAKNLNESLIDLQELGKYEQ
Как описано в настоящем документе, сконструированный с помощью гликоинженерии шиповидный белок SARS-CoV-2 или его вариант может включать белки, содержащие аминокислотную последовательность, которая (i) фактически идентична аминокислотной последовательности, представленной в SEQ ID NO: 1 (например, по меньшей мере на 90%, 95% или 97% идентична SEQ ID NO:1, такой как SEQ ID NO:2); и (ii) кодируются последовательностью нуклеиновой кислоты, способной гибридизоваться по меньшей мере в умеренно жестких условиях с любой последовательностью нуклеиновой кислоты, кодирующей шиповидный белок, указанный в настоящем документе, или способной гибридизоваться по меньшей мере в умеренно жестких условиях с любой последовательностью нуклеиновой кислоты, кодирующей шиповидный белок, указанный в настоящем документе, но использующей синонимичные кодоны (например, кодоны, который не имеют идентичной нуклеотидной последовательности, но кодирует идентичную аминокислоту).
Анализ специфичного для клетки распределения гликоформ, консервативности последовательностей, экранирования гликанов и их взаимных корреляций привел к разработке вакцины SMG, в которой практически все гликановые экраны удалены. Гликозилирование S-белка SARS-CoV-2 оказывает большое влияние на вирусную инфекцию, целостность белка и иммунный ответ. Белок S из эпителиальных клеток легких содержит больше сиалилированных гликанов сложного типа для облегчения связывания с рецептором, а гликосайты N801 и N1194, как было показано, необходимы для свертывания белка S и вирусной инфекции. Это сделало консервативные эпитопы более восприимчивыми к иммунной системе, так что можно было вызвать более эффективные и широкие защитные В- и Т-клеточные ответы против вируса и его вариантов.
Сконструированный с помощью гликоинженерии шиповидный белок коронавируса по настоящему изобретению нацелен на весь эктодомен S-белка, в частности, на консервативные домены, экранированные гликанами, стимулируя выработку как RBD, так и не-RBD-нейтрализующих антител и ответы Т-клеток CD8, которые имеют решающее значение для перекрестной защиты.
В соответствии с некоторыми аспектами в настоящем изобретении предлагается вакцина или фармацевтическая композиция, содержащая описанный здесь иммуноген. В настоящем изобретении также предлагается способ лечения или профилактики коронавирусной инфекции, включающий введение субъекту (например, млекопитающему), нуждающемуся в этом, эффективного количества иммуногена, фармацевтической композиции или вакцины, как описано в настоящем документе.
В соответствии с одним воплощением вакцина может включать адъювант. Примеры адъювантов включают без ограничения гидроксид алюминия, фосфат алюминия, неполный адъювант Фрейнда (IFA), сквален, квасцы, алгидрогель, MF59, QS-21, CpG 1018, AS03, AS37, Matrix-M или их комбинацию.
Вакцину или фармацевтическую композицию можно приготовить любым подходящим способом. Смешивание со стандартными фармацевтически приемлемыми носителями и/или вспомогательными веществами можно выполнить с использованием обычных методов в фармацевтике. Точная природа препарата будет зависеть от нескольких факторов, включая вводимую вакцину и желаемый способ введения. Подходящие типы препаратов полностью описаны в Remington's Pharmaceutical Sciences, 19th Edition, Mack Publishing Company, Восточная Пенсильвания, США.
Вакцину или фармацевтическую композицию, как описано здесь, можно вводить любым способом. Такие способы включают введение, например, парентерально, например, всеми способами введения в кожу или через кожу: т.е. внутримышечно, внутривенно, внутрибрюшинно, внутрикожно, мукозально, субмукозально или подкожно. Кроме того, их можно наносить местно в виде капель, спрея, геля или мази на эпителий слизистой оболочки глаз, носа, рта, ануса или влагалища или на эпидермис наружной кожи любой части тела. Другими возможными способами применения являются спрей, аэрозоль или порошковое нанесение при ингаляции через дыхательные пути. В качестве альтернативы введение можно осуществлять с пищей. Эффективное количество композиции вакцины может зависеть от любого количества переменных, включая, без ограничений, вид, породу, размер, рост, массу тела, возраст, общее состояние здоровья пациента, тип состава или режим или способ введения. Соответствующее эффективное количество специалисты в данной области техники могут рутинно определить с использованием стандартных технологий оптимизации, а также квалифицированного и информированного мнения практикующего врача и других факторов, очевидных для специалистов в данной области.
В соответствии с одним воплощением композиция может содержать дополнительный терапевтический агент, такой как противовирусный агент. Предлагаемая фармацевтическая композиция полезна для лечения коронавирусной инфекции. Примеры дополнительного противовирусного агента включают без ограничения рибавирин, пенцикловир, нитазоксанид, нафамостат, хлороквин, ремдесивир (GS-5734) и фавипиравир (Т-705), интерферон, адефовир, тенофовир, ацикловир, бривудин, цидофовир, фомивирсен, фоскамет, ганцикловир, амантадин, римантадин, занамивир, ремдесивир, молнупиравир и паксловид.
Если не указано иное, все используемые здесь технические и научные термины имеют такое же значение, которое обычно понимается специалистом в данной области техники. Хотя способы и материалы, аналогичные или эквивалентные описанным здесь, могут быть использованы при практическом применении или изучении настоящего изобретения, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены по ссылке во всей своей полноте. В случае конфликта настоящая спецификация, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры носят исключительно иллюстративный характер и не предназначены для ограничения.
Примеры
Пример 1. Генные конструкты
Последовательности шиповидного белка SARS-CoV-2 были сконструированы на основе последовательностей генов, загруженных из базы данных GISAID. В общей сложности из базы данных GISAID (Глобальная инициатива по обмену данными о птичьем гриппе) (версия: 18 апреля 2021 г.) были извлечены 1 117 474 последовательностей S-белков всех доступных штаммов SARS-CoV-2.
Последовательности ДНК шиповидного белка SARS-CoV-2 Wuhan/WHOl/2019 и дельта-варианта синтезировали с кодонами, оптимизированными для экспрессии в клетках человека. Сайт расщепления фурином заменили на GSAG (SEQ ID NO: 9), и сконструировали заместители 2P для того, чтобы белок оставался в состоянии до слияния. Трансмембранный домен заменили сайтом расщепления тромбином, фолдоном и гистидиновой меткой на С-конце шипа. Модифицированную последовательность HA клонировали в вектор pTT для экспрессии и очистки белка.
Пример 2. Экспрессия и очистка S-белка SARS-CoV-2
Плазмиду, которая кодирует секретируемый шип SARS-CoV-2, трансфицировали в линии эмбриональных клеток почек человека HEK293EBNA (номер ATCC CRL-10852) или клеток HEK293S GnTI с использованием реагента для трансфекции (либо полиэтиленимина, либо FectoPRO) и культивировали в экспрессионной среде Freestyle 293 (Invitrogen) с добавлением 0,5% телячьей сыворотки. Надосадочную жидкость собирали через 5 дней после трансфекции и очищали центрифугированием. После этого шиповидные белки очищали с помощью хроматографии с хелатированием никеля, а элюированные фракции концентрировали с помощью фильтра Millipore Amicon Ultra Filter (100 кДа) и загружали в колонку для гель-фильтрации superpose™ (10/300 GL; GE), предварительно уравновешенную в трис-буфере. (20 мМ трис/HCl, 20 мМ NaCl, 50 мМ глутамата, 50 мМ аргинина) и собирали соответствующие фракции тримера. Очищенный SHM обрабатывали Endo H (NEB) в течение ночи при комнатной температуре для получения шиповидного белка с одним GlcNAc в сайтах гликозилирования, Spikemg. Для удаления EndoH SMG дополнительно очищали путем замены буфера с использованием Millipore Amicon Ultra Filter (100 кДа). Метод экспрессии и очистки модифицировали по сравнению с предыдущим исследованием в лаборатории, опубликованным в PNAS.
Продуцирование псевдовирусов, несущих сконструированными с помощью гликоинженерии, (фиг. 1D) основано на предыдущих исследованиях (Y. Watanabe, J. D. Allen, D. Wrapp, J. S. McLellan, M. Crispin, Site-specific glycan analysis of the SARS-CoV-2 spike. Science 369, 330-333 (2020); Q. Yang, T. A. Hughes, A. Kelkar, X. Yu, K. Cheng, S. Park, W.-C. Huang, J. F. Lovell, S. Neelamegham, Inhibition of SARS-CoV-2 viral entry upon blocking N-and O-glycan elaboration, Life 9, e61552 (2020)). Для продуцирования псевдовирусов, мутантных по сайтам гликозилирования, (фиг. IF) клетки HEK293T временно трансфицировали конструктом pVax-nCoV-SA19, содержащим мутации в каждом сайте гликозилирования, и экспрессирующей люциферазу HIV-1 геномной плазмидой (pNL4-3.luc.RE).
Пример 3. Характеристика белка SMG
Чтобы охарактеризовать белок SMG, была проведена эксклюзионная хроматография с использованием ENrich™ SEC 650 (колонка 10 x 300; Biorad), предварительно уравновешенная буфером на основе трис (20 мМ трис/HCl, 20 мМ NaCl, 50 мМ глутамат, 50 мМ аргинин). Затем для проверки чистоты образца белка образцы объединили с загрузочным буфером, разделили с помощью 7,5% ДСН-ПААГ и окрашивали Кумасси бриллиантовым синим-плюс (EBL).
Пример 4. Анализ гликопептидов методом масс-спектрометрии
Две аликвоты по 20 мкг шиповидного белка SARS-CoV-2 из двух биологических повторов денатурировали при 55°C в течение 1 ч в 50 мМ буфере триэтиламмония гидрокарбоната, содержащем 10 мМ трис(2-карбоксиэтил)фосфина. Затем шиповидный белок восстанавливали и алкилировали добавлением 18 мМ йодацетамида (IAA) и инкубированием в течение 30 минут в темноте. Алкилированные оболочечные белки расщепляли отдельно с использованием различных комбинаций химотрипсина или альфа-литической протеазы в отношении 1:10 (мас/мас) или трипсина в отношении 1:20 (мас/мас) (Mass Spectrometry Grade, Promega). После ферментативного расщепления в течение ночи образцы высушивали в концентраторе SpeedVac и обрабатывали для определения методом ЖХ-МС/МС. Классификация гликанов сопровождалась предварительным исследованием в соответствии с составом, обнаруженным и визуализированным с помощью Graphpad Prism 9.0.0.
Пример 5. Эксперименты по вакцинации и заражению
Самок золотого сирийского хомяка в возрасте от 6 до 7 недель (n = 5) иммунизировали внутримышечно 25 мкг очищенных белков SFG или SMG, смешанных с 250 мкг гидроксида алюминия, в день 0 и день 14. Кровь собирали через 28 и 42 дня после первой иммунизации, и образцы сыворотки брали у каждого хомячка. Через 4 недели после второй вакцинации хомяков инфицировали 1 x 104 БОЕ вируса SARS-CoV-2 TCDC#4 (hCoV-19/Тайвань/4/2020, номер GISAID ID: EPI ISL 411927) интраназально в объеме 100 мкл на хомяка. Массу тела каждого хомяка регистрировали ежедневно после инфицирования. На 3-й день после инфицирования хомяков умерщвляли углекислым газом. Правое легкое брали для определения вирусной нагрузки (анализ TCID50). Левое легкое фиксировали в 4% параформальдегиде для гистологического исследования. Все эксперименты на животных были оценены и одобрены комитетом по содержанию и использованию лабораторных животных Academia Sinica.
В качестве альтернативы, для двухдозовой схемы вакцинации самок мышей BALB/c в возрасте от 6 до 8 недель (n=5) иммунизировали внутримышечно 10 мкг очищенного SFG, SHM или SMG, смешанного с гидроксидом алюминия (50 мкг) в дни 0 и 14. Сыворотку собирали на 28-й день после первой вакцинации для оценки содержания анти-S IgG, подтипа IgG и нейтрализующих титров (описано в дополнительных материалах и методах). Лимфатические узлы мышей, иммунизированных SFG или SMG, собирали на 21-й день после первой вакцинации для анализа ответа Т-клеток (описано в дополнительных материалах и методах). Для анализа В-клеточного репертуара и титров сыворотки против вариантов, самок мышей BALB/c в возрасте от 6 до 8 недель (n=5) иммунизировали внутримышечно 20 мкг очищенного SFG или SMG, смешанного с гидроксидом алюминия (20 мкг) в дни 0, 14 и 56; мышей умерщвляли на 84-й день для сбора цельной крови на анти-S IgG и оценку нейтрализующего титра, а также селезенки для сортировки В-клеток, специфичных к S-белку (описано в дополнительных материалах и методах).
Для исследования вакцинации хомяков и заражения вирусом самцов золотистых сирийских хомяков в возрасте от 6 до 7 недель (n = 5) иммунизировали внутримышечно 25 мкг очищенного SFG или SMG, смешанного с гидроксидом алюминия (250 мкг) в дни 0 и 14. Через четыре недели после второй иммунизации каждому хомяку интраназально вводили 1 x 104 TCID50 SARS-CoV-2 (hCoV-19/Тайвань/4/2020) в 100 мкл ФСБ. Массу тела регистрировали ежедневно после инфицирования. На 3-й день после заражения хомяков умерщвляли углекислым газом. Верхнюю долю левого легкого фиксировали в 10% параформальдегиде для гистопатологического исследования, а остальную часть легкого собирали для определения вирусной нагрузки (анализ TCID50).
Для вакцинации трансгенных мышей и исследования заражения вирусом самцов трансгенных мышей CAG-hACE2 в возрасте от 6 до 8 недель или самцов трансгенных мышей K18-hACE2 в возрасте 12 недель (приобретенных в лаборатории Джексона) иммунизировали внутримышечно 10 мкг очищенный SFG или SMG, смешанных с гидроксидом алюминия (50 мкг) в дни 0 и 14. Трансгенных мышей CAG-hACE2 заражали интраназально через 4 недели после второй иммунизации 1 x 103 TCID50 WT SARS-CoV-2. В первом испытании (n=3) всех мышей умерщвляли на 7 день после заражения (dpi) для гистопатологического исследования верхней доли левого легкого; во втором испытании (n = 7) трех мышей умерщвляли на 4 dpi для определения титра вируса легкого, а четырех мышей оставили до 14 dpi для анализа выживаемости. Сыворотку собирали за 1 день до заражения вирусом.
Для исследований заражения с использованием VOC мышам CAG-hACE2 вводили 1 x 103 TCID50 альфа-варианта (hCoV-19/Тайвань/792/2Q20) (n = 5) или гамма-варианта (hCoV-19/Тайвань/906/2021) SARS-CoV-2 в 50 мкл ФСБ на мышь. Кроме того, мышей K18-hACE2 интраназально заразили через 4 недели после второй иммунизации 1 x 104 TCID50 дельта-SARS-CoV-2 (hCoV-19/Taiwan/1144/2021) (n = 4) в 50 мкл ФСБ на мышь. Для всех моделей заражения вариантами SARS-CoV-2 массу тела каждой мыши регистрировали ежедневно до 14 dpi.
Для испытания на профилактическую защиту антител самцам трансгенных мышей K18-hACE2 возраста 8 недель (n = 3) внутрибрюшинно вводили m31A7 (15 мг/кг) или ФСБ за 1 день до интраназального заражения 1 x 103 TCID50 SARS-CoV-2 дикого типа (WT) (hCoV-19/Тайвань/4/2020). Массу и температуру тела регистрировали ежедневно до 5 dpi. Все эксперименты на животных были оценены и одобрены комитетом по содержанию и использованию лабораторных животных Academia Sinica (одобрения № 21-10-1716, 18-12-1272 и 20-10-1522).
Пример 6. Гистологическое и иммуногистохимическое (ИГХ) окрашивание
Легкие хомячка на 3 dpi собирали без промедления и помещали на фиксацию в 10% нейтральном забуференном формалине на 24 часа, затем переносили в 70% этанол на 72 часа. Залитую в парафин легочную ткань обрезали до толщины 5 мм. Для гистологического окрашивания ткань окрашивали гематоксилином и эозином (H&E). Для иммуногистохимического (ИГХ) окрашивания срезы ткани депарафинизировали ксилолом и регидратировали градиентом этанола. Извлечение антигена проводили путем нагревания предметных стекол до 95°С в течение 10 минут в 10 мМ буфере цитрата натрия (рН 6,0) в микроволновой печи. После охлаждения при комнатной температуре и промывания ФСБ наносят 3% H2O2 для устранения активности эндогенной пероксидазы. Срезы ткани блокировали 5% нормальной козьей сывороткой и 1% BSA в IX ФСБT в течение 1 часа с последующей инкубацией с кроличьими первичными антителами анти-N и анти-S в разведении 1:50 (поликлональные анти-SARS-CoV-2 антитела) в течение ночи при 4°C. Затем ткань инкубировали со вторичным антителом козы против кроличьих антител против пероксидазы хрена (HRP) в разведении 1:500 в течение 1 часа и визуализировали путем инкубации с субстратом 3,3-диаминобензидина (DAB) и контрастного окрашивания гематоксилином.
Пример 7. Иммунофлюоресцентное (ИФ) окрашивание
Для иммунофлуоресцентного окрашивания после этапов извлечения антигена ткань пермеабилизировали с помощью Triton X-100 в ФСБ. Срезы ткани блокировали 5% нормальной козьей сывороткой и 1% BSA в IX ФСБT в течение 1 часа. Затем инкубировали с гасителем автофлуоресценции в течение 5 минут. После этого образцы инкубировали с кроличьими первичными антителами анти-N и анти-S в разведении 1:50 (поликлональные антитела против SARS-CoV-2) в течение ночи при 4°C, вторичными антителами Alexa Fluor-488 (1:500, Термо Fisher) в течение 1 часа при комнатной температуре и 4,6-диамидино-2-фенилиндолом (DAPI), ядерный красителем, в течение 3 минут при комнатной температуре. Покровные стекла помещали на предметные стекла микроскопа и визуализировали под конфокальным микроскопом Leica TCS SP8X с объективом HC PL APO CS2 10x/1,40 (Leica AG, Вецлар, Германия).
Пример 8. Эксперименты по вакцинации и заражению трансгенных мышей
Самцов 8-недельных трансгенных мышей CAG-hACE2 (n=3) иммунизировали внутримышечно 10 мкг очищенного белка SFG или SMG, смешанного с 50 мкг гидроксида алюминия, в день 0 и день 14.14 Кровь собирали через 28 дней и 42 дня после первой иммунизации, а образцы сыворотки собирали у каждой трансгенной мыши. Через 6 недель после второй вакцинации хомяков заражали 1 x 103 БОЕ SARS-CoV-2 TCDC#4 (hCoV-19/Тайвань/4/2020, номер доступа GISAID ID: EPI_ISL 411927) интраназально в объеме 100 мкл на мышь. Массу тела и выживаемость каждой трансгенной мыши регистрировали ежедневно после заражения. На 7-й день после заражения всех трансгенных мышей умерщвляли углекислым газом. Легкое фиксировали в 4% параформальдегиде для гистопатологического исследования. Все эксперименты на животных были оценены и одобрены комитетом по содержанию и использованию лабораторных животных Academia Sinica.
Пример 9. Количественное определение титра вируса в легочной ткани с помощью инфекционного анализа клеточной культуры (TCID50)
Среднюю, нижнюю и посткавальную доли легких хомяков гомогенизировали в 600 мкл минимальной эссенциальной среды Игла, модифицированной по способу Дульбекко, (DMEM) с 2% фетальной бычьей сывороткой (FBS) и 1% пенициллином/стрептомицином с использованием гомогенизатора. Гомогенат ткани центрифугировали при 15000 об/мин в течение 5 минут и собирали надосадочную жидкость для титрования живых вирусов. Вкратце, 10-кратные серийные разведения каждого образца прибавляли к монослою клеток Vero E6 в четырех повторов и инкубировали в течение 4 дней. Затем клетки фиксировали 10% формальдегидом и окрашивали 0,5% кристаллическим фиолетовым в течение 20 минут. Планшеты промывали водопроводной водой и оценивали на инфицирование. 50-процентную инфицирующую дозу для культуры ткани (TCID50)/мл рассчитывали по методу Рида и Мюнча.
Пример 10. Исследования вакцинации мышей
Самок мышей BALB/c в возрасте от 6 до 8 недель (n = 5) иммунизировали внутримышечно 20 мкг очищенных белков SFG или SMG, смешанного с 20 мкг гидроксида алюминия, в день 0, день 14 и день 56. Кровь собирали через 14 дней после третьей иммунизации, и у каждой мыши брали образцы сыворотки. Все эксперименты на животных были оценены и одобрены комитетом по содержанию и использованию лабораторных животных Academia Sinica.
Пример 11. Оценка титра антител в сыворотке
Анти-S ELISA использовали для определения титра сывороточного IgG. Планшеты блокировали 5% обезжиренным молоком и последовательно добавляли мышиное поликлональное анти-S первичное антитело и вторичное антитело, конъюгированное с HRP. Использовали раствор субстрата пероксидазы (TMB) и 1 M стоп-раствор H2SO4, и оптическую плотность (OD 450 нм) считывали с помощью микропланшетного ридера. Исследуемый штамм включал SARS-CoV-2 (дикий тип, варианты B.1.1.7 и B.1.135), RnGT13 и SARS-CoV-1.
Антитело m31A7 выделили методом скрининга отдельных В-клеток, а затем охарактеризовали. Праймеры сконструировали на основе предыдущей публикации (Tiller T., Busse E. E., Wardemann H. Cloning and expression of murine Ig genes from single В-cells./ Immunol. Methods 350, 183-193) (2009)). Полимеразную цепную реакцию (ПЦР) проводили при 50°С в течение 30 мин, 95°С в течение 15 мин с последующим 40 циклами инкубации при 94°С в течение 30 с, 50°С в течение 30 с и 72°С в течение 1 мин, с заключительным удлинением при 72°С в течение 10 мин. Полувложенную ПЦР второго раунда выполнили с использованием ПЦР-смеси KOD One PCR (TQYQRO) вместе с 1 мкл неочищенного продукта ПЦР первого раунда при 98°C в течение 2 мин с последующими 45 циклами инкубации при 98°C в течение 10 с, 55°C в течение 10 с и 68°С в течение 10 с, с заключительным удлинением при 68°С в течение 1 мин. Затем продукты ПЦР анализировали электрофорезом и секвенированием. Гены Ig V и L были идентифицированы в международной информационной системе ImMunoGeneTics (http://imgt.org/IMGT_vquest/input). Затем гены амплифицировали из продукта ПЦР второго раунда с одиночными ген-специфичными праймерами генов V и L, содержащими сайты рестрикции, для клонирования в векторы, содержащие каркас экспрессии человеческого IgH или IgL. Химерные экспрессионные конструкты IgH и IgL котрансфицировали в Expi293 для продуцирования антител. После того, как m31A7 был выделен, антитело впоследствии оценивали на связывание S-белка с помощью ELISA и сортировки клеток с активацией флуоресценции, активность нейтрализации псевдовируса, кинетику связывания и картирование эпитопов, а также определения структуры.
Пример 12. Анализ нейтрализации псевдовирусов
Чтобы определить инфекционные единицы псевдотипированных лентивирусных векторов, мы высевали клетки 293T-ACE2 с соответствующей плотностью в 96-луночные (100 мкл на лунку) планшеты для тканевых культур за 1 день до инфицирования. После инкубации в течение ночи (37°C, 5% CO2) в высеянные клетки прибавляли 100 мл трех предварительно смешанных содержащих псевдовирусы надосадочных жидкостей и четырехкратные серийные разведения сыворотки иммунизированных мышей. Клетки инкубировали в течение 48 часов при 37°C/5% CO2 для обеспечения экспрессии репортерного гена нано-люциферазы. Активность люциферазы измеряли с помощью ридера ELISA. Процент ингибирования рассчитывали по следующему уравнению 100*[1-(RLUSample/RLUmock-treatment)] (RLUSample - относительные единицы люминесценции, испускаемой образцом, RLUmock-treatment - относительные единицы измерения, испускаемые при фиктивной обработке). Данные анализировали с помощью Graphpad Prism, а значения pNT50 рассчитывали, используя значение 50% ингибирующей концентрации для всех образцов.
Пример 13. Анализы уменьшения бляшкообразования
Клетки Vero E6 высевали в 24-луночные культуральные планшеты в DMEM с 10% FBS и антибиотиками за 1 день до инфицирования. SARS-CoV-2 инкубировали с антителами в течение 1 часа при 37°C, после чего добавляли в монослой клеток еще на час. Затем удаляли смеси вирус-антитело, и клеточный монослой однократно промывали ФСБ перед покрытием средой, содержащей 1% метилцеллюлозы, на 5-7 дней. Клетки фиксировали 10% формальдегидом в течение ночи. После удаления покровной среды клетки окрашивали 0,7% кристаллическим фиолетовым и подсчитывали бляшки. Процент ингибирования рассчитывали как [1 - (VD/VC)] x 100%, где VD и VC относятся к титру вируса в присутствии и в отсутствие сыворотки соответственно.
Для анализа нейтрализации по ЦПЭ клетки Vero E6 высевали на 6-луночный планшет в количестве 2×105 клеток/лунку в течение ночи для достижения 90% степени смыкания монослоя. Сыворотку и вирусы смешивали перед добавлением на монослой еще на час. Планшеты оставляют затвердевать при комнатной температуре на 30 минут, затем инкубируют при 37°C до появления цитопатических эффектов (ЦПЭ).
Статистический анализ: все данные выражены как среднее ± стандартная ошибка среднего. Для всех анализов значения P были получены из t-теста Стьюдента (непарный, двусторонний), за исключением сравнения кривых с использованием t-теста Стьюдента (парный, двусторонний). Все графики были созданы с помощью программного обеспечения GraphPad Prism версии 9.0.0.
Пример 14. Дизайн и характеристика гликоинженерной S-белковой вакцины (SMG), покрытой моно-GlcNAc
Рекомбинантный нативный белок с последовательностью (аминокислоты 14-1209) из исходного штамма SARS-CoV-2 Wuhan (hCoV/Wuhan/WHO 1/2019) был оптимизирован по кодонам для экспрессии в клетках человека остатками GSAG (SEQ ID NO: 9) для замены исходного сайта расщепления фурина и 2 мутаций пролина с целью фиксации нативного шипа в его состоянии до слияния, а на его С-конце добавили последовательность тримеризации фолдона и His-метку и экспрессировали в клетках HEK293S человека (фиг. 1). Сначала был получен и очищен промежуточный рекомбинантный нативный шип с высоким содержанием маннозы, где все N-гликаны, обозначенные знаком ответвления (фиг. 1а), являются N-гликанами Man5. Затем с помощью эндогликозилазы EndoH удалили избыток гликанов и получили конечный продукт, моногликозилированный нативный шип (фиг. 1b). Очищенный SMG представляет собой тример с кажущейся молекулярной массой ~520 кДа в растворе и высокой степенью чистоты (фиг. 1c и 1d). Уменьшение размера из-за удаления N-гликанов анализировали с помощью ДСН-ПААГ по сравнению с обычным SFG и промежуточным SHM (фиг. 1d). Масс-спектрометрический анализ SMG показал, что большинство сайтов N-гликозилирования содержат почти 100% одиночного сахара, N-ацетилглюкозамина (GlcNAc), за исключением N603 и N1194, где GlcNAc составляет >90% (фиг. 1f). Напротив, исходный полностью гликозилированный нативный шип имеет гетерогенные N-гликаны на всех сайтах N-гликозилирования, содержащих комплексный тип, гибридный тип и другие.
Пример 15. Вакцина SMG обеспечивала наилучшую защиту от SARS-COV-2 и вариантов in vivo
Чтобы оценить in vivo защитную эффективность вакцины SMG против SARS-CoV-2, мы сначала провели контрольное заражение SARS-CoV-2 дикого типа у сирийских хомяков, вакцинированных SMG или SFG (фиг. 2A). У хомяков, вакцинированных SMG (n= 5), наблюдалось меньшее снижение массы тела по сравнению с группами, получавшими SFG и фосфатно-солевой буфер (ФСБ) (фиг. 2B), тогда как аналогичное снижение титра вируса наблюдалось в легких обоих SFG- и SMG-вакцинированных хомяков (фиг. 2C). Кроме того, согласно данным гистопатологического окрашивания и иммуноокрашивания антинуклеокапсидного (N) белка, в легких иммунизированных хомяков наблюдалось меньше поражений (фиг. 2D). Поскольку у хомяков при заражении SARS-CoV-2 проявлялось заболевание только от легкой до умеренной степени тяжести, мы затем использовали модели тяжелого заболевания, высокочувствительных к CAG-hACE2 (C.-Y. Tsai, C.-Y. Chen, J.-T. Jan, Y.-C. Chou,M.-L. Chang, L. A. Lu, P.-Y. Huang, M. F. C. Chu, T.-T. Hsu, Y.-P. Hsueh, Sex-biased response to and brain cell infection by SARS-CoV-2 in a highly susceptible human ACE2 transgenic model.bioRxiv, 2021) или K18-hACE2 (E. S. Winkler, A. L. Bailey, N. M. Kafai, S. Nair, В. T. McCune, J. Yu, J. M. Fox, R. E. Chen, J. T. Earnest, S. P. Keeler, J. H. Ritter, L.-I. Kang, S. Dort, A. Robichaud, R. Head, M. J. Holtzman, M. S. Diamond, SARS-CoV-2 infection of human ACE2-transgenic mice causes severe lung inflammation and impaired function. Nat. Immunol. 21, 1327-1335 (2020)) трансгенных мышей (фиг. 2E). Анализ титра связывания анти-S IgG, титров нейтрализующих антител, IgG подтипа анти-S и отношения IgG2c:IgG1 (фиг. 2, F к I) у мышей CAG-hACE2 показал результаты, сходные с мышами BALB/c (фиг. 6, C-G). После интраназального заражения WT SARS-CoV-2 вирус не обнаруживался в легких как SFG-, так и SMG-вакцинированных мышей CAG-hACE2 (n = 3) с помощью окрашивания анти-N через 7 дней после заражения (dpi) (фиг. 2J) или медианы инфицирующей дозы культуры тканей (TCID50) при 4 dpi (фиг. 2K), тогда как в контрольной группе наблюдался вирусный титр более 1000 TCID50 (фиг. 2K). Группа SMG (n = 4) показала лучшую (75%) выживаемость, чем SFG (50%) при 14 dpi (фиг. 2, L и M). Затем мы оценили степень защиты, обеспечиваемую вакцинацией SMG, против заражения альфа-вариантом у мышей CAG-hACE2 (n = 5). Мы обнаружили, что вакцинация SMG обеспечивает 100% выживаемость до 14 dpi (фиг. 2, N и O). Мыши, вакцинированные SMG, также показали 60% выживаемость при заражении гамма-вариантом у мышей CAG-hACE2 (n = 5) (фиг. 22 P и Q) и 75% выживаемость при заражении дельта-вариантом у мышей K18-hACE2. (n = 4) (фиг. 4, R и S), тогда как менее 50% мышей, вакцинированных SFG, выжили до 14 dpi при заражении гамма- и дельта-вариантами (фиг. 2, Q-S). Улучшенная защита in vivo, обеспечиваемая вакцинацией SMG, является дополнительным доказательством того, что удаление гликановых экранов из иммуногена является выгодной стратегией для получения превосходного иммунного ответа.
Пример 16. Вакцинация SMG обеспечивает лучшую защиту от смертельной дозы инфекции SARS-CoV-2 у трансгенных мышей hACE2
Трансгенные мыши CAG-hACE2 могут заболеть тяжелыми заболеваниями и погибнуть при заражении вирусом SARS-CoV-2. Две дозы вакцин SFG, SMG или только адъюванта вводили внутримышечно на 0 и 14 сутки, сыворотку брали на 28 и 42 сутки, для интраназального инфицирования каждой мыши использовали 1х103 TCID50 SARS-CoV-2 (фиг. 3а). Титры специфических для шипа антител IgG у мышей, иммунизированных SMG, в 1,9 раза выше, чем в группе SFG (40 000 против 20 000), а титры нейтрализации SMG в 2,8 раза выше, чем в группе SFG (фиг. 3b и 3c). Неожиданно в этой модели тяжелого заболевания вакцинация SFG не смогла защитить трансгенных мышей CAG-hACE2 от тяжелого заболевания, что наблюдалось по быстрому снижению массы тела, и все мыши умерли до 7-го дня после инфицирования вирусом. Прогрессирование заболевания в группе, вакцинированной SFG, было лишь немного лучше, чем в группе, получавшей только адъювант (фиг. 3d и 3e). В противоположность им, группа, вакцинированная SMG, продемонстрировала небольшую потерю веса, и все мыши группы пережили инфекцию SARS-CoV-2. Этот результат демонстрирует превосходство вакцинации SMG на модели трансгенных мышей с тяжелым заболеванием SARS-CoV-2.
Пример 17. Антитела, индуцированные вакциной SMG у мышей, для усиления полноты связывания и нейтрализации и эффективности против вариантов SARS-CoV-2
Затем мы проанализировали, существуют ли различия в ответах антител, вызванных вакцинацией SFG или SMG, которые имеют нативную последовательность шипа из штамма Wuhan, в отношении их способности нейтрализовать недавно появившиеся варианты SARS-CoV-2, вызывающие озабоченность (фиг. 4). По сравнению с SFG, иммунизация SMG вызывала лучшее связывание IgG, специфичного для шипа, не только с нативными шипами WT (штамм Wuhan), но также с вариантами D614G, B.l.1.7, B.1.351, CoV RnGT13 летучих мышей и SARS-CoV-1 (фиг. 4b). Псевдотипированные вирусы вариантов SARS-CoV-2 использовали для оценки способности нейтрализовать инфекции из сыворотки, иммунизированной вакциной. Опять, сыворотки от иммунизации SMG обладают превосходной нейтрализующей способностью по отношению к псевдовирусам D614G, B.1.1.7 и B.1.351, и они в 1,4, 2,7 и 1,5 раза лучше, чем сыворотки, индуцированные SFG, соответственно (фиг. 4c и 4d). Наконец, настоящий вирус SARS-CoV-2 D614G и B.1.1.7 использовали в анализе нейтрализации по уменьшению числа бляшек (фиг. 4e и 4f). Вакцинация SMG вызывает лучший ответ нейтрализующих антител на варианты D614G и B.1.1.7 по сравнению с вакцинацией SFG, и они в 2,0 и 1,4 раза лучше, соответственно.
Пример 18: Гликозилирование влияет на S-белок псевдовируса, взаимодействуя с ACE2 на клетках нескольких типов
Чтобы понять важность гликозилирования, мы экспрессировали S-белок в эпителиальных клетках легких, клетках, первыми подверженных инфицированию, и обнаружили, что сиалирование S-белка необходимо для более высокой авидности к рецептору (фиг. 5А). Аналогичная картина также наблюдалась у S-белка, генерируемого клетками HEK293T (фиг. 5B), и авидность также была снижена у S-белка только с гликанами с высоким содержанием маннозы или в гликоформе со всеми N-гликанами, усеченными до одного N- глюкозамина (GlcNAc) (фиг. 5C). Влияние его гликозилирования было дополнительно изучено с помощью псевдовирусной инфекции в клетках HEK293T, экспрессирующих ангиотензинпревращающий фермент 2 (hACE2) человека, что выявило постоянную тенденцию при применении того же количества вируса (фиг. 5D). Это позволило заключить, что гликаны сложного типа и сиалирование функционально важны для инфицирующей способности, опосредованной S-белком. Также была создана полная панель из 24 вариантов псевдовирусов на основе лентивирусов (содержащих 22 N- и 2 O-сайты гликозилирования) для оценки эффективности проникновения вируса в пять линий клеток, экспрессирующих hACE2, включая HEK293T, Vero-E6, и три линии клеток легких человека, A549, Calu-1 и Calu-3 (фиг. 5, E-G). Эти псевдовирусы были основаны на конструкте S с делецией 19 аминокислот на С-конце, которая давала самый высокий титр вируса. Продукцию псевдовируса количественно определяли с помощью иммуноанализа p24, и результаты нормировали по титру каждого мутантного штамма (фиг. 5F). Каждый аспарагин (Asn) N-сайта гликозилирования был заменен на глутамин (Gln) с целью минимизации структурного влияния из-за их химического сходства, а каждый треонин (Thr) или серин (Ser) G-сайта гликозилирования был заменен на аланин (Ala). Поскольку мутагенез действительно изменил аминокислоты, полученное изменение инфицирующей способности будет происходить из-за коллективных факторов, включая конформационные сдвиги, связанные с гликозилированием, которые влияют на вовлечение рецептора, и поверхностное содержание S-белка, на которое влияет экспрессия, фолдинг и перенос белка. Результаты показали, что нарушение гликозилирования S-белка снижает инфицирующую способность. Существенное снижение наблюдалось для двух мутаций в рецептор-связывающем домене (RBD), N33 IQ и N343Q, а также для мутаций двух О-сайтов гликозилирования (T323A и S325A), несмотря на низкую занятость последнего (фиг. 5G). Кроме того, делеция гликозилирования N122 в N-концевом домене (NTD) приводила к снижению инфицирующей способности и низкой экспрессии белка (фиг. 5G). Две мутации NTD, N149Q и N165Q, повышали инфицирующую способность в клетках Vero-E6 и Calu-1 соответственно, хотя в других клетках наблюдалось снижение числа инфекций (фиг. 5G). Обратите внимание, что гликаны, присоединенные к этому остатку N165, структурно расположены проксимально относительно соседнего RBD в тримерном S-белке, и его мутация снижает связывание ACE2, вероятно, из-за конформационного сдвига RBD в сторону «нижнего» состояния. Мы идентифицировали два мутанта, N801Q и N1194Q (фиг. 5F), которые повсеместно устраняли инфекционность вируса во всех пяти клетках. Сайт гликозилирования N801 расположен вблизи проксимальной области пептида слияния (FPPR), а N1194 находится вблизи центра спирали гептадного повтора 2 (HR2) и является последним N-сайтом гликозилирования, предшествующим трансмембранному домену (фиг. 5Е). Обе эти мутации вызывали экспрессию с низким выходом. Мутант N80IQ был более склонен к деградации, а мутант N1194Q нарушал тримеризацию S-белка, что может частично объяснять снижение инфекционности псевдовирусов, несущих эти мутанты.
Пример 19. S-белок из эпителиальных клеток легких содержит больше сиалированных гликанов сложного типа, а высококонсервативные эпитопы в S-белке в большей степени экранированы гликанами
Анализ профиля гликанов S-белка выявил более высокое содержание гликанов сложного типа (78%) и меньшее количество гликанов гибридного типа (менее 1%) у S-белка в линии эпителиальных клеток легких человека BEAS-2B (фиг. 6A) по сравнению с S-белком, продуцируемым в клеточной линии эпителия почек человека, HEK293T (61 и 23% соответственно) (фиг. 6B). Среди гликанов с высоким содержанием маннозы N-связанный гликан маннозы-5 (man5) был преобладающим типом, обнаруженным в HEK293T-экспрессированном S-белке, хотя он наблюдается только в сайте N61 S-белка из клеток BEAS-2B. Кроме того, гликаны сложного типа в сайтах N74, N149, N282 и N1194 в клетках BEAS-2B подвергались более разнообразному процессингу (множественные антенны, галактозилирование, фукозилирование или сиалирование), чем гликаны в клетках HEK293T. Напротив, гликаны в сайтах N122, N331, N1098 и N1134 были менее разнообразны. Более того, N149 и N17 не содержали коровой фукозы в BEAS-2B. Мы наблюдали в целом более высокую степень сиалирования всех 22 N-сайтов гликозилирования в BEAS-2B (53%), чем в клетках HEK293T (35%), HEK293E (26%) или ранее описанных клетках HEK293F (15%) (Y. Watanabe, J. D. Allen, D. Wrapp, J. S. McLellan, M. Crispin, Site-specific glycan analysis of the SARS-CoV-2 spike. Science 369, 330-333 (2020)). В частности, два N-сайта гликозилирования (N331 и N343) RBD более сиалированы в BEAS-2B (99 и 39%), чем в HEK293T (49 и 15%). Несмотря на различия, S-белок из всех типов клеток содержит гликановый пояс некомплексного типа, расположенный вокруг средней части домена S2 (фиг. 6С), где N-Сайт гликозилирования N801 является критическим для инфекции (фиг. 5G), N1074 содержит различные гликаны, а N717 необходим для экспрессии S-белка.
На основе смоделированной структуры S-белка SARS-CoV-2 и профиля гликанов из клеток BEAS-2B мы провели структурный анализ покрытия гликанами площадей поверхности белка и наложили на результаты множественного выравнивания с использованием 1 117 474 последовательностей S-белка (S. Elbe, G. Buckland-Merrett, Data, disease and diplomacy: GISAID’s innovative contribution to global health. Global Chall. 1, 33-46 (2017)). Было выявлено несколько областей, которые были высококонсервативными, но экранированными гликанами, включая нижний край RBD, стволовую область S2 с гликановым поясом некомплексного типа и С-концевую часть S2, включающую соединительный домен (CD) и HR2 (фиг. 6, D и E). На уровне первичной последовательности эти области были показаны как консервативные эпитопы. Анализ консервативности последовательности также показал, что большинство областей сайта гликозилирования были высококонсервативными, а наиболее консервативными (частота мутаций ниже 0,02%) были области NTD (N61, N122, N165 и N234), RBD (S325, N331 и N343), субдомен 1/2 (SD1/2) (N603 и N657), область стебля субъединицы 2 (S2) (N709, N1098, N1134, N1158, N1173, N1194) и N801 вблизи FPPR. Большинство этих областей содержат от 20 до 40% консервативных поверхностных остатков, и среди них определенный процент остатков был экранирован гликанами: 36% в RBD и около 50% в других областях. Несмотря на отсутствие N-сайтов гликозилирования, в области HR1 69% консервативных поверхностных остатков были покрыты гликанами, происходящими из соседних доменов. Эти результаты подчеркнули важность гликозилирования S-белка как структурно, так и эволюционно, что привело к мысли, что обнажение консервативных областей, экранированных гликанами, может вызывать иммунные ответы против консервативных эпитопов. (Более важно описать 12 консервативных эпитопов в качестве мишеней для дизайна вакцины. 10 из 12 эпитопов экранированы гликанами, а удаление экранированных гликанов открывает консервативные эпитопы, вызывая разнообразные защитные реакции.)
Пример 20. SMG была разработана как вакцина, и вакцина SMG вызывала лучший иммунный ответ при использовании различных подклассов антител
Первоначальная попытка мутировать несколько сайтов гликозилирования привела к заметному снижению экспрессии S-белка. Тем не менее, когда авторы экспрессировали его в клетках GnTI HEK293S, они смогли получить гликоформы S-белка с высоким содержанием маннозы (SHM) с хорошим выходом и чистотой. Затем гликаны обрезали с помощью эндогликозидазы H (Endo H) до одного GlcNAe на каждом N-сайте гликозилирования, что привело к получению растворимого продукта усечения S-белка, покрытого моно-GlcNAc, который назвали SMG (фиг. 7A). В SMG согласно данным масс-спектрометрии все N-сайты гликозилирования в основном заняты одиночными GlcNAc, а загрузка необработанными О-гликанами слишком мала, чтобы их можно было обнаружить. Этот модифицированный SMG и SHM, а также исходный полностью гликозилированный S-белок (SFG) смешали с гидроксидом алюминия (квасцами) в качестве адъюванта и затем использовали для иммунизации мышей BALB/c (n = 5) внутримышечной инъекцией (фиг. 7В). Для сравнения SFG в этом исследовании был экспрессирован клетками HEK293E и содержал разнообразные гликаны, это похоже на иммуногены, используемые во многих существующих в настоящее время вакцинах против COVID-I9, которые либо одобрены, либо проходят клинические исследования, включая экспрессированные клетками насекомых вакцины с S-белком от Sanofi и Novax (P. J. Klasse, D. F. Nixon, J. P. Moore, Imnumogemeity of clinically relevant SARS-CoV-2 vaccines in nonhuman primates and humans. Sci. Adv. 7, eabe8065 (2021)), рекомбинантную S-вакцину из клеток яичника китайского хомяка (CHO) от Medigen (T.-Y, Kuo. M.-Y. Lin, R. L. Coffman, J. D. Campbell, P. Traquina, Y.-J. Lin, L. T.-C. Lin, J. Cheng, Y'.-C. Wu, C.-C. Wu. W.-H. Tang. C.-G. Hoang, K.-C. Tsao, C. Chen, Development of CpG-adjuvanted stable prefusion SARS-CoV-2 spike antigen as a subunit vaccine against COVID-19. Sci. Rep.10, 20085 (2020)), вакцины на основе аденовируса от AstraZeneca и Johnson & Johnson, а также мРНК-вакцины от Pfizer-BioNTech и Moderna (P. J. Klasse, D. F. Nixon. J. P. Moore, Immuhogenicity of clinically relevant SARS-CoV-2 vaccines in nonhuman primates and humans. Sci. Adv. 7, eabe8065 (2021)). Белки SFG и SMG демонстрируют по существу одинаковую трехмерную структуру в растворе, что показано анализом негативного окрашивания.
Мыши, иммунизированные SMG, индуцировали более высокий гуморальный иммунный ответ после второй иммунизации по сравнению с SFG, со значительно более высоким (в 1,44 раза) титром иммуноглобулина G (IgG) против белка S (титр конечной точки: SFG, 39 408 ± 1619; SMG, 56 957 ± 5091; P = 0,0079) (фиг. 7C) и в 3,6 раза более высокую эффективность нейтрализации антител, как показано ингибированием псевдовирусной инфекции SARS-CoV-2 (обратный полумаксимальный титр нейтрализации pNT50: SFG, 1346 ± 285; SMG, 4791 ± 767; P = 0,0159) (фиг. 6D), тогда как группа, иммунизированная SHM, показала такие же титры анти-S IgG (39 086 ± 11 654) и отсутствие различий в титре pNT50 по сравнению с группой SFG. Анализ титра подтипа IgG и продукции интерферона-γ (IFN-γ) или интерлейкина-4 (IL-4) Т-фолликулярными хелперными клетками (Tfh) показал, что вакцина SMG индуцирует больше IgG2a, который является маркером для Т-хелперных 1-клеток (TH1) лимфоцитов у мышей BALB/c, более сбалансированный ответ TH1/TH2 и большее количество клеток Tfh, экспрессирующих IFN-γ, по сравнению с группами, вакцинированными SFG и SHM (фиг. 7, E - J). Более того, вакцина SMG индуцировала более высокую частоту клеток IL-21+ Tfh (фиг. 7K) и повышенную частоту CD8+-T-клеток, продуцирующих гранзим В (фиг. 7L). Эти данные показывают, что SMG вызывает более сильный гуморальный и клеточный адаптивный иммунный ответ по сравнению с ответом, индуцированным SFG. После этого авторы исследовали частоту В-клеток, специфичных к S-белку (CD3-CD19+S+), в селезенке мышей, иммунизированных после третьей дозы SFG или SMG (фиг. 6А), и обнаружили, что мыши, иммунизированные SMG, продуцировали больше S-белок-специфических В-клеток (фиг. 6М). Анализ репертуара В-клеток у мышей, иммунизированных SFG и SMG (n = 5), показал, что в группе SMG использовалось больше генов легкой цепи лямбда по сравнению с группой SFG (SFG, 1,92%; SMG, 9,68%) (фиг. 7N). Кроме того, антитела, полученные из нескольких специфических локусов генов вариабельной области тяжелой цепи Ig (IGHV) (фиг. 7О) и вариабельной области каппа-цепи Ig (IGHV) (фиг. 7P), были более представлены в группе SMG, чем в группе SFG, особенно ген IGHV1-18 (фиг. 7О). Это открытие свидетельствует о том, что эпитопы В-клеток могут обрабатываться по-разному в этих двух группах, и остается еще исследовать, является ли это различие иммунологически полезным и почему. Кроме того, трехдозовая вакцинация SMG вызывала более высокий конечный титр IgG, чем двухдозовая вакцинация против S-белка дикого типа (WT) (конечный титр: SFG, 208 911 ± 50 092; SMG, 376 410 ± 80 873). Мы наблюдали различия между группами SMG и SFG в кривых связывания IgG в сыворотке, измеренных с помощью твердофазного иммуноферментного анализа (ELISA) против S-белка из VOC SARS-CoV-2 (P. R. Kraisse, T. R. Fleming, I. M. Longing R. Peto, S. Briand, D. L. Heymann, V. Beral, M. D. Snape, H. Rees, A.-M, Ropero, R. D. Ralicer, j. P. Cramer, C. Munoz-Fonteia, M. Gruber, R. Gaspar, J. A. Singh, K. Suhbarao, M. D. Van Kerkhove, S. Swatninathan, M. J. Ryan, A.-M. Henao-Restrepo, SARS-CoV-2 variants and vaccines. N. Engl. J Med 385, 179-186 (2021)), включая альфа (B.1.1.7; P = 0,0488), бета (B.1.351; P = 0,0010), гамма (P.1, P = 0,0068) и дельта (B.1.617.2; P = 0,0068), но не обнаружили никаких статистических различий в анализе титров конечной точки (фиг. 7Q). Также наблюдались различия в ответах нейтрализующих антител против VOC по кривой нейтрализации псевдовирусов, включая альфа (P = 0,0156), бета (P = 0,0156) и дельта (P = 0,0078), но никаких различий не наблюдалось в значения титра pNT50 нейтрализации псевдовируса или аутентичного вируса (фиг. 7, R и S) по сравнению с SFG.
Пример 21. Антитело широкого нейтрализующего действия было выделено из В-клеток мышей, иммунизированных SMG
Сортировка В-клеток, специфичных к S-белку, от мышей, иммунизированных SMG, привела к выявлению моноклонального антитела (mAb) m31A7 из амплифицированных клонов IGHV1-18, подмножества, которое уникально распространено в репертуаре В-клеток, иммунизированных SMG (фиг. 8О). Это mAb взаимодействует с полноразмерным S-белком, SI и RBD, но не с S2 (фиг. 8A), и связывается с клетками HEK293T, которые экспрессируют S-белок из разных вариантов SARS-CoV-2 (фиг. 8B). Кроме того, было показано, что m31A7 нейтрализует различные варианты псевдовируса (WT, D614G, альфа, бета и дельта) при субпикомолярной полумаксимальной ингибирующей концентрации (IC50), до 1000 раз превышающей описанную для mAb человека EY6A (фиг. 8C). Профилактическое исследование также продемонстрировало хорошую эффективность m31A7 in vivo у мышей K18-hACE2 (n = 3), зараженных WT SARS-CoV-2 (фиг. 8D). Мыши, получавшие профилактическое лечение, сохраняли как массу тела, так и температуру (фиг. 8, E и F). Интерферометрический анализ биослоя (BLI) использовали для измерения констант диссоциации m31A7 и его Fab-связывания с белком S при 70,9 пМ и 4,66 нМ соответственно (фиг. 8G). Картирование эпитопа с помощью масс-спектрометрии водородно-дейтериевого обмена (HDX-MS) выявило области его потенциального связывания в RBD (фиг. 8H), которые перекрываются с наблюдаемым эпитопом в кристаллической структуре RBD в комплексе с m31A7-Fab. Структура, полученная методом криоэлектронной микроскопии (EM), дополнительно прояснила связывание m31A7 только с RBD в «верхнем» состоянии (фиг. 8I), с N165-гликаном из соседнего NTD вблизи интерфейса RBD-m31A7 (фиг. 8J). Образ m31A7 в RBD аналогичен образу mAb класса VH1-58 человека (фиг. 8K), но он приближается к RBD под другим углом, со смещенными локальными контактными областями на кончике петли, минуя большинство ключевых мутировавших остатков VOC, таких как E484 и K417, но не T478 (фиг. 8F). Подробный интерфейс RBD-m31A7 и ингибирующий механизм этого mAb, индуцированного SMG, находятся в стадии дальнейшего изучения.
Пример 22. Вакцинация Дельта SMG вызвала большее количество нейтрализующих антител против варианта псевдовируса SARS-CoV-2
Экспрессионный конструкт белка SMG дельта-варианта SARS-CoV-2:


Сигнальный пептид из A/Brisbane/59/2007(HlNl)): MKVKLLVLLCTFTATYAGT (SEQ ID NO: 4)

Метка His: HHHHHHJSEQ ID NO: 8)
Мышей BALB/c (n=5) дважды иммунизировали на неделе 0 и неделе 2 вакциной Дельта SFG или SMG. Сыворотку собирали на 6-й неделе и впоследствии изучали нейтрализующую способность с использованием анализа на псевдовирусы (фиг. 9А). Псевдотипированные вирусы дельта-вариантов SARS-CoV-2 использовали для оценки способности нейтрализовать инфекции из сыворотки, иммунизированной вакциной. Опять же, сыворотка после иммунизации SMG обладает превосходной способностью нейтрализовать псевдовирусы WT, альфа, бета, гамма, дельта и омикрон. Их соответствующие титры дельта SFG в сравнении с SMG (pNT50, более высокий лучше) составляют 1018 в сравнении с 3336 (против псевдовируса WT), 1396 в сравнении с 2680 (против альфа-псевдовируса), 337 в сравнении с 2282 (против бета-псевдовируса), 814 в сравнении с 4424 (против гамма-псевдовируса), 1138 в сравнении с 6680 (против дельта-псевдовируса) и 144 в сравнении с 2628 (против псевдовируса омикрон), соответственно.
Пример 23. Вакцинация дельта или WT SMG вызывала большее количество нейтрализующих антител против псевдовируса варианта SARS-CoV-2 омикрон
Мышей BALB/c (n=5) дважды иммунизировали на неделе 0 и неделе 2 вакциной дельта/WT SFG или SMG. Сыворотку собирали на 6-й неделе и впоследствии тестировали нейтрализующую способность с использованием анализа с псевдовирусами (фиг. 10А). Псевдотипированные вирусы варианта SARS-CoV-2 Омикрон использовали для оценки способности нейтрализовать инфекции из сыворотки, иммунизированной вакциной, либо из WT SFG/SMG, либо из дельта SFG/SMG. Вакцинация WT SFG не вызывает нейтрализации против псевдовируса Омикрон, в то время как WT SMG обеспечивает небольшую защиту. Аналогично, вакцинация дельта SFG вызывает небольшую нейтрализацию псевдовирусной инфекции Омикрон, однако дельта SMG обеспечивает превосходную нейтрализацию.
Пример 24. Белок Дельта SMG можно хранить при комнатной температуре в растворе или в виде порошка
Белок дельта SMG в фосфатно-солевом буфере с добавлением двух аминокислот (pbs-aa), 50 мМ L-аргинина и 50 мМ L-глутамата, фильтровали через фильтр 0,22 мкм и хранили при комнатной температуре (КТ) или 4°C. Белки собирали в разные моменты времени, включая 3, 7, 14, 21 день и 3 месяца. Собранные образцы смешивали с красителем 5X SDS-PAGE Loading Dye, нагревали при 100°C в течение 5 минут и хранили при 4°C до появления геля (фиг. 11 A и B). ФСБ с 50 мМ L-аргинина и 50 мМ L-глутамата или без них тестировали на сохранение дельта SHM или SMG (первые 3 дорожки) при 4°C. Дельта-SMG тестировали на лиофилизацию с вспомогательным веществом или без него и хранили при комнатной температуре в течение более 2 недель (последние 2 дорожки) (фиг. 11С). Анализ на стабильность показывает, что белок Дельта SMG можно хранить в растворе, и он стабилен как при комнатной температуре, так и при 4 градусах C в течение не менее 21 дня. Более того, дельта SMG можно лиофилизировать и хранить при комнатной температуре, сохраняя стабильность не менее 3 месяцев.
Последовательности
SEQ ID NO: 1
QCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIVNNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLEGKQG NFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETKCTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVWLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVSVITPGTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSYECDIPIGAGICASYQTQTNSPRRARSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDCLGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAMQMAYRFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQDWNQNAQALNTLVKQLSSNFGAISSVLNDILSRLDKVEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGWFLHVTYVPAQEKNFTTAPAICHDGKAHFPREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDWIGIVNNTVYDPLQPELDSFKEELD KYFKNHTSPDVDLGDISGINASWNIQKEIDRLNEVAKNLNESLIDLQELGKYEQY
SEQ ID NO: 2
QCVNLRTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIVNNATNWIKVCEFQFCNDPFLDVYYHKNNKSWMESGVYSSANNCTFEYVSQPFLMDLEGKQGNFKNLREFVFKNIDGY FKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAA YYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETKCTLKSFTVEKGIYQTSNFRVQPTESIVR FPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCF TNVYADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYRYRLF RKSNLKPFERDISTEIYQAGSKPCNGVEGFNCYFPLQSYGFQPTNGVGYQPYRVWLSFELLHA PATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEI LDITPCSFGGVSVITPGTNTSNQVAVLYQGVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAG CLIGAEHVNNSYECDIPIGAGICASYQTQTNSRGSAGSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDC LGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAMQMAY RFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQNWNQNAQALNTLVKQLSS NFGAISSVLNDILSRLDPPEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSEC VLGQSKRVDFCGKGYHLMSFPQSAPHGWFLHVTYVPAQEKNFTTAPAICHDGKAHFPREGVFV SNGTHWFVTQRNFYEPQIITTDNTFVSGNCDWIGIVNNTVYDPLQPELDSFKEELDKYFKNHT SPDVDLGDIS GINASWNIQKEIDRLNEVAKNLNE S LIDLQELGKYEQ
Экспрессионный конструкт белка SMG дельта-варианта SARS-CoV-2
SEQ ID NO:3

Сигнальный пептид, модифицированный из A/Brisbane/59/2007(HlNl)
MKVKLLVLLCTFTATYAGT (SEQ ID NO: 4)
Сайт расщепления тромбина
LVPRGS (SEQ ID NO: 5)
T4 фолдон
PGSGYIPEAPRDGQAYVRKDGEWVLLSTFLG (SEQ ID NO: 6)
Сайт расщепления HRV3C
GSGSLEVLFQGP (SEQ ID NO: 7)
Метка His
HHHHHH (SEQ ID NO: 8)
Остатки, заменяющие оригинальный сайт расщепления фурина
GSAG (SEQ ID NO: 9)
Высококонсервативные эпитопы
TESIVRFPNITNL (SEQ ID NO.: 41)
NITNLCPFGEVFNATR (SEQ ID NO: 42)
LYNSASFSTFK (SEQ ID NO: 43)
LDSKVGGNYN (SEQ ID NO: 44)
KSNLKPFERDIST (SEQ ID NO: 45)
KPFERDISTEIYQAG (SEQ ID NO: 46)
GPKKSTNLVKNKC (SEQ ID NO: 47)
N CD V VIGIVNNT V Y (SEQ ID NO: 48)
PELDSFKEELDKYFKNHTS (SEQ ID NO: 49)
VNIQKEIDRLNEVA (SEQ ID NO: 50)
NLNESLIDLQ (SEQ ID NO: 51)
LGKYEQYIKWP (SEQ ID NO: 52)
--->
РЎРџРРЎРћРљ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АКАДЕМРРђ РЎРРќРРљРђ
МА, Чэ
ВОН, Чи-Хуэй
РҐРЈРђРќ, Хань-Р
<120> УСОВЕРШЕНСТВОВАННАЯ РљРћР РћРќРђР’РР РЈРЎРќРђРЇ Р’РђРљР¦РРќРђ
<130> G4590-16000PCT
<140> PCT/US2022/071682
<141> 2022-04-12
<150> US 63/173,752
<151> 2021-04-12
<150> US 63/190,199
<151> 2021-05-18
<160> 52
<170> PatentIn version 3.5
<210> 1
<211> 1196
<212> PRT
<213> SARS-CoV-2
<400> 1
Gln Cys Val Asn Leu Thr Thr Arg Thr Gln Leu Pro Pro Ala Tyr Thr
1 5 10 15
Asn Ser Phe Thr Arg Gly Val Tyr Tyr Pro Asp Lys Val Phe Arg Ser
20 25 30
Ser Val Leu His Ser Thr Gln Asp Leu Phe Leu Pro Phe Phe Ser Asn
35 40 45
Val Thr Trp Phe His Ala Ile His Val Ser Gly Thr Asn Gly Thr Lys
50 55 60
Arg Phe Asp Asn Pro Val Leu Pro Phe Asn Asp Gly Val Tyr Phe Ala
65 70 75 80
Ser Thr Glu Lys Ser Asn Ile Ile Arg Gly Trp Ile Phe Gly Thr Thr
85 90 95
Leu Asp Ser Lys Thr Gln Ser Leu Leu Ile Val Asn Asn Ala Thr Asn
100 105 110
Val Val Ile Lys Val Cys Glu Phe Gln Phe Cys Asn Asp Pro Phe Leu
115 120 125
Gly Val Tyr Tyr His Lys Asn Asn Lys Ser Trp Met Glu Ser Glu Phe
130 135 140
Arg Val Tyr Ser Ser Ala Asn Asn Cys Thr Phe Glu Tyr Val Ser Gln
145 150 155 160
Pro Phe Leu Met Asp Leu Glu Gly Lys Gln Gly Asn Phe Lys Asn Leu
165 170 175
Arg Glu Phe Val Phe Lys Asn Ile Asp Gly Tyr Phe Lys Ile Tyr Ser
180 185 190
Lys His Thr Pro Ile Asn Leu Val Arg Asp Leu Pro Gln Gly Phe Ser
195 200 205
Ala Leu Glu Pro Leu Val Asp Leu Pro Ile Gly Ile Asn Ile Thr Arg
210 215 220
Phe Gln Thr Leu Leu Ala Leu His Arg Ser Tyr Leu Thr Pro Gly Asp
225 230 235 240
Ser Ser Ser Gly Trp Thr Ala Gly Ala Ala Ala Tyr Tyr Val Gly Tyr
245 250 255
Leu Gln Pro Arg Thr Phe Leu Leu Lys Tyr Asn Glu Asn Gly Thr Ile
260 265 270
Thr Asp Ala Val Asp Cys Ala Leu Asp Pro Leu Ser Glu Thr Lys Cys
275 280 285
Thr Leu Lys Ser Phe Thr Val Glu Lys Gly Ile Tyr Gln Thr Ser Asn
290 295 300
Phe Arg Val Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr
305 310 315 320
Asn Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala Ser
325 330 335
Val Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp Tyr
340 345 350
Ser Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr Gly
355 360 365
Val Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala
370 375 380
Asp Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro Gly
385 390 395 400
Gln Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp Phe
405 410 415
Thr Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys Val
420 425 430
Gly Gly Asn Tyr Asn Tyr Leu Tyr Arg Leu Phe Arg Lys Ser Asn Leu
435 440 445
Lys Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly Ser
450 455 460
Thr Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu Gln
465 470 475 480
Ser Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr Arg
485 490 495
Val Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val Cys
500 505 510
Gly Pro Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn Phe
515 520 525
Asn Phe Asn Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn Lys
530 535 540
Lys Phe Leu Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr Thr
545 550 555 560
Asp Ala Val Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr Pro
565 570 575
Cys Ser Phe Gly Gly Val Ser Val Ile Thr Pro Gly Thr Asn Thr Ser
580 585 590
Asn Gln Val Ala Val Leu Tyr Gln Asp Val Asn Cys Thr Glu Val Pro
595 600 605
Val Ala Ile His Ala Asp Gln Leu Thr Pro Thr Trp Arg Val Tyr Ser
610 615 620
Thr Gly Ser Asn Val Phe Gln Thr Arg Ala Gly Cys Leu Ile Gly Ala
625 630 635 640
Glu His Val Asn Asn Ser Tyr Glu Cys Asp Ile Pro Ile Gly Ala Gly
645 650 655
Ile Cys Ala Ser Tyr Gln Thr Gln Thr Asn Ser Pro Arg Arg Ala Arg
660 665 670
Ser Val Ala Ser Gln Ser Ile Ile Ala Tyr Thr Met Ser Leu Gly Ala
675 680 685
Glu Asn Ser Val Ala Tyr Ser Asn Asn Ser Ile Ala Ile Pro Thr Asn
690 695 700
Phe Thr Ile Ser Val Thr Thr Glu Ile Leu Pro Val Ser Met Thr Lys
705 710 715 720
Thr Ser Val Asp Cys Thr Met Tyr Ile Cys Gly Asp Ser Thr Glu Cys
725 730 735
Ser Asn Leu Leu Leu Gln Tyr Gly Ser Phe Cys Thr Gln Leu Asn Arg
740 745 750
Ala Leu Thr Gly Ile Ala Val Glu Gln Asp Lys Asn Thr Gln Glu Val
755 760 765
Phe Ala Gln Val Lys Gln Ile Tyr Lys Thr Pro Pro Ile Lys Asp Phe
770 775 780
Gly Gly Phe Asn Phe Ser Gln Ile Leu Pro Asp Pro Ser Lys Pro Ser
785 790 795 800
Lys Arg Ser Phe Ile Glu Asp Leu Leu Phe Asn Lys Val Thr Leu Ala
805 810 815
Asp Ala Gly Phe Ile Lys Gln Tyr Gly Asp Cys Leu Gly Asp Ile Ala
820 825 830
Ala Arg Asp Leu Ile Cys Ala Gln Lys Phe Asn Gly Leu Thr Val Leu
835 840 845
Pro Pro Leu Leu Thr Asp Glu Met Ile Ala Gln Tyr Thr Ser Ala Leu
850 855 860
Leu Ala Gly Thr Ile Thr Ser Gly Trp Thr Phe Gly Ala Gly Ala Ala
865 870 875 880
Leu Gln Ile Pro Phe Ala Met Gln Met Ala Tyr Arg Phe Asn Gly Ile
885 890 895
Gly Val Thr Gln Asn Val Leu Tyr Glu Asn Gln Lys Leu Ile Ala Asn
900 905 910
Gln Phe Asn Ser Ala Ile Gly Lys Ile Gln Asp Ser Leu Ser Ser Thr
915 920 925
Ala Ser Ala Leu Gly Lys Leu Gln Asp Val Val Asn Gln Asn Ala Gln
930 935 940
Ala Leu Asn Thr Leu Val Lys Gln Leu Ser Ser Asn Phe Gly Ala Ile
945 950 955 960
Ser Ser Val Leu Asn Asp Ile Leu Ser Arg Leu Asp Lys Val Glu Ala
965 970 975
Glu Val Gln Ile Asp Arg Leu Ile Thr Gly Arg Leu Gln Ser Leu Gln
980 985 990
Thr Tyr Val Thr Gln Gln Leu Ile Arg Ala Ala Glu Ile Arg Ala Ser
995 1000 1005
Ala Asn Leu Ala Ala Thr Lys Met Ser Glu Cys Val Leu Gly Gln
1010 1015 1020
Ser Lys Arg Val Asp Phe Cys Gly Lys Gly Tyr His Leu Met Ser
1025 1030 1035
Phe Pro Gln Ser Ala Pro His Gly Val Val Phe Leu His Val Thr
1040 1045 1050
Tyr Val Pro Ala Gln Glu Lys Asn Phe Thr Thr Ala Pro Ala Ile
1055 1060 1065
Cys His Asp Gly Lys Ala His Phe Pro Arg Glu Gly Val Phe Val
1070 1075 1080
Ser Asn Gly Thr His Trp Phe Val Thr Gln Arg Asn Phe Tyr Glu
1085 1090 1095
Pro Gln Ile Ile Thr Thr Asp Asn Thr Phe Val Ser Gly Asn Cys
1100 1105 1110
Asp Val Val Ile Gly Ile Val Asn Asn Thr Val Tyr Asp Pro Leu
1115 1120 1125
Gln Pro Glu Leu Asp Ser Phe Lys Glu Glu Leu Asp Lys Tyr Phe
1130 1135 1140
Lys Asn His Thr Ser Pro Asp Val Asp Leu Gly Asp Ile Ser Gly
1145 1150 1155
Ile Asn Ala Ser Val Val Asn Ile Gln Lys Glu Ile Asp Arg Leu
1160 1165 1170
Asn Glu Val Ala Lys Asn Leu Asn Glu Ser Leu Ile Asp Leu Gln
1175 1180 1185
Glu Leu Gly Lys Tyr Glu Gln Tyr
1190 1195
<210> 2
<211> 1193
<212> PRT
<213> SARS-CoV-2
<400> 2
Gln Cys Val Asn Leu Arg Thr Arg Thr Gln Leu Pro Pro Ala Tyr Thr
1 5 10 15
Asn Ser Phe Thr Arg Gly Val Tyr Tyr Pro Asp Lys Val Phe Arg Ser
20 25 30
Ser Val Leu His Ser Thr Gln Asp Leu Phe Leu Pro Phe Phe Ser Asn
35 40 45
Val Thr Trp Phe His Ala Ile His Val Ser Gly Thr Asn Gly Thr Lys
50 55 60
Arg Phe Asp Asn Pro Val Leu Pro Phe Asn Asp Gly Val Tyr Phe Ala
65 70 75 80
Ser Thr Glu Lys Ser Asn Ile Ile Arg Gly Trp Ile Phe Gly Thr Thr
85 90 95
Leu Asp Ser Lys Thr Gln Ser Leu Leu Ile Val Asn Asn Ala Thr Asn
100 105 110
Val Val Ile Lys Val Cys Glu Phe Gln Phe Cys Asn Asp Pro Phe Leu
115 120 125
Asp Val Tyr Tyr His Lys Asn Asn Lys Ser Trp Met Glu Ser Gly Val
130 135 140
Tyr Ser Ser Ala Asn Asn Cys Thr Phe Glu Tyr Val Ser Gln Pro Phe
145 150 155 160
Leu Met Asp Leu Glu Gly Lys Gln Gly Asn Phe Lys Asn Leu Arg Glu
165 170 175
Phe Val Phe Lys Asn Ile Asp Gly Tyr Phe Lys Ile Tyr Ser Lys His
180 185 190
Thr Pro Ile Asn Leu Val Arg Asp Leu Pro Gln Gly Phe Ser Ala Leu
195 200 205
Glu Pro Leu Val Asp Leu Pro Ile Gly Ile Asn Ile Thr Arg Phe Gln
210 215 220
Thr Leu Leu Ala Leu His Arg Ser Tyr Leu Thr Pro Gly Asp Ser Ser
225 230 235 240
Ser Gly Trp Thr Ala Gly Ala Ala Ala Tyr Tyr Val Gly Tyr Leu Gln
245 250 255
Pro Arg Thr Phe Leu Leu Lys Tyr Asn Glu Asn Gly Thr Ile Thr Asp
260 265 270
Ala Val Asp Cys Ala Leu Asp Pro Leu Ser Glu Thr Lys Cys Thr Leu
275 280 285
Lys Ser Phe Thr Val Glu Lys Gly Ile Tyr Gln Thr Ser Asn Phe Arg
290 295 300
Val Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr Asn Leu
305 310 315 320
Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala Ser Val Tyr
325 330 335
Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp Tyr Ser Val
340 345 350
Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr Gly Val Ser
355 360 365
Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala Asp Ser
370 375 380
Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro Gly Gln Thr
385 390 395 400
Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp Phe Thr Gly
405 410 415
Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys Val Gly Gly
420 425 430
Asn Tyr Asn Tyr Arg Tyr Arg Leu Phe Arg Lys Ser Asn Leu Lys Pro
435 440 445
Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly Ser Lys Pro
450 455 460
Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu Gln Ser Tyr
465 470 475 480
Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr Arg Val Val
485 490 495
Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val Cys Gly Pro
500 505 510
Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn Phe Asn Phe
515 520 525
Asn Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn Lys Lys Phe
530 535 540
Leu Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr Thr Asp Ala
545 550 555 560
Val Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr Pro Cys Ser
565 570 575
Phe Gly Gly Val Ser Val Ile Thr Pro Gly Thr Asn Thr Ser Asn Gln
580 585 590
Val Ala Val Leu Tyr Gln Gly Val Asn Cys Thr Glu Val Pro Val Ala
595 600 605
Ile His Ala Asp Gln Leu Thr Pro Thr Trp Arg Val Tyr Ser Thr Gly
610 615 620
Ser Asn Val Phe Gln Thr Arg Ala Gly Cys Leu Ile Gly Ala Glu His
625 630 635 640
Val Asn Asn Ser Tyr Glu Cys Asp Ile Pro Ile Gly Ala Gly Ile Cys
645 650 655
Ala Ser Tyr Gln Thr Gln Thr Asn Ser Arg Gly Ser Ala Gly Ser Val
660 665 670
Ala Ser Gln Ser Ile Ile Ala Tyr Thr Met Ser Leu Gly Ala Glu Asn
675 680 685
Ser Val Ala Tyr Ser Asn Asn Ser Ile Ala Ile Pro Thr Asn Phe Thr
690 695 700
Ile Ser Val Thr Thr Glu Ile Leu Pro Val Ser Met Thr Lys Thr Ser
705 710 715 720
Val Asp Cys Thr Met Tyr Ile Cys Gly Asp Ser Thr Glu Cys Ser Asn
725 730 735
Leu Leu Leu Gln Tyr Gly Ser Phe Cys Thr Gln Leu Asn Arg Ala Leu
740 745 750
Thr Gly Ile Ala Val Glu Gln Asp Lys Asn Thr Gln Glu Val Phe Ala
755 760 765
Gln Val Lys Gln Ile Tyr Lys Thr Pro Pro Ile Lys Asp Phe Gly Gly
770 775 780
Phe Asn Phe Ser Gln Ile Leu Pro Asp Pro Ser Lys Pro Ser Lys Arg
785 790 795 800
Ser Phe Ile Glu Asp Leu Leu Phe Asn Lys Val Thr Leu Ala Asp Ala
805 810 815
Gly Phe Ile Lys Gln Tyr Gly Asp Cys Leu Gly Asp Ile Ala Ala Arg
820 825 830
Asp Leu Ile Cys Ala Gln Lys Phe Asn Gly Leu Thr Val Leu Pro Pro
835 840 845
Leu Leu Thr Asp Glu Met Ile Ala Gln Tyr Thr Ser Ala Leu Leu Ala
850 855 860
Gly Thr Ile Thr Ser Gly Trp Thr Phe Gly Ala Gly Ala Ala Leu Gln
865 870 875 880
Ile Pro Phe Ala Met Gln Met Ala Tyr Arg Phe Asn Gly Ile Gly Val
885 890 895
Thr Gln Asn Val Leu Tyr Glu Asn Gln Lys Leu Ile Ala Asn Gln Phe
900 905 910
Asn Ser Ala Ile Gly Lys Ile Gln Asp Ser Leu Ser Ser Thr Ala Ser
915 920 925
Ala Leu Gly Lys Leu Gln Asn Val Val Asn Gln Asn Ala Gln Ala Leu
930 935 940
Asn Thr Leu Val Lys Gln Leu Ser Ser Asn Phe Gly Ala Ile Ser Ser
945 950 955 960
Val Leu Asn Asp Ile Leu Ser Arg Leu Asp Pro Pro Glu Ala Glu Val
965 970 975
Gln Ile Asp Arg Leu Ile Thr Gly Arg Leu Gln Ser Leu Gln Thr Tyr
980 985 990
Val Thr Gln Gln Leu Ile Arg Ala Ala Glu Ile Arg Ala Ser Ala Asn
995 1000 1005
Leu Ala Ala Thr Lys Met Ser Glu Cys Val Leu Gly Gln Ser Lys
1010 1015 1020
Arg Val Asp Phe Cys Gly Lys Gly Tyr His Leu Met Ser Phe Pro
1025 1030 1035
Gln Ser Ala Pro His Gly Val Val Phe Leu His Val Thr Tyr Val
1040 1045 1050
Pro Ala Gln Glu Lys Asn Phe Thr Thr Ala Pro Ala Ile Cys His
1055 1060 1065
Asp Gly Lys Ala His Phe Pro Arg Glu Gly Val Phe Val Ser Asn
1070 1075 1080
Gly Thr His Trp Phe Val Thr Gln Arg Asn Phe Tyr Glu Pro Gln
1085 1090 1095
Ile Ile Thr Thr Asp Asn Thr Phe Val Ser Gly Asn Cys Asp Val
1100 1105 1110
Val Ile Gly Ile Val Asn Asn Thr Val Tyr Asp Pro Leu Gln Pro
1115 1120 1125
Glu Leu Asp Ser Phe Lys Glu Glu Leu Asp Lys Tyr Phe Lys Asn
1130 1135 1140
His Thr Ser Pro Asp Val Asp Leu Gly Asp Ile Ser Gly Ile Asn
1145 1150 1155
Ala Ser Val Val Asn Ile Gln Lys Glu Ile Asp Arg Leu Asn Glu
1160 1165 1170
Val Ala Lys Asn Leu Asn Glu Ser Leu Ile Asp Leu Gln Glu Leu
1175 1180 1185
Gly Lys Tyr Glu Gln
1190
<210> 3
<211> 1271
<212> PRT
<213> SARS-CoV-2 (Delta strain)
<400> 3
Met Lys Val Lys Leu Leu Val Leu Leu Cys Thr Phe Thr Ala Thr Tyr
1 5 10 15
Ala Gly Thr Gln Cys Val Asn Leu Arg Thr Arg Thr Gln Leu Pro Pro
20 25 30
Ala Tyr Thr Asn Ser Phe Thr Arg Gly Val Tyr Tyr Pro Asp Lys Val
35 40 45
Phe Arg Ser Ser Val Leu His Ser Thr Gln Asp Leu Phe Leu Pro Phe
50 55 60
Phe Ser Asn Val Thr Trp Phe His Ala Ile His Val Ser Gly Thr Asn
65 70 75 80
Gly Thr Lys Arg Phe Asp Asn Pro Val Leu Pro Phe Asn Asp Gly Val
85 90 95
Tyr Phe Ala Ser Thr Glu Lys Ser Asn Ile Ile Arg Gly Trp Ile Phe
100 105 110
Gly Thr Thr Leu Asp Ser Lys Thr Gln Ser Leu Leu Ile Val Asn Asn
115 120 125
Ala Thr Asn Val Val Ile Lys Val Cys Glu Phe Gln Phe Cys Asn Asp
130 135 140
Pro Phe Leu Asp Val Tyr Tyr His Lys Asn Asn Lys Ser Trp Met Glu
145 150 155 160
Ser Gly Val Tyr Ser Ser Ala Asn Asn Cys Thr Phe Glu Tyr Val Ser
165 170 175
Gln Pro Phe Leu Met Asp Leu Glu Gly Lys Gln Gly Asn Phe Lys Asn
180 185 190
Leu Arg Glu Phe Val Phe Lys Asn Ile Asp Gly Tyr Phe Lys Ile Tyr
195 200 205
Ser Lys His Thr Pro Ile Asn Leu Val Arg Asp Leu Pro Gln Gly Phe
210 215 220
Ser Ala Leu Glu Pro Leu Val Asp Leu Pro Ile Gly Ile Asn Ile Thr
225 230 235 240
Arg Phe Gln Thr Leu Leu Ala Leu His Arg Ser Tyr Leu Thr Pro Gly
245 250 255
Asp Ser Ser Ser Gly Trp Thr Ala Gly Ala Ala Ala Tyr Tyr Val Gly
260 265 270
Tyr Leu Gln Pro Arg Thr Phe Leu Leu Lys Tyr Asn Glu Asn Gly Thr
275 280 285
Ile Thr Asp Ala Val Asp Cys Ala Leu Asp Pro Leu Ser Glu Thr Lys
290 295 300
Cys Thr Leu Lys Ser Phe Thr Val Glu Lys Gly Ile Tyr Gln Thr Ser
305 310 315 320
Asn Phe Arg Val Gln Pro Thr Glu Ser Ile Val Arg Phe Pro Asn Ile
325 330 335
Thr Asn Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg Phe Ala
340 345 350
Ser Val Tyr Ala Trp Asn Arg Lys Arg Ile Ser Asn Cys Val Ala Asp
355 360 365
Tyr Ser Val Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys Cys Tyr
370 375 380
Gly Val Ser Pro Thr Lys Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr
385 390 395 400
Ala Asp Ser Phe Val Ile Arg Gly Asp Glu Val Arg Gln Ile Ala Pro
405 410 415
Gly Gln Thr Gly Lys Ile Ala Asp Tyr Asn Tyr Lys Leu Pro Asp Asp
420 425 430
Phe Thr Gly Cys Val Ile Ala Trp Asn Ser Asn Asn Leu Asp Ser Lys
435 440 445
Val Gly Gly Asn Tyr Asn Tyr Arg Tyr Arg Leu Phe Arg Lys Ser Asn
450 455 460
Leu Lys Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly
465 470 475 480
Ser Lys Pro Cys Asn Gly Val Glu Gly Phe Asn Cys Tyr Phe Pro Leu
485 490 495
Gln Ser Tyr Gly Phe Gln Pro Thr Asn Gly Val Gly Tyr Gln Pro Tyr
500 505 510
Arg Val Val Val Leu Ser Phe Glu Leu Leu His Ala Pro Ala Thr Val
515 520 525
Cys Gly Pro Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys Val Asn
530 535 540
Phe Asn Phe Asn Gly Leu Thr Gly Thr Gly Val Leu Thr Glu Ser Asn
545 550 555 560
Lys Lys Phe Leu Pro Phe Gln Gln Phe Gly Arg Asp Ile Ala Asp Thr
565 570 575
Thr Asp Ala Val Arg Asp Pro Gln Thr Leu Glu Ile Leu Asp Ile Thr
580 585 590
Pro Cys Ser Phe Gly Gly Val Ser Val Ile Thr Pro Gly Thr Asn Thr
595 600 605
Ser Asn Gln Val Ala Val Leu Tyr Gln Gly Val Asn Cys Thr Glu Val
610 615 620
Pro Val Ala Ile His Ala Asp Gln Leu Thr Pro Thr Trp Arg Val Tyr
625 630 635 640
Ser Thr Gly Ser Asn Val Phe Gln Thr Arg Ala Gly Cys Leu Ile Gly
645 650 655
Ala Glu His Val Asn Asn Ser Tyr Glu Cys Asp Ile Pro Ile Gly Ala
660 665 670
Gly Ile Cys Ala Ser Tyr Gln Thr Gln Thr Asn Ser Arg Gly Ser Ala
675 680 685
Gly Ser Val Ala Ser Gln Ser Ile Ile Ala Tyr Thr Met Ser Leu Gly
690 695 700
Ala Glu Asn Ser Val Ala Tyr Ser Asn Asn Ser Ile Ala Ile Pro Thr
705 710 715 720
Asn Phe Thr Ile Ser Val Thr Thr Glu Ile Leu Pro Val Ser Met Thr
725 730 735
Lys Thr Ser Val Asp Cys Thr Met Tyr Ile Cys Gly Asp Ser Thr Glu
740 745 750
Cys Ser Asn Leu Leu Leu Gln Tyr Gly Ser Phe Cys Thr Gln Leu Asn
755 760 765
Arg Ala Leu Thr Gly Ile Ala Val Glu Gln Asp Lys Asn Thr Gln Glu
770 775 780
Val Phe Ala Gln Val Lys Gln Ile Tyr Lys Thr Pro Pro Ile Lys Asp
785 790 795 800
Phe Gly Gly Phe Asn Phe Ser Gln Ile Leu Pro Asp Pro Ser Lys Pro
805 810 815
Ser Lys Arg Ser Phe Ile Glu Asp Leu Leu Phe Asn Lys Val Thr Leu
820 825 830
Ala Asp Ala Gly Phe Ile Lys Gln Tyr Gly Asp Cys Leu Gly Asp Ile
835 840 845
Ala Ala Arg Asp Leu Ile Cys Ala Gln Lys Phe Asn Gly Leu Thr Val
850 855 860
Leu Pro Pro Leu Leu Thr Asp Glu Met Ile Ala Gln Tyr Thr Ser Ala
865 870 875 880
Leu Leu Ala Gly Thr Ile Thr Ser Gly Trp Thr Phe Gly Ala Gly Ala
885 890 895
Ala Leu Gln Ile Pro Phe Ala Met Gln Met Ala Tyr Arg Phe Asn Gly
900 905 910
Ile Gly Val Thr Gln Asn Val Leu Tyr Glu Asn Gln Lys Leu Ile Ala
915 920 925
Asn Gln Phe Asn Ser Ala Ile Gly Lys Ile Gln Asp Ser Leu Ser Ser
930 935 940
Thr Ala Ser Ala Leu Gly Lys Leu Gln Asn Val Val Asn Gln Asn Ala
945 950 955 960
Gln Ala Leu Asn Thr Leu Val Lys Gln Leu Ser Ser Asn Phe Gly Ala
965 970 975
Ile Ser Ser Val Leu Asn Asp Ile Leu Ser Arg Leu Asp Pro Pro Glu
980 985 990
Ala Glu Val Gln Ile Asp Arg Leu Ile Thr Gly Arg Leu Gln Ser Leu
995 1000 1005
Gln Thr Tyr Val Thr Gln Gln Leu Ile Arg Ala Ala Glu Ile Arg
1010 1015 1020
Ala Ser Ala Asn Leu Ala Ala Thr Lys Met Ser Glu Cys Val Leu
1025 1030 1035
Gly Gln Ser Lys Arg Val Asp Phe Cys Gly Lys Gly Tyr His Leu
1040 1045 1050
Met Ser Phe Pro Gln Ser Ala Pro His Gly Val Val Phe Leu His
1055 1060 1065
Val Thr Tyr Val Pro Ala Gln Glu Lys Asn Phe Thr Thr Ala Pro
1070 1075 1080
Ala Ile Cys His Asp Gly Lys Ala His Phe Pro Arg Glu Gly Val
1085 1090 1095
Phe Val Ser Asn Gly Thr His Trp Phe Val Thr Gln Arg Asn Phe
1100 1105 1110
Tyr Glu Pro Gln Ile Ile Thr Thr Asp Asn Thr Phe Val Ser Gly
1115 1120 1125
Asn Cys Asp Val Val Ile Gly Ile Val Asn Asn Thr Val Tyr Asp
1130 1135 1140
Pro Leu Gln Pro Glu Leu Asp Ser Phe Lys Glu Glu Leu Asp Lys
1145 1150 1155
Tyr Phe Lys Asn His Thr Ser Pro Asp Val Asp Leu Gly Asp Ile
1160 1165 1170
Ser Gly Ile Asn Ala Ser Val Val Asn Ile Gln Lys Glu Ile Asp
1175 1180 1185
Arg Leu Asn Glu Val Ala Lys Asn Leu Asn Glu Ser Leu Ile Asp
1190 1195 1200
Leu Gln Glu Leu Gly Lys Tyr Glu Gln Asp Ile Arg Ser Leu Val
1205 1210 1215
Pro Arg Gly Ser Pro Gly Ser Gly Tyr Ile Pro Glu Ala Pro Arg
1220 1225 1230
Asp Gly Gln Ala Tyr Val Arg Lys Asp Gly Glu Trp Val Leu Leu
1235 1240 1245
Ser Thr Phe Leu Gly Gly Ser Gly Ser Leu Glu Val Leu Phe Gln
1250 1255 1260
Gly Pro His His His His His His
1265 1270
<210> 4
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 4
Met Lys Val Lys Leu Leu Val Leu Leu Cys Thr Phe Thr Ala Thr Tyr
1 5 10 15
Ala Gly Thr
<210> 5
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 5
Leu Val Pro Arg Gly Ser
1 5
<210> 6
<211> 31
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 6
Pro Gly Ser Gly Tyr Ile Pro Glu Ala Pro Arg Asp Gly Gln Ala Tyr
1 5 10 15
Val Arg Lys Asp Gly Glu Trp Val Leu Leu Ser Thr Phe Leu Gly
20 25 30
<210> 7
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 7
Gly Ser Gly Ser Leu Glu Val Leu Phe Gln Gly Pro
1 5 10
<210> 8
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 8
His His His His His His
1 5
<210> 9
<211> 4
<212> PRT
<213> SARS-CoV-2
<400> 9
Gly Ser Ala Gly
1
<210> 10
<400> 10
000
<210> 11
<400> 11
000
<210> 12
<400> 12
000
<210> 13
<400> 13
000
<210> 14
<400> 14
000
<210> 15
<400> 15
000
<210> 16
<400> 16
000
<210> 17
<400> 17
000
<210> 18
<400> 18
000
<210> 19
<400> 19
000
<210> 20
<400> 20
000
<210> 21
<400> 21
000
<210> 22
<400> 22
000
<210> 23
<400> 23
000
<210> 24
<400> 24
000
<210> 25
<400> 25
000
<210> 26
<400> 26
000
<210> 27
<400> 27
000
<210> 28
<400> 28
000
<210> 29
<400> 29
000
<210> 30
<400> 30
000
<210> 31
<400> 31
000
<210> 32
<400> 32
000
<210> 33
<400> 33
000
<210> 34
<400> 34
000
<210> 35
<400> 35
000
<210> 36
<400> 36
000
<210> 37
<400> 37
000
<210> 38
<400> 38
000
<210> 39
<400> 39
000
<210> 40
<400> 40
000
<210> 41
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 41
Thr Glu Ser Ile Val Arg Phe Pro Asn Ile Thr Asn Leu
1 5 10
<210> 42
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 42
Asn Ile Thr Asn Leu Cys Pro Phe Gly Glu Val Phe Asn Ala Thr Arg
1 5 10 15
<210> 43
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 43
Leu Tyr Asn Ser Ala Ser Phe Ser Thr Phe Lys
1 5 10
<210> 44
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 44
Leu Asp Ser Lys Val Gly Gly Asn Tyr Asn
1 5 10
<210> 45
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 45
Lys Ser Asn Leu Lys Pro Phe Glu Arg Asp Ile Ser Thr
1 5 10
<210> 46
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 46
Lys Pro Phe Glu Arg Asp Ile Ser Thr Glu Ile Tyr Gln Ala Gly
1 5 10 15
<210> 47
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 47
Gly Pro Lys Lys Ser Thr Asn Leu Val Lys Asn Lys Cys
1 5 10
<210> 48
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 48
Asn Cys Asp Val Val Ile Gly Ile Val Asn Asn Thr Val Tyr
1 5 10
<210> 49
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 49
Pro Glu Leu Asp Ser Phe Lys Glu Glu Leu Asp Lys Tyr Phe Lys Asn
1 5 10 15
His Thr Ser
<210> 50
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 50
Val Asn Ile Gln Lys Glu Ile Asp Arg Leu Asn Glu Val Ala
1 5 10
<210> 51
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 51
Asn Leu Asn Glu Ser Leu Ile Asp Leu Gln
1 5 10
<210> 52
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Polypeptide
<400> 52
Leu Gly Lys Tyr Glu Gln Tyr Ile Lys Trp Pro
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
| АНТИТЕЛА ПРОТИВ SARS-COV-2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2832025C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Однодоменное антитело и его модификации, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, и способ их применения для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2763001C1 |
| БЕЛОК И ВАКЦИНА ПРОТИВ ИНФЕКЦИИ SARS-CoV-2 | 2020 |
|
RU2815060C1 |
| Выделенный рекомбинантный вирус на основе вируса гриппа для индукции специфического иммунитета к вирусу гриппа и/или профилактики заболеваний, вызванных вирусом гриппа | 2021 |
|
RU2813150C2 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ БЕЛКОВОГО/ПЕПТИДНОГО АНТИГЕНА | 2021 |
|
RU2830627C1 |
| Генная конструкция для экспрессии рекомбинантных белков на основе участка S-белка SARS-CoV-2, включающего RBD и SD1, слитого с Fc фрагментом IgG, способ получения рекомбинантных белков, антигены и антигенные композиции для индукции длительного антительного и клеточного иммунитета против вируса SARS-CoV-2 | 2021 |
|
RU2802825C2 |
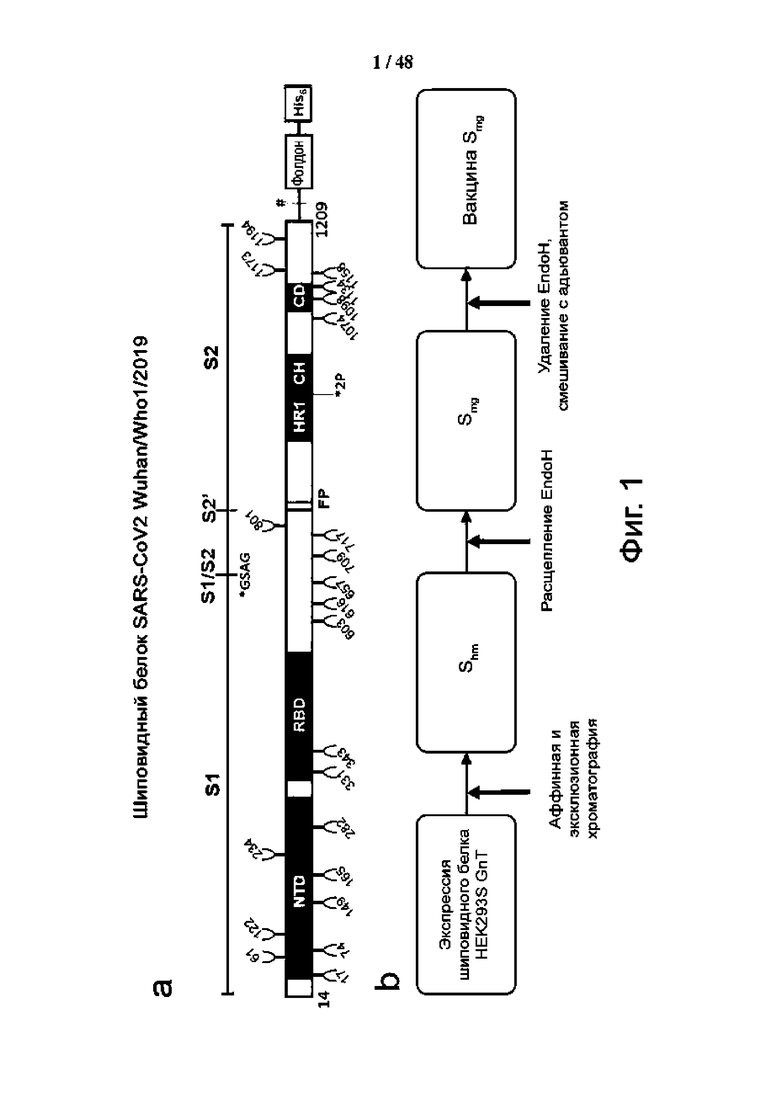
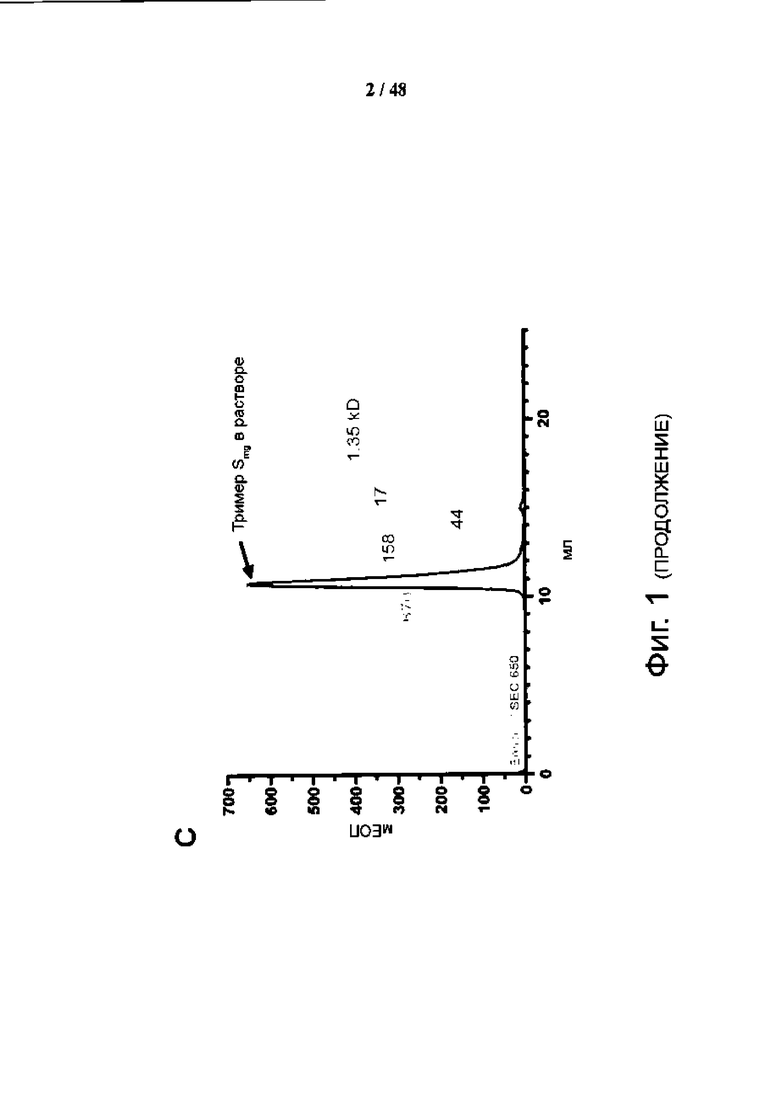












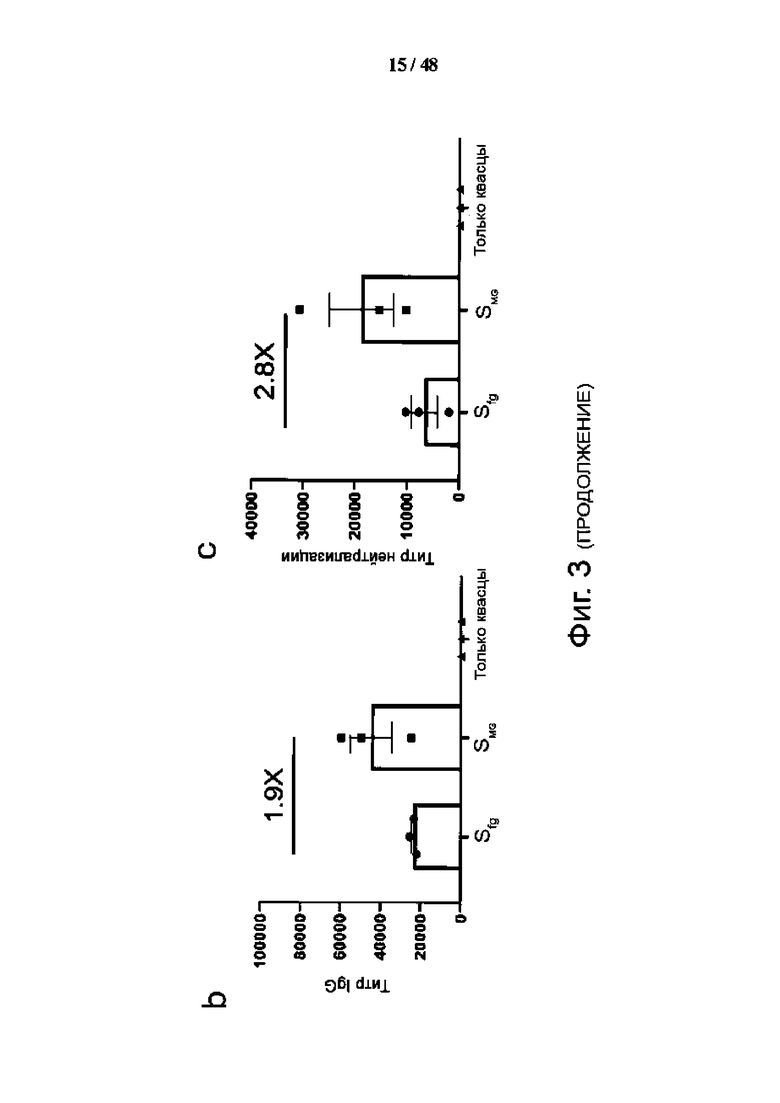
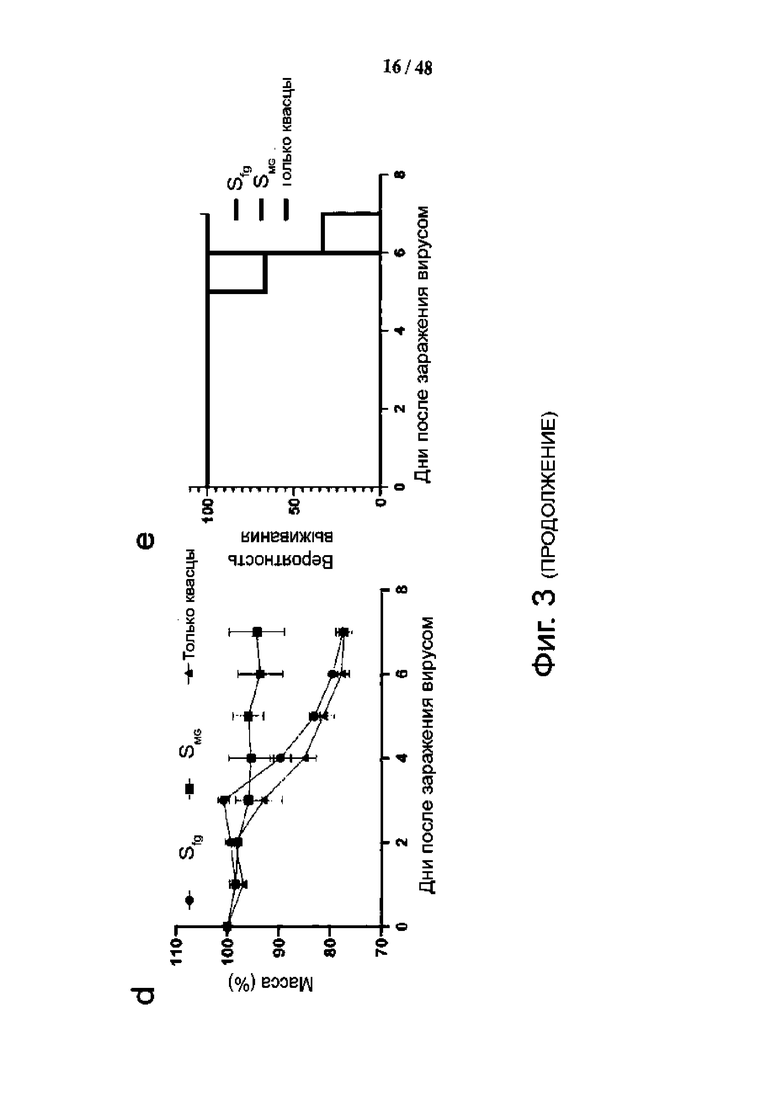






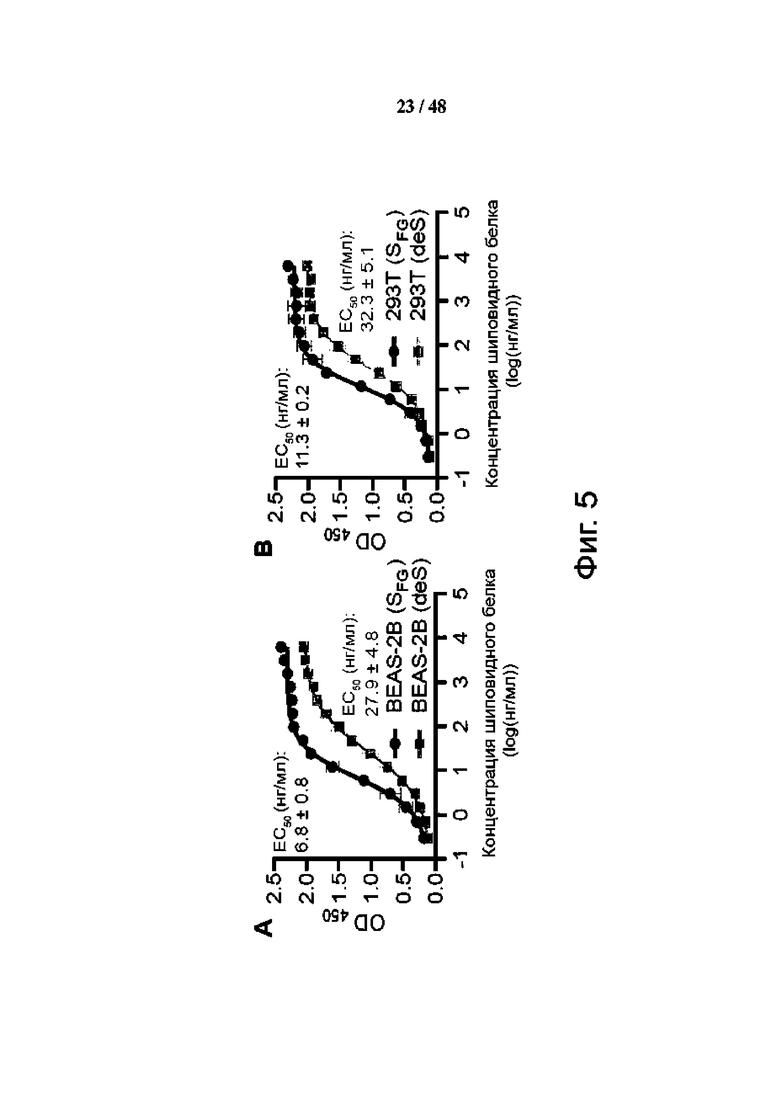
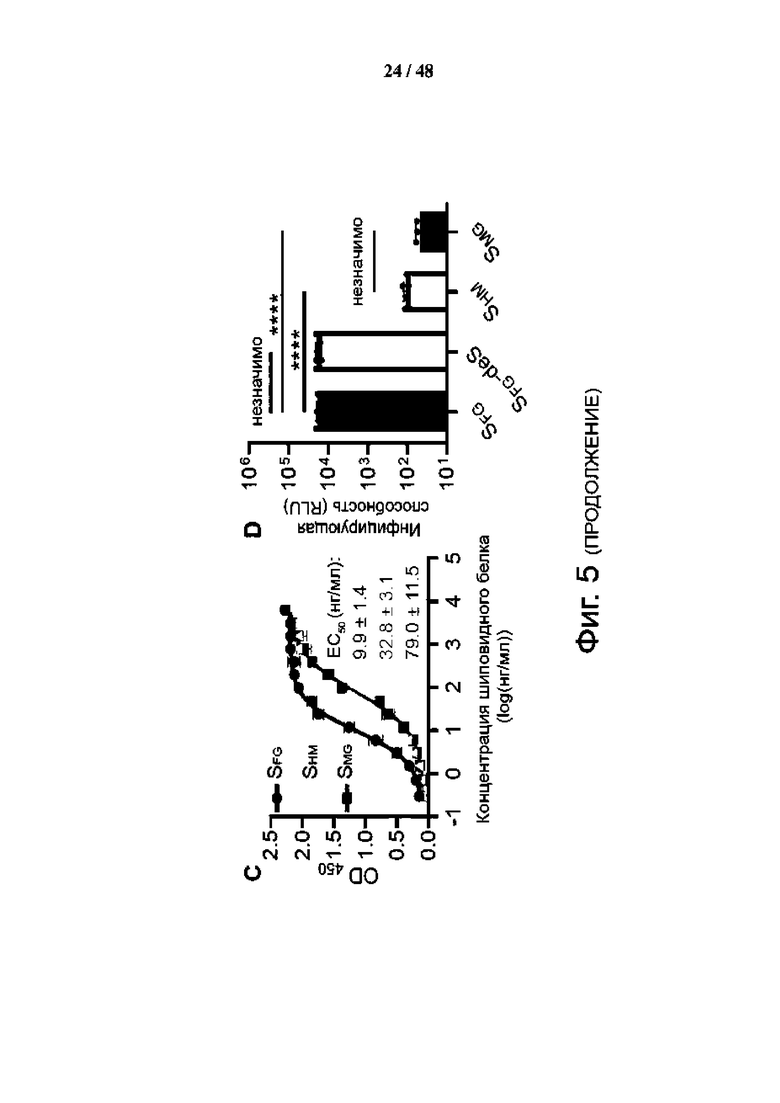


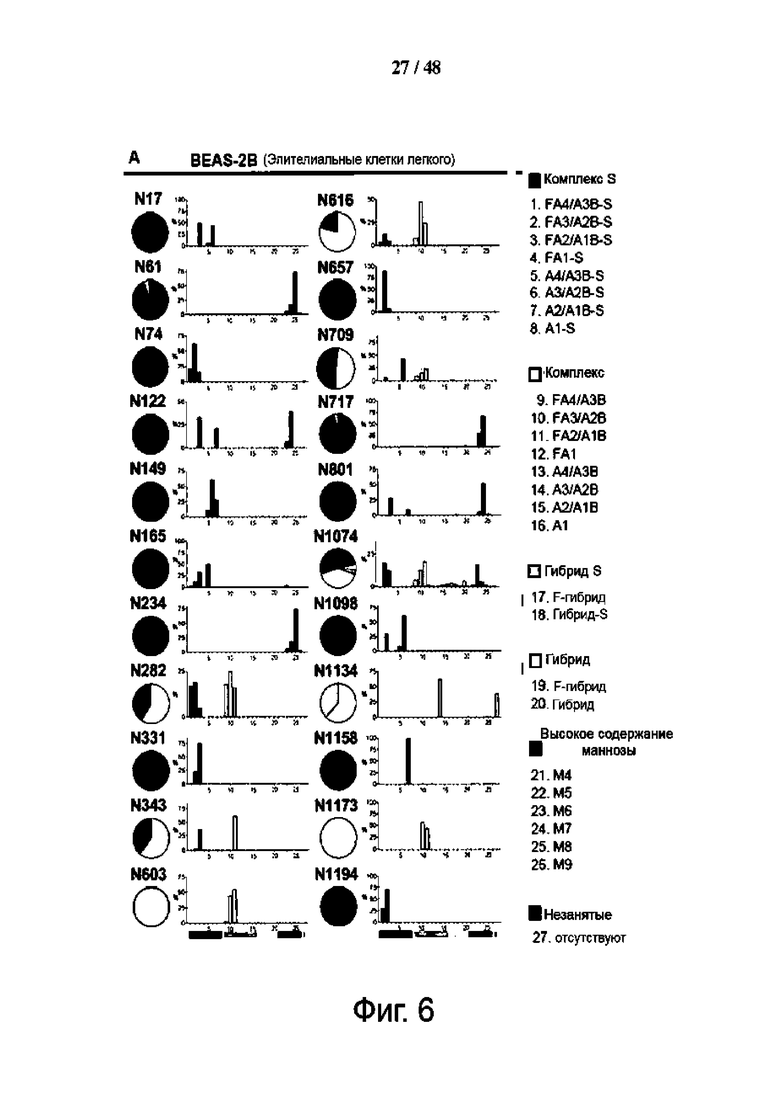



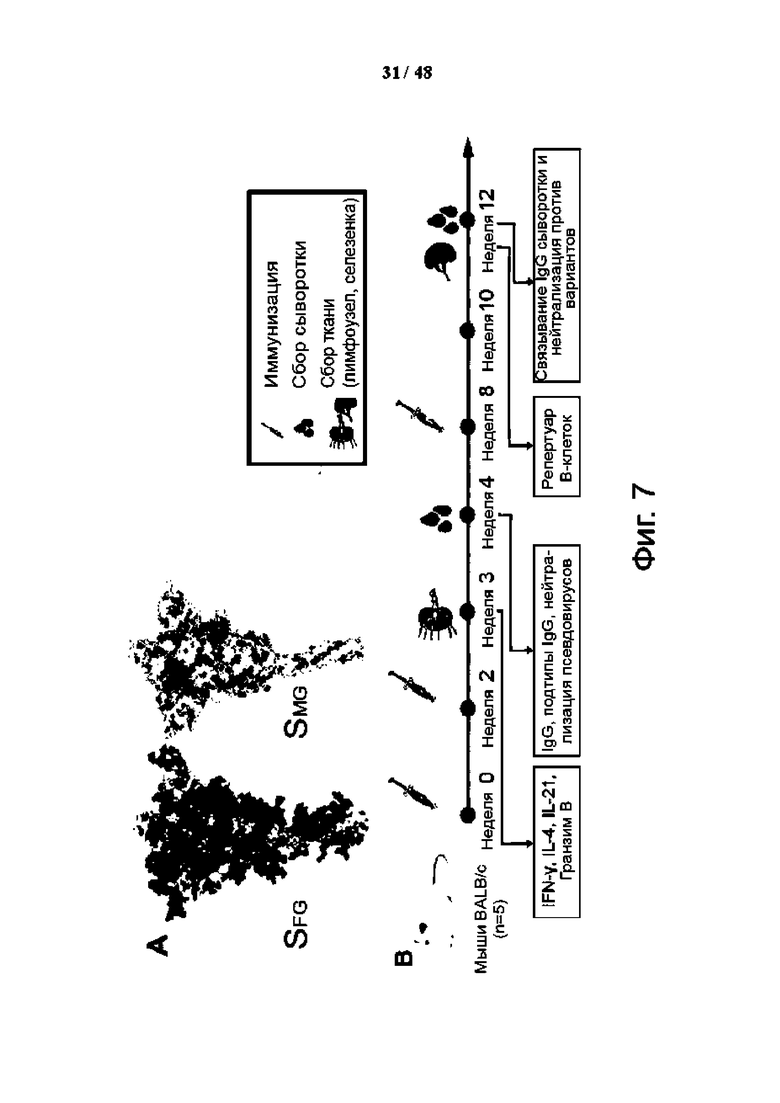
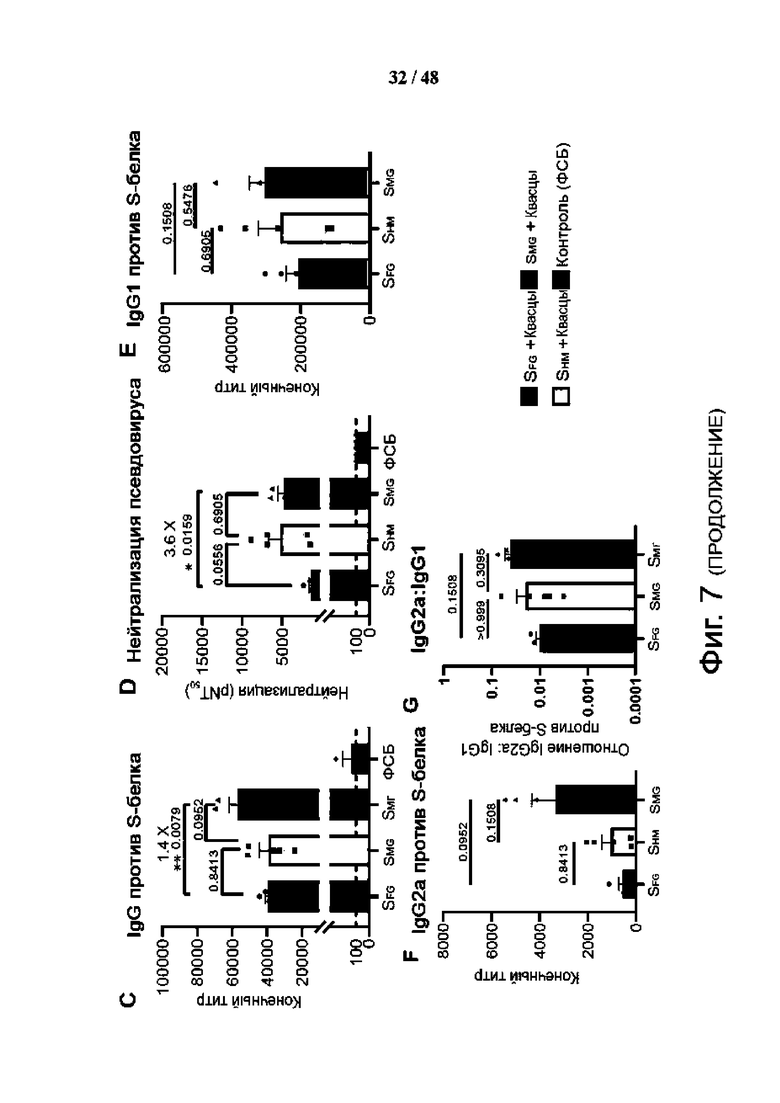



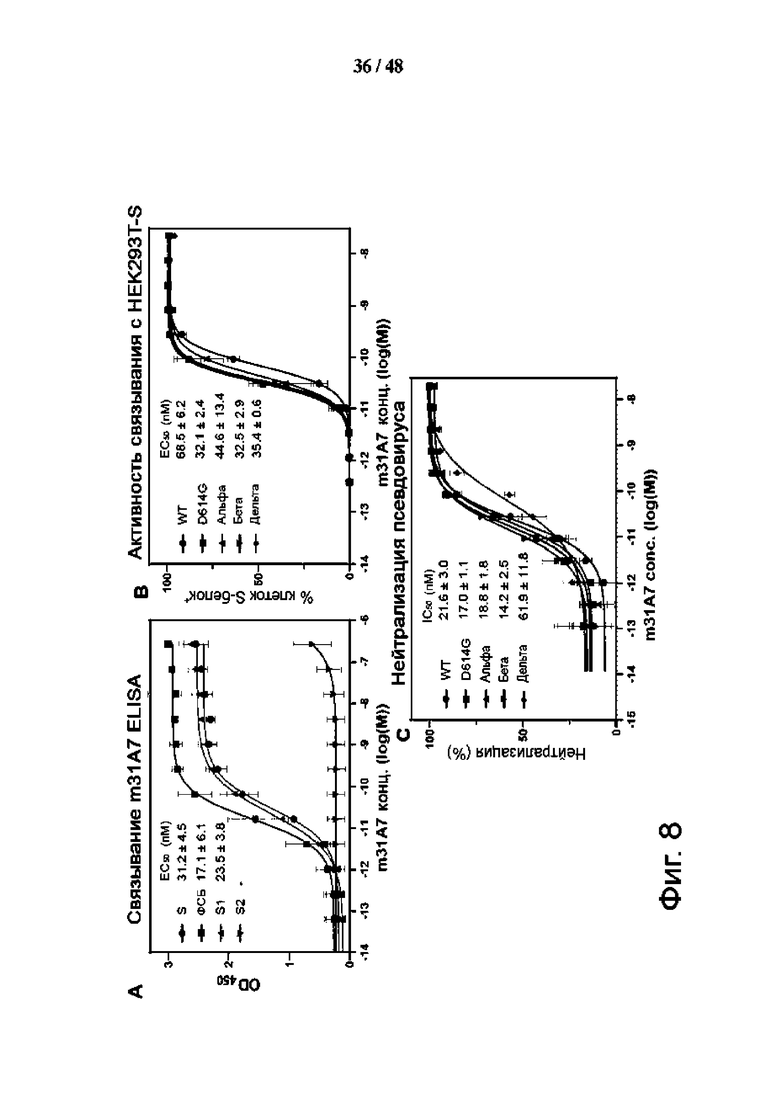
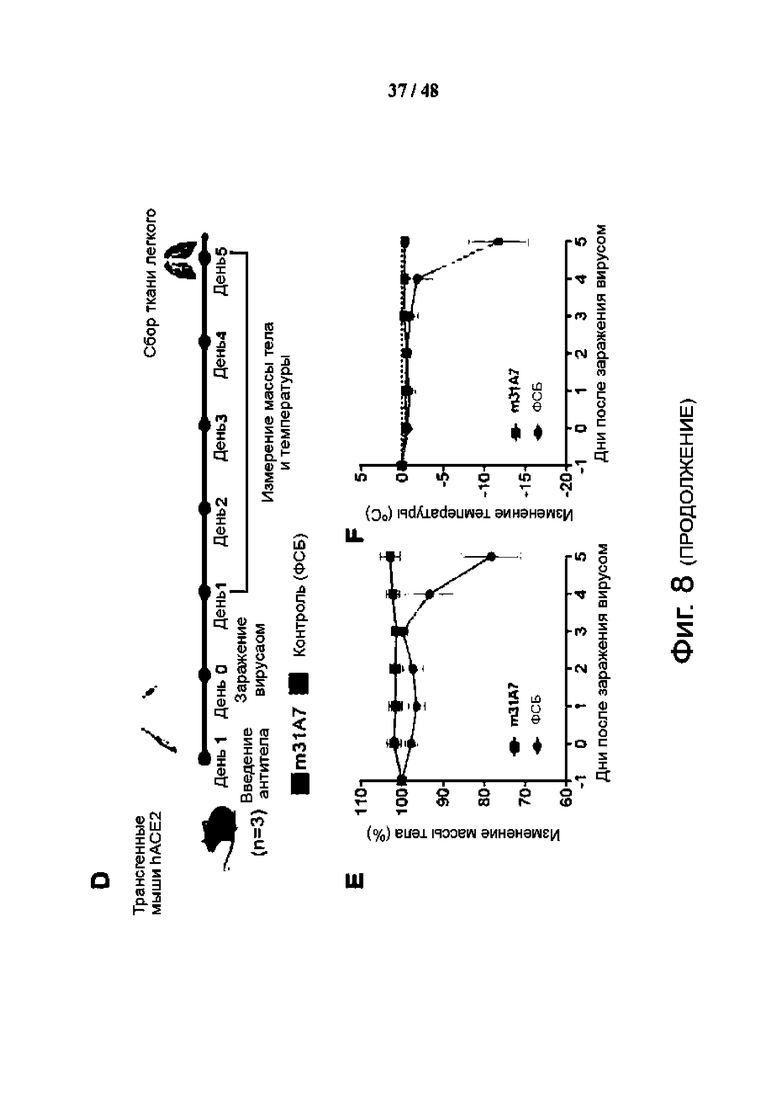
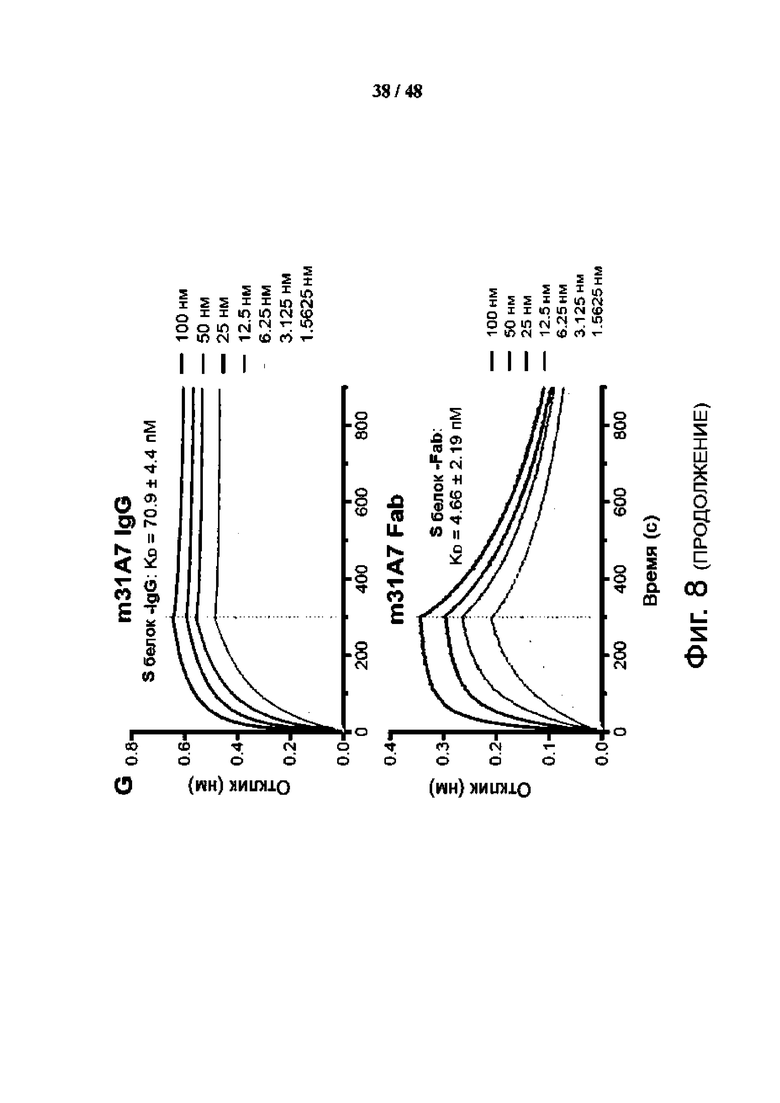



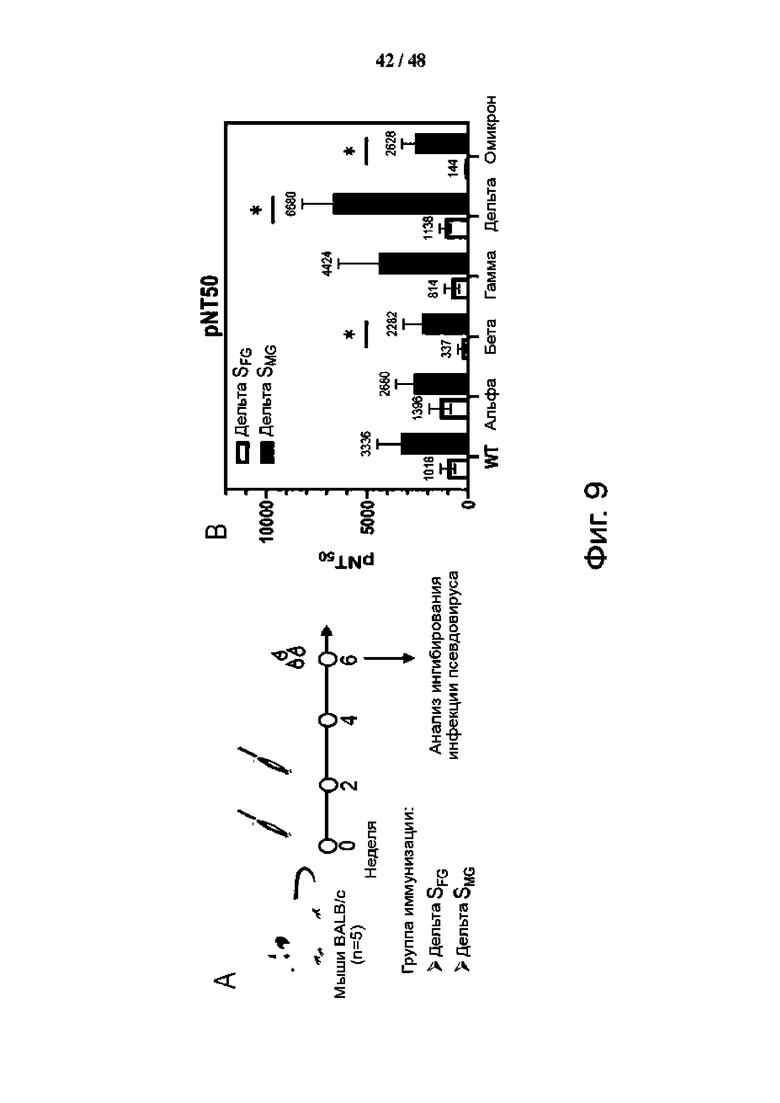



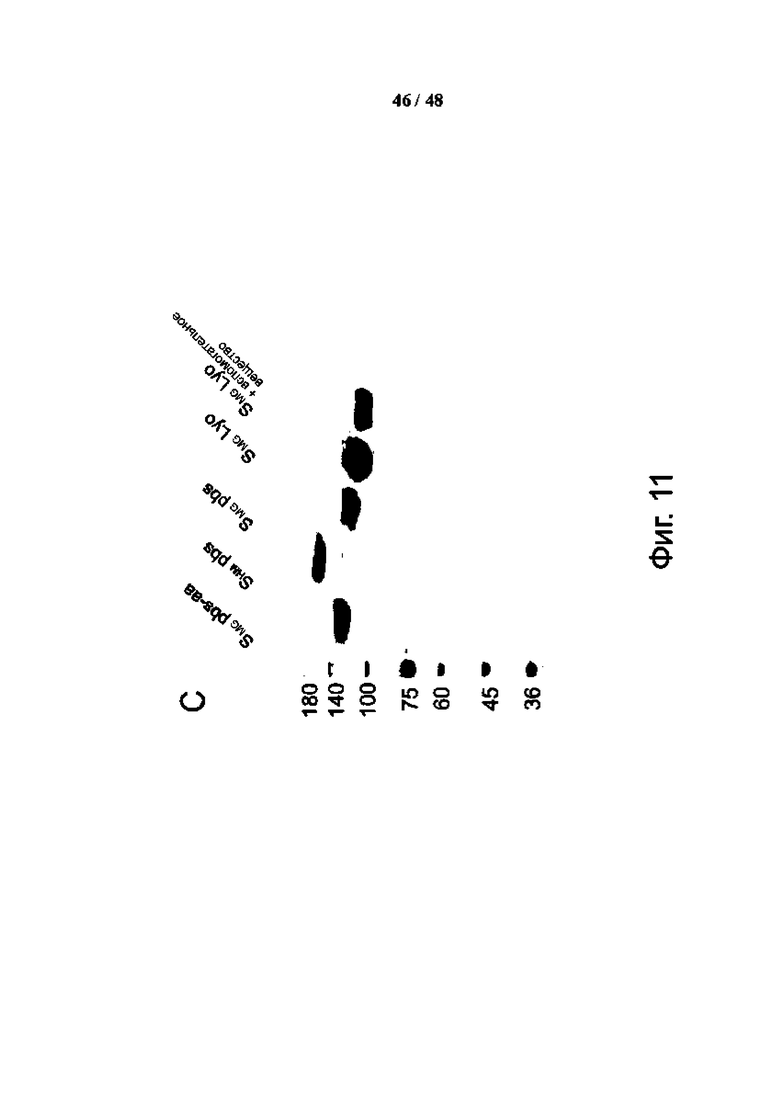


Изобретение относится к биотехнологии. Описан иммуноген, содержащий сконструированный с помощью гликоинженерии шиповидный белок коронавируса, содержащий множество усеченных N-гликанов и один или более немодифицированных O-гликанов, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса состоит из аминокислотной последовательности SEQ ID NO: 1 или ее варианта, характеризующегося по меньшей мере 96% идентичностью с аминокислотной последовательностью SEQ ID NO: 1, или ее иммунологически активного фрагмента. Предложена иммуногенная композиция для индукции иммунного ответа против коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) или его варианта у нуждающегося в этом субъекта, содержащая эффективное количество описанного иммуногена. Раскрыт способ индукции иммунного ответа против коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) или его варианта у нуждающегося в этом субъекта, содержащий введение субъекту эффективного количества предложенной иммуногенной композиции. Таким образом, в настоящем изобретении предлагаются улучшенные иммуногены, вакцины и способы для более эффективной профилактики и лечения новых коронавирусных инфекций. 3 н. и 17 з.п. ф-лы, 13 ил., 22 пр.
1. Иммуноген, содержащий сконструированный с помощью гликоинженерии шиповидный белок коронавируса, содержащий множество усеченных N-гликанов и один или более немодифицированных O-гликанов, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса состоит из аминокислотной последовательности SEQ ID NO: 1 или ее варианта, характеризующегося по меньшей мере 96% идентичностью с аминокислотной последовательностью SEQ ID NO: 1, или ее иммунологически активного фрагмента.
2. Иммуноген по п. 1, где множество усеченных N-гликанов представляют собой моносахариды.
3. Иммуноген по п. 2, где моносахариды представляют собой N-ацетилглюкозамины (GlcNAc).
4. Иммуноген по п. 1, где множество усеченных N-гликанов расположены в рецептор-связывающем домене (RBD), тем самым открывая большое количество высококонсервативных эпитопов, имеющих аминокислотные последовательности TESIVRFPNITNL (SEQ ID NO.: 41), NITNLCPFGEVFNATR (SEQ ID NO: 42), LYNSASFSTFK (SEQ ID NO: 43), LDSKVGGNYN (SEQ ID NO: 44), KSNLKPFERDIST (SEQ ID NO: 45), KPFERDISTEIYQAG (SEQ ID NO: 46) и/или GPKKSTNLVKNKC (SEQ ID NO: 47).
5. Иммуноген по п. 1, где множество усеченных N-гликанов локализуются в домене гептадного повтора 2 (HR2), тем самым открывая большое количество высококонсервативных эпитопов, имеющих аминокислотные последовательности NCDVVIGIVNNTVY (SEQ ID NO: 48), PELDSFKEELDKYFKNHTS (SEQ ID NO: 49), VNIQKEIDRLNEVA (SEQ ID NO: 50), NLNESLIDLQ (SEQ ID NO: 51) и/или LGKYEQYIKWP (SEQ ID NO: 52).
6. Иммуноген по п. 1, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса получен из нативного шиповидного белка коронавируса методом гликоинженерии in vitro, где нативный шиповидный белок коронавируса представляет собой шиповидный белок коронавируса тяжелого острого респираторного синдрома 2 (SAR-CoV-2) или его вариантов.
7. Иммуноген по п. 6, где вариант выбран из группы, состоящей из D614G, альфа (линии B.1.1.7 и Q), бета (линии B.1.351 и потомки), гамма (линии P.1 и потомки), эпсилон (В. 1.427 и В. 1.429), эта (В. 1.525), йота (В. 1.526), каппа (В. 1.617.1), 1.617.3, мю (В. 1.621, В. 1.621.1), дзета (P.2), дельта (линии B. 1.617.2 и AY) и омикрон (линии B. 1.1.529 и BA).
8. Иммуноген по п. 1, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса присутствует в виде тримера.
9. Иммуноген по п. 6, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса сохраняет ту же третичную структуру, что и нативный шиповидный белок коронавируса.
10. Иммуноген по п. 4, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса способен индуцировать усиленный иммунный ответ по сравнению с нативным шиповидным белком коронавируса.
11. Иммуноген по п. 10, где усиленный иммунный ответ представляет собой повышенный титр IgG, повышенный титр IgM, повышенный нейтрализационный титр, повышенный клеточный ответ, опосредованный CD4 Т-клетками, повышенный клеточный ответ, опосредованный CD8 Т-клетками, или их сочетание.
12. Иммуноген по п. 6, где сконструированный с помощью гликоинженерии шиповидный белок получают с использованием одного или нескольких химических или ферментативных способов.
13. Иммуноген по п. 12, где сконструированный с помощью гликоинженерии шиповидный белок получают с использованием эндогликозидазы H (Endo H).
14. Иммуноген по п. 1, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса содержит полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1, где полипептид состоит из 22 усеченных N-гликанов, каждый из которых содержит фрагмент GlcNAc.
15. Иммуноген по п. 1, где сконструированный с помощью гликоинженерии шиповидный белок коронавируса содержит полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 2, где полипептид состоит из 21 усеченного N-гликана, каждый из которых содержит фрагмент GlcNAc.
16. Иммуногенная композиция для индукции иммунного ответа против коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) или его варианта у нуждающегося в этом субъекта, содержащая эффективное количество иммуногена по любому из пп. 1-15.
17. Иммуногенная композиция по п. 16, дополнительно содержащая адъювант, и указанный адьювант выбирают из гидроксида алюминия, фосфата алюминия, неполного адъюванта Фрейнда (IFA), сквалена, квасцов, алгидрогеля, MF59, QS-21, CpG 1018, AS03, AS37, Matrix-M и их сочетания.
18. Иммуногенная композиция по п. 16, где иммуногенная композиция представляет собой усовершенствованную коронавирусную вакцину, способную вызывать усиленный иммунный ответ по сравнению с вакциной, использующей нативный шиповидный белок коронавируса, где коронавирус представляет собой SAR-CoV-2 или его вариант.
19. Способ индукции иммунного ответа против коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) или его варианта у нуждающегося в этом субъекта, содержащий введение субъекту эффективного количества иммуногенной композиции по п. 16 или 17.
20. Способ по п. 19, где иммунный ответ содержит выработку нейтрализующих антител против SARS-CoV-2 или его варианта, где вариант выбран из группы, состоящей из D614G, альфа (линии B.1.1.7 и Q), бета (линии B.1.351 и потомки), гамма (линии P.1 и потомки), эпсилон (В. 1.427 и В. 1.429), эта (В. 1.525), йота (В. 1.526), каппа (В. 1.617.1), 1.617.3, мю (В. 1.621, В. 1.621.1), дзета (P.2), дельта (линии B. 1.617.2 и AY) и омикрон (линии B. 1.1.529 и BA).
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| ЛОВИТЕЛЬ ДЛЯ ЦЕПНЫХ НАКЛОННЫХ КОНВЕЙЕРОВ | 1949 |
|
SU86353A1 |
Авторы
Даты
2024-03-26—Публикация
2022-04-12—Подача