УРОВЕНЬ ТЕХНИКИ
Протеинкиназы представляют собой группу ферментов, которые регулируют активность их белков-мишеней путем добавления фосфатных групп к белковому субстрату. Киназы играют важную роль во многих физиологических процессах, включая деление клеток, дифференциацию, клеточный гомеостаз и передачу сигнала. Киназы могут быть подразделены в соответствии с их мишенями на Серин/Треонин-киназы и Тирозин-киназы. Тирозин-киназы далее подразделяют на рецепторные Тирозин-киназы и нерецепторные Тирозин-киназы. Члены семейства Янус-киназ (JAK) млекопитающих являются нерецепторными Тирозин-киназами.
Семейство JAK имеет в своем составе четырех членов; JAK1, JAK2, JAK3 и TYK2. JAK1, JAK2 и TYK2 являются универсально экспрессируемыми, в то время как экспрессия JAK3 ограничена гематопоэтическими клетками. Семейство JAK вовлечено во внутриклеточную передачу сигнала от >70 различных цитокинов. Цитокины связываются с их рецепторами клеточной поверхности, что приводит к димеризации рецептора и последующей активации/фосфорилированию Тирозин-киназ JAK. Киназы JAK либо постоянно связаны с рецептором, либо задействуются в результате связывания цитокинов. Специфические тирозиновые остатки на рецепторе затем фосфорилируются активированными JAK и выполняют функцию докинг-сайтов для белков STAT. Белки STAT фосфорилируются киназами JAK, димеризуются, затем перемещаются в ядро, где они связывают специфичные элементы ДНК и активируют транскрипцию генов. Сигналы JAK1 вместе со всеми изоформами JAK находятся в зависимости от цитокинов.
Киназы JAK имеют существенное значение для разнообразных физиологических функций. Это было продемонстрировано с помощью генно-инженерных мышиных моделей, которые лишены специфических киназ JAK. Мыши Jak1-/- погибают перинатально, в то время как мыши Jak2-/- имеют дефекты в эритропоэзе и умирают около E12 дня. Мыши Jak3-/- являются жизнеспособными, но имеют фенотип SCID с дефицитом Т-клеток, В-клеток и NK-клеток. Мыши TYK2-/- проявляют признаки синдрома гипер-IgE. Эти фенотипы демонстрируют существенные и незаменимые роли функции JAK in vivo (K. Ghoreschi, A. Laurence, J. J. O'Shea, Immunol. Rev. 228, 273 (2009)).
Более того, мутации в ферментах JAK были связаны с заболеваниями у людей. Инактивирующие мутации в JAK3 (или родственной общей гамма-цепи цитокиновых рецепторов) вызывают тяжелый фенотип SCID (J. J. O'Shea, M. Pesu, D. C. Borie, P. S. Changelian, Nat. Rev. Drug Discov. 3, 555 (2004)). Делеции TYK2 приводят к синдрому гипер-IgG и повышенному риску инфекции (Y. Minegishi et al., Immunity. 25, 745 (2006)). Ни о каких инактивирующих мутациях не сообщалось для JAK1 или JAK2, в соответствии с данными от мышей, что демонстрирует, что мыши с дефицитом JAK1 и JAK2 не являются жизнеспособными. Однако были выявлены некоторые мутации, которые приводят к постоянно активной JAK2, вызывающие миелопролиферативные заболевания и подтверждающие центральную роль JAK2 в гематопоэзе (O. bdel-Wahab, Curr. Opin. Hematol. 18, 117 (2011)). JAK2 является единственным членом семейства JAK, связанным с передачей сигнала критических гематопоэтических цитокинов IL-3, GMCSF, ЕРО и TPO.
Большое количество генетических данных мыши и человека, демонстрирующих центральную роль функции киназы JAK в аутоиммунном заболевании, гематопоэзе и онкологии, было обосновано использованием ингибиторов пан-JAK в клинических испытаниях для аутоиммунных заболеваний и новообразований (см. K. Ghoreschi, et al, Immunol. Rev. 228, 273 (2009), и A. Quintas-Cardama, H. Kantarjian, J. Cortes, S. Verstovsek, Nat. Rev. Drug Discov. 10, 127 (2011)).
Значительное количество литературы собрало данные о том, что связывание пути Jak/STAT с различными заболеваниями и расстройствами, включая гиперпролиферативные заболевания и рак, такой как лейкоз и лимфомы, иммунологические и воспалительные заболевания, такие как отторжение трансплантата, астма, хроническое обструктивное заболевание легких, аллергия, ревматоидный артрит, сахарный диабет I типа, амиотрофический боковой склероз и рассеянный склероз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет новые соединения, которые являются ингибиторами киназ Jak. Изобретение также предоставляет способ лечения и профилактики JAK-опосредованных заболеваний и расстройств с использованием новых соединений, а также фармацевтические композиции, содержащие соединения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет соединения формулы I или их фармацевтически приемлемые соли, или стереоизомеры:
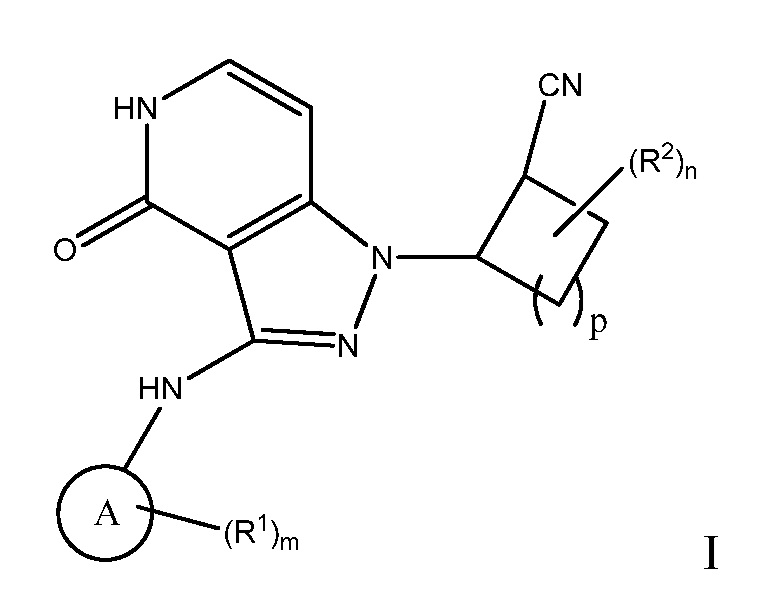
A выбирают из арила и гетероарила;
n равно 0, 1, 2, 3 или 4;
m равно 0, 1, 2, 3 или 4;
p равно 0, 1, 2, 3 или 4;
R1 выбирают из:
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-10 алкиламино(карбонил)0-1C0-10 алкила,
(C1-10)гетероалкиламино(карбонил)0-1C0-10 алкила,
C3-12 циклоалкиламино(карбонил)0-1C0-10 алкила,
арил C0-10 алкиламиноамино(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкиламино(карбонил)0-1C0-10 алкила,
C1-10 алкилсульфонилC0-10 алкила,
C1-10 гетероалкилсульфонилC0-10 алкила,
(C3-12)циклоалкилC0-10алкилсульфонилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила,
гетероарилC0-10 алкилсульфонилC0-10 алкила,
арилC0-10 алкилсульфонилC0-10 алкила,
C1-10 алкилсульфамоилC0-10 алкила,
C1-10 гетероалкилсульфамоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила,
гетероарилC0-10 алкилсульфамоилC0-10 алкила,
арилC0-10 алкилсульфамоилC0-10 алкила,
C1-10 алкилсульфонимидоилC0-10 алкила,
C1-10 гетероалкилсульфонимидоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфонимидоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонимидоилC0-10 алкила,
гетероарилC0-10 алкилсульфонимидоилC0-10 алкила,
арилC0-10 алкилсульфонимидоилC0-10 алкила,
C1-10 алкилтиоC0-10 алкила,
(C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2NH2,
-SO2NH(C1-10 алкил),
-SO2N(C1-10 алкил)2,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинилC0-10 алкила,
C1-10 гетероалкилсульфинилC0-10алкила,
(C3-12)циклоалкилC0-10алкилсульфинилC0-10алкила,
(C3-12)циклогетероалкилC0-10алкилсульфинилC0-10алкила,
гетероарилC0-10 алкилсульфинилC0-10алкила,
арилC0-10алкилсульфинилC0-10алкила,
C0-10 алкилсульфиниламиноC0-10 алкила,
C1-4ациламино C0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси,
циано,
(C1-6алкил) циано, и
C1-6галогеналкила; и
где два R1 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца;
R2 выбирают из:
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкила,
(C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкиламиноC0-10 алкила,
(C1-10) гетероалкиламиноC0-10алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
C1-10 алкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10 алкилсульфонила,
(C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси,
циано,
(C1-6алкил)циано, и
C1-6галогеналкила, и
где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и
где R1 и R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3;
R3 независимо выбирают из:
галогена,
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, и
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
((C0-10)алкил)1-2аминокарбонилокси,
арил (C0-10)алкиламинокарбонилокси,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
Оксо (=O),
-SO2NH2,
-SO2NH(C1-10 алкил),
-SO2N(C1-10 аклил)2,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
амино,
(C0-10 алкил)1-2 амино,
-(окси)0-1(карбонил)0-1N(C0-10 алкил)1-2
гидрокси,
(C1-10 алкил)OH,
C1-10 алкокси,
(C1-10 алкил)циано,
циано и
C1-6галогеналкила; и
R3 необязательно замещен 1, 2 или 3 заместителями R4, выбранными из водорода, гидрокси, (C1-6)алкила, (C1-6)алкокси, (C1-10 алкил)OH, галогена, CO2H, -(C0-6)алкилCN,
-O(C=O)C1-C6 алкила, NO2, трифторметокси, трифторэтокси, трифторметила, трифторэтила,
-N-C(O)O(C0-6)алкила, C1-10 алкилсульфонила, оксо (O=), аминосульфонила, -SO2NH2,
-SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, -SO2C1-6алкила, -SO2CF3, -SO2CF2H, -C1-10 алкилсульфинила, -O(0-1)(C1-10)галогеналкила, амино(C1-6алкил)0-2 и NH2.
Характерные соединения по настоящему изобретению включают, но не ограничиваются следующими соединениями и их фармацевтически приемлемыми солями и стереоизомерами:
2-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-{[1-циклопропилэтил]амино}циклогексанкарбонитрил;
5-гидрокси-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-азетидин-1-ил-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-азетидин-1-ил-2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(диметиламино)циклогексанкарбонитрил;
2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-{[1-циклопропилэтил]амино}циклогексанкарбонитрил;
5-азетидин-1-ил-2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(диметиламино)циклогексанкарбонитрил;
5-азетидин-1-ил-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-(диметиламино)-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{4-оксо-3-[(2,2,2-трифторэтил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(3-гидрокси-3-метилазетидин-1-ил)циклогексанкарбонитрил;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(3-гидроксиазетидин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
(2-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентанкарбонитрил;
(2-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
2-[4-оксо-3-({4-[2,2,2-трифтор-1-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
2-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
2-(4-оксо-3-{[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
4-({1-[2-цианоциклопентил]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
2-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-N-(1-метил-1H-пиразол-3-ил)ацетамид;
N-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]-1,3-оксазол-5-карбоксамид;
N-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]пиримидин-2-карбоксамид;
2-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-N-(1-метил-1H-пиразол-3-ил)ацетамид;
трет-бутил[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]карбамат;
2-(3-{[3-(аминометил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(1-метилэтил)бензолсульфонамид;
N-бензил-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(циклопропилметил)бензолсульфонамид;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(2-метоксиэтил)бензолсульфонамид;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-циклогексилбензолсульфонамид;
2-(3-{[4-(морфолин-4-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[3-(2H-1,2,3-триазол-2-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
N-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]-1,3-оксазол-5-карбоксамид;
N-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]пиримидин-2-карбоксамид;
2-(3-{[3-(1-гидроксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
трет-бутил[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]карбамат;
2-(3-{[4-(аминометил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(аминометил)-4-фторфенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(морфолин-4-илметил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
трет-бутил[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-фторбензил]карбамат;
трет-бутил[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-5-фторбензил]карбамат;
2-{3-[(3-{[4-(1-гидрокси-1-метилэтил)-1H-1,2,3-триазол-1-ил]метил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(1-гидрокси-2-метокси-1-метилэтил)-4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(1,3-дигидрокси-1-метилпропил)-4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(1,2-дигидрокси-1-метилэтил)-4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-(2,3-дигидро-1H-изоиндол-5-иламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({3-[(4-метил-1H-1,2,3-триазол-1-ил)метил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({3-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
N-{1-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2,2,2-трифторэтил}-2-метилпропан-2-сульфинамид;
2-(4-оксо-3-{[3-(2,2,4-триметил-1,3-диоксолан-4-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{4-оксо-3-[(3-{[(2,2,2-трифторэтил)амино]метил}фенил)амино]- 4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[3-(аминометил)-4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
6-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил;
N-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-(диметилсульфамоил)бензил]ацетамид;
2-[3-({3-[(диметиламино)метил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[3-(1,2-дигидрокси-1-метилэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-{[1-(5-цианоспиро[2.5]окт-6-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил]амино}-N,N-диметилбензолсульфонамид;
2-(аминометил)-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамид;
2-(4-оксо-3-{[3-(1H-пиразол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[4-(пирролидин-1-илкарбонил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[4-(1H-1,2,3-триазол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(1H-имидазол-1-илметил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
6-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил;
2-(3-{[4-гидрокси-4-(гидроксиметил)-1,1-диоксидо-3,4-дигидро-2H-тиохромен-6-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(4-оксо-3-{[3-(1H-1,2,4-триазол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[3-(1H-1,2,4-триазол-4-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(4-{[4-(1-гидрокси-1-метилэтил)-1H-1,2,3-триазол-1-ил]метил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
N-{1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2,2,2-трифторэтил}-2-метилпропан-2-сульфинамид;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-{4-оксо-3-[(4-{[(2,2,2-трифторэтил)амино]метил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-[4-оксо-3-({4-[(пирролидин-1-илсульфонил)метил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(1,1-диоксидо-2,3-дигидро-1-бензотиофен-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(2-этил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентанкарбонитрил;
2-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
2-(4-оксо-3-{[2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2,3-дигидро-1H-инден-2-карбоновая кислота;
2-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентанкарбонитрил;
2-(3-{[2-(циклопропилметил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-метил-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-[3-({4-[1-(диметиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[2-(циклопентилметил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{4-оксо-3-[(4-{1-[(2,2,2-трифторэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N,2-триметилбензамид;
2-(3-{[3-метил-4-(морфолин-4-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-циклопропил-N,N-диметилбензамид;
2-[3-({4-[1-амино-2,2-дифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[4-(2,2-дифтор-1-гидроксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[4-оксо-3-({4-[пирролидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-{4-оксо-3-[(4-{1-[(2,2,2-трифторэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[2-(1-метилэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(2-метилпропил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-этил-2,3-дигилро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[2-(циклопропилметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({3-[(метилсульфанил)метил]-5-(1H-1,2,3-триазол-1-илметил)фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[2-(1-метилэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(2-гидроксиэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(3-гидрокси-1,1-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[4-оксо-3-({4-[1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({4-[1-метил-1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[2-(3-гидрокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-(3-{[2-(2-метоксиэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-(аминометил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
N-трет-бутил-4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
2-(4-оксо-3-((4-(пропан-2-илсульфонимидоил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
2-(3-{[4-(метилсульфонимидоил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензонитрил;
2-[3-({4-[1-(этиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-(4-оксо-3-((4-(2,2,2-трифтор-1-(изопропиламино)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
этил 3-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноат;
изопропил 3-(4-((1-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноат;
2-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((1'-гидрокси-1'-(трифторметил)-1',3'-дигидроспиро[циклопропан-1,2'-инден]-5'-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
2-(4-оксо-3-((4-(1,1,1-трифтор-2-метоксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((2,3-диметил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((3-метил-1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((2-(2,5-диметилморфолино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
трет-бутил-4-(5-((1-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-оксоизоиндолин-2-ил)циклогексанкарбоксилат;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
N-трет-бутил-4-({1-2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамид;
2-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
N-трет-бутил-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамид;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамид;
2-[3-({4-[1-(2-метоксиэтил)-1H-пиразол-4-ил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[3-хлор-4-(1-метил-1H-пиразол-4-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[1-метил-1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({2-[1,2-диметилпропил]-2,3-дигидро-1H-изоиндол-5-ил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]пропаноат;
трет-бутил[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]ацетат;
трет-бутил-2-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]-2-метилпропаноат;
2-(3-{[2-(1-метилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]-3-метилбутаноат;
2-[4-оксо-3-(1,2,3,4-тетрагидроизохинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[4-оксо-3-(1,2,3,4-тетрагидроизохинолин-7-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[4-оксо-3-({2-[(5-пиперидин-1-илпиразин-2-ил)карбонил]-2,3-дигидро-1H-изоиндол-5-ил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-((2-(3-метокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(2-метокси-1,1-диметилэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(3-метокси-1,1-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(циклопентилметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,3-дигидро-2H-изоиндол-2-ил]пропаноат;
трет-бутил[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,3-дигидро-2H-изоиндол-2-ил]ацетат;
трет-бутил-3-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-8-азабицикло[3.2.1]октан-8-карбоксилат;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
2-{3-[(2,2-диметил-1,1-диоксидо-3-оксо-2,3-дигидро-1-бензотиофен-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[3-гидрокси-2,2-диметил-1,1-диоксидо-2,3-дигидро-1-бензотиофен-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-гидрокси-1,1-диоксидо-3H-спиро[1-бензотиофен-2,1'-циклогексан]-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогептанкарбонитрил;
2-(3-{[1-метил-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[4-(1,3-оксазол-2-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[4-(1,3-тиазол-2-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[4-(1,2,4-оксадиазол-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(4-изоксазол-3-илфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(4-изоксазол-5-илфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[4-(1,2,4-оксадиазол-5-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[4-(1,3-оксазол-5-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[4-(3-гидроксиоксетан-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(2-метил-1,3-бензотиазол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[4-(3-метилоксетан-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[1-(2-цианоэтил)-1H-пиразол-4-ил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
этил 1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-метилфенил]-1H-пиразол-4-карбоксилат;
изопропил 6-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)хинолин-2-карбоксилат;
2-(4-оксо-3-{[4-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[1-(2-цианоэтил)-1H-пиразол-4-ил]-3-метилфенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[4-оксо-3-({4-[1-трифторметил)циклопропил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-{3-[(2-трет-бутил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-[4-оксо-3-({4-[1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({4-[2-метил-1-(1H-1,2,3-триазол-1-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-{4-оксо-3-[(4-пиперидин-4-илфенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-{3-[(2-ацетил-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-{[1-(дифторметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[3-({4-[1-метил-1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({4-[2-метил-1-(2H-1,2,3-триазол-2-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({3-метил-4-[1-метил-1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-{3-[(2-циклогексил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-[3-({3-метил-4-[2-метил-1-(2H-1,2,3-триазол-2-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-[3-({3-метил-4-[2-метил-1-(1H-1,2,3-триазол-1-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
трет-бутил-4-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоксилат;
2-[4-оксо-3-({4-[1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
трет-бутил-4-(5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)циклогексанкарбоксилат;
2-(3-{[1,1-диоксидо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
2-(3-{[2-(3-метокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
N-трет-бутил-4-({1-[2-цианоциклогептил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамид;
2-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогептанкарбонитрил;
2-(4-оксо-3-{[2-(пиперидин-1-илкарбонил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
2-(3-{[1,1-диоксидо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
2-[3-({4-[1-(4-трет-бутил-1H-1,2,3-триазол-1-ил)-2-метилпропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
трет-бутил-1-{1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2-метилпропил}-1H-1,2,3-триазол-4-карбоксилат;
2-(4-оксо-3-{[1-оксо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(4-оксо-3-{[1-оксо-2-(тетрагидро-2H-тиопиран-4-ил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-[4-оксо-3-({4-[2-(трифторметил)пирролидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил;
2-(3-{[2-(4-метилтетрагидро-2H-пиран-4-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[2-(4-метилтетрагидро-2H-пиран-4-ил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-{[3-гидрокси-1,1-диоксидо-2',3',5',6'-тетрагидро-3H-спиро[1-бензотиофен-2,4'-пиран]-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((3-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил;
4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензойная кислота;
4-(5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)циклогексанкарбоновая кислота;
4-(4-(1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)фенил)-4-гидроксициклогексанкарбоновая кислота;
трет-бутил-5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-метилизоиндолин-2-карбоксилат;
2-(3-((2-изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((4-(8-азабицикло[3.2.1]октан-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-(3-((1,1-диоксидо-3H-спиро[бензо[b]тиофен-2,1'-циклогексан]-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил;
2-{3-[(1,1-диоксидо-2',3',5',6'-тетрагидро-3H-спиро[1-бензотиофен-2,4'-пиран]-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил;
2-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил;
4,4-дифтор-2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил;
2-[4-оксо-3-({4-2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогептанкарбонитрил;
2-[4-оксо-3-({4-2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрил;
2-(3-{[2-(4,4-дифтор-1-метилциклогексил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил; и
2-[4-оксо-3-({4-[2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил.
Изобретение также охватывает фармацевтические композиции, содержащие соединение формулы I или II, и способы лечения или профилактики JAK-опосредованных заболеваний с использованием соединений формулы I или II.
Изобретение описано с использованием следующих определений, если не указано иное.
В данном контексте, за исключением особо оговоренных случаев, "алкил" предназначен для включения насыщенных алифатических углеводородных групп как с разветвленной, так и неразветвленной цепью, в том числе всех изомеров, имеющих указанное число атомов углерода. Обычно используемые сокращения для алкильных групп используют во всем описании, например, метил может быть представлен посредством "Me" или CH3, этил может быть представлен посредством "Et" или CH2CH3, пропил может быть представлен посредством "Pr" или CH2CH2CH3, бутил может быть представлен посредством "Bu" или CH2CH2CH2CH3 и т.д. "C1-6 алкил" (или "C1-C6алкил"), например, означает алкильные группы с линейной или разветвленной цепью, в том числе все изомеры, имеющие указанное количество атомов углерода. C1-6 алкил включает все гексилалкильные и пентилалкильные изомеры, а также н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. "C1-4 алкил" означает н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил.
Термин "алкилен" относится насыщенным алифатическим углеводородным группам как с разветвленной, так и неразветвленной цепью, в том числе ко всем изомерам, имеющим указанное количество атомов углерода, и имеющим два присоединения в концевой области цепи. Для иллюстрации, термин "незамещенный-C4алкилен-B" означает A-CH2-CH2-CH2-CH2-B.
Термин "алкокси" обозначает линейную или разветвленную алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик.
"Ацил" означает радикал -C(O)R, где R необязательно замещен алкилом, алкенилом, циклоалкилом, гетероциклоалкилом, арилом гетероарилом и т.д.
"Ациламино" означает радикал -NRR', где R представляет собой Н, ОН или алкокси и R' представляет собой ацил, как определено в настоящей заявке.
Термин "алкил" относится к алифатической углеводородной группе, которая может быть линейной или разветвленной и имеющей указанное число атомов углерода. Неограничивающие примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил и тому подобное.
Термин "гетероалкил" относится к алкильной группе, где 1, 2 или 3 атома углерода замещены гетероатомом, независимо выбранным из N, О или S.
"Алкенил" относится к алифатической углеводородной группе, содержащей, по меньшей мере, одну углерод-углеродную двойную связь, и которая может быть линейной или разветвленной и имеющей указанное число атомов углерода. Предпочтительно алкенил содержит одну углерод-углеродную двойную связь, и до четырех неароматических углерод-углеродных двойных связей могут присутствовать. Примеры алкенильных групп включают этенил, пропенил, н-бутенил, 2-метил-1-бутенил, 3-метилбут-2-енил, н-пентенил, октенил и деценил.
"Алкинил" относится к алифатической углеводородной группе, содержащей, по меньшей мере, одну углерод-углеродную тройную связь, и которая может быть линейной или разветвленной и имеющей указанное число атомов углерода. Неограничивающие примеры подходящих алкинильных групп включают этинил, пропинил, 2-бутинил и 3-метилбутинил.
"Алкокси" относится к алкил-О-группе, в которой алкильная группа имеет вид, как описано выше. C1-6алкокси, например, включает в себя метокси, этокси, пропокси, изопропокси и тому подобное.
"Алкоксиалкил" относится к алкильной группе, описанной выше, в которой один или более (в частности, от 1 до 3) атомов водорода заменены алкоксигруппами. Примеры включают CH2OCH3, CH2CH2OCH3 и CH(OCH3)CH3.
"Аминоалкил" относится к алкильной группе, описанной выше, в которой один атом водорода замещен аминогруппой, моноалкиламино или диалкиламино группой. Примеры включают CH2NH2, CH2CH2NHCH3 и CH(N(CH3)2)CH3.
Термин "C0", используемый в таких выражениях, как "C0-6 алкил" означает прямую ковалентную связь; или когда термин фигурирует в конце заместителя, C0-6 алкил означает водород или C1-6алкил. Аналогичным образом, когда целое число, определяющее наличие некоторого числа атомов в группе равно нулю, то это означает, что атомы, примыкающие к ней, присоединены непосредственно связью. Например, в структуре 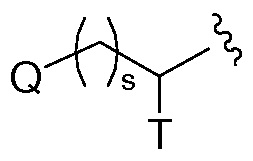 , в которой s является целым числом равным нулю, 1 или 2, структура представляет собой
, в которой s является целым числом равным нулю, 1 или 2, структура представляет собой 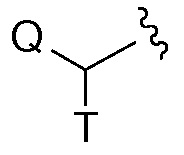 , когда s равен нулю.
, когда s равен нулю.
Термин "C3-8 циклоалкил" (или "C3-C8 циклоалкил") означает циклическое кольцо алкана, имеющего в общем от трех до восьми атомов углерода (т.е. циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, или циклооктил). Термины "C3-7 циклоалкил", "C3-6 циклоалкил", " C5-7 циклоалкил" и т.п. имеют аналогичные значения.
Термин "галоген" (или "гало") относится к фтору, хлору, брому и иоду (альтернативно именуемые как фтор (F), хлор (Cl), бром (Br) и йод (I)).
Термин "арил" относится к ароматическим моно- и поли-карбоциклическим кольцевым системам, где отдельные карбоциклические кольца в поликольцевых системах сконденсированы или присоединены друг к другу через одинарную связь. Подходящие арильные группы включают фенил, нафтил, 2,3-дигидро-1Н-инденил и бифенил.
Термин "карбоцикл" (и его вариации, такие как "карбоциклический" или "карбоциклил"), в данном контексте, если не указано иное, относится к (i) C3-C8 моноциклическому насыщенному или ненасыщенному кольцу, или (ii) в C7-C12 бициклической насыщенной или ненасыщенной кольцевой системе. Каждое кольцо в (ii) либо независимо, либо скондесировано с другим кольцом, и каждое кольцо является насыщенным или ненасыщенным. Карбоцикл может быть присоединен к остальной части молекулы через любой атом углерода, что приводит к стабильному соединению. Конденсированные бициклические карбоциклы являются разновидностью карбоциклов; т.е., термин "конденсированный бициклический карбоцикл" обычно относится к C7-C10 бициклической кольцевой системе, в которой каждое кольцо является насыщенным или ненасыщенным и два смежных атома углерода являются общими для каждого из колец в кольцевой системе. Конденсированный бициклический карбоцикл, в котором одно кольцо является насыщенным, и другое кольцо является насыщенным представляет собой насыщенную бициклическую кольцевую систему. Конденсированный бициклический карбоцикл, в котором одно кольцо является бензолом, а другое является насыщенным представляет собой ненасыщенную бициклическую кольцевую систему. Конденсированный бициклический карбоцикл, в котором одно кольцо является бензолом, а другое является ненасыщенным представляет собой ненасыщенную кольцевую систему. Насыщенные карбоциклические кольца также называют циклоалкильными кольцами, например, циклопропил, циклобутил и т.д. Если не указано иное, карбоцикл является незамещенным или замещен C1-6 алкилом, C1-6 алкенилом, C1-6 алкинилом, арилом, галогеном, NH2 или OH. Разновидностью конденсированных бициклических ненасыщенных карбоциклов являются те бициклические карбоциклы, в которых одно кольцо представляет собой бензольное кольцо, а другое кольцо является насыщенным или ненасыщенным, с присоединением через любой атом углерода, что приводит к стабильному соединению. Типичные примеры этой разновидности включают в себя следующее:

"Цианоалкил" относится к алкильной группе, описанной выше, в которой один атом водорода замещен цианогруппой. Примеры включают CH2CN, CH2CH2CN и CH(CN)CH3.
"Циклоалкил" означает карбоциклическую кольцевую систему, имеющую от 3 до 12 кольцевых атомов углерода; указанная кольцевая система может быть (а) моноциклическим насыщенным карбоциклом, необязательно сконденсированным с бензольным или частично ненасыщенным карбоциклом, или (б) бициклическим насыщенным карбоциклом. Для бициклической системы, в струтуре либо (а), либо (б), кольца сконденсированы через два смежных кольцевых атома углерода (например, декалин), через один кольцевой атом углерода (например, спиро[2.2]пентан), или соединены мостиковыми группами (например, норборнан). Дополнительные примеры в пределах указанного выше значения включают в себя, но не ограничиваются ими, циклопропан, циклобутан, циклопентан, циклогексан, пергидроиндан, декалин, спиро[4.5]декан, бицикло[2.2.2]октан и тому подобное.
"Галогеналкил" относится к алкильной группе, описанной выше, в которой один или более (в частности, от 1 до 5) атомов водорода заменены атомами галогена, вплоть до полного замещения всех атомов водорода галогруппами. C1-6галогеналкил, например, включает в себя -CF3, -CF2CF3, CHFCH3 и тому подобное.
"Гетероцикл", "гетероциклический" или "гетероциклил" представляет собой моноциклическую или бициклическую 3-12-членную кольцевую систему, в которой, по меньшей мере, одно кольцо является неароматическим (насыщенным или частично ненасыщенным) и содержащую, по меньшей мере, один гетероатом, выбранный из O, S и Н. В бициклической кольцевой системе, второе кольцо может быть гетероарилом, гетероциклом или насыщенным, частично ненасыщенным или ароматическим карбоциклом, и точка(точки) присоединения к остальной части молекулы может быть на любом кольце. Для бициклической системы, кольца могут быть сконденсированы через два смежных кольцевых атома (например, хинолин), через один кольцевой атом углерода (например, 1,4-диоксаспиро[4.5]декан), или соединены мостиковыми группами (например, 8-азабицикло[3.2.1]октанил). Поэтому "гетероциклил" включает гетероарилы, а также дигидро и тетрагидро аналоги. Присоединение гетероциклильного заместителя может происходить через атом углерода или через гетероатом.
Примеры гетероциклов (гетероциклила) включают, но не ограничиваются ими, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиаморфолинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, дигидроимидазолил, дигидроиндолил, 1,2,3,4-тетрагидроизохинолинил, 5,6,7,8-тетрагидро-имидазо[1,2-а]пиразин, 2,3-дигидробензофуранил, бензо-1,4-диоксанил, бензимидазолил, бензофуранил, бензофуразанил, бензопиразолил, бензотриазолил, бензотиофенил, бензоксазолил, карбазолил, карболинил, циннолинил, фуранил, имидазолил, индолинил, индолил, индолазинил, индазолил, изобензофуранил, изоиндолил, изохинолил, изотиазолил, изоксазолил, нафтпиридинил, оксадиазолил, оксазолил, оксазолин, изоксазолин, оксетанил, пиранил, пиразинил, пиразолил, пиридазинил, пиридопиридинил, пиридазинил, пиридинил, пиримидил, пирролил, хиназолинил, хинолил, хиноксалинил, тетрагидропиранил, тетразолил, тетразолопиридил, тиадиазолил, тиазолил, тиенил, триазолил, азетидинил, азиридинил, 1,4-диоксанил, гексагидроазепинил, пиперазинил, пиперидинил, пирролидинил, морфолинил, тиоморфолинил, дигидробензоимидазолил, дигидробензофуранил, дигидробензотиофенил, дигидробензоксазолил, дигидрофуранил, дигидроимидазолил, дигидроиндолил, дигидроизооксазолил, дигидроизотиазолил, дигидрооксадиазолил, дигидрооксазолил, дигидропиразинил, дигидропиразолил, дигидропиридинил, дигидропиримидинил, дигидропирролил, дигидрохинолинил, дигидротетразолил, дигидротиадиазолил, дигидротиазолил, дигидротиенил, дигидротриазолил, дигидроазетидинил, метилендиоксибензоил, тетрагидрофуранил и тетрагидротиенил и их N-оксиды.
Насыщенные гетероциклические соединения образуют разновидность гетероциклов; т.е., термины "насыщенный гетероциклический и (C3-12) гетероциклоалкил" обычно относится к гетероциклу, определенному выше, в котором вся кольцевая система (как моно-, так и поли-циклическая) является насыщенной. Термин "насыщенное гетероциклическое кольцо" относится к 4-8-членному насыщенному моноциклическому кольцу или стабильной 7-12-членной бициклической кольцевой системе, которая состоит из атомов углерода и одного или более гетероатомов, выбранных из N, О и S. Типичные примеры включают пиперидинил, пиперазинил, азепанил, пирролидинил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолидинил, изотиазолидинил, тетрагидрофурил и (или тетрагидрофуранил).
Гетероароматические соединения образуют другую разновидность гетероциклов; т.е., термин "гетероароматический" (альтернативно "гетероарил") обычно относится к гетероциклу, определенному выше, в котором вся кольцевая система (как моно-, так и поли-циклическая) является ароматической кольцевой системой. Термин "гетероароматическое кольцо" относится к 5- или 6-членному моноциклическому ароматическому кольцу или 7-12-членной бициклической системе, которая состоит из атомов углерода и одного или более гетероатомов, выбранных из N, О и S. Для бициклического гетероарила только одно из колец должно быть гетероароматическим, второе кольцо может быть гетероароматическим или ароматическим, насыщенным или частично ненасыщенным карбоциклом, и точка(точки) присоединения к остальной части молекулы может быть на любом кольце. В случае замещенных гетероарильных колец, содержащих, по меньшей мере, один атом азота (например, пиридин), такие замещения могут быть таковыми, что приводят к образованию N-оксида. Примеры гетероарила включают, но не ограничиваются ими, фуранил, тиенил (или тиофенил), пирролил, имидазолил, пиразолил, оксазолил, тиазолил, изоксазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, нафтиридинил, бензотиенил, бензофуранил, бензимидазол, бензпиразолил, индолил, изоиндолил, индолизинил, индазолил, пуринил, хинолизинил, фталазинил, хиноксалинил, хиназолинил, бензоксазолил, бензизоксазолил, 5,6,7,8-тетрагидрохинолинил, имидазо[1,2-а]пиридинил, имидазо[1,2-а]-пиримидинил, 5,6-дигидропирроло[1,2-b]пиразолил, пирроло[3,2-с]пиридинил, пирроло[2,3-b]пиридинил, тиено[2,3-b]пирролил, фуропиридин и тиенопиридин.
Характерные примеры бициклических гетероциклов включают бензотриазолил, индолил, изоиндолил, индазолил, индолинил, изоиндолинил, хиноксалинил, хиназолинил, циннолинил, хроманил, изохроманил, тетрагидрохинолинил, хинолинил, тетрагидроизохинолинил, изохинолинил, 2,3-дигидробензофуранил, 2,3-дигидро-бензо-1,4-диоксинил (т.е.  ), имидазо(2,1-b)(1,3)тиазол, (т.е.
), имидазо(2,1-b)(1,3)тиазол, (т.е. 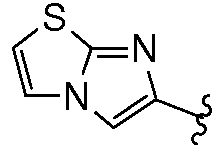 ) и бензо-1,3-диоксолил (т.е.
) и бензо-1,3-диоксолил (т.е. 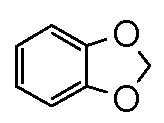 ). В определенных контекстах в данном описании,
). В определенных контекстах в данном описании, 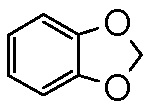 в качестве альтернативы называют фенил, имеющий в качестве заместителя метилендиокси, присоединенный к двум смежным атомам углерода.
в качестве альтернативы называют фенил, имеющий в качестве заместителя метилендиокси, присоединенный к двум смежным атомам углерода.
Неограничивающие примеры замещенных гетероарилов включают: изоиндолинон, изоиндолин-1-он, 2,3-дигидро-1Н-пиразоло[4,3-с]пиридин-4(5Н)-он, 2,3,4,5-тетрагидробензо[d]изотиазол 1,1-диоксид и 2,3,4,5-тетрагидробензо[b]тиофен 1,1-диоксид.
"Гидроксиалкил" относится к алкильной группе, описанной выше, в которой один или более (в частности, от 1 до 3) атомов водорода заменены на гидроксильные группы. Примеры включают CH2OH, CH2CHOH и CHOHCH3.
"Алкилен", "алкенилен", "алкинилен", "циклоалкилен", "арилен", "гетероарилен" и "гетероциклилен" относятся к двухвалентному радикалу, полученному путем удаления одного атома водорода из алкильной, алкенильной, алкинильной, циклоалкильной, арильной, гетероарильной и гетероциклильной группы соответственно, каждая из которых имеет значение, определенное выше.
Если специально не указано иное, "ненасыщенное" кольцо является частично или полностью ненасыщенным кольцом. Например, "ненасыщенный моноциклический C6 карбоцикл" относится к циклогексену, циклогексадиену и бензолу.
Если специально не указано иное, все диапазоны, приведенные в данном описании, являются инклюзивными. Например, гетероцикл описанный как содержащий от "1 до 4 гетероатомов" означает, что гетероцикл может содержать 1, 2, 3 или 4 гетероатома.
Когда какая-либо переменная встречается более одного раза в любой составляющей или в любой формуле, изображающей и описывающей соединения по настоящему изобретению, ее определение в каждом случае не зависит от ее определения в каждом другом случае. Кроме того, комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к получению стабильных соединений.
Термин "сульфамоил" является суффиксом для обозначения радикалов, полученных из сульфамидов, таких как -SO2NH2 и -SO2N(RR1).
Термин "сульфонимидоил" является суффиксом для обозначения радикала 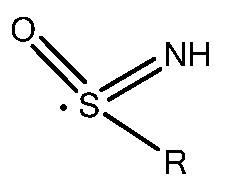 , где R представляет собой C(1-10) алкил, арил, гетероарил, циклоалкил, гетероциклоалкил и т.п., такие, как, например, метил, этил, изопропил и пропил.
, где R представляет собой C(1-10) алкил, арил, гетероарил, циклоалкил, гетероциклоалкил и т.п., такие, как, например, метил, этил, изопропил и пропил.
Термин "замещенный" (например, как в "арил, который необязательно замещен одним или более заместителями...") включает в себя моно- и поли-замещение названным заместителем в тех случаях, когда это одиночное и множественное замещение (включая множественное замещение в одном и том же месте) химически допускается.
Термин "окси" подразумевает атом кислорода (O). Термин "тио" подразумевает атом серы (S). Термин "оксо" подразумевает "=O". Термин "карбонил" подразумевает "С=О".
Когда какая-либо переменная (например, R2, R3 и т.д.) встречается более чем один раз в любом заместителе или в формуле I или формуле II, ее определение в каждом случае не зависит от ее определения в каждом другом случае. Кроме того, комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к получению стабильных соединений.
По стандартной номенклатуре, используемой в данном описании, концевая часть называемой боковой цепи описывается первой, с последующим описанием смежной функциональной группы по направлению к точке присоединения. Например, C1-5алкилкарбониламиноC1-6алкильный заместитель соответствует 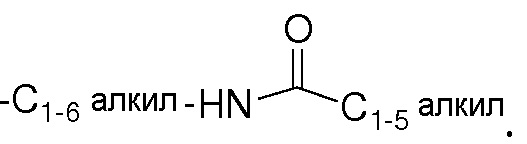 .
.
При выборе соединений по настоящему изобретению, любому обычному специалисту в данной области техники будет понятно, что различные заместители, т.е. R1, R2, R3 и т.д., должны быть выбраны в соответствии с хорошо известными принципами связности химической структуры.
Линии, проведенные в кольцевые системы от заместителей, указывают, что указанная связь может быть присоединена к любому из замещаемых кольцевых атомов. Если кольцевая система является полициклической, предполагается, что связь может быть присоединена к любому из подходящих атомов углерода только на проксимальном кольце.
Понятно, что заместители и типы замещения в соединениях по настоящему изобретению могут быть выбраны любым обычным специалистом в данной области техники, с получением соединений, которые являются химически стабильными и которые могут быть легко синтезированы с помощью методик, известных в данной области техники, а также тех способов, что изложены ниже, из легко доступных исходных веществ. Если заместитель сам замещен более чем одной группой, следует понимать, что эти множественные группы могут быть на том же атоме углерода или на различных атомах углерода, при условии, что в результате получаются стабильные структуры. Фразу "необязательно замещенный одним или более заместителями" следует принимать, как равноценную фразе "необязательно замещенный, по меньшей мере, одним заместителем", и в таких случаях один из вариантов осуществления будет иметь от нуля до трех заместителей.
Структурные представления соединений, имеющих заместители, заканчивающиеся метильной группой могут отображать концевую метильную группу, либо используя обозначение "CH3", например, "-CH3", либо используя прямую линию, представляющую присутствие метильной группы, например, 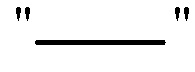 , т.е.
, т.е. 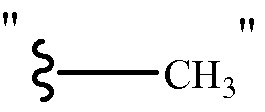 и
и 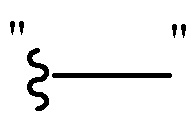 имеют эквивалентные значения
имеют эквивалентные значения
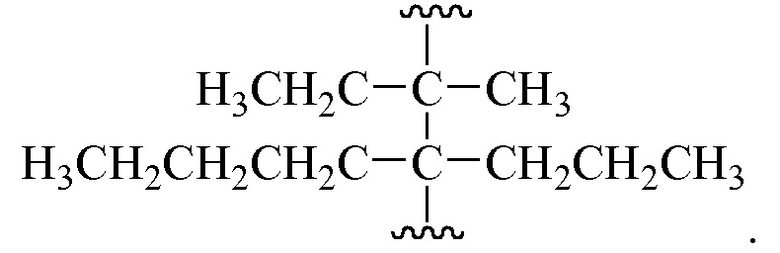
Для определения переменных, содержащих термины, имеющие повторяющиеся термины, например, (CRiRj)r, где r равно числу 2, Ri является определенной переменной, и Rj является определенной переменной, значение Ri может отличаться в каждом конкретном случае, в котором она встречается, и значение Rj может отличаться в каждом конкретном случае, в котором она встречается. Например, если Ri и Rj независимо выбраны из группы, состоящей из метила, этила, пропила и бутила, тогда (CRiRj)2 может быть
"Пациент" включает как человека, так и животных.
"Млекопитающее" означает человека и других млекопитающих животных.
"Терапевтически эффективное количество" означает такое количество лекарственного препарата или фармацевтического средства, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которая является искомой исследователем, ветеринаром, врачом или другим клиницистом.
Термин "лечение" или "лечить" включает облегчение, улучшение, ослабление или иное уменьшение признаков и симптомов, связанных с заболеванием или расстройством.
Термин "композиция", как в фармацевтической композиции, предназначен, чтобы охватить продукт, содержащий активный ингредиент(ы) и инертный ингредиент(ы) (фармацевтически приемлемые эксципиенты), который составляет носитель, а также любой продукт, который получается прямо или косвенно в результате комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению включают любую композицию, полученную смешиванием соединения формулы I или II и фармацевтически приемлемых эксципиентов.
Термин "необязательно замещенный" означает "незамещенный или замещенный", и, следовательно, общие структурные формулы, описанные в настоящей заявке, охватывают соединения, содержащие указанный необязательный заместитель, а также соединения, которые не содержат необязательный заместитель.
Каждая переменная определяется независимо, каждый раз это происходит в рамках родовых определений структурной формулы. Например, когда есть более чем один заместитель для арила/гетероарила, каждый заместитель независимо выбирают в каждом случае, и каждый заместитель может быть таким же или отличаться от другого(других). В качестве другого примера, для группы -(CR3R3)2- каждое появление двух групп R3 может быть одинаковым или разным. В данном контексте, если явно не указано иное, каждая ссылка на конкретное соединение по настоящему изобретению или общая формула соединений по настоящему изобретению предназначена для охватывания соединения(соединений), а также их фармацевтически приемлемых солей.
В одном варианте осуществления настоящего изобретения, A выбирают из: фенила, изоиндолинила, 2,3-дигидро-1H-изоиндолила, хинолинила, пиридинила, 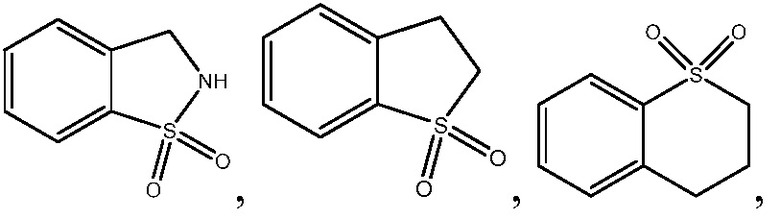
 , 2,3-дигидро-1Н-инденила, бензотазолила, 1,3-бензотиазолила и 1,2,3,4-тетрагидроизохинолинила.
, 2,3-дигидро-1Н-инденила, бензотазолила, 1,3-бензотиазолила и 1,2,3,4-тетрагидроизохинолинила.
В одном варианте осуществления настоящего изобретения, р равно 2, 3 или 4. В варианте настоящего осуществления р равно 3 или 4. В еще одном варианте осуществления р равно 2.
В одном варианте осуществления изобретения m равно 1, 2, 3 или 4. В другом варианте осуществления, m равно 0, 1, 2 или 3. В еще одном варианте, m равно 4.
В одном варианте осуществления настоящего изобретения, n равно 0, 1, 2 или 3. В варианте настоящего осуществления, n равно 0, 1 или 2.
В одном варианте осуществления изобретения, R1 выбирают из галогена, Оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-10 алкиламино(карбонил)0-1C0-10 алкила, (C1-10)гетероалкиламино(карбонил)0-1C0-10 алкила, C3-12 циклоалкиламино(карбонил)0-1C0-10 алкила, арил C0-10 алкиламиноамино(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкиламино(карбонил)0-1C0-10 алкила, C1-10 алкилсульфонилC0-10 алкила, (C3-12)циклоалкилC0-10алкилсульфонилC0-10 алкила, (C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила, гетероарилC0-10 алкилсульфонилC0-10 алкила, арилC0-10 алкилсульфонилC0-10 алкила, C1-10 алкилсульфамоилC0-10 алкила, C1-10 гетероалкилсульфамоилC0-10 алкила, (C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила, гетероарилC0-10 алкилсульфамоилC0-10 алкила, арилC0-10 алкилсульфамоилC0-10 алкила, C1-10 алкилсульфонимидоилC0-10 алкила,
C1-10 гетероалкилсульфонимидоилC0-10 алкила, (C3-12)циклоалкилC0-10 алкилсульфонимидоилC0-10 алкила, (C3-12)циклогетероалкилC0-10алкилсульфонимидоилC0-10 алкила, гетероарилC0-10 алкилсульфонимидоилC0-10 алкила, арилC0-10 алкилсульфонимидоилC0-10 алкила, C1-10 C1-10 алкилтиоC0-10 алкила, (C0-10 алкил)1-2 амино, -CO2(C0-10 алкил), -(C0-10 алкил)CO2H, -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, -SO2CF3, -SO2CF2H, C1-10 алкилсульфинилC0-10 алкила, гидрокси, -(C1-10 алкил)OH, -C1-10 алкилалкокси, циано, (C1-6алкил) циано и C1-6галогеналкила; где два R1 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца и где R1 необязательно замещен 1, 2, 3 или 4 заместителями R3.
В одном варианте осуществления изобретения R1 выбирают из галогена, оксо (= O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, C0-10 алкиламино(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила, C1-10 алкилсульфонилC0-10 алкила, (C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила, C1-10 алкилсульфамоилC0-10 алкила, (C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила, арилC0-10 алкилсульфамоилC0-10 алкила,
C1-10 алкилсульфонимидоилC0-10 алкила, C1-10 алкилтиоC0-10 алкила, (C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил), -(C0-10 алкил)CO2H, -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, гидрокси, -(C1-10 алкил)OH, -C1-10 алкилалкокси, циано и C1-6галогеналкила; и где два R1 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R1 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3.
В одном варианте осуществления R1 выбирают из: аминометила, 1-аминоэтила,
изопропилсульфонила, трет-бутилсульфонила, трет-бутилсульфамоила, метила, пирролидинилкарбонила, этиламинометила, изопропиламинометила, изопропила, трет-бутила, изобутила, этила, пропила, циклопропилметила, фтора, метилкарбонила, метилтиометила, триазолилметила, оксо, гидроксиэтила, метоксиэтила, трет-бутилоксикарбонила, 2-метокси-1,1-диметилэтила, 3-метокси-1,1-диметилпропила, 3-метокси-2,2-диметилпропила, диметилсульфамоила, циклопентилметила, трет-бутилксикарбонилэтила, трет-бутилоксикарбонилметила, трет-бутилксикарбонилизопропила, циклогексила, циклопентила, метиламинометила, пирролидинилкарбонила, пиперидинила, метокси, дифторметила, этоксикарбонилдиметилэт-2-ила, (изопропокси)карбонилдиметилэт-2-ила, тетрагидропиранила, оксазолила, пиразолила, хлора, оксетанила, оксадиазолила, 1,2,4-оксадиазолила, пиперидинилкарбонила, изоксазолила, пирролидинила, изопропилкарбокси, циклопропила, трифторэтила, 2,2,2-трифторэтила, морфолинила, пропила, циклобутила, карбокси, метилсульфонила, сульфамоила, гидроксиметила, пиразолиламинокарбонилметила, 1,3-оксазолилкарбониламинометила, пиримидинилкарбониламинометила, трет-бутилоксикарбониламинометила, изопропилсульфонила, пирролидинилсульфонилметила, пиразолилкарбониламинометила, оксазолилкарбониламинометила, пиримидинилкарбониламинометила, изопропилсульфамоила, фенилметилсульфамоила, (циклопропилметил)сульфамоила, этилсульфамоила, циклогексилсульфамоила, пиперидинилсульфонила, морфолинилсульфонила, 1,2,3-триазолилметила, морфолинилметила, диоксоланила, трифторэтиламинометила, метилсульфонила, метилкарбониламинометила, пиразолилметила,
имидазолилметила, (2,2,2-трифторэтил)аминометила, диметиламинокарбонила, морфолинилкарбонила, пирролидинила, 3-гидрокси-1,1-диметилпропила, 3-гидрокси-2,2-диметилпропила, 2-метокси-1-метилэтила, гидроксипропила, 2-гидроксипропила, 1-гидрокси-1-метилэтила, трифторметила, триазолилизопропила, 1,2-диметилпропила, трет-бутилоксикарбонилдиметилэт-2-ила, пиразинилкарбонила, 8-азабицикло[3.2.1]октанила, трифторметокси, дифторэтила, тиазолила, 1,3-тиазолила, триазолилизобутила, тетрагидротиопиранила, этоксикарбонила, изопропилсульфонимидоила, метилсульфонимидоила, гидрокси, циано, метоксиизопропила и 4,5-дигидро-1,2,4-оксадиазолила; и где два R1 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R1 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3.
В одном варианте осуществления изобретения R2 выбирают из галогена, оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкиламиноC0-10 алкила, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила, C1-10 алкилсульфонила, (C0-10 алкил)1-2 амино, -(C0-10 алкил)CO2H, гидрокси, -(C1-10 алкил)OH, -C1-10 алкилалкокси, (C1-6алкил)циано и C1-6галогеналкила; где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3;
В одном варианте осуществления изобретения R2 выбирают из галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкиламиноC0-10 алкила, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила, (C0-10 алкил)1-2 амино и гидрокси; где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3.
В другом варианте осуществления изобретения R2 выбирают из: фтора, гидрокси,
1-циклопропиэтиламино, диметиламино, азетидинила, этиламино, метила; где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3.
В одном варианте осуществления изобретения R3 независимо выбирают из галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, -CO2(C0-10 алкил), -(C0-10 алкил)CO2H, Оксо (=O), -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 аклил)2, C1-10 алкилсульфинила, амино, (C0-10 алкил)1-2 амино, гидрокси, (C1-10 алкил)OH, C1-10 алкокси, (C1-10 алкил)циано, циано и C1-6галогеналкила; и R3 необязательно замещен 1, 2 или 3 заместителями R4, выбранными из водорода, гидрокси, (C1-6)алкила, (C1-6)алкокси, (C1-10 алкил)OH, галогена, CO2H, -(C0-6)алкилCN, -O(C=O)C1-C6 алкила, NO2, трифторметокси, трифторэтокси, трифторметила, трифторэтила, -N-C(O)O(C0-6)алкила, C1-10 алкилсульфонила, оксо (O=), аминосульфонила, -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, -SO2C1-6алкила, -SO2CF3, -SO2CF2H, -C1-10 алкилсульфинила, -O(0-1)(C1-10)галогеналкила, амино(C1-6алкил)0-2 и NH2.
В одном варианте осуществления изобретения R3 независимо выбирают из галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, -CO2(C0-10 алкил), Оксо (=O), C1-10 алкилсульфинила, амино, (C0-10 алкил)1-2 амино, гидрокси, (C1-10 алкил)OH, C1-10 алкокси, (C1-10 алкил)циано, циано и C1-6галогеналкила.
В одном варианте осуществления R3 независимо выбирают из: трифторметила, гидрокси, метила, пиперидинила, карбокси, трет-бутилоксикарбонила, трет-бутила, метоксиэтила, циано, метокси, фтора, амино, фенила, циклопропила, трет-бутилсульфинила, 1-гидроксиметилэтила, дифторметила, диметиламино, цианоэтила, оксо, изопропила и трифторэтила.
В одном варианте осуществления R4 представляет собой водород, гидрокси и (C1-6)алкил. В варианте настоящего осуществления, R4 представляет собой водород.
В одном варианте осуществления настоящего изобретения представляет собой соединение формулы I, где: A выбирают из арила и гетероарила; n равно 0, 1, 2, 3 или 4; m равно 0, 1, 2, 3 или 4; p равно 0, 1, 2, 3 или 4; R1 независимо выбирают из: галогена, Оксо (= O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, C0-10 алкиламино(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила, C1-10 алкилсульфонилC0-10 алкила, (C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила, C1-10 алкилсульфамоилC0-10 алкила, (C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила, арилC0-10 алкилсульфамоилC0-10 алкила,
C1-10 алкилсульфонимидоилC0-10 алкила, C1-10 алкилтиоC0-10 алкила, (C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил), -(C0-10 алкил)CO2H, -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, гидрокси, -(C1-10 алкил)OH, -C1-10 алкилалкокси, циано и C1-6галогеналкила; и где два R1 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R1 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3;
R2 выбирают из: галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкиламиноC0-10 алкила, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила, (C0-10 алкил)1-2 амино и гидрокси; где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; где R1 и R2 каждый каждый необязательно замещен 1, 2, 3 или 4 заместителями R3; и R3 независимо выбирают из: галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, -CO2(C0-10 алкил), Оксо (=O), C1-10 алкилсульфинила, амино, (C0-10 алкил)1-2 амино, гидрокси, (C1-10 алкил)OH, C1-10 алкокси, (C1-10 алкил)циано, циано и C1-6галогеналкила.
В одном варианте осуществления изобретения, A выбирают из фенила, пиридинила, 2,3-дигидро-1H-изоиндолила, тиохроманила, 2,3-дигидро-1,2-бензотиазолила, 2,3-дигидро-1-бензотиофенила и 2,3-дигидро-1Н-инденила; R1 выбирают из: галогена, Оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-8 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-8)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-10 алкиламино(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила, C0-10 гетероалкилсульфонилC0-10 алкила, (C3-8)циклогетероалкилC0-10алкилсульфонилC0-10 алкила, C1-10 алкилсульфамоилC0-10 алкила, (C3-8)циклоалкилC0-10 алкилсульфамоилC0-10 алкила, циклогетероалкилC0-10алкилсульфамоилC0-10 алкила,
арилC0-10 алкилсульфамоилC0-10 алкила, -(C0-10 алкил)CO2H, -SO2NH2, -SO2NH(C1-10 алкил),
-SO2N(C1-10 алкил)2, C0-10 алкилсульфиниламиноC0-10 алкила, -(C1-10 алкил)OH, -C1-10 алкилалкокси и C1-6галогеналкила; где R1 необязательно замещен 1, 2, 3 или 4 заместителями R3.
В варианте данного осуществления изобретения, R1 выбирают из: фтора, метилсульфонила, хлора, трифторметила, трифторметокси, диметилсульфамоил, сульфамоил, гидроксиэтила, трифторэтила, пиразолилкарбамоилметила, пиразолилкарбониламинометила, трет-бутилоксикарбониламинометила, аминометила, изопропилсульфамоила, бензилсульфамоила, (циклопропилметил)сульфамоила, этилсульфамоила, циклогексилсульфамоила, пиперидинилсульфамоила, морфолинилсульфонила, триазолилметила, пирролидинилкарбонила, оксазолилкарбониламинометила, пиримидинилкарбониламинометила, гидроксиэтила, 1-гидроксиэтила, морфолинилметила,
1-гидроксиметилэтила, гидрокси(метилпропила), 1-гидрокси(метилпропила), гидроксипропила, этилгидрокси, (трет-бутил)сульфиниламинометила, диоксоланила, метиламинометила, метилкарбониламинометила, (диметиламино)метила, пиразолилметила, имидазолилметила, оксо, гидрокси, гидроксиметила, метила, трет-бутила, (трет-бутил)сульфиниламинометила, (этил)аминометила, пирролидинилсульфонилметила, трифторэтила, (2,2,2-трифторэтила), карбокси, циклопропилметила, диметиламинометила, циклопентилметила, метиламинометила,
1-(метиламино)этила, этиламинометила, диметиламинокарбонила, диметилкарбамоила, морфолинилкарбонила, циклопропила, аминоэтила, 1-аминоэтила, пирролидинила, метилэтила, изобутила, циклопропилметила, метилсульфанилметила, 3-гидрокси(диметилпропила), триазолилметила, 3-гидрокси-2,2-диметилпропила и метоксиэтила; где R1 необязательно замещен 1, 2, 3 или 4 заместителями R3;
R2 выбирают из: циклопропилэтиламино, 1-циклопропилэтиламино, гидрокси, азетидинила, диметиламино, трифторэтила, метила, этила; где два R2 необязательно может объединяться с атомом кольца, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R2 необязательно замещен 1, 2, 3 или 4 заместителями R3; и R3 независимо выбирают из: хлора, фтора, метокси, метила, трифторэтила, гидроксиметилэтила, гидрокси, изопропила, этила; где R3 необязательно замещен 1, 2 или 3 заместителями R4.
В одном варианте осуществления настоящее изобретение выбирают из соединений формулы II или их фармацевтически приемлемых солей или стереоизомеров:
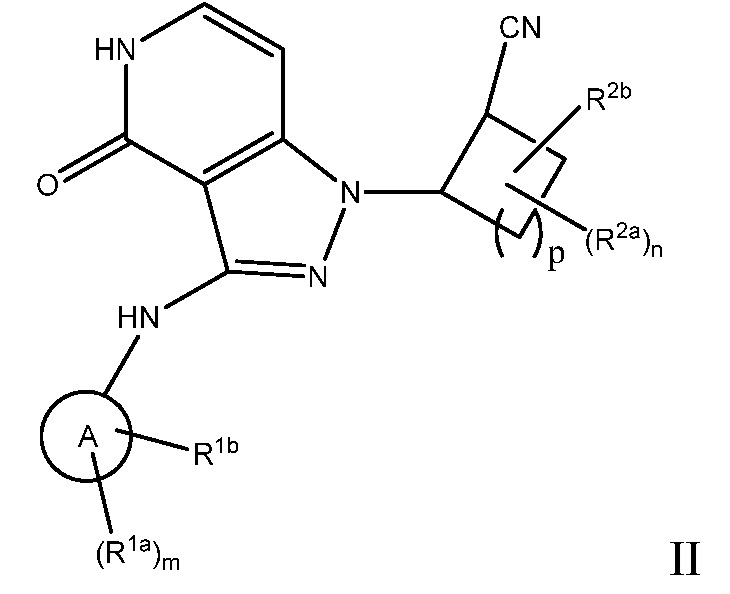
A выбирают из арила и гетероарила;
n равно 0, 1 или 2;
m равно 0, 1, 2 или 3;
p равно 0, 1, 2, 3 или 4;
R1a выбирают из:
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10алкила,
C0-10 алкиламино(карбонил)0-1C0-10 алкила,
(C0-10 алкил)1-2 амино,
C1-10 алкилтиоC0-10 алкила,
C1-10 алкилсульфонилC0-10 алкила,
-SO2NH2,
-SO2NH(C1-10 алкил),
-SO2N(C1-10 алкил)2,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси, и
C1-6галогеналкила; и
где два R1a могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца;
R2a выбирают из:
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
(C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси, и
C1-6галогеналкила, где два R2a могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца;
где R1a и R2a независимо необязательно замещены 1, 2, 3 или 4 заместителями R3a;
R3a независимо выбирают из:
галогена,
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, и
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
Оксо (=O),
гидрокси,
(C1-10 алкил)OH,
C1-10 алкокси, и
C1-6галогеналкила;
R3a необязательно замещен 1, 2 или 3 заместителями R4a выбранными из водорода, гидрокси, (C1-6)алкила, (C1-6)алкокси, (C1-10 алкил)OH, галогена, CO2H, -(C0-6)алкилCN,
-O(C=O)C1-C6 алкила, NO2, трифторметокси, трифторэтокси, трифторметила, трифторэтила, -N-C(O)O(C0-6)алкила, C1-10 алкилсульфонила, оксо (O=), аминосульфонила,
-SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, -SO2C1-6алкила, -SO2CF3, -SO2CF2H, -C1-10 алкилсульфинила, -O(0-1)(C1-10)галогеналкила, амино(C1-6алкил)0-2 и NH2;
R1b выбирают из:
водорода,
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила,
C2-10 алкенил(окси)0-1(карбонил)0-1C0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
арил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила,
C0-10 алкиламино(карбонил)0-1C0-10 алкила,
(C1-10)гетероалкиламино(карбонил)0-1C0-10 алкила,
C3-12 циклоалкиламино(карбонил)0-1C0-10 алкила,
арил C0-10 алкиламиноамино(карбонил)0-1C0-10 алкила,
гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила,
(C3-12)гетероциклоалкиламино(карбонил)0-1C0-10 алкила,
C0-10 алкилсульфонилC0-10 алкила,
C1-10 гетероалкилсульфонилC0-10 алкила,
(C3-12)циклоалкилC0-10алкилсульфонилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила,
гетероарилC0-10 алкилсульфонилC0-10 алкила,
арилC0-10 алкилсульфонилC0-10 алкила,
C1-10 алкилсульфамоилC0-10 алкила,
C1-10 гетероалкилсульфамоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила,
гетероарилC0-10 алкилсульфамоилC0-10 алкила,
арилC0-10 алкилсульфамоилC0-10 алкила,
C1-10 алкилсульфонимидоилC0-10 алкила,
C1-10 гетероалкилсульфонимидоилC0-10 алкила,
(C3-12)циклоалкилC0-10 алкилсульфонимидоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфонимидоилC0-10 алкила,
гетероарилC0-10 алкилсульфонимидоилC0-10 алкила,
арилC0-10 алкилсульфонимидоилC0-10 алкила,
C1-10 алкилтиоC0-10 алкила,
(C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2NH2,
-SO2NH(C1-10 алкил),
-SO2N(C1-10 алкил)2,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинилC0-10 алкила,
C1-10 гетероалкилсульфинилC0-10алкила,
(C3-12)циклоалкилC0-10алкилсульфинилC0-10алкила,
(C3-12)циклогетероалкилC0-10алкилсульфинилC0-10алкила,
гетероарилC0-10 алкилсульфинилC0-10алкила,
арилC0-10алкилсульфинилC0-10алкила,
C0-10 алкилсульфиниламиноC0-10 алкила,
C1-4ациламино C0-10 алкила,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси,
циано,
(C1-6алкил) циано, и
C1-6галогеналкила;
R2b выбирают из:
водорода,
галогена,
Оксо (=O),
C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C3-12 циклоалкила,
(C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила,
C0-10 алкиламиноC0-10 алкила,
(C1-10) гетероалкиламиноC0-10алкила,
C3-12 циклоалкил C0-10 алкиламиноC0-10 алкила,
арил C0-10 алкиламиноC0-10 алкила,
гетероарил C0-10 алкиламиноC0-10 алкила,
(C3-12)гетероциклоалкил C0-10 алкиламиноC0-10 алкила,
C1-10 алкилсульфонила,
(C3-12)циклоалкилC0-10алкилсульфонила,
(C3-12)циклогетероалкилC0-10 алкилсульфонила,
(C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил),
-(C0-10 алкил)CO2H,
-SO2CF3,
-SO2CF2H,
C1-10 алкилсульфинила,
гидрокси,
-(C1-10 алкил)OH,
-C1-10 алкилалкокси,
циано,
(C1-6алкил)циано, и
C1-6галогеналкила; где R1b и R2b каждый необязательно замещен 1, 2 или 3 заместителями R3b;
R3b независимо выбирают из: галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, арил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, -CO2(C0-10 алкил), Оксо (=O), C1-10 алкилсульфинила, амино, (C0-10 алкил)1-2 амино, гидрокси, (C1-10 алкил)OH, C1-10 алкокси, (C1-10 алкил)циано, циано и C1-6галогеналкила. галогена, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, Оксо (=O), амино, гидрокси, (C1-10 алкил)OH, C1-10 алкокси и C1-6галогеналкила; где R3b необязательно замещен 1, 2 или 3 заместителями R4b; и
R4b независимо выбирают из водорода, гидрокси, (C1-6)алкила, (C1-6)алкокси, (C1-10 алкил)OH, галогена, -O(C=O)C1-C6 алкила, трифторметокси, трифторэтокси, трифторметила, трифторэтила, оксо (O=), -O(0-1)(C1-10)галогеналкила, амино(C1-6алкил)0-2 и NH2.
В варианте осуществления настоящего изобретения формулы II, R1b выбирают из: галогена, Оксо (=O), C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C1-10 гетероалкил(окси)0-1(карбонил)0-1C0-10 алкила, C3-12 циклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкила, C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C1-10)гетероалкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, (C3-12)гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, гетероарил C0-10 алкил(окси)0-1(карбонил)0-1аминоC0-10 алкила, C0-10 алкиламино(карбонил)0-1C0-10 алкила, гетероарил C0-10 алкиламино(карбонил)0-1C0-10 алкила, C0-10 алкилсульфонилC0-10 алкила, (C3-12)циклогетероалкилC0-10алкилсульфонилC0-10 алкила, C1-10 алкилсульфамоилC0-10 алкила, (C3-12)циклоалкилC0-10 алкилсульфамоилC0-10 алкила,
(C3-12)циклогетероалкилC0-10алкилсульфамоилC0-10 алкила, арилC0-10 алкилсульфамоилC0-10 алкила,
C1-10 алкилсульфонимидоилC0-10 алкила, C1-10 алкилтиоC0-10 алкила, (C0-10 алкил)1-2 амино,
-CO2(C0-10 алкил), -(C0-10 алкил)CO2H, -SO2NH2, -SO2NH(C1-10 алкил), -SO2N(C1-10 алкил)2, гидрокси, -(C1-10 алкил)OH, -C1-10 алкилалкокси, циано и C1-6галогеналкила; и где R1b каждый необязательно замещен 1, 2, 3 или 4 заместителями R3b.
В другом варианте осуществления настоящего изобретения формулы II, R1b выбирают из: аминометила, 1-аминоэтила, изопропилсульфонила, трет-бутилсульфонила, трет-бутилсульфамоила, метила, пирролидинилкарбонила, этиламинометила, изопропиламинометила, изопропила, трет-бутила, изобутила, этила, пропила, циклопропилметила, фтора, метилкарбонила, метилтиометила, триазолилметила, оксо, гидроксиэтила, метоксиэтила, трет-бутилоксикарбонила, 2-метокси-1,1-диметилэтила, 3-метокси-1,1-диметилпропила, 3-метокси-2,2-диметилпропила, диметилсульфамоила, циклопентилметила, трет-бутилксикарбонилэтила, трет-бутилоксикарбонилметила, трет-бутилксикарбонилизопропила, циклогексила, циклопентила, метиламинометила, пирролидинилкарбонила, пиперидинила, метокси, дифторметила, этоксикарбонилдиметилэт-2-ила, (изопропокси)карбонилдиметилэт-2-ила, тетрагидропиранила, оксазолила, пиразолила, хлора, оксетанила, оксадиазолила, 1,2,4-оксадиазолила, пиперидинилкарбонила, изоксазолила, пирролидинила, изопропилкарбокси, циклопропила, трифторэтила, 2,2,2-трифторэтила, морфолинила, пропила, циклобутила, карбокси, метилсульфонила, сульфамоила, гидроксиметила, пиразолиламинокарбонилметила, 1,3-оксазолилкарбониламинометила, пиримидинилкарбониламинометила, трет-бутилоксикарбониламинометила, изопропилсульфонила, пирролидинилсульфонилметила, пиразолилкарбониламинометила, оксазолилкарбониламинометила, пиримидинилкарбониламинометила, изопропилсульфамоила, фенилметилсульфамоила, (циклопропилметил)сульфамоила, этилсульфамоила, циклогексилсульфамоила, пиперидинилсульфонила, морфолинилсульфонила, 1,2,3-триазолилметила, морфолинилметила, диоксоланила, трифторэтиламинометила, метилсульфонила, метилкарбониламинометила, пиразолилметила,
имидазолилметила, (2,2,2-трифторэтил)аминометила, диметиламинокарбонила, морфолинилкарбонила, пирролидинила, 3-гидрокси-1,1-диметилпропила, 3-гидрокси-2,2-диметилпропила, 2-метокси-1-метилэтила, гидроксипропила, 2-гидроксипропила, 1-гидрокси-1-метилэтила, трифторметила, триазолилизопропила, 1,2-диметилпропила, трет-бутилоксикарбонилдиметилэт-2-ила, пиразинилкарбонила, 8-азабицикло[3.2.1]октанила, трифторметокси, дифторэтила, тиазолила, 1,3-тиазолила, триазолилизобутила, тетрагидротиопиранила, этоксикарбонила, изопропилсульфонимидоила, метилсульфонимидоила, гидрокси, циано, метоксиизопропила и 4,5-дигидро-1,2,4-оксадиазолила; и где R1b каждый необязательно замещен 1, 2, 3 или 4 заместителями R3b.
В другом варианте осуществления настоящего изобретения, R2b выбирают из водорода. В другом варианте осуществления настоящего изобретения, R2b представляет собой галоген, C1-10 алкил(окси)0-1(карбонил)0-1C0-10 алкил, C3-12 циклоалкил, (C3-12) гетероциклоалкил C0-10 алкил(окси)0-1(карбонил)0-1C0-10 алкил, C0-10 алкиламиноC0-10 алкил, C3-12 циклоалкил C0-10 алкиламиноC0-10 алкил, (C0-10 алкил)1-2 амино и гидрокси; и где R2b каждый необязательно замещен 1, 2, 3 или 4 заместителями R3b.
В другом варианте осуществления настоящего изобретения, R2b выбирают из: фтора, гидрокси,
1-циклопропилэтиламино, диметиламино, азетидинила, этиламино, метила; где R2b каждый необязательно замещен 1, 2, 3 или 4 заместителями R3b.
В одном варианте осуществления изобретения, R2b выбирают из водорода, метила и фтора.
В одном из вариантов осуществления изобретения, R1a выбирают из водорода, оксо, метила, фтора, диметил сульфамоила, гидрокси, гидроксиметила, циклопропила, (метилтио)метила, изопропила, метилсульфонила, хлора, пропила и этила.
В одном варианте осуществления изобретения R3а выбирают из оксо, метила, фтора, трифторметила, гидроксиметила, гидрокси, этила, циклопропила, (метилсульфанил)метила, гидроксипропила, гидроксиэтила, метоксиэтила, хлора, аминометила, дифторметила и (метилкарбонил)аминометила.
В одном варианте осуществления изобретения R4a выбирают из водорода, гидрокси, метила, оксо, трифторметила, метокси, 1-гидрокси-1-метилэтила, амино, метоксиэтила, дифторметила, диметиламино и этила.
В одном варианте осуществления изобретения формулы II, R3b независимо выбирают из: трифторметила, гидрокси, метила, пиперидинила, карбокси, трет-бутилоксикарбонила, трет-бутила, метоксиэтила, циано, метокси, фтора, амино, фенила, циклопропила, трет-бутилсульфинила, 1-гидроксиметилэтила, дифторметила, диметиламино, цианоэтила, оксо, изопропила и трифторэтила.
Оптические изомеры - Диастереомеры - Геометрические изомеры - Таутомеры
Соединения по настоящему изобретению могут содержать один или более асимметрических центров и могут, таким образом, существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Настоящее изобретение подразумевает содержание всех таких изомерных форм соединений по настоящему изобретению либо в виде отдельных соединений, либо их смесей.
Некоторые из соединений, описанные в настоящей заявке, содержат олефиновые двойные связи, и, если не указано иное, подразумевают включение в себя как E, так и Z геометрических изомеров.
Некоторые из описанных в настоящей заявке соединений могут существовать с различными точками присоединения водорода, именуемые таутомерами. Таким примером может быть кетон и его енольная форма, известные как кетоенольные таутомеры. Индивидуальные таутомеры, а также их смеси охватываются соединениями формулы I или формулы II.
Конкретные варианты осуществления настоящего изобретения включают соединение, которое выбирают из группы, состоящей из заявленных соединений согласно Примерам, приведенным в настоящей заявке, или их фармацевтически приемлемым солям.
Соединения по настоящему изобретению могут содержать один или более асимметрических центров и могут, таким образом, встречаться в виде "стереоизомеров" в том числе рацематов и рацемических смесей, энантиомерных смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Дополнительные асимметричные центры могут присутствовать в зависимости от природы различных заместителей в молекуле. Каждый такой асимметричный центр будет независимо образовывать два оптических изомера, и предполагается, что все возможные оптические изомеры и диастереомеры в смесях и в виде чистых или частично очищенных соединений включены в объем настоящего изобретения. Настоящее изобретение подразумевает содержание всех таких изомерных форм этих соединений. Когда связи с хиральным углеродом изображены в виде прямых линий в формулах по изобретению, следует понимать, что как (R), так и (S) конфигурации хирального углерода, и, следовательно, как энантиомеры, так и их смеси, охватываются формулой. Например, формула I демонстрирует структуру класса соединений без конкретной стереохимии. Когда соединения по настоящему изобретению содержат один хиральный центр, термин "стереоизомер" включает как энантиомеры, так и смеси энантиомеров, такие как конкретные смеси 50:50, называемые рацемическими смесями.
Соединения по настоящему изобретению могут содержать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений формулы (I), а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические и позиционные изомеры. Например, если соединение формулы (I) включает в себя двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также смеси охватываются объемом настоящего изобретения.
Диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основании их физико-химических различий с помощью способов, хорошо известных специалистам в данной области техники, такими как, например, хроматографией и/или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерной смеси в дастереомерную смесь посредством реакции с соответствующим оптически активным соединением (например, хиральный дополнительный реагент, такой как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереомеров и превращения (например, гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Также, некоторые соединения Формулы (I) могут быть атропоизомерами (например, замещенные биарилы) и рассматриваются как часть настоящего изобретения. Энантиомеры также могут быть разделены с использованием хиральной колонки ВЭЖХ.
Также возможно, что соединения формулы (I) могут существовать в различных таутомерных формах, и все такие формы включены в объем настоящего изобретения. Кроме того, например, все кетоенольные и имин-енаминовые формы соединений включены в изобретение.
Все стереоизомеры (например, геометрические изомеры, оптические изомеры и им подобные) соединений по настоящему изобретению (в том числе стереизомеры солей, сольватов, сложных эфиров и пролекарств соединений, а также солей, сольватов и сложных эфиров пролекарств), такие как те, которые могут существовать из-за асимметрических атомов углерода в различных заместителях, в том числе энантиомерные формы (которые могут существовать даже в отсутствие асимметрических атомов углерода), ротамерные формы, атропизомеры, и диастереомерные формы включены в объем настоящего изобретения, так же как и позиционные изомеры (такие, как, например, 4-пиридил и 3-пиридил). (Например, если соединение формулы (I) включает в себя двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также смеси охвачены объемом настоящего изобретения. Также, например, все кетоенольные и имин-енаминовые формы соединений включены в изобретение.) Индивидуальные стереоизомеры соединений по изобретению могут быть, например, по существу свободным от других изомеров или могут быть смешаны, например, в виде рацематов или со всеми остальными, или остальными выборочными, стереоизомерами. Хиральные центры по настоящему изобретению могут иметь конфигурацию S или R, как определено в Правилах ИЮПАК 1974. Использование терминов "соль", "сольват", "сложный эфир", "пролекарство" и т.п., направлено на применение в равной степени к солям, сольватам, сложным эфирам и пролекарствам энантиомеров, стереоизомеров, ротамеров, таутомеров, позиционных изомеров, рацематов или к пролекарствам соединений по изобретению.
В настоящей заявке, когда конкретное стереоизомерное соединение названо с использованием "и" в стереоизомерном обозначении, например, 1-бром-4-((S и R)пропан-2-илсульфонимидоил)бензол, "и" означает рацемическую смесь энантиомеров. То есть, индивидуальные энантиомеры не были отдельно выделены.
Когда стереоизомерная номенклатура включает в себя "или", например, (1S,2S или 1R,2R)-2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил, "или" указывает, что хиральное разделение рацемата на индивидуальные энантиомеры было выполнено, но фактическая оптическая активность конкретного энантиомера не была обязательно определена.
Независимые синтезы этих диастереомеров или их хроматографическое разделение может быть достигнуто, как известно в данной области путем соответствующей модификации методики, раскрытой в данной заявке. Их абсолютная стереохимия может быть определена с помощью рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных продуктов, которые подвергают дериватизации, в случае необходимости, с реагентом, содержащим асимметрический центр известной абсолютной конфигурации. При желании, рацемические смеси соединений могут быть разделены для того, чтобя выделить индивидуальные энантиомеры. Разделение может быть осуществлено способами, хорошо известными в данной области техники, такими как сочетание рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси, с последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография. Реакция сочетания часто представляет собой образование солей с использованием энантиомерно чистой кислоты или основания. Диастереомерные производные могут затем быть преобразованы в чистые энантиомеры путем отщепления добавленного хирального остатка. Рацемическая смесь соединений также может быть разделена непосредственно хроматографическими способами с использованием хиральных стационарных фаз, чьи способы хорошо известны в данной области техники. Альтернативно, любой энантиомер соединения может быть получен стереоселективным синтезом с использованием оптически чистых исходных веществ или реагентов известной конфигурации способами, хорошо известными в данной области техники.
Соли
Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований, включающих неорганические основания и органические основания. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и тому подобные. Особенно предпочтительными являются соли аммония, кальция, трехвалентного магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая замещенные амины природного происхождения, циклических аминов и основных ионообменных смол, таких как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиаминоэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этил-морфолин, N-этил-пиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобные.
Когда соединение по настоящему изобретению является основным, соли могут быть получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористоводородную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту, 1-гидрокси-2-нафтойную (ксинафоат) кислоту и тому подобные. Особенно предпочтительными являются лимонная, бромистоводородная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты.
Следует понимать, что, если не указано иное, ссылки на соединение формулы I, его разновидности, варианты его осуществления, а также конкретные соединения подразумевают также включение их фармацевтически приемлемых солей и стереоизомеров.
Кроме того, некоторые кристаллические формы соединений по настоящему изобретению могут существовать в виде полиморфов и, в силу этого, все формы надлежат включению в настоящее изобретение. Кроме того, некоторые соединения по настоящему изобретению могут образовывать сольваты с водой (гидраты) или обычными органическими растворителями. Такие сольваты включены в объем настоящего изобретения.
Меченые соединения
В соединениях общей формулы I, атомы могут демонстрировать свой природный изотопный состав, или один или более атомов могут быть искусственно обогащены определенным изотопом, имеющим один и тот же атомный номер, но атомная масса или массовое число отличается от атомной массы или массового числа, преимущественно встречающегося в природе. Настоящее изобретение подразумевает включение всех подходящих изотопных вариантов соединений общей формулы I. Например, различные изотопные формы водорода (H), включают протий (1Н) и дейтерий (2Н). Протий является преобладающим изотопом водорода, встречающимся в природе. Обогащение дейтерием может давать определенные терапевтические преимущества, такие как увеличение периода полураспада in vivo или снижение требуемой дозировки, или может предоставить соединение, используемое в качестве стандарта для определения характеристик биологических образцов. Обогащенные изотопами соединения в рамках общей формулы I могут быть получены без излишнего экспериментирования с помощью традиционных способов, хорошо известных специалистам в данной области техники, или способами, аналогичными описанным в схемах и примерах в данной заявке с использованием соответствующих изотопно-обогащенных реагентов и/или промежуточных продуктов.
Полезность
Соединение формулы I или его фармацевтически приемлемая соль и фармацевтические композиции могут быть использованы для лечения или профилактики различных состояний или заболеваний, опосредованных Янус-киназами, в частности, заболеваний или состояний, которые могут быть облегчены путем ингибирования Янус-киназы такой как JAK1, JAK2, JAK3 или TYK2. Такие состояния и заболевания включают, но не ограничиваются ими:
1) артриты, включая ревматоидный артрит, ювенильный артрит и псориатический артрит; (2) астму и другие обструктивные заболевания дыхательных путей, в том числе хроническую астму, позднюю астму, гиперчувствительность дыхательных путей, бронхит, бронхиальную астму, аллергическую астму, эндогенную бронхиальную астму, экзогенную бронхиальную астму, пылевую астму, рецидивирующую обструкцию дыхательных путей и хроническую обструктивную болезнь легких, включая эмфизему; (3) аутоиммунные заболевания или нарушения, включая те, которые относятся к одному органу или аутоиммунные нарушения клеток одного типа, например, тиреоидит Хашимото, аутоиммунная гемолитическая анемия, аутоиммунный атрофический гастрит злокачественной анемии, аутоиммунный энцефаломиелит, аутоиммунный орхит, болезнь Гудпасчера, аутоиммунная тромбоцитопения, симпатическая офтальмия, тяжелая миастения, болезнь Грейвса, первичный билиарный цирроз, хронический агрессивный гепатит, неспецифический язвенный колит и мембранозная гломерулопатия, те, которые относят к включающим в себя системные аутоиммунные расстройства, например, системная красная волчанка, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, узелковый полиартериит, рассеянный склероз и буллезный пемфигоид, и дополнительные аутоиммунные заболевания, которые могут быть В-клеточными (гуморальными) или Т-клеточными, в том числе синдром Когана, анкилозирующий спондилит, гранулематоз Вегенера, аутоиммунное облысение, диабет I типа или юношеский диабет и тиреоидит; (4) рак или опухоли, в том числе алиментарный рак/рак желудочно-кишечного тракта, рак толстой кишки, рак печени, рак кожи, включая опухоли тучных клеток и плоскоклеточный рак, рак груди и молочной железы, рак яичников, рак предстательной железы, лимфома, лейкемия, в том числе острая миелогенная лейкемия и хроническая миелогенная лейкемия, рак почки, рак легкого, рак мышцы, рак кости, рак мочевого пузыря, рак мозга, меланома, в том числе меланома полости рта и метастатическая меланома, саркома Капоши, миеломы, включая множественную миелому, миелопролиферативные заболевания, пролиферативная диабетическая ретинопатия, и нарушения, связанные с ангиогенезом, включая твердые опухоли; (5) сахарный диабет, в том числе сахарный диабет I типа и осложнения диабета; (6) заболевания глаз, нарушения или состояния, в том числе аутоиммунные заболевания глаз, кератоконъюнктивит, весенний конъюнктивит, увеит, включая увеит, связанный с болезнью Бехчета и увеит, вызванный линзами, кератит, герпетический кератит, конический кератит, эпителиальная дистрофия роговицы, кератолейкома, глазной пемфигус, язва Мурена, склерит, офтальмопатия Грейвса, синдром Фогта-Коянаги-Харада, сухой кератоконъюнктивит (сухой глаз), фликтена, иридоциклит, саркоидоз, эндокринная офтальмопатия, симпатическая офтальмия, аллергический конъюнктивит и глазная неоваскуляризация; (7) интестинальные воспаления, аллергии или состояния, включая болезнь Крона и/или язвенный колит, воспалительное заболевание кишечника, глютеновые энтеропатии, проктит, эозинофильный гастроэнтерит и мастоцитоз; (8) нейродегенеративные заболевания, включая заболевания двигательных нейронов, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, церебральную ишемию, или нейродегенеративное заболевание,вызванное травматическим повреждением, ударом, глутаматной нейротоксичностью или гипоксией; ишемические/реперфузионные повреждения при инсульте, ишемия миокарда, почечная ишемия, инфаркт миокарда, сердечная гипертрофия, атеросклероз и артериосклероз, гипоксия органа и агрегация тромбоцитов; (9) кожные заболевания, состояния или расстройства, включая атопический дерматит, экзему, псориаз, склеродермию, зуд и зудящие состояния; (10) аллергические реакции, включая анафилаксию, аллергический ринит, аллергический дерматит, аллергическую крапивницу, отек Квинке, аллергическую астму, или аллергическую реакцию на укусы насекомых, продукты питания, лекарства, или пыльцу; (11) отторжение трансплантата, в том числе отторжения трансплантата островков поджелудочной железы, отторжение трансплантата костного мозга, болезнь трансплантат против хозяина, отторжение трансплантов клеток и органов, таких как костный мозг, хрящ, роговица, сердце, межпозвоночный диск, островок, почка, конечность, печень, легкое, мышца, миобласт, нервы, поджелудочная железа, кожа, тонкая кишка или трахея, и ксенотрансплантация.
Соответственно, другой аспект настоящего изобретения предоставляет способ лечения или профилактики JAK-опосредованного заболевания или расстройства, включающий введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I. В одном варианте осуществления такие болезни включают астму и ревматоидный артрит. В другом варианте осуществления такие заболевания включают рецидивирующую обструкцию дыхательных путей, и хроническую обструктивную болезнь легких (ХОБЛ) или обструктивные заболевания дыхательных путей. В варианте настоящего осуществления болезнь представляет собой ХОБЛ.
Другой аспект настоящего изобретения предусматривает применение соединения формулы I в производстве лекарственного средства для лечения или профилактики JAK-опосредованных заболеваний или расстройств.
Одним из аспектов изобретения является применение соединения формулы I или его фармацевтически приемлемой соли, или его стереоизомера в производстве лекарственного средства для лечения заболевания или расстройства, которое облегчается при селективном ингибировании Янус-киназ JAK1 и JAK2.
Другим аспектом настоящего изобретения является применение соединения формулы I или его фармацевтически приемлемой соли, или его стереоизомера и второго активного средства в производстве лекарственного средства для лечения заболевания или расстройства, которое облегчается при селективном ингибировании Янус-киназ JAK1 и JAK2.
Диапазоны доз
Величина профилактической или терапевтической дозы соединения формулы I будет, конечно, варьироваться в зависимости от природы и тяжести состояния, подлежащего лечению, и от конкретного соединения формулы I и способа его введения. Она будет также варьироваться в зависимости от целого ряда факторов, включая возраст, вес, общее состояние здоровья, пол, диету, время введения, скорость экскреции, комбинацию лекарственных средств и реакцию отдельного пациента. В целом, суточная доза составляет от приблизительно 0,001 мг до приблизительно 100 мг на кг массы тела млекопитающего, предпочтительно от 0,01 мг до приблизительно 10 мг на кг. С другой стороны, в некоторых случаях может быть необходимым использовать дозы вне этих пределов.
Количество активного ингредиента, которое может быть скомбинировано с материалами-носителями для получения единичной дозированной формы, будет варьироваться в зависимости от хозяина, подвергающегося лечению, и конкретного способа введения. Например, препарат, предназначенный для перорального введения человеку, может содержать от 0,05 мг до 5 г, активного агента, смешанного с соответствующим и пригодным количеством материала-носителя, которое может варьироваться от приблизительно 5 до приблизительно 99,95 процентов от общей массы композиции. В некоторых случаях, стандартные дозированные формы могут содержать от приблизительно 0,05 до приблизительно 3 г активного ингредиента. Стандартные дозированные формы будут в целом содержать от приблизительно 0,1 мг до приблизительно 0,4 г активного ингредиента, как правило, 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 1 мг, 2 мг, 5 мг, 10 мг, 25 мг , 50 мг, 100 мг, 200 мг или 400 мг.
Фармацевтические композиции
Другой аспект настоящего изобретения предоставляет фармацевтические композиции, содержащие соединения формулы I с фармацевтически приемлемым носителем. Для лечения любого из заболеваний, опосредованных простаноидами, соединения формулы I могут быть введены перорально, путем ингаляционного распыления, наружно, парентерально или ректально в виде стандартных дозированных составов, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и основы лекарственной формы. Термин парентеральный, в данном контексте, включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или инфузионные методы. В дополнение к лечению теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и т.д., соединение по настоящему изобретению является эффективным в лечении людей.
Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, подходящей для перорального применения, например, в виде таблеток, пастилок, таблеток для рассасывания, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, сиропов или эликсиров. Композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов для того, чтобы обеспечить фармацевтически изящные и приятные на вкус препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые пригодны для изготовления таблеток. Эти эксципиенты могут быть, например, инертными разбавителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующими и дезинтегрирующими агентами, например, кукурузный крахмал или альгиновая кислота; связующими агентами, например крахмал, желатин или гуммиарабик, и смазывающими агентами, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми, или они могут быть покрыты известными способами с целью замедлить дезинтеграцию и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить пролонгированное действие в течение более длительного периода. Например, вещество для временной задержки, такой как моностеарат глицерина или дистеарат может быть использовано. Они могут быть также покрыты с помощью способа, описанного в патенте США 4256108; 4166452; и 4265874, с образованием осмотических терапевтических таблеток для контролируемого высвобождения.
Композиции для перорального применения могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активные ингредиенты смешаны со смешивающимися с водой растворителями, такими как пропиленгликоль, ПЭГи и этанол, или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активное вещество в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такие эксципиенты представляют собой суспендирующие агенты, например, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующие или смачивающие агенты могут быть фосфатидами природного происхождения, например, лецитин, или продуктами конденсации алкиленоксида с жирными кислотами, например, полиоксиэтилен стеарат, или продуктами конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гепта-дека-этилен-оксицетанол, или продуктами конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гексита, такими как полиоксиэтиленсорбитмоноолеат, или продуктами конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например, полиэтиленсорбитанмоноолеат. Водные суспензии могут также содержать один или более консервантов, например, этил- или н-пропил, п-гидроксибензоат, один или более красителей, один или более ароматизаторов, и один или более подсластителей, таких как сахароза, сахарин или аспартам.
Масляные суспензии могут быть составлены путем суспендирования активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как были указаны выше, и ароматизаторы могут быть добавлены для обеспечения приятного вкуса лекарственного препарата для перорального введения. Эти композиции могут быть защищены добавлением антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии добавлением воды, предоставляют активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты представлены теми, которые уже упоминались выше. Дополнительные эксципиенты, например, подсластители, ароматизаторы и красители, также могут присутствовать.
Фармацевтические композиции по изобретению могут также быть в форме эмульсии "масло-в-воде". Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой фосфатиды природного происхождения, например, соевые бобы, лецитин и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например сорбитан моноолеат, и продукты конденсации указанных частичных сложных эфиров с этиленоксидом, например, полиоксиэтилен сорбитанмоноолеат. Эмульсии могут также содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть составлены с подсластителями, например, глицерином, пропиленгликолем, сорбитом или сахарозой. Такие препараты могут также содержать мягчительное средство, консервант, и ароматизаторы и красители. Фармацевтические композиции могут быть в форме стерильной инъецируемой водной или масляной суспензии. Эта суспензия может быть получена в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были указаны выше. Стерильный инъекционный препарат может также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Из числа приемлемых основ лекарственной формы и растворителей, которые могут быть использованы, значатся вода, раствор Рингера и изотонический раствор хлорида натрия. Также могут быть использованы сорастворители, такие как этанол, пропиленгликоль или полиэтиленгликоли. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или суспендирующей среды. Для этого может быть использовано любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение в приготовлении инъекционных лекарственных средств.
Дозированные формы для ингаляционного введения, могут в целях удобства быть приготовлены в виде аэрозолей или сухих порошков. Для композиций, пригодных и/или адаптированных для ингаляционного введения, предпочтительно, чтобы активное вещество находилось в форме уменьшенного размера частиц, и более предпочтительно в форме уменьшенного размера, полученного или достижимого путем микронизации.
В одном варианте осуществления лекарственное средство адаптировано для применения с помощью аэрозольного дозирующего ингалятора под давлением (pMDI), который высвобождает отмеренные дозы лекарства при каждом приведении в действие. Состав для ингаляторов pMDI может быть в виде растворов или суспензий в галогенированных углеводородных пропеллентах. Тип используемого в pMDIs пропеллента смещается в настоящее время в сторону гидрофторалканов (HFAs), также известных как фторуглеводороды (HFCs). В частности, 1,1,1,2-тетрафторэтан (HFA 134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227) используются в некоторых продаваемых в настоящее время фармацевтических продуктах для ингаляции. Композиция может содержать другие фармацевтически приемлемые эксципиенты для ингаляционного применения, такие как этанол, олеиновая кислота, поливинилпирролидон и тому подобное.
Ингаляторы MDI под давлением обычно имеют два компонента. Во-первых, это составной элемент контейнер, в котором частицы лекарственного средства хранятся под давлением в виде суспензии или раствора. Во-вторых, составной элемент держатель, используемый для удерживания и приведения в действие контейнера. Как правило, контейнер будет содержать несколько доз препарата, хотя возможны также контейнеры с разовой дозой. Компонент контейнер, как правило, включает в себя выпускной клапан, из которого содержимое контейнера могло быть выпущено. Аэрозольный препарат выпускается из MDI путем приложения силы на компонент контейнер для того, чтобы вытолкнуть его в компонент держатель, тем самым открывая выпускной клапан и, в результате чего частицы лекарства переносятся из выпускного клапана через компонент держатель и выпускаются из выпускного отверстия держателя. При выпуске из контейнера, частицы лекарства "распыляются", образуя аэрозоль. Предполагается, что пациент координирует выпускание аэрозольного лекарства с его или ее вдохом, так что частицы лекарства захватываются эспираторным потоком пациента и доставляются в легкие. Как правило, ингаляторы pMDI используют пропелленты для создания давления содержимого контейнера и для приведения в движение частиц лекарства из выпускного отверстия компонента держателя. В ингаляторах pMDI композиция представлена в виде жидкости или суспензии и находится внутри контейнера вместе с пропеллентом. Пропеллент может принимать различные формы. Например, пропеллент может содержать сжатый газ или сжиженный газ.
В другом варианте осуществления лекарственный препарат адапирован для применения с ингалятором сухого порошка (DPI). Композиция для ингаляции, пригодная для применения в ингаляторах DPI, обычно содержит частицы активного ингредиента и частицы фармацевтически приемлемого носителя. Размер частиц активного вещества может варьироваться от приблизительно 0,1 мкм до приблизительно 10 мкм; однако, для эффективной доставки к дальним участкам легких, по меньшей мере, 95 процентов частиц активного препарата составляют 5 мкм или меньше. Каждый из активных агентов может присутствовать в концентрации 0,01 - 99%. Как правило, однако, каждый из активных агентов присутствует в концентрации приблизительно от 0,05 до 50%, более часто приблизительно 0,2-20% от общей массы композиции.
Как отмечалось выше, в дополнение к активным ингредиентам, ингалируемый порошок предпочтительно содержит фармацевтически приемлемый носитель, который может быть составлен из любого фармакологически инертного вещества или комбинации веществ, которое является приемлемым для ингаляции. Преимущественно, частицы носителя состоят из одного или более кристаллических сахаров; частицы носителя могут состоять из одного или более сахарных спиртов или полиолов. Предпочтительно, частицы носителя представляют собой частицы декстрозы или лактозы, особенно лактозы. В вариантах осуществления настоящего изобретения, которые используют обычные сухие порошковые ингаляторы, такие как Handihaler, Rotohaler, Diskhaler, Twisthaler и Turbohaler, размер частиц носителя может находиться в диапазоне от приблизительно 10 мкм до приблизительно 1000 мкм. В некоторых из этих вариантов осуществления, размер частиц носителя может находиться в диапазоне от приблизительно 20 мкм до приблизительно 120 мкм. В некоторых других вариантах осуществления размер, по меньшей мере, 90% масс. частиц носителя составляет менее 1000 мкм и предпочтительно лежит между 60 мкм и 1000 мкм. Относительно большой размер этих частиц носителя дает хорошие характеристики текучести и захвата. При присутствии, количество частиц носителя будет, как правило, составлять до 95%, например, до 90%, преимущественно до 80% и предпочтительно до 50% по массе в расчете на общую массу порошка. Количество любого пылевидного вещества эксципиента, если оно присутствует, может составлять до 50%, и преимущественно до 30%, в особенности до 20% масс. в расчете на общую массу порошка. Порошок необязательно может содержать улучшитель эффективности, такой как L-лейцин или другая аминокислота, и/или металлические соли стеариновой кислоты, такие как стеарат магния или кальция.
Соединения формулы I могут быть также введены в форме суппозиториев для ректального введения лекарственного средства. Эти композиции могут быть получены смешиванием лекарственного средства с подходящим не раздражающим эксципиентом, который является твердым при температуре окружающей среды, но жидкими при ректальной температуре, и поэтому будет плавиться в прямой кишке с высвобождением лекарственного средства. Такими веществами являются масло какао и полиэтиленгликоли.
Для наружного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие соединения формулы I. (Для назначений по настоящей заявке, наружное применение должно включать жидкость для ополаскивания рта и раствор для полоскания горла.) Композиции для наружного применения могут обычно быть составлены из фармацевтического носителя, сорастворителя, эмульгатора, вещества, способствующего всасыванию, системы консервантов и мягчительного средства.
Комбинации с другими лекарственными средствами
Для лечения и профилактики JAK-опосредованных заболеваний соединение формулы I может вводиться совместно с другими лекарственными средствами. Таким образом, в другом аспекте настоящее изобретение предоставляет фармацевтические композиции для лечения JAK-опосредованных заболеваний, содержащие терапевтически эффективное количество соединения формулы I и одно или более других лекарственных средств. В частности, для лечения воспалительных заболеваний ревматоидного артрита, псориаза, воспалительного заболевания кишечника, ХОБЛ, астмы и аллергического ринита соединение формулы I может быть объединено со средствами, такими как: (1) ингибиторы TNF-α, такие как Ремикейд® и Энбрел®); (2) неселективные ингибиторы СОХ-I/СОХ-2 (такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин); (3) ингибиторы СОХ-2 (такие как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб и эторикоксиб); (4) другие средства для лечения ревматоидного артрита, включая метотрексат низкой дозы, лефлуномид, циклесонид, гидроксихлорохин, d-пеницилламин, ауранофин или парентеральное или пероральное золото; (5) ингибитор биосинтеза лейкотриенов, ингибитор 5-липоксигеназы (5-LO) или антагонист белка, активирующего 5-липоксигеназу (FLAP), такой как зилеутон; (6) антагонист рецептора LTD4, такой как зафирлукаст, монтелукаст и пранлукаст; (7) ингибитор PDE4, такой как рофлумиласт; (8) антагонисты антигистаминовых рецепторов H1, такие как цетиризин, лоратадин, дезлоратадин, фексофенадин, астемизол, азеластин и хлорфенирамин; (9) агонист α1- и α2-адренорецептора сосудосуживающее симпатомиметическое средство, такое как пропилгекседрин, фенилэфрин, фенилпропаноламин, псевдоэфедрина гидрохлорид, нафазолина гидрохлорид, оксиметазолина гидрохлорид, тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид и этилнорэпинефрина гидрохлорид; (10) антихолинергические средства, такие как ипратропия бромид, тиотропия бромид, окситропия бромид, клиндиния бромид, гликопирролат, пирензепин и телензепин; (11) агонисты β-адренорецепторов, такие как метапротеренол, изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, сальметерол, тербуталин, орципреналин, битолтерола мезилат и пирбутерол или метилксантанины, включая теофиллин и аминофиллин, кромогликат натрия; (12) миметик инсулиноподобного фактора роста типа I (IGF-I); (13) ингаляционные глюкокортикоиды с уменьшенными системными побочными эффектами, такие как преднизон, преднизолон, флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат, циклесонид и мометазона фуроат.
Способы синтеза
СХЕМЫ И ПРИМЕРЫ
Сокращения, используемые в настоящей заявке, имеют следующие табличные значения. Сокращения, не приведенные в таблице ниже, имеют значения, как их обычно используют, если специально не указано иное.
Сокращения алкильных групп
СПОСОБЫ СИНТЕЗА
Соединения по настоящему изобретению могут быть получены в соответствии со следующими общими схемами с использованием соответствующих веществ, и далее представлены с помощью последующих конкретных примеров. Соединения, показанные в примерах, не должны быть интерпретированы как образующие только род, говоря другими словами, рассматриваться как изобретение. Нижеописанные иллюстративные примеры, таким образом, не ограничиваются перечисленными соединениями или какими-либо конкретными заместителями, используемыми для иллюстративных целей. Нумерация заместителя, как показано на схемах, не обязательно находится в соответствии с нумерацией, используемой в формуле изобретения, и часто, для ясности, показан один заместитель, присоединенный к соединению, в котором предусмотрены несколько заместителей в соответствии с определениями по настоящему изобретению, перечисленными выше в данном описании.
Специалисты в данной области техники легко поймут, что известные вариации условий и способов следующих препаративных процедур могут быть использованы для получения этих соединений. Изобретение будет проиллюстрировано далее на следующих не ограничивающих примерах, в которых, если не указано иное:
Все реакции перемешивали (механически, магнитными мешальниками/пластинами для смешивания или встряхивали) и проводили в инертной атмосфере азота или аргона, если не указано иное.
Все исходные вещества, используемые для получения промежуточных продуктов и конечных соединений, описанных в настоящей заявке, получали от коммерческих поставщиков и использовали в том виде, в каком они были получены.
Все температуры даны в градусах Цельсия (°C), если не указано иное.
Температура окружающей среды составляет 15-25°С.
Большинство соединений очищали с помощью обращенно-фазовой препаративной ВЭЖХ, жидкостной хроматографии среднего давления на силикагеле, сверхкритической жидкостной хроматографии, перекристаллизации и/или полоскания (суспензии в растворителе с последующим фильтрованием твердого вещества).
Ход реакций контролировали при помощи тонкослойной хроматографии (ТСХ) и/или ЖХМС и/или ЯМР, и время реакций приведено только для иллюстрации.
Все конечные продукты анализировали с помощью ЯМР и ЖХМС. Промежуточные продукты анализировали с помощью ЯМР и/или ТСХ и/или ЖХМС.
Способ 1
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 1. При использовании соответствующего основания, такого как DBU, в подходящем растворителе, таком как MeCN, EtOH, н-бутанол или трет-BuOH, при температуре от 25-110°С любой защищенный пиразолопиридон 1А (PG = подходящая защитная группа) может вступать в реакцию сопряженного присоединения с необязательно замещенными нитрилами 1B с получением аддукта 1С, как правило, в виде смеси оптических изомеров, промежуточных продуктов в синтезе примеров по настоящему изобретению. Изомеры промежуточного продукта 1С могут быть разделены на их соответствующие индивидуальные оптические изомеры с использованием соответствующего хроматографического метода (ахирального и/или хирального). Промежуточный продукт 1С вступает в реакцию кросс-сочетания с замещенными арил- и гетероарил-галогенидами 1D с использованием соответствующей каталитической системы палладий/лиганд, такой как Pd2(dba)3 или Pd2(dba)3∙CHCl3 и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (трет-Bu XPhos) или ди-трет-бутил[3,4,5,6-тетраметил-2',4',6'-три(пропан-2-ил)бифенил-2-ил]фосфан (Me4 tBu-X-Phos), или 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (XPhos) или [(2-ди-трет-бутилфосфин-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладий (II) метансульфонат (трет-BuXPhos Pd G3). Стандартные условия используют 1-2 эквивалента арил/гетероарил-галогенида относительно пиразолопиримидина с загрузкой 10-25% Pd-предкатализатора, используя приблизительное соотношение Pd : лиганд от 1 : 2 до 1 : 2,5. Как правило, кросс-сочетание проводят с использованием растворителей либо 2-пропанола, либо трет-амилового спирта, а также в интервале от 1 до 3,1 эквивалентов основания KOAc либо K3PO4. Реакции обычно проводили в интервале температур 65-80°С с получением промежуточных продуктов 1Е по настоящему изобретению. Защитная группа в промежуточных продуктах 1E может быть удалена либо с использованием условий гидрогенолиза (газ Н2, Pd/C, в подходящем растворителе, таком как EtOAc, EtOH, MeOH, либо с использованием комбинации этих растворителей), либо удаление обеспечивается подходящей кислотой с получением Примеров 1F по настоящему изобретению. Альтернативно, защитная группа в промежуточных продуктах 1С может быть удалена либо с использованием условий гидрогенолиза (газ Н2, Pd/C, в подходящем растворителе, таком как EtOAc, EtOH, MeOH, или с использованием комбинации этих растворителей), либо удаление обеспечивается подходящей кислотой с получением промежуточного продукта 1G. Промежуточный продукт 1G вступает в реакцию кросс-сочетания с замещенными арил- и гетероарил-галогенидами 1D с использованием соответствующей каталитической системы палладий/лиганд, такой как Pd2(dba)3 или Pd2(dba)3∙CHCl3 и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (трет-Bu XPhos) или ди-трет-бутил[3,4,5,6-тетраметил-2',4',6'-три(пропан-2-ил)бифенил-2-ил]фосфан (Me4 tBu-X-Phos), или 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (XPhos) или [(2-ди-трет-бутилфосфин-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладий (II) метансульфонат (трет-BuXPhos Pd G3). Стандартные условия используют 1-2 эквивалента арил/гетероарил-галогенида относительно пиразолопиримидина с загрузкой 10-25% Pd-предкатализатора, используя приблизительное соотношение Pd : лиганд от 1 : 2 до 1 : 2,5. Как правило, кросс-сочетание проводят с использованием растворителей либо 2-пропанола, либо трет-амилового спирта, а также в интервале от 1 до 3,1 эквивалентов основания KOAc либо K3PO4. Реакции обычно проводили в интервале температур 65-80°С с получением Примеров 1F по настоящему изобретению.
СХЕМА 1
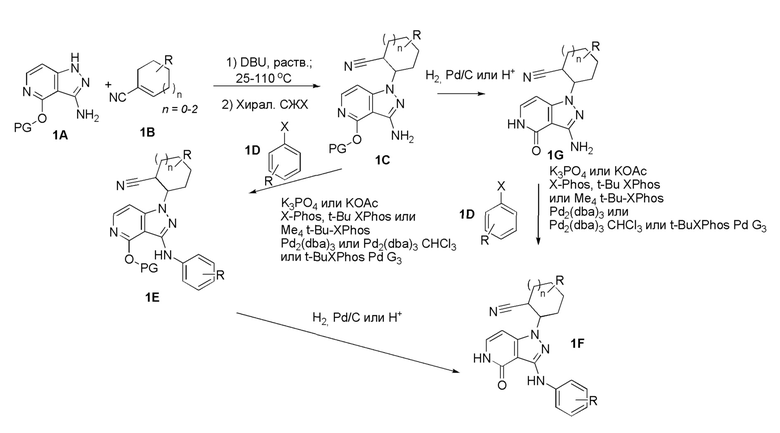
Способ 2
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 2. Пиразоло-пиридон 2А окисляется с использованием соответствующего окислителя, такого как IBX или реактив Джонса в подходящем растворителе, таком как ДМСО или ацетон, при температуре в интервале 0-50°С с получением кетона 2В. Кетон 2B дополнительно может вступать в реакцию с замещенным амином в условиях восстановительного аминирования с использованием боргидрида, такого как NaBH3CN, в подходящей системе растворителей, такой как MeOH/ТГФ/АсОН, с получением Примеров 2С по настоящему изобретению. Альтернативно, кетон 2B может вступать в реакцию с BAST в подходящем растворителе, таком как ДХМ, при температуре 0°С с получением промежуточного продукта 2D. Защитная группа в промежуточных продуктах 2D может быть удалена либо с использованием условий гидрогенолиза (газ Н2, Pd/C, в подходящем растворителе, таком как EtOAc, EtOH, MeOH, или с использованием комбинации этих растворителей), либо удаление обеспечивается подходящей кислотой с получением Примеров 2Е по настоящему изобретению.
СХЕМА 2
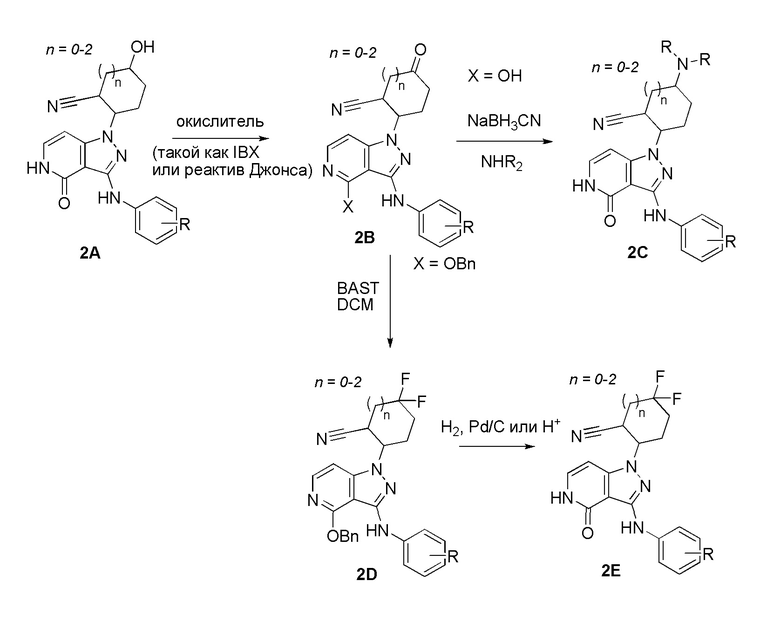
Способ 3
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 3. Пиразоло-пиридон 3A может быть обработан подходящей кислотой, такой как ТФУК или HCl, в подходящем растворителе, таком как ДХМ, EtOAc или MeOH, приблизительно при температуре окружающей среды с получением соответствующих амин-содержащих Примеров 3В по настоящему изобретению. В качестве альтернативы, защищенные промежуточные продукты 3C могут вступать в реакцию таким же образом с получением Примеров 3В по настоящему изобретению.
СХЕМА 3
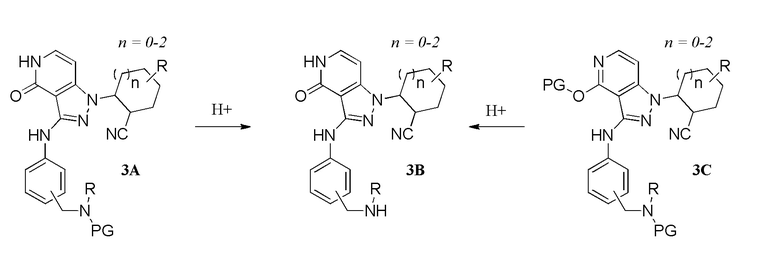
Способ 4
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 4. Промежуточные продукты 4B могут быть обработаны 2-метилпропан-2-сульфинамидом (или другим подходящим заменителем аммиака) в присутствии кислоты Льюиса, такой как изопропоксид титана, с последующей обработкой восстановителем, таким как боргидрид натрия, с получением Примеров 4A после гидрогенолиза в присутствии источника кислоты (такого как HCl) в растворителе, таком как EtOAc. Альтернативно, промежуточные продукты 4B могут быть обработаны соответствующим образом замещенным амином с использованием аналогичных условий с полученим Примеров 4С по настоящему изобретению. Промежуточные продукты 4В также могут быть обработаны боргидридом натрия в подходящем растворителе, таком как MeOH, с последующим стандартным гидрогенолизом с получением спиртосодержащих Примеров 4D по настоящему изобретению.
СХЕМА 4
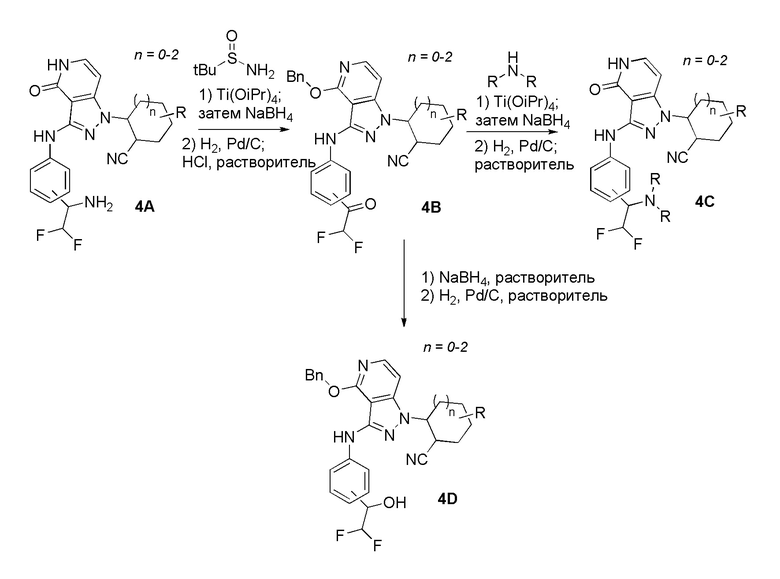
Способ 5
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 5. Диоксолан-содержащие промежуточные продукты 5А могут быть обработаны подходящей кислотой, такой как HCl, в растворителе (ТГФ) с получением диол-содержащих Примеров 5В по настоящему изобретению.
СХЕМА 5
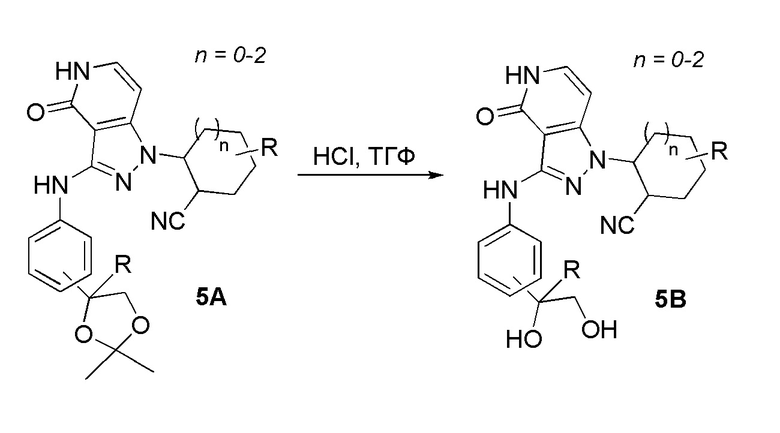
Способ 6
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 6. Промежуточные продукты 6A, содержащие сложноэфирную группу, могут быть обработаны подходящим основанием, таким как гидроксид натрия, в системе растворителей, такой как MeOH/вода, при комнатной температуре с получением Примеров 6В по настоящему изобретению последующим гидрогенолизом.
СХЕМА 6
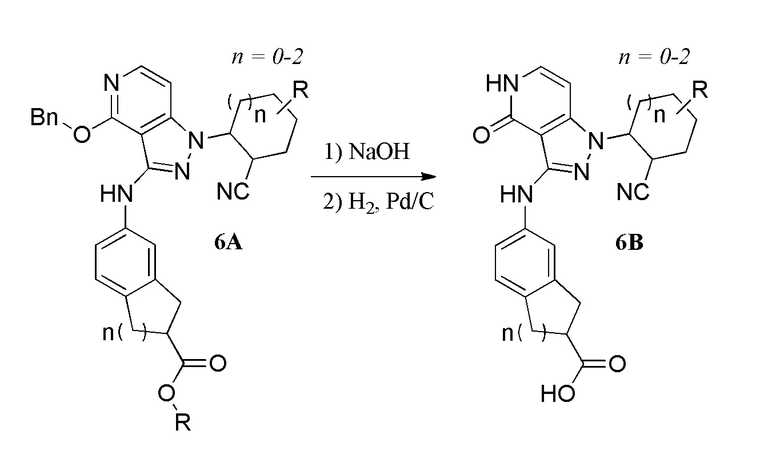
Способ 7
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 7. Лактонные промежуточные продукты 7A могут вступать в реакцию с аминами в присутствии кислоты Льюиса, такой как трихлорид алюминия, при или около 80°С с получением соответствующих амидных промежуточных продуктов 7B, которые могут затем быть дополнительно обрабатаны i-PrMgCl в подходящей системе растворителей, такой как ТГФ/NMP, с последующей обработкой бис(диметиламино)фосфорилхлоридом при температуре кипения с получением промежуточных продуктов 7С по настоящему изобретению.
СХЕМА 7
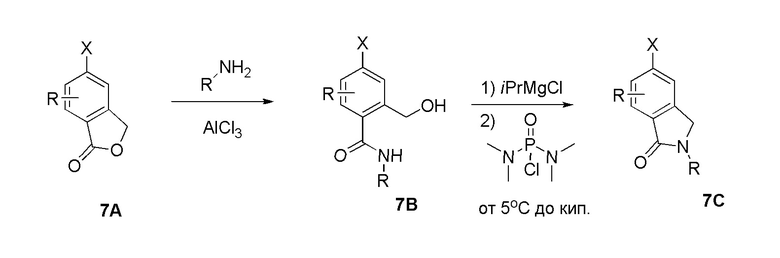
Способ 8
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 8. Промежуточные продукты 8А могут вступать в реакцию с соответствующим образом замещенным гетероциклом в присутствии основания, такого как карбонат калия, с добавкой, такой как иодид калия, в подходящем растворителе (таком как ацетон) при температуре кипения с получением Примеров 8E по настоящему изобретению. Альтернативно, промежуточные продукты 8A могут вступать в реакцию сначала с азидом натрия в растворителе, таком как ДМСО, с получением промежуточного азида, который может далее вступать в реакцию с соответствующим образом замещенным алкином 8B в присутствии соли меди (такой как пентагидрат сульфата меди) и аскорбата натрия с получением соответствующих триазольных промежуточных продуктов 8C для применения в синтезе примеров по настоящему изобретению. Альтернативно, промежуточные продукты 8A могут вступать в реакцию с соответствующим образом замещенным амином 8F в присутствии основания, такого как ТЭА, в соответствующем растворителе, таком как ТГФ, с получением промежуточных продуктов 8G, которые могут быть использованы в синтезе примеров по настоящему изобретению.
СХЕМА 8
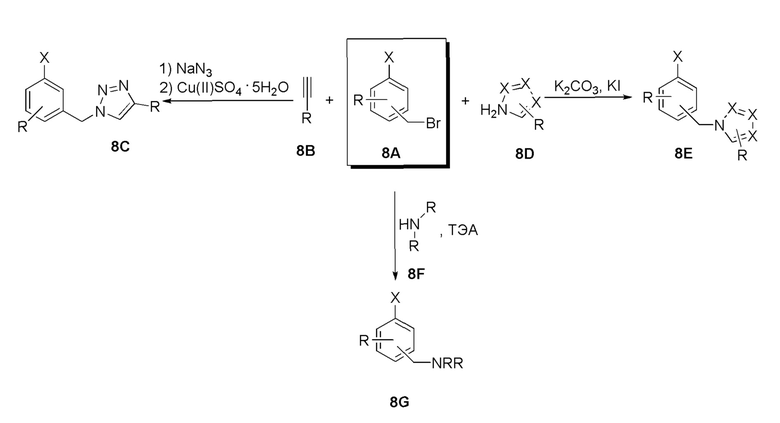
Способ 9
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 9. Промежуточные продукты 9A, содержащие трифторметилкетон, могут быть восстановлены подходящим восстановителем, таким как боргидрид натрия, в растворителе, таком как MeOH, с получением соответствующих спиртовых промежуточных продуктов 9B для применения в синтезе примеров по настоящему изобретению. Оптические изомеры могут быть дополнительно разделены с применением соответствующих хиральных хроматографических методов с получением соответствующих диастереомеров/энантиомеров. Альтернативно, промежуточные продукты 9А могут вступать в реакцию с LiHMDS с последующим взаимодействием с восстановителем, таким как комплекс боран-ТГФ, с получением соответствующих аминных промежуточных продуктов 9C. Оптические изомеры могут быть дополнительно разделены с использованием соответствующих хиральных хроматографических методов с получением соответствующих диастереомеров/энантиомеров для применения в качестве промежуточных продуктов в синтезе примеров по настоящему изобретению.
СХЕМА 9
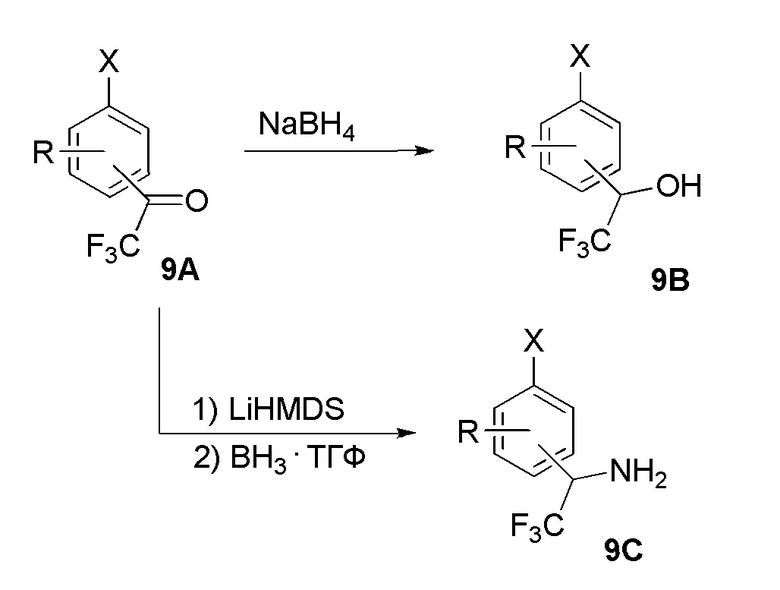
Способ 10
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 10. Аминосодержащие промежуточные продукты 10А могут вступать в реакцию с соответствующим образом замещенной карбоновой кислотой 10B в присутствии амид-связывающих реагентов (таких как EDC и HOBt) в растворителе, таком как ДХМ, с получением соответствующих амидных промежуточных продуктов 10С для применения в синтезе примеров по настоящему изобретению. Альтернативно, промежуточные продукты 10А могут вступать в реакцию с BOC2O в растворителе, таком как этанол или ДХМ, с получением карбаматных промежуточных продуктов 10D для применения в синтезе примеров по настоящему изобретению.
СХЕМА 10
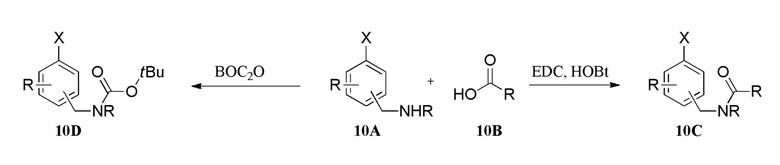
Способ 11
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 11. Сульфонилхлоридные промежуточные продукты 11А могут вступать в реакцию с соответствующим образом замещенным амином в присутствии подходящего основания (такого как DIPEA) в растворителе, таком как ДХМ, с получением промежуточных соединений 11В, которые могут быть использованы в синтезе примеров по настоящему изобретению.
СХЕМА 11
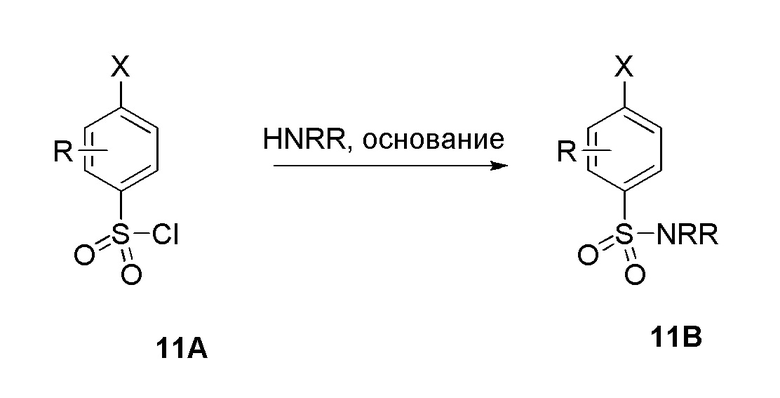
Способ 12
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 12. Карбокислотные промежуточные продукты 12А могут вступать в реакцию в амид-связывающих условиях с использованием таких реагентов, как EDC или HOBt, или, альтернативно, могут быть преобразованы в соответствующий хлорангидрид с использованием реагента, такого как тионилхлорид, с получением амидных промежуточных продуктов 12C, которые могут быть использованы в синтезе примеров по настоящему изобретению.
СХЕМА 12
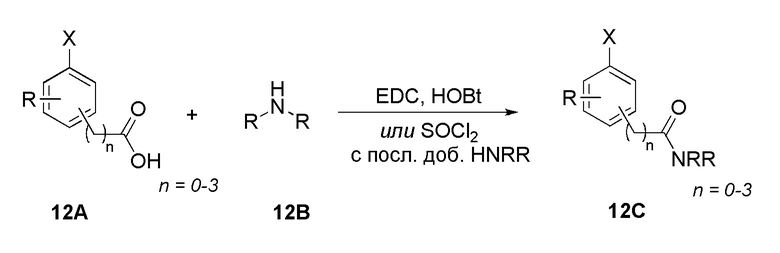
Способ 13
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 13. Аминные промежуточные продукты 13А или 13В могут вступать в реакцию с соответствующим ангидридом (или в подходящих амид-связывающих условиях) с получением промежуточного амида, который дополнительно может быть восстановлен с использованием восстановителя, такого, как боран-диметилсульфидный комплекс при температуре приблизительно 75°С с получением промежуточных соединений 13С или 13D, которые могут быть использованы в синтезе примеров по настоящему изобретению.
СХЕМА 13
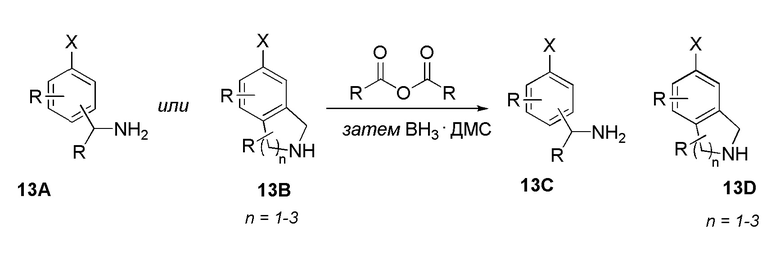
Способ 14
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 14. Аминные промежуточные соединения 14А могут вступать в реакцию с соответствующим образом замещенным альдегидом в присутствии восстановителя, такого как боргидрид натрия, в подходящем растворителе (таком как MeOH) с получением промежуточных продуктов 14В, которые могут быть использованы в синтезе примеров по настоящему изобретению. Альтернативно, промежуточные продукты 14А могут вступать в реакцию с соответствующим образом замещенным алкилгалогенидом в присутствии основания, такого как гидрид натрия, в растворителе ДМФА с получением промежуточных продуктов 14C, которые могут быть использованы в синтезе примеров по настоящему изобретению.
СХЕМА 14
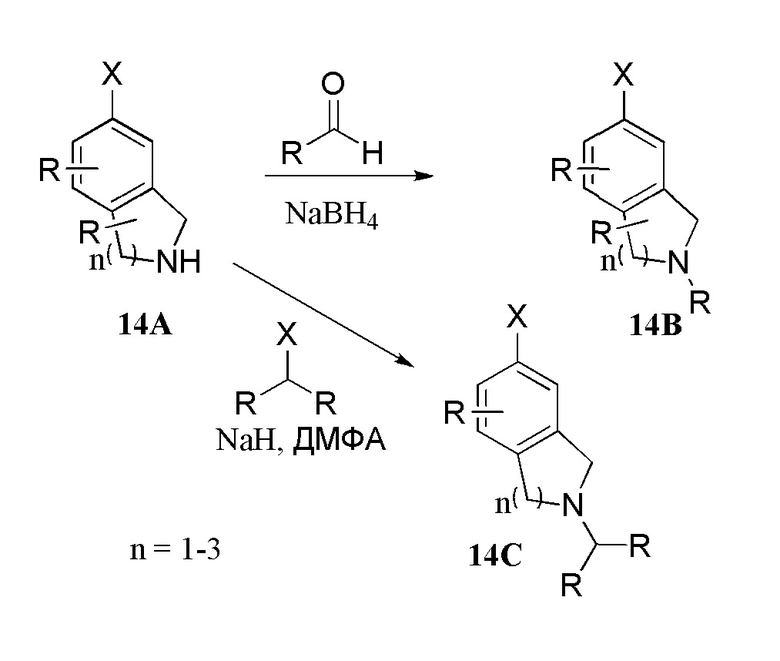
Способ 15
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 15. Соответствующим образом замещенные альдегиды 15А могут вступать в реакцию с 2-метилпропан-2-сульфинамидом (может быть использована рацемическая смесь или оптически чистые энантиомеры) в присутствии кислоты Льюиса, такой как этоксид титана, в растворителе, таком как ТГФ, при температуре кипения с получением соответствующих промежуточных продуктов 15B, которые далее могут быть обработаны триметил(трифторметил)силаном и источником фторида, таким как TBAF, с получением промежуточных продуктов 15C, которые могут быть использованы в синтезе примеров по настоящему изобретению. Оптические изомеры могут быть дополнительно разделены с применением соответствующих хиральных хроматографических методов с получением соответствующих индивидуальных диастереомеров/энантиомеров.
СХЕМА 15
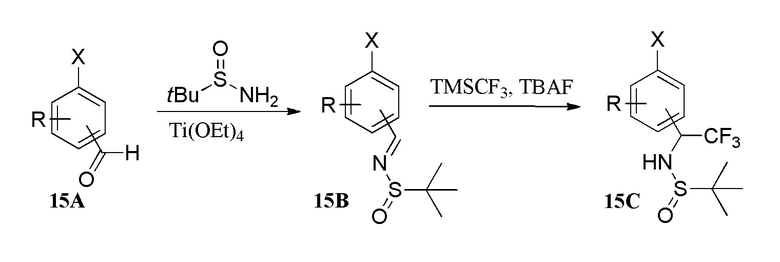
Способ 16
Общие процедуры получения промежуточных продуктов по настоящему изобретению описаны на схеме 16. Сульфонилхлориды 16А могут вступать в реакцию с соответствующим образом замещенным амином в присутствии подходящего основания, такого как триэтиламин, в растворителе, таком как дихлорметан, с получением сульфонамидных промежуточных продуктов 16B. Промежуточные продукты 16В могут быть обработаны окислительными средами, чтобы повлиять на внутримолекулярную циклизацию, с получением промежуточных продуктов 16C или 16E (могут быть использованы среды, такие как перйодная кислота с триоксидом хрома и уксусной кислотой или диацетат иодбензола и йод). Промежуточные продукты 16C могут быть восстановлены с использованием подходящего восстановителя, такого как комплекс боран-тетрагидрофуран или боран-диметилсульфидный комплекс, с получением промежуточных продуктов 16D, которые могут быть использованы в синтезе примеров по настоящему изобретению. Альтернативно, промежуточные продукты 16E могут вступать в реакцию с соответствующим образом замещенным алкилгалогенидом в присутствии основания, такого как карбонат цезия, с получением промежуточных продуктов 16D последующим восстановлением либо комплексом боран-тетрагидрофуран, либо боран-диметилсульфидным комплексом.
СХЕМА 16
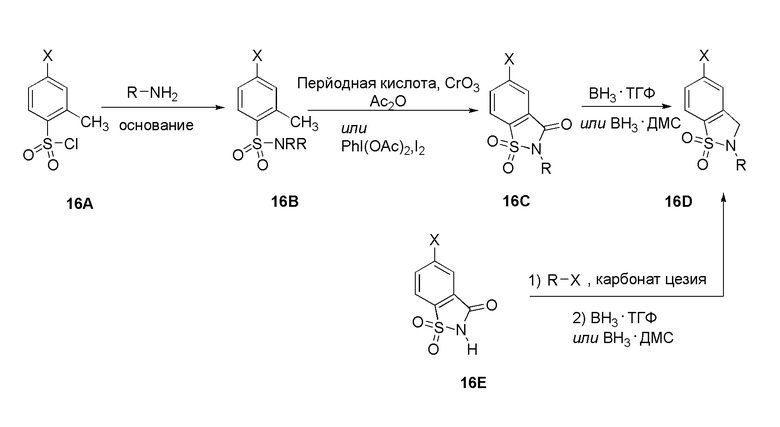
ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ
Следующие экспериментальные процедуры описывают более подробно получение химических веществ, используемых в синтезе примеров по настоящему изобретению. Приведенные в качестве примеров процедуры служат только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения каким-либо образом.
Промежуточный продукт 1
4-(Бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амин
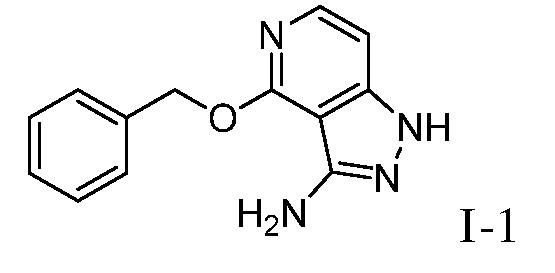
Стадия 1: 2-(Бензилокси)-4-метоксиникотинонитрил
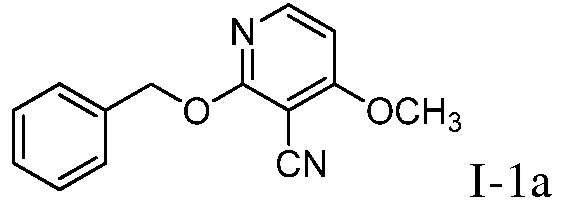
К перемешиваемой суспензии 3-циано-2-гидрокси-4-метоксипиридина (40,0 г, 266 ммоль) в толуоле (800 мл) добавляли карбонат серебра (92,0 г, 333 ммоль), с последующим добавлением бензилбромида (57,0 г, 333 ммоль). Полученную смесь нагревали до 50°С и перемешивали в течение ночи. Реакционную смесь фильтровали для удаления неорганических твердых веществ, промывая осадок на фильтре с помощью ДХМ. Фильтрат концентрировали в вакууме. Петролейный эфир (100 мл) добавляли к неочищенному остатку, и истертые в порошок твердые вещества собирали путем фильтрования с получением 2-(бензилокси)-4-метоксиникотинонитрила. МСНР (ИЭС) вычислено для C14H13N2O2 [M+H]+: 241, найдено: 241. 1H ЯМР (600 MГц CDCl3) δ 8,21 (д, J=6,6 Гц, 1H), 7,48 (д, J=7,8 Гц, 2H), 7,38 (м, 2H), 7,32 (м, 1H), 6,58 (д, J=6,0 Гц, 1H), 5,51 (с, 2H), 3,99 (с, 3H).
Стадия 2: 4-(Бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин
Перемешиваемую суспензию 2-(бензилокси)-4-метоксиникотинонитрила (63 г, 0,26 моль) в смеси растворителей гидразингидрата (210 мл) и безводного этанола (420 мл) нагревали до кипения приблизительно при 110°C. Реакционную смесь кипятили с обратным холодильником в течение 3 дней. Затем смесь концентрировали в вакууме и разбавляли EtOAc (200 мл) и промывали водой (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат = 10:1-1:1) с получением 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амина. МСНР (ИЭС) рассчитано для C13H13N4O [M+H]+: 241, найдено 241. 1H ЯМР (ДМСО-d6, 400MГц): δ 11,87 (уш.с, 1H), δ 7,67 (д, 1H, J=6,0 Гц), 7,38-7,49 (м, 2H), 7,34-7,38 (м, 2H), 7,28-7,31 (м, 1H), 6,80 (д, 1H, J=4,0 Гц), 5,49 (с, 2H), 5,15 (с, 2H).
Промежуточный продукт 2
(цис)-2-[3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил (рацемическая смесь)
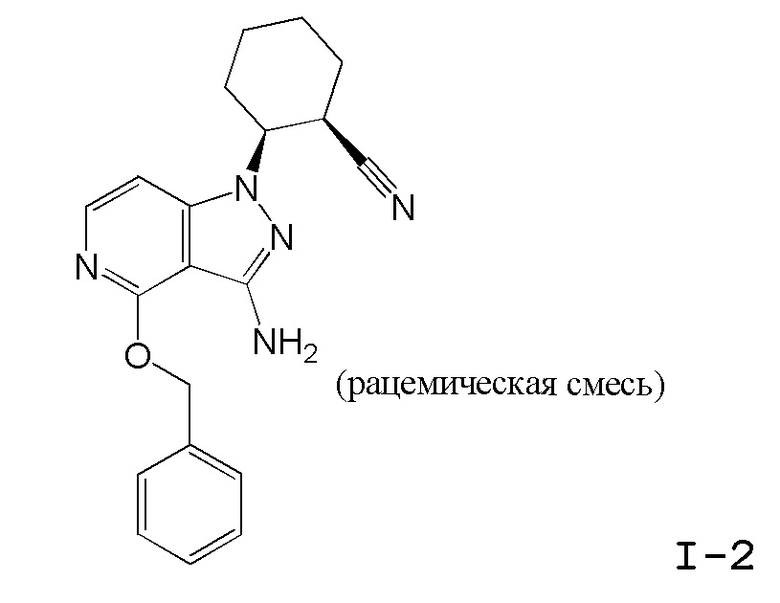
К раствору 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амина (I-1; 15 мг, 0,062 ммоль) в этаноле (0,2 мл) в запаиваемой трубке добавляли 1-цианоциклогексан (0,070 мл, 0,624 ммоль) и DBU (0,019 мл, 0,125 ммоль). Трубку запаивали и нагревали при 90°С в течение 24 часов. Затем реакционную смесь охлаждали до комнатной температуры, концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (0-100% EtOAc/гексаны). Первый элюированный продукт представляет собой побочный (транс)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрил и второй элюированный продукт представляет собой основной (цис)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрил (рацемическая смесь). МСНР (ИЭС) рассчитано для C20H22N5O [M+H]+: 348, найдено 348. 1H ЯМР (600 MГц, CDCl3): δ 7,80 (д, J=6,6 Гц, 1H), 7,45 (д, J=7,2 Гц, 2H), 7,37 (т, J=7,2 Гц, 2H), 7,32 (т, J=7,2 Гц, 1H), 6,79 (д, J=6,6 Гц, 1H), 5,51 (с, 2H), 4.45 (уш.с, 2H), 4,24 (м, 1H), 3,32 (с, 1H), 2,52 (дк, J=12,6, 3,6 Гц, 1H), 2,12-2,18 (м, 2H), 2,07 (м, 1H), 1,71-1,78 (м, 3H), 1,46 (м, 1H).
Промежуточный продукт 3
(транс)-2-[3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрил (рацемическая смесь)
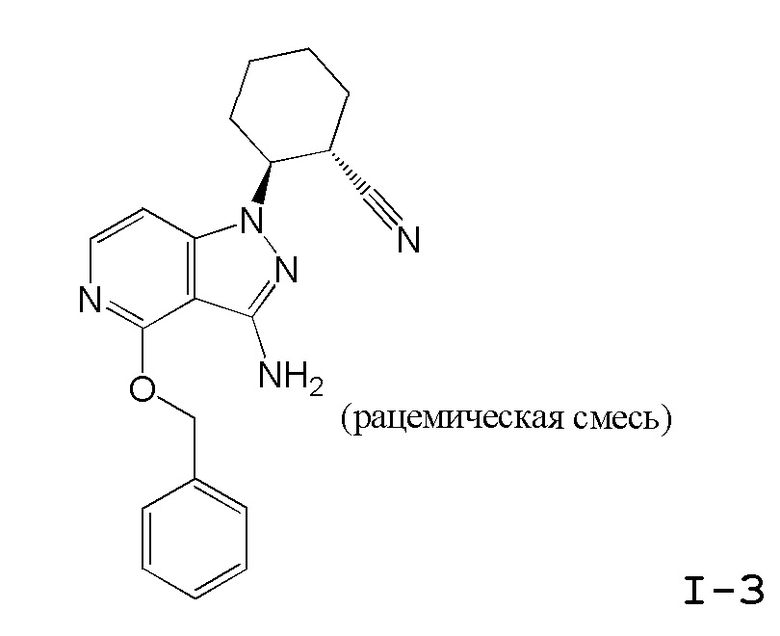
4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин (I-1; 20,0 г, 83,0 ммоль) помещали в толстостенную реакционную колбу (500 мл) с последующим добавлением ацетонитрила (167 мл), циклогекс-1-енкарбонитрила (71,0 г, 0,670 моль) и DBU (25,0 г, 0,170 моль). Колбу герметично закрывали и нагревали при 120°С в течение 4 дней. После 4 дней происходило почти ~ 80% превращение в основной транс-изомер с незначительным количеством обнаруженного цис-продукта. Смесь охлаждали, концентрировали в вакууме, и остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/EtOAc, в который добавлен 1% ДХМ) с получением продукта (транс)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрила (рацемическая смесь). МСНР (ИЭС) рассчитано для C20H22N5O [M+H]+: 348, найдено 348; 1H ЯМР (600 MГц, CDCl3): δ 7,83 (д, J=6,0 Гц, 1H), 7,46 (д, J=7,8 Гц, 2H), 7,38 (т, J=7,8 Гц, 2H), 7,32 (т, J=7,2 Гц, 1H), 6,77 (д, J=6,6 Гц, 1H), 5,50 (с, 2H), 4,44 (с, 2H), 4,18 (м, 1H), 3,19 (м, 1H), 2,30 (м, 1H), 1,90-1,98 (м, 3H), 1,84 (м, 1H), 1,74 (м, 1H), 1,44 (м, 1H), 1,32 (м, 1H).
Промежуточные продукты 4 и 5
(1R,2R)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
и (1S,2S)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
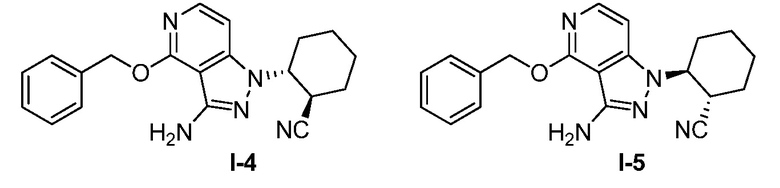
Указанные в заголовке соединения I-4 и I-5 разделяли из рацемической смеси, следуя описанной ниже процедуре:
Используемая колонка: Chiral Technology IC 2,1×25 см, 5 мкм.
Подвижная фаза: 28%/72% 2-пропанол/СО2 (никаких других модификаторов).
Линейная скорость потока: 65 мл/мин, время хроматографирования - 8 мин, с примесью - 10 минут.
Длина волны: 220 нм.
Подготовка пробы: 7 граммов рацемической смеси растворяли в смеси метанол/ДМФА 3:1 (80 мл) и фильтровали для удаления каких-либо твердых частиц. Вводили пробу объемом 0,30 мл и элюирование индивидуальных энантиомеров наблюдали на 4,97 минуте (1R,2R; I-4 МСНР (ИЭС) рассчитано для C20H22N5O [M+H]+: 348, найдено 348) и на 6,02 минуте (1S,2S; I-5 МСНР (ИЭС) рассчитано для C20H22N5O [M+H]+: 348, найдено 348).
Промежуточные продукты 6 и 7
(1R,2R)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил
и (1S,2S)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрил
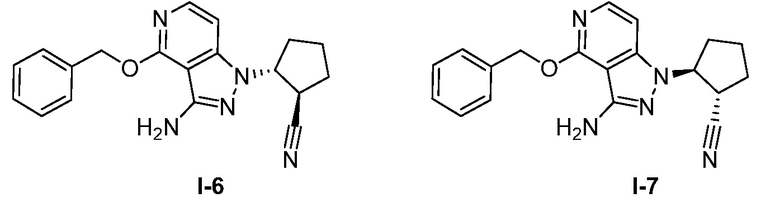
В продуваемую и поддерживаемую в инертной атмосфере азота 5000-мл 4-горлую круглодонную колбу помещали 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин (I-1; 250 г, 1,04 моль), этанол (3000 мл), циклопент-1-ен-1-карбонитрил (300 г, 3,22 моль) и DBU (317 г, 2,08 моль). Полученный раствор нагревали до кипения с обратным холодильником и перемешивали в течение ночи. Реакционную смесь охлаждали и концентрировали в вакууме, и полученный остаток наносили на колонку с силикагелем и элюировали смесью этилацетата/петролейного эфира (1:10-1:2) с получением рацемического 2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклопентан-1-карбонитрила.
Рацемический 2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклопентан-1-карбонитрил (100 г, 300 ммоль) очищали с помощью хиральной препаративной СЖХ при следующих условиях:
Используемая колонка: Phenomenex Lux Cellulose-4, 2×25 см, 5 мкм
Подвижная фаза: СО2 (80%), метанол с 0,1% ДЭА (20%)
Длина волны: УФ 254 нм.
Пик A, I-6: (1R,2R)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентан-1-карбонитрил МСНР (ИЭС) рассчитано для C19H20N5O [M+H]+: 334, найдено 334. 1H-ЯМР (300MГц, CDCl3): δ 7,86-6,84 (м, 7H), 5,55 (с, 2H), 4,94-4,86 (с, 2H), 4,49 (с, 1H), 3,34-3,26 (м, 1H), 2,39-2,01 (м, 6H).
Пик B, I-7: (1S,2S)- 2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентан-1-карбонитрил МСНР (ИЭС) рассчитано для C19H20N5O [M+H] +: 334, найдено 334. 1H-ЯМР (300MГц, CDCl3): δ 7,86-6,84 (м, 7H), 5,55 (с, 2H), 4,94-4,86 (с, 2H), 4,49 (с, 1H), 3,34-3,26 (м, 1H), 2,39-2,01 (м, 6H).
Промежуточные продукты 8 и 9
(1R,2R,5S)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрил
и (1S,2S,5R)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрил
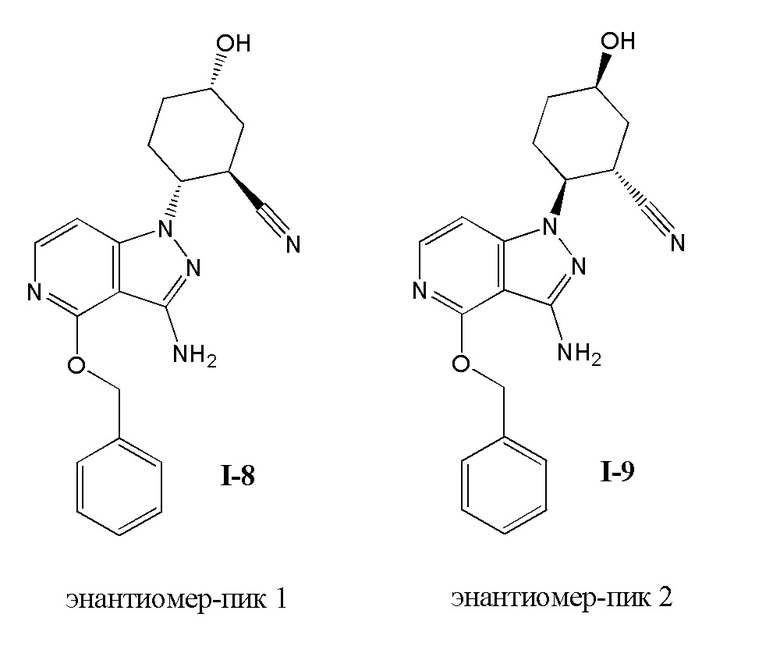
В колбу добавляли 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин (I-1; 6,00 г, 25,0 ммоль), 5-гидроксициклогекс-1-енкарбонитрил (9,23 г, 74,9 ммоль), DBU (7,53 мл, 49,9 ммоль) и EtOH (50 мл).Полученную смесь нагревали при 85°С в течение 50 ч, затем охлаждали, концентрировали в вакууме и разбавляли EtOAc/H2O. Слои разделяли, и органический слой промывали H2O и насыщенным раствором соли. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который подвергали хроматографии на силикагеле (0-50% ацетон/ДХМ) с получением основного диастереомера в виде рацемической смеси (1R,2R,5S) и (1S,2S,5R)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрила. Индивидуальные энантиомеры разделяли с помощью препаративной хиральной СЖХ с использованием следующих условий, чтобы получить два энантиомера:
Используемая колонка: Chiral Technology AZ-H 2,1×25 см, 5 мкм.
Подвижная фаза: 29%/71% метанол/СО2
Линейная скорость потока: 63 мл/мин
Длина волны: 220 нм
Пик A, I-8: (1R,2R,5S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрил. МСНР (ИЭС) рассчитано для C20H22N5O2 [M+H]+: 364, найдено 364. 1H ЯМР (600 MГц, CDCl3): δ 7,86 (д, J=6,0 Гц, 1H), 7,50 (д, J=7,2 Гц, 2H), 7,41 (т, J=7,2 Гц, 2H), 7,36 (т, J=7,2 Гц, 2H), 6,80 (д, J=6,0 Гц, 1H), 5,54 (с, 2H), 4,55 (с, 2H), 4,24-4,27 (м, 2H), 3,76 (т, J=10,8 Гц, 1H), 2,44-2,50 (м, 1H), 2,37 (д, J=13,2 Гц, 1H), 1,94-2,00 (м, 2H), 1,61-1,82 (м, 2H).
Peak B, I-9: (1S,2S,5R)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрил. МСНР (ИЭС) рассчитано для C20H22N5O2 [M+H]+: 364, найдено 364. 1H ЯМР (600 MГц, CDCl3): δ 7,86 (д, J=6,0 Гц, 1H), 7,50 (д, J=7,2 Гц, 2H), 7,41 (т, J=7,2 Гц, 2H), 7,36 (т, J=7,2 Гц, 2H), 6,80 (д, J=6,0 Гц, 1H), 5,54 (с, 2H), 4,55 (с, 2H), 4,24-4,27 (м, 2H), 3,76 (т, J=10,8 Гц, 1H), 2,44-2,50 (м, 1H), 2,37 (д, J=13,2 Гц, 1H), 1,94-2,00 (м, 2H), 1,61-1,82 (м, 2H).
Промежуточный продукт 10
(1S,2S)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
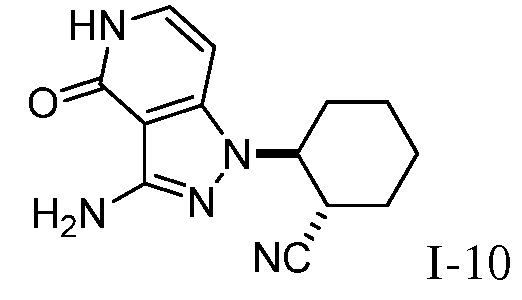
К раствору (1S,2S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)циклогексанкарбонитрила (I-5; 695 мг, 2,00 ммоль) в EtOAc (10,0 мл) добавляли 10% палладий на углероде (213 мг, 10% масс.) при комнатной температуре. Колбу герметично закрывали и дегазировали путем вакуумирования и заполнения водородом (3×) и перемешивали в атмосфере водорода из баллона при комнатной температуре в течение 2 часов. Смесь разбавляли 25% MeOH/CH2Cl2, фильтровали через целит, и фильтрат концентрировали в вакууме. Остаток растирали в порошок при помощи CH2Cl2, и твердое вещество собирали фильтрованием с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H16N5O [M+H] +: 258, найдено 258.
Таблица 1 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 10, используя промежуточный продукт 7 в качестве исходного вещества.
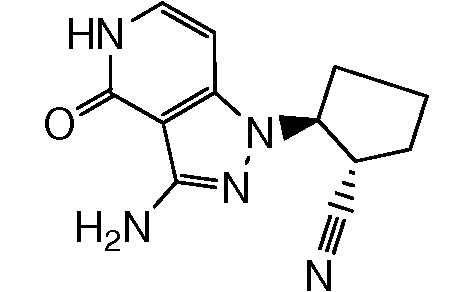
найдено 244
Промежуточный продукт 12
2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил
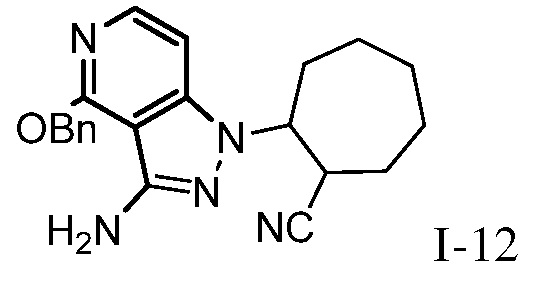
Стадия 1: 1-((Триметилсилил)окси)циклогептанкарбонитрил
Циклогептанон (20,0 г, 178 ммоль) в дихлорметане (250 мл) помещали в 500-мл круглодонную колбу. Добавляли дийодид цинка (0,57 г, 1,8 ммоль) и триметилсилан-карбонитрил (21,21 г, 213,8 ммоль) при 0°С соответственно. Полученный раствор перемешивали в течение 1 ч при комнатной температуре, а затем разбавляли дихлорметаном (200 мл). Полученную смесь промывали водой (3×100 мл) и насыщенным раствором соли (3×100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением неочищенного указанного в заголовке соединения.
Стадия 2: Циклогепт-1-енкарбонитрил
В продуваемую и поддерживаемую в инертной атмосфере азота 500 мл круглодонную колбу помещали 1-[(триметилсилил)окси]циклогептан-1-карбонитрил (35,0 г, 166 ммоль), фосфороил трихлорид (127 г, 828 ммоль) и пиридин (200 мл). Полученный раствор перемешивали в течение 16 ч при 100°С. Реакцию останавливали с помощью ледяной воды (500 мл), и полученный раствор экстрагировали этилацетатом (3×200 мл). Органические слои объединяли, промывали водой (3×200 мл) и насыщенным раствором соли (3×200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:10) с получением указанного в заголовке соединения. GCMS (ES) рассчитано для C8H11N [M]+: 121, найдено 121.
Стадия 3: 2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил
В 100 мл круглодонную колбу помещали 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин (I-1; 2,0 г, 8,3 ммоль), циклогепт-1-ен-1-карбонитрил (2,02 г, 16,7 ммоль), 1,8-диазабицикло[5,4,0]ундец-7-ен (2,65 г, 16,7 ммоль) и ацетонитрил (15 мл). Полученный раствор перемешивали в течение 16 ч при 80°С. Добавляли воду (100 мл), и смесь экстрагировали этилацетатом (3×200 мл). Органические слои объединяли, промывали водой (3×200 мл) и насыщенным раствором соли (3×200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:5) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C21H24N5O [M + H]+ 362, найдено 362. 1H ЯМР (300 MГц, CDCl3) δ 7,88-7,83 (м, 1H), 7,50-7,48 (м, 2H), 7,44-7,35 (м, 3H), 6,81 (д, J=6,0 Гц, 1H), 5,55 (с, 2H), 4,50 (уш.с, 2H), 3,54-3,26 (м, 1H), 2,61-2,51 (м, 0,3H), 2,28-2,11 (м, 1,7H), 2,06-1,61 (м, 9H).
Промежуточные продукты 13 и 14
(цис)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил (рацемическая смесь) и (транс)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил (рацемическая смесь)
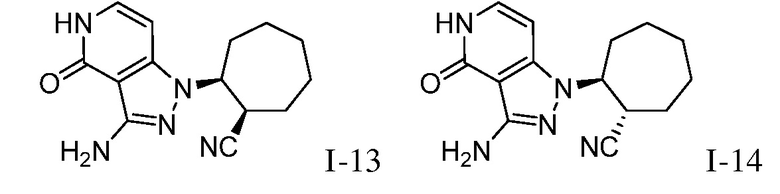
Удаление защитной группы предшествовало в аналогичной процедуре, как описано выше для промежуточного продукта 10. Диастереомеры разделяли с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (XBridge Phenyl; 35-60% ACN/Вода, содержащая 0,05% ТФУК) с получением указанного в заголовке соединения.
Пик А (I-13): (цис)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил (рацемическая смесь). Tуд = 11,2 минут. МСНР (ИЭС) рассчитано для C14H18N5O [M + H]+: 272, найдено 272.
Пик В (I-14): (транс)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил (рацемическая смесь). Tуд = 12,5 минут. МСНР (ИЭС) рассчитано для C14H18N5O [M + H]+: 272, найдено 272.
Промежуточные продукты 15 и 16
(1S,2S или 1R,2R)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил и (1R,2R или 1S,2S)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил
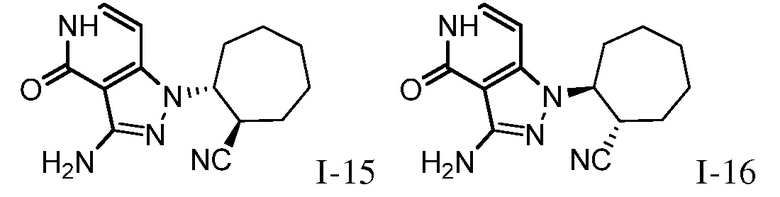
Указанные в заголовке соединения разделяли хиральной препаративной ВЭЖХ из рацемической смеси (транс)-2-(3-амино-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-1-ил)циклогептанкарбонитрила (I-14), следуя описанной ниже процедуре:
Используемая колонка: ChiralPak IA, 2×25 см, 5 мкм
Подвижная фаза: 40% EtOH в гексанах
Peak A (I-15): (1S,2S или 1R,2R)-2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил. Tуд = 8,0 минут. МСНР (ИЭС) рассчитано для C14H18N5O [M + H]+: 272, найдено 272. 1H ЯМР (400 MГц, ДМСО-d6) δ 10,75 (уш.с, 1H), 7,10-7,07 (м, 1H), 6,54 (д, J=7,2 Гц, 1H), 5.39 (с, 2H), 4,71-4,66 (м, 1H), 3,45-3,39 (м, 1H), 2,02-1,85 (м, 3H), 1,76-1,73 (м, 3H), 1,61-1,58 (м, 4H).
Peak B (I-16): (1R,2R или 1S,2S)- 2-(3-Амино-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрил. Tуд = 11,0 минут. МСНР (ИЭС) рассчитано для C14H18N5O [M + H]+: 272, найдено 272. 1H ЯМР (400 MГц, ДМСО-d6) δ 10,75 (уш.с, 1H), 7,10-7,07 (м, 1H), 6,54 (д, J=7,2 Гц, 1H), 5,39 (с, 2H), 4,71-4,66 (м, 1H), 3,44-3,39 (м, 1H), 2,08-1,85 (м, 3H), 1,76-1,73 (м, 3H), 1,61-1,58 (м, 4H).
Промежуточный продукт 17
5-Бром-2-(2,2,2-трифторэтил)изоиндолин-1-он
Стадия 1: 4-Бром-2-(гидроксиметил)-N-(2,2,2-трифторэтил)бензамид
К перемешиваемой суспензии хлорида алюминия (8,14 г, 61,0 ммоль) в CH2Cl2 при 0°С в атмосфере аргона добавляли 2,2,2-трифторэтанамин (6,08 мл, 77 ммоль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 4 ч. К реакционной смеси добавляли 5-бромизобензофуран-1(3Н)-он (10,0 г, 46,9 ммоль), и нагревали при 80°С в течение ночи. Реакционную смесь осторожно гасили водой со льдом (150 мл) и перемешивали, пока лед не растает. Полученную смесь разбавляли CH2Cl2 (150 мл) и фильтровали через слой силикагеля, элюируя дополнительным количеством CH2Cl2. Слои разделяли, и водный слой экстрагировали CH2Cl2 (3×100 мл). Объединенные органические слои сушили над сульфатом натрия и концентрировали в вакууме с получением 4-бром-2-(гидроксиметил)-N-(2,2,2-трифторэтил)бензамида. МСНР (ИЭС) рассчитано для C10H10BrF3NO2 [M+H]+: 312, 314 (1:1), найдено 312, 314 (1:1).
Стадия 2: 5-Бром-2-(2,2,2-трифторэтил)изоиндолин-1-он
К перемешиваемому раствору (охлажденному до 5°С) 4-бром-2-(гидроксиметил)-N-(2,2,2-трифторэтил)бензамида (6,79 г, 21,8 ммоль) в безводном ТГФ (100 мл) и N-метил-2-пирролидиноне (40,0 мл) в атмосфере аргона медленно добавляли раствор изопропилмагнийхлорида (50 мл, 100 ммоль), чтобы поддерживать температуру ниже 10°C. После того как завершали добавление, реакционную смесь перемешивали при температуре ниже 10°С в течение 1 ч, а затем при комнатной температуре в течение дополнительного часа. Затем реакционную смесь охлаждали до 5°С и по каплям добавляли бис(диметиламино)фосфорилхлорид (4,19 мл, 28,3 ммоль). Полученную реакционную смесь нагревали с обратным холодильником в течение 24 ч, затем концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 2/1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C10H8BrF3NO [M+H]+: 294, найдено 294. 1H ЯМР (600 MГц, ДМСО-d6): δ 7,93 (д, J=1,1 Гц 1H), 7,72 (д, J=1,1 Гц, 1H), 7,67-7,68 (с, 1H), 4,58 (с, 2H), 4,35 (к, 2H).
Промежуточный продукт 18
2-[1-(3-Бромбензил)-1H-1,2,3-триазол-4-ил]пропан-2-ол
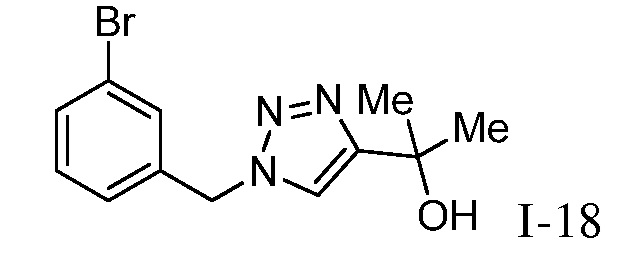
К раствору 1-бром-3-(бромметил)бензола (5,0 г, 20 ммоль) в ДМСО (40 мл) добавляли азид натрия (1,3 г, 20 ммоль). Полученную смесь оставляли перемешиваться при комнатной температуре в течение 18 часов, прежде чем ее разбавляли водой и экстрагировали диэтиловым эфиром (2×). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный остаток растворяли в трет-BuOH (65 мл) и воде (39 мл) и к этой смеси добавляли 2-метилбут-3-ин-2-ол (2,3 г, 27 ммоль). Затем добавляли раствор пентагидрата сульфата меди (II) (0,26 г, 1,0 ммоль) в воде (10 мл), с последующим добавлением раствора аскорбата натрия (0,83 г, 4,2 ммоль) в воде (8 мл). Полученную смесь оставляли перемешиваться при комнатной температуре в течение 2 часов и затем разбавляли водой и экстрагировали EtOAc (2×). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C12H15BrN3O [M+H]+: 296, 298 (1:1), найдено: 296, 298 (1:1).
Таблица 2 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 18, используя 1-бром-4-(бромметил)бензол в качестве исходного вещества.
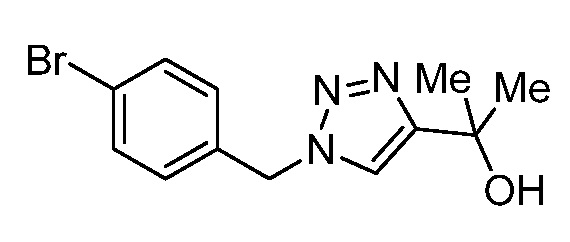
Промежуточные продукты 20 и 21
(S или R)-1-(4-Бромфенил)-2,2,2-трифторэтанол и (S или R)-1-(4- Бромфенил)-2,2,2-трифторэтанол
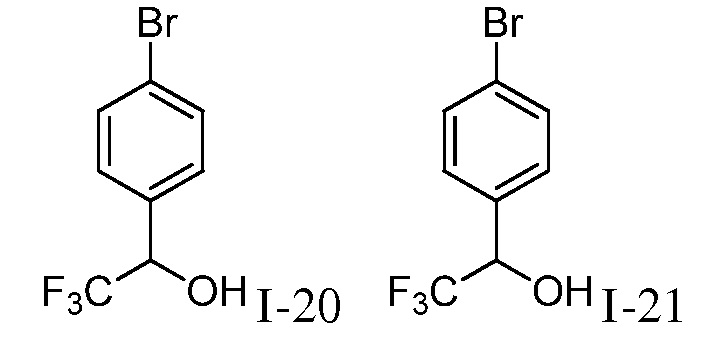
4'-Бром-2,2,2-трифторацетофенон (3,00 мл, 19,8 ммоль) перемешивали в МеОН (66 мл) при 0°С. Добавляли боргидрид натрия (0,748 г, 19,8 ммоль), и смеси давали нагреться до комнатной температуры. Смесь перемешивали в течение 3 часов, затем гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой затем промывали насыщенным раствором соли, сушили над безводным MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (5% EtOAc/гексаны) с получением рацемической смеси указанных в заголовке соединений. Рацемический остаток разделяли путем очистки хиральной СЖХ, используя следующий способ:
Используемая колонка: Chiral Technology OJ-H 2,1×25 см, 5 мкм
Подвижная фаза: 5% изопропиловый спирт/CO2
Пик A, I-19: (S или R)-1-(4-бромфенил)-2,2,2-трифторэтанол: 1H ЯМР (500 MГц, CDCl3) δ 7,55 (д, J=8,5 Гц, 2H), 7,36 (д, J=8,5 Гц, 2H), 5,03 - 4,98 (м, 1H), 2,79 (уш.с, 1H).
Peak B, I-20: (S или R)-1-(4-бромфенил)-2,2,2-трифторэтанол: 1H ЯМР (500 MГц, CDCl3) δ 7,55 (д, J=8,5 Гц, 2H), 7,36 (д, J=8,5 Гц, 2H), 5,03 - 4,98 (м, 1H), 2,79 (уш.с, 1H).
Промежуточный продукт 22
N-(3-Бромбензил)оксазол-5-карбоксамид
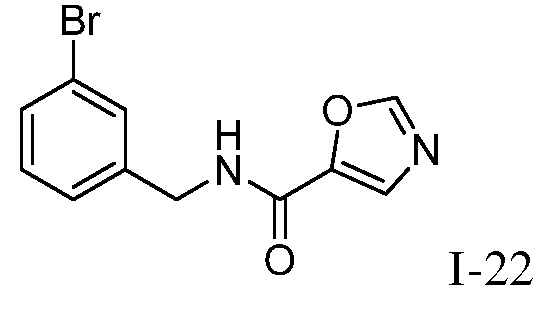
К раствору (3-бромфенил)метанамина (820 мг, 4,4 ммоль) и оксазол-5-карбоновой кислоты (500 мг, 4,4 ммоль) в ДХМ (50 мл), добавляли HOBt (1,2 г, 8,8 ммоль), ТЭА (2,2 г, 22 ммоль) и EDCI (1,7 г, 8,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем распределяли между водой и ДХМ. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (1:1 петролейный эфир/EtOAc) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3): δ 7,83 (с, 1H), 7,70 (с, 1H), 7,41 (д, J=1,6 Гц, 1H), 7,37 (дт, J=7,6 Гц, 1,6 Гц, 1H), 7,21-7,14 (м, 1H), 7,16 (т, J=7,6 Гц, 1H), 6,57 (уш., 1H), 4.53 (д, J=6,0 Гц, 2H).
Таблица 3 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 22.
Промежуточный продукт 25
трет-Бутил-4-бромбензилкарбамат
К раствору (4-бромфенил)метанамина (1,0 г, 5,4 ммоль) в этаноле (20 мл) добавляли Boc2O (2,0 г, 6,4 ммоль). Полученную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли в вакууме, и полученный остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/EtOAc: 4/1) с получением трет-бутил-4-бромбензилкарбамата. МСНР (ИЭС) рассчитано для C12H17BrNO2 [M+H]+: 286, найдено 286. 1H ЯМР (400 MГц, CDCl3): δ 7,44 (д, J=6,0 Гц, 2H), 7,14 (д, J=8,4 Гц, 2H), 4,85 (уш.с, 1H), 4,25 (д, J=6,0 Гц, 2H), 1,45 (с, 9H).
Таблица 4 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 25.
Промежуточный продукт 28
4-Бром-N-изопропилбензолсульфонамид
К раствору пропан-2-амина (160 мг, 2,6 ммоль) и DIPEA (780 мг, 6,0 ммоль) в CH2Cl2 (7 мл) добавляли раствор 4-бромбензол-1-сульфонилхлорида (510 мг, 2,0 ммоль) в CH2Cl2 (14 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи, затем выливали в воду (20 мл) и экстрагировали CH2Cl2 (3×15 мл). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (петролейный эфир/EtOAc: 20/1) с получением 4-бром-N-изопропилбензолсульфонамида. 1H ЯМР (400 MГц, CDCl3): δ 7,75 - 7,72 (м, 2H), 7,65 - 7,62 (м, 2H), 4,43 (д, J=7,52 Гц, 1H), 3,49 - 3,44 (м, 1H), 1,08 (д, J=6,4 Гц, 6H).
Таблица 5 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 28. В некоторых случаях, сульфонилирование проводили в отсутствии DIPEA с использованием избытка амин-связывающего партнера вместо него (1,75-5 экв.).
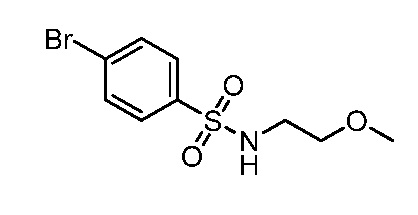
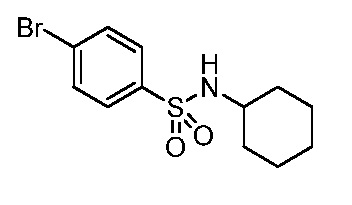
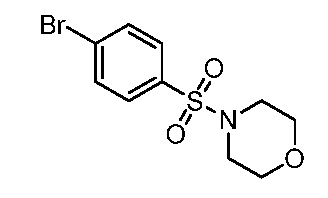
Промежуточные продукты 36 и 37
1-(3-Бромбензил)-1H-1,2,3-триазол и 2-(3-бромбензил)-2H-1,2,3-триазол
К перемешиваемому раствору 1-бром-3-(бромметил)бензола (5,0 г, 20,0 ммоль) в ацетоне (200 мл) в атмосфере N2 добавляли 1H-1,2,3-триазол (2,1 г, 30,0 ммоль) с последующим добавлением K2CO3 (4,1 г, 30,0 ммоль) и KI (0,16 г, 1,0 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 12 ч, затем разбавляли H2O (200 мл) и экстрагировали EtOAc (200 мл × 2). Объединенные органические слои промывали водным раствором КОН (10%, 50 мл), затем насыщенным раствором соли (200 мл). Органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (петролейный эфир/EtOAc: 50:1) с получением 1-(3-бромбензил)-1Н-1,2,3-триазола 1H ЯМР (CDCl3, 400MГц): δ 7,70 (с, 1H), 7,50 (т, J=3,2 Гц, 1H), 7,41 (д, J=7,1 Гц, 1H), 7,22 (д, J=3,2 Гц, 1H), 7,20-7,15 (м, 2H), 5,51(с, 2H) и 2-(3-бромбензил)-2H-1,2,3-триазола 1H ЯМР (CDCl3, 400MГц): δ 7,63 (с, 2H), 7,43 (д, J=4,8 Гц, 2H), 7,20 (т, J=3,4 Гц, 2H), 5,56 (с, 2H).
Таблица 6 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточные продукты 36 и 37.
Промужеточный продукт 44
1-(3-Бромбензил)-4-метил-1H-1,2,3-триазол
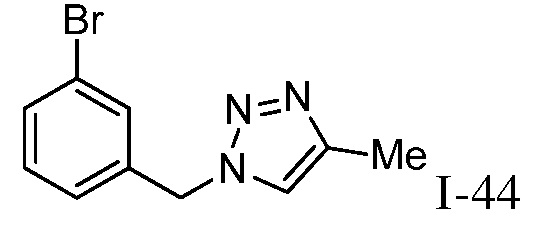
Стадия 1: 1-(Азидометил)-3-бромбензол
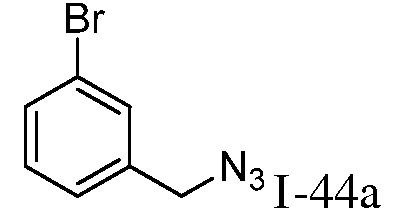
К раствору 1-бром-3-(бромметил)бензола (2,0 г, 8,0 ммоль) в ДМСО (50 мл) добавляли NaN3 (0,65 г, 10 ммоль). Полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь гасили водой (50 мл) и экстрагировали ДХМ (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли (50 мл), затем сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 1-(азидометил)-3-бромбензола, который использовали без дальнейшей очистки.
Стадия 2: 1-(3-Бромбензил)-4-метил-1H-1,2,3-триазол
Смесь 1-(азидометил)-3-бромбензола (3,2 г, 15 ммоль), триметил(проп-1-ин-1-ил)силана (1,6 мл, 14 ммоль) и Et3N (2,2 мл, 4,5 ммоль) в ДМФА (50 мл) перемешивали при 100°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, а затем добавляли насыщенный водный раствор NH4Cl (25 мл) и экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали H2O (3×50 мл), затем сушили над Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400MГц): δ 7,63 (с, 2H), 7,43 (д, J=4,8 Гц, 2H), 7,20 (т, J=3,4 Гц, 2H), 5,56 (с, 2H).
Промежуточный продукт 45
(4-Бромфенил)(пирролидин-1-ил)метанон
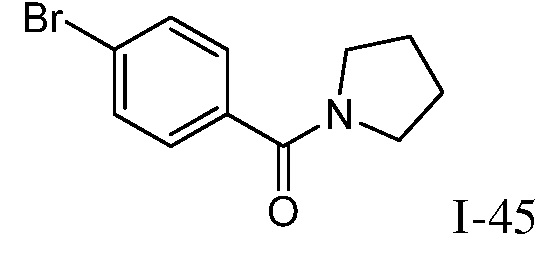
К суспензии 4-бромбензойной кислоты (150 мг, 0,75 ммоль) в ДХМ (7,5 мл) последовательно добавляли пирролидин (53 мг, 0,75 ммоль), НОВТ (110 мг, 0,78 ммоль) и Et3N (190 мг, 1,9 ммоль) при комнатной температуре, затем к смеси добавляли EDCI (150 мг, 0,78 ммоль) порциями. Полученную смесь перемешивали в течение ночи, затем выливали в воду и промывали разбавленной водной HCl (5 мл), насыщенным водным раствором NaHCO3 (15 мл) и насыщенным раствором соли (10 мл). Органический слой сушили над Na2SO4, фильтровали, затем концентрировали в вакууме с получением сырого продукта, который очищали с помощью препаративной ТСХ (петролейный эфир/EtOAc: 3:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H13BrNO [M+H]+: 254, найдено: 254. 1H ЯМР (400 MГц, CDCl3): δ 7,46 (д, J=8,4 Гц, 2H), 7,33 (д, J=8,4 Гц, 2H), 3,55 (т, J=6,8 Гц, 2H), 3,33 (т, J=6,4 Гц, 2H), 1,92-1,77 (м, 4H).
Таблица 7 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 45.
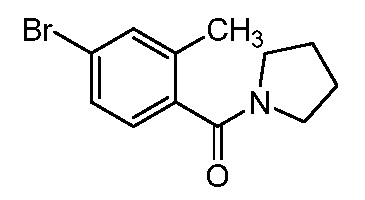
найдено 268
Промежуточный продукт 47
4-Бром-N,N,2-триаметилбензамид
Раствор 4-бром-2-метилбензойной кислоты (2,15 г, 10,0 ммоль) и тионилхлорида (3,6 г, 30 ммоль) нагревали при 80°С в течение 3 ч. Избыток тионилхлорида удаляли в вакууме, и полученный остаток растворяли в дихлорметане (50 мл) и охлаждали до 0°С (баня лед/вода). Диметиламин (газ) барботировали в реакционный раствор в течение 5 мин. Полученный раствор перемешивали при 20°С в течение 10 мин, затем концентрировали в вакууме и разбавляли этилацетатом (100 мл). Реакционную смесь последовательно промывали водным раствором гидроксида натрия (1,0 N, 20 мл), водой (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением 4-бром-2-метил-N,N,диметилбензамида. 1H ЯМР (400 MГц, CDCl3): δ 7,40-7,39 (м, 1H), 7,36 (дд, J=8,03, 1,51 Гц, 1H), 7,06 (д, J=8,03 Гц, 1H), 3,13 (с, 3H), 2,84 (с, 3H), 2,28 (с, 3H).
Таблица 8 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 47.
Промежуточный продукт 49
4-Хлор-2-циклопропил-N,N-диметилбензамид
В продуваемую и поддерживаемую в инертной атмосфере азота 25-мл колбу Шленка добавляли 2-бром-4-хлор-N,N-диметилбензамид (0,26 г, 1,0 ммоль), циклопропилбороновую кислоту (0,13 г, 1,5 ммоль), толуол (5 мл), воду (0,25 мл), трициклогексилфосфин (14 мг, 0,050 ммоль), ацетат палладия (II) (22,4 мг, 0,10 ммоль) и фосфат калия (0,85 г, 4,0 ммоль). Полученную смесь перемешивали в течение 3 ч при 100°С в масляной бане, затем охлаждали до 20°С и разбавляли этилацетатом (100 мл), промывали водой (2×20 мл) и насыщенным раствором соли (2×20 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением остатка, который очищали с помощью хроматографии (5%-10% этилацетат/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 7,18-7,03 (м, 2H), 6,85 (с, 1H), 3,14 (с, 3H), 2,87 (с, 3H), 1,91-1,82 (м, 1H), 1,00-0,90 (м, 2H), 0,88-0,64 (м, 2H).
Промежуточный продукт 50
(+) 1-(3-Бромфенил)этанол
К раствору 1-(3-бромфенил)этанона (1,0 г, 5,0 ммоль) в EtOH (15 мл) добавляли NaBH4 (470 мг, 12,0 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме, и остаток очищали с помощью хроматографии на силикагеле (гексаны/EtOAc: 5/1) с получением (+)1-(3-бромфенил)этанола. МСНР (ИЭС) рассчитано для C8H10BrO [M+H]+: 201, найдено 201. 1H ЯМР (CDCl3, 400MГц): δ 7,51-7,50 (м, 1H), 7,39-7,36 (м, 1H), 7,26-7,24 (м, 1H), 7,21-7,17 (м, 1H), 4,84-4,79 (м, 1H), 2,35 (с, 1H), 1,45 (д, J=6,48 Гц, 3H).
Таблица 9 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 50.
Промежуточный продукт 52
4-(3-Бромбензил)морфолин
К суспензии 1-бром-3-бромметил-бензола (530 мг, 2,10 ммоль) в ТГФ (10 мл) добавляли морфолин (200 мг, 1,80 ммоль) и Et3N (350 мг, 3,5 ммоль). Полученную суспензию перемешивали при комнатной температуре в течение 8 часов. Затем добавляли воду (35 мл), и смесь экстрагировали EtOAc (50 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ТСХ (петролейный эфир/EtOAc: 5/1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H15BrNO [M+H]+: 255, найдено 255. 1H ЯМР (CDCl3, 400 MГц): δ 7,51 (с, 1H), 7,40 (д, J=8,0 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,19 (т, J=8,0 Гц, 1H), 3,66 (м, 4H), 3,47 (с, 2H), 2,41 (м, 4H).
Промежуточный продукт 53
N-(3-Бромбензил)-2,2,2-трифторэтанамин
Суспензию 1,3-дибром-бензола (500 мг, 2,00 ммоль) в 2,2,2-трифтор-этиламине (790 мг, 8,00 ммоль) перемешивали при 40-50°С в течение 10 часов. Затем смесь концентрировали в вакууме с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H15BrNO [M+H]+: 268, найдено 268.
Таблица 10 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 53.
Промежуточный продукт 55
(R)-N-(1-(4-Бромфенил)этил)-2,2,2-трифторэтанамин
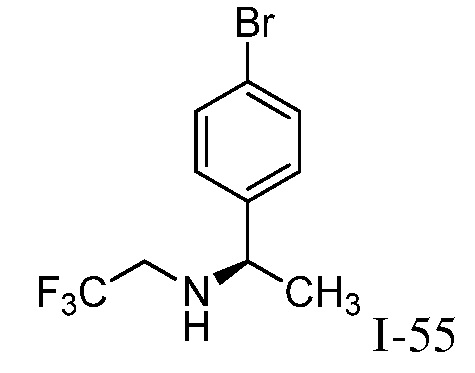
Стадия 1: (R)-N-(1-(4-Бромфенил)этил)-2,2,2-трифторацетамид
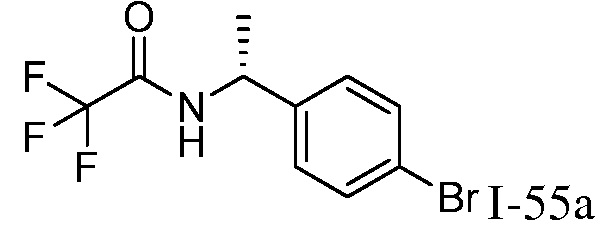
К раствору (R)-1-(4-бромфенил)этанамина (3,00 г, 15,0 ммоль) в CH2Cl2 (70 мл) добавляли TFAA (3,78 г, 18,0 ммоль) при 0°С. Полученную реакционную смесь перемешивали в течение 1 ч при 20°С, а затем гасили добавлением воды. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением (R)-N-(1-(4-бромфенил)этил)-2,2,2-трифторацетамида. 1H ЯМР (300 MГц, CDCl3): δ 7,51 (д, J=8,4 Гц, 2H), 7,20 (д, J=8,4 Гц, 2H), 6,40 (с, уш., 1H), 5,15-5,05 (м, 1H), 1,57 (д, J=6,9 Гц, 3H).
Стадия 2: (R)-N-(1-(4-бромфенил)этил)-2,2,2-трифторэтанамин
К перемешиваемому раствору (R)-N-(1-(4-бромфенил)этил)-2,2,2-трифторацетамида (1,00 г, 3,38 ммоль) в ТГФ (20 мл) добавляли боран-диметилсульфидный комплекс (2,0 М в ТГФ, 8,4 мл, 17 ммоль). Полученный раствор перемешивали в течение 4 ч при 75°С. Смесь осторожно выливали в смесь лед/вода (50 мл) и экстрагировали EtOAc (40 мл × 2). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3): δ 7,53 (д, J=8,4 Гц, 2H), 7,22 (д, J=8,4 Гц, 2H), 6,44 (с, уш., 1H), 5,16-5,09 (м, 1H), 1,60 (д, J=7,2 Гц, 3H).
Таблица 11 раскрывает промежуточный продукт, который получали аналогичным образом тому, как описано для промежуточного продукта 55.
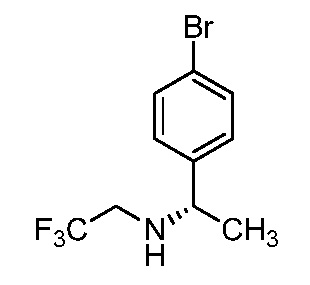
Промежуточный продукт 57
5-Бром-2-метилизоиндолин
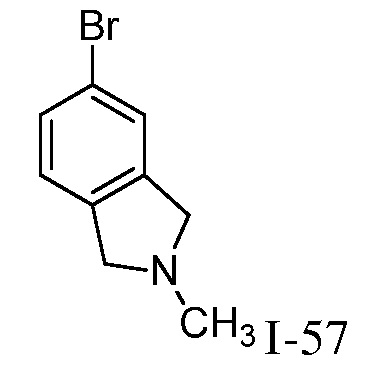
В 100-мл круглодонную колбу помещали 5-бром-2,3-дигидро-1Н-изоиндол (1,00 г, 5,05 ммоль), формальдегид (0,23 г, 40% в воде, 7,60 ммоль), боргидрид натрия (0,29 г, 7,60 ммоль) и метанол (50 мл). Полученный раствор перемешивали в течение 1 ч при 15°С, затем экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле с использованием этилацетата/петролейного эфира (1:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для: C9H10BrN [M + H]+: 212, 214 (1:1), найдено 212, 214 (1:1).
Промежуточный продукт 58
5-Бром-2-этилизоиндолин
Стадия 1: 1-(5-Броизоиндолин-2-ил)этанон
В 50-мл трехгорлую колбу помещали 5-бромизоиндолин гидрохлорид (0,234 г, 1,00 ммоль), уксусную кислоту (4 мл) и уксусный ангидрид (0,31 г, 3,0 ммоль). Смесь перемешивали при 20°С в течение 2 ч, затем разбавляли этилацетатом (50 мл). Раствор промывали водой (3×15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (2-50% этилацетата в петролейном эфире) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CD3OD) δ 7,54 (д, J=4,8 Гц, 1H), 7,48 (д, J=8,0 Гц, 1H), 7,27 (дд, J=8,0, 4,8 Гц, 1H), 4,88 (д, J=16,4 Гц, 2H), 4,72 (д, J=16,4 Гц, 2H), 2,18 (с, 3H).
Стадия 2: 5-Бром-2-этилизоиндолин
В 50-мл трехгорлую колбу помещали 1-(5-бромизоиндолин-2-ил)этанон (0,17 г, 0,71 ммоль), тетрагидрофуран (10 мл) и боран-диметилсульфидный комплекс (0,35 мл, 1,0 М в тетрагидрофуране, 3,5 ммоль). Раствор нагревали с обратным холодильником в течение 2 ч, затем охлаждали до 20°С, и осторожно добавляли по каплям воду (3 мл). Полученную смесь концентрировали в вакууме и разбавляли этилацетатом (50 мл). Раствор промывали соответственно водой (15 мл) и насыщенным раствором соли (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3) δ 7,44-7,38 (м, 2H), 7,11 (д, J=8,0 Гц, 1H), 4,52 (д, J=14,0 Гц, 1H), 4,49 (д, J=14,0 Гц, 1H), 4,16 (д, J=14,0 Гц, 1H), 4,13 (д, J=14,0 Гц, 1H), 3,12 (к, J=7,2 Гц, 2H), 1,30 (т, J=7,2 Гц, 3H).
Таблица 12 раскрывает промежуточные продукты, которые получали аналогичным образом тому, как описано для промежуточного продукта 58.
Промежуточный продукт 63
5-Бром-2-изопропилизоиндолин
В 100-мл круглодонную колбу помещали раствор 5-бром-2,3-дигидро-1Н-изоиндола гидрохлорида (2,00 г, 8,53 ммоль) в N,N-диметилформамиде (50 мл). Осторожно добавляли гидрид натрия (0,85 г, 60% в минеральном масле, 21 ммоль), и полученную реакционную смесь перемешивали в течение 45 минут при 20°С. Добавляли по каплям 2-йодпропан (2,17 г, 12,8 ммоль) при той же температуре, затем полученный раствор перемешивали в течение 16 ч при 50°С в масляной бане. Реакционную смесь охлаждали до комнатной температуры, затем осторожно гасили добавлением воды (80 мл). Полученную смесь экстрагировали этилацетатом (3×40 мл). Органические слои объединяли, промывали водой (50 мл) и насыщенным раствором соли (50 мл) соответственно, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для: C11H15BrN [M + H]+: 240, найдено: 240; 1H ЯМР (300 MГц, CDCl3) δ 7,46-7,32 (м, 2H), 7,07 (д, J=7,8 Гц, 1H), 4,92 (д, J=7,8 Гц, 4H), 2,79-2,71 (м, 1H), 1,19 (д, J=6,3 Гц, 6H).
Таблица 13 раскрывает промежуточный продукт, полученный с применением аналогичных процедур, как описано для промежуточного продукта 63, с использованием соответствующего алкилирующего агента. В отдельных случаях, общую процедуру модифицировали использованием в качестве альтернативы 1,0-2,5 эквивалентов основания ТЭА или NaH и ДХМ или ДМФА в качестве растворителя.
Промежуточный продукт 65
(R)-N-((S)-1-(3-Бромфенил)-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамид
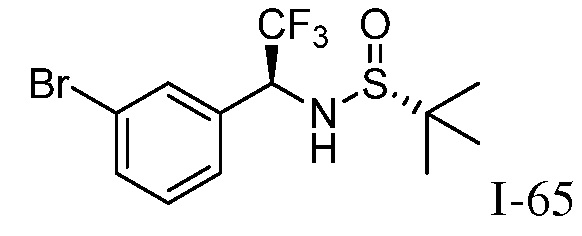
Стадия 1: (R,E)-N-(3-Бромбензилиден)-2-метилпропан-2-сульфинамид
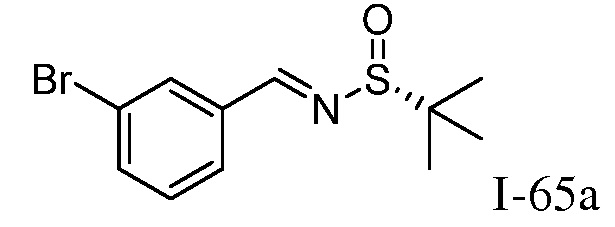
К суспензии 3-бромбензальдегида (2,00 г, 10,8 ммоль) и (S)-2-метилпропан-2-сульфинамида (2,90 г, 21,6 ммоль) в ТГФ (50 мл) добавляли этоксид титана (3,10 г, 10,8 ммоль). Смесь нагревали до кипения с обратным холодильником в течение 5 ч, затем охлаждали до комнатной температуры и гасили добавлением воды (30 мл). Полученную смесь фильтровали, и фильтрат экстрагировали EtOAc (30 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (30 мл × 2), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (петролейный эфир:этилацетат = от 40:1 до 10:1) с получением (R,E)-N-(3-бромбензилиден)-2-метилпропан-2-сульфинамида. МСНР (ИЭС) рассчитано для C11H15BrNOS [M+H]+: 288, найдено: 288. 1H ЯМР (400 MГц, CDCl3): δ 8,51 (с, 1H), 8,00 (с, 1H), 7.72 (д, J=8,0 Гц, 1H), 7,61 (д, J=8,0 Гц, 1H), 7,34 (т, J=8,0 Гц, 1H), 1,25 (с, 9H).
Стадия 2: (R)-N-((S)-1-(3-бромфенил)-2,2,2-трифторэтил)2-метилпропан-2-сульфинамид
К суспензии (R,E)-N-(3-бромбензилиден)-2-метилпропан-2-сульфинамида (150 мг, 0,520 ммоль) и TBAF (210 мг, 1 ммоль) в ТГФ (15 мл) добавляли по каплям TMSCF3 (0,84 мл, 1,7 ммоль) при -55°C, и полученную смесь перемешивали в течение 1 ч. Реакционную смесь гасили добавлением водного раствора NH4Cl и экстрагировали с помощью EtOAc (15 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (15 мл × 2), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали препаративной ТСХ (силикагель, элюированный смесью петролейный эфир:EtOAc = 10:1) с получением (R)-N-((S)-1-(3-бромфенил)-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамида. МСНР (ИЭС) рассчитано для C12H16BrF3NOS [M+H]+: 358, найдено 358.
Таблица 14 раскрывает промежуточные продукты, которые получали аналогичным образом тому, как описано для промежуточного продукта 65. В некоторых случаях, использовали (R)-2-метилпропан-2-сульфинамид для получения альтернативного диастереомера.
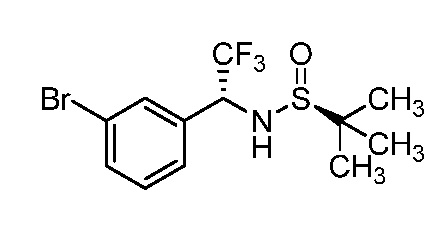
Рассчитано 358,
найдено 358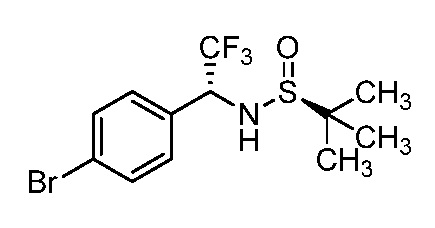
найдено 358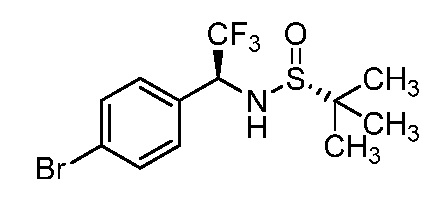
найдено 358
Промежуточные продукты 69 и 70
(R или S)-1-(4-Бромфенил)-2,2,2-трифторэтанамин и (R или S)-1-(4-Бромфенил)-2,2,2-трифторэтанамин
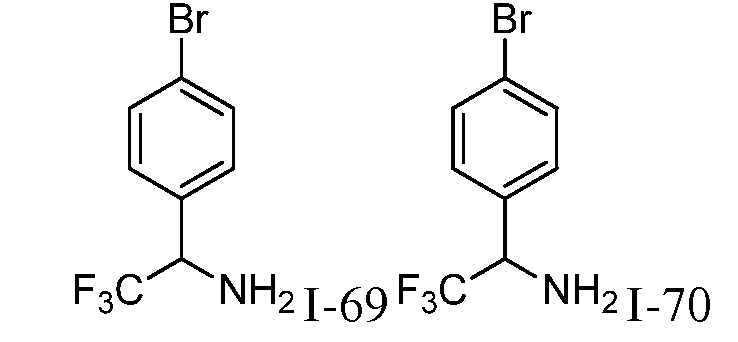
К раствору 1-(4-бромфенил)-2,2,2-трифторэтанона (1,00 г, 3,95 ммоль) в толуоле (14 мл) при комнатной температуре по каплям добавляли раствор бис(триметилсилил)амида в ТГФ (4,35 мл, 4,35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, затем добавляли BH3.ТГФ (7,90 мл, 7,90 ммоль) и перемешивали в течение дополнительных 20 минут. Реакционную смесь охлаждали до 0°С и осторожно гасили водным раствором гидроксида натрия (2,0 М; 5,93 мл, 11,9 ммоль) в течение приблизительно 5 минут. Полученную смесь перемешивали при комнатной температуре в течение 90 минут, а затем слои разделяли. Органический слой промывали NaOH (1N), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением рацемического 1-(4-бромфенил)-2,2,2-трифторэтанамина. Индивидуальные энантиомеры разделяли с помощью препаративной хиральной СЖХ с использованием следующих условий для получения двух энантиомеров:
Используемая колонка: Chiralpak AZ-H, 21×250 мм
Длина волны УФ: 220 нм
Линейная скорость потока: 70 мл/мин
Модификатор: MeOH (7%)
Пик A (I-69): (R или S)-1-(4-бромфенил)-2,2,2-трифторэтанамин; МСНР (ИЭС) рассчитано для C8H8BrF3N [M+H]+: 254, 256 (1:1), найдено: 254, 256 (1:1).
Пик B (I-70): (S или R)-1-(4-бромфенил)-2,2,2-трифторэтанамин; МСНР (ИЭС) рассчитано для C8H8BrF3N[M+H]+: 254, 256 (1:1); найдено: 254, 256 (1:1).
Промежуточный продукт 71
N-(5-Бром-2-(N,N-диметилсульфамоил)бензил)ацетамид
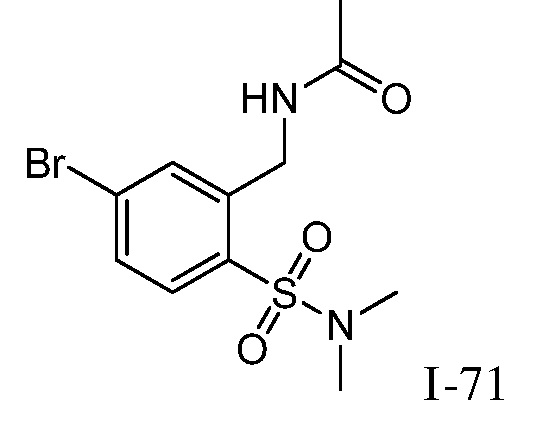
Стадия 1: N-(3-Бромбензилацетамид)ацетамид
Смесь (3-бромфенил)метанамина (5,4 г, 29 ммоль), AcCl (2,7 г, 29 ммоль) и Et3N (5,9 г, 58 ммоль) в ДХМ (100 мл) перемешивали при комнатной температуре в течение 3 ч, затем гасили водой (20 мл) и экстрагировали ДХМ (3×20 мл). Объединенные органические слои концентрировали в вакууме. Остаток перекристаллизовывали из смеси гексаны/EtOAc (10/1, 55 мл) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400 MГц): δ 7,40-7,36 (м, 2H), 7,20-7,15 (м, 2H), 6,01 (уш.с, 1H), 4,37 (д, J=6,0 Гц, 2H), 2,01 (с, 3H).
Стадия 2: 2-(Ацетамидометил)-4-бромбензол-1-сульфонилхлорид
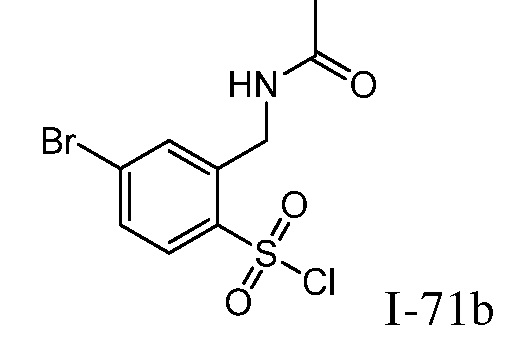
Смесь N-(3-бромбензил)ацетамида (0,45 г, 2,0 ммоль) в ClSO3H (1,64 г, 14 ммоль) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили путем осторожного добавления воды (20 мл) и затем экстрагировали ДХМ (20 мл × 3). Объединенные органические слои концентрировали в вакууме, и полученный остаток растирали в порошок при помощи ДХМ/Гекс. (1/25, 100 мл) с получением после фильтрации указанного в заголовке соединения, которое использовали на следующей стадии без дополнительной очистки.
Стадия 3: N-(5-бром-2-(N,N-диметилсульфамоил)бензил)ацетамид
К раствору 2-(ацетамидометил)-4-бромбензол-1-сульфонилхлорида (100 мг, 0,3 ммоль) в ДХМ (1 мл) добавляли диметиламина гидрохлорид (50 мг, 0,6 ммоль) и пиридин (0,13 г, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали в вакууме. Полученный остаток разбавляли ДХМ (20 мл). Дихлорметановый раствор промывали H2O (2×20 мл) и насыщенным раствором соли (20 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400 MГц): δ 7,81 (с, 1H), 7,67 (д, J=8,6 Гц, 1H), 7,55 (д, J=8,6 Гц, 1H), 6,43 (уш.с, 1H), 4,63 (д, J=6,6 Гц, 2H), 2,81 (с, 6H), 1,97 (с, 3H).
Промежуточный продукт 72
5-Бром-2-(трет-бутил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
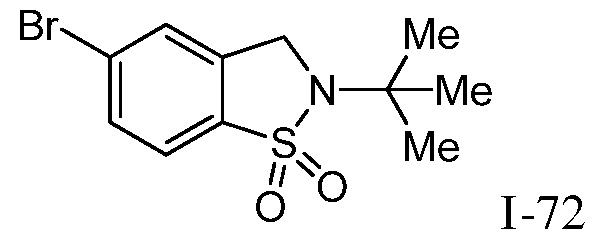
Стадия 1: 4-Бром-N-(трет-бутил)-2-метилбензолсульфонамид
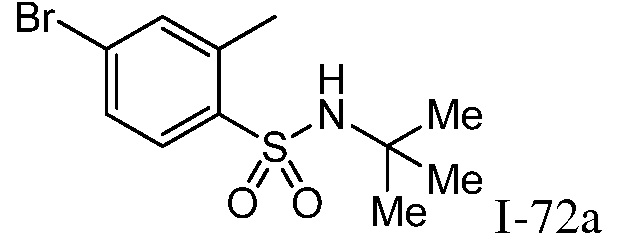
К раствору 4-бром-2-метилбензол-1-сульфонилхлорида (2,0 г, 7,4 ммоль) в CH2Cl2 (15 мл) добавляли раствор 2-метилпропан-2-амина (0,65 г, 8,9 ммоль) и триэтиламина (0,90 г, 8,9 ммоль) в CH2Cl2 (30 мл) при 0°С. Реакционную смесь перемешивали при 0°С в течение 2 ч, а затем при комнатной температуре в течение 16 часов. Смесь промывали HCl (0,1 М, 15 мл) и насыщенным водным раствором NaHCO3 (15 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,78 (д, J=8,4 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,59-7,56 (м, 2H), 2,57 (с, 3H), 1,09 (с, 9H).
Стадия 2: 5-Бром-2-(трет-бутил)бензо[d]изотиазол-3(2H)-он 1,1-диоксид
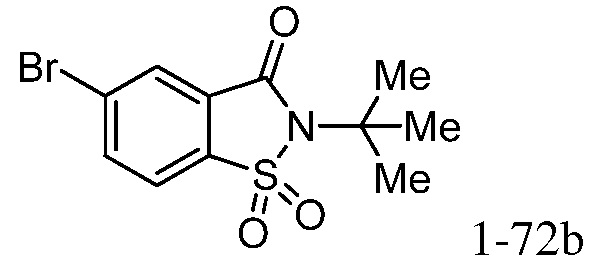
Смесь H5IO6 (5,9 г, 26 ммоль) в ацетонитриле (50 мл) перемешивали при комнатной температуре в течение 1 ч, затем добавляли CrO3 (33 мг, 0,33 ммоль) с последующим добавлением уксусного ангидрида (2,7 г, 26 ммоль). Полученный раствор охлаждали до 0°С, и к нему добавляли 4-бром-N-(трет-бутил)-2-метилбензолсульфонамид (1,0 г, 3,3 ммоль). После перемешивания при 0°С в течение 15 минут, реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов. Растворитель удаляли в вакууме, а остаток экстрагировали EtOAc (100 мл). Этилацетатный раствор промывали насыщенным водным раствором NaHCO3 (40 мл) и насыщенным раствором соли и сушили над Na2SO4. После фильтрования и концентрирования в вакууме остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/EtOAc = 20:1) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,82-8,14 (м, 3H), 1,66 (с, 9H).
Стадия 3: 5-Бром-2-(трет-бутил)-2,3-дигидро-бензо[d]изотиазол 1,1-диоксид
К раствору 5-бром-2-(трет-бутил)бензо[d]изотиазол-3(2Н)-она 1,1-диоксида (0,20 г, 0,63 ммоль) в ТГФ (4 мл) добавляли BH3.Me2S (240 мг, 3,00 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь гасили с помощью HCl (2,0 М; 15 мл), затем экстрагировали EtOAc (2×50 мл). Объединенные экстракты промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью препаративной ТСХ с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,83-7,56 (м, 3H), 4,55 (с, 2H), 1,46 (с, 9H).
Альтернативно, вышеописанная стадия 3 может быть проведена с использованием комплекса BH3-ТГФ в качестве восстановителя (и нагревания до ~75°C), чтобы осуществить восстановление карбонильной группы (как описано для промежуточного продукта 72, стадия 2).
Таблица 15 включает промежуточные продукты, которые получали аналогичным образом тому, как описано для промежуточного продукта 72.
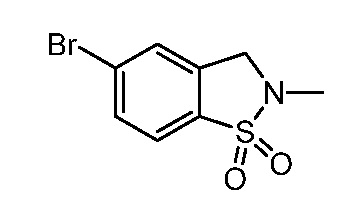
Промежуточный продукт 74
5-Бром-2-этил-2,3-дигидробензо[d]изотиазол 1,1-диоксид
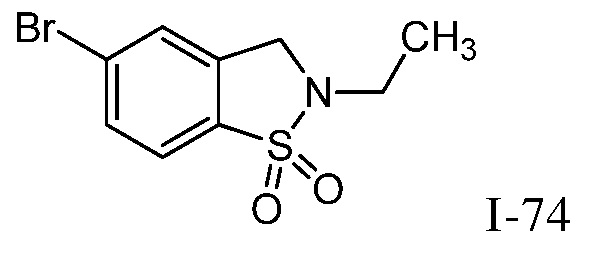
Стадия 1: 4-Бром-N-этил-2-метилбензолсульфонамид
В 100-мл 3-горлую круглодонную колбу помещали в раствор 4-бром-2-метилбензол-1-сульфонилхлорида (3,0 г, 9,7 ммоль) в дихлорметане (30 мл), этанамин (700 мг, 15,5 ммоль) и DIPEA (4,32 г, 29,1 ммоль). Полученный раствор перемешивали в течение 0,5 ч при 25°С. Смесь промывали водой (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (5:1 петролейный эфир/этилацетат) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3) δ: 7,47-7,51 (м, 2H), 7,84 (д, J=8,4 Гц, 1H), 2,99-3,06 (м, 2H), 2,66 (с, 3H), 1,13 (т, J=2,4 Гц, 3H).
Стадия 2: 5-Бром-2-этилбензо[d]изотиазол-3(2H)-он 1,1-диоксид
К раствору 4-бром-N-этил-2-метилбензол-1-сульфонамида (1,00 г, 3,59 ммоль) в 1,2-дихлорэтане (10 мл) добавляли йодбензола диацетат (3,50 г, 10,9 ммоль) и I2 (900 мг, 3,54 ммоль). Полученный раствор перемешивали в течение 16 ч при 60°С. Смесь промывали водой (100 мл) и водным раствором сульфита натрия (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью 5:1 петролейный эфир/этилацетат с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ: 7,70-7,79 (м, 1H), 7,97 (м, 1H), 8,18 (с, 1H), 3,84 (к, J=7,2 Гц, 2H), 1,45 (т, J=7,6 Гц, 3H).
Стадия 3: 5-Бром-2-этил-2,3-дигидробензо[d]изотиазол 1,1-диоксид
К раствору 5-бром-2-этилбензо[d]изотиазол-3(2Н)-она 1,1-диоксида (80 мг, 0,28 ммоль) в тетрагидрофуране (5 мл) добавляли BH3-S(Me)2 (2,0 М в ТГФ, 0,70 мл, 1,4 ммоль). Полученный раствор перемешивали в течение 4 ч при 70°С, а затем гасили добавлением воды со льдом (30 мл). Затем смесь экстрагировали этилацетатом (3×30 мл), и объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением неочищенного 5-бром-2-этил-2,3-дигидробензо[d]изотиазола 1,1-диоксида. МСНР (ИЭС) рассчитано для C9H11BrNO2S [M+H]+: 276, найдено 276. 1H ЯМР (300 MГц, CDCl3) δ: 7,77 (с, 2H), 7,57 (с, 1H), 4,34 (с, 2H), 3,21-3,41 (м, 2H), 1,38 (т, J=7,2 Гц, 3H).
Промежуточные продукты, описанные в таблице 16, получали аналогичным образом тому, как раскрыто для промежуточного продукта 74.
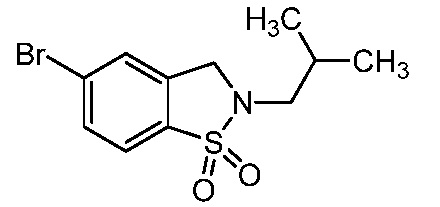
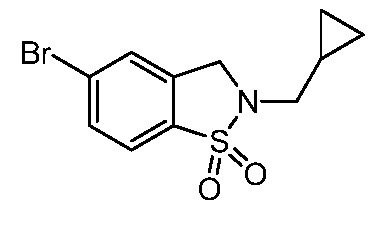
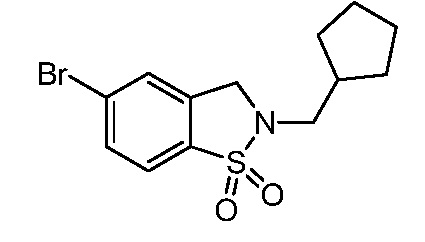
Промежуточный продукт 78
5-Бром-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
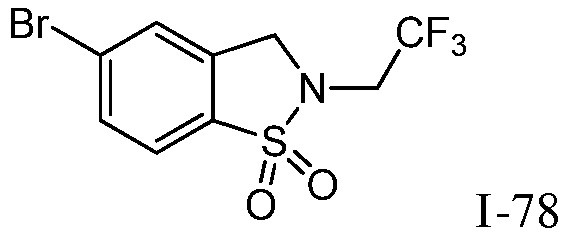
Стадия 1: 4-Бром-2-метил-N-(2,2,2-трифторэтил)бензолсульфонамид
Образование 4-бром-2-метил-N-(2,2,2-трифторэтил)бензолсульфонамида проводили аналогичным образом, как описано на стадии 1 способа получения I-74а.
Стадия 2: 5-Бром-2-(2,2,2-трифторэтил)бензо[d]изотиазол-3(2H)-он 1,1-диоксид
Смесь перйодной кислоты (1,12 г, 4,91 ммоль), 4-бром-2-метил-N-(2,2,2-трифторэтил)бензолсульфонамида (163 мг, 0,491 ммоль), триоксида хрома (9,8 мг, 0,098 ммоль) в ацетонитриле (5 мл) нагревали до кипения с обратным холодильником при 83°С в течение 2 ч. Реакционную смесь концентрировали в вакууме для удаления ацетонитрила. Затем добавляли воду, и смесь экстрагировали EtOAc (× 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3, а затем водным раствором Na2S2O3 и насыщенным раствором соли. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (5-15% EtOAc/гексаны) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 600MГц): δ 8,24 (д, J=1,2 Гц, 1H), 8,04 (дд, J=8,1, 1,8 Гц, 1H), 7,83 (д, J=8,4 Гц, 1H), 4,30 (к, J=8,4 Гц, 2H).
Стадия 3: 5-Бром-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
К смеси 5-бром-2-(2,2,2-трифторэтил)бензо[d]изотиазол-3(2Н)-она 1,1-диоксида (515 мг, 1,50 ммоль) в ТГФ (10 мл) добавляли BH3.ТГФ (1,0 М, 15,0 мл, 15,0 ммоль) и реакционную смесь нагревали в запаянной трубке при 75°С в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и гасили путем осторожного добавления реакционной смеси к смеси воды со льдом и ДХМ. Полученную двухфазную смесь перемешивали в течение 2 часов, затем экстрагировали ДХМ (× 3). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (EtOAc/гексаны: 5-30%) с получением целевого продукта с примесями. Продукт снова очищали хроматографией на силикагеле (EtOAc/гексаны: 0-20%) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 600MГц): δ 7,69 (уш.с, 2H), 7,58 (уш.с, 1H), 4,53 (с, 2H), 3,82 (к, J=9,0 Гц, 2H).
Промежуточный продукт 79
5-Бром-2-(3-гидрокси-2,2-диметилпропил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
Стадия 1: 5-Бром-2-(3-гидрокси-2,2-диметилпропил)бензо[d]изотиазол-3(2H)-он 1,1-диоксид
К перемешиваемому раствору 5-бром-2,3-дигидро-1,2-бензотиазол-1,1,3-триона (0,10 г, 0,38 ммоль) в N-метил-2-пирролидоне (3 мл) добавляли 3-бром-2,2-диметилпропан-1-ол (0,19 г, 1,2 ммоль) с последующим добавлением карбоната цезия (0,37 г, 1,1 ммоль). Полученную реакционную смесь перемешивали в течение 16 ч при 130°С. Реакционную смесь охлаждали до комнатной температуры и гасили добавлением воды (10 мл). Полученную смесь экстрагировали этилацетатом (2×20 мл). Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью 1:1 этилацетат/петролейный эфир с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C12H15BrNO4S [M + H]+: 348, 350 (1:1), найдено: 348, 350 (1:1).
Стадия 2: 5-Бром-2-(3-гидрокси-2,2-диметилпропил)-2,3-дигидро-1,2-бензотиазол-1,1-дион
К перемешиваемому раствору 5-бром-2-(3-гидрокси-2,2-диметилпропил)бензо[d]изотиазол-3(2Н)-она 1,1-диоксида (0,20 г, 0,57 ммоль) в тетрагидрофуране (5,0 мл) добавляли раствор боран-диметилсульфида (1,40 мл, 2,0 М в тетрагидрофуране, 2,8 ммоль). Полученный раствор перемешивали в течение 2 ч при 75°С. Реакцию останавливали путем осторожного добавления воды/льда (10 мл). Полученную смесь экстрагировали этилацетатом (2×30 мл). Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали на силикагеле, элюируя смесью 1:1 этилацетат/петролейный эфир с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C12H17BrNO3S [M + H]+: 334, 336 (1:1), найдено 334, 336 (1:1).
Таблица 17 раскрывает промежуточный продукт, который получали с применением аналогичных процедур, как описано выше для промежуточного продукта 79.
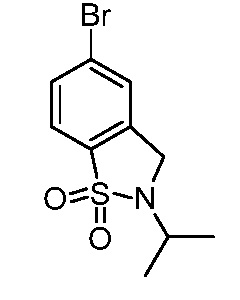
Промежуточный продукт 81
5-Бром-2-(2-метоксиэтил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
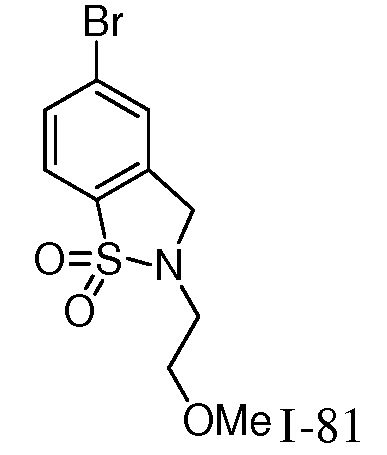
К перемешиваемому раствору 5-бром-2,3-дигидро-1,2-бензотиазол-1,1-диона (0,20 г, 0,81 ммоль) в N,N-диметилформамиде (5 мл) добавляли 1-бром-2-метоксиэтан (0,13 г, 0,96 ммоль) и карбонат цезия (0,39 г, 1,2 ммоль). Реакционную смесь перемешивали в течение 4 ч при 50°С, а затем гасили водой (20 мл). Смесь экстрагировали этилацетатом (2×30 мл), органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (1/1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C10H12BrNO3S [M+H]+: 306, найдено 306.
Таблица 18 раскрывает промежуточные продукты, полученные с применением аналогичных процедур, как описано для промежуточного продукта 81, исходя из соответствующего бензотиазола или бромизоиндолинона и алкилирующего агента. В некоторых случаях, общую процедуру модифицировали использованием в качестве альтернативы от 1,0 до 1,5 эквивалентов основания CsCO3 или NaH.
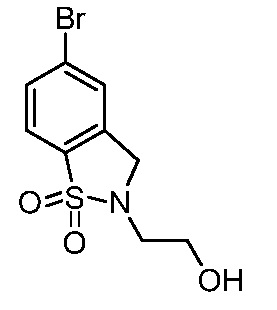
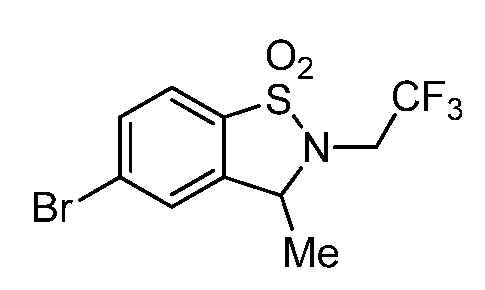
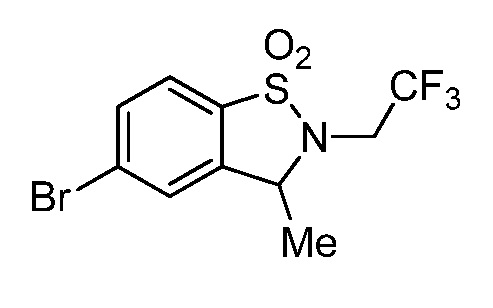
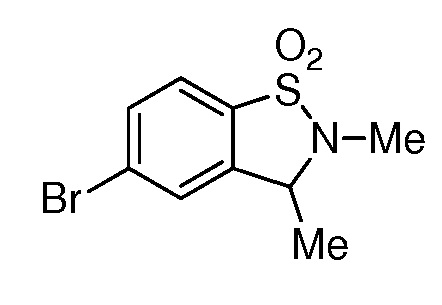
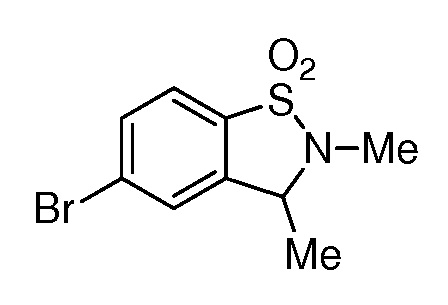
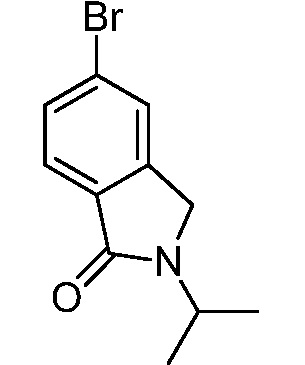
Промежуточный продукт 89
5-Бром-2-(4-гидрокси-2-метилбутан-2-ил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
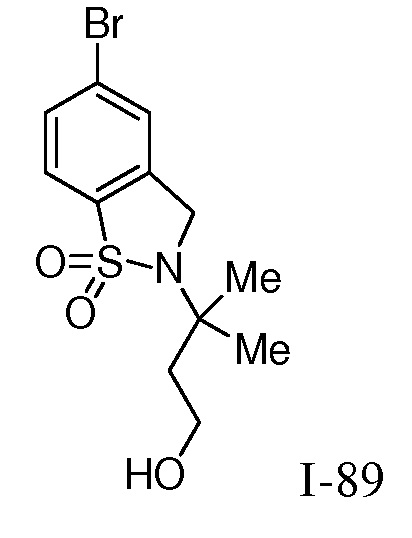
Стадия 1: Этил 3-(4-бром-2-метилфенилсульфонамидо)-3-метилбутаноат
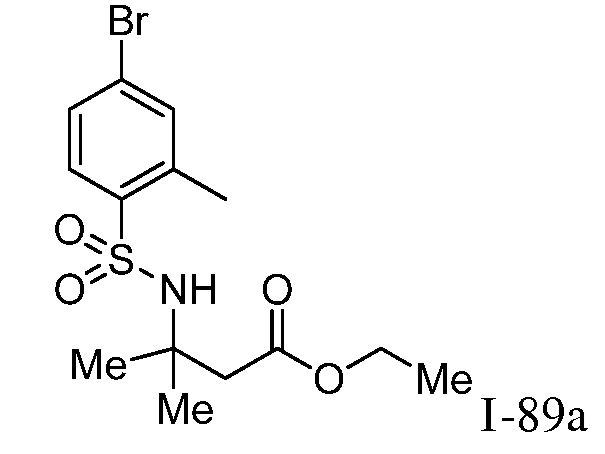
К 4-бром-2-метилбензол-1-сульфонилхлориду (2,00 г, 7,42 ммоль) в дихлорметане (40 мл) добавляли этил-3-амино-3-метилбутаноат гидрохлорид (1,62 г, 8,92 ммоль) и триэтиламин (1,88 г, 18,6 ммоль). Полученный раствор перемешивали в течение 4 ч при комнатной температуре, затем концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/петролейный эфир: 1/1) с получением указанного в заголовке соединения.
Стадия 2: Этил-3-(5-бром-1,1-диоксидо-3-оксобензо[d]изотиазол-2(3Н)-ил)-3-метилбутаноат
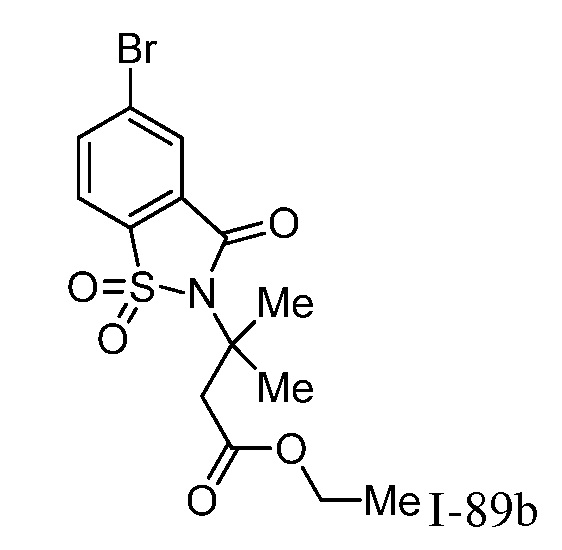
К этил-3-(4-бром-2-метилфенилсульфонамидо)-3-метилбутаноату (0,50 г, 1,3 ммоль) в ацетонитриле (100 мл) добавляли перйодную кислоту (2,40 г, 10,5 ммоль) и триоксид хрома (26 мг, 0,26 ммоль). Полученную смесь перемешивали в течение 4 ч при комнатной температуре. Твердые вещества удаляли путем фильтрации, и фильтрат концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (1/1) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 8,15 (д, J=1,8 Гц, 1H), 7,96 (дд, J=8,1, 1,8 Гц, 1H), 7,71 (д, J=8,1 Гц, 1H), 4,08 (к, J=7,2 Гц, 2H), 3,12 (с, 2H), 1,88 (с, 6H), 1,12 (т, J=7,2 Гц, 3H).
Стадия 3: 5-Бром-2-(4-гидрокси-2-метилбутан-2-ил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
К этил 3-(5-бром-1,1-диоксидо-3-оксобензо[d]изотиазол-2(3Н)-ил)-3-метилбутаноату (0,20 г, 0,51 ммоль) в тетрагидрофуране (5 мл) добавляли боран-метилсульфидный комплекс (0,25 мл, 10 М в тетрагидрофуране, 2,50 ммоль). Полученный раствор перемешивали в течение 16 ч при 50°С и осторожно гасили с помощью воды со льдом (10 мл). Смесь экстрагировали этилацетатом (3×30 мл), и объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/петролейный эфир: 1/1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C12H17BrNO3S [M + H]+: 334, 336 (1:1), найдено: 334, 336 (1:1).
Таблица 19 раскрывает промежуточный продукт, полученный с применением аналогичных процедур, как описано для промежуточного продукта 89.
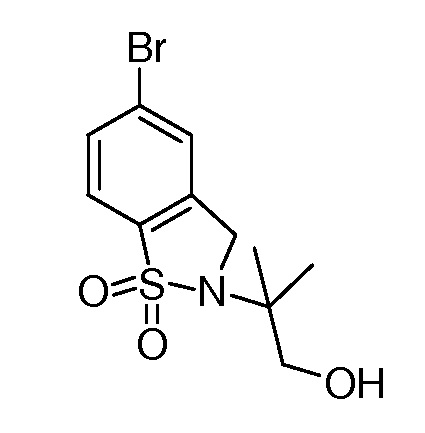
Промежуточный продукт 91
трет-Бутил-2-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)-2-метилпропаноат
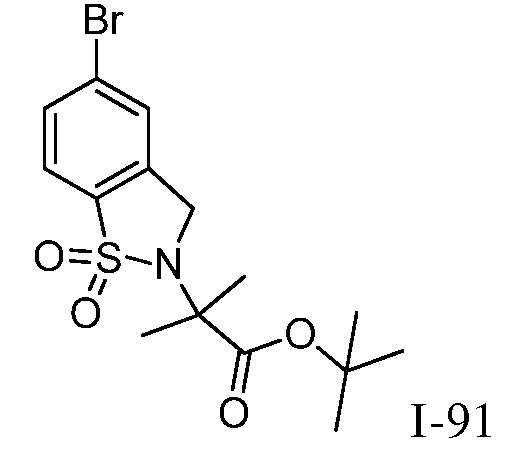
Стадия 1: трет-Бутил-2-(4-бром-2-метилфенилсульфонамидо)-2-метилпропаноат
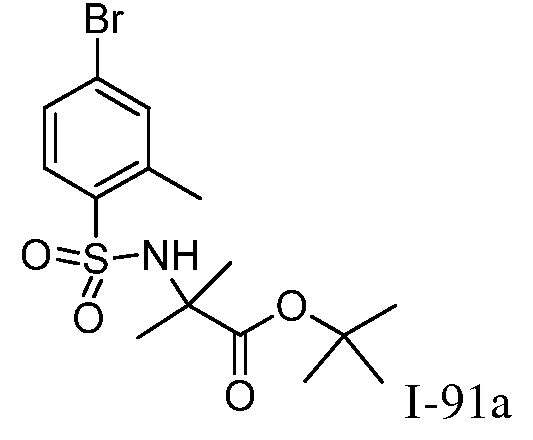
В 100-мл круглодонную колбу помещали 4-бром-2-метилбензол-1-сульфонилхлорид (4,00 г, 14,8 ммоль) в дихлорметане (40 мл), трет-бутил-2-амино-2-метилпропаноат гидрохлорид (3,47 г, 17,8 ммоль) и триэтиламин (3,74 г, 37,0 ммоль). Полученный раствор перемешивали в течение 4 ч при комнатной температуре. Смесь концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:1) с получением трет-бутил-2-(4-бром-2-метилфенилсульфонамидо)-2-метилпропаноата. МСНР (ИЭС) рассчитано для C15H23BrNO4S [M + H]+: 392, 394 (1:1), найдено 392, 394 (1:1).
Стадия 2: трет-Бутил-2-(4-бром-2-(бромметил)фенилсульфонамидо)-2-метилпропаноат
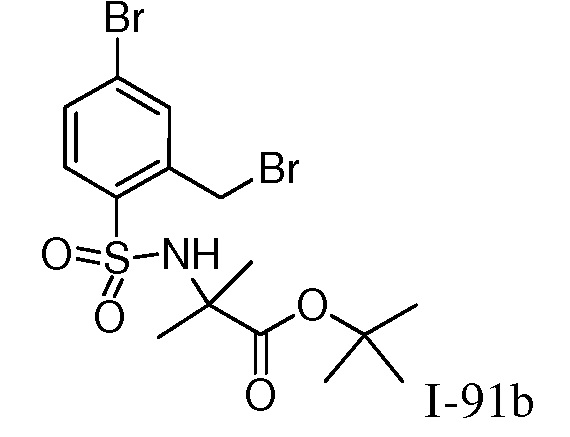
В 250-мл круглодонную колбу помещали трет-бутил-2-(4-бром-2-метилфенилсульфонамидо)-2-метилпропаноат (3,00 г, 7,68 ммоль) в четыреххлористом углероде (100 мл), N-бромсукцинимид (2,04 г, 11,4 ммоль) и добавляли перекись бензоила (0,19 г, 0,76 ммоль) при 80°С. Полученный раствор перемешивали в течение 24 ч при 80°С. Полученный раствор концентрировали в вакууме, и добавляли воду (30 мл). Смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C15H22Br2NO4S [M + H]+: 470, 472 (1:1), найдено 470, 472 (1:1).
Стадия 3: трет-Бутил-2-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-2-метилпропаноат
В 250-мл круглодонную колбу помещали трет-бутил-2-(4-бром-2-(бромметил)фенилсульфонамидо)-2-метилпропаноат (3,10 г, 6,35 ммоль) и бикарбонат натрия (1,07 г, 12,7 ммоль) в смеси ацетонитрил/вода (5:1, 30 мл). Полученный раствор перемешивали в течение 3 ч при 75°С, а затем концентрировали в вакууме. Добавляли воду (30 мл), и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:3) с получением трет-бутил-2-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-2-метилпропаноата. МСНР (ИЭС) рассчитано для C15H21BrNO4S [M + H]+: 390, 392 (1:1), найдено 390, 392 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,64 (с, 1H), 7,53 (м, 2H), 4,75 (с, 2H), 1,77 (с, 6H), 1,38 (с, 9H).
Таблица 20 раскрывает промежуточные продукты, которые были получены аналогичным образом, что и промежуточный продукт 91 с использованием соответствующего амина.
Промежуточный продукт 95
трет-Бутил-3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)-3-метилбутаноат
Стадия 1: 3-(5-Бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)-3-метилбутановая кислота
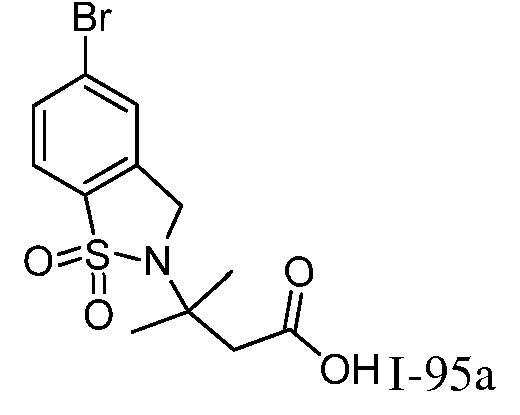
В 50-мл круглодонную колбу помещали 5-бром-2-(4-гидрокси-2-метилбутан-2-ил)-2,3-дигидро-бензо[d]изотиазол-1,1-диоксид (I-89; 0,35 г, 1,05 ммоль) и дихлорметан (2 мл). Добавляли реагент Джонса (0,60 мл, 1,57 ммоль), и реакционную смесь перемешивали в течение 10 минут при -5°С. Добавляли воду (50 мл), и смесь экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой (2×30 мл) и насыщенным раствором соли (2×30 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (1:3) с получением 3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-3-метилбутановой кислоты. МСНР (ИЭС) рассчитано для C12H15BrNO4S [M + H]+: 348, 350 (1:1), найдено 348, 350 (1:1).
Стадия 2: трет-Бутил-3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-3-метилбутаноат
В 10-мл круглодонную колбу помещали 3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-3-метилбутановую кислоту (0,28 г, 0,80 ммоль), трет-бутил-2,2,2-трихлорацетимидат (8,79 г, 40,2 ммоль) и дихлорметан (2 мл). Смесь перемешивали в течение 72 ч при комнатной температуре, а затем гасили водой (10 мл). Смесь экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой (2×30 мл) и насыщенным раствором соли (2×30 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (1:5) с получением трет-бутил-3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)-3-метилбутаноата. МСНР (ИЭС) рассчитано для C16H23BrNO4S [M + H]+: 404, 406 (1:1), найдено 404, 406 (1:1).
Промежуточный продукт 96
5-Бром-2-(3-метокси-2,2-диметилпропил)-2,3-дигидробензо[d]изотиазол 1,1-диоксид
В 100-мл круглодонной колбе 5-бром-2-(3-гидрокси-2,2-диметилпропил)-2,3-дигидро-1,2-бензотиазол-1,1-дион (I-79; 0,14 г, 0,42 ммоль) объединяли с ДХМ (40 мл) и триметилоксония тетрафторборатом (0,25 г, 1,7 ммоль) при температуре окружающей среды. Полученную смесь перемешивали в течение 16 часов, затем гасили водой (30 мл). Полученную смесь экстрагировали EtOAc (3×30 мл), и объединенные органические слои концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью EtOAc/петролейный эфир (1:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H19BrNO3S [M + H]+: 348, 350 (1:1), найдено 348, 350 (1:1).
Таблица 21 раскрывает промежуточные продукты, полученные с применением аналогичных процедур, как описано для промежуточного продукта 96.
Промежуточный продукт 99
5-Бром-2,3-дигидробензо[b]тиофен 1,1-диоксид
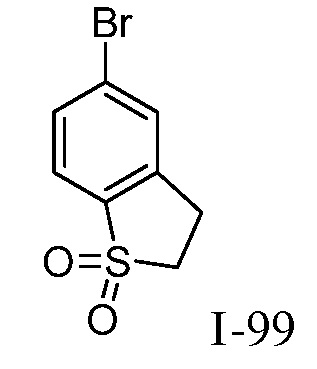
К раствору 5-бром-бензо[b]тиофена 1,1-диоксида (1,00 г, 4,08 ммоль) в этаноле (14 мл) при 0°С добавляли боргидрид натрия (193 мг, 5,10 ммоль). Полученную реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем охлаждали до 0°C и гасили с помощью HCl (1N). Смесь разбавляли этилацетатом (25 мл), слои разделяли и водный слой экстрагировали этилацетатом (3×25 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/этилацетат 5:1) с получением указанного в заголовке соединения. 1H ЯМР (500 MГц, CDCl3): δ 7,62 - 7,53 (м, 2H), 7,51 (с, 1H), 3,55 - 3,45 (м, 2H), 3,39 - 3,29 (м, 2H).
Промежуточный продукт 100
1-((4-Бромбензил)сульфонил)пирролидин
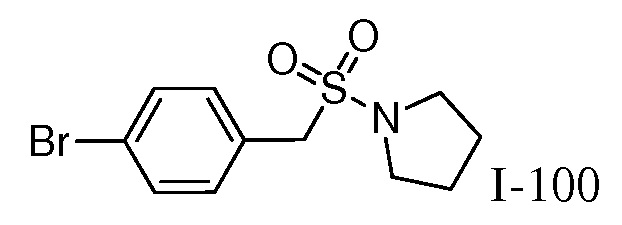
Стадия 1: (4-Бромфенил)метансульфонат натрия
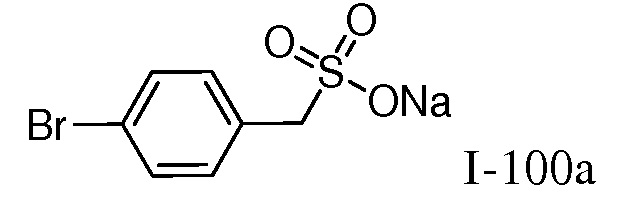
К кипящему раствору 1-бром-4-(бромметил)бензола (200 г, 0,8 моль) в EtOH (500 мл) добавляли раствор сульфита натрия (101 г, 0,80 моль) в H2O (500 мл) в течение 60 минут. Полученную реакционную смесь перемешивали при кипячении с обратным холодильником в течение 2 ч, затем смесь охлаждали до 0°С и перемешивали в течение 30 минут. Смесь фильтровали, и твердое вещество промывали EtOH и сушили в вакууме с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, D2O) δ: 7,50 (д, 2H), 7,20 (д, 2H), 4,05 (с, 2H).
Стадия 2: (4-Бромфенил)метансульфонихлорид
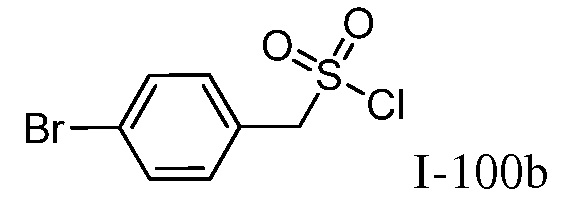
К интенсивно перемешиваемой суспензии (4-бромфенил)метансульфоната натрия (167 г, 0,611 моль) в ДМФА (650 мл) при -10°С по каплям добавляли тионилдихлорид (162 мл, 2,23 моль). Полученный реакционный раствор перемешивали при комнатной температуре в течение 2 ч, затем выливали в лед при интенсивном перемешивании. Смесь фильтровали, и полученное твердое вещество растворяли в EtOAc, затем промывали H2O и насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ: 7,66 (д, 2H), 7,39 (д, 2H), 4,87 (с, 2H).
Стадия 3: 1-((4-бромбензил)сульфонил)пирролидин
К перемешиваемой смеси карбоната калия (74,8 г, 0,542 моль) в ДХМ (70 мл) и H2O (220 мл) при -10°С порциями добавляли пирролидин (21,2 г, 0,298 моль), и полученную смесь перемешивали в течение 20 минут. Затем добавляли по каплям (4-бромфенил)метансульфонилхлорид (73,0 г, 0,271 моль) в ДХМ (400 мл). Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Органическую фазу отделяли, промывали H2O, насыщенным раствором соли, сушили над Na2SO4 и концентрировали в вакууме. Остаток перекристаллизовывали из 5% EtOAc/петролейного эфира с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ: 7,52 (д, 2H), 7,25 (д, 2H), 4,20 (с, 2H), 3,20-3,30 (м, 4H), 1,80-1,92 (м, 4H).
Промежуточный продукт 101
(+) 4-(3-Бромефенил)-2,2,4-триметил-1,3-диоксолан
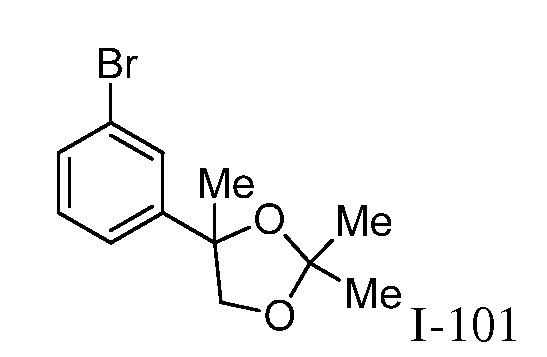
Стадия 1: 1-Бром-3-(проп-1-ен-2-ил)бензол
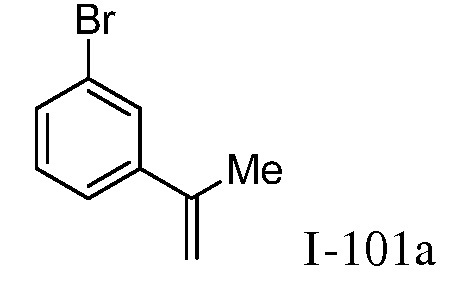
К суспензии Ph3PMeBr (21,4 г, 60,0 ммоль) в ТГФ (500 мл) добавляли трет-BuOK (6,72 г, 60,0 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. К смеси по каплям добавляли 1-(4-бромфенил)этанон (10,0 г, 50,0 ммоль) при 0°С, затем смесь перемешивали в течение 24 ч. Добавляли Н2О (300 мл), и смесь экстрагировали EtOAc (300 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (300 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 20:1) с получением 1-бром-4-(проп-1-ен-2-ил)бензола.
Стадия 2: 2-(3-Бромефенил)пропан-1,2-диол
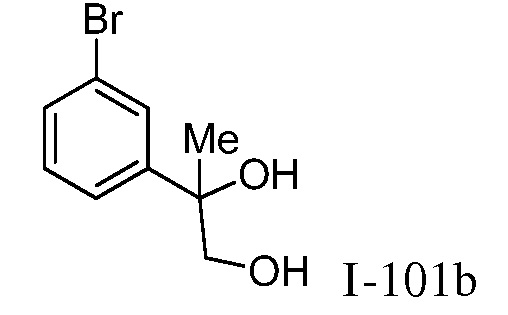
К раствору 1-бром-3-(проп-1-ен-2-ил)бензола (10,0 г, 50,7 ммоль) при 0°С добавляли смесь K2OsO4.2H2O (930 мг, 2,50 ммоль), K3Fe(CN)6 (83,0 г, 230 ммоль) и K2CO3 (21,0 г, 150 ммоль) в трет-BuOH (300 мл) и H2O (300 мл). Реакционную смесь гасили добавлением насыщенного водного раствтора Na2S2O3 (200 мл) и экстрагировали EtOAc (500 мл). Органический слой промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением рацемата указанного в заголовке соединения.
Стадия 3: 4-(3-бромфенил)-2,2,4-триметил-1,3-диоксолан
Суспензию 2-(4-бромфенил)пропан-1,2-диола (6,0 г, 26 ммоль), 2,2-диметоксипропана (6 мл) и TsOH (1,1 г, 6,5 ммоль) в толуоле (100 мл) перемешивали в течение ночи при комнатной температуре. Смесь гасили Н2О и экстрагировали EtOAc. Органический слой промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали в вакууме с получением рацемата указанного в заголовке соединения. 1H ЯМР (CDCl3, 400 MГц): δ 7,56 (с, 1H), 7,56-7,20 (м, 3H), 4,08-4,06 (м, 2H) , 1,59-1,39 (м, 6H), 1,39 (д, J=5,2 Гц, 3H).
Промежуточный продукт 102
4-Бром-2-(гидроксиметил)бензолсульфонамид
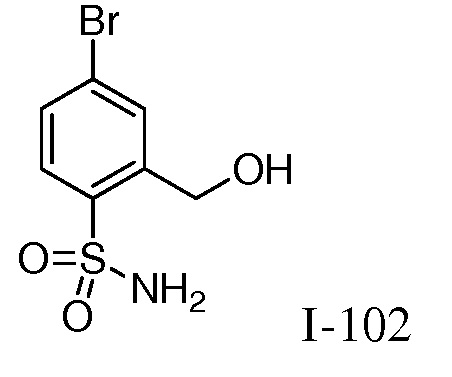
Стадия 1: 4-Бром-2-метилбензолсульфонамид
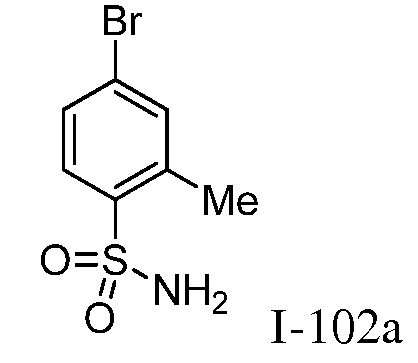
Хлорсульфоновую кислоту (63,0 г, 540 ммоль) медленно добавляли к охлажденному раствору (0°С) 1-бром-3-метилбензола (10 г, 58 ммоль) в CHCl3 (100 мл). Реакционную смесь оставляли перемешиваться в течение 2 ч при 0°С. Реакционную смесь осторожно выливали в ледяную воду (400 мл) и экстрагировали EtOAc (500 мл). Слои разделяли, и органический слой промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт растворяли в ТГФ (100 мл) и охлаждали до 0°С, затем к раствору добавляли NH3/H2O (25%, 150 мл). Смесь перемешивали при той же температуре в течение 4 часов. Реакционную смесь экстрагировали EtOAc (200 мл × 2), и объединенные органические слои промывали водой (2×200 мл) и насыщенным раствором соли (100 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 4-бром-2-метилбензолсульфонамида. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,76 (д, J=8,4 Гц, 1H), 7,64 (с, 1H), 7,59 (дд, J=8,4, 2,0 Гц, 1H), 7,48 (уш.с, 2H), 2,58 (с, 3H).
Стадия 2: N-((4-Бром-2-метилфенил)сульфонил)ацетамид
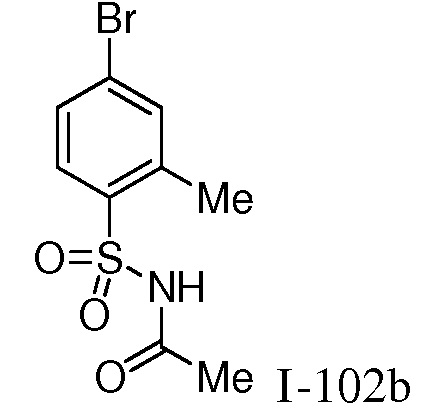
К раствору 4-бром-2-метилбензолсульфонамида (7,0 г, 28 ммоль) в пиридине (70 мл) добавляли Ас2О (5,7 г, 56 ммоль) с последующим добавлением DMAP (1,0 г, 8,4 ммоль). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре, а затем гасили насыщенным водным раствором NH4Cl и H2O. Полученную смесь экстрагировали EtOAc (200 мл × 2). Объединенные органические слои промывали HCl (1,0 М, 30 мл) и насыщенным растовром соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который перекристаллизовывали из EtOAc с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 12,26 (уш.с, 1H), 7,85 (д, J=8,4 Гц, 1H), 7,69-7,63 (м, 2H), 2,57 (с, 3H), 1,95 (с, 3H).
Стадия 3: 4-бром-2-(гидроксиметил)бензолсульфонамид
К раствору N-((4-бром-2-метилфенил)сульфонил)ацетамида (0,50 г, 1,7 ммоль) в водном растворе NaOH (1,0 М, 24 мл) добавляли KMnO4 (2,7 г, 17 ммоль), и реакцию оставляли протекать при 80°С при перемешивании в течение 16 часов. Реакцию останавливали ацетоном. Полученное нерастворимое вещество удаляли фильтрованием, и фильтрат разбавляли H2O и подкисляли до рН = 3 с помощью HCl (1,0 M). Смесь экстрагировали EtOAc (100 мл). Органический слой промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 2-(N-ацетилсульфамоил)-5-бромбензойной кислоты, которую переносили на восстановление без дополнительной очистки. К раствору 5-бром-2-сульфамоилбензойной кислоты (0,14 г, 0,53 ммоль) в ТГФ (5 мл) добавляли BH3.Me2S (160 мг, 2,10 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 часов, охлаждали до комнатной температуры, затем осторожно гасили с помощью водной HCl (2,0 М) до рН = 3. Полученную смесь экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ТСХ с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,87-7,85 (м, 1H), 7,72 (д, J=8,4 Гц, 1H),7,63 (дд, J=8,4, 2,0 Гц, 1H), 7,29 (с, 2H), 5,56 (т, J=5,6 Гц, 1H), 4,85 (д, J=5,6 Гц, 2H).
Промежуточный продукт 103
4-(Бензилокси)-2-(5-хлор-2-(метилсульфонил)фенил)бутан-2-ол
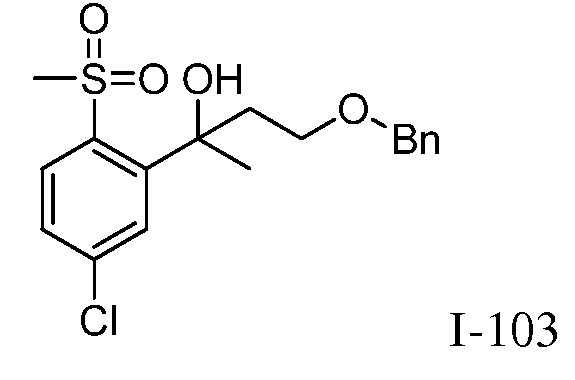
Стадия 1: (2-Бром-4-хлофенил)(метил)сульфан
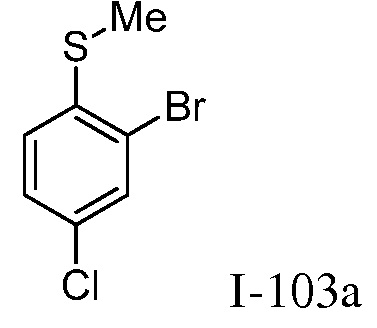
Раствор 2-бром-4-хлор-1-фторбензола (2,5 мл, 20 ммоль) и тиометоксида натрия (1,45 г, 20,7 ммоль) в ДМФА (20 мл) перемешивали при 100°С в течение 2 ч. Реакционную смесь добавляли в воду (20 мл) при перемешивании, и водную смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/EtOAc: 20/1) с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, ДМСО-d6): δ 7,74 (д, J=8,6, 2,3 Гц, 1H), 7,49 (дд, J=8,6, 2,3 Гц, 1H), 7,28 (д, J=8,6 Гц, 1H), 2,51 (м, 3H).
Стадия 2: 4-(Бензилокси)-2-(5-хлор-2-(метилтио)фенил)бутан-2-ол
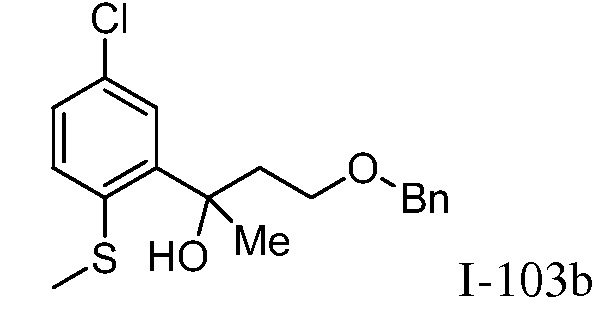
К раствору в ТГФ комплекса изопропилмагнийхлорид-хлорид лития (1,0 М, 2,43 мл, 3,16 ммоль) в высушенной в сушильном шкафу пробирке добавляли по каплям (2-бром-4-хлорфенил)(метил)сульфан (500 мг, 2,11 ммоль; высушенный путем прохождения через слой чистого сульфата магния) в атмосфере аргона при 0°С. Ледяную баню удаляли, и пузырек оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Добавляли по каплям 4-(бензилокси)бутан-2-ол (1,12 г, 6,31 ммоль) в охлажденную реакционную смесь. Полученную реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи, затем концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/EtOAc: 10/1) с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, ДМСО-d6): δ 7,55 (д, J=2,4 Гц, 1H), 7,27-7,20 (м, 5H), 7,18 (д, J=7,4 Гц, 2H), 5,23 (с, 1H), 4,29 (с, 2H), 3,43-3,39 (м, 1H), 3,17-3,12 (м, 1H), 2,40 (с, 3H), 2,55-2,50 (м, 1H); 2,16-2,12 (м, 1H), 1,55 (с, 3H).
Стадия 3: 4-(Бензилокси)-2-(5-хлор-2-(метилсульфонил)фенил)бутан-2-ол
К раствору 4-(бензилокси)-2-(5-хлор-2-(метилтио)фенил)бутан-2-ола (297 мг, 0,880 ммоль) в CH2Cl2 (7 мл), охлажденному на ледяной бане, добавляли мета-хлорпероксибензойную кислоту (380 мг, 2,20 ммоль). После перемешивания при комнатной температуре в течение ночи, реакционную смесь разбавляли CH2Cl2 (5 мл) и промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/EtOAc: 20-30%) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C18H22ClO4S[M+H]+: 369, найдено 369. 1H ЯМР (600 MГц, ДМСО-d6): δ 8,08 (д, J=8,7 Гц, 1H), 7,65 (д, J=2,2 Гц, 1H), 754 (дд, J=8,7, 2,2 Гц, 1H), 7,24-7,25 (м, 3H), 7,16 (д, J=7,5 Гц, 2H), 5,47 (с, 1H), 4,29-4,30 (м, 2H), 3,46-3,43 (дт, J=9,7, 6,8 Гц, 1H), 3,37-3,33 (дт, J=9,7, 6,8 Гц, 1H), 3,32 (с, 3H), 2,43-2,38 (дт, J=14,0, 6,8 Гц, 1H), 2,18-2,15 (дт, J=14,0, 6,8 Гц, 1H), 1,60 (с, 3H).
Таблица 22 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 103.
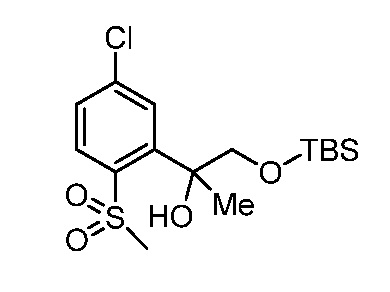
Промежуточный продукт 105
6-Хлор-4-гидрокси-4-(гидроксиметил)тиохроман 1,1-диоксид
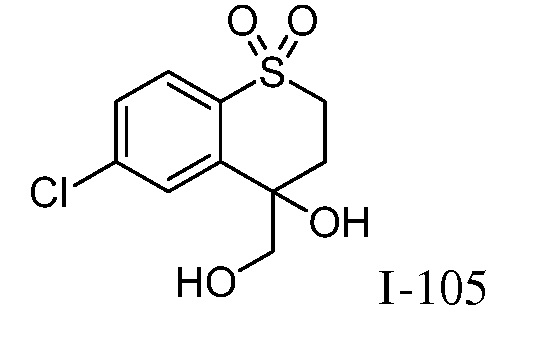
Стадия 1: 6-Хлор-4-гидрокси-4-((изопропоксидиметилсили)метил)тихроман 1,1-диоксид
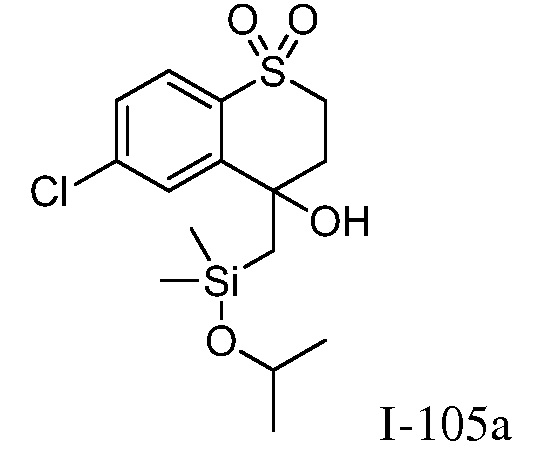
В трехгорлую круглодонную колбу загружали магниевую стружку (71,1 мг, 2,93 ммоль), которую сушили тепловой пушкой при быстром токе N2. После охлаждения до комнатной температуры, скорость потока N2 снижали, и добавляли 1 мл раствора 6-хлор-4-гидрокси-4-((изопропоксидиметилсили)метил)тиохроман 1,1-диоксида (470 мг, 2,82 ммоль) в сухом ТГФ (3,5 мл) и две капли 1,2-дибромэтана (2,0 мкл, 0,022 ммоль). Смесь перемешивали при комнатной температуре, и в течение нескольких минут начиналась экзотермическая реакция. Медленно добавляли оставшийся раствор при комнатной температуре. После того, как добавление было завершено, реакционную смесь перемешивали при комнатной температуре. Смесь охлаждали до 0°С, и раствор 6-хлортиохроман-4-он 1,1-диоксида (500 мг, 2,17 ммоль) в ТГФ (2,0 мл) добавляли по каплям при 0°С, затем нагревали до комнатной температуры в течение ночи. Полученную смесь гасили раствором хлорида аммония (10% водный) и экстрагировали этилацетатом (3×5 мл). Объединенные органические слои промывали насыщенным раствором соли (3×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения, которое далее использовали без дополнительной очистки.
Стадия 2: 6-хлор-4-гидрокси-4-(гидроксиметил)тиохроман 1,1-диоксид
К неочищенной смеси 6-хлор-4-гидрокси-4-((изопропоксидиметилсилил)метил)тиохроман 1,1-диоксида (392 мг, 1,08 ммоль), фторида калия (62,7 мг, 1,08 ммоль) в ТГФ (0,5 мл) и метанола (0,5 мл) добавляли перекись водорода (30%; 0,29 мл, 3,24 ммоль) в виде одной порции при комнатной температуре. Полученный мутный раствор выдерживали, обеспечивая перемешивание, при температуре меньше 50°С и при комнатной температуре в течение 2 ч. Реакционную смесь гасили водным раствором тиосульфата натрия, экстрагировали этилацетатом (3×5 мл) и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью 0-100% гексаны/EtOAc с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, ДМСО-d6): δ 7,74 (д, J=8,5 Гц, 1H), 7,65 (д, J=2,2 Гц, 1H), 7,58 (дд, J=8,5, 2,2 Гц, 1H), 5,10 (т, J=5,8 Гц, 1H), 3,68-3,62 (м, 2H), 3,54-3,50 (ддд, J=14,2, 8,3, 2,8 Гц, 1H), 3,46-3,42 (дд, J=11,3, 5,4 Гц, 1H), 2,62-2,56 (ддд, J=14,8, 8,3, 2,8 Гц, 1H), 2,36-2,28 (м, 1H) (обратите внимание: невозможно установить один гидроксильный протон; вероятно, из-за перекрывания с пиками растворителя).
Промежуточный продукт 106
Метил 5-бром-2,3-дигидро-1H-инден-2-карбоксилат
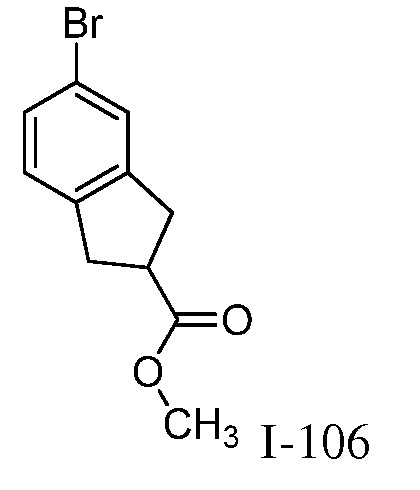
Стадия 1: Метил 6-бром-1-оксо-2,3-дигидро-1H-инден-2-карбоксилат
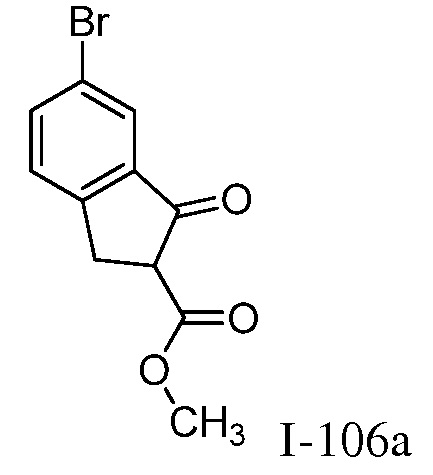
В продуваемую и поддерживаемую в инертной атмосфере азота 50-мл круглодонную колбу помещали раствор 5-бром-2,3-дигидро-1Н-инден-1-она (1,00 г, 4,74 ммоль) в тетрагидрофуране (15 мл). Добавляли гидрид натрия (0,38 г, 60% в минеральном масле, 9,48 ммоль) с последующим добавлением диметилкарбоната (0,90 г, 10 ммоль). Полученную смесь перемешивали в течение 30 минут при 50°С, затем гасили добавлением соляной кислоты (20 мл, 1,0 М). Полученную смесь экстрагировали этилацетатом (2×50 мл). Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H10BrO3 [M + H]+: 269, 271 (1:1), найдено 269, 271 (1:1).
Стадия 2: Метил 5-бром-2,3-дигидро-1Н-инден-2-карбоксилат
В продуваемую и поддерживаемую в инертной атмосфере азота 25-мл круглодонную колбу помещали раствор метил 6-бром-1-оксо-2,3-дигидро-1Н-инден-2-карбоксилата (0,70 г, 2,6 ммоль) в трифторуксусной кислоте (10 мл). Добавляли по каплям триэтилсилан (4 мл) при 0°С, и полученный раствор перемешивали в течение 18 ч при 10°С. Реакционную смесь концентрировали в вакууме и полученный остаток разбавляли этилацетатом (50 мл) и промывали водой (100 мл). Органический слой концентрировали в вакууме с получением указанного в заголовке соединения. GCMS (ИЭС) рассчитано для C11H11BrO2 [M]+: 254, найдено 254.
Промежуточный продукт 107
1-([3-Бром-5-[(метилсульфанил)метил]фенил]метил)-1H-1,2,3-триазол
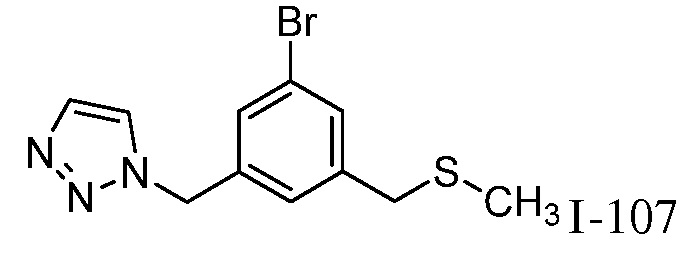
Стадия 1: 1-Бром-3,5-бис(бромметил)бензол
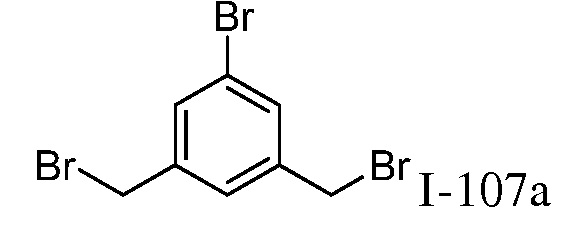
К перемешиваемому раствору 1-бром-3,5-диметилбензола (5,00 г, 27,0 ммоль) в ацетонитриле (80 мл) добавляли AIBN (0,045 г, 0,27 ммоль) и N-бромсукцинимид (7,20 г, 40,5 ммоль). Реакционную смесь перемешивали в течение 1 ч при 80°С, а затем гасили путем добавления водного раствора хлорида аммония (300 мл). Полученный раствор экстрагировали этилацетатом (100 мл × 3). Органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/петролейный эфир: 1/100) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,70 (с, 2H), 7,64 (с, 1H), 4,70 (с, 4H).
Стадия 2: (3-Бром-5-(бромметил)бензил)(метил)сульфан
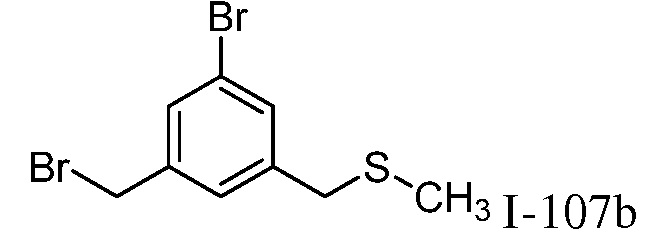
1-Бром-3,5-бис(бромметил)бензол (0,500 г, 1,46 ммоль), (метилсульфанил)натрий (0,102 г, 1,46 ммоль) и этанол (10 мл) объединяли, и полученный раствор перемешивали в течение 1 ч при 60°С. Реакционную смесь концентрировали в вакууме с получением остатка, который использовали на следующей стадии без дополнительной очистки.
Стадия 3: 1-([3-бром-5-[(метилсульфанил)метил]фенил]метил)-1Н-1,2,3-триазол
К перемешиваемому раствору (3-бром-5-(бромметил)бензил)(метил)сульфана (0,500 г, 1,61 ммоль) в ацетонитриле (15 мл) добавляли 1Н-1,2,3-триазол (0,220 г, 3,19 ммоль) и карбонат калия (0,442 г, 3,20 ммоль). Реакционную смесь перемешивали в течение 1 ч при 25°С. Затем реакционную смесь гасили добавлением воды (30 мл), и полученный раствор экстрагировали этилацетатом (50 мл × 3). Органические слои объединяли, промывали водой (3×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (этилацетат/петролейный эфир: 1:2) с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6): δ 8,24 (с, 1H), 7,77 (с, 1H), 7,49 (с, 1H), 7,39 (с, 1H), 7,23 (с, 1H), 5,64 (с, 2H), 1,93 (с, 3H).
Промежуточный продукт 108
1,1'-((5-Бром-1,3-фенилен)бис(метилен))бис(1H-пиразол)
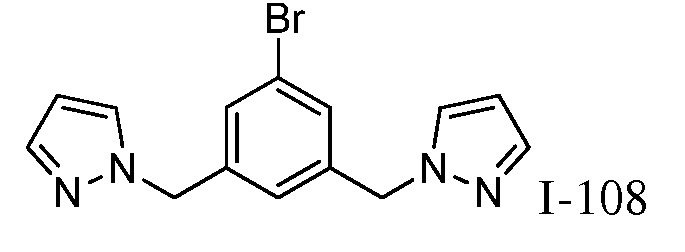
Стадия 1: 1-Бром-3,5-бис(бромметил)бензол (альтернативный синтез)
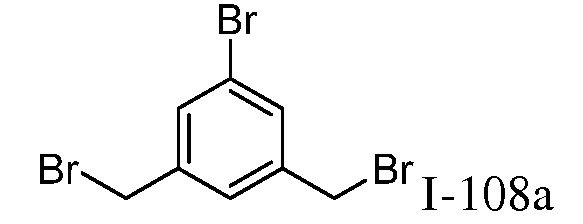
1-Бром-3,5-диметилбензол (5,00 г, 27,0 ммоль), N-бромсукцинимид (7,20 г, 40,5 ммоль), AIBN (0,045 г, 0,27 ммоль) и ацетонитрил (80 мл) объединяли в колбе в атмосфере азота. Полученный раствор перемешивали в течение 1 ч при 80°С, затем разбавляли водным раствором хлорида аммония (50 мл), а затем экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои концентрировали в вакууме, и остаток очищали на силикагеле, элюируя петролейным эфиром с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,70 (с, 2H), 7,64 (с, 1H), 4,70 (с, 4H).
Стадия 2: 1,1'-((5-Бром-1,3-фенилен)бис(метилен))бис(1Н-пиразол)
К смеси 1Н-пиразола (1,80 г, 26,4 ммоль) в ацетонитриле (120 мл) добавляли карбонат калия (3,60 г, 26,1 ммоль). Полученную смесь перемешивали в течение 1 ч при 25°С, затем добавляли 1-бром-3,5-бис(бромметил)бензол (3,00 г, 8,75 ммоль), и раствор перемешивали в течение 16 ч при 25°С. Реакцию останавливали добавлением водного раствора хлорида аммония, и смесь экстрагировали этилацетатом (3×150 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1/1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C14H14BrN4 [M + H]+: 317, найдено 317.
Промежуточный продукт 109
4-Гидроксициклогекс-1-ен-1-карбонитрил
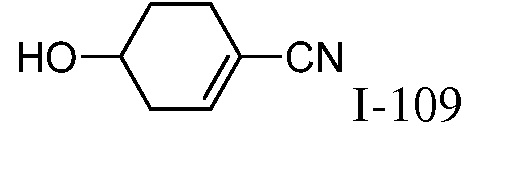
Стадия 1: 4-Оксоциклогекс-1-ен-1-карбонитрил
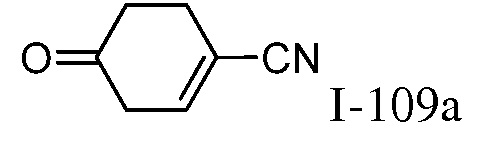
В запаянной трубке {[(3E)-4-метоксибута-1,3-диен-2-ил]окси}(триметил)силан (5,65 мл, 29,0 ммоль) и акрилонитрил (1,91 мл, 29,0 ммоль) объединяли в бензоле (9,67 мл), нагревали до кипения, и смесь оставляли перемешиваться в течение 16 часов. Реакционную смесь затем охлаждали до температуры окружающей среды, и летучие вещества упаривали в вакууме. Остаток перемешивали в смеси водной HCl (1,0 N; 29,0 мл, 29,0 ммоль) и ТГФ (9,7 мл). После перемешивания при температуре окружающей среды в течение 3 часов, реакционную смесь экстрагировали диэтиловым эфиром. Органический слой промывали деионизированной водой (2×), насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью 0-50% гексаны/ацетон с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, CDCl3): δ 6,68 (тт, J=4,0, 1,5 Гц, 1H), 3,05 (дт, J=4,3, 2,2 Гц, 2H), 2,71 (тк, J=6,9, 1,9 Гц, 2H), 2,57 (т, J=6,9 Гц, 2H).
Стадия 2: 4-гидроксициклогекс-1-ен-1-карбонитрил
К перемешиваемому раствору 4-оксоциклогекс-1-ен-1-карбонитрила (170 мг, 1,40 ммоль) в МеОН (2,3 мл) при -78°С добавляли хлорид церия (III) (484 мг, 1,96 ммоль) в МеОН (4,7 мл). Полученную смесь перемешивали в течение 5 мин при -78°С перед тем, как добавляли NaBH4 (48 мг, 1,3 ммоль) в виде одной порции. Смесь перемешивали в течение 20 минут и затем оставляли нагреваться до температуры окружающей среды. После перемешивания в течение 30 минут, реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром (3×). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, CDCl3): δ 6,50 (тт, J=3,9, 1,8 Гц, 1H), 4,03-3,98 (м, 1H), 3,50 -3,42 (кд, J=11,4, 4,5 Гц, 1H), 2,50 (уш.д, J=19,2 Гц, 1H), 2,46-2,38 (м, 1H), 2,33-2,23 (м, 1H), 2,21-2,13 (м, 1H), 1,90-1,84 (м, 1H), 1,76-1,67 (м, 1H).
Промежуточный продукт 110
4-Бром-2-(гидроксиметил)бензолсульфонамид
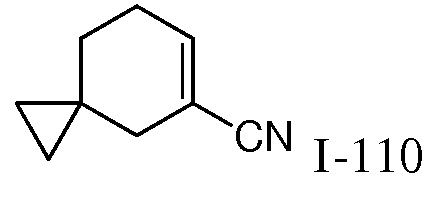
Стадия 1: 8-Метилен-1,4-диоксаспиро[4.5]декан
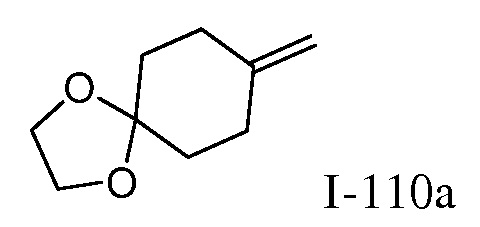
К суспензии PPh3CH3Br (17,2 г, 48,0 ммоль) в ТГФ (100 мл) добавляли трет-BuONa (3,7 г, 38 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 3 ч при той же температуре, затем в эту смесь добавляли раствор 1,4-диоксаспиро[4.5]декан-8-она (3,0 г, 19 ммоль) в ТГФ (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч, затем гасили насыщенным водным раствором NH4Cl (10 мл). Полученную смесь экстрагировали с помощью CH2Cl2 (3×10 мл) и объединенные органические слои концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/EtOAc: 10/1) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400MГц): δ 4,65 (с, 2H), 3,96 (с, 4H), 2,27 (т, J=6,5 Гц, 4H), 1,69 (т, J=6,5 Гц, 4H).
Стадия 2: Спиро[2.5]октан-6-он этиленкетон
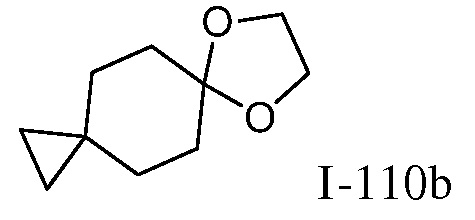
К раствору 8-метилен-1,4-диоксаспиро[4.5]декана (10 г, 65 ммоль) и CH2I2 (56,0 г, 210 ммоль) в ТГФ (100 мл) добавляли Zn(Et)2 (1,0 М, 110 мл, 110 ммоль) при комнатной температуре в атмосфере азота, и смесь перемешивали в течение 5 ч при той же температуре. Реакционную смесь гасили осторожным добавлением водного раствора НСl (2,0 М; 150 мл), затем экстрагировали CH2Cl2 (3×20 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексаны/EtOAc: 30/1) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400MГц): δ 3,96 (с, 4H), 1,69 (т, J=6,4 Гц, 4H), 1,42 (т, J=6,4 Гц, 4H), 0,27 (с, 4H).
Стадия 3: Спиро[2.5]октан-6-он
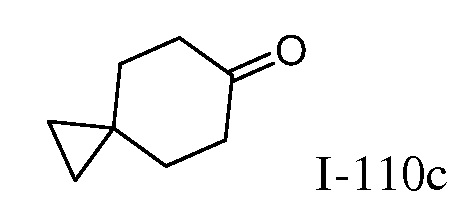
К раствору спиро[2.5]октан-6-он этиленкетона (3,00 г, 17,9 ммоль) в ТГФ (100 мл) добавляли HCl (1,0 М; 100 мл), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли петролейным эфиром. Слои разделяли, органический слой концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 10/1) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400MГц): δ 2,39 (т, J=6,4 Гц, 4H), 1,65 (т, J=6,4 Гц, 4H), 0,46 (с, 4H).
Стадия 4: 6-Оксоспиро[2.5]октан-5-карбонитрил
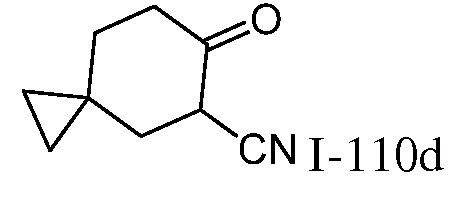
К раствору NH(i-Pr)2 (1,2 г, 12 ммоль) в ТГФ (10 мл) добавляли н-BuLi (5,0 мл, 11,5 ммоль) в атмосфере азота при -78°С. Полученную смесь перемешивали при 0°С в течение 30 мин, в реакционную смесь добавляли раствор спиро[2.5]октан-6-она (1,3 г, 10 ммоль) в ТГФ (10 мл) при -78°С. После перемешивания при этой температуре в течение 30 мин, эту смесь добавляли к раствору TsCN (3,7 г, 20 ммоль) в ТГФ (10 мл) при -78°С и перемешивали в течение 30 мин. Реакционную смесь осторожно гасили насыщенным раствором гидроксида аммония (10 мл), и смесь нагревали до комнатной температуры, затем подкисляли HCl (1,0 М). Смесь экстрагировали EtOAc (2×20 мл). Объединенные органические слои концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 10/1) с получением указанного в заголовке соединения. 1H ЯМР (CDCl3, 400MГц): δ 3,46-3,42 (м, 1H), 2,46-2,40 (м, 1H), 2,33-2,26 (м, 1H), 2,19-2,13 (м, 1H), 1,94-1,83 (м, 1H), 1,59-1,53 (м, 1H), 1,26-1,17 (м, 1H), 0,54-0,44 (м, 2H), 0,36-0,33 (м,2H).
Стадия 5: (транс)-6-Гидроксиспиро[2.5]октан-5-карбонитрил (рацемический)
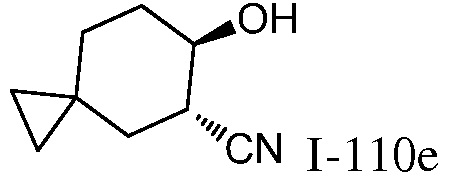
Смесь 6-оксоспиро[2.5]октан-5-карбонитрила (3,0 г, 20 ммоль) и LiBH4 (1,8 г, 80 ммоль) в ТГФ (100 мл) перемешивали при комнатной температуре в течение ночи. Смесь гасили путем осторожного добавления водного раствора HCl (1,0 М; 40 мл) и экстрагировали ДХМ (3×15 мл). Объединенные органические слои концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 5/1) с получением (транс)-6-гидроксиспиро[2.5]октан-5-карбонитрила (рацемического). 1H ЯМР (CDCl3, 400MГц): δ 4,46-4,24 (м, 1H), 3,72 (уш.с, 1H), 3,54-3,46 (м, 1H), 2,29-2,18 (м, 3H), 2,12-1,68 (м, 3H), 1,08-0,95 (м, 1H), 0,88-0,81 (м, 1H), 0,8-0,73 (м, 2H).
Стадия 6: Спиро[2.5]окт-5-ен-6-карбонитрил
К раствору (транс)-6-гидроксиспиро[2.5]октан-5-карбонитрила (рацемического) (1,7 г, 11 ммоль) и DIPEA (2,9 г, 22 ммоль) в ДХМ (60 мл) добавляли MsCl (1,5 г , 12 ммоль), и смесь перемешивали при комнатной температуре в течение 3 ч. Добавляли DBU (6,9 г, 45 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. После разбавления водой смесь экстрагировали EtOAc (3×20 мл), и полученный органический слой промывали водным раствором НСl (1,0 М; 20 мл), насыщенным водным раствором NaHCO3 (20 мл) и насыщенным раствором соли. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (гексаны/EtOAc: 80/1) с получением спиро[2.5]окт-5-ен-6-карбонитрила. 1H ЯМР (CDCl3, 400MГц): δ 6,70-6,68 (м, 1H), 2,31-2,35 (м, 2H), 2,08-2,04 (м, 2H), 1,43-1,4 (м, 2H), 0,44-0,34 (м, 4H).
Промежуточный продукт 111
1-Бром-4-(трет-бутилсульфонил)бензол
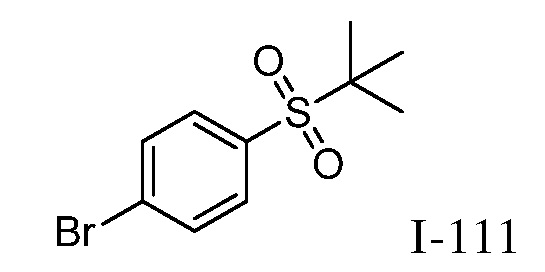
К раствору (4-бромфенил)(трет-бутил)сульфана (1,00 г, 4,08 ммоль) в ДХМ (10 мл) добавляли м-СРВА (2,01 г, 8,97 ммоль, макс. 77% масс.) при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение одного часа, прежде чем гасили добавлением насыщенных растворов Na2S2O3 и Na2CO3. Водную фазу экстрагировали ДХМ (× 3), и органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, ДМСО-d6) δ 7,93 (д, 2H, J=8,5 Гц), 7,79 (д, 2H, J=8,5 Гц), 1,28 (с, 9H).
Промежуточный продукт 112
1-Бром-4-((S и R)-пропан-2-илсульфонимидоил)бензол
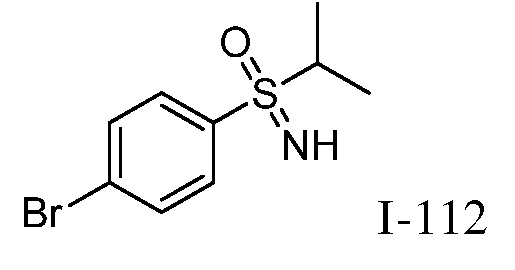
Стадия 1: (4-Бромфенил)(изопропил)сульфан
К 4-бромтиофенолу (1,00 г, 5,29 ммоль) добавляли ТГФ (17,6 мл) и затем NaH (233 мг, 5,82 ммоль, 60% масс. в минеральном масле), и реакционную смесь перемешивали при 0°С в течение 1 часа, прежде чем добавляли 2-бромпропан (1,24 г, 10,1 ммоль). Реакционную смесь перемешивали в течение ночи, затем фильтровали через целит и концентрировали в вакууме. Остаток затем очищали на силикагеле, элюируя смесью 2-30% EtOAc/гексаны с получением указанного в заголовке соединения 1H ЯМР (600 MГц, CDCl3) δ 7,41 (д, 2H, J=8,4 Гц), 7,25 (д, 2H, J=8,4 Гц), 3,34 (септет, 1H, J=6,6 Гц), 1,29 (д, 6H, J=6,6 Гц).
Стадия 2: 1-Бром-4-(изопропилсульфинил)бензол
К (4-бромфенил)(изопропил)сульфану (1,25 г, 5,40 ммоль) добавляли CH2Cl2 (18,0 мл) и затем м-СРВА (1,21 г, 5,40 ммоль, макс. 77% масс.) при 0°С. Реакционную смесь перемешивали в течение ночи, затем гасили добавлением насыщенных растворов NaHCO3 и сульфита натрия. Затем раствор перемешивали в течение 15 минут, экстрагировали ДХМ (× 3), и органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Сырой продукт очищали на силикагеле, элюируя смесью 2-40% EtOAc/гексаны с получением указанного в заголовке соединения. 1H ЯМР (600 MГц, CDCl3) δ 7,65 (д, 2H, J=8,4 Гц), 7,46 (д, 2H, J=8,4 Гц), 2,81 (септет, 1H, J=6,6 Гц), 1,23 (д, 3H, J=6,6 Гц), 1,12 (д, 3H, J=6,6 Гц).
Стадия 3: 4-Метил-N-[(R и S)-изопропилоксидо-(4-бромфенил)-λ4-сульфанилиден]-бензолсульфонамид
Дегазированные трифторметансульфонат меди (II) (21 мг, 0,057 ммоль) и ацетонитрил (17,2 мл) вместе с 1-бром-4-(изопропилсульфинил)бензолом (175 мг, 0,708 ммоль) перемешивали в атмосфере аргона в течение 10 минут перед тем, как добавляли [N-(п-толуолсульфонил)имино]фенилиодинан (378 мг, 1,01 ммоль), и реакционную смесь перемешивали при 25°С в течение ночи, а затем при 50°С в течение 7 часов. Реакционную смесь концентрировали в вакууме и очищали на силикагеле, элюируя смесью 0-40% EtOAc/гексаны с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C16H19NO3S2Br [M+H] +: 416, найдено 416. 1H ЯМР (600 MГц, CDCl3) δ 7,80 (м, 4H), 7,73 (д, 2H, J=7,5 Гц), 7,24 (м, 2H), 3,60 (септет, 1H, J=6,6 Гц), 2,37 (с, 3H), 1,35 (д, 3H, J=6,6 Гц), 1,25 (д, 3H, J=6,6 Гц).
Стадия 4: 1-бром-4-((S и R)-пропан-2-илсульфонимидоил)бензол
К 4-метил-N-[(R и S)-изопропилоксидо-(4-бромфенил)-λ4-сульфанилиден]-бензолсульфонамиду (1,39 г, 3,34 ммоль) добавляли концентрированную серную кислоту (20 мл) при 0°С и реакционную смесь перемешивали при этой температуре в течение 45 минут, прежде чем оставляли нагреваться до комнатной температуры в течение 15 минут. Затем реакционную смесь разбавляли CH2Cl2 и гасили медленным добавлением насыщенного раствора бикарбоната натрия. Нейтрализованный раствор затем экстрагировали CH2Cl2 (× 3), затем EtOAc (× 2), и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка на силикагеле элюированием 5-80% EtOAc в гексанах давала указанное в заголовке соединение. 1H ЯМР (600 MГц, CDCl3) δ 7.80 (м, 4H), 7,81 (д, 2H, J=8,4 Гц), 7,69 (д, 2H, J=8,4 Гц), 3,27 (септет, 1H, J=6,6 Гц), 1,33 (д, 3H, J=7,2 Гц), 1,28 (д, 3H, J=6,6 Гц).
Промежуточный продукт 113
1-(4-Бромфенил)-N-этил-2,2,2-трифторэтанамин
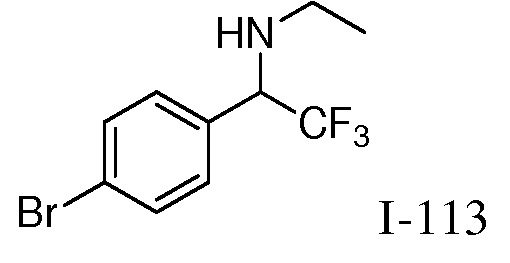
Стадия 1: 1-(4-Бромфенил)-2,2,2-трифторэтанол
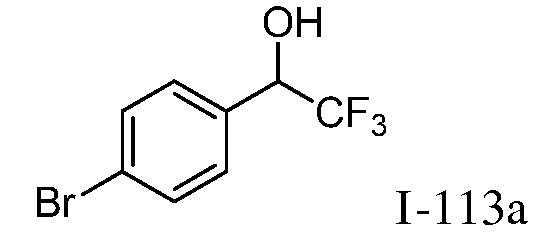
1-(4-бромфенил)-2,2,2-трифторэтанон (1,73 г, 6,84 ммоль) растворяли в ТГФ (3,4 мл) и обрабатывали боргидридом натрия (0,285 г, 7,52 ммоль) при 0°С. Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем разбавляли ДХМ и промывали водой и насыщенным раствором соли. Объединенные органические слои сушили над Na2SO4, фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, элюируя 5-30% EtOAc в гексанах, и необходимые фракции концентрировали в вакууме с получением 1-(4-бромфенил)-2,2,2-трифторэтанола. 1H ЯМР (500 MГц, CDCl3) δ 7,56 (д, J=8,5 Гц, 2H), 7,36 (д, J=8,5 Гц, 2H), 5,06-4,96 (м, 1H), 2,63 (д, J=4,5 Гц, 1H).
Стадия 2: 1-(4-Бромфенил)-2,2,2-трифторэтил трифторметансульфонат
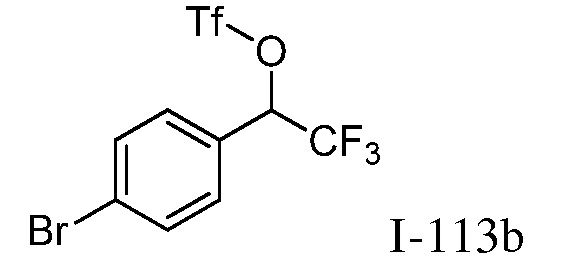
Раствор 1-(4-бромфенил)-2,2,2-трифторэтанола (1,5 г, 5,9 ммоль) и 2,6-лутидина (1,10 мл, 9,41 ммоль) в ДХЭ (12 мл) охлаждали до -15°С, и добавляли по каплям трифторметансульфоновый ангидрид (8,82 мл, 8,82 ммоль, 1,0 М в ДХМ). Реакционную смесь перемешивали от -15°C до комнатной температуры в течение 1 часа. Реакционную смесь разбавляли ДХМ и промывали водой, HCl (1N) и насыщенным раствором соли. Объединенные органические слои сушили над Na2SO4, фильтровали, и фильтрат концентрировали в вакууме с получением 1-(4-бромфенил)-2,2,2-трифторэтил трифторметансульфоната. 1H ЯМР (500 MГц, CDCl3) δ 7,64 (д, J=8,3 Гц, 2H), 7,37 (д, J=8,3 Гц, 2H), 5,85-5,74 (м, 1H).
Стадия 3: 1-(4-бромфенил)-N-этил-2,2,2-трифторэтанамин
1-(4-бромфенил)-2,2,2-трифторэтил трифторметансульфонат (1,0 г, 2,6 ммоль) растворяли в циклогексане (10 мл) и этиламине (3,88 мл, 7,75 ммоль, 2,0 М в ТГФ), и добавляли измельченный, высушенный карбонат калия (0,714 г, 5,17 ммоль) (сушили в вакууме при 60°С в течение одного часа). Реакционную смесь нагревали до 75°С и перемешивали в течение ночи. Реакционную смесь разбавляли дихлорметаном и промывали водой. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением 1-(4-бромфенил)-N-этил-2,2,2-трифторэтанамина, который переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C10H12BrF3N [M+H]+: 282, 284 (1:1), найдено 282, 284 (1:1).
Следуя аналогичной методике, которая изложена выше для промежуточного продукта 113, синтезировали следующий промежуточный продукт в таблице 23. В некоторых случаях, общую процедуру модифицировали использованием в качестве альтернативы 0,1 эквивалента DMAP.
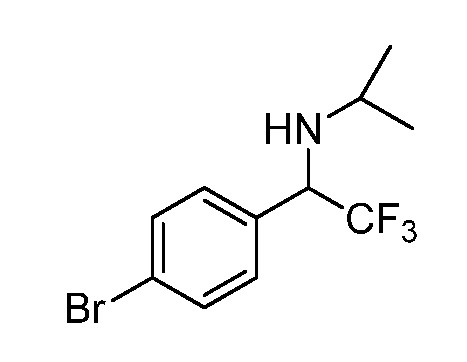
Промежуточный продукт 115
Этил 3-(4-бромфенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноат
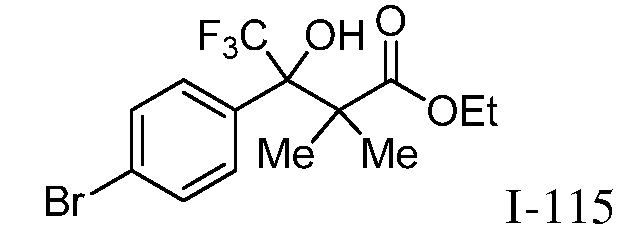
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали этил изобутират (689 мг, 5,90 ммоль) и ТГФ (2,5 мл). Раствор охлаждали до -78°С, и добавляли диизопропиламид лития (3,0 мл, 5,9 ммоль, 2,0 М в ТГФ). Реакционную смесь перемешивали в течение 30 мин с последующим добавлением 1-(4-бромфенил)-2,2,2-трифторэтанона (0,5 г, 2 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 ч и гасили добавлением насыщенного водного раствора NH4Cl (10 мл). Полученную смесь экстрагировали EtOAc (3×10 мл), и объединенные органические слои концентрировали в вакууме, и остаток очищали с помощью колоночной хроматографии на силикагеле (градиент гексаны/EtOAc) с получением этил 3-(4-бромфенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноата. МСНР (ИЭС) рассчитано для C14H17BrF3O3 [M+H]+: 370, найдено 370. 1H ЯМР (CDCl3, 500MГц): δ 7,60 (д, J=8,2 Гц, 2H), 7,53 (д, J=8,5 Гц, 2H), 4,31 - 4,27 (м, 2H), 1,38 (д, J=3,5 Гц, 3H), 1,30 (с, 6H).
Таблица 24 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 115.
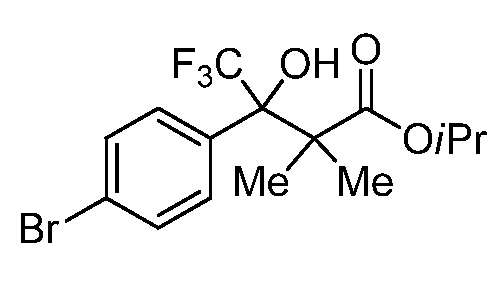
Промежуточный продукт 117
5-Бром-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-1-ол
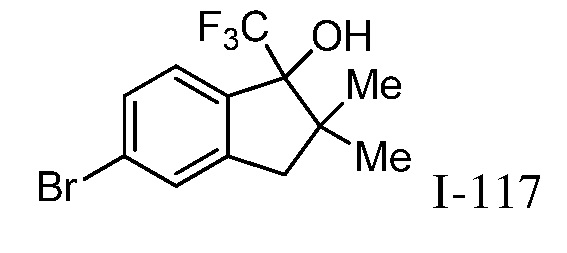
Стадия 1: 5-Бром-2,2-диметил-2,3-дигидро-1H-инден-1-он
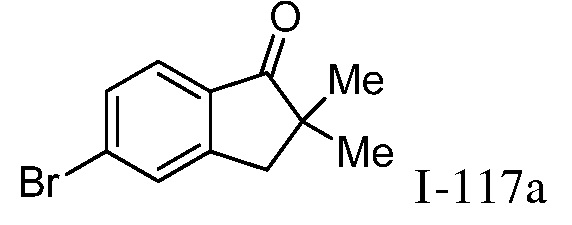
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали 5-бром-2,3-дигидро-1Н-инден-1-он (500 мг, 2,40 ммоль) и ДМФА (7,5 мл). Раствор охлаждали до 0°С, и добавляли гидрид натрия (237 мг, 5,9 ммоль, 60% масс.). Реакционную смесь перемешивали в течение 30 мин с последующим добавлением йодметана (0,37 мл, 5,9 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 ч и гасили добавлением насыщенного водного раствора NH4Cl (10 мл). Полученную смесь экстрагировали Et2O (3×20 мл), и объединенные органические слои концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (градиент гексаны/EtOAc) с получением 5-бром-2,2-диметил-2,3-дигидро-1Н-инден-1-она. МСНР (ИЭС) рассчитано для C11H12BrO [M+H]+: 240, найдено 240. 1H ЯМР (CDCl3, 500MГц): δ 7,64-7,61 (м, 2H), 7,53 (д, J=8,22 Гц, 1H), 2,99 (с, 2H), 1,26 -1,24 (с, 6H).
Стадия 2: 5-Бром-2,2-диметил-1-(трифторметил)-2,3-дигидро-1Н-инден-1-ол
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали 5-бром-2,2-диметил-2,3-дигидро-1Н-инден-1-он (2,2 г, 9,5 ммоль) и ТГФ (23 мл). Раствор охлаждали до 0°С, и добавляли (трифторметил)триметилсилан (7,0 мл, 47 ммоль). За этим последовало медленное (экзотермическое) добавление фторида тетрабутиламмония (11,9 мл, 11,9 ммоль, 1,0 М в ТГФ). Реакционную смесь нагревали до комнатной температуры в течение 1-2 ч и перемешивали всю ночь. Реакционную смесь гасили добавлением насыщенного водного раствора NH4Cl (10 мл), и полученную смесь экстрагировали EtOAc (3×40 мл). Объединенные органические слои концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (градиент гексаны/EtOAc) с получением 5-бром-2,2-диметил-1-(трифторметил)-2,3-дигидро-1Н-инден-1-ола. 1H ЯМР (CDCl3, 500MГц): δ 7,43 - 7,41 (м, 2 H), 7,33 (д, J=8,11 Гц, 1H), 2,89 (д, J=15,69 Гц, 1H), 2,82 (д, J=15,64 Гц, 1H), 1,27 (с, 3H), 1,16 (с, 3H).
Таблица 25 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 117.
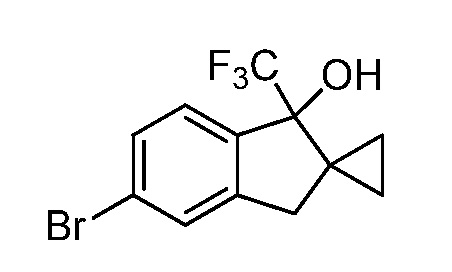
Промежуточный продукт 119
(R или S) 1-Бром-4-(1,1,1-трифтор-2-метоксипропан-2-ил)бензол
Стадия 1: (R или S) 2-(4-Бромфенил)-1,1,1-трифторпропан-2-ол и (R или S) 2-(4-Бромфенил)-1,1,1-трифторпропан-2-ол
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали 1-(4-бромфенил)-2,2,2-трифторэтанон (2,0 г, 7,9 ммоль) и ТГФ (13 мл). Раствор охлаждали до 0°С, и добавляли метилмагнийбромид (17 мл, 23,7 ммоль, 1,4 М). Реакционную смесь нагревали до комнатной температуры в течение 1-2 ч и гасили добавлением насыщенного водного раствора NH4Cl (10 мл). Полученную смесь экстрагировали Et2O (3×20 мл), и объединенные органические слои концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (градиент гексаны/EtOAc) с получением рацемического 2-(4-бромфенил)-1,1,1-трифторпропан-2-ола. 1H ЯМР (CDCl3, 500MГц): δ 7,54 (д, J=8,31 Гц, 2H), 7,47 (д, J=8,26 Гц, 2H), 2,44 (с, 1H), 1,78 (с, 3H). Разделение энантиомеров достигали очищением с помощью СЖХ при использовании колонки Chiral Technology AZ-H 2,1×25 см, 5 мкм, при 70 мл/мин с системой растворителей 5%/95% (метанол/CO2).
Время удерживания составляло 2,55 минут для промежуточного продукта 119a (МСНР (ИЭС) рассчитано для C9H9BrF3O [M+H]+: 269, найдено 269) и 3,19 минут для промежуточного продукта 119b (МСНР (ИЭС) рассчитано для C9H9BrF3O [M+H]+: 269, найдено 269).
Стадия 2: (R или S) 1-бром-4-(1,1,1-трифтор-2-метоксипропан-2-ил)бензол
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали (R или S)-2-(4-бромфенил)-1,1,1-трифторпропан-2-ол (I-119а; 300 мг , 1,1 ммоль) и ДМФА (3,5 мл). Раствор охлаждали до 0°С, и добавляли гидрид натрия (67 мг, 1,7 ммоль, 60% масс.). Реакционную смесь перемешивали в течение 30 мин с последующим добавлением йодметана (0,21 мл, 3,3 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 1-2 ч, а гасили добавлением насыщенного водного раствора NH4Cl (10 мл). Полученную смесь экстрагировали Et2O (3×20 мл), и объединенные органические слои концентрировали в вакууме с получением остатка, который очищали колоночной хроматографией на силикагеле (градиент гексаны/EtOAc) с получением (R или S) 1-бром-4-(1,1,1-трифтор-2-метоксипропан-2-ил)бензола. 1H ЯМР (CDCl3, 500MГц): δ 7,54 (д, J=8,19 Гц, 2H), 7,38 (д, J=8,14 Гц, 2H), 3,23 (с, 3H), 1,76 (с, 3H).
Промежуточный продукт 120
(4-Бром-2-метилфенил)(4,4-дифторпиперидин-1-ил)метанон
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали 4-бром-2-метилбензойную кислоту (750 мг, 3,50 ммоль), ДМФА (9 мл), (1- [бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксид гексафторфосфат; HATU) (2,6 г, 7,0 ммоль), основание Хенига (2,4 мл, 14 ммоль) и 4,4-дифторпиперидин (840 мг, 7,0 ммоль). Полученную реакционную смесь перемешивали в течение 12-16 ч и концентрировали в вакууме. Сырой остаток очищали колоночной хроматографией на силикагеле, элюируя при помощи градиента гексаны/EtOAc с получением (4-бром-2-метилфенил)(4,4-дифторпиперидин-1-ил)метанона. 1H ЯМР (500 MГц, CDCl3): δ 7,42 - 7,37 (м, 2H), 7,05 (д, J=8,06 Гц, 1H), 4,02 (м, 1H), 3,82 (м, 1H), 3,38 - 3,34 (м, 2H), 2,30 (с, 3H), 2,11 - 2,07 (м, 2H), 1,90 - 1,86 (м, 2H).
Промежуточный продукт 121
(2R,5S)-4-(6-Бромхинолин-2-ил)-2,5-диметилморфолин
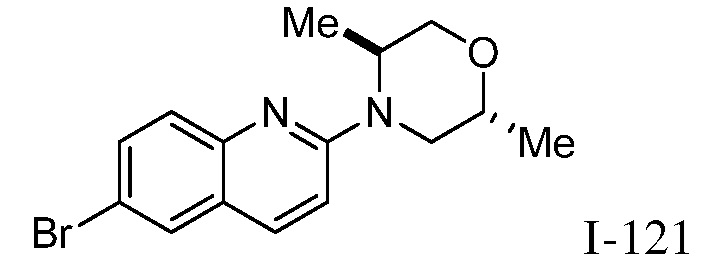
В высушенную в сушильном шкафу пробирку для микроволнового реактора с магнитным мешальником в атмосфере N2 загружали 6-бром-2-хлорхинолин (200 мг, 0,800 ммоль), ACN (0,4 мл), триэтиламин (0,80 мл, 5,8 ммоль), и (2R,5S)-диметилморфолин (475 мг, 4,10 ммоль). Реакционную смесь нагревали до 90°С в течение 12-16 ч, и концентрировали в вакууме. Сырой остаток очищали колоночной хроматографией на силикагеле, элюируя при помощи градиента гексаны/EtOAc с с получением (2R,5S)-4-(6-бромхинолин-2-ил)-2,5-диметилморфолина. 1H ЯМР (500 MГц, CDCl3): δ 7,81 (д, J=9,19 Гц, 1H), 7,74 (с, 1H), 7,60 - 7,55 (м, 2H), 6,94 (д, J=9,22 Гц, 1H), 4,39 (м, 1H), 4,28 (м, 1H), 3,89 - 3,85 (м, 2H), 3,66 (м, 1H), 2,90 (м, 1H), 1,34 - 1,29 (м, 6H).
Таблица 26 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 121.
Промежуточный продукт 124
трет-Бутил-4-(5-бром-1-оксоизоиндолин-2-ил)циклогексанкарбоксилат
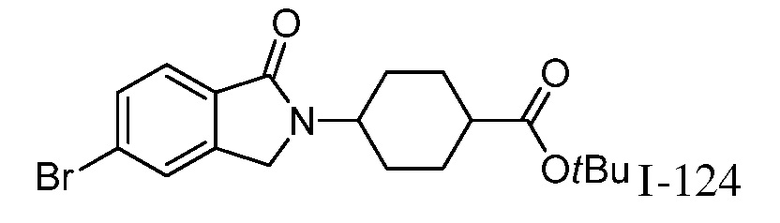
В высушенную в сушильном шкафу круглодонную колбу с магнитным мешальником в атмосфере N2 загружали метил 4-бром-2-(бромметил)бензоат (500 мг, 1,60 ммоль), ТГФ (4,8 мл), триэтиламин (0,60 мл, 4,1 ммоль) и трет-бутил-4-аминоциклогексанкарбоксилат (647 мг, 3,30 ммоль). Реакционную смесь нагревали до кипения с обратным холодильником в течение 12-16 ч и концентрировали в вакууме. Сырой остаток очищали колоночной хроматографией на силикагеле, с элюируя при помощи градиента гексаны/EtOAc с получением трет-бутил-4-(5-бром-1-оксоизоиндолин-2-ил)циклогексанкарбоксилата. 1H ЯМР (500 MГц, CDCl3): δ 7,70 (д, J=7,92 Гц, 1H), 7,62 - 7,58 (м, 2H), 4,33 - 4,29 (м, 2H), 4,24 (м, 1H), 2,60 (м, 1H), 1,74 - 1,66 (м, 3H), 1,60 - 1,52 (м, 5H).
Таблица 27 раскрывает промежуточные продукты, полученные с использованием аналогичных процедур, как описано для промежуточного продукта 124 с использованием соответствующего амина. В некоторых случаях, общую процедуру модифицировали использованием толуола в качестве растворителя.
Промежуточный продукт 131
4-Бром-N-(трет-бутил)-N-метилбензолсульфонамид
К раствору 4-бром-N-(трет-бутил)бензолсульфонамида (I-35; 1,0 г, 3,4 ммоль) и карбоната калия (0,946 г, 6,84 ммоль) в ДМФА (20 мл) добавляли метилиодид (0,428 мл, 6,84 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 6 ч, затем гасили водой (50 мл) и экстрагировали этилацетатом (50 мл × 3), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, элюируя смесью 0-10% EtOAc/гексаны с получением 4-бром-N-(трет-бутил)-N-метилбензолсульфонамида. 1H ЯМР (600 MГц, CDCl3): δ 7,65 (д, J=8,8 Гц, 2H), 7,58 (д, J=8,8 Гц, 2H), 2,94 (с, 3H), 1,32 (с, 9H).
Промежуточный продукт 132
4-(4-Бром-2-хлорфенил)-1-метил-1H-пиразол
4-Бром-2-хлор-1-йодбензол (500 мг, 1,58 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (295 мг, 1,41 ммоль), PdCl2(dppf) (115 мг, 0,158 ммоль) и трехосновный фосфат калия (1,03 г, 4,73 ммоль) объединяли в 20-мл пробирке для микроволнового реактора и растворяли в диоксане (10 мл) и воде (1,0 мл). Пробирку герметично закрывали и продували аргоном. Реакционную смесь перемешивали при 90°С в течение 2 часов. Пробирку затем охлаждали до комнатной температуры и разбавляли этилацетатом. Органический слой промывали водой и насыщенным раствором соли, а затем сушили, используя сульфат магния. Затем раствор фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью хроматографии на силикагеле, элюируя 10-50% EtOAc в гексанах, и необходимые фракции концентрировали в вакууме с получением 4-(4-бром-2-хлорфенил)-1-метил-1Н-пиразола. МСНР (ИЭС) рассчитано для C10H9BrClN2 [M+H]+: 271, найдено 271.
Таблица 28 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 132.
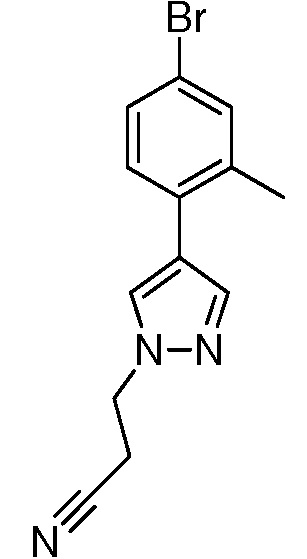
найдено 290
Промежуточный продукт 134
4-(4-Бромфенил)-1-(2-метоксиэтил)-1H-пиразол
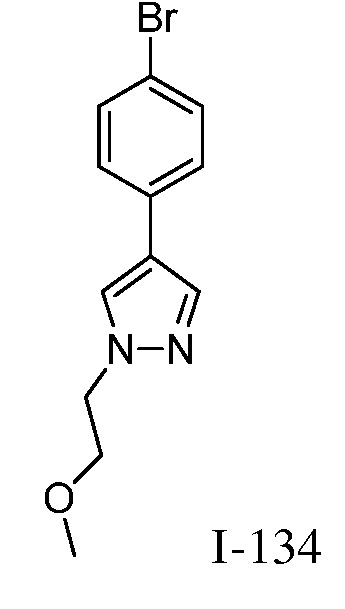
4-(4-бромфенил)пиразол (150 мг, 0,672 ммоль) и карбонат цезия (876 мг, 2,69 ммоль) объединяли в 20-мл пробирке и растворяли в ДМФА (1,3 мл). Затем добавляли 2-бромэтил-метиловый эфир (0,253 мл, 2,69 ммоль). Реакционную смесь перемешивали в течение ночи при 60°С. Затем реакционную смесь разбавляли этилацетатом и промывали водой (2 ×). Органический раствор сушили над MgSO4 и концентрировали в вакууме с получением 4-(4-бромфенил)-1-(2-метоксиэтил)-1Н-пиразола, который переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C12H14BrN2O [M+H]+: 281, найдено 281.
Промежуточный продукт 135
Этил 1-(4-бром-2-метилфенил)-1H-пиразол-4-карбоксилат
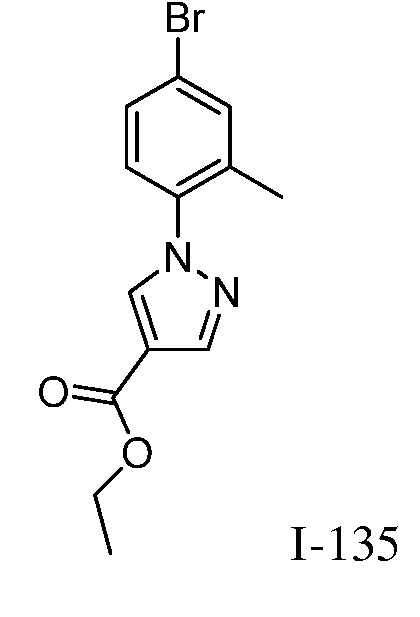
Этил-4-пиразолкарбоксилат (202 мг, 1,44 ммоль), 5-бром-2-йодтолуол (0,20 мл, 1,4 ммоль), (1S,2S,N1E,N2E)-N1,N2-бис(пиридин-2-илметилен)циклогексан-1,2-диамин (84 мг, 0,29 ммоль), оксид меди (I) (10 мг, 0,072 ммоль) и карбонат цезия (939 мг, 2,88 ммоль) объединяли в 5-мл пробирке для микроволнового реактора и растворяли в ацетонитриле (3,0 мл). Реакционную смесь перемешивали при 82°С в течение ночи. Затем реакционную смесь фильтровали через целит, промывая этилацетатом. Раствор концентрировали в вакууме и очищали с помощью хроматографии на силикагеле, элюируя 10-25% этилацетатом в гексанах с получением этил 1-(4-бром-2-метилфенил)-1Н-пиразол-4-карбоксилата. МСНР (ИЭС) рассчитано для C13H14BrN2O2 [M+H]+: 309, найдено 309.
Промежуточный продукт 136
Изопропил 6-бромхинолин-2-карбоксилат
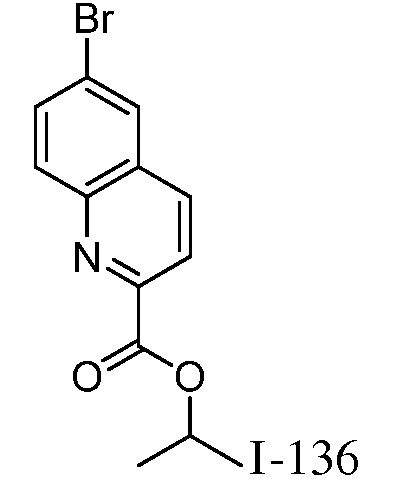
6-Бромхинолин-2-карбоновую кислоту (40 мг, 0,16 ммоль) и HATU (121 мг, 0,317 ммоль) растворяли в ДМФА (0,5 мл) в 4-мл пробирке и оставляли перемешиваться при комнатной температуре в течение 5 минут. Затем добавляли к реакционной смеси 2-пропанол (24 мкл, 0,31 ммоль) и N,N-диизопропилэтиламин (83 мкл, 0,48 ммоль) в ДМФА (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь разбавляли этилацетатом и промывали большим количеством воды. Органический слой сушили с помощью MgSO4, фильтровали и концентрировали в вакууме с получением изопропил 6-бромхинолин-2-карбоксилата, который переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C13H13BrNO2 [M+H]+: 294, найдено 294.
Промежуточный продукт 137
Бром-4-(1-бром-2-метилпропил)бензол
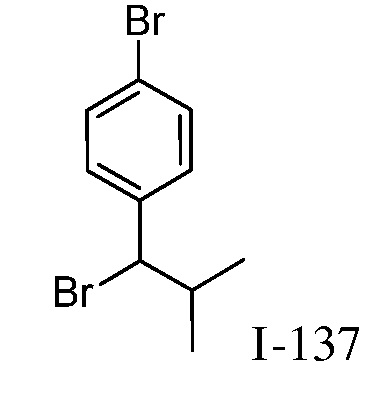
Стадия 1: 1-(4-Бромфенил)-2-метилпропан-1-ол
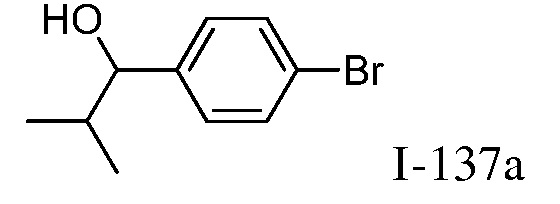
К раствору 4-бромбензальдегида (9,2 г, 0,048 моль) в ТГФ (150 мл), охлажденному до 0-4°С в атмосфере азота добавляли изопропилмагнийхлорид (1,0 М в ТГФ, 58,4 мл). Реакционную смесь выдерживали при той же температуре в течение 30 мин, затем нагревали до комнатной температуры и перемешивали в течение 4 ч, затем добавляли насыщенный водный раствором бикарбоната натрия (150 мл). Гашеную реакционную смесь экстрагировали EtOAc (200 мл), и органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (3:1) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, ДМСО-d6) δ 7,49 (д, J=6,6 Гц, 2H), 7,30 (д, J=6,6 Гц, 2H), 5,18 (д, J=6,6 Гц, 1H), 4,26-4,21 (м, 1H), 1,82-1,71 (м, 1H), 0,85 (д, J=6,6 Гц, 3H), 0,75 (д, J=6,6 Гц, 3H).
Стадия 2: 1-Бром-4- (1-бром-2-метилпропил) бензол
Раствор 1-(4-бромфенил)-2-метилпропан-1-ола (2,50 г, 11,0 ммоль) в бромистоводородной кислоте (48%, 40 мл) перемешивали при комнатной температуре в течение 1 часа и затем экстрагировали гексаном (3×40 мл). Объединенные органические слои промывали водой, затем насыщенным водным раствором гидрокарбоната натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки. 1H ЯМР (300 MГц, CDCl3) δ 7,49 (д, J=6,6 Гц, 2H), 7,27 (д, J=6,6 Гц, 2H), 4,68 (д, J=8,4 Гц, 1H), 2,34-2,23 (м, 1H), 1,17 (д, J=6,9 Гц, 3H), 0,91 (д, J=6,9 Гц, 3H).
Таблица 29 раскрывает промежуточный продукт, который получали использованием аналогичных процедур, как описано для промежуточного продукта 137.
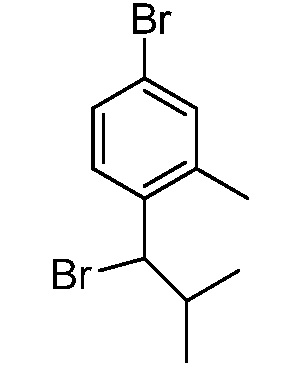
Промежуточные продукты 139 и 140
2-(1-(4-Бромфенил)этил)-2H-1,2,3-триазол и 1-(1-(4-Бромфенил)этил)-4,5-дигидро-1H-1,2,3-триазол
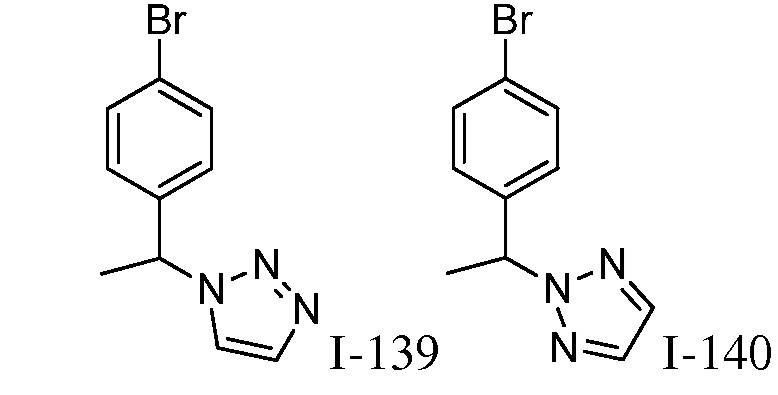
Стадия 1: 1-Бром-4-(1-бромэтил)бензол
В 100-мл 3-горлую круглодонную колбу помещали 1-бром-4-этилбензол (5,10 г, 27,6 ммоль), N-бромсукцинимид (5,77 г, 32,4 ммоль) и азо-бис-изобутиронитрил (0,89 г, 5,4 ммоль) в хлороформе (100 мл). Смесь нагревали с обратным холодильником в течение 3 часов и охлаждали до температуры окружающей среды. Затем добавляли воду (100 мл) и органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:20) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 7,44 (д, J=8,4 Гц, 2H), 7,31 (д, J=8,4 Гц, 2H), 5,15 (к, J=6,9 Гц, 1H), 2,01 (д, J=6,9 Гц, 3H).
Стадия 2: 2-(1-(4-бромфенил)этил)-2Н-1,2,3-триазол и 1-(1-(4-Бромфенил)этил)-4,5-дигидро-1H-1,2,3-триазол
В 100 мл 3-горлой круглодонной колбе объединяли 1-бром-4-(1-бромэтил)бензол (4,60 г, 17,5 ммоль) с N,N-диметилформамидом (60 мл), затем добавляли 1H-1,2,3-триазол (1,45 г, 21,0 ммоль) и карбонат калия (6,04 г, 43,7 ммоль). Раствор нагревали при 80°С в течение 5 часов, затем выливали в воду (100 мл). Полученную смесь экстрагировали этилацетатом (3×60 мл) и органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и полученное твердое вещество растирали в порошок при помощи этилацетата/петролейного эфира (1:3, 10 мл) и фильтровали с получением двух указанных в заголовке соединений.
2-(1-(4-Бромфенил)этил)-2H-1,2,3-триазол (I-139): МСНР (ИЭС) рассчитано для C10H11BrN3 [M + H]+: 252, 254 (1:1), найдено 252, 254 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,62 (с, 2H), 7,44 (д, J=8,4 Гц, 2H), 7,16 (д, J=8,4 Гц, 2H), 5,82 (к, J=7,2 Гц, 1H), 1,96 (д, J=7,2 Гц, 3H).
1-(1-(4-Бромфенил)этил)-4,5-дигидро-1H-1,2,3-триазол (I-140): МСНР (ИЭС) рассчитано для C10H11BrN3 [M + H]+: 252, 254 (1:1), найдено 252, 254 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,72 (с, 1H), 7,49 (д, J=8,4 Гц, 2H), 7,44 (с, 1H), 7,14 (д, J=8,4 Гц, 2H), 5,81 (к, J=7,2 Гц, 1H), 1,98 (д, J=7,2 Гц, 3H).
Таблица 30 раскрывает промежуточные продукты, полученные в соответствии с процедурами, аналогичных тем, которые описаны для промежуточного продукта 139, стадия 2, используя 1-бром-4-(1-бром-2-метилпропил)бензол (промежуточный продукт 137) или 4-бром-1-(1-бром-2-метилпропил)-2-метилбензол (промежуточный продукт 138).
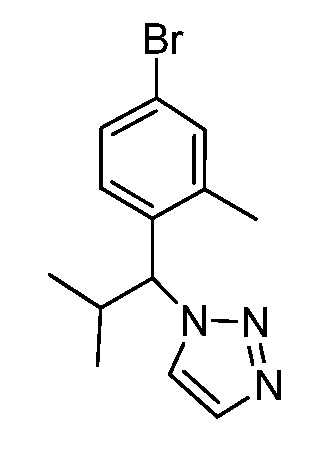
Промежуточный продукт 145
1-(1-(4-Бромфенил)-2-метилпропил)-4-трет-бутил-1H-1,2,3-триазол
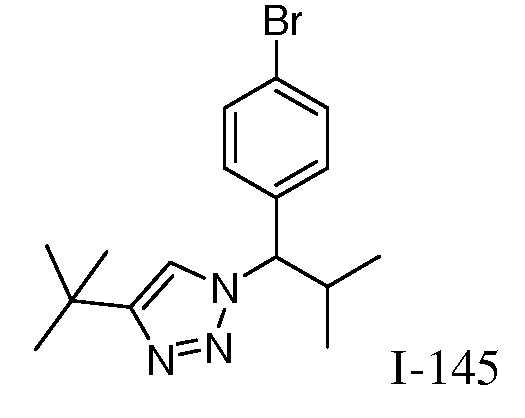
Стадия 1: 1-(1-Азидо-2-метилпропил)-4-бромбензол
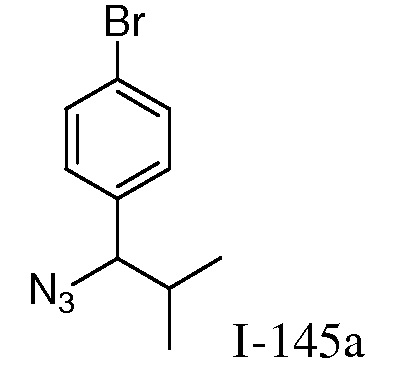
К раствору 1-бром-4-(1-бром-2-метилпропил)бензола (I-137; 1,0 г, 3,4 ммоль) в ДМФА (10,0 мл) добавляли азид натрия (0,45 г, 6,9 ммоль). Смесь нагревали при 90°С в течение 4 часов и затем разбавляли водой (50 мл) с последующей экстракцией с помощью EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли (3×50 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя петролейным эфиром с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C10H13BrN3 [M + H]+ : 254, 256 (1:1), найдено 254, 256 (1:1); 1H ЯМР (400 MГц, CDCl3) δ 7,50 (д, J=8,4 Гц, 2H), 7,16 (д, J=8,4 Гц, 2H), 4,17-4,15 (м, 1H), 2,05-1,90 (м, 1H), 1,04 (с, 3H), 0,94 (с, 3H).
Стадия 2: 1-(1-Азидо-2-метилпропил)-4-бромбензол
Смесь 1-(1-азидо-2-метилпропил)-4-бромбензола (0,25 г, 0,98 ммоль), CuSO4 (31 мг, 0,20 ммоль), 3,3-диметилбут-1-ин (0,16 г, 2,0 ммоль) и аскорбат натрия (0,40 г, 2,0 ммоль) в воде (3,0 мл) и н-бутаноле (3,00 мл) перемешивали при температуре окружающей среды в течение 24 часов. Затем смесь гасили насыщенным раствором гидроксида аммония (10 мл) и экстрагировали EtOAc (2×20 мл). Объединенные органические слои промывали насыщенным раствором соли (2×20 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью ДХМ/петролейного эфира (1:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C16H23BrN3 [M + H]+: 336, 338 (1:1), найдено 336, 338 (1:1); 1H ЯМР (400 MГц, CDCl3) δ 7,52 (д, J=8,4 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 7,30 (с, 1H), 5,01-4,98 (м, 1H), 2,82-2,76 (м, 1H), 1,35 (с, 9H), 0,91 (с, 6H).
Таблица 31 раскрывает промежуточный продукт, который получали в соответствии с процедурами, аналогичных тем, которые описаны для промежуточного продукта 145, используя трет-бутил пропиолат.
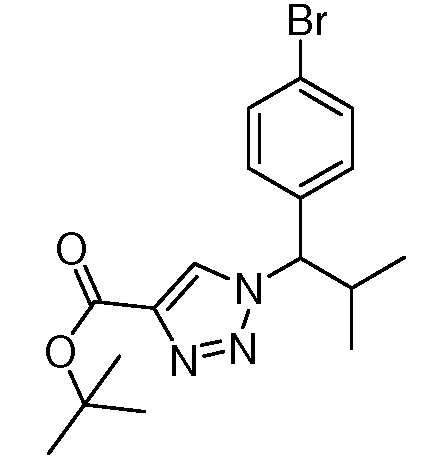
Промежуточный продукт 147
5-Бром-2-[(2S)-3-метилбутан-2-ил]-2,3-дигидро-1H-изоиндол
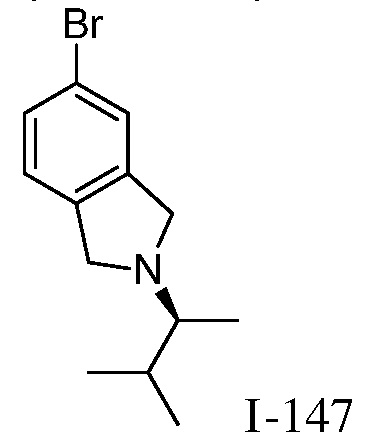
Стадия 1: (S)-5-Бром-2-(3-метилбутан-2-ил)изоиндолин-1,3-дион
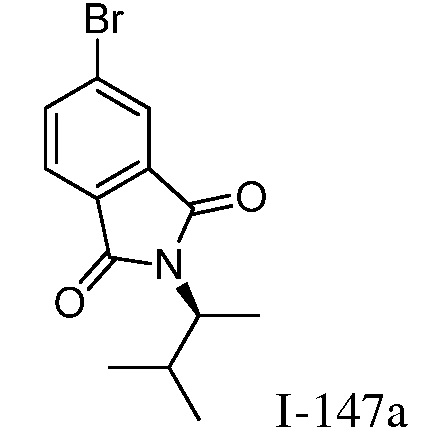
В продуваемую и поддерживаемую в инертной атмосфере азота 100-мл круглодонную колбу помещали 5-бром-1,3-дигидро-2-бензофуран-1,3-дион (5,40 г, 23,8 ммоль), (S)-3-метилбутан-2-амин (2,50 г, 28,7 ммоль), диизопропиламин (9,20 г, 71,2 ммоль) и толуол (50 мл). Полученный раствор перемешивали в течение 5 часов при 110°С. Смесь концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:20) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H14BrNO2 [M]+: 295, 297 (1:1), найдено 295, 297 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,96 (с, 1H), 7,87-7,83 (м, 1H), 7,70-7,68 (м, 1H), 4,10-3,89 (м, 1H), 2,43-2,31 (м, 1H), 1,46 (д, J=7,2 Гц, 3H), 1,02 (д, J=6,9 Гц, 3H), 0,83 (д, J=6,9 Гц, 3H).
Стадия 2: 5-Бром-2-[(2S)-3-метилбутан-2-ил]-2,3-дигидро-1H-изоиндол
В 500-мл круглодонную колбу помещали раствор 5-бром-2-[(2S)-3-метилбутан-2-ил]-2,3-дигидро-1Н-изоиндол-1,3-диона (2,00 г, 6,75 ммоль) в тетрагидрофуране (20 мл) и боран-диметилсульфид (2,0 М в ТГФ, 6,8 мл, 68 ммоль). Полученный раствор перемешивали в течение 48 ч при 80°С. Затем реакцию останавливали соляной кислотой (3,0 М, 100 мл), и полученный раствор экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали водой (2×50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:10) с получением 5-бром-2-[(2S)-3-метилбутан-2-ил]-2,3-дигидро-1Н-изоиндола. МСНР (ИЭС) рассчитано для C13H19BrN [M + H]+: 268, 270 (1:1), найдено 268, 270 (1:1).
Таблица 32 раскрывает промежуточный продукт, который получали с использованием аналогичных процедур, как описано для промежуточного продукта 147, используя (R)-3-метилбутан-2-амин, чтобы заменить (S)-3-метилбутан-2-амин.
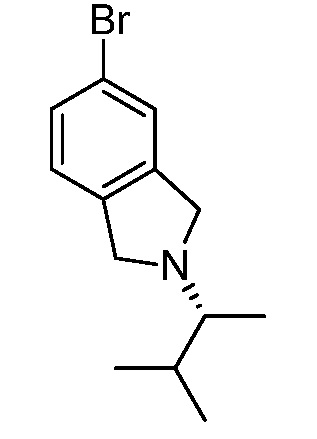
Промежуточный продукт 149
трет-Бутил-3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)пропаноат
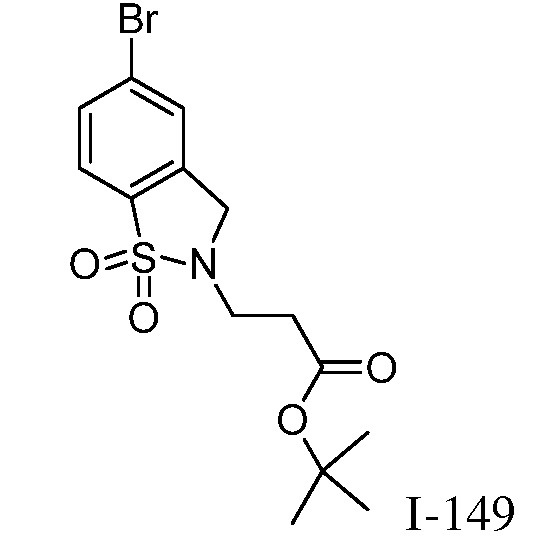
В 50-мл 3-горлую круглодонную колбу помещали карбонат калия (0,33 г, 2,4 ммоль), 5-бром-2,3-дигидро-бензо[d]изотиазол 1,1-диоксид (0,20 г, 0,81 ммоль), трет-бутилакрилат (0,10 г, 0,81 ммоль) и N,N-диметилформамид (10 мл). Смесь перемешивали при 60°С в течение 2 часов и охлаждали. Добавляли воду (50 мл) и смесь экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1: 4) с получением трет-бутил-3-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)пропаноата. МСНР (ИЭС) рассчитано для C14H19BrNO4S [M + H]+: 376, 378 (1:1), найдено 376, 378 (1:1).
Таблица 33 раскрывает промежуточный продукт, который получали с использованием аналогичной процедуры, как описано для промежуточного продукта 149, исходя из соответствующего бензотиазола или бромизоиндолинона. В некоторых случаях, общую процедуру модифицировали использованием в качестве альтернативы от 3,0 до 4,0 эквивалентов основания K2CO3 или ТЭА и ДМФА или трет-BuOH, в качестве растворителя.
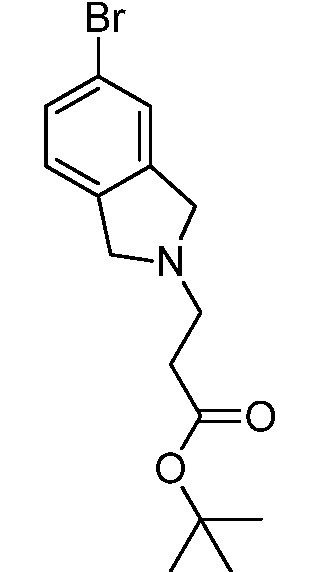
Промежуточный продукт 151
(5-Бромизоиндолин-2-ил)(5-(пиперидин-1-ил)пиразин-2-ил)метанон
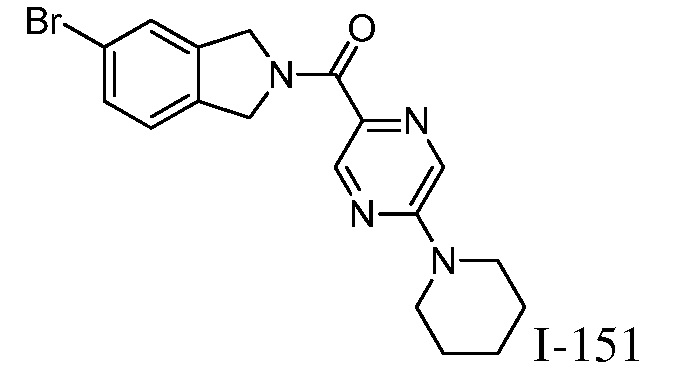
В 50-мл 3-горлую круглодонную колбу помещали 5-(пиперидин-1-ил)пиразин-2-карбоновую кислоту (1,57 г, 7,57 ммоль), О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (2,88 г, 7,57 ммоль), N,N-диизопропилэтиламин (1,95 г, 15,2 ммоль), HCl-соль 5-бромизоиндолина (1,18 г, 5,05 ммоль) и N,N-диметилформамид (20 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов, затем добавляли воду (20 мл). Смесь экстрагировали EtOAc (3×30 мл), и объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C18H20BrN4O [M + H]+: 387, 389 (1:1), найдено 387, 389 (1:1); 1H ЯМР (400 MГц, CDCl3) δ 8,99 (с, 1H), 8,28 (с, 1H), 7,47-7,41 (м, 2H), 7,29-7,14 (м, 1H), 5,30 (д, J=16,0 Гц, 2H), 5,02 (д, J=16,0 Гц, 2H), 3,76-3,74 (м, 4H), 1,74-1,72 (м, 6H).
Промежуточный продукт 152
(5-Броизоиндолин-2-ил)(пиперидин-1-ил)метанон
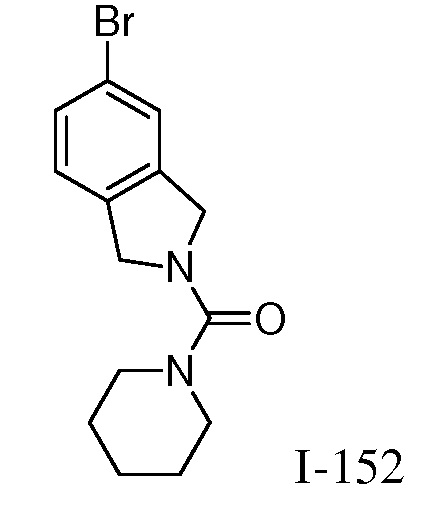
В 500-мл круглодонную колбу помещали 5-броизоиндолина гидрохлорид (5,0 г, 21 ммоль) и пиперидин (2,72 г, 32,0 ммоль) в ДХМ (300 мл). Добавляли трифосген (3,16 г, 10,7 ммоль) при 0°С. Смесь перемешивали в течение 20 мин при 0°С, затем в раствор добавляли пиперидин (2,72 г, 32,0 ммоль) при 0°С и перемешивали в течение 40 мин. Смесь гасили водой (100 мл) и экстрагировали этилацетатом (3×1500 мл). Органические слои объединяли, промывали насыщенным раствором соли (2×100 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя смесью петролейный эфир/EtOAc (19:1) с получением (5-бромизоиндолин-2-ил)(пиперидин-1-ил)метанона. МСНР (ИЭС) рассчитано для C14H18BrN2O [M + H]+: 309, 311 (1:1), найдено 309, 311 (1:1).
Промежуточный продукт 153
HCl-Соль 5-бром-1-(дифторметил)изоиндолина
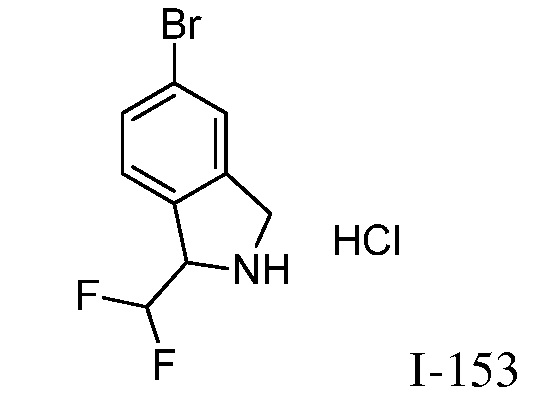
Стадия 1: (5-Бром-2-йодфенил)метанол
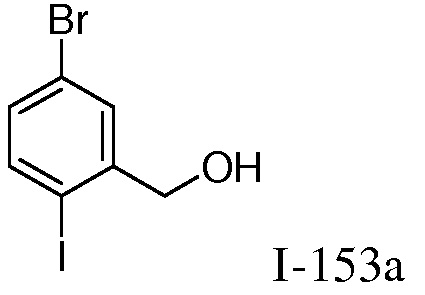
В 1 л круглодонную колбу загружали раствор 5-бром-2-йодбензойной кислоты (15,0 г, 45,9 ммоль) в тетрагидрофуране (150 мл), затем добаляли по каплям боран-тетрагидрофуран (459 мл, 0,460 моль, 1,0 М). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем гасили добавлением воды (200 мл). Полученную смесь экстрагировали дихлорметаном (3×100 мл), и объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CD3OD) δ 7,72 (д, J=8,4 Гц, 1H), 7,66 (д, J=2,4 Гц, 1H), 7,20-7,17 (м, 1H), 4,54 (с, 2H).
Стадия 2: (5-Бром-2-йодбензил)окси)(трет-бутил)диметилсилан
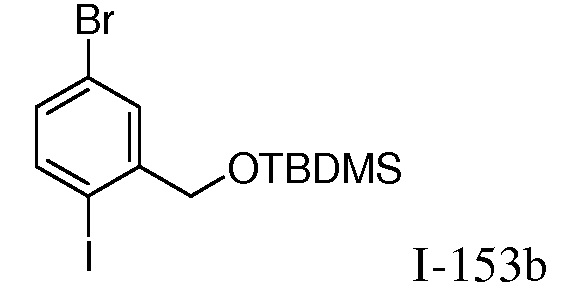
В 1 л 3-горлой круглодонной колбе (5-бром-2-йодфенил)метанол (14,0 г, 44,7 ммоль) и 1H-имидазол (6,09 г, 89,0 ммоль) объединяли с дихлорметаном (150 мл). Затем добавляли по каплям трет-бутилхлордиметилсилан (10,1 г, 67,1 ммоль) при 0-4°С. Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов, затем добавляли воду (50 мл). Полученную смесь экстрагировали этилацетатом (3×50 мл), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя 5-10% этилацетатом в петролейном эфире с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3) δ 7,67-7,62 (м, 2H), 7,15-7,12 (м, 1H), 4,61 (с, 2H), 1,01 (с, 9H), 0,20 (с, 6H).
Стадия 3: 1-(4-Бром-2-(((трет-бутилдиметилсилил)окси)метил)фенил)-2,2-дифторэтанон
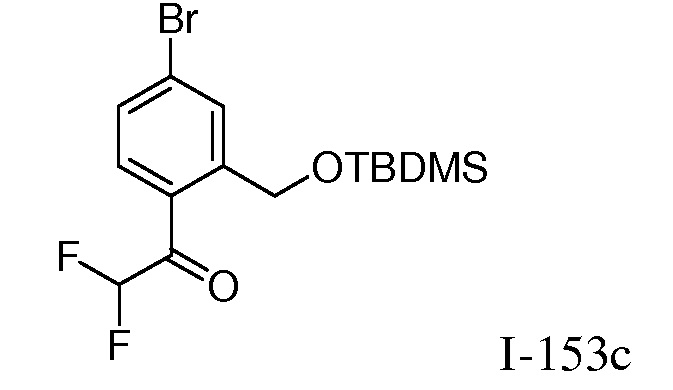
В 250 мл 3-горлую круглодонную колбу в атмосфере азота загружали раствор ((5-бром-2-йодбензил)окси)(трет-бутил)диметилсилана (12,0 г, 28,1 ммоль) в тетрагидрофуране (120 мл). Бутиллитий (11,2 мл, 28,1 ммоль, 2,5 М в тетрагидрофуране) добавляли по каплям в течение 1 ч при -78°С, затем добавляли этил 2,2-дифторацетат (5,23 г, 42,1 ммоль). Реакционную смесь перемешивали при -78°С в течение дополнительных 2 часов, затем гасили водой (100 мл). Полученную смесь экстрагировали этилацетатом (3×50 мл), и объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, CDCl3) δ 8,08 (с, 1H), 7,82 (д, J=8,0 Гц, 1H), 7,59-7,56 (м, 1H), 6,40-6,13 (м, 1H), 5,03 (с, 2H), 0,99 (с, 9H), 0,17 (с, 6H).
Стадия 4: N-(1-(4-Бром-2-(((трет-бутилдиметилсилил)окси)метил)фенил)-2,2-дифторэтил)-2-метилпропан-2-сульфинамид
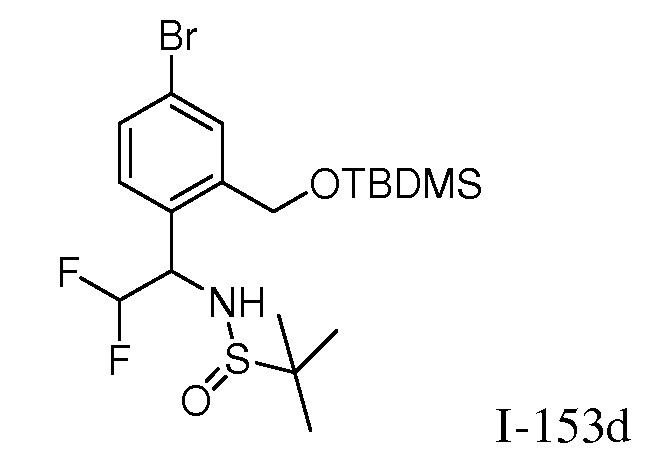
В 500-мл круглодонную колбу загружали при температуре окружающей среды ТГФ (120 мл), 1-(4-бром-2-(((трет-бутилдиметилсилил)окси)метил)фенил)-2,2-дифторэтанон (10,0 г , 26,4 ммоль), 2-метилпропан-2-сульфинамид (4,79 г, 39,5 ммоль) и тетраэтоксититан (12,0 г, 52,7 ммоль). Реакционную смесь нагревали при 80°С в течение 16 часов, затем добавляли боргидрид натрия (3,01 г, 79,2 ммоль). Смесь перемешивали при температуре окружающей среды в течение дополнительных 2 часов, затем добавляли насыщенный водный раствор хлорида аммония (100 мл). Гашеную реакционную смесь экстрагировали этилацетатом (3×50 мл), и объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки. МСНР (ИЭС) рассчитано для C19H33BrF2NO2SSi [M + H]+: 484, 486 (1:1), найдено 484, 486 (1:1).
Стадия 5: N-(1-(4-Бром-2-(гидроксиметил)фенил)-2,2-дифторэтил)-2-метилпропан-2-сульфинамид
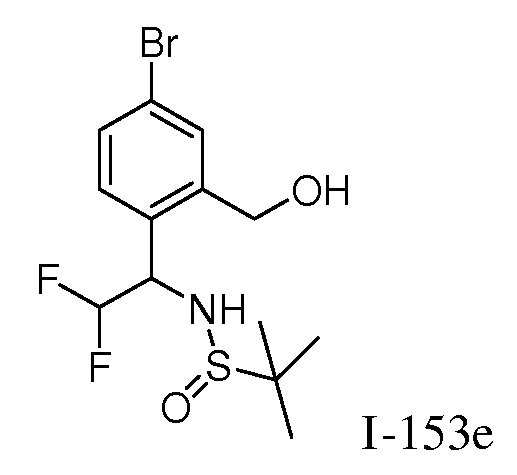
В 250 мл круглодонную колбу загружали N-(1-(4-бром-2-(((трет-бутилдиметилсили)окси)метил)фенил)-2,2-дифторэтил)-2-метилпропан-2-сульфинамид (12,00 г, 24,77 ммоль), раствор тетрабутиламмония фторида в ТГФ (49,5 мл, 49,5 ммоль) и ТГФ (150 мл). Реакционную смесь выдерживали при температуре окружающей среды в течение 2 часов, затем промывали водой (3×50 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью дихлорметан/метанол (200:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H19BrF2NO2S [M + H]+: 370, 372 (1:1), найдено 370, 372 (1:1).
Стадия 6: HCl-Соль 5-бром-1-(дифторметил)изоиндолина
N-(1-(4-Бром-2-(гидроксиметил)фенил)-2,2-дифторэтил)-2-метилпропан-2-сульфинамид (0,50 г, 1,4 ммоль) и тионилхлорид (0,41 мл, 5,6 ммоль) объединяли с дихлорметаном (5 мл) при температуре окружающей среды. Реакционную смесь перемешивали при той же температуре в течение 5 часов, затем концентрировали в вакууме. Остаток растворяли в водном растворе гидроксида натрия (5,0 М, 5,0 мл, 25 ммоль) и изопропаноле (5 мл). Полученный раствор затем перемешивали при температуре окружающей среды в течение 1 часа. Отделенный органический слой обрабатывали концентрированной хлористоводородной кислотой (12,0 М, 0,2 мл) и происходило выпадение осадка. Твердое вещество собирали фильтрацией и сушили в вакууме с получением соли хлористоводородной кислоты и указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C9H9BrF2N [M + H]+: 248, 250 (1:1), найдено 248, 250 (1:1).
Промежуточный продукт 154
трет-Бутил-5-бром-1-метилизоиндолин-2-карбоксилат
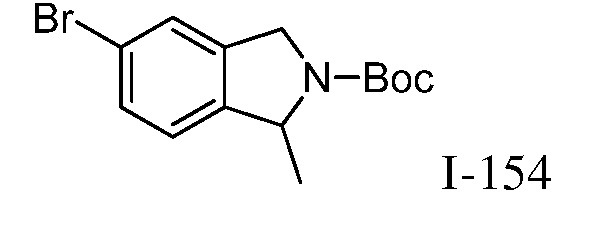
Стадия 1: 3-Гидрокси-3-метилизоиндолин-1-он
В продуваемую и поддерживаемую в инертной атмосфере азота 500-мл трехгорлую круглодонную колбу помещали изоиндолин-1,3-дион (10,00 г, 68,03 ммоль) в дихлорметане (300 мл). К этому раствору добавляли метилмагнийиодид (100 мл, 2,0 М в диэтиловом эфире, 0,200 моль) по каплям в бане лед/вода. После перемешивания в течение 5 ч, реакцию останавливали насыщенным водным раствором хлорида аммония (100 мл). Полученную смесь экстрагировали дихлорметаном (3×100 мл). Органические слои объединяли, промывали насыщенным раствором соли (150 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением 3-гидрокси-3-метилизоиндолин-1-она. 1H ЯМР (300 MГц, ДМСО-d6) δ 8,80 (уш., 1H), 7,62-7,56 (м, 3H), 7,49-7,44 (м, 1H), 6,09 (с, 1H), 1,59 (с, 3H).
Стадия 2: 3-Метилизоиндолин-1-он
В продуваемую и поддерживаемую в инертной атмосфере азота 500-мл трехгорлую круглодонную колбу помещали раствор 3-гидрокси-3-метилизоиндолин-1-она (5,70 г, 35,0 ммоль) в дихлорметане (100 мл). Триэтилсилан (40,6 г, 0,350 моль) и комплекс трифторборан-диэтиловый эфир (28 мл) добавляли по каплям, соответственно, при -15°C. Полученный раствор перемешивали в течение 18 ч при температуре окружающей среды. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (40 мл) и экстрагировали дихлорметаном (3×60 мл). Органические слои объединяли, промывали насыщенным раствором соли (150 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя 20-50% этилацетата в петролейном эфире с получением 3-метилизоиндолин-1-она. 1H ЯМР (300 MГц, ДМСО-d6) δ 8,61 (уш.с, 1H), 7,83-7,58 (м, 3H), 7,50-7,43 (м, 1H), 4,65-4,58 (м, 1H), 1,36 (д, J=6,6 Гц, 3H).
Стадия 3: 6-Бром-3-метилизоиндолин-1-он
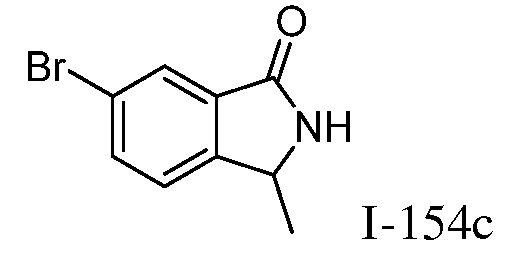
В продуваемую и поддерживаемую в инертной атмосфере азота 100-мл трехгорлую круглодонную колбу помещали алюминия трихлорид (4,98 г, 37,7 ммоль) и раствор 3-метилизоиндолин-1-она (2,20 г, 15,0 ммоль) в 1,2-дихлорэтане (30 мл). Бром (1,00 мл, 19,74 ммоль) добавляли по каплям, и смесь кипятили с обратным холодильником в течение 15 ч. После охлаждения до температуры окружающей среды реакционную смесь гасили насыщенным водным раствором тиосульфата натрия (10 мл). Смесь экстрагировали этилацетатом (100 мл), и органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:1). Остаток растирали в порошок при помощи диэтилового эфира с получением 6-бром-3-метилизоиндолин-1-она. 1H ЯМР (300 MГц, ДМСО-d6) δ 8,00 (с, 1H), 7,72 (д, J=8,0 Гц, 1H), 7,52 (с, 1H), 7,34 (д, J=8,0 Гц, 1H), 4,73-4,68 (м, 1H), 1,53 (д, J=6,8 Гц, 3H).
Стадия 4: 5-Бром-1-метилизоиндолин
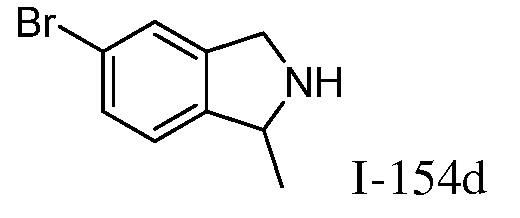
В 100-мл круглодонную колбу помещали 6-бром-3-метилизоиндолин-1-он (0,80 г, 3,5 ммоль), боргидрид натрия (1,21 г, 31,8 ммоль) и ТГФ (40 мл). Комплекс трифторборан-диэтиловый эфир (6,02 г, 42,4 ммоль) добавляли по каплям в бане лед/вода. Смесь перемешивали в течение 16 ч при 70°С. После охлаждения до температуры окружающей среды реакционную смесь гасили водой (80 мл). Добавляли водный раствор гидроксида натрия (5,0 М), чтобы довести до рН = 10. Смесь экстрагировали дихлорметаном (3×60 мл). Органические слои объединяли, промывали насыщенным раствором соли (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток растворяли в соляной кислоте (6,0 М, 60 мл) с последующим добавлением толуола (30 мл). Смесь кипятили с обратным холодильником в течение 10 мин и охлаждали до температуры окружающей среды. Водный слой отделяли и рН доводили до 10 с помощью водного раствора гидроксида натрия (5,0 М), затем экстрагировали дихлорметаном (3×40 мл). Органические слои объединяли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением 5-бром-1-метилизоиндолина. 1H ЯМР (400 MГц, CDCl3) δ 7,45-7,37 (м, 2H), 7,07 (д, J=8,0 Гц, 1H), 4,46-4,41 (м, 1H), 4,28-4,16 (м, 2H), 2,31 (уш.с, 1H), 1,45 (д, J=6,4 Гц, 3H).
Стадия 5: трет-Бутил-5-бром-1-метилизоиндолин-2-карбоксилат
В 100-мл круглодонную колбу помещали 5-бром-1-метилизоиндолин (0,45 г, 2,1 ммоль), дихлорметан (30 мл), триэтиламин (0,43 г, 4,3 ммоль) и ди-трет-бутил дикарбонат (0,93 г, 4,2 ммоль). Смесь перемешивали в течение 18 ч при температуре окружающей среды. Растворитель удаляли в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный (1:10) с получением трет-бутил-5-бром-1-метилизоиндолин-2-карбоксилата. 1H ЯМР (400 MГц, CDCl3) δ 7,43-7,38 (м, 2H), 7,11-7,08 (м, 1H), 5,13-4,92 (м, 1H), 4,82-4,58 (м, 2H), 1,55-1,48 (м, 12H).
Промежуточный продукт 155
трет-Бутил-3-(4-бромфенил)-8-азабицикло[3.2.1]окт-3-ен-8-карбоксилат
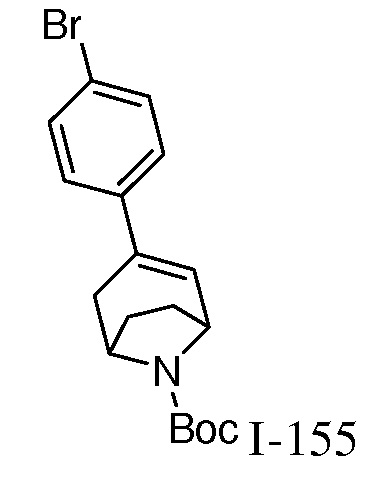
Стадия 1: трет-Бутил-3-(((трифторметил)сульфонил)окси)-8-азабицикло[3.2.1]окт-3-ен-8-карбоксилат
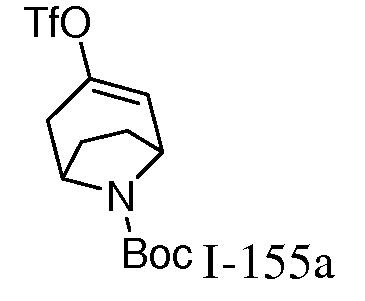
В 250 мл 3-горлую круглодонную колбу помещали раствор (1R,5S)-трет-бутил-3-оксо-8-азабицикло[3.2.1]октан-8-карбоксилата (5,00 г, 22,2 ммоль) в тетрагидрофуране (100 мл). Бис(триметилсилил)амид лития (1,0 М в тетрагидрофуране, 26,6 мл, 26,6 ммоль) добавляли по каплям при -78°С. Смесь перемешивали при -78 C в течение 1 часа. Затем добавляли раствор 1,1,1-трифтор-N-фенил-N-((трифторметил)сульфонил)метансульфонамида (9,51 г, 26,6 ммоль) в тетрагидрофуране (30 мл) при -78°С. Смесь перемешивали в течение дополнительных 16ч при температуре окружающей среды. Растворитель удаляли в вакууме, и остаток растворяли в этилацетате (100 мл), промывали водой (2×50 мл) и насыщенным раствором соли (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (5: 100) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H19F3NO5S [M + H]+: 358, найдено 358; 1H ЯМР (400 MГц, CDCl3) δ 6,08 (д, J=5,4 Гц, 1H), 4,59-4,33 (м, 2H), 3,12-2,94 (м, 1H), 2,31-2,13 (м, 1H), 2,09-1,93 (м, 3H), 1,79-1,63 (м, 1H), 1,46 (с, 9H).
Стадия 2: трет-Бутил-3-(4-бромфенил)-8-азабицикло[3.2.1]окт-3-ен-8-карбоксилат
В 100-мл 3-горлую круглодонную колбу загружали трет-бутил-3-(((трифторметил)сульфонил)окси)-8-азабицикло[3.2.1]окт-3-ен-8-карбоксилат (0,50 г, 1,1 ммоль), (4-бромфенил)боронову кислоту (0,25 г, 1,3 ммоль), аддукт дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладия(II)-дихлорметан (77 мг, 0,11 ммоль), фосфат калия (0,27 г, 1,3 ммоль) и ДМФА (8 мл). Смесь нагревали при 80°С в течение 4 часов, затем добавляли воду (30 мл), и смесь экстрагировали этилацетатом (3×30 мл). Органические слои объединяли, промывали водой (30 мл) и насыщенным раствором соли (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:20) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C18H23BrNO2 [M + H]+: 365, 367 (1:1), найдено 365, 367 (1:1); 1H ЯМР (400 MГц, CDCl3) δ 7,42 (д, J=8,4 Гц, 2H), 7,21 (д, J=8,4 Гц, 2H), 6,43 (д, J=5,4 Гц, 1H), 4,52-4,48 (м, 2H), 3,09-3,01 (м, 1H), 2,28-1,92 (м, 4H), 1,76-1,65 (м, 1H), 1,46 (с, 9H).
Промежуточный продукт 156
(1S,4S)-трет-Бутил-4-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)циклогексанкарбоксилат
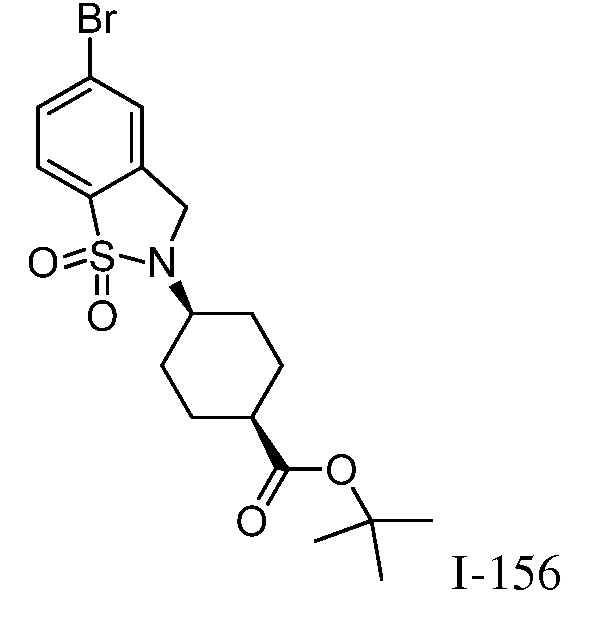
Стадия 1: (1R,4R)-трет-Бутил-4-гидроксициклогексанкарбоксилат
Раствор (1R,4R)-4-гидроксициклогексанкарбоновой кислоты (0,50 г, 3,5 ммоль) и 1,1-ди-трет-бутокси-N,N-диметилметанамина (2,12 г, 10,4 ммоль) в толуоле (20 мл) нагревали при 90°С в течение 16 часов, затем охлаждали до температуры окружающей среды. Добавляли водный раствор NaOH (4,0 М, 50 мл), и полученную смесь экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным водным раствором NaOH (2×50 мл), затем насыщенным раствором соли (2×50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме с получением сырого указанного в заголовке продукта. 1H ЯМР (300 MГц, CDCl3) δ 3,88-3,85 (м, 1H), 2,31-2,26 (м, 1H), 1,68-1,62 (м, 4H), 1,44 (с, 9H), 1,25-1,22 (м, 4H).
Стадия 2: (1R,4R)-трет-Бутил-4-(тозилокси)циклогексанкарбоксилат
(1R,4R)-трет-Бутил-4-гидроксициклогексанкарбоксилат (0,70 г, 2,1 ммоль), N,N-диметиламинопиридин (3,0 мг, 0,021 ммоль), триэтиламин (424 мг, 4,19 ммоль) и 4-метилбензол-1-сульфонилхлорид (0,48 г, 2,5 ммоль) объединяли с ДХМ (20 мл) в 50-мл круглодонной колбе в атмосфере азота при температуре окружающей среды. Смесь перемешивали в течение 16 часов, затем добавляли воду (50 мл). Смесь экстрагировали при помощи EtOAc (2×50 мл), и объединенные органические слои промывали насыщенным раствором соли (2×50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (10:1) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 7,78 (д, J=7,5 Гц, 2H), 7,32 (д, J=7,5 Гц, 2H), 4,41-4,36 (м, 1H), 2,47 (с, 3H), 2,16-2,14 (м, 1H), 1,95-1,86 (м, 4H), 1,51-1,45 (м, 4H), 1,44 (с, 9H).
Стадия 3: (1S,4S)-трет-бутил-4-(5-бром-1,1-диоксидобензо[d]изотиазол-2(3Н)-ил)циклогексанкарбоксилат
В 8-мл круглодонную колбу помещали 5-бром-2,3-дигидробензо[d]изотиазол 1,1-диоксид (50 мг, 0,20 ммоль), 2-метилпропан-2-олат калия (45 мг, 0,40 ммоль) и (1R,4R)-трет-бутил-4-(тозилокси)циклогексанкарбоксилат (86 мг, 0,24 ммоль) в N,N-диметилформамиде (0,50 мл) и бензоле (0,50 мл). Реакционную смесь нагревали при 100°С в течение 16 часов. Добавляли воду (10 мл), и смесь экстрагировали с помощью EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным раствором соли (2×50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали с помощью препаративной ТСХ (5:1 петролейный эфир/EtOAc) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C18H25BrNO4S [M + H]+: 430, 432 (1:1) найдено 430, 432 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,68-7,66 (м, 2H), 7,59 (с, 1H), 4,36 (с, 2H), 3,73-3,70 (м, 1H), 2,56-2,53 (м, 1H), 2,19-2,16 (м, 2H), 1,96-1,91 (м, 4H), 1,75-1,61 (м, 2H), 1,58 (с, 9H).
Таблица 34 раскрывает промежуточный продукт, который получали аналогичным образом, что и промежуточный продукт 156.
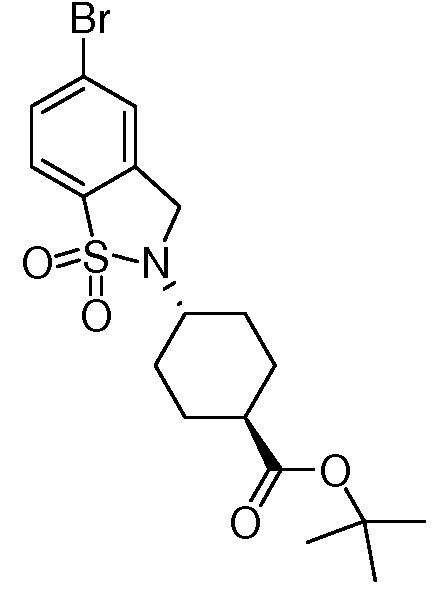
найдено 430, 432 (1:1)
Промежуточные продукты 158 и 159
(1S,4S и 1R,4R)-трет-Бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилат и (1R,4S и 1S,4R)-трет-Бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилат
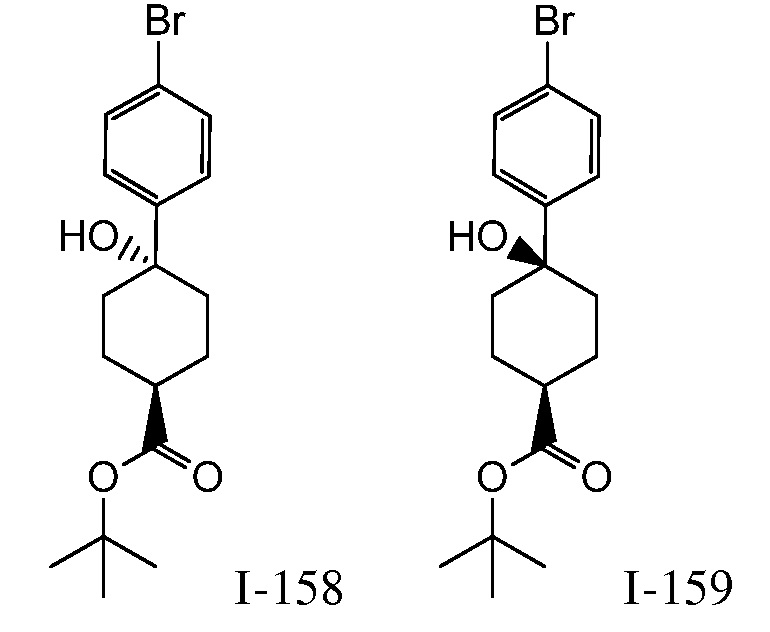
Стадия 1: 4-Оксоциклогексанкарбоновая кислота
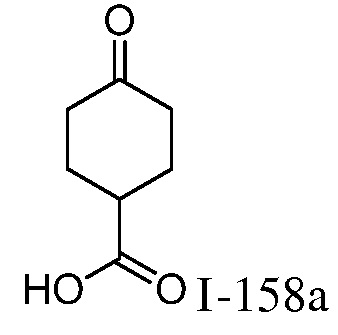
К раствору этил 4-оксоциклогексанкарбоксилата (11,0 г, 64,6 ммоль) в этаноле (80 мл) добавляли раствор NaOH (2,58 г, 64,6 ммоль) в воде (40 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов, затем подкисляли до рН = 1-3 с помощью HCl (4,0 М). Полученный раствор экстрагировали EtOAc (2×150 мл), и объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме с получением сырого указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C7H11O3 [M + H]+: 143, найдено 143.
Стадия 2: трет-Бутил-4-оксоциклогексанкарбоксилат
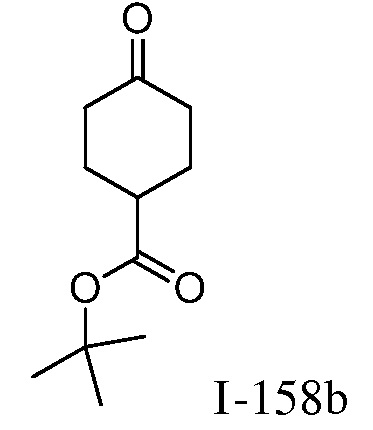
Раствор 4-оксоциклогексанкарбоновой кислоты (8,0 г, 0,040 моль), 4-диметиламинопиридина (6,88 г, 56,3 ммоль) и ди-трет-бутил дикарбоната (26,1 мл, 113 ммоль) в трет-бутиловом спирте (80 мл) нагревали при 70°С в течение 12 часов. Смесь охлаждали и концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (15:1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H19O3 [M + H]+: 199, найдено 199.
Стадия 3: (1S,4S и 1R,4R)-трет-бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилат и (1S,4R и 1R,4S)-трет-бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилат
К охлажденному раствору 1-бром-4-йодбензола (5,00 г, 17,7 ммоль) в тетрагидрофуране (100 мл) при -78°С по каплям добавляли бутиллитий (8,48 мл, 21,2 ммоль, 2,0 М в ТГФ) в течение 5 мин. Реакционную смесь перемешивали при -78°С в течение 1 часа, затем добавляли по каплям трет-бутил-4-оксоциклогексанкарбоксилат (2,80 г, 14,1 ммоль). Реакционную смесь поддерживали при -78°С в течение дополнительного часа, а затем гасили водой (10 мл). Гашеную реакционную смесь экстрагировали этилацетатом (2×80 мл), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (10:1) с получением рацемической смеси указанного в заголовке соединения. Диастереомеры разделяли с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (RP18 XBridge; 38-70% ацетонитрил/вода, содержащая 0,05% аммиака) с получением указанных в заголовке соединений (1S,4S и 1R,4R)-трет-Бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилата (I-156). МСНР (ИЭС) рассчитано для C17H24BrO3 [M+H]+: 355, 357 (1:1), найдено 355, 357 (1:1); 1H (400 MГц, ДМСО-d6) δ 7,53 (д, J=8,4 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H), 4,94 (с, 1H), 2,55-2,52 (м, 1H), 1,94-1,86 (м, 4H), 1,74-1,72 (м, 2H), 1,56-1,52 (м, 2H), 1,41 (с, 9H) и
(1S,4R и 1R,4S)-трет-бутил-4-(4-бромфенил)-4-гидроксициклогексанкарбоксилата (I-157). МСНР (ИЭС) рассчитано для C17H24BrO3 [M+H]+: 355, 357 (1:1), найдено 355, 357 (1:1); 1H ЯМР (400 MГц, ДМСО-d6) δ 7,50 (д, J=8,8 Гц, 2H), 7,45 (д, J=8,8 Гц, 2H), 4,90 (с, 1H), 2,28-2,27 (м, 1H), 1,84-1,62 (м, 8H), 1,43 (с, 9H).
Таблица 35 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточные продукты 158 и 159.
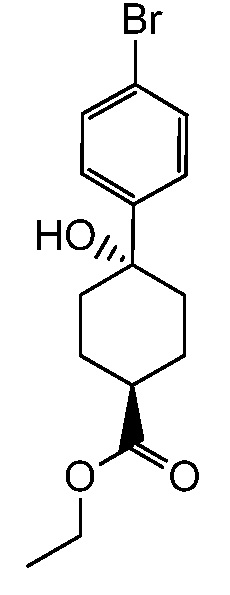
найдено 327, 329 (1:1)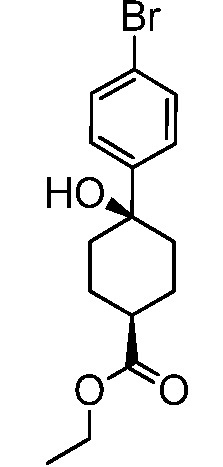
найдено 327, 329 (1:1)
Промежуточный продукт 162
Бром-3-гидрокси-2,2-диметил-2,3-дигидробензо[b]тиофен-1,1-диоксид
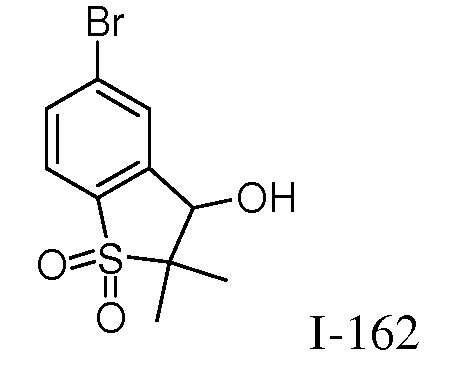
Стадия 1: Метил 2-((4-бромфенил)тио)ацетат
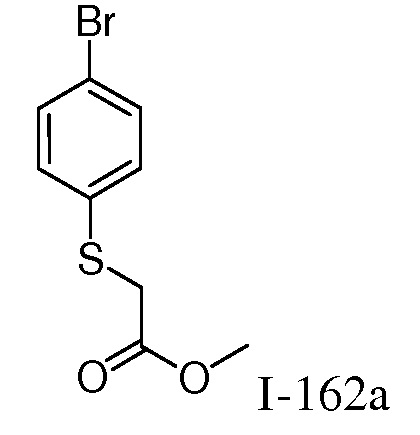
В 250-мл круглодонную колбу помещали 4-бромбензотиол (5,00 г, 26,4 ммоль), метил-2-бромацетат (6,07 г, 39,7 ммоль), триэтиламин (7,37 мл, 52,9 ммоль) и тетрагидрофуран (130 мл). Смесь нагревали при 70°С в течение 4 часов, затем концентрировали в вакууме. Остаток растворяли в воде (100 мл), затем экстрагировали этилацетатом (3×150 мл). Органические слои объединяли, промывали насыщенным раствором соли (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением сырого указанного в заголовке соединения. GCMS (ES) рассчитано для C9H9BrO2S [M]+: 260, 262 (1:1), найдено 260, 262 (1:1).
Стадия 2: 2-((4-Бромфенил)тио)уксусная кислота
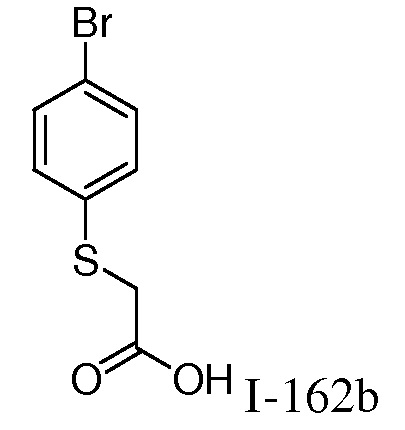
В 500-мл круглодонную колбу помещали метил 2-((4-бромфенил)тио)ацетат (7,40 г, 28,3 ммоль), гидроксид натрия (2,26 г, 56,6 ммоль) в метаноле (200 мл) и воде (20 мл). Смесь перемешивали при температуре окружающей среды в течение 16 часов, затем концентрировали в вакууме. Добавляли воду (100 мл) с последующим добавлением соляной кислоты (6,0 М) до рН = 5. Смесь экстрагировали этилацетатом (3×100 мл), и объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением сырого указанного в заголовке соединения. GCMS (ES) рассчитано для C8H7BrO2S [M]+: 246, 248 (1:1), найдено 246, 248 (1:1).
Стадия 3: 2-((4-Бромфенил)тио)ацетилхлорид
Раствор 2-((4-бромфенил)тио)уксусной кислоты (6,20 г, 25,1 ммоль) в тионилхлориде (150 мл) нагревали с обратным холодильником в течение 1 часа, затем концентрировали в вакууме с получением сырого указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки.
Стадия 4: 5-Бромбензо[b]тиофен-3(2H)-он
2-((4-бромфенил)тио)ацетилхлорид (21 г, 79 ммоль) добавляли по каплям к суспензии хлорида алюминия (13,7 г, 103 ммоль) в 1,2-дихлорэтане (150 мл) при 0-4°С. Смесь нагревали и выдерживали при температуре окружающей среды в течение 16 часов. Реакционную смесь добавляли к соляной кислоте (1,5 М, 150 мл), затем экстрагировали 1,2-дихлорэтаном (3×300 мл). Объединенные органические слои промывали насыщенным раствором соли (2×200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:30) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 7,88 (д, J=2,1 Гц, 1H), 7,66-7,62 (м, 1H), 7,31 (д, J=8,4 Гц, 1H), 3,83 (с, 2H).
Стадия 5: 5-Бромбензо[b]тиофен-3(2H)-он 1,1-диоксид
В 500-мл круглодонную колбу помещали 5-бромбензо[b]тиофен-3(2Н)-он (10,0 г, 43,7 ммоль) в 1,2-дихлорэтане (200 мл) при 0-4°С с последующим добавлением 3-хлорпербензойной кислоты (22,6 г, 131 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов, и добавляли насыщенный раствор бикарбоната натрия (150 мл) и воду (200 мл). Смесь экстрагировали 1,2-дихлорэтаном (3×500 мл), и объединенные органические слои промывали насыщенным раствором соли (2×200 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на соликагеле, элюируя смесью этилацетат/петролейный эфир (1:10) с получением указанного в заголовке соединения. 1H ЯМР (300 MГц, CDCl3) δ 8,15 (д, J=1,8 Гц, 1H), 8,08-8,04 (м, 1H), 7,86 (д, J=8,4 Гц, 1H), 4,13 (с, 2H).
Стадия 6: 5-Бром-2,2-диметилбензо[b]тиофен-3(2H)-он 1,1-диоксид
В 50-мл круглодонную колбу добавляли 5-бромбензо[b]тиофен-3(2H)-он 1,1-диоксид (0,51 г, 1,9 ммоль), йодметан (0,69 г, 4,9 ммоль) и 1,5-диазабицикло[4.3.0]нон-5-ен (0,73 мл, 4,9 ммоль) в тетрагидрофуране (20 мл). Смесь нагревали при 70°С в течение 3 часов, затем охлаждали до комнатной температуры. Добавляли воду (50 мл) и полученную смесь экстрагировали этилацетатом (3×50 мл). Органические слои объединяли, промывали насыщенным раствором соли (2×100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:30) с получением указанного в заголовке соединения. GCMS (ES) рассчитано для C10H9BrO3S [M]+: 288, 290 (1:1), найдено 288, 290 (1:1); 1H ЯМР (400 MГц, CDCl3) δ 8,17 (д, J=1,8 Гц, 1H), 8,09-8,07 (м, 1H), 7,91 (д, J=6,4 Гц, 1H), 1,65 (с, 6H).
Стадия 7: Бром-3-гидрокси-2,2-диметил-2,3-дигидробензо[b]тиофен 1,1-диоксид
В 50-мл круглодонную колбу помещали 5-бром-2,2-диметилбензо[b]тиофен-3(2H)-он 1,1-диоксид (0,60 г, 2,1 ммоль) в метаноле (20 мл), затем добавляли боргидрид натрия (0,450 г, 10,4 ммоль). Реакционную смесь перемешивали в течение 1 ч, затем гасили водой (2 мл). Смесь экстрагировали этилацетатом (3×20 мл), и органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,85-7,80 (м, 3H), 6,62 (д, J=6,0 Гц, 1H), 5,99 (д, J=6,0 Гц, 1H), 1,46 (с, 3H), 1,18 (с, 3H).
Таблица 36 раскрывает промежуточные продукты, которые получали аналогичным образом, что и промежуточный продукт 162, используя соответствующий электрофил.
I-163
Промежуточный продукт 165
(R и S)-2-(4-Бромфенил)-2-(трифторметил)пирролидин
Стадия 1: 3-(4-Бромбензоил)-1-винилпирролидин-2-он
Калия трет-бутоксид (6,26 г, 55,8 ммоль) добавляли к раствору 1-винилпирролидин-2-она (6,20 г, 55,8 ммоль) и метил 4-бромбензоата (10,00 г, 46,50 ммоль) в тетрагидрофуране (150 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа, затем добавляли воду (200 мл) и рН доводили до 7 с помощью хлористоводородной кислоты (1,0 М). Полученную смесь экстрагировали EtOAc (3×200 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-25% EtOAc в петролейном эфире с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C13H13BrNO2 [M + H]+: 294, 296 (1:1), найдено 294, 296 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,90 (д, J=6,6 Гц, 2H), 7,65 (д, J=6,6 Гц, 2H), 7,06-6,97 (м, 1H), 4,55-4,50 (м, 3H), 3,77-3,68 (м, 1H), 3,62-3,55 (м, 1H), 2,80-2,71 (м, 1H), 2,37-2,28 (м, 1H).
Стадия 2: 5-(4-Бромфенил)-3,4-дигидро-2H-пиррол
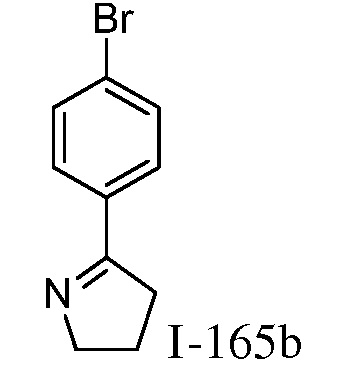
Суспензию 3-(4-фторбензоил)-1-винилпирролидин-2-она (5,0 г, 17,0 ммоль) в HCl (8,0 М, 20,0 мл, 160 ммоль) нагревали с обратным холодильником в течение 16 часов. Смесь охлаждали до температуры окружающей среды и экстрагировали EtOAc (3×20 мл). Водный слой подщелачивали до рН = 13 с помощью NaOH (15%-ный водный раствор) и экстрагировали ДХМ (5×20 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-25% EtOAc в петролейном эфире с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C10H11BrN [M + H]+: 224, 226 (1:1), найдено 224, 226 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,74-7,69 (м, 2H), 7,56-7,52 (м, 2H), 4,09-4,02 (м, 2H), 2,96-2,88 (м, 2H), 2,10-2,00 (м, 2H).
Стадия 3 (S и R)-2-(4-Бромфенил)-2-(трифторметил)пирролидин
К охлажденному льдом раствору 5-(4-бромфенил)-3,4-дигидро-2Н-пиррола (0,80 г, 3,6 ммоль) в ацетонитриле (3 мл) последовательно добавляли трифторметансульфокислоту (0,67 г, 4,5 ммоль), гидрофторид калия (0,84 г, 11 ммоль) и триметил(трифторметил)силан (5,08 г, 35,7 ммоль) при 0°C. Смесь нагревали до температуры окружающей среды и перемешивали в течение 48 часов, затем добавляли насыщенный водный раствор NaHCO3 до рН>7. Раствор экстрагировали EtOAc (3×10 мл), и объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-20% ДХМ в петролейном эфире с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C11H12BrF3N [M + H]+: 294, 296 (1:1), найдено 294, 296 (1:1); 1H ЯМР (300 MГц, CDCl3) δ 7,49 (д, J=5,4 Гц, 2H), 7,42 (д, J=5,4 Гц, 2H), 3,29-3,21 (м, 1H), 3,16-3,08 (м, 1H), 2,60-2,51 (м, 1H), 2,25-2,16 (м, 1H), 2,08-1,94 (м, 1H), 1,89-1,75 (м, 1H).
Промежуточные продукты 166 и 167
(R или S)-2-(4-Бромфенил)-2-(трифторметил)пиперидин и (R или S)-2-(4-Бромфенил)-2-(трифторметил)пиперидин
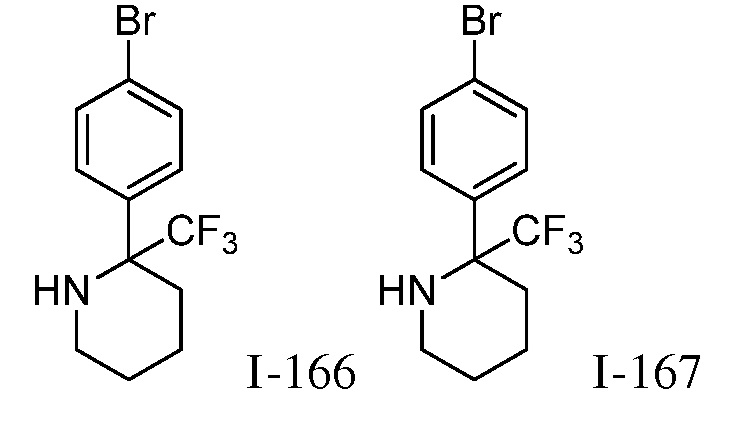
Стадия 1: 4-Бромбензоилхлорид
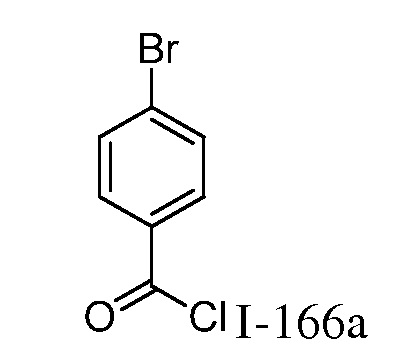
Раствор 4-бромбензойной кислоты (10,0 г, 49,7 ммоль) в сернокислом дихлориде (59 г, 0,50 моль) нагревали при 80°С в течение 16 часов. Затем смесь концентрировали в вакууме с получением указанного в заголовке соединения, которое переносили на следующую стадию без дополнительной очистки.
Стадия 2: трет-Бутил-3-(4-бромбензоил)-2-оксопиперидин-1-карбоксилат
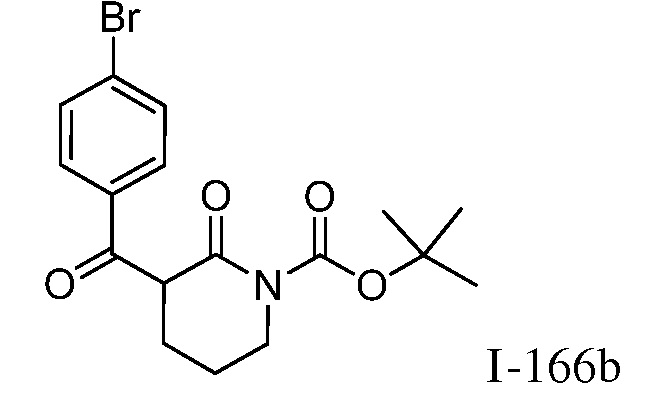
Лития бис(триметилсилил)амид (1,0 М в ТГФ, 2,11 мл, 2,11 ммоль) добавляли к раствору трет-бутил-2-оксопиперидин-1-карбоксилата (0,20 г, 1,0 ммоль) в ТГФ (2 мл) при -78°С. Полученную смесь перемешивали в течение 10 мин, затем добавляли 4-бромбензоилхлорид (0,22 г, 1,0 ммоль). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 1 часа, затем добавляли насыщенный водный раствор хлорида аммония (20 мл). Гашеную реакционную смесь экстрагировали EtOAc (3×10 мл), и объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-1% EtOAc в петролейном эфире с получением трет-бутил-3-(4-бромбензоил)-2-оксопиперидин-1-карбоксилата. МСНР (ИЭС) рассчитано для: C17H21BrNO4 [M + H]+: 382, 384 (1:1), найдено 382, 384 (1:1).
Стадия 3: 6-(4-Бромфенил)-2,3,4,5-тетрагидропиридин
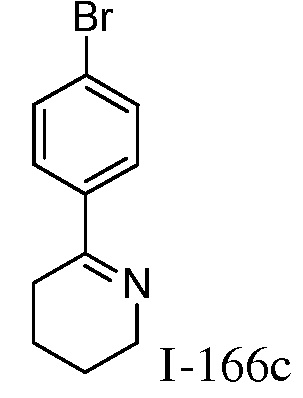
трет-Бутил-3-(4-фторбензоил)-2-оксопиперидин-1-карбоксилат (2,00 г, 5,23 ммоль) объединяли с HCl (8,0 М, 43,6 мл, 0,520 моль) при температуре окружающей среды. Полученный раствор нагревали при 80°С в течение 16 часов. Затем реакционную смесь выливали в насыщенный водный раствор Na2CO3 (50 мл) и экстрагировали EtOAc (3×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-1% EtOAc в петролейном эфире с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для: C11H13BrN [M + H]+: 238, 240 (1:1), найдено 238, 240 (1:1).
Стадия 4: (R или S)-2-(4-бромфенил)-2-(трифторметил)пиперидин и (R или S)-2-(4-бромфенил)-2-(трифторметил)пиперидин
К раствору 6-(4-бромфенил)-2,3,4,5-тетрагидропиридина (1,0 г, 4,2 ммоль) в ацетонитриле (10 мл) добавляли последовательно трифторметансульфокислоту (3,30 г, 22,0 ммоль), гидрофторид калия (3,94 калия г, 50,4 ммоль) и триметил(трифторметил)силан (5,97 г, 42,0 ммоль) при 0-4°С. Полученную смесь перемешивали при температуре окружающей среды в течение 48 часов. Реакционную смесь затем гасили насыщенным водным раствором NaHCO3 (50 мл) с последующей экстракцией EtOAc (3×30 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 0-1% ДХМ в петролейном эфире с получением рацемической смеси указанного в заголовке соединения. Указанные в заголовке соединения затем разделяли хиральной СЖХ, следуя нижеописанной процедуре:
Используемая колонка: Chiralpak IA, 2×25см
Подвижная фаза: 15% iPrOH в CO2
Пик A (I-166): (R или S)-2-(4-Бромфенил)-2-(трифторметил)пиперидин. Tуд = 4,74 мин. МСНР (ИЭС) рассчитано для C12H14BrF3N [M + H]+: 308, 310 (1:1), найдено 308, 310 (1:1).
Пик B (I-167): (R или S)-2-(4-Бромфенил)-2-(трифторметил)пиперидин. Tуд = 5,48 мин. МСНР (ИЭС) рассчитано для C12H14BrF3N [M + H]+: 308, 310 (1:1), найдено 308, 310 (1:1).
Пример 1-1
(цис)-2-{3-[(4-Фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил (рацемическая смесь)
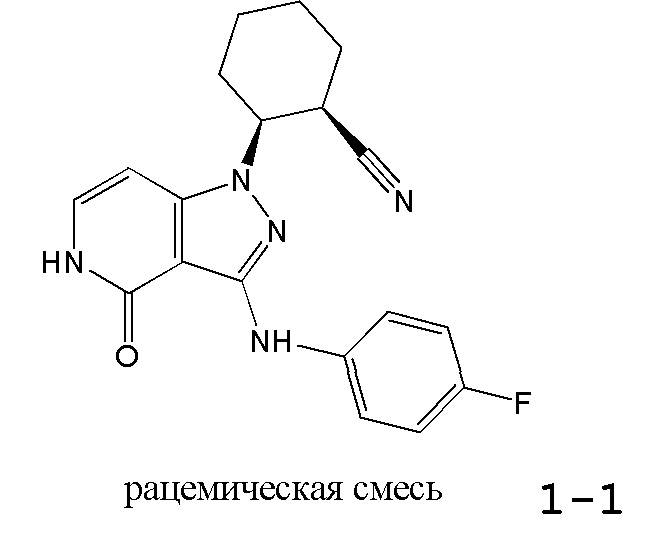
Стадия 1: цис-2-(4-(Бензилокси)-3-((4-фторфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (рацемическая смесь)
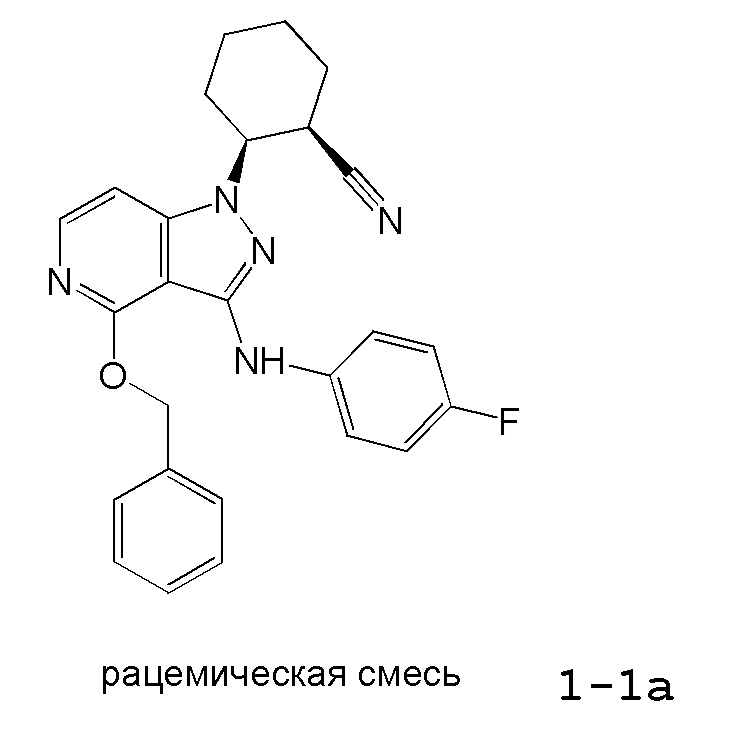
В пробирку загружали (цис)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрил (I-2; 24 мг; 0,069 ммоль), ди-трет-бутил(2',4',6'-триизопропил-3,4,5,6-тетраметил[1,1'-бифенил]-2-ил)фосфин (20 мг, 0,041 ммоль), Pd2(dba)3 (13 мг, 0,014 ммоль) и ацетат калия (17 мг, 0,17 ммоль). Добавляли 2-пропанол (0,75 мл) и 4-бромфторбензол (19 мкл, 0,17 ммоль), и смесь барботировали с помощью N2. Затем пробирку герметично закрывали и нагревали при 85°С в течение 2,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (30 мл) и промывали водой (10 мл), затем насыщенным раствором соли (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением остатка, который очищали хроматографией на силикагеле (0-100% EtOAc/гексаны) с последующей дополнительной очисткой препаративной тонкослойной хроматографией (20% ацетон/гексаны) с получением указанного в заголовке соединения (рацемической смеси). МСНР (ИЭС) рассчитано для C26H25FN5O [M+H]+: 442, найдено 442.
Стадия 2: (цис)-2-{3-[(4-Фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил (рацемическая смесь)
К раствору цис-2-(4-(бензилокси)-3-((4-фторфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила (рацемической смеси) (25 мг, 0,057 ммоль) в EtOAc (2 мл) в атмосфере азота добавляли 10% Pd/C (10 мг). Реакционную смесь помещали в атмосферу Н2 (баллон) и энергично перемешивали при комнатной температуре в течение 2 часов. Баллон Н2 убирали, и добавляли EtOH (2 мл) и МеОН (2 мл). Смесь подвергали воздействию ультразвука в течение нескольких минут, и затем катализатор удаляли путем фильтрации. Фильтрат концентрировали в вакууме, и остаток очищали с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (С-18; ацетонитрил/вода, содержащая 0,1% ТФУК). Лиофилизация фракций, содержащих целевой продукт, давала указанное в заголовке соединение (рацемическую смесь). МСНР (ИЭС) рассчитано для C19H19FN5O [M+H]+: 352, найдено 352. 1H ЯМР (600 MГц, ДМСО-d6): δ 11,06 (д, J=5,4 Гц, 1H), 8,00 (с, 1H), 7,74 (м, 2H), 7,17 (м, 1H), 7,02 (м, 2H), 6,59 (д, J=7,2 Гц, 1H), 4,58 (м, 1H), 3,43 (м, 1H), 2,21 (м, 1H), 1,99 (м, 1H), 1,82-1,90 (м, 3H), 1,66 (м, 1H), 1,45-1,58 (м, 2H).
Пример 2-1
(транс)-2-{3-[(4-Фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил (рацемическая смесь)
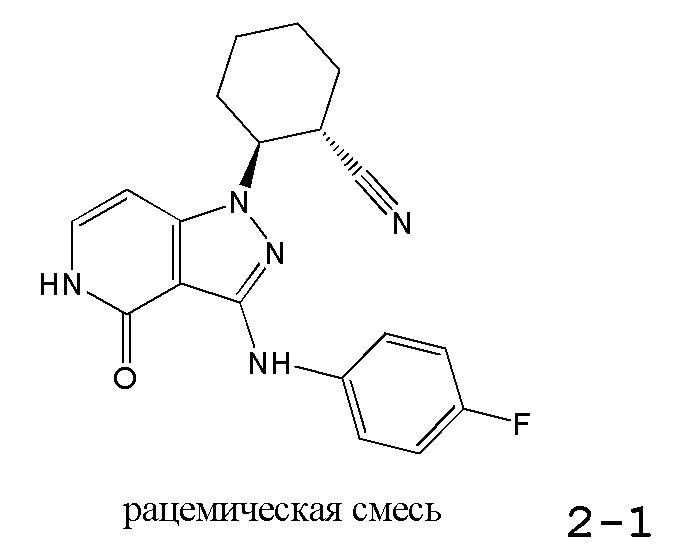
Стадия 1: (транс)-2-(4-(Бензилокси)- 3-((4-фторфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (рацемическая смесь)
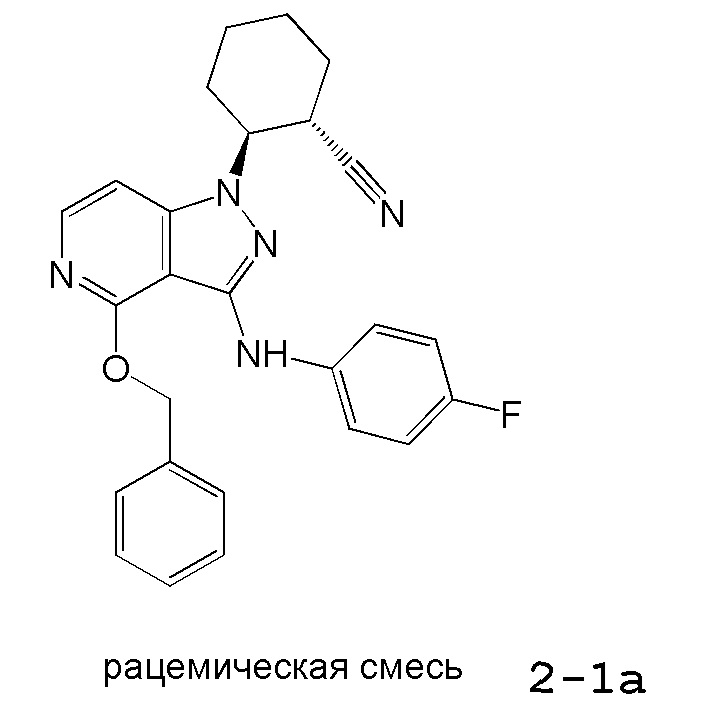
В пробирку загружали (транс)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрил (I-3; 36,0 мг; 0,104 ммоль), ди-трет-бутил(2',4',6'-триизопропил-3,4,5,6-тетраметил[1,1'-бифенил]-2-ил)фосфин (30 мг, 0,062 ммоль), Pd2(dba)3 (19 мг, 0,021 ммоль) и ацетат калия (25 мг, 0,26 ммоль). Добавляли 2-пропанол (1,0 мл) и 4-бромфторбензол (28 мкл, 0,26 ммоль), и смесь барботировали с помощью N2. Затем пробирку герметично закрывали и нагревали при 85°С в течение 2,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (30 мл) и промывали водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка остатка с помощью хроматографии на силикагеле (0-100% EtOAc/гексаны) давала указанного в заголовке соединения (рацемическую смесь). МСНР (ИЭС) рассчитано для C26H25FN5O [M+H]+: 442, найдено 442.
Стадия 2: (транс)-2-{3-[(4-Фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил (рацемическая смесь)
К раствору (транс)-2-(4-(бензилокси)-3-((4-фторфенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрилу (рацемической смеси) (45 мг, 0,057 ммоль) в EtOAc (4 мл) добавляли EtOH (1 мл) и 10% Pd/C (10 мг). Реакционную смесь помещали в атмосферу Н2 (баллон) и энергично перемешивали при комнатной температуре в течение 2 часов. Баллон Н2 затем убирали, и катализатор удаляли фильтрацией. Фильтрат концентрировали в вакууме, и остаток очищали с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (С-18; ацетонитрил/вода, содержащая 0,1% ТФУК). Лиофилизация фракций, содержащих целевой продукт, давала указанное в заголовке соединение (рацемическую смесь). МСНР (ИЭС) рассчитано для C19H19FN5O [M+H]+: 352, найдено 352. 1H ЯМР (600 MГц, ДМСО-d6): δ 11,05 (д, J=5,4 Гц, 1H), 8,07 (с, 1H), 7,66 (м, 2H), 7,18 (дд, J=7,2, 6,0 Гц, 1H), 7,09 (м, 2H), 6,63 (д, J=7,2 Гц, 1H), 4,64 (м, 1H), 3,28 (м, 1H), 2,15 (м, 1H), 1,68-1,87 (м, 5H), 1,45 (м, 1H), 1,33 (м, 1H).
Пример 3-1
(1R,2R)-2-{3-[(2-Фторапиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил
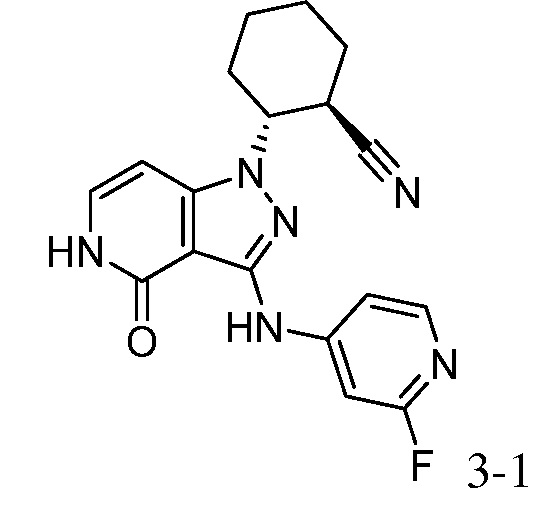
Стадия 1: (1R,2R)-2-(4-(Бензилокси)-3-((2-фторпиридин-4-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
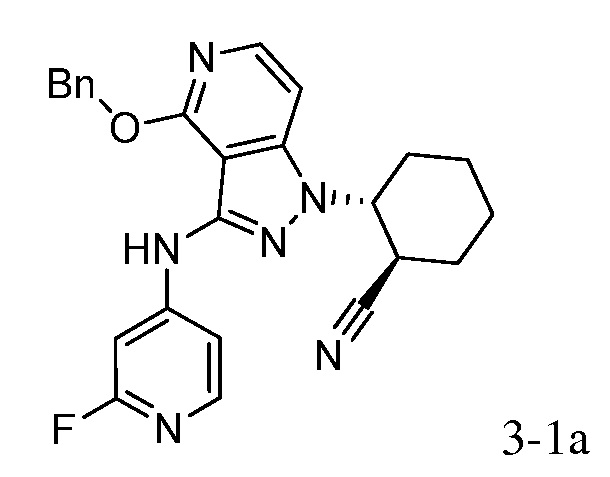
В пробирку загружали (1R,2R)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексанкарбонитрил (I-4; 28 мг; 0,082 ммоль), ди-трет-бутил(2',4',6'-триизопропил-3,4,5,6-тетраметил[1,1'-бифенил]-2-ил)фосфин (24 мг, 0,049 ммоль ), Pd2(dba)3 (15 мг, 0,016 ммоль), 4-бром-2-фторпиридина (36,1 мг, 0,205 ммоль) и ацетат калия (20,1 мг, 0,205 ммоль). Добавляли 2-пропанол (1,0 мл), и смесь барботировали с помощью N2. Затем пробирку герметично закрывали и нагревали при 85°С в течение 2,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (30 мл) и промывали водой (10 мл) и насыщенным раствором соли (10 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Очистка остатка с помощью хроматографии на силикагеле (0-100% EtOAc/гексаны) с последующей дополнительной очисткой препаративной тонкослойной хроматографией (25% ацетон/гексаны) давала указанное в заголовке соединение. МСНР (ИЭС) рассчитано для C25H24FN6O [M+H]+: 443, найдено 443. 1H ЯМР (600 MГц, CDCl3): δ 7,97 (д, J=5,4 Гц, 1H), 7,93 (д, J=6,0 Гц, 1H), 7,62 (с, 1H), 7,50 (д, J=7,2 Гц, 2H), 7,45 (т, J=7,2 Гц, 2H), 7,40 (т, J=7,2 Гц, 1H), 7,28 (с, 1H), 6,91 (д, J=6,6 Гц, 1H), 6,85 (д, J=5,4 Гц, 1H), 5,56 (с, 2H), 4,33 (м, 1H), 3,29 (м, 1H), 2,37 (м, 1H), 1,98-2,10 (м, 3H), 1,91 (м, 1H), 1,80 (м, 1H), 1,41-1,55 (м, 2H).
Стадия 2: (1R,2R)-2-{3-[(2-Фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрил
К раствору (1R,2R)-2-(4-(Бензилокси)-3-((2-фторпиридин-4-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (33 мг, 0,074 ммоль) в EtOAc (3 мл) добавляли EtOH (0,5 мл) и 10% Pd/C (10 мг). Реакционную смесь помещали в атмосферу Н2 (баллон) и энергично перемешивали при комнатной температуре в течение 2 часов. Баллон Н2 затем убирали, и катализатор удаляли фильтрацией. Фильтрат концентрировали в вакууме, и остаток очищали с помощью хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C18H18FN6O [M+H]+: 353, найдено 353. 1H ЯМР (600 MГц, ДМСО-d6): δ 11,2 (с, 1H), 8,99 (с, 1H), 7,93 (д, J =6,0 Гц, 1H), 7,50 (д, J=6,0 Гц, 1H), 7,36 (с, 1H), 7,23 (м, 1H), 6,69 (д, J=7,2 Гц, 1H), 4,72 (м, 1H), 3,30 (м, 1H), 2,16 (м, 1H), 1,67-1,92 (м, 5H), 1,46 (м, 1H), 1,34 (м, 1H).
Таблица 37 раскрывает Примеры, которые получали по аналогии с Примером 3-1, исходя из соответствующего энантиомерно чистого карбонитрила. В отдельных случаях, общую процедуру модифицировали использованием в качестве альтернативы от 1,75 до 2,7 эквивалентов основания K3PO4 или КОАс и/или 0,11% мол. [(2-ди-трет-бутилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладия (II) метансульфоната (t-BuXPhos Pd G3), и/или 1,2-1,4 эквивалентов арилбромид-связывающего партнера в концентрации приблизительно 0,1 М в трет-амиловом спирте, при 70-90°С. В некоторых случаях, реакцию гидрогенолиза проводили с использованием EtOAc, MeOH или ТГФ в качестве растворителя.
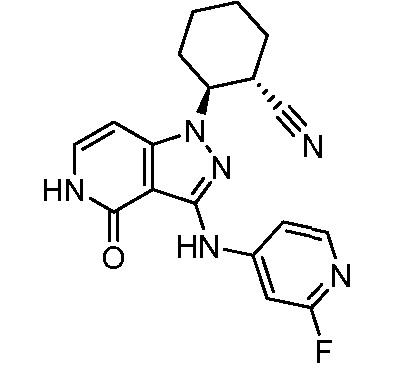
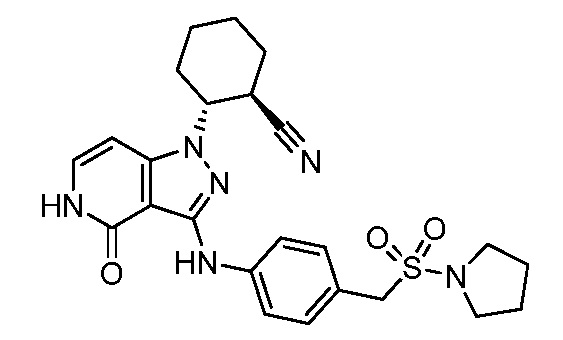
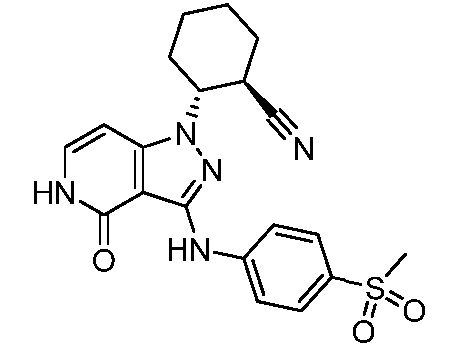
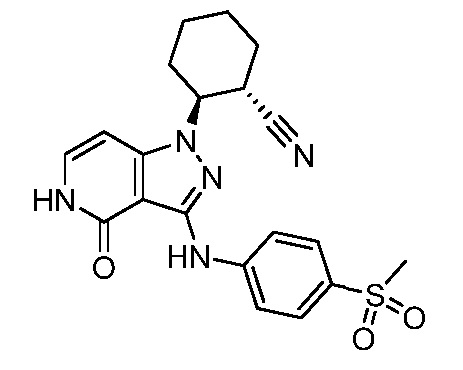
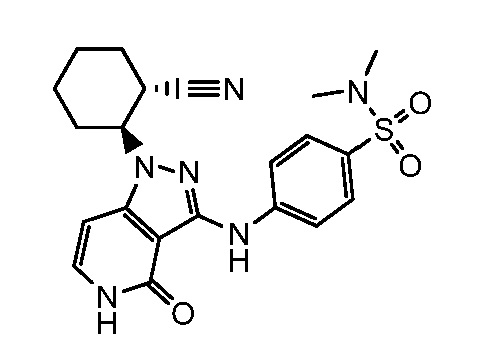
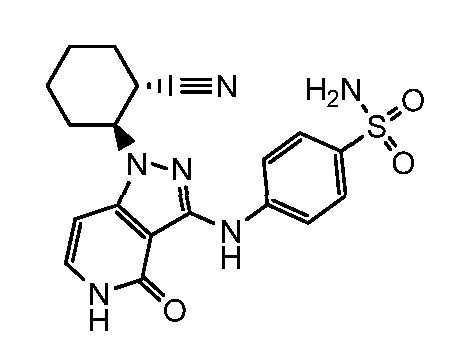
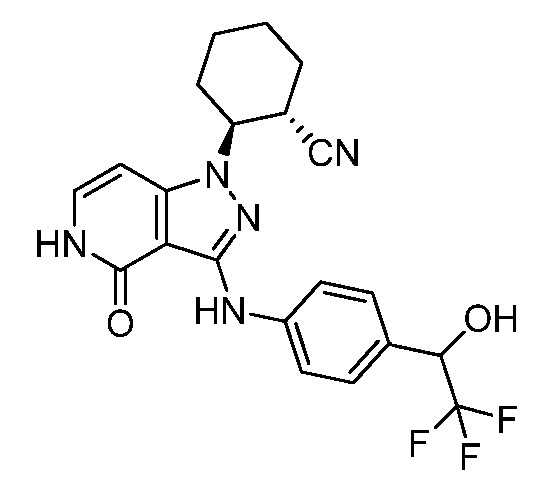
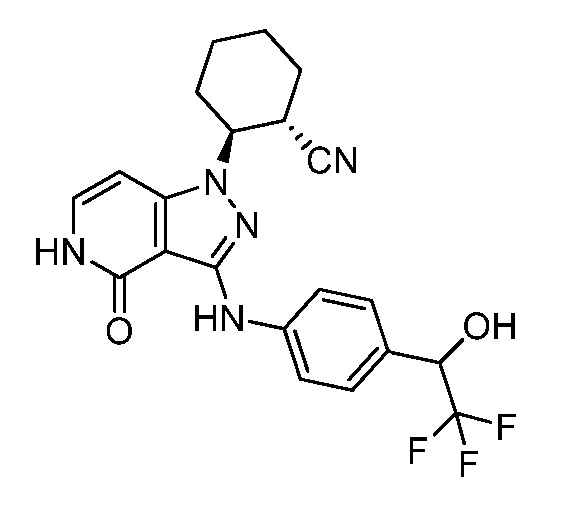
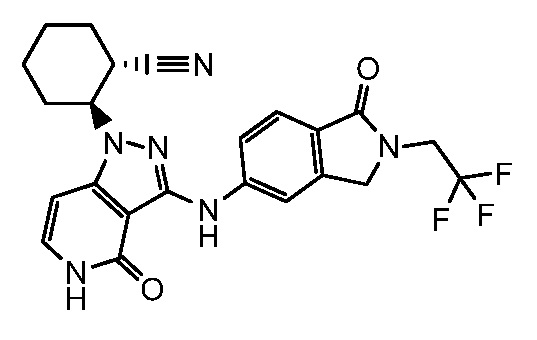
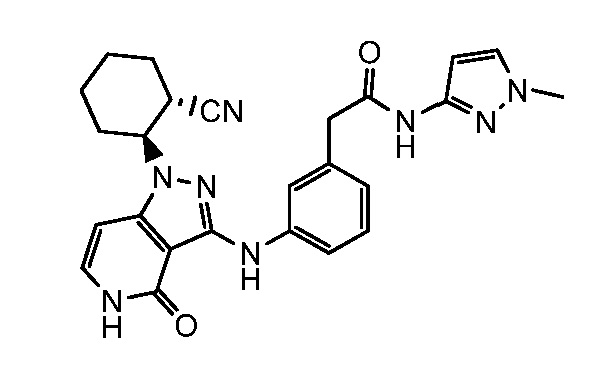
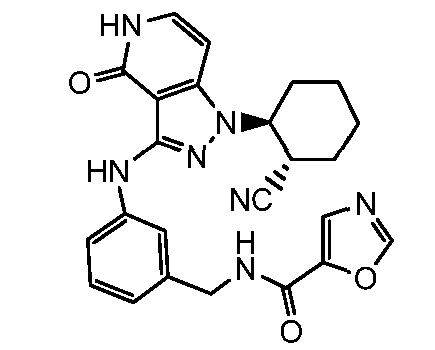
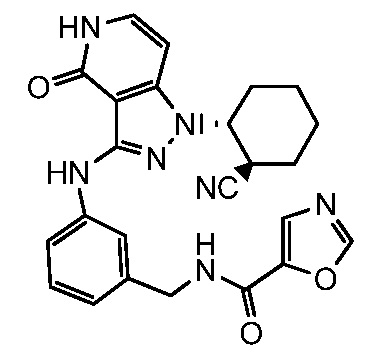
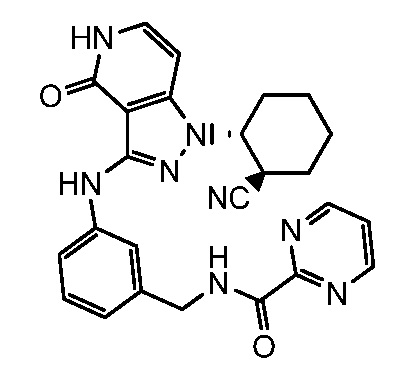
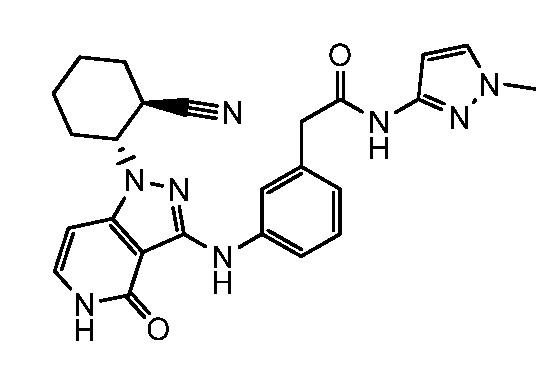
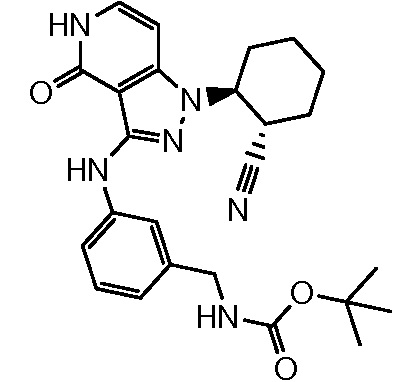
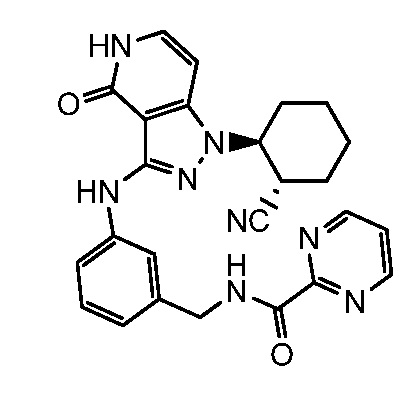
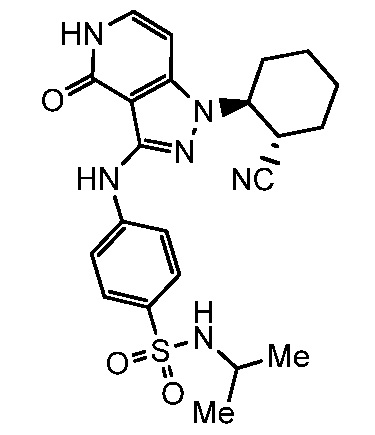
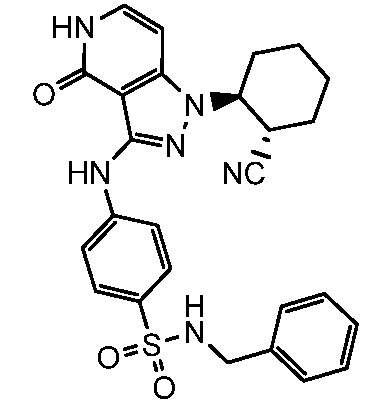
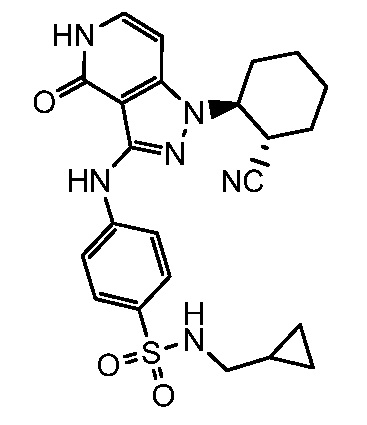
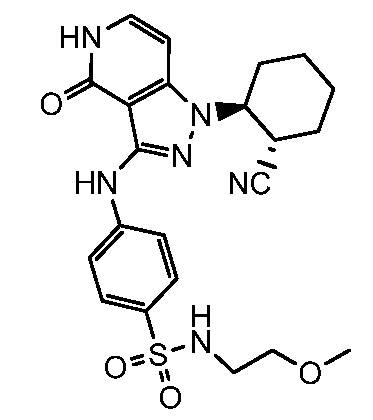
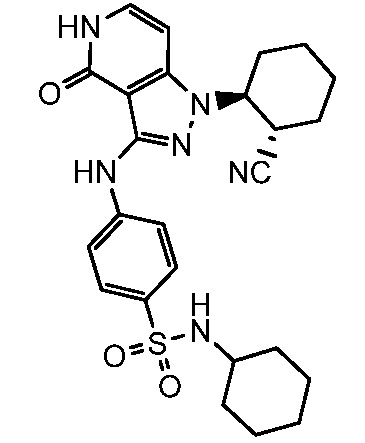
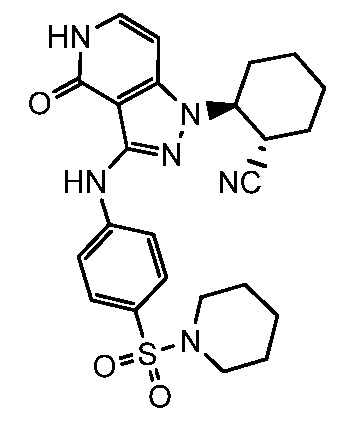
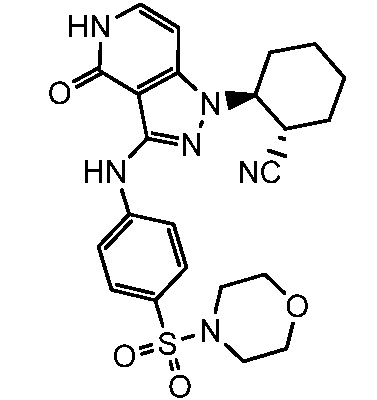
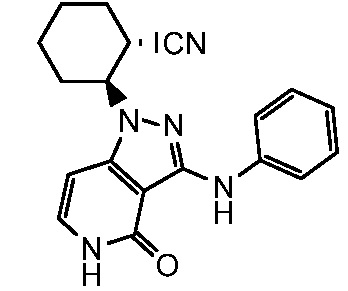
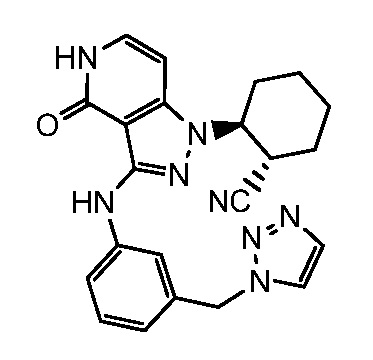
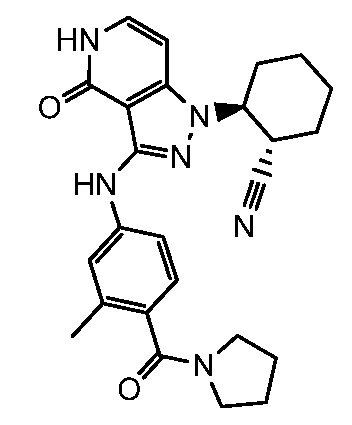
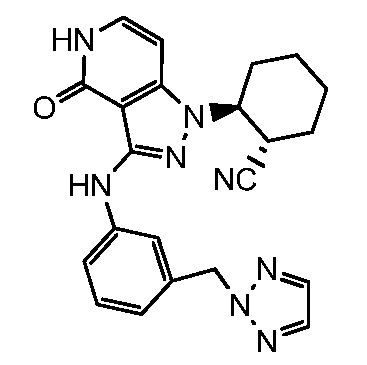
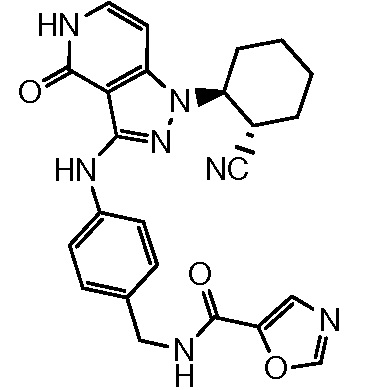
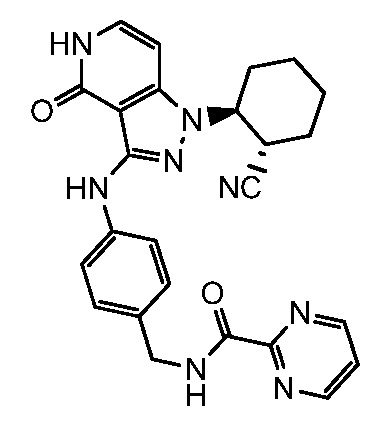
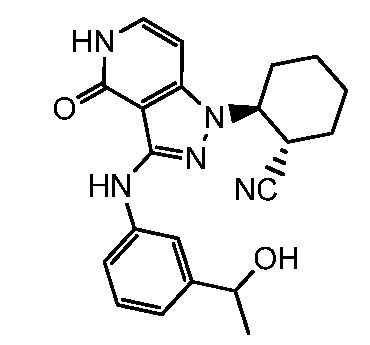
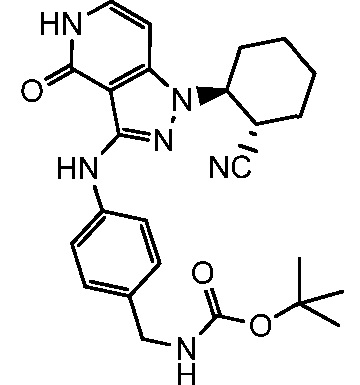
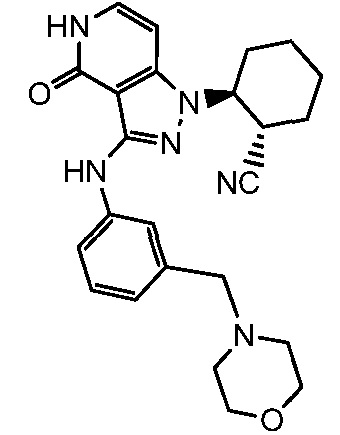
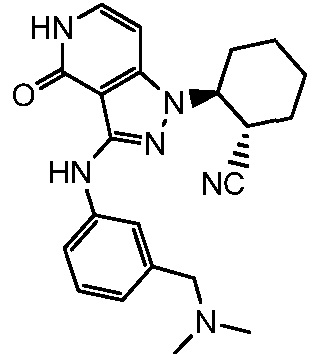
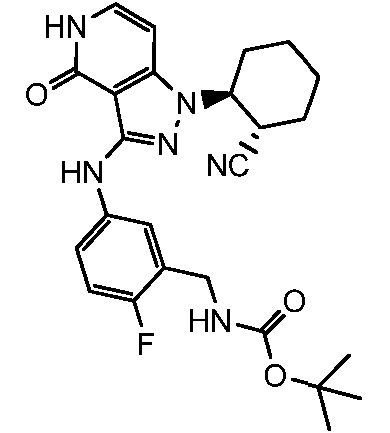
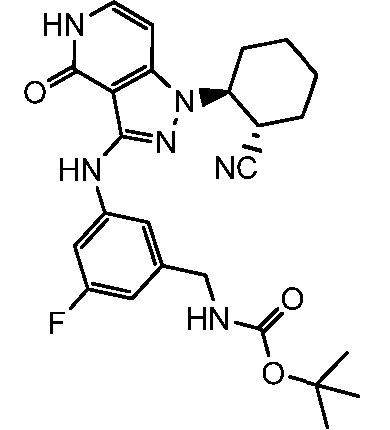
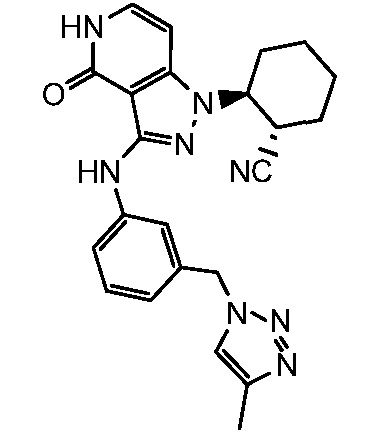
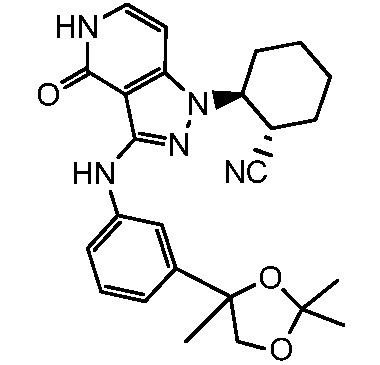
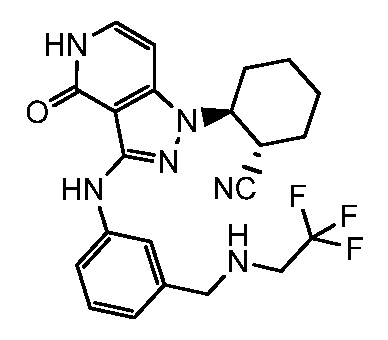
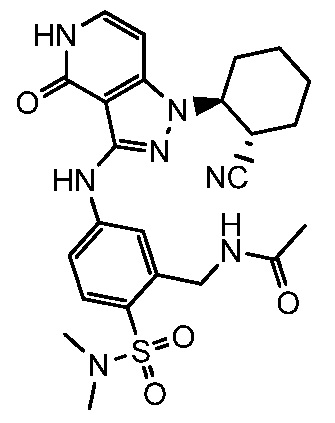
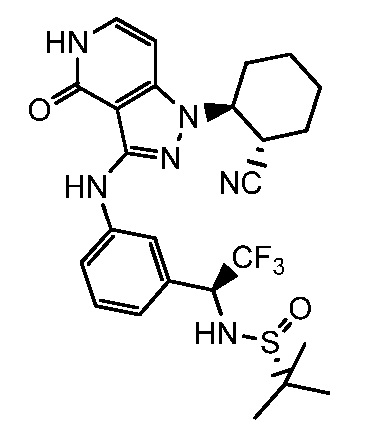
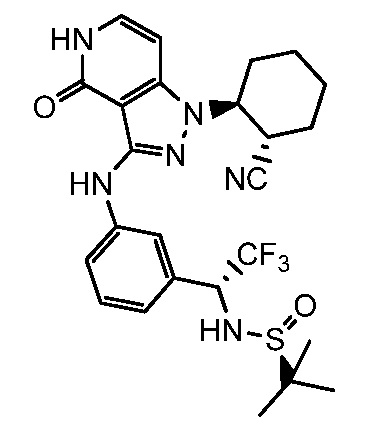
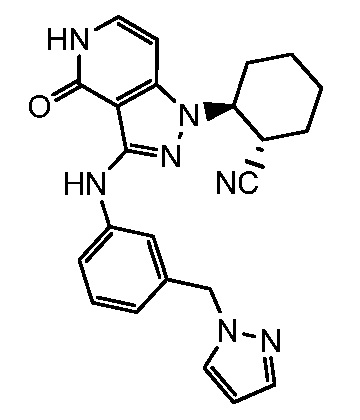
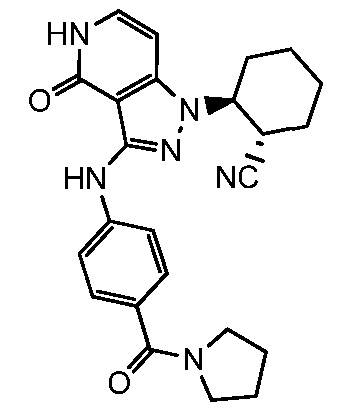
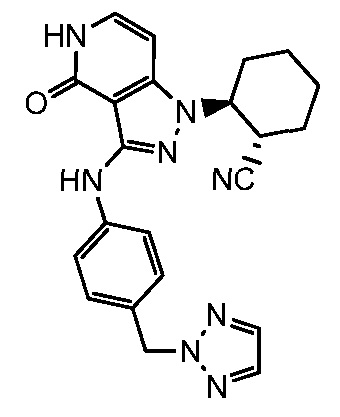
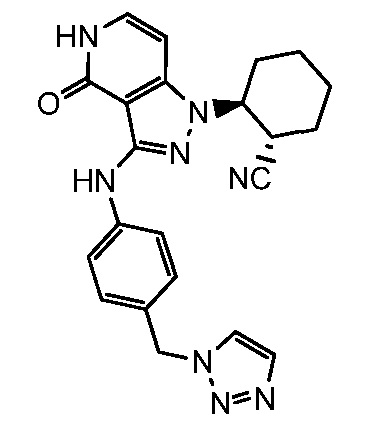
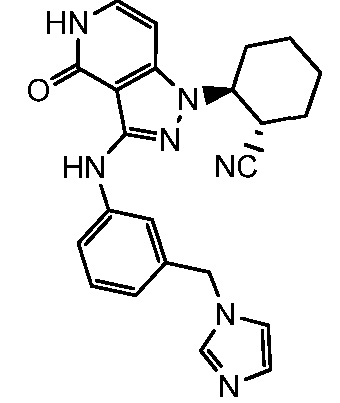
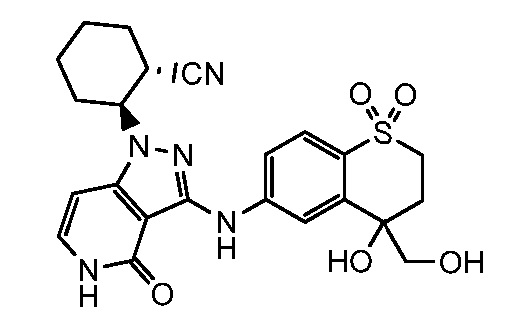
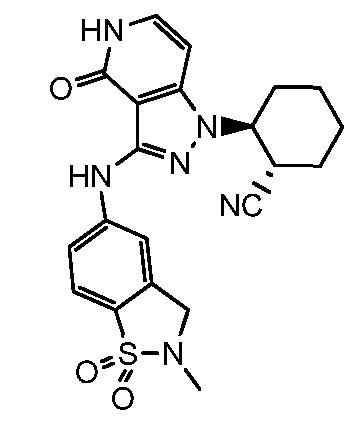
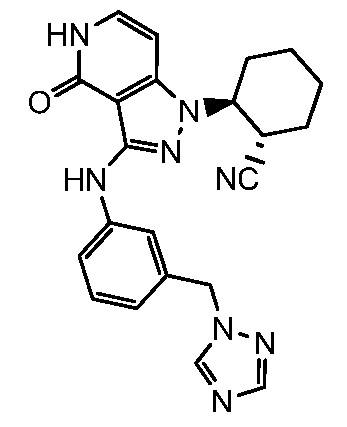
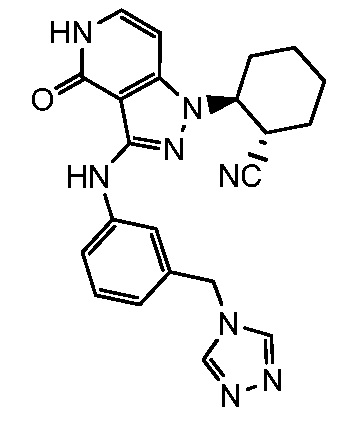
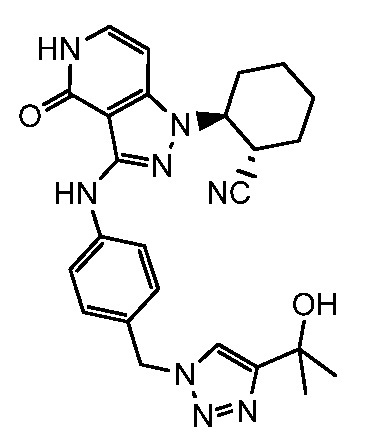
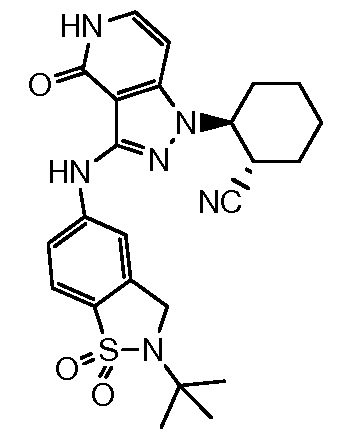
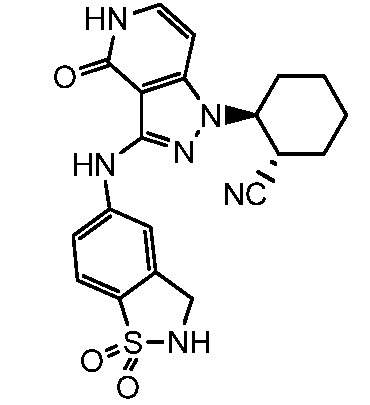
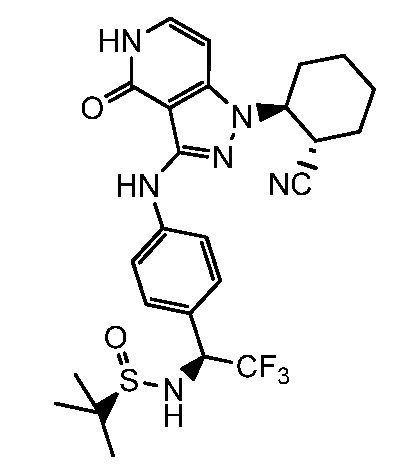
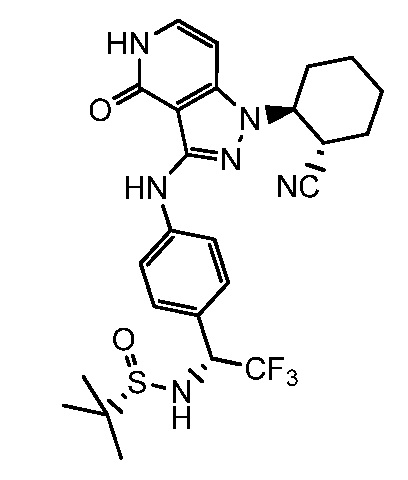
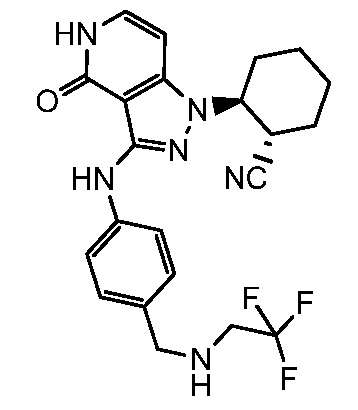
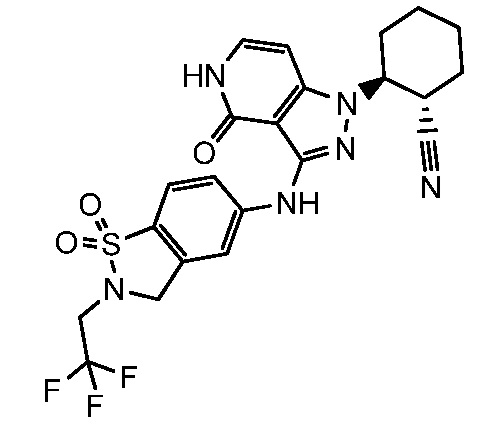
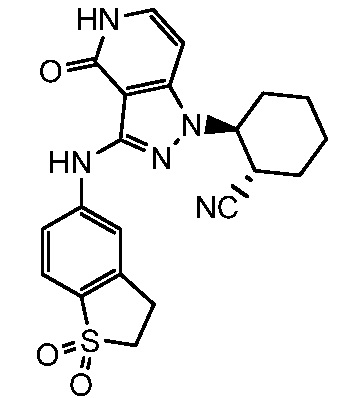
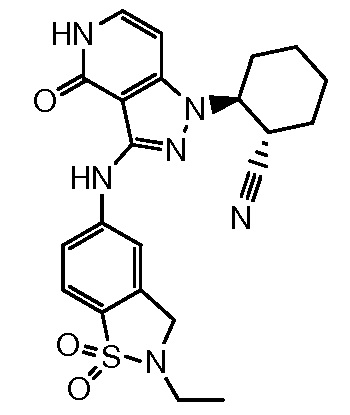
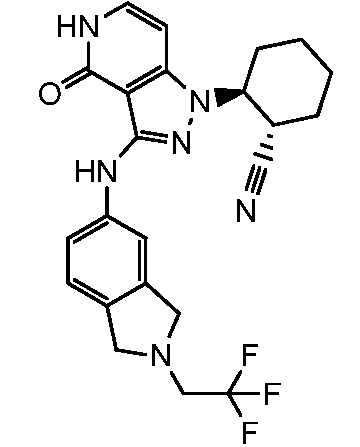
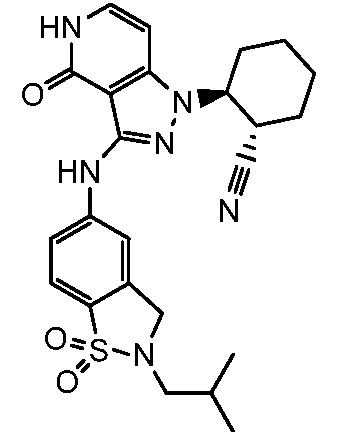
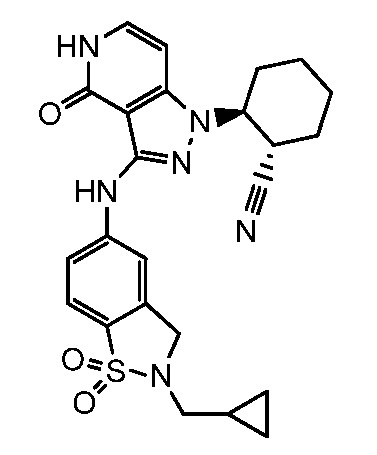
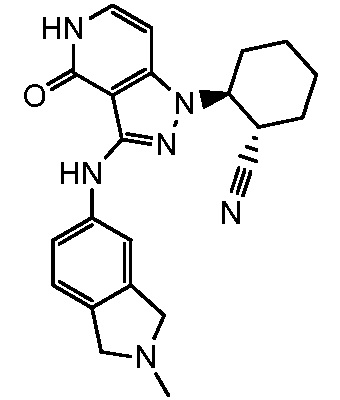
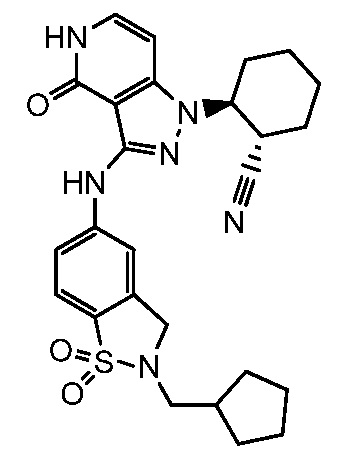
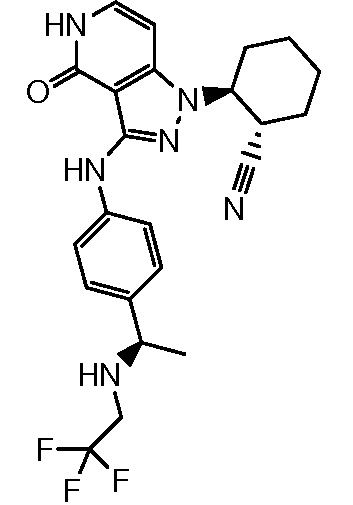
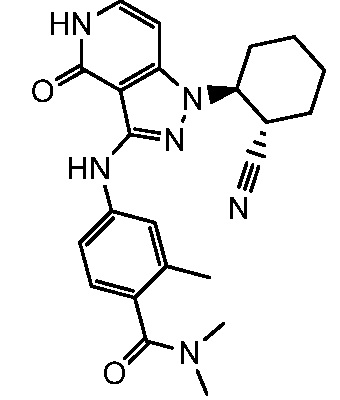
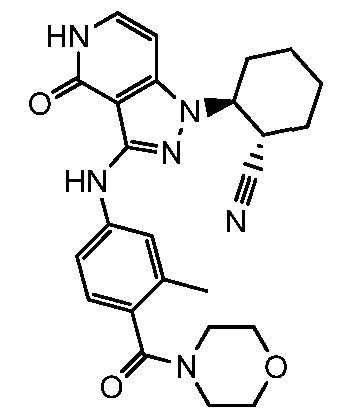
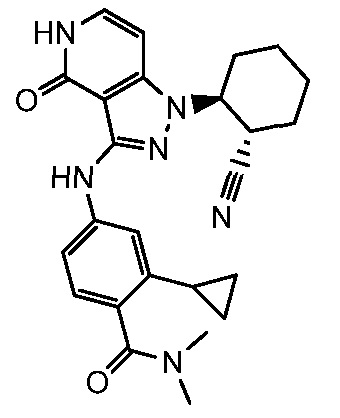
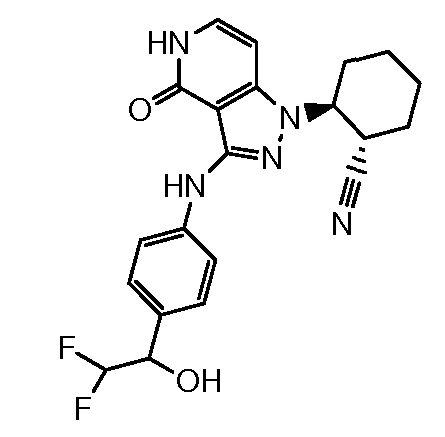
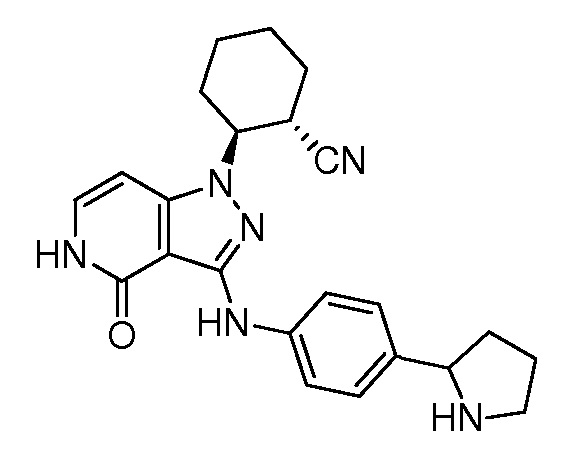
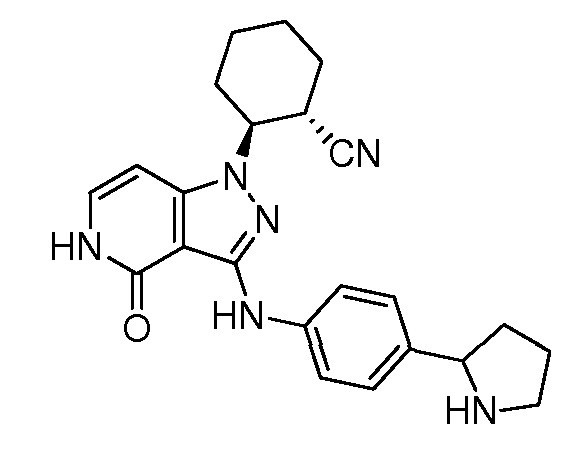
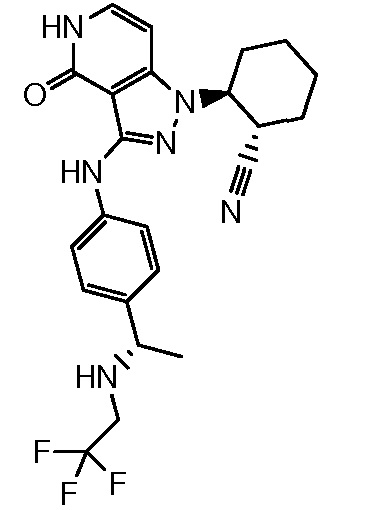
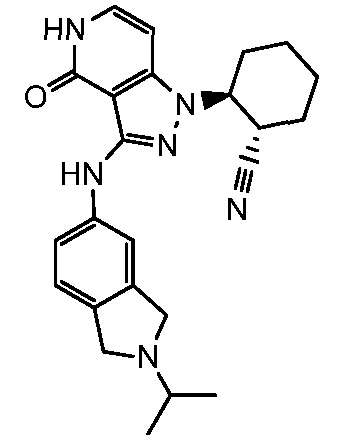
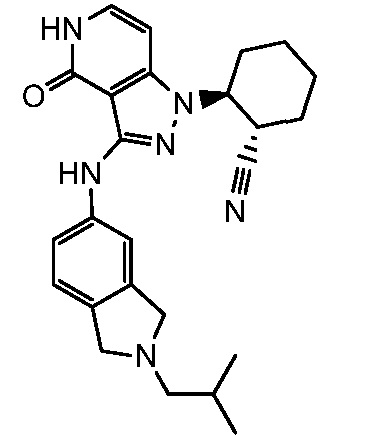
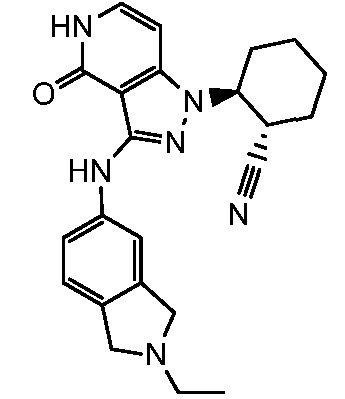
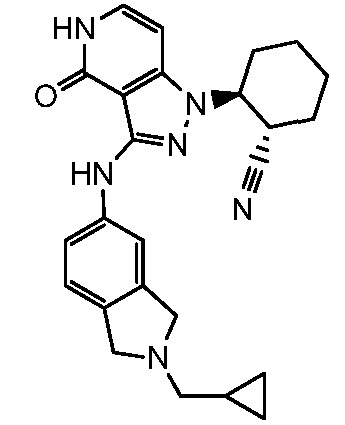
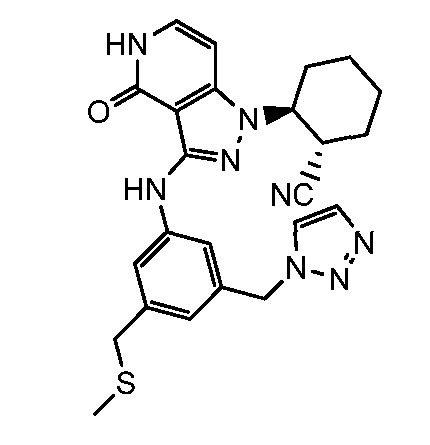
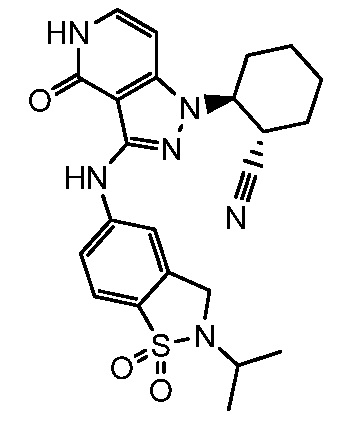
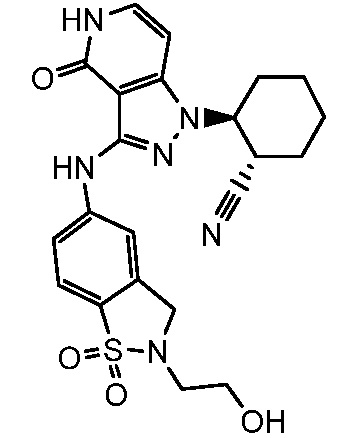
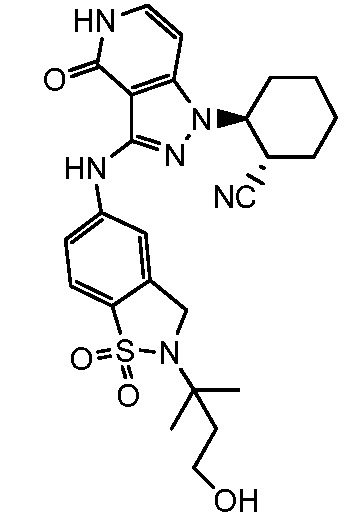
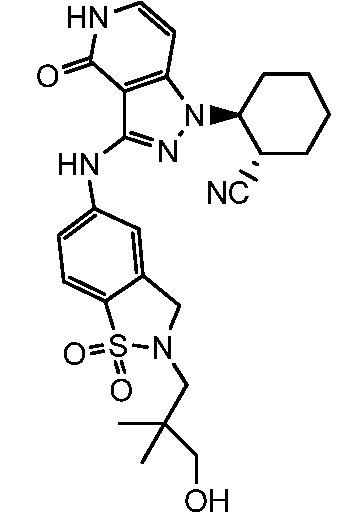
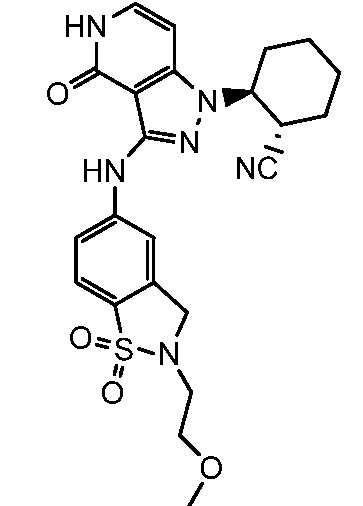
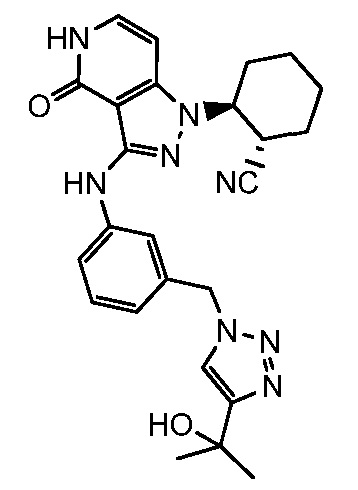
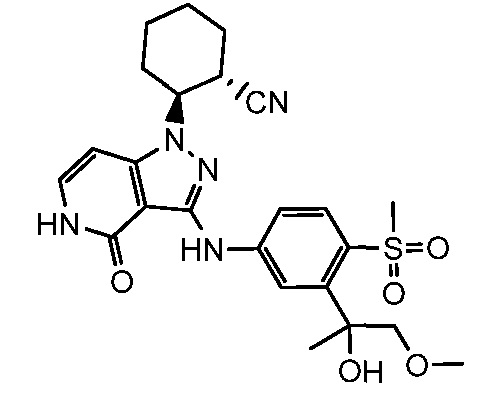
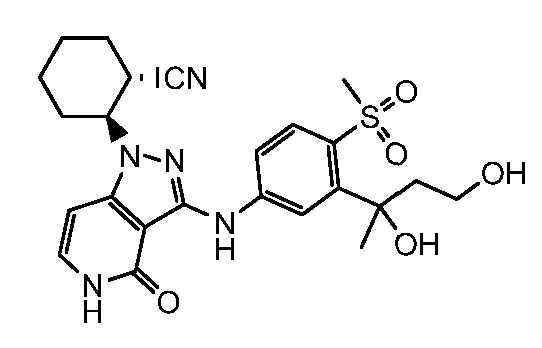
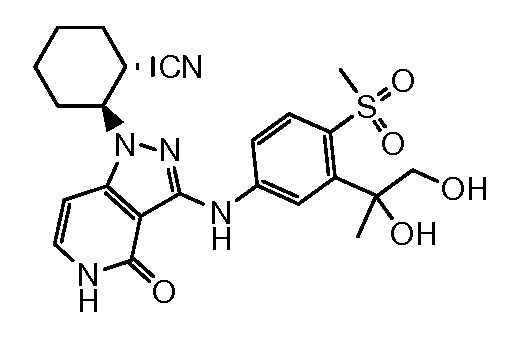
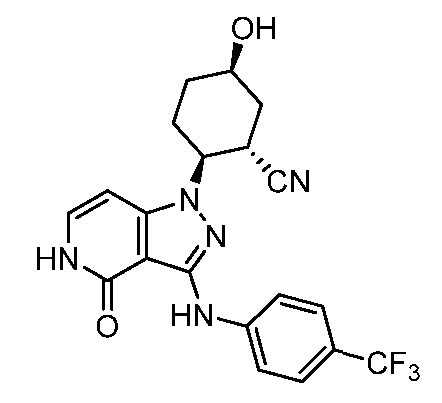
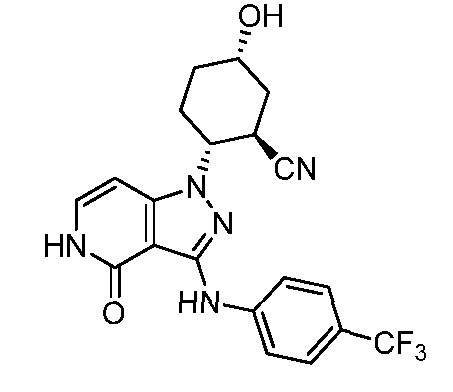
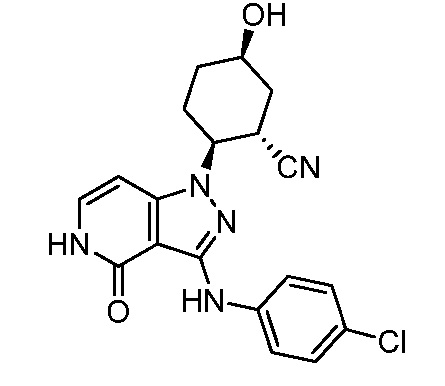
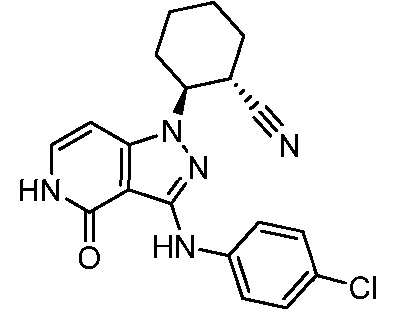
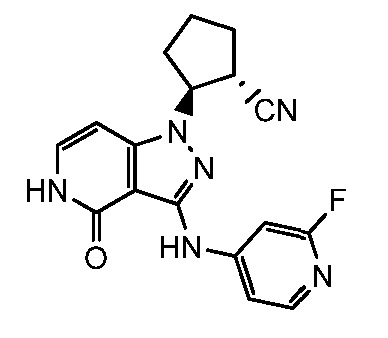
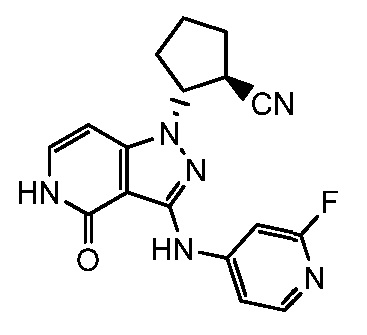
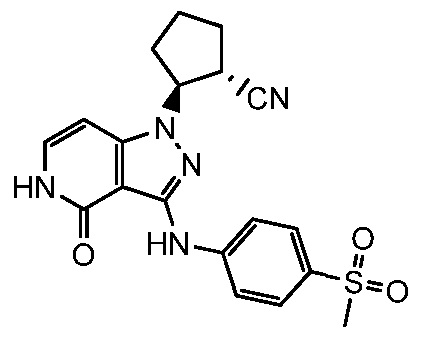
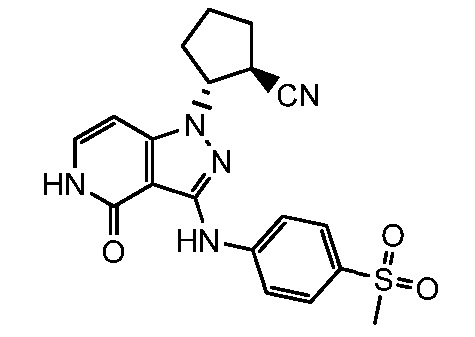
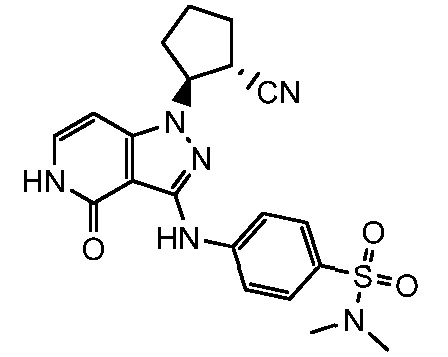
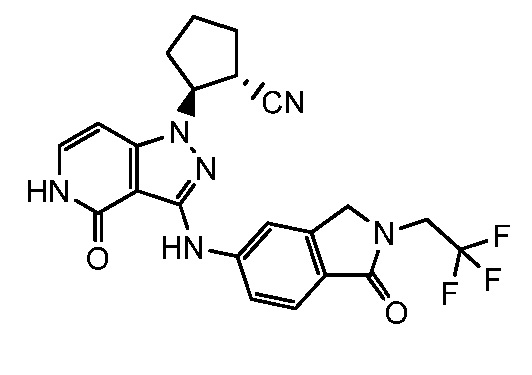
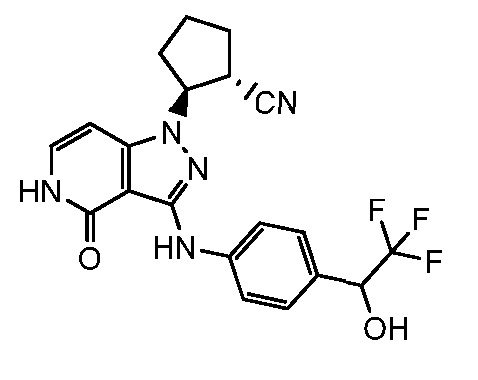
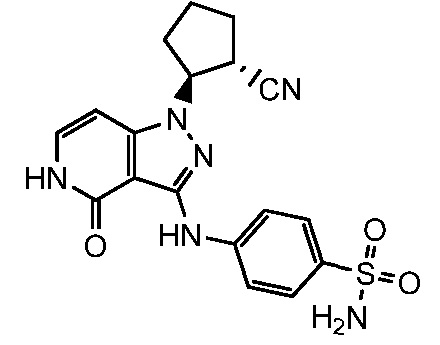
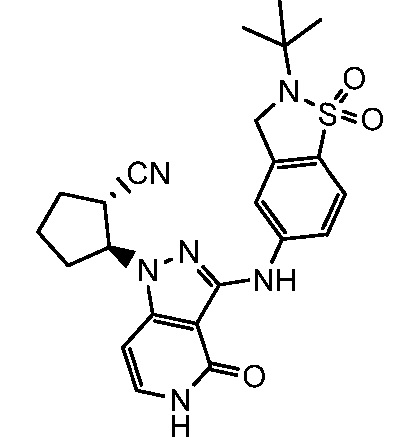
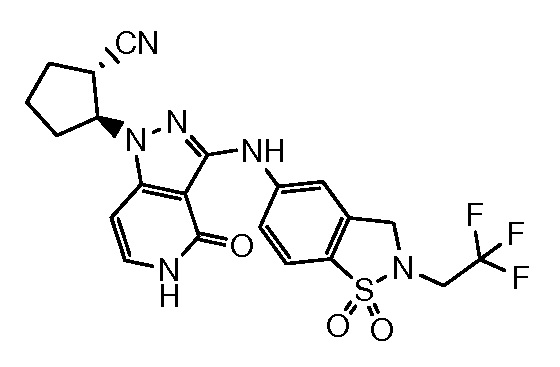
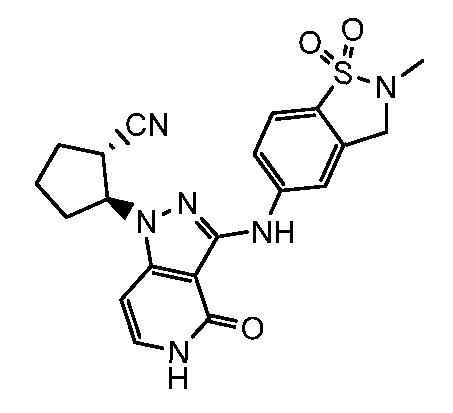
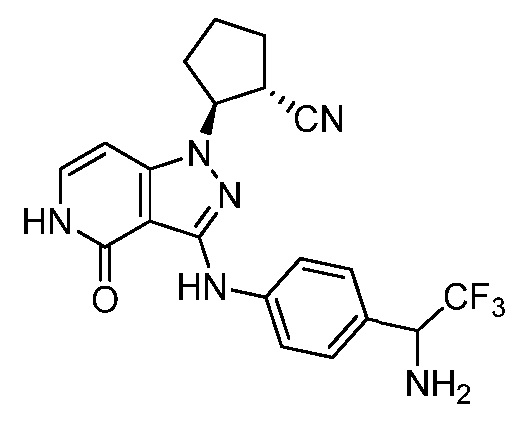
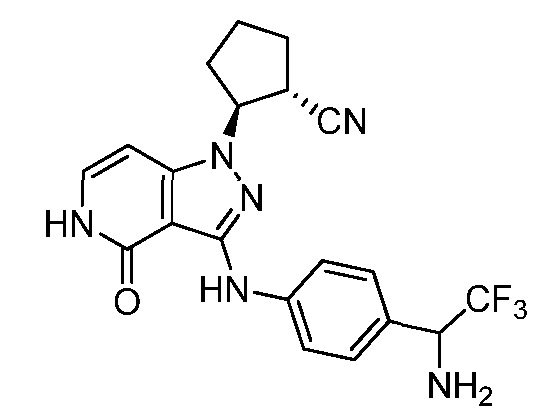
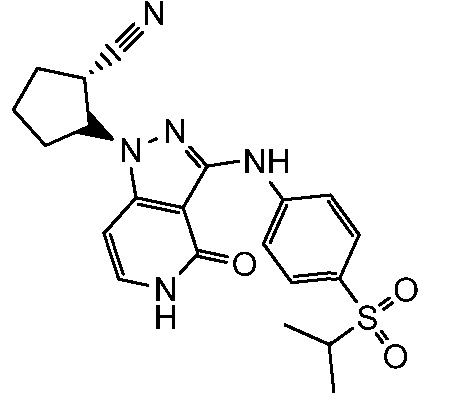
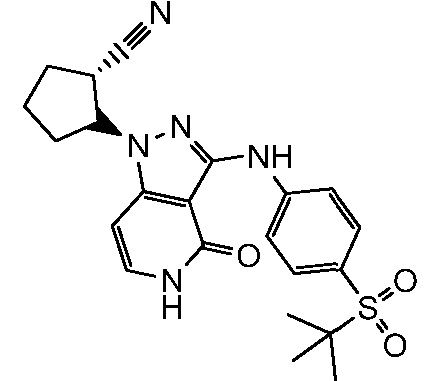
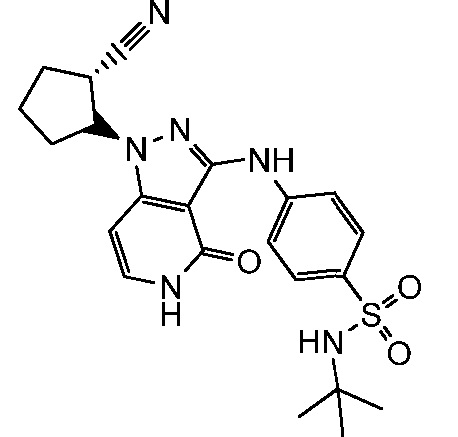
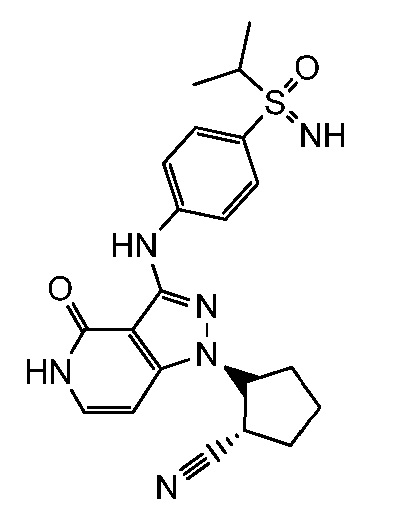
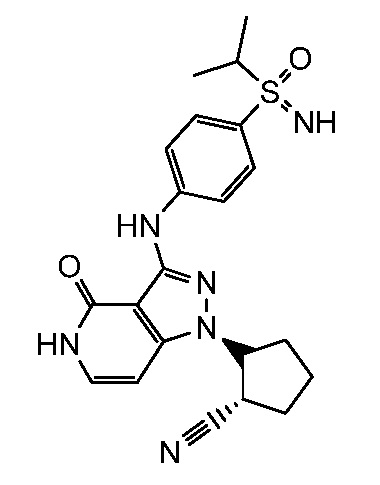
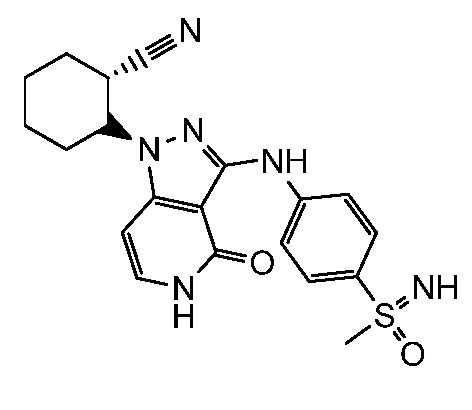
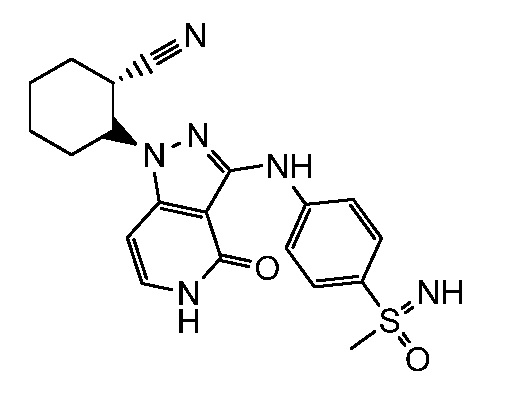
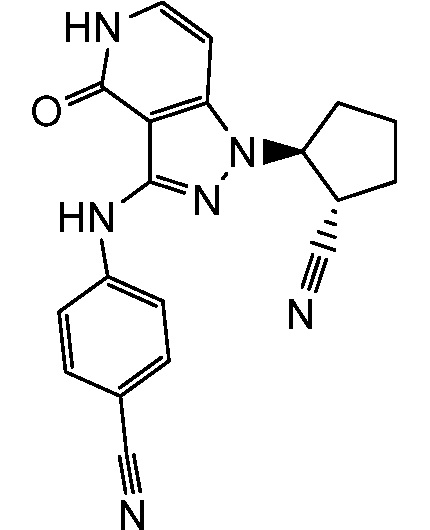
найдено 345
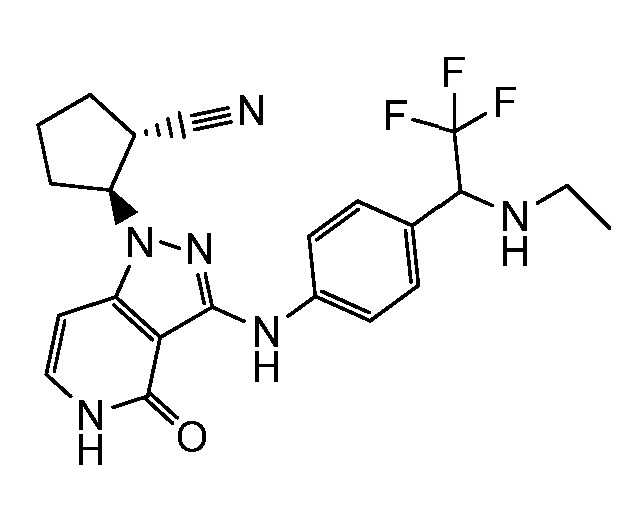
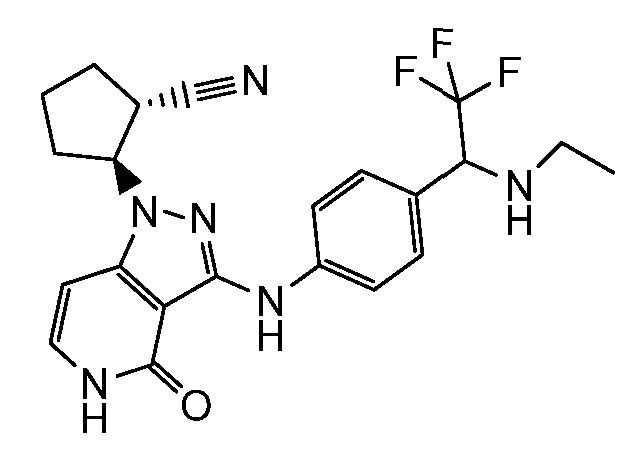
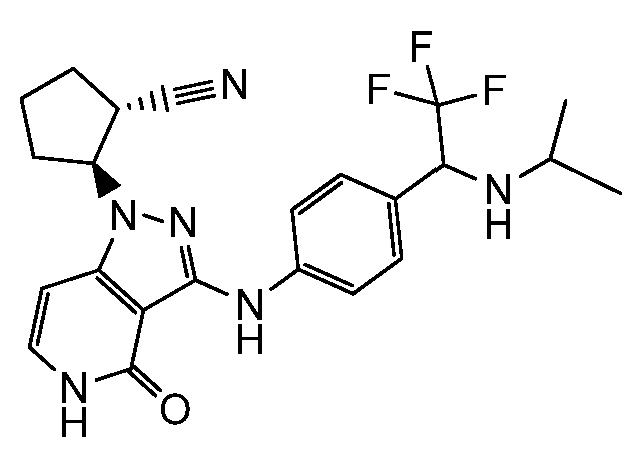
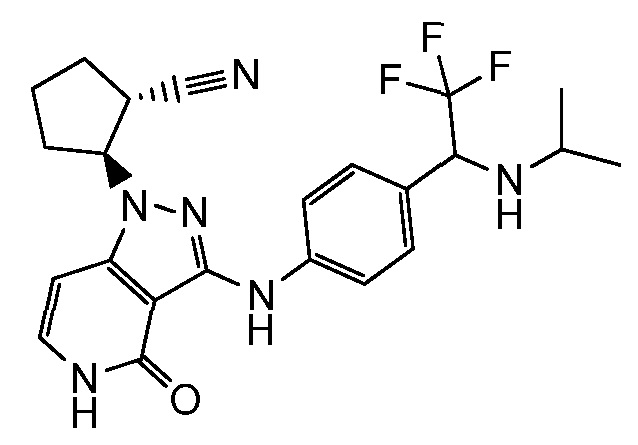
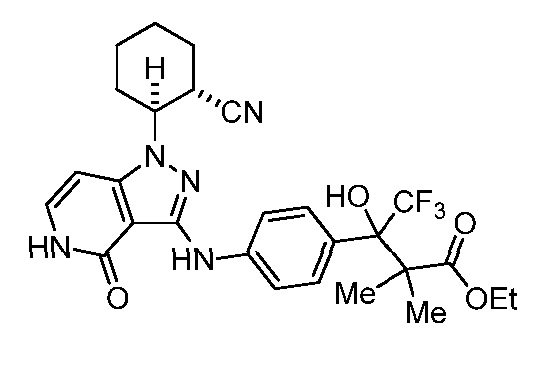
(из I-115. Получен из Пика A посредством СЖХ, Chiralpak IC, 30% MeOH в CO2, Tуд = 4,41 минут)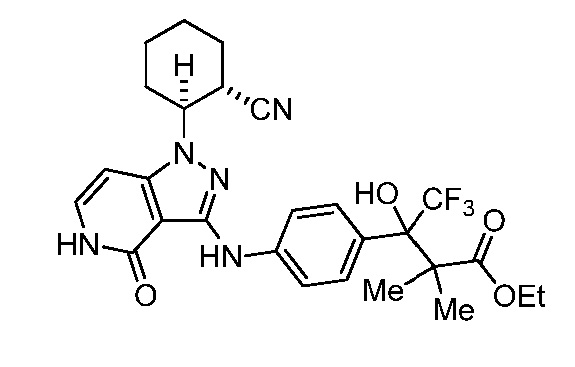
(из I-115. Получен из Пика B посредством СЖХ, Chiralpak IC, 30% MeOH в CO2, Tуд = 5,91 минут)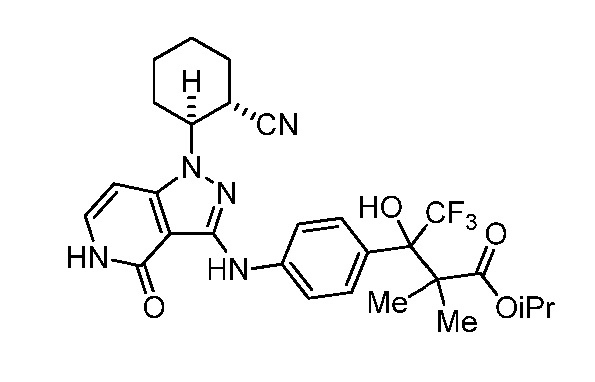
(из I-116. Получен из Пика A посредством СЖХ, Chiralpak IC, 30% MeOH в CO2, Tуд = 3,57 минут)
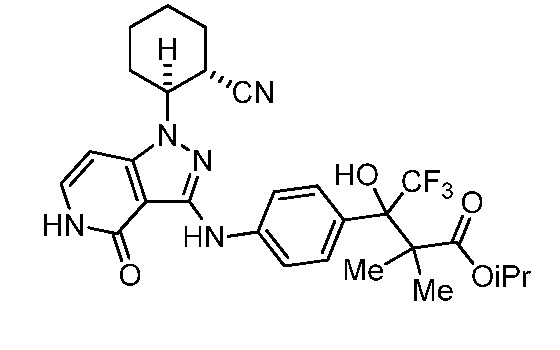
(из I-116. Получен из Пика B посредством СЖХ, Chiralpak IC, 30% MeOH в CO2, Tуд = 4,87 минут)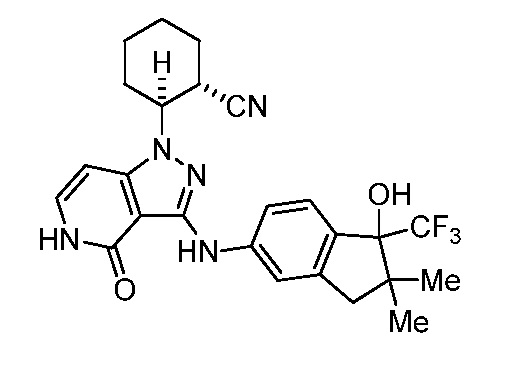
(из I-117. Получен из Пика A посредством СЖХ, Lux-4, 35% MeOH в CO2, Tуд = 3,58 минут)
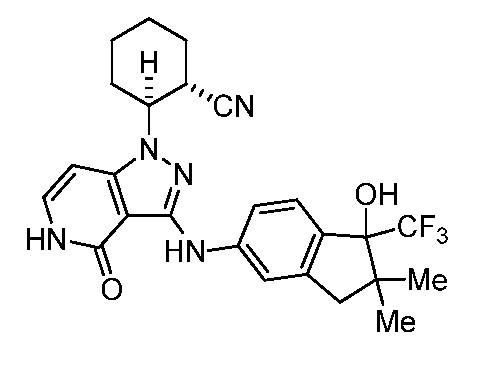
(из I-117. Получен из Пика B посредством СЖХ, Lux-4, 35% MeOH в CO2, Tуд = 5,06 минут)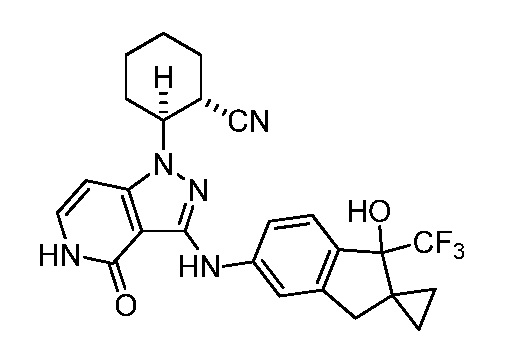
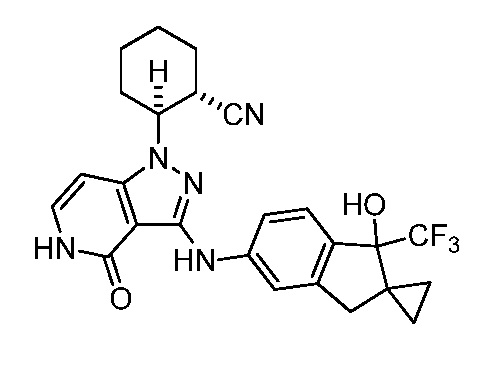
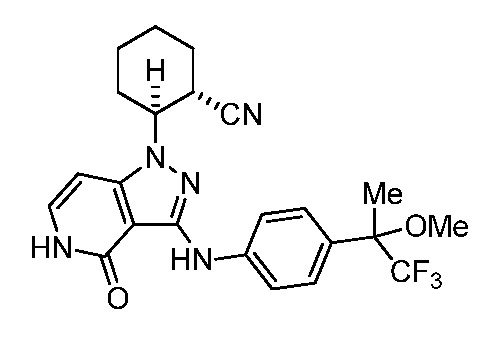
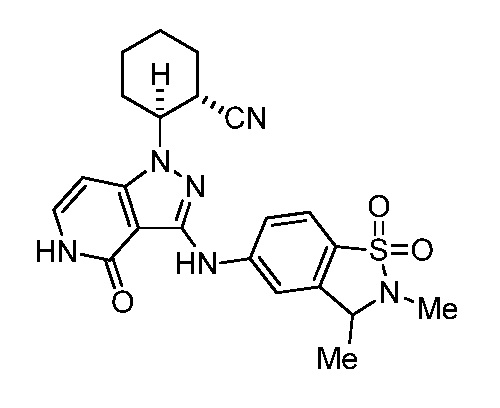
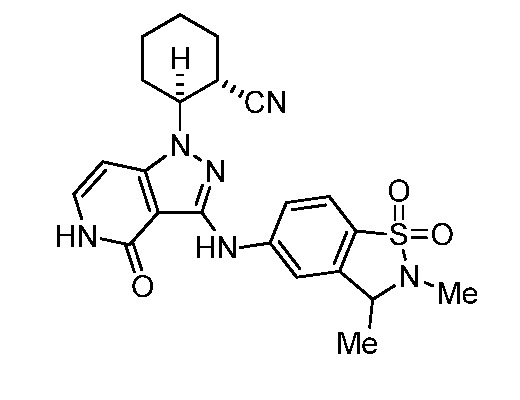
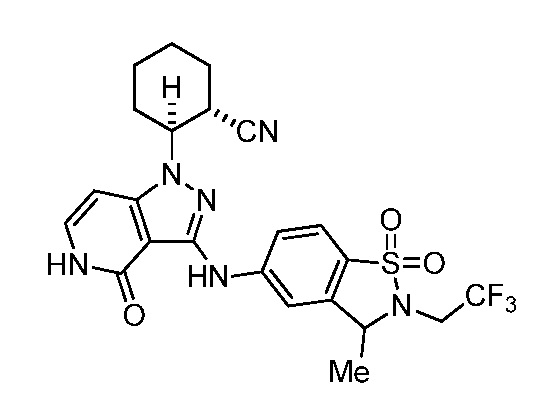
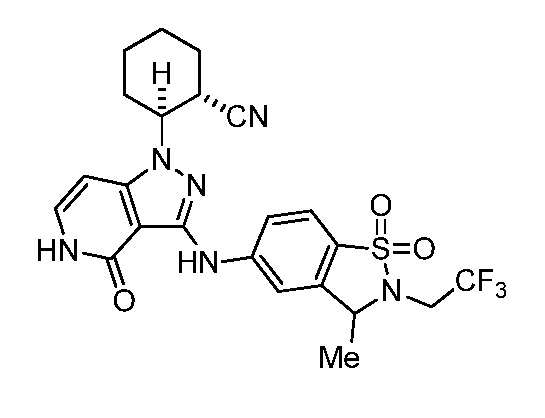
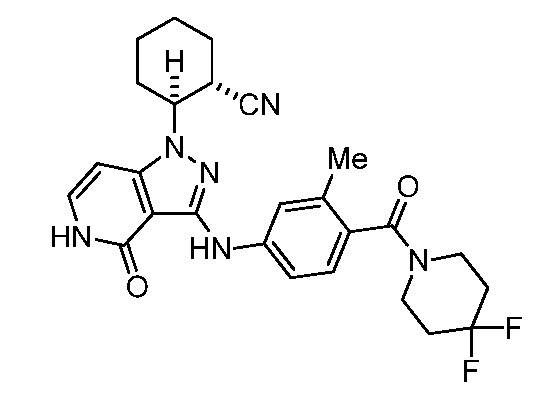
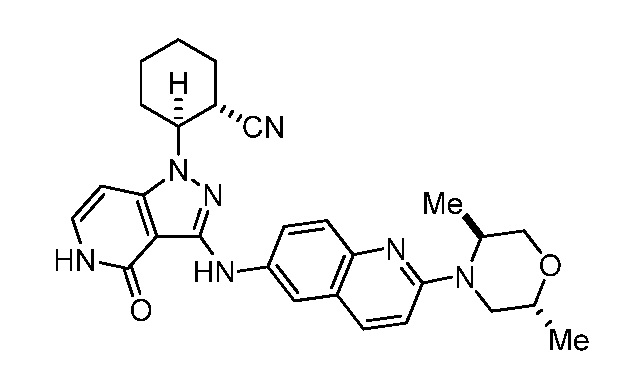
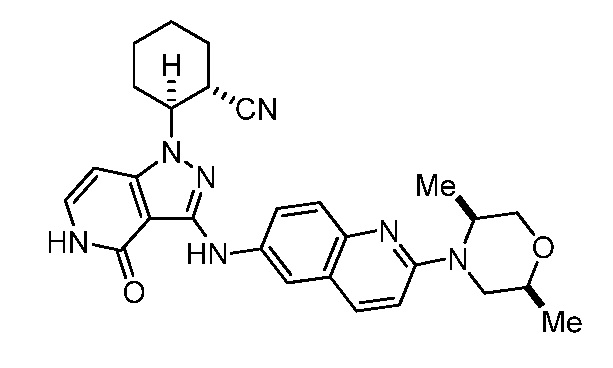
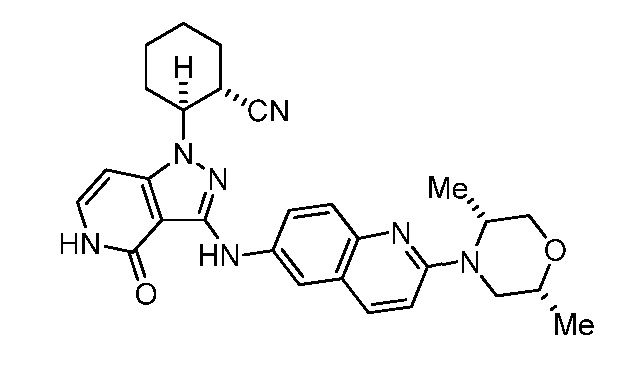
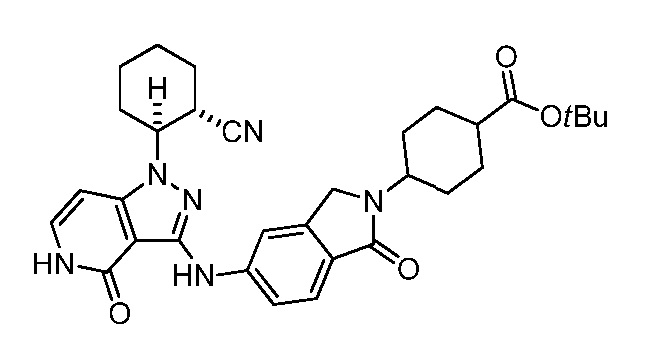
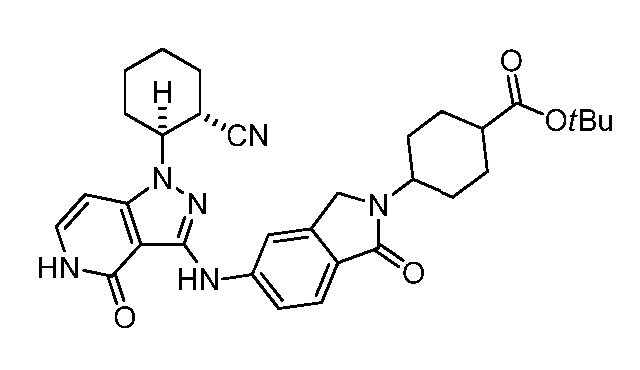
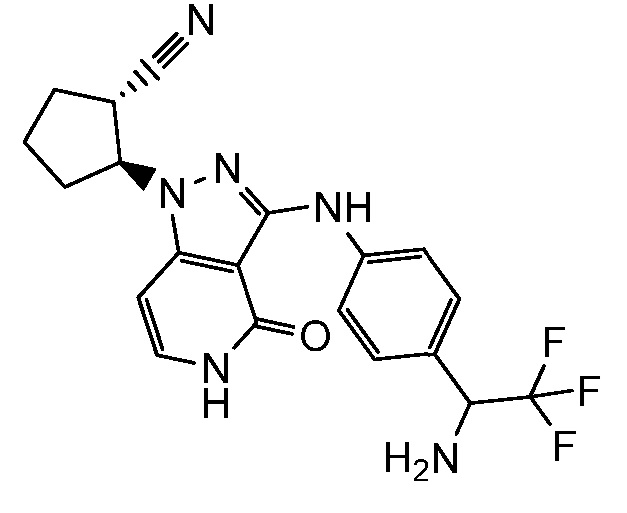
(из I-69)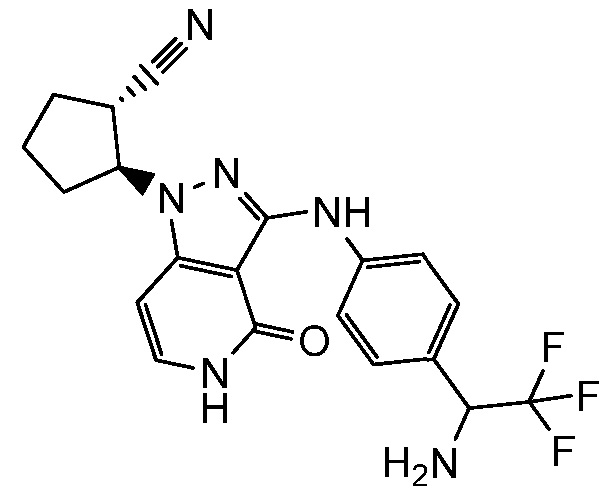
(из I-70)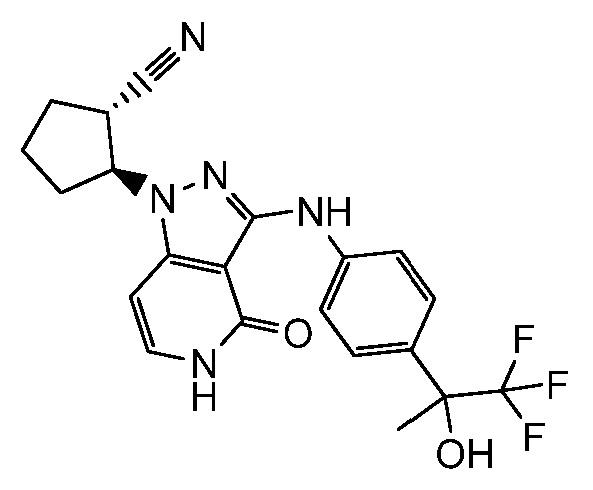
(из I-119a)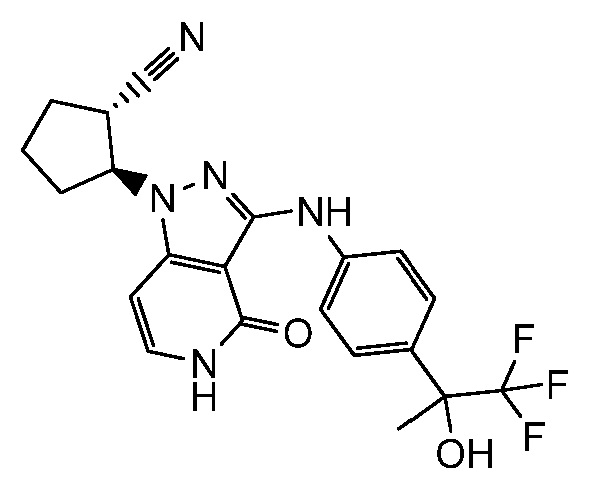
(из I-119b)
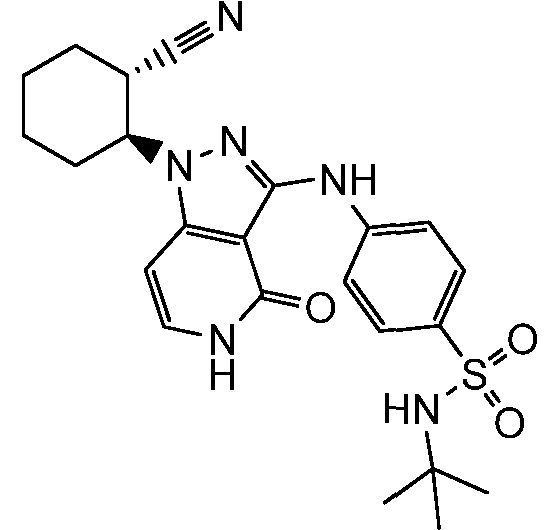
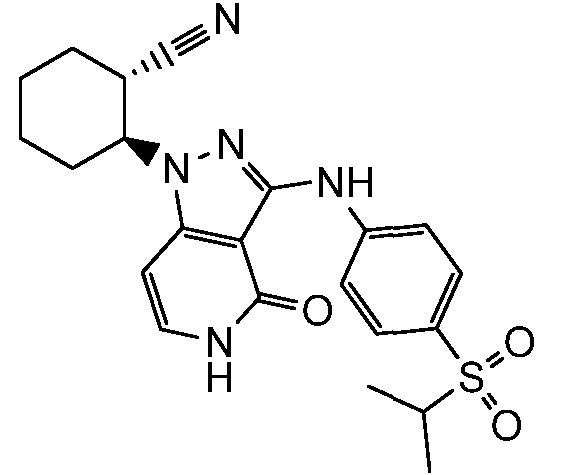
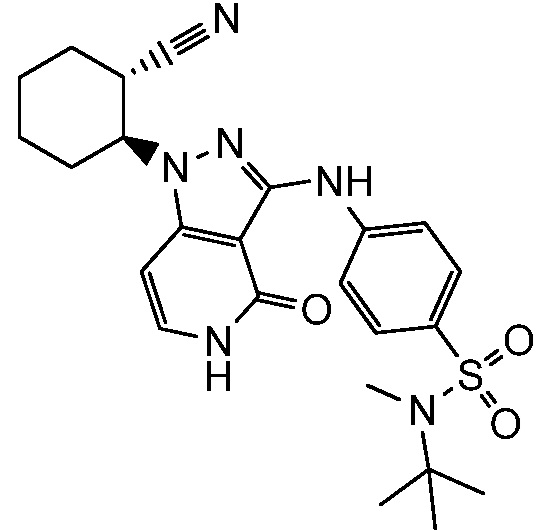
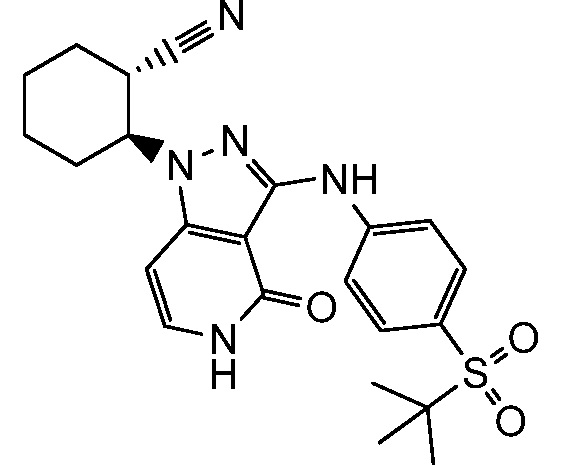
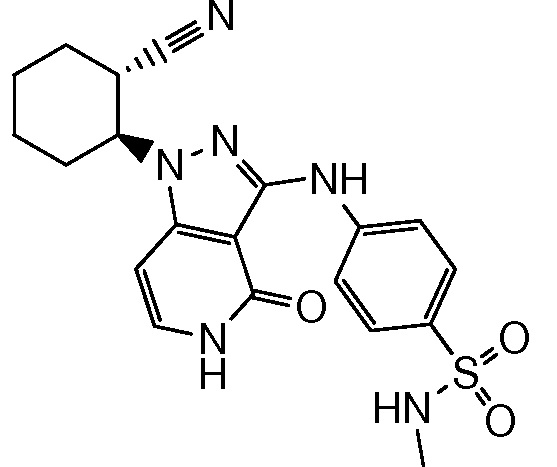
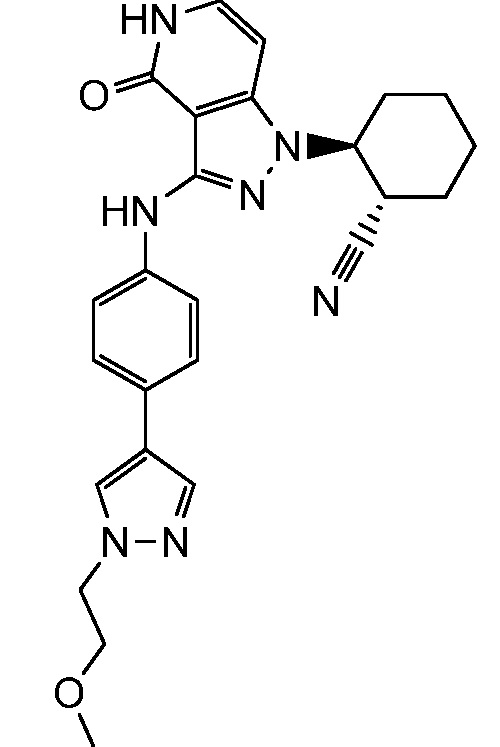
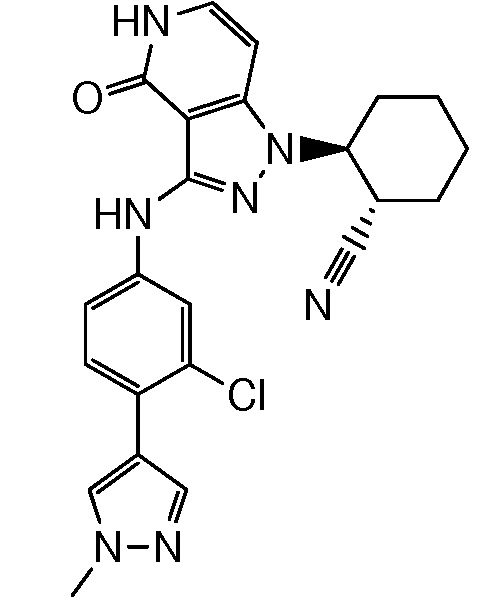
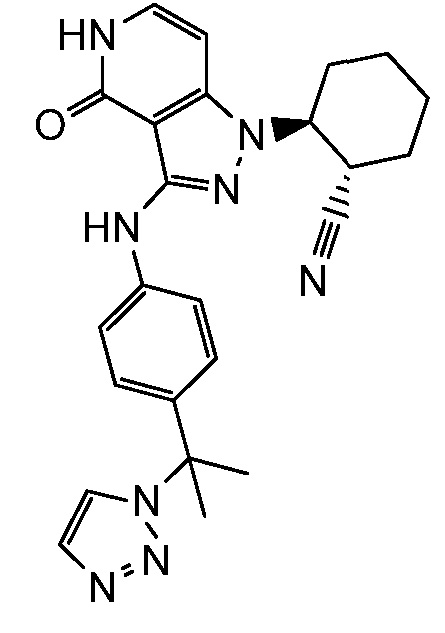
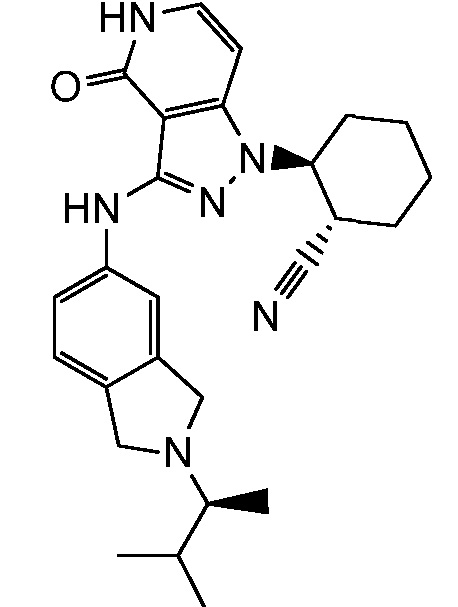
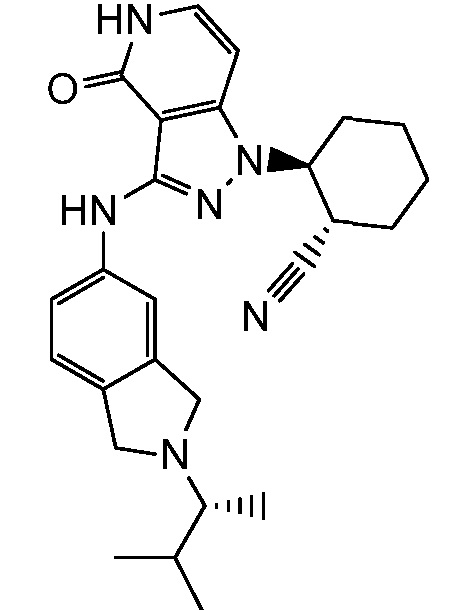
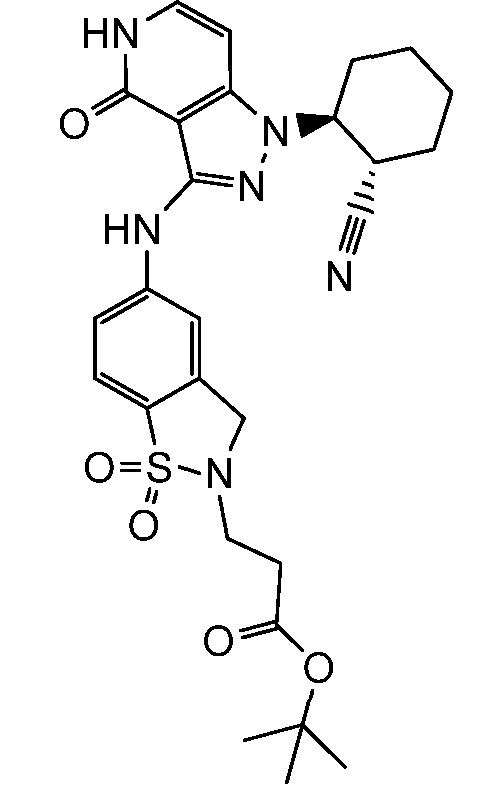
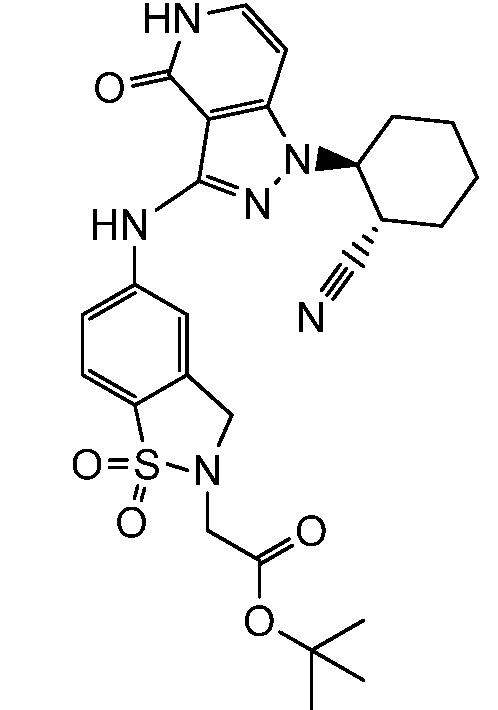
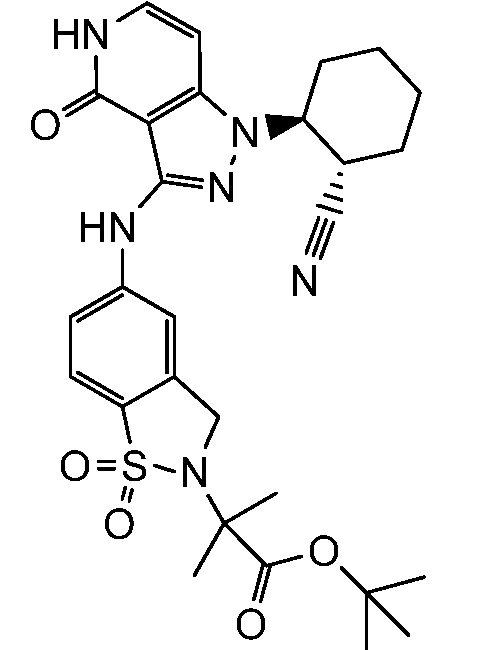
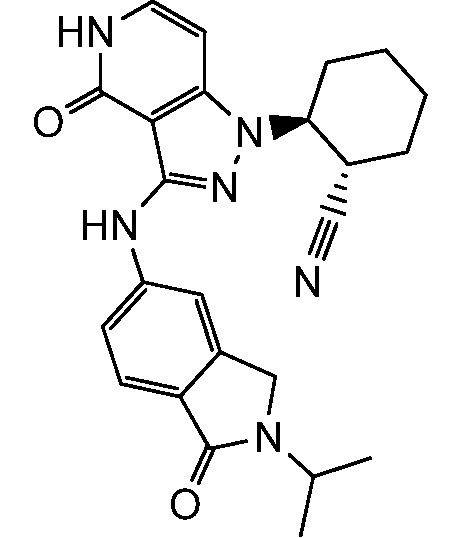
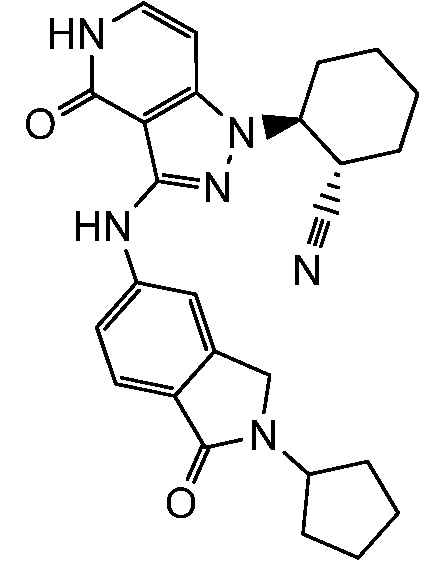
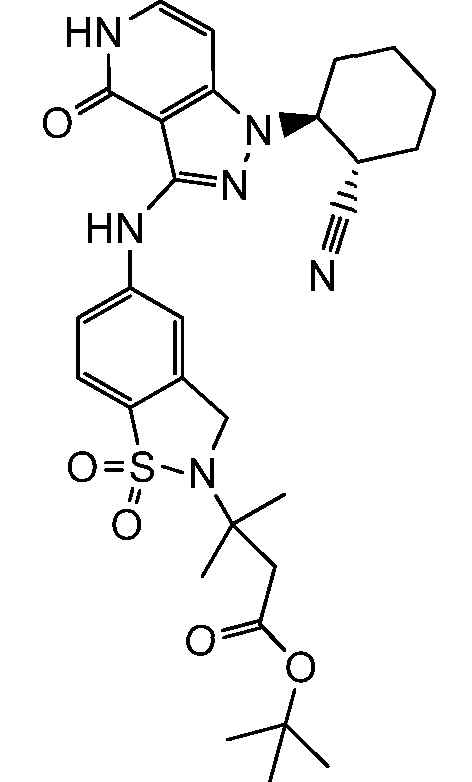
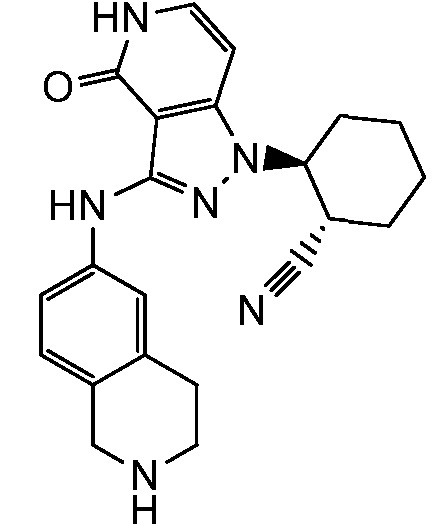
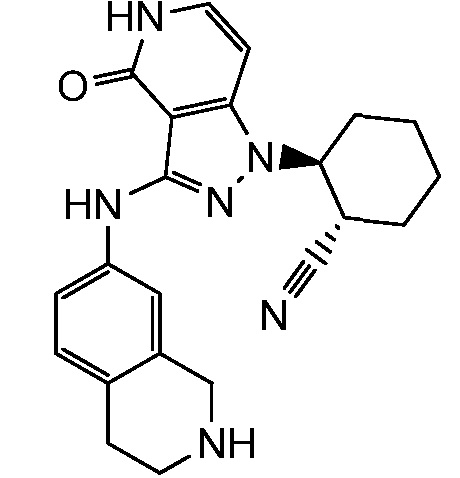
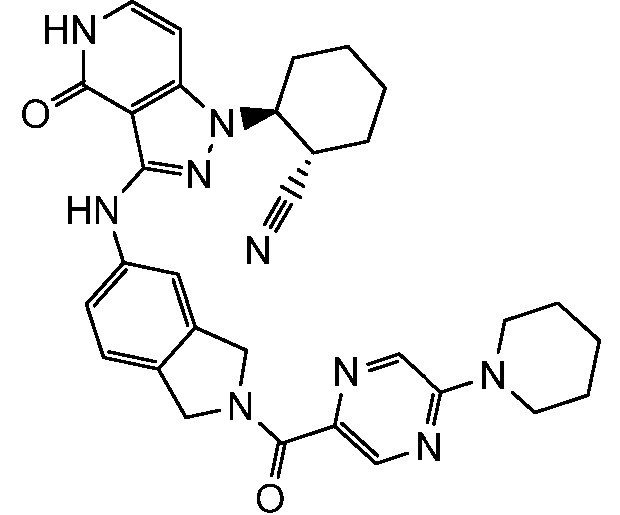
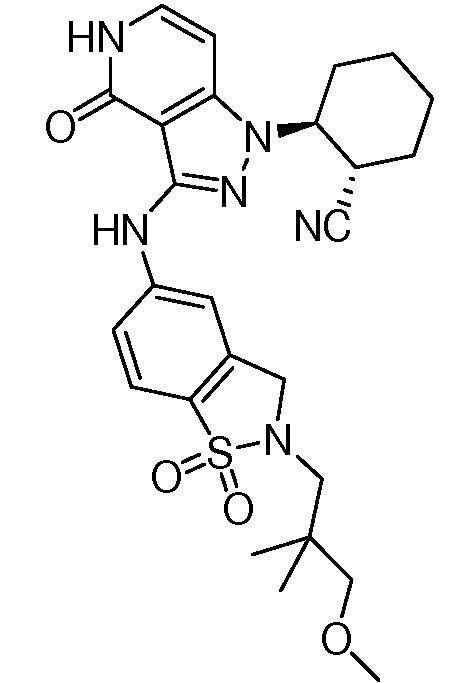
525, найдено 525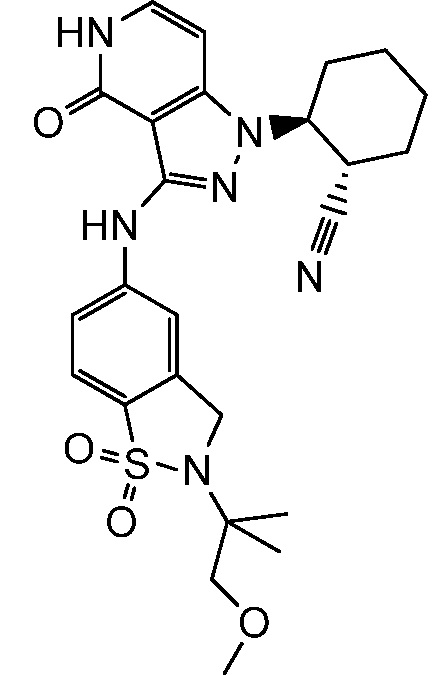
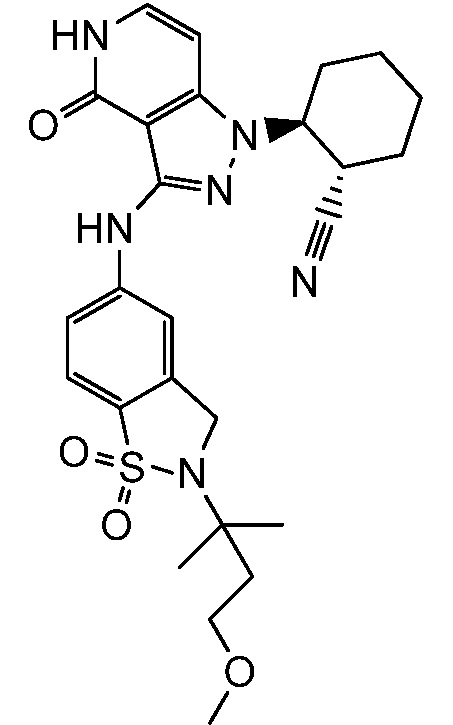
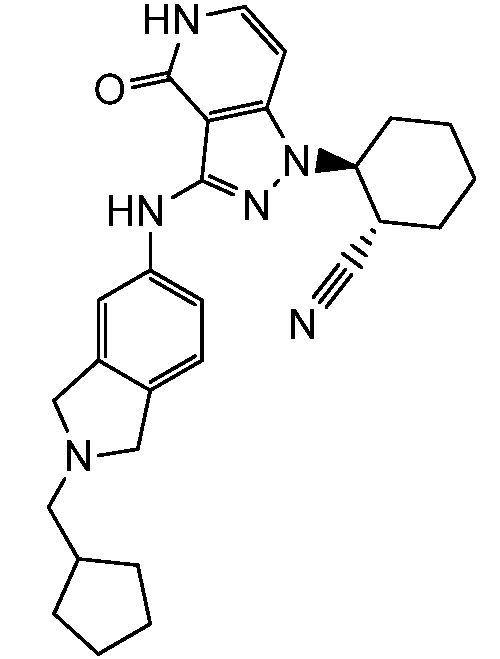
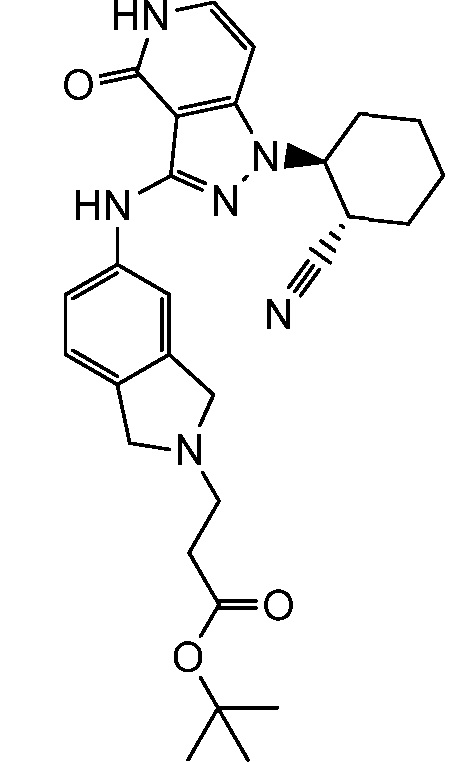
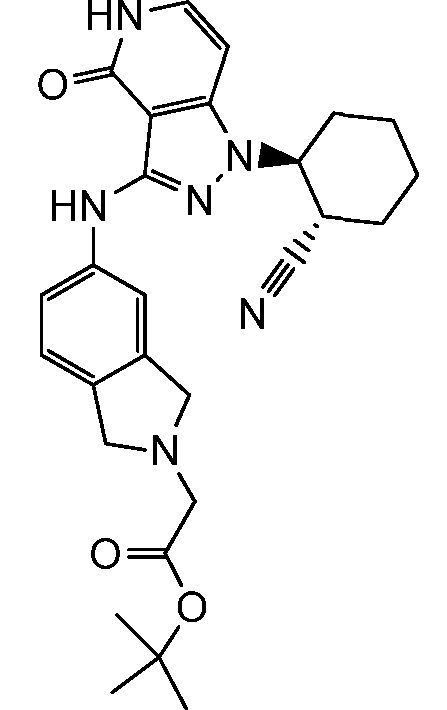
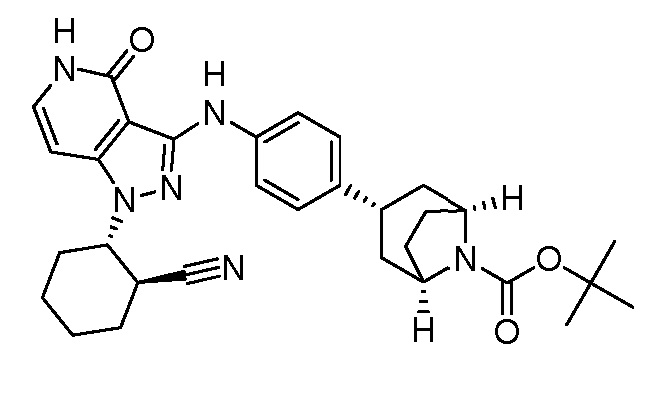
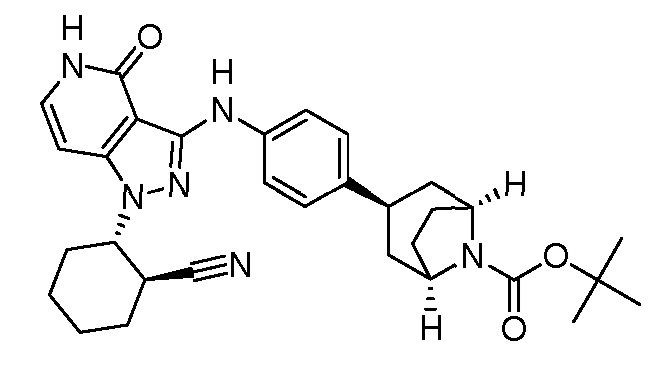
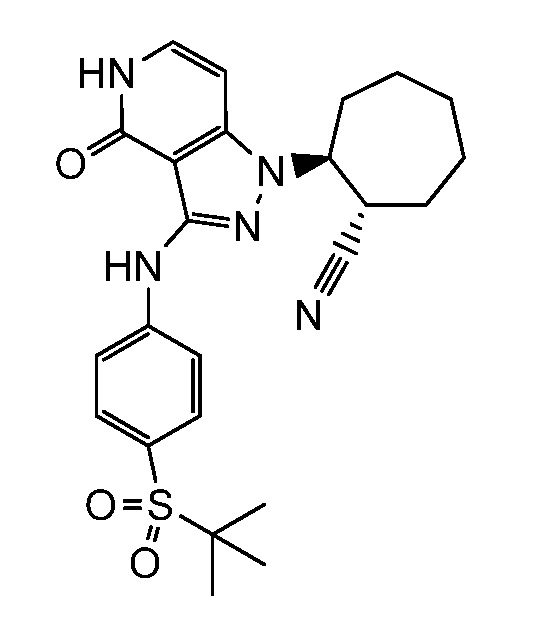
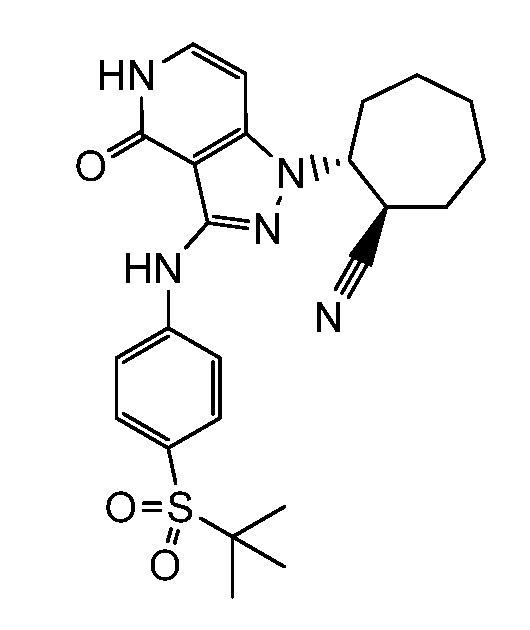
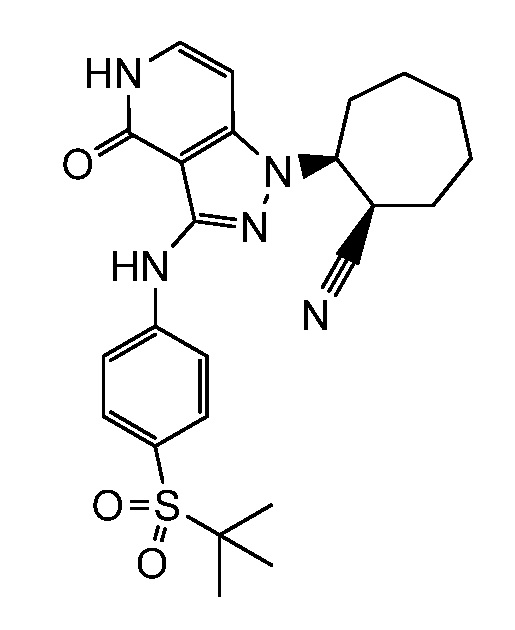
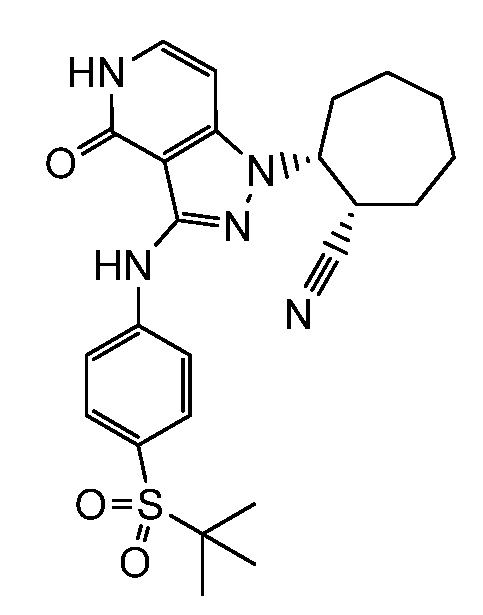
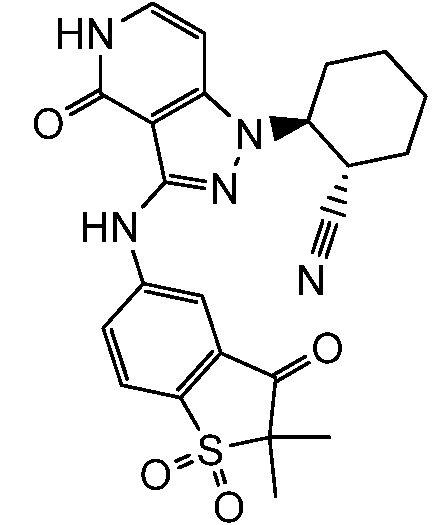
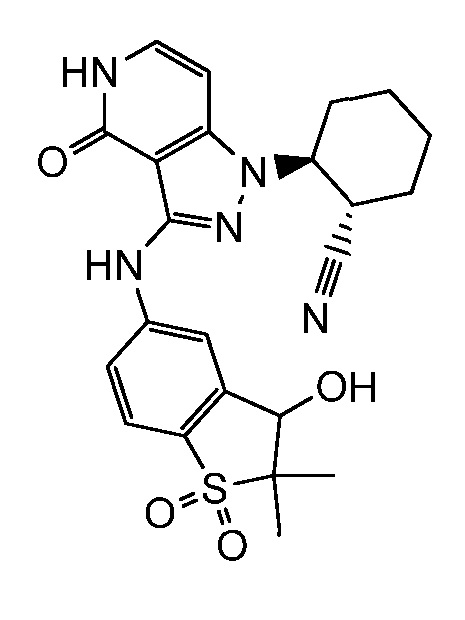
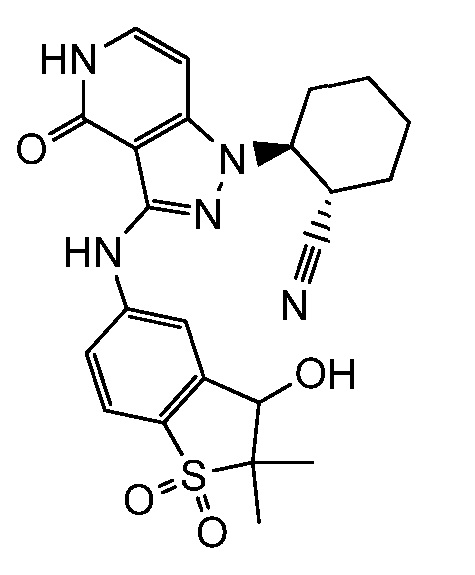
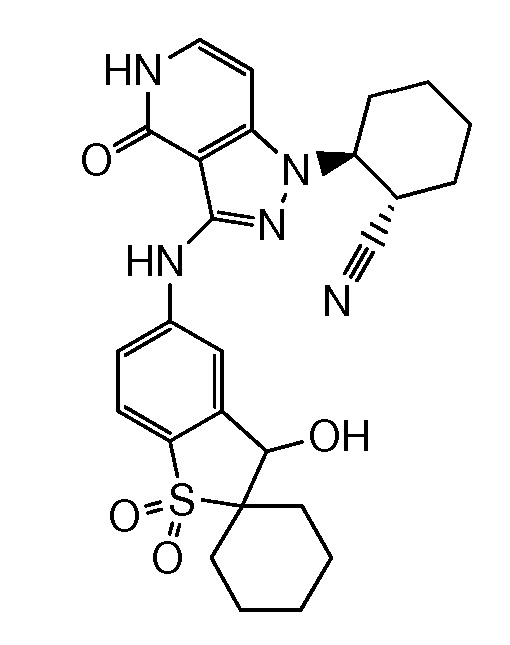
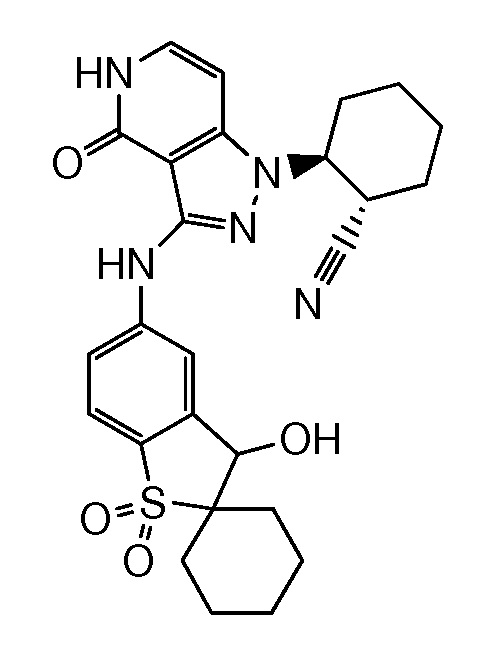
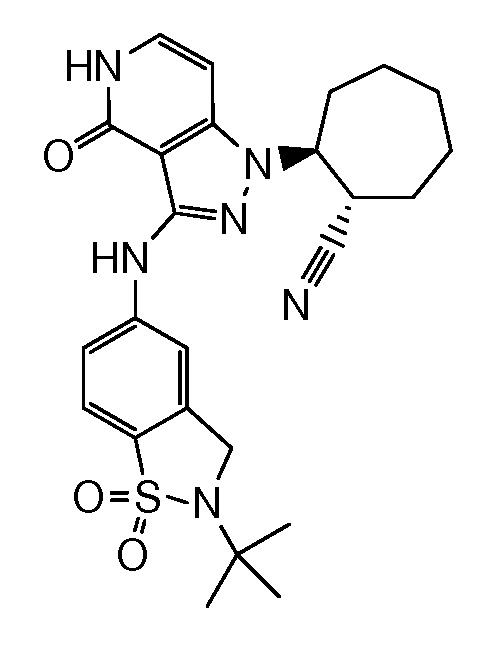
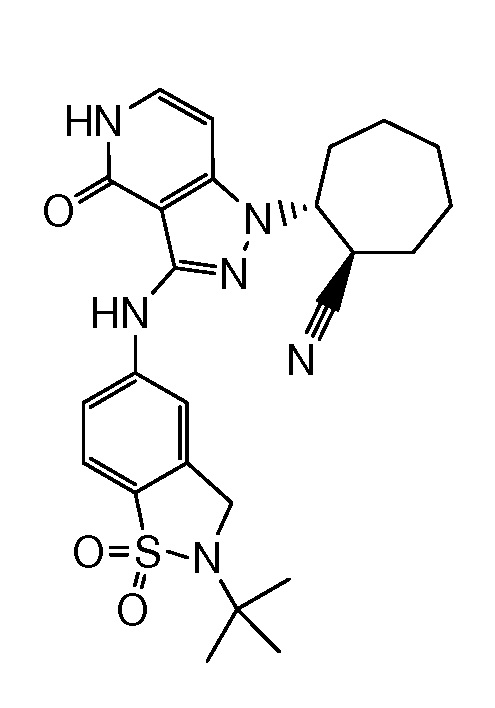
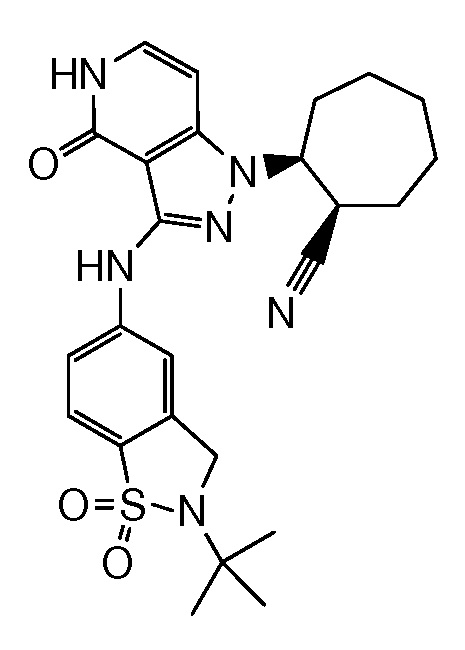
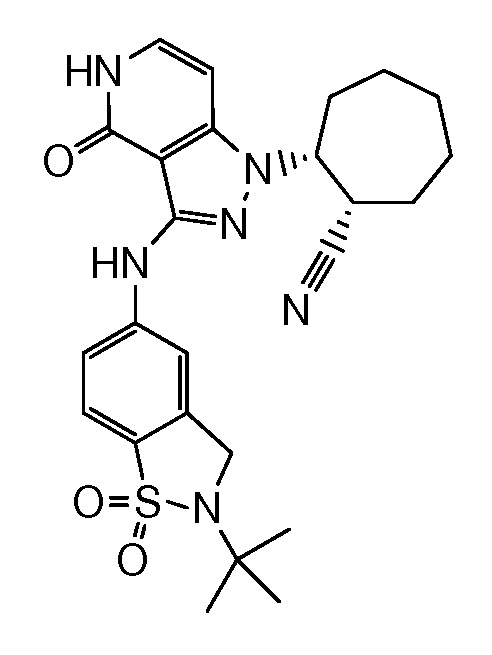
Пример 3-5
(1S,2S)-2-(3-{[4-(Метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
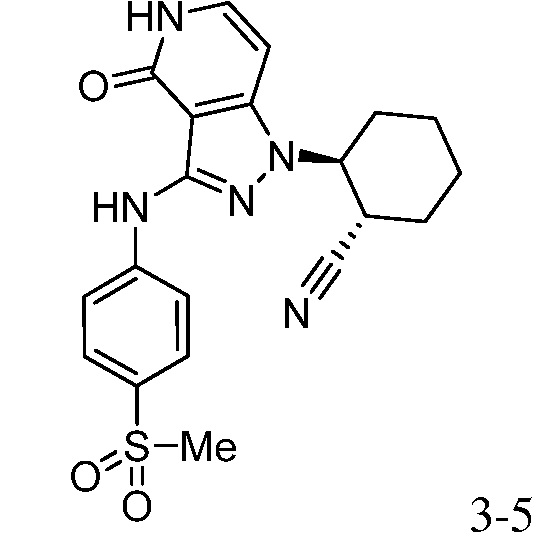
Стадия 1: (1S,2S)-2-(4-(Бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
Смесь (1S,2S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)циклогексанкарбонитрила (I-5; 6,24 г, 18,0 ммоль), 1-бром-4-(метилсульфонил)бензола (8,44 г, 35,9 ммоль), Pd2(dba)3 (1,64 г, 1,80 ммоль) и 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-три-изопропилбифенила (тетраметил-трет-Bu-Xphos; 2,59 г, 5,38 ммоль) в 2-пропаноле (70 мл) помещали в пробирку и герметично закрывали. Смесь продували аргоном в течение 10 мин, а затем нагревали при 85°С в течение 2 часов. Реакционную смесь охлаждали и разбавляли этилацетатом, фильтровали через целит, полученный фильтрат концентрировали в вакууме. Полученный остаток очищали с помощью хроматографии на силикагеле (0-80% EtOAc/гексаны) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C27H28N5O3S [M+H]: 502; найдено 502.
Стадия 2: (1S,2S)-2-(4-(Бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
(1S,2S)-2-(4-(бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (8,58 г, 17,1 ммоль) и Pd/C (10%; 0,85 г, 0,80 ммоль) объединяли в колбе и помещали в атмосферу азота. Добавляли этилацетат (100 мл) и ТГФ (100 мл), из смеси откачивали газ в вакууме и обратно заполняли H2 (3 ×). Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода (давление баллона) в течение ночи. Катализатор удаляли фильтрованием реакционной смеси через целит, промывая при помощи EtOAc. Полученный фильтрат концентрировали в вакууме с получением остатка, который очищали хроматографией на силикагеле (0-6% МеОН/ ДХМ) и растирали в порошок при помощи МеОН с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C20H22N5O3S [M+H]+: 412, найдено 412. 1H ЯМР (600 MГц, ДМСО-d6): δ 11,1 (с, 1H), 8,66 (с, 1H), 7,85 (д, J=8,4 Гц, 2H), 7,75 (д, J=9,0 Гц, 2H), 7,22 (м, 1H), 6,68 (д, J=7,2 Гц, 1H), 4,70 (м, 1H), 3,35 (м, 1H), 3,10 (с, 3H), 2,16 (м, 1H), 1,68-1,91 (м, 5H), 1,46 (м, 1H), 1,33 (м, 1H).
Таблица 38 раскрывает промежуточные продукты, используемые в синтезе соединений примеров 4 и 5. Промежуточные продукты от I-168 до I-170 были получены с применением процедур, аналогичных тем, которые используются в процессе получения промежуточных продуктов I-8 и I-9 и с использованием общей процедуры для Примера 3-1.
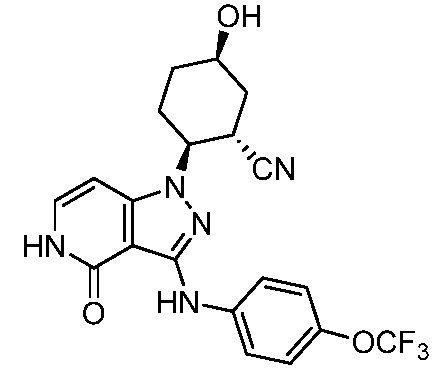
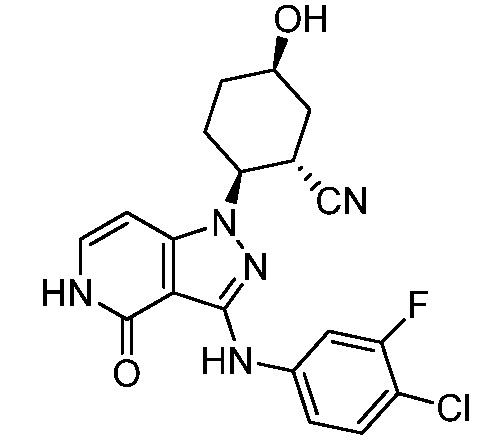
Примеры 4-1, 4-2, 4-3, и 4-4
(1R,2R,5S)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил (4-1)
(1S,2S,5R)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил (4-2)
(1R,2R,5R)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил (4-3)
(1S,2S,5S)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил (4-4)
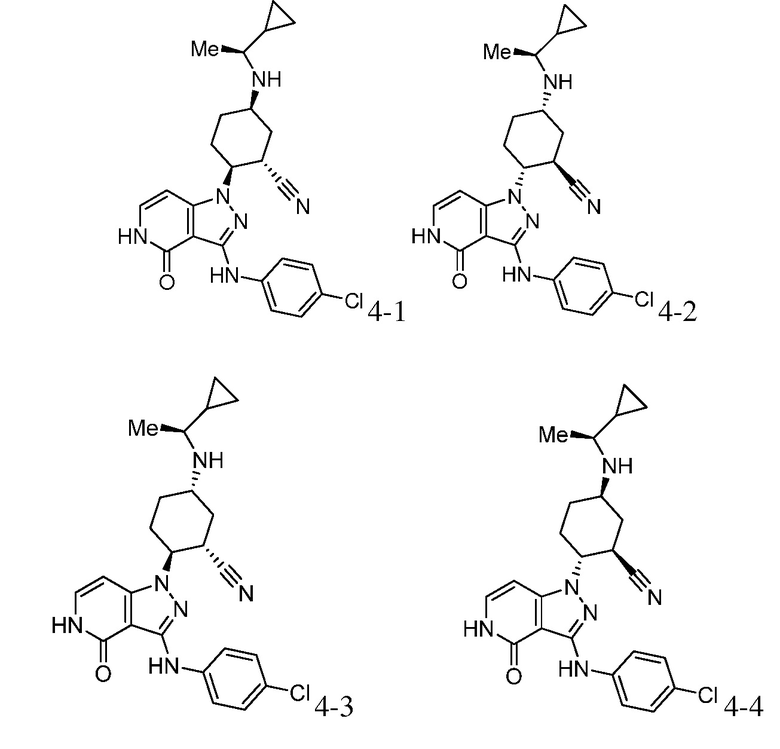
Стадия 1: (1R,2R)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-оксоциклогексанкарбонитрил и
(1S,2S)-2-(3-((4-Хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-оксоциклогексанкарбонитрил
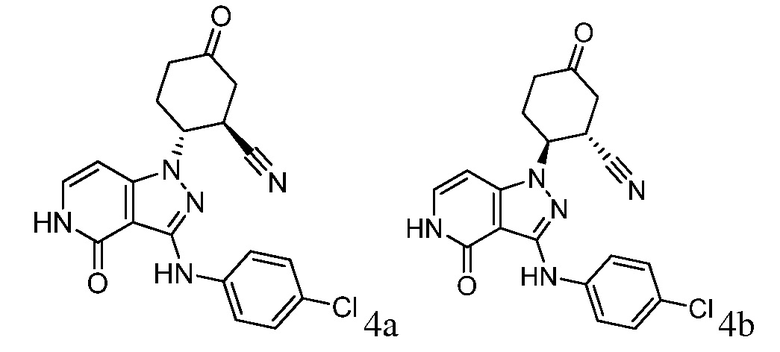
К раствору (рацемического)-2-(3-((4-хлорфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксициклогексанкарбонитрила (I-168; 77 мг, 0,20 ммоль) в ДМСО (2,0 мл) добавляли IBX (стабилизированный, 45% масс.; 312 мг, 0,502 ммоль), и смесь нагревали при 50°С в течение 3 ч. Смесь охлаждали до комнатной температуры, перемешивали с нас. раствором Na2S2O3 и нас. раствором NaHCO3 в течение 30 мин, экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой кетон, (4a и 4b) использовали на следующей стадии без очистки.
Стадия 2: Указанные в заголовке соединения 4-1, 4-2, 4-3 и 4-4
К смеси сырого кетона из предыдущей стадии (70,0 мг, 0,183 ммоль), (s)-1-циклопропилэтиламина (150 мкл, 1,47 ммоль) и уксусной кислоты (84,0 мкл, 1,47 ммоль) в MeOH/ТГФ добавляли NaCNBH4 (28,8 мг, 0,458 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч, разбавляли EtOAc и нас. раствором NaHCO3. Органический слой отделяли, промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии (сухая нагрузка, 0-20% МеОН/ДХМ) с получением двух смесей, каждая содержащая два диастереомера. Две смеси отдельно подвергали хиральному разделению с получением 4 диастереомеров:
Используемая колонка: Phenomenex Lux-4 IC, 2,1×25см, 5 мкм.
Подвижная фаза: 39%/61% MeOH/CO2 (с 0,25% модификатора диметиламина).
Линейная скорость потока: 62 мл/мин, 7 мин время хроматографирования
Длина волны: 220 нм.
Диастереомер 1; Пример 4-1: (1S,2S,5R)-2-(3-((4-Хлофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил МСНР (ИЭС) рассчитано для C24H28ClN6O [M+H]+: 451, найдено 451. 1H ЯМР (600 MГц, Ацетон-d6): δ 10,1 (с, 1H), 8,09 (с, 1H), 7,78 (д, J=7,8 Гц, 2H), 7,27-7,29 (м, 3H), 6,60 (д, J=7,2 Гц, 1H), 4,64 (тд, J=12,0, 3,6 Гц, 1H), 3,96 (т, J=12.0 Гц, 1H), 3,33 (д, J=21,0 Гц, 1H), 2,50-2,58 (м, 1H), 2,16-2,30 (м, 2H), 1,87-2,08 (м, 3H), 1,60-1,68 (м, 2H), 1,17 (с, 3H), 0,70-0,80 (м, 1H), 0,50-0,58 (м, 1H), 0,34-0,46 (м, 2H), 0,18-0,23 (м, 1H).
Диастереомер 2; Пример 4-2: (1R,2R,5S)-2-(3-((4-Хлофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил МСНР (ИЭС) рассчитано для C24H28ClN6O [M+H]+: 451, найдено 451.
Диастереомер 3; Пример 4-3: (1S,2S,5S)-2-(3-((4-Хлофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил МСНР (ИЭС) рассчитано для C24H28ClN6O [M+H]+: 451, найдено 451.
Диастереомер 4; Пример 4-4: (1R,2R,5R)-2-(3-((4-Хлофенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(((S)-1-циклопропилэтил)амино)циклогексанкарбонитрил МСНР (ИЭС) рассчитано для C24H28ClN6O [M+H]+: 451, найдено 451. 1H ЯМР (600 MГц, Ацетон-d6): δ 10,1 (с, 1H), 8,09 (с, 1H), 7,74 (д, J=9,0 Гц, 2H), 7,27-7,29 (м, 3H), 6,62 (д, J=7,2 Гц, 1H), 4,64-4,69 (м, 1H), 3,59 (т, J=10,2 Гц, 1H), 3,00-3,12 (м, 1H), 2,49-2,56 (м, 1H), 2,05-2,26 (м, 5H), 1,26-1,70 (м, 3H), 1,16 (с, 3H), 0,70-0,80 (м, 1H), 0,40-0,49 (м, 2H), 0,24-0,38 (м, 1H), 0,10-0,17 (м, 1H).
Примеры 5-1 и 5-2
(1S,2S,5R)-2-(3-((4-Хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(диметиламино)циклогексанкарбонитрил (5-1) и
(1S,2S,5S)-2-(3-((4-Хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(диметиламино)циклогексанкарбонитрил (5-2)
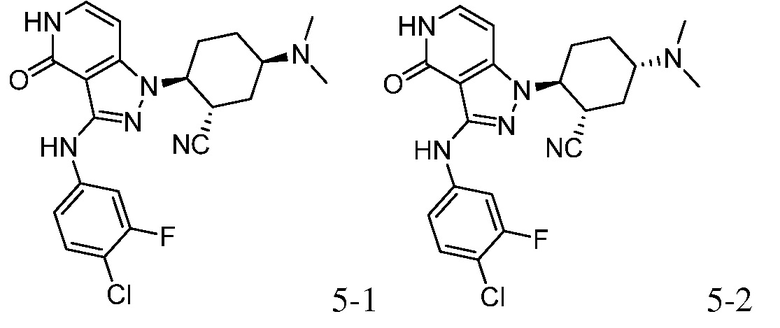
Стадия 1: (1S,2S)-2-(3-((4-Хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-оксоциклогексанкарбонитрил
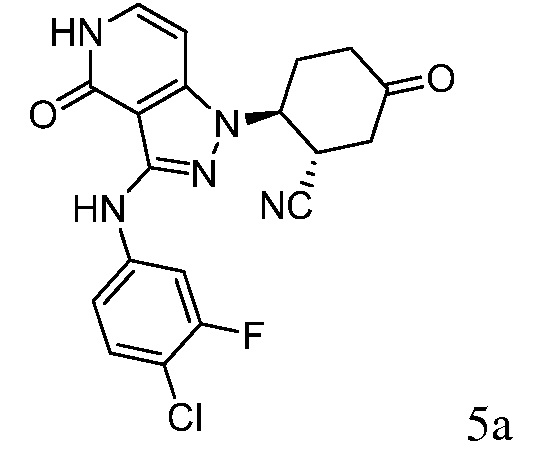
К раствору (1S,2S,5R)-2-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-гидроксицилогексанкарбонитрила(I-170; 0,55 г, 1,4 ммоль) в ДМСО (14 мл) добавляли IBX (стабилизированный, 45% масс.; 2,1 г, 3,4 ммоль). Смесь нагревали при 50°С и выдерживали в течение 2,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли смесью воды (70 мл), водного раствора тиосульфата натрия (15 мл) и водного раствора бикарбоната натрия (15 мл) и энергично перемешивали в течение 20 минут. Реакционную смесь экстрагировали EtOAc (50 мл). Органический слой промывали водой (15 мл) и насыщенным раствором соли (15 мл), затем сушили над Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C19H16ClFN5O2 [M+H]+: 400, найдено 400.
Стадия 2: (1S,2S,5R)-2-(3-((4-Хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(диметиламино)циклогексанкарбонитрил (5-1) и (1S,2S,5S)-2-(3-((4-Хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-(диметиламино)циклогексанкарбонитрил (5-2)
К суспензии (1S,2S)-2-(3-((4-хлор-3-фторфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-5-оксоциклогексанкарбонитрила (0,18 г, 0,45 ммоль) в смеси ТГФ (2,3 мл) и MeOH (2,3 мл) добавляли диметиламин (0,16 г, 3,6 ммоль) и уксусную кислоту (0,21 мл, 3,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, затем добавляли цианоборгидрид натрия (0,71 г, 1,1 ммоль), и реакционную смесь оставляли перемешиваться в течение 18 часов при комнатной температуре. Реакционную смесь концентрировали в вакууме с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (ДХМ/MeOH).
Пик A, Пример 5-1. МСНР (ИЭС) рассчитано для C21H23ClFN6O [M+H]+: 429, найдено 429. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,10 (д, J=5,6 Гц, 1H), 8,47 (с, 1H), 7,84 - 7,78 (м, 1H), 7,43 - 7,36 (м, 2H), 7,24 - 7,19 (м, 1H), 6,61 (д, J=7,4 Гц, 1H), 4,80 - 4,74 (м, 1H), 3,59 - 3,52 (м, 1H), 2,43 - 2,35 (м, 1H), 2,19 (с, 6H), 2,14 - 2,10 (м, 2H), 2,06 - 1,99 (м, 1H), 1,90 - 1,82 (м, 1H), 1,68 - 1,61 (м, 1H), 1,61 - 1,53 (м, 1H).
Пик В дополнительно очищали с помощью обращенно-фазовой ВЭЖХ (С-18; ацетонитрил/вода, содержащая 0,1% ТФУК). Фракции, содержащие целевой продукт, разбавляли EtOAc, промывали насыщенным расвором NаНСО3, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением Примера 5-2. МСНР (ИЭС) рассчитано для C21H23ClFN6O [M+H]+: 429, найдено 429. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,10 (д, J=5,7 Гц, 1H), 8,44 (с, 1H), 7,80 (дд, J=12,4, 2,5 Гц, 1H), 7,49 (дд, J=8,8, 2,3 Гц, 1H), 7,38 (т, J=8,7 Гц, 1H), 7,21 (дд, J=7,2, 6,0 Гц, 1H), 6,64 (д, J=7,3 Гц, 1H), 4,75 - 4,67 (м, 1H), 3,46 - 3,39 (м, 1H), 2,48 - 2,42 (м, 1H), 2,23 - 2,15 (м, 7H), 1,94 - 1,89 (м, 2H), 1,86 - 1,80 (м, 1H), 1,77 - 1,69 (м, 1H), 1,54 - 1,44 (м, 1H).
Таблица 39 содержит Примеры от 5-3 по 5-28, которые получали аналогичным образом, что и Примеры 5-1 и 5-2, исходя из соответствующим образом замещенных гидрокси-содержащих промежуточных продуктов и аминов посредством реакций последовательного окисления и восстановительного аминирования.
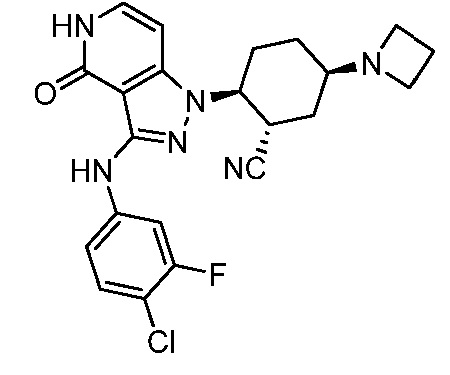
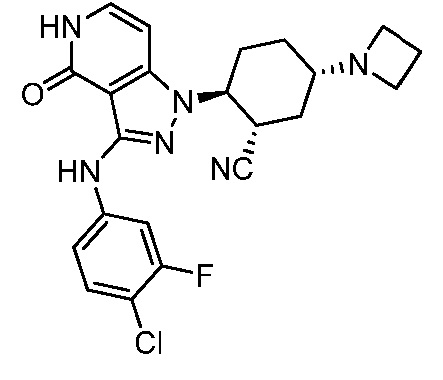
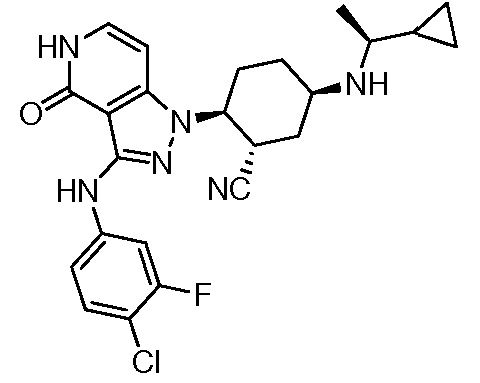
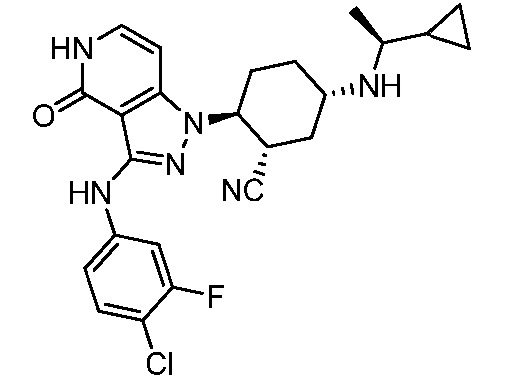
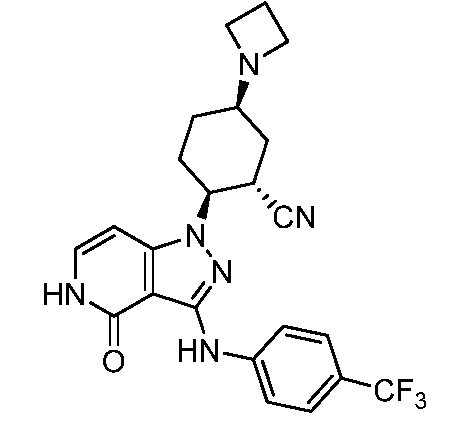
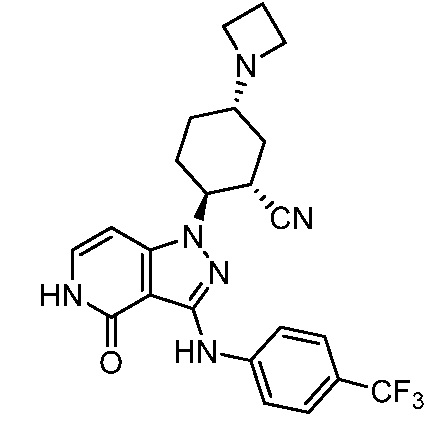
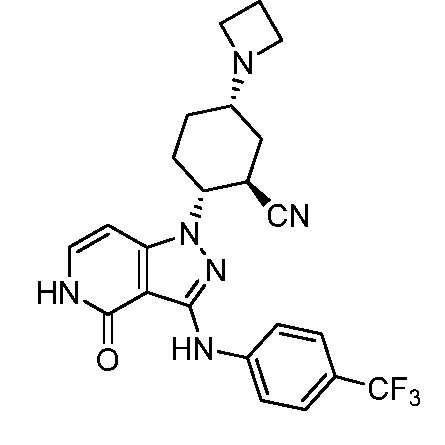
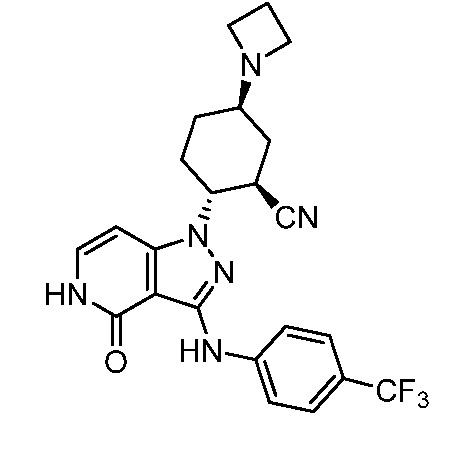
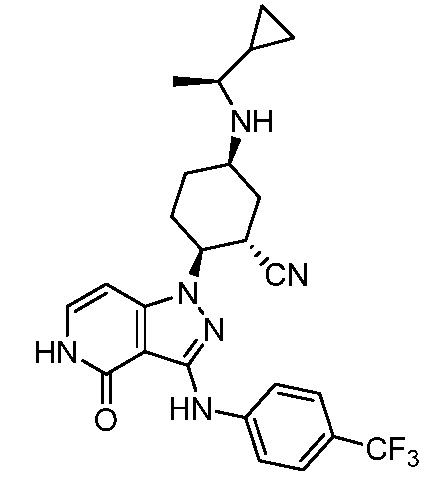
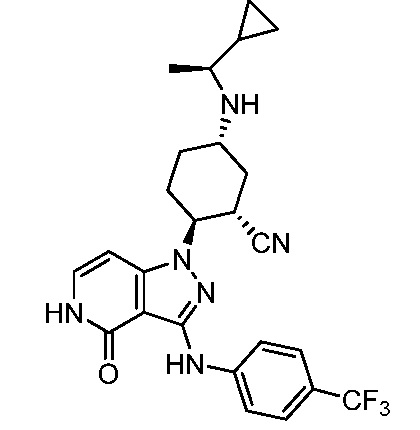
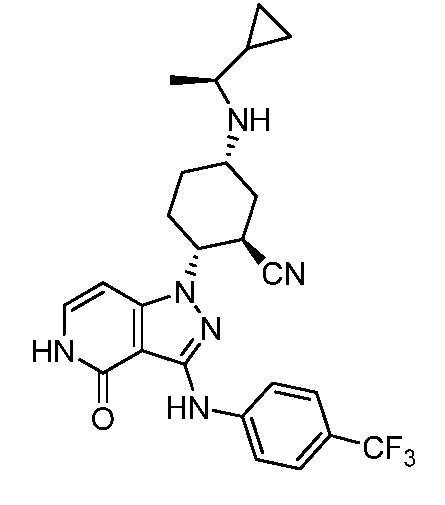
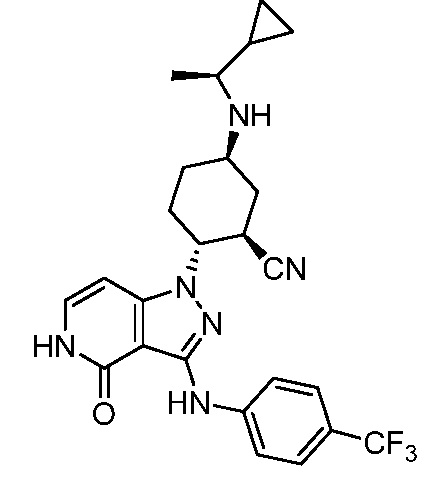
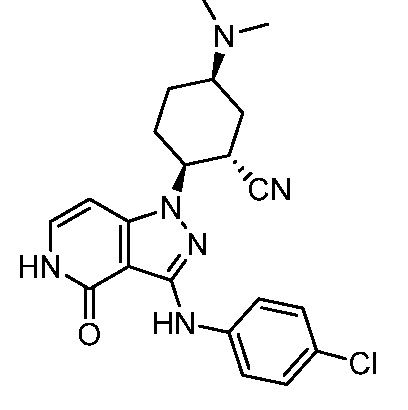
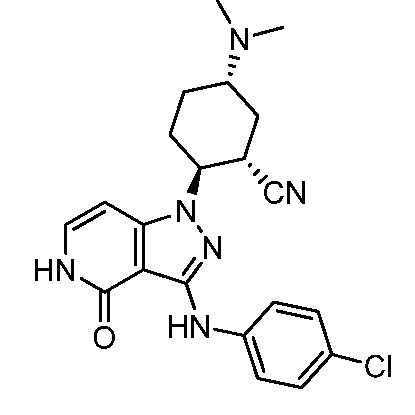
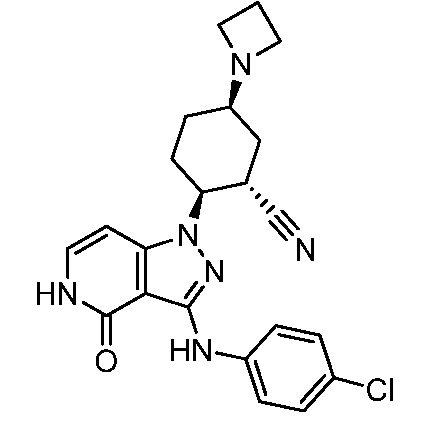
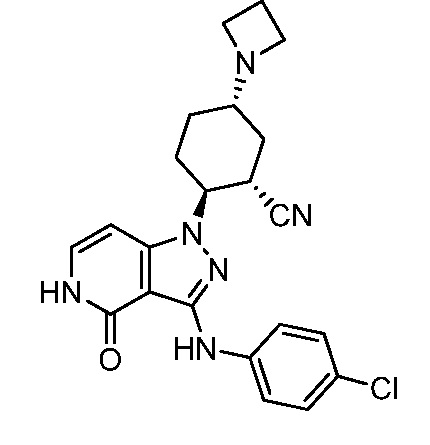
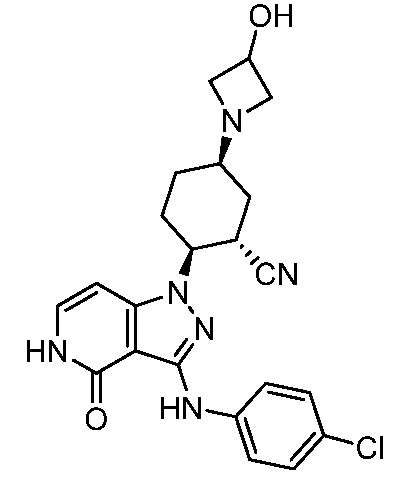
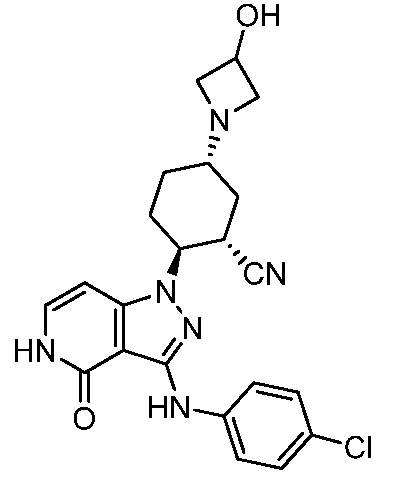
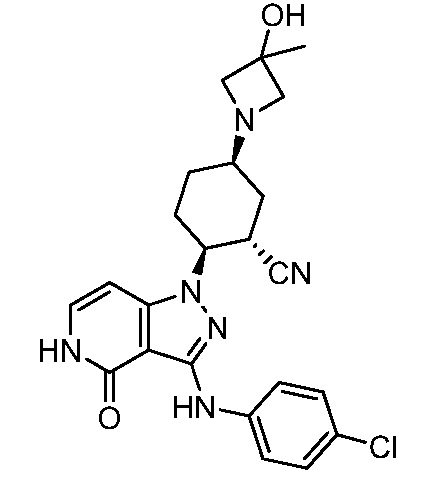
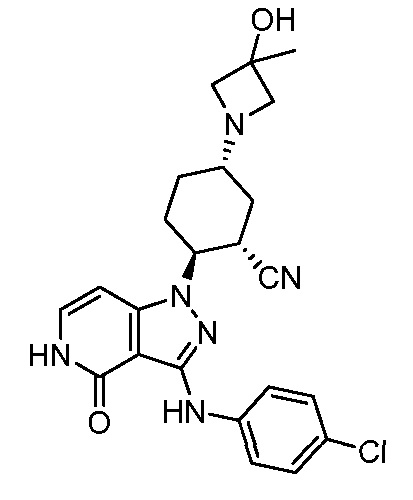
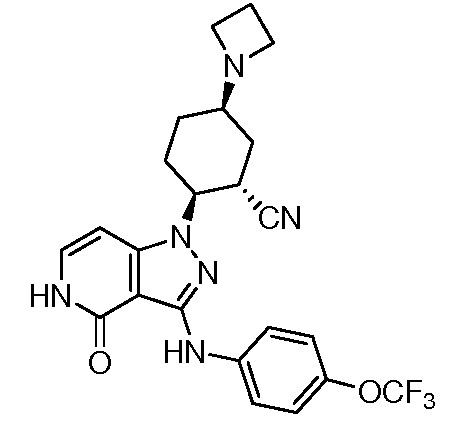
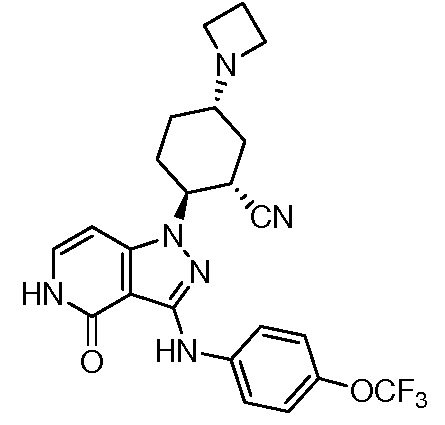
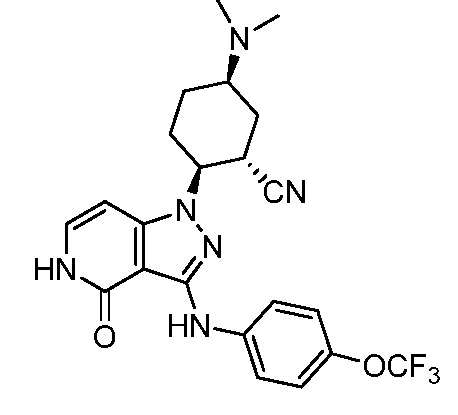
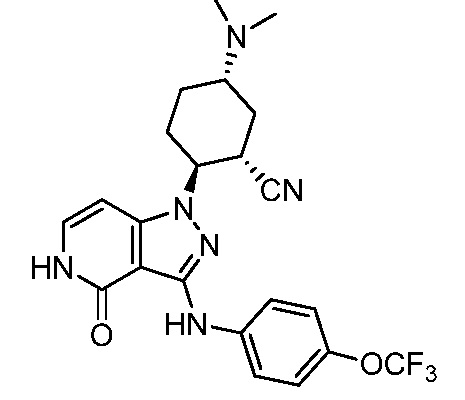
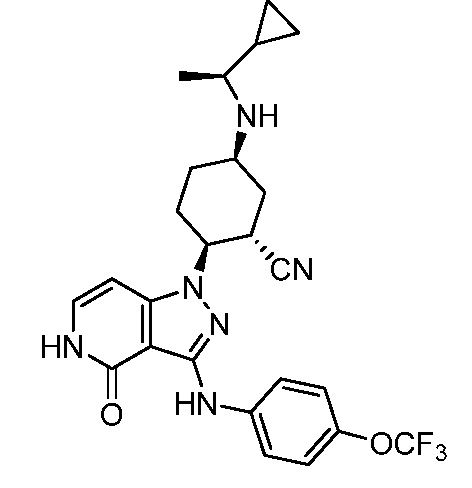
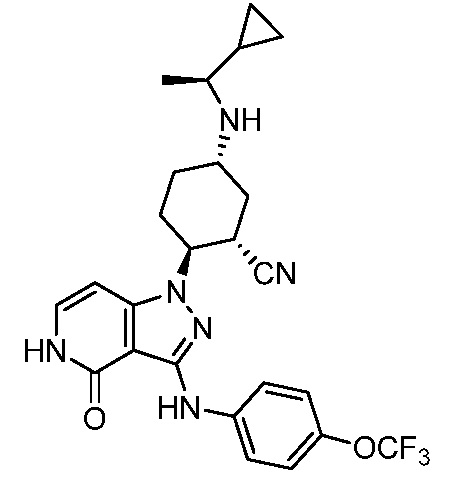
Пример 6-1
(1S,2S)-2-(3-((3-(Аминометил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
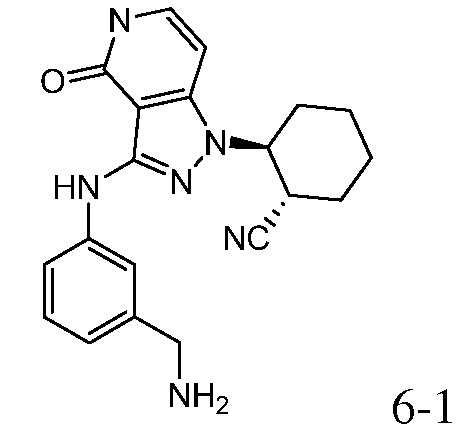
В колбу, содержащую Пример 3-16 (0,29 г, 0,63 ммоль), добавляли раствор HCl-МеОН, и полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали в вакууме с получением (1S,2S)-2-(3-((3-(аминометил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила (HCl-соли). МСНР (ИЭС) рассчитано для C20H23N6O [M+H]+: 363, найдено 363. 1H ЯМР (400 MГц, ДМСО-d6): δ 11,12 (д, J=5,6 Гц, 1H), 8,41 (уш., 3H), 8,15 (с, 1H), 7,78-7,76 (м, 1H), 7,55 (с, 1H), 7,34-7,30 (м, 1H), 7,27-7,19 (м, 1H), 6,99-6,95 (м, 1H), 6,66 (д, J=7,2 Гц, 1H), 4,69-4,63 (м, 1H),3,98 (д, J=5,2 Гц, 2H), 2,70-2,64 (м, 1H), 2,18-2,15 (м, 1H), 1,91-1,88 (м, 2H), 1,79-1,73 (м, 3H), 1,69-1,33 (м, 2H).
Таблица 40 содержит Примеры, которые получали аналогичным образом, что и Пример 6-1.
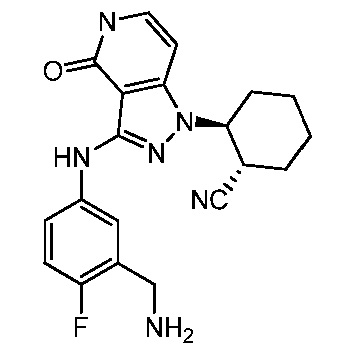
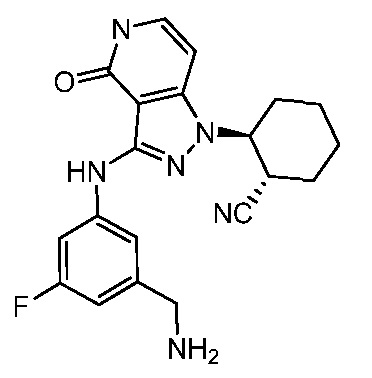
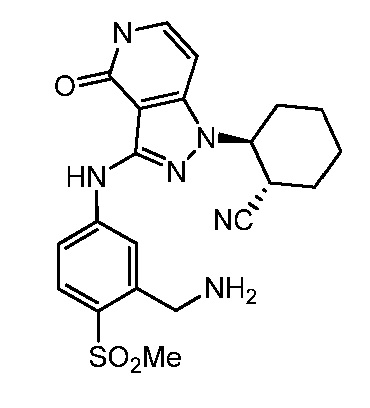
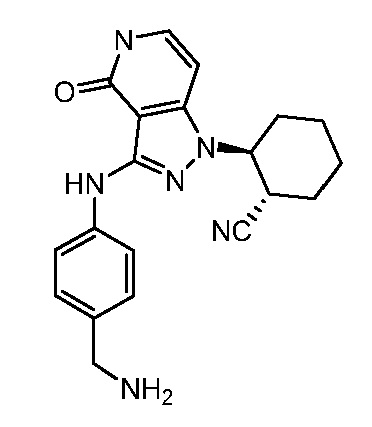
Пример 7-1
(1S,2S)-2-(3-((3-((S)-1-Амино-2,2,2-трифторэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрилкарбонитрил
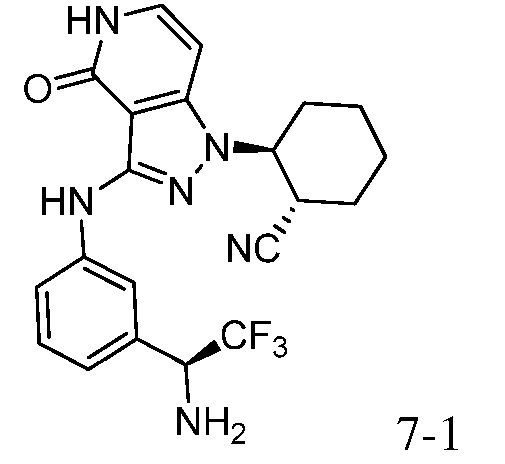
К раствору HCl в EtOAc (1,0 М, 1,5 мл) добавляли (R)-N-((S)-1-(3-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-2,2,2-трифторэтил)-2-метилпропан-2-сульфинамид (Пример 3-55; 12 мг, 0,020 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. После концентрирования в вакууме, полученный остаток очищали с помощью препаративной ВЭЖХ (Прибор: YMC-Actus, Колонка: Triart C-18 150×30 мм; 5 мкм, Подвижная фаза A: вода, Подвижна фаза B: ацетонитрил) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C21H22F3N6O [M+H]+ : 431, найдено 431.
Таблица 41 раскрывает Примеры, которые полученные аналогичным образом, что и Пример 7-1.
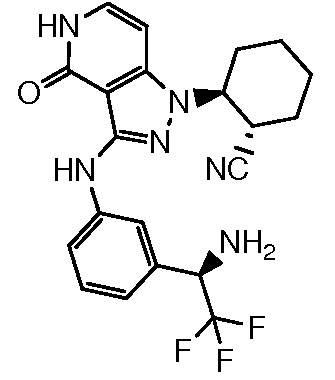
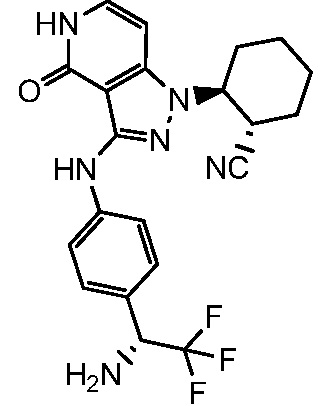
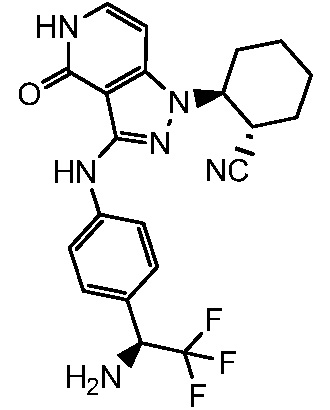
Пример 8-1
2-(Аминометил)-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамид
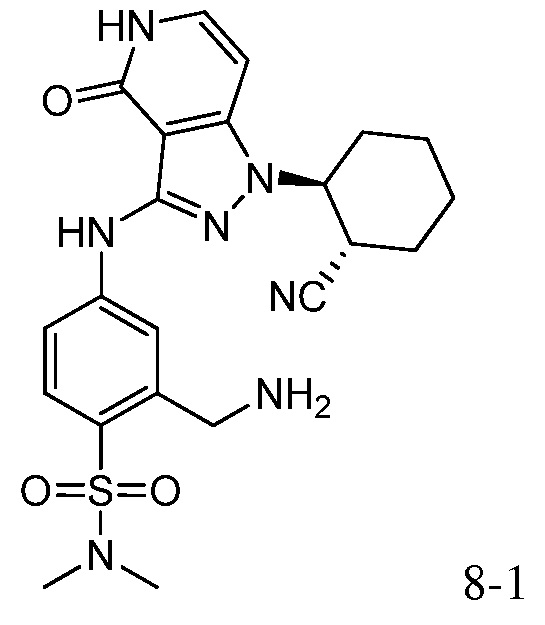
Смесь Примера 3-40 (10 мг, 0,020 ммоль) в HCl (1,0 М, 10 мл) кипятили с обратным холодильником в течение 4 ч. После удаления растворителя остаток очищали с помощью препаративной ВЭЖХ с получением 2-(аминометил)-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-N,N-диметилбензолсульфонамида. МСНР (ИЭС) рассчитано для C22H28N7O3S [M+H]+: 470, найдено 470.
Примеры 9-1 и 9-2
(S или R)-2-(1-(3-(4-(1-Амино-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил и
(R или S)-2-(1-(3-(4-(1-Амино(-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил
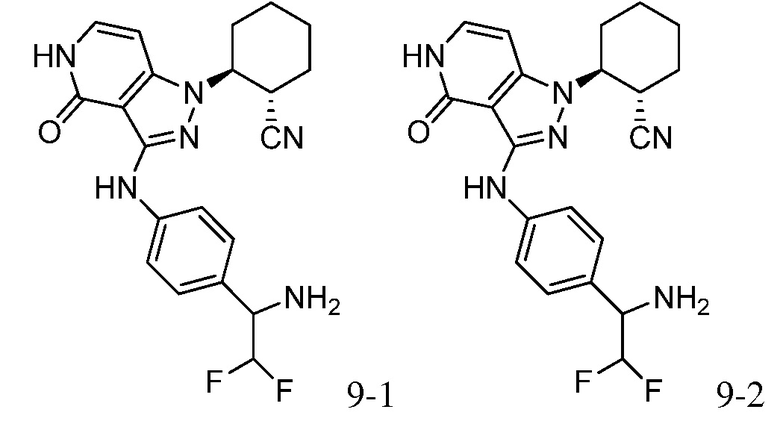
Стадия 1: 1-(4-Бромфенил)-2,2-дифторэтанон
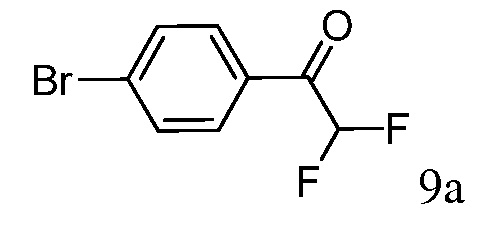
В 100-мл 3-горлую круглодонную колбу добавляли раствор 1,4-дибромбензола (0,23 г, 0,99 ммоль) в тетрагидрофуране (50 мл). Раствор помещали в атмосферу азота и охлаждали до -78°С. По каплям добавляли н-бутиллитий (0,4 мл, 2,5 М), и полученный раствор перемешивали в течение 30 мин при той же температуре. Этил 2,2-дифторацетат (0,14 г, 1,1 ммоль) добавляли по каплям к смеси, и полученный раствор перемешивали в течение дополнительного 1 ч при -78°С. Реакцию останавливали путем осторожного добавления соляной кислоты (2,0 мл, 1,0 М). Смесь экстрагировали этилацетатом (2×10 мл), и органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением 1-(4-бромфенил)2,2-дифторэтан-1-она. GCMS рассчитано для C8H5BrF2O [M]+: 234, найдено 234.
Стадия 2: (1S,2S)-2-(4-(Бензилокси)-3-((4-(2,2-дифторацетил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
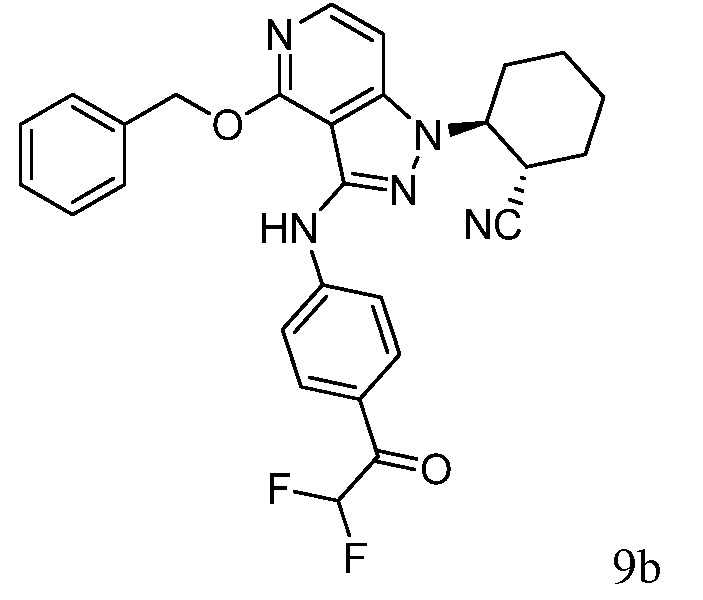
В 100-мл круглодонную колбу помещали (1S,2S)-2-[3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил]циклогексан-1-карбонитрил (I-7; 0,50 г, 1,4 ммоль), 1-(4-бромфенил)-2,2-дифторэтан-1-он (0,67 г, 2,9 ммоль), трис(дибензилиденацетон)дипалладий (0) (0,33 г, 0,36 ммоль), ди-трет-бутил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,45 г, 1,0 ммоль), ацетат калия (0,28 г, 2,8 ммоль) и изопропанол (50 мл). Полученную смесь перемешивали в течение 16 ч при 80°С. Смесь фильтровали, и фильтрат концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/петролейный эфир: 1:10) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C28H26F2N5O2 [M + H]+: 502, найдено 502.
Стадия 3: N-(1-(4-((4-(Бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-2,2-дифторэтил)-2-метилпропан-2-сульфинамид (смесь диастереомеров)
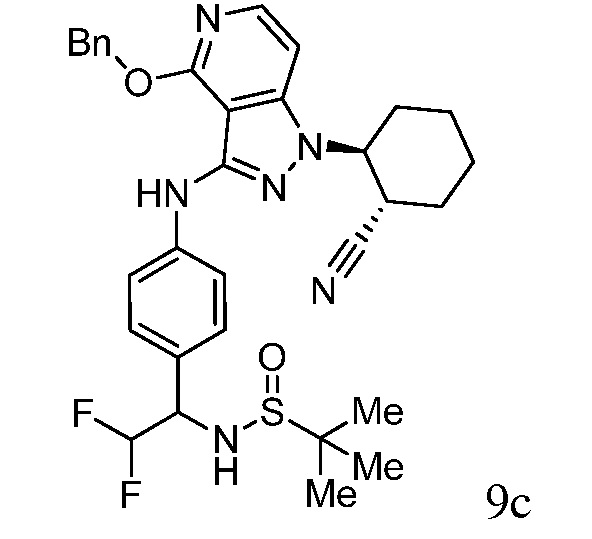
В 100-мл круглодонную колбу, продуваемую азотом, помещали (1S,2S)-2-(4-(бензилокси)-3-((4-(2,2-дифторацетил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (0,25 г, 0,50 ммоль), 2-метилпропан-2-сульфинамид (0,12 г, 0,99 ммоль), изопропоксид титана (0,28 г, 1,0 ммоль) и тетрагидрофуран (40 мл). Смесь перемешивали в течение 4 ч при 80°С и охлаждали до комнатной температуры. Добавляли порциями боргидрид натрия (93 мг, 1,5 ммоль). Смесь перемешивали в течение 3 ч при температуре окружающей среды и гасили водой (50 мл). Твердые вещества отфильтровывали, и полученный фильтрат экстрагировали этилацетатом (3×100 мл). Объединенные органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде смеси диастереомеров. МСНР (ИЭС) рассчитано для C32H37F2N6O2S [M + H]+: 607, найдено 607.
Стадия 4: (S или R)-2-(1-(3-(4-(1-Амино-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил и (S или R)-2-(1-(3-(4-(1-Амино-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил
В 50-мл круглодонную колбу помещали N-(1-(4-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-2,2-дифтоэтил)-2-метилпропан-2-сульфинамид (смесь диастереомеров) (0,25 г, 0,50 ммоль), 10% палладий на углероде (0,20 г), этилацетат (20 мл) и хлористоводородную кислоту (1 мл, 1 М). Полученную смесь перемешивали в течение 5 ч при температуре окружающей среды в атмосфере водорода (0,203 МПа). Твердое вещество удаляли фильтрованием. Фильтрат доводили до рН = 8 насыщенным водным раствором карбоната натрия и смесь экстрагировали этилацетатом (3×50 мл). Органические слои объединяли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением (1S,2S)-2-(3-[[4-(1-амино-2,2-дифторэтил)фенил]амино]-4-оксо-1H,4H,5H-пиразоло[4,3-c]пиридин-1-ил)циклогексан-1-карбонитрила (смеси диастереомеров). Твердое вещество очищали с помощью хиральной препаративной ВЭЖХ в следующих условиях: колонка, Chiralpak IA, 2×25 см, 5 мкм; подвижная фаза, гексан и этанол (поддержание 40,0% этанола в течение 30 мин); детектор, УФ 254/220 нм. Это дает (S или R)-2-(1-(3-(4-(1-Амино-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил (9-1) МСНР (ИЭС) рассчитано для C21H23F2N6O [M + H]+: 413, найдено 413; 1H ЯМР (400 MГц, ДМСО-d6) δ 11,10 (д, J=5,6 Гц, 1H), 8,07 (с, 1H), 7,64 (д, J=8,8 Гц, 2H), 7,33 (д, J=8,8 Гц, 2H), 7,24-7,21 (м, 1H), 5,93 (д, J=4,4 Гц, 1H), 4,81-4,61 (м, 1H), 4,12-3,95 (м, 1H), 3,33 (д, J=11,2 Гц, 1H), 2,21 (д, J=11,2 Гц, 3H), 1,91-1,75 (м, 5H), 1,77-1,33 (м, 3H) и (S или R)-2-(1-(3-(4-(1-Амино-2,2-дифторэтил)фениламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексил)ацетонитрил (9-2) МСНР (ИЭС) рассчитано для C21H23F2N6O [M + H]+: 413, найдено 413; 1H ЯМР (400 MГц, ДМСО-d6) δ 11,09 (д, J=5,6 Гц, 1H), 8,07 (с, 1H), 7,64 (д, J=8,8 Гц, 2H), 7,33 (д, J=8,8 Гц, 2H), 7,24-7,21 (м, 1H), 5,93 (д, J=4,4 Гц, 1H), 4,72-4,65 (м, 1H), 4,06-4,01 (м, 1H), 3,33 (д, J=11,2 Гц, 1H), 2,20 (д, J=11,8 Гц, 2H), 1,91-1,75 (м, 5H), 1,87-1,33 (м, 4H).
Таблица 42 раскрывает соединения, которые получали в соответствии с аналогичными процедурами, как описано выше в Примерах 9-1 и 9-2, с использованием диметиламина вместо 2-метилпропан-2-сульфинамида.
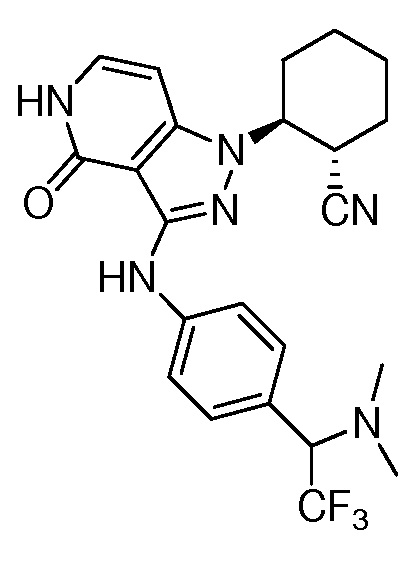
найдено 459
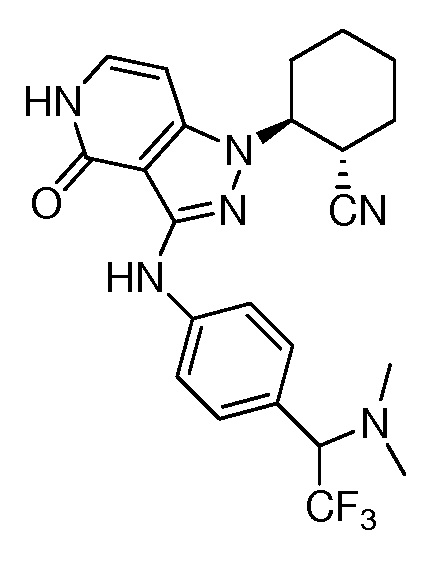
найдено 459
Пример 10-1
Рацемический-(1S,2S)-2-(3-((4-(2,2-дифтор-1-гидроксиэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
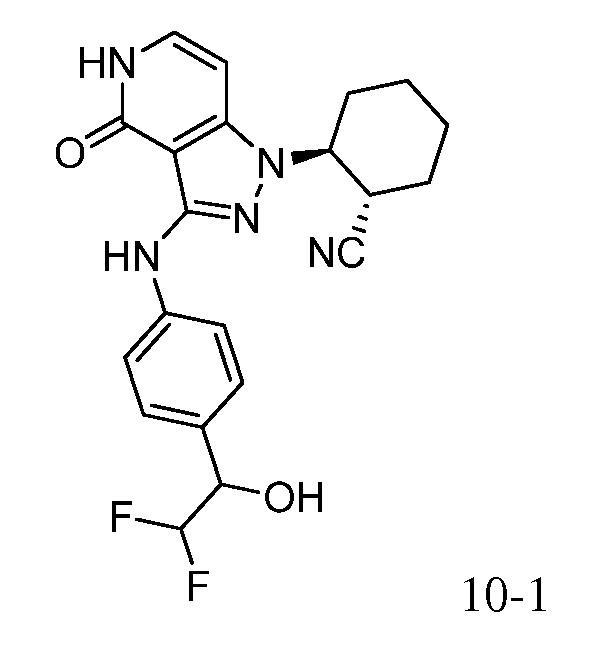
Стадия 1: (1S,2S)-2-(4-(Бензилокси)-3-((4-(2,2-дифтор-1-гидроксиэтил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (смесь диастереомеров)
В 100-мл круглодонную колбу помещали раствор Примера 9b (0,13 г, 0,26 ммоль) в метаноле (10 мл). Добавляли порциями боргидрид натрия (30 мг, 0,79 ммоль), и полученную смесь перемешивали в течение 3 ч при температуре окружающей среды. К реакционной смеси добавляли воду (20 мл), и смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением рацемической смеси указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C28H28F2N5O2 [M + H]+: 504, найдено 504.
Стадия 2: (1S,2S)-2-(3-((4-(2,2-Дифтор-1-гидроксиэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (смесь диастереомеров)
Удаление защиты проводили в соответствии с аналогичной процедурой, как описано выше для Примера 3-1 с получением диастереомерной смеси Примера 10-1. МСНР (ИЭС) рассчитано для C22H22F2N5O2 [M + H]+: 414, найдено 414; 1H ЯМР (400 MГц, ДМСО-d6) δ 11,10 (д, J=5,6 Гц, 1H), 8,10 (с, 1H), 7,66 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,4 Гц, 2H), 7,24-7,21 (м, 1H), 6,68 (д, J=7,2 Гц, 1H), 6,11-5,82 (м, 2H), 4,72-4,64 (м, 2H), 3,38-3,35 (м, 1H), 2,20 (д, J=10,0 Гц, 2H), 1,95-1,13 (м, 6H).
Пример 11-1
(1S,2S)-2-(3-((3-(1,2-Дигидроксипропан-2-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (смесь диастереомеров)
К суспензии (1S,2S)-2-{4-оксо-3-[3-(2,2,4-триметил-[1,3]диоксолан-4-ил)-фениламино]-4,5-дигидро-пиразоло[4,3-c]пиридин-1-ил}-циклогексанкарбонитрила (смесь диастереомеров Примера 3-38; 10 мг, 0,022 ммоль) в ТГФ (1 мл) добавляли HCl (0,4 мл). Полученную суспензию перемешивали при комнатной температуре в течение 8 часов. Смесь концентрировали в вакууме, и полученный остаток очищали с помощью препаративной ВЭЖХ (способ описан ниже) с получением указанного в заголовке соединения (смесь диастереомеров). МСНР (ИЭС) рассчитано для C22H25N5O3 [M + H]+: 408, найдено 408.
Прибор: Gilson 215
Колонка: ASB C-18, 150×25мм, 5 мкм
Подважная фаза A: Вода (0,01 моль/л бикарбонат аммония)
Подвижная фаза B: Ацетонитрил (нейтральный)
Пример 12-1
(1S,2S)-2-(3-(Изоиндолин-5-иламино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (ТФУК-соль)
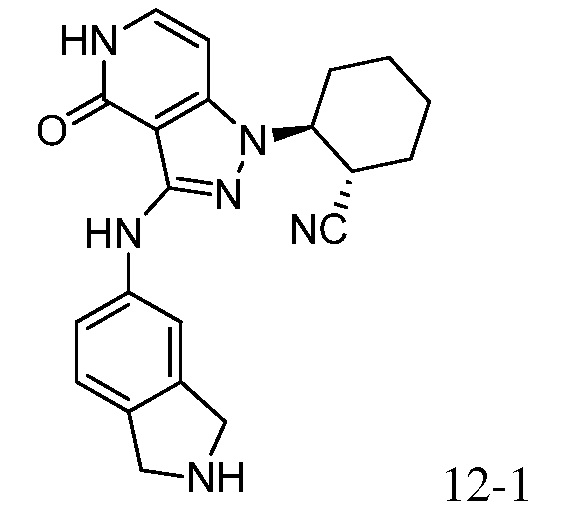
К перемешиваемому раствору трет-бутил-5-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)изоиндолин-2-карбоксилата (полученный аналогичным образом, как описано в Примере 3-16; 35 мг, 0,062 ммоль) в ДХМ (0,5 мл) добавляли ТФУК (0,5 мл). Полученный раствор перемешивали при комнатной температуре в течение приблизительно 3 ч. Реакционную смесь концентрировали в вакууме с получением сырого остатка, который переносили в МеОН (2 мл) и очищали с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором. Лиофилизация фракций, содержащих целевой продукт, давала указанное в заголовке соединение в виде ТФУК-соли. МСНР рассчитано для C21H23N6O [M+H]+: 375, найдено: 375. 1H ЯМР (600 MГц, ДМСО-d6): δ 11,07 (д, J=5,4 Гц, 1H), 9,24 (уш.с, 2H), 8,19 (с, 1H), 7,67 (с, 1H), 7,60 (д, J=8,4 Гц, 1H), 7,28 (д, J=7,8 Гц, 1H), 7,20 (т, J=7,8 Гц, 1H), 6,65 (д, J=7,2 Гц, 1H), 4,66 (дт, J=10,8, 4,2 Гц, 1H), 4,47 (уш.т, J=4,8 Гц, 2H), 4,41 (уш.т, J=5,4 Гц, 2H), 3,31 (м перекрывание с пиком воды, 1H) 2,16 (уш.д, J=10,8 Гц, 1H), 1,86-1,71 (м, 4H), 1,47 (уш.к, J=12,6 Гц, 1H), 1,32 (уш.к, J=13,2 Гц, 1H).
Таблица 43 содержит примеры, которые получали аналогичным образом, что и Пример 12-1.
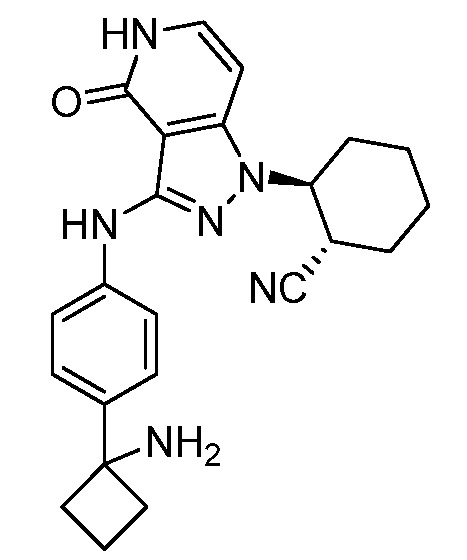
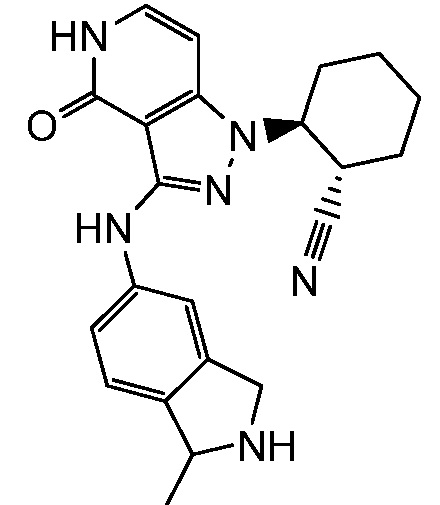
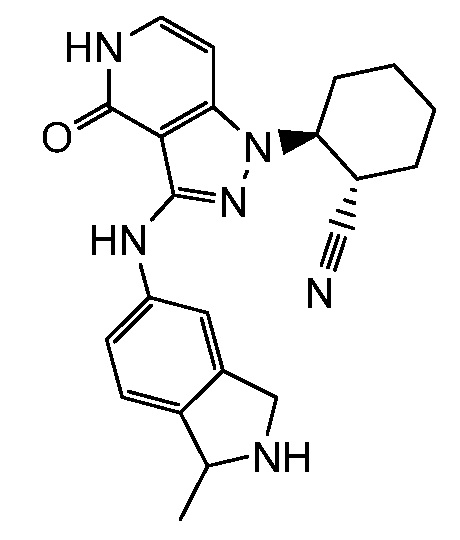
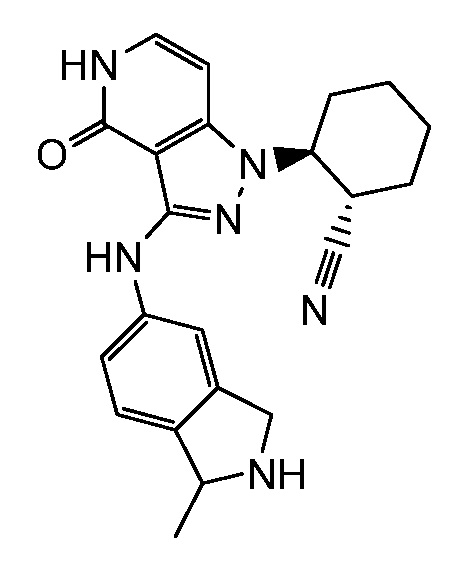
Пример 13-1
5-((1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,3-дигидро-1H-инден-2-карбоновая кислота (смесь диастереомеров)
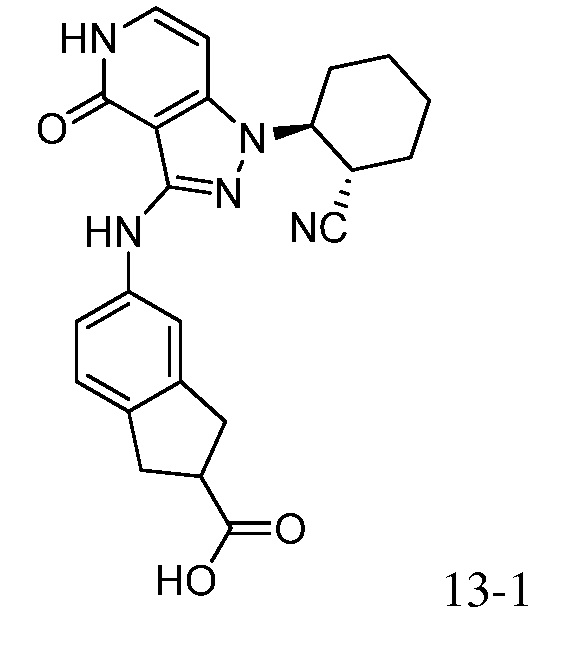
Стадия 1: Метил 5-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,3-дигидро-1H-инден-2-карбоксилат (смесь диастереизомеров)
В продуваемую и поддерживаемую в инертной атмосфере азота 50-мл круглодонную колбу помещали I-3 (0,80 г, 2,3 ммоль), I-106 (0,70 г, 2,7 ммоль), ди-трет-бутил(2',4',6'-триизопропилбифенил-2-ил)фосфин (0,70 г, 1,6 ммоль), трис(дибензилиденацетон)дипалладий (0) - хлороформ (0,70 г, 0,68 ммоль), ацетат калия (0,30 г, 3,1 ммоль) и изопропанол (20 мл). Полученную смесь перемешивали в течение 6 ч при 80°С, затем охлаждали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/петролейный эфир: 1/3) с получением указанного в заголовке соединения (смесь диастереомеров): МСНР (ИЭС) рассчитано для C31H32N5O3 [M + H]+: 522, найдено 522.
Стадия 2: 5-((4-(Бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,3-дигидро-1H-инден-2-карбоновая кислота (смесь диастереомеров)
В продуваемую и поддерживаемую в инертной атмосфере азота 25-мл круглодонную колбу помещали 13-1a (смесь диастереомеров; 0,15 г, 0,29 ммоль), метанол (10 мл), гидроксид натрия (50,0 мг, 1,25 ммоль) и воду (10 мл). Полученную смесь перемешивали в течение 3 ч при 15°С, а затем экстрагировали этилацетатом (3×50 мл). Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (смесь диастереомеров). МСНР (ИЭС) рассчитано для C30H30N5O3 [M + H]+: 508, найдено 508.
Стадия 3: 5-((1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,3-дигидро-1H-инден-2-карбоновая кислота (смесь диастереомеров)
Защитную группы удаляли также, как описано в Примере 3-1, с получением 5-(1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)-2,3-дигидро-1H-инден-2-карбоновой кислоты (смеси диастереомеров). МСНР (ИЭС) рассчитано для C23H24N5O3 [M + H]+: 418, найдено 418; 1H ЯМР (400 MГц, ДМСО-d6) δ 11,04 (уш.с, 1H), 7,95 (уш.с, 1H), 7,47 (с, 1H), 7,41 (д, J=10,8 Гц, 1H), 7,21 (д, J=10,0 Гц, 1H), 7,11 (д, J=10,8 Гц, 1H), 6,66 (д, J=10,0 Гц, 1H ), 4,71-4,62 (м, 1H), 3,14-3,04 (м, 4H), 2,27-2,14 (м, 1H), 1,89-1,75 (м, 5H), 1,64-1,38 (м, 3H).
Пример 14-1
Рацемический транс-6-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил
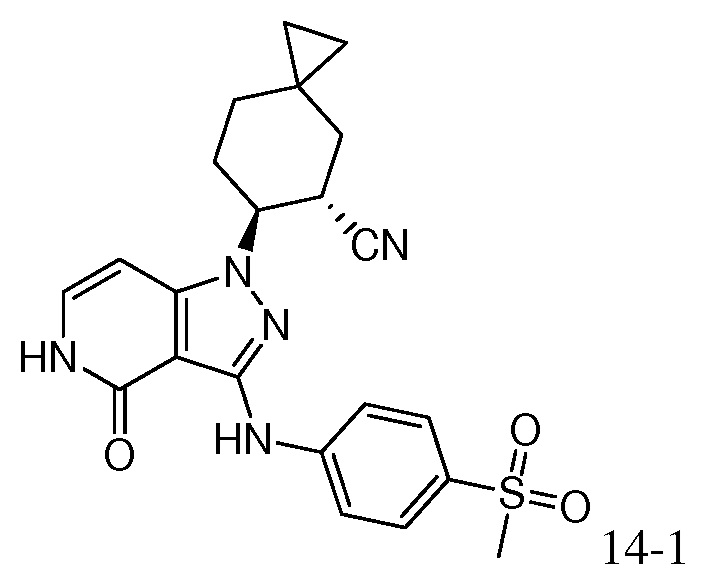
Стадия 1: цис и транс-6-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил (рацемическая смесь)
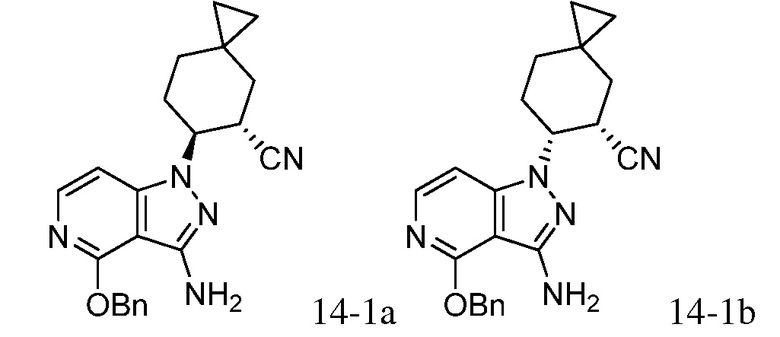
Смесь спиро[2.5]окт-5-ен-6-карбонитрила (I-110; 1,38 г, 10,4 ммоль), DBU (0,32 г, 2,2 ммоль) и 4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-3-амина (I-1; 0,25 г, 1,1 ммоль) в EtOH (4 мл) перемешивали при 100°C в запаяном сосуде в течение 7 дней. После удаления растворителя в вакууме, остаток очищали с помощью колоночной хроматографии на силикагеле (Гекс.:EtOAc = 5:1) с получением индивидуальных цис/транс изомеров 6-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)спиро[2.5]октан-5-карбонитрила (рацемического).
Транс изомер 14-1a: 1H ЯМР (CDCl3, 400MГц): δ 7,48 (д, J=6,4 Гц, 1H), 7,11-6,96 (м, 5H), 6,43 (д, J=6,2 Гц, 1H), 5,14 (с, 2H), 4,11 (уш., 2H), 3,92-3,85 (м, 1H), 3,05-2,98 (м, 1H), 1,93-1,77 (м, 2H), 1,66-1,55 (м, 2H), 1,07-1,02 (м, 1H), 0,69-0,66 (м, 1H), 0,16-0,10 (м, 2H), 0,03-0,00 (м, 2H).
Цис изомер 14-1b: 1H ЯМР (CDCl3, 400MГц): δ 7,76 (д, J=6.4 Гц, 1H), 7,42-7,4 (м, 2H), 7,35-7,25 (м, 3H), 6,78 (д, J=6,4 Гц, 1H), 5,46 (с, 2H), 4,42 (уш., 2H), 4,31-4,26 (м, 1H), 3,31-3,27 (м, 1H), 2,71-2,61 (м, 1H), 2,14-2,06 (м, 2H), 1,85-1,78 (м, 1H), 1,57-1,46 (м, 1H), 1,33-1,21 (м, 1H), 0,81-0,72 (м, 2H), 0,56-0,52 (м, 1H), 0,34-0,31 (м, 2H).
Стадия 2: Рацемический транс-6-(4-(бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил
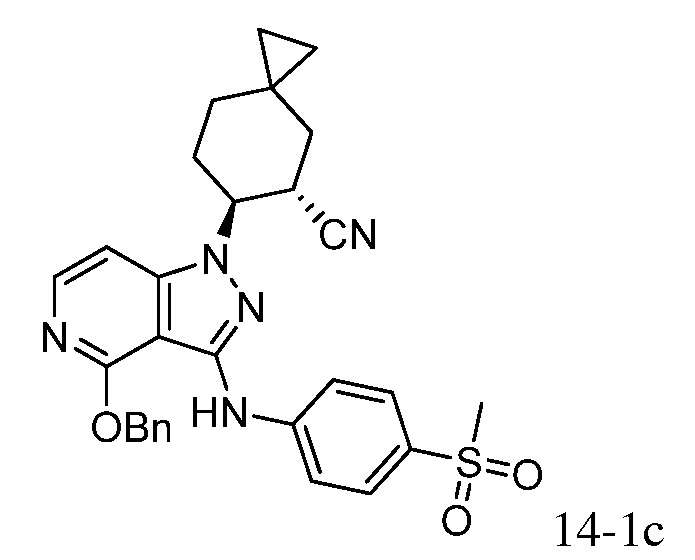
К суспензии транс-6-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)спиро[2.5]октан-5-карбонитрила (рацемический; 50 мг, 0,13 ммоль) и КОАс (34 мг, 0,34 ммоль) в i-PrOH (0,5 мл) добавляли Pd2(dba)3 (27 мг, 0,030 ммоль), трет-BuXPhos (34 мг, 0,080 ммоль) и 1-бром-4-(метилсульфонил)бензол (40 мг, 0,16 ммоль) в атмосфере азота. Полученную суспензию нагревали до 105°С, используя микроволновое излучение в течение 1 ч, затем охлаждали до комнатной температуры и фильтровали. Фильтрат очищали препаративной ТСХ (силикагель, Гекс.:EtOAc = 1:1) с получением рацемического-транс-6-(4-(бензилокси)-3-((4-(метилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрила. МСНР рассчитано для C29H30N5O3S [M+H]+: 528; найдено 528; 1H ЯМР (CDCl3, 400MГц): δ 7,95 (д, J=6,0 Гц, 1H), 7,89-7,87 (м, 2H), 7,63-7,59 (м, 3H), 7,55-7,53 (м, 2H), 7,48-7,4 (м, 3H), 6,94 (д, J=6,0 Гц, 1H), 5,6 (с, 2H), 4,45-4,38 (м, 1H), 3,52-3,45 (м, 1H), 3,03 (с, 3H), 2,37-2,23 (м, 2H), 2,11-2,01 (м, 2H), 1,51-1,47 (м, 1H), 1,14-1,08 (м, 1H), 0,59-0,47 (м, 4H).
Стадия 3: Рацемический транс-6-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрил
Смесь рацемического 14-1c (37 мг, 0,070 ммоль) и Pd/C (10 мг) в ТГФ/EtOAc (1 мл, 1/1) перемешивали при комнатной температуре в атмосфере Н2 (0,103 МПа) в течение ночи. Катализатор удаляли фильтрованием, и фильтрат концентрировали в вакууме. Остаток промывали МеОН, затем ТГФ с получением рацемического-транс-6-(3-((4-(метилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрила. МСНР (ИЭС) рассчитано для C22H25N5O3S [M+H]+: 438, найдено 438. 1H ЯМР (ДМСО-d6, 400MГц): δ 11,18 (с, 1H), 8,72 (с, 1 H), 7,88-7,79 (м, 4H), 7,32-7,24 (м, 1H), 6,73 (д, J=7,3 Гц, 1H), 4,90-4,79 (м, 1H), 3,49-3,42 (м, 1H), 3,14 (с, 3H), 2,31-2,24 (м, 1H), 2,04-1,91 (м, 3H), 1,44-1,41 (м, 1H), 1,00-0,98 (м, 1H), 0,50-0,36 (м, 4H).
Таблица 44 раскрывает Примеры, которые получали аналогичным образом, как описано для Примера 14-1, используя соответствующие промежуточные продукты.
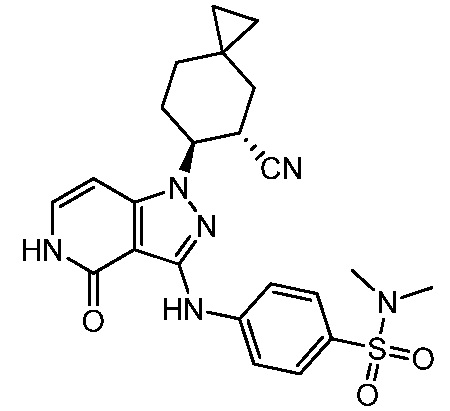
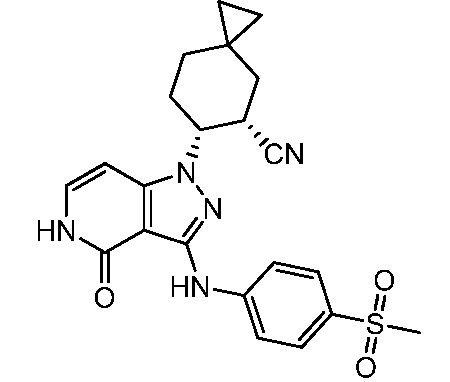
Пример 15
(1S,2S)-2-(3-{[4-(1,3-Оксазол-2-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
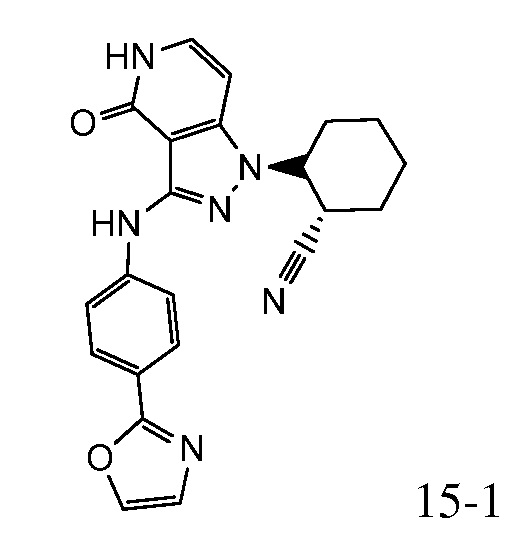
(1S,2S)-2-(3-амино-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-1-ил)циклогексанкарбонитрил (I-10; 52 мг, 0,20 ммоль), 2-(4-бромфенил)оксазол (53,8 мг, 0,240 ммоль), Pd2(dba)3 (22 мг, 0,024 ммоль), трет-BuXPhos (20,4 мг, 0,0480 ммоль) и ацетат калия (39,3 мг, 0,400 ммоль) и 2-пропанол (2,50 мл) добавляли в пробирку, пробирку герметично закрывали и дегазировали путем вакуумирования/заполняли аргоном. Полученную смесь перемешивали при 85° в течение 2 часов, затем охлаждали, концентрировали в вакууме и очищали с помощью обращенно-фазовой ВЭЖХ (5% -50% ацетонитрила в воде с 0,1% модификатора ТФУК). Необходимые фракции лиофилизировали с получением указанного в заголовке соединения (ТФУК-соли). МСНР (ИЭС) рассчитано для C22H21N6O2 [M+H] +: 401, найдено 401. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,20 (д, 1H, J=5,7 Гц), 8,48 (с, 1H), 8,18 (с, 1H), 7,94 (д, 2H, J=8,5 Гц), 7,85 (д, 2H, J=8,5 Гц), 7,35 (с, 1H), 7,29 (дд, 1H, J=7,3, 5,8 Гц), 6,75 (д, 1H, J=7,4 Гц), 4,77 (м, 1H), 2,25 (д, 1H, J=11,1 Гц), 1,96 (м, 2H), 1,84 (м, 3H), 1,56 (м, 1H), 1,44 (м, 1H).
Таблица 45 раскрывает Примеры, которые получали по аналогии с Примером 15-1, исходя из соответствующего энантиомерно чистого карбонитрил-пиридона и бромида. В некоторых случаях, общую процедуру модифицировали использованием, как альтернативы, Pd2(dba)3∙CHCl3 в ДМФА или смеси ДМФА и 2-пропанола в качестве растворителя, при 70-90°С. Для анализа Примеров 15-33, 15-37 и 15-38 использовали МСНР в режиме регистрации отрицательных ионов с подвижной фазой 10% ACN в воде (с NH4HCO3).
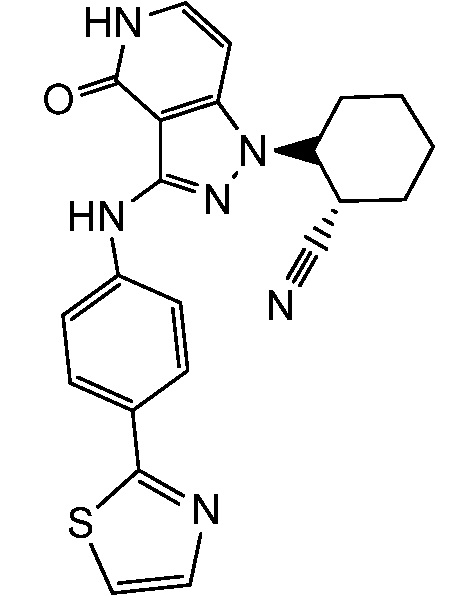
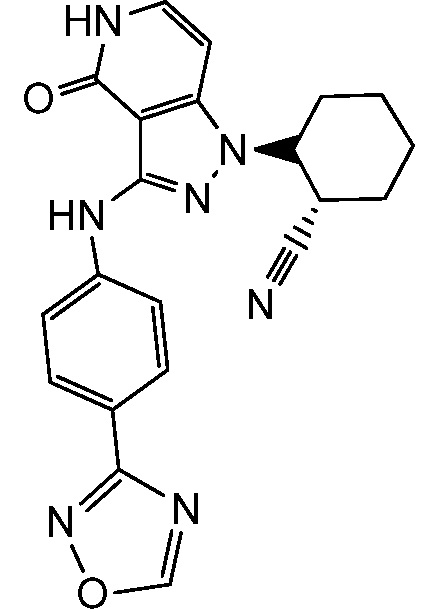
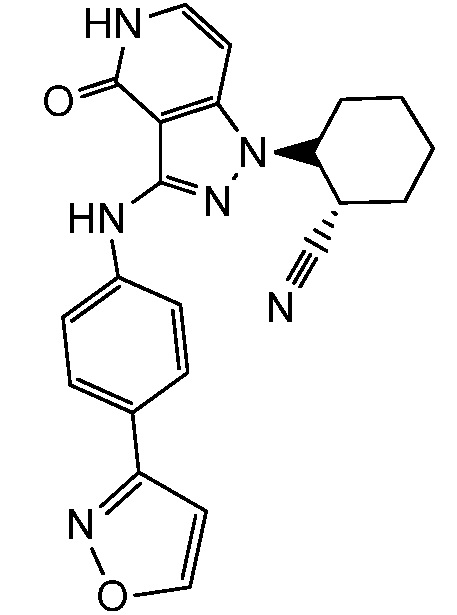
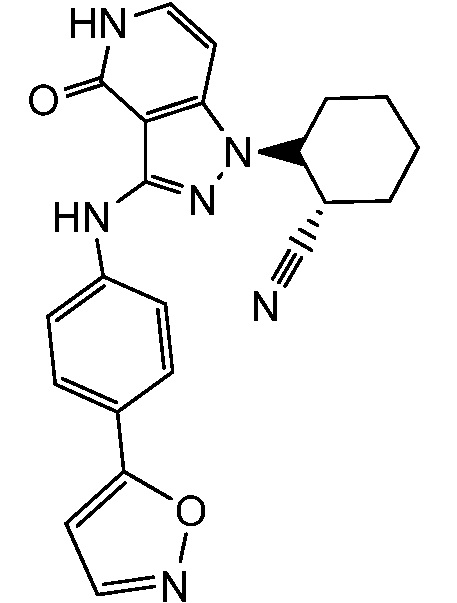
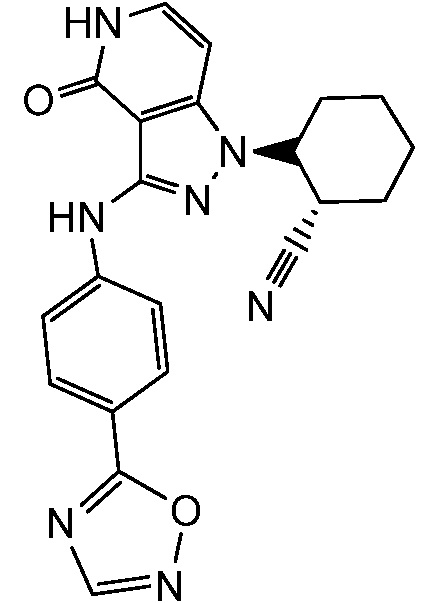
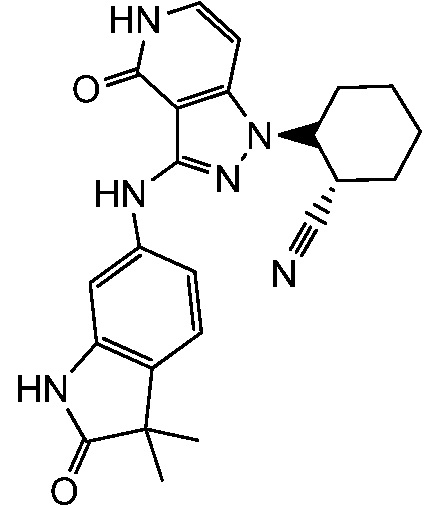
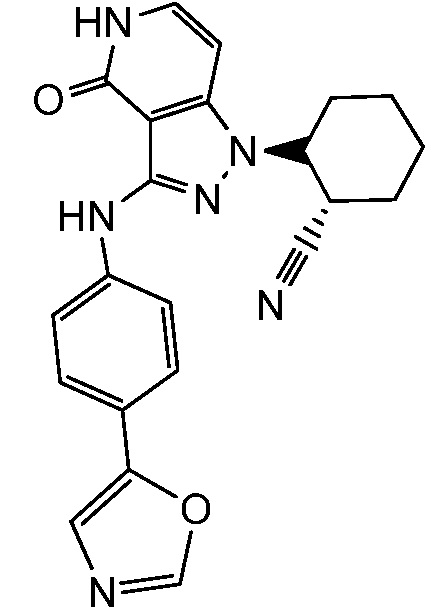
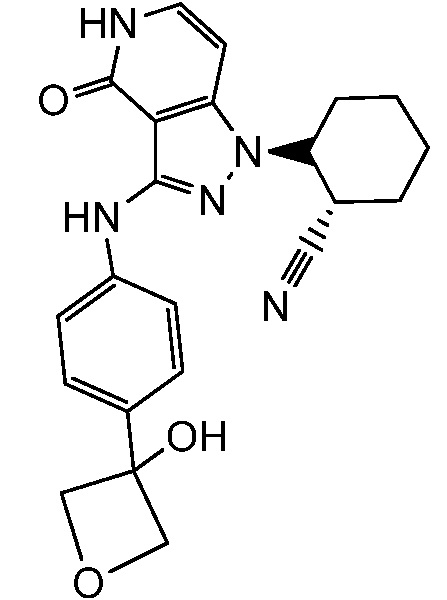
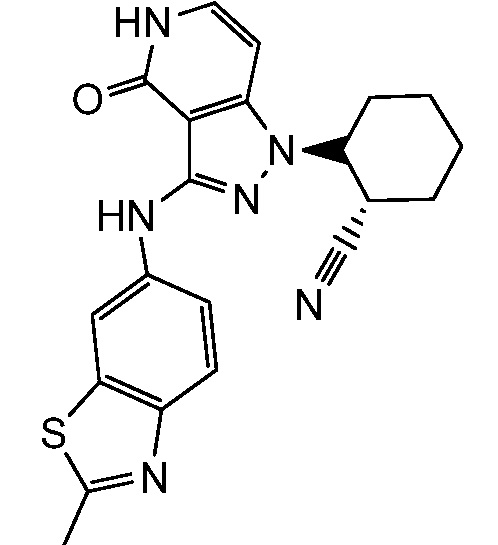
(из I-119a)
(из I-119b)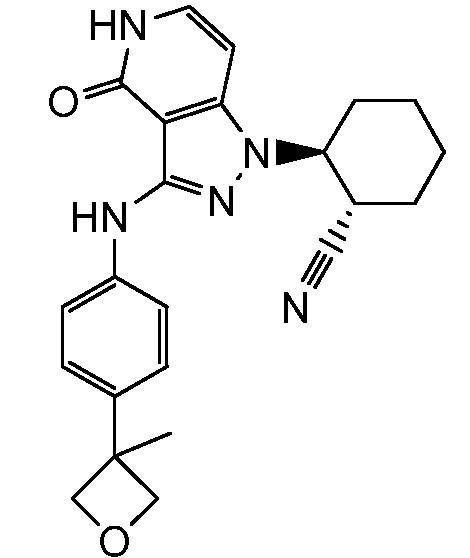
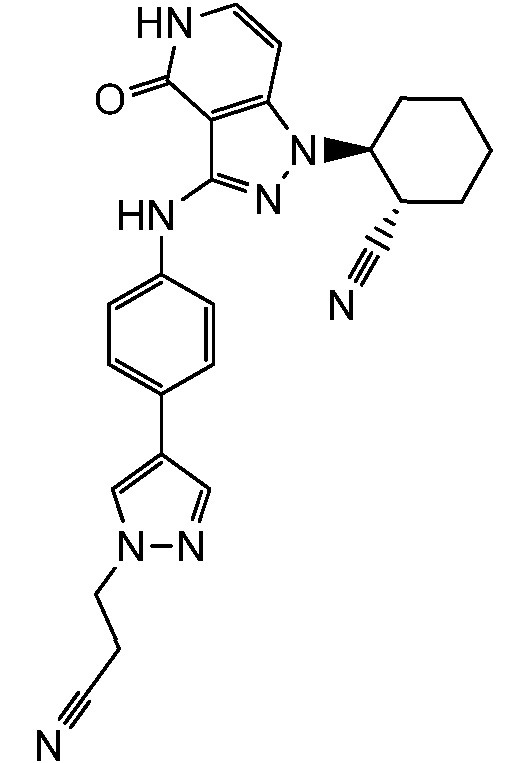
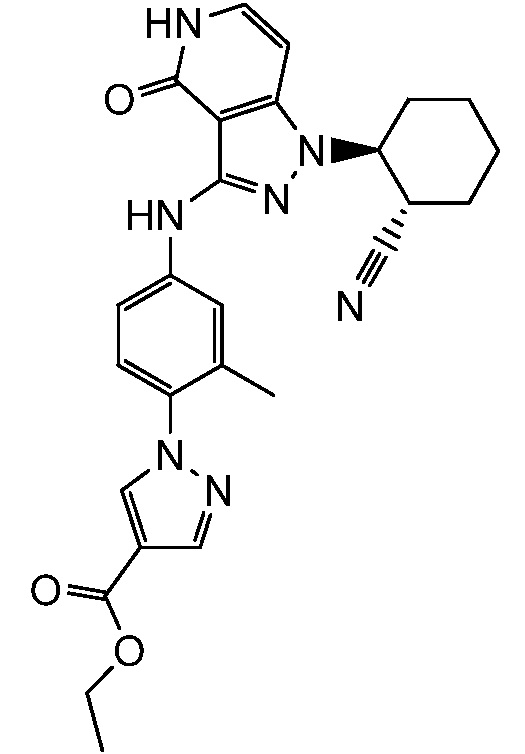
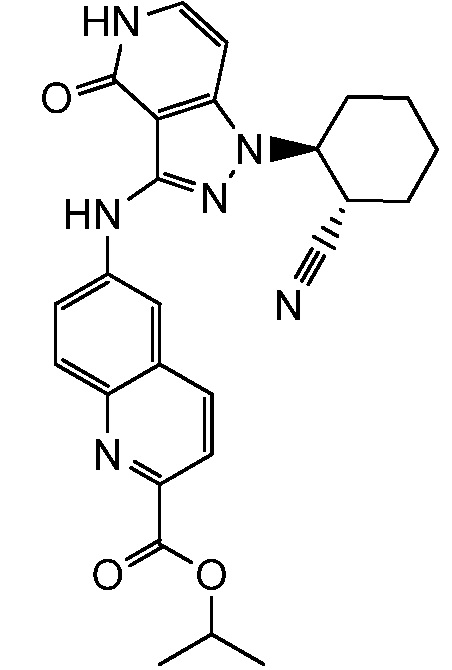
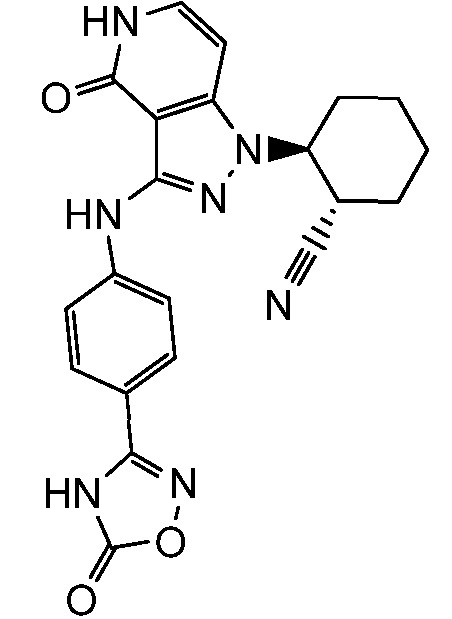
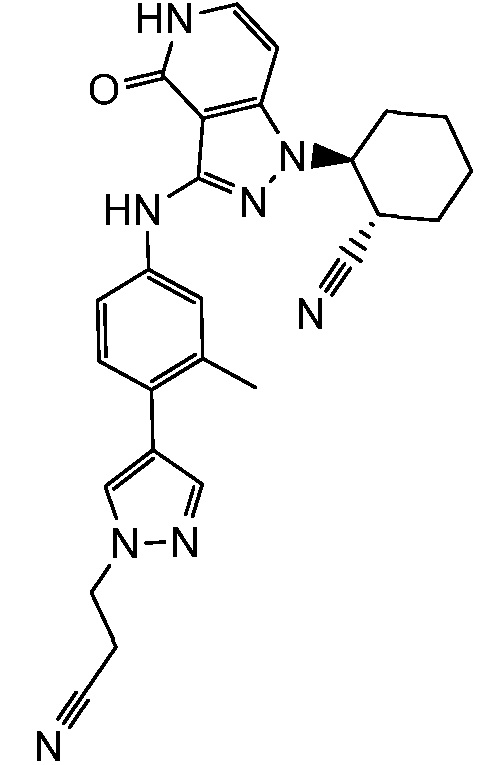
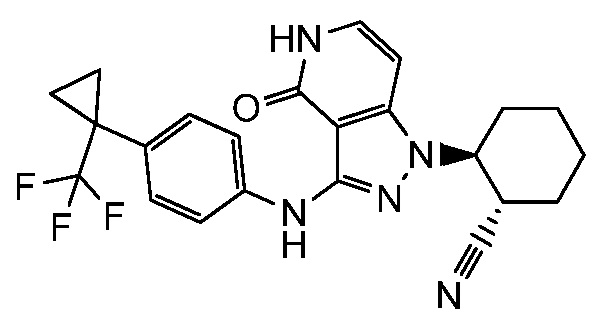
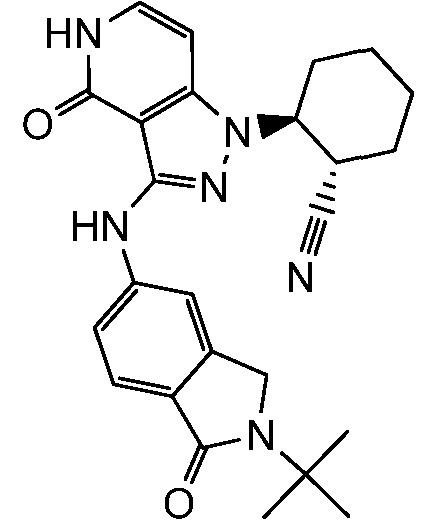
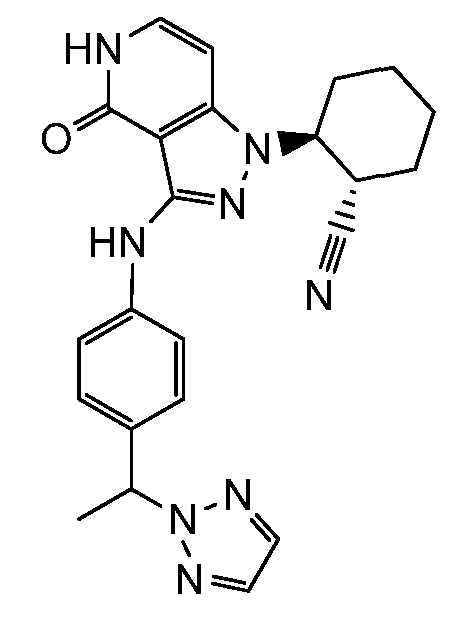
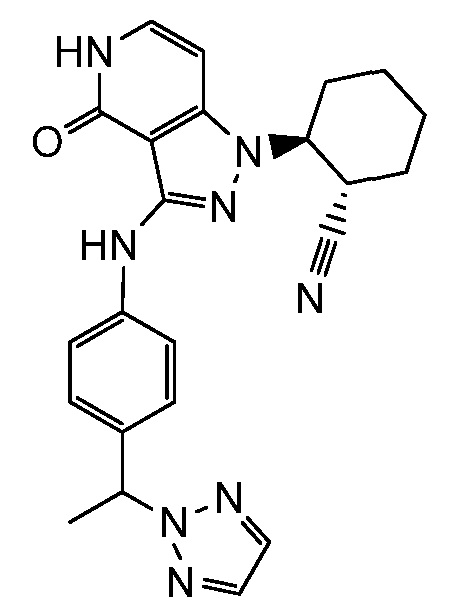
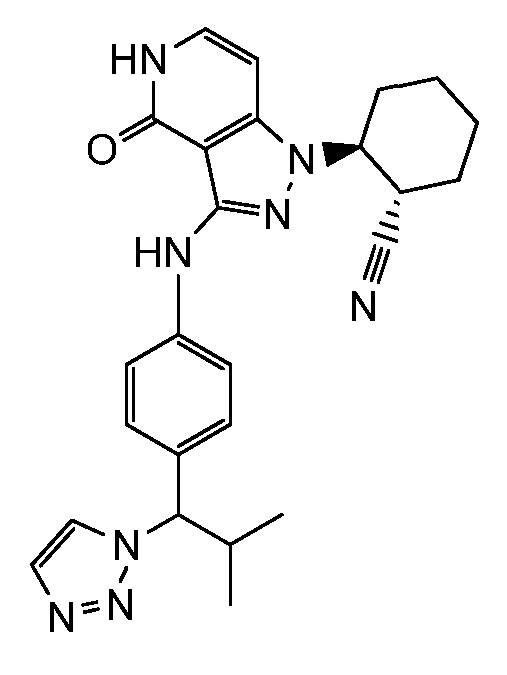
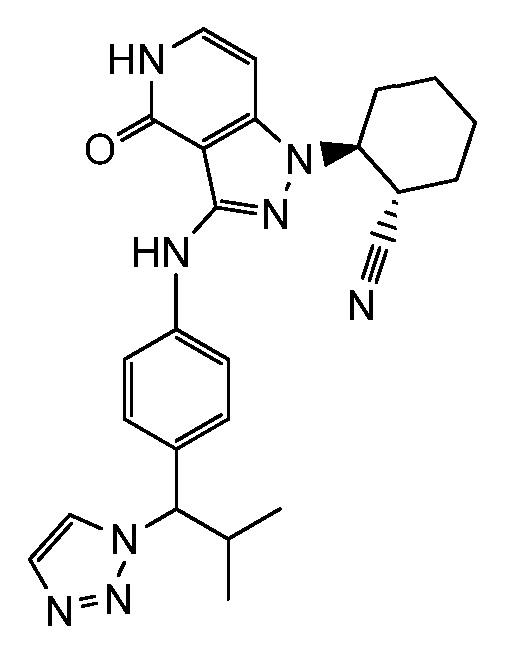
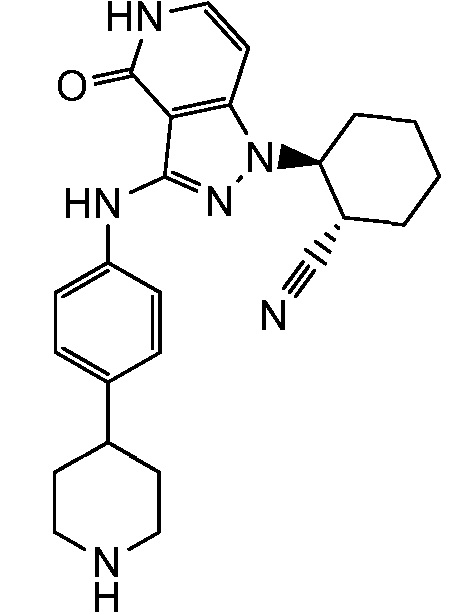
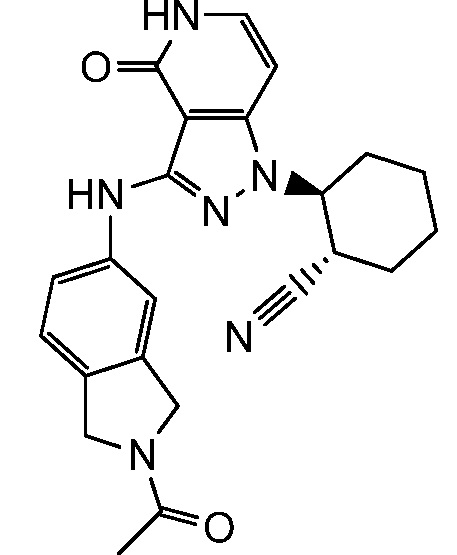
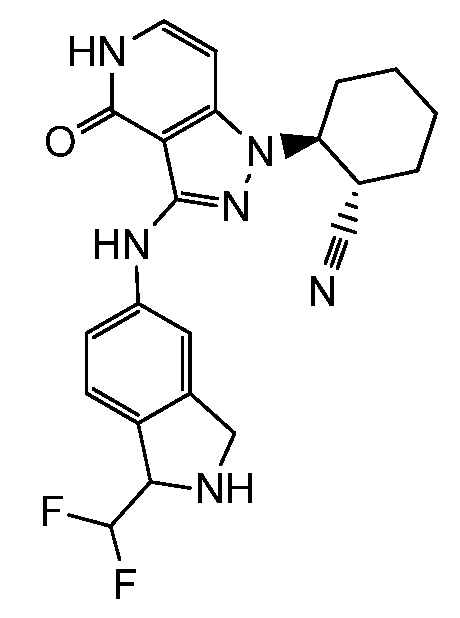
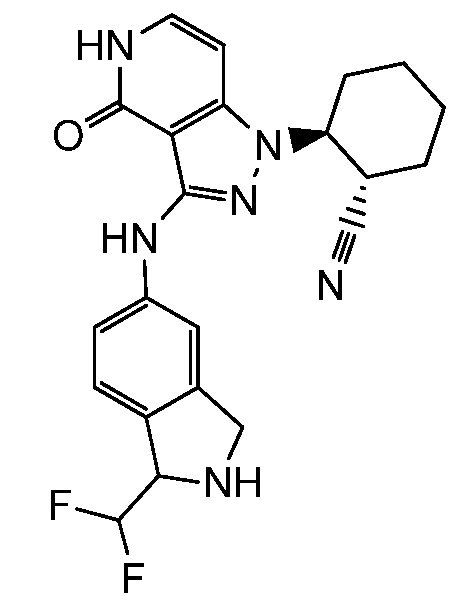
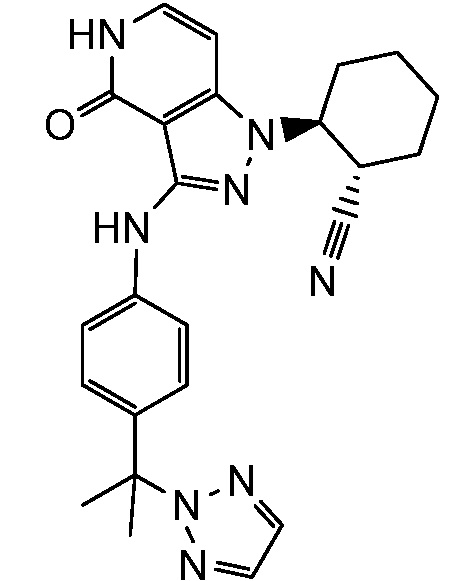
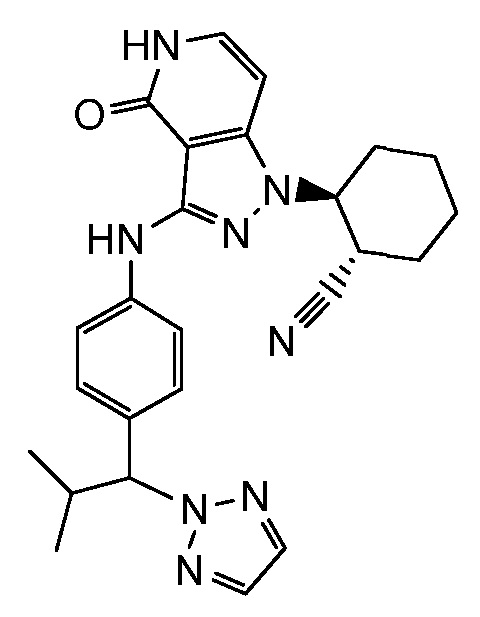
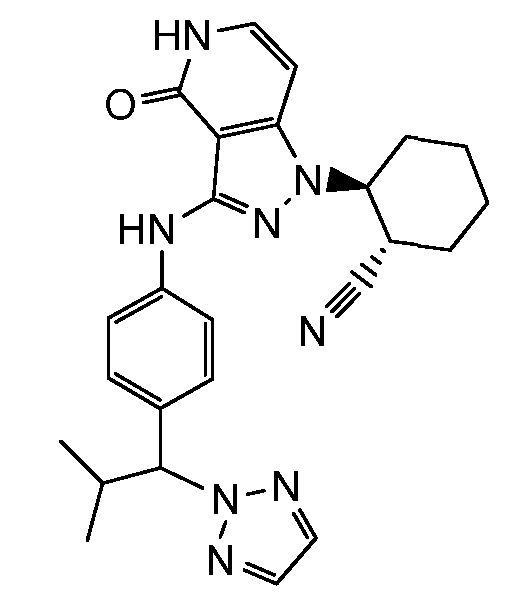
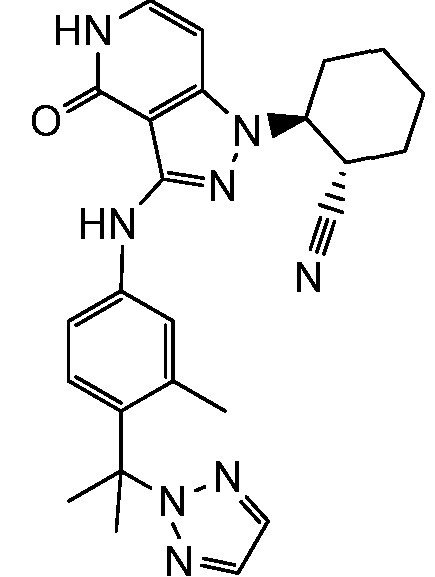
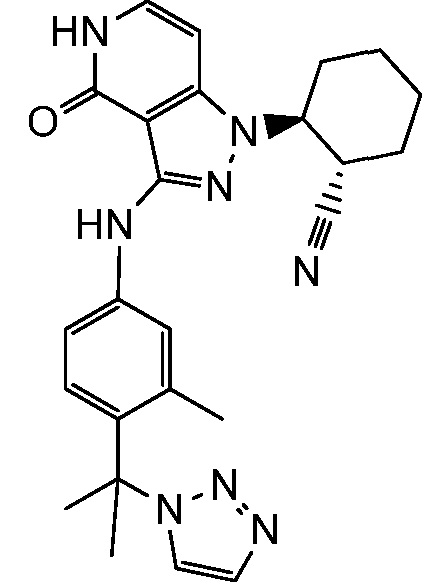
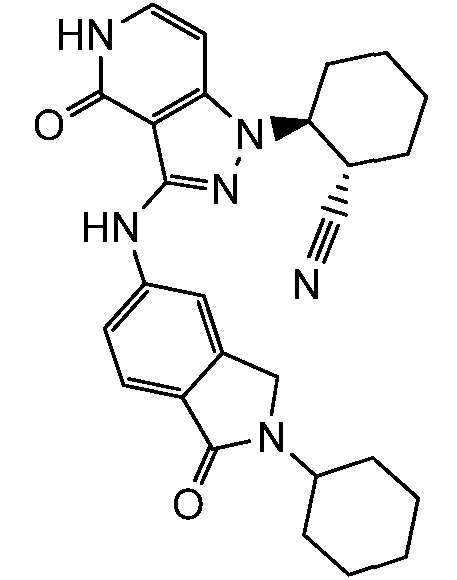
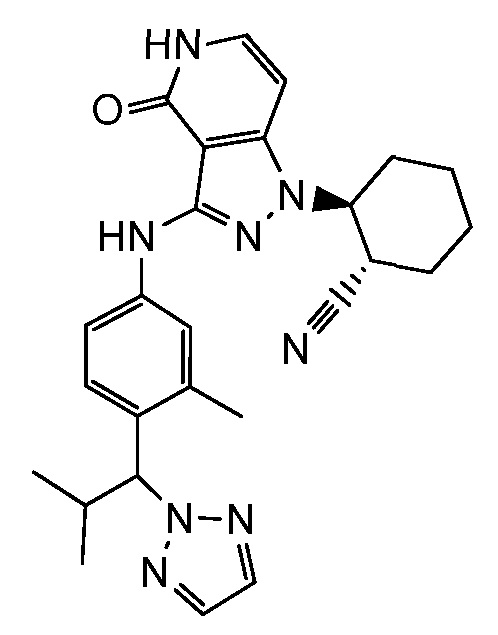
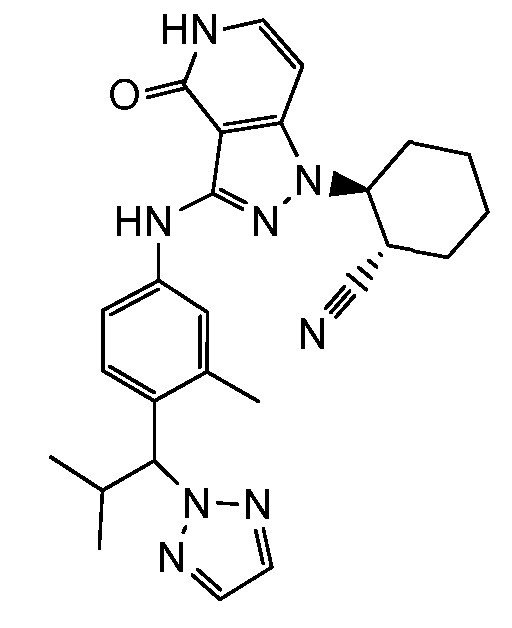
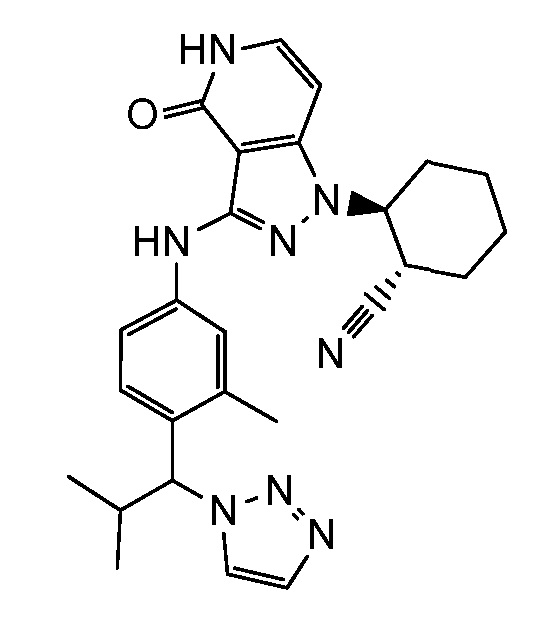
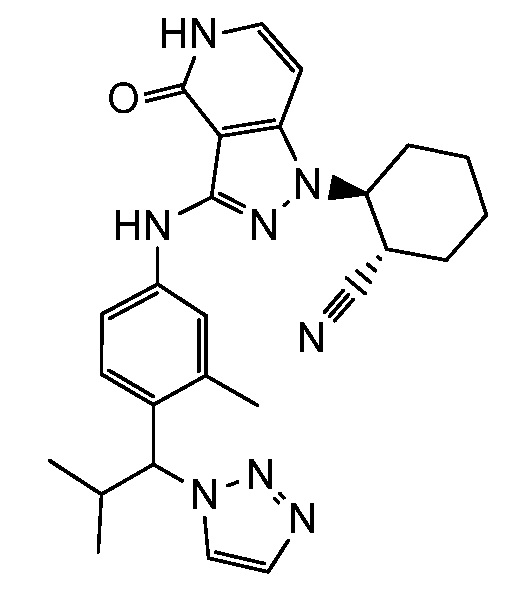
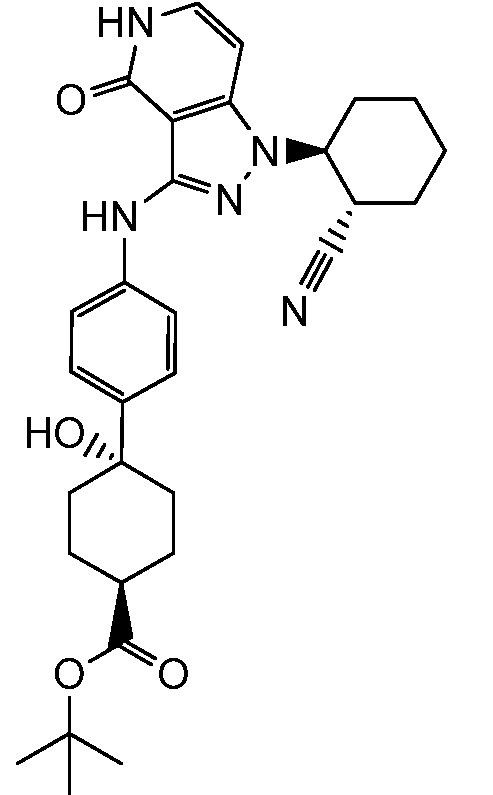
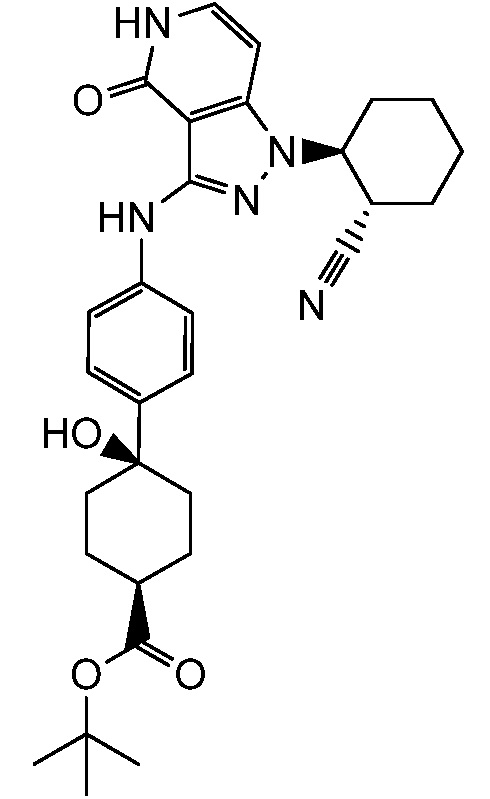
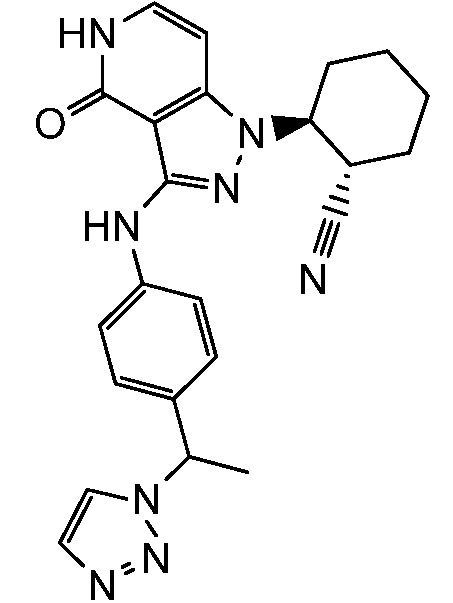
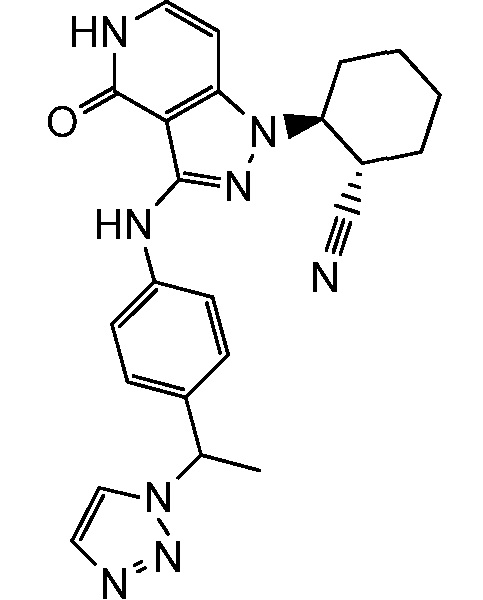
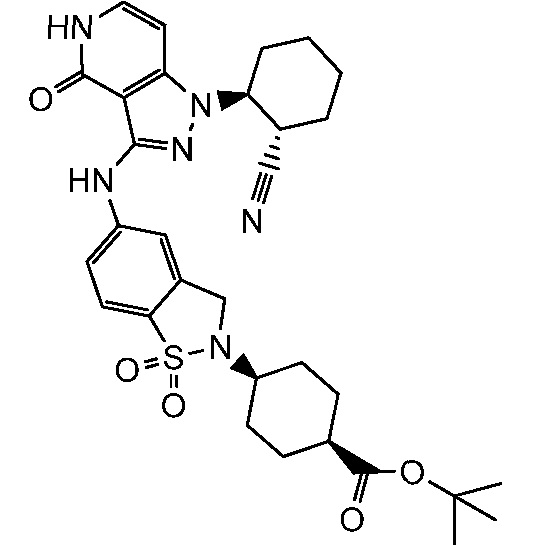
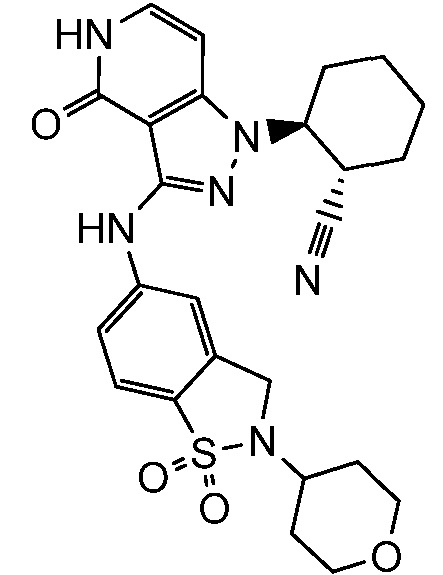
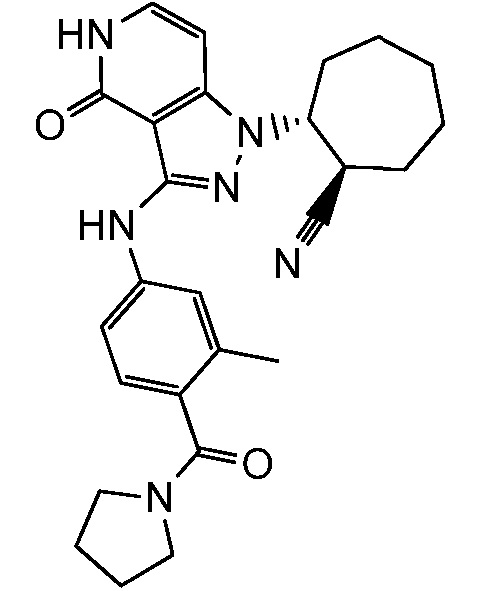
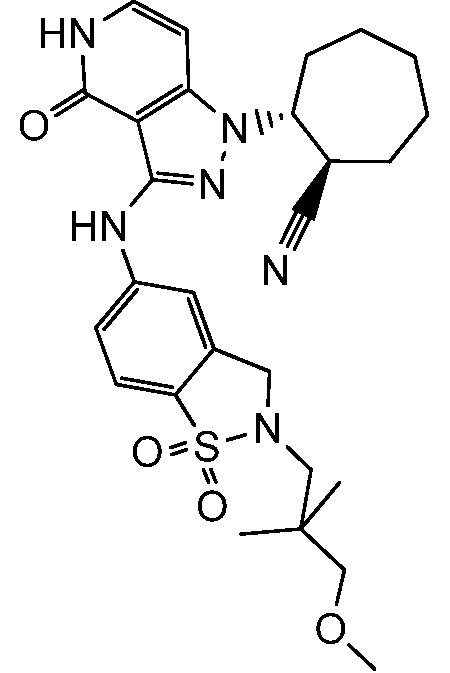
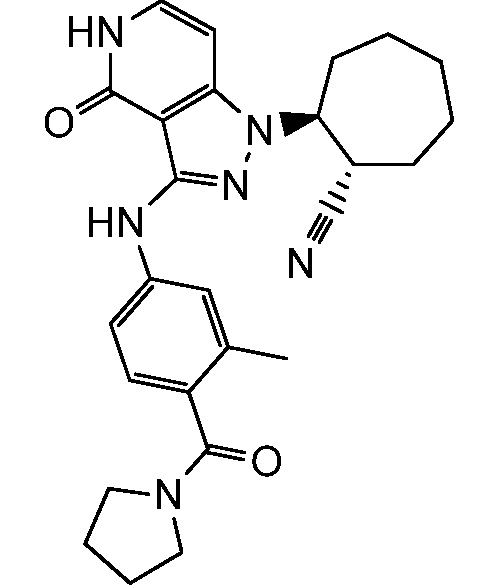
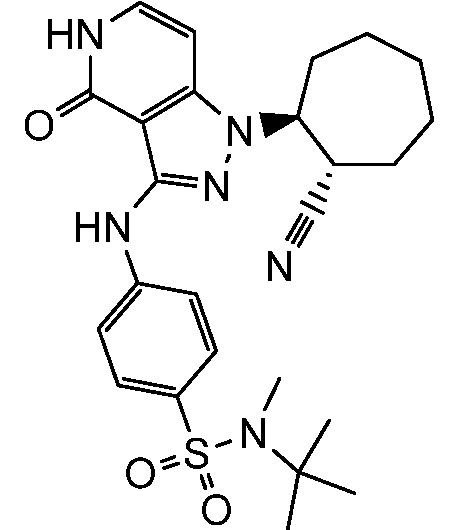
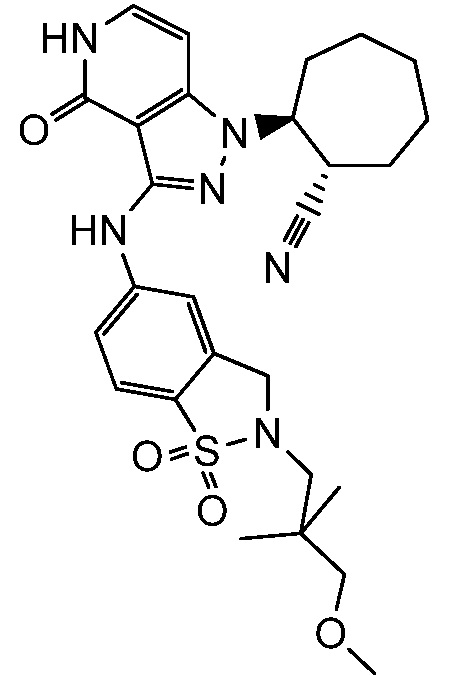
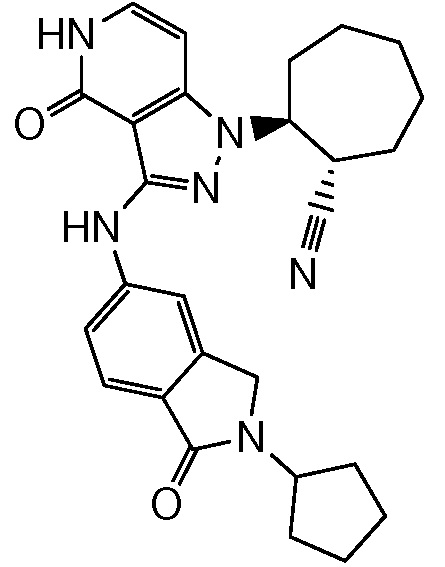
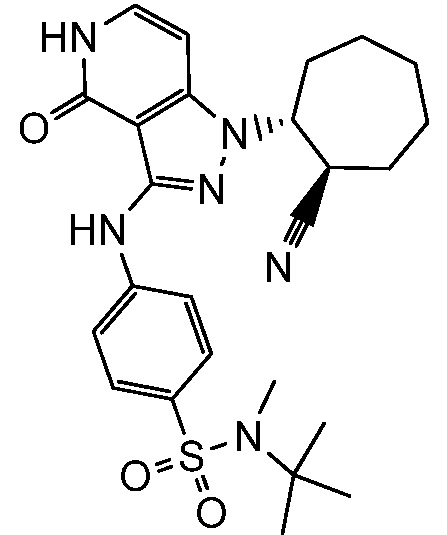
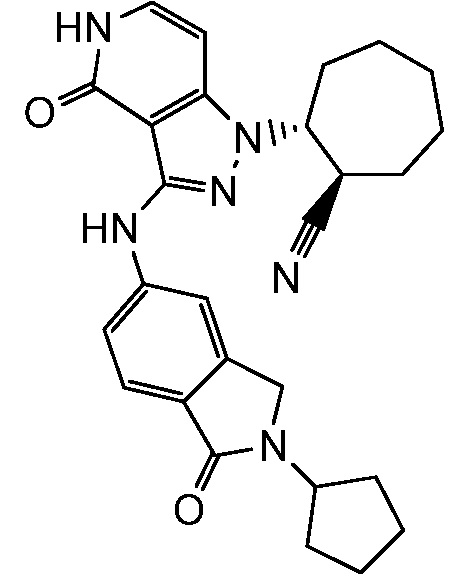
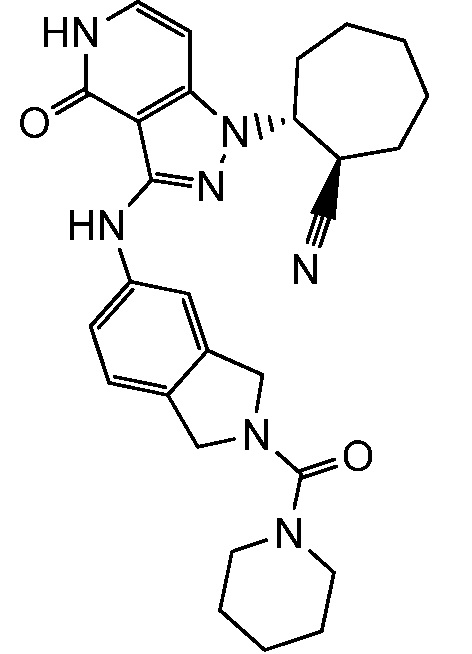
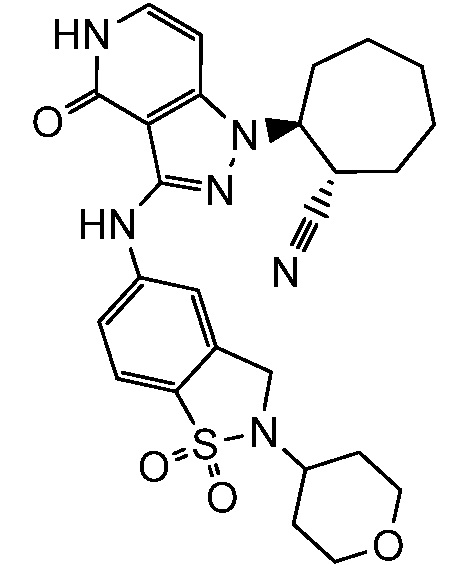
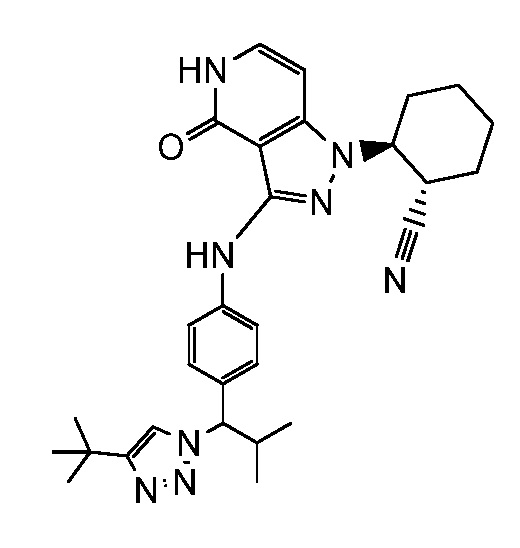
388 [M-124] триазол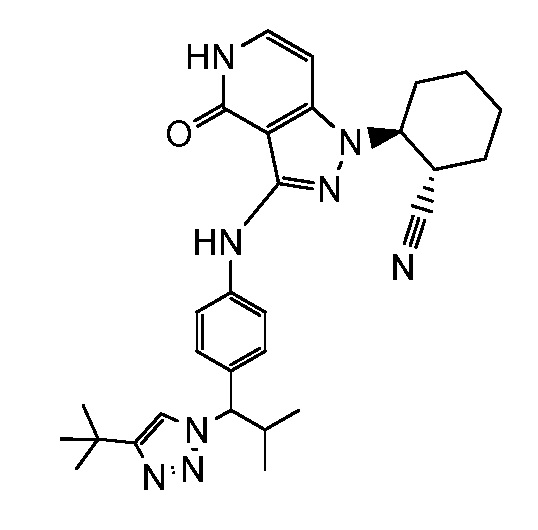
388 [M-124] триазол
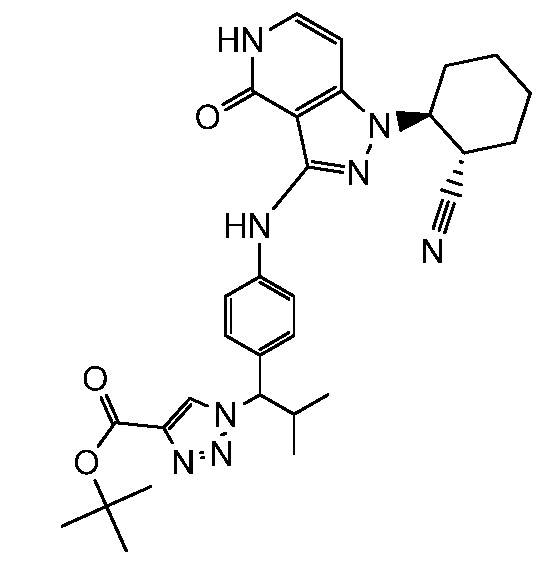
388 [M-124] триазол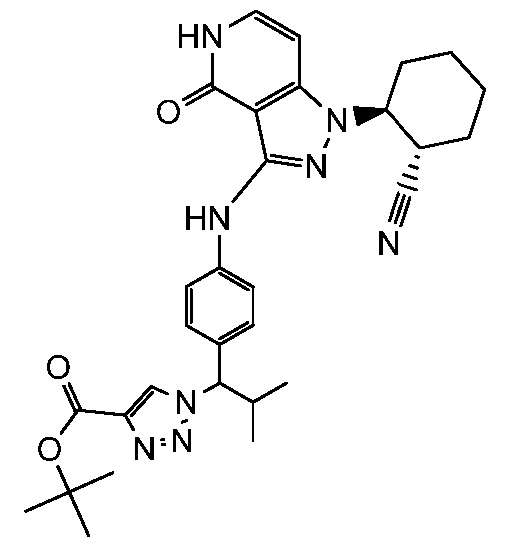
388 [M-124] триазол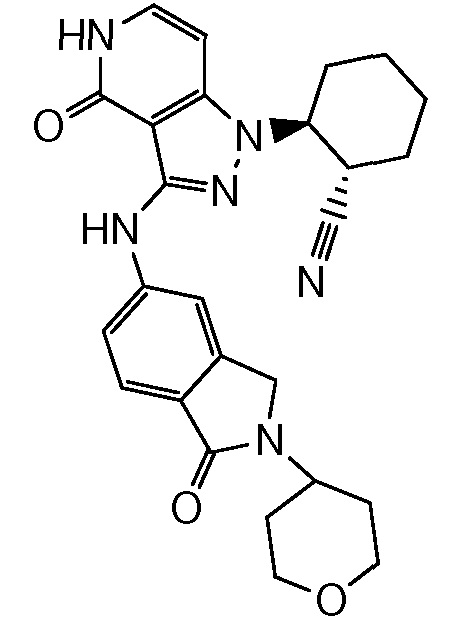
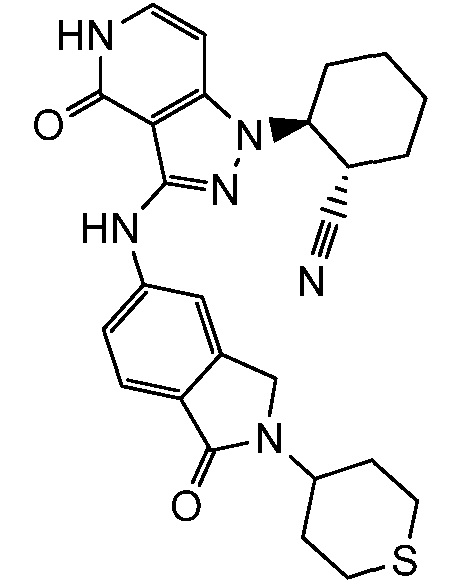
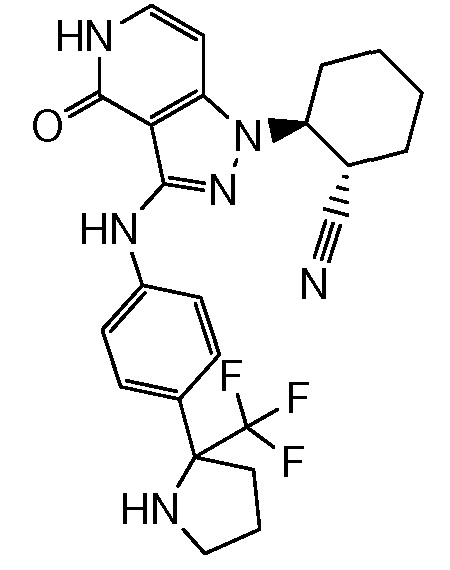
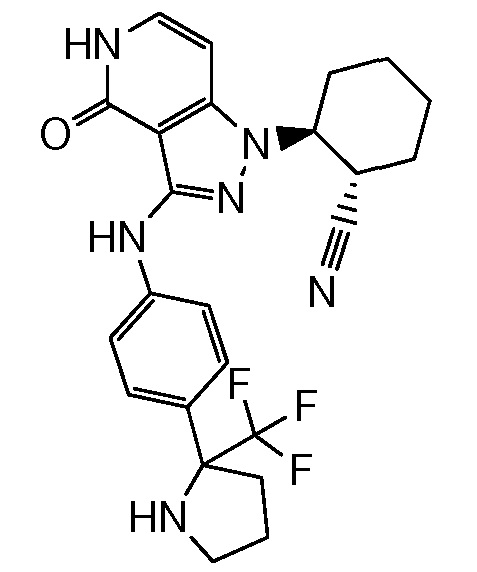
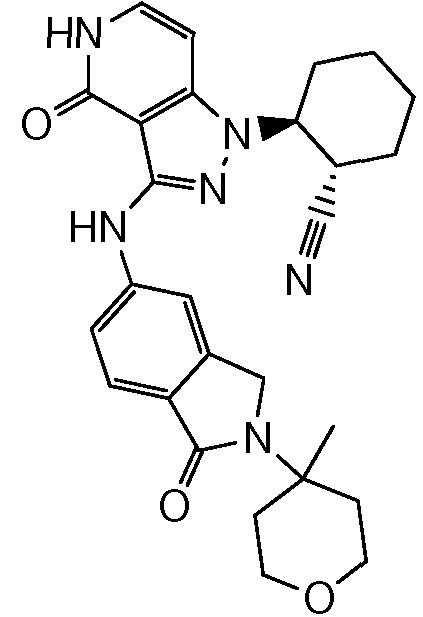
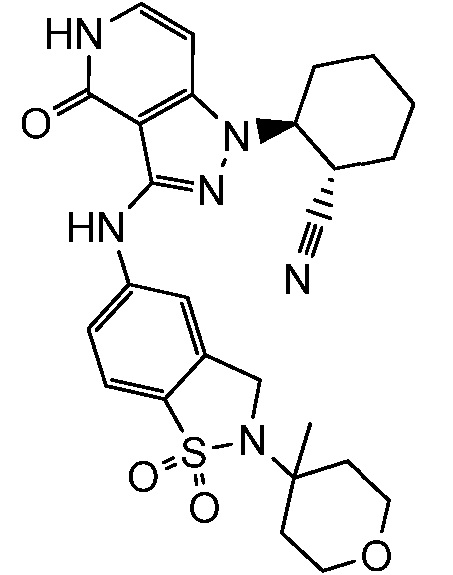
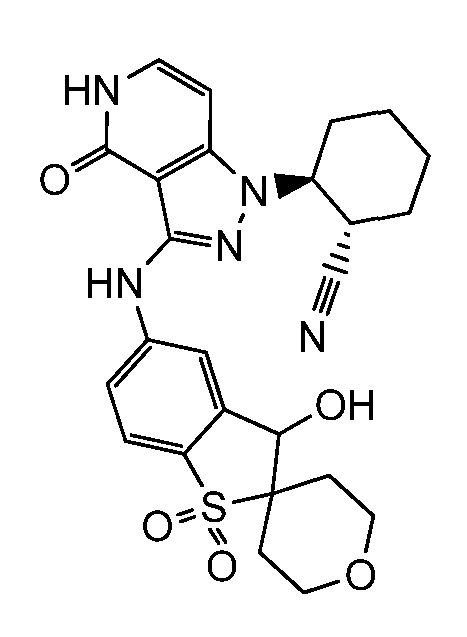
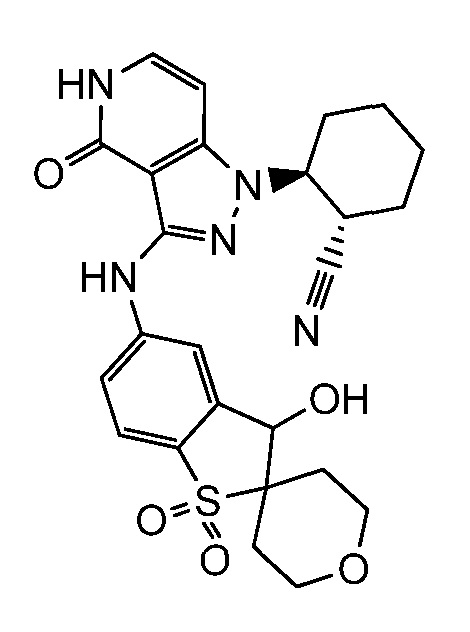
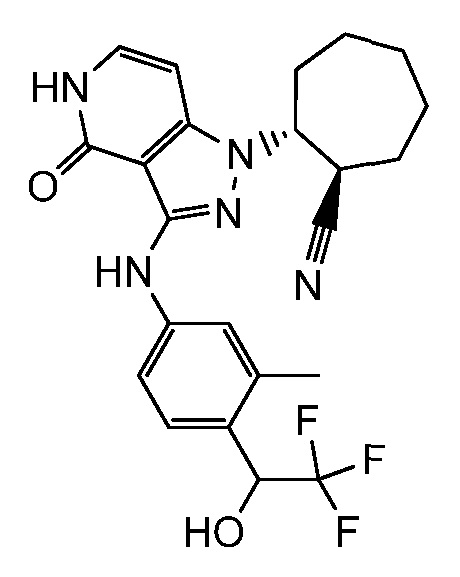
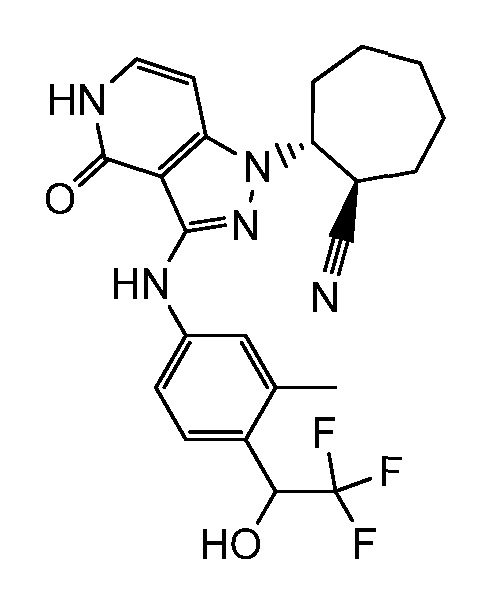
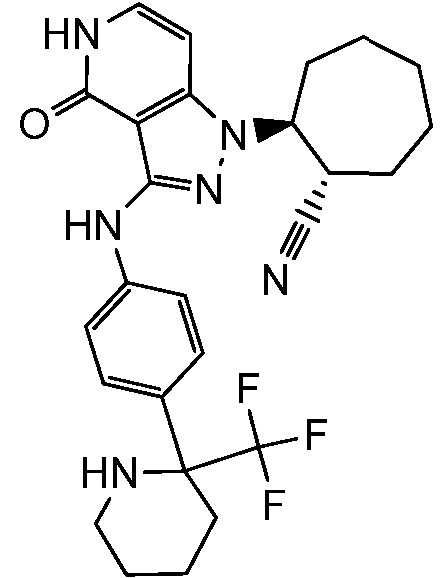
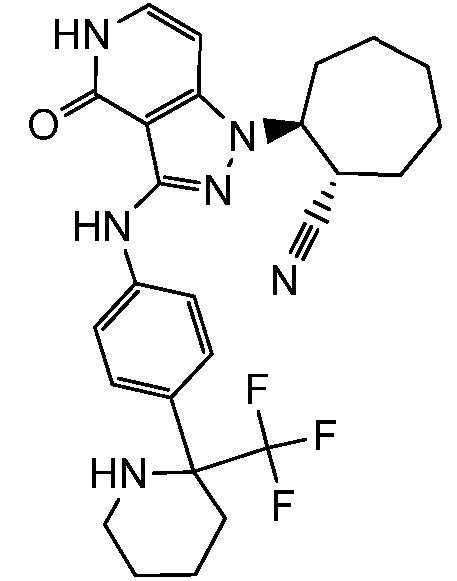
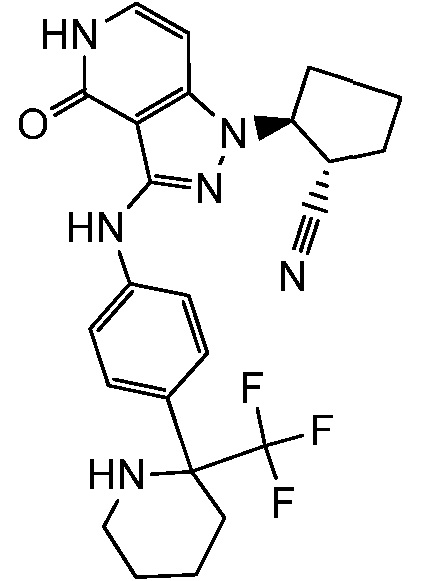
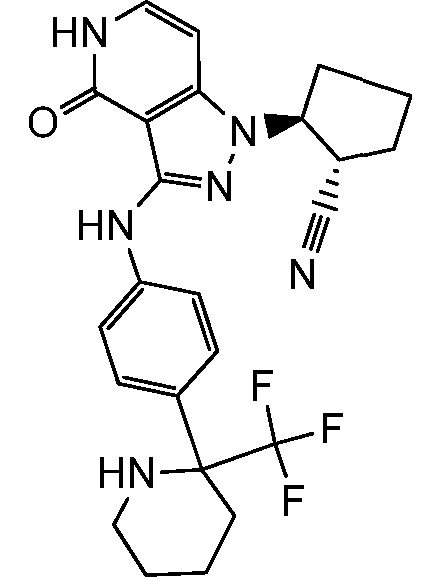
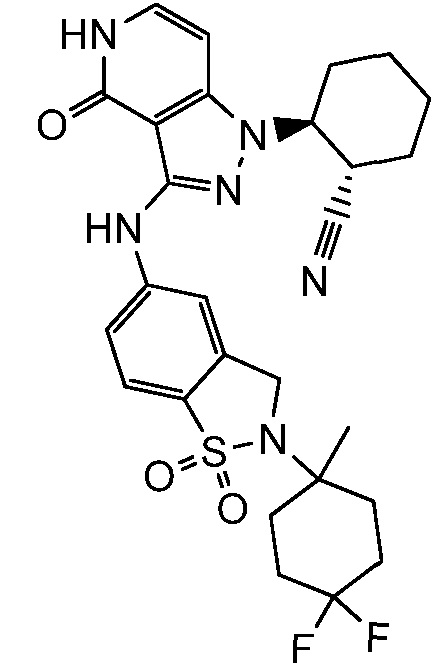
Пример 16-1
4-((1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензойная кислота, HCl
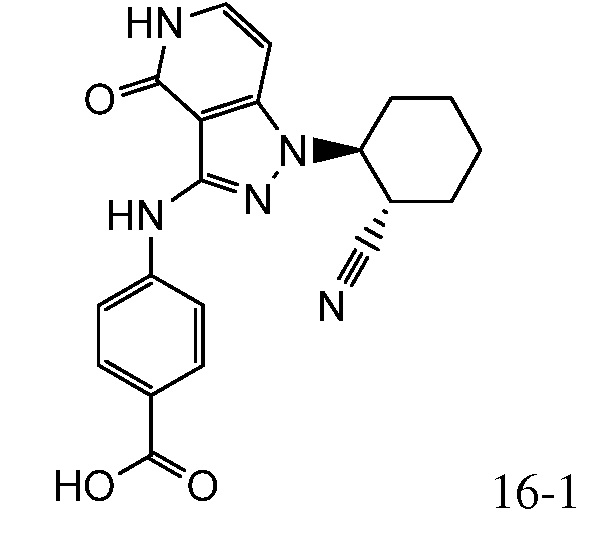
Стадия 1: трет-Бутил-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензоат
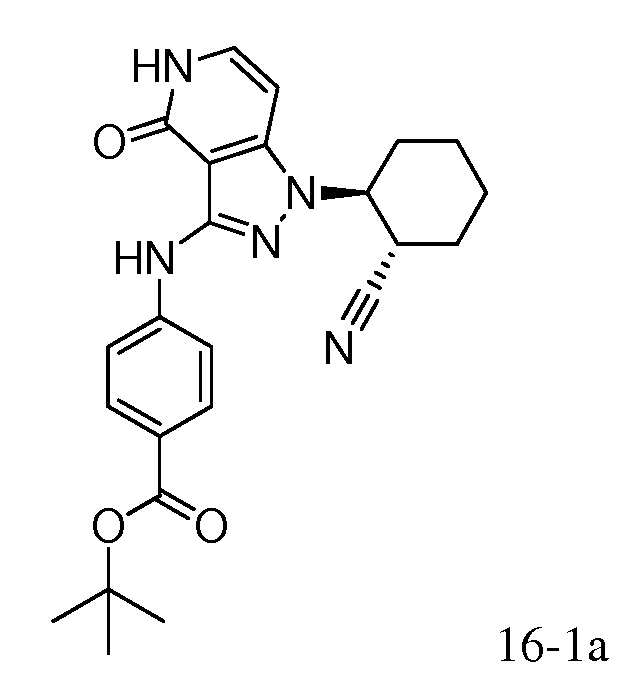
(1S,2S)-2-(3-амино-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-1-ил)циклогексанкарбонитрил (I-10; 100 мг, 0,389 ммоль), трет-бутил-4-бромбензоат (90 мкл, 0,47 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (33,0 мг, 0,078 ммоль) и ацетат калия (114 мг, 1,17 ммоль) объединяли в пробирке для микроволнового реактора и растворяли в 2-пропаноле (2 мл). Аргон барботировали в течение 10 минут с последующим добавлением Pd2(dba)3 (35,6 мг, 0,0390 ммоль). Пробирку затем герметично закрывали и продували дополнительным количеством аргона. Реакционную смесь перемешивали при 85°С в течение ночи. Реакционную смесь затем фильтровали через целит и концентрировали в вакууме. Сырое вещество очищали с помощью хроматографии на силикагеле, элюируя 25-75% этилацетатом в гексанах. Необходимые фракции концентрировали в вакууме с получением трет-бутил-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-3-ил)амино)бензоата. МСНР (ИЭС) рассчитано для C24H28N5O3 [M+H]+: 434, найдено 434.
Стадия 2: 4-((1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-3-ил)амино)бензойная кислота (HCl-соль)
трет-Бутил-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-3-ил)амино)бензоат (150 мг, 0,346 ммоль) растворяли в соляной кислоте (5,0 мл, 20 ммоль, 4,0 М в диоксане) и перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали в вакууме с получением 4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-3-ил)амино)бензойной кислоты (HCl-соли). МСНР (ИЭС) рассчитано для C20H20N5O3 [M+H]+: 378, найдено 378. 1H ЯМР (500 MГц, ДМСО-d6): δ 11,16 (с, 1H), 8,50 (с, 1H), 7,86 (д, J=8,5 Гц, 2H), 7,73 (д, J=8,5 Гц, 2H), 7,25 (т, J=6,0 Гц, 1H), 6,70 (д, J=7,0 Гц, 1H), 4,77-4,69 (м, 1H), 3,40-3,33 (м, 1H), 2,24-2,17 (м, 1H), 1,93-1,87 (м, 2H), 1,83-1,70 (м, 3H), 1,54-1,45 (м, 1H), 1,42-1,34 (м, 1H).
Таблица 46 содержит Примеры, которые получали аналогичным образом, что и Пример 16-1. В некоторых случаях, общую процедуру модифицировали альтернативным использованием HCl или ТФУК в качестве кислоты и ДХМ или диоксана в качестве растворителя.
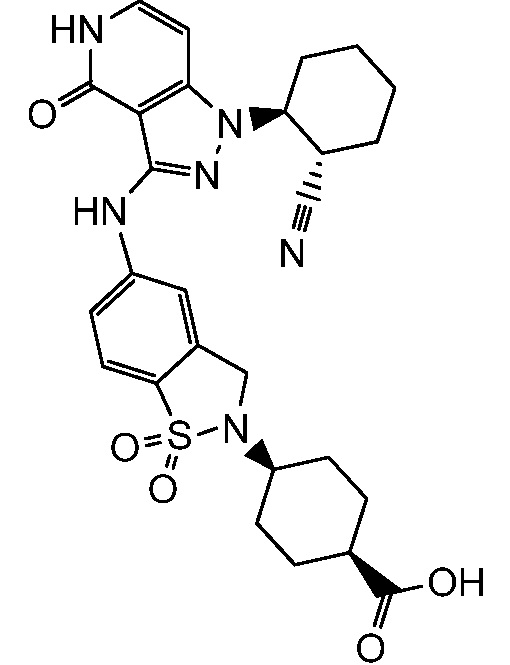
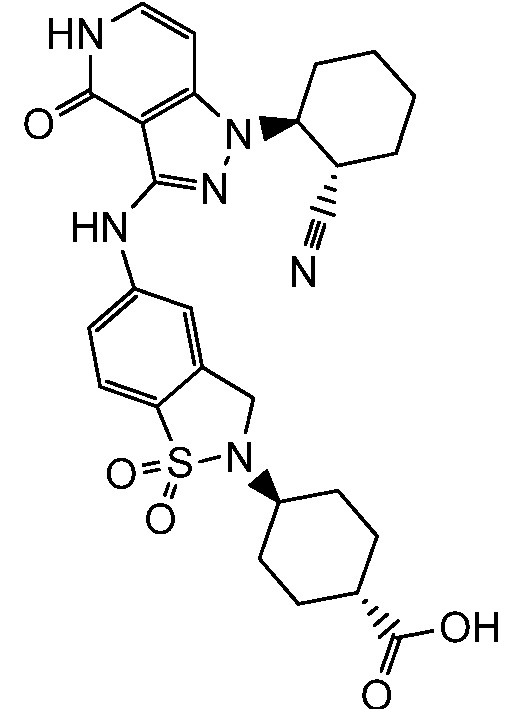
(из I-157)
Пример 17-1
(1R,4S и 1S,4R)-4-(4-(1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)фенил)-4-гидроксициклогексанкарбоновая кислота
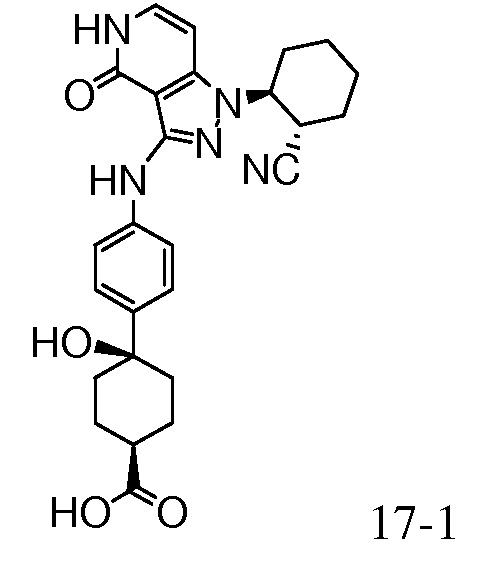
Стадия 1: (1R,4S и 1S,4R)-этил 4-(4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоксилат
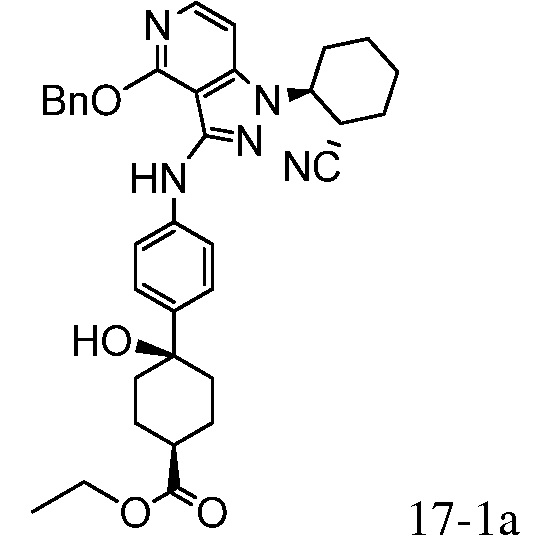
(1R,4S и 1S,4R)-этил 4-(4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоксилат синтезировали в соответствии с процедурой, аналогичной описанной для трет-бутил-4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1Н-пиразоло[4,3-с]пиридин-3-ил)амино)бензоата (Пример 16-1a) из I-161. МСНР (ИЭС) рассчитано для C35H40N5O4 [M + H]+: 594, найдено 594.
Стадия 2: (1R,4S и 1S,4R)-4-(4-(1-((1S,2S)-2-Цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)фенил)-4-гидроксициклогексанкарбоновая кислота
К смеси (1R,4S и 1S,4R)-этил 4-(4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоксилата (38 мг, 0,075 ммоль) в тетрагидрофуране (1 мл) по каплям добавляли раствор гидроксида лития (9,04 мг, 0,377 ммоль) в воде (3 мл) при 0°С. Полученную смесь перемешивали в течение 4 ч при комнатной температуре, а затем рН доводили до 6 при помощи буферного раствора 0,067 М динатрийгидрофосфата и 0,067 М одноосновного фосфата калия 1:19. Раствор экстрагировали этилацетатом (30 мл), промывали водой (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (XBridge RP18; 40-56% ацетонитрил/вода) с получением (1R,4S и 1S,4R)-4-(4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоновой кислоты. МСНР (ИЭС) рассчитано для C26H30N5O4 [M + H]+: 476, найдено 476; 1H ЯМР (400 MГц, ДМСО-d6) δ 12,05 (уш.с, 1H), 11,10 (д, J=5,6 Гц, 1H), 8,00 (с, 1H), 7,60 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,4 Гц, 2H), 7,24 (т, J=7,2 Гц, 1H), 6,69 (д, J=7,6 Гц, 1H), 4,73-4,65 (м, 2H), 2,25-2,22 (м, 2H), 1,94-1,70 (м, 14H), 1,65-1,35 (м, 2H).
Таблица 47 раскрывает Пример, который получали аналогичным способом, как описано для Примера 17.
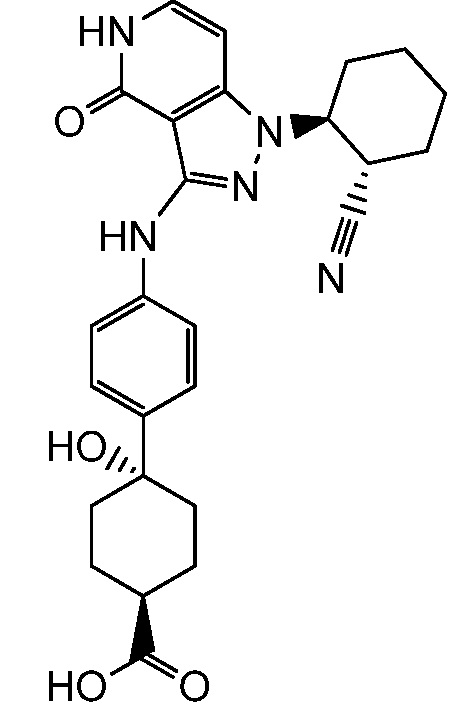
Пример 18-1
трет-Бутил-5-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-метилизоиндолин-2-карбоксилат
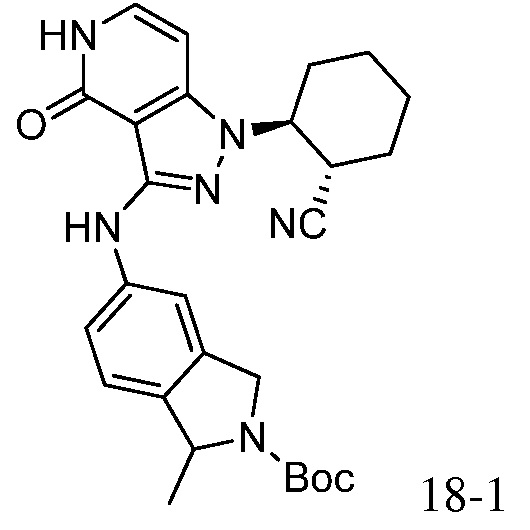
В 50-мл 3-горлую круглодонную колбу помещали (1S,2S)-2-(3-{[(1S и 1R)-1-метил-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (Пример 12-3; 70 мг, 0,18 ммоль), триэтиламин (36,5 мг, 0,360 ммоль), ди-трет-бутил дикарбонат (59 мг, 0,27 ммоль) и дихлорметан (10 мл). Смесь перемешивали в течение 50 мин при температуре окружающей среды. Смесь концентрировали в вакууме, и остаток очищали с помощью препаративной ТСХ (100% этилацетат) с получением трет-бутил-5-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-метилизоиндолин-2-карбоксилата. МСНР (ИЭС) рассчитано для C27H33N6O3 [M + H]+: 489, найдено 489; 1H ЯМР (300 MГц, ДМСО-d6) δ 11,09 (уш.с, 1H), 8,04 (с, 1H), 7,55-7,53 (м, 2H), 7,20-7,15 (м, 2H), 6,63 (д, J=7,2 Гц, 1H), 4,90-4,81 (м, 1H), 4,69-4,41 (м, 3H), 3,38-3,31 (м, 1H), 2,19-2,11 (м, 1H), 1,89-1,35 (м, 10H), 1,42 (с, 9H).
Примеры 19-1 и 19-2
(1S,2S)-2-(3-(((S или R)-2-Изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил и (1S,2S)-2-(3-(((S или R)-2-Изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
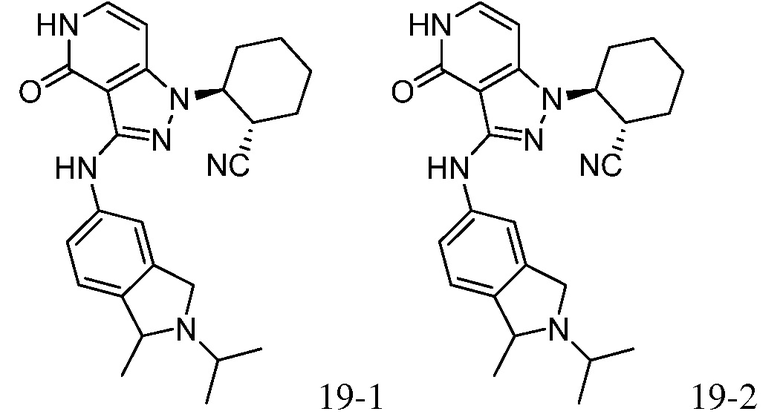
В 50-мл 3-горлую круглодонной колбе (1S,2S)-2-(3-{[(1S и 1R)-1-метил-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (Пример 12-3; 0,16 г, 0,41 ммоль) растворяли в метаноле (10 мл) и пропан-2-оне (2,0 мл) Полученную смесь перемешивали в течение 40 мин при температуре окружающей среды. Добавляли порциями боргидрид натрия (0,31 г, 8,2 ммоль) при 0°С. Смесь перемешивали в течение дополнительных 16 ч при температуре окружающей среды. Реакционную смесь гасили водой (10 мл) и экстрагировали дихлорметаном (3×30 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле, элюируя 2-10% МеОН в ДХМ с получением (1S,2S)-2-(3-(2-изопропил-1-метилизоиндолин-5-иламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила. Рацемический продукт разделяли с помощью хиральной препаративной ВЭЖХ при следующих условиях: колонка, Chiralpak IA, подвижная фаза, гексан (с 0,2% изопропанола) и изопропанол (поддержание 15% гексана в течение 12 мин); детектор. УФ 254/220 нм с получением (1S,2S)-2-(3-(((S или R)-2-изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила и (1S,2S)-2-(3-(((R или S)-2-изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила.
Пик A (19-1): Tуд = 9,72 минут. МСНР (ИЭС) рассчитано для C25H31N6O [M + H]+: 431, найдено 431;
1H ЯМР (400 MГц, CD3OD) δ 7,69 (с, 1H), 7,57 (д, J=8,4 Гц, 1H), 7,24-7,19 (м, 2H), 6,71 (д, J=7,6 Гц, 1H), 4,61-4,54 (м, 2H), 4,36-4,18 (м, 2H), 3,48-3,33 (м, 2H), 2,34-2,31 (м, 1H), 2,14-1,82 (м, 5H), 1,67-1,45 (м, 5H), 1,30-1,28 (д, J=6,6 Гц, 3H), 1,21-1,19 (д, J=6,3 Гц, 3H).
Пик B (19-2): Tуд = 12,74 минут. МСНР (ИЭС) рассчитано для C25H31N6O [M + H]+: 431, найдено 431;
1H ЯМР (300 MГц, CD3OD) δ 7,65 (с, 1H), 7,51 (д, J=8,1 Гц, 1H), 7,24-7,19 (м, 2H), 6,69 (д, J=7,2 Гц, 1H), 4,61-4,54 (м, 2H), 4,36-4,18 (м, 2H), 3,45-3,33 (м, 2H), 2,33-2,29 (м, 1H), 2,13-1,82 (м, 5H), 1,67-1,43 (м, 5H), 1,30-1,28 (д, J=6,6 Гц, 3H), 1,21-1,19 (д, J=6,3 Гц, 3H).
Пример 20-1
(1S,2S)-2-(3-((4-((1R,3S,5S)-8-азабицикло[3.2.1]октан-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила гидрохлорид
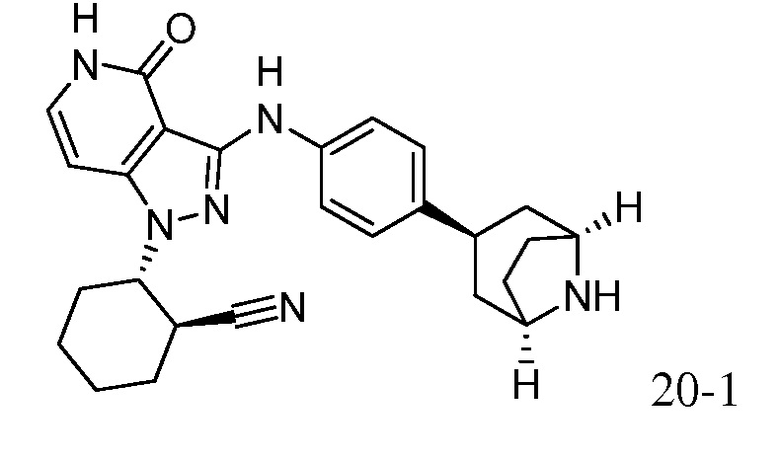
В 25-мл 3-горлой круглодонной колбе раствор (1R,3S,5S)-трет-бутил-3-(4-((1-((1S,2S)-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-8-азабицикло[3.2.1]октан-8-карбоксилата (Пример 3-166; 29 мг, 0,050 ммоль) растворяли в этилацетате (8 мл). Газообразный хлористый водород барботировали в раствор с получением насыщенного раствора, затем полученную смесь перемешивали в течение 2 ч при 0°С. Реакционную смесь фильтровали, и твердое вещество промывали диэтиловым эфиром (50 мл) с получением (1S,2S)-2-(3-((4-((1R,3S,5S)-8-азабицикло[3.2.1]октан-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила гидрохлорида. МСНР (ИЭС) рассчитано для C26H31N6O [M+H]+: 443, найдено 443; 1H ЯМР (300 MГц, CD3OD) δ 7,58 (д, J=8,7 Гц, 2H), 7,22-7,17 (м, 3H), 6,65 (д, J=7,5 Гц, 1H), 4,59-4,51 (м, 1H), 4,12-4,03 (м, 2H), 3,39-3,33 (м, 1H), 3,18-3,09 (м, 1H), 2,29-2,21 (м, 1H), 2,18-1,51 (м, 15H).
Таблица 48 раскрывает Пример, который получали по аналогии с Примером 20-1, исходя из Примера 3-165.
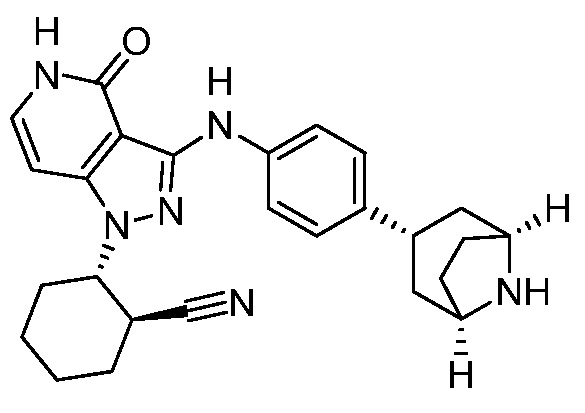
Пример 21-1
(1S,2S)-2-(3-((2,2-Диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
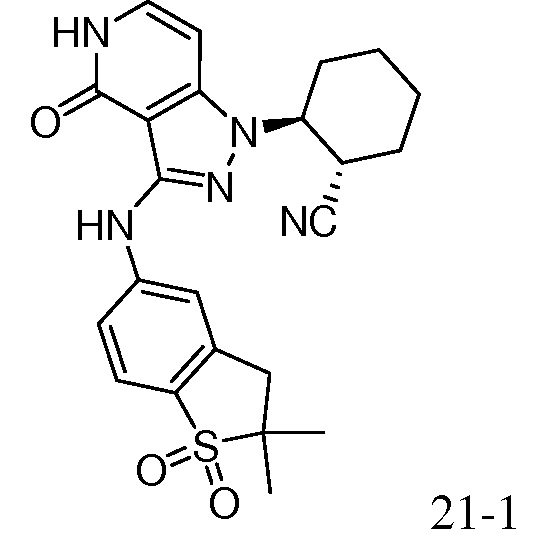
Стадия 1: (1S,2S)-2-(4-(Бензилокси)-3-((2,2-диметил-1,1-диоксидо-3-оксо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
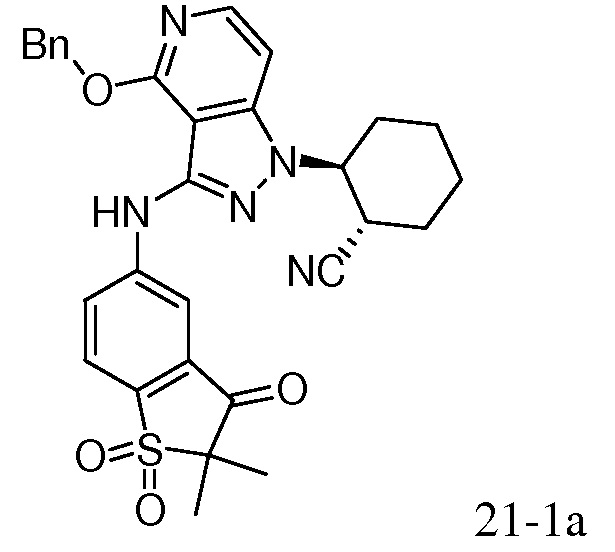
В 100-мл круглодонную колбу добавляли ацетат калия (56,5 мг, 0,576 ммоль), 2-ди-трет-бутилфосфино-2'4'6-триизопропилбифенил (92 мг, 0,22 ммоль), аддукт трис(дибензилиденацетон)дипалладий (0) - хлороформ (75 мг, 0,072 ммоль), 5-бром-2,2-диметилбензо[b]тиофен-3(2H)-он 1,1-диоксид (I-162f; 0,10 г, 0,34 ммоль), (1S,2S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с] пиридин-1-ил)циклогексанкарбонитрил (I-1; 0,10 г, 0,29 ммоль) и 2-пропанол (30 мл). Смесь перемешивалии в течение 4 ч при 80°С в атмосфере азота. Смесь охлаждали, и твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:2) с получением (1S,2S)-2-(4-(бензилокси)-3-((2,2-диметил-1,1-диоксидо-3-оксо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила. МСНР (ИЭС) рассчитано для C30H30N5O4S [M + H]+: 556, найдено 556.
Стадия 2: (1S,2S)-2-(4-(Бензилокси)-3((3-гидрокси-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
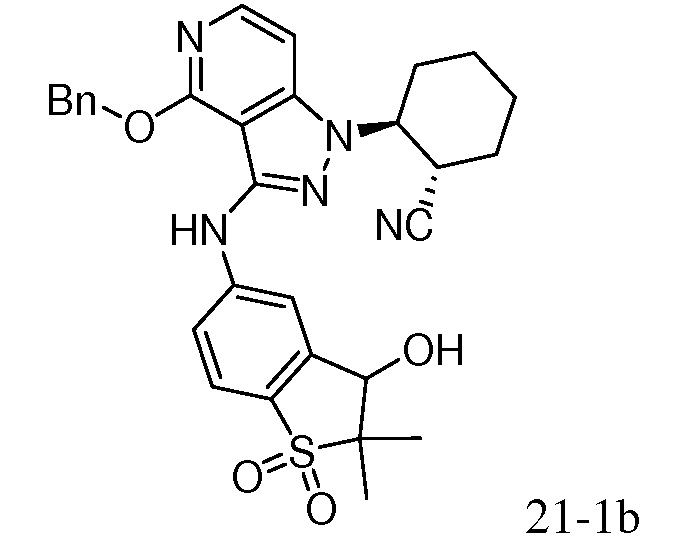
В 50-мл круглодонную колбу к раствору (1S,2S)-2-(4-(бензилокси)-3-((2,2-диметил-1,1-диоксидо-3-оксо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила (0,11 г, 0,20 ммоль) в метаноле (20 мл) добавляли боргидрид натрия (22,5 мг, 0,594 ммоль). Смесь перемешивали в течение 3 ч при температуре окружающей среды. Смесь гасили водой (3 мл) и затем экстрагировали этилацетатом (3×10 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:1) с получением (1S,2S)-2-(4-(бензилокси)-3((3-гидрокси-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила. МСНР (ИЭС) рассчитано для C30H32N5O4S [M + H]+: 558, найдено 558.
Стадия 3: O-(5-((4-(Бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-3-ил)-1H-имидазол-1-карботиоат
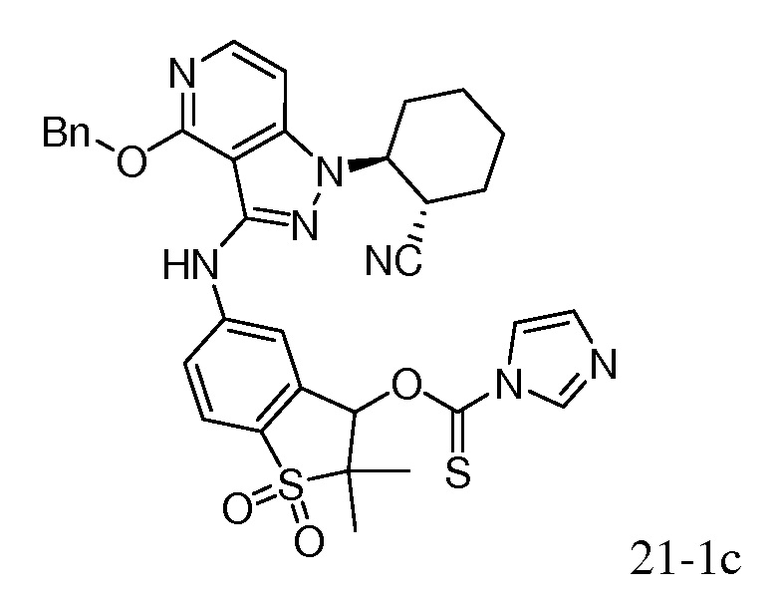
В 25-мл круглодонную колбу помещали раствор (1S,2S)-2-(4-(бензилокси)-3-((3-гидрокси-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила (20 мг, 0,036 ммоль) в дихлорметане (5 мл) с последующим добавлением 4-диметиламинопиридина (87 мг, 7,2 мкмоль) и ди(1H-имидазол-1-ил)метантиона (9,6 мг, 0,054 ммоль). Смесь перемешивали в течение 30 мин при температуре окружающей среды. Смесь концентрировали в вакууме, и остаток очищали с помощью препаративной ТСХ, элюируя смесью этилацетат/петролейный эфир (1:1) с получением O-(5-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-3-ил)-1H-имидазол-1-карботиоата. МСНР (ИЭС) рассчитано для C34H34N7O4S2 [M + H]+: 668, найдено 668.
Стадия 4: (1S,2S)-2-(4-(Бензилокси)-3-((2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогекснкарбонитрил
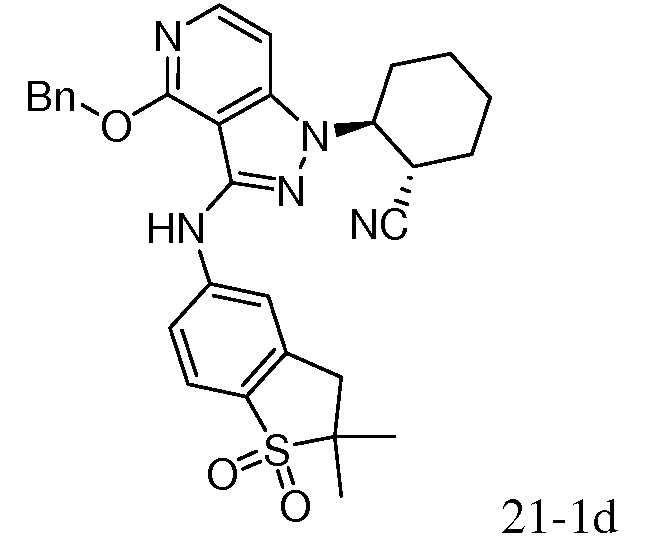
В 50-мл трехгорлую круглодонную колбу помещали раствор 2,2'-азобис(2-метилпропионитрила) (26 мг, 0,16 ммоль), О-(5-((4-(бензилокси)-1-((1S,2S)-2-цианоциклогексил)-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-3-ил)-1H-имидазол-1-карботиоата (0,10 г, 0,16 ммоль) и трибутилстаннана (92 мг, 0,31 ммоль) в толуоле (20 мл) в атмосфере азота. Раствор перемешивали в течение 1 ч при 110°С. Смесь концентрировали в вакууме, и остаток очищали на силикагеле, элюируя этилацетатом с получением (1S,2S)-2-(4-(бензилокси)-3-((2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила. МСНР (ИЭС) рассчитано для C30H32N5O3S [M + H]+: 542, найдено 542.
Стадия 5: (1S,2S)-2-(3-((2,2-Диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил
В 25-мл круглодонную колбу добавили палладий на углероде (80 мг, 0,075 ммоль, 10% масс.), (1S,2S)-2-(4-(бензилокси)-3-((2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрил (75 мг, 0,14 ммоль) и этилацетат (15 мл). Смесь перемешивали в течение 16 ч при температуре окружающей среды в атмосфере водорода (0,152 МПа). Твердое вещество отфильтровывали, и фильтрат концентрировали в вакууме с получением (1S,2S)-2-(3-((2,2-диметил-1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила. МСНР (ИЭС) рассчитано для C23H26N5O3S [M + H]+: 452, найдено 452; 1H ЯМР (400 MГц, ДМСО-d6) δ 11,18 (с, 1H), 8,64 (с, 1H), 7,75 (д, J=9,6 Гц, 2H), 7,63 (д, J=8,4 Гц, 2H), 7,28 (д, J=6,4 Гц, 1H), 6,73 (д, J=7,2 Гц, 1H), 4,76 (д, J=5,2 Гц, 1H), 3,38-3,33 (м, 1H), 3,15 (с, 2H), 2,36-2,21 (м, 1H), 1,94-1,78 (м, 3H), 1,38 (с, 6H), 0,65 (д, J=6,6 Гц, 3H).
Таблица 49 содержит Примеры, которые получали аналогичным образом, что и Пример 21-1, исходя из соответствующего тиофенового промежуточного продукта.
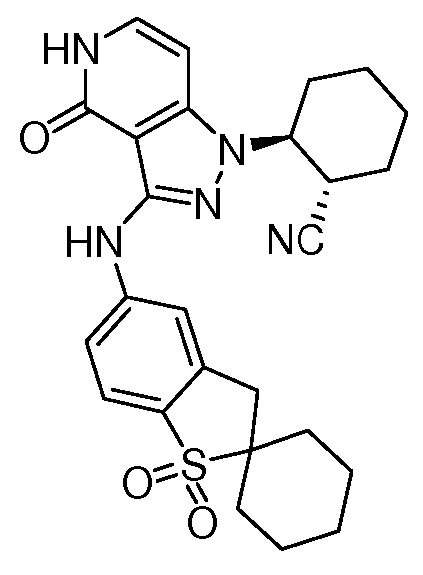
найдено 492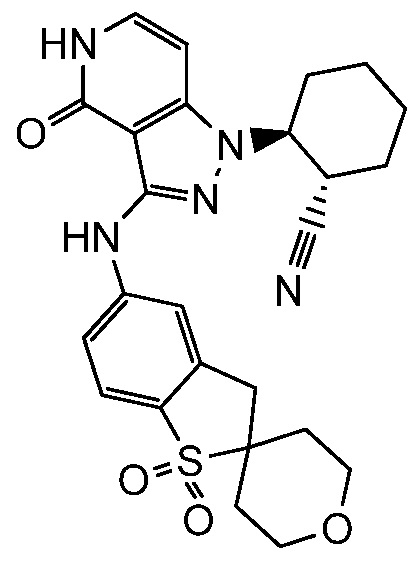
найдено 494
Примеры 22-1 и 22-2
(1R,2S или 1S,2R)-2-(3-((4-(трет-Бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил и (1R,2S или 1S,2R)-2-(3-((4-(трет-Бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил
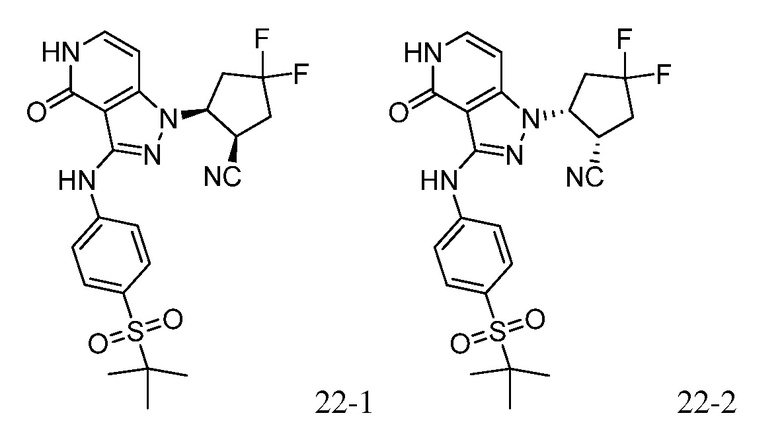
Стадия 1: (1S,2R и 1R,2S)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклопентанкарбонитрил и (1S,2S и 1R,2R)-2-(3-Амино-4-(бензилокси)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклопентанкарбонитрил
В 25-мл круглодонную колбу помещали 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-а]азепин (1,90 г, 12,5 ммоль), 4-гидроксициклопент-1-енкарбонитрил (34,1 мг, 0,312 ммоль), 4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-3-амин (I-1; 1,50 г, 6,24 ммоль) и ацетонитрил (7 мл). Смесь перемешивали в течение 6 ч при 80°С. Смесь охлаждали, и добавляли воду (20 мл). Смесь экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой (3×50 мл) и насыщенным раствором соли (3×50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (2:3) с получением (1S,2R и 1R,2S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)-4-гидроксициклопентанкарбонитрила (МСНР (ИЭС) рассчитано для C19H20N5O2 [M + H]+: 350, найдено 350) и (1S,2S и 1R,2R)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)-4-гидроксициклопентанкарбонитрила (МСНР (ИЭС) рассчитано для C19H20N5O2 [M + H]+: 350, найдено 350), каждый в виде рацемической смеси как R, так и S гидрокси-диастереомеров.
Стадия 2: (1S,2R и 1R,2S)-2-(4-(Бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклопентанкарбонитрил
В 50-мл круглодонную колбу помещали ацетат калия (0,20 г, 2,0 ммоль), ди-трет-бутил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфин (85 мг, 0,20 ммоль), аддукт трис(дибензилиденацетон)дипалладий (0) - хлороформ (0,10 г, 0,10 ммоль), (1S,2R и 1R,2S)-2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)-4-гидроксициклопентанкарбонитрил (0,35 г, 1,0 ммоль), 1-бром-4-(трет-бутилсульфонил)бензол (0,33 г, 1,2 ммоль), изопропанол (40 мл) и N,N-диметилформамид (1,5 мл). Смесь дегазировали азотом (×3), затем перемешивали в течение 6 ч при 80°С. Смесь охлаждали, добавляли воду (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали насыщенным раствором соли (2×20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя 10-50% EtOAc в петролейном эфире с получением (1S,2R и 1R,2S)-2-(4-(бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклопентанкарбонитрила в виде рацемической смеси как R, так и S гидрокси диастереомеров. МСНР (ИЭС) рассчитано для C29H32N5O4S [M + H]+: 546, найдено 546.
Стадия 3: (1S,2R и 1R,2S)-2-(4-(Бензилокси)-3-(4-(трет-бутилсульфонил)фениламино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-оксоциклопентанкарбонитрил
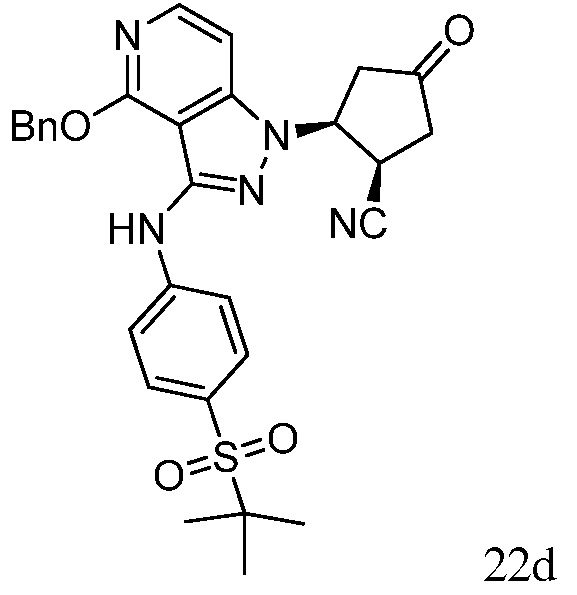
В 100-мл круглодонную колбу помещали (1S,2R и 1R,2S)-2-(4-(бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-гидроксициклопентанкарбонитрил (0,46 г, 0,42 ммоль) и реагент Джонса (1,8 М в разбавленной серной кислоте, 3,0 мл, 1,7 ммоль) в ацетоне (50 мл). Смесь перемешивали в течение 10 мин при 0°С. Смесь охлаждали и добавляли изопропанол (10 мл). Смесь перемешивали в течение 30 мин при 0°С и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали насыщенным раствором соли (2×200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (1,5: 1) с получением указанного в заголовке соединения. МСНР (ИЭС) рассчитано для C29H30N5O4S [M + H]+: 544, найдено 544.
Стадия 4: (1S,2R и 1R,2S)-2-(4-(Бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил
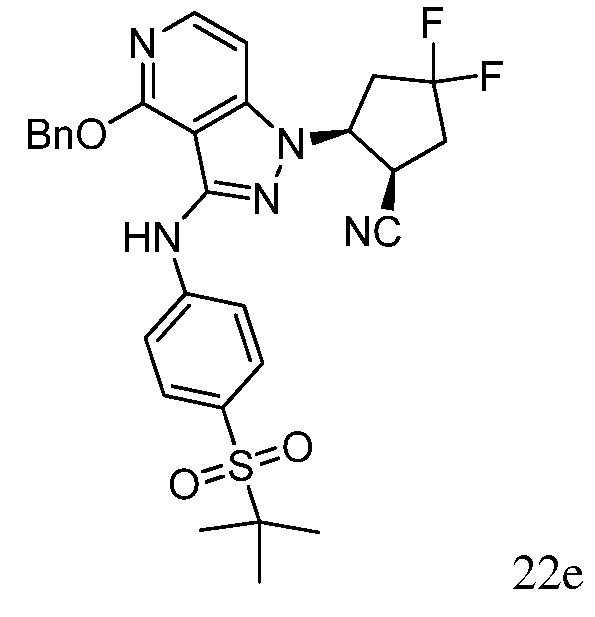
В 100-мл круглодонную колбу помещали (1S,2R и 1R,2S)-2-(4-(бензилокси)-3-((4-(трет-бутилсульфонил)фенил)аимно)-1H-пиразоло[4,3-c]пиридин-1-ил)-4-оксоциклопентанкарбонитрил (0,24 г, 0,44 ммоль) и ДХМ (15 мл). Смесь дегазировали азотом (×3) и добавляли по каплям бис(2-метоксиэтил)аминосеры трифторид (0,98 г, 4,4 ммоль) при 0°С. Смесь перемешивали в течение 4 ч при 0°С. Добавляли воду (20 мл), и полученный раствор экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали насыщенным раствором соли (2×50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали на силикагеле, элюируя смесью петролейный эфир/этилацетат (3:1) с получением (1S,2R и 1R,2S)-2-(4-(бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрила. МСНР (ИЭС) рассчитано для C29H30F2N5O3S [M + H]+: 566, найдено 566.
Стадия 5: (1S,2R или 1R,2S)-2-(3-(4-(трет-Бутилсульфонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил и (1S,2R или 1R,2S)-2-(3-(4-(трет-Бутилсульфонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил
В 50-мл круглодонную колбу помещали (1S,2R и 1R,2S)-2-(4-(бензилокси)-3-((4-(трет-бутилсульфонил)фенил)амино)-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил (0,16 г, 0,33 ммоль), дихлорметан (5 мл) и 2,2,2-трифторуксусную кислоту (1 мл). Смесь перемешивали в течение 6 ч при температуре окружающей среды, а затем концентрировали в вакууме, и остаток очищали с помощью обращенно-фазовой ВЭЖХ с масс-спектрометрическим детектором (RP18 XBridge; 30-60% ацетонитрил/вода, содержащая 0,05% бикарбоната аммония) с получением (1S,2R и 1R,2S)-2-(3-(4-(трет-бутилсульфонил)фениламино)-4-оксо-4,5-дигидропиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрила. Рацемический продукт разделяли хиральной препаративной ВЭЖХ при следующих условиях: колонка, Chiralpak IB; подвижная фаза, гексан (0,1% ДЭА) в этаноле (0,1% ДЭА) (2:1 в течение 17 мин); детектор УФ 220 / 254 нм.
Пик A (22-1): (1R,2S или 1S,2R)-2-(3-((4-(трет-Бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил. Tуд = 15 минут. МСНР (ИЭС) рассчитано для C22H24F2N5O3S [M + H]+: 476, найдено 476; 1H ЯМР (300 MГц, ДМСО-d6) δ 11,26 (уш.с, 1H), 8,79 (уш.с, 1H), 7,91 (д, J=5,7 Гц, 2H), 7,66 (д, J=9,0 Гц, 2H), 7,34-7,30 (м, 1H), 6,64 (д, J=7,5 Гц, 1H), 5,60-5,54 (м, 1H), 3,95-3,89 (м, 1H), 3,01-2,73 (м, 4H), 1,24 (с, 9H).
Пик B (22-2): (1S,2R или 1R,2S)-2-(3-((4-(трет-Бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрил. Tуд = 18 минут. МСНР (ИЭС) рассчитано для C22H24F2N5O3S [M + H]+: 476, найдено 476; 1H ЯМР (300 MГц, ДМСО-d6) δ 11,27 (уш.с, 1H), 8,79 (уш.с, 1H), 7,91 (д, J=5,7 Гц, 2H), 7,66 (д, J=9,0 Гц, 2H), 7,34-7,30 (м, 1H), 6,64 (д, J=7,5 Гц, 1H), 5,58-5,54 (м, 1H), 3,97-3,89 (м, 1H), 3,02-2,73 (м, 4H), 1,24 (с, 9H).
Таблица 50 содержит примеры, которые получали аналогичным образом, что и Примеры 22-1 и 22-2, исходя из соответствующего диастереомера 2-(3-амино-4-(бензилокси)-1H-пиразоло[4,3-с]пиридин-1-ил)-4-гидроксициклопентанкарбонитрила и арилбромида.
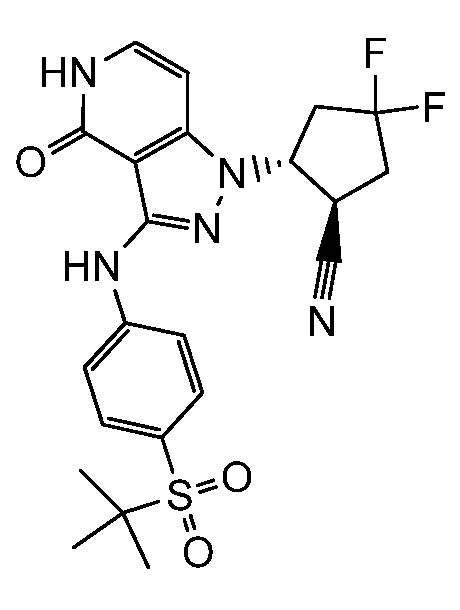
найдено 476
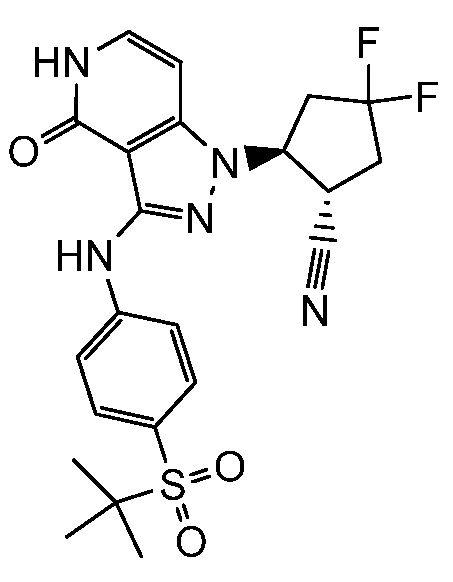
найдено 476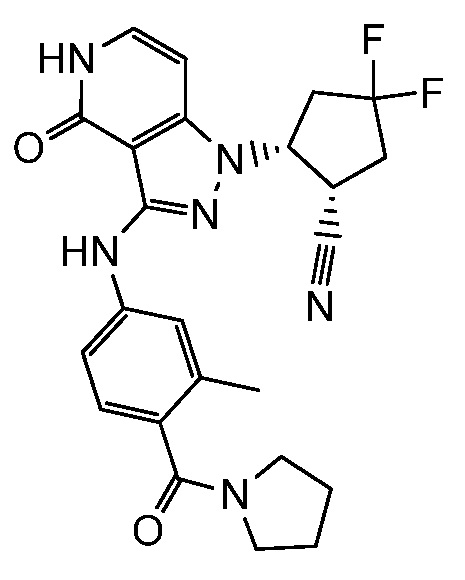
найдено 467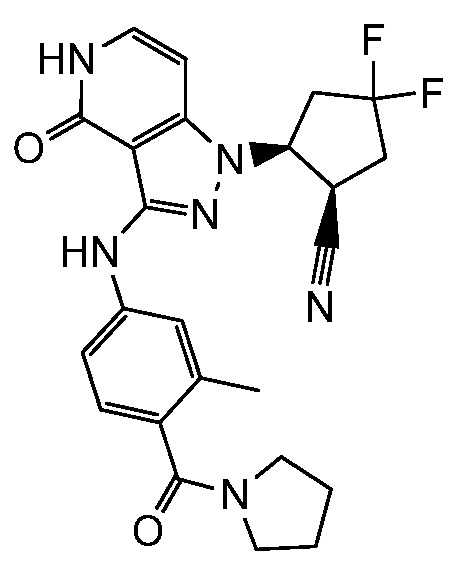
найдено 467
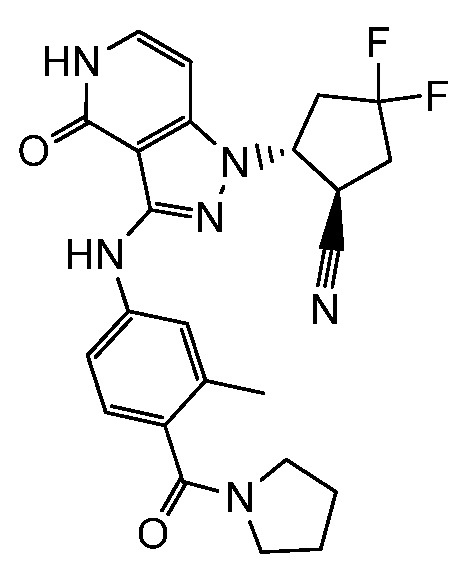
найдено 467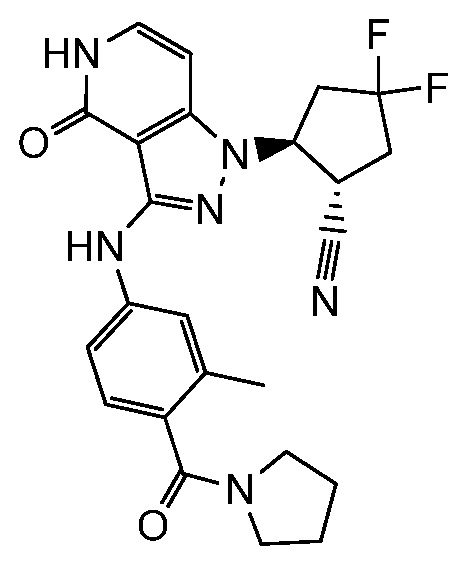
найдено 467
БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
Протокол биохимического HTRF-анализа JAK
Способность соединений ингибировать активность JAK1, JAK2, JAK3 и Tyk2 измеряли с использованием рекомбинантного очищенного GST-меченого каталитического домена для каждого фермента (Invitrogen JAK1 № M4290, JAK2 № M4290, JAK3 № M4290, Tyk2 № M4290) в биохимическом анализе формата HTRF. Реакции задействовали общий пептидный субстрат, LCB-EQEDEPEGDYFEWLW-NH2 (собственного получения). Основной протокол анализа заключается в следующем: во-первых, 250 нл разбавленных в ДМСО соединений отмеряли в лунки сухого 384-луночного черного планшета (Greiner № 781076) с использованием акустического дозатора Labcyte Echo 555. Последующие добавления реагентов задействовали Agilent Bravo. Далее, 18 мкл 1,11× фермента и 1,11× субстрата в 1× буфере для анализа (Invitrogen киназный буфер № PV3189, 2 мМ DTT, 0,05% BSA) добавляли в лунки и встряхивали, и затем предварительно инкубировали в течение 30 минут при комнатной температуре, чтобы привести в равновесие связывание соединения. После уравновешивания, добавляли 2 мкл 10× АТФ в 1× буфере для анализа, чтобы инициировать киназную реакцию и планшеты встряхивали и затем инкубировали при комнатной температуре в течение 120 минут. В конце инкубации, 20 мкл 2× останавливающего буфера (стрептавидин-DyLight 650 (Thermo № 84547B/100 мл), Eu-меченое антитело PY20 (Perkin Elmer № AD0067), ЭДТА, ГЭПЭС и Тритон) добавляли для остановки реакции. Планшеты встряхивали и центрифугировали, а затем инкубировали 60 минут при комнатной температуре, а затем считывали на Perkin Elmer Envision (λвозб = 337 нм, λэм = 665 нм и 615, время задержки TRF = 20 мкс). Сигнал HTRF = 10,000 * считывание при 665 нм / считывание при 615 нм. После нормализации до необработанного контроля, рассчитывали процентное ингибирование сигнала HTRF при каждой концентрации соединения. Кривую зависимости процента ингибирования по отношению к log концентрации соединения приводили в соответствии с 4-параметровым уравнением доза-ответ для расчета значений IC50.
Окончательные условия реакции представляли собой:
(нM)
(мкM)
(мкM)
Концентрации анализируемых соединений составляли 1496, 499, 175, 49,9, 18,7, 6,2, 2,1, 0,75, 0,24, 0,075 и 0,0125 нМ, с 1,25% остаточного ДМСО.
БИОЛОГИЧЕСКИЕ ДАННЫЕ
Примеры по настоящему изобретению оценивали в анализах связывания JAK1 и JAK2 in vitro. В следующую таблицу сведены биологические данные, раскрытые в настоящем изобретении, как значения IC50 JAK1 и IC50 JAK2.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-(2-ЦИАНОГЕТЕРОЦИКЛИЛ)ПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2669922C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| НОВЫЕ СОЕДИНЕНИЯ, КОТОРЫЕ ЯВЛЯЮТСЯ ИНГИБИТОРАМИ ERK | 2013 |
|
RU2660429C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ | 2006 |
|
RU2408584C2 |
| ПУРИНОВЫЕ ИНГИБИТОРЫ ЧЕЛОВЕЧЕСКОЙ ФОСФАТИДИЛИНОЗИТ 3-КИНАЗЫ ДЕЛЬТА | 2013 |
|
RU2658006C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ RORc | 2017 |
|
RU2757571C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЙ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2290179C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ПРИМЕНЕНИЕ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ КАТЕПСИНА S | 2001 |
|
RU2317988C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ KDM5, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840256C1 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
Изобретение относится к органической химии, а именно к соединению формулы I или его фармацевтически приемлемой соли
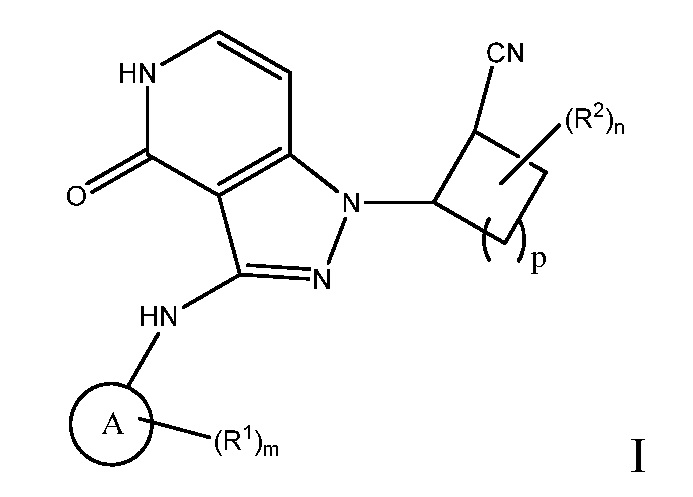 , где A выбирают из фенила, изоиндолинила, хинолинила, пиридинила,
, где A выбирают из фенила, изоиндолинила, хинолинила, пиридинила,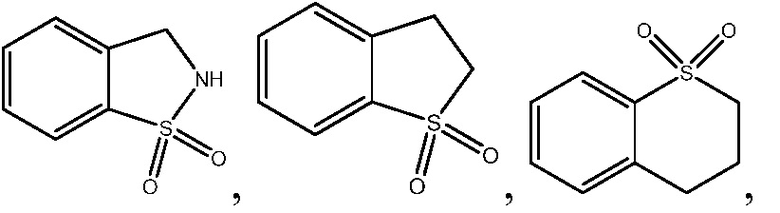
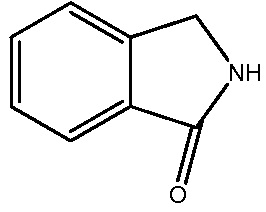 , 2,3-дигидро-1Н-инденила, бензотазолила и 1,2,3,4-тетрагидроизохинолинила; n равно 0, 1, 2 или 3; m равно 0, 1, 2 или 3; p равно 2, 3 или 4; R1 выбирают из: галогена, оксо (=O), C1-6алкил(окси)0-1(карбонил)0-1C1-6алкила, C3-6циклоалкилC0-6алкила, гетероарил(карбонил)0-1C0-6 алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из азота, азота и кислорода, и азота и серы, (C3-12)гетероциклоалкил(карбонил)0-1C0-6алкила, где 3-12-членный гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота, кислорода, серы, азота и кислорода, и кислорода и серы, C1-6алкил(окси)1(карбонил)1аминоC1-6алкила, гетероарил(карбонил)1аминоC1-6 алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота и кислорода, C0-6алкиламино(карбонил)0-1C1-6алкила, гетероариламино(карбонил)1C1-6алкила, где гетероарил представляет собой 5-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота, C1-6алкилсульфонила, (C3-6)циклогетероалкилсульфонилC0-6алкила, где циклогетероалкил содержит 1-2 гетероатома, выбранных из азота и кислорода, C1-6алкилсульфонимидоила, C1-6алкилтиоC1-6алкила, -CO2H, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, -(C1-6алкил)OH, -C1-6алкилалкокси, циано, и C1-6галогеналкила; и где два R1 могут необязательно связываться с кольцевыми атомами, к которым они присоединены с образованием 3-6-членного кольца; R2 выбирают из: галогена, C1-6алкила, (C3-6)гетероциклоалкила, где гетероциклоалкил содержит 1 гетероатом азота, C3-6циклоалкилC1-6алкиламино, (C1-6 алкил)1-2амино, и гидрокси, где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R1 и R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3; R3 независимо выбирают из: галогена, C1-6алкила, фенила, C3-6циклоалкила, пиперидинила, -CO2(C1-6 алкил), -CO2H, амино, (C1-6алкил)1-2амино, гидрокси, (C1-6алкил)OH, C1-6алкоксиC1-6алкила, (C1-6алкил)циано, C1-6алкилсульфинилC1-6алкила, -O(C=O)C1-6алкила, оксо и C1-6галогеналкила. Изобретение также относится к фармацевтической композиции, обладающей способностью игбировать активность Янус-киназ JAK1 и JAK2, и способам лечения на основе указанных соединений. Технический результат: получены новые соединения, которые могут найти применение в медицине для лечения артрита, астмы и обструктивных заболеваний дыхательных путей, аутоиммунных заболеваний или расстройств и рака. 7 н. и 7 з.п. ф-лы, 50 табл., 22 пр.
, 2,3-дигидро-1Н-инденила, бензотазолила и 1,2,3,4-тетрагидроизохинолинила; n равно 0, 1, 2 или 3; m равно 0, 1, 2 или 3; p равно 2, 3 или 4; R1 выбирают из: галогена, оксо (=O), C1-6алкил(окси)0-1(карбонил)0-1C1-6алкила, C3-6циклоалкилC0-6алкила, гетероарил(карбонил)0-1C0-6 алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из азота, азота и кислорода, и азота и серы, (C3-12)гетероциклоалкил(карбонил)0-1C0-6алкила, где 3-12-членный гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота, кислорода, серы, азота и кислорода, и кислорода и серы, C1-6алкил(окси)1(карбонил)1аминоC1-6алкила, гетероарил(карбонил)1аминоC1-6 алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота и кислорода, C0-6алкиламино(карбонил)0-1C1-6алкила, гетероариламино(карбонил)1C1-6алкила, где гетероарил представляет собой 5-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота, C1-6алкилсульфонила, (C3-6)циклогетероалкилсульфонилC0-6алкила, где циклогетероалкил содержит 1-2 гетероатома, выбранных из азота и кислорода, C1-6алкилсульфонимидоила, C1-6алкилтиоC1-6алкила, -CO2H, -SO2NH2, -SO2NH(C1-6алкил), -SO2N(C1-6алкил)2, -(C1-6алкил)OH, -C1-6алкилалкокси, циано, и C1-6галогеналкила; и где два R1 могут необязательно связываться с кольцевыми атомами, к которым они присоединены с образованием 3-6-членного кольца; R2 выбирают из: галогена, C1-6алкила, (C3-6)гетероциклоалкила, где гетероциклоалкил содержит 1 гетероатом азота, C3-6циклоалкилC1-6алкиламино, (C1-6 алкил)1-2амино, и гидрокси, где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и где R1 и R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3; R3 независимо выбирают из: галогена, C1-6алкила, фенила, C3-6циклоалкила, пиперидинила, -CO2(C1-6 алкил), -CO2H, амино, (C1-6алкил)1-2амино, гидрокси, (C1-6алкил)OH, C1-6алкоксиC1-6алкила, (C1-6алкил)циано, C1-6алкилсульфинилC1-6алкила, -O(C=O)C1-6алкила, оксо и C1-6галогеналкила. Изобретение также относится к фармацевтической композиции, обладающей способностью игбировать активность Янус-киназ JAK1 и JAK2, и способам лечения на основе указанных соединений. Технический результат: получены новые соединения, которые могут найти применение в медицине для лечения артрита, астмы и обструктивных заболеваний дыхательных путей, аутоиммунных заболеваний или расстройств и рака. 7 н. и 7 з.п. ф-лы, 50 табл., 22 пр.
1. Соединение формулы I или его фармацевтически приемлемая соль, или его стереоизомер:
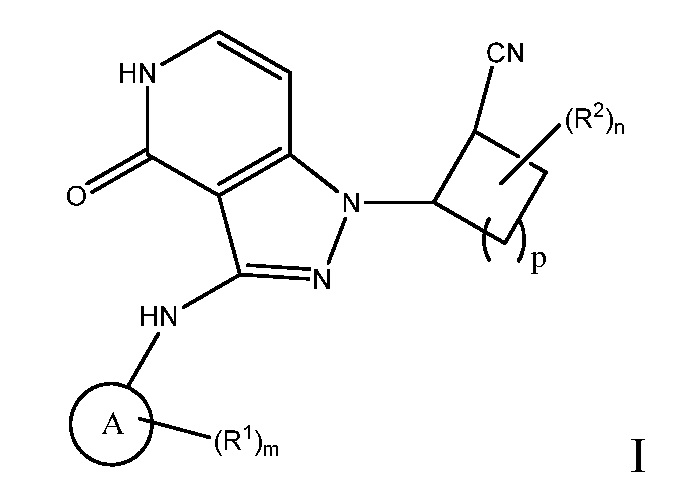
A выбирают из фенила, изоиндолинила, хинолинила, пиридинила,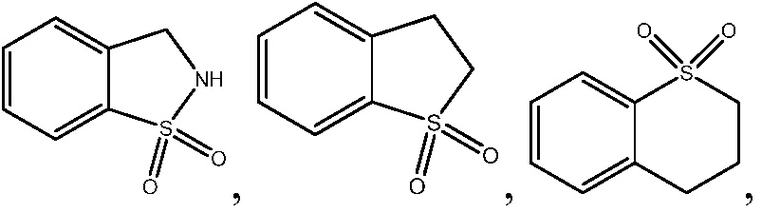
 , 2,3-дигидро-1Н-инденила, бензотазолила и 1,2,3,4-тетрагидроизохинолинила;
, 2,3-дигидро-1Н-инденила, бензотазолила и 1,2,3,4-тетрагидроизохинолинила;
n равно 0, 1, 2 или 3;
m равно 0, 1, 2 или 3;
p равно 2, 3 или 4;
R1 выбирают из:
галогена,
оксо (=O),
C1-6алкил(окси)0-1(карбонил)0-1C1-6алкила,
C3-6циклоалкилC0-6алкила,
гетероарил(карбонил)0-1C0-6 алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из азота, азота и кислорода, и азота и серы,
(C3-12)гетероциклоалкил(карбонил)0-1C0-6алкила, где 3-12-членный гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота, кислорода, серы, азота и кислорода, и кислорода и серы,
C1-6алкил(окси)1(карбонил)1аминоC1-6алкила,
гетероарил(карбонил)1аминоC1-6алкила, где гетероарил представляет собой 5-6-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота и кислорода,
C0-6алкиламино(карбонил)0-1C1-6алкила,
гетероариламино(карбонил)1C1-6алкила, где гетероарил представляет собой 5-членное кольцо, содержащее 1-2 гетероатома, выбранных из азота,
C1-6алкилсульфонила,
(C3-6)циклогетероалкилсульфонилC0-6алкила, где циклогетероалкил содержит 1-2 гетероатома, выбранных из азота и кислорода,
C1-6алкилсульфонимидоила,
C1-6алкилтиоC1-6алкила,
-CO2H,
-SO2NH2,
-SO2NH(C1-6алкил),
-SO2N(C1-6алкил)2,
-(C1-6алкил)OH,
-C1-6алкилалкокси,
циано, и
C1-6галогеналкила; и
где два R1 могут необязательно связываться с кольцевыми атомами, к которым они присоединены с образованием 3-6-членного кольца;
R2 выбирают из:
галогена,
C1-6алкила,
(C3-6)гетероциклоалкила, где гетероциклоалкил содержит 1 гетероатом азота,
C3-6циклоалкилC1-6алкиламино,
(C1-6 алкил)1-2амино, и
гидрокси,
где два R2 могут необязательно связываться с кольцевым атомом, к которому каждый присоединен с образованием 3-6-членного насыщенного кольца; и
где R1 и R2 каждый необязательно замещен 1, 2, 3 или 4 заместителями R3;
R3 независимо выбирают из:
галогена,
C1-6алкила,
фенила,
C3-6циклоалкила,
пиперидинила,
-CO2(C1-6алкил),
-CO2H,
амино,
(C1-6алкил)1-2амино,
гидрокси,
(C1-6алкил)OH,
C1-6алкоксиC1-6алкила,
(C1-6алкил)циано,
C1-6алкилсульфинилC1-6алкила,
-O(C=O)C1-6алкила,
оксо и
C1-6галогеналкила.
2. Соединение по п.1, где R1 выбирают из: фтора, метилсульфонила, хлора, трифторметила, трифторметокси, диметилсульфамоила, сульфамоила, гидроксиэтила, трифторэтила, пиразолилкарбамоилметила, пиразолилкарбониламинометила, трет-бутилоксикарбониламинометила, аминометила, изопропилсульфамоила, бензилсульфамоила, (циклопропилметил)сульфамоила, этилсульфамоила, циклогексилсульфамоила, пиперидинилсульфонила, морфолинилсульфонила, триазолилметила, пирролидинилкарбонила, оксазолилкарбониламинометила, пиримидинилкарбониламинометила, гидроксиэтила, 1-гидроксиэтила, морфолинилметила, 1-гидроксиметилэтила, гидрокси(метилпропила), 1-гидрокси(метилпропила), гидроксипропила, этилгидрокси, (трет-бутил)сульфиниламинометила, диоксоланила, метиламинометила, метилкарбониламинометила, (диметиламино)метила, пиразолилметила, имидазолилметила, оксо, гидрокси, гидроксиметила, метила, трет-бутила, (трет-бутил)сульфиниламинометила, (этил)аминометила, пирролидинилсульфонилметила, трифторэтила, (2,2,2-трифторэтила), карбокси, циклопропилметила, диметиламинометила, циклопентилметила, метиламинометила, 1-(метиламино)этила, этиламинометила, диметиламинокарбонила, диметилкарбамоила, морфолинилкарбонила, циклопропила, аминоэтила, 1-аминоэтила, пирролидинила, метилэтила, изобутила, циклопропилметила, метилсульфанилметила, 3-гидрокси(диметилпропила), триазолилметила, 3-гидрокси-2,2-диметилпропила и метоксиэтила; где R1 необязательно замещен 1, 2, 3 или 4 заместителями R3.
3. Соединение по п.1 или его фармацевтически приемлемая соль, или стереоизомер, выбранное из:
2-{3-[(4-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-{[1-циклопропилэтил]амино}циклогексанкарбонитрила;
5-гидрокси-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-азетидин-1-ил-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-азетидин-1-ил-2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(диметиламино)циклогексанкарбонитрила;
2-{3-[(4-хлор-3-фторфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-{[1-циклопропилэтил]амино}циклогексанкарбонитрила;
5-азетидин-1-ил-2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(4-хлорфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}-5-(диметиламино)циклогексанкарбонитрила;
5-азетидин-1-ил-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-{[1-циклопропилэтил]амино}-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
5-(диметиламино)-2-(4-оксо-3-{[4-(трифторметокси)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамида;
(2-{3-[(2-фторпиридин-4-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклопентанкарбонитрила;
(2-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
2-[4-оксо-3-({4-[2,2,2-трифтор-1-гидроксиэтил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
2-(4-оксо-3-{[1-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
2-(4-оксо-3-{[4-(2,2,2-трифтор-1-гидроксиэтил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
2-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-N-(1-метил-1H-пиразол-3-ил)ацетамида;
N-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]-1,3-оксазол-5-карбоксамида;
N-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]пиримидин-2-карбоксамида;
2-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-N-(1-метил-1H-пиразол-3-ил)ацетамида;
трет-бутил[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]карбамата;
2-(3-{[3-(аминометил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(1-метилэтил)бензолсульфонамида;
N-бензил-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамида;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(циклопропилметил)бензолсульфонамида;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-(2-метоксиэтил)бензолсульфонамида;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-циклогексилбензолсульфонамида;
2-(3-{[4-(морфолин-4-илсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[4-оксо-3-(фениламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[3-(2H-1,2,3-триазол-2-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
N-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]-1,3-оксазол-5-карбоксамида;
N-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]пиримидин-2-карбоксамида;
2-(3-{[3-(1-гидроксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
трет-бутил[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензил]карбамата;
2-(3-{[4-(аминометил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-(аминометил)-4-фторфенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-(морфолин-4-илметил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
трет-бутил[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-фторбензил]карбамата;
трет-бутил[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-5-фторбензил]карбамата;
2-[3-({3-[(4-метил-1H-1,2,3-триазол-1-ил)метил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({3-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
N-{1-[3-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2,2,2-трифторэтил}-2-метилпропан-2-сульфинамида;
2-(4-оксо-3-{[3-(2,2,4-триметил-1,3-диоксолан-4-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{4-оксо-3-[(3-{[(2,2,2-трифторэтил)амино]метил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[3-(аминометил)-4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
N-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-(диметилсульфамоил)бензил]ацетамида;
2-[3-({3-[(диметиламино)метил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
4-{[1-(5-цианоспиро[2.5]окт-6-ил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил]амино}-N,N-диметилбензолсульфонамида;
2-(аминометил)-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N-диметилбензолсульфонамида;
2-(4-оксо-3-{[3-(1H-пиразол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[4-(пирролидин-1-илкарбонил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[4-(1H-1,2,3-триазол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-(1H-имидазол-1-илметил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
6-(3-{[4-(метилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)спиро[2.5]октан-5-карбонитрила;
2-(3-{[4-гидрокси-4-(гидроксиметил)-1,1-диоксидо-3,4-дигидро-2H-тиохромен-6-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-метил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(4-оксо-3-{[3-(1H-1,2,4-триазол-1-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[3-(1H-1,2,4-триазол-4-илметил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(4-{[4-(1-гидрокси-1-метилэтил)-1H-1,2,3-триазол-1-ил]метил}фенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
N-{1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2,2,2-трифторэтил}-2-метилпропан-2-сульфинамида;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-{4-оксо-3-[(4-{[(2,2,2-трифторэтил)амино]метил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(1,1-диоксидо-2,3-дигидро-1-бензотиофен-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(2-этил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
2-(4-оксо-3-{[2-(2,2,2-трифторэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(циклопропилметил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-метил-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-[3-({4-[1-(диметиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-{[2-(циклопентилметил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{4-оксо-3-[(4-{1-[(2,2,2-трифторэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N,N,2-триметилбензамида;
2-(3-{[3-метил-4-(морфолин-4-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-циклопропил-N,N-диметилбензамида;
2-(3-{[4-(2,2-дифтор-1-гидроксиэтил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[4-оксо-3-({4-[пирролидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-{4-оксо-3-[(4-{1-[(2,2,2-трифторэтил)амино]этил}фенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[2-(1-метилэтил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(2-метилпропил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-этил-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[2-(циклопропилметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({3-[(метилсульфанил)метил]-5-(1H-1,2,3-триазол-1-илметил)фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-{[2-(1-метилэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(2-гидроксиэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(3-гидрокси-1,1-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(3-гидрокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
2-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
N-трет-бутил-4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамида;
2-(3-{[4-(метилсульфонимидоил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклопентил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензонитрила;
2-[3-({4-[1-(этиламино)-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
2-(4-оксо-3-((4-(2,2,2-трифтор-1-(изопропиламино)этил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
этил-3-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноата;
изопропил-3-(4-((1-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4,4,4-трифтор-3-гидрокси-2,2-диметилбутаноата;
2-(3-((1-гидрокси-2,2-диметил-1-(трифторметил)-2,3-дигидро-1H-инден-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((1'-гидрокси-1'-(трифторметил)-1',3'-дигидроспиро[циклопропан-1,2'-инден]-5'-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-((4-(1,1,1-трифтор-2-метоксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((2,3-диметил-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((3-метил-1,1-диоксидо-2-(2,2,2-трифторэтил)-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((4-(4,4-дифторпиперидин-1-карбонил)-3-метилфенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((2-(2,5-диметилморфолино)хинолин-6-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
трет-бутил-4-(5-((1-2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-оксоизоиндолин-2-ил)циклогексанкарбоксилата;
2-[3-({4-[1-амино-2,2,2-трифторэтил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
N-трет-бутил-4-({1-2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)бензолсульфонамида;
2-[3-({4-[(1-метилэтил)сульфонил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
N-трет-бутил-4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамида;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамида;
2-[3-({4-[1-(2-метоксиэтил)-1H-пиразол-4-ил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-{[3-хлор-4-(1-метил-1H-пиразол-4-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({4-[1-метил-1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({2-[1,2-диметилпропил]-2,3-дигидро-1H-изоиндол-5-ил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]пропаноата;
трет-бутил-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]ацетата;
трет-бутил-2-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]-2-метилпропаноата;
2-(3-{[2-(1-метилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,1-диоксидо-1,2-бензоизотиазол-2(3H)-ил]-3-метилбутаноата;
2-[4-оксо-3-(1,2,3,4-тетрагидроизохинолин-6-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[4-оксо-3-(1,2,3,4-тетрагидроизохинолин-7-иламино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[4-оксо-3-({2-[(5-пиперидин-1-илпиразин-2-ил)карбонил]-2,3-дигидро-1H-изоиндол-5-ил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-((2-(3-метокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидробензо[d]изотиазол-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(2-метокси-1,1-диметилэтил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(3-метокси-1,1-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(циклопентилметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
трет-бутил-3-[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,3-дигидро-2H-изоиндол-2-ил]пропаноата;
трет-бутил[5-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-1,3-дигидро-2H-изоиндол-2-ил]ацетата;
трет-бутил-3-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-8-азабицикло[3.2.1]октан-8-карбоксилата;
2-(3-{[4-(трет-бутилсульфонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
2-{3-[(2,2-диметил-1,1-диоксидо-3-оксо-2,3-дигидро-1-бензотиофен-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[3-гидрокси-2,2-диметил-1,1-диоксидо-2,3-дигидро-1-бензотиофен-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-гидрокси-1,1-диоксидо-3H-спиро[1-бензотиофен-2,1'-циклогексан]-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-трет-бутил-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогептанкарбонитрила;
2-(3-{[1-метил-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[4-(1,3-оксазол-2-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[4-(1,3-тиазол-2-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[4-(1,2,4-оксадиазол-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(4-изоксазол-3-илфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(4-изоксазол-5-илфенил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[4-(1,2,4-оксадиазол-5-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[4-(1,3-оксазол-5-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[4-(3-гидроксиоксетан-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(2-метил-1,3-бензотиазол-6-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(4-оксо-3-((4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[4-(3-метилоксетан-3-ил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({4-[1-(2-цианоэтил)-1H-пиразол-4-ил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
этил-1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-2-метилфенил]-1H-пиразол-4-карбоксилата;
изопропил-6-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)хинолин-2-карбоксилата;
2-(4-оксо-3-{[4-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)фенил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({4-[1-(2-цианоэтил)-1H-пиразол-4-ил]-3-метилфенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[4-оксо-3-({4-[(1-трифторметил)циклопропил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-{3-[(2-трет-бутил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-[4-оксо-3-({4-[1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({4-[2-метил-1-(1H-1,2,3-триазол-1-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-{4-оксо-3-[(4-пиперидин-4-илфенил)амино]-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-{3-[(2-ацетил-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-{[1-(дифторметил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[3-({4-[1-метил-1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({4-[2-метил-1-(2H-1,2,3-триазол-2-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({3-метил-4-[1-метил-1-(2H-1,2,3-триазол-2-ил)этил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-{3-[(2-циклогексил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-[3-({3-метил-4-[2-метил-1-(2H-1,2,3-триазол-2-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-[3-({3-метил-4-[2-метил-1-(1H-1,2,3-триазол-1-ил)пропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
трет-бутил-4-(4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)фенил)-4-гидроксициклогексанкарбоксилата;
2-[4-оксо-3-({4-[1-(1H-1,2,3-триазол-1-ил)этил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
трет-бутил-4-(5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)циклогексанкарбоксилата;
2-(3-{[1,1-диоксидо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
2-(3-{[2-(3-метокси-2,2-диметилпропил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
N-трет-бутил-4-({1-[2-цианоциклогептил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)-N-метилбензолсульфонамида;
2-{3-[(2-циклопентил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогептанкарбонитрила;
2-(4-оксо-3-{[2-(пиперидин-1-илкарбонил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
2-(3-{[1,1-диоксидо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
2-[3-({4-[1-(4-трет-бутил-1H-1,2,3-триазол-1-ил)-2-метилпропил]фенил}амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
трет-бутил-1-{1-[4-({1-[2-цианоциклогексил]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил}амино)фенил]-2-метилпропил}-1H-1,2,3-триазол-4-карбоксилата;
2-(4-оксо-3-{[1-оксо-2-(тетрагидро-2H-пиран-4-ил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(4-оксо-3-{[1-оксо-2-(тетрагидро-2H-тиопиран-4-ил)-2,3-дигидро-1H-изоиндол-5-ил]амино}-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-[4-оксо-3-({4-[2-(трифторметил)пирролидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила;
2-(3-{[2-(4-метилтетрагидро-2H-пиран-4-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[2-(4-метилтетрагидро-2H-пиран-4-ил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-{[3-гидрокси-1,1-диоксидо-2',3',5',6'-тетрагидро-3H-спиро[1-бензотиофен-2,4'-пиран]-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((3-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогептанкарбонитрила;
4-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)бензойной кислоты;
4-(5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1,1-диоксидобензо[d]изотиазол-2(3H)-ил)циклогексанкарбоновой кислоты;
4-(4-(1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-иламино)фенил)-4-гидроксициклогексанкарбоновой кислоты;
трет-бутил-5-((1-(2-цианоциклогексил)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-3-ил)амино)-1-метилизоиндолин-2-карбоксилата;
2-(3-((2-изопропил-1-метилизоиндолин-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((4-(8-азабицикло[3.2.1]октан-3-ил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-(3-((1,1-диоксидо-3H-спиро[бензо[b]тиофен-2,1'-циклогексан]-5-ил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила;
2-{3-[(1,1-диоксидо-2',3',5',6'-тетрагидро-3H-спиро[1-бензотиофен-2,4'-пиран]-5-ил)амино]-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил}циклогексанкарбонитрила;
2-(3-((4-(трет-бутилсульфонил)фенил)амино)-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)-4,4-дифторциклопентанкарбонитрила;
4,4-дифтор-2-(3-{[3-метил-4-(пирролидин-1-илкарбонил)фенил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклопентанкарбонитрила;
2-[4-оксо-3-({4-2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогептанкарбонитрила;
2-[4-оксо-3-({4-2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклопентанкарбонитрила;
2-(3-{[2-(4,4-дифтор-1-метилциклогексил)-1,1-диоксидо-2,3-дигидро-1,2-бензизотиазол-5-ил]амино}-4-оксо-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил)циклогексанкарбонитрила; и
2-[4-оксо-3-({4-[2-(трифторметил)пиперидин-2-ил]фенил}амино)-4,5-дигидро-1H-пиразоло[4,3-c]пиридин-1-ил]циклогексанкарбонитрила.
4. Фармацевтическая композиция, обладающая способностью ингибировать активность Янус-киназ JAK1 и JAK2, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
5. Способ лечения JAK-опосредованного заболевания, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
6. Способ лечения состояния у млекопитающего, которое может быть ослаблено путем ингибирования Янус-киназ JAK1 и JAK2, где состояние выбирают из артрита, астмы и обструктивных заболеваний дыхательных путей, аутоиммунных заболеваний или расстройств и рака, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по
п.1 или его фармацевтически приемлемой соли или стереоизомера.
7. Способ по п.6, где указанное состояние представляет собой артрит.
8. Способ по п.7, где указанное состояние выбирают из ревматоидного артрита, ювенильного артрита и псориатического артрита.
9. Способ по п.6, где указанное состояние представляет собой астму или обструктивные заболевания дыхательных путей.
10. Способ по п.9, где указанное состояние выбирают из: хронической астмы, поздней астмы, гиперчувствительности дыхательных путей, бронхита, бронхиальной астмы, аллергической астмы, эндогенной бронхиальной астмы, экзогенной бронхиальной астмы, пылевой астмы, рецидивирующей обструкции дыхательных путей и хронической обструктивной болезни легких (ХОБЛ) и эмфиземы.
11. Способ по п.6, где указанное состояние представляет собой аутоиммунные заболевания или нарушения.
12. Способ лечения астмы у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
13. Способ лечения артрита у млекопитающего, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
14. Применение соединения по п.1 или его фармацевтически приемлемой соли или стереоизомера в производстве лекарственного средства для лечения заболевания или расстройства, ослабляемого ингибированием Янус-киназ JAK1 и JAK2.
| WO 2013017479 A1, 07.02.2012 | |||
| WO 2011003418 A1, 13.01.2011 | |||
| WO 2012127506 A1, 27.09.2012 | |||
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ЯНУС-КИНАЗЫ 3 | 2006 |
|
RU2434013C2 |
Авторы
Даты
2018-05-28—Публикация
2014-03-19—Подача