Изобретение относится к онкологии, а именно к экспериментальной онкологии, и может быть использовано для изучения опухолевых очагов в органах экспериментальных животных после трансплантации им митохондрий опухоли человека.
Рак толстой кишки является распространенной злокачественной опухолью желудочно-кишечного тракта, по частоте уступающей только раку желудка и пищевода, и связан с высоким уровнем смертности (см. Ladabaum U. et al., 2020). В настоящее время заболеваемость колоректальным раком (КРР) резко возросла, и он стал третьим по распространенности типом рака. Из-за неудовлетворенных стратегий скрининга и лечения, а также роста заболеваемости это заболевание также стало второй ведущей причиной смерти от рака в мире. В 2020 году на КРР приходилось 10% глобальной заболеваемости и 9,4% смертей от рака (см. Sung H. et al., 2021).
Ежегодно от КРР умирает около 900 000 человек во всем мире, что составляет около 10% от общего числа смертей, связанных с раком (см. Dekker E. et al., 2019). На основе прогнозов роста населения, старения и человеческого развития ожидается, что к 2040 году во всем мире будет зарегистрировано около 3,2 миллиона новых случаев КРР. Рост заболеваемости КРР в первую очередь объясняется повышенным воздействием факторов риска окружающей среды, вызванных изменением образа жизни и диеты в сторону вестернизации (см. Siegel R.L. et al., 2020).
По имеющимся сведениям, вероятность возникновения КРР может быть связана с широким спектром факторов, таких как воспалительные заболевания кишечника, язвенный колит и синдром Крона (см. Canavan C. et al., 2006), семейный анамнез (см. Valle L. et al., 2019) и образ жизни – нездоровая диета, злоупотребление спиртными напитками, гиподинамия и курение (см. Keum N, Giovannucci E., 2019; см. Sung H. et al., 2021).
Учитывая физиологию и анатомию толстой кишки, рак толстой кишки можно разделить на левосторонние карциномы толстой кишки – LCC и правосторонние карциномы толстой кишки – RCC (см. Gervaz P. et al., 2004). Клиническая гетерогенность LCC и RCC также была изучена более конкретно, например, метастазирование, рецидив, прогноз и чувствительность лечения (см. Wu C., 2018; см. Grass F. et al., 2019; см. Blakely A.M. et al., 2020). Эти исследования указывали, что локализация первичной опухоли является независимым прогностическим фактором при КРР, и она используется в качестве основы для разработки стратегий лечения.
Следует отметить, что LCC и RCC несовместимы по многим аспектам, например, эмбриональному происхождению, анатомическому кровоснабжению и клиническим проявлениям. Это может вызвать разницу в ответе на лечение, а прогнозом являются молекулярно-биологические характеристики (см. Guo J.N. et al., 2021). Однако стратификация по опухолевым клеткам, молекулярным путям, мутационному статусу и экспрессии опухолевых генов демонстрирует лишь умеренную прогностическую точность и ограниченную клиническую полезность (см. Guinney J. et al., 2015).
Правосторонние опухоли RCC обычно являются микросателлитными нестабильными опухолями, тогда как опухоли LCC являются хромосомными нестабильными опухолями. Опухоли RCC и LCC имеют разные гистологические и молекулярные характеристики. Опухоли LCC легче обнаружить в виде небольших аденом на ранней стадии при колоноскопическом скрининге. Опухоли правостороннего КРР по-прежнему обнаруживаются на ранней стадии, но с ними гораздо сложнее, чем с опухолями LCC, из-за их сложной морфологии (см. Nitsche U. et al., 2016; см. Baran, B. et al., 2018).
Пациенты с RCC чаще бывают пожилого возраста и женского пола и имеют более позднюю стадию опухоли, больший размер опухоли и более плохо дифференцированные опухолевые клетки, чем пациенты с LCC (см. Lee J.M. et al., 2019). Считается, что различия в характеристиках RCC и LCC вызваны различиями в эмбриологическом происхождении, фекальном воздействии и времени обнаружения. Большинство предыдущих исследований показали, что LCC был связан с более высоким рецидивом и более низкой выживаемостью, чем RCC (см. Bustamante-Lopez L.A. et al., 2019), в нескольких исследованиях был сделан вывод, что LCC на ранней стадии имел лучший прогноз, чем RCC (см. Warschkow R. et al., 2016; см. Yang J. et al., 2016).
Показано, что гетерогенность LCC и RCC поможет понять идентификация подтипов ферроптоза. Ключевой ген ALOX5, идентифицированный с помощью систему фероптоза, также показал хорошие прогностические способности. Это исследование предоставило новый инструмент для идентификации иммунофенотипов ферроптоза, прогнозирования прогноза и обеспечения индивидуальной иммунотерапии при LCC и RCC (см. Zhang H. C. et al., 2022).
Пол может быть первой характеристикой пациента, которую следует учитывать при обсуждении различий в опухолях между подгруппами пациентов. Гендерные различия в поведении опухоли существуют у больных раком толстой кишки, но точные механизмы неизвестны (см. Majek O. et al., 2013).
Высокий уровень смертности от рака толстой кишки в основном обусловлен отдаленными метастазами, а степень дифференцировки КРР и гистопатологический тип – все это факторы, влияющие на прогноз пациентов (см. Gupta P. et al., 2019; см. Recio-Boiles A., Cagir B., 2022). Учитывая недавние достижения в области скрининга, диагностики и лечения рака толстой кишки, долгосрочный прогноз больных раком толстой кишки остается плохим (см. LiuY. et al., 2022).
Несмотря на то, что современные исследования смогли прояснить патогенез КРР и обеспечить эффективные стратегии скрининга, его распространенность все еще растет. Лучшее понимание возникновения, прогрессирования и метастазирования КРР может помочь в разработке молекулярных маркеров для раннего выявления и методов стратификации риска для улучшения клинической помощи пациентам с КРР. LiuY. et al. (2022) подробно сравнили отдаленные формы метастазирования у мужчин и женщин больных КРР, используя базу данных SEER, чтобы понять различия в выживаемости между пациентами с различными формами метастазирования.
Метастазы в одном месте возникли более чем у трех четвертей от общего числа пациентов. В целом, печень и головной мозг были наиболее распространенными и наименее распространенными местами одиночных метастазов у пациентов с КРР, соответственно, что согласовывалось с предыдущими сообщениями (см. Wang J. et al., 2020). Из-за гематоэнцефалического барьера у меньшего числа пациентов были только метастазы в мозг (0,33% против 0,53%), но в сочетании с метастазами из других мест метастазы в мозг превышали 1% у обоих полов. Аналогичным образом, когда метастазы в легкие сочетались с метастазами в печень, число пациентов было намного выше, чем у пациентов только с метастазами в легкие. Авторы считают, что как только опухоль развивает отдаленные метастазы в одном органе, она может ускорить метастазирование в другие органы; хотя метастазирование в мозг само по себе является редкостью, когда оно имеет метастазы в других органах. Интересно, что у мужчин было больше шансов иметь единичные метастазы в легких, чем у женщин.
Наиболее распространенным местом отдаленного метастазирования у пациентов с КРР является печень. LiuY. et al. (2022) обнаружили различия в прогнозе в зависимости от пола, и выживаемость пациентов с единичными метастазами в печени, которая у мужчин была значительно ниже, чем у женщин. После метастазирования опухоли выживаемость пациентов снижалась, и снижалась еще больше с увеличением метастатических участков. Такие результаты были получены при других опухолях (см. Wang J. et al., 2020). Печень и легкие являются двумя наиболее распространенными местами одиночных метастазов у женщин (см. Riihimäki M. et al., 2014).
Значительные доказательства подтверждают так называемую гипотезу «общей почвы» в патогенезе как сердечно-сосудистых заболеваний (ССЗ), так и различных видов рака, особенно, гормонозависимого и желудочно-кишечного. Это означает, что эти два состояния имеют общие патофизиологические механизмы и профили факторов риска (см. Donati M.B., 2010; см. Kenzik K.M. et al., 2018; см. Brown J.C. et al., 2019; см. Keramida K. et al., 2019; см. Marchetti M. et al., 2020). В этом контексте несколько компонентов системы гемостаза были предложены в качестве потенциальных биомаркеров для обеих патологий (см. Vilar R. et al., 2020).
Рак толстой кишки и рак прямой кишки обычно рассматривают как единую опухоль, называемую колоректальным раком. Тем не менее, за последние десятилетия были накоплены доказательства того, что это разные заболевания в отношении их топографии, хирургической сложности, осложнений, характера метастазирования и терапевтического подхода (см. Kornmann M. et al., 2013; см. Paschke S. et al., 2018). Также с точки зрения эпидемиологии они имеют различную заболеваемость и различное распределение по полу. Имеют ли эти два подтипа рака разные предсказательные и прогностические биомаркеры, на сегодняшний день еще не исследовано (см. Paschke S. et al., 2018).
Митохондрии представляют собой уникальные органеллы, которые несут внеядерный генетический материал, и они связаны с различными метаболическими заболеваниями, дегенеративными заболеваниями, возрастными заболеваниями человека и раком (см. Burke P.J., 2017). Доказано, что митохондрии играют значительную роль в канцерогенезе и прогрессировании КРР посредством ретроградной регуляции ядра (см. Vyas S. et al., 2016).
Кроме того, активные формы кислорода (АФК), продуцируемые в митохондриях, могут способствовать пролиферации и миграции опухолевых клеток (см. Han Y. et al., 2019). Соответственно, исследования митохондрий широко признаны в самых разных областях. Совсем недавно было продемонстрировано, что митохондрии из неопухолевых клеточных линий ингибируют образование опухоли в том же ядерном контексте, включая ингибирование апоптоза, пролиферации, бескислородной выживаемости, лекарственной устойчивости, образования колоний и инвазии, а также усиление ответа опухолевых клеток на терапию (см. Kaipparettu B.A. et al., 2019). Кроме того, двунаправленная связь между митохондриями и ядром облегчает ретроградную регуляцию ядра (см. Cardamone M.D. et al., 2018). Во время образования опухолевых клеток метаболизм перепрограммируется, чтобы способствовать быстрой пролиферации.
Появляются новые данные, свидетельствующие о том, что динамическая природа митохондрий способствует их выходу за пределы границ клеток, позволяя осуществлять их перемещение между клетками млекопитающих, радикально оспаривая ранее известные концепции внутриклеточной сегрегации митохондрий и наследования митохондриальной ДНК – мтДНК (см. Valenti D. et al., 2021). Их сигнальная роль может распространяться на межклеточную коммуникацию, показывая, что митохондриальный геном и даже целые митохондрии действительно мобильны и могут опосредовать передачу информации между клетками. Эта задача переноса подвижности митохондрий и мтДНК недавно была названа «момиома», чтобы указать на все «подвижные функции митохондрий и митохондриального генома» (см. Singh B. et al., 2017).
Митохондриальный межклеточный перенос способствует интеграции митохондрий в эндогенную митохондриальную сеть клеток-реципиентов, способствуя изменениям их биоэнергетического статуса и других функциональных навыков клеток-реципиентов не только in vitro, но и in vivo (см. Sinha P. et al., 2016). Кроме того, горизонтальный перенос митохондриальных генов может привести к серьезным последствиям в патофизиологии митохондриальной дисфункции (см. Shanmughapriya S. et al., 2020).
Хотя физиологическая значимость этого явления все еще остается предметом дискуссий, несколько научных исследований in vitro и in vivo показали, как перенос митохондрий между клетками способен восстанавливать митохондриальные дыхательные дефекты в клетках-реципиентах, восстанавливая и регулируя передачу сигналов, пролиферацию или устойчивость к химиотерапии, а также действуя как средство восстановления тканей (см. Liu D. et al., 2021).
Техническим результатом настоящего изобретения является создание способа получения опухолевых очагов колоректального рака в организме мышей Balb/c Nude путем трансплантации митохондрий, изолированных из аденокарциномы ободочной кишки человека.
Поставленная цель достигается тем, что самцам мышей линии Balb/c Nude однократно внутрибрюшинно вводят митохондрии, изолированные из аденокарциномы восходящего отдела ободочной кишки человека из расчета 3 мг белка на 1 животное в 0,4 мл физиологического раствора и на 36 сутки проводят регистрацию морфологически подтвержденного опухолевого роста в органах экспериментальных животных.
Изобретение «Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных» является новым, так как оно неизвестно в области экспериментальных исследований в онкологии о свойствах митохондрий, изолированных из аденокарциномы ободочной кишки человека, вызывать при парентеральном введении развитии опухолевых очагов в организме животных.
Новизна изобретения заключается в использовании митохондрий, изолированных из аденокарциномы ободочной кишки человека, для воспроизведения в организме мышей линии Balb/c Nude вновь образованных опухолевых очагов колоректального рака. Проведение экспериментальной митохондриальной трансплантации приводило к росту в организме животных очагов роста злокачественной опухоли, доказанных при морфологическом исследовании.
Изобретение «Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных» является промышленно применимым, так как может быть использовано в научно-исследовательских учреждениях онкологического профиля для воспроизведения экспериментальной трансплантации митохондрий, изолированных из опухоли, изучения новых свойств митохондрий клеток колоректального рака человека вызывать при парентеральном введении в организме животных рост и развитие опухолевых очагов.
Для лучшего понимания способа приводим фигуры.
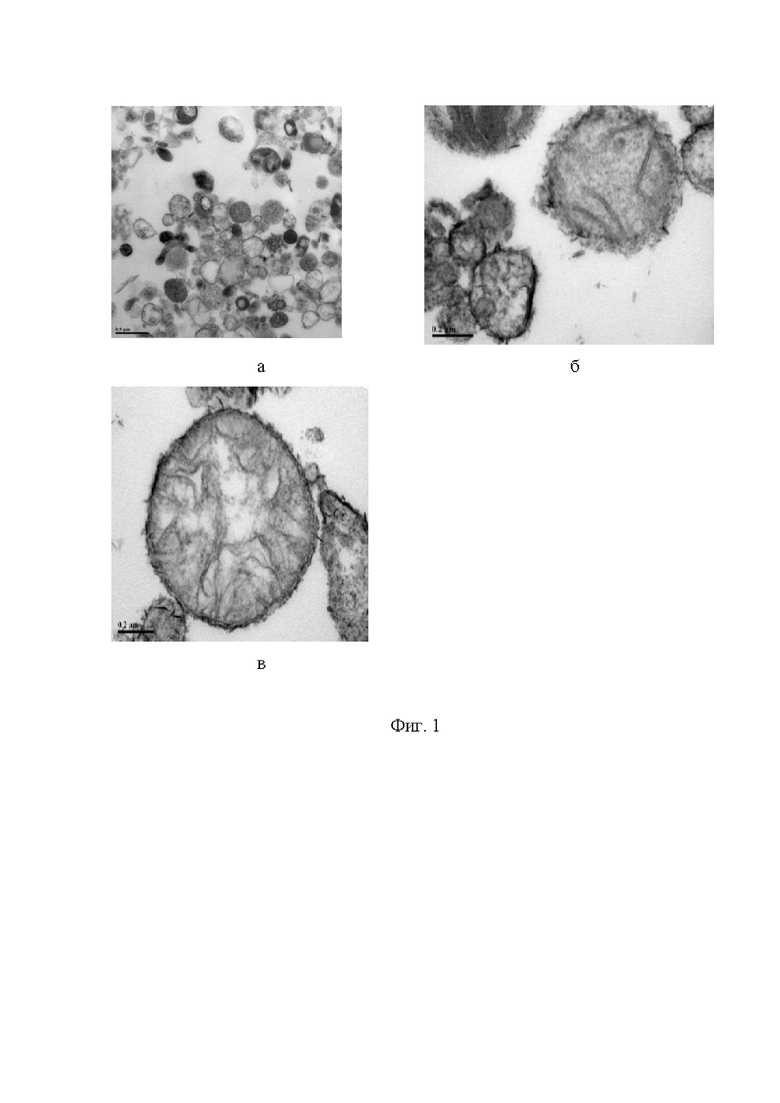
Фигура 1. Электронная микрофотография препарата митохондрий аденокарциномы.
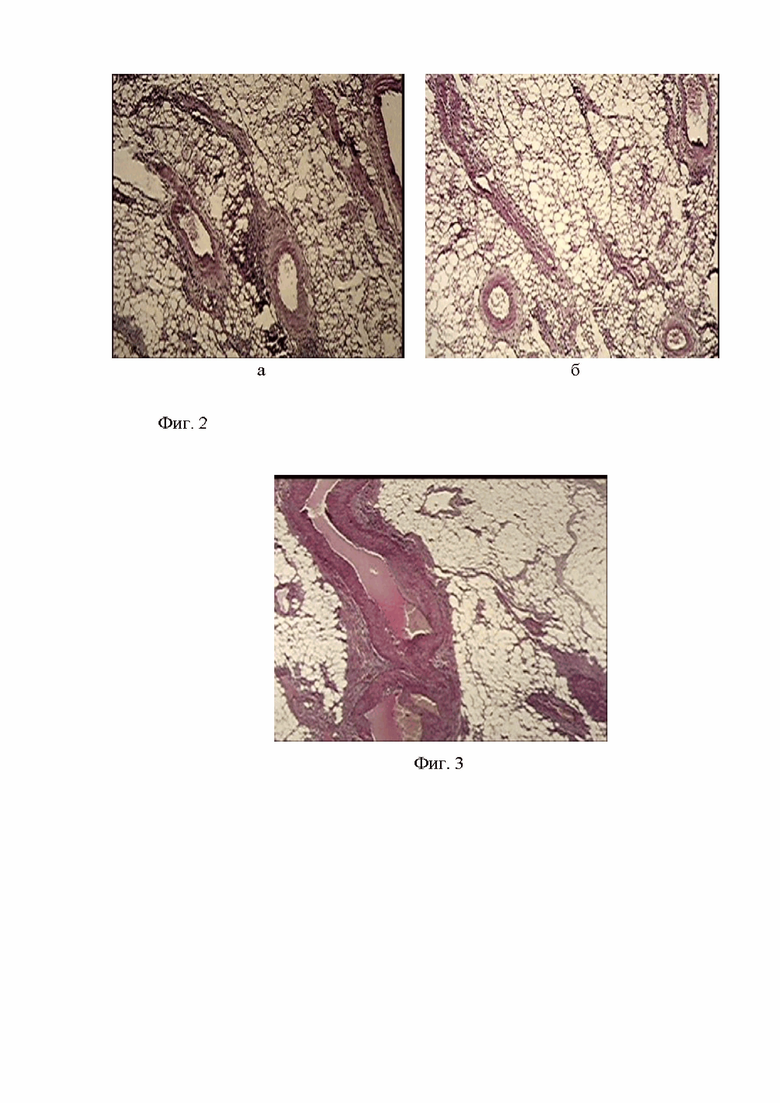
Фигура 2. Фрагменты брыжейки мыши Balb/c Nude с трансплантацией митохондрий, выделенных из клеток аденокарциномы восходящего отдела ободочной кишки человека. Окр.гем.-эоз., ув.х10.
Фигура 3. Фрагмент брыжейки больного П. с аденокарциномой восходящего отдела ободочной кишки. В жировой клетчатке расширенные полнокровные кровеносные сосуды. Окр. гем.-эоз., ув.об.х10.
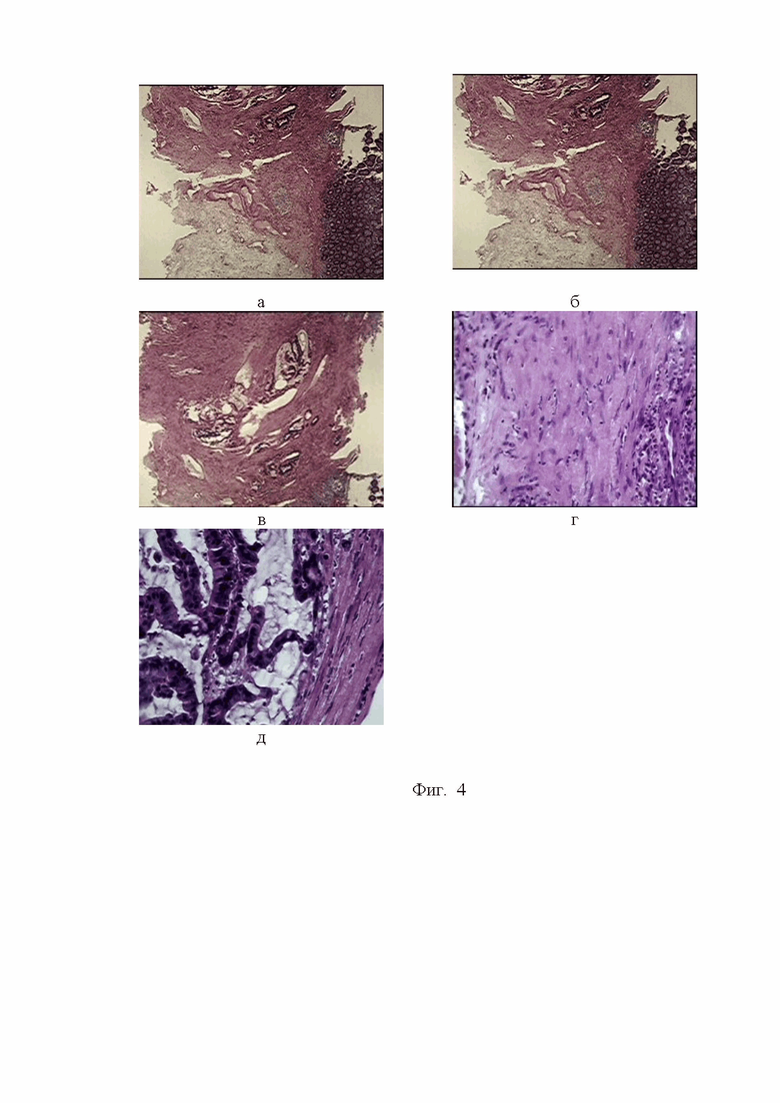
Фигура 4. Микроструктурные изменения в стенке толстого кишечника у пациента с высокодифференцированной аденокарциномой. Окр. гем.-эоз. Ув.об.х10,х40,х100.
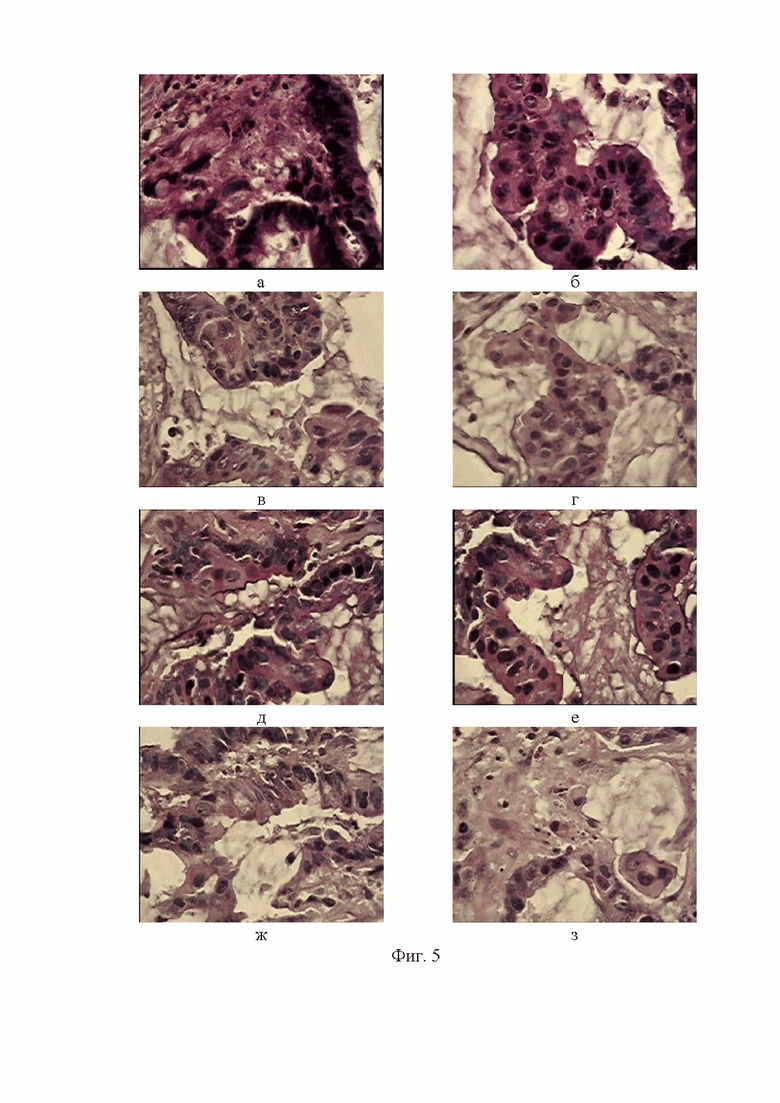
Фигура 5.Фрагменты опухолевой инвазии у пациента П. Окр.гем.-эоз.Ув.об.х100.
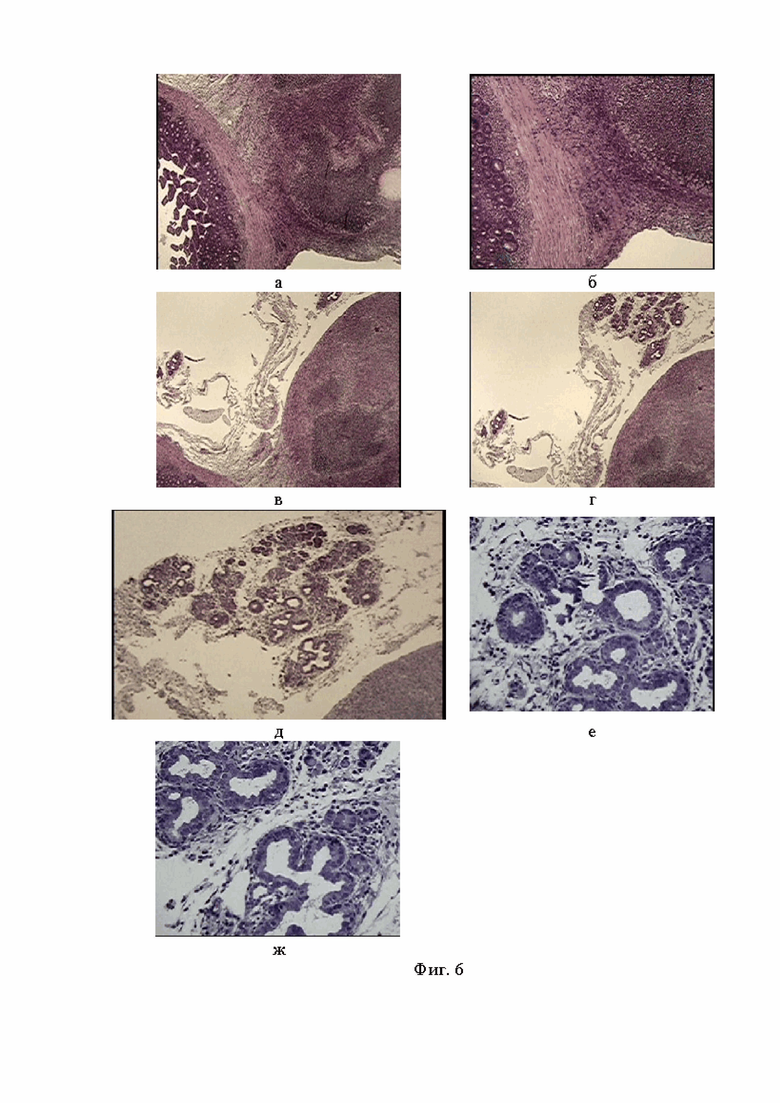
Фигура 6. Фрагменты жировой клетчатки мыши Balb/c Nude , исходящей из локуса прямого соприкосновения и спаивания кишечника и печени, включающей атипичные структуры по виду напоминающие интраэпителиальную неоплазию опухоли кишки. Окр. гем.-эоз.Ув. об. х5, х10, х 40.
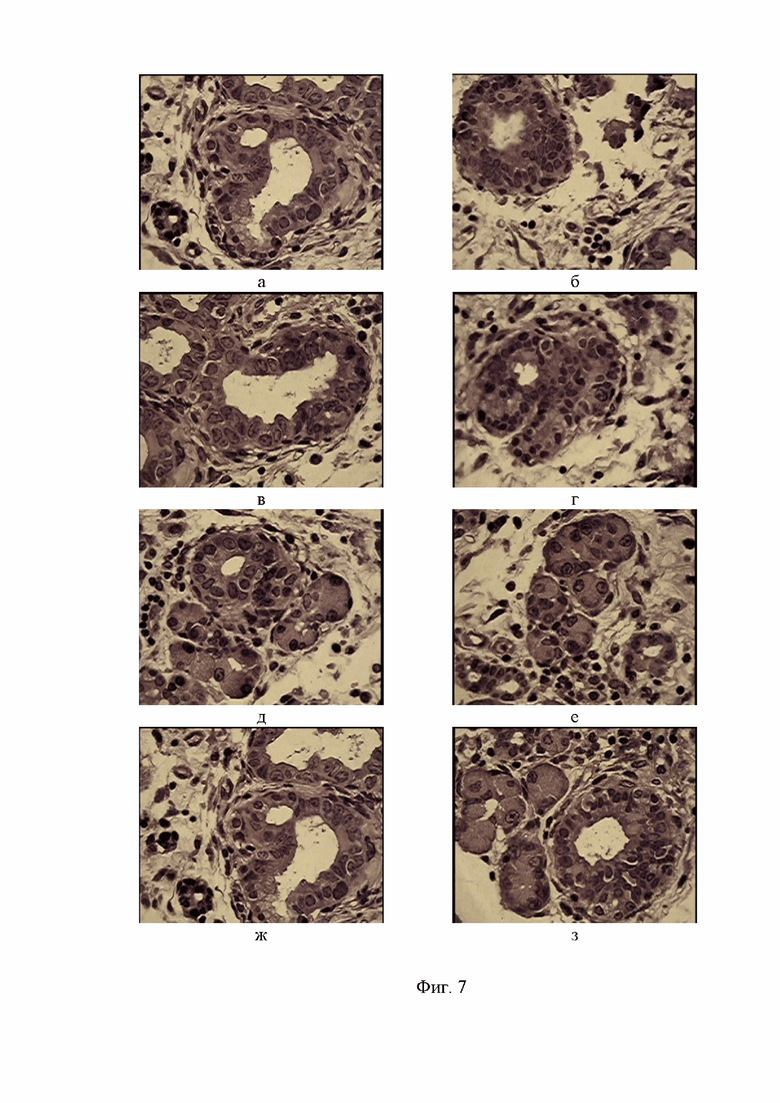
Фигура 7. Фрагменты жировой клетчатки мыши Balb/c Nude с участками интраэпителиальной неоплазии опухоли кишки по железисто- сосочковому типу. Окр. гем.-эоз.Ув. об. х100.
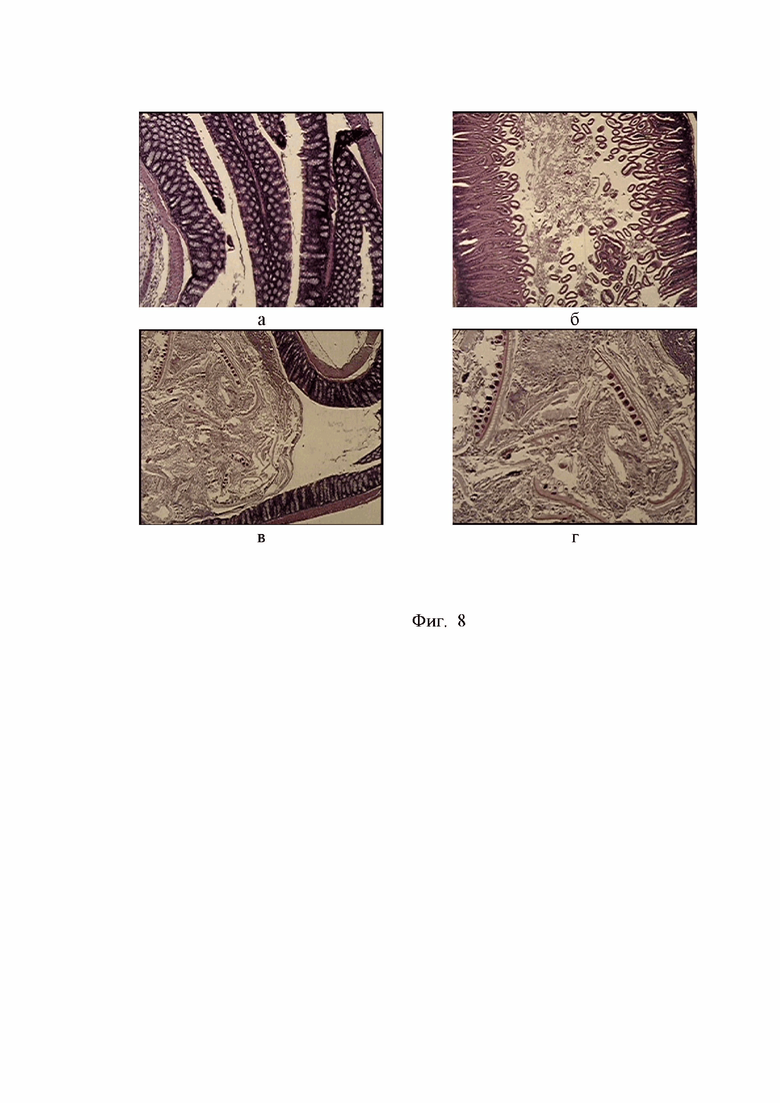
Фигура 8. Фрагменты тонкого кишечника мыши Balb/c Nude через 36 суток после трансплантации митоходрий высокодифференцированной аденокарциномы восходящего отдела ободочной кишки пациента П.: а, б – участки кишки без патологических включений; в, г – крупный конгломерат патологических субстанций, включая обрывки эпителия, некротические и фибринозные массы. Окр. гем.-эоз., ув.об.х40.
Фигура 9. Фрагменты печени мыши Nude через 6 суток после трансплантации митоходрий высокодифференцированной аденокарциномы восходящего отдела ободочной кишки пациента П.
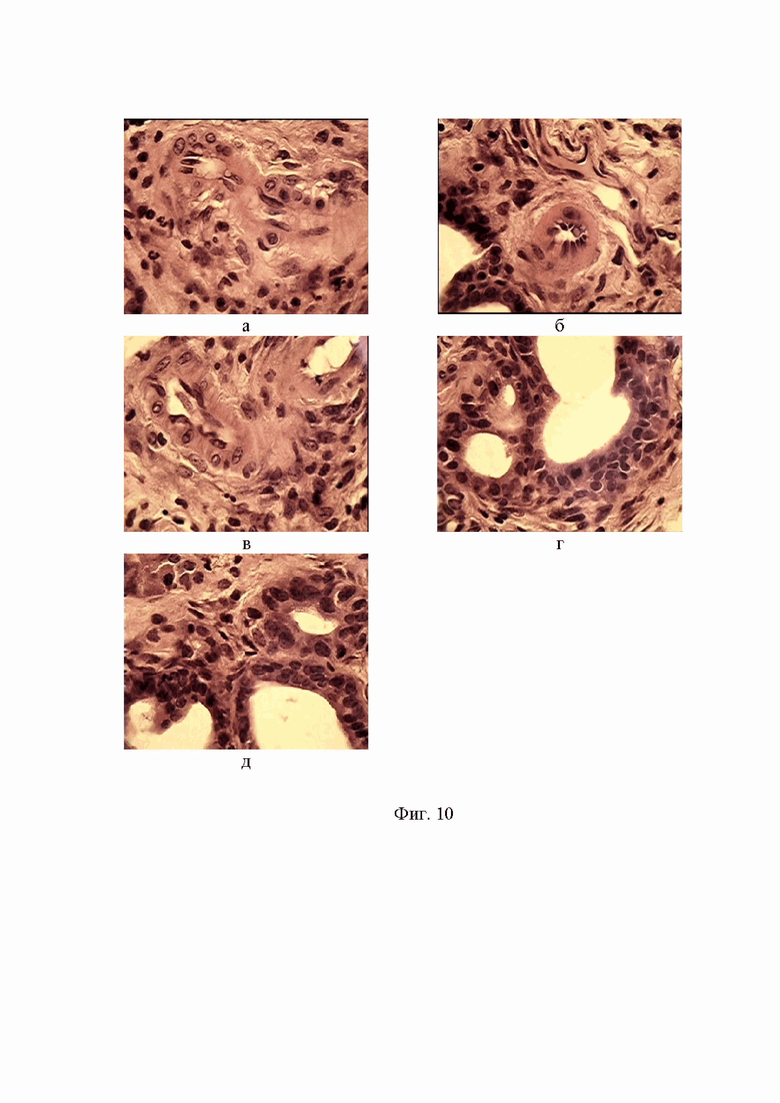
Фигура 10. Фрагменты узлового образования печени мыши Nude с участками канцероматоза, демонстрирующего интраэпителиальную неоплазию кишки с характерными элементами сосочковой и железистоподобной структуры, многорядностью эпителия, наслоением ядер клеток неправильной округлой формы. Окр. гем.-эоз.Ув.об.х100.
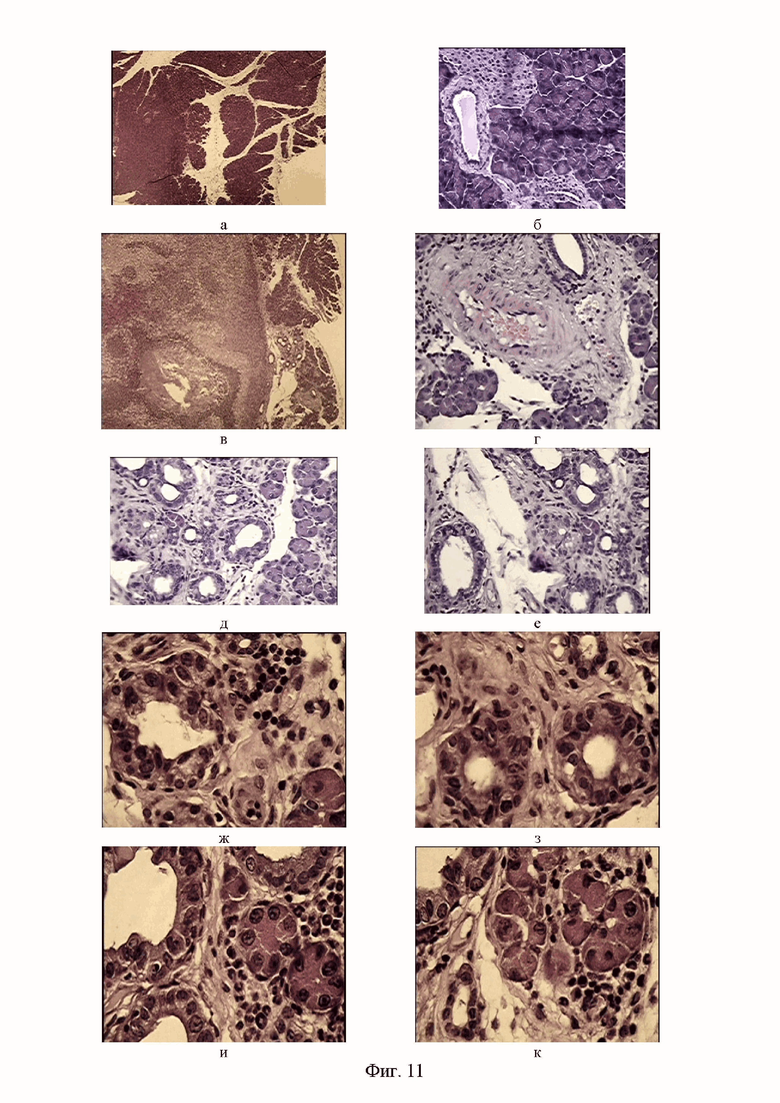
Фигура 11. Участки жировой клетчатки мыши Nude, интимно спаянной со структурой поджелудочной железы, включающие структуры, сходными с атипичным эпителием при аденокарциноме толстой кишки, расположенными в сосочкоподобные комплексы. Окр. гем-эоз. Ув.об.х10, х40, х100.
Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных выполняется следующим образом.
Во время операции – лапоратомии производят удаление у больного злокачественной опухоли. Часть опухоли быстро помещают в стерильный холодный раствор, содержащий 0,22 М маннитол, 0,3 М сахароза, 1мМ ЭДТА, 2 мМ TRIS-HCL, 10мМ HEPES, pH 7,4.
Митохондрии выделяют с применением дифференциального центрифугирования на высокоскоростной рефрижераторной центрифуге Avanti J-E, BECMAN COULTER, USA по методу Егоровой М.В. и Афанасьева С.А. (см. Егорова М.В., Афанасьев С.А., 2011; см. Гуреев А.П., Кокина А.В., 2015).
Для разрушения межклеточных связей, клеточной стенки и плазматических мембран применяют механическую обработку тканей с измельчением ножницами и гомогенизацией в стеклянном гомогенизаторе с тефлоновым пестиком (гомогенизатор Поттера-Эльвегейма). На каждый грамм ткани добавляют по 10 мл стерильной среды выделения (0,22 М маннитол, 0,3 М сахароза, 1мМ ЭДТА, 2 мМ TRIS-HCL, 10мМ HEPES, pH 7,4). Ткани гомогенизируют и центрифугируют первый раз 10 мин при скорости 1000 g, температура 0-2°С, второе и третье центрифугирование осуществляется при 20000 g, 20 мин, температура 0-2 °С. Между центрифугированием проводят процедуру ресуспендирования осадка митохондрий в среде выделения. Митохондрии дополнительно очищают от лизосом, пероксисом, меланосом и т.п., центрифугируя в 23% градиенте Перколла. Суспензию субклеточных структур наслаивают на градиент Перколла, центрифугируют 15 мин при 21000 g, после этого наблюдается разделение на 3 фазы, оставляют нижний слой митохондрий и ресуспендируют средой выделения. Следующую промывку митохондрий осуществляют путем центрифугирования в течение 10 мин при 15000 g, температура 0-2 °С. Митохондриальные образцы разводят 0,9% раствором NaCl до концентрация белка 3 мг белка в 0,4 мл физиологического раствора.
Мышам линии Balb/c Nude внутрибрюшинно одноразово трансплантируют свежеизолированные митохондрии аденокарциномы человека из расчета 3 мг белка на 1 животное в 0,4 мл физиологического раствора.
Всех животных умерщвляли путем декапитации на гильотине на 36 сутки после парентеральной трансплантации митохондрий, изолированных из аденокарциномы ободочной кишки человека, когда у животных появлялись следующие симптомы: потеря массы тела ≥25%, вялость, отказ от еды.
Приводим пример применения способа. Характеристика больного. Больной П. 1945 г.р. Поступил в ФГБУ «НМИЦ онкологии» МЗ России 07.11.2022 г. с жалобами на периодические боли в животе.
Из анамнеза. Эпидемиологический анамнез не отягощен. Сопутствующая патология «цирроз печени», вирусный гепатит С – положительный (выявлен около 20 лет назад). Самостоятельно обратился в ФГБУ «НМИЦ онкологии» Минздрава России для дообследования и хирургического лечения после выявления злокачественного новообразования ободочной кишки по месту жительства. Выполнена видеоколоноскопия 17.10.2022 г.: в восходящей кишке определяется экзофитное бугристое образование около 4,0 см в диаметре, занимающее 1/3 окружности кишки и суживающее просвет кишки на 1/3. Поверхность его эрозирована, с налетом фибрина. Ультразвуковое исследование органов брюшной полости 21.07.2021 г.: выраженные диффузно-очаговые образования обеих долей печени. Диффузные изменения в поджелудочной железе. Гепатоспленомегалия, перегиб, уплотнение стенки желчного пузыря. КТ органов грудной полости 07.11.2022 г.: патологических изменений в органах грудной клетки не выявлено. МРТ брюшной полости и забрюшинного пространства 07.11.2022 г.: МРТ-картина утолщения, нарушения слоев, опухолевая инфильтрация стенок восходящей ободочной кишки, параколитической клетчатки. Цирротические изменения печени с очагами дисплазии и гиперрегенерации, признаки портальной гипертензии, гепатоспленомегалии. Многоузловое опухолевое, вероятнее гепатоцеллюлярное, менее вероятно вторичное поражение печени, не менее 6 очагов. Кисты почек.
Диагноз: С18.2 рак восходящего отдела ободочной кишки с T2N0M0, стадия I, клиническая группа 2.
Сопутствующая патология: С61 рак предстательной железы Т2N0M0 G2, Gleason 6 (3+3), состояние после гормонотерапии, сочетанной лучевой терапии (брахитерапии от 07.09.2017, курса конформной лучевой терапии СОД на ПО 40изоГр и лимфатический коллектор 46изоГр), кл.р.2. В18.2 хронический вирусный гепатит С. К74.6 цирроз печени HCV-ассоциированный, класс В по Чайлд-Пью. Е11.8 сахарный диабет 2 типа. 125 ИБС. 142 МКД. НРС по типу СВЭС. 150 ХСН 1. ФК 2. I11 ГБ3. Ст АГ1, группа риска ОССН 4.
Гистологическое исследование от 21.10.2022 г.: в биоптатах очаги высокодифференцированной (low-grade/G1) аденокарциномы с воспалением, изъязвлением на фоне тубулярно-ворсинчатой аденомы с интраэпителиальной неоплазией высокой степени high-grade/ тяжелая дисплазия эпителия, код мкб по результатам исследования: С18.2 восходящей ободочной кишки.
Получение митохондрий из опухолевого материала. После удаления опухоли, часть материала сразу помещали в холодную стерильную среду выделения - 0,22 М маннитол, 0,3 М сахароза, 1мМ ЭДТА, 2 мМ TRIS-HCL, 10мМ HEPES, pH 7,4.
Митохондрии выделяют с применением дифференциального центрифугирования на высокоскоростной рефрижераторной центрифуге Avanti J-E, BECMAN COULTER, USA по методу Егоровой М.В. и Афанасьева С.А. (см. Егорова М.В., Афанасьев С.А., 2011;см. Гуреев А.П., Кокина А.В., 2015). Для разрушения межклеточных связей, клеточной стенки и плазматических мембран применяют механическую обработку тканей с измельчением ножницами и гомогенизацией в стеклянном гомогенизаторе с тефлоновым пестиком (гомогенизатор Поттера-Эльвегейма). На каждый грамм ткани добавляют по 10 мл стерильной среды выделения (0,22 М маннитол, 0,3 М сахароза, 1мМ ЭДТА, 2 мМ TRIS-HCL, 10мМ HEPES, pH 7,4). Ткани гомогенизируют и центрифугируют первый раз 10 мин при скорости 1000 g, температура 0-2 °С, второе и третье центрифугирование осуществляется при 20000 g, 20 мин, температура 0-2 °С. Между центрифугированием проводят процедуру ресуспендирования осадка митохондрий в среде выделения. Митохондрии дополнительно очищают от лизосом, пероксисом, меланосом и т.п., центрифугируя в 23% градиенте Перколла. Суспензию субклеточных структур наслаивают на градиент Перколла, центрифугируют 15 мин при 21000 g, после этого наблюдается разделение на 3 фазы, оставляют нижний слой митохондрий и ресуспендируют средой выделения. Следующую промывку митохондрий осуществляют путем центрифугирования в течение 10 мин при 15000 g, температура 0-2 °С. Митохондриальные образцы разводили 0,9% раствором NaCl до концентрация белка 3 мг белка в 0,4 мл физиологического раствора.
Визуальное подтверждение наличия митохондрий аденокарциномы ободочной кишки, полученных методом дифференциального центрифугирования, производили при помощи просвечивающей электронной микроскопии по методу M. A. Afanasyeva et al. (см. M. A. Afanasyeva, A. S. Ustiugova, 2018) срезы исследовали и фотографировали с помощью электронного микроскопа Jeol Jem-1011, Япония. Результаты электронно-микроскопической визуализации митохондрий представлены на фигуре 1 (а,б,в).
Характеристика животных-реципиентов.
Мышам линии Balb/c Nude (n=6) внутрибрюшинно одноразово вводят свежеизолированные митохондрии злокачественной опухоли человека из расчета 3 мг белка на 1 животное в 0,4 мл физиологического раствора.
Контролем служат мыши-самцы линии Balb/c Nude, которым одноразово внутрибрюшинно соответственно вводят 0,4 мл физиологического раствора.
Всех животных умерщвляли путем декапитации на гильотине на 36 сутки после парентеральной трансплантации митохондрий, изолированных из аденокарциномы человека, когда у животных появлялись следующие симптомы: потеря массы тела ≥25%, вялость, отказ от еды.
Морфологическое исследование.
При вскрытии экспериментальных животных – тотальный тромбоз, распад легких, печени, гнойно-воспалительная реакция, множественные узловые образования на кишечнике и брыжейке. Сравнительное экспериментально-клиническое морфологическое исследование свидетельствовало об однотипных с пациентом изменениях брыжейки (см. фиг. 2 а,б; фиг. 3), связанных с развитием густой сети расширенных кровеносных сосудов, заполненных форменными элементами крови, кровоизлиянием, тромбированием. Кровеносное наполнение брыжейки отражало активную динамику комплексных патологических процессов онкологической и неонкологической направленности, переноса метаболитов, продуктов распада и факторов, детерминирующих пролиферацию или гибель клеточных систем.
На фоне очагов некроза, кровоизлияния и воспаления (см. фиг 4 а,б) в подслизистой мышечной оболочке больного П. наблюдается интраэпителиальная дисплазия высокой степени тяжести (см. фиг. 4 в, г, д), периваскулярная и периневральная инвазия с лимфоидной инфильтрацией по периферии опухоли, гиперплазия крипт, хроническое воспаление.
Как видно из фиг. 5 элементы дифференцированной аденокарциномы располагаются железисто- и сосочкоподобными группами и комплексами, а также разрозненно. Атипический эпителий имеет различную форму - как близкую к кубической, так и призматическую, нередко с закругленными краями. Ядра с грубой структурой хроматина неправильной овоидной или веретеновидной формы, последние могут наслаиваться друг на друга, что можно заметить на рисунке 5ж. Границы между клетками нечеткие, а цитоплазма не развита. Во многих полях зрения можно обнаружить железы, выстланные несколькими слоями клеток и эта многослойность демонстрирует высокую пролиферативную активность клеток аденокарциномы толстой кишки.
При сравнении клинических препаратов дифференцированной аденокарциномы с экспериментальными образцами, полученными при внутрибрюшинной трансплантации взвеси митохондрий, можно найти сходные черты. Прежде всего, это множественные некротические и воспалительные крупные узловые образования печени, тесно спаянные с кишечником в единый патологический конгломерат (см. фиг. 6 а, б).
Согласно проведенному сравнительному гистоанализу в прилежащей к конгломерату жировой клетчатке мыши Balb/c Nude четко фиксируются патологические структуры, напоминающие железистые – и сосочкоподобные элементы, диагносцированные у пациента как дифференцированная аденокарцинома (см. фиг. 6 в - ж). Следует отметить, что при малом увеличении микроскопа (х5,х10) канцеролитические преобразования эпителия толстого кишечника на препаратах у пациента характеризуются прорастанием подслизистой мышечной оболочки с тяжелой степенью интраэпителиальной дисплазии в форме, напоминающей ветвление, тогда как на препаратах мыши в процессе канцерогенеза доминируют округлые железистоподобные и сосочковые структуры. Это не принципиальное отличие, поскольку при большем увеличении (х100) просматриваются значительные черты сходства (см. фиг. 7 а - з). Обращает внимание многорядность эпителия с периваскулярной инвазией, встречающиеся фигуры патологического митоза, лимфоцитарная инфильтрация по периферии опухолевых конгломераций. На многих полях зрения просматривается именно сосочкоподобные железистые элементы, которые, в значительной степени сходны с морфологическими признаками высокодифференцированной формы рака толстой кишки.
Это был первый морфологически зафиксированный локус формирования интраэпителиальной неоплазии кишки у мышей Balb/c Nude после введения митохондрий высокодифференцированной аденокарциномы ободочной кишки человека.
Необходимо пояснить, что при постановке основного диагноза пациенту П. отмечалось, что в готовых гистологических препаратах регистрировались очаги высокодифференцированной аденокарциномы с воспалением и изъязвлением. Подчеркнем, что это наблюдалось на фоне поверхностных фрагментов тубулярно-ворсинчатой аденомы с интраэпителиальной неоплазией (тяжелой дисплазией эпителия 2-3 степени). В лимфатических узлах отмечался синусовый гистиоцитоз, фолликулярная гиперплазия. В стенке кишки – гиперплазия крипт, хроническое воспаление. Установлена цирротическая трансформация печени с наличием цирротических узлов, очаговое поражение правой доли печени.
На приведенных снимках тонкой кишки и некоторых внутренних органов у мышей Balb/c Nude, наряду с сохранением типичной структуры с участками неповрежденного опустошенного кишечника (см. фиг. 8 а, б), были отмечены крайне негативные деструктивные изменения. Так, внутри кишечника определялись крупные конгломерации ввиде узлов, заполненных элементами деструктивного распада, включая фрагменты эпителиального происхождения, некротические и фибринозные массы (рисунок 8 в, г).
Ткань печени претерпевала глубокие патологические изменения. На препаратах печени макроскопически были отмечены множественные узловые образования, в области которых при микроскопии определялись обширные очаги некроза. По периферии таких участков выявлялись крупные клетки с наличием патологического митоза и очаговой лимфо-лейкоцитарной и плазмоцитарной инфильтрацией (см. фиг. 9 а, б). Определялись очаги апоптоза с выходом множества мелких апоптотических телец, а также петрификаты с дистрофически измененными клетками. Наблюдались светлые очаги слизеобразования и жировой гепатоз (см. фиг. 9 в - з). Вместе с тем, были выявлены незначительные участки с сохраненной структурой печени (см. фиг. 9 г).
Особого внимания заслуживает тот факт, что в участках тесного прилегания кишечника и диффузно-очагового узлового образования печени наблюдалось резко выраженное прорастание подслизистой и мышечной оболочки с периваскулярной инвазией и лейкоцитарно-лимфоцитарной инфильтрацией. По краю, прилежащему к соединительнотканной оболочке печени, четко выражена ворсинчатая кайма (см. фиг. 9 б), по-видимому, имеющая отношение к аденоматозному процессу, на фоне которого наблюдается формирование малигнизированных участков.
Именно на таком участке нами были отмечены стуктуры с признаками канцероматоза, демонстрирующего интраэпителиальную неоплазию кишки с характерными элементами сосочковой и железистоподобной структуры, многорядностью эпителия, наслоением ядер клеток неправильной округлой формы (см. фиг. 10 а - д).
Это был уже второй обнаруженный нами локус формирования интраэпителиальной неоплазии кишки у мышей Balb/c Nude после введения митохондрий высокодифференцированной аденокарциномы ободочной кишки человека.
На препарате поджелудочной железы, тесно контактирующей с дистрофически измененной печенью, значительных дегенеративных изменений не наблюдалось. Однако, можно было видеть примыкающие к Лангергансовым островкам расширенные кровеносные сосуды с кровенаполнением и тромбозом (см. фиг. 11а, б).
Однако, в жировой клетчатке, интимно спаянной со структурой поджелудочной железы, был обнаружен новый третий очаг метастазирования высокодифференцированной аденокарциномы, полностью совпадающий по структуре входящих элементов очага, обнаруженного у верхнего полюса печени (указано стрелкой на рисунке 11 в).
Итак, из микрокартины органов брюшной полости мышей Nude видно, что патологические изменения коснулись практически всех систем, включая сигнальный признак митохондриального переноса факторов тотального тромбоза, мощных воспалительных процессов с образованием множества крупных и мелких узлов, располагающихся по кишечнику, брыжейке, печени. В печени были образованы крупные патологически измененные участки – диффузно-узловые формы воспалительного, некротического, апоптотического и др. дегенеративно – дистрофического характера.
Обобщая результаты морфологического исследования органов у мыши Balb/c Nude после внутрибрюшинной трансплантации митохондрий, изолированных из высокодифференцированной аденокарциномы восходящего отдела ободочной кишки у пациента, необходимо указать на важную роль состояния организма больного. Состояние пациента было отягощено раком предстательной железы, излеченным брахитерапией, а также наличием комплексной коморбидной патологии, включая цирроз печени, варикозное раширение вен пищевода с эпизодами кровотечения, ИБС, сахарный диабет.
На этом фоне митохондриального переноса различных факторов, индуцирующих острую ситуацию тромбоза и воспаления, были определены участки, маркирующие онкологический процесс.
На сравнительно небольших участках жировой клетчатки, прилежащей к печени, поджелудочной железе, пограничной соединительной ткани узла печени, прилегающего к стенке кишечника, были сформированы структуры, подобные атипичному эпителию при аденокарциноме толстой кишки, образующие сосочкоподобные комплексы.
Повторяемость признаков атипии клеток организма-реципиента по структуре ядер и цитоплазмы, многорядному расположению клеточного эпителия, встречающимся фигурам патологического митоза, общему кластерному типу дисплазии эпителия, позволяет отнести данные изменения к формированию очагов интраэпителиальной high-grade неоплазии, диагносцированной в организме-донора.
Таким образом, данное исследование морфологически подтверждает возможность митохондриального переноса специфических факторов онкогенеза и сопряженных с ним коморбидных состояний, указывающее на целостность и взаимосвязь многогранных патологических процессов.
Технико-экономическая эффективность «Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных» заключается в том, что применение парентеральной трансплантации митохондрий, изолированных из злокачественной опухоли человека, у мышей-самцов линии Balb/c Nude вызывает рост и развитие в организме злокачественных очагов. Это дает возможность изучать патогенез злокачественного роста под влиянием трансплантации митохондрий, изолированных из злокачественной опухоли человека, и механизм митохондриального воздействия, вызывающего развитие злокачественных опухолевых очагов колоректального рака человека, что важно для клиники, так как доказывает новый ранее не известный механизм диссеминации колоректального рака. Способ экономичен, доступен для исполнения.
Список литературы:
1. Ladabaum U., Dominitz J.A., Kahi C., Schoen R.E. Strategies for colorectal cancer screening. Gastroenterology.2020;158(2):418–32. doi: 10.1053/j.gastro.2019.06.043.
2. Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71:209–49. doi:10.3322/caac.21660.
3. Dekker E., Tanis P.J., Vleugels J.L.A., Kasi P.M., Wallace M.B. Colorectal Cancer. Lancet (London England). 2019;394(10207):1467–80. doi: 10.1016/S0140-6736(19)32319-0.
4. Siegel R.L., Miller K.D., Goding Sauer A., Fedewa S.A., Butterly L.F., Anderson J.C., Cercek A., Smith R.A., Jemal A. Colorectal cancer statistics. 2020. CA Cancer J Clin. 2020;70(3):145-164. doi: 10.3322/caac.21601.
5. Canavan C., Abrams K.R., Mayberry J. Meta-analysis: colorectal and small bowel cancer risk in patients with Crohn's disease. Aliment Pharmacol Ther. 2006;23:1097–104. doi:10.1111/j.1365-2036.2006.02854.x.
6. Valle L., Vilar E., Tavtigian S.V., Stoffel E.M. Genetic predisposition to colorectal cancer: syndromes, genes, classification of genetic variants and implications for precision medicine. J Pathol. 2019;247:574–88. doi:10.1002/path.5229.
7. Keum N., Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 2019;16:713–32. doi:10.1038/s41575-019-0189-8.
8. Gervaz P, Bucher P, Morel P. Two Colons-Two Cancers: Paradigm Shift and Clinical Implications. J Surg Oncol. 2004;88(4):261–6. doi: 10.1002/jso.20156.
9. Wu C. Systemic Therapy for сolon сancer. Surg Oncol Clin N Am. 2018;27(2):235–42. doi: 10.1016/j.soc.2017.11.001.
10. Grass F., Lovely J.K., Crippa J., Ansell J., Hubner M., Mathis K.L., et al. Comparison of recovery and оutcome аfter left and right сolectomy. Colorectal Dis. 2019;21(4):481–6. doi: 10.1111/codi.14543.
11. Blakely A.M., Lafaro K.J., Eng O.S., Ituarte P.H.G., Fakih M., Lee B., et al. The Association of tumor laterality and survival аfter сytoreduction for сolorectal сarcinomatosis. J Surg Res. 2020;248:20–7. doi: 10.1016/j.jss.2019.10.001.
12. Guo JN, Li MQ, Deng SH, Chen C, Ni Y, Cui BB, Liu YL. Prognostic immune-related analysis based on differentially expressed genes in left- and right-sided colon adenocarcinoma. Front Oncol. 2021;11:640196. doi: 10.3389/fonc.2021.640196.
13. Guinney J., Dienstmann R., Wang X., et al. The consensus molecular subtypes of colorectal cancer. Nat Med. 2015;21:1350–1356. doi: 10.1038/nm.3967.
14. Nitsche U., Stogbauer F., Spath C., Haller B., Wilhelm D., Friess H., Bader F.G. Right sided colon cancer as a distinct histopathological subtype with reduced prognosis. Dig Surg. 2016;33(2):157–163. doi: 10.1159/000443644.
15. Baran B., Mert Ozupek N., Yerli Tetik N., Acar E., Bekcioglu O., Baskin Y. Difference between left-sided and right-sided colorectal сancer: а focused review of literature. Gastroenterology research. 2018;11(4):264–273. https://doi.org/10.14740/gr1062w.
16. Lee J.M., Han Y.D., Cho M.S., Hur H., Min B.S., Lee K.Y., Kim N.K. Impact of tumor sidedness on survival and recurrence patterns in colon cancer patients. Ann Surg Treat Res. 2019;96(6):296-304. doi: 10.4174/astr.2019.96.6.296.
17. Bustamante-Lopez L.A., Nahas S.C., Nahas C., Pinto R.A., Marques C., Cecconello I. Is there a difference between right-versus left-sided colon cancers? Does side make any difference in long term follow-up? Arq. Bras. Cir. Dig. 2019;32:e1479. doi: 10.1590/0102-672020190001e1479.
18. Warschkow R., Sulz M.C., Marti L., Tarantino I., Schmied B.M., Cerny T., Güller U. Better survival in right-sided versus left-sided stage I - III colon cancer patients. BMC Cancer. 2016;16:554. doi: 10.1186/s12885-016-2412-0.
19. Yang J., Du X.L., Li S.T., Wang B.Y., Wu Y.Y., Chen Z.L., Lv M., et al. Characteristics of differently located colorectal cancers support proximal and distal сlassification: а population-based study of 57,847 patients. PLoS One. 2016 Dec 9;11(12):e0167540. doi: 10.1371/journal.pone.0167540.
20. Zhang, H. C., Deng, S. H., Pi, Y. N., Guo, J. N., Xi, H., Shi, X., et al. Identification and validation in a novel quantification system of ferroptosis patterns for the prediction of prognosis and immunotherapy response in left- and right-sided colon cancer. Frontiers in immunology. 2022;13:855849. doi: 10.3389/fimmu.2022.855849.
21. Majek O., Gondos A., Jansen L., Emrich K., Holleczek B., Katalinic A., et al. Sex differences in colorectal cancer survival: population-based analysis of 164,996 colorectal cancer patients in Germany. PLoS One. 2013;8(7):e68077. doi: 10.1371/journal.pone.0068077.
22. Gupta P., Chiang S.F., Sahoo P.K., Mohapatra S.K., You J.F., Onthoni D.D., et al. Prediction of colon cancer stages and survival period with machine learning approach. Cancers (Basel). 2019;11(12):2007. doi: 10.3390/cancers11122007.
23. Recio-Boiles A., Cagir B. Colon Cancer. StatPearls. Treasure Island (FL): StatPearls Publishing; 2022.
24. Liu Y., Kang R., Zheng H., Wang P., Jiang W., Xiong B., et al. Female colon cancer metastasis pattern and prognosis: a seer-based study. BioMed research international. 2022; 3865601. doi: 10.1155/2022/3865601.
25. Wang J., Li S., Liu Y., Zhang C., Li H., Lai B. Metastatic patterns and survival outcomes in patients with stage IV colon cancer: a population-based analysis. Cancer Medicine . 2020;9(1):361–373. doi: 10.1002/cam4.2673.
26. Riihimäki M., Hemminki A., Fallah M., Thomsen H., Sundquist K., Sundquist J., Hemminki K. Metastatic sites and survival in lung cancer. Lung Cancer. 2014;86(1):78-84. doi: 10.1016/j.lungcan.2014.07.020.
27. Donati M.B. The “common soil hypothesis”: evidence from population studies? Thromb Res. 2010; 125(Suppl 2):S92–5. doi:10.1016/S0049-3848(10)70023-2.
28. Kenzik K.M., Balentine C., Richman J., Kilgore M., Bhatia S., Williams G.R. New-onset cardiovascular morbidity in older adults with stage I to III colorectal cancer. J Clin Oncol. 2018;36:609–16. doi:10.1200/JCO.2017.74.9739.
29. Brown J.C., Caan B.J., Prado C.M., Weltzien E., Xiao J., Cespedes Feliciano E.M., et al. Body composition and cardiovascular events in patients with colorectal cancer: a population-based retrospective cohort study. JAMA Oncol. 2019;5:967–72. doi:10.1001/jamaoncol.2019.0695.
30. Keramida K., Charalampopoulos G., Filippiadis D., Tsougos E., Farmakis D. Cardiovascular complications of metastatic colorectal cancer treatment. J Gastrointest Oncol. 2019;10:797–806. doi:10.21037/jgo.2019.03.04.
31. Marchetti M., Falanga A. Hemostatic biomarkers in occult cancer and cancer risk prediction. Thromb Res. 2020;191(Suppl 1):S37–42. doi:10.1016/S0049-3848(20)30395-9.
32. Vilar R., Fish R.J., Casini A., Neerman-Arbez M. Fibrin(ogen) in human disease: both friend and foe. Haematologica. 2020;105:284–96. doi:10.3324/haematol.2019.236901.
33. Kornmann M., Staib L., Wiegel T., Kron M., Henne-Bruns D., Link K.H., et al. Long-term results of two adjuvant trials reveal differences in chemo-sensitivity and the pattern of metastases between colon cancer and rectal cancer. Clin Colorectal Cancer. 2013;12:54–61. doi:10.1016/j.clcc.2012.07.005.
34. Paschke S., Jafarov S., Staib L., Kreuser E.D., Maulbecker-Armstrong C., Roitman M., et al. Are colon and rectal cancer two different tumor entities? A proposal to abandon the term colorectal cancer. Int J Mol Sci. 2018;19:2577. doi:10.3390/ijms19092577.
35. Burke P.J. Mitochondria, bioenergetics and apoptosis in cancer. Trends Cancer. 2017;3(12):857-870. doi: 10.1016/j.trecan.2017.10.006.
36. Vyas S., Zaganjor E., Haigis M.C. Mitochondria and сancer. Cell. 2016;166(3):555-566. doi: 10.1016/j.cell.2016.07.002.
37. Han Y., Kim B., Cho U., Park I.S., Kim S.I., Dhanasekaran D.N., Tsang B.K., Song Y.S. Mitochondrial fission causes cisplatin resistance under hypoxic conditions via ROS in ovarian cancer cells. Oncogene. 2019;38(45):7089-7105. doi: 10.1038/s41388-019-0949-5.
38. Kaipparettu B.A., Ma Y., Park J.H., Lee T.L., Zhang Y., Yotnda P., Creighton C.J., Chan W.Y., Wong L.C. Correction: crosstalk from non-cancerous mitochondria can inhibit tumor properties of metastatic cells by suppressing oncogenic pathways. PLoS One. 2019;14(8):e0221671. doi: 10.1371/journal.pone.0221671.
39. Cardamone M.D., Tanasa B., Cederquist C.T., Huang J., Mahdaviani K., Li W., Rosenfeld M.G., Liesa M., Perissi V. Mitochondrial retrograde signaling in mammals is mediated by the transcriptional cofactor GPS2 via direct mitochondria-to-nucleus translocation. Mol Cell. 2018;69(5):757-772.e7. doi: 10.1016/j.molcel.2018.01.037.
40. Valenti D., Vacca R. A., Moro L., Atlante A. Mitochondria can cross cell boundaries: an overview of the biological relevance, pathophysiological implications and therapeutic perspectives of intercellular mitochondrial transfer. International journal of molecular sciences. 2021; 22(15):8312. doi:10.3390/ijms22158312.
41. Singh B., Modica-Napolitano J.S., Singh K.K. Defining the momiome: Promiscuous information transfer by mobile mitochondria and the mitochondrial genome. Semin. Cancer Biol. 2017;47:1–17. doi: 10.1016/j.semcancer.2017.05.004.
42. Sinha P., Islam M.N., Bhattacharya S., Bhattacharya J. Intercellular mitochondrial transfer: Bioenergetic crosstalk between cells. Curr. Opin. Genet. Dev. 2016;38:97–101. doi: 10.1016/j.gde.2016.05.002.
43. Shanmughapriya S., Langford D., Natarajaseenivasan K. Inter and Intracellular mitochondrial trafficking in health and disease. Ageing Res. Rev. 2020;62:101128. doi: 10.1016/j.arr.2020.101128.
44. Liu D., Gao Y., Liu J., Huang Y., Yin J., Feng Y., Shi L., Meloni B.P., Zhang C., Zheng M., et al. Intercellular mitochondrial transfer as a means of tissue revitalization. Signal Transduct. Target. Ther. 2021;6:1–18. doi: 10.1038/s41392-020-00440-z.
45. Егорова М.В., Афанасьев С.А. Выделение митохондрий из клеток и тканей животных и человека: Современные методические приемы. Сибирский медицинский журнал. 2011;26(1-1):22-28.
46. Гуреев А.П., Кокина А.В., Сыромятникова М.Ю., Попов В.Н. Оптимизация методов выделения митохондрий из разных тканей мыши. Вестник ВГУ, серия: химия, биология, фармация. 2015; 4: 61-65.
47. M. A. Afanasyeva, A. S. Ustiugova, S. A. Golyshev, A. T. Kopylov, A. V. Bogolyubova, D. E. Demin, P. V. Belousov, A. M. Schwartz. Isolation of Large Amounts of Highly Pure Mitochondria for “Omics” Studies. Biochemistry (Moscow), 2018.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ формирования опухолевого роста в легких экспериментальных животных | 2023 |
|
RU2810431C1 |
| Способ исследования PDX-модели колоректального рака | 2024 |
|
RU2835140C1 |
| Способ образования опухолевых узлов меланомы в организме экспериментальных животных | 2022 |
|
RU2796892C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени | 2023 |
|
RU2813334C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени при наличии мутаций в генах KRAS | 2023 |
|
RU2797847C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени при отсутствии мутаций в генах KRAS | 2023 |
|
RU2819653C1 |
| Способ экспериментальной биотерапии меланомы В16/F10 | 2022 |
|
RU2779698C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени и при наличии мутаций в генах KRAS и BRAF | 2021 |
|
RU2760174C1 |
| Способ обнаружения свойств митохондрий глиобластомы человека индуцировать экстракраниальный диффузный опухолевый рост в органах экспериментальных животных | 2023 |
|
RU2794641C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени и при отсутствии мутаций в генах KRAS и BRAF | 2021 |
|
RU2764955C1 |

Изобретение относится к онкологии, а именно к экспериментальной онкологии, и может быть использовано для изучения опухолевых очагов в органах экспериментальных животных после трансплантации им митохондрий опухоли человека. Для этого самцам мышей линии Balb/c Nude однократно внутрибрюшинно вводят митохондрии, изолированные из аденокарциномы восходящего отдела ободочной кишки человека, из расчета 3 мг белка на 1 животное в 0,4 мл физиологического раствора и на 36 сутки проводят регистрацию морфологически подтвержденного опухолевого роста в органах экспериментальных животных. Изобретение позволяет изучать патогенез злокачественного роста под влиянием трансплантации митохондрий, изолированных из злокачественной опухоли человека, и механизм митохондриального воздействия, вызывающего развитие злокачественных опухолевых очагов колоректального рака человека. 1 пр., 11 ил.
Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных, заключающийся в том, что самцам мышей линии Balb/c Nude однократно внутрибрюшинно вводят митохондрии, изолированные из аденокарциномы восходящего отдела ободочной кишки человека, из расчета 3 мг белка на 1 животное в 0,4 мл физиологического раствора и на 36 сутки проводят регистрацию морфологически подтвержденного опухолевого роста в органах экспериментальных животных.
| Способ модификации развития аденокарциномы в эксперименте | 2020 |
|
RU2743960C1 |
| КИБЛИЦКАЯ А.А | |||
| и др | |||
| ПУТИ МОДЕЛИРОВАНИЯ ОПУХОЛЕВОГО РОСТА У МЫШЕЙ В ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЯХ РАКА ЖЕЛУДКА ЧЕЛОВЕКА / Южно-Российский онкологический журнал, 2021, т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| НЕХАЕВА Т.Л | |||
| и др | |||
| Разнообразие опухолевых моделей для тестирования противоопухолевой активности веществ у мышей / ВОПРОСЫ | |||
Авторы
Даты
2023-07-04—Публикация
2023-04-26—Подача