Изобретение относится к области медицины в целом, более точно к технологии разработки генного и генно-клеточного препарата и способам лечения неизлечимого на дату представления заявочных материалов наследственного заболевания метахроматической лейкодистрофии (МЛД), представляющей собой тяжелое наследственное нейродегенеративное заболевание, возникающие вследствие дефицита лизосомного фермента арилсульфатазы A (ARSA) или белка-активатора сапозина B (SapB) в организме человека. В результате дефицит ARSA приводит к поражению миелиновой оболочки, покрывающей большинство нервных волокон центральной (ЦНС) и периферической нервной системы (ПНС). В заявленном техническом решении разработан препарат для генной и генно-клеточной терапии и способ лечения МЛД, заключающийся во внутривенном или интратекальном введении препарата, содержащего рекомбинантный аденоассоциированный вирус 9 серотипа, с уникальной последовательностью кодон-оптимизированного гена ARSA (AAV9-coARSA) или в трансплантации мезенхимных стволовых клеток (МСК) человека, генетически модифицированных AAV9-coARSA (МСК-ARSA). Заявленный препарат и способы доставки фермента ARSA позволяют восстановить дефицит фермента ARSA в нервной системе неизлечимо больного человека, за счет того, что заявленное техническое решение позволяет предотвратить причину возникновения заболевания.
Далее в целях исключения неоднозначного понимания текста заявителем приведены использованные в заявочном материале термины и их расшифровка:
ГСК – гемопоэические стволовые клетки;
ГЭБ – гемато-энцефалический барьер;
кДНК – комплементарная дезоксирибонуклеиновая кислота;
КМ – костный мозг;
МЛД – метахроматическая лейкодистрофия;
мРНК – матричная рибонуклеиновая кислота;
МСК – мезенхимные стволовые клетки;
МСК-ARSA – мезенхимные стволовые клетки, модифицированные AAV9-coARSA;
ПНС – периферическая нервная система;
СМЖ – спинномозговая жидкость;
ЦНС – центральная нервная система;
AAV9-coARSA — аденоассоциированный вирус 9 серотипа, содержащий уникальную последовательность кодон-оптимизированного гена ARSA;
ARSA – фермент арилсульфаза А;
ARSA – ген, кодирующий арилсульфатазу А.
Вестерн-блоттинг (вестерн-блот, белковый иммуноблот, англ. Western blot) – аналитический метод, используемый для определения в образце специфичных белков. На первом этапе используют электрофорез белков в полиакриламидном геле для разделения денатурированных полипептидов по длине (как правило, в присутствии SDS) или по трехмерной структуре белка (в нативном состоянии). Далее белки переносят на нитроцеллюлозную или PVDF-мембрану, затем детектируют с использованием антител, специфичных к заданному белку.
Метахроматическая лейкодистрофия – это редкое наследственное заболевание из группы лизосомных болезней накопления с аутосомно-рецессивным механизмом наследования нарушения обмена веществ. На дату представления заявленного технического решения лекарства для лечения МЛД из исследованного уровня техники не выявлено. Терапия сводится к купированию болевого синдрома и симптомов заболевания. В случае мягких форм болезни, характеризующихся умеренными проявлениями клинической картины, существует возможность трансплантации костного мозга (в том числе, стволовых клеток). Однако эти методики только разрабатываются и проходят клинические испытания, в результате которых будет выяснена возможность замедления прогрессирования болезни, а также возможность полной остановки развития патологического процесса на уровне клеток центральной нервной системы. Тем не менее, данные, полученные в процессе исследования периферической нервной системы, не так драматичны, а долгосрочные результаты проведенной терапии на сегодняшний день неоднозначны. В то же время ведутся разработки других вариантов лечения метахроматической лейкодистрофии. Они включают в себя методы генной терапии, фермент-заместительной терапии, субстрат-снижающую терапию и повышение активности собственного фермента.
Таким образом, краткая суть данного заболевания заключается в накоплении сульфатидов, содержащихся в миелине, а также в различных клетках и тканях организма, но преимущественно в клетках ЦНС и ПНС. Накопление возникает из-за дефицита лизосомного фермента ARSA или белка-активатора SapB. Нарушения в функционировании или недостаточность фермента ARSA возникает из-за мутаций генов ARSA и PSAP.
При МЛД сульфатиды накапливаются в олигодендроцитах, микроглии, некоторых нейронах ЦНС, шванновских клетках, макрофагах ПНС, а также в клетках внутренних органов, например, желчного пузыря, из-за чего повышается вероятность возникновения злокачественных новообразований данного органа (McFadden K., Ranganathan S., Pathology of the gallbladder in a child with metachromatic leukodystrophy. Pediatr Dev Pathol, 2015. 18(3): p. 228-230). Клинические проявления и степень нейродегенерации при МЛД разнообразны и зависят от типа (вида) мутации и степени дефицита фермента. МЛД подразделяют на позднюю инфантильную, ювенильную и взрослую формы (Brown T.M., et al., Development of the Impact of Juvenile Metachromatic Leukodystrophy on Physical Activities scale, 2017. 2(1): p. 15). Клиническая манифестация при поздней инфантильной форме МЛД начинается до 3 лет. Эта форма считается самой тяжелой и характеризуется серьезным дефицитом ARSA, что влечет за собой быструю нейродегенерацию. Кроме поражения ЦНС, выявляется периферическая невропатия. Ювенильная форма развивается в возрасте 3-16 лет и характеризуется менее выраженным клиническим проявлением в сравнении с поздней инфантильной формой. При поздней инфантильной и ранней ювенильной формах наблюдаются быстрая прогрессия заболевания и при отсутствии терапии смерть наступает в течение нескольких лет от начала заболевания. Клиническая манифестация при взрослой форме МЛД начинается обычно после 16 лет. Взрослая форма МЛД прогрессирует медленно, часто ошибочно диагностируется как деменция с ранним началом или шизофрения.
Заявленное техническое решение основывается на идее того, что доставка фермента ARSA в ЦНС пациентов с МЛД позволяет остановить прогрессирование заболевания за счет восстановления метаболизма сульфатидов, накопление которых приводит к развитию нейродегенерации у пациентов с МЛД. Техническое решение заключается в доставке ARSA методами генной (интратекальная или внутривенная инъекция AAV9-coARSA) и генно-клеточной (внутривенное введение МСК-ARSA) терапии. Известно, что AAV9 способен преодолевать ГЭБ, доставлять ген фермента и эффективно трансдуцировать клетки нервной системы. AAV9 способен транспортироваться антероградно вдоль нейрона и транссинаптически трансдуцировать нейроны в широком диапазоне от места инъекции, а МСК способны мигрировать в область нейровоспаления и нейродегенерации, поэтому после интратекального и/или внутривенного введения AAV9-coARSA и/или внутривенной трансплантации МСК-ARSA концентрация фермента доводится до нормального физиологического уровня и нейродегенерация предотвращается или замедляется. Таким образом, становится возможным восстановление ферментативной активности ARSA и улучшение качества жизни пациентов. Указанный технический результат становится возможным вследствие использования неочевидного для специалистов подхода, использованного заявителем. Введение AAV9-coARSA и МСК-ARSA позволяют предотвратить развитие МЛД. Способы обеспечивают восполнение дефицита фермента ARSA в ЦНС и ПНС.
Заявленное техническое решение предоставляет возможность решения технически неразрешимого препятствия, существующего в мире на дату представления заявленного технического решения, а именно – обеспечение преодоления ГЭБ для доставки в ЦНС и ПНС недостающего фермента, и представляет возможность восстановления ферментативной активности ARSA в организме больного, тем самым обеспечивая улучшение качества жизни пациентов, страдающих МЛД, что позволяет сделать логически обоснованный вывод о соответствии заявленного технического решения не только критерию «мировая новизна», но и критерию «изобретательский уровень» в соответствии с заявленным техническим решением, а именно – разработанным генным и генно-клеточным препаратом и способом терапии МЛД, который представляет собой интратекальное или внутривенное введение рекомбинантного AAV9, содержащего последовательность кодон-оптимизированного гена ARSA, или внутривенное введение МСК, генетически модифицированных с помощью AAV9-coARSA.
Полученные генный и генно-клеточный препараты обеспечивают возможность доставки недостающего фермента ARSA в ЦНС и ПНС, вследствие чего, по мнению заявителя, обеспечивается возможность полной остановки нейродегенерации и излечение больных пациентов, страдающих МЛД.
В результате реализации заявленного технического решения становится возможным решать нереализуемые на дату подачи заявки проблему, такую как лечение пациентов с МЛД, конкретнее – заявленное техническое решение обеспечивает доставку ARSA в ЦНС и ПНС малоинвазивным путем.
Решение указанной проблемы в мире представляется актуальным ввиду отсутствия на дату представления настоящей заявки эффективных и безопасных способов терапии МЛД. На дату представления заявочных материалов в качестве лечения предлагается только симптоматическая терапия, однако активно исследуются новые подходы к терапии этих заболеваний. На стадии разработки находятся перспективные терапевтические стратегии, которые активно исследуются в настоящее время, а именно трансплантация костного мозга или гемопоэтических стволовых клеток, фермент-заместительная терапия и восстановление экспрессии функционального фермента с использованием методов генной терапии. Однако эти методы терапии не показывают необходимого уровня эффективности. Слабая эффективность таких подходов как фермент-заместительная терапия связана с тем, что при внутривенном введении вещества плохо преодолевают ГЭБ. С этой точки зрения прямая инъекция в головной мозг рекомбинантного фермента ARSA имеет преимущество, однако такие подходы трудно применимы к человеку, поскольку существуют такие недостатки как необходимость серьезного хирургического вмешательства, плохое биораспределение терапевтического препарата и, следовательно, необходимость во множественных инъекциях. Тем не менее, такие подходы активно исследуются и проходят клинические испытания (NCT01510028, S. Stroobants, Intracerebroventricular enzyme infusion corrects central nervous system pathology and dysfunction in a mouse model of metachromatic leukodystrophy, 2011).
Генная терапия с использованием вирусных векторов, способных пересекать ГЭБ, может быть эффективна. Существуют in vivo исследования, где используют аденоассоциированный вирусный вектор 5 серотипа (AAV5). Интрацеребральная доставка AAV5 в мозг мышей с моделью МЛД позволило добиться продолжительной экспрессии ARSA в головном мозге (3–15 месяцев) и предотвратить невропатологические и нейромоторные нарушения [Sevin C., et al., Intracerebral adeno-associated virus-mediated gene transfer in rapidly progressive forms of metachromatic leukodystrophy, 2006. 15(1): p. 53-64].
Также были получены хорошие результаты использования AAV9. Инъекция AAV9, кодирующего ARSA и репортерный ген зеленого флуоресцентного белка в яремную вену новорожденных мышей с МЛД привела к длительной экспрессии фермента, накопление сульфатидов в головном и спинном мозге было значительно снижено и не отличалось от такового у мышей дикого типа. Было выяснено, что AAVrh.10 более эффективно распространяется от мест интрацеребральной инъекции, чем AAV1, AAV2, AAV5, AAV7 или AAV8. Введение AAVrh.10-ARSA в мозг мышей с МЛД привело к снижению накопления определенных видов сульфатидов в олигодендроцитах. Были проведены клинические испытания AAVrh.10-ARSA. AAVrh.10-ARSA вводили в белое вещество головного мозга. Активность ARSA в спинномозговой жидкости (СМЖ) значительно возросла после инъекции, достигая 20-70% от контрольных значений при последней оценке. Однако после прекращения терапии состояние пациентов продолжало ухудшаться (NCT01801709).
Трансплантация костного мозга (КМ) и гемопоэтических стволовых клеток (ГСК) часто используется для терапии МЛД и других ЛБН, поскольку клетки здорового донора синтезируют нормальный фермент на физиологическом уровне и в некоторых случаях, как правило при менее агрессивных формах заболевания, данная процедура помогает увеличивать активность фермента и смягчать симптомы заболевания. Однако трансплантация КМ и ГСК без дополнительной генетической модификации не всегда имеет достаточный терапевтический эффект при лечении ЛБН (S. Groeschel, Long-term Outcome of Allogeneic Hematopoietic Stem Cell Transplantation in Patients With Juvenile Metachromatic Leukodystrophy Compared With Nontransplanted Control Patients, 2016).
Таким образом, вышеописанные методы лечения МЛД являются недостаточно эффективными и актуален поиск новых препаратов и методов лечения.
Заявителем проведен анализ выявленного уровня техники по научной и патентной информации в области терапии МЛД, и выявлен ряд аналогов, которые используются в настоящее время для облегчения симптомов и для остановки усугубления нейродегенерации у больных МЛД.
Из исследованного уровня техники выявлено изобретение по патенту RU2727015C2 «Векторы AAV, нацеленные на центральную нервную систему». Сущностью известного технического решения является нуклеиновая кислота, кодирующая капсидный белок AAV, где нуклеиновая кислота содержит последовательность, кодирующую капсид AAV, которая кодирует капсидный белок, содержащий: полипептид, имеющий последовательность SEQ ID NO: 53, причем вплоть до 3 аминокислот указанного полипептида заменены, и замены имеют место в VP3 части капсидного белка AAV или полипептид, имеющий последовательность SEQ ID NO: 56, причем вплоть до 1 аминокислоты указанного полипептида заменено, и замена имеет место в VP3 части капсидного белка AAV. Нуклеиновая кислота по меньшей мере на 99% идентична SEQ ID NO: 13. Нуклеиновая кислота где VP1/VP2 часть последовательности на 100% идентична VP1/VP2 части SEQ ID NO: 13. Нуклеиновая кислота по меньшей мере на 99% идентична SEQ ID NO: 10. Нуклеиновая кислота где VP1/VP2 часть последовательности на 100% идентична VP1/VP2 части SEQ ID NO: 10. Нуклеиновая кислота представляет собой плазмиду, фаг, вирусный вектор, искусственную хромосому бактерий или искусственную хромосому дрожжей, вектор AAV, содержащий кодирующую последовательность. Дополнительно содержит последовательность, кодирующую rep AAV. Клетка in vitro для получения вирусной частицы AAV, содержащая нуклеиновую кислоту, стабильно вставленную в геном. Вирусная частица для доставки нуклеиновой кислоты в клетку, представляет собой частицу AAV, аденовирусную частицу, частицу вируса герпеса или бакуловирусную частицу. Капсидный белок AAV, содержащий полипептид, имеющий последовательность SEQ ID NO: 53, причем вплоть до 3 аминокислот указанного полипептида заменены, и замены имеют место в VP3 части капсидного белка AAV. Полипептид, имеющий последовательность SEQ ID NO: 56, причем вплоть до 1 аминокислоты указанного полипептида заменено, и замена имеет место в VP3 части капсидного белка AAV. Капсидный белок AAV содержащий аминокислотную последовательность, идентичную SEQ ID NO: 53 и SEQ ID NO: 56. Частица AAV, содержащая: геном вектора AAV и капсид AAV, содержащий капсидные белки AAV, где капсид AAV заключает в капсид геном вектора AAV. Частица AAV содержит гетерологичную нуклеиновую кислоту и кодирует антисмысловую РНК, микроРНК или РНКи, терапевтический полипептид, фактор роста или фактор дифференцировки, инсулиноподобный фактор роста-1, глиальный нейротрофический фактор, нейтрофин-3, нейтрофин-4, артемин, нейртерин, персефин, нейротрофический фактор головного мозга, фактор роста нервов, цилиарный нейротрофический фактор, трансформирующий фактор роста альфа, фактор роста тромбоцитов, ингибирующий лейкоз фактор, пролактин, транспортер монокарбоксилата 1 или ядерный фактор 1A, репортерный белок, также является функционально связанной с конститутивным промотором, функционально связанной со специфическим для клеток ЦНС или предпочтительным для клеток ЦНС промотором. Промотор представляет собой промотор нейрон-специфической енолазы, синапсина, MeCP2, глиофибриллярного кислого белка, S100β, wdr16, Foxj1, LRP2, основного белка миелина, фосфодиэстеразы циклических нуклеотидов, протеолипидного белка, Gtx или Sox10. Способ получения рекомбинантной частицы AAV, содержащей капсид AAV, включающий: обеспечение клетки in vitro нуклеиновой кислотой, последовательностью, кодирующей rep AAV, геномом вектора AAV, содержащим гетерологичную нуклеиновую кислоту, и функциями помощника для получения продуктивной инфекции AAV; и обеспечение сборки рекомбинантной частицы AAV, содержащей капсид AAV и заключенный в капсид геном вектора AAV. Фармацевтический состав для доставки представляющей интерес нуклеиновой кислоты пациенту-млекопитающему содержит нуклеиновую кислоту. Способ доставки представляющей интерес нуклеиновой кислоты в клетку ЦНС, включающий приведение клетки в контакт с частицей AAV, введение эффективного количества частиц AAV или фармацевтического состава. Частицу AAV доставляют непосредственно в ЦНС посредством интратекальной, интрацеребральной, интравентрикулярной, интраназальной, внутриушной, внутриглазной или периокулярной доставки или любой их комбинации. Способ доставки представляющей интерес нуклеиновой кислоты в область ЦНС, граничащую с областью нарушенного ГЭБ барьера у пациента-млекопитающего, включающий внутривенное введение эффективного количества частиц AAV или фармацевтического состава.
Таким образом, более кратко сущностью известного технического решения являются химерные последовательности капсидов AAV, способные к широкомасштабному переносу генов в ЦНС с минимальным тропизмом для периферических органов. Химерные капсиды можно использовать для получения векторов AAV для использования в исследовательских или терапевтических целях, когда является желательным перенос генов в олигодендроциты без широкого биораспределения вектора в нейронах или в периферических органах.
Недостатком известного технического решения является то, что не исследован терапевтический эффект векторов, содержащих химерные капсиды конкретно для терапии МЛД. Указано, что капсиды имеют тропизм к олигодендроцитам, а в случае МЛД необходима трансдукция всех клеток нервной системы и ЦНС, и ПНС, что не приводит к терапевтическим улучшениям. Таким образом, известное техническое решение не обеспечивает возможность высокоэффективного излечения от МЛД, то есть для лечения МЛД необходима разработка препарата и исследование специфичных векторов, содержащих именно ген ARSA, а также разработка способов, позволяющих безопасно модифицировать клетки всей нервной системы на долговременную экспрессию здорового гена, приводящего собственно к излечению от ранее неизлечимой болезни МЛД.
Использование AAV9-coARSA в заявленном техническом решении позволяет добиться высокого уровня трансдукции клеток нервной системы, за счет способности данного вектора проходить ГЭБ, тем самым обеспечивая доставку фермента и увеличивая его активность. AAV9 также способен пересекать ГЭБ, и внутривенное введение препарата позволяет трансдуцировать клетки и ЦНС, и ПНС. Благодаря способности МСК мигрировать в ГЭБ, введение МСК-ARSA обеспечивает равномерное распределение фермента по всей нервной системе и полное излечение от ранее не излечимого заболевания.
Из исследованного уровня техники выявлено изобретение по патенту CN108707627A «Лентивирусный вектор, способ его получения и применение при МЛД». Сущностью известного технического решения является лентивирусный вектор МЛД, отличающийся тем, что вектор модифицирован на 5'-конце лентивирусного вектора pTYF, и специфическая модификация выглядит следующим образом: 5'-конец донорский сайт сплайсинга удален или сконструирован, и сконструированный донорный сайт не является потенциальным сайтом для гомологичной рекомбинации между упаковывающим вектором и эталонным лентивирусом, он по-прежнему выполняет функцию сигнала упаковки вируса. При этом лентивирусный вектор дополнительно содержит ген ARSA. Нуклеотидная последовательность гена ARSA показана в SEQ ID NO. 1 или имеет по меньшей мере 80% гомологии, предпочтительно по меньшей мере 85% гомологии с ней, кроме того, предпочтительна нуклеотидная последовательность с по меньшей мере 95% гомологией. Последовательность дополнительно содержит промоторную последовательность, которая представляет собой EF1α и/или CMV, предпочтительно EF1α, нуклеотидная последовательность EF1α была такой, как показано в SEQ ID NO: 2 или имеет нуклеотидную последовательность с гомологией по меньшей мере 90% - 95% гомологии. Упаковывающая вспомогательная плазмида pNHP и pHEF-VSV-G, котрансфицированную клеткой млекопитающего. Предпочтительно клетки млекопитающих представляют собой клетки HEK293T и / или клетки TE671. Способ получения лентивируса: точечная мутация донорного сайта сплайсинга на 5'-конце лентивирусного вектора pTYF, промотор синтеза целого гена и последовательность гена ARSA, вставленные в лентивирусный вектор. Сконструированный лентивирусный вектор и упаковывающую плазмиду-помощник котрансфицировали в клетки для получения рекомбинантного лентивируса. Сайт вставки находится между сайтами расщепления BamHI и SpeI. Плазмида-помощник для упаковки представляет собой pNHP и pHEF-VSV-G. Время культивирования после котрансфекции клеток млекопитающих составляет 24-72 часа. Рекомбинантная клетка представляет собой рекомбинантную стволовую клетку, предпочтительно стволовую клетку периферической крови и / или мезенхимную стволовую клетку. Фармацевтическая композиция, содержит лентивирусный вектор, рекомбинантный лентивирус. В препарате лентивирусный вектор, рекомбинантный лентивирус, рекомбинантная клетка или фармацевтическая. Применение как лекарственные средства и/или агентах для лечения МЛД. Композиция дополнительно включает фармацевтически приемлемый наполнитель.
Таким образом, более кратко сущностью известного технического решения является применение препаратов и/или средств для лечения МЛД, а именно – стволовые клетки, трансдуцированные лентивирусом, способные стабильно экспрессировать большое количество гена ARSA.
Недостатками применения вектора, описанного в известном техническом решении, являются, например, существенные ограничения лентивирусных векторов, которые способны интегрироваться в геном клетки, что вызывает опасения по поводу безопасности, поскольку существует риск злокачественного новообразования клеток.
Для решения такой проблемы необходима разработка более безопасного способа терапии МЛД. AAV в заявленном техническом решении являются самыми безопасными векторами для генной терапии из известных на сегодняшний день. Они не встраиваются в геном клетки и не вызывают инсерционный мутагенез, вызывающий злокачественное новообразование клеток. Также AAV не вызывают какие-либо заболевания человека или иммунный ответ. При этом AAV9 показывают высокий уровень трансдукции как нервных клеток, так и МСК.
Из исследованного уровня техники выявлено изобретение по патенту РФ 201891842 «Способы и композиции для доставки арилсульфатазы А в ЦНС». Сущностью известного технического решения является способ лечения МЛД, включающий этап интратекального введения субъекту, нуждающемуся в лечении, рекомбинантного фермента ARSA в терапевтически эффективной дозе и с интервалом между введениями в течение периода лечения, достаточного для улучшения, стабилизации или снижения темпов ухудшения одной или более двигательных функций по сравнению с исходным уровнем. Введение рекомбинантного фермента ARSA дополнительно приводит к улучшению, стабилизации или снижению темпов ухудшения одной или более когнитивных, адаптивных и/или исполнительных функций. Одна или более двигательных функций включают в себя функцию крупной моторики. Функцию крупной моторики оценивают с помощью теста оценки функционирования крупной моторики (GMFM). Тест GMFM представляет собой GMFM-88. Исходный балл GMFM-88 превышает 40% или составляет меньше 40%. Введение рекомбинантного фермента ARSA приводит к уменьшению балла GMFM-88 меньше чем на 10%, 20%, 30%, 40% или 50% и стабилизации. Способ лечения МЛД, включающий этап интратекального введения субъекту, нуждающемуся в лечении, рекомбинантной ARSA в терапевтически эффективной дозе и с некоторым интервалом между введениями в течение периода лечения, достаточного для уменьшения уровней биомаркера, накапливающегося при МЛД в физиологической жидкости, выбранной из группы, состоящей из СМЖ, мочи, крови и сыворотки крови, по сравнению с исходным уровнем биомаркера. Биомаркер выбран из группы, состоящей из сульфатида, лизосульфатида и их комбинаций. Исходный уровень сульфатидов в СМЖ превышает приблизительно 0,1-0,3 мкг/мл. Введение рекомбинантного фермента ARSA приводит к снижению уровней сульфатидов в СМЖ больше чем на приблизительно 0,1-0,2 мкг/мл. Способ лечения синдрома МЛД, включающий этап интратекального введения субъекту, нуждающемуся в лечении, рекомбинантного фермента ARSA в терапевтически эффективной дозе и с некоторым интервалом между введениями в течение периода лечения, достаточного для увеличения уровней биомаркера, сниженных при МЛД, в ткани головного мозга по сравнению с исходным уровнем биомаркера. Биомаркер представляет собой метаболит, где метаболит представляет собой N-ацетиласпартат. Уровни N-ацетиласпартата оценивают с помощью спектроскопии протонного магнитного резонанса. Способ лечения синдрома МЛД, включающий этап интратекального введения субъекту, нуждающемуся в лечении, рекомбинантного фермента ARSA в терапевтически эффективной дозе и с некоторым интервалом между введениями в течение периода лечения, достаточного для стабилизации или снижения вовлечения в повреждение головного мозга по сравнению с исходным уровнем. Повреждение головного мозга оценивают по баллу тяжести МЛД, определяемому с помощью МРТ. Введение рекомбинантного фермента ARSA приводит к снижению балла тяжести МЛД, определяемого с помощью МРТ, у субъекта по сравнению с исходным уровнем. Терапевтически эффективная доза составляет или превышает 10 мг - 200 мг. Интервал между введениями составляет одну-две недели или даже один месяц. Субъектом для введения является млекопитающее или человек в возрасте от 12 месяцев, при диагностике, проявлении симптомов МЛД или наличии риска развития МЛД. ARSA вводят в позвоночный канал в поясничной области путем люмбальной пункции посредством периодического или постоянного доступа к имплантированному устройству для интратекальной доставки лекарственных средств. Период лечения составляет по меньшей мере 6-24 месяца. У субъекта не наблюдаются серьезные нежелательные эффекты, ассоциированные с введением рекомбинантной ARSA. Рекомбинантный фермент ARSA при интратекальном введении субъекту, имеющему риск развития МЛД или страдающему от нее, в терапевтической эффективной дозе и с некоторым интервалом между введениями в течение периода лечения, достаточно для улучшения, стабилизации или снижения темпов ухудшения одной или более двигательных функций и повреждений головного мозга по сравнению с исходным уровнем, также для уменьшения уровней сульфатидов в СМЖ по сравнению с исходным уровнем. Рекомбинантный фермент ARSA содержит аминокислотную последовательность, по меньшей мере на 85%-98% идентичную на аминокислотном уровне с последовательностью SEQ ID NO: 1. Способ или рекомбинантный фермент ARSA по любому из предыдущих пунктов, где рекомбинантный фермент ARSA содержит из аминокислотной последовательности SEQ ID NO: 1. Способ или рекомбинантный фермент ARSA по любому из предыдущих пунктов, где рекомбинантный фермент ARSA содержит аминокислотную последовательность, содержащую не более четырех несовпадений с SEQ ID NO: 1. Способ или рекомбинантный фермент ARSA по любому из предыдущих пунктов, где рекомбинантный фермент ARSA содержит аминокислотную последовательность, содержащую не более трех несовпадений с SEQ ID NO: 1. Способ или рекомбинантный фермент ARSA по любому из предыдущих пунктов, где рекомбинантный фермент ARSA содержит аминокислотную последовательность, содержащую не более двух несовпадений с SEQ ID NO: 1. Способ или рекомбинантный фермент ARSA по любому из предыдущих пунктов, где рекомбинантный фермент ARSA содержит аминокислотную последовательность, содержащую не более одного несовпадения с SEQ ID NO: 1.
Таким образом, более кратко сущностью известного технического решения является способ фермент-заместительной терапии МЛД и фармацевтическая композиция для прямой доставки рекомбинантного ARSA в ЦНС (интратекальное введение фермента в СМЖ).
Недостатками известного технического решения является:
– во-первых, при введении фермента в СМЖ есть риск осложнений;
– во-вторых, возникает сложность в достижении равномерного распределения фермента по нервной системе;
– в-третьих, одного введения такого препарата (рекомбинантного фермента) не достаточно, необходимо на протяжении всей жизни пациента делать инъекции, а это увеличивает вероятность возникновения рисков, к тому же необходимы постоянные затраты на приобретение рекомбинантного фермента.
К тому же предыдущие клинические испытания подобных препаратов на пациентах с другими ЛБН, затрагивающими ЦНС, не показали ожидаемой эффективности, неврологические нарушения продолжались.
Для решения такой проблемы необходима разработка препарата и способа, позволяющего исправить клетки нервной системы, а именно перепрограммировать или модифицировать на долговременную экспрессию здорового гена.
При интратекальном и/или внутривенном введении AAV9-coARSA в заявленном техническом решении нейроны будут трансдуцироваться в широком диапазоне от места инъекции через антероградный нейрональный транспорт. Эта способность AAV9 позволяет достичь большего количества пораженных участков мозга и достичь терапевтического эффекта минимально инвазивным способом. Благодаря способности AAV9 пересекать ГЭБ, внутривенное введение генного препарата также позволяет трансдуцировать клетки нервной системы. МСК также способны мигрировать в ГЭБ, особенно при воспалениях. Введение генномодифицированных МСК со сверхэкспрессией ARSA обеспечивает равномерное распределение фермента по всей нервной системе.
Из исследованного уровня техники выявлено изобретение по патенту РФ 2665381 «Внутрижелудочковая доставка ферментов при лизосомных болезных накопления». Сущностью известного технического решения является способ профилактики или лечения лизосомной болезни накопления, которая вызвана дефицитом фермента у пациента, включающий внутрижелудочковое введение фермента в головной мозг пациента, при этом введение одной дозы фермента занимает более трех - восьми часов. Указанная профилактика или лечение включает введение фермента в боковые желудочки и/или в четвертый желудочек головного мозга. Количество фермента, введенного пациенту достаточно для снижения уровня фермента в печени, легких, селезенке или почках пациента. Профилактика или лечение включает мониторинг уровней сфингомиелина у пациента и введение дополнительного фермента в ответ на зарегистрированные уровни фермента. Фермент вводят с помощью постоянного катетера и включает множественные инфузии. Лизосомными болезнями накопления являются: мукополисахаридоз I, вызванный недостаточностью альфа-L-идуронидазы, мукополисахаридоз II, вызванный недостаточностью идуронат-2-сульфатазы, болезнь Гоше, вызванный недостаточностью глюкоцереброзидазы, болезнь Помпе, вызванный недостаточностью альфа-глюкозидазы. классическая поздняя инфантильная болезнь Баттена (CLN2), вызванный недостаточностью трипептидилпептидазы, а также заболевания указанные в таблице 1.
Таким образом, более кратко сущностью известного технического решения является внутрижелудочковая доставка лизосомных гидролитических ферментов в головной мозг пациентам с лизосомными болезнями накопления.
Недостатком известного технического решения является то, что при введении фермента в головной мозг есть высокая инвазивность данной процедуры, а также цитотоксичность фермента при высоких концентрациях и ограниченность скорости паренхиматозной диффузии в головном мозге.
Наиболее близким к заявляемому техническому решению по технической сущности и достигаемому техническому результату, направленому на лечение МЛД, выбранным в качестве прототипа, является изобретение по патенту WO2020227166A1 «Композиции, полезные для лечения метахроматической лейкодистрофии» (Compositions useful in treatment of metachromatic leukodystrophy). Сущностью прототипа является аденоассоциированный вирус (AAV) используемый для лечения МЛД. AAV включает: капсид AAVhu68 и векторный геном, упакованный в капсид AAV, где векторный геном содержит инвертированные концевые повторы и последовательность нуклеиновой кислоты, кодирующую функциональную человеческую ARSA под контролем регуляторных последовательностей, которые регулируют экспрессию ARSA. Кодирующая последовательность ARSA включает последовательность нуклеотидов от 55 до 1521 из SEQ ID NO: 1 или последовательность, по меньшей мере на 95-99,9% идентичную ей, кодирующая функциональную ARSA. Функциональный белок ARSA содержит сигнальный пептид и аминокислотную последовательность (ак) 19 ак 507 из SEQ ID NO: 2. Сигнальный пептид имеет аминокислотную последовательность от 1 до 18 ак из SEQ ID NO: 2 или аминокислотную последовательность от 1 до 20 ак из SEQ ID NO: 4. Регуляторные последовательности управляют экспрессией ARSA в клетках нервной системы и содержат повсеместный промотор, включая промотор куриного β-актина. Регуляторные элементы содержат одну или несколько из последовательности Козака, последовательности полиаденилирования, интрона, энхансера и сигнала ТАТА. Кодирующая последовательность ARSA по меньшей мере на 95-99,9% идентична SEQ ID NO: 1 и кодирует функциональную ARSA. Кодирующая последовательность ARSA представляет собой SEQ ID NO: 1 или SEQ ID NO: 3. Векторный геном имеет последовательность от 1 нуклеотида до 3883 нуклеотида SEQ ID NO: 5. Капсид AAVhu68 продуцируется из последовательности, кодирующей предсказанную аминокислотную последовательность SEQ ID NO: 7.
Водный буфер фармацевтической композиции состоит из: искусственной цереброспинальной жидкости, содержащий забуференный физиологический раствор, смесь натрия, кальция, магния, калия и поверхностно-активное вещество. Поверхностно-активное вещество присутствует в количестве от 0,0005% до примерно 0,001% фармацевтической композиции. Раствор имеет pH в диапазоне от 7,5 до 7,8. Буфер для композиции пригоден для внутрисистемной большой инъекции, внутривенной доставки, интратекального введения или интрацеребровентрикулярного введения.
Вектор, содержащий кассету экспрессии, причем кассета экспрессии содержит последовательность нуклеиновой кислоты, кодирующую функциональную ARSA под контролем регуляторных последовательностей, которые управляют экспрессией ARSA. Функциональный белок ARSA включает сигнальный пептид и аминокислотную последовательность 19 ак 507 из SEQ ID NO: 2. Сигнальный пептид имеет аминокислотную последовательность от 1 до 18 ак из SEQ ID NO: 2 или аминокислотную последовательность от 1 до 20 ак из SEQ ID NO: 4. Кодирующая последовательность ARSA имеет последовательность нуклеотидов от 55 до 1521 из SEQ ID NO: 1 или последовательность, по меньшей мере, на 95-99,9% идентичную ей, которая кодирует функциональную ARSA. Кодирующая последовательность ARSA представляет собой SEQ ID NO: 1 или SEQ ID NO: 3. Вектор представляет собой вирусный вектор, выбранный из рекомбинантного аденоассоциированного вируса, рекомбинантного парвовируса, рекомбинантного лентивируса, рекомбинантного ретровируса или рекомбинантного аденовируса. Или невирусный вектор, выбранный из «голой» ДНК, «голой» РНК, неорганической частицы, липидной частицы, вектора на основе полимера или состава на основе хитозана.
Способ лечения МЛД или заболевания, связанного с мутацией гена ARSA, включающий введение эффективного количества AAV. Способ, в котором вектор вводят посредством субзатылочной инъекции под контролем компьютерной томографии в большую цистему. Это включает доставку AAV, фармацевтической композиции или вектора в разовой дозе. AAV вводят в дозе между 3,00 × 1010 копий генома (КГ) на грамм (КГ/г) массы мозга и 1,00 x 1012 КГ/г массы мозга. После введения симптомы заболевания у субъекта улучшаются и/или прогрессирование заболевания задерживается. Это подходит пациентам кто моложе 7 лет для необходимости облегчения симптомов МЛД или заболевания, связанного с мутацией гена ARSA, и/или для задержки прогрессирования МЛД или заболевания, связанного с мутацией гена ARSA.
Система продуцирования AAV включает культуру клеток, содержащий: последовательность нуклеиновой кислоты, кодирующая капсидный белок AAVhu68, векторный геном, достаточное количество репродуктивных функций и вспомогательных функций AAV для обеспечения упаковки векторного генома в капсид AAVhu68. Векторный геном имеет последовательность от нуклеотидов 1 до нуклеотидов 3883 из SEQ ID NO: 5. Культура клеток представляет собой культуру клеток 293 почки эмбриона человека. REP AAV происходит от AAV2. Последовательность, кодирующая REP AAV, и гены CAP находятся на одной и той же молекуле нуклеиновой кислоты, причем между REP и CAP необязательно имеется спейсер. Cпейсер представляет собой полинуклеотидную последовательность SEQ ID NO: 24.
Таким образом, более кратко сущностью прототипа является интрацеребральное введение рекомбинантного AAV, имеющий капсид AAVhu68 и векторный геном, содержащий последовательность нуклеиновой кислоты, кодирующей функциональный ARSA.
Недостатками прототипа является то, что в нем описывается интрацеребральная доставка AAVhu68, кодирующего ARSA. Интрацеребральная доставка (инъекция непосредственно в мозг) является высокоинвазивным методом, который может привести к серьезным осложнениям. Кроме того, заявителем выявлены клинические исследования (NCT01801709), которые показывают, что такой способ доставки не помогает остановить прогрессирование лизосомных болезней накопления, связанных с нарушением работы нервной системы, в силу указанного прототип в целом не обеспечивает возможность полного, надёжного и доступного для широкого круга пациентов излечения.
Для предотвращения таких недостатков необходима разработка препарата и менее инвазивного способа, позволяющих безопасно и в то же время эффективно доставлять недостающий фермент в ЦНС и ПНС для эффективного излечения пациентов. Использование способов генной и генно-клеточной терапии, описанных в заявленном техническом решении, позволяет добиться наилучшего трансдуцирования нейронов от места инъекции, позволяя достичь большего количества трансдуцированных участков мозга при интратекальном и/или внутривенном введении AAV9-coARSA. За счет способности AAV9 пересекать ГЭБ, внутривенное введение AAV9-coARSA также позволит трансдуцировать клетки нервной системы. Трансплантация МСК-ARSA обеспечивает равномерное распределение по всей нервной системе, за счет способности МСК мигрировать в ГЭБ.
Целью и техническим результатом заявленного технического решения является:
1. Разработка генного и генно-клеточного препарата для терапии МЛД.
2. Разработка способов генной и генно-клеточной терапии МЛД с применением рекомбинантного AAV9-coARSA и МСК, генетически модифицированных рекомбинантным AAV9-coARSA.
3. Уменьшение инвазивности при лечении МЛД.
4. Повышение эффективности при лечении МЛД.
5. Достижение равномерного распределения терапевтического фермента.
Заявленный технический результат в виде равномерного распределения терапевтического фермента в места нейродегенерации и нейровоспаления достигается за счет природных свойств AAV9-coARSA и МСК, трансдуцированных AAV9-coARSA. Известно, что МСК способны преодолевать ГЭБ и мигрировать в нервную систему при нейровоспалении, что характерно для МЛД. AAV9 также способны преодолевать ГЭБ и транспортироваться антероградно вдоль нейрона и трансдуцировать нейроны в широком диапазоне от места инъекции в ЦНС и ПНС вследствие наличия высоких трансдуцирующих свойств ААV 9 серотипа.
Сущностью заявленного технического решения является препарат для лечения метахроматической лейкодистрофии, включающий рекомбинантный аденоассоциированный вирус 9 серотипа, содержащий кодон-оптимизированную последовательность гена ARSA, представленную SEQ ID NO: 1. Препарат для лечения метахроматической лейкодистрофии, состоящий из мезенхимных стволовых клеток, генетически модифицированных рекомбинантным аденоассоциированным вирусом 9 серотипа, содержащим кодон-оптимизированную последовательность гена ARSA, представленную в SEQ ID NO: 1. Способ лечения метахроматической лейкодистрофии, заключающийся в однократном внутривенном введении препарата по п.1 или п.2, или в однократном интратекальном введении препарата по п.1.
Таким образом, в заявленном техническом решении разработаны генный и генно-клеточный препараты и способы терапии МЛД, заключающиеся в том, что: проводят внутривенное введение рекомбинантного AAV9-coARSA; проводят интратекальное введение рекомбинантного AAV9-coARSA; проводят внутривенное введение МСК, предварительно генетически модифицированных рекомбинантным AAV9-coARSA.
Рекомбинантный AAV9-coARSA экспрессирует ген фермента ARSA, способен преодолевать ГЭБ и равномерно распределять продукт экспрессии по ЦНС и ПНС. МСК-ARSA сверхэкспрессируют и секретируют фермент ARSA и обеспечивают его доставку и равномерное распределение по всей ЦНС у пациентов с МЛД.
Заявленное техническое решение поясняется Фиг. 1–Фиг. 6.
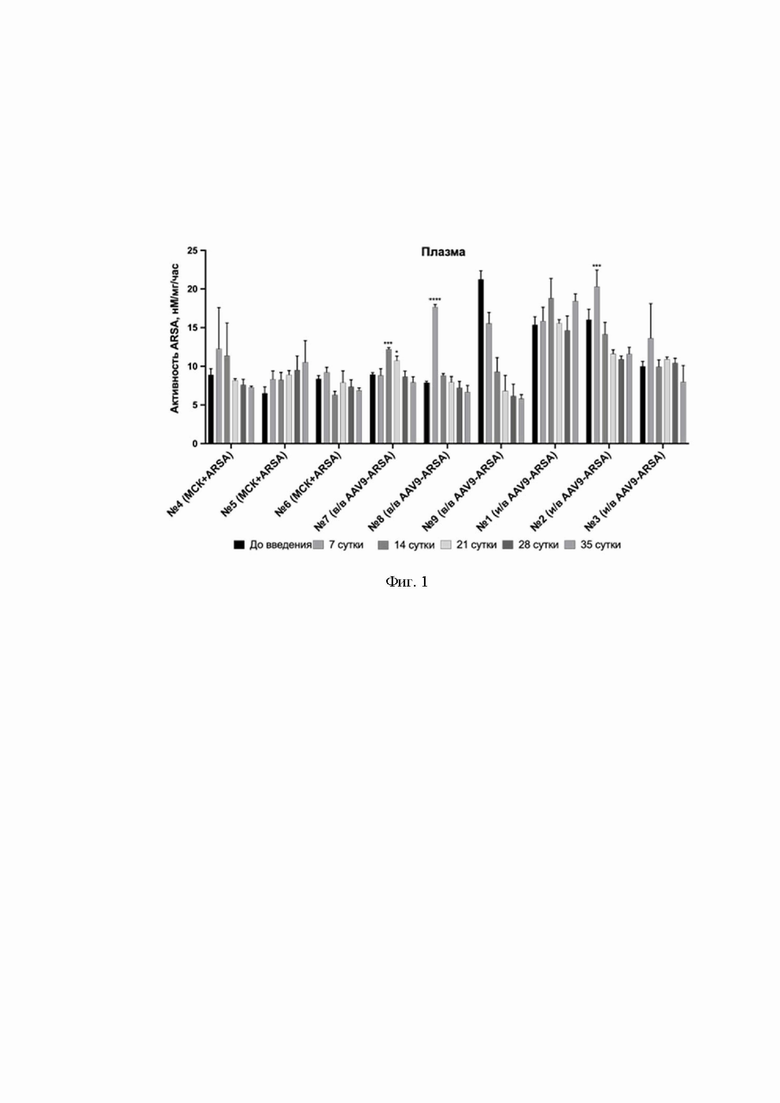
На Фиг. 1 показана динамика ферментативной активности ARSA в плазме свиней: до введения, на 7, 14, 21, 28, 35 сутки. По оси Х указаны образцы плазмы свиней № 1 – № 9, которым внутривенно ввели генетически модифицированные МСК (обозначение МСК+ARSA), образцы плазмы свиней, которым внутривенно ввели AAV9-coARSA (обозначение в/в AAV9-coARSA), образцы плазмы свиней, которым интратекально ввели AAV9-coARSA (обозначение и/в AAV9-coARSA).
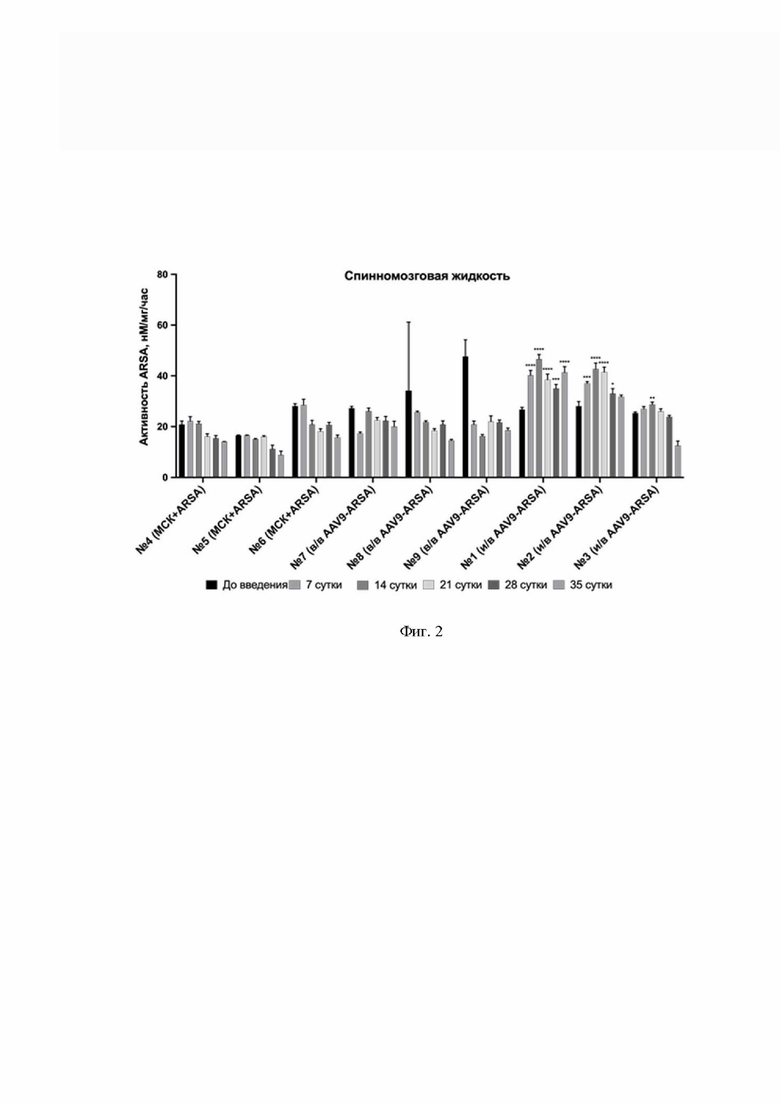
На Фиг. 2 показана динамика ферментативной активности ARSA в спинномозговой (СМЖ) свиней: до введения, на 7, 14, 21, 28, 35 сутки. По оси Х указаны образцы СМЖ свиней № 1 – № 9, которым внутривенно ввели генетически модифицированные МСК (обозначение МСК+ARSA), образцы СМЖ свиней, которым внутривенно ввели AAV9-coARSA (обозначение в/в AAV9-coARSA), образцы СМЖ свиней, которым интратекально ввели AAV9-coARSA (обозначение и/в AAV9-coARSA).
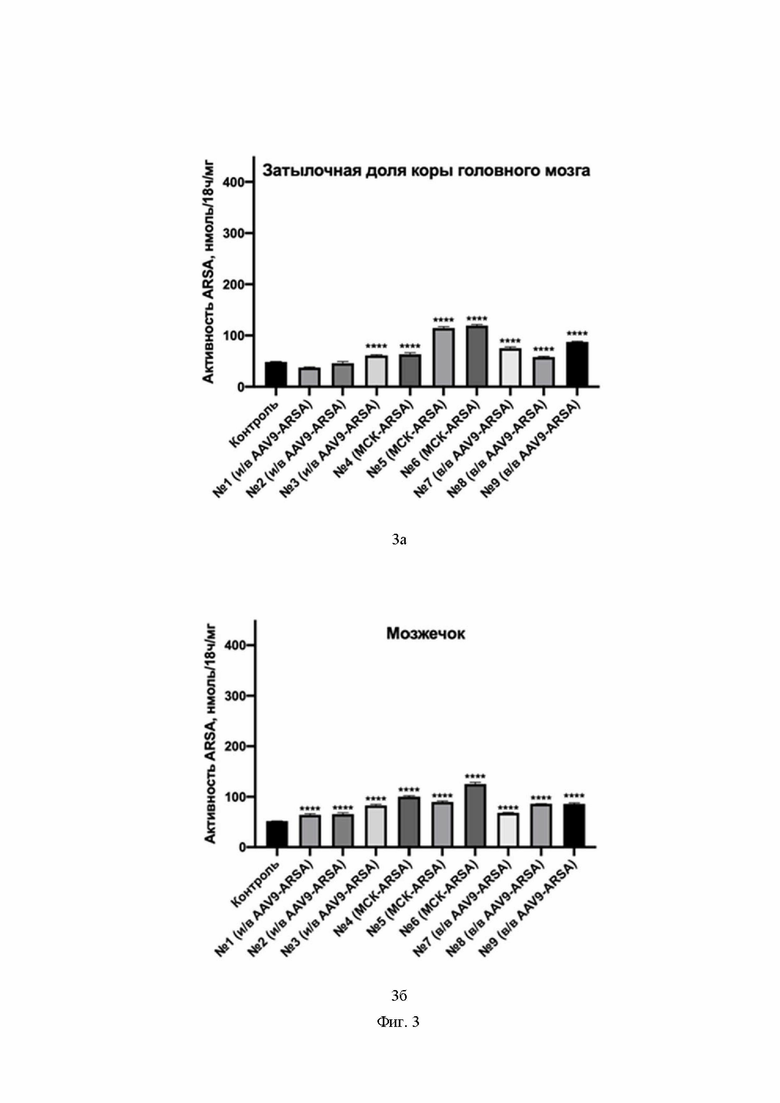
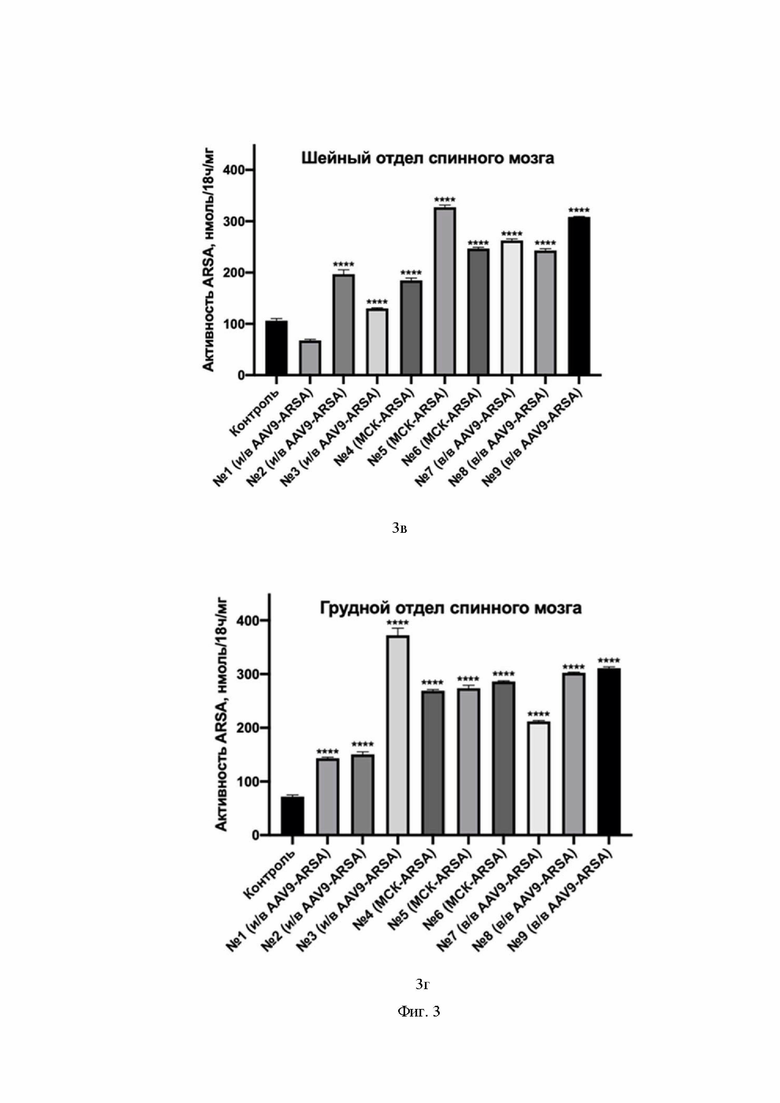
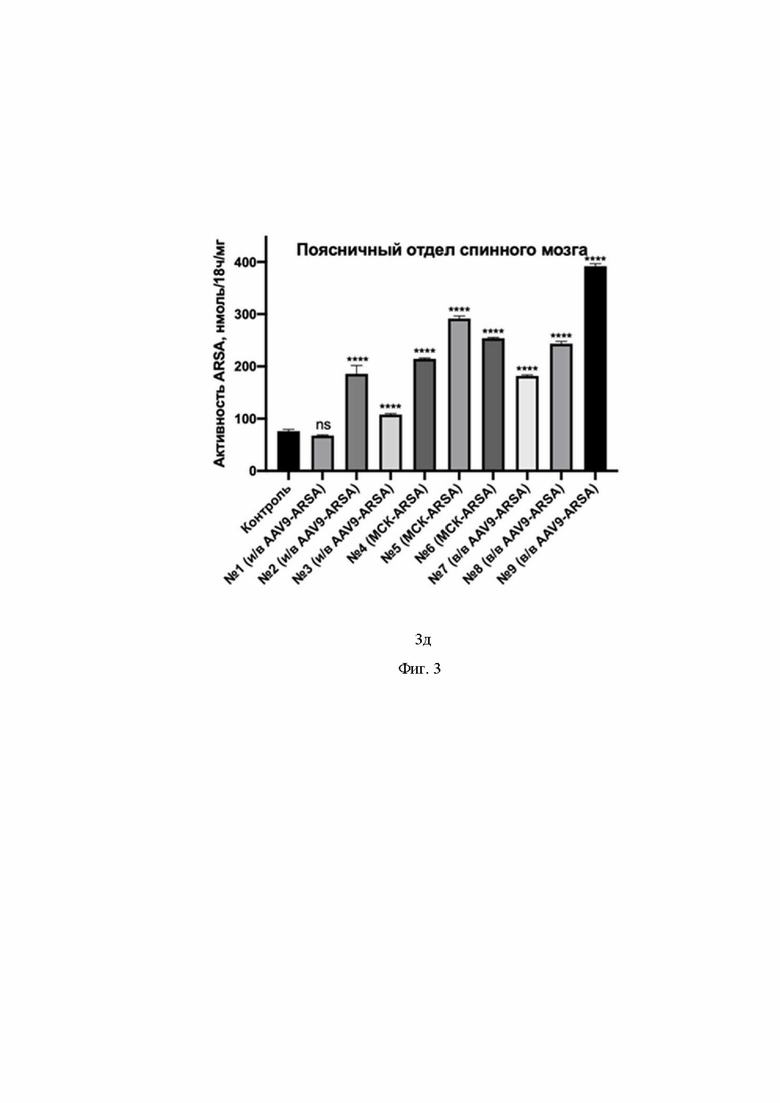
На Фиг. 3 показан уровень ферментативной активности ARSA в гомогенатах органов ЦНС свиней № 1 – № 9 на 35 сутки после введения препаратов: затылочная доля коры головного мозга (3а), мозжечок (3б), шейный отдел спинного мозга (3в), грудной отдел спинного мозга (3г), поясничный отдел спинного мозга (3д). По оси Х указаны образцы гомогенатов органов группы интактных свиней (обозначение контроль), образцы гомогенатов органов свиней, которым внутривенно ввели генетически модифицированные МСК (обозначение МСК-ARSA), образцы гомогенатов органов свиней, которым внутривенно ввели AAV9-coARSA (обозначение в/в AAV9-coARSA), образцы гомогенатов органов свиней, которым интратекально ввели AAV9-coARSA (обозначение и/в AAV9-coARSA).
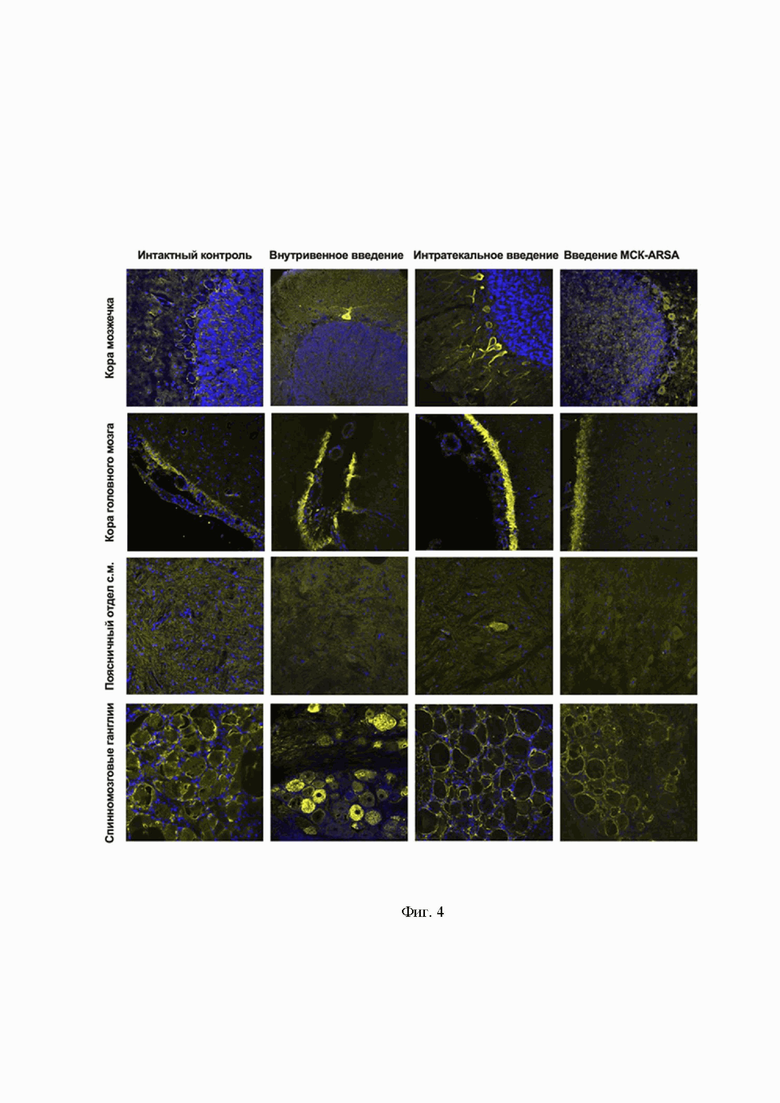
На Фиг. 4 показан анализ экспрессии ARSA путем иммуногистохимического анализа криостатных срезов органов ЦНС (по вертикали – кора мозжечка, кора головного мозга, поясничный отдел спинного мозга, спинномозговые ганглии). По горизонтали представлены образцы срезов органов контрольной группы свиней без введения AAV9-coARSA (обозначение интактный контроль), образцы срезов органов экспериментальной группы свиней с внутривенным введением AAV9-coARSA (обозначение внутривенное введение), образцы срезов органов экспериментальной группы свиней с интратекальным введением AAV9-coARSA (обозначение интратекальное введение) и образцы срезов органов экспериментальной группы свиней с внутривенным введением генетически модифицированных с помощью AAV9-coARSA МСК (обозначение введение МСК-ARSA).
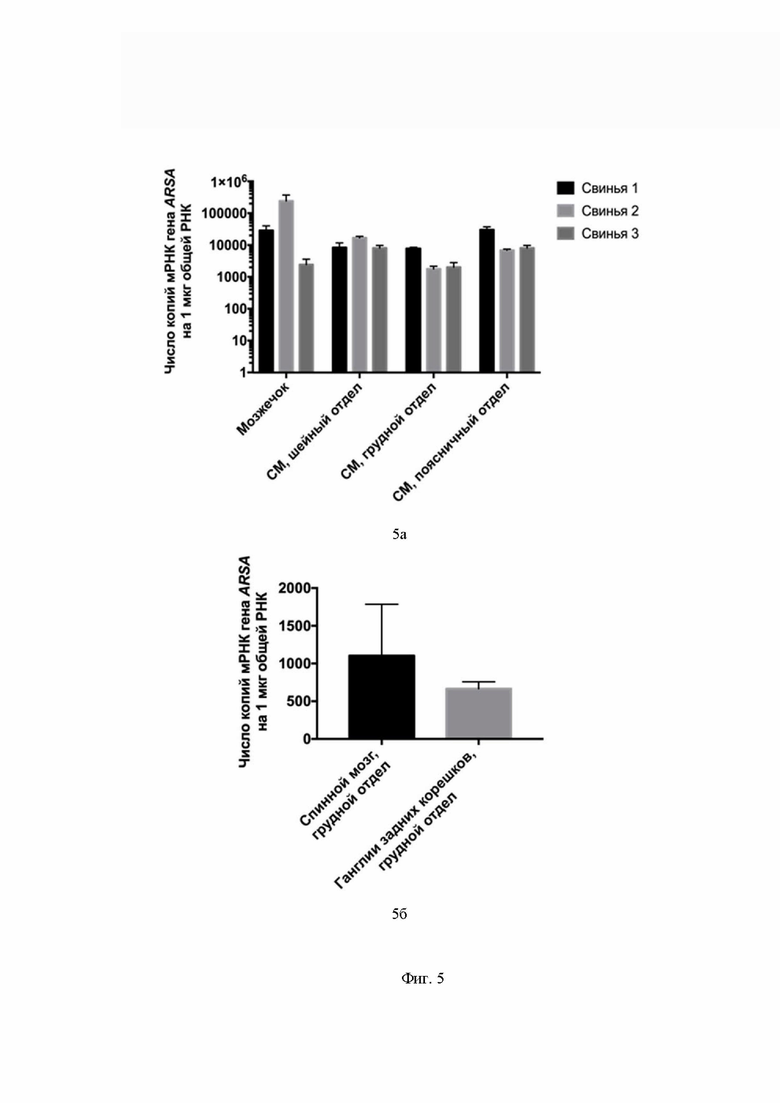
На Фиг. 5 показано количество копий мРНК гена ARSA в органах нервной системы свиней 1, 2, 3 на 35 сутки после введения препаратов. 5а – результаты интратекального введения AAV9-coARSA. 5б – результаты внутривенного введения AAV9-coARSA свинье №9. По оси Х указаны образцы РНК мозжечка, шейного отдела спинного мозга (обозначение СМ, шейный отдел), грудного отдела спинного мозга (обозначение СМ, грудной отдел), поясничного отдела спинного мозга (обозначение СМ, поясничный отдел). По оси У указано число копий мРНК гена ARSA на 1 мкг общей РНК. Данные получены с помощью количественной ПЦР.
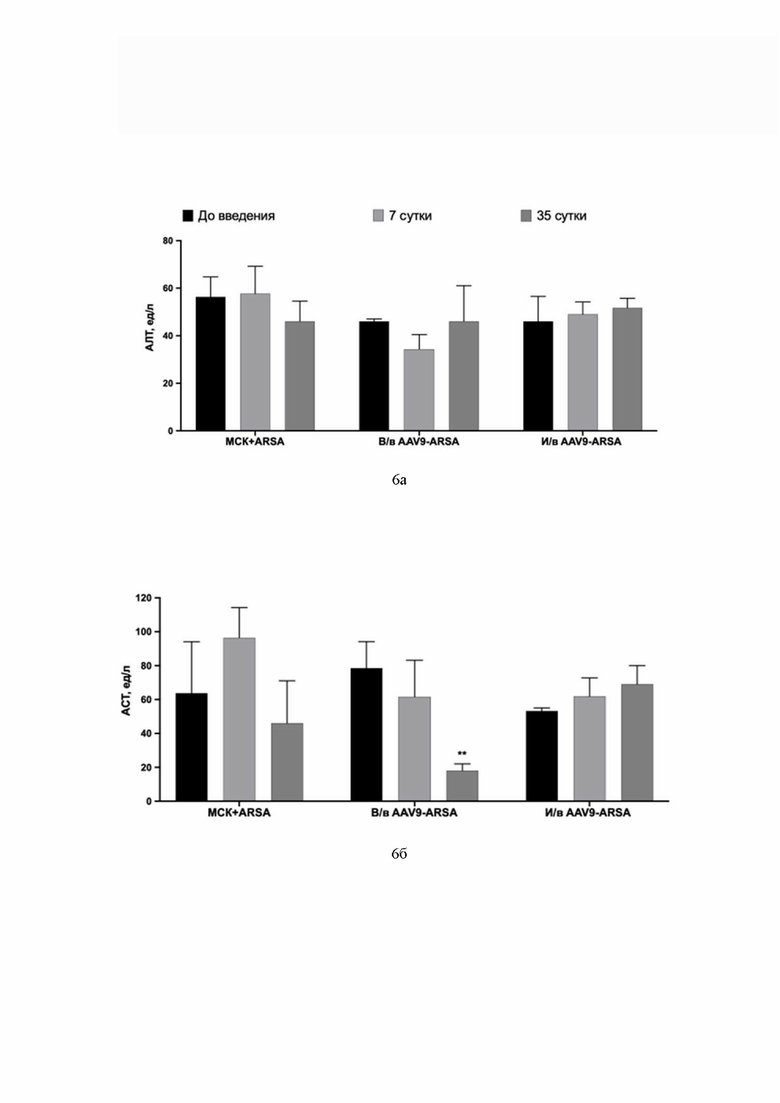
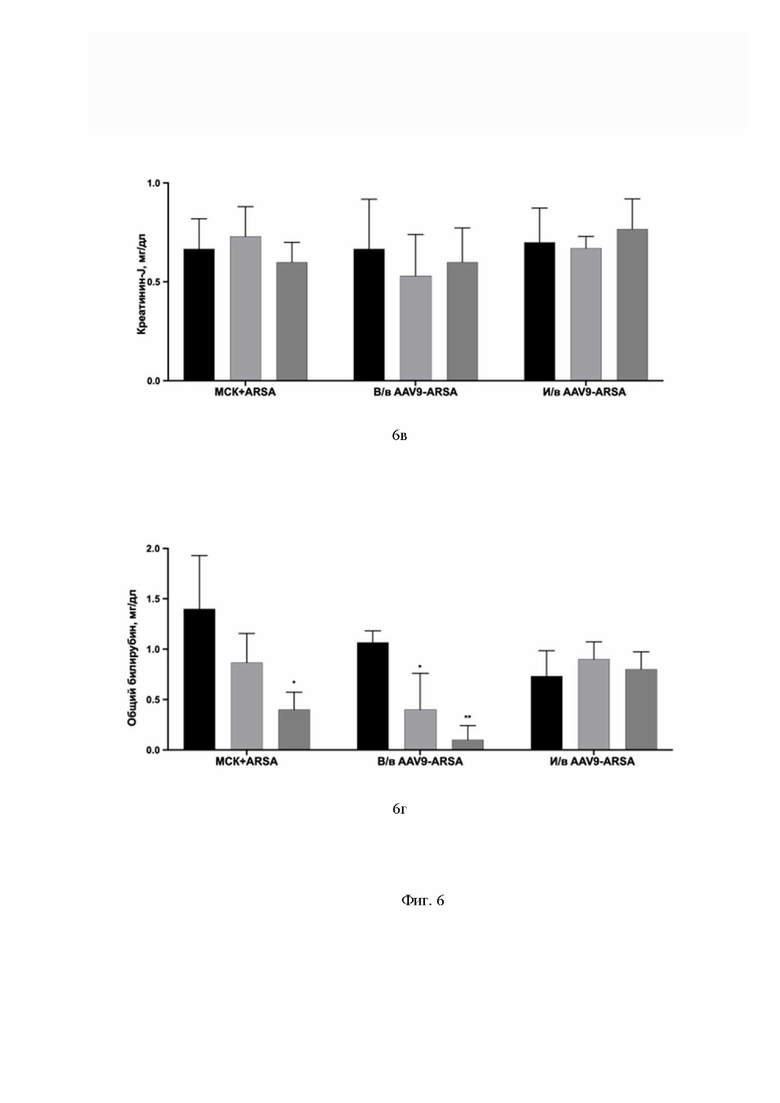
На Фиг. 6 показаны данные анализа уровней аланинаминотрансферазы (обозначение АЛТ) (6а), аспартатаминотрансферазы (обозначение АСТ) (6б), креатинина-J (6в) и общего билирубина (6г) в сыворотке крови свиней до введения, на 7 сутки, на 35 сутки. Данные получены с помощью иммуноферментного анализа (ИФА). По оси Х указаны образцы сыворотки экспериментальной группы свиней с внутривенным введением генетически модифицированных МСК с помощью AAV9-coARSA (обозначение МСК-ARSA), экспериментальной группы свиней с внутривенным введением AAV9-coARSA (обозначение в/в AAV9-coARSA), экспериментальной группы свиней с интратекальным введением AAV9-coARSA (обозначение и/в AAV9-coARSA).
Далее заявителем приведено описание заявленного технического решения.
Поставленная цель и заявленный технический результат достигаются путем внутривенного и/или интратекального введения AAV9-coARSA, и/или внутривенного введения модифицированных МСК-ARSA.
Идея заявленного технического решения основана на том, что благодаря способности МСК мигрировать в ГЭБ к нейровоспалению, введение генетически модифицированных МСК со сверхэкспессией ARSA обеспечивает равномерное распределение фермента по всей нервной системе. При интратекальном или внутривенном введении AAV9-coARSA нейроны трансдуцируются в широком диапазоне от места инъекции через антероградный нейрональный транспорт. Эта способность AAV9 позволяет достичь большего количества трансдуцированных участков мозга и достичь терапевтического эффекта минимально инвазивным способом. AAV9 также способен пересекать ГЭБ, внутривенное введение препарата. В результате разработки получен генный и генно-клеточный препарат, обладающий неизвестными из исследованного уровня техники лечебным эффектом, обеспечивающая возможность лечения ранее неизлечимого заболевания МЛД.
Практическая реализация заявленного изобретения осуществляется в 3 этапа в нижеприведённой последовательности, а именно:
1 этап: Получение и анализ функциональности векторной плазмиды pAAV-ARSA, содержащей уникальную кодон-оптимизированную последовательность гена ARSA;
2 этап: Получение и анализ функциональности препарата для генной терапии, а именно рекомбинантного аденоассоциированного вируса AAV9-coARSA, содержащего уникальную кодон-оптимизированную последовательность гена ARSA;
3 этап: Проверка эффективности и безопасности внутривенного, интратекального введения AAV9-coARSA и внутривенного введения МСК-ARSA крупным лабораторным животным.
Далее заявителем приведены примеры каждого из этапов осуществления заявленного технического решения.
Пример 1. Проведение 1 этапа – получение и анализ функциональности векторной плазмиды pAAV-coARSA, содержащей уникальную кодон-оптимизированную последовательность гена ARSA
Производили кодонную оптимизацию нуклеотидной последовательности гена. Для оптимизации кодонного состава гена ARSA использовали известные алгоритмы, например, OptimumGene (GeneScript, США), который учитывает различные факторы, влияющие на уровни экспрессии генов, такие, как смещение кодонов, GC-состав, содержание CpG-динуклеотидов, вторичную структуру мРНК, тандемные повторы, сайты рестрикции, которые могут помешать клонированию, преждевременные сайты полиаденилирования, дополнительные минорные сайты связывания с рибосомой.
Синтез и клонирование оптимизированной по кодонному составу кДНК гена ARSA в плазмидный вектор pAAV-MCS (Addgene, США) осуществляет компания GenScript (США). Правильность сборки генетической конструкции pAAV-coARSA подтверждали рестрикционным анализом.
Для подтверждения функциональности генетической конструкции pAAV-ARSA, им трансфицируют (генетически модифицируют) иммортализированую линию первичных человеческих эмбриональных клеток почки HEK293T. Для этого используют трансфекционный агент TurboFect (Thermo Fisher Scientific Inc., США) в соответствии с методикой, рекомендуемой производителем. Для оценки эффективности трансфекции в качестве положительного контроля используют плазмидный вектор pAAV-Katushka2S кодирующий дальне-красный флуоресцентный белок.
Эффективность экспрессии рекомбинантного белка in vitro с помощью полученной плазмидной конструкции подтверждают путем теста на активность и вестрн-блот.
Активность фермента ARSA определяют в лизате HEK293T через 24 часа после трансфекции. Концентрацию общего белка в образцах определяют с помощью набора Pierce™ BCA Protein Assay Kit (ThermoFisher Scientific, США). Образцы нормализовывают относительно концентрации общего белка. Для определения активности ARSA 50 мкл образца лизата клеток инкубируют с раствором субстрата нитрокатехол сульфата (0.01М p-Nitrocatechol sulfate dipotassium salt (#N7251, Sigma), 0,5 M ацетат натрия, 0,5 мM Na4P2O7, 10 % хлорид натрия, pH=5) в течение 1 часа при 37 °C, после чего останавливают реакцию добавлением 1 Н гидроксида натрия. В качестве стандартов используют разведения сульфатазы (#S9626, Sigma). Оптическую плотность измеряют при длине волны 515 нм.
Вестерн-блот анализ проводят с использованием первичных поликлональных антител кролика к ARSA (Кат. № PAG619Hu01, Cloud-Clone Corp., США) разведение 1:500 в блокирующем буфере. По результатам анализа заявителем в образцах лизатов клеток НЕК293Т, трансфицированных pAAV-ARSA, получены ожидаемые размеры около 33 кДа.
Пример 2. Проведение 2 этапа – получение и анализ функциональности препарата для генной терапии, а именно рекомбинантного аденоассоциированного вируса AAV9-coARSA, содержащего уникальную кодон-оптимизированную последовательность гена ARSA.
На основе плазмиды получают препарат на основе рекомбинантного вируса AAV9-coARSA. Для получения рекомбинантных AAV9 вирусов используют AAV Helper free system. Клетки AAV293 сеют в количестве 1,5 млн., монослой должен составлять 70-80%. На следующий день проводят ко-трансфекцию с использованием кальций-фосфатного метода тремя плазмидами (векторная плазмида, pAAV-RC и pHelper). Вирус собирают через 72 часа после трансфекции. Клетки собирают скребком, проводят криолиз, центрифугируют при 10 000 × g в течение 10 минут для избавления от клеточного дебриса. Вирусный сток хранят при –80 °C. Вирус концентрируют с использованием AAV Purification Mega Kit (Cell Biolabs, Inc., США) в соответствии с методикой, рекомендуемой производителем.
Полученным рекомбинантным вирусом трансдуцируют МСК для получения генно-клеточного прпарата. Эффективность генетической модификации полученными вирусными векторами проверяют путем вестрн-блот анализа и теста на активность фермента.
Пример 3. Проведение 3 этапа – проверка эффективности и безопасности препарата и способа с помощью внутривенного, интратекального введения AAV9-coARSA и внутривенного введения МСК-ARSA крупным лабораторным животным.
Эффективность и безопасность полученных генного и генно-клеточного препаратов проверяли на крупных лабораторных животных.
В экспериментальной работе использовали свиней в возрасте 4 месяцев (весом 5 кг), которые случайным образом распределили на 4 группы:
1) Контрольная группа интактных свиней без введения препарата;
2) Экспериментальная группа свиней (свиньи № 1-3), которым интратекально вводят рекомбинантный AAV9-coARSA, кодирующий фермент ARSA, в дозе 1 x 1012 геномных копий/кг;
3) Экспериментальная группа свиней (свиньи № 7-9), которым внутривенно вводят рекомбинантный AAV9-coARSA, кодирующий фермент ARSA, в дозе 3,77 x 1013 геномных копий/кг;
4) Экспериментальная группа свиней (свиньи № 4-6), которым внутривенно вводят МСК, генетически модифицированные с помощью AAV-coARSA, в количестве 2,7 млн. клеток/кг.
В каждой группе по 3 особи. Животных содержали в специализированных помещениях Казанской государственной академии ветеринарной медицины имени Н.Э. Баумана (КГАВМ) под наблюдением квалифицированного персонала. Все эксперименты проводили в соответствии с этическими стандартами и действующим законодательством.
До введения исследуемого препарата у свиней забирали образцы СМЖ, цельной крови в пробирки, содержащие антикоагулянт NaC и гель, активатор; плазму и сыворотку из цельной крови выделяли с помощью центрифугирования в течение 20 минут при 1900 об/мин, хранли СМЖ, плазму и сыворотку при -80 °С. Также цельную кровь и СМЖ забирали через 7, 14, 21 суток после введения клеток. Образцы плазмы и СМЖ использовали для определения ферментативной активности ARSA.
На 35 сутки после введения рекомбинантного AAV9-coARSA и МСК-ARSA свиней подвергали эвтаназии, с использованием методов, которые соответствуют принципам, изложенным в Рекомендациях Европейской комиссии по эвтаназии экспериментальных животных, извлекали спинной мозг (шейный, грудной, поясничные отделы), ганглии задних корешков (шейный, грудной, поясничные отделы), мозжечок, кору затылочной доли, скрытый нерв, сердце, печень, почки, селезенка, легкие. Все органы гомогенизировали для проведения теста на активность и ПЦР-РВ или препарировали для проведения ИГХ анализа.
Результаты, описанные на Этапах 1-3, приведены на Фиг. 1 – Фиг.6.
Графические материалы, иллюстрирующие примеры конкретного выполнения заявленного технического решения на Фиг.1 – Фиг.6, экспериментально доказали возможность достижения заявленных технических результатов.
Так, из данных, приведенных на Фиг. 1, видно, что ферментативная активность ARSA в плазме крови свиней увеличивается на 7-21 сутки.
После внутривенного введения AAV9-coARSA активность ARSA увеличивается до 124%, после интратекального введения AAV9-coARSA активность ARSA увеличивается до 26%, после внутривенного введения МСК-ARSA статистически значимого увеличения активности ARSA не детектируется. Такие результаты показывают, что интратекальное и внутривенное введение AAV9-coARSA крупным лабораторным животным приводит к трансдукции клеток, которые после чего начинают экспрессировать и секретировать функционально активный фермент, обнаруживаемый в плазме животных.
Из данных, приведенных на Фиг. 2, видно, что ферментативная активность ARSA в СМЖ свиней увеличивается от 17 до 74% на 7-21 сутки после интратекального введения AAV9-coARSA, сравнительно с образцами СМЖ до введения препарата.
После внутривенного введения AAV9-coARSA или МСК-ARSA увеличение ферментативной активности ARSA в СМЖ не наблюдалось. Такие результаты также подтверждают, что AAV9-coARSA кодирует активный фермент ARSA, а также говорят о том, что интратекальное введение вируса позволяет эффективнее трансдуцировать клетки ЦНС.
Из данных, приведенных на Фиг. 3, видно, что ферментативная активность ARSA в гомогенатах органов ЦНС увеличивается после введения препаратов. В гомогенате затылочной доли коры головного мозга активности ARSA увеличивается у всех свиней, кроме №1 и №2. У свиней №3, 4, 5, 6, 7, 8, 9 обнаружено увеличение на 26 %, 30 %, 136 %, 145 %, 54 %, 19 %, 80 %, соответственно.
В гомогенате мозжечка детектировано увеличение активности ARSA у всех свиней. У свиней №1, 2, 3, 4, 5, 6, 7, 8, 9 обнаружено увеличение на 23 %, 26 %, 59 %, 93 %, 73 %, 141 %, 31 %, 66 %, 65 %, соответственно.
В гомогенате шейного отдела спинного мозга детектировано увеличение активности ARSA у всех свиней, кроме №1. У свиней №2, 3, 4, 5, 6, 7, 8, 9 обнаружено увеличение на 85 %, 22 %, 74 %, 200 %, 132 %, 147 %, 129 %, 190 % соответственно.
Ферментативная активность ARSA увеличивается в гомогенате грудного отдела спинного мозга свиней. У свиней №1, 2, 3, 4, 5, 6, 7, 8, 9 обнаружено увеличение на 99 %, 109 %, 400 %, 273 %, 280 %, 300 %, 194 %, 320 % и 331 %, соответственно.
В гомогенате поясничного отдела спинного мозга детектировано увеличение активности ARSA у всех свиней, кроме №1. У свиней №2, 3, 4, 5, 6, 7, 8, 9 обнаружено увеличение на 144 %, 41 %, 182 %, 283 %, 233 %, 139 %, 220 %, 415 %, соответственно. Такие результаты показывают, что после генетической модификации полученным AAV9-coARSA клетки нервной системы начинают экспрессировать функционально активный фермент in vivo. Причем увеличение наблюдается во всех группах животных.
Из данных, приведенных на Фиг.4, видно, что анализ экспрессии ARSA в криостатных срезах органов нервной системы свиней путем иммуногистохимического анализа подтверждает успешную генетическую модификацию клеток нервной системы подопытных животных. Анализ экспрессии ARSA в коре мозжечка и в коре затылочной доли головного мозга при интратекальном введении показало различное количество нейронов Пуркинье внутри группы на S = 54,8 мм2: у 1 свиньи обнаружены единичные сверхэкспрессирующие ARSA нейроны Пуркинье, у 2 и 3 свиньи – не менее 100 и 20 сверхэкспрессирующих нейронов Пуркинье, соответственно.
В тоже время у контрольной свиньи (без введения AAV9-coARSA) экспрессия ARSA была ниже и чаще всего локализовалась лишь на периферии цитоплазмы тела клетки. Сверхэкспрессия ARSA у контрольной свиньи, аналогичная той, что обнаружена в опытной группе, найдена лишь у 1 клетки Пуркинье на S = 328,8 мм2. Анализ экспрессии ARSA в коре мозжечка головного мозга при внутривенном введении AAV9-coARSA показал различное количество нейронов Пуркинье внутри группы на S = 54,8 мм2: у 7 и 9 свиней были обнаружено от 5-10 сверхэкспрессирующих ARSA нейронов Пуркинье, у 8 свиньи – не менее 15 сверхэкспрессирующих нейронов Пуркинье, соответственно. Обнаруженные сверхэкспрессирующие ARSA нейроны Пуркинье чаще всего локализовались поодиночке в границах одной извилины. При внутривенном введении МСК-ARSA сверхэкспрессии ARSA в мозжечке, нейронах Пуркинье, в частности, не было обнаружено, интенсивность свечения ARSA и его распределение в клетке соответствовало контрольной группе животных. Анализ экспрессии ARSA в коре затылочной доли головного мозга, показал большую экспрессию ARSA в субарахноидальном пространстве у свиней с внутривенным введением AAV9-coARSA по сравнению с контрольной группой интактных животных и группой с внутривенным введением МСК-ARSA. Однако при статистической обработке средней интенсивности свечения ARSA в данной области достоверной разницы между группами не выявлено. Как у свиней 2 и 3 опытной группы, так и контрольной на поперечных срезах коры головного мозга были обнаружены ARSA+-клетки, специфическое свечение в которых было локализовано на периферии цитоплазмы тела клетки и частично в отростках Анализ экспрессии ARSA в шейном, грудном и поясничном отделах спинного мозга не показал достоверных различий в экспрессии ARSA в белом и сером веществе группы животных при интратекальном введении и контрольных животных. В белом веществе экспрессия ARSA была заметно выше, при сравнении с серым веществом, и локализовалась преимущественно в отростках и телах глиальных клеток. Общая картина экспрессии ARSA в поясничном отделе спинного мозга была схожей с вышеописанной. Однако в вентральных рогах поясничного отдела спинного мозга опытных свиней были обнаружены единичные сверхэкспрессирующие ARSA мотонейроны, что не наблюдалось у животных контрольной группы. Анализ экспрессии ARSA в спинномозговых ганглиях (шейный отдел), выявило сверхэкспрессирующие ARSA нейроны при внутривенном введении AAV9-coARSA. Количество сверхэкспрессирующих ARSA нейронов сильно варьировало внутри группы, однако достоверной разницы по данному показателю между спиномозговыми ганглиями выявлено не было. Экспрессия ARSA в спиномозговых ганглиях шейного отдела при внутривенном введении МСК-ARSA соответствовало аналогичному в контроле.
Анализ экспрессии ARSA в спинномозговых ганглиях (грудной отдел), выявил сверхэкспрессирующие ARSA нейроны при внутривенном введении AAV9-coARSA. Количество сверхэкспрессирующих ARSA нейронов сильно варьировало внутри группы, однако, достоверной разницы по данному показателю между спиномозговыми ганглиями выявлено не было. Экспрессия ARSA в спиномозговых ганглиях грудного отдела при внутривенном введении МСК-AAV9-coARSA соответствовало аналогичному в контроле. Анализ экспрессии ARSA в спинномозговых ганглиях (поясничного отдел), выявил сверхэкспрессирующие ARSA нейроны при внутривенном введении AAV9-coARSA. Количество сверхэкспрессирующих ARSA нейронов сильно варьировало внутри группы, однако, достоверной разницы по данному показателю между спиномозговыми ганглиями выявлено не было. Экспрессия ARSA в спиномозговых ганглиях поясничного отдела при внутривенном введении МСК-AAV9-coARSA соответствовало аналогичному в контроле.
Из данных, приведенных Фиг. 5, видно наличие сверхэкспрессия кодон-оптимизированного гена ARSA в органах ЦНС свиней, которым интратекально вводили AAV9-coARSA. В мозжечке, шейном, грудном, поясничном отделах спинного мозга свиньи №1 детектировано 28951, 8408, 7818, 30439 копий мРНК гена ARSA на мкг общей РНК, соответственно. В мозжечке, шейном, грудном, поясничном отделах спинного мозга свиньи №2 детектировано 243934, 17031, 1804, 6889 копий мРНК гена ARSA на мкг общей РНК, соответственно.
В мозжечке, шейном, грудном, поясничном отделах спинного мозга свиньи №3 детектировано 2436, 8104, 2027, 8104 копий мРНК гена ARSA на мкг общей РНК, соответственно. Количество копий мРНК гена ARSA в органах ЦНС и ПНС свиньи №9 на 35 сутки после внутривенного введения AAV9-coARSA в грудном отделе спинного мозга детектировано 1104 копий мРНК гена ARSA на мкг общей РНК. В ганглиях задних корешков грудного отдела детектировано 666 копий мРНК гена ARSA на мкг общей РНК. В группе с введением МСК-ARSA в образцах органов нервной системы мРНК гена ARSA не была обнаружена.
Из данных, приведенных на Фиг. 6, видно, что биохимические показатели в сыворотке крови свиней после интратекального введения AAV9-coARSA показали значения АЛТ, креатинина-J и билирубина остаются неизменными после введения препаратов. После внутривенного введения AAV9-coARSA и МСК-ARSA значения АЛТ и креатинина-J остаются неизменными. На 35 сутки после введения препарата уровень АСТ статистически значимо ниже у группы животных, которым внутривенно вводили AAV9-coARSA. Также уровень билирубина значительно снижается на 7 и 35 сутки после внутривенного введения AAV9-coARSA. После внутривенного введения генетически модифицированных МСК, на 35 сутки уровень общего билирубина значительно ниже, сравнительно с образцами до введения препарата.
Таким образом, из Примеров 1–3 и Фиг. 1 – Фиг.6 можно сделать вывод, что заявителем разработаны заявленные способы с применением заявленных препаратов:
– лечения метахроматической лейкодистрофии с применением заявленного препарата для генной терапии, а именно однократное внутривенное введение препарата, включающего рекомбинантный аденоассоциированный вирус 9 серотипа, содержащий кодон-оптимизированную последовательность гена ARSA, представленную SEQ ID NO: 1.
– лечения метахроматической лейкодистрофии с применением заявленного препарата для генной терапии, а именно однократное интратекальное введение препарата, включающего рекомбинантный аденоассоциированный вирус 9 серотипа, содержащий кодон-оптимизированную последовательность гена ARSA, представленную SEQ ID NO: 1.
– лечения метахроматической лейкодистрофии с применением заявленного препарата для генно-клеточной терапии, а именно однократное внутривенное введение препарата, состоящего из мезенхимных стволовых клеток, генетически модифицированных рекомбинантным аденоассоциированным вирусом 9 серотипа, содержащим кодон-оптимизированную последовательность гена ARSA, представленную в SEQ ID NO: 1.
При этом заявитель делает логический вывод о том, что, поскольку использование каждого заявленного способа по отдельности позволяет достигнуть заявленный технический результат, то он (заявленный технический результат) несомненно также будет достигнут при любом сочетании заявленных способов. При этом сочетание заявленных способов возможно использовать, например, при более тяжелых формах заболевания.
Исходя из очевидности сделанного вывода, заявителем не приведены примеры осуществления заявленных способов в любом их сочетании, при этом в формулу изобретения сочетание способов включены в качестве зависимых пунктов 6, 7, 8, так как они являются частными случаями способов по пунктам 3, 4, 5, а именно:
– способ, заключающийся в сочетании способов по п.3 и п.4;
– способ, заключающийся в сочетании способов по п.3 и п.5;
– способ, заключающийся в сочетании способов по п.4 и п.5.
Из описанного выше можно сделать общий вывод о том, что в заявленном техническом решении достигнуты все поставленные цели и реализованы все заявленные технические результаты, а именно:
1. Разработаны генный и генно-клеточный препараты для терапии МЛД.
2. Разработан способ генной и генно-клеточной терапии МЛД с применением рекомбинантного AAV9-coARSA и МСК, генетически модифицированных рекомбинантным AAV9-coARSA.
3. Достигнуто уменьшение инвазивности при лечении МЛД по сравнению с прототипом.
4. Повышена эффективность при лечении МЛД по сравнению с прототипом.
5. Достигнуто равномерное распределение терапевтического фермента.
При этом в примерах конкретного выполнения экспериментально доказано, что путем использования собранного генетического препарата и разработанного способа достигается увеличение количества и активности фермента ARSA, недостающего у пациентов с МЛД, в плазме крови, в СМЖ так и в гомогенате органов свиней.
В заявленном техническом решении заявителем разработан генный и генно-клеточный препарат в своей совокупности, характеризующийся тем, что обеспечивает возможность терапии пациентов страдающих МЛД. При этом, по мнению заявителя, принимая во внимание факт того, что из исследованного уровня техники известна как таковая технологии преодоления мезенхимными стволовыми клетками и аденоассоциированным вирусом 9 серотипа ГЭБ и доставки недостающего фермента в ЦНС при лизосомных болезнях накопления. Учитывая этот факт, можно утверждать, что заявленное техническое решение позволяет восстановить активность фермента в ЦНС и, следовательно, метаболизм сульфатидов, таким образом, достигается остановка нейродегенерации и излечение пациентов.
Заявленное техническое решение удовлетворяет условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены источники, в которых описаны признаки, совпадающие по исполняемой ими функции и форме выполнения этих признаков, перечисленные в формуле изобретения, включая характеристику назначения.
Заявленное техническое решение удовлетворяет условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, характеризующиеся созданием генного и генно-клеточного препарата и использованием способа терапии МЛД, подразумевающего интратекальное и внутривенное введение рекомбинантного AAV9-coARSA и внутривенное введение генетически модифицированных стволовых клеток, сверхэкспрессирующего гена ARSA, для восстановления активности фермента в ЦНС и остановки нейродегенерации. Кроме того, заявленное техническое решение, по мнению заявителя, не является очевидным для специалиста, так как обеспечивает реализацию задачи по остановке нейродегенерации и значительному облегчению симптомов МЛД, практически неизлечимой на дату представления заявочных материалов.
Заявленное техническое решение удовлетворяет условию патентоспособности «промышленная применимость», предъявляемому к изобретениям, так как оно может быть использовано в промышленных масштабах для создания препаратов, предназначенных для лечения МЛД.
--->
Перечень последовательностей
SEQUENCE LISTING
SEQ ID NO: 1
<110> федеральное государственное автономное образовательное учреждение
высшего образования "Казанский (Приволжский) федеральный университет"
(ФГАОУ ВО КФУ)) (federalnoe gosudarstvennoe avtonomnoe obrazovatelnoe
uchrezhdenie vysshego obrazovaniya "Kazanskij (Privolzhskij) federalnyj
universitet" (FGAOU VO KFU))
<120> Препарат для лечения метахроматической лейкодистрофии и способ лечения
<160> 1
<210> 1
<211> 1530
<212> DNA
<213> Artificial Sequence
<400> 1
atgtccatgg gcgccccccg gtctctgctg ctggcactgg cagcaggact ggcagtggcc 60
agacccccta acatcgtgct gatcttcgca gacgatctgg gatacggcga cctgggctgc 120
tatggccacc caagctccac cacacccaat ctggaccagc tggcagcagg aggactgagg 180
ttcaccgatt tttacgtgcc agtgagcctg tgtaccccat ccagggcagc actgctgaca 240
ggcaggctgc cagtgcgcat gggcatgtat cctggcgtgc tggtgccatc tagcagggga 300
ggactgccac tggaggaggt gaccgtggca gaggtgctgg cagccagagg ctacctgaca 360
ggaatggccg gcaagtggca cctgggagtg ggacctgagg gcgccttcct gccaccccac 420
cagggcttcc accggtttct gggcatccct tattcccacg accagggccc atgccagaac 480
ctgacctgtt ttcctccagc aacaccatgc gacggaggat gtgatcaggg actggtgcct 540
atcccactgc tggccaatct gtctgtggag gcacagccac cttggctgcc tggactggag 600
gcaaggtaca tggcattcgc acacgacctg atggcagatg cacagcggca ggatagacct 660
ttctttctgt actatgcctc ccaccacacc cactatccac agttcagcgg ccagtccttt 720
gcagagagga gcggaagggg accattcggc gactccctga tggagctgga tgccgccgtg 780
ggcaccctga tgacagcaat cggcgacctg ggactgctgg aggagaccct ggtcatcttc 840
accgccgata acggccccga gacaatgcgg atgtctagag gaggatgcag cggactgctg 900
agatgtggca agggaaccac atacgaggga ggcgtgcgcg agcctgcact ggcattttgg 960
ccaggacaca tcgcacctgg agtgacccac gagctggcat cctctctgga cctgctgcca 1020
acactggcag cactggcagg agcaccactg cctaatgtga ccctggacgg cttcgatctg 1080
tctccactgc tgctgggcac cggcaagtcc cccagacagt ctctgttctt ttaccccagc 1140
tatcctgatg aggtgcgggg cgtgtttgcc gtgagaaccg gcaagtacaa ggcccacttc 1200
tttacacagg gctctgccca cagcgacacc acagccgatc ctgcatgcca cgcaagctcc 1260
tctctgaccg cacacgagcc accactgctg tacgacctgt ccaaggaccc cggcgagaac 1320
tataatctgc tgggaggagt ggcaggagca acccctgagg tgctgcaggc cctgaagcag 1380
ctgcagctgc tgaaggcaca gctggacgca gcagtgacat tcggaccaag ccaggtggca 1440
aggggagagg accccgcact gcagatctgc tgtcaccctg gatgcacccc aaggccagca 1500
tgctgtcact gtcctgatcc acacgcctga 1530
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная генетическая конструкция, аденоассоциированный вирус для терапии метахроматической лейкодистрофии | 2023 |
|
RU2821568C1 |
| Способ терапии болезни Тея-Сакса и болезни Сандхоффа с помощью генетически модифицированных мезенхимных стволовых клеток человека со сверхэкспрессией β-гексозаминидазы A | 2020 |
|
RU2748383C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ В ЦНС АРИЛСУЛЬФАТАЗЫ А | 2011 |
|
RU2783380C2 |
| Препарат для стимулирования регенерации и нейропротекции нервной ткани и способ его использования | 2023 |
|
RU2828544C1 |
| ВЕКТОРЫ И ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2588667C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ В ЦНС АРИЛСУЛЬФАТАЗЫ А | 2011 |
|
RU2671503C2 |
| КОМПОЗИЦИИ, СПОСОБЫ И ПРИМЕНЕНИЯ ПЕРЕНОСА ГЕНОВ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2805606C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ МОЗГА | 2014 |
|
RU2664471C2 |
| ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ АТАКСИИ ФРИДРЕЙХА | 2018 |
|
RU2774892C2 |
| ВЕКТОРЫ НА ОСНОВЕ АДЕНОАССОЦИИРОВАННЫХ ВИРУСОВ ДЛЯ ЛЕЧЕНИЯ МУКОПОЛИСАХАРИДОЗОВ | 2016 |
|
RU2744593C2 |
Изобретение относится к области биотехнологии. Описан препарат для лечения метахроматической лейкодистрофии, включающий рекомбинантный аденоассоциированный вирус 9 серотипа, содержащий кодон-оптимизированную последовательность гена ARSA, представленную SEQ ID NO: 1, препарат для лечения метахроматической лейкодистрофии, состоящий из мезенхимных стволовых клеток, генетически модифицированных рекомбинантным аденоассоциированным вирусом 9 серотипа, содержащим кодон-оптимизированную последовательность гена ARSA, представленную в SEQ ID NO: 1, и способ лечения метахроматической лейкодистрофии. В одном из вариантов реализации способ лечения метахроматической лейкодистрофии включает однократное внутривенное введение вышеуказанных препаратов или однократное интратекальное введение препарата, включающего рекомбинантный аденоассоциированный вирус 9 серотипа. Изобретение расширяет арсенал средств для генной и генно-клеточной терапии метахроматической лейкодистрофии. 3 н.п. ф-лы, 6 ил., 1 табл., 3 пр.
1. Препарат для лечения метахроматической лейкодистрофии, включающий рекомбинантный аденоассоциированный вирус 9 серотипа, содержащий кодон-оптимизированную последовательность гена ARSA, представленную SEQ ID NO: 1.
2. Препарат для лечения метахроматической лейкодистрофии, состоящий из мезенхимных стволовых клеток, генетически модифицированных рекомбинантным аденоассоциированным вирусом 9 серотипа, содержащим кодон-оптимизированную последовательность гена ARSA, представленную в SEQ ID NO: 1.
3. Способ лечения метахроматической лейкодистрофии, заключающийся в однократном внутривенном введении препарата по п.1 или 2 или в однократном интратекальном введении препарата по п.1.
| А.А | |||
| Шаймарданова, Д.С | |||
| Чулпанова, В.В | |||
| Соловьева, А.И | |||
| Муллагулова, К.В | |||
| Китаева, А.А | |||
| Ризванов Новые терапевтические стратегии для лечения метахроматической лейкодистрофии // Гены и клетки | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| стр | |||
| Механический грохот | 1922 |
|
SU41A1 |
| WO 2014090404 A1, 19.06.2014 | |||
| WO 2020227166 A1, 12.11.2020. | |||
Авторы
Даты
2022-04-04—Публикация
2021-06-01—Подача