Изобретение относится к области экспериментальной медицины и касается создания нового эффективного средства для коррекции митохондриальной дисфункции у лабораторных животных.
Митохондриальные заболевания включают в себя нарушения, вызываемые огромным разнообразием молекулярных повреждений или дефектов, причем фенотипическое проявление заболевания дополнительно усложняется стохастическими распределениями митохондрий в различных тканях.
Известна генетическая конструкция для коррекции митохондриальной дисфункции (см. патент РФ № 2642972 по кл. МПК A61K48/00, опуб. 29.01.2018), представляющая собой участок митохондриальной ДНК, отсутствующий в мутантной ДНК, содержащий на концах последовательности нуклеотидов, комплементарные олигонуклеотидам SEQ ID №1 и SEQ ID №2 из набора олигонуклеотидов.
Данная конструкция только в перспективе может быть использована для коррекции митохондриальной дисфункции. Однако следует учесть, что все эксперименты проведены пока только на культуре клеток и нет исследований на животных.
Известен способ коррекции митохондриальной дисфункции при ишемии мозга в эксперименте (см. патент Украины № 104516 по кл. МПК А61P 25/28, опубл. 10.02.2016), заключающийся во введении нейропротективного средства, в качестве которого используют цереброкурин, который вводят внутрибрюшинно раз в сутки в дозе 0,02 мл / 100 г веса животного в течение 21 дня.
Однако, следует принять во внимание, что наилучшие результаты этот препарат показал при интрацеребральном введении (инъекция непосредственно в мозг) при исследовании на монгольских песчанках (Meriones uniculatus). Данный метод введения травматичен и нежелателен при массовом применении препарата.
Наиболее близким к заявляемому является иммуномодулирующее средство для инъекций, содержащее активное начало и целевые добавки (см. патент РФ № 2077882 по кл. МПК А61К 31/115, опубл. 27.04.1997). В качестве активного начала оно содержит формальдегид, а в качестве целевых добавок NaCl и дистиллированную воду, при этом оно представляет собой инъекционный раствор, содержащий, мас.%: формальдегид 0,07 0,24, NaCl 0,9 0,95, дистиллированная вода - остальное до 100%.
Приведенные аналоги показывают, что создание средств для коррекции митохондриальных дисфункций является далеко не решенной задачей. Поэтому поиск новых средств коррекции весьма актуален.
Технической проблемой заявляемого изобретения является создание эффективного и простого в применении средства для коррекции митохондриальной дисфункции в эксперименте.
Техническим результатом является повышение мембранного потенциала митохондрий и повышение кислородзависимого метаболизма нейтрофилов.
Технический результат достигается применением иммуномодулирующего средства, содержащего муравьиный альдегид в количестве 0,076-0,078% в изотоническом растворе хлорида натрия 0,85-0,95%-ной концентрации в качестве средства для повышения мембранного потенциала митохондрий и повышение кислородзависимого метаболизма нейтрофилов.
Известно, что естественный метаболит - альдегид муравьиной кислоты используется для иммунокоррекции при различных нарушениях иммунного статуса организма (см. патент РФ № 2077882), для лечения вирусных инфекций (см. патент РФ № 2146134), в качестве холестеринорегулирующего средства (см. патент РФ № 2352331), для активизации собственных стволовых клеток организма (см. патент РФ № 2376985).
Однако, до настоящего времени неизвестно использование препарата на основе муравьиного альдегида для коррекции митохондриальной дисфункии у лабораторных животных.
Изобретение поясняется иллюстрациями, где представлено:
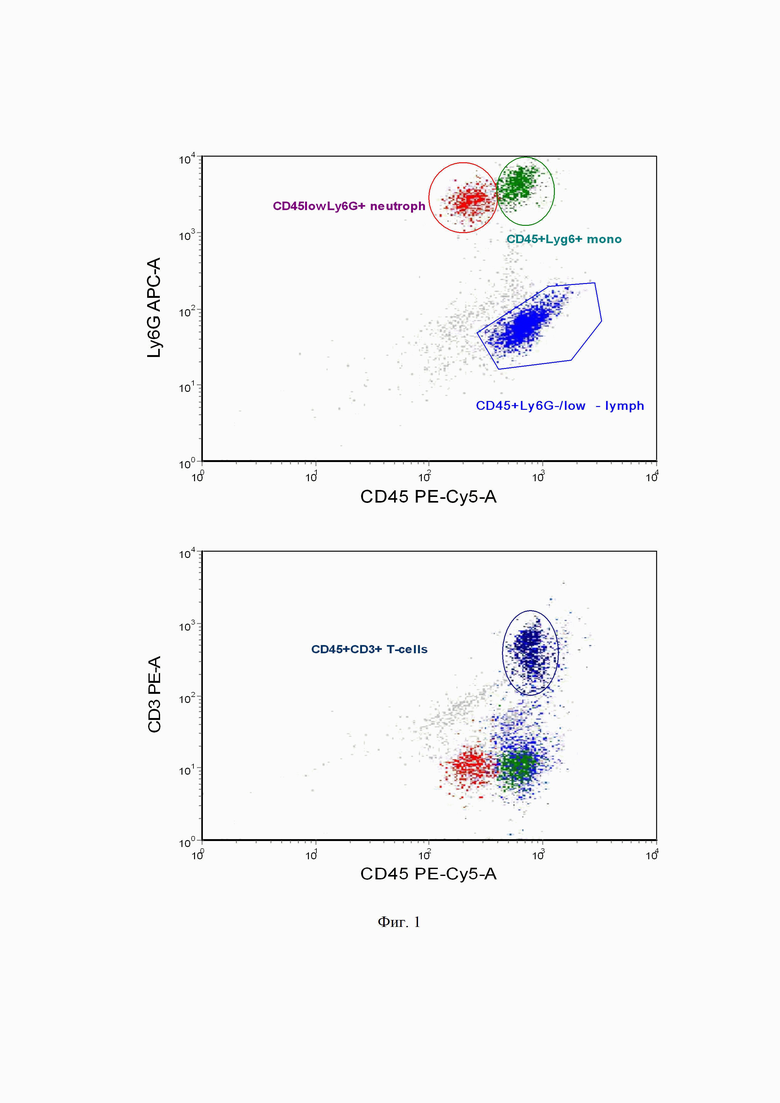
на фиг. 1 - субпопуляции клеток крови мышей всех групп, оцененных на предмет включения митохондриального красителя JC-1 и маркера апоптоза BCL-2, где А -оценка δψ потенциала митохондрий в пределах лимфоцитов (CD45+ Ly6G-), моноцитов (Ly6G+Cd45+) и нейтрофилов (Ly6G+CD45low), Б - количество BCL-2+, основного белка участвующего в апоптозе клеток.
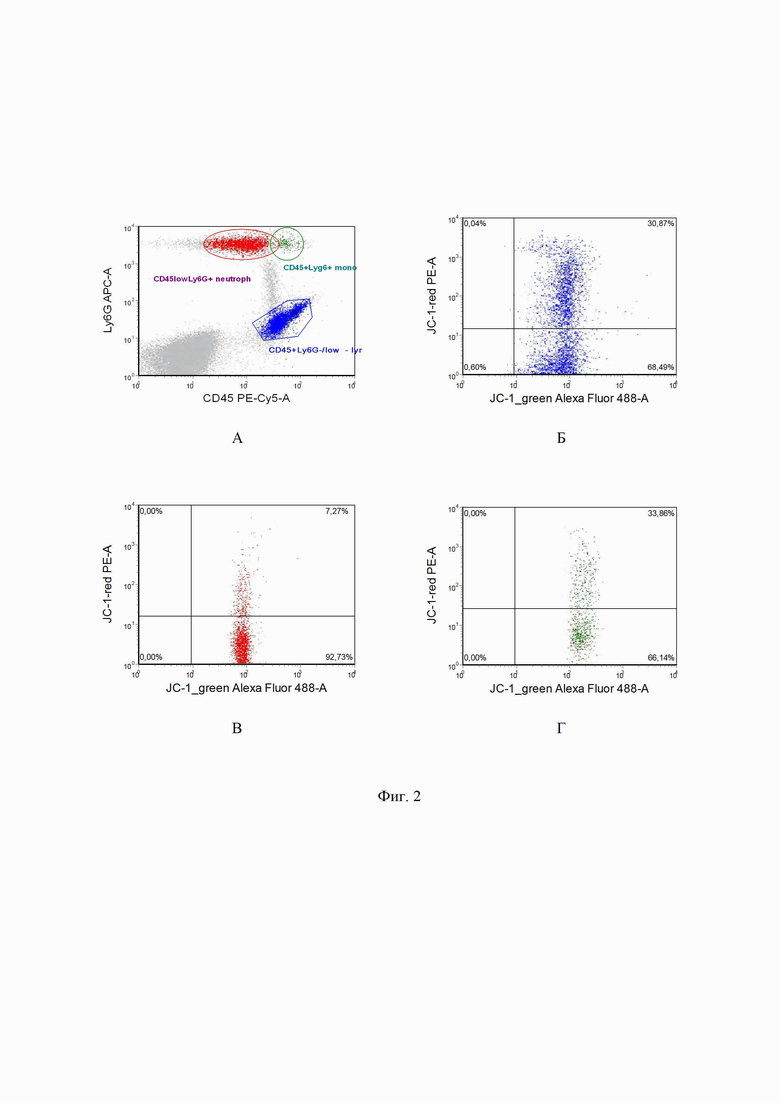
на фиг. 2 - пример оценки δψ потенциала митохондрий различных популяций, а также пропорции мономеров и агрегатов лимфоцитов, нейтрофилов и моноцитов крови мыши: где А - точечный график расположения клеток оцениваемых популяций образца в пределах лимфоцитов (популяция CD45+ Ly6G-), в пределах мoноцитов (популяция Ly6G+Cd45+ клетки), в пределах нейтрофилов (популяция Ly6G+CD45low клеток), Б - пропорция мономеров (правый нижний квадрант) - 68,5% и пропорция агрегатов (активированные клетки, правый верхний квадрант) - 30,8% в пределах популяции лимфоцитов; В - пропорция мономеров (правый нижний квадрант) - 92,7% и пропорция агрегатов (правый верхний квадрант) - 7,3% в пределах нейтрофилов; Г - пропорция мономеров ( правый нижний квадрант) - 66,1% и пропорция агрегатов (активированные клетки, правый верхний квадрант) - 33,9% в пределах популяции моноцитов.
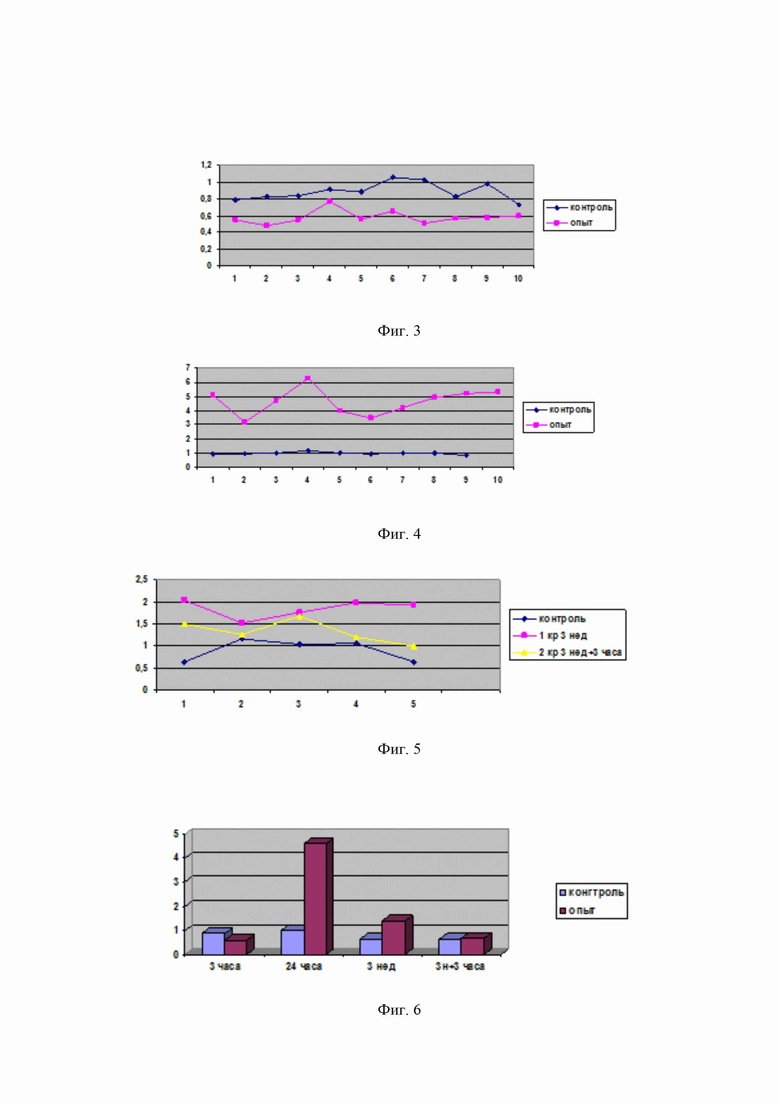
на фиг. 3, 4, 5 - изменения показателей кислород-зависимого метаболизма нейтрофилов крови через 3 часа после введения средства (фиг. 3), через 24 часа (фиг. 4), через 3 недели (фиг.5);
на фиг. 6 - сравнение средних показателей кислородзависимого метаболизма нейтрофилов крови методом хемилюминесценции во всех анализируемых группах мышей.
Водный раствор муравьиного альдегида (альдегид муравьиной кислоты) - прозрачная бесцветная жидкость со своеобразным острым запахом, смешивающаяся с водой и спиртом во всех соотношениях.
Муравьиный альдегид - представитель класса альдегидов НСОН. Представляет собой бесцветный газ с резким запахом, мол. массой 30,03, плотность его при 20°С равна 0,815, температура плавления 92°С, температура кипения 19,2°С. Хорошо растворим в воде, спирте.
Изотонический раствор натрия хлорида для инъекций - бесцветная прозрачная жидкость солоноватого вкуса. Раствор стерилен, апирогенен.
Хлорид натрия - кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в воде (1:3).
Заявляемое средство представляет собой прозрачную бесцветную жидкость без запаха слегка солоноватого вкуса.
Средство готовят следующим образом.
Берут 2 весовых части 36,5-37,5%-ного медицинского раствора муравьиного альдегида, добавляют его в 998 весовых частей стерильного 0,85-0,95%-ного раствора хлорида натрия для инъекций до получения 0,076-0,078%-ного раствора альдегида. Средство хранят в темном месте при температуре 15-35°С.
Для доказательств возможности коррекции митохондриальной дисфункции при введении заявляемого средства лабораторным животным проводилось 2 теста.
1. Проводилась оценка потенциала мембраны митохондрий с применением митохондриального флуоресцентного красителя JC-1, а также оценка пропорции клеток с признаками апоптоза на основании оценки пропорции BCL2+ популяций. Оба показателя оценивались иммунологически с применением метода проточной цитометрии.
2. Проводилась оценка кислородзависимой активации нейтрофилов методом хемилюминесценции
В первом тесте проводилась индивидуальная оценка активности митохондрий клеток крови каждого животного, во втором тесте для достижения адекватных результатов кровь животных пулировалась, при этом для каждой группы животных оценивалось 2 образца - кровь контрольной группы и пулированная кровь опытной группы.
Исследования проводились на 140 половозрелых мышах-самцах гибридах F1 (СВАхС57Вl6). Животные находились в стандартных полипропиленовых боксах для содержания животных в условиях вивария, при естественном световом режиме, на стандартном пищевом рационе (брикетированный корм ПК-120-1 ООО «Лабораторснаб», РФ) со свободным доступом к поилкам с водой.
Вся работа с лабораторными животными выполнялась в соответствии с общепринятыми этическими нормами и соответствовала правилам Европейской конвенции по защите животных, используемых для научных целей (ETS 123).
Средство вводили однократно внутримышечно в дозе 12,5 мл/кг, что соответствовало 0,25 мл препарата на мышь (масса тела мышей в среднем составляла 20,5±0,24 г.). Забой животных осуществляли методом декапитации под эфирным наркозом через 1, 3 и 24 часа после введения препарата. Контрольным животным вводили внутримышечно 0,25 мл 0,9% раствора хлористого натрия (физиологический раствор).
Оценка активности митохондрий под влиянием средства проводилась в нескольких группах животных:
1 - контроль (животные получали аналогичный испытуемому препарату объем физиологического раствора (0,9% раствор NaCL) -10 животных
2 - животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 1 час от введения -20 животных
3 - животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 3 часа от введения - 20 животных
4 - животные, получившие указанную дозу препарата и подвергнутые эвтаназии через 24 часа от введения - 20 животных
5 - животные, получившие препарат и подвергнутые эвтаназии через 3 недели отведения препарата -20 животных
6 - животные, получившие препарат двукратно (1-одномоментно с животными 2-5 групп и повторное введение через 3 недели от первого) и подвергнутые эвтаназии через 3 часа от повторного введения -20 животных.
Забор крови производили в одноразовые стерильные пробирки с раствором К2ЭДТА.
Пример 1. Изучение мембранного потенциала митохондрий (δψ).
Энергия, выделяемая в ходе реакций окисления в митохондриальной дыхательной цепи, хранится в виде отрицательного электрохимического градиента мембраны митохондрий, и δψ является поляризованным. Коллапс δψ приводит к деполяризации мембранного потенциала митохондрий, и часто, но не всегда, наблюдается на ранних стадиях апоптоза, также изменения данного показателя описаны во время процессов некроза (в результате деполяризации мембраны) и процессов остановки клеточного цикла (в результате гиперполяризации мембраны). Несмотря на идущие научные дискуссии, было сделано обобщение, что деполяризация митохондрий является одним из первых событий, происходящих во время апоптоза, и может даже быть предпосылкой для высвобождения цитохрома с.
Таким образом, деполяризация показателя δψ опосредовано может указывать на снижение функционального потенциала мембраны митохондрий, то есть об их деактивации, возможно в итоге приводящей к гибели клеток.
В настоящее время проточная цитометрия стала методом выбора для анализа мембранного потенциала митохондрий δψ в целых клетках. При этом в качестве тестового зонда используют мембранно-проницаемые липофильные катионные флуорохромы которые проникают в клетки, и их флуоресценция является отражением δψ. Одним из предложенных к оценке данного состояния флуорохромов является JC-1 (5,5’,6,6’-тетрахлор-1,1’,3,3’-тетраэтил-бензимидазол карбоцианин йодид), который является агрегатообразующим катионным красителем, чувствительным к δψ.
Спектр излучения флуоресценции JC-1 зависит от его концентрации, которая, в свою очередь, определяется состоянием δψ. JC-1 может существовать в двух различных состояниях, агрегатах или мономерах, каждый из которых имеет разные спектры излучения. JC-1 образует мономеры при низких концентрациях красителя и агрегаты при более высоких концентрациях. Как агрегаты JC-1, так и мономеры проявляют флуоресценцию в зеленом конце спектра, которая измеряется в зеленом канале (FL-1) на проточных цитометрах.
Когда живые клетки инкубируются с JC-1, JC-1 проникает в плазматическую мембрану клетки как мономер. Поглощение JC-1 в митохондрии обусловлено δψ. Далее δψ нормальных, здоровых митохондрий поляризуется и JC-1 быстро поглощается такими митохондриями. Это поглощение увеличивает градиент концентрации JC-1, что приводит к образованию агрегатов JC-1 (известных как J-агрегаты) в митохондриях.
Агрегаты JC-1 демонстрируют красный спектральный сдвиг, приводящий к более высоким уровням излучения красной флуоресценции, которое измеряется в красном канале (FL-2) на большинстве проточных цитометров.
Таким образом, на основании оценки количества JC-1green+ (мономеры) и JC1red+ (агрегаты) клеток можно говорить о состоянии мембраны митохондрий в изучаемом пуле клеток и преобладание JC1red+ (агрегаты) клеток будет косвенно указывать на активацию митохондрий.
Важно, что краситель JC-1 может использоваться как качественная (учитывая сдвиг от зеленого к красному излучению флуоресценции), так и количественная (учитывая только чистую интенсивность флуоресценции) мера мембранного потенциала митохондрий.
Накопление флуоресцентных красителей в митохондриях можно оптически обнаружить с помощью проточной цитометрии, флуоресцентной микроскопии, конфокальной микроскопии и с помощью считывателя флуоресцентных пластин.
Использование определения коэффициента флуоресценции дает исследователям возможность сравнивать измерения мембранного потенциала, а также оценивать процент деполяризации митохондрий, происходящей в патологическом состоянии (например, клеточный стресс, апоптоз и т. Д.).
Учитывая то, что таким образом изучается не столько активация митохондрий, сколько апоптоз, то для исключения вероятности данного процесса параллельно те же самые клетки крови животных изучены на предмет количества BCL-2+ клеток с применением метода многопараметровой проточной цитометрии.
Оценка δψ потенциала митохондрий и количество BCL-2+ клеток изучалось иммунологически с применением методов проточной цитометрии в крови в пределах нескольких популяций цельной крови мышей.
В пределах лейкоцитов - CD45+ клетки, в пределах лимфоцитов (популяция CD45+ Ly6G-) в пределах мoноцитов (популяция Ly6G+Cd45+ клетки), в пределах нейтрофилов (популяция Ly6G+CD45low клеток), а также дополнительно количество BCL-2+ клеток оценено в пределах CD45+CD3+ Т-клеток. Оцениваемые популяции представлены на фиг 1 А, Б.
На фиг. 2 А - показан точечный график расположения клеток оцениваемых популяций образца в пределах лимфоцитов (популяция CD45+ Ly6G-), в пределах мoноцитов (популяция Ly6G+Cd45+ клетки), в пределах нейтрофилов (популяция Ly6G+CD45low клеток).
На фиг. 2 Б видно, что пропорция мономеров (правый нижний квадрант) составляет 68,5%. Пропорция агрегатов (активированные клетки, правый верхний квадрант) - 30,8% в пределах популяции лимфоцитов крови мыши.
На фиг. 2 В видно, что пропорция мономеров (правый нижний квадрант) составляет 92,7%. Пропорция агрегатов (правый верхний квадрант) - 7,3% в пределах нейтрофилов.
На фиг. 2 Г - пропорция мономеров (правый нижний квадрант) - 66,1%. Пропорция агрегатов (правый верхний квадрант) - 33,8% в пределах моноцитов периферической крови мыши.
Пример 2. Оценка кислород-зависимой активации нейтрофилов проводилась методом хемилюминсценции.
Пулированную периферическую кровь (5 контролей и 10 опытных особей) разбавляли рабочим раствором Хэнкса с гепарином в соотношении 1:1 и выделяли мононуклеары посредством центрифугирования при 3000 об/мин 1 час на градиенте плотности фиколл-гиппак (10 мл 10771 г/см3 и 10 мл г/см3 11191 Merc).
Кольцо мононуклеаров аккуратно отбирали, мононуклеары переносили в пробирку и разбавляли раствором Хэнкса с гепарином 1:5, аккуратно ресуспендировали и центрифугировали 10 минут при 3000 об/мин. В полученном образце убирали надосадок, а осадок диспергировали в 2 мл рабочего раствора Хэнкса с гепарином.
Производили подсчет клеток в полученном растворе в камере Горяева в 16 квадратах.
Далее на люминометре LKB WALLAC 1251 Luminometer запускали программу и оценивали люминол-зависимую зимозан-индуцированную хемилюминесценцию в 10 кюветах с контрольными образцами и в 10 кюветах с опытными образцами с общей концентрацией клеток в каждой кювете 1*106 в растворе Хэнкса с добавлением люминола. Исходя из количества заданных циклов по программе, величина пика Imax была достигнута с последующим понижением.
В таблице 1 представлены результаты исследования кислородзависимой активации нейтрофилов методом хемилюминесценции через 3 часа после введения средства.
Таблица 1.
Судя по полученным данным, видимой разницы между контролем и опытом (животные, забитые через 3 часа после введения препарата) не наблюдается, и можно сделать вывод о том, что спустя 3 часа после внутримышечного введения препарата изменения показателей кислород-зависимого метаболизма нейтрофилов крови не выявлены, а скорее даже несколько подавлены с учетом данных опытной группы (см. фиг. 3). На фиг. 3 по горизонтальной оси указаны номера исследованных кювет, а по вертикальной оси указаны значения максимального показателя хемилюминесценции Imax, mV.
Экспериментальные данные результатов исследования кислород-зависимой активации нейтрофилов методом хемилюминесценции через 24 часа после внутримышечного введения я средства представлены в таблице 2, где показано, что через сутки после достигается значительное достоверное (р=0,01) увеличение максимального показателя хемилюминесценции Imax, отношение среднего значения опытного к контролю составляет 4,655162.
Таблица 2.
Следует отметить, что в 10 -й кювете в контроле явно виден дискордантный (выбивающийся из общих значений) результат, поэтому при оценке среднего результата его не учитывали.
Полученные данные позволяют говорить о существенном повышении кислородозависимого метаболизма нейтрофилов под влиянием испытуемого препарата, что опосредованно можно расценить как активация митохондрий в данной клеточной субпопуляции (см. Фиг. 4). На фиг. 4 по горизонтальной оси указаны номера исследованных кювет, а по вертикальной оси указаны значения показателя Imax, mV.
Результаты исследований кислород-зависимой активации нейтрофилов методом хемилюминесценции через 3 недели после внутримышечного (в/м) введения средства (группа 5, пул из 5 животных) и после двухкратного в/м введения (группа 6, пул из 5 животных) представлены в таблице 3.
Таблица 3.
3 недели+3 часа 2-кратное введение препарата)
Для подтверждения результатов был выполнен дополнительный анализ оставшихся десяти животных (5 из 5 группы и 5 из 6 группы) (см. таблица 4).
Таблица 4.
Согласно полученным данным, выявлена тенденция к практически 2-кратному повышению активности нейтрофилов у животных, исследования которых проводили через 3 недели после первого введения препарата. У отдельных животных, подвергшихся двукратному введению препарата, также выявлена разница в активации нейтрофилов в сравнении с контролем, но в целом при этом однократное введение препарата было более эффективным в сравнении с двукратным введением.
На фиг. 6 представлено сравнение средних показателей хемилюминесценции во всех анализируемых группах. По горизонтальной оси указано время исследования после инъекции препарата, а по вертикальной оси указаны результаты Imax, mV. На фигуре 6 представлено сравнение средних показателей хемилюминесценции во всех анализируемых группах и видно, что под влиянием заявляемого средства проявляется кислород-зависимая активация нейтрофилов. При этом максимальный эффект выявлен спустя сутки от введения препарата, данный эффект сохранялся в течение трех недель, постепенно снижаясь.
Таким образом, после проведения экспериментов выявлено влияние препарата на δψ митохондрий. Через несколько часов после введения препарата происходит активация нормальных здоровых митохондрий, что проявляется в их поляризации. Данные процессы выявлены на разных сроках от введения препарата и в различных клеточных популяциях. На более ранних сроках наибольший и равномерный эффект проявился на моноцитах, в то время как более длительное воздействие препарата приводило к поляризации мембран в лимфоцитах и у некоторых особей в суммарной популяции моноцитов-нейтрофилов крови. Полученные данные подтверждают возможность активации митохондрий под влиянием заявляемого средства.
Изобретение относится к применению иммуномодулирующего средства для внутримышечных инъекций, содержащего муравьиный альдегид в количестве 0,076-0,078% в изотоническом растворе хлорида натрия 0,85-0,95%-ной концентрации для повышения мембранного потенциала митохондрий и повышения кислородзависимого метаболизма нейтрофилов. 6 ил., 4 табл., 2 пр.
Применение иммуномодулирующего средства для внутримышечных инъекций, содержащего активную часть в виде муравьиного альдегида в количестве 0,076-0,078% и добавку в виде изотонического раствора хлорида натрия для инъекций 0,85-0,95%-ной концентрации - остальное, в качестве средства для повышения мембранного потенциала митохондрий и повышения кислородзависимого метаболизма нейтрофилов.
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 1995 |
|
RU2077882C1 |
| БЕЛЬСКИХ ЭДУАРД СЕРГЕЕВИЧ "Клинико-функциональная оценка роли митохондриальной дисфункции при обострении" Диссертация на соискание учёной степени кандидата медицинских наук | |||
| Рязань, 2019 г | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
Авторы
Даты
2022-01-31—Публикация
2021-07-12—Подача