Область техники
Изобретение относится к области физиологии и медицины, а именно к онкологии, иммунологии, неврологии, геронтологии, кардиологии и используется для лечения прогрессирующих фатальных сердечно-сосудистых, онкологических, нейродегене-ративных, аутоиммунных и наследственных болезней цивилизации (БЦ), протекающих с объективно подтвержденным моно- или олигоклональным кроветворением (гемопоэзом). Изобретение направлено на профилактику старения и внезапной смерти человека, остановку прогрессирования и предотвращения рецидивов иммуноассоциированных БЦ путем перепрограммирования системного иммунного ответа организма на существующие патогены, репарацию клеточных систем врожденного иммунитета и восстановления поликлональности кроветворения как фундаментальной биологической основы здоровья и долголетия млекопитающих и человека.
Предшествующий уровень техники
Мировым трендом в развитии современной системы здравоохранения является персонализированная медицина, также называемая персонифицированной, прецизионной, индивидуализированной медициной, которая представляет собой совокупность методов профилактики патологического состояния, диагностики и лечения в случае возникновения этого состояния. Эти методы основаны на индивидуальных особенностях пациента, к которым относят генетические, эпигенетические, транскриптомные, протеомные, метаболомные и метагеномные маркеры, а также совокупность вариативных фенотипических признаков как всего организма пациента, так и его отдельных тканей или клеток.
Расшифровка генома человека и генетизация медицины привели к появлению нового направления в персонализированной медицине − генной терапии, которое базируется на достижениях молекулярной биологии, генной и клеточной инженерии, а также новых информационных технологиях. Изначально под генной терапией понималось лечение наследственных заболеваний путем коррекции мутантных генов на уровне хромосомной ДНК. Однако сложность проблемы заставила ученых пересмотреть взгляды на методологию. К настоящему времени исследователи лишь «нащупали» подходы к такому решению проблемы (технология химеропластики). Ввиду сложности задачи корректировки генома, наибольшее распространение получили методы, основанные на введении в организм больного полноценных функционально активных (терапевтических) генов в составе плазмидной ДНК (А.А. Бабаев с соавт., 2007). В последние годы генная терапия получила новый инструмент коррекции генома, называемый редактированием генов, или редактированием геномов. Это тип генной инженерии, при котором ДНК вставляется, удаляется или заменяется в геноме организма с использованием специализированных программируемых нуклеаз или «молекулярных ножниц» (Ребриков Д.В., 2016). Быстро развивающиеся технологии редактирования генома из научно-исследовательских лабораторий уверенно переходят в клиническую практику. Разработаны принципиально новые методы изменения генома человеческих эмбрионов на ранних стадиях развития, и к клиническому применению разрешены самые дорогостоящие инновационные генотерапевтические препараты. Создан молекулярный инструментарий для исправления генетических нарушений у людей в любом возрасте. Врач, по сути, становится корректором генетической инструкции по построению и функционированию организма человека. Однако безопасность этих технологий вызывает много вопросов и сомнений, так как нельзя исключить ошибки в расчетах и ятрогенный фактор. Поэтому разработка и создание новых более безопасных технологий генной терапии для персонализированной медицины, основанных на альтернативных геномному редактированию научных принципах работы, приобретает большую актуальность и практическую значимость для клиники.
Одно из уже реализованных решений борьбы с с различными фатальными неинфекционными болезнями было разработано в 60-х годах прошлого века и называется трансплантацией (пересадкой) костного мозга (КМ) или трансплантацией гемопоэтических стволовых клеток (ГСК). КМ - единственная ткань взрослого организма, содержащая в норме большое количество незрелых, недифференцированных и низкодифференцированных клеток, так называемых стволовых клеток (СК), близких по строению к эмбриональным клеткам. Все другие незрелые клетки, например, незрелые клетки кожи, имеют более высокую степень дифференцировки и зрелости, чем клетки КМ, и имеют уже заданную специализацию. Это уникальное свойство СК КМ и позволило разработать универсальную технологию перепрограммирования иммунитета пациента с БЦ путем трансплантации КМ. Именно трансплантация КМ позволила впервые в мире полностью излечить ряд онкологических пациентов с терминальными формами гемобластозов и лимфоидными злокачественными новообразованиями (ЗНО), а также показать клиническую эффективность трансплантации КМ еще при более чем 300 иммуноассоциированных генетических, онкологических и аутоиммунных фатальных БЦ человека. Однако эта технология имеет риск смертельного исхода в 6-10% случаев и ряд серьезных фатальных осложнений (венооклюзионную болезнь, реакцию «трансплантат против хозяина», пневмониты, неприживление трансплантата у пациента и др.). Поэтому поиск менее смертельной и более безопасной альтернативы для перепрограммирования и перезапуска иммунитета у пациентов с иммуноассоциированными БЦ имеет крайне важное и крайне актуальное значение для всей мировой медицины.
Одним из рекомендуемых научных подходов к лечению старения и терапии многих БЦ может стать биотехнология, основанная на блокировании молекулярных механизмов клонального гемопоэза (КГ) (Jaiswal S., 2020). Природоподобное изменение генома доминирующего клона ГСК и ГПК в кроветворении млекопитающих, включая человека, было бы способно привести к физиологическому блокированию репродуктивных и функциональных свойств этих клеточных систем, позволило бы снизить процентное количество патоспецифичных (иммунотоллерантных или иммуноагрессивных) иммунокомпетентных потомков этих клеток в общем объеме циркулирующей крови организма с моно- или олигоклональным гемопоэзом и за счет активации подавленных клонов ГСК и ГПК восстановить поликлональность кроветворения и остановить или профилактировать прогрессирование патологических процессов болезни или старения и даже предотвращать внезапную смерть. Однако технологические решения для реализации этого подхода в эксперименте и в клинике пока что не известны.
В качестве наиболее близкого к настоящему изобретению решения может быть принят способ лечения онкологических, нейродегенеративных, аутоимунных заболеваний и травм головного и спинного мозга с использованием биомедицинского клеточного продукта БМКП), который состоит из линии аутологичных или аллогенных ГСК и ГПК, выделенных из нативного КМ путем эксфузии или из периферической крови (ПК) путем лейкоцитофереза, размноженных путем культивирования в лейкоконцентрате мононуклеаров (МНК) в среде, препятствующей гемопоэтической дифференцировке, для увеличения общего количества ГСК и ГПК не менее 1,5% от общего количества МНК в биомедицинском клеточном продукте и приобретения первичных гемопоэтических, регуляторных и регенеративных свойств ГСК и ГПК, и инкубированных с лекарственным препаратом двухцепочечной ДНК (дцДНК) человека для активации гемопоэтических, регуляторных и регенеративных свойств этих клеток, причем в качестве препарата дцДНК человека использована стерильная форма лекарственной субстанции Панаген® (патент РФ на изобрение № 2798554, публ. 23.06.2023, МПК C12N 5/071, A61K 35/28, A61P 35/00, A61P 25/28, A61P 37/00). Активация гемопоэтических, регуляторных и регенеративных свойств ГСК и ГПК в результате их инкубирования с препаратом Панаген® в этом известном техническом решении не обеспечивает реконструкцию и восстановление молекулярной структуры ГСК и ГПК и их вывод в терминальную дифференцировку, что не дает возможности восстановления (регенерации, реституции) свойств КМ, утраченных в результате приобретенного КГ (моно- или олигоклонального гемопоэза), с восстановлением поликлональности последнего.
Сущность изобретения
Задачей настоящего изобретения является разработка и создание природоподобного способа остановки прогрессирования и рецидивов различных неинфекицонных (в частности, онкологических, нейродегенеративных, сердечно-сосудистых и наследственных) БЦ, осложненных КГ, и профилактики старения и внезапной смерти путем блокирования моно - и олигоклональности гемопоэза и восстановления поликлональности кроветворения организма млекопитающего для реставрации молекулярно-биологического потенциала врожденного иммунитета, а также определение перспектив клинического применения этого способа для увеличения средней продолжительности жизни и активного долголетия у пожилых и старых людей и других млекопитающих.
Указанная задача решается в настоящем изобретении тем, что предложен персонализированный способ реституции КМ для профилактики старения, внезапной смерти и остановки прогрессирования различных фатальных неинфекционных болезней, осложненных КГ, включающий следующие стадии:
(а) проводят геноориентированную молекулярно-биологической диагностику гемопоэтических стволовых клеток (ГСК) костного мозга (КМ) с маркерами CD34+, CD45+ и лейкоцитов ПК пациента путем геномного анализа с использованием секвенирования экзома или ПЦР-диагностики для выявления дополнительных соматических мутаций в генах клональности AKT1, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53 в ГСК КМ и в лейкоцитах ПК пациента, а также протеомного анализа белковых антигенов мембранной поверхности (иммунома) ГСК КМ пациента с использованием проточной многоцветной лазерной цитофлюориметрии для получения патоспецифического профиля белков мембранной поверхности клона или клонов ГСК, причем при наличии мутаций, по меньшей мере, в одном из указанных генов клональности, определяемых путем геномного анализа, и наличии паталогического профиля белков ГСК, характерного для патоспецифической иммунной недостаточности и определяемого путем протеомного анализа, устанавливают факт наличия у пациента КГ;
(b) при наличии у пациента генетически и протеомно доказанного КГ, установленного на стадии (а), проводят мобилизацию ГСК и ГПК пациента путем стимуляции гранулоцитарным колониестимулирующим фактором, а на 5-й и 6-й день стимуляции проводят сбор аутологичных ГСК с маркерами CD34+, CD45+, HLA DR+ и гемопоэтических прогениторных клеток (ГПК) с маркерами CD34+, CD45-, HLA DR- путем выделения лейкоконцентрата аутологичных мобилизованных МНК с помощью лейкоцитофереза ПК или эксфузии нативного КМ с максимально возможным удалением патологического клона или клонов ГСК и ГПК из КМ и ПК пациента, очистку выделенного лейкоконцентрата от эритроцитов, тромбоцитов и гранулоцитов с получением очищенного лейкоконцентрата и его последующую криоконсервацию для дальнейшего хранения;
(c) при наличии у пациента КГ, установленного на стадии (а) и после проведения стадии (b) определяют иммунный статус пациента и в зависимости от количественных показателей этого иммунного статуса проводят немиелоаблативную иммуносупрессию или иммуностимуляцию или иммуномодуляцию организма пациента для целенаправленного изменения существующего аутоагрессивного иммунологического контекста основных молекулярно-биологических структур КМ а также с целью деплеции аутореактивных Т- и В-лимфоцитов;
(d) проводят размораживание криоконсервированного лейконцентрата, содержащего доминирующие клоны ГСК и ГПК и полученного на стадии (b), его облучение ионизирующей радиацией в дозе 0,3-1,5 Гр для нанесения микроповреждений геному этих клонов ГСК и ГПК и дальнейшей активации и запуска их клеточного цикла и последующее геномное модулирование и коммитирование ГСК и ГПК путем инкубации в течение 45-60 минут лейкоконцентрата пациента, содержащего ГСК с микроповреждениями ДНК, с препаратом нуклеосомных мономеров геномной ДНК (hDNAnmr) человека при постоянном перемешивании инкубируемой массы с получением в результате этой инкубации высокотехнологичного лекарственного препарата для его реинфузии пациенту;
(e) после стадии (с) и нормализации показателей крови пациента проводят внутривенную реинфузию пациенту препарата, полученного на стадии (d);
(f) на следующий день после завершения стадии (е) проводят иммунотерапию с использованием антитимоцитарного глобулина (АТГ) для дополнительной деплеции Т-лимфоцитов, содержащихся в лейкоконцентрате МНК ПК с реставрированными ГСК, и аутореактивных лимфоцитов в циркуляции, выживших после иммуносупрессии на стадии (с);
(g) на 3-й, 6-й, 9-й и 12-й месяцы после стадии (е) проводят молекулярно-биологическую диагностику путем геномного и протеомного анализов в объеме стадии (а) для мониторинга смены клональности гемопоэза и оценку эффективности проведенного лечения не ранее, чем через 6 месяцев после проведения стадии (е), при этом на уровне протеома ГСК результат проведенного лечения признают положительным при доказанной смене протеома субпопуляционного состава по большинству изученных мембранных антигенов ГСК, приближении их к усредненным показателям мембранного протеома ГСК здоровых доноров, нормализации мегакариоцитарного звена и восстановлении части поврежденных миелоидно-коммитированных и лимфоидных клеток предшественников, а на уровне генома ГСК положительным результатом проведенного лечения считают смену клональности при выявлении не менее 50% новых мутаций генов клональности и генов стволовости при сравнении ДНК-образцов ГСК и лимфоцитов ПК до лечения с последующими аналогичными ДНК-образцами, полученными в динамике указанного геномного мониторинга.
После завершения предыдущих стадий (a)-(f) больной может быть выписан из стационара. Стадия (g) стадия представляет собой период реконституции гемопоза и его целью является анализ клинических, генетических и протеомных изменений иммунома ГСК и степени перепрограммирования системного иммунного ответа на патогены.
Согласно настоящему изобретению в качестве препарата hDNAnmr человека можно использовать лекарственную субстанцию Панаген®, полученную из клеток и ткани человеческой плаценты от здоровой роженицы.
Кроме того, препарат hDNAnmr человека можно получить как из клеток крови самого пациента, так и из клеток и ткани паренхиматозных человеческих органов здорового донора с получением натрий хлорид/натрий хлорид-энзиматически депротеинизированной высокоочищенной дцДНК человека с примесью белков не более 5% и примесью РНК не более 10% и фрагментированной со смесью фрагментов от 1000 до 5000 пар нуклеотидов (п.н.).
В соответствии с вышеуказанной задачей настоящего изобретения основным техническим результатом изобретения является восстановление поликлональности кроветворения организма млекопитающего путем природоподобного изменения генома доминирующего клона аутологичных ГСК и ГПК.
Термин «реституция костного мозга» (РКМ) никогда ранее не использовался в клинической медицине как общеизвестная медицинская терминология или лечебная биотехнология. Этот термин состоит из двух хорошо известных медицинских понятий - «костный мозг» и «реституция». КМ это важнейший орган кроветворной системы, осуществляющий гемопоэз (или кроветворение), а также процесс создания новых клеток крови взамен погибающих и отмирающих. Он также является одним из органов иммунопоэза - процесса образования всех миллиардов иммунных клеток организма. Для иммунной системы человека КМ вместе с периферическими лимфоидными органами является функциональным аналогом так называемой фабрициевой сумки, имеющейся у птиц (Брюховецкий А.С., Хотимченко Ю.С., 2020). У взрослого человека в норме преобладет костномозговой тип кроветворения, и в его гемопоэзе уже не участвуют вилочковая железа и селезенка, как это происходит в детстве и юности человека (Брюховецкий А.С., Шурдов М.А., 2023). Поэтому даже минимальное повреждение небольшой части структурных элементов КМ приводит к существенным нарушениям кроветворения и расстройствам иммунитета, следствием чего является прогрессирование или рецидивы фатальных иммуноассоциированных БЦ (Брюховецкий А.С., 2021; Гривцова Л.Ю., 2019). Поэтому восстановление исходной морфологии и функции поврежденного КМ, существовавшей до болезни, может стать фундаментальным решением проблемы профилактики старения и лечения большинства аутоиммунных, нейродегенеративных, онкологических, сердечно-сосудистых, наследственных и других БЦ.
Термин «реституция» в биологии и в медицине подразумевает полное восстановление и регенерацию (т. е. замещение дефекта равноценной тканью) органа, ткани или клетки. Неполную регенерацию и восстановление называют субституцией. «Восстановление, возобновление утраченных сил, здоровья», «возвращение к прежнему состоянию здоровья, какое было до болезни» было обозначено термином "реституция" еще в 1907 году в «Словаре иностранных слов, вошедших в состав русского языка» (Павленков Ф., 1907). Восстановление поврежденных органов и тканей в современной Викепидии (2023) также определяется медицинским термином реституция (от лат. Res-titutio — восстановление). Синонимами слова "реституция" являются такие термины как «восстановление», «репарация», «компенсация» и «регенерация» (Википедия, 2023). В монографии «Восстановительная медицина» (В.А. Епифанов, 2013) дается следующее определение медицинского термина «реституция»: «Реституция - процесс восстановления деятельности обратимо поврежденных структур органов и тканей организма человека и животных путем активации морфологически сохранных, но функционально бездеятельных структур, находящихся в состоянии глубокой депрессии, в значительной степени». Это самое наукоёмкое и научно-обоснованное определение медицинского понимания термина "реституция", которое отражает суть происходящих процессов в поврежденных органах, тканях и клетках организма и позволяет построить реальные стратегии восстановления повреждений любых органов и тканей. Поэтому реституция КМ предполагает восстановление гемопоэза и иммунопоэза организма до состояния, предшествующего болезни (восстановление status quo морфологии и функциональности врожденного иммунитета КМ). Таким образом, термин «реституция костного мозга» как новый медицинский термин является идеальным отражением фундаментальных биологических процессов, связанных с восстановлением морфофункциональной структуры поврежденного КМ до его доболезненного состояния.
Предложенный способ реституции КМ открывает биологическую возможность перезапуска систем врожденного иммунитета, основанную на фармакологических (геномных) модуляциях и минимальных манипуляциях с клонами аутологичных ГСК КМ. Он направлен на перепрограммирование иммунитета и смену системных иммунных реакций организма с патологических на физиологические иммунные реакции у больных с прогрессирующими и рецидивирующими аутоиммунными, нейродегенеративными, онкологическими, сердечно-сосудистыми, наследственными и другими болезнями с КГ.
Современный уровень развития клинической медицины и медицинских биотехнологий позволяет диагностировать на уровне генома кроветворных клеток наличие КГ, который в настоящее время считается фундаментальным механизмом патогенеза старения как возрастзависимой болезни и большинства БЦ (Jaiswal S., 2020; Tsai F.D. and Lindsley R.C., 2020; Mitchell E., Chapman М.S., Williams N. et al., 2022; Kar S.P., Quiros P.M., Gu М. et al., 2022). Kabir I., Zhang X., Dave J.M. et al. (2022) утверждают, что революция в области анализа отдельных клеток выявила гетерогенность популяций определенных типов клеток, и все чаще признается, что клональная экспансия отдельных клеток лежит в основе целого ряда заболеваний, помимо рака, включая сосудистые патологии, цирроз и нейродегенерацию (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017). Например, множественные предшественники гладкомышечных клеток дают начало нормальной артериальной стенке во время развития, но несколько избранных предшественников внутри стенки участвуют в формировании атеросклеротических бляшек (Chappell et al., 2016; Greif et al., 2012; Jacobsen и др., 2017; Mysra et al., 2018). Кроме того, при возрастном клональном кроветворении с неопределенным потенциалом (CHIP) СК, несущие соматические мутации, дают доминантные варианты лейкоцитов, а CHIP связан с повышенным риском серьезных заболеваний, связанных с атеросклерозом, инфарктом миокарда и ишемического инсульта (Jaiswal S., Lybby, 2020; Jaiswal S. et al.., 2017). Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов при нормальном старении (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Исследования в основном были сосредоточены на автономных клеточных механизмах, лежащих в основе клональной экспансии, а неклеточная автономная регуляция недостаточно хорошо изучена, особенно при старении и БЦ. Примечательно, что недавнее неоднозначное биоинформатическое исследование ставит под сомнение точку зрения о том, что увеличение соматических мутаций с возрастом лежит в основе повышенной заболеваемости раком в более позднем возрасте, и вместо этого утверждает, что снижение иммунной системы имеет первостепенное значение (Palmer et al., 2018).
Проведенные авторами настоящего изобретения секвенирования полного экзома 22000 генов человека и анализ наличия мутаций генов клональности показали, что большинство прогрессирующих и рецидивирующих БЦ осложняются клональным КГ (Брюховецкий А.С.,Шурдов М.А.,2023), и он может и, по-видимому, должен стать главной мишенью и основной целью для стратегий лекчения большинства иммуноассоциированных БЦ. G.A. Challen and M.A. Goodell (2020) утверждают, что недавнее открытие широкой распространенности клонального кроветворения (КГ) при негематологических заболеваниях изменило представление гематологов и других врачей о роли и месте ГСК в организме человека. Хотя колебания активности клонов СК давно известны, в целом вклад ГСК в выработку крови считался довольно стабильным при отсутствии явных заболеваний, таких как лейкемия или недостаточность КМ. По сути, КГ является результатом конкуренции долгоживущих СК в КМ (Challen G.A. and Goodell M.A., 2020). КГ относится к любому состоянию клональной экспансии в кроветворной системе. Опухоли лимфоидной и кроветворной системы, например хронический миелоидный лейкоз или миелодиспластический синдром, являются типичным примером КГ. Однако те же самые мутации, обнаруженные при этих видах рака, также наблюдаются у значительной части здорового пожилого населения. Чтобы отличить наличие этих мутаций в незлокачественных условиях от злокачественного КГ, был введен термин клональный гематопоэз с неопределенным потенциалом (CHIP) (Steensma DP, Bejar R, Jaiswal S, et al., 2015). CHIP определяется наличием связанной с раком соматической мутации в крови или КМ у лиц без выявленных опухолей кроветворной системы или других клональных состояний, таких как моноклональная гаммапатия.
Ведущий американский специалист в области исследования КГ Jaiswal S. (2020) в своем научном аналитическом обзоре показал, что соматические мутации со временем накапливаются во всех клетках организма, что подтверждают и другие исследователи (Welch J.S., Ley T.J., Link D.C., et al., 2012; Alexandrov L.B., Jones P.H., Wedge D.C., et al.,2015; Martincorena I., Campbell P.J. ,2015; Blokzijl F., de Ligt J., Jager M., et al., 2016; Hoang M.L., Kinde I., Tomasetti C., et al., 2016). Эти мутации чаще всего представляют собой замены оснований (известные как однонуклеотидные варианты [SNV]), небольшие вставки или делеции (indels) или изменения числа копий больших хромосомных областей (известные как структурные варианты [SV]). По оценкам, ГСК приобретают примерно 20 соматических мутаций в год во всем геноме (Lee-Six H., Øbro N.F., Shepherd M.S., et al., 2018 ; Osorio F.G., Rosendahl Huber A., Oka R., et al., 2018) и примерно 0,1 мутации в год в экзонах, кодирующих белок (Welch J.S., Ley T.J., Link D.C., et al., 2012), подавляющее большинство из которых являются SNV. В КМ только долгоживущие ГСК обладают способностью к самообновлению на протяжении всей жизни организма (Reya T., Morrison S.J., Clarke M.F., Weissman I.L., 2001). Поэтому в большинстве случаев только мутации, возникающие в ГСК, сохраняются на протяжении всей жизни человека. Учитывая, что на человека приходится примерно от 50 000 до 200 000 ГСК, ожидается, что к 70 годам у людей будет от 350 000 до 1 400 000 мутаций в пуле ГСК. Если хотя бы одна из этих мутаций способна обеспечить селективное преимущество в отношении ГСК, в которой она возникает, клональная экспансия в крови должна быть обычным явлением при старении (Jaiswal S., Ebert B.L., 2019) и возникновении БЦ. То есть КГ, тесно связан со старением, как это подтверждается рядом исследований у лиц без признаков опухолей крови (Xie M., Lu C., Wang J. et al., 2014; Genovese G., Kähler A.K., Handsaker R.E., et al., 2014; Jaiswal S., Fontanillas P., Flannick J., et al., 2014; McKerrell T., Park N., Moreno T. et al., 2015; Buscarlet M., Provost S., Zada Y.F. et al., 2017; Acuna-Hidalgo R., Sengul H., Steehouwer M. et al., 2017; Coombs C.C., Zehir A., Devlin S.M. et al., 2017).
В большинстве исследований мутации, используемые для определения КГ, аналогичны мутациям, обнаруживаемым при гематологическом раке (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Coombs C.C., Zehir A., Devlin S.M. et al., 2017). Наиболее часто мутирующие гены при КГ включают DNMT3A, TET2, ASXL1, JAK2 TP53 и SF3B1, которые также часто мутируют при остром миелоидном лейкозе (Ley T.J., Miller C., Ding L. et al., 2013; Lindsley R.C., Mar B.G., Mazzola E. et al., 2015), миелодиспластическом синдроме (Bejar R., Stevenson K., Abdel-Wahab O. et al., 2011; Papaemmanuil E., Gerstung M., Malcovati L. et al., 2013) и миелопролиферативных новообразованиях (Nangalia J., Massie C.E., Baxter E.J. et al, 2013), и у людей с КГ эти виды рака развиваются с большей скоростью, чем у людей без мутаций (Genovese G., Kähler A.K., Handsaker R.E., et al, 2014; Abelson S., Collord G., Ng S.W.K. et al, 2018; Jaiswal S., Fontanillas P., Flannick J. et al, 2014; Desai P., Mencia-Trinchant N., Savenkov O. et al, 2018; Bolton K.L., Ptashkin R.N., Gao T. et al, 2019). Однако мутации, вызывающие КГ, также могут быть обнаружены в циркулирующих иммунных клетках, таких как гранулоциты, моноциты и лимфоциты. Это открытие повышает вероятность того, что КГ может привести к измененным иммунным ответам, которые потенциально могут усиливать вероятность развития/возврата БЦ и старения.
Основываясь на имеющихся собственных данных по КГ и аутоиммунным, нейродегенеративным, онкологическим и наследственным БЦ (Брюховецкий А.С., Шурдов М.А., 2023), авторы настоящего изобретения полагают, что реституционные (восстановительные) механизмы саногенеза в поврежденных органах и тканях достаточно жестко связаны с иммунитетом и соответственно с кроветворением. Именно системообразующая и регуляторная, управляющая роль ГСК формирует реституционный саногенетический механизм восстановления поврежденных органов и тканей. Если в организме эукариот существует поликлональность гемопоэза (работают все или большинство существующих клонов ГСК), то саногенетические механизмы организма работают исправно и четко. Поликлональность кроветворения обеспечивает постоянную замену или ремонт пострадавших специализированных клеток крови и реставрацию специализированных дифференцированных клеток органов и тканей (Jaiswal S., 2020) Чем больше клонов ГСК участвуют в процессе формирования пула всех 36 миллиардов циркулирующих в организме клеток крови, тем меньше шансов возникновения болезни или нарушений гемопоэза, иммунопоэза и саногенеза (Fabre M.A., de Almeida J.D., Fiorillo E. et al, 2022).
Много лет в иммунологии, онкологии и гематологии существовала догма о том, что ГСК это всего лишь родоначальницы и прародительницы всех клеток крови и иммунитета, что они способны из одной клетки восстановить весь многомиллиардный клеточный пул крови, но никаких управляющих и регуляторных функций у них нет и не было (Тупицын Н.Н., 2005, Гривцова Л.Ю., Тупицын Н.Н., 2016). За последние десятилетия накоплено много важных научных фактов о том, что ГСК это не только прародительницы всех клеток крови, но, образно выражаясь, это главные «композиторы», «дирижеры» и «оранжировщики» в большом "оркестре" всех существующих иммунных реакций, происходящих в организма человека и животных (Брюховецкий А.С., Шурдов М.А., 2023). Все 230 известных типов клеток организма человека (Alberts B., Johnson A., Lewis J. Et al, 2007) находятся в зависимости или подчинены управлению ГСК. Оказалось, что ГСК являются главными регуляторными системами организма, формируя в конкретных условиях необходимое количество требуемых регуляторных, киллерных и цитотоксических клеток крови в ответ на появление в организме патогена (онкогена, вируса, бактерию, простейшего и др.) и обеспечивают иммунную память (de Laval B., Maurizio J., Kandalla P.K. et al, 2020). ГСК являются самыми медленными клетками в организме человека и животных. Клеточный цикл ГСК в организме человека составляет 360 дней. Клеток с более медленным клеточным циклом в организме человека в норме нет. (Белушкина Н.Н., Хомяков Ю.Н., 2009). Как говорил основоположник кибернетики и математической теории систем великий математик Норберт Винер, «управляющей в любой самой сложной системе является самая медленная фаза» (Н. Винер, 1967). Это положение справедливо всегда для всех химических, биохимических, физических и математических систем и сегодня это положение не подлежит обсуждению в теории систем. Поэтому ГСК в иерархии всех клеток организма занимает самое верхнее доминирующее положение и все клетки тела находятся к ней в подчиненной зависимости. ГСК это теоретически бессмертные клетки или точнее самые долгоживущие клетки в организме, как и нейроны головного и спинного мозга.
Однако, в процессе жизни человека и животных или стрессорного воздействия окружающей среды происходит накопление достаточно большого количества дополнительных соматических мутаций в долгоживущих клеточных системах и во всех СК. Часть этих дополнительных соматических мутаций в таких долгоживущих клетках как ГСК становится драйверами КГ. В крови формируется один или несколько доминирующих клонов кроветворения, которые «выигрывают соревнование» среди других ГСК и получают приоритет в репродукции клеток крови в КМ, регуляторные и управляющие функции, их цикл становится самым длительным среди других клонов ГСК. Постепенно расширяясь в объеме, потомки ГСК и ГПК доминирующего клона (клонов) кроветворения вытесняют иммунокомпетентные клетки (ИКК) других клонов во всей циркулирующей крови и формируют моноклональность гемопоэза (доминирование потомков одного клона ГСК) или олигоклональность гемопоэза (доминирование несколько клонов ГСК) в ПК и в КМ. Иногда количество ИКК доминирующего клона (клонов) ГСК в общей циркуляции клеток крови составляет не менее 4%, но иногда достигает 70% или даже 93%. Именно они начинают определять возникновение и манифестацию клинических проявлений большинства фатальных БЦ. КГ можно рассматривать геномно-постгеномным заболеванием собственных ГСК и главным фундаментальным процессом этипатогенеза большинства иммуноассоциированных БЦ.
Считается, что КГ развивается с возрастом в течение очень длительного периода времени. Однако это не объясняет наличие драйверных мутаций в генах клональности у молодых людей при большинстве аутоиммунных, нейродегенеративных, онкологических и наследственных БЦ ( Брюховецкий А.С., 2023). Поэтому механизм накопления критического количества драматических мутаций в ГСК необязательно обусловлен только возрастом. В его основе лежат и другие механизмы формирования КГ. Они подробно обсуждены и исследованы в работе G.A. Challen and M.A. Goodell, 2020. Ранее авторы настоящего изобретения в эксперименте обнаружили и описали один из таких механизмов формирования патоспецифических клонов ГСК при взаимодействии ГПК и ГСК с опухолевыми клетками (ОК). Этот механизм формирования онкоспецифической клональности ГСК был описан на примерах мультиформной глиобластомы, рака легкого и рака молочной железы (Bryukchovetskiy A.S., Bryukchovetskiy I.S., 2019). До этих исследований авторы изобретения были убеждены, что ГСК всегда приходят в зону повреждения ткани на «градиент концентрации воспаления», чтобы оказывать свое регуляторное и управляющее воздействие и решить судьбу ОК, посылая к ней экзосомы с регуляторными цитокинами и другими биологически активными веществами, приводящих ОК либо к терминальной дифференцировке или перенаправляющих её в апоптоз (программную клеточную гибель). При этом сами ГСК в неизменном виде возвращаются снова в свои ниши в КМ и ждут своего нового часа для работы. Но это оказалось методологической ошибкой и научным заблуждением. Это только один из возможных сценариев отношений ГСК и ОК. В большинстве случаев ОК при встрече с ГСК секретируют значительное количество экзосом, содержащих онкоспецифические белки (ОСБ), которые при взаимодействии ГСК и ОК поглощаются ГСК путем горизонтального и вертикального межклеточного переноса. ОСБ попадают в цитоплазму и ядра некоторых клонов ГСК и, с одной стороны, иммунизируют их навсегда, а с другой стороны, формируют дополнительные соматические мутации и накопление в них ОСБ. Этим они создают им геномно-протеомное преимущество праймированных опухолью клонов ГСК перед другими ГСК, еще более замедляя их клеточный цикл. Результатом подобной иммунизации (вакцинации) ГСК является формирование определенного онкоспецифического клона (клонов) ГСК и иммунотолерантности ГСК к другим ОК. При необходимости системного ответа собственного иммунитета организма человека на существование ОК в организме такая ГСК не способна к формированию клеток-эффекторов, обладающих цитотоксичностью к ОК. Иммунотолерантный ответ онкоспецифических клональных ГСК предполагает терпимость потомков иммунизированных ГСК в виде ИКК (НК-клеток, НКТ-клеток, гамма-клеток, дельта-клеток, Т-клеток, дендритных клеток, цитотоксических лимфоцитов, макрофагов и др.) доминирующего клона к наличию и существованию в организме ОСБ и/или к стремительному нарастанию количества ОК в организме человека при раке и других ЗНО. То, что ранее принималось за патологическую реакцию собственного иммунитета против патологических агентов или извращенную толерантность к ОК и опухолевым тканям организма, «ускользание» ОК от НК-клеток и НКТ-клеток является на самом деле адекватной системной иммунной реакцией отдельного иммунизированного к ОСБ клона или клонов собственных молекулярно-биологически измененных ГСК. Не все клоны ГСК имеют подобное молекулярно-биологическое повреждение. Их количество незначительно, но их доминирование в системе гемопоэза, обусловленное их геномно-транскриптомно-протеомными изменениями, дает им глобальное преимущество в выживании, репродукции, регуляции и управлении гемопоэзом и иммунопоэзом. В случаях, когда в геноме ГСК уже были генетические изменения наследственного характера, «неустойчивость генома» ГСК у больных с наследственным дефектом генома формируется гораздо быстрее и быстрее формируются фатальные осложнения и прогрессирование болезни.
С другой стороны, все известные БЦ имеют доказанную «неустойчивость генома» специализированных дифференцированных клеток. Впервые это в отношении ОК показал Теодор Бовери (Teodor Boveri, 1914) , а затем это подтвердило большое количество исследователей (L. A. Loeb, 1976; Reya T, Morrison S.J. Clark M.F., Weissman I. L. ,2001; F.Urh et al, 2005; P. Duesburg et al, 2011). Неустойчивость генома формируется в поврежденном нейроне при всех нейродегенеративных БЦ (болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз (БАС) и др.) (Snyder Е. et al., 2001; Брюховецкий А.С., 2021). Все аутоиммунные заболевания сопровождаются определенной неустойчивостью генома вовлеченных в воспалительный процесс тканей. Из-за постоянного системного воспаления вокруг тканей в них тоже формируется неустойчивость генома. Стабилизатором этой неустойчивости генома в дифференцированных клетках солидных органов должны являться клетки иммунной системы и ГСК, которые способны стабилизировать состояние этих клеток, нормализовать их функционирование или запустить в них процессы программируемой гибели (Bryukhovetskiy I.S., 2020). Важно, что в случае КГ у пациента с иммуноассоциированной БЦ имеется неустойчивость генома как в ГСК, так и в дифференцированных поврежденных клетках органов или тканей, что приводит к еще большей разбалансировке генома в этих клетках, к прогрессированию и рецидиву заболевания. ГСК, которая должна регулировать и стабилизировать поврежденные клетки, еще более их разбалансирует и вызывает неадекватные системные иммунные реакции. Решение проблемы очевидно. С одной стороны, надо блокировать или устранить клоны ГСК, формирующие КГ, а с другой стороны, надо уменьшить их объем или максимально сократить очаг «геномной неустойчивости» в специализированных дифференцированных клетках пострадавших тканей и органов.
Таким образом, клональные молекулярно-биологические изменения ГСК и ГПК нарушают поликлональность кроветворения и приводят к формирования моно- и олигоклонального гемопоэза при старении и практически при всех основных неинфекционных БЦ. Моно- и олигоклональный гемопоэз в целом ряде случаев имеет важнейшее место в патогенезе большинства онкологических, неврологических и сердечно-сосудистых болезней и старения (S. Jaiswal, 2020). Более того, сообщалось, что КГ с неопределенным потенциалом является причиной внезапной смертности людей более чем в 40% случаев, что нельзя было объяснить только гематологическим раком (Jaiswal S., Fontanillas P., Flannick J., et al.,2014).
Научные исследования авторов настоящего изобретения показали, что у 15-ти пациентов с аутоиммунными заболеваниями (рассеянный склероз, ревматоидный артрит, хроническая воспалительная демиелинизирующая полинейропатия), у 15-ти пациентов с нейродегенеративными болезнями (болезнь Альцгеймера, болезнь Паркинсона, системная корковая атрофия, БАС и др.), у 15-ти пациентов с сердечно-сосудистыми заболеваниями (церебральный стенозирующий атеросклероз, кардиосклероз, ишемическая болезнь сердца) и у 20-ти пациентов с онкологическими заболеваниями (нейроэндокринный рак, рак молочной железы, рак печени, мультиформная глиобластома и др.) в 97,1% случаев при наличии клинической картины прогрессирования болезни или ее рецидива выявлялись генетические признаки наличия мутаций в генах клональности (AKT1, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53) как в КМ, так и в ПК (Брюховецкий А.С., Шурдов М.А., 2023). Исследование было выполнено в рамках изучения полного экзома 22 000 генов человека при исследовании методом секвенирования нового поколения (NGS). А при протеомном картировании антигенов мембранных белков ГСК пациента методом проточной мноцветной цитофлюориметрии выявлены патоспецифические (онкоспецифические, вазокардиоспецифические, нейроспецифические и аутоиммунные) протеомные признаки доминирующего клона ГСК. Это позволило утверждать, что КГ формирует доминирующие патоспецифические кроветворные клоны ГСК в КМ и ПК, которые является патогенетической фундаментальной основой развития и прогрессирования большинства БЦ. Было показано, что именно КГ формирует «извращенный» иммунный системный ответ организма при наличии повреждений в тканеспецифических клетках тканей и органов человека и животных (Брюховецкий А.С., Гривцова Л.Ю., Шатлов П.А., 2023). Чтобы преодолеть негативные системные явления КГ, приводящие к повреждениям органов и тканей, главной стратегией современной терапии при КГ может стать способ по настоящему изобретению, способный обеспечить блокирование и полную эрадикацию (уничтожение) доминирующего клона (клонов) ГСК и ГПК в КМ и других здоровых клонов ГСК, ингибированных (подавленных) доминирующим клоном (клонами) ГСК КМ, что приведет к «перезапуску» врожденного иммунитета человека за счет активации, репродукции и пролиферации ингибированных ранее клонов ГСК и перепрограммированию системного иммунного ответа организма.
Исследования авторов настоящего изобретения показали, что в результате осуществления способа по настоящему изобретению в 85% маломанипулированных ГСК происходит блокирование репродуктивных и пролиферативных свойств доминирующего клона (клонов) кроветворения у пациента и путем терминальной дифференцировки ГСК дифференцируются до гемопоэтических предшественников, не способных к репродукции, а в оставшихся 15% ГСК отмечается увеличение длины теломер хромосом ГСК в 1,5-2 раза и гомологичная рекомбинация (равнозначная замена) мутантых участков ДНК на здоровые участки дцДНК, что обеспечит приоритет их выживаемости. Следствием этих манипуляций с аутологичными ГСК доминирующего клона (клонов) кроветворения является их дальнейшее бесплодие и постепенное естественное вымирание в организме больного. Кроме того, невозможность восполнения формирующегося дефицита ИКК данного клона (клонов) в крови приводит к их последующему постепенному вырождению и исчезновению (эрадикации) ИКК доминирующего клона ГСК из циркулирующей крови. Это приводит к последующей вынужденной замене их на ИКК других здоровых потомков ГСК, ингибированных ранее в КМ. Вынужденная активация большинства ранее ингибированных клонов ГСК в КМ, возникающая из-за отсутствия или малого количества ГСК доминирующего клона, изменяет ландшафт активированных клонов кроветворения с моно- и/или олигоклональности гемопоэза на поликлональность кроветворения (гемопоэза) у пациента при разных аутоиммунных, нейродегенеративных, сердечно-сосудистых, онкологических заболеваниях и моногенных наследственных болезнях нервной системы.
Фундаментальной молекулярно-биологической основой предложенного способа реституции КМ является ex vivo генотерапия аутологичных ГСК и ГПК пациента, осуществляемая путем геномного модулирования (координированной индукции генов) и коммитирования (терминальной дифференцировки) собственных ГСК в лейконцентрате МНК ПК или эксфузата КМ пациента. Для такого геномного модулирования и коммитирования в лейкоконцентрат добавляют препарат hDNAnmr человека, представляющей собой модифицированную геномную дцДНК человека, способную путем известного молекулярного механизма интернализоваться в ГСК и ГПК и сформировать скоординированную индукцию генов ГСК. Интернализованные фрагменты дцДНК запускают пролиферацию покоящихся ГСК и ГПК и принимают участие в транзитных репаративных процессах, протекающих в клетках этого типа, что сопровождается корректировкой возможных нарушений ДНК ядерного хроматина, восстановлением нарушенных генетических локусов, и, как следствие, повышением жизнеспособности СК (С.С. Богачев с соавт., 2008; 2014; 2019). Препарат hDNAnmr это специальным образом подготовленная фрагментированная ДНК, содержащая комплексы с белками ядерного матрикса. hDNAnmr представляет собой смесь фрагментов геномной дцДНК здорового человека, в совокупности которых представлены все геномные последовательности человеческого генома. Фрагменты не содержат в себе посторонних векторных или вирусных последовательностей. Преимущественный размер фрагментов от 200 до 6000 п.н.. Фрагменты экстраклеточной дцДНК полностью насыщают внутренние компартменты клетки в течение около 60 минут при соотношении 0,2 мкг экстраклеточной ДНК на миллион (106) клеток в объеме 0,5-2 мл при содержании СК в образце от 0,1 до 5% (Dolgova et al., 2014; 2016). Во внутренних компартментах клетки может присутствовать до 106 фрагментов экстраклеточной дцДНК размером 0,5-1 тысяч пар оснований.
В качестве препарата hDNAnmr в настоящем изобретении может быть использован препарат Панаген®, полученный из клеток и ткани человеческой плаценты от здоровой роженицы. Этот препарат зарегистрирован в Государстенном реестре лекарственных средств Российской Федерации 09.06.2008 за № ЛСР-004429/08. Способ получения этого препарата описан в статье: Изучение гемостимулирующей активности нуклепротеидного комплекса, выделенного из плаценты человека / В.И. Масычева, Е.Д. Даниленко, Г.Г. Шимина [и др.] // Сибирский онкологический журнал. - 2012. - № 5 (53). - с. 34-35. Для использования в настоящем изобретении препарат hDNAnmr можно также получить способом, аналогичным получению препарата Панаген®, из клеток и ткани паренхиматозных человеческих органов здорового донора с получением натрий хлорид/натрий хлорид-энзиматически депротеинизированной высокоочищенной дцДНК человека с примесью белков не более 5% и примесью РНК не более 10% и фрагментированной со смесью фрагментов от 1000 до 5000 п.н.
Основой принципа восстановления поврежденных ГСК согласно настоящему изобретению являются три базовых общебиологических явления:
1. Способность СК различного генеза интернализовать фрагменты дцДНК естественным природным механизмом (Ritter et al., in press; Petrova et al., in press; Potter et al., in press).
2. Имманентное, строго хронометрированное формирование пангеномных одноцепочечных разрывов, манифестирующих начало терминальной дифференцировки СК и приводящих клетку (Vayolin et al., 1998) в состояние, которое авторы настоящего изобретения определяют как «рекомбиногенная ситуация» (Лихачева А.С., Шурдов М.А., Богачев С.С., 2008).
3. Активность механизма гомологичной рекомбинации, при которой происходит замена мутантных участков ДНК на дцДНК здорового донора или двухцепочечные искусственные фрагменты ДНК, или происходит амплификация теломерных или центромерных повторов.
В результате многолетних работ по генетике ГСК и ГПК в лаборатории индуцированных клеточных процессов ИЦиГ СО РАН (руководитель лаборатории д.б.н. С.С. Богачев) было открыто и описано новое общебиологическое явление - способность СК различного генеза интернализировать внутрь клетки фрагменты экстраклеточной дцДНК. В механизме интернализации принимают участие заряд клеточной поверхности, домен связывания гепарина и кластеры положительно заряженных аминокислот, протеогликаны/гликопротеины и скавенджер-рецепторы гликокаликса. Интернализация происходит за счет кавеолярного/клатринового пути (Ritter et al., 2022 in press; Petrova et al., 2022 in press; Dolgova et al, 2014). Установлено, что низкодифференцированные ГСК (C-Kit+, CD34+) захватывают фрагменты экстраклеточной дцДНК, при этом доставленный во внутреннее клеточное пространство ДНК материал индуцирует терминальную дифференцировку прогенитора и активацию пролиферации клеток-потомков (Potter et al., 2022 in press).
Приведенные выше факты свидетельствуют, что при попадании дцДНК внутрь ГСК происходит индукция терминальной дифференцировки (коммитирование) и связанная с ней активация пролиферации прогениторов. Авторы настоящего изобретения полагают, что аналогично процессу терминальной дифференцировки и возникновению пангеномных одноцепочечных разрывов, наблюдаемых в эмбриональных СК, в ГСК, при коммитировании также индуцируются пангеномные одноцепочечные разрывы и, как следствие, развивается рекомбиногенная ситуация (Лихачева А.С. с соавт.,. 2008). Во время появления пангеномных одноцепочечных разрывов, переводящих хроматин ядра в линейную форму с последующей его реорганизацией («репрограммированием») в выбранном направлении дифференцировки, и последующего восстановления целостности континуума в результате лигирования одноцепочечных разрывов создается новая трехмерная архитектура хроматина с учетом новых торсионных напряжений, определяющих его новую 3D-организацию. Пангеномные одноцепочечные разрывы закрываются в течение 96 часов, после чего клетка приобретает характеристики коммитированного потомка. Репаративно-рекомбинационная молекулярная «машина», осуществляющая процесс разрыва и восстановления хроматина, неизвестна. Было сделано предположение, что во время рекомбиногенной ситуации, развившейся в ГСК, возможен процесс гомологичного обмена между находящимися внутри клетки захваченными экстраклеточными фрагментами и подходящими для рекомбинации локусами хроматина.
В отличие от всех существующих разрешенных и неразрешенных способов терапии различных болезней человека и животных с верифицированным генетическим дефектом в персонализированной медицине, способ по настоящему изобретению не использует стандартных средств доставки генетического материала (плазмид, олигонуклиотидов, векторов, вирусов и т.д.) в геном реставрируемой клетки и является исключительно природоподобной технологией реставрации генома клеток эукариот, которая использует исключительно саногенетический механизм биореставрации повреждений хроматина генома, которая может быть названа геномным балансированием хроматина ГСК. При этом практически исключается возможность некорректного встраивания экстраклеточных фрагментов в связи с отсутствием молекулярной основы такой интеграции, а именно нефункциональных двухцепочечных разрывов, репарирующихся по механизму NHEJ. Возможен не приводящий к геномным изменениям гомологичный челенж (равнозначный обмен), изначально не предусмотренный филогенетической программой данного организма. Все теоретически возможные ошибки или неправильные топические локации дцДНК в результате гомологичной рекомбинации будут пресечены и автоматически исправлены генетически детерминированными механизмами митоза клетки.
Иммунопатогенетическое обоснование способа
Неинфекционные фатальные БЦ представляются перспективными заболеваниями для применения предложенного способа реституции КМ в связи с тем, что в их патогенезе фундаментальное место занимает КГ (Брюховецкий А.С., Шурдов М.А., 2023; Брюховецкий А.С., Гривцова Л.Ю., Шаталов П.А., 2023), который сначала приводит к классическим проявлениям аутоиммунных процессов, связанных с нарушением иммунологической толерантности и формированием иммунологической агрессии, включая этапы распознавания и презентации антигенов, активацию, пролиферацию и дифференцировку клеток адаптивного иммунного ответа. В дальнейшем КГ запускает цепь хронических тканеспецифических воспалительных иммунопатогенетических событий, направленных против нервной системы, которые и приводят к дегенерации специвализированных высокодифференцированных клеток. Таким образом, формирование КГ сначала запускает процесс дегенерации и атрофии в органе-мишени, а затем хроническое системное воздействие на основные звенья патогенеза этих болезней и обеспечивает его перманентность и дальнейшее прогрессирование. Блокирование КГ может и должно стать основной мишенью и перспективной целью молекулярнонацеленной (таргетной) терапии этих заболеваний. Представление о том, что ГСК при иммуноассоциированных БЦ интактны, а в патологический процесс вовлекаются только ИКК клетки на ранних этапах дифференцировки, оказалось ошибочным (Брюховецкий А.С., Гривцова Л.Ю., 2021), что позволило предположить и подтвердить неэффективность аутологичной и сингенной трансплантации КМ в экспериментальных моделях при болезни Альцгеймера, болезни Паркинсона, рассеянного склероза с использованием иммуноаблации высокодозным циклофосфамидом и тотального облучения тела (total body irradiation, TBI) (Karussis D. M., Slavin S., Lehmann D. et al., 1992; Karussis D. M., Vourka-Karussis U., Lehmann D. et al., 1993; Van Gelder M., Kinwel-Bohré E. P., van Bekkum D. W. 1993; Qin C, Lu Y, Wang K, et al., 2020; Qin C., Wang K., Zhang L.et al., 2022).
Потенциальная эффективность реституции КМ при большинстве неинфекционных (онкологических, аутоиммунных, сердечно-сосудистых, наследственных и др.) болезней основана на ряде научных фактов, полученных при их изучении:
Наличие КГ в организме человека, страдающего неинфекционными фатальными БЦ, обусловленно накоплением дополнительных соматических мутаций в определенных генах клональности аутологичных ГСК КМ и их доминированием в процессах кроветворения организма человека (Брюховецкий А.С., Шурдов М.А., 2023).
Реальная возможность геномной и постгеномной (транскриптомной и протеомной) диагностики молекулярно-биологического повреждения аутологичных ГСК при неинфекционных фатальных БЦ (Bryukhovetskiy A.S., Grivtsova L.Yu., Sharma H.S., 2020) и возможность генно-инженерной реставрации поврежденной ГСК методом «гомологичной рекомбинации» с использованием дцДНК и дцРНК человека (Лихачева А.Н., Богачев С.А. Шурдов М.А., 2008).
К настоящему времени идентифицированы такие внутриклеточные сенсоры дцДНК, как STING, DAI, семейство NOD-like белков, RLH-геликазы, белки семейства HIN-200. Одни из этих факторов непосредственно взаимодействуют с двуцепочечной ДНК, другие являются охарактеризованными посредниками в передаче сигнала с неизвестного ДНК-сенсора. Результатом активации каскада событий, запускаемых цитозольной дцДНК, является индукция ядерных транскрипционных факторов NF-κB и IRF3/IRF7 и усиление продукции интерферона-бета, а также процессинг предшественников провоспалительных цитокинов IL-1β и IL-18 путем формирования инфламмасом. Поэтому в настоящее время понятны пути реализации сигнала от момента определения внутриклеточной дцДНК до формирования клеточного иммунного ответа (Алямкина Е.А., Долгова Е.В., Проскурина А.С. и соавт., 2013).
Способность подавления гиперактивности патогенетически значимых аутореактивных Т- и В-лимфоцитов в крови пациента с неинфекционными фатальными БЦ за счет применения иммуносупрессивной терапии и формирование иммунологической толерантности к специфичным для заболевания антигенам (Чкадуа Г.З.. Борунова А.А., Брюховецкий А.С., 2022; Брюховецкий А.С. с соавт.2023);
Перевод большей части коммитированного патологического клона ГСК в терминальную дифференцировку посредством обработки аутологичной ГСК дцДНК человека и программная эрадикация доминирующего клона ГСК в течении 6-8 месяцев и его замещение в гемопоэзе на ингибированные ранее клоны ГСК, находившиеся в КМ в состоянии покоя (Брюховецкий А.С, с соавт.2023).
Биотехнологическая возможность геноориентированного и протеом-основанного мониторинга молекулярных изменений аутологичных ГСК и перепрограммирования системного иммунного ответа организма пациента с неинфекционными фатальными БЦ путем полногеномного секвенирования экзома и протоемного картирования и профилирования мембранных белков иммунома аутологичных ГСК.
Концепция эффективности способа реституции КМ основана на ожидаемом достижении иммунной реконституции после умеренной лимфодеплеции и замещения доминирующих патологических клонов ГСК на здоровые, но ингибированные ранее клоны ГСК, и тем самым. восстановлении адекватного баланса между аутореактивными клетками, с одной стороны, и клетками, отвечающими за иммуносупрессию и иммунорегуляцию, с другой. Ожидаемым эффектом является также достижение длительной иммунологической аутотолерантности. Отсутствие новых очагов активности по данным магнитно-резонансной томографии и клинических рецидивов после реституции КМ у пациентов с прогресиирующими формами неинфекционных фатальных БЦ коррелирует со снижением циркулирующих в крови субпопуляций клеток с фенотипами Th17 и dpTh1/Th17 (Darlington P. J., Touil T., Doucet J. S. et al., 2013).
Ввиду проведения молекулярно-биологической природоподобной реконструкции кроветворных СК при нейродегенеративных болезнях и ряде аутоиммунных заболеваний, не требуется миелоаблация, что на определенном этапе позволило отказаться от высокоинтенсивных миелоаблативных режимов кондиционирования и трансплантации КМ с сохранением иммуноаблативного действия - субтотальной элиминации аутореактивных клонов Т- и В-лимфоцитов в ПК. Однако использование только немиелоаблативного режима кондиционирования при экспериментальном аутоиммунном энцефаломиелите без поддержки ГСК не приводило к достижению долгосрочной ремиссии, что свидетельствует о возможных иммуномодулирующих эффектах самого лейкоконцентрата МНК ПК с ГСК. Исследования показали, что предполагаемая редиверсификация репертуара клеток (иммунологическая реконституция) может иметь место именно после трансплантации ГСК. Непосредственно после реинфузии аутологичных ГСК возможна селективная экспансия небольшого количества аутореактивных клонов Т-лимфоцитов, сохранившихся после проведенного режима кондиционирования. Кроме того, в самом лейконцентрате МНК ПК с ГСК также содержится примесь Т-лимфоцитов, которые могут быть компонентом для последующей иммунной реконституции. Иммунотерапия с использованием АТГ в первые дни после АТГСК (Д+1, Д+2, Д+3) приводит к дополнительной лимфодеплеции и истощению субпопуляций Т-лимфоцитов MAIT (mucosal associated invariant), характеризующихся фенотипом CD8+ и секрецией провоспалительных интерлейкинов IL-17 и интерферона-гамма (Полушин А.Ю ,Залялов Ю.А.Тотолян Н.А. и соавт.,2021).
Краткое описание чертежей
Фиг. 1 - микрофотографии, демонстрирующие интернализацию TAMRA-меченого ДНК зонда в СК различного генеза (стрелками обозначены TAMRA+ клетки):
А - клетки Кребс-2;
B - Клетки Эпштейн-Барр-трансформированной В-лимфомы;
С - сферообразование в культуре клеток Эпштейн-Барр-трансформированной В-лимфомы. TAMRA+ клетка в течение 20-30 минут объединяется с несколькими близко расположенными клетками. В процессе наблюдения все клетки, находящиеся в поле зрения, находятся в непрерывном хаотическом движении. При контакте клеток с TAMRA+ клеткой формируется прочный ассоциат, на основе которого в течение 8-14 часов формируется свободно плавающая сфера;
D - розетки костномозговых стромальных ниш, в центре которых находятся TAMRA+ клетки.
Фиг. 2А - диаграммы стимуляции колониеобразования гранулоцитарно-макрофагального (GM) ростка кроветворения при индукции hDNA в сравнении с контролем.
Фиг. 2B - диаграммы стимуляции колониеобразования эритроидного (E) ростка кроветворения при индукции hDNA в сравнении с контролем.
Фиг. 3А - микрофотографии, демонстрирующие оценку совместной локализации маркеров примитивных ГСК c-Kit и Sca-1 и одновременно способности этих клеток интернализовать TAMRA+ двуцепочечный ДНК зонд (маркер TAMRA) в интактном КМ мыши.
Фиг. 3B - cравнительные диаграммы содержания клеток, меченных соответствующим маркером в популяции клеток отдельной колонии (увеличение количества Sca-1 в Е-колониях свидетельствует о том, что в этом ростке клетки стали делиться симметрично, и количество ГСК в колонии увеличилось: снижение количества Sca-1 в GM-колониях означает, что при индукции в этом ростке СК клетки ушли в коммитирование; снижение количества c-Kit в Е- и GM-колониях означает, что при индукции СК клетки ушли в коммитирование; снижение количества TAMRA+ клеток в Е- и GM-колониях означает, что при индукции TAMRA+ СК аналогично c-Kit ушли в коммитирование.
Фиг. 3С - результаты real-time ПЦР-анализа интернализации Alu двуцепочечного ДНК зонда в Sca-1/c-Kit ГСК.
Фиг. 4 - гистограмма распределения длины миграции ДНК клеток OTF9-63 до и после культивирования в разное время в присутствии ракового антигена, где X - длина миграции ДНК в мкм (длина столбца 3 мкм); Z - количество ячеек; а - недифференцированные клетки; b, с, e - дифференцировка в течение 24, 36 и 96 ч соответственно. d - недифференцированные эмбриональные клетки, облученные рентгеновскими лучами в дозе 200 рад (длина миграции среди экспонированных клеток включает размер ядра).
Фиг. 5 - оценка количества теломерных повторов в ГСК-колониях мыши после обработки индукторами методом количественной дот-блот гибридизации.
Фиг. 6 - оценка количества теломерных повторов в ГСК колониях мыши после обработки индукторами методом ПЦР в реальном времени.
Фиг. 7 - динамика гибели крыс-самкок линии Вистар в контрольной группе и после введения клеток КМ, обработанных hDNAnmr.
Фиг. 8 - доменная структура белка FUS человека (зачеркнут участок, который был удалён при конструировании трансгенной кассеты).
Фиг 9 - содержание укороченной формы белка FUS человека в тканях нервной системы ΔFUS(1-359) мышей.
Фиг. 10 - фенотипические проявления нейродегенеративного процесса у трансгенных Thy-1/FUS 1-359 мышей.
Фиг. 11 - детекция трансгенной кассеты в геноме мыши ΔFUS(1-359) методом ПЦР (1% агарозный гель).
Фиг. 12 - проявление локомоторных нарушений в трансгенной модели FUS-протеинопатии на модели БАС у мышей.
Фиг. 13 - результаты профилирования экспрессии маркеров клеточной поверхности ГСК (иммунофенотипический профиль мембранных антигенов ГСК (CD34+, CD45+) согласно Примеру 1.
Фиг. 14 - результаты профилирования экспрессии маркеров клеточной поверхности ГСК (иммунофенотипический профиль мембранных антигенов ГСК (CD34+, CD45+) согласно Примеру 2.
Фиг. 15 - результаты профилирования экспрессии маркеров клеточной поверхности ГСК (иммунофенотипический профиль мембранных антигенов ГСК (CD34+, CD45+) согласно Примеру 3.
Фиг. 16 - результаты профилирования экспрессии маркеров клеточной поверхности ГСК (иммунофенотипический профиль мембранных антигенов ГСК (CD34+, CD45+) согласно Примеру 4.
Осуществление изобретения
Далее предложенный способ реституции КМ описан более подробно по стадиям.
Стадия (а). Геномная и постгеномная (протеомная)
диагностика КГ
На данной стадии определяют показания к клиническому применению реституции КМ по настоящему изобретению. Главной биологической мишенью технологии являются незрелые клеточные системы организма человека и млекопитающих на ранних этапах их дифференцировки. Как правило, этим условиям удовлетворяют преимущественно тоти- и мультипотентные СК и прогениторные клетки эукариот.
При определении показаний к проведению лечения по предложенному способу необходимо объективизировать наличия факта патологической клональности гемопоэза у пациента. Наличие моно- или олигоклональности кроветворения на современном этапе развития науки и техники может быть объективно подтверждено геомным и протеомным анализами. Для генетического подтверждения факта наличия клональности гемопоэза выявляют мутации генов клональности (гены AKT1, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53) в ГСК (СD34+, СD45+) и ГПК (СD34+, СD45-), находящихся в ПК и КМ пациента, с использованием технологии геномного секвенирования экзома или ПЦР-диагностики в реальном времени. Для этого нужно выделить ГСК и ГПК с использованием клеточного сортера (иммуносепаратора) на магнитных шариках с использованием моноклональных антител к СD34+ на аппарате типа CliniMAXTM (Германия). Наличие мутаций в одном из клональных генов позволяет говорить о наличии КГ.
Помимо геномного анализа, необходимо дополнительно определить протеомную составляющую КГ, которая позволит подтвердить наличие КГ на уровне профиля белков ГСК, характерного для патоспецифической иммунной недостаточности КМ мозга пациента. В этих целях путем проточной многоцветной цитофлюориметрии на аппарате типа FaxCan в лейконцентрате КМ или мобилизованной ПК определяют экспрессию антигенов мембранной поверхности ГСК. Проводят картирование и профилирование не менее 21 белковых маркеров мембранной поверхности ГСК: CD45, HLA DR, CD38, CD33, CD13, CD71, CD117, CD90 (Thy-1), CD50, CD56, CD19, CD61, CD7, CD10, CD2, CD61, CD62L, CD81, CD28, CD300, cd185.
Пациента обследуют по стандартному диагностическому протоколу, аналогичному протоколу обследования для доноров КМ, а именно пациента предварительно обследуют на инфекции ВИЧ 1 и ВИЧ 2, синдром иммунодефицита; сифилис, гепатиты В и С; острые инфекционные заболевания.
Стадия (b). Мобилизация, сбор, криоконсервация и хранение
доминирующего клона (клонов) ГСК
Для мобилизации доминирующего клона ГСК и ГПК с их выходом в кровяное русло и с целью увеличения их количества в ПК пациент получает 8 инъекций гранулоцитарного колониестимулирующего фактора (Г-КСФ), такого как филграстим, граноцит, нейпоген и др., подкожно с интервалом в 10-12 часов в течение 4 дней согласно стандартной методике стимуляции кроветворения с целью мобилизации ГСК в периферическое русло. Схема с использованием филграстима: на 1-2-й день - 4,4 мкг/кг в день, на 3-4-й день - 8,8 мкг/кг в день. Ежедневно производят общий анализ крови и на 4-5-й день делают УЗИ брюшной полости и фиброгастроскопию (для исключения кровотечения из желудка после стимуляции Г-КСФ во время лейкоцитофереза).
Затем, на 5-й день у пациента путем лейкоцитофереза на клеточном сепараторе (например, на аппарате типа Spectra Optia®) собирают фракцию МНК (ядросодержащих) клеток (ЯК) крови, обогащенную суммарным пулом ГСК, их количество варьирует от 0,3 до 2%.
На 5-й день у пациента путем лейкоцитофереза на клеточном сепараторе собирают фракцию МНК крови (МНК), обогащенную суммарным пулом ГСК, их количество варьирует от 0,3 до 2%. Для максимально возможного удаления патологического клона (клонов) ГСК и ГПК из ПК пациента на 5-й день продолжают стимуляцию кроветворения у пациента и на 6-й день повторяют сбор фракции МНК, обогащенную суммарным пулом ГСК.
В среднем получают от 14х109 до 40х109 ядросодержащих клеток (ЯК) МНК, в которых находится 0,3-2% СD34+ клеток (от 4,8х107 СD34+ от ЯК ). Пакет с биоматериалом аутологичных МНК ПК пациента в течении 2-х часов доставляют в криобанк, где МНК ПК очищают от эритроцитов, тромбоцитов и гранулоцитов на градиенте Фиколла. Определяют субпопуляционный состав CD34+ клеток путем многопараметровой проточной цитометрии (одновременная окраска клеток антителами к 5-6-ти разным антигенам, нагруженными различными флуорохромными красителями). Очищенный лейкоконцентрат МНК может быть разделен на 2 пакета по 10 мл или на ампулы по 5-20 мл (в зависимости от числа CD34+ клеток и клинических целей), а затем направлен на криоконсервирование. Согласно стандартному методу криоконсервации к клеточной суспензии добавляют диметилсульфоксид (ДМСО) в конечной концентрации 6-10%, смесь замораживают со скоростью 1 градус/мин до -80ºС или -120ºС с использованием программируемого электронного замораживателя и храненят в жидком азоте или парах жидкого азота.
На этом этапе обязательно производят подсчет ЯК и CD34+ клеток. Как было установлено, оптимальная концентрация замораживаемых клеток составляет 40-100х106 клеток/мл.
Стадия (с). Иммунокоррекция организма пациента
В течение 3-5 дней после сбора лейконцентрата МНК, осуществляемого на стадии (b), у пациента происходит естественное снижение количества лейкоцитов и ГПК в ПК до физиологических показателей нормы. В этот период больному обеспечивают максимальное ограничение любых лечебных манипуляций (кроме процедур, обеспечивающих витальные функции жизнеобеспечения).Затем, при нормализации показателей ПК, проводят исследование иммунного статуса пациента и проводится комплексная оценка этого статуса врачом-иммунологом для последующей иммунокоррекции. Исследование имунного статуса раскрыто, например, в следующих источниках информации:
https://nmtmed.ru/component/price/?action=description&id_anal=2000048#:~:text=%D0%A1%D0%BF%D1%80%D0%B0%D0%B2%D0%BA%D0%B0%3A%20%D0%98%D0%BC%D0%BC%D1%83%D0%BD%D0%BD%D1%8B%D0%B9%20%D1%81%D1%82%D0%B0%D1%82%D1%83%D1%81%20%D1%80%D0%B0%D1%81%D1%88%D0%B8%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9%20%E2%80%94%20%D0%BA%D0%BE%D0%BC%D0%BF%D0%BB%D0%B5%D0%BA%D1%81%D0%BD%D1%8B%D0%B9,%D0%B7%D0%B2%D0%B5%D0%BD%D1%8C%D0%B5%D0%B2%20%D0%B8%D0%BC%D0%BC%D1%83%D0%BD%D0%B8%D1%82%D0%B5%D1%82%D0%B0%20%D0%B2%20%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D0%B7%D0%BC%D0%B5%20%D1%87%D0%B5%D0%BB%D0%BE%D0%B2%D0%B5%D0%BA%D0%B0 (дата доступа 30.09.2023);
https://medcentr-endomedlab.ru/immunologija/immunnyj_status.html?ysclid=ln64xo3zdi173980241 (дата доступа 30.09.2023).
Целью иммунокоррекции при аутоиммунных, онкологических и наследственных болезнях и нормальных показателях иммунного статуса является, с одной стороны, подавление оставшихся в КМ и циркулирующих в ПК клеток доминирующего клона ГСК и их потомков в виде ИКК и разрушение иммунологического контекста устоявшихся взаимоотношений и взаимодействий между ГСК доминирующего клона (клонов) КМ и другими клеточными системами других здоровых клонов ГСК и клетками ниши КМ. С другой стороны, при сердечно-сосудистых, дегенеративных (нейродегенеративных) и атрофических системных процессах в организме пациента целью иммунокоррекции является, наоборот, формирование нового имуннологического контекста для выживания поврежденных ГСК и клеток КМ путем стимуляции, активации или модуляции клеток нишевого микроокружения ГСК и ИКК ПК. Таким образом, в зависимости от основной нозологии болезни и особенностей иммунного статуса пациента (реального состояния процентного клеточного состава ИКК) имеются различные направления воздействия на врожденный и адаптивный иммунитет пациента на данной стадии лечения. При онкологических, аутоиммунных и наследственных заболеваниях стадия иммунокоррекции обеспечивается проведением немиелоаблативной иммунносупресии. Применяется стандартная схема иммуносупрессивной терапии, проводимой в течение 3-х дней: антитимоцитарный иммуноглобулин (Ig) по 10 мг/кг в сутки (например, при весе пациента 60 кг вводят 600 мг/сутки); флюдарабин по 30 мг/кг в сутки, преднизолон 2 мг/кг в сутки. В зависимости от тяжести состояния больных с аутоиммунными, онкологическими и прогрессирующими наследственными заболеваниями доза иммуносупрессивных препаратов с учетом данных иммунного статуса может быть уменьшена на треть или даже на полловину стандартных доз.
При тяжелых сердечно-сосудистых заболеваниях и дегенеративно-атрофических (нейродегенеративных) болезнях проведение иммуносупрессии резко ухудшает состояние пациентов из-за грубых молекулярно-биологических повреждений ГСК, поэтому для этого контингента пациентов необходима, наоборот, активация и стимуляция иммунитета и формирование нового и поддерживающего микроокружения клональных ГСК для их выживания и обеспечния восстановления. Иммуностимуляция и иммуноактивация организма на этой стадии осуществляется путем применения адаптогенов (препараты на основе женьшеня, радиолы розовой, пантокрина, лимонника), больших доз минерально-витаминных препаратов (селен, мильгамма, нейромультивит и т.д.), курсового применения иммуномодулятора полиоксидония внутривенно №10, а затем в свечах per rectum 14 дней, иммуностимуляторов типа Галовит, Т-активин и других иммуноактиваторов и иммуномодуляторов.
В ряде случаев в результате проводимой ранее терапии препаратами на основе иммунных противоопухолевых моноклональных антител или препаратов, изменяющих течение рассеянного склероза или таргетных препаратов у пациентов имеют место «выпадение» или резкое снижение и иммунодефицит отдельных клеточных групп ИКК, что требует реальной коррекции проводимой иммунотерапии с учетом выявленных особенностей поражения иммунитета. Для этого редуцируются дозы иммунных препаратов или часть из них исключается из протокола лечения.
Стадия (d). Фармакологическое геномное модулирование и коммитирование
ГСК и ГПК (ex vivo генотерапия)
Непосредственно перед реинфузией, проводимой на нижеописанной стадии (е), паолученный на стадии (d) криоконсервированный лейконцентрат размораживают на водяной бане при температуре 37-40°С до момента перехода замороженного материала в жидкую фазу. Далее путем центрифугирования при 1500 об/мин лейконцентрат осаждают на дно пластикового пакета, убирают надосадочную жидкость и разводят в 100 мл 0,9% физиологического раствора NaCl. Процедуру повторяют дважды.
Далее из пластикового пакета шприцем извлекают 1 мл собранного биоматериала, который без дальнейшей обработки сохраняют для исследований в качестве контрольного образца.
Основную часть полученного биоматериала непосредственно в пакете облучают ионизирующей радиацией в дозе 0,3-1,5 Гр для нанесения микроповреждений генома ГСК и ГПК и дальнейшей активации их клеточного цикла. Затем в условиях клинической лаборатории учреждения оценивают общую клеточность полученного биоматериала под микроскопом в камере Горяева.
Далее в условиях стерильного ламинарного шкафа к облученному биоматериалу мобилизованных МНК, находящихся в полимерном криомешке, добавляют препарат hDNAnmr человека (например, лекарственную субстанцию Панаген®) из расчета 1 мг препарата в 1 мл физраствора на 15х106 МНК (ГСК (CD34+)) в растворе биоматериала МНК и инкубируют облученный биоматериал с препаратом hDNAnmr в течение 45-60 минут. В течение всего времени инкубации осуществляют постоянное перемешивание облученного биоматериала с препаратом hDNAnmr вручную или используют инкубатор для хранения тромбоцитов, обеспечивающий перемешивание инкубируемого матерала и предотвращающий слипание клеточных элементов. В результате инкубации происходит геномное модулирование и коммитирование ГСК и ГПК с необратимым переходом клетки из стадии стволовой в специфическую линию дифференцировки, завершающуюся формированием клетки, способной проявлять ограниченный набор свойств, конститутивных и индуцируемых, - клетка или её предшественник больше не может превращаться в другую. Таким образом, получают препарат для реинфузии пациенту.
Из препарата для реинфузии забирают 1 мл для исследований результатов геномоделирующего воздействия на аутологичные ГСК и ГПК пациента (опытный образец). Опытный и ранее отобранный контрольный образцы отправляют на холоде в генетическую лабораторию для исследований проведенной генетической модуляции и определения количества и длины теломерной ДНК хромосом ГСК и ГПК после осуществленной реставрации. В лаборатории образцы высеваются на микрокристаллическую целлюлозу и дается время для формирования колоний ГСК. Через 9 дней суммарный пул колоний собирают и выделяют геномную ДНК. Далее ДНК, полученная из контрольного и опытного образца, гибридизуется со специфическим теломерным зондом, меченным радиоактивным фосфором. Результаты гибридизации обсчитываются. Проводится ряд стандартных тестов на генетическую стабильность полученного клеточного препарата. По результатам проведенных исследований выдается паспорт количественной оценки ДНК теломерных районов коммитированных потомков ГСК в сравнении с контрольным образцом.
Стадия (е). Реинфузия клеточного препарата
Реинфузию полученного на стадии (d) клеточного препарата проводит врач-трансфузиолог в условиях палаты интенсивной терапии под наблюдением анестезиолога-реаниматолога. Перед реинфузией проводят пациенту внутримышечную премедикацию раствором дексаметазона в дозе 4 мг и антигистаминным препаратом (димедрол, супрастин и др.) в дозе 1 мл. Препарат для реинфузии, доставленный из генетической лаборатории в специализированном контейнере, вводят пациенту внутривенно медленно в течении 3-4-х часов через систему переливания крови. После проведения этой процедуры продолжают наблюдение анестезиологом-реаниматологом в течение 6 часов. Реаниматолог вместе с лечащим врачом должны осуществлять контроль состояния пациента для оценки степени риска развития возможных осложнений. Кроме того, у пациентов с неврологическими заболеваниями показано наблюдение нейрохирурга или невролога.
В ходе реинфузии оценивают признаки токсичности. Последующие исследования контрольных показателей крови проводят в течение 3-7-ми дней. При снижении лейкоцитов в крови ниже 10х109/л применяют ципрофлоксацин 500 мг 1 раз в день. Для пролонгированного подавления потомков патологического клона в циркулирующей крови можно применить иммуносупрессивные персонифицированные дендритные вакцины в дозе 5х106 дендритных клеток в комбинации с Мовалисом 15 мг в течение 1 месяца с интервалом 1 раз в 2 недели. Преднизолон по 15 мг/сутки в течение 3-х дней, затем 5 мг в течение недели, затем 2,5 мг в течение 2-х недель . Мониторинг показателей крови (гемограмма) проводят раз в 3 дня.
Стадия (f). Иммунотерапия
Используют АТГ для дополнительной деплеции Т-лимфоцитов, содержащихся в лейконцентрате МНК ПК с реставрированными ГСК, и лимфоцитов в циркуляции, выживших после иммуносупресии. Применяют АТГ в течение 3-4 дней при дозе 10 мг/кг массы тела в день. Кроме того, АТГ обладает иммуномодулирующим действием за счет увеличения экспансии Т-регуляторных клеток, что, в свою очередь, положительно влияет на процессы иммунологической толерантности (Feng X. et al., 2008). После завершения этой стадии и восстановления нормальных показателей крови пациент может быть выписан из стационара.
Стадия (g). Геноориентированная и протеом-основанная оценка эффективности
и мониторинг смены клональности гемопоэза у пациента
Целью этой стадии является анализ динамики генетических и протеомных изменений иммунома ГСК и перепрограмирование системного иммунного ответа организма, приводящего к смене патологической моноклональности или олигоклональности гемопоэза на поликлональность кроветворения и восстановлению функций врожденного иммунитета. Реализация цели обеспечивается геноориентированным и протем-основанным мониторингом генетических и протеомных характеристик клонов ГСК КМ и ПК. Анализ мутаций генов клональности и протеомики иммунома ГСК пациента в постреституционный период проводят через 3, 6, 9 и 12 месяцев после проведения стадии (f) способа по настоящему изобретению. Основными критериями эффективности проведенного лечения является улучшение клинической симптоматики, остановка прогрессирования болезни, увеличение безрецидивного периода болезни. Срок ожидаемого результата крайне индивидуален для каждого пациента и зависит от объема повреждения органа, давности повреждения, степени компенсации нарушенных функций. Лабораторным критерием эффективности проведенной терапии является объективное подтверждения факта перестройки кроветворения пациента с моно- или олигоклонального кроветворения на поликлональное кроветворение. Для этого у пациента производят ДНК-анализ экзома клеток лейконцентрата КМ и ДНК-анализ экзома лейкоцитов ПК на наличие мутаций в основных генах клональности крови и КМ, для чего больному проводят полногеномное секвенирование экзома крови и КМ методом секвенирования нового поколения (NGS). Секвенирование проводят на приборе MSISEQ-G400 с использованием мультиплексной панели MGIEasy Exome Capture V5 с целью выявления патоморфизмов, а также с целью поиска герминальных мутаций в генах при КГ: AKT1, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53. Биоинформатическая обработка данных проводят с использованием программ для демультиплексирования, картирования (BOWTIE2 v 2.2.5 ), определения вариантов (GATK 3.8-0) и аннотирования (SNPEff 4.3T Annovar 2017J) и других инструментов, а затем это же исследование повторяют в крови через 3 и 6 месяцев и сравнивают с результатами первичного ДНК-анализа, проведенного на стадии (а). Положительным результатом проведенной терапии считают смену клональности при выявлении не менее 50% новых мутаций генов клональности и генов стволовости, что свидетельствует об изменении клональности кроветворения и появлении в ПК крови потомков ГСК, имеющих другие типы нарушения мутаций в генах клональности, при неизменности основных патогенных мутаций (полиморфизмов) в анализе полного экзома исследуемого человека. Оценка риска патогенности (выполняется согласно рекомендациям ACMG (SF v2.0)/МГНЦ) включает критерии низкой популяционной частоты (частота варианта 1000 genomes и/или EXAC<0, 01), повреждающего эффекта (nonsens, framesift), наличия информации о варианте в локус-специфических базах данных и др.
Эффективность терапии определяют в период от 100 дней до 6-12 месяцев после проведения стадии (f) и оценивают клиническими шкалами и электрофизиологическими методами исследования (ЭКГ, церебральным картированием ЭЭГ, транскраниальной магнитной стимуляцией, КТ, МРТ, соматосенсорными вызванными потенциалами и электонейромиографией), а также комплексным уродинамическим исследованием у больных с повреждением спинного мозга.
Возможные осложнения и способы их профилактики и устранения
Авторы настоящего изобретения не отметили ни одного факта серьезных нежелательных жизнеугрожающих явлений, связанных с проведением вышеописанных этапов предложенного способа, у 30 исследованных пациентов, что, по-видимому, связано с применением аутологичного биоматериала. У двух тяжелых неврологических больных (больная БАС и больной с рассеянным склерозом) после проведения иммуносупрессии отмечалось субъективное ухудшение самочувствия, обусловленное активацией хронической уроинфекции и появлением гнойно-септических осложнений (катетер-ассоциированная инфекция на подключичный катетер). У четырех пациентов с БАС с выраженными дыхательными нарушениями наросла дыхательная недостаточность, что было связано с применением Г-КСФ и активацией болезни, которые были купированы приемом нестероидных противовоспалительных препаратов.У двух пациентов имело место возникновение аллергических реакций, возможными причинами которых могли быть индивидуальная чувствительность к криопротектору (следовые количества которого могли остаться в препарате для реинфузии) или лекарственную субстанцию Панаген® возможно в случае недостаточной отмывки ГСК от нее перед употреблением. Способы устранения подобных аллергических реакций являются стандартными. Для профилактики возможных аллергических реакций пациента на препарат, вводимый на стадии (е), целесообразно за 20 минут до реинфузии произвести однократное внутримышечное введение Дексометазона в дозе 4 мг/мл и инъекцию антигистаминного препарата. Наличие возможных осложнений заставляет проводить трансфузию только в условиях реанимации стационарного отделения.
Результаты доклинического исследования
эффективности предложенного способа лечения
На первом этапе стратегия реституции КМ была проверена экспериментально. Сделано предположение, что наиболее наглядно детектировать процессы изменения в хроматине можно, ориентируясь на длину локусов, содержащих повторяющиеся последовательности. Для экспериментальной проверки были выбраны локусы теломерных повторов. Такой выбор был сделан по следующим причинам. Во-первых, теломерные повторы не отличаются по первичной последовательности у всех млекопитающих. Это позволяло использовать человеческую hDNAnmr в экспериментах на животных (в частности, лекарственную субстанцию Панаген®). Во-вторых, при культивировании МНК,обработанных hDNAnmr в полужидкой среде, можно получить количество материала измененных ГСК, достаточное для анализа изменения количества теломерной ДНК. Далее, существует, как минимум, три независимых метода определения длинны теломер, и наконец, изменение длины теломер можно оценить по корреляции с изменением продолжительности жизни старых экспериментальных животных при реинфузии генетически измененных ex vivo гемопоэтических прогениторов от старых животных старым животным.
В рамках существующей парадигмы длина теломер прямо коррелирует с продолжительностью жизни. Если удастся увеличить длину теломер, используя описываемый подход, то в биологическом тесте можно увиддеть увеличение продолжительности жизни не только у экспериментальных животных, но и у человека.
Идея способа по настоящекму изобретнию была апробирована на экспериментальных моделях старых линейных мышей и крыс, в клонах ГСК которых удалось ex vivo увеличить длину теломер в два раза по сравнению с контролем. Эти генетические события проявились в витальных экспериментах по увеличению продолжительности жизни у млекопитающих, где реинфузия таких генетически ремоделированных аутологичных ГСК позволили увеличить продолжительность жизни старых мышей на 28%, а старых крыс на 57% в сравнении с естественной продолжительностью жизни в контрольной группе (Заключительный отчет НИР от 2022 года, выполненный МНРЦ им А.Ф.Цыба-филиал ФГБУ НМИЦ радиологии Минздрава России, г. Обнинск Калужской области). Все элементы технологии были экспериментально валидированы.
Существует три различных метода введения терапевтической генетической конструкции больному − in vivo, in situ и ex vivo (А.А. Бабаев, Г.П. Ежова, Н.А. Новикова, В.В. Новиков, 2007). Стадии (d) и (е) в предложенном способе должны быть отнесены к еx vivo генной терапии, так как представляют собой технологию, основанную на реинфузии генетически реставрированных и генетически модулированных собственных (аутологичных) клеток больного.
При этом подходе из организма изолируют ГСК и ГПК, вводят в них требуемую генетическую информацию и затем возвращают в тот же организм. Эти клетки иммунная система не отторгает. Преимуществом терапии ex vivo является то, что можно полностью охарактеризовать полученные отреставрированные клетки до их реинфузии в организм, получить многочисленные клоны этих клеток и отобрать клоны с высоким уровнем экспрессии требуемых или альтернативных генов, а также исключить клоны с опасными трансформациями, которые могли бы нанести вред организму.
Была проведена оценка изменения количества теломерной ДНК в ГСК во фракции МНК, полученных от пожилых мышей и крыс, после обработки образца МНК фрагментированной до размера 1-10 нуклеосомных мономеров hDNAnmr человека.
Краткая характеристика биологических феноменов, позволяющих провести такую оценку, представлена на фиг. 1-4.
Были проведены следующие эксперименты. МНК КМ мышей и крыс обрабатывались препаратом hDNAnmr.
Первая линия экспериментов. Определение длины теломер. Мыши. Обработанные и не обработанные МНК высевали на микрокристаллическую целлюлозу. Через 9 суток выросшие колонии в массе, без деления на гемопоэтические ростки, отмывали от среды и выделяли геномнаую ДНК. Далее оценивали количество теломерной ДНК четырьмя способами. Было установлено, что количество теломерной ДНК в экспериментальном образце примерно в 2 раза больше, чем в контроле (фиг. 5-6). Из бедренных костей мыши выделяли КМ, отмывали и обрабатывали индукторами (Ангиогенин, Панаген) в течение двух часов. Клетки отмывались, после подсчета клетки высевались на микрокристаллическую целлюлозу. Из выросших колоний выделялась ДНК. Количество ДНК определялось с использованием Qubit. ДНК в количестве 1 мкг в четырех повторах для каждого растворяли в 200 мкл 0,5 М NaOH, прогревали при +95°С и наносили на мембрану Hybond N с использованием дотера. Мембрану прижигали 15 минут УФ (ламинар, 30 см от лампы) предгибридизовали в буфере 5×SSC, 5% SDS, 5% декстран сульфат 500 000, 5× раствор Денхарта, 100 мкг/мл суммарной РНК дрожжей в течение 30-60 минут. Меченый 5’ Р32 олигонуклеотид прогревали 5 минут 95°С и вносили в новую порцию гибидизационного буфера. На качалке гибридизовали при 37°С в течение ночи. Отмывали 3 раза по 15 минут 5×SSC, 0.1% SDS. Экспонировали 2 суток и анализировали с использованием фосфоимиджера. Интенсивность сигнала анализировали в программе Quantity1.
Вторая линия экспериментов. Оценка продолжительности жизни старых экспериментальных животных, получивших терапию коммитированными ГСК.
Старым крысам-самкам линии Вистар (возраст 13 месяцев) было реинфузировано 106 обработанных 200 нг hDNAnmr клеток КМ мозга животных такого же возраста. Контроль представляли собой животные такого же возраста, получавшие инъекции 0,9% физиологического раствора. 58% экспериментальных животных дожили до 28 месяцев (75 лет при перерасчете на человека), тогда как в контрольной группе на этот момент не осталось ни одной живой крысы.
Таким образом, было показано, что обработка ГСК препаратом hDNAnmr с их последующей реинфузией экспериментальным животным приводит к проявлению явного антивозрастного эффекта. Более того, этот эффект имеет под собой четко определяемый материальный носитель, а именно увеличение длины теломер ГСК, что хорошо укладывается в современные представления о причинах старости.
Одним из наиболее ожидаемых технологически продвинутых и перспективных клинических результатов применения данной технологии является возможность остановки прогрессирования фатальных осложнений и профилактики рецидивов основных БЦ, старения и наследственных болезней. Это стало возможным из-за нового понимания этиопатогенеза этих болезней, в молекулярно-биологической основе которых лежит патосфецифический моно- или олигоклональный гематопоэз. Клональная экспансия отдельных клеток лежит в основе ряда других заболеваний, помимо рака, включая сосудистые патологии, цирроз и нейродегенерацию (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017. Патологический клональный гематопоэз формируется вследствие накопления дополнительных соматических мутаций в ГСК, что приводит к доминированию патологических клонов ГСК в крови, в результате чего ГСК утрачивают возможность выполнении системных надзорных и контрольных регуляторных функций и нарушаются системообразующие защитные иммунные реакции. В итоге нарушается поликлональность кроветворения как биологическая основа здоровья и долголетия у эукариот. Кроме того, при возрастном клональном кроветворении с неопределенным потенциалом (CHIP) СК, несущие соматические мутации, дают доминантные варианты лейкоцитов, а CHIP связан с повышенным риском серьезных заболеваний, связанных с атеросклерозом, инфарктом миокарда и ишемическим инсультом (Jaiswal & Libby 2020; Jaiswal, S., 2017). Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов при нормальном старении (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Способ по настоящму изобретению позволяет значительно уменьшить (блокировать) репаративный и регуляторный потенциал потомков патоспецифического моно- и/или олигоклонального гематопоэза как фундаментальной причины возникновения онкологических, аутоиммунных, сердечно-сосудистых и нейродегенеративных проявлений фатальных БЦ, наследственных болезней и старении. Патоспецифический (онкоспецифический, нейроспецифический, аутоиммунный, кардиоспецифический и др.) олигоклональный гемопоэз обусловлен мутациями генов клональности и изменением протеомной структуры ГСК (Брюховецкий А.А., 2015), что проявляется изменением профиля протеомных антигенов мембранной поверхности ГСК. Патологические клоны ГСК формируют смертельные аутоиммунореактивные и/или аутоиммунотолерантные реакции ИКК иммунной системы к патологическим тканям организма человека и млекопитающих.
Главным молекулярным ориентиром и терапевтической целью применения предложенного способа является блокирование функциональности, репродуктивности и поддерживающих патогенез болезни патоспецифических клонов ГСК млекопитающего, содержащих патоспецифические (онкоспецифические, кардиоспецифические, нейроспецифические, аутоиммуноспецифические и др.) белки, и достижение (восстановление) консенсуса поликлональности СК и ПК в организме млекопитающего как фундаментальной биологической основы здоровья и долголетия (фиг. 7-8).
Третья линия эксперимента. Для иллюстрации эффективности предложенной технологии была использована животная модель БАС на основе трансгенных мышей лини ΔFUS(1-359), воспроизводящих FUS-протеинопатию. Данная линия трансгенных мышей с эктопной экспрессией склонного к агрегации мутантного гена FUS(1-359) с удалённым сигналом ядерной локализации была ранее разработана и валидирована в НИИ биологичеки активных веществ РАН. Этот ген представляет собой высоко-консервативный ядерный РНК/ДНК связывающий белок. Мутации в этом гене ассоциированы с рядом наследственных форм БАС и фронтотемпоральной дегенерации. В нервных тканях данных животных с накоплением мутантной человеческой формы белка FUS происходит формирование отложений, сходных с теми, которые обнаруживаются в аутопсийном материале больных БАС. В результате у мышей воспроизводится FUS-протеинопатия и развивается прогрессирующий нейродегенеративный процесс с селективной потерей двигательных нейронов. Данная модель хорошо охарактеризована и используется в качестве модели БАС. В результате была создана генетическая конструкция, кодирующая аберрантную форму белка FUS с удалённым сигналом ядерной локализации и неспособная к взаимодействию с РНК. Поэтому в модели отобрана модифицированная форма белка FUS(1-359), у которой отсутствовал сигнал ядерной локализации и был мутирован РНК-распознающий и РНК-связывающий домены, что привело к нарушению его взаимодействия с РНК и перераспределению белка в клетке с накоплением в цитоплазме (фиг. 8). Следует отметить, что в последовательностях гена, кодирующих эти участки белка FUS, было обнаружено наибольшее число мутаций, ассоциированных с наследственными формами БАС.
Трансгенная кассета была сконструирована на основе вектора 323_PTSC-21K человека. Использование промотора Thy-1 обеспечило преимущественно нейроспецифическую экспрессию трансгенной кассеты, которая была введена в пронуклеус ранних эмбрионов мыши и было получено поколение животных с модифицированным геномом в двух независимых линиях (No6 и No19), в которых введённая модификация передавалась по наследству (фиг. 9). Анализ белка из тканей спинного мозга, ствола и коры головного мозга ΔFUS(1-359) мышей подтвердил присутствие укороченной аберрантной формы белка FUS человека, которая кодировалась трансгенной кассетой (фиг. 9).
Существенное преимущество полученной модели заключается в развитии патологического фенотипа при исключительно низком уровне трансгенной мутантной укороченной изоформы белка FUS человека, которой было достаточным для инициации и развития нейродегенеративного процесса. Часть мышей была переведена на другой генетический фон путём обратного скрещивания с аутбредной линией лабораторных мышей CD1. Животные линии ΔFUS(1-359), как на оригинальном гибридном генетическом фоне C57BL/6xCBA, так и во втором поколении после возвратных скрещиваний с CD1, рождались без внешних признаков патологии, они нормально развивались, были фертильны и оставляли жизнеспособное потомство. С возрастом у них проявлялись признаки развития нейродегенеративного процесса, выраженность и динамика которых не зависела от генетического фона линии ΔFUS(1-359). Первые признаки, наиболее часто выражавшиеся в прогрессирующих односторонних парезах задних и передних конечностей, отмечались у взрослых половозрелых животных, начиная с возраста 10-12 недель (фиг. 10).
Неврологическая симптоматика развивалась стремительно, модельное заболевание характеризовалось быстрой прогрессией и часто даже инструментальными методами не удавалось выявить у животных отклонения, предшествующие переходу из предсимптоматической в симптоматическую стадию (фиг. 3). Не позднее, чем через две недели после выявления первых симптомов заболевание переходило в терминальную стадию с тетраплегией и к возрасту 25 недель все трансгенные животные погибали.
Генотипирование животных. Наличие трансгенной кассеты в геноме мышей определяли методом ПЦР. В качестве матрицы использовали геномную ДНК из неочищенных лизатов биопсийного материала. Ткани уха или хвоста весом от 10 до 100 мг исследуемого животного инкубировали в течение ночи в буфере, содержащем 100 мM NaCl, 50 мM Tris (pH 8,0), 2 мM ЭДТА и 0,5 мг/мл протеиназы К при температуре 55ºС, после чего протеиназу К инактивировали прогреванием при 85ºС в течение 1 часа. В ПЦР брали 1 мкл инактивированного лизата и проводили реакцию в 20 мкл смеси, которая содержала буфер (50 mM KCl, 10 mM Tris/HCl pH 9,0, 1,5 mM MgCl2); 0,2 мМ дНТФ; 0.5 мМ каждого праймера и 0,5 единиц TaqDNA полимеразы (Евроген, Россия). Амплификацию проводили на амплификаторе Mastercycler Nexus (Eppendorf AG, Германия). Размер амплифицированного продукта после конвенциональной ПЦР определяли в агарозном геле. Электрофоретическое разделение фрагментов ДНК проводили в 1хTAE буфере, содержащем 40 мМ Трис-HCl, 20 мМ уксусной кислоты, 1 мМ ЭДТА). 1%-ный агарозный гель, приготовленный на том же буфере, содержал 0,5 мг/мл этидия бромида. В качестве молекулярного маркера для определения размера фрагментов ДНК использовали ДНК 100 + bp DNA Ladder (Евроген, Россия). Электрофорез проводили в камере Biorad Sub-Cell GT, при значении напряжения 130V. Визуализацию фрагментов ДНК и документирование результатов осуществляли в аппарате BioSpectrum AC Chemi HR 410 (UVP, США) в проходящем ультрафиолетовом свете (фиг. 11).
Пример агарозного гель-электрофореза продуктов ПЦР реакции представлен на фиг. 4. Фрагмент в 255 пар оснований означал наличие трансгенной вставки у животных, поэтому эти животные относили к группе FUS Het. При отсутствии характерной бэнды животных относили к контрольной дикотипной группе.
Тестируемый объект и способ введения. В качестве тестируемого объекта выступал БМКП из клеток мышей линии ΔFUS(1-359), обработанных очищенной дцДНК, полученной из печени мыши. Ранее работы с аутологичным биомедицинским клеточным продуктом на трансгенных животных линии ΔFUS(1-359) не проводились. Способ введения продукта - внутривенно в хвостовую вену.
Формирование групп животных. Результаты генотипирования потомства, полученного путём скрещивания гемизиготных самцов по трансгенной алели ΔFUS(1-359) с дикотипными самками позволили определить и отобрать необходимое количество животных для проведения запланированных экспериментов. В группы были набраны животные одного возраста из смежных помётов. На момент введения клеток животным было 45 дней. Животных наблюдали в течение 30 дней после введения клеток.
На момент проявления первых симптомов нейромышечной дистрофии животные опытной группы были в возрасте 73 дней. К этому же возрасту одно животное в контрольной группе погибло и у ещё одного наблюдались выраженные симптомы: парезы задних конечностей, общий сниженный мышечный тонус, истощение, дегидратация. Моторные тесты были проведены в возрасте 70 дней. Для сравнения использовали дикотипных животных линии CD1 (WT).
По итогам проведённых исследований можно сделать следующее заключение. В ходе исследований были созданы группы трансгенных животных, которым однократно внутривенно на досимптомной фазе был введён аутологичный БМКП NВ-004429. Введение БМКП трансгенным животным линии ΔFUS(1-359) в возрасте 45 дней продлевает на 24 дня бессимптомное проживание по сравнению с интактными трансгенными животными той же линии, что при средней продолжительности жизни животных в 140 дней составляет 17% (фиг. 12).
Проведённое поведенческое тестирование было предназначено для выявления глобальных значимых отличий. Положительным заключением было то, что в показателях физиологических тестов на выявление моторных дисфункций трансгенные животные линии ΔFUS(1-359), которым вводили NВ-004429, показывали хорошие результаты в сравнении с контрольной группой. Эффект от введения также затрагивает мышечную силу и координацию движений у трансгенных животных. Это говорит о том, что имеется тенденция к улучшению моторных показателей у трансгенных животных с введением маломанипулированного аутоиммунного клеточного препарата.
Клинические исследования эффективности и безопасности
реституции КМ у пациентов с различными заболеваниями
Для изучения безопасности и эффективности способа по настоящему изобретению были пролечены 20 инкурабельных пациентов, у которых были исчерпаны возможности стандартной терапии. Далее приведены клинические примеры проведенной реституции КМ по настоящему изобретению у онкологического пациента с нейроэндокринным раком кишечника, осложненного сердечно-сосудистыми расстройствами и обострением подагры (пример 1), у молодого пациента с нейродегенеративным заболеванием в форме (БАС (пример 2), у больной с прогрессированием болезни, обусловленной наследственным аутосомно-рецессивным заболеванием Смита-Ленсли-Опица (пример 3), а также у больного с аутоиммунным заболеванием - сахарным диабетом 1-го типа (пример 4).
Пример 1. Онкологический пациент с выраженными сердечно-сосудистыми нарушениями.
Пациент К-ов 67 лет. История болезни №2022/0025, находился в клинике АО Клинический госпиталь «НейроВита» с 13.07.2022 по 29.07.2022, 16 койко-дней. Диагноз основного заболевания: Нейроэндокринная опухоль тонкой кишки T3N0M0. Резекция тонкой кишки, формирование илеостомы. От 29.10.2018 1 курс ПХТ по схеме XELOX. Лекарственная терапия октреотидом-депо (до 05.2019 г.). Прогрессирование заболевания 26.10.2021: рост очагов в печени, лекарственная терапия соматулином. Химиоэмболизация сегментарных ветвей правой печеночной артерии иринотеканом от 11.11.2021, 08.02.2022, терапия соматулином 120 мг 1 раз в 28 дней. Стабилизация. Сопутствующие заболевания: Ишемическая болезнь сердца. Постинфарктный кардиосклероз (2018 г.). Стенозирующий атеросклероз коронарных артерий. ТБКА со стентированием ПКА, ПМЖВ, АО от 19.11.2021. Гипертоническая болезнь 3 ст. Риск 4. Нарушение ритма и проводимости сердца: пароксизмальная форма фибрилляции предсердий, параксизмальная наджелудочковая тахикардия, радиочастотная аблация медленного пути АВ-соединения, каватрикуспидального истмусат 31.01.2021. Антриковентикулярная блокада 1 ст. Наджелудочковая экстрасистолия. ХСН 2а, 2 ФК (NYHA), субкомпенсация. Гистологическое заключение от 29.10.2018: нейроэндокринная опухоль G2 c вовлечением стенки тонкой кишки, с признаками лимфососудистой инвазии и переневральной инвазии, без метастазов. Край резекции кишки без признаков опухолевого роста. Осложнение заболевания: ДВС от 15.05.2022, системная воспалительная реакция от 15.05.2022 без установленного патогена, абсцесс печени от 16.02.2022, нижнедолевая пневмония справа от 16.05.2022 в стадии разрешения, кандидоз ротовой полости от 20.02.2022. Пациент консилиумом онкологов признан некурабельным, предложено нахождение в хосписе для онкологических больных.
Жалобы при поступлении: жалобы на боли в правом подреберье, общую слабость, вялость, периодические боли в области сердца с иррадиацией в левую руку, боли и отечность в мелких суставах рук и ног.
Анамнез заболевания. У пациента ранее диагностирована нейроэндокринная опухоль тонкой кишки pT3N0M0. Прогрессирование заболевания: метастазы в печень, по брыжейке тонкой кишки. 28.10.2018: Лапаротомия, резекция тонкой кишки, формирование илеостомы. 1 курс ПХТ по схеме XELOX. Лекарственная терапия октреотидом-депо (до 05.2019 г.). 27.11.2019 закрытие илеостомы, формирование илеотрансверзоанастомоза, биопсия печени. В 2021 г. прогрессирование заболевания, лекарственная терапия соматулином (последнее введение 21.10.2021). Прогрессирование заболевания: рост очагов в печени. Проведено 2 курса внутриартериально химиотерапии иринотеканом от 11.11.2021 и 08.02.2022 +Ланреатид 120 мг п/к ( последнее введение 04.06.22).
18.11.2021: На серии МР-томограмм гепатобилиарной зоны до и после внутривенного введения контрастного вещества (КВ) (Гадовист 7,5 мл) печень увеличена в размерах: кранио-каудальный размер 15,9 см, билобарный размер 19,2 см, передне-задний размер левой доли 8,7 см. В структуре печени определяются очаговые образования в количестве не менее 15, расположенные в правой доле, и в S3, S4 левой доли, образования определяются в паренхиме и субкапсулярно размерами от 3-3,5 до 94 мм. Наиболее крупный на границе S8/S5 с неровными бугристыми контурами, неоднородной структуры за счет участков некроза в центральных отделах, размерами 93х78х94 мм, после в/в контрастирования выявляется активное неравномерное накопление контраста с сохранением длительного контрастного усиления (КУ) фиброзными перегородками, также определяется перитуморозное контрастирование в артериальную и венозную фазы. Остальные патологические очаги меньших размеров, с признаками рестрикции, диффузии, контрастный препарат накапливают однородно или по контуру, пик контрастирования преимущественно выявляется в артериальную фазу. В воротах выявляются л/у, аксиальными размерами до 13х7 мм. Диаметр воротной вены 13 мм. Желчный пузырь увеличен в поперечнике до 38 мм, с перегибом в области тела, стенка не утолщена, в просвете выявляется высокобелковый сладж размером 29х13 мм, в структуре которого определяются мелкие конкременты. Внутрипеченочные желчные протоки не расширены, визуализация внепеченочных желчных протоков резко затруднена на фоне увеличенных л/у ворот печени.
19.11.2021 операция:стентирование правой коронарной артерии, бифуркационное стентирование ствола левой коронарной артерии.
22.11.2021 операция: химиоэмболизация сегментарных ветвей правой печеночной артерии (иринотеканом).
02.02.2022: МР - картина множественных очагов в печени, без существенной динамики по сравнению с исследованием от 18.11.21. Печень увеличена (вертикальный размер правой доли до 171 мм), контуры четкие и ровные. Наиболее крупный очаг в S8/S5 сегментах с неровными контурами, признаками распада в центральных отделах максимальными размерами 78х68х79 мм, при предыдущем иследовании размеры 93х78х94мм. Сохраняются субкапсулярные очаги в количестве 3 шт. в S5 - диаметром 36, 18мм и 17мм.
08.02.2022 операция: Химиоэмболизация сегментарных ветвей правой печеночной артерии.
10.04.2022. При сравнении с исследованием от 02.02.2022 отмечается положительная динамика в виде нерезкого уменьшения большинства вторичных очагов в печени. Появление признаков острого калькулезного холецистита, холедохолитиаз.
10.04.2022 УЗИ гепатобилиарной области. Заключение: УЗ признаки очаговых образований правой доли печени, вероятнее MTS. Холецистит, утолщение и уплотнение стенок желчного пузыря, наличие взвеси в небольшом количестве. Конкременты желчного пузыря. Умеренное увеличение размеров печени
С 11.05.2022 отмечено повышение температуры тела выше 38ºС, самостоятельно принимал Амоксиклав+НПВС - без эффекта. Лихорадка 2-3 раза в день выше 38ºС сохранялась до момента госпитализации. Госпитализирован в клинику «Нейровита» 15.05.2022 с явлениями лихорадки неясного генеза для уточнения этиологии лихорадки и проведения коррегирующей терапии. На фоне консервативного лечения состояние с положительной динамикой. Продолжена терапия Соматулином, последнее введение 01.07.2022. У пациента прогрессирующее злокачественное новообразование с признаками резистентности к проводимой терапии. Пациент соответствовал критериям включения в Протокол персонализированной реститутции костного мозга в лечении злокачественных опухолей и был включен в этот Протокол: морфологически подтвержденный диагноз ЗНО, прогрессирование на фоне проводимой стандартной терапии или резистентность к терапии, возраст 18-85 лет. Пациенту 27.06.2022 выполнен лейкоцитоферез и сбор ГСК, клеточность полученного материала достаточная. По желанию и добровольному согласию пациента, в рамках программы по исследованию иммунного ответа, выполнены исследования ГПК крови (полногеномное секвенирование жидкостного КМ, выявлен патологический клон).
Согласно указанному Протоколу, с целью усиления врожденного иммунного противоопухолевого ответа, запланирована реинфузия пациенту аутологичных ГСК. С 13.07.2022 была начата иммуносупрессия Метилпреднизолоном № 2, с 14.07.2022 Сиролимус №4. 19.07.2022 выполнена ex vivo генотерапия в виде реинфузии аутологичных ГСК, реставрированных лекарственной субстанцией Панаген согласно настоящему изобретению.
Анамнез жизни. Более 30 лет работал главным инженером космодрома Байконур в Казахстане, имел неоднократные контакты с компонентами ракетного топлива и подвергался частым стрессам.
Объективно: Состояние пациента удовлетворительное. Индекс Карновского 90%, шкала ECOG 0. Сознание ясное, контактен, ориентирован во времени и пространстве. Лицо симметрично, язык по средней линии. Нормостеническое телосложение. Костная система без особенностей. Рост 182 см, вес 70 кг, температура 36,8ºС. Периферические лимфоузлы не увеличены, безболезненные, подвижные, мягкоэластичной консистенции. Зев спокоен. Видимые слизистые чистые, влажные, розовые. Кожные покровы бледно-розовые, сухие, тургор мягких тканей снижен. Носовое дыхание свободное. ЧДД=14/мин. SpO2 на воздухе 95-97%. Грудная клетка не изменена. Дыхание везикулярное, проводится над всеми отделами лёгких, хрипов нет. Перкуторный тон ясный - легочный. Тоны сердца приглушены, ритмичные, ЧСС=81, АД 132/74 мм рт.ст. Язык сухой, бледно-розовой окраски. Живот правильной формы, не вздут, при пальпации мягкий, болезненный в правом подреберье, перитонеальных симптомов нет. Печень +3 см от края реберной дуги. Селезенка не пальпируется. Послеоперационные рубцы соответствуют сроку давности оперативного лечения, без признаков рецидива и воспаления. Мочеиспускание не нарушено. Стул 5 раз в сут., кашеобразный, без патологических примесей. Область почек визуально не изменена, поколачивание по поясничной области безболезненное. Диурез снижен. Моча насыщенно-желтого цвета, без патологических примесей. Эндокринная система визуально без патологии. Нервная система без особенностей. Менингеальных знаков нет. Цель госпитализации: реинфузия маломанипулированного препарата аутологичных ГСК согласно Протоколу персонализированной реститутции КМ мозга в лечении злокачественных опухолей с целью усиления врожденного иммунного противоопухолевого ответа.
В АО Клинический госпиталь "НейроВита" 22.06.2022 было выполнено картирование и профилирование маркеров клеточной поверхности ГСК пациента (материал - эксфузат КМ), результаты представлены в Таблице 1.
Таблица 1
Результаты картирования и профилирования маркеров
клеточной поверхности ГСК (пациент К-ов)
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента К-ова в сравнении с усредненными профилями экспрессии белков здоровых доноров (54 человека), больных БАС (66 пациентов) и онкологических (при ЗНО) больных (500 пациентов) представлены на фиг. 13, на которой красная линия - показатели пациента (до лечения), черная линия - средние показатели здоровых доноров, оранжевая линия - средние показатели при БАС, синия линия - средние показатели при ЗНО.
Заключение по результатам биоинформационного анализа картирования и профилирования маркеров клеточной поверхности ГСК
Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента К-ова указывает на статистически отчетливое угнетение экспрессии CD33 и маркера CD45 RO, повышение количества CD56+ клеток и значительное увеличение нормализованной сигнальной интенсивности маркера CD2. Выявлены диссоциация в числе CD61+ клеток и CD41+ клеток (маркеры тромбоцитарного ростка), относительное снижение уровней CD117+ ГСК, увеличение пропорции В-лимфоидных предшественников CD19+, CD10+ и снижение полипотентных CD38+, HLA-DR+ клеток (в том числе присутствие нетипичной для нормы популяции CD38-DR+ клеток). Данный протеомный профиль мембранных белков ГСК пациента представляет собой достоверный онкоспецифический профиль протеомного повреждения ГСК по 22 точкам сравнения ГСК пациента с аналогичными профилями больных раком и других ЗНО и сравнения с аналогичными данными здоровых доноров и убедительно свидетельствует о фенотипе протеом-основанной онкоспецифической иммунной недостаточности в организме пациента, но пока в состоянии частичной компенсации, несмотря на наличие распадающихся метастазов в печени. Отмечено угнетение миелоидных линий кроветворения. У пациента отмечено приближение профиля маркеров мембранной поверхности к типичному профилю больных раком, что говорит не в пользу нейроэндокринного новообразования и характеризуется онкоспецифическими характерными изменениями маркеров мембранной поверхности ГСК больного, характерные для опухолевого олигоклонального гемопоэза. Это свидетельствует об онкоспецифическом протеомном органическом повреждении молекулярной белковой структуры всех ГСК и изменении внутриклеточной сигнальной трансдукции ГСК у пациента. У обследуемого имеются иммунологические предпосылки для возникновения других системных воспалительных и аутоиммунных заболеваний органов и систем.
Анализ полного экзома пациента
Биоматериал - ПК и ГСК КМ пациента. Забор материала выполнен 22.06.2022 после проведения лейкоцитофереза мобилизованных ГСК. Был проведен анализ ДНК клеток КМ и лимфоцитов ПК пациента методом секвенирования нового поколения (NGS). Целевое парноконцевое секвенирование проводилось на приборе MGISEQ-G400 с использованием мультиплексной панели MGIEasy Exome Capture V5 с целью поиска дополнительных соматичеких мутаций в генах при КГ: AKT1, ASXL1, CBL, DNMT1, DNMT3А, DNMT3D, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53. Биоинформатическая обработка данных проводилась с использованием программ для демультиплексирования, картирования (BOWTIE2 v 2.2.5 ), определения вариантов (GATK 3.8-0) и аннотирования (SNPEff 4.3T Annovar 2017J) и других инструментов. Оценка риска патогенности выполнялась согласно рекомендациям ACMG (SF v2.0)/МГНЦ с использованием критерия низкой популяционной частоты (частота варианта 1000 genomes и/или EXAC). Выявленные мутации в генах клональности представлены в Таблице 2.
Таблица 2
Мутации генов клональности ГСК в ПК и КМ пациента К-ова
(список выявленных геномных вариантов в генах при КГ)
последовательность
патогенности
КТ органов брюшной полости 14.07.2022. Исследование выполнено по программе непрерывного спирального сканирования с коллимацией 2 мм.
Проведение КУ: Омнипак 75мл в/в болюсно.
Лучевая нагрузка: 18,5 мЗв.
Состояние после операции: илеостома от 2018 г.
ПЕЧЕНЬ - положение и форма обычные, в размерах несколько увеличена, высотой до 143 мм. Было до 155 мм. Определяются множественные очаги пониженной плотности в паренхиме и подкапсульно в правой и левой доле печени, не накапливающие КВ при КУ, и объемные образования неоднородной плотности, за счет зоны мягкотканной плотности по периферии и жидкостной плотности в центре с перифокальным отеком паренхимы печени в V-VIII сегментах размером патологической зоны 75 х 63 х 57 мм (было 76 х 63 х 62 мм), накапливающей КВ при КУ по периферии (шириной стенки до 19 мм), с незначительным перифокальным отеком общим размером было 80х72х68 мм.
Аналогичные патологические участки в VII сегменте - 25 х 26 х 25 мм (было 25 х 33 х 22 мм), в VI сегменте - 15 х 14 х 18 мм (было 16 х 25 х 22 мм), в IV-V сегментах - 21 х 23 х 36 мм (было 26 х 27 х 25 мм) и 23 х 14 х 21 мм (было 22 х 14 х 22 мм), также накапливающих КВ при КУ по периферии или полностью, с наличием небольших высокоплотных участков на этом фоне в объемных патологических образованиях (плотностью до 120 едН), размерами до 6 мм.
Воротная вена до 17 мм.
Желчный пузырь - положение обычное, спавшейся формы, в размерах сокращен. Контуры относительно четкие, накапливающие КВ при КУ по контуру. Плотность содержимого достоверно не определяется. Паравезикальная клетчатка диффузно уплотнена до жидкостных значений (отечность сохранена в прежнем объеме). Холедох расширен до 8 мм.
Селезенка - положение и форма обычные, в размерах не увеличена. Контуры четкие, ровные. Структура паренхимы однородная. Сосудистая ножка дифференцирована. Добавочная долька селезенки в области ворот размером до 12 мм округлой формы.
Поджелудочная железа - головка 32 мм, тело 8 мм, хвост 15 мм прослеживается на всем протяжении. Контуры четкие. Парапанкреатическая клетчатка дифференцирована.
Почки - положение и форма обычные, в размерах не увеличены. Контуры четкие, неровные. Структура паренхимы почек неоднородная: в паренхиме правой и левой почки определяются единичные округлые образования жидкостной плотности размером максимально справа до 12 мм, слева до 5 мм. В паренхиме левой почки определяется кольцевидное образование с уплотненным контуром жидкостной плотности, размером 23 х 24 мм, накапливающее КВ при КУ по контуру.
По ходу ветвей верхней брыжеечной вены определяется образование неправильной формы размером 30 х 19х 30 мм (без динамики), с мелкими участками обызвествлений на этом фоне (дифференцировать с кальцинатами вдоль сосудов).
Лимфатические узлы в области ворот печени и брыжейки увеличены количественно и с размерами до 7х13 мм. Подпеченочно определяются зоны уплотнения клетчатки до жидкостных значений с распространением на гемиколон справа.
Стенки брюшной аорты с циркулярными кальцинатами.
Заключение: КТ признаки множественных образований печени, вероятно, вторичного генеза (из них объемные образования правой доли печени с признаками распада), внутрибрюшной лимфаденопатии, хронического холецистита, расширения холедоха, кист почек, кистозного образования левой почки (вероятней вторичного генеза), объемного образования брыжейки (вероятней вторичного генеза), остаточных инфильтративных изменений забрюшинной клетчатки, гемиколон справа, атеросклероз аорты.
В сравнении с предыдущим исследованием от 21.06.2022 небольшая положительная динамика в виде уменьшения объема перифокального отека патологических зон в печени и остаточных инфильтративных изменений в брюшной полости и забрюшинной клетчатки.
КТ головного мозга с в/в контрастированием 14.07.2022. Исследование выполнено по программе непрерывного спирального сканирования с коллимацией 2 мм. КУ: Омнипак 100 мл болюсно в/в. Лучевая нагрузка: 3,8 мЗв. Срединные структуры не смещены. Желудочки мозга: ВКК4ж - 13%, ВКК3ж - 3%. Боковые желудочки симметричные, не расширены: ВКК2 - 10%. Цистерны основания мозга прослеживаются, не деформированы. Сильвиевы щели и конвекситальные борозды прослеживаются с обеих сторон, несколько расширены. Зон патологической плотности в веществе мозга не выявлено. Кости свода и основания черепа без видимой костно-травматической патологии. Придаточные полости носа - в левой гайморовой пазухе определяется утолщения слизистой размером до 11 мм с бугристым контуром. Патологического накопления КВ при КУ не выявлено.
Заключение: КТ-данных об остром нарушении мозгового кровообращения не выявлено. Признаки гипертрофии слизистой в левой гайморовой пазухе. Патологического накопления КВ при КУ не выявлено.
Консультация иммунолога, 15.07.2022. Исследование иммунной системы от 21.06.2022, выявлено уменьшение количества Т-клеток без нарушения иммунорегуляторного индекса, значительное увеличение количества NK-клеток, количество NKT-лимфоцитов в пределах нормы, незначительное уменьшение количества В-клеток.
Рекомендовано: Тималин 10 мг в/м на ночь ежедневно (развести содержимое ампулы в 1 мл физраствора) х 10 дней. Провести 3 курса с интервалом в 2-3 недели. Галавит табл. по 25 мг сублингвально по 1 табл. 4 раза в день х 20 дней (принимать по схеме: 10 дней ежедневно, 5 дней - через день, 5 дней - через 2 дня). Иммунный контроль через 3 мес.
ЛЕЧЕНИЕ: Инфузионная терапия, гастропротекторы, гепатопротекторы, альбумин в/в капельно. 13.07.2022 - 14.07.2022 - Метипред 140мг/сутки в/в капельно. 14.07.2022 - 17.07.2022 - Сиролимус 2мг/сутки. 19.07.2022 - реинфузия ГСК: с информированного согласия пациента, в асептических условиях блока реанимации и интенсивной терапии в/в введен аутологичный клеточный генно-модулированный препарат ГСК, полученный согласно стадиям b), d) способа по настоящему изобретению и содержащий 36х109 аутологичных МНК ПК в 100 мл Sol. Polyglukini. Предварительно МНК были собраны у пациента и заморожены в парах азота. Перед введением МНК разморожены, предобработаны лекарственной субстанцией Панаген® и через 40 минут отмыты от ДМСО и лекарственной субстанции Панаген® в соответствии со стандартной методикой. Процедуру введения генно-модулированного клеточного препарата в центральный венозный катетер пациент перенес удовлетворительно. Осложнений во время процедуры не было.
Динамика мутаций генов клональности в МНК ПК пациента К-ова до и после лечения (реституции КМ). Диагноз: С17. Нейроэндокринная опухоль тонкой кишки 4 степени с метастазами в печень. Мутации генов клональности ГСК в ПК пациента до лечения (22.06.2022) представлены в Таблице 2 (см. выше), а после лечения в разное время - в Таблице 3 (30.12.2022) и в Таблице 5 (05.04.2023).
Таблица 3
Мутации генов клональности в лейкоцитах ПК после лечения
(список выявленных герминальных мутаций)
Заключение. В результате проведенного лечения патологический клон (клоны) гемопоэза в КМ ПК онкологического пациента Кор-кова заблокирован(ы) и места патологических клонов заняли потомки других клонов кроветворения, что позволяет утверждать о смене моноклональности (олигоклональности) на поликлональность кроветворения и утверждать об эффективности проведенной персонализованной реститутции КМ.
Катамнез на 28.10.2022. Больной чувствует себя удовлетворительно, ходил в горы, купался в горном озере. При обследовании КТ с КУ данных о прогрессировании онкологического процесса нет, обращает внимание увеличение забрюшинных лимфоузлов на 1-2 мм. Состояние расценено как стабилизация онкологического заболевания.
Катамнез на 01.06.2023. Больной чувствует себя удовлетворительно, набрал более 7 кг веса за период после проведенного лечения, перестали выпадать волосы, они стали более густыми и с минимальным количеством седины. До лечения больной постоянно был вынужден вызывать скорую помощь из-за обострений подагры и болей в сердце после инфаркта миокарда. За прошедшее время больного не разу не беспокоили подагрические боли и боли в области сердца. За последние 6 месяцев ни разу не вызывал скорую помощь из-за сердечных болей. Компенсировались явления геморроя. Ежедневно гуляет по 3-5 км, разгладились морщины на лице. Со слов жены стал внешне выглядеть как до болезни, стал бодр, энергичен и реагирует на посторонних женщин, много шутит. Практически нет простуд, которые были очень часто до проведенного лечения. Если бы не проблемы со стулом, вызванные удалением большого количества кишечника, чувствовал бы себя абсолютно здоровым человеком. При обследовании КТ с КУ данных о прогрессировании онкологического процесса нет, обращает внимание увеличение забрюшинных лимфоузлов на 1-2 мм. Состояние расценено как стабилизация онкологического заболевания.
01.03.2023 были проведены контрольные протеомные исследования ГСК пациента (материал - эксфузат КМ). Результаты картирования и профилирования маркеров клеточной поверхности ГСК пациента представлены в Таблице 4.
Таблица 4
Результаты картирования и профилирования маркеров
клеточной поверхности ГСК пациента К-ова до и после лечения
(на 22.06.2022)
(на 01.03.2023)
(общее кол-во от ЯК)
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента К-ова до и после лечения в сравнении с усредненными профилями экспрессии белков здоровых доноров, больных БАС и онкологических (при ЗНО) больных представлены на фиг. 13, где красная линия - показатели пациента на 22.06.2022 (до лечения), зеленая линия - показатели пациента на 01.03.2023 (после лечения), черная линия - средние показатели здоровых доноров, оранжевая линия - средние показатели при БАС, синия линия - средние показатели при ЗНО.
Заключение после контрольных иссследований по результатам биоинформационного анализа картирования и профилирования маркеров клеточной поверхности ГСК
Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента К-ова в динамике указывает на статистически значимую нормализацию (приближение исследуемых показателей к усреднённым показателям доноров) белкового ландшафта ГСК по маркерам HLA-DR, CD38, CD13, CD33, CD45RO, CD105, CD71, CD44, CD2, CD133. Динамическое сопоставление собственных данных пациента подтвердило факт положительных изменений мембранного профиля ГСК, которые прежде всего коснулись миелоидного ростка кроветворения. Отмечена тенденция к нормализации уровней мегакраиоцитарно-коммитированных ГСК (CD61, CD41). Однако ряд маркеров ГСК остается сниженным и в первую очередь это касается Thy-1+ предшественников (наиболее ранние субпопуляции ГСК) и предшественников клеток врожденного иммунитета CD56, а также CD123+. Кроме того, зафиксировано резкое повышение уровней CD117+ как в сравнении с собственными данными пациента до лечения, так и в сравнении с усредненными данными доноров. Полученный после лечения профиль мембранных белков ГСК пациента свидетельствует о частичной реституции (восстановлении) протеомного профиля ГСК, однако по пяти маркерам (CD90, CD56, CD123, CD117, CD2) сохраняется онкоспецифический профиль протеомного повреждения ГСК. Целесообразно проведение повторных процедур реституции ГСК для консолидации полученных данных.
Примерно через 8 месяцев после лечения пациента, 05.04.2023 провели контрольное определение мутаций генов клональности в лейкоцитах ПК и в ГСК КМ пациента. Результаты представлены в Таблицах 5, 6.
Таблица 5
Мутации генов клональности в лейкоцитах ПК на 05.04.2023
Таблица 6
Мутации генов клональности в КМ на 05.04.2023
Примечания к Таблицам 5,6:
* - мутации генов клональности от 15.08.2022;
** - мутации генов клональности на 30.12.2022;
***- мутации генов клональности на 05.04.2023.
Заключение. В результате проведенного лечения патологический клон (клоны) гемопоэза в ПК и КМ онкологического пациента К-ова заблокирован(ы) и места патологических клонов заняли потомки других клонов кроветворения, что позволяет утверждать о смене моноклональности (олигоклональности) на поликлональность кроветворения и утверждать об эффективности проведеннной персонализованной реституции КМ. Через 5 месяцев изменились 19 мутаций генов клональности, а через 8 месяцев изменились 29 мутаций генов клональности.
Пример 2. Пациент с нейродегенеративным заболеванием.
Пациент Л-ко 1989 года рождения, находился в клинике АО Клинический госпиталь «НейроВита» с 20.11.2022 по 16.12.2022. Диагноз основного заболевания: Болезнь моторного нейрона (клинически отчетливый БАС). Пирамидная недостаточность. Асимметричный тетрапарез. Сопутствующие заболевания: Гипертоническая болезнь I ст., риск ССО 2. Жалобы при поступлении на слабость (нарушена мелкая моторика) и похудание мышц правой кисти; непроизвольные подёргивания в мышцах плеч, правого предплечья.
Анамнез заболевания. Считает себя больным с мая-июня 2022 г., когда появились нарушения мелкой моторики, неполное раскрытие правой кисти, сила мышц сохранялась. Это состояние со слов больного не прогрессируют. В июне 2022 г. отметил появление подёргиваний в мышцах правой руки. Впервые был предположительно поставлен диагноз БАС. По данным МРТ головного мозга (14.07.2022) - без патологических изменений. По данным МРТ шейного отдела позвоночника (14.07.22) - дегенеративно-дистрофические изменения, грыжи м/п дисков C3-С7. По результатам электронейромиографии (18.07.22) - денервационные изменения в мышцах правой в/к. С 26.09.2022 по 11.1020.22г. находится на лечении и обследовании в неврологическом отделении № 3 ГМПБ № 2, где был подтвержден диагноз БАС (по El Escorial, отчетливый БАС).
Госпитализирован в клинический госпиталь "НейроВита" в плановом порядке для обследования и определения дальнейшей тактики лечения. На постоянной основе принимает Рилузол, Коэнзим Q, Карнитин.
Анамнез жизни. Раннее развитие без особенностей, рос и развивался соответственно возрасту. Сопутствующие заболевания - артериальная гипертензия. Аллергоанамнез: идиосинкразии нет, аллергии на пищевые продукты нет. Медико-социальный анамнез: индивидуальный предприниматель, в получении листа нетрудоспособности не нуждается.
Объективный статус на момент поступления. Нормостенического телосложения, достаточного питания. Кожные покровы смуглые, теплые, влажные, тургор тканей сохранен. Группы периферических лимфатических узлов мягко-эластической консистенции, не увеличены, безболезненные при пальпации. Органы дыхания: форма грудной клетки коническая. Дыхание смешанное, ЧДД - 15 в минуту. Тоны сердца умеренно ритмичны, пульс 78 в мин., удовлетворительного наполнения. АД 120/80 мм рт. ст. Живот не увеличен, мягкий, безболезненный. Симптомов раздражения брюшины нет. Печень и селезенка не пальпируются, перкуторно не увеличены. Кишечные шумы выслушиваются. Система мочеотделения: мочеиспускание свободное, безболезненное. Пальпация области почек - безболезненная. Симптом поколачивания отрицателен с обеих сторон. Стул регулярный.
Неврологический статус. Сознание ясное. Состояние удовлетворительное, стабильное. Высшие мозговые функции сохранны, глазодвигательных нарушений нет. Мимическая и жевательная мускулатура интактны. Фонация, глотание, артикуляция не нарушены; язык по средней линии, с фасцикуляциями, без атрофий, мандибулярный рефлекс оживлен, симптом Маринеску-Радовичи (+) с двух сторон. Смешанный асимметричный тетрапарез, силовой в руках, рефлекторный в ногах, со снижением силы в m.biceps brachi справа до 3 баллов, в m.extansor digitorum communis справа до 3 баллов, слева до 4,5 баллов, межкостных мышцах правой кисти до 2/3 баллов, левой кисти до 4 баллов, m.flexor pollicis brevis с двух сторон до 3,5-4 баллов, в других группах мышц отчетливых парезов не выявлено. Сухожильные рефлексы на руках и коленные оживлены D>S, ахилловы оживлены D=S; яркие кистевые знаки с двух сторон; патологические стопные знаки не вызываются. Мышечный тонус повышен по пирамидному типу в предплечья с двух сторон до 1 балла по Ашворт, в мышцах плечевого пояса и плеч с двух сторон, в мышцах правого предплечья и правого бедра. Атрофии мелких мышц правой кисти, мышц правого предплечья. Чувствительных нарушений нет. Постурально-кинетический тремор правой кисти. Координаторных, экстрапирамидных и тазовых нарушений нет. Имеют место клинические признаки сочетанного повреждения центрального и периферического мотонейронов на бульбарном, шейном и пояснично-крестцовом уровнях, ЭМГ выявляет денервационные изменения на всех 4-х уровнях. Имеющиеся данные позволяют диагностировать болезнь двигательного нейрона (по El Escorial, отчетливый БАС).
Согласно Функциональной рейтинговой шкалы ALSFRS-R ∑ _47_ баллов (1,2,3 - 12 баллов; 4,5,6,7,8,9 - 23 баллов; 10,11,12 - 12 баллов).
Результаты лабораторных, клинических исследований. Дата забора материала 21.11.2022 г. Группа крови A (II) Rh «+» полож. Антитела к ВИЧ 1, 2 отрицательный. Антитела к Treponema pallidum (суммарные) ИФА 0.16 S/CO отрицательный (референсные значения: < 1,0 - отрицательный; >= 1,0 - положительный). HBs антиген (HBsAg) отрицательный. Антитела к вирусу гепатита С (anti-HCV) сумм. отрицательный. ОАК: HGB - 156 г/л; RBC - 5,3х1012/л; WBC - 6,5х109/л; PLT - 190 х109/л. БХ анализ крови: Альбумин 52,4 г/л. Общ. белок 81,7 г/л. Креатинин - 95 мкмоль/л. Мочевина - 5,8 ммоль/л. CRP - 0,91мг\л. Общ. билирубин 20,2 мкмоль/л. АЛТ - 20,2 Ед/л. АСТ - 24,1 Ед/л. А-амилаза - 43,9 Ед/л. ГГТП 20,6 Ед/л. ЛДГ 205 Ед/л. ЩФ 67 Ед/л. Кальций общий - 2,74 ммоль/л. Глюкоза плазмы - 4,78 (N-6,15) ммоль/л. Железо - 24,3 ммоль/л. Холестерин 6,0 ммоль/л. Калий - 4,87 ммоль/л. Натрий - 145,2 ммоль/л. Хлориды 105 ммоль/л. Коагулограмма в норме. КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ (04.12.22г.): Фибриноген 3,49 г/л. Тромбиновое время 17,1 сек. Протромбиновое время 13,4 сек. Протрoмбин (по Квику) 98%. МНО 1,01. АЧТВ 28,9 сек. ЭКГ (21.11.2022) - ритм синусовый, чсс 75. Нормальное положение ЭОС. Неполная блокада правой ножки пучка Гиса. Систолическая перегрузка левого желудочка.
ДИАГНОСТИЧЕСКАЯ ЭНДОСКОПИЯ ВЕРХНИХ ОТДЕЛОВ ЖКТ (22.11.2022). Заключение: Аксиальная хиатальная грыжа на фоне недостаточности кардии. Очаговый гастрит. Постъязвенный рубец антрального отдела желудка. МСКТ органов брюшной полости и малого таза с КУ (21.11.2022). Заключение: Достоверных КТ признаков патологических изменений органов брюшной полости, забрюшинного пространства и малого таза не выявлено. Количественное увеличение паховых и брыжеечных лимфоузлов. КТ органов грудной клетки (21.11.2022). Заключение: КТ-признаков очаговых и инфильтративных изменений легких не выявлено, признаки единичных минимальных плевро-пульмональных фиброзных уплотнений обоих легких, признаки хронического бронхита, остеохондроза грудного отдела позвоночника с единичными грыжами Шморля.
ЭЭГ с картированием (21.11.2022). Заключение: Эпилептиформной активности не выявлено. Признаков очагового поражения коры головного мозга не отмечается. Значимой межполушарной асимметрии не определяется. Отмечаются умеренные диффузные нарушения биоэлектрической активности головного мозга, преимущественно связанные с дисфункцией в деятельности диэнцефально-стволовых структур.
Консультация онкоиммунолога (28.11.2022): Диагноз: болезнь моторного нейрона. Заключение по исследованию иммунной системы от 21.11.2022. Выявлено: количество Т-клеток в пределах нормальных показателей; структурное перераспределение в популяции Т-лимфоцитов, характеризующееся увеличением субпопуляции CD4+ лимфоцитов при одновременном уменьшении CD8+ цитотоксических клеток, сопровождающееся увеличением иммунорегуляторного индекса; количество NK-клеток и NKT-лимфоцитов в пределах нормы; количество В-лимфоцитов в норме.
Рекомендовано: Показатели клеточного иммунитета в пределах субкомпенсированной нормы. Коррекция не показана. Возможно применение персонализированной адоптивной иммунотерапии (препараты аутологичных ГСК, приготовленные согласно способу по настоящему изобретению). Иммунный контроль через 3-4 месяца.
Анализ мутаций генов клональности у пациента Л-ко
В декабре 2022 г. был выполнен анализ ДНК лимфоцитов ПК и ГСК КМ пациента методом секвенирования нового поколения (NGS) аналично анализу, описанному выше в Примере 1. Оценка риска патогенности выполнялась согласно рекомендациям ACMG (SF v2.0)/МГНЦ с использованием критериев низкой популяционной частоты (частота варианта 1000genomes и/или EXAC<0,01) и повреждающего эффекта (nonsense, frameshift), а также с использованием локус-специфичных баз данных о вариантах и др. Результаты анализа показаны в Таблице 7.
Таблица 7
Мутации генов клональности в лейкоцитах ПК и в ГСК КМ пациента Л-ко
(список выявленных герминальных мутаций)
* - мутация только в лейкоцитах ПК, в ГСК КМ отсутствует.
Анализ на наличие жизнеспособных ГСК в лейкоконц ентрате пациента показал, что количество жизнеспособных CD34+7-AAD- клеток составляет 0,48 % от общего количества лейкоцитов.
28.11.2022 было проведено картирование и профилирование маркеров клеточной поверхности ГСК в лейкоконцентрате ПК пациента Л-ко. Результаты представлены в столбце "До лечения (на 28.11.2022)" Таблицы 8.
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента Л-ко в сравнении с усредненными профилями экспрессии белков здоровых доноров (54 человека), больных БАС (66 пациентов) и онкологических (при ЗНО) больных (500 пациентов) представлены на фиг. 14, на которой красная линия - показатели пациента (до лечения), черная линия - средние показатели здоровых доноров, зеленая линия - средние показатели при БАС, фиолетовая линия - средние показатели при ЗНО.
Заключение по результатам биоинформационного анализа картирования и профилирования маркеров клеточной поверхности ГСК
Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента Л-ко указывает на присутствие дискордантности на уровне экспрессии на СК миелоидных антигенов CD13 и CD33, на снижение пропорции CD117+ клеток и CD34+, CD38+ клеток, а также на снижение пропорции CD45low CD34+ клеток. Выявлено снижение числа наиболее ранних СК клеток CD34+CD90+. Также обращает на себя внимание практически полное отсутсвие CD56+CD34+ клеток. Выявленные особенности могут отражать нарушения на уровне наиболее ранних ГСК и бипотентных миелоидно-коммитированных ГСК.
Полученный профиль ГСК пациента Ле-ко совпал по 6 показателям с усредненными профилями пациентов с БАС.
Полученные данные свидетельствуют о присутствии нарушений в процессе дифференцировки ГСК, могущих приводить к неправильному функционированию иммунной системы на уровне ранних предшественников и дефициту клеток миелоидной дифференцировки.
Данный профиль мембранных белков ГСК пациента Лев-нко И.А. представляет собой достоверный патологический профиль протеомного повреждения ГСК по 19 точкам сравнения ГСК пациента с аналогичными профилями больных раком и других ЗНО и здоровых доноров и убедительно свидетельствует о фенотипе протеом-основанной нейроспецифической иммунной недостаточности (по 11 точкам) в организме пациента, в первую очередь, о серьезном нарушения функций иммунной системы на уровне миелоидной линии и на ранних этапах дифференцировок ГСК.
Больному Л-ко в клинике, после проведения врачебного консилиума, предложен протокол лечения БАС способом персонализированной реституции КМ согласно настоящему избретению. Данный протокол базируется на том, что при нейродегенеративных заболеваниях имеется иммуноопосредованное воспаление в очагах дегенерации, которое способствует прогрессированию клинических симптомов. Протокол включает в себя мобилизацию и сбор СД34+ фракции МНК, проведение иммуносупрессивной и противовоспалительной терапии и сочетание внутривенной и интратекальной цитотрансфузии фракции МНК (CD34+) ПК в сочетании с моторной реабилитацией. Проведение иммуносупрессивной терапии на первом этапе направлено на подавление иммуноопосредованных механизмов воспаления, играющих роль в прогрессировании нейродегенеративных заболеваний. Введение фракции МНК (CD34+) ПК направлено, с одной стороны, на уменьшение воспалительных реакций путем эпигенетической и клеточной регуляции механизмов клеточных и гуморальных воспаления, с другой стороны, оказывает протективное действие на нейроны, стимулируя эндогенный нейрогенез в очагах повреждения.
Лечение было проведено в несколько этапов: этап I - обследование; этап II - сбор фракции МНК ПК и их криоконсервация; этап III - иммуносупрессивная терапия (после сбора ГСК). Через 2-3 дня после иммуносупрессорной терапии проводилось первое внутривенное введение предподготовленных генетически модулированных клеток фракции МНК (CD34+) ПК, повторное внутривенное этой фракции через 6 месяцев после первой цитотрансфузии. Каждые два месяца планируется проведение интратекальной цитотрансфузии аутологичных клеток этой фракции.
Пациенту с предварительного информированного согласия начато выполнение программы лечения согласно утвержденному протоколу. 23.11.2022 - консультация врача-гематолога, определившего тактику мобилизации и сепарации фракции МНК (CD34+) ПК. 24.11.22-29.11.22 была проведена стимуляция гемопоэза с последующим двойным сбором фракции МНК (CD34+) ПК методом сепарации. Процедуру пациент перенес удовлетворительно. 30.11.2022 - пациенту с предварительного информированного согласия проведена интратекальная цитотрансфузия фракции МНК (CD34+) ПК. Манипуляции пациент перенес удовлетворительно, признаков менингизма не отмечено. 07.12.2022 - консультация врача-химиотерапевта. После обследования и проведения врачебного консилиума пациенту предложено участие в протоколе лечения БАС - «Персонализированная адоптивная иммунотерапия прогрессирующих нейродегенеративных болезней нервной системы c КГ». После получения от пациента информированного согласия планируется начать III этап протокола - иммуносупрессивную терапию с последующей реинфузией аутологичных ГСК. 07.12.2022 - 09.12.2022 - пациенту проведена иммуносупрессивная терапия, процедуры пациент перенес удовлетворительно. 13.12.2022 - в условиях палаты интенсивной терапии под контролем врача-трансфузиолога проведена реинфузия фракции МНК (CD34+) ПК,т.е. препарата, полученного согласно стадиям b), d) способа по настоящему изобретению. Процедуру пациент перенес удовлетворительно.
Пациент в клинике получал курс комплексной специализированной реабилитационно-восстановительной терапии: симптоматическое лекарственное лечение, физиопроцедуры: структурно-резонансная терапия. В связи с окончанием программы обследования и лечения в клинике пациент в стабильном состоянии выписывается на амбулаторное лечение под наблюдение невролога, терапевта по месту жительства.
Катамнез на 01.03 2023 г. Через 3 месяца после проведения реституции КМ согласно настоящему изобретению у пациента отмечено изчезновение фибриллярных подергиваний в мышцах рук и плечевого пояса, атрофии мышц конечностей не увеличились. Согласно функциональной рейтинговой шкалы ALSFRS-R ∑ _47_ баллов (1, 2, 3 - 12 баллов; 4, 5, 6, 7, 8, 9 - 23 балла; 10, 11, 12 - 12 баллов) состояние за 3 месяца не изменилось. При игольчатой электронейромиографии существенных изменений ЭМГ не выявлено, отмечена компенсация состояния.
29.05.2023. Состояние стабильно, ухудшения клинического и нейрофизиологического больной не отмечает.
12.04.2023 были проведены контрольные протеомные исследования ГСК пациента (материал - лейкоконцентрат ПК пациента). По результатам картирования и профилирования маркеров клеточной поверхности ГСК пациента, которые представлены в Таблице 8, отмечена смена клональности кроветворения.
Таблица 8
Результаты картирования и профилирования маркеров клеточной поверхности ГСК в лейкоконцентрате ПК пациента Л-ко до и после лечения
(на 28.11.2022)
(на 12.04.2023)
(общее кол-во от ЯК)
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента Л-ко до и после лечения в сравнении с усредненными профилями экспрессии белков здоровых доноров, больных БАС и онкологических (при ЗНО) больных представлены на фиг. 14, на которой красная линия - показатели пациента на 28.11.2022 (до лечения), синия линия - показатели пациента на 12.04.20232 (после лечения), черная линия - средние показатели здоровых доноров, зеленая линия - средние показатели при БАС, фиолетовая линия - средние покаатели при ЗНО.
Заключение после контрольных иссследований по результатам биоинформационного анализа картирования и профилирования маркеров клеточной поверхности ГСК
Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента Л-ко от 12.04.2023 в сравнении с данными от 28.11.2022 показывает изменение субпопуляционного состава по большинству изученных антигенов. ГСК пациента по большинству параметров совпадают с усредненными донорскими показателями, отмечена нормализация в отношении миелкароицитарного звена, части популяций миелоидно-коммитированных предшественников и лимфоидных клеток-предшественников. Полученные данные свидетельствуют о частичном восстановлении процессов дифференцировки ГСК на уровне костно-мозговых предшественников.
В мае 2023 г. провели контрольное определение мутаций генов клональности в лейкоцитах ПК пациента. Результаты показаны в Таблице 9.
Таблица 9
Мутации генов клональности в лейкоцитах ПК пациента Л-ко
Заключение генетиков. При сравнении ДНК образца от мая 2023 г. (Таблица 9) с ДНК образцом от декабря 2022 г. (Таблица 7) выявлены новые мутации в генах клональности, которые в Таблице 9 выделены жирным шрифтом. Генетические варианты, присутствующие в обоих образцах, указаны обычным шрифтом. Варианты, присутствующие только в более раннем образце от декабря 2022 г. (Таблица 7), выделены курсивом. Полученные результаты позволяют утверждать о смене кроветворных клонов у пациента.
Пример 3. Больная с наследственным заболеванием, осложненным аутоиммунными повреждениями суставов и соединительной ткани организма. Пациентка С-ва 2001 года рождения. Находилась в клиническом госпитале «НейроВита» с 28.11.2022 по 10.12.2022. Поступила повторно, в плановом порядке.
Основной клинический диагноз при поступлении: Ювенильный ревматоидный артрит, полиартикулярный вариант, ремиссия. Фиброзная дисплазия правой м/берцовой кости. Конкурирующее заболевание: Синдром Смита-Лемли-Опица. Последствия закрытой черепно-мозговой травмы (2015 г.) Сотрясение головного мозга. Сопутствующие заболевания: Хронический атрофический гастрит (хеликобактер-ассоциированный), гастроэзофагеальная рефлюксная болезнь, хроническая герпетическая инфекция, хроническая ВПЧ-инфекция. Генитальные кондиломы, с/п хир. удаления 2022 г.
Жалобы. При поступлении предъявляла жалобы на периодические боли в различных суставах (мелких суставах кистей рук и плечей, боли коленных и тазобедренных суставов), слабой и умеренной интенсивности. Периодически утренняя скованность. Герпетические высыпания в области половых органов, проявляются в первые дни цикла. Эпизодическое ощущение тяжести в желудке, иногда сопровождающееся горечью, кислым.
Анамнез жизни. Перинатальный анамнез не отягощен. Раннее развитие без особенностей. В развитии не отставала. Профилактические прививки по нац. календарю. Бытовые условия хорошие, питание регулярное, старается соблюдать гастро-энтерологическое питание (вареная пища, без специй).
Наследственность: отягощена (у мамы псориатический артрит с 50 лет). Травмы, операции: в 2015г. закрытая черепно-мозговая травма, травма переносицы.
Гинекологический анамнез: менструации с 13 летнего возраста. На момент госпитализации 28 день цикла, mensis регулярные, длительность 4 дня (достаточные). Живет с мужчиной в гражданском браке, половая жизнь регулярная.
Аллергоанамнез: лидокаин (слабость, пошатывание после инъекций). Клинико-экспертный анамнез: пациентка на момент госпитализации учится в институте. Вредные привычки: курение, употребление алкоголя, наркотических средств отрицает.
Анамнез заболевания: Развитие заболевания - первые жалобы с октября 2015 г., когда после травмы (через 3 недели) появился боль и отек правого коленного сустава. Обследована в ГДБ г. Рыбинска, выставлен диагноз посттравматический артрит правого коленного сустава. Болезнь Шляттера. РФ фактор отриц. Анализ крови на АТ к лямблиям отриц. РПГА на иерсиниоз отриц. МРТ правого коленного сустава - признаки травматических изменений заднего рога медиального мениска (2 ст). УЗИ правого сустава (2015 г.) без патологии. В лечении р-р димексида+найз-гель на правый коленный сустав №10, биоптрон №7. На фоне лечения кратковременное улучшение, с 09.11.2015 вновь отечность и усиление болей. После ноября 2015 г. появились летучие боли в крупных и средних суставах, субфебрильная температура. С 19.01.2016 по 29.01.2016 находилась на лечении в КБ № 10 с диагнозом: Атропатия, полиартралгия. РФ 30,4 (20.01.16), СРБ 10. РФ от 28.01.2016 - 10 (0-16). АТ к лямблиям, аскаридам, Нр, хламидиям - отрицательные. УЗИ коленных суставов (2016 г.) без патологии. Пациентке поставлен диагноз: ювенильный ревматоидный артрит, подобрана терапия метатрексатом. На протяжении с 2017 по 2021 г. проводилась терапия р-р метатрексата 2,0 в неделю (мед. документов не представлено). В 2021 г. по просьбе пациентки, при замене препарата на плаквенил стала отмечать боль в животе, трудно купируемая медикаментозно, из-за чего пациентка отказалась от приема лекарств. Герпетические высыпания в области половых органов, проявляются в первые дни цикла, до лечения Валтрексом сопровождались выраженной болезненностью, дискомфортом при мочеиспускании. Курсовое противогерпетическое лечение Валтрексом не было закончено по причине болезненных ощущений в области живота (эпигастрия). Небольшие разрастания, возвышающиеся над кожей промежности, наружных половых органах и в вульве - появились более 6 лет назад, до начала половой жизни (генитальные кондиломы), с/п хир. удаления 2022 г.
При первичной госпитализации в клинику пациентке проведено комплексное обследование для включение в программу лечения согласно протоколу «Персонализированная реституция КМ мозга прогрессирующих аутоиммунных болезней с КГ».
Фиброгастродуоденоскопия (19.10.2022). Заключение: Патологии не выявлено. КТ органов грудной клетки (17.10.2022). Заключение: КТ-признаков очаговых и инфильтративных изменений легких не выявлено, признаки единичных плевро-диафрагмальных тяжей обоих легких, дегенеративно-дистрофические изменения грудного отдела позвоночника: остеохондроза (1 ст.) с нарушением статики: S-образным сколиозом (1cт), эностозы тел Тн9, Тн11, L1 позвонков. МСКТ головного мозга (18.10.2022). Заключение: КТ-признаков патологических изменений головного мозга и костей черепа не выявлено. УЗИ органов брюшной полости (19.10.22). Заключение: УЗ-картина соответствует возрастным нормам. УЗИ органов забрюшинного пространства (19.10.22). Заключение: УЗ-картина соответствует возрастным нормам. УЗИ малого таза (24.10.22). Протокол: ПНМ - 19.10.2022, 6-й день менструального цикла. Матка расположена типично, по средней линии, тело не увеличено, размеры тела 5,5 х 3,4 х 5,0 см, контуры ровные, миометрий однородный. Внутримышечные сосуды не расширены, патологических скоплений не выявлено. Шейка матки не гипертрофирована, 3,4 х 2,5см. Цервикальный канал не деформирован. Эндоцервикс не утолщен. Эндометрий структурный, соответствует фазе цикла, контуры ровные. М-ЭХО - 3,8 мм. Патологической васкуляризации при ЦДК и ЭД не выявлено. Маточные трубы не визуализируются. Правый яичник размерами 3,6 х 2,2 х 2,0 см, объем 5,3 см3, фолликулов в срезе 5, максимальный 10,4 мм в диаметре. Левый яичник размерами: 2,95 х 2, 1х 2,05см, объем 4,2 см3, фолликулов в срезе 6, максимальный в диаметре 9 мм. Свободная жидкость в позадиматочном пространстве не определяется. Заключение: ЭХО-признаки 1-й фазы менструального цикла.
Консультация врача -иммунолога. Исследование иммунной системы от 17.10.2022. Выявлено: количество Т-клеток и их субпопуляционная структура в пределах нормы, количество NK-клеток и NKT-лимфоцитов в пределах нормы, количество В-лимфоцитов в норме. Рекомендовано: Панавир свечи 200 мкг на ночь по схеме 5 дней ежедневно + 5 дней через день. Возможно проведение персонализированной адоптивной иммунотерапии (препараты аутологичных ГСК, дендритно-клеточная провтивовирусная вакцина). Иммунный контроль через 3 месяца.
Консультации гематолога (21.10.2022). Расписана программа стимуляции и сепарации фракции МНК (CD34+) ПК. Контроль клинического анализа крови в процессе стимуляции и через сутки после сбора фракции МНК (CD34+) ПК.
Консультация ревматолога. Пациентка с диагнозом: ювенильный ревматоидный артрит, полиартикулярный вариант, ремиссия. Рекомендации: изменить иммунный ответ организма с использованием персонализированной терапии фракцией МНК (CD34+) ПК согласно протоколу программы (способ по настоящему изобретению). Решить вопрос о лечении препаратами железа.
Анализ полного экзома пациентки С-вой
Биоматериал - ПК (венозная кровь) пациентки. В декабре 2022 г. был проведен ДНК анализ 22000 генов в лимфоцитах ПК и КМ пациентки методом секвенирования нового поколения (NGS) аналично анализу, описанному выше в Примере 2. Результаты анализа показаны в Таблице 10.
Таблица 10
Герминальные мутации в генах клональности пациентки С-вой
вариант
ENST00000554581.1:c.726G>A
вариант
ENST00000269305.4:c.215C>G
Заключение. Выявлена мутация в гетерозиготном состоянии в гене DHCR7 в 6 экзоне, приводящая к аминокислотной замене (missense_variant ENST00000355527.3:с.470Т>С:exon6:р.L157P; rs753960624). Данная мутация классифицируется как патогенная и ассоциирована с синдромом Смита-Лемли-Опица и нарушениями холестеринового обмена: https://www.ncbi.nlm.nih.gov/snp/rs753960624#clinical_significance (дата доступа 27.10.2023); https://varsome.com/variant/hg38/rs753960624?annotation-mode=germline (дата доступа 27.10.2023).
30.09.2022 было проведено картирование и профилирование маркеров клеточной поверхности ГСК в эксфузате КМ пациентки. Результаты представлены в Таблице 11.
Таблица 11
Результаты картирования и профилирования маркеров клеточной поверхности ГСК пациентки С-вой
(общее кол-во от ЯК)
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациентки С-вой (до лечения) в сравнении с усредненными профилями экспрессии белков здоровых доноров, больных БАС и онкологических (при ЗНО) больных представлены на фиг. 15, на которой красная линия - показатели пациентки, черная линия - средние показатели здоровых доноров, зеленая линия - средние показатели при БАС, фиолетовая линия - средние покаатели при ЗНО.
Согласно клиническому протоколу «Персонализированная реституция костного мозга прогрессирующих аутоиммунных болезней с КГ» на 1-м этапе, с 24 по 27.10.22 проведена стимуляция костно-мозгового кроветворения с применением Г-КСФ (Нейпомакс 300 мкг/сут п/кожно 1-3 дни, 300 мкг 2 раза/сут. п/кожно - 4 й день). На 2-м этапе (28.10.2022) проведена сепарация фракции МНК (CD34+) ПК согласно рекомендациям врача-гематолога. Объем продукта афереза 334 мл, WBC (белые кровяные тельца) 106,93х109/мл, CD34+ 0,40% = 2,21х106/кг. Полученный материал - 4 мл лейкоконцентрата CD34+ и 4 мл ПК - отправлен для картирования мембранных антигенов ГСК, а также для определения генов клональности.
Заключение по результатам биоинформационного анализа картирования и профилирования маркеров клеточной поверхности ГСК (28.10.2022)
Количество жизнеспособных CD34+7-AAD-клеток составляет 0,48% в пределах лейкоцитов. Анализ указывает на статистически отчетливое угнетение миелоидного звена гемопоэза, а именно - на достоверное снижение количества клеток миелоидной рестрикции (CD34+, CD13+, CD33+ ,CD117+, CD123+), и полное отсутствие мегакариоцитарных предшественников (CD61+) у пациентки. В сравнении с показателями доноров повышено количество предшественников с экспрессией антигена CD44, (адгезивная функция ГСК усилена) Полученные данные свидетельствуют о глубоких нарушения в процессе дифференцировки ГСК, способных приводить к неправильному функционированию иммунной системы и дефициту клеток миело-мегакриоцитарной дифференцировки. Данный профиль мембранных белков ГСК пациентки представляет собой достоверный патологический профиль протеомного повреждения ГСК по 19 точкам сравнения ГСК пациента с аналогичными профилями больных раком и других ЗНО и здоровых доноров и убедительно свидетельствует о фенотипе протеом-основанной аутоиммунноспецифической клональности гемопоэза и существующей иммунной недостаточности КМ мозга в организме пациента, в первую очередь - серьезного нарушения барьерных функций иммунной системы на уровне миелодной и мегакариоцитарной линии.
Кроме того, пациентке в стационаре проводилась противоанемическая терапия - в/в инфузии препарата железа (р-р Ликферр 200 мг № 4), терапия препаратами фолиевой кислоты, в/в озонотерапия, 26.10.2022 удаление вульвовагинальных папиллом и кондилом. 08.11.2022 введена персонифицированная противогерпетическая вакцина - п/к. Процедуру перенесла удовлетворительно.
Соматический статус. Общее состояние удовлетворительное, сознание ясное. Самочувствие не нарушено. Вес 58 кг, рост 173см. Т 36,8ºС, ЧСС 76/мин, ЧД 15/мин. АД 108/66 мм. рт. ст. Кожа чистая. Подкожная жировая клетчатка развита удовлетворительно. Щитовидня железа не увеличена. КМС - при пассивных движениях болезненности в суставах нет, движения в полном объеме, кожа над ними не изменена. Носоглотка без катаральных явлений, миндалины чистые, 1 ст. В легких дыхание везикулярное, проводится, хрипов нет. Тоны сердца звучные, ритм правильный. Живот мягкий, безболезненный, легкий дефанс мышц в эпигастрии. Печень и селезенка не увеличены. Физиологические отправления в норме. Стул регулярный, оформленный, без примесей. Небольшие разрастания, возвышающиеся над кожей промежности, и на наружных половых органах.
Неврологический статус. Данных об острой очагово-неврологической симптоматики не выявлено. В сознании, на момент осмотра в месте, времени и собственной личности ориентируется правильно. ВНД - не изменена. При взгляде в стороны отмечается мелкоразмашистый затухающий, горизонтальный нистагм. Чувствительность на лице интактна. Тонус мышц сохранен. Сухожильные рефлексы диффузно снижены. Брюшные рефлексы abs. Сила мышц конечностей, аксиальной мускулатуры достаточная. Нарушение болевой чувствительности по типу гемигипестезии слева на теле, в левом плече, предплечье. Менингеальных симптомов нет. Тазовые функции контролирует.
Клинический анализ крови от 17.10.2022. Биохимичческие показатели крови в пределах нормы. Группа крови: B (III) Rh «+» ПОЛОЖ.АгKell «+» полож.
Клинический анализ крови от 28.11.22. НВ 120 г/л; Эр 4,7*1012; НСТ 38%; Тромб. 273*109; Лейкоциты 4,31*109/л.
Коагулограмма от 28.11.22. Протромбиновое время 17,6 сек; МНО 1,09; Фибриноген 2,55 г/л (2,0-4,0), АЧТВ 31,5сек (26,0-40,0); Д-димер 108 нг/мл. Б\х исследование крови от 28.11.2022: в пределах нормальных значений. Витамин В12 - 1635 пг/мл. Общий анализ мочи от 28.11.2022: Цвет желтая, мутная. Относительная плотность. 1,027 г/мл; РН 6,0; Белок - 0,15; Глюкоза. - нет, Бил - нет ; Лейкоц. <6,0; Эр. <19,1, Цил., эпителий - нет. Бактерии - 2,8*105. ЭКГ от 28.11.22. Заключение: Ритм эктопический, чсс 67 уд в мин. Нормальное положение электрической оси сердца. Неполная блокада правой ножки пучка Гиса. Диффузных очаговых изменений миокарда нет. За время пребывания в клиническом госпитале продолжено лечение согласно протоколу «Персонализированная реституция КМ прогрессирующих аутоиммунных болезней с КГ». На 3-м этапе, с 30.11.2022 до 02.12.2022 проведена иммуносупрессивная терапия по схеме: Флударабин 4 0мг в/в кап. 1, 2 дни, Мабтера 600 мг в/в кап. 3-й день. На введение Мабтеры отмечена инфузионная реакция в виде гортано-глоточной дизестезии, кожного зуда, в связи с чем была усилена премедикация (Дексаметазон 8 мг, Супрастин 2,0 в/мыш), сделан 40-минутный перерыв в инфузии, в дальнейшем скорость инфузии была снижена и продолжена со скоростью около 30 мл/час в течение 6 часов. Повторных инфузионных реакций не отмечено. Помимо этого у пациентки зарегистрированы следующие побочные эффекты: инсомния, стоматит, дизурия, абдоминалгии, миалгии. 06.12.2022. проведена реинфузия препарата аутологичных ГСК, полученного согласно стадиям b), d) способа по настоящему изобретению. Манипуляцию перенесла удовлетворительно. Вечером 06.12.22- приступ тревоги, учащенные сердцебиения, ночью с 06 на 07.12 - бессонница с 3часов.
На фоне проведенной терапии состояние пациентки стабилизировалось, интенсивность болей в мышцах, суставах снизилась. Пациентка в стабильном, удовлетворительном состоянии выписывается в связи с окончанием программы обследования и лечения. Даны рекомендации - продолжить подобранное лечение в амбулаторных условиях под наблюдением невролога, ревматолога по месту жительства.
Катамнез на 01.03.2023. В течении 2-х месяцев после проведения реституции КМ по настоящему изобретению еще отмечались периодические боли в мелких суставах рук и ног, но в последний месяц состояние полностью нормализовалось, полностью исчезли боли и отеки в суставах в дневное и ночное время. Практически прекратились приступы тревоги и страха. Прекратились герпетические высыпания.22.04.2023 У больной имели место появление синяков на голени и бедрах, которые самостоятельно проходили. Были выполнены генетические исследования на тромбофилию , патологии не выявлено. Через месяц синяки полностью исчезли и больше не появлялись.
В апреле 2023 г. провели контрольное определение мутаций генов клональности в ГСК КМ пациентки. Результаты показаны в Таблице 12.
Таблица 12
Мутации генов клональности в ГСК КМ пациентки С-вой
мутация
ENST00000375687.4:c.2444T>C
ENST00000540549.1:c.5284A>G
ENST00000269305.4:c.215C>G
Заключение генетиков. При сравнении ДНК образца от апреля 2023 г. (Таблица 12) с ДНК образцом от декабря 2022 г. (Таблица 10) выявлены новые мутации в генах клональности, которые в Таблице 10 выделены жирным шрифтом. Генетические варианты, присутствующие в обоих образцах, указаны обычным шрифтом. Варианты, присутствующие только в более раннем образце от декабря 2022 г. (Таблица 10), выделены курсивом. Полученные результаты позволяют утверждать о смене кроветворных клонов у пациентки.
Пример 4. Больной с аутоиммунным заболеванием.
Пациент П-ч 1997 года рождения, в ноябре 2022 г. находился на лечении в клиническом госпитале «НейроВита» Поступил с основным клиническим диагнозом: Сахарный диабет 1 типа, инсулинзависимый. Целевой уровень HbA1C меньше 7%. Осложнения: Дистальная диабетическая сенсорная симметричная полинейропатия, диабетическая нефропатия, ХБП 1 ст., ретинопатия, диабетическая гастропатия.
Жалобы при поступлении: эпизодическое онемение, жжение, покалывание в нижних конечностях.
Анамнез заболевания: у пациента выявлен сахарный диабет 1 типа около 10 лет назад, сам пациент связывает развитие данного заболевания с перенесенной аллергической реакцией на креветки. При первом обращении в больницу с плохим самочувствием был выявлен подъем глюкозы крови выше 20 ммоль/л. В связи с лабильностью течения СД, частыми гипогликемиями, особенно в ночное время, жалобами неврологического характера пациенту была показана помповая инсулинотерапия с целью уменьшения вариабельности гликемии в течении суток, уменьшения количества гипогликемий, а также количества инъекций инсулина в сутки. с 2014 г. находится на помповой инсулинотерапии 70 ед./сутки. Замена инсулиновой помпы осенью 2021 г.
Анамнез жизни: раннее развитие без особенностей. Рос и развивался соответственно возрасту, в физическом и умственном развитии от сверстников не отставал. Высшее образование. Живет с родителями.
Наследственный анамнез - наследственность по СД не отягощена, диету соблюдает.
Перенесенные операции, травмы: Перелом левого запястья в возрасте 10 лет.
В анамнезе лазерное лечение по поводу пролиферативной ретинопатии (ежегодно проходит лечение по профилактике осложнений).
Эпиданамнез: за последние 6 месяцев страны с тропическим климатом и экзотические страны не посещал. Короновирусную инфекцию перенес легко без клинических проявлении в 2020 г. ПЦР тест Covid-19 на момент госпитализации - отрицательный.
Аллергия пищевая - креветки.
Вредные привычки: курение, употребление алкоголя, наркотических средств - отрицает.
Клинико-экспертный анамнез. Работает по профессии - инженер программист. Нуждается в листе нетрудоспособности (первичный).
Биохимические исследования крови (14.11.2022): АЛТ 18,3 Ед/л, АСТ 28,4 Ед/л, ЩФ 63 МЕ/л, ГГТ 13,4 МЕ/л, ЛДГ 121 Ед/л, CРБ 0,41 мг/л, альфа-амилаза 66,7 МЕ/л, общий белок 72,5 г/л, альбумин 46,0 г/л, билирубин общий 10,9 мкмоль/л, билирубин прямой 2,2 мкмоль/л, мочевая кислота 293,5 мкмоль/л, мочевина 5,2 ммоль/л , креатинин 88 мкмоль/л, глюкоза 4,53 ммоль/л, холестерин общий 4,5 ммоль/л, калий 4,16 ммоль/л , натрий 142,4 ммоль/л, хлориды 106,3 ммоль/л, кальций общий 2,42 ммоль/л, железо 13,8 мкмоль/л.
Гормоны (14.11.2022): инсулин 8,87 мкМЕ/мл, Индекс Caro (инсулинорезистетность) 0,51 (более 0,33), HOMA (Homeostatic Model Assessment) 1,79 (менее 2,77), С-пептид < 0.01 (L) нг/мл.
Аутоантитела: антитела к инсулину (IAA), IgG 1.45 Ед/мл (<5,0) - антитела не обнаружены).
Коагулологические исследоавания: фибриноген 2,25 г/л, тромбиновое время 17,6 сек, протромбиновое время 14,5 сек, протрoмбин (по Квику) 81%, МНО 1,14, АЧТВ 35,4 сек, Д-димер 487.00 нг/мл (мужчины менее 443).
21.11.2022 проведено картирование и профилирование маркеров клеточной поверхности ГСК в лейкоконцентрате ПК пациента. Результаты представлены в столбце " До лечения (на 21.11.2022)" Таблицы 13 (см. ниже).
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента П-ч в сравнении с усредненными профилями экспрессии белков здоровых доноров, больных БАС и онкологических (при ЗНО) больных представлены на фиг. 16, на которой красная линия - показатели пациента (до лечения), серая линия - средние показатели здоровых доноров, оранжевая линия - средние показатели при БАС, синия линия - средние показатели при ЗНО.
Количество жизнеспособных CD34+7-AAD-клеток составляет 0,3% в пределах лейкоцитов. Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента П-ч показывает на наличие нарушений на уровне миелоидного ростка кроветворения, о чем свидетельствует снижение экспрессии пан-миелоидных антигенов CD13 и CD33, снижение пропорции CD117+ и CD133+ клеток. Следует также отметить повышенное количество CD34+ и CD38+ клеток, что может являться признаком активации данного клона, а также снижение пропорции CD45low CD34+ и CD34+CD90+ клеток, что может отражать нарушения на уровне наиболее ранних стволовых кроветворных клеток.
Полученные данные свидетельствуют о наличии нарушений в процессе дифференцировки ГСК, что можнт приводить к неправильному функционированию иммунной системы и дефициту клеток миелоидной дифференцировки.
Полученный профиль мембранных белков ГСК пациента Пилькевич А.В. представляет собой достоверный патологический профиль протеомного повреждения ГСК по 19 точкам сравнения ГСК пациента с аналогичными профилями больных раком(3 точки совпадения) и других ЗНО и здоровых доноров и убедительно свидетельствует о фенотипе протеом-основанной специфической аутоиммунной недостаточности в организме пациента, в первую очередь серьезного нарушения функций иммунной системы на уровне миелоидной линии и на ранних этапах дифференцировок ГСК.
По результатам комплексного обследования пациента он был включен в программу терапии согласно протоколу «Персонализированная адоптивная иммунотерапия диабетической полинейропатии при сахарном диабете 1-го и 2-го типа c КГ». После обследования на I-м этапе реализации программы клинического протокола выполнена стимуляция костно-мозгового кроветворения препаратами Г-КСФ с 17.11.2022 до 20.11.2022.
На II-м этапе (21.11.2022) выполнена сепарация фракции МНК (CD34) ПК пациента, процедуру перенес удовлетворительно. Объем продукта афереза - 348 мл. Лейк. 187,73 х109/мл, CD34+ 0,33% от образца ЯК = 3,31 х106/кг. На III-м этапе клинического протокола проведена иммуносупрессия с 23.11.2022 по 25.11.2023, процедуры перенес удовлетворительно.
С предварительного информированного согласия пациента 30.11.2022 проведена реинфузия пациенту персонализированной адоптивной аутологичной моноклональной фракции МНК (CD34) ПК, т.е. реинфузия препарата, полученного согласно стадиям b), d) способа по настоящему изобретению. Процедуру перенес удовлетворительно.
18.04.2023 проведено контрольное картирование и профилирование маркеров клеточной поверхности ГСК в КМ пациента. Результаты представлены в Таблице 13.
Результаты профилирования экспрессии маркеров клеточной поверхности ГСК пациента П-ч в сравнении с усредненными профилями экспрессии белков здоровых доноров, больных БАС и онкологических (при ЗНО) больных представлены на фиг. 16, на которой зеленая линия - показатели пациента после лечения.
Таблица 13
Результаты картирования и профилирования маркеров клеточной поверхности ГСК пациента П-ча
(на 21.11.2022)
(на 18.04.2023)
(общее кол-во от ЯК)
Количество жизнеспособных CD34+7-AAD-клеток на 18.04.2023 составляет 1,2% в пределах лейкоцитов.
Биоинформационный анализ результатов картирования и профилирования белковых маркеров клеточной поверхности ГСК пациента П-ч в динамике указывает на статистически значимую нормализацию (приближение исследуемых показателей к усреднённым показателям доноров) белкового ландшафта ГСК по маркерам CD117, CD33, CD7, CD19), также выявляется тенденция к нормализации количества CD38+, CD13+, CD56+, CD123+ и CD133+. Динамическое сопоставление данных пациента подтвердило факт положительных изменений мембранного профиля ГСК, которые коснулись в основном миелоидного ростка кроветворения, а также ряда антигенов, ассоциированных с наиболее ранними популяциями ГСК (CD133+). Однако ряд маркеров ГСК остается сниженным и в первую очередь это касается мегакариоцитарных антигенов и отдельных лимфоидных антигенов (CD2).
Настоящий профиль мембранных белков ГСК пациента П-ч свидетельствует о частичной реституции протеомного профиля ГСК, однако по маркерам CD38, CD56, CD13, CD123, CD133, CD2 и по мегакариоцитарным антигенам сохраняется патологический профиль протеомного повреждения ГСК. Целесообразно проведение повторных процедур реинфузии согласно настоящему изобретению для консолидации реституции клонов кроветворения.
Далее приведены данные о мутации генов клональности в лейкоцитах ПК пациента П-ч на ноябрь 2022 г. (Таблица 14) и на май 2023 г. (Таблица 15).
Таблица 14
Мутации генов клональности в пациента П-ч (ноябрь 2022 г.)
значения
значения
Таблица 15
Мутации генов клональности в пациента П-ч (май 2023 г.)
Заключение генетиков от 15.05.2023. При сравнении ДНК образца венозной крови от мая 2023 г. (Таблица 15) с ДНК образцом от ноября 2022 г. (Таблица 14) выявлены новые мутации в генах клональности, которые в Таблице 15 выделены жирным шрифтом. Генетические варианты, присутствующие в обоих образцах, указаны обычным шрифтом. Варианты, присутствующие только в более раннем образце от ноября 2022 г. (Таблица 14), выделены курсивом.. Полученные результаты свидельствуют о смене кроветворных клонов у пациента.
Катамнез на 15.05.2023. Пациент жалоб не предъявляет, снизились в два раза дозы длинных инсулинов и на треть удалось снизить дозы коротких инсулинов. У пациента отмечается низкий уровень EIR, наблюдается сниженный уровень HbA1C (гликолизированного гемоглобина), низкий уровень аутоантител, повышенный уровень С-пептида.
Использованные сокращения
hDNAnmr - нуклеосомные мономеры геномной ДНК
АТГ - антитимоцитарный глобулин
БАС - боковой амиотрофический склероз
БМКП - биомедицинский клеточный продукт
БЦ - болезни цивилизации
Г-КСФ - колониестимулирующий фактор
ГПК - гемопоэтические прогениторные клетки
ГСК - гемопоэтические стволовые клетки
дцДНК - двухцепочечная ДНК
ЗНО - злокачественные новообразования
ИКК - иммунокомпетентные клетки
КВ - контрастное вещество
КГ - клональный гемопоэз
КМ - костный мозг
КУ - контрастное усиление
МНК - мононуклеарные клетки
ОК - опухолевые клетки
ОСБ - онкоспецифические белки
ПК - периферическая кровь
п.к. - пары нуклеотидов
СК - стволовые клетки
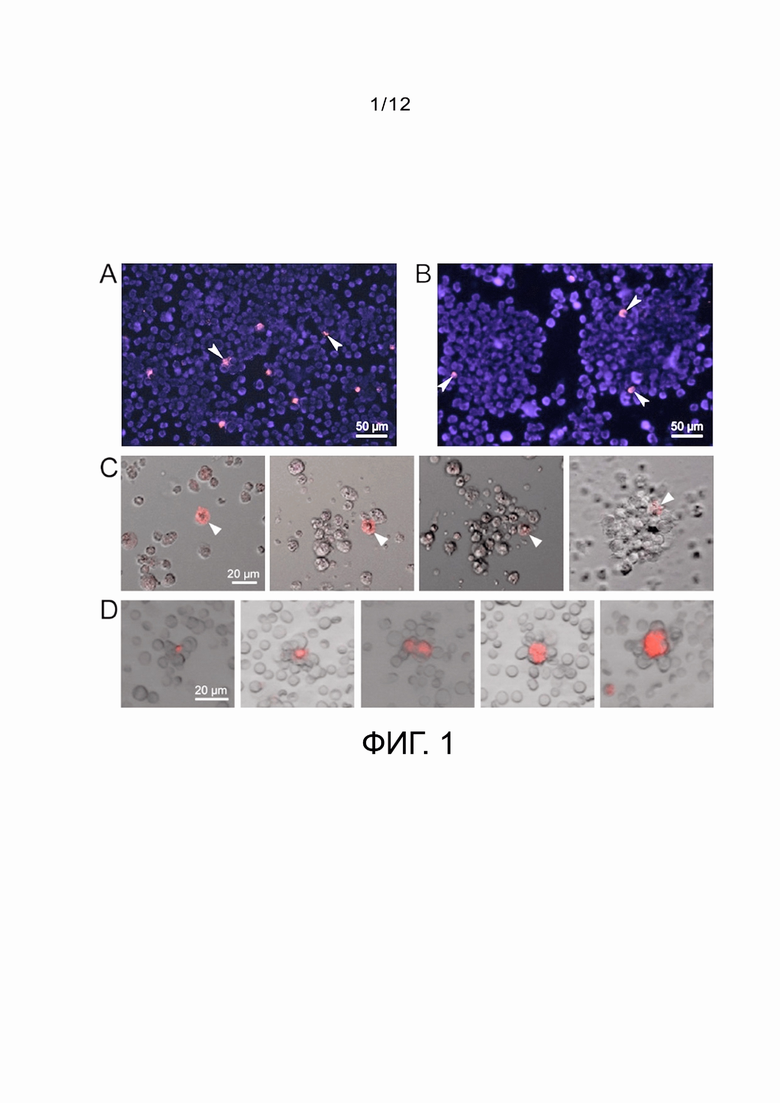
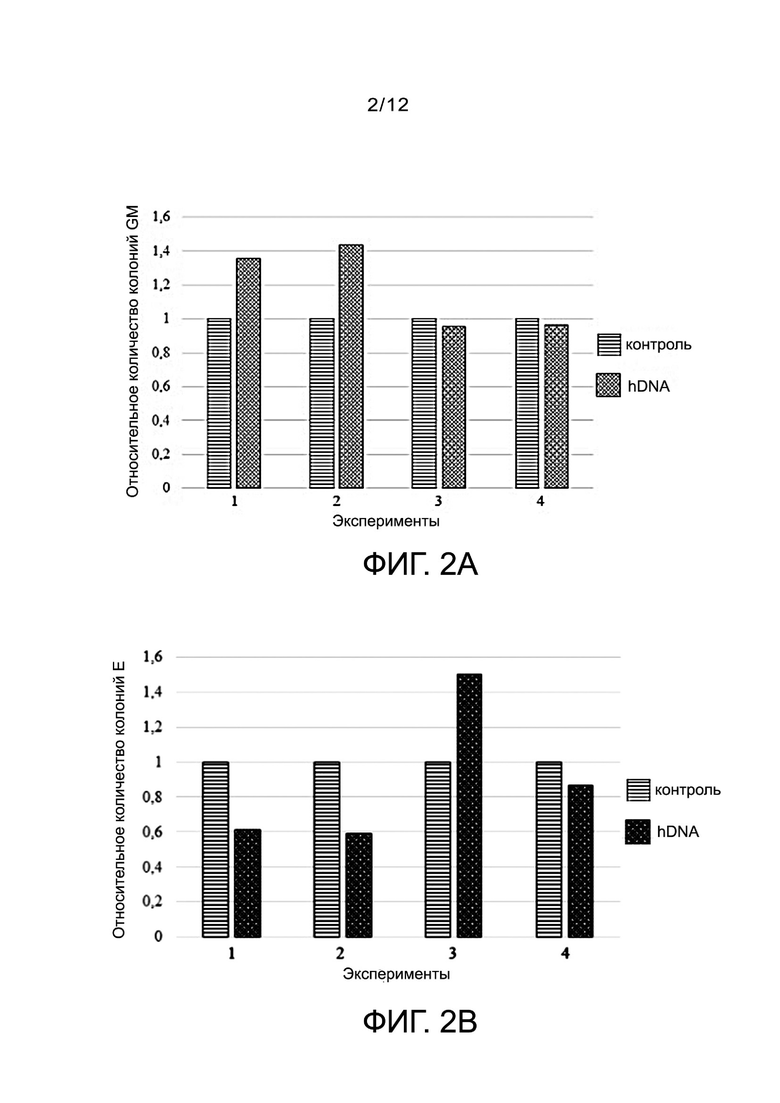
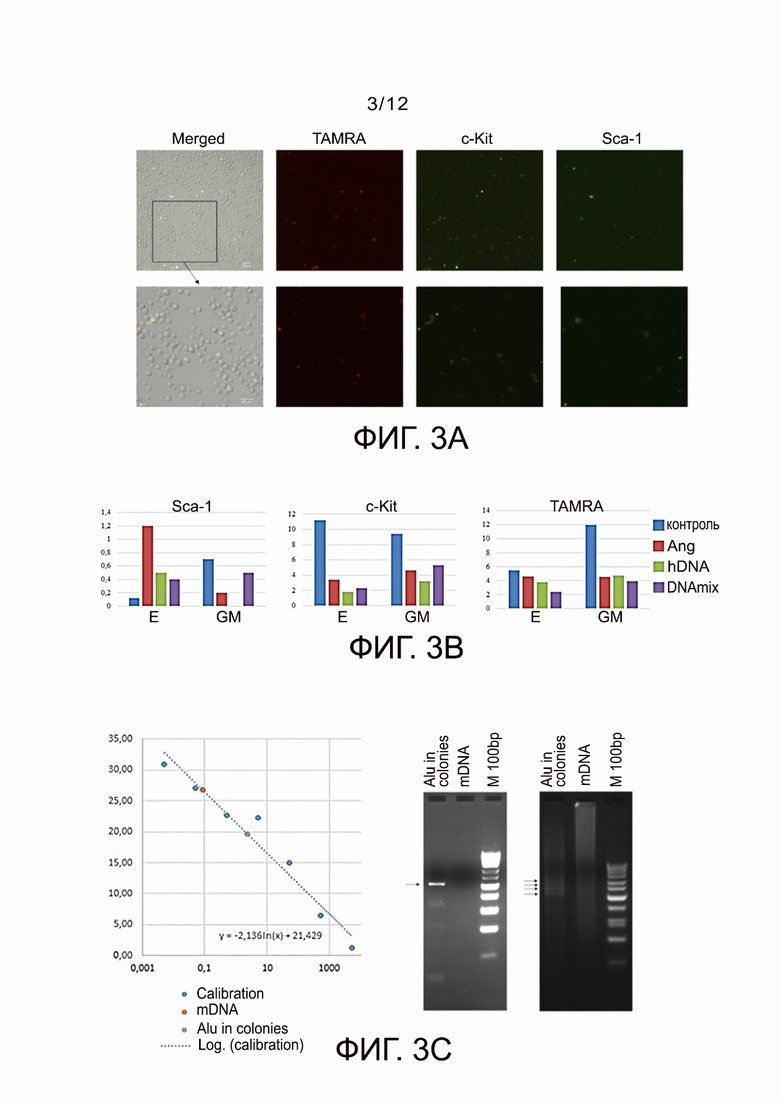
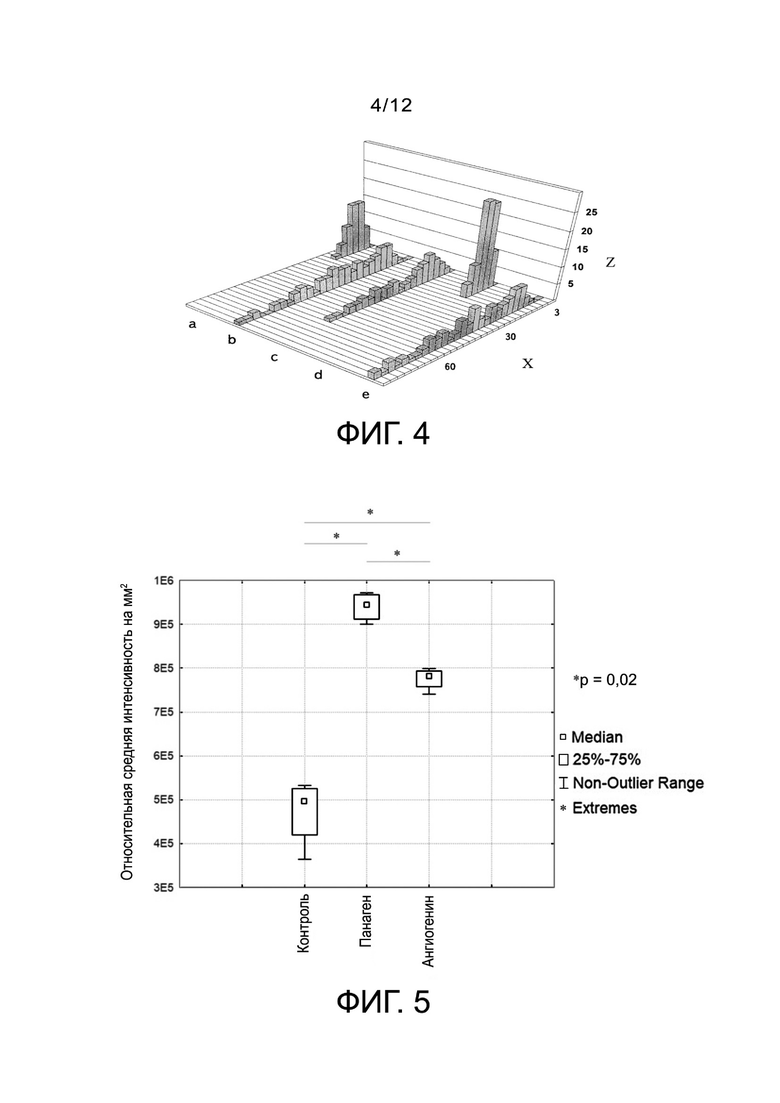
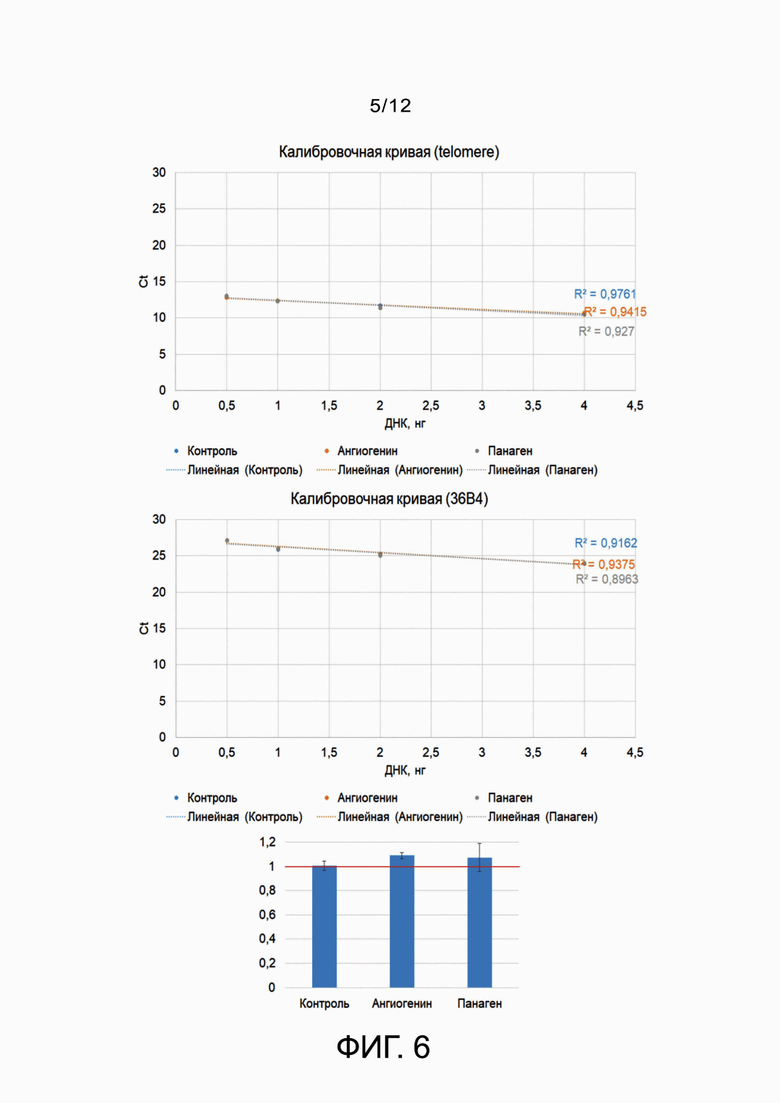
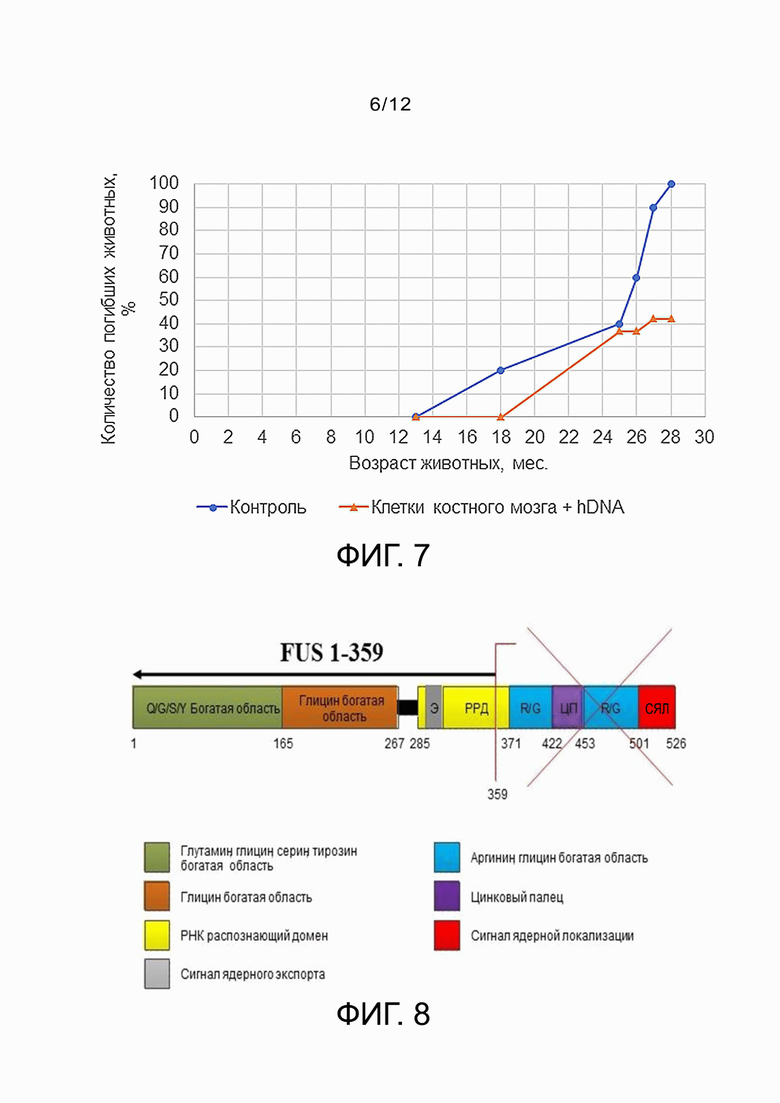
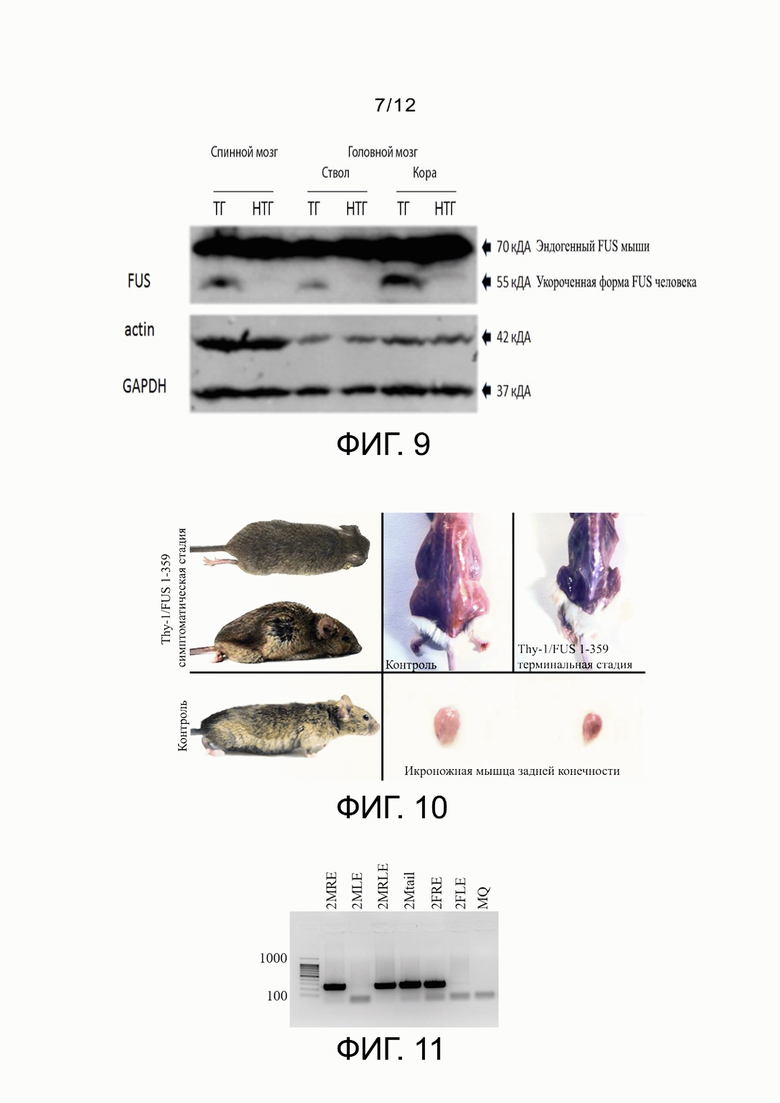
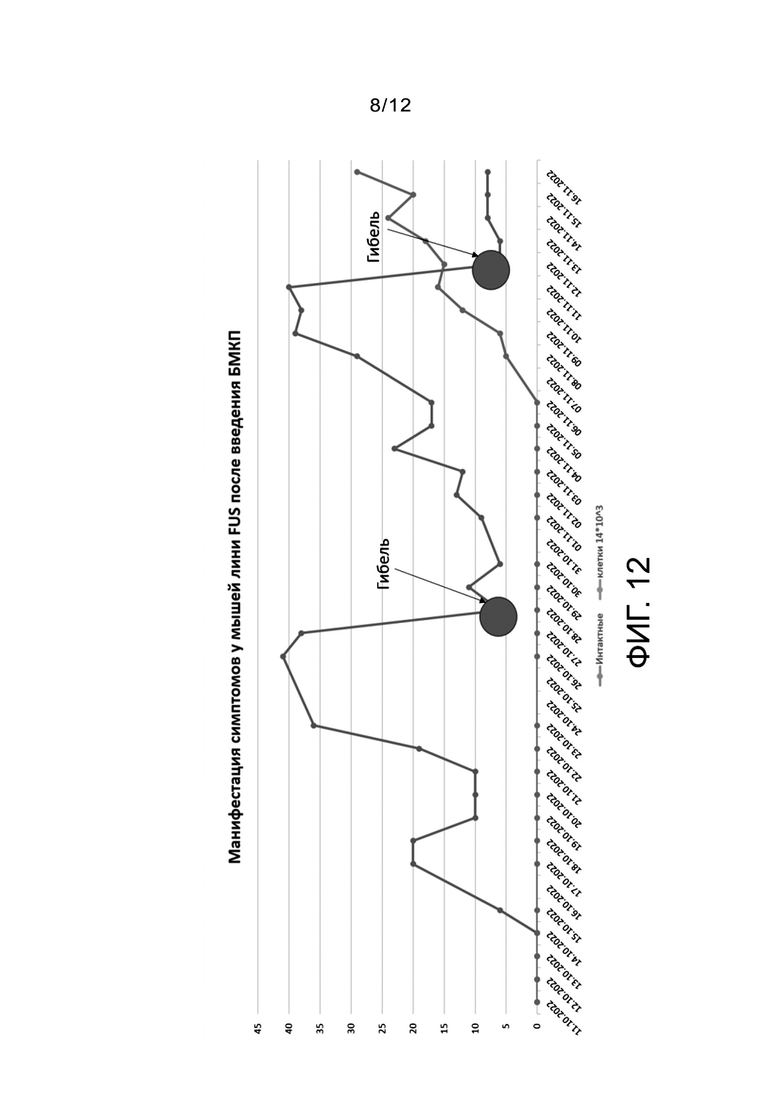
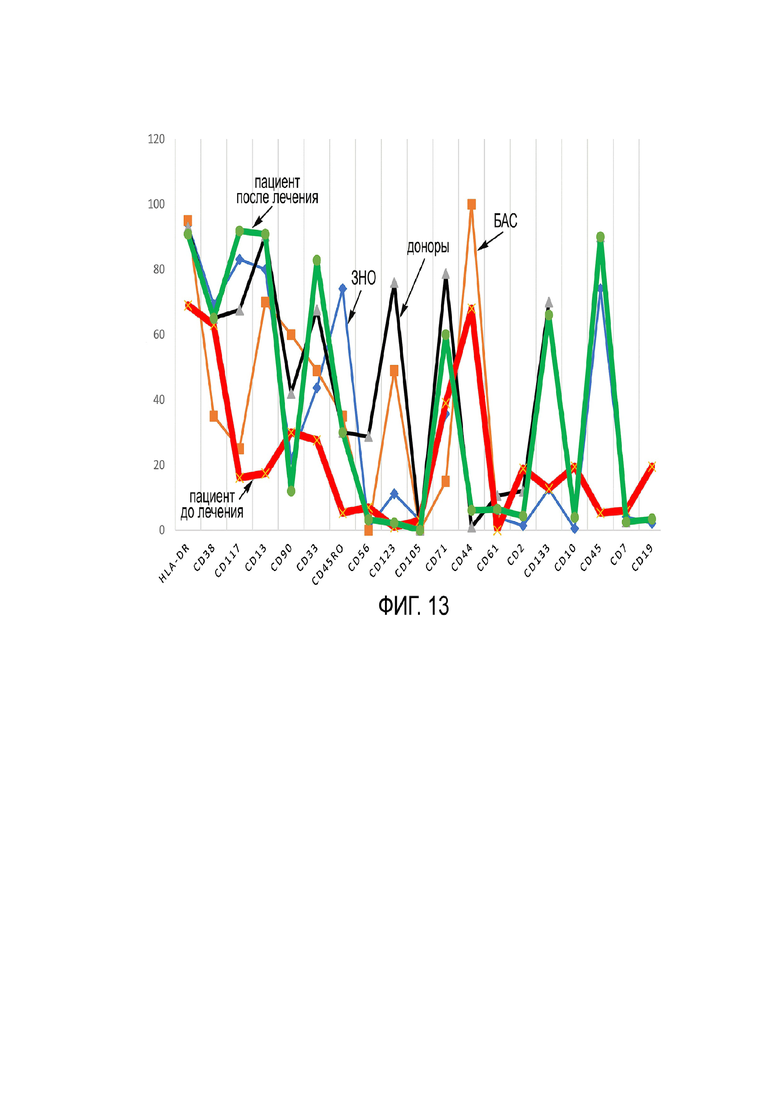
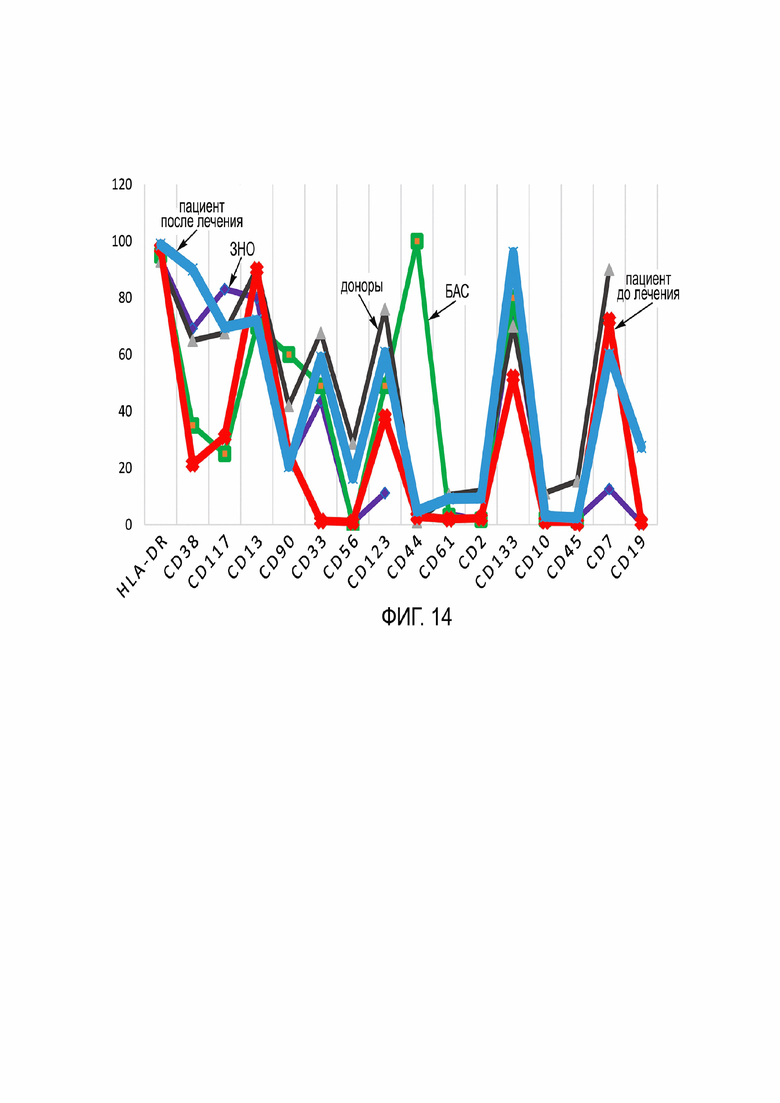
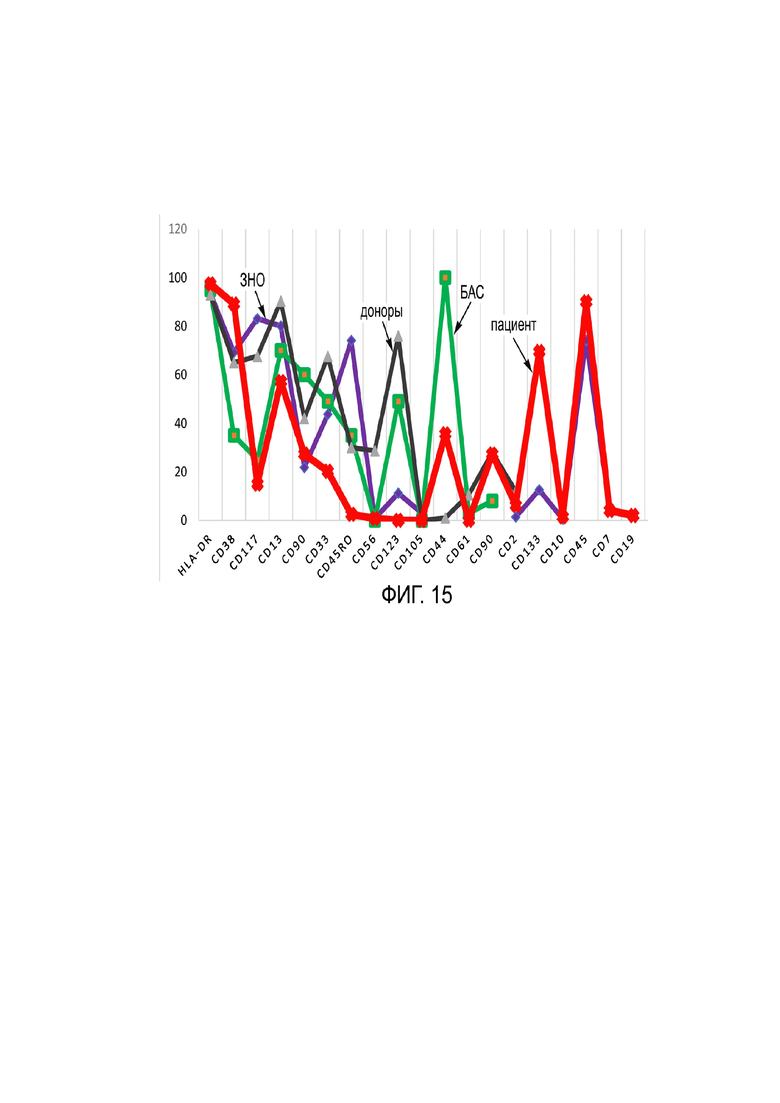
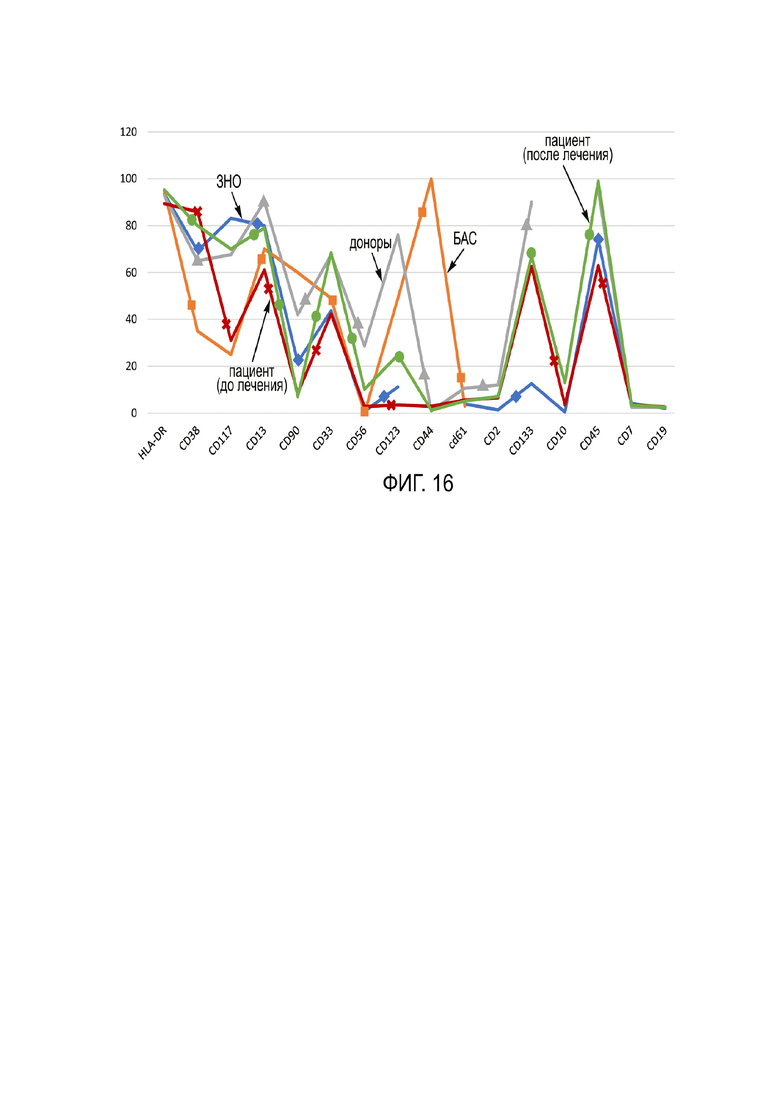
Изобретение относится к области биотехнологии, а именно к способу реституции костного мозга. Способ включает стадии: (а) диагностика гемопоэтических стволовых клеток (ГСК) костного мозга (КМ) и лейкоцитов периферической крови (ПК) пациента путем геномного анализа или ПЦР-диагностики; (b) при наличии у пациента клонального гемопоэза мобилизация ГСК и ГПК пациента, на 5-й и 6-й день мобилизации - сбор аутологичных ГСК и гемопоэтических прогениторных клеток (ГПК) путем выделения лейкоконцентрата аутологичных мобилизованных мононуклеаров с максимально возможным удалением патологического клона/клонов ГСК и ГПК из КМ и ПК пациента, очистка лейкоконцентрата от эритроцитов, тромбоцитов и гранулоцитов с получением очищенного лейкоконцентрата и его последующая криоконсервация; (c) при наличии у пациента клонального гемопоэза и после проведения стадии (b) - определение иммунного статуса пациента и в зависимости от количественных показателей статуса - немиелоаблативная иммуносупрессия, или иммуностимуляция, или иммуномодуляция организма пациента; (d) размораживание лейконцентрата, полученного на стадии (b), его облучение ионизирующей радиацией в дозе 0,3-1,5 Гр для нанесения микроповреждений геному клонов ГСК и ГПК, геномное модулирование и коммитирование ГСК и ГПК путем инкубации в течение 45-60 минут лейкоконцентрата пациента, содержащего ГСК с микроповреждениями ДНК, с препаратом нуклеосомных мономеров геномной ДНК человека с получением препарата для его реинфузии пациенту; (e) после стадии (с) и нормализации показателей крови пациента - внутривенная реинфузия пациенту препарата, полученного на стадии (d); (f) иммунотерапия пациента антитимоцитарным глобулином; (g) на 3-й, 6-й, 9-й и 12-й месяцы после стадии (е) - диагностика в объеме стадии (а) для мониторинга смены клональности гемопоэза. Изобретение обеспечивает восстановление поликлональности кроветворения путем природоподобного изменения генома доминирующего клона аутологичных ГСК и ГПК. 2 з.п. ф-лы, 16 ил., 15 табл, 4 пр.
1. Персонализированный способ реституции костного мозга для профилактики старения, внезапной смерти и остановки прогрессирования различных фатальных неинфекционных болезней, осложненных клональным гемопоэзом, включающий следующие стадии:
(а) проводят геноориентированную молекулярно-биологической диагностику гемопоэтических стволовых клеток (ГСК) костного мозга (КМ) с маркерами CD34+, CD45+ и лейкоцитов периферической крови (ПК) пациента путем геномного анализа с использованием секвенирования экзома или ПЦР-диагностики для выявления дополнительных соматических мутаций в генах клональности AKT1, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, MTOR, PPM1D, PTEN, SF3B1, TET2, TP53 в ГСК КМ и в лейкоцитах ПК пациента, а также протеомного анализа белковых антигенов мембранной поверхности ГСК КМ пациента с использованием проточной многоцветной лазерной цитофлюориметрии для получения патоспецифического профиля белков мембранной поверхности клона или клонов ГСК, причем при наличии мутаций, по меньшей мере, в одном из указанных генов клональности, определяемых путем геномного анализа, и наличии паталогического профиля белков ГСК, характерного для патоспецифической иммунной недостаточности и определяемого путем протеомного анализа, устанавливают факт наличия у пациента клонального гемопоэза;
(b) при наличии у пациента клонального гемопоэза, установленного на стадии (а), проводят мобилизацию ГСК и ГПК пациента путем стимуляции гранулоцитарным колониестимулирующим фактором, а на 5-й и 6-й день стимуляции проводят сбор аутологичных ГСК с маркерами CD34+, CD45+, HLA DR+ и гемопоэтических прогениторных клеток (ГПК) с маркерами CD34+, CD45-, HLA DR- путем выделения лейкоконцентрата аутологичных мобилизованных мононуклеаров с помощью лейкоцитофереза ПК или эксфузии нативного КМ с максимально возможным удалением патологического клона или клонов ГСК и ГПК из КМ и ПК пациента, очистку выделенного лейкоконцентрата от эритроцитов, тромбоцитов и гранулоцитов с получением очищенного лейкоконцентрата и его последующую криоконсервацию для дальнейшего хранения;
(c) при наличии у пациента клонального гемопоэза, установленного на стадии (а), и после проведения стадии (b) определяют иммунный статус пациента и в зависимости от количественных показателей этого иммунного статуса проводят немиелоаблативную иммуносупрессию, или иммуностимуляцию, или иммуномодуляцию организма пациента для целенаправленного изменения существующего иммунологического контекста основных молекулярно-биологических структур КМ;
(d) проводят размораживание криоконсервированного лейконцентрата, содержащего доминирующие клоны ГСК и ГПК и полученного на стадии (b), его облучение ионизирующей радиацией в дозе 0,3-1,5 Гр для нанесения микроповреждений геному этих клонов ГСК и ГПК и дальнейшей активации их клеточного цикла и последующее геномное модулирование и коммитирование ГСК и ГПК путем инкубации в течение 45-60 минут лейкоконцентрата пациента, содержащего ГСК с микроповреждениями ДНК, с препаратом нуклеосомных мономеров геномной ДНК человека (hDNAnmr) при постоянном перемешивании инкубируемой массы с получением в результате этой инкубации препарата для его реинфузии пациенту;
(e) после стадии (с) и нормализации показателей крови пациента проводят внутривенную реинфузию пациенту препарата, полученного на стадии (d);
(f) на следующий день после завершения стадии (е) проводят иммунотерапию с использованием антитимоцитарного глобулина для дополнительной деплеции Т-лимфоцитов, содержащихся в лейкоконцентрате МНК ПК с реставрированными ГСК, и аутореактивных лимфоцитов в циркуляции, выживших после иммуносупрессии на стадии (с);
(g) на 3-й, 6-й, 9-й и 12-й месяцы после стадии (е) проводят молекулярно-биологическую диагностику путем геномного и протеомного анализов в объеме стадии (а) для мониторинга смены клональности гемопоэза и оценку эффективности проведенного лечения не ранее чем через 6 месяцев после проведения стадии (е), при этом на уровне протеома ГСК результат проведенного лечения признают положительным при доказанной смене протеома субпопуляционного состава по большинству изученных мембранных антигенов ГСК, приближении их к усредненным показателям мембранного протеома ГСК здоровых доноров, нормализации мегакариоцитарного звена и восстановлении части поврежденных миелоидно-коммитированных и лимфоидных клеток предшественников, а на уровне генома ГСК положительным результатом проведенного лечения считают смену клональности при выявлении не менее 50% новых мутаций генов клональности и генов стволовости при сравнении ДНК-образцов ГСК и лимфоцитов ПК до лечения с последующими аналогичными ДНК-образцами, полученными в динамике указанного геномного мониторинга.
2. Персонализированный способ реституции костного мозга по п.1, отличающийся тем, что в качестве препарата нуклеосомных мономеров геномной ДНК человека (hDNAnmr) используют лекарственную субстанцию Панаген®, полученную из клеток и ткани человеческой плаценты от здоровой роженицы.
3. Персонализированный способ реституции костного мозга по п.1, отличающийся тем, что препарат нуклеосомных мономеров геномной ДНК человека (hDNAnmr) получают из клеток и ткани паренхиматозных человеческих органов здорового донора с получением натрий хлорид/натрий хлорид-энзиматически депротеинизированной высокоочищенной двухцепочечной ДНК человека с примесью белков не более 5% и примесью РНК не более 10% и фрагментированной со смесью фрагментов от 1000 до 5000 пар нуклеотидов.
| Биомедицинский клеточный продукт для лечения онкологических, нейродегенеративных, аутоимунных заболеваний и травм головного и спинного мозга | 2021 |
|
RU2798554C2 |
| WO 2018191440 A1, 18.10.2018 | |||
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2322264C1 |
| US 11613786 B2, 28.03.2023 | |||
| BARRIGA F | |||
| et al | |||
| Hematopoietic stem cell transplantation: clinical use and perspectives, Biol Res., 2012, Volume 45(3), pp | |||
| Приспособление для выпечки формового хлеба в механических печах с выдвижным подом без смазки форм жировым веществом | 1921 |
|
SU307A1 |
Авторы
Даты
2024-04-22—Публикация
2023-11-01—Подача