ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка имеет право на приоритет в соответствии с 35 U.S.C. 119(e) по предварительной патентной заявке США № 62/197675, поданной 28 июля 2015 года, которая настоящим включена в настоящее описание посредством ссылки во всей полноте.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Иммунотерапия рака продемонстрировала интересные клинические результаты при различных солидных опухолях и гематологических злокачественных образованиях. Эндогенная иммунная система, как правило, не реагирует на злокачественные клетки или может быть активно иммуносупрессивной по отношению к реакции организма на присутствие злокачественных клеток. Одним из способов улучшения лечения опухолей является принуждение иммунной системы к распознаванию опухоли с помощью генной инженерии лейкоцитов. Могут быть сконструированы T-клетки для экспрессии синтетического иммунорецептора, содержащего внеклеточное направленное антитело и внутриклеточный сигнальный домен, известного как химерный антигенный рецептор (CAR). Было показано, что T-клетки, экспрессирующие CAR, направленный на CD19, обладают выраженной антилейкозной эффективностью, причем полная ремиссия достигается у 90% подвергаемых лечению пациентов с острым лимфобластным лейкозом (Maude, et al., NEJM, vol. 371:1507-17, 2014). Эти результаты сопровождаются устойчивой пролиферацией T-клеток и хорошо документированной инфильтрацией T-клеток в опухолевые участки у подвергаемых такому лечению пациентов с лейкозом. Несмотря на высокую частоту ответа, демонстрируемую при гемопоэтических злокачественных образованиях, эффективность T-клеток с CAR при солидных опухолях (а также при некоторых лимфоидных опухолях) может быть ограничена. Возможные объяснения этого включают потенциальное повреждение способности Т-клеток к инфильтрации солидных опухолей, плохой траффик, иммуносупрессивное микроокружение опухоли и экспрессию малого количества опухолеспецифичных антигенов на клетках солидных опухолей.
В данной области техники существует потребность в повышении эффективности композиций и способов, которые лечат раковые заболевания, путем улучшения специфичности к опухолевым клеткам и улучшения инфильтрации такими композициями опухолевых участков как в солидных опухолях, так и в гематологических злокачественных образованиях. Настоящее изобретение удовлетворяет эту потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Как раскрыто в настоящем документе, настоящее изобретение включает в себя композиции и способы применения фагоцитарной клетки с направленной эффекторной активностью.
В одном аспекте настоящее изобретение включает в себя модифицированную клетку, содержащую химерный антигенный рецептор (CAR), причем CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен стимулирующей и/или костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые обладают направленной эффекторной активностью.
В другом аспекте настоящее изобретение включает в себя модифицированную клетку, содержащую последовательность нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), причем последовательность нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен, последовательность нуклеиновой кислоты, кодирующую трансмембранный домен, и последовательность нуклеиновой кислоты, кодирующую внутриклеточный домен стимулирующей и/или костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые экспрессируют CAR и обладают направленной эффекторной активностью.
В еще одном аспекте настоящее изобретение включает в себя способ модификации клетки, содержащий введение химерного антигенного рецептора (CAR) в моноцит, макрофаг или дентритную клетку, причем CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен стимулирующей и/или костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые экспрессируют CAR и обладают направленной эффекторной активностью.
В еще одном аспекте настоящее изобретение включает в себя композицию, содержащую клетку, модифицированную в соответствии со способом, описанным в настоящем документе.
В различных вариантах осуществления приведенных выше аспектов или любого другого аспекта настоящего изобретения, описанного в настоящем документе, антигенсвязывающий домен CAR содержит антитело, выбранное из группы, состоящей из моноклонального антитела, поликлонального антитела, синтетического антитела, человеческого антитела, гуманизированного антитела, однодоменного антитела, одноцепочечного вариабельного фрагмента и их антигенсвязывающих фрагментов. В другом варианте осуществления антигенсвязывающий домен CAR выбирают из группы, состоящей из анти-CD19 антитела, анти-HER2 антитела и их фрагмента. В еще одном варианте осуществления внутриклеточный домен CAR содержит двойные сигнальные домены.
В другом варианте осуществления направленная эффекторная активность направлена на антиген на клетке-мишени, который специфически связывает антигенсвязывающий домен CAR. В еще одном варианте осуществления направленную эффекторную активность выбирают из группы, состоящей из фагоцитоза, направленной клеточной цитотоксичности, презентации антигена и секреции цитокинов.
В другом варианте осуществления композиция дополнительно содержит средство, выбранное из группы, состоящей из нуклеиновой кислоты, антибиотика, противовоспалительного средства, антитела или его фрагментов антитела, фактора роста, цитокина, фермента, белка, пептида, белка слияния, синтетической молекулы, органической молекулы, углевода и т.п., липида, гормона, микросомы, их производного или варианта и любой их комбинации.
В другом варианте осуществления модифицированная клетка имеет по меньшей мере один повышенно отрегулированный маркер M1 и по меньшей мере один пониженно отрегулированный маркер M2. В еще одном варианте осуществления модифицированная клетка генетически модифицирована для экспрессии CAR. В еще одном варианте осуществления направленная эффекторная активность усилена путем ингибирования активности CD47 или SIRPa.
В другом варианте осуществления введение CAR в клетку содержит введение кодирующей CAR последовательности нуклеиновой кислоты, такое как электропорация мРНК, кодирующей CAR, или трансдуцирование клетки вирусным вектором, содержащим кодирующую CAR последовательность нуклеиновой кислоты.
В другом варианте осуществления направленная эффекторная активность направлена на антиген на клетке-мишени, который специфически связывает антигенсвязывающий домен CAR. В другом варианте осуществления направленную эффекторную активность выбирают из группы, состоящей из фагоцитоза, направленной клеточной цитотоксичности, презентации антигена и секреции цитокинов.
В другом варианте осуществления способ, описанный в настоящем документе, дополнительно содержит ингибирование активности CD47 или SIRPα для усиления направленной эффекторной активности, например путем приведения клетки в контакт с блокирующим анти-CD47 или блокирующим анти-SIRPα антителом. В еще одном варианте осуществления способ дополнительно содержит модификацию клетки для доставки средства к мишени, причем средство выбирают из группы, состоящей из нуклеиновой кислоты, антибиотика, противовоспалительного средства, антитела или его фрагментов антитела, фактора роста, цитокина, фермента, белка, пептида, белка слияния, синтетической молекулы, органической молекулы, углевода и т.п., липида, гормона, микросомы, их производного или варианта и любой их комбинации.
В одном аспекте настоящее изобретение включает в себя фармацевтическую композицию, содержащую клетку, описанную в настоящем документе.
В другом аспекте настоящее изобретение включает в себя применение модифицированной клетки, описанной в настоящем документе, в производстве лекарственного средства для лечения иммунного ответа у нуждающегося в этом субъекта. В еще одном аспекте настоящее изобретение включает в себя применение модифицированной клетки, описанной в настоящем документе, в производстве лекарственного средства для лечения опухоли или рака у нуждающегося в этом субъекта.
В еще одном аспекте настоящее изобретение включает в себя способ лечения заболевания или состояния, ассоциированного с опухолью или раком, у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе.
В еще одном аспекте настоящее изобретение включает в себя способ лечения опухоли у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе.
В другом аспекте настоящее изобретение включает в себя способ стимулирования иммунного ответа на целевую опухолевую клетку или опухолевую ткань у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Нижеследующее подробное описание предпочтительных вариантов осуществления настоящего изобретения будет более понятным при чтении в сочетании с прилагаемыми чертежами. С целью иллюстрации настоящего изобретения на чертежах показаны варианты осуществления, которые в настоящее время являются предпочтительными. Следует, однако, понимать, что настоящее изобретение не ограничено точными конфигурациями и средствами вариантов осуществления, показанных на чертежах.
Фигура 1A представляет собой серию изображений, показывающих концептуальную схему химерного антигенного рецептора (CAR), состоящего из гена/продукта гена, содержащего внеклеточный домен с направляющей функцией, шарнирный домен, трансмембранный домен, внутриклеточный сигнальный домен(ы) и/или 2A (P2A, T2A) для стехиометрической совместной экспрессии дополнительного продукта гена который может быть или не быть секретируемым, включая любой ген/транскрипт/белок, включая, но без ограничения цитокин, моноклональное антитело, фрагмент антитела, одноцепочечный вариабельный фрагмент, фермент, дополнительный рецептор, доминантно-негативный рецептор, опухоль-ассоциированный антиген(ы) и любую их комбинацию. Кроме того, конструкция CAR может включать в себя совместную доставку материала для редактирования генов CRISPR/Cas9 или может быть введена в контексте предварительно отредактированной CRISPR/Cas9 клетки.
Фигура 1B представляет собой серию изображений, показывающих конкретные примеры конструкций CAR, включая CARMA-ζ, CARMA-γ и CARMA-дектин, которые содержат антиген-специфический scFv, шарнир CD8, трансмембранный CD8 и, соответственно, CD3-ζ, общую γ-субъединицу FcεRI или внутриклеточный домен дектина-1.
Фигура 2A представляет собой график, показывающий экспрессию CAR19z на поверхности миелоидных клеток после лентивирусной трансдукции. Лентивирус с CAR19z титровали в троекратных дилютерах и использовали для трансдукции 1e5 на 0,1 мл mRFP+ THP1-клеток. mRFP представляет собой ген-репортер (красный флуоресцентный белок), который экспрессируется благодаря лентивирусной трансдукции миелоидной клеточной линии THP1. Эти клетки могут быть индуцированы для дифференцировки в макрофагах при воздействии химического PMA. THP1-клетки собирали через 24 часа после трансдукции и окрашивали на поверхностную экспрессию CAR биотинилированным белком L, а затем стрептавидином-APC.
Фигура 2B представляет собой график, показывающий размножение и сортировку с помощью FACS трансдуцированных THP1-клеток для генерации 100% CAR19z-положительной сублинии mRFP+THP1.
Фигура 2C демонстрирует экспрессию анти-CD19, анти-HER2 и антимезотелиновых лентивирусных конструкций CAR на макрофагах THP1 с событиями CAR(+) в верхнем правом квадранте.
Фигура 3A представляет собой блок-схему, показывающую обзор генерации сублинии CARMA при использовании модели на макрофагах THP1, дифференцировку с помощью 1 нг/мл форбол-12-миристат-13-ацетата (PMA) и анализ фагоцитоза in vitro.
Фигура 3B представляет собой график, показывающий, что макрофаги с анти-CD19 CAR, но не макрофаги дикого типа (Wt), фагоцитировали опухолевые клетки K562, которые экспрессировали CD19, что было продемонстрировано с помощью анализа фагоцитоза на основе флуоресцентной микроскопии.
Фигура 3C представляет собой график, показывающий, что макрофаги с анти-HER2 CAR, но не макрофаги дикого типа (Wt), фагоцитировали опухолевые клетки K562, которые экспрессировали HER2, что было продемонстрировано с помощью анализа фагоцитоза на основе флуоресцентной микроскопии.
Фигура 3D представляет собой график, показывающий, что макрофаги с антимезотелиновыми CAR, но не макрофаги дикого типа (Wt), фагоцитировали опухолевые клетки K562, которые экспрессировали мезотелин, что было продемонстрировано с помощью анализа фагоцитоза на основе флуоресцентной микроскопии.
Фигура 3E представляет собой типичный график FACS, показывающий, что фагоцитоз опухоли CARMA был подтвержден с помощью анализа на основе проточной цитометрии, в котором mRFP+ CARMA против CD19 совместно культивировали с CD19+ GFP+ клетками K562, и количественно определяли двойные положительные события.
Фигура 3F представляет собой изображение, показывающее mRFP в стандартном поле зрения 10x, используемом при табулировании функции фагоцитоза CARMA.
Фигура 3G представляет собой изображение, показывающее наложение в стандартном поле зрения 10x, используемом при табулировании функции фагоцитоза CARMA.
Фигура 3H представляет собой серию изображений, показывающих, что двойные положительные события mRFP/GFP на основе FACS определяли как события фагоцитоза и подтверждали как таковые с помощью анализа Amnis Imagestream FACS. Показанные события гейтировали на двойные положительные события и упорядочивали от максимума к минимуму с помощью алгоритма phagocytosis-erode от Amnis Imagestream.
Фигура 3I представляет собой серию изображений, показывающих, что фагоцитоз опухолевых клеток mRFP+ CARMA в модели клеточной линии THP-1 был дополнительно продемонстрирован с помощью конфокальной микроскопии, подтвердившей посредством трехмерных реконструкций конфокальной z-серии, что GFP+ опухолевые клетки полностью заключены внутри фагосом.
Фигура 3J представляет собой серию изображений, показывающих, что фагоцитоз опухолевых клеток mRFP+ CARMA в модели клеточной линии THP-1 был дополнительно продемонстрирован с помощью конфокальной микроскопии, подтвердившей посредством трехмерных реконструкций конфокальной z-серии, что GFP+ опухолевые клетки полностью заключены внутри фагосом.
Фигура 3K представляет собой серию изображений, которые демонстрируют развитие одной клетки CARMA с течением времени, причем первым этапом является контакт и образование иммунологического синапса, за чем следует фагоцитарное поглощение, деградация опухоли, причем в качестве маркера гибели клеток используют потерю GFP, разрушение фагосом и восстановление фагосом, что демонстрирует, что CARMA выживают после фагоцитоза опухолевых клеток.
Фигура 4A представляет собой график, показывающий тестирование макрофагов с анти-CD19 CAR в in vitro анализе фагоцитоза с CD19+ (мишень) или CD19- (контроль) GFP+ опухолевыми клетками K562. Только несущие антиген опухолевые клетки были фагоцитированы, что демонстрирует антигенную специфичность CARMA. Для демонстрации необходимости для функционирования CARMA внутриклеточного сигнального домена использовали конструкции CAR19-Δζ (у которых отсутствует внутриклеточный сигнальный домен).
Фигура 4B представляет собой график, показывающий, что макрофаги CAR19-Δζ не могли фагоцитировать опухолевые клетки.
Фигура 4C представляет собой график, показывающий, что макрофаги CAR19-Δζ обладали значительно сниженной противоопухолевой функцией по in vitro анализу специфического лизиса на основе люциферазы.
Фигура 4D представляет собой график, показывающий in vitro анализ фагоцитоза CARMA, выполненный в присутствии R406 (ингибитор Syk). R406 независимо прекращал действие фагоцитарной функции CARMA, что указывает на то, что сигнализация CAR в макрофагах зависит от Syk и приводит к полимеризации актина и опосредованной NMIIA фагоцитарной функции.
Фигура 4E представляет собой график, показывающий in vitro анализ фагоцитоза CARMA, выполненный в присутствии цитохалазина D (ингибитор полимеризации актина). Цитохалазин D независимо прекращал действие фагоцитарной функции CARMA, что указывает на то, что сигнализация CAR в макрофагах зависит от Syk и приводит к полимеризации актина и опосредованной NMIIA фагоцитарной функции.
Фигура 4F представляет собой график, показывающий in vitro анализ фагоцитоза CARMA, выполненный в присутствии блеббистатина (ингибитор немышечного миозина IIA). Блеббистатин независимо прекращал действие фагоцитарной функции CARMA, что указывает на то, что сигнализация CAR в макрофагах зависит от Syk и приводит к полимеризации актина и опосредованной NMIIA фагоцитарной функции.
Фигура 5A представляет собой график проточной цитометрии, показывающий экспрессию CD47 на целевых линиях опухолевых клеток относительно изотипического контроля. В этих экспериментах использовали K562 и K562-CD19+ (K19), которые являются клеточными линиями с высокой экспрессией CD47.
Фигура 5B представляет собой график, показывающий, что добавление моноклонального анти-CD47 антитела селективно усиливало опосредованный макрофагами с CAR, но не Wt, фагоцитоз несущих антиген опухолевых клеток-мишеней. Макрофаги Wt или CAR19ζ инкубировали с CD19+ опухолевыми клетками K562 с 0, 0,01, 0,10, 1,00 или 10,0 мкг/мл моноклонального анти-CD47 антитела.
Фигура 5C представляет собой график, показывающий, что добавление моноклонального анти-SIRPα антитела селективно усиливало опосредованный макрофагами с CAR, но не Wt, фагоцитоз несущих антиген опухолевых клеток-мишеней. Макрофаги Wt или CAR19ζ инкубировали с CD19+ опухолевыми клетками K562 с 0, 0,01, 0,10, 1,00 или 10,0 мкг/мл моноклонального анти-SIRPα антитела.
Фигура 5D представляет собой график, демонстрирующий, что блокада оси CD47/SIRPα моноклональными анти-SIRPα антителами усиливала полифагоцитоз (определяемый как поглощение макрофагами 2 или более опухолевых клеток за один раз) макрофагами с CAR.
Фигура 5E представляет собой график, показывающий in vitro анализ фагоцитоза. Для контроля увеличения опсонизации блокирующими моноклональными антителами к CD47/SIRPα в in vitro анализе фагоцитоза использовали контрольное моноклональное анти-CD47 антитело (клон 2D3), которое связывает CD47 но не блокирует сайт связывания CD47 с SIRPα. Только клон, который блокирует сайт связывания (анти-CD47, клон B6H12), или непосредственная блокада рецептора SIRPα вели к усилению фагоцитоза опухоли CARMA.
Фигура 5F представляет собой график, показывающий фагоцитоз антиген-негативных (CD19-негативных) опухолевых клеток in vitro. Для проверки, ведет ли блокада оси CD47/SIRPα на макрофагах с CAR к потере антигенной специфичности, проводили in vitro фагоцитоз антиген-негативных (CD19-негативных) опухолевых клеток в присутствии моноклонального анти-CD47 или анти-SIRPα антитела, и наблюдали отсутствие фагоцитоза.
Фигура 5G представляет собой график, показывающий усиление специфичности фагоцитоза CARMA в присутствии блокирующего моноклонального антитела к SIRPα по тестированию путем нокаута рецептора SIRPα на макрофагах THP1 и сравнения фагоцитоза опухоли CARMA или SIRPα-KO CARMA в отсутствие или в присутствии анти-SIRPα антитела. Для делеции SIRPα использовали CRISPR/Cas9, и перед функциональными анализами клетки сортировали для отсутствия SIRPα. Нокаут SIRPα усиливал функцию CARMA, а добавление анти-SIRPα обратно к нокаут-клеткам не вело к дальнейшему усилению фагоцитоза.
Фигура 6A представляет собой график, показывающий специфический лизис CD19+ GFP+ люцифераза+ клеток K562 макрофагами CAR19ζ CARMA, но не Wt (при использовании модели на макрофагах THP-1) в in vitro анализе киллинга на основе люциферазы через 48 часов в зависимости от дозы.
Фигура 6B представляет собой график, демонстрирующий специфический лизис опухолевых клеток THP-1-моноцитами с CAR19ζ или Wt (недифференцированными, поэтому модель является моделью на моноцитах, а не на макрофагах) в in vitro анализе киллинга на основе люциферазы через 48 часов в зависимости от дозы.
Фигура 6C представляет собой панель изображений, показывающих вызываемую люциферазой биолюминесценцию, получаемую от положительных по люциферазе CD19+ опухолевых клеток K562 после 48-часового совместного культивирования с макрофагами Wt или CAR19ζ in vitro в отсутствие или в присутствии 10 мкг/мл моноклонального анти-SIRPα антитела.
Фигура 6D представляет собой график, демонстрирующий специфический лизис макрофагов Wt или CAR19ζ +/- моноклональное анти-SIRPα антитело.
Фигура 7A представляет собой серию графиков, показывающих, что конструкции CAR с внутриклеточным доменом общей γ-субъединицы FcεRI (CAR19γ, CARMA19γ) были сгенерированы, упакованы в лентивирус и использованы для трансдукции миелоидных клеток THP-1 при троекратном последовательном разбавлении вируса. CAR19γ экспрессировалась на макрофагах THP-1.
Фигура 7B представляет собой график, показывающий сортировку макрофагов с CAR19γ или макрофагов с CAR19ζ для 100% положительности по CAR и их использование для функциональной характеризации in vitro. Макрофаги как с CAR19ζ, так и с CAR19γ фагоцитировали CD19+ опухолевые клетки и демонстрировали синергию с блокадой оси CD47/SIRPα посредством добавления моноклонального анти-SIRPα антитела.
Фигура 7C представляет собой график, показывающий in vitro анализ фагоцитоза с ингибированием Syk с помощью R406, который демонстрирует, что макрофаги как с CAR19ζ, так и с CAR19γ передают сигнал для управления фагоцитозом опухоли посредством Syk.
Фигура 7D представляет собой график, показывающий, что макрофаги THP1 с CAR19ζ и CAR19γ, но не Wt макрофаги THP1, эффективно уничтожали CD19+ опухолевые клетки в in vitro анализе специфического лизиса на основе люциферазы после 24 часов совместного культивирования при различных отношениях E:T.
Фигура 8A представляет собой график, показывающий, что макрофаги реагировали на консервативные молекулярные признаки инфекции, такие как ассоциированные с патогенами молекулярные структуры, посредством конститутивно экспрессируемых рецепторов распознавания патогенов.
Фигура 8B представляет собой график, показывающий in vitro анализ фагоцитоза, проведенный с использованием макрофагов с CAR, которые были независимо примированы лигандами к TLR1-9 или контролем со средой для усиления функции фагоцитоза опухоли CARMA. Лиганды к TLR1, 2, 4, 5 и 6 усиливали фагоцитарную функцию CARMA.
Фигура 8C представляет собой график, показывающий различие между лигандами TLR, которые усиливали или не усиливали фагоцитоз опухолевых клеток CARMA в диапазоне концентраций лигандов TLR3 или TLR6.
Фигура 9A представляет собой график, показывающий, что β-глюкан, дрожжевой продукт, связывался с дектином-1 на поверхности макрофагов и приводил к активации и эффекторной функции. Для тестирования способности β-глюкана усиливать функцию CARMA были проведены in vitro анализы фагоцитоза опухоли в отсутствие или в присутствии 5 мкг/мл β-глюкана. β-глюкан усиливал фагоцитарную способность макрофагов с CAR, но не Wt.
Фигура 9B представляет собой серию графиков, показывающих in vitro анализы специфического лизиса на основе люциферазы, проведенные при различных отношениях эффектор (E):мишень (T) в присутствии 0, 0,5, 5 или 50 мкг/мл β-глюкана, для тестирования способности β-глюкана к усилению киллинга опухоли CARMA. β-глюкан усиливал специфический лизис несущих антиген опухолевых клеток макрофагами THP-1 с CAR, но не Wt.
Фигура 10A представляет собой серию изображений, показывающих, что были сгенерированы конструкции CAR, состоящие из внутриклеточного сигнального домена дектина-1. Эти конструкции были упакованы в лентивирус и использованы для трансдукции миелоидных клеток THP-1 при троекратном последовательном разбавлении титров лентивируса.
Фигура 10B представляет собой график, показывающий, что CAR детектировали на поверхности макрофагов, экспрессирующих конструкции CAR CD8TM-Dectin1.
Фигура 10C представляет собой график, показывающий, что CAR детектировали на поверхности макрофагов, экспрессирующих конструкций CAR DectinTM-Dectin1.
Фигура 10D представляет собой график, показывающий, что макрофаги с CAR CD8TM-Dectin1 и CAR DectinTM-Dectin1 тестировали в люциферазном анализе киллинга in vitro. Обе конструкции продемонстрировали специфический лизис опухолевых клеток.
Фигура 10E представляет собой график, показывающий, что макрофаги с Dectin1-CAR тестировали в in vitro анализе фагоцитоза опухоли с опухолевыми клетками K562 (контроль) или K19 (мишень). Макрофаги с Dectin1-CAR селективно фагоцитировали несущие когнатный антиген опухолевые клетки.
Фигура 10F представляет собой серию изображений, показывающих, что макрофаги с CAR с дектином-1 демонстрировали способность к фагоцитозу множества опухолевых клеток.
Фигура 10G представляет собой график, показывающий in vitro анализ фагоцитоза опухоли. Макрофаги с Dectin1-CAR демонстрировали синергию с блокадой SIRPα или с примированием лигандом TLR.
Фигура 11A представляет собой серию графиков, показывающих уровни кальретикулина в трех различных линиях CD19+ клеток-мишеней относительно изотипического контроля.
Фигура 11B представляет собой график, показывающий нормализованную среднюю интенсивность флуоресценции при экспрессии кальретикулина в трех различных линиях CD19+ клеток-мишеней.
Фигура 11C представляет собой график, показывающий, что низкие уровни кальретикулина умеренно защищали клетки-мишени, особенно клеточные линии Nalm6 и JEKO, от фагоцитоза макрофагами с CAR19z. Эти данные показывают, что осаждение/индукцию кальретикулина можно использовать как дополнительную тактику для усиления эффекторной функции CARMA.
Фигура 12A представляет собой серию графиков, показывающих клонирование конструкций анти-HER2 CAR в плазмиды экспрессии мРНК, их транскрипцию in vitro и непосредственную электропорацию мРНК в первичные человеческие моноциты.
Фигура 12B представляет собой серию графиков, показывающих эффективность электропорации мРНК анти-HER2 CAR в макрофаги из первичных человеческих моноцитов (полностью дифференцированные) 79,7%.
Фигура 12C представляет собой график, показывающий, что хотя электропорация мРНК приводит к высокой эффективности трансфекции CAR как моноцитов, так и макрофагов, экспрессия CAR была временной из-за деградации мРНК, достигая пика на день 2 и исчезая к дню 7 после электропорации in vitro.
Фигура 13A представляет собой график, показывающий инъекцию мышам NSGS посредством и/п инъекции 1E6 CBG/GFP+ клеток SKOV3 рака яичника человека, модель метастатического внутрибрюшинного карциноматоза HER2+ рака яичника. Мышам совместно инъецировали или ложно-электропорированные, или электропорированные мРНК анти-HER2 CAR первичные человеческие макрофаги (отношение E:T 1:1), и визуализировали опухолевую нагрузку. Макрофаги с CAR демонстрировали незначительное снижение роста опухоли в течение приблизительно двух недель. Первая временная точка, в которой опухолевую нагрузку количественно определяли биолюминесцентно, находилась через 24 часа после обработки, что демонстрирует, что моноциты и макрофаги с CAR имели активность в первые 24 часа.
Фигура 13B представляет собой график, показывающий инъекцию мышам NSGS посредством и/п инъекции 1E6 CBG/GFP+ клеток SKOV3 рака яичника человека, модель метастатического внутрибрюшинного карциноматоза HER2+ рака яичника. Мышам совместно инъецировали или ложно-электропорированные, или электропорированные мРНК анти-HER2 CAR первичные человеческие моноциты (отношение E:T 1:1), и визуализировали опухолевую нагрузку. Моноциты с CAR демонстрировали незначительное снижение роста опухоли в течение приблизительно двух недель. Первая временная точка, в которой опухолевую нагрузку количественно определяли биолюминесцентно, находилась через 24 часа после обработки, что демонстрирует, что моноциты и макрофаги с CAR имели активность в первые 24 часа.
Фигура 14A представляет собой серию графиков, показывающих, что лентивирусную доставку трансгенов CAR в макрофаги из первичных человеческих моноцитов тестировали с использованием нескольких конструкций CAR. CAR19 доставляли в человеческие макрофаги с помощью лентивирусной трансдукции, демонстрирующей эффективность трансдукции 4,27% и 38,9% в группах контроля и лентивируса с CAR19 (MOI 10), соответственно.
Фигура 14B представляет собой серию типичных графиков FACS, показывающих экспрессию анти-HER2 CAR в первичных человеческих макрофагах с эффективностью трансдукции 1,47 и 18,1% в условиях контроля и MOI 10 CAR LV, соответственно.
Фигура 15A представляет собой серию графиков, показывающих, что эффективность трансдукции достигала пика в середине трансдукции (день 4) для анти-CD19. Макрофаги из моноцитов генерировали путем дифференцировки отобранных CD14+ клеток (из продуктов афереза нормальных доноров) в кондиционированной GM-CSF среде в течение 7 дней. Для оптимизации доставки CAR с помощью лентивирусной трансдукции анти-CD19 лентивирус использовали для трансдукции макрофагов в различные моменты процесса дифференцировки моноцита в макрофаг.
Фигура 15B представляет собой серию графиков, показывающих, что эффективность трансдукции достигала пика в середине трансдукции (день 4) для анти-HER2. Макрофаги из моноцитов генерировали путем дифференцировки отобранных CD14+ клеток (из продуктов афереза нормальных доноров) в кондиционированной GM-CSF среде в течение 7 дней. Для оптимизации доставки CAR с помощью лентивирусной трансдукции анти-HER2 лентивирус использовали для трансдукции макрофагов в различные моменты процесса дифференцировки моноцита в макрофаг.
Фигура 15C представляет собой серию графиков, показывающих, что эффективность фагоцитоза изменялась вместе с эффективностью трансдукции CAR, достигая пика у макрофагов, трансдуцированных на день 4 процесса дифференцировки.
Фигура 16A представляет собой серию графиков, показывающих, что были протестированы альтернативные подходы к трансдукции для доставки трансгенов в первичные человеческие макрофаги с учетом того, что электропорация мРНК была временной, и лентивирус был только умеренно эффективным и требовал высокого титра. В качестве эффективного подхода к трансдукции первичных человеческих макрофагов был идентифицирован аденовирус (рекомбинантный, дефицитный по репликации). Экспрессию рецептора аденовируса Коксаки (докинг-белок для Ad5) и CD46 (докинг-белок для Ad35) тестировали относительно изотипического контроля на первичных человеческих макрофагах, и наблюдали высокую экспрессию CD46, но не рецептора аденовируса Коксаки. Таким образом, для трансдукции первичных человеческих макрофагов использовали химерный аденовирус Ad5f35, и он был сконструирован с помощью стандартных методов молекулярной биологии для экспрессии химерного антигенного рецептора (GFP и пустые вирусы Ad5f35 использовали как контроль) к HER2.
Фигура 16B представляет собой график, показывающий, что при MOI 1000 Ad5f35 эффективно доставлял трансген (в качестве модельного трансгена использовали GFP) в человеческие макрофаги, и экспрессия возрастала со временем, что было видно по количественной оценке сигнала GFP на IVIS Spectrum.
Фигура 16C представляет собой график, показывающий сравнение кинетики трансдукции первичных человеческих макрофагов в различные моменты времени в широком диапазоне MOI вплоть до 10000.
Фигура 16D представляет собой серию типичных графиков FACS экспрессии анти-HER2 CAR на трансдуцированных Ad5f35 человеческих макрофагах через 48 часов после трансдукции в широком диапазоне вирусных MOI.
Фигура 16E представляет собой серию типичных флуоресцентных микроскопических изображений трансдуцированных Ad5f35-GFP первичных человеческих макрофагов, причем наивысшая эффективность трансдукции была продемонстрирована при MOI 1000.
Фигура 17A представляет собой серию графиков, показывающих тестирование первичных человеческих CARMA в in vitro анализе фагоцитоза с помощью анализа FACS. Макрофаги (нетрансдуцированные или с анти-HER2 CAR) окрашивали DiI перед совместным культивированием с GFP+ клетками SKOV3 рака яичника. Измеряли уровень фагоцитоза, определяемый по двойным положительным событиям DiI/GFP, оказавшийся равным 26,6% в группе CAR и 4,55% в контрольной группе.
Фигура 17B представляет собой серию изображений, визуально демонстрирующих, что эти двойные положительные события представляют собой фагоцитоз. Для проверки, что двойные положительные события DiI/GFP являлись событиями фагоцитоза, а не дублетами, к группе эксперимента добавляли цитохалазин D (ингибитор фагоцитоза), и он полностью прекращал опосредованный CAR фагоцитоз вплоть до 1,74%. Для дальнейшей проверки, что первичные человеческие макрофаги с CAR могут фагоцитировать опухолевые клетки, двойные положительные события гейтировали с помощью Amnis Imagestream FACS и упорядочивали от максимума к минимуму с помощью алгоритма phagocytosis-erode от Amnis.
Фигура 17C представляет собой серию изображений, показывающих изображения конфокальной микроскопии окрашенных DiI макрофагов CAR-HER2, совместно культивированных с SKOV3-GFP.
Фигура 18 представляет собой график, показывающий, что человеческие макрофаги с CAR, но не UTD, фагоцитировали клетки рака молочной железы. Первичные человеческие макрофаги с анти-HER2 CAR генерировали с использованием трансдукции Ad5f35-CAR макрофагов моноцитарного происхождения. Эти клетки (или контрольные нетрансдуцированные клетки) использовали в качестве эффекторов в основанном на FACS in vitro анализе фагоцитоза клеток SKBR3 рака молочной железы человека. Кроме того, добавление моноклонального анти-SIRPα антитела усиливало фагоцитоз клеток рака молочной железы макрофагами CARMA, но не UTD. Эти результаты демонстрируют, что синергия между блокадой оси CD47/SIRPα, наблюдаемая с CARMA в модели THP-1, переходит на исследования на первичных человеческих макрофагах.
Фигура 19 представляет собой серию типичных графиков FACS, показывающих, что CARMA проявляют интактный фагоцитоз частиц pH-Rodo Green E.Coli. Для того чтобы продемонстрировать, что макрофаги с CAR остались функциональными клетками врожденного иммунитета в противомикробном смысле и не потеряли способность реагировать на инфекционные стимулы, использовали контрольные нетрансдуцированные макрофаги или макрофаги с CAR в основанном на FACS анализе фагоцитоза E.Coli.
Фигура 20A представляет собой график, показывающий тестирование первичных человеческих анти-HER2 CARMA в качестве эффекторных клеток в in vitro анализах киллинга на основе люциферазы. Анти-HER2 CARMA, но не контрольные UTD макрофаги, приводили к специфическому лизису HER2+ клеток K562, но не контрольных клеток K562, у которых отсутствовала экспрессия HER2, после 48 часов совместного культивирования.
Фигура 20B представляет собой график, показывающий in vitro анализ киллинга на основе люциферазы с использованием клеток SKBR3 рака молочной железы в качестве мишеней. CARMA, но не контрольные UTD или контрольные трансдуцированные пустым Ad5f35 макрофаги, обладали значительной противоопухолевой активностью в отношении обеих моделей после 48 часов совместного культивирования.
Фигура 20C представляет собой график, показывающий in vitro анализ киллинга на основе люциферазы с использованием клеток SKOV3 рака яичника в качестве мишеней. CARMA, но не контрольные UTD или контрольные трансдуцированные пустым Ad5f35 макрофаги, обладали значительной противоопухолевой активностью в отношении обеих моделей после 48 часов совместного культивирования.
Фигура 20D представляет собой график, показывающий синергию между блокадой оси CD47/SIRPα в анализе киллинга. Клетки SKOV3 рака яичника совместно культивировали со средой, контрольными не трансдуцированными макрофагами, анти-HER2 CARMA, анти-HER2 CARMA+анти-CD47 mAB (10 мкг/мл) или анти-HER2 CARMA+анти-SIRPα (10 мкг/мл), и последовательно измеряли сигнал люциферазы. CARMA приводили к полной эрадикации опухоли к дню 13, причем кинетика эрадикации опухоли была даже более быстрой при блокировке оси CD47/SIRPα.
Фигура 20E представляет собой график, показывающий синергию с β-глюканом, которую демонстрировали в модели на макрофагах THP-1 CARMA, причем примирование CARMA β-глюканом приводило к улучшению кинетики киллинга опухоли.
Фигура 20F представляет собой график, показывающий, что воздействие CARMA на LPS (лиганд TLR-4) или поли-IC (лиганд TLR-3) приводило к модуляции противоопухолевого эффекта.
Фигура 21 представляет собой серию изображений, показывающих способность первичных человеческих CARMA уничтожать опухоли в люциферазном анализе in vitro. GFP+ клетки SKOV3 рака яичника совместно культивировали с контрольными UTD макрофагами, контрольными UTD макрофагами плюс 10 мкг/мл трастузумаба, контрольными трансдуцированными пустым вирусом Ad5f35 макрофагами или анти-HER2 первичными человеческими CARMA. CARMA, но не контрольные группы, оказались способны к уничтожению опухолевых клеток.
Фигура 22A представляет собой панель графиков, показывающих измерение зависящей от дозы повышающей регуляции маркеров M1 CD80/CD86 и зависящей от дозы понижающей регуляции маркеров M2 CD163 с помощью FACS. Макрофаги являются фенотипически пластичными клетками, способными перенимать различные функциональные признаки, которые обычно классифицируют как макрофаги M1 и M2, причем M1 являются воспалительными/активированными, а M2 являются иммуносупрессивными/стимулирующими опухоли. Маркеры M1 и M2 измеряли через 48 часов после трансдукции первичных человеческих макрофагов вирусом Ad5f35 с CAR.
Фигура 22B представляет собой серию графиков, показывающих, являлось ли воздействие на маркеры M1 и M2 результатом экспрессии CAR или трансдукции Ad5f35. Макрофаги трансдуцировали или ничего не несущим пустым Ad5f35, или анти-HER2 Ad5f35, и пустой/CAR Ad5f35 продемонстрировали одинаковую картину сдвига фенотипа.
Фигура 22C представляет собой график, показывающий, что CARMA, испытавшие воздействие супрессивных цитокинов, сохраняли свою активность киллинга в in vitro анализе специфического лизиса на основе люциферазы через 48 часов. Контрольные UTD макрофаги, кондиционированные с супрессивными цитокинами, продемонстрировали усиление роста опухоли.
Фигура 22D представляет собой панель графиков, показывающих резистентность к иммуносупрессии человеческих макрофагов с CAR, контрольных UTD, трансдуцированных пустым Ad5f35 или Ad5f35 с анти-HER2 CAR макрофагов, испытавших воздействие 10 нг/мл IL-4, канонического индуцирующего M2 цитокина, или раковых клеток, которые, как было показано ранее, вызывают инверсию макрофагов в M2 при совместном культивировании (SKOV3, клеточная линия рака яичника; HDLM2, клеточная линия ходжкинской лимфомы). Контрольные UTD макрофаги повышающе регулировали CD206, маркер M2, который специфически реагирует на стимуляцию IL-4 путем фосфорилирования STAT6. Трансдуцированные пустым Ad5f35, а тем более CAR-Ad5f35 макрофаги демонстрировали резистентность к индуцированной IL-4 и опухолью инверсии в фенотип M2.
Фигура 22E представляет собой график, показывающий метаболический фенотип контрольных UTD макрофагов или макрофагов с анти-HER2 CAR, испытавших воздействие IL-4 в течение 24 часов для поляризации в M2 (или нет), и интенсивность потребления кислорода.
Фигура 22F представляет собой график, показывающий, что фенотипический, метаболический и функциональный анализы указывают на то, что CARMA резистентны к инверсии в M2.
Фигура 23A представляет собой панель графиков, показывающих первичные человеческие моноциты от нормального донора (очищенные с помощью положительной селекции по CD14), трансдуцированные Ad5f35-CAR-HER2 при MOI в диапазоне от 0 (UTD) до 1000. Экспрессию CAR измеряли с помощью FACS через 48 часов после трансдукции. Моноциты с CAR эффективно генерировали с помощью Ad5f35, с пиком экспрессии при MOI 1000.
Фигура 23B представляет собой график, показывающий эффективность трансдукции первичных моноцитов.
Фигура 23C представляет собой график, показывающий, что моноциты сохраняли высокую жизнеспособность (измеренную с помощью анализа FACS Live/Dead Aqua) при MOI вплоть до 1000.
Фигура 23D представляет собой серию графиков, показывающих, что человеческие моноциты с CAR, но не нетрансдуцированные (UTD), повышающе регулировали маркеры активации M1.
Фигура 23E представляет собой серию графиков, показывающих, что человеческие моноциты с CAR, но не нетрансдуцированные (UTD), понижающе регулировали маркеры M2.
Фигура 24A представляет собой график, показывающий киллинг моноцитами с анти-HER2 CAR HER2+ клеток SKBR3 (человеческий рак молочной железы), определенный с помощью in vitro анализа киллинга на основе люциферазы.
Фигура 24B представляет собой график, показывающий киллинг моноцитами с анти-HER2 CAR HER2+ клеток SKOV3 (человеческий рак яичника), определенный с помощью in vitro анализа киллинга на основе люциферазы.
Фигура 25A представляет собой схему использования мышей NOD-scid IL2Rg-null-IL3/GM/SF, NSG-SGM3 (NSGS) для моделирования ксенотрансплантатов человеческого HER2(+) рака яичника in vivo. На день 0 мышам инъецировали интраперитонеально (и/п) 7,5E5 положительных по люциферазе зеленого жука-щелкуна (CBG luc)/положительных по зеленому флуоресцентному белку (GFP) клеток SKOV3 рака яичника в качестве модели внутрибрюшинного карциноматоза, агрессивной по своему характеру метастатической модели солидного злокачественного образования. Мышей или оставляли без лечения (только опухоль), или инъецировали им одну дозу из 4E6 нетрансдуцированных (UTD) или с CAR-HER2 (CARMA) человеческих макрофагов на день 0 посредством и/п инъекции.
Фигура 25B представляет собой график, показывающий визуализацию мышей сериями с использованием биолюминесценции (общий поток; фотоны в секунду) в качестве имитации опухолевой нагрузки.
Фигура 25C представляет собой график, показывающий процентное выживание мышей, которые получали лечение CARMA. У подвергаемых лечению CARMA мышей опухолевая нагрузка снижалась приблизительно на два порядка величины.
Фигура 25D представляет собой панель изображений, показывающих, что у мышей, подвергаемых лечению CARMA, было 30-дневное преимущество по выживаемости (p=0,018) относительно мышей, не подвергаемых лечению или подвергаемых лечению UTD макрофагами.
Фигура 25E представляет собой панель графиков, показывающих опухоли, которые собирали у мышей, которые умерли на день 36, и подвергали оценке на присутствие адоптивно перенесенных человеческих макрофагов с помощью экспрессии человеческого CD45 в анализе FACS.
Фигура 26A представляет собой график, показывающий проверку поверхностной экспрессии CAR с помощью анализа FACS через 48 часов после трансдукции человеческих макрофагов или не трансдуцированных (UTD), или трансдуцированных пустыми вирионами Ad5f35 без трансгена (пустые) или Ad5f35-CAR-HER2-ζ (CARMA) при множественности заражения 1000.
Фигура 26B представляет собой панель графиков, показывающих оценку поверхностных маркеров для демонстрации поляризации макрофагов M1 в клетках, трансдуцированных или пустым Ad5f35, или Ad5f35 с CAR-HER2-ζ. Маркеры M1 (HLA DR, CD86, CD80, PDL1) были повышенно отрегулированы, тогда как маркеры M2 (CD206, CD163) были пониженно отрегулированы.
Фигура 26C представляет собой схему использования мышей NSGS в и/п модели HER2+ метастатического рака яичника и их стратификации по четырем группам лечения (n=5 на группу). Мышей оставляли без лечения или делали им и/п инъекции по 1E7 нетрансдуцированных, трансдуцированных пустым Ad5f35 макрофагов или трансдуцированных CAR-HER2-ζ макрофагов на день 0.
Фигура 26D представляет собой панель изображений, показывающих мониторинг опухолевой нагрузки с помощью серийной биолюминисцентной визуализации, причем типичные данные показаны на день 27 после приживления опухоли.
Фигура 26E представляет собой график, показывающий мониторинг опухолевой нагрузки с помощью серийной биолюминисцентной визуализации, причем типичные данные показаны на день 27 после приживления опухоли.
Фигура 27A представляет собой схему использования мышей NSGS в и/п модели HER2+ метастатического рака яичника и их стратификации по четырем группам лечения (n=5 на группу), включая отсутствие лечения и 3E6, 1E7 или 2E7 человеческих макрофагов с CAR-HER2-ζ, вводимых и/п на день 0.
Фигура 27B представляет собой график, показывающий мониторинг опухолевой нагрузки с помощью серийной биолюминисцентной визуализации. В этой модели наблюдали зависящий от дозы ответ на количество макрофагов.
Фигура 27C представляет собой график, показывающий, что единичные дозы макрофагов с CAR-HER2 по 3E6, 1E7 или 2E7 макрофагов на мышь приводили к зависящей от дозы эрадикации опухоли (по сравнению с не получавшими лечения мышами) к дню 36 после приживления.
Фигура 28 представляет собой иллюстрацию предлагаемого терапевтического подхода для CARMA. Кратко говоря, моноциты пациента могут быть отобраны из периферической крови, дифференцированы ex vivo и трансдуцированы для экспрессии CAR, костимулированы (или нет) синергическими соединениями и инъецированы обратно в пациента внутривенно, интраперитонеально, интратуморально, посредством инвазивной радиологической процедуры или другим способом. Следует отметить, что процесс дифференцировки может быть пропущен, и моноциты могут быть трансдуцированы и влиты обратно в пациента. Источником моноцитов также может быть совпадающий по HLA донор.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое средним специалистом в области техники, к которой относится настоящее изобретение. Хотя для тестирования настоящего изобретения можно использовать на практике любые способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, предпочтительные материалы и способы описаны в настоящем документе. В описании и формуле настоящего изобретения будет использоваться нижеследующая терминология.
Кроме того, следует понимать, что терминология, используемая в настоящем документе, предназначена только для целей описания конкретных вариантов осуществления, и не предназначена для ограничения.
Единственное число используется в настоящем документе для ссылки на один или более чем один (т.е. по меньшей мере на один) грамматический объект статьи. В качестве примера, "элемент" означает один элемент или более чем один элемент.
Термин "приблизительно", как используется в настоящем документе при ссылке на измеряемое значение, такое как количество, продолжительность времени и тому подобное, предназначен для того, чтобы охватывать изменения, составляющие±20% или±10%, более предпочтительно±5%, даже более предпочтительно±1% и, еще более предпочтительно, ±0,1% от указанного значения, если такие изменения являются подходящими для выполнения раскрытых способов.
Термин "активация", как используется в настоящем документе, относится к состоянию моноцита/макрофага, который был в достаточной степени стимулирован для индуцирования детектируемой клеточной пролиферации или был стимулирован для проявления своей эффекторной функции. Активация может быть также связана с индуцированной продукцией цитокинов, фагоцитозом, клеточной сигнализацией, киллингом клеток-мишеней или процессированием и презентацией антигена. Термин "активированные моноциты/макрофаги" относится, помимо прочего, к моноцитам/макрофагам, которые претерпевают клеточное деление или проявляют эффекторную функция.
Термин "средство", или "биологическое средство", или "терапевтическое средство", как используется в настоящем документе, относится к молекуле, которая может экспрессироваться, высвобождаться, секретироваться или доставляться к мишени с помощью модифицированной клетки, описанной в настоящем документе. Средство включает, но без ограничения, нуклеиновую кислоту, антибиотик, противовоспалительное средство, антитело или его фрагменты антитела, фактор роста, цитокин, фермент, белок, пептид, белок слияния, синтетическую молекулу, органическую молекулу (например, малую молекулу) углевод и т.п., липид, гормон, микросому, их производное или вариант и любую их комбинацию. Средство может связывать любой фрагмент клетки, такой как рецептор, антигенную детерминанту или другой сайт связывания, присутствующий на мишени или клетке-мишени. Средство может диффундировать или транспортироваться в клетку, где оно может действовать внутриклеточно.
Термин "антитело", как используется в настоящем документе, относится к молекуле иммуноглобулина, которая специфически связывается с антигеном. Антитела могут представлять собой интактные иммуноглобулины, полученные из природных источников или из рекомбинантных источников, и могут представлять собой иммунореактивные части интактных иммуноглобулинов. Антитела, как правило, представляют собой тетрамеры иммуноглобулиновых молекул. Антитела в настоящем изобретении могут существовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, Fv, Fab и F(ab)2, а также одноцепочечные антитела (scFv) и гуманизированные антитела (Harlow et al., 1999, In: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, In: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
Термин "фрагмент антитела" относится к части интактного антитела и относится к определяющим антигены вариабельным областям интактного антитела. Примеры фрагментов антител включают, но без ограничения, фрагменты Fab, Fab', F(ab')2 и Fv, линейные антитела, scFv-антитела и мультиспецифические антитела, образованные из фрагментов антител.
Термин "тяжелая цепь антитела", как используется в настоящем документе, относится к большей из полипептидных цепей двух типов, присутствующих во всех молекулах антител в их природных конформациях.
Термин "легкая цепь антитела", как используется в настоящем документе, относится к меньшей из полипептидных цепей двух типов, присутствующих во всех молекулах антител в их природных конформациях. Легкие цепи α и β относятся к двум главным изотипам легких цепей антител.
Под термином "синтетическое антитело", как используется в настоящем документе, понимается антитело, которое сгенерировано с использованием технологии рекомбинантной ДНК, такое как, например, антитело, экспрессируемое бактериофагом, как описано в настоящем документе. Термин также следует понимать как означающий антитело, которое было сгенерировано с помощью синтеза молекулы ДНК, кодирующей данное антитело, причем данная молекула ДНК экспрессирует белок антитела, или аминокислотной последовательности, определяющей данное антитело, причем данные ДНК или аминокислотная последовательность были получены с использованием технологии синтеза ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области техники.
Термин "антиген" или "Ag", как используется в настоящем документе, определяет молекулу, которая вызывает иммунный ответ. Данный иммунный ответ может включать в себя или производство антител, или активацию специфических иммунологически компетентных клеток, или и то, и другое. Специалисту будет понятно, что любая макромолекула, включая практически все белки или пептиды, может служить антигеном. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, тем самым кодирует "антиген", как этот термин используют в настоящем документе. Кроме того, специалисту в данной области техники будет понятно, что антиген не обязательно кодируется исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает в себя, но без ограничения, использование частичных нуклеотидных последовательностей из более чем одного гена, и что эти нуклеотидные последовательности расположены в различных комбинациях для вызывания желаемого иммунного ответа. Кроме того, специалисту будет понятно, что антиген вообще не обязательно закодирован "геном". Совершенно очевидно, что антиген может быть создан синтезом или может быть получен из биологического образца. Такой биологический образец может включать, но без ограничения, образец ткани, образец опухоли, клетку или биологическую жидкость.
Термин "противоопухолевый эффект", как используется в настоящем документе, относится к биологическому эффекту, который может проявляться в уменьшении объема опухоли, уменьшении количества опухолевых клеток, уменьшении количества метастазов, увеличении ожидаемой продолжительности жизни или ослаблении различных физиологических симптомов, ассоциированных с раковым состоянием. "Противоопухолевый эффект" может также проявляться в способности пептидов, полинуклеотидов, клеток и антител настоящего изобретения предотвращать изначальное возникновение опухоли.
Термин "аутоантиген" означает в соответствии с настоящим изобретением любой собственный антиген, который распознается иммунной системой как чужеродный. Аутоантигены включают, но без ограничения, клеточные белки, фосфопротеины, белки клеточной поверхности, клеточные липиды, нуклеиновые кислоты, гликопротеины, включая рецепторы клеточной поверхности.
Термин "аутоиммунное заболевание", как используется в настоящем документе, определяют как нарушение, которое является результатом аутоиммунного ответа. Аутоиммунное заболевание является результатом несоответствующей и чрезмерной реакции на собственный антиген. Примеры аутоиммунных заболеваний включают, помимо прочего, но без ограничения, болезнь Аддисона, гнездную алопецию, анкилозирующий спондилит, аутоиммунный гепатит, аутоиммунный паротит, болезнь Крона, диабет (типа I), дистрофический буллезный эпидермолиз, эпидидимит, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барра, болезнь Хашимото, гемолитическую анемию, системную красную волчанку, множественный склероз, миастению гравис, вульгарную пузырчатку, псориаз, ревматическую лихорадку, ревматоидный артрит, саркоидоз, склеродермию, синдром Шегрена, спондилоартропатию, тиреоидит, васкулит, витилиго, микседему, пернициозную анемию, язвенный колит.
Как используется в настоящем документе, термин "аутологичный" понимается как относящийся к любому материалу, полученному от того же индивидуума, которому он должен быть позже повторно введен.
"Аллогенный" относится к трансплантату, полученному от другого животного того же вида.
"Ксеногенный" относится к трансплантату, полученному от животного другого вида.
Термин "рак", как используется в настоящем документе, определяют как заболевание, отличающееся быстрым и неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных раков включают, но без ограничения, рак молочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почек, рак печени, рак головного мозга, лимфому, лейкоз, рак легкого и т.п. В некоторых вариантах осуществления рак представляет собой медуллярную карциному щитовидной железы.
Термин "химерный антигенный рецептор" или "CAR", как используется в настоящем документе, относится к искусственному T-клеточному поверхностному рецептору, который сконструирован для экспрессии на иммунной эффекторной клетке и специфически связывает антиген. CAR можно применять в качестве терапии с адоптивным переносом клеток. Моноциты удаляют из пациента (кровь, опухолевая или асцитная жидкость) и модифицируют таким образом, что они экспрессируют рецепторы, специфичные к конкретной форме антигена. В некоторых вариантах осуществления CAR экспрессируются, например, со специфичностью к опухоль-ассоциированному антигену. CAR могут также содержать внутриклеточный домен активации, трансмембранный домен и внеклеточный домен, содержащий область связывания опухоль-ассоциированного антигена. В некоторых аспектах CAR содержат слияния моноклональных антител, полученных из одноцепочечных вариабельных фрагментов (scFv), слитых с трансмембранным и внутриклеточным доменом из CD3-дзета. Специфичность конструкций CAR может происходить от лигандов рецепторов (например, пептидов). В некоторых вариантах осуществления CAR может быть нацелен на раки посредством перенаправления моноцита/макрофага, экспрессирующего CAR, специфичный к опухоль-ассоциированным антигенам.
Термин "химерная внутриклеточная сигнальная молекула" относится к рекомбинантному рецептору, содержащему один или более внутриклеточных доменов одной или более стимулирующих и/или костимулирующих молекул. Химерная внутриклеточная сигнальная молекула по существу не имеет внеклеточного домена. В некоторых вариантах осуществления химерная внутриклеточная сигнальная молекула содержит дополнительные домены, такие как трансмембранный домен, детектируемую метку и спейсерный домен.
Как используется в настоящем документе, термин "консервативные модификации последовательности" предназначен для обозначения аминокислотных модификаций, которые не воздействуют или не изменяют значительно характеристики связывания антитела, содержащего данную аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, присоединения и делеции. Модификации могут быть введены в антитело настоящего изобретения посредством стандартных методов, известных в данной области техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативными являются замены, в которых аминокислотный остаток заменяется на аминокислотный остаток, имеющий схожую боковую цепь. В данной области техники определены семейства аминокислотных остатков, имеющих схожие боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков в областях CDR антитела могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененное антитело может быть подвергнуто тестированию на способность связывать антигены с использованием функциональных анализов, описанных в настоящем документе.
"Костимулирующий лиганд", как этот термин используется в настоящем документе, включает молекулу на антиген-презентирующей клетке (например, aAPC, дентритной клетке, B-клетке и т.п.), которая специфически связывает когнатную костимулирующую молекулу на моноците/макрофаге, посредством этого обеспечивая сигнал, который опосредует ответ моноцитов/макрофагов, включая, но без ограничения, пролиферацию, активацию, дифференцировку и т.п. Костимулирующий лиганд может включать, но без ограничения, CD7, B7-1 (CD80), B7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцируемый костимулирующий лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM), CD30L, CD40, CD70, CD83, HLA-G, MICA, MICB, HVEM, рецептор лимфотоксина-бета, 3/TR6, ILT3, ILT4, HVEM, агонист или антитело, которые связывают рецептор толл-лиганда, и лиганд, который специфически связывается с B7-H3. Костимулирующий лиганд также охватывает, в числе прочего, антитело, которое специфически связывается с костимулирующей молекулой, присутствующей на моноците/макрофаге, такой как, но без ограничения, CD27, CD28, 4-1BB, OX40, CD30, CD40, PD-1, ICOS, функционально-связанный антиген-1 лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, B7-H3, и лиганд, который специфически связывается с CD83.
"Костимулирующая молекула" относится к молекуле на клетке врожденного иммуннитета, которая используется для усиления или ослабления первоначального стимула. Например, рецепторы распознавания патоген-ассоциированных структур, такие как TLR (усиление) или ось CD47/SIRPα (ослабление), являются молекулами на клетках врожденного иммуннитета. Костимулирующие молекулы включают, но без ограничения, TCR, CD3-дзета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD86, общую FcR-гамма, FcR-бета (Fc-эпсилон R1b), CD79a, CD79b, Fc-гамма RIIa, DAP10, DAP12, T-клеточный рецептор (TCR), CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, PD-1, ICOS, функционально-связанный антиген-1 лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, B7-H3, лиганд, который специфически связывается с CD83, CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD127, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, NKp44, NKp30, NKp46, NKG2D, другие костимулирующие молекулы, описанные в настоящем документе, любое их производное, вариант или фрагмент, любую синтетическую последовательность костимулирующей молекулы, которая обладает такими же функциональными возможностями, и любую их комбинацию.
"Костимулирующий сигнал", как используется в настоящем документе, относится к сигналу, который в комбинации с первичным сигналом, таким как активация CAR на макрофаге, ведет к активации макрофага.
Термины "цитотоксический" или "цитотоксичность" относятся к киллингу или повреждению клеток. В одном варианте осуществления цитотоксичность метаболически усиленных клеток улучшена, например возросла цитолитическая активность макрофагов.
"Заболевание" представляет собой состояние здоровья животного, при котором данное животное не может поддерживать гомеостаз, и при котором, если не происходит облегчения заболевания, то здоровье животного продолжает ухудшаться. Напротив, "нарушение" у животного представляет собой состояние, при котором животное способно поддерживать гомеостаз, но при котором состояние здоровья животного является менее благоприятным, чем это было бы при отсутствии нарушения. При отсутствии лечения нарушение не обязательно приводит к дальнейшему ухудшению состояния здоровья животного.
"Эффективное количество" или "терапевтически эффективное количество" используются в настоящем документе взаимозаменяемо, и относятся к количеству соединения, состава, материала или композиции, как описано в настоящем документе, эффективному для достижения конкретного биологического результата или обеспечивающему терапевтическую или профилактическую пользу. Такие результаты могут включать, но без ограничения, противоопухолевую активность, определенную любым средством, пригодным в данной области техники.
Термин "кодирующий" относится к свойству, присущему специфическим последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза в биологических процессах других полимеров и макромолекул, имеющих или определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК), или определенную последовательность аминокислот и биологические свойства, проистекающие из них. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, производит белок в клетке или другой биологической системе. Как кодирующая нить, нуклеотидная последовательность которой идентична последовательности мРНК и обычно приводится в перечнях последовательностей, так и некодирующая нить, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться кодирующей белок или другой продукт этих гена или кДНК.
Как используется в настоящем документе, "эндогенный" относится к любому материалу из организма, клетки, ткани или системы, или производимому внутри них.
Как используется в настоящем документе, термин "экзогенный" относится к любому материалу, введенному в организм, клетку, ткань или систему, или производимому снаружи от них.
Термин "размножение", как используется в настоящем документе, относится к увеличению количества, а именно к увеличению количества моноцитов/макрофагов. В одном варианте осуществления количество моноцитов/макрофагов, которые размножают ex vivo, возрастает относительно количества, первоначально присутствующего в культуре. В другом варианте осуществления количество моноцитов/макрофагов, которые размножают ex vivo, возрастает относительно клеток других типов в культуре. Термин "ex vivo", как используется в настоящем документе, относится к клеткам, которые были удалены из живого организма (например, человека) и размножаются вне организма (например, в культуральной чашке, тестовой пробирке или биореакторе).
Термин "экспрессия", как используется в настоящем документе, определен как транскрипция и/или трансляция конкретной нуклеотидной последовательности, управляемая ее промотором.
Термин "вектор экспрессии" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий контрольные последовательности экспрессии, функционально связанные с подлежащей экспрессии нуклеотидной последовательностью. Вектор экспрессии содержит достаточно действующих в цис-положении элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в системе in vitro экспрессии. Векторы экспрессии включают все известные в данной области техники, такие как космиды, плазмиды (например, оголенные или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают в себя рекомбинантный полинуклеотид.
Термин "гомологичный", как используется в настоящем документе, относится к идентичности последовательностей субъединиц между двумя полимерными молекулами, например между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Когда положение субъединицы в обеих из двух молекул занято одной и той же мономерной субъединицей, например, если положение в каждой из двух молекул ДНК занято аденином, то они гомологичны в этом положении. Гомология между двумя последовательностями является непосредственной функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях гомологичны, две последовательности гомологичны на 50%; если 90% положений (например, 9 из 10) совпадают или гомологичны, две последовательности гомологичны на 90%. Применительно к нуклеиновой кислоте или белку, "гомологичный", как используется в настоящем документе, относится к последовательности, которая имеет идентичность последовательности приблизительно 50%. Более предпочтительно, гомологичная последовательность имеет идентичность последовательности приблизительно 75%, даже более предпочтительно, имеет идентичность последовательности по меньшей мере приблизительно 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%.
"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую от нечеловеческого иммуноглобулина. По большей части гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены на остатки из CDR отличного от человека вида (донорное антитело), такого как мышь, крыса или кролик, имеющие желаемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области (FR) Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются ни в реципиентном антителе, ни в импортированной CDR или каркасных последовательностях. Эти модификации делают для дополнительного уточнения и оптимизации активности антитела. В общем случае, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют нечеловеческому иммуноглобулину, и все или по существу все из FR-областей имеют последовательность от человеческого иммуноглобулина. Гуманизированное антитело в оптимальном случае также будет содержать по меньшей мере часть иммуноглобулиновой константной области (Fc), обычно от человеческого иммуноглобулина. Для дальнейших подробностей смотри Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
Термин "полностью человеческий" относится к иммуноглобулину, такому как антитело, если вся молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела.
Термин "идентичность", как используется в настоящем документе, относится к идентичности последовательностей субъединиц между двумя полимерными молекулами, в частности между двумя аминокислотными молекулами, например между двумя полипептидными молекулами. Когда две аминокислотные последовательности имеют одинаковые остатки в одинаковых положениях, например, если положение в каждой из двух полипептидных молекул занято аргинином, то они идентичны в этом положении. Идентичность или степень, в которой две аминокислотные последовательности имеют одинаковые остатки в одинаковых положениях в выравнивании, часто выражается в процентах. Идентичность между двумя аминокислотными последовательностями является непосредственной функцией количества совпадающих или идентичных положений; например, если половина (например, пять положений в полимере длиной десять аминокислот) положений в двух последовательностях идентичны, две последовательности идентичны на 50%; если 90% положений (например, 9 из 10) совпадают или идентичны, две аминокислотные последовательности идентичны на 90%.
Под "по существу идентичным" понимается полипептид или молекула нуклеиновой кислоты, демонстрирующая идентичность по меньшей мере 50% с эталонной аминокислотной последовательностью (например, любой из аминокислотных последовательностей, описанных в настоящем документе) или последовательностью нуклеиновой кислоты (например, любой из последовательностей нуклеиновой кислоты, описанных в настоящем документе). Предпочтительно, такая последовательность по меньшей мере на 60%, более предпочтительно на 80% или 85% и, более предпочтительно, на 90%, 95% или даже 99% идентична последовательности, используемой для сравнения, на уровне аминокислот или нуклеиновой кислоты.
Направляющая последовательность нуклеиновой кислоты может быть комплементарна одной нити (нуклеотидной последовательности) целевого участка двухнитевой ДНК. Процентная комплементарность между направляющей последовательностью нуклеиновой кислоты и целевой последовательностью сможет составлять по меньшей мере 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 63%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Направляющая последовательность нуклеиновой кислоты может иметь длину по меньшей мере 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или более нуклеотидов. В некоторых вариантах осуществления направляющая последовательность нуклеиновой кислоты содержит непрерывный участок из 10-40 нуклеотидов. Вариабельный направляющий домен может состоять из последовательности ДНК, последовательности РНК, модифицированной последовательности ДНК, модифицированной последовательности РНК (смотри, например, модификации, описанные в настоящем документе) или любой их комбинации.
Идентичность последовательности обычно измеряют с использованием программного обеспечения для анализа последовательностей (например, программного пакета для анализа последовательностей от Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, программы BLAST, BESTFIT, GAP или PILEUP/PRETTYBOX). Такое программное обеспечение совмещает идентичные или схожие последовательности посредством присваивания степени гомологии различным заменам, делециям и/или другим модификациям. Консервативные замены обычно включают замены в следующих группах: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В типичном подходе к определению степени идентичности можно использовать программу BLAST с оценкой вероятности между e-3 и e-100, указывающей на близкородственную последовательность.
Термин "иммуноглобулин" или "Ig", как используется в настоящем документе, определяют как класс белков, которые функционируют как антитела. Антитела, экспрессируемые B-клетками, иногда называют BCR (B-клеточным рецептором) или антигенным рецептором. Пятью членами, включаемыми в этот класс белков, являются IgA, IgG, IgM, IgD и IgE. IgA является первичным антителом, которое присутствует в выделениях тела, таких как слюна, слезы, грудное молоко, желудочно-кишечные выделения и выделения слизи дыхательного и мочеполового трактов. IgG является наиболее распространенным циркулирующим антителом. IgM является основным иммуноглобулином, продуцируемым при первичном иммунном ответе у большинства субъектов. Он является наиболее эффективным иммуноглобулином при агглютинации, связывании комплемента и других реакциях антител и играет важную роль в защите от бактерий и вирусов. IgD является иммуноглобулином, который не обладает никакими известными функциями антител, но может служить антигенным рецептором. IgE является иммуноглобулином, который опосредует немедленную гиперчувствительность, вызывая высвобождение медиаторов из тучных клеток и базофилов при воздействии аллергена.
Термин "иммунный ответ", как используется в настоящем документе, определяют как клеточный ответ на антиген, который происходит, когда лимфоциты идентифицируют антигенные молекулы как чужеродные и индуцируют образование антител и/или активируют лимфоциты для удаления антигена.
Как используется в настоящем документе, "инструктирующий материал" включает публикацию, запись, диаграмму или любой другой носитель, который можно использовать для передачи полезности композиций и способов настоящего изобретения. Инструктирующий материал набора настоящего изобретения может, например, быть прикреплен к контейнеру, который содержит нуклеиновую кислоту, пептид и/или композицию настоящего изобретения, или может поставляться вместе с контейнером, который содержит нуклеиновую кислоту, пептид и/или композицию. В качестве альтернативы, инструктирующий материал может поставляться отдельно от контейнера, для того чтобы получатель использовал вместе инструктирующий материал и соединение.
Термин "выделенный" означает измененный или удаленный из естественного состояния. Например, нуклеиновая кислота или пептид, естественно присутствующие в живом животном, не являются "выделенными", но те же самые нуклеиновая кислота или пептид, частично или полностью отделенные от сопутствующих материалов их естественного состояния, являются "выделенными". Выделенные нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в ненативном окружении, таком как, например, клетка-хозяин.
"Лентивирус", как используется в настоящем документе, относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов в том, что они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, так что они являются одним наиболее эффективных способов вектора доставки генов. ВИЧ, SIV и FIV являются примерами лентивирусов. Векторы, получаемые из лентивирусов, предлагают средства для достижеия значительных уровней переноса генов in vivo.
Под термином "модифицированный", как используется в настоящем документе, понимается изменение состояния или структуры молекулы или клетки настоящего изобретения. Молекулы могут быть модифицированы многими способами, в том числе химически, структурно и функционально. Клетки могут быть модифицированы с помощью введения нуклеиновых кислот.
Под термином "модулирование", как используется в настоящем документе, понимается опосредование детектируемого повышения или снижения уровня ответа у субъекта по сравнению с уровнем ответа у этого субъекта в отсутствие лечения или соединения и/или по сравнению с уровнем ответа у во всем остальном идентичного, но не получавшего лечения субъекта. Термин охватывает изменение и/или воздействие на нативный сигнал или ответ и тем самым опосредование положительного терапевтического ответа у субъекта, предпочтительно человека.
В контексте настоящего изобретения используются следующие сокращения для часто встречающихся оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину, и "U" относится к уридину.
Если не указано иное, термин "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает в себя все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга, и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК" может также включать в себя интроны, если нуклеотидная последовательность, кодирующая белок, может в некоторых вариантах содержать интрон(ы).
Термин "функционально связанный" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты помещена в функциональную взаимосвязь со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор воздействует на транскрипцию или экспрессию кодирующей последовательности. Обычно функционально связанные последовательности ДНК соприкасаются и, если необходимо соединить две кодирующие белок области, находятся в одной и той же рамке считывания.
Термин "сверхэкспрессированный" опухолевый антиген или "сверхэкспрессия" опухолевого антигена предназначен для обозначения аномального уровня экспрессии опухолевого антигена в клетке из области заболевания, такой как солидная опухоль, в определенных ткани или органе пациента, относительно уровня экспрессии в нормальной клетке из этих ткани или органа. Пациенты с солидными опухолями или гематологическим злокачественным образованием, характеризующимися сверхэкспрессией опухолевого антигена, могут быть определены с помощью стандартных анализов, известных в данной области техники.
"Парентеральное" введение иммуногенной композиции включает, например, методы подкожной (п/к), внутривенной (в/в), внутримышечной (в/м), внутриопухолевой (в/о) интраперитонеальной (и/п) или интрастернальной инъекции или инфузии.
Термин "полинуклеотид", как используется в настоящем документе, определяют как цепь нуклеотидов. Кроме того, нуклеиновые кислоты представляют собой полимеры нуклеотидов. Таким образом, термины нуклеиновые кислоты и полинуклеотиды, как используется в настоящем документе, являются взаимозаменяемыми. Специалист в данной области техники владеет общим знанием о том, что нуклеиновые кислоты являются полинуклеотидами, которые могут быть гидролизованы до мономерных "нуклеотидов". Мономерные нуклеотиды могут быть гидролизованы до нуклеозидов. Как используется в настоящем документе, полинуклеотиды включают, но без ограничения, все последовательности нуклеиновой кислоты, которые получены с помощью любого средства, доступного в данной области техники, включая, без ограничения, рекомбинантные средства, т.е. клонирование последовательностей нуклеиновой кислоты из рекомбинантной библиотеки или клеточного генома с использованием обычной технологии клонирования и PCR™ и т.п., и средства синтеза.
Как используется в настоящем документе, термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не налагается никаких ограничений на максимальное количество аминокислот, которое может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Как используется в настоящем документе, термин относится как к более коротким цепям, которые также обычно называют в данной области техники, например, пептидами, олигопептидми и олигомерами, так и к более длинным цепям, которые обычно называют в данной области техники белками, которых существует много типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, белки слияния и другие. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
Термин "промотор", как используется в настоящем документе, определяют как последовательность ДНК, распознаваемую аппаратом синтеза клетки или введенным аппаратом синтеза, необходимую для начала специфической транскрипции полинуклеотидной последовательности.
Как используется в настоящем документе, термин "промотор/регуляторная последовательность" означает последовательность нуклеиновой кислоты, которая требуется для экспрессии продукта гена, функционально связанного с данными промотором/регуляторной последовательностью. В некоторых случаях данная последовательность может представлять собой последовательность корового промотора, а в других случаях данная последовательность может также включать в себя последовательность энхансера и другие регуляторные элементы, которые требуются для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, экспрессирующую продукт гена ткань-специфическим образом.
"Конститутивный" промотор представляет собой нуклеотидную последовательность, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке в большинстве или всех физиологических условиях клетки.
"Индуцируемый" промотор представляет собой нуклеотидную последовательность, которая, когда функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает производство продукта гена в клетке по существу только тогда, когда в клетке присутствует индуктор, который соответствует промотору.
"Ткань-специфический" промотор представляет собой нуклеотидную последовательность, которая, когда функционально связана с полинуклеотидом, который кодирует или определяется геном, вызывает производство продукта гена в клетке по существу только тогда, когда клетка представляет собой клетку ткани соответствующего промотору типа.
Термин "резистентность к иммуносупрессии" относится к отсутствию супрессии или снижению супрессии активности или активации иммунной системы.
Термин "путь трансдукции сигнала" относится к биохимической взаимосвязи между множеством молекул трансдукции сигнала, которые играют роль в передаче сигнала из одной части клетки в другую часть клетки. Фраза "рецептор клеточной поверхности" включает в себя молекулы и комплексы молекул, способные к приему сигнала и передаче сигнала через плазматическую мембрану клетки.
"Одноцепочечные антитела" относятся к антителам, образованным с помощью методов рекомбинантной ДНК, в которых фрагменты тяжелых и легких цепей иммуноглобулинов связаны с областью Fv посредством сконструированного участка из аминокислот. Известны различные способы генерации одноцепочечных антител, включая описанные в патенте США № 4694778; Bird (1988) Science 242:423-442; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; Ward et al. (1989) Nature 334:54454; Skerra et al. (1988) Science 242:1038-1041.
Под термином "специфически связывает", как используется в настоящем документе по отношению к антителу, понимается антитело, которое распознает конкретный антиген, но по существу не распознает или не связывает другие молекулы в образце. Например, антитело, которое специфически связывается с антигеном из одного вида, может также связываться с этим антигеном из одного или более видов. Но такая межвидовая реактивность сама по себе не изменяет классификацию антитела как специфического. В другом примере антитело, которое специфически связывается с антигеном, может также связываться с различными аллельными формами этого антигена. Однако такая перекрестная реактивность сама по себе не изменяет классификацию антитела как специфического. В некоторых случаях термины "специфическое связывание" или "специфически связывающийся" можно использовать в связи с взаимодействием антитела, белка или пептида со вторым химическим веществом для обозначения зависимости взаимодействия от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на этом химическом веществе; например, антитело распознает и связывается с конкретной белковой структурой, а не вообще с белками. Если антитело является специфическим для эпитопа "A", присутствие молекулы, содержащей эпитоп A (или свободного немеченого A), в реакции, содержащей меченый "A" и антитело, уменьшит количество меченого A, связанного с антителом.
Под термином "стимуляция" понимается первичный ответ, индуцируемый связыванием стимулирующей молекулы (например, комплекса TCR/CD3) с ее когнатным лигандом, что опосредует событие трансдукции сигнала, такое как, но без ограничения, трансдукция сигнала посредством механизма Fc-рецептора или посредством синтетического CAR. Стимуляция может опосредовать изменение экспрессии некоторых молекул, например понижающую регуляцию TGF-бета и/или реорганизацию структур цитоскелета и т.п.
"Стимулирующая молекула", как этот термин используется в настоящем документе, означает молекулу на моноците/макрофаге, которая специфически связывается с когнатным стимулирующим лигандом, присутствующим на антиген-презентирующей клетке.
Термин "стимулирующая лиганд", как используется в настоящем документе, означает лиганд, который, когда присутствует на антиген-презентирующей клетке (например, aAPC, дентритной клетке, B-клетке и т.п.) или опухолевой клетке, может специфически связываться с партнером по когнатному связыванию (называемым в настоящем документе "стимулирующей молекулой") на моноците/макрофаге, тем самым опосредуя ответ иммунной клетки, включая, но без ограничения, активацию, инициацию иммунного ответа, пролиферацию и т.п. Стимулирующие лиганды хорошо известны в данной области техники, и к ним относятся, в числе прочего, лиганд толл-подобного рецептора (TLR), антитело к толл-подобному рецептору, агонист и антитело к рецептору моноцитов/макрофагов. Кроме того, цитокины, такие как интерферон-гамма, являются сильными стимуляторами макрофагов.
Предполагается, что термин "субъект" включает в себя живые организмы, у которых может быть вызван иммунный ответ (например, млекопитающих). "Субъект" или "пациент", как используется в настоящем документе, может представлять собой человека или не являющееся человеком млекопитающее. К не являющимся человеком млекопитающим относятся, например, домашний скот и домашние животные, например такие млекопитающие, как овцы, крупный рогатый скот, свиньи, собачьи, кошачьи и мыши. Предпочтительно, субъект является человеком.
Как используется в настоящем документе, "по существу очищенная" клетка представляет собой клетку, которая по существу свободна от других типов клеток. По существу очищенная клетка также относится к клетке, которая была отделена от клеток других типов, с которыми она обычно связана в своем естественном состоянии. В некоторых случаях популяция по существу очищенных клеток означает однородную популяцию клеток. В других случаях данный термин относится просто к клеткам, которые были отделены от клеток, с которыми они естественным образом связаны в своем естественном состоянии. В некоторых вариантах осуществления клетки культивируют in vitro. В других вариантах осуществления клетки не культивируют in vitro.
Термин "целевой участок" или "целевая последовательность" относится к геномной последовательности нуклеиновой кислоты, которая определяет часть нуклеиновой кислоты, с которой связывающая молекула может специфически связываться в достаточных для того, чтобы произошло связывание, условиях.
Под "мишенью" понимается клетка, орган или участок в теле, которые нуждаются в лечении.
Как используется в настоящем документе, термин "T-клеточный рецептор" или "TCR" относится к комплексу мембранных белков, которые участвуют в активации T-клеток в ответ на презентацию антигена. TCR отвечает за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости. TCR состоит из гетеродимера цепей альфа (α) и бета (β), хотя в некоторых клетках TCR состоит из цепей гамма и дельта (γ/δ). TCR могут существовать в формах альфа/бета и гамма/дельта, которые структурно схожи, но имеют различные анатомические местоположения и функции. Каждая цепь состоит из двух внеклеточных доменов, вариабельного и константного домена. В некоторых вариантах осуществления TCR может быть модифицирован на любой клетке, содержащей TCR, включая, например, хелперную T-клетку, цитотоксическую T-клетку, T-клетку памяти, регуляторную T-клетку, T-клетку-естественный киллер и гамма-дельта T-клетку.
Термин "терапевтический", как используется в настоящем документе, означает лечение и/или профилактику. Терапевтический эффект достигается путем подавления, ремиссии или ликвидации болезненного состояния.
Термин "трансфицированный", или "трансформированный", или "трансдуцированный", как используется в настоящем документе, относится к процессу, посредством которого экзогенную нуклеиновую кислоту переносят или вводят в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку субъекта и ее потомство.
"Лечить" заболевание, как этот термин используется в настоящем документе, означает снижать частоту или тяжесть по меньшей мере одного признака или симптома заболевания или нарушения, испытываемого субъектом.
Термин "опухоль" как используется в настоящем документе, относится к аномальному росту ткани, которая может быть доброкачественной, предраковой, злокачественной или метастатической.
Фраза "под транскрипционным контролем" или "функционально связанный", как используется в настоящем документе, означает, что промотор находится в правильных положении и ориентации по отношению к полинуклеотиду для управления инициацией транскрипции с помощью РНК-полимеразы и экспрессией полинуклеотида.
"Вектор" представляет собой композицию веществ, которая содержит выделенную нуклеиновую кислоту, и которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области техники известны многочисленные векторы, включая, но без ограничения, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор" включает в себя автономно реплицирующиеся плазмиду или вирус. Термин также следует интерпретировать как включающий в себя неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосомы и т.п. Примеры вирусных векторов включают, но без ограничения, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и т.п.
Диапазоны: на протяжении настоящего раскрытия различные аспекты настоящего изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов дано только для удобства и краткости и не должно рассматриваться в качестве негибкого ограничения объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретно раскрывающее все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание диапазона, такого как от 1 до 6, следует рассматривать как конкретно раскрывающее такие поддиапазоны, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и так далее, а также отдельные числовые значения в пределах этого диапазона, например 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применяется независимо от ширины диапазона.
Описание
Накопленные данные свидетельствуют о том, что макрофаги в изобилии присутствуют в микроокружении опухоли при многих раках, где они могут принимать классически активированный (M1, противоопухолевый) или альтернативно активированный (M2, проопухолевый) фенотип. Макрофаги являются сильными эффекторами врожденной иммунной системы и способны на по меньшей мере три различных противоопухолевых функции: фагоцитоз, клеточную цитотоксичность и презентацию антигена для организации адаптивного иммунного ответа. В то время как T-клетки требуют антиген-зависимой активации через T-клеточный рецептор или химерный иммунорецептор, макрофаги могут быть активированы различными способами. Непосредственная активация макрофагов является антиген-независимой, опираясь на такие механизмы, как распознавание ассоциированных с патогенами молекулярных структур толл-подобными рецепторами (TLR). Опосредованная иммунными комплексами активация является антиген-зависимой, но требует присутствия антиген-специфических антител и отсутствия ингибирующего взаимодействия CD47-SIRPα.
Было показано, что опухоль-ассоциированные макрофаги перепрограммируются микроокружением опухоли, становясь ключевыми иммуносупрессивными игроками в микроокружении. Поэтому возможность генетически конструировать макрофаги для предотвращения развития иммуносупрессивного генетического перепрограммирования будет представлять собой огромный прогресс в данной области.
Настоящее изобретение включает в себя композиции и способы для лечения злокачественного образования у субъекта. Настоящее изобретение включает в себя экспрессию химерного антигенного рецептора в моноците, макрофаге или дентритной клетке. Такая модифицированная клетка привлекается в микроокружение опухоли, где она играет роль сильного иммунного эффектора путем инфильтрации опухоли и киллинга клеток-мишеней.
Химерный антигенный рецептор (CAR)
В одном аспекте настоящего изобретения генерируют модифицированный моноцит, макрофаг или дентритную клетку посредством экспрессии в них CAR. Таким образом, настоящее изобретение охватывает CAR и конструкцию нуклеиновой кислоты, кодирующую CAR, причем CAR включает в себя антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен.
В одном аспекте настоящее изобретение включает в себя модифицированную клетку, содержащую химерный антигенный рецептор (CAR), причем CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые обладают направленной эффекторной активностью. В другом аспекте настоящее изобретение включает в себя модифицированную клетку, содержащую последовательность нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), причем данная последовательность нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен, последовательность нуклеиновой кислоты, кодирующую трансмембранный домен, и последовательность нуклеиновой кислоты, кодирующую внутриклеточный домен костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые экспрессируют CAR и обладают направленной эффекторной активностью. В одном варианте осуществления направленная эффекторная активность направлена на антиген на клетке-мишени, который специфически связывает антигенсвязывающий домен CAR. В другом варианте осуществления направленную эффекторную активность выбирают из группы, состоящей из фагоцитоза, направленной клеточной цитотоксичности, презентации антигена и секреции цитокинов.
Антигенсвязывающий домен
В одном варианте осуществления CAR настоящего изобретения содержит антигенсвязывающий домен, который связывается с антигеном на клетке-мишени. Примеры клеточных поверхностных маркеров, которые могут играть роль антигена, который связывается с антигенсвязывающим доменом CAR, включают ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками.
Выбор антигенсвязывающего домена зависит от типа и количества антигенов, которые присутствуют на поверхности клетки-мишени. Например, антигенсвязывающий домен может быть выбран так, чтобы распознавать антиген, который играет роль клеточного поверхностного маркера на клетке-мишени, ассоциированного с конкретным болезненным состоянием.
В одном варианте осуществления антигенсвязывающий домен связывается с опухолевым антигеном, таким как антиген, который является специфическим для представляющих интерес опухоли или рака. В одном варианте осуществления опухолевый антиген настоящего изобретения содержит один или более антигенных эпитопов рака. Неограничивающие примеры опухоль-ассоциированных антигенов включают CD19; CD123; CD22; CD30; CD171; CS-1 (также называемый подгруппой-1 CD2, CRACC, SLAMF7, CD319 и 19A24); лектиноподобную молекулу-1 C-типа (CLL-1 или CLECL1); CD33; вариант III рецептора эпидермального фактора роста (EGFRvIII); ганглиозид G2 (GD2); ганглиозид GD3 (aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer); член семейства рецепторов TNF B-клеточный антиген созревания (BCMA); Tn-антиген ((Tn Ag) или (GalNAcα-Ser/Thr)); простатоспецифический мембранный антиген (PSMA); подобный рецепторной тирозинкиназе орфанный рецептор-1 (ROR1); Fms-подобную тирозинкиназу-3 (FLT3); опухоль-ассоциированный гликопротеин-72 (TAG72); CD38; CD44v6; карциноэмбриональный антиген (CEA); молекулу адгезии эпителиальных клеток (EPCAM); B7H3 (CD276); KIT (CD117); субъединицу альфа-2 рецептора интерлейкина-13 (IL-13Ra2 или CD213A2); мезотелин; рецептор-альфа интерлейкина-11 (IL-11Ra); антиген стволовых клеток предстательной железы (PSCA); протеазу, серин 21 (Testisin или PRSS21); рецептор-2 фактора роста эндотелия сосудов (VEGFR2); антиген Льюис(Y); CD24; рецептор-бета фактора роста тромбоцитов (PDGFR-бета); стадиеспецифический эмбриональный антиген-4 (SSEA-4); CD20; фолатный рецептор-альфа; рецепторную тирозинпротеинкиназу ERBB2 (Her2/neu); муцин-1, связанный с клеточной поверхностью (MUC1); рецептор эпидермального фактора роста (EGFR); молекулу адгезии нервных клеток (NCAM); простазу; простатическую кислую фосфатазу (PAP); мутировавший фактор элонгации-2 (ELF2M); эфрин B2; белок активации фибробластов-альфа (FAP); рецептор инсулин-подобного фактора роста-1 (рецептор IGF-I), карбоангидразу IX (CAIX); субъединицу протеасомы (просомы, макропейна), бета-типа, 9 (LMP2); гликопротеин-100 (gp100); онкогенный белок слияния, состоящий из области кластеризации точек разрыва (BCR) и гомолог-1 вирусного онкогена мышиного лейкоза Абельсона (Abl) (bcr-abl); тирозиназу; рецептор-2 эфрина типа A (EphA2); фукозил GM1; молекулу адгезии сиалила Льюис (sLe); ганглиозид GM3 (aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer); трансглутаминазу-5 (TGS5); высокомолекулярный опухоль-ассоциированный антиген меланомы (HMWMAA); ганглиозид O-ацетил-GD2 (OAcGD2); фолатный рецептор-бета; опухолевый эндотелиальный маркер-1 (TEM1/CD248); родственный опухолевому эндотелиальному маркеру-7 белок (TEM7R); клаудин-6 (CLDN6); рецептор тиреостимулирующего гормона (TSHR); член D класса C группы 5 связанных с G-белком рецепторов (GPRC5D); белок-61 открытой рамки считывания хромосомы X (CXORF61); CD97; CD179a; киназу анапластической лимфомы (ALK); полисиаловую кислоту; плацента-специфический блок-1 (PLAC1); гексасахаридную часть гликоцерамида globoH (GloboH); антиген дифференцировки молочной железы (NY-BR-1); уроплакин-2 (UPK2); клеточный рецептор-1 вируса гепатита A (HAVCR1); адренорецептор-бета 3 (ADRB3); паннексин-3 (PANX3); связанный с G-белком рецептор-20 (GPR20); комплекс лимфоцитарного антигена-6, локус K 9 (LY6K); ольфакторный рецептор 51E2 (OR51E2); белок альтернативной рамки считывания TCR-гамма (TARP); белок опухоли Вильмса (WT1); раково-тестикулярный антиген-1 (NY-ESO-1); раково-тестикулярный антиген 2 (LAGE-1a); меланома-ассоциированный антиген-1 (MAGE-A1); транслокационно-вариантный ген ETS 6, расположенный на хромосоме 12p (ETV6-AML); спермальный белок-17 (SPA17); член 1A семейства антигенов X (XAGE1); ангиопоэтин-связывающий рецептор-2 клеточной поверхности (Tie 2); меланомный раково-тестикулярный антиген-1 (MAD-CT-1); меланомный раково-тестикулярный антиген-2 (MAD-CT-2); связанный с fos антиген 1; опухолевый белок p53 (p53); мутантный p53; простеин; сурвивин; теломеразу; опухолевый антиген-1 карциномы предстательной железы (PCTA-1 или галектин-8), меланомный антиген-1, распознаваемый T-клетками (MelanA или MART1); мутант саркомы крыс (Ras); теломеразную обратную транскриптазу человека (hTERT); точки разрыва характерных для саркомы транслокаций; меланомный ингибитор апоптоза (ML-IAP); ERG (ген слияния трансмембранной протеазы, серин 2 (TMPRSS2) ETS); N-ацетилглюкозаминилтрансферазу V (NA17); белок с парным боксом Pax-3 (PAX3); андрогеновый рецептор; циклин B1; получаемый из нейробластомы гомолог вирусного онкогена миелоцитоматоза птиц v-myc (MYCN); член C семейства гомологов Ras (RhoC); относящийся к тирозиназе белок-2 (TRP-2); цитохром P450 1B1 (CYP1B1); подобный белкам цинковых пальцев CCCTC-связывающий фактор (BORIS или Brother of the Regulator of Imprinted Sites), антиген плоскоклеточной карциномы, распознаваемый T-клетками 3 (SART3); белок с парным боксом Pax-5 (PAX5); проакрозин-связывающий белок sp32 (OY-TES1); лимфоцит-специфическую протеинтирозинкиназу (LCK); заякоревающий киназу A белок-4 (AKAP-4); точку разрыва X при синовиальной саркоме 2 (SSX2); рецептор для конечных продуктов гликирования (RAGE-1); почечный убиквитарный белок-1 (RU1); почечный убиквитарный белок-2 (RU2); легумаин; вирус E6 папилломы человека (HPV E6); вирус E7 папилломы человека (HPV E7); кишечную карбоксилэстеразу; мутировавший белок теплового шока 70-2 (mut hsp70-2); CD79a; CD79b; CD72; лейкоцит-ассоциированный иммуноглобулин-подобный рецептор-1 (LAIR1); Fc-фрагмент рецептора IgA (FCAR или CD89); член 2 подсемейства A лейкоцитарных иммуноглобулин-подобных рецепторов (LILRA2); член f подобного молекуле CD300 семейства (CD300LF); член A семейства 12 лектиновых доменов C-типа (CLEC12A); антиген-2 стромальных клеток костного мозга (BST2); содержащий EGF-подобный модуль муцин-подобный подобный рецептору гормона белок-2 (EMR2); лимфоцитарный антиген-75 (LY75); глипикан-3 (GPC3); Fc-рецептор- подобный белок-5 (FCRL5); и иммуноглобулин лямбда-подобный полипептид-1 (IGLL1).
Антигенсвязывающий домен может представлять собой любой домен, который связывается с антигеном, и может включать, но без ограничения, моноклональное антитело, поликлональное антитело, синтетическое антитело, человеческое антитело, гуманизированное антитело, нечеловеческое антитело и любой их фрагмент. Таким образом, в одном варианте осуществления часть антигенсвязывающего домена содержит антитело млекопитающего или его фрагмент. В другом варианте осуществления антигенсвязывающий домен CAR выбирают из группы, состоящей из анти-CD19 антитела, анти-HER2 антитела и их фрагмента.
В некоторых случаях антигенсвязывающий домен происходит из того же вида, в котором CAR будет в конце концов использован. Например, для использования на людях антигенсвязывающий домен CAR содержит человеческое антитело, гуманизированное антитело или их фрагмент.
В некоторых аспектах настоящего изобретения антигенсвязывающий домен функционально связан с другим доменом CAR, таким как трансмембранный домен или внутриклеточный домен, для экспрессии в клетке. В одном варианте осуществления нуклеиновая кислота, кодирующая антигенсвязывающий домен, функционально связана с нуклеиновой кислотой, кодирующей трансмембранный домен, и нуклеиновой кислотой, кодирующей внутриклеточный домен.
Трансмембранный домен
По отношению к трансмембранному домену может быть сконструирован CAR, содержащий трансмембранный домен, который соединяет антигенсвязывающий домен CAR с внутриклеточным доменом. В одном варианте осуществления трансмембранный домен естественным образом ассоциирован с одним или более доменами в CAR. В некоторых случаях трансмембранный домен может быть выбран или модифицирован с помощью аминокислотной замены для предупреждения связывания таких доменов с трансмембранными доменами таких же или других поверхностных мембранных белков для минимизации взаимодействий с другими членами рецепторного комплекса.
Трансмембранный домен может происходить или из природного, или из рекомбинантного источника. Если источник является природным, домен может происходить от любого связанного с мембраной или трансмембранного белка. Трансмембранные области, особенно полезные в настоящем изобретении, могут происходить (т.е. содержать по меньшей мере трансмембранную область(и)) из альфа, бета или дзета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, толл-подобного рецептора-1 (TLR1), TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8 и TLR9. В некоторых случаях можно использовать различные человеческие шарниры, включая также шарнир человеческого Ig (иммуноглобулина).
В одном варианте осуществления трансмембранный домен может быть синтетическим, в случае чего он будет содержать преимущественно гидрофобные остатки, такие как лейцин и валин. Предпочтительно, на каждом конце синтетического трансмембранного домена может быть обнаружен триплет из фенилаланина, триптофана и валина.
Внутриклеточный домен
Внутриклеточный домен или иначе цитоплазматический домен CAR включает в себя аналогичный или такой же внутриклеточный домен, что и химерная внутриклеточная сигнальная молекула, описанная в ином месте в настоящем документе, и отвечает за активацию клетки, в которой экспрессируется CAR.
В одном варианте осуществления внутриклеточный домен CAR включает в себя домен, отвечающий за активацию и/или трансдукцию сигнала.
Примеры внутриклеточных сигнальных доменов для использования в настоящем изобретении включают, но без ограничения, цитоплазматическую часть поверхностного рецептора, костимулирующей молекулы и любой молекулы, которые совместно действуют для инициирования трансдукции сигнала в моноците, макрофаге или дентритной клетке, а также любое производное или вариант этих элементов и любую синтетическую последовательность, которая обладает такими же функциональными возможностями.
Примеры внутриклеточных доменов включают фрагмент или домен из одной или более молекул или рецепторов, включая, но без ограничения, TCR, CD3-дзета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD86, общую FcR-гамма, FcR-бета (Fc-эпсилон R1b), CD79a, CD79b, Fc-гамма RIIa, DAP10, DAP12, T-клеточный рецептор (TCR), CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, PD-1, ICOS, функционально-связанный антиген-1 лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, B7-H3, лиганд, который специфически связывается с CD83, CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD127, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, NKp44, NKp30, NKp46, NKG2D, толл-подобный рецептор 1 (TLR1), TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, другие костимулирующие молекулы, описанные в настоящем документе, любое их производное, вариант или фрагмент, любую синтетическую последовательность костимулирующей молекулы, которая обладает такими же функциональными возможностями, и любую их комбинацию.
В одном варианте осуществления внутриклеточный домен CAR содержит двойные сигнальные домены, такие как 41BB, CD28, ICOS, TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, бета-цепь рецептора CD116, CSF1-R, LRP1/CD91, SR-A1, SR-A2, MARCO, SR-CL1, SR-CL2, SR-C, SR-E, CR1, CR3, CR4, дектин-1, DEC-205, DC-SIGN, CD14, CD36, LOX-1, CD11b, вместе с любым из сигнальных доменов, перечисленных в приведенном выше абзаце, в любой комбинации. В другом варианте осуществления внутриклеточный домен CAR включает в себя любую часть из одной или более костимулирующих молекул, такую как по меньшей мере один сигнальный домен из CD3, гамма-цепь Fc-эпсилон RI, любое их производное или вариант, любую их синтетическую последовательность, которая обладает такими же функциональными возможностями, и любую их комбинацию.
Между антигенсвязывающим доменом и трансмембранным доменом CAR или между внутриклеточным доменом и трансмембранным доменом CAR может быть включен спейсерный домен. Как используется в настоящем документе, термин "спейсерный домен" в общем означает любой олиго- или полипептид, который выполняет функцию связывания трансмембранного домена или с антигенсвязывающим доменом, или с внутриклеточным доменом в полипептидной цепи. В одном варианте осуществления спейсерный домен может содержать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот и, наиболее предпочтительно, от 25 до 50 аминокислот. В другом варианте осуществления короткий олиго- или полипептидный линкер, предпочтительно длиной от 2 до 10 аминокислот, может образовывать связь между трансмембранным доменом и внутриклеточным доменом CAR. Пример линкера включает дублет глицин-серин.
Человеческие антитела
Предпочтительным при использовании антигенсвязывающего домена CAR является использование человеческих антител или их фрагментов. Полностью человеческие антитела являются особенно желательными для терапевтического лечения субъектов-людей. Человеческие антитела могут быть получены множеством способов, известных в данной области техники, включая способы фагового отображения с использованием библиотек антител, полученных из человеческих иммуноглобулиновых последовательностей, включая усовершенствования этих способов. Смотри также патенты США №№ 4444887 и 4716111; и публикации PCT WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741; которые включены в настоящий документ посредством ссылки во всей полноте.
Человеческие антитела можно также получать с использованием трансгенных мышей, которые не могут экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены человеческих иммуноглобулинов. Например, комплексы иммуноглобулиновых генов человеческих тяжелых и легких цепей могут быть введены случайным образом или с помощью гомологичной рекомбинации в мышиные эмбриональные стволовые клетки. В качестве альтернативы, человеческая вариабельная область, константная область и дополнительная область могут быть введены в мышиные эмбриональные стволовые клетки в добавление к генам человеческих тяжелых и легких цепей. Мышиные гены тяжелых и легких цепей иммуноглобулинов могут быть сделаны нефункциональными по отдельности или одновременно с введением человеческих иммуноглобулиновых локусов с помощью гомологичной рекомбинации. Например, было описано, что гомозиготная делеция гена соединяющей области (JH) тяжелой цепи антитела у химерных мышей с и гаметной мутацией приводит к полному ингибированию продукции эндогенных антител. Модифицированные эмбриональные стволовые клетки размножают и микроинъецируют в бластоцисты для получения химерных мышей. Затем химерных мышей скрещивают для получения гомозиготного потомства, которое экспрессирует человеческие антитела. Трансгенных мышей иммунизируют обычным образом выбранным антигеном, например целым полипептидом настоящего изобретения или его частью. Антитела, направленные на выбранную мишень, могут быть получены от иммунизированных трансгенных мышей с использованием обычной гибридомной технологии. Человеческие иммуноглобулиновые трансгены, несомые трансгенными мышами, перестраиваются во время дифференцировки B-клеток, а затем подвергаются переключению класса и соматической мутации. Таким образом, при использовании такого способа можно получать терапевтически полезные антитела IgG, IgA, IgM и IgE, включая, но без ограничения, IgG1 (гамма-1) и IgG3. Обзор данной технологии получения человеческих антител смотри в документе Lonberg and Huszar (Int. Rev. Immunol., 13:65-93 (1995)). Подробное рассмотрение данной технологии получения человеческих антител и человеческих моноклональных антител и протоколов получения таких антител смотри, например, в публикациях PCT №№ WO 98/24893, WO 96/34096 и WO 96/33735; и патентах США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; и 5939598, которые включены в настоящий документ посредством ссылки во всей полноте. Кроме того, для получения человеческих антител, направленных на выбранный антиген, с использованием технологии, аналогичной описанной выше, могут быть задействованы такие компании, как Abgenix, Inc. (Freemont, Calif.) и Genpharm (San Jose, Calif.). Для конкретного рассмотрения переноса множества генов человеческих гаметических иммуноглобулинов мышам с гаметной мутацией, который приводит к производству человеческих антител после антигенной пробы смотри, например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immunol., 7:33 (1993); и Duchosal et al., Nature, 355:258 (1992).
Человеческие антитела также могут быть получены из библиотек фагового отображения (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al., Nature Biotech., 14:309 (1996)). Технологию фагового отображения (McCafferty et al., Nature, 348:552-553 (1990)) можно использовать для получения человеческих антител и фрагментов антител in vitro из репертуаров генов иммуноглобулиновых вариабельных (V) доменов от неиммунизированных доноров. В соответствии с этим способом гены V-доменов антител клонируют внутри рамки считывания гена или главного, или минорного белка оболочки нитевидного бактериофага, такого как M13 или fd, и отображают как функциональные фрагменты антител на поверхности фаговой частицы. Поскольку нитевидная частица содержит однонитевую копию ДНК фагового генома, селекция на основании функциональных свойств антитела также приводит к селекции гена, кодирующего антитело, проявляющее эти свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговое отображение может быть выполнено в различных форматах; их обзор смотри, например, в документе Johnson, Kevin S, and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового отображения можно использовать несколько источников сегментов V-генов. Clackson et al., Nature, 352:624-628 (1991) выделили множество разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Может быть создан репертуар V-генов неиммунизированных людей-доноров, и могут быть выделены антитела к разнообразному множеству антигенов (включая собственные антигены) по существу в соответствии со способами, описанными в документах Marks et al., J. Mol. Biol., 222:581-597 (1991) или Griffith et al., EMBO J., 12:725-734 (1993). Смотри также патенты США №№ 5565332 и 5573905, которые включены в настоящий документ посредством ссылки во всей полноте.
Человеческие антитела также могут быть сгенерированы с помощью активированных in vitro B-клеток (смотри патенты США №№ 5567610 и 5229275, которые включены в настоящий документ посредством ссылки во всей полноте). Человеческие антитела также могут быть сгенерированы in vitro с использованием гибридомных методов, таких как, но без ограничения, описанные Roder et al. (Methods Enzymol., 121:140-167 (1986)).
Гуманизированные антитела
В качестве альтернативы, в некоторых вариантах осуществления нечеловеческое антитело может быть гуманизированным, причем конкретные последовательности или области антитела модифицированы для повышения сходства с антителом, естественно производимым в человеке. Например, в настоящем изобретении антитело или его фрагмент могут содержать нечеловеческий scFv млекопитающего. В одном варианте осуществления гуманизирована часть, соответствующая антигенсвязывающему домену.
Гуманизированное антитело может быть получено с использованием множества способов, известных в данной области техники, включая, но без ограничения, трансплантацию CDR (смотри, например, европейский патент № EP 239400; международную публикацию № WO 91/09967; и патенты США №№ 5225539, 5530101 и 5585089, которые включены в настоящий документ во всей полноте посредством ссылки), венирование или перекладку (смотри, например, европейские патенты №№ EP 592106 и EP 519596; документы Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering, 7(6):805-814; и Roguska et al., 1994, PNAS, 91:969-973, которые включены в настоящий документ во всей полноте посредством ссылки), перетасовку цепей (смотри, например, патент США № 5565332, который включен в настоящий документ во всей полноте посредством ссылки) и способы, раскрытые, например, в публикации патентной заявки США № US2005/0042664, публикации патентной заявки США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO 9317105, документах Tan et al., J. Immunol., 169:1119-25 (2002), Caldas et al., Protein Eng., 13(5):353-60 (2000), Morea et al., Methods, 20(3):267-79 (2000), Baca et al., J. Biol. Chem., 272(16):10678-84 (1997), Roguska et al., Protein Eng., 9(10):895-904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s-5977s (1995), Couto et al., Cancer Res., 55(8):1717-22 (1995), Sandhu J S, Gene, 150(2):409-10 (1994) и Pedersen et al., J. Mol. Biol., 235(3):959-73 (1994), которые включены в настоящий документ во всей полноте посредством ссылки. Часто каркасные остатки в каркасных областях заменяют соответствующим остатком из антитела-донора CDR для изменения, предпочтительно улучшения, связывания антигена. Эти каркасные замены идентифицируют посредством способов, хорошо известных в данной области техники, например посредством моделирования взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях. (Смотри, например, документы Queen et al., патент США № 5585089; и Riechmann et al., 1988, Nature, 332:323, которые включены в настоящий документ посредством ссылки во всей полноте.)
Гуманизированное антитело содержит один или более аминокислотных остатков, оставшихся в нем от источника, который является нечеловеческим. Эти нечеловеческие аминокислотные остатки часто называют "импортными" остатками, которые обычно берут из "импортного" вариабельного домена. Таким образом, гуманизированный антитела содержат одну или более CDR из нечеловеческих иммуноглобулиновых молекул и каркасных областей от человека. Гуманизация антител хорошо известна в данной области техники и может в основном быть выполнена в соответствии со способом Winter и сотр. (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)) посредством замены CDR грызуна или последовательностей CDR на соответствующие последовательности человеческого антитела, то есть трансплантации CDR (EP 239400; публикация PCT № WO 91/09967; и патенты США №№ 4816567; 6331415; 5225539; 5530101; 5585089; 6548640, содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте). В таких гуманизированных антителах по существу меньшая, чем интактный человеческий вариабельный домен, часть заменена соответствующей последовательностью из отличного от человека вида. На практике, гуманизированные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые каркасные (FR) остатки заменены остатками из аналогичных участков антител грызунов. Гуманизация антител также может быть получена посредством венирования или перекладки (EP 592106; EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., Protein Engineering, 7(6):805-814 (1994); и Roguska et al., PNAS, 91:969-973 (1994)) или перетасовки цепей (патент США № 5565332), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте.
Выбор человеческих вариабельных доменов, как легких, так и тяжелых, для использования в получении гуманизированных антител заключается в уменьшении антигенности. В соответствии с так называемым способом "наилучшего соответствия" последовательность вариабельного домена антитела грызуна подвергают скринингу по всей библиотеке известных человеческих последовательностей вариабельных доменов. Затем человеческую последовательность, которая является наиболее близкой к последовательности грызуна, принимают в качестве человеческого каркаса (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте). Другой способ использует конкретный каркас, происходящий от консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Тот же самый каркас может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых включено в настоящий документ посредством ссылки в настоящем документе во всей полноте).
Могут быть гуманизированы антитела, которые сохраняют высокую аффинность к антигену-мишени, и которые обладают другими полезными биологическими свойствами. В соответствии с одним аспектом настоящего изобретения гуманизированные антитела получают посредством способа анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и хорошо известны специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатных иммуноглобулиновых последовательностей. Исследование этих отображений позволяет проанализировать вероятную роль остатков в функционировании кандидатной иммуноглобулиновой последовательности, т.е. проанализировать остатки, которые влияют на способность кандидатного иммуноглобулина связываться с антигеном-мишенью. Таким образом, FR остатки могут быть выбраны и объединены из реципиентной и импортной последовательностей таким образом, что достигается желаемая характеристика антитела, такая как повышение аффинности к антигену-мишени. В общем случае, остатки CDR непосредственно и наиболее существенно участвуют в воздействии на связывание антигена.
Гуманизированное антитело сохраняет такую же антигенную специфичность, что и исходное антитело. Однако при использовании некоторых способов гуманизации аффинность и/или специфичность связывания антитела с антигеном-мишенью можно улучшить, используя способы "направленной эволюции", как описано в документе Wu et al., J. Mol. Biol., 294:151 (1999), содержание которого включено в настоящий документ посредством ссылки в настоящем документе во всей полноте.
Векторы
Вектор можно использовать для введения CAR в моноцит, макрофаг или дентритную клетку, как описано в ином месте в настоящем документе. В одном аспекте настоящее изобретение включает в себя вектор, содержащий последовательность нуклеиновой кислоты, кодирующую CAR, как описано в настоящем документе. В одном варианте осуществления вектор содержит плазмидный вектор, вирусный вектор, ретротранспозон (например, PiggyBack, Sleeping Beauty), сайт-направленный инсерционный вектор (например, CRISPR, нуклеазы с Zn пальцем, TALEN), или суицидный вектор экспрессии, или другой вектор, известный в данной области техники.
Все конструкции, упомянутые выше, способны к использованию с плазмидами лентивирусных векторов третьего поколения, другими вирусными векторами или РНК, одобренными для применения в человеческих клетках. В одном варианте осуществления вектор представляет собой вирусный вектор, такой как лентивирусный вектор. В другом варианте осуществления вектор представляет собой РНК-вектор.
The production of любой of the молекулы описанный в настоящем документе can be verified by sequencing. экспрессия of the full length белки may be verified с использованием immunoblot, immunohistochemistry, flow cytometry или другой технология хорошо известный и доступный в данной области техники.
Настоящее изобретение предлагает также вектор, в который вставлена ДНК настоящего изобретения. Векторы, включая полученные из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долгосрочного переноса генов, поскольку они обеспечивают продолжительную стабильную интеграцию трансгена и его распространение в дочерних клетках. Лентивирусные векторы имеют дополнительное преимущество над векторами, полученными из онкоретровирусов, таких как вирусы лейкоза мышей, заключающееся в том, что они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Кроме того, они имеют дополнительное преимущество, заключающееся в том, что они приводят к низкой иммуногенности у субъекта, которому их вводят.
Экспрессия природных или синтетических нуклеиновых кислот обычно достигается посредством функционального связывания нуклеиновой кислоты или ее частей с промотором и включения этой конструкции в вектор экспрессии. Вектор обычно способен к репликации в клетке млекопитающего и/или также способен к интеграции в клеточный геном млекопитающего. Типичные векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промоторы, подходящие для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Нуклеиновая кислота может быть клонирована в любое количество векторов различных типов. Например, нуклеиновая кислота может быть клонирована в вектор, включая, но без ограничения, плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы для создания зондов и векторы для секвенирования.
Вектор экспрессии может быть предоставлен клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области техники и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY, и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые подходят в качестве векторов, включают, но без ограничения, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В общем случае, подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, последовательность промотора, удобные сайты эндонуклеазной рестрикции и один или более селектируемых маркеров (например, WO 01/96584; WO 01/29058; и патент США № 6326193).
Дополнительные элементы промоторов, например энхансеры, регулируют частоту инициации транскрипции. Обычно они расположены в области 30-110 п.о. в обратном направлении от сайта начала, хотя недавно было показано, что ряд промоторов также содержат функциональные элементы в прямом направлении от сайта начала. Расстояние между элементами промоторов часто является гибким, так что функция промотора сохраняется, когда элементы инвертированы или перемещены друг относительно друга. В промоторе тимидинкиназы (tk) расстояние между элементами промоторов можно увеличивать до 50 п.о. друг от друга, пока активность не начнет снижаться. Оказывается, что в зависимости от промотора отдельные элементы могут функционировать для активации транскрипции или вместе, или независимо.
Примером промотора является последовательность немедленно-раннего промотора цитомегаловируса (CMV). Эта последовательность промотора представляет собой последовательность сильного конститутивного промотора, способного к управлению высокими уровнями экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако можно также использовать последовательности других конститутивных промоторов, включая, но без ограничения, ранний промотор вируса обезьян 40 (SV40), мышиный вирус опухоли молочной железы (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса птичьего лейкоза, немедленно-ранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, промотор фактора элонгации-1α, а также промоторы человеческих генов, такие как, но без ограничения, промотор актина, промотор миозина, промотор гемоглобина и промотор креатинкиназы. Кроме того, настоящее изобретение не должно быть ограничено использованием конститутивных промоторов. Индуцируемые промоторы также рассматриваются как часть настоящего изобретения. Использование индуцируемого промотора обеспечивает молекулярный переключатель, способный к включению экспрессии полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или к выключению экспрессии, когда экспрессия нежелательна. Примеры индуцируемых промоторов включают, но без ограничения, промотор металлотионеина, промотор глюкокортикоидов, промотор прогестерона и промотор тетрациклина.
Для того чтобы оценить экспрессию полипептида или его частей, вектор экспрессии, подлежащий введению в клетку, может также содержать или ген селектируемого маркера, или репортерный ген, или и тот, и другой для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которые пытались трансфицировать или инфицировать посредством вирусных векторов. В других аспектах селектируемый маркер может располагаться на отдельном фрагменте ДНК и использоваться в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы подходящими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Подходящие селектируемые маркеры включают, например, гены резистентности к антибиотикам, такие как neo и тому подобные.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональных свойств регуляторных последовательностей. В общем случае, репортерный ген представляет собой ген, который не присутствует или не экспрессируется реципиентными организмом или тканью, и который кодирует полипептид, экспрессия которого проявляется в некотором легко детектируемом свойстве, например ферментативной активности. Экспрессию репортерного гена анализируют в подходящий момент времени после того, как ДНК была введена в реципиентные клетки. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфеникол-ацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие системы экспрессии хорошо известны и могут быть приготовлены с использованием известных способов или получены коммерчески. В общем случае, в качестве промотора идентифицируют конструкцию с минимальной 5'-фланкирующей областью, демонстрирующую наивысший уровень экспрессии репортерного гена. Такие области промотора могут быть связаны с репортерным геном и могут использоваться для оценки средств в отношении способности к модулированию промотор-управляемой транскрипции.
Введение нуклеиновых кислот
В одном аспекте настоящее изобретение включает в себя способ модификации клетки, содержащий введение химерного антигенного рецептора (CAR) в моноцит, макрофаг или дентритную клетку, причем CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен костимулирующей молекулы, и причем клетка представляет собой моноцит, макрофаг или дентритную клетку, которые экспрессируют CAR и обладают направленной эффекторной активностью. В одном варианте осуществления, введение CAR в клетку содержит введение кодирующей CAR последовательности нуклеиновой кислоты. В другом варианте осуществления введение последовательности нуклеиновой кислоты содержит электропорацию кодирующей CAR мРНК.
В данной области техники известны способы введения и экспрессии генов, таких как CAR, в клетку. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяина, например клетку млекопитающего, бактериальную, дрожжевую клетку или клетку насекомого, с помощью любого способа данной области техники. Например, вектор экспрессии может быть перенесен в клетку-хозяина с помощью физических, химических или биологических средств.
Физические способы введения полинуклеотида в клетку-хозяина включают преципитацию фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области техники. Смотри, например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY. Нуклеиновые кислоты могут быть введены в клетки-мишени с использованием коммерчески доступных способов, которые включают электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Германия)), (ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg, Германия). Нуклеиновые кислоты также могут быть введены в клетки с использованием опосредованной катионными липосомами трансфекции с использованием липофекции, с использованием полимерной инкапсуляции, с использованием опосредованной пептидами трансфекции или с использованием систем биолистической доставки частиц, таких как "генные пушки" (смотри, например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Биологические способы введения полинуклеотида, представляющего интерес, в клетку-хозяина включают использование ДНК- и РНК-векторов. РНК-векторы включают векторы, имеющие РНК-промотор и/или другие подходящие домены для производства транскрипта РНК. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым способом введения генов в клетки млекопитающего, например в человеческие. Другие вирусные векторы могут происходить от лентивируса, поксвирусов, вируса простого герпеса, аденовирусов и аденоассоциированных вирусов и т.п. Смотри, например, патенты США №№ 5350674 и 5585362.
Химические средства введения полинуклеотида в клетку-хозяина включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для использования в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула).
В случае, если используют невирусную систему доставки, типичным носителем для доставки является липосома. Предусмотрено использование липидных композиций для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водном внутреннем пространстве липосомы, рассеяна в липидном бислое липосомы, прикреплена к липосоме с помощью связывающей молекулы, которая связана как с липосомой, так и с олигонуклеотидом, захвачена в липосому, связана в комплекс с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, объединена с липидом, может содержаться в виде суспензии в липиде, содержаться в мицелле или образовывать с ней комплекс или быть иначе связана с липидом. Соответствующие композиции липида, липида/ДНК или липида/вектора экспрессии не ограничены какой-либо конкретной структурой в растворе. Например, они могут присутствовать в структуре бислоя, в виде мицелл или со "схлопнувшейся" структурой. Они также могут просто быть рассеяны в растворе, возможно образуя агрегаты, которые не являются однородными по размеру и форме. Липиды представляют собой жирные вещества, которые могут представлять собой природные или синтетические липиды. Например, липиды включают жирные капли, которые естественным образом возникают в цитоплазме, а также класс соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Липиды, подходящие для использования, могут быть получены из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") может быть получен от Sigma, St. Louis, MO; дицетилфосфат ("DCP") может быть получен от K & K Laboratories (Plainview, NY); холестерин ("Choi") может быть получен от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды могут быть получены от Avanti Polar Lipids, Inc. (Birmingham, AL). Маточные растворы липидов в хлороформе или смеси хлороформ/метанол можно хранить при приблизительно -20°C. Хлороформ используют в качестве единственного растворителя, так как он легче испаряется, чем метанол. "Липосома" является общим термином, охватывающим множество одно- и многослойных липидных носителей, образуемых посредством создания замкнутых липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы содержат множество липидных слоев, разделенных водной средой. Они образуются спонтанно при суспендировании фосфолипидов в избытке водного раствора. Липидные компоненты претерпевают само-перегруппировку до образования замкнутых структур и захватывают воду и растворенные вещества между липидными бислоями (Ghosh et al., 1991 Glycobiology 5: 505-10). При этом также охватываются композиции, которые имеют в растворе другие структуры, чем нормальная везикулярная структура. Например, липиды могут принимать мицеллярную структуру или просто существовать в виде неоднородных агрегатов липидных молекул. Также рассматриваются комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия молекул, описанных в настоящем документе, на клетку, для того чтобы подтвердить присутствие нуклеиновых кислот в клетке-хозяине, может быть осуществлено множество анализов. Такие анализы включают, например, "молекулярные биологические" анализы, хорошо известные специалистам в данной области техники, такие как Саузерн- и нозерн-блоттинг, ПЦР-РВ и ПЦР; "биохимические" анализы, такие как детектирование присутствия или отсутствия конкретного пептида, например с помощью иммунологических средств (ELISA и вестерн-блоттинги) или посредством анализов, описанных в настоящем документе, для идентификации средств, попадающих в пределы объема настоящего изобретения.
В одном варианте осуществления одну или более из последовательностей нуклеиновой кислоты вводят с помощью способа, выбранного из группы, состоящей из трансдукции популяции клеток, трансфекции популяции клеток и электропорации популяции клеток. В одном варианте осуществления популяция клеток содержит одну или более из последовательностей нуклеиновой кислоты, описанных в настоящем документе.
В одном варианте осуществления нуклеиновые кислоты, введенные в клетку, представляют собой РНК. В другом варианте осуществления РНК представляет собой мРНК, которая содержит in vitro транскрибируемую РНК или синтетическую РНК. РНК получают посредством in vitro транскрипции с использованием генерируемой полимеразной цепной реакцией (ПЦР) матрицы. Представляющая интерес ДНК из любого источника может быть непосредственно превращена посредством ПЦР в матрицу для in vitro синтеза мРНК с использованием подходящих праймеров и РНК-полимеразы. Источник ДНК может представлять собой, например, геномную ДНК, плазмидную ДНК, фаговую ДНК, кДНК, синтетическую последовательность ДНК или любой другой подходящий источник ДНК. Желаемой матрицей для in vitro транскрипции является CAR.
ПЦР можно использовать для создания матрицы для in vitro транскрипции мРНК, которую затем вводят в клетки. Способы осуществления ПЦР хорошо известны в данной области техники. Праймеры для использования в ПЦР конструируют так, чтобы они имели области, которые по существу комплементарны областям ДНК, подлежащей использованию в качестве матрицы для ПЦР. "По существу комплементарный", как используется в настоящем документе, относится к последовательностям нуклеотидов, в которых большинство или все из оснований в последовательности праймеров комплементарны, или одно или более оснований некомплементарны или не совпадают. По существу комплементарные последовательности способны к отжигу или гибридизации с предполагаемой ДНК-мишенью при условиях отжига, используемых для ПЦР. Праймеры могут быть сконструированы так, чтобы они были по существу комплементарны любой части матрицы ДНК. Например, праймеры могут быть сконструированы для амплификации части гена, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-НТО. Праймеры также могут быть сконструированы для амплификации части гена, которая кодирует конкретный домен, представляющий интерес. В одном варианте осуществления праймеры конструируют для амплификации кодирующей области человеческой кДНК, включая полностью или частично 5'- и 3'-НТО. Праймеры, подходящие для ПЦР, генерируют с помощью синтетических способов, которые хорошо известны в данной области техники. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны нуклеотидам на матрице ДНК, которые расположены в обратном направлении от последовательности ДНК, которая должна быть амплифицирована. "В обратном направлении" используют в настоящем документе для обозначения локализации 5' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны двухнитевой матрице ДНК, которая расположена в прямом направлении от последовательности ДНК, которая должна быть амплифицирована. "В прямом направлении" используют в настоящем документе для обозначения локализации 3' по отношению к последовательности ДНК, подлежащей амплификации, относительно кодирующей нити.
Также можно использовать химические структуры, которые обладают способностью обеспечения стабильности и/или эффективности трансляции РНК. РНК, предпочтительно, содержит 5'- и 3'-НТО. В одном варианте осуществления 5'-НТО имеет длину между нулем и 3000 нуклеотидов. Длину последовательностей 5'- и 3'-НТО, подлежащих присоединению к кодирующей области, можно изменять различными способами, включая, но без ограничения, конструирование праймеров для ПЦР, которые отжигаются на различных областях НТО. Используя этот подход, средний специалист в данной области техники может модифицировать длины 5'- и 3'-НТО, требуемые для достижения оптимальной эффективности трансляции после трансфекции транскрибируемой РНК.
5'- и 3'-НТО могут представлять собой природные эндогенные 5'- и 3'-НТО для представляющего интерес гена. В качестве альтернативы, последовательности НТО, которые являются не эндогенными для представляющего интерес гена, могут быть присоединены посредством включения последовательностей НТО в прямые и обратные праймеры или посредством любых других модификаций матрицы. Использование последовательностей НТО, которые являются не эндогенными для представляющего интерес гена, может подходить для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в последовательностях 3'-НТО могут уменьшать стабильность мРНК. Поэтому, 3'-НТО могут быть выбраны или сконструированы для увеличения стабильности транскрибируемой РНК на основании свойств НТО, которые хорошо известны в данной области техники.
В одном варианте осуществления 5'-НТО может содержать последовательность Козак эндогенного гена. В качестве альтернативы, когда 5'-НТО, которая является не эндогенной для представляющего интерес гена, добавляют посредством ПЦР, как описано выше, консенсусная последовательность Козак может быть повторно сконструирована посредством присоединения последовательности 5'-НТО. Последовательности Козак могут увеличивать эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не являются необходимыми для всех РНК для обеспечения эффективной трансляции. В данной области техники известна необходимость в последовательностях Козак для многих мРНК. В других вариантах осуществления 5'-НТО может происходить от РНК-вируса, РНК-геном которого стабилен в клетках. В других вариантах осуществления можно использовать различные аналоги нуклеотидов в 3'- или 5'-НТО для препятствования экзонуклеазной деградации мРНК.
Для обеспечения синтеза РНК из матрицы ДНК без необходимости в клонировании генов, к матрице ДНК в обратном направлении по отношению к подлежащей транскрипции последовательности должен быть прикреплен промотор транскрипции. Когда последовательность, которая функционирует в качестве промотора для РНК-полимеразы, присоединяют к 5'-концу прямого праймера, промотор РНК-полимеразы становится включенным в продукт ПЦР в обратном направлении от открытой рамки считывания, которая подлежит транскрипции. В одном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в другом месте в настоящем документе. Другие подходящие промоторы включают, но без ограничения, промоторы РНК-полимераз T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в данной области техники.
В одном варианте осуществления мРНК имеет как кэп на 5'-конце, так и 3'-поли(A)-хвост, что определяет связывание рибосомы, инициацию трансляции и стабильность мРНК в клетке. На кольцевой матрице ДНК, например плазмидной ДНК, РНК-полимераза производит длинный конкатемерный продукт, который не подходит для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной с конца 3'-НТО, приводит к мРНК нормального размера, которая не эффективна в эукариотической трансфекции, даже если ее полиаденилировать после транскрипции.
На линейной матрице ДНК РНК-полимераза фага T7 может удлинять 3'-конец трнаскрипта за пределами последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
Обычным способом интеграции поли-A/T-удлинений в матрицу ДНК является молекулярное клонирование. Однако поли-A/T-последовательность, интегрированная в плазмидную ДНК, может вызывать нестабильность плазмиды, и поэтому плазмидные матрицы ДНК, полученные из бактериальных клеток, часто сильно загрязнены делециями и другими аберрациями. Это делает процедуры клонирования не только трудоемкими и требующими времени, но часто и не надежными. Поэтому очень желателен способ, который позволит конструировать матрицы ДНК с поли-A/T-3'-удлинением без клонирования.
Поли-A/T-сегмент транскрипционной матрицы ДНК может быть получен во время ПЦР посредством использования обратного праймера, содержащего поли-T-хвост, такой как 100T-хвост (размер может составлять 50-5000 T), или после ПЦР посредством любого другого способа, включая, но без ограничения, лигирование ДНК или in vitro рекомбинацию. Поли(A)-хвосты также обеспечивают стабильность РНК и уменьшают ее деградацию. Обычно длина поли(A)-хвоста положительно коррелирует со стабильностью транскрибируемой РНК. В одном варианте осуществления поли(A)-хвост составляет от 100 до 5000 аденозинов.
Поли(A)-хвосты РНК могут быть дополнительно удлинены после in vitro транскрипции с использованием поли(A)-полимеразы, такой как поли-A-полимераза E. coli (E-PAP). В одном варианте осуществления увеличение длины поли(A)-хвоста от 100 нуклеотидов до 300-400 нуклеотидов приводит к приблизительно двукратному повышению эффективности трансляции РНК. Кроме того, стабильность мРНК может увеличивать присоединение различных химических групп к 3'-концу. Такое присоединение может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, с использованием поли(A)-полимеразы можно вводить в поли(A)-хвост аналоги АТФ. Аналоги АТФ могут дополнительно увеличивать стабильность РНК.
5'-кэпы также придают стабильность молекулам РНК. В предпочтительном варианте осуществления РНК, получаемые посредством способов, раскрытых в настоящем документе, включают в себя 5'-кэп. 5'-кэп обеспечивают с использованием способов, известных в данной области техники и описанных в настоящем документе (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., РНК, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, получаемые посредством способов, раскрытых в настоящем документе, могут также содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственно сконструированную последовательность, которая инициирует кэп-независимое связывание рибосомы с мРНК и облегчает инициацию трансляции. Могут быть включены любые растворенные вещества, подходящие для электропорации клеток, которые могут содержать факторы, облегчающие клеточную проницаемость и жизнеспособность, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
В литературе известны некоторые транскрибируемые in vitro РНК (IVT-РНК) векторы, которые используют стандартным образом в качестве матрицы для in vitro транскрипции, и которые генетически модифицируют таким образом, что получают стабилизированные транскрипты РНК. Протоколы, используемые в настоящее время в данной области техники, основаны на плазмидном векторе со следующей структурой: 5' промотор РНК-полимеразы, обеспечивающий транскрипцию РНК, затем представляющий интерес ген, который фланкирован 3' и/или 5' нетранслируемыми областями (НТО), и кассета 3'-полиаденилирования, содержащая 50-70 нуклеотидов A. До начала транскрипции in vitro круговую плазмиду линеаризуют ниже кассеты полиаденилирования ферментами рестрикции типа II (последовательность распознавания соответствует сайту расщепления). Таким образом, кассета полиаденилирования соответствует в дальнейшем поли(A)-последовательности в транскрипте. В результате этой процедуры некоторые нуклеотиды остаются в качестве части сайта расщепления фермента после линеаризации и расширяют или маскируют поли(A)-последовательность на 3'-конце. Не ясно, влияет ли этот нефизиологический выступ на количество белка, получаемое внутриклеточно от такой конструкции.
В одном аспекте конструкцию РНК доставляют в клетки с помощью электропорации. Смотри, например, композиции и способы электропорации конструкций нуклеиновой кислоты в клетки млекопитающего, изложенные в US 2004/0014645, US 2005/0052630A1, US 2005/0070841A1, US 2004/0059285A1, US 2004/0092907A1. Различные параметры, включая напряженность электрического поля, требующуюся для электропорации клеток любого известного типа, в общем известны из соответствующей научной литературы, а также многочисленных патентов и заявок в данной области. Смотри, например, патент США № 6678556, патент США № 7171264 и патент США № 7173116. Аппараты для терапевтического применения электропорации доступны коммерчески, например MedPulser™ DNA Electroporation Therapy System (Inovio/Genetronics, San Diego, Calif.), и описаны в таких патентах, как патент США № 6567694; патент США № 6516223, патент США № 5993434, патент США № 6181964, патент США № 6241701 и патент США № 6233482; электропорацию также можно использовать для трансфекции клеток in vitro, как описано, например, в US20070128708A1. Электропорацию также можно использовать для доставки нуклеиновых кислот в клетки in vitro. Соответственно, опосредованное электропорацией введение в клетки нуклеиновых кислот, включая экспрессионные конструкции, с использованием любого из множества доступных устройств и систем электропорации, известных специалистам в данной области техники, представляет собой перспективное новое средство для доставки представляющей интерес РНК в клетку-мишень.
Источники клеток
В одном варианте осуществления в композициях и способах, описанных в настоящем документе, используют фагоцитарные клетки. Источник фагоцитарных клеток, таких как моноциты, макрофаги и/или дентритные клетки, получают от субъекта. Неограничивающие примеры субъектов включают людей, собак, кошек, мышей, крыс и их трансгенные виды. Предпочтительно, субъект является человеком. Клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, ткань селезенки, пуповину и опухоли. В некоторых вариантах осуществления можно использовать любое количество клеточных линий моноцитов, макрофагов, дентритных клеток или предшественников, доступных в данной области техники. В некоторых вариантах осуществления клетки могут быть получены из единицы крови, отобранной у субъекта, с использованием любого количества способов, известных специалисту, таких как разделение с помощью фиколла. В одном варианте осуществления клетки из циркулирующей крови индивидуума получают посредством афереза или лейкафереза. Продукт афереза обычно содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие белые кровяные клетки, красные кровяные клетки и тромбоциты. Клетки, отобранные посредством афереза, могут быть промыты для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду, например в фосфатно-солевой буфер (ФСБ), или в раствор для промывания, в котором отсутствует кальций, и может отсутствовать магний, или могут отсутствовать многие, если не все, двухвалентные катионы, для последующих этапов обработки. После промывания клетки могут быть ресуспендированы во множестве биосовместимых буферов, таких как, например, свободный от Ca, свободный от Mg ФСБ. В качестве альтернативы, нежелательные компоненты образца афереза могут быть удалены, а клетки непосредственно ресуспендированы в культуральной среде.
В другом варианте осуществления клетки выделяют из периферической крови посредством лизирования красных кровяных клеток и истощения лимфоцитов и красных кровяных клеток, например посредством центрифугирования в градиенте PERCOLL™. В качестве альтернативы, клетки могут быть выделены из пуповины. В любом случае, определенная субпопуляция моноцитов, макрофагов и/или дентритных клеток может быть затем выделена посредством способов положительной или отрицательной селекции.
Выделенные таким образом мононуклеарные клетки могут быть истощены по клеткам, экспрессирующим определенные антигены, включая, но без ограничения, CD34, CD3, CD4, CD8, CD14, CD19 или CD20. Истощение этих клеток может быть осуществлено с использованием выделенного антитела, биологического образца, содержащего антитело, такого как асцитная жидкость, антитела, связанного с физической подложкой, и связанного с клеткой антитела.
Обогащение популяции моноцитов, макрофагов и/или дентритных клеток посредством отрицательной селекции может быть выполнено с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектируемых клеток. Предпочтительным способом является клеточная сортировка и/или селекция посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, которая использует коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на отрицательно селектируемых клетках. Например, обогащение клеточной популяции моноцитами, макрофагами и/или дентритными клетками посредством отрицательной селекции может быть выполнено с использованием коктейля моноклональных антител, который обычно включает в себя антитела к CD34, CD3, CD4, CD8, CD14, CD19 или CD20.
Во время выделения желаемой популяции клеток путем положительной или отрицательной селекции можно варьировать концентрацию клеток и поверхности (например, частиц, таких как гранулы). В некоторых вариантах осуществления может быть желательным значительное уменьшение объема, в котором смешаны вместе гранулы и клетки (т.е. увеличение концентрации клеток), для обеспечения максимального контакта клеток и гранул. Например, в одном варианте осуществления используют концентрацию, составляющую 2 миллиарда клеток на мл. В одном варианте осуществления используют концентрацию, составляющую 1 миллиард клеток на мл в другом варианте осуществления, используют больше чем 100 миллионов клеток на мл. В другом варианте осуществления используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток на мл. В еще одном варианте осуществления используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток на мл. В других вариантах осуществления можно использовать концентрации, составляющие 125 или 150 миллионов клеток на мл. Использование высоких концентраций клеток может приводить к увеличению выхода клеток, активации клеток и размножения клеток.
В одном варианте осуществления популяция клеток содержит моноциты, макрофаги или дентритные клетки настоящего изобретения. Примеры популяций клеток включают, но без ограничения, мононуклеарные клетки периферической крови, клетки пуповинной крови, очищенную популяцию моноцитов, макрофагов или дентритных клеток и клеточную линию. В другом варианте осуществления мононуклеарные клетки периферической крови содержат популяцию моноцитов, макрофагов или дентритных клеток. В еще одном варианте осуществления очищенные клетки содержат популяцию моноцитов, макрофагов или дентритных клеток.
В другом варианте осуществления клетки имеют повышенно отрегулированные маркеры M1 и пониженно отрегулированные маркеры M2. Например, в фагоцитарной клетке повышенно отрегулирован по меньшей мере один маркер M1, такой как HLA DR, CD86, CD80 и PDL1. В другом примере, в фагоцитарной клетке пониженно отрегулирован по меньшей мере один маркер M2, такой как CD206, CD163. В одном варианте осуществления клетка имеет по меньшей мере один повышенно отрегулированный маркер M1 и по меньшей мере один пониженно отрегулированный маркер M2.
В еще одном варианте осуществления направленная эффекторная активность в фагоцитарной клетке усилена путем ингибирования активность или CD47, или SIRPα. Активность CD47 и/или SIRPα можно ингибировать с помощью обработки фагоцитарной клетки анти-CD47 или анти-SIRPα антителом. В качестве альтернативы, активность CD47 или SIRPα may be inhibited by любой способ известный to those skilled в данной области техники.
Размножение клеток
В одном варианте осуществления клетки или популяцию клеток, содержащую моноциты, макрофаги или дентритные клетки, культивируют для размножения. В другом варианте осуществления клетки или популяцию клеток, содержащую клетки-предшественники, культивируют для дифференцировки и размножения моноцитов, макрофагов или дентритных клеток. Настоящее изобретение включает в себя размножение популяции моноцитов, макрофагов или дентритных клеток, содержащих химерный антигенный рецептор, как описано в настоящем документе.
Как показывают данные, раскрытые в настоящем документе, размножение клеток с помощью способов, раскрытых в настоящем документе, может приводить к умножению приблизительно в 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 200 раз, 300 раз, 400 раз, 500 раз, 600 раз, 700 раз, 800 раз, 900 раз, 1000 раз, 2000 раз, 3000 раз, 4000 раз, 5000 раз, 6000 раз, 7000 раз, 8000 раз, 9000 раз, 10000 раз, 100000 раз, 1000000 раз, 10000000 раз или больше, и в любое без исключения целое или дробное число раз между ними. В одном варианте осуществления клетки размножаются в диапазоне от приблизительно 20 раз до приблизительно 50 раз.
После культивирования клетки могут быть инкубированы в клеточной среде в аппарате для культивирования в течение некоторого периода времени или до тех пор, пока клетки не достигнут конфлюэнтности или высокой плотности клеток для оптимального пассажа до переноса клеток в другой аппарат для культивирования. Аппарат для культивирования может представлять собой любой аппарат для культивирования, обычно используемый для культивирования клеток in vitro. Предпочтительно, уровень конфлюэнтности перед переносом клеток в другой аппарат для культивирования составляет 70% или больше. Более предпочтительно, уровень конфлюэнтности составляет 90% или больше. Период времени может представлять собой любой отрезок времени, подходящий для культивирования клеток in vitro. Культуральная среда может быть заменена во время культивирования клеток в любое время. Предпочтительно, культуральную среду заменяют приблизительно каждые 2-3 дня. Затем клетки собирают из аппарата для культивирования, после чего клетки можно использовать немедленно или хранить для последующего использования.
Этап культивирования, как описано в настоящем документе, (контакт со средствами, как описано в настоящем документе) может быть очень коротким, например меньше 24 часов, в том числе 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 часа. Этап культивирования, как описано в настоящем документе ниже (контакт со средствами, как описано в настоящем документе) может быть более продолжительным, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более дней.
В одном варианте осуществления клетки можно культивировать в течение от нескольких часов (приблизительно 3 часов) до приблизительно 14 дней или в течение любого целочисленного количества часов в этом диапазоне. Условия, подходящие для культивирования клеток, включают подходящие среды (например, полная среда для макрофагов, DMEM/F12, DMEM/F12-10 (Invitrogen)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью или человеческую сыворотку), L-глутамин, инсулин, M-CSF, GM-CSF, IL-10, IL-12, IL-15, TGF-бета и TNF-α или любые другие добавки для роста клеток, известные специалисту в данной области техники. Другие добавки для роста клеток включают, но без ограничения, поверхностно-активное вещество, плазманат и восстанавливающие средства, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer с добавлением аминокислот, пирувата натрия и витаминов, или без сыворотки, или дополненные подходящим количеством сыворотки (или плазмы), или определенным набором гормонов, и/или количеством цитокина(ов), достаточным для роста и размножения клеток. Антибиотики, например пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения субъекту. Клетки-мишени сохраняют в условиях, необходимых для поддержания роста, например при подходящих температуре (например, 37° C) и атмосфере (например, воздух плюс 5% CO2).
Среда, используемая для культивирования клеток, может включать в себя средство, которое может активировать клетки. Например, в культуральную среду включают средство, о котором известно в данной области техники, что оно активирует моноцит, макрофаг или дентритную клетку.
Терапия
Модифицированные клетки, описанные в настоящем документе, могут быть включены в композицию для лечения субъекта. В одном аспекте композиция содержит модифицированную клетку, содержащую химерный антигенный рецептор, описанный в настоящем документе. Композиция может включать в себя фармацевтическую композицию, а также включать в себя фармацевтически приемлемый носитель. Может быть введено терапевтически эффективное количество фармацевтической композиции, содержащей модифицированные клетки.
В одном аспекте настоящее изобретение включает в себя способ лечения заболевания или состояния, ассоциированного с опухолью или раком, у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе. В другом аспекте настоящее изобретение включает в себя способ лечения солидной опухоли у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе. В другом аспекте настоящее изобретение включает в себя способ стимулирования иммунного ответа на целевую опухолевую клетку или опухолевую ткань у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей модифицированную клетку, описанную в настоящем документе. В еще одном аспекте настоящее изобретение включает в себя применение модифицированной клетки, описанной в настоящем документе, в производстве лекарственного средства для лечения иммунного ответа у нуждающегося в этом субъекта. В еще одном аспекте настоящее изобретение включает в себя применение модифицированной клетки, описанной в настоящем документе, в производстве лекарственного средства для лечения опухоли или рака у нуждающегося в этом субъекта.
Модифицированные клетки, сгенерированные, как описано в настоящем документе, обладают направленной эффекторной активностью. В одном варианте осуществления модифицированные клетки имеют направленную эффекторную активность, направленную на антиген на клетке-мишени, например с помощью специфического связывания с антигенсвязывающим доменом CAR. В другом варианте осуществления направленная эффекторная активность включает, но без ограничения, фагоцитоз, направленную клеточную цитотоксичность, презентацию антигена и секрецию цитокинов.
В другом варианте осуществления модифицированная клетка, описанная в настоящем документе, обладает способностью к доставке средства, биологического средства или терапевтического средства к мишени. Клетка может быть модифицирована или сконструирована для доставки средства к мишени, причем средство выбирают из группы, состоящей из нуклеиновой кислоты, антибиотика, противовоспалительного средства, антитела или его фрагментов антитела, фактора роста, цитокина, фермента, белка, пептида, белка слияния, синтетической молекулы, органической молекулы, углевода и т.п., липида, гормона, микросомы, их производного или варианта и любой их комбинации. В качестве неограничивающего примера, макрофаг, модифицированный с помощью CAR, который направлен на опухолевый антиген, способен секретировать средство, такое как цитокин или антитело, способствующее функции макрофага. Антитела, такие как анти-CD47/анти-SIRPα mAB, могут также способствовать функции макрофага. В еще одном примере, макрофаг, модифицированный с помощью CAR, который направлен на опухолевый антиген, сконструирован для кодирования миРНК, которая способствует функции макрофага путем понижающей регуляции ингибирующих генов (т.е. SIRPα). В другом примере, макрофаг с CAR сконструирован для экспрессии доминантно-негативного (или с иной мутацией) варианта рецептора или фермента, который способствует функции макрофага.
В одном варианте осуществления макрофаг модифицирован с помощью нескольких генов, причем по меньшей мере один ген включает в себя CAR, и по меньшей мере один другой ген содержит генетический элемент, который усиливает функцию макрофага с CAR. В другом варианте осуществления макрофаг модифицирован с помощью нескольких генов, причем по меньшей мере один ген включает в себя CAR, и по меньшей мере один другой ген способствует или перепрограммирует функцию других иммунных клеток (таких как T-клетки в микроокружении опухоли).
Кроме того, модифицированные клетки могут быть введены в животное, предпочтительно в млекопитающее, даже более предпочтительно в человека, для подавления иммунной реакции, в том числе реакций, общих для аутоиммунных заболеваний, таких как диабет, псориаз, ревматоидный артрит, множественный склероз, РТПХ, усиливающих индукцию толерантности к аллотрансплантату, отторжение трансплантата и т.п. Кроме того, клетки настоящего изобретения можно использовать для лечения любого состояния, при котором для лечения или облегчения заболевания желательно ослабление или иное ингибирование иммунного ответа, особенно опосредованного клетками иммунного ответа. В одном аспекте настоящее изобретение включает в себя лечение состояния, такого как аутоиммунное заболевание, у субъекта, содержащее введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей популяцию клеток, описанных в настоящем документе. Кроме того, клетки настоящего изобретения можно вводить в качестве предварительного лечения или кондиционирования до начала лечения с помощью альтернативной противораковой иммунотерапии, включая, но без ограничения, T-клетки с CAR, проникающие в опухоль лимфоциты или ингибиторы контрольных точек.
Примеры аутоиммунных заболеваний включают, но без ограничения, синдром приобретенного иммунодефицита (СПИД, который представляет собой вирусное заболевание с аутоиммунным компонентом), гнездную алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха (AIED), аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунную тромбоцитопеническую пурпуру (ATP), болезнь Бехчета, кардиомиопатию, целиакию спру, герпетиформный дерматит; синдром хронической усталости и иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полинейропатию (CIPD), рубцовый пемфигоид, болезнь холодовых агглютининов, CREST-синдром, болезнь Крона, болезнь Дегоса, ювенильный дерматомиозит, дискоидную волчанку, первичную криоглобулинемию смешанного типа, фибромиалгию, фибромиозит, болезнь Грейвса, синдром Гийена-Барра, тиреоидит Хашимото, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA-нефропатию, инсулинзависимый сахарный диабет, ювенильный хронический артрит (болезнь Стилла), ювенильный ревматоидный артрит, болезнь Меньера, смешанное заболевание соединительной ткани, множественный склероз, миастению гравис, пернициозную анемию, узелковый полиартериит, полихондрит, полигландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматическую лихорадку, ревматоидный артрит, саркоидоз, склеродермию (прогрессирующий системный склероз (PSS), также известный как системный склероз (SS)), синдром Шегрена, синдром мышечной скованности, системную красную волчанку, артериит Такаясу, темпоральный артериит/гигантоклеточный артериит, язвенный колит, увеит, витилиго и гранулематоз Вегенера.
Клетки также можно использовать для лечения воспалительных нарушений. Примеры воспалительных нарушений включают в себя, но без ограничения, хронические и острые воспалительные нарушения. Примеры воспалительных нарушений включают болезнь Альцгеймера, астму, атопическую аллергию, аллергию, атеросклероз, бронхиальную астму, экзему, гломерулонефрит, реакцию трансплантат против хозяина, гемолитическую анемию, остеоартрит, сепсис, инсульт, трансплантацию ткани и органов, васкулит, диабетическую ретинопатию и вентилятор-индуцированное повреждение легких.
Клетки настоящего изобретения можно использовать для лечения рака. Раки включают опухоли, которые не васкуляризированы или еще по существу не васкуляризированы, а также васкуляризированные опухоли. Раки могут включать несолидные опухоли (такие как гематологические опухоли, например, лейкозы и лимфомы) или могут включать солидные опухоли. Типы рака, подвергаемые лечению с помощью клеток настоящего изобретения, включают, но без ограничения, карциному, бластому и саркому и некоторые лейкозы или лимфоидные злокачественные образования, доброкачественные и злокачественные опухоли и злокачественные образования, например саркомы, карциномы и меланомы. Также включены опухоли/раки взрослых и педиатрические опухоли/раки.
Солидные опухоли представляют собой аномальные массы ткани, которые обычно не содержат цист или жидких участков. Солидные опухоли могут быть доброкачественными или злокачественными. Различные типы солидных опухолей названы по типу клеток, которые их образуют (такое как саркомы, карциномы и лимфомы). Примеры солидных опухолей, таких как саркомы и карциномы, включают фибросаркому, миксосаркому, липосаркому, хондросаркому, остеосаркому и другие саркомы, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, лимфоидное злокачественное образование, рак поджелудочной железы, рак молочной железы, раки легких, рак яичника, рак предстательной железы, гепатоклеточную карциному, плоскоклеточную карциному, базально-клеточную карциному, аденокарциному, карциному потовой железы, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, феохромоцитому, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому, карциному желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, опухоль яичка, семиному, карциному мочевого пузыря, меланому и опухоли ЦНС (такие как глиомы (такие как глиома ствола головного мозга и смешанные глиомы), глиобластома (также известная как мультиформная глиобластома), астроцитома, лимфома ЦНС, герминома, медуллобластома, шваннома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, акустическая неврома, олигодендроглиома, менингиома, нейробластома, ретинобластома и метастазы в головном мозге).
Гематологические раки представляют собой раки крови или костного мозга. Примеры гематологических (или гематогенных) раков включают лейкозы, включая острые лейкозы (такие как острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелогенный лейкоз и миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз), хронические лейкозы (такие как хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз и хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому, болезнь Ходжкина, неходжкинскую лимфому (вялотекущую и развитую формы), множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, миелодиспластический синдром, волосатоклеточный лейкоз и миелодисплазию.
Клетки настоящего изобретения могут быть введены в дозировках, с помощью способов и в моменты времени, которые должны быть определены в соответствующих доклинических и клинических экспериментах и исследованиях. Композиции клеток могут быть введены множество раз в дозировках в пределах этих диапазонов. Введение клеток настоящего изобретения можно комбинировать с другими методами, полезными для лечения целевого заболевания или состояния, как определено специалистами в данной области техники.
Подлежащие введению клетки настоящего изобретения могут быть аутологичными, аллогенными или ксеногенными по отношению к субъекту, подвергаемому терапии.
Введение клеток настоящего изобретения может быть осуществлено любым удобным способом, известным специалистам в данной области техники. Клетки настоящего изобретения можно вводить субъекту с помощью аэрозольной ингаляции, инъекции, приема внутрь, трансфузии, имплантации или трансплантации. Композиции, описанные в настоящем документе, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, внутрь узлов, внутрь костного мозга, внутримышечно, посредством внутривенной (в/в) инъекции или интраперитонеально. В других случаях клетки настоящего изобретения инъецируют непосредственно в очаг воспаления в субъекте, локальный очаг заболевания в субъекте, лимфатический узел, орган, опухоль и т.п.
Фармацевтические композиции
Фармацевтические композиции настоящего изобретения могут содержать клетки, как описано в настоящем документе, в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или вспомогательными средствами. Такие композиции могут содержать буферы, такие как нейтральный буферный раствор, фосфатный буферный раствор и тому подобные; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты. Композиции настоящего изобретения, предпочтительно, составляют для внутривенного введения.
Фармацевтические композиции настоящего изобретения можно вводить соответствующим подлежащему лечению (или предупреждению) заболеванию образом. Количество и частота введения будут определяться такими факторами, как состояние пациента и тип и тяжесть заболевания пациента, хотя соответствующие дозировки могут быть определены с помощью клинических исследований.
Когда указано "иммунологически эффективное количество", "эффективное против иммунного ответа количество", "эффективное ингибирующее иммунный ответ количество" или "терапевтическое количество", точное количество композиций настоящего изобретения, подлежащее введению, может быть определено врачом с учетом индивидуальных различий в возрасте, весе, иммунном ответе и состояния пациента (субъекта). Как правило, можно утверждать, что фармацевтическая композиция, содержащая клетки, описанные в настоящем документе, может быть введена в дозировке, составляющей от 104 до 109 клеток на кг веса тела, предпочтительно от 105 до 106 клеток на кг веса тела, включая все целочисленные значения в пределах данных диапазонов. Композиции клеток, описанные в настоящем документе, также можно вводить в этих дозировках множество раз. Клетки могут быть введены посредством использования способов введения, которые хорошо известны в иммунотерапии (смотри, например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988). Оптимальные режимы приема и лечения для конкретного пациента могут быть легко определены специалистом в области медицины путем мониторинга пациента на наличие признаков заболевания и соответствующей корректировки лечения.
В некоторых вариантах осуществления может быть желательно вводить моноциты, макрофаги или дентритные клетки субъекту, а затем повторно отбирать кровь (или осуществлять аферез), активировать в ней моноциты, макрофаги или дентритные клетки в соответствии с настоящим изобретением и повторно вливать пациенту эти активированные клетки. Этот процесс можно осуществлять множество раз каждые несколько недель. В некоторых вариантах осуществления можно активировать клетки из отборов крови объемом от 10 мл до 400 мл. В некоторых вариантах осуществления активируют клетки из отборов крови объемом 20 мл, 30 мл, 40 мл, 50 мл, 60 мл, 70 мл, 80 мл, 90 мл или 100 мл. Без ограничения теорией, использование такого протокола с множеством отборов крови/множеством повторных вливаний позволяет исключить некоторые популяции клеток.
В некоторых вариантах осуществления настоящего изобретения клетки модифицируют с использованием способов, описанных в настоящем документе, или других способов, известных в данной области техники, причем клетки размножают до терапевтических уровней, вводят пациенту в сочетании (например, до, одновременно или после) с любым количеством соответствующих модальностей лечения, включая, но без ограничения, лечение с помощью средств, таких как противовирусная терапия, цидофовир и интерлейкин-2, цитарабин (также известный как ARA-C), или лечение с помощью натализумаба для пациентов с MS, или лечение для пациентов с PML. В других вариантах осуществления клетки настоящего изобретения могут использоваться в комбинации с терапией CART-клетками, химиотерапией, лучевой терапией, иммуносупрессивными средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммуноаблативными средствами, такими как анти-CD52 антитело алемтузумаб (CAM PATH), анти-CD3 антитела или другие терапии антителами, цитоксином, флударибином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Данные препараты или ингибируют кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506), или ингибируют киназу p70S6, что важно для индуцируемой факторами роста сигнализации (рапамицин). (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В другом варианте осуществления клеточные композиции настоящего изобретения вводят пациенту в сочетании (например, до, одновременно или после) с трансплантацией костного мозга, лимфоаблативной терапией с использованием или химиотерапевтических средств, таких как флударабин, наружная дистанционная лучевая терапия (XRT), циклофосфамид, ритуксан, или антител, таких как OKT3 или CAMPATH. Например, в одном варианте осуществления субъекты могут проходить стандартное лечение с помощью высоких доз химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления после трансплантата субъекты получали введение клеток настоящего изобретения. В дополнительном варианте осуществления клетки могут быть введены до или после хирургии.
Дозировка вышеуказанных препаратов, подлежащих введению субъекту, будет изменяться в зависимости от точной природы подвергаемого лечению состояния и реципиента лечения. Пересчет дозировок для введения человеку может быть осуществлен в соответствии с принятой в данной области техники практикой. Доза для CAMPATH, например, обычно будет находиться в диапазоне от 1 до приблизительно 100 мг для взрослого пациента при обычном введении ежедневно в течение периода от 1 до 30 дней. Предпочтительная ежедневная доза составляет от 1 до 10 мг в день, хотя в некоторых случаях можно использовать большие дозы, составляющие вплоть до 40 мг в день (описано в патенте США № 6120766).
Следует понимать, что способ и композиции, которые были бы полезны в настоящем изобретении, не ограничены конкретными составами, приведенными в примерах. Нижеследующие примеры приведены для предоставления средним специалистам в данной области техники полного раскрытия и описания того, как получать и применять клетки, способы размножения и культивирования и терапевтические способы настоящего изобретения, и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением.
Практика настоящего изобретения использует, если не указано иное, обычные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалиста в данной области техники. Такие методы подробно описаны в литературе, такой как "Molecular Cloning: A Laboratory Manual", четвертое издание (Sambrook, 2012); "Oligonucleotide Synthesis" (Gait, 1984); "Culture of Animal Cells" (Freshney, 2010); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1997); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Short Protocols in Molecular Biology" (Ausubel, 2002); "Polymerase Chain Reaction: Principles, Applications and Troubleshooting", (Babar, 2011); "Current Protocols in Immunology" (Coligan, 2002). Эти методы применимы к получению полинуклеотидов и полипептидов настоящего изобретения и как таковые могут быть рассмотрены при создании и осуществлении настоящего изобретения. Особенно полезные методы для конкретных вариантов осуществления будут рассмотрены в нижеследующих разделах.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Настоящее изобретение далее описано подробно посредством ссылки на нижеследующие экспериментальные примеры. Эти примеры приведены только с целью иллюстрации и не предназначены для ограничения, если не указано иное. Таким образом, настоящее изобретение никоим образом не должно быть истолковано как ограниченное нижеследующими примерами, а, скорее, должно быть истолковано как охватывающее любые и все вариации, которые станут очевидными благодаря идеям, предлагаемым в настоящем документе.
Помимо последующего описания, полагают, что средний специалист в данной области техники может, с использованием предшествующего описания и нижеследующих иллюстративных примеров, создавать и использовать соединения настоящего изобретения и осуществлять на практике заявленные способы. Поэтому нижеследующие рабочие примеры конкретно указывают на предпочтительные варианты осуществления настоящего изобретения, и их не следует интерпретировать как ограничивающие каким-либо образом остальную часть раскрытия.
Далее описаны материалы и способы, используемые в этих экспериментах.
Культура клеток: THP1, K562, SKOV3, SKBR3, HDLM2, MD468 и все клеточные линии культивировали в RPMI 1640, дополненной 10% фетальной бычьей сывороткой и пенициллином/стрептомицином при 37°C в 5% CO2. THP1 mRFP+ сублинию (Wt) генерировали с помощью лентивирусной трансдукции и FACS очистки mRFP+ клеточных линий. THP1 mRFP+ сублинию использовали для генерации сублиний THP1 mRFP+ CAR19z+ (CAR19z; CARMA19z), THP1 mRFP+ CAR19Δz+ (CAR19Δz; CARMA19Δz), THP1 mRFP+ MesoZ+ и THP1 mRFP+ CARHer2z+ (CARHer2z; CARMAHer2z). Дифференцировку моноцитов индуцировали путем культивирования клеток в течение 48 часов с 1 нг/мл форбол-12-миристат-13-ацетата в культуральной среде.
Первичные человеческие макрофаги: Первичные человеческие моноциты очищали из продукта афереза нормального донора с использованием микрогранул Miltenyi CD14 (Miltenyi, 130-050-201). Моноциты культивировали в среде X-Vivo, дополненной 5% человеческой сывороткой AB, или RPMI 1640, дополненной 10% фетальной бычьей сывороткой, с пенициллином/стрептомицином, глютамаксом и 10 нг/мл рекомбинантного человеческого GM-CSF (PeproTech, 300-03) в течение 7 дней в мешках для дифференцировки клеток MACS GMP (Miltenyi, 170-076-400). Макрофаги собирали на день 7 и криосохраняли в FBS+10% DMSO в ожидании последующего использования.
Анализ фагоцитоза: Сублинии Wt или CARMA mRFP+ THP1 дифференцировали в течение 48 часов с 1 нг/мл форбол-12-миристат-13-ацетата. Опухолевые сублинии, несущие антиген GFP+, т.е. CD19+ GFP+ клетки K562, добавляли к дифференцированным макрофагам THP1 в отношении 1:1 после отмывания PMA. Макрофаги совместно культивировали с опухолевыми клетками-мишенями в течние 4 часов, и количественно определяли фагоцитоз с помощью флуоресцентной микроскопии с использованием EVOS FL Auto Cell Imaging System. Среднее из трех полей зрения рассматривали как n, и все условия количественно определяли в трех повторностях. Фагоцитоз на основе FACS анализировали на BD LSR-Fortessa. Для анализа данных проточной цитометрии использовали FlowJo (Treestar, Inc.). Живые синглеты, гейтированные как двойные положительные события mRFP/GFP, рассматривали как фагоцитоз. Блокаду оси CD47/SIRPα осуществляли путем добавления блокирующих моноклональных антител при начале совместного культивирования в указанных концентрациях (мышиные против человеческого CD47, клон B6H12, eBioscience #14-0479-82; мышиные против человеческого CD47, клон 2D3, в качестве негативного контроля, eBioscience #14-0478-82; мышиные против человеческого SIRPα, клон SE5A5, BioLegend #323802). Костимуляцию TLR осуществляли путем добавления агонистов TLR1-9 (набор агонистов человеческих TLR 1-9; Invivogen #tlrl-kit1hw) во время совместного культивирования.
Анализ киллинга in vitro: Макрофаги Wt или несущие CAR совместно культивировали с несущими антиген или контрольными положительными по люциферазе зеленого жука-щелкуна (CBG)/зеленому флуоресцентному белку (GFP) опухолевыми клетками-мишенями при изменении отношения эффектора к мишени (начиная с 30:1 и уменьшая в троекратных дилютерах). Для определения опухолевой нагрузки использовали биолюминесцентную визуализацию с помощью IVIS Spectrum Imaging System (Perkin Elmer). Процентную долю специфического лизиса рассчитывали следующим образом:
% специфического лизиса=((обработанная лунка - лунка только с опухолевыми клетками)/(максимальный киллинг - лунка только с опухолевыми клетками)*100)
Цейтраферная микроскопия: Флуоресцентную цейтраферную видеомикроскопию опосредованного CAR фагоцитоза осуществляли с использованием EVOS FL Auto Cell Imaging System. Изображения регистрировали каждые 40 секунд в течение 18 часов. Анализ изображений осуществляли с помощью программного обеспечения для визуализации FIJI.
Получение и трансфекция лентивирусов: Конструкции химерных антигенных рецепторов были заново синтезированы GeneArt (Life Technologies) и клонированы в лентивирусный вектор, как описано ранее. Концентрированный лентивирус генерировали с использованием клеток HEK293T, как описано ранее.
Получение и трансфекция аденовирусов: Химерные аденовирусные векторы Ad5f35, кодирующие GFP, CAR, или без трансгена под управлением промотора CMV получали и титровали в соответствии со стандартной молекулярно-биологической процедурой. Первичные человеческие макрофаги трансдуцировали с различной множественностью заражения и визуализировали сериями в отношении экспрессии GFP и жизнеспособности с использованием EVOS FL Auto Cell Imaging System. Экспрессию CAR оценивали с помощью анализа FACS поверхностной экспрессии CAR с использованием меченого His антигена и вторичного антитела против His-APC (R&D Biosystems, клон AD1.1.10).
Проточная цитометрия: FACS выполняли на BD LSR Fortessa. Поверхностную экспрессию CAR детектировали с помощью биотинилированного белка L (GenScript M00097) и стрептавидина-APC (BioLegend, #405207) или меченого His антигена и вторичного антитела против His-APC (R&D Biosystems, клон AD1.1.10). Fc-рецепторы блокировали с помощью Human Trustain FcX (BioLegend, #422301) до начала окрашивания. Экспрессию CD47 определяли с использованием мышиного антитела против человеческого CD47 с APC (eBioscience #17-0479-41) с изотипическим контролем мышиным IgG1-каппа с APC для определения фона. Экспрессию кальретикулина определяли с помощью мышиного антитела против кальретикулина с PE, клон FMC75 (Abcam #ab83220). Все результаты в потоке гейтировали на живые (Live/Dead Aqua Fixable Dead Cell Stain, Life Technologies L34957) одиночные клетки.
Цитометрия Imagestream: FACS с флуоресцентной визуализацией одиночных клеток осуществляли на проточном цитометре ImageStream Mark II Imaging (EMD Millipore). Кратко говоря, окрашенные mRFP+ или DiI макрофаги (с CAR или контрольные) совместно культивировали с GFP+ опухолевыми клетками в течение 4 часов до начала фиксации и получения данных на ImageStream. Данные анализировали с использованием программного обеспечения ImageStream (EMD Millipore).
Электропорация РНК: Конструкции CAR клонировали в плазмиды для транскрипции in vitro под контролем промотора T7 с использованием стандартных молекулярно-биологических методов. мРНК CAR транскрибировали in vitro с использованием набора для транскрипции in vitro mMessage mMachine T7 Ultra (Thermo Fisher), очищали с использованием набора для очистки РНК RNEasy (Qiagen) и электропорировали в человеческие макрофаги с помощью электропоратора BTX ECM850 (BTX Harvard Apparatus). Экспрессию CAR анализировали в различные моменты времени после электропорации с помощью анализа FACS.
Примирование TLR/дектином-1: Примирование TLR или дектином-1 в макрофагах Wt или с CAR перед in vitro анализами фагоцитоза или киллинга осуществляли посредством предварительной инкубации клеток с рекомендуемыми дозами или агонистов TLR 1-9 (набор агонистов человеческих TLR1-9, Invivogen), или бета-глюкана (MP Biomedicals, LLC), соответственно, в течение 30 минут до совместного культивирования. Функцию макрофагов Wt или с CAR in vitro сравнивали для условий без примирования и с примированием.
Фенотип макрофагов/моноцитов: Для различения M1/M2 были оценены следующие поверхностные маркеры как часть панели FACS для иммунофенотипа макрофагов/моноцитов: CD80, CD86, CD163, CD206, CD11B, HLA-DR, HLA-A/B/C, PDL1 и PDL2 (BioLegend). Для блокады Fc-рецептора перед иммуноокрашиванием использовали TruStain FcX. До оценки фенотипа макрофаги/моноциты подвергали или не подвергали активирующим условиям, т.е. трансдукции Ad5f35 в течение 48 часов.
Анализ Seahorse: Метаболический фенотип и потребление кислорода макрофагами определяли с использованием анализа Seahorse (Seahorse XF, Agilent). Контрольные макрофаги или макрофаги с CAR подвергали воздействию контроля со средой или иммуносупрессивных цитокинов в течение 24 часов до анализа. Клетки последовательно обрабатывали олигомицином, FCCP и ротеноном на протяжении всего анализа Seahorse. Анализ осуществляли в 6 повторностях для каждого варианта условий.
Анализы in vivo: Мышей NOD-scid IL2Rg-null-IL3/GM/SF, NSG-SGM3 (NSGS) использовали для моделей человеческого ксенотрансплантата. Мышей, которым приживляли положительные по CBG-люциферазе человеческие клетки SKOV3 рака яичника, или оставляли без лечения, или подвергали лечению с помощью нетрансдуцированных, трансдуцированных пустым Ad5f35 или трансдуцированных Ad5f35 с CAR-HER2 человеческих макрофагов в различных дозах. Для отслеживания опухолевой нагрузки осуществляли серийную биолюминесцентную визуализацию (IVIS Spectrum, Perkin Elmer). После умерщвления собирали органы и опухоль для анализа FACS. Общую выживаемость отслеживали и сравнивали с использованием анализа Каплана-Мейера.
Далее описаны результаты экспериментов.
Фигура 1A представляет собой концептуальную схему химерного антигенного рецептора (CAR), состоящего из гена/продукта гена, содержащего внеклеточный домен с направляющей функцией, шарнирный домен, трансмембранный домен, внутриклеточный сигнальный домен(ы) и/или 2A (P2A, T2A) для стехиометрической совместной экспрессии дополнительного продукта гена, который может быть или не быть секретируемым, включая любой ген/транскрипт/белок, включая, но без ограничения, цитокин, моноклональное антитело, фрагмент антитела, одноцепочечный вариабельный фрагмент, фермент, дополнительный рецептор, доминантно-негативный рецептор, опухоль-ассоциированный антиген(ы) и любую их комбинацию. Кроме того, конструкция CAR может включать в себя совместную доставку материала для редактирования генов CRISPR/Cas9 или может быть введена в контексте предварительно отредактированной CRISPR/Cas9 клетки. Конкретные примеры конструкций CAR смоделированы на фигуре 1B, включая CARMA-ζ, CARMA-γ и CARMA-дектин, которые содержат антиген-специфический scFv, шарнир CD8, трансмембранный CD8 и, соответственно, CD3-ζ, общую γ-субъединицу FcεRI или внутриклеточный домен дектина-1.
Фигура 2A представляет собой график, показывающий, что CAR19z экспрессировался на поверхности миелоидных клеток после лентивирусной трансдукции. Лентивирус с CAR19z титровали в троекратных дилютерах и использовали для трансдукции 1e5 на 0,1 мл mRFP+ THP1-клеток. mRFP представляет собой ген-репортер (красный флуоресцентный белок), который экспрессируется благодаря лентивирусной трансдукции миелоидной клеточной линии THP1. Эти клетки могут быть индуцированы для дифференцировки в макрофагах при воздействии химического PMA. THP1-клетки собирали через 24 часа после трансдукции и окрашивали на поверхностную экспрессию CAR биотинилированным белком L, а затем стрептавидином-APC. Трансдуцированные THP1-клетки размножали и сортировали с помощью FACS для генерации 100% CAR19z-положительной сублинии mRFP+THP1 (фигура 2B). Фигура 2C демонстрирует экспрессию анти-CD19, анти-HER2 и антимезотелиновых лентивирусных конструкций CAR на макрофагах THP1 с событиями CAR(+) в верхнем правом квадранте.
Фигура 3A представляет собой блок-схему, показывающую обзор генерации сублинии CARMA при использовании модели на макрофагах THP1, дифференцировку с помощью 1 нг/мл форбол-12-миристат-13-ацетата (PMA) и анализ фагоцитоза in vitro. Макрофаги с анти-CD19, анти-HER2 и антимезотелиновыми CAR, но не макрофаги дикого типа (Wt), фагоцитировали опухолевые клетки K562, которые экспрессировали, соответственно, CD19, HER2 или мезотелин, что было продемонстрировано с помощью анализа фагоцитоза на основе флуоресцентной микроскопии (фигуры 3B-3D). Фагоцитоз опухоли CARMA был дополнительно подтвержден с помощью анализа на основе проточной цитометрии, в котором mRFP+ CARMA против CD19 совместно культивировали с CD19+ GFP+ клетками K562, и количественно определяли двойные положительные события (показан типичный график FACS - фигура 3E). Показано стандартное поле зрения 10x, используемое при табулировании функции фагоцитоза CARMA, или только mRFP (фигура 3F), или наложение (фигура 3G). Двойные положительные события mRFP/GFP на основе FACS определяли как события фагоцитоза и подтверждали как таковые с помощью анализа Amnis Imagestream FACS. Показанные события гейтировали на двойные положительные события и упорядочивали от максимума к минимуму с помощью алгоритма phagocytosis-erode Amnis Imagestream (фигура 3H). Фагоцитоз опухолевых клеток mRFP+ CARMA в модели клеточной линии THP-1 был дополнительно продемонстрирован с помощью конфокальной микроскопии, подтвердившей посредством трехмерных реконструкций конфокальной z-серии, что GFP+ опухолевые клетки полностью заключены внутри фагосом (фигуры 3I и 3J). Фигура 3K демонстрирует развитие одной клетки CARMA с течением времени, причем первым этапом является контакт и образование иммунологического синапса, за чем следует фагоцитарное поглощение, деградация опухоли, причем в качестве маркера гибели клеток используют потерю GFP, разрушение фагосом и восстановление фагосом, что демонстрирует, что CARMA выживают после фагоцитоза опухолевых клеток. Фигура 3L демонстрирует способность CARMA к полифагоцитозу множества опухолевых клеток за один раз.
Макрофаги с анти-CD19 CAR тестировали в in vitro анализе фагоцитоза с CD19+ (мишень) или CD19- (контроль) GFP+ опухолевыми клетками K562. Только несущие антиген опухолевые клетки были фагоцитированы, что демонстрирует антигенную специфичность CARMA (фигура 4A). Для демонстрации необходимости для функционирования CARMA внутриклеточного сигнального домена использовали конструкции CAR19-Δζ (у которых отсутствует внутриклеточный сигнальный домен). Макрофаги CAR19-Δζ не могли фагоцитировать опухолевые клетки и обладали значительно сниженной противоопухолевой функцией по in vitro анализу специфического лизиса на основе люциферазы (фигуры 4B и 4C). CARMA анализы фагоцитоза in vitro выполняли в присутствии R406 (ингибитор Syk), цитохалазина D (ингибитор полимеризации актина) или блеббистатина (ингибитор немышечного миозина IIA). R406, цитохалазин D и блеббистатин независимо прекращали действие фагоцитарной функции CARMA, что указывает на то, что сигнализация CAR в макрофагах зависит от Syk и приводит к полимеризации актина и опосредованной NMIIA фагоцитарной функции (фигуры 4D-4F).
Фигура 5A представляет собой график проточной цитометрии, показывающий экспрессию CD47 на целевых линиях опухолевых клеток относительно изотипического контроля. В этих экспериментах использовали K562 и K562-CD19+ (K19), которые являются клеточными линиями с высокой экспрессией CD47.
Фигура 5B представляет собой график, показывающий, что добавление моноклонального анти-CD47 антитела селективно усиливало опосредованный макрофагами с CAR, но не Wt, фагоцитоз несущих антиген опухолевых клеток-мишеней. Макрофаги Wt или CAR19ζ инкубировали с CD19+ опухолевыми клетками K562 с 0, 0,01, 0,10, 1,00 или 10,0 мкг/мл моноклонального анти-CD47 антитела.
Фигура 5C представляет собой график, показывающий, что добавление моноклонального анти-SIRPα антитела селективно усиливало опосредованный макрофагами с CAR, но не Wt, фагоцитоз несущих антиген опухолевых клеток-мишеней. Макрофаги Wt или CAR19ζ инкубировали с CD19+ опухолевыми клетками K562 с 0, 0,01, 0,10, 1,00 или 10,0 мкг/мл моноклонального анти-SIRPα антитела.
Фигура 5D представляет собой график, демонстрирующий, что блокада оси CD47/SIRPα моноклональными анти-SIRPα антителами усиливала полифагоцитоз (определяемый как поглощение макрофагами 2 или более опухолевых клеток за один раз) макрофагами с CAR.
Для контроля увеличения опсонизации блокирующими моноклональными антителами к CD47/SIRPα в in vitro анализе фагоцитоза использовали контрольное моноклональное анти-CD47 антитело (клон 2D3), которое связывает CD47 но не блокирует сайт связывания CD47 с SIRPα. Только клон, который блокирует сайт связывания (анти-CD47, клон B6H12), или непосредственная блокада рецептора SIRPα вели к усилению фагоцитоза опухоли CARMA (фигура 5E).
Для проверки, ведет ли блокада оси CD47/SIRPα на макрофагах с CAR к потере антигенной специфичности, проводили in vitro фагоцитоз антиген-негативных (CD19-негативных) опухолевых клеток в присутствии моноклонального анти-CD47 или анти-SIRPα антитела, и наблюдали отсутствие фагоцитоза (фигура 5F).
Усиление специфичности фагоцитоза CARMA в присутствии блокирующего моноклонального антитела к SIRPα тестировали путем нокаута рецептора SIRPα на макрофагах THP1 и сравнения фагоцитоза опухоли CARMA или SIRPα-KO CARMA в отсутствие или в присутствии анти-SIRPα антитела. Для делеции SIRPα использовали CRISPR/Cas9, и перед функциональными анализами клетки сортировали для отсутствия SIRPα. Нокаут SIRPα усиливал функцию CARMA, а добавление анти-SIRPα обратно к нокаут-клеткам не вело к дальнейшему усилению фагоцитоза (фигура 5G).
Фигура 6A демонстрирует специфический лизис CD19+ GFP+ люцифераза+ клеток K562 макрофагами CAR19ζ CARMA, но не Wt (при использовании модели на макрофагах THP-1) в in vitro анализе киллинга на основе люциферазы через 48 часов в зависимости от дозы.
Фигура 6B представляет собой график, демонстрирующий специфический лизис опухолевых клеток THP-1-моноцитами с CAR19ζ или Wt (недифференцированными, поэтому модель является моделью на моноцитах, а не на макрофагах) в in vitro анализе киллинга на основе люциферазы через 48 часов в зависимости от дозы.
Фигура 6C представляет собой панель изображений, показывающих вызываемую люциферазой биолюминесценцию, получаемую от положительных по люциферазе CD19+ опухолевых клеток K562 после 48-часового совместного культивирования с макрофагами Wt или CAR19ζ in vitro в отсутствие или в присутствии 10 мкг/мл моноклонального анти-SIRPα антитела. Фигура 6D представляет собой график, демонстрирующий специфический лизис макрофагов Wt или CAR19ζ +/- моноклональное анти-SIRPα антитело.
Конструкции CAR с внутриклеточным доменом общей γ-субъединицы FcεRI (CAR19γ, CARMA19γ) были сгенерированы, упакованы в лентивирус и использованы для трансдукции миелоидных клеток THP-1 при троекратном последовательном разбавлении вируса. CAR19γ экспрессировалась на макрофагах THP-1 (фигура 7A).
Макрофаги с CAR19γ или макрофаги с CAR19ζ сортировали для 100% положительности по CAR и использовали для функциональной характеризации in vitro. Макрофаги как с CAR19ζ, так и с CAR19γ фагоцитировали CD19+ опухолевые клетки и демонстрировали синергию с блокадой оси CD47/SIRPα посредством добавления моноклонального анти-SIRPα антитела (фигура 7B).
Макрофаги как с CAR19ζ, так и с CAR19γ передают сигнал для управления фагоцитозом опухоли посредством Syk, что было продемонстрировано в in vitro анализе фагоцитоза с ингибированием Syk с помощью R406 (фигура 7C).
Макрофаги THP1 с CAR19ζ и CAR19γ, но не Wt макрофаги THP1, эффективно уничтожали CD19+ опухолевые клетки в in vitro анализе специфического лизиса на основе люциферазы после 24 часов совместного культивирования при различных отношениях E:T (фигура 7D).
Как белые кровяные клетки врожденной иммунной системы макрофаги реагируют на консервативные молекулярные признаки инфекции, такие как ассоциированные с патогенами молекулярные структуры, посредством конститутивно экспрессируемых рецепторов распознавания патогенов. Толл-подобные рецепторы являются наиболее хорошо охарактеризованными рецепторами распознавания патогенов, и известно, что они активируют макрофаги.
Для усиления функции фагоцитоза опухоли CARMA были проведены in vitro анализы фагоцитоза с использованием макрофагов с CAR, которые были независимо примированы лигандами к TLR1-9 или контролем со средой. Лиганды к TLR1, 2, 4, 5 и 6 усиливали фагоцитарную функцию CARMA (фигура 8A). Это подтверждает, что лиганды TLR можно использовать для примирования CARMA в процессе производства, или для усиления сигнализации CAR и функции нижележащего эффектора можно закодировать сигнальные домены TLR в конструкции CAR в качестве новой конструкции CARMA второго/последующего поколения.
Фигуры 8B и 8C демонстрируют, что различие между лигандами TLR, которые усиливали или не усиливали фагоцитоз опухолевых клеток CARMA, распространяется на широкий диапазон концентраций лигандов TLR3 или TLR6.
β-глюкан, дрожжевой продукт, связывался с дектином-1 на поверхности макрофагов и приводил к активации и эффекторной функции. Для тестирования способности β-глюкана усиливать функцию CARMA были проведены in vitro анализы фагоцитоза опухоли в отсутствие или в присутствии 5 мкг/мл β-глюкана. β-глюкан усиливал фагоцитарную способность макрофагов с CAR, но не Wt (фигура 9A).
Для тестирования способности β-глюкана к усилению киллинга опухоли CARMA проводили in vitro анализы специфического лизиса на основе люциферазы при различных отношениях E:T в присутствии 0, 0,5, 5 или 50 мкг/мл β-глюкана. β-глюкан усиливал специфический лизис несущих антиген опухолевых клеток макрофагами THP-1 с CAR, но не Wt (фигура 9B). Эти результаты показывают, что β-глюкан можно использовать в качестве адъюванта в процессе производства CARMA, или внутриклеточный сигнальный домен дектина-1 можно закодировать в трансгене CAR.
Учитывая, что β-глюкан усиливал функцию CARMA, были сгенерированы конструкции CAR, состоящие из внутриклеточного сигнального домена дектина-1 (фигура 10A). Эти конструкции были упакованы в лентивирус и использованы для трансдукции миелоидных клеток THP-1 при троекратном последовательном разбавлении титров лентивируса. CAR детектировали на поверхности обеих конструкций, как CAR CD8TM-Dectin1, так и CAR DectinTM-Dectin1 (фигуры 10B и 10C). Клетки сортировали для 100% положительности и использовали для последующих функциональных экспериментов in vitro.
Макрофаги с CAR CD8TM-Dectin1 и CAR DectinTM-Dectin1 тестировали в люциферазном анализе киллинга in vitro. Обе конструкции продемонстрировали специфический лизис опухолевых клеток (10D).
Макрофаги с Dectin1-CAR тестировали в in vitro анализе фагоцитоза опухоли с опухолевыми клетками K562 (контроль) или K19 (мишень), и макрофаги с Dectin1-CAR селективно фагоцитировали несущие когнатный антиген опухолевые клетки (фигура 10E). Макрофаги с CAR с дектином-1 демонстрировали способность к фагоцитозу множества опухолевых клеток (фигура 10F).
В in vitro анализе фагоцитоза опухоли макрофаги с Dectin1-CAR демонстрировали синергию с блокадой SIRPα или с примированием лигандом TLR (фигура 10G).
Фигура 11A представляет собой серию графиков, показывающих уровни кальретикулина в трех различных линиях CD19+ клеток-мишеней относительно изотипического контроля. Фигура 11B представляет собой график, показывающий нормализованную среднюю интенсивность флуоресценции при экспрессии кальретикулина в трех различных линиях CD19+ клеток-мишеней.
Фигура 11C представляет собой график, показывающий, что низкие уровни кальретикулина умеренно защищали клетки-мишени, особенно клеточные линии Nalm6 и JEKO, от фагоцитоза макрофагами с CAR19z. Эти данные показывают, что осаждение/индукцию кальретикулина можно использовать как дополнительную тактику для усиления эффекторной функции CARMA.
Для проверки и тестирвоания функции CAR в макрофагах из первичных человеческих моноцитов тестировали несколько подходов к доставке генов. На фигуре 12A конструкции анти-HER2 CAR клонировали в плазмиды экспрессии мРНК, транскрибировали in vitro, и мРНК непосредственно электропорировали в первичные человеческие моноциты. Фигура 13A демонстрирует стратегию гейтирования, жизнеспособность и эффективность трансфекции 84,3% относительно ложно-электропорированных клеток. Фигура 12B демонстрирует эффективность электропорации мРНК анти-HER2 CAR в макрофаги из первичных человеческих моноцитов (полностью дифференцированные) 79,7%.
Фигура 12C представляет собой график, демонстрирующий, что хотя электропорация мРНК приводит к высокой эффективности трансфекции CAR как моноцитов, так и макрофагов, экспрессия CAR является временной из-за деградации мРНК, достигая пика на день 2 и исчезая к дню 7 после электропорации in vitro.
Мышам NSGS инъецировали посредством и/п инъекции 1E6 CBG/GFP+ клеток SKOV3 рака яичника человека, модель метастатического внутрибрюшинного карциноматоза HER2+ рака яичника. Мышам совместно инъецировали или ложно-электропорированные, или электропорированные мРНК анти-HER2 CAR первичные человеческие моноциты или первичные человеческие макрофаги (отношение E:T 1:1), и визуализировали опухолевую нагрузку. Макрофаги с CAR (фигура 13A) и моноциты с CAR (фигура 13B) демонстрировали незначительное снижение роста опухоли в течение приблизительно двух недель. Первая временная точка, в которой опухолевую нагрузку количественно определяли биолюминесцентно, находилась через 24 часа после обработки, что демонстрирует, что моноциты и макрофаги с CAR имели активность в первые 24 часа.
Лентивирусную доставку трансгенов CAR в макрофаги из первичных человеческих моноцитов тестировали с использованием нескольких конструкций CAR. На фигуре 14A CAR19 доставляли в человеческие макрофаги с помощью лентивирусной трансдукции, демонстрирующей эффективность трансдукции 4,27% и 38,9% в группах контроля и лентивируса с CAR19 (MOI 10), соответственно. Показана стратегия гейтирования с помощью FACS.
Фигура 14B представляет собой типичный график FACS, показывающий экспрессию анти-HER2 CAR в первичных человеческих макрофагах с эффективностью трансдукции 1,47 и 18,1% в условиях контроля и MOI 10 CAR LV, соответственно.
Макрофаги из моноцитов генерировали путем дифференцировки отобранных CD14+ клеток (из продуктов афереза нормальных доноров) в кондиционированной GM-CSF среде в течение 7 дней. Для оптимизации доставки CAR с помощью лентивирусной трансдукции анти-CD19 и анти-HER2 лентивирусы использовали для трансдукции макрофагов в различные моменты процесса дифференцировки моноцита в макрофаг. Эффективность трансдукции достигала пика в середине трансдукции (день 4) как для анти-CD19, так и для анти-HER2 конструкций CAR (фигуры 15A и 15B). Первичные человеческие макрофаги с анти-CD19 CAR использовали в основанном на FACS in vitro анализе фагоцитоза CD19+ GFP+ опухолевых клеток K562, причем события CD11b+/GFP+ определяли как события фагоцитоза. В данном анализе использовали макрофаги, трансдуцированные в различные моменты времени на фигуре 15A. Фигура 15C демонстрирует, что эффективность фагоцитоза изменялась вместе с эффективностью трансдукции CAR, достигая пика у макрофагов, трансдуцированных на день 4 процесса дифференцировки.
Были протестированы альтернативные подходы к трансдукции для доставки трансгенов в первичные человеческие макрофаги с учетом того, что электропорация мРНК была временной, и лентивирус был только умеренно эффективным и требовал высокого титра. В качестве эффективного подхода к трансдукции первичных человеческих макрофагов был идентифицирован аденовирус (рекомбинантный, дефицитный по репликации). Экспрессию рецептора аденовируса Коксаки (докинг-белок для Ad5) и CD46 (докинг-белок для Ad35) тестировали относительно изотипического контроля на первичных человеческих макрофагах, и наблюдали высокую экспрессию CD46, но не рецептора аденовируса Коксаки (фигура 16A). Таким образом, для трансдукции первичных человеческих макрофагов использовали химерный аденовирус Ad5f35, и он был сконструирован с помощью стандартных методов молекулярной биологии для экспрессии химерного антигенного рецептора (GFP и пустые вирусы Ad5f35 использовали как контроль) к HER2.
Фигура 16B показывает, что при MOI 1000 Ad5f35 эффективно доставлял трансген (в качестве модельного трансгена использовали GFP) в человеческие макрофаги, и экспрессия возрастала со временем, что было видно по количественной оценке сигнала GFP на IVIS Spectrum. Фигура 16C сравнивает кинетику трансдукции первичных человеческих макрофагов в различные моменты времени в широком диапазоне MOI вплоть до 10000.
Фигура 16C показывает типичные графики FACS экспрессии анти-HER2 CAR на трансдуцированных Ad5f35 человеческих макрофагах через 48 часов после трансдукции в широком диапазоне вирусных MOI.
Фигура 16D показывает типичные флуоресцентные микроскопические изображения трансдуцированных Ad5f35-GFP первичных человеческих макрофагов, причем наивысшая эффективность трансдукции была продемонстрирована при MOI 1000.
Первичные человеческие CARMA были протестированы в in vitro анализе фагоцитоза с помощью анализа FACS. Макрофаги (нетрансдуцированные или с анти-HER2 CAR) окрашивали DiI перед совместным культивированием с GFP+ клетками SKOV3 рака яичника. Измеряли уровень фагоцитоза, определяемый по двойным положительным событиям DiI/GFP, оказавшийся равным 26,6% в группе CAR и 4,55% в контрольной группе (фигура 17A). Для проверки, что двойные положительные события DiI/GFP являлись событиями фагоцитоза, а не дублетами, к группе эксперимента добавляли цитохалазин D (ингибитор фагоцитоза), и он полностью прекращал опосредованный CAR фагоцитоз вплоть до 1,74%. Для дальнейшей проверки, что первичные человеческие макрофаги с CAR могут фагоцитировать опухолевые клетки, двойные положительные события гейтировали с помощью Amnis Imagestream FACS и упорядочивали от максимума к минимуму с помощью алгоритма phagocytosis-erode от Amnis, что визуально демонстрирует, что эти двойные положительные события представляют собой фагоцитоз (фигура 17B). Кроме того, окрашенные DiI макрофаги CAR-HER2 совместно культивировали с SKOV3-GFP и визуализировали с помощью конфокального микроскопа, и фагоцитоз был подтвержден.
Первичные человеческие макрофаги с анти-HER2 CAR генерировали с использованием трансдукции Ad5f35-CAR макрофагов моноцитарного происхождения. Эти клетки (или контрольные нетрансдуцированные клетки) использовали в качестве эффекторов в основанном на FACS in vitro анализе фагоцитоза клеток SKBR3 рака молочной железы человека. Фигура 18 демонстрирует, что человеческие макрофаги с CAR, но не UTD, фагоцитировали клетки рака молочной железы. Кроме того, добавление моноклонального анти-SIRPα антитела усиливало фагоцитоз клеток рака молочной железы макрофагами CARMA, но не UTD. Эти результаты демонстрируют, что синергия между блокадой оси CD47/SIRPα, наблюдаемая с CARMA в модели THP-1, переходит на исследования на первичных человеческих макрофагах.
Макрофаги представляют собой белые кровяные клетки врожденной иммунной системы и поэтому обладают сигнальными противомикробными свойствами. Для того чтобы продемонстрировать, что макрофаги с CAR остаются функциональными клетками врожденного иммунитета в противомикробном смысле и не теряют способность реагировать на инфекционные стимулы, использовали контрольные нетрансдуцированные макрофаги или макрофаги с CAR в основанном на FACS анализе фагоцитоза E.Coli. Фигура 19 представляет собой типичный график FACS показывающий, что CARMA проявляют интактный фагоцитоз частиц pH-Rodo Green E.Coli.
Первичные человеческие анти-HER2 CARMA тестировали в качестве эффекторных клеток в in vitro анализах киллинга на основе люциферазы. Анти-HER2 CARMA, но не контрольные UTD макрофаги, приводили к специфическому лизису HER2+ клеток K562, но не контрольных клеток K562, у которых отсутствовала экспрессия HER2, после 48 часов совместного культивирования (фигура 20A). Чтобы продемонстрировать, что киллинг CARMA может быть перенесен на опухолевые клетки, экспрессирующие HER2 на физиологическом уровне (в отличие от K562-HER2, которые лентивирусно трансдуцированы для сверхэкспрессии HER2), в качестве мишеней использовали клетки SKBR3 рака молочной железы и клетки SKOV3 рака яичника. CARMA, но не контрольные UTD или контрольные трансдуцированные пустым Ad5f35 макрофаги, обладали значительной противоопухолевой активностью в отношении обеих моделей после 48 часов совместного культивирования (фигуры 20B и 20C). Для того чтобы протестировать синергию между блокадой оси CD47/SIRPα в анализе киллинга, клетки SKOV3 рака яичника совместно культивировали со средой, контрольными не трансдуцированными макрофагами, анти-HER2 CARMA, анти-HER2 CARMA+анти-CD47 mAB (10 мкг/мл) или анти-HER2 CARMA+анти-SIRPα (10 мкг/мл), и последовательно измеряли сигнал люциферазы. CARMA приводили к полной эрадикации опухоли к дню 13, причем кинетика эрадикации опухоли была даже более быстрой при блокировке оси CD47/SIRPα (фигура 20D). Синергию с β-глюканом, которую демонстрировали в модели на макрофагах THP-1 CARMA, тестировали в аналогичном эксперименте, и примирование CARMA β-глюканом приводило к улучшению кинетики киллинга опухоли (фигура 20E). Воздействие CARMA на LPS (лиганд TLR-4) или поли-IC (лиганд TLR-3) приводило к модуляции противоопухолевого эффекта (фигура 20F).
Способность первичных человеческих CARMA уничтожать опухоли in vitro была продемонстрирована с помощью люциферазного анализа на фигурах 20A-20F. Для проверки этих результатов GFP+ клетки SKOV3 рака яичника совместно культивировали с контрольными UTD макрофагами, контрольными UTD макрофагами плюс 10 мкг/мл трастузумаба, контрольными трансдуцированными пустым вирусом Ad5f35 макрофагами или анти-HER2 первичными человеческими CARMA. CARMA, но не контрольные группы, оказались способны к уничтожению опухолевых клеток (фигура 21).
Макрофаги являются фенотипически пластичными клетками, способными перенимать различные функциональные признаки, которые обычно классифицируют как макрофаги M1 и M2, причем M1 являются воспалительными/активированными, а M2 являются иммуносупрессивными/стимулирующими опухоли. Через 48 часов после трансдукции первичных человеческих макрофагов вирусом Ad5f35 с CAR с помощью FACS измеряли зависящую от дозы повышающую регуляцию маркеров M1 CD80/CD86 и зависящую от дозы понижающую регуляцию маркеров M2 CD163 (фигура 22A). Для проверки, являлся ли этот эффект результатом экспрессии CAR или трансдукции Ad5f35, макрофаги трансдуцировали или ничего не несущим пустым Ad5f35, или анти-HER2 Ad5f35, и пустой/CAR Ad5f35 продемонстрировали одинаковую картину сдвига фенотипа (фигура 22B).
Микроокружение солидных опухолей обычно иммуносупрессивно и может приводить к поляризации макрофага в состояние M2. Для проверки, является ли CARMA, M1-поляризованный из-за вирусной трансдукции, резистентным к иммуносупрессивной цитокин-опосредованной инверсии в M2, контрольные нетрансдуцированные или с анти-HER2 CAR человеческие макрофаги подвергали воздействию IL-4, IL-10 или IL-13 в течение 24 часов перед совместным культивированием с клетками SKOV3 рака яичника. Контрольные UTD макрофаги, кондиционированные с супрессивными цитокинами, приводили к усилению роста опухоли, тогда как CARMA, испытавшие воздействие супрессивных цитокинов, сохраняли свою активность киллинга в in vitro анализе специфического лизиса на основе люциферазы через 48 часов (фигура 22C).
Для дальнейшей проверки резистентности к иммуносупрессии человеческие макрофаги с CAR, контрольные UTD, трансдуцированные пустым Ad5f35 или Ad5f35 с анти-HER2 CAR макрофаги подвергали воздействию 10 нг/мл IL-4, канонического индуцирующего M2 цитокина, или раковых клеток, которые, как было показано ранее, вызывают инверсию макрофагов в M2 при совместном культивировании (SKOV3, клеточная линия рака яичника; HDLM2, клеточная линия ходжкинской лимфомы). Контрольные UTD макрофаги повышающе регулировали CD206, маркер M2, который специфически реагирует на стимуляцию IL-4 путем фосфорилирования STAT6. Трансдуцированные пустым Ad5f35, а тем более CAR-Ad5f35 макрофаги демонстрировали резистентность к индуцированной IL-4 и опухолью инверсии в фенотип M2 (фигура 22D).
Для дальнейшей характеризации фенотипа макрофагов с CAR метаболический фенотип исследовали с использованием анализа Seahorse для измерения потребление кислорода. Макрофаги M2 имеют более высокую интенсивность базального потребления кислорода, чем макрофаги M0 или M1 из-за более сильной зависимости от окислительного фосфорилирования для производства АТФ. Контрольные UTD макрофаги или макрофаги с анти-HER2 CAR подвергали воздействию IL-4 в течение 24 часов для поляризации в M2 (или нет), и измеряли интенсивность потребления кислорода. Контрольные UTD макрофаги демонстрировали характерное повышенное базальное потребление кислорода, характерное для макрофагов M2, тогда как CARMA не реагировали на IL-4, что подтверждает их резистентность к инверсии в M2 (фигура 22E). Эти данные вместе иллюстрируют, при использовании фенотипического, метаболического и функционального анализов, что CARMA резистентны к инверсии в M2.
Первичные человеческие моноциты от нормального донора (очищенные с помощью положительной селекции по CD14) трансдуцировали Ad5f35-CAR-HER2 при MOI в диапазоне от 0 (UTD) до 1000. Экспрессию CAR измеряли с помощью FACS через 48 часов после трансдукции. Моноциты с CAR эффективно генерировали с помощью Ad5f35, с пиком экспрессии при MOI 1000 (фигуры 23A и 23B). Моноциты сохраняли высокую жизнеспособность (измеренную с помощью анализа FACS Live/Dead Aqua) при MOI вплоть до 1000 (фигура 23C). Человеческие моноциты с CAR, но не нетрансдуцированные (UTD), повышающе регулировали маркеры активации M1 (фигура 23D) и понижающе регулировали маркеры M2 (фигура 23E), как видно по анализу с помощью FACS, демонстрирующему фенотип моноцитов M1 через 48 часов после трансдукции.
Киллинг моноцитов с анти-HER2 CAR определяли с помощью in vitro анализа киллинга на основе люциферазы в диапазоне отношений эффектор:мишень (E:T). Нетрансдуцированные (UTD) моноциты или моноциты с CAR-HER2-дзета (CAR) совместно культивировали in vitro или с HER2+ клетками SKBR3 (человеческий рак молочной железы), или с HER2+ клетками SKOV3 (человеческий рак яичника). Специфический лизис рассчитывали и определяли через 24, 48 и 96 часов после начала совместного культивирования. Моноциты с CAR, но не UTD, лизировали in vitro клетки рака как молочной железы, так и яичника (фигуры 24A и 24B).
Мышей NOD-scid IL2Rg-null-IL3/GM/SF, NSG-SGM3 (NSGS) использовали для моделирования ксенотрансплантатов человеческого HER2(+) рака яичника in vivo. На день 0 мышам инъецировали интраперитонеально (и/п) 7,5E5 положительных по люциферазе зеленого жука-щелкуна (CBG luc)/положительных по зеленому флуоресцентному белку (GFP) клеток SKOV3 рака яичника в качестве модели внутрибрюшинного карциноматоза, агрессивной по своему характеру метастатической модели солидного злокачественного образования. Мышей или оставляли без лечения (только опухоль), или инъецировали им одну дозу из 4E6 нетрансдуцированных (UTD) или с CAR-HER2 (CARMA) человеческих макрофагов на день 0 посредством и/п инъекции (схема, фигура 25A). Мышей визуализировали сериями с использованием биолюминесценции (общий поток; фотоны в секунду) в качестве имитации опухолевой нагрузки. У мышей, которые получали лечение CARMA, опухолевая нагрузка снижалась приблизительно на два порядка величины (фигуры 25B и 25C). У мышей, подвергаемых лечению CARMA, было 30-дневное преимущество по выживаемости (p=0,018) относительно мышей, не подвергаемых лечению или подвергаемых лечению UTD макрофагами (фигура 25D). Для демонстрации трафика макрофагов в солидный опухолевый узел опухоли собирали у мышей, которые умерли на день 36, и подвергали оценке на присутствие адоптивно перенесенных человеческих макрофагов с помощью экспрессии человеческого CD45 в анализе FACS (фигура 25E).
Человеческие макрофаги или не трансдуцировали (UTD), или трансдуцировали пустыми вирионами Ad5f35 без трансгена (пустые) или Ad5f35-CAR-HER2-ζ (CARMA) при множественности заражения 1000. Поверхностную экспрессию CAR проверяли с помощью анализа FACS через 48 часов после трансдукции (фигура 26A). Поверхностные маркеры оценивали для демонстрации поляризации макрофагов M1 в клетках, трансдуцированных или пустым Ad5f35, или Ad5f35 с CAR-HER2-ζ. Маркеры M1 (HLA DR, CD86, CD80, PDL1) были повышенно отрегулированы, тогда как маркеры M2 (CD206, CD163) были пониженно отрегулированы (фигура 26B). Мышей NSGS снова использовали в и/п модели HER2+ метастатического рака яичника, и стратифицировали их по четырем группам лечения (n=5 на группу). Мышей оставляли без лечения или делали им и/п инъекции по 1E7 нетрансдуцированных, трансдуцированных пустым Ad5f35 макрофагов или трансдуцированных CAR-HER2-ζ макрофагов на день 0 (фигура 26C). Мониторинг опухолевой нагрузки осуществляли с помощью серийной биолюминисцентной визуализации, причем типичные данные показаны на день 27 после приживления опухоли (фигуры 26D и 26E). Получавшие CARMA мыши имели примерно в 2400 раз меньшую опухолевую нагрузку, чем мыши, не получавшие лечения, на день 20 после обработки.
Мышей NSGS использовали в и/п модели HER2+ метастатического рака яичника, и стратифицировали их по четырем группам лечения (n=5 на группу), включая отсутствие лечения и 3E6, 1E7 или 2E7 человеческих макрофагов с CAR-HER2-ζ, вводимых и/п на день 0 (фигура 27A). Мониторинг опухолевой нагрузки осуществляли с помощью серийной биолюминисцентной визуализации, и наблюдали в этой модели зависящий от дозы макрофагов ответ (фигура 27B). Единичные дозы макрофагов с CAR-HER2 по 3E6, 1E7 или 2E7 макрофагов на мышь приводили к зависящей от дозы эрадикации опухоли (по сравнению с не получавшими лечения мышами) к дню 36 после приживления (фигура 27C).
Фигура 28 представляет собой иллюстрацию предлагаемого терапевтического подхода для CARMA. Кратко говоря, моноциты пациента могут быть отобраны из периферической крови, дифференцированы ex vivo и трансдуцированы для экспрессии CAR, костимулированы (или нет) синергическими соединениями и инъецированы обратно в пациента внутривенно, интраперитонеально, интратуморально, посредством инвазивной радиологической процедуры или другим способом. Следует отметить, что процесс дифференцировки может быть пропущен, и моноциты могут быть трансдуцированы и влиты обратно в пациента. Источником моноцитов также может быть совпадающий по HLA донор.
Другие варианты осуществления
Перечисление списка элементов в любом определении переменной в настоящем документе включает определения этой переменной как любого одного элемента или комбинации (или подкомбинации) перечисленных элементов. Описание варианта осуществления в настоящем документе включает в себя этот вариант осуществления в форме любого одного варианта осуществления или в комбинации с любыми другими вариантами осуществления или их частями.
Раскрытия всех без исключения патентов, патентных заявок и публикаций, цитируемых в настоящем документе, настоящим включены в настоящий документ посредством ссылки во всей полноте. При том, что настоящее изобретение было раскрыто со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и вариации настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отхода от сущности и объема настоящего изобретения. Прилагаемую формулу изобретения следует интерпретировать как включающую в себя все такие варианты осуществления и эквивалентные изменения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЙ БЕЛОК SIRPα-4-1BBL И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2769769C2 |
| ГЛИКАНЗАВИСИМЫЕ ИММУНОТЕРАПЕВТИЧЕСКИЕ МОЛЕКУЛЫ | 2016 |
|
RU2754661C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-SIRPα АНТИТЕЛА | 2019 |
|
RU2812199C2 |
| СПОСОБЫ EX VIVO ЭКСПАНСИИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2814083C2 |
| NK-клеточная линия, экспрессирующая PSMA-специфический химерный антигенный рецептор и секретирующая блокатор взаимодействия CD47/SIRPa | 2020 |
|
RU2757353C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2680010C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| КОМПОЗИЦИИ ДЛЯ Т-КЛЕТОЧНОЙ ТЕРАПИИ С ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2819805C2 |
| ПОЛИПЕПТИДЫ ТРАНСПОЗАЗЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2735700C2 |
| АНТИТЕЛО К SIRPα И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2822496C1 |

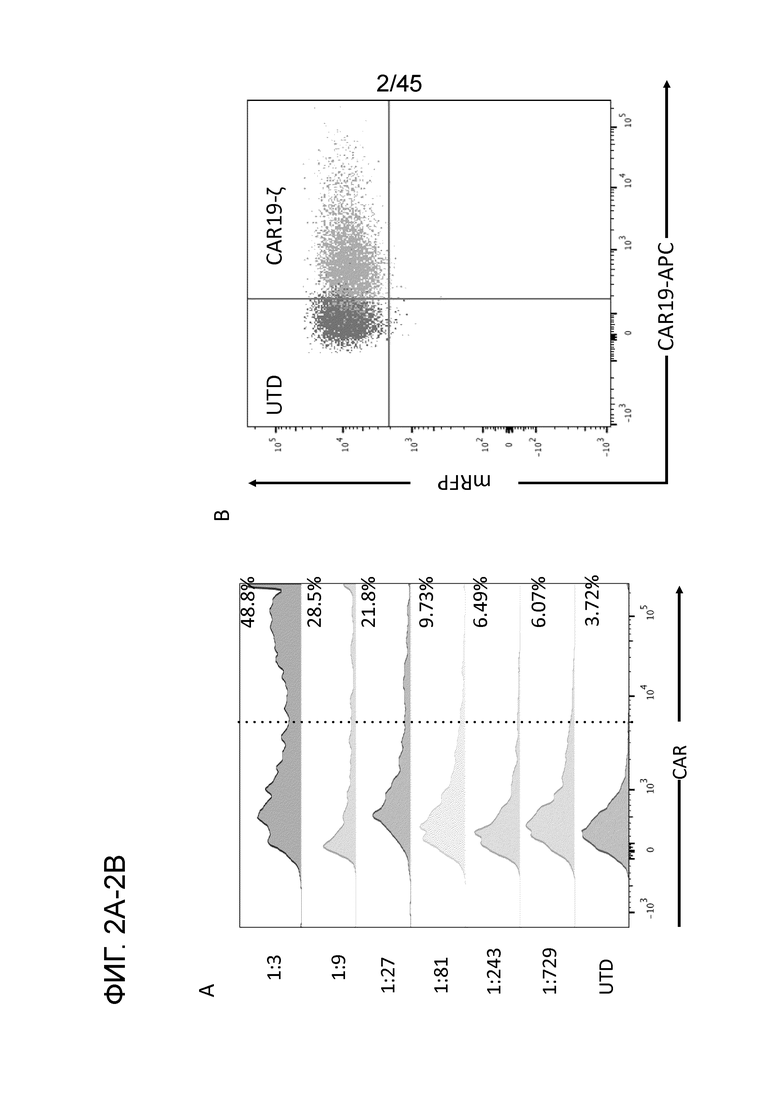

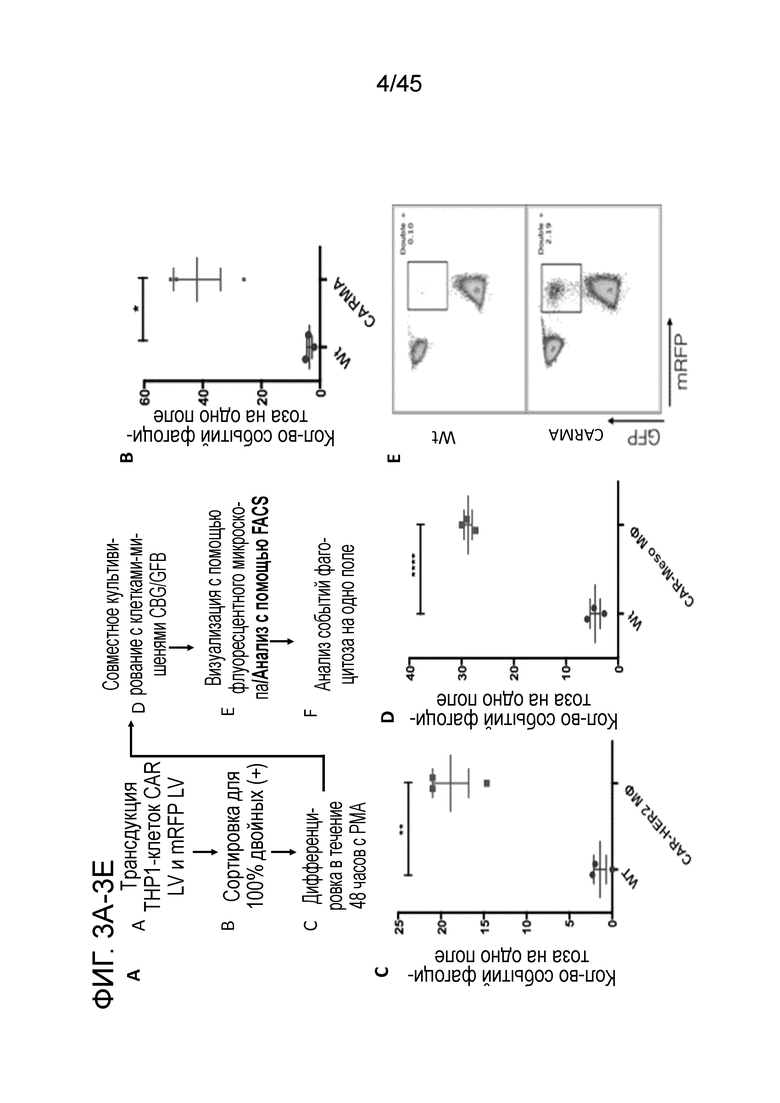
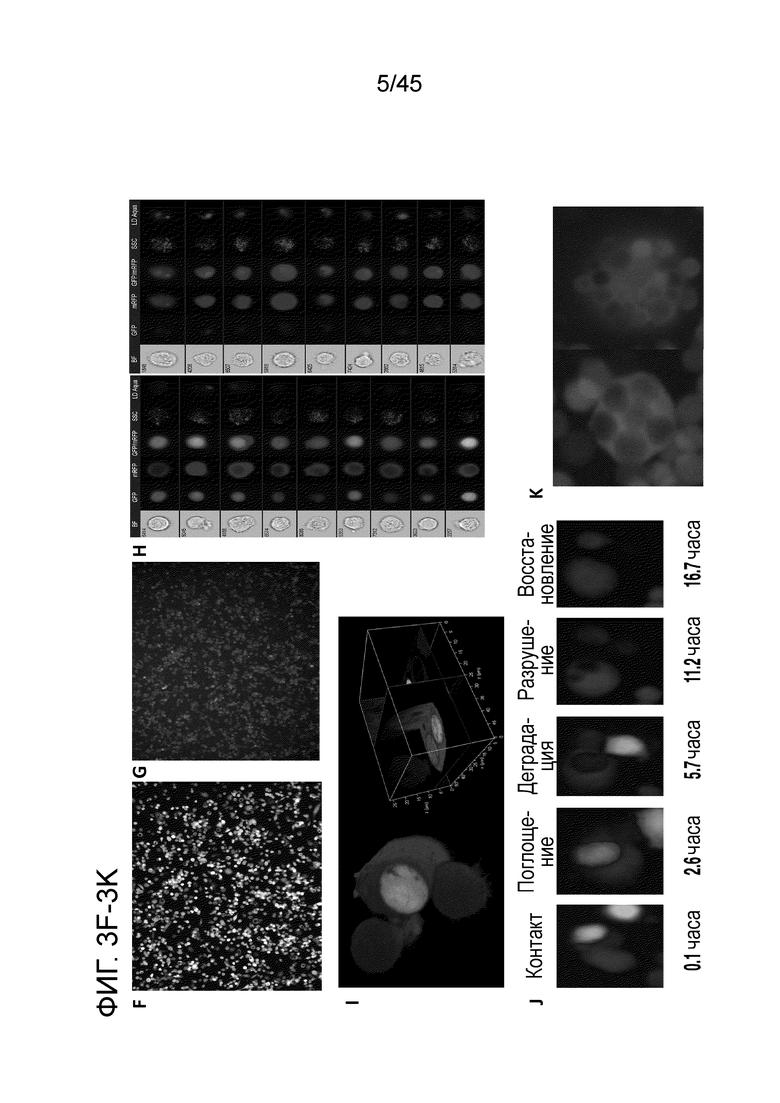
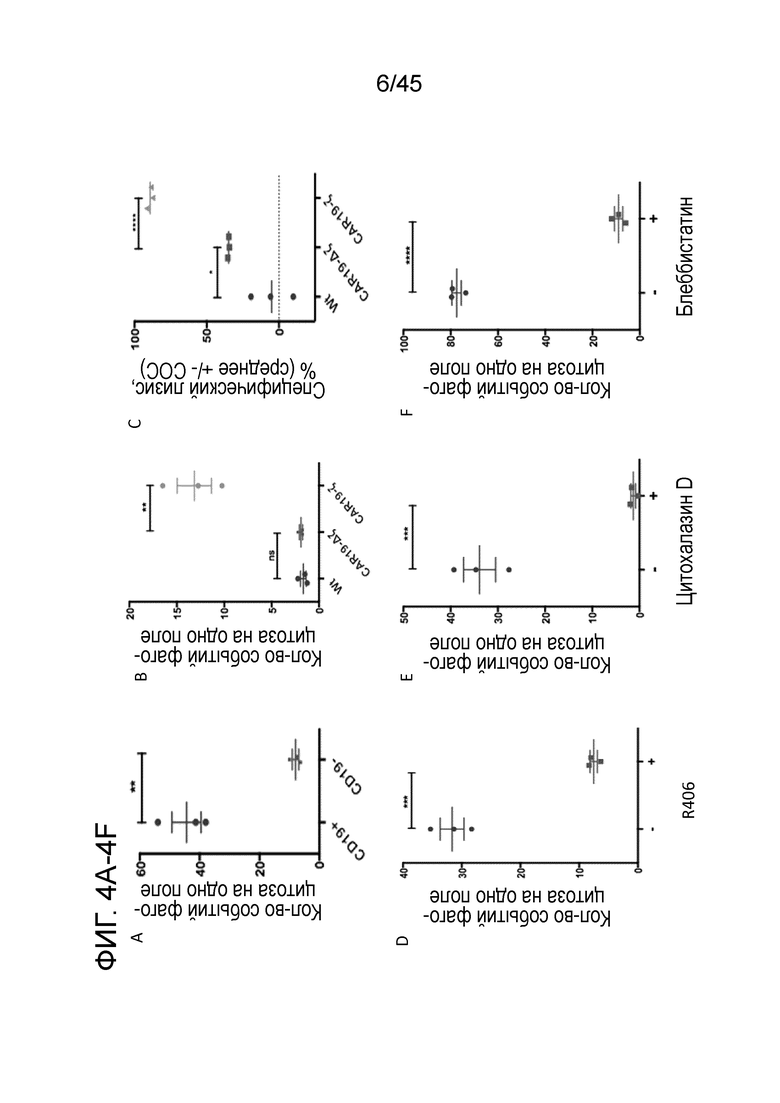
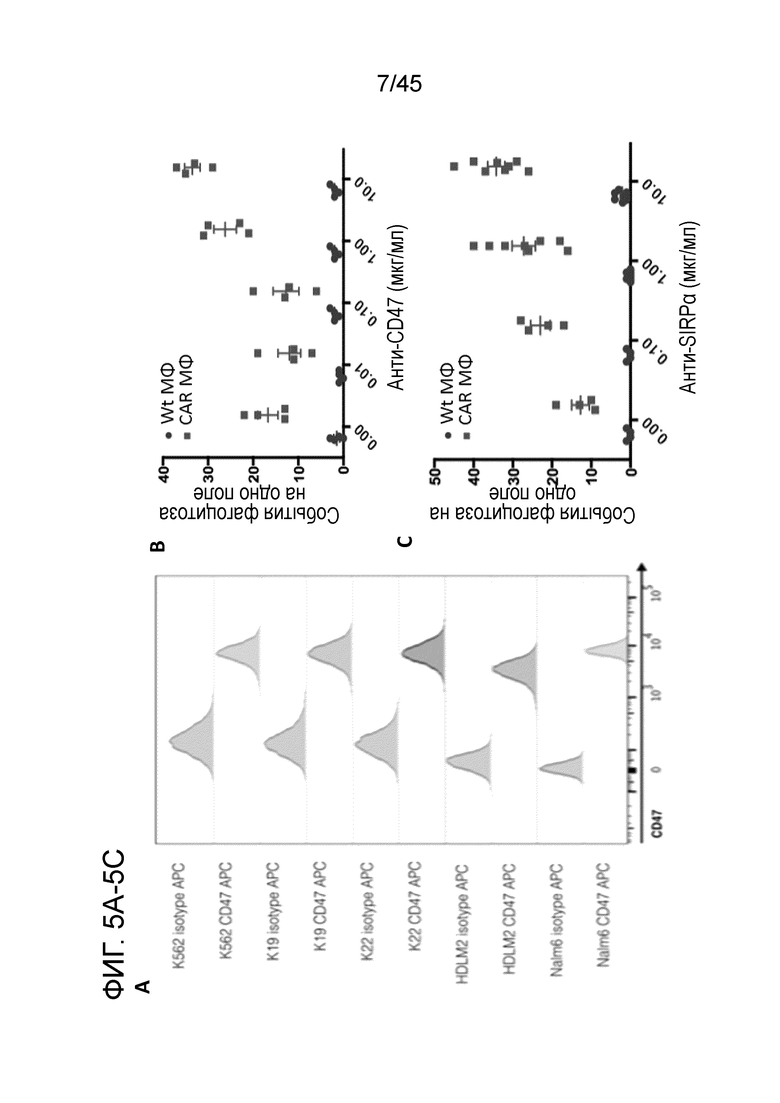
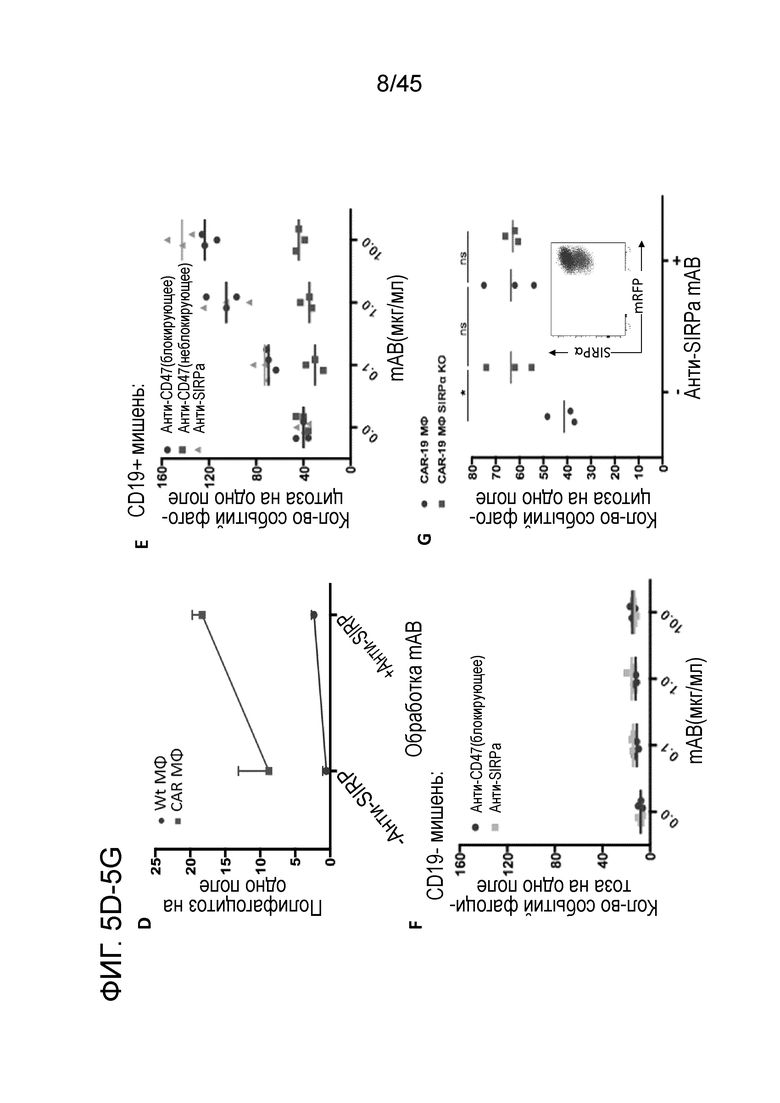
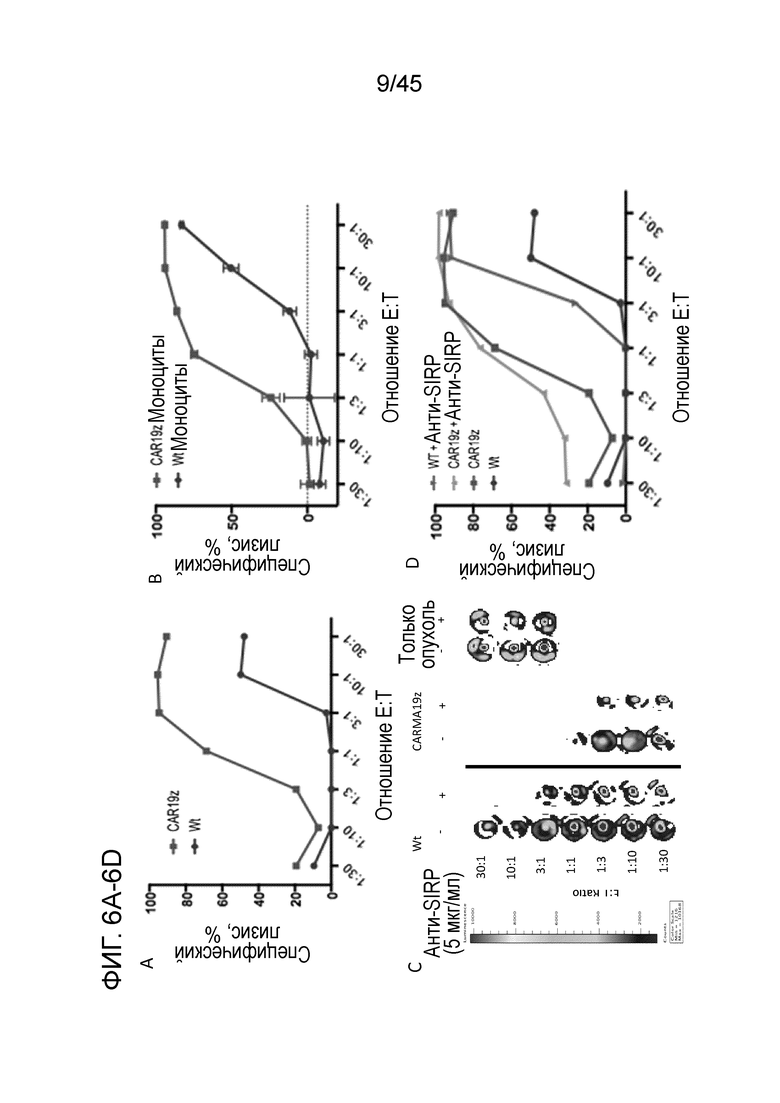
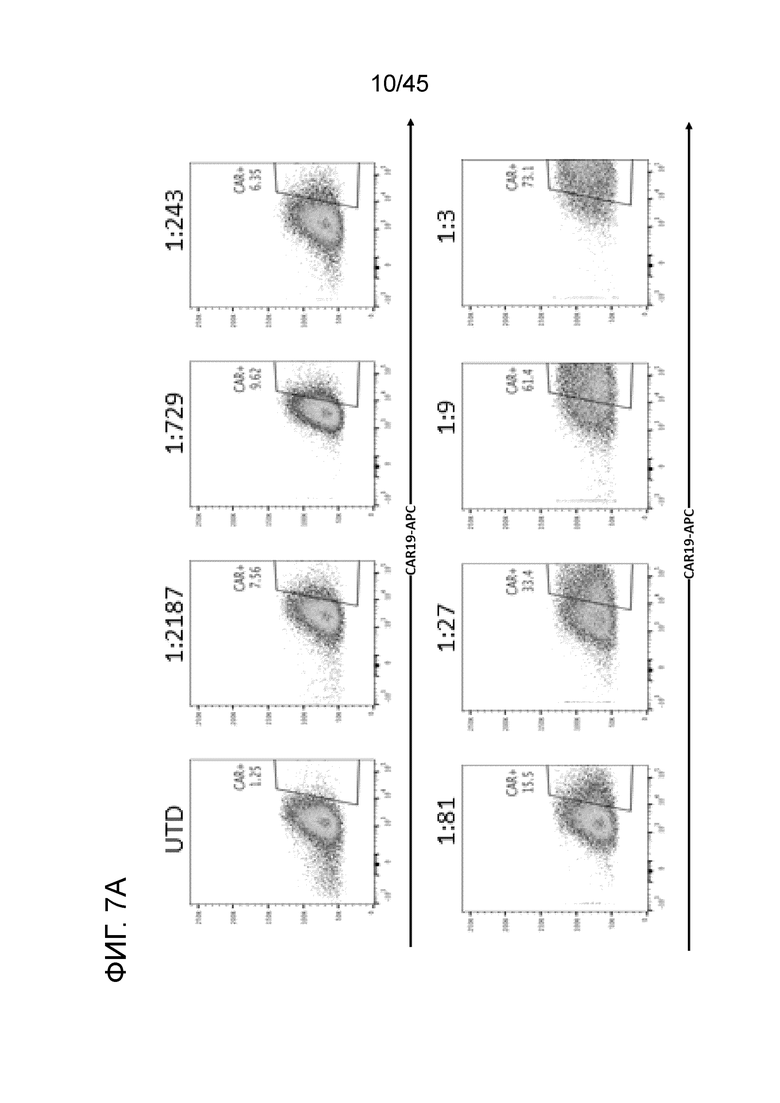
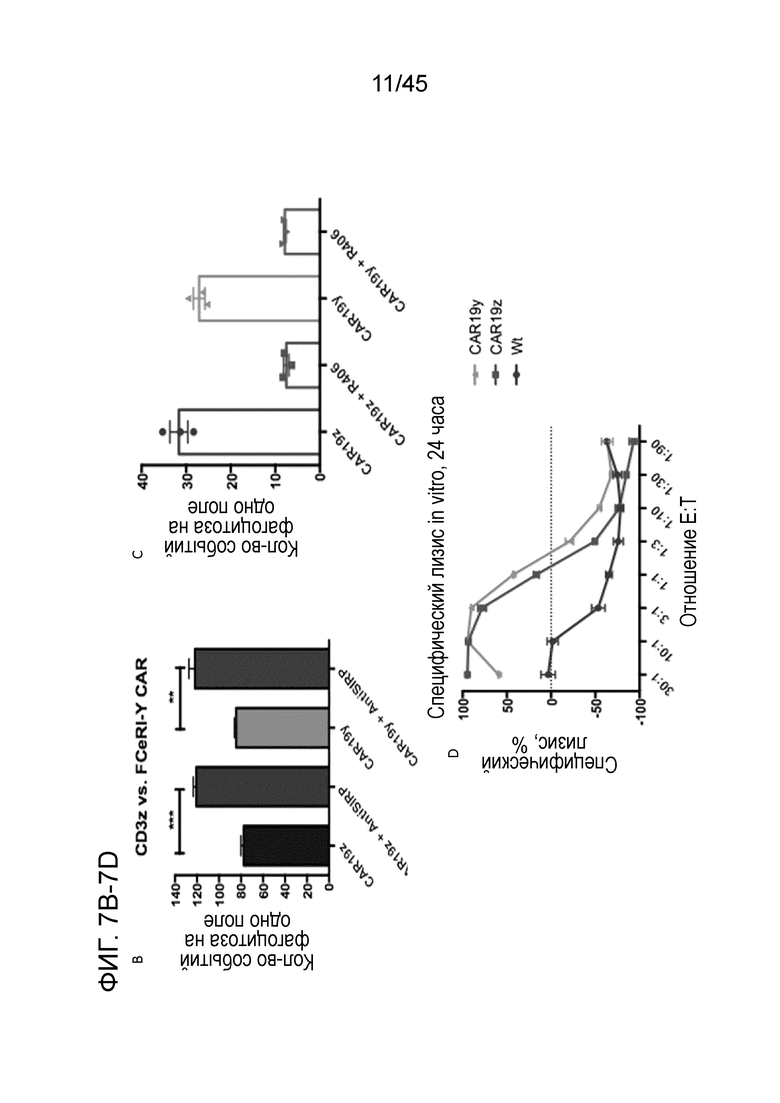
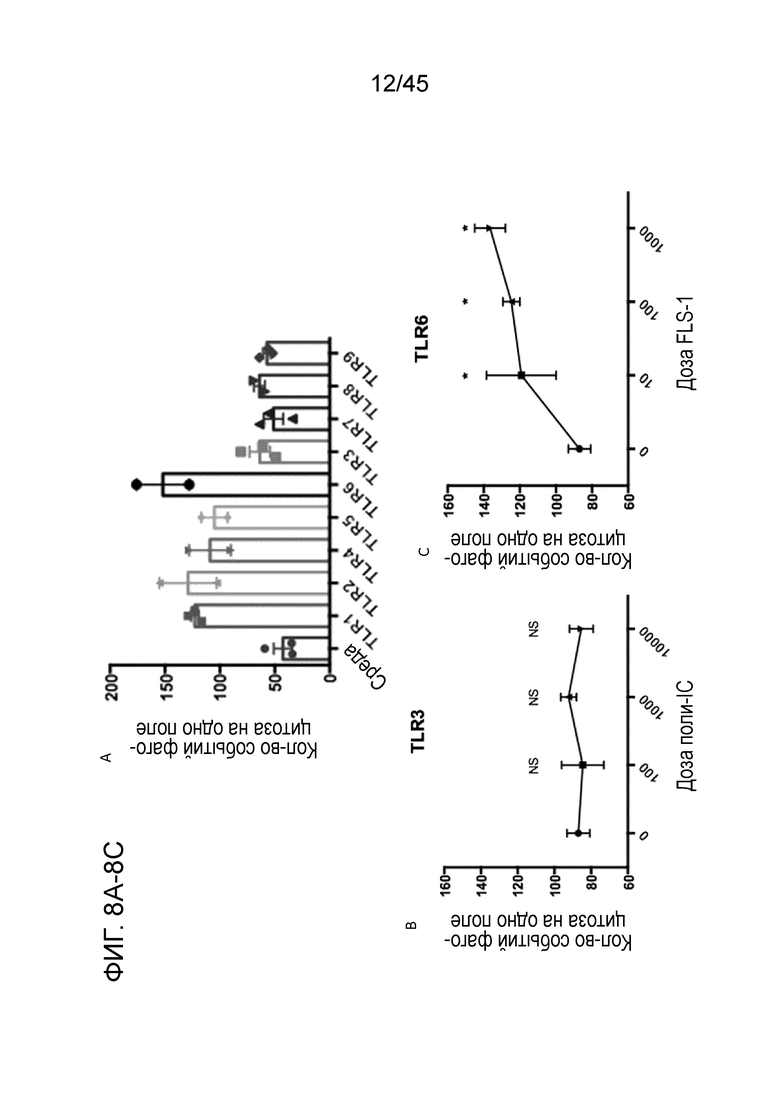
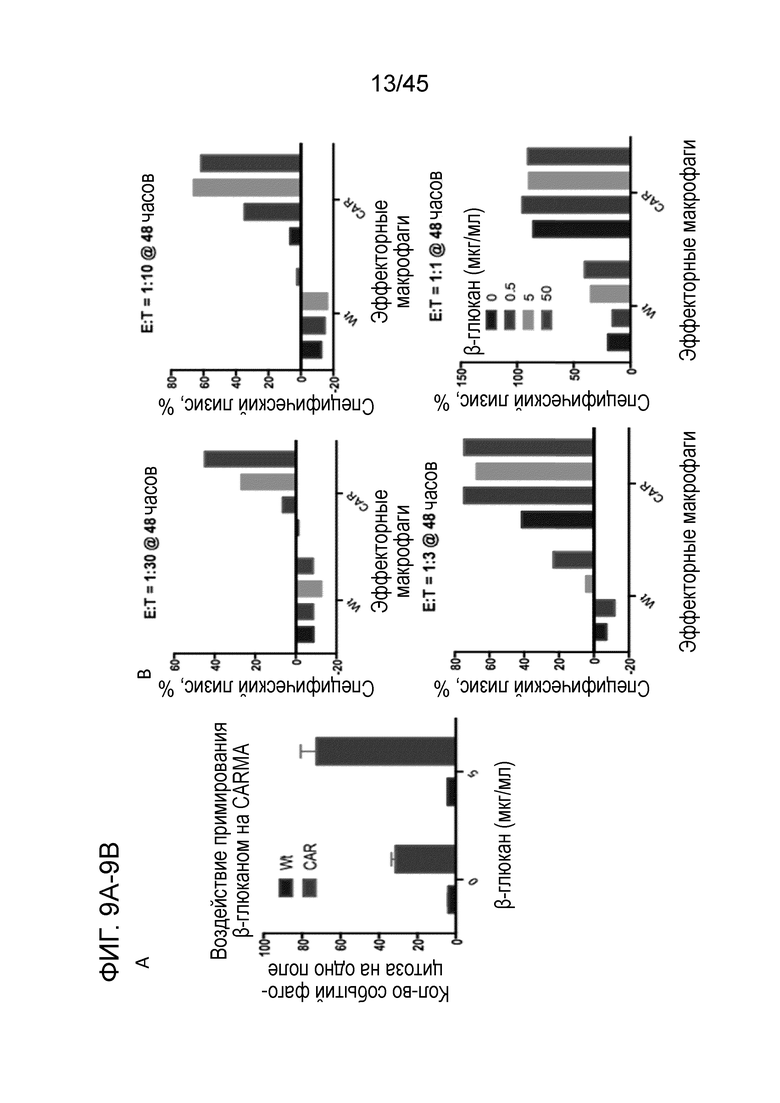
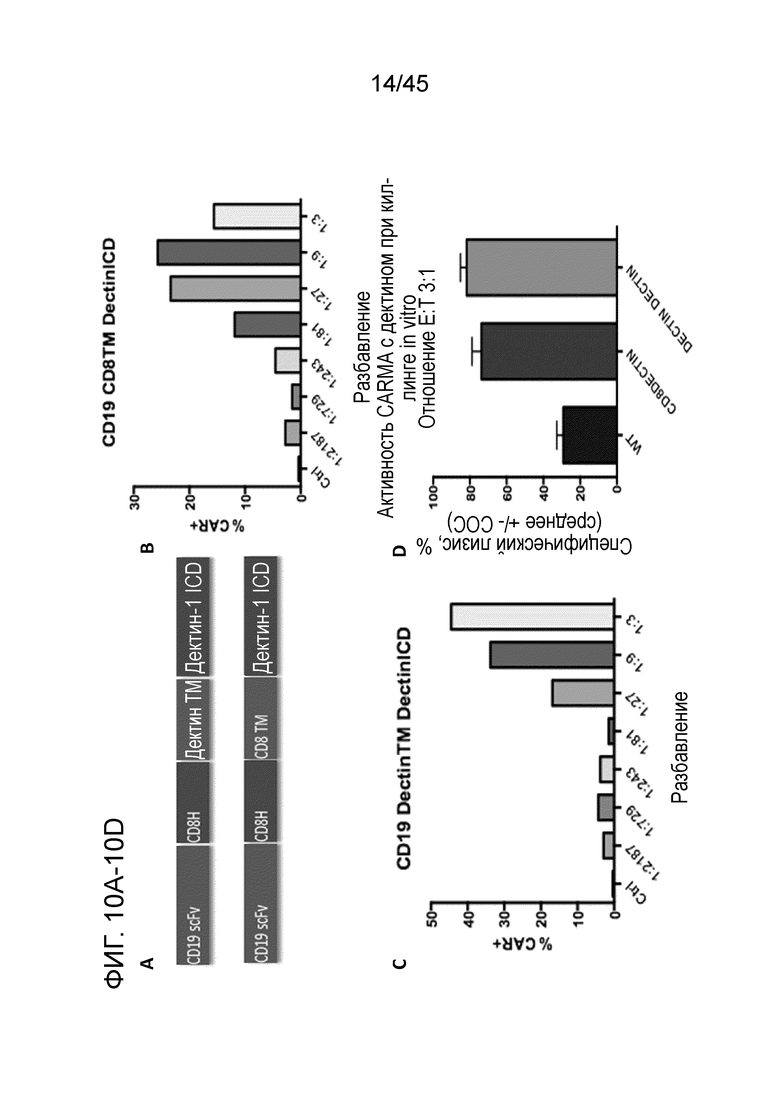
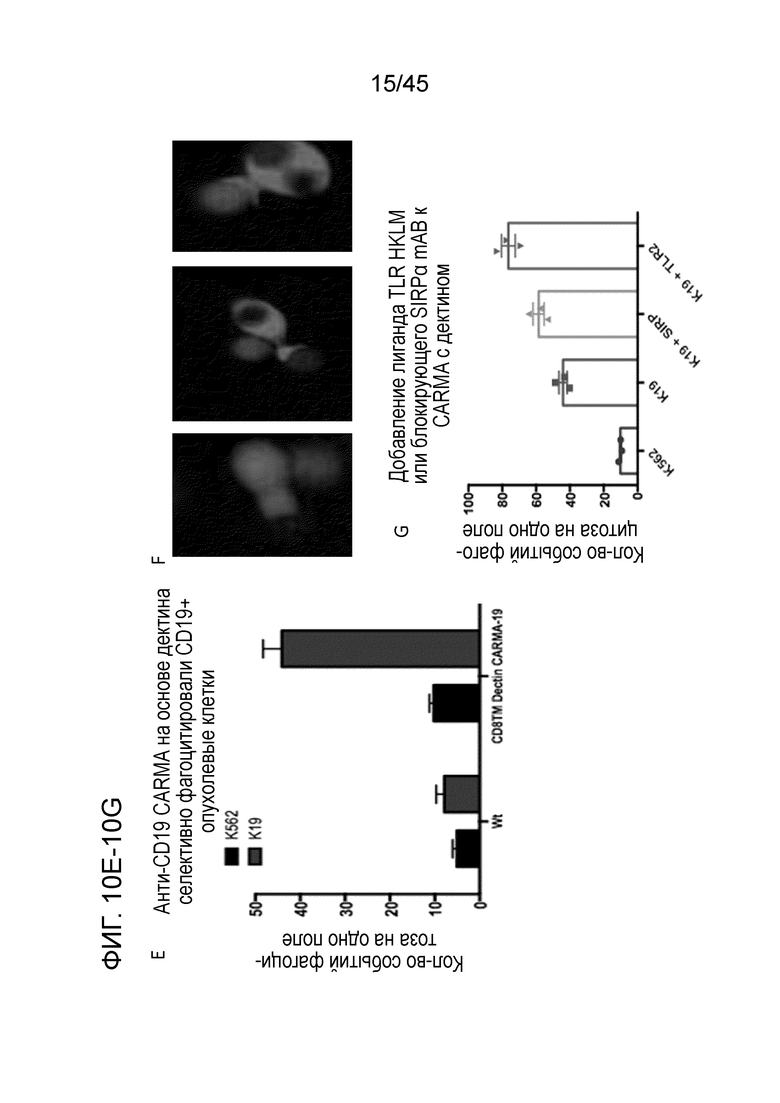
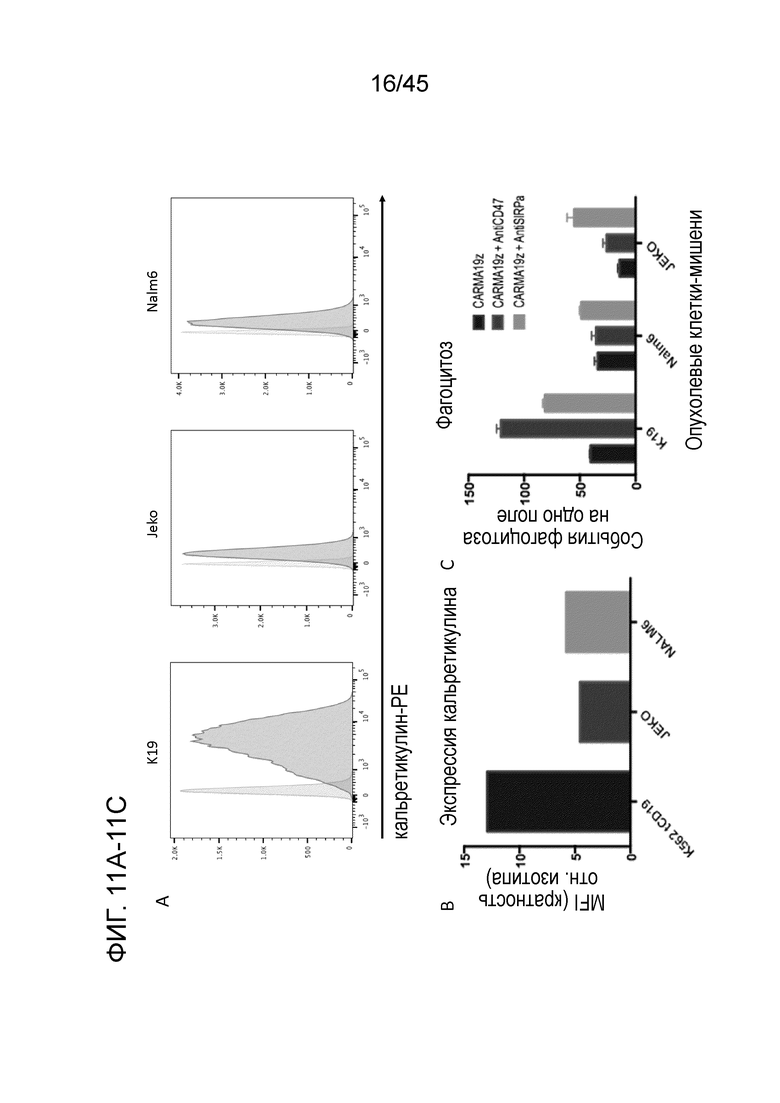
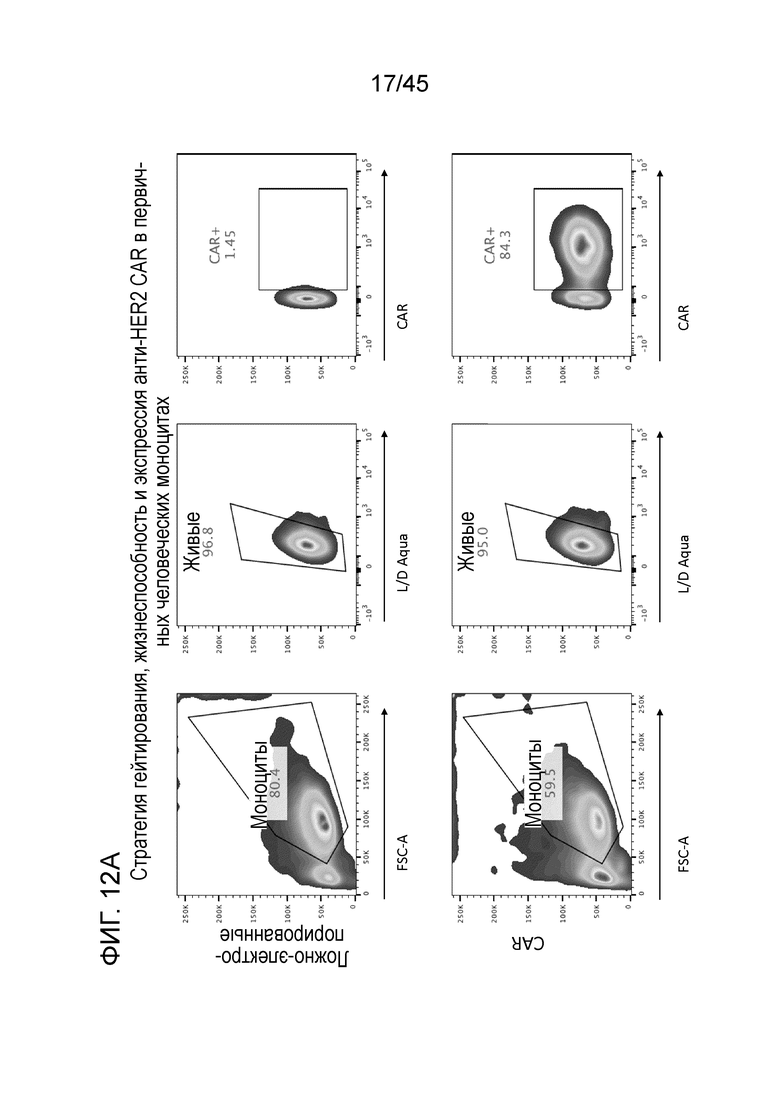
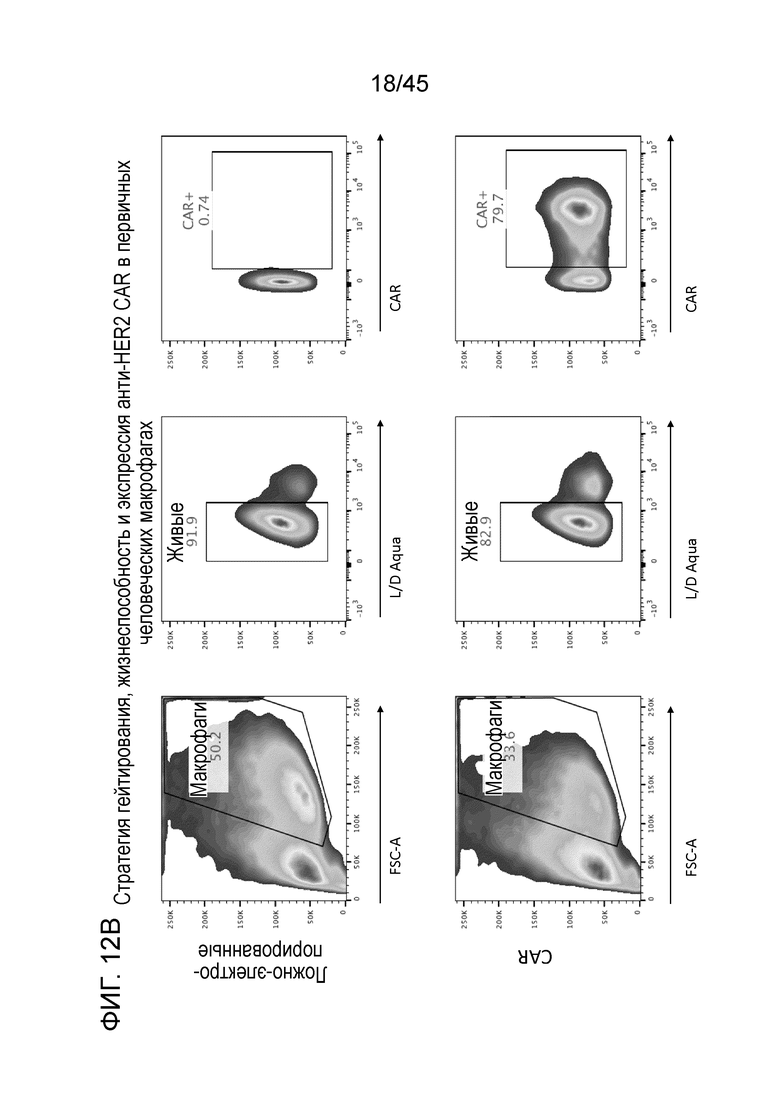
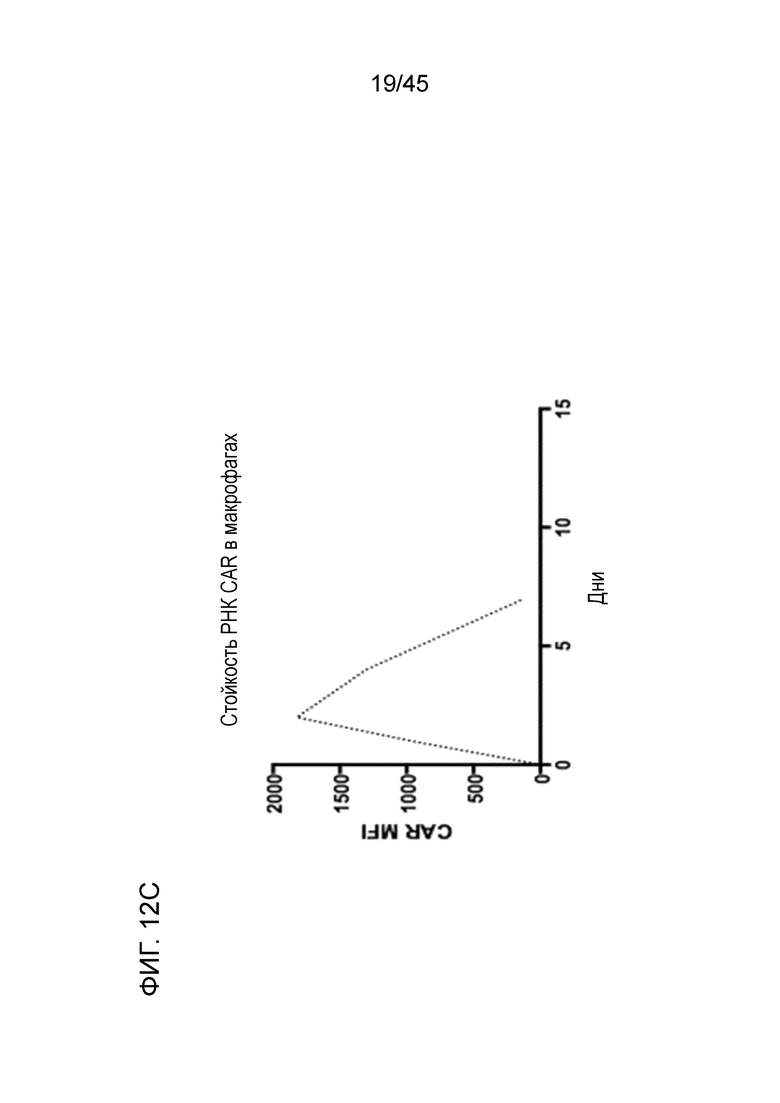
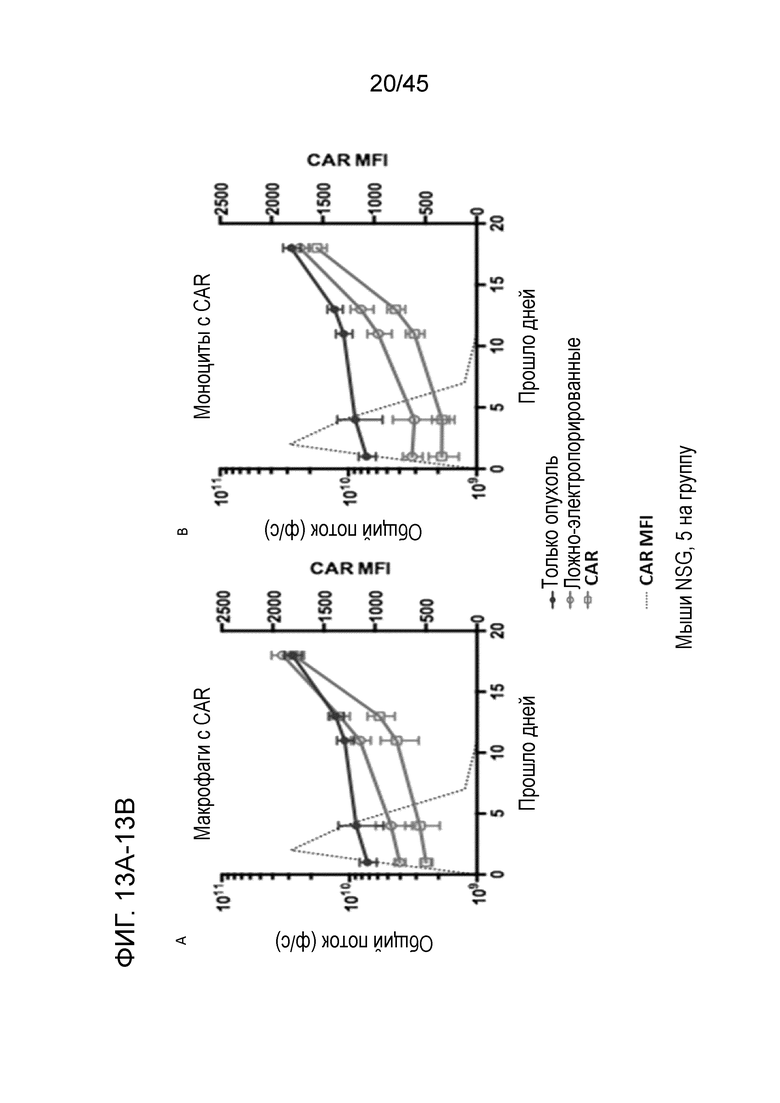
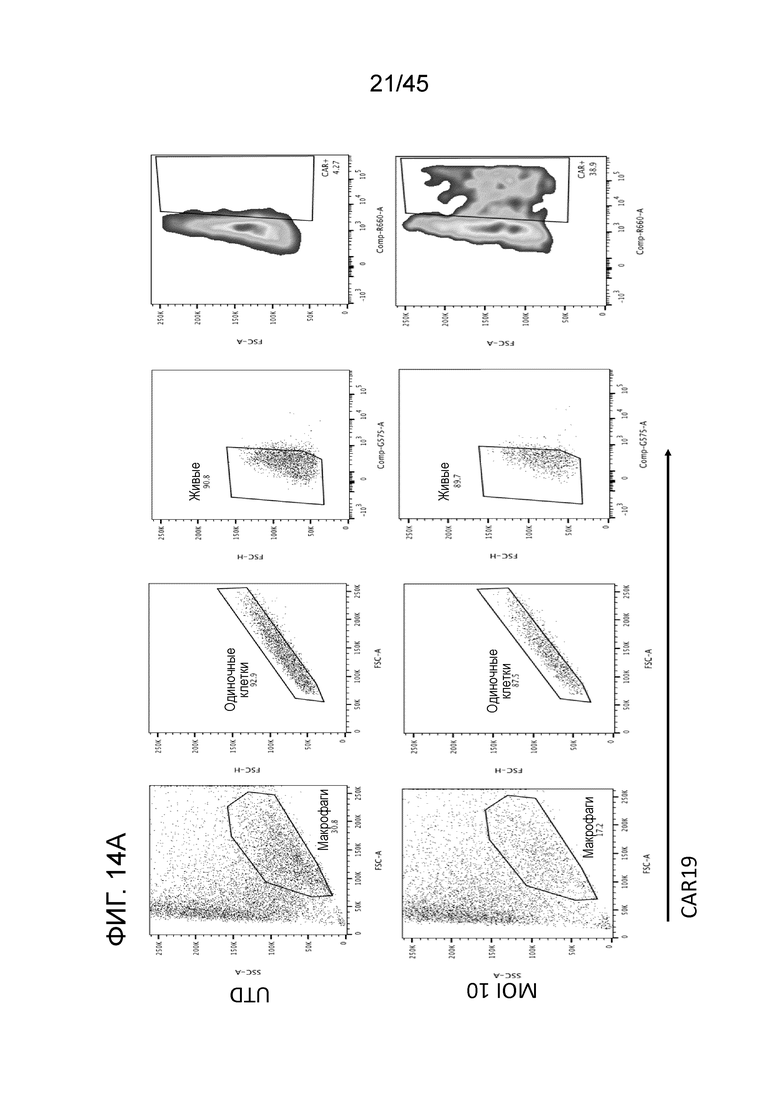
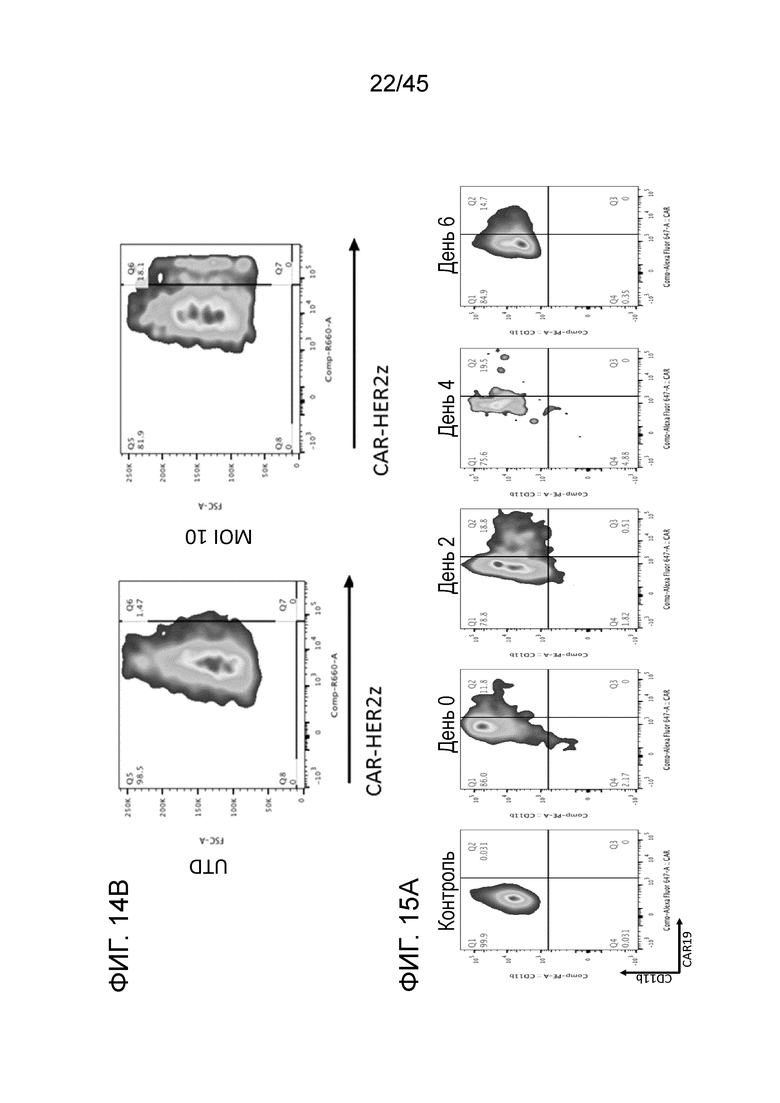

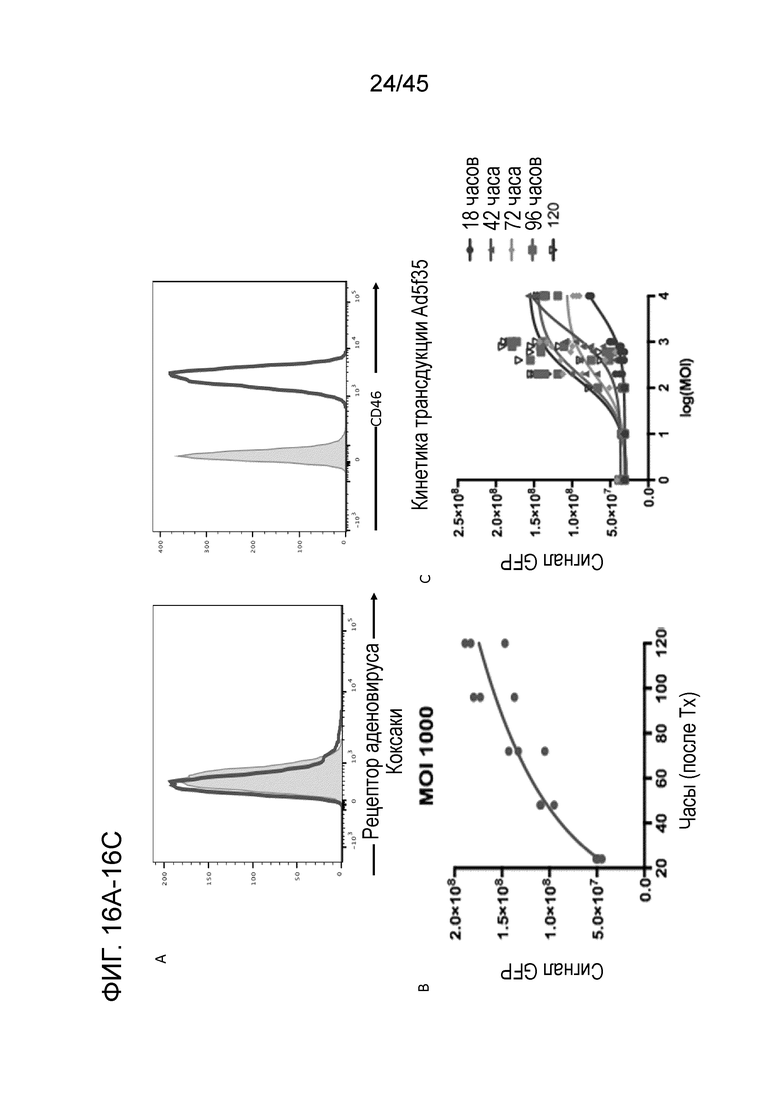
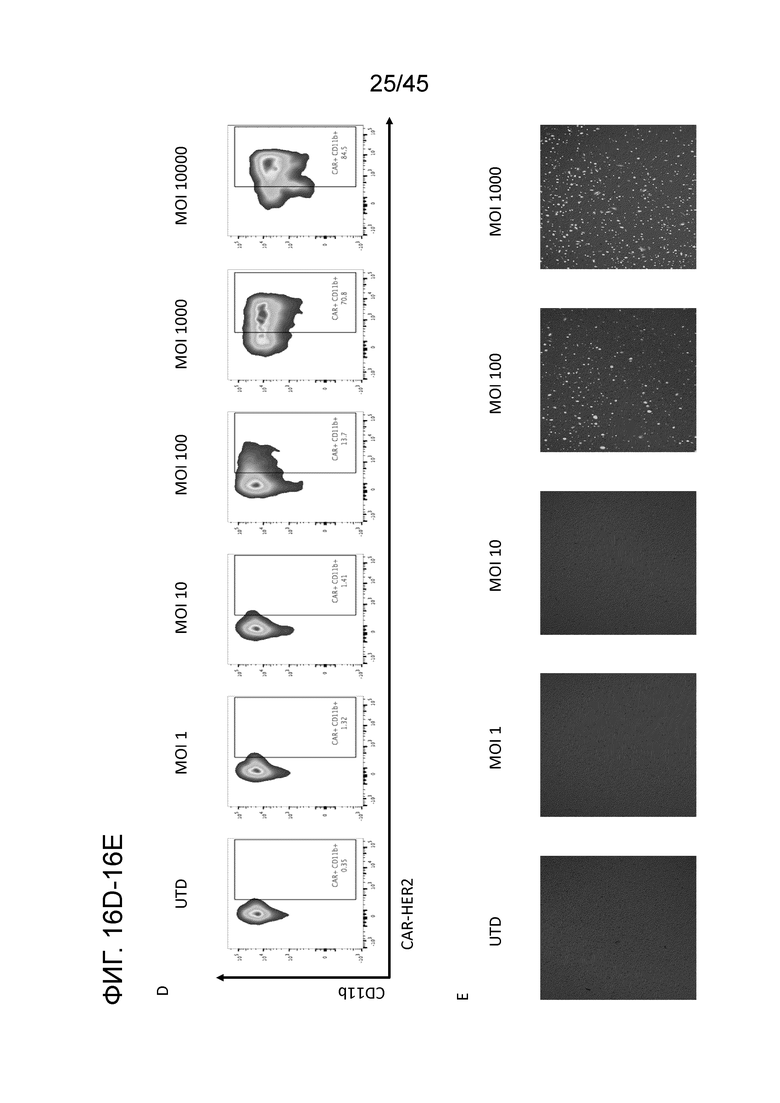

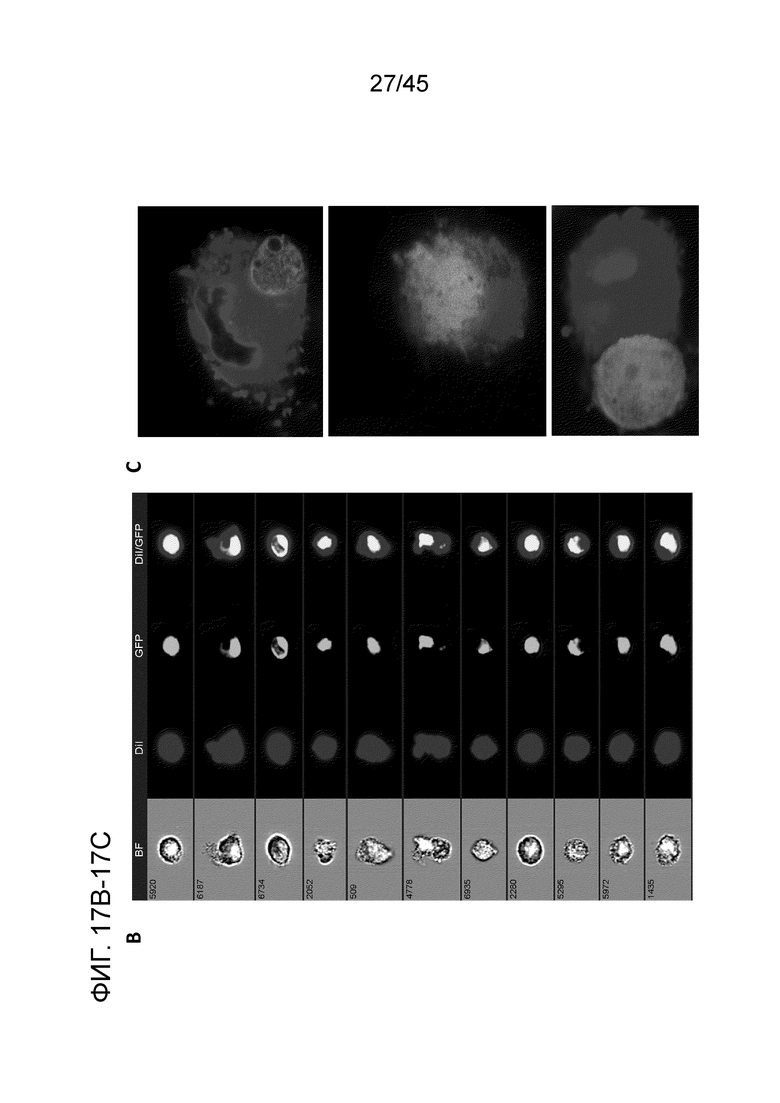
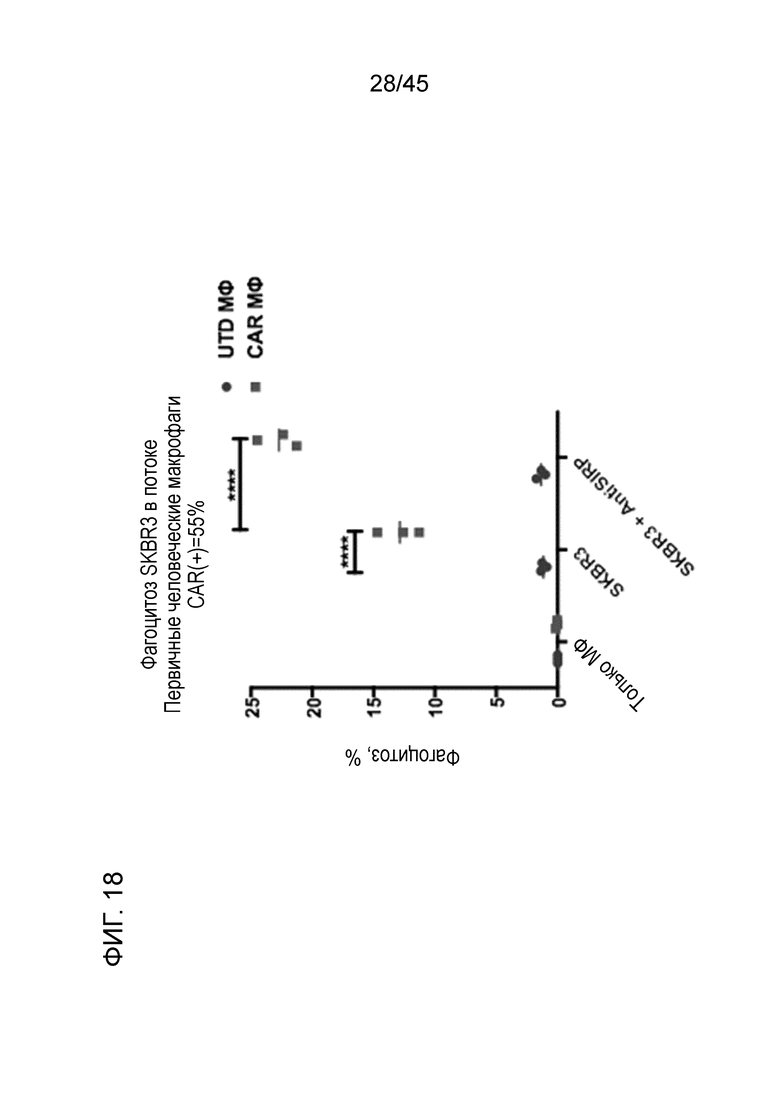
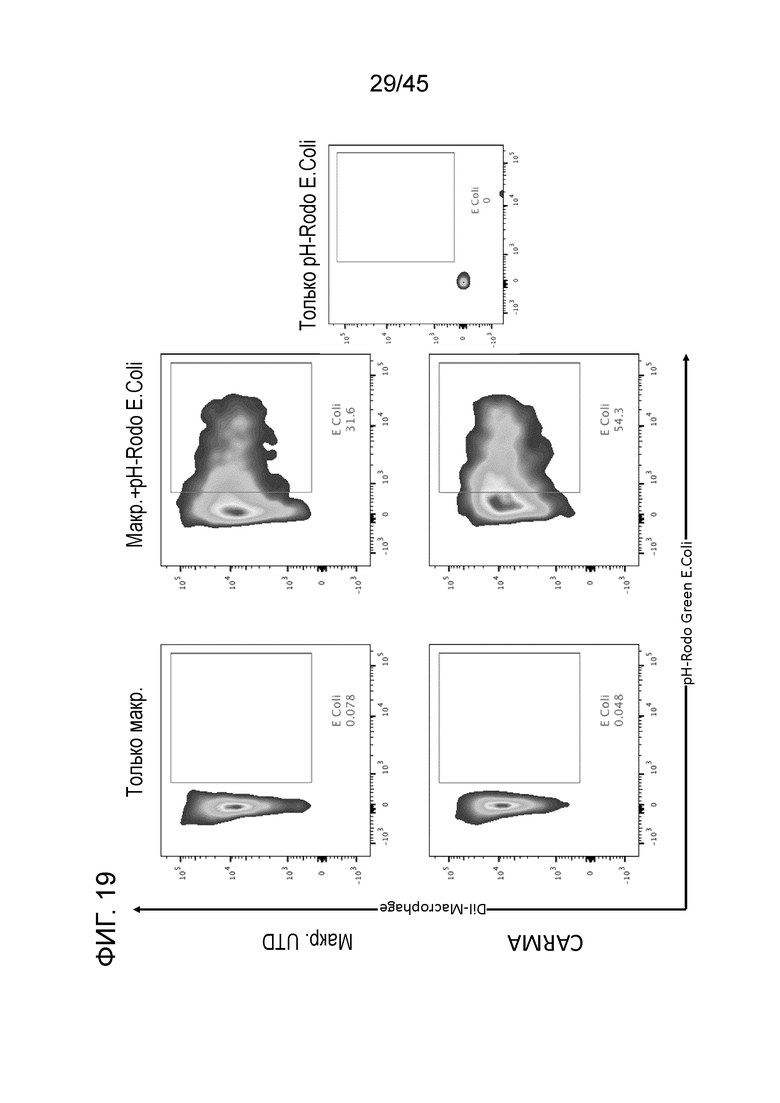
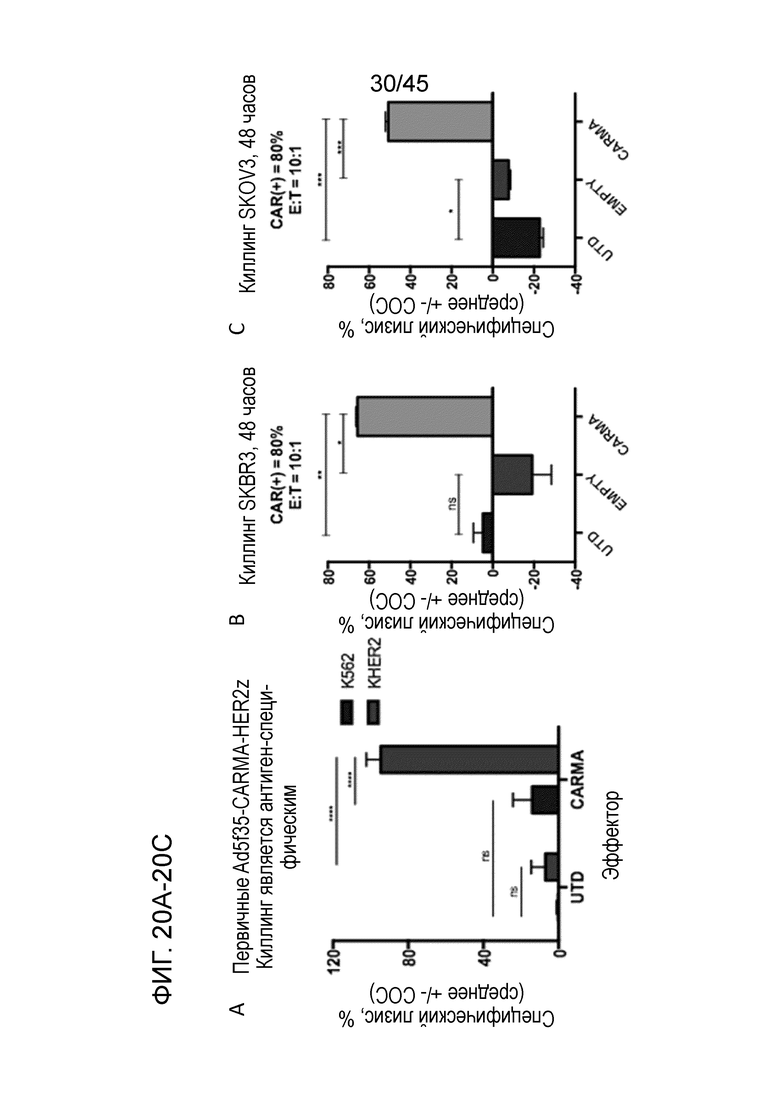
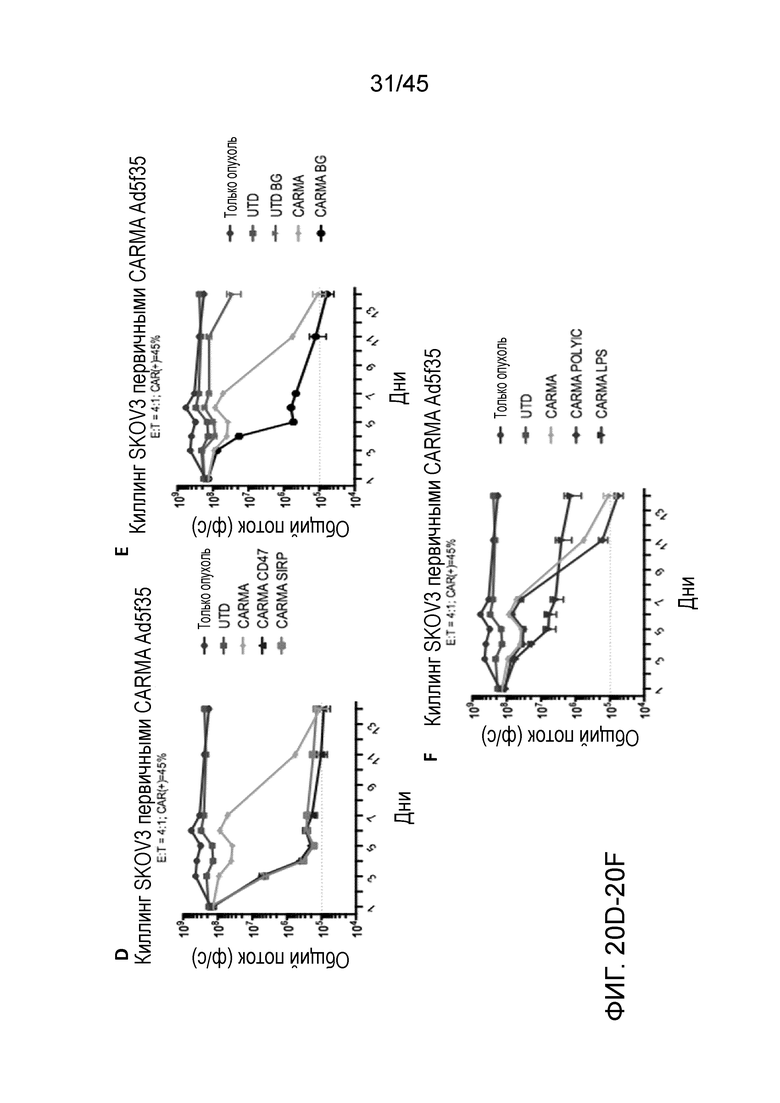
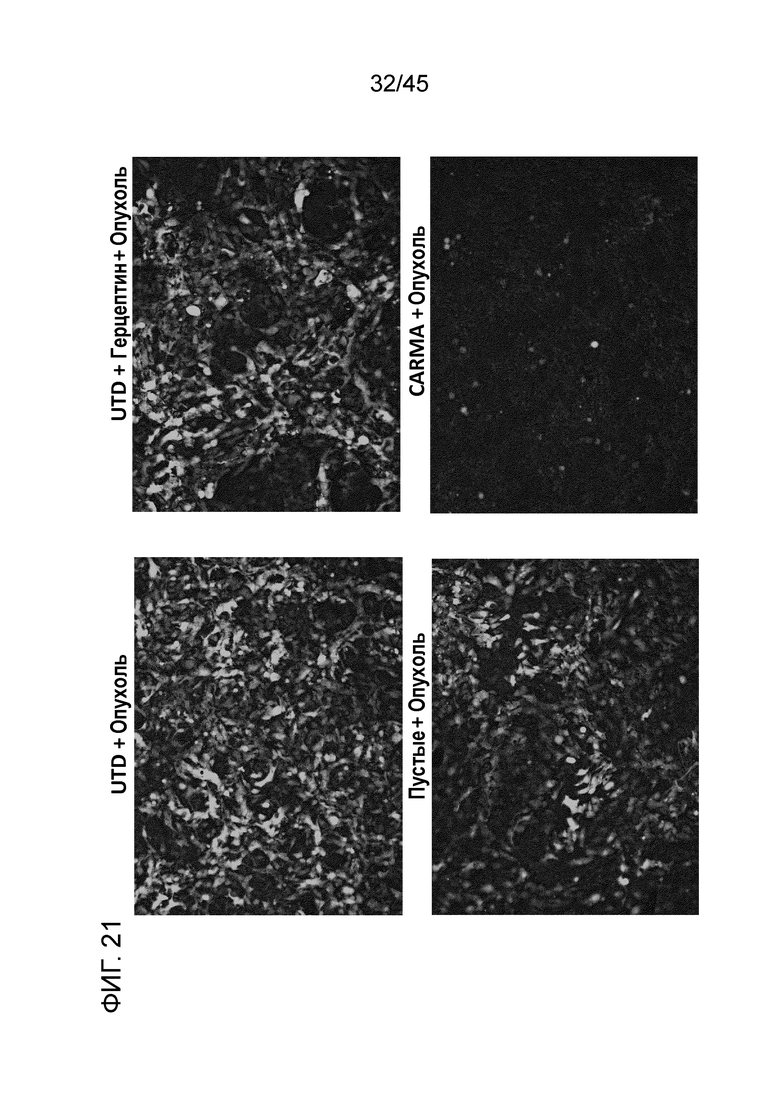
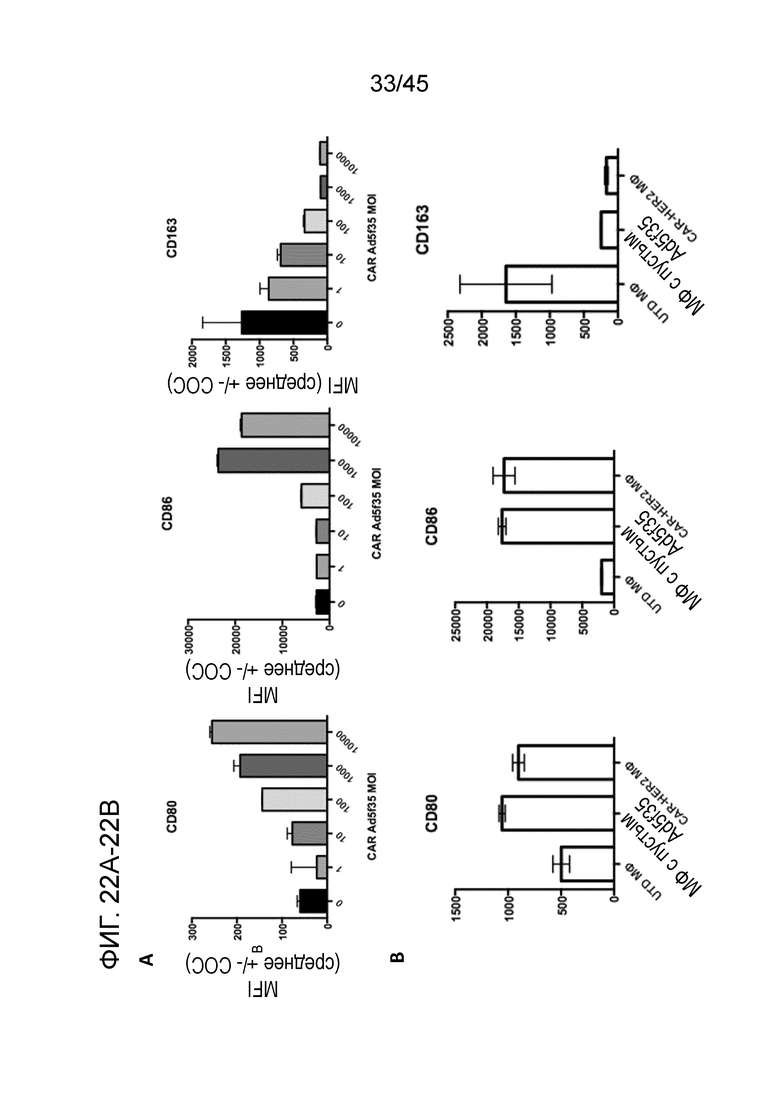
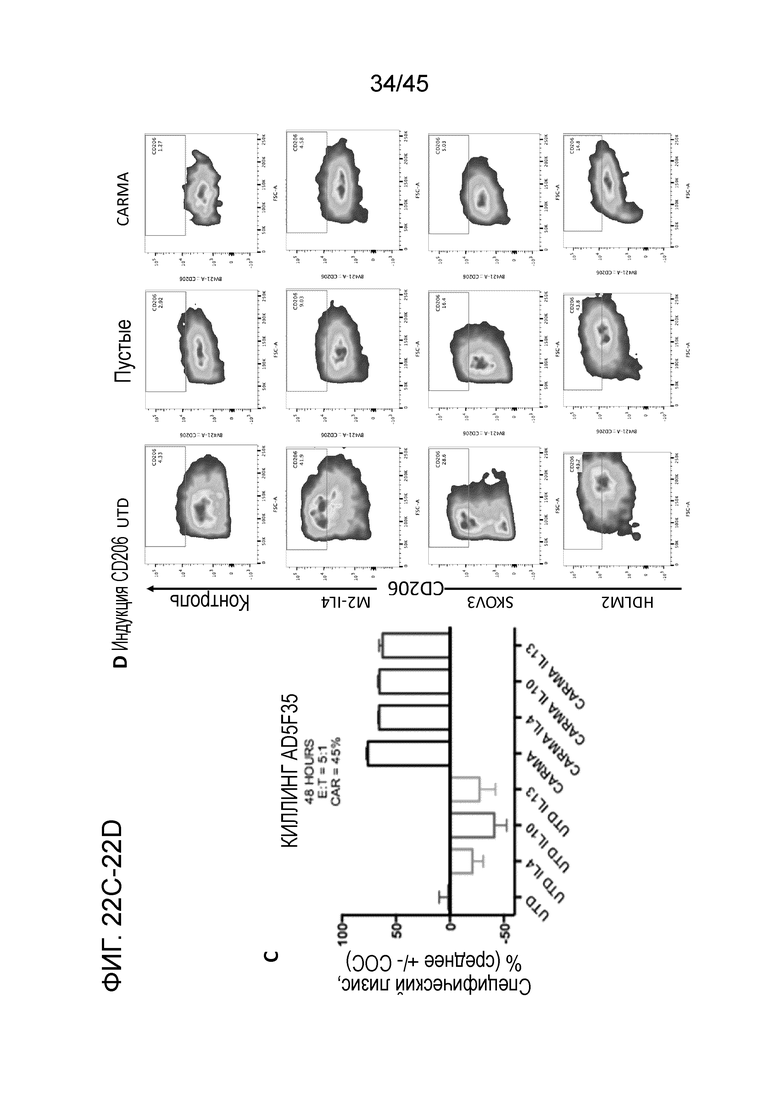
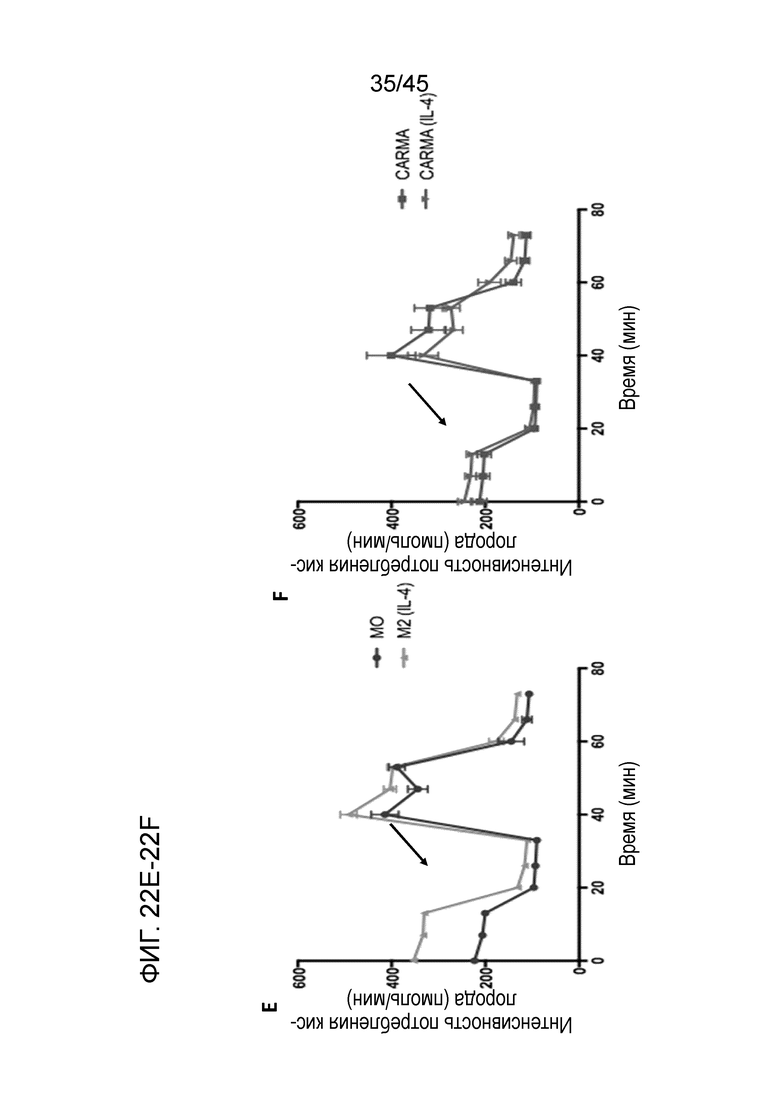
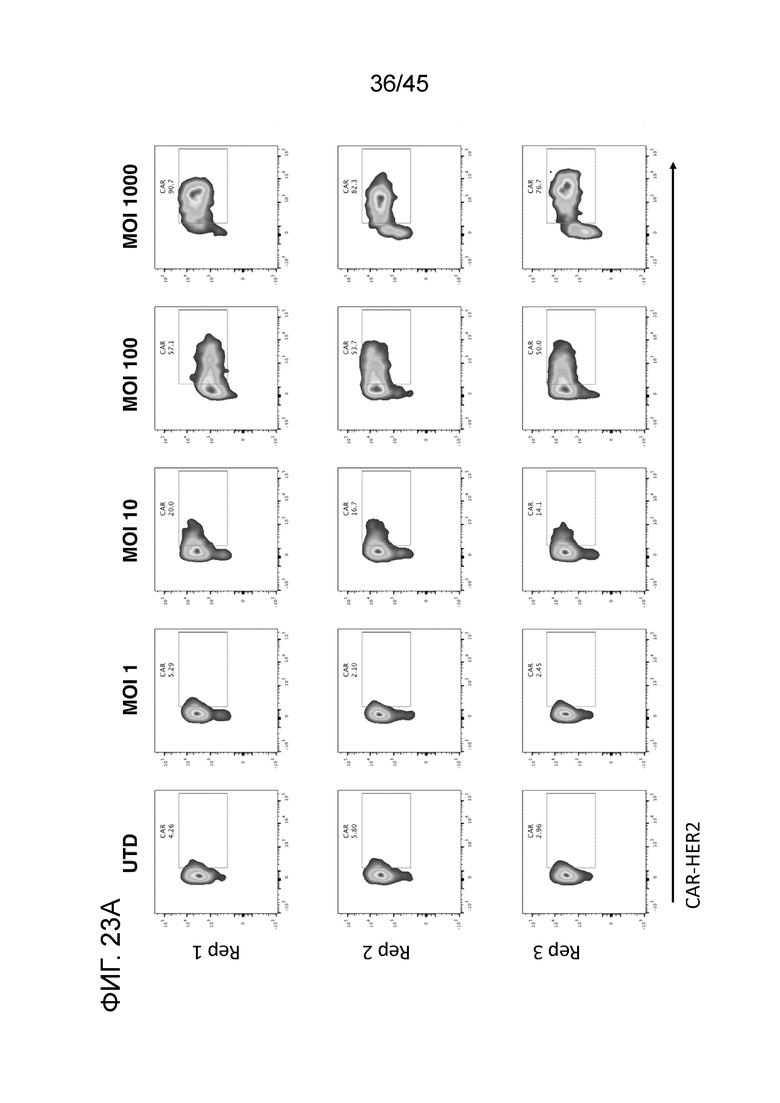
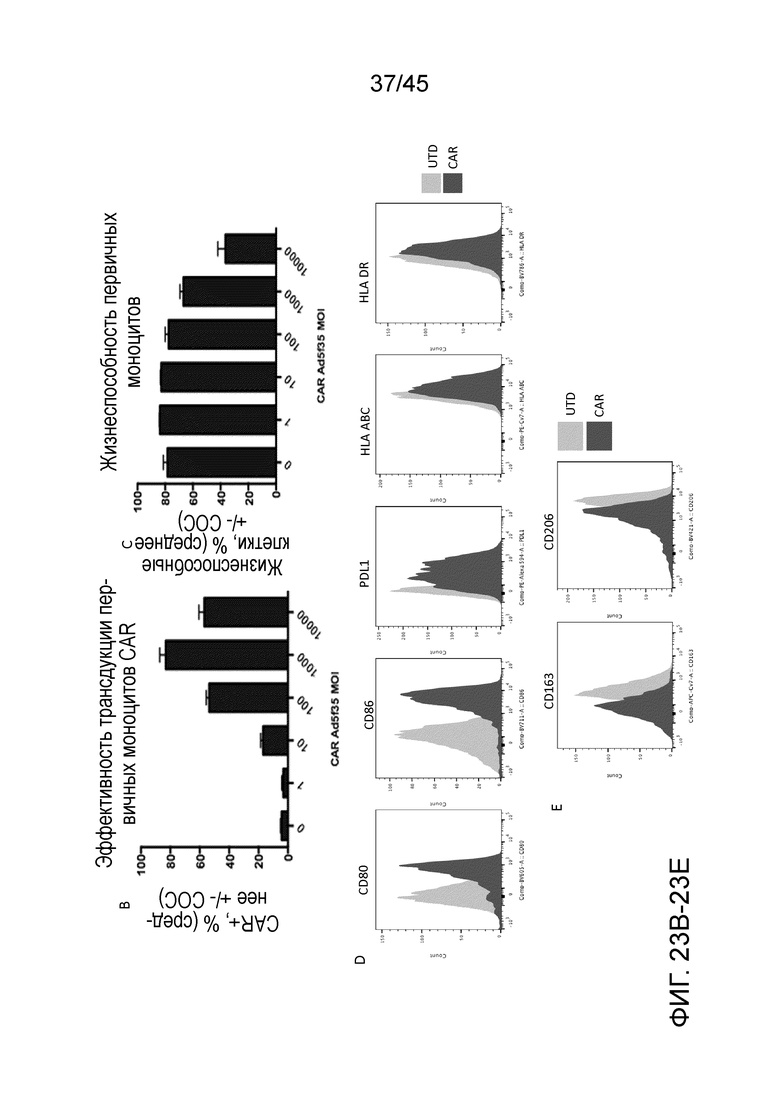
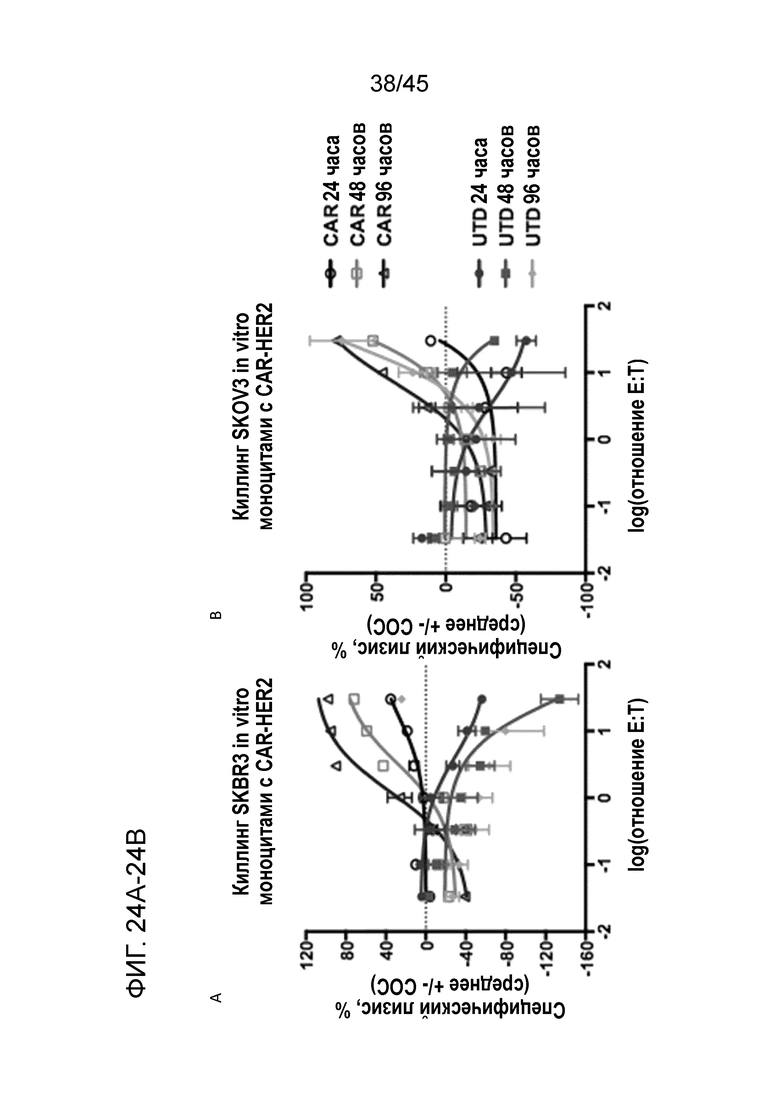
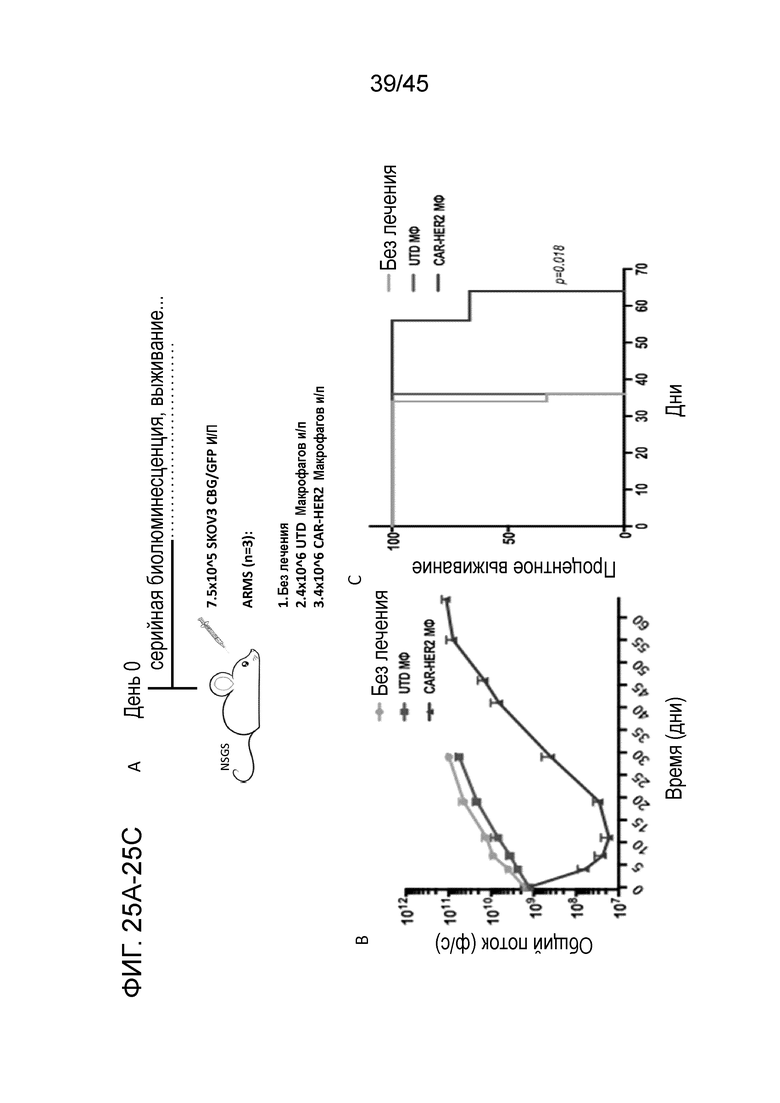
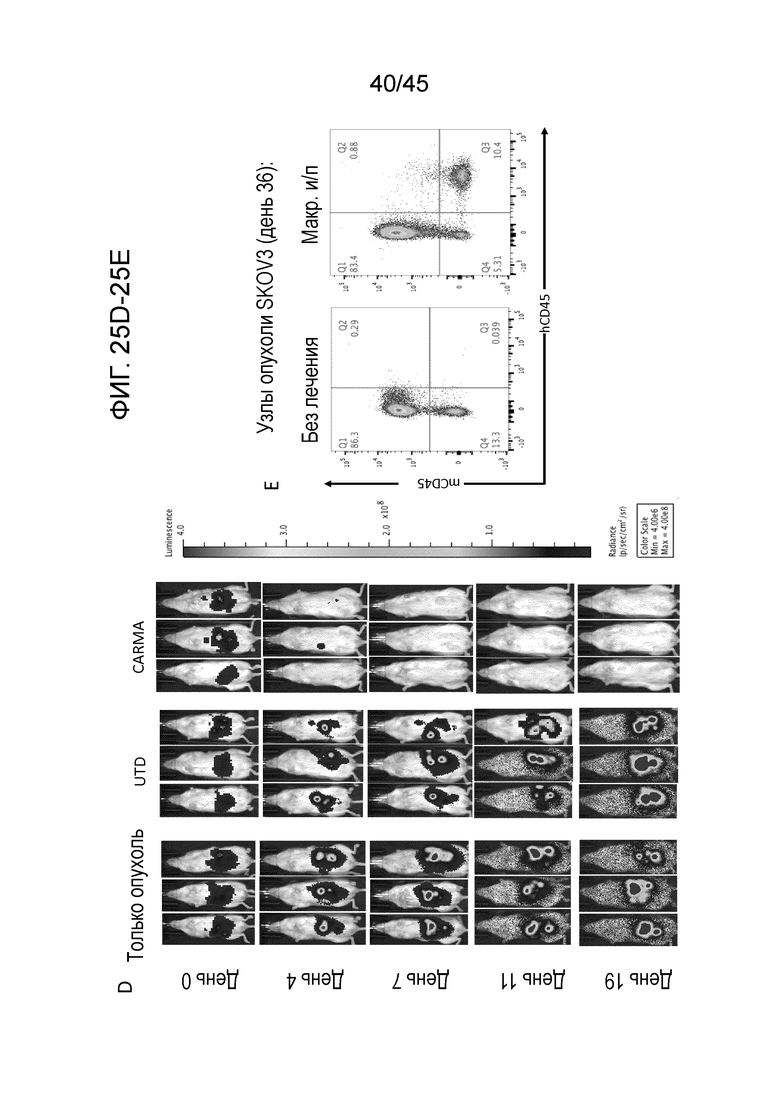
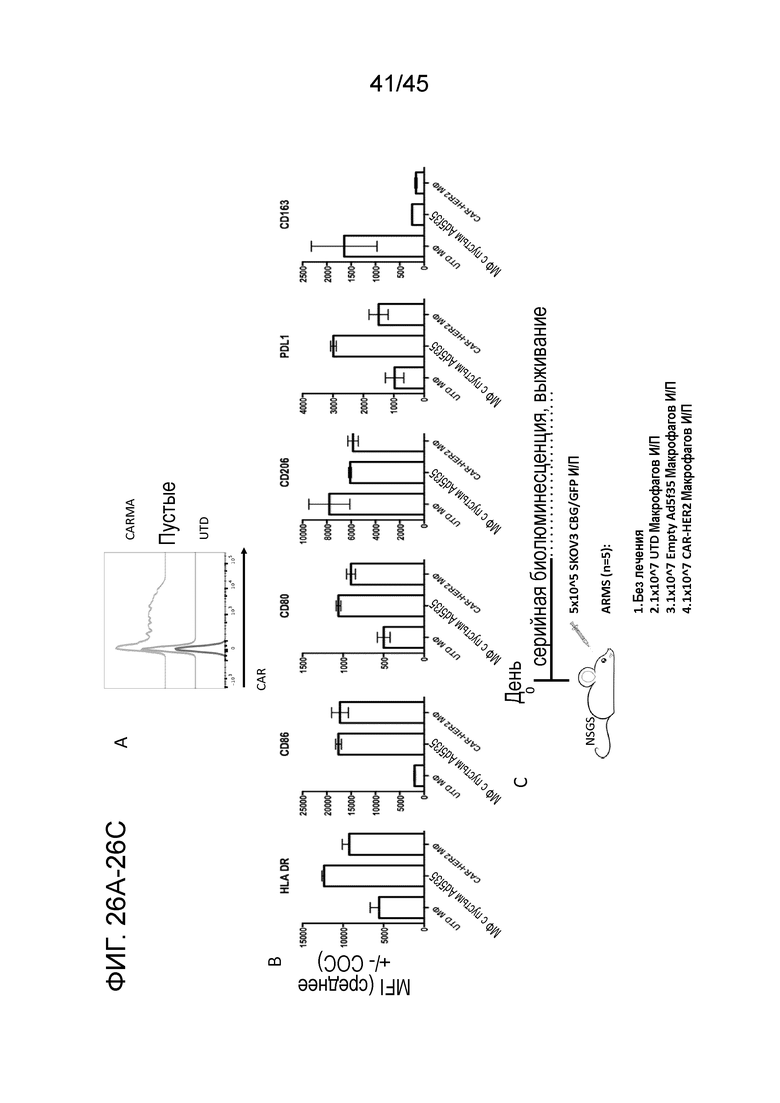
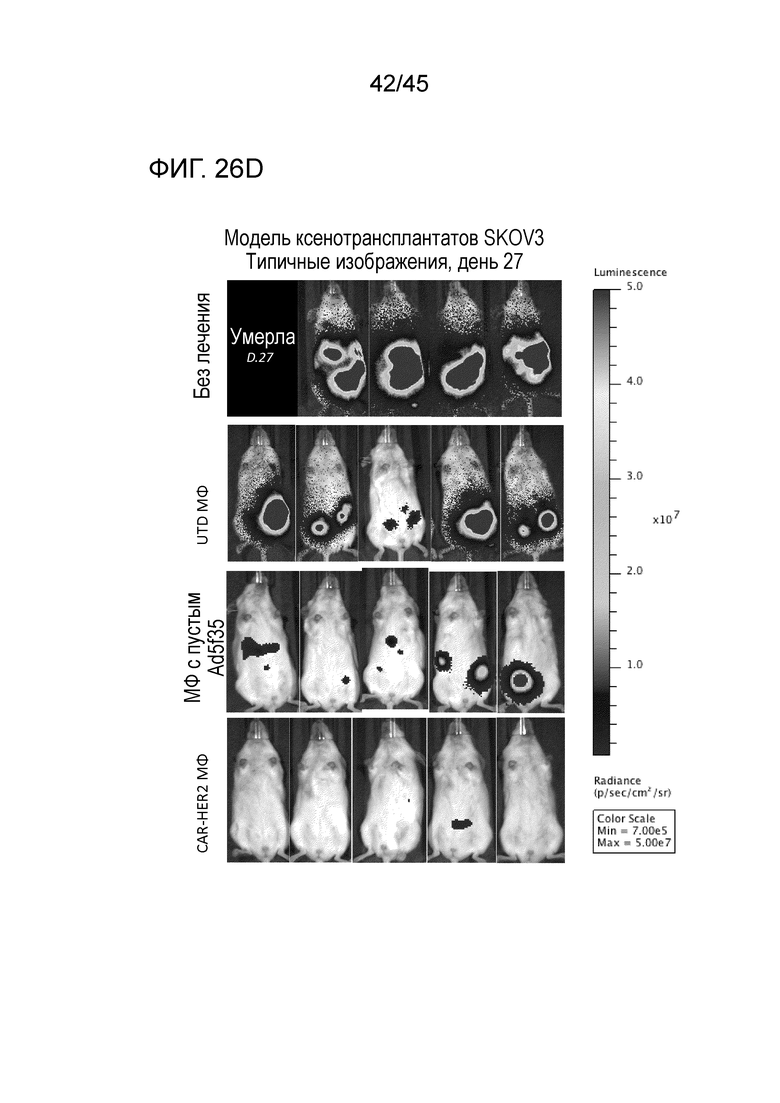
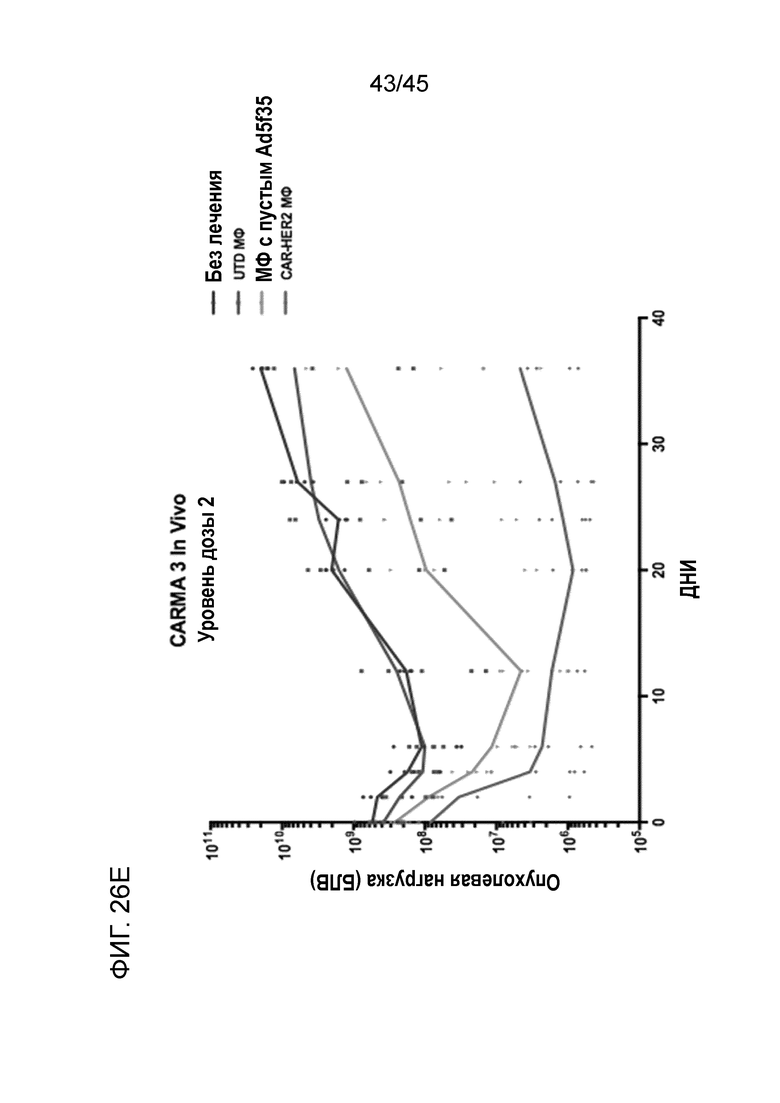
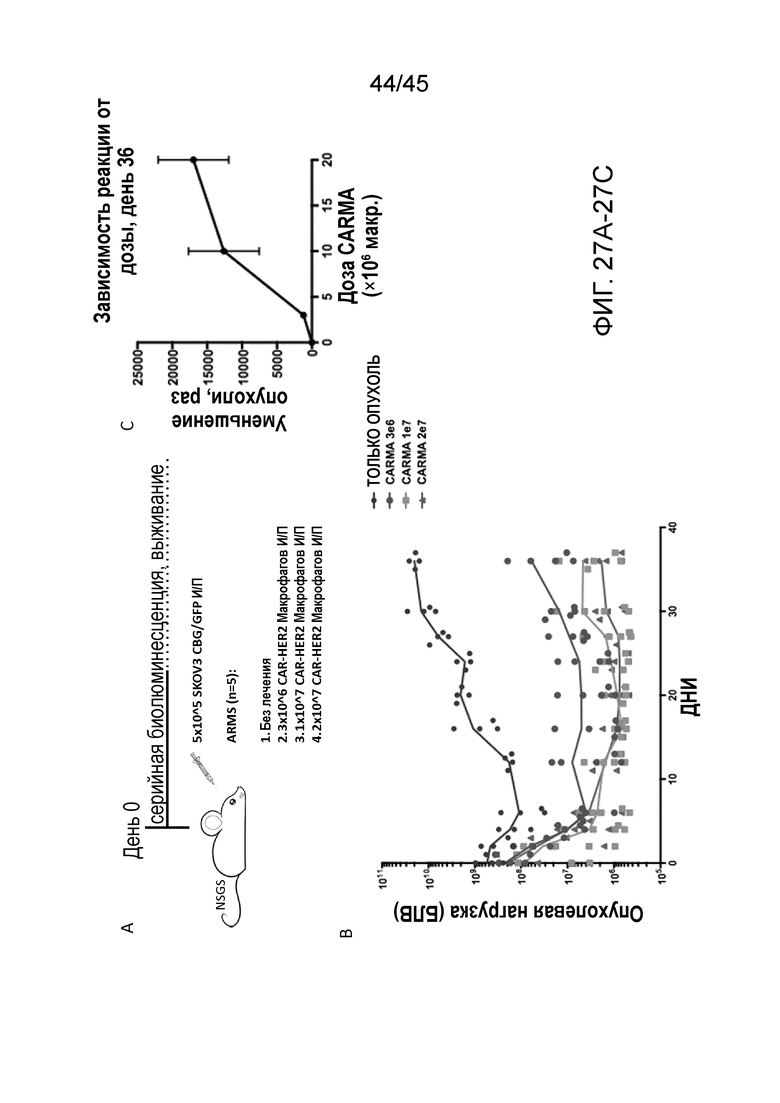
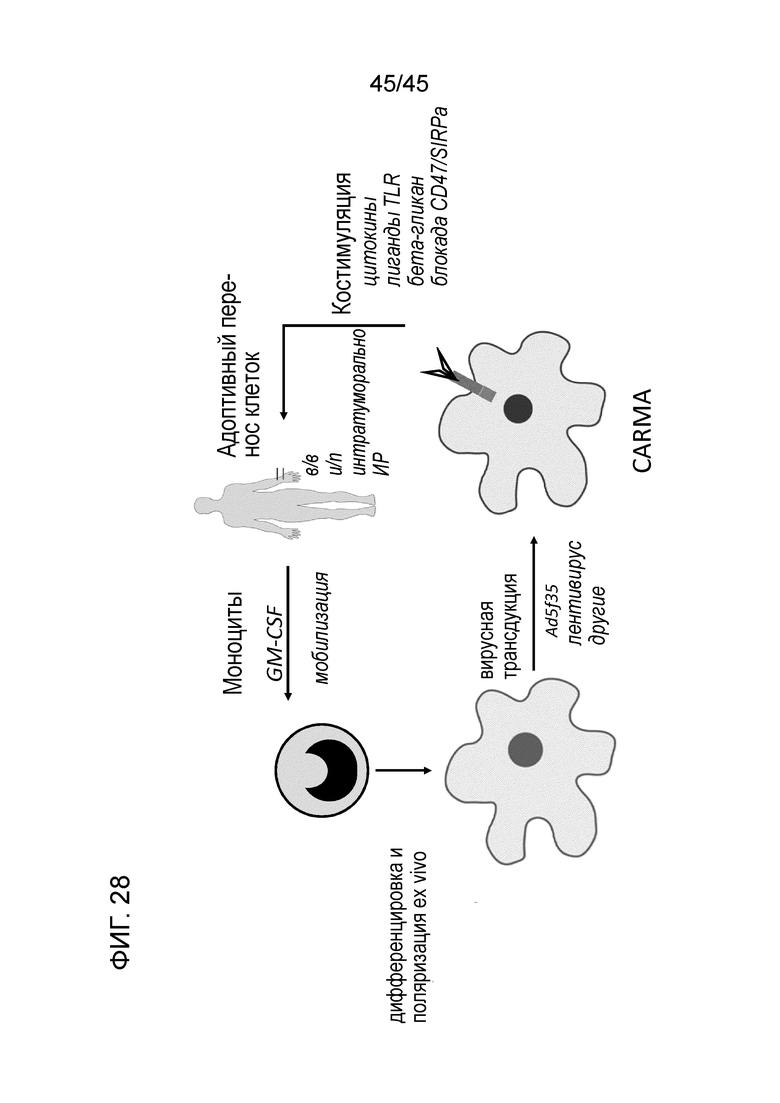
Изобретение относится к области биотехнологии, в частности к цитотоксической клетке, представляющей собой макрофаг, которая содержит CAR и аденовирусный компонент Ad5f35, а также к содержащей ее композиции. Также раскрыт способ приготовления указанной цитотоксической клетки, предусматривающий введение CAR в макрофаг с использованием аденовирусного вектора Ad5f35. Изобретение эффективно для лечения опухоли или рака, а также для стимуляции иммунного ответа на целевую опухолевую клетку или опухолевую ткань у субъекта. 10 н. и 12 з.п. ф-лы, 28 ил.
1. Цитотоксическая клетка, генетически модифицированная для экспрессии химерного антигенного рецептора (CAR), содержащая CAR, причем данный CAR содержит антигенсвязывающий домен, который связывается с антигеном, ассоциированным с опухолью или раком, трансмембранный домен и внутриклеточный домен стимулирующей и/или костимулирующей молекулы, причем указанная клетка представляет собой макрофаг, и где указанная клетка содержит аденовирусный компонент Ad5f35.
2. Цитотоксическая клетка, содержащая последовательность нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), причем последовательность нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий домен, который связывается с антигеном, ассоциированным с опухолью или раком, последовательность нуклеиновой кислоты, кодирующую трансмембранный домен, и последовательность нуклеиновой кислоты, кодирующую внутриклеточный домен стимулирующей и/или костимулирующей молекулы, причем данная клетка представляет собой макрофаг, который экспрессирует CAR, и где указанная клетка содержит аденовирусный компонент Ad5f35.
3. Цитотоксическая клетка по п. 1 или 2, в которой антигенсвязывающий домен CAR содержит антитело, выбранное из группы, состоящей из моноклонального антитела, поликлонального антитела, синтетического антитела, человеческого антитела, гуманизированного антитела, однодоменного антитела, одноцепочечного вариабельного фрагмента и их антигенсвязывающих фрагментов.
4. Цитотоксическая клетка по п. 1 или 2, в которой антигенсвязывающий домен CAR выбирают из группы, состоящей из анти-CD19 антитела, анти-HER2 антитела и их фрагмента.
5. Цитотоксическая клетка по п. 1 или п. 2, в которой внутриклеточный домен CAR содержит двойные сигнальные домены.
6. Цитотоксическая клетка по п. 1 или 2, дополнительно содержащая средство, выбранное из группы, состоящей из нуклеиновой кислоты, антибиотика, противовоспалительного средства, антитела или его фрагментов антитела, фактора роста, цитокина, фермента, белка, пептида, белка слияния, синтетической молекулы, органической молекулы, углевода и т.п., липида, гормона, микросомы, их производного или варианта и любой их комбинации.
7. Цитотоксическая клетка по п. 1 или 2, причем данная модифицированная клетка представляет собой макрофаг, который имеет по меньшей мере один повышенно отрегулированный маркер M1 и по меньшей мере один пониженно отрегулированный маркер M2 по сравнению с немодифицированным макрофагом.
8. Фармацевтическая композиция для лечения опухоли или рака, содержащая эффективное количество цитотоксической клетки по п. 1 или 2 и фармацевтически приемлемый носитель.
9. Применение цитотоксической клетки по п. 1 или 2 в производстве лекарственного средства для стимуляции иммунного ответа на целевую опухолевую клетку или опухолевую ткань у нуждающегося в этом субъекта.
10. Применение цитотоксической клетки по п. 1 или 2 в производстве лекарственного средства для лечения опухоли или рака у нуждающегося в этом субъекта.
11. Способ лечения заболевания или состояния, ассоциированного с опухолью или раком, у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей цитотоксическую клетку по п. 1 или 2.
12. Способ лечения опухоли у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей цитотоксическую клетку по п. 1 или 2.
13. Способ стимуляции иммунного ответа на целевую опухолевую клетку или опухолевую ткань у субъекта, содержащий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей цитотоксическую клетку по п. 1 или 2.
14. Способ приготовления цитотоксической клетки по п. 1, содержащий:
введение химерного антигенного рецептора (CAR) в макрофаг с использованием аденовирусного вектора Ad5f35, причем CAR содержит антигенсвязывающий домен, который связывается с антигеном, ассоциированным с опухолью или раком, трансмембранный домен и внутриклеточный домен стимулирующей и/или костимулирующей молекулы.
15. Способ по п. 14, в котором введение CAR в клетку содержит введение кодирующей CAR последовательности нуклеиновой кислоты.
16. Способ по п. 15, в котором введение последовательности нуклеиновой кислоты содержит электропорацию кодирующей CAR мРНК.
17. Способ по п. 15, в котором введение последовательности нуклеиновой кислоты содержит трансдукцию клетки вирусным вектором, содержащим кодирующую CAR последовательность нуклеиновой кислоты.
18. Способ по п. 14, в котором внутриклеточный домен CAR содержит двойные сигнальные домены.
19. Способ по п. 14, в котором антигенсвязывающий домен CAR содержит антитело, выбранное из группы, состоящей из синтетического антитела, человеческого антитела, гуманизированного антитела, однодоменного антитела, одноцепочечного вариабельного фрагмента и их антигенсвязывающих фрагментов.
20. Способ по п. 14, в котором антигенсвязывающий домен CAR выбирают из группы, состоящей из анти-CD19 антитела, анти-HER2 антитела и их фрагмента.
21. Способ по п. 14, дополнительно включающий введение средства в указанную клетку, причем средство выбирают из группы, состоящей из нуклеиновой кислоты, антибиотика, противовоспалительного средства, антитела или его фрагментов антитела, фактора роста, цитокина, фермента, белка, пептида, белка слияния, синтетической молекулы, органической молекулы, углевода и т.п., липида, гормона, микросомы, их производного или варианта и любой их комбинации.
22. Фармацевтическая композиция для лечения опухоли или рака, содержащая эффективное количество цитотоксической клетки, приготовленной по п. 14, где указанная цитотоксическая клетка содержит CAR, содержащий антигенсвязывающий домен, который связывается с антигеном, ассоциированным с опухолью или раком, трансмембранный домен и внутриклеточный домен стимулирующей и/или костимулирующей молекулы.
| BIGLARI A | |||
| et al., Human monocytes expressing a CEA-specific chimeric CD64 receptor specifically target CEA-expressing tumour cells in vitro and in vivo, Gene Therapy, 2006, Vol | |||
| Насос | 1917 |
|
SU13A1 |
| АППАРАТ ДЛЯ РАЗРЕЗАНИЯ ПЕРЕДВИГАЮЩЕЙСЯ НА ПОДВИЖНОМ СТОЛЕ ТОРФЯНОЙ ПОЛОСЫ ПРИ ПОМОЩИ НОЖЕЙ, УКРЕПЛЕННЫХ НА ПОВЕРХНОСТИ БАРАБАНА | 1922 |
|
SU602A1 |
| CARMEN S.M., YONG et al., Using Electroporation to Determine Function of a Chimeric Antigen Receptor in T Cell and Macrophage Cell Lines, The Open Gene | |||
Авторы
Даты
2022-03-15—Публикация
2016-07-28—Подача