Родственная заявка
[0001] По данной заявке испрашивается приоритет и преимущество относительно заявки на выдачу патента США № 62/051,794, поданной 17 сентября 2014 года, содержание которой включено во всей ее полноте посредством ссылки.
Область техники, к которой относится настоящая заявка
[0002] В общем, раскрытые в настоящем документе варианты осуществления относятся к местному введению сочетания первого действующего вещества, например, фармацевтического соединения или его соли, и второго действующего вещества для лечения офтальмологических заболеваний или состояний. Раскрытые в настоящем документе варианты осуществления включают в себя офтальмологические составы, содержащие первое действующее вещество или его соль и второе действующее вещество, где состав представляет собой раствор или суспензию. Раствор или суспензия могут дополнительно содержать солюбилизатор и являются пригодными для доставки первого действующего вещества или его соли в задний отдел глаза, защищая в то же время передний отдел глаза субъекта.
Предпосылки создания изобретения
[0003] Лечение заболеваний или нарушений заднего отдела глаза местно вводимыми действующими веществами не было эффективным вследствие неэффективной доставки действующего вещества в целевое место назначения. Подавляющее большинство лекарств для местного применения проникает через роговицу. Однако, роговица неодинаково проницаема для всех местно вводимых действующих веществ, поскольку относительную проницаемость действующего вещества определяет основная структура роговицы. Действительно, наибольшим барьером для проникновения действующего вещества является эпителий роговицы, который изобилует клеточными мембранами, а потому более предрасположен к проникновению липофильных средств. И наоборот, поскольку строма роговицы в значительной мере состоит из воды, то действующие вещества проникают через нее легче, если они представляют собой гидрофильные вещества. Эндотелий представляет собой монослой, который вновь является липофильным. Действующие вещества, которые являются липофильными или амфифильными, то есть могут вести себя как заряженные, так и как незаряженные, лучше всего проникают через роговицу. По аналогии с роговицей, липофильные или двухфазные вещества того же типа могут проникать в конъюнктивальный эпителий или в кровеносные сосуды внутри конъюнктивального эпителия или под ним. Однако, вследствие природы липофильных мембран в конъюнктиве и ее естественной сосудистой системе, большинство действующих веществ обычно не проникает через конъюнктиву и внутрь глаза. Вещества с ограниченной проницаемостью в сосудистые ткани в конъюнктивальных и субконъюктивальных областях «смываются» в системное кровообращение.
[0004] Вследствие ограниченной проницаемости многих капель для местного применения через роговичный и конъюнктивальные барьеры, основным недостатком капель для местного применения может являться необходимость высокой концентрации действующих веществ в составе для местного применения с целью достижения значимых терапевтических уровней лекарства во внутренних тканях глаза. В зависимости от действующего вещества, самой молекулы или ее высоких концентраций, состав для местного применения может быть токсичным для переднего отдела глаза, включая конъюнктиву, роговицу и/или хрусталик, вызывая различные повреждения поверхности глаза, такие как дефекты эпителия роговицы и эрозии.
[0005] Офтальмологические побочные эффекты, наблюдаемые после лечения анти-EGFR лекарственными средствами, например, противораковыми анти-EGFR лекарственными средствами, пролили свет на ключевую роль, которую играет EGFR-зависимый путь передачи сигналов в поддержании и восстановлении здоровья эпителия роговицы человека. У пациентов, получавших анти-EGFR лекарственные средства, могут развиваться изменения роговицы, такие как дегенерация и дефекты эпителия, изъязвление, истончение эпителия роговицы, эрозии и/или отек роговицы, кератит, а также перфорация, при проведении терапии или даже после окончания анти-EGFR терапии. Важная роль EGFR-зависимого пути передачи сигнала в гомеостазе и патофизиологии эпителия роговицы хорошо известна. Активация EGFR одновременно необходима и достаточна для миграции, пролиферации и дифференцировки эпителия роговицы. Кроме того, EGFR является первичным медиатором заживления ран в экспериментах in vitro с иммортализованными клетками эпителия роговицы человека. Поэтому, лечение офтальмологических заболеваний или нарушений (например, заболеваний или нарушений заднего отдела глаза) могло бы выигрывать от введения средства, сохраняющего активность EGFR, в дополнение к введению состава, содержащего действующее вещество (например, действующее вещество, характеризующееся токсическим или анти-EGFR действием).
[0006] Настоящая заявка относится к новым составам, которые преодолевают проблемы, встречающиеся при офтальмологической доставке существующих терапевтических средств для местного применения. Настоящая заявка обеспечивает сочетанные эффекты снижения воздействия лекарств на роговицу и передний отдел глаза и защиты роговицы и тканей переднего отдела глаза, увеличивая при этом биодоступность заднего отдела глаза. Посредством снижения воздействия на роговицу, защиты тканей роговицы и увеличения биодоступности заднего отдела, состав согласно настоящей заявке улучшает офтальмологическую переносимость и увеличивает терапевтический индекс действующего вещества.
Сущность настоящего изобретения
[0007] Настоящая заявка относится к фармацевтическим составам в форме раствора и/или суспензии, которые снижают воздействие первого действующего вещества в переднем отделе глаза, например, на поверхности глаза, состоящей из роговицы и конъюнктивы, и защищают глаз, например передний отдел глаза, посредством поддержания активности EGFR. Фармацевтические составы согласно настоящей заявке увеличивают биодоступность первого действующего вещества в заднем отделе глаза, например, в центральной части сосудистой оболочки и/или в центральной части сетчатки, и защищают и/или улучшают состояние переднего отдела глаза.
[0008] Настоящая заявка обеспечивает состав, содержащий первое действующее вещество и необязательно второе действующее вещество, в форме раствора или суспензии с лучшими характеристиками по сравнению с композицией в форме геля. Настоящая заявка предусматривает, что первое действующее вещество и/или второе действующее вещество могут быть включены вместе в состав в виде раствора и/или суспензии. Повышенное содержание первого действующего вещества в переднем отделе глаза ограничивают офтальмологическую переносимость капель для местного применения, содержащих первое действующее вещество, и могут вызывать дефекты эпителия роговицы и эрозии. Присутствие второго действующего вещества может предотвращать повреждение, которое может быть обусловлено воздействием первого действующего вещества, оказывать лечебное воздействие на повреждение, которое может быть обусловлено воздействием первого действующего вещества, и/или улучшать общее состояние поверхности глаза, в частности эпителия роговицы. Второе действующее вещество может быть включено в состав вместе с первым действующим веществом, или представлено в виде отдельного состава, который вводят в сочетании с составом, содержащим первое действующее вещество.
[0009] Составы согласно настоящей заявке снижают воздействие первого действующего вещества на передний отдел глаза, такой как поверхность роговицы или конъюнктивы, защищают от повреждений и/или восстанавливают повреждения переднего отдела глаза, такого как поверхность роговицы или конъюнктивы, и поддерживают адекватные концентрации первого действующего вещества, необходимые для связывания с соответствующими рецепторами в тканях-мишенях, и обеспечивают терапевтический эффект в заднем отделе глаза, таком как сосудистая оболочка или сетчатка.
[0010] Настоящая заявка относится к составам и способам, применимым для лечения патологических состояний, которые являются результатом ангиогенеза, неоваскуляризации и/или транссудации глаза или усугубляются ими, например, при диабетической ретинопатии (включая фоновую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию и диабетический макулярный отек); возрастной макулярной дегенерации (AMD) (включая неоваскулярную (влажную/экссудативную) AMD, сухую AMD и географическую атрофию сетчатки); патологической неоваскуляризации (CNV) сосудистой оболочки и транссудации любого механизма (например, при миопии высокой степени, травме, серповидно-клеточной анемии; гистоплазмозе глаза, ангиодных полосах сетчатки, травматическом повреждении сосудистой оболочки, друзах зрительного нерва или некоторых дистрофиях сетчатки); патологической неоваскуляризации сетчатки и транссудации любого механизма (например, при серповидно-клеточной анемии, болезни Илза, глазном ишемическом синдроме, каротидно-кавернозном свище, семейной экссудативной витреоретинопатии, синдроме повышенной вязкости крови, идиопатическом окклюзионном артериолите, дробьевидной ретинохороидопатии, васкулите сетчатки, саркоидозе или токсоплазмозе); увеите; окклюзии вен сетчатки (центральной или ответвлений); травме глаза; отеке, индуцированном хирургическим вмешательством; неоваскуляризации, индуцированной хирургическим вмешательством; кистозном макулярном отеке; ишемии глаза; ретинопатии недоношенных; болезни Коутса; серповидно-клеточной ретинопатии; и/или неоваскулярной глаукоме. Согласно одному варианту осуществления, патологическое состояние представляет собой AMD. Согласно одному варианту осуществления, патологические состояния являются результатом ангиогенеза и/или неоваскуляризации глаза или усугубляются ими.
[0011] Настоящая заявка также относится к составам и способам, применимым для профилактики и/или лечения повреждений эпителия роговицы, ассоциированных с заболеванием, включая системное заболевание (например, злокачественная опухоль, диабет и т.п.) и заболевание глаз, или с побочным эффектом лекарства, вводимого местно или системно (например, анти-EGFR средства и ингибиторы EGFR). Состав согласно настоящей заявке содержит, по меньшей мере, одно антиангиогенное средство, противовоспалительное средство или средство против сосудистой проницаемости для применения при лечении ангиогенных нарушений глаза и модулятор EGFR (например, средство, поддерживающее активность или активирующее EGFR) для применения при профилактике и/или лечении повреждений эпителия роговицы.
[0012] Согласно вариантам осуществления настоящей заявки, первое действующее вещество представляет собой антиангиогенный ингибитор киназ, и второе действующее вещество представляет собой модулятор киназ (например, активатор). Согласно одному варианту осуществления, первое действующее вещество ингибирует киназу, отличную от киназы, модулируемой вторым действующим веществом (например, активность сохраняется или происходит активация). Примеры некоторых ингибиторов киназ, которые могут быть использованы для получения благоприятных терапевтических результатов, включают в себя ингибиторы рецепторных тирозинкиназ, например, без ограничения киназные рецепторы VEGFR, FGFR, Tie-2 и Ephrin. Примеры модуляторов киназ, которые могут быть использованы для получения благоприятных терапевтических результатов, включают в себя активаторы рецепторной тирозинкиназы ErbB, например, без ограничения EGFR1/ErbB1/HER1, ErbB2/HER2/Neu, ErbB3/HER3 и ErbB4/HER. Согласно одному варианту осуществления, тирозинкиназа ErbB рецептора представляет собой EGFR1. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество представляет собой никотиновую кислоту, никотинамид или витамин K, или их сочетание. Согласно дополнительному варианту осуществления, второе действующее вещество представляет собой никотиновую кислоту или никотинамид. Согласно другому варианту осуществления, второе действующее вещество представляет собой витамин K.
[0013] Согласно некоторым вариантам осуществления, второе действующее вещество согласно настоящей заявке снижает или уменьшает ингибирование EGFR в переднем отделе глаза, вызванное высокими концентрациями первого действующего вещества согласно настоящей заявке (например, транзиторные высокие концентрации первого действующего вещества после введения первого действующего вещества в передний отдел глаза).
[0014] Варианты осуществления настоящей заявки относятся к офтальмологическому составу для лечения неоваскуляризации глаза, содержащему первое действующее вещество формулы I:
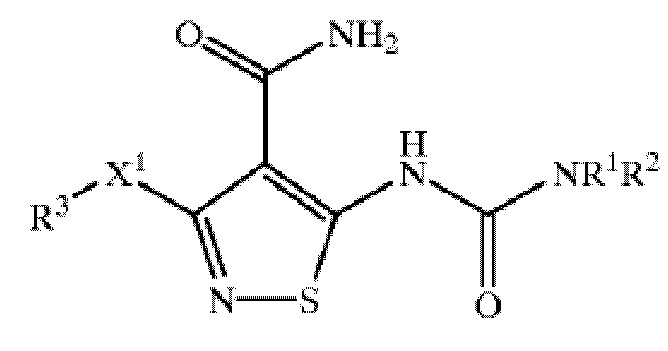 (I)
(I)
или его фармацевтически приемлемую соль; второе действующее вещество, где второе действующее вещество представляет собой модулятор EGFR (например, активатор), такой как никотиновая кислота, никотинамид или витамин K, или их сочетание; и фармацевтически приемлемые наполнители; причем первое действующее вещество или его фармацевтически приемлемая соль присутствует в количестве приблизительно от 0,02% приблизительно до 1,2% (масс./об.), так что состав формирует раствор или суспензию, и где:
X 1 представляет собой O или S;
R1 представляет собой H, C1-C10алкил, C2-C10алкенил, C2-C10алкинил, C(O)(C1-C10алкил), (CH2)t(C6-C10арил), (CH2)t(4-10-членная гетероциклическая группа), C(O)(CH2)t(C6-C10арил) или C(O)(CH2)t(5-10-членная гетероциклическая группа), где:
t представляет собой целое число от 0 до 5;
алкильная группа необязательно включает в себя 1 или 2 гетеро-фрагмента, выбранных из O, S и N(R6), при условии, что два атома O, два атома S, или атом O и атом S не присоединены непосредственно друг к другу;
арильные и гетероциклические группы необязательно конденсированы с C6-C10арильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
1 или 2 атома углерода в вышеупомянутых гетероциклических фрагментах необязательно замещены оксо-фрагментом (=O) или анионом кислорода;
фрагменты (CH2)t необязательно включают в себя углерод-углеродную двойную или тройную связь, если t представляет собой целое число от 2 до 5; и
вышеупомянутые группы R1, за исключением H, необязательно замещены 1-3 группами R4;
R2 представляет собой H;
R3 представляет собой (CH2)t(C6-C10арил), где:
t представляет собой целое число от 0 до 5;
арильная группа необязательно конденсирована с C6-C10арильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
фрагменты (CH2)t необязательно включают в себя углерод-углеродную двойную или тройную связь, если t представляет собой целое число от 2 до 5; и
вышеупомянутые группы R3 необязательно замещены 1-5 группами R4;
каждую группу R4 независимо выбирают из C1-C10алкила, C2-C10алкенила, C2-C10алкинила, галогена, циано, нитро, трифторметила, трифторметокси, азидо, OR5, C(O)R5, C(O)OR5, NR6C(O)R5, NR6C(O)OR5, OC(O)R5, NR6SO2R5, SO2NR5R6, C(O)NR5R6, NR5R6, S(O)jR7, где j представляет собой целое число от 0 до 2, SO3H, NR5(CR6R7)tOR6, (CH2)t(C6-C10арил), SO2(CH2)t(C6-C10арил), S(CH2)t(C6-C10арил), O(CH2)t(C6-C10арил), (CH2)t(5-10-членная гетероциклическая группа) и (CR6R7)mOR6, где:
m представляет собой целое число от 1 до 5;
t представляет собой целое число от 0 до 5;
алкильная группа необязательно включает в себя 1 или 2 гетеро-фрагмента, выбранных из O, S и N(R6), при условии, что два атома O, два атома S, или атом O и атом S не присоединены непосредственно друг к другу;
арильные и гетероциклические группы необязательно конденсированы с C6-C10арильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
1 или 2 атома углерода в вышеупомянутых гетероциклических фрагментах необязательно замещены оксо-фрагментом (=O) или анионом кислорода; и
алкильные, арильные и гетероциклические фрагменты вышеупомянутых групп R4 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, NR6SO2R5, SO2NR5R6, C(O)R5, C(O)OR5, OC(O)R5, NR6C(O)R5, C(O)NR5R6, NR5R6, (CR6R7)mOR6, где m представляет собой целое число от 1 до 5, OR5, и заместителей, перечисленных в определении группы R5; и
каждая группа R5, R6 и R7 независимо представляет собой H или C1-C6алкил.
[0015] Согласно одному варианту осуществления, группа R3 представляет собой (CH2)t(C6-C10арил), где t представляет собой целое число от 1 до 3, и группа R3 необязательно замещена 1-4 группами R4.
[0016] Согласно дополнительному варианту осуществления, группа R3 представляет собой бензил, необязательно замещенный 1-4 заместителями, независимо выбранными из галогена и C1-C4алкила. Согласно дополнительному варианту осуществления, группа R3 представляет собой бензил, замещенный 1-4 заместителями, независимо выбранными из метила, фтора, хлора и брома.
[0017] Согласно одному варианту осуществления, группа R1 представляет собой (CH2)t(5-10-членная гетероциклическая группа), где t представляет собой целое число от 0 до 5, необязательно замещенную 1 или 2 заместителями, независимо выбранными из C1-C4алкила, гидрокси и гидроксиметила.
[0018] Настоящая заявка относится к гетероциклическому фрагменту группы R1 в формуле I, выбранному из морфолино, пирролидинила, имидазолила, пиперазинила, пиперидинила и 2,5-диазабицикло[2.2.1]гепт-2-ила, переменная t в группе R1 варьирует от 2 до 5, и группа R1 необязательно замещена одной или несколькими гидроксигруппами.
[0019] Например, гетероциклический фрагмент группы R1 в формуле I согласно настоящей заявке представляет собой пирролидин.
[0020] Согласно дополнительному варианту осуществления настоящей заявки, первое действующее вещество представляет собой:
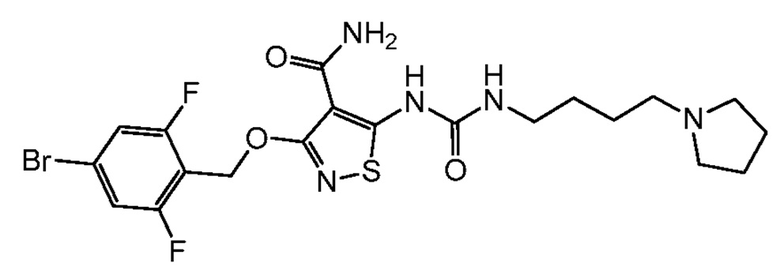 (II).
(II).
[0021] Согласно дополнительному варианту осуществления настоящей заявки, первое действующее вещество представляет собой гидрохлорид соединения формулы II, а именно соединение I:
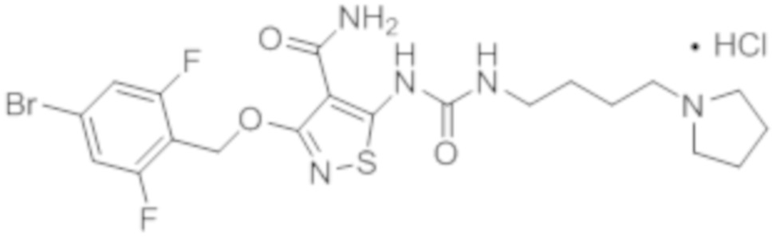 (соединение I).
(соединение I).
[0022] Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество представляет собой никотиновую кислоту, никотинамид или витамин K, или их сочетание. Согласно дополнительному варианту осуществления, второе действующее вещество представляет собой витамин K.
[0023] Варианты осуществления настоящей заявки относятся к составам, содержащим приблизительно от 0,005% приблизительно до 5,0% (масс./об.) первого действующего вещества формулы I или II или его фармацевтически приемлемой соли, например, соединения I. Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в составах для местного введения составляет приблизительно 0,005% - приблизительно 0,01%, приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,1%, приблизительно 0,1% - приблизительно 0,2%, приблизительно 0,2% - приблизительно 0,3%, приблизительно 0,3% - приблизительно 0,4%, приблизительно 0,4% - приблизительно 0,5%, приблизительно 0,5% - приблизительно 0,6%, приблизительно 0,6% - приблизительно 0,7%, приблизительно 0,7% - приблизительно 0,8%, приблизительно 0,8% - приблизительно 0,9%, приблизительно 0,9% - приблизительно 1,0%, приблизительно 1,1% - приблизительно 2,0%, приблизительно 2,1% - приблизительно 3,0%, приблизительно 3,1% - приблизительно 4,0% или приблизительно 4,1% - приблизительно 5,0% (масс./об.). Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в составах для местного введения составляет приблизительно 0,1% - приблизительно 1,2%, приблизительно 0,2% - приблизительно 1,2%, приблизительно 0,3% - приблизительно 1,2%, приблизительно 0,4% - приблизительно 1,2%, 0,1% - приблизительно 1,1%, приблизительно 0,2% - приблизительно 1,1%, приблизительно 0,3% - приблизительно 1,1%, приблизительно 0,4% - приблизительно 1,1%, 0,1% - приблизительно 1,0%, приблизительно 0,2% - приблизительно 1,0%, приблизительно 0,3% - приблизительно 1,0%, приблизительно 0,4% - приблизительно 1,0%, 0,1% - приблизительно 0,8%, приблизительно 0,2% - приблизительно 0,8%, приблизительно 0,3% - приблизительно 0,8%, приблизительно 0,4% - приблизительно 0,8%, 0,1% - приблизительно 0,6%, приблизительно 0,2% - приблизительно 0,6%, приблизительно 0,3% - приблизительно 0,6%, приблизительно 0,4% - приблизительно 0,6%, 0,1% - приблизительно 0,5%, приблизительно 0,2% - приблизительно 0,5%, приблизительно 0,3% - приблизительно 0,5%, приблизительно 0,4% - приблизительно 0,5%, 0,1% - приблизительно 0,4%, приблизительно 0,2% - приблизительно 0,4%, приблизительно 0,3% - приблизительно 0,4% (масс./об.). Согласно некоторым вариантам осуществления, составы включают в себя приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения I или его свободного основания (формула II).
[0024] Согласно некоторым вариантам осуществления, настоящая заявка относится к раствору первого действующего вещества (например, соединения I) и второго действующего вещества (например, никотиновой кислоты, никотинамида или витамина K, или их сочетания), который включает в себя один или несколько солюбилизаторов.
[0025] Согласно некоторым вариантам осуществления, состав содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, и второе действующее вещество и солюбилизатор.
[0026] Согласно некоторым вариантам осуществления, солюбилизатор в составе может представлять собой циклодекстрин, например, 2-гидроксипропил-β-циклодекстрин, метил-β-циклодекстрин, произвольно метилированный β-циклодекстрин, этилированный β-циклодекстрин, триацетил-β-циклодекстрин, перацетилированный β-циклодекстрин, карбоксиметил-β-циклодекстрин, гидроксиэтил-β-циклодекстрин, 2-гидрокси-3-(триметиламмонио)пропил-β-циклодекстрин, глюкозил-β-циклодекстрин, мальтозил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрина, разветвленный β-циклодекстрин, гидроксипропил-γ-циклодекстрин, произвольно метилированный γ-циклодекстрин, триметил-γ-циклодекстрин, или их сочетание.
[0027] Согласно одному варианту осуществления, солюбилизатор в составе представляет собой 2-гидроксипропил-β-циклодекстрин или сульфобутилэфир-β-циклодекстрина.
[0028] Согласно одному варианту осуществления, состав может дополнительно содержать один или несколько из бензалкония хлорида (BAK), хлорида натрия и регулятора pH.
[0029] Согласно дополнительным вариантам осуществления, состав содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) первого действующего вещества или его фармацевтически приемлемой соли, и буфер, например, трометамин. Согласно одному варианту осуществления, состав содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) первого действующего вещества или его фармацевтически приемлемой соли, и приблизительно 0,3% - приблизительно 1,0% (масс./об.) трометамина, и необязательно дополнительно содержит приблизительно 0,005% (масс./об.) бензалкония хлорида (BAK).
[0030] Согласно некоторым вариантам осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Например, второе действующее вещество включает в себя без ограничения никотиновую кислоту (или ниацин/витамин B3), никотинамид и витамин K, или их сочетание. «Витамин K», согласно определению в настоящем документе, включает в себя один или несколько представителей семейства витамина K и его пролекарств, природного или синтетического происхождения. Семейство витамина K включает в себя витамин K1 (также известный как филлохинон, фитоменадион или фитонадион), витамин K2 и любые гомологи витамина K2. Гомологи витамина K2 называют менахинонами, и они характеризуются некоторым числом изопреноидных остатков в боковых цепях. Синтетический витамин K включает в себя без ограничения витамин K3 (т.е. менадион), витамин K4, витамин K5. Согласно одному варианту осуществления, второе действующее вещество представляет собой никотиновую кислоту и/или никотинамид. Согласно другому варианту осуществления, второе действующее вещество представляет собой никотиновую кислоту. Согласно другому варианту осуществления, второе действующее вещество представляет собой никотинамид. Согласно еще одному варианту осуществления, второе действующее вещество представляет собой витамин K. Согласно другому варианту осуществления, второе действующее вещество представляет собой витамин K1. Согласно еще одному варианту осуществления, второе действующее вещество представляет собой витамин K2. Согласно еще одному варианту осуществления, второе действующее вещество представляет собой гомолог витамина K2. Согласно еще одному варианту осуществления, второе действующее вещество представляет собой синтетический витамин K (например, витамин K3, витамин K4 или витамин K5). Согласно одному варианту осуществления, второе действующее вещество представляет собой витамин K3 (т.е. менадион).
[0031] Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в составах для местного введения составляет приблизительно 0,00001% - приблизительно 5,0% (масс./об.). Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в составах для местного введения составляет приблизительно 0,00001% - приблизительно 1,0%, приблизительно 0,00001% - приблизительно 0,1%, приблизительно 0,00001% - приблизительно 0,01%, приблизительно 0,00001% - приблизительно 0,001%, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001% (масс./об.). Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в составах для местного введения составляет приблизительно 0,00001% - приблизительно 0,0001%, 0,000012% - приблизительно 0,0001%, 0,000014% - приблизительно 0,0001%, 0,000016% - приблизительно 0,0001%, 0,000018% - приблизительно 0,0001%, 0,00002% - приблизительно 0,0001%, 0,00003% - приблизительно 0,0001%, 0,00004% - приблизительно 0,0001%, 0,00005% - приблизительно 0,0001%, 0,00006% - приблизительно 0,0001%, 0,00007% - приблизительно 0,0001%, 0,00008% - приблизительно 0,0001%, 0,00009% - приблизительно 0,0001%, 0,000016% - приблизительно 0,00009%, 0,000018% - приблизительно 0,00009%, 0,00002% - приблизительно 0,00009%, 0,00003% - приблизительно 0,00009%, 0,00004% - приблизительно 0,00009%, 0,00005% - приблизительно 0,00009%, 0,00006% - приблизительно 0,00009%, 0,00007% - приблизительно 0,00009% или 0,00008% - приблизительно 0,00009% (масс./об.). Согласно некоторым вариантам осуществления, составы включают в себя приблизительно 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,000081%, 0,000082%, 0,000083%, 0,000084%, 0,000085%, 0,000086%, 0,000087%, 0,000088% или 0,000089% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли.
[0032] Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в составах составляет приблизительно 0,5 мкМ, приблизительно 0,6 мкМ, приблизительно 0,7 мкМ, приблизительно 0,8 мкМ, приблизительно 0,9 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 7 мкМ, приблизительно 8 мкМ или приблизительно 9 мкМ. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества составляет приблизительно 1 мкМ.
[0033] Настоящая заявка относится к составу, характеризующемуся значением pH приблизительно от 4,5 приблизительно до 7,5 при температуре приблизительно 40°C или ниже. Согласно некоторым вариантам осуществления, значение pH состава составляет приблизительно от pH 5,0 приблизительно до 7,0. Согласно одному варианту осуществления, значение pH состава составляет приблизительно 6,0 при температуре приблизительно 40°C или ниже.
[0034] Согласно другому варианту осуществления, настоящая заявка относится к применению состава, содержащего первое действующее вещество (например, формулы I, или соединение I или его свободное основание формулы II) и второе действующее вещество (например, никотиновую кислоту, никотинамид или витамин K, или их сочетание), для производства лекарственного средства для доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза или васкулопатического или воспалительного заболевания глаза, описанного в настоящем документе, например, диабетической ретинопатии (включая фоновую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию и диабетический макулярный отек); возрастной макулярной дегенерации (AMD) (включая неоваскулярную (влажную/экссудативную) AMD, сухую AMD и географическую атрофию сетчатки); патологической неоваскуляризации (CNV) сосудистой оболочки любого механизма (например, при миопии высокой степени, травме, серповидно-клеточной анемии; гистоплазмозе глаза, ангиодных полосах сетчатки, травматическом повреждении сосудистой оболочки, друзах зрительного нерва или некоторых дистрофиях сетчатки); патологической неоваскуляризации сетчатки любого механизма (например, при серповидно-клеточной анемии, болезни Илза, глазном ишемическом синдроме, каротидно-кавернозном свище, семейной экссудативной витреоретинопатии, синдроме повышенной вязкости крови, идиопатическом окклюзионном артериолите, дробьевидной ретинохороидопатии, васкулите сетчатки, саркоидозе или токсоплазмозе); увеита; окклюзии вен сетчатки (центральной или ответвлений); травмы глаза; отека, индуцированного хирургическим вмешательством; неоваскуляризации, индуцированной хирургическим вмешательством; кистозного макулярного отека; ишемии глаза; ретинопатии недоношенных; болезни Коутса; серповидно-клеточной ретинопатии; и/или неоваскулярной глаукомы. Согласно одному варианту осуществления, заболевание глаза представляет собой AMD. Согласно одному варианту осуществления, заболевания глаза являются результатом ангиогенеза и/или неоваскуляризации глаза или усугубляются ими.
[0035] Согласно другому варианту осуществления, настоящая заявка относится к составу для применения при производстве лекарственного средства, пригодного для доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза или васкулопатического или воспалительного заболевания глаза. Согласно одному варианту осуществления, состав содержит первое действующее вещество и второе действующее вещество. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Состав может дополнительно содержать один или несколько фармацевтически приемлемых наполнителей.
[0036] Согласно другому варианту осуществления, настоящая заявка относится к составу для применения при производстве лекарственного средства для лечения и/или уменьшения интенсивности симптома офтальмологического заболевания или нарушения (например, заболевания заднего отдела глаза, или васкулопатического или воспалительного заболевания глаза). Согласно одному варианту осуществления, состав содержит первое действующее вещество и второе действующее вещество. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Состав может дополнительно содержать один или несколько фармацевтически приемлемых наполнителей.
[0037] Согласно еще одному варианту осуществления, настоящая заявка относится к составу для применения в способе доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отела глаза. Согласно одному варианту осуществления, состав содержит первое действующее вещество и второе действующее вещество. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно одному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Состав может дополнительно содержать один или несколько фармацевтически приемлемых наполнителей.
[0038] Согласно еще одному варианту осуществления, настоящая заявка относится к составу для применения в способе лечения и/или уменьшения интенсивности симптома офтальмологического заболевания или нарушения (например, васкулопатического или воспалительного заболевания заднего отдела глаза). Согласно одному варианту осуществления, состав содержит первое действующее вещество и второе действующее вещество. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Состав может дополнительно содержать один или несколько фармацевтически приемлемых наполнителей.
[0039] Согласно другому варианту осуществления, настоящая заявка относится к комбинированной терапии для доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза, где терапия включает в себя введение первого действующего вещества и второго действующего вещества. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Согласно одному варианту осуществления, первое действующее вещество вводят одновременно со вторым действующим веществом. Согласно другому варианту осуществления, первое действующее вещество вводят перед введением второго действующего вещества. Согласно другому варианту осуществления, первое действующее вещество вводят после введения второго действующего вещества.
[0040] Согласно другому варианту осуществления, настоящая заявка относится к комбинированной терапии для лечения и/или уменьшения интенсивности симптома офтальмологического заболевания или нарушения (например, васкулопатического или воспалительного заболевания заднего отдела глаза), включающей в себя введение первого действующего вещества и второго действующего вещества. Согласно одному варианту осуществления, первое действующее вещество представляет собой ингибитор VEGFR. Согласно одному варианту осуществления, первое действующее вещество представляет собой соединение формулы I или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение формулы II или его фармацевтически приемлемую соль. Согласно дополнительному варианту осуществления, первое действующее вещество представляет собой соединение I. Согласно одному варианту осуществления, второе действующее вещество представляет собой модулятор EGFR (например, активатор). Согласно дополнительному варианту осуществления, второе действующее вещество выбирают из никотиновой кислоты, никотинамида и витамина K, и их сочетания. Согласно одному варианту осуществления, первое действующее вещество вводят одновременно со вторым действующим веществом. Согласно другому варианту осуществления, первое действующее вещество вводят перед введением второго действующего вещества. Согласно другому варианту осуществления, первое действующее вещество вводят после введения второго действующего вещества.
[0041] Согласно некоторым вариантам осуществления, длительность воздействия первого действующего вещества (например, соединения I) и второго действующего вещества составляет от 1 до 90 суток или превышает 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, длительность воздействия первого действующего вещества (например, соединения I) и второго действующего вещества превышает 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, схема приема включает в себя несколько курсов местного офтальмологического введения субъекту состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев), или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) или в течение более чем 90 суток. Например, схема приема включает в себя введение состава один раз в сутки, два раза в сутки, три раза в сутки или четыре раза в сутки в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев), или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Например, схема приема включает в себя введение состава один, два, три или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, схема приема включает в себя введение один раз на 1 сутки, один или два раза на 2-90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, с последующим введением один раз в сутки на 2-90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, с последующим введением один, два, три или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, одна схема введения включает в себя введение один или два раза в сутки в течение 1, 2, 3, 4 или 5 суток подряд. Для схемы с введением два или три раза в сутки, субъектам местно офтальмологически вводят дозу состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, на 1 и 4 сутки с интервалом приблизительно в 4, 6 или 8 часов. Согласно другому варианту осуществления, субъектам местно офтальмологически вводят дозу состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, в течение 4 суток подряд с интервалом приблизительно в 4, 6 или 8 часов. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы в сутки состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, в течение 5 суток подряд. Согласно еще одним вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, в течение 5-90 суток подряд. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы состава, содержащего первое действующее вещество (например, соединение I) и второе действующее вещество, по меньшей мере, в течение 25 суток подряд. Согласно одному варианту осуществления, субъектам местно офтальмологически вводят одну или две дозы, по меньшей мере, в течение 90 суток подряд или более.
[0042] Например, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев), или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 10 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Схема введения в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из описанных параграфом выше схем, включающих в себя введение в течение суток подряд или через сутки. Согласно некоторым вариантам осуществления, состав согласно настоящей заявке вводят 1 р/сут или 2 р/сут. Согласно некоторым вариантам осуществления, состав согласно настоящей заявке вводят 1 р/сут, 2 р/сут, 3 р/сут или 4 р/сут при введении в малых дозах (например, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл или 5 мг/мл), и 1 р/сут или 2 р/сут в высоких дозах (например, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл или 10 мг/мл).
[0043] Согласно некоторым вариантам осуществления, состав, содержащий первое действующее вещество (например, формулы II или соединение I) и второе действующее вещество, вводят субъекту в один глаз или в оба глаза. Например, состав согласно настоящей заявке, содержащий приблизительно 0,2% - приблизительно 1,0% (масс./об.) соединения формулы II или приблизительно 0,1% - 1,2% (масс./об.) соединения I и второе действующее вещество, вводят один раз в сутки (1 р/сут), два раза в сутки (2 р/сут), три раза в сутки (3 р/сут) или четыре раза (4 р/сут) в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, соединение формулы II или соединение I объединяют в комплекс с комплексообразующим веществом, например, с циклодекстрином (например, гидроксипропил-β-циклодекстрином (HP-β-CD, KLEPTOSE® HPB) (%)) в соотношении приблизительно 1:8, где к составу добавляют приблизительно 2% - 13% (масс./об.) циклодекстрина (например, Kleptose® HPB (%)). Состав может дополнительно содержать приблизительно 0,1% - приблизительно 0,2% буфера, например, 10 мМ фосфатного буфера. Требуемая осмолярность состава может оставлять приблизительно 200 - приблизительно 300 мОсм, что достигается добавлением требуемого для получения требуемой осмолярности количества соли, например, хлорида натрия. Значение pH состава может составлять приблизительно 6,0.
[0044] Настоящая заявка относится к фармацевтической композиции, содержащей частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, формулы II или соединения I) и/или второго действующего вещества) или его фармацевтически приемлемой соли, где частицы имеют средний диаметр от 100 нм до 100 мкм.
[0045] Настоящая заявка относится к суспензионному составу, содержащему фармацевтическую композицию, где фармацевтическая композиция содержит частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, формулы II или соединения I) и/или второго действующего вещества) или его фармацевтически приемлемой соли, описанные в настоящем документе.
Краткое описание графических материалов
[0046] На фиг. 1 представлена серия иммуноблотов фосфорилирования EGFR в иммортализованных клетках эпителия роговицы (клетках hTCEpi), обработанных различными концентрациями первого действующего вещества согласно настоящей заявке или контролем (AG1478, ингибитором EGFR-киназы) и EGF (верхние панели: иммуноблоттинг всех EGFR, средние панели: иммуноблоттинг, демонстрирующий фосфорилирование тирозина 1068 в EGFR, нижние панели: иммуноблоттинг, демонстрирующий фосфорилирование тирозина 1045 в EGFR).
[0047] На фиг. 2 представлена серия иммуноблотов фосфорилирования EGFR в иммортализованных клетках эпителия роговицы (клетках hTCEpi), обработанных различными концентрациями первого действующего вещества согласно настоящей заявке либо отдельно, либо после обработки витамином K3 (50 мкМ), никотиновой кислотой (10 мкМ) или никотинамидом (10 мкМ) (первый ряд: иммуноблоттинг всего EGFR, второй ряд: иммуноблоттинг, демонстрирующий фосфорилирование тирозина 1068 в EGFR, третий ряд: иммуноблоттинг, демонстрирующий фосфорилирование тирозина 1045 в EGFR).
[0048] На фиг. 3А представлена серия электронных микрофотографий, демонстрирующих миграцию/пролиферацию иммортализованных клеток эпителия роговицы (клеток hTCEpi), обрабатываемых в течение 30 минут указанными концентрациями первого действующего вещества согласно настоящей заявке или контролем (AG1478, ингибитором EGFR-киназы) с последующей обработкой в течение 16 часов первым действующим веществом или контролем вместе с указанными концентрациями EGF или VEGF. На фиг. 3В представлена серия столбчатых графиков, количественно определяющих миграцию/пролиферацию клеток hTCEpi на фиг. 3A.
[0049] На фиг. 4А представлена серия электронных микрофотографий, демонстрирующих миграцию/пролиферацию иммортализованных клеток эпителия роговицы (клеток hTCEpi), обработанных указанными концентрациями витамина K3 менадиона в течение 4 часов, а затем дополненных различными концентрациями первого действующего вещества согласно настоящей заявке, с последующей обработкой витамином K3, первым действующим веществом вместе с EGF. На фиг. 4В представлена серия столбчатых графиков, количественно определяющих миграцию/пролиферацию клеток hTCEpi на фиг. 4A.
[0050] На фиг. 5А представлена серия изображений ран эпителия в момент ранения (0 часов) и после ранения роговиц, обработанных носителем, указанными концентрациями соединения формулы I или II или AG1478. На фиг. 5B и 5C представлена серия столбчатых графиков, количественно определяющих заживление ран через 16 часов (фиг. 5B) или 24 часа (фиг. 5C) после ранения роговиц, обработанных носителем, указанными концентрациями соединения формулы I или II или AG1478. На фиг. 5D представлен график, демонстрирующий временную динамику заживления ран роговиц, обработанных носителем, указанными концентрациями соединения формулы I или II или AG1478.
[0051] На фиг. 6А представлена серия изображений ран эпителия в момент ранения (0 часов) и после ранения роговиц, обработанных носителем, менадионом, соединением формулы I или II, или менадионом в сочетании с соединением формулы I или II. На фиг. 6B представлена серия столбчатых графиков, количественно определяющих заживление ран через 16 часов или 24 часа после ранения роговиц, обработанных носителем, менадионом, соединением формулы I или II, или менадионом в сочетании с соединением формулы I или II. На фиг. 6C представлен график, демонстрирующий временную динамику заживления ран роговиц, обработанных носителем, менадионом, соединением формулы I или II, или менадионом в сочетании с соединением формулы I или II.
[0052] На фиг. 7А представлена серия иммуноблотов, демонстрирующих общий VEGFR2, фосфорилированный VEGFR2 и α-тубулин (в качестве контроля нагрузки) в эндотелиальных клетках сетчатки человека, обработанных указанными концентрациями менадиона в течение 4 часов, с последующей обработкой в течение 30 минут различными концентрациями соединения формулы I или II (1 нМ, 10 нМ, 100 нМ или 1 мкМ), а затем 10 нг/мл VEGF. На фиг. 7B представлен график, количественно определяющий рост эндотелиальных клеток сетчатки человека после обработки указанными концентрациями менадиона в течение 4 часов, с последующей обработкой в течение 30 минут различными концентрациями соединения формулы I или II (0,1 нМ, 1 нМ, 10 нМ или 100 нМ), а затем 10 нг/мл VEGF в течение ночи.
[0053] На фиг. 8 представлена серия иммуноблотов, демонстрирующих общий EGFR2, фосфорилированный EGFR и α-тубулин (в качестве контроля нагрузки) в клетках hTCEpi, обработанных указанными концентрациями менадиона в течение 4 часов, с последующей инкубацией с 8,0 нМ EGF в течение указанных периодов времени.
[0054] На фиг. 9А показано распределение по размерам частиц, содержащих 5% соединения формулы II и 1% плуроника F-127, полученного с использованием мелкоизмельчающей среды в течение длительного периода времени при высокой скорости валков. На фиг. 9В показано распределение по размерам частиц, содержащих 5% соединения формулы II и 1% плуроника F-127, полученного с использованием крупноизмельчающей среды в течение короткого периода времени при низкой скорости валков. На фиг. 9С показано распределение по размерам частиц, содержащих 3% соединения I, 0,6% Трис HCl и 2% глицерина, полученных без измельчения. На фиг. 9D показано распределение по размерам частиц, содержащих 0,4% соединения формулы II, 10 мкМ менадиона, 0,08% плуроника F-127 и 2,5% глицерина, после хранения при 40°C в течение 7 суток.
[0055] На фиг. 10 показано распределение по размерам частиц, содержащих 5% менадиона и 1% HPMC.
[0056] На фиг. 11 показано распределение по размерам частиц, содержащих 5% соединения формулы II и 1% плуроника F-127, полученных с использованием крупноизмельчающей среды в течение короткого периода времени при низкой скорости валков.
Подробное описание
[0057] Вещества, соединения, композиции, изделия и способы, описанные настоящем документе, могут быть лучше поняты с учетом последующего подробного описания конкретных аспектов раскрытого объекта изобретения и включенных в него примеров. Перед раскрытием и описанием веществ, соединений, композиций, изделий, устройств и способов согласно настоящему изобретению, следует понимать, что описанные ниже аспекты не ограничены конкретными способами или конкретными реагентами, а потому могут варьировать. Также следует понимать, что использованная в настоящем документе терминология предназначена для описания лишь конкретных аспектов и не предназначена для ограничения.
[0058] Кроме того, на всем протяжении настоящего описания, приводятся ссылки на различные публикации. Раскрытия указанных публикаций включены во всей их полноте в настоящую заявку посредством ссылки с целью более полного описания состояния уровня техники, к которому относится раскрытый объект изобретения. Раскрытые ссылки также по отдельности и в определенной форме включены в настоящий документ посредством ссылки по причине заключенного в них материала, который обсуждается в предложении, в котором приводится ссылка.
[0059] Настоящая заявка относится к композициям или составам, которые содержат первое действующее вещество и/или второе действующее вещество, для применения при лечении офтальмологических нарушений, обусловленных пролиферацией эндотелиальных клеток, усиленной проницаемостью сосудов, воспалением, ангиогенезом или неоваскуляризацией, и второе действующее вещество для применения при профилактике или лечении повреждения, причиненного переднему отделу глаза первым действующим средством, системным заболеванием и/или офтальмологическим заболеванием.
[0060] Настоящая заявка также относится к сочетанию первого действующего вещества, например, соединения формулы I или II, и второго действующего вещества, например, никотиновой кислоты, никотинамида, витамина K или их сочетания. Согласно одному варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, и второе действующее вещество или его фармацевтически приемлемую соль вводят одновременно. В качестве альтернативы, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят до введения второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят после введения второго действующего вещества или его фармацевтически приемлемой соли.
[0061] Составы согласно настоящей заявке применимы для профилактики или ингибирования неоваскуляризации и транссудации, ассоциированной с офтальмологическими нарушениями, при профилактике или ингибировании заболеваний роговицы. В некоторых случаях, составы согласно настоящей заявке вызывают регрессию неоваскуляризации. Вкратце, в контексте настоящей заявки, следует понимать, что первые действующие вещества представляют собой любую молекулу, как синтетическую, так и природного происхождения, которая оказывает воздействие для ингибирования роста сосудов, снижения проницаемости сосудов и/или снижения воспаления.
[0062] Составы согласно настоящей заявке также применимы для профилактики и/или лечения повреждений эпителия роговицы, обусловленных системными заболеваниями (например, злокачественной опухолью, сахарным диабетом и т.п.), заболеваниями глаз или побочным эффектом местно или системно вводимого лекарства (например, анти-EGFR средства или соединения формулы I или II, характеризующиеся анти-EGFR активностью). Вкратце, в контексте настоящей заявки, следует понимать, что вторые действующие вещества представляют собой любую молекулу, как синтетическую, так и природного происхождения, которая оказывает воздействие для профилактики и/или репарации отека роговицы, изъязвления или любой другой аномалии роговицы. В частности, настоящая заявка относится к составам, содержащим первое действующее вещество и второе действующее вещество, каждое в терапевтически эффективном количестве.
Основные определения
[0063] В настоящем описании и в последующей формуле изобретения, приводятся ссылки на целый ряд терминов, которые следует определить как имеющие следующие значения. Все проценты, соотношения и пропорции в настоящем документе определены по массе, если иное не указано особо. Все температуры представлены в градусах Цельсия (°C), если иное не указано особо.
[0064] Под «фармацевтически приемлемым» подразумевают вещество, которое не является биологически или каким-либо иным образом нежелательным, т.е. вещество можно вводить индивидууму вместе с соответствующим действующим соединением, не вызывая клинически неприемлемых биологических эффектов или не взаимодействуя неблагоприятным образом с любым из других компонентов фармацевтической композиции или состава, в котором оно содержится.
[0065] Если конкретно не указано обратное, то процентное содержание компонента по массе учитывается исходя из суммарной массы состава или композиции, в состав которой включен компонент.
[0066] Используемый в настоящем документе термин «эффективное количество» означает «количество одного или нескольких из раскрытых соединений, эффективное в дозировках и в течение промежутков времени, необходимых для достижения целевого или терапевтического результата». Эффективное количество может варьировать в соответствии с факторами, известными в данной области техники, такими как стадия заболевания, возраст, пол и вес подвергающегося лечению человека или животного. Хотя в примерах, представленных в настоящем документе, могут быть описаны конкретные схемы приема лекарственного средства, специалисту в данной области техники должно быть понятно, что схема приема лекарственного средства может быть изменена для обеспечения оптимального терапевтического ответа. Например, в течение суток можно вводить несколько отдельных доз, или доза может быть пропорционально снижена, что определяется остротой терапевтической ситуации. Кроме того, составы согласно настоящему раскрытию можно вводить с частотой, необходимой для достижения терапевтического количества.
[0067] Эффективное количество или эффективная доза для человека может быть определена, исходя из таковой для животного (например, экспериментального животного). Например, эффективная доза для человека может быть вычислена на основании пересчета, представленного в таблице ниже.
[0068] Пересчет доз для животных в эквивалентные дозы для людей (HED) с использованием показателя 0,67 для площади поверхности тела
[0069] Используемый в настоящем документе термин «наполнитель» включает в себя любое другое соединение, которое может быть включено в состав или может быть сочетано с одним или несколькими из ингибиторов, раскрытых в настоящем документе, и которое не является терапевтически или биологически активным соединением. По этой причине, наполнитель должен быть фармацевтически или биологически приемлемым или уместным (например, наполнитель, как правило, должен быть нетоксичен для субъекта). Термин «наполнитель» включает в себя единственное такое соединение, но также предполагает включение множества наполнителей. Для целей настоящей заявки, термины «наполнитель» и «носитель» используются взаимозаменяемо на всем протяжении описания настоящей заявки, и упомянутые термины определены в настоящем документе как «ингредиенты, которые используются в практике составления безопасной и эффективной фармацевтической композиции».
[0070] Используемый в настоящем документе термин «субъект» означает индивидуума. Поэтому термин «субъект» может включать в себя домашних животных (например, кошек, собак, и т.п.), домашний скот (например, крупный рогатый скот, лошадей, свиней, овец, коз и т.п.), лабораторных животных (например, мышей, кроликов, крыс, морских свинок и т.п.) и птиц. Термин «субъект» также может включать в себя примата или человека.
[0071] Под термином «снижать» или другими формами этого слова, такими как «снижая» или «снижение», подразумевается уменьшение явления или характеристики (например, транссудации или отека тканей). Следует понимать, что он, как правило, связан с некоторым стандартным или ожидаемым значением, другими словами, он взаимосвязан, но не всегда обязательно, со стандартным или относительным значением, на которое приводится ссылка.
[0072] Используемый в настоящем документе термин «лечить» или другие формы этого слова, такие как «подвергнутый лечению» или «лечение» означают, что введение соединения или состава согласно настоящей заявке смягчает заболевание или нарушение у хозяина и/или снижает, ингибирует или устраняет конкретную ассоциированную с нарушением характеристику или явление (например, транссудацию или изъязвление роговицы).
[0073] Поскольку способы согласно настоящей заявке нацелены на профилактику нарушений, следует понимать, что термин «профилактика» не требует того, чтобы болезненное состояние было полностью предотвращено. Используемый в настоящем документе термин «профилактика» скорее относится к способности специалиста в данной области техники определить предрасположенную к нарушениям популяцию, так что введение соединений согласно настоящей заявке может происходить до начала заболевания. Термин не предполагает того, что болезненного состояния можно будет полностью избежать.
[0074] Используемый в настоящем документе термин «уменьшение интенсивности» или другие формы этого слова, такие как «уменьшать интенсивность», означают, что введение терапевтического средства согласно настоящей заявке уменьшает интенсивность одного или нескольких симптомов заболевания или нарушения у хозяина и/или снижает, ингибирует или устраняет конкретный симптом, ассоциированный с заболеванием или нарушением, до и/или после введения терапевтического средства.
[0075] Раскрытые соединения первого действующего вещества влияет на транссудацию или патологическую неоваскуляризацию посредством ингибирования рецепторной тирозинкиназы. Раскрытые соединения - вторые действующие вещества - влияют на повреждения эпителия роговицы путем модулирования (например, активации) рецепторной тирозинкиназы.
[0076] На всем протяжении описания и формулы изобретения настоящей заявки слово «содержать» и другие формы этого слова, такие как «содержащий» и «содержит», означает включение в себя без ограничения, и не предназначено для исключения, например, других добавок или компонентов.
[0077] При использовании по тексту описания и приложенной формулы изобретения, формы единственного числа включают в себя формы множественного числа, если контекстом прямо не предписано иное.
[0078] Термины «необязательный» и «необязательно» означают, что описанное за ним событие или обстоятельство может иметь место или может не иметь места, и что описание включает в себя случаи, когда событие или обстоятельство имеет место, и случаи, когда оно не имеет места.
[0079] любому минимальному изменению концентрации или количества терапевтического средства (например, первого действующего вещества или второго действующего вещества), которое не изменяет эффективность средства при приготовлении состава и при лечении заболевания или нарушения. Например, без ограничения, концентрация терапевтического средства является потенциально эффективной, если концентрация варьирует от 0,005% до 5,0% (например, ±0,0005%). Применительно к диапазону концентраций терапевтических средств/действующих веществ согласно настоящей заявке, например, первого действующего вещества или второго действующего вещества, термин «приблизительно» также относится к любому изменению установленного количества или диапазона, который представляет собой потенциально эффективное количество или диапазон.
[0080] В настоящем документе, диапазоны могут быть заданы как «приблизительно от» одного конкретного числового значения и/или «приблизительно до» другого конкретного числового значения. Если такой диапазон задан, то другой аспект включает в себя числовые значения от одного конкретного числового значения и/или до другого конкретного числового значения. По аналогии, если числовые значения выражены в виде приблизительных числовых значений с использованием предшествующего «приблизительно», то следует понимать, что конкретное числовое значение формирует другой аспект. Также следует понимать, что предельные числовые значения каждого из диапазонов обоюдно значимы применительно к другому предельному числовому значению и независимо от другого предельного числового значения. Также следует понимать, что в настоящем документе раскрыт целый ряд величин, и что в настоящем документе, в дополнение к самому числовому значению, каждое числовое значение также раскрыто как «приблизительно» это конкретное числовое значение. Например, если раскрыто числовое значение «10», то также раскрыто числовое значение «приблизительно 10». Также следует понимать, что если раскрыто числовое значение, то также раскрыто числовое значение, «меньшее или равное» ему, числовое значение, «большее или равное» ему, и возможные диапазоны между числовыми значениями, что соответственно очевидно специалисту в данной области техники. Например, если раскрыто числовое значение «10», то также раскрыто «меньше или равно 10», а также «больше или равно 10». Также следует понимать, что на всем протяжении описания данные представлены в разнообразных форматах, и что приведенные данные представляют собой предельные числовые значения и исходные числовые значения, и диапазоны для любого сочетания числовые значения. Например, если раскрыты конкретное числовое значение «10» и конкретное числовое значение «15», то следует понимать, что также считаются раскрытыми числовые значения, большие, большие или равные, меньшие, меньшие или равные, и равные 10 и 15, а также числовые значения между 10 и 15. Также следует понимать, что также раскрыто каждое единичное числовое значение между двумя конкретными числовыми значениями. Например, если раскрыты числовые значения 10 и 15, то также раскрыты числовые значения 11, 12, 13 и 14.
[0081] Если не указано иное, то используемый в настоящем документе термин «галоген» включает в себя фтор, хлор, бром или йод. Предпочтительные галогеновые группы представляют собой фтор, хлор и бром.
[0082] Если не указано иное, то используемый в настоящем документе термин «алкил» включает в себя разветвленные и неразветвленные насыщенные алифатические углеводородные группы, содержащие указанное число атомов углерода. Например, подразумевается, что C1-6алкил включает в себя C1, C2, C3, C4, C5 и C6 алкильные группы. Примеры алкила включают в себя без ограничения метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, н-пентил, втор-пентил и н-гексил. Согласно определенным вариантам осуществления, неразветвленный или разветвленный алкил содержит в своем остове шесть или менее атомов углерода (например, C1-C6 для неразветвленной цепи, C3-C6 для разветвленной цепи), и согласно другому варианту осуществления неразветвленный или разветвленный алкил содержит четыре или менее атомов углерода. По аналогии, циклоалкилы содержат в своей кольцевой структуре от трех до восьми атомов углерода, и согласно другим вариантам осуществления циклоалкилы содержат в кольцевой структуре пять или шесть атомов углерода.
[0083] Алкил может быть замещен путем замены атома водорода по одному или нескольким атомам углерода углеводородной остова. Такие заместители могут включать в себя, например, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имидино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил, или ароматический или гетероароматический фрагмент. Циклоалкилы могут быть дополнительно замещены, например, описанными выше заместителями и дополнительными заместителями, такими как алкил, алкенил и алкинил. «Алкиларильный» или «аралкильный» фрагмент представляет собой алкил, замещенный арилом (например, фенилметил (бензил)).
[0084] Если не указано иное, то используемый в настоящем документе термин «алкенил» включает в себя ненасыщенные алифатические группы, аналогичные по длине и возможному замещению с описанными выше алкилами, но содержащие, по меньшей мере, одну двойную связь. Например, термин «алкенил» включает в себя неразветвленные алкенильные группы (например, этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил), разветвленные алкенильные группы, циклоалкенильные (например, алициклические) группы (например, циклопропенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил), алкил-замещенные или алкенил-замещенные циклоалкенильные группы и циклоалкил-замещенные или циклоалкенил-замещенные алкенильные группы. Согласно определенным вариантам осуществления, неразветвленная или разветвленная алкенильная группа содержит в своем остове шесть или менее атомов углерода (например, C2-C6 для неразветвленной цепи, C3-C6 для разветвленной цепи). По аналогии, циклоалкенильные группы могут содержать в своей кольцевой структуре от трех до восьми атомов углерода, и согласно некоторым вариантам осуществления циклоалкенильные группы содержат в кольцевой структуре пять или шесть атомов углерода. Термин «C2-C6» включает в себя алкенильные группы, содержащие от двух до шести атомов углерода. Термин «C3-C6» включает в себя алкенильные группы, содержащие от трех до шести атомов углерода. Алкенил может быть замещен путем замены атома водорода по одному или нескольким атомам углерода углеводородного остова. Такие заместители могут включать в себя, например, алкинильные группы, атомы галогена, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил, или ароматический или гетероароматический фрагмент.
[0085] Если не указано иное, то используемый в настоящем документе термин «алкинил» включает в себя ненасыщенные алифатические группы, аналогичные по длине и возможному замещению с описанными выше алкилами, но содержащие, по меньшей мере, одну тройную связь. Например, «алкинил» включает в себя неразветвленные алкинильные группы (например, этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил), разветвленные алкинильные группы и циклоалкил-замещенные или циклоалкенил-замещенные алкинильные группы. Согласно определенным вариантам осуществления, неразветвленная или разветвленная алкинильная группа содержит в своем остове шесть или менее атомов углерода (например, C2-C6 для неразветвленной цепи, C3-C6 для разветвленной цепи). Термин «C2-C6» включает в себя алкинильные группы, содержащие от двух до шести атомов углерода. Термин «C3-C6» включает в себя алкинильные группы, содержащие от трех до шести атомов углерода. Алкинил может быть замещен путем замены атома водорода по одному или нескольким атомам углерода углеводородного остова. Такие заместители могут включать в себя, например, атомы галогена, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил, или ароматический или гетероароматический фрагмент.
[0086] Если не указано иное, то используемый в настоящем документе термин «алкокси» включает в себя O-алкильные группы, где «алкил» определен выше.
[0087] Если не указано иное, то используемый в настоящем документе термин «арил» включает в себя 5- и 6-членные «неконъюгированные», или содержащие одно кольцо, ароматические группы, а также «конъюгированные», или полициклические, системы, содержащие, по меньшей мере, одно ароматическое кольцо. Примеры арильных групп включают в себя бензол, фенил и т.п. Кроме того, термин «арил» включает в себя полициклические арильные группы, например, трициклические, бициклические, например, нафталин.
[0088] Арильные группы, содержащие в кольцевой структуре гетероатомы, могут называться «ароматические гетероциклы», «арильные гетероциклы», «гетероциклы», «гетероарилы» или «гетероароматические соединения».
[0089] Арил или гетероарил может быть замещен по одному или нескольким положениям кольца описанными выше заместителями, такими как, например, галоген, гидроксил, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, аралкиламинокарбонил, алкениламинокарбонил, алкилкарбонил, арилкарбонил, аралкилкарбонил, алкенилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил, или ароматический или гетероароматический фрагмент. Арильные группы также могут быть конденсированы или соединены мостиковыми связями с алициклическими или гетероциклическими кольцами, которые не являются ароматическими, с формированием полициклической системы (например, тетралин, метилендиоксифенил).
[0090] Если не указано иное, то используемый в настоящем документе термин «4-10-членные гетероциклические группы» включает в себя ароматические и неароматические гетероциклические группы, содержащие один или несколько гетероатомов, каждый из которых выбран из O, S и N, причем каждая гетероциклическая группа содержит в своей кольцевой системе от 4 до 10 атомов. Неароматические гетероциклические группы включают в себя группы, содержащие в своей кольцевой системе только 4 атома, а ароматические гетероциклические группы должны содержать в своей кольцевой системе, по меньшей мере, 5 атомов. Пример 4-членной гетероциклической группы представляет собой азетидинил (полученный из азетидина). Пример 5-членной гетероциклической группы представляет собой тиазолил, и пример 10-членной гетероциклической группы представляет собой хинолинил.
[0091] Примеры неароматических гетероциклических групп представляют собой пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3H-индолил и хинолизинил.
[0092] Примеры ароматических гетероциклических групп представляют собой пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
[0093] Вышеуказанные группы-производные перечисленных выше соединений, могут быть присоединены по C-атому или N-атому, где это возможно. Например, группа-производное пиррола может представлять собой пиррол-1-ил (присоединена по N-атому) или пиррол-3-ил (присоединена по C-атому). «4-10-Членный гетероциклический» фрагмент может быть замещен.
[0094] Если не указано иное, то используемое в настоящем документе выражение «фармацевтически приемлемая(ые) соль(и)» включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях первых действующих веществ (например, формулы I или II) или вторых действующих веществ. Соединения формулы I или II и вторые действующие вещества, которые являются основными по своей природе, способны формировать широкий ряд солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений формулы I или II и вторых действующих веществ, представляют собой кислоты, которые формируют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлориды, гидробромиды, гидройодиды, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, изоникотинаты, ацетаты, лактаты, салицилаты, цитраты, кислые цитраты, малеаты, гентизинаты, фумараты, глюконаты, глюкаронаты, сахараты, формиаты, бензоаты, глутаматы, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты и памоаты [т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоаты)].
[0095] Соединения первых действующих веществ (например, формулы I или II) и вторых действующих веществ, которые являются кислотными по своей природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочноземельных металлов, и в частности соли натрия и калия.
[0096] Согласно некоторым вариантам осуществления, соль представляет собой кислотно-аддитивную соль, например, соль HCl.
[0097] Определенные соединения формулы I или II и определенные вторые действующие вещества могут иметь центры асимметрии, а потому существуют в различных энантиомерных формах. Настоящая заявка относится к применению всех оптических изомеров и стереоизомеров соединений формулы I или II и их смесей и вторых действующих веществ и их смесей. Соединения формулы I или II и вторые действующие вещества также могут существовать в виде E/Z геометрических изомеров или таутомеров. Настоящая заявка относится к применению всех таких геометрических изомеров или таутомеров и их смесей.
[0098] Подаваемая заявки также включает в себя изотопно-меченые соединения и их фармацевтически приемлемые соли, которые идентичны таковым, раскрытым в формуле I или II, но с учетом того, что один или несколько атомов заменены атомом с атомной массой или массовым числом, отличными от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения согласно настоящей заявке, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 35S, 18F и 36Cl, соответственно. Соединения формулы I или II, их конъюгаты и фармацевтически приемлемые соли упомянутых соединений или упомянутых конъюгатов, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, подпадают под объем настоящей заявки. Определенные изотопно-меченые соединения согласно настоящей заявке (например, соединения формулы I или II), например соединения, в состав которых входят радиоактивные изотопы, такие как 3H и 14C, применимы при анализе распределения лекарственного средства и/или субстрата в ткани. Меченые тритием, т.е. 3H, и углеродом-14, т.е. 14C, изотопы являются особенно предпочтительными вследствие простоты их получения и способности к обнаружению. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может давать определенные терапевтические преимущества, которые являются результатом большей метаболической устойчивости, например, повышенный период полураспада in vivo или уменьшение дозы, а потому может быть предпочтительным в некоторых случаях. Изотопно-меченые соединения формулы I или II согласно настоящей заявке и их сложные эфиры или липидные конъюгаты, как правило, могут быть получены проведением процедур, раскрытых ниже в схемах и/или в разделах примеров и получения, путем замены немеченого изотопом реагента легко доступным изотопно-меченым реагентом.
[0099] Настоящая заявка также охватывает фармацевтические составы, содержащие производные соединений формулы I или II, или их фармацевтически приемлемые соли, и вторые действующие вещества или их фармацевтически приемлемые соли. Соединения формулы I или II, или их фармацевтически приемлемые соли, и вторые действующие вещества или их фармацевтически приемлемые соли, содержащие свободные амино или амидогруппы могут быть преобразованы до конъюгированных производных, где аминокислотный остаток или полипептидная цепь из двух или нескольких (например, двух, трех или четырех) аминокислотных остатков ковалентно присоединены посредством амидной или сложноэфирной связи к свободной аминогруппе соединений формулы I или II, или их фармацевтически приемлемых солей, или вторых действующих веществ или их фармацевтически приемлемых солей. Аминокислотные остатки включают в себя без ограничения 20 встречающихся в природе аминокислот, обычно обозначаемых трехбуквенными символами, а также включают в себя 4-гидроксипролин, гидроксилизин, десмозин, изодесмозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон.
[00100] Дополнительные типы производных также охватываются настоящим изобретением. Амидные и сложноэфирные фрагменты могут содержать группы, включая без ограничения функциональные группы простого эфира, амина и карбоновой кислоты. Свободные гидроксигруппы могут быть получены с использованием групп, включая без ограничения гемисукцинаты, сложные фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как описано в D. Fleisher, et al., Advanced Drug Delivery Reviews (1996) 19, 115. Карбаматные конъюгаты гидроксигрупп и аминогрупп также включены, равно как и конъюгаты с карбонатами и сложные сульфатные эфиры гидроксигрупп. Настоящим изобретением также охватывается получение гидроксигрупп как простых (ацилокси)метилэфиров и (ацилокси)этилэфиров, где ацильная группа может представлять собой сложный алкилэфир, необязательно замещенный группами, включая без ограничения функциональные группы простого эфира, амина и карбоновой кислоты, или где ацильная группа представляет собой сложный эфир аминокислоты, как описано выше. Производные такого типа описаны в R. P. Robinson et al., J. Medicinal Chemistry (1996) 39, 10.
[00101] Термин «киназа» относится к любому ферменту, который катализирует присоединение фосфатных групп к остатку белка; например, сериновые и треониновые киназы катализируют присоединение фосфатных групп к остаткам серинам и треонина.
[00102] Термин «VEGFR киназа» и «VEGFR» относится к любому из рецепторов факторов роста сосудистого эндотелия.
[00103] Термины «передача сигналов посредством VEGF» и «VEGF каскад» относятся как к восходящим, так и к нисходящим компонентам сигнального каскада VEGF.
[00104] Термины «ErbB киназа» и «ErbB рецептор» относятся к любому представителю семейства рецепторных тирозинкиназ ErbB, включая EGFR (ErbB1 или HER1), HER2/c-neu (ErbB2), HER3 (ErbB3) и HER4 (ErbB4).
[00105] Термины «путь передачи посредством EGF» и «каскад EGF» относятся как к восходящим, так и к нисходящим компонентам сигнального каскада EGF.
[00106] Термин «фармацевтически приемлемый» относится к тому факту, что носитель, разбавитель или наполнитель должен быть совместим с другими ингредиентами состава и безвреден для его реципиента.
[00107] Термины «введение соединения» или «осуществление введения соединение» относится к акту обеспечения соединением согласно настоящей заявке или фармацевтическим составом нуждающегося в лечении субъекта.
[00108] Термин «васкулостаз» относится к сохранению гомеостатического функционирования сосудов, ведущего к нормальному физиологическому функционированию.
[00109] Термин «васкулостатические средства» относится к средствам, которые ориентированы на устранение состояний, при которых васкулостаз нарушен, путем профилактики утраты или восстановления или сохранения васкулостаза.
[00110] Термины «композиция» и «состав» используются в настоящем документе взаимозаменяемо и относятся к общепринятому пониманию композиции или состава, известному из уровня техники.
[00111] Настоящая заявка относится к офтальмологическому составу. Согласно некоторым вариантам осуществления, офтальмологический состав согласно настоящей заявке представляет собой гелевый состав или полугелевый состав, или и то и другое.
[00112] Термин «гель» согласно настоящей заявке представляет собой полутвердую лекарственную форму согласно настоящей заявке, содержащую суспендированные частицы. Полутвердая форма не является текучей; она не течет и не принимает форму своего контейнера при комнатной температуре. Полутвердая форма не течет при низком напряжении сдвига и, как правило, характеризуется поведением при пластической деформации. Коллоидная дисперсия представляет собой систему, в которой частицы коллоидного объема (т.е. как правило, между 1 нм и 1 мкм) распределены равномерно по всей жидкости.
[00113] Согласно некоторым вариантам осуществления, термин «гель» представляет собой полутвердую систему, состоящую либо из суспензий малых неорганических частиц, либо из органических молекул, глубоко проникающих в жидкость. «Гели» также делят на однофазные и двухфазные системы. «Гели» также состоят из мезофазы или состояния вещества, среднего между жидкостью и твердым, которое представляет собой частично упорядоченную структуру, которая является состоянием действующих веществ в «гелевых каплях» согласно настоящим вариантам осуществления. Двухфазный гель состоит из сети маленьких отдельных частиц. В двухфазной системе гелевая масса иногда относится к так называемой взвеси (например, бентонитовая взвесь), если размер частиц суспендируемого вещества большой. Как гели, так и взвеси являются тиксотропными, формируя полутвердые формы в покое и становясь жидкостью при колебаниях. Полутвердые составы следует встряхивать перед введением для обеспечения гомогенности, что должно быть отмечено на этикетке (смотри раздел «Суспензии»). Однофазные гели состоят из органических молекул, равномерно распределенных во всей жидкости таким образом, что не существует четких границ между диспергированными макромолекулами и жидкостью. Однофазные гели также могут состоять из низкомолекулярных (LMW) органических молекул, где компонент, ответственный за превращение в гель, представляет собой действующий ингредиент. Так называемые «LMW гидрогели» отличаются от традиционных загустителей воды, таких как высокомолекулярные синтетические полимеры, полисахариды и белки. Высокомолекулярные загустители являются высокоупорядоченными и однонаправленными по причине водородных связей, тогда как силы, регулирующие LMW гидрогели, в большей мере представляют собой ненаправленные ван-дер-ваальсовые (гидрофобные) силы взаимодействия. На практике наблюдается, что LMW гидрогели ведут себя как высоко анизотропные (обычно фибриллярные) структуры, которые распространяются по всей жидкости, создавая физически разветвленную или переплетенную сеть. Таким образом, гели могут иметь характер от неупорядоченных до слабо упорядоченных, обладая до некоторой степени двойным лучепреломлением, характеристикой жидкого кристалла. Гели вводят посредством местного пути введения или, после встряхивания, в форме гидрогеля в виде глазных капель.
[00114] Полутвердый гель согласно настоящей заявке является полутвердым согласно определениям USP и литературы, на которую в них ссылаются. Кажущаяся вязкость полутвердого состава увеличивается с концентрацией. Клиническая дозировка настоящего состава варьирует от низкой, составляющей ≤1 мг/мл (0,1%), до высокой, составляющей ≤6 мг/мл (0,6%). Низкие дозы являются менее вязкими и подпадают под категорию «растворов», тогда как высокие дозы являются более вязкими и подходят под определение «геля».
[00115] Термин «желе» согласно настоящей заявке представляет собой класс гелей, которые представляют собой полутвердые системы, состоящие из суспензий, приготовленных либо из маленьких неорганических частиц, либо из больших органических молекул, глубоко проникающих в жидкость, в которых структурный сцепленный матрикс содержит большую долю жидкости, как правило, воды.
[00116] Термин «раствор» согласно настоящей заявке представляет собой чистую гомогенную жидкую лекарственную форму, которая содержит одно или несколько химических веществ, растворенных в растворителе или смеси совместно перемешанных растворителей. Раствор представляет собой жидкий препарат, который содержит одно или несколько растворенных химических веществ в подходящем растворителе или в смеси перемешанных растворителей. Поскольку молекулы лекарственного вещества в растворе диспергированы равномерно, использование растворов в качестве лекарственных форм, как правило, дает гарантию одинакового дозирования при введении и высокую точность, если раствор разбавляют или смешивают как-либо иначе.
[00117] Термин «жидкость» согласно настоящей заявке представляет собой лекарственную форму, состоящую из чистого химического вещества в его жидком состоянии. Жидкость обладает свойством текучести; она течет и принимает форму своего контейнера при комнатной температуре. Жидкости демонстрируют ньютоновское поведение или поведение псевдопластического течения.
[00118] Термин «суспензия» согласно настоящей заявке представляет собой жидкую лекарственную форму, которая содержит твердые частицы, диспергированные в жидкой основе.
[00119] Соединения первых действующих веществ (например, формулы I или II) и вторых действующих веществ включают в терапевтические составы в исходной форме или в форме соли. Фармацевтически приемлемые нетоксичные соли включают в себя основно-аддитивные соли (образованные со свободной карбоксильной или другими анионными группами), которые получают из неорганических оснований, таких как, например, натрий, калий, аммоний, кальций или гидроксиды железа, и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п. Такие соли получают в виде кислотно-аддитивных солей с любыми свободными катионными группами, и, как правило, получают с неорганическими кислотами, такими как, например, соляная, серная или фосфорная кислоты, или органическими кислотами, такими как уксусная, лимонная, паратолуолсульфоновая, метансульфоновая, щавелевая, винная, миндальная и т.п. Соли согласно настоящей заявке включают в себя соли аминов, образованные путем протонирования аминогруппы неорганическими кислотами, такими как соляная кислота, бромистводородная кислота, йодистоводородная кислота, серная кислота, фосфорная кислота и т.п. Соли согласно настоящей заявке также включают в себя соли аминов, образованные путем протонирования аминогруппы подходящими органическими кислотами, такими как паратолуолсульфоновая кислота, уксусная кислота и т.п. Дополнительные наполнители, которые предусмотрены для использования в практике настоящей заявки, представляют собой наполнители, доступные специалисту в данной области техники, например, таковые, приведенные в United States Pharmacopoeia Vol. XXII и National Formulary Vol. XVII, U.S. Pharmacopoeia Convention, Inc., Rockville, Md. (1989), соответствующее содержание которых включено в настоящий документ посредством ссылки. Кроме того, в состав настоящей заявки включены полиморфы соединений согласно настоящей заявке.
[00120] Варианты осуществления настоящей заявки относятся к офтальмологической композиции или составу для лечения неоваскуляризации глаза, содержащим первое действующее вещество формулы I:
 (I)
(I)
или его фармацевтически приемлемую соль; второе действующее вещество или его фармацевтически приемлемую соль, где второе действующее вещество представляет собой никотиновую кислоту, никотинамид или витамин K, или их сочетание; и фармацевтически приемлемые наполнители; первое действующее вещество или его фармацевтически приемлемая соль присутствует в количестве приблизительно от 0,02% приблизительно до 1,2% (масс./об.), где:
X 1 представляет собой O или S;
R1 представляет собой H, C1-C10алкил, C2-C10алкенил, C2-C10алкинил, C(O)(C1-C10алкил), (CH2)t(C6-C10арил), (CH2)t(4-10-членная гетероциклическая группа), C(O)(CH2)t(C6-C10арил) или C(O)(CH2)t(5-10-членная гетероциклическая группа), где:
t представляет собой целое число от 0 до 5;
алкильная группа необязательно включает в себя 1 или 2 гетеро-фрагмента, выбранных из O, S и N(R6), при условии, что два атома O, два атома S или атом O и атом S не соединены непосредственно друг с другом;
арильные и гетероциклические группы необязательно конденсированы с C6-C10аоильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
1 или 2 атома углерода в вышеупомянутых гетероциклических фрагментах необязательно замещены оксо-фрагментом (=O) или анионом кислорода;
фрагменты (CH2)t необязательно включают в себя углерод-углеродную двойную или тройную связь, где t представляет собой целое число от 2 до 5; и
вышеупомянутые группы R1, за исключением H, необязательно замещены 1-3 группами R4;
R2 представляет собой H;
R3 представляет собой (CH2)t(C6-C10арил), где:
t представляет собой целое число от 0 до 5;
арильная группа необязательно конденсирована с C6-C10арильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
фрагменты (CH2)t необязательно включают в себя углерод-углеродную двойную или тройную связь, где t представляет собой целое число от 2 до 5; и
каждую группу R4 независимо выбирают из C1-C10алкила, C2-C10алкенила, C2-C10алкинила, галогена, циано, нитро, трифторметила, трифторметокси, азидо, OR5, C(O)R5, C(O)OR5, NR6C(O)R5, NR6C(O)OR5, OC(O)R5, NR6SO2R5, SO2NR5R6, C(O)NR5R6, NR5R6, S(O)jR7, где j представляет собой целое число от 0 до 2, SO3H, NR5(CR6R7)tOR6, (CH2)t(C6-C10арил), SO2(CH2)t(C6-C10арил), S(CH2)t(C6-C10арил), O(CH2)t(C6-C10арил), (CH2)t(5-10-членная гетероциклическая группа) и (CR6R7)mOR6, где:
m представляет собой целое число от 1 до 5;
t представляет собой целое число от 0 до 5;
алкильная группа необязательно включает в себя 1 или 2 гетеро-фрагмента, выбранных из O, S и N(R6), при условии, что два атома O, два атома S или атом O и атом S не соединены непосредственно друг с другом;
арильные и гетероциклические группы необязательно конденсированы с C6-C10арильной группой, насыщенной C5-C8циклической группой или 5-10-членной гетероциклической группой;
1 или 2 атома углерода в вышеупомянутых гетероциклических фрагментах необязательно замещены оксо-фрагментом (=O) или анионом кислорода; и
алкильные, арильные и гетероциклические фрагменты выше упомянутых групп R4 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, NR6SO2R5, SO2NR5R6, C(O)R5, C(O)OR5, OC(O)R5, NR6C(O)R5, C(O)NR5R6, NR5R6, (CR6R7)mOR6, где m представляет собой целое число от 1 до 5, OR5, и заместителей, перечисленных в определении группы R5; и
каждая группа R5, R6 и R7 независимо представляет собой H или C1-C6алкил.
[00121] Согласно одному варианту осуществления, группа R3 представляет собой (CH2)t(C6-C10арил), где t представляет собой целое число от 1 до 3, и группа R3 необязательно замещена 1-4 группами R4.
[00122] Согласно дополнительному варианту осуществления, группа R3 представляет собой бензил, необязательно замещенный 1-4 заместителями, независимо выбранными из галогена и C1-C4алкила. Согласно дополнительному варианту осуществления, группа R3 представляет собой бензил, замещенный 1-4 заместителями, независимо выбранными из метила, фтора, хлора или брома.
[00123] Согласно одному варианту осуществления, группа R1 представляет собой (CH2)t(5-10-членная гетероциклическая группа), где t представляет собой целое число от 0 до 5, необязательно замещенную 1 или 2 заместителями, независимо выбранными из C1-C4алкила, гидрокси или гидроксиметила.
[00124] Настоящая заявка относится к гетероциклическому фрагменту группы R1 в формуле I, выбранному из морфолино, пирролидинила, имидазолила, пиперазанила, пиперидинила и 2,5-диазабицикло[2.2.1]гепт-2-ила, переменная t в группе R1 варьирует от 2 до 5, и группа R1 необязательно замещена одной или несколькими гидроксигруппами.
[00125] Например, гетероциклический фрагмент группы R1 в формуле I согласно настоящей заявке представляет собой пирролидин.
[00126] Согласно дополнительным вариантам осуществления настоящей заявки, первое действующее вещество представляет собой:
 (II).
(II).
[00127] Соединение согласно настоящей заявке представляет собой 3-[(4-бром-2,6-дифторфенил)метокси]-5-[[[[4-(1-пирролидинил)бутил]амино]карбонил]амино]-4-изотиазолкарбоксамида гидрохлорид молекулярной формулы C20H24BrF2N5O3S⋅HCl с молекулярной массой 568,86 г/моль, характеризующийся тем, что молекула не содержит центр асимметрии и не является хиральной. Соединение согласно настоящей заявке представлено соединением I:
 (соединение I).
(соединение I).
[00128] Соединение I согласно настоящей заявке представляет собой ингибитор тирозинкиназной активности VEGFR-2, который блокирует VEGF-стимулированное автофосфорилирование этого рецептора, а также прлиферацию эндотелиальных клеток. Оно является селективным (>500×) применительно концентрации, требуемой для ингибирования зависимой от эпидермального фактора роста (EGFR) и инсулин-зависимой (IR) рецепторных тирозин киназ. Соединение I описано в патенте США № 6,235,764. Согласно некоторым вариантам осуществления, соединения формулы I или II представляют собой ингибиторы VEGFR-2.
[00129] Вторые действующие вещества согласно настоящей заявке представляют собой модуляторы (например, активаторы) тирозинкиназной активности EGFR.
[00130] Первое действующее вещество и второе действующее вещество могут вводиться вместе как часть одного и того же состава, содержащего первое действующее вещество, второе действующее вещество и фармацевтический наполнитель. Первое действующее вещество и второе действующее вещество также могут вводиться по отдельности. Согласно одному варианту осуществления, первое действующее вещество и второе действующее вещество вводят по отдельности в виде двух составов, где один состав содержит первое действующее вещество и фармацевтический наполнитель, и второй содержит второе действующее вещество и фармацевтический наполнитель.
[00131] Согласно одному варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, и второе действующее вещество или его фармацевтически приемлемую соль, вводят одновременно. В качестве альтернативы, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят перед введением второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят после введения второго действующего вещества или его фармацевтически приемлемой соли.
Общие свойства
[00132] Соединение I согласно настоящей заявке имеет характеристики, представленные в таблице 1. Варианты осуществления предусматривают три состава, содержащие соединение I или его свободное основание - соединение формулы II.
Таблица 1A: Общие свойства лекарственной субстанции - соединения I.
обозначение: соединение I
[00133] Композиции содержащих соединение I составов перечислены в таблице 1B. Вещества, содержащиеся в составах, перечислены в таблице 1C.
Таблица 1B: Содержащие соединение I составы: гелевые капли, суспензия и раствор
или
1%-20% сульфобутилэфир-β-циклодекстрин (SBE-β-CD, CAPTISOL®); ± 0,122% трометамин (Трис); 0,1-0,2% натрия дигидрофосфат, безводный; 0%-0,6% натрия хлорид; pH~6,0-7,0
или
1%-20% HP-β-CD (KLEPTOSE® HPB или KLEPTOSE® HP); 0,1-0,2% натрия дигидрофосфат, безводный; 0,50%-0,6% натрия хлорид; pH~6,0-7,0
Таблица 1C: Вещества, содержащиеся в составах
[00134] Композиции содержащих соединение I составов и второго действующего вещества перечислены в таблице 1D. Вещества, содержащиеся в составах, перечислены в таблице 1E.
Таблица 1D: Содержащие соединение I составы: гелевые капли, суспензия и раствор
или
1%-20% сульфобутилэфир-β-циклодекстрин (SBE-β-CD, CAPTISOL®); ±0,122% трометамин (Трис); 0,1-0,2% натрия дигидрофосфат, безводный; 0%-0,6% натрия хлорид; pH~6,0-7,0
или
1%-20% HP-β-CD (KLEPTOSE® HPB или KLEPTOSE® HP); 0,1-0,2% натрия дигидрофосфат, безводный; 0,50%-0,6% натрия хлорид; pH~6,0-7,0
Таблица 1E: Вещества, содержащиеся в составах
Офтальмологические растворы
[00135] Настоящая заявка относится к составам, содержащим первое действующее вещество (например, соединение I и/или его свободное основание (соединение формулы II)) и/или второе действующее вещество, полученным в виде раствора с вязкостью, близкой к воде. Раствор включает в себя фармацевтически приемлемые средства/наполнители, например, без ограничения циклодекстрин. Полученный тем самым раствор представляет собой прозрачный и бесцветный раствор, пригодный для местного офтальмологического применения.
[00136] Растворы согласно настоящей заявке уменьшают воздействие первого действующего вещества на передний отдел глаза; тем самым, позволяя увеличивать в растворе концентрацию первого действующего вещества, например, соединения формулы I или II, и увеличивать частоту применения, тем самым способствуя поддержанию высокой концентрации первого действующего вещества в заднем отделе глаза.
[00137] Растворы согласно настоящей заявке содержат приблизительно от 0,005% приблизительно до 5,0% (масс./об.) первого действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I. Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в растворах для местного введения составляет приблизительно 0,005% - приблизительно 0,01%, приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,1%, приблизительно 0,1% - приблизительно 0,2%, приблизительно 0,2% - приблизительно 0,3%, приблизительно 0,3% - приблизительно 0,4%, приблизительно 0,4% - приблизительно 0,5%, приблизительно 0,5% - приблизительно 0,6%, приблизительно 0,6% - приблизительно 0,7%, приблизительно 0,7% - приблизительно 0,8%, приблизительно 0,8% - приблизительно 0,9%, приблизительно 0,9% - приблизительно 1,0%, приблизительно 1,0 - приблизительно 2,0%, приблизительно 2,0 - приблизительно 3,0%, приблизительно 3,0 - приблизительно 4,0% или приблизительно 4,0 - приблизительно 5,0% (масс./об.). Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в составах для местного введения составляет приблизительно 0,1% - приблизительно 1,2%, приблизительно 0,2% - приблизительно 1,2%, приблизительно 0,3% - приблизительно 1,2%, приблизительно 0,4% - приблизительно 1,2%, 0,1% - приблизительно 1,1%, приблизительно 0,2% - приблизительно 1,1%, приблизительно 0,3% - приблизительно 1,1%, приблизительно 0,4% - приблизительно 1,1%, 0,1% - приблизительно 1,0%, приблизительно 0,2% - приблизительно 1,0%, приблизительно 0,3% - приблизительно 1,0%, приблизительно 0,4% - приблизительно 1,0%, 0,1% - приблизительно 0,8%, приблизительно 0,2% - приблизительно 0,8%, приблизительно 0,3% - приблизительно 0,8%, приблизительно 0,4% - приблизительно 0,8%, 0,1% - приблизительно 0,6%, приблизительно 0,2% - приблизительно 0,6%, приблизительно 0,3% - приблизительно 0,6%, приблизительно 0,4% - приблизительно 0,6%, 0,1% - приблизительно 0,5%, приблизительно 0,2% - приблизительно 0,5%, приблизительно 0,3% - приблизительно 0,5%, приблизительно 0,4% - приблизительно 0,5%, 0,1% - приблизительно 0,4%, приблизительно 0,2% - приблизительно 0,4%, приблизительно 0,3% - приблизительно 0,4% (масс./об.). Согласно некоторым вариантам осуществления, растворы содержат приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения I или его свободного основания (формула II).
[00138] Растворы согласно настоящей заявке могут дополнительно содержать приблизительно 0,00001% - приблизительно 5,0% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Растворы согласно настоящей заявке могут дополнительно содержать приблизительно 0,00001% - приблизительно 1,0%, приблизительно 0,00001% - приблизительно 0,1%, приблизительно 0,00001% - приблизительно 0,01%, приблизительно 0,00001% - приблизительно 0,001%, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в растворах для местного введения составляет приблизительно 0,00001% - приблизительно 0,0001%, 0,000012% - приблизительно 0,0001%, 0,000014% - приблизительно 0,0001%, 0,000016% - приблизительно 0,0001%, 0,000018% - приблизительно 0,0001%, 0,00002% - приблизительно 0,0001%, 0,00003% - приблизительно 0,0001%, 0,00004% - приблизительно 0,0001%, 0,00005% - приблизительно 0,0001%, 0,00006% - приблизительно 0,0001%, 0,00007% - приблизительно 0,0001%, 0,00008% - приблизительно 0,0001%, 0,00009% - приблизительно 0,0001%, 0,000016% - приблизительно 0,00009%, 0,000018% - приблизительно 0,00009%, 0,00002% - приблизительно 0,00009%, 0,00003% - приблизительно 0,00009%, 0,00004% - приблизительно 0,00009%, 0,00005% - приблизительно 0,00009%, 0,00006% - приблизительно 0,00009%, 0,00007% - приблизительно 0,00009%, 0,00008% - приблизительно 0,00009% (масс./об.). Согласно некоторым вариантам осуществления, растворы содержат приблизительно 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,000081%, 0,000082%, 0,000083%, 0,000084%, 0,000085%, 0,000086%, 0,000087%, 0,000088% или 0,000089% (масс./об.) второго действующего вещества.
[00139] Растворы согласно настоящей заявке могут дополнительно содержать приблизительно 0,5 мкМ, приблизительно 0,6 мкМ, приблизительно 0,7 мкМ, приблизительно 0,8 мкМ, приблизительно 0,9 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 7 мкМ, приблизительно 8 мкМ или приблизительно 9 мкМ второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества составляет приблизительно 1 мкМ.
[00140] Согласно некоторым вариантам осуществления, состав содержит циклодекстрин для улучшения растворимости первого действующего вещества (например, соединения I). Циклодекстрин, олигосахарид, образованный 6-8 остатками декстрозы, объединенных посредством 1-4 связей, увеличивают растворимость действующих веществ, которые характеризуются плохой или слабой растворимостью в воде или водных растворах (например, в фосфатном буферном растворе). Циклодекстрины формируют гидрофильные комплексы с гидрофобными действующими веществами.
[00141] Один или несколько циклодекстринов могут быть использованы в растворе согласно настоящей заявке. Неограничивающие примеры циклодекстринов для применения в составе согласно настоящей заявке представляют собой, например: 2-гидроксипропил-β-циклодекстрин, метил-β-циклодекстрин, произвольно метилированный β-циклодекстрин, этилированный β-циклодекстрин, триацетил-β-циклодекстрин, перацетилированный β-циклодекстрин, карбоксиметил-β-циклодекстрин, гидроксиэтил-β-циклодекстрин, 2-гидрокси-3-(триметиламмонио)пропил-β-циклодекстрин, глюкозил-β-циклодекстрин, мальтозил-β-циклодекстрин, сульфобутилэфир-β-циклодекстрин, разветвленный β-циклодекстрин, гидроксипропил-γ-циклодекстрин, произвольно метилированный γ-циклодекстрин, триметил-γ-циклодекстрин, или их сочетание.
[00142] Согласно некоторым вариантам осуществления, содержащий циклодекстрин раствор соединения формулы II или соединения I представляет собой прозрачный и бесцветный раствор и характеризуется вязкостью, сходной с водой. Согласно некоторым вариантам осуществления, настоящая заявка относится к раствору, содержащему соединение I, один или несколько циклодекстринов и второе действующее вещество для местного применения, и местно офтальмологически вводимому.
[00143] Офтальмологический раствор согласно настоящей заявке содержит циклодекстрин и фармацевтические наполнители, выбранные в концентрациях, оптимальных для офтальмологического раствора или ниже. Наполнители согласно настоящей заявке представляют собой, например, бензалкония хлорид (BAK) и NaCl. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,001 - приблизительно 0,005% (масс./об.) бензалкония хлорида (BAK). Количество BAK варьирует в зависимости от требований к применению.
[00144] Офтальмологический раствор содержит, например, без ограничения приблизительно 0,005% - 5,0% соединения I или его свободного основания, приблизительно 2% - приблизительно 25% циклодекстрина, например, без ограничения гидроксипропил-β-циклодекстрина (HPβCD) или метилциклодекстрина (KLEPTOSE® HPB), и/или сульфобутилэфир-β-циклодекстрина (CAPTISOL®), приблизительно 0,1% - приблизительно 0,7% соли, например, без ограничения NaCl, и/или приблизительно 0,005% антимикробного средства, например, без ограничения бензалкония хлорида (BAK). Состав содержит соединение I или его свободное основание и циклодекстрин в соотношении 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10 или от 1:10 до 1:20. Согласно некоторым вариантам осуществления, содержащий циклодекстрин офтальмологический раствор дополнительно содержит трометамин (также известный как Трис, трис(гидроксиметил)аминометан или Трис-буфер). Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,05% - 1% Трис. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,05% - 0,5% Трис. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,05% - 0,2% Трис. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,1% - 0,15% Трис. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 1% Трис. Согласно некоторым вариантам осуществления, офтальмологический раствор дополнительно содержит приблизительно 0,005% - 5,0% второго действующего вещества.
[00145] Офтальмологические растворы согласно настоящим вариантам осуществлениям содержат, например, без ограничения: приблизительно 0,3% - приблизительно 5,0% соединения I (приблизительно 3 мг/мл - приблизительно 50,0 мг/мл), приблизительно 0,05% натрия дигидрофосфата моногидрата, приблизительно 2% глицерина; приблизительно 0,4% соединения I, приблизительно 7% HPβCD, приблизительно 0,7% NaCl, приблизительно 0,005% BAK; приблизительно 0,4% соединения I, приблизительно 4% HPβCD, приблизительно 0,7% NaCl, приблизительно 0,005% BAK; приблизительно 0,4% соединения I, приблизительно 7% HPβCD, приблизительно 1% трометамина, приблизительно 0,4% NaCl, приблизительно 0,005% BAK; и приблизительно 0,6% соединения I, приблизительно 7% HPβCD, приблизительно 0,7% NaCl, приблизительно 0,005% BAK. Для концентраций соединения I приблизительно от 0,005% приблизительно до 5,0%, в соответствующем молярном соотношении присутствует циклодекстрин. Согласно некоторым вариантам осуществления, офтальмологический раствор дополнительно содержит приблизительно 0,005% - 5,0% второго действующего вещества.
[00146] Дополнительные офтальмологические растворы содержат, например, без ограничения: приблизительно 0,4% соединения формулы II (свободное основание), приблизительно 7,15% HPβCD, приблизительно 0,7% NaCl; приблизительно 0,1% соединения формулы II (свободное основание), приблизительно 1,79% HPβCD, приблизительно 0,85% NaCl; приблизительно 0,2% соединения формулы II (свободное основание), приблизительно 3,57% HPβCD, приблизительно 0,8% NaCl; приблизительно 0,6% соединения формулы II (свободное основание), приблизительно 10,72% HPβCD, приблизительно 0,6% NaCl; приблизительно 0,4% соединения формулы II (свободное основание), приблизительно 8,41% HPβCD, приблизительно 0,65% NaCl; приблизительно 0,4% соединения I, приблизительно 10,51 HPβCD, приблизительно 0,65% NaCl; приблизительно 0,4% соединения формулы II (свободное основание), приблизительно 10,51% HPβCD, приблизительно 0,15% NaCl, приблизительно 1,0% трометамина (Трис); и/или приблизительно 0,1% соединения формулы II (свободное основание), приблизительно 2,63% HPβCD, приблизительно 0,8% NaCl; приблизительно 0,6% соединения I (в виде свободного основания), приблизительно 15,77% HPβCD, приблизительно 0,37% NaCl. Для концентраций соединения формулы II приблизительно от 0,005% приблизительно до 5,0% в соответствующем молярном соотношении присутствует циклодекстрин. Согласно некоторым вариантам осуществления, офтальмологический раствор дополнительно содержит приблизительно 0,005% - 5,0% второго действующего вещества.
[00147] Согласно некоторым вариантам осуществления, офтальмологические растворы содержат приблизительно 1,0% - приблизительно 25% циклодекстрина. Например, без ограничения содержащие соединение I составы содержат приблизительно 2,0% - приблизительно 3,0% HPβCD, приблизительно 3,0% - приблизительно 5,0% HPβCD, приблизительно 5,0% - приблизительно 10% HPβCD или приблизительно 10% - приблизительно 25% HPβCD. Согласно некоторым вариантам осуществления, офтальмологический раствор дополнительно содержит приблизительно 0,005% - 5,0% второго действующего вещества.
[00148] Согласно дополнительным вариантам осуществления, офтальмологические растворы приготовлены, например, без ограничения следующим образом: приблизительно 8,41% KLEPTOSE® HPB и приблизительно 0,142% фосфата; приблизительно 8,9% KLEPTOSE® HPB и приблизительно 0,142% фосфата; приблизительно 4,88% CAPTISOL® и приблизительно 0,142 фосфата; и/или приблизительно 4,88% CAPTISOL® и приблизительно 0,122% фосфата.
[00149] Согласно некоторым вариантам осуществления, офтальмологические растворы, содержащие циклодекстрины, являются прозрачными и бесцветными, и чрезвычайно вязкими, умеренно вязкими или характеризуются вязкостью, сходной с водой.
[00150] Согласно некоторым вариантам осуществления, офтальмологический раствор согласно настоящей заявке характеризуется значением pH приблизительно от 4,5 приблизительно до 7,5 при температуре приблизительно 40°C или ниже.
[00151] Согласно некоторым вариантам осуществления, офтальмологический раствор согласно настоящей заявке характеризуется значением pH приблизительно от 5,0 приблизительно до 7,0 при температуре приблизительно 40°C или ниже.
[00152] Например, офтальмологический раствор согласно настоящей заявке характеризуется значением pH приблизительно 6,0 при температуре приблизительно 40°C или ниже.
[00153] Офтальмологические растворы согласно настоящей заявке могут содержать различные добавки, включаемые в состав обычным путем, такие как буферные вещества (например, фосфатные буферы, боратные буферы, цитратные буферы, тартратные буферы, ацетатные буферы, аминокислоты, натрия ацетат, натрия цитрат, и т.п.), регуляторы тоничности (например, сахариды, такие как сорбит, глюкоза и маннит, многоатомные спирты, такие как глицерин, концентрированный глицерин, PEG и полипропиленгликоль, соли, такие как натрия хлорид, и т.д.), консерванты и антисептики (например, бензалкония хлорид, бензаткония хлорид, пара-оксибензоаты, такие как метил-пара-оксибензоат или этил-пара-оксибензоат, бензиловый спирт, фенэтиловый спирт, сорбиновая кислота или ее соль, тимеросал, хлорбутанол, и т.д.), солюбилизирующие вспомогательные средства или стабилизаторы частиц (например, растворимые в воде полимеры, такие как поливинилпирролидон, поверхностно-активные вещества, такие как тилоксапол, полисорбаты, полоксамер, и т.д.), модификаторы pH (например, соляная кислота, уксусная кислота, фосфорная кислота, гидроксид натрия, гидроксид калия, гидроксид аммония и т.п.), загустители (например, HEC, гидроксипропилцеллюлоза, метилцеллюлоза, HPMC, карбоксиметилцеллюлоза и их соли), хелатирующие вещества (например, натрия эдетат, натрия цитрат, конденсированный натрия фосфат и т.д.) и стабилизаторы второго действующего вещества (например, EDTA, пропилгаллат и их сочетание).
[00154] Офтальмологические растворы согласно настоящей заявке содержат циклодекстрин и могут дополнительно содержать дополнительные наполнители, например, без ограничения приблизительно 0,5% - приблизительно 3% поверхностно-активного вещества и эмульгатора, например, без ограничения полисорбата 80 или эквивалентных ему наполнителей; приблизительно 0,05% - приблизительно 0,4% неионогенного жидкого полимера по типу алкиларилполиэфир-спиртов, например, без ограничения тилоксапола; и/или приблизительно 0,05% - приблизительно 0,6% гидрофильного неионогенного поверхностно-активного вещества, например, без ограничения полоксамера, такого как полоксамер 407.
[00155] Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,01% - приблизительно 0,5%, приблизительно 0,02% - приблизительно 0,5%, приблизительно 0,04% - приблизительно 0,5%, приблизительно 0,06% - приблизительно 0,5%, приблизительно 0,08% - приблизительно 0,5%, приблизительно 0,08% - приблизительно 0,4%, приблизительно 0,08% - приблизительно 0,3%, приблизительно 0,08% - приблизительно 0,2%, приблизительно 0,08% - приблизительно 0,18%, приблизительно 0,08% - приблизительно 0,16%, приблизительно 0,08% - приблизительно 0,14% или приблизительно 0,08% - приблизительно 0,12% EDTA. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,04%, приблизительно 0,06%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,12, приблизительно 0,14%, приблизительно 0,16%, приблизительно 0,18% или приблизительно 0,2% EDTA. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,1% EDTA.
[00156] Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,001% - приблизительно 0,5%, приблизительно 0,002% - приблизительно 0,5%, приблизительно 0,005% - приблизительно 0,5%, приблизительно 0,01% - приблизительно 0,5%, приблизительно 0,02% - приблизительно 0,5%, приблизительно 0,03% - приблизительно 0,5%, приблизительно 0,04% - приблизительно 0,5%, приблизительно 0,01% - приблизительно 0,4%, приблизительно 0,01% - приблизительно 0,3%, приблизительно 0,01% - приблизительно 0,2%, приблизительно 0,01% - приблизительно 0,1%, приблизительно 0,01% - приблизительно 0,08%, приблизительно 0,01% - приблизительно 0,06% пропилгаллата. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,01%, приблизительно 0,02%, приблизительно 0,03%, приблизительно 0,04%, приблизительно 0,05%, приблизительно 0,06%, приблизительно 0,07%, приблизительно 0,08%, приблизительно 0,09% пропилгаллата. Согласно некоторым вариантам осуществления, офтальмологический раствор содержит приблизительно 0,05% пропилгаллата.
Концентрация в различных тканях глаза - доставка в виде офтальмологического раствора
[00157] Офтальмологический раствор, содержащий циклодекстрин, улучшает биодоступность первых действующих веществ согласно настоящей заявке в заднем отделе глаза. Без привязки к какой-либо теории, согласно одному варианту осуществления, содержащий циклодекстрин состав образует прозрачный и бесцветный раствор, который снижает воздействие действующего вещества, например, соединения I, на роговицу приблизительно в 5-15 раз по сравнению с воздействием на роговицу эквимолярного количества состава в виде гелевых капель.
[00158] Без привязки к какой-либо теории, согласно одному варианту осуществления, содержащий циклодекстрин офтальмологический раствор увеличивает терапевтический индекс соединения I в процессе местного офтальмологического введения. После введения, гидрофильный комплекс циклодекстрин-соединение I фармакологически инертен в роговице. Без привязки к какой-либо теории, согласно некоторым вариантам осуществления, комплекс циклодекстрин-соединение I усиливает переносимость роговицей соединения I. Без привязки к какой-либо теории, согласно некоторым вариантам осуществления, спонтанная диссоциация циклодекстрина и соединения I в периферической сосудистой системе увеличивает биодоступность в целевой ткани, например, в сосудистой оболочке или сетчатке.
[00159] В отличие от других составов, содержащих соединение I, которые согласно некоторым вариантам осуществления вносят вклад в токсичность в отношении роговицы, офтальмологический раствор на основе циклодекстрина, содержащий сходную концентрацию соединения I, снижает воздействие на роговицу, а потому увеличивает терапевтический индекс и соответствующие благоприятные эффекты у пациентов. Согласно одному варианту осуществления, использование раствора соединения I на основе циклодекстрина обеспечивает приблизительно 10-кратное снижение воздействия на роговицу по сравнению с эквимолярными концентрациями гелевых капель. Согласно некоторым вариантам осуществления, раствор соединения I на основе циклодекстрина снижает воздействие соединения I на роговицу в 5, 20, 30, 40 или 50 раз. Согласно одному варианту осуществления, местное офтальмологическое дозированное введение приблизительно 0,005% - приблизительно 5,0% соединения I в виде раствора на основе циклодекстрина на протяжении 1-90 суток или 3-9 месяцев не оказывает какого-либо отрицательного или токсичного эффекта на роговицу, сосудистую оболочку и/или сетчатку. Согласно еще одному варианту осуществления, местное офтальмологическое дозированное введение приблизительно 0,6% - приблизительно 5,0% соединения I в виде раствора на основе циклодекстрина в течение 1-90 суток не оказывает какого-либо отрицательного или токсического эффекта на роговицу, сосудистую оболочку и/или сетчатку.
[00160] Снижение воздействия на роговицу коррелирует с увеличением биодоступности и терапевтического индекса действующего вещества в заднем отделе глаза, например, в сетчатке или сосудистой оболочке. Например, токсический эффект, вызываемый первым действующим соединением или подходящим носителем, не наблюдается в роговице или в других частях глаза при местном офтальмологическом введении состава, содержащего приблизительно 0,1% - приблизительно 5,0% соединения I и циклодекстрин, по меньшей мере, в течение 30 суток или более чем 60 суток.
[00161] Согласно одному варианту осуществления, если состав, содержащий приблизительно 0,4% (приблизительно 4 мг/мл) соединения I или его свободного основания и циклодекстрин, вводят местно офтальмологически, то концентрация действующего вещества в центральной части сосудистой оболочки составляет приблизительно 0,2 мкМ - приблизительно 0,9 мкМ, концентрация действующего вещества в центральной части сетчатки составляет приблизительно 0,02 мкМ - приблизительно 0,4 мкМ, концентрация действующего вещества во внутриглазной жидкости составляет приблизительно 0,003 мкМ - приблизительно 0,009 мкМ, и концентрация действующего вещества в роговице составляет 6 мкМ - 40 мкМ. Используемый в составе циклодекстрин представляет собой, например, без ограничения KLEPTOSE® HPB или CAPTISOL®.
[00162] Согласно некоторым вариантам осуществления, раствор соединения I или его свободного основания на основе циклодекстрина увеличивает биодоступность действующего вещества в центральной части сосудистой оболочки и в центральной части сетчатки, снижая при этом концентрацию в роговице. Согласно некоторым вариантам осуществления, местное введение соединения I или его свободного основания, включенного в состав с циклодекстрином, снижает концентрацию в роговице приблизительно в 5 - приблизительно в 15 раз по сравнению с концентрацией в роговице эквимолярного количества гелевых капель.
[00163] Без привязки к какой-либо теории, согласно некоторым вариантам осуществления, объединенные эффекты снижения воздействия лекарства на роговицу с возможностью избежать плохой переносимости глазом с одновременным увеличением биодоступности заднего отдела глаза увеличивают терапевтический индекс и соответствующие положительные эффекты у пациентов.
[00164] Согласно некоторым вариантам осуществления, продолжительность воздействия соединения I и второго действующего вещества составляет от 1 до 90 суток или превышает 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, схема приема включает в себя несколько курсов местного офтальмологического введения субъекту состава, содержащего соединение I и второе действующее вещество, где второе действующее вещество вводят в виде отдельного состава или как часть состава, содержащего соединение I, в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Например, схема приема включает в себя введение состава один раз в сутки, два раза в сутки, три раза в сутки или четыре раза в сутки в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Например, схема приема включает в себя введение соединения формулы I или II и второго действующего вещества один раз, два раза, три раза или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, схема приема включает в себя введение один раз на 1 сутки, один раз или два раза на 2 сутки - 90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, с последующим введением один раз в сутки на 2-90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, с последующим введением один, два, три или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, одна схема введения включает в себя введение один раз в сутки или два раза в сутки в течение 1, 2, 3, 4 или 5 суток подряд. Для схемы с введением два или раза в сутки, субъектам местно офтальмологически вводят дозу состава, содержащего соединение I, и второго действующего вещества на 1 сутки и 4 сутки с интервалом приблизительно в 4, 6 или 8 часов. Согласно другому варианту осуществления, субъектам местно офтальмологически вводят дозы состава, содержащего соединение I, и второго действующего вещества с интервалом приблизительно в 4, 6 или 8 часов в течение 4 суток подряд. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы в сутки состава, содержащего соединение I, и второго действующего вещества в течение 5 суток подряд. Согласно еще одним вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы состава, содержащего соединение I и второе действующее вещество, в течение 5-90 суток подряд. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы состава, содержащего соединение I, и второго действующего вещества, по меньшей мере, в течение 25 суток подряд. Согласно одному варианту осуществления, субъектам местно офтальмологически вводят одну или две дозы, по меньшей мере, в течение 90 суток подряд или более. Второе действующее вещество может вводиться по отдельности или как часть состава, содержащего соединение I. При введении по отдельности, второе действующее вещество или его фармацевтически приемлемая соль могут вводиться отдельно или в виде состава.
[00165] Например, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и/или второго действующего вещества, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 3 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 4 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 10 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше. Согласно некоторым вариантам осуществления, состав согласно настоящей заявке вводят 1 р/сут, 2 р/сут, 3 р/сут или 4 р/сут при введении в малых дозах (например, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл или 5 мг/мл), и 1 р/сут или 2 р/сут в высоких дозах (например, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл или 10 мг/мл).
[00166] Согласно некоторым вариантам осуществления, состав, содержащий 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 1 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 2 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 3 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 4 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 5 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 6 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 10 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 10 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 1 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше.
[00167] Настоящая заявка относится к растворам на основе циклодекстрина, содержащим гидроксипропил-β-циклодекстрин (HP-β-CD, KLEPTOSE® HPB) или CAPTISOL®, которые хорошо переносятся при местном введении в течение 30-90 суток или в течение 4-6 месяцев. Согласно некоторым вариантам осуществления, введение один или два раза в сутки приблизительно 0,005% - приблизительно 5,0% (масс./об.) соединения I или его свободного основания и второго действующего вещества в растворе, содержащем приблизительно 1,0% - приблизительно 25% HP-β-CD или CAPTISOL®, хорошо переносится субъектом.
[00168] Согласно некоторым вариантам осуществления, состав, содержащий соединение формулы II или соединение I и второе действующее вещество, вводят субъекту в один глаз или в оба глаза. Например, состав согласно настоящей заявке, содержащий приблизительно 0,2% - приблизительно 1,0% (масс./об.) соединения формулы II или приблизительно 0,1% - 1,2% (масс./об.) соединения I и второе действующее вещество, вводят один раз в сутки (1 р/сут), два раза в сутки (2 р/сут), три раза в сутки (3 р/сут) или четыре раза в сутки (4 р/сут) в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий соединение формулы II или соединение I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта. Например, состав, содержащий приблизительно 0,2% - приблизительно 1,0% (масс./об.) соединения формулы II или приблизительно 0,1% - 1,2% (масс./об.) соединения I, и второе действующее вещество вводят один раз в сутки (1 р/сут), два раза в сутки (2 р/сут), три раза в сутки (3 р/сут) или четыре раза в сутки (4 р/сут) в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев).
[00169] Согласно некоторым вариантам осуществления, соединение формулы II или соединение I формируют комплекс с комплексообразующим веществом, например, с циклодекстрином (например, Kleptose® HPB (%)) в соотношении приблизительно 1:8, при котором к составу добавляют приблизительно 2% - 13% (масс./об.) циклодекстрина (например, Kleptose® HPB (%)). Состав может дополнительно содержать приблизительно 0,1% - приблизительно 0,2% буфера, например, 10 мМ фосфатного буфера. Требуемая осмолярность состава составляет приблизительно 200 - приблизительно 300 мОсм, что достигается добавлением требуемого для получения требуемой осмолярности количества соли, например, хлорида натрия. Значение pH состава составляет приблизительно 6,0 при температуре приблизительно 40°C или ниже. Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше.
Офтальмологические суспензии
[00170] Настоящая заявка относится к суспензиям первого действующего вещества (например, соединения I), содержащим действующего вещество и фармацевтически приемлемые наполнители. Настоящая заявка также относится к суспензиям первого действующего вещества (например, соединения I) и второго действующего вещества, содержащим первое действующее вещество, второе действующее вещество и фармацевтически приемлемые наполнители. Например, суспензии соединения I и суспензии второго действующего вещества могут включать в себя без ограничения буферные вещества, кислоты и основания, например, без ограничения HCl и NaOH. Согласно одному варианту осуществления, суспензии соединения I или его свободного основания могут включать в себя буферное вещество, например, без ограничения трометамин (Трис). Согласно другому варианту осуществления, суспензии соединения I или его свободного основания и второго действующего вещества могут включать в себя буферное вещество, например, без ограничения трометамин (Трис). Суспензия соединения формулы II или соединения I и второго действующего вещества на основе трометамина пригодны для местного офтальмологического введения.
[00171] Суспензии согласно настоящей заявке содержат приблизительно 0,005% приблизительно до 5,0% (масс./об.) первого действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I. Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в суспензиях для местного введения составляет приблизительно 0,005% - приблизительно 0,01%, приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,1%, приблизительно 0,1% - приблизительно 0,2%, приблизительно 0,2% - приблизительно 0,3%, приблизительно 0,3% - приблизительно 0,4%, приблизительно 0,4% - приблизительно 0,5%, приблизительно 0,5% - приблизительно 0,6%, приблизительно 0,6% - приблизительно 0,7%, приблизительно 0,7% - приблизительно 0,8%, приблизительно 0,8% - приблизительно 0,9%, приблизительно 0,9% - приблизительно 1,0%, приблизительно 1,0% - приблизительно 2,0%, приблизительно 2,0% - приблизительно 3,0%, приблизительно 3,0% - приблизительно 4,0% или приблизительно 4,0% - приблизительно 5,0% (масс./об.). Согласно некоторым вариантам осуществления, концентрация соединения I или его свободного основания (формула II) в составах для местного введения составляет приблизительно 0,1% - приблизительно 1,2%, приблизительно 0,2% - приблизительно 1,2%, приблизительно 0,3% - приблизительно 1,2%, приблизительно 0,4% - приблизительно 1,2%, 0,1% - приблизительно 1,1%, приблизительно 0,2% - приблизительно 1,1%, приблизительно 0,3% - приблизительно 1,1%, приблизительно 0,4% - приблизительно 1,1%, 0,1% - приблизительно 1,0%, приблизительно 0,2% - приблизительно 1,0%, приблизительно 0,3% - приблизительно 1,0%, приблизительно 0,4% - приблизительно 1,0%, 0,1% - приблизительно 0,8%, приблизительно 0,2% - приблизительно 0,8%, приблизительно 0,3% - приблизительно 0,8%, приблизительно 0,4% - приблизительно 0,8%, 0,1% - приблизительно 0,6%, приблизительно 0,2% - приблизительно 0,6%, приблизительно 0,3% - приблизительно 0,6%, приблизительно 0,4% - приблизительно 0,6%, 0,1% - приблизительно 0,5%, приблизительно 0,2% - приблизительно 0,5%, приблизительно 0,3% - приблизительно 0,5%, приблизительно 0,4% - приблизительно 0,5%, 0,1% - приблизительно 0,4%, приблизительно 0,2% - приблизительно 0,4%, приблизительно 0,3% - приблизительно 0,4% (масс./об.). Согласно некоторым вариантам осуществления, суспензии содержат приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения I или его свободного основания (формула II).
[00172] Суспензии согласно настоящей заявке могут дополнительно содержать приблизительно 0,00001% - приблизительно 5,0% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Суспензии согласно настоящей заявке могут дополнительно содержать приблизительно 0,00001% - приблизительно 1,0%, приблизительно 0,00001% - приблизительно 0,1%, приблизительно 0,00001% - приблизительно 0,01%, приблизительно 0,00001% - приблизительно 0,001%, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества в суспензиях для местного введения составляет приблизительно 0,00001% - приблизительно 0,0001%, 0,000012% - приблизительно 0,0001%, 0,000014% - приблизительно 0,0001%, 0,000016% - приблизительно 0,0001%, 0,000018% - приблизительно 0,0001%, 0,00002% - приблизительно 0,0001%, 0,00003% - приблизительно 0,0001%, 0,00004% - приблизительно 0,0001%, 0,00005% - приблизительно 0,0001%, 0,00006% - приблизительно 0,0001%, 0,00007% - приблизительно 0,0001%, 0,00008% - приблизительно 0,0001%, 0,00009% - приблизительно 0,0001%, 0,000016% - приблизительно 0,00009%, 0,000018% - приблизительно 0,00009%, 0,00002% - приблизительно 0,00009%, 0,00003% - приблизительно 0,00009%, 0,00004% - приблизительно 0,00009%, 0,00005% - приблизительно 0,00009%, 0,00006% - приблизительно 0,00009%, 0,00007% - приблизительно 0,00009% или 0,00008% - приблизительно 0,00009% (масс./об.). Согласно некоторым вариантам осуществления, суспензии содержат приблизительно 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,000081%, 0,000082%, 0,000083%, 0,000084%, 0,000085%, 0,000086%, 0,000087%, 0,000088% или 0,000089% (масс./об.) второго действующего вещества.
[00173] Суспензии согласно настоящей заявке могут дополнительно содержать приблизительно 0,5 мкМ, приблизительно 0,6 мкМ, приблизительно 0,7 мкМ, приблизительно 0,8 мкМ, приблизительно 0,9 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 7 мкМ, приблизительно 8 мкМ или приблизительно 9 мкМ второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества составляет приблизительно 1 мкМ.
[00174] Офтальмологические суспензии могут содержать различные добавки, включаемые в состав обычным путем, такие как буферные вещества (например, фосфатные буферы, боратные буферы, цитратные буферы, тартратные буферы, ацетатные буферы, аминокислоты, натрия ацетат, натрия цитрат, и т.п.), регуляторы тоничности (например, сахариды, такие как сорбит, глюкоза и маннит, многоатомные спирты, такие как глицерин, концентрированный глицерин, PEG и полипропиленгликоль, соли, такие как натрия хлорид, и т.д.), консерванты и антисептики (например, бензалкония хлорид, бензаткония хлорид, пара-оксибензоаты, такие как метил-пара-оксибензоат или этил-пара-оксибензоат, бензиловый спирт, фенэтиловый спирт, сорбиновая кислота или ее соль, тимеросал, хлорбутанол, и т.д.), солюбилизирующие вспомогательные средства или стабилизаторы частиц (например, циклодекстрины и их производное, растворимые в воде полимеры, такие как поливинилпирролидон, поверхностно-активные вещества, такие как тилоксапол, полисорбаты, полоксамер, и т.д.), модификаторы pH (например, соляная кислота, уксусная кислота, фосфорная кислота, гидроксид натрия, гидроксид калия, гидроксид аммония и т.п.), загустители (например, HEC, гидроксипропилцеллюлоза, метилцеллюлоза, HPMC, карбоксиметилцеллюлоза и их соли), хелатирующие вещества (например, натрия эдетат, натрия цитрат, конденсированный натрия фосфат и т.д.) и стабилизаторы второго действующего вещества (например, EDTA, пропилгаллат и их сочетание).
[00175] Офтальмологическая суспензия согласно настоящей заявке содержит фармацевтические наполнители, выбранные в концентрациях, оптимальных для офтальмологического раствора или ниже. Наполнители согласно настоящей заявке включают в себя, например, натрия фосфата моногидрат, глицерин и бензалкония хлорид (BAK).
[00176] Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,01% - приблизительно 0,5%, приблизительно 0,02% - приблизительно 0,5%, приблизительно 0,04% - приблизительно 0,5%, приблизительно 0,06% - приблизительно 0,5%, приблизительно 0,08% - приблизительно 0,5%, приблизительно 0,08% - приблизительно 0,4%, приблизительно 0,08% - приблизительно 0,3%, приблизительно 0,08% - приблизительно 0,2%, приблизительно 0,08% - приблизительно 0,18%, приблизительно 0,08% - приблизительно 0,16%, приблизительно 0,08% - приблизительно 0,14% или приблизительно 0,08% - приблизительно 0,12% EDTA. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,04%, приблизительно 0,06%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,12, приблизительно 0,14%, приблизительно 0,16%, приблизительно 0,18% или приблизительно 0,2% EDTA. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,1% EDTA.
[00177] Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,001% - приблизительно 0,5%, приблизительно 0,002% - приблизительно 0,5%, приблизительно 0,005% - приблизительно 0,5%, приблизительно 0,01% - приблизительно 0,5%, приблизительно 0,02% - приблизительно 0,5%, приблизительно 0,03% - приблизительно 0,5%, приблизительно 0,04% - приблизительно 0,5%, приблизительно 0,01% - приблизительно 0,4%, приблизительно 0,01% - приблизительно 0,3%, приблизительно 0,01% - приблизительно 0,2%, приблизительно 0,01% - приблизительно 0,1%, приблизительно 0,01% - приблизительно 0,08%, приблизительно 0,01% - приблизительно 0,06% пропилгаллата. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,01%, приблизительно 0,02%, приблизительно 0,03%, приблизительно 0,04%, приблизительно 0,05%, приблизительно 0,06%, приблизительно 0,07%, приблизительно 0,08%, приблизительно 0,09% пропилгаллата. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,05% пропилгаллата.
[00178] Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, и второе действующее вещество, и может дополнительно содержать трометамин (т.е. Трис). Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,05% - 1% Трис. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,2% - 1,0% Трис. Согласно некоторым вариантам осуществления, офтальмологическая суспензия содержит приблизительно 0,4% - 0,8% Трис. Суспензия соединения I или его свободного основания и/или второго действующего вещества на основе трометамина может содержать дополнительные буферы и наполнители, например, без ограничения фосфатный буфер. Суспензии могут дополнительно содержать один или несколько поверхностно-активных веществ и эмульгаторов, например, без ограничения полисорбат 80 или эквивалентные ему наполнители; один или несколько неионогенных жидких полимеров по типу алкиларилполиэфир-спиртов, например, без ограничения тилоксапол; и/или один или несколько гидрофильных неионогенных поверхностно-активных веществ, например, без ограничения полоксамер, такой как полоксамер 407.
[00179] Настоящая заявка относится к суспензиям действующих веществ согласно настоящей заявке, составленных в присутствии наполнителей, таких как без ограничения повидон, полисорбат 80 (PS80), полиэтиленгликоль (PEG) 400, тилоксапол, полоксамер, глицерин и BAK в Трис-буфере.
[00180] Согласно одному варианту осуществления, суспензия соединения I или его свободного основания содержит приблизительно 0,1-0,5% фосфатного буфера. Согласно другому варианту осуществления, суспензия соединения I или его свободного основания и второго действующего вещества содержит приблизительно 0,1-0,5% фосфатного буфера. Согласно некоторым вариантам осуществления, значение pH суспензии на основе трометамина составляет от pH 4 до pH 7, например, pH 6,0. Согласно некоторым вариантам осуществления, приготовленные в Трис-буфере суспензии, содержат приблизительно 0,5% - приблизительно 2% полисорбата 80; приблизительно 0,05% - приблизительно 0,2% тилоксапола; и/или приблизительно 0,05% - приблизительно 0,4% полоксамера 407.
[00181] Согласно некоторым таким вариантам осуществления, суспензии согласно настоящей заявке дополнительно содержат приблизительно 0,01% - приблизительно 1% или приблизительно 1% - приблизительно 2,0% (масс./об.) глицерина. Согласно конкретному варианту осуществления, суспензии содержат приблизительно 2% (масс./об.) глицерина.
[00182] Согласно некоторым вариантам осуществления, суспензии согласно настоящей заявке дополнительно содержат приблизительно 0,001% - приблизительно 0,005% (масс./об.) бензалкония хлорида (BAK). Количество BAK может варьировать в зависимости от каких-либо наблюдаемых неблагоприятных эффектов. BAK может быть разрушительным применительно к клеткам на поверхности глаза, а потому количество в составе может варьировать для достижения оптимального для проникновения в глаз уровня соединения I, без нарушения целостности клеточных слоев глаза и повышенной токсичности.
[00183] Согласно некоторым вариантам осуществления, суспензия необязательно содержит буферы. В некоторых вариантах, буферы могут представлять собой, например, дигидрофосфат натрия, фосфорную кислоту и Трис-буфер. Концентрация соединения I в суспензии составляет приблизительно 0,005% - приблизительно 5,0% (масс./об.). Суспензия, приготовленная без добавления буфера, дополнительно содержит приблизительно 0,005% BAK и приблизительно 2% глицерина, и имеет pH 6,0. Согласно другому варианту осуществления, суспензия, приготовленная без добавления буфера, содержит приблизительно 1% полисорбата 80, приблизительно 0,1% тилоксапола, приблизительно 0,2% полоксамера 407, приблизительно 0,005% BAK, приблизительно 2,0% глицерина, и имеет pH 6,0.
[00184] В случае суспензий, приготовленных в фосфорной кислоте/Трис, суспензия содержит приблизительно 0,14% фосфорной кислоты, приблизительно 0,2% Трис-основания, приблизительно 1,0% полисорбата 80, приблизительно 0,005% BAK, приблизительно 2,0% глицерина, и имеет pH 6,0. Согласно одному варианту осуществления, суспензия дополнительно содержит приблизительно 0,2% тилоксапола. Значение pH суспензии варьирует приблизительно от pH 6,0 до pH 7,2.
[00185] Суспензии, приготовленные только в трометамине (Трис), содержат приблизительно 1% полисорбата 80, приблизительно 0,1% тилоксапола, приблизительно 0,2% полоксамера 407, приблизительно 0,6% Трис, приблизительно 0,005% BAK, и приблизительно 2,0% глицерина, и имеет pH 6,0. Согласно другому варианту осуществления, приготовленная в Трис суспензия содержит, приблизительно 1% Трис, приблизительно 0,45% NaCl, приблизительно 0,025% EDTA, приблизительно 0,2% HPMC, приблизительно 0,1% полисорбата 80, приблизительно 0,005% BAK, и имеет pH 6,0. В указанных суспензиях, 1н HCl и/или 1н NaOH используют для титрования до соответствующего pH.
[00186] Суспензия согласно настоящей заявке содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, и приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05 - приблизительно 0,09% или приблизительно 0,09 - приблизительно 0,2% (масс./об.) натрия дигидрофосфата моногидрата и/или приблизительно 0,3% - приблизительно 1,0% Трис. В качестве альтернативы, суспензия согласно настоящей заявке содержит приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% второго действующего вещества, и приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,09% или приблизительно 0,09% - приблизительно 0,2% (масс./об.) натрия дигидрофосфата моногидрата и/или приблизительно 0,3% - приблизительно 1,0% Трис.
[00187] Согласно конкретному варианту осуществления, суспензия содержит приблизительно 0,14% или приблизительно 0,2% (масс./об.) Трис-буфера. Согласно дополнительным вариантам осуществления, суспензии приготавливают приблизительно в 0,6% Трис или приблизительно в 1,0% Трис. Другие эквивалентные буферные системы, хорошо известные в данной области техники, также используют в суспензиях согласно настоящей заявке. Согласно одному варианту осуществления, в состав включают приблизительно 0,4% соединения формулы II или соединения I в качестве действующего вещества, приблизительно 5% кремофора RH40, приблизительно 2,0% глицерина и приблизительно 0,005% BAK. Согласно другому варианту осуществления, в состав включают приблизительно 0,4% соединения формулы II или соединения I в качестве действующего вещества, приблизительно от 0,005% приблизительно до 5,0% второго действующего вещества, приблизительно 5% кремофора RH40, приблизительно 2,0% глицерина и приблизительно 0,005% BAK.
[00188] Согласно некоторым вариантам осуществления, суспензия согласно настоящей заявке характеризуется значением pH приблизительно от 4,0 приблизительно до 7,5 при температуре приблизительно 40°C или ниже.
[00189] Согласно некоторым вариантам осуществления, суспензия согласно настоящей заявке характеризуется значением pH приблизительно от 5,0 приблизительно до 7,0 при температуре приблизительно 40°C или ниже.
[00190] Например, суспензия согласно настоящей заявке характеризуется значением pH 6,0 при температуре приблизительно 40°C или ниже.
[00191] Согласно некоторым вариантам осуществления, первое действующее вещество может быть включено в состав в виде раствора согласно вариантам осуществления, описанным в настоящем документе, а второе действующее вещество может быть включено в состав в виде суспензии согласно вариантам осуществления, описанным в настоящем документе.
[00192] Согласно другим вариантам осуществления, первое действующее вещество может быть включено в состав в виде суспензии согласно вариантам осуществления, описанным в настоящем документе, а второе действующее вещество может быть включено в состав в виде раствора согласно вариантам осуществления, описанным в настоящем документе.
Концентрация в различных тканях глаза - доставка в виде офтальмологической суспензии
[00193] Согласно некоторым вариантам осуществления, суспензия соединения I или его свободного основания обеспечивает сходную концентрацию первого действующего вещества в центральной части сосудистой оболочки и в центральной части сетчатки при сравнении с концентрацией первого действующего вещества, доставляемого в форме гелевых капель (обсуждается ниже).
[00194] Согласно некоторым вариантам осуществления, суспензия на основе Трис соединения I или его свободного основания со вторым действующим веществом или без него увеличивает биодоступность первого действующего вещества в центральной части сосудистой оболочки и в центральной части сетчатки, снижая при этом концентрацию в роговице и предупреждая и/или проводя лечение повреждений и/или заболеваний роговицы (например, покраснения, изъязвления, аномалий роговицы и т.д.). Согласно некоторым вариантам осуществления, местная доставка соединения I или его свободного основания в суспензии на основе Трис-основания снижает концентрацию соединения I в роговице приблизительно в 5-10, 10-20, 20-30, 30-40 или приблизительно в 50-100 раз по сравнению с концентрацией в роговице эквимолярного количества соединения I или его свободного основания, доставляемого в виде гелевых капель.
[00195] Объединенные эффекты снижения воздействия лекарства на роговицу с возможностью избежать плохой переносимости глазом с одновременным поддержанием или увеличением биодоступности заднего отдела глаза с усилением ингибирования рецепторной тирозинкиназы (RTK), например, VEGFR, значительно увеличивают терапевтический индекс и соответствующие положительные эффекты у пациентов. Дополнительная профилактика и/или лечение повреждений передней поверхности глаза вторым действующим веществом, таким как модулятор EGFR (например, активатор), дополнительно увеличивают терапевтический индекс и соответствующие положительные эффекты у пациентов.
[00196] Введение один раз или два раза в сутки приблизительно 0,005% - приблизительно 5,0% (масс./об.) суспензии соединения I согласно настоящей заявке в течение 30-90 суток или 4-6 месяцев хорошо переносится глазом.
Гелевые капли
[00197] Согласно некоторым вариантам осуществления, офтальмологическая композиция или состав согласно настоящей заявке приготовлены в виде гелевых капель. Состав в виде гелевых капель включает в себя не более чем приблизительно 0,05% натрия дигидрофосфата моногидрата для получения требуемой буферной емкости и свободно текучих поддающихся фильтрованию составов с приблизительно 0,005% - приблизительно 2,0% соединения I и/или с приблизительно 0,005% - приблизительно 5% второго действующего вещества без необходимости добавления поверхностно-активного вещества.
[00198] Состав в виде гелевых капель согласно настоящей заявке содержит приблизительно от 0,005% приблизительно до 2,0% (масс./об.) первого действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I. Концентрация соединения I или его свободного основания (формула II) в гелевых каплях для местного введения может составлять приблизительно 0,005% - приблизительно 0,01%, приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,1%, приблизительно 0,1% - приблизительно 0,2%, приблизительно 0,2% - приблизительно 0,3%, приблизительно 0,3% - приблизительно 0,4%, приблизительно 0,4% - приблизительно 0,5%, приблизительно 0,5% - приблизительно 0,6%, приблизительно 0,6% - приблизительно 0,7%, приблизительно 0,7% - приблизительно 0,8%, приблизительно 0,8% - приблизительно 0,9%, приблизительно 0,9% - приблизительно 1,0% или приблизительно 1,0% - приблизительно 2,0% (масс./об.). Согласно некоторым вариантам осуществления, гелевые капли содержат приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0% или приблизительно 2% (масс./об.) соединения I или его свободного основания (формула II).
[00199] Состав в виде гелевых капель согласно настоящей заявке могут дополнительно содержать приблизительно 0,00001% - приблизительно 5,0% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Состав в виде гелевых капель согласно настоящей заявке может дополнительно содержать приблизительно 0,00001% - приблизительно 1,0%, приблизительно 0,00001% - приблизительно 0,1%, приблизительно 0,00001% - приблизительно 0,01%, приблизительно 0,00001% - приблизительно 0,001%, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001% (масс./об.) второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Концентрация второго действующего вещества в гелевых каплях для местного введения может составлять приблизительно 0,00001% - приблизительно 0,0001%, 0,000012% - приблизительно 0,0001%, 0,000014% - приблизительно 0,0001%, 0,000016% - приблизительно 0,0001%, 0,000018% - приблизительно 0,0001%, 0,00002% - приблизительно 0,0001%, 0,00003% - приблизительно 0,0001%, 0,00004% - приблизительно 0,0001%, 0,00005% - приблизительно 0,0001%, 0,00006% - приблизительно 0,0001%, 0,00007% - приблизительно 0,0001%, 0,00008% - приблизительно 0,0001%, 0,00009% - приблизительно 0,0001%, 0,000016% - приблизительно 0,00009%, 0,000018% - приблизительно 0,00009%, 0,00002% - приблизительно 0,00009%, 0,00003% - приблизительно 0,00009%, 0,00004% - приблизительно 0,00009%, 0,00005% - приблизительно 0,00009%, 0,00006% - приблизительно 0,00009%, 0,00007% - приблизительно 0,00009% или 0,00008% - приблизительно 0,00009% (масс./об.). Согласно некоторым вариантам осуществления, гелевые капли содержат приблизительно 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,000081%, 0,000082%, 0,000083%, 0,000084%, 0,000085%, 0,000086%, 0,000087%, 0,000088% или 0,000089% (масс./об.) второго действующего вещества.
[00200] Состав в виде гелевых капель согласно настоящей заявке может дополнительно содержать приблизительно 0,5 мкМ, приблизительно 0,6 мкМ, приблизительно 0,7 мкМ, приблизительно 0,8 мкМ, приблизительно 0,9 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 7 мкМ, приблизительно 8 мкМ или приблизительно 9 мкМ второго действующего вещества или его фармацевтически приемлемой соли, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания. Согласно некоторым вариантам осуществления, концентрация второго действующего вещества составляет приблизительно 1 мкМ.
[00201] Согласно некоторым вариантам осуществления, офтальмологические композиции в виде гелевых капель согласно настоящей заявке включают в себя глицерин и регулятор тоничности. Некоторые варианты осуществления настоящей заявки относятся к офтальмологической композиции, включающей в себя маннит. Содержание глицерина или маннита в количестве, необходимом для предупреждения любых изменений растворимости соединения I, и глицерина в количестве приблизительно 2,0 - приблизительно 2,5%, обеспечивает осмолярность приблизительно 225 - приблизительно 300 мОсм/кг в зависимости от концентрации фосфата. Согласно дополнительным вариантам осуществления, глицерин составляет приблизительно 2%, и фосфат составляет приблизительно 0,05%, от офтальмологической композиции в виде гелевых капель. Концентрации глицерина и фосфата согласно настоящей заявке составляют количество, при котором уровень тоничности офтальмологической композиции составляет приблизительно 240 мОсм/кг.
[00202] Офтальмологическая композиция в виде гелевых капель согласно настоящей заявке может дополнительно включать в себя бензалкония хлорид (BAK). Согласно некоторым вариантам осуществления, содержание BAK составляет приблизительно 0,005%, что достаточно для предохранения офтальмологической композиции от загрязнения микробами. Согласно некоторым вариантам осуществления согласно настоящей заявке, BAK не требуется при применении офтальмологической композиции в виде стерильного продукта для однократного применения.
[00203] Согласно некоторым вариантам осуществления, содержащий соединение I офтальмологический состав в виде гелевых капель включает в себя: приблизительно 0,005% - приблизительно 2,0% соединения I или его свободного основания, приблизительно 0,05% натрия фосфата, приблизительно 2% глицерина в качестве средства-регулятора тоничности, приблизительно 0,005% BAK в качестве консерванта, воду (очищенную, т.е. дистиллированную или деионизированную) в качестве носителя, и гидроксид натрия для корректировки до pH 6,0. Согласно одному варианту осуществления, другие наполнители не добавляются.
[00204] Гелевые капли согласно настоящей заявке содержат приблизительно 0,005% - приблизительно 2,0% действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, и приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05 - приблизительно 0,09% или приблизительно 0,09 - приблизительно 0,2% (масс./об.) натрия дигидрофосфата моногидрата. Согласно конкретному варианту осуществления, гелевые капли содержат приблизительно 0,05%, приблизительно 0,05-0,2% или приблизительно 0,2% (масс./об.) буфера с добавлением натрия дигидрофосфата моногидрата. Другие эквивалентные буферные системы, хорошо известные в данной области техники, также используют в гелевых каплях согласно настоящей заявке. Согласно одному варианту осуществления, соединение I или его свободное основание включают в состав, содержащий приблизительно 0,4% - приблизительно 2,0% первого действующего вещества, приблизительно 5% кремофора RH40, приблизительно 2,0% глицерина и приблизительно 0,005% BAK.
[00205] Согласно одному варианту осуществления, содержащие соединение I гелевые капли включают в себя приблизительно 0,3% - приблизительно 2,0% (3-20 мг/мл) соединения I, приблизительно 0,05% - приблизительно 0,2% натрия фосфата и приблизительно 2% глицерина. Значение pH композиции составляет pH 5,0-7,0.
[00206] Офтальмологический состав в виде гелевых капель, содержащий соединение I и второе действующее вещество, включает в себя: приблизительно 0,005% - приблизительно 2,0% соединения I или его свободного основания, приблизительно 0,00001% - приблизительно 5% (например, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001%) второго действующего вещества, приблизительно 0,05% натрия фосфата, приблизительно 2% глицерина в качестве средства-регулятора тоничности, приблизительно 0,005% BAK в качестве консерванта, воду (очищенную, т.е. дистиллированную или деионизированную) в качестве носителя, и гидроксид натрия для корректировки до pH 6,0. Согласно одному варианту осуществления, другие наполнители не добавляются.
[00207] Гелевые капли согласно настоящей заявке содержат приблизительно 0,005% - приблизительно 2,0% действующего вещества формулы I или II, или его фармацевтически приемлемой соли, например, соединения I, приблизительно 0,00001% - приблизительно 5% (например, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001%) второго действующего вещества, и приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05 - приблизительно 0,09% или приблизительно 0,09 - приблизительно 0,2% (масс./об.) натрия дигидрофосфата моногидрата. Согласно конкретному варианту осуществления, гелевые капли содержат приблизительно 0,05%, приблизительно 0,05-0,2% или приблизительно 0,2% (масс./об.) буфера с добавлением натрия дигидрофосфата моногидрата. Другие эквивалентные буферные системы, хорошо известные в данной области техники, также используют в гелевых каплях согласно настоящей заявке. Согласно одному варианту осуществления, соединение I или его свободное основание включают в состав, содержащий приблизительно 0,4% - приблизительно 2,0% первого действующего вещества, приблизительно 0,005% - приблизительно 5,0% второго действующего вещества, приблизительно 5% кремофора RH40, приблизительно 2,0% глицерина и приблизительно 0,005% BAK.
[00208] Согласно одному варианту осуществления, содержащие соединение I гелевые капли включают в себя приблизительно 0,3% - приблизительно 2,0% (3-20 мг/мл) соединения I, приблизительно 0,005% - приблизительно 5,0% второго действующего вещества, приблизительно 0,05% - приблизительно 0,2% натрия фосфата и приблизительно 2% глицерина. Значение pH композиции составляет pH 5,0-7,0.
[00209] Настоящая заявка относится к гелевым каплям, содержащим действующие вещества (например, первое действующее вещество и второе действующее вещество) согласно настоящей заявке, включенных в состав в присутствии наполнителей, таких как без ограничения, повидон, полисорбат 80 (PS80), полиэтиленгликоль (PEG) 400, тилоксапол, полоксамер, глицерин и BAK в фосфатном буфере.
Глазные капли
[00210] В настоящем документе раскрыт состав, содержащий первое действующее вещество, например, соединение формулы I или II, и/или второе действующее вещество, например, никотиновую кислоту, никотинамид или витамин K, или их сочетание, в виде глазных капель, формы доставки лекарств, которая фармацевтически приемлема для пациентов, удобна, безопасна и начинает действовать через несколько минут. Стандартные глазные капли, используемые в терапии в соответствии с федеральной нормативно-правовой практикой США, являются стерильными, характеризуются значением pH приблизительно 6,0-7,4, и, в случае более чем однократного применения, содержат консервант, но будучи открытыми, имеют ограниченный срок годности, обычно один месяц. Если глазные капли упакованы в стерильный диспенсер с разовой дозой исключительно для однократного применения, от использования консерванта можно отказаться.
[00211] Один способ приготовления глазных капель включает в себя смешивание наиболее чистых форм раскрытого соединения формулы I или II (например, с чистотой более 99%) и/или второго действующего вещества, и соединения и/или второго действующего вещества, с буфером и регуляторами тоничности, для корректировки до физиологических значений pH и осмолярности. Примеры буферных веществ для поддержания или корректировки pH включают в себя без ограничения ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Примеры регуляторов тоничности представляют собой натрия хлорид, маннит и глицерин. Согласно некоторым вариантам осуществления, также добавляют другие фармацевтически приемлемые ингредиенты.
[00212] Затем, приготовленный раствор разделяют на аликвоты либо во множество отдельных стерильных картриджей для однократного применения, каждый из которых подходит для введения разовой дозы, или в единичный картридж для введения разовой дозы. Такие отдельные картриджи для однократного применения представляют собой, например, конический или цилиндрический диспенсер конкретного объема с контейнером, имеющим боковые стенки, поддающиеся сжатию по радиальной линии относительно продольной оси для того, чтобы раздавать содержимое контейнера с одного его конца.
[00213] Настоящая заявка относится к офтальмологическим растворам/суспензиям в виде глазных капель, упакованным в многодозовую форму или разовую форму, например, в виде пластиковой бутыли с капельницей. В составах для многодозой формы, требуются консерванты для предупреждения заражения микробами после открывания контейнера. Подходящие консерванты включают в себя без ограничения: бензалкония хлорид, тимеросал, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, динатрия эдетат, сорбиновую кислоту, поликватерниум-1 или другие средства, известные специалистам в данной области техники, и которые все предполагаются для применения в настоящей заявке. Такие консерванты обычно используют в количестве приблизительно от 0,001 приблизительно до 1,0% (масс./об.).
[00214] Без ограничения какой-либо теорией, состав согласно настоящей заявке в виде глазных капель обеспечивает ритмичное введение лекарства. Путь, посредством которого соединение I получает доступ к заднему отделу глаза, не является прямой диффузией через роговицу, с последующей диффузией внутриглазную жидкость, стекловидное тело, сетчатку и, в завершение, сосудистую оболочку. Скорее, после местной инстилляции, соединение I достигает значимой биодоступности в заднем направлении с использованием окружного пути вокруг, а не через, глазное яблоко.
[00215] В определенных клинических условиях, растворы/суспензии в виде глазных капель могут приготавливаться вместе с другими фармацевтическими средствами, для уменьшения раздражения от другого средства и для улучшения клинического ответа. Такие средства включают в себя без ограничения сосудосуживающие средства, такие как фенилэфрин, оксиметазолин, нафтазолин или тетрагидрозолин; стабилизатор тучных клеток, такой как олопатадин; антигистаминовое средство, такое как азеластин; антибиотик, такой как тетрациклин; стероидное противовоспалительное лекарство, такое как бетаметазон; нестероидное противовоспалительное лекарство, такое как диклофенак; иммуномодулятор, такой как имиквимод или интерфероны; и противовирусные средства, валацикловир, цидофовир и трифлуридин. Дозы, используемые для описанных выше целей, варьируют, но составляют количество, эффективно подавляющее дискомфорт, зуд, воспаление или боль в глазу. Если композиции вводят местно, то «фармацевтически эффективное количество» соединения формулы I или II, как правило, может находиться в диапазоне концентраций приблизительно от 0,05 мг/мл приблизительно до 10 мг/мл, и «фармацевтически эффективное количество» второго действующего вещества, как правило, может находиться в диапазоне концентраций приблизительно от 0,05 мг/мл приблизительно до 10 мг/мл, с введением 1-4 капель композиции в качестве разовой дозы от 1 до 4 раз в сутки. Наиболее распространенным способом доставки офтальмологического лекарства является инстилляция капель на роговицу (т.е. «глазные капли»).
[00216] Ключевым требованием является то, что состав является стерильным и производится в стерильном окружении. Идеальное раскрытое соединение для применения в офтальмологических растворах/суспензиях должно быть растворимым и/или смешиваемым с водной средой при нормальных значениях pH и тоничности глаза. Более того, раскрытые соединения должны быть стабильными, нетоксичными, долго действующими и достаточно мощными для противодействия разбавлению концентрации лекарства в процессе моргания и слезоотделения.
Лекарственные формы
[00217] Состав согласно настоящей заявке может быть пригоден для офтальмологического применения. Согласно одному варианту осуществления, состав представляет собой раствор. Раствор согласно настоящей заявке может быть прозрачным, бесцветным, стерильным, изотоничным, забуференным водным свободнотекучим жидким препаратом. Фармацевтический продукт (например, первое действующее вещество и/или второе действующее вещество) характеризуется значением pH приблизительно 6,0 и может храниться при +5°C. Фармацевтический продукт может предоставляться в системе упаковки/укупорки, состоящей из полупрозрачной офтальмологической бутыли-дозатора с капельницей и крышкой.
[00218] Согласно некоторым вариантам осуществления, клиническая концентрация соединения I в офтальмологическом растворе или суспензии не превышает приблизительно 0,1 мг/мл, не превышает 0,2 мг/мл, приблизительно 0,2 - приблизительно 1,0 мг/мл, приблизительно 0,3 - приблизительно 1,0 мг/мл, приблизительно 0,4 - приблизительно 1,0 мг/мл, приблизительно 0,5 - приблизительно 1,0 мг/мл, приблизительно 0,6 - приблизительно 1,0 мг/мл, приблизительно 0,7 - приблизительно 1,0 мг/мл, приблизительно 0,8 - приблизительно 1,0 мг/мл, приблизительно 0,9 - приблизительно 1,0 мг/мл, приблизительно 1,0 - приблизительно 2,0 мг/мл, приблизительно 2,0 - приблизительно 3,0 мг/мл, приблизительно 3,0 - приблизительно 4,0 мг/мл, приблизительно 4,0 - приблизительно 5,0 мг/мл, приблизительно 5,0 - приблизительно 6,0 мг/мл, приблизительно 5,0 - приблизительно 10,0 мг/мл, приблизительно 10 - приблизительно 20 мг/мл, приблизительно 20 - приблизительно 30 мг/мл, приблизительно 30 - приблизительно 40 мг/мл или приблизительно 40 - приблизительно 50 мг/мл.
[00219] Согласно другим вариантам осуществления, клинические концентрации соединения I и второго действующего вещества в офтальмологическом растворе или суспензии независимо не превышают 0,1 мг/мл, не превышают 0,2 мг/мл, приблизительно 0,2 - приблизительно 1,0 мг/мл, приблизительно 0,3 - приблизительно 1,0 мг/мл, приблизительно 0,4 - приблизительно 1,0 мг/мл, приблизительно 0,5 - приблизительно 1,0 мг/мл, приблизительно 0,6 - приблизительно 1,0 мг/мл, приблизительно 0,7 - приблизительно 1,0 мг/мл, приблизительно 0,8 - приблизительно 1,0 мг/мл, приблизительно 0,9 - приблизительно 1,0 мг/мл, приблизительно 1,0 - приблизительно 2,0 мг/мл, приблизительно 2,0 - приблизительно 3,0 мг/мл, приблизительно 3,0 - приблизительно 4,0 мг/мл, приблизительно 4,0 - приблизительно 5,0 мг/мл, приблизительно 5,0 - приблизительно 6,0 мг/мл, приблизительно 5,0 - приблизительно 10,0 мг/мл, приблизительно 10 - приблизительно 20 мг/мл, приблизительно 20 - приблизительно 30 мг/мл, приблизительно 30 - приблизительно 40 мг/мл или приблизительно 40 - приблизительно 50 мг/мл.
[00220] Согласно одному варианту осуществления, согласно настоящей заявке дозировка соединения формулы I или II составляет приблизительно 0,005% - приблизительно 5,0% (приблизительно 0,5% - приблизительно 50 мг/мл). Целевая фармакологическая активность (или концентрация) состава согласно настоящей заявке в отношении патологической неоваскуляризации сосудистой оболочки или сетчатки достигается при офтальмологическом введении составов, содержащих приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% (масс./об.) соединения I. Настоящая заявка относится к тому, что после местного офтальмологического введения оптимальной дозы (например, приблизительно от 0,005% приблизительно до 5,0%), в центральной части целевой ткани сосудистой оболочки достигается и поддерживается фармакологически активная концентрация. Согласно одному варианту осуществления, первое действующее вещество (соединение формулы II или соединение I) включают в состав в концентрации приблизительно 0,005 - приблизительно 5,0% (масс./об.), второе действующее вещество (никотиновая кислота, никотинамид или витамин K, или их сочетание) включают в состав в концентрации приблизительно 0,005 - приблизительно 5,0% (масс./об.), и комбинацию дозированно вводят в глаз один или два раза в сутки более 60 суток подряд. Концентрации в плазме, наблюдаемые после местного введения, значительно ниже уровня, ожидаемого для индукции системной токсичности.
Таблица 2: Резюме фармакодинамических свойств in vitro для соединения I
(6)
(5)
(1500)
(3330)
(5850)
(3)
(8)
[00221] Согласно некоторым вариантам осуществления, соединение I характеризуется мощным ингибированием тирозинкиназной активности в отношении различных рецепторов проангиогенных факторов роста со значениями IC50 ниже приблизительно 100 нМ (см. таблицу 3). Соединение I также блокирует высокоаффинные VEGF рецепторы, например, VEGFR-1/Flt-1, но с меньшей эффективностью (значения IC50 приблизительно 122 нМ (69,41 нг/мл)).
Таблица 3: Ингибирование тирозинкиназ in vitro по титрационной кривой, построенной по 10 значениям (257 нМ - 5000 нМ), для соединения I
[00222] Хотя ингибирование VEGFR считается необходимым для снижения проницаемости сосудов и профилактике дальнейшего роста неоваскулатуры, одновременное ингибирование передачи сигналов VEGF с ингибированием других связанных с факторами роста путями передачи сигналов (например, PDGF и ангиопоэтины/Tie2) могут быть увязаны с уникальными терапевтическими эффектами. Терапевтические эффекты более широкого ингибирования путей передачи сигналов могут вносить вклад в регрессию вновь сформированных патологических сосудов в заднем отделе глаза.
[00223] Согласно некоторым вариантам осуществления, приблизительно 300 нМ (приблизительно 170,67 нг/мл) соединения I ингибирует киназную функцию VEGFR-2 (см. таблицу 4). Также наблюдается значительная блокада сходного набора рецепторов проангиогенных факторов роста, включая FGFRs1-3, Tie-2 и EphB-4. Неожиданным является открытие того, что соединение I в концентрации приблизительно 300 нМ ингибирует киназную активность VEGFR-2, которая падает до обычного уровня, обнаруживаемого в центральной части сосудистой оболочки и сетчатки спустя 5 суток после местного офтальмологического введения.
Таблица 4: Ингибирование тирозинкиназ in vitro 300 нМ (170,67 нг/мл) соединения I
при 300 нМ соединения I
Таблица 5: Ингибирование тирозинкиназ in vitro 1 мкМ (568,9 нг/мл) соединения I
при 1 мкМ соединения I
Обзор лекарственной субстанции и фармацевтического продукта
[00224] Фармацевтический продукт: Содержащие соединение I и/или второе действующее вещество офтальмологические составы для клинических исследований производили в дозировках 0,05% - 1,0% соединения I и приблизительно 0,00001% - приблизительно 5% (например, приблизительно 0,00001% - приблизительно 0,0002% или приблизительно 0,00001% - приблизительно 0,0001%) второго действующего вещества. Согласно некоторым вариантам осуществления, дозировка соединения I в составе составляет 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,6%, 0,8% или 1,0%. Согласно некоторым вариантам осуществления, дозировка второго действующего вещества в составе составляет 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,6%, 0,8%, 1,0%, 2,0%, 3,0%, 4,0% или 5,0%. Содержащие соединение I и/или второе действующее вещество офтальмологические составы (растворы или суспензии) предназначены для однократного в течение суток местного введения в глаз в условиях клиники. В дополнение к первому и второму действующим веществам, согласно некоторым вариантам осуществления фармацевтический продукт может дополнительно содержать приблизительно 0,005% BAK в качестве консерванта, очищенную воду в качестве носителя, и быть скорректированным добавлением натрия гидроксида до pH 6,0.
Гелевые капли на основе натрия фосфата
[00225] Офтальмологические преимущества содержащего соединение I состава на основе натрия фосфата (представлен в таблице 6) являются результатом способностью API к саможелированию в буферах, таких как натрия фосфат. Спонтанное формирование самообразующегося тиксотропного геля, содержащего соединение I, из прозрачного раствора осуществляют путем увеличения концентрации первого действующего вещества в фосфате натрия. После достижения концентрацией первого действующего вещества в фосфатном буфере состояния сверхнасыщения, внутри геля наблюдаются нерастворимые частицы соединения I.
[00226] Современное состояние уровня техники предполагает, что нанесение геля с повышенной вязкостью на поверхность глаза будет увеличивать время удержания на роговице. Увеличение времени удержания на роговице, в свою очередь, способствует всасыванию лекарства глазом. В результате, внутриглазные концентрации лекарства из вязких гелей будут увеличены по сравнению с невязкими составами, такими как подобные воде растворы. Одним подходом к увеличению вязкости является использование различных увеличивающих вязкость наполнителей, например, карбоксиметилцеллюлозы, что в результате приводит к усилению внутриглазного всасывания различных лекарственных субстанций после местного офтальмологического введения. Настоящая заявка относится к тиксотропному гелю, содержащему соединение I и/или второе действующее вещество, формирующемуся в отсутствие каких-либо увеличивающих вязкость наполнителей. Например, если соединение I, или соединение I и второе действующее вещество, растворяют в простом буфере, таком как натрия фосфат, то формируется тиксотропный гель. Тиксотропный гель, который формируется в отсутствие каких-либо увеличивающих вязкость наполнителей, приготавливается в виде гелевых капель.
[00227] Настоящая заявка относится к зависимой от дозы и зависимой от частоты введения дозы доставке соединения I к тканям заднего отдела глаза.
[00228] Составы в виде гелевых капель согласно настоящей заявке (представлены в таблице 6) отличаются между собой разными аспектами, такими как концентрация первого действующего вещества, концентрация натрия фосфата, присутствие или отсутствие регуляторов тоничности (глицерин) или консервантов (бензалкония хлорид, BAK), солюбилизирующих поверхностно-активных веществ (полисорбат 80, тилоксапол и/или полоксамер) и регуляторов pH.
Суспензия на основе трометамина
[00229] Настоящая заявка относится к суспензии соединения I и/или второго действующего вещества в составе на основе трометамина. Согласно некоторым вариантам осуществления, суспензия соединения I и/или второго действующего вещества в составе на основе трометамина содержит не менее 95% субстанции первого действующего вещества в нерастворимой форме. Эта характеристика является отличительной в сравнении с растворимым или полурастворимым состоянием соединения I в гелевых каплях (гелевые капли (гель), которые не являются полностью растворимыми с ростом концентрации первого действующего вещества) или в составе на основе циклодекстрина. Составы, содержащие соединение I, на основе трометамина демонстрируют повышенную мутность с ростом концентрации первого действующего вещества. Местное капельное офтальмологическое введение суспензии соединения I и/или второго действующего вещества, которая представляет собой сочетание растворимых и нерастворимых компонентов первого действующего вещества, благоприятно одновременно с точки зрения безопасности/переносимости и эффективности.
[00230] Настоящая заявка относится к соединению I в суспензии на основе трометамина, вводимому в целевые ткани в концентрациях, 10-1000-кратных значениям IC50 в клетке для различных проангиогенных RTK (см., например, таблицу 7).
[00231] Безопасность роговицы и переносимость ею местно вводимого соединения I является прямым следствием количества растворимого (в отличие от нерастворимого) первого действующего вещества, наносимого на поверхность роговицы, и получаемой в результате концентрации в ткани роговицы. Согласно некоторым вариантам осуществления, субъекты, получающие местное офтальмологическое введение суспензии на основе трометамина, способны переносить более высокие уровни концентрации первого действующего вещества в составе по сравнению с эквимолярными составами в виде гелевых капель на основе натрия фосфата. Безопасность роговицы и переносимость ею местно вводимого соединения I также является следствием введения второго действующего вещества, например, никотиновой кислоты, никотинамида или витамина K, или их сочетания, которые представляют собой модулятор (например, активатор) EGFR, что предупреждает или оказывает лечебное воздействие на повреждения или заболевания роговицы, обусловленные ингибированием EGFR.
Таблица 6: Фармакокинетические результаты для местного офтальмологического введения соединения I в виде гелевых капель на основе натрия фосфата
* CD: Соединение I
Таблица 7: Фармакокинетические результаты для местного офтальмологического введения соединения I в виде суспензии на основе трометамина
мг/мл
суток
в сутки
[хороид], нМ
[хороид], нМ
[сетчатка], нМ
[сетчатка], нМ
[AH], нМ
[AH], нМ
в плазме, нМ
* CD: соединение I
[00232] Настоящая заявка относится к офтальмологической биодоступности соединения I в заднем отделе глаза после введения суспензии на основе трометамина. Офтальмологическая биодоступность соединения I в заднем отделе глаза прямо пропорциональна общему количеству (растворимому плюс нерастворимому, см. Таблицу 7) вводимого лекарства, соединения I. Хотя нерастворимые частицы лекарства не являются легкодоступными для тканей заднего отдела глаза; характерные и уникальные физико-химические свойства соединения I позволяют и нерастворимым и растворимым компонентам проникать в ткани заднего отдела глаза, такие как сосудистая оболочка и сетчатка. Как следствие, с суспензией на основе трометамина могут достигаться концентрации лекарства, даже большие по сравнению с таковыми в случае составов в виде гелевых капель, содержащих эквивалентные количества первого действующего вещества. Таким образом, суспензия на основе трометамина обеспечивает: a) улучшенную переносимость со стороны роговицы и b) сохраняющуюся и улучшенную биодоступность в заднем отделе глаза, в частности сосудистой оболочки, основной целевой ткани для лечения неоваскулярной (влажной) AMD. В дополнение, второе действующее вещество, например, никотиновая кислота, никотинамид или витамин K, или их сочетание, которое представляет собой модулятор (например, активатор) EGFR, которое предупреждает или лечит повреждения или заболевания роговицы, обусловленные ингибированием EGFR, предупреждает и/или лечит повреждения роговицы, потенциально связанные с введением соединения I, увеличивая тем самым терапевтический индекс соединения I.
Раствор на основе циклодекстрина
[00233] Циклодекстрины, которые представляют собой циклические олигосахариды, сформированные 6-8 остатками декстрозы (α-, β- и γ-C) и объединенные посредством 1-4 связей, хорошо известны за их способность действовать в качестве солюбилизаторы для относительно нерастворимых лекарств (см. Stella & He, Cyclodextrins, Toxicol. Pathol., 36: 30-42 (2008)).
[00234] Согласно некоторым вариантам осуществления, в предложенном для использования в клинике составе в виде офтальмологического раствора, содержащего соединение I или его свободное основание и второе действующее вещество, 2-гидроксипропил-β-циклодекстрин (HP-β-CD, также известный как KLEPTOSE® HPB) в молярном соотношении не менее 1:6 или сульфобутилэфир-β-циклодекстрин (SBE-β-CD, также известный как CAPTISOL®) в молярном соотношении не менее 1:2 обеспечивает растворимость, которая соответствует клинической дозировке 0,1-1,2% соединения I.
[00235] Согласно некоторым вариантам осуществления, растворы соединения I или его свободного основания и/или второго действующего вещества на основе циклодекстрина не только улучшают растворимость первого действующего вещества до получения однородного раствора, но при местном офтальмологическом введении также характеризуются новой и ранее не наблюдавшейся способностью увеличивать терапевтический индекс первого действующего вещества в заднем отделе глаза. Растворы соединения I и/или второго действующего вещества согласно настоящей заявке уменьшают воздействие соединения I на передний отдел глаза, увеличивая тем самым концентрацию первого действующего вещества в растворе и увеличивая частоту его введения для поддержания высоких концентраций в заднем отделе глаза. Обе указанные полезные способности относятся к известному свойству циклодекстрина формировать гидрофильные комплексы с гидрофобными лекарствами (см. Stella & He, Cyclodextrins, Toxicol. Pathol., 36: 30-42 (2008)). Введение второго действующего вещества в виде сочетания с первым действующим веществом предупреждает повреждения и заболевания роговицы, обусловленные ингибированием EGFR при системных заболеваниях (например, при злокачественной опухоли, сахарном диабете), при глазных заболеваниях или при введении первого действующего вещества, например, соединения формулы I или II, увеличивая тем самым терапевтический индекс первого действующего вещества, например, соединений формулы I или II.
[00236] При включении в состав вместе с соединением I или его свободным основанием и/или вторым действующим веществом, циклодекстрин может формировать прозрачный бесцветный раствор, который обладает сходной с водой вязкостью. После местного офтальмологического введения, комплекс соединение I/циклодекстрин имеет вид фармакологически неактивного и метаболически инертного. Комплекс соединение I/циклодекстрин наделяет роговицу переносимостью до момента, когда циклодекстрин спонтанно диссоциирует от первого действующего вещества, тем самым делая возможной высокую концентрацию соединения I в месте его действия в заднем отделе глаза, например, в сосудистой оболочке и сетчатке.
[00237] Согласно некоторым вариантам осуществления, растворы соединения I на основе циклодекстрина характеризуются сниженным воздействием соединения I на роговицу по сравнению с составами в виде гелевых капель со сходными концентрациями лекарств. Применение растворов соединения I на основе циклодекстрина обеспечивает приблизительно 10-кратное снижение концентраций в сетчатке по сравнению с введением эквимолярных доз составов в виде гелевых капель. Согласно некоторым вариантам осуществления, спустя 20-30 суток после местного офтальмологического введения приблизительно 0,2-2,0%, например, приблизительно 0,6%, соединения I в виде раствора на основе циклодекстрина, неблагоприятные эффекты, относимые на счет тестируемого вещества или носителя, не наблюдались. Настоящая заявка относится к более высоким концентрациям соединения I в целевых тканях заднего отдела глаза, т.е. в центральной части сосудистой оболочки и в центральной части сетчатки, где раствор соединения I на основе циклодекстрина вводится местно. Согласно некоторым вариантам осуществления, объединенные эффекты снижения воздействия лекарства на роговицу с возможностью избежать плохой переносимости глазом с одновременным увеличением биодоступности заднего отдела глаза с возможностью усилить ингибирование RTK, значительно увеличивают терапевтический индекс и соответствующие положительный(ые) эффект(ы) у подвергаемых лечению субъектов. Согласно другим вариантам осуществления, объединенные эффекты снижения воздействия лекарства на роговицу с возможностью избежать плохой переносимости глазом и предупреждения или лечения повреждений или заболеваний роговицы вторым действующим веществом с одновременным увеличением биодоступности заднего отдела глаза с возможностью усилить ингибирование RTK, значительно увеличивают терапевтический индекс и соответствующие положительный(ые) эффект(ы) у подвергаемых лечению субъектов.
[00238] Настоящая заявка относится к расширению терапевтического окна и для суспензионных составов (см. пример 3) и для составов на основе циклодекстрина, содержащих соединение I, по причине значительно сниженного воздействия (приблизительно в 10-100 раз или на 1-2 порядка). Сниженное воздействие улучшает безопасность/переносимость роговицы, что делает возможным местное введение более высоких концентраций соединения I или введение его с большей частотой. Более высокие концентрации позволяют соединению I более высокой концентрации в целевой ткани заднего отдела глаза, что улучшает терапевтическую эффективность соединения I.
[00239] Согласно некоторым вариантам осуществления, местное офтальмологическое введение глазных гелевых капель связано с сильным воздействием на ткани роговицы (≥100 мкМ) и соответствующими неблагоприятными симптомами в переднем отделе глаза, такими как дискомфорт, воспаление роговицы и конъюнктивы, эрозия и/или истончение и дегенерация эпителия роговицы. Наоборот, повторяющиеся местные офтальмологические введения офтальмологического раствора соединения I вызывает воздействие на роговицу, которое приблизительно в 5-10 раз меньше воздействия эквимолярной дозы глазных гелевых капель, и не вызывают неблагоприятных клинических или гистопатологических симптомов. Местное офтальмологическое введение офтальмологического раствора соединения I также достигает равного или большего целевого терапевтического воздействия на центральную часть сосудистой оболочки по сравнению с эквимолярной дозой глазных гелевых капель. Таким образом, сочетание сниженного воздействия на роговицу и соответствующей улучшенной переносимости глазом с одновременным поддержанием или улучшением доставки лекарства к целевым тканям заднего отдела глаза, вместе с улучшенной физико-химической стабильностью, обеспечивает у субъекта больший полезный эффект по сравнению с составом в виде глазных гелевых капель.
Фармакокинетические результаты с местным офтальмологическим введением растворов соединения I на основе циклодекстрина в течение 1-5 суток
[00240] Настоящая заявка относится к офтальмологической фармакокинетике различных составов и схем лечения соединения I после местного офтальмологического введения. Три дозировки в девяти (9) различных офтальмологических составах для местного введения, содержащих соединение I, использовали для введения либо один раз в сутки (1 р/сут), либо два раза в сутки (2 р/сут) в течение 1, 2, 3, 4 или 5 суток подряд. С использованием пипетки прямого вытеснения каждый субъект получал приблизительно 30 мкл одного из трех (3) содержащих соединение I составов или используемый в составе носитель путем билатерального местного офтальмологического введения.
[00241] Композиция каждого содержащего соединение I состава описана в таблице 8A. Все дозы вводили в пределах±1 часа относительно запланированного времени введения. На 1 сутки, группы 1, 2, 4-6, 8, 10, 11, 13, 15 и 17 получали одну дозу (1 р/сут) в течение либо одних (1), либо четырех (4) суток. На 1-4 сутки, группы 3, 7, 9, 12, 14 и 16 получали 2 р/сут дозу с интервалом приблизительно 8 в 07:00 и 15:00 в течение (4) суток. Некоторые субъекты получали 2 р/сут дозу только носителя в течение пяти (5) суток подряд.
[00242] Согласно некоторым вариантам осуществления, введение дозы проводили спустя приблизительно 0,5, приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23 или приблизительно 24 часов после введения дозы на 1 сутки. Для отслеживания эффектов лечения отбирали образцы внутриглазной жидкости, роговицы, центральной части и периферической части сетчатки, и центральной части и периферической части сосудистой оболочки. Образцы внутриглазной жидкости, роговицы, центральной части сетчатки и центральной части сосудистой оболочки подвергали анализу.
[00243] В таблице 8A-C представлены фармакокинетические результаты с местным офтальмологическим введением растворов соединения I на основе циклодекстрина в течение 1-5 суток.
Таблица 8A: Офтальмологические составы
[00244] В таблице 8B представлены средние концентрации соединения I во внутриглазной жидкости, сетчатке, сосудистой оболочке и роговице (LLOQ: нижний предел количественного определения; LLOQ представляет собой наименьшую концентрацию аналита, которая может быть количественно определена с достаточной точностью и аккуратностью).
Таблица 8B
LLOQ для внутриглазной жидкости=0,000903 мкМ
LLOQ для центральной части сетчатки=0,0181 мкМ
LLOQ для периферической части сетчатки=0,00873 мкМ (группы 1-8); LLOQ=0,00898 мкМ (группы 12-16)
LLOQ для центральной части сосудистой оболочки=0,175 мкМ
LLOQ для периферической части сосудистой оболочки=0,0349 мкМ (группы 1-8); LLOQ=0,0359 мкМ (группы 12-16)
LLOQ для роговицы=0,0181 мкМ (группы 1-5); LLOQ=0,0453 мкМ (группы 6-8, 10-13, 15, 16A, 17); LLOQ=0,0873 мкМ (группы 4, 9, 16B)
N/A=не определено; образцы не подвергались анализу согласно протокола исследования.
*Среднее значение исходя из n=1.
[00245] В таблице 8C представлены средние тканевые концентрации соединения I во внутриглазной жидкости, центральной части и периферической части сетчатки, центральной части и периферической части сосудистой оболочки и роговице для групп 1-10. Любые значения <LLOQ исключались из статистических расчетов. Если все значения для данной точки времени были <LLOQ, то среднее указывалось как <LLOQ.
Таблица 8C
LLOQ для внутриглазной жидкости=0,000903 мкМ
LLOQ для центральной части сетчатки=0,0181 мкМ
LLOQ для периферической части сетчатки=0,00873 мкМ (группы 1-8); LLOQ=0,00898 мкМ (группы 12-16)
LLOQ для центральной части сосудистой оболочки=0,175 мкМ
LLOQ для периферической части сосудистой оболочки=0,0349 мкМ (группы 1-8); LLOQ=0,0359 мкМ (группы 12-16)
LLOQ для роговицы=0,0181 мкМ (группы 1-5); LLOQ=0,0453 мкМ (группы 6-8, 10-13, 15, 16A, 17); LLOQ=0,0873 мкМ (группы 4, 9, 16B)
N/A=не определено; образцы не подвергались анализу согласно протокола исследования.
*Среднее значение исходя из n=1.
Фармакокинетические результаты с местным офтальмологическим введением растворов соединения I на основе циклодекстрина в течение 5 суток
[00246] Настоящая заявка относится к офтальмологической фармакокинетике различных схем местного офтальмологического введения растворов соединения I, содержащих гидроксипропил-β-циклодекстрин (HDβCD), после офтальмологического введения дозы. Различные офтальмологические растворы соединения I для местного введения вводят либо один раз в сутки (1 р/сут), либо два раза в сутки (2 р/сут), в течение 4 или 5 суток подряд. Каждый субъект получал приблизительно 30 мкл одной из четырех дозировок соединения I путем билатерального местного офтальмологического введения.
[00247] Все дозы вводили в пределах±1 часа относительно запланированного времени введения, за исключением некоторых субъектов с введением дозы на 1 сутки. Отбор образцов из глаза субъектов после введения соединения I проводили на 5 сутки спустя 1 час после введения первой суточной дозы, за исключением нескольких случаев, когда отбор образцов из глаза проводили на 4 сутки спустя 24 часа после введения первой суточной дозы.
[00248] Собирали образцы внутриглазной жидкости, роговицы, центральной части и периферической части сетчатки, и центральной части и периферической части сосудистой оболочки. Образцы роговицы, центральной части сетчатки и центральной части сосудистой оболочки подвергали анализу; образцы внутриглазной жидкости, периферической части сетчатки и периферической части сосудистой оболочки анализу не подвергали.
[00249] В таблице 9 (A-B) представлены фармакокинетические результаты с местным офтальмологическим введением растворов соединения I на основе циклодекстрина в течение 5 суток.
Таблица 9A: Офтальмологические составы
[00250] В таблице 9B представлен обзор средних тканевых концентраций соединения I в центральной части сетчатки, центральной части сосудистой оболочки и роговице. Любые значения <LLOQ исключались из статистических расчетов. Если все значения для данного момента времени были <LLOQ, то среднее указывалось как <LLOQ.
Таблица 9B: Средние концентрации соединения I в сетчатке, сосудистой оболочке и роговице.
Центральная часть сосудистой оболочки LLOQ=0,174 мкМ
Роговица LLOQ=0,0174 мкМ
*Среднее значение исходя из n=1.
Концентрации соединения I (в мкМ) в различных жидкостях и тканях глаза
[00251] Согласно некоторым вариантам осуществления, концентрацию первого действующего вещества в различных тканях и жидкостях глаза измеряют после местного офтальмологического введения раствора приблизительно 0,4% (приблизительно 4 мг/мл) соединения I и циклодекстрина. Среднюю концентрацию соединения I измеряют в центральной части сосудистой оболочки, центральной части сетчатки, внутриглазной жидкости и роговице. Соединение I находится в растворе (0,4% или 4 мг/мл) с 8,41% KLEPTOSE® и 0,142% фосфатного буфера; 8,9% KLEPTOSE® HPB и 0,142% фосфатного буфера; 4,88% CAPTISOL® и 0,142% фосфатного буфера; или 4,88% CAPTISOL® и 0,122% фосфатного буфера (см. таблицу 10A-B).
[00252] Согласно некоторым вариантам осуществления, после местного офтальмологического введения раствора приблизительно 0,4% (приблизительно 4 мг/мл) соединения I и циклодекстрина, концентрация соединения I в центральной части сосудистой оболочки составляет приблизительно 0,2 мкМ и приблизительно 0,8 мкМ. Концентрация соединения I в центральной части сетчатки составляет приблизительно 0,05 мкМ - приблизительно 0,15 мкМ. Согласно некоторым вариантам осуществления, после местного офтальмологического введения раствора приблизительно 0,4% (приблизительно 4 мг/мл) соединения I и циклодекстрина, концентрация соединения I во внутриглазной жидкости составляет приблизительно 0,003 мкМ - приблизительно 0,008 мкМ; и концентрация соединения I в роговице составляет приблизительно 6,0 мкМ - приблизительно 40 мкМ. В растворе соединения I, вводимого в глаз посредством местного введения, используют KLEPTOSE® HPB or CAPTISOL®.
[00253] Согласно некоторым вариантам осуществления, после местного введения два раза в сутки составов в виде глазных гелевых капель, содержащих 0,3% соединения I с добавлением и без добавления бензалкония хлорида, средние концентрации соединения I в тканях глаза являются наивысшими в роговице, составляя приблизительно 200 мкМ - приблизительно 350 мкМ, приблизительно 2,0 мкМ - приблизительно 5,0 мкМ в периферической части сосудистой оболочки, приблизительно 0,2 мкМ - приблизительно 0,7 мкМ в центральной части сосудистой оболочки, приблизительно 0,05 мкМ - приблизительно 0,5 мкМ в периферической части сетчатки и приблизительно 0,01 мкМ - приблизительно 0,05 мкМ во внутриглазной жидкости.
[00254] Согласно некоторым вариантам осуществления, содержащие соединение I суспензионные составы на основе Трис хорошо переносятся, никак не обнаруживаясь в роговице, и лишь с редкими единичными случаями возникновения умеренного конъюнктивита. Согласно некоторым вариантам осуществления, на 30 сутки местного введения два раза в сутки суспензий на основе Трис, содержащих 0,3% соединения I с добавлением и без добавления бензалкония хлорида, средние концентрации соединения I в тканях глаза, измеренные через 1 час±15 минут после первого суточного местного офтальмологического введения являются наивысшими в роговице, например, составляя приблизительно 2,00 мкМ - приблизительно 4,0 мкМ. Концентрация в периферической части сосудистой оболочки для той же дозы составляет приблизительно 0,7 мкМ - приблизительно 1,5 мкМ; концентрация в центральной части сосудистой оболочки составляет приблизительно 0,3 мкМ - приблизительно 0,4 мкМ; концентрация в периферической части сетчатки составляет приблизительно 0,08 мкМ - приблизительно 0,09 мкМ); концентрация в центральной части сетчатки составляет приблизительно 0,04 мкМ - приблизительно 0,07 мкМ; и концентрация во внутриглазной жидкости составляет приблизительно 0,001 мкМ - приблизительно 0,002 мкМ.
[00255] Настоящая заявка относится к растворам соединения I на основе циклодекстрина (например, к растворам, содержащим гидроксипропил-β-циклодекстрин (HP-β-CD, KLEPTOSE® HPB)), которые хорошо переносятся при местном введении субъектам до 30 суток, два раза в сутки приблизительно 0,1% соединения I (в растворе с приблизительно 2,0% - приблизительно 2,5% HP-β-CD), два раза в сутки приблизительно 0,2% соединения I (в растворе с приблизительно 4,0% - приблизительно 4,5% HP-β-CD), один или два раза в сутки приблизительно 0,4% соединения I (в растворе с приблизительно 8,0% - приблизительно 8,5% HP-β-CD), и один или два раза в сутки приблизительно 0,6% соединения I (в растворе с HP-β-CD в концентрации приблизительно до 14%). Более того, согласно дополнительным вариантам осуществления, приблизительно 0,4% (масс./об.) растворы соединения I на основе циклодекстрина в Kleptose® HPB, Kleptose® HP или Captisol® хорошо переносятся при введении два раза в сутки до 24 суток.
[00256] Настоящая заявка относится к дозолимитирующей токсичности в отношении роговицы, наблюдаемой для содержащих соединение I офтальмологических составах в виде гелевых капель. Согласно некоторым вариантам осуществления, глазные гелевые капли приблизительно 5-кратно - приблизительно 15-кратно более высокие концентрации соединения I в роговице по сравнению с раствором на основе циклодекстрина, и приблизительно 50-кратно - приблизительно 100-кратно более высокие концентрации соединения I в роговице по сравнению с суспензиями на основе Трис. Суспензии соединения I на основе Трис и растворы на основе циклодекстрина согласно настоящей заявке хорошо переносятся при отсутствии свидетельств выраженной офтальмологической токсичности. Согласно некоторым вариантам осуществления, введение приблизительно 0,005% - приблизительно 5,0% (масс./об.) раствора соединения I на основе циклодекстрина или суспензии соединения I на основе Трис один или два раза в сутки в течение, по меньшей мере, 30 суток хорошо переносится субъектами. Настоящая заявка относится к получению наивысших концентраций соединения I в центральной части сосудистой оболочки с использованием растворов на основе циклодекстрина по сравнению с эквимолярными дозами гелей и/или составов на основе Трис.
Таблица 10A: Средняя концентрация соединения I (в мкМ) в различных жидкостях и тканях глаза
LLOQ для сосудистой оболочки=0,184 мкМ
LLOQ для сетчатки=0,0229 мкМ
LLOQ для внутриглазной жидкости=0,000918 мкМ
LLOQ для роговицы=0,0918 мкМ.
Таблица 10B: План исследования
(мг/сутки)
(мкл/доза)
(мкл/сутки)
** Гидроксипропил-β-циклодекстрин (HPβCD) производства Roquette.
*** CAPTISOL® представляет собой полианионное производное β-циклодекстрина с сульфонатом натрия, отделенным от липофильной полости бутилэфирной спейсерной группой или сульфобутилэфиром (SBE).
[00257] В таблице 11 представлены концентрации содержащих соединение I составов в роговице и в центральной части сосудистой оболочки.
Таблица 11:
(мкМ)
(мкМ)
(Captisol®)
(Kleptose® HP)
(Kleptose® HPB)
Протокол I фазы исследования с увеличением дозы у пациентов с неоваскулярной AMD
[00258] Настоящая заявка относится к I фазе исследования, представляющего собой 12-недельное открытое мультицентровое исследование с увеличением дозы для оценки безопасности, переносимости и фармакокинетики после местного офтальмологического введения соединения I пациентам с неоваскулярной возрастной макулярной дегенерацией (AMD). Всего до 60 пациентов подвергались лечению офтальмологическим раствором соединения I, вводимым местно 1-2 раза в сутки в течение 3 месяцев, в ходе которого были запланированы 3 группы для получения монотерапии с увеличением дозы и 1 группа для получения вспомогательной терапии с использованием однократной интравитреальной инъекции Lucentis® вместе с монотерапией с максимально переносимой дозой (15 пациентов в каждой группе). Пациентам, которые достигали заранее определенного уровня зрения и показателей повреждения CNV, подтвержденных независимым центром по расшифровке изображений, разрешали одновременно прервать местное офтальмологическое введение и получать стандартное лечение.
[00259] Настоящая заявка относится к 3 дозировкам, варьирующим от 0,1% до 1,0% (масс./об.) офтальмологического раствора (в виде соединения I), для клинических исследований. Дозировки составляли приблизительно 0,1%, приблизительно 0,3%, приблизительно 0,6%, и приблизительно 1,0% (масс./об.) гидрохлорида соединения I.
Приготовление составов
[00260] Неограничивающие примеры составов согласно настоящей заявке представлены в таблице 12.
Таблица 12: Обзор содержащих продукт композиций, протестированных в скрининговых исследования продукта
1:4, 1:8, 1:10, 1:12
1:6, 1:8, 1:10
1:6, 1:10
1:2, 1:3, 1:4, 1:6, 1:8, 1:10
HPβCD
1:8
0,1, 0,4%
5,5, 6,5
фосфат, Трис
a Молярное соотношение соединение I/циклодекстрин.
b KLEPTOSE® HPB.
c CAPTISOL®.
Анализ фосфорилирования тирозина EGFR в клетках для определения EGFR активности соединений формулы I или II
[00261] Анализ тирозина EGFR в эпителиальных клетках роговицы проводят для определения того, способны ли высокие концентрации EGF преодолевать ингибирование киназной активности EGFR. Клетки инкубировали без сыворотки, а затем предварительно обрабатывали различными концентрациями соединения формулы I или II, например, соединения I, или контролем, а затем обрабатывали EGF. Затем, клетки инкубировали, и проводили иммуноблотинг для определения концентраций фосфорилированного EGFR и общего EGFR, что использовали для определения активности рецептора (IC50).
Анализ фосфорилирования тирозина EGFR в клетках для определения EGFR активности сочетания соединений формулы I или II и второго действующего вещества
[00262] Анализ тирозина EGFR в эпителиальных клетках роговицы проводят для определения того, способны ли витамин K или никотиновая кислота/никотинамид преодолевать ингибирование EGFR, и существует ли увеличение активности EGFR. Клетки инкубировали без сыворотки, а затем предварительно обрабатывали различными концентрациями соединения формулы I или II, например, соединения I, и насыщающими концентрациями витамина K или никотиновой кислоты/никотинамида, а затем обрабатывали EGF. Клетки инкубировали, и проводили иммуноблотинг для определения концентраций фосфорилированного EGFR (тиирозин 1068 и тирозин 1045) и общего EGFR, что использовали для определения активности рецептора (IC50).
Определение эффектов различных концентраций соединений формулы I или II и EGF на миграцию/пролиферацию клеток (заживление ран in vitro)
[00263] Определение миграции/пролиферации клеток в эпителиальных клетках роговицы проводили для определения миграции/пролиферации клеток в присутствии различных концентраций соединения формулы I или II и EGF. Клетки помещали в планшеты с силиконовыми пробками. Затем, клетки инкубировали без сыворотки, и предварительно обрабатывали различными концентрациями соединения формулы I или II или контролем. Затем, силиконовые пробки удаляли для создания бесклеточной зоны, и обрабатывали EGF. Миграцию клеток количественно оценивали исходя из электронных микрофотографий.
Определение миграции/пролиферации клеток, обработанных соединениями формулы I или II и/или вторым действующим веществом
[00264] Определение миграции/пролиферации клеток в эпителиальных клетках роговицы проводили для определения миграции/пролиферации клеток в присутствии различных концентраций соединения формулы I или II, витамина K или никотиновой кислоты/никотинамида. Клетки помещали в планшеты с силиконовыми пробками. Затем, клетки инкубировали без сыворотки, и предварительно обрабатывали различными концентрациями соединения формулы I или II или контролем. Пробки удаляли, и обрабатывали клетки 1) EGF, 2) EGF и витамином K или 3) EGF и никотиновой кислотой/никотинамидом. Миграцию клеток количественно оценивали исходя из электронных микрофотографий.
Определение эффектов соединений формулы I или II на естественное и EGF-опосредованное заживление ран роговицы in vivo
[00265] Определение эффектов соединения формулы I или II на скорости фонового и стимулированного лигандом заживления ран роговицы проводили на мышах. На роговицы мышей C57/Bl наносили раны, затем предварительно обрабатывали соединением формулы I или II, а затем добавляли EGF. Размер раны отслеживали при помощи окрашивания флуоресцеином и флуоресцентной фотографии и количественно оценивали.
Определение эффектов соединений формулы I или II и второго действующего вещества на естественное и EGF-опосредованное заживление ран роговицы in vivo
[00266] Определение эффектов соединения формулы I или II и/или второго действующего вещества на заживление ран роговицы проводили на мышах. На роговицы мышей C57/Bl наносили раны, затем предварительно обрабатывали соединением формулы I или II, а затем добавляли EGF, витамин K или никотиновую кислоту/никотинамид. Размер и закрытие раны отслеживали.
Дозы лечения
[00267] Состав согласно настоящей заявке эффективен при лечении (т.е. стабилизации или регрессии повреждения) или профилактике неоваскуляризации (NV) сосудистой оболочки или сетчатки глаза у субъекта-млекопитающего. Соединение I согласно настоящей заявке в определенной дозе ингибирует рецепторную тирозинкиназу, и второе действующее вещество в определенной дозе ингибирует рецепторную тирозинкиназу ErbB. Согласно некоторым вариантам осуществления, содержащий соединение I состав в определенной дозе ингибирует рецепторную тирозинкиназу, включая VEGFR, FGFR, Tie2 и EphB-4. Ингибирование нескольких RTK одновременно составом согласно настоящей заявке в определенной дозе имеет синергический эффект и эффективно при лечении или регрессии NV в заднем отделе глаза. Согласно некоторому варианту осуществления, второе действующее вещество прямо или опосредованно модулирует (например, активирует) рецепторную тирозинкиназу ErB, включая EGFR, HER2, HER3 и Erb4. Активация нескольких рецепторных тирозинкиназ ErB одновременно составом согласно настоящей заявке в определенной дозе может иметь синергический эффект и эффективно при профилактике или лечении повреждений или заболеваний роговицы.
[00268] Согласно одному варианту осуществления, настоящая заявка относится к способу лечения (т.е. стабилизации или регрессии повреждения) или профилактики неоваскуляризации (NV) сосудистой оболочки или сетчатки глаза путем введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или II, или его фармацевтически приемлемой соли, и второго действующего вещества или его фармацевтически приемлемой соли, где соединение формулы I или II, или его фармацевтически приемлемую соль, и второе действующее вещество или его фармацевтически приемлемую соль вводят одновременно. В качестве альтернативы, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят перед введением второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят после введения второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, настоящая заявка относится к способу лечения (т.е. стабилизации или регрессии повреждения) или профилактики неоваскуляризации (NV) сосудистой оболочки или сетчатки глаза путем введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или II, или его фармацевтически приемлемой соли перед введением терапевтически эффективной дозы состава, описанного в настоящем документе.
[00269] Согласно другому варианту осуществления, настоящая заявка относится к способу лечения (т.е. стабилизации или регрессии повреждения) или профилактики неоваскуляризации (NV) сосудистой оболочки или сетчатки глаза и профилактики или лечения повреждения или заболевания роговицы путем введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или II, или его фармацевтически приемлемой соли, и второго действующего вещества или его фармацевтически приемлемой соли, где соединение формулы I или II, или его фармацевтически приемлемую соль, и второе действующее вещество или его фармацевтически приемлемую соль вводят одновременно. В качестве альтернативы, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят перед введением второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, соединение формулы I или II, или его фармацевтически приемлемую соль, вводят после введения второго действующего вещества или его фармацевтически приемлемой соли. Согласно другому варианту осуществления, настоящая заявка относится к способу лечения (т.е. стабилизации или регрессии повреждения) или профилактики неоваскуляризации (NV) сосудистой оболочки или сетчатки глаза и профилактики или лечения повреждения или заболевания роговицы путем введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или II, или его фармацевтически приемлемой соли, перед введением терапевтически эффективной дозы состава, описанного в настоящем документе.
[00270] Согласно дополнительному варианту осуществления, состав согласно настоящей заявке эффективен при лечении NV и лечении и/или профилактике повреждения или заболевания роговицы, обусловленного системным заболеванием, глазным заболеванием или введением соединения формулы I или II при местном офтальмологическом введении один, два, три или четыре раза в сутки приблизительно 0,005% - приблизительно 5,0% (приблизительно 0,05 - приблизительно 50 мг/мл) соединения I и второго действующего вещества. Состав, содержащий соединение I или его свободное основание (соединение формулы II) и второе действующее вещество, для лечения или регрессии NV и лечения и/или профилактики повреждения или заболевания роговицы представляет собой раствор, содержащий второе действующее вещество, соединение формулы I или II и циклодекстрин, или суспензию, содержащую Трис. При введении субъекту, раствор или суспензия, подвергаясь воздействию кислорода воздуха с индукцией вызванной кислородом ретинопатии (OIR) или NV, например, способен эффективно снижать среднюю площадь преретинальной NV с небольшим повреждением или заболеванием роговицы или без него. Профилактика или лечение NV содержащим соединение I составом и/или суспензией достигается посредством ингибирования нескольких рецепторных тирозинкиназ (RTK), включая VEGFR-2. Профилактика или лечение повреждений или заболеваний роговицы вторым действующим веществом достигается посредством модулирования (например, активации) EGFR.
[00271] Любые из раскрытых в настоящем документе заболеваний или состояний могут подвергаться лечению или профилактике путем достижения в тканях целевой концентрации приблизительно 200 нМ - приблизительно 2 мкМ раскрытых соединений или их фармацевтически приемлемых солей, содержащего их состава и/или суспензии. Один вариант осуществления настоящей заявки относится к способу лечения патологического ангиогенеза в заднем отделе глаза, путем достижения в тканях целевой концентрации приблизительно 200 нМ - приблизительно 2 мкМ раскрытых соединений или их фармацевтически приемлемых солей, содержащего их состава и/или суспензии. Другой вариант указанного варианта осуществления относится к достижению в тканях целевой концентрации приблизительно 300 нМ - приблизительно 2 мкМ одного или нескольких из раскрытых соединений их фармацевтически приемлемых солей, и/или содержащего их состава.
[00272] Согласно варианту осуществления согласно настоящей заявке, приблизительно 0,2 - приблизительно 1,0% (приблизительно 2 - приблизительно 10 мг/мл) соединения I, включенного в состав раствора или суспензии, могут эффективно ингибировать при введении киназную функцию VEGFR-2 и обеспечивать существенную блокаду целого ряда рецепторов проангиогенных факторов роста, включая FGFR1-3, Tie-2 и EphB-4. Концентрация 2-10 мг/мл соединения I в составе обеспечивает фармакологически эффективные концентрации лекарства в центральной части сосудистой оболочки и сетчатки после 1-5 суток местного офтальмологического введения.
[00273] Согласно некоторым вариантам осуществления, продолжительность воздействия соединения I составляет от 1 до 90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, схема приема включает в себя несколько курсов местного офтальмологического введения субъекту состава, содержащего соединение I, в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Например, схема приема включает в себя введение состава один раз в сутки, два раза в сутки, три раза в сутки или четыре раза в сутки в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Например, схема приема включает в себя введение состава один, два, три или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, схема приема включает в себя введение один раз на 1 сутки, один раз или два раза на 2 сутки - 90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, с последующим введением один раз в сутки на 2-90 сутки. Например, схема приема включает в себя введение один, два, три или четыре раза на 1 сутки, а затем один раз, два раза, три раза или четыре раза через сутки (т.е. на 1, 3, 5, 7 сутки и т.д.) в течение до 90 суток. Например, одна схема введения включает в себя один раз в сутки или два раза в сутки в течение 1, 2, 3, 4 или 5 суток подряд. Для схемы с введением два или раза в сутки, субъектам местно офтальмологически вводят дозы содержащего соединение I состава на 1 и 4 сутки с интервалом приблизительно в 4, 6 или 8 часов. Согласно другому варианту осуществления, субъектам местно офтальмологически вводят дозы содержащего соединение I состава с интервалом приблизительно в 4, 6 или 8 часов в течение 4 суток подряд. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы в сутки содержащего соединение I состава в течение 5 суток подряд. Согласно еще одним вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы содержащего соединение I состава в течение 5-90 суток подряд. Согласно некоторым вариантам осуществления, субъектам местно офтальмологически вводят одну или две дозы содержащего соединение I состава, по меньшей мере, в течение 25 суток подряд. Согласно одному варианту осуществления, субъектам местно офтальмологически вводят одну или две дозы, по меньшей мере, в течение 90 суток подряд или более.
[00274] Согласно некоторым вариантам осуществления, настоящая заявка относится к составу, содержащему соединение I или его свободное основание и/или второе действующее вещество, вводимому местно в задний отдел глаза субъекта для лечения AMD, патологической CNV и/или патологической NV. Например, состав вводят в глаз субъекта 1, 2, 3 или 4 раза в сутки. Согласно конкретным вариантам осуществления, состав вводят в глаз субъекта 2 или 3 раза в сутки. Например, состав вводят субъекту в один глаз или в оба глаза. Например, состав согласно настоящему раскрытию, содержащий приблизительно 1 мг/мл первого действующего вещества, вводят субъекту в один глаз или в оба глаза два раза в сутки (2 р/сут). Согласно некоторым вариантам осуществления, субъекту в один глаз или в оба глаза вводят приблизительно 1 мг/мл один раз в сутки (1 р/сут) или 2 р/сут, приблизительно 2 мг/мл 1 р/сут или 2 р/сут, приблизительно 3 мг/мл 1 р/сут или 2 р/сут, приблизительно 4 мг/мл 1 р/сут или 2 р/сут, приблизительно 5 мг/мл 1 р/сут или 2 р/сут, приблизительно 6 мг/мл 1 р/сут или 2 р/сут, приблизительно 7 мг/мл 1 р/сут или 2 р/сут, приблизительно 8 мг/мл 1 р/сут или 2 р/сут, приблизительно 9 мг/мл 1 р/сут или 2 р/сут или приблизительно 10 мг/мл 1 р/сут или 2 р/сут.
[00275] Например, состав, содержащий приблизительно 1 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 1 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза 1 р/сут субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 2 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 3 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 4 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 5 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 6 мг/мл соединения I и/или второго действующего вещества, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят 2 р/сут в один глаз или в оба глаза субъекта в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 7 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 8 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 3 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 9 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 4 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий приблизительно 10 мг/мл первого действующего вещества (например, соединения I) и второе действующее вещество, вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше. Согласно некоторым вариантам осуществления, состав согласно настоящей заявке вводят 1 р/сут, 2 р/сут, 3 р/сут или 4 р/сут при введении в малых дозах (например, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл или 5 мг/мл), и 1 р/сут или 2 р/сут при введении в больших дозах (например, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл или 10 мг/мл).
[00276] Согласно другому варианту осуществления, состав, содержащий 1 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 1 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 2 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 2 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 3 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 3 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 4 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 4 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 5 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 5 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 6 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 6 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 7 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 7 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 8 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 8 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 9 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 9 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 10 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 2 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, состав, содержащий 10 мг/мл соединения I, и второе действующее вещество вводят в один глаз или в оба глаза субъекта 1 р/сут в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше.
[00277] Настоящая заявка относится к составам, представленным в таблице 13, для введения в один глаз или в оба глаза субъекта.
Таблица 13
*QS=количество, необходимое для достижения осмолярности.
[00278] Согласно некоторым вариантам осуществления, состав, содержащий соединение формулы II или соединение I, вводят субъекту в один глаз или в оба глаза. Например, субъекту в один глаз или в оба глаза один раз в сутки (1 р/сут) или два раза в сутки (2 р/сут) вводят приблизительно 0,2% - приблизительно 1,0% (масс./об.) соединения формулы II или приблизительно 0,1% - 1,2% (масс./об.) состава, содержащего соединение I, в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев). Согласно некоторым вариантам осуществления, соединение формулы II или соединение I объединяют в комплекс с комплексообразующим веществом, например, с циклодекстрином (например, Kleptose® HPB (%)) в соотношении приблизительно 1:8, причем в состав добавляют приблизительно 2% - 13% (масс./об.) циклодекстрина (например, Kleptose® HPB (%)). Состав дополнительно содержит приблизительно 0,1% - приблизительно 0,2% буфера, например, 10 мМ фосфатного буфера. Целевая осмолярность состава составляет приблизительно 200 - приблизительно 300 мОсм, что достигается путем добавления достаточного для достижения целевой осмолярности количества соли, например, натрия хлорида. Значение pH состава составляет приблизительно 6,0 при температуре приблизительно 40°C или ниже. Схема приема в течение 1-90 суток или в течение более чем 90 суток (например, 4 месяца, 6 месяцев, 8 месяцев или 12 месяцев) может представлять собой любую из схем с использованием суток, идущих подряд, или чередующихся суток, описанных в параграфе выше. Согласно некоторым вариантам осуществления, состав, содержащий соединение формулы II или соединение I, дополнительно содержит второе действующее вещество. Согласно некоторому варианту осуществления, состав, содержащий соединение формулы II или соединение I, вводят со вторым действующим веществом.
[00279] Второе действующее вещество, например, никотиновая кислота, никотинамид или витамин K или их сочетание, в определенных дозах прямо или опосредованно модулирует (например, активирует) ErbB рецепторную тирозинкиназу (RTK), включая EGFR, HER2, HER3 и HER4. Модулирование (например, активирование) одной или нескольких ErbB RTK составом согласно настоящей заявке в определенной дозе является одновременным и обладает синергическим эффектом, и эффективно при профилактике или лечении повреждений или заболеваний роговицы (например, изъязвлений роговицы, дефектов эпителия роговицы, кератита, и т.д.) в заднем отделе глаза.
[00280] Способы согласно настоящей заявке объединяют со стандартом лечения, включая без ограничения лечение лазером и лечение инъецируемыми антинеоваскулярными средствами.
Грануломерические композиции и составы, содержащие грануломерические композиции
[00281] Настоящая заявка относится к фармацевтической композиции, содержащей частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, соединения формулы II или соединения I) и/или второго действующего вещества), или его фармацевтически приемлемую соль, где частицы имеют средний диаметр от 100 нм до 100 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 20 мкм до 90 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 20 мкм до 80 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 20 мкм до 70 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 30 мкм до 70 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 30 мкм до 60 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 30 мкм до 50 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 30 мкм до 40 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 50 мкм до 70 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 50 мкм до 60 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр, по меньшей мере, 30 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм, приблизительно 60 мкм, приблизительно 65 мкм или приблизительно 70 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 50 мкм или приблизительно 60 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 100 нм до 8 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 100 нм до 200 нм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр не более чем 150 нм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр приблизительно 150 нм, приблизительно 140 нм, приблизительно 130 нм, приблизительно 120 нм, приблизительно 110 нм или приблизительно 100 нм. Согласно другим вариантам осуществления, частицы имеют средний диаметр от 1 мкм до 5 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр от 2 мкм до 4 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр приблизительно 1 мкм, приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм или приблизительно 5 мкм. Согласно некоторым вариантам осуществления, частицы имеют средний диаметр приблизительно 3 мкм.
[00282] Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 70 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 60 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 10 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 9 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 8 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 7 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 6 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 5 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 4 мкм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 300 нм или менее. Согласно некоторым вариантам осуществления, по меньшей мере, 90% частиц имеют диаметр 200 нм или менее.
[00283] Согласно некоторым вариантам осуществления, фармацевтическая композиция содержит частицы первого действующего вещества (например, первого действующего вещества (например, соединения формулы II или соединения I)) и частицы второго действующего вещества (например, никотиновой кислоты, никотинамида, витамина K, или их сочетания). Согласно некоторым вариантам осуществления, фармацевтическая композиция содержит частицы первого действующего вещества (например, первого действующего вещества (например, соединения формулы II или соединения I)) и частицы витамина K (например, менадиона).
[00284] Согласно некоторым вариантам осуществления, первое действующее вещество (например, соединение формулы II или соединение I) и второе действующее вещество (например, никотиновую кислоту, никотинамид, витамин K, или их сочетание) измельчают вместе на валковой мельнице с получением частиц, содержащих первое действующее вещество и второе действующее вещество. Согласно некоторым вариантам осуществления, первое действующее вещество и второе действующее вещество измельчают на валковой мельнице по отдельности, а затем частицы, содержащие первое действующее вещество, и частицы, содержащие второе действующее вещество, смешивают или измельчают вместе на валковой мельнице. Согласно некоторым вариантам осуществления, первое действующее вещество или второе действующее вещество измельчают на валковой мельнице первым, а затем частицы добавляют к другому действующему веществу для дополнительного измельчения на валковой мельнице.
[00285] Согласно некоторым вариантам осуществления, фармацевтическая композиция, содержащая частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества или второго действующего вещества) дополнительно содержит один или несколько наполнителей. Наполнитель может быть выбран из любого подходящего наполнителя, известного в данной области техники, например, для получения офтальмологического раствора. Согласно некоторым вариантам осуществления, наполнитель выбирают из полисорбата (Твин) 80, полоксамера (Плуроник) F-127, гипромеллозы (гидроксипропилметил-целлюлоза или HPMC), повидона (PVP K-29/32 или K-30) и тилоксапола, или из их сочетания. Согласно некоторым вариантам осуществления, наполнитель выбирают из HPMC, Твин 80, Плуроник F-127 и тилоксапола, или из их сочетания.
[00286] Согласно некоторым вариантам осуществления, частицы, содержащие первое действующее вещество (например, соединение формулы II или соединение I), и частицы, содержащие второе действующее вещество (например, никотиновую кислоту, никотинамид, витамин K, или их сочетание) содержат одинаковый(ые) носитель(и).
[00287] Согласно некоторым вариантам осуществления, фармацевтическая композиция, содержащая частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества или второго действующего вещества) дополнительно содержит поверхностно-активное вещество, такие как бензалкония хлорид (BAC).
[00288] Согласно некоторым вариантам осуществления, фармацевтическая композиция, содержащая частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества или второго действующего вещества) дополнительно содержит наполнитель (например, для увеличения биодоступности действующего вещества). Согласно некоторым вариантам осуществления, наполнитель представляет собой гидроксиэтилцеллюлозу (HEC). Согласно некоторым вариантам осуществления, HEC присутствует в количестве, равном приблизительно 0,1% - приблизительно 1%, приблизительно 0,1% - приблизительно 0,9%, приблизительно 0,1% - приблизительно 0,8%, приблизительно 0,1% - приблизительно 0,7%, приблизительно 0,1% - приблизительно 0,6%, приблизительно 0,1% - приблизительно 0,5%, приблизительно 0,1% - приблизительно 0,4% или приблизительно 0,1% - приблизительно 0,3%. Согласно некоторым вариантам осуществления, HEC присутствует в количестве, равном приблизительно 0,2% или приблизительно 0,3%.
[00289] Согласно некоторым вариантам осуществления, частицы согласно настоящей заявке содержат соединение формулы II (т.е. свободное основание соединения I). Согласно другим вариантам осуществления, частицы согласно настоящей заявке содержат соединение I.
[00290] Согласно некоторым вариантам осуществления, частицы согласно настоящей заявке получают путем измельчения на валковой мельнице. Факторы, которые могут влиять на размер частиц, включают в себя без ограничения использование свободного основания или соли действующего вещества (например, соединение I относительно соединения формулы II), добавление наполнителя, скорость валка в процессе измельчения, размера емкости для измельчения и продолжительности измельчения.
[00291] Согласно некоторым вариантам осуществления, частицы согласно настоящей заявке получают без измельчения на валковой мельнице.
[00292] Согласно некоторым вариантам осуществления, частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, соединения формулы II или соединения I) и/или второго действующего вещества) стерилизуют. Согласно некоторым вариантам осуществления, стерилизацию проводят гамма-излучением. Согласно некоторым вариантам осуществления, частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, соединения формулы II или соединения I) и/или второго действующего вещества) стабильны после стерилизации (например, остаются по существу свободными от примесей или продуктов распада в результате стерилизации).
[00293] Настоящая заявка относится к суспензионному составу, содержащему фармацевтическую композицию, где фармацевтическая композиция содержит частицы действующего вещества согласно настоящей заявке (например, первого действующего вещества (например, соединения формулы II или соединения I) и/или второго действующего вещества), или его фармацевтически приемлемой соли, как описано в настоящем документе.
[00294] Согласно некоторым вариантам осуществления, суспензионный состав содержит частицы первого действующего вещества (например, соединения формулы II или соединения I), где первое действующее вещество содержится в концентрации приблизительно 0,1 мг/мл - приблизительно 10 мг/мл. Согласно некоторым вариантам осуществления, первое действующее вещество (например, соединение формулы II или соединение I) содержится в концентрации приблизительно 0,2 мг/мл - приблизительно 10 мг/мл, приблизительно 0,5 мг/мл - приблизительно 10 мг/мл, приблизительно 1 мг/мл - приблизительно 10 мг/мл, приблизительно 2 мг/мл - приблизительно 9 мг/мл, приблизительно 2 мг/мл - приблизительно 8 мг/мл, приблизительно 3 мг/мл - приблизительно 8 мг/мл, приблизительно 3 мг/мл - приблизительно 7 мг/мл, приблизительно 3 мг/мл - приблизительно 6 мг/мл, приблизительно 4 мг/мл - приблизительно 6 мг/мл или приблизительно 4 мг/мл - приблизительно 5 мг/мл. Согласно некоторым вариантам осуществления, первое действующее вещество содержится в концентрации приблизительно 0,1 мг/мл, 0,3 мг/мл, 0,5 мг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 3 мг/мл, приблизительно 4 мг/мл, приблизительно 6 мг/мл или приблизительно 10 мг/мл. Согласно некоторым вариантам осуществления, первое действующее вещество содержится в концентрации приблизительно 1 мг/мл - приблизительно 4 мг/мл или приблизительно 2 мг/мл - приблизительно 4 мг/мл. Согласно некоторым вариантам осуществления, первое действующее вещество содержится в концентрации приблизительно 2 мг/мл или приблизительно 4 мг/мл.
[00295] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), дополнительно содержит второе действующее вещество (например, никотиновую кислоту, никотинамид, витамин K, или их сочетание). Согласно некоторым вариантам осуществления, второе действующее вещество представляет собой витамин K (например, менадион). Согласно некоторым вариантам осуществления, второе действующее вещество присутствует в количестве менее чем 10 мкМ. Согласно некоторым вариантам осуществления, второе действующее вещество присутствует в количестве приблизительно 0,5 мкМ, приблизительно 0,6 мкМ, приблизительно 0,7 мкМ, приблизительно 0,8 мкМ, приблизительно 0,9 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 7 мкМ, приблизительно 8 мкМ или приблизительно 9 мкМ. Согласно некоторым вариантам осуществления, второе действующее вещество присутствует в количестве приблизительно 1 мкМ.
[00296] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), дополнительно содержит наполнитель, выбранный из полисорбата (Твин) 80, полоксамера (Плуроник) F-127, гипромеллозы (гидрокси-пропилметилцеллюлоза или HPMC), повидона (PVP K-29/32 или K-30) и тилоксапола, или из их сочетания. Согласно некоторым вариантам осуществления, наполнитель выбирают из HPMC, Твин 80, Плуроник F-127 и тилоксапола, или их сочетания. Согласно некоторым вариантам осуществления, наполнитель представляет собой Плуроник F-127, Твин 80, HPMC или тилоксапол, или их сочетание. Согласно некоторым вариантам осуществления, наполнитель присутствует в концентрации приблизительно 0,01% - приблизительно 0,2%, приблизительно 0,01% - приблизительно 0,15%, приблизительно 0,01% - приблизительно 0,12%, приблизительно 0,01% - приблизительно 0,1%, приблизительно 0,01% - приблизительно 0,09%, приблизительно 0,02% - приблизительно 0,09%, приблизительно 0,03% - приблизительно 0,09%, приблизительно 0,04% - приблизительно 0,09% или приблизительно 0,04% - приблизительно 0,08%. Согласно некоторым вариантам осуществления, суспензия состав содержит приблизительно 0,08% или приблизительно 0,04% Плуроника F-127. Согласно некоторым вариантам осуществления, суспензия состав содержит приблизительно 0,08% HPMC. Согласно другим вариантам осуществления, суспензия состав содержит приблизительно 0,04% тилоксапола.
[00297] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), дополнительно содержит буферное вещество. Согласно некоторым вариантам осуществления, буферное вещество выбирают из фосфатных буферов, боратных буферов, цитратных буферов, тартратных буферов, ацетатных буферов, аминокислот, натрия ацетата, натрия цитрата, Трис-буферов, и т.п. Согласно некоторым вариантам осуществления, буферное вещество представляет собой Трис. Согласно некоторым вариантам осуществления, буферное вещество присутствует в концентрации приблизительно 0,1% - приблизительно 2%, приблизительно 0,2% - приблизительно 1,8%, приблизительно 0,3% - приблизительно 1,6%, приблизительно 0,4% - приблизительно 1,4%, приблизительно 0,4% - приблизительно 1,2%, приблизительно 0,4% - приблизительно 1%, приблизительно 0,4% - приблизительно 0,8%, приблизительно 0,4% - приблизительно 0,7% или приблизительно 0,5% - приблизительно 0,7%. Согласно некоторым вариантам осуществления, суспензионный состав содержит приблизительно 0,6% Трис.
[00298] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), дополнительно содержит реагент-регулятор тоничности. Согласно некоторым вариантам осуществления, реагент-регулятор тоничности представляет собой глицерин. Согласно некоторым вариантам осуществления, реагент-регулятор тоничности присутствует в количестве приблизительно 1% - приблизительно 10%, приблизительно 2% - приблизительно 10%, приблизительно 3% - приблизительно 10%, приблизительно 4% - приблизительно 10%, приблизительно 5% - приблизительно 10%, приблизительно 2% - приблизительно 9%, приблизительно 2% - приблизительно 8%, приблизительно 2% - приблизительно 7%, приблизительно 2% - приблизительно 6%, приблизительно 2% - приблизительно 5%, приблизительно 2% - приблизительно 4% или приблизительно 2% - приблизительно 3%. Согласно некоторым вариантам осуществления, суспензионный состав содержит приблизительно 2% или приблизительно 2,5% глицерина.
[00299] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), характеризуется pH менее 7,5. Согласно некоторым вариантам осуществления, значение pH составляет приблизительно 6,0 - приблизительно 7,0. Согласно некоторым вариантам осуществления, значение pH составляет приблизительно 6,0 или приблизительно 7,0.
[00300] Согласно некоторым вариантам осуществления, суспензионный состав, содержащий частицы первого действующего вещества (например, соединения формулы II или соединения I), дополнительно содержит гидроксиэтилцеллюлозу (HEC). Согласно некоторым вариантам осуществления, HEC присутствует в количестве приблизительно 0,1% - приблизительно 1%, приблизительно 0,1% - приблизительно 0,9%, приблизительно 0,1% - приблизительно 0,8%, приблизительно 0,1% - приблизительно 0,7%, приблизительно 0,1% - приблизительно 0,6%, приблизительно 0,1% - приблизительно 0,5%, приблизительно 0,1% - приблизительно 0,4% или приблизительно 0,1% - приблизительно 0,3%. Согласно некоторым вариантам осуществления, HEC присутствует в количестве приблизительно 0,2% или приблизительно 0,3%.
[00301] Одно из первого действующего вещества, второго действующего вещества и одного или нескольких наполнителей, описанных в настоящей заявке, могут присутствовать в любой концентрации или с любым уровнем содержания, описанными в настоящем документе, в сочетании с оставшимися из первого действующего вещества, второго действующего вещества и одного или нескольких наполнителей, описанных в настоящей заявке, в любой концентрации или с любым уровнем содержания, описанными в настоящем документе.
[00302] Согласно некоторым вариантам осуществления, состав согласно настоящей заявке содержит первое действующее вещество в количестве приблизительно от 0,1% приблизительно до 1,2% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), Трис в количестве приблизительно 0,4% - приблизительно 0,8% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), глицерин в количестве приблизительно 2% - приблизительно 4% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), HEC в количестве приблизительно 0,1% - приблизительно 0,3% (или в любом диапазоне между указанными значениями, как описано в настоящем документе) и HPMC в количестве приблизительно 0,04% - приблизительно 0,09% (или в любом диапазоне между указанными значениями, как описано в настоящем документе). Согласно некоторым вариантам осуществления, первое действующее вещество представляет собой соединение формулы II или соединение I. Согласно некоторым вариантам осуществления, состав согласно настоящей заявке содержит соединение формулы II или соединение I в количестве приблизительно 0,4%, Трис в количестве приблизительно 0,6%, глицерин в количестве приблизительно 2%, HEC в количестве приблизительно 0,2%, и HPMC в количестве приблизительно 0,08%. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр от 30 мкм до 60 мкм. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр от 50 мкм до 60 мкм. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр приблизительно 50 мкм или 60 мкм. Согласно некоторым вариантам осуществления, состав характеризуется pH менее 7,0. Согласно некоторым вариантам осуществления, состав характеризуется pH приблизительно 6.
[00303] Согласно некоторым вариантам осуществления, состав согласно настоящей заявке содержит первое действующее вещество в количестве приблизительно от 0,1% приблизительно до 1,2% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), второе действующее вещество в количестве приблизительно 0,00001% - приблизительно 0,0001% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), Трис в количестве приблизительно 0,4% - приблизительно 0,8% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), глицерин в количестве приблизительно 2% - приблизительно 4% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), HEC в количестве приблизительно 0,1% - приблизительно 0,3% (или в любом диапазоне между указанными значениями, как описано в настоящем документе), и HPMC в количестве приблизительно 0,04% - приблизительно 0,09% (или в любом диапазоне между указанными значениями, как описано в настоящем документе). Согласно некоторым вариантам осуществления, первое действующее вещество представляет собой соединение формулы II или соединение I. Согласно некоторым вариантам осуществления, второе действующее вещество представляет собой витамин K3 (например, менадион). Согласно некоторым вариантам осуществления, состав согласно настоящей заявке содержит соединение формулы II или соединение I в количестве приблизительно 0,4%, витамин K3 в количестве приблизительно 0,000086%, Трис в количестве приблизительно 0,6%, глицерин в количестве приблизительно 2%, HEC в количестве приблизительно 0,2%, и HPMC в количестве приблизительно 0,08%. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр от 30 мкм до 60 мкм. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр от 50 мкм до 60 мкм. Согласно некоторым вариантам осуществления, состав содержит частицы первого действующего вещества, где частицы имеют средний диаметр приблизительно 50 мкм или 60 мкм. Согласно некоторым вариантам осуществления, частицы также содержат второе действующее вещество. Согласно некоторым вариантам осуществления, состав характеризуется значением pH менее 7,0. Согласно некоторым вариантам осуществления, состав характеризуется значением pH приблизительно 6.
Показания и способы лечения
[00304] Настоящим изобретением предусмотрены способы лечения офтальмологических заболеваний или состояний. Раскрытые способы относятся к лечению, профилактике или сдерживанию неоваскуляризации глаза (NV), или к лечению заболевания или состояния, которое связано с началом NV, путем введения субъекту одного или нескольких из раскрытых соединений (например, первого действующего вещества (например, соединения формулы I или II) и необязательно второго действующего вещества), и содержащих их составов.
[00305] Один аспект раскрытого способа относится к лечению или профилактике NV путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания) и/или содержащих их составов. Один вариант осуществления этого аспекта относится к способу лечения NV путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00306] Раскрытые способы относятся к профилактике или сдерживанию патологической неоваскуляризации глаза (NV) или к лечению заболевания или состояния, которое связано с началом NV, путем введения субъекту одного или нескольких из раскрытых соединений формулы I или II и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и содержащих их составов.
[00307] Рассматриваемые варианты осуществления предусматривают применения состава соединения I или его свободного основания (формулы II) и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания) для производства лекарственного средства для лечения субъекта с заболеванием заднего отдела глаза или васкулопатическим или воспалительным заболеванием глаза. Указанные заболевания включают в себя, например, диабетическую ретинопатию (включая фоновую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию и диабетический макулярный отек); возрастную макулярную дегенерацию (AMD) (включая неоваскулярную (влажную/экссудативную) AMD, сухую AMD и географическую атрофию сетчатки); патологическую неоваскуляризацию (CNV) сосудистой оболочки любого механизма (например, при миопии высокой степени, травме, серповидно-клеточной анемии; гистоплазмозе глаза, ангиодных полосах сетчатки, травматическом повреждении сосудистой оболочки, друзах зрительного нерва или некоторых дистрофиях сетчатки); патологическую неоваскуляризацию сетчатки любого механизма (например, при серповидно-клеточной ретинопатии, болезни Илза, глазном ишемическом синдроме, каротидно-кавернозном свище, семейной экссудативной витреоретинопатии, синдроме повышенной вязкости крови, идиопатическом окклюзионном артериолите, дробьевидной ретинохороидопатии, васкулите сетчатки, саркоидозе или токсоплазмозе); увеит; окклюзию вен сетчатки (центральной или ответвлений); травму глаза; отек, индуцированный хирургическим вмешательством; неоваскуляризацию, индуцированную хирургическим вмешательством; кистозный макулярный отек; ишемию глаза; ретинопатию недоношенных; болезнь Коутса; серповидно-клеточную ретинопатию; и/или неоваскулярную глаукому. Согласно одному варианту осуществления, заболевание глаза представляет собой AMD. Согласно одному варианту осуществления, заболевания глаза возникают вследствие ангиогенеза и/или неоваскуляризации глаза или усугубляются ими.
[00308] Согласно одному аспекту настоящей заявки, состав используют для лечения возрастной макулярной дегенерации (AMD) (включая неоваскулярную (влажную/экссудативную) AMD, сухую AMD и географическую атрофию сетчатки). Растворы или суспензии используют для лечения неоваскулярной (экссудативной или влажной) AMD. Согласно другому варианту осуществления, растворы или суспензии используют для лечения сухой AMD. Согласно еще одному варианту осуществления, растворы или суспензии используют для лечения географической атрофии сетчатки.
[00309] Состав согласно настоящей заявке предотвращает, отсрочивает или лечит начало патологической неоваскуляризации (CNV) сосудистой оболочки любого механизма (например, при миопии высокой степени, травме, серповидно-клеточной анемии; гистоплазмозе глаза, ангиодных полосах сетчатки, травматическом повреждении сосудистой оболочки, друзах зрительного нерва или некоторых дистрофиях сетчатки) у субъектов.
[00310] Состав согласно настоящей заявке отсрочивает начало, предотвращает прогрессию или лечит формирование патологической неоваскуляризации (CNV) сосудистой оболочки под нейросенсорной сетчаткой. Состав согласно настоящей заявке является эффективным для лечения CNV.
[00311] Один аспект этого способа относится к лечению или профилактике неоваскуляризации глаза путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или их фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания). Один вариант осуществления этого аспекта относится к способу лечения отека и неоваскуляризации глаза путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00312] Раскрытые способы также относятся к профилактике или сдерживанию отека глаза, или к лечению заболевания или состояния, которое связано с началом отека глаза, путем введения субъекту одного или нескольких из раскрытых соединений формулы I или II и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания).
[00313] Один аспект этого способа относится к лечению или профилактике отека глаза путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или их фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания). Один вариант осуществления этого аспекта относится к способу лечения отека глаза путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00314] Другой раскрытый способ относится к лечению или сдерживанию отека сетчатки или неоваскуляризации сетчатки, или к лечению заболевания или состояния, которое связано с началом отека сетчатки или неоваскуляризации сетчатки, путем введения субъекту одного или нескольких из раскрытых соединений формулы I или II и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания). Один аспект этого способа относится к лечению или профилактике отека сетчатки или неоваскуляризации сетчатки путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или их фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания). Один вариант осуществления этого аспекта относится к способу лечения отека сетчатки или неоваскуляризации сетчатки путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00315] Другой вариант осуществления этого аспекта относится к способу отсрочивания или профилактики развития непролиферативной ретинопатии в пролиферативную ретинопатию путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00316] Один аспект раскрытых способов относится к заболеваниям, которые являются прямым или опосредованным результатом сахарного диабета, в частности, к диабетическому макулярному отеку и диабетической ретинопатии. Сосудистое русло глаза при сахарном диабете становится нестабильным, приводя со временем к таким состояниям, как непролиферативная ретинопатия, макулярный отек и пролиферативная ретинопатия. Поскольку жидкость просачивается в центр макулы, т.е. в ту часть глаза, которая отвечает за острое прямое зрение, наслоения жидкости и ассоциированного белка начинают осаждаться на макуле и под ней. Результатом этого является набухание, что приводит к тому, что центральное зрение субъекта постепенно деформируется. Такое состояние относится к так называемому «макулярному отеку». Другое состояние, которое может возникнуть, представляет собой непролиферативную ретинопатию, при которой вокруг макулярной области глаза могут наблюдаться сосудистые изменения, такие как микроаневризмы. При пролиферативной диабетической ретинопатии, новые патологические кровеносные сосуды растут в сетчатке и из нее внутрь стекловидного тела, где такие аномальные сосуды могут изменить морфологию сетчатки в макуле и/или вызвать кровотечение внутри стекловидного тела и затемнить оптическую ось.
[00317] Дополнительный раскрытый способ относится к лечению, профилактике или сдерживанию диабетической ретинопатии, или к лечению заболевания или состояния, которое связано с началом диабетической ретинопатии, путем введения субъекту одного или нескольких из раскрытых соединений формулы I или II и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания).
[00318] Один аспект раскрытого способа относится к лечению или профилактике диабетической ретинопатии путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или их фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания). Один вариант осуществления этого аспекта относится к способу лечения диабетической ретинопатии путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00319] Диабетическая пролиферативная ретинопатия характеризуется неоваскуляризацией. Новые кровеносные сосуды являются хрупкими и предрасположены к кровотечению. Результатом является рубцевание сетчатки, а также окклюзия или тотальное блокирование распространения света через глаз в связи с аномальным формированием новых кровеносных сосудов. Обычно, субъекты с диабетическим макулярным отеком страдают от непролиферативной стадии ретинопатии; однако, развитие макулярного отека у субъектов не редко начинается лишь в начале пролиферативной стадии.
[00320] Еще один дополнительно раскрытый способ относится к профилактике или сдерживанию диабетического макулярного отека, или к лечению заболевания или состояния, которое связано с началом диабетического макулярного отека, путем введения субъекту одного или нескольких из раскрытых соединений формулы I или II и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания).
[00321] Один аспект этого способа относится к лечению или профилактике диабетического макулярного отека путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислота или никотинамида, или их сочетания), или содержащих их составов. Один вариант осуществления этого аспекта относится к способу лечения диабетического макулярного отека путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и необязательно второго действующего вещества (например, витамина K, никотиновой кислоты или никотинамида, или их сочетания), и/или содержащих их составов, и необязательно b) одного или нескольких носителей или совместимых наполнителей.
[00322] Другой аспект раскрытого способа относится к лечению или профилактике NV и к лечению и/или профилактике повреждений или заболеваний роговицы путем введения субъекту эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, второго действующего вещества, и/или содержащих их составов. Один вариант осуществления этого аспекта относится к способу лечения NV и лечения и/или профилактики повреждений или заболеваний роговицы путем введения субъекту композиции из: а) эффективного количества одного или нескольких из раскрытых соединений формулы I или II, или фармацевтически приемлемых солей, и/или содержащих их составов, b) второго действующего вещества, и необязательно с) одного или нескольких носителей или совместимых наполнителей. Согласно одному варианту осуществления, повреждение или заболевание роговицы обусловлены соединением формулы I или II.
Наборы
[00323] Также раскрыты наборы, включающие в себя раскрытые соединения и композиции, для доставки лекарства человеку, млекопитающему или клетке. Наборы могут содержать одну или несколько упакованных стандартных доз композиции, содержащей одно или несколько соединений формулы I или II, и одну или несколько упакованных стандартных доз второго действующего вещества, которые подлежат доставке человеку, млекопитающему или клетке. Ампулы со стандартными дозами или мультидозные контейнеры, в которые подлежащие доставке соединения формулы I или II или второе действующее вещество упакованы перед использованием, могут включать в себя герметичный контейнер, содержащий количество действующего вещества или фармацевтически приемлемой соли, или содержащий их состав, подходящий для его фармацевтически эффективной дозы или множества эффективных доз. Соединения могут быть упакованы в виде стерильного состава, а герметичный контейнер разработан для сохранения стерильности состава до момента использования.
[00324] Набор согласно настоящей заявке содержит флакон-дозатор глазных капель одноразового использования для доставки офтальмологического состава. Согласно альтернативному варианту осуществления, набор согласно настоящей заявке содержит флакон-дозатор глазных капель многоразового использования. Флакон-дозатор глазных капель многоразового использования содержит подходящее количество противоинфекционного средства и/или консерванта, например, без ограничения 0,005% BAK. Офтальмологический дозатор согласно настоящей заявке имеет насадку и колпачок. Контейнер согласно настоящей заявке имеет полупрозрачный офтальмологический флакон-дозатор из LDPE с насадкой-капельницей из LDPE и колпачком из HDPE. Контейнер может иметь другой тип или форму, требуемые и/или используемые в данной области техники.
[00325] Последующие примеры являются иллюстративными, но не ограничивающими, для способов и композиций согласно настоящей заявке. Другие подходящие модификации и адаптации различных условий и параметров, обычно встречающихся в терапии и очевидных специалистам в данной области техники, подпадают под сущность и объем вариантов осуществления.
Общая методика
Валковая мельница
[00326] Горизонтальная валковая мельница состоит из нескольких приводных валков, размещенных в металлическом корпусе. Отдельные контейнеры, расположенные между валками, будут вращаться при оборотах в минуту, определяемых скоростью валков и диаметром контейнера. В контейнер добавляют взвесь лекарственного средства, состоящую из API и необязательно стабилизаторов, воды и/или измельчающей среды, перед помещением между валками. Используемой средой служат гранулы различных размеров, например, от 800 микрон до 3000 микрон, которые могут быть сделаны из стабилизированного оксидом иттрия циркония. После измельчения дисперсию отделяют от среды путем переноса содержимого на вставку центрифужной пробирки, оснащенную ситом. После центрифугирования, например, при приблизительно 300 x G в течение приблизительно 5 минут, дисперсию собирают под сеткой (под которой осталась среда).
Оптическая микроскопия (OM)
[00327] Морфология и распределение по размерам частиц композиций могут быть оценены оптической микроскопией, а также могут быть получены микрофотографии частиц, например, с использованием системы Olympus BX51, оснащенной масляно-иммерсионным 100x объективом (с 1000-кратным увеличением). На каждой микрофотографии может быть установлена калибровочная шкала (от 1 мкм до 100 мкм) в качестве средства сравнения.
Распределение частиц по размерам (PSD)
[00328] Распределение частиц по размерам может быть проанализировано с использованием дифракционного рассеяния лазерного излучения, например, с Horiba LA-950 V2. Исходя из общих предположений, настраивают условия и значение индекса рефракции. Распределения являются распределениями по объему. Плотность образца доводят до общего диапазона процентного пропускания от источника синего света LED. Небольшая кювета для образца (наполненная водой) может быть использована вместо проточной кюветы для минимизации количества образца.
Вычисление
[00329] Следующее уравнение использовали для определения объема растворителя (метанол:вода=50:50), необходимого для получения образцов сосудистой оболочки, сетчатки и роговицы при определенной концентрации ткани:
ОбъемРастворитель=(МассаТкань/КонцТкань) - ОбъемТкань Уравнение 1,
где КонцТкань=целевая концентрация ткани (мг/мл), МассаТкань=масса ткани (мг), ОбъемРастворитель=объем растворителя (метанол:вода=50:50) (мл), ОбъемТкань=объем ткани (мл), допускающий плотность 1,0 г/мл.
[00330] Для вычисления концентрации в нг/г (нг лекарственного средства/г ткани) использовали следующее уравнение:
Концнг/г=Концнг/мл × (ОбъемОбщий/МассаТкань) Уравнение 2,
где Концнг/г=вычисляемая концентрация (нг лекарственного средства/г ткани), Концнг/мл=вычисляемая концентрация (нг лекарственного средства/мл гомогената), ОбъемОбщий=общий объем гомогената ткани (мл), МассаТкань=масса ткани (г).
[00331] Чтобы затем вычислить концентрацию лекарственного средства в ткани* в мкМ (мкмоль лекарственного средства/объем ткани), использовали следующее уравнение, предполагающее плотность ткани 1 г/мл:
КонцмкМ =Концнг/г/MW Уравнение 3,
где КонцмкМ=вычисленная концентрация (мкмоль лекарственного средства/объем ткани), Концнг/г=вычисленная концентрация (нг лекарственного средства/г ткани), MW=молекулярная масса (г/моль), *ткань=сосудистая оболочка, сетчатка или роговица.
[00332] Для вычисления концентрации лекарственного средства в жидкости** в мкМ (мкмоль лекарственного средства/объем жидкости) использовали следующее уравнение:
КонцмкМ=Концнг/мл/MW Уравнение 4,
где КонцмкМ=вычисленная концентрация (мкмоль лекарственного средства/объем жидкости), Концнг/мл=вычисленная концентрация (нг лекарственного средства/мл жидкости), MW=молекулярная масса (г/моль), **жидкость=плазма.
[00333] Примечание: концентрации любых образцов <LLOQ в организме согласно данному отчету опускали или исключали для вычисления регистрируемых статистических значений (среднее, стандартное отклонение и процентный коэффициент вариации).
Система балльной оценки по Драйзу раздражения глаза для роговицы, радужной оболочки и конъюнктивы
Draize et al. (1944) Methods for the study of irritation and toxicity of substances applied topically to the skin and mucous membranes.
Баллы 0 присваивают каждому параметру, если роговица, радужная оболочка или конъюнктива являются нормальными.
ПРИМЕРЫ
[00334] Соединение I является эффективным и селективным низкомолекулярным ингибитором VEGFR-2, наряду с другими проангиогенными RTK, такими как рецепторы FGF (FGFR-1-3), Tie-2 и эфриновый рецептор B4 (EPHB-4). Показано, что соединение I ингибирует фосфорилирование определенных RTK, пролиферацию эндотелиальных клеток и патологический ангиогенез после системного введения в модели роговицы мышевидных и зоны роста крыс, а также рост опухолевых ксенотрансплантатов человека у бестимусных мышей. Что касается потенциальных офтальмологических показаний, то описываемые ниже примеры согласно настоящей заявке продемонстрировали, что местное офтальмологическое введение соединения I обеспечивает существенное ингибирование патологической неоваскуляризации сетчатки и сосудистой оболочки на клинически соответствующих моделях грызунов. Далее представлено краткое описание этих данных.
[00335] Следующие исследования проводили для измерения эффекта раскрытых соединений на пропотевание жидкости из сосудов и неоваскуляризацию ткани сетчатки.
Пример 1
Первичные фармакодинамические показатели
[00336] Фармакологические исследования эффективности соединения I in vitro. Соединение I эффективно ингибирует тирозинкиназную активность рецептора фактора роста эндотелия сосудов 2 (VEGF-2), а также выбранной подгруппы других проангиогенных RTK, в ходе различных анализов in vitro. В частности, соединение I блокировало VEGF-стимулируемое фосфорилирование VEGFR-2 в цельных клетках вместе с пролиферацией культивируемых эндотелиальных клеток. Соединение I ингибировало активность рекомбинантной тирозинкиназы VEGFR-2 и FGFR-2 с 50% ингибирующей концентрацией (IC50) 10,55 нМ (6 нг/мл) и 8,79 нМ (5 нг/мл), соответственно, а также ингибировало аутофосфорилирование VEGFR-2 в интактных клетках с IC50=5,27 нМ (3 нг/мл). Такое ингибирование было селективным в сравнении со многими другими тирозинкиназами, например, IC50 VEGFR-2 было в приблизительно 500 раз и 1000 раз ниже такового в отношении тирозинкиназ рецептора эпидермального фактора роста (EGFR) и инсулинового рецептора (IR), соответственно (см. таблицу 2).
[00337] При использовании кривой титрования по 10 точкам, которая охватывала от 257 до 5000 нМ (146-2845 нг/мл), соединение I демонстрировало эффективное ингибирование тирозинкиназной активности для нескольких рецепторов проангиогенного фактора роста, о чем свидетельствует IC50<100 нМ (56,89 нг/мл) (см. таблицу 3). IC50 для данной выбранной группы киназ были следующими: рекомбинантный KDR (человеческая изоформа VEGFR-2)=1,27 нМ (0,72 нг/мл), Tie-2=10,10 нМ (5,75 нг/мл), и FGFR 1-3=8,50 нМ (4,84 нг/мл), 3,08 нМ (1,75 нг/мл) и 33,9 нМ (19,29 нг/мл), соответственно. Соединение также блокировало другой высокоаффинный рецептор VEGF VEGFR-1/Flt-1, но с более низкой эффективностью: IC50=122 нМ (69,41 нг/мл).
[00338] Хотя ингибирование VEGFR, по-видимому, важно для снижения сосудистой проницаемости и предупреждения дальнейшего неоваскулярного роста, одновременное ингибирование передачи сигнала VEGF с ингибированием путей передачи сигнала другого фактора роста (например, PDGF и ангиопоэтинов/Tie2) может быть связано с уникальными терапевтическими эффектами. Терапевтические эффекты более широкого ингибирования путей передачи сигнала могут способствовать регрессии вновь образованных патологических сосудов в заднем отделе глаза.
[00339] 300 нМ (170,67 нг/мл) соединения I полностью ингибировали VEGFR-2 киназную функцию (см. таблицу 4) и обеспечивали значительную блокаду подобной группы рецепторов проангиогенного фактора роста, в том числе FGFR-1-3, Tie-2 и EphB-4. Неожиданно обнаружили, что концентрация 300 нМ была способна полностью ингибировать VEGFR-2 киназную функцию. Данная концентрация попадает в типичный диапазон в центральной части сосудистой оболочки и сетчатке спустя 5 суток местного офтальмологического введения у кроликов и собак.
Обзор лекарственного вещества и лекарственного продукта
[00340] Лекарственное вещество: Активный фармацевтический ингредиент (API), гидрохлорид формулы II (соединения I, CP 547,632-01), представляет собой малую молекулу отдельного полиморфа. Вещество API обязательно получают с чистотой, превышающей 99,7%. В токсикологических исследованиях какая-либо примесь в лекарственном веществе ≥0,15% соответствует требованиям, и существующие нормативы для новых неизвестных отдельных примесей допускают не более чем 0,2%. Конечные лекарственное вещество и лекарственный продукт анализируют с использованием стандартных способов.
[00341] Лекарственный продукт: Офтальмологические составы, содержащие соединение I, для клинических исследований приготавливали в дозировках от 0,05% до 1,0% (как соединение I). Дозировки, используемые для партий GLP, составляли 0% (плацебо), 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,6%, 0,8% и 1,0% соединения I. В клиническом испытании офтальмологические составы, содержащие соединение I, (растворы или суспензии) использовали для ежесуточного однократного применения посредством местного введения в глаз. Кроме активного ингредиента лекарственный продукт может дополнительно содержать 0,005% BAK в качестве консерванта, очищенную воду в качестве носителя, и его pH корректируют натрия гидроксидом до pH 6,0.
Пример 2
Гелевые капли на основе натрия фосфата
[00342] Офтальмологические эффекты соединения I в составе на основе натрия фосфата (приведенном в таблице 6) обуславливаются свойствами самостоятельного желатинирования API в буферах, таких как натрия фосфат. Спонтанное образование самостоятельно формирующегося тиксотропного геля соединения I из прозрачного раствора происходило из-за увеличивающейся концентрации API в фосфате натрия. Этот гель сначала выглядел прозрачным, а затем демонстрировал повышенную густоту/вязкость при более высоких концентрациях API, а также становился все более мутным, т.e. непрозрачным. Как только концентрация API в фосфатном буфере достигала перенасыщенного состояния, в геле также наблюдали нерастворимые частицы соединения I.
[00343] Нанесение геля с повышенной вязкостью на поверхность глаза повышало время удержания на роговице. Повышенное время удержания на роговице, в свою очередь, облегчает всасывание глазом лекарственного средства. В результате, внутриглазные концентрации лекарственного средства вязких гелей повышаются по сравнению с невязкими составами, такими как подобные воде растворы. Одним способом повышения вязкости является применение различных усиливающих вязкость вспомогательных средств, например, карбоксиметилцеллюлозы, которая фактически обеспечивает повышенную внутриглазное всасывание различных лекарственных веществ после местного офтальмологического введения. В данном исследовании, однако, тиксотропный гель соединения I неожиданно формировался при отсутствии каких-либо усиливающих вязкость вспомогательных средств. Например, если соединение I растворяли в простом буфере, таком как натрия фосфат, формировался тиксотропный гель. Тиксотропный гель, который формировался без каких-либо усиливающих вязкость вспомогательных средств, определяли как гелевые капли в данном примере.
[00344] Гелевые капли соединения I наносили на глаза голландских кроликов. Гелевые капли соединения I вводили голландским кроликам в течение 4 или 5 последовательных суток с введением дозы три раза в сутки. Концентрации соединения I в целевых тканях измеряли через один час после последней введенной дозы. Доставка соединения I в ткани заднего отдела зависела от дозы и зависела от частоты дозы.
[00345] Составы в виде гелевых капель (приведенные в таблице 6) отличались некоторыми аспектами, такими как концентрация API, концентрация натрия фосфата, присутствие или отсутствие регуляторов тоничности (глицерин) или консервантов (бензалкония хлорида/BAK), растворяющих поверхностно-активных веществ (полисорбата 80, тилоксапола и/или полоксамера) и регуляторов pH.
Пример 3
Суспензия на основе трометамина
[00346] Соединение I (приблизительно от 1 мг/мл приблизительно до 10 мг/мл) в составе на основе трометамина формировало суспензию. Суспензия соединения I в составе на основе трометамина содержала >95% активного лекарственного вещества в нерастворимой форме. Данная характеристика отличается от растворимого или полурастворимого состояния соединения I в гелевых каплях (гелевые капли (гель) не находятся в полностью растворимом состоянии, так как концентрация действующего вещества повышается) или в составе на основе циклодекстрина. Составы соединения I на основе трометамина демонстрировали усиливающуюся непрозрачность по мере повышения концентрации действующего вещества. Предполагали, что введение в глаз суспензии соединения I в виде капель (которая является комбинацией растворимых и нерастворимых компонентов действующего вещества) для местного введения обеспечит уникальные преимущества, относящиеся как к безопасности/переносимости, так и к эффективности.
[00347] Суспензию на основе трометамина соединения I вводили голландским кроликам в течение 4 или 5 последовательных суток с введением дозы три раза в сутки. Концентрации соединения I в ткани глаза и плазме измеряли через один час после последней введенной дозы. Соединение I в суспензии на основе трометамина обеспечивало концентрации в целевых тканях, от 10 до 1000 раз превышающие его клеточную IC50 в отношении различных проангиогенных RTK. См. таблицу 7.
[00348] Безопасность роговицы и переносимость ею соединения I при местном применении являлась прямым следствием количества растворимого (в отличие от нерастворимого) действующего вещества, наносимого на поверхность роговицы, и получающиеся в результате концентрации в ткани роговицы. Животные, которые получали местное офтальмологическое введение суспензии на основе трометамина, были способны переносить более высокий уровень концентрации действующего вещества в составе по сравнению с эквимолярными составами в виде гелевых капель на основе натрия фосфата. Результаты, полученные как от голландских кроликов, так и от собак породы бигль, свидетельствовали о том, что глазные побочные эффекты, такие как дискомфорт и воспаление, а в некоторых случаях истончение роговицы, чаще наблюдались при превышении концентрации соединения I в роговице 100 мкМ.
[00349] Введение суспензии на основе трометамина оказывало неожиданный эффект на биодоступность соединения I в заднем отделе глаза. Наблюдали, что биодоступность соединения I в заднем отделе глаза была прямо пропорциональна общему количеству вводимого лекарственного средства (нерастворимого плюс растворимого, см. таблицу 7). Хотя частицы нерастворимого лекарственного средства не являлись легкодоступными для тканей переднего отдела, присущие и уникальные физико-химические свойства соединения I позволили как нерастворимым, так и растворимым компонентам проникнуть в ткани заднего отдела, такие как сосудистая оболочка и сетчатка. Следовательно, с суспензией на основе трометамина достигались даже более высокие концентрации лекарственного средства, чем те, которые достигаются с составами в виде гелевых капель, содержащими эквивалентные количества действующего вещества. Таким образом, суспензия на основе трометамина обеспечивала a) улучшенную переносимость роговицей и b) повышенную биодоступность в заднем отделе, особенно в сосудистой оболочке, основной целевой ткани для лечения неоваскулярной (влажной) AMD.
Пример 4
Раствор на основе циклодекстрина
[00350] Циклодекстрины, которые являются циклическими олигосахаридами, состоящими из 6-8 остатков декстрозы (α-, β- и γ-CD), соединенных посредством 1-4 связей, хорошо известны своей способностью действовать в качестве солюбилизатора относительно нерастворимых лекарственных средств (См. Stella & He, Cyclodextrins, Toxicol. Pathol., 36: 30-42 (2008)).
[00351] Клинический состав соединения I или офтальмологический раствор его свободного основания в 2-гидроксипропил-β-циклодекстрине (HP-β-CD, KLEPTOSE® HPB) в молярном соотношении не менее 1:6, или в сульфобутилэфир-β-циклодекстрине (SBE-β-CD, CAPTISOL®) в соотношении не менее 1:2, обеспечивал растворимость с клиническими дозировками 0,1-1,0% соединения I.
[00352] Растворы соединения I или его свободного основания на основе циклодекстрина не только улучшали растворимость действующего вещества в однородном растворе, но при местном офтальмологическом введении также обладали новым и не наблюдавшимся ранее свойством существенно повышать терапевтический индекса действующего вещества в заднем отделе глаза. Раствор снижал воздействие на передний отдел, обеспечивая тем самым повышенную концентрацию действующего вещества в растворе и повышенную частоту доставки, что поддерживало высокие концентрации в заднем отделе. Обе этих полезных характеристики связаны с известным свойством циклодекстрина формировать гидрофильные комплексы с гидрофобными лекарственными средствами. См. Stella & He, Cyclodextrins, Toxicol. Pathol., 36: 30-42 (2008). При получении состава с соединением I или его свободным основанием циклодекстрин образовывал прозрачный, бесцветный раствор и обладал подобной воде вязкостью. После местного офтальмологического введения комплекс соединения I/циклодекстрина являлся фармакологически неактивным и метаболически инертным. Комплекс соединения I/циклодекстрина обеспечивал переносимость роговицей до тех пор, пока циклодекстрин спонтанно не диссоциировал от действующего вещества, обеспечивая тем самым доступность высокой концентрации соединения I в предназначенном ему участке действия в заднем отделе глаза, например, в сосудистой оболочке и сетчатке.
[00353] В ходе исследований местного офтальмологического введения голландским кроликам от 1 до 30 суток, растворы соединения I на основе циклодекстрина демонстрировали сильно пониженные воздействия на роговицу по сравнению с составами в виде гелевых капель (см. пример 2) при подобных концентрациях лекарственного средства. Применение растворов соединения I на основе циклодекстрина обеспечивало приблизительно 10-кратное снижение концентраций в роговице по сравнению с введением эквимолярных составов в виде гелевых капель. Следовательно, после 30 суток местного офтальмологического введения 0,6% соединения I в виде раствора на основе циклодекстрина не отмечали никаких неблагоприятных результатов, связанных с тестируемым препаратом или носителем. Раствор соединения I на основе циклодекстрина также достигал равные или существенно более высокие концентрации лекарственного средства в целевых тканях заднего отдела, таких как центральная часть сосудистой оболочки и центральная часть сетчатки. Комбинированные эффекты снижения воздействия лекарственного средства на роговицу для того, чтобы избежать плохой переносимости глазом, с повышением в то же время биодоступности в заднем отделе для того, чтобы усилить ингибирование RTK, может значительно повысить терапевтический индекс и соответствующую пользу, испытываемую больными.
[00354] Как для суспензионных составов (см. пример 3), так и для циклодекстриновых составов терапевтическое окно расширялось за счет существенно сниженного воздействия (снижения в 10-100 раз или на 1-2 порядка). Пониженное воздействие улучшает безопасность/переносимость роговицы, что обеспечивает местное введение более высоких концентраций или введения с большей частотой дозы соединения I. Более высокие концентрации обеспечивают достижение лекарственным средством более высоких концентраций в задней части целевых тканей глаза, что усиливает терапевтическую эффективность соединения I.
[00355] Данное исследование продемонстрировало, что у кроликов и собак местное офтальмологическое введение дозы глазных гелевых капель ассоциировалось с высоким воздействием на ткань роговицы (≥ 100 нМ) и соответствующими неблагоприятными результатами в переднем отделе, такими как дискомфорт, воспаление роговицы и конъюнктивы, эрозия эпителия и/или истончение и дегенерация роговицы. Напротив, повторное местное офтальмологическое введение дозы офтальмологического раствора соединения I обеспечивало воздействие на роговицу, которое было приблизительно в 5-10 раз ниже, чем при эквимолярной дозе глазных гелевых капель, а неблагоприятные клинические или гистопатологические результаты отсутствовали. Более того, местное офтальмологическое введение дозы офтальмологического раствора соединения I достигало равного или более высокого целевого терапевтического воздействия в центральной части сосудистой оболочки по сравнению с эквимолярной дозой офтальмологической гелевой капли. В целом, комбинация пониженного воздействия на роговицу и соответствующей улучшенной переносимости глазом при одновременном поддерживании или обеспечении доставки лекарственного средства в целевые ткани заднего отдела наряду с улучшенной физико-химической стабильностью обеспечит более высокую пользу для больных по сравнению с офтальмологическим составом в виде гелевых капель.
Пример 5
Результаты фармакокинетического исследования местного офтальмологического применения растворов соединения I на основе циклодекстрина в течение 1-5 суток
[00356] После местного офтальмологического введения дозы различных составов и режимов дозирования соединения I у голландских кроликов исследовали офтальмологические фармакокинетические показатели. Девять (9) различных офтальмологических составов для местного введения с тремя дозами соединения I вводили либо один раз в сутки (1 р/сут), либо два раза в сутки (2 р/сут) в течение 1, 4 или 5 последовательных суток. План исследования (см. таблицы 10A-B) предусматривал семьдесят два (72) кролика, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу одного из трех (3) составов соединения I или состав носителя с использованием пипетки прямого вытеснения.
[00357] Композиция каждого состава соединения I описывается в таблице 8A. Все дозы вводили в запланированное время введения±1 час. В день 1 группы 1, 2, 4-6, 8, 10, 11, 13, 15 и 17 получали одну дозу (1 р/сут) в течение либо одних (1), либо четырех (4) суток. В дни 1-4 группы 3, 7, 9, 12, 14 и 16 получали введение дозы 2 р/сут с интервалом приблизительно 8 часов в 07:00 и 15:00 в течение четырех (4) суток. Животные в группах 18 и 19 получали 2 р/сут введение дозы составов только с носителем в течение пяти (5) последовательных суток.
[00358] Отбор образцов из глаза осуществляли для группы 1 через 0,5, 1, 2, 4, 8 или 24 часа после введения дозы относительно дня 1 введения дозы. Отбор образцов из глаза осуществляли для групп 2 и 6 через 1, 8 и 24 часа после введения дозы относительно утреннего введения дозы на 5 сутки. Отбор образцов из глаза для групп 3, 7, 8, 11 и 13 осуществляли через 1 и 24 часа после введения дозы относительно утреннего введения дозы на 5 сутки. Отбор образцов из глаза для групп 4, 9, 10, 12, 14, 15, 16 и 17 осуществляли через 1 час после введения дозы относительно утреннего введения дозы на 5 сутки. Отбор образцов из глаза в группе 5 осуществляли через 0,5, 1, 2, 4, 8 и 24 часа после введения дозы относительно введения дозы на 1 сутки. Животных в группах 18 и 19 подвергали только клиническим наблюдениям в течение пяти (5) суток.
[00359] Отбирали образцы внутриглазной жидкости, роговицы, центральной части и периферической части сетчатки, а также центральной части и периферической части сосудистой оболочки. Образцы внутриглазной жидкости, роговицы, центральной части сетчатки и центральной части сосудистой оболочки затем анализировали. Образцы периферической части сетчатки и периферической части сосудистой оболочки анализировали только для групп 1-8, 12, 14 и 16 согласно протоколу исследования.
[00360] Анализировали образцы внутриглазной жидкости, роговицы, центральной части и периферической части сетчатки, а также центральной части и периферической части сосудистой оболочки кролика. Для определения концентрации соединения I в различных тканях строили калибровочные кривые в контрольной матрице.
Пример 6
Результаты фармакокинетического исследования местного офтальмологического применения растворов соединения I на основе циклодекстрина в течение 5 суток
[00361] После местного офтальмологического введения голландским кроликам с использованием различных схем введения офтальмологических растворов соединения I для местного введения, содержащих гидроксипропил-β-циклодекстрин (HDβCD), вычисляли офтальмологические фармакокинетические показатели. Девять (9) различных офтальмологических растворов для местного введения с четырьмя различными дозами соединения I вводили либо один раз в сутки (1 р/сут), либо два раза в сутки (2 р/сут) в течение либо 4, либо 5 последовательный суток. План исследования предусматривал сорок (40) кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу одного из четырех (4) дозировок соединения I с использованием пипетки прямого вытеснения.
[00362] Все дозы вводили в запланированное время введения±1 час, за исключением дня 1 для групп 1, 4 и 10. Первую дозу на 1 сутки вводили в 12:00, а вторую дозу (для групп 1 и 10) вводили через приблизительно 4 часа. Это было связано с отсрочиванием доставки составов. Все остальное введение дозы для этих групп соответствовало плану. В день 1 группы 4-8 и 11-12 получали одну дозу (1 р/сут) в течение четырех (4) суток. В дни 1-4 группы 1-3 и 9-10 получали 2 р/сут введение дозы спустя приблизительно 8 часов в течение четырех (4) суток.
[00363] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп за исключением групп 5b и 6b, для которых отбор образцов из глаза осуществляли через 24 часа после первой суточной дозы на 4 сутки.
[00364] Образцы крови для сбора плазмы получали непосредственно перед запланированной эвтаназией для всех животных. Собирали образцы внутриглазной жидкости, роговицы, центральной части и периферической части сетчатки, а также центральной части и периферической части сосудистой оболочки. Анализировали образцы роговицы, центральной части сетчатки и центральной части сосудистой оболочки для групп 1-12. Образцы внутриглазной жидкости, периферической части сетчатки и периферической части сосудистой оболочки не анализировали.
Пример 7
Концентрации соединения I (в мкМ) в различных жидкостях и тканях глаза
[00365] Офтальмологический раствор соединения I, содержащий циклодекстрин, получали и тестировали на различных группах животных. После местного офтальмологического введения раствора 0,4% (4 мг/мл) соединения I и циклодекстрина измеряли концентрацию действующего вещества в различных тканях и жидкостях глаза. Среднюю концентрацию соединения I измеряли в центральной части сосудистой оболочки, центральной части сетчатки, внутриглазной жидкости и роговице. Соединение I находилось в растворе (0,4% или 4 мг/мл) с 8,41% KLEPTOSE® и 0,142% фосфатного буфера; 8,9% KLEPTOSE® HPB и 0,142% фосфата; 4,88% CAPTISOL® и 0,142% фосфата или 4,88% CAPTISOL® и 0,122% фосфата. См. таблицу 10A-B.
[00366] Концентрация соединения I в центральной части сосудистой оболочки составляла от 0,259 мкМ до 0,769 мкМ. См. таблицу 10A. Концентрация соединения I в центральной части сетчатки составляла от 0,0531 мкМ до 0,124 мкМ. См. таблицу 10A. Концентрация соединения I во внутриглазной жидкости составляла от 0,00313 мкМ до 0,00656 мкМ. См. таблицу 10A. И концентрация соединения I в роговице составляла от 6,49 мкМ до 30 мкМ. См. таблицу 10A. Для получения растворов использовали циклодекстрины KLEPTOSE® HPB или CAPTISOL®. См. таблицу 10B.
Пример 8
Офтальмологические токсикологические исследования
[00367] Дозолимитирующая токсичность в отношении глаз характеризовалась изменениями роговицы и конъюнктивы у голландских кроликов и собак породы бигль. Эти офтальмологические изменения при токсикологических исследованиях с повторным введением дозы глазных гелевых капель с соединением I основывались на клинических офтальмологических и гистопатологических оценках и ограничивались гиперемией конъюнктивы, хемозом, застоем и выделением крови, помутнение роговицы и эпителиальной эрозией, а также кератоконъюнктивитом. Не наблюдали никаких неблагоприятных изменений, затрагивающих более глубокие структуры глаза (радужную оболочку, хрусталики, цилиарное тело, сетчатку, сосудистую оболочку, склеру) или зрительный нерв. Ретинальная функция была нормальной во всех обрабатываемых тестируемым препаратом и носителем группах при выполнении полноформатных электроретинограмм у кроликов.
[00368] Цели поисковых офтальмологических токсикологических исследований заключались в идентификации a) офтальмологического состава для местного введения, который хорошо переносится, и b) состава, который мог бы достигать целевых терапевтических концентраций соединения I в центральной части сосудистой оболочки.
[00369] Средние концентрации соединения I в тканях глаза голландских кроликов после местного введения дважды в сутки составов в виде глазных гелевых капель с 0,3% соединения I с бензалкония хлоридом и без такового были самыми высокими в роговице (236-260 мкМ), намного превышая таковые в периферической части сосудистой оболочки (2,79-4,10 мкМ), центральной части сосудистой оболочки (0,340-0,496 мкМ), периферической части сетчатки (0,150-0,309 мкМ) и внутриглазной жидкости (0,0197-0,0395 мкМ).
[00370] Суспензионные составы на основе Трис хорошо переносились, при этом при клинических офтальмологических обследованиях выявляли незначительные изменения роговицы только лишь с немногими единичными случаями умеренного конъюнктивита у голландских кроликов. Более того, глаза животных, которые получили 0,3% (масс./об.) суспензию соединения I на основе Трис два раза в сутки в течение 30 суток считали нормальными при микроскопических оценках. Средние концентрации соединения I в тканях глаза, оцениваемые через 1 час±15 минут после первой суточной местной офтальмологической дозы на 30 сутки для местного введения дозы два раза в сутки с 0,3% суспензиями соединения I на основе Трис с бензалкония хлоридом и без такового, были самыми высокими в роговице (2,69-3,10 мкМ) намного превышая таковые в периферической части сосудистой оболочки (0,781-1,21 мкМ), центральной части сосудистой оболочки (0,303-0,319 мкМ), периферической части сетчатки (0,0819-0,0868 мкМ), центральной части сетчатки (0,0495-0,0592 мкМ) и внутриглазной жидкости (0,00127-0,00145 мкМ).
[00371] Растворы на основе циклодекстрина с использованием гидроксипропил-β-циклодекстрина (HP-β-CD, KLEPTOSE® HPB) хорошо переносились при местном введении голландским кроликам в течение 30 суток два раза в сутки 0,1% соединения I (2,1% HP-β-CD), два раза в сутки при 0,2% соединения I (4,21% HP-β-CD), один или два раза в сутки при 0,4% соединения I (8,41% HP-β-CD) и один или два раза в сутки при 0,6% соединения I (до 12,62% HP-β-CD). Более того, в подобном исследовании с повторным введением дозы растворы 0,4% (масс./об.) соединения I на основе циклодекстрина в Kleptose® HPB, Kleptose® HP или Captisol® хорошо переносились при введении дозы два раза в сутки в течение 24 суток. Не обнаруживали явной токсичности для глаз, связанной с обработкой соединением I или носителем, в ходе клинических офтальмологических или микроскопических осмотров в каждом исследовании.
[00372] В 24-суточном исследовании концентрации в тканях глаза из глаз, обработанных растворами соединения I на основе циклодекстрина, оцениваемые через 1 час±15 минут после первой суточной местной офтальмологической дозы на 24 сутки, представлены в порядке убывания: самая высокая в роговице (6,49-30 мкМ) >> в извлеченной перфоратором центральной части сосудистой оболочки (0,212-0,769 мкМ) > в извлеченной перфоратором центральной части сетчатки (0,0531-0,124) > во внутриглазной жидкости (0,002-0,007).
[00373] Вкратце, наблюдали дозолимитирующую токсичность в отношении роговицы с офтальмологическими составами Гелевые капли соединения I. Глазные гелевые капли обеспечивали концентрации соединения I в роговице, в 5-15 раз превышающие таковые с раствором на основе циклодекстрина, и концентрации соединения I в роговице в 50-100 раз превышающие таковые с суспензиями на основе Трис. Суспензии на основе Трис и растворы соединения I на основе циклодекстрина хорошо переносились без признака явной токсичности для глаз. Уровни дозы, которые были хорошо переносимыми, для растворов соединения I на основе циклодекстрина или суспензий на основе Трис при введении один или два раза в сутки варьировали приблизительно от 0,005% приблизительно до 5,0% (масс./об.) в течение по меньшей мере 30 суток. Растворы на основе циклодекстрина также обеспечивали самые высокие концентрации соединения I в центральной части сосудистой оболочки при использовании эквимолярных доз трех составов и соответствовали целевым терапевтическим концентрациям или превышали таковые.
Пример 9
Протокол I фазы исследования с повышением дозы у больных с неоваскулярной AMD
[00374] Исследование I фазы представляет собой 12-недельное открытое мультицентровое исследование с повышением дозы, разработанное для оценки безопасности, переносимости и фармакокинетических показателей после местного офтальмологического введения соединения I у больных с неоваскулярной возрастной макулярной дегенерацией (AMD). Всего до 60 больных обрабатывали один - два раза в сутки местным офтальмологическим введением дозы офтальмологического раствора соединения I в течение трех месяцев, при этом предусматривали три группы, получающие монотерапию с повышением дозы, и одну группу, получающую вспомогательную терапию с использованием одной интравитреальной инъекции Lucentis® с максимально переносимой монотерапией (15 больных на получающую терапию группу). Больным, которые отвечали предварительно определенным критериям поражения зрения и CNV, что подтверждено независимым центром интерпретации данных, позволили одновременно прекратить местное офтальмологическое введение дозы и получать лечение согласно стандарту оказания медицинской помощи.
[00375] Офтальмологический раствор соединения I для клинических исследований приготавливали, по меньшей мере, в 3 дозировках, варьирующих от 0,1% до 1,0% (как соединение I). Дозировки для GLP партий составляли 0% (плацебо), 0,1%, 0,3%, 0,6% и 1,0% соединения I HCl. Получившим пользу когортам вводили постепенно увеличивающиеся до 2-3 раз дозы (единичные скачки приблизительно на полпорядка).
Пример 10
[00376] Местный состав «негелевого», «невязкого» гомогенного офтальмологического раствора, который является как физически, так и химически стабильным при дозировках лекарственного средства 0,1-1,0% (1-10 мг/мл), получали путем измерения концентрации соединения I, концентрации циклодекстринового комплексообразующего средства, pH и тоничности, относительно растворимости и стабильности соединения I. Подходящая буферная система предотвращает смещение pH в сторону стабильности при концентрациях менее 1 мг/мл. В качестве буферных средств оценивали как фосфат, так и трометамол (Трис). Для регулирования тоничности использовали натрия хлорид.
[00377] Показатели качества продукта представлены в таблице 14.
Таблица 14: Показатели качества продукта
Получение состава
[00378] Составы, представленные в таблицах 12 и 13, получали с использованием описанной общей методике.
[00379] Состав доводили до нужного объема водой для инъекции и взбалтывали в течение 30 минут при 500 оборотах в минуту. Конечное значение pH проверяли и корректировали с помощью либо NaOH, либо HCl до целевого диапазона. Приблизительно 5-мл аликвоты непосредственно фильтровали в полупрозрачные 5-мл бутылки из LDPE при постоянном взбалтывании с постоянной скоростью с помощью трубки Watson Marlow Pumpsil D, соединенной с наполнителем Flexicon и присоединенной к 0,2-микронному капсульному фильтру из PVDF. Образцы хранили при 2-8°C до завершения получения всех образцов. Затем все образцы предоставляли для анализа на предмет хранения и для тестирования.
Пример 11
Анализ фосфорилирования тирозина EGFR в эпителиальных клетках роговицы (клетках hTCEpi) с целью определения активности соединений формулы I или II в отношении EGFR
[00380] Проводили анализ тирозина EGFR в эпителиальных клетках роговицы с целью определения того, могут ли более высокие концентрации EGF преодолевать ингибирование киназной активности EGFR соединением формулы I или II.
[00381] Клетки hTCEpi в 35-мм чашках инкубировали без сыворотки, а затем предварительно обрабатывали различными концентрациями соединения формулы I или II, например, соединения I, или контроля AG1478 (ингибитора EGFR-киназы), в течение 30 минут с последующей обработкой EGF (10, 50, 100 нг/мл) в течение 15 минут. Шесть концентраций соединения формулы I или II, например, 0, 1 мкМ, 3 мкМ, 10 мкМ, 30 мкМ, 100 мкМ, или 1 мкМ AG1478 в качестве контроля использовали для каждой концентрации EGF (10, 50, 100 нг/мл). Дополнительными контролями опыта служило отсутствие соединения формулы I или II или отсутствие EGF. Все эксперименты повторяли три раза. Затем клетки собирали и подвергали иммуноблоттингу для определения фосфорилированного EGFR (по тирозину 1068 и тирозину 1045) и общего EGFR.
[00382] Фосфорилированный EGFR служил показателем рецепторной активности. Как показано на фиг. 1, высокие концентрации соединения формулы I или II были способны ингибировать стимулируемое лигандом фосфорилирование тирозина EGFR, а повышающиеся концентрации соединения формулы I или II снижали фосфорилирование тирозина EGFR в обоих сайтах. Повышающиеся концентрации EGF преодолевают ингибирование EGFR и неблагоприятные для роговицы факторы из-за соединения формулы I или II (фиг. 1). EGFR-специфический ингибитор AG1478 характеризуется IC50=3 нМ, и при 1 мкМ AG1478 полностью блокировал фосфорилирование EGFR. По имеющимся оценкам, 100 мкМ соединения формулы I или II ингибирует фосфорилирование EGFR на ~ 75-80%.
Пример 12
Анализ фосфорилирования тирозина EGFR в эпителиальных клетках роговицы (клетках hTCEpi) с соединениями формулы I или II и вторым активным средством
[00383] Выполняли анализ тирозина EGFR в эпителиальных клетках роговицы с целью определения того, могут ли витамин K, никотиновая кислота или никотинамид препятствовать соединениям формулы I или II ингибировать EGFR, а также повышается ли активность EGFR.
[00384] Клетки hTCEpi в 35-мм чашках инкубировали без сыворотки, а затем предварительно обрабатывали витамином K (50 мкМ), никотиновой кислотой (10 мкМ) или никотинамидом (10 мкМ) в течение 4 часов, с последующей обработкой различными концентрациями соединения формулы I или II, например, соединения I, в течение 30 минут. Затем клетки инкубировали с EGF (50 нг/мл) в течение 15 минут. Клетки собирали, и подвергали клеточные лизаты иммуноблоттингу для определения концентрации фосфорилированного EGFR (по тирозину 1068 и тирозину 1045) и общего EGFR. Как показано на фиг. 2, витамин K, никотиновая кислота или никотинамид преодолевали опосредованные соединением формулы I или II неблагоприятные факторы для роговицы (ингибирование EGFR). Кроме того, на фиг. 2 показано, что витамин K3 (менадион) наиболее эффективно ослабляет опосредованное соединением формулы I или II ингибирование фосфорилирования тирозина EGFR.
Пример 13
Определение миграции/пролиферации клеток (заживления ран in vitro) в эпителиальных клетках роговицы (клетках hTCEpi): эффекты соединений формулы I или II и EGF
[00385] Определение миграции/пролиферации клеток в эпителиальных клетках роговицы выполняли для определения миграции/пролиферации клеток в присутствии варьирующих концентраций соединения формулы I или II и EGF.
[00386] Клетки hTCEpi высевали с силиконовыми пробками. Затем клетки лишали сыворотки и предварительно обрабатывали различными концентрациями соединения формулы I или II или контрольным соединением AG1478 в течение 30 минут. Затем силиконовые пробки удаляли для создания бесклеточной зоны. Клетки фотографировали, а затем обрабатывали EGF (10, 50 или 100 нг/мл) или VEGF (10 нг/мл) вместе с соединением формулы I или II или AG1478 в течение 16 часов. Клетки снова фотографировали и по микрофотографиям количественно характеризовали миграцию клеток. Все эксперименты повторяли три раза.
[00387] Четыре концентрации соединения формулы I или II (0, 3 мкМ, 10 мкМ, 30 мкМ) или 3,2 мкМ AG1478 (ингибитора EGFR-киназы) использовали для каждой концентрации EGF или VEGF. Дополнительными контролями опыта служило отсутствие соединения формулы I или II или отсутствие EGF.
[00388] Данные позволяют определение того, препятствует ли соединение формулы I или II критериям заживления раны эпителия роговицы (миграции и пролиферации клеток) in vitro, а также преодолевают ли более высокие уровни EGF ингибирование рецепторной тирозинкиназы. Как показано на фиг. 3A и 3B, соединение формулы I или II вызывало зависимое от дозы ингибирование опосредованного EGFR «заживления ран» in vitro в клетках hTCEpi.
Пример 14
Определение миграции/пролиферации клеток (заживления ран in vitro) в эпителиальных клетках роговицы (клетках hTCEpi): эффекты соединений формулы I или II и второго действующего вещества
[00389] Определение миграции/пролиферации клеток в эпителиальных клетках роговицы выполняли для определения миграции/пролиферации клеток в присутствии варьирующих концентраций соединения формулы I или II отдельно или вместе с витамином K, никотиновой кислотой или никотинамидом.
[00390] Клетки hTCEpi высевали с силиконовыми пробками. Затем клетки лишали сыворотки и предварительно обрабатывали различными концентрациями аналога витамина K3 менадиона в течение 4 часов, и дополняли различными концентрациями соединения формулы I или II в течение 30 минут. Пробки удаляли. Клетки фотографировали, а затем обрабатывали различными концентрациями витамина K, EGF и/или соединения формулы I или II. Клетки снова фотографировали и по микрофотографиям количественно характеризовали миграцию клеток. Дополнительными контролями опыта служило отсутствие соединения формулы I или II или отсутствие EGF. Все эксперименты повторяли три раза.
[00391] Как показано на фиг. 4A и 4B, ингибиторные эффекты соединения формулы I или II на заживление ран in vitro могут быть обращены путем добавления 0,3 мкМ менадиона. Наблюдали статистически значимое различие в заживлении ран in vitro при объединении 0,3 мкМ соединения формулы I или II с 0,3 мкМ менадиона по сравнению с 0,3 мкМ соединения формулы I или II отдельно.
Пример 15
Определение фонового и опосредованного EGF заживления ран роговицы in vivo: эффекты соединений формулы I или II
[00392] Определение эффектов соединения формулы I или II на фоновые и стимулированные лигандом скорости заживления ран роговицы выполняли у мышей C57/Bl.
[00393] Роговицы мышей C57/Bl в возрасте 8 недель повреждали (1,5-мм поверхностной раной эпителия), а затем предварительно обрабатывали соединением формулы I или II (0, 1,0 мкМ, 10 мкМ, 30 мкМ или 50 мкМ) с последующим добавлением EGF (0, 10, 100 нг/мл). В качестве контроля использовали AG1478 (ингибитор EGFR-киназы) в отсутствие и в присутствии 100 нг/мл EGF. Размер ран отслеживали с помощью окрашивания флуоресцеином и флуоресцентной фотографии на протяжении 40 часов. Затягивание ран количественно характеризовали с использованием программного обеспечения Image J.
[00394] Как показано на фиг. 5A, 5B, 5C, и 5D, заживление раны эпителия роговицы in vivo снижалось в зависимости от дозы в присутствии соединения формулы I или II. Максимальное ингибирование заживления ран наблюдали с концентрациями соединения формулы I или II, которые в пять раз превышали таковые для AG1478. Предварительная обработка соединением формулы I или II в течение 48 часов перед нанесением раны роговицы ингибировала заживление раны эпителия роговицы при более низкой концентрации соединения формулы I или II по сравнению с отсутствием предварительной обработки.
Пример 16
Определение фонового и опосредованного EGF заживления ран роговицы in vivo: эффекты соединения формулы I или II и второго действующего вещества
[00395] Определение эффектов соединения формулы I или II и/или второго действующего вещества на заживление ран роговицы выполняли у мышей C57/Bl.
[00396] Роговицы мышей C57/Bl в возрасте 8 недель предварительно обрабатывали путем местного введения носителя, 0,3 мкМ менадиона, 10 мкМ соединения формулы I или II, 0,3 мкМ менадиона и 10 мкМ соединения формулы I или II за 48 часов перед повреждением роговиц (1,5-мм поверхностной раной эпителия). Размер ран отслеживали с помощью окрашивания флуоресцеином и флуоресцентной фотографии. Затягивание ран контролировали на протяжении 40 часов.
[00397] Как показано на фиг. 6A, 6B, и 6C, менадион (0,3 мкМ) обращал эффекты предварительной обработки соединением формулы I или II (10 мкМ) на заживление раны эпителия роговицы.
Пример 17
Эффект менадиона на ингибирование VEGFR соединениями формулы I или II
[00398] Эндотелиальные клетки сетчатки человека обрабатывали 0, 0,3, или 3 мкМ менадиона в течение 4 часов с последующей 30-минутной обработкой различными концентрациями соединения формулы I или II (1 нМ, 10 нМ, 100 нМ или 1 мкМ) в менадионе. Затем клетки стимулировали с помощью 0,5 нМ (10 нг/мл) VEGF. Клетки лизировали. Лизаты растворяли с помощью 7,5% SDS-PAGE, переносили на нитроцеллюлозу и подвергали иммуноблоттингу на предмет фосфорилированного VEGFR2, общего VEGFR2 или α-тубулина в качестве контроля нагрузки. Как показано на фиг. 7A, менадион не изменял IC50 ингибирования фосфорилирования VEGFR2, опосредованного соединением формулы I или II.
Пример 18
Эффект менадиона на пролиферацию первичных клеток микрососудистого эндотелия сетчатки человека
[00399] Эндотелиальные клетки сетчатки человека предварительно обрабатывали менадионом в течение 4 часов, затем указанной концентрацией соединения формулы I или II в течение 30 минут и дополняли 0,5 нМ (10 нг/мл) VEGF в течение ночи. Жизнеспособные клетки количественно определяли с помощью Alamar Blue Assay (Thermo Fisher). Данные наносили на график как кратность роста относительно клеток, обработанных без VEGF или соединения формулы I или II, и представляли как среднее±S.E.M. на фиг. 7B. Как показано на фиг. 7B, менадион не изменял IC50 опосредованного соединением формулы I или II ингибирования опосредованной VEGF пролиферации эндотелиальных клеток сетчатки.
Пример 19
Определение механизма, с помощью которого менадион усиливает активность EGFR
[00400] Клетки hTCEpi предварительно обрабатывали менадионом (0, 0,3 или 3,0 мкМ) в течение 4 часов. Затем клетки инкубировали с 8,0 нМ (50 нг/мл) EGF в течение 0-3 часов. Клетки лизировали, лизаты растворяли с помощью SDS-PAGE и подвергали иммуноблоттингу на предмет фосфорилированного EGFR (pY1068), общего EGFR или α-тубулина. Как показано на фиг. 8, обработка менадионом не изменяла фоновое фосфорилирование EGFR или замедляла дефосфорилирование EGFR. Менадион (0,3 мМ) замедлял кинетические показатели разложения EGFR, что указывает на то, что менадион может поддерживать передачу сигнала рецептора EGFR путем замедления кинетических показателей разложения рецептора или повышения скорости синтеза новых рецепторов.
Пример 20-1
Офтальмологические фармакокинетические показатели при применении составов у голландских кроликов
[00401] Не предусматривающее применение требований GLP исследование выполняли для оценки офтальмологических фармакокинетических показателей первого действующего вещества согласно настоящей заявке (например, соединения формулы I или II) в суспензии или растворе при введении один или два раза в сутки в виде местного закапывания в оба глаза голландским кроликам в течение четырех суток. План исследования (таблица 15-1) предусматривал сорок пять (45) голландских кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу. Введение выполняли согласно режиму введения дозы в таблице 15-1.
Таблица 15-1: План исследования
Офтальмологический раствор
Офтальмологический раствор
Офтальмологический раствор
Офтальмологический раствор
Офтальмологический раствор
Офтальмологический раствор
Офтальмологический раствор
QD - один раз в сутки. BID - два раза в сутки.
[00402] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп. Собирали образцы цельной крови с использованием K2EDTA в качестве антикоагулянта у всех животных на 5 сутки через 1 час после введения дозы. Цельную кровь помещали на лед до центрифугирования образцов в центрифуге для отделения плазмы. Образцы внутриглазной жидкости, конъюнктивы, роговицы, центральной части сетчатки, периферической части сетчатки, центральной части сосудистой оболочки и периферической части сосудистой оболочки собирали после некропсии. Затем образцы замораживали при -70°C или ниже. Анализировали образцы плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы всех групп 1-15.
[00403] Для всех получающих дозу групп концентрации соединения формулы I или II в тканях глаза, оцениваемые на 5 сутки, представлены в порядке убывания: самая высокая в роговице >> в центральной части сосудистой оболочки > в центральной части сетчатки (таблица 15-2). Самые высокие концентрации соединения формулы I или II в роговице наблюдали в группе 10. Самые низкие концентрации соединения формулы I или II в роговице наблюдали в группе 8. В целом, более высокие концентрации в центральной части сетчатки и центральной части сосудистой оболочки ассоциировались с более высокими концентрациями соединения формулы I или II в роговице. Не наблюдали никакого преимущества других составов над офтальмологическими растворами соединения формулы I или II в отношении снижения концентраций в роговице или повышения концентраций соединения формулы I или II в центральной части сетчатки или центральной части сосудистой оболочки.
Таблица 15-2
LLOQ в плазме=0,00188 мкМ.
LLOQ в центральной части сетчатки=0,00751 мкМ.
LLOQ в центральной части сосудистой оболочки=0,0563 мкМ.
LLOQ в роговице=0,0376 мкМ.
[00404] Макроскопические обследования глаза с использованием шкалы Драйза для оценки раздражения глаз выполняли у всех животных до первого ведения дозы каждые сутки на протяжении исследования. Все составы были хорошо переносимыми. Кроме того, животных обследовали на предмет общего состояния здоровья перед исследованием, в ходе введения дозы и при некропсии. Все животные, предназначенные для исследования, были нормальными. Оценивания после некропсии предусматривали наблюдения в дополнение к тем, которые уже отмечены в листах оценки по Драйзу и в формах офтальмологического обследования. Для всех составов оценивали наблюдения за введением дозы с использованием системы оценки раздражения глаз по Драйзу. Наблюдения аномалий не отмечали за исключением следующих: перед некропсией на 5 сутки отмечали уровень 1 покраснения обоих глаз у одного животного в группе I и одного животного в группе M.
Пример 20-2
Офтальмологические фармакокинетические показатели при применении составов у голландских кроликов
[00405] Не предусматривающее применение требований GLP исследование выполняли для оценки офтальмологических фармакокинетических показателей первого действующего вещества согласно настоящей заявке (например, соединения формулы I или II) в суспензии или растворе при введении один, три или четыре раза в сутки в виде местного закапывания в оба глаза голландским кроликам в течение четырех суток. План исследования (таблица 16-1) предусматривал тридцать девять (39) голландских кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу. Введение выполняли согласно режиму введения дозы в таблице 16-1.
Таблица 16-1: План исследования
Офтальмологический раствор (контроль)
Офтальмологический раствор (контроль)
Офтальмологический раствор
Офтальмологический раствор
Крупные 3-мкм частицы в суспензии
Крупные 3-мкм частицы+HPBCD в суспензии
Сверхкрупные 35-мкм частицы в суспензии
Сверхкрупные 35-мкм частицы в суспензии
Сверхкрупные 35-мкм+HPBCD в суспензии
0,3 мкМ витамина К3; Сверхкрупные частицы в суспензии
1,0 мкМ витамина К3; Сверхкрупные частицы в суспензии
QD - Один раз в сутки. TID - Три раза в сутки. QID - Четыре раза в сутки.
[00406] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп. Собирали образцы цельной крови с использованием K2EDTA в качестве антикоагулянта у всех животных на 5 сутки через 1 час после введения дозы. Цельную кровь помещали на лед до откручивания образцов в центрифуге для отделения плазмы. Образцы внутриглазной жидкости, конъюнктивы, роговицы, центральной части сетчатки, периферической части сетчатки, центральной части сосудистой оболочки и периферической части сосудистой оболочки собирали после некропсии. Затем образцы замораживали при -70°C или ниже. Анализировали образцы плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы всех групп 1-13.
[00407] Для всех групп, получающих введение дозы соединения формулы I или II в ткани глаза, оцениваемые на 5 сутки, представлены в порядке убывания: самая высокая в роговице >> в центральной части сосудистой оболочки > в центральной части сетчатки (таблица 16-2). Самые высокие концентрации соединения формулы I или II в роговице наблюдали в группе 1. Самые низкие концентрации соединения формулы I или II в роговице наблюдали в группе 3. В целом, более высокие концентрации в центральной части сетчатки и центральной части сосудистой оболочки ассоциировались с более высокими концентрациями соединения формулы I или II в роговице. Не наблюдали никакого преимущества других составов над офтальмологическими растворами соединения формулы I или II в отношении снижения концентраций в роговице или повышения концентраций соединения формулы I или II в центральной части сетчатки или центральной части сосудистой оболочки.
Таблица 16-2
(мкМ)
LLOQ в плазме=0,00188 мкМ.
LLOQ в центральной части сетчатки=0,00751 мкМ.
LLOQ в центральной части сосудистой оболочки=0,0282 мкМ.
LLOQ в роговице=0,0376 мкМ.
[00408] Макроскопические обследования глаза с использованием шкалы Драйза для оценки раздражения глаз выполняли у всех животных до первого ведения дозы каждые сутки на протяжении исследования. Все составы были хорошо переносимыми. Кроме того, животных обследовали на предмет общего состояния здоровья перед исследованием, в ходе введения дозы и при некропсии. Все животные, предназначенные для исследования, были нормальными. Оценивания после некропсии предусматривали наблюдения в дополнение к тем, которые уже отмечены в листах оценки по Драйзу и в формах офтальмологического обследования. Для всех составов оценивали наблюдения за введением дозы с использованием системы оценки раздражения глаз по Драйзу. На протяжении исследования отмечали наблюдения следующих аномалий: животные в группах 7, 9, 10, 11 12, и 13 испытывали учащенное моргание после введения дозы на протяжении нескольких суток исследования; у одного животного в группе 11 наблюдался 1 уровень выделения на 3 сутки.
Пример 20-3
Офтальмологические фармакокинетические показатели при применении составов у голландских кроликов
[00409] Не предусматривающее применение требований GLP исследование выполняли для оценки офтальмологических фармакокинетических показателей первого действующего вещества согласно настоящей заявке (например, соединения формулы I или II) в суспензии при введении один, два или три раза в сутки в виде местного закапывания в оба глаза голландским кроликам в течение четырех суток. План исследования (таблица 17-1) предусматривал тридцать девять (39) голландских кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу. Различные суспензионные составы согласно настоящей заявке оценивали и сравнивали с двумя контрольными составами a) раствором глазных капель на основе циклодекстрина (контрольная группа 13, таблица 17-1) и b) экспериментальным суспензионным составом, используемым в предварительных фармакокинетических исследованиях на кроликах (группа 10, таблица 17-1). Сравнение переменных для составов каждой суспензии, приведенной в таблице 17-1, представлено в таблице 17-2. Соединения формулы I или II использовали в тестируемых суспензиях, тогда как состав раствора Eye Drops получали с соединением I.
Таблица 17-1: План исследования
QD - Один раз в сутки. BID - Два раза в сутки. TID - Три раза в сутки.
Таблица 17-2
(контроль)
(контроль)
[00410] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп. Собирали образцы цельной крови с использованием K2EDTA в качестве антикоагулянта у всех животных на 5 сутки через 1 час после введения дозы. Цельную кровь помещали на лед до откручивания образцов в центрифуге для отделения плазмы. Образцы внутриглазной жидкости, конъюнктивы, роговицы, центральной части сетчатки, периферической части сетчатки, центральной части сосудистой оболочки и периферической части сосудистой оболочки собирали после некропсии. Затем образцы замораживали при -70°C или ниже. Анализировали образцы плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы всех групп 1-13.
[00411] Концентрации соединения формулы I или II в тканях глаз, оцениваемые на 5 сутки, представлены в порядке убывания: самая высокая в роговице >> в центральной части сосудистой оболочки > в центральной части сетчатки. Концентрации соединения формулы I или II в роговице варьировали от 1,5 до 14,7 мкМ, при этом самые высокие концентрации наблюдали в группе 13, а самые низкие в группе 1. Все суспензионные составы в группах 1-12 обеспечивали боле низкие средние концентрации в роговице по сравнению с контрольным раствором глазных капель в группе 13. Эти наблюдения, похоже, не зависели от присутствия или отсутствия витамина K3/менадиона в суспензионном составе. Концентрации в центральной части сосудистой оболочки варьировали от < 0,028 до 0,27 мкМ, при этом самые высокие концентрации наблюдали в группе 11, а самые низкие в группе 2. Концентрации в центральной части сетчатки варьировали от 0,009 до 0,069 мкМ; группа 11 характеризовалась самыми высокими концентрациями в центральной части сетчатки, а группа 1 характеризовалась самыми низкими концентрациями в центральной части сетчатки. Концентрации соединения формулы I или II в плазме были очень низкими, в приблизительно 10 раз и 100 раз ниже таковых в центральной части сетчатки и центральной части сосудистой оболочки, соответственно. См. таблицу 17-3.
Таблица 17-3
LLOQ в плазме=0,00188 мкМ.
LLOQ в центральной части сетчатки=0,00751 мкМ.
LLOQ в центральной части сосудистой оболочки=0,0282 мкМ.
LLOQ в роговице=0,0376 мкМ.
[00412] Кроме того, определяли концентрации витамина K3 в образцах плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы для животных из групп 8 и 9. Для определения концентрации витамина K3 строили калибровочную кривую в контрольной матрице. См. таблицу 17-4.
Таблица 17-4
LLOQ в плазме=0,291 мкМ.
LLOQ в центральной части сетчатки=11,6 мкМ.
LLOQ в центральной части сосудистой оболочки=43,6 мкМ.
LLOQ в роговице=2,91 мкМ.
[00413] Макроскопические обследования глаза с использованием шкалы Драйза для оценки раздражения глаз выполняли у всех животных до первого ведения дозы каждые сутки на протяжении исследования. Все составы были хорошо переносимыми, за исключением состава для одного животного в группе 11 на 4 сутки введения дозы, у которого отмечали хемоз конъюнктивы, а также для одного животного в группе 12 на 4 сутки введения дозы, у которого отмечали покраснение конъюнктивы. Кроме того, животных обследовали на предмет общего состояния здоровья перед исследованием, в ходе введения дозы и при некропсии. Все животные, предназначенные для исследования, были нормальными. Оценивания после некропсии предусматривали наблюдения в дополнение к тем, которые уже отмечены в листах оценки по Драйзу. Для всех составов оценивали наблюдения за введением дозы с использованием системы оценки раздражения глаз по Драйзу. На протяжении исследования отмечали наблюдения следующих аномалий: животные в группах 4, 6, 7, 8, 9 и 11 испытывали учащенное моргание после введения дозы на протяжении нескольких суток исследования; у одного животного в группе 4 наблюдали 1 уровень покраснения обоих глаз и 1 уровень хемоза левого глаза перед некропсией на 5 сутки; а у одного животного в группе 5 наблюдали 1 уровень хемоза правого глаза перед некропсией на 5 сутки.
Пример 20-5
Офтальмологические фармакокинетические показатели при применении составов у голландских кроликов
[00414] Не предусматривающее применение требований GLP исследование выполняли для оценки офтальмологических фармакокинетических показателей первого действующего вещества согласно настоящей заявке (например, соединения формулы I или II) в суспензии при введении один или два раза в сутки в виде местного закапывания в оба глаза голландским кроликам в течение четырех суток. План исследования (таблица 18-1) предусматривал сорок девять (49) голландских кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу. Различные суспензионные составы согласно настоящей заявке оценивали и сравнивали с раствором глазных капель на основе циклодекстрина (контрольные группы 2 и 3, таблица 18-1). Сравнение переменных для составов каждой суспензии, приведенной в таблице 18-1, представлено в таблице 18-2. Соединения формулы I или II использовали в тестируемых суспензиях, тогда как состав раствора Eye Drops получали с соединением I.
Таблица 18-1
Офтальмологический раствор, pH 6
Офтальмологический раствор, pH 6 (контроль)
Офтальмологический раствор, pH 6 (контроль)
0,6% TRIS+0,08% HPMC+2,0% глицерина+0,2% HEC;
1,0 мкM витамина К3; 30-мкм частицы, pH ~7,5
0,6% Трис+2,0% глицерина+0,3% HEC+0,04% Tylox;
1,0 мкM витамина К3; 30-мкм частицы, pH 6
0,6% Трис+2,0% глицерина+0,2% HEC+0,04% Tylox;
1,0 мкM витамина К3; 30-мкм частицы, pH 6
0,6% Трис+2,0% глицерина+0,3% HEC+0,04% Tylox;
1,0 мкM витамина К3; 30-мкм частицы, pH 7
0,6% Трис+2,0% глицерина+0,2% HEC+0,04% Tylox;
1,0 мкM витамина К3; 30-мкм частицы, pH 7
0,6% Трис+2,0% глицерина+0,3% HEC+0,08% HPMC;
1,0 мкM витамина К3; 30-мкм частицы, pH 6
0,6% Трис+2,0% глицерина+0,2% HEC+0,08% HPMC;
1,0 мкM витамина К3; 30-мкм частицы, pH 6
0,6% Трис+2,0% глицерина+0,2% HEC+0,08% HPMC;
1,0 мкM витамина К3; Нативные (~50 мкм), pH 6 (контроль)
1,0 мкM витамина К3;
30-мкм частицы, pH 7
Таблица 18-2
[00415] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп. Собирали образцы цельной крови с использованием K2EDTA в качестве антикоагулянта у всех животных на 5 сутки через 1 час после введения дозы. Цельную кровь помещали на лед до откручивания образцов в центрифуге для отделения плазмы. Образцы внутриглазной жидкости, конъюнктивы, роговицы, центральной части сетчатки, периферической части сетчатки, центральной части сосудистой оболочки и периферической части сосудистой оболочки собирали после некропсии. Затем образцы замораживали при -70°C или ниже. Для всех групп 1-16 анализировали образцы плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы по PAN-90806.
[00416] Концентрации соединения формулы I или II в тканях глаз, оцениваемые на 5 сутки, представлены в порядке убывания: самая высокая в роговице >> в центральной части сосудистой оболочки > в центральной части сетчатки. Концентрации соединения формулы I или II в роговице варьировали от 3 до 34 мкМ, при этом самые высокие концентрации наблюдали в группе 9, а самые низкие в группе 1. Концентрации в центральной части сосудистой оболочки варьировали от <0,056 до 0,24 мкМ, при этом самые высокие концентрации наблюдали в группах 6 и 14, а самые низкие в группе 1. Концентрации в центральной части сетчатки варьировали от 0,02 до 0,14 мкМ; группа 6 характеризовалась самыми высокими концентрациями в центральной части сетчатки, а группа 1 характеризовалась самыми низкими концентрациями в центральной части сетчатки. Концентрации соединения формулы I или II в плазме были очень низкими, в приблизительно 10 раз и 100 раз ниже таковых в центральной части сетчатки и центральной части сосудистой оболочки, соответственно. См. таблицу 18-3.
Таблица 18-3
LLOQ в центральной части сетчатки=0,00751 мкМ.
LLOQ в центральной части сосудистой оболочки=0,0563 мкМ.
LLOQ в роговице=0,0188 мкМ.
[00417] Макроскопические обследования глаза с использованием шкалы Драйза для оценки раздражения глаз выполняли у всех животных до первого ведения дозы каждые сутки на протяжении исследования. Все составы были хорошо переносимыми. Кроме того, животных обследовали на предмет общего состояния здоровья перед исследованием, в ходе введения дозы и при некропсии. Все животные, предназначенные для исследования, были нормальными. Оценивания после некропсии предусматривали наблюдения в дополнение к тем, которые уже отмечены в листах оценки по Драйзу. Для всех составов оценивали наблюдения за введением дозы с использованием системы оценки раздражения глаз по Драйзу, которые кратко описаны ниже. Наблюдения аномалий не отмечали.
Пример 20-4
Офтальмологические фармакокинетические показатели при применении составов у голландских кроликов
[00418] Не предусматривающее применение требований GLP исследование выполняли для оценки офтальмологических фармакокинетических показателей первого действующего вещества согласно настоящей заявке (например, соединения формулы I или II) в суспензии при введении один или два раза в сутки в виде местного закапывания в оба глаза голландским кроликам в течение четырех суток. План исследования (таблица 19-1) предусматривал сорок семь (47) голландских кроликов, каждый из которых получал 30-мкл билатеральную местную офтальмологическую дозу. Различные суспензионные составы согласно настоящей заявке оценивали и сравнивали с раствором глазных капель на основе циклодекстрина (контрольная группа 1, таблица 19-1). Сравнение переменных для составов каждой суспензии, приведенной в таблице 19-1, представлено в таблице 19-2. Соединения формулы I или II использовали в тестируемых суспензиях, а также в растворе Eye Drops. Однако в определенных суспензиях тестировали разные партии соединения I (группы 13, 14 и 15, таблица 19-1).
Таблица 19-1
Офтальмологический раствор, pH 6 (контроль)
HPMC;
30-мкм частицы
HPMC;
3-мкм частицы
HPMC;
50-мкм частицы (контроль)
HPMC;
30-мкм частицы (контроль)*
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
HPMC;
50-мкм частицы
*Образцы анализировали на предмет витамина K3.
QD - Один раз в сутки. BID - Два раза в сутки.
Таблица 19-2
[00419] Отбор образцов из глаза осуществляли через один час после первой суточной дозы на 5 сутки для всех групп. Собирали образцы цельной крови с использованием K2EDTA в качестве антикоагулянта у всех животных на 5 сутки через 1 час после введения дозы. Цельную кровь помещали на лед до откручивания образцов в центрифуге для отделения плазмы. Образцы внутриглазной жидкости, конъюнктивы, роговицы, центральной части сетчатки, периферической части сетчатки, центральной части сосудистой оболочки и периферической части сосудистой оболочки собирали после некропсии. Затем образцы замораживали при -70°C или ниже. Анализировали образцы плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы всех групп 1-15. Образцы группы 5 анализировали только на предмет витамина K3.
[00420] Концентрации соединения формулы I или II в тканях глаз, оцениваемые на 5 сутки через 1 час после первой дозы, представлены в порядке убывания: самая высокая в роговице >> в центральной части сосудистой оболочки >в центральной части сетчатки. Концентрации соединения формулы I или II в роговице варьировали от 1 до 25 мкМ, при этом самые высокие концентрации наблюдали в группе 12, а самые низкие в группе 7. Концентрации в центральной части сетчатки варьировали от 0,06 до 0,2 мкМ, при этом самые высокие концентрации наблюдали в группах 12 и 14, а самые низкие в группе 7. Концентрации в центральной части сетчатки варьировали от 0,03 до 0,1 мкМ; группа 12 характеризовалась самыми высокими концентрациями в центральной части сетчатки, а группа 7 характеризовалась самыми низкими концентрациями в центральной части сетчатки. Концентрации соединения формулы I или II в плазме были очень низкими, в приблизительно 10 раз и 100 раз ниже таковых в центральной части сетчатки и центральной части сосудистой оболочки, соответственно. См. таблицу 19-3.
Таблица 19-3
LLOQ в центральной части сетчатки=0,00751 мкМ.
LLOQ в центральной части сосудистой оболочки=0,0563 мкМ.
LLOQ в роговице=0,0376 мкМ.
[00421] Аналитическим методом определяли витамин K3 в образцах плазмы, центральной части сетчатки, центральной части сосудистой оболочки и роговицы животных из группы 5. Для определения концентрации витамина K3 использовали калибровочную кривую, построенную по контрольному стекловидному телу. Ответы внутреннего стандарта (IS) были разнородными для образцов центральной части сосудистой оболочки и плазмы. Таким образом, положительные результаты в плазме, вероятно, были связаны с пониженным ответом IS. Ответ витамина K3 в плазме был подобен фоновым уровням. В образцах центральной части сосудистой оболочки наблюдали положительные ответы витамина K3, но пониженный ответ IS ставил количественные результаты под сомнение. Образцы центральной части сетчатки и роговицы характеризовались нормальным ответом IS, а количественные результаты для витамина K3 отсутствовали. См. таблицу 19-4.
Таблица 19-4
LLOQ в центральной части сетчатки=0,581 мкМ.
LLOQ в центральной части сосудистой оболочки=2,18 мкМ.
LLOQ в роговице=0,145 мкМ.
[00422] Макроскопические обследования глаза с использованием шкалы Драйза для оценки раздражения глаз выполняли у всех животных до первого ведения дозы каждые сутки на протяжении исследования. В целом, составы хорошо переносились, за исключением двух животных в группе 6 на 4 сутки введения дозы, у которых отмечали хемоз конъюнктивы, одного животного в группе 8 на 3 сутки, у которого отмечали конъюнктивальное выделение, одного животного в группе 10 на 5 сутки введения дозы, у которого отмечали хемоз конъюнктивы и конъюнктивальное выделение, одного животного в группе 13 и одного животного в группе 14 на 5 сутки введения дозы, у которых отмечали хемоз конъюнктивы. Кроме того, животных обследовали на предмет общего состояния здоровья перед исследованием, в ходе введения дозы и при некропсии. Все животные, предназначенные для исследования, были нормальными. Оценивания после некропсии предусматривали наблюдения в дополнение к тем, которые уже отмечены в листах оценки по Драйзу. Для всех составов оценивали наблюдения за введением дозы с использованием системы оценки раздражения глаз по Драйзу. На протяжении исследования отмечали следующие наблюдения: у одного животного в группе 8 наблюдали выделение из левого глаза во время дозирования на 3 сутки. У животных в группе 12 во время некропсии наблюдали хемоз обоих глаз.
Пример 21
Получение частиц, содержащих соединение формулы II
[00423] Суспензионные составы, содержащие частицы соединения формулы II, получали путем валкового измельчения. Крупные частицы получали с использованием более крупной измельчающей среды (например, 3 мм в диаметре) в течение короткого периода времени при низкой скорости валков (фиг. 9B). Наночастицы получали с использованием более мелкой среды (например, 0,8 мм в диаметре) в течение более длительного периода времени при высокой скорости валков (фиг. 9A). Соединение формулы II в двух концентрациях (т.е. 0,4% и 0,2%) разбавляли из стокового раствора 5% API раствором глицерина до получения надлежащей тоничности. Наилучшие меры предосторожности в отношении чистоты включали в себя автоклавирование контактирующих с продуктом частей, фильтрацию вспомогательных растворов и перемещения с использованием предварительно упакованных стерильных сырьевых материалов. Кроме того, все перемещения осуществляли в вытяжном шкафу с ламинарным потоком в чистой зоне.
[00424] Дополнительные примеры частиц, содержащих соединения формулы I или II, показаны в таблицах 21 и 22.
Таблица 21
~50 мкм
Таблица 22
ПРИМЕР 22
Получение состава соединения I/Трис
[00425] Получали неизмельченную суспензию соединения I. Состав состоял из 3% соединения I; 0,6% Трис-HCl, pH 6; 2% глицерина. Соединение I добавляли непосредственно в раствор, смешивали без измельчения и характеризовали (фиг. 9C).
Пример 23
Частицы, содержащие соединение формулы II и витамин K3
[00426] Добавление витамина K3 (менадиона) в суспензионный состав может оказывать полезный эффект in vivo. Менадион добавляли в состав в виде измельченной суспензии. Сначала менадион измельчали точно так же, как измельчали соединение формулы II, 5% суспензию с плуроником F-127 в качестве стабилизатора. Затем эту суспензию добавляли в соединение формулы II перед измельчением (составы крупных частиц и наночастиц). Затем измельченные 5% суспензии (содержащие менадион суспензии) разбавляли до 0,4% соединения формулы II (в глицерине, как описывалось ранее).
[00427] Менадион, по-видимому, не влияет на какие-либо физические характеристики измельченных частиц соединения формулы II (фиг. 9D). Однако, при самой высокой концентрации добавленного менадиона (10 мкМ) выявляли частицы витамина K3, которые увеличивались в размере. Кроме того, наблюдали небольшое количество очень крупных частиц, за пределами диапазона свободного основания, которые предположительно являлись витамином K3. Был сделан вывод, что витамин K3 не может равномерно распределяться, как другие частицы, в суспензии, поскольку он увеличивается в размере более быстрыми темпами, чем соединение формулы II.
Пример 24
Получение частиц, содержащих менадион
[00428] Состав менадиона/соединения формулы II со временем может образовывать более крупные кристаллы. Требовался оптимизированный состав для возможности добавления менадиона в виде суспензии. Составы, содержащие 5% менадиона, просеивали с использованием валковой мельницы таким же путем, как и при просеивании составов соединения формулы II. Состав HPMC давал мелкую гомогенную суспензию, которая демонстрировала кратковременную стабильность при 40°C (фиг. 10).
Пример 25
Получение частиц, содержащих соединение формулы II
[00429] Состав HPMC для менадиона использовали с соединением формулы II для обеспечения состава, в который менадион мог быть добавлен в виде суспензии. Обнаружили, что частицы сверхкрупного (30-40 микрон) размера при использовании HPMC могли быть измельчены за более короткое время, чем при использовании плуроника F-127 в качестве стабилизатора (фиг. 11A и 11B). Затем суспензия могла быть разбавлена суспензией менадиона/HPMC.
Пример 25
Стабильность менадиона в составах согласно настоящей заявке
[00430] В исследовании стабильности концентрация менадиона составляла 20 мкМ. Менадион составляли следующим образом: 0,43% (масс./об.) соединения I (неизмельченного, 50 мкм), 0,6% Трис/HCl, pH 6, 2% глицерина, 0,2% HEC, 0,08% HPMC и 20 мкМ менадиона. Из этого состава получали десять тестируемых составов:
1. без глицерина (без N2),
2. контрольный состав (без N2),
3. контрольный состав, барботированный N2,
4.+0,3% Na тиосульфата (пентагидрата), барботированный N2*,
5.+0,1% Na2 EDTA, барботированный N2,
6.+0,5% витамина E TPGS, барботированный N2,
7.+0,05% пропилгаллата, барботированный N2,
8.+0,02% BHT, барботированный N2,
9.+комплекс менадиона/HPb-циклодекстрина, барботированный N2,
10.+антиоксидантный комплекс (№ 5 - № 9), барботированный N2.
[00431] 7 мл каждого состава добавляли в оранжевый 40-мл сосуд (при оранжевом освещении). Фильтрованный газообразный азот медленно барботировали в нижней части сосуда до тех пор, пока образуемая пена не начинала выходить из верхней части сосуда, который затем быстро закрывали. Получали комплекс менадиона/HPb-циклодекстрина (№ 9) путем смешивания приблизительно эквимолярных концентрированных растворов циклодекстрина и менадиона перед добавлением в состав (приблизительно 2 часа).
Пример 26
Способы валкового измельчения и характеристика частиц согласно настоящей заявке
Валковая мельница
[00432] Горизонтальная валковая мельница (US Stoneware, модель 755) состоит из четырех, приводимых в движение двигателем 12ʺ резиновых валков, находящихся в металлическом корпусе. Отдельные бутылки, помещенные между валками, будут вращаться с оборотами в минуту, определяемыми скоростью валков и диаметром бутылки. Взвесь лекарственного средства, состоящую из API, стабилизаторов, воды и измельчающей среды, добавляли в бутылку и плотно закрывали крышкой перед помещением между валками. Используемая среда представляла собой чрезвычайно плотные гранулы из стабилизированного оксидом иттрия циркония, диаметр которых варьировал от 800 микрон до 3000 микрон. После измельчения дисперсию отделяли от среды путем переноса содержимого на вставку центрифужной пробирки, оснащенную ситом. Небольшую вставку помещали в центрифужную пробирку. Затем центрифугу прогоняли при приблизительно 300 x G в течение приблизительно 5 минут. Дисперсию собирали под сеткой (под которой осталась среда) в пробирку.
Оптическая микроскопия (OM)
[00433] Оптические микроскопические микрофотографии наночастиц получали с использованием системы Olympus BX51, оснащенной масляно-иммерсионным 100x объективом (с 1000-кратным увеличением). На каждой микрофотографии устанавливали калибровочную шкалу (от 1 мкм до 100 мкм) в качестве средства сравнения. (Калибровочная шкала также служит эффективным средством измерения более крупных частиц при более низких увеличениях.)
Распределение частиц по размерам (PSD)
[00434] Распределение частиц по размерам анализировали с использованием дифракционного рассеяния лазерного излучения с Horiba LA-950 V2. Исходя из общих предположений, настраивали условия и значение индекса рефракции. Распределения являлись распределениями по объему. Плотность образца доводили до общего диапазона процентного пропускания от источника синего света LED. Небольшую кювету для образца (наполненную водой) использовали вместо проточной кюветы для минимизации количества образца.
Включение посредством ссылки
[00435] Полное раскрытие каждого из патентных документов и научных статей, на которые приводится ссылка в настоящем документе, включено посредством ссылки во всех отношениях. В настоящей заявке основной документ определяется с достаточной тщательностью, и материалы, которые относятся к раскрытию, истолковываются на основании контекста ссылки. Не подразумевается, что цитирование публикаций и патентных документов является допущением того, что какая-либо или какой-либо из них является релевантным источником предшествующего уровня техники, равно как не означает оно и какого-либо допущения относительно их содержания или даты. Хотя заявка была описана посредством письменного описания, специалисты в данной области техники смогут признать, что заявка сможет быть применена на практике в разнообразных вариантах осуществления, и вышеизложенные описание и примеры представлены в целях иллюстрации, но не ограничения последующей формулы изобретения.
Эквиваленты
[00436] Настоящая заявка может быть осуществлена в других конкретных формах, не выходя за рамки ее сущности или существенных характеристик. Поэтому вышеизложенные варианты осуществления следует рассматривать во всех аспектах скорее как иллюстративные, чем ограничивающие заявку, описанную в настоящем документе. Следовательно, объем заявки определяется скорее приложенной формулой изобретения, чем вышеизложенным описанием, и все изменения, которые подпадают под объем и диапазон эквивалентности формулы изобретения, подлежат быть охваченными им.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОФТАЛЬМОЛОГИЧЕСКИЕ СОСТАВЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВ И ЗАЩИТЫ ПЕРЕДНЕГО ОТДЕЛА ГЛАЗА | 2015 |
|
RU2704810C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ СОСТАВЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ К ЗАДНЕМУ СЕГМЕНТУ ГЛАЗА | 2014 |
|
RU2768489C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ СОСТАВЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ К ЗАДНЕМУ СЕГМЕНТУ ГЛАЗА | 2014 |
|
RU2665953C2 |
| КОМПОЗИЦИИ ГИАЛУРОНОВОЙ КИСЛОТЫ С ВЫСОКОЭЛАСТИЧНЫМИ СВОЙСТВАМИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2727809C2 |
| ЛЕЧЕНИЕ ОФТАЛЬМОЛОГИЧЕСКИХ НАРУШЕНИЙ С ИСПОЛЬЗОВАНИЕМ МОЧЕВИНЫ И ЕЕ ПРОИЗВОДНЫХ | 2003 |
|
RU2339369C2 |
| КОМПОЗИЦИЯ ГЛАЗНЫХ КАПЕЛЬ | 2017 |
|
RU2753511C2 |
| ИСПОЛЬЗОВАНИЕ КОНТАКТНЫХ ЛИНЗ ПРИ ЛЕЧЕНИИ ОФТАЛЬМОЛОГИЧЕСКОГО НАРУШЕНИЯ | 2013 |
|
RU2647783C2 |
| ФТОРСОДЕРЖАЩИЕ АНТАГОНИСТЫ ИНТЕГРИНА | 2014 |
|
RU2698195C2 |
| КОМПОЗИЦИЯ ГЛАЗНЫХ КАПЕЛЬ | 2012 |
|
RU2623066C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ СО СТОРОНЫ ОРГАНА ЗРЕНИЯ | 2018 |
|
RU2761436C1 |
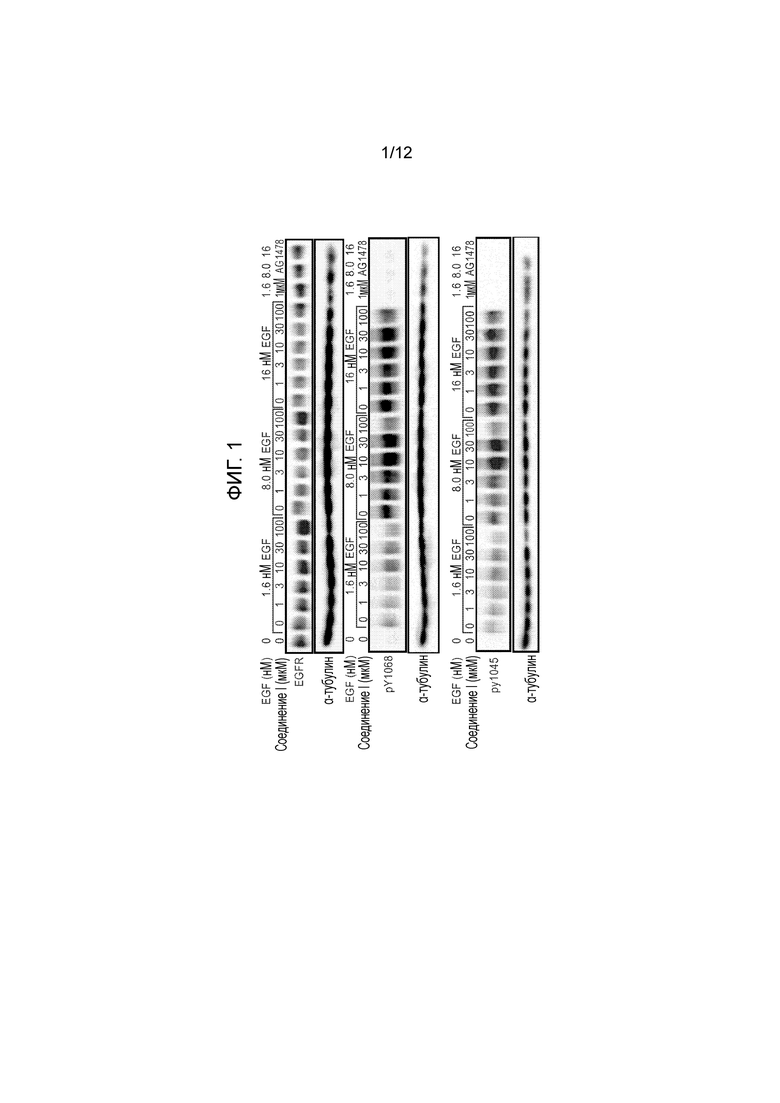

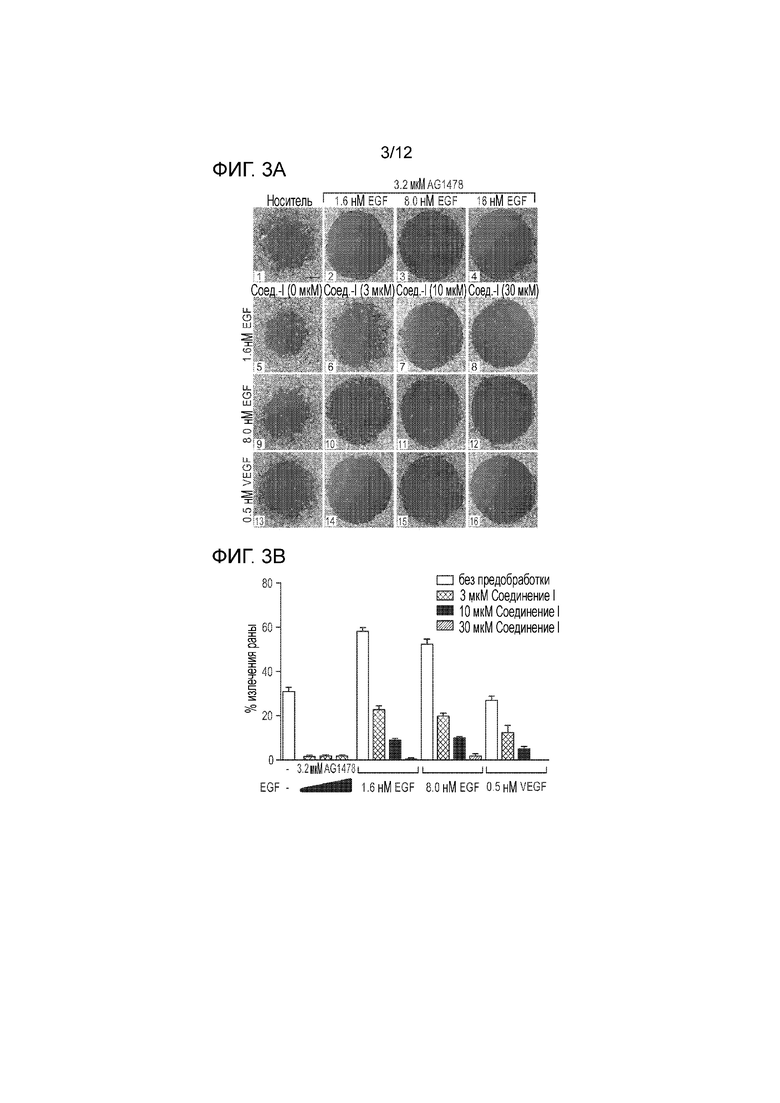
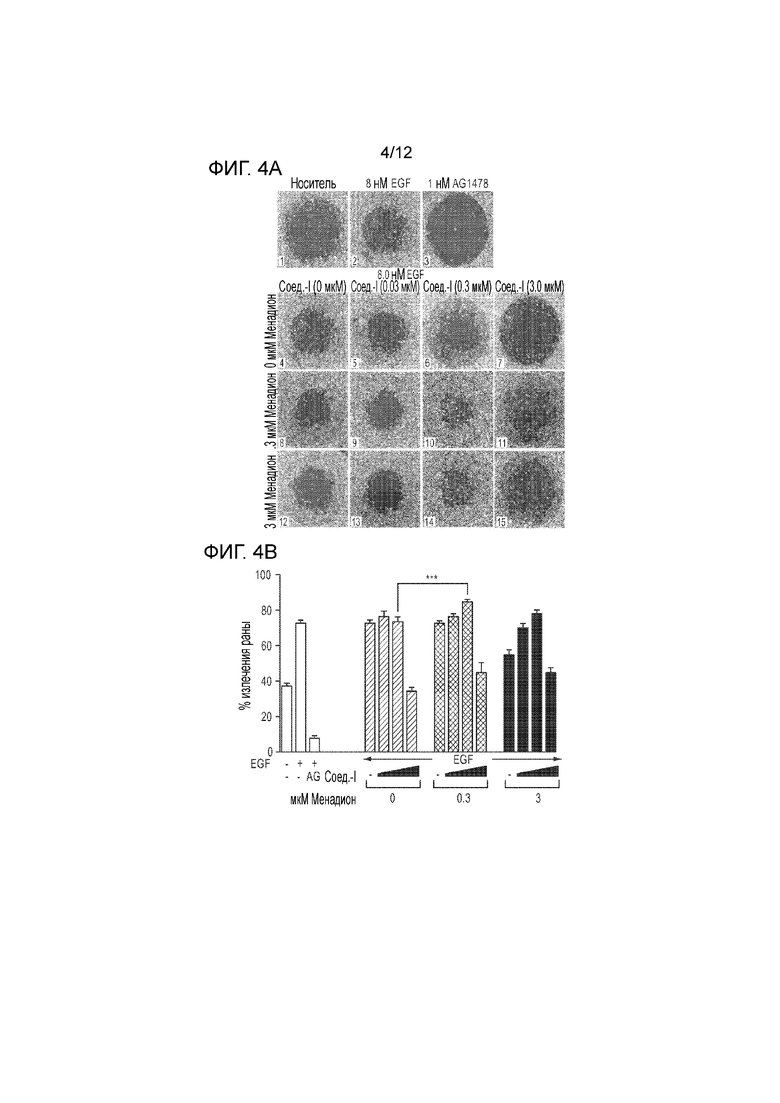
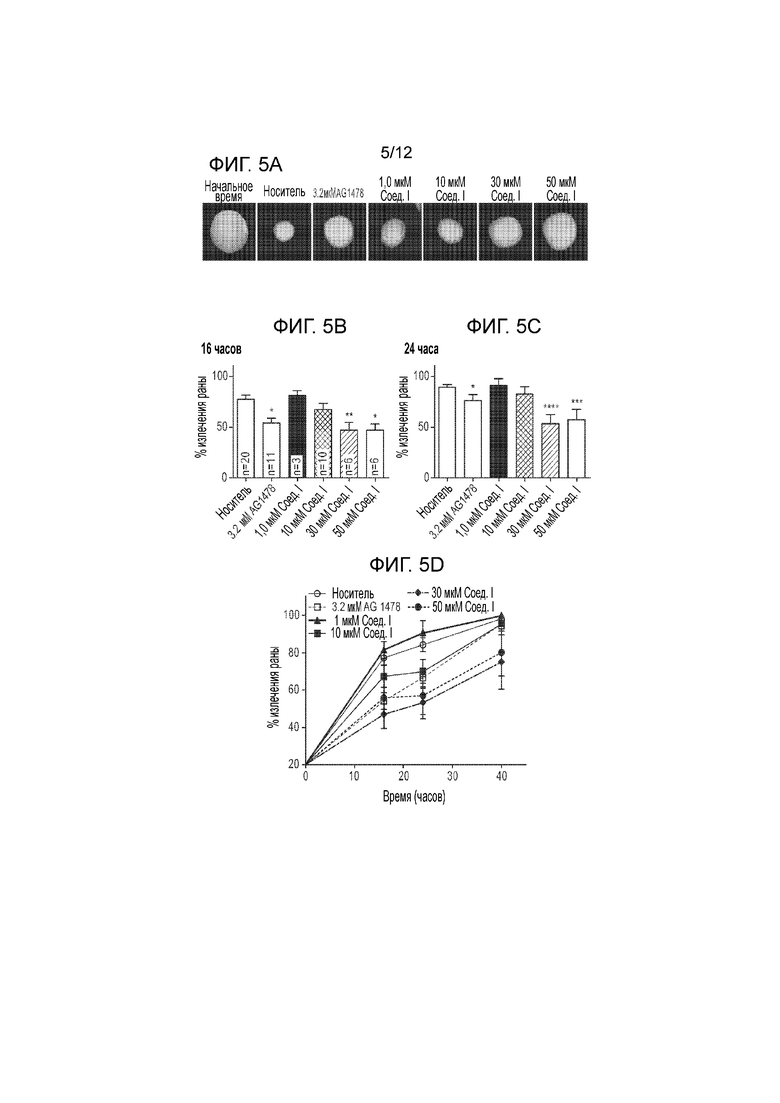
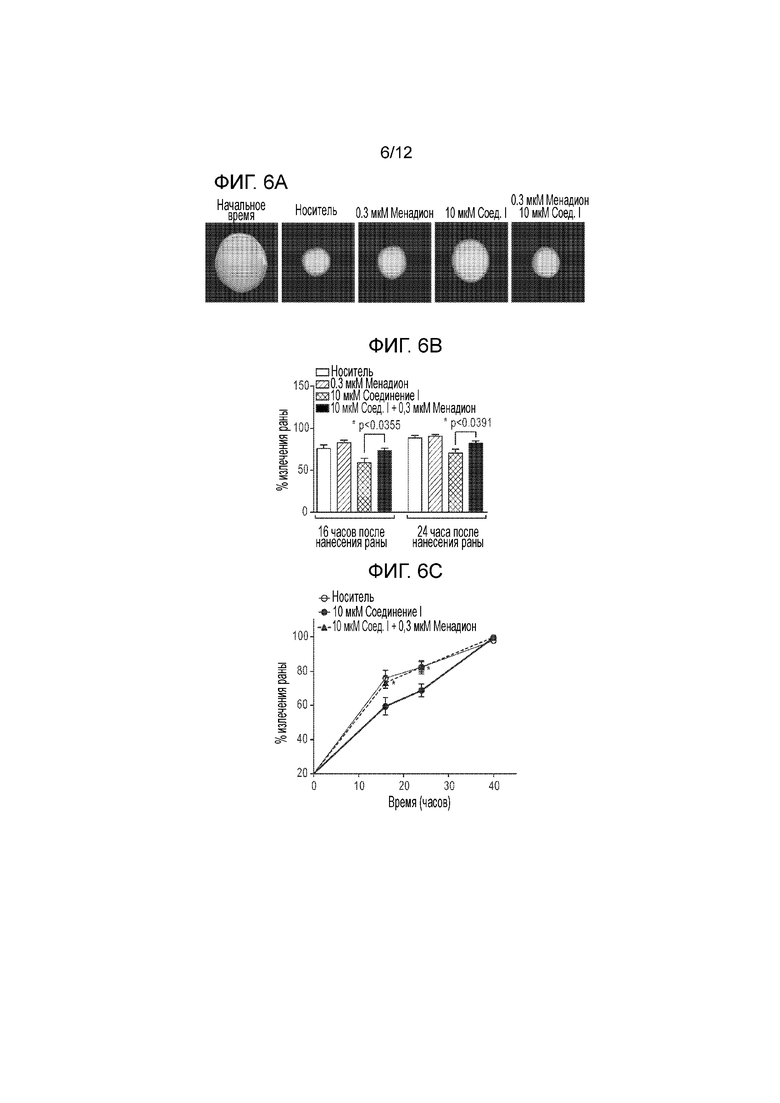
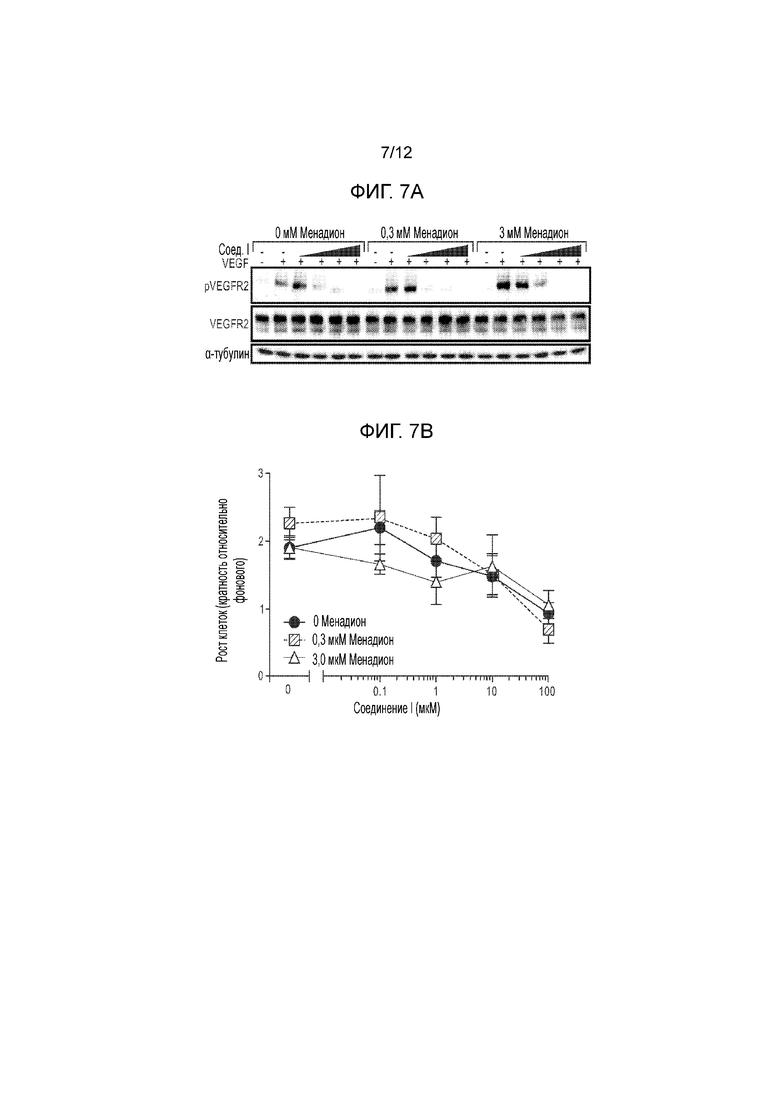
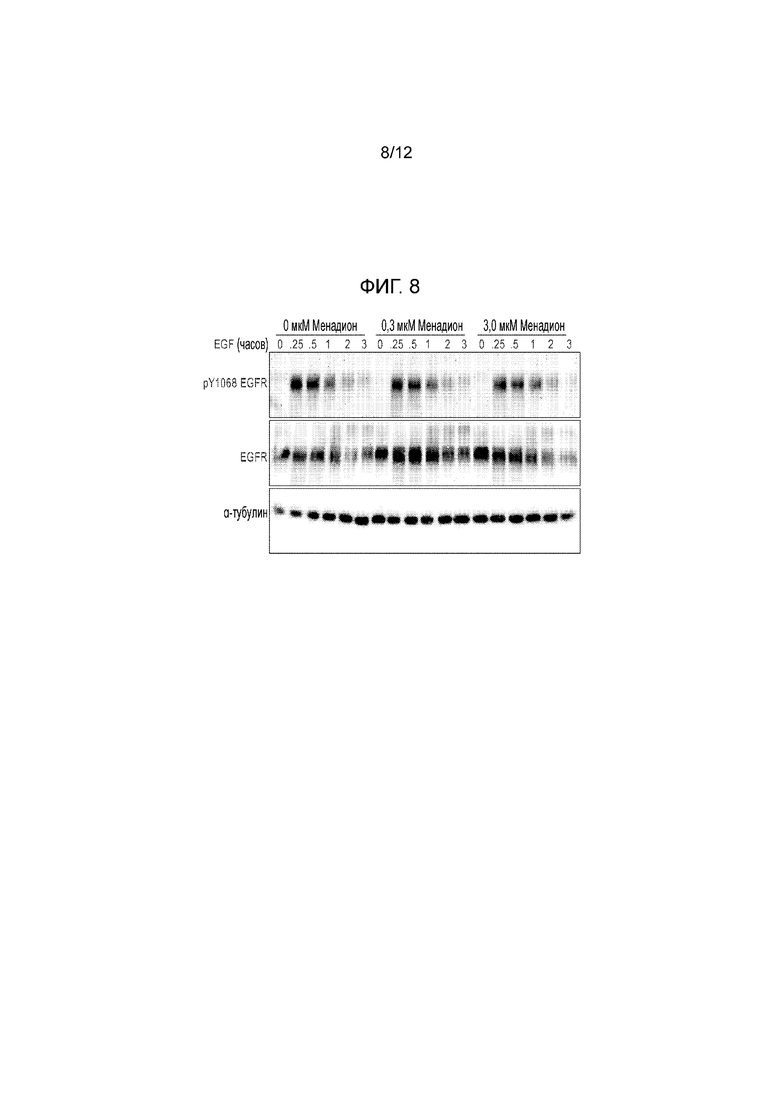
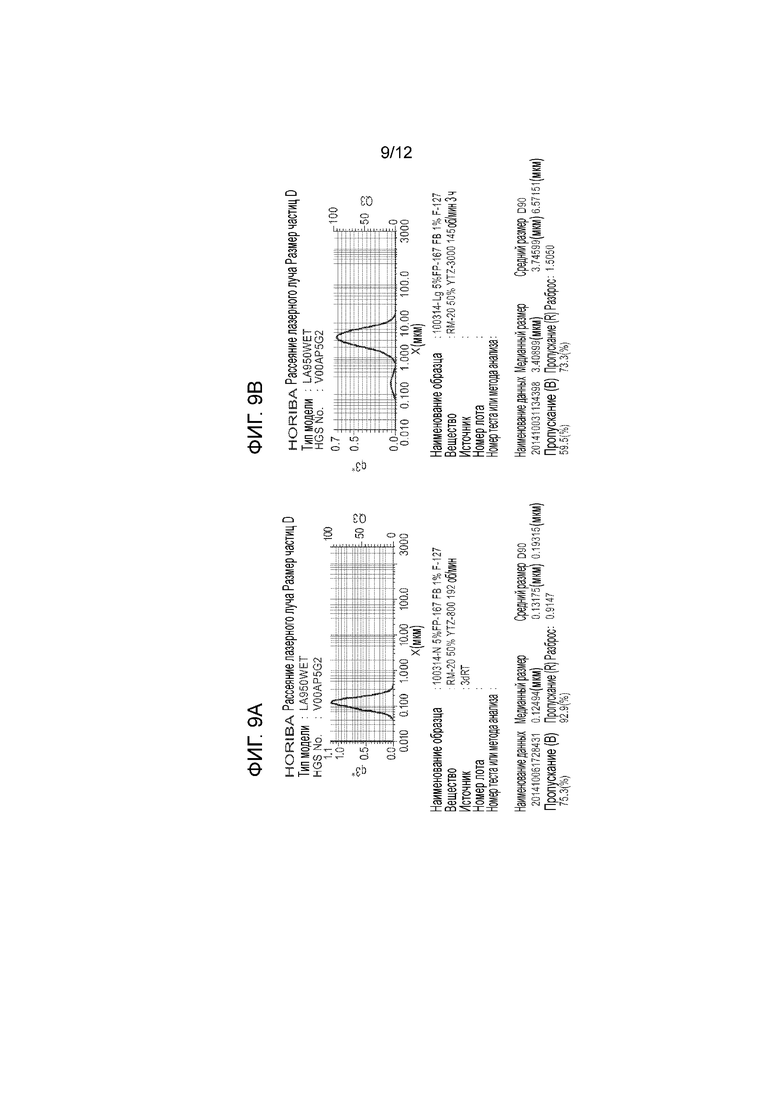



Группа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза. Офтальмологический суспензионный состав для местного применения содержит частицы действующего вещества формулы II или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых наполнителей. Указанное действующее вещество или его фармацевтически приемлемая соль присутствует в количестве от приблизительно 0,005% до приблизительно 5,0% (мас./об.). Указанные частицы имеют средний диаметр от 100 нм до 100 мкм. Офтальмологический суспензионный состав применяют для изготовления лекарственного средства, пригодного для доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза. Использование группы изобретений обеспечивает сочетанные эффекты снижения воздействия лекарств на роговицу и передний отдел глаза и защиты роговицы и тканей переднего отдела глаза, увеличивая при этом биодоступность заднего отдела глаза, а также позволяет улучшить офтальмологическую переносимость и увеличить терапевтический индекс действующего вещества. 2 н. и 19 з.п. ф-лы, 11 ил., 22 табл., 26 пр.
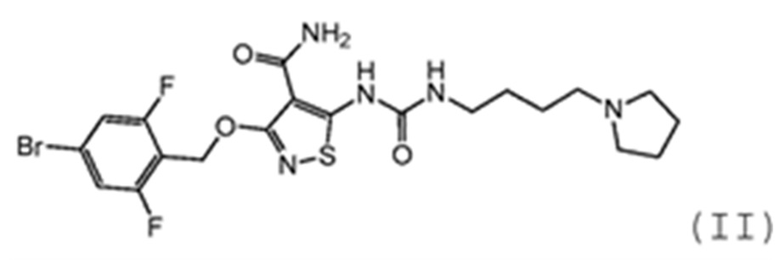
1. Офтальмологический суспензионный состав для местного применения, содержащий частицы первого действующего вещества формулы II:
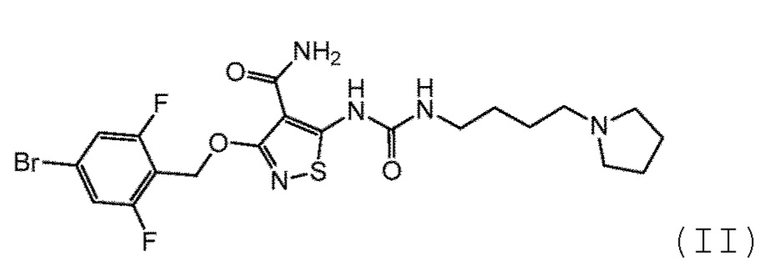
или его фармацевтически приемлемую соль и
один или более фармацевтически приемлемых наполнителей,
где первое действующее вещество или его фармацевтически приемлемая соль присутствует в количестве от приблизительно 0,005% до приблизительно 5,0% (масс./об.) и где частицы имеют средний диаметр от 100 нм до 100 мкм.
2. Состав по п. 1, где фармацевтически приемлемая соль первого действующего вещества представляет собой соединение I
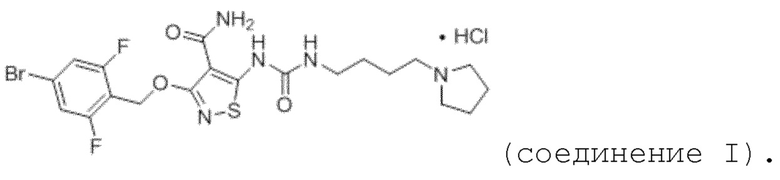
3. Состав по п. 1, содержащий от приблизительно 0,1% до приблизительно 2% масс./об. соединения формулы II или его фармацевтически приемлемой соли.
4. Состав по п. 1, содержащий от приблизительно 0,2% до приблизительно 1,0% масс./об. соединения формулы II или его фармацевтически приемлемой соли.
5. Состав по любому из пп. 1-4, где один или более фармацевтически приемлемых наполнителей выбраны из гидроксипропилметилцеллюлозы (НРМС), карбоксиметилцеллюлозы и их солей и гидроксиэтилцеллюлозы (НЕС).
6. Состав по п. 5, где один или более фармацевтически приемлемых наполнителей выбраны из гидроксипропилметилцеллюлозы (НРМС) и карбоксиметилцеллюлозы и их солей.
7. Состав по п. 5, где один или более фармацевтически приемлемых наполнителей выбраны из карбоксиметилцеллюлозы и их солей.
8. Состав по любому из пп. 1-7, дополнительно включающий трометамин и/или глицерин.
9. Состав по п. 8, содержащий трометамин в количестве приблизительно 0,6% масс./об.
10. Состав по п. 8 или 9, содержащий глицерин в количестве приблизительно 2,0% масс./об.
11. Состав по любому из пп. 1-10, дополнительно содержащий неионный жидкий полимер и/или гидрофильное неионное поверхностно-активное вещество.
12. Состав по п. 11, где неионный жидкий полимер представляет собой алкиларилполиэфир-спиртового типа.
13. Состав по п. 12, где неионный жидкий полимер типа алкиларилполиэфир-спиртов представляет собой тилоксапол.
14. Состав по п. 11, где гидрофильное неионное поверхностно-активное вещество представляет собой полоксамер.
15. Состав по любому из пп. 1-14, дополнительно содержащий полисорбат (Твин) 80 и/или повидон (PVP K-29/32 или K-30).
16. Состав по любому из пп. 1-15, где частицы имеют средний диаметр от 20 мкм до 90 мкм.
17. Состав по любому из пп. 1-15, где частицы имеют средний диаметр от 30 мкм до 60 мкм.
18. Состав по любому из пп. 1-15, где частицы имеют средний диаметр от 1 мкм до 5 мкм.
19. Состав по любому из пп. 1-15, где по меньшей мере 90% частиц имеют средний диаметр 70 мкм или менее.
20. Состав по любому из пп. 1-15, где частицы имеют средний диаметр приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм, приблизительно 60 мкм, приблизительно 65 мкм или приблизительно 7 0 мкм.
21. Применение состава по любому из пп. 1-20 для изготовления лекарственного средства, пригодного для доступа к заднему отделу глаза и/или для лечения и/или уменьшения интенсивности заболевания заднего отдела глаза, выбранного из группы, состоящей из: диабетической ретинопатии; возрастной макулярной дегенерации (AMD); патологической неоваскуляризации (CNV) сосудистой оболочки; патологической неоваскуляризации сетчатки; увеита; окклюзии вен сетчатки; травмы глаза; отека, индуцированного хирургическим вмешательством; неоваскуляризации, индуцированной хирургическим вмешательством; кистозного макулярного отека; ишемии глаза; ретинопатии недоношенных; болезни Коутса; серповидно-клеточной ретинопатии; и/или неоваскулярной глаукомы.
| WO 2012052418 A1, 26.04.2012 | |||
| WO 2012162627 A1, 29.11.2012 | |||
| WO 2013126799 A1, 29.08.2013 | |||
| US 2005074497 A1, 07.04.2005 | |||
| BEEBE JS et al | |||
| Комнатная печь | 1922 |
|
SU547A1 |
| Cancer Res., 2003, 63(21), p.7301-9. | |||
Авторы
Даты
2022-03-24—Публикация
2015-09-17—Подача