Изобретение относится к области биотехнологии, биоинженерии, биохимии и может быть использовано для получения моноклональных антител (МКАТ), применяемых в иммуноферментном анализе для выявления шигаподобного токсина II типа.
Шигаподобные токсины, наряду с шига-токсином, относятся к семейству токсинов, продуцируемых рядом энтеробактерий, и подразделяются на I и II типы. Природными продуцентами шигаподобных токсинов являются шига-токсинпродуцирующие штаммы Escherichia coli (STEC) [Melton-Celsa A.R. Shiga toxin (Stx). Classification, structure, and Function. Microbiol Spectr. 2014; 2 (2): 23].
Представители семейства шигаподобных токсинов имеют сходную молекулярную структуру, для которой характерно наличие одной субъединицы А (~32 кДа) и пяти субъединиц В (~7,7 кДа каждая). В субъединице А выделяют также связанные между собой дисульфидной связью фрагменты А1 и А2, которые разделяются после проникновения в клетку-мишень, после чего фрагмент А1 блокирует синтез белка в клетке [Szewczak А.А., Moore Р.В., Chan Y.L. The conformation of the sarcin/ricin loop from 28S ribosomal RNA. Proc. Natl. Acad. Sci. USA. 1993; 90: 9581-9585].
Шигаподобные токсины оказывают выраженное нейротоксическое действие, нарушая, прежде всего, функционирование центральной нервной системы. Проявляется это синдромом интоксикации и нарушением всех видов обмена, примерно в 5% случаев поражение шигаподобными токсинами приводит к развитию гемолитико-уремического синдрома. Особенно высокий уровень летальности при этом наблюдается у новорожденных детей [Taylor М.С. Enterohaemorrhagic Escherichia coli and Shigella dysenteriae type 1-induced haemolytic uraemic syndrome. Pediatr. Nephrol. 2008; 23: 1425-1431].
Среди шигаподобных токсинов наибольшей опасностью обладают представители II типа. Гемолитико-уремический синдром и другие тяжелые системные осложнения у человека регистрируются в подавляющем большинстве случаев при инфекциях, вызванных штаммами Е. coli, продуцирующими шигаподобный токсин II типа [Boerlin, P. Associations between virulence factors of Shiga toxin-producing Escherichia coli and disease in humans / P.Boerling [et al.] // J. Clin. Microbiol. - 1999. - Vol. 37, № 3. - P. 497-503].
Вспышки заболеваний, вызываемых STEC, происходят регулярно. Как правило, частой причиной вспышек является кишечная палочка серотипа 0157. В то же время наиболее известной является вспышка 2011 года в Европе, вызванная кишечной палочкой серотипа О104:Н4. По данным Всемирной организации здравоохранения в результате этой вспышки погибло 53 человека [E.coli: Rapid Responce in a crisis. European Food Safety Authority. [Электронный ресурс]. URL.: wvm.efsa.europa.eu/en/press/news/ 120711]; [Онищенко Г.Г., Дятлов И.А., Светоч H.B. Молекулярно-генетическая характеристика шига-токсинпродуцирующих Escherichia coli, выделенных при вспышке пищевой инфекции в Санкт-Петербурге в 2013 году. Вестник РАМН. 2015; 1: 70-80].
Для выявления шигаподобных токсинов активно используют иммунохимические средства диагностики. Они представлены как на зарубежном, так и на отечественном рынке. Фирма R-Biopharm AG (Германия) производит и реализует наборы мультиплексного иммунохроматографического анализа для одновременного выявления шигаподобного токсина I и II типов и специфического антигена 0157 - RIDA®QUICK Verotoxin/015 Combi. Этот же производитель предлагает набор RIDASCREEN® Verotoxin для иммуноферментного полу количественного выявления шигаподобных токсинов.
Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека Российской Федерации (Роспотребнадзор) разработаны и утверждены к применению методические указания по лабораторной диагностике заболеваний, вызываемых Е. coli, продуцирующих шигаподобные токсины - инфекций в пищевых продуктах - МУК 4.2.2963-11 [МУК 4.2.2963-11 Методические указания по лабораторной диагностике заболеваний, вызываемых Escherichia coli, продуцирующих шига-токсины (STEC-культуры) и обнаружению возбудителей STEC-инфекций в пищевых продуктах. Москва, 2011. [Электронный ресурс]. URL.: www.docs.cntd.ru/document/1200094087]. Данные методические указания предусматривают использование диагностических наборов для латекс-агглютинации производства ФБУН «ГНЦ ПМБ» и иммунохроматографических наборов DUOPATH® Verotoxins (Merck Millipore, США).
Для создания современных средств иммунодиагностики оптимальным вариантом является использование МКАТ, которые позволяют повысить чувствительность иммунологических методов благодаря своей высокой специфичности. Другим преимуществом МКАТ является возможность их наработки в препаративных количествах за сравнительно короткий промежуток времени при наличии специфичных гибридных клеточных линий. В России отсутствуют отечественные средства на основе МКАТ для выявления шигаподобного токсина II типа, а перечень проводимых работ в этом направлении крайне ограничен.
Техническим результатом предполагаемого изобретения является получение штамма гибридных культивируемых клеток животных Mus musculus 365Е11, продуцирующих одноименные мышиные МКАТ к шигаподобному токсину II типа и пригодные для конструирования на их основе тест-систем для выявления шигаподобного токсина II типа.
Технический результат достигается тем, что предложен штамм гибридных клеток Mus musculus 365Е11, продуцирующих одноименные мышиные МКАТ к шигаподобному токсину II типа.
Штамм гибридных культивируемых клеток животных Mus musculus 365Е11 - продуцент мышиных МКАТ, специфичных к шигаподобному токсину II типа, депонирован в Государственной коллекции микроорганизмов ФГБУ «48 ЦНИИ» Минобороны России под номером 365Е11.
Штамм гибридных культивируемых клеток животных Mus musculus 365Е11 получают следующим образом:
Препарат шигаподобного токсина II типа выделяют из культуральной жидкости микробной культуры Е. coli RKI № 11 2027 (серотип О104:Н4, из Государственной коллекции микроорганизмов ФГБУ «48 ЦНИИ» Минобороны России), очистку проводят методами гидрофобной, ионообменной и эксклюзионной хроматографии. Чистоту фракций препарата шигаподобного токсина II типа оценивают методом электрофореза в денатурирующих условиях. Специфическую активность препарата шигаподобного токсина контролируют в иммуноферментном и иммунохроматографическом тестах. Концентрацию белка определяют по методу Лоури.
Мышей линии BALB/c иммунизируют препаратом шигаподобного анатоксина II типа. Иммунизацию проводят трехкратно, с интервалом 7 суток, препарат вводят подкожно в возрастающих дозах (10, 20 и 40 мкг на мышь) с адъювантом гель гидроксида алюминия. За четыре дня до проведения гибридизации проводят бустер-иммунизацию, препарат вводят внутрибрюшинно в дозе 40 мкг на мышь. Слияние спленоцитов иммунных мышей с клетками мышиной миеломы Sp2/0-Ag14 проводят по методике G.Kohler и C.Milstein в модификации De St.Fazekas и D.Scheidegger. В качестве агента для слияния применяют полиэтиленгликоль (ПЭГ). Слившиеся клетки рассевают в лунки культуральных планшетов с заранее приготовленным фидерным слоем. После гибридизации проводят селекцию, скрининг, клонирование, культивирование и криоконсервацию гибридных клеток. Для характеристики МКАТ, продуцируемых гибридной клеточной линией 365Е11, осуществляют выращивание клеток in vivo в виде асцитической жидкости с последующим выделением из нее фракции иммуноглобулинов путем ионообменной хроматографии.
Характеристика штамма гибридных культивируемых клеток животных Mus musculus 365Е11:
Морфологическая характеристика. Культура гибридных клеток 365Е11 представлена слабо прикрепленными к подложке округлыми клетками размером с исходную миеломную клетку.
Культуральные свойства. Штамм гибридных клеток 365Е11 культивируют в виде стационарной суспензии в культуральных флаконах с площадью поверхности роста 25 см2 и 75 см2 в среде RPMI-1640 с 10% фетальной телячьей сыворотки, 2 мМ L-глютамина, 1 мМ пирувата натрия и 80 мг/л гентамицина в атмосфере 5% углекислого газа при температуре 37°С. Оптимальная посевная концентрация клеток составляет 2105 клеток на 1 мл, время культивирования 3-4 суток, кратность рассева 1:4.
Культивирование гибридных клеток в организме животного. Для культивирования штамма гибридных клеток 365Е11 in vivo используются мыши линии BALB/c в возрасте 10-20 недель, обработанные пристаном (0,5 мл внутрибрюшинно). Через 14 суток мышам в брюшную полость вводят по 2⋅106 клеток в среде RPMI-1640. Появление асцитов регистрируют на 7-10 сутки, а отбор асцитической жидкости производят на 10-14 сутки в соответствии со скоростью развития каждой отдельной асцитной опухоли.
Продуктивность гибридной клеточной линии. Титр антител в культуральной жидкости на 3-4 сутки культивирования в иммуноферментном анализе (ИФА) составляет 1:800, титр антител в асцитической жидкости - 1:2560000. Продукция МКАТ сохраняется на протяжении 10 пассажей in vitro и 5 пассажей in vivo (срок наблюдения).
Контаминация штамма гибридных клеток. Бактерии и грибы не выявлены.
Криоконсервация. Суспензию гибридных клеток замораживают в защитной среде (90% фетальной телячьей сыворотки, 10% диметилсульфоксида) в концентрации 2⋅106 клеток на 1 мл в криопробирках со скоростью 1°С в 1 мин до минус 70°С, затем перемещают в хранилище с жидким азотом. Жизнеспособность восстанавливаемой культуры гибридомы после криоконсервации составляет 90%.
Характеристика полезного продукта. Полученный штамм гибридных клеток 365Е11 производит специфичные МКАТ субкласса IgG1 к шигаподобному токсину II типа. МКАТ из асцитической жидкости выделяют методом ионообменной хроматографии. Специфическую активность очищенных МКАТ оценивают в непрямом твердофазном ИФА. Концентрацию иммуноглобулинов определяют по методу Лоури.
Изобретение осуществляют следующим образом.
Получение препарата шигаподобного токсина II типа.
Для получения препарата шигаподобного токсина II типа используют культуральную жидкость штамма кишечной палочки RKI № 11 2027 (О104:Н4).
Клетки E.coli RKI №11 2027 (О104:Н4) культивируют в колбах в среде «CAYE» (Merck, Германия) с добавлением митомицина до конечной концентрации 400 мкг/мл при температуре 37°С. Культуральную жидкость осветляют центрифугированием, дважды осаждают сульфатом аммония при 65% насыщения, ресуспендируют в дистиллированной воде и диализуют против 0,1 М фосфатного буферного раствора (ФБР) с рН 7,0.
Хроматографическую очистку шигаподобного токсина осуществляют с использованием системы «ActaPrime Plus» (GE Healthcare, США). Гидрофобную хроматографию проводят на колонке «HiPrep Phenyl HP 16/10» (GE Healthcare, США) (3 мл/мин, посадочный буферный раствор - 0,1 М ФБР с 0,8 М сульфата аммония с рН 7,2, градиентная элюция - снижением концентрации сульфата аммония от 0,8 до 0,0 М). Ионообменная хроматография осуществляется на колонке «HiPrep DEAE FF 16/10» (GE Healthcare, США) (5 мл/мин, посадочный буферный раствор - 0,1 М трис-HCl буферный раствор с рН 6,5, градиентная элюция - повышением концентрации NaCl от 0,0 до 1,0 М), затем на колонке «HiPrep CM FF 16/10» (GE Healthcare, США) (5 мл/мин, посадочный буферный раствор - 0,05 М цитратный буферный раствор с рН 4,2, градиентная элюция - повышением концентрации NaCl от 0,0 до 1,0 М). Эксклюзионную хроматографию проводят на колонке «HiLoad 16/600 Superdex 200» (GE Healthcare, США) (1 мл/мин, 0,05 М трис-HCl буферный раствор с 0,15 М NaCl, рН 7,2). Промежуточные переводы полуфабрикатов в необходимые буферные системы осуществляли гель-фильтрацией на колонке «HiPrep 26/10 Desalting» (GE Healthcare, США) со скоростью протока 10 мл/мин.
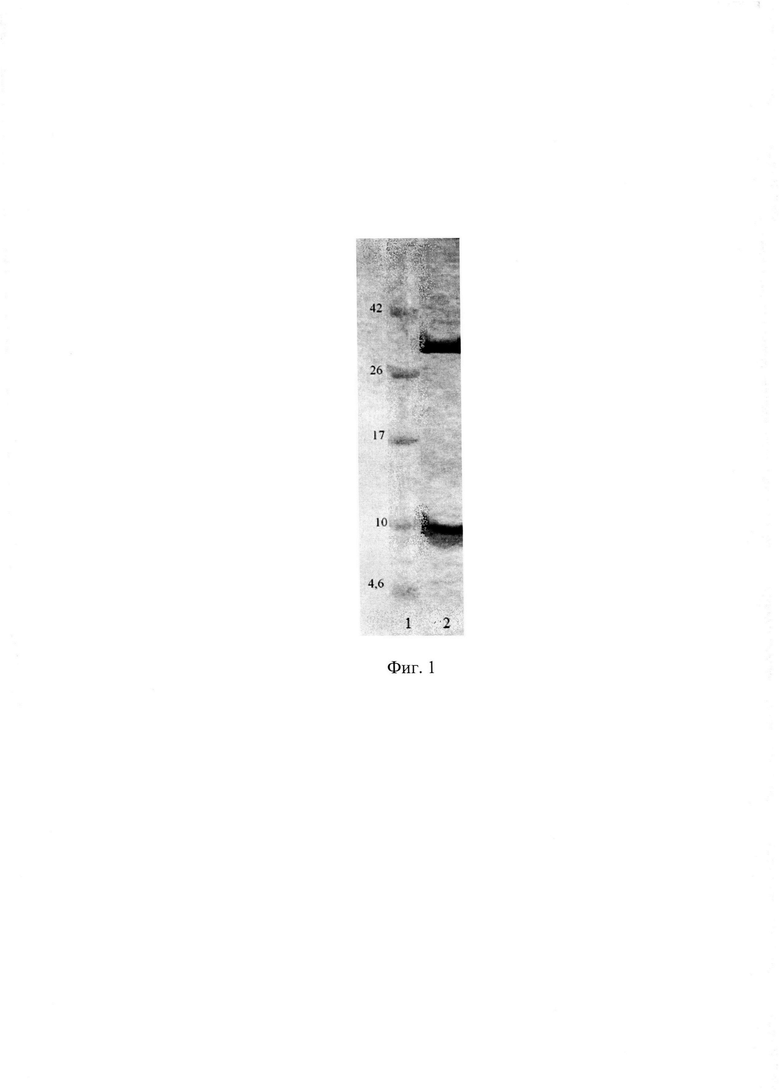
Чистоту фракций препарата шигаподобного токсина II типа оценивают методом электрофореза в полиакриламидном геле в денатурирующих условиях с добавлением 2-меркаптоэтанола. Окраску геля проводят раствором Coomassie brilliant blue R-250. Электрофореграмма исследуемого препарата представлена на фиг. 1, где на дорожке 1 нанесены маркеры молекулярных масс, а на дорожке 2 нанесен препарат шигаподобного токсина II типа. Результаты электрофореза показывают высокую чистоту исследуемого токсинного препарата, а молекулярные массы субъединиц, из которых он состоит, примерно равны 8 и 30 кДа, что соответствует данным литературы о строении шигаподобного токсина II типа.
Специфическую активность препарата шигаподобного токсина контролируют в иммуноферментном тесте RIDASCREEN® Verotoxin (R-Biopharm AG, Германия) и в иммунохроматографическом экспересс-тесте DUOPATH® Verotoxin (Merck Millipore, США) в соответствии с инструкциями производителей. Концентрацию белка определяют по методу Лоури.
Иммунизация лабораторных животных
Для иммунизации используют препарат шигаподобного анатоксина II типа. Для его приготовления к смеси сорбированного на геле гидроксида алюминия шигаподобного токсина добавляют 2,5% раствор глютарового альдегида из расчета 50 мкл на 1 мг белка. Полученную смесь выдерживают при температуре 22°С в течение 30 мин при постоянном перемешивании, а затем при температуре 4°С в течение 12 ч.
Мышей линии BALB/c иммунизируют препаратом шигаподобного анатоксина II типа по схеме: подкожное введение отобранной группе мышей препарата шигаподобного анатоксина II типа в дозе 10 мкг на мышь, интервал 7 суток; подкожное введение отобранной группе мышей препарата шигаподобного анатоксина II типа в дозе 20 мкг на мышь, интервал 7 суток; подкожное введение отобранной группе мышей препарата шигаподобного анатоксина II типа в дозе 40 мкг на мышь.
Кровь иммунизированных мышей отбирают на 10 сутки после заключительной инъекции. Титры специфических антител в полученных сыворотках определяют в непрямом твердофазном ИФА. За 4 дня до проведения гибридизации мышам с наибольшими титрами антител делают внутрибрюшинную бустерную инъекцию препарата шигаподобного анатоксина II типа в 0,9% растворе натрия хлорида в дозе 40 мкг на мышь.
Гибридизация
Гибридизация проводится по методике G.Kohler и C.Milstein в модификации De St.Fazekas и D.Scheidegger. Животных умерщвляют дислокацией шейных позвонков, извлекают селезенки, выделяют спленоциты путем перфузии селезенок средой RPMI-1640 и проводят процедуру слияния (гибридизации) спленоцитов иммунных мышей с клетками мышиной миеломы Sp2/0-Ag14 (ATCCOCRL-1581™) в количественном соотношении 1:10, соответственно. В качестве агента для слияния применяют 50% раствор ПЭГ с молекулярной массой 1450 (Sigma-Aldrich, США). Слившиеся клетки рассевают в лунки 96-луночных культуральных планшетов (ТРР, Швейцария) с двухдневным фидерным слоем, состоящим из перитонеальных мышиных макрофагов. Культивирование полученных гибридных клеток осуществляют в СО2-инкубаторе (Lamsystems, Россия) при температуре 37°С во влажной атмосфере, содержащей 5% углекислого газа, в среде RPMI-1640 (Sigma-Aldrich, США) с 20% фетальной телячьей сыворотки (Биолот, Россия), 2 мМ L-глютамина (Gibco, Германия), 1 мМ пирувата натрия (Sigma-Aldrich, США) и 80 мг/л гентамицина.
Селекция
Селекцию полученных гибридных клеток проводят в ростовой среде, содержащей однократный раствор гипоксантина-аминоптерина-тимидина (HAT), (Sigma-Aldrich, США). После 10 суток культивирования селекционную среду заменяют на более щадящую среду с 2 мМ гипоксантина и 2 мМ тимидина (Sigma-Aldrich, США), а после 20 суток культуры поддерживают на среде RPMI-1640 с 10% фетальной телячьей сыворотки без селекционных добавок.
Скрининг гибридных клеток
Отбор положительных гибридных клеток, продуцирующих специфичные МКАТ, осуществляют методом непрямого твердофазного ИФА. Для проведения ИФА в лунки планшета MAXISORP NUNC-IMMUNO PLATE (Thermo Scientific, США) вносят по 100 мкл препарата шигаподобного токсина II типа в концентрации 10 мкг/мл в 0,05 М карбонатно-бикарбонатном буферном растворе с рН 9,6 и инкубируют при температуре 4°С в течение 18 ч. Трижды отмывают 0,01 М PBS с добавлением 0,05% Tween 20 (Merck, Германия) (PBS-T), каждый раз внося в лунки планшета по 300 мкл отмывающего раствора. Затем в лунки вносят по 100 мкл супернатантов культуральных жидкостей тестируемых гибридных клеток и среду культивирования (отрицательный контроль, К-), инкубируют при 37°С на планшетном орбитальном шейкере (Elmi, Латвия) при скорости вращения платформы 400 оборотов в 1 мин в течение 1 ч. Все исследуемые точки дублируются не менее чем в трех повторностях. После этого лунки планшета трижды отмывают раствором PBS-T и добавляют в лунки по 100 мкл кроличьих антител к IgG мыши, конъюгированных с пероксидазой хрена (Sigma-Aldrich, США) в рабочем разведении в соответствии с инструкцией изготовителя. Планшет инкубируют 1 ч при тех же условиях, затем трижды отмывают PBS-T. После этого в лунки вносят по 100 мкл субстратно-индикаторного раствора (5 мг ортофенилендиамина, 1 мл цитратно-перекисного раствора с рН 4,7 на 10 мл дистиллированной воды). Реакцию останавливают через 20 мин добавлением в лунки по 100 мкл 1 М серной кислоты. Положительную реакцию оценивают по появлению желто-коричневого окрашивания раствора. Учет результатов проводят на планшетном фотометре (Tecan, Австрия) при длине волны 492 нм. Исследование культуральных жидкостей гибридных клеточных линий, находящихся в логарифмической фазе роста, проводят не менее трех раз с интервалом 3-4 дня. Контроль морфофункционального состояния гибридных клеток в лунках планшета проводят ежедневно с использованием инвертированного микроскопа (Биолам-1, Россия). Результаты тестирования специфической активности гибридных клеточных линий, продуцирующих МКАТ к шигаподобному токсину II типа, представлены в таблице 1.
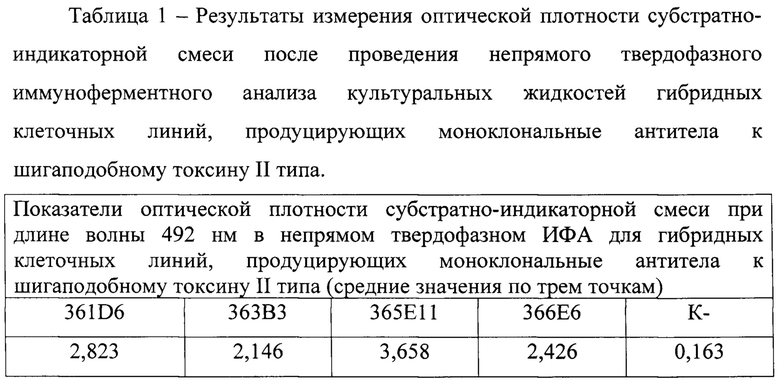
Для дальнейшей работы отобрали гибридную клеточную линию 365Е11, обладающую наилучшими продуктивными (по результатам ИФА) и культуральными свойствами (таблица 1).
Клонирование
Клонирование гибридных клеток проводят методом лимитирующих разведений (из расчета 1 клетка на лунку) в 96-луночных планшетах с фидерным слоем перитонеальных макрофагов. Скрининг клонов проводят методом непрямого твердофазного ИФА, как описано выше. Исследуют только те лунки, которые содержат моноклональную популяцию клеток. Клоны, показавшие наилучший результат в ИФА тестируют не менее трех раз с интервалом 3-4 дня. Наиболее стабильные клоны гибридных клеток подвергают криоконсервации.
Культивирование
Культивирование гибридной клеточной линии 365Е11 ведут в культуральных флаконах (ТРР, Швейцария) Т-25 и Т-75 при температуре 37°С в атмосфере 5% углекислого газа. Средой культивирования является RPMI-1640 с 10% фетальной телячьей сыворотки, 2 мМ L-глютамина, 1 мМ пирувата натрия и 80 мг/л гентамицина. Количество клеток при культивировании поддерживают в диапазоне 2⋅105-1⋅106 клеток на 1 мл. Обновление среды путем частичной замены производят ежедневно. Оценку характера и скорости роста осуществляли в инвертированном световом микроскопе.
Культивирование клона гибридной клеточной линии 365Е11 в организме животного. Для стимуляции процесса образования асцитных форм опухолей мышам-реципиентам интраперитонеально вводят по 0,5 мл пристана (Sigma-Aldrich, США). Через 14 суток вводят внутрибрюшинно не менее 2⋅106 гибридных клеток 365Е11 в среде RPMI-1640. Появление асцитов регистрируют на 7-10 сутки, а отбор асцитической жидкости производят на 10-14 сутки в соответствии со скоростью развития каждой отдельной асцитной опухоли.
Контаминация
Контаминацию культуры гибридных клеток 365Е11 бактериями и грибами исследуют бактериологическим методом - результат отрицательный.
Криоконсервация
Клон гибридных клеток 365Е11 замораживают в криопробирках объемом 1,8 мл (Thermo, США). В качестве среды для криоконсервации используют фетальную телячью сыворотку (Биолот, Россия) с 10% диметилсульфоксида (Sigma-Aldrich, США). Снятие клеток с поверхности культуральных флаконов производят потряхиванием и пипетированием. Суспензию клеток центрифугируют при 1000 оборотов в 1 мин в течение 10 мин на центрифуге 5810 R (Eppendorf, Германия), супернатант удаляют, осадок клеток ресуспендируют в среде для криоконсервации и разливают в криопробирки по 1 мл. Криопробирки охлаждают до минус 70°С со скоростью заморозки ГС в 1 мин. Длительное хранение культур осуществляют в жидком азоте. Жизнеспособность культуры гибрид омы после криоконсервации оценивают в камере Горяева после окраски 0,4% трипановым синим, после размораживания она составила 90%.
Выделение, очистка и определение субкласса МКАТ, продуцируемых гибридной клеточной линией 365Е11.
Клеточные компоненты, содержащиеся в асцитической жидкости, удаляют центрифугированием при 1000 g в течение 15 мин, надосадочную жидкость сливают и осаждают глобулиновую фракцию добавлением насыщенного раствора сульфата аммония (Thermo, США) в соотношении 1:1, выдерживают при температуре 22°С в течение 30 мин. Преципитат осаждают центрифугированием при 8000 g в течение 30 мин, супернатант удаляют. Осадок растворяют в 0,5 М растворе калия фосфорнокислого двузамещенного с рН 8,9, диализуют против 0,1 М ФБР с рН 7,5 в течение 18 ч со сменой ФБР через 2 и 6 ч. Ионообменную хроматографию проводят с использованием системы «ActaPrime Plus». Для этого в колонку «HiPrep DEAE FF 16/10», уравновешенную 0,05 M ФБР с рН 7,5, наносят образец со скоростью 3 мл/мин, иммуноглобулины элюируют при той же скорости градиентом ФБР (от 0,1 М до 0,5 М). Мониторинг проводят по оптической плотности при длине волны 280 нм.
Специфическую активность фракций элюата, содержащих МКАТ 365Е11, оценивают в непрямом твердофазном ИФА, как описано выше. Концентрацию иммуноглобулинов во фракциях определяют по методу Лоури. Фракции элюата характеризуются титрами МКАТ 1:640000 и более и содержанием белка не менее 3 мг/мл.
Для определения субкласса очищенных МКАТ 365Е11, продуцируемых одноименной гибридной клеточной линией, используют иммунохроматографический экспресс-тест IsoQuick™ (Thermo, США) согласно инструкции производителя. МКАТ 365Е11 относятся к субклассу IgG1.
Оценка диагностических свойств МКАТ, продуцируемых гибридной клеточной линией 365Е11, в отношении целевой мишени.
Для оценки диагностических свойств МКАТ, продуцируемых гибридной клеточной линией 365Е11, используют фракции иммуноглобулинов с наибольшими специфической активностью в ИФА и содержанием белка. Исследование проводят в «сэндвич»-варианте ИФА. Для этого из очищенных МКАТ синтезируют иммунопероксидазный конъюгат (ИПК) по методике перйодатного окисления.
Для проведения ИФА в лунки 96-луночного планшета вносят по 100 мкл МКАТ в концентрации 20 мкг/мл в 0,05 М карбонатно-бикарбонатном буферном растворе с рН 9,6 и инкубируют при температуре 4°С в течение 18 ч. Трижды отмывают PBS-T, каждый раз внося в лунки планшета по 300 мкл отмывающего раствора. Затем в лунки вносят по 100 мкл последовательных двукратных разведений шигаподобного токсина II типа от 64 нг/мл до 0,25 нг/мл, инкубируют при 37°С на планшетном орбитальном шейкере при скорости вращения платформы 400 оборотов в 1 мин в течение 1 ч. После этого лунки планшета трижды отмывают раствором PBS-T и добавляют в лунки по 100 мкл ИПК, разведенного PBS-T до рабочей концентрации. Свободные центры связывания блокируют добавлением в ИПК бычьего сывороточного альбумина (Диа М, Россия) до конечной концентрации 100 мкг/мл. Планшет инкубируют 1 ч в тех же условиях, затем трижды отмывают PBS-T. После этого в лунки вносят по 100 мкл субстратно-индикаторного раствора на основе ортофенилендиамина. Реакцию останавливают через 20 мин добавлением в лунки по 100 мкл 1 М серной кислоты. Положительную реакцию оценивают по появлению желто-коричневого окрашивания раствора. Учет результатов проводят на планшетном фотометре при длине волны 492 нм. Результаты ИФА считают положительными, если оптическая плотность в лунках с исследуемыми пробами превышает величину 0,3. При этом фоновые значения иммунопероксидазного конъюгата (К-) не должны превышать величину оптической плотности равную 0,15. По результатам данного ИФА была составлена таблица 2.
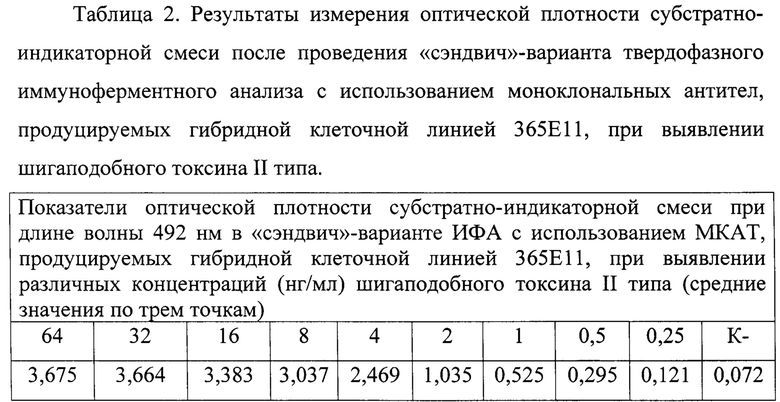
Как показывает проведенный анализ, МКАТ, продуцируемых гибридной клеточной линией 365Е11, позволяют в «сэндвич»-варианте твердофазного ИФА выявлять шигаподобный токсин II типа в концентрации 1 нг/мл и более (таблица 2).
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм гибридных культивируемых клеток животных Mus musculus 5B9 - продуцент мышиного моноклонального антитела 5B9, антитело моноклональное мышиное 5В9 и антитело рекомбинантное химерное (мышь-человек) xi5В9, нейтрализующие рицин Ricinus communis | 2022 |
|
RU2802436C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 3F11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА B | 2014 |
|
RU2566553C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 1G7 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА В | 2014 |
|
RU2571208C1 |
| Штамм гибридных культивируемых клеток животных Mus musculus 1F11PAL - продуцент мышиных моноклональных антител, специфичных к пептидогликан-ассоциированному липопротеину (PAL) Legionella pneumophila | 2018 |
|
RU2699983C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 2Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 1 К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2583306C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 3Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 2А К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2590587C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ВИРУСУ ВЕЗИКУЛЯРНОЙ БОЛЕЗНИ СВИНЕЙ ШТАММ Т-75 | 1997 |
|
RU2117700C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ВИРУСУ БОЛЕЗНИ АУЕСКИ ШТАММ УНИИЭВ 18 В | 1995 |
|
RU2092554C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК F3H10 ЖИВОТНЫХ MUS MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИФТЕРИЙНОМУ ТОКСИНУ | 2009 |
|
RU2407795C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК G10B6 ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИФТЕРИЙНОМУ ТОКСИНУ | 2009 |
|
RU2401303C1 |
Настоящее изобретение относится к области биотехнологии, в частности к штамму гибридных культивируемых клеток Mus musculus 365Е11. Данный штамм продуцирует моноклональные антитела к шигаподобному токсину II типа и депонирован в Государственной коллекции микроорганизмов ФГБУ «48 ЦНИИ» Минобороны России под номером 365Е11. Настоящее изобретение позволяет использовать гибридную клеточную линию 365Е11 для получения моноклональных антител, обеспечивающих выявление шигаподобного токсина II типа в «сэндвич»-варианте твердофазного иммуноферментного анализа. 1 ил., 2 табл., 1 пр.
Штамм гибридных культивируемых клеток животных Mus musculus 365Е11 - продуцент мышиных моноклональных антител, позволяющих выявлять шигаподобный токсин II типа в «сэндвич»-варианте твердофазного иммуноферментного анализа в концентрации 1 нг/мл и более, депонированный в Государственной коллекции микроорганизмов филиала федерального государственного бюджетного учреждения «48 Центральный научно-исследовательский институт» Министерства обороны Российской Федерации (г. Киров) под номером 365Е11.
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 2Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 1 К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2583306C1 |
| ШТАММ БАКТЕРИОФАГА Escherichia coli ECD4, ОБЛАДАЮЩИЙ ЛИТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К БАКТЕРИЯМ Escherichia coli СЕРОТИПА О104:Н4 | 2012 |
|
RU2496874C1 |
| КОТКОВА Н.В | |||
| Экспериментальная колиэнтеротоксемия, обусловленная шигаподобным токсином Escherichia coli, автореферат диссертации на соискание ученой степени кандидата ветеринарных наук, Краснодар, 2007, 21 с., с | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2022-03-24—Публикация
2020-12-21—Подача