Изобретение относится к области микробиологии и биотехнологии, конкретно к гибридомной технологии, и представляет собой клон гибридных клеток F3H10 животных Mus Musculus L., продуцирующих в клеточных культурах и брюшной полости сингенных животных моноклональные антитела (далее МКАТ) к токсину коринебактерии - возбудителя дифтерии (далее ДТ). Гибридома может быть использована в диагностических тест-системах для специфической индикации ДТ в клинических образцах.
Возбудитель дифтерии (Corynebacterium diphteriae) и продуцируемый им токсин являются причиной острого респираторного заболевания людей, нередко заканчивающегося летальным исходом. Токсин Corynebacterium diphteriae полностью определяет симптоматику дифтерии и является одним из центральных объектов мониторинга бактериальных токсинов в клинике. В настоящее время анализ токсинов приобретает большое значение в связи с угрозой эпидемий. В ряде случаев, в том числе и при заболевании дифтерией, не удается точно поставить диагноз на основании симптомов [Murray PR, Rosenthal KS, Pfaller MA. // Medical Microbiology, 6th Edition, 2009. Elsevier], в связи с чем задача лабораторной диагностики токсинов заключается в разработке тестов с максимально возможной чувствительностью и специфичностью. ДТ необходимо детектировать в концентрации, не превышающей 10 нг/мл [Pappenheimer A.M. Diphtheria toxin // Annu. Rev. Biochem. 1977. V. 46. P. 69-94].
В настоящее время для быстрой и чувствительной диагностики токсинов наиболее используемыми и достоверными являются системы на основе иммуноферментного анализа (ИФА) с использованием антител против токсинов [The EFSA Journal. 2007, V. 130. P.4-352].
Чувствительность и специфичность ИФА определяется в значительной степени качеством антител. Моноклональные антитела имеют преимущества перед поликлональными, т.к. на их основе получают стандартизованные препараты.
Для определения ДТ МКАТ используют в сэндвич-вариантах ИФА. Токсин из раствора связывается поликлональными антителами, сорбированными на твердой подложке, затем (вторым слоем) с токсином связываются детектирующие МКАТ, конъюгированные с меткой (например, с пероксидазой, фосфатазой или биотином). Концентрацию тестируемого токсина определяют по калибровочной кривой, полученной в сэндвич-варианте ИФА с токсином известной концентрации. Чувствительность определения ДТ в сэндвич-варианте ИФА достигает 0,1-4 нг/мл [Свиридов ВВ, Зайцев ЕМ, Дельвиг АА, Мазурова ИК, Семенов БФ. Применение моноклональных антител для определения дифтерийного токсина и его структурных компонентов // Молекулярная генетика, микробиология и вирусология. 1986; 1:30-35; Engler КН, Efstratiou AJ. Rapid enzyme immunoassay for determination of toxigenicity among clinical isolates of corynebacteria // J Clin Microbiol. 2000; 38(4):1385-1389]. Использование поликлональных антител может снижать воспроизводимость результатов из-за нестандартности данных препаратов.
Известен способ количественного обнаружения биологических токсинов на основе иммуноанализа с помощью биологических микрочипов. Биологический микрочип представляет собой упорядоченный массив индивидуальных микроячеек на твердой подложке, в которых иммобилизуют МКАТ к различным биотоксинам бактериального и растительного происхождения. Применение микрочипов позволяет одновременно анализировать образец на наличие нескольких биотоксинов. В микрочипе используют конкурентный вариант и сэндвич-вариант иммуноанализа. В конкурентном варианте одновременно анализируют ДТ и пять других токсинов, а именно стафилококковый токсин SeB, В-субъединицу холерного токсина, летальный фактор и протективный антиген сибиреязвенного токсина и С-фрагмент столбнячного токсина. В чипе применяют конкурентный вариант иммунофлуоресцентного анализа, в котором МКАТ к ДТ и к пяти другим токсинам (стафилококковому токсину SeB, В-субъединице холерного токсина, летальному фактору и протективному антигену сибиреязвенного токсина и С-фрагменту столбнячного токсина) локально иммобилизуют на поверхности эпоксидных слайдов. Для детекции ДТ и других токсинов используют меченные флуоресцентным красителем Alexa Fluor 532 обозначенные выше токсины в постоянной концентрации. Также в анализируемый образец вносят нативные (немеченые) токсины, которые конкурируют за места связывания на МКАТ с высокоочищенными, конъюгированными с красителем токсинами. Концентрацию тестируемого токсина определяют по калибровочной кривой, полученной в конкурентном ИФА с токсином известной концентрации. Флуоресцентные сигналы регистрируют с помощью сканера микрочипов, оборудованного диодным лазером с длиной волны возбуждения 532 нм. Чувствительность определения ДТ в биологическом чипе достигает 306 нг/мл [Rucker VC, Havenstrite KL, Herr AE. Antibody microarrays for native toxin detection // Anal Biochem. 2005; 339(2):262-270].
Известен гидрогелевый микрочип, который представляет собой упорядоченный массив трехмерных гидрогелевых ячеек на твердой подложке, полученный методом фото- или химически модифицированной полимеризации и содержащий иммобилизованные МКАТ к различным биотоксинам бактериального и растительного происхождения [патент РФ № 2216547, C07K 17/08, опубл. 2003]. Гидрогелевый микрочип предназначен для скрининга широкого круга опасных токсинов. Однако в настоящее время чип выявляет ограниченное число токсинов и, в частности, не детектирует ДТ, который представляет серьезную угрозу здоровью и жизни людей.
Известен наиболее близкий к заявляемому клон гибридных культивируемых клеток животных Mus musculus ММ ДТ 12 - продуцент моноклональных антител к ДТ класса IgG1 [Зайцев ЕМ, Свиридов ВВ, Титова НГ, Лебедев ВС, Гарипова МИ, Волгарева ГМ, Семенов БФ. Антитоксические свойства моноклональных антител к дифтерийному токсину // Молекулярная генетика, микробиология и вирусология. 1985; 2:37-41]. Клон получен в результате гибридизации спленоцитов мышей, иммунизированных коммерческим препаратом дифтерийного анатоксина (производство ЦНИИВС им. Мечникова), с клетками миеломы X63-Ag8.6. Моноклональные антитела ММ ДТ 12 связываются с В-фрагментом ДТ. Основным недостатком известного клона, продуцирующего МКАТ к ДТ, является то, что при его участии в сандвич-варианте ИФА в паре с другими МКАТ к ДТ наблюдается достаточно высокая оптическая плотность в отрицательных контрольных образцах (без токсина), по-видимому за счет неспецифического взаимодействия связывающих и проявляющих МКАТ [Свиридов ВВ, Зайцев ЕМ, Дельвиг АА, Мазурова ИК, Семенов БФ. Применение моноклональных антител для определения дифтерийного токсина и его структурных компонентов // Молекулярная генетика, микробиология и вирусология. 1986; 1:30-35].
Задачей изобретения является получение клона гибридных клеток, продуцирующих высокоспецифичные МКАТ против ДТ, не обладающих связыванием с другими бактериальными токсинами, с пределом обнаружения токсина в ИФА ниже 10 нг/мл.
Поставленная задача решается за счет клона гибридных культивируемых клеток животных Mus musculus L. F3H10 - продуцента МКАТ к ДТ.
Указанный клон гибридных культивируемых клеток животных Mus musculus L. F3H10 получают путем слияния клеток миеломы линии SP-2/0 и клеток подколенных лимфатических узлов мышей BALB/c, иммунизированных ДТ (производство ГУ НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи), при использовании в качестве сливающего агента полиэтиленгликоля с молекулярной массой 4000 и последующим отбором гибридных клеток на селективной среде: на среде Игла в модификации Дульбекко с 20% сыворотки плода коровы, 4 мМ L-глутамином, 5 мМ меркаптоэтанолом и ГАТ (0,1 мМ гипоксантином, 4×10-7 М аминоптерином, 1,6×10-5 М тимидином). Методом предельных разведений отбирают стабильные клоны, продуцирующие антитела, в непрямом ИФА специфически связывающие ДТ. На следующем этапе из клонов, продуцирующих МКАТ, специфичные к ДТ, отбирают клоны, которые в сэндвич-варианте ИФА определяют ДТ в концентрации ниже 10 нг/мл. Далее отбирают клоны, которые в микрочипе перекрестно не взаимодействуют с другими бактериальными токсинами, а именно с рицином, летальным фактором токсина Bacillus anthracis, протективным антигеном токсина Bacillus anthracis, холерным токсином, стафилококковыми токсинами SeA, SeB, SeI, SeG. Отобранный клон F3H10 продуцирует антитела, которые при детекции ДТ в сэндвич-варианте ИФА позволяют выявить ДТ в концентрации, не превышающей 10 нг/мл. В частности, чувствительность сэндвич-варианта ИФА, где в качестве проявляющих антител используются МКАТ F3H10, а в качестве связывающих антител используются МКАТ, узнающие другую антигенную детерминанту ДТ, составляет 1,3 нг/мл. Эта чувствительность сохраняется при определении ДТ в смывах носоглотки человека.
МКАТ могут быть использованы для количественного обнаружения ДТ в одновременном и параллельном анализе с рядом других биологических токсинов в формате биологического микрочипа. Чувствительность определения в формате микрочипа достигает 2 нг/мл.
Гибридома F3H10 характеризуется следующими свойствами.
1. Кариологическая характеристика.
Кариотип клеток клона F3H10 по видовой принадлежности мышиный, по модальному числу хромосом 88.
2. Морфологическая характеристика.
Клон гибридомы F3H10 представлен крупными округлыми клетками, близкими по морфологии клеткам исходной миеломной линии SP-2/0.
3. Стандартные условия выращивания in vitro.
Посевная концентрация при выращивании in vitro - (1,0-2,0)×105 кл/см3. Среда культивирования - среда Игла в модификации Дульбекко с 10% сыворотки плода коровы. Температура культивирования 37°C. Содержание CO2 в атмосфере культивирования - 5%.
4. Культуральные свойства клона.
Гибридома F3H10 является суспензионно-монослойной, около 60% клеток находятся в суспензии, не прикрепляясь к поверхности культурального сосуда, частота пассирования при посевной дозе (1,0-2,0)×105 кл/см3 - 3-4 суток. Гибридный клон не теряет способности синтезировать антитела при пассировании in vitro в течение 6 месяцев (срок наблюдения). Продуктивность клона по антителам in vitro составляет в величинах титра супернатанта в ИФА 1:10000-1:20000.
5. Культивирование гибридомы в организме животного.
Вид животного - инбредные мыши линии BALB/c. Доза клеток - 1-2×106 на одну мышь. За 10-14 дней до введения гибридомы мышам в брюшную полость вводят 0,5 мл 2,6,10,14-тетраметилпентадекана (пристана). Опухоль растет смешанным асцитно-солидным образом. Асцит образуется на 7-12 сутки в объеме от 3 до 10 мл в мыши. Перевиваемость 100%. Гибридный клон сохраняет способность продуцировать антитела на постоянном уровне (контроль по титру антител) при перевивании клеток животным на протяжении 6 пассажей (срок наблюдения). Титр МКАТ в асцитных жидкостях в ИФА составляет 1:0,5×106-1:1×106.
6. Контаминация клона.
Контаминации F3H10 бактериями, дрожжами и грибами не выявлено.
7. Биотехнологическая характеристика полезного продукта.
Антитела, продуцируемые клетками клона F3H10, относятся к классу иммуноглобулинов IgG3 по данным ИФА с типирующими моноспецифическими антисыворотками против отдельных классов иммуноглобулинов мыши. Легкие цепи МКАТ CT-F5/H3 относятся к «κ» типу.
Иммуноблотингом показано, что МКАТ F3H10 связываются с В-фрагментом ДТ.
Константа аффинности, рассчитанная по методу Битти [Beatty JD, Beatty BG and Vlahos WG: Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay // J Immnol Methods 1987; 100:173-179], составляет для МКАТ F3H10 1,3×109 м-1.
8. Способ криоконсервации.
Среда криоконсервирования содержит 90% сыворотки плода коровы и 10% криопротектора - диметилсульфоксида (ДМСО).
Режим замораживания и отогрева
Замораживание: осадок клеток, полученный после низкоскоростного центрифугирования, суспендируют в среде для криоконсервирования из расчета 1-3×106 кл в мл среды. Суспензию клеток перемешивают и разливают по 1 мл в криопробирки (Nunc). Промаркированные пробирки помещают в низкотемпературный холодильник (-70°C) на сутки, а затем в сосуд Дьюара с жидким азотом (для долгосрочного хранения). Восстановление клеток после размораживания: быстрое размораживание на водяной бане при 37°C до полного оттаивания. Затем суспензию клеток переносят в стерильную центрифужную пробирку с 10 мл культуральной среды без сыворотки. Клетки осаждают центрифугированием (10 мин при 150 г), затем осадок клеток суспендируют в среде Игла в модификации Дульбекко, содержащей 10% сыворотки плода коровы, и переносят в емкость для культивирования. Жизнеспособность клеток после криоконсервирования составляет (80±10)%.
Изобретение иллюстрируют графические материалы.
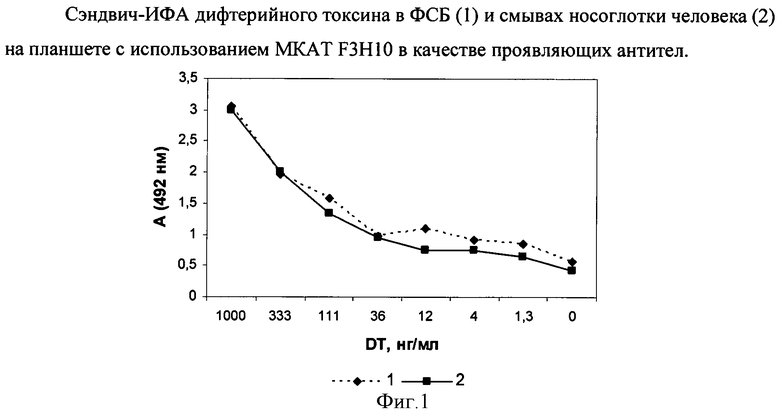
Фиг.1. Сэндвич-ИФА ДТ в ФСБ (1) и смывах носоглотки (2) на планшете с использованием МКАТ F3H10 в качестве проявляющих антител.
При анализе полученных данных оптическое поглощение (А 492 нм) рассчитывают как медиану оптического поглощения трех одинаковых ячеек микропланшета. Аналитическую чувствительность анализа, т.е. наименьшую тестируемую концентрацию ДТ, определяют как концентрацию, соответствующую значению оптического поглощения, превышающего не менее чем на два стандартных отклонения оптическое поглощение многократно измеренной нулевой точки.
Величину чувствительности определяют экспериментально, по полученным калибровочным кривым и рассчитывают следующим образом:
IF0+2·SD,
где IF0 - значение интенсивности флуоресценции для каждого измерения нулевой пробы; SD - среднее квадратичное отклонение от среднего арифметического значения IF0.
SD вычисляют по следующей формуле
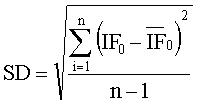 ,
,
где 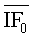 - среднее арифметическое значение интенсивности флуоресценции при измерении нулевой пробы; n - число измерений.
- среднее арифметическое значение интенсивности флуоресценции при измерении нулевой пробы; n - число измерений.
Для представленной кривой чувствительность составляет 1,3 нг/мл.
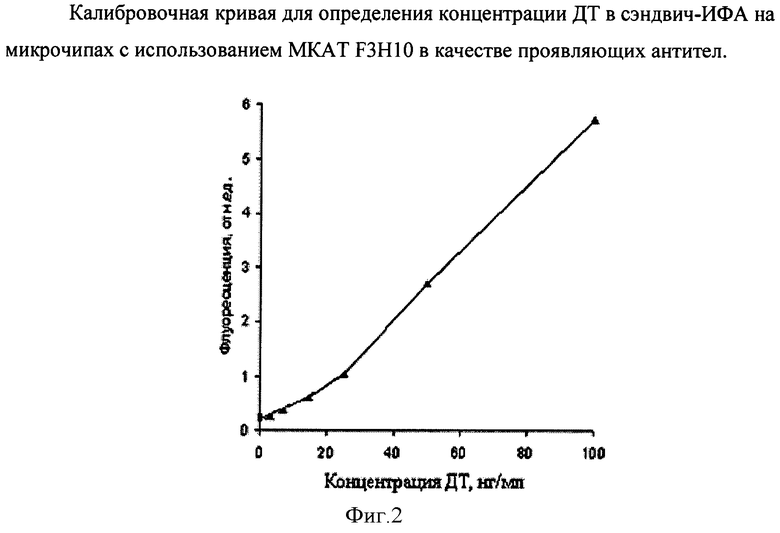
Фиг.2. Калибровочная кривая для определения концентрации ДТ в сэндвич-ИФА на микрочипах с использованием МКАТ F3H10 в качестве проявляющих антител.
Расчет интенсивности флуоресцентного сигнала от каждой ячейки биочипа и определение концентраций токсинов проводят с помощью специального программного обеспечения ImagelAssay (ИМБ, Москва). При анализе полученных данных интенсивность флуоресценции рассчитывают как медианный сигнал от четырех одинаковых гелевых ячеек.
Величину чувствительности определяют экспериментально, по полученным калибровочным кривым и рассчитывают, как указано в подписи к фиг.1. Для представленной кривой чувствительность составляет 2 нг/мл.
Изобретение иллюстрируют примеры.
Пример 1. Получение клона F3H10
Гибридому получают при слиянии мышиной миеломы SP-2/0 с клетками лимфоузлов мыши BALB/c конвенциональной категории, иммунизированной цельным ДТ (производство ГУ НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи). В первый день иммунизации токсин вводят в подушечки задних лапок мышей по 15 мкг/мышь ДТ, разведенного в 0,1 мл физиологического раствора, с добавлением 0,1 мл неполного адъюванта Фрейнда. На 14 и 28 сутки вводят ДТ в дозе 15 мкг/мышь с неполным адъювантом Фрейнда и в физиологическом растворе соответственно. Через 6 суток после последней иммунизации извлекают подколенные лимфоузлы и проводят гибридизацию 5×106 лимфоцитов мыши с 1×106 клетками миеломной линии SP-2/0 в 1 мл полиэтиленгликоля 4000 в течение 1 мин совместной инкубации.
После удаления полиэтиленгликоля центрифугированием клетки высевают на 96-луночные планшеты на слой фидерных клеток - макрофагов, выделенных из перитонеальной полости мыши инбредной линии. Селекцию гибридных клеток проводят на среде Игла в модификации Дульбекко, с 20% сыворотки плода коровы, 4 мМ L-глутамином, 5 мМ меркаптоэтанолом и ГАТ. Через 21 сутки - время полной гибели миеломных клеток, клетки гибридомы культивируют на среде без аминоптерина. Дальнейшее культивирование гибридом проводят на среде, не содержащей селективных компонентов ГАТ. 3-кратное клонирование гибридом проводят методом лимитирующих разведений в 96-луночных планшетах на слое фидерных клеток. В двух последних клонированиях процент позитивных клонов составляет 100%.
Для скрининга клонов, продуцирующих МКАТ, специфически связывающие ДТ, используют непрямой ИФА с ДТ. В лунки ИФА-планшета сорбируют ДТ при концентрации белка 1 мкг/мл в 0,1 М бикарбонатном буфере рН 9,0. В каждую лунку вносят по 100 мкл раствора антигена и инкубируют в течение ночи при 4°C. После сорбции свободные центры связывания блокируют 1% раствором бычьего сывороточного альбумина при 37°C в течение 1 ч. Лунки планшета отмывают ФСБ с 0,1% твин-20, далее вносят по 100 мкл/лунку анализируемых супернатантов, отобранных из лунок планшета, в которых растут и продуцируют антитела гибридомы. Инкубируют в течение 1 ч при 37°C. Отмывают, как описано выше, вносят по 100 мкл/лунку пероксидазного конъюгата кроличьих антител против иммуноглобулинов мыши, инкубируют 40 мин при 37°C, отмывают и вносят по 100 мкл/лунку субстрата пероксидазы: раствор орто-фенилдиамина в концентрации 1 мг/мл в 50 мМ цитратном буфере рН 4,5, содержащем 0,015% перекиси водорода. После развития окраски реакцию останавливают добавлением 100 мкл/лунку 10% серной кислоты. Интенсивность окраски регистрируют спектрофотометрически, определяя оптическое поглощение при длине волны 492 нм. Отбирают клоны, продуцирующие МКАТ, специфически связывающие ДТ.
Пример 2. Применение МКАТ F3H10 в сэндвич-варианте ИФА на ДТ
В сэндвич-варианте ИФА используют МКАТ F3H10 в качестве детектирующих антител и в качестве связывающих - МКАТ, направленные против эпитопов молекулы ДТ, с которыми не взаимодействует МКАТ F3H10. Связывающие МКАТ сорбируют первым слоем на дне ИФА-микропланшетов по 100 мкл/лунку в концентрации 10 мкг/мл. Свободные центры связывания пластика блокируют 1%-ным раствором сухого молока в течение 1 часа при 37°C. Отмывают ФСБ с 0,1% твин-20. Затем вносят анализируемые образцы в объеме 100 мкл/лунку, содержащие ДТ в различных разведениях, инкубируют 45 мин при 37°C, отмывают ФСБ с 0,1% твин-20. Вносят конъюгат детектирующих МКАТ F3H10 с биотином в объеме 100 мкл/лунку при концентрации антител 10 мкг/мл. Инкубируют 45 мин при 37°C, отмывают, вносят конъюгат стрептавидина с пероксидазой хрена, инкубируют (45 мин при 37°C) и отмывают. Затем вносят субстрат пероксидазы: раствор орто-фенилдиамина в концентрации 1 мг/мл в 50 мМ цитратном буфере рН 4,5, содержащем 0,015% перекиси водорода. Через 15 мин реакцию останавливают добавлением 10% серной кислоты. Интенсивность окраски регистрируют спектрофотометрически при длине волны 492 нм. Анализ растворов с известной концентрацией ДТ показывает, что чувствительность определения ДТ достигает 1,3 нг/мл. При инкубации ДТ с связывающими МКАТ не в ФСБ, а в присутствии смывов носоглотки человека, чувствительность определения ДТ не меняется и составляет - 1,3 нг/мл (фиг.1).
Пример 3. Количественный анализ ДТ с использованием биологического микрочипа
На гидрогелевые чипы иммобилизуют связывающие МКАТ против ДТ (как в примере 2) и МКАТ против 8 других токсинов (рицина, летального фактора токсина Bacillus anthracis, протективного антигена токсина Bacillus anthracis, холерного токсина, стафилококковых токсинов SeA, SeB, SeI, SeG). Концентрация каждого из антител в полимеризационной смеси составляет 0,8±0,2 мг/мл, объем гелевого элемента 0,1 нл. Каждый гелевый элемент содержит одно из девяти вышеназванных МКАТ, кроме того, в чип входят контрольные гелевые элементы, не содержащие антител.
Добавляют 30 мкл анализируемого образца и 30 мкл раствора биотинилированных МКАТ F3H10 и инкубируют на биочипе в течение 17 ч при 37°C. После процедуры отмывки (20 мин, ФСБ с 0,1% твин-20) добавляют флуоресцентно меченный стрептавидин, инкубируют 10 мин при 37°C, повторно отмывают и регистрируют флуоресцентные сигналы (фиг.2).
Гидрогелевые чипы получают следующим образом [патент РФ № 2216547, МКИ С07К 17/08, опубл. 2003]. Стеклянные слайды для изготовления микрочипов обрабатывают растворами 1 н NaOH, H2SO4, промывают водой, затем погружают в раствор 1% 3-метакрилоксипропилтри-метоксисилана в этиловом спирте, отмывают в этиловом спирте, воде и высушивают. Полимеризационную смесь, содержащую гелеобразующие мономеры на основе метакриламида и N-замещенных аминосахаров, а также подлежащие иммобилизации МКАТ, наносят с помощью робота QArray (Genetix, Великобритания) в виде микрокапель объемом 0,1 нл на поверхность активированной подложки. Полимеризацию гелевых ячеек проводят под лампой ультрафиолетового света с максимумом излучения 350 нм (Sylvania GTE lamp, F15T8/350Bl, Великобритания) на расстоянии 8 см от лампы, в течение 50 мин при 20°С в токе азота. При нанесении пином 150 мкм получают гелевые элементы полусферической формы диаметром 120 мкм. Биочипы после полимеризации отмывают в течение 40 мин ФСБ с 0,1% твин-20. Для уменьшения неспецифического взаимодействия реагентов с поверхностью биочипа поверхность обрабатывают блокирующим буфером в течение 1 ч, затем промывают дистиллированной водой.
Качество полученных биочипов проверяют в проходящем свете с помощью биочип-анализатора (ИМБ РАН), снабженного специальным программным обеспечением TestChip и QualityControl (ИМБ РАН). В результате проверки качества отбраковывают биочипы, для которых отклонения значений радиусов гелевых элементов превышают 5% внутри каждого биочипа и 8% между всеми биочипами данной партии.
Пример 4. Одновременный анализ нескольких биотоксинов, в том числе ДТ, на одном микрочипе
Анализ проводят как в примере 3, но биотинилированные МКАТ F3H10 вносят в смеси с биотинилированными антителами к другим токсинам (рицину, летальному фактору токсина Bacillus anthracis, протективному антигену токсина Bacillus anthracis, холерному токсину, стафилококковым токсинам SeA, SeB, SeI, SeG). Пределы обнаружения биотоксинов для параллельного анализа такие же, как и при определении каждого токсина в отдельности. Для ДТ минимально детектируемая доза составляет 2 нг/мл.
Предложенные анализы можно использовать для тестирования на наличие токсина в клинических образцах.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛОН ГИБРИДНЫХ КЛЕТОК G10B6 ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИФТЕРИЙНОМУ ТОКСИНУ | 2009 |
|
RU2401303C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401300C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401301C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401299C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS 365E11, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ШИГАПОДОБНОМУ ТОКСИНУ II ТИПА | 2020 |
|
RU2768838C1 |
| Штамм гибридных культивируемых клеток H.sapiens/Mus musculus 8D4E9-Ba-LF-продуцент человеческих моноклональных антител против летального фактора возбудителя сибирской язвы | 2018 |
|
RU2699193C1 |
| КЛОН КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. Н-24-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К СТАФИЛОКОККОВОМУ ЭНТЕРОТОКСИНУ Н (SEH) | 2016 |
|
RU2616289C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 2Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 1 К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2583306C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 1E6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К СПОРАМ Bacillus anthracis | 2010 |
|
RU2439148C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 3F11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА B | 2014 |
|
RU2566553C1 |
Изобретение касается нового клона гибридных клеток F3H10, продуцирующих в условиях клеточной культуры и брюшной полости сингенных животных моноклональные антитела к дифтерийному токсину. Клон получен путем слияния клеток мышиной миеломы SP-2/0 с клетками подколенных лимфоузлов мышей линии BALB/c, иммунизированных в подушечки задних лапок препаратом дифтерийного токсина (производство ГУ НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи). В качестве сливающего агента был использован полиэтиленгликоль с молекулярной массой 4000. Селекция гибридомы проведена на среде Игла в модификации Дульбекко с добавлением сыворотки плода коровы и гипоксантина-аминоптерина-тимидина. Гибридома синтезирует моноклональные антитела, специфически взаимодействующие с дифтерийным токсином и которые относятся к классу IgG по данным ИФА с типирующими антисыворотками против отдельных классов Ig мыши. Титр антител достигает в культуральной жидкости 1:10000 - 1:20000, в асцитной 1:1000000. Антитела могут быть использованы для конструирования иммунобиологических тест-систем детекции дифтерийного токсина, превосходящих по чувствительности, специфичности и воспроизводимости аналоги. 2 ил.
Клон гибридных культивируемых клеток животных Mus musculus L. F3H10 - продуцент моноклональных антител к дифтерийному токсину.
| Зайцев Е.М | |||
| с соавт | |||
| Антитоксические свойства моноклональных антител к дифтерийному токсину | |||
| Молекулярная генетика, микробиология и вирусология, 1985 г., 2, с.37-41 | |||
| СПОСОБ ВЫЯВЛЕНИЯ ДИФТЕРИЙНОГО ТОКСИНА | 1996 |
|
RU2127886C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ДИФТЕРИИ У ДЕТЕЙ | 1995 |
|
RU2129276C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭКЗОТОКСИНА КОРИНЕБАКТЕРИЙ ДИФТЕРИИ В КРОВИ БОЛЬНЫХ С ТОКСИЧЕСКОЙ ФОРМОЙ ДИФТЕРИЙНОЙ ИНФЕКЦИИ | 1993 |
|
RU2087911C1 |
Авторы
Даты
2010-12-27—Публикация
2009-06-18—Подача