Группа изобретений относится к области биохимии и фармакологии, а именно к лекарственным средствам на основе пептидов, улучшающих функциональные свойства эндотелия сосудов при их нарушении различного генеза, в том числе атеросклерозе.
Заболевания сердечно-сосудистой системы, связанные с атеросклерозом и рестенозом, являются основными причинами инвалидности и смертности в развитых странах. Согласно оценкам Всемирной организации здравоохранения, в ближайшее десятилетие они угрожают стать основной причиной смертности в развивающихся странах. Атеросклероз является хроническим воспалительно-метаболическим заболеванием, развивающимся с нарушением сложных взаимодействий между несколькими типами клеток в сосудистой стенке [Гаврилова Н.Е., Метельская В.А., Перова Н.В., Яровая Е.Б., Мазаев В.П., Уразалина С.Ж., Бойцов С.А. Взаимосвязь между выраженностью коронарного атеросклероза, факторами риска и маркерами атеросклеротического поражения каротидных и периферических артерий // Кардиоваскулярная терапия и профилактика. 2013. Т. 12. № 1. С. 40-45]. Одной из возможных причин атеросклероза является эндотелиальная дисфункция. В настоящее время для лечения атеросклероза сосудов используют препараты из группы статинов, такие как Ловастатин, Аторвастатин и другие [Справочник лекарственных средств VIDAL (рег. №: П N012626/01 от 23.08.10) http://www.vidal.ru/]. Все указанные препараты на основе статинов имеют сходный механизм действия и побочные эффекты. Лованстатин - гиполипидемическое средство из группы статинов, ингибитор ГМГ-КоА-редуктазы. Является пролекарством, поскольку имеет в своей структуре закрытое лактоновое кольцо, которое после поступления в организм гидролизуется. Лактоновое кольцо статинов по своей структуре схоже с частью фермента ГМГ-КоА-редуктазы. По принципу конкурентного антагонизма молекула статина связывается с той частью рецептора коэнзима А, где прикрепляется этот фермент. Другая часть молекулы статина ингибирует процесс превращения гидроксиметилглутарата в мевалонат, промежуточный продукт в синтезе молекулы холестерина. Ингибирование активности ГМГ-КоА-редуктазы приводит к серии последовательных реакций, в результате которых снижается внутриклеточное содержание холестерина и происходит компенсаторное повышение активности липопротеинов низкой плотности (ЛПНП) и соответственно ускорение катаболизма холестерина (Xc). Гиполипидемический эффект статинов связан со снижением уровня общего Хс. Однако в настоящее время ведущей гипотезой развития атеросклероза является эндотелиальная дисфункция, тогда как нарушение метаболизма липопротеинов, в том числе ЛПНП, интерпретируется как вторичное проявление этого заболевания. Таким образом, препараты из группы статинов не могут устранить эндотелиальную дисфункцию, являющуюся причиной атеросклероза. Кроме того, применение Ловастатина имеет ряд побочных эффектов со стороны сердечно-сосудистой, центральной нервной, пищеварительной, костно-мышечной систем, половой и выделительной систем. В связи с этим поиск новых эффективных и безопасных средств лечения сердечно-сосудистых заболеваний актуален.
Настоящее изобретение направлено на решение задачи получения пептида, обладающего способностью улучшать функциональную активность эндотелия сосудов, проявляющейся в активации пролиферации, защитных свойств эндотелиальных клеток, снижении апоптоза, и применения этого пептида для изготовления фармацевтической композиции, улучшающей функциональные свойства эндотелия сосудов.
Технический результат изобретения заключается в том, что предлагается применение пептида β-аспартил-аланина формулы H-Asp(Ala)-OH для улучшения функциональной активности эндотелия сосудов, а также для изготовления фармацевтической композиции, улучшающей функциональную активность эндотелия сосудов за счет регуляции пролиферации, апоптоза и функциональных свойств клеток эндотелия сосудов.
Обнаружено, что пептид β-аспартил-аланин формулы H-Asp(Ala)-OH обладает вазопротекторной биологической активностью за счёт активации пролиферации, защитных свойств эндотелиальных клеток, снижения апоптоза, при этом действие пептида имеет геропротекторный характер, выражающийся в предотвращении атеросклеротических изменений в эндотелии. Также было обнаружено, что применение пептида H-Asp(Ala)-OH нивелирует действие цитотоксических веществ на клетки эндотелия сосудов.
Предлагается применение пептида β-аспартил-аланина формулы H-Asp(Ala)-OH для приготовления лекарственного средства, улучшающего функциональные свойства эндотелия сосудов.
Другой аспект настоящего изобретения относится к фармацевтической композиции, улучшающей функциональные свойства эндотелия сосудов, содержащей в качестве активного начала эффективное количество пептида β-аспартил-аланина формулы H-Asp(Ala)-OH и фармацевтически приемлемый носитель.
При этом фармацевтическая композиция находится в форме, подходящей для парентерального, перорального, интраназального или местного способа введения.
Следующий аспект настоящего изобретения касается способа профилактики и лечения эндотелиальной дисфункции, в том числе при атеросклерозе сосудов, заключающегося во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид формулы H-Asp(Ala)-OH, в дозах 0,1-10 мкг/кг массы тела по крайней мере один раз в день при внутримышечном введении, 1-10 мкг/кг массы тела по крайней мере один раз в день при интраназальном введении и 10-100 мкг/кг массы тела по крайней мере два раза в день при пероральном введении в течение периода, необходимого для достижения терапевтического эффекта – не менее 30 дней.
Пептид β-аспартил-аланин формулы H-Asp(Ala)-OH получают классическим методом пептидного синтеза в растворе.
Регулирующее действие пептида H-Asp(Ala)-OH на пролиферацию, апоптоз и функциональную активность клеток эндотелия сосудов выявлено при его экспериментальном изучении.
Изучение биологической активности проводили в органотипических и диссоциированных культурах эндотелия сосудов крыс и человека в норме, при старении и атеросклерозе.
Понятие «фармацевтическая композиция» подразумевает различные лекарственные формы, содержащие эффективное количество пептида H-Asp(Ala)-OH, которые могут найти лечебное применение в медицине в качестве средства, стимулирующего функции эндотелия сосудов.
Для получения фармацевтических композиций по настоящему изобретению эффективное количество пептида H-Asp(Ala)-OH в качестве активного начала смешивают с фармацевтически приемлемыми носителями согласно принятым в фармацевтике способам компаундирования [см., например, Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов / А.С. Гаврилов - М.: ГЭОТАР-Медиа, 2016. - 760 с.; Краснюк И.И. Фармацевтическая технология. Технология лекарственных форм: учебник / И.И. Краснюк, Г.В. Михайлова, Л.И. Мурадова. - М.: ГЭОТАР-Медиа, 2016. - 560 с.; Технология изготовления лекарственных форм: учебник / В. А. Гроссман - М.: ГЭОТАР-Медиа, 2018. - 336 с.; Фармацевтическая технология. Изготовление лекарственных препаратов [Электронный ресурс]: учеб. пособие / Лойд В. Аллен, А.С. Гаврилов. - М.: ГЭОТАР-Медиа, 2014. - 512 с.; Контроль качества лекарственных средств [Электронный ресурс]: учебник / под ред. Т.В. Плетенёвой - М.: ГЭОТАР-Медиа, 2014. - 560 с.; Фармацевтическая технология. Технология лекарственных форм [Электронный ресурс]: учебник / И.И. Краснюк, Г.В. Михайлова, Л.И. Мурадова. - М.: ГЭОТАР-Медиа, 2013. - 560 с.].
Понятие «эффективное количество» подразумевает использование такого количества активного начала, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в лекарственной форме.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм.
Сущность изобретения иллюстрируется следующими графическими материалами:
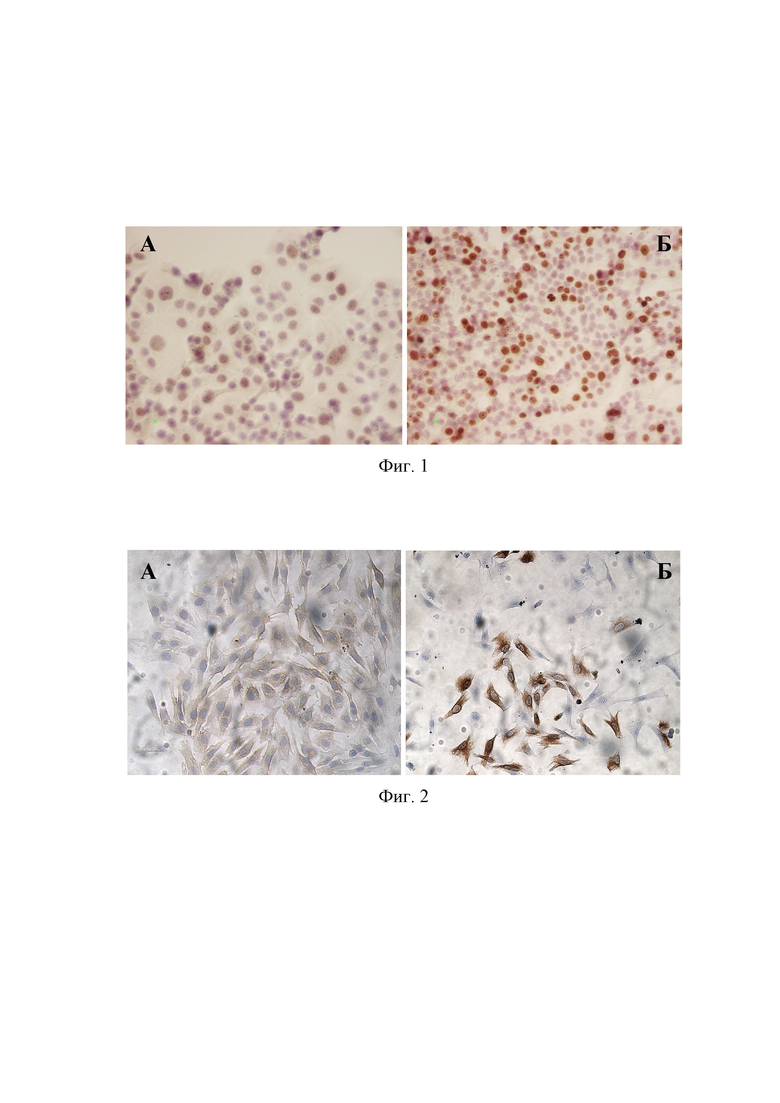
На Фигуре 1 показано влияние пептида H-Asp(Ala)-OH на экспрессию маркера пролиферации Ki67 в культуре клеток пуповины человека, 3 пассаж: А – контроль, Б – пептид H-Asp(Ala)-OH, иммуноцитохимическое окрашивание с докраской ядер гематоксилином, х 200.
На Фигуре 2 показано влияние пептида H-Asp(Ala)-OH на экспрессию маркера Cx43 в культуре клеток эндотелия пуповины человека, 3 пассаж: А – контроль, Б – пептид H-Asp(Ala)-OH, иммуноцитохимическое окрашивание с докраской ядер гематоксилином, х 400.
Изобретение иллюстрируется примером синтеза пептида β-аспартил-аланин общей формулы H-Asp(Ala)-OH (пример 1), примером испытания токсичности (пример 2), оценки биологической активности и механизма действия пептида в культурах эндотелиоцитов крыс и человека в норме, при старении и атеросклерозе (примеры 3-4), демонстрирующими его фармакологические свойства и подтверждающими возможность получения профилактического и/или лечебного эффекта (пример 5), примером эффективности применения фармацевтической композиции на основе пептида β-аспартил-аланина формулы H-Asp(Ala)-OH для улучшения функции сосудов у больных цереброваскулярной болезнью (пример 6).
Пример 1. Синтез пептида H-Asp(Ala)-OH
Название соединения: β-аспартил-аланин
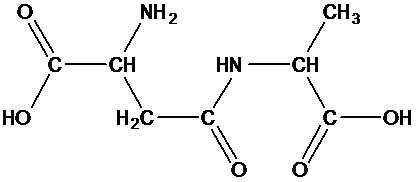
Структурная формула: H-Asp(Ala)-OH
Брутто-формула: C7H12N2O5
Молекулярный вес без противоиона: 204,18
Противоион - ацетат
Внешний вид: белый аморфный порошок без запаха
Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме:
Характеристика готового препарата
Растворимость: растворим в воде, изотоническом растворе натрия хлорида 0,9%; нерастворим в спирте 95%, хлороформе, эфире и других органических растворителях.
Прозрачность и цветность раствора: раствор 0,05 г препарата в 10 мл воды прозрачен и бесцветен.
- рН 0,001% раствора: 4,0-5,0 (потенциометрически);
- содержание влаги: не более 10 %;
- удельное оптическое вращение: [α]D22: от -50 ° до -54 ° (c=1, H2O);
- содержание основного вещества по ВЭЖХ: не менее 97%;
- тонкослойная хроматография: ТСХ-индивидуален, Rf = 0,82 (ацетонитрил-вода 1:3).
Пример синтеза
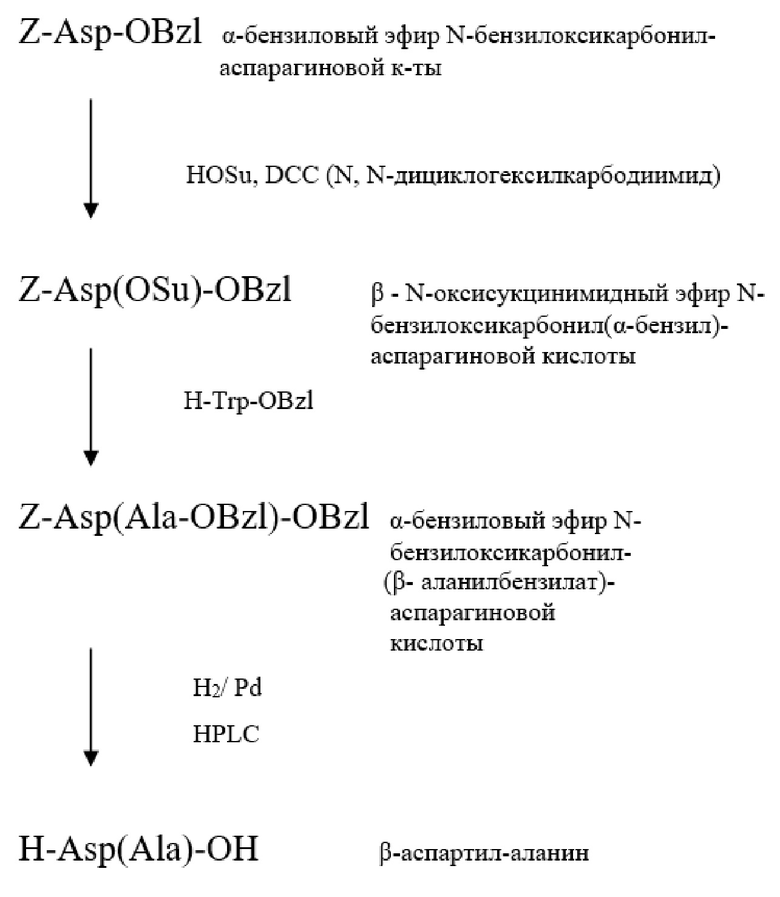
1. Z-Asp(OSu)-OH (I), β-N-оксисукцинимидный эфир N-бензилоксикарбонил(α-бензил)-аспарагиновой кислоты. 2,21 г (6,2 ммоль) мелкоизмельченного порошка N-бензилоксикарбонил(α-бензил)-аспарагиновой кислоты растворяют в 50 мл диметилформамида и добавляют 0,71 г (6,2 ммоль) мелкоизмельченного порошка N-оксисукцинимида. 1,27 г (6,2 ммоль) порошка N, N'-дициклогексилкарбодиимида растворяют в 20 мл диметилформамида. Оба раствора охлаждают до температуры –15°С. Растворы объединяют и перемешивают при охлаждении льдом в течение 24 часов. Полученный раствор активированного эфира используют на следующей стадии.
2. Z-Asp(Ala-OBzl)-OBzl (II), α-бензиловый эфир N-бензилоксикарбонил-(β- ала-нилбензилат)-аспарагиновой кислоты. К раствору активированного эфира Z-Asp(OSu)-OBzl (I), полученного на предыдущей стадии, добавляют 1,34 г (6,2 ммоль) мелкоизмельченного порошка тозилата бензилового эфира аланина и 0,86 мл триэтиламина. Перемешивают реакционную смесь при комнатной температуре в течение 2 суток. Затем в реакционную смесь при перемешивании постепенно вливают 150 мл 2 н раствора серной кислоты, продукт выпадает в виде масла, который затем растворяют в 50 мл этилацетата.
Затем содержимое реакционной колбы расслаивают в делительной воронке, нижнюю водную фазу сливают в стакан вместимостью 250 мл, а верхнюю органическую фазу - в стакан вместимостью 500 мл. Процедуру повторяют трижды с новыми порциями этилацетата (по 30 мл), затем все этилацетатные порции объединяют в исходной делительной воронке, в которую добавляют 20 мл 2 н раствора серной кислоты и осуществляют экстракцию, повторяя процедуру дважды. Затем этилацетатный раствор промывают последовательно водой (30 мл), дважды раствором бикарбоната натрия (30 мл), дважды раствором серной кислоты (30 мл) и водой (30 мл). Затем в этилацетатный раствор добавляют около 20 мг безводного сульфата натрия и оставляют на 10-12 часов.
Отфильтрованный этилацетатный раствор упаривают в вакууме при температуре не выше 40°С на вакуумном роторном испарителе (Buchi Rotavapor R-114 или аналогичном) до прекращения отгонки растворителя и образования на дне колбы густого сиропа, который растворяют в 20 мл этилацетата, добавляя к раствору при постоянном перемешивании порциями гексан до появления устойчивой мути (около 20 мл). Колбу с полученной мутной системой оставляют в холодильнике при температуре 4°С в течение не менее 2 суток для завершения процесса кристаллизации.
Выпавший кристаллический продукт отфильтровывают под вакуумом через пористый фильтр Шота, 2 раза промывают гексаном (5 мл), далее продукт переносят в чашку Петри без крышки. Окончательно продукт высушивают над пятиокисью фосфора в вакууме при температуре не выше 40°С до постоянного веса.
3. H-Asp(Ala)-OH (III), β-аспартил-аланин. α-Бензиловый эфир N- бензилоксикарбонил-(β-аланилбензилат)-аспарагиновой кислоты (II), полученный на предыдущей стадии, растворяют в смеси метанола (60 мл), дистиллированной воды (20 мл) и уксусной кислоты (20 мл) в присутствии 3 мл катализатора палладия на угле (Pd/C).
Контроль за полнотой деблокирования проводят в режиме ТСХ на пластинках Silufol в системе бензол-ацетон (2:1), деблокированный продукт имеет нулевую подвижность, исходный продукт имеет Rf=0,86. Реакция деблокирования считается законченной, если имеются только следовые количества исходного продукта (визуально).
Объединенный фильтрат упаривают в вакууме при температуре не выше 40°С.
Для очистки 290 мг препарата растворяют в 4 мл 0,01 % трифторуксусной кислоты и подвергают высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50×250 мм Diasorb-130-C16T, 7 мкм. Хроматограф Beckman System Gold, 126 Solvent Module,168 Diode Array Detector Module. Условия хроматографирования - А: 0,1% трифторуксусная кислота; В: 50% раствор ацетонитрила в 0,1% трифторуксусной кислоте; градиент В 0 → 5% за 80 мин. Объем пробы 5 мл, детекция при длине волны 215 нм, сканирование при длинах волн 190-600 нм, скорость потока 10 мл/мин.
Отбирают фракции основного пика, свободного от примесей (в примерном интервале 48,0 мин. - 60,0 мин), объединяют их и упаривают в вакууме до образования сиропа, повторяя упаривание ещё 5 раз каждый раз с новой порцией (10 мл) 10% уксусной кислоты. Остаток в колбе сушат в вакууме при температуре не выше 40°С над твердым КОН в течение не менее 2 суток. После сушки продукт не должен иметь запаха.
После упаривания и сушки в вакууме остаток растворяют в 20 мл деионизованной воды и лиофилизируют.
4. Анализ готового препарата
- Содержание основного вещества определяют методом ВЭЖХ на колонке Phenomenex C 18 LUNA 4,6×150 mm. A: 0,1% TFA, B: MeCN; градиент B 0-100% за 10 мин. Скорость потока 1 мл/ мин. Детекция при длине волны 220 нм, сканирование при длинах волн 190-600 нм, проба 20 мкл. Содержание основного вещества не менее 97%.
- ТСХ: на хроматограммах образцов, обработанных раствором нингидрина, допускается наличие только двух пятен (препарата и ГСО) фиолетового цвета с совпадающими Rf; на хроматограммах образцов, обработанных раствором бензидина, допускается наличие только двух пятен (препарата и ГСО) темно-синего цвета с совпадающими Rf (ацетонитрил-вода 1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
- Содержание влаги: не более 10% (гравиметрически по потере массы при сушке 20 мг при температуре 100 °C).
- рН 0,01% раствора: от 4,0 до 5,0 (потенциометрически).
- Удельное оптическое вращение: от –50° до –54° в пересчете на сухое вещество (0,1% водный раствор, температура 23 °С, D-линия спектра натрия).
Пример 2. Изучение токсичности пептида H-Asp(Ala)-OH
Общетоксическое действие пептида исследовали в соответствии с требованиями «Руководства по проведению доклинических исследований лекарственных средств. ФГБУ «НЦЭСМП» Минздравсоцразвития России. Часть 1» (Москва, Гриф и К, 2012. 944 с.) острой токсичности при однократном введении препарата, а также хронической токсичности при длительном введении пептида.
Исследование острой токсичности проведено на 110 белых беспородных мышах-самцах с массой тела 20-24 г. Животные были рандомизированно разделены на 11 равных групп по 10 животных в каждой группе. Препарат вводили животным однократно внутримышечно или внутрижелудочно (через зонд) в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг (в несколько тысяч раз превышающих терапевтическую дозу (ТД), рекомендуемую для клинического изучения, которая составляет 0,0014 мг/кг) в объеме 0,25 мл изотонического 0,9% раствора натрия хлорида. Животным контрольной группы в том же объеме вводили 0,9% раствор NaCl.
В течение 72 часов и далее через 14 суток ни в одной группе животных гибели мышей не обнаружено. Не отмечено каких-либо изменений общего состояния, поведения, двигательной активности, волосяного и кожного покрова, физиологических отправлений животных.
Таким образом, дипептид H-Asp(Ala)-OH в дозах, превышающих терапевтическую, рекомендуемую для клинических испытаний, в несколько тысяч раз, не вызывает острых токсических реакций при внутримышечном или внутрижелудочном введении, что указывает на большую терапевтическую широту препарата.
Хроническую токсичность дипептида H-Asp(Ala)-OH, полученного заявляемым способом, изучали при длительном введении его крысам с массой тела 150-250 мг. Животным ежедневно вводили внутримышечно или внутрижелудочно (через зонд) препарат в дозах 0,1 мг/кг (70 ТД), 1,0 мг/кг (700 ТД), 3 мг/кг (2000 ТД) в 0,5 мл физиологического раствора в течение 30 дней. Наблюдение за животными вели в течение 60 дней после начала эксперимента. Отмечали поведение животных, потребление корма и воды, состояние волосяного покрова и слизистых оболочек. Взвешивание животных проводилось еженедельно. В начале и при завершении эксперимента проводили гематологические и биохимические исследования. Оценивали функции сердечно-сосудистой системы, печени, поджелудочной железы, почек и надпочечников. После окончания введения препарата животных подвергали патоморфологическому исследованию с целью оценки состояния различных отделов головного и спинного мозга, сердца, аорты, легких, печени, почек, органов эндокринной и иммунной систем.
При оценке общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены.
Изучение подострой и хронической токсичности дипептида H-Asp(Ala)-OH свидетельствует об отсутствии побочных эффектов при длительном применении препарата внутримышечно или внутрижелудочно в дозах, превышающих терапевтическую в 70-2000 раз.
Пример 3. Влияние пептида H-Asp(Ala)-OH на пролиферацию, апоптоз и активацию защитных свойств эндотелиоцитов сосудов крыс в органотипической и диссоциированной культурах
Органотипическое культивирование ткани сосудов (аорты) молодых 3-месячных (n=60) и старых 20-месячных крыс линии Wistar (n=60) проводили в питательной среде следующего состава из расчёта на 100 мл: раствор Хенкса 38 мл, среда Игла 36 мл, фетальная бычья сыворотка 25 мл, глюкоза 40% - 1,0 мл, гентамицин 100 Ед/мл. После извлечения сосудов их помещали в стерильную чашку Петри и разделяли на эксплантаты (фрагменты величиной около 1 мм3). Эксплантаты культивировали в течение 3 суток в 3 мл питательной среды в СО2-инкубаторе при температуре 36,7 °С в среде с 5% содержанием СО2. Пептид H-Asp(Ala)-OH добавляли в культуры в концентрации 0,05 нг/мл, т.к. ранее она оказалась наиболее эффективной в этом эксперименте. В контрольные культуры добавляли аналогичное количество питательной среды. Для моделирования цитотоксического воздействия использовали циклофосфан (ЦФ), который добавляли в культуры в концентрации 2 мг/мл.
В эксплантатах сосудов после 3 суток культивирования определялись две зоны: центральная и периферическая. Центральная зона была представлена клетками, исходно размещёнными на коллагеновой подложке. Периферическая зона (зона роста) состояла из выселившихся по окружности вновь образованных клеток. Для количественной оценки роста эксплантатов определялся индекс площади (ИП). Это отношение площади всего эксплантата к площади центральной зоны.
Диссоциированную культуру клеток сосудов получали из аорты молодой крысы лини Wistar (3 мес). Кусочки аорты подвергали действию 0,2% коллагеназы II в течение 10 минут при температуре 37°С в термостате и центрифугировали в течение 5 мин при 400 g. В клетки добавляли 2 мл среды RPMI c добавлением 20% фетальной бычьей сыворотки, HEPES 1,5% и антибиотиков 50 000 ЕД/фл пенициллина G и 50 мг/фл стрептомицина. Клетки выращивали во флаконах с обработанной поверхностью вместимостью 50 мл в 5 мл культуральной среды (20% фетальной бычьей сыворотки, 82,5% RPMI, 1,5% НЕРЕS, L-глутамин) при температуре 36,7°С в среде с 5% содержанием СО2. Через 5-7 дней, когда первичная культура достигала монослоя, проводилась процедура ее пересеивания в концентрации 5х103 клеток на флакон вместимостью 50 мл. При каждом пересеве раствор с пептидами добавляли в культуральную среду в концентрации 100 нг/мл. Пассирование проводили через 3 дня на четвертый, когда культура достигала монослоя. Культивирование проводили до 3 пассажа.
Для иммуноцитохимического исследования органотипических и диссоциированных культур клеток сосудов клетки фиксировали 96% спиртом. Блокаду эндогенной пероксидазы проводили 3% водным раствором перекиси водорода в течение 15 мин. Пермеабилизацию мембран клеток проводили 0,5% раствором Triton Х100. Затем использовали первичные моноклональные антитела к маркерам CXCL12 (1:200, Vectorlab), Ki67 (1:150, Vectorlab), p53 (1:50, Dako). Инкубацию со вторичными антителами, конъюгированными с пероксидазой хрена (EnVision Detection System, Peroxidase/DAB, Rabbit, Mouse), проводили в течение 30 минут. Для оценки результатов иммуноцитохимического окрашивания проводили морфометрическое исследование с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Nikon Eclipse E400, цифровой камеры Nikon DXM1200, персонального компьютера на базе Intel Pentium 4 и программы «Видеотест-Морфология 5.2». В каждом случае анализировали 5 полей зрения при увеличении 100. Площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Этот параметр характеризует количество клеток, в которых экспрессируется исследуемый маркер.
Статистическая обработка данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилось в программе Statistica. Для анализа вида распределения использовали критерий Шапиро-Уилка. Для проверки статистической однородности нескольких выборок были использованы непараметрические процедуры однофакторного дисперсионного анализа (критерий Крускала–Уоллиса). Критический уровень достоверности нулевой гипотезы принимали равным 0,05.
В органотипических культурах клеток сосудов молодых крыс под действием пептида H-Asp(Ala)-OH ИП достоверно повышался по сравнению с контролем на 29±1% (р<0,05), а в органотипических культурах клеток сосудов старых крыс под действием пептида H-Asp(Ala)-OH ИП повышался по сравнению с контролем на 56±2%. Введение в культуральную среду ЦФ приводило к уменьшению ИП эксплантатов, полученных от молодых и старых крыс, на 16% и 18% соответственно. Одновременное добавление в органотипические культуры сосудов молодых и старых крыс ЦФ и пептида H-Asp(Ala)-OH приводило к повышению ИП до уровня контрольных значений, что свидетельствует о нивелировании цитотоксического действия ЦФ.
Пептид H-Asp(Ala)-OH не влиял на площадь экспрессии маркера пролиферации Ki67 в органотипических культурах сосудов молодых крыс. В органотипических культурах старых крыс пептид H-Asp(Ala)-OH повышал площадь экспрессии Ki67 в 2 раза. Результаты по влиянию пептида H-Asp(Ala)-OH на индекс площади зоны роста эксплантатов сосудов коррелируют с данными по экспрессии белка Ki67, который является маркером пролиферации клеток. Таким образом, влияние дипептида H-Asp(Ala)-OH на зону роста эксплантатов сосудов связано с его стимулирующим действием на экспрессию белка Ki67.
В органотипических культурах сосудов молодых крыс пептид H-Asp(Ala)-OH повышал площадь экспрессии хемокина CXCL12 в 3,2 раза по сравнению с контролем, в органотипических культурах сосудов старых крыс - в 3,15 раза по сравнению с контролем. Пептид H-Asp(Ala)-OH не влиял на площадь экспрессии проапоптотического белка р53 в органотипических культурах сосудов молодых и старых крыс.
В диссоциированных культурах клеток сосудов молодой крысы пептид H-Asp(Ala)-OH повышал площадь экспрессии маркера пролиферации Ki67 на 96,7%. Пептид H-Asp(Ala)-OH повышал площадь экспрессии хемокина CXCL12 на 84,3% по сравнению с контролем в диссоциированных культурах клеток сосудов молодой крысы. Пептид H-Asp(Ala)-OH снижал площадь экспрессии проапоптотического белка р53 на 164,5% по сравнению с контролем в диссоциированных культурах клеток сосудов молодой крысы.
Таким образом, пептид H-Asp(Ala)-OH активирует пролиферацию (увеличение ИП, экспрессии Ki67), снижает апоптоз (уменьшение экспрессии р53) и активирует защитные функции клеток эндотелия (повышение экспрессии хемокина CXCL12) сосудов крыс разного возраста. Кроме того, пептид H-Asp(Ala)-OH нивелирует цитотоксическое воздействие ЦФ на органотипическую культуру сосудов молодых и старых крыс. Эти данные указывают на геро- и вазопротекторные свойства пептида H-Asp(Ala)-OH в отношении эндотелия сосудов.
Пример 4. Влияние пептида H-Asp(Ala)-OH на пролиферацию, апоптоз и межклеточные контакты эндотелиоцитов сосудов человека
Объектами для морфофункционального исследования явились первичные культуры клеток сосудов пуповины человека. Из пуповины выделяли фрагмент вены диаметром 0,1 см и помещали в питательную среду. Для получения первичных культур эндотелиоцитов из вены пуповины человека использовали модификацию стандартного метода [Crampton S.P., Davis J., Hughes C.C. Isolation of human umbilical vein endothelial cells (HUVEC) // J Vis Exp. 2007. N3. P. 183]. Клетки выращивали до 3 пассажа («молодая» культура) и до 14 пассажа («старая» культура). Все культуры были разделены на 2 группы: 1 - контроль (без добавления пептида), 2 – добавление пептида H-Asp(Ala)-OH в концентрации 20 нг/мл. При каждом пересеве производили добавление раствора с пептидом в ростовую среду в концентрации 20 нг/мл. Пассирование производили через 3 суток на 4-е, когда культуры достигали монослоя. Культивирование проводили до 3 пассажа («молодые» культуры) и до 14 пассажа («старые» культуры), на которых клетки были рассеяны на планшеты и было произведено иммуноцитохимическое окрашивание. Первичные культуры эндотелиоцитов сосудов пуповины человека к 14 пассажу теряли способность к пролиферации, а уровень апоптоза в них возрастал, в связи с чем именно этот пассаж был выбран в качестве модели «старых» клеток [Хохлов А.Н., Клебанов А.А., Кармушаков А.Ф., Шиловский Г.А., Насонов М.М., Моргунова Г.В. Тестирование геропротекторов в экспериментах на клеточных культурах: выбор оптимальной модельной системы // Вестник Московского университета. Серия 16: Биология. 2014. № 1. С. 13-18]. Для иммуноцитохимического исследования использовали первичные антитела: Ki67 (антитела моноклональные мышиные к человеческому белку Ki67, клон MIB-1, разведение 1:50, Dako, США), p53 (антитела моноклональные мышиные к человеческому белку р53, клон DO-7, разведение 1:100, Dako, США), Cx43 (антитела кроличьи поликлональные к белку Cx43 человека, крысы и мыши, клон GJA1, разведение 1:100, Abcam, Англия).
Белок Ki67 является общепризнанным и широко используемым маркером пролиферации. Процесс старения характеризуется достижением предела Хейфлика и снижением либо полным прекращением способности клеток к делению. В связи с этим белок Ki67 может являться важным маркером для оценки снижения пролиферативной активности клеток и степени инволютивных процессов в исследуемом органе. Белок р53 является транскрипционным фактором, выполняющим функцию супрессора образования злокачественных опухолей путем активации апоптоза в тканях организма. Белок р53 активируется при повреждениях ДНК, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о старении клетки и нарушении ее функциональной активности. Повышенная экспрессия белка р53 в эндотелии сосудов характерна для сердечно-сосудистой патологии [Yokoyama M., Shimizu I., Nagasawa A., Yoshida Y., Katsuumi G., Wakasugi T., Hayashi Y., Ikegami R., Suda M., Ota Y., Okada S., Fruttiger M., Kobayashi Y., Tsuchida M., Kubota Y., Minamino T. p53 plays a crucial role in endothelial dysfunction associated with hyperglycemia and ischemia // J Mol Cell Cardiol. 2019. Vol. 129. P. 105-117]. Cx43 – gap junction alpha-1 protein (GJA1), коннексин 43. Коннексин 43 входит в семейство коннексинов, которые являются компонентами щелевых контактов, образующих межклеточные каналы и обеспечивающих диффузию низкомолекулярных соединений между соседними клетками. Коннексин 43 экспрессируется в клетках сосудов, включённых в атеросклеротические бляшки, в том числе в гладкомышечных клетках [Pfenniger A., Chanson M., Kwak B.R. Connexins in atherosclerosis. // Biochim Biophys Acta. 2013. Vol. 1828. N1. P. 157-166]. Для оценки результатов иммуноцитохимического окрашивания проводили морфометрическое исследование с использованием системы компьютерного анализа микроскопических изображений и программного обеспечения «Vidеotest Morphology 5.0». В каждом случае анализировали 10 полей зрения при увеличении 200. Площадь экспрессии рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Статистическая обработка экспериментальных данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилась в программе Statistica 6.0. Для анализа вида распределения использовали критерий Шапиро-Уилка. Критический уровень достоверности нулевой гипотезы принимали равным 0,05.
В контрольных «старых» культурах эндотелиоцитов площадь экспрессии Ki67 составила 1,6±0,1%, что в 2,6 раза ниже по сравнению с этим показателем в «молодых» культурах (4,2±0,4)%. Пептид H-Asp(Ala)-OH повышал площадь экспрессии пролифератропного белка Ki67 в «молодых» и «старых» культурах эндотелиоцитов в 1,3 и 1,9 раза соответственно по сравнению с контролем («молодые» культуры представлены на Фиг. 1). В контрольных «старых» культурах эндотелиоцитов площадь экспрессии p53 составила 4,5±0,5%, что в 3,8 раза выше по сравнению с показателем в «молодых» культурах эндотелиоцитов (1,2±0,1%). Пептид H-Asp(Ala)-OH снижал площадь экспрессии проапоптотического белка р53 в «старых» культурах эндотелиоцитов в 2,3 раза по сравнению с контролем. В контрольных «старых» культурах эндотелиоцитов площадь экспрессии Сх43 составила 0,70±0,01%, что достоверно не отличалось от этого показателя в «молодых культурах» (0,80±0,01)%. В «молодых» культурах эндотелиоцитов площадь экспрессии Сх43 при добавлении пептида H-Asp(Ala)-OH составила 1,34±0,07%, что в 1,68 раза больше, чем в соответствующем контроле (Фиг. 2).
Данные о влиянии пептида H-Asp(Ala)-OH на экспрессию белков Ki67, p53, Cx43 в культурах эндотелиоцитов человека при их старении могут играть важную роль в понимании молекулярных механизмов антиатеросклеротического действия этого пептида. Известно, что нарушение целостности эндотелиальной выстилки интимы артерий может быть вызвано апоптотической гибелью клеток эндотелия сосудов. Причиной развития апоптоза клеток эндотелия сосудов при атеросклерозе может быть индукция перекисного окисления липидов и накопления активных радикалов кислорода. Исследование, проведенное на коронарных артериях, взятых от 52 умерших больных с атеросклерозом и ИБС на различных стадиях атерогенеза, показало увеличение апоптотического индекса эндотелиоцитов в коронарных артериях, пораженных атеросклерозом, по сравнению с неповрежденными сегментами сосудов контрольной группы. При этом процессы апоптоза клеток эндотелия сосудов интенсивно протекают только на ранних стадиях атеросклеротического процесса [Владимирская Т.Э., Швед И.А., Криворот С.Г. Апоптоз клеток стенки коронарных артерий как фактор развития и прогрессирования коронаросклероза // Актуальные вопросы кардиологии. 2013. N 9. P. 22–26]. Экспрессия Cx43 резко снижается в местах атеросклеротического поражения сосудов у человека и животных. Атеросклеротическое поражение аорты человека характеризуются резким уменьшением количества щелевых контактов, что определяется по снижению экспрессии Cx43. То есть при развитии атеросклеротических поражений разрушается трехмерная клеточная сеть, формируемая щелевыми соединениями [Orekhov A.N., Andreeva E.R., Bobryshev Y.V. Cellular mechanisms of human atherosclerosis: Role of cell-to-cell communications in subendothelial cell functions // Tissue Cell. 2016. Vol. 48. N 1. P. 25-34]. Следовательно, стимуляция пролиферации (экспрессия белка Ki67), образование межклеточных контактов (экспрессия Сх43) и снижение апоптоза (белок р53) под действием пептида H-Asp(Ala)-OH могут указывать на способность этого дипептида предотвращать развитие атеросклероза на его начальной стадии.
Пример 5. Влияние пептида H-Asp(Ala)-OH на экспрессию эндотелина-1 в эндотелии сосудов человека при атеросклерозе
Четыре фрагмента ткани атеросклеротической аорты человека диаметром 0,2 см были получены при операции аортокоронарного шунтирования. Ткань измельчали, заливали 10 мл HBSS с добавлением 0,2% коллагеназы I (Gibco), центрифугировали при 400 g и инкубировали в течение 20 мин при температуре 37°С в термостате. После центрифугирования осадок клеток растворяли в 2 мл среды М199 c добавлением 10% эмбриональной бычьей сыворотки и антибиотика. Цикл выделения повторяли 3 раза, растворенный осадок эндотелиоцитов накапливали в отдельной пробирке. Концентрация клеток для посева составляла 3х104 клеток на мл. Клетки выращивали до 3 пассажа («молодая» культура) и 6 пассажа («старая» культура). Поскольку эндотелий был выделен из ткани сосудов, пораженных атеросклерозом, пролиферация клеток в культуре наблюдалась только до 6 пассажа, далее большая часть эндотелиоцитов вступала в апоптоз. На 3 и 6 пассаже клетки разделяли на 2 группы: 1 - контроль (добавление культуральной среды), 2 – добавление пептида H-Asp(Ala)-OH в концентрации 10 нг/мл. Исследование экспрессии эндотелина-1 проводили иммунофлуоресцентным методом с использованием первичных антител к anti-endotelin-1 (моноклональные, 1:100, Novocastra). В качестве вторичных антител использовали антитела, конъюгированные с флуорохромом Alexa Fluor 647 (1:1000, Abcam). Ядра клеток докрашивали Hoechst 33258 (Sigma, США) в течение 1 мин.
Эндотелин-1 – пептид, синтезируемый эндотелием сосудов, обладающий вазоконстрикторными и митогенными свойствами. Эндотелин-1 обладает широким спектром биологических эффектов: активирует пролиферацию фибробластов, синтез компонентов внеклеточного матрикса, вазоактивных веществ (простациклин, оксид азота), факторов, активирующих тромбоциты. Нарушение синтеза эндотелина-1 является признаком эндотелиальной дисфункции и наблюдается при патологии сосудов сетчатки, почек, сердца, легких и других органов.
Для анализа полученных результатов использовали конфокальный микроскоп Olympus FluoView 1000 (Япония), программное обеспечение «Olympus FluoView ver 3.1b». В каждом случае анализировали 10 полей зрения при увеличении 200. Экспрессию эндотелина-1 оценивали по показателю яркости экспрессии на клетку в условных единицах (у.е). Статистическая обработка экспериментальных данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилась в программе Statistica 6.0. Для анализа вида распределения использовали критерий Шапиро-Уилка. Критический уровень достоверности нулевой гипотезы принимали равным 0,05.
В «молодой» и «старой» контрольных культурах эндотелиоцитов площадь экспрессии эндотелина-1 не различалась и составила 13,8±0,2 у.е. Пептид H-Asp(Ala)-OH не влиял на экспрессию эндотелина-1 в «молодых» культурах эндотелия, где этот показатель составил 13,5±0,2 у.е. и повышал этот показатель в «старых» культурах в 2 раза до 28,9±0,1 у.е.
Таким образом, пептид H-Asp(Ala)-OH стимулирует синтез эндотелина-1 в эндотелиоцитах человека при атеросклерозе в модели репликативного клеточного старения. Этот эффект свидетельствует о способности пептида повышать функциональную активность эндотелия при атеросклерозе.
Пример 6. Влияние фармацевтической композиции на основе пептида H-Asp(Ala)-OH на функцию сосудов у больных цереброваскулярной болезнью
Клиническое исследование проводили у 152 больных с атеросклерозом сосудов в виде цереброваскулярной болезни в возрасте от 62 до 78 лет, которых методом простой рандомизации разделили на 4 группы. Пациенты контрольной группы (n=20) получали общепринятое лечение – актовегин по 200 мг 2 раза в день в течение 30 дней. Пациенты 1 основной группы (ОГ-1, n=43) дополнительно к общепринятому лечению получали фармацевтическую композицию на основе пептида β-аспартил-аланин формулы H-Asp(Ala)-OH в дозах 10,0 мкг/кг (ОГ-1/1, n=24) или 100,0 мкг пептида на 1 кг массы тела (ОГ-1/2, n=19) перорально по 1 капсуле 2 раза в день ежедневно в течение 30 дней. Во вторую основную группу (ОГ-2) вошло 48 человек, которые получали фармацевтическую композицию на основе дипептида β-аспартил-аланин формулы H-Asp(Ala)-OH в виде раствора интраназально по 5 капель в каждый носовой ход в дозах 1,0 мкг/кг (ОГ-2/1, n=26) или 10,0 мкг/кг массы тела (ОГ-2/1, n=22) в день в течение 30 дней. В третью основную группу (ОГ-3) вошли 41 человек, которые получали фармацевтическую композицию на основе дипептида β-аспартил-аланин формулы H-Asp(Ala)-OH в виде раствора для внутримышечного применения по 1 мл в дозах 0,1 мкг/кг массы тела (ОГ-3/1, n=20) или 10,0 мкг/кг массы тела (ОГ-3/2, n=21) в день в течение 30 дней. Пациенты предъявляли жалобы на частые головные боли, головокружение, эмоциональную лабильность, сниженную умственную работоспособность. При лабораторном исследовании выявлялось нарушение липидного обмена, выражавшееся в достоверном по сравнению с нормой повышении содержания в сыворотке крови общего холестерина до 7,9±0,5 ммоль/л, липопротеидов низкой плотности (ЛПНП) до 3,78±0,06 ммоль/л, триглицеридов до 2,7±0,09 ммоль/л, что коррелировало с клиническими проявлениями заболевания (Таблица).
После применения общепринятых средств у пациентов всех групп субъективные и лабораторные показатели улучшились по сравнению с показателями до лечения. Однако у пациентов основных групп положительная динамика была выражена достоверно больше. В частности, содержание общего холестерина снизилось до показателей 5,9±0,6 ммоль/л в ОГ-1, 5,7±0,4 ммоль/л в ОГ-2 и 5,6±0,7 ммоль/л в ОГ-3, приближающихся к верхней границе нормы (р<0,05 по сравнению с показателем до лечения и с показателем у пациентов после лечения общепринятыми средствами), при этом в контрольной группе показатель снизился только до 7,0±0,6 ммоль/л. Аналогичная динамика наблюдалась в показателях ЛПНП и триглицеридов: у пациентов основных групп после курса лечения показатели приблизились к физиологической норме, в то время как у пациентов контрольной группы, получавших только общепринятое лечение, данные показатели улучшились относительно исходных значений, но оставались выходящими за пределы нормальных значений. Динамика субъективных показателей коррелировала с динамикой лабораторных показателей. Так, у 75-83% пациентов трех основных групп уменьшилась частота головных болей, нарушения сна, повысилась умственная работоспособность, снизились проявления эмоциональной лабильности. Положительная динамика субъективных показателей отмечалась у 60% пациентов контрольной группы. Таким образом, результаты проведенного клинического исследования свидетельствуют о том, что эффективность лечения пациентов с атеросклерозом артерий в виде цереброваскулярной болезни достоверно повышается при включении в комплексную терапию фармацевтической композиции на основе пептида H-Asp(Ala)-OH по сравнению с пациентами, получавшими только общепринятое лечение.
Таблица – Влияние фармацевтической композиции на основе пептида H-Asp(Ala)-OH на показатели липидного обмена у больных атеросклерозом артерий
(контроль)
H-Asp(Ala)-OH
(ммоль/л)
5,9±0,6*^
ОГ-1/2
5,7±0,3*^
5,7±0,4*^
ОГ-2/2
5,6±0,5*^
5,6±0,7*^
ОГ-3/2
5,4±0,5*^
3,21±0,02*^
ОГ-1/2
3,16±0,07*^
3,16±0,03*^
ОГ-2/2
3,12±0,08*^
3,08±0,04*^
ОГ-3/2
3,03±0,08*^
2,1±0,08*^
ОГ-1/2
2,0±0,06*^
2,0±0,09*^
ОГ-2/2
1,8±0,05*^
1,9±0,1*^
ОГ-3/2
1,6±0,06*^
* р<0,05 – достоверно по сравнению с показателем до лечения;
^ р<0,05 – достоверно по сравнению с показателем в контрольной группе.
Группа изобретений относится к области биохимии и фармакологии, а именно к лекарственным средствам на основе пептидов, улучшающим функциональные свойства эндотелия сосудов при их нарушении различного генеза, в том числе атеросклерозе. Предлагается применение пептида формулы β-аспартил-аланин H-Asp(Ala)-OH для улучшения функциональной активности эндотелия сосудов, а также в способе профилактики и/или лечения эндотелиальной дисфункции, например, такой как эндотелиальная дисфункция при атеросклерозе, рестенозе, ишемической болезни сердца, нарушениях мозгового кровообращения. 3 н.п. ф-лы, 2 ил., 1 табл., 6 пр.
1. Применение пептида β-аспартил-аланина формулы H-Asp(Ala)-OH для улучшения функциональной активности эндотелия сосудов.
2. Применение пептида β-аспартил-аланина формулы H-Asp(Ala)-OH для приготовления лекарственного средства, улучшающего функциональную активность эндотелия сосудов.
3. Способ профилактики и лечения эндотелиальной дисфункции в органах и тканях, заключающийся во введении пациенту лекарственного средства, улучшающего функциональную активность эндотелия сосудов, включающего пептид β-аспартил-аланина формулы H-Asp(Ala)-OH, при этом при парентеральном введении доза лекарственного средства составляет 0,1-10 мкг/кг массы тела по крайней мере один раз в день, при интраназальном – 1,0-10 мкг/кг массы тела по крайней мере один раз в день, при пероральном – 10,0-100 мкг/кг массы тела по меньшей мере два раза в день в течение периода, необходимого для достижения терапевтического эффекта.
| US 20180132516 A1, 17.05.2018 | |||
| ОЛИГОПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ФАКТОРА РОСТА СОСУДИСТОГО ЭНДОТЕЛИЯ (VEGF) ПО ОТНОШЕНИЮ К СТИМУЛИРОВАНИЮ АНГИОГЕНЕЗА | 2008 |
|
RU2375373C1 |
| АНТАГОНИСТЫ РЕЦЕПТОРОВ ЭНДОТЕЛИНА | 1994 |
|
RU2126418C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАММА-L-ГЛУТАМИЛГИСТАМИНА, ПРИМЕНЕНИЕ ГАММА-L-ГЛУТАМИЛГИСТАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2141968C1 |
Авторы
Даты
2022-03-28—Публикация
2021-06-30—Подача