1. Область изобретения
Настоящее изобретение относится к новым соединениям в качестве антагонистов рецепторов эндотелина (ET), способам их получения, их использованию и фармацевтическим композициям.
2. Описание известного уровня техники
Эндотелины представляют собой семейство вазоактивных пептидов с 21 аминокислотным остатком и двумя внутримолекулярными дисульфидными связями. Они содержат ET-1, оригинальный ET, выделенный из культуральных сред эндотелиальных свиных клеток, ET-2 и ET-3.
Эндотелины, биосинтез которых повышен за счет многих биологических и патологических факторов, широко распространены как в периферических, так и в мозговых тканях млекопитающих и проявляют ряд биологических реакций путем связывания по меньшей мере с двумя различными субтипами рецепторов ET, рецепторами ETA и ETB.
Рецепторы ET присутствуют в сердечно-сосудистых, почечных, печеночных и нервных тканях. Рецепторы ET также обнаруживаются в респираторной, желудочно-кишечной, эндокринной, центральной нервной и мочеполовой системах, в крови и кроветворных органах, органах чувств и других тканях в организме.
Эндотелипы являются наиболее сильно- и долгодействующими эндогенными констрикторами кровяных сосудов, идентифицированных на сегодняшний день. Эндотелины также вызывают сокращение различных бессосудистых гладких мышц, включая дыхательные пути и миокард. Кроме того, эндотелины являются ульцерогенными и провоспалительными. Эндотелины обладают регуляторными функциями в отношении секреции гормонов или пептидов, нейротрансмиссии, ионного транспорта и метаболизма.
Заявка на Европатент N 436189А раскрывает эндотелин-антагонистические циклические пентапептиды. Заявка на Европатент N 457195А раскрывает эндотелин-антагонистические олигопептиды, содержащие L-лейцин и D-триптофан. Они не могут вводиться перорально. Заявка на Европатент N 460679A описывает эндотелин-антагонистические производные пептидов, причем конкретно раскрываются трипептиды. Заявка PCT WO 92/20706 описывает антагонисты эндотелинов, при этом конкретно раскрываются гексапептиды. Заявка на Европатент N 526708А описывает эндотелин-антагонистические производные бензосульфонамида. Заявка на Европатент N 5105262A также описывает эндотелин-антагонистические производные бензосульфонамида. Хотя производные бензосульфонамида могут вводиться перорально их антагонистическая активность не высока. В заявке на Европатент N 13891A раскрываются дипептидные производные фенилаланина и триптофана, обладающие свойствами по разрушению опухолевых тканей. Патент Франции N 2294694 раскрывает производные фенилаланил-фенилаланила, проявляющие противоязвенные эффекты.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новые соединения, представленные общей формулой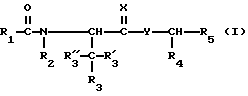
R1 обозначает фенил, замещенный (C1-C4)-алкилом, (C1-C4) алкокси или галогеном;
R2 обозначает (C1-C4)-алкил;
R3 обозначает фенил, бифенил, нафтил, тиенил, фурил, тетразолил, имидазолил, пиридил, хинолинил, пиридил-фенил, тиенил-фенил, фурил-фенил, имидазолил-фенил, изоксазолил-фенил; где названные арильные и гетероарильные радикалы, независимо друг от друга, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из (C1-C4)-алкила, (C1-C4)-алкокси, фенил-(C1-C4)-алкокси, галогена, CF3, гидрокси, циано, циано-(C2-C5)-алканоила, нитро;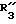 обозначает водород, фенил, фенил, замещенный (C1-C4)- алкилом, (C1-C4)-алкокси, галогеном, CF3, гидрокси, нитро;
обозначает водород, фенил, фенил, замещенный (C1-C4)- алкилом, (C1-C4)-алкокси, галогеном, CF3, гидрокси, нитро; обозначает водород;
обозначает водород;
C(=X) обозначает C(=O) или C(=S); и Y обозначает NH или метилен, или C(= X) обозначает CHOH и Y обозначает метилен;
R4 обозначает -(CH2)s- Ar', где s равно целому числу 1; и
Ar' обозначает фенил, нафтил, бифенил, индол-3-ил, I-(C1-C4)-алкил-индол-3-ил, или хинолинил; где названные арильные и гетероарильные радикалы, независимо друг от друва, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из (C1-C4)-алкила, (C1-C4)-алкокси, галогена, CF3, гидрокси и нитро; и R5 обозначает COOH; или его фармацевтически приемлемая соль.
Обширные фармакологические исследования показали, что соединения I и их фармацевтически приемлемые соли, например, обладают выраженными фармацевтическими, например эндотелин-рецептор-антагонистическими свойствами и благоприятным фармакологическим профилем. Соединения предлагаемого изобретения связываются как с рецепторами ETA, так и с рецепторами ETB. По сравнению с известными антагонистами рецепторов эндотелина, соединения в соответствии с настоящим изобретением содержат самое большее две пептидные связи. Кроме того, они отличаются от известных соединений не только по своей неожиданной и благоприятной стабильности.
Антагонисты рецепторов ET настоящего изобретения пригодны при различных заболеваниях человека, вызванных эндотелинами, либо самостоятельно, либо в сочетании с другими факторами. В частности, они пригодны при лечении различных сердечно-сосудистых заболеваний, таких как церебральный и коронарный вазоспазм, церебральная и коронарная ишемия, субарахноидальное кровоизлияние, различных типов гипертензии, легочной гипертензии, сердечной недостаточности, болезни Рейно, диабета, атеросклероза или рестеноза вследствие денудации после пластической операции на сосудах.
Соединения настоящего изобретения также обеспечивают новые терапевтические возможности при астме, почечной недостаточности, диализе, гломерулярном поражении, печеночной недостаточности, язве желудка и двенадцатиперстной кишки, трофической язве, различных дисфункциях головного мозга, включая мигрень, доброкачественной гиперплазии предстательной железы и глазных заболеваниях, при глаукоме в частности.
Они также пригодны для устранения отрицательных эффектов циклоспорина и могут быть использованы в отношении эндотоксинового бактериально-токсического шока или дессиминированного внутрисосудистого свертывания (генерализованного тромбогеморрагического синдрома).
Соединения формулы I и их фармацевтически приемлемые соли поэтому могут быть использованы, например, в качестве фармацевтически активных компонентов, которые используются, например, при лечении различных сердечно-сосудистых заболеваний, таких как церебральный и коронарный вазоспазм, церебральная и коронарная ишемия, субарахноидальное кровоизлияние, различных типов гипертензии, легочной гипертензии, сердечной недостаточности, болезни Рейно, диабета, атеросклероза или рестеноза вследствие денудации после пластической операции на сосудах, а также при лечении астмы, почечной недостаточности, при диализе, при гломерулярном поражении, печеночной недостаточности, язве желудка и двенадцатиперстной кишки, трофической язве, различных дисфункциях головного мозга, включая мигрень, доброкачественной гиперплазии предстательной железы и глазных заболеваниях, при глаукоме в частности. Таким образом, предлагаемое изобретение относится к использованию соединений в соответствии с изобретением и их фармацевтически приемлемых солей для получения соответствующих лекарственных препаратов и к терапевтическому лечению различных сердечно-сосудистых заболеваний, таких как церебральный и коронарный вазоспазм, церебральная и коронарная ишемия, субарахноидальное кровоизлияние, различных типов гипертензии, легочной гипертензии, сердечной недостаточности, болезни Рейно, диабета, атеросклероза или рестеноза вследствие денудации после пластической операции на сосудах, а также при лечении астмы, почечной недостаточности, при диализе, при гломерулярном поражении, печеночной недостаточности, язве желудка и двенадцатиперстной кишки, трофической язве, различных дисфункциях головного мозга, включая мигрень, доброкачественной гиперплазии предстательной железы и глазных заболеваниях, при глаукоме в частности. Промышленное производство активных веществ также включено в получение фармацевтических препаратов.
Кроме того, соединения настоящего изобретения могут быть использованы в качестве научно-исследовательских инструментов, например с целью определения ведущих соединений, проявляющих превосходный профиль связывания как с рецепторами ETA, так и с рецепторами ETB.
Получение соединений формулы I и их солей осуществляют способом, известным per se и в котором, например,
а) соединение формулы
или его соль или реакционноспособное производное подвергают взаимодействию с соединением формулы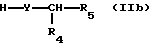
при этом отщепляют свободные функциональные группы, за исключением тех, которые участвуют в реакции, находящиеся по выбору в защищенной форме, а также любые присутствующие защитные группы, или
б) соединение формулы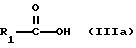
или его соль или реакционноспособное производное подвергают взаимодействию с соединением формулы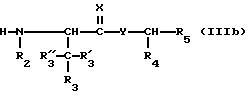
при этом отщепляют свободные функциональные группы, за исключением тех, которые участвуют в реакции, находящиеся по выбору в защищенной форме, а также любые присутствующие защитные группы, и, если желательно, превращают соединение I, полученное в соответствии со способом или иным образом, в свободной форме или в форме соли, в соединение формулы I, разделяют смесь изомеров, полученную в соответствии со способом, и выделяют желательный изомер и/или превращают свободное соединение формулы I, полученное в соответствии со способом, в соль, либо превращают соль соединения I, полученную в соответствии со способом, в свободное соединение I или в другую соль.
Реакции, описанные выше и ниже в различных вариантах, осуществляют известным per se способом, например, в отсутствие
или, как правило, в присутствии пригодного растворителя или разбавителя, либо в их смеси, причем реакцию, в зависимости от требований, осуществляют с охлаждением, при комнатной температуре или с нагреванием, например при температуре в диапазоне приблизительно от -80oC до температуры кипения реакционной среды, предпочтительно при температуре приблизительно от -10oC до +200oC С, и если подходит, то в закрытом реакторе, под давлением, в атмосфере инертного газа и/или в безводных условиях.
Варианты способа а) и б)
Соединения формулы IIa и IIIa, соответственно, содержат свободную карбоксильную группу или ее реакционноспособные кислотные производные, например, полученные активированные сложные эфиры или реакционноспособные ангидриды, а также реакционноспособные циклические амиды. Реакционноспособные кислотные производные могут быть также образованы in situ.
Активированные сложные эфиры соединений формулы IIa и IIIa, соответственно, имеющие карбоксильную группу, представляют собой, в частности, сложные эфиры, которые не насыщены у связующего атома углерода эстерифицирующего радикала, например типа сложного винилового эфира, такого как сложный виниловый эфир (получаемый, например, трансэстерификацией соответствующего сложного эфира с винилацетатом; метод активированных сложных виниловых эфиров), сложные карбамоиловые эфиры (получаемые, например, путем обработки соответствующей кислоты реагентом изоксазолия; метод 1,2-оксазолия или метод Вудворда) или 1-низший алкоксивиниловый сложный эфир (получаемый, например, путем обработки соответствующей кислоты низшим алкоксиацетиленом; этоксиацетиленовый метод), либо сложные эфиры типа амидино, такие как N,N'-двузамещенные амидиноэфиры (получаемые, например, путем обработки соответствующей кислоты пригодным N,N'-двузамещенным карбодиимидом, например N,N'-дициклогексил-карбодиимидом; карбодиимидный метод) или N,N-двузамещенные амидиноэфиры (получаемые, например, путем обработки соответствующей кислоты пригодным N,N-двузамещенным цианамидом; цианамидный метод), пригодные сложные ариловые эфиры, в частности фениловые эфиры, которые замещены заместителями, притягивающими электроны (получаемые, например, путем обработки соответствующих кислот пригодно замещенным фенолом, например 4-нитрофенолом, 4-метилсульфонилфенолом, 2,4,5-трихлорфенолом, 2,3,4,5,6-пентахлорфенолом или 4-фенил-диазофенолом, в присутствии конденсатора, такого как N,N'-дициклогексилкарбодиимид; метод активированных арильных эфиров), цианометиловые эфиры (получаемые, например, путем обработки соответствующей кислоты хлорацетонитрилом в присутствии основания; метод цианометиловых сложных эфиров), тиоэфиры, в частности фенилтиоэфиры, которые не замещены или замещены, например, нитро (получаемые, например, путем обработки соответствующей кислоты тиофенолами, которые не замещены или замещены, например, с помощью нитро, inter alia с использованием ангидридного метода или карбодиимидного метода; метод активированных тиоловых эфиров), или, в особенности, сложные аминоэфиры или амидоэфиры (получаемые, например, путем обработки соответствующей кислоты N-гидроксиаминосоединением или N-гидроксиамидосоединением, например N-гидроксисукцинимидом, N-гидроксипиперидином, N-гидроксифталимидом, имидом N-гидрокси-5- норборнен-2,3-дикарбоновой кислоты, 1-гидроксибензотриазолом или 3-гидрокси-3,4-дигидро-1,2,3-бензотриазин-4-оном, например в соответствии с ангидридным методом или карбодиимидным методом; метод активированных сложных N-гидрокси-эфиров). Также могут быть использованы внутренние сложные эфиры, например γ -лактоны.
Ангидриды кислот могут быть симметрическими или, предпочтительно, смешанными ангидридами этих кислот, например ангидридами с неорганическими кислотами, такими как галоидангидриды, в частности фторангидриды (получаемые, например, путем обработки соответствующей кислоты, например трифтортриазином), хлорангидриды (получаемые, например, путем обработки соответствующей кислоты тионилхлоридом, пентахлоридом фосфора, фосгеном или оксалилхлоридом; метод хлорангидридов), азиды (получаемые, например, из соответствующего кислого эфира посредством соответствующего гидразида и его обработки азотистой кислотой; азидный метод), ангидридами с полуэфирами угольной кислоты, например низший алкил-полуэфирами угольной кислоты (получаемыми, например, путем обработки соответствующей кислоты сложными эфирами низшего алкила хлоругольной кислоты или 1-низший алкоксикарбонил-2-низший алкокси-1,2-дигидрохинолином; метод смешанных ангидридов O-алкилугольной кислоты); или ангидридами с дигалогенированной, в особенности дихлорированной, фосфорной кислотой (получаемыми, например, путем обработки соответствующей кислоты хлорангидридом фосфорной кислоты; метод хлорангидридов фосфорной кислоты); ангидридами с другими производными фосфорной кислоты (например теми, которые могут быть получены с фенил N-фенилфосфорамидохлоридатом или путем реакции амидов алкилфосфорной кислоты в присутствии ангидридов сульфокислот и/или присадок, снижающих рацемизацию, таких как N-гидроксибензотриазол, или в присутствии сложного диэтилового эфира цианофосфиновой кислоты) или с производными фосфорной кислоты, либо ангидридами с органическими кислотами, такими как смешанные ангидриды с органическими кислотами, например смешанные ангидриды с органическими карбоновыми кислотами (получаемые, например, путем обработки соответствующей кислоты низший алкан- или фенил-низший алкан карбонилгалогенидом, который не замещен или замещен, как например, фенилацетилхлорид, пивалоилхлорид или трифторацетилхлорид; метод смешанных ангидридов карбоновой кислоты) или с органическими сульфокислотами (получаемые, например, путем обработки соли, такой как соль щелочного металла, соответствующей кислоты с помощью пригодного органического сульфонилгалогенида, такого как низший алкан- или арил-, например метан- или p-толуол-сульфонил хлорид; метод смешанных ангидридов сульфокислот), а также асимметрическими ангидридами (получаемыми, например, путем конденсации соответствующей кислоты в присутствии карбодиимида или 1-диэтиламинопропина; метод симметрических ангидридов).
Пригодными циклическими амидами являются, в частности, амиды с пятичленными диазациклами ароматического характера, такие как амиды с имидазолами, например имидазолом (получаемые, например, путем обработки соответствующей кислоты N,N'-карбонилдиимидазолом; метод имидазолов) или пиразолом, например 3,5-диметилпиразолом (получаемые, например, посредством кислого гидразида путем обработки ацетилацетоном; метод пиразолидов).
Конденсацию свободной карбоновой кислоты (IIb или IIIb, соответственно) с помощью соответствующего амина можно предпочтительно осуществлять в присутствии одного из обычных конденсирующих агентов или с использованием ангидридов карбоновых кислот или галогенидов карбоновых кислот, таких как хлориды, либо активированных сложных эфиров карбоновых кислот, таких как сложные p-нитрофениловые эфиры. Примерами обычных конденсирующих агентов являются карбодиимиды, например диэтил-, дипропил-, N-этил-N'-(3-диметиламинопропил)-карбодиимид, или, в особенности, дихлоргексилкарбодиимид, и, кроме того, пригодные карбонильные соединения, например карбонилимидазол, соединения 1,2-оксазолия, например 2-этил-5-фенил-1,2-оксазолий-3'-сульфонат и 2-трет-бутил-5-метилизоксазолий перхлорат, или пригодные ациламиносоединения, например 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, соединения N,N, N',N'-тетраметилурония, такие как O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторофосфат, и, кроме того, активированные производные фосфорной кислоты, например дифенилфосфорил азид, диэтилфосфорил цианид, фенил-N-фенилфосфорамидохлоридат, бис(2-оксо-3-оксазолидинил)фосфиновый хлорангидрид или 1-бензотриазолилокси-трис(диметиламино)фосфония гексафторфосфат.
Если желательно, тогда прибавляют органическое основание, предпочтительно третичный амин, например три-низший алкиламин, имеющий объемные радикалы, например этил диизопропиламин или триэтиламин, и/или гетероциклическое основание, например 4-диметиламинопиридин или предпочтительно N-метил-морфолин или пиридин.
Конденсацию активированных сложных эфиров, реакционноспособных ангидридов или реакционноспособных циклических амидов с соответствующими аминами обычно осуществляют в присутствии органического основания, например простых три-низших алкиламинов, таких как триэтиламин или трибутиламин, или одного из числа вышеприведенных органических оснований. При желании можно дополнительно использовать конденсирующий агент, например описанный в отношении свободных карбоновых кислот.
Конденсацию ангидридов кислот с аминами можно осуществлять, например, в присутствии неорганических карбонатов, например карбонатов аммония или щелочных металлов, либо водород-карбонатов, таких как карбонат натрия или калия, либо водород-карбонат (при желании вместе с сульфатом).
Хлорангидриды карбоновых кислот, например производные хлоругольной кислоты, полученные из кислоты формулы IIa или IIIa соответственно конденсируют с соответствующими аминами предпочтительно в присутствии органического амина, например вышеупомянутых три-низших алкиламинов или гетероциклических оснований, и если подходит, то в присутствии водород-сульфата.
Конденсацию предпочтительно осуществляют в инертных апротонных, предпочтительно безводных, растворителях или смесях растворителей, например в карбоксамиде, например формамиде или диметилформамиде, галоидзамещенном углеводороде, например метиленхлориде, четыреххлористом углероде или хлоробензоле, кетоне, например ацетоне, циклическом эфире, например тетрагидрофуране, сложном эфире, например этилацетате, или нитриле, например ацетонитриле, либо в их смеси; если желательно, то при пониженной или повышенной температуре, например при температуре приблизительно от -40 до +100oC, предпочтительно при температуре приблизительно от -10 до +50oC, а в случае использования сложных арилсульфониловых эфиров - при температуре приблизительно от +100 до +200oC, и если подходит, то в атмосфере инертного газа, например атмосфере азота или аргона.
Также можно использовать водные, например спиртовые, растворители, например бензол или толуол. Ацетон также можно при желании добавлять в присутствии гидроксидов щелочных металлов в качестве оснований.
Конденсацию также можно осуществлять в соответствии с методикой, известной как твердофазный синтез, который открыт в работах R. Merrifield и описан, например, в Angew. Chem. 97, 801 - 812 (1985), Naturwissenschaften 71, 252 - 258 (1984) или в работе R. A. Houghten, Proc. Natl. Acad. Sci. USA 82, 5131 - 5135 (1985).
Исходное вещество, промежуточные соединения могут быть получены в соответствии с общепринятыми методами, известными специалистам, методами, описанными в общих чертах в данной заявке, и методами, проиллюстрированными в примерах.
Исходное вещество формулы IIa, в которой Y обозначает кислород или серу, получается, например, путем взаимодействия соединения формулы IIIa или его соли или реакционноспособного производного со сложным эфиром формулы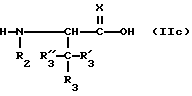
с использованием, например, условий связывания, описанных в отношении вариантов способа а) и б), по выбору с превращением полученного сложного эфира в соответствующий тиоэфир, например путем обработки сложного эфира реагентом Lawesson, и с последующим гидролизом полученного сложного эфира, например с использованием пригодных оснований, таких как гидроксид лития.
Соединения формулы (IIc), получаемые из натуральных α/ -аминокислот, являются по существу известными или могут быть получены с использованием традиционных методов, известных специалистам. Соединения формулы (IIc), в которых R3 обозначает арил или гетероарил, либо известны, либо могут быть получены с использованием традиционных методов, известных специалистам, например, как раскрыто в схемах II-IV и в рабочих примерах.
Соединения формул (IIb) и (IIIa) либо известны, либо могут быть получены с использованием традиционных методов, известных специалистам.
Исходное вещество формулы (IIIb) либо известно, либо может быть получено с использованием общепринятых методов, известных специалистам, например путем взаимодействия N-защищенного соединения формулы (IIc) с соединением формулы (IIb), например с использованием условий связывания, описанных в отношении вариантов способа а) и б).
Как пример, соединения настоящего изобретения, представленные общей формулой (I), в которой X обозначает кислород, Y обозначает -NH-, низший алкил-N или кислород и R5 обозначает COOH (представлены формулой I'), получают, например, в соответствии со СХЕМОЙ I из промежуточного соединения, представленного формулой (IIa).
Промежуточное соединение (IIa) получают, например, в соответствии со СХЕМАМИ II и III.
Как пример, соединения в соответствии с настоящим изобретением, представленные общей формулой (I), в которой C(=X) обозначает C=O, CH-OH или C= N-OH, Y обозначает CH2 и R5 обозначает карбокси, получают, например, в соответствии со СХЕМОЙ IV;
соединения в соответствии с настоящим изобретением, представленные общей формулой (I), в которой C=(X) обозначает C=S или C=H-низший алкил и Y обозначает NH, получают, например, в соответствии со СХЕМОЙ V;
соединения в соответствии с настоящим изобретением, представленные общей формулой (I), в которой R5 обозначает CH2OH, CONH2, CN, тетразолил или CO-NO-OH, получают, например, в соответствии со СХЕМОЙ VI.
Функциональные группы в исходных веществах (например, R5), которые не принимают участие в реакции, особенно карбокси, могут быть защищены при помощи пригодных защитных групп (традиционных защитных групп), которые обычно используются при синтезе пептидных соединений.
Эти защитные группы могут уже присутствовать в предшественниках и они предназначены для защиты релевантных функциональных групп от нежелательных вторичных реакций, таких как ацилирование, эстерификация или сольволиз, и так далее. В определенных случаях защитные группы могут дополнительно вызывать селективное проведение реакций, например стереоселективное. Характерной особенностью защитных групп является то, что они могут быть легко отщеплены, то есть без нежелательных вторичных реакций, например с помощью сольволиза, восстановления, фотолизиса, а также ферментативно, например также в физиологических условиях. Радикалы, аналогичные защитным группам, могут, тем не менее, присутствовать в конечных продуктах. Выше и ниже в данном описании отсылка дается на защитные группы в узком смысле, если в конечных продуктах не присутствуют релевантные радикалы.
Защита функциональных групп такими защитными группами, сами защитные группы, а также реакции их отщепления описаны, например, в стандартных работах, таких как J. F. W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973; Th. W. Greene, "Protective Groups in Organic Synthesis", Wiley, New York 1981; "The Peptides", Volume 3 (E. Gross and J. Meienhofer, editors), Academic Press, London and New York 1981; "Methoden der organischen Chemie", (Methods of Organic Chemistry), Houben-Weyl, 4th Edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974; H.-D. Jakubke and H. Jescheit, "Aminosauren, Peptide, Proteine" ("Amino acids, peptides, proteins"), Verlag Chemie, Weinheim, Deerfield Beach and Basel 1982; Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" ("The Chemistry of Carbohydrates: monosaccharides and derivatives"), Georg Thieme Verlag, Stuttgart 1974.
Карбоксильная группа защищена, например, как группа сложного эфира, которую можно селективно отщепить в мягких условиях. Карбоксильную группу, которая защищена в эстерифицированной форме, эстерифицируют главным образом группой низшего алкила, которая предпочтительно разветвлена в положении 1 группы низшего алкила или защищена пригодными заместителями в положении 1 или 2 группы низшего алкила.
Защищенная карбоксильная группа, которую эстерифицируют группой низшего алкила, представляет собой, например метоксикарбонил или этоксикарбонил.
Защищенная карбоксильная группа, которую эстерифицируют группой низшего алкила, разветвленной в положении 1 группы низшего алкила, представляет собой, например, трет-низший алкоксикарбонил, например, трет-бутоксикарбонил.
Защищенная карбоксильная группа, которую эстерифицируют группой низшего алкила, замещенной в положении 1 или 2 группы низшего алкила пригодными заместителями, представляет собой, например, арилметоксикарбонил, имеющий один или два арильных радикала, где арил представляет собой фенил, незамещенный или замещенный один раз, два раза или три раза, например, низшим алкилом, например трет-низшим алкилом, таким как трет-бутил, низшим алкокси, например метокси, гидроксилом, галогеном, например хлором, и/или нитро, например бензилоксикарбонил, бензилоксикарбонил, замещенный указанными заместителями, например 4-нитробензилоксикарбонил или 4-метоксибензилоксикарбонил, дифенилметоксикарбонил или дифенилметоксикарбонил, замещенный указанными заместителями, например ди-(4-метоксифенил)-метоксикарбонил, и, кроме того, карбокси, который эстерифицируют группой низшего алкила, где низшая алкильная группа замещена в положении 1 или 2 пригодными заместителями, например 1-низший алкокси-низший алкоксикарбонил, такой как метоксиметоксикарбонил, 1-метоксиэтоксикарбонил или 1-этоксиэтоксикарбонил, 1-низший алкилтио-низший алкоксикарбонил, например 1-метилтио-метоксикарбонил или 1-этилтиоэтоксикарбонил, ароилметоксикарбонил, где группа ароила представляет собой бензоил, не замещенный или замещенный, например, галогеном, таким как бром, например фенацилоксикарбонил, 2-гало-низший алкоксикарбонил, например 2,2,2-трихлорэтоксикарбонил, 2-бромэтоксикарбонил или 2-иодоэтоксикарбонил, а также 2-(тризамещенный силил)-низший алкоксикарбонил, где заместители, независимо один от другого, представляют собой в каждом случае алифатический, аралифатический, циклоалифатический или ароматический углеводородный радикал, не замещенный или замещенный, например, низшим алкилом, низшим алкокси, арилом, галогеном и/или нитро, например низшим алкилом, фенил-низшим алкилом, циклоалкилом или фенилом, каждый из которых не замещен или замещен, как описано выше, например 2-три-низший алкилсилил-низший алкоксикарбонил, такой как 2-три-низший алкилсилилэтоксикарбонил, например 2-триметилсилилэтоксикарбонил или 2-(ди-n-бутил-метил-силил)- этоксикарбонил, либо 2-триарилсилилэтоксикарбонил, такой как трифенилсилилэтоксикарбонил.
Карбоксильная группа также может быть защищена в виде органической группы силилоксикарбонила. Органическая группа силилоксикарбонила представляет собой, например, группу три-низшего алкилсилилоксикарбонила, например триметилсилилоксикарбонила. Атом кремния группы силилоксикарбонила также может быть замещен двумя группами низшего алкила, например группами метила, и амино- или карбоксильной группой второй молекулы формулы I. Соединения, обладающие такими защитными группами, могут быть получены, например, с использованием диметил-хлорсилана в качестве силилирующего агента.
Защищенной карбоксильной группой является предпочтительно низший алкоксикарбонил, например метокси-, этокси- или трет-бутоксикарбонил, бензилоксикарбонил, 4-нитробензилоксикарбонил, 9-флуоренилметоксикарбонил или дифенилметоксикарбонил.
Отщепление защитных групп, которые не являются компонентами искомого конечного продукта формулы I, например карбокси-защитных групп, осуществляют известным per se способом, например с использованием сольволиза, в частности гидролиза, алкоголиза или ацидолиза, либо при помощи восстановления, в частности гидрогенолиза или химического восстановления, а также фотолизиса, при желании поэтапно или одновременно, при этом также можно использовать ферментационные методы. Отщепление защитных групп описано, например, в стандартных работах, которые упомянуты выше в разделе, относящемся к "Защитным группам".
Так например, защищенный карбокси, например низший алкоксикарбонил, трет-низший алкоксикарбонил, низший алкоксикарбонил, который замещен в положении 2 три-замещенной группой силила или в положении 1 низшим алкокси или низшим алкил-тио, либо дифенилметоксикарбонил, который не замещен или замещен, могут быть превращены в свободный карбокси путем обработки пригодной кислотой, такой как муравьиная кислота, хлороводород или трифторуксусная кислота, при желании с одновременным добавлением нуклеофильного соединения, такого как фенол или анизол. Карбокси также может быть освобожден от низшего алкоксикарбонила при помощи оснований, таких как гидроксиды, например гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия или гидроксид калия. Бензил-оксикарбонил, который не замещен или замещен, может быть освобожден, например, при помощи гидрогенолиза, то есть путем обработки водородом в присутствии металлического гидрирующего катализатора, такого как палладиевый катализатор. Кроме того, пригодно замещенный бензилоксикарбонил, такой как 4-нитробензил-окси-карбонил, может быть превращен в свободный карбокси восстановлением, например путем обработки дитионатом щелочного металла, таким как дитионат натрия, или восстановительным металлом, например цинком, либо солью восстановительного металла, такой как соль хрома (II), например хлорид хрома (II), обычно в присутствии агента, высвобождающего водород, который вместе с металлом может продуцировать водород в момент выделения, такого как кислота, главным образом пригодная карбоновая кислота, такая как низший алканкарбоновая кислота, которая не замещена или замещена с помощью, например, гидрокси, такая как, например, уксусная кислота, муравьиная кислота, гликолевая кислота, дифенилгликолевая кислота, молочная кислота, миндальная кислота, 4-хлорминдальная кислота или винная кислота, либо в присутствии спирта или тиола, при этом предпочтительно добавлять воду. При помощи обработки восстановительным металлом или солью металла, как описано выше, 2-гало-низший алкоксикарбонил (при желании после превращения группы 2-бромо-низшего алкоксикарбонила в соответствующую группу 2-иодо-низшего алкоксикарбонила) или ароилметоксикарбонил также можно превратить в свободный карбокси. Ароилметоксикарбонил может быть отщеплен путем обработки нуклеофильным, предпочтительно солеобразующим реагентом, таким как тио-фенолят натрия или иодид натрия. 2-(Три-замещенный силил)-низший алкоксикарбонил, такой как 2-три-низший алкилсилил-низший алкоксикарбонил, также можно превратить в свободный карбокси путем обработки солью фтористоводородной кислоты, которая продуцирует анион фторида, такой как фторид щелочного металла, например фторид натрия или калия, если подходит, то в присутствии макроциклического полиэфира ("краун-эфира"), либо фторидом органического четвертичного основания, такого как фторид тетра-низшего алкиламмония или фторид три-низший алкиларил-низшего алкиламмония, например фторид тетраэтиламмония или фторид тетрабутиламмония, в присутствии апротонного полярного растворителя, такого как диметилсульфоксид или N,N-диметилацетамид. Карбокси, который защищен в виде органического силилоксикарбонила, такого как три-низший алкилсилилокси-карбонил, например триметилсилилоксикарбонил, может быть высвобожден сольволитически традиционным способом, например обработкой водой, спиртом или кислотой, либо фторидом, как описано выше. Эстерифицированный карбокси можно освободить от защиты ферментативно, например с использованием эстераз или пригодных пептидаз, например эстерифицированного аргинина или лизина, такого как лизин-метиловый эфир, с использованием трипсина.
Соединение в соответствии с настоящим изобретением, которое получают данным способом, может быть превращено в другое соединение в соответствии с настоящим изобретением известным per se способом.
Соединение в соответствии с настоящим изобретением, содержащее гидроксильную группу, может быть эстерифицировано с помощью способов, известных per se. Эстерификацию можно осуществлять, например, с использованием спирта, такого как замещенный или незамещенный низший алканол, или его реакционноспособного сложного эфира. Пригодными реакционноспособными сложными эфирами желательных спиртов являются, например, те, которые используются с сильными неорганическими или органическими кислотами, такие как соответствующие галогениды, сульфаты, низшие алкансульфонаты или замещенные или незамещенные бензолсульфонаты, например хлориды, бромиды, иодиды, метан-, бензол- или p-толуолсульфонаты. Эстерификацию можно осуществлять, например, в присутствии основания, гидрида, гидроксида или карбоната щелочного металла или амина. Наоборот, соответствующие простые эфиры, такие как соединения низшего алкокси, могут быть отщеплены, например, при помощи сильных кислот, таких как минеральные кислоты, например галоидводородные кислоты, такие как бромистоводородная или иодистоводородная кислота, которые могут предпочтительно присутствовать в форме галогенидов пиридиния, либо при помощи кислот Льюиса, например галогенидов элементов основной группы III или соответствующих подгрупп. Эти реакции могут быть проведены, при необходимости, с охлаждением или нагреванием, например, при температуре приблизительно от -20 до +100oC, в присутствии или в отсутствие растворителя или разбавителя, в атмосфере инертного газа и/или под давлением и, где подходит, то в закрытом реакторе.
Соединения формулы I, в которых R2 обозначает водород, могут быть N-алкилированы известным per se способом. Алкилирование осуществляют, например, с использованием реакционноспособного сложного эфира низшего галоидалкила, например бромида или иодида, низшего алкансульфоната, например метансульфоната или p-толуолсульфоната, или ди-низшего алкилсульфата, например диметил сульфата, предпочтительно в основных условиях, таких как в присутствии раствора гидроксида натрия или раствора гидроксида калия, и благоприятно в присутствии межфазного катализатора, такого как тетрабутиламмония бромид или бензилтриметиламмония хлорид, если могут быть необходимы более сильные основные конденсирующие агенты, такие как амиды, гидриды или алкоксиды щелочного металла, например амид натрия, гидрид натрия или этилат натрия. Кроме того, соединения формулы I, в которых R2 обозначает иное, нежели водород, например являющийся низшим алкилом, могут быть получены в восстановительных условиях, например с использованием пригодного альдегида. Соответствующие соединения формулы I, в которых R2 обозначает водород, могут быть также ацилированы известным per se способом, например в соответствии с ацилированием, описанным для варианта а).
В соединениях формулы I, которые содержат в качестве заместителя экстерифицированную или амидированную группу карбоксила, группу этого типа можно превратить в свободную карбоксильную группу, например при помощи гидролиза, например в присутствии основного агента или кислотного агента, такого как минеральная кислота. Трет-бутилоксикарбонил, например, может быть также превращен в карбоксил, например известным per se способом, таким как обработка тригалоуксусной кислотой, такой как трифторуксусная кислота.
Предлагаемое изобретение относится в частности к способам, описанным в примерах.
Соли соединений формулы I могут быть получены известным per se способом. Так, например, кислые аддитивные соли соединений формулы I получают путем обработки кислотой или пригодным ионообменным реагентом. Соли могут быть превращены в свободные соединения традиционным способом, а кислые аддитивные соли могут быть превращены, например, путем обработки пригодным основным агентом.
В зависимости от процедуры и реакционных условий соединения в соответствии с изобретением, имеющие солеобразующие, в особенности основные свойства, могут быть получены в свободной форме или, предпочтительно, в форме солей.
В свете тесного взаимодействия между новым соединением в свободной форме и в форме его солей, в предшествующем и нижеприведенном описании свободное соединение или его соли могут быть поняты как означающие соответствующие соли или свободное соединение. Новые соединения, включая их соли солеобразующих соединений, также могут быть получены в форме их гидратов, либо они могут включать другие растворители, используемые для кристаллизации.
В зависимости от выбора исходных веществ и процедур новые соединения могут присутствовать в форме одного из числа возможных изомеров или их смесей, например в виде чистых оптических изомеров, таких как антиподы, либо в виде смесей изомеров, таких как рацематы, диастереоизомерные смеси или смеси рацематов, в зависимости от числа асимметрических атомов углерода.
Кислые аддитивные соли могут быть получены путем нейтрализации соединения формулы (I), имеющего основную группу, с помощью кислоты или кислотного ионообменника.
Соли с основанием могут быть получены нейтрализацией соединения формулы (I), имеющего кислотную группу, с помощью основного соединения.
Рацематы и смеси диастереоизомеров, полученные в соответствии с настоящим изобретением, могут быть разделены на чистые изомеры или рацематы известным per se способом на основе физико-химических различий в этих соединениях, например, фракционной кристаллизацией. Рацематы, полученные в соответствии с настоящим изобретением, также могут быть превращены в оптические антиподы известными способами, например перекристаллизацией из оптически активного растворителя, хроматографией на хиральных абсорбентах, с помощью пригодных микроорганизмов, путем расщепления специфическими иммобилизованными ферментами, посредством образования соединений включения, например с использованием хиральных краун-эфиров, при этом только один энантиомер может образовывать комплекс, или путем превращения в диастереизомерные соли, например путем взаимодействия рацемата основного конечного вещества с оптически активной кислотой, такой как карбоновая кислота, например винная кислота или яблочная кислота, либо сульфокислота, например камфарсульфокислота, и путем разделения смеси диастереомеров, полученной таким путем, например на основе различия в степени растворимости компонентов, составляющих эту смесь, на отдельные стереоизомеры, из которых желательный энантиомер может быть высвобожден под действием пригодных агентов. Более активный энантиомер преимущественно выделяют.
Предлагаемое изобретение также относится к тем вариантам способа, в соответствии с которыми соединение, получаемое в качестве промежуточного на любой стадии способа, используют в качестве исходного вещества и проводят недостающие стадии, или используют или, в особенности, образуют в реакционных условиях исходное вещество в форме производного или соли, и/или рацематов или антиподов.
В способе настоящего изобретения используют предпочтительно те исходные вещества, которые приводят к получению соединений, описанных в начале в качестве особенно пригодных. Предлагаемое изобретение аналогичным образом относится к новым исходным веществам, которые специально разработаны для получения соединений в соответствии с предлагаемым изобретением, к их использованию и к способам их получения. Изобретение особенно касается новых исходных веществ формул IIa, IIb, IIIa и IIIb, в которых переменные величины имеют значения, указанные выше, их получения и использования, например, в качестве исходного вещества.
Предлагаемое изобретение также относится к фармацевтическим препаратам, которые содержат соединения в соответствии с изобретением или их фармацевтически приемлемые соли в качестве активных компонентов, и к способам их получения.
Фармацевтические препараты в соответствии с предлагаемым изобретением, которые содержат соединение в соответствии с изобретением или его фармакологически приемлемые соли, - это такие, которые предназначены для энтерального, такого как пероральный, ректального и парентерального введения (а) теплокровным животным, при этом активный компонент присутствует как таковой или вместе с фармацевтически приемлемым носителем. Суточная доза активного компонента зависит от возраста и индивидуального состояния пациента, а также от режима введения лекарственного препарата. Новые фармацевтические препараты содержат, например, приблизительно от 10% до 80%, предпочтительно от 20% до 60%, активного компонента.
Фармакологически активные соединения настоящего изобретения могут быть использованы при получении фармацевтических композиций, содержащих эффективное количество этих соединений в отдельности или в сочетании или смеси с наполнителями или носителями, пригодными для энтерального или парентерального введения. Предпочтительны таблетки и желатиновые капсулы, которые включают активный компонент вместе с а) разбавителями, например лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином, б) глидантами, например кремнеземом, тальком, стеариновой кислотой, его магниевыми или кальциевыми солями и/или полиэтиленгликолем; для таблеток также в) связующими, например алюмосиликатом магния, крахмальной пастой, желатиной, трагантом, метилцеллюлозой, карбоксиметилцеллюлозой натрия и/или поливинилпирролидоном, если желательно, то г) диспергаторами или дезинтеграторами, например крахмалами, агаром, альгиновой кислотой или ее натриевой солью, либо пенообразующими смесями и/или д) адсорбентами, красителями, ароматизирующими и подслащивающими агентами. Инъецируемые препараты представляют собой предпочтительно водные изотонические растворы или суспензии, а суппозитории преимущественно получают из жирных эмульсий или суспензий. Эти соединения можно стерилизовать и/или вводить в них дополнительные вещества, например консерванты, стабилизаторы, смачивающие вещества или эмульгаторы, солюбилизаторы, соли для регулировки осмотического давления и/или забуференные растворы. Кроме того, они также могут содержать другие терапевтически ценные вещества. Эти препараты получают в соответствии с традиционными методиками смешивания, гранулирования или нанесения покрытий и с содержанием приблизительно от 0,1 до 100%, предпочтительно от 1 до 50%, активного компонента. Унифицированная доза для млекопитающего массой приблизительно от 50 до 70 кг может содержать приблизительно от 0,2 до 2000 мг, предпочтительно от 1 до 200 мг, активного компонента.
Следующие примеры иллюстрируют предлагаемое изобретение, описанное выше; однако они не должны восприниматься как ограничивающие объем притязаний. Температуры указаны в градусах Цельсия.

Не являющиеся коммерчески доступными 3-замещенные производные аланина были синтезированы в соответствии со Схемой II или в соответствии с работой М. J. O'Donnell, Tetrahedron Lett. 30, 2641 (1978).
Пример 1:
N-(3,5-Диметилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофан
К перемешанному раствору N-BOC-N-метил-(D)-фенилаланина (2,1 г, 7,5 ммоль) [BOC = трет-бутилоксикарбонил] в сухом DMF [N,N- диметилформамид] (15 мл) прибавляют хлоргидрат сложного метилового эфира (L)-триптофана (2 г, 7,8 ммоль) и гидроксибензтриазол (1,2 г, 8,8 ммоль). Смесь охлаждают до температуры 0oC и прибавляют по каплям 1-(3-диметиламинопропил)-3- этилкарбодиимид (1,7 мл, 9,2 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 2 часов. Гомогенную смесь разбавляют этилацетатом (500 мл) и промывают тремя порциями воды (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением сложного метилового эфира N-BOC-N-метил-(D)- фенилаланил-(L)-триптофана в виде белой пены. [α]D = +42o (c = 1,0; этанол).
Вышеуказанное неочищенное вещество растворяют в смеси трифторуксусной кислоты (6 мл) и этандитиола (1,5 мл) и перемешивают в атмосфере азота при комнатной температуре в течение 1 часа. Прибавляют 4 M раствор хлороводорода в диоксане (2 мл). Хлористоводородную соль осаждают путем прибавления простого эфира (400 мл) и гексана (200 мл), фильтруют и промывают простым эфиром с получением хлоргидрата сложного метилового эфира N-BOC-N-метил- (D)-фенилаланил-(L)-триптофана в виде белого порошка. [α]D = -29o (c = 1,0; этанол).
Раствор вышеуказанной хлористоводородной соли (200 мг, 0,48 ммоль) и 3,5-диметилбензойной кислоты (87 мг, 0,57 ммоль) в DMF (1 мл) обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимидом (0,11 мл, 0,6 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 2 часов. Гомогенную смесь разбавляют этилацетатом (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1:1, приводит к получению сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил(L)-триптофана в виде белой пены.
Это вещество гидролизуют при температуре 0oC с помощью гидроксида лития (20 мг, 0,47 ммоль) в смеси 2:1 MeOH/воды (9 мл). Через 3 часа реакционную смесь разбавляют простым эфиром (200 мл) и промывают тремя порциями воды (100 мл). Объединенные водные слои подкисляют до pH = 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата (200 мл). Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде белой пены; температура плавления 91 - 94oC. FAB-MS (масс-спектроскопия с бомбардировкой ускоренными атомами) m/e 498 (M+H)+ [α]D = -46o (c = 1,095; этанол). ЖХВР (Chiralcel OD, гексан/изопропанол/TFA (трифторуксусная кислота) 900 : 100: 3)) ee > 95%. ЯМР (CDCl3, 400 МГц): д [ppm] 8,29 (с), 8,15 (с), 7,56 (д, J = 7,8 Гц), 7,47 (д, J = 7,8 Гц), 7,3 - 6,7 (м), 6,48 (с), 5,92 (с), 5,41 (дд, J = 6,8, 9,7 Гц), 4,84 (дд, J = 5,8, 13,2 Гц), 4,33 (дд, J = 2, 7,2 Гц), 3,4 - 2,75 (м), 2,70 (с), 2,18 (с), 1,91 (с).
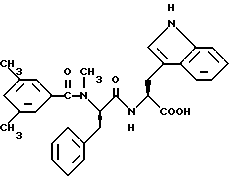
Пример 2:
Восстановление сложного метилового эфира N-(3,5- диметил-бензоил)-N-метил-(D)-фенилаланил-(L)-триптофана (смотри выше) с помощью L-селектрида [три-втор-бутилборогидрида лития] в сухом THF [тетрагидрофуране] при температуре 0oC приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофанола в виде бесцветного масла; FAB-MS m/e 484 (M+H)+.
Пример 3:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)- фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидродиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (с = 1,0; этанол)) с хлоргидратом (L)-триптофанамида в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)- триптофанамида; FAB-MS m/e 494 (M+H)+.
Пример 4:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)- (4-фенил)фенилаланина (смотри Пример 55) с хлоргидратом (L)-триптофанонитрила (смотри Пример 8) в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенил-фенил)аланил-(L)-триптофанонитрила.
Раствор вышеуказанного нитрила (100 мг, 0,18 ммоль) в толуоле (10 мл) обрабатывают с помощью азида тетрабутилолова (71 мг, 0,21 ммоль) и нагревают с обратным холодильником в течение 4 часов в атмосфере азота. Охлажденный раствор обрабатывают смесью дихлорметана (10 мл), метанола (6 мл) и аммиака (0,2 мл), перемешивают при комнатной температуре в течение 30 минут и концентрируют. Хроматография неочищенного вещества градиентом от этилацетата/гексана/уксусной кислоты, 1 : 1 : 0,01, до этилацетата/уксусной кислоты, 1 : 0,01, приводит к получению 5-[N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил-(L)- триптофенил]-1H-тетразола в виде бесцветного твердого вещества; FAB-MS m/e 598 (M+H)+; температура плавления 141 - 143oC.
Пример 5:
N-(3,5-Диметилбензоил)-транс-3-фенил-(D)-пролинил-(L)- триптофан и
N-(3,5-диметилбензоил)-транс-3-фенил-(L)-пролинил-(L)- триптофан
Раствор хлоргидрата сложного метилового эфира транс-3-фенил-(D,L)-пролина (2,0 г, 8,3 ммоль) (J. Y. L. Chung et al., J. Org. Chem. 55, 270 (1990)) и 3,5-диметилбензоилхлорида (1,6 г, 9,5 ммоль) в дихлорметане (20 мл) обрабатывают DMAP [диметиламинопиридином] (2,4 г, 19,6 ммоль). Реакционную смесь перемешивают в течение 2 часов, разбавляют дихлорметаном (300 мл) и промывают тремя порциями воды (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Неочищенный материал хроматографируют на кремнеземе с помощью этилацетата/гексана, 1 : 1, с получением сложного метилового эфира N-(3,5-диметилбензоил)-3-фенил-(D,L)-пролина в виде смеси транс- и цис-изомеров.
Это вещество гидролизуют при комнатной температуре с помощью 1 M раствора гидроксида лития (6 мл) в THF с получением N-(3,5-диметилбензоил)-транс-3-фенил- (D,L)-пролина в виде белой пены.
К перемешанному раствору N-(3,5-диметилбензоил)-транс-3- фенил-(D,L)-пролина (225 мг, 0,69 ммоль) в сухом DMF (2 мл) прибавляют хлоргидрат сложного метилового эфира (L)-триптофана (180 мг, 0,7 ммоль) и гидроксибензтриазол (115 мг, 0,85 ммоль). Смесь охлаждают до температуры 0oC и прибавляют по каплям 1-(3-диметиламинопропил)-3-этилкарбодиимид (0,15 мл, 0,85 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Гомогенную смесь разбавляют этилацетатом (100 мл) и промывают бикарбонатом натрия (70 мл) и двумя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1:1, приводит к получению 2 диастереоизомерных сложных эфиров: сложного метилового эфира N-(3,5-диметил-бензоил)-транс-3-фенил-(D)-пролинил-(L)-триптофана и сложного метилового эфира N-(3,5-диметилбензоил)-транс-3-фенил-(L)-пролинил-(L)-триптофана, каждый из которых представлен в виде белой пены.
Каждый из вышеприведенных сложных эфиров гидролизуют отдельно при температуре 0oC с помощью 1 M раствора гидроксида лития в метаноле. Реакционную смесь разбавляют простым эфиром и промывают тремя порциями воды. Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата. Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанных в заголовке соединений, каждое в виде белой пены; FAB-MS m/e 510 (M+H)+ каждый.
Пример 6:
Гидроксамовая кислота N-(3,5-диметилбензоил)-N-метил- (D)-(4-фенилфенил)аланил-(L)-триптофана
К перемешанному раствору метилата натрия (1,2 ммоль) в сухом метаноле (5 мл) прибавляют при комнатной температуре в атмосфере азота хлоргидрат гидроксиламина. После 20-минутного перемешивания прибавляют сложный метиловый эфир N-(3,5-диметилбензoил)-N-метил- (D)-(4-фенилфенил) аланил-(L)-тpиптофaнa (260 мг, 0,44 ммоль; смотри Пример 55). Реакционную смесь перемешивают в течение 3 часов, разбавляют простым эфиром (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием градиента от этилацетата/гексана, 1 : 2, до этилацетата приводит к получению указанного в заголовке соединения в виде белой пены; FAB-MS m/e 589 (M+H)+.
Пример 7:
Взаимодействие (3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланина (Пример 55) с хлоргидратом сложного метилового эфира (D,L)-(3-бензо[b]тиенил)аланина (P. N. Rao, Int. J. Peptide Protein Res. 29, 118 (1987)) с последующим хроматографическим разделением двух диастереоизомерных сложных эфиров и гидролизом сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил- (D)-(3-бензо[b] тиенил)аланина; FAB-MS m/e 591 (M+H)+ и N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)-аланил-(L)-(3- бензо[b] тиенил)аланина; FAB-MS m/e 591 (M+H)+.
Пример 8:
N-(3,5-Диметилбензоил)-N-метил-(D)-фенилаланил-(L)- триптофанонитрил
К перемешанному раствору хлоргидрата (L)-триптофанамида (1 г, 4,2 ммоль) и ди-трет-бутил дикарбоната (1,1 г, 5 ммоль) в дихлорметане (10 мл) прибавляют по каплям триэтиламин (0,7 мл, 5 ммоль). Через 1 час реакционную смесь разбавляют дихлорметаном (200 мл) и промывают 1 М раствором хлористоводородной кислоты (100 мл), насыщенным раствором бикарбоната натрия (100 мл) и водой (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением N-BOC-(L)-триптофанамида.
Вышеуказанное неочищенное вещество растворяют в дихлорметане (40 мл) и обрабатывают имидазолом (0,4 г) и хлорангидридом фосфорной кислоты (0,4 мл). После перемешивания при комнатной температуре в течение ночи прибавляют пиридин (4 мл) и вновь хлорангидрид фосфорной кислоты (0,4 мл). После перемешивания в течение одного часа при комнатной температуре реакционную смесь разбавляют дихлорметаном (200 мл) и промывают тремя порциями 1 M раствора хлористоводородной кислоты (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1:2, приводит к получению N-BOC-(L)-триптофанонитрила (0,5 г) в виде белого твердого вещества. Вышеуказанное вещество растворяют в смеси трифторуксусной кислоты (4 мл) и этандитиола (1 мл) и перемешивают в атмосфере азота при комнатной температуре в течение одного часа. Прибавляют 4 М раствор хлороводорода в диоксане (2 мл). Хлоргидрат осаждают путем прибавления простого эфира (400 мл) и гексана (200 мл), фильтруют и промывают простым эфиром с получением хлоргидрата (L)-триптофанонитрила в виде белого твердого вещества.
К перемешанному раствору N-(3,5-диметилбензоил)-N-метил-(D)- фенилаланина (200 мг, 0,64 ммоль), полученному из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол) в сухом DMF (5 мл) прибавляют описанный выше хлоргидрат (L)- триптофанонитрила (120 мг, 0,65 ммоль) и гидроксибензтриазол (90 мг, 0,66 ммоль). Смесь охлаждают до температуры 0oC и прибавляют по каплям 1-(3-диметиламинопропил)-3-этилкарбодиимид (0,13 мл, 0,68 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 2 часов. Гомогенную смесь разбавляют этилацетатом (200 мл) и промывают тремя порциями воды (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 2 : 3, приводит к получению указанного в заголовке соединения в виде слегка желтой пены; FAB-MS m/e 479 (M+H)+.
Пример 9:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом (L)-триптамина в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенил-аланил-(L)-триптамина; FAB-MS m/e 454 (M+H)+.
Пример 10:
В соответствии с методикой, описанной в Примере 1, но начиная с N-BOC-(D)-фенилаланина и хлоргидрата сложного метилового эфира (L)-триптофана, получают N-(3,5-диметилбензоил)-(D)-фенилаланил-(L)-триптофан; температура плавления 95-98oC; [α]D = + 19o (c = 0,465; этанол); FAB-MS m/e 484 (M+H)+.
Пример 11:
В соответствии с методикой, описанной в Примере 12, но начиная с N-(3,5-диметилбензоил)-(D)-фенилаланина и хлоргидрата сложного метилового эфира N-метил-(L)-триптофана, получают N-(3,5-диметилбензоил)-(D)-фенилаланил-N-метил-(L)-триптофан; FAB-MS m/e 498 (M+H)+.
Пример 12:
N-(3,5-Диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил-N-метил- (L)-триптофан
К перемешанному раствору N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланина (207 мг, 0,53 ммоль; смотри Пример 55) в сухом DMF (8 мл) прибавляют хлоргидрат сложного метилового эфира N-метил-(L)-триптофана (185 мг, 0,69 ммоль) и гидроксибензтриазол (137 мг, 1,02 ммоль). Смесь охлаждают до температуры 0oC и прибавляют по каплям 1-(3-диметиламинопропил)-3-этилкарбодиимид (0,12 мл, 0,66 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Гомогенную смесь разбавляют этилацетатом (200 мл) и промывают тремя порциями воды (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1 : 3, приводит к получению сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)-аланил-(L)-триптофана в виде белой пены. Вещество гидролизуют при температуре 0oC с помощью гидроксида лития (5 мг, 0,12 ммоль) в MeOH (0,6 мл) и воде (60 мл). Через 3 часа реакционную смесь разбавляют простым эфиром (100 мл) и промывают тремя порциями воды (60 мл). Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата (100 мл). Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде белой пены; FAB-MS m/e 588 (M+H)+; [α]D = - 17oC (с = 0,96; метанол).
Пример 13:
В соответствии с методикой, описанной в Примере 12, и, начиная с N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина и хлоргидрата сложного метилового эфира N-метил-(L)-триптофана, получают N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-N-метил-(L)-триптофан; FAB-MS m/e 510 (M-H)-.
Пример 14:
В соответствии с методикой, описанной в Примере 12, и, начиная с N-(3,5-диметилбензоил)-(1-метилпропил)-(D)-фенилаланина (получен путем восстановительного алкилирования сложного метилового эфира (D)-фенилаланина с помощью этилметилкетона в присутствии цианоборогидрида натрия с последующим N-ацилированием с помощью 3,5-диметилбензоил хлорида в присутствии DMAP и гидролизом части сложного метилового эфира в соответствии с Примером 1) и хлоргидрата сложного метилового эфира (L)-триптофана, получают N-(3,5-диметилбензоил)-N-(1-метилпропил)- (D)-фенилаланил-(L)-триптофан; FAB-MS m/e 540 (M+H)+.
Пример 15:
В соответствии с методикой, описанной в Примере 12, и, начиная с N-(3,5-диметилбензоил)-N-этил-(D)-фенилаланина (получен путем алкилирования сложного метилового эфира N-(3,5-диметилбензоил)- (D)-фенилаланина с помощью этилиодида в присутствии гидрида натрия с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1) и хлоргидрата сложного метилового эфира (L)-триптофана, получают N-(3,5-диметилбензоил)-этил-(D)-фенилаланил-(L)-триптофан; FAB-MS m/e 510 (M-H)-.
Пример 16:
В соответствии с методикой, описанной в Примере 12, и, начиная с N-(3,5-диметилбензоил)-N-(циклогексилметил)- (D)-фенилаланина (получен путем восстановительного алкилирования сложного метилового эфира (D)-фенилаланина с помощью циклогексанкарбоксальдегида в присутствии цианоборогидрида натрия с последующим N-ацилированием с помощью 3,5-диметилбензоил хлорида в присутствии DMAP и гидролизом части сложного метилового эфира в соответствии с Примером 1) и хлоргидрата сложного метилового эфира (L)-триптофана, получают N-(3,5-диметилбензоил)-N-(циклогексилметил)-(D)-фенилаланил- (L)-триптофан; FAB-MS m/e 580 (M+H)+.
Пример 17:
В соответствии с методикой, описанной в Примере 12, и начиная с N-(3,5-диметилбензоил)-N-циклогексил-(D)-фенилаланина (получен путем восстановительного алкилирования сложного метилового эфира (D)-фенилаланина с помощью циклогексанона в присутствии цианоборогидрида натрия с последующим N-ацилированием с помощью 3,5-диметилбензоил хлорида в присутствии DMAP и гидролизом части сложного метилового эфира в соответствии с Примером 1) и хлоргидрата сложного метилового эфира (L)-триптофана, получают N-(3,5-диметилбензоил)-N-циклогексил- (D)-фенилаланил-(L)-триптофан; FAB-MS m/e 566 (M+H)+.
Пример 18:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с уксусной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-ацетил-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 408 (M+H)+.
Пример 19:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с бензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-бензоил-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 470 (M+H)+.
Пример 20:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с транс-2-фенил-1-циклопропанкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(транс-2-фенил-1 - циклопропилкарбонил)-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 510 (M+H)+.
Пример 21:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 2-нафтойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(2-нафтоил)-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 520 (M+H)+.
Пример 22:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с p-толуиловой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(4-метилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофана: FAB-MS m/e 484 (M+H)+.
Пример 23:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с m-толуиловой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-метилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 484 (M+H)+.
Пример 24:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-дихлорбензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению (3,5-дихлорбензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 538 (M+H)+.
Пример 25:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-дифторбензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению (3,5-дифторбензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 506 (M+H)+.
Пример 26:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-бис(трифторметил)бензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-[(3,5-бис(трифторметил)бензоил] -N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 606 (M+H)+.
Пример 27:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-бис(трифторметил)фенилуксусной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-[(3,5-бис(трифторметил)фенилацетил]-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 620 (M+H)+.
Пример 28:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3-метил-1-циклогексанкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-метил-1 -циклогексилкарбонил)- N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 490 (M+H)+.
Пример 29:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3-метилвалериановой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-метилвалероил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 464 (M+H)+.
Пример 30:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 2-метилмасляной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(2-метилбутироил)-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 450 (M+H)+.
Пример 31:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-дигидроксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-дигидроксибензоил)-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 502 (M+H)+.
Пример 32:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 2,5-дигидроксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(2,5-дигидроксибензоил)-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 502 (M+H)+.
Пример 33:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 2-тиофенкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(2-тиофенкарбонил)-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 474 (M+H)+.
Пример 34:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 5-метил-2-тиофенкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(5-метил-2-тиофенкарбонил)-N-метил-(D)- фенилаланил-(L)-триптофана; FAB-MS m/e 488 (M+H)+.
Пример 35:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3-метил-2-тиофенкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-метил-2-тиофенкарбонил)-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 488 (M+H)+.
Пример 36:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 4-фенилбензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(4-фенилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 546 (M+H)+.
Пример 37:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-диметоксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметоксибензоил)-N- метил-(D)-фенилаланил-(L)-триптофана; FAB-MS m/e 530 (M+H)+.
Пример 38:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 4-метоксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(4-диметоксибензоил)-N-метил-(D)- фенилаланил-(L)-триптофана; FAB-MS m/e 500 (M+H)+.
Пример 39:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 2-метоксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(2-диметоксибензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 498 (M+H)+.
Пример 40:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-динитробензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-динитробензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 558 (M+H)+.
Пример 41:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3,5-дибромобензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-дибромобензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 626 (M+H)+.
Пример 42:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 3-метоксибензойной кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-диметоксибензоил)-N-метил-(D)-фенилаланил- (L)-триптофана; FAB-MS m/e 500 (M+H)+.
Пример 43:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с изоникотиновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(4-пиридилкарбонил)-N-метил-(D)- фенилаланил-(L)-триптофана; FAB-MS m/e 471 (M+H)+.
Пример 44:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с 6-хлоро-2-пиридинкарбоновой кислотой в соответствии с Примером 12, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(6-хлоро-2-пиридинкарбонил)-N-метил-(D)- фенилаланил-(L)-триптофана; FAB-MS m/e 503 (M+H)+.
Пример 45:
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил-(L)-триптофана (смотри Пример 1) с изопропил хлороформиатом в присутствии триэтиламина, с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-изопропоксикарбонил-N-метил-(D)-фенилаланил-(L)- триптофана; FAB-MS m/e 452 (M+H)+.
Пример 46:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(L)-изолейцина (получен в соответствии с методикой, описанной в Примере 78) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-диметилбензоил)-N-метил-(L)-триптофана; FAB-MS m/e 464 (M+H)+.
Пример 47:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)- (3,5-диметилфенил)аланина (получен из 3,5-диметилбензоилбромида в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил- (D,L)-(3,5-диметилфенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 524 (M-H)-.
Пример 48:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-циклогексилаланина (получен из бромометилциклогексана в соответствии с общим методом А по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил- (D,L)-циклогексилаланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 504 (M+H)+.
Пример 49:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-циклогексилглицина (получен из бромоциклогексана в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)- N-метил-(D, L)-циклогексилглицин-(L)- триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 488 (M-H)-.
Пример 50:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-(2-нафтил)аланина (получен из (D)-(2-нафтил)аланина в соответствии с Примером 55) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3-диметилбензоил)-N-метил-(D)-(2-нафтил)аланил-(L)-триптофана; FAB-MS m/e 546 (M-H)-.
Пример 51:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-фенилглицина (получен из бензилбромида в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D, L)-фенилглицин-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 484 (M+H)+.
Пример 52:
К раствору 2-(гидроксиметил)тиофена (5,7 г, 49,9 ммоль) и тетрабромметана (24,8 г, 74,9 ммоль) в THF (85 мл) прибавляют трифенилфосфин (19,6 г, 74,9 ммоль) при температуре 0oC. Смесь перемешивают при комнатной температуре в течение 3 часов, разбавляют простым диэтиловым эфиром и фильтруют целитом. Фильтрат концентрируют в вакууме, разбавляют вновь простым диэтиловым эфиром и фильтруют. Фильтрат конденсируют в вакууме с получением 2-(бромометил)тиофена.
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-тиенил)аланина (получен из 2-(бромометил)тиофена в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-тиенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 504 (M+H)+.
Пример 53:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-фурил)аланина (получен из 3-(бромометил)фурана в соответствии с методикой, описанной в Примере 52, в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-(3-фурил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 488 (M+H)+.
Пример 54:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-пиридил)аланина (получен из коммерчески доступного 2-(хлорметил)пиридина в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-(2-пиридил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 499 (M+H)+.
Пример 55:
N-(3,5-Диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил-(L)-триптофан
Раствор тионилхлорида (6,5 мл) в сухом метаноле (280 мл) при температуре -20oC обрабатывают (D)-(4-фенилфенил)аланином (3,7 г, 13,3 ммоль) (Y. Yabe et al., Chem. Phaem. Bull. 24(12), 3149 (1976)). Реакционную смесь кипятят с обратным холодильником в течение ночи и концентрируют в вакууме. Перекристаллизация из метанола/простого эфира дает хлоргидрат сложного метилового эфира (D)-(4-фенилфенил)аланина; [α]D = + 13o (c = 1,025; метанол). Раствор вышеуказанного вещества (315 мг, 0,94 ммоль) в сухом THF (0,4 мл) обрабатывают при комнатной температуре водой (0,4 мл), формалином (0,15 мл, 1,88 ммоль) и только что перегнанным циклопентадиеном (0,3 мл, 3,63 ммоль). Слегка желтый раствор перемешивают при комнатной температуре в течение 2 часов, промывают гексаном (100 мл), разбавляют 4% раствором бикарбоната натрия (100 мл) и экстрагируют хлороформом (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением бициклического промежуточного вещества (0,39 г). Это вещество растворяют при комнатной температуре в атмосфере азота в хлороформе (4,7 мл) и обрабатывают трифторуксусной кислотой (4,7 мл) и триэтилсиланом (0,45 мл). Раствор перемешивают в течение 20 часов и концентрируют в вакууме. Неочищенный продукт растворяют в этилацетате (200 мл) и промывают 1 M хлористоводородной кислотой (100 мл) и насыщенным раствором бикарбоната натрия (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением N-метил-(D)-фенилфенилаланина в виде белой пены. Раствор вышеуказанного вещества в хлороформе (5 мл) обрабатывают 2 M раствором карбоната натрия (0,6 мл) и 3,5-диметилбензоилхлоридом (0,3 мл, 1,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часа, разбавляют этилацетатом (200 мл) и промывают 4 % раствором бикарбоната натрия (100 мл), водой (100 мл), 1 M хлористоводородной кислотой (100 мл) и вновь водой (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 4:1, приводит к получению сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенилаланина; [α]D = + 48o (c = 0,685; метанол); ee > 98% (ЖХВР: Chiralcel OF).
Это вещество (110 мг, 0,27 ммоль) гидролизуют при температуре 0oC с помощью гидроксида лития (13 мг, 0,31 ммоль) в MeOH (0,8 мл), воде (0,4 мл) и THF (0,4 мл). Через 2 часа реакционную смесь разбавляют простым эфиром (200 мл) и промывают тремя порциями воды (100 мл). Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата (200 мл). Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланина в виде белой пены; [α]D = + 7,5o (c = 1,0; метанол).
Раствор вышеуказанного вещества (103 мг, 0,27 ммоль), хлоргидрата сложного метилового эфира (L)-триптофана (100 мг, 0,39 ммоль) и гидроксибензтриазола (70 мг, 0,52 ммоль) в сухом DMF (3 мл) обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимидом (0,07 мл, 0,38 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Гомогенную смесь разбавляют этилацетатом (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1: 1, приводит к получению сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил-(L)-триптофана в виде белой пены; de > 98% (ЖХВР: Chiralcel OD).
Это вещество гидролизуют при температуре 0oC с помощью гидроксида лития (10 мг, 0,23 ммоль) в MeOH (метанол) (2 мл), THF (1 мл) и воде (1 мл). Через 3 часа реакционную смесь разбавляют простым эфиром (100 мл) и промывают тремя порциями воды (60 мл). Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата (100 мл). Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде белой пены; FAB-MS m/e 574 (M+H)+; [α]D/= + 2,5 (c = 1,0; этанол); ЯМР (CDCl3, 400 МГц): д [ppm] 8,32 (c), 8,22 (с), 7,6 - 6,8 (м), 6,93 (с), 6,8 (м), 6,51 (с), 5,97 (с), 5,46 (т, J = 8 Гц), 4,85 (к, J = 6 Гц), 4,36 (м), 3,4 - 2,8 (м), 2,73 (с), 2,15 (с), 1,85 (с).
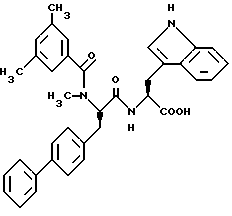
Пример 56:
Смесь 3-метилбифенила (5,23 г, 31,1 ммоль), N-бромосукцинимида (5,56 г, 31,2 ммоль), бензоилпероксида (135 мг, 0,56 ммоль) и четыреххлористого углерода (150 мл) кипятят с обратным холодильником в течение 17 часов. Смесь концентрируют в вакууме и остаток очищают колоночной флеш-хроматографией (гексан) с получением 3-фенилбензилбромида.
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-фенилфенил)аланина (получен из 3-фенилбензоилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-фенилфенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 574 (M+H)+.
Пример 57:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-дифенил)аланина (получен из коммерчески доступного дифенилбромометана в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-(3-дифенил)-аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 572 (M-H)-.
Пример 58:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(4-хинолил)аланина [получен из 4-(бромометил)хинолина (из 4-(гидроксиметил)хинолина в соответствии с методикой, описанной в Примере 52) в соответствии с общим методом B по схеме III] с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-(4-хинолил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 547 (M-H)-.
Пример 59:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-хлорофенил)аланина (получен из коммерчески доступного 2-хлоробензилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-хлорофенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 530 (M-H)-.
Пример 60:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-хлорофенил)аланина (получен из коммерчески доступного 3-хлоробензилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-хлорофенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 532 (M+H)+.
Пример 61:
Взаимодействие N-(3,5-диметилбензоил)-1-метил- (D, L)-(4-хлорофенил)аланина (получен из коммерчески доступного 4-хлоробензилхлорида в соответствии с общим методом A по схеме II) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению (3,5-диметилбензоил)-N-метил-(D, L)-(2-хлорофенил)аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 530 (M-H)-.
Пример 62:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-[(4-2- пиридил)фенил] аланина [получен из 4-(2-пиридил)бензилбромида (из 4-(2-пиридил)толуола в соответствии с методикой, описанной в Примере 56) в соответствии с общим методом B по схеме III] с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил- (D, L)-[(4-(2-пиридил)фенил] аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 575 (M+H)+.
Пример 63:
Взаимодействие (3,5-диметилбензоил)-1-метил- (D, L)-(3-фенил-проп-1-ил)глицина (получен из коммерчески доступного 1-бромо-3-фенилпропана в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-(3-фенил-проп-1-ил)глицил-(L)- триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 524 (M-H)-.
Пример 64:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-тирозина (получен из (D)-тирозина в соответствии с методикой, описанной в Примере 55) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)- тирозил-(L)-триптофана; FAB-MS m/e 512 (M-H)-.
Пример 65:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-O-метил-(D)-тирозина (получен O-метилированием N-(3,5-диметилбензоил)-N-метил-(D)-тирозина (Пример 64)) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-O-метил-(D)-тирозил-(L)-триптофана; FAB-MS m/e 528 (M+H)+.
Пример 66:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-O-бензил-(D)-тирозина (получен O-бензилированием N-(3,5-диметилбензоил)-N-метил-(D)-тирозина (Пример 64)) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-O-бензил-(D)-тирозил-(L)-триптофана; FAB-MS m/e 602 (M-H)-.
Пример 67:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом сложного метилового эфира (L)-фенилаланина в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)- N-метил-(D)-фенилаланил-(L)- фенилаланина; FAB-MS m/e 457 (M-H)-.
Пример 68:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом сложного метилового эфира (L)-(1-нафтил)аланина в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)- N-метил-(D)-фенилаланил-(L)-(1-нафтил) аланина; FAB-MS m/e 509 (M+H)+.
Пример 69:
Взаимодействие N-(3,5-диметилбензоил)-метил-(D)-(4-фенилфенил)аланина (Пример 55) с хлоргидратом сложного метилового эфира (L)-(1-нафтил)аланина с последующим гидролизом части сложного метилового эфира приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланил-(L)-(1-нaфтил)аланина; FAB-MS m/e 585(M+H)+.
Пример 70:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (с = 1,0; этанол)) с хлоргидратом сложного метилового эфира (L)-(2-нафтил)аланина с последующим гидролизом части сложного метилового эфира приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)-(2-нафтил)аланина; FAB-MS m/e 509 (M+H)+.
Пример 71:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (с = 1,0; этанол)) с хлоргидратом сложного метилового эфира (L)-гомо-фенилаланина в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)-гомо-фенилаланина; FAB-MS m/e 473 (M+H)+.
Пример 72:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом сложного метилового эфира (D,L)-Нинд-метил-триптофана с последующим гидролизом части сложного метилового эфира приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(D, L)-Нинд-метилтриптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 512 (M+H)+.
Пример 73:
3-[N-[N-Диметилбензоил)-N-метил-(D)-фенилаланил] - (2-аминоэтил)]индол-4-карбоновая кислота
Синтез метил 3-(2-аминоэтил)индол-4-карбоксилата:
Раствор метил индол-4-карбоксилата (1,1 г, 6,2 ммоль) и соли Eschenmoser [N, N-диметилметиленаммония иодид] (1,3 г, 7 ммоль) в ацетонитриле (15 мл) кипятят с обратным холодильником в течение 3 часов. Реакционную смесь концентрируют, повторно растворяют в дихлорметане (400 мл) и промывают 1 M раствором гидроксида натрия (200 мл) и водой (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют. Полученный метил 3-(диметиламинометил)индол-4-карбоксилат (1,2 г) метилируют с помощью метил иодида (0,7 мл) в смеси дихлорметана (25 мл) и простого эфира (13 мл). Реакционную смесь концентрируют, продукт растворяют в DMSO (7 мл) и обрабатывают цианидом калия (700 мг, 10 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляют этилацетатом (200 мл) и промывают тремя порциями воды (100 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография сырого вещества на кремнеземе с использованием этилацетата/гексана, 2 : 3, приводит к получению метил 3-(цианометил)индол-4-карбоксилата в виде темного масла. Гидрирование в уксусной кислоте в присутствии катализатора в виде оксида платины дает искомое промежуточное вещество в виде твердого тела оранжевого цвета.
Взаимодействие:
Раствор вышеуказанного 3-(2-аминоэтил)индол-4-карбоксилата (50 мг, 0,23 ммоль), гидроксибензтриазола (37 мг, 0,27 ммоль) и N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (70 мг, 0,23 ммоль; получен из соответствующего сложного метилового эфира, дописанного в Примере 78, путем гидролиза с помощью гидроксида лития: [α]D = + 88o (c = 1,0; этанол)) в DMF (1 мл) при температуре 0oC обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимидом (0,05 мл, 0,27 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 2 часов. Гомогенную смесь разбавляют этилацетатом (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография неочищенного вещества на кремнеземе с использованием этилацетата/гексана, 1:1, приводит к получению 3-N-[N-(3,5-диметилбензоил)-N-метил-(D)-(фенилаланил] (2-аминоэтил)индол- 4-карбоксилата в виде белой пены. Это вещество гидролизуют при комнатной температуре с помощью гидроксида лития (7 мг, 0,15 ммоль) в смеси MeOH (3 мл), THF (1 мл) и воды (2 мл). Через 72 часа реакционную смесь разбавляют простым эфиром (200 мл) и промывают тремя порциями воды (100 мл). Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата (200 мл). Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде белой пены; FAB-MS m/e 498 (M+H)+.
Пример 74:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина [получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)] с хлоргидратом сложного метилового эфира (D,L)-(2-пиридил)-аланина (получен в соответствии с Примером 54 согласно общему методу A в соответствии со схемой III) в соответствии с Примером 1 с последующим препаративным ЖХВР-разделением 2 диастереоизомерных сложных эфиров и гидролизом частей сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(D)-(2-пиридил)-аланина; FAB-MS m/e 460 (M+H)+ и N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)-(2-пиридил)аланина; FAB-MS m/e 460 (M+H)+.
Пример 75:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом сложного метилового эфира (D,L)-(4-фенилфенил)-аланина (получен из коммерчески доступного 4-фенилбензил-хлорида согласно общему методу A в соответствии со схемой III) в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(D,L)-(4-фенилфенил)аланина в виде смеси 2 диастереоизомеров; FAB-MS m/e 533 (M-H)-.
Пример 76:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с хлоргидратом сложного этилового эфира (D,L)-(4-хинолинил)-аланина (получен, как описано в Примере 58 в соответствии с общим методом B согласно схеме III) в соответствии с Примером 1 с последующим гидролизом части сложного этилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(D,L)- (4-хинолинил)аланина в виде смеси 2 диастереоизомеров; FAB-MS m/e 508 (M-H)-.
Пример 77:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен из соответствующего сложного метилового эфира, описанного в Примере 78, путем гидролиза с помощью гидроксида лития в смеси метанол/вода: [α]D = + 88o (c = 1,0; этанол)) с метил 3-(3-индолил)-2-гидроксипропионатом (получен из 3-индолпирувата восстановлением с помощью борогидрида натрия) в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению сложного этилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-1-карбокси-2-(3-индолила) в виде смеси 2 диастереоизомеров; FAB-MS m/e 499 (M+H)+.
Пример 78:
5-(R)-[N-(3,5-Диметилбензоил)-N-метил] амино-2-(R)-(3-индолил)метил- 4-оксо-6-фенилкапроновая кислота
Перемешанный раствор N-BOC-N-метил-(D)-фенилаланина (3 г, 10,5 ммоль) в метиленхлориде (25 мл) обрабатывают при температуре 0oC с использованием незначительного избытка диазометана в простом эфире (25 мл). Реакционную смесь перемешивают при температуре 0oC и концентрируют в вакууме с получением сложного метилового эфира N-BOC-N-метил-(D)-фенилаланина в виде бесцветного масла. Вышеуказанное вещество растворяют в смеси трифторуксусной кислоты (8 мл) и этандитиола (2 мл) и перемешивают в атмосфере азота при комнатной температуре в течение 1 часа. Добавляют 4 M раствор хлороводорода в диоксане (3,6 мл). Хлоргидрат осаждают путем прибавления простого эфира (400 мл) и гексана (300 мл), фильтруют и промывают простым эфиром с получением хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланина (2,4 г) в виде белого порошка. Раствор вышеуказанного хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланина (2,4 г, 10 ммоль) и 3,5-диметилбензойной кислоты (1,8 г, 11 моль) в DMF (15 мл) при температуре 0oC обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимидом (2,2 мл, 11 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Гомогенную смесь разбавляют этилацетатом (500 мл) и промывают тремя порциями воды (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Неочищенное вещество хроматографируют на кремнеземе с использованием этилацетата/-гексана, 1 : 2, получая сложный метиловый эфир N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина в виде бесцветного масла. [α]D = + 111o (c = 0,94; этанол).
Охлажденный (- 70oC) раствор диметил метилфосфоната (800 мг, 6,4 ммоль) в сухом THF (15 мл) в атмосфере азота обрабатывают 1,5 M раствором бутиллития в гексане (4,2 мл, 6,3 ммоль). Перемешивание продолжают при температуре - 70oC в течение 30 минут. Прибавляют по каплям раствор вышеупомянутого сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (850 мг, 2,6 ммоль) в сухом THF (5 мл). Бесцветную реакционную смесь перемешивают при температуре -70oC в течение 2 часов. Реакционную смесь охлаждают путем прибавления 1 мл уксусной кислоты, разбавляют этилацетатом (400 мл) и промывают тремя порциями воды (300 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография неочищенного вещества на кремнеземе с использованием этилацетата приводит к получению диметил 3-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-2-оксо-4-фенил-1-бутилфосфоната в виде бесцветного масла. [α]D = + 145o (c = 0,99; этанол).
К охлажденной (0oC) суспензии гидрида натрия (20 мг 60% в масле, 0,5 ммоль) в сухом THF (1 мл) в атмосфере азота прибавляют по каплям диметил 3-(R)-[N-(3,5-диметилбензоил)-N-метил] амино-2-оксо-4- фенил-1-бутилфосфонат (200 мг, 0,5 ммоль) в сухом THF (0,5 мл). Перемешивание продолжают в течение 30 минут. Прибавляют по каплям бензил индол-3-пируват (140 мг, 0,5 ммоль; получен из коммерчески доступной индол-3-пировиноградной кислоты и бензилбромида) в 0,5 мл сухого THF. Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Желтую реакционную смесь разбавляют этилацетатом (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография неочищенного вещества на кремнеземе с использованием этилацетата приводит к получению смеси E/Z продуктов (105 мг). Это вещество подвергают гидрогенолизу под давлением 5 атм водорода в этаноле при температуре 50 - 60oC в присутствии катализатора Уилкинсона (хлорид трис-(трифенилфосфин)-родия(I)). Хроматография на кремнеземе с использованием этилацетата/гексана, 1 : 2, приводит к получению бензил 5-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-2-(R,S)-(3- индолил)метил-4-оксо-6-фенилгексаноата в виде смеси 2 : 3 диастереоизомеров. Разделение диастереоизомеров с помощью препаративной ЖХВР (кремнезем, гексан/изопропанол, 30 : 1) с последующим гидрогенолитическим удалением (Pd/C, водород 1 атм) части сложного бензилового эфира приводит к получению 5-(R)-[N-(3,5-диметилбензоил)- N-метил] aмино-2-(R)-(3-индолил)метил-4-окcо-6-фенилкапроновой кислоты, de > 98% и ee > 92% (ЖХВР, chiralcel, OD), FAB-MS m/e 497 (M+H)+, и 5-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-2-(S)-(3-индолил)метил- 4-оксо-6-фенил-капроновой кислоты, de > 98% и ee > 92% (ЖХВР, chiralcel, OD), FAB-MS m/e 497 (M+H)+.
Пример 79:
4-[N-(3,5-Диметилбензоил)-N-метил] амино-2-(3-индолил)метил- 5-фенилпентановая кислота
К суспензии гидрида натрия (9 мг, 0,22 ммоль) в THF (1 мл) добавляют раствор метил 3-(3-индолил)-2-(диметилфосфоно)-пропионата (80 мг, 0,169 ммоль) в THF (0,7 мл) в атмосфере азота и смесь перемешивают при температуре 0oC в течение 30 минут. К смеси прибавляют раствор 2-(R)-[N-(3,5-диметилбензоил)-N-метил] -амино-3-фенил-1-пропанала (50 мг, 0,169 ммоль) в THF (0,3 мл), и все это перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием этилацетата/гексана, 1 : 2, получая метил 4-[N-(3,5-диметилбензоил)-N-метил] амино-2-(3-индолил)метил-5- фенилпент-2-еноат в виде белой пены. Раствор метил 4-[N- (3,5-диметилбензоил)-N-метил] aмино-2-(3-индолил)метил-5-фенилпент-2-еноата (40 мг, 0,08 ммоль) в метаноле (2 мл) гидрируют в присутствии палладированного угля (5 мг) в атмосфере азота при комнатной температуре в течение 24 часов. Катализатор отфильтровывают и фильтрат концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием этилацетата/гексана, 1 : 2, получая метил 4-[N-(3,5-диметилбензоил)-N-метил] амино-2-(3-индолил)-метил-5-фенилпентаноат. Гидролиз метил 4-[N-(3,5-диметилбензоил)-N-метил] амино-2-(3- индолил)метил-5-фенилпентаноата в соответствии с Примером 1 приводит к получению 4-[N-(3,5-диметилбензоил)-N-метил] амино-2-(3- индолил)метил-5-фенил-пентановой кислоты в виде смеси изомеров; FAB-MS m/e 467 (M-H)-.
Исходное вещество может быть получено, например, следующим образом:
Синтез 2-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-3-фенил-1-пропанала:
К раствору сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланина (получен в соответствии с Примером 78) (895 мг, 2,75 ммоль) в THF (15 мл) добавляют L-селектрид (11 мл, 11 ммоль) при температуре 0oC и реакционную смесь перемешивают при этой же температуре в течение ночи. Смесь разбавляют диэтиловым эфиром, промывают водой, сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на силикагеле (этилацетат) с получением 2-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-3-фенил-1-пропанола.
К перемешанному раствору диметилсульфоксида (0,12 мл) в метиленхлориде (4 мл) в атмосфере азота добавляют оксалилхлорид (0,132 мл, 1,52 ммоль) при температуре - 35oC и реакционную смесь перемешивают в течение 30 минут. К смеси прибавляют раствор 2-(R)-1-(3,5-диметилбензоил)-N-метил]амино-3-фенил-1-пропанола (410 мг, 1,38 ммоль) в метиленхлориде (4 мл) и перемешивание продолжают при температуре - 35oC в течение 30 минут, после чего прибавляют триэтиламин (0,7 мл, 5 ммоль) при температуре - 35oC. Реакционную смесь нагревают до комнатной температуры, разбавляют водой (10 мл) и экстрагируют метиленхлоридом (10 мл x 3). Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением 2-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-3-фенил-1-пропанала в виде желтого масла.
Синтез 3-(3-индолил)-2-(диметилфосфоно)пропионата:
К перемешанному раствору индола (5,6 г, 47,8 ммоль) в ацетонитриле (130 мл) прибавляют соль Eschenmoser (10 г, 54 ммоль) в атмосфере азота и смесь перемешивают в течение 30 минут. Смесь концентрируют в вакууме и остаток разбавляют 1 M раствором гидроксида натрия и экстрагируют метиленхлоридом. Органический слой сушат в присутствии карбоната натрия и концентрируют в вакууме с получением 3-(диметиламинометил)индола в виде бурого масла. К раствору 3-(диметиламинометил)индола в метиленхлориде (200 мл) прибавляют по каплям метилиодид (5 мл, 80 ммоль). Смесь нагревают при комнатной температуре в течение 6 часов и концентрируют в вакууме с получением (3-индолилметил)триметиламмоний иодида в виде бурой пены. К охлажденной (0oC) суспензии гидроксида натрия (1,5 г, 37 ммоль) в DMF (100 мл) прибавляют триметил фосфоноацетат (6,7 мл, 41 ммоль) и смесь перемешивают при температуре 0oC в течение 30 минут. К смеси прибавляют (3-индолилметил) триметиламмоний иодид и все это перемешивают при комнатной температуре в течение ночи. Смесь разбавляют водой и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на силикагеле этилацетатом с получением 3-(3-индолил)-2-(диметилфосфоно)пропионата в виде бурого масла.
К суспензии гидрида натрия (9 мг, 0,22 ммоль) в THF (1 мл) добавляют раствор метил 3-(3-индолил)-2-(диметилфосфоно)пропионата (80 мг, 0,25 ммоль) в THF (0,7 мл) при температуре 0oC в атмосфере азота и смесь перемешивают при температуре 0oC в течение 30 минут. К смеси прибавляют раствор 2-(R)-[N-(3,5-диметилбензоил)-N-метил] -амино-3-фенил-1-пропанала (50 мг, 0,169 ммоль) в THF (0,3 мл), и все это перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием этилацетата/гексана, 1 : 2, получая метил 4-[N-(3,5-диметилбензоил)-N-метил]амино-2-(3-индолилметил)-5-фенил- пент-2-еноат в виде белой пены. Раствор метил 4-[N-(3,5-диметилбензоил)-N-метил] амино-2-(3-индолил)-метил-5-фенилпент- 2-еноата (40 мг, 0,08 ммоль) в метаноле (2 мл) гидрируют в присутствии палладированного угля (5 мг) в атмосфере азота при комнатной температуре в течение 24 часов. Катализатор отфильтровывают и фильтрат концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием этилацетата/гексана, 1 : 2, получая метил 4-[N-(3,5-диметилбензоил)-N-метил]амино-2-(3-индолил)-метил-5- фенилпентаноат. Гидролиз метил 4-[N-(3,5-диметилбензоил)-N-метил]aмино-2-(3-индолил)метил-5-фенилпентаноата в соответствии с Примером 1 приводит к получению 4-[N-(3,5-диметилбензоил)-N-метил]амино-2-(3-индолил)метил- 5-фенилпентановой кислоты.
Пример 80:
Реакция Хорнера-Виттига в соответствии с Примером 78 между диметил 3-[N-(3,5-диметилбензоил)-N-метил] амино-2-оксо-4- фенил-1-бутилфосфонатом (получен в соответствии с Примером 78) и метил 1-нафтил пируватом с последующей каталитической гидрогенизацией двойной связи в присутствии катализатора Уилкинсона в соответствии с Примером 78 и гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению 5-[N-(3,5-диметилбензоил)-N-метил]амино-2-(1-нафтил)метил-4-оксо-6- фенилкапроновой кислоты в виде смеси изомеров; FAB-MS m/e 506 (M-H)-.
Исходное вещество может быть получено, например, следующим образом:
Синтез метил 1-нафтил пирувата:
Натрий (677 мг, 29,4 ммоль) растворяют в этаноле (48 мл). К раствору прибавляют 1-нафтилацетонитрил (5,07 г, 30,3 ммоль), затем через 20 минут диэтил оксалат (4,1 мл, 30,3 ммоль) при комнатной температуре, и смесь перемешивают при комнатной температуре в течение 2 часов и кипятят с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры прибавляют уксусную кислоту (2 мл). Смесь разбавляют водой и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и упаривают в вакууме с получением 3-циано-3-(1-нафтил)-пирувата. Смесь 3-циано-3-(1-нафтил)пирувата (6,56 г, 24,6 ммоль) и 30%-ной серной кислоты (400 мл) нагревают при температуре 100oC в течение 2 часов. После охлаждения смесь экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и упаривают в вакууме с получением 3-(1-нафтил)пировиноградной кислоты. К раствору 3-(1-нафтил)пировиноградной кислоты (1,86 г, 8,7 ммоль) в простом диэтиловом эфире (20 мл) прибавляют раствор диазаметанового диэтилового эфира (25 мл). Смесь концентрируют в вакууме и остаток хроматографируют на силикагеле с использованием гексана и этилацетата (3 : 2), получая метил 3-(1-нафтил)пируват.
Пример 81:
Восстановительное алкилирование хлоргидрата сложного метилового эфира (L)-триптофана с помощью 2-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-3-фенил-1-пропанала (получен в соответствии с Примером 79) в метаноле в присутствии цианоборогидрида натрия в соответствии с Примером 14 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-{2-(R)-[N-(3,5-диметилбензоил)-N-метил]-амино-3-фенил-проп-1-ил}-(L)- триптофана; FAB-MS m/e 484 (М + Н)+.
Пример 82:
100 мг бензил-5-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-2-(R)-(3-индолил)метил- 4-оксо-6-(4-бифенилил)гексаноата, который получен, как описано в Примере 84, растворяют в 750 мкл тетрагидрофурана и 36 мкл воды. При температуре 0oC в атмосфере азота прибавляют 4 мг борогидрида натрия. Смесь перемешивают при температуре 0oC в течение одного часа и при комнатной температуре в течение одного часа. Затем прибавляют 280 мкл насыщенного водного раствора хлористого аммония, перемешивают в течение 30 минут и смесь экстрагируют простым эфиром. Упаривание эфирной фазы приводит к получению неочищенного продукта, который очищают флеш-хроматографией на силикагеле с использованием смеси этилацетата и гексана (2 : 1) в качестве элюента. 15 мг полученного лактона затем обрабатывают с помощью 2 мг гидроксида лития в смеси 500 мкл метанола и 250 мкл воды в течение 12 часов при температуре окружающей среды. Упаривание растворителя приводит к получению литий 5-(R)-[N-(3,5-диметилбензоил)-N-метил] амино-2-(R)-(3-индолил)метил-4- гидрокси-6-(4-бифенилил)-гексаноата.
Пример 83:
Реакция Хорнера-Виттига в соответствии с Примером 78 между диметил 3-[N-(3,5-диметилбензоил)-N-метил]амино-2-оксо-4-(2- тиенил)-1-бутилфосфонатом [из сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D,L)-(2-тиенил)аланина, полученного в соответствии с Примером 52), как описано в Примере 78] и метил 3-индол пируватом с последующей каталитической гидрогенизацией двойной связи в присутствии катализатора Уилкинсона в соответствии с Примером 78 и гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению 5-[N-(3,5-диметилбензоил)-N-метил]амино-2-(3- индолил)метил-4-оксо-6-(2-тиенил)капроновой кислоты в виде смеси изомеров; FAB-MS m/e 501 (M-H)-.
Пример 84:
Реакция Хорнера-Виттига в соответствии с Примером 78 между диметил 3-(R)-[N-(3,5-диметилбензоил)-N-метил] амино-2-оксо-4-(4-фенилфенил)-1- бутилфосфонатом [из сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-(4-фенилфенил)аланина, полученного в соответствии с Примером 55), как описано в Примере 78] и бензил 3-индол пируватом с последующей каталитической гидрогенизацией двойной связи в присутствии катализатора Уилкинсона в соответствии с Примером 78, препаративным ЖХВР-разделением 2 диастереоизомеров и гидрогенолизом части сложного бензилового эфира в соответствии с Примером 78 приводит к получению 5-(R)-[N-(3,5-диметилбензоил)-N-метил]амино-2-(R)-(3-индолил)метил-4-оксо- 6-(4-фенилфенил)капроновой кислоты; FAB-MS m/e 573 (M+H)+ и 5-(R)-[N-(3,5-диметилбензоил)-N-метил]-амино-2-(S)-(3-индолил)метил-4-оксо- 6-(4-фенилфенил)капроновой кислоты; FAB-MS m/e 573 (M+H)+.
Пример 85:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)- 3-фенил-3-(4-фенилфенил)аланина (получен в соответствии с Примером 108) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D,L)-3-фенил-3-(4-фенилфенил)аланил-(L)- триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 650 (M+H)+.
Пример 86:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)- (5-дибензосуберил)аланина (получен из коммерчески доступного 5-хлородибензосуберана в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)- N-метил-(D,L)-(5-(дибензосуберил) аланил-(L)-триптофана в виде смеси 2 диастереоизомеров; FAB-MS m/e 600 (M+H)+.
Пример 87:
N-(5-Метил-2-тиенилкарбонил)-N-метил-(D)-фенилаланил-(L)-триптофан
Взаимодействие хлоргидрата сложного метилового эфира N-метил-(D)-фенилаланил(L)-триптофана с 5-метил-тиенил-2-карбоновой кислотой в соответствии с Примером 1 с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(5-метил-2-тиенилкарбонил)-N-метил-(D)-фенилаланил-(L)-триптофана: FAB-MS m/e (M-H)-.
Пример 88:
N-(3,5-Диметилбензоил)-1,2,3,4-тетрагидро-3-изохинолинкарбонил-(L)-триптофан
Раствор хлоргидрата метил 1,2,3,4-тетрагидро-3-изохинолинкарбоксилата (2,0 г, 9 ммоль) и 3,5-диметилбензойной кислоты (1,6 г, 10 ммоль) в DMF (15 мл) обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимидом (1,9 мл, 10 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 2 часов. Гомогенную смесь разбавляют этилацетатом (500 мл) и промывают тремя порциями воды (200 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Хроматография на кремнеземе с использованием этилацетата/гексана, 1 : 3, приводит к получению метил N-(3,5-диметилбензоил)-1,2,3,4-тетрагидро-3-изохинолинкарбоксилата в виде бесцветного масла. Это вещество гидролизуют с помощью 1 M раствора гидроксида натрия в THF с получением диметилбензоил)-1,2,3,4-тетрагидро-3-изохинолинкарбоновой кислоты в виде белого твердого тела.
К перемешанному раствору N-(3,5-диметилбензоил)-1,2,3,4-тетрагидро-3-изохинолинкарбоновой кислоты (350 мг, 1,1 ммоль) в сухом DMF (2 мл) прибавляют хлоргидрат сложного метилового эфира (L)-триптофана (290 мг, 1,1 ммоль) и гидроксибензтриазол (180 мг, 1,3 ммоль). Смесь охлаждают до температуры 0oC и прибавляют по каплям 1-(3-диметиламинопропил)-3-этилкарбодиимид (0,25 мл, 1,3 ммоль). Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение ночи. Гомогенную смесь разбавляют этилацетатом (100 мл) и промывают тремя порциями воды (70 мл). Органический слой сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме. Неочищенное вещество хроматографируют на кремнеземе с помощью этилацетата/гексана, 1 : 1, с получением смеси 2 диастереоизомерных сложных метиловых эфиров N-(3,5-диметилбензоил)-1,2,3,4-тетрагидро-3- изохинолинкарбонил-(L)-триптофана в виде белой пены.
Это вещество гидролизуют при температуре 0oC с помощью 1 M раствора гидроксида натрия в THF. Реакционную смесь разбавляют простым эфиром и промывают тремя порциями воды. Объединенные водные слои подкисляют до pH 2 с помощью 1 M раствора хлористоводородной кислоты и экстрагируют двумя порциями этилацетата. Этилацетатные экстракты сушат в присутствии сульфата магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде белой пены; температура плавления 119 - 126oC. FAB-MS m/e 496 (M+H)+.
Пример 89:
Реакция Хорнера-Виттига в соответствии с Примером 78 между диметил 3-[N-(3,5-диметилбензоил)-1,2,3,4-тетpaгидpо-3- изохинолинкарбонилметилфосфонатом [из метил N-(3,5-диметилбензоил)- 1,2,3,4-тетрагидро-3-изохинолинкарбоксилата, полученного в соответствии с Примером 88), как описано в Примере 78] и метил 3-индол пируватом с последующей каталитической гидрогенизацией двойной связи в присутствии катализатора Уилкинсона в соответствии с Примером 78 и гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению 3-[N-(3,5-диметилбензоил)-1,2,3,4-тетрагидро- 3-изохинолинкарбонил] -2-(3-индолил)метил-пропионовой кислоты в виде смеси изомеров; FAB-MS m/e 495 (M+H)+.
Пример 90:
Взаимодействие N-(3,5-диметилбензоил)-1,2,3,4- тетрагидро-3-изохинолинкарбоновой кислоты (получена в соответствии с Примером 88) с хлоргидратом сложного метилового эфира (L)- (1-нафтил)аланина с последующим гидролизом части сложного метилового эфира в соответствии с Примером 12 приводит к получению N-(3,5-диметилбензоил)-1,2,3,4-тетрагидро-3-изохинолинкарбонил- (L)-1-нафтилаланина в виде смеси 2 диастереоизомеров; FAB-MS m/e 507 (M+H)+.
Пример 91:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-3-[4-(3-тиенил)фенил] аланина (получен из 4-(3-тиенил)бензилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана с последующим разделением двух диастереоизомеров с помощью ЖХВР приводит к получению (D,L)-изомера и (L,L)-изомера. Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(3-тиенил)фенил] аланил- (L)-триптофан; FAB-MS m/e 578 (M-H)+.
Исходное вещество может быть получено, например, следующим образом:
Синтез 4-(3-тиенил)бензилбромида:
Раствор 4-бромотолуола (0,9 мл, 7,3 ммоль) в THF (3 мл) прибавляют к сухим магниевым опилкам (0,815 г, 33,5 атома) в атмосфере азота. После инициации экзотермической реакции в реакционную смесь прибавляют по каплям раствор 4-бромотолуола (3,16 мл, 25,7 ммоль) в THF (3 мл). Перемешивание продолжают в течение 10 минут. Смесь прибавляют по каплям к суспензии 3-бромотиофена (2,8 мл, 29,9 ммоль) и хлорида [1,2-бис(дифенилфосфино)-этан] никеля (II) (0,72 г, 1,4 ммоль) в простом диэтиловом эфире (50 мл), которую перемешивали в течение 10 минут. Реакционную смесь охлаждают 1 н. раствором хлористоводородной кислоты и экстрагируют простым эфиром. Органический слой промывают насыщенным раствором бикарбоната натрия и солевым раствором, сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток перекристаллизовывают из этанола с получением 4-(3-тиенил)-толуола. К раствору 4-(3-тиенил)толуола (3,56 г, 20,5 ммоль) в четыреххлористом углероде (100 мл) прибавляют N-бромосукцинимид (3,64 г, 20,5 ммоль) и бензил пероксид (80 мг, 3,3 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 24 часов и концентрируют в вакууме. Реакционную смесь перекристаллизовывают из этанола с получением 4-(3-тиенил)бензил бромида.
Пример 92:
Гидролиз (L, L)-изомера, полученного в Примере 91, в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)- N-метил-(L)-3-[4-(3-тиенил)фенил]аланил-(L)-триптофан; FAB-MS m/e 578 (M-H)+.
Пример 93:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-3-[4-(2-тиенил)фенил] аланина (получен из 4-(2-тиенил)бензилбромида [получен согласно описанию в Примере 91) в соответствии с общим методом В по схеме III] с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим разделением двух диастереоизомеров с помощью ЖХВР приводит к получению (D,L)-изомера и (L,L)-изомера. Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(2-тиенил)фенил]аланил-(L)-триптофан; FAB-MS m/e 578 (M-H)+.
Исходное вещество может быть получено, например, следующим образом:
4-(2-Тиенил)бензилбромид получают из 4-бромотолуола и 2-бромотиофена в соответствии с Примером 91.
Пример 94:
Гидролиз (L, L)-изомера, полученного в Примере 93, в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-3-[4-(2-тиенил)фенил]аланил-(L)-триптофан; FAB-MS m/e 578 (M-H)+.
Пример 95:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)-3-[4-(5- изоксазолил)фенил]аланина (получен из 4-(5-изоксазолил)-бензилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 12 с последующим разделением двух диастереоизомеров с помощью колоночной хроматографии среднего давления приводит к получению (D,L)-изомера и (L,L)-изомера. Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(5- изоксазолил)-фенил]аланил-(L)-триптофан; FAB-MS m/e 565 (M-H)+.
Исходное вещество может быть получено, например, следующим образом:
В соответствии с Примером 56 4-(5-изоксазолил)толуол [Lin et al., J. Org. Chem. 45, 4857 (1980)] броминируют с получением 4-(5-изоксазолил)бензил бромида.
Пример 96:
Гидролиз (L, L)-изомера, полученного в Примере 95, в соответствии с Примером 12 позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-3-[4-(5-изоксазолил)фенил]аланил- (L)-триптофан; FAB-MS m/e 563 (M-H)+.
Пример 97:
Гидролиз сложного этилового эфира 1-(3,5-диметилбензоил)-(D,L)-3-[4-(5-изоксазолил)фенил] аланина (получен в соответствии с Примером 56) в соответствии с Примером 1 и взаимодействие с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 позволяют получить N-(3,5-диметилбензоил) -(D,L)-3-[4-(5-изоксазолил)фенил]аланил-(L)-триптофан; FAB-MS m/e 549 (M-H)+.
Пример 98:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-(D, L)- 3-(4-цианофенил)аланина [получен из 4-цианобензил бромида (из 4-цианотолуола, как описано в методике согласно Примеру 56) в соответствии с общим методом B по схеме III] с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим разделением двух диастереоизомеров с помощью колоночной хроматографии среднего давления приводит к получению (D,L)-изомера и (L, L)-изомера. Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3-(4- цианофенил)аланил-(L)-триптофан; FAB-MS m/e 521 (M-H)+.
Пример 99:
Гидролиз (L,L)-изомера, полученного в Примере 98, в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-3-(4- (цианофенил)аланил-(L)-триптофан; FAB-MS m/e 521 (M-H)+.
Пример 100:
Раствор сложного метилового эфира [(D,L)-изомера: получен в Примере 98] (500 мг, 0,932 ммоль) и азида тетрабутилолова (464 мг, 1,4 ммоль) в толуоле (50 мл) кипятят с обратным холодильником в течение 20 часов в атмосфере азота. К смеси прибавляют метиленхлорид (50 мл), метанол (30 мл) и гидроксид аммония (1 мл). Все это перемешивают при комнатной температуре в течение 1 часа, затем концентрируют в вакууме. Полученный остаток хроматографируют на кремнеземе с помощью гексана/этилацетата (1 : 4 + 0,5% уксусная кислота) с получением производного тетразола. Гидролиз полученного соединения в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(5-тетразолил)-фенил]аланил- (L)-триптофан; FAB-MS m/e 564 (M-H)+.
Пример 101:
В соответствии с методикой, описанной в Примере 100, образование кольца тетразола из сложного метилового эфира [(L,L)-изомера: получен в Примере 98] с последующим гидролизом сложного метилового эфира в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-3-[4-(5-тетразолил)-фенил]аланил-(L)- триптофан; FAB-MS m/e 564 (M-H)+.
Пример 102:
Взаимодействие N-(3,5-диметилбензоил)-N-метил- (D,L)-3-[4-(3-изоксазолил)фенил] аланина (получен из 4-(3-изоксазолил)- бензилбромида в соответствии с общим методом B по схеме III) с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим разделением двух диастереоизомеров с помощью колоночной хроматографии среднего давления приводит к получению (D,L)-изомера и (L,L)-изомера. Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3-диметилбензоил)-N-метил-(D)-[4-(3- изоксазолил)-фенил]аланил-(L)-триптофан; FAB-MS m/e 565 (M-H)+.
Исходное вещество может быть получено, например, следующим образом:
4-(3-Изоксазолил)бензил бромид получают из 4-(3-изоксазолилтолуола [получен из p-толуолальдегида в соответствии с методикой синтеза 2-(3-изоксазолил)мезитилена: L. D. Nunno et al., Tetrahedron, 43, 2181 (1987)] в соответствии с Примером 56.
Пример 103:
Гидролиз (L, L)-изомера, полученного в Примере 102, в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-3-[4-(5-изоксазолил)фенил]аланил- (L)-триптофан; FAB-MS m/e 565 (M-H)+.
Пример 104:
Сложный этиловый эфир N-(3,5-диметилбензоил)-N-метил-(D,L)-3-[4-(5-изоксазолил)фенил] аланина (получен в Примере 95) обрабатывают 3 эквивалентами гидроксида лития с получением N-(3,5-диметилбензоил)-N-метил-(D,L)-3-[4-(2-цианоацетил)-фенил] аланина. Взаимодействие полученного выше соединения с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим разделением двух диастереоизомеров с помощью колоночной хроматографии среднего давления приводит к получению (D,L)-изомера [содержащего 20 % (L,L)-изомера] и (L,L)-изомера [содержащего 25 % (D,L)-изомера] . Гидролиз (D,L)-изомера в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил)-N-метил-(D)-3- [4-(2-цианоацетил)фенил] аланил-(L)-триптофан; FAB-MS m/e 563 (M-H)+.
Пример 105:
Гидролиз (L,L)-изомера, полученного в Примере 104, в соответствии с Примером 1 позволяет получить N-(3,5-диметилбензоил) -N-метил-(L)-3-[4-(2-цианоацетил)фенил]аланил-(L)-триптофан; FAB-MS m/e 563 (M-H)+.
Пример 106:
К раствору моногидрата (D)-3-(4-нитрофенил)аланина (4,56 г, 20 ммоль) в MeOH (80 мл) в атмосфере азота медленно прибавляют тионил хлорид (24 мл, 320 ммоль). Реакционную смесь нагревают при температуре дефлегмации в течение ночи и концентрируют в вакууме. Остаток берут в простом эфире, затем фильтруют. Полученные осадки промывают несколькими порциями простого эфира и сушат в вакууме с получением хлоргидрата сложного метилового эфира (D)-3-(нитрофенил)аланина.
К охлажденному до температуры 0oC раствору вышеуказанного сложного эфира (2,60 г, 10 ммоль) и 3,5-диметилбензойной кислоты (1,95 г, 13 ммоль) в DMF (60 мл) в атмосфере азота прибавляют 1-(3-диметиламинопропил)-3-этил-карбодиимид (2,38 мл, 13 ммоль) при перемешивании. Реакционную смесь медленно нагревают до комнатной температуры и перемешивание продолжают в течение 3 дней. Реакционную смесь разбавляют этилацетатом и промывают 1 н. раствором хлористоводородной кислоты и насыщенным раствором бикарбоната натрия. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного метилового эфира N-(3,5-диметилбензоил)-(D)-3-(4-нитрофенил)аланина.
К охлажденному до температуры 0oC раствору вышеуказанного сложного эфира (2,5 г, 7,0 ммоль) и метил иодида (1,3 г, 21,0 ммоль) в DMF (26 мл) медленно прибавляют гидрид натрия (60% в масле: 0,28 г, 7,0 ммоль) при перемешивании. Через 30 минут реакционную смесь охлаждают водой и экстрагируют этилацетатом.
Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-нитрофенил)аланина.
Вышеуказанный сложный эфир гидролизуют при комнатной температуре с помощью гидроксида лития (323 мл, 7,7 ммоль) в MeOH/воде, 10 : 1, (55 мл). Через 2 часа реакционную смесь разбавляют водой и промывают этилацетатом. Водный слой подкисляют с помощью 1 н. раствора хлористоводородной кислоты и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-нитрофенил)аланина.
Взаимодействие соединения, полученного выше, с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 позволяет получить сложный метиловый эфир N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-нитрофенил)аланил-(L)-триптофана. Гидролиз вышеуказанного сложного эфира в соответствии с Примером 1 приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-3-(4- нитрофенил)аланил-(L)-триптофана; FAB-MS m/e 541 (M-H)+.
Пример 107:
Раствор N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-нитрофенил)аланил-(L)-триптофана (20 мг), полученный в Примере 106, в MeOH (1 мл), гидрируют в присутствии оксида платины (1 мг) под давлением водорода 3,8 атм. Через 1 час катализатор удаляют с помощью фильтрации и фильтрат концентрируют в вакууме. Сырое вещество очищают препаративной тонкослойной хроматографией на кремнеземе с использованием ацетата/MeOH/уксусной кислоты, 90 : 10 : 1, с получением N-(3,5-диметилбензоил)-N-метил-(D)- 3-(4-аминофенил)аланил-(L)-триптофана; FAB-MS m/e 511 (M-H)+.
Пример 108:
Взаимодействие N-(3,5-диметилбензоил)-N-метил-3-(4- бифенил)-3-фенил-(D, L)-аланина [получен из бромо-(4-бифенил)-метилметана в соответствии с общим методом B по схеме III] с хлоргидратом сложного метилового эфира (L)-триптофана в соответствии с Примером 1 с последующим разделением четырех диастереоизомеров с помощью колоночной хроматографии среднего давления приводит к получению (R,D,L)-изомера, (S,D,L)-изомера, (R,L,L)-изомера и (S,L,L)-изомера. Гидролиз (R,D,L)-изомера в соответствии с Примером 1 позволяет получить (3R)-N-(3,5-диметилбензоил)-N-метил-3-(4-бифенил)-3-фенил- (D)-аланил-(L)-триптофан; FAB-MS m/e 648 (M-H)+.
Исходное вещество может быть получено, например, следующим образом:
Синтез бромо-(4-бифенил)-фенилметана:
К раствору диметилсульфоксида (3,9 мл, 54,4 ммоль) в метиленхлориде (70 мл) в атмосфере азота прибавляют трифторуксусную кислоту (5,7 мл, 40,8 ммоль) при перемешивании при температуре - 70oC. Через 10 минут прибавляют 4-бифенилметанол (5 г, 27,2 ммоль) и после перемешивания в течение 30 минут прибавляют триэтиламин (30 мл, 218 ммоль). Реакционную смесь нагревают до комнатной температуры, разбавляют водой и экстрагируют метиленхлоридом. Органический слой промывают последовательно 1 н. раствором хлористоводородной кислоты и насыщенным раствором бикарбоната натрия, сушат в присутствии сульфата магния и концентрируют с получением 4-бифенилметанала.
К охлажденному до температуры 0oC раствору 4-бифенил-метанала в THF (50 мл) в атмосфере азота медленно прибавляют 3 M раствор бромида фенилмагния в диэтиловом эфире (5,7 3л, 15,7 ммоль) при перемешивании. Реакционную смесь нагревают до комнатной температуры и перемешивание продолжают в течение 15 часов. Смесь разбавляют водой и экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором хлористого аммония, сушат в присутствии хлорида магния и концентрируют в вакууме. Остаток очищают колоночной флеш-хроматографией на силикагеле с использованием 15%-ного диэтилового эфира в гексане, получая (4-бифенил)фенилметанол.
К раствору (4-бифенил)фенилметанола (0,737 г, 2,83 ммоль) в метиленхлориде (40 мл) в атмосфере азота прибавляют тионилбромид (3,7 мл, 47,8 ммоль) при комнатной температуре с перемешиванием. Через 2 часа реакционную смесь берут в метиленхлориде и затем промывают водой. Органический слой сушат в присутствии сульфата натрия и концентрируют в вакууме с получением бромо-(4-бифенил)-фенилметана.
Пример 109:
Гидролиз (S, D, L)-изомеpa, полученного в Примере 108, в соответствии с Примером 1 позволяет получить (3S)-N-(3,5-диметилбензоил)-N-метил-3- (4-бифенил)-3-фенил-(D)-аланил-(L)-триптофан; FAB-MS m/e 648 (M-H)+.
Пример 110:
Гидролиз (R, L, L)-изомеpa, полученного в Примере 108, в соответствии с Примером 1 позволяет получить (3S)-N-(3,5-диметилбензоил) -N-метил-3-(4-бифенил)-3-фенил-(L)-аланил-(L)-триптофан; FAB-MS m/e 648 (M-H)+.
Пример 111:
Гидролиз (S, L, L)-изомера, полученного в Примере 108, в соответствии с Примером 1 позволяет получить (3S)-1-(3,5-диметилбензоил)-N-метил-3-(4-бифенил)-3-фенил-(L)-аланил- (L)-триптофан; FAB-MS m/e 648 (M-H)+.
Пример 112:
К перемешанному раствору хлоргидрата сложного метилового эфира 3-(4-бифенил)аланина (755 мг, 2,6 ммоль) и ди-трет-бутил дикарбоната (680 мг, 3,1 ммоль) в метиленхлориде (10 мл) прибавляют по каплям триэтиламин (0,432 мл, 3,1 ммоль) при температуре 0oC в атмосфере азота. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 часов. Смесь последовательно промывают 0,1 н. раствором хлористоводородной кислоты, насыщенным раствором бикарбоната натрия и солевым раствором, после чего сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 2, получая сложный метиловый эфир N-BOC-3-(4-бифенил)аланина в виде желтого масла.
К охлажденному до температуры 0oC раствору соединения, полученного выше (953 мг), и метил иодида (0,486 мл, 7,8 ммоль) в DMF (8 мл) прибавляют гидрид натрия (60%; 104 мг, 2,6 ммоль) в атмосфере азота. Реакционную смесь медленно нагревают до комнатной температуры и экстрагируют этилацетатом (10 мл x 2). Органический слой промывают водой (5 мл x 2), насыщенным раствором хлористого натрия и сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного метилового эфира N-BOC-3-(4-бифенил)аланина. Гидролиз вышеуказанного сложного метилового эфира (855 мг, 2,3 ммоль) с помощью гидрата гидроксида лития (146 мг, 3,5 ммоль) приводит к получению N-BOC-3-(4-бифенил)аланина.
Взаимодействие BOC-3-(4-бифенил)аланина (750 мг, 2,1 ммоль) в соответствии с общим методом B, приведенным в схеме III, с хлоргидратом сложного метилового эфира (L)-триптофана (642 мг, 2,5 ммоль) в присутствии 1-гидроксибензотриазола (340 мг, 2,5 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида (462 мкл, 2,5 ммоль) приводит к получению сложного метилового эфира N-BOC-N-метил-3-(4-бифенил)аланил-(L)-триптофана (1,16 г, 95%). Перемешанный раствор сложного метилового эфира N-BOC-N-метил-3-(4-бифенил)аланил-(L)- триптофана (1,0 г, 1,8 ммоль) в толуоле (10 мл) обрабатывают реагентом Lawesson (364 мг, 0,9 ммоль) при комнатной температуре в атмосфере азота в течение ночи. Полученную смесь разбавляют этилацетатом и промывают водой и солевым раствором, затем сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 2, с получением смеси двух диастереоизомеров (590 мг, 57%), которые разделяют с помощью ЖХВР (кремнезем, гексан/изопропанол, 30 : 1) с получением сложного метилового эфира BOC-N-метил-(D)-3-(4-бифенил)тиоаланил- (L)-триптофана и сложного метилового эфира N-BOC-N-метил-(L)-3- (4-бифенил)тиоаланил-(L)-триптофана.
Перемешанный раствор сложного метилового эфира N-BOC-N-метил-(D)--3(4-бифенил)тиоаланил-(L)-триптофана (145 мг, 0,25 ммоль) и дитиотрейтола (77 мг, 0,05 ммоль) в 1,4-диоксане (0,64 мл) прибавляют к 4 н. раствору хлороводорода в 1,4-диоксане (2,6 мл) при комнатной температуре в атмосфере азота. Смесь перемешивают в течение 4 часов, концентрируют в вакууме и промывают простым эфиром с получением хлоргидрата сложного метилового эфира N-метил-(D)-3-(4-бифенил)тиоаланил-(L)-тpиптофана.
Перемешанный раствор хлоргидрата сложного метилового эфира N-метил-(D)-3-(4-бифенил)тиоаланил-(L)-триптофана (150 мг) обрабатывают 3,5-диметилбензойной кислотой (50 мг, 0,33 ммоль), 1-гидроксибензотриазолом (45 мг, 0,33 ммоль) и 1-(диметиламинопропил)-3-этилкарбодиимидом (60 мкл, 0,33 ммоль) в DMF (1 мл) при комнатной температуре в атмосфере азота в течение ночи. Смесь разбавляют этилацетатом и промывают насыщенным раствором бикарбоната натрия и водой, затем сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 2, с получением сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-3-(4- бифенил)тиоаланил-(L)-триптофана.
Гидролиз сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-бифенил)тиоаланил-(L)-триптофана (40 мг, 0,066 ммоль) с помощью гидрата гидроксида лития (4 мг, 0,099 ммоль) позволяет получить N-(3,5-диметилбензоил)-N-метил- (D)-3-(4-бифенил)тиоаланил-(L)-триптофан; FAB-MS m/e 590 (M-H)+.
Пример 113:
В соответствии с методикой, описанной в Примере 112, сложный метиловой эфир N-BOC-N-метил-(L)-3-(4-бифенил)тиоаланил-(L)-триптофана (получен в Примере 112) BOC-разблокируют, N-3,5-диметилбензоилируют и гидролизуют в соответствии с Примером 1, получая N-(3,5-диметилбензоил)-N-метил-(L)-3-(4-бифенил)тиоаланил-(L)-триптофан; FAB-MS m/e 590 (M-H)+.
Пример 114:
К раствору хлоргидрата сложного метилового эфира (D)-тирозина (6,95 г, 30 ммоль) и 3,5-диметилбензойной кислоты (4,73 г, 31,5 ммоль) в DMF (15 мл) прибавляют по каплям 1-(3-диметиламинопропил)-3-этил-карбодиимид (5,46 M раствор) (5,77 мл, 31,5 ммоль) при температуре 0oC в атмосфере азота. Реакционную смесь перемешивают при температуре 0oC в течение 1 часа, затем при комнатной температуре в течение ночи. Смесь разбавляют 250 мл ледяной воды и экстрагируют этилацетатом дважды. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-тирозина.
К раствору сложного метилового эфира N-3,5-диметилбензоил-тирозина (4,11 г, 12,6 ммоль) и пиридина (5 мл) в метиленхлориде (25 мл) прибавляют ангидрид трифторуксусной кислоты (2,2 мл, 13,2 ммоль) при температуре 0oC в атмосфере азота. После перемешивания при комнатной температуре в течение 4 часов реакционную смесь промывают последовательно H2O, 0,5 н. NaOH, H2O, 1 н. HCl и H2O. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 2, получая сложный метиловый эфир N-3,5-диметилбензоил-O-трифторметан-сульфонил-тирозина.
К суспензии сложного метилового эфира N-3,5-диметилбензоил-O-трифторметансульфонил-тирозина (1,84 г, 4 ммоль), фуранбороновой кислоты (0,90 г, 8 ммоль) (полученной в соответствии с известной методикой: W. Thompson et al., J. Org. Chem., 1984, 49, 5237), карбоната калия (0,83 г, 6 ммоль) и толуола (50 мл) прибавляют тетракис(трифенилфосфин)палладий (O) (0,14 г, 0,12 ммоль) в атмосфере азота. Смесь нагревают до температуры 90oC в течение 2 часов, затем разбавляют этилацетатом и промывают последовательно насыщенным раствором NaHCO3, H2O, 10% лимонной кислотой и H2O. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-[4-(2-фурил)фенил]аланина.
Затем прибавляют метил иодид (0,55 мл, 8,82 ммоль), гидрид натрия (без масла: 70,6 мг, 2,94 ммоль) в DMF (3 мл) при температуре 0oC в атмосфере азота. Реакционную смесь перемешивают при температуре 0oC в течение 1 часа, затем при комнатной температуре в течение ночи. Смесь разбавляют водой и экстрагируют этилацетатом дважды. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-N-метил-[4-(2-фурил)фенил]аланина, который гидролизуют с помощью гидрата гидроксида лития (118 мг, 2,82 ммоль) с получением N-3,5-диметилбензоил-N-метил-[4-(2-фурил)фенил]аланина.
К раствору N-3,5-диметилбензоил-N-метил-[4-(2-фурил)фенил]аланина (0,64 г, 1,7 ммоль) в DMF последовательно прибавляют хлоргидрат сложного метилового эфира триптофана (0,56 г, 2,2 ммоль), 1-гидроксибензотриазол (0,504 г, 3,73 ммоль) и 1-(3-диметиламинопропил)-3-этил-карбодиимид (5,46 M раствор) (0,37 мл, 2,03 ммоль) при температуре 0oC в атмосфере азота. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов, затем при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и дважды промывают 10% лимонной кислотой. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием этилацетата/гексана, 1 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-N-метил-3-[4-(2-фурил)фенил] аланил-триптофана в виде смеси диастереоизомеров, которые разделяют ЖХВР на (D,L)-изомер. Гидролиз (D, L)-изомера (102 мг, 0,18 ммоль) с помощью гидрата гидроксида лития (7,8 мг, 0,185 ммоль) приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(2-фурил)фенил)-аланил-(L)- триптофана.
Пример 115:
Гидролиз (L,L)-изомера (20 мг, 0,035 ммоль), полученного в Примере 114, с помощью гидрата гидроксида лития (1,52 мг, 0,036 ммоль) позволяет получить N-(3,5-диметилбензоил)-N-метил-3-(L)-3-[4-(2-фурил)фенил] -аланил-(L)-триптофан.
Пример 116:
К суспензии гидрида натрия (60% в масле: 0,82 г, 20,5 ммоль) в сухом DMF (4,5 мл) в атмосфере азота прибавляют имидазол (1,37 г, 20,1 ммоль) при перемешивании при комнатной температуре. После перемешивания в течение 20 минут прибавляют 4-бромобензальдегида диметилацеталь (4,63 г, 20 ммоль) и медный порошок (0,13 г, 2,0 ммоль), после чего реакционную смесь перемешивают при температуре 130oC в течение 2 часов, затем при температуре 150oC в течение 2,5 часа. Раствор перемешивают в течение 1 часа и фильтруют на целите. Органический слой отделяют, промывают водой, сушат в присутствии сульфата натрия и концентрируют в вакууме. Остаток растворяют в 1 н. растворе хлористоводородной кислоты (20 мл) и перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь разбавляют 5 н. раствором NaOH (4 мл) и экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат в присутствии сульфата натрия и концентрируют в вакууме. Полученное твердое тело промывают гексаном и сушат в вакууме с получением 4-(1-имидазолил)бензальдегида.
К охлажденному до температуры 0oC раствору 4-(1-имидазолил)бензальдегида (1,41 г, 8,16 моль) и этил азидоацетата (10,6 г, 81,7 ммоль) в MeOH (50 мл) в атмосфере азота прибавляют метилат натрия (28 масс.% раствор в MeOH, 13,2 мл, 65 ммоль) по каплям. Перемешивание продолжают в течение 1,5 часа. Затем реакционную смесь разбавляют солевым раствором (100 мл) и экстрагируют тремя порциями простого эфира. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением 2-азидо-3-[4-(1-имидазолил)фенил]-2-пропената.
Раствор 2-азидо-3-[4-(1-имидазолил)фенил]-2-пропената (0,56 г, 2,09 ммоль) в уксусной кислоте (2 мл) и MeOH (30 мл) гидрируют в присутствии оксида платины (0,18 г) под давлением водорода 30 атм в течение ночи. Катализатор удаляют фильтрацией и фильтрат концентрируют в вакууме. Неочищенный остаток растворяют в метиленхлориде и промывают двумя порциями насыщенного раствора бикарбоната натрия. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного метилового эфира 3-[4-(1-имидазолил)фенил]аланила.
Раствор сложного метилового эфира 3-[4-(1-имидазолил)фенил]аланила (0,69 г, 2,8 ммоль) в 1 н. растворе хлористоводородной кислоты (2,7 мл) и воды (1,8 мл) прибавляют в только что перегнанный циклопентадиен (0,50 мл, 6,1 ммоль) и формальдегид (37% водный раствор) (0,24 мл, 30 ммоль) при энергичном перемешивании.
После перемешивания в течение 1 часа при комнатной температуре реакционную смесь промывают гексаном, нейтрализуют с помощью насыщенного раствора бикарбоната натрия и экстрагируют метиленхлоридом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением циклоаддукта.
Раствор вышеуказанного неочищенного вещества (0,39 г) в хлороформе (5,7 мл) в атмосфере азота прибавляют к трифторуксусной кислоте (5,7 мл) и триэтилсилана (0,55 мл, 3,42 ммоль) при перемешивании при комнатной температуре. Смесь перемешивают в течение 20 часов, затем концентрируют при пониженном давлении. Неочищенный продукт растворяют в 1 н. растворе хлористоводородной кислоты и промывают гексаном/простым эфиром, 1 : 1. Водный слой нейтрализуют с помощью насыщенного раствора бикарбоната натрия и экстрагируют метиленхлоридом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного метилового эфира 3-[4-(1-имидазолил)фенил]-N-метил-аланила.
К охлажденному до температуры 0oC раствору сложного метилового эфира 3-[4-(l-имидазолил)фенил] -N-метил-аланила (0,28 г) и 3,5-диметилбензойной кислоты (0,175 г, 1,17 ммоль) в метиленхлориде (2,0 мл) в атмосфере азота прибавляют 1-(3- диметиламинопропил)-3-этил-карбодиимид (0,21 мл, 1,15 ммоль) при перемешивании. Через 30 минут реакционную смесь медленно нагревают до комнатной температуры и далее перемешивают в течение ночи. Смесь разбавляют этилацетатом и промывают двумя порциями воды и солевого раствора. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Неочищенное вещество очищают колоночной хроматографией на кремнеземе с использованием метиленхлорида/MeOH, 30 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-N-метил-3-[4-(1-имидазолил)фенил]аланина.
Вышеуказанный сложный эфир гидролизуют с помощью гидроксида лития (19 мг, 0,45 ммоль) в MeOH/THF/воде, 2 : 2 : 1 (2,5 мл) в течение ночи. Реакционную смесь подкисляют с помощью 1 н. раствора хлористоводородной кислоты (0,45 мл), разбавляют водой и экстрагируют двумя порциями этилацетата. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением N-(3,5-диметилбензоил)-N- метил-3-[4-(1-имидазолил)фенил]-аланина.
К перемешанному раствору вышеуказанной кислоты (60 мг, 0,16 ммоль) в сухом DMF (3 мл) в атмосфере азота прибавляют хлоргидрат сложного метилового эфира (L)-триптофана (61 мг, 0,24 ммоль) и 1-гидроксибензотриазол (38 мг, 0,28 ммоль). Смесь охлаждают до температуры 0oC и по каплям прибавляют 1-(3-диметиламинопропил)-3-этил-карбодиимид (0,029 мл, 0,16 ммоль). После перемешивания в течение 1 часа реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение ночи. Смесь разбавляют этилацетатом и промывают водой и солевым раствором. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Неочищенное вещество очищают препаративной тонкослойной хроматографией с использованием метиленхлорида/MeOH, 9 : 1, получая сложный метиловый эфир N-3,5-диметилбензоил-N-метил-3-[4-(1-имидазолил)фенил] аланил-(L)-триптофана. Вышеуказанный сложный эфир (0,1 г, 0,173 ммоль) гидролизуют при температуре 0oC с помощью гидроксида лития (13,5 мг, 0,32 ммоль) в MeOH/воде, 5 : 1 (5,0 мл). Через 2 часа реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 1 часа. Реакционную смесь подкисляют с помощью 1 н. раствора хлористоводородной кислоты (0,35 мл), разбавляют водой и экстрагируют этилацетатом. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток промывают простым эфиром и сушат в вакууме с получением N-(3,5-диметилбензоил)-N-метил-3-[4-(1-имидазолил)-фенил] -(D,L)-аланил-(L)- триптофана: FAB-MS m/e 564 (M-H)+.
Пример 117:
Раствор сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-(D)-тирозина (253 мг, 0,74 ммоль) (получен из (D)-тирозина в соответствии с методикой, описанной в Примере 55), Ph3Bi(OAc)2 [диацетат трифенилвисмута] (895 мг, 1,6 ммоль) (получен в соответствии с описанной в литературе методикой: Н. Brunner, U. Obermann and P. Winner, Organometallics 1989, 8, 821-826) и порошок Cu (43 мг, 0,68 ммоль) в метиленхлориде (15 мл) перемешивают при комнатной температуре в атмосфере азота в течение ночи. Эту реакционную смесь концентрируют в вакууме и сырое вещество хроматографируют на кремнеземе с гексаном/этилацетатом, 3 : 1, получая сложный метиловый эфир N-(3,5-диметилбензоил)-N-метил-O-фенил-(D)-тирозина в виде бесцветного масла. Гидролиз сложного метилового эфира, полученного выше (294 мг, 0,70 ммоль) при помощи гидрата гидроксида лития (31 мг, 0,74 ммоль) приводит к получению соответствующей кислоты.
К раствору вышеуказанной кислоты (215 мг, 0,53 ммоль) в DMF последовательно прибавляют хлоргидрат сложного метилового эфира триптофана (177 мг, 0,70 ммоль), 1-гидроксибензотриазол (160 мг, 1,2 ммоль) и 1-(3-диметил-аминопропил)-3-этил-карбодиимид (5,46 M раствор) (0,12 мл, 0,66 ммоль) при температуре 0oC в атмосфере азота. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов, затем при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и промывают 10% раствором лимонной кислоты и 4% раствором бикарбоната натрия. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием гексана/этилацетата, 2 : 1, получая сложный метиловый эфир (феноксифенил)аланил-триптофана (325 мг, 98 %).
Гидролиз сложного метилового эфира, полученного выше (325 мг, 0,52 ммоль) при помощи гидрата гидроксида лития (23 мг, 0,55 ммоль) приводит к получению N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-феноксифенил)-аланил-(L)-триптофана.
Пример 118:
К перемешанному раствору хлоргидрата сложного трет-бутилового эфира L-аланина (1,03 г, 5,69 ммоль), триэтиламина (0,792 мл, 5,69 ммоль) и сульфата магния (463 мг) в метиленхлориде (11 мл) прибавляют бензальдегид (0,549 мл, 5,40 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре в течение 17 часов, затем разбавляют водой (10 мл) и солевым раствором и сушат в присутствии сульфата магния и концентрируют в вакууме с получением сложного трет-бутилового эфира N-(фенилметилен)аланина в виде бесцветного масла.
К раствору сложного трет-бутилового эфира N-(фенилметилен)аланина (210 мг, 0,90 ммоль), 4-(3-тиенил)фенилметил бромида (250 мг, 0,99 ммоль) и пиридина (7 мл, 0,09 ммоль) в метиленхлориде (1,8 мл) прибавляют гидроксид калия (505 мг, 9,0 ммоль) и карбонат калия (1,24 г, 9,0 ммоль). Смесь перемешивают при комнатной температуре в течение 2 дней, затем фильтруют и промывают метиленхлоридом. Фильтрат и промывки концентрируют в вакууме с получением неочищенного 3-[4-(3-тиенил)фенил]аланина в виде желтого масла.
Раствор 3-[4-(3-тиенил)фенил]аланина в метаноле (2 мл) медленно прибавляют к раствору тионилхлорида (6,8 мл, 94 ммоль) в метаноле (5 мл) при температуре -10oC. Смесь медленно нагревают до комнатной температуры, затем кипятят с обратным холодильником в течение ночи. Реакционную смесь концентрируют в вакууме, разбавляют этилацетатом (10 мл) и экстрагируют водой (10 мл x 3). Водный слой делают основным с помощью бикарбоната натрия и экстрагируют этилацетатом (10 мл x 3). Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме с получением неочищенного сложного метилового эфира 3-[4-(3-тиенил)фенил]аланина.
Перемешанный раствор сложного метилового эфира 3-[4-(3-тиенил)фенил] аланина (650 мг) и триэтиламина (1,64 г, 11,8 ммоль) в 1,4-диоксане (10 мл) прибавляют к 3,5-диметилбензоил хлориду (517 мг, 3,07 ммоль) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем разбавляют простым эфиром и промывают 1 н. раствором хлористоводородной кислоты, насыщенным раствором бикарбоната натрия и водой. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с помощью ацетата/гексана, 1 : 2, с получением сложного метилового эфира N-(3,5-диметилбензоил)-2-метил-3-[4-(3-тиенил)фенил]аланина.
К охлажденному до температуры 0oC раствору вышеуказанного сложного эфира N-(3,5-диметилбензоил)-2-метил-3-[4-(3-тиенил)фенил] аланина (200 мг, 0,49 ммоль) и метил иодида (0,122 мл, 1,96 ммоль) в DMF (2 мл) прибавляют гидрид натрия (60%; 39 мг, 0,98 ммоль) в атмосфере азота. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 дней. Смесь разбавляют водой и экстрагируют этилацетатом (10 мл x 2). Органический слой промывают водой (5 мл x 2), сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с помощью ацетата/гексана, 1 : 2, с получением сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-2-метил-3-[4-(3-тиенил)фенил]аланина.
Перемешанный раствор сложного метилового эфира N-(3,5-диметилбензоил)-N-метил-2-метил-3-[4-(3-тиенил)фенил] аланина (100 мг, 0,245 ммоль) и гидроксида калия (40 мг, 0,72 ммоль) в этаноле (5 мл) кипятят с обратным холодильником в течение ночи. Смесь разбавляют водой и промывают простым эфиром. Водный слой промывают солевым раствором, сушат в присутствии сульфата магния и концентрируют в вакууме с получением соответствующего неочищенного N-(3,5-диметилбензоил)-N-метил-2-метил-3-[4-(3-тиенил)фенил]аланина.
К раствору N-(3,5-диметилбензоил)-N-метил-2-метил-3-[4-(3-тиенил)фенил] аланина (135 мг, 0,33 ммоль) в DMF последовательно прибавляют хлоргидрат сложного метилового эфира триптофана (110 мг, 0,43 ммоль), 1-гидроксибензотриазол (58 мг, 0,43 ммоль) и 1-(3-диметил-аминопропил)-3-этил-карбодиимид (5,46 M раствор) (79 мкл, 0,43 ммоль) при температуре 0oC в атмосфере азота. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов, затем при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и дважды промывают 10% раствором лимонной кислоты. Органический слой сушат в присутствии сульфата магния и концентрируют в вакууме. Остаток хроматографируют на кремнеземе с использованием гексана/этилацетата, 1 : 1, получая (D, L)-изомер (55 мг) и (L, L)-изомер (80 мг: включает 15% (D,L)-изомера (общее 67%) сложного метилового эфира 3-[4-(3-тиенил)-фенил]аланина-триптофана. Гидролиз (D,L)-изомера (55 мг, 0,09 ммоль) при помощи гидрата гидроксида лития (6 мг, 0,14 ммоль) приводит к получению N-(3,5-диметилбензоил)-N-метил-(L)-2-метил-3-[4-(3-тиенил)фенил)-аланил- (L)-триптофана; FAB-MS m/e 592 (M-H)+.
Пример 119:
Гидролиз (L,L)-изомера (80 мг, 0,13 ммоль), полученного в Примере 118, с помощью гидрата гидроксида лития (8 мг, 0,20 ммоль) позволяет получить N-(3,5-диметилбензоил)-N-метил-(L)-2-метил-3-[4-(3-тиенил)фенил] -аланил- (L)-триптофан; FAB-MS m/e 594 (M-H)+.
Пример 120:
К раствору 5-(4-метилфенил)-изоксазола (17 г) и N-бромосукцинимида (19 г) в тетрахлорметане (500 мл) в атмосфере азота прибавляют бензоил пероксид (0,43 г) и смесь нагревают при температуре дефлегмации в течение ночи. Растворитель упаривают и остаток очищают флеш-хроматографией (силикагель, гексан/этил ацетат, 4 : 1) с получением чистого 5-(4-бромометилфенил)-изоксазола.
ЯМР (CDCl3, 400 МГц): δ [ppm] 8,32 (д, 1,8 Гц, 1H), 7,78 (д, 8,2 Гц, 2H), 7,51 (д, 8,2 Гц, 2H), 6,54 (д, 1,8 Гц, 1H), 4,52 (с, 2H).
5-(4-Бромометилфенил)-изоксазол (700 мг) и сложный этиловый эфир N-дифенилметилен-глицила (890 мг) растворяют в дихлорметане (20 мл) и перемешивают энергично с раствором гидрогенсульфата тетрабутиламмония в 2,5 молярном водном растворе гидроксида натрия при комнатной температуре в течение ночи. Органический слой затем отделяют и концентрируют. Остаток распределяют между простым эфиром и водой и эфирную фазу промывают водой и солевым раствором, сушат в присутствии сульфата магния и упаривают с получением неочищенного сложного этилового эфира N-дифенилметилен-3-[4-(5-изоксазолил)фенил] аланина, который используют для последующей стадии без дополнительной очистки.
Неочищенный сложный этиловый эфир N-дифенилметилен-3-[4-(5-изоксазолил)фенил] аланина (280 мг) обрабатывают моногидратом p-толуолсульфокислоты (100 мг) в ацетонитриле (35 мл) и воде (3,5 мл) при температуре окружающей среды в течение 3,5 часа. После концентрации остаток экстрагируют простым эфиром и 1 н. раствором гидроксида натрия, промывают солевым раствором, сушат и концентрируют с получением сложного этилового эфира 3-[4-(5-изоксазолил)фенил] аланина, который используют для последующей стадии без дополнительной очистки.
Неочищенный сложный этиловый эфир 3-[4-(5-изоксазолил)-фенил]аланина (660 мг) растворяют в хлороформе (6,6 мл), энергично перемешивают с 2 н. раствором карбоната натрия (1,4 мл) и, после охлаждения до температуры 10oC, прибавляют 3,5-диметилбензоилхлорид (0,7 мл). Перемешивание продолжают в течение 1 часа при температуре 10oC и в течение 2 часов при комнатной температуре. Затем экстракция смесью дихлорметан/вода, промывка 10% водным раствором лимонной кислоты и солевым раствором с последующим упариванием приводят к получению неочищенного продукта. Флеш-хроматография (силикагель, гексан/этил ацетат, 4 : 1) позволяет получить чистый сложный этиловый эфир N-(3,5-диметилбензоил)-3-[4- (5-изоксазолил)фенил]аланина. ЯМР (CDCl3, 400 МГц): δ [ppm] 8,28 (д, 1,8 Гц, 1H), 7,72 (д, 8,2 Гц, 2H), 7,33 (с, 2H), 7,26 (д, 8,2 Гц, 2H), 7,15 (с, 1H), 6,65 (д, 7,3 Гц, 1H), 6,50 (д, 1,8 Гц, 1H), 5,09 (м, 1H), 4,24 (кв, 7,1 Гц, 2H), 3,32 (м, 2H), 2,34 (с, 6H), 1,29 (т, 7,1 Гц, 3H).
Раствор сложного этилового эфира N-(3,5-диметилбензоил)-3-[4-(5-изоксазолил)фенил] аланина (3,8 г) и метилиодида (1,8 мл) в сухом N,N-диметилформамиде (40 мл) охлаждают в ледяной бане с последующим порционным прибавлением гидрида натрия (60% в масле, 390 мг). Смесь нагревают до комнатной температуры в течение 5 часов, затем выливают на воду, экстрагируют этилацетатом, органическую фазу промывают водой, солевым раствором, сушат и упаривают. Флеш-хроматография остатка на силикагеле (гексан/этилацетат, 3 : 1) позволяет получить чистый сложный этиловый эфир N-(3,5-диметилбензоил)-N-метил-3-[4-(5-изоксазолил)фенил]-аланина. ЯМР (CDCl3, 400 МГц): δ [ppm] 8,30 (д, широкий, 1H), 7,75 (м, 2H), 7,41 (д, широкий, 1H), 7,12 (д, широкий, 1H), 6,97 (с, 0,5H), 6,93 (с, 0,5H), 6,70 (с, 1H), 6,53 (д, широкий, 1H), 6,36 (д, широкий, 1H), 5,40 (м, 0,5H), 4,58 (м, 0,5H), 4,27 (м, 2H), 3,54 (м, 0,5H), 3,25 (м, 1H), 3,05 (м, 2H), 2,78 (с, 1,5H), 2,23 (с, 3H), 2,13 (с, 3H), 1,27 (м, 3H).
Сложный этиловый эфир N-(3,5-диметилбензоил)-N- метил-3-[4-(5-изоксазолил)фенил] аланина обрабатывают моногидратом гидроксида лития (5 мг) в метаноле (0,5 мл), тетрагидрофураном (0,25 мл) и водой (0,25 мл) в течение 3 часов при комнатной температуре. Затем смесь распределяют между водой и простым эфиром, водную фазу подкисляют 1 н. раствором хлористоводородной кислоты и затем экстрагируют этилацетатом. Этилацетатную фазу промывают солевым раствором, сушат и упаривают с получением N-(3,5-диметилбензоил)-N-метил-3-[4-(5-изоксазолил)фенил] аланина. ЯМР (CDCl3, 400 МГц): δ [ppm] 8,48 (с), 8,30 (с), 7,80 (м), 7,43 (м), 7,03 (с), 6,94 (с), 6,75 (с), 6,69 (с), 6,36 (с), 5,16 (м), 4,65 (м), 3,55 (м), 3,40 (м), 3,25 (м), 3,10 (м), 2,80 (с), 2,26 (с), 2,14 (с).
При температуре 0oC N-(3,5-диметилбензоил)-N-метил-3-[4-(5- изоксазолил)фенил]аланин (445 мг) перемешивают в N,N-диметилформамиде (24 мл) вместе с хлоргидратом сложного метилового эфира (L)-триптофана (400 мг), гидроксибензтриазолом (330 мг) и 1-(3-диметиламинопропил)-3-этилкарбодиимидом (0,32 мл) в течение 1 часа и при комнатной температуре в течение ночи. После экстракции этилацетатом и 10% водным раствором лимонной кислоты органическую фазу промывают 4 % водным раствором бикарбоната натрия и солевым раствором, сушат и упаривают. Флеш-хроматография на силикагеле (гексан/этилацетат, 2 : 1) приводит к получению продукта в виде смеси диастереоизомеров. Разделение хроматографией среднего давления на колонке силикагеля с использованием простого эфира/дихлорметана (1 : 1) в качестве растворителя приводит к получению сложного метилового эфира [N-(3,5-диметилбензоил)-N-метил-3-[4-(5-изоксазолил)фенил]-(D)- аланил]-(L)-триптофана. ЯМР (CDCl3, 400 МГц): δ [ppm] 8,60 (с), 8,30 (м), 7,70 (м), 7,55 (м), 7,70 (м), 7,10 (м), 6,90 (м), 6,50 (м), 5,85 (с), 5,43 (м), 4,90 (м), 4,33 (м), 3,75 (с), 3,70 (с), 3,35 (м), 3,15 (м), 2,85 (с), 2,57 (с), 2,35 (с), 2,20 (с), 1,93 (с), 1,85 (с).
Сложный метиловый эфир [N-(3,5-диметилбензоил)-N-метил-3-[4-(5- изоксазолил)фенил] -(D)-аланил]-(L)-триптофана (50 мг) обрабатывают моногидратом гидроксида лития (3,8 мг) в метаноле (1 мл), тетрагидрофураном (0,5 мл) и водой (0,5 мл) в течение 1 часа при температуре 0oC и в течение 2 часов при комнатной температуре. Затем смесь распределяют между водой и простым эфиром, водную фазу подкисляют 1 н. раствором хлористоводородной кислоты и затем экстрагируют этилацетатом. Этилацетатную фазу промывают солевым раствором, сушат и упаривают с получением [N-(3,5-диметилбензоил)-N-метил-3-[4-(5-изоксазолил)фенил] -(D)-аланил] - (L)-триптофана. ЯМР (CDCl3, 400 МГц): δ [ppm] 8,29 (с), 8,12 (с), 7,70 (м), 7,55 (м), 7,28 (м), 7,17 (м), 7,07 (м), 6,98 (м), 6,86 (м), 6,61 (с), 6,53 (с), 6,49 (с), 5,97 (с), 5,43 (м), 4,87 (м), 4,40 (м), 3,90 (м), 3,33 (м), 2,08 (м), 2,77 (с), 2,18 (с), 1,89 (с).
Пример 121:
Таблетки, каждая содержащая 50 мг активного ингредиента, например N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил-(L)-триптофана, могут быть получены следующим образом:
Состав (для 10000 таблеток)
Активный ингредиент - 500,0 г
Лактоза - 500,0 г
Картофельный крахмал - 352,0 г
Желатина - 8,0 г
Тальк - 60,0 г
Стеарат магния - 10,0 г
Кремнезем (высокодисперсный) - 20,0 г
Этанол - Сколько потребуется
Активный ингредиент смешивают с лактозой и 292 г картофельного крахмала, после чего смесь увлажняют с использованием спиртового раствора желатины и гранулируют при помощи сита. После сушки оставшийся картофельный крахмал, тальк и стеарат магния, а также высокодисперсный кремнезем перемешивают и смесь сжимают с получением таблеток массой 145,0 мг каждая и с содержанием активного ингредиента 50,0 мг, которые при желании могут быть снабжены установочными метками для более точной регулировки дозы.
Пример 122:
Таблетки с покрытием, каждая содержащая 100 мг активного ингредиента, например N-(3,5-диметилбензоил)-N-метил-(D)-фенилаланил- (L)-триптофана, могут быть получены следующим образом:
Состав (для 1000 таблеток)
Активный ингредиент - 100,00 г
Лактоза - 100,00 г
Кукурузный крахмал - 70,00 г
Тальк - 8,50 г
Стеарат кальция - 1,50 г
Гидроксипропилметилцеллюлоза - 2,36 г
Щеллак - 0,64 г
Вода - Сколько потребуется
Дихлорметан - Сколько потребуется
Активный ингредиент, лактозу и 40 г кукурузного крахмала перемешивают и увлажняют, после чего гранулируют с помощью пасты, полученной из 15 г кукурузного крахмала и воды (при нагревании). Гранулы сушат и оставшийся кукурузный крахмал, тальк и стеарат кальция добавляют и смешивают с гранулами.
Смесь сжимают с получением таблеток массой 280 мг каждая и с содержанием активного ингредиента 50,0 мг, которые покрывают раствором гидроксипропилметилцеллюлозы и щеллака в дихлорметане (конечная масса таблетки с покрытием составляет 283 мг).
Пример 123:
Таблетки и таблетки с покрытием, содержащие другое соединение формулы I или фармацевтически приемлемую соль соединения формулы I, например, как описано в Примерах 1 - 120, также могут быть получены способом, аналогичным описанному в Примерах 121 и 122.
Фармакологические эксперименты
Реакция связывания рецептора эндотелина (ET)
Сродство связывания с рецептором ET соединений настоящего изобретения определяют в соответствии с методом, описанным ниже (опубликован в работе Takai et al. (1992) Biochem. Biophys. Res. Commun. 184, 953-959). ET-1 и ET-3 поставляются компанией Peptide Institute Inc. (Осака, Япония), [125I] ET-1 и [125I] ET-3 (≈74 Tbq/ммоль каждый) поставляются из компании Amersham International (Bucks, U.K.).
Плазменные мембраны свиного легкого (2 мкг белка) инкубируют при температуре 37oC в течение одного часа с использованием 30 пМ [125I] ET-1 или 10 пМ [125I] ET-3 в отсутствие или в присутствии различных количеств немеченых лигандов при общем объеме 1 мл 20 мМ HEPES (pH 7,4) с содержанием 145 мМ NaCl, 3 мМ KCl, 3 мМ MgCl2, 1 мМ EGTA, 1 мг/мл бычьего сывороточного альбумина и 0,2 мг/мл бацитрацина. После инкубации несвязанные [125I] ET разделяют центрифугированием при 20000 x г в течение 20 минут при температуре 4oC с последующей вытяжкой супернатанта. Радиоактивность в мембранном осадке измеряют в автоматическом счетчике гамма-квантов Wallac-1470 Wizard (Pharmacia). Неспецифическое связывание определяют как мембранно-ассоциированную радиоактивность в присутствии насыщающих концентраций ET (100 нМ). Неспецифическое связывание вычитают из общего связывания, и разницу определяют как специфическое связывание. Общее связывание всегда меньше 15% от общей радиоактивности.
Связывание с рецептором ETA определяют с использованием [125I] ET-1 в присутствии 1 нМ немеченого ET-3, а связывание с рецептором ETB определяют с помощью только [125I] ET-3. При использовании анализа Scatchard рецептор ETA показывает кажущуюся константу диссоциации (Kd), равную 44 пМ, и максимальные сайты связывания (Bmax), равные 342 фмоль/мг белка, тогда как рецептор ETB имеет Kd, равную 8 пМ, и Bmax, равный 363 фмоль/мг белка. Из кривых ингибирования относительно связывания [125I] ET вычисляют кажущуюся константу сродства связывания (Ki) одного из испытуемых соединений (Пример 55) в виде параметра сродства к рецепторам ETA и ETB.
Табл. 1 показывает результаты реакции связывания в виде процента (%) ингибирования специфических рецепторов ETA и ETB, связывающихся при концентрации соответственно 10-5 M и 10-7M испытуемых соединений.
Сокращение коронарной артерии свиней
Анализ на сокращение осуществляют в соответствии с опубликованным методом (S. Shetty et al., Biochem. Biophys. Res. Commun. 191, 459-464, 1993), описанным ниже:
Свежие свиные сердца получают из местной скотобойни, сразу же погружают в охлажденный на льду лактированный раствор Рингера и переносят в лабораторию в течение 30 минут после убоя. Левую переднюю нисходящую коронарную артерию вырезают и помещают в аэрированный физиологический солевой раствор. Артериальные препараты очищают от прилегающих соединительных тканей и нарезают кругами длиной от 0,5 до 1,0 см.
Две самозакрывающиеся петли для пересевов из нержавеющей стали вводят в каждый артериальный круг и полученное приспособление отдельно суспендируют в 20 мл ванне для органов с водяной рубашкой, имеющей постоянную температуру, для регистрации изометрической силы. Ванны наполняют физиологическим солевым раствором при температуре 37oC и непрерывно аэрируют с применением 95% O2 и 5% CO2. Одна из петель соединена со стеклянным стержнем внутри ванны для органов, тогда как другая соединена с динамометрическим преобразователем перемещения (Grass FT-03) при помощи шелковой нитки. Ткани подвергают напряжению покоя силой 4 г и уравновешивают в течение 90 минут в физиологическом солевом растворе перед началом экспериментов.
Эндотелий извлекают из препаратов путем осторожного соскоба со стенок интимной поверхности деревянным аппликатором. Неспособность как 1 мкМ ацетилхолина расслабить мезентереальные кольца, сокращенные с использованием 1 мкМ фенилэфрина, так и 0,1 мкМ вещества P расслабить коронарные кольца, сокращенные с использованием 3 мкМ PGF2α демонстрирует эффективность извлечения эндотелия. Кривые зависимости от концентрации для ET-3 в отсутствие (контроль) или в присутствии концентрации испытуемого соединения, равной 10-6 M, получают путем кумулятивных добавок в ванны для органов. Эффекты соединения (Пример 1) оценивают в сосудах под напряжением покоя.
Сокращение трахеи морских свинок
Анализы на сокращение осуществляют в основном в соответствии с опубликованным методом (Takai et al., Biochem. Biophys. Res. Common. 184, 953-959, 1992). Трахею, которую выделили из самцов морских свинок породы Hartley весом 350-500 г, нарезают на круги длиной приблизительно 2 мм после удаления прилегающего жира и соединительных тканей. Эпителий извлекают механически из кругов. Препараты помещают в ванны для органов, содержащие забуференный раствор Кребса-Хенселейта или раствор Тироде, при температуре 37oC, pH 7,4, которые барботируют с применением 95% O2 и 5% CO2. Напряжение измеряют изометрически с помощью динамометрического преобразователя перемещения (Nikhon Kohden, Tokyo, TB-612T) при начальном напряжении, равном 1 г. Кривые зависимости от концентрации для ET-3 получают путем его кумулятивного добавления. Ингибирующие активности данных соединений исследуют путем прибавления их раствором DMSO в ванны за 10-40 минут перед добавлением ET-3. Эти активности оценивают численно значениями pA2, которые представляют собой отрицательные логарифмы концентраций соединений, которые индуцируют сдвиг кривых зависимости от концентраций в направлении 2-кратного увеличения диапазона концентраций ET-3. Сокращение, продуцируемое с помощью концентраций 60 мМ KCl или 10 мкМ карбахола, используют в качестве эталона. Данные представлены в табл. 2.
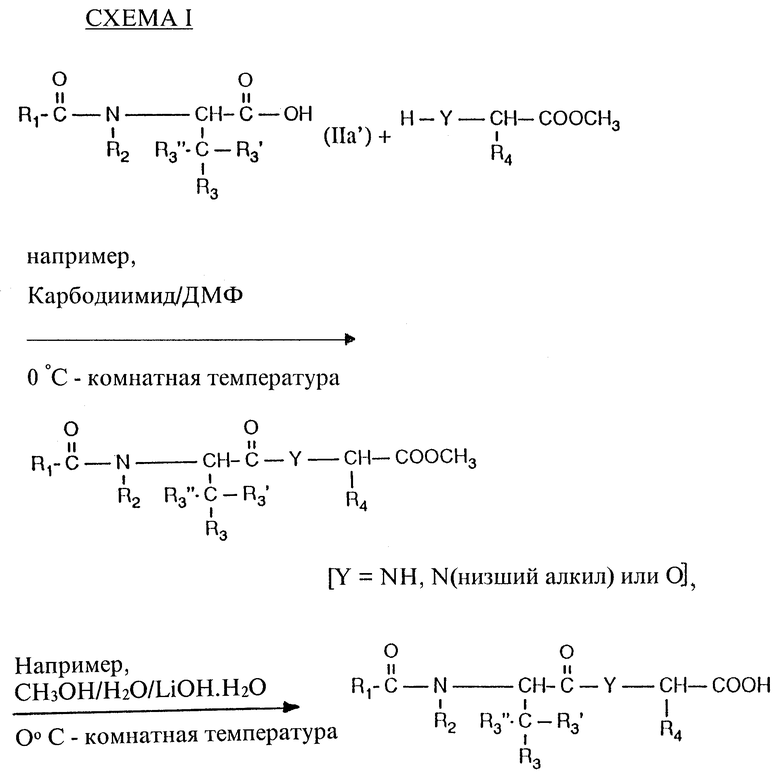
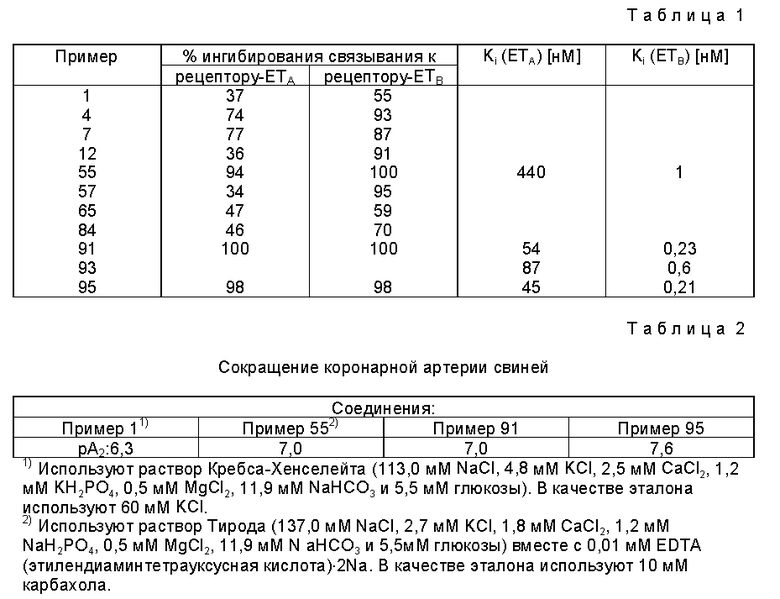
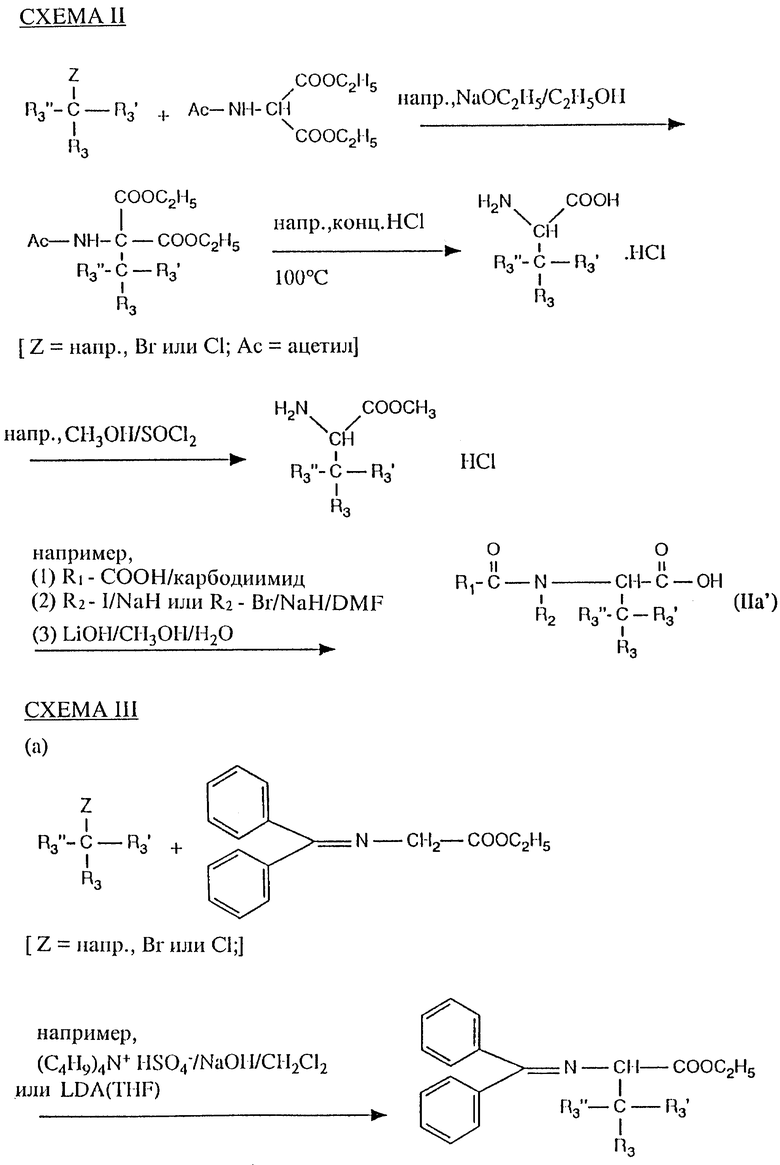
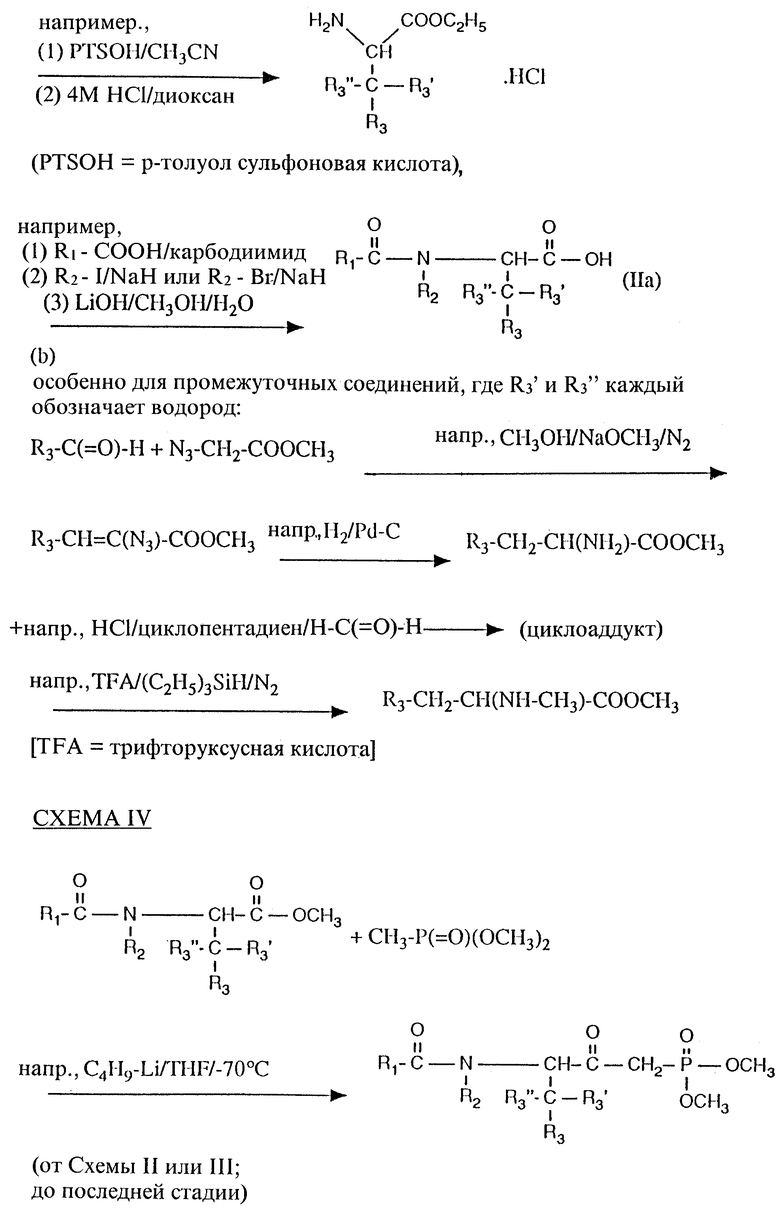

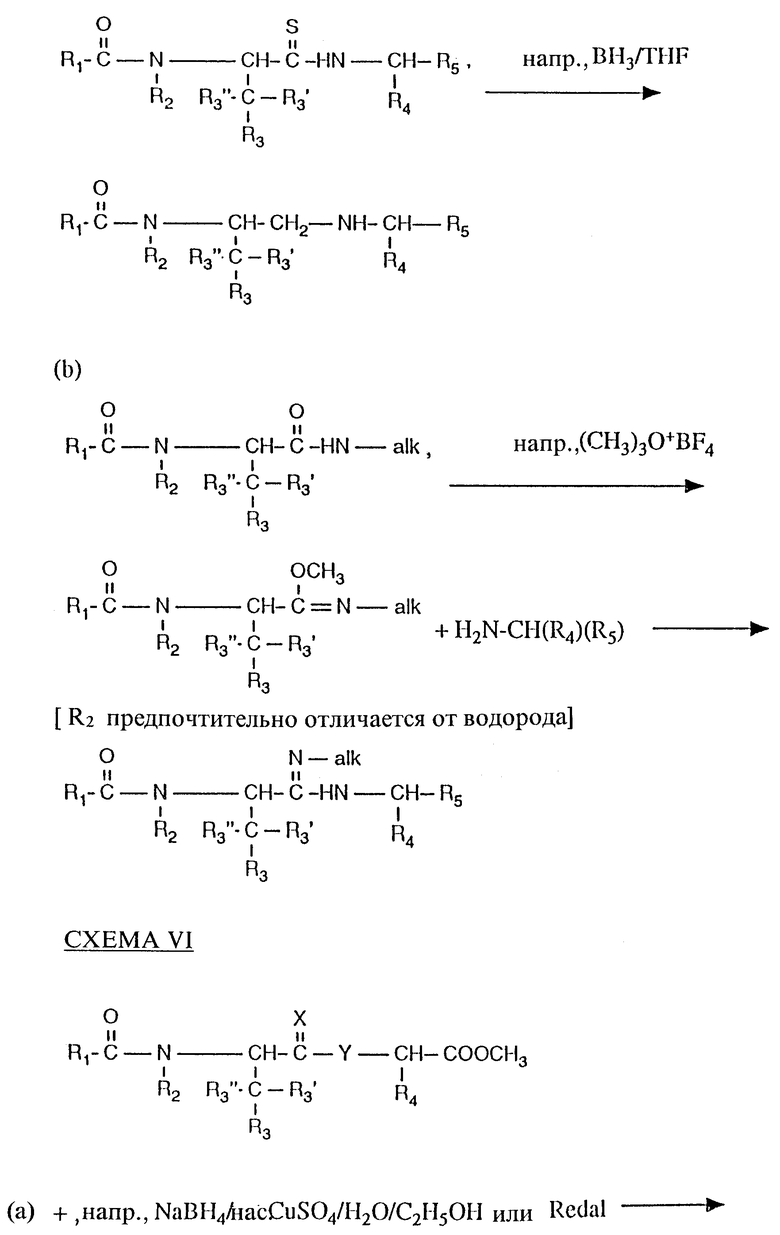

Использование: в медицине. Сущность изобретения: соединение общей формулы I 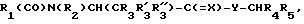 где R1 - фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси или галогеном; R2 - C1 - C4-алкил; R3-фенил, бифенил, нафтил, тиенил, фурил, тетразолил, имидазолил, пиридил, хинолинил, пиридил-фенил, тиенил-фенил, фурил-фенил, имидазолил-фенил, изоксазолил-фенил; где названные арильные и гетероарильные радикалы, независимые друг от друга, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, фенил- C1 - C4-алкокси, галогена, CF3, гидрокси, циано, циано- C2 - C5-алканоила и нитро; R3-водород, фенил или фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси, галогеном, CF3, гидрокси, нитро;
где R1 - фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси или галогеном; R2 - C1 - C4-алкил; R3-фенил, бифенил, нафтил, тиенил, фурил, тетразолил, имидазолил, пиридил, хинолинил, пиридил-фенил, тиенил-фенил, фурил-фенил, имидазолил-фенил, изоксазолил-фенил; где названные арильные и гетероарильные радикалы, независимые друг от друга, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, фенил- C1 - C4-алкокси, галогена, CF3, гидрокси, циано, циано- C2 - C5-алканоила и нитро; R3-водород, фенил или фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси, галогеном, CF3, гидрокси, нитро; 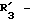 водород; С(=Х) обозначает С(= О) или С(=S); Y обозначает NH или метилен, или С(=Х) обозначает СНОН и Y обозначает метилен;
водород; С(=Х) обозначает С(= О) или С(=S); Y обозначает NH или метилен, или С(=Х) обозначает СНОН и Y обозначает метилен; 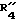 обозначает -(CH2)s - Ar, где s равно целому числу 1 и Ar - фенил, нафтил, бифенил, индол-3-ил, 1- C1 - C4-алкил-индол-3-ил или хинолинил; где названные арильные и гетероарильные радикалы, независимо друг от друга, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, галогена, CF3, гидрокси, нитро; и R5 - COOH, или его фармацевтически приемлемая соль. Фармацевтический препарат содержит антагонист, ингибирующий связывание эндотелина, причем в качестве антагониста используют эффективное количество соединения I. 3 с. и 13 з.п.ф-лы, 2 табл.
обозначает -(CH2)s - Ar, где s равно целому числу 1 и Ar - фенил, нафтил, бифенил, индол-3-ил, 1- C1 - C4-алкил-индол-3-ил или хинолинил; где названные арильные и гетероарильные радикалы, независимо друг от друга, являются в каждом случае незамещенными или замещенными заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, галогена, CF3, гидрокси, нитро; и R5 - COOH, или его фармацевтически приемлемая соль. Фармацевтический препарат содержит антагонист, ингибирующий связывание эндотелина, причем в качестве антагониста используют эффективное количество соединения I. 3 с. и 13 з.п.ф-лы, 2 табл.
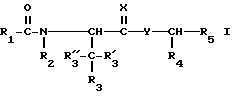
где R1 обозначает фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси или галогеном;
R2 обозначает C1 - C4-алкил;
R3 обозначает фенил, бифенил, нафтил, тиенил, фурил, тетразолил, имидазолил, пиридил, хинолинил, пиридил-фенил, тиенил-фенил, фурил-фенил, имидазолил-фенил или изоксазолил-фенил, где названные арильные и гетероарильные радикалы, независимо друг от друга, являются в каждом случае незамещенными или замещенными заместителем, выбранным из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, фенил-C1 - C4-алкокси, галогена, CF3, гидрокси, циано, циано-C2 - C5-алканоила и нитро;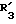 обозначает водород, фенил или фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси, галогеном, CF3, гидрокси или нитро;
обозначает водород, фенил или фенил, замещенный C1 - C4-алкилом, C1 - C4-алкокси, галогеном, CF3, гидрокси или нитро;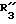 обозначает водород;
обозначает водород;
C(=X) обозначает C(=O) или C(=S);
Y обозначает NH или метилен,
или C(=X) обозначает CHOH и Y обозначает метилен;
R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает фенил, нафтил, бифенилил, индол-3-ил, 1-C1 - C4-алкил-индол-3-ил, или хинолинил; где названные арильные и гетероарильные радикалы, независимо друг от друга, являются в каждом случае незамещенными или замещенными заместителем, выбранным из группы, состоящей из C1 - C4-алкила, C1 - C4-алкокси, галогена, CF3, гидрокси и нитро;
R5 обозначает COOH;
или его фармацевтически приемлемая соль.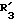 обозначает водород или фенил;
обозначает водород или фенил; 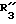 обозначает водород или (ii) R3 обозначает фенил или фенил, замещенный циано или циано-C2-C5-алканоилом;
обозначает водород или (ii) R3 обозначает фенил или фенил, замещенный циано или циано-C2-C5-алканоилом; 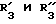 каждый обозначает водород; C(=X) обозначает C(=O) или C(= S); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает индол-3-ил; и R5 обозначает карбокси; или его фармацевтически приемлемая соль.
каждый обозначает водород; C(=X) обозначает C(=O) или C(= S); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает индол-3-ил; и R5 обозначает карбокси; или его фармацевтически приемлемая соль.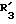 обозначает водород или фенил;
обозначает водород или фенил; 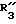 обозначает водород; C(=X) обозначает C(=O) и Y обозначает -NH- или -CH2-, или C(=X) обозначает CHOH и Y обозначает метилен; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает нафтил, индолил или хинолинил; и R5 обозначает карбокси; или его фармацевтически приемлемая соль.
обозначает водород; C(=X) обозначает C(=O) и Y обозначает -NH- или -CH2-, или C(=X) обозначает CHOH и Y обозначает метилен; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает нафтил, индолил или хинолинил; и R5 обозначает карбокси; или его фармацевтически приемлемая соль.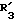 обозначает фенил; или (ii) R3 обозначает фенил, 4-бифенилил, или 4-(2-пиридил)-фенил и
обозначает фенил; или (ii) R3 обозначает фенил, 4-бифенилил, или 4-(2-пиридил)-фенил и 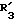 обозначает водород, а
обозначает водород, а 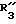 обозначает водород; C(= X) обозначает C(=O) и Y обозначает -NH-; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.
обозначает водород; C(= X) обозначает C(=O) и Y обозначает -NH-; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.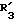 и
и 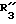 каждый обозначает водород; C(=X) обозначает C(=O); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.
каждый обозначает водород; C(=X) обозначает C(=O); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.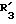 и
и 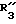 каждый обозначает водород; C(= X) обозначает C(=O); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.
каждый обозначает водород; C(= X) обозначает C(=O); Y обозначает NH; R4 обозначает -(CH2)s -Ar', где s равно целому числу 1 и Ar' обозначает 3-индолил; и R5 обозначает COOH; или его фармацевтически приемлемая соль.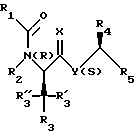
8. Соединение по любому из пп.1 - 6 формулы I, отличающееся тем, что Y обозначает метилен, имеет следующую стереохимию:
9. Соединение по пп.1 - 8 формулы I, отличающееся тем, что оно представляет собой соединение, выбранное из группы, включающей:
N-(3,5-диметилбензоил)-N-метил(D)-фенилаланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил (D)-(4-фенилфенил)аланил-N-метил-(L)-триптофан;
N-(3,5-дихлорбензоил)-N-метил-(D)-фенилаланил-(L)-триптофан;
N-(4-метоксибензоил)-N-метил-(D)-фенилаланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D)-(2-нафтил)аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил (D)-(4-фенилфенил)аланил-(D)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D, L)-(3-фенилфенил)-аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-хлорфенил)-аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D, L)-[4-(2-пиридил)фенил)] -аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D)-тирозил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-O-метил-(D)-тирозил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-O-бензил-(D)-тирозил-(L)-триптофан; и
N-(3,5-диметилбензоил)-N-метил-(D, L)-(2-тиенил)аланил-(L)-триптофан,
или его фармацевтически приемлемую соль.
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(2-тиенил)фенил] -аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(3-оксазолил)фенил] -аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(2-фурил)фенил] -аланил-(L)-триптофан и
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(1-имидазолил)фенил] -(D, L)-аланил-(L)-триптофан,
или его фармацевтически приемлемую соль.
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(3-тиенил)фенил] -аланил-(L)-триптофан и
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(5-изоксазолил) фенил]-аланил-(L)-триптофан,
или его фармацевтически приемлемую соль.
N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-цианофенил)аланил-(L)-триптофан;
(3S)-N-(3,5-диметилбензоил)-N-метил-3-[4-(бифенил)-3-фенил-(D)-аланил-(L)-триптофан;
N-(3,5-диметилбензоил)-N-метил-(D)-3-(4-бифенил)тиоаланил-(L)-триптофан и
N-(3,5-диметилбензоил)-N-метил-(D)-3-[4-(2-фурил)фенил]-аланил-(L)-триптофан,
или его фармацевтически приемлемую соль.
| Способ получения производных дипептидов или их фармакологически приемлемых солей | 1989 |
|
SU1836381A3 |
| Способ получения гетероциклических кетонов | 1988 |
|
SU1678207A3 |
| EP 0460679 А, 1991 | |||
| EP 0457195 А, 1991 | |||
| СПОСОБ РАЗМАГНИЧИВАНИЯ ОТКЛЮЧЕННОЙЭЛЕКТРОМАГНИТНОЙ МУФТЫ ПРИ УСТАНОВКЕДВУХ МУФТ | 1972 |
|
SU436189A1 |
| ЦЕФАЛОСТАТ | 2005 |
|
RU2294694C2 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.1, с.410-411. | |||
Авторы
Даты
1999-02-20—Публикация
1994-10-17—Подача