ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому пути химического синтеза и новым промежуточным соединениям, применимым для получения ингибиторов неприлизина (NEP) и их пролекарств, в частности, пролекарству ингибитора NEP сакубитрила.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
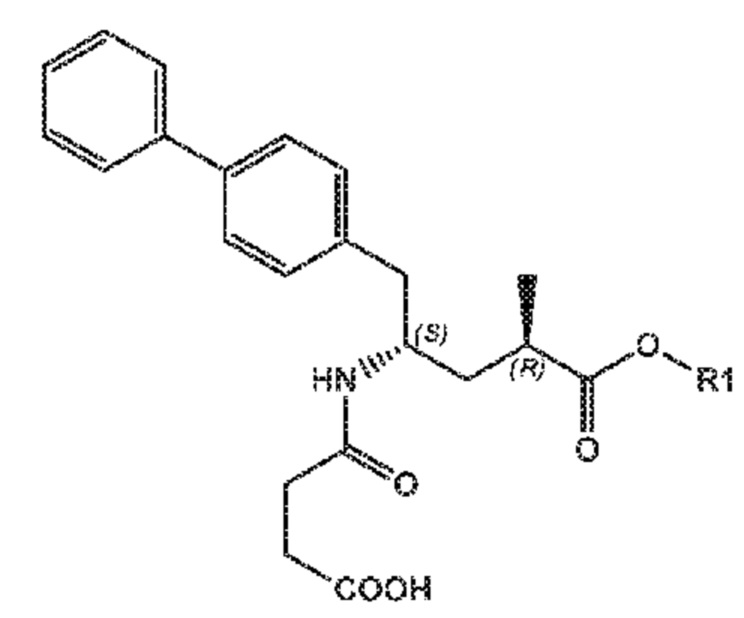
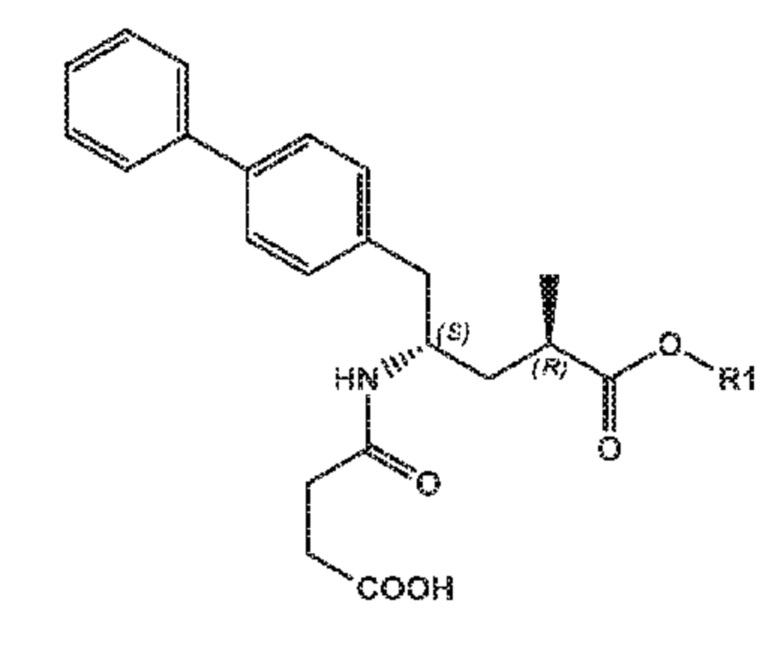
Пролекарство ингибитора NEP сакубитрила, этилового сложного эфира (N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенил метил)-4-амино-(2R)-метилбутановой кислоты; наименование по IUPAC:: 4-{[(1S,3R)-1-([1,1'-бифенил]-4-илметил)-4-этокси-3-метил-4-оксобутил]амино}-4-оксобутановая кислота, также известное как AHU377) представлено следующей формулой (A):
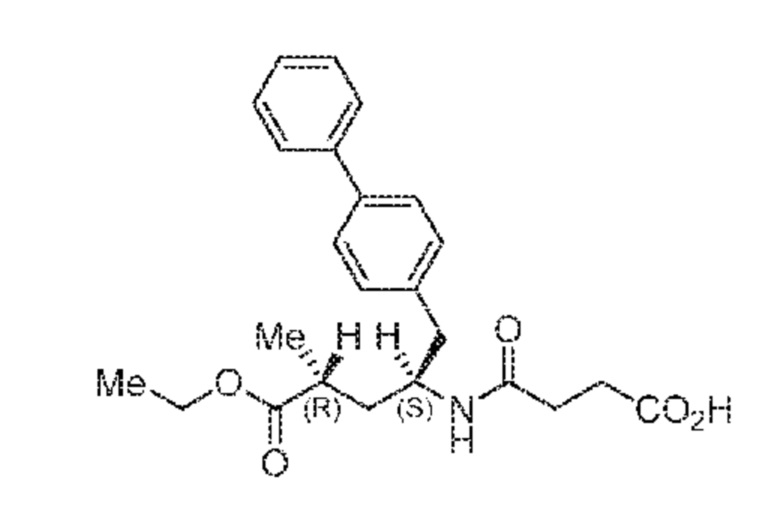 (A)
(A)
Сакубитрил вместе с валсартаном, известным блокатором ангиотензинового рецептора (ARB), образует гидратный комплекс натриевой соли, известный как LCZ696, содержащий анионные формы сакубитрила и валсартана, катионы натрия и молекулы воды при молярном отношении 1:1:3:2,5, соответственно (отношение 6:6:18:15 в асимметрической единичной ячейке кристалла в твердом состоянии), и который схематично представлен в формуле (B).
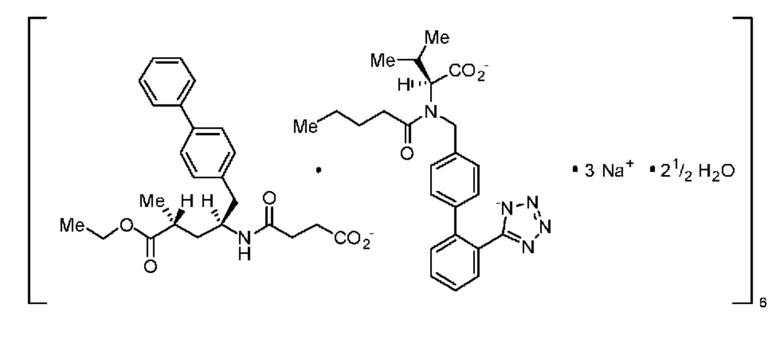 (B)
(B)
К указанному комплексу также относятся следующие химические наименования: Тринатрийгемипентагидрат [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)бутират] или Октадеканатрийгексакис(4-{[(1S,3R)-1-([1,1'-бифенил]-4-илметил)-4-этокси-3-метил-4-оксобутил]амино}-4-оксобутаноат) гексакис(N-пентаноил-N-{[2'-(1H-тетразол-1-ил-5-ил)[1,1'-бифенил]-4-ил]метил}-l-валинат)-вода (1/15) (номенклатура IUPAC).
LCZ696 действует в качестве ингибитора неприлизина ангиотензинового рецептора (ARNI) и, следовательно, является применимым, в частности, при лечении гипертензии или хронической середечной недостаточности. Его применимость была подтверждена клиническими испытаниями, например, в основном испытании PARADIGM-HF.
Пути химического синтеза для получения ингибиторов NEP и их пролекарств, в частности, сакубитрила, и его предшественников ранее были описаны, например, в Ksander et al., J. Med. Chem. 1995, 38, pp. 1689-1700; в патенте США № 5,217,996, в международных патентных заявках WO 2008/031567, WO 2008/083967, WO 2009/090251, WO 2010/081410, WO 2011/035569, WO 2011/088797, WO 2012/025501, WO 2012/025502, WO 2014/032627 и WO 2016/135751, и в опубликованных недавно патентных заявках CN, таких как CN 104557600 A, CN 105152980 A, CN105330569 A, CN 105601524 A, CN 105753741 A, CN 105884656 A и CN 105924355 A и других.
Однако все еще существует потребность в разработке способа химического синтеза сакубитрила, который является подходящим для промышленного получения в экономичных и благоприятных для окружающей среды условиях, и предоставляет вещество лекарственного средства с высокой химической чистотой и с высокой стереохимической селективностью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым промежуточным соединениям и стадиям способа и способам получения соединения формулы (XV), в особенности, (XV-a), представленного ниже, и его дальнейшему применению в производстве сакубитрила.
В первом аспекте, настоящее изобретение предоставляет следующие новые соединения:
Соединение формулы (XV) или его соль
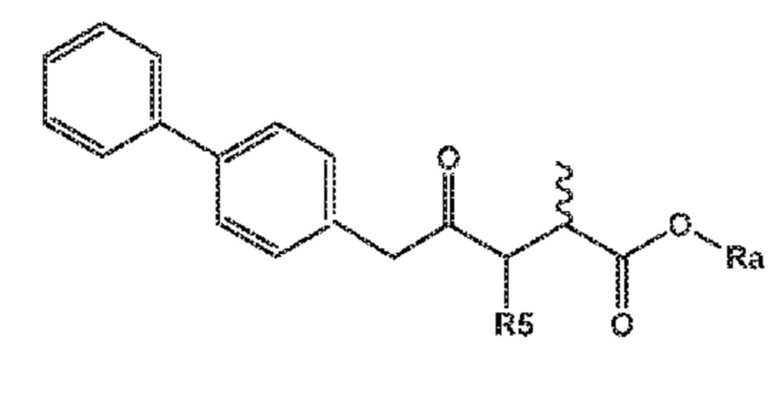 (XV)
(XV)
где
R5 выбирают из водорода и группы -CO-OR*, и
Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (XV) представлено формулой (XV-a) со следующей стереохимией:
 (XV-a)
(XV-a)
где
R5 выбирают из водорода и группа -CO-OR*, и
Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (XV) представляет собой соединение формулы (I) или его соль;
 (I)
(I)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (I) представлено формулой (I-a) со следующей стереохимией:
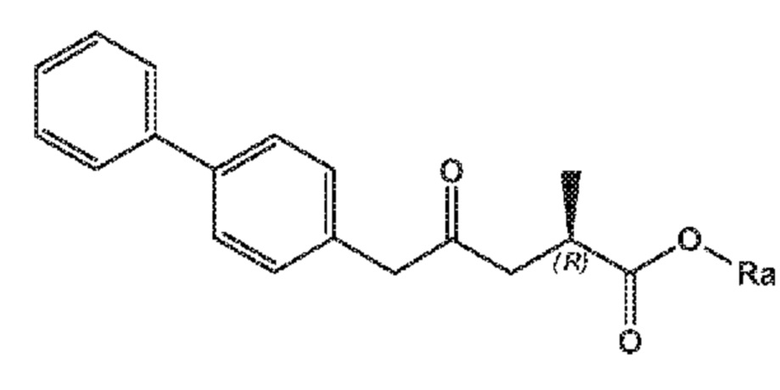 (I-a)
(I-a)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (XV) представляет собой соединение формулы (II), или его соль;
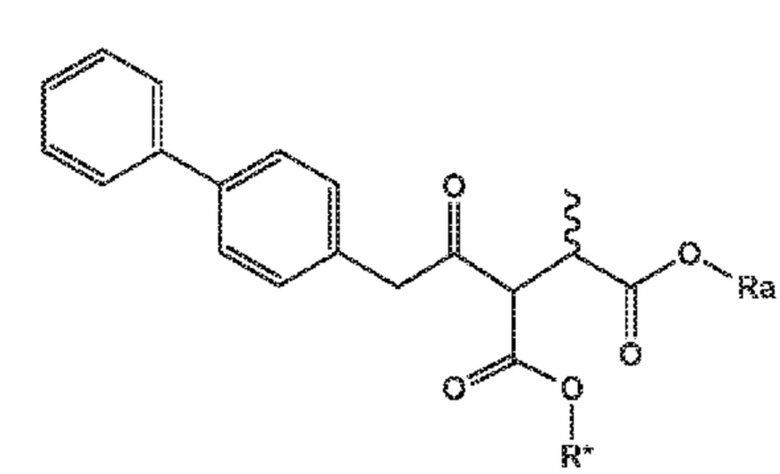 (II)
(II)
где
Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (II) представлено формулой (II-a) со следующей стереохимией
 (II-a)
(II-a)
где Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила;
Соединение формулы (XVI) или его соль
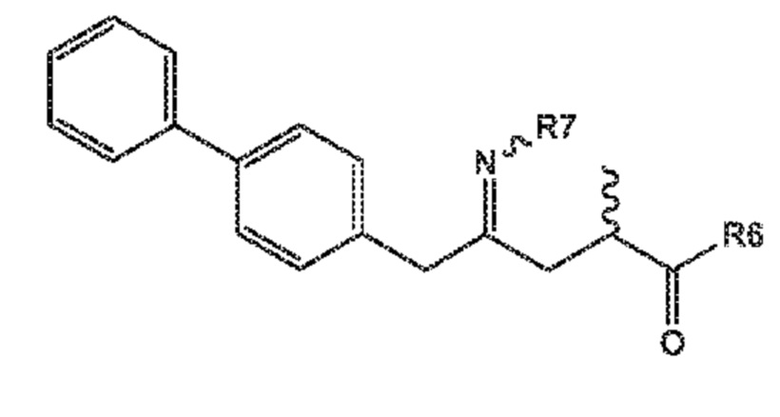 (XVI)
(XVI)
где
R6 представляет собой -O-Ra, и R7 выбирают из:
-S(=O)-Rb
-OH
A, где A представляет собой -O-C(=O)-Rc или -O-Rd,
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно, этила и
Rb, Rc и Rd независимо выбирают из C1-C6-алкил, C6-C10-арил, C6-C10-арил-C1-C6-алкил, C3-C8-циклоалкил, C3-C8-циклоалкил-C1-C6-алкил, гетероциклил или гетероциклил-C1-C6-алкил, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галоген, C1-C7-алкил, галоген-C1-C7-алкил, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкил, или
R6 и R7 вместе представляют -O- или образуют связь.
В одном его варианте осуществления, соединение формулы (XVI) представлено формулой (XVI-a) со следующей стереохимией:
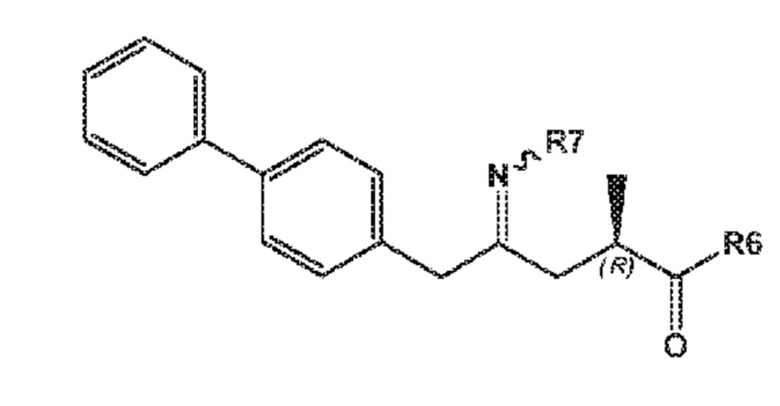 (XVI-a)
(XVI-a)
где
R6 представляет собой -O-Ra, и R7 выбирают из:
-S(=O)-Rb
-OH, и
A, где A представляет собой -O-C(=O)-Rc или -O-Rd
где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и
Rb, Rc и Rd независимо выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила или
R6 и R7 вместе представляют -O- или образуют связь.
В его варианте осуществления A соединение формулы (XVI) представляет собой соединение формулы (X), или его соль
 (X)
(X)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно, этила, и
Rb выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила.
В одном его варианте осуществления, соединение формулы (X) представлено формулой (X-a) со следующей стереохимией:
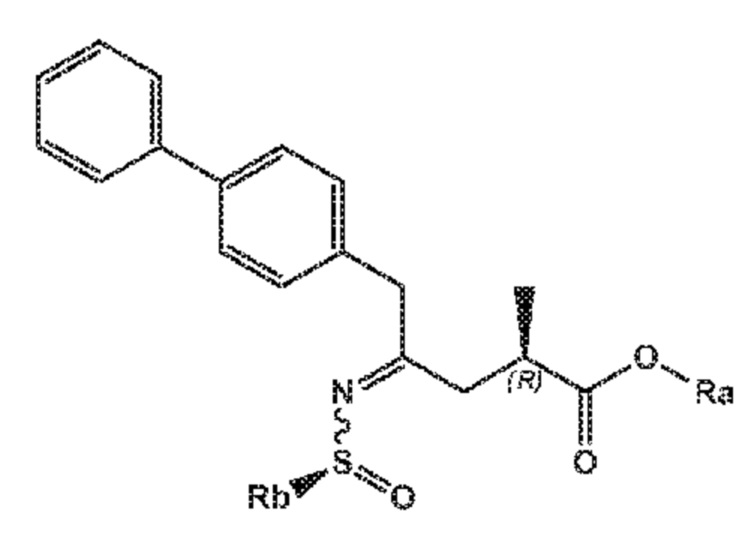 (X-a)
(X-a)
где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и Rb выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси и C1-C7-алкокси-C1-C7-алкила.
В его варианте осуществления B, соединение формулы (XVI) представляет собой соединение формулы (XVII), или его соль
 (XVII)
(XVII)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила.
В одном его варианте осуществления, соединение формулы (XVII) представлено формулой (XVII-a) со следующей стереохимией
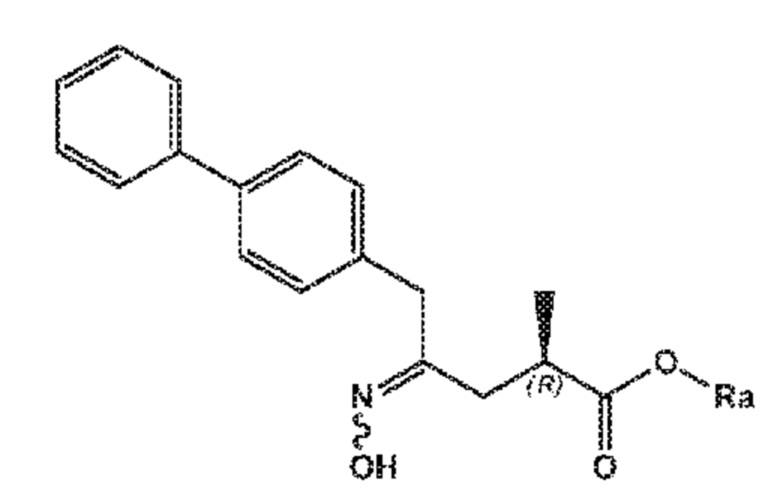 (XVII-a)
(XVII-a)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила.
В его варианте осуществления C соединение формулы (XVI) представляет собой соединение формулы (XVII*) или его соль
 (XVII*)
(XVII*)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила, и Rc выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила.
В одном его варианте осуществления, соединение формулы (XVII*) представлено формулой (XVII*-a) со следующей стереохимией
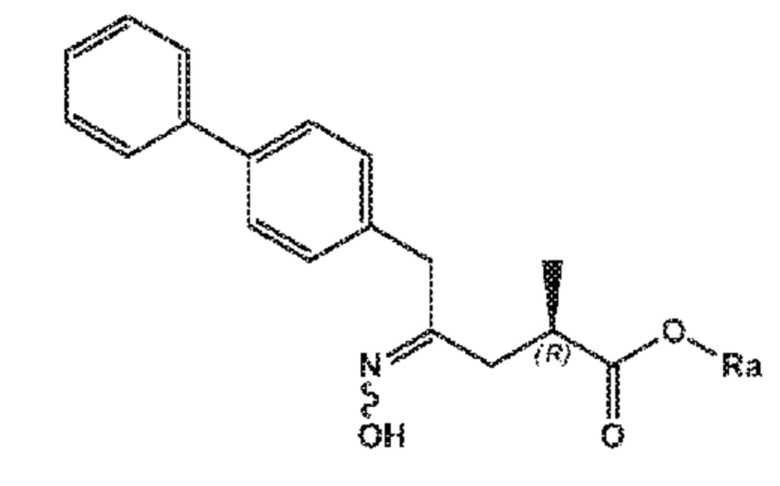 (XVII*-a)
(XVII*-a)
где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила, и Rc выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила.
В его варианте осуществления D, соединение формулы (XVI) представляет собой соединение формулы (XVII**) или его соль:
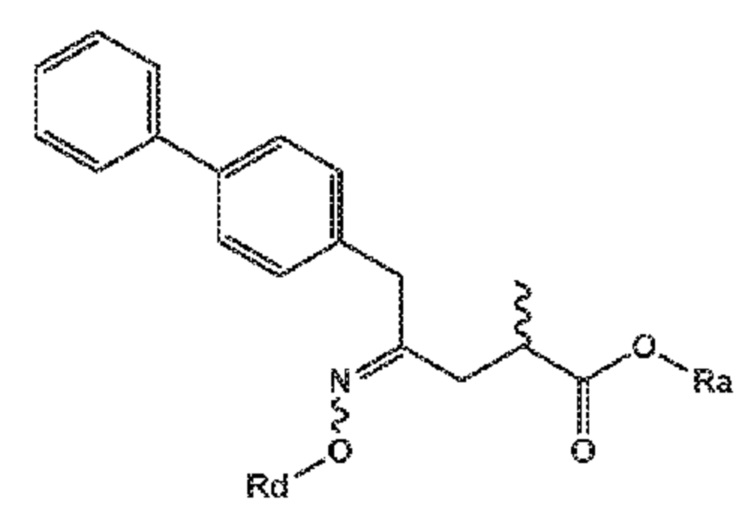 (XVII**)
(XVII**)
где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и Rd выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила.
В одном его варианте осуществления, соединение формулы (XVII**) представлено формулой (XVII**-a) со следующей стереохимией:
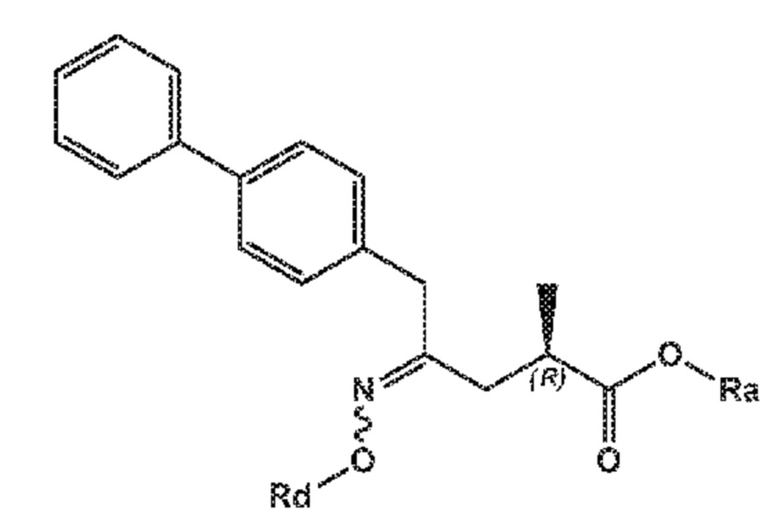 (XVII**-a)
(XVII**-a)
где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и Rd выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси и C1-C7-алкокси-C1-C7-алкила.
В его варианте осуществления E, соединение формулы (XVI) представляет собой соединение формулы (XVIII) или его соль
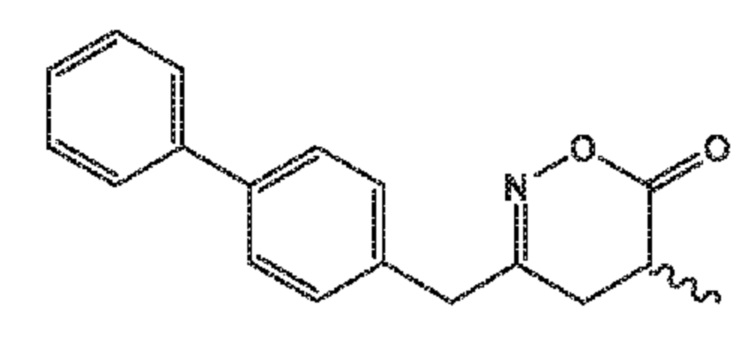 (XVIII)
(XVIII)
В одном его варианте осуществления, соединение формулы (XVIII) представлено формулой (XVIII-a) со следующей стереохимией:
 (XVIII-a).
(XVIII-a).
В его варианте осуществления F, соединение формулы (XVI) представляет собой соединение формулы (XIX) или его соль
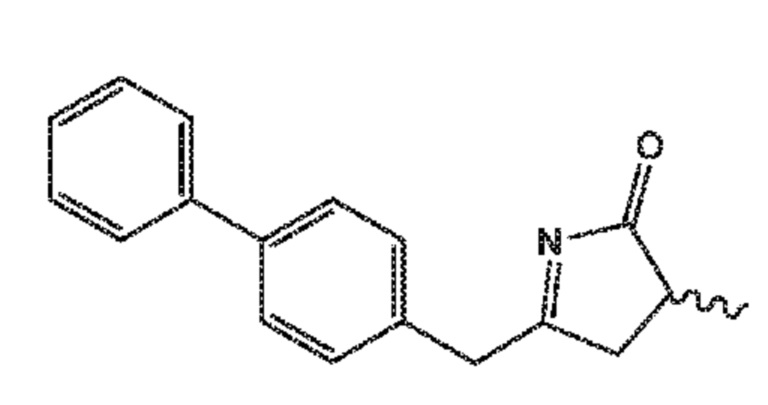 (XIX)
(XIX)
В одном его варианте осуществления, соединение формулы (XIXI) представлено формулой (XIX-a) со следующей стереохимией
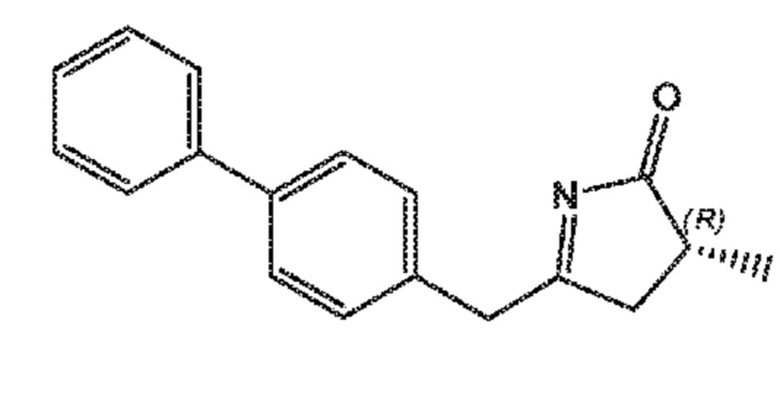 (XIX-a)
(XIX-a)
Во втором аспекте, настоящее изобретение предоставляет новый способ получения нового соединения формулы (I), в частности, формулы (I-a), или его соли, как определено в описании настоящего изобретения. Этот способ включает несколько стадий через новые промежуточные соединения и отображен на следующих СХЕМАХ 1-4, соответственно, где каждый способ, отображенный на соответствующих СХЕМАХ 1, 2, 3 или 3* представляет отдельный вариант осуществления настоящего изобретения.
СХЕМА 1
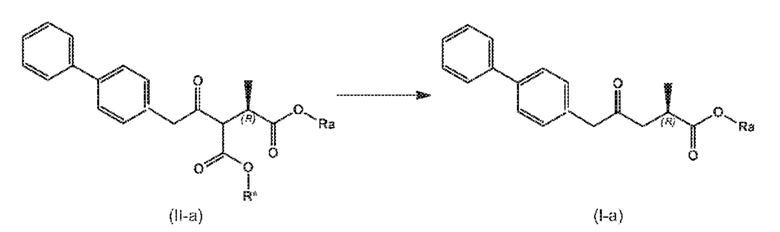
СХЕМА 1-a
СХЕМА 1 и СХЕМА 1-a отображают способ, включающий взаимодействие нового промежуточного соединения формулы (II), предпочтительно, соединения формулы (II-a), или его соли, где Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, в условиях - если требуется - реакции удаления защитной группы с условиями последующей реакции декарбоксилирования, и необязательно - если необходимо или желательно, например, если Ra отщепляется во время удаления защитной группы - посредством введения фрагмента Ra, выбранного из карбоксилзащитной группы и C1-C6-алкила, с предоставлением соединения формулы (I), предпочтительно формулы (I-a), или его соли, где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила. Если R* и Ra являются различными и Ra уже представляет собой C1-C6-алкил, особенно этил, тогда только R* (например, трет-бутил) может отщепляться селективно, в то же время при тех же условиях C1-C6-алкил, например, этил, остается связанным. Если желательно - и не раскрыто явным образом на СХЕМЕ 1 - это может происходить с последующим преобразованием соединения формулы (I), особенно (I-a) в соль, например, с использованием кислоты.
В одном варианте осуществления, соединение формулы (II) может быть получено согласно реакции, как отображено на следующих СХЕМАХ 2 и 2-a:

СХЕМА 2

СХЕМА 2-a
Как СХЕМА 2, так и СХЕМА 2-a, отображают способ, включающий взаимодействие соединения формулы (III) с производным пропионата формулы (IV), предпочтительно формулы (IV-a), где X представляет собой уходящую группу и Ra выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, с получением соединения формулы (II), предпочтительно формулы (II-a), где Ra и R*, независимо друг от друга, выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила.
Если желательно - и не раскрыто явным образом на СХЕМЕ 2 - этот способ может включать замену карбоксилзащитных групп R* и Ra на группу, выбранную из водорода и C1-C6-алкила, с предоставлением соединения формулы (II).
В одном варианте осуществления, соединение формулы (III) может быть получено согласно реакции, как отображено на следующей СХЕМЕ 3:
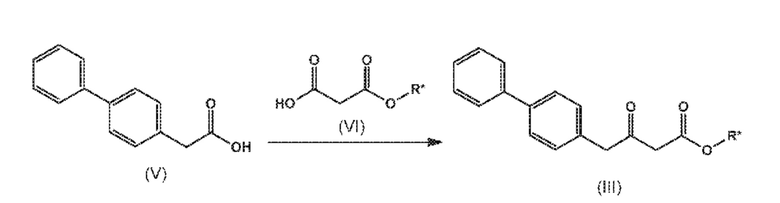
СХЕМА 3
СХЕМА 3 отображает способ, включающий взаимодействие соединения формулы (V), или его реакционноспособного производного с солью однозамещенного сложного эфира малоновой кислоты формулы (VI), где R* выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, с получением соединения формулы (III).
В качестве альтернативы способу, отображенному на приведенных выше СХЕМАХ 1-3, новое соединение формулы (I), в частности, соединение формулы (I-a), или его соль, также может быть получено способом, отображенным на следующей СХЕМЕ 3* или 3*-a, который также представляет отдельный вариант осуществления настоящего изобретения.
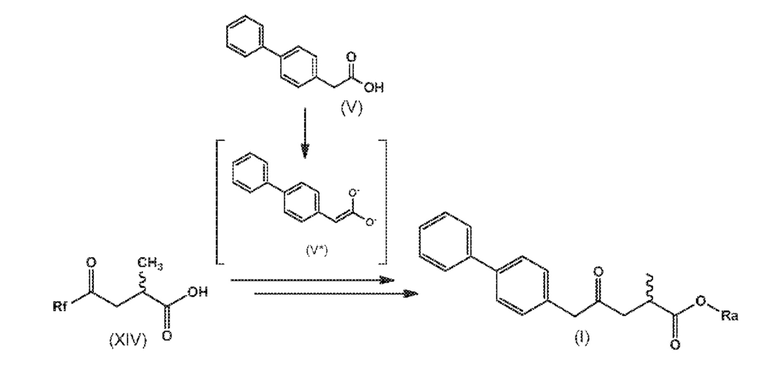
СХЕМА 3*

СХЕМА 3*-a
СХЕМА 3* и СХЕМА 3*-a отображают способ, включающий взаимодействие промежуточного соединения формулы (XIV), предпочтительно, соединения формулы (XIV-a) или его соли, где Rf выбирают из группы -O-R* где R* выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно, метила; -N(CH3)-O(CH3), морфолинила и имидазолинила, с полученным in situ активированным дианионным производным соединения формулы (V) или его солью, а именно соединением формулы (V*), в присутствии основания, и с последующей реакцией декарбоксилирования, с получением соединения формулы (I), или его соли, где Ra представляет собой водород. Такое соединение формулы XIV является известным в данной области техники. Если необходимо или желательно, полученное соединение формулы (I) или его соль, где Ra представляет собой водород, может взаимодействовать с агентом, вводящим карбоксилзащитную группу, с предоставлением соединения формулы (I), где Ra представляет собой карбоксилзащитную группу, или
полученное соединение формулы (I) или его соль, где Ra представляет собой водород, взаимодействует с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (I), где Ra представляет собой C1-C6-алкил, предпочтительно этил.
В одном варианте осуществления, соединение формулы (V), используемое в качестве исходного соединения на СХЕМАХ 3 и 3*, может быть получено согласно реакции, как отображено на следующей СХЕМЕ 4:
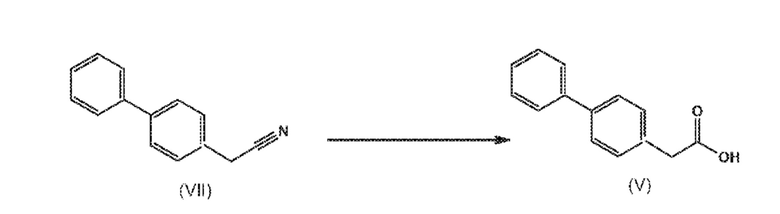
СХЕМА 4
СХЕМА 4 отображает способ, включающий гидролиз цианидного соединения формулы (VII) с получением соединения формулы (V).
В предпочтительном варианте осуществления, реакции, отображенные на СХЕМАХ 1-4 выше, выполняют последовательно, как одну стадию после другой:
СХЕМА 4 → СХЕМА 3 → СХЕМА 2 → СХЕМА 1 или
СХЕМА 4 → СХЕМА 3*.
В другом варианте осуществления, последовательность реакций начинается со СХЕМЫ 3:
СХЕМА 3 → СХЕМА 2 → СХЕМА 1.
В другом варианте осуществления, последовательность реакций начинается со СХЕМЫ 2:
СХЕМА 2 → СХЕМА 1.
В третьем аспекте, настоящее изобретение предоставляет новый способ получения соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa) или его соли, как отображено ниже и как определено в описании настоящего изобретения, посредством различных реакций, все из которых начинаются с нового соединения формулы (I), в частности, соединения формулы (I-a), или его соли, как определено в описании настоящего изобретения. Общая схема реакций отображена на следующих СХЕМАХ 5, 5-a и 5-aa:
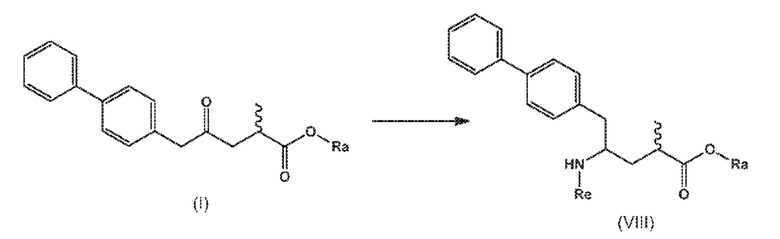
СХЕМА 5
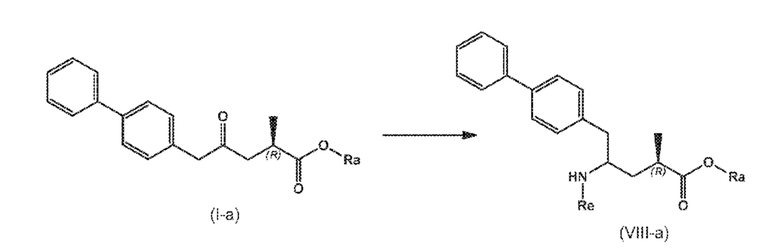
СХЕМА 5-a
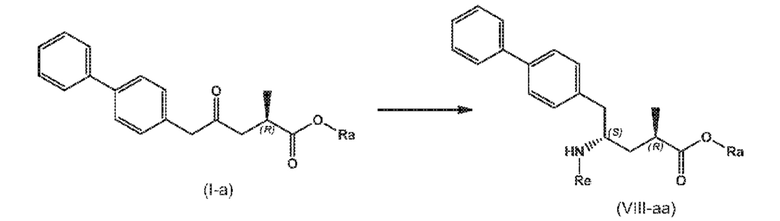
СХЕМА 5-aa
Эта реакция может быть достигнута посредством различных реакций, отображенных на следующих СХЕМАХ 6-10, соответственно, где способ, отображенный на каждой СХЕМЕ 5, 6, 7, 8, 9 и 10 представляет отдельный, альтернативный вариант осуществления настоящего изобретения.
В одном варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции («Реакция с аммиаком, первичным или вторичным амином или их солями»), как отображено на СХЕМАХ 5, 5-A и 5-aa выше (следовательно, не показанной отдельно).
В этом варианте осуществления, СХЕМЫ 5, 5-A и 5-aa отображают способ, включающий взаимодействие нового промежуточного соединения формулы (I), предпочтительно, соединения формулы (I-a), или его соли, где Ra представляет собой водород, с аммиаком, первичным или вторичным амином или их солями, и необязательное отщепление любых нежелательных заместителей амина, с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно соединения формулы (VIII-aa) или его соли, где Ra и Re представляют водород, или если первичный амин имеет формулу NH2-Re, причем Re является азотзащитной группой, с предоставлением соединения формулы (VIII), в частности, формулы (VIII-a), более предпочтительно формулы (VIII-aa), или его соли, где Ra представляет собой водород и Re представляет собой азотзащитную группу, и
необязательное взаимодействие полученного соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra и Re представляют собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), где Ra представляет собой водород, и Re представляет сбой азотзащитную группу, и/или
необязательное последующее взаимодействие необязательного аминозащищенного аналога соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 5, 5-a или 5-aa, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, отображенные на СХЕМАХ 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В одном варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции, как отображено на следующих СХЕМАХ 6, 6-1, 6-A и 6-aa («Реакция с использованием трансаминазы»):
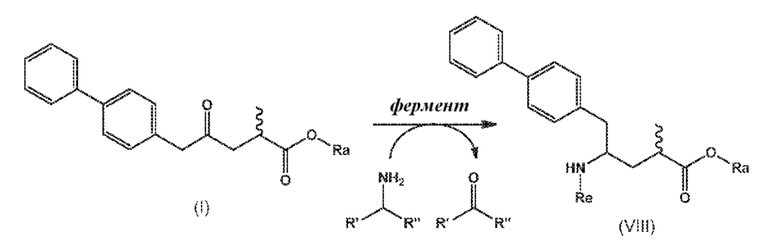
СХЕМА 6
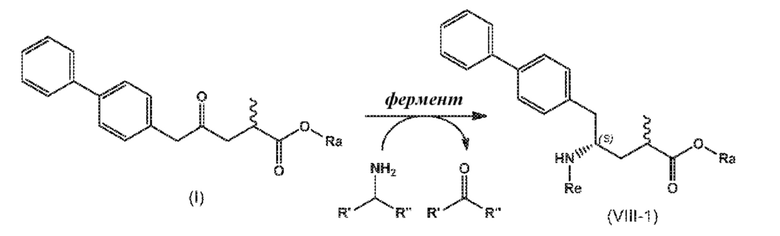
СХЕМА 6-1
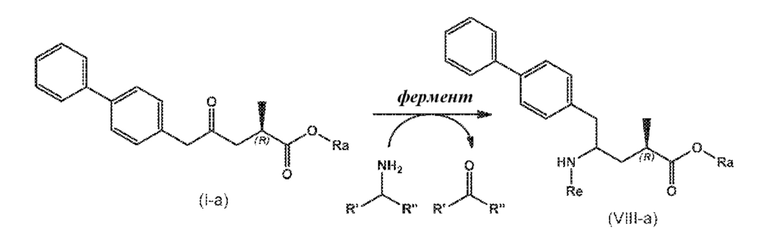
СХЕМА 6-a
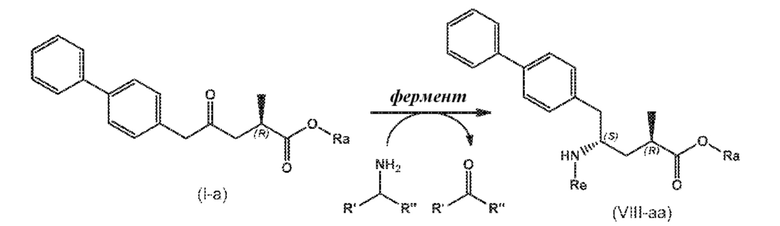
СХЕМА 6-aa
СХЕМЫ 6, 6-1, 6-A и 6-aa («Реакция с использованием трансаминазы») отображает способ, включающий преобразование нового промежуточного соединения формулы (I) или соединения формулы (I-a), или его соли, где Ra выбирают из водорода и C1-C6-алкила, предпочтительно водорода, в соединение формулы (VIII), предпочтительно, соединение формулы (VIII-1), или соединение формулы (VIII-a), более предпочтительно соединение формулы (VIII-aa), где Ra выбирают из водорода и C1-C6-алкила, предпочтительно, водорода, и Re представляет собой водород, или его соль, посредством приведения его в контакт с (S)-селективной ω-трансаминазой в присутствии донора амина общей формулы R'R''CH-NH2 и кофермента, где степень конверсии соединения формулы (I) в соединение формулы (VIII), предпочтительно, соединение формулы (VIII-1), в частности, степень конверсии соединения формулы (I-a) в соединение формулы (VIII-a), предпочтительно, соединение формулы (VIII-aa), составляет более 50%.
Эта реакция необязательно сопровождается последующим взаимодействием полученного соединения формулы (VIII), в частности, соединения формулы (VIII-a), или формулы (VIII-a), предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra и Re представляют собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-1), или соединения формулы (VIII-a), предпочтительно формулы (VIII-aa), где Ra представляет собой водород, и Re представляет собой азотзащитную группу.
В последующем или альтернативно, необязательный аминозащищенный аналог соединения формулы (VIII), в частности, соединения формулы (VIII-1), или соединения формулы (VIII-a), предпочтительно соединения формулы (VIII-aa), где Ra представляет собой водород, необязательно взаимодействует с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-1), или соединения формулы (VIII-a), предпочтительно соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 6, 6-1, 6-a или 6-aa, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, как отображено на СХЕМАХ 2, 2-3, или 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В одном варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции, как отображено на следующих СХЕМАХ 7, 7-a и 7-aa («реакция через новое сульфинимидное соединение формулы (X)»):

СХЕМА 7
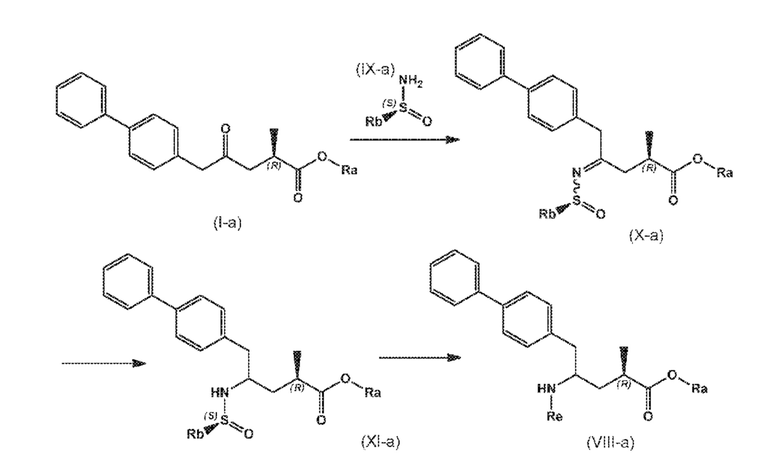
СХЕМА 7-a

СХЕМА 7-aa
СХЕМЫ 7, 7-A и 7-aa отображает способ, включающий взаимодействие нового промежуточного соединения формулы (I), предпочтительно, соединения формулы (I-a), или его соли, где Ra выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, с аминосульфинильным соединением формулы (IX), особенно, соединением формулы (IX-a), или его солью, где Rb выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила и C1-C7-алкокси, галоген-C1-C7-алкокси и C1-C7-алкокси-C1-C7-алкила, с получением сульфинимидного соединения формулы (X), предпочтительно, соединения формулы (X-a), или его соли, где Rb выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила, и Ra выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, затем восстановление полученного соединения формулы (X), предпочтительно формулы (X-a), или его соли, в присутствии восстановителя с получением сульфинамидного соединения формулы (XI), предпочтительно, соединения формулы (XI-a), более предпочтительно, соединения формулы (XI-aa) или его соли, где Rb выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила, и Ra выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила,
затем взаимодействие полученного сульфинамидного соединения формулы (XI), предпочтительно, соединения формулы (XI-a), более предпочтительно, соединения формулы (XI-aa), или его соли, посредством гидролиза сульфонамидной группы в присутствии кислоты с предоставлением соединения формулы (VIII), в частности, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и Re представляет собой водород, и
необязательное удаление карбоксилзащитной группы из полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой водород и Re представляет собой водород, и/или
необязательное взаимодействие полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой водород, и Re представляют собой азотзащитную группу,
необязательное последующее взаимодействие необязательного аминозащищенного аналога соединения формулы (VIII) предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 7, 7-a или 7-aa, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, как отображено на СХЕМАХ 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В другом варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции, как отображено на следующих СХЕМАХ 8, 8-a и 8-aa («реакция с гидроксиламином через новые соединения формулы (XVII) и формулы (XVIII)»):

СХЕМА 8
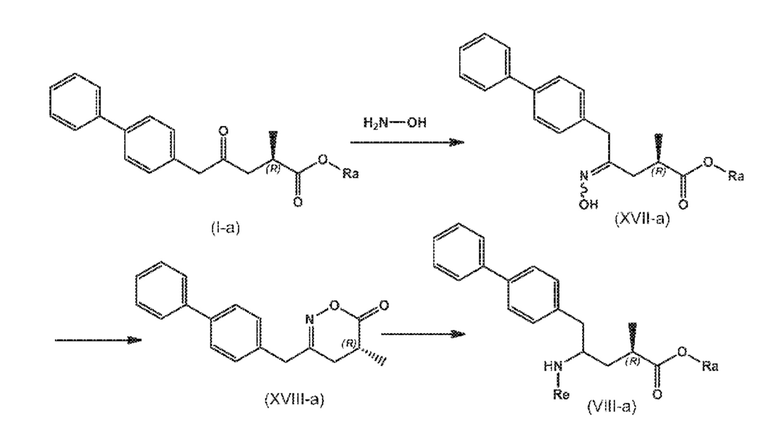
СХЕМА 8-A
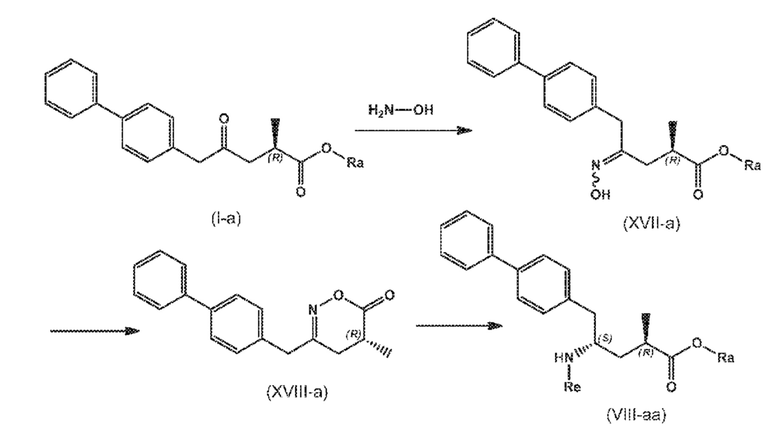
СХЕМА 8-AA
СХЕМЫ 8, 8-A и 8-AA отображают способ, включающий взаимодействие нового промежуточного соединения формулы (I), предпочтительно, соединения формулы (I-a), или его соли, где Ra представляет собой водород, с гидроксиламином или его солью, с предоставлением соединения формулы (XVII), предпочтительно, соединения формулы (XVII-a), или его соли, где Ra представляет собой водород,
последующую циклизацию полученного соединения формулы (XVII), предпочтительно, соединения формулы (XVII-a), или его соли, с получением соответствующего соединения формулы (XVIII), предпочтительно, соединения формулы (XVIII-a), или его соли,
затем восстановление полученного соединения формулы (XVIII), предпочтительно, соединения формулы (XVIII-a), или его соли, в присутствии восстановителя, с получением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra и Re оба представляют собой водород, и
необязательное взаимодействие полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra и Re представляют собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соль, где Ra представляет собой водород, и Re является азотзащитной группой,
необязательное последующее взаимодействие аминозащищенного аналога соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно, этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 8, 8-A или 8-AA, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, как отображено на СХЕМАХ 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В другом варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции, как отображено на следующих СХЕМАХ 9, 9-a и 9-aa («реакция с аммиаком или аммонием через новые соединения формулы (XIX) и (XX)»:
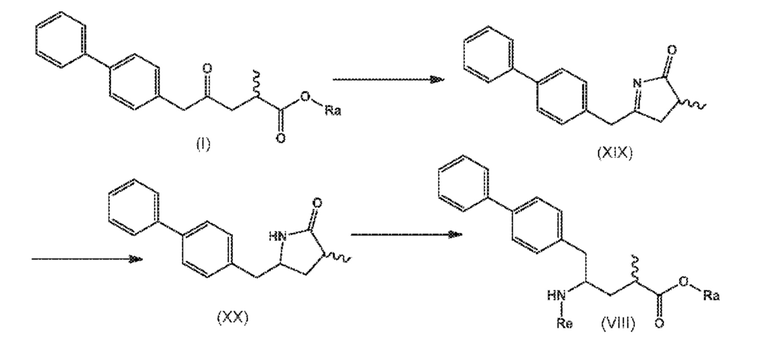
СХЕМА 9
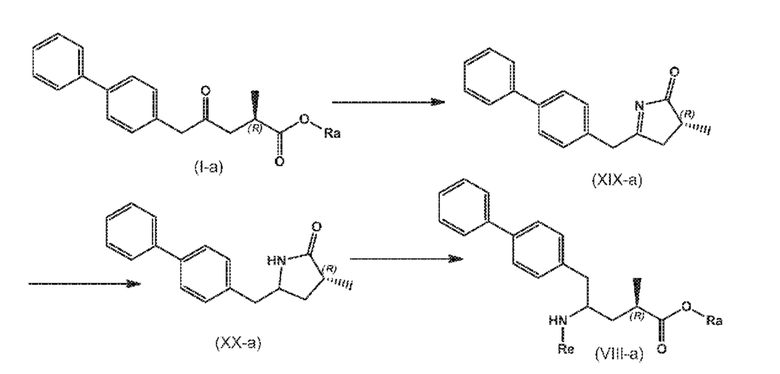
СХЕМА 9-a
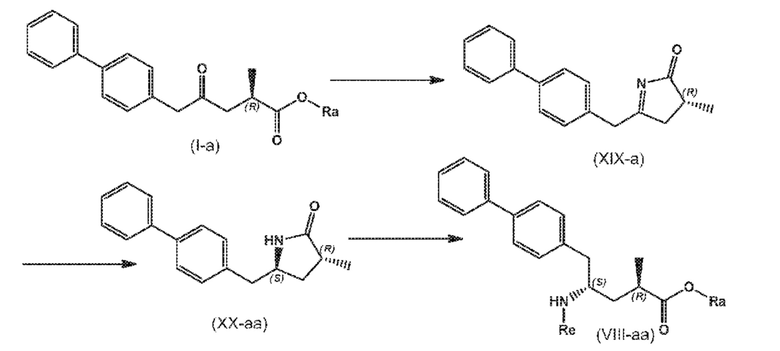
СХЕМА 9-aa
СХЕМЫ 9, 9-A и 9-AA отображают способ, включающий взаимодействие нового промежуточного соединения формулы (I), предпочтительно, соединения формулы (I-a), или его соли, где Ra представляет собой водород, с аммиаком или солью аммония, получая на выходе соединение формулы (XIX), предпочтительно, соединение формулы (XIX-a), или его соль,
восстановление полученного соединения формулы (XIX), особенно, соединения формулы (XIX-a), с использованием восстановителя, с получением лактамного соединения формулы (XX), предпочтительно, соединения формулы (XX-a), более предпочтительно, соединения формулы (XX-aa), или его соли, и
взаимодействие полученного соединения формулы (XX) в условиях реакции с раскрытием цикла, необязательно в присутствии C1-C7-спирта, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra выбирают из водорода и C1-C6-алкила, предпочтительно этила, и Re представляет собой водород,
необязательное взаимодействие полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra и Re представляют собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), где Ra представляет собой водород, и Re является азотзащитной группой,
необязательное последующее взаимодействие аминозащищенного аналога соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 9, 9-A или 9-AA, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, как отображено на СХЕМАХ 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В одном варианте осуществления, новое соединение формулы (I) может быть преобразовано в соединение формулы (VIII) согласно реакции, как отображено на следующих СХЕМАХ 10, 10-a и 10-aa («реакция с О-замещенным гидроксиламином через новые соединения формулы (XVII***), особенно, соединения формулы (XVII*) и соединения формулы (XVII**)»):
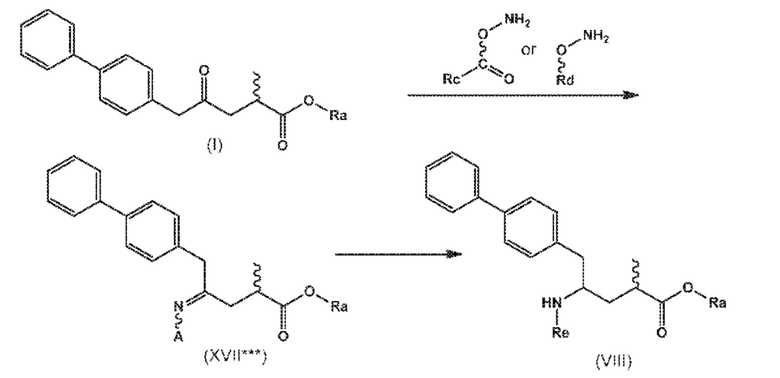
СХЕМА 10
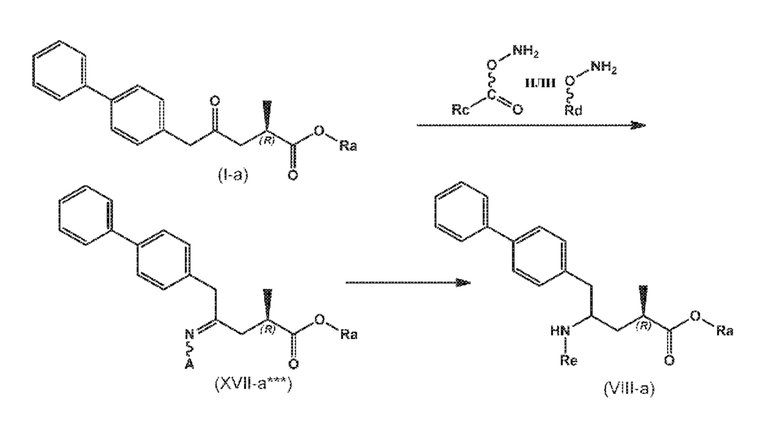
СХЕМА 10-a
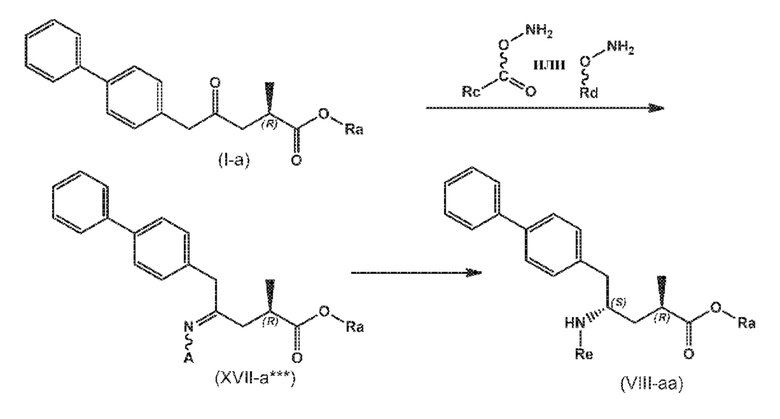
СХЕМА 10-aa
СХЕМЫ 10, 10-A и 10-AA отображают способ, включающий взаимодействие нового промежуточного соединения формулы (I), предпочтительно, соединения формулы (I-a), или его соли, где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, с O-замещенным гидроксиламином, выбранным из
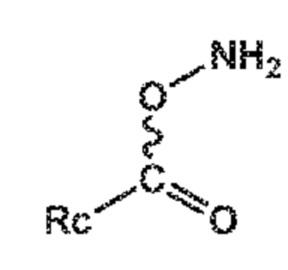 и
и 
или в каждом случае, его солью,, где Rc и Rd независимо выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила,
с предоставлением соединения формулы (XVII***), предпочтительно формулы (XVII***-a), или его соли, где Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила, и A представляет собой -O-C(=O)-Rc или -O-Rd, где Rc и Rd независимо выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила,
восстановление полученного соединения формулы (XVII***), предпочтительно, соединения формулы (XVII***-a), или его соли с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra выбирают из водорода, карбоксилзащитной группы и C1-C6-алкила, предпочтительно этила, и Re представляет собой водород, и
необязательное удаление любой карбоксилзащитной группы из полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли и/или
необязательное взаимодействие полученного соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой водород, и Re является азотзащитной группой,
необязательное последующее взаимодействие аминозащищенного аналога соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (VIII), предпочтительно, соединения формулы (VIII-a), более предпочтительно, соединения формулы (VIII-aa), или его соли, где Ra представляет собой C1-C6-алкил, предпочтительно, этил, и Re представляет собой водород или азотзащитную группу.
В одном варианте осуществления СХЕМЫ 9, 9-A или 9-AA, соединение формулы (I) получают способом, отображенным на СХЕМЕ 1, необязательно включающим стадии реакции, отображенные на СХЕМАХ 2-4, или способом, отображенным на СХЕМЕ 3*, необязательно включающим стадии реакции, отображенные на СХЕМЕ 4.
В дополнительном варианте осуществления, способ, отображенный на СХЕМАХ 5-10, продолжают посредством превращения полученного соединения формулы (VIII) или его соли
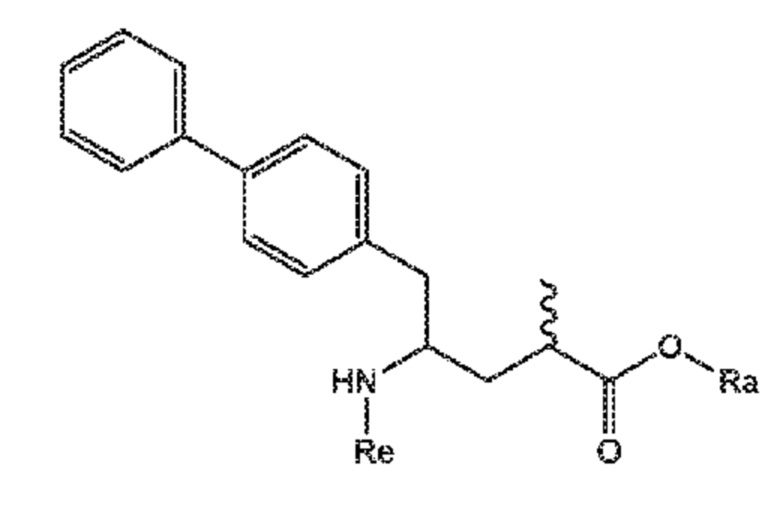 (VIII)
(VIII)
предпочтительно, соединения формулы (VIII-a), или его соли
 (VIII-a)
(VIII-a)
более предпочтительно, соединения формулы (VIII-aa), или его соли
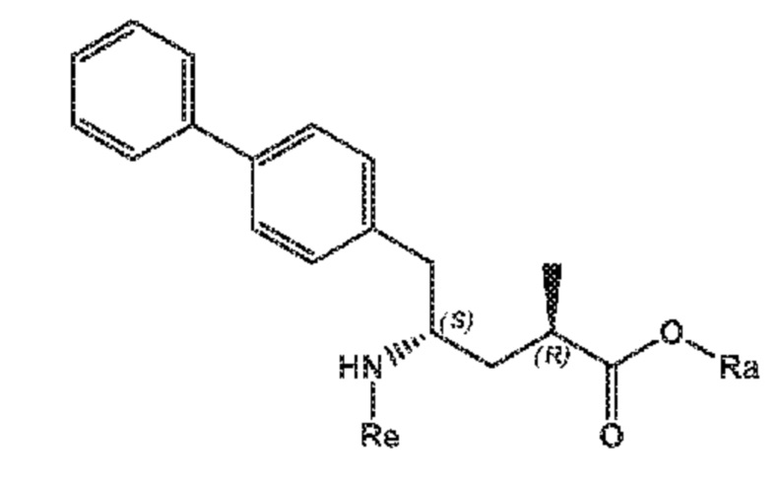 (VIII-aa)
(VIII-aa)
где Ra выбирают из водорода и C1-C6-алкила, предпочтительно, этила, и Re выбирают из водорода и азотзащитной группы,
в соединение формулы (10)
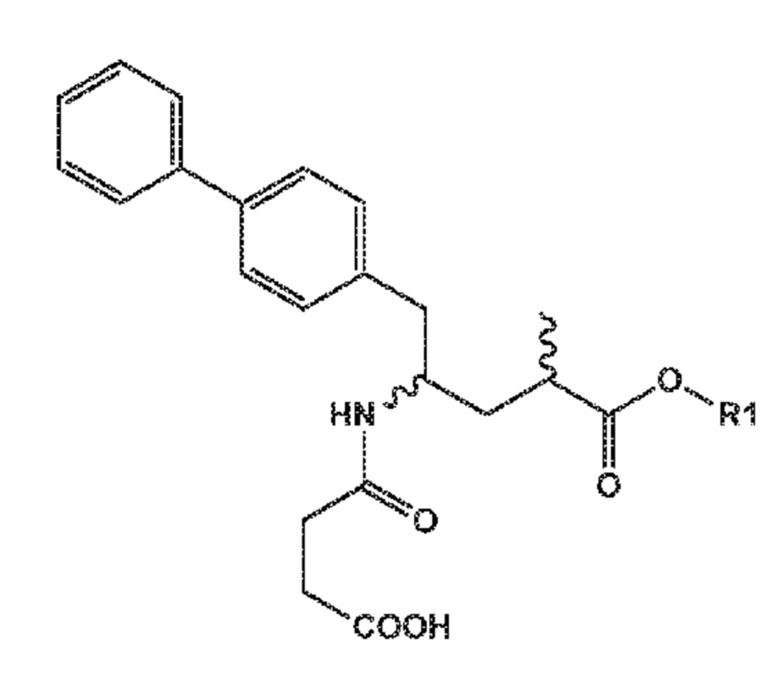 (10)
(10)
предпочтительно, соединение формулы (10-a)
 (10-a),
(10-a),
где R1 представляет собой водород или C1-C6-алкил, предпочтительно, этил, в частности, в соединение N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановую кислоту или ее соль, или этиловый сложный эфир N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты или его соль, посредством
необязательного удаления - если присутствует - любой азотзащитной группы Re,
необязательного взаимодействия полученного соединения формулы (VIII), где Ra и Re представляют собой водород, с реагентом для реакции сочетания в присутствии C1-C6-алканола, предпочтительно, этанола, с предоставлением соединения формулы (VIII), где Ra выбирают из C1-C6-алкила, предпочтительно этила, и Re представляет собой водород, и
взаимодействие соединения формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, предпочтительно, этила, и Re представляет собой водород, с ангидридом янтарной кислоты.
В четвертом аспекте, настоящее изобретение предоставляет применение нового соединения формулы (XV), в частности, соединения формулы (I) или (II), нового соединения формулы (XVI), в частности, соединения формулы (X), (XVII), (XVII*), (XVII**), (XVIII), и (IX), или его предпочтительного стереоизомера, как отображено выше, при получении соединения формулы (10)
 (10)
(10)
предпочтительно, соединения формулы (10-a)
 (10-a),
(10-a),
где R1 представляет собой водород или C1-C6-алкил, предпочтительно этил,
предпочтительно, при получении N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты или ее солей, или этилового сложного эфира N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты (известного в данной области как AHU377 или сакубитрил) или его солей.
В дополнительных вариантах осуществления, настоящее изобретение относится к любому одному или более новым соединениям, способам и применениям, как представлено в формуле изобретения, которая включена в описание настоящего изобретения посредством ссылки.
Настоящее изобретение также относится к любой последовательной комбинации стадий способа, описанной выше и ниже.
В его вышеуказанных аспектах, которые также более подробно приведены ниже, настоящее изобретение предоставляет следующие преимущества: путь синтеза является подходящим для производства в промышленном масштабе. Путь синтеза является благоприятным с точки зрения затрат и охраны окружающей среды. Соединения формулы (I) и (XVI), которые являются промежуточными соединениями, желательными для синтеза сакубитрила, могут быть получены с высоким выходом и высокой стереоселективностью.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Общие термины:
Общие определения, используемые выше и ниже, если не определены другим образом, имеют следующие значения, где замена одного или более или всех выражений или символов на более конкретные определения, может быть проведена независимо для каждого варианта осуществления настоящего изобретения и приводит к более предпочтительным вариантам осуществления.
Там, где применяют множественную форму для соединений, исходных веществ, промежуточных соединений, солей, фармацевтических препаратов, заболеваний, расстройств и т.п., подразумевается, что она означает одно (предпочтительное) или более одиночных соединений, солей, фармацевтических препаратов, заболеваний, расстройств и т.п., там, где применяют форму единственного числа или неопределенный артикль («a», «an»), не подразумевают исключение множественной формы, но лишь предпочтительно означает «одно».
Хиральные соединения
Термин "хиральный" относится к молекулам, которые обладают свойством отсутствия наложения на их партнера по зеркальному отражению, в то время как термин "ахиральный" относится к молекулам, которые могут накладываться на их партнера по зеркальному отражению.
В формулах настоящей заявки термин "  " на C-sp3 представляет ковалентную связь, где стереохимия связи не определена. Это означает, что термин "
" на C-sp3 представляет ковалентную связь, где стереохимия связи не определена. Это означает, что термин "  " на C-sp3 включает (S) конфигурацию, а также (R) конфигурацию соответствующего хирального центра. Кроме того, смеси, например, смеси энантиомеров, такие как рацематы, также охватываюися настоящим изобретением. Особенно предпочтительными являются одиночные стереоизомеры соединений формулы (1) или (2), особенно конкретные стереоизомеры соединений формулы (1-a) и (1-b).
" на C-sp3 включает (S) конфигурацию, а также (R) конфигурацию соответствующего хирального центра. Кроме того, смеси, например, смеси энантиомеров, такие как рацематы, также охватываюися настоящим изобретением. Особенно предпочтительными являются одиночные стереоизомеры соединений формулы (1) или (2), особенно конкретные стереоизомеры соединений формулы (1-a) и (1-b).
В формулах настоящей заявки термин " " на C-sp2 представляет ковалентную связь, где стереохимия или геометрия связи не определена. Это означает, что термин "
" на C-sp2 представляет ковалентную связь, где стереохимия или геометрия связи не определена. Это означает, что термин " " на C-sp2 включает (Z) конфигурацию, а также (E) конфигурацию соответствующей двойной связи. Кроме того, смеси, например, смеси изомеров по двойным связям, также охватываются настоящим изобретением.
" на C-sp2 включает (Z) конфигурацию, а также (E) конфигурацию соответствующей двойной связи. Кроме того, смеси, например, смеси изомеров по двойным связям, также охватываются настоящим изобретением.
В формулах настоящей заявки термин " " на C-sp3 указывает на абсолютную стереохимию, либо (R) или (S).
" на C-sp3 указывает на абсолютную стереохимию, либо (R) или (S).
В формулах настоящей заявки термин " " на C-sp3 указывает на абсолютную стереохимию, либо (R) или (S).
" на C-sp3 указывает на абсолютную стереохимию, либо (R) или (S).
В формулах настоящей заявки, термин ʺ  ʺ указывает на C-sp3-C-sp3 связь или C-sp2-C-sp2 связь.
ʺ указывает на C-sp3-C-sp3 связь или C-sp2-C-sp2 связь.
Соединения согласно настоящему изобретению могут обладать одним или несколькими асимметрическими центрами. Предпочтительные абсолютные конфигурации являются такими, как конкретно указано в описании настоящего изобретения. Однако, любые возможные чистые энантиомер, чистый диастереоизомер, или их смеси, например, смеси энантиомеров, такие как рацематы, охватываются настоящим изобретением.
Соединения со стереогенным центром, но без указания конкретной конфигурации рассматриваются как смеси соединений с соответствующими конфигурациями, например, R,R; R,S; S,R и SS, или чистые энантиомеры/диастереомеры.
Стереоизомерная, особенно, энантиомерная чистота, там, где она упоминается, относится ко всем диастереомерам соединения, взятым вместе (100%). Ее определяют посредством хиральной хроматографии (примеры включают ВЭЖХ, СДЖХ и ГХ) или ЯМР (с добпалением хиральных элементов и/или металлов). Конкретные примеры методов включают: хиральную ВЭЖХ, оборудованную хиральной колонкой Chiralpak ВД 4,6 мм × 250 мм, 5 мкм (Daicel Corporation, Osaka, Japan) при 25°C; подвижная фаза Гепт:EtOAc:CH3CN, 90:8:2.
Термин "по существу оптически чистое" соединение, как определено в описании настоящего изобретения, относится к соединению, полученное способом согласно изобретению, где соединение имеет оптическую чистоту, равную по меньшей мере 70% (ee=энантиомерный избыток), более предпочтительно по меньшей мере 90% (ee) и, наиболее предпочтительно, по меньшей мере 95% (ee) или более, такую как 100% (ee). Значение оптической чистоты приводится в % избытка одного энантиомера по сравнению с другим энантиомером. Таким образом, оптическая чисота в % является частное различия между концентрациями (R) и (S) энантиомеров и суммы концентраций обоих энантиомеров (оптическая чистота A в %=([A]-[B]): ([A]+[B]) × 100, где A и B представляют концентрации (R) и (S) энантиомеров или наоборот).
Пролекарства
Термин "пролекарство", как используют в описании настоящего изобретения, представляет, в частности, соединения которые превращаются in vivo в родительское соединение, например, посредство гидролиза в крови, например, как описано в T. Higuchi и V. Stella, «Пролекарства as Novel Delivery Systems», volume 14 of ACS Symposium Series; Edward B. Roche, editor, ʺBioreversible Carriers in Drug Designʺ, American Pharmaceutical Association и Pergamon Press, 1987; H Bundgaard, editor, ʺDesign of Prodrugsʺ, Elsevier, 1985; Judkins et al., Synthetic Communications 1996, 26, 4351-4367, и "Organic Chemistry of Drug Design и Drug Action", second edition, R. B. Silverman (particularly chapter 8, pages 497-557), Elsevier Academic Press, 2004.
Пролекарства, следовательно, включают лекарственные средства, имеющие функциональную группу, которая превратилась в ее обратимое производное. Обычно, такие пролекарства превращаются в активное лекарственное средство посредством гидролиза. В качестве примеров могут быть приведены следующие:
Пролекарства также включают соединения, превращаемые в активное лекарственное средство посредством оксислительной или восстановительной реакции. В качестве примеров можно привести:
Окислительная активация
- N- и O-деалкилирование
- Окислительное деаминирование
- N-окисление
- Эпоксидирование
Восстановительная активация
- Восстановление азо-группы
- Восстановление сульфоксида
- Восстановление дисульфида
- Биовосстановительное алкилирование
- Восстановление нитро-группы
Ингибитор NEP
Термин "Ингибитор NEP" описывает соединение, которое ингибирует активность фермента нейтральной эндопептидазы (NEP, EC 3.4.24.11).
В настоящем изобретении термины "NEP-ингибитор" или "пролекарство NEP-ингибитора" относится к самим веществам или к их солям, предпочтительно, их фармацевтически приемлемым солям. Примерами являются соли натрия, калия, магния, кальция или аммония. Соли кальция являются предпочтительными
Пролекарство ингибитора NEP, этиловый сложный эфир N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты необязательно может дополнительно взаимодействовать с получением активного ингибитора NEP N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты, либо in vitro или in vivo.
Трансаминаза:
В контексте настоящего изобретения, трансаминаза представляет собой пиридоксаль-фосфат-зависимый фермент, катализирующий перенос аминогруппы (NH2) от первичного амина к карбонильной группы (C=O) акцепторной молекулы. Трансаминазы классифицируют по E.C. 2.6.1.X. В особенно предпочтительном варианте осуществления согласно настоящему изобретению, трансаминаза представляет собой (R)- или (S)-селективную трансаминазу, конкретно, в предпочтительном варианте осуществления, ω-трансаминазу, в частности, (S)-селективную ω-трансаминазу.
В контексте настоящего изобретения ω-трансаминаза представляет собой фермент, предпочтительно, с классификационным кодом E.C.2.6.1.18. Эти аминотрансаминазы отличаются тем, что они, в-основном, используют амины в качестве субстратов. Эти ферменты дополнительно характеризуются проявлением константы равновесия реакций, катализируемых ω-трансаминазой, которая превышает 1.
В настоящем изобретении под термином трансаминаза также понимают, в частности, ω-трансаминазу, экстракт организма, такого как микроорганизм или клетка, содержащие трансаминазу, в частности, ω-трансаминазу, или живую или мертвую клетку или сам микроорганизм, содержащий трансаминазу, в частности, ω-трансаминазу. Такие микроорганизм или клетка или экстракт или трансаминазный фермент могут применяться в иммобилизованной или неиммобилизованной форме.
Трансаминаза, в частности ω-трансаминаза, может также являться рекомбинантно продуцируемой природной (дикого типа) или генетически модифицированной трансаминазой, в частности, ω-трансаминазой, которая кодируется частично или полностью последовательностью нуклеиновой кислоты или ее производной последовательностью, содержащейся в одном из идентифицированных выше организмов или являющейся ее эквивалентом.
Недавно представленная общая схема ω-трансаминаз, которые могут применяться и/или быть оптимизированы для применения согласно настоящему изобретению, описана, например, в Koszelewski et al. (2010) Trends in Biotechnology, 28(6):324-332, и Malik at al (2012) Appl Microbiol Biotechnol.; 94(5):1163-71. Такие трансаминазы могут быть получены, например, из таких микрорганизмов, как Chromobacterium violaceum, Vibrio fluvialis, Alcaligenes denitrificans, Klebsiella pneumoniae, и Bacillus thuringiensis и другие.
В одном варианте осуществления, ω-трансаминазы, применяемые в настоящем изобретении, были получены от Codexis Inc. с ссылочными номерами ATA-217 (часть набора для скрининга Codex® ATA), а также дополнительно генетически модифицированные варианты ω-трансаминаз (также полученные от Codexis Inc.). Такие генетически модифицированные ω-трансаминазы описаны, например, в патенте США № 8,470,564.
Кофермент
Для трансаминаз требуется кофермент Пиридоксаль-5'-фосфат (PLP). «Пиридоксаль-фосфат», «PLP», «пиридоксаль-5'-фосфат», «PYP» и «P5P» в описании настоящего изобретения используют взаимозаменяемо в отношении соединения, которое действует в качестве кофермента в реакциях с участием трансаминазы.
В нескольких вариантах осуществления, пиридоксальфосфат определяется структурой 1-(4'-формил-3'-гидрокси-2'-метил-5'-пиридил)метоксифосфоновой кислоты, номер CAS [54-47-7], Пиридоксаль-5'-фосфат может быть получен in vivo фосфорилированием и окислением пиридоксола (также известного как Витамин B6). В реакциях трансаминирования с использованием трансаминазных ферментов, аминогруппа донора амина переносится к коферменту с получением кето-побочного продукта, в то время как пиридоксаль-5'-фосфат преобразуется в пиридоксаминфосфат. Пиридоксаль-5'-фосфат регенерируется посредством реакции с различными кето-соединениями (акцепторами аминогруппы). Перенос аминогруппы от пиридоксаминфосфата к акцептору аминогруппы продуцирует хиральный амин и регенерирует кофермент.
В нескольких вариантах осуществления, пиридоксаль-5'-фосфат может быть заменен другими членами семейства витамина B6, включающими пиридоксин (PN), пиридоксаль (PL), пиридоксамин (PM), и их фосфорилированные аналогом; пиридоксинфосфат (PNP), и пиридоксаминфосфат (PMP).
Донор амина
В контексте настоящего изобретения донор амина представляет собой молекулу, способную к предоставлению аминогруппы к акцептору амина, с использованием трансаминазы, в частности, ω-трансаминазы. В особенно предпочтительном варианте осуществления донором амина является амин или аминокислота.
В нескольких вариантах осуществления, доноры аминогруппы представляют собой молекулы следующей общей формулы,
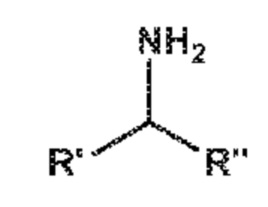
в которой каждый из R' и R'', когда их берут независимо, представляет собой алкил, циклоалкил, гетероциклоалкил, арил, или гетероарил, который является незамещенным или замещенным одной или более ферментативно неингибирующими группами. R' может являться одинаковым с R'' или отличающимся от R'' по структуре или хиральности. В нескольких вариантах осуществления, R' и R'', взятые вместе, могут образовывать кольцо, которое является незамещенным, замещенным или конденсированным с другими кольцами. Типичные доноры аминогруппы, которые могут применяться, включают хиральные и ахиральные аминокислоты, и хиральные и ахиральные амины. Доноры аминогруппы, которые могут применяться, включают, посредством примера, а не ограничения, изопропиламин (2-аминопропан), β-аланин, аланин, в частности, D,L-аланин, L-аланин или D-аланин, α-метилбензиламин (α-MBA), глутамат, фенилаланин, глицин, 3-аминобутират, 2-аминобутан, γ-аминобутират и соль, например, хлорид, любого одного из них. В предпочтительном варианте осуществления, изопропиламин (2-аминопропан) представляет собой донор амина.
В таком варианте осуществления, полученный кетоновый продукт будет представлять собой ацетон, фенилпировиноградную кислоту, ее соль, пировиноградную кислоту, ее соль, глиоксиловую кислоту, ее соль, ацетофенон, 2-кетоглутарат, 3-оксобутират, 2-бутанон, 3-оксопирролидин (3-OP), 3-пиридилметилкетон (3-PMK), этиловый сложный эфир 3-оксомасляной кислоты (3-OBEE), метиловый сложный эфир 3-оксопентановой кислоты (3-OPME), N-1-boc-3-оксопиперидинон и N-1-boc-3-оксопирролидин (B3OP) или соль, например, хлорид, любого одного из них. В предпочтительном варианте осуществления, полученный кетоновый продукт представляет собой ацетон.
Условия ферментативной реакции:
«Подходящие условия реакции» относится к тем условиям в растворе реакции, катализируемой трансаминазой (например, интервалам загрузки фермента, загрузки субстрата, загрузки кофактора, температуре, pH, буферам, сорастворителям и т.д.), при которых выбранная трансаминаза является способной к преобразованию субстратного соединения в соединение продукта (например, конверсии соединения формулы (I), предпочтительно (I-a), в соединение формулы (VIII), предпочтительно (VIII-a), в частности, (VIII-aa)). Иллюстративные «подходящие условия реакции» предоставлены в раскрытии настоящего изоретения и иллюстрируются Примерами.
«Загрузка», таким образом, как в сочетаниях «загрузка соединения» или «загрузка фермента» или «загрузка кофактора» относится к концентрации или количеству компонента в реакционной смеси в начале реакции.
«Субстрат» в контексте катализируемого трансаминазой процесса реакции относится к соединению или молекуле, на которые действует фермент. Например, иллюстративный субстрат для трансаминазы в способе, раскрытом в описании настоящего изобретения, представляет собой соединение (I).
«Продукт» в контексте катализируемого трансаминазой процесса реакции относится к соединению или молекуле, являющимися результатом действия фермента. Например, иллюстративный продукт для трансаминазы в способе, раскрытом в описании настоящего изобретения, представляет собой соединение (VIII).
В контексте настоящего изобретения, реакция трансаминазы является энантиоселективной, т.е. позволяет получить желательный энантиомер в количестве, превышающем количество нежелательного энантиомера (в контексте настоящего изобретения, термин энантиомер относится к конкретному стереогенному центру, где вводят группу амина; поскольку предпочтительный субстрат уже содержит стереогенный центр, на практике желательное соединение должно иметь диастереомерную чистоту). В нескольких вариантах осуществления, желательный энантиомер образуется с по меньшей мере 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более энантиомерном избытком (ee).
В настоящем изобретении является предпочтительным, чтобы акцептор аминогруппы превращался в желательное хиральное соединение амина при степени конверсии свыше 50%, или по меньшей мере 60, 70, 80, 90, 95, 99, в частности, 100%.
Определение заместителей
Алкил определяют, как радикал или часть радикала в виде прямой или разветвленной (один раз или, если желательно и возможно, много раз) углеродной цепи, и он представляет собой, в особенности C1-C7-алкил, предпочтительно C1-C6-алкил, более предпочтительно C1-C4-алкил.
Термины «C1-C7-», «C1-C6-» и «C1-C4-», соответственно, определяют фрагмент, содержащий до и включающий максимально 7, в особенности, содержащий до и включающий максимально 6 и 4 соответственно, атомов углерода, причем указанный фрагмент является разветвленным (один или более раз) или прямоцепным и связанным через концевой или неконцевой углерод.
Циклоалкил представляет собой, например, C3-C7-циклоалкило и представляет собой, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Циклопентил и циклогексил являются предпочтительными
Алкокси представляет собой, например, C1-C7-алкокси и представляет собой, например, метокси, этокси, n-пропилокси, изопропилокси, n-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси и также включает соответствующие радикалы пентилокси, гексилокси и гептилокси. C1-C4-алкокси является предпочтительным.
Алканоил представляет собой, например, C2-C8-алканоил и представляет собой, например, ацетил [-C(=O)Me], пропионил, бутирил, изобутирил или пивалоил. C2-C5-Алканоил является предпочтительным, в особенности, ацетил.
Гало или галоген представляет собой предпочтительно фтор, хлор, бром или йод, наиболее предпочтительно, хлор, бром, или йод.
Галогеналкил представляет собой, например, галоген-C1-C7-алкил и представляет собой, в частности, галоген-C1-C4-алкил, такой как трифторметил, 1,1,2-трифтор-2-хлорэтил или хлорметил. Предпочтительным галоген-C1-C7-алкилом является трифторметил.
Алкенил может представлять собой линейный или разветвленный алкил, содержащий двойную связь и включающий в себя, предпочтительно, от 2 до 12 атомов углерода, причем включающие в себя от 2 до 10 атомов углерода являются особенно предпочтительными. Особенно предпочтительным является линейный C2-C7-алкенил, более предпочтительно C2-C4-алкенил. Несколькими примерами алкильных групп являются этил и изомеры пропила, бутила, пентила, гексила, гептила, октила, нонила, децила, ундецила, додецила, тетрадецила, гексадецила, октадецила и эйкозила, каждый из которых содержит двойную связь. Особенно предпочтительным является аллил.
Алкилен представляет собой бивалентный радикал, производный от C1-7-алкила и, особенно, представляет собой C2-C7-алкилен или C2-C7-алкилен и, необязательно, может прерываться одним или более, например, до трех, атомами кислорода, NR14 или серы, где R14 представляет собой алкил, каждый из которых может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из, например, C1-C7-алкила, C1-C7-алкокси-C1-C7-алкила или C1-C7-алкокси.
Алкенилен представляет собой бивалентный радикал, производный от C2-7-алкенила и может прерываться одним или более, например, до трех, атомами кислорода, NR14 или серы, где R14 представляет собой алкил, и является незамещенным или замещенным одним или более, например, до трех, заместителями, предпочтительно независимо выбранными из заместителей указанных выше для алкилена.
Арил является радикалом или частью радикала и представляет собой, например C6-10-арил, и, предпочтительно, представляет собой моно- или полициклический, особенно, моноциклический, бициклический или трициклический арильный фрагмент с 6-10 атомами углерода, такой как фенил, нафтил или флуоренил, предпочтительно, фенил, и который может быть незамещенным или замещенным одним или более заместителями, независимо выбранными из, например, C1-C7-алкила, C1-C7-алкокси-C1-C7-алкила или C1-C7-алкокси.
Термин арилалкил относится к арил-C1-C7-алкилу, где арил является таким, как определено выше, и представляет собой, например, бензил.
Термин карбоксил относится к -CO2H.
Арилокси относится к арил-O- где арил является таким, как определено выше.
Незамещенный или замещенный гетероциклил представляет собой моно- или полициклическую, предпочтительно, моно-, би- или трициклическую, наиболее предпочтительно, моно-, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему, предпочтительно, с 3-14 (более предпочтительно, 5-14) кольцевыми атомами и с одним или более, предпочтительно от одного до четырех, гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и незамещенную или замещенную одним или более, например, до трех заместителей, предпочтительно, независимо выбранных из группы, состоящей из галогена, C1-C7-алкила, галоген-C1-C7-алкила, C1-C7-алкокси, галоген-C1-C7-алкокси, такого как трифторметокси и C1-C7-алкокси-C1-C7-алкокси. Когда гетероциклил является ароматической кольцевой системой, его также именуют гетероарил. Гетероциклил предпочтительно представляет собой имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиранил, диазинил, оксазинил, тиазинил, диоксинил, дитиинил, азепанил, оксепанил, тиепанил, индолил, изоиндолил, хинолинил, изохинолинил, бензазепинил, карбазолил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолинидил, тиазолидил, диоксоланил, дитиоланил, фуразанил, оксадиазолил, тиадиазолил, дитиазолил, тетразолил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксотиоморфолинил, диоксотиоморфолинил, диоксанил, дитианил, азепанил, оксепанил, тиепанил или их бензоконденсированные варианты.
В гетероциклилалкиле, гетероциклил предпочтительно является таким, как только что определено, и присоединен к алкилу, как определено для алкила. Примерами являются имидазолилметил, пиридилметил или пиперидинилметил.
Ацетил представляет собой -C(=O)C1-C7-алкил, предпочтительно -C(=O)Me.
Сульфонил представляет собой (незамещенный или замещенный) C1-C7-алкилсульфонил, такой как метилсульфонил, (незамещенный или замещенный) фенил- или нафтил-C1-C7-алкилсульфонил, такой как фенилметансульфонил, или (незамещенный или замещенный) фенил- или нафтилсульфонил; где если присутствуют более одного заместителя, например, от одного до трех заместителей, заместители выбирают независимо из циано, галогена, галоген-C1-C7-алкила, галоген-C1-C7-алкилокси- и C1-C7-алкилокси. Особенно предпочтительным является C1-C7-алкилсульфонил, такой как метилсульфонил, и (фенил- или нафтил)-C1-C7-алкилсульфонил, такой как фенилметансульфонил.
Сульфенил представляет собой (незамещенный или замещенный) C6-10-арил-C1-C7-алкилсульфенил или (незамещенный или замещенный) C6-10-арилсульфенил, где, если присутствуют более одного заместителя, например, от одного до четырех заместителей, заместители выбирают независимо из нитро, галогена, галоген-C1-C7-алкила и C1-C7-алкилокси.
Имид относится к (незамещенной или замещенной) функциональной группе, состоящей из двух ацильных групп, связанных с азотом, предпочтительно, циклической группе, производной от дикарбоновых кислот. Особенно предпочтительным является сукцинимидил, производный от янтарной кислоты или фталимидил, производный от фталевой кислоты. Имидильная группа может быть замещена одним или более заместителями, независимо выбранными из, например, C1-C7-алкила, C1-C7-алкокси-C1-C7-алкила, C1-C7-алкокси или галогена.
Азид относится к группе -N=N+=N-.
Силил, как используют в описании настоящего изобретения, относится к группе имеющей формулу -SiR11R12R13, где R11, R12 и R13 представляют собой, независимо друг от друга, C1-C7-алкил, C6-C10-арил или фенил-C1-C4-алкил. Предпочтительными примерами для R11, R12 и R13 являются метил, этил, изопропил, трет-бутил, фенил или фенил-C1-4-алкил.
Соли
Соли представляют собой конкретно фармацевтически приемлемые соли или, как правило, соли любых промежуточных соединений, указанных в описании настоящего изобретения, кроме тех случаев, где соли исключены по химическим причинам, которые квалифицированный специалист в данной области легко поймет. Они могут быть образованы, где присутствуют солеобразующие группы, такие как основные или кислотные группы, которые могут существовать в диссоциированной форме по меньшей мере частично, например, в интервале pH от 4 до 10 в водных растворах, или могут быть выделены, особенно, в твердом, особенно, в кристаллической форме.
Такие соли образуются, например, как кислотно-аддитивные соли, предпочтительно, с органическими или неорганическими кислотами, из соединений или любых промежуточных соединений, указанных в описании настоящего изобретения с основным атомом азота (например, имино или амино), особенно, фармацевтически приемлемые соли. Подходящими неорганическими кислотами, являются например, галогенсодержащие кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновая, фосфоновая, сульфоновая или сульфаминовая кислоты, например уксусная кислота, пропионовая кислота, молочная кислота, фумаровая кислота, янтарная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, бензойная кислота, метан- или этансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота, или другие органические протнные кислоты, такие как аскорбиновая кислота.
В присутствии отрицательно заряженных радикалов, таких как карбокси или сульфо, соли также могут быть образованы с основаниями, например, соли металлов или аммония, такие как соли щелочных металлов или соли щелочноземельных металлов, например соли натрия, калия, магния или кальция, или соли аммония с аммиаком или подходящими органическими аминами, такими как третичные моноамины, например, триэтиламин или три(2-гидроксиэтил)амин, или гетероциклическими основаниями, например, N-этил-пиперидином или N,N'-диметилпиперазином.
Когда основная группа и кислотная группа присутствуют в одной и той же молекуле, любые промежуточные соединения, указанные в описании настоящего изобретения, могут также образовывать внутренние соли.
Для целей выделения или очистки любых промежуточных соединений, указанных в описании настоящего изобретения, также возможно применять фармацевтически неприемлемые соли, например пикраты или перхлораты.
Принимая во внимание тесную взаимосвязь между соединениями и промежуточными соединениями в свободной форме и в форме их солей, включая те соли, которые могут применяться в качестве промежуточных соединений, например, при очистке или идентификации соединений или их солей, любую ссылку на «соединения», «исходные вещества» и «промежуточные соединения» ниже и выше по тексту описания настоящего изобретения следует понимать, как относящуюся к одной или более их солям или смеси соответствующего свободного соединения, промежуточного соединения или исходного вещества и одной или более их солей, каждая из которых подразумевается как включающая также любой сольват или соль любого одного или более из перечисленных, как соответствующие и подходящие, и если явным образом не указано другое. Также включаемыми могут быть различные кристаллические формы, и тогда они также являются включенными.
Азотзащитные группы
Термин "азотзащитная группа" включает любую группу, которая способна обратимо защищать функциональность азота, предпочтительно функциональность амина и/или амида. Предпочтительно, азотзащитная группа представляет собой защитную группу для амина и/или защитную группу для амида. Подходящие азотзащитные группы традиционно применяются, например, в пептидной химии и описаны, например, в соответствующих главах стандартных справочниках, таких как J. F. W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London и New York 1973, in P. G. M. Wuts и T. W. Greene, ʺGreene's Protective Groups in Organic Synthesis', fourth edition, Wiley, New Jersey, 2007, и "Peptides"; volume 3 (editors: E. Gross и J. Meienhofer), Academic Press, London and New York 1981, и "Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, fourth edition, volume 15/I, Georg Thieme Verlag, Stuttgart 1974.
Предпочтительные азотзащитные группы, как правило, включают в себя: незамещенный или замещенный C1-C6-алкил, предпочтительно C1-C4-алкил, более предпочтительно C1-C2-алкил, наиболее предпочтительно C1-алкил, незамещенный или замещенный C2-4-алкенил, где каждый C1-C6-алкил и C2-4-алкенил является необязательно моно-, ди- или тризамещенным триалкилсилил-C1-C7-алкокси (например, триметилсилилэтокси), циклоалкилом, арилом, предпочтительно, фенилом, или гетероциклической группой, предпочтительно, пирролидинилом, где циклоалкилиная группа, арильное кольцо или гетероциклическая группа является незамещенной или замещенной одним или более, например, двумя или тремя остатками, например, выбранными из группы, состоящей из C1-C7-алкила, гидрокси, C1-C7-алкокси, C2-C8-алканоил-окси, галогена, нитро, циано, и CF3; арил-C1-C2-алкоксикарбонил (предпочтительно фенил-C1-C2-алкоксикарбонил, например, бензилоксикарбонил); C1-10-алкенилоксикарбонил; C1-6-алкилкарбонил (например, ацетил или пивалоил); C6-10-арилкарбонил; C1-6-алкоксикарбонил (например, трет-бутоксикарбонил); C6-10-арил-C1-6-алкоксикарбонил; аллил или циннамил; сульфонил или сульфенил; сукцинимидильную группу, замещенный силил, например, триарилсилил или триалкилсилил (например, триэтилсилил).
Примерами предпочтительных азотзащитных групп являются ацетил, бензил, кумил, бензгидрил, тритил, бензилоксикарбонил (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), бензилоксиметил (BOM), пивалоил-окси-метил (POM), трихлорэтоксикарбонил (Troc), 1-адамантилоксикарбонил (Adoc), аллил, аллилоксикарбонил, триметилсилил, трет-бутил-диметилсилил (TBDMS), триэтилсилил (TES), триизопропилсилил (TIPS), триметилсилилэтоксиметил (SEM), трет-бутоксикарбонил (BOC), трет-бутил, 1-метил-1,1-диметилбензил, (фенил)метилбензол, пиридинил и пивалоил. Наиболее предпочтительными азотзащитными группами являются ацетил, бензил, бензилоксикарбонил (Cbz), триэтилсилил (TES), триметилсилилэтоксиметил (SEM), трет-бутоксикарбонил (BOC), пииролидинилметил и пивалоил.
Примерами более предпочтительных азотзащитных групп являются пивалоильная, пирролидинилметильная, трет-бутоксикарбонильная, бензильная и силильная группы, особенно, силильные группы согласно формуле SiR11R12R13, где R11, R12 и R13 представляют собой, независимо друг от друга, C1-C7-алкил, C6-C10-арил или фенил-C1-C4-алкил. Предпочтительными примерами R11, R12 и R13 являются метил, этил, изопропил, трет-бутил и фенил.
Примерами наиболее предпочтительных азотзащитных групп являются трет-бутоксикарбонил (BOC), бензоил, стирил, 1-бутенил, бензил, п-метоксибензил (PMB) и пирролидинилметил, в частности, пивалоил и трет-бутоксикарбонил (BOC).
В одном варианте осуществления термин азотзащитная группа относится к группе, которую выбирают из группы, состоящей из:
C1-C6-алкила, который является незамещенным или моно-, ди- или тризамещенным три-C1-C6-алкилсилил-C1-C7-алкокси, C6-C10-арилом, или гетероциклической группой, являющейся моно-, би- или трициклической кольцевой системой с 5-14 кольцевыми атомами и 1-4 гетероатомами, независимо выбранными из N, O, S, S(O) или S(O)2, где арильное кольцо или гетероциклическая группа являются незамещенными или замещенными одним, двумя или тремя остатками, выбранными из группы, состоящей из C1-C7-алкила, гидроксила, C1-C7-алкокси, C2-C8-алканоил-окси, галогена, нитро, циано и CF3;
C6-C10-арил-C1-C2-алкоксикарбонила; C1-C10-алкенилоксикарбонила; C1-C6-алкилкарбонила; C6-C10-арилкарбонила; C1-C6-алкоксикарбонила; C6-C10-арил-C1-C6-алкоксикарбонила; аллила; циннамила; сульфонила; сульфенила; сукцинимидила и силила, где каждая силильная группа представляет собой группу SiR11R12R13, где R11, R12 и R13, независимо друг от друга, представляют собой C1-C7-алкил, C6-C10-арил или фенил-C1-C4-алкил.
Как правило, в настоящей заявке термин "азотзащитная группа" включает любую группу, которая способна к обратимой защите функциональности аминогруппы.
Если в варианте осуществления требуется удаление азотзащитной группы, определенной выше, удаление обычно может выполняться посредством использования известных методов, например, описанных в ссылках, цитируемых выше. Предпочтительно, азотзащитную группу, определенную выше, удаляют посредством использования кислых или основных условий. Примерами кислых условий являются хлористоводородная кислота, трифторуксусная кислота, серная кислота. Примерами основных условий являются гидроксид лития, этоксид натрия. Могут применяться нуклеофилы, такие как боргидрид натрия. В случае N-бензила в качестве аминозащитной группы, его можно удалить гидрированием или посредством применения нескольких подходящих окислителей, например, нитрата церия аммония (CAN) или 2,3-дихлор-5,6-дициано-п-бензохинона (DDQ).
Карбоксилзащитные группы
Карбоксилзащитной группой (например, Ra или R* в данном раскрытии) может быть любая группа, известная в данной области, особенно C1-C6-алкил, например, этил, метил, аллил или трет-бутил или C6-C10-арил-C1-C6-алкил, например, бензил, или силильная группа SiR11R12R13, где R11, R12 и R13, независимо друг от друга, представляют собой C1-C7-алкил, C6-C10-арил или фенил-C1-C4-алкил. Предпочтительными примерами для R11, R12 и R13 являются метил, этил, изопропил, трет-бутил, фенил или фенил-C1-4-алкил. Сами карбоксилзащитные группы, реакции для их введения, и реакции для их удаления описаны, например, в стандартных справочниках, таких как J. F. W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, in T. W. Greene, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, in "Peptides"; Volume 3 (editors: E. Gross and J. Meienhofer), Academic Press, London и New York 1981, in "Methoden der Organischen Chemie" (Methods of Organic chemistry), Houben Weyl, 4th edition, Volume 15/I, Georg Thieme Verlag, Stuttgart 1974, in H.-D. Jakubke и H. Jescheit, "Aminosäuren, Peptide, Proteine" (Amino acids, peptides, proteins), Verlag Chemie, Weinheim, Deerfield Beach, и Basel 1982, и in Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of carbohydrates: monosaccharides and derivatives), Georg Thieme Verlag, Stuttgart 1974.
Например, C1-C6-алкил, например, этил, защитная группа R* или Ra может удаляться гидролизом, например, в присутствии основания, такого как гидроксид щелочного металла, например, гидроксид лития, в присутствии соответствующего растворителя, например, циклического простого эфира, такого как тетрагидрофуран и воды, например, при температуре в интервале от 0 до 50°C, таким образом, как от 10 до 30°C.
Как правило, это предполагает, что во всех случаях применения термина «защитная группа» в описании настоящего изобретения, защитную группу применяют лишь как таковую, если ее удаляют для получения последующего продукта - если она остается, защитная группа становится заместителем. Таким образом, алкил, такой как этил, если его удаляют, является защитной группой, если он остается, он становится постоянным фрагментом.
Там, где указаны защитные группы, их характеристикой является то, что, в отличие от групп, которые остаются в молекуле, они отщепляются на следующей стадии реакции; следовательно, алкил, такой как этил, в качестве защитной группы, исходя из этой функции, следует отличать от алкила, такого как этил, который остается в продукте реакции.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Следующие разделы описывают более подробно необходимые индивидуальные стадии способа, приведенные на СХЕМАХ 1-10 выше.
Реакция согласно СХЕМАМ 1 и 1-A
В одном варианте осуществления настоящего изобретения, реакции удаления защитных групп и декарбоксилирования предпочтительно происходят в присутствии кислоты, такой как неорганическая кислота, например, галогенводородная кислота, такая как хлористоводородная кислота, в соответствующих растворителе или смеси растворителей, например, в смеси органической кислоты, такой как уксусная кислота, и воды, например, при повышенных температурах от 50°C до температуры кипячения с обратным холодильником реакционной смеси, таким образом, как от 90 до 120°C; или с гидроксидом щелочного металла, таким как гидроксид натрия, в соответствующих растворителе или смеси растворителей, таких как спирт, например, этанол, или эфир, например, тетрагидрофуран или 1,4-диоксан при температурах, например, в интервале от 30°C до температуры кипячения с обратным холодильником реакционной смеси, например, от 40 до 90°C, с последующим подкислением, например, с использованием HCl, для декарбоксилирования; или с использованием хлорида щелочного металла, такого как хлорид натрия, в присутствии соответствующего растворителя, например, ДМСО, например, при повышенных температурах от 50°C до температуры кипячения с обратным холодильником реакционной смеси, таким образом, как от 90 до 160°C (декарбоксилирование по Крапчо); или в случае, когда R* представляет собой трет-бутил и Ra представляет собой (неудаленный) этил, в присутствии кислоты, такой как трифторуксусная кислота, в соответствующем растворителе или смеси растворителей и при обычных температурах; или, если R* представляет собой бензил или аллил, посредством гидрирования в присутствии катализатора гидрирования, такого как благородный металл, например, Pd или Pd на древесном угле, в соответствующем растворителе или смеси растворителей, например, спирте, таком как метанол или этанол.
Введение фрагмента Ra, отличного от водорода в декарбоксилированное соединение с удаленной защитной группой (где вместо фрагмента Ra присутствует водород) может предпочтительно проводиться, исходя из соответствующего полученного в результате соединения формулы (I), особенно (I-a) где Ra представляет собой водород, посредством реакции со спиртом формулы Ra-OH, где Ra является таким, как определено для соединения формулы (I), особенно, Ra представляет собой C1-C6-алкил, такой как этил, в присутствии активирующего агента, например, агента для превращения кислоты в ацилгалогенид или ангидрид кислоты.
Подходящие реагенты для образования ацилгалогенида выбирают, например, из тионилхлорида, тионилбромида, PCl3, PCl5, оксалилхлорида, Me2C=C(Cl)NMe2, PhCOCl, PBr3, PBr5, Ph3PBr2, оксалилбромида или Me2C=C(Br)NMe2.
Реакция предпочтительно происходит в обычном растворителе, таком как C1-C6-алкил-спирт, например, метанол или этанол, и при соответствующих температурах, например, в интервале от 0 до 100°C, например, от 10 до 90°C.
Реакция согласно СХЕМАМ 2 и 2-A
В одном варианте осуществления настоящего изобретения, для пропионатного производного формулы (IV), предпочтительно, производного формулы (IV-a), уходящая группа X предпочтительно представляет собой галоген, например, бром, йод или хлор или активированную спиртовую группу, например, мезилат или тозилат.
Эта реакция предпочтительно происходит в присутствии галогенида тетраалкиламмония, например, йодида тетрабутиламмония, и основания, например, карбоната щелочного металла, такого как карбонат калия, в соответствующем растворителе, например ацетоне, предпочтительно при температурах в интервале от -10 до 50°C, например, при от -5 до 30°C. Альтернативными условиями для этого превращения являются, например, (a) гидросульфат тетрабутиламмония в толуоле при кипячении с обратным холодильником (см. также, например, Monatshefte für Chemie 1990, 121, 173-187), (b) алкоксид натрия в спиртах при повышенных температурах (например, метоксид натрия в метаноле при кипячении с обратным холодильником) (см. также например, (a) J. Org. Chem. 1989, 54, 1876-1883; (b) Tetrahedron Lett. 1984, 25, 1047-1048; (c) J. Org. Chem. 1998, 63, 3677-3679), возможно в присутствии соли меди (I) (например, бромида) и триалкиламина (например, триэтиламина) (см. также например, Synthesis 1985, 1043-1047) или (c) гидрид натрия в ТГФ (см. также например, J. Org. Chem. 1995, 60, 5107-5113; (b) Tetrahedron Lett. 1993, 34, 2051-2054). Эти и другие условия превращения для алкилирований β-дикарбонильных соединений являются хорошо известными квалифицированному специалисту в данной области.
Реакция согласно СХЕМЕ 3
Соединение формулы (III) в дополнительном варианте осуществления настоящего изобретения, предпочтительно может быть получено посредством способа, включающего реакцию уксусной кислоты соединения формулы (V), или его реакционноспособного производного, с солью однозамещенного сложного эфира малоновой кислоты формулы (VI), где R* представляет собой карбоксилзащитную группу.
Соответствующие условия реакции являются хорошо известными в данной области. Реакция предпочтительно происходит в присутствии реагента для реакции сочетании, такого как N,N-карбонилимидазол, в соответствующем растворителе или смеси растворителей, например, эфире, таком как тетрагидрофуран, и/или нитриле, таком как ацетонитрил, в присутствии соли щелочноземельного металла, такого как хлорид магния, и основания, например, основания третичного азота, такого как триметиламин, при предпочтительных температурах в интервале от -20 до 50°C, например, от -10 до 30°C. Альтернативные условия (где условия также могут комбинироваться, иными словами, способы получения активированного ацилирующего агента и активированного метиленового аниона могут быть смешаны)) для этого превращения, представляют собой, например, (a) применение соответствующего ацилхлорида, например, полученного обработкой соответствующей кислоты оксалилхлоридом или тионилхлоридом, вместо ацилимидазолида в иных идентичных условиях, или потенциально в комбинации с применением триалкиламинового или пиридиного основания и кислоты Мельдрума (см. также например, Bioorg. Med. Chem. 2015, 23, 149-159; (b) J. Am. Chem. Soc. 2006, 128, 6938-6946), (b) применение реагента для реакции сочетания, например, дициклогексилдиимидазола в комбинации с кислотой Мельдрума в дихлорметане при 0-20°C, и последующего раскрытия промежуточного продукта с использованием спирта, например, этанола, потенциально в присутствии кислотного катализатора, например, п-толуолсульфоновой кислоты (см. также например, US 2004/2508 A1), или (c) применение активированного смешанного ангидрида, например, полученного обработкой кислоты алкилхлорформиатом, например, этилхлорформиатом, потенциально в комбинации с алкилмагнийгалогенидом или алкиллитиевым реагентом в качестве основания для депротонирования моноалкилмалонатной соли щелочного металла (см. также например, J. Chem. Soc., Perkin Trans. 1, 2002, 1663-1671; (b) WO2008/36420 A2) в ТГФ при пониженной температуре, например, -30°C.
Реакция согласно СХЕМАМ 3* и 3*-a
Соединение формулы (III) в дополнительном варианте осуществления настоящего изобретения, предпочтительно может быть получено способом, включающим взаимодействие промежуточного соединения формулы (XIV), предпочтительно, соединения формулы (XIV-a), или его соли, где Rf выбирают из группи -O-R*, где R* выбирают из карбоксилзащитной группы и C1-C6-алкила, предпочтительно, метила; -N(CH3)-O(CH3) (амида Вайнреба), морфолинила, и имидазолинила, с полученным in situ активированным дианионным производным соединения формулы (V), или его соли, а именно, соединением формулы (V*), в присутствии основания, с последующей реакцией декарбоксилирования, с получением соединения формулы (I), или его соли, где Ra представляет собой водород.
Исходное соединение формулы (XIV) или (XIV-a) является известным в данной области техники и доступным для приобретения, или может быть легко получено из соединения следующей формулы:

способами, известными в данной области; в частности, исходное соединение формулы (XIV-a) может быть получено, например, посредством асимметрического гидрирования в присутствии хирального катализатора. Способы введения конкретной предпочтительной группы Rf, например, метокси-группы, амида Вайнреда или вторичной амидной группы также являются хорошо известными в данной области.
Активированное дианионное производное соединения формулы (V), так называемого реагента Иванова (V*), может быть получено in situ посредством бис-депротонирования соединения формулы (V) обработкой с использованием очень сильных оснований, например, алкиллитиевых реагентов, оснований амидов лития или реагента Гриньяра (Synthesis 1982, 521-578 и приведенные там ссылки). Депротонирование предпочтительно проводят добавление реагента Гриньяра, такого как изопропилмагнийхлорид или втор-бутил магнийбромид, предпочтительно в присутствии LiCl (например, i-PrMgCl•LiCl, так называемый ТурбоГриньяр, доступный от Sigma-Aldrich, Кат. № 656984), в соответствующем растворителе, например, эфире, таком как тетрагидрофуран, при предпочтительных температурах в интервале от -20 до 50°C, например, от -10 до 40°C.
Активированное дианионное производное формулы (V*) затем добавляют к соединению формулы (XIV) в присутствии основания, или альтернативно к солям соединения формулы (XIV). Подходящими основаниями, являются, например, реагент Гриньяра, такой как изопропилмагнийхлорид или втор-бутилмагнийбромид, или сильные основания, такие как гидрид натрия. Добавление предпочтительно выполняют в соответствующем растворителе, например, эфире, таком как тетрагидрофуран, при предпочтительных температурах в интервале от -20 до 70°C, например, от -20 до 30°C, в течение периода от 1 ч до 24 ч.
Последующая реакция декарбоксилирования затем предпочтительно происходит в присутствии кислоты, такой как неорганическая кислота, например, галогенводородная кислота, такая как хлористоводородная кислот, в соответствующем растворителе или смеси растворителей, например, в смеси органической кислоты, такой как уксусная кислота, и воды, или в органическом растворителе, например, тетрагидрофуране, и ее проводят при температурах от 0°C до комнатной температуры. Альтернативно, декарбоксилирования можно также достичь нагревом до температуры кипячения с обратным холодильником растворителя.
Если необходимо или желательно, полученное соединение формулы (I), или его соль, где Ra представляет собой водород, может взаимодействовать с агентом, вводящим карбоксилзащитную группу, с предоставлением соединения формулы (I), где Ra представляет собой карбоксилзащитную группу, или полученное соединение формулы (I), или его соль, где Ra представляет собой водород, взаимодействует с реагентом для реакции сочетания в присутствии C1-C6-алканола, в особенности, этанола, с предоставлением соединения формулы (I), где Ra представляет собой C1-C6-алкил, предпочтительно этил, согласно методикам, например, описанным для СХЕМЫ 1 выше или в общей части для карбоксилзащитных групп.
Реакция согласно СХЕМЕ 4
Соединение формулы (V) может, например, в дополнительном варианте осуществления настоящего изобретения предпочтительно быть получено способом, включающим гидролиз цианида формулы (VII).
Гидролиз может предпочтительно происходить в присутствии основания, например, гидроксида щелочного металла, такого как гидроксид калия, в соответствующем растворителе, например, спирте, таком как диол, например, этиленгликоль, при повышенных температурах, например, от 30°C до температуры кипячения с обратным холодильником для реакционной смеси.
Альтернативно, соединение формулы V (бифенилуксусная кислота) также является доступным для приобретения (Sigma-Aldrich, номер по каталогу 196487, CAS № 5728-52-9).
Реакция согласно СХЕМАМ 5-10:
Как описано выше, а также ниже, способы, образующие варианты осуществления настоящего изобретения, все в последовательности, индивидуально или в любой комбинации, могут применяться в синтезе ингибиторов NEP или их пролекарств, в частности, NEP-ингибиторов или их пролекарств, таких как сакубитрил.
Соединение формулы (I), в особенности (I-a), может, таким образом, применяться (в дополнительном варианте осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями) при получении соединения формулы (VIII), в особенности, соединения формулы (VIII-a) или его соли, соответственно.
Это превращение может выполняться рядом различных путей, как подробно представлено на СХЕМАХ 6-10.
Реакция согласно СХЕМАМ 5, 5-a и 5-aa:
В одном варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями), который включает взаимодействие соединения формулы (I), особенно, (I-a), где Ra представляет собой водород, или его соли, с аммиаком, первичным или вторичным амином или их солями, с получением на выходе соединения формулы (VIII), где Ra представляет собой водород, если исходят из соединения формулы (I), особенно, (I-a), где Ra представляет собой водород, или его соли. Альтернативно, соединение формулы (VIII) также может быть получено реакцией соединения формулы (I), особенно, формулы (I-a), с первичным или вторичным амином, таким как бензиламин, или хиральный бензиламин, например, фенэтиламин, с получением соответствующего (бензил-)защищенного амина, который затем превращается в аминокислоту (VIII) посредством гидролитического расщепления соответсующего (бензил-)замещенного амина.
Соответствующие условия реакции являются хорошо известными в данной области техники. Реакция предпочтительно происходит с солью аммония, например, формиатом аммония, ацетатом аммония или гидроксидом аммония, самим аммиаком по отдельности или в комбинации с алкоксидами титана, например, изопропоксидом титана, или солями гидроксиламина, такими как гидрохлорид гидроксиламина, последний может также применяться в комбинации с гидрированием, с соответствующим восстановителем, таким как боргидрид натрия, трис(ацетокси)боргидрид натрия или цианборгидрид натрия, или восстановление может также происходить посредством гидрирования, обычно с Pd-катализаторами (например, 10% Pd/C) или никель Рэнея; в соответствующем растворителе или смеси растворителей, например, в воде, спирте, таком как этанол, и/или эфире, таком как тетрагидрофуран, или смеси двух или более из них, при предпочтительных температурах в интервале от 10 до 50°C или до 100°C, например, от 20 до 40 или до 80°C.
Это соединение формулы (VIII), особенно формулы (VIII-a), или его соль, может затем применяться, в дополнительном варианте осуществления настоящего изобретения, для получения соответствующего соединения формулы (VIII), особенно, соединения формулы (VIII-a), где Ra представляет собой C1-C6-алкил, например, посредством взаимодействия соединения формулы (VIII), особенно, соединения формулы (VIII-a), где Ra представляет собой водород, с агентом, вводящим аминозащитную группу, например, трет-бутоксикарбонилом, с последующей реакцией аминозащищенного аналога соединения формулы (VIII), особенно, соединения формулы (VIII-a), с активирующим реагентом, например, тионилхлоридом, в присутствии спирта, в особенности, этанола, с получением соответствующего соединения формулы (VIII), особенно, соединения формулы (VIII-a), где Ra представляет собой C1-C6-алкил, особенно, этил, например, при температурах в интервале от 50 до 80°C, например, от 65 до 75°C.
Соответствующие условия и реагенты, которые могут применяться для этой последовательности стадий непосредственно или аналогичным образом, можно, например, найти в WO 2008/083967A, особенно, в ее Примерах 8 и 9.
Реакция согласно СХЕМАМ 6, 6-1, 6-a и 6-aa:
В одном варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями), который включает преобразование соединения формулы (I), особенно, соединения формулы (I-a) или его соли, где Ra выбирают из водорода и C1-C6-алкила, предпочтительно водорода, в соединение формулы (VIII), в частности, (VIII-a), предпочтительно, в соединение формулы (VIII-a), в частности, (VIII-aa), где Ra выбирают из водорода и C1-C6-алкила, предпочтительно водорода, и Re представляет собой водород, или его соль, посредством приведения его в контакт с (S)-селективной ω-трансаминазой в присутствии донора амина и кофермента.
Степень конверсии из соединения формулы (I) в соединение формулы (VIII), предпочтительно в соединение формулы (VIII-1), особенно, степень конверсии из соединения формулы (I-a) в соединение формулы (VIII-a), более предпочтительно, соединение формулы (VIII-aa), составляет более 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98%, или по меньшей мере около 99% или даже 100%.
В нескольких вариантах осуществления, трансаминаза способна к преобразованию субстрата, соединения формулы (I) и (I-a), соответственно, в частности, соединения (R)-5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты, в продукт, соединение формулы (VIII-1) и (VIII-aa), соответственно, в частности, соединение (2R,4S)-5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановую кислоту, при энантиомерном избытке (по отношению к стереогенному центру трансаминирования), большем, чем 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более в сравнении с соответствующим соединением формулы (VIII-1b)
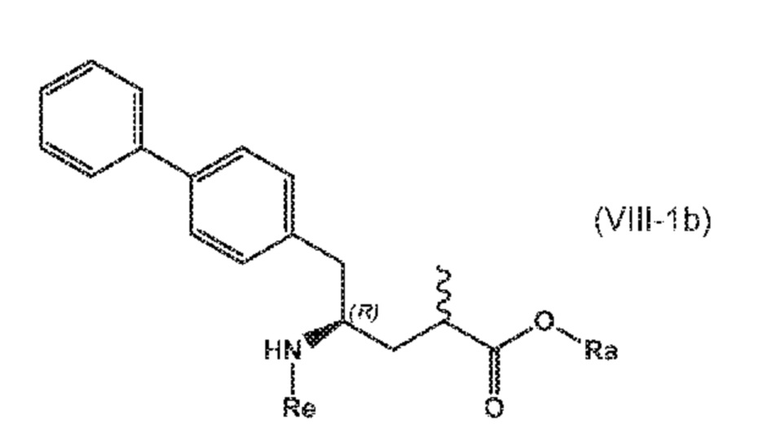
и (VIII-ab), соответственно,
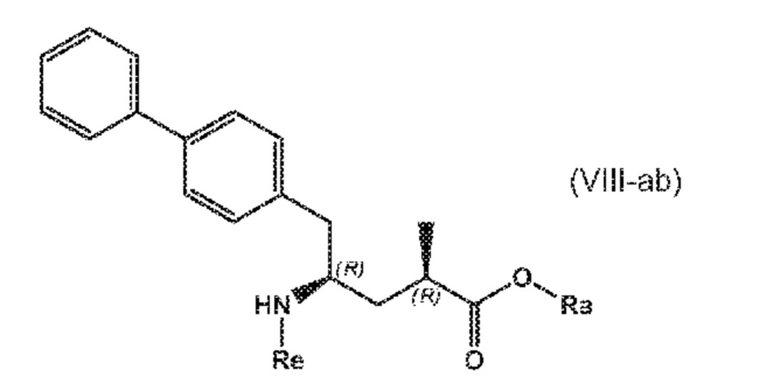
где Ra выбирают из водорода и C1-C6-алкила, предпочтительно водорода, и Re представляет собой водород, в частности, по сравнению с соединением (2R,4R)-5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановой кислотой при подходящих условиях реакции.
В нескольких вариантах осуществления, трансаминазы, используемые в раскрытии настоящего изобретения, способны к преобразованию соединения (I) в соединение (VIII-1) и соединения (I-a) в соединение (VIII-aa), соответственно, с увеличенной переносимостью присутствия субстрата при подходящих условиях реакции. Таким образом, в нескольких вариантах осуществления трансаминазы способны к преобразованию субстратного соединения (I) и (I-a) в соединение продукта (VIII-1) и (VIII-aa), соответственно, в присутствии субстрата с концентрацией загрузки равной по меньшей мере около 1 г/л, около 5 г/л, около 10 г/л, около 20 г/л, около 30 г/л, около 40 г/л, около 50 г/л, около 70 г/л, около 100 г/л, около 125 г/л, около 150 г/л. около 175 г/л или около 200 г/л или более. Такая загрузка субстратом все еще позволяет достичь процента конверсии, равного по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98%, или по меньшей мере около 99%, или 100%, за время реакции, равное около 120 ч или менее, около 96 ч или менее, около 72 ч или менее, около 48 ч или менее, около 36 ч или менее, или около 24 ч или менее, при подходящих условиях реакции.
Подходящие условия реакции для достижения таких степеней конверсии могут быть определены по отношению к концентрациям или количествам трансаминазы, субстрата, кофактора, буфера, co-растворителя, pH, и/или условиям, включающим температуру и время реакции, как дополнительно описано ниже и в Примерах.
Подробные способы использования трансаминазных ферментов
Для описанных выше способов предпочтительно применяют ω-трансаминазы, полученные от Codexis Inc. под ссылочным номером ATA-217 (часть набора Codex® ATA для скрининга), а также дополнительные генетически модифицированные варианты ω-трансаминаз (также полученные от Codexis Inc.). Такие генетически модифицированные ω-трансаминазы описаны, например, в патенте США № 8,470,564.
В вариантах осуществления настоящего изобретения и иллюстрируемые в Примерах, различные интервалы подходящих условий реакции, которые могут применяться в способах, включают но не ограничены приведенным, интервалы донора аминогруппы, pH, температуры, буфера, системы растворителя, загрузки субстрата, загрузки фермента (трансаминазы), загрузки кофактора, давления, и времени реакции. Дополнительные подходящие условия реакции для осуществления заявленного способа с участием трансаминазы могут быть легко оптимизированы с учетом инструкций, предоставленных в настоящем описании, посредством рутинного экспериментирования, которое включает, но не ограничено приведенными, контактирование трансаминазы и субстратного соединения в экспериментальных условиях реакции, касающихся концентрации, pH, температуры, растворителя, и обнаружение соединения-продукта.
В одном варианте осуществления настоящего изобретения, для трансаминазы применяют изопропиламин (также именуемый здесь «IPM») в качестве донора амина. Подходящие условия реакции включают донор амина, в частности, IPM, присутствующий при концентрации, равной по меньшей мере от около 0,1 до около 3,0 M, 0,2 до около 2,5 M, около 0,5 до около 2 M или от около 1 до около 2 M. В нескольких вариантах осуществления, донор аминогруппы присутствует при концентрации, равной около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 1,0, 1,5, 2,0, 2,5 или 3,0 M. Более высокие концентрации донора амина, например, IPM, могут применяться для сдвига равновесия в сторону образования аминного продукта.
Подходящие условия реакции также обычно включают кофактор. В одном варианте осуществления, кофактором является пиридоксаль-5'-фосфат (также известный как пиридоксаль-фосфат, PLP, P5P). В нескольких вариантах осуществления, кофактор PLP присутствует естественным образом в клеточном экстракте, и его не требуется добавлять. В других вариантах осуществления, подходящие условия реакции включают кофактор, добавленный в ферментную реакционную смесь, например, при использовании частично очищенного или очищенного трансаминазного фермента. Подходящие условия реакции могут включать присутствие кофактора, предпочтительно PLP, при концентрации от около 0,1 г/л до около 10 г/л, от около 0,2 г/л до около 5 г/л, от около 0,5 г/л до около 2,5 г/л. В нескольких вариантах осуществления, условия реакции включают концентрацию PLP около 0,1 г/л или менее, 0,2 г/л или менее, 0,5 г/л или менее, 1 г/л или менее, 2,5 г/л или менее, 5 г/л или менее, или 10 г/л или менее. В нескольких вариантах осуществления, кофактор может добавляться либо в начале реакции и/или дополнительный кофактор добавляют во время реакции.
Концентрация субстратного соединения формулы (I) или (I-a) в реакционной смеси может варьировать, принимая во внимание, например, желательное количество соединения-продукта, эффект концентрации субстрата на активность фермента, стабильность фермента в условиях реакции, и процент конверсии субстрата в продукт. В нескольких вариантах осуществления, подходящие условия реакции включают загрузку субстратного соединения, равную по меньшей мере около от 0,5 до около 200 г/л, от 1 до около 200 г/л, от 5 до около 150 г/л, от около 10 до около 100 г/л, от 20 до около 100 г/л или от около 50 до около 100 г/л. В нескольких вариантах осуществления, подходящие условия реакции включают загрузку субстратного соединения, равную по меньшей мере около 0,5 г/л, по меньшей мере около 1 г/л, по меньшей мере около 5 г/л, по меньшей мере около 10 г/л, по меньшей мере около 15 г/л, по меньшей мере около 20 г/л, по меньшей мере около 30 г/л, по меньшей мере около 50 г/л, по меньшей мере около 75 г/л, по меньшей мере около 100 г/л, по меньшей мере около 150 г/л или по меньшей мере около 200 г/л, или даже более.
Подходящие условия реакции включают концентрацию трансаминазы от около 0,01 до около 50 г/л; около 0,05 до около 50 г/л; от около 0,1 до около 40 г/л; от около 1 до около 40 г/л; от около 2 до около 40 г/л; от около 5 до около 40 г/л; от около 5 до около 30 г/л; от около 0,1 до около 10 г/л; от около 0,5 до около 10 г/л; от около 1 до около 10 г/л; от около 0,1 до около 5 г/л; от около 0,5 до около 5 г/л; или от около 0,1 до около 2 г/л. В нескольких вариантах осуществления, концентрация трансаминаы равна около 0,01, 0,05, 0,1, 0,2, 0,5, 1, 2, 5, 10, 15, 20, 25, 30, 35, 40 или 50 г/л.
Во время протекания реакций трансаминирования, pH реакционной смеси может изменяться. pH реакционной смеси может поддерживаться при желательном pH или в пределах желательного интервала pH. Это можно проделать добавлением кислоты или основания, до и/или во время протекания реакции. Альтернативно, pH можно контролировать посредством использования буфера. В нескольких вариантах осуществления, подходящие условия реакции включают pH раствора, включающий pH от около 6 до около 12, pH от около 6 до около 10, pH от около 6 до около 8, pH от около 7 до около 10, pH от около 7 до около 9, или pH от около 7 до около 8. В нескольких вариантах осуществления, условия реакции включают pH раствора около 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10. 10,5, 11, 11,5 или 12.
Соответственно, в нескольких вариантах осуществления, условие реакции включает буфер. Подходящие буферы для поддержания желательных интервалов pH являются известными в области и включают, посредством примера и без ограничения, боратный, карбонатный, фосфатный, триэтаноламиновый буфер и т.п. В нескольких вариантах осуществления, буфером является борат. В нескольких вариантах осуществления способа, подходящие условия реакции включают буферный раствор триэтаноламина, где концентрация триэтаноламина составляет от около 0,01 до около 0,4 M, от 0,05 до около 0,4 M, от 0,1 до около 0,3 M, или от около 0,1 до около 0,2 M. В нескольких вариантах осуществления, условие реакции включает концентрацию триэтаноламина около 0,01, 0,02, 0,03, 0,04, 0,05, 0,07, 0,1, 0,12, 0,14, 0,16, 0,18, 0,2, 0,3, или 0,4 M. В нескольких вариантах осуществления, условия реакции включают воду в качестве подходящего растворителя без присутствия буфера.
В вариантах осуществления способа трансаминирования, подходящая температура может применяться для условий реакции, например, с учетом повышения скорости реакции при более высоких температурах, и временной период активности фермента во время реакции. Соответственно, в нескольких вариантах осуществления, подходящие условия реакции включают температуру от около 10°C до около 70°C, от около 10°C до около 65°C, от около 15°C до около 60°C, от около 20°C до около 60°C, от около 20°C до около 55°C, от около 30°C до около 55°C, или от около 40°C до около 50°C. В нескольких вариантах осуществления, подходящие условия реакции включают температуру около 10°C, 15°C, 20°C, 25°C, 30°C, 35°C, 40°C, 45°C, 50°C, 55°C, 60°C, 65°C, или 70°C. В нескольких вариантах осуществления, температура во время ферментативной реакции может поддерживаться при одной температуре на протяжении всего хода реакции. В нескольких вариантах осуществления, температура во время ферментативной реакции может регулироваться по температурному профилю во время прохождения реакции.
Способы настоящего раскрытия, как правило, выполняют в растворителе. Подходящие растворители включают воду, водные буферные растворы, органические растворители, полимерные растворители, и/или системы сорастворителей, которые, как правило, содержат водные растворители, органические растворители и/или полимерные растворители. Водные растворители (вода или водная система coрастворителя) может иметь забуференный pH или небуференный рН. В нескольких вариантах осуществления, способы с использованием трансаминазы, как правило, выполняют в водной системе сорастворителя, содержащей органический растворитель (например, этанол, изопропанол (IPA), диметилсульфоксид (ДМСО), этилацетат, бутилацетат, 1-октанол, гептан, октан, метил-трет-бутиловый эфир (MTBE), толуол, и т.п.), ионные или полярные растворители (например, тетрафторборат 1-этил-4-метилимидазолия, тетрафторборат 1-бутил-3-метилимидазолия, гексафторфосфат 1-бутил-3-метилимидазолия, глицерин, полиэтиленгликоль и т.п.). В нескольких вариантах осуществления, сорастворителем может являться полярный растворитель, такой как полиол, диметилсульфоксид, ДМСО, или низший спирт. Неводный компонент растворителя водной системы сорастворителя может быть смешиваемым с водным компонентом, обеспечивая единую жидкую фазу phase, или может быть частично смешиваемым или несмешиваемым с водным компонентом, обеспечивая две жидкие фазы. Иллюстративные водные системы сорастворителей могут включать воду и один или более сорастворителей, выбранных из органического растворителя, полярного растворителя, и полиольного растворителя. Как правило, компонент сорастворителя водной системы сорастворителя выбирают таким образом, что он не оказывает неблагоприятного инактивирующего воздействия на трансаминазный фермент в условиях реакции. Соответствующие системы сорастворителей могут быть легко идентифицированы посредством измерения ферментативной активности установленного трансаминазного фермента с определенным интересующим субстратом в кандидатной системе сорастворителя, с использованием теста на активность фермента, такого, как описан в данном документе.
В нескольких вариантах осуществления способа, подходящие условия реакции включают водный сорастворитель, где сорастворитель содержит полиольные растворители, в частности, гликоли. Примеры подходящих полиольных растворителей включают посредством примера и без ограничения, полиэтиленгликоль, метиловый эфир полиэтиленгликоля, диметиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля и полипропиленгликоль. В нескольких вариантах осуществления, водный сорастворитель содержит полиэтиленгликоль, который является доступным с различными молекулярными массами. Особенно применимыми являются гликоли с низкой молекулярной массой, такие как PEG200 - PEG600. Соответственно, в нескольких вариантах осуществления, водный сорастворитель содержит PEG200 от около 1% до около 40% об/об; от около 1% до около 40% об/об; от около 2% до около 40% об/об; от около 5% до около 40% об/об; от 2% до около 30% об/об; от 5% до около 30% об/об; от 1 до около 20% об/об; от около 2% до около 20% об/об; от около 5% до около 20% об/об; от около 1% до около 10% об/об; от около 2% до около 10% об/об. В нескольких вариантах осуществления, подходящее условие реакции включает водный сорастворитель, содержащий PEG200 при около 1%, 2%, 5%, 10%, 15%, 20%; 25%; 30%; 35%; 35% или около 40% об/об.
В нескольких вариантах осуществления способа, подходящие условия реакции включают водный сорастворитель, где сорастворитель содержит ДМСО при от около 1% до около 80% (об/об), от около 1 до около 70% (об/об), от около 2% до около 60% (об/об), от около 5% до около 40% (об/об), от 10% до около 40% (об/об), от 10% до около 30% (об/об), или от около 10% до около 20% (об/об). В нескольких вариантах осуществления способа, подходящие условия реакции включают водный сорастворитель, содержащий ДМСО по меньшей мере при около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% (об/об).
Количества реагирующих веществ, применяемых в реакции трансаминирования, будет, как правило, варьировать в зависимости от количества желательного продукта, и сопутствующих количеств используемого субстрата трансаминазы. Рядовые специалисты в области легко смогут понять, как варьировать эти количества, чтобы приспособить их к желательному уровню производительности и масштабу производства.
В нескольких вариантах осуществления, порядок добавления реагирующих веществ не является решающим. Реагирующие вещества могут добавляться вместе в одно и то же время с растворителем (например, монофазным растворителем, бифазной водной системой сорастворителя, и т.п.), или альтернативно, некоторые реагирующие вещества могут добавляться раздельно, а некоторые вместе в различные моменты времени. Например, кофактор, трансаминаза и субстрат трансаминазы могут добавляться сначала в растворитель.
Твердые реагирующие вещества (например, фермент, соли, и т.д.) могут быть обеспечены для реакции в разнообразных и различных формах, включающих порошок (например, лиофилизированный, высушенный распылением, и т.п.), раствор, эмульсию, суспензию и т.п. Реагирующие вещества могут быть легко лиофилизированы или распылительно высушены с использованием методов и оборудования, известных рядовым специалистам в области. Например, раствор белка может быть заморожен при -80°C небольшими аликвотами, затем добавлен в предварительно охлажденную камеру лиофилизации с последующим применением вакуума.
Для улучшенной эффективности смешивания, когда применяют водную систему сорастворителей, трансаминаза и кофактор могут быть добавлены и смешаны сначала в водной фазе. Органическая фаза может быть добавлена затем и смешиваться, при последующем добавлении субстрата трансаминазы. Альтернативно, субстрат трансаминазы может быть предварительно смешан с органической фазой, перед добавлением к водной фазе.
Для реакции трансаминирования, как правило, обеспечивают протекание до тех пор, пока дальнейшая конверсия кетонового субстрата в аминный продукт не изменится значительно с течением времени реакции, например, конверсия менее 10% субстрата, или конверсия менее 5% субстрата. В нескольких вариантах осуществления, обеспечивают протекание реакции до полной или почти полной конверсии кетонного субстрата в аминный продукт. Превращение субстрата в продукт может подвергаться мониторингу, с использованием известных методов обнаружения субстрата и/или продукта. Подходящие методы включают газовую хроматографию, ВЭЖХ, и т.п. Конверсионные выходы хирального аминного продукта, генерируемого в реакционную смесь, как правило, составляют более, чем около 50%, могут также составлять более, чем около 60%, могут также составлять более, чем около 70%, могут также составлять более, чем около 80%, могут также составлять более, чем около 90%, и часто составляют более около 97%.
Как правило, реакция трансаминирования будет проходить в течение времени реакции, составляющего около 120 ч или менее, около 96 ч или менее, около 72 ч или менее, около 48 ч или менее, около 36 ч или менее, около 24 ч или менее, около 18 ч или менее, или около 12 ч или менее, при подходящих условиях реакции.
В нескольких вариантах осуществления, способы получения соединений формулы (VIII-1) и (VIII-aa) с использованием трансаминазы при подходящих условиях реакции приводят к по меньшей мере около 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше конверсии кетонового субстрата, например, соединения формулы (I) и (I-a), соответственно, в аминное соединение продукта, например, соединение формулы (VIII-1) и (VIII-aa), соответственно, в течение приблизительно 120 ч или менее, в течение приблизительно 96 ч или менее, в течение приблизительно 72 ч или менее, в течение приблизительно 48 ч или менее, в течение приблизительно 36 ч или менее, в течение приблизительно 24 ч или менее, или даже в течение меньшего периода времени.
В дополнительном варианте осуществления, подходящие условия реакции включают начальную загрузку субстрата в растворе реакции, который затем контактирует с трансаминазой. Этот раствор реакции далее дополняют дополнительными субстратными соединениями при непрерывном добавлении с течением времени при скорости, равной по меньшей мере около 1 г/л/ч, по меньшей мере около 2 г/л/ч, по меньшей мере около 4 г/л/ч, по меньшей мере около 6 г/л/ч, или выше. Таким образом, согласно эти подходящим условиям реакции, трансаминазу добавляют в раствор, имеющий начальную загрузку субстрата, равную по меньшей мере около 20 г/л, 30 г/л или 40 г/л. Это добавление трансаминазы затем сопровождают последующим непрерывным добавлением дополнительного субстрата в раствор со скоростью около 2 г/л/ч, 4 г/л/ч или 6 г/л/ч, до достижения гораздо большей конечной загрузки субстрата, равной по меньшей мере около 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 100 г/л, 150 г/л, 200 г/л или более. Соответственно, в нескольких вариантах осуществления способа, подходящие условия реакции включают добавление трансаминазы в раствор, имеющий начальную загрузку субстрата, равную по меньшей мере около 20 г/л, 30 г/л, или 40 г/л с последующим добавлением дополнительного субстрата в раствор со скоростью около 2 г/л/ч, 4 г/л/ч, или 6 г/л/ч до достижения конечной загрузки субстрата, равной по меньшей мере около 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 100 г/л или более. Это условие реакции дополнения субстратом обеспечивает достижение более высокой загрузки субстратов при поддержании высоких степеней конверсии кетонового субстрата в аминный продукт, равных по меньшей мере около 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше. В нескольких вариантах осуществления этого способа, дополнительный добавленный субстрат находится в растворе, содержащем изопропиламин или ацетат изопропиламина при концентрации, равной по меньшей мере около 0,5 M, по меньшей мере около 1,0 M, по меньшей мере около 2,5 M, по меньшей мере около 5,0 M, по меньшей мере около 7,5 M, по меньшей мере около 10,0 M.
В нескольких вариантах осуществления способов, реакции трансаминирования могут включать следующие подходящие условия реакции: (a) загрузка субстрата при от около 5 г/л до 200 г/л; (b) от около 0,1 до 50 г/л трансаминазы; (c) от около 0,1 до 4 M изопропиламина (IPM); (d) от около 0,1 до 10 г/л пиридоксальфосфатного (PLP) кофактора; (e) pH от около 6 до 10; и (f) температура от около 30 до 60°C.
В нескольких вариантах осуществления способов, реакции трансаминирования могут включать следующие подходящие условия реакции: (a) загрузка субстрата при от около 10 до около 80 г/л; (b) от около 0,5 до 25 г/л трансаминазы; (c) от около 0 до 10% об/об PEG200; (d) от около 0,1 до 2 M изопропиламина (IPM); (e) от около 0,1 до 1 г/л пиридоксальфосфатного (PLP) кофактора; (f) pH от около 8 до 10; (g) температура от около 40 до 55°C, и (h) время реакции от 18 час до 36 час.
В нескольких вариантах осуществления способов, реакции трансаминирования могут включать следующие подходящие условия реакции: (a) загрузка субстрата от около 25 до около 100 г/л; (b) от около 0,5 до 10 г/л трансаминазы; (c) от около 0 до 10% об/об PEG200; (d) от около 0,1 до 2 M изопропиламина (IPM); (e) от около 0,1 до 1 г/л пиридоксальфосфатного (PLP) кофактора; (f) от около 0,005 до около 0,1 M боратного (или сравнимого) буфера; (g) pH от около 8 до 10; и (h) температура от около 40 до 55°C.
В нескольких вариантах осуществления, применяют дополнительные компоненты реакции или выполняют дополнительные методы для дополнений условий реакции. Они могут включать принятие мер для стабилизации или предотвращения инактивации фермента, снижения ингибирования продукта, сдвига равновесия реакции в сторону образования продукта.
Соответственно, в нескольких вариантах осуществления способа получения амина, такого как хиральный амин, могут добавляться дополнительные количества акцептора аминогруппы (до насыщения) и/или образованный акцептор аминогруппы (кетон) может непрерывно удаляться из реакционной смеси. Например, может применяться мост растворителя или двухфазная система сорастворителей для перемещения аминного продукта в экстракционный раствор, и, таким образом, снижения ингибирования аминным продуктом и также сдвига равновесия в сторону образования продукта (см., например, Yun и Kim, 2008, Biosci. Biotechnol. Biochem. 72(11):3030-3033).
В нескольких вариантах осуществления, где выбор донора аминогруппы приводит к карбонильному побочному продукту, который имеет давление паров выше, чем у воды (например, низкокипящий сопродукт, такой как летучее органическое карбонильное соединение), карбонильный побочный продукт может удаляться посредством продувки раствор реакции нереакционноспособным газом или посредством применения вакуума для снижения давления реакции и удаления карбонильного побочного продукта, присутствующего в газовой фазе. Нереакционноспособный газ является любым газом, который не взаимодействует с компонентами реакции. Различные нереакционноспособные газы включают азот и благородные газы (например, инертные газы). В нескольких вариантах осуществления, нереакционноспособным газом является газообразный азот. В нескольких вариантах осуществления, донором аминогруппы, применяемым в способе, является изопропиламин (IPM), который образует карбонильный побочный продукт ацетон при переносе аминогруппы к акцептору аминогруппы. Ацетон может удаляться продувкой газообразным азотом или применением вакуума к раствору реакции и удалением ацетона из газовой фазы посредством ловушки для ацетона, такой как холодильник или другая холодная ловушка. Альтернативно, ацетон может удаляться восстановлением в изопропанол, используя трансаминазу.
В нескольких вариантах осуществления способов, приведенных выше, где удаляют карбонильный побочный продукт, соответствующий донор аминогруппы может добавляться во время реакции трансаминирования для восполнения донора аминогруппы и/или поддержания pH реакции. Восполнение донора аминогруппы также сдвигает равновесие в сторону образования продукта, таким образом, увеличивая конверсию субстрата в продукт. Таким образом, в нескольких вариантах осуществления, где донором аминогруппы является изопропиламин, и ацетоновый продукт удаляют in situ, изопропиламин может добавляться к раствору для восполнения донора аминогруппы, утраченного во время удаления ацетона.
В дополнительных вариантах осуществления, любой из описанных способов для конверсии субстратного соединения в соединение продукта может дополнительно включать одну или несколько стадий, выбранных из: экстракции; выделения; очистки; и кристаллизации соединения продукта. Способы, технологии, и протоколы для экстракции, выделения, очистки и/или кристаллизации аминного продукта из биокаталитических реакционных смесей, производимых раскрытыми выше способами, известны рядовому специалисту в области и/или могут быть оценены посредством рутинных экспериментов. Дополнительно, иллюстративные способы предоставлены в Примерах ниже.
После реакции трансаминирования, полученное соединение формулы (VIII) или (VIII-a), особенно (VIII-1) или (VIII-aa), или его соль, где Ra и Re представляют собой водород, может затем применяться в дополнительном варианте осуществления настоящего изобретения, для получения соответствующего соединения формулы (VIII) или (VIII-a), особенно, соединения формул (VIII-1) и (VIII-aa), где Ra представляет собой водород и Re является азотзащитной группой, такой как трет-бутоксикарбонил, например, посредством взаимодействия соединения формулы (VIII), особенно соединения формулы (VIII-1) или (VIII-aa), где Ra представляет собой водород, с агентом, вводящим такую аминозащитную группу, например, трет-бутоксикарбонилом.
Альтернативно или впоследствии, необязательно аминозащищенный аналог соединения формулы (VIII) или (VIII-a), особенно (VIII-1) или (VIII-aa), где Ra представляет собой водород и Re представляет собой водород или азотзащитную группу, предпочтительно водород, может затем взаимодействовать с активирующим реагентом, например, тионилхлоридом, в присутствии спирта, в особенности, этанола, с получением на выходе соответствующего соединения формулы (VIII) или (VIII-a), особенно, соединения формулы (VIII-1) или (VIII-aa), где Ra представляет собой C1-C6-алкил, особенно этил, например, при температурах в интервале от 50 до 80°C, например, от 65 до 75°C.
Соответствующие условия и реагенты, которые могут применяться для этой последовательности стадий непосредственно или аналогичным образом можно, например, найти в WO 2008/083967A, особенно ее Примерах 8 и 9.
Реакция согласно СХЕМАМ 7, 7-a и 7-aa:
В другом варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями), который включает взаимодействие соединения формулы (I), особенно (I-a), где Ra представляет собой карбоксилзащитную группу или особенно C1-C6-алкил, например, этил, с сульфинамидным соединением формулы (IX), Rb-S(=O)-NH2, особенно (IX-a), и/или его энантиомером, или его солью, соответственно, где Rb представляет собой органический фрагмент, предпочтительно выбранный из группы, состоящей из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси, и C1-C7-алкокси-C1-C7-алкила; особенно объемный фрагмент, такой как трет-алкильный, например, трет-бутильный, или арильный, например, п-толильный, фрагмент; с получением сульфинимидного соединения формулы (X), особенно соединения формулы (X-a), где Rb является таким, как определено для соединения формулы (IX) и Ra является таким, как только что определено.
Эта реакция предпочтительно происходит, например, в условиях реакции Эльмана (см. также, например, F. Chemla, F. Ferreira, J. Org. Chem. 2004, 69, 8244), особенно в соответствующем растворителе или смеси растворителей, например, галогенированном углеводороде, таком как дихлорметан, или эфире, таком как тетрагидрофуран, предпочтительно в присутствии слабоактивного кислотного катализатора, такого как п-толуолсульфонат пиридиния, Ti(OiPr)4 или Ti(OEt)4 в качестве кислоты Льюиса (см. также, например, T. Boultwood, D. P. Affron, A. D. Trowbridge, J. A. Bull, J. Org. Chem. 2013, 78, 6632), например при температуре в интервале от 0 до 100°C, например, от 15 до 70°C.
Реакция предпочтительно сопровождается способом (также, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями, образующим вариант осуществления настоящего изобретения), включающим восстановление соединения формулы (X), особенно соединения формулы (X-a), с получением сульфинамидного соединения формулы (XI), или его соли, особенно, формулы (XI-a), более предпочтительно формулы (XI-aa) или его соли, где Rb и Ra такие как определено для соединения формулы (X) выше, в присутствии восстановителя.
В качестве восстановителя, предпочтительно применяют водород в присутствии катализатора, такого как Ru, например, в условиях катализа с переносом с использованием, например, изопропанола в качестве растворителя при предпочтительной температуре 40-90°C, комплексного гидрида, такого как боргидрид щелочного металла, например, применяют боргидрид натрия (если желательно, в присутствии кислоты, например, борной кислоты, толуолсульфоновой кислоты или бензойной кислоты), алюмогидрид щелочного металла, такой как литийалюминийгидрид.
Реакция предпочтительно происходит в обычном растворителе, например, эфире, таком как диэтиловый эфир или тетрагидрофуран, и при соответствующих температурах, например, в интервале от -78°C до 40°C, например, от -78°C до 20°C.
Альтернативно, дииизобутилалюминийгидрид, боран, L-Селектрид (литий три-втор-бутил(гидридо)борат-(1-)) или LiBEt3H (литийтриэтилборгидрид) могут применяться в соответствующем растворителе, таком как эфир, например, тетрагидрофуран, при низких температурах, например, в интервале от -100 до 0°C, например, при -78°C.
Соединение формулы (XI), особенно (XI-a), может затем дополнительно взаимодействовать, чтобы приводить к соединению формулы (VIII), особенно, соединению формулы (VIII-a), или его соли: В этой реакции, сульфинамидное соединение формулы (XI), или его соль, особенно соединение формулы (XI-a), или его соль, где Rb такой, как определено для соединения формулы (X), и Ra выбирают из водорода, карбоксилзащитной группы, и C1-C6-алкила, предпочтительно этила или водорода, более предпочтительно, этила, гидролизуют в присутствии кислоты.
Подходящая кислота является органической кислотой, такой как уксусная кислота или лимонная кислота, или предпочтительно неорганической кислотой, например, галогенводородной кислотой, таки как хлористоводородная кислота, серная кислота, фосфорная кислота или смесь двух или более из них, предпочтительно в водном растворе, в частности, содержащем дополнительный органический растворитель, такой как спирт, например, метанол, этанол или изопропанол, или эфир, например, 1,4-диоксан, тетрагидрофуран, трет-бутилметиловый эфир или диэтиловый эфир, или смеси двух или более из этих растворителей, предпочтительно при температурах в интервале например, до 0 до 60°C, например, от 20 до 25°C, или до температуры кипячения с обратным холодильником.
Этот способ предпочтительно приводит к соли соединения формулы (VIII), особенно соединения формулы (VIII-a), с использованной кислотой (кислотами).
Если желательно, соль соединения формулы (VIII), особенно (VIII-a), может затем быть преобразована в свободное соединение формулы (VIII), особенно соединение формулы (VIII-a), используя общепринятые способы, или в другую соль, например, с использованием ионообменной хроматографии, нейтрализации основанием, например, гидроксидом щелочного металла, или т.п.
Соединение (XI), особенно соединение (XI-a), может альтернативно превращаться в соединение (VIII), особенно соединение (VIII-a), где Ra представляет собой C1-C6-алкил, предпочтительно этил, в отсутствии воды, например, посредством применения безводной неорганической кислоты, например, галогенводородной кислоты, такой как хлористоводородная кислота, либо применяемой как газ или генерируемой in situ, используя подходящий реагент, в присутствии спирта формулы Ra-OH, где Ra выбирают из карбоксилзащитной группы, и C1-C6-алкила, особенно этила, соответственно.
Подходящие реагенты для генерации неорганических кислот in situ, например, выбирают из тионилхлорида, тионилбромида, PCl3, PCl5, оксалилхлорида, Me2C=C(Cl)NMe2, PhCOCl, PBr3, PBr5, Ph3PBr2, оксалилбромида или Me2C=C(Br)NMe2.
Реакция предпочтительно происходит в традиционном растворителе, таком как спирт, например, метанол или этанол, и при соответствующих температурах, например, в интервале от 0 до 50°C, например, от 10 до 30°C.
Пример соответствующих условий реакций можно обнаружить в Org. Lett. 2012, 14, 2062-2065 (удаление защитных групп сульфиниламина и сопутствующая этерификация; тионилхлорид в метаноле).
Сульфинамидное соединение формулы (IX) Rb-S(=O)-NH2, особенно (IX-a), где Rb является трет-бутилом, хорошо известно в данной области и является доступным для приобретения в обеих стереоизомерных формах (см. например, Sigma-Aldrich, номер по каталогу 497401, CAS № 196929-78-9 для (R)-энантиомера; номер по каталогу 513210, CAS № 343338-28-3 для (S)-энантиомера). Соединения с другими значениями Rb (и также известное одно для Rb=трет-бутил) может быть получено, например, (для получения соединения формулы (IX-a), предпочтительно асимметричного) моноокислением дисульфида формулы (XII)
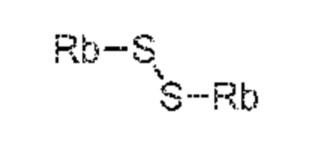 (XII),
(XII),
где Rb является таким, как определено для соединения формулы (IX), особенно, соединения формулы (IX-a), с последующим амидированием полученного в результате сульфинилсульфидного соединения формулы (XIII),
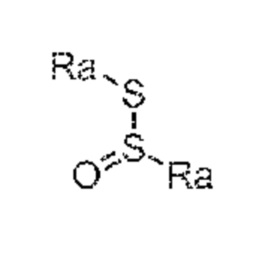 (XIII)
(XIII)
особенно, соединения формулы (XIII-a),
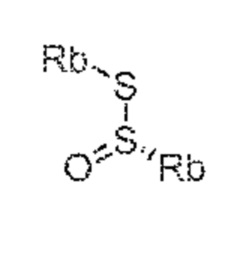 (XIII-a)
(XIII-a)
и/или его энантиомера,
где Rb является только что определенным, с использованием амида металла и последующей SN2 атакой с получением тиола формулы Ra-SH и соединения формулы (IX), особенно, соединения формулы (IX-a).
Для синтеза соединения формулы (IX-a) через (XIII-a), асимметричное моноокисление предпочтительно проводят в присутствии хирального лиганда, например, бензоциклопентанолимина, с наименованием (1S,2R)-1-[(2-гидрокси-3,5-ди-трет-бутил-бензилиден)-амино]-индан-2-ол формулы
 ,
,
или другие лиганды выбирают из лигандов следующей формулы:

где R1 представляет собой водород, трет-бутил или метокси; и R2 представляет собой трет-бутил, изопропил, бензил или фенил.
В качестве примера может быть указано соединение (с R1=R2=трет-бутил) с наименованием N-(3,5-ди-трет-бутилсалицилметилен)-трет-лейцинол.
Моноокисления предпочтительно достигают с использованием, особенно пероксида водорода, в соответствующем растворителе, таком как кетон, например, ацетон, например, в условиях, описанных Ellman et al. (cf. D. J. Weix, J. A. Ellman, Org. Lett. 2003, 5, 1317) в присутствии ванадильного комплекса, особенно ванадил-бис-ацетилацетоната, в соответствующем растворителе или смеси растворителей, например, кетоне, таком как ацетон, предпочтительно при низких температурах, например, в интервале от -20 до 20°C, например, от -5 до 5°C.
Полученное сульфинилсульфидное соединение формулы (XIII), особенно (XIII-a), затем взаимодействует в условиях SN2 замещения с амидом металла, особенно амидом щелочного металла, таким как амид лития, в соответствующем растворителе или смеси растворителей, например, NH3 в циклическом эфире, таком как тетрагидрофуран, предпочтительно при низких температурах, например, в интервале от -100 до 0°C, например, от -80 до -50°C, что приводит к сульфинамиду формулы (IX), особенно, формулы (IX-a).
Реакция согласно СХЕМАМ 8, 8-a и 8-aa:
В другом варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями), который включает взаимодействие соединения формулы (I), особенно (I-a), где Ra представляет собой водород, или его соль, с гидроксиламином или его солью, получая на выходе соединение формулы (XVII), особенно формулы (XVII-a), где Ra представляет собой водород, если начинают от соединения формулы (I), особенно (I-a), где Ra представляет собой водород, или его соли.
Реакция предпочтительно происходит с солью гидроксиламина, например, гидрохлоридом гидроксиламина, в соответствующем растворителе или смеси растворителей, например, в спирте, таком как этанол, в присутствии основания, например, пиридина, при предпочтительных температурах в интервале от 0 до 100°C, например, в интервале от 20 до 90°C.
Реакция предпочтительно сопровождается способом (также образующим отдельный вариант осуществления изобретения), включающий циклизацию соединения формулы (XVII), особенно формулы (XVII-a), с получением циклического соединения O-ацилоксима формулы (XVIII), особенно формулы (XVIII-a).
Циклизация предпочтительно происходит в присутствии кислоты, такой как органическая кислота, например, сульфоновая кислота, такая как, п-толуолсульфоновая кислота, присутствующая в стехиометрических или каталитических количествах, предпочтительно в каталитических количествах, например, от 0,05 до 0,5 эквив., в соответствующем растворителе или смеси растворителей, например, в толуоле, например, при повышенных температурах от 50°C до температуры кипячения с обратным холодильником реакционной смеси, такой как от 70 до 90°C.
Соединение формулы (XVIII), особенно (XVIII-a), может затем быть дополнительно преобразовано (в дополнительном способе согласно изобретению, либо в виде единственной стадии или с использованием предыдущих стадий выше) посредством способа, включающего восстановление циклического O-ацилоксима с предоставлением соединения формулы (VIII), особенно формулы (VIII-a), или его соли, соответственно, где Ra представляет собой водород или карбоксилзащитную группу или особенно C1-C6-алкил, более особенно этил. Восстановления производных циклического оксима в соответствующие амины обычно достигают с использованием катализируемых металлами реакций гидрирования (например, Pd или Rh на твердых носителях, таких как активированный углерод или оксид алюминия или никель Рэнея) или комплексных гидридов (например, боргидрида натрия или алюмогидрида лития).
Альтернативного прямого восстановления свободного оксима формулы (XVII), предпочтительно, свободного оксима формулы (XVII-a) до соответствующих аминов формулы (VIII) можно, как правило, достичь катализируемых металлами реакций гидрирования (например, Pd или Rh на твердых носителях, таких как активированный углерод или оксид алюминия или никель Рэнея) или комплексных гидридов (например, боргидрида натрия или алюмогидрида лития).
Восстановления можно достичь, используя водород в присутствии катализатора из переходного металла, такого как RhCl(PPh3)3, [Ru(S)-BINAP(п-цимол)Cl]Cl, Pd/C или Pt/C (если желательно, в присутствии кислоты, например, бензойной кислоты), например, при повышенном давлении до 30 бар, в соответствующем растворителе или смеси растворителей, например, ТГФ, метаноле или ТГФ/вода, например, при температурах от 20°C до 80°C, таким образом, как от 25 до 70°C; или восстановлением при двухстадийном подходе, состоящем из (1) восстановления C-N двойной связи, используя агент гидрирования, например, боргидрид натрия, с последующим (2) восстановлением N-O связи, используя водород и катализатор, например, катализатор из благородного металла с носителем или без носителя, такой как Pt или Pd или Pd или Pt на древесном угле, например, в соответствующем растворителе, таком как спирт, например, метанол или этанол, при температурах, например, в интервале от 0°C до температуры кипячения с обратным холодильником, например, от 20 до 50°C.
Реакция согласно СХЕМАМ 9, 9-a и 9-aa:
В другом варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другими предшествующими и последующими стадией или стадиями), который включает взаимодействие соединения формулы (I), особенно (I-a), где Ra представляет собой водород, или его соль, с аммиаком или солью аммония, получая на выходе соединение формулы (XIX), особенно (XIX-a). Соединение может также присутствовать в виде смеси изомеров по двойным связям в любом отношении.
Реакция предпочтительно происходит с солью аммония, например, ацетатом аммония, в соответствующем растворителе или смеси растворителей, например, в органической кислоте, такой как уксусная кислота, при предпочтительных температурах в интервале от 50 до 150°C, например, в интервале от 100 до 140°C.
Реакция предпочтительно сопровождается способом, включающим восстановление соединения формулы (XIX), особенно (XIX-a), с получением соединения циклического лактама формулы (XX), особенно формулы (XX-a).
Восстановление предпочтительно происходит с использованием водорода в присутствии катализатора из переходного металла, такого как Pd/C, например, при повышенном давлении до 10 бар, например, в интервале 3-8 бар, в соответствующем растворителе или смеси растворителей, например, метаноле, например, при температурах от 20°C до 150°C, таких как от 80 до 140°C. Другие возможные методы восстановления включают восстановление C-N двойной связи с использованием гидрирующего реагента, отличного от водород, например, соли гидрида, такой как алюмогидрид лития (см. например, (Chem. Ber. 1971, 104, 2134-2142)).
Соединение (XX), особенно соединение (XX-a), затем может быть преобразовано в соединение (VIII), особенно в соединение (VIII-a), как описано, например, в WO 2008/083967A, особенно ее Примерах 7 и 13. Соединение (VIII) с Ra=H может быть получено обработкой соединения (XX) в водных кислых условиях, например, нагревом соединения (XX) в смеси уксусной кислоты и концентрированной хлористоводородной кислоты при кипячении с обратным холодильником. Соединение (VIII) с Ra=C1-C6-алкил может быть получено обработкой соединения (XX) неорганической кислотой (например, серной кислотой или хлористоводородной кислотой) или органической кислотой (например, п-толуолсульфоновой кислотой) в присутствии спирта, потенциально используемого в качестве растворителя реакции, при повышенной температуре (например, 80-120°C).
Реакция согласно СХЕМАМ 10, 10-a и 10-aa
В другом варианте осуществления, превращение включает способ (образующий вариант осуществления настоящего изобретения, по отдельности или немедленно, или с другим предшествующими и последующими стадией или стадиями) который включает взаимодействие соединения формулы (I), особенно (I-a), где Ra представляет собой водород или карбоксилзащитную группу или особенно C1-C6-алкил, более особенно, этил, с О-замещенным гидроксиламином, выбранным из:
 и
и 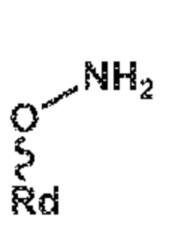
или в каждом случае, его солью, где Rc и Rd независимо выбирают из C1-C6-алкила, C6-C10-арила, C6-C10-арил-C1-C6-алкила, C3-C8-циклоалкила, C3-C8-циклоалкил-C1-C6-алкила, гетероциклила или гетероциклил-C1-C6-алкила, где указанный гетероциклил представляет собой полициклическую, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему с 5-14 атомами в кольце и с одним или несколькими гетероатомами, независимо выбранными из азота, кислорода, серы, S(=O)- или S-(=O)2, и, где каждая арильная или гетероциклильная группа может быть необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из галогена, C1-C7-алкила, галоген-C1-C7-алкила, и C1-C7-алкокси, галоген-C1-C7-алкокси и C1-C7-алкокси-C1-C7-алкила; предпочтительно O-(C1-C6-алкил-ацил)-гидроксиламина, O-(C6-C10-арил-C1-C6-алкил)-гидроксиламина или O-C1-C6-алкил-гидроксиламина, или в каждом случае его соль, с получением на выходе соединения формулы (XVII***), особенно (XVII***-a), или его соль, соответственно.
Реакция с О-замещенным гидроксиламином предпочтительно происходит в присутствии кислоты, такой как органическая кислота, например, сульфоновая кислота, такая как п-толуолсульфоновая кислота, присутствующая в стехиометрических или каталитических количествах, предпочтительно в каталитических количествах, например, от 0,05 до 0,5 эквив., в соответствующем растворителе или смеси растворителей, например, в толуоле, например, при повышенных температурах от 50°C до температуры кипячения с обратным холодильником реакционной смеси, такой как от 70 до 90°C.
Заместители Rc и Rd предпочтительно выбирают таким образом, чтобы избежать циклизации соединения формулы (XVII***) в соединение формулы (XVIII) (см. СХЕМУ 8), и/или - если желательно - могут удаляться, чтобы получить на выходе соответствующее соединение, где A представляет собой гидроксил, т.е. соединение формулы (XVII).
Альтернативно, чтобы избежать циклизации, в соединении формулы (XVII***) Ra может иметь одно из указанных значений, отличных от водорода.
Соединение формулы (XVII***), особенно (XVII***-a) может затем быть дополнительно преобразовано (в дополнительном способе согласно настоящему изобретению, либо в виде единственной стадии или с использованием предыдущих реакций, приведенных выше) посредством способа, включающего восстановление группы O-замещенного оксима с предоставлением соединения формулы (VIII), особенно формулы (VIII-a), или его соли, соответственно, где Ra представляет собой водород или карбоксилзащитную группу или особенно C1-C6-алкил, более особенно, этил. Восстановления производных оксимов в соответствующие амины, как правило, достигают, используя реакции гидрирования, катализируемые металлами (например, Pd или Rh на твердых носителях, как активированный углерод или оксид алюминия или никель Рэнея) или комплексными гидридами (например, боргидридом натрия или алюмогидридом лития).
Восстановления можно достичь, используя водород в присутствии катализатора из переходного металла, такого как RhCl(PPh3)3, [Ru(S)-BINAP(п-цимол)Cl]Cl, Pd/C или Pt/C (если желательно, в присутствии кислоты, например, бензойной кислоты), например, при повышенном давлении до 30 бар, в соответствующем растворителе или смеси растворителей, например, ТГФ, метаноле или ТГФ/вода, например, при температурах от 20°C до 80°C, таким образом, как от 25 до 70°C; или восстановлением при двухстадийном подходе, состоящем из (1) восстановления C-N двойной связи, используя агент гидрирования, например, боргидрид натрия, с последующим (2) восстановлением N-O связи, используя водород и катализатор, например, катализатор из благородного металла с носителем или без носителя, такой как Pt или Pd или Pd или Pt на древесном угле, например, в соответствующем растворителе, таком как спирт, например, метанол или этанол, при температурах, например, в интервале от 0°C до температуры кипячения с обратным холодильником, например, от 20 до 50°C.
Усовершенствованная реакция соединения формулы (VIII) с получением ингибитора NEP
В другом варианте осуществления настоящего изобретения, промежуточные соединения, в частности, новые соединения формулы (XV), в частности, соединения формулы (I) или (II), и соединения формулы (XVI), в частности, соединения формул (X), (XVII), (XVII*), (XVII**), (XVIII), и (IX), или их предпочтительный стереоизомер, как отображено выше, и продукты способа согласно настоящему изобретению могут применяться в синтезе ингибиторов NEP или их солей или пролекарств, в частности, они могут применяться в синтезе ингибиторов NEP, содержащих γ-амино-δ-бифенил-α-метилалкановую кислоту, или каркас сложного эфира кислоты. Ингибиторы NEP или их пролекарства, содержащие γ-амино-δ-бифенил-α-метилалкановую кислоту, или каркас сложного эфира кислоты включают, например, пролекарство ингибитора NEP, этилового сложного эфира N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты и соответствующий ингибитор NEP, N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановую кислоту.
Термин "ингибитор NEP" описывает соединение, которое ингибирует активность фермента нейтральной эндопептидазы (NEP, EC 3.4.24.11).
Соединения формулы (VIII) или их соли, предпочтительно, соединения формулы (VIII-a), или их соли, более предпочтительно, соединения формулы (VIII-aa), или их соли, как описано выше в описании настоящего изобретения могут дополнительно взаимодействовать с ингибитором NEP или их солями или их пролекарством, в частности, с пролекарством ингибитора NEP, этиловым сложным эфиром N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенил-метил)-4-амино-(2R)-метилбутановой кислотой или соответствующим ингибитором NEP N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислотой, как описано Ksander et al. in J. Med. Chem. 1995, 38, 1689-1700, или как описано в WO 2008/31567.
В предпочтительном варианте осуществления настоящего изобретения соединение согласно формуле (VIII), предпочтительно, соединение формулы (VIII-a), более предпочтительно, соединение формулы (VIII-aa), или его соль, дополнительно взаимодействует с получением пролекарства ингибитора NEP формулы (10)
 (10),
(10),
предпочтительно, пролекарства формулы (10-a)
 (10-a),
(10-a),
где R1 представляет собой водород или C1-C6-алкил, предпочтительно этил, посредством реакции с янтарной кислотой или ее производным, предпочтительно, с ангидридом янтарной кислоты.
Удаление защитных групп азотной функциональности, т.е. удаление Boc-группы, - если необходимо - повторное введение группы этилового сложного эфира, и последовательное сочетание с янтарным ангидридом доставляет желательное пролекарственное соединение ингибитора NEP. Необязательно, сложный эфир может быть омылен до свободной кислоты, предоставляя лекарственное соединение ингибитора NEP.
В одном варианте осуществления, соединение формулы (10-a) представляет собой этиловый сложный эфир N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты (известный в данной области как AHU377) или его соль.

Пролекарство ингибитора, этиловый сложный эфир N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты необязательно дополнительно взаимодействует с получением ингибитора NEP, N-(3-карбокси-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты.
Например, это преобразование может выполняться с использованием Boc-защищенной аминокислоты, например, согласно СХЕМЕ Z, приведенной ниже, где Boc соответствует R' и R'' представляет собой H в формуле (8-a) и R1 представляет собой H, и аминоэтилового сложного эфира (верхняя правая формула на СХЕМЕ Z ниже с R'=H, R''=H, R1=Et). Если R1 является этилом, реакция проходит идентично. Если R1 является другой алкильной группой, тогда прежде необходимо провести переэтерификацию или омыление.
СХЕМА Z:
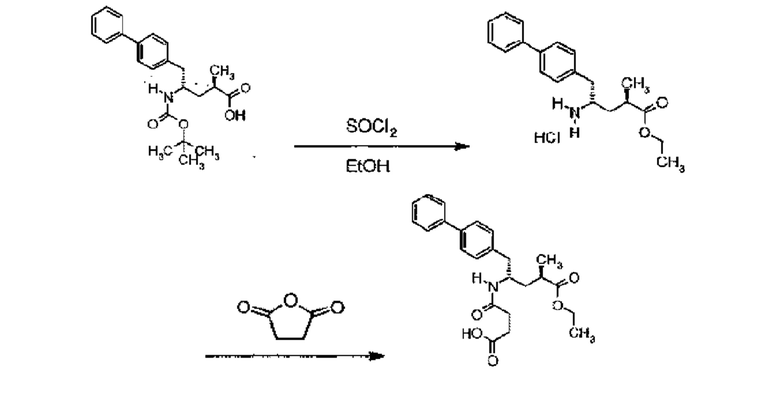
Если требуется дополнительная конверсия в соответствующие соли, ее можно достичь посредством выполнения следующих дополнительных стадий:
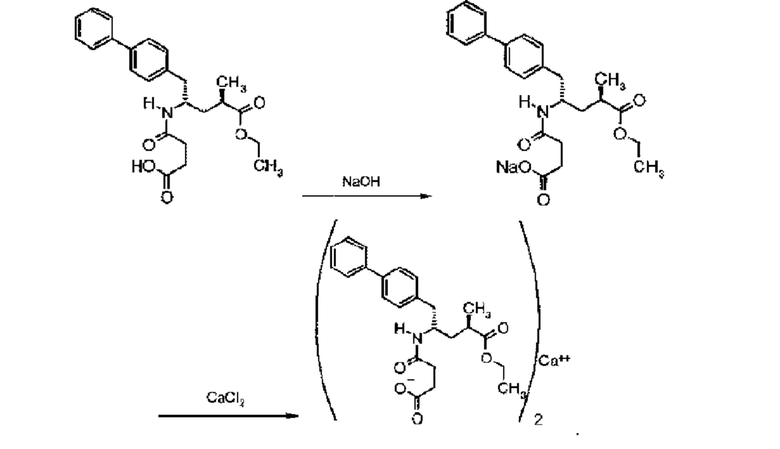
Условия для этих реакций известны специалисту в данной области техники (см. например, WO 2008/031567).
Соединения
Настоящее изобретение также относится к новым соединениям, указанным выше и ниже. Из этих соединений, соединения, указанные конкретно в Примерах, являются наиболее предпочтительными.
Примеры
Следующие прмеры предназначены для иллюстрации настоящего изобретения без ограничения его обхема, в то время как, они с другой стороны, представляют предпочтительные варианты осуществления стадий реакций, промежуточных соединений и/или способа согласно настоящему изобретению.
СОКРАЩЕНИЯ
Водн., водн. Водный
Ac ацетил
Bu бутил
КДИ N,N-карбонилдиимидазол
Et этил
ч час (часы)
Me метил
мин минута (минуты)
ЯМР ядерный магнитный резонанс
Pd/C палладий на углероде
Ph фенил
КТ комнатная температура
В приведенных данных ЯМР используют следующие сокращения: с, синглет; д, дублет; т, триплет; кв., квартет; квинт., квинтет; м, мультиплет.
Следует отметить, что в Примерах номера соединений, такие как 1 или 2, являются отличающимися и отдельными от номеров соединений, представленных в скобках выше, и в формуле изобретения, такие как просто (1) или (2), чтобы пояснить парадигматически.
Общая схема I
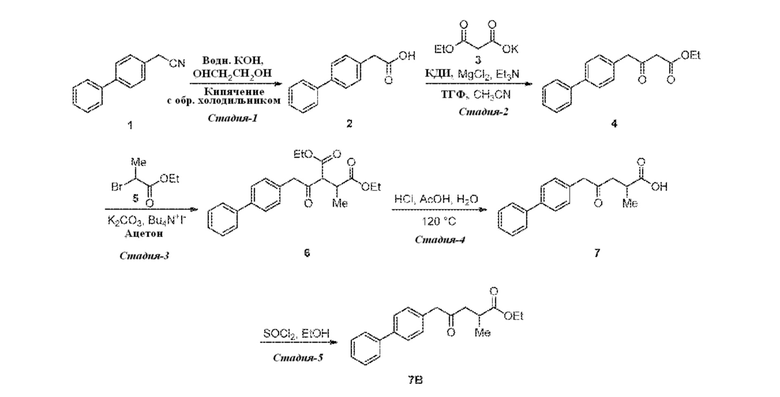
Пример 1. Стадия-1 - получение 2-([1,1'-бифенил]-4-ил)уксусной кислоты 2
К раствору 2-([1,1'-бифенил]-4-ил)ацетонитрила 1 (например, от Sigma-Aldrich, номер по каталогу 133612, CAS № 31603-77-7) (100 г, 517,46 ммоль) в этиленгликоле (1000 мл) добавляют раствор гидроксида калия (590 г, 10515 ммоль) в воде (1000 мл), и полученную в результате смесь нагревают до 120°C и перемешивают в течение 16 ч. Реакционную смесь охлаждают до 0°C и подкисляют концентрированной HCl при перемешивании. Отделенное твердое вещество собирают фильтрацией, промывают водой и сушат. Твердое вещество растворяют в этилацетате и этилацетатный слой промывают водой, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением твердого вещества белого цвета. Твердое вещество переносят в петролейный эфир, перемешивают в течение ~30 мин, отфильтровывают и сушат с получением 2-([1,1'-бифенил]-4-ил)уксусной кислоты 2 в виде твердого вещества белого цвета. (107,2 г, 97,6%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,41 (шир. с, 1 H), 7,59-7,66 (м, 4 H), 7,44-7,47 (м, 2 H); 7,34-7,37 (м, 3 H), 3,61 (с, 2 H) мд; МС (MM-ЭР, APCI): режим отрицательных ионов 257,0 [M+HCO2]-.
Пример 2. Стадия-2 - получение этил 4-([1,1'-бифенил]-4-ил)-3-оксобутаноата 4
К раствору 2-([1,1'-бифенил]-4-ил)уксусной кислоты 2 (107 г, 504,12 ммоль) в тетрагидрофуране (1000 мл) при 0°C в атмосфере N2 по частям добавляют N,N-карбонилдиимидазол (64,1 г, 395,3 ммоль), и полученную в результате смесь перемешивают при такой же температуре в течение 15 мин и затем нагревают до комнатной температуры и перемешивают в течение 16 ч. В отдельной колбе, к перемешиваемой суспензии этилмалоната калия 3 (138 г, 810,76 ммоль) в ацетонитриле (1000 мл) при 0°C в атмосфере N2 добавляют хлорид магния (96 г, 1008,3 ммоль) с последующим добавлением триэтиламина (160 мл, 1147,9 ммоль) и перемешивают при такой же температуре в течение 3 ч и при комнатной температуре в течение 2 ч. Смесь активированной кислоты затем по каплям добавляют к перемешиваемой суспензии соли магния, и полученную в результате смесь затем перемешивают при комнатной температуре в течение 24 ч. Раствор гидросульфата натрия (600 г) в H2O (2 л) затем добавляют к реакционной смеси и перемешивают в течение 5 мин. Смесь далее разбавляют водой и экстрагируют этилацетатом. объединенный органический слой промывают водой, водн. раствором 5% NaOH, окончательно насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением твердого вещества коричневого цвета. Полученный неочищенный продукт очищают колоночной хроматографией (силикагель, 230-400 меш; элюент: 0-20% этилацетат в петролейном эфире). Полученное твердое вещество суспендируют в смеси петролейного эфира и диэтилового эфира (8:2), фильтруют, промывают петролейным эфиром и сушат с получением этил-4-([1,1'-бифенил]-4-ил)-3-оксобутаноата 4 в виде твердого вещества грязно-белого цвета (128 г, 89,9%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,59-7,66 (м, 4 H), 7,42-7,47 (м, 2 H), 7,32-7,37 (м, 1 H), 7,25-7,28 (м, 2 H), 4,10 (кв., 2 H), 3,91 (с, 2 H), 3,68 (с, 2 H), 1,18 (т, 3 H) мд.
Пример 3. Стадия-3 - получение диэтил-2-(2-([1,1'-бифенил]-4-ил)ацетил)-3-метилсукцината 6
К перемешиваемой смеси этил-4-([1,1'-бифенил]-4-ил)-3-оксобутаноата 4 (64 г, 226,68 ммоль) добавляют карбонат калия (63 г, 455,83 ммоль) и йодид тетрабутиламмония (17 г, 46,02 ммоль) в ацетоне (1800 мл) при 0°C в атмосфере N2, по каплям добавляют этил 2-бромпропионат 5 (26,5 мл, 204,06 ммоль), и полученную в результате смесь перемешивают при комнатной температуре в течение 48 ч. Реакционную смесь концентрируют при пониженном давлении для удаления ацетона, и остаток разбавляют водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением неочищенного продукта 6 в виде вязкого масла вино-красного цвета (159 г).
Полученный неочищенный продукт отбирают для следующей стадии без дополнительной очистки.
Пример 4. Стадия-4 - получение 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7
Смесь диэтил-2-(2-([1,1'-бифенил]-4-ил)ацетил)-3-метилсукцината 6 (159 г, 415,73 ммоль), уксусной кислоты (1500 мл), концентрированной хлористоводородной кислоты (1500 мл) и воды (750 мл) нагревают до 120°C и перемешивают в течение 6 ч. Реакционную смесь концентрируют при пониженном давлении, и остаток разбавляют водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением неочищенного продукта.
Полученный неочищенный продукт очищают колоночной хроматографией (два раза) (силикагель, 230-400 меш; элюент: 0-35% этилацетат в петролейном эфире) и затем полученное твердое вещество промывают петролейным эфиром и сушат с получением 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7 в виде твердого вещества белого цвета (55,3 г, 47,1%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,13 (шир. с, 1H), 7,61-7,67 (м, 4 H), 7,45-7,48 (м, 2 H), 7,34-7,38 (м, 1 H), 7,27-7,29 (м, 2 H), 3,82 (с, 2 H), 2,88 (дд, 1 H), 2,72 (ддкв., 1 H), 2,57 (дд, 1 H), 1,06 (д, 3 H) мд; МС (MM-ЭР, APCI): режим отрицательных ионов 281,0 [M - H]-.
Пример 5. Стадия-5 - получение этилового сложного эфира 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7B
К раствору 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7 (55 г, 194,8 ммоль) в этаноле (500 мл), добавляют тионилхлорид (43 мл, 589,5 ммоль), и полученную в результате смесь перемешивают при 80°C в течение 3 ч.
Реакционную смесь концентрируют при пониженном давлении для удаления летучих продуктов, и остаток разбавляют водой и экстрагируют этилацетатом. Объединенный органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением неочищенного продукта.
Полученный неочищенный продукт смешивают с продуктом, полученным в другой партии (~14,1 г) и очищают колоночной хроматографией (дважды) (силикагель, 230-400 меш; элюент: 0-3% этилацетата в петролейном эфире). Продукт 7B собирают в двух фракциях в виде вязких масел бледно-желтого цвета. (Обе фракции растворяют в дихлорметане и концентрируют при пониженном давлении при 45°C). Фракция-1: 50,5 г (>99% чистоты); Фракция-2: 17 г (~95% чистоты).
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,56-7,61 (м, 4 H), 7,43-7,47 (м, 2 H), 7,34-7,38 (м, 1 H), 7,27-7,30 (м, 2 H), 4,13 (кв., 2 H), 3,77 (с, 2 H), 2,93-3,01 (м, 2 H), 2,50-2,57 (ддкв., 1 H), 1,25 (т, 3 H), 1,17 (д, 3 H) мд; 13C-ЯМР (100 МГц, ДМСО-d6): δ 206,3, 175,7, 140,7, 140,0, 133,0, 129,9, 128,8, 127,5, 127,3, 127,1, 60,6, 49,8, 45,1, 34,9, 17,1, 14,2 мд; МС (MM-ЭР, APCI): режим положительных ионов 311,0 [M+H]+; ИК-спектр: 3029, 2977, 2361, 1717, 1603, 1519, 1486, 1458, 1403, 1375, 1338, 1262, 1184, 1041, 925, 837, 760, 737, 697 см-1.
Общая схема II:

Пример 6. Синтез (R)-4-метокси-2-метил-4-оксобутановой кислоты 12
Соединение 12 является доступным для приобретения и может быть получено в соответствии с методиками из литературных источников (например, Adv. Synth. Catal. 2003, 345, 308-322; Adv. Synth. Catal. 2004, 346, 1263-1266; Chem. Eur. J. 2009, 15, 3983-4010; Chem. Eur. J. 2012, 18, 14267-14271) из 4-метокси-2-метилен-4-оксобутановой кислоты 11.
Пример 7. Синтез ( R )-5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7
Раствор 4-бифенилуксусной кислоты 2 (10,0 г, 45,70 ммоль, 1,00 эквив.) в ТГФ (36 мл) при 35°C обрабатывают 20% раствором iPrMgCl⋅LiCl в ТГФ (100 г, 137,7 ммоль, 3,00 эквив.) в течение 20 мин. После перемешивания в течение 1,5 ч, раствор охлаждают до 0°C. В отдельной колбе, раствор соединения 12 (8,45 г, 54,83 ммоль, 1,20 эквив.) в ТГФ (48 мл) при -15°C обрабатывают 20% раствором iPrMgCl⋅LiCl в ТГФ (41,8 г, 57,56 ммоль, 1,25 эквив.) в течение 20 мин. После перемешивания при -15°C в течение 10 мин, раствор нагревают до комнатной температуры и дополнительно перемшивают при этой температуре в течение 45 мин перед добавлением в течение 1 ч к ранее полученному раствора дианиона 4-бифенилуксусной кислоты 2. Раствор нагревают до 5°C и перемешивают в течение 15 ч перед погашением посредством добавления 1 M водной HCl (240 мл). Реакционную смесь перемешивают в течение 30 мин, затем экстрагируют изопропилацетатом (2 × 200 мл). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют в вакууме с получением соединения 7 в виде неочищенного продукта.
Общая схема III:
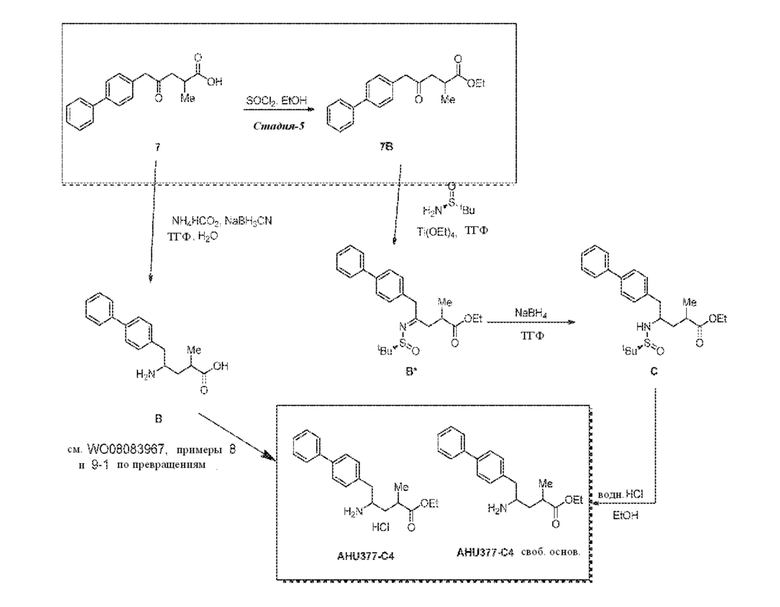
Пример 8. Получение 5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановой кислоты B
Ацетат аммония (1,45 г, 18,81 ммоль) добавляют к раствору 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты 7 (242 мг, 0,857 ммоль) в смеси ТГФ и воды (1:1 об/об, 2,5 мл) при комнатной температуре. Суспензию желтого цвета обрабатывают цианборгидридом натрия (58 мг, 0,923 ммоль) и перемешивают при 40°C в течение ночи. Водную 6 M хлористоводородную кислоту (5 мл) медленно добавляют для контроля выделения газа, с последующим добавлением этилацетата (8 мл). Фазы разделяют, и органический слой концентрируют при пониженном давлении. К остатку добавляют этилацетат, и растворитель удаляют при пониженном давлении с получением соответствующей гидрохлоридной соли 5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановой кислоты B в виде твердого вещества бежевого цвета (250 мг, 91,2%, др 45:55 с преобладанием син-изомера).
1H-ЯМР (400 МГц, ДМСО-d6, син-изомер): δ 12,35 (шир. с, 1 H), 8,24 (шир. с, 3 H), 7,64-7,68 (м, 4 H), 7,44-7,48 (м, 2 H), 7,33-7,37 (м, 3 H), 3,09 (дд, 1 H), 2,89 (дд, 1 H), 2,65 (ддкв., 1 H), 1,93 (ддд, 1 H), 1,48 (ддд, 1 H), 1,01 (д, 3 H); 1H-ЯМР (500 МГц, ДМСО-d6, анти-изомер): δ 12,31 (шир. с, 1 H), 8,19 (шир. с, 3 H), 7,64-7,68 (м, 4 H), 7,44-7,48 (м, 2 H), 7,34-7,38 (м, 3 H), 3,42 (шир. с, 1 H), 3,05 (дд, 1 H), 2,89 (дд, 1 H), 2,65 (ддкв., 1 H), 1,86 (ддд, 1 H), 1,58 (ддд, 1 H), 1,06 (д, 3 H) мд; МС (ES-API): режим положительных ионов 284,1 [M+H]+.
Пример 9. (2 R ,4 S )-этил 5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентаноат (AHU377-C4)
К раствору (R)-этил-5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентаноата (100 мг, 0,322 ммоль) в ТГФ (5 мл) при комнатной температуре добавляют (S)-2-метилпропан-2-сульфинамида (43 мг, 0,355 ммоль, Sigma-Aldrich, номер по каталогу 497401), с последующим добавлением этоксида титана (294 мг, 1,289 ммоль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 12 ч, затем охлаждают и по каплям добавляют при 0°C к суспензии боргидрида натрия (37 мг, 0,978 ммоль) в ТГФ (5 мл). Реакционную смесь дополнительно перемешивают при комнатной температуре в течение 1 ч, затем охлаждают до 0°C. Добавляют водную 3 M хлористоводородную кислоту (20 мл), и фазы разделяют. Органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток растворяют в этаноле (3 мл), с последующим добавлением водной 6M хлористоводородной кислоты (2 мл). Реакционную смесь последовательно нагревают до 120°C в микроволновой печи в течение 30 мин. После концентрирования в вакууме, остаток переносят в воду и дихлорметан. Фазы разделяют, и органический слой очищают препаративной ТСХ с получением этил-5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентаноата (AHU377-C4) (20 мг, 19,9%; (2R,4S):(2S,4R):(2S,4S):(2R,4R) 52:10:11:27) в виде смеси диастереоизомеров, с желательным (2R,4S)-этил 5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентаноатом в виде основного изомера.
1H-ЯМР (400 МГц, ДМСО-d6, (2R,4S)-изомер в виде гидрохлоридной соли): δ 8,30 (шир. с, 3 H), 7,64-7,68 (м, 4 H), 7,44-7,48 (м, 2 H), 7,34-7,37 (м, 3 H), 3,98 (кв., 2 H), 3,38 (дддд, 1 H), 3,09 (дд, 1 H), 2,82 (дд, 1 H), 2,76 (ддкв., 1 H), 1,86 (ддд, 1 H), 1,62 (ддд, 1 H), 1,09 (т, 3 H), 1,07 (д, 3 H) мд; МС (ЭР-API): режим положительных ионов 312,4 [M+H]+.
Общая схема IV:
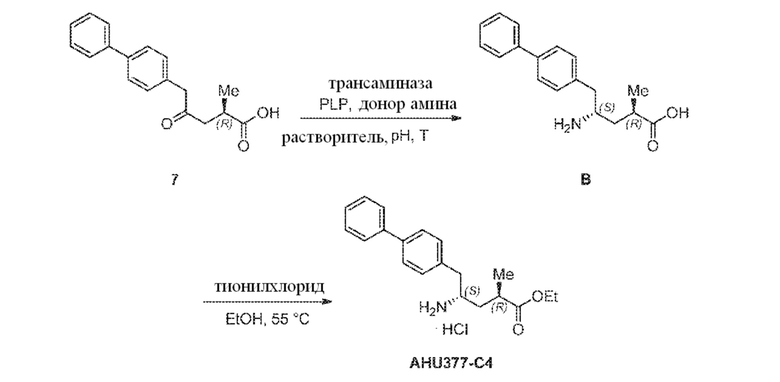
Пример 10. (2R,4S)-5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановая кислота B
Гидрохлорид изопропиламина (19,95 г, 208,8 ммоль) растворяют в водном растворе 0,1 M K2HPO4 (100 мл; pH 9,36), затем добавляют пиридоксаль-5'-фосфат (PLP) (27 мг). Значение pH доводят до pH 9,00 добавлением изопропиламина. (R)-5-([1,1'-Бифенил]-4-ил)-2-метил-4-оксопентановую кислоту 7 (40 мг, 0,142 ммоль) суспендируют в 1800 мкл этого буферного раствора и суспендируют, используя ультразвук в течением 2 мин, с последующим доведением до pH 9,00 добавлением изопропиламина. Трансаминазу ATA-447 (30 мг; Codexis Inc., Redwood City, CA, USA) растворяют в 200 мкл буферного раствора и встряхивают в течение 5 мин, затем добавляют к реакционной смеси. Реакционную смесь встряхивают при 50°C и 180 об/мин в течение 5 д, обеспечивая 78% конверсию в желательный продукт B с др > 99:1.
Общая схема V:
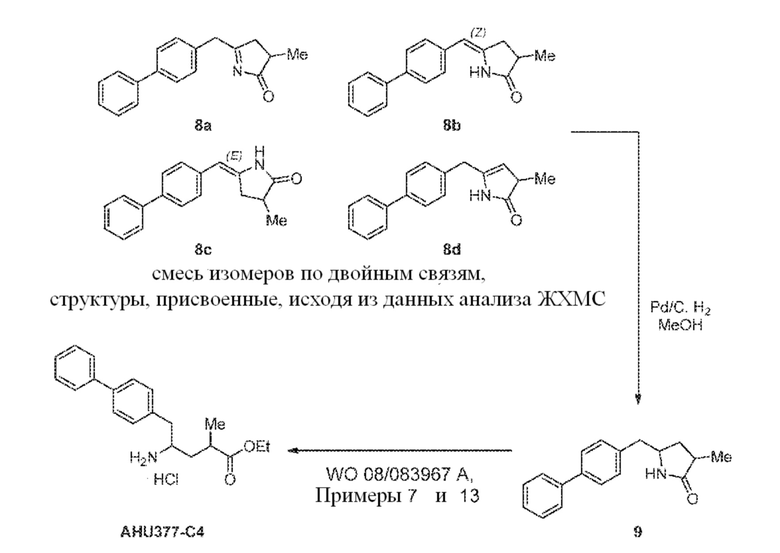
Пример 11. Получение 5-([1,1'-бифенил]-4-илметил)-3-метилпирролидин-2-она
Ацетат аммония (3,32 г, 43,07 ммоль) добавляют к раствору 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты (1,52 г, 5,38 ммоль) в уксусной кислоте (18 мл) с получением суспензии в устойчивом к давлению пузырьке для микроволоновой печи, который немедленно герметично закрывают. Пузырек помещают в масляную баню при комнатной температуре и далее нагревают до 130°C. Через 17 ч, пузырек охлаждают до комнатной температуры перед открытием, и раствор желтого цвета распределяют между метилендихлоридом (30 мл) и раствором 0,1 M дикалийгидрофосфата (30 мл раствора 1,74 г в 100 мл воды). Водную фазу промывают метилендихлоридом и объединенные органические фазы экстрагируют дважды раствором 1 M дикалийгидрофосфата (30 мл раствора 17,4 г в 100 мл воды). Органическую фазу сушат над твердым сульфатом натрия и раствор упаривают посредством роторного испарения с получением твердого вещества желтого цвета (1,35 г, 95% приблизительный выход).
1H-ЯМР (400 МГц, CDCl3-d) мд 1,20-1,40 (м, 5 H) 1,93 (т, 3 H) 2,62 (с, 1 H) 2,69-2,85 (м, 3 H) 2,94 (дд, 2 H) 3,37 (ддд, 1 H) 4,25-4,31 (м, 1 H) 5,96 (т, 1 H) 6,59 (шир. с, 1 H) 6,75 (с, 1 H) 7,27-7,49 (м, 14 H) 7,52-7,67 (м, 11 H) 8,32 (шир. с, 1 H)
LC-МС (колонка: ACQUITY UPLC® HSS T3 1,8 мкм; температура колонки: 60,0°C; скорость потока 1,0 мл/мин; градиент от 5% до 98% B в течение 9,4 мин; элюент A: вода+0,05% муравьиной кислоты+3,75 мМ уксусной кислоты; элюент B: ацетонитрил+0,04% муравьин кислот); три основных сигнала, все m/z соответствуют массе пирролинонового продукта: 3,92 мин (27%); 4,34 мин (64%); 4,66 мин (9%).
Палладий на углероде (4 мг, 10% Джонсона-Мэтти DLR 0462) добавляют к раствору неочищенной смеси от предыдущего эксперимента (0,2 г, 0,76 ммоль) в метаноле (2 мл). Суспензию герметично закрывают, и свободное пространство многократно продувают азотом с последующим добавлением газообразного водорода, окончательно достигая давления 4 бар. Реакцию оставляют перемешивать в течение 4,5 ч при комнатной температуре, с последующим периодом в течение 24 ч при 130°C. После сброса давления и продувки свободного пространства азотом смесь продукта отфильтровывают для удаления катализатора, и затем подвергают анализу методом ВЭЖХ.
ВЭЖХ (ReproShell C18, 75 мм x 3 мм; температура колонки 35 °C; скорость потока 0,8 мл/мин; элюент A: 5 ммоль NaH2PO4, доведенного с использованием H3PO4 до pH 3; элюент B: ацетонитрил/метанол 2:3; градиент от 15% до 95% B). Относительную стереоселективность сравнивают с доступными эталонными соединениями, указывая на отношение 56:44 для отношения транс- к цис-изомеру соединения 9.
Общая схема IV:

Пример 12. Получение 3-([1,1'-бифенил]-4-илметил)-5-метил-4H-1,2-оксазин-6(5H)-она
Пиридин (10,4 мл, 128,3 ммоль) добавляют к суспензии 5-([1,1'-бифенил]-4-ил)-2-метил-4-оксопентановой кислоты (10,02 г, 35,12 ммоль) и гидроксиламина гидрохлорид (7,00 г, 98,65 ммоль) в абсолютном этаноле (120 мл). Реакционную смесь нагревают до кипячения с обратным холодильником и поддерживают при кипячении с обратным холодильником в течение 30 мин. После охлаждения до комнатной температуры, реакционную смесь концентрируют в вакууме. Остаток обрабатывают водой (80 мл) и этилацетатом (150 мл), и фазы разделяют. Водный слой экстрагируют этилацетатом (2 × 80 мл), и объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток совместно упаривают с толуолом (100 мл и 50 мл) для удаления остаточного пиридина, получая масло коричнево-бежевого цвета, которое отверждается при стоянии. Неочищенный продукт используют непосредственно на следующей стадии без очистки.
Моногидрат п-толуолсульфоновой кислоты (0,756 г, 3,97 ммоль) добавляют к суспензии продукта с предыдущей стадии в толуоле (120 мл). Активированные молекулярные сита 4 Å (6 г) и реакционную смесь нагревают до 80°C, с последующим перемешиванием при 80°C в течение 2 ч. Добавляют моногидрат п-толуолсульфоновой кислоты (0,653 г, 3,43 ммоль), и реакционную смесь дополнительно перемешивают при 80°C в течение 4 ч. После охлаждения до комнатной температуры, твердые вещества отфильтровывают. К фильтрату добавляют этилацетат (100 мл), и раствор экстрагируют водой (3 × 100 мл). Объединенные водные слои обратно экстрагируют этилацетатом (80 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением масла коричневато-желтого цвета. Продукт перекристализуют из смеси этилацетат/гептан 1:1 с получением 3-([1,1'-бифенил]-4-илметил)-5-метил-4H-1,2-оксазин-6(5H)-она в виде твердого вещества светло-бежевого цвета (3,17 г, 32,0%).
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,64-7,67 (м, 4 H), 7,44-7,48 (м, 2 H), 7,34-7,41 (м, 3 H), 3,75 (с, 2 H), 2,70 (ддкв., 1 H), 2,60 (дд, 1 H), 2,46 (дд, 1 H), 1,07 (д, 3 H) мд; МС (ЭР-API): режим положительных ионов 280,1 [M+H]+.
Пример 13. Получение 5-([1,1'-бифенил]-4-ил)-4-амино-2-метилпентановой кислоты
Смесь 3-([1,1'-бифенил]-4-илметил)-5-метил-4H-1,2-оксазин-6(5H)-она (28 мг, 0,100 ммоль) и 5% Pt/Al2O3 (6 мг; тип Джонсона-Мэтти B301099, 20% сухой массы) в метаноле (3 мл) гидрируют при 40°C и давлении водорода 3 бар в течение 3 ч. Реакционную смесь охлаждают и анализируют методом ВЭЖХ, получая 75% продукта по данным ВЭЖХ (др 65:35, с преобладанием (2R,4R)-изомера).
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПИРИДАЗИНОНОВЫЕ ГЕРБИЦИДЫ | 2016 |
|
RU2764746C2 |
| НОВЫЕ ХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2019 |
|
RU2792933C2 |
| НОВОЕ КОНДЕНСИРОВАННОЕ ПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2770727C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПИРАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ | 2018 |
|
RU2781426C2 |
| НОВЫЕ ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ, ИХ ПОЛУЧЕНИЕ, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 1998 |
|
RU2240326C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТРИАЗОЛА И ТОЛИЛТРИАЗОЛА ДЛЯ СНИЖЕНИЯ КОРРОЗИИ | 2017 |
|
RU2749854C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2015 |
|
RU2733400C2 |
| НОВЫЕ АЗАХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2018 |
|
RU2773290C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2004 |
|
RU2369601C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ И ОНКОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2009 |
|
RU2545023C9 |
Изобретение относится к новому химическому синтезу, новым промежуточным соединениям и катализаторам, применимым для получения сакубитрила - ингибитора неприлизина (NEP). Оно дополнительно относится к новым промежуточным соединениям и их применению для пути указанного нового химического синтеза. Так, например, изобретение относится к новому соединению формулы (XV) или его соли, в которой R5 выбирают из водорода и группы -CO-OR*, и Ra и R*, независимо друг от друга, выбирают из водорода и C1-C6-алкила.
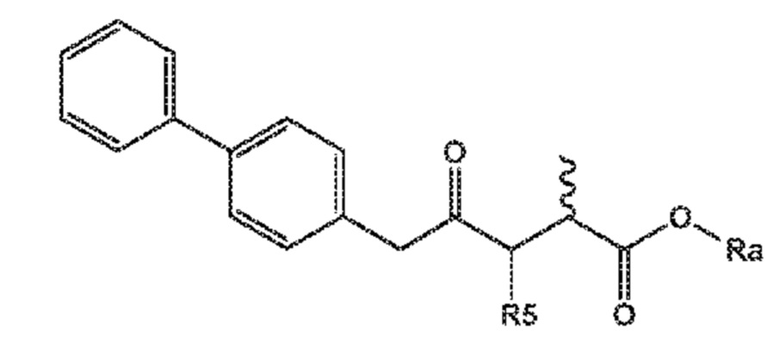 (XV). 11 н. и 7 з.п. ф-лы, 13 пр.
(XV). 11 н. и 7 з.п. ф-лы, 13 пр.
1. Соединение формулы (XV) или его соль
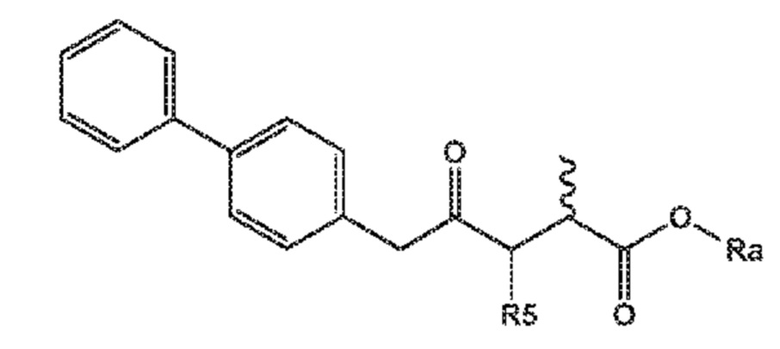 (XV),
(XV),
где
R5 выбирают из водорода и группы -CO-OR*, и
Ra и R*, независимо друг от друга, выбирают из водорода и C1-C6-алкила.
2. Соединение формулы (XV) по п. 1, где
а) соединение представляет собой соединение формулы (I) или его соль;
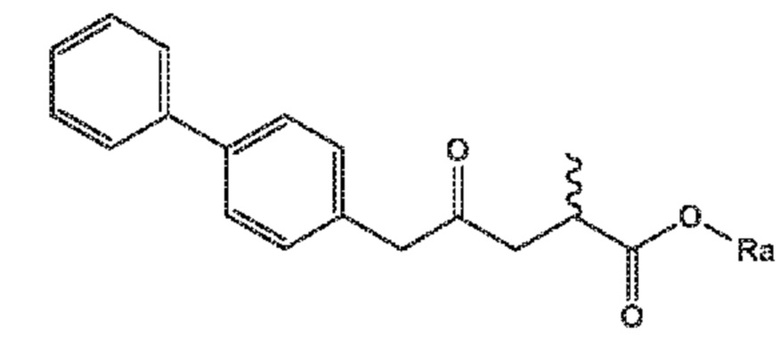 (I),
(I),
где Ra выбирают из водорода и C1-C6-алкилаили
b) соединение представляет собой соединение формулы (II), или его соль;
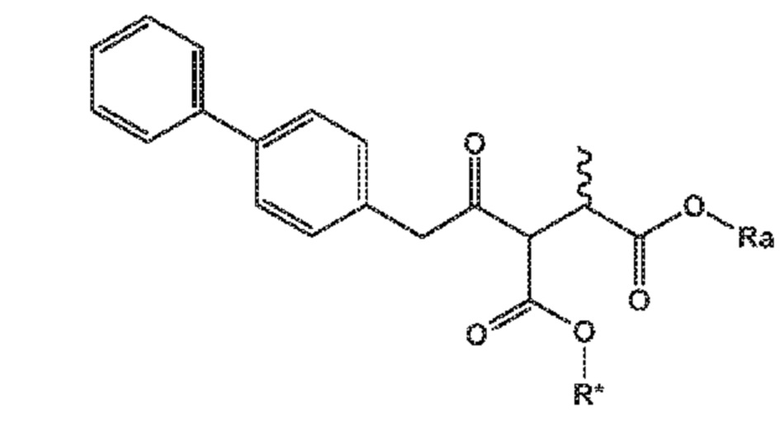 (II),
(II),
где Ra и R*, независимо друг от друга, выбирают из водорода и C1-C6-алкила.
3. Соединение формулы (XVI), или его соль
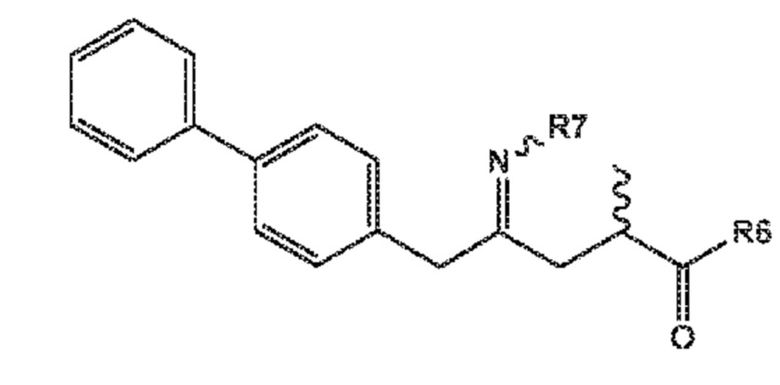 (XVI),
(XVI),
где
R6 представляет собой -O-Ra и R7 выбирают из
-S(=O)-Rb и
-OH,
где Ra выбирают из водорода и C1-C6-алкила, и
Rb представляет собой C1-C6-алкил, или
R6 и R7 вместе представляют -O-.
4. Соединение формулы (XVI) по п. 3, где
а) соединение представляет собой соединение формулы (X), или его соль;
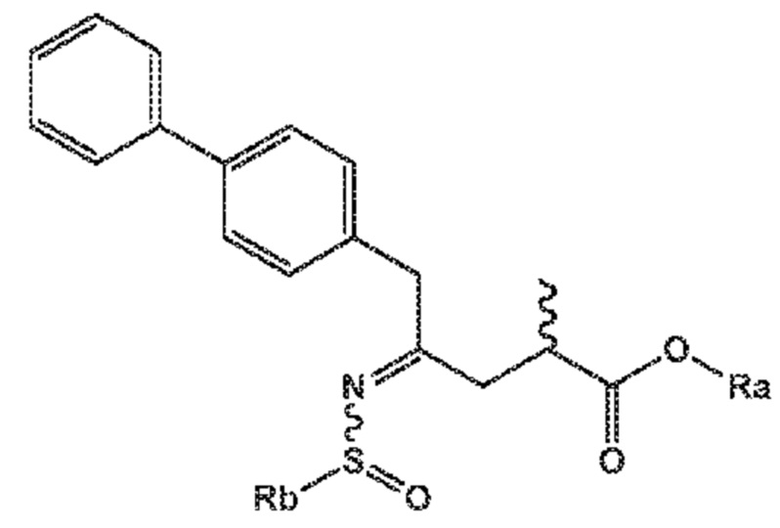 (X),
(X),
где
Ra выбирают из водорода и C1-C6-алкила,
Rb представляет собой C1-C6-алкил,
b) соединение представляет собой соединение формулы (XVII), или его соль
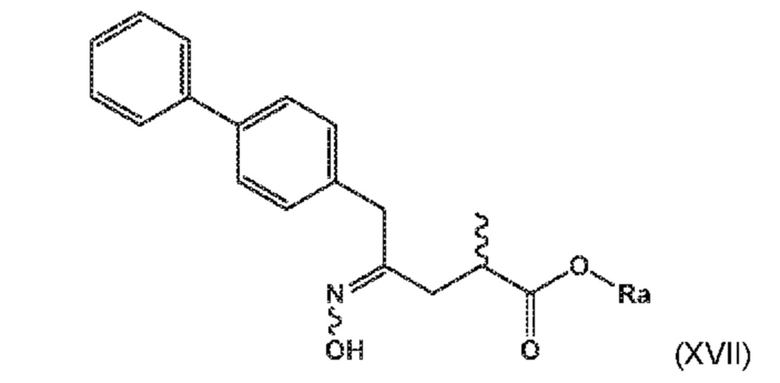 (XVII),
(XVII),
где Ra выбирают из водорода и C1-C6-алкила,
или
с) соединение представляет собой соединение формулы (XVIII)
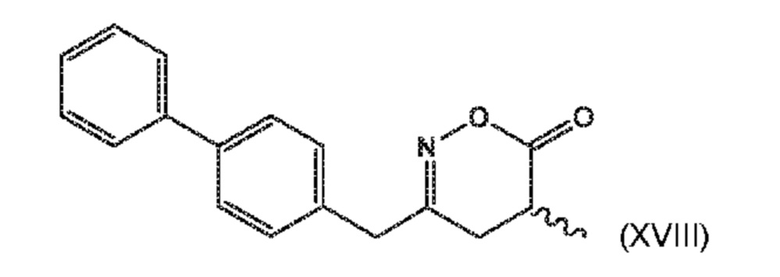 (XVIII).
(XVIII).
5. Способ получения соединения формулы (I) или его соли;
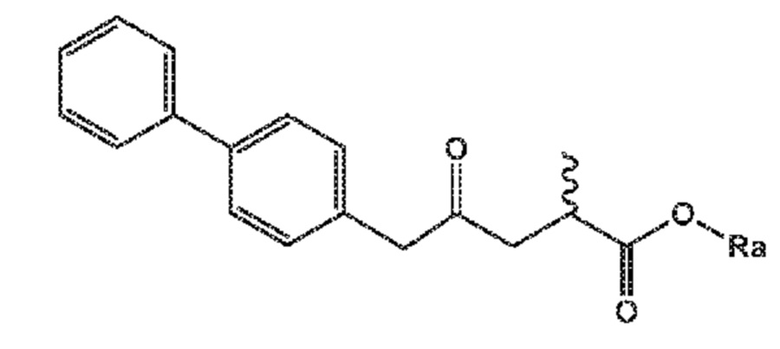 (I),
(I),
где Ra выбирают из водорода и C1-C6-алкила,
включающий взаимодействие соединения формулы (II) или его соли
 (II),
(II),
где Ra и R*, независимо друг от друга, выбирают из водорода и C1-C6-алкила,
в условиях - если требуется - реакции удаления защитной группы, с последующими условиями реакции декарбоксилирования, и необязательно посредством введения фрагмента Ra, представляющего собой C1-C6-алкил, с предоставлением соединения формулы (I).
6. Способ по п. 5, где соединение формулы (II) или его соль
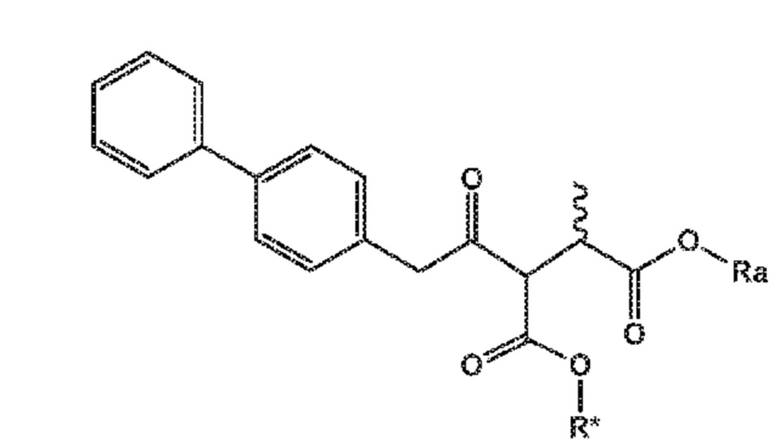 (II),
(II),
где Ra и R*, независимо друг от друга, выбирают из водорода и C1-C6-алкила,
получают посредством способа, включающего взаимодействие соединения формулы (III),
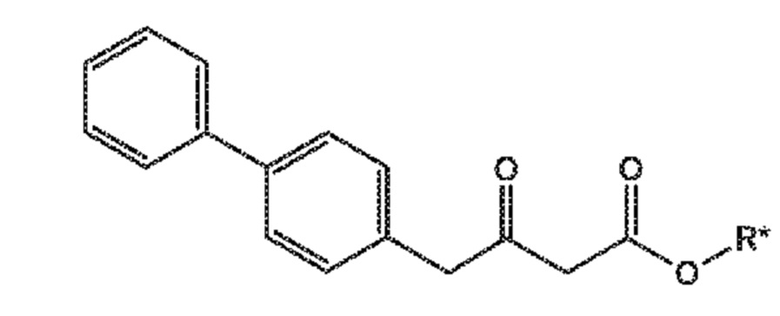 (III),
(III),
где R* представляет собой C1-C6-алкил,
с производным пропионата формулы (IV),
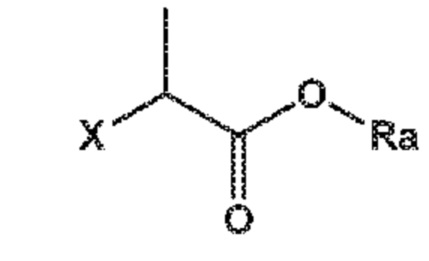 (IV),
(IV),
где X представляет собой уходящую группу, и Ra представляет собой C1-C6-алкил,
с предоставлением соединения формулы (II).
7. Способ по п. 6, где соединение формулы (III),
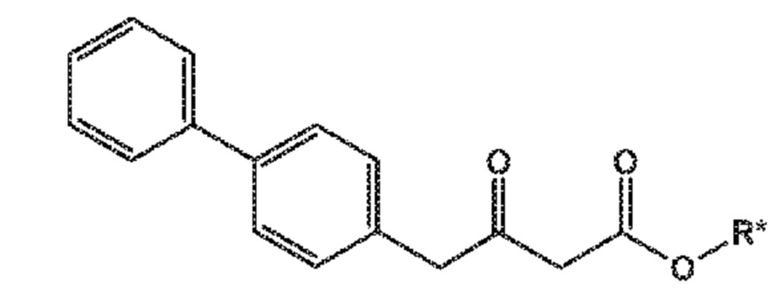 (III),
(III),
где R* представляет собой C1-C6-алкил,
получают посредством способа, включающего взаимодействие соединения формулы (V),
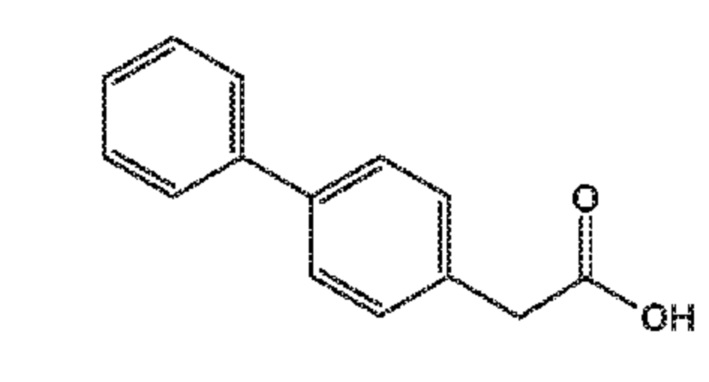 (V)
(V)
или его реакционноспособного производного,
с солью однозамещенного сложного эфира малоновой кислоты формулы (VI),
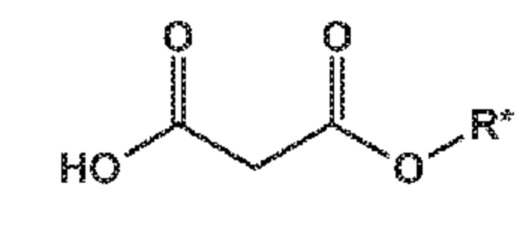 (VI),
(VI),
где R* представляет собой C1-C6-алкил.
8. Способ получения соединения формулы (I) или его соли;
 (I),
(I),
где Ra выбирают из водорода и C1-C6-алкила,
включающий взаимодействие активированного дианионного производного соединения формулы (V) или его соли
 (V)
(V)
с соединением формулы (XIV), или его солью
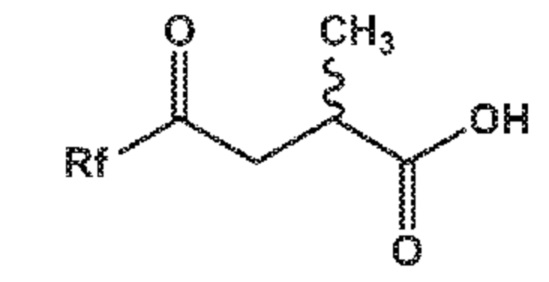 (XIV),
(XIV),
где Rf представляет собой
- -O-R*, где R* представляет собой C1-C6-алкил,
в присутствии основания, и
с последующей реакцией декарбоксилирования,
с получением соединения формулы (I), или его соли, где Ra представляет собой водород,
необязательно с последующим взаимодействием соединения формулы (I), или его соли, где Ra представляет собой водород, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (I), где Ra представляет собой C1-C6-алкил.
9. Способ по п. 7 или 8, где соединение формулы (V),
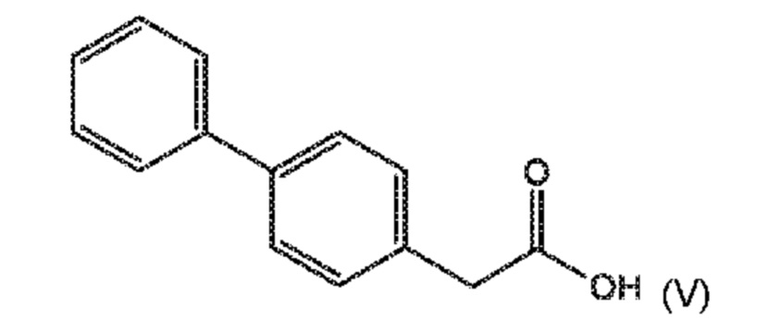 (V)
(V)
получают посредством способа, включающего гидролиз цианида формулы (VII)
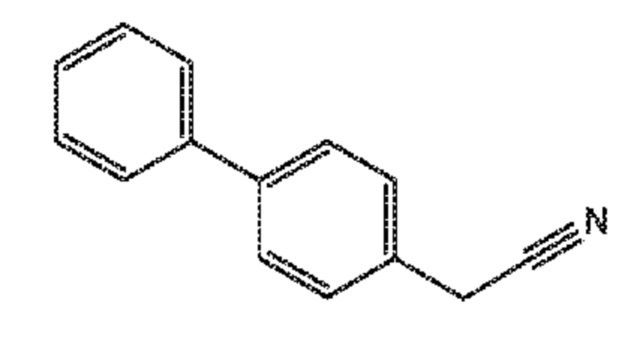 (VII).
(VII).
10. Способ получения соединения формулы (VIII) или его соли
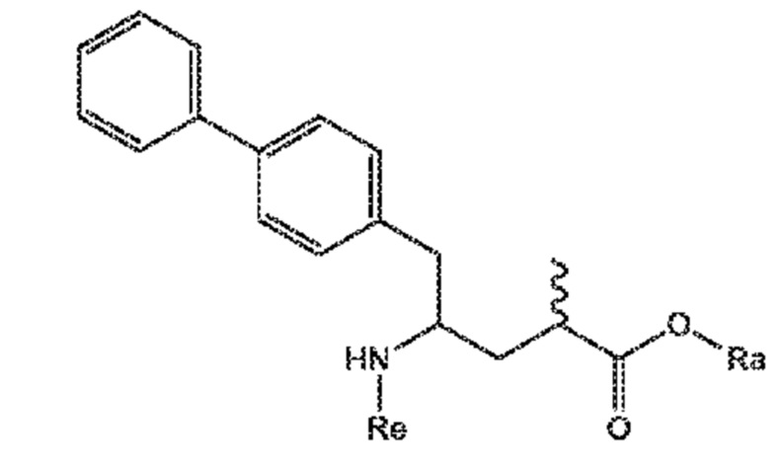 (VIII),
(VIII),
где Ra выбирают из водорода и C1-C6-алкила, и
Re выбирают из водорода и азотзащитной группы,
посредством способа, включающего
взаимодействие соединения формулы (I) или его соли;
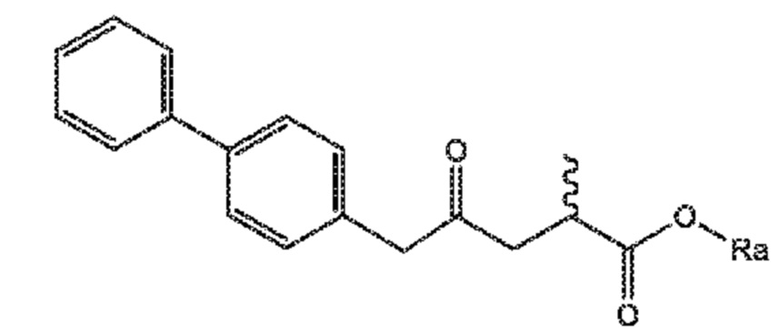 (I),
(I),
где Ra представляет собой водород,
с аммиаком, первичным или вторичным амином или их солями, с предоставлением соединения формулы (VIII), где Ra и Re представляют собой водород, или его соль,
с последующим
необязательным взаимодействием полученного соединения формулы (VIII) или его соли, где Ra представляет собой водород, и Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), где Ra представляет собой водород, и Re представляет собой азотзащитную группу, и/или
необязательно сопровождается взаимодействием соединения формулы (VIII), где Ra представляет собой водород, и Re выбирают из водорода и азотзащитной группы, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra представляет собой C1-C6-алкил, и Re является азотзащитной группой.
11. Способ получения соединения формулы (VIII) или его соли
 (VIII),
(VIII),
где Ra выбирают из водорода и C1-C6-алкила, и
Re выбирают из водорода и азотзащитной группы,
посредством способа, включающего
преобразование соединения формулы (I) или его соли;
 (I),
(I),
где Ra выбирают из водорода и C1-C6-алкила,
в соединение формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, и Re представляет собой водород, или его соль,
посредством приведения его в контакт с (S)-селективной ω-трансаминазой в присутствии донора амина и кофермента, где степень конверсии из соединения формулы (I) в соединение формулы (VIII), составляет более 50%,
с последующим
необязательным взаимодействием полученного соединения формулы (VIII) или его соли, где Ra выбирают из водорода или C1-C6-алкила, и Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), где Ra представляет собой водород, и Re представляет собой азотзащитную группу, и/или
необязательно сопровождается взаимодействием соединения формулы (VIII), где Ra представляет собой водород, и Re выбирают из водорода и азотзащитной группы, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra представляет собой C1-C6-алкил, и Re является азотзащитной группой.
12. Способ получения соединения формулы (VIII) или его соли
 (VIII),
(VIII),
где Ra выбирают из водорода и C1-C6-алкила, и
Re выбирают из водорода и азотзащитной группы,
посредством способа, включающего
a) взаимодействие соединения формулы (I) или его соли;
 (I),
(I),
где Ra представляет собой C1-C6-алкил,
с аминосульфинильным соединением формулы (IX), или его солью,
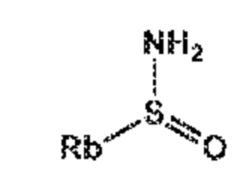 (IX),
(IX),
где Rb представляет собой C1-C6-алкил,
с получением сульфинимидного соединения формулы (X), или его соли
 (X),
(X),
где Rb представляет собой C1-C6-алкил,
Ra представляет собой C1-C6-алкил,
b) восстановление полученного соединения формулы (X), или его соли, в присутствии восстановителя с получением сульфинамидного соединения формулы (XI) или его соли
 (XI),
(XI),
где Rb представляет собой C1-C6-алкил, и
Ra представляет собой C1-C6-алкил,
c) взаимодействие полученного сульфинамидного соединения формулы (XI) или его соли, посредством гидролиза сульфонамидной группы в присутствии кислоты, с предоставлением соединения формулы (VIII) или его соли, где Ra представляет собой C1-C6-алкил, и Re представляет собой водород, и
d) удаление - если присутствует - любой C1-C6-алкил из полученного соединения формулы (VIII) или его соли, с предоставлением соединения формулы (VIII) или его соли, где Ra представляет собой водород, и Re представляет собой водород,
необязательно с последующим взаимодействием полученного соединения формулы (VIII) или его соли, где Ra выбирают из водорода или C1-C6-алкила, и Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, и Re представляет собой азотзащитную группу, и/или
необязательно с последующим взаимодействием соединения формулы (VIII), где Ra представляет собой водород, и Re выбирают из водорода и азотзащитной группы, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra представляет собой C1-C6-алкил, и Re является азотзащитной группой.
13. Способ получения соединения формулы (VIII) или его соли
 (VIII),
(VIII),
где Ra выбирают из водорода и C1-C6-алкила, и
Re выбирают из водорода и азотзащитной группы,
посредством способа, включающего
a) взаимодействие соединения формулы (I) или его соли;
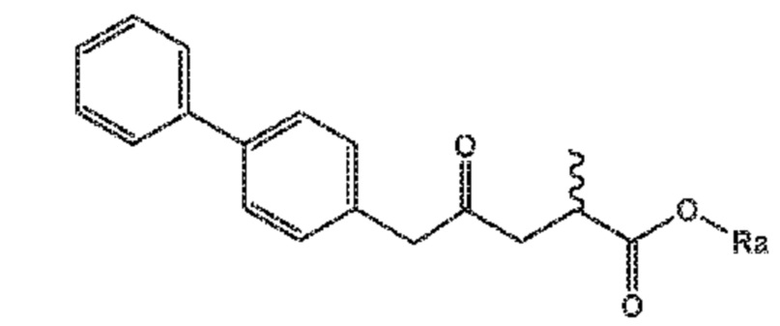 (I),
(I),
где Ra представляет собой водород,
с гидроксиламином или его солью с предоставлением соединения формулы (XVII) или его соли
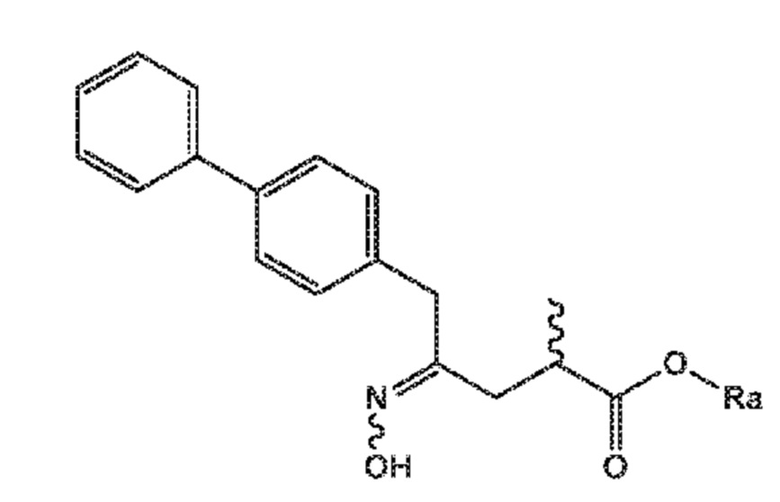 (XVII),
(XVII),
где Ra представляет собой водород,
b) последующую циклизацию полученного соединения формулы (XVII) с получением соответствующего соединения формулы (XVIII),
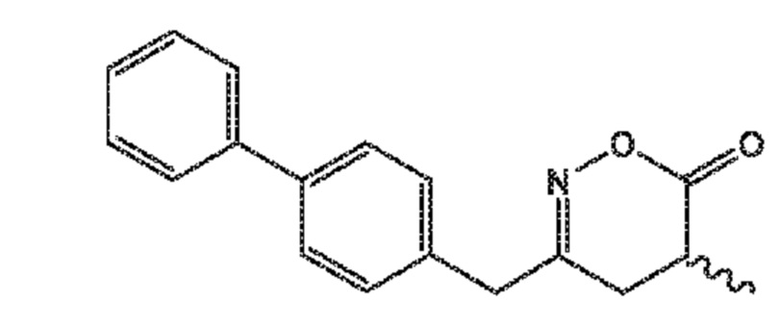 (XVIII)
(XVIII)
c) восстановление полученного соединения формулы (XVIII) в присутствии восстановителя, с получением соединения формулы (VIII), где как Ra, так и Re представляют водород,
необязательно с последующим взаимодействием полученного соединения формулы (VIII) или его соли, где Ra и Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), где Ra представляет собой водород, и Re представляет собой азотзащитную группу, и/или
необязательно с последующим взаимодействием соединения формулы (VIII), где Ra представляет собой водород, и Re выбирают из водорода и азотзащитной группы, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra представляет собой C1-C6-алкил, и Re является азотзащитной группой.
14. Способ получения соединения формулы (VIII) или его соли
 (VIII),
(VIII),
где Ra выбирают из водорода и C1-C6-алкила, и
Re выбирают из водорода и азотзащитной группы,
посредством способа, включающего
a) взаимодействие соединения формулы (I) или его соли;
 (I),
(I),
где Ra представляет собой водород,
с аммиаком или солью аммония, получая на выходе соединение формулы (XIX),
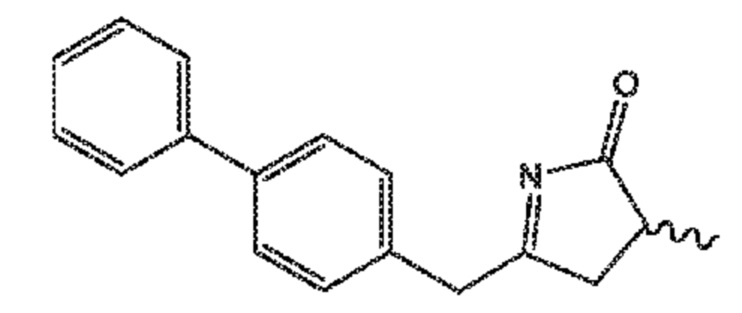 (XIX)
(XIX)
b) восстановление полученного соединения формулы (XIX), с использованием восстановителя, с получением соединения лактама формулы (XX),
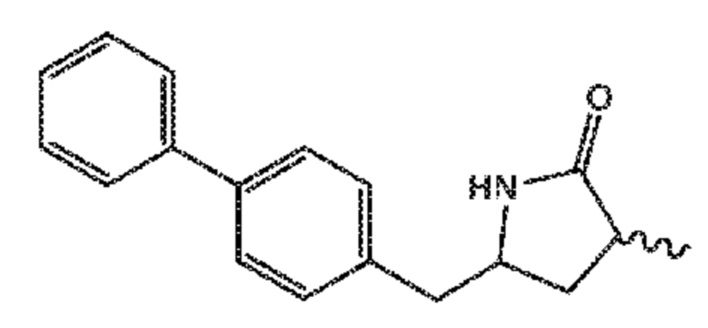 (XX)
(XX)
c) взаимодействие полученного соединения формулы (XX) в условиях реакции с раскрытием цикла, необязательно в присутствии C1-C7-спирта, с предоставлением соединения формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, и Re представляет собой водород,
с последующим
необязательным взаимодействием полученного соединения формулы (VIII) или его соли, где Ra выбирают из водорода или C1-C6-алкила, и Re представляет собой водород, с агентом, вводящим аминозащитную группу, с предоставлением соединения формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, и Re представляет собой азотзащитную группу, и/или
необязательно с последующим взаимодействием соединения формулы (VIII), где Ra представляет собой водород, и Re выбирают из водорода и азотзащитной группы, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra представляет собой C1-C6-алкил, и Re является азотзащитной группой.
15. Способ по любому одному из пп. 10-14, где соединение формулы (I) получают способом, по любому одному из пп. 5-8.
16. Способ по любому одному из пп. 10-14, где полученное соединение формулы (VIII) или его соль
 (VIII),
(VIII),
где Ra выбирают из водорода и этила, и Re выбирают из водорода и азотзащитной группы,
преобразуют в соединение формулы (10)
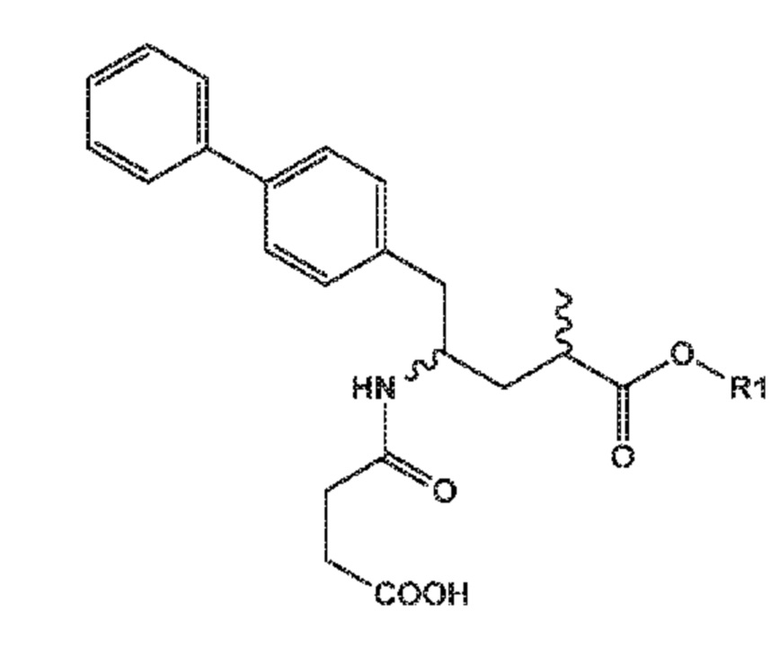 (10),
(10),
где R1 представляет собой водород или C1-C6-алкил, посредством
необязательного удаления - если присутствует - любой азотзащитной группы Re,
необязательного взаимодействия полученного соединения формулы (VIII), где Ra и Re представляют собой водород, с реагентом для реакции сочетания в присутствии C1-C6-алканола, с предоставлением соединения формулы (VIII), где Ra выбирают из C1-C6-алкила, и Re представляет собой водород, и
взаимодействие соединения формулы (VIII), где Ra выбирают из водорода и C1-C6-алкила, и Re представляет собой водород, с ангидридом янтарной кислоты.
17. Применение соединения по любому одному из пп. 1-4 при получении N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты или ее соли или этилового сложного эфира N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты.
18. Соединение формулы (XIX)
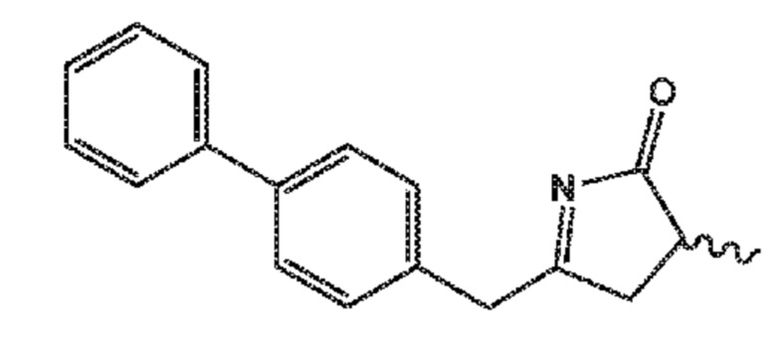 (XIX).
(XIX).
| Способ получения олефинов | 1973 |
|
SU511021A3 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| RU 2009113666 A, 20.10.2010 | |||
| WO 2008083967 A2, 17.07.1998 | |||
| В.В | |||
| Бочкарев | |||
| Оптимизация технологических процессов органического синтеза, 2010, Томск, см | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2022-03-31—Публикация
2016-12-08—Подача