Настоящее изобретение охватывает новые азахинолиновые производные общей формулы (I), как описано и определено в описании настоящего изобретения, способы получения указанных соединений, промежуточные соединения, полезные для получения указанных соединений, фармацевтические композиции и комбинации, содержащие указанные соединения, и применение указанных соединений для получения фармацевтических композиций для контроля, лечения и/или профилактики заболеваний, в частности для контроля, лечения и/или профилактики инфекций, вызванных гельминтами, в частности инфекций, вызванных желудочно-кишечными и внекишечными нематодами, у животных и людей, составы, содержащие такие соединения, и способы контроля, лечения и/или профилактики инфекций, вызванных гельминтами, в частности, инфекций, вызванных желудочно-кишечными и внекишечными нематодами, у животных и людей, в которых указанные соединения применяются в качестве единственного агента или в сочетании с другими активными ингредиентами.
Уровень техники
Возникновение резистентности против всех коммерчески доступных антигельминтных агентов, как оказалось, является увеличивающейся проблемой в области ветеринарной медицины. Широкое использование антигельминтных агентов для управления борьбы с нематодами привело к значительному выбору высокорезистентных популяций гельминтов. Поэтому распространение сопротивления против всех классов антигельминтных лекарственных средств угрожает эффективной борьбе с гельминтами у крупного рогатого скота, коз, овец и лошадей. Кроме того, успешная профилактика дирофиляриоза сердца у собак, которая в настоящее время опирается исключительно на использование макроциклических лактонов, находится под угрозой, так как потеря эффективности для множества макроциклических лактонов была описана для некоторых областей Соединенных штатов Америки - особенно в тех областях, где проблема заражения сердечным гельминтом высока. Наконец, экспериментальные исследования инфекции с личинками Dirofilaria immitis из предполагаемой области случаев потери эффективности в Lower Mississippi Дельта подтвердили in vivo существование резистентности к макроциклическому лактону.
Хотя резистентность человеческих гельминтов к антигельминтным агентам в настоящее время является редкой, распространение антигельминтной резистентности в ветеринарной области, как упоминалось ранее, необходимо учитывать при лечении гельминтоза у человека. Продолжительные терапии с регулярным введением доз против филяриоза могут приводить к высокорезистентным генотипам, и резистентности уже были описаны для определенных антигельминтных агентов (например, празиквантел, бензимидазол и никлозамид).
Поэтому срочно требуются преодаляющие резистентность антигельминтные агенты с новыми молекулярными режимами действия.
Задача настоящего изобретения состоит в предоставление соединений, которые могут использоваться в качестве антигельминтных агентов в медицине, особенно ветеринарии, обладающих удовлетворительной или улучшенной антигельминтной активностью против широкого спектра гельминтов, особенно при относительно низких дозах, для контроля, лечения и/или профилактики инфекций, вызванных гельминтами, у животных и людей, предпочтительно без каких-либо неблагоприятных токсических эффектов для организма, подлежащего лечению.
Определенные карбоксамиды циннолина описаны в US 20070142328 A1 в качестве средств, подходящих для лечения и/или профилактики тревожных расстройств, когнитивных расстройств и/или расстройств настроения или тому подобного.
Кроме того, WO 2013148603 описывает циннолины и их активность в качестве ингибиторов тирозинкиназы Брутона (BTK) для лечения заболеваний, расстройств или состояний, связанных с BTK.
Недавно опубликованная заявка WO 2018/087036 раскрывает производные хинолина и их использование для контроля, лечения и/или профилактики заболеваний, таких как инфекции гельминтами.
Однако в уровне техники не описываются новые азахинолиновые производные общей формулы (I) согласно настоящему изобретению, как описано и определено в описании настоящего изобретения.
Было обнаружено, и это составляет основу настоящего изобретения, что соединения согласно настоящему изобретению имеют удивительные и предпочтительные свойства.
В частности, было обнаружено, что соединения согласно настоящему изобретению эффективно взаимодействуют с Slo-1 нематод. Это взаимодействие характеризуется достижением паралича/ингибирования, в частности, желудочно-кишечных нематод, не паразитирующих нематод и филярий, для которых данные приводятся в части экспериментов по биологической активности. Поэтому соединения согласно настоящему изобретению могут использоваться в качестве антигельминтных агентов для контроля, лечения и/или профилактики инфекций, вызванных желудочно-кишечными и внекишечных гельминтных, в частности желудочно-кишечных и внекишечных инфекций, вызванных нематодами, включая филярии.
Описание изобретения
Первым объектом настоящего изобретения являются соединения общей формулы (I):
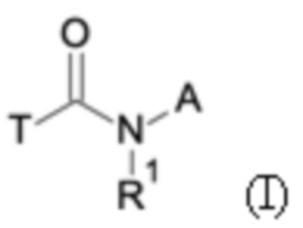
где:
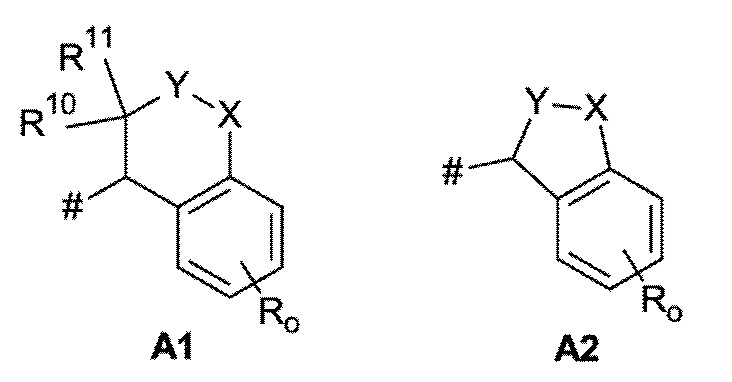
A представляет собой A1 или A2,
o представляет собой 0, 1, 2, 3 или 4,
R выбирают из группы, состоящей из водорода, галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, -S(O)-C1-C4-галогеноалкил и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
X, Y независимо выбирают из группы, состоящей из CR7R8, O, S, и N-R9, где по меньшей мере один из X и Y представляет собой CR7R8, или
X, Y образуют вместе кольцевой член, выбранный из группы, состоящей из -C(O)-O-, -C(O)-NR9-, -S(O)-NR9-, -SO2-NR9- и -SO2-O-
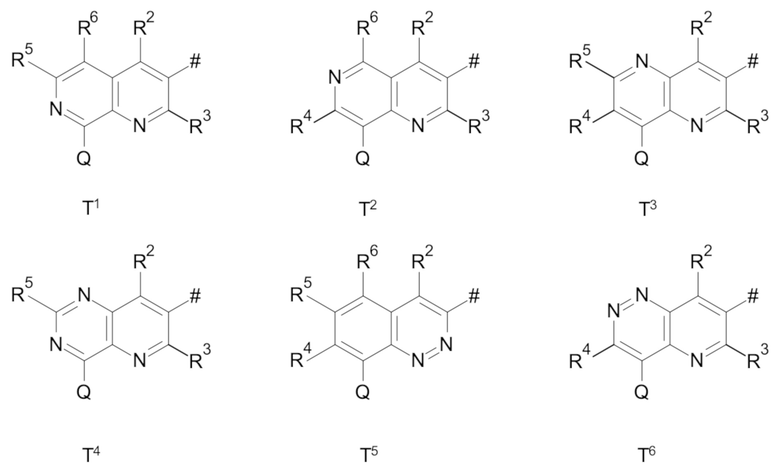
T выбирают из T1 - T6
R1 выбирают из группы, состоящей из водорода, циано, -CHO, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, C3-C6-галогеноциклоалкила, имеющего от 1 до 5 атомов галогена, C3-C4-алкенила, C3-C4-алкинила, C1-C4-алкокси-C1-C4-алкила, C3-C6-циклоалкил-C1-C3-алкила, циано-C1-C4-алкила, -NH-C1-C4-алкила, -N(C1-C4-алкила)2, NH2-C1-C4-алкила-, C1-C4-алкил-NH-C1-C4-алкила-, (C1-C4-алкил)2N-C1-C4-алкила-, C1-C4-алкил-C(O)-, C1-C4-галогеноалкил-C(O)-, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси-C(O)-, бензилокси-C(O)-, C1-C4-алкокси-C1-C4-алкил-C(O)-, -SO2-C1-C4-алкила, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенил-C1-C4-алкила, необязательно замещенного 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R2 выбирают из группы, состоящей из
водорода, галогена, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2;
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
C1-C6-алкила, C3-C6-циклоалкила, C2-C4-алкенила, C3-C6-циклоалкенила, C2-C4-алкинила или фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-алкил-C(O)-, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4- 10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4- 10-членного гетероциклоалкила, гетероспироциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-алкил-C(O)-, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-алкокси-C1-C4-алкила-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и 4- 10-членного гетероциклоалкила,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, -OH, циано, C1-C4-алкила, C3-C6-циклоалкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси-C1-C4-алкила, C1-C4-алкокси, C1-C4-алкил-C(O)-, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила,
R5 выбирают из группы, состоящей из водорода, галогена, -OH, циано, C1-C4-алкила, C3-C6-циклоалкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси-C1-C4-алкила, C1-C4-алкокси, C1-C4-алкила-C(O)-, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила,
R6 выбирают из группы, состоящей из водорода, галогена, -OH, циано, C1-C4-алкила, C3-C6-циклоалкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси-C1-C4-алкила, C1-C4-алкокси, C1-C4-алкил-C(O)-, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила,
R7 выбирают из группы, состоящей из водорода, -OH, галогена, C1-C4-алкила и C1-C4-алкокси,
R8 выбирают из группы, состоящей из водорода, -OH, галогена, C1-C4-алкила и C1-C4-алкокси,
или R7 и R8 образуют, вместе с атомом водорода, к которому они присоединены, 3- 6-ти членное кольцо, выбранное из группы, состоящей из C3-C6-циклоалкила и 3-6-членного гетероциклоалкила,
R9 выбирают из группы, состоящей из водорода, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и C1-C4-алкокси,
R10 выбирают из группы, состоящей из водорода, -OH, C1-C4-алкила и C1-C4-алкокси,
R11 выбирают из группы, состоящей из водорода, C1-C4-алкила и C1-C4-алкокси,
или R10 и R11 образуют, вместе с атомом водорода, к которому они присоединены, 3- 6-ти членное кольцо, выбранное из группы, состоящей из C3-C6-циклоалкила и 3-6-членного гетероциклоалкила,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -OH, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(-C(O)-C1-C4-алкила), -N(C1-C4-алкил)(-C(O)-C1-C4-алкила), C1-C4-алкокси, C1-C4-алкокси-C(O)-;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, -NH-C(O)-C1-C4-алкила, -N(C1-C4-алкила)(-C(O)-C1-C4-алкила), C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и (C1-C4-алкокси)2P(=O)-;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, бензо-C5-C6-циклоалкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
моноциклического или бициклического гетероцикла, выбранного из группы 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R14 выбирают из группы, состоящей из
-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкил)2, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкил)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R15 выбирают из группы, состоящей из
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
Q выбирают из группы, состоящей из 6-10-членного арила и 5- 10-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из галогена, SF5, циано, -CHO, нитро, оксо, C1-C4-алкила, C1-C4-гидроксиалкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4-6-членным гетероциклилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,
где когда Y представляет собой O, S или N-R9, ни один из R7, R8, R10 и R11 не представляет собой-OH, и где когда X представляет собой O, S или N-R9, ни один из R7 и R8 не представляет собой -OH,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
Определения
Термин «замещенный» означает, что один или более атомов водорода при обозначенном атоме или группе замещены заместителем, выбранным из указанной группы, при условии, что нормальная валентность обозначенного атома в существующих условиях не будет превышена. Допускаются комбинации заместителей и/или переменных.
Термин «необязательно замещенный» означает, что количество заместителей может быть равным или отличным от нуля. Если не указано иное, возможно, что необязательно замещенные группы замещены таким большим количеством необязательных заместителей, которые могут быть присоединены путем замещения атома водорода атомом, не являющимся водородом, при любой доступном атоме углерода или атоме азота. Как правило, число необязательных заместителей, если они присутствуют, может быть 1, 2, 3, 4 или 5, в частности 1, 2 или 3.
Как применено в описании настоящего изобретения, термин «один или более», например, в определении заместителей соединений общей формулы (I) согласно настоящему изобретению, означает «1, 2, 3, 4 или 5, особенно 1, 2, 3 или 4, более конкретно 1, 2 или 3, еще более конкретно 1 или 2".
Как применяется в описании настоящего изобретения, оксо-заместитель представляет собой атом кислорода, который связан с атомом углерода или атомом серы через двойную связь.
Термин «заместитель в кольце» означает заместитель, присоединенный к ароматическому или неароматическому кольцу, который замещает доступный атом атома в кольце.
Если сложный заместитель состоит из более чем одной части, например, (C1-C4-алкокси) -(C1-C4-алкил)-, положение данной части может находиться в любом подходящем положении указанного сложного заместителя, то есть C1-C4-алкокси часть может быть присоединена к любому атому углерода C1-C4-алкильной части указанной (C1-C4-алкокси)-(C1-C4-алкильной) группы. Дефис в начале или в конце такого сложного заместителя указывает точку присоединения указанного сложного заместителя к остальной части молекулы. Если кольцо, содержащее атомы углерода и необязательно один или более гетероатомов, таких как атом азота, атом кислорода или атом серы, например, замещено заместителем, возможно, указанный заместитель может быть связан в любом подходящем положении указанного кольца, с подходящим атомом углерода и/или подходящим гетероатомом.
Как применяется в настоящей заявке, положение, через которое соответствующий заместитель соединен с остальной частью молекулы, может в показанной структуре быть изображено знаком «решетка» (#) или пунктирной линией в указанном заместителе.
Термин «содержащий» при использовании в описании настоящего изобретения включает «состоящий из».
Если в описании настоящего изобретения любой признак сопровождается «как указано в описании настоящего изобретения», это означает, что он может упоминаться в любом месте в описании настоящего изобретения.
Термины, упомянутые в описании настоящего изобретения, имеют следующие значения:
Термин “атом галогена” означает атом фтора, хлора, брома или иода, в частности атом фтора, хлора или брома.
Термин “C1-C6-алкила” означает линейную или разветвленную, насыщенную, одновалентную углеводородную группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода. Термин “C1-C4-алкил” означает линейную или разветвленную, насыщенную, одновалентную углеводородную группу, имеющую 1, 2, 3, или 4 атома углерода, например, метильную, этильную, н-пропильную, изопропильную, н-бутильную, втор-бутильную, изобутильную или трет-бутильную группу, или их изомер. В частности, указанная группа имеет 1, 2 или 3 атома углерода (“C1-C3-алкил”), например, метильная, этильная, н-пропильная или изопропильная группа.
Термин “C1-C4-гидроксиалкил” означает линейную или разветвленную, насыщенную, одновалентную углеводородную группу, в которой термин “C1-C4-алкил” определен выше, и в которой 1 или 2 атома водорода замещены гидрокси группой, например, гидроксиметильная, 1-гидроксиэтильная, 2-гидроксиэтильная, 1,2-дигидроксиэтильная, 3-гидроксипропильная, 2-гидроксипропильная, 1-гидроксипропильная, 1-гидроксипропан-2-ильная, 2-гидроксипропан-2-ильная, 2,3-дигидроксипропильная, 1,3-дигидроксипропан-2-ильная, 3-гидрокси-2-метил-пропильная, 2-гидрокси-2-метил-пропильная, 1-гидрокси-2-метил-пропильная группа.
Термин “-NH(C1-C4-алкил)” или “-N(C1-C4-алкил)2” означает линейную или разветвленную, насыщенную, одновалентную группу, в которой термин “C1-C4-алкил” имеет значение, как указано выше, например, метиламино, этиламино, н-пропиламино, изопропиламино, N,N-диметиламино, N-метил-N-этиламино или N,N-диэтиламино группа.
Термин “-S-C1-C4-алкил”, “-S(O)-C1-C4-алкил” или “-SO2-C1-C4-алкил” означает линейную или разветвленную, насыщенную группу, в которой термин “C1-C4-алкил” имеет значение, как указано выше, например, метилсульфанильная, этилсульфанильная, н-пропилсульфанильная, изопропилсульфанильная, н-бутилсульфанильная, втор-бутилсульфанильная, изобутилсульфанильная или трет-бутилсульфанильная группа, метилсульфинильная, этилсульфинильная, н-пропилсульфинильная, изопропилсульфинильная, н-бутилсульфинильная, втор-бутилсульфинильная, изобутилсульфинильная или трет-бутилсульфинильная группа, или метилсульфонильная, этилсульфонильная, н-пропилсульфонильная, изопропилсульфонильная, н-бутилсульфонильная, втор-бутилсульфонильная, изобутилсульфонильная или трет-бутилсульфонильная группа.
Термин “C1-C4-галогеналкил” означает линейную или разветвленную, насыщенную, одновалентную углеводородную группу, в которой термин “C1-C4-алкил” имеет значение, как указано выше, и в которой один или более атомов водорода замещены, одинаково или различно, атомом галогена. В частности, указанный атом галогена представляет собой атом фтора. Более конкретно, все указанные атомы галогена представляют собой атомы фтора (“C1-C4-фторалкил”). Указанная C1-C4-галогеноалкильная группа представляет собой, например, фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, пентафторэтил, 3,3,3-трифторпропил или 1,3-дифторпропан-2-ил.
Термин “C1-C4-алкокси” означает линейную или разветвленную, насыщенную, одновалентную группу формулы (C1-C4-алкил)-O-, в которой термин “C1-C4-алкил” имеет значение, как указано выше, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси или трет-бутокси группа, или их изомер.
Термин “C1-C4-галогеналкокси” означает линейную или разветвленную, насыщенную, одновалентную C1-C4-алкокси группу, как указано выше, в которой один или более из атомов водорода замещены, одинаково или различно, атомом галогена. В частности, указанный атом галогена представляет собой атом фтора. Указанная C1-C4-галогеноалкокси группа представляет собой, например, фторметокси, дифторметокси, трифторметокси, 2,2,2-трифторэтокси или пентафторэтокси.
Термин “C2-C4-алкенил” означает линейную или разветвленную, одновалентную углеводородную группу, которая содержит одну двойную связь, и которая имеет 2, 3 или 4 атома углерода. Указанная C2-C4-алкенильная группа представляет собой, например, этенильная (или “винильная”), проп-2-ен-1-ильная (или “аллильная”), проп-1-ен-1-ильная, бут-3-енильная, бут-2-енильная, бут-1-енильная, проп-1-ен-2-ильная (или “изопропенильная”), 2-метилпроп-2-енильная, 1-метилпроп-2-енильная, 2-метилпроп-1-енильная или 1-метилпроп-1-енильная группа. В частности, указанная группа представляет собой аллил.
Термин “C2-C4-алкинил” означает линейную одновалентную углеводородную группу, которая содержит одну тройную связь, и которая содержит 2, 3 или 4 атома углерода. Указанная C2-C4-алкинильная группа представляет собой, например, этинильную, проп-1-инильную, проп-2-инильную (или “пропаргильную”), бут-1-инильную, бут-2-инильную, бут-3-инильную или 1-метилпроп-2-инильную, группу. В частности, указанная алкинильную группа представляет собой проп-1-инил или проп-2-инил.
Термин “C3-C6-циклоалкил” означает насыщенное, одновалентное, моноциклическое углеводородное кольцо, которое содержит 3, 4, 5 или 6 атома углерода (“C3-C6-циклоалкил”). Указанная C3-C6-циклоалкильная группа представляет собой, например, моноциклическое углеводородное кольцо, например, циклопропильная, циклобутильная, циклопентильная или циклогексильная группа.
Термин “C3-C6-галогенциклоалкил” означает насыщенное, одновалентное, моноциклическое углеводородное кольцо, в котором термин “C3-C6-циклоалкил” имеет значение, как указано выше, и в котором один или более атомов водорода замещены, одинаково или различно, атомом галогена. В частности, указанный атом галогена представляет собой атом фтора или хлора. Указанная C3-C6-галогеноциклоалкильная группа представляет собой, например, моноциклическое углеводородное кольцо, замещенные одним или двумя атомами фтора или хлора, например, 1-фтор-циклопропильная, 2-фторциклопропильная, 2,2-дифторциклопропильная, 2,3-дифторциклопропильная, 1-хлорциклопропильная, 2-хлорциклопропильная, 2,2-дихлорциклопропильная, 2,3-дихлорциклопропильная, 2-фтор-2-хлорциклопропильная и 2-фтор-3-хлорциклопропильная группа.
Термин “-NH(C3-C6-циклоалкил)” или “-N(C1-C4-алкил)(C3-C6-циклоалкил)” означает линейную или разветвленную, насыщенную, моновалентную группу, в которой термин “C1-C4-алкил” и термин “C3-C6-циклоалкил”, каждый как определено выше, например, циклопропиламино, циклобутиламино, циклопентиламино, циклогексиламино, N-метил-N-циклопропиламино, N-этил-N-циклопропиламино, N-метил-N-циклобутиламино, N-этил-N-циклобутиламино, N-метил-N-циклопентиламино, N-этил-N-циклопентиламино, N-метил-N-циклогексиламино, или N-этил-N-циклогексиламино группу.
Термин “бензо-C5-C6-циклоалкил” означает моновалентное, бициклическое углеводородное кольцо, где насыщенное, моновалентное, моноциклическое углеводородное кольцо, которое содержит 5 или 6 атомов углерода (“C5-C6-циклоалкил”), аннелировано с фенильным кольцом. Указанная бензо-C5-C6-циклоалкильная группа представляет собой, например, бициклическое углеводородное кольцо, например, индан (т.е. 2,3-дигидро-1H-инден) или тетралин (т.е. 1,2,3,4-тетрагидронафталиновая) группа.
Термин "спироциклоалкил" означает насыщенную, моновалентную бициклическую углеводородную группу, в которой два кольца делят один общий кольцевой атом углерода, и где указанная бициклическая углеводородная группа содержит 5, 6, 7, 8, 9, 10 или 11 атомов углерода, причем возможно указанная спироциклоалкильная группа присоединена к остатку молекулы через любой один из атомов углерода, за исключением спиро атома углерода. Указанная спироциклоалкильная группа представляет собой, например, спиро[2.2]пентил, спиро[2.3]гексил, спиро[2.4]гептил, спиро[2.5]октил, спиро[2.6]нонил, спиро[3.3]гептил, спиро[3.4]октил, спиро[3.5]нонил, спиро[3.6]децил, спиро[4.4]нонил, спиро[4.5]децил, спиро[4.6]ундецил или спиро[5.5]ундецил.
Термин “гетероциклоалкил” означает моноциклический или бициклический, насыщенный или частично насыщенный гетероцикл с 4, 5, 6, 7, 8, 9 или 10 кольцевыми атомами в общем (“4-10-членная гетероциклоалкильная” группа), в частности 4, 5 или 6 кольцевыми атомами (“4-6-членная гетероциклоалкильная” группа), которая содержит один или два идентичных или различных кольцевых гетероатомов из ряда N, O и S, причем, возможно, указанная гетероциклоалкильная группа присоединена к остатку молекулы через любой один из атомов углерода, за исключением спиро атома углерода, или, если присутствует, атома азота.
Указанная гетероциклоалкильная группа, без ограничения к этому, может представлять собой 4-членное кольцо, такое как азетидинил, оксетанил или тиетанил, например; или 5-членное кольцо, такое как тетрагидрофуранил, оксоланил, 1,3-диоксоланил, тиоланил, пирролидинил, имидазолидинил, пиразолидинил, 1,1диоксидотиоланил, 1,2-оксазолидинил, 1,3-оксазолидинил, 1,3-тиазолидинил или 1,2,4-тиазолидинил, например; или 6-ти членное кольцо, такое как тетрагидропиранил, тетрагидротиопиранил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, оксанил, 1,3-диоксанил, 1,4-диоксанил или 1,2-оксазинанил, например; или 7-членное кольцо, такое как азепанил, 1,4-диазепанил или 1,4-оксазепанил, например; или бициклическое 7-членное кольцо, такое как 6-окса-3-азабицикло[3.1.1]гептан, например; или бициклическое 8-членное кольцо, такое как 5,6-дигидро-4H-фуро[2,3-c]пиррол или 8-окса-3-азабицикло[3.2.1]октан, например; или бициклическое 9-ми членное кольцо, такое как октагидро-1H-пирроло[3,4-b]пиридин, 1,3-дигидро-изоиндол, 2,3-дигидро-индол или 3,9-диокса-7-азабицикло[3.3.1]нонан, например; или бициклическое 10-членное кольцо, такое как декагидрохинолин или 3,4-дигидроизохинолин, например.
Термин “гетероспироциклоалкил” означает бициклический, насыщенный гетероцикл с 6, 7, 8, 9, 10 или 11 кольцевыми атомами в общем, в котором два кольца делят один общий атом углерода, где “гетероспироциклоалкил” содержит один или два идентичных или различных кольцевых гетероатома из ряда: N, O, S; причем, возможно, указанная гетероспироциклоалкильная группа присоединена к остатку молекулы через любой один из атомов углерода, за исключением спиро атома углерода, или, если присутствует, атома азота.
Указанная гетероспироциклоалкильная группа представляет собой, например, азаспиро[2.3]гексил, аза-спиро[3.3]гептил, оксаазаспиро[3.3]гептил, тиаазаспиро[3.3]гептил, оксаспиро[3.3]гептил, оксазаспиро[5.3]нонил, оксазаспиро[4.3]октил, оксазаспиро[2.5]октил, азаспиро[4.5]децил, оксазаспиро[5.5]ундецил, диазаспиро[3.3]гептил, тиазаспиро[3.3]гептил, тиазаспиро[4.3]октил, азаспиро[5.5]ундецил, или один из других гомологичных вариантов, таких как спиро[3.4]-, спиро[4.4]-, спиро[2.4]-, спиро[2.5]-, спиро[2.6]-, спиро[3.5]-, спиро[3.6]-, спиро[4.5]- и спиро[4.6]-.
Термин “6- или 10-членный арил” означает моновалентное, моноциклическое или бициклическое ароматическое кольцо, имеющее 6 или 10 кольцевых атомов углерода, например, фенильную или нафтильную группу.
Термин “гетероарил” означает моновалентное, моноциклическое, бициклическое или трициклическое ароматическое кольцо, имеющее 5, 6, 9 или 10 кольцевых атомов (“5-10-членная гетероарильная” группа), в частности 5 или 6 кольцевых атомов (“5-6-членная гетероарильная” группа), которая содержит по меньшей мере один кольцевой гетероатом и необязательно один, два или три других кольцевых гетероатомов из ряда: N, O и/или S, и которая связана через кольцевой атом углерода или необязательно через кольцевой атом азота (если допускается валентностью).
Указанная гетероарильная группа может представлять собой 5-членную гетероарилую группу, такую как, например, тиенил, фуранил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил или тетразолил; или 6-членную гетероарильную группу, такую как, например, пиридинил, дигидропиридинил, пиридазинил, пиримидинил, тетрагидропиримидинил, пиразинил или триазинил.
Термин “гетероциклил” означает гетероцикл, выбранный из группы, состоящей из гетероциклоалкила и гетероарила. В частности, термин “4-6-членный гетероциклил” означает гетероцикл, выбранный из группы, состоящей из 4-6-членный гетероциклоалкил, и 5- 6-членного гетероарила.
В общем случае и, если не указано иное, гетероарильные или гетероариленовые группы включают все их возможные изомерные формы, например: таутомеры и позиционные изомеры относительно точки соединения с остальной частью молекулы. Таким образом, для некоторых иллюстративных неограничивающих примеров термин пиридинил включает пиридин-2-ил, пиридин-3-ил и пиридин-4-ил; или термин тиенил включает тиен-2-ил и тиен-3-ил.
Термин “C1-C4”, как применяется в описании настоящего изобретения, например, в контексте определения “C1-C4-алкил”, “C1-C4-галогеноалкил”, “C1-C4-гидроксиалкил”, “C1-C4-алкокси” или “C1-C4-галогеноалкокси” означает алкильную группу, имеющую конечное число атомов углерода от 1 до 4, т.е. 1, 2, 3 или 4 атома углерода.
Кроме того, как применяется в настоящей заявке, термин “C3-C6”, как применяется в описании настоящего изобретения, например, в контексте определения “C3-C6-циклоалкил” или C3-C6-галогенциклоалкил, означает циклоалкильную группу, имеющую конечное число атомов углерода от 3 до 6, т.е. 1, 2, 3, 4, 5 или 6 атомов углерода.
Когда задан диапазон значений, указанный диапазон охватывает каждое значение и поддиапазон в указанном диапазоне.
Например:
"C1-C4" охватывает C1, C2, C3, C4, C1-C4, C1-C3, C1-C2, C2-C4, C2-C3, и C3-C4;
"C2-C6" охватывает C2, C3, C4, C5, C6, C2-C6, C2-C5, C2-C4, C2-C3, C3-C6, C3-C5, C3-C4, C4-C6, C4-C5, и C5-C6;
"C3-C4" охватывает C3, C4, и C3-C4;
"C3-C10" охватывает C3, C4, C5, C6, C7, C8, C9, C10, C3-C10, C3-C9, C3-C8, C3-C7, C3-C6, C3-C5, C3-C4, C4-C10, C4-C9, C4-C8, C4-C7, C4-C6, C4-C5, C5-C10, C5-C9, C5-C8, C5-C7, C5-C6, C6-C10, C6-C9, C6-C8, C6-C7, C7-C10, C7-C9, C7-C8, C8-C10, C8-C9 и C9-C10;
"C3-C8" охватывает C3, C4, C5, C6, C7, C8, C3-C8, C3-C7, C3-C6, C3-C5, C3-C4, C4-C8, C4-C7, C4-C6, C4-C5, C5-C8, C5-C7, C5-C6, C6-C8, C6-C7 и C7-C8;
"C3-C6" охватывает C3, C4, C5, C6, C3-C6, C3-C5, C3-C4, C4-C6, C4-C5, и C5-C6;
"C4-C8" охватывает C4, C5, C6, C7, C8, C4-C8, C4-C7, C4-C6, C4-C5, C5-C8, C5-C7, C5-C6, C6-C8, C6-C7 и C7-C8;
"C4-C7" охватывает C4, C5, C6, C7, C4-C7, C4-C6, C4-C5, C5-C7, C5-C6 и C6-C7;
"C4-C6" охватывает C4, C5, C6, C4-C6, C4-C5 и C5-C6;
"C5-C10" охватывает C5, C6, C7, C8, C9, C10, C5-C10, C5-C9, C5-C8, C5-C7, C5-C6, C6-C10, C6-C9, C6-C8, C6-C7, C7-C10, C7-C9, C7-C8, C8-C10, C8-C9 и C9-C10;
"C6-C10" охватывает C6, C7, C8, C9, C10, C6-C10, C6-C9, C6-C8, C6-C7, C7-C10, C7-C9, C7-C8, C8-C10, C8-C9 и C9-C10.
Как применяется в описании настоящего изобретения, термин “уходящая группа” означает атом или группу атомов, которая замещается в ходе химической реакции в виде стабильной группы, взятой вместе со связывающими электронами. В частности, такая уходящая группа выбрана из группы, содержащей: галогенид, в частности фторид, хлорид, бромид или иодид, (метилсульфонил)окси, [(трифторметил)сульфонил]окси, [(нонафторбутил)сульфонил]окси, (фенилсульфонил)окси, [(4-метилфенил)сульфонил]окси, [(4-бромфенил)сульфонил]окси, [(4-нитрофенил)сульфонил]окси, [(2-нитрофенил)сульфонил]окси, [(4-изопропилфенил)сульфонил]окси, [(2,4,6-триизопропилфенил)сульфонил]окси, [(2,4,6-триметилфенил)сульфонил]окси, [(4-трет-бутилфенил)сульфонил]окси и [(4-метоксифенил)сульфонил]окси.
Оксо заместитель в контексте настоящего изобретения означает атом кислорода, который связан с атомом углерода через двойную связь.
Для соединений общей формулы (I) возможно существование в виде изотопных вариантов. Поэтому настоящее изобретение включает один или более изотопных вариантов соединений общей формулы (I), в частности дейтерий-содержащие соединения общей формулы (I).
Термин “изотопный вариант” соединения или реагента определяется как соединение, проявляющее не существующую в природе долю одного или более изотопов, которые составляют такое соединение.
Термин “изотопный вариант соединения общей формулы (I)” определяется как соединение общей формулы (I), проявляющее не существующую в природе долю одного или более изотопов, которые составляют такое соединение.
Выражение “не существующая в природе доля” означает долю такого изотопа, которая выше, чем его содержание в природе. Содержания в природе изотопов, применяемые в этом контексте, описаны в “Isotopic Compositions of the Elements 1997”, Pure Appl. Chem., 70(1), 217-235, 1998.
Примеры таких изотопов включают стабильные и радиоактивные изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора, брома и иода, как например 2H (дейтерий), 3H (тритий), 11C, 13C, 14C, 15N, 17O, 18O, 32P, 33P, 33S, 34S, 35S, 36S, 18F, 36Cl, 82Br, 123I, 124I, 125I, 129I и 131I, соответственно.
В отношении лечения и/или профилактики нарушений, указанных в настоящей заявке, изотопный вариант (варианты) соединений общей формулы (I) предпочтительно содержат дейтерий (“дейтерий-содержащие соединения общей формулы (I)”). Изотопные варианты соединений общей формулы (I), в которых один или более радиоактивных изотопов, таких как 3H или 14C, включены, полезны, например, при исследованиях распределения лекарственного средства и/или субстрата в тканях. Эти изотопы, в частности, предпочтительны из-за легкости их включения и обнаружения. Позитронно-активные изотопы, такие как 18F или 11C, могут быть включены в соединение общей формулы (I). Эти изотопные варианты соединения общей формулы (I) полезны для применений in vivo визуализации. Дейтерий-содержащие и 13C-содержащие соединения общей формулы (I) могут применяться в анализах масс-спектрометрии в контексте преклинических или клинических исследований.
Изотопные варианты соединений общей формулы (I) обычно могут быть получены способами, известными специалисту в данной области, такими как описанные в схемах и/или примерах в описании настоящего изобретения, путем замещения реагента на изотопный вариант указанного реагента, предпочтительно на дейтерий-содержащий реагент. В зависимости от желаемых сайтов дейтерирования, в некоторых случаях дейтерий из D2O может быть включен либо непосредственно в соединения, либо в реагенты, которые полезны для синтеза таких соединений. Дейтерий в виде газа также является полезным реагентом для включения дейтерия в молекулы. Каталитическое дейтерирование олефиновых связей и ацетильных связей представляет собой быстрый путь для включения дейтерия. Катализаторы на основе металлов (то есть Pd, Pt, и Rh) в присутствии дейтерия в виде газа могут быть использованы для непосредственного обмена дейтерия на водород в функциональных группах, содержащих углеводороды. Различные дейтерированные реагенты и синтетические строительные блоки коммерчески доступны от таких компаний, таких как, например, C/D/N Isotopes, Quebec, Canada; Cambridge Isotope Laboratories Inc., Andover, MA, USA; и CombiPhos Catalysts, Inc., Princeton, NJ, USA.
Термин “дейтерий-содержащее соединение общей формулы (I)” определяется как соединение общей формулы (I), в которых один или более атомов водорода замещены одним или более атомами дейтерия, и в которых содержание дейтерия в таком дейтерированном положении соединения общей формулы (I) выше, чем содержание дейтерия в природе, которое составляет около 0.015%. В частности, в дейтерий-содержащем соединении общей формулы (I) содержание дейтерия в каждом дейтерированном положении соединения общей формулы (I) составляет более 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80%, предпочтительно более 90%, 95%, 96% или 97%, даже более предпочтительно более 98% или 99% в указанном положении (положениях). Понятно, что содержание дейтерия в каждом дейтерированном положении не зависит от содержания дейтерия в другом дейтерированном положении (положениях).
Селективное включение одного или более атомов дейтерия в соединение общей формулы (I) может изменять физико-химические свойства (такие как, например, кислотность [C. L. Perrin, et al., J. Am. Chem. Soc., 2007, 129, 4490], основность [C. L. Perrin et al., J. Am. Chem. Soc., 2005, 127, 9641], липофильность [B. Testa et al., Int. J. Pharm., 1984, 19(3), 271]) и/или метаболический профиль молекулы и может приводить к изменениям соотношения родоначального соединения и метаболитов или количеств образованных метаболитов. Такие изменения могут приводить к определенным терапевтическим преимуществам и следовательно могут быть предпочтительны в некоторых применениях. Уменьшенные скорости метаболизма и выключение метаболизма, при которых соотношение метаболитов изменяется, описаны (A. E. Mutlib et al., Toxicol. Appl. Pharmacol., 2000, 169, 102). Эти изменения при воздействии родоначального лекарственного средства и метаболитов могут иметь важные последствия в отношении фармакодинамики, переносимости и эффективности дейтерий-содержащего соединения общей формулы (I). В некоторых случаях замещение на дейтерий уменьшает или исключает образование нежелательного или токсичного метаболита и усиливает образование желаемого метаболита (например, Nevirapine: A. M. Sharma et al., Chem. Res. Toxicol., 2013, 26, 410; Efavirenz: A. E. Mutlib et al., Toxicol. Appl. Pharmacol., 2000, 169, 102). В других случаях основной эффект дейтерирования состоит в уменьшении скорости системного клиренса. В результате биологический период полувыведения соединения увеличивается. Потенциальные клинические преимущества будут включать способность поддерживать подобное системное воздействие с уменьшенными пиковыми уровнями и повышенными остаточными уровнями. Это может привести к снижению побочных эффектов и повышению эффективности, в зависимости от конкретного фармакокинетического/фармакодинамического взаимоотношения конкретного соединения. ML-337 (C. J. Wenthur et al., J. Med. Chem., 2013, 56, 5208) и Odanacatib (K. Kassahun et al., WO 2012/112363) являются примерами этого эффекта дейтерия. Сообщалось также о других случаях, при которых сниженные скорости метаболизма приводят к увеличению воздействия лекарственного средства без изменения скорости системного клиренса (например, Rofecoxib: F. Schneider et al., Arzneim. Forsch. / Drug. Res., 2006, 56, 295; Telaprevir: F. Maltais et al., J. Med. Chem., 2009, 52, 7993). Дейтерированные лекарственные средства, демонстрирующие этот эффект, могут иметь уменьшенные требования дозировки (например, меньшее количество доз или более низкая доза для достижения желаемого эффекта) и/или могут приводить к снижению метаболических нагрузок.
Соединение общей формулы (I) может иметь множество потенциальных сайтов воздействия на метаболизм. Для оптимизации вышеописанных эффектов по физико-химическим свойствам и метаболический профиль могут быть выбраны дейтерий-содержащие соединения общей формулы (I), имеющие определенную модель одного или более дейтерий-водородного обмена (обменов). В частности, атом(ы) дейтерия дейтерий-содержащего соединения (соединений) общей формулы (I) присоединяется/присоединяются к атому углерода и/или располагается/располагаются в тех положениях соединения общей формулы (I), которое являются сайтами воздействия на метаболизирующие ферменты, такие как, например, цитохром P450.
Если в описании настоящего изобретения используется множественная форма слова соединения, соли, полиморфы, гидраты, сольваты и тому подобное, это означает также одно соединение, соль, полиморф, изомер, гидрат, сольват или тому подобное.
Под «стабильным соединением» или «стабильной структурой» понимается соединение, которое является достаточно устойчивым, чтобы выдержать выделение до полезной степени чистоты из реакционной смеси и состава в эффективный терапевтический агент.
Соединения согласно настоящему изобретению необязательно содержат один или более асимметричных центров, в зависимости от расположения и природы различных желаемых заместителей. Возможно, что в конфигурации присутствует один или более асимметричных атома углерода (R) или (S), что может привести к рацемическим смесям в случае одного асимметричного центра, и диастереомерным смесям в случае множества асимметричных центров. В некоторых случаях возможно, что асимметрия также присутствует из-за ограниченного вращения вокруг данной связи, например, центральной связи, примыкающей к двум замещенным ароматическим кольцам указанных соединений.
Предпочтительными соединениями являются соединения, которые обеспечивают более желательную биологическую активность. Отделенные, чистые или частично очищенные изомеры и стереоизомеры, или рацемические или диастереомерные смеси соединений согласно настоящему изобретению также включены в объем настоящего изобретения. Очистка и разделение таких материалов могут быть выполнены стандартными методами, известными в данной области техники.
Предпочтительными изомерами являются те, которые обеспечивают более желательную биологическую активность. Эти отделенные, чистые или частично очищенные изомеры или рацемические смеси соединений согласно настоящему изобретению также включены в объем настоящего изобретения. Очистка и разделение таких материалов могут быть выполнены стандартными методами, известными в данной области техники.
Оптические изомеры могут быть получены путем разделения рацемических смесей в соответствии с обычными способами, например, путем образования диастереоизомерных солей с использованием оптически активной кислоты или основания или образования ковалентных диастереомеров. Примерами подходящих кислот являются винная, диацетилвинная, дитолуоилвинная и камфоросульфоновая кислота. Смеси диастереоизомеров могут быть разделены на их отдельные диастереомеры на основе их физических и/или химических различий с помощью способов, известных в данной области, например, путем хроматографии или фракционной кристаллизации. Оптически активные основания или кислоты затем высвобождаются из отделенных диастереомерных солей. Различные способы разделения оптических изомеров включают применение хиральной хроматографии (например, ВЭЖХ колонки с применением хиральной фазы), с или без обычной дериватизации, необязательно выбранной для максимизации разделения энантиомеров. Стабильные ВЭЖХ колонки с применением хиральной фазы являются коммерчески доступными, такие как произведенные компанией Daicel, например, Chiracel OD и Chiracel OJ, например, среди многих других, которые все доступны для выбора рутинным путем. Ферментативные разделения, с или без дериватизации, также применяются. Оптически активные соединения согласно настоящему изобретению могут подобным образом быть получены посредством хиральных синтезов, применяя оптически активные исходные вещества.
Чтобы различать различные типы изомеров друг от друга, делается ссылка на Правила IUPAC часть E (Pure Appl Chem 45, 11-30, 1976).
Настоящее изобретение включает все возможные стереоизомеры соединений согласно настоящему изобретению, в виде отдельных стереоизомеров, или в виде любой смеси указанных стереоизомеров, например, (R) - или (S)-изомеров в любом соотношении. Выделение одного стереоизомера, например, одного энантиомера или одного диастереомера соединения согласно настоящему изобретению, достигается с помощью любого подходящего способа из уровня техники, такого как хроматография, особенно хиральная хроматография, например.
Кроме того, соединения согласно настоящему изобретению могут существовать в виде таутомеров. Например, любое соединение согласно настоящему изобретению, которое содержит модель замещения, приводящую к α-CH-составляющей при азахинолине, которая имеет повышенную CH-кислотность, может существовать в виде таутомера или даже смеси в любом количестве двух таутомеров:
Настоящее изобретение включает все возможные таутомеры соединений согласно настоящему изобретению в виде отдельных таутомеров, или в виде любой смеси указанных таутомеров, при любом соотношении.
Кроме того, соединения согласно настоящему изобретению могут существовать как N-оксиды, которые определяются тем, что по меньшей мере один атом азота соединений согласно настоящему изобретению окислен. Настоящее изобретение включает все такие возможные N-оксиды.
Настоящее изобретение также охватывает полезные формы соединений согласно настоящему изобретению, такие как метаболиты, гидраты, сольваты, пролекарства, соли, в частности фармацевтически приемлемые соли и/или сопреципитаты.
Соединения согласно настоящему изобретению могут существовать в виде гидрата или в виде сольвата, когда соединения согласно настоящему изобретению содержат полярные растворители, в частности воду, метанол или этанол, например, в качестве структурного элемента кристаллической решетки соединений. Количество полярных растворителей, в частности воды, может находиться при стехиометрическом или нестехиометрическом соотношении. В случае стехиометрических сольватов, например, гидрата, геми-, (полу-), моно-, сескви-, ди-, три-, тетра-, пента- и т.д. сольваты или гидраты, соответственно, возможны. Настоящее изобретение включает все такие гидраты или сольваты.
Кроме того, соединения согласно настоящему изобретению могут существовать в свободной форме, например, в виде свободного основания или в виде свободной кислоты, или в виде цвиттериона, или могут существовать в форме соли. Указанной солью может быть любая соль, либо органическая, либо неорганическая аддитивная соль, в частности любая фармацевтически приемлемая органическая или неорганическая аддитивная соль, которая стандартным образом применяется в фармацевтике, или которая применяется, например, для выделения или очистки соединений согласно настоящему изобретению.
Термин “фармацевтически приемлемая соль" относится к неорганической или органической соли кислотного добавления соединения согласно настоящему изобретению. Например, смотрите S. M. Berge, et al. “Pharmaceutical Salts,” J. Pharm. Sci. 1977, 66, 1-19.
Подходящая фармацевтически приемлемая соль соединений согласно настоящему изобретению может представлять собой, например, соль кислотного добавления соединения согласно настоящему изобретению, несущего атом азота в цепи или в кольце, например, которое является достаточно основным, как например соль кислотного добавления с неорганической кислотой или “минеральной кислотой”, такой как соляная, бромистоводородная, иодистоводородная, серная, сульфаминовая, бисерная, фосфорная или азотная кислота, например, или с органической кислотой, такой как муравьиная, уксусная, ацетоуксусная, пировиноградная, трифторуксусная, пропионовая, масляная, гексановая, гептановая, ундекановая, лауриновая, бензойная, салициловая, 2- (4-гидроксибензоил)-бензойная, камфорная, коричная, циклопентанпропионовая, диглюконовая, 3-гидрокси-2-нафтойная, никотиновая, памовая, пектиновая, 3-фенапропионовая, пивалиновая, 2-гидроксиэтансульфоновая, итаконовая, трифторметансульфоновая, додецилсульфоновая, этансульфоновая, бензолсульфоновая, пара-толуолсульфоновая, метансульфоновая, 2-нафталинсульфоновая, нафталиндисульфоновая, камфорсульфоновая, лимонная, винная, стеариновая, молочная, щавелевая, малоновая, янтарная, яблочная, адипиновая, альгиновая, малеиновая, фумаровая, D-глюконовая, миндальная, аскорбиновая, глюкогептановая, глицерофосфорная, аспарагиновая, сульфосалициловая или тиоциановая кислота, например.
Кроме того, другой подходящей фармацевтически приемлемой солью соединения согласно настоящему изобретению, которое является достаточно кислотным, является соль щелочного металла, например соль натрия или калия, соль щелочноземельного металла, например кальция, магния или стронция, или соль алюминия или цинка, или аммониевая соль, производная от аммиака или от органического первичного, вторичного или третичного амина, имеющего от 1 до 20 атома углерода, как, например этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, диэтиламиноэтанол, трис(гидроксиметил)аминометан, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, 1,2-этилендиамин, N-метилпиперидин, N-метил-глюкамин, N,N-диметил-глюкамин, N-этил-глюкамин, 1,6-гександиамин, глюкозамин, саркозин, серинол, 2-амино-1,3-пропандиол, 3-амино-1,2-пропандиол, 4-амино-1,2,3-бутантриол, или соль с четвертичным ионом аммония, имеющую от 1 до 20 атомов углерода, как например тетраметиламмоний, тетраэтиламмоний, тетра(н-пропил)аммоний, тетра(н-бутил)аммоний, N-бензил-N,N,N-триметиламмоний, холин или бензалконий.
Специалистам в данной области техники также понятно, что кислотные аддитивные соли заявленных соединений могут быть получены реакцией соединений с подходящей неорганической или органической кислотой с помощью любого из ряда известных способов. Альтернативно, соли щелочных и щелочноземельных металлов кислотных соединений согласно настоящему изобретению получают путем взаимодействия соединений согласно настоящему изобретению с соответствующим основанием с помощью множества известных способов.
Настоящее изобретение включает все возможные соли соединений согласно настоящему изобретению в виде отдельных солей, или в виде любой смеси указанных солей, в любом соотношении.
В описании настоящего изобретения, в частности в Экспериментальной части, для синтеза промежуточных соединений и примеров согласно настоящему изобретению, когда соединение упоминается в форме соли с соответствующим основанием или кислотой, точный стехиометрический состав указанной солевой формы, в виде, полученным посредством соответствующего способа получения и/или очистки, в большинстве случаев неизвестен.
Если не указано иное, суффиксы в химических названиях или структурных формулах, относящихся к солям, такие как «гидрохлорид», «трифторацетат», «натриевая соль» или «х HCl», «x CF3COOH», «x Na+», например, означают форму соли, где стехиометрия формы соли не уточняется.
Это относится аналогичным образом к случаям, когда промежуточные соединения или примерные соединения или их соли были получены посредством описанных способов получения и/или очистки, в виде сольватов, таких как гидраты, с (если определено) неизвестным стехиометрическим составом.
Кроме того, настоящее изобретение включает все возможные кристаллические формы, или полиморфы соединений согласно настоящему, изобретению либо в виде отдельного полиморфа, либо в виде смеси более одного полиморфа, при любом соотношении.
Кроме того, настоящее изобретение также включает пролекарства соединений согласно настоящему изобретению. Термин «пролекарства» в контексте настоящего изобретения означает соединения, которые сами по себе могут быть биологически активными или неактивными, но превращаются (например, метаболически или гидролитически) в соединения согласно настоящему изобретению во время их пребывания в организме.
В соответствии со вторым вариантом выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
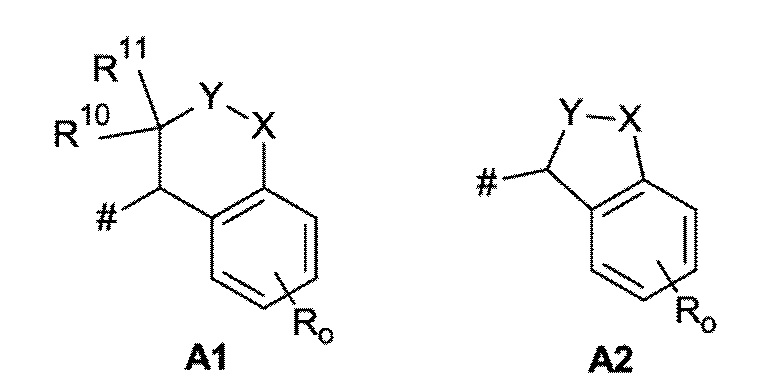
A представляет собой A1 или A2,
o представляет собой 0, 1, 2, 3 или 4,
R выбирают из группы, состоящей из водорода, галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, -S(O)-C1-C4-галогеноалкила и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
X, Y независимо выбирают из группы, состоящей из CR7R8, O, S и N-R9, где по меньшей мере один из X и Y представляет собой CR7R8, или
X, Y образуют вместе кольцевой член, выбранный из группы, состоящей из -C(O)-O-, -C(O)-NR9-, -S(O)-NR9-, -SO2-NR9- и -SO2-O-,
T выбирают из T1 - T6 как определено выше
R1 выбирают из группы, состоящей из водорода, циано, -CHO, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, C3-C6-галогеноциклоалкила, имеющего от 1 до 5 атомов галогена, C3-C4-алкенила, C3-C4-алкинила, C1-C4-алкокси-C1-C4-алкила, C3-C6-циклоалкил-C1-C3-алкила, циано-C1-C4-алкила, -NH-C1-C4-алкила, -N(C1-C4-алкила)2, NH2-C1-C4-алкила-, C1-C4-алкил-NH-C1-C4-алкила-, (C1-C4-алкил)2N-C1-C4-алкила-, C1-C4-алкил-C(O)-, C1-C4-галогеноалкил-C(O)-, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси-C(O)-, бензилокси-C(O)-, C1-C4-алкокси-C1-C4-алкил-C(O)-, -SO2-C1-C4-алкила и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенил-C1-C4-алкила, необязательно замещенного 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R2 выбирают из группы, состоящей из
водорода, галогена, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2;
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
C1-C6-алкила, C3-C6-циклоалкила, C2-C4-алкенила, C3-C6-циклоалкенила, C2-C4-алкинила или фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-алкил-C(O)-, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -NO2, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, гетероспироциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-алкил-C(O)-, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкил, C1-C4-алкокси-C1-C4-алкила-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и 4-10-членного гетероциклоалкила,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R5 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R6 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R7 выбирают из группы, состоящей из водорода, -OH, фтора, C1-C4-алкила и C1-C4-алкокси,
R8 выбирают из группы, состоящей из водорода, -OH, фтора, C1-C4-алкила и C1-C4-алкокси,
R9 выбирают из группы, состоящей из водорода, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и C1-C4-алкокси,
R10 выбирают из группы, состоящей из водорода, -OH, C1-C4-алкила и C1-C4-алкокси,
R11 выбирают из группы, состоящей из водорода, C1-C4-алкила и C1-C4-алкокси,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -OH, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(-C(O)-C1-C4-алкила), C1-C4-алкокси;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано,-COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, -NH-C(O)-C1-C4-алкила, -N(C1-C4-алкил)-(-C(O)-C1-C4-алкила), C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и (C1-C4-алкокси)2P(=O)-;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, бензо-C5-C6-циклоалкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R14 выбирают из группы, состоящей из
-NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2;
C1-C4-алкила, C3-C6-циклоалкил, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкил)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
R15 выбирают из группы, состоящей из
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена;
фенила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического и бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
Q представляет собой замещенное фенильное кольцо формулы (Q1)
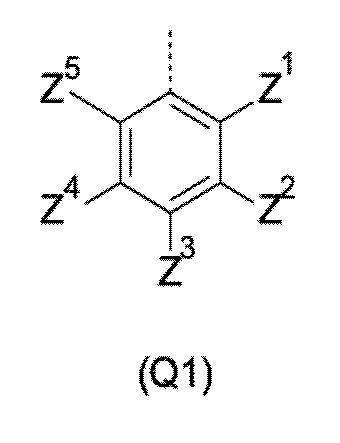
где:
Z1, Z2, Z3, Z4 и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, -CHO, нитро, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4 - 6-ти членным гетероциклилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z3, Z4 и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, CHO, нитро, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-алкокси-C(O)-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклоалкила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4-6-членным гетероциклоалкилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,-CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Z2 и Z3 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6- членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z1, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, CHO, нитро, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклоалкила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4 - 6-ти членным гетероциклоалкилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,-CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Q представляет собой пиридиновое кольцо формулы (Q2)

где:
Z6, Z7, Z8 и Z9 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой пиримидиновое кольцо формулы (Q3)

где:
Z10, Z11 и Z12 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой пиридиновое кольцо формулы (Q4)
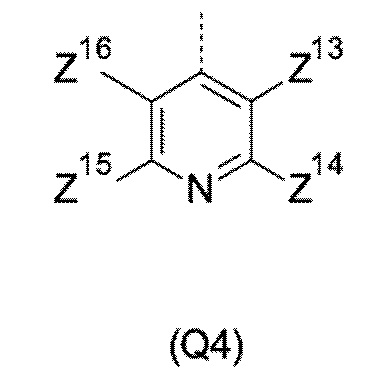
где:
Z13, Z14, Z15 и Z16 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C1-C4-гидроксиалкила, NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-CO-C1-C4-алкила, и моноциклических гетероциклов, выбранных из группы 4-7-членного гетероциклоалкила или 5-ти членных гетероарилов, имеющих по меньшей мере один атом азота, через который гетероарильное кольцо соединяется с пиридиновым кольцом, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Q представляет собой пиридиновое кольцо формулы (Q5)
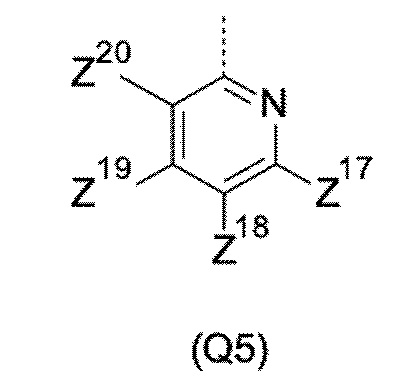
где:
Z17, Z18, Z19 и Z20 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q6)
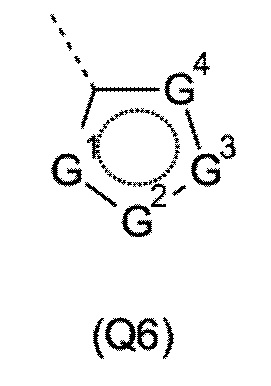
где:
G1 - G4 независимо выбирают из группы, состоящей из N, O, S, C-Z21 и N-Z22, где не более чем один из G1 - G4 представляет собой O, не более чем один из G1 - G4 представляет собой S, не более чем один из G1 - G4 представляет собой N-Z22, и где
каждый Z21 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, и
каждый Z22 независимо выбирают из группы, состоящей из водорода, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкил-C3-C6-циклоалкила, C1-C4-алкокси-C1-C4-алкила или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q7)
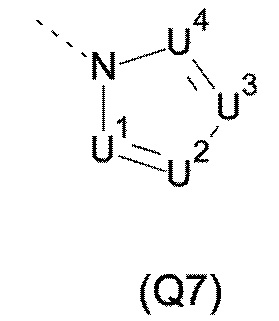
где:
U1 - U4 независимо выбирают из группы, состоящей из N и C-Z23, где не более чем три из U1 - U4 представляют собой N, и где
каждый Z23 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
где когда Y представляет собой O, S или N-R9, ни один из R7, R8, R10 и R11 не представляет собой-OH, и где когда X представляет собой O, S или N-R9, ни один из R7 и R8 не представляет собой-OH,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с третьим вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A представляет собой A1 или A2,

o равно 0, 1 или 2,
R выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
X, Y независимо выбирают из группы, состоящей из CR7R8, O, S и N-R9, где по меньшей мере один из X и Y представляет собой CR7R8,
T выбирают из T1 - T6, как определено выше
R1 выбирают из группы, состоящей из водорода, C1-C4-алкила, C3-C6-циклоалкила, C3-C4-алкенила, C3-C4-алкинила, C1-C4-алкокси-C1-C4-алкила, C3-C6-циклоалкил-C1-C3-алкила, циано-C1-C4-алкила,
R2 выбирают из группы, состоящей из
водорода, галоген, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2,-C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2;
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
C1-C4-алкила, C3-C6-циклоалкила, C2-C4-алкенила, C3-C6-циклоалкенила, C2-C4-алкинила или фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, гетероспироциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-алкил-C(O)-, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкила, C1-C4-алкокси-C1-C4-алкил-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, и 4-10-членного гетероциклоалкила,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R5 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R6 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R7 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R8 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R9 представляет собой C1-C4-алкил,
R10 выбирают из группы, состоящей из водорода, -OH, C1-C4-алкила и C1-C4-алкокси,
R11 представляет собой водород,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -NH(-C(O)-C1-C4-алкила), C1-C4-алкокси;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано,-COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, -NH-C(O)-C1-C4-алкила, -N(C1-C4-алкил)-(-C(O)-C1-C4-алкила), C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и (C1-C4-алкокси)2P(=O)-;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
фенила, бензо-C5-C6-циклоалкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
R14 выбирают из группы, состоящей из
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила; и
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
R15 выбирают из группы, состоящей из
C1-C4-алкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
Q представляет собой замещенное фенильное кольцо формулы (Q1)
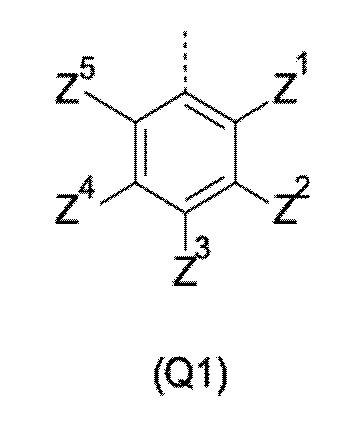
где:
Z1, Z2, Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, 4-6-членный гетероциклила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-ти членный гетероциклоалкил, 5-ти членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-алкокси-C(O)-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, или
Z2 и Z3 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z1, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, или
Q представляет собой пиридиновое кольцо формулы (Q2)

где:
Z6, Z7, Z8 и Z9 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой пиримидиновое кольцо формулы (Q3)
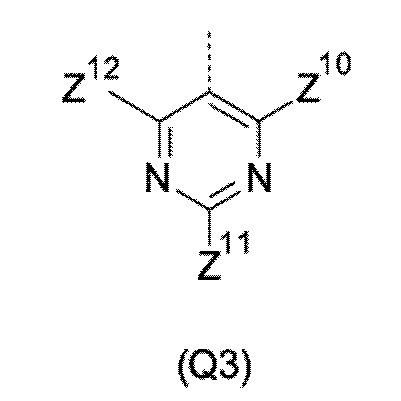
где:
Z10, Z11 и Z12 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой пиридиновое кольцо формулы (Q4)

где:
Z13, Z14, Z15 и Z16 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C1-C4-гидроксиалкила, NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-CO-C1-C4-алкила, и моноциклических гетероциклов, выбранных из группы 4-7-членного гетероциклоалкила или 5-ти членных гетероарилов, имеющих по меньшей мере один атом азота, через который гетероарильное кольцо соединяется с пиридиновым кольцом, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Q представляет собой пиридиновое кольцо формулы (Q5)
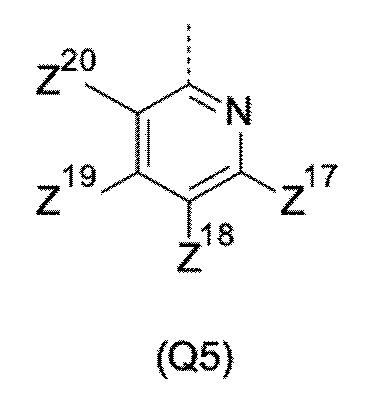
где:
Z17, Z18, Z19 и Z20 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q6)
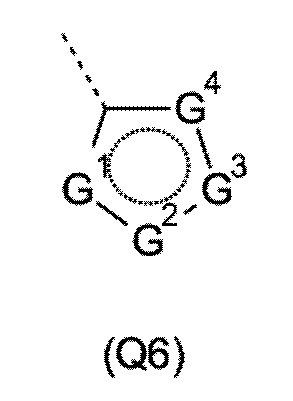
где:
G1 - G4 независимо выбирают из группы, состоящей из N, O, S, C-Z21 и N-Z22, где не более чем один из G1 - G4 представляет собой O, не более чем один из G1 - G4 представляет собой S, не более чем один из G1 - G4 представляет собой N-Z22, и где
каждый Z21 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, и
каждый Z22 независимо выбирают из группы, состоящей из водорода, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкил-C3-C6-циклоалкила, C1-C4-алкокси-C1-C4-алкила, или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q7)
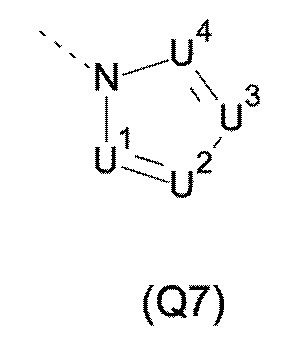
где:
U1 - U4 независимо выбирают из группы, состоящей из N и C-Z23, где не более чем три из U1 - U4 представляют собой N, и где
каждый Z23 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
где когда Y представляет собой O, S или N-R9, R10 не представляет собой -OH,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с четвертым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A представляет собой A1 или A2,
 ,
,
o равно 0 или 1,
R выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
X выбирают из группы, состоящей из CR7R8, O, S, и N-R9,
Y представляет собой CR7R8,
T выбирают из T1 - T6 имеют значения, как определено выше
R1 представляет собой водород или C1-C4-алкил,
R2 выбирают из группы, состоящей из
водорода, галогена,
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
C1-C4-алкила, C3-C6-циклоалкила, C2-C4-алкенила или C3-C6-циклоалкенила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкокси-C(O)- и -C(O)-NH2; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, гетероспироциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, оксо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, C1-C4-алкил, C1-C4-алкил-C(O)-, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси-C1-C4-алкила-, C1-C4-алкокси-C1-C4-алкила-, -NH2, -N(C1-C4-алкила)2, и 4-10-членного гетероциклоалкила,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R5 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R6 выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R7 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R8 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R9 представляет собой C1-C4-алкил,
R10 выбирают из группы, состоящей из водорода, -OH и C1-C4-алкила,
R11 представляет собой водород,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -NH(-C(O)-C1-C4-алкила), C1-C4-алкокси;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-N(C1-C4-алкила)2, -NH-C(O)-C1-C4-алкила, C1-C4-алкила, C1-C4-алкокси, C3-C6-циклоалкила, -NH2, -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила и (C1-C4-алкокси)2P(=O)-;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и C1-C4-алкокси;
фенила и бензо-C5-C6-циклоалкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, оксо, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
R14 выбирают из группы, состоящей из
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, C1-C4-алкила, C1-C4-алкокси и C3-C6-циклоалкила; и
4-10-членного гетероциклоалкила,
R15 выбирают из группы, состоящей из
C1-C4-алкила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из -OH и -COOH; и
6-членного гетероарила,
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Z2 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(C3-C6-циклоалкила), -N(C1-C4-алкил)(C3-C6-циклоалкила), C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -S-(C1-C4-алкила) и 4-6-членного гетероциклоалкила, и
Z3 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила) и -N(C1-C4-алкила)2,
Z4 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(C3-C6-циклоалкила), -N(C1-C4-алкил)(C3-C6-циклоалкила), C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -S-(C1-C4-алкила) и 4-6-членного гетероциклоалкила,
Z5 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Q представляет собой пиридиновое кольцо формулы (Q4)

где:
Z13, Z14, Z15 и Z16 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-алкокси, C1-C4-гидроксиалкила, NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-CO-C1-C4-алкила, и моноциклических гетероциклов, выбранных из группы 4 - 7-ми членного гетероциклоалкила или 5-ти членных гетероарилов, имеющих по меньшей мере один атом азота, через который гетероарильное кольцо соединяется с пиридиновым кольцом, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Q представляет собой пиридиновое кольцо формулы (Q5)

где:
Z17, Z18, Z19 и Z20 независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси, или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q6)

где:
G1 - G4 независимо выбирают из группы, состоящей из N, O, S, C-Z21 и N-Z22, где не более чем один из G1 - G4 представляет собой O, не более чем один из G1 - G4 представляет собой S, не более чем один из G1 - G4 представляет собой N-Z22, и где
каждый Z21 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, и
каждый Z22 независимо выбирают из группы, состоящей из водорода, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкил-C3-C6-циклоалкила, C1-C4-алкокси-C1-C4-алкила или
Q представляет собой 5-членный ароматический гетероцикл формулы (Q7)
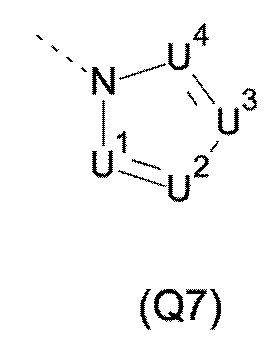
где:
U1 - U4 независимо выбирают из группы, состоящей из N и C-Z23, где не более чем три из U1 - U4 представляют собой N, и где
каждый Z23 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В конкретном варианте выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) согласно второму, третьему или четвертому варианту выполнения настоящего изобретения выше, в которой:
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1, Z2, Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, -CHO, нитро, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4 - 6-ти членным гетероциклилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6- членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, CHO, нитро, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-алкокси-C(O)-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклоалкила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4 - 6-ти членным гетероциклоалкилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,-CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, или
Z2 и Z3 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z1, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, SF5, циано, CHO, нитро, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C3-C6-циклоалкил-C1-C4-алкокси, циано-C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH-SO2-(C1-C4-алкила),-N(SO2-[C1-C4-алкил])(C1-C4-алкила), (C1-C4-алкоксиимино)-C1-C4-алкила, 4-6-членного гетероциклоалкила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-O-(C1-C4-алкила), -CH2-NH(C1-C4-алкила), -CH2-N(C1-C4-алкила)2, метила, замещенного 4 - 6-ти членным гетероциклоалкилом, который сам по себе необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, метила или циано, -CH2-S-(C1-C4-алкила), -CH2-S(O)-(C1-C4-алкила), -CH2-SO2-(C1-C4-алкила), -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), -S-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -S(O)-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена, -SO2-(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,-CONH(C1-C4-алкила), -CONH(C3-C6-циклоалкила), -NHCO(C1-C4-алкила), -NHCO(C3-C6-циклоалкила), -NHCO(C1-C4-галогеноалкила), имеющего от 1 до 5 атомов галогена,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В конкретном варианте выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) согласно второму, третьему или четвертому варианту выполнения настоящего изобретения выше, в которой:
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1, Z2, Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(C3-C6-циклоалкила), -N(C1-C4-алкил)(C3-C6-циклоалкила), 4-6-членного гетероциклила, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-членный гетероциклоалкил, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-алкокси-C(O)-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, или
Z2 и Z3 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6-членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z1, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкил, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В конкретном варианте выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) согласно второму, третьему или четвертому варианту выполнения настоящего изобретения выше, в которой:
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Z2 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(C3-C6-циклоалкила), -N(C1-C4-алкил)(C3-C6-циклоалкила), C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -S-(C1-C4-алкил) и 4-6-членного гетероциклоалкила, и
Z3 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила) и -N(C1-C4-алкила)2,
Z4 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -NH(C3-C6-циклоалкила), -N(C1-C4-алкил)(C3-C6-циклоалкила), C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -S-(C1-C4-алкил) и 4-6-членного гетероциклоалкила,
Z5 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси.
В соответствии с пятым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A выбирают из группы, состоящей из


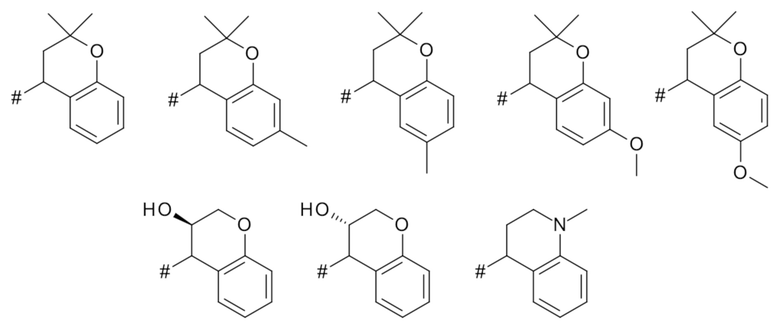 ,
,
T выбирают из T1 - T6, как определено выше
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
водорода, хлора, фтора, брома,
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
метила, этила, пропила, изопропила, циклопропила, циклогексила, пропенила, циклопентенила, циклогексенила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из циано, этокси-C(O)-, и -C(O)-NH2; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из азетидина, пирролидина, пиразолидина, имидазолидина, 1,2,4-триазолидина, пиперидина, пиперазина, тетрагидропиридина, дигидро-2H-пирана, тетрагидропирана, 1,2-оксазолидина, 1,2-оксазина, морфолина, тиоморфолина, 3,4-дигидроизохинолина, 2,3-дигидро-индола, 1,3-дигидро-изоиндола, 3,9-диокса-7-азабицикло[3.3.1]нонана, 6-окса-3-азабицикло[3.1.1]гептана, 8-окса-3-азабицикло[3.2.1]октана, имидазола, пиразола, 1,2,4-триазола, 1,2,3-триазола, 4-окса-7-азаспиро[2.5]октана, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из фтора, хлора, циано, -OH, оксо, -COOH, метокси-C(O)-, этокси-C(O)-, трет-бутокси-C(O)-, -C(O)-NH2, метила, метил-C(O)-, трифторметила, гидроксиметила-, метоксиметила-, -NH2, -NMe2, пирролидина,
R3 представляет собой водорода, хлора или метила,
R4 выбирают из группы, состоящей из водорода, фтора, хлора, циано, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, фтора, хлора и метила,
R6 выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -NH(-C(O)-метила), метокси;
метила, этила, пропила, изопропила, бутила, изобутила, циклопропила, циклобутила, бензила, 1-фенилэтила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из фтора, -OH, -COOH, метокси-C(O)-, этокси-C(O)-, трет-бутокси-C(O)-, -C(O)-NH2, -C(O)-NMe2, -NH-C(O)-метила, метила, метокси, циклопропила, -NH2, NMe2, S-метила, S(O)-метила, SO2-метила, и (EtO)2P(=O)-;
гетероциклил-метила, гетероциклил-этила, где гетероциклильный заместитель выбирают из группы, состоящей из пирролидина, морфолина, пиразола, 1,2,4-оксадиазола, пиридина, каждый из которых необязательно замещен 1 заместителем, независимо выбранным из группы, состоящей из фтора, хлора, -OH, оксо и метила;
фенила; и
моноциклического или бициклического гетероцикла, выбранного из группы оксетана, тиетана, пирролидина, морфолина, тетрагидропирана, пиридина и пиразола, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора, хлора, -OH, оксо, метила;
R14 выбирают из группы, состоящей из
метила, этила, изопропила, бутила, циклопентила, бензила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора, -OH, метила, метокси и циклопентила; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из пирролидина и тетрагидропирана,
R15 выбирают из группы, состоящей из
метила и этила, каждый из которых необязательно замещен 1 заместителем, независимо выбранным из группы, состоящей из -OH и -COOH; и
пиридина,
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, фтора, хлора, -OH, метила, этила, -NHMe, -NMe2, трифторметила, метокси, трифторметокси, -SMe и морфолинила, и
Z3 каждый независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси и -NMe2,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с шестым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
T, A и R1 - R15 имеют значения, как определено для пятого варианта выполнения первого объекта настоящего изобретения выше, и где
Q представляет собой пиридиновое кольцо формулы (Q4)

где:
Z13, Z14, Z15 и Z16 независимо выбирают из группы, состоящей из водорода, фтора, хлора, циано, метила, метокси, этокси, изопропокси, гидроксиметила, NH2, -NHMe -NMe2, -NH-C(O)-Me, морфолинила, или
Q представляет собой пиридиновое кольцо формулы (Q5)

где:
Z17, Z18, Z19 и Z20 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, этила, метокси и этокси, или
Q выбирают из группы, состоящей из



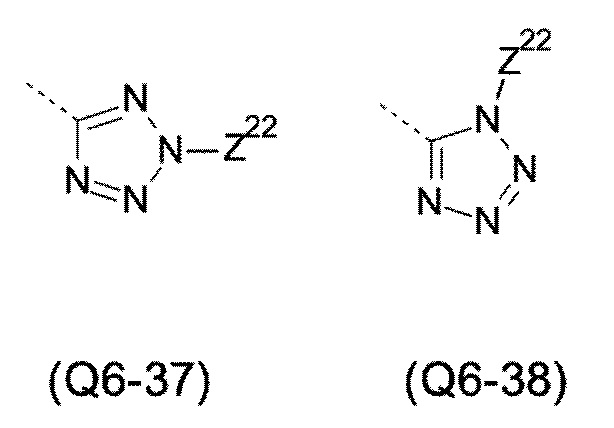
где:
каждый Z21 независимо выбирают из группы, состоящей из водорода, фтора, хлора, циано, метила, трифторметила, метокси и
Z22 представляет собой водорода, метила, или
Q выбирают из группы, состоящей из
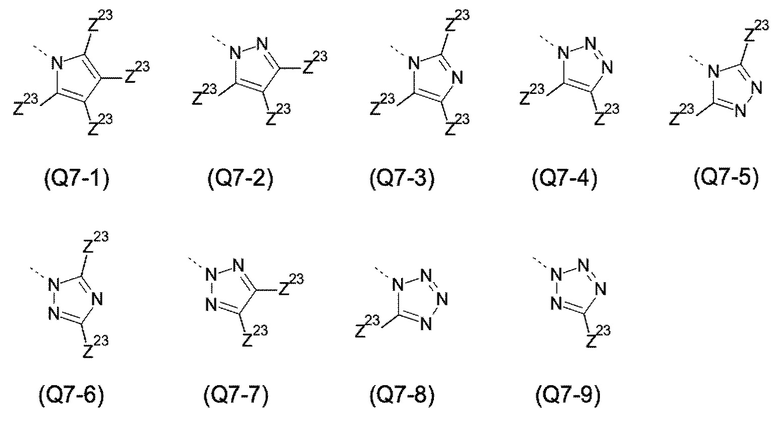
где:
каждый Z23 независимо выбирают из группы, состоящей из водорода, фтора, хлора, циано, метила, трифторметила, метокси, или
Q выбирают из группы, состоящей из
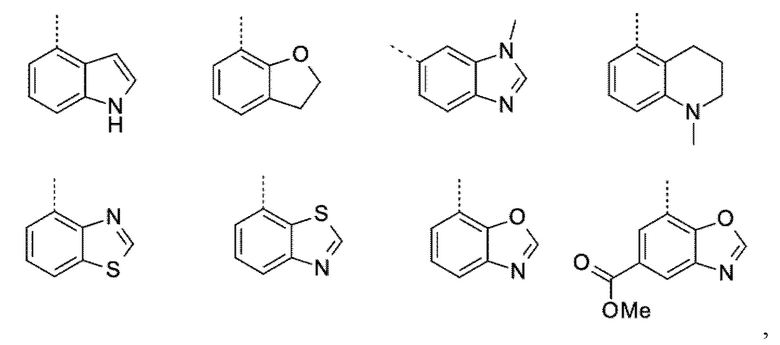
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В альтернативном варианте выполнения пятого и шестого варианта выполнения первого объекта настоящего изобретения выше, A выбирают из группы, состоящей из:
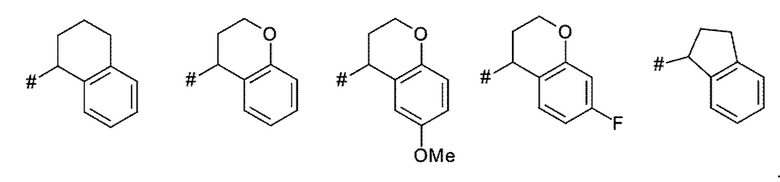
В другом альтернативном варианте выполнения пятого и шестого варианта выполнения первого объекта настоящего изобретения выше, A выбирают из группы, состоящей из:

предпочтительно A представляет собой
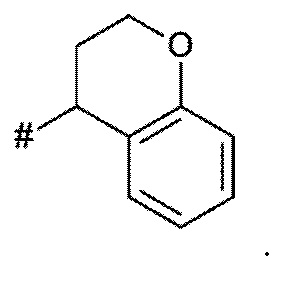
В соответствии с седьмым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A выбирают из группы, состоящей из:
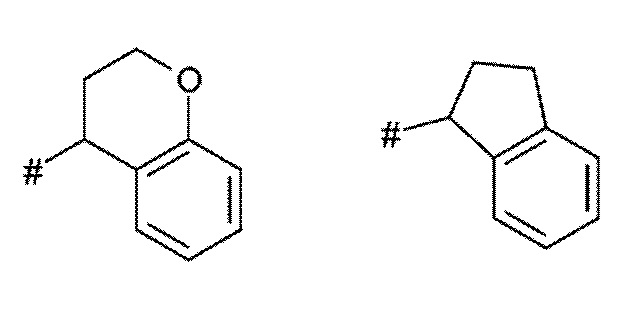 ,
,
предпочтительно A представляет собой
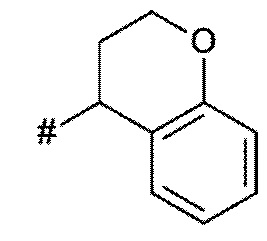 ;
;
T выбирают из T1 - T6, как определено выше
R1 представляет собой водорода или метила,
R2 выбирают из группы, состоящей из
водорода, хлора, фтора, брома,
-NH2, -NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила; и
моноциклического гетероцикла, выбранного из группы, состоящей из азетидина, пирролидина, пиразолидина, имидазолидина, 1,2,4-триазолидина, пиперазина, 1,2-оксазолидина, морфолина, тиоморфолина, тетрагидропирана, имидазола, пиразола, 1,2,3-триазола, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из фтора, -OH, оксо, -COOH, метокси-C(O)-, этокси-C(O)-, трет-бутокси-C(O)-, -C(O)-NH2, метила, метил-C(O)-, трифторметила, гидроксиметила-, метоксиметила-, -NH2, -NMe2, пирролидина,
R3 представляет собой водород,
R4 выбирают из группы, состоящей из водорода, хлора, фтора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, хлора, фтора и метила,
R6 выбирают из группы, состоящей из водорода, фтора, метила и метокси,
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, фтора, хлора, -OH, метила, этила, -NHMe, -NMe2, трифторметила, метокси, трифторметокси, -SMe и морфолинила, и
Z3 каждый независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси и -NMe2
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
в соответствии с восьмым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A представляет собой
 ;
;
T выбирают из T1 - T6 имеют значения, как определено выше
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
водорода, хлора, фтора, брома,
-NH2, -NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила; и
моноциклического гетероцикла, выбранного из группы, состоящей из тетрагидропирана, морфолина и 2-фторазетидина,
R3 представляет собой водород,
R4 выбирают из группы, состоящей из водорода, хлора, фтора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, хлора, фтора и метила,
R6 выбирают из группы, состоящей из водорода, фтора, метила и метокси,
Q выбирают из группы, состоящей из фенила, 1,3-бензотиазол-4-ила, 1,3-бензотиазол-7-ила, 1,3-бензоксазол-7-ила, 1H-индол-4-ила, 1-метил-1H-бензимидазол-6-ила, 2,3,4-трифторфенила, 2,3,4-трихлорфенила, 2,3,5-трифторфенила, 2,3,5-трихлорфенила, 2,3,6-трифторфенила, 2,3,6-трихлорфенила, 2,3-дифторфенила, 2,3-дихлорфенила, 2,4,5-трифторфенила, 2,4,5-трихлорфенила, 2,4,6-трифторфенила, 2,4,6-трихлорфенила, 2,4,6-трифтор-3-метоксифенила, 2,4,6-трихлор-3-метоксифенила, 2,4-дифтор-3-гидроксифенила, 2,4-дихлор-3-гидроксифенила, 2,4-дифтор-3-метоксифенила, 2,4-дихлор-3-метоксифенила, 2,4-дифтор-3-(диметиламино)фенила, 2,4-дихлор-3-(диметиламино)фенила, 2,5-дифтор-4-метоксифенила, 2,5-дихлор-4-метоксифенила, 2,6-дифторфенила, 2,6-дихлорфенила, 2-фтор-3-хлорфенила, 2-хлор-3-фторфенила, 2-фтор-3-(диметиламино)фенила, 2-хлор-3-(диметиламино)фенила, 2-хлор-4-фторфенила, 2-фтор-4-хлорфенила, 2-хлор-5-фторфенила, 2-фтор-4-(диметиламино)фенила, 2-хлор-4-(диметиламино)фенила, 2-хлор-6-фторфенила, 2-фторфенила, 2-хлорфенила, 2-фтор-3-(трифторметокси)фенила, 2-хлор-3-(трифторметокси)фенила, 2-фтор-3-(трифторметил)фенила, 2-хлор-3-(трифторметил)фенила, 3-(диметиламино)фенила, 3-(метиламино)фенила, 3-(трифторметокси)фенила, 3,4,5-трифторфенила, 3,4,5-трихлорфенила, 3,4-дифтор-5-(диметиламино)фенила, 3,4-дихлор-5-(диметиламино)фенила, 3,4-дифторфенила, 3,4-дихлорфенила, 3,4-дифтор-2-метоксифенила, 3,4-дихлор-2-метоксифенила, 3,5-дифтор-4-(диметиламино)фенила, 3,5-дихлор-4-(диметиламино)фенила, 3,5-дифтор-4-хлорфенила, 3,5-дихлор-4-фторфенила, 3,5-дифторфенила, 3,5-дихлорфенила, 3,5-диметилфенила, 3-фтор-2-хлор-5-метилфенила, 3-хлор-2-фтор-5-метилфенила, 3-хлор-2-метилфенила, 3-фтор-4-(диметиламино)-5-хлорфенила, 3-фтор-4-(диметиламино)фенила, 3-хлор-4-(диметиламино)фенила, 3-хлор-4-фторфенила, 3-фтор-4-метилфенила, 3-хлор-4-метилфенила, 3-фтор-5-(диметиламино)фенила, 3-хлор-5-(диметиламино)фенила, 3-фтор-5-(метилсульфанил)фенила, 3-хлор-5-(метилсульфанил)фенила, 3-фтор-5-(морфолин-4-ил)фенила, 3-хлор-5-(морфолин-4-ил)фенила, 3-фтор-5-(трифторметил)фенила, 3-хлор-5-(трифторметил)фенила, 3-фтор-5-этилфенила, 3-хлор-5-этилфенила, 3-хлор-5-фторфенила, 3-фтор-5-метоксифенила, 3-хлор-5-метоксифенила, 3-фтор-5-метилфенила, 3-фторфенила, 3-хлорфенила, 3-фтор-4-метоксифенила, 3-хлор-4-метоксифенила, 3-фтор-5-метилфенила, 3-хлор-5-метилфенила, 4-фтор-3-(диметиламино)фенила, 4-хлор-3-(диметиламино)фенила, 4-фтор-3-метоксифенила, 4-хлор-3-метоксифенила, 5-хлор-2,4-дифторфенила, 5-фтор-2,4-дихлорфенила, 5-фтор-2-хлор-3-метилфенила, 5-хлор-2-фтор-3-метилфенила, 5-фтор-2-хлор-4-метилфенила, 5-хлор-2-фтор-4-метилфенила, 5-хлор-2-фторфенила, 5-хлор-2-метоксифенила и 5-фтор-2-метоксифенила,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с девятым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I), выше, в которой:
A представляет собой
 ;
;
T выбирают из T1 - T6, как определено выше
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
водорода, хлора, фтора, брома
-NH2, -NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила; и
моноциклического гетероцикла, выбранного из группы, состоящей из тетрагидропирана, морфолина и 2-фтор азетидина,
R3 представляет собой водород,
R4 выбирают из группы, состоящей из водорода, хлора, фтора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, хлора, фтора и метила,
R6 выбирают из группы, состоящей из водорода, фтора, метила и метокси,
Q выбирают из группы, состоящей из фенила, 2,3,4-трифторфенила, 2,3,4-трихлорфенила, 2,3,5-трифторфенила, 2,3,5-трихлорфенила, 2,3,6-трифторфенила, 2,3,6-трихлорфенила, 2,3-дифторфенила, 2,3-дихлорфенила, 2,4,5-трифторфенила, 2,4,5-трихлорфенила, 2,4,6-трифторфенила, 2,4,6-трихлорфенила, 2,6-дифторфенила, 2,6-дихлорфенила, 2-фтор-3-хлорфенила, 2-хлор-3-фторфенила, 2-хлор-4-фторфенила, 2-фтор-4-хлорфенила, 2-хлор-5-фторфенила, 2-хлор-6-фторфенила, 2-фторфенила, 2-хлорфенила, 3,4,5-трифторфенила, 3,4,5-трихлорфенила, 3,4-дифторфенила, 3,4-дихлорфенила, 3,5-дифтор-4-хлорфенила, 3,5-дихлор-4-фторфенила, 3,5-дифторфенила, 3,5-дихлорфенила, 3-хлор-4-фторфенила, 3-хлор-5-фторфенила, 3-фторфенила, 3-хлорфенила, 5-хлор-2,4-дифторфенила, 5-фтор-2,4-дихлорфенила, 5-хлор-2-фторфенила,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с десятым вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (II):

где:
T выбирают из T1 - T6, как определено выше
предпочтительно T выбирают из T1, T2 или T3 имеют значения, как определено выше, и
R1 - R6 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II) выше, в которой:
T представляет собой T1, как определено выше:
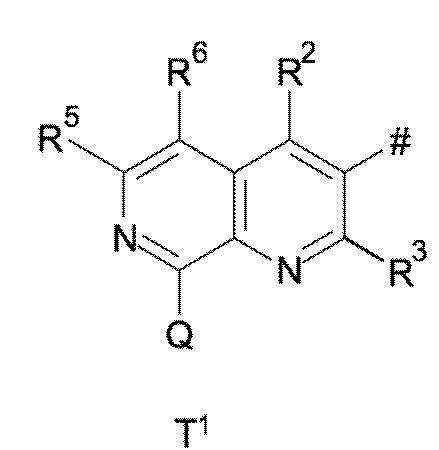 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II) выше, в которой:
T представляет собой T2, как определено выше:
 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II) выше, в которой:
T представляет собой T3, как определено выше:
 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II) выше, в которой:
T представляет собой T4, как определено выше:
 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II) выше, в которой:
T представляет собой T5, как определено выше:
 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с другим конкретным вариантом выполнения первого объекта настоящего изобретения настоящее изобретение охватывает соединения общей формулы (I) или (II), выше, в которых:
T представляет собой T6, как определено выше:
 , и
, и
A и R1 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
Другие варианты выполнения первого объекта настоящего изобретения:
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
A представляет собой A1 или A2,
 ,
,
o равно 0, 1 или 2,
R выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси, циано, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена,
T выбирают из T1 - T6, как определено выше
X, Y независимо выбирают из группы, состоящей из CR7R8, O, S, и N-R9, где по меньшей мере один из X и Y представляет собой CR7R8,
R7 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R8 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R9 представляет собой C1-C4-алкил,
R10 выбирают из группы, состоящей из водорода, -OH, C1-C4-алкила и C1-C4-алкокси, и
R11 представляет собой водород,
где когда Y представляет собой O, S или N-R9, R10 не представляет собой -OH,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T1 - T6, как определено выше
A представляет собой A1 или A2,
 ,
,
o равно 0 или 1,
R выбирают из группы, состоящей из галогена, C1-C4-алкила и C1-C4-алкокси,
X выбирают из группы, состоящей из CR7R8, O, S, и N-R9,
Y представляет собой CR7R8,
R7 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R8 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R9 представляет собой C1-C4-алкил,
R10 выбирают из группы, состоящей из водорода, -OH и C1-C4-алкила, и
R11 представляет собой водород,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T1 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно A представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T2 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно A представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T3 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно А представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T4 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно А представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T5 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно А представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой:
T выбирают из T6 выше и
A выбирают из группы, состоящей из
 ,
,
предпочтительно А представляет собой
 ,
,
и R1 - R9 и R12 - R15 имеют значения, как определено для любого из вариантов выполнения первого объекта настоящего изобретения выше;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R2 выбирают из группы, состоящей из
водорода, галогена, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2,-C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2;
-NR12R13;
-OR14;
-SR15, -S(O)R15, -SO2R15;
C1-C4-алкила, C3-C6-циклоалкила, C2-C4-алкенила, C3-C6-циклоалкенила, C2-C4-алкинила или фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы, состоящей из 4-10-членного гетероциклоалкила, гетероспироциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, C1-C4-алкила, C1-C4-алкил-C(O)-, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, гидрокси-C1-C4-алкил, C1-C4-алкокси-C1-C4-алкила-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкил)2, и 4-10-членного гетероциклоалкила,
R12 и R13 независимо выбирают из группы, состоящей из
водорода, -NH(-C(O)-C1-C4-алкила), C1-C4-алкокси;
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, C1-C4-алкокси-C(O)-, -C(O)-NH2, -C(O)-NH(C1-C4-алкила), -C(O)-N(C1-C4-алкила)2, -NH-C(O)-C1-C4-алкила, -N(C1-C4-алкил)-(-C(O)-C1-C4-алкила), C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила, -NH2, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, -S-C1-C4-алкила, -S(O)-C1-C4-алкила, -SO2-C1-C4-алкила, -S-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -S(O)-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, -SO2-C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, и (C1-C4-алкокси)2P(=O)-;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
фенила, бензо-C5-C6-циклоалкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена; и
моноциклического или бициклического гетероцикла, выбранного из группы 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
R14 выбирают из группы, состоящей из
C1-C4-алкила, C3-C6-циклоалкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, C3-C6-циклоалкила; и
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -OH, оксо, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
R15 выбирают из группы, состоящей из
C1-C4-алкила, фенил-C1-C4-алкила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
гетероциклил-C1-C4-алкила, где гетероциклильный заместитель выбирают из группы, состоящей из 4-10-членного гетероциклоалкила, 5-членного гетероарила и 6-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R1 представляет собой водород или метил;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R2 выбирают из группы, состоящей из
водорода, хлора,
-NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила; и
моноциклического гетероцикла, выбранного из группы, состоящей из тетрагидропирана, морфолина и тиоморфолина;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R3 выбирают из группы, состоящей из водорода, хлор или метил;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R4 выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси и трифторметила;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R5 выбирают из группы, состоящей из водорода, фтора, хлора и метила;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
R6 выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси;
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I) или (II), выше, в которых:
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1, Z2, Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, гидрокси, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, 4-6-членный гетероциклил, который необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из фтора, хлора, брома, метила и циано, -S-(C1-C4-алкила), -S(O)-(C1-C4-алкила), -SO2-(C1-C4-алкила), или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6- членный гетероциклоалкил, 5-ти членный гетероарил или 6-ти членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z3, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-алкокси-C(O)-, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, или
Z2 и Z3 образуют, вместе с атомом углерода, к которому они присоединены, 5- или 6- членное насыщенное или частично насыщенное гетероциклическое кольцо, 5-членный гетероарил или 6-членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо, и
Z1, Z4, и Z5 независимо выбирают из группы, состоящей из водорода, галогена, циано, C1-C4-алкила, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена,
предпочтительно
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси, -NH(C1-C4-алкила), -N(C1-C4-алкила)2, C1-C4-галогеноалкила, имеющего от 1 до 5 атомов галогена, C1-C4-галогеноалкокси, имеющего от 1 до 5 атомов галогена, -S-(C1-C4-алкила) и 4-6-членного гетероциклоалкила, и
Z3 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-алкокси и -N(C1-C4-алкила)2, или
Z1 и Z2 образуют, вместе с атомом углерода, к которому они присоединены, 5-членный гетероциклоалкил или 5-ти членный гетероарил, каждый из которых может быть необязательно замещен одним или двумя заместителями, выбранными из группы, состоящей из метила, фтора и оксо,
Z3 и Z5 представляют собой водород, и
Z4 выбирают из группы, состоящей из водорода и C1-C4-алкокси-C(O)-,
более предпочтительно
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, фтора, хлора, -OH, метила, этила, -NHMe, -NMe2, трифторметила, метокси, трифторметокси, -SMe и морфолинила, и
Z3 каждый независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси и -NMe2,
даже более предпочтительно
Q выбирают из группы, состоящей из фенила, 2,3-дифторфенила, 2,3-дихлорфенила, 2,6-дифторфенила, 2,6-дихлорфенила, 2-фтор-3-хлорфенила, 2-хлор-3-фторфенила, 2-хлор-4-фторфенила, 2-фтор-4-хлорфенила, 2-хлор-5-фторфенила, 2-хлор-6-фторфенила, 2-фторфенила, 2-хлорфенила, 3,4-дифторфенила, 3,4-дихлорфенила, 3,5-дифторфенила, 3,5-дихлорфенила, 3-хлор-4-фторфенила, 3-хлор-5-фторфенила, 3-фторфенила, 3-хлорфенила, 5-хлор-2-фторфенила, 2,3,5-трифторфенила и 2,3,5-трихлорфенила,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В другом варианте выполнения первого объекта настоящего изобретения, настоящее изобретение охватывает соединения формулы (I), выше, в которой
A представляет собой A3 или A4
 ,
,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В конкретном другом варианте выполнения первого объекта настоящее изобретение охватывает комбинации двух или более из вышеуказанных вариантов выполнения настоящего изобретения, обозначенных как “другие варианты выполнения первого объекта настоящего изобретения”.
Настоящее изобретение охватывает любую подкомбинацию в рамках любого варианта выполнения настоящего изобретения или объекта настоящего изобретения соединений общей формулы (I) или (II), выше.
Настоящее изобретение охватывает соединения общей формулы (I), которые раскрыты в части Примеры в данном документе, ниже.
Соединения в соответствии с изобретением общей формулы (I) и (II) могут быть получены в соответствии со схемами 1-6, как показано в экспериментальной части настоящего изобретения (общие методики). Описанные схемы и процедуры иллюстрируют пути синтеза соединений общей формулы (I) и (II) по изобретению и не предназначены для ограничения. Специалисту в данной области техники понятно, что порядок превращений, приведенный в качестве примеров на схемах 1-6, может быть изменен различными способами. Порядок превращений, приведенный в качестве примера на этих схемах, поэтому не является ограничивающим. Кроме того, взаимопревращение любого из заместителей, T, Q, A, R1, R2, R3, R4, R5 или R6, может быть достигнуто до и/или после приведенных в качестве примеров превращений. Эти модификации могут быть такими, как введение защитных групп, отщепление защитных групп, восстановление или окисление функциональных групп, галогенирование, металлирование, замещение или другие реакции, известные специалисту в данной области. Эти преобразования включают те, которые вводят функциональную группу, которая позволяет дальнейшее взаимопревращение заместителей. Соответствующие защитные группы и их введение и отщепление хорошо известны специалисту в данной области (смотрите, например, T.W. Greene и P.G.M. Wuts в Protective Groups in Organic Synthesis, 3rd edition, Wiley 1999). Конкретные примеры описаны в последующих абзацах.
Далее несколько схем получения соединений общей формулы (I) и (II) описаны на схемах 1-6.
В соответствии со вторым объектом изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I), как определено выше, причем указанные способы включают стадию обеспечения реакции промежуточного соединения формулы 1N-T1, 1N-T2, 1N-T3, 1N-T4, 1N-T5, или 1N-T6:


где A, R1, R3, R4, R5, R6, и Q имеют значения, как определено для соединений общей формулы (I), как определено выше,
с соединением общей формулы 1F:

где R2 представляет собой NR12R13, OR14, или SR15, каждый имеет значения, как определено для соединений общей формулы (I), как определено выше,
таким образом получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше.
В соответствии с альтернативным вариантом выполнения второго объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I), как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1M-T1, 1M-T2, 1M-T3, 1M-T4, 1M-T5, или 1M-T6:
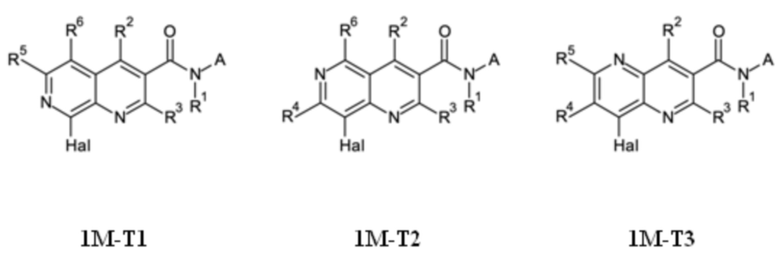

где A, R1, R2, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше, и где Hal представляет собой галоген, в частности хлор, бром или иод,
с соединением общей формулы 1H:

где Q имеет значения, как определено для соединения общей формулы (I), выше, и каждый R может индивидуально представлять собой H или Me, или оба R представляют собой пинаколат,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше.
В соответствии с альтернативным вариантом выполнения второго объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1W-T1, 1W-T2, 1W-T3, 1W-T4, 1W-T5, или 1W-T6:

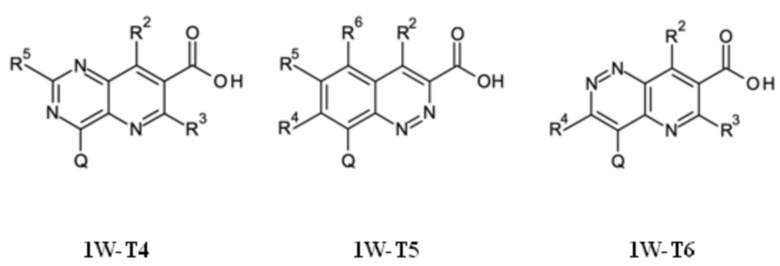
где Q, R2, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 1V:

где R1 и A имеют значения, как определено для соединения общей формулы (I), выше,
таким образом, получая соединение общей формулы (I):
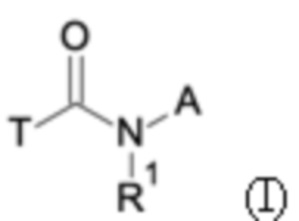
где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше.
В соответствии с альтернативным вариантом выполнения второго объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1X-T1, 1X-T2, 1X-T3, 1X-T4, 1X-T5, или 1X-T6:


где Q, A, R1, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 1Y:

где R2 представляет собой C1-C4-алкокси, который необязательно замещен, как определено для соединения общей формулы (I), выше,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R3, R4, R5, R6, и Q имеют значения, как определено выше, и R2 представляет собой C1-C4-алкокси, который необязательно замещен, имеют значения, как определено выше.
В соответствии с альтернативным вариантом выполнения второго объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1N-T1, 1N-T2, 1N-T3, 1N-T4, 1N-T5, или 1N-T6:


где A, R1, R3, R4, R5, R6, и Q имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 2A:

где R2 представляет собой C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил, фенил-C1-C4-алкил, гетероциклил-C1-C4-алкил, фенил или моноциклический или бициклический гетероцикл, каждый имеет значения, как определено для соединения общей формулы (I), выше, Met представляет собой магний или цинк, и X представляет собой хлор, бром или иод,
таким образом, получая соединение общей формулы (I):
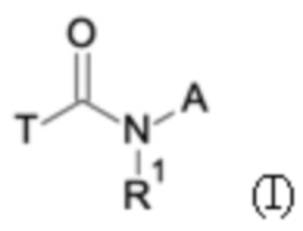
где T, A, R1, R3, R4, R5, R6, и Q имеют значения, как определено выше, и R2 представляет собой C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, имеют значения, как определено выше.
в соответствии с третьим объектом настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1N-T1, 1N-T2, 1N-T3, 1N-T4, 1N-T5, или 1N-T6:
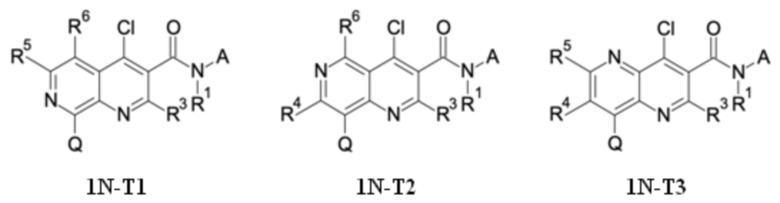
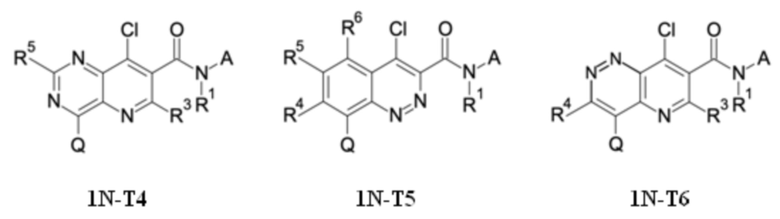
где A, R1, R3, R4, R5, R6, и Q имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 1F:

где R2 представляет собой NR12R13, OR14, SR15, как определено для соединения общей формулы (I) выше,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше.
затем при необходимости превращение указанного соединения в сольваты, соли и/или сольваты таких солей с использованием соответствующих (i) растворителей и/или (ii) оснований или кислот.
В соответствии с альтернативным вариантом выполнения третьего объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1M-T1, 1M-T2, 1M-T3, 1M-T4, 1M-T5, или 1M-T6:
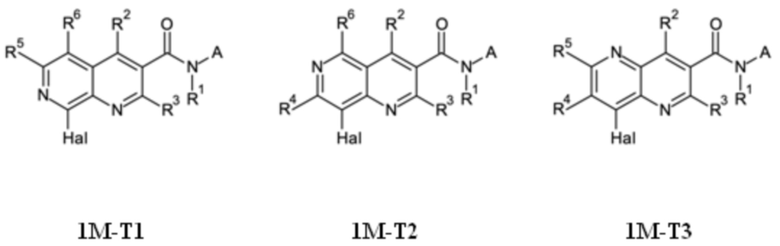

где A, R1, R2, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше, и где Hal представляет собой галоген, в частности хлор, бром или иод,
с соединением общей формулы 1H:
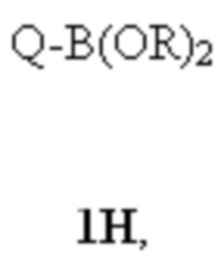
где Q имеет значения, как определено для соединения общей формулы (I), выше, и каждый R может индивидуально представлять собой H или Me, или оба R представляют собой пинаколат,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше.
затем при необходимости превращение указанного соединения в сольваты, соли и/или сольваты таких солей с использованием соответствующих (i) растворителей и/или (ii) оснований или кислот.
В соответствии с альтернативным вариантом выполнения третьего объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1W-T1, 1W-T2, 1W-T3, 1W-T4, 1W-T5, или 1W-T6:
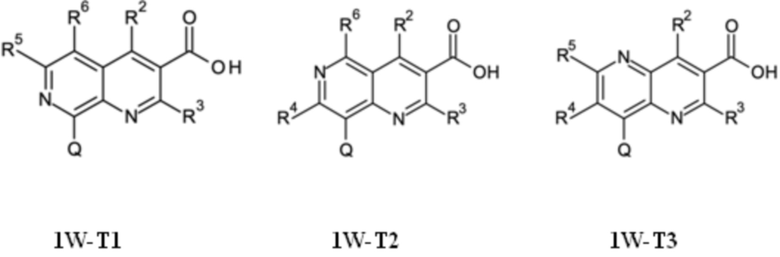

где Q, R2, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 1V:

где R1 т A имеют значения, как определено для соединения общей формулы (I), выше,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше,
затем при необходимости превращение указанного соединения в сольваты, соли и/или сольваты таких солей с использованием соответствующих (i) растворителей и/или (ii) оснований или кислот.
В соответствии с альтернативным вариантом выполнения третьего объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1Х-T1, 1Х-T2, 1Х-T3, 1Х-T4, 1Х-T5, или 1Х-T6:
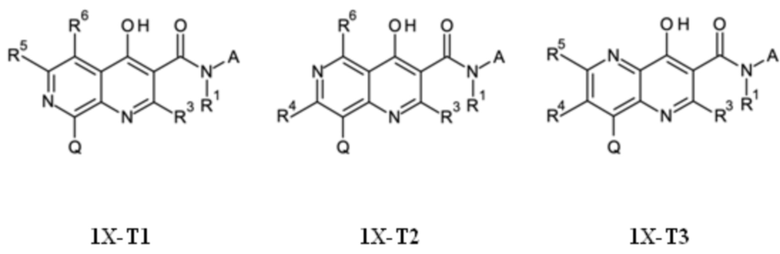
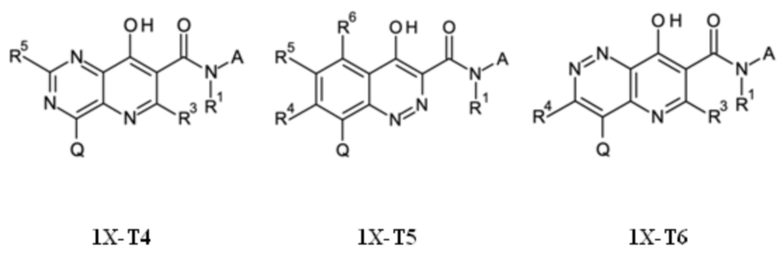
где Q, A, R1, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 1Y:

где R2 представляет собой C1-C4-алкокси, который необязательно замещен, как определено для соединения общей формулы (I), выше,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R2, R3, R4, R5, R6, и Q имеют значения, как определено выше, и R2 представляет собой C1-C4-алкокси, который необязательно замещен, имеют значения, как определено выше,
затем при необходимости превращение указанного соединения в сольваты, соли и/или сольваты таких солей с использованием соответствующих (i) растворителей и/или (ii) оснований или кислот.
В соответствии с альтернативным вариантом выполнения третьего объекта настоящего изобретения, настоящее изобретение охватывает способы получения соединений общей формулы (I) имеют значения, как определено выше, причем указанные способы включают стадию обеспечения реакции соединения общей формулы 1N-T1, 1N-T2, 1N-T3, 1N-T4, 1N-T5, или 1N-T6:
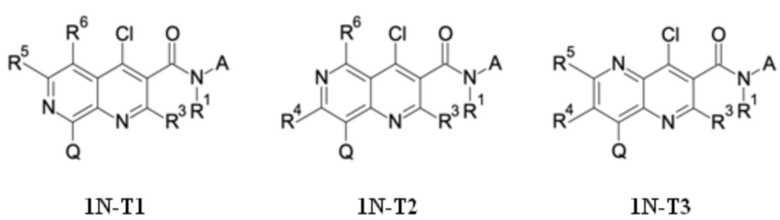
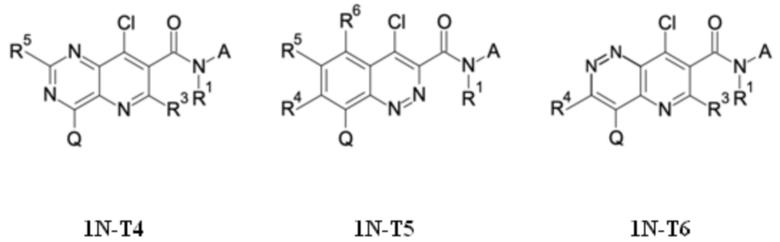
где Q, A, R1, R3, R4, R5 и R6 имеют значения, как определено для соединения общей формулы (I), выше,
с соединением общей формулы 2A:

где R2 представляет собой C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил, фенил-C1-C4-алкил, гетероциклил-C1-C4-алкил, фенил или моноциклический или бициклический гетероцикл, каждый имеет значения, как определено для соединения общей формулы (I), выше, Met представляет собой магний или цинк, и X представляет собой хлор, бром или иод,
таким образом, получая соединение общей формулы (I):

где T, A, R1, R3, R4, R5, R6, и Q имеют значения, как определено выше, и R2 представляет собой C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, имеют значения, как определено выше,
затем при необходимости превращение указанного соединения в сольваты, соли и/или сольваты таких солей с использованием соответствующих (i) растворителей и/или (ii) оснований или кислот.
Настоящее изобретение охватывает способы получения соединений по настоящему изобретению общей формулы (I) и (II), причем указанные способы включают стадии, описанные в разделе «Экспериментальный раздел».
В соответствии с четвертым объектом настоящее изобретение охватывает промежуточные соединения, которые полезны для получения соединений общей формулы (I) и (II), выше.
В частности, настоящее изобретение охватывает промежуточные соединения общих формул (I-INT-T1), (I-INT-T2), (I-INT-T3), (I-INT-T4), (I-INT-T5) и (I-INT-T6):

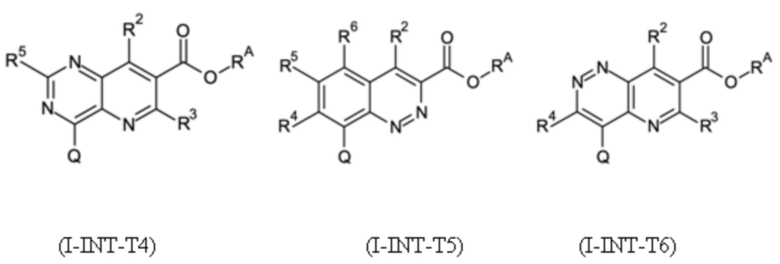
где
R2 представляет собой -OH или как определено для соединения общей формулы (I) выше,
R3, R4, R5, R6, и Q имеют значения, как определено для соединения общей формулы (I) выше, и
RA представляет собой H или C1-C4-алкил,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В частности, настоящее изобретение также охватывает промежуточные соединения формулы (II-INT-T1), (II-INT-T2), (II-INT-T3), (II-INT-T4), (II-INT-T5) и (II-INT-T6):
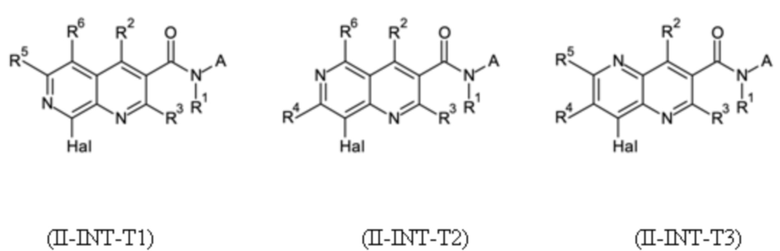

где
R2 представляет собой -OH или как определено для соединения общей формулы (I) выше,
A, R1, R3, R4, R5, и R6 имеют значения, как определено для соединения общей формулы (I) выше, и
Hal представляет собой галоген,
и их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, а также смеси указанного.
В соответствии с пятым объектом настоящее изобретение охватывает применение промежуточных соединений для получения соединения общей формулы (I), как определено выше.
В частности, настоящее изобретение охватывает применение промежуточных соединений общей формулы (I-INT-T1), (I-INT-T2), (I-INT-T3), (I-INT-T4), (I-INT-T5) и (I-INT-T6):
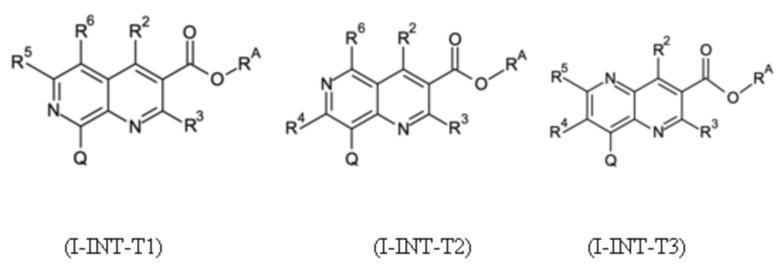

где
R2 представляет собой -OH или как определено для соединения общей формулы (I) выше,
R3, R4, R5, R6, и Q имеют значения, как определено для соединения общей формулы (I) выше, и
RA представляет собой H или C1-C4-алкил,
для получения соединения общей формулы (I), как определено выше.
В частности, настоящее изобретение охватывает применение промежуточных соединений общей формулы (II-INT-T1), (II-INT-T2), (II-INT-T3), (II-INT-T4), (II-INT-T5) и (II-INT-T6):
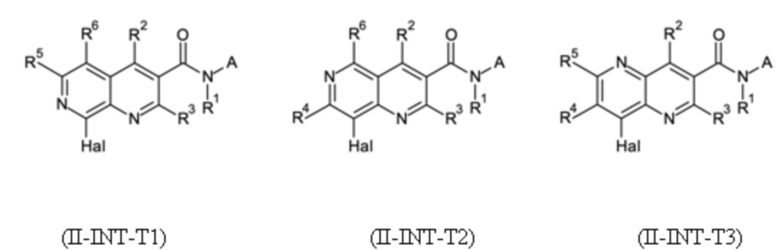

где
R2 представляет собой -OH, как определено для соединения общей формулы (I) выше,
A, R1, R3, R4, R5, и R6 имеют значения, как определено для соединения общей формулы (I) выше, и
Hal представляет собой галоген,
для получения соединения общей формулы (I), как определено выше.
Настоящее изобретение охватывает промежуточные соединения, которые раскрыты в Экспериментальной части в описании настоящего изобретения, ниже.
Соединения общей формулы (I) и (II), согласно настоящему изобретению, могут быть превращены в любую соль, предпочтительно фармацевтически приемлемые соли, как описано в настоящей заявке, любым способом, который известен специалисту в данной области техники. Аналогично любая соль соединения общей формулы (I) и (II) согласно настоящему изобретению, может быть превращена в свободное соединение любым способом, который известен специалисту в данной области техники.
Соединения общей формулы (I) и (II) согласно настоящему изобретению продемонстрировали ценный фармакологический спектр действия, которого нельзя было предсказать. Соединения соответствовали настоящему изобретению, как неожиданно было обнаружено, эффективно взаимодействовать с Slo-1, и поэтому можно использовать указанные соединения для лечения или профилактики заболеваний, особенно гельминтоза, в частности, желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций с нематодами у людей и животных.
Соединения согласно настоящему можно использовать изобретению для контроля, лечения и/или профилактики гельминтоза, в частности желудочно-кишечных и внекишечного гельминтоза. Этот способ включает введение нуждающемуся в этом млекопитающему небольшого количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, изомера, полиморфа, метаболита, гидрата, сольвата или сложного эфира; которые эффективны для лечения нарушения.
В альтернативном варианте этот способ включает введение птицам, а именно птицам клеточного содержания или, в частности, домашней птице, нуждающимся в этом, количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, изомера, полиморфа, метаболита, гидрата, сольвата или сложного эфира; которые эффективны для лечения нарушения.
В частности, в области ветеринарной медицины соединения согласно настоящему изобретению подходят с благоприятной токсичностью у теплокровных животных, для борьбы с паразитами, в частности гельминтами, которые встречаются в животноводстве, разведении животных, зоопарке, лаборатории, у экспериментальных и домашних животных. Они активны против всех или конкретных стадий развития паразитов, в частности гельминтов.
Сельскохозяйственные животные включают, например, млекопитающих, таких как овцы, козы, лошади, ослы, верблюды, буйволы, кролики, олени, палевые олени и, в частности, крупный рогатый скот и свиньи; или птиц, таких как индейки, утки, гуси и, в частности, цыплята; или рыб или ракообразных, например, в аквакультуре.
Домашние животные включают, например, млекопитающих, таких как хомяки, морские свинки, крысы, мыши, шиншиллы, хорьки или, в частности, собаки, кошки; птицы клеточного содержания; рептилии; амфибии или аквариумные рыбы.
Настоящее изобретение также обеспечивает способы лечения гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
Эти нарушения хорошо охарактеризованы у животных, и их можно лечить путем введения фармацевтических композиций согласно настоящему изобретению.
Термин «лечить» или «лечение», используемый в описании настоящего изобретения, используется традиционно, например, контроль или уход за субъектом с целью борьбы, облегчения, уменьшения, освобождения, улучшения состояния болезни или нарушения, таких как инфекция, вызванная нематодами. В частности и особенно в области здоровья животных или ветеринарной области, термин «лечить» или «лечение» включает профилактическое, метафилактическое или терапевтическое лечение.
Гельминты, патогенные для человека или животных, включают, например, скребни, нематоды, пентастомы и плоские черви (например, моногенеи, цестоды и трематоды).
Примерные гельминты включают, без какого-либо ограничения:
Моногенеи: например: Dactylogyrus spp., Gyrodactylus spp., Microbothrium spp., Polystoma spp., Troglocephalus spp.
Цестоды: из отряда Pseudophyllidea, например: Bothridium spp., Diphyllobothrium spp., Diplogonoporus spp., Ichthyobothrium spp., Ligula spp., Schistocephalus spp., Spirometra spp.
из отряда Циклофиллиды, например: Andyra spp., Anoplocephala spp., Avitellina spp., Bertiella spp., Cittotaenia spp., Davainea spp., Diorchis spp., Diplopylidium spp., Dipylidium spp., Echinococcus spp., Echinocotyle spp., Echinolepis spp., Hydatigera spp., Hymenolepis spp., Joyeuxiella spp., Mesocestoides spp., Moniezia spp., Paranoplocephala spp., Raillietina spp., Stilesia spp., Taenia spp., Thysaniezia spp., Thysanosoma spp.
Трематоды: из класса дигенетические сосальщики, например: Austrobilharzia spp., Brachylaima spp., Calicophoron spp., Catatropis spp., Clonorchis spp. Collyriclum spp., Cotylophoron spp., Cyclocoelum spp., Dicrocoelium spp., Diplostomum spp., Echinochasmus spp., Echinoparyphium spp., Echinostoma spp., Eurytrema spp., Fasciola spp., Fasciolides spp., Fasciolopsis spp., Fischoederius spp., Gastrothylacus spp., Gigantobilharzia spp., Gigantocotyle spp., Heterophyes spp., Hypoderaeum spp., Leucochloridium spp., Metagonimus spp., Metorchis spp., Nanophyetus spp., Notocotylus spp., Opisthorchis spp., Ornithobilharzia spp., Paragonimus spp., Paramphistomum spp., Plagiorchis spp., Posthodiplostomum spp., Prosthogonimus spp., Schistosoma spp., Trichobilharzia spp., Troglotrema spp., Typhlocoelum spp.
Нематоды: из отряда Trichinellida, например: Capillaria spp., Eucoleus spp., Paracapillaria spp., Trichinella spp., Trichomosoides spp., Trichuris spp.
из отряда Тиленхиды, например: Micronema spp., Parastrongyloides spp., Strongyloides spp.
из отряда Rhabditina, например: Aelurostrongylus spp., Amidostomum spp., Ancylostoma spp., Angiostrongylus spp., Bronchonema spp., Bunostomum spp., Chabertia spp., Cooperia spp., Cooperioides spp., Crenosoma spp., Cyathostomum spp., Cyclococercus spp., Cyclodontostomum spp., Cylicocyclus spp., Cylicostephanus spp., Cylindropharynx spp., Cystocaulus spp., Dictyocaulus spp., Elaphostrongylus spp., Filaroides spp., Globocephalus spp., Graphidium spp., Gyalocephalus spp., Haemonchus spp., Heligmosomoides spp., Hyostrongylus spp., Marshallagia spp., Metastrongylus spp., Muellerius spp., Necator spp., Nematodirus spp., Neostrongylus spp., Nippostrongylus spp., Obeliscoides spp., Oesophagodontus spp., Oesophagostomum spp., Ollulanus spp.; Ornithostrongylus spp., Oslerus spp., Ostertagia spp., Paracooperia spp., Paracrenosoma spp., Parafilaroides spp., Parelaphostrongylus spp., Pneumocaulus spp., Pneumostrongylus spp., Poteriostomum spp., Protostrongylus spp., Spicocaulus spp., Stephanurus spp., Strongylus spp., Syngamus spp., Teladorsagia spp., Trichonema spp., Trichostrongylus spp., Triodontophorus spp., Troglostrongylus spp., Uncinaria spp.
из отряда Спируриды, например: Acanthocheilonema spp., Anisakis spp., Ascaridia spp.; Ascaris spp., Ascarops spp., Aspiculuris spp., Baylisascaris spp., Brugia spp., Cercopithifilaria spp., Crassicauda spp., Dipetalonema spp., Dirofilaria spp., Dracunculus spp.; Draschia spp., Enterobius spp., Filaria spp., Gnathostoma spp., Gongylonema spp., Habronema spp., Heterakis spp.; Litomosoides spp., Loa spp., Onchocerca spp., Oxiuris spp., Parabronema spp., Parafilaria spp., Parascaris spp., Passalurus spp., Physaloptera spp., Probstmayria spp., Pseudofilaria spp., Setaria spp., Skjrabinema spp., Spirocerca spp., Stephanofilaria spp., Strongyluris spp., Syphacia spp., Thelazia spp., Toxascaris spp., Toxocara spp., Wuchereria spp.
Скребни: из отряда Oligacanthorhynchida, например: Macracanthorhynchus spp., Prosthenorchis spp.; из отряда Moniliformida, например: Moniliformis spp.
из отряда Polymorphida, например: Filicollis spp.; из отряда Echinorhynchida, например: Acanthocephalus spp., Echinorhynchus spp., Leptorhynchoides spp.
Пентастомы: из отряда Porocephalida, например: Linguatula spp.
Соединения согласно настоящему изобретению могут применяться в частности для лечения и предотвращения, т.е. профилактики, гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
Посредством применения соединений согласно настоящему изобретению для борьбы с животными паразитами, в частности гельминтами, предполагается уменьшить или предотвратить болезнь, случаи смерти и снижения производительности (в случае мяса, молока, шерсти, шкур, яиц, меда и тому подобного), так что становится возможным более экономичное и простое разведение животных и достижение лучшего благополучия животных.
Термин «борьба» или «контроль», как применяется в описании настоящего изобретения в отношении области защиты животных, означает, что соединения согласно настоящему изобретению эффективны для снижения частоты возникновения соответствующего паразита у животного, инфицированного такими паразитами, до безобидных уровней. Более конкретно, «борьба», как применяется в описании настоящего изобретения, означает, что соединения согласно настоящему изобретению эффективны для уничтожения соответствующего паразита, ингибирования его роста или ингибирования его пролиферации.
В соответствии с другим объектом, настоящее изобретение охватывает соединения общей формулы (I), как описано выше, или их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, в частности их фармацевтически приемлемые соли, или их смеси, для применения для лечения или профилактики заболеваний, в частности гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
Фармацевтическая активность соединений согласно настоящему изобретению может быть пояснена посредством их взаимодействия с ионным каналом Slo-1.
В соответствии с другим объектом, настоящее изобретение охватывает применение соединений общей формулы (I), как описано выше, или их стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов и солей и, в частности их фармацевтически приемлемых солей, или их смесей, для лечения или профилактики заболеваний, в частности гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
В соответствии с другим объектом, настоящее изобретение охватывает применение соединений общей формулы (I), как описано выше, или их стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов и солей и, в частности их фармацевтически приемлемых солей, или их смесей, в способе лечения или профилактики заболеваний, в частности гельминтоза, особенно желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
В соответствии с другим объектом, настоящее изобретение охватывает применение соединений общей формулы (I), как описано выше, или их стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов и солей и, в частности их фармацевтически приемлемых солей, или их смесей, для получения фармацевтической композиции, предпочтительно лекарственного средства, для профилактики или лечения заболеваний, в частности гельминтоза, особенно желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами.
В соответствии с другим объектом, настоящее изобретение охватывает способ лечения или профилактики заболеваний, в частности гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами, применяя эффективное количество соединения общей формулы (I), как описано выше, или его стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов и солей, в частности его фармацевтически приемлемых солей или их смесей.
В соответствии с другим объектом, настоящее изобретение охватывает соединения общей формулы (I), как описано выше, или их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, в частности их фармацевтически приемлемые соли, или их смеси, для применения в качестве антиэндопаразтарного средства.
В соответствии с другим объектом, настоящее изобретение охватывает соединения общей формулы (I), как описано выше, или их стереоизомеры, таутомеры, N-оксиды, гидраты, сольваты и соли, в частности их фармацевтически приемлемые соли, или их смеси, для применения в качестве антигельминтного средства, в частности для применения в качестве нематицидного средства, платигельминтоцидное средство, акантоцефалицидное средство или пентастомицидное средство
В соответствии с другим объектом, настоящее изобретение охватывает фармацевтические композиции, в частности ветеринарную композицию, содержащую соединение общей формулы (I), как описано выше, или его стереоизомер, таутомер, N-оксид, гидроксид, сольват, соль, в частности фармацевтически приемлемую соль, или их смесь, и один или более эксципиентов, в частности один или более фармацевтически приемлемых эксципиентов. Можно использовать обычные методики для приготовления таких фармацевтических композиций в соответствующих лекарственных формах.
В соответствии с другим объектом, настоящее изобретение охватывает способ получения фармацевтической композиции, в частности ветеринарной композиции, включающий стадию смешивания соединения общей формулы (I), как описано выше, или его стереоизомера, таутомера, N-оксида, гидроксида, сольвата, соли, в частности фармацевтически приемлемой соли, или их смеси, с одним или более эксципиентами, в частности одним или более фармацевтически приемлемыми эксципиентами.
В соответствии с другим объектом, настоящее изобретение охватывает способ лечения или профилактики заболеваний, в частности гельминтоза, в частности желудочно-кишечного и внекишечного гельминтоза, более конкретно желудочно-кишечных и внекишечных инфекций, вызванных нематодами, с применением фармацевтической композиции, в частности ветеринарной композиции, содержащей эффективное количество соединения общей формулы (I), как описано выше, или его стереоизомеров, таутомеров, N-оксидов, гидратов, сольватов и солей, в частности их фармацевтически приемлемых солей, или их смесей.
Соответственно, настоящее изобретение охватывает способ контроля гельминтных инфекций у людей и/или животных путем введения антигельминтно эффективного количества по меньшей мере одного соединения общей формулы (I) или (II) выше человеку или животному, нуждающемуся в этом.
Кроме того, настоящее изобретение относится к фармацевтическим композициям, в частности ветеринарным композициям, которые содержат по меньшей мере одно соединение согласно изобретению, обычно вместе с одним или более фармацевтически приемлемыми эксципиентами, и к их применению для вышеупомянутых целей.
Соединения согласно настоящему изобретению могут иметь системную и/или местную активность. С этой целью их можно вводить подходящим образом, например, через пероральный, парентеральный, легочный, назальный, подъязычный, лингвальный, буккальный, ректальный, вагинальный, дермальный, трансдермальный, конъюнктивальный, ушной путь или в виде имплантата или стента. Такое введение может быть проведено профилактически, метафилактически или терапевтически.
Для этих путей введения можно вводить соединения согласно настоящему изобретению в подходящих формах введения.
Для перорального введения можно получить соединения согласно настоящему изобретению в лекарственных формах, известных в данной области техники, которые доставляют соединения согласно настоящему изобретению быстро и/или модифицированным образом, таких как, например, таблетки (таблетки без покрытия или покрытые оболочкой таблетки, например с энтеросолюбильными покрытиями или покрытиями с контролируемым высвобождением, которые растворяются с задержкой или нерастворимы), перорально-распадающиеся таблетки, пленки/пластины, пленки/лиофилизаты, капсулы (например, твердые или мягкие желатиновые капсулы), таблетки с сахарным покрытием, гранулы, пеллеты, жевательные резинки (например мягкие жевательные резинки), порошки, эмульсии, суспензии, аэрозоли или растворы. Можно включать соединения согласно настоящему изобретению в кристаллической и/или аморфизированной и/или растворенной форме в указанные лекарственные формы.
Парентеральное введение может быть осуществлено с предотвращением стадии абсорбции (например, внутривенно, внутриартериально, внутрисердечно, внутриспинально или эндолюмбально) или с включением абсорбции (например, внутримышечно, подкожно, внутрикожно, чрескожно или внутрибрюшинно). Формы введения, которые подходят для парентерального введения, включают, среди прочего, препараты для инъекций и инфузии в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков.
Примерами, подходящими для других путей введения, являются фармацевтические формы для ингаляции (в том числе порошковые ингаляторы, небулайзеры), назальные капли, назальные растворы, назальные спреи; таблетки/пленки/пастилки/капсулы для лингвального, сублингвального или буккального введения; суппозитории; глазные капли, глазные мази, глазные ванны, линзы, ушные капли, ушные аэрозоли, ушные порошки, ушные протирки, ушные тампоны; вагинальные капсулы, водные суспензии (лосьоны, микстуры, требующие взбалтывания), липофильные суспензии, эмульсии, мази, кремы, трансдермальные терапевтические системы (такие как, например, пластыри), молоко, пасты, пены, точечно наносимые средства, пылевидные порошки, имплантаты или стенты.
Соединения согласно настоящему изобретению могут быть включены в указанные формы введения. Это может быть осуществлено известным образом путем смешивания с фармацевтически приемлемыми эксципиентами. Фармацевтически приемлемые эксципиенты включают, среди прочего,
• наполнители и носители (например, целлюлоза, микрокристаллическая целлюлоза (например, Avicel®), лактоза, маннит, крахмал, фосфат кальция (такой как, например, Di-Cafos®)),
• основания мази (например, вазелин, парафины, триглицериды, воски, шерстный воск, спирты шерстного воска, ланолин, гидрофильная мазь, полиэтиленгликоли),
• основания для суппозиторий (например полиэтиленгликоль, кокосовое масло, твердый жир),
• растворители (например, вода, этанол, изопропанол, глицерин, пропиленгликоль, жирные масла триглицеридов средней длины цепи, жидкие полиэтиленгликоли, парафины),
• поверхностно-активные вещества, эмульгаторы, диспергирующие средства или смачивающие средства (например, натрия додецилсульфат), лецитин, фосфолипиды, жирные спирты (такие как, например, Lanette®), сложные эфиры сорбитана и жирной кислоты (такие как, например, Span®), полиоксиэтиленовые сложные эфиры сорбитана и жирной кислоты (такие как, например, Tween®), полиоксиэтиленовые глицериды жирной кислоты (такие как, например, Cremophor®), полиоксиэтиленовые сложные эфиры жирной кислоты, полиоксиэтиленовые сложные эфиры жирного спирта, глицериновые сложные эфиры жирной кислоты, полоксамеры (такие как, например, Pluronic®),
• буферы, кислоты и основания (например фосфаты, карбонаты, лимонная кислота, уксусная кислота, соляная кислота, раствор гидроксида натрия, аммония карбонат, трометамол, триэтаноламин),
• изотонические средства (например, глюкоза, хлорид натрия),
• адсорбенты (например, высоко диспергированные диоксиды кремния),
• повышающие вязкость средства, гелеобразоатели, загустители и/или связующие вещества (например, поливинилпирролидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза-натрий, крахмал, карбомеры, полиакриловые кислоты (такие как, например, Carbopol®); альгинаты, желатин),
• дезинтегрирующие средства (например, модифицированный крахмал, карбоксиметилцеллюлоза-натрий, натрия крахмала гликолят (как например, Explotab®), поперечно-сшитый поливинилпирролидон, кроскармеллоза-натрий (как например, AcDiSol®)),
• регуляторы скорости потока, смазывающие вещества, вещества, способствующие скольжению и смазки, облегчающие выемке изделий из форм (например, стеарат магния, стеариновая кислота, тальк, высоко диспергированные диоксиды кремния (как например, Aerosil®)),
• покрывающие вещества (например, сахара, шеллак) и пленкообразователи для пленок или диффузионные мембраны, которые растворяются быстро или модифицированным образом (например, поливинипирролидоны (такие как, например, Kollidon®), поливиниловый спирт, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза фталат, целлюлозы ацетат, целлюлозы ацетат фталат, полиакрилаты, полиметакрилаты, такие как, например, Eudragit®)),
• материалы капсулы (например, желатин, гидроксипропилметилцеллюлоза),
• синтетические полимеры (например, полилактиды, полигликолиды, полиакрилаты, полиметакрилаты (такие как, например, Eudragit®), поливинипирролидоны (такие как, например, Kollidon®), поливиниловые спирты, поливинилацетаты, полиэтиленоксиды, полиэтиленгликоли и их сополимеры и блок-сополимеры),
• пластификаторы (например, полиэтиленгликоли, пропиленгликоль, глицерин, триацетин, триацетилцитрат, дибутилфталат),
• усилители проникновения,
• стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота, аскорбилпальмитат, натрия аскорбат, бутилгидроксианизол, бутилгидрокситолуол, пропилгаллат),
• консерванты (например, парабены, сорбиновая кислота, тиомерзал, бензалкония хлорид, хлоргексидина ацетат, натрия бензоат),
• красители (например, неорганические пигменты, такие как, например, оксиды железа, диоксид титана),
• ароматизаторы, подсластители, ароматизаторы и/или средства против запаха.
Кроме того, настоящее изобретение относится к фармацевтической композиции, которая содержит по меньшей мере одно соединение согласно настоящему изобретению, обычно вместе с одним или более фармацевтически приемлемыми эксципиентами и их применению согласно настоящему изобретению.
В соответствии с другим объектом настоящее изобретение охватывает фармацевтические комбинации, в частности лекарственные средства, содержащие по меньшей мере одно соединение общей формулы (I) согласно настоящему изобретению и по меньшей мере один или более дополнительные активные ингредиенты, в частности для лечения и/или профилактики эндо- и/или эктопаразитарной инфекции.
Термин «эндопаразит» в настоящем изобретении используется, как известно специалистам в данной области, и относится в частности к гельминтам. Термин «эктопаразит» в настоящем изобретении используется, как известно специалистам в данной области, и относится в частности к членистоногим, в частности насекомым или акаридам.
В частности, настоящее изобретение охватывает фармацевтическую комбинацию, в частности ветеринарную комбинацию, которая содержит:
один или более первых активных ингредиентов, в частности соединений общей формулы (I), как указано выше, и
один или более дополнительных активных ингредиентов, в частности один или более эндо- и/или эктопаразитицидов.
Термин «комбинация» в настоящем изобретении используется, как известно специалистам в данной области техники, причем указанная комбинация может быть фиксированной комбинацией, нефиксированной комбинацией или набором из частей.
«Фиксированная комбинация» в настоящем изобретении используется, как известно специалистам в данной области, и определяется как комбинация, в которой, например, первый активный ингредиент, такой как одно или более соединений общей формулы (I) согласно настоящему изобретению, и дополнительный активный ингредиент присутствуют вместе в одной единичной дозировке или в одной лекарственной форме. Одним из примеров «фиксированной комбинации» является фармацевтическая композиция, в которой первый активный ингредиент и дополнительный активный ингредиент присутствуют в смеси для одновременного введения, например, в составе. Другим примером «фиксированной комбинации» является фармацевтическая комбинация, в которой первый активный ингредиент и другой активный ингредиент присутствуют в одной единице без смешивания.
Нефиксированная комбинация или «набор из частей» в настоящем изобретении используется, как известно специалистам в данной области, и определяется как комбинация, в которой первый активный ингредиент и дополнительный активный ингредиент присутствуют в более чем одной единице. Одним из примеров нефиксированной комбинации или набора из частей является комбинация, в которой первый активный ингредиент и дополнительный активный ингредиент присутствуют раздельно. Компоненты нефиксированной комбинации или набора из частей можно вводить раздельно, последовательно, одновременно, в одно и то же время или в хронологическом порядке
Соединения согласно настоящему зрения могут быть введены в виде единственного фармацевтического агента или в сочетании с одним или более другими фармацевтически активными ингредиентами, где комбинация не вызывает неприемлемых побочных эффектов. Настоящее изобретение также охватывает такие фармацевтические комбинации. Например, соединения согласно настоящему изобретению могут быть объединены с известными эктопаразитицидами и/или эндопаразитицидами.
Другие или дополнительные активные ингредиенты, указанные в настоящей заявке под их “общим названием”, известны и описаны, например, в справочнике пестицидов (“The Pesticide Manual” 16th Ed., British Crop Protection Council 2012) или могут быть обнаружены в интернете (например, http://www.alanwood.net/pesticides). Классификация основана на принципе системы IRAC, действующей на момент подачи заявки на заявки на патент.
Примерами эктопаразитицидов и/или эндопаразитицидов являются инсектициды, акарициды и нематоциды, и они включают, в частности:
(1) Ингибиторы ацетилхолинэстеразы (AChE), например карбаматы, например, аланикарб, альдикарб, Бендиокарб, Бенфуракарб, Бутокарбоксим, Бутоксикарбоксим, Карбарил, Карбофуран, Карбосульфан, Этиофенкарб, Фенобукарб, Форметанат, Фуратиокарб, изопрокарб, Метиокарб, Метомил, Метолкарб, Оксамил, пиримикарб, пропоксур, тиодикарб, тиофанокс, триазамат, триметакарб, XMC, и Ксилилкарб; или фосфорорганические соединения, например, ацефат, азаметифос, азинфос-этил, азинфос-метил, Кадузафос, хлорэтоксифос, хлорфенвинфос, хлормефос, хлорпирифос, хлорпирифос-метил, Кумафос, цианофос, деметон-S-метил, диазинон, дихлорвос/DDVP, дикротофос, диметоат, диметилвинфос, дисульфотон, EPN, Этион, Этопрофос, Фамфур, Фенамифос, Фенитротион, Фентион, Фостиазат, гептенофос, Имициафос, изофенфос, изопропил-O-(метоксиаминотио-фосфорил) салицилат, изоксатион, Малатион, Мекарбам, Метамидофос, Метидатион, Мевинфос, Монокротофосфос, Налед, Ометоат, Оксидеметон-метил, Паратион, Паратион-метил, Фентоат, Форат, Фосалон, Фосмет, Фосфамидон, Фоксим, пиримифос-метил, профенофос, пропетамфос, протиофос, пираклофос, пиридафентион, Хиналфос, Сульфотеп, Тебупиримфос, Темефос, Тербуфос, тетрахлорвинфос, тиометон, триазофос, трихлорфон и Вамидотион.
(2) Антагонисты GABA-зависимого хлоридного канала, например, циклодиеновые хлорорганические соединения, например, хлордан и Эндосульфан; или фенилпиразолы (фипролы), например, Этипрол и Фипронил.
(3) Модуляторы натриевого канала/Блокаторы потенциал-зависимого натриевого канала, например пиретроиды, например, акринатрин, аллетрин, d-цис-транс Аллетрин, d-транс-аллетрин, Бифентрин, Биоаллетрин, Биоаллетрина S-циклопентенил-изомер, Биоресметрин, циклопротрин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, гамма-цигалотрин, циперметрин, альфа-циперметрин, бета-циперметрин, тета-циперметрин, зета-циперметрин, цифенотрин [(1R)-транс-изомеры], дельтаметрин, Эмпентрин [(EZ)-(1R) изомеры), Эсфенвалерат, Этофенпрокс, Фенпропатрин, Фенвалерат, Флуцитринат, Флуметрин, тау-Флувалинат, галфенпрокс, Имипротрин, Кадетрин, Перметрин, Фенотрин [(1R)-транс-изомер), Праллетрин, пиретрин (пиретрум), Ресметрин, Силафлуофен, Тефлутрин, тетраметрин, тетраметрин [(1R) изомеры)], Тралометрин, и Трансфлутрин; или ДДТ; или метоксихлор.
(4) Агонисты никотинового ацетилхолинового рецептора (nAChR), например, неоникотиноиды, например, ацетамиприд, Клотианидин, динотефуран, Имидаклоприд, Нитенпирам, тиаклоприд, и Тиаметоксам; или Никотин; или Сульфоксахлор или флупирадифурон.
(5) Аллостерические модуляторы никотинового ацетилхолинового рецептора (nAChR), такие как например спиносины, например, Спинеторам и Спиносад.
(6) Аллостерические модуляторы глутамат-зависимого хлоридного канала (GluCl), например авермектины/мильбемицины, например, абамектин, Эмамектина бензоат, Лепимектин и Мильбемектин.
(7) Миметики ювенильного гормона, например, аналоги ювенильного гормона, например, гидропрен, Кинопрен и Метопрен; или Феноксикарб; или Пирипроксифен.
(9) Модуляторы органа слуха у насекомых, например, пиметрозин; или Флоникамид.
(10) Ингибиторы роста клещей, например, Клофентезин, гекситиазокс, и Дифловидазин; или Этоксазол.
(12) ингибиторы митохондриального АТФ-синтеза, такие как АТФ-дезинтеграторы, такие как, например; диафентиурон или оловоорганические митициды, например, азоциклотин, цигексатин, и Фенбутатина оксид; или Пропаргит; или тетрадифон.
(13) Средства, разобщающие окислительное фосфорилирование посредством разрушения протонового градиента, например, хлорфенапир, DNOC и Сульфлурамид.
(14) Блокаторы никотинергического ацетилхолинового рецептора, такие как, например, Бенсультап, Картапа гидрохлорид, тиоциклам и Тиосультап-натрий.
(15) Ингибиторы биосинтеза хитина, типа 0, например Бистрифлурон, Хлофлуазурон, дифлубензурон, Флуциклоксурон, Флуфеноксурон, гексафлумурон, Луфенурон, Новалурон, Новифлумурон, Тефлубензурон и Трифлумурон.
(16) Ингибиторы биосинтеза хитина, типа 1, например, Бупрофезин.
(17) Ингибиторы линьки (в частности, для Двукрылых, т.e. мух), такие как, например, циромазин.
(18) Агонисты рецептора экдизона, например, Хромафенозид, галофенозид, метоксифенозид и Тебуфенозид.
(19) Октопаминергические агонисты, такие как, например, амитраз.
(20) Ингибиторы транспорта электронов митохондриального комплекса III, например Гидраметилнон; или Ацехиноцил; или Флуакрипирим.
(21) Ингибиторы транспорта электронов митохондриального комплекса I, например, из группы METI акарицидов, например, Феназахин, Фенпироксимат, пиримидифен, пиридабен, Тебуфенпирад и Толфенпирад; или Ротенон (Деррис).
(22) Блокаторы потенциалзависимого натриевого канала, например, Индоксакарб; или Метафлумизон.
(23) Ингибиторы ацетил-КоА-карбоксилазы, например, производные тетроновой и тетраминовой кислоты, например, Спиродиклофен, Спиромезифен и Спиротетрамат.
(25) Ингибиторы транспорта электронов митохондриального комплекса II, например, бета-кетонитрильная производная, например, циенопирафен и Цифлуметофен, и Карбоксанилид, как например, Пифлубумид.
(28) Модуляторы рианодинового рецептора, такие как, например, диамиды, например, хлорантранилипрол, циантранилипол и флубендиамид,
Другие активные ингредиенты с неизвестным или недоказанным механизмом действие, такие как, например, афидопиропен, афоксоланер, азадирахтин, бенклотиаз, бензоксимат, бифеназат, бромфланилид, бромпропилат, хинометионат, криолит, цикланилипрол, циклоксаприд, цигалодиамид, диклоромезотиаз, дикофол, дифловидазин, флометоквин, флуазаиндолизин, флуенсульфон, флуфенерим, флуфеноксистробин, флуфипрол, флугексафон, флуопирам, флураланер, флуксаметамид, фуфенозид, гуадипир, гептафлутрин, имидаклотиз, ипродион, лотиланер, меперфлутрин, паичонгдинг, пифлубумид, пиридалил, пирифлуквиназон, пириминостробин, сароланер, тетраметилфлутрин, тетранилипрол, тетрахлорантранилипрол, тиоксазафен, трифлумезопирим и иодметан; кроме того, препараты на основе Bacillus firmus (I-1582, BioNeem, Votivo), а также следующие активные соединения: 1-{2-фтор-4-метил-5-[(2,2,2-трифторэтил)сульфинил]фенил}-3-(трифторметил)-1H-1,2,4-триазол-5-амин (известный из WO 2006/043635) (CAS 885026-50-6), {1'-[(2E)-3-(4-хлорфенил)проп-2-ен-1-ил]-5-фторспиро[индол-3,4'-пиперидин]-1(2H)-ил}(2-хлорпиридин-4-ил)метанон (известный из WO 2003/106457) (CAS 637360-23-7), 2-хлор-N-[2-{1-[(2E)-3-(4-хлорфенил)проп-2-ен-1-ил]пиперидин-4-ил}-4-(трифторметил)фенил]изоникотинамид (известный из WO 2006/003494) (CAS 872999-66-1), 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-метокси-1,8-диазаспиро[4.5]дец-3-ен-2-он (известный из WO 2010052161) (CAS 1225292-17-0), 3-(4-хлор-2, 6-диметилфенил)-8-метокси-2-оксо-1,8-диазаспиро[4.5]дец-3-ен-4-ил-этилкарбонат (известный из EP 2647626) (CAS-1440516-42-6), 4-(бут-2-ин-1-илокси)-6-(3,5-диметилпиперидин-1-ил)-5-фторпиримидин (известный из WO 2004/099160) (CAS 792914-58-0), PF1364 (известный из JP 2010/018586) (CAS-Reg.No. 1204776-60-2), N-[(2E)-1-[(6-хлорпиридин-3-ил)метил]пиридин-2(1H)-илиден]-2,2,2-трифторацетамид (известный из WO 2012/029672) (CAS 1363400-41-2), (3E)-3-[1-[(6-хлор-3-пиридил)метил]-2-пиридилиден]-1,1,1-трифторпропан-2-он (известный из WO 2013/144213) (CAS 1461743-15-6), N-[3-(бензилкарбамоил)-4-хлорфенил]-1-метил-3-(пентафторэтил)-4-(трифторметил)-1H-пиразол-5-карбоксамид (известный из WO 2010/051926) (CAS 1226889-14-0), 5-бром-4-хлор-N-[4-хлор-2-метил-6-(метилкарбамоил)фенил]-2-(3-хлор-2-пиридил)пиразол-3-карбоксамид (известный из CN 103232431) (CAS 1449220-44-3), 4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-2-метил-N-(цис-1-оксидо-3-тиетанил)бензамид, 4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-2-метил-N-(транс-1-оксидо-3-тиетанил)бензамид и 4-[(5S)-5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-2-метил-N-(цис-1-оксидо-3-тиетанил)бензамид (известный из WO 2013/050317 A1) (CAS 1332628-83-7), N-[3-хлор-1-(3-пиридинил)-1H-пиразол-4-ил]-N-этил-3-[(3,3,3-трифторпропил)сульфинил]пропанамид, (+)-N-[3-хлор-1-(3-пиридинил)-1H-пиразол-4-ил]-N-этил-3-[(3,3,3-трифторпропил)сульфинил]пропанамид и (-)-N-[3-хлор-1-(3-пиридинил)-1H-пиразол-4-ил]-N-этил-3-[(3,3,3-трифторпропил)сульфинил]пропанамид (известный из WO 2013/162715 A2, WO 2013/162716 A2, US 2014/0213448 A1) (CAS 1477923-37-7), 5-[[(2E)-3-хлор-2-пропен-1-ил]амино]-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[(трифторметил)сульфинил]-1H-пиразол-3-карбонитрил (известный из CN 101337937 A) (CAS 1105672-77-2), 3-бром-N-[4-хлор-2-метил-6-[(метиламино)тиохометил]фенил]-1-(3-хлор-2-пиридинил)-1H-пиразол-5-карбоксамид, (Liudaibenjiaxuanan, известный из CN 103109816 A) (CAS 1232543-85-9); N-[4-хлор-2-[[(1,1-диметилэтил)амино]карбонил]-6-метилфенил]-1-(3-хлор-2-пиридинил)-3-(фторметокси)-1H-пиразол-5-карбоксамид (известный из WO 2012/034403 A1) (CAS 1268277-22-0), N-[2-(5-амино-1,3,4-тиадиазол-2-ил)-4-хлор-6-метилфенил]-3-бром-1-(3-хлор-2-пиридинил)-1H-пиразол-5-карбоксамид (известный из WO 2011/085575 A1) (CAS 1233882-22-8), 4-[3-[2,6-дихлор-4-[(3,3-дихлор-2-пропен-1-ил)окси]фенокси]пропокси]-2-метокси-6-(трифторметил)пиримидин (известный из CN 101337940 A) (CAS 1108184-52-6); (2E)- и 2(Z)-2-[2-(4-цианофенил)-1-[3-(трифторметил)фенил]этилиден]-N-[4-(дифторметокси)фенил]гидразинкарбоксамид (известный из CN 101715774 A) (CAS 1232543-85-9); циклопропанкарбоновая кислота-3-(2,2-дихлорэтенил)-2,2-диметил-4-(1H-бензимидазол-2-ил)фениловый сложный эфир (известный из CN 103524422 A) (CAS 1542271-46-4); (4aS)-7-хлор-2,5-дигидро-2-[[(метоксикарбонил)[4-[(трифторметил)тио]фенил]амино]карбонил]индено[1,2-e][1,3,4]оксадиазин-4a(3H)-карбоновая кислота метиловый сложный эфир (известный из CN 102391261 A) (CAS 1370358-69-2); 6-дезокси-3-O-этил-2,4-ди-O-метил-1-[N-[4-[1-[4-(1,1,2,2,2-пентафторэтокси)фенил]-1H-1,2,4-триазол-3-ил]фенил]карбамат]-α-L-маннопираноза (известный из US 2014/0275503 A1) (CAS 1181213-14-8); 8-(2-циклопропилметокси-4-трифторметилфенокси)-3-(6-трифторметилпиридазин-3-ил)-3-азабицикло[3.2.1]октан (CAS 1253850-56-4), (8-anti)-8-(2-циклопропилметокси-4-трифторметилфенокси)-3-(6-трифторметилпиридазин-3-ил)-3-азабицикло[3.2.1]октан (CAS 933798-27-7), (8-syn)-8-(2-циклопропилметокси-4-трифторметилфенокси)-3-(6-трифторметилпиридазин-3-ил)-3-азабицикло[3.2.1]октан (известный из WO 2007040280 A1, WO 2007040282 A1) (CAS 934001-66-8) и N-[3-хлор-1-(3-пиридинил)-1H-пиразол-4-ил]-N-этил-3-[(3,3,3-трифторпропил)тио]-пропанамид (известный из WO 2015/058021 A1, WO 2015/058028 A1) (CAS 1477919-27-9) и N-[4-(аминотиоксометил)-2-метил-6-[(метиламино)карбонил]фенил]-3-бром-1-(3-хлор-2-пиридинил)-1H-пиразол-5-карбоксамид (известный из CN 103265527 A) (CAS 1452877-50-7), 5-(1,3-диоксан-2-ил)-4-[[4-(трифторметил)фенил]метокси]-пиримидин (известный из WO 2013/115391 A1) (CAS 1449021-97-9), 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-метокси-1-метил-1,8-диазаспиро[4.5]дец-3-ен-2-он (известный из WO 2010/066780 A1, WO 2011/151146 A1) (CAS 1229023-34-0), 3-(4-хлор-2,6-диметилфенил)-8-метокси-1-метил-1,8-диазаспиро[4.5]декан-2,4-дион (известный из WO 2014/187846 A1) (CAS 1638765-58-8), 3-(4-хлор-2,6-диметилфенил)-8-метокси-1-метил-2-оксо-1,8-диазаспиро[4.5]дец-3-ен-4-ил-карбоновой кислоты сложный этиловый эфир (известный из WO 2010/066780 A1, WO 2011151146 A1) (CAS 1229023-00-0), N-[1-[(6-хлор-3-пиридинил)метил]-2(1H)-пиридинилиден]-2,2,2-трифтор-ацетамид (известный из DE 3639877 A1, WO 2012029672 A1) (CAS 1363400-41-2), [N(E)]-N-[1-[(6-хлор-3-пиридинил)метил]-2(1H)-пиридинилиден]-2,2,2-трифтор-ацетамид, (известный из WO 2016005276 A1) (CAS 1689566-03-7), [N(Z)]-N-[1-[(6-хлор-3-пиридинил)метил]-2(1H)-пиридинилиден]-2,2,2-трифтор-ацетамид, (CAS 1702305-40-5), 3-эндо-3-[2-пропокси-4-(трифторметил)фенокси]-9-[[5-(трифторметил)-2-пиридинил]окси]-9-азабицикло[3.3.1]нонан (известный из WO 2011/105506 A1, WO 2016/133011 A1) (CAS 1332838-17-1).
Активные ингредиенты с неизвестными или неспецифическими механизмами действия, например, фентрифанил, феноксакрим, циклопрен, хлорбензилат, хлордимеформ, флубензимин, дицикланил, амидофлумет, хинометионат, триаратен, клотиазобен, тетразул, олеат калия, керосин, метоксадиазон, госсиплур, флутензин, бромпропилат, криолит;
Активные ингредиенты из других классов, например, бутакарб, диметилан, клоэтокарб, фосфокарб, пиримифос(-этил), Паратион(-этил), метакрифос, Изопропил-о-салицилат, трихлорфон, сулпрофос, пропафос, себуфос, пиридатион, Протоат, дихлофентион, деметон-S-метилсульфон, изазофос, цианофенфос, диалифос, карбофенотион, аутатиофос, аромфенвинфос(-метил), азинфос(-этил), хлорпирифос(-этил), фосметилан, иодфенфос, диоксабензофос, формотион, фонофос, флупиразофос, фенсульфотион, этримфос;
Хлорорганические соединения, например, камфехлор, линдан, гептахлор; или Фенилпиразолы, например, ацетопрол, пирафлупрол, пирипрол, ванилипрол, сизапронил; или изоксазолин, например, сароланер, афоксоланер, лотиланер, флураланер;
Пиретроиды, например, (цис-, транс-)метофлутрин, профлутрин, флуфенпрокс, флуброцитринат, флубфенпрокс, фенфлутрин, протрифенбут, пирезметрин, RU 15525, тераллетрин, цис-ресметрин, гептафлутрин, биоэтанометрин, биоперметрин, фенпиритрин, цис-циперметрин, цис-перметрин, клоцитрин, цигалотрин (лямбда), хловапортрин, или галогенированные углеводородные соединения (HCH);
неоникотиноиды, например, нитиазин;
дихлормезотиаз, трифлумезопирим;
макроциклические лактоны, например, немадектин, ивермектин, латидектин, моксидектин, селамектин, эприномектин, дорамектин, эмамектинбензоат; милбемициноксим;
Трифен, Эпофенонан, диофенолан;
Биологические вещества, гормоны, феромоны, например, природные продукты, например, турингиенсин, кодлемон или ним-компоненты Codlemon или Neem;
динитрофенолы, например, динокап, динобутон, бинапакрил;
бензоилмочевины, например, флуазурон, пенфлурон,
Амидиновые производные, например, Хлормебуформ, симиазол, демидитраз;
Акарициды для защиты пчел от клещей Варроа, например, органические кислоты, например, муравьиная кислота, щавелевая кислота.
Неограничивающие примеры инсектицидов и акарицидов, представляющих особый интерес для использования для здоровья животных, представляют собой и включают в частности [т.е. Mehlhorn et al., Encyclpaedic Reference of Parasitology 4th edition (ISBN 978-3-662-43978-4)]:
Эффекторы на управляемые лигандами хлоридные каналы членистоногих: хлордан, гептахлор, эндокулфан. Диэльдрин, бромциклен, токсафен, линдан, фипронил, пирипрол, сисапронил, афоксоланер, флураланер, сароланер, лотиланер, флюксаметамид, бромфланилид, авермектин, дорамектин, эприномектин, ивермектин, милбемицин, моксидектин, селамектин;
Модуляторы октопаминовых рецепторов членистоногих: амитраз, BTS27271, цимиазол, демидитраз;
Эффекторы натриевых каналов членистоногих, зависящих от напряжения: DDT, метоксихлор, метафлумизон, индоксакарб, цинерин I, цинерин II, джасмолин I, джасмолин II, пиретрин I, пиретрин II, аллетрин, альфациперметрин, биоаллетрин, бетацисфлутрин, цифлутрин, цигалотрин, циперметрин, дельтаметрин, этофенпрокс, фенвалерат, флуцитринат, флуметрин, гальфенпрокс, перметрин, фенотрин, ресметрин, тау-флувалинат, тетраметрин;
Эффекторы никотиновых холинергических синапсов членистоногих (ацетилхолиновая эстераза, ацетилхолиновые рецепторы): бромприпилат, бендиокарб, карбарил, метомил, промацил, пропоксур, азаметифос, хлорфенвинфос, хлорпирифос, кумафос, цитиоат, диазинон, диклорвос, дикротофос, диметоат, этнон, фамфур, фенитротион, фентион, гептенофос, малатион, налед, фосмет, фоксим, фталофос, пропетамфос, темефос, тетрахлорвинфос, трихлорфон, имидаклоприд, нитенпирам, динотефуран, спиносад, спинеторам;
Эффекторы процессов развития членистоногих: циромазин, дицикланил, дифлубензурон, флюазурон, люфенурон, трифлюмурон, феноксикарб, гидропрен, метопрен, пирипроксифен, феноксикарб, гидропрен, S-метопрен, пирипроксифен.
Примерные активные ингредиенты из группы эндопаразитицидов в качестве дополнительного или другого активного ингредиента согласно настоящему изобретению включают, без ограничения, антигельминтно активные соединения и антипротозойно активные соединения.
Антигельминтные агенты включают, например, следующие активные вещества против нематод, трематод и/или цестод:
из класса макроциклических лактонов, например: эприномектин, абамектин, немадектин, моксидектин, дорамектин, селамектин, лепимектин, латидектин, милбемектин, эмамектин, милбемицин;
из класса бензимидазолов и пробензимидазолов, например: оксибендазол, мебендазол, триклабендазол, тиофанат, парбендазол, оксфендазол, нетобимин, фенбендазол, фебантел, тиабендазол, циклобендазол, камбендазол, альбендазолсульфоксид, альбендазол, флубендазол;
из класса депсипетидов, предпочтительно циклических депсипетидов, особенно 24-членных циклических депсипетидов, например: эмодепсид, PF1022A;
из класса тетрагидропиримидинов, например: морантел, пирантел, оксантел;
из класса имидазотиазолов, например: бутамизол, левамизол, тетрамизол;
из класса аминофениламидинов, например: амидантел, диацилированный амидантел (dAMD), трибендимидин;
из класса аминоацетонитрилов, например: монепантел;
из класса парагерквиамидов, например: парагерквиамид, дерквиантел;
из класса салициланилидов, например: трибромсалан, бромксанид, бротианид, клиоксанид, клосантел, никлосамид, оксиклозанид, рафоксанид;
из класса замещенных фенолов, например: нитроксинил, битионол, дикофенол, гексахлорфен, никлофолан, мениклофолан;
из класса органофосфатов, например: трихлорфон, нафталофос, дихлорвос/DDVP, круфомат, коумафос, галоксон;
из класса пиперазинов/хинолинов, например: празиквантел, эпсипрантел;
из класса пиперазинов, например: пиперазин, гидроксизин;
из класса тетрациклинов, например: тетрациклин, хлортетрациклин, доксициклин, окситетрациклин, ролитетрациклин;
из различных других классов, например: бунамидин, ниридазол, резорантел, омфалотин, олтипраз, нитросканат, нитроксинил, оксамниквин, миразан, Мирацил, лукантон, гикантон, гетолин, эметин, диэтилкарбамазин, дихлорфен, диамфенетид, клоназепам, бефениум, амосканат, клорсулон;
Активными ингредиентами против простейших согласно настоящему изобретению являются, без ограничения к этому, следующие активные ингредиенты:
из класса триазинов, например: диклазурил, поназурил, летразурил, толтразурил;
из класса полиэфирных ионофоров, например: монензин, салиномицин, мадурамицин, наразин;
из класса макроциклических лактонов, например: милбемицин, эритромицин;
из класса хинолонов, например: энрофлоксацин, прадофлоксацина;
из класса хинолонов, например: энрофлоксацин, прадофлоксацина;
из класса хининов, например: хлороквин;
из класса пиримидинов, например: пириметамин;
из класса сульфонамидов, например: сульфахиноксалин, триметоприм, сульфаклозин;
из класса тиаминов, например: ампролиум;
из класса линкозамидов, например: клиндамицин;
из класса карбанилидов, например: имидокарб;
из класса нитрофуранов, например: нифуртимокс;
из класса алкалоиды хиназолинона, например: галофугинон;
из других классов, например: оксамниквин, паромомицин,
из класса вакцины или антигены микроорганизмов, например: Babesia canis rossi, Eimeria tenella, Eimeria praecox, Eimeria necatrix, Eimeria mitis, Eimeria maxima, Eimeria brunetti, Eimeria acervulina, Babesia canis vogeli, Leishmania infantum, Babesia canis, Dictyocaulus viviparus.
Все вышеупомянутые смесительные партнеры могут, если они способны на основании их функциональных групп, необязательно образовывать соли с подходящими основаниями или кислотами.
Основываясь на стандартных лабораторных методах, известных для оценки соединений, полезных для лечения гельминтоза, стандартными испытаниями токсичности и стандартными фармакологическими анализами для определения лечения состояний, указанных выше у животных, и путем сопоставления этих результатов с результатами для известных активных ингредиентов или медикаментов, которые используются для лечения этих состояний, эффективная доза соединений согласно настоящему описанию может быть легко определена для лечения каждого желаемого показания. Количество активного ингредиента, которое должно вводиться при лечении одного из этих состояний, может широко варьироваться в соответствии с такими условиями, как конкретное соединение и применяемая дозированная единица, способ введения, период лечения, возраст и пол подлежащего лечению субъекта, и характер и степень подлежащего лечению состояния.
Общее количество вводимого активного ингредиента обычно будет составлять от около 0,001 мг/кг до около 200 мг/кг массы тела в день и предпочтительно от около 0,01 мг/кг до около 20 мг/кг массы тела в день. Клинически полезные режимы дозирования будут варьироваться от одного до трех раз в день до дозирования один раз в четыре недели. Кроме того, возможен «отдых от лекарственного средства», при котором субъект не получает дозу лекарственного средства в течение определенного периода времени, который является полезным для общего баланса между фармакологическим эффектом и переносимостью. Кроме того, можно проводить лечение длительного действия, когда субъект получает лечение один раз в течение более четырех недель. Единица дозирования может содержать от около 0,5 мг до около 1500 мг активного ингредиента и может вводиться один или более раз в день или менее одного раза в день. Средняя суточная доза для введения путем инъекции, включая внутривенные, внутримышечные, подкожные и парентеральные инъекции, и использования инфузионных методов будет предпочтительно составлять от 0,01 до 200 мг/кг общей массы тела. Средний дневной режим ректального введения дозы будет предпочтительно составлять от 0,01 до 200 мг/кг общей массы тела. Средний дневной режим вагинального введения дозы предпочтительно будет составлять от 0,01 до 200 мг/кг общей массы тела. Средний ежедневный режим местного дозирования предпочтительно будет составлять от 0,1 до 200 мг, вводимых от 1 до 4 раза в день. Трансдермальная концентрация будет предпочтительно такой, которая необходима для поддержания суточной дозы от 0,01 до 200 мг/кг. Средний ежедневной режим дозирования ингаляцией будет предпочтительно составлять от 0,01 до 100 мг/кг общей массы тела.
Конечно, конкретный начальный и продолжающийся режим дозирования для каждого субъекта будет варьироваться в зависимости от характера и тяжести состояния, определяемого лечащим диагностом, активности конкретного используемого соединения, возраста и общего состояния субъекта, времени введения, пути введения, скорости экскреции лекарственного средства, комбинации лекарственных средств и тому подобного. Желаемый способ лечения и количество доз соединения согласно настоящему изобретению или его фармацевтически приемлемой соли или сложного эфира или композиции может быть установлен специалистами в данной области с использованием обычных тестов на лечение.
Экспериментальная часть
Аббревиатуры:
Различные аспекты изобретения, описанные в настоящей заявке, проиллюстрированы следующими примерами, которые не предназначены для ограничения настоящего изобретения каким-либо образом.
Эксперименты по тестированию примеров, описанные в настоящей заявке, служат для иллюстрации настоящего изобретения, и настоящее изобретение не ограничивается приведенными примерами.
Экспериментальная часть - общая часть
Все реагенты, для которых синтез не описан в экспериментальной части, являются либо коммерчески доступными, либо известными соединениями, либо могут быть получены из известных соединений известными способами специалистом в данной области.
Соединения и промежуточные соединения, полученные согласно способам согласно настоящему изобретению, могут потребовать очистки. Очистка органических соединений хорошо известна специалисту в данной области, и может быть несколько способов очистки одного и того же соединения. В некоторых случаях очистка не требуется. В некоторых случаях соединения могут быть очищены путем кристаллизации. В некоторых случаях примеси могут быть исключены с использованием подходящего растворителя. В некоторых случаях соединения могут быть очищены с помощью хроматографии, в частности колоночной флэш-хроматографии, с использованием, например, предварительно заполненных силикагелем картриджей, например, Biotage SNAP картриджи KP-Sil® или KP-NH®, в комбинации со системой Biotage autopurifier (SP4® или Isolera Four®) и элюентами, такими как градиенты гексан/этилацетат или дихлорметан/метанол. В некоторых случаях соединения могут быть очищены препаративной ВЭЖХ с использованием, например, автоочистителя Waters, оснащенного детектором на диодной матрице и/или масс-спектрометром с ионизацией распылением в реальном времени, в сочетании с подходящей предварительно набитой обращеннофазовой колонкой и элюентами, такими как градиент воды и ацетонитрила, который может содержать добавки, такие как трифторуксусная кислота, муравьиная кислота или водный аммиак.
В некоторых случаях способы очистки, как описано выше, могут обеспечить те соединения согласно настоящему изобретению, которые обладают достаточно щелочной или кислотной функциональностью в форме соли, как например, в случае соединения согласно настоящему изобретению, которое является достаточно основным, трифторацетат или формиатную соль, например, или, в случае соединения согласно настоящему изобретению, которое является достаточно кислотным, например, аммониевая соль. Соль этого типа может быть либо превращена в ее свободное основание, либо в свободную кислотную форму, соответственно, различными способами, известными специалисту в данной области, или ее можно использовать в качестве солей в последующих биологических анализах. Следует понимать, что конкретная форма (например, соль, свободное основание и т.д.) соединения согласно настоящему изобретению, как выделено и как описано в настоящей заявке, не необязательно находятся в единственной форме, в которой указанное соединение может быть применено в биологическом анализе для количественной оценки конкретной биологической активности.
Аналитические способы
Аналитическая жидкостная хроматография
Аналитическую (UP) LC-MS проводили с помощью различного оборудования, как описано ниже. Массы (m/z) приводятся на основе ионизации электрораспылением из ионизации с электрораспылением положительно заряженных ионов, если не указан отрицательный режим (ESI-).
Способ L1:
тип Устройства: система Waters UPLC; колонка: Zorbax Eclipse Plus C18, 50 мм x 2,1 мм, 1,8 мкм; элюент A: ацетонитрил + 1 мл муравьиной кислоты / L, элюент B: вода Миллипор + 0,9 мл муравьиной кислоты / L; градиент: 0.0 мин 10% A → 1.7 мин 95% A → 2.40 мин 95% A → 2.41 мин 10% A→ 2.5 мин 10% A; печь: 55°C; поток: 0.85 мл/мин; УФ-обнаружение: 210 нм. Waters SQD2 MS детектор: 100-1000 Amu, ES-ионизация, положительная или нейтральная.
Способ L2:
тип Устройства: система Waters UPLC; колонка: Zorbax Eclipse Plus C18, 50 мм x 2,1 мм, 1,8 мкм; элюент A: ацетонитрил + 1 мл муравьиной кислоты / L, элюент B: вода Миллипор + 0,9 мл муравьиной кислоты / L; градиент: 0.0 мин 10% A → 1.8 мин 95% A → 2.50 мин 95% A → 2.52 мин 10% A→ 2.60 мин 10% A; печь: 55°C; поток: 1 мл/мин; УФ-обнаружение: 210 нм, детектор Agilent MS: 100-1000 Amu, ES-ионизация, положительная или нейтральная.
Способ L3:
Тип устройства MS: Agilent Technologies 6130 Quadrupole LC-MS; Тип устройства ВЭЖХ: Agilent Technologies 1260 Infinity; колонка: Waters XSelect (C18, 50x2.1мм, 3.5мкм); поток: 1 мл/мин; температура колонки: 35°C; элюент A: 0.1% муравьиной кислоты в ацетонитриле; элюент B: 0.1% муравьиной кислоты в воде; линейный градиент: t=0 мин 5% A, t=3.5 мин 98% A, t=6 мин 98% A; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI пол/отр) массовый диапазон: 100-800; обнаружение: ELSD (PL-ELS 2100): поток газа 1.2 мл/мин, температура газа: 70°C, зонд: 50°C.
Способ L4:
Тип устройства MS: Agilent Technologies 6130 Quadrupole LC-MS; Тип устройства ВЭЖХ: Agilent Technologies 1260 Infinity; колонка: Waters XSelect (C18, 50x2.1мм, 3.5мкм); поток: 0.8 мл/мин; температура колонки: 35°C; элюент A: 0.1% муравьиной кислоты в ацетонитриле; элюент B: 0.1% муравьиной кислоты в воде; линейный градиент: t=0 мин 5% A, t=3.5 мин 98% A, t=6 мин 98% A; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI пол/отр) массовый диапазон: 100 - 800; обнаружение: ELSD (PL-ELS 2100): поток газа 1.2 мл/мин, температура газа: 70°C, зонд: 50°C.
Способ L5:
Тип устройства MS: Agilent Technologies LC/MSD SL; Тип устройства ВЭЖХ: Agilent Technologies 1100 Series; колонка: Waters XSelect (C18, 30x2.1 мм, 3.5 мкм); поток: 1 мл/мин; температура колонки: 25°C, элюент A: 95% ацетонитрил + 5% 10 мМ бикарбоната аммония в воде, элюент B: 10 мМ бикарбоната аммония в воде pH=9.0; линейный градиент: t=0 мин 5% A, t=1.6 мин 98% A, t=3 мин 98% A; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI pos/neg) диапазон масс: 100-800.
Способ L6:
Тип устройства MS: Agilent Technologies LC/MSD SL; Тип устройства ВЭЖХ: Agilent Technologies 1100 Series; колонка: Waters XSelect (C18, 50x2.1мм, 3.5 мкм; поток: 0.8 мл/мин; температура колонки: 25°C; элюент A: 95% ацетонитрил + 5% 10 мМ бикарбоната аммония в воде; элюент B: 10 мМ бикарбоната аммония в воде pH=9.0; линейный градиент: t=0 мин 5% A, t=3.5 мин 98% A, t=6 мин 98% A; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI pos/neg) диапазон масс: 100-800.
Для следующих методов жидкостной хроматографии:
LCMS анализ проводили на SHIMADZU LCMS, состоящей из UFLC 20-AD и LCMS 2020 MS детектора. Детектор с диодной матрицей сканировал от 190 до 400 нм. Масс-спектрометр был снабжен источником электрораспылительного иона (ESI), работающим в положительном или отрицательном режиме. Масс-спектрометр сканировали между m/z 90-900 со временем сканирования от 0,5 до 1,0 с.
Способ жидкостной хроматографии - масс-спектрометрии M1:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.80 мин с общим временем прохода 2.10 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M2:
Используемой колонкой была EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 4.20 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M3:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M4:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M5:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M6:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M7:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.80 мин с общим временем прохода 3.30 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M8:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M9:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 4.20 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M10:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M11:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M12:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M13:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M14:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M15:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M16:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M17:
Применяли колонку CORTECS C18+ 100A, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.60 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M18:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M19:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.60 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M20:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M21:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.09% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M22:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M23:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M24:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M25:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 4.6×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 mM NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.75 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.80 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M26:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 4.90 мин с общим временем прохода 5.30 мин. Температура колонки составляла 45°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M27:
Используемой колонкой была Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M28:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M29:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 4.60 мин с общим временем прохода 5.30 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M30:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.80 мин с общим временем прохода 3.30 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M31:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 4.70 мин с общим временем прохода 5.00 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M32:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 5.20 мин с общим временем прохода 5.70 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M33:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.20 мин с общим временем прохода 2.60 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M34:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M35:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M36:
Применяли колонку CORTECS C18+ 100A, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M37:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M38:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M39:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 5.70 мин с общим временем прохода 6.50 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M40:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 60% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M41:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 45°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M42:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M43:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M44:
Применяли колонку HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 100% B (B: MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M45:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 3.10 мин с общим временем прохода 3.60 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M46:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.10 мин с общим временем прохода 2.60 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M47:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 4.20 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M48:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 80% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 5.00 мин с общим временем прохода 5.60 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M49:
Используемой колонкой была Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.10 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M50:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.00 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 0.80 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M51:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M52:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M53:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M54:
Используемой колонкой была Omega, 3.0мкм, 2.1×30 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.60 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M55:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3 + NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M56:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M57:
Применяли колонку Kinetex EVO, 2.6 мкм, 4.6×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.80 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M58:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3 + NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M59:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.80 мин с общим временем прохода 3.00 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M60:
Применяли колонку Kinetex 2.6мкм EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M61:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.03%NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M62:
Используемой колонкой была Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M63:
Применяли колонку Kinetex 2.6мкм EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 2.90 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M64:
Применяли колонку XBridge C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M65:
Применяли колонку Kinelex 2.6u XB-C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.80 мин с общим временем прохода 3.00 мин. Температура колонки составляла 45°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M66:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M67:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M68:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M69:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: Ацетонитрил) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M70:
Применяли колонку Kinetex 2.6 мкм EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 5.00 мин с общим временем прохода 5.60 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M71:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03%NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M72:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03%NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 4.20 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M73:
Применяли колонку Kinetex 2.6 мкм EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M74:
Применяли колонку Kinetex 2.6 мкм EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M75:
Используемой колонкой была XBridge C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.04% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M76:
Используемой колонкой была XBridge C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M77:
Используемой колонкой была XBridge C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M78:
Используемой колонкой была XBridge C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M79:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 60% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 5.00 мин с общим временем прохода 5.30 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M80:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 60% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 5.00 мин с общим временем прохода 5.30 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M81:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 40% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M82:
Применяли колонку Kinelex 2.6u XB-C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M83:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 5.20 мин с общим временем прохода 5.70 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M84:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 5.20 мин с общим временем прохода 5.70 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M85:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.60 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M86:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 4.80 мин с общим временем прохода 5.20 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M87:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M88:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A ( A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M89:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 100% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M90:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M91:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 4.20 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M92:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3) и заканчивающийся при 95% B (B: MeCN) за 4.0 мин с общим временем прохода 5.6 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M93:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 3.50 мин с общим временем прохода 4.50 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M94:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3) и заканчивающийся при 95% B (B: MeCN) за 1.8 мин с общим временем прохода 2.0 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M95:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A ( A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M96:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.7 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M97:
Применяли колонку Shim-pack XR-ODS, 3.0 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.65 мин с общим временем прохода 1.90 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M98:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 1.7 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M99:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.04% NH4OH в воде) и заканчивающийся при 95% B (B: MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M100:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 5.20 мин с общим временем прохода 5.60 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M101:
Применяли колонку Kinetex XB-C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.60 мин с общим временем прохода 1.90 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M102:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 1.65 мин с общим временем прохода 1.90 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M103:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 100% B (B: MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 45°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M104:
Используемой колонкой была InertSustain AQ-C18, 3.0 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M105:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M106:
Применяли колонку Kinelex 2.6u XB-C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.50 мин с общим временем прохода 6.00 мин. Температура колонки составляла 45°C со скоростью потока 1.50 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M107:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.03% NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M108:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 4.60 мин с общим временем прохода 5.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M109:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 75% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 100% B (B: MeCN) за 6.00 мин с общим временем прохода 6.60 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M110:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 1.80 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M111:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 0.1% FA в воде) и заканчивающийся при 80% B (B: 0.1% FA в MeCN) за 4.8 мин с общим временем прохода 5.2 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M112:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 65% A (A: 0.05% TFA в воде) и заканчивающийся при 95% B (B: 0.05% TFA в MeCN) за 5.00 мин с общим временем прохода 5.60 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M113:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 2.95 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M114:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.05% TFA в воде) и заканчивающийся при 60% B (B: 0.05% TFA в MeCN) за 5.00 мин с общим временем прохода 5.60 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M115:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 1.6 мин с общим временем прохода 1.8 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M116:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 95% B (B: 0.1%FA в MeCN) за 4.7 мин с общим временем прохода 5.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M117:
Применяли колонку CORTECS C18+, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.60 мин с общим временем прохода 1.90 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M118:
Применяли колонку Kinetex EVO C18, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.03%NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M119:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M120:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 5 мМ NH4HCO3) и заканчивающийся при 95% B (B: MeCN) за 1.6 мин с общим временем прохода 1.8 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M121:
Используемой колонкой была XSelect CSH C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.75 мин с общим временем прохода 2.00 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M122:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 75% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 5.00 мин с общим временем прохода 5.60 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M123:
Используемой колонкой была Xselect CSH C18, 2.5 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.7 мин с общим временем прохода 2 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M124:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.1% FA в MeCN) за 1.70 мин с общим временем прохода 2.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M125:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 4.7 мин с общим временем прохода 5.0 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M126:
Используемой колонкой была Omega, 3.0 мкм, 2.1×30 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.09% FA в воде) и заканчивающийся при 95% B (B: 0.1% FA в MeCN) за 1.37 мин с общим временем прохода 1.50 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M127:
Применяли колонку Kinetex EVO C18 100A, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 5.2 мин с общим временем прохода 5.60 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M128:
Применяли колонку CORTECS C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 95% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 4.4 мин с общим временем прохода 5.0 мин. Температура колонки составляла 45°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M129:
Применяли колонку Poroshell HPH-C18, 2.7 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 6.5 мМ NH4HCO3+NH3H2O в воде) и заканчивающийся при 95% B (B: MeCN) за 4.8 мин с общим временем прохода 5.1 мин. Температура колонки составляла 45°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M130:
Применяли колонку Kinetex EVO, 2.6 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 70% A (A: 5 мМ NH4HCO3 в воде) и заканчивающийся при 95% B (B: MeCN) за 2.7 мин с общим временем прохода 3.0 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M131:
Используемой колонкой была Ascentis Express C18, 2.7 мкм, 2.1×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.05% TFA в воде) и заканчивающийся при 100% B (B: 0.05% TFA в MeCN) за 2.70 мин с общим временем прохода 3.00 мин. Температура колонки составляла 40°C со скоростью потока 1.00 мл/мин.
Способ жидкостной хроматографии - масс-спектрометрии M132:
Применяли колонку Shim-pack XR-ODS, 2.2 мкм, 3.0×50 мм. Применяли линейный градиент, начинающийся при 90% A (A: 0.1% FA в воде) и заканчивающийся при 100% B (B: 0.05% FA в MeCN) за 1.60 мин с общим временем прохода 1.80 мин. Температура колонки составляла 40°C со скоростью потока 1.20 мл/мин.
1H-ЯМР данные
1H-ЯМР данные определили с помощью Bruker Avance 400 (оборудованного проточной ячейкой (объем 60 мкл), или с помощью Bruker AVIII 400, оборудованного 1.7 мм cryo CPTCI зондом, или с помощью Bruker AVIII 400 (400.13МГц), оборудованного 5 мм зондом, или с помощью Bruker AVII 600 (600.13 МГц), оборудованного 5 мм cryo TCI зондом, или с помощью Bruker AVIII 600 (601.6 МГц), оборудованного 5 мм cryo CPMNP зондом, или с помощью Bruker AVIII 500 (500.13МГц), оборудованного 5 мм широкополосным зондом или 5 мм Prodigy™ зондом, с тетраметилсиланом в качестве контроля (0.0) и растворителями CD3CN, CDCl3 или D6-ДМСО. Альтернативные 1H- и 13C-ЯМР типы устройств: Bruker DMX300 (1H-ЯМР: 300 МГц; 13C ЯМР: 75 МГц), Bruker Avance III 400 (1H-ЯМР: 400 МГц; 13C ЯМР: 100 МГц) или Bruker 400 Ultrashield (1H-ЯМР: 400 МГц; 13C ЯМР: 100 МГц) или Bruker Mercury Plus 300/400 ЯМР Spectrometer.
Химические сдвиги (δ) показаны в частях на миллион [ppm]; используются следующие аббревиатуры: s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, br. = расширенный; константы связывания приводятся в Герцах [Гц].
Перечень ЯМР пиков
Данные 1H-ЯМР выбранных примеров записаны в виде списков сигналов 1H-ЯМР. Для каждого сигнала, перечислены δ-значение в ppm и интенсивность сигнала в круглых скобках. Между парами δ-значений и значений интенсивности стоят точка с запятой в качестве разделителей.
Пример списка сигналов имеет поэтому вид:
δ 1 (интенсивность 1), δ 2 (интенсивность 2), …; δ i (интенсивность i), …, δ n (интенсивность n)
Интенсивность узких сигналов коррелирует с высотой сигналов в печатном примере ЯМР-спектра в см и показывает реальные отношения интенсивностей сигналов. Из широких сигналов несколько пиков или середина сигнала и их относительная интенсивность в сравнении с наиболее интенсивным сигналом могут быть показаны.
Для калибровки химического сдвига для спектров 1H, мы использовали тетраметилсилан и/или химический сдвиг растворителя, используемого, в частности, в случае спектров, измеренных в ДМСО. Поэтому в списки сигналов ЯМР может входить пик тетраметилсилана, но не обязательно.
Списки сигналов 1H-ЯМР аналогичны классическим 1Н-ЯМР и содержат поэтому, как правило, все пики, которые перечислены в классической ЯМР-интерпретации.
Кроме того, они могут показать аналогичные классическим 1H-ЯМР сигналам растворителей, стереоизомеров целевых соединений, которые также являются объектом настоящего изобретения, и/или пики примесей.
Для того, чтобы показать сигналы в дельта-диапазоне растворителей и/или воды, обычные пики растворителей, например, пики ДМСО в ДМСО-D6 и пик воды показаны в наших списках сигналов 1H-ЯМР и имеют, как правило, в среднем высокую интенсивность.
Пики стереоизомеров целевых соединений и/или пики примесей обычно имеют в среднем более низкую интенсивность, чем пики целевых соединений (например, с чистотой >90%).
Такие стереоизомеры и/или примеси могут быть типичными для конкретного процесса получения. Поэтому их пики могут помочь идентифицировать воспроизводимость нашего процесса получения с помощью "отпечатков пальцев побочных продуктов".
Эксперт, который рассчитывает пики целевых соединений с помощью известных способов (MestreC, ACD-моделирования, но также и с эмпирически оцененных средних значений) может выделить пики целевых соединений при необходимости, используя дополнительные фильтры интенсивности. Такое выделение будет аналогично соответствующему пику классической интерпретации 1H-ЯМР.
Дальнейшие подробности описания ЯМР-данных со списками пиков можно найти в публикации “Citation of NMR Peaklist Data within Patent Applications” в Research Disclosure Database Number 564025.
Микроволны
Biotage™ Initiator, микроволновый синтезатор; температурный диапазон: 40°C - 250°C; диапазон давления: 0 - 20 бар; диапазон мощности: 0 - 400 Вт.
Экспериментальная часть - общие методики
Синтез соединений формулы (I) может быть выполнен согласно или по аналогии со следующими схемами (Схема 1-6). В этом и в общем контексте настоящего изобретения скрещенные связи обозначают цис/транс-смеси.
Схема 1 для получения соединения (I) с T = T1 (I-T1)

Аминопиридины T1-a могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в European Journal of Organic Chemistry, 2012 (31), 6248-6259, в арил- или гетарил-замещенные аминопиридины T1-b. Такие замещенные аминопиридины могут быть легко превращены с помощью (алкоксиметилен)малонатов T1-c, растворенных в соответствующем спиртовом растворителе или толуоле, предпочтительно в условиях связывания, в (пирид-3-иламинометилен)-малонаты T1-d, или без применения какого-либо растворителя, как описано в WO 20060135551. Закрытие кольца проводят в высококипящих растворителях, предпочтительно в дифениловом простом эфире или ксилоле, с получением сложных эфиров азахинолинона и карбоновой кислоты T1-e, как описано в WO 2002004444. Сложные эфиры азахинолинона и карбоновой кислоты T1-e могут быть превращены в соответствующие хлористые аза-хинолиноны T1-f в присутствии хлорирующих агентов, таких как оксихлорид фосфора, как описано в WO 2008154447, с подобными азахинолинами. В зависимости от природы нуклеофила R2H, хлористые азахинолины T1-f реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением сложных эфиров азахинолинона и карбоновой кислоты T1-g, как описано в WO 199703074. Альтернативно, T1-f могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-639, например, в сложные эфиры азахинолина и карбоновой кислоты T1-g. Промежуточные сложные эфиры T1-g реагируют в гидролитических условиях с получением карбоновых кислот азахинолина T1-h, как описано для подобных синтезов в CN 102199152. Конечные продукты I-T1 получают в условиях амидного сочетания, например, через хлориды карбоновых кислот, образованные из T1-h, которые объединяются с аминами R1-NH-A в основных условиях, например, пиридином, триэтиламином или N,N-диизопропил этиламином, или через образование амида из карбоновых кислот T1-h, которые объединяются с аминами R1-NH-A и реагентами дегидротации, например, N-(3-di-метиламиноизопропил)-N'-этил-карбодиимид-гидрохлорид (EDC). Подобные синтезы описаны в WO 201501476, например.
Схема 2a для получения соединения (I) с T = T2 (I-T2)

Аминопиридины T2-a могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в Journal of Organic Chemistry, 1999, 64 (26), 9430-9443, в арил- или гетарил-замещенные аминопиридины T2-b. Такие аминопиридины могут быть легко превращены с помощью (алкоксиметилен)малонатов T2-c, растворенных в соответствующем спиртовом растворителе или толуоле, предпочтительно в условиях связывания, в (пирид-4-иламинометилен)-малонаты T2-d, как описано в Journal of Medicinal Chemistry, 2007, 50 (22), 5471-5484, или без применения какого-либо растворителя, как описано в Medicinal Chemistry Letters, 2012, 3 (1), 74-78. Закрытие кольца проводят в высококипящих растворителях, предпочтительно в дифениловом простом эфире или ксилоле, с получением сложных эфиров азахинолинона и карбоновой кислоты T2-e, как описано в WO 2016196961. Промежуточные сложные эфиры T2-e реагируют в гидролитических условиях с получением азахинолоновых карбоновых кислот T2-f, как описано для подобных синтезов в WO 2009036412. Азахинолоновых карбоновые кислоты T2-f могут быть превращены в соответствующий хлористый азахинолин T2-g в присутствии хлорирующих агентов, таких как оксихлорид фосфора, как описано в WO 2016196961, с подобными азахинолинами. Одновременно образуется хлорид кислоты и может быть превращен с аминами R1-NH-A в амиды T2-h в присутствии оснований, таких как триэтиламин. В зависимости от природы нуклеофила R2H, хлористые азахинолины T2-h реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением конечных соединений I-T2. Альтернативно, T2-h могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-6391, например, в конечные соединения I-T2.
Схема 2b для получения соединения (I) с T = T2 (I-T2)

Аминопиридины T2-a могут быть легко превращены с помощью (алкоксиметилен)малонатов T2-c, растворенных в соответствующем спиртовом растворителе или толуоле, предпочтительно в условиях связывания, в (пирид-4-иламинометилен)-малонаты T2-i, как описано в Journal of Medicinal Chemistry, 2007, 50 (22), 5471-5484, или без применения какого-либо растворителя, как описано в Medicinal Chemistry Letters, 2012, 3 (1), 74-78. Закрытие кольца проводят в высококипящих растворителях, предпочтительно в дифениловом простом эфире или ксилоле, с получением сложных эфиров азахинолинона и карбоновой кислоты T2-j, как описано в WO 2016196961. Промежуточные сложные эфиры T2-j реагируют в гидролитических условиях с получением азахинолоновых карбоновых кислот T2-k, как описано для подобных синтезов в WO 2009036412. Азахинолоновые карбоновые кислоты T2-k могут быть превращены в соответствующие амиды T2-l в условиях амидного связывания, например, через хлориды карбоновых кислот, образованные из T2-k, которые объединяются с аминами R1-NH-A в основных условиях, например, пиридин, триэтиламин или N,N-диизопропил этиламин или через образование амида из карбоновых кислот T2-k, которые объединяются с аминами R1-NH-A и реагентами дегидротации, например, N-(3-диметиламиноизопропил)-N'-этил-карбодиимид-гидрохлорид (EDC). Подобные синтезы описаны в WO 200903641, например.
Азахинолоновые амиды T2-l могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано для подобных реакций в WO 2015144001, в арил- или гетарил-замещенные Азахинолоновые амиды T2-m.
Азахинолоновые амиды T2-m могут быть превращены в соответствующий хлористый азахинолин T2-h в присутствии хлорирующих агентов, таких как оксихлорид фосфора или оксалил хлорид, как описано в WO 2008154447, с подобными азахинолинами. В зависимости от природы нуклеофила R2H, хлористые азахинолины T2-h реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением конечных соединений I-T2. Альтернативно, T2-h могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-6391, например, в конечные соединения I-T2.
Схема 3 для получения соединения (I) с T = T3 (I-T3)
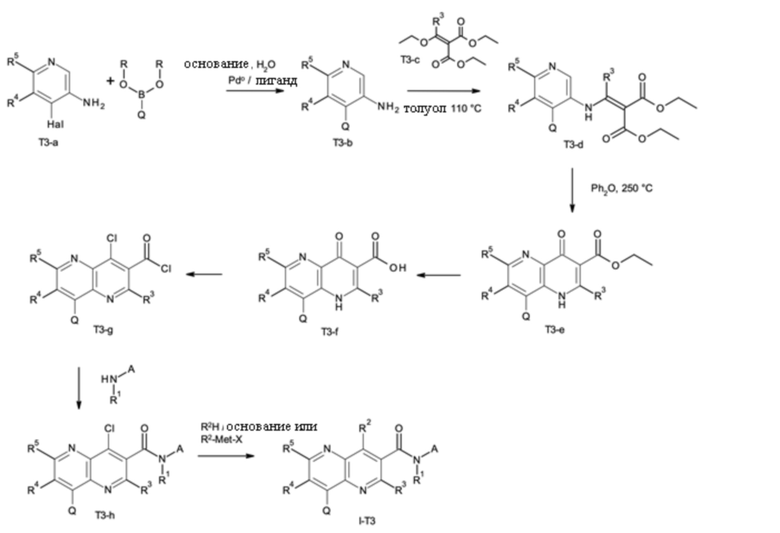
Аминопиридины T3-a могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в WO 2015170693 в арил- или гетарил-замещенные аминопиридины T3-b. Такие аминопиридины могут быть легко превращены с помощью (алкоксиметилен)малонатов T3-c, растворенных в соответствующем спиртовом растворителе или толуоле, предпочтительно в условиях связывания, в (пирид-3-иламинометилен)-малонаты T3-d, как описано в US 20140336182, или без применения какого-либо растворителя, как описано в Journal of the American Chemical Society, 1946, 68, 1204-1208. Закрытие кольца проводят в высококипящих растворителях, предпочтительно в дифениловом простом эфире или ксилоле, с получением сложных эфиров азахинолинона и карбоновой кислоты T3-e, как описано в WO 2013132376. Промежуточные сложные эфиры T3-e реагируют в гидролитических условиях с получением азахинолоновых карбоновых кислот T3-f, как описано для подобных синтезов в WO 20060223843. Карбоновые кислоты T3-f могут быть превращены в соответствующие хлориды кислот T3-g в присутствии хлорирующих агентов, таких как оксихлорид фосфора, как описано в WO 2006125974, с подобными азахинолинами. Хлорид кислоты может быть легко превращен с аминами R1-NH-A в амиды T3-h в присутствии оснований, таких как триэтиламин. В зависимости от природы нуклеофила R2H, хлористые азахинолины T3-h реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением конечных соединений I-T3. Альтернативно, T3-h могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-6391, например, в конечные соединения I-T3.
Схема 4 для получения соединения (I) с T = T4 (I-T4)

Аминопиримидины T4-a могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в WO 2008134679 или WO 2009112461 в арил- или гетарил-замещенные пиримидины T4-b. Затем, T4-b может быть легко превращен в пиримидиниловый сложный эфир T4-c в условиях автоклава и атмосфере монооксида углерода в присутствии метанола, как описано в WO 199835967. Следующая стадия включает акриловый сложный эфир T4-d, который может быть превращен с помощью T4-c с обеспечением азахинолонов, таких как T4-e, как описано в Journal of the Chemical Society [Section C: Organic] (1967), (18), 1745-1750. Промежуточные соединения T4-e реагируют в гидролитических условиях с получением азахинолоновых карбоновых кислот T4-f, как описано для подобных синтезов в WO 2009089263. Карбоновые кислоты T4-f могут быть превращены в соответствующие хлориды кислот T4-g в присутствии хлорирующих агентов, таких как оксихлорид фосфора, как описано в EP 115469 с подобными нафтиридинами. Хлорид кислоты может быть легко превращен с аминами R1-NH-A в амиды T4-h в присутствии оснований, таких как триэтиламин. В зависимости от природы нуклеофила R2H, хлористые азахинолины T4-h реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением конечных соединений I-T4. Альтернативно, T4-h могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-6391, например, в конечные соединения I-T4.Схема 5 для получения соединения (I) с T = T5 (I-T5)

2-Галогенанилины T5-a могут быть легко превращены в оксоацетогидразоноил цианиды T5-b в ходе двухстадийной реакции диазотирования-конденсации с 2-цианоацетамидом, как описано в Journal of Medicinal Chemistry, 2015, 58(14), 5437-5444. Циклизация T5-b в циннолин карбоксамиды T5-c происходит в присутствии кислот Льюиса, например, трихлорида алюминия, как описано в WO 2013148603. Аминофункциональные группы T5-c могут быть омылены в присутствии гидроксильных оснований, например, гидроксида калия, с получением циннолиновой карбоновой кислоты T5-d, как описано в WO 2004016615. T5-d может быть легко хлорирована, например, с помощью оксихлорида фосфора, в хлорид циннолиновой карбоновой кислоты T5-e, как описано в WO 2012162254. Хлорид кислоты может быть превращен с помощью аминов R1-NH-A в амиды T5-f в присутствии оснований, таких как триэтиламин, как описано в WO 2012162254. В зависимости от природы нуклеофила R2H, хлористые циннолины T5-f реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением циннолинкарбоксамидов T5-g, как описано в Bioorganic & Medicinal Chemistry Letters, 2013, 23(1), 71-74. Альтернативно, T5-f могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Journal of Medicinal Chemistry, 2013, 56(3), 1023-1040. Наконец, T5-g могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в WO 201314860, с обеспечением конечных соединений I-T5.
Схема 6 для получения соединения (I) с T = T6 (I-T6)
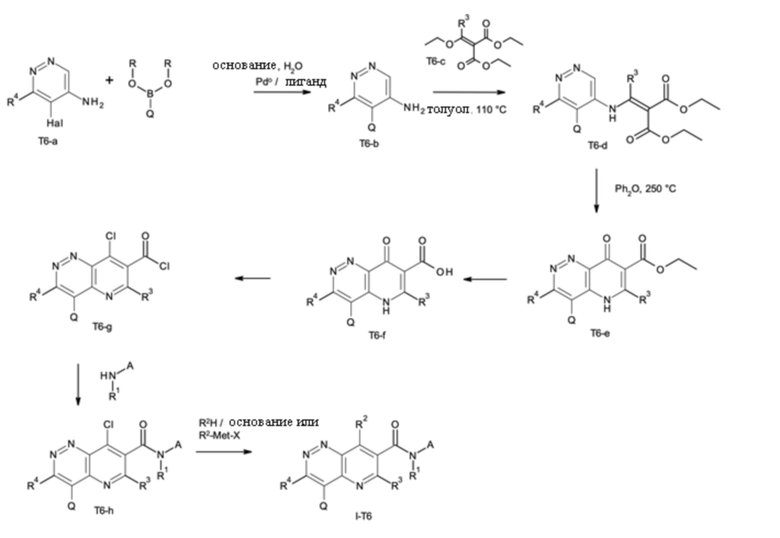
Аминопиридазины T6-a могут быть превращены посредством реакции перекрестного сочетания Сузуки с бороновыми кислотами или сложными эфирами бороновых кислот Q-B(OR)2 (R=H; R = Me или R,R = пинаколат), как описано в WO 2014143241 в арил- или гетарил-замещенные аминопиридазины T6-b. Такие аминопиридазины могут быть легко превращены с помощью (алкоксиметилен)малонатов T6-c, растворенных в соответствующем спиртовом растворителе или толуоле, предпочтительно в условиях связывания, в (пиридазин-4-иламинометилен)-малонаты T6-d, как описано для подобных реакций в US 20140336182, или без применения какого-либо растворителя, как описано в Journal of the American Chemical Society, 1946, 68, 1204-1208. Закрытие кольца проводят в высококипящих растворителях, предпочтительно в дифениловом простом эфире или ксилоле, с получением сложных эфиров 8-оксо-5,8-дигидропиридо[3,2-c]пиридазина и карбоновой кислоты T6-e, как описано в WO 2013132376. Промежуточные сложные эфиры T6-e реагируют в гидролитических условиях с получением 8-оксо-5,8-дигидропиридо[3,2-c]пиридазин-7-карбоновых кислот T6-f, как описано для подобных синтезов в WO 20060223843. Карбоновые кислоты T6-f могут быть превращены в соответствующие хлориды кислот T6-g в присутствии хлорирующих агентов, таких как оксихлорид фосфора, как описано в WO 2006125974, с подобными азахинолинами. Хлорид кислоты может быть легко превращен с аминами R1-NH-A в амиды T6-h в присутствии оснований, таких как триэтиламин. В зависимости от природы нуклеофила R2H, 8-хлор-пиридо[3,2-c]пиридазин-7-карбоксамиды T6-h реагируют с R2H в присутствии основания, например, этилата натрия, метилата натрия, трет-бутилата калия, триэтиламин N,N-диизопропил этиламина, диазабициклоундекана, гидрида натрия, гидроксида лития, гидроксида натри, гидроксида калия, карбоната калия, карбоната цезия, или тому подобного, с получением конечных соединений I-T6. Альтернативно, T6-h могут быть превращены с помощью определенных соединений Гриньяра или органических соединений металлов R2Met-X, например, C1-C4-алкил-Met-X, C3-C6-циклоалкил-Met-X, C2-C4-алкенил-Met-X, C3-C6-циклоалкенил-Met-X, C2-C4-алкинил-Met-X или фенил-C1-C4-алкил-Met-X (Met = Mg, Zn; X = I, Br, Cl), вводя C1-C4-алкил, C3-C6-циклоалкил, C2-C4-алкенил, C3-C6-циклоалкенил, C2-C4-алкинил или фенил-C1-C4-алкила, каждый из которых необязательно замещен, как определено выше для R2 группы, как описано в Tetrahedron Letters, 2000, 41(33), 6387-6391, например, в конечные соединения I-T6.Экспериментальная часть - Примеры
Промежуточные соединения (T1)
2-(3,5-Дихлорфенил)пиридин-3-амин (T1-b-1)

2-Бромпиридин-3-амин, 2.00 г (11.6 ммоль), 3,5-дихлорфенилбороновую кислоту, 3.30 г (17.3 ммоль), трис(дибензилиденацетон)дипалладий, 0.50 г (0.6 ммоль), три-трет-бутилфосфин тетафторборат, 0.30 г (1.2 ммоль), и фторид калия, 2.00 г (34.7 ммоль), растворяли в 80 мл тетрагидрофурана и 20 мл воды. Смесь перемешивали при 60°C всю ночь. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 10:1) с получением 1.40 г (51%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M34): Rt = 0.77 мин; m/z = 239 (M+1)+.
2-(2,3-Дихлорфенил)пиридин-3-амин (T1-b-2)
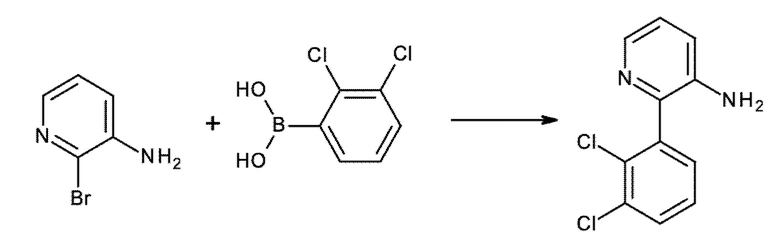
Соединение синтезировали тем же способом, как описано в T1-b-1 с получением 1.56 г (62%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M34): Rt = 0.82 мин; m/z = 239 (M+1)+.
Диэтил ({[2-(3,5-дихлорфенил)пиридин-3-ил]амино}метилен)малонат (T1-d-1)

2-(3,5-Дихлорфенил)пиридин-3-амин, 1.40 г (5.6 ммоль) и диэтил 2-(этоксиметилен)-малонат, 3.80 г (17.6 ммоль), растворяли в 30 мл толуола. Полученную смесь перемешивали при 110°C в течение всю ночь. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 1:2) с получением 2.40 г (40%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M20): Rt = 1.32 мин; m/z = 409 (M+1)+.
Диэтил ({[2-(2,3-дихлорфенил)пиридин-3-ил]амино}метилен)малонат (T1-d-2)

Соединение синтезировали тем же способом, как описано в T1-d-1 с получением 2.10 г (70%) продукта в виде масла желтого цвета.
LC-MS (Способ M20): Rt = 1.19 мин; m/z = 409 (M+1)+.
Этил 8-(3,5-дихлорфенил)-4-оксо-1,4-дигидро-1,7-нафтиридин-3-карбоксилат (T1-e-1)
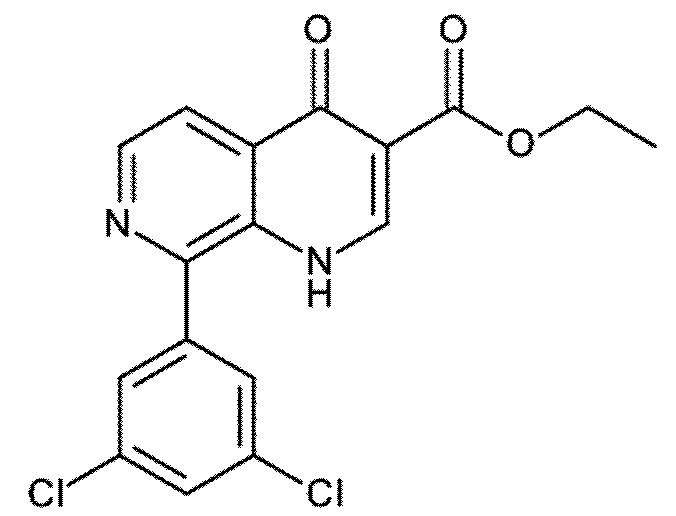
Диэтил ({[2-(3,5-дихлорфенил)пиридин-3-ил]амино}метилен)малонат, 2.40 г (5.9 ммоль), растворяли в 50 мл дифенилового простого эфира. Полученную смесь перемешивали при 230°C в течение 30 мин. После охлаждения до комнатной температуры, 500 мл петролейного простого эфира добавляли, и осажденное твердое вещество собирали посредством фильтрации с получением 460 мг (9%) продукта в виде твердого вещества коричневого цвета.
LC-MS (Способ M17): Rt = 0.77 мин; m/z = 363 (M+1)+.
Этил 8-(2,3-дихлорфенил)-4-оксо-1,4-дигидро-1,7-нафтиридин-3-карбоксилат (T1-e-2)

Соединение синтезировали тем же способом, как описано в T1-e-1 с получением 460 мг (21%) продукта в виде твердого вещества коричневого цвета.
LC-MS (Способ M20): Rt = 0.93 мин; m/z = 363 (M+1)+.
Этил 4-хлор-8-(3,5-дихлорфенил)-1,7-нафтиридин-3-карбоксилат (T1-f-1)

Этил 8-(3,5-дихлорфенил)-4-оксо-1,4-дигидро-1,7-нафтиридин-3-карбоксилат, 460 мг (1.3 ммоль), растворяли в 10 мл оксихлорида фосфора. Полученную смесь перемешивали при 100°C в течение 2 часов. Растворитель удаляли под вакуумом с получением 460 мг (неочищенный) продукта в виде масла черного цвета.
LC-MS (Способ M20): Rt = 1.55 мин; m/z = 381 (M+1)+.
Этил 4-хлор-8-(2,3-дихлорфенил)-1,7-нафтиридин-3-карбоксилат (T1-f-2)

Соединение синтезировали тем же способом, как описано в T1-f-1 с получением 460 мг (55%) продукта в виде масла черного цвета.
LC-MS (Способ M3): Rt = 1.32 мин; m/z = 381 (M+1)+.
Этил 8-(3,5-дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоксилат (T1-g-1)

Этил 4-хлор-8-(3,5-дихлорфенил)-1,7-нафтиридин-3-карбоксилат, 230 мг (0.6 ммоль), растворяли в 10 мл тетрагидрофурана. Диметиламин, 3.0 мл (2M в тетрагидрофуране, 6.0 ммоль), добавляли. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом с получением 230 мг (неочищенный) продукта в виде масла коричневого цвета.
LC-MS (Способ M21): Rt = 1.24 мин; m/z = 390 (M+1)+.
Этил 8-(2,3-дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоксилат (T1-g-2)
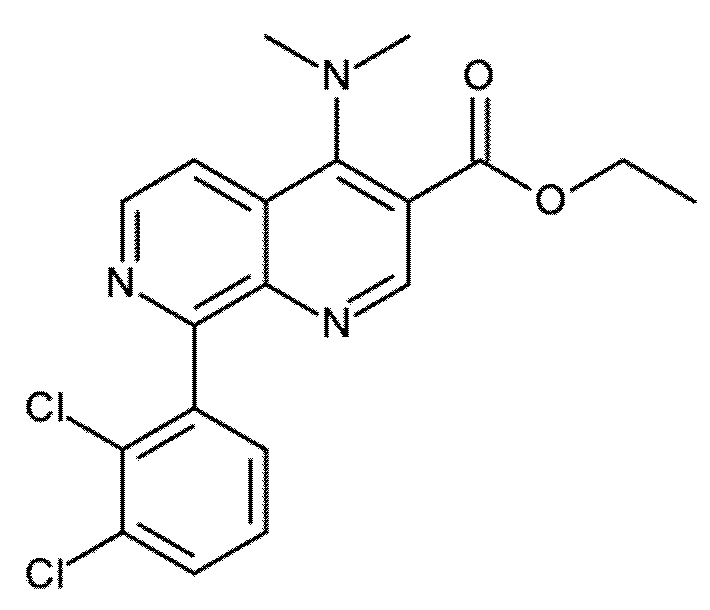
Соединение синтезировали тем же способом, как описано в T1-g-1 с получением 210 мг (63%) продукта в виде твердого вещества коричневого цвета.
LC-MS (Способ M3): Rt = 1.14 мин; m/z = 390 (M+1)+.
Этил 8-(3,5-дихлорфенил)-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоксилат (T1-g-3)

Этил 4-хлор-8-(3,5-дихлорфенил)-1,7-нафтиридин-3-карбоксилат, 260 мг (неочищенный), растворяли в 5 мл тетрагидрофурана. Морфолин, 310 мг (5.2 эквив.), добавляли. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия с получением 230 мг (78%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M21): Rt = 1.23 мин; m/z = 432 (M+1)+.
Этил 8-(3,5-дихлорфенил)-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоксилат (T1-g-4)

Соединение синтезировали тем же способом, как описано в T1-g-3 с получением 200 мг (64%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M21): Rt = 1.19 мин; m/z = 432 (M+1)+.
8-(3,5-Дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоновая кислота (T1-h-1)
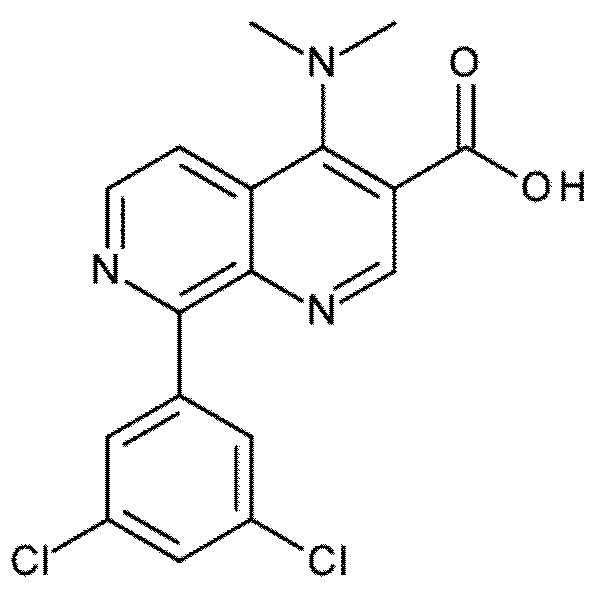
Этил 8-(3,5-дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоксилат, 230 мг (0.6 ммоль), растворяли в 4.0 мл тетрагидрофурана и 1.0 мл воды. Гидроксид лития, 140 мг (5.9 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Смесь экстрагировали с помощью этилацетата и значение рН водной фазы доводили до 7 с помощью 2Н раствора хлорводорода. Осажденное твердое вещество отфильтровывали, промывали водой и сушили на воздухе с получением 130 мг (57%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M21): Rt = 0.81 мин; m/z = 362 (M+1)+.
8-(2,3-Дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоновая кислота (T1-h-2)

Соединение синтезировали тем же способом, как описано в T1-h-1 с получением 190 мг (89%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M3): Rt = 0.82 мин; m/z = 362 (M+1)+.
8-(3,5-Дихлорфенил)-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоновая кислота (T1-h-3)

Соединение синтезировали тем же способом, как описано в T1-h-1 с получением 100 мг (44%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M21): Rt = 1.00 мин; m/z = 404 (M+1)+.
8-(2,3-Дихлорфенил)-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоновая кислота (T1-h-4)
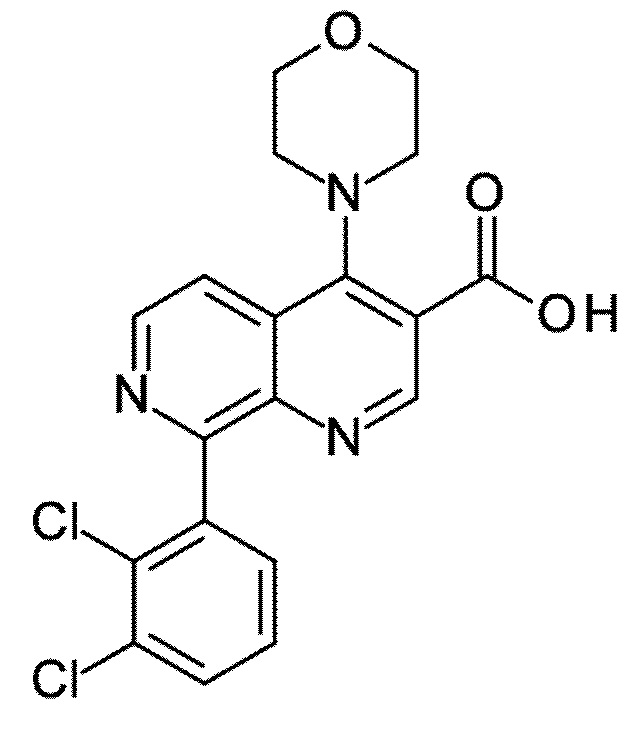
Соединение синтезировали тем же способом, как описано в T1-h-1 с получением 160 мг (73%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M3): Rt = 0.99 мин; m/z = 404 (M+1)+.
Примеры (T1)
Пример T1-1
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,7-нафтиридин-3-карбоксамид

8-(3,5-Дихлорфенил)-4-(диметиламино)-1,7-нафтиридин-3-карбоновую кислоту, 120 мг (0.3 ммоль), (S)-хроман-4-амин, 60 мг (0.4 ммоль), HATU,189 мг (0.5 ммоль), N,N-диизопропилэтиламин, 129 мг (1.0 ммоль), растворяли в 3 мл N,N-диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли под вакуумом и остаток очищали посредством препаративной ВЭЖХ с получением 36 мг (20%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M30): Rt = 1.61 мин; m/z = 493 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.05-2.08 (m, 1H), 2.19-2.24 (m, 1H), 3.11 (s, 6H), 4.22-4.31 (m, 2H), 5.25 (q, 1H), 6.80 (d, 1H), 6.94 (t, 1H), 7.18 (t, 1H), 7.38 (d, 1H), 7.73 (s, 1H), 8.06-8.09 (m, 3H), 8.65 (d, 1H), 8.74 (s, 1H), 9.18 (d, 1H).
Пример T1-2
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,7-нафтиридин-3-карбоксамид

Соединение синтезировали тем же способом, как описано в пример T1-1 с получением 74 мг (29%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M36): Rt = 1.20 мин; m/z = 493 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.01-2.07 (m, 1H), 2.17-2.20 (m, 1H), 3.16 (s, 6H), 4.17-4.29 (m, 2H), 5.22 (q, 1H), 6.79 (d, 1H), 6.92 (t, 1H), 7.14-7.19 (m, 1H), 7.34 (d, 1H), 7.40-7.49 (m, 2H), 7.7-7.8 (m, 1H), 8.13 (d, 1H), 8.57 (s, 1 H), 8.64 (d, 1H), 9.16(d, 1H).
Пример T1-3
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоксамид

Соединение синтезировали тем же способом, как описано в пример T1-1 с получением 78 мг (57%) продукта в виде твердого вещества светло-желтого цвета.
LC-MS (Способ M35: Rt = 1.85 мин; m/z = 535 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.07-2.11 (m, 1H), 2.20-2.27 (m, 1H), 3.31-3.40 (m, 4H), 3.87-3.90 (m, 4H), 4.24-4.30 (m, 2H), 5.27 (q, 1H), 6.81 (d, 1H), 6.95 (t, 1H), 7.19 (t, 1H),7.41 (d, 1H), 7.74 (t, 1H), 8.06-8.10 (m, 3H), 8.71 (d, 1H), 8.83 (s, 1 H), 9.28 (d, 1H).
Пример T1-4
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,7-нафтиридин-3-карбоксамид

Соединение синтезировали тем же способом, как описано в пример T1-1 с получением 59 мг (29%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M37): Rt = 1.60 мин; m/z = 535 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.03-2.08 (m, 1H), 2.18-2.23 (m, 1H), 3.32-3.33 (m, 4H), 3.88 (m, 4H), 4.22-4.48 (m, 2H), 5.24 (q, 1H), 6.78-6.80 (m, 1H), 6.91 (t, 1H), 7.11-7.20 (m, 1H), 7.35-7.51 (m, 3H), 7.75-7.78 (m, 1H), 8.08 (d, 1H), 8.67-8.69 (m, 2H), 9.25 (d, 1H).
Промежуточные соединения (T2)
3-(2,3-Дихлорфенил)пиридин-4-амин (T2-b-1)

3-Бромпиридин-4-амин, 2.00 г (11.6 ммоль), 2,3-дихлорфенилбороновую кислоту, 3.30 г (17.3 ммоль), трис(дибензилиденацетон)дипалладий, 530 мг (0.6 ммоль), три-трет-бутилфосфин тетафторборат, 335 мг (1.2 ммоль), и фторид калия, 2.00 г (34.7 ммоль), растворяли в 40 мл тетрагидрофурана и 10 мл воды. Смесь перемешивали при 110°C всю ночь. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата и объединенную органическую фазу сушили над безводным сульфатом натрия. Растворитель удаляли под вакуумом и остаток очищали посредством колоночной хроматографии на силикагеле (дихлорметан / метанол = 20:1) с получением 1.90 г (59%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M33): Rt = 1.22 мин; m/z = 239 (M+1)+.
Диэтил ({[3-(2,3-дихлорфенил)пиридин-4-ил]амино}метилен)малонат (T2-d-1)
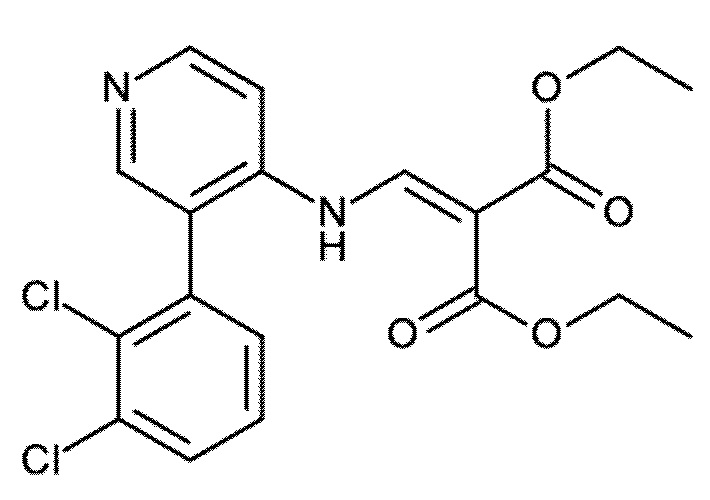
3-(2,3-Дихлорфенил)пиридин-4-амин, 1.90 г (8.0 ммоль) и диэтил 2-(этоксиметилен)малонат, 5.70 г (23.8 ммоль), растворяли в 30 мл толуола. Полученную смесь перемешивали при 110°C всю ночь. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 1:2) с получением 1.10 г (33%) продукта в виде масла желтого цвета.
LC-MS (Способ M33): Rt = 1.52 мин; m/z = 409 (M+1)+.
Этил 8-(2,3-дихлорфенил)-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксилат (T2-e-1)
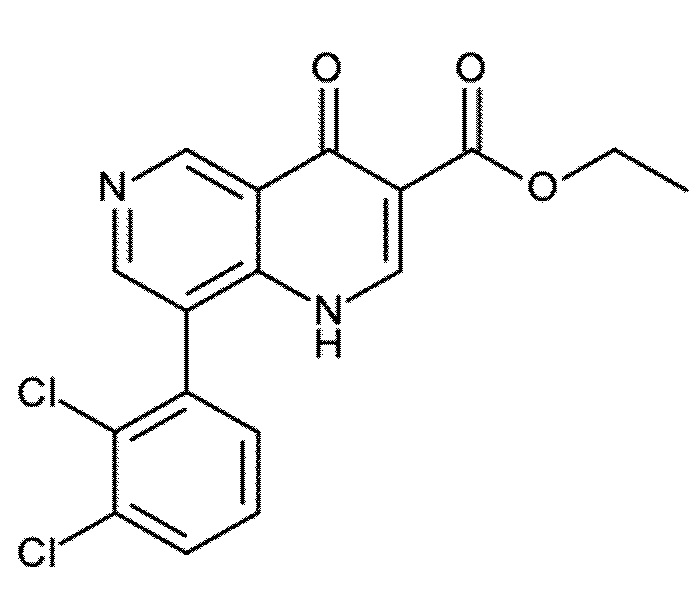
1000 мл дифенилового простого эфира помещали в трехгорлую колбу, диэтил ({[3-(2,3-дихлорфенил)пиридин-4-ил]амино}метилен)малонат, 1.00 г (2.4 ммоль), растворенный в 100 мл дифенилового простого эфира, добавляли при возврате флегмы. Полученную смесь перемешивали при возврате флегмы в течение 10 мин. После охлаждения до комнатной температуры, реакционную смесь промывали пять раз с помощью 4Н раствора хлороводорода. Водную фазу лиофилизировали и затем очищали с помощь обращеннофазовой колонки с получением 540 мг (61%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M31): Rt = 1.93 мин; m/z = 363 (M+1)+.
8-(2,3-Дихлорфенил)-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоновая кислота (T2-f-1)

Этил 8-(2,3-дихлорфенил)-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксилат, 540 мг (1.5 ммоль), растворяли в 16 мл тетрагидрофурана и 4 мл воды. Гидроксид лития, 625 мг (14.9 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Смесь экстрагировали с помощью этилацетата и значение рН водной фазы доводили до 7 с помощью 2Н раствора хлорводорода. Осажденное твердое вещество фильтровали, промывали водой и сушили на воздухе с получением 300 мг (50%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M17): Rt = 0.80 мин; m/z = 335 (M+1)+.
4-Хлор-8-(2,3-дихлорфенил)-1,6-нафтиридин-3-карбонил хлорид (T2-g-1)

8-(2,3-Дихлорфенил)-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоновую кислоту, 250 мг (0.8 ммоль), растворяли в 5 мл толуола. N,N-Диизопропилэтиламин, 289 мг (2.2 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C в течение 1 часа. Оксихлорид фосфора, 572 мг (3.7 ммоль), добавляли при 60°C. Полученную смесь перемешивали при 60°C в течение 30 минут. Растворитель удаляли под вакуумом с получением 250 мг (неочищенный) продукта в виде масла коричневого цвета. Остаток непосредственно применяли на следующей стадии без дальнейшей очистки.
4-Хлор-8-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,6-нафтиридин-3-карбоксамид (T2-h-2)

4-Хлор-8-(2,3-дихлорфенил)-1,6-нафтиридин-3-карбонил хлорид, 250 мг (0.7 ммоль) и (S)-хроман-4-амин, 120 мг (0.8 ммоль), растворяли в 5 мл дихлорметана. Триэтиламин, 340 мг (3.4 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель удаляли под вакуумом с получением 250 мг (неочищенный) продукта в виде масла коричневого цвета.
LC-MS (Способ M17): Rt = 1.06; m/z = 484 (M+1)+.
Диэтил {[(3-бромпиридин-4-ил)амино]метилен}малонат (T2-i-1)

3-Бромпиридин-4-амин, 2.00 г (11.6 ммоль) и диэтил 2-(этоксиметилен)малонат, 7.49 г (34.7 ммоль), растворяли в 50 мл толуола. Полученную смесь перемешивали при 110°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Остаток очищали посредством колоночной хроматографии на силикагеле (простой петролейный эфир/ этилацетат = 2:3) с получением 3.50 г (88%) продукта в виде твердого вещества коричневого цвета.
LC-MS (Способ M20): Rt = 0.86 мин; m/z = 343/345 (M+1)+.
Этил 8-бром-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксилат (T2-j-1)

Диэтил {[(3-бромпиридин-4-ил)амино]метилен}малонат, 3.00 г (8.7 ммоль), растворяли в 50 мл дифенилового простого эфира. Полученную смесь перемешивали при 230°C в течение 40 мин. После охлаждения до комнатной температуры, 500 мл петролейного простого эфира добавляли, осажденное твердое вещество собирали посредством фильтрации с получением 1.42 г (50%) продукта в виде твердого вещества коричневого цвета.
LC-MS (Способ M12): Rt = 0.59 мин; m/z = 297/299 (M+1)+.
8-Бром-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоновая кислота (T2-k-1)
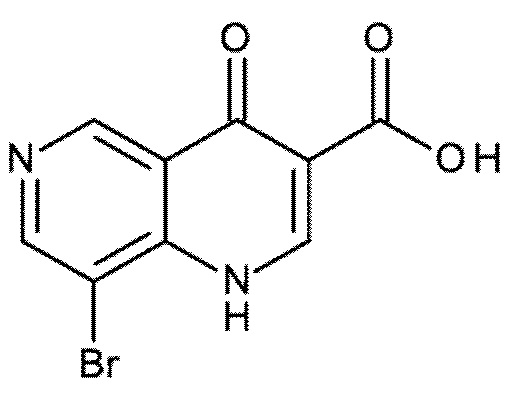
Этил 8-бром-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксилат, 1.42 г (4.8 ммоль), растворяли в 40.0 мл тетрагидрофурана и 10 мл воды. Гидроксид лития, 1.15 г (47.8 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 65°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Смесь экстрагировали с помощью этилацетата и значение рН водной фазы доводили до 7 с помощью 2Н раствора хлорводорода. Осажденное твердое вещество фильтровали, промывали водой и сушили на воздухе с получением 1.10 г (86%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M12): Rt = 0.56 мин; m/z = 269/271 (M+1)+.
8-Бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксамид (T2-l-1)

8-Бром-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоновая кислота, 600 мг (2.2 ммоль), (S)-хроман-4-амин, 400 мг (2.7 ммоль), HATU, 1.27 г (3.3 ммоль), N,N-диизопропилэтиламин, 865 мг (6.7 ммоль), растворяли в 10 мл N,N-диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию погасили насыщенным раствором хлорида натрия. Осадок собирали посредством фильтрации, промывали водой и высушивали под вакуумом с получением 650 мг (73%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M20): Rt = 0.94 мин; m/z = 400/402 (M+1)+.
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксамид (T2-m-1)
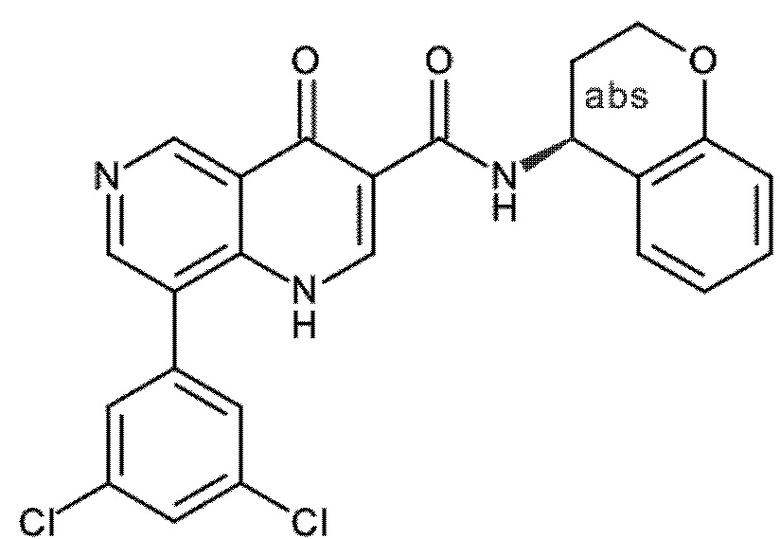
8-Бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксамид, 450 мг (1.1 ммоль), 3,5-дихлорфенилбороновую кислоту, 322 мг (1.7 ммоль), трис(дибензилиденацетон)дипалладий, 52 мг (0.06 ммоль), три-трет-бутилфосфин тетафторборат, 33 мг (0.1 ммоль), и фторид калия, 196 мг (3.4 ммоль), растворяли в 8 мл тетрагидрофурана и 2 мл воды. Смесь перемешивали при 60°C всю ночь. Растворитель удаляли под вакуумом. После охлаждения до комнатной температуры, Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 20:1) с получением 420 мг (40%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M29): Rt = 3.21 мин; m/z = 466 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.04-2.09 (m, 1H), 2.20-2.27 (m, 1H), 4.15-4.20 (m, 1H), 4.29-4.34 (m, 1H), 5.24 (q, 1H), 6.82-6.93 (m, 2H), 7.18-7.26 (m, 2H), 7.70 (d, 2H), 7.84 (d, 1H), 8.64-8.68 (m, 2H), 9.39 (s, 1H), 10.10 (d, 1H), 11.98-11.99 (m, 1H).
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксамид (T2-m-2)

Это соединение синтезировали способом, описанным для T2-m-1 с получением 460 мг (70%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M30): Rt = 1.73 мин; m/z = 466 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.03-2.08 (m, 1H), 2.18-2.24 (m, 1H), 4.14-4.20 (m, 1H), 4.28-4.35 (m, 1H), 5.23 (q, 1H), 6.82-6.93 (m, 2H), 7.18-7.27 (m, 2H), 7.54-7.63 (m, 2H), 7.90 (d, 1H), 8.62-8.66 (m, 2H), 9.43 (s, 1H), 10.06 (d, 1H), 12.02 (br, 1H).
4-Хлор-8-(3,5-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,6-нафтиридин-3-карбоксамид (T2-h-1)

8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-оксо-1,4-дигидро-1,6-нафтиридин-3-карбоксамид, 200 мг (0.4 ммоль), N,N-диизопропилэтиламин, 166 мг (1.29 ммоль), растворяли в 10 мл толуола. Полученную смесь перемешивали при 80°C в течение 1 часа. После охлаждения до комнатной температуры, оксихлорид фосфора, 329 мг (2.1 ммоль), добавляли по каплям. Полученную смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель удаляли под вакуумом с получением 200 мг (неочищенный) продукта в виде масла коричневого цвета, которое применяли на следующей стадии без дальнейшей очистки.
LC-MS (Способ M2): Rt = 2.71 мин; m/z = 484 (M+1)+.
4-Хлор-8-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,6-нафтиридин-3-карбоксамид (T2-h-2)

Это соединение синтезировали способом, описанным для T2-h-1 с получением 300 мг (неочищенный) продукта в виде масла оранжевого цвета, которое применяли на следующей стадии без дальнейшей очистки.
LC-MS (Способ M20): Rt = 1.17 мин; m/z = 484 (M+1)+.
Примеры (T2)
Пример T2-1
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,6-нафтиридин-3-карбоксамид

(4-Хлор-8-(3,5-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,6-нафтиридин-3-карбоксамид, 100 мг (0.2 ммоль), растворяли в 5 мл тетрагидрофурана. Диметиламин, 1.0 мл (2M in тетрагидрофуран, 2.1 ммоль), добавляли. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением 8.8 мг (8.1%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M29): Rt = 2.62 мин; m/z = 493 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.02-2.07 (m, 1H), 2.19-2.22 (m, 1H), 3.20 (s, 6H), 4.21-4.28 (m, 2H), 5.24 (q, 1H), 6.80 (d, 1H), 6.93 (t, 1H), 7.17 (t, 1H), 7.37 (d, 1H), 7.68 (d, 1H), 7.37 (d, 2H), 8.73 (d, 2H), 9.13 (d, 1H), 9.54 (s, 1H).
Пример T2-2
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,6-нафтиридин-3-карбоксамид
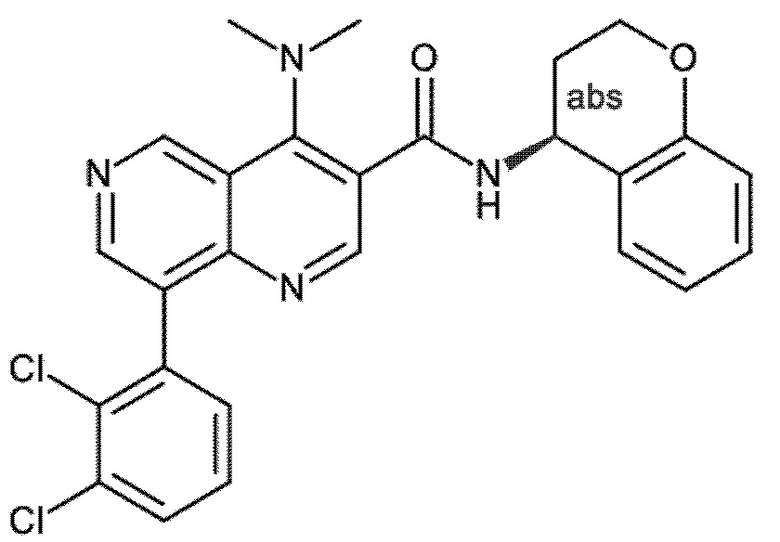
Соединение синтезировали тем же способом, как описано в пример T2-1 с получением 19.4 мг (12%) продукта в виде твердого вещества желтого цвета
LC-MS (Способ M14): Rt = 1.30 мин; m/z = 493 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.02-2.05 (m, 1H),2.16-2.23 (m, 1H), 3.42 (s, 6H), 4.15-4.30 (m, 2H), 5.19 (q, 1H), 6.80 (d, 1H), 6.90 (t, 1H), 7.18 (t, 1H), 7.33 (d, 1H), 7.47-7.56 (m, 2H), 7.83 (d, 1H), 8.49 (s, 1H), 8.68 (s, 1H), 9.23 (s, 1H), 9.65 (s, 1H).
Пример T2-3
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,6-нафтиридин-3-карбоксамид
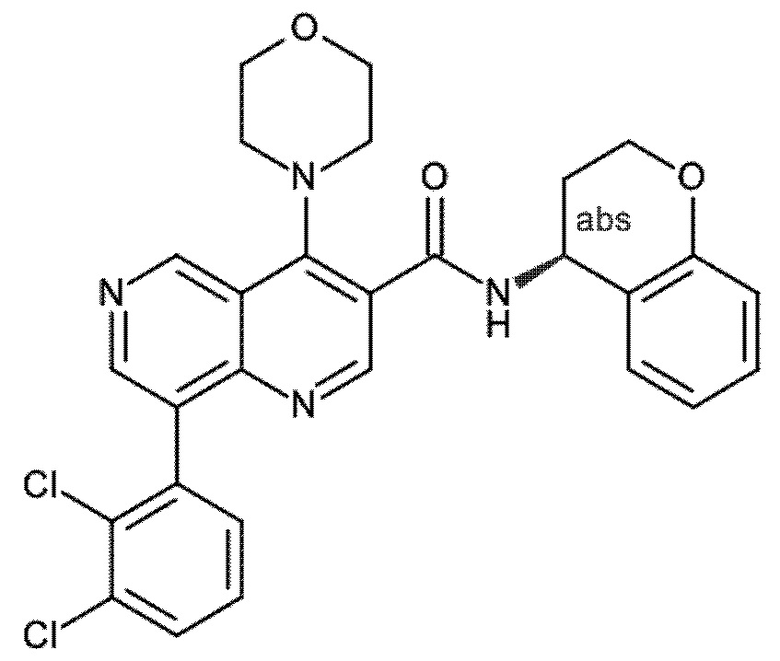
4-Хлор-8-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,6-нафтиридин-3-карбоксамид, 250 мг (неочищенный), растворяли в 5 мл тетрагидрофурана. Морфолин, 450 мг (5.2 ммоль), добавляли. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением 86.8 мг (31%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M33): Rt = 3.34 мин; m/z = 535 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.03-2.07 (m, 1H), 2.19-2.23 (m, 1H), 3.40-3.44 (m, 4H), 3.90-3.92 (m, 4H), 4.20-4.30 (m, 2H), 5.23 (q, 1H), 6.79 (d, 1H), 6.91 (t, 1H), 7.17 (t, 1H), 7.35-7.50 (m, 3H), 7.77 (d, 1H), 8.65 (s, 1H), 8.75 (s, 1H), 9.22 (d, 1H), 9.58 (s, 1H).
Пример T2-4
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,6-нафтиридин-3-карбоксамид

Соединение синтезировали тем же способом, как описано в пример T2-3 с получением 14.1 мг (12%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M29): Rt = 1.77 мин; m/z = 535 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.04-2.28 (m, 2H),3.39-3.40 (m, 4H), 3.89-3.92 (m, 4H), 4.22-4.26 (m, 2H), 5.24 (q, 1H), 6.81 (d, 1H), 6.94 (t, 1H), 7.18 (t, 1H), 7.39 (d, 1H), 7.70-7.75 (m, 3H), 8.81 (s, 1H), 8.86 (s, 1H), 9.24 (d, 1H), 9.54 (s, 1H).
Промежуточные соединения (T3)
4-(3,5-Дихлорфенил)пиридин-3-амин (T3-b-1)
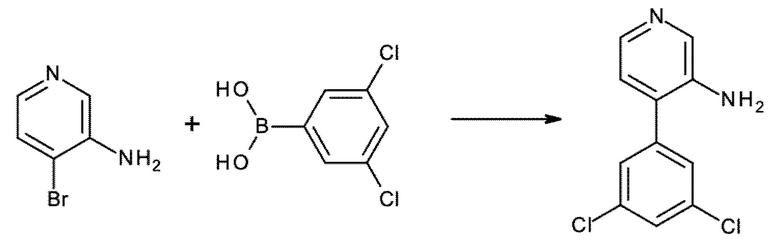
4-Бромпиридин-3-амин, 2.00 г (11.6 ммоль), 3,5-дихлорфенилбороновую кислоту, 3.30 г (17.3 ммоль), трис(дибензилиденацетон)дипалладий, 265 мг (0.3 ммоль), три-трет-бутилфосфин тетафторборат, 168 мг (0.6 ммоль), и фторид калия, 2.00 г (34.7 ммоль), растворяли в 16 мл тетрагидрофурана и 4 мл воды. Смесь перемешивали при 60°C всю ночь. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (дихлорметанhttp://www.baidu.com/link?url=a1k_jfY8qX4Z4-vGWj_RkHuLWAVgMzdj0LwoaQ600t1cD4yjSNdvyhC46Hst4r_EgnG7QJP4AdyMK21JAtwH9g2Ru0nDaw0wbQlbIWhXxbfduIDwCybisvvVfAsNfNt5 / метанол = 20:1) с получением 2.96 г (91%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M16): Rt = 0.74 мин; m/z = 239 (M+1)+.
4-(2,3-Дихлорфенил)пиридин-3-амин (T3-b-2)

Соединение синтезировали тем же способом, как описано в пример T3-b-1 с получением 2.36 г (79%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M3): Rt = 0.68 мин; m/z = 239 (M+1)+.
Диэтил ({[4-(3,5-дихлорфенил)пиридин-3-ил]амино}метилен)малонат (T3-d-1)

4-(3,5-Дихлорфенил)пиридин-3-амин, 2.96 г (12.4 ммоль) и диэтил 2-(этоксиметилен)малонат, 8.02 г (37.1 ммоль), растворяли в 30 мл толуола. Полученную смесь перемешивали при 110°C всю ночь. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 1:2) с получением 3.90 г (63 %) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M16): Rt = 1.30 мин; m/z = 409 (M+1)+.
Диэтил ({[4-(2,3-дихлорфенил)пиридин-3-ил]амино}метилен)малонат (T3-d-2)

Соединение синтезировали тем же способом, как описано в пример T3-d-1 с получением 3.0 г (67%) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M3): Rt = 1.24 мин; m/z = 409 (M+1)+.
Этил 8-(3,5-дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоксилат (T3-e-1)
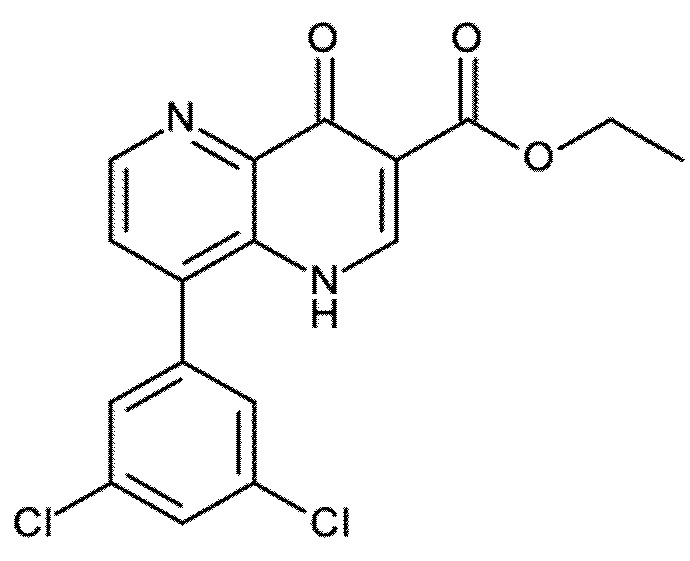
100 мл дифенилового простого эфира помещали в трехгорловую колбу, диэтил диэтил ({[4-(3,5-дихлорфенил)пиридин-3-ил]амино}метилен)малонат, 3.90 г (9.5 ммоль), растворенный в 50 мл дифенилового простого эфира, добавляли при возврате флегмы. Полученную смесь перемешивали при возврате флегмы в течение 5 мин. После охлаждения до комнатной температуры, реакционную смесь промывали пять раз с помощью 4Н раствора хлороводорода. Водную фазу лиофилизировали и затем очищали с помощью хроматографии на обращеннофазовой колонке (ацетонитрил / вода = 2:3) с получением 300 мг (9%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M17): Rt = 0.83 мин; m/z = 363 (M+1)+.
Этил 8-(2,3-дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоксилат (T3-e-2)

Соединение синтезировали тем же способом, как описано в пример T3-e-1 с получением 300 мг (11%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M5): Rt = 0.98 мин; m/z = 363 (M+1)+.
8-(3,5-Дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоновая кислота (T3-f-1)

Этил 8-(3,5-дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоксилат, 270 мг (0.7 ммоль), растворяли в 8.0 мл тетрагидрофурана и 2.0 мл воды. Гидроксид лития, 312 мг (7.4 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата. Значение рН водной фазы доводили до 7 с помощью 2Н раствора хлорводорода. Осажденное твердое вещество отфильтровывали, промывали водой и высушивали под вакуумом с получением 180 мг (73%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M25): Rt = 0.89 мин; m/z = 335 (M+1)+.
8-(2,3-Дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоновая кислота (T3-f-2)

Соединение синтезировали тем же способом, как описано в пример 1 (стадия 4) с получением 200 мг (69%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M4): Rt = 0.81 мин; m/z = 335 (M+1)+.
4-Хлор-8-(3,5-дихлорфенил)-1,5-нафтиридин-3-карбонил хлорид (T3-g-1)
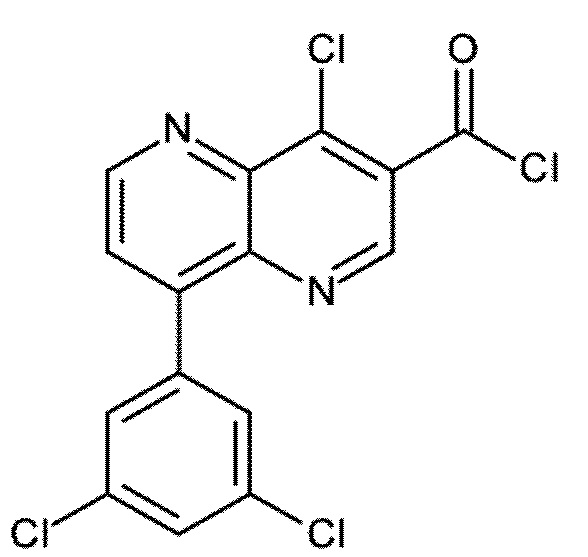
8-(3,5-Дихлорфенил)-4-оксо-1,4-дигидро-1,5-нафтиридин-3-карбоновую кислоту, 160 мг (0.5 ммоль), растворяли в 5 мл толуола. N,N-Диизопропилэтиламин, 185 мг (1.4 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C в течение 1 часа. Оксихлорид фосфора, 366 мг (2.4 ммоль), добавляли при 60°C. Полученную смесь перемешивали при 60°C в течение 30 мин. Растворитель удаляли под вакуумом с получением 160 мг (неочищенного) продукта в виде масла коричневого цвета. Остаток непосредственно применяли на следующей стадии без очистки.
4-Хлор-8-(2,3-дихлорфенил)-1,5-нафтиридин-3-карбонил хлорид (T3-g-2)

Соединение синтезировали тем же способом, как описано в пример T3-g-1 с получением 200 мг (неочищенного) продукта в виде масла коричневого цвета. Остаток непосредственно применяли на следующей стадии без дальнейшей очистки.
4-Хлор-8-(3,5-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,5-нафтиридин-3-карбоксамид (T3-h-1)

4-Хлор-8-(3,5-дихлорфенил)-1,5-нафтиридин-3-карбонил хлорид, 160 мг (0.4 ммоль) и (S)-хроман-4-амин, 77 мг (0.5 ммоль), растворяли в 5 мл дихлорметана. Триэтиламин, 218 мг (2.2 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли под вакуумом с получением 160 мг (неочищенного) продукта в виде масла коричневого цвета.
LC-MS (Способ M17): Rt = 1.29 мин; m/z = 484 (M+1)+.
4-Хлор-8-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,5-нафтиридин-3-карбоксамид (T3-h-2)
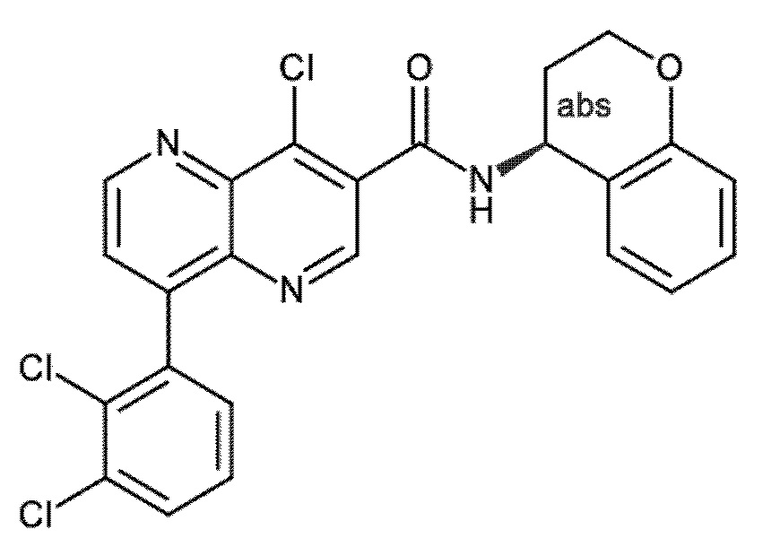
Соединение синтезировали тем же способом, как описано в пример T3-h-1 с получением 200 мг (неочищенного) продукта в виде масла коричневого цвета.
LC-MS (Способ M27): Rt = 1.29 мин; m/z = 484 (M+1)+.
Примеры (T3)
Пример T3-1
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,5-нафтиридин-3-карбоксамид

4-Хлор-8-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-1,5-нафтиридин-3-карбоксамид (T3-h-2) 80 мг (неочищенный), растворяли в 10 мл тетрагидрофурана при комнатной температуре. Диметиламин, 1.7 мл (1 M в тетрагидрофуране, 1.7 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли под вакуумом. Воду добавляли, полученную смесь экстрагировали с помощью этилацетата и объединенные органические фазы высушивали над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством препаративной ВЭЖХ с получением 12 мг (14.5 %) продукта в виде твердого вещества светло-желтого цвета.
LC-MS (Способ M26): Rt = 1.99 мин; m/z = 493 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.02-2.08 (m, 1H), 2.15-2.20 (m, 1H), 3.31 (s, 6H), 4.23-4.26 (m, 2H), 5.23 (q, 1H), 6.79 (d, 1H), 6.92 (t, 1H), 7.16 (t, 1H), 7.33 (d, 1H), 7.73-7.77 (m, 4H), 8.57 (s, 1H), 8.89 (d, 1H), 9.09 (d, 1H).
Пример T3-2
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,5-нафтиридин-3-карбоксамид

Соединение синтезировали тем же способом, как описано в примере T3-1 с получением 8.4 мг (9%) продукта в виде твердого вещества светло-желтого цвета.
LC-MS (Способ M24): Rt = 1.46 мин; m/z = 535 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.05-2.21 (m, 2H),3.63-3.65 (m, 4H), 3.82-3.84 (m, 4H), 4.23-4.29 (m, 2H), 5.25 (q, 1H), 6.79 (d, 1H), 6.92 (t, 1H), 7.17 (t, 1H), 7.37 (d, 1H), 7.45-7.48 (m, 3H), 7.81 (d, 1H), 8.68 (s, 1H), 8.94 (d, 1H), 9.17 (d, 1H).
Пример T3-3
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)-1,5-нафтиридин-3-карбоксамид
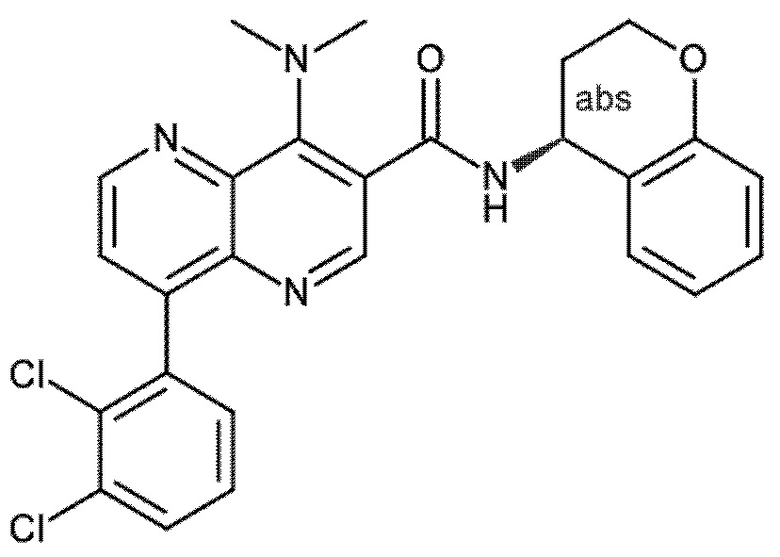
Соединение синтезировали тем же способом, как описано в пример T3-1 с получением 20.0 мг (20%) продукта в виде твердого вещества светло-желтого цвета.
LC-MS (Способ M28): Rt = 1.23 мин; m/z = 493 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 1.99-2.05 (m, 1H), 2.15-2.22 (m, 1H), 3.31 (s, 6H), 4.23-4.27 (m, 2H), 5.23 (q, 1H), 6.79 (d, 1H), 6.90 (t, 1H), 7.16 (t, 1H), 7.31-7.37 (m, 2H), 7.47 (t, 1H), 7.64 (d, 1H), 7.74 (d, 1H), 8.46 (s, 1H), 8.92 (d, 1H), 9.05 (d, 1H).
Пример T3-4
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(морфолин-4-ил)-1,5-нафтиридин-3-карбоксамид
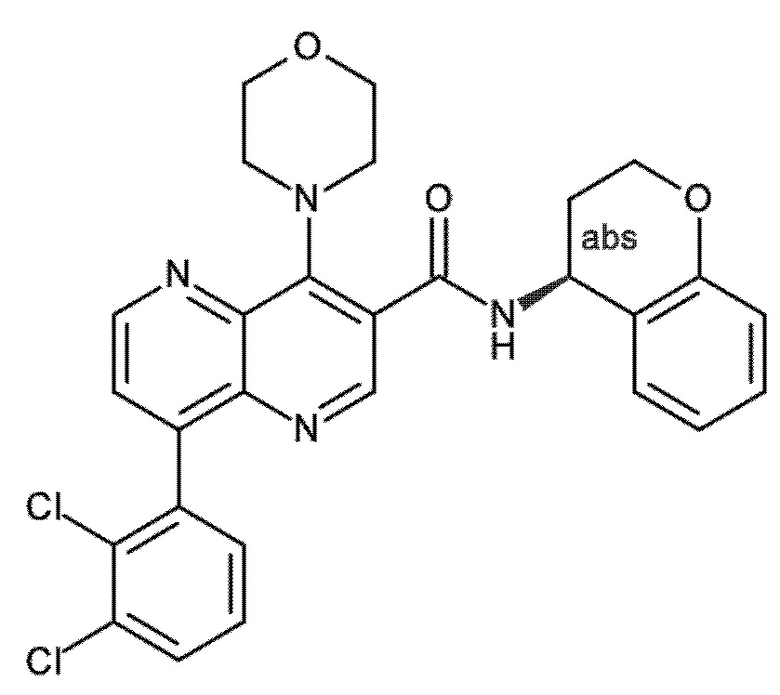
Соединение синтезировали тем же способом, как описано в примере T3-1 с получением 17.8 мг (16%) продукта в виде твердого вещества светло-желтого цвета.
LC-MS (Способ M28): Rt = 1.52 мин; m/z = 535 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.06-2.07 (m, 1H), 2.17-2.22 (m, 1H), 3.64-3.66 (m, 4H), 3.82-3.83 (m, 4H), 4.23-4.28 (m, 2H), 5.24 (q, 1H), 6.79 (d, 1H), 6.91 (t, 1H), 7.16 (t, 1H), 7.33-7.38 (m, 2H), 7.49 (t, 1H), 7.68 (d, 1H), 7.76 (d, 1H), 8.57 (s, 1H), 8.97 (d, 1H), 9.15 (d, 1H).
Промежуточные соединения (T4)
4-Хлор-6-(3,5-дихлорфенил)пиримидин-5-амин (T4-b-1)

К перемешанному раствору 4,6-дихлорпиримидин-5-амина (12.5 г, 76.2 ммоль) и (3,5-дихлорфенил)бороновой кислоты (11.28 г, 59 ммоль) в диоксане (275 мл) добавляли 2 M водный раствор карбоната калия (120 мл, 250 ммоль) и (2.75 г, 2.38 ммоль) тетракис(трифенил-фосфин)палладия (0). Смесь продували аргоном и нагревали до 90°С в течение 14 часов. После охлаждения до температуры окружающей среды и выпаривания растворителей оставшееся вещество растворяли в дихлорметане (500 мл), промывали солевым раствором (250 мл), высушили над сульфатом натрия и снова выпаривали в вакууме. Оставшееся твердое вещество растирали в дихлорметане, отфильтровывали и промывали петролейным простым эфиром и сушили на воздухе с получением 4,26 г соединения, указанного в названии в виде твердого вещества. Дополнительные количества могут быть получены из маточного раствора после выпаривания растворителей и флэш-хроматографии с получением еще 1,46 г соединения, указанного в названии.
1H ЯМР (400 МГц, CD3CN) ЯМР Перечень пиков:
δ=8.6084(0.4);8.3369(10.5);7.7350(0.8);7.7303(0.9);7.6528(13.7);7.6481(16.0);7.5954(4.8); 7.5907(7.6);7.5861(4.0);5.4476(1.2);4.8312(2.8);3.6002(0.6);2.1641(110.8);2.1139(0.4);2.1077 (0.4);1.9644(1.8);1.9581(3.5);1.9526(22.8);1.9464(42.4);1.9403(58.5);1.9341(40.9);1.9280 (21.2);1.7687(0.3);0.1460(0.7);0.0078(7.0);-0.0003(143.1);-0.1497(0.7)
Метил 5-амино-6-(3,5-дихлорфенил)пиримидин-4-карбоксилат (T4-c-1)

В автоклав загружали 4-хлор-6-(3,5-дихлорфенил)пиримидин-5-амин (5,72 г, 20.8 ммоль), метанол (280 мл) и триэтиламин (4.46 г, 44 ммоль). Его продували аргоном с последующим добавлением [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (1.53 г, 2.09 ммоль). Атмосферу в автоклаве дважды продували монооксидом углерода при 10 бар и перемешивали при давлении монооксида углерода 5 бар при 50°С в течение 18 часов. Автоклаву позволили охладиться до температуры окружающей среды, давление сбросили и реакционную смесь выпаривали в вакууме. Оставшийся материал очищали флэш-хроматографией (картридж с силикагелем 12 г, градиент этилацетата в циклогексане - 5-95% об./об.). Было получено 3,93 г соединения, указанного в названии.
1H ЯМР (400 МГц, CD3CN) ЯМР Перечень пиков:
δ=8.5682(4.4);7.6344(3.7);7.6298(7.1);7.6207(2.7);7.6167(2.2);7.6114(0.9);6.1151(0.9);3.9277(16.0);2.4658(0.4);2.1813(92.7);1.9718(0.4);1.9647(1.1);1.9585(2.2);1.9528(15.0);1.9467(27.8);1.9405(38.4);1.9343(26.2);1.9281(13.4);0.1461(0.5);0.0079(5.1);-0.0002(102.0);-0.0086(4.1);-0.1496(0.5)
Метил 4-(3,5-дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-d]пиримидин-7-карбоксилат (T4-e-1)

Смесь метил 5-амино-6-(3,5-дихлорфенил)пиримидин-4-карбоксилата (1 г, 3.29 ммоль) и п-толуолсульфоновой кислоты гидрата (81.3 мг, 0.42 ммоль) в ксилоле (80 мл) получали, и 40 мл ксилола отгоняли в атмосфере аргона. Метил (2E)-3-метоксиакрилат (572 мг, 4.9 ммоль) добавляли и еще 20 мл растворителя отгоняли. Оставшуюся смесь нагревали с возвратом флегмы в течение 2 часов. Ксилол (40 мл) и метил (2E) -3-метоксиакрилат (572 мг, 4,9 ммоль) добавляли и 40 мл растворителей отгоняли в течение 1 часа. Добавление ксилола и метил (2E) -3-метоксиакрилата с последующей отгонкой растворителя повторяли еще раз. Затем реакционную смесь выдерживали при температуре окружающей среды всю ночь и обрабатывали 1М трет-бутилатом калия (5 мл, 5 ммоль в тетрагидрофуране) и перемешивали при 80°С в течение 3 часов. Реакционную смесь охлаждали до температуры окружающей среды и нейтрализовали ледяной уксусной кислотой и выпаривали в вакууме. Оставшееся твердое вещество растирали в ледяной уксусной кислоте и отфильтровывали. Твердое вещество промывали уксусной кислотой, затем водой и высушили в десикаторе над серной кислотой с получением 528 мг соединения, указанного в названии.
1H ЯМР (400 МГц, DMSO-d6) ЯМР Перечень пиков:
δ=12.1844(0.4);12.1612(0.4);12.1560(0.4);12.1378(0.4);12.1283(0.4);12.1003(0.4);12.0909(0.5);12.0611(0.4);12.0376(0.4);12.0210(0.3);9.2667(4.6);8.5652(4.0);8.4972(0.4);8.0140(8.5);7.8870(5.1);4.0136(0.4);3.9796(0.4);3.7912(16.0);3.7025(0.7);3.6821(0.6);3.6748(0.5);3.6349(0.5);3.6071(0.6);3.5829(0.5);3.5598(0.6);3.5418(0.6);3.5368(0.6);3.4934(0.8);3.3240(10.1);3.2140(1.3);3.1102(0.5);3.0507(0.4);3.0424(0.4);2.9703(0.4);2.9348(0.4);2.8559(0.6);2.8507(0.5);2.8363(0.6);2.8280(0.6);2.7080(1.4);2.6730(2.6);2.6688(2.7);2.5022(168.9);2.3323(2.3);2.2539(1.7);2.1681(0.4);2.1523(0.4);1.9857(0.4);0.1400(0.5);0.1290(0.5);0.1005(0.7);-0.0004(30.3)
4-(3,5-Дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-d]пиримидин-7-карбоновая кислота (T4-f-1)

(250 мг, 0.71 ммоль) Метил 4-(3,5-дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-d]пиримидин-7-карбоксилата и гидроксида натрия (102 мг, 2.55 ммоль) в воде (15 мл) дефлегмировали в течение 22 часов. Реакционную смесь охладили, и суспензию отфильтровали с отсасыванием. Остаток на фильтре промыли небольшим количеством воды. Объединенные фильтраты подкисляли уксусной кислотой, и продукт выпадал в осадок после добавления некоторого количества этилацетата. Твердые вещества отфильтровывали, промывали с помощью этилацетата и воды и высушили в десикаторе над серной кислотой с получением 125 мг соединения, указанного в названии.
1H ЯМР (400 МГц, DMSO-d6) ЯМР Перечень пиков:
δ=9.4552(0.8);9.4143(9.9);8.7817(0.5);8.7307(9.6);8.3910(0.5);8.3158(0.4);8.0823(0.4);7.9650(16.0);7.9448(12.1);7.8925(0.4);7.8871(0.3);4.7406(0.3);4.6683(0.4);4.6475(0.4);4.6429(0.3);4.6323(0.4);4.6242(0.4);4.6074(0.3);4.5946(0.4);4.5679(0.4);4.5355(0.4);4.5192(0.4);4.5058(0.4);4.5040(0.4);4.4750(0.4);4.4600(0.5);4.4393(0.4);4.4208(0.4);4.3917(0.6);4.3818(0.6);4.3478(0.6);4.3289(0.6);4.3186(0.6);4.3055(0.5);4.2824(0.6);4.2673(0.6);4.2346(0.7);4.2035(0.8);4.2006(0.7);4.1870(0.7);4.1702(0.7);4.1397(0.8);4.1162(0.8);4.1023(0.9);4.0929(0.9);4.0826(0.9);4.0736(0.9);4.0642(1.0);4.0495(1.0);4.0426(1.0);3.9996(1.1);3.9954(1.1);3.9814(1.2);3.9695(1.2);3.9196(1.4);3.9107(1.5);3.8791(1.6);3.8665(1.7);3.8264(2.0);3.8158(2.0);3.8050(2.2);3.7605(2.6);3.5606(5.6);3.5545(5.7);3.5344(5.9);3.5057(5.9);3.4894(5.8);3.3851(4.3);3.3242(3.2);3.2824(2.7);3.2439(2.3);3.2274(2.1);3.2134(2.0);3.2077(1.9);3.1987(1.9);3.1939(1.8);3.1667(1.7);3.1225(1.4);3.1196(1.4);3.1115(1.5);3.0976(1.4);2.9984(1.2);2.9819(1.2);2.9617(1.1);2.9556 (1.1);2.9335(1.2);2.9178(1.1);2.9005(1.2);2.8700(1.2);2.8653(1.2);2.8599(1.2);2.8424(1.3);2.8019(1.3);2.7898(1.3);2.7362(1.7);2.6709(6.0);2.6432(3.4);2.5015(616.2);2.3276(4.2);2.2651 (0.5);2.2588(0.5);2.2501(0.4);2.2079(0.3);1.9082(2.2);1.3579(0.3);1.3411(0.3);1.3264(0.3);1.3037(0.4);1.2823(0.5);1.2747(0.6);1.2353(3.2);1.2025(0.7);1.1808(0.4);1.1737(0.4);1.1509(0.3);1.1232(0.4);1.1116(0.4);1.0978(0.4);1.0773(0.4);0.9278(0.3);0.8832(0.4);0.8491(0.6);0.8357 (0.6);0.8260(0.5);-0.0004(8.0)
8-Хлор-4-(3,5-дихлорфенил)пиридо[3,2-d]пиримидин-7-карбонил хлорид (T4-g-1)
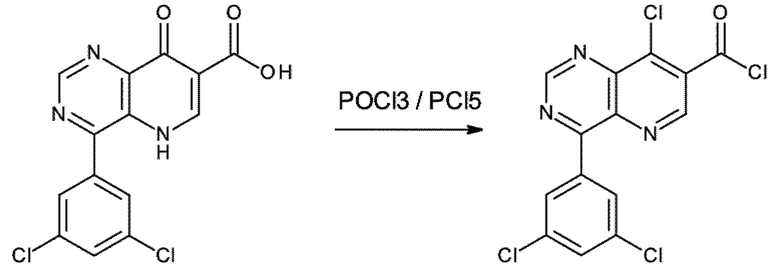
Перемешанную смесь 4-(3,5-дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-d]пиримидин-7-карбоновой кислоты (105 мг, 0.312 ммоль) и оксихлорида фосфора (291 мкл, 3.12 ммоль) нагревали с возвратом флегмы течение 1 часа, и пентахлорид фосфора (260 мг, 1.25 ммоль) затем добавили. Смесь нагревали с возвратом флегмы еще 2,5 часа, затем выпарили в вакууме. Толуол (1 мл) добавляли, и смесь выпарили в вакууме снова с получением 116 мг соединения, указанного в названии. Вещество применяли на следующей стадии в таком виде.
8-Хлор-4-(3,5-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]пиридо[3,2-d]пиримидин-7-карбоксамид (T4-h-1)

Раствор 8-хлор-4-(3,5-дихлорфенил)пиридо[3,2-d]пиримидин-7-карбонил хлорида (116 мг, 0.31 ммоль) в хлороформе (10 мл) охлаждали до -5°C. Последовательно, раствор (S)-хроман-4-амин гидрохлорида (58 мг, 0.31 ммоль) и триэтиламина (87 мкл, 0.62 ммоль) в хлороформе (2 мл) добавляли по каплям. Смесь перемешивали в течение еще 60 минут при -5°C, затем разбавили дополнительным объемом хлороформа. Органический слой промыли 5% водным фосфатом мононатрия, затем промыли солевым раствором. Органический слой отделили, высушили над сульфатом натрия и выпарили в вакууме с получением 120 мг соединения, указанного в названии. Вещество применяли на следующей стадии в таком виде.
Примеры (T4)
Пример T4-1
4-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(диметиламино)-пиридо[3,2-d]пиримидин-7-карбоксамид
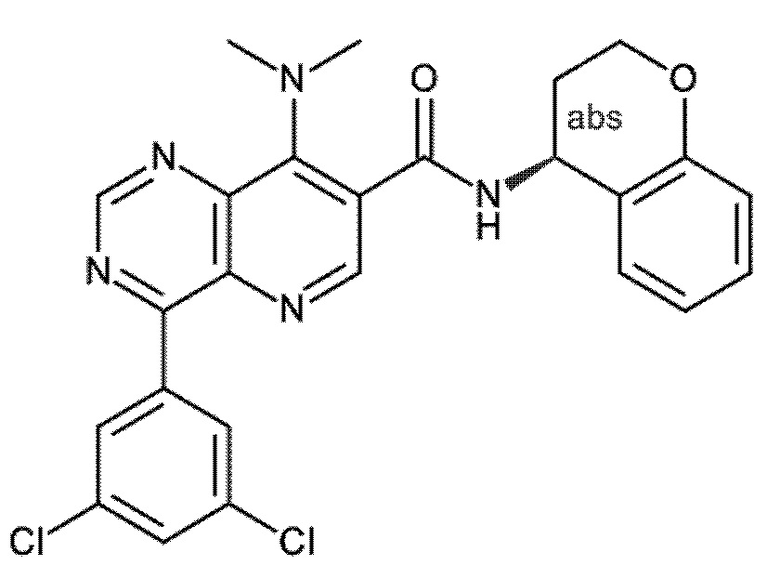
К перемешанному раствору 8-хлор-4-(3,5-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]пиридо[3,2-d]пиримидин-7-карбоксамида (71 мг, 0.14 ммоль) в тетрагидрофуране (20 мл) добавляли триметиламин (61 мкл, 0.437 ммоль) при 0°C и по каплям 2M раствор диметиламина в тетрагидрофуране (219 мкл, 0.437 ммоль). Реакционной смеси позволили охладиться до температуры окружающей среды в течение 1,5 часов и разбавили дихлорметаном. Смесь промывали 5%-ым водным фосфатом мононатрия, с последующим промыванием солевым раствором. Отделенный органический слой сушили над сульфатом натрия, и растворители удаляли в вакууме. Оставшийся остаток очищали флэш-хроматографией (картридж с силикагелем 15 г, градиент этилацетата в циклогексане - 10% - 30% об./об.), и 60.9 мг соединения, указанного в названии, получали.
LC-MS (Способ L1): Rt = 1.58 мин; m/z = 494 (M+1)+.
1H ЯМР (400 МГц, CD3CN) ЯМР Перечень пиков:
δ=9.2386(2.6);8.6644(2.4);8.2811(2.6);8.2763(2.6);7.6454(0.9);7.6405(1.6);7.6356(0.9);7.3788(0.6);7.3622(0.6);7.2063(0.3);7.1852(0.6);7.1679(0.4);6.9507(0.5);6.9323(0.8);6.9162(0.4); 6.8303(0.8);6.8088(0.7);5.4466(0.7);5.3040(0.4);5.2867(0.4);4.3127(0.4);4.3039(0.4);4.2962 (0.4);4.2875(0.3);4.2545(0.4);4.2473(0.5);4.2315(0.4);4.2244(0.6);3.7967(0.6);3.3678(16.0);2.4629(0.4);2.2848(0.4);2.2747(0.4);2.2624(0.5);2.2480(0.4);2.1473(61.9);2.1131(1.2);2.1069(1.2);2.1007(0.9);2.0950(0.5);1.9637(3.8);1.9576(6.6);1.9518(52.1);1.9456(97.7);1.9395(135.7);1.9333(92.8);1.9271(47.4);1.7740(0.5);1.7679(0.7);1.7617(0.5);1.2702(2.0);0.1460(1.7);0.0902(1.5);0.0847(1.2);0.0780(1.0);0.0521(0.9);0.0079(16.0);-0.0002(388.0);-0.0086(15.9);-0.1495(1.7)
Пример T4-2
4-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(морфолин-4-ил)пиридо[3,2-d]пиримидин-7-карбоксамид
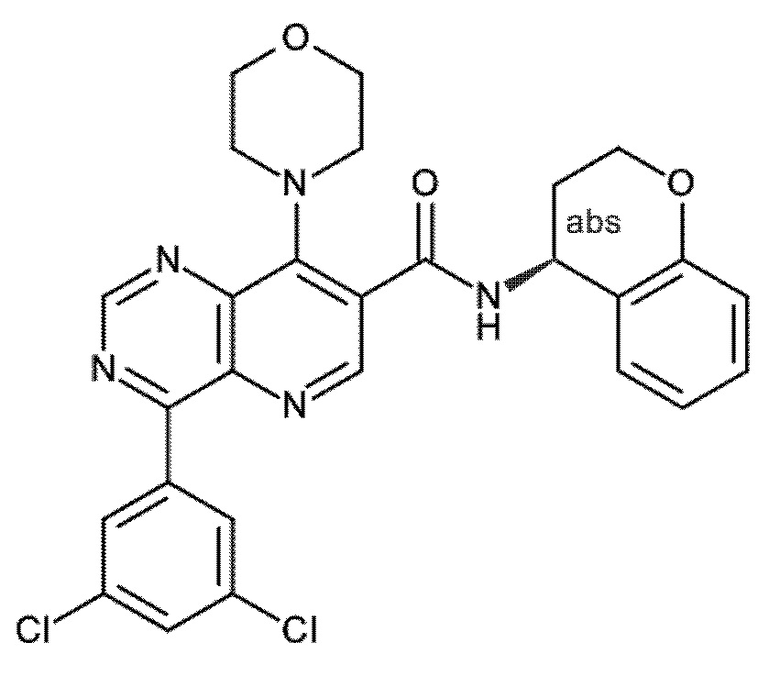
Соединение, указанное в названии, получали аналогичным образом, как описано для T4-1.
LC-MS (Способ L2): Rt = 1.64 мин; m/z = 536 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) ЯМР Перечень пиков:
δ=16.8598(0.4);9.3671(14.9);9.2292(4.0);9.2090(3.8);8.7746(14.1);8.3142(1.3);8.2962(15.9);8.2916(16.0);7.8651(4.7);7.8603(8.3);7.3908(3.6);7.3726(4.1);7.2010(2.0);7.1818(3.9);7.1633(2.4);6.9600(2.7);6.9408(4.7);6.9223(2.3);6.8172(5.0);6.7967(4.9);5.2719(1.0);5.2591(2.5);5.2410(2.4);5.2271(1.0);4.3086(1.1);4.2950(2.2);4.2792(2.8);4.2719(3.3);4.2429(2.5);4.2214(1.1);3.9161(0.5);3.8573(7.8);3.8499(11.8);3.8379(9.5);3.8081(0.5);3.7043(0.5);3.6730(9.4);3.6628(11.1);3.3795(0.5);3.3473(1.7);3.3188(397.9);2.6705(4.1);2.6143(0.5);2.5939(0.5);2.5055(532.4);2.5015(671.9);2.4976(498.7);2.3281(4.0);2.3052(0.5);2.2558(1.0);2.2437(1.3);2.2331(1.5);2.2225(1.6);2.2096(1.7);2.1960(1.4);2.1173(1.0);2.1093(1.3);2.1012(1.7);2.0945(1.9);2.0809(1.6);2.0661(1.3);2.0591(1.4);1.9882(0.8);1.3981(2.0);1.2348(6.6);1.1749(0.5);1.1067(0.5);0.8539(0.8);0.8302(0.5);0.1461(1.6);0.0377(0.5);-0.0002(324.9);-0.1497(1.6);-0.7272(0.5)
Промежуточные соединения (T5)
2-Амино-N'-(2-бромфенил)-2-оксоацетогидразоноил цианид (T5-b-1)

К перемешанному раствору 2-броманилина (10.0 г, 58 ммоль) в уксусной кислоте (30 мл) добавляли воду (18 мл) и соляную кислоту (18.2 г, 174 ммоль, 15 мл) при комнатной температуре. Полученную смесь охлаждали до -10°C. Раствор нитрита натрия (4.4 г, 64 ммоль) в воде (18 мл) добавляли по каплям при такой скорости, что внутренняя температура не превышала 0°C. Полученный раствор оранжевого цвета перемешивали при температурах от -5°C до -10°C в течение 30 мин. При -10°C этот раствор добавляли в течение 10 мин к перемешанному раствору 2-цианоацетамида (6.1 г, 73 ммоль) и ацетата натрия (7.6 г, 93 ммоль) в смеси этанола (135 мл) и воды (360 мл). Полученную суспензию желтого цвета перемешивали в течение 18 часов при 0°C при нагревании до комнатной кислоты. Реакционную смесь охлаждали до 0°C. Твердое вещество отфильтровали, промывали ледяной водой (1000 мл) и сушили в вакууме. 15.1 г (60 ммоль, 98% от теоретического выхода) соединения, указанного в названии, получали (цис/транс смесь).
LC-MS (Способ L3): Rt = 1.84 мин; m/z = 267/269 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 10.02 (s, 1H), 8.02 - 7.91 (m, 2H), 7.73 - 7.57 (m, 2H), 7.48 - 7.35 (m, 1H), 7.09 (td, J = 8.0, 1.5 Гц, 1H).
4-Амино-8-бромциннолин-3-карбоксамид гидрохлорид (T5-c-1)

Суспензию 2-амино-N'-(2-бромфенил)-2-оксоацетогидразоноил цианида (5.00 г, 18.72 ммоль) в хлорбензоле (37 мл) добавляли при перемешивании к хлориду алюминия (11.23 г, 84.00 ммоль). Полученную суспензию перемешивали в атмосфере азота при 130°C в течение 1 ч и позволили охладиться до комнатной кислоты всю ночь. Соляную кислоту (2 M; 50 мл) осторожно добавляли при перемешивании. Полученную смесь перемешивали при 100°C в течение 1 ч и затем охлаждали до комнатной кислоты. Образованный осадок собирали посредством фильтрации, промывали водой (50 мл) и сушили в вакууме. Тритурация с этилацетатом обеспечила 4.97 г (16.37 ммоль, 87% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L3): Rt = 1.10 мин, m/z = 267/269 (M+H)+ [свободный амин].
8-Бром-4-гидроксициннолин-3-карбоновая кислота (T5-d-1)

Смесь 4-амино-8-бромциннолин-3-карбоксамид гидрохлорида (1.00 г, 3.29 ммоль) и водного гидроксида калия (15 г, 66 ммоль; 25%) в 1,4-диоксане (10 мл) перемешивали при 100°C всю ночь. Реакционную смесь охлаждали до комнатной температуры и медленно переливали в соляную кислоту (1 M, 350 мл). Полученную суспензию перемешивали в течение 15 минут. Осадок собирали посредством фильтрации и сушили на воздухе с получением 0.71 г (2.64 ммоль, 80% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L3): Rt = 1.60 мин; m/z = 269/271 (M+H)+.
1H ЯМР (400 МГц, DMSO-d6) δ 14.16 (s, 2H), 8.33 - 8.18 (m, 2H), 7.55 (t, J = 7.9 Гц, 1H).
8-Бром-4-хлорциннолин-3-карбонил хлорид (T5-e-1)
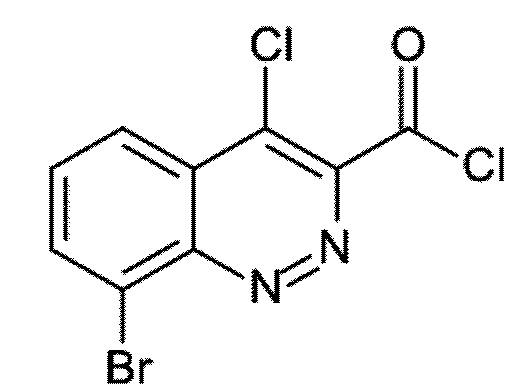
В атмосфере азота суспензию 8-бром-4-гидроксициннолин-3-карбоновой кислоты (0.61 г, 2.27 ммоль) в оксихлориде фосфора (3.48 г, 22.67 ммоль, 2.11 мл) перемешивали при 110°C в течение 2 часов. Полученному раствору зеленого цвета позволили охладиться до комнатной кислоты и концентрировали под вакуумом. Неочищенный продукт обрабатывали в атмосфере азота. Вещество совместо выпаривали с сухим дихлорметананом с получением неочищенного соединения, указанного в названии. Вещество хранили в атмосфере азота и применяли на следующей стадии в таком виде.
(8-Бром-4-хлор-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]циннолин-3-карбоксамид (T5-f-1)
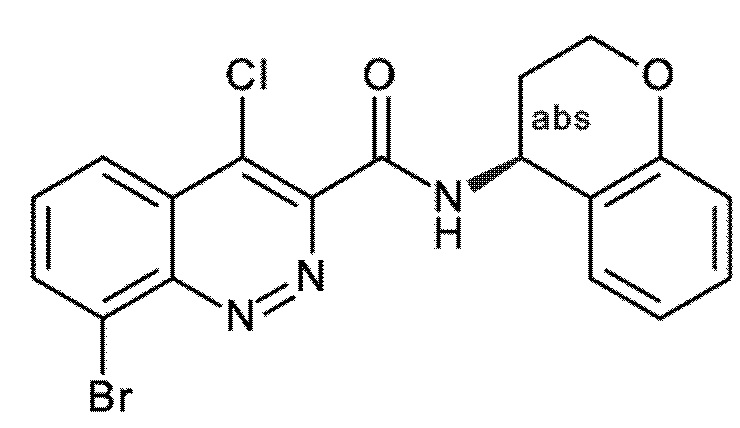
В атмосфере азота к перемешанному раствору неочищенного 8-бром-4-хлорциннолин-3-карбонил хлорида (2.27 ммоль) в дихлорметане (25 мл) добавляли триэтиламин (688 мг, 6.80 ммоль, 0.95 мл) и (S)-хроман-4-амин гидрохлорид (463 мг, 2.49 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали соляной кислотой (1 M, 20 мл). Водный слой экстрагировали с помощью дихлорметана (2×20 мл). Объединенные органические слои сушили с помощью сульфата натрия и концентрировали под вакуумом. 922 мг (2.20 ммоль, 97% от теоретического выхода) соединения, указанного в названии, получали.
LC-MS (Способ L3): Rt = 2.07 мин; m/z = 418/420 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.48 (d, J = 8.3 Гц, 1H), 8.49 (dd, J = 7.5, 1.1 Гц, 1H), 8.36 (dd, J = 8.5, 1.1 Гц, 1H), 7.99 (dd, J = 8.5, 7.5 Гц, 1H), 7.43 - 7.34 (m, 1H), 7.24 - 7.14 (m, 1H), 6.95 (td, J = 7.5, 1.2 Гц, 1H), 6.81 (dd, J = 8.2, 1.1 Гц, 1H), 5.38 (q, J = 6.0 Гц, 1H), 4.40 - 4.19 (m, 2H), 2.32 - 2.19 (m, 1H), 2.19 - 2.05 (m, 1H).
8-Бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамид (T5-g-1)

К перемешанному раствору (8-бром-4-хлор-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]циннолин-3-карбоксамида (400 мг, 0.96 ммоль) в тетрагидрофуране (5 мл) в атмосфере азота добавляли триэтиламин (193 мг, 1.91 ммоль, 0.27 мл) и раствор диметиламина в тетрагидрофуране (2 M; 1.05 ммоль, 0.53 мл). Полученную смесь перемешивали при комнатной температуре в закрытом сосуде в течение 72 ч. Летучие соединения удаляли под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 340 мг (0.80 ммоль, 83% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L3): Rt = 1.70 мин; m/z = 427/429 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.23 (d, J = 8.3 Гц, 1H), 8.27 - 8.18 (m, 2H), 7.62 (dd, J = 8.5, 7.5 Гц, 1H), 7.38 (d, J = 6.8 Гц, 1H), 7.23 - 7.15 (m, 1H), 6.94 (td, J = 7.5, 1.2 Гц, 1H), 6.81 (dd, J = 8.2, 1.1 Гц, 1H), 5.33 (q, J = 5.9 Гц, 1H), 4.36 - 4.21 (m, 2H), 3.17 (s, 6H), 2.28 - 2.17 (m, 1H), 2.14 - 2.02 (m, 1H).
8-Бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамид (T5-g-2)

К перемешанному раствору (8-бром-4-хлор-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]циннолин-3-карбоксамида (400 мг, 0.96 ммоль) в смеси метанола (5 мл) и тетрагидрофурана (1 мл) в атмосфере азота добавляли трет-бутоксид натрия (96 мг, 1.00 ммоль). Полученную смесь перемешивали при комнатной температуре в закрытом сосуде всю ночь. При перемешивании реакционную смесь добавляли к соляной кислоте (1 M, 20 мл). Полученную суспензию перемешивали в течение 10 минут. Осадок собирали посредством фильтрации, промывали водой (20 мл) и сушили на воздухе. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 260 мг (0.63 ммоль, 66% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L3): Rt = 2.03 мин; m/z = 414/416 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.48 (d, J = 8.3 Гц, 1H), 8.39 - 8.25 (m, 2H), 7.78 (dd, J = 8.5, 7.4 Гц, 1H), 7.41 - 7.34 (m, 1H), 7.25 - 7.15 (m, 1H), 7.00 - 6.90 (m, 1H), 6.82 (dd, J = 8.2, 1.1 Гц, 1H), 5.44 - 5.33 (m, 1H), 4.35 - 4.26 (m, 2H), 4.24 (s, 3H), 2.30 - 2.18 (m, 1H), 2.18 - 2.06 (m, 1H).
Примеры (T5)
Пример T5-1
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамида (65 мг, 0.15 ммоль), (3,5-дихлорфенил)бороновой кислоты (32 мг, 0.17 ммоль) и карбоната натрия (32 мг, 0.30 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (7 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота в закрытом сосуде. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 68 мг (0.14 ммоль, 91% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 3.51 мин; m/z = 493/495 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.23 (d, J = 8.4 Гц, 1H), 8.29 (dd, J = 8.6, 1.2 Гц, 1H), 7.93 (dd, J = 7.1, 1.2 Гц, 1H), 7.83 (dd, J = 8.6, 7.1 Гц, 1H), 7.76 - 7.67 (m, 3H), 7.36 (d, J = 7.6 Гц, 1H), 7.22 - 7.11 (m, 1H), 6.97 - 6.89 (m, 1H), 6.80 (dd, J = 8.2, 1.0 Гц, 1H), 5.33 (q, J = 6.0 Гц, 1H), 4.29 (q, J = 6.6, 6.1 Гц, 2H), 3.17 (s, 6H), 2.27 - 2.15 (m, 1H), 2.15 - 2.02 (m, 1H).
Пример T5-2
8-(3-Хлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамида (65 мг, 0.15 ммоль), (3-хлорфенил)бороновой кислоты (26 мг, 0.17 ммоль) и карбоната натрия (32 мг, 0.30 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (7 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 51 мг (0.11 ммоль, 73% от теоретического выхода) соединения, указанного в названии.
LC-MS LC-MS (Способ L4): Rt = 3.10 мин; m/z = 459/461 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.21 (d, J = 8.4 Гц, 1H), 8.26 (dd, J = 8.3, 1.5 Гц, 1H), 7.92 - 7.79 (m, 2H), 7.73 (q, J = 1.4 Гц, 1H), 7.67 - 7.58 (m, 1H), 7.58 - 7.48 (m, 2H), 7.36 (d, J = 7.6 Гц, 1H), 7.22 - 7.12 (m, 1H), 6.97 - 6.88 (m, 1H), 6.80 (dd, J = 8.2, 1.1 Гц, 1H), 5.33 (q, J = 6.0 Гц, 1H), 4.29 (t, J = 5.5 Гц, 2H), 3.16 (s, 6H), 2.28 - 2.16 (m, 1H), 2.15 - 2.02 (m, 1H).
Пример T5-3
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамид
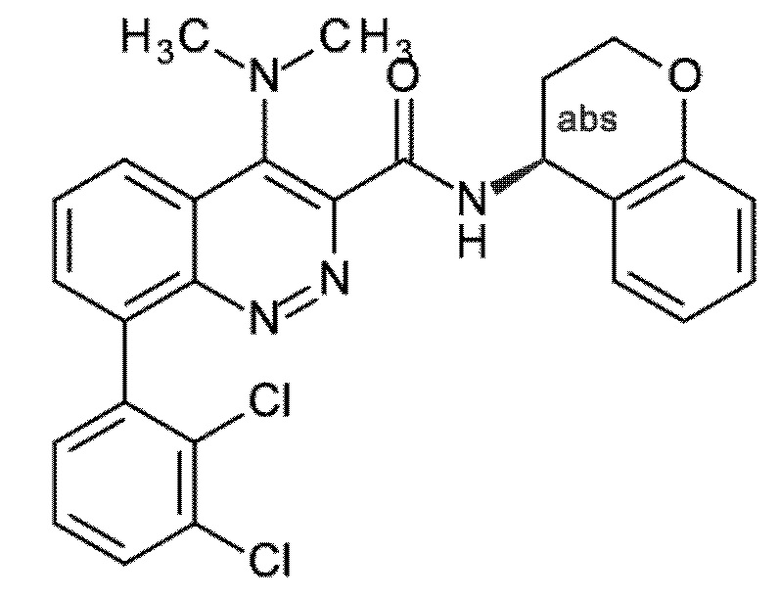
Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамида (65 мг, 0.15 ммоль), (2,3-дихлорфенил)бороновой кислоты (32 мг, 0.17 ммоль) и карбоната натрия (32 мг, 0.30 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (7 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 60 мг (0.12 ммоль, 80% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 3.17 мин; m/z = 493/495 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.19 (dd, J = 12.0, 8.4 Гц, 1H), 8.32 (dd, J = 8.6, 1.3 Гц, 1H), 7.84 (dd, J = 8.6, 7.0 Гц, 1H), 7.80 - 7.71 (m, 2H), 7.54 - 7.37 (m, 2H), 7.33 (t, J = 6.5 Гц, 1H), 7.21 - 7.11 (m, 1H), 6.90 (t, J = 7.5 Гц, 1H), 6.79 (d, J = 7.9 Гц, 1H), 5.31 (d, J = 6.1 Гц, 1H), 4.27 (t, J = 5.1 Гц, 2H), 3.18 (s, 6H), 2.26 - 2.13 (m, 1H), 2.12 - 1.99 (m, 1H).
Пример T5-4
8-(3,4-Дифторфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-(диметиламино)циннолин-3-карбоксамида (65 мг, 0.15 ммоль), (3,4-дифторфенил)бороновой кислоты (26 мг, 0.17 ммоль) и карбоната натрия (32 мг, 0.30 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (7 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 60 мг (0.12 ммоль, 80% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 3.03 мин; m/z = 461 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.21 (d, J = 8.4 Гц, 1H), 8.26 (dd, J = 8.4, 1.5 Гц, 1H), 7.92 - 7.72 (m, 3H), 7.63 - 7.48 (m, 2H), 7.36 (d, J = 7.6 Гц, 1H), 7.22 - 7.13 (m, 1H), 6.97 - 6.88 (m, 1H), 6.80 (dd, J = 8.2, 1.1 Гц, 1H), 5.33 (q, J = 6.0 Гц, 1H), 4.36 - 4.22 (m, 2H), 3.16 (s, 6H), 2.27 - 2.14 (m, 1H), 2.14 - 2.01 (m, 1H).
Пример T5-5
8-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамида, (3,5-дихлорфенил)бороновой кислоты (25 мг, 0.13 ммоль) и карбоната натрия (26 мг, 0.24 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (5 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота в закрытом сосуде. Реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью этилацетата (1 мл), фильтровали и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 39 мг (0.08 ммоль, 67% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 4.20 мин; m/z = 480/482 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.50 (d, J = 8.4 Гц, 1H), 8.38 (dd, J = 8.4, 1.3 Гц, 1H), 8.07 (dd, J = 7.2, 1.3 Гц, 1H), 7.98 (dd, J = 8.4, 7.2 Гц, 1H), 7.78 (d, J = 1.9 Гц, 2H), 7.74 (t, J = 1.9 Гц, 1H), 7.35 (d, J = 7.6 Гц, 1H), 7.23 - 7.13 (m, 1H), 6.99 - 6.88 (m, 1H), 6.81 (dd, J = 8.2, 1.1 Гц, 1H), 5.38 (q, J = 6.1 Гц, 1H), 4.29 (t, J = 5.3 Гц, 2H), 4.25 (s, 3H), 2.28 - 2.18 (m, 1H), 2.18 - 2.07 (m, 1H).
Пример T5-6
8-(3-Хлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамид
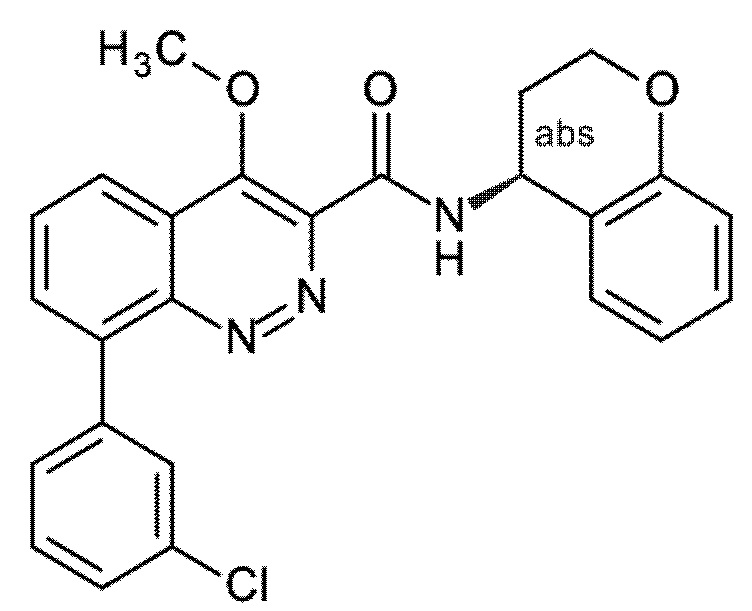
Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамида, (3-хлорфенил)бороновой кислоты (21 мг, 0.13 ммоль) и карбоната натрия (26 мг, 0.24 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (5 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота в закрытом сосуде. Реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью этилацетата (1 мл), фильтровали и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) обеспечило 32 мг (0.07 ммоль, 60% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 4.05 мин; m/z = 446/448 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.47 (d, J = 8.4 Гц, 1H), 8.35 (dd, J = 8.1, 1.7 Гц, 1H), 8.06 - 7.94 (m, 2H), 7.79 (q, J = 1.3 Гц, 1H), 7.71 - 7.62 (m, 1H), 7.57 - 7.53 (m, 2H), 7.35 (d, J = 7.6 Гц, 1H), 7.24 - 7.12 (m, 1H), 6.98 - 6.87 (m, 1H), 6.81 (dd, J = 8.2, 1.1 Гц, 1H), 5.38 (q, J = 6.1 Гц, 1H), 4.29 (t, J = 5.4 Гц, 2H), 4.25 (s, 3H), 2.29 - 2.18 (m, 1H), 2.18 - 2.06 (m, 1H).
Пример T5-7
8-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамида, (2,3-дихлорфенил)бороновой кислоты (25 мг, 0.13 ммоль) и карбоната натрия (26 мг, 0.24 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (5 мг, 0.01 ммоль) добавляли и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота в закрытом сосуде. Реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью этилацетата (1 мл), фильтровали и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) и препаративной ВЭЖХ обеспечило 32 мг (0.07 ммоль, 55% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 3.99 мин; m/z = 480/482 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.50 - 9.39 (m, 1H), 8.39 (dd, J = 8.4, 1.3 Гц, 1H), 7.99 (dd, J = 8.4, 7.1 Гц, 1H), 7.91 (d, J = 6.8 Гц, 1H), 7.78 (dd, J = 7.8, 1.8 Гц, 1H), 7.56 - 7.43 (m, 2H), 7.33 (dd, J = 7.1, 3.2 Гц, 1H), 7.22 - 7.11 (m, 1H), 6.96 - 6.87 (m, 1H), 6.80 (d, J = 8.1 Гц, 1H), 5.36 (q, J = 6.1 Гц, 1H), 4.25 (s, 5H), 2.28 - 2.15 (m, 1H), 2.15 - 2.03 (m, 1H).
Пример T5-8
8-(3,4-Дифторфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамид

Перемешанную смесь 8-бром-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-4-метоксициннолин-3-карбоксамида (50 мг, 0.12 ммоль), (3,4-дифторфенил)бороновой кислоты (21 мг, 0.13 ммоль) и карбоната натрия (26 мг, 0.24 ммоль) в 1,4-диоксане (1 мл) и воде (0.15 мл) барботировали азотом. [1,1'-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (5 мг, 0.01 ммоль) добавляли, и полученную смесь перемешивали при 60°C в течение 4 часов в атмосфере азота в закрытом сосуде. Реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью этилацетата (1 мл), фильтровали и концентрировали под вакуумом. Очищение посредством колоночной флэш-хроматографии (градиент гептан / 5%-100% этилацетат) и препаративной ВЭЖХ обеспечило 30 мг (0.07 ммоль, 55% от теоретического выхода) соединения, указанного в названии.
LC-MS (Способ L4): Rt = 3.87 мин; m/z = 448 (M+1)+.
1H ЯМР (400 МГц, DMSO-d6) δ 9.46 (d, J = 8.4 Гц, 1H), 8.35 (dd, J = 8.2, 1.6 Гц, 1H), 8.07 - 7.93 (m, 2H), 7.89 - 7.78 (m, 1H), 7.65 - 7.54 (m, 2H), 7.35 (d, J = 6.9 Гц, 1H), 7.23 - 7.14 (m, 1H), 6.98 - 6.88 (m, 1H), 6.81 (dd, J = 8.2, 1.1 Гц, 1H), 5.43 - 5.33 (m, 1H), 4.29 (t, J = 5.4 Гц, 2H), 4.25 (s, 3H), 2.29 - 2.18 (m, 1H), 2.18 - 2.06 (m, 1H).
Промежуточные соединения (T6)
5-(2,3-Дихлорфенил)пиридазин-4-амин (T6-b-1)

5-Бромпиридазин-4-амин, 2.00 г (11.5 ммоль), 2,3-дихлорфенилбороновую кислоту, 3.30 г (17.2 ммоль), трис(дибензилиденацетон)дипалладий, 265 мг (0.3 ммоль), три-трет-бутилфосфин тетафторборат, 167 мг (0.6 ммоль), и фторид калия, 2.00 г (34.7 ммоль), растворяли в 16 мл тетрагидрофурана и 4 мл воды. Смесь перемешивали при 60°C всю ночь. Растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата, и объединенную органическую фазу сушили над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством колоночной хроматографии на силикагеле (дихлорметан / метанол = 20:1) с получением 2.1 г (75%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M1): Rt = 0.91 мин; m/z = 240 (M+1)+.
Диэтил ({[5-(2,3-дихлорфенил)пиридазин-4-ил]амино}метилен)малонат (T6-d-2)

5-(2,3-Дихлорфенил)пиридазин-4-амин, 2.10 г (8.8 ммоль) и диэтил 2-(этоксиметилен)малонат, 5.70 г (26.2 ммоль), растворяли в 30 мл толуола. Полученную смесь перемешивали при 110°C всю ночь. Растворитель удаляли под вакуумом и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный простой эфир / этилацетат = 1:2) с получением 1.7 г (46 %) продукта в виде твердого вещества белого цвета.
LC-MS (Способ M2): Rt = 2.21 мин; m/z = 410 (M+1)+.
Этил 4-(2,3-дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-c]пиридазин-7-карбоксилат (T6-e-1)
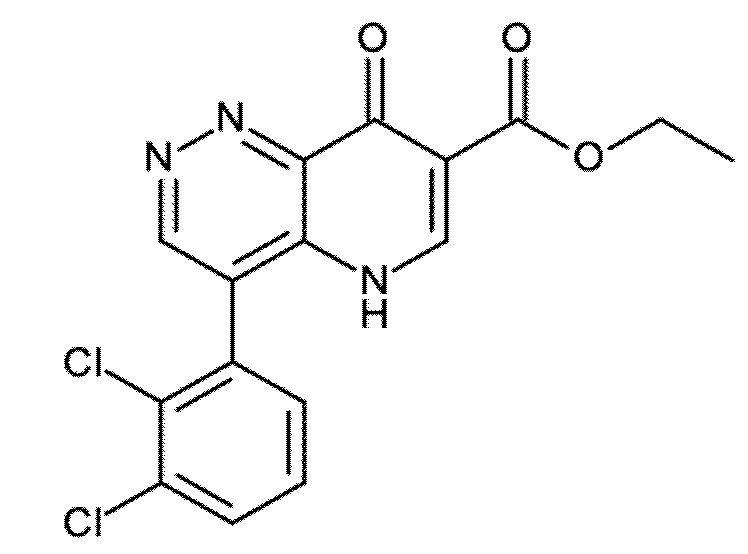
100 мл дифенилового простого эфира помещали в трехгорлую колбу, диэтил ({[5-(2,3-дихлорфенил)пиридазин-4-ил]амино}метилен)малонат, 1.70 г (4.1 ммоль), растворенный в 50 мл дифенилового простого эфира, добавляли при возврате флегмы. Полученную смесь перемешивали при возврате флегмы в течение 15 мин. После охлаждения до комнатной температуры, реакционную смесь промывали пять раз с помощью 4Н раствора хлороводорода. Водную фазу лиофилизировали и затем очищали с помощь обращеннофазовой колонки (ацетонитрил / вода = 2:3) с получением 280 мг (15%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M3): Rt = 0.87 мин; m/z = 364 (M+1)+.
4-(2,3-Дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-c]пиридазин-7-карбоновая кислота (T6-f-1)

Этил 4-(2,3-дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-c]пиридазин-7-карбоксилат, 280 мг (0.8 ммоль), растворяли в 5 мл тетрагидрофурана и 5 мл воды. Гидроксид лития, 55 мг (2.3 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C всю ночь. После охлаждения до комнатной температуры, растворитель удаляли под вакуумом. Воду добавляли, смесь экстрагировали с помощью этилацетата. Значение рН водной фазы доводили до 7 с помощью 2Н раствора хлорводорода. Осажденное твердое вещество отфильтровывали, промывали водой и высушивали под вакуумом с получением 150 мг (56%) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M4): Rt = 0.78 мин; m/z = 336 (M+1)+.
8-Хлор-4-(2,3-дихлорфенил)пиридо[3,2-c]пиридазин-7-карбонил хлорид (T6-g-1)
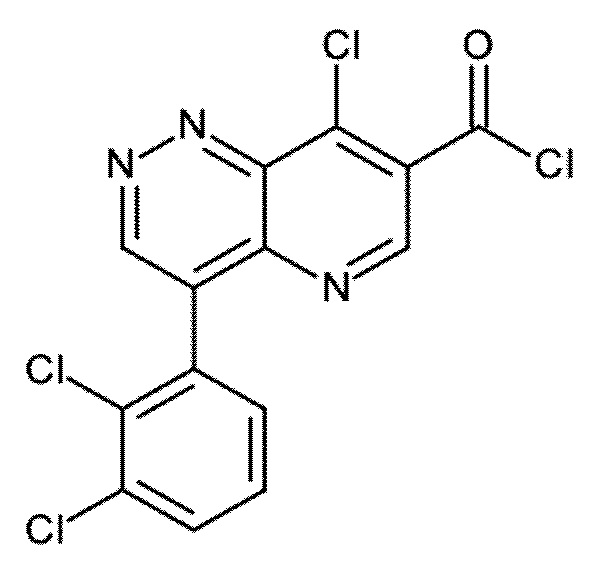
4-(2,3-Дихлорфенил)-8-оксо-5,8-дигидропиридо[3,2-c]пиридазин-7-арбоновую кислоту, 150 мг (0.5 ммоль), растворяли в 5 мл толуола. N,N-Диизопропилэтиламин, 173 мг (1.3 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при 60°C в течение 1 часа. Оксихлорид фосфора, 684 мг (4.5 ммоль), добавляли при 60°C. Полученную смесь перемешивали при 60°C в течение 30 мин. Растворитель удаляли под вакуумом с получением 150 мг (неочищенного) продукта в виде масла коричневого цвета. Остаток непосредственно применяли на следующей стадии без дальнейшей очистки.
8-Хлор-4-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]пиридо[3,2-c]пиридазин-7-карбоксамид (T6-h-1)

8-Хлор-4-(2,3-дихлорфенил)пиридо[3,2-c]пиридазин-7-карбонил хлорид, 150 мг (0.4 ммоль), и (S)-хроман-4-амин, 72 мг (0.5 ммоль), растворяли в 5 мл дихлорметана. Триэтиламин, 203 мг (2.0 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли под вакуумом с получением 150 мг (неочищенного) продукта в виде масла коричневого цвета.
LC-MS (Способ M5): Rt = 1.20 мин; m/z = 485 (M+1)+.
Примеры (T6)
Пример T6-1
4-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(диметиламино) пиридо[3,2-c]пиридазин-7-карбоксамид

8-Хлор-4-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]пиридо[3,2-c]пиридазин-7-карбоксамид (T6-h-1) 75 мг (неочищенный), растворяли в 10 мл тетрагидрофурана. Диметиламин, 1.6 мл (1 M в THF, 1.6 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли под вакуумом. Воду добавляли, полученную смесь экстрагировали с помощью этилацетата, и объединенную органическую фазу сушили над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством препаративной ВЭЖХ с получением 3.3 мг (4.2 %) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M6): Rt = 1.51 мин; m/z = 494 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.02-2.05 (m, 1H), 2.15-2.17 (m, 1H), 3.48 (s, 6H), 4.26-4.27 (m, 2H), 5.20-5.22 (m, 1H), 6.79 (d, 1H), 6.91 (t, 1H), 7.16 (t, 1H), 7.33 (d, 1H), 7.47-7.52 (m, 2H), 7.78 (d, 1H), 8.58 (s, 1H), 9.12 (d, 1H), 9.40 (s, 1H).
Пример T6-2
4-(2,3-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(морфолин-4-ил)пиридо[3,2-c]пиридазин-7-карбоксамид

8-Хлор-4-(2,3-дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]пиридо[3,2-c]пиридазин-7-карбоксамид (T6-h-1) 75 мг (неочищенный), растворяли в 10 мл тетрагидрофурана. Диметиламин, 1.6 мл (1 M в THF, 1.6 ммоль), добавляли при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли под вакуумом. Воду добавляли, полученную смесь экстрагировали с помощью этилацетата, и объединенную органическую фазу сушили над безводным сульфатом натрия. Растворитель удаляли под вакуумом, и остаток очищали посредством препаративной ВЭЖХ с получением 4.2 мг (4 %) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M7): Rt = 1.73 мин; m/z = 536 (M+1)+.
1H-ЯМР (300 МГц, DMSO-d6): δ [ppm] = 2.08-2.09 (m, 1H), 2.21-2.27 (m, 1H), 3.82-3.84 (m, 4H), 3.88-3.40 (m, 4H), 4.23-4.29 (m, 2H), 5.22-5.25 (m, 1H), 6.79 (d, 1H), 6.92 (t, 1H), 7.16 (t, 1H), 7.35 (d, 1H), 7.45-7.55 (m, 2H), 7.82 (d, 1H), 8.69 (s, 1H), 9.18 (d, 1H), 9.47 (s, 1H).
Пример T6-3
4-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(диметиламино) пиридо[3,2-c]пиридазин-7-карбоксамид
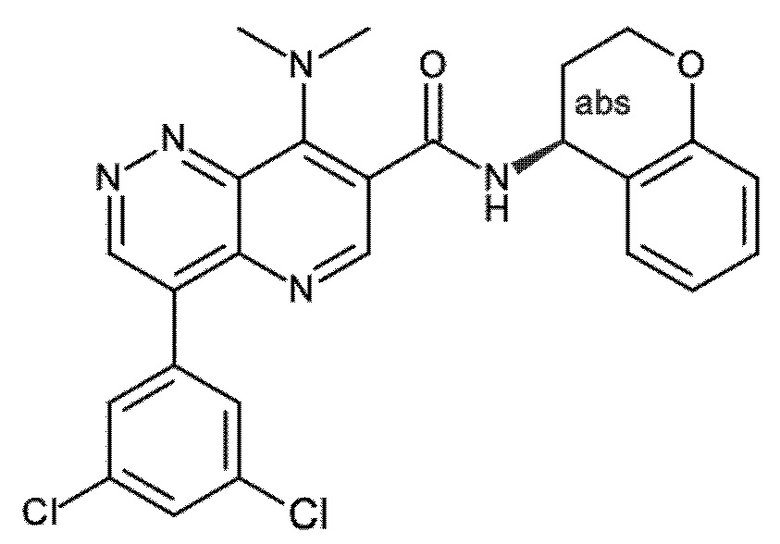
Соединение синтезировали тем же способом, как описано в примере T6-1 с получением 9.7 мг (9 %) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M7): Rt = 1.65 мин; m/z = 494 (M+1)+.
1H-ЯМР (300 МГц, CD3OD): δ [ppm] = 2.14-2.20 (m, 1H), 2.24-2.31 (m, 1H), 3.54 (s, 6H), 4.20-4.30 (m, 2H), 5.29 (q, 1H), 6.78 (d, 1H), 6.91 (t, 1H), 7.15 (t, 1H), 7.32 (d, 1H), 7.58 (d, 1H), 7.77 (d, 2H), 8.61 (s, 1H), 9.32 (d, 1H).
Пример T6-4
4-(3,5-Дихлорфенил)-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-8-(морфолин-4-ил)пиридо[3,2-c]пиридазин-7-карбоксамид

Соединение синтезировали тем же способом, как описано в примере T6-2 с получением 9 мг (10 %) продукта в виде твердого вещества желтого цвета.
LC-MS (Способ M11): Rt = 1.70 мин; m/z = 536 (M+1)+.
1H-ЯМР (400 МГц, DMSO-d6): δ [ppm] = 2.07-2.11 (m, 1H), 2.21-2.27 (m, 1H), 3.80-3.81 (m, 4H), 3.90-3.91 (m, 4H), 4.23-4.33 (m, 2H), 5.26 (q, 1H), 6.82 (d, 1H), 6.95 (t, 1H), 7.19 (t, 1H), 7.39 (d, 1H), 7.80 (s, 1H), 7.93 (s, 2H), 8.81 (s, 1H), 9.20 (d, 1H), 9.61 (s, 1H).
Таблица 1: Примеры T1-5 - T1-15, T2-5 - T2-12 и T3-5 - T3-20
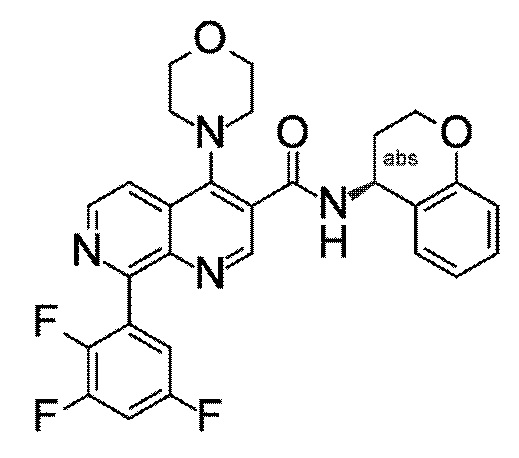
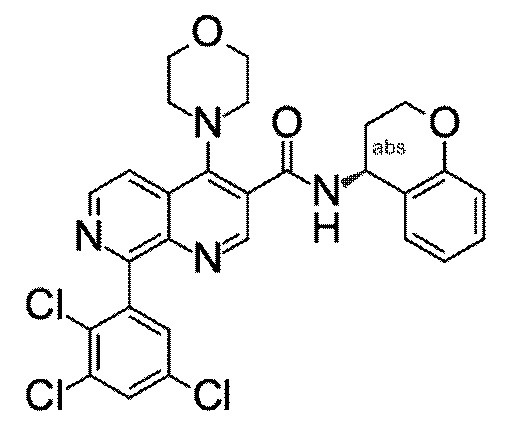
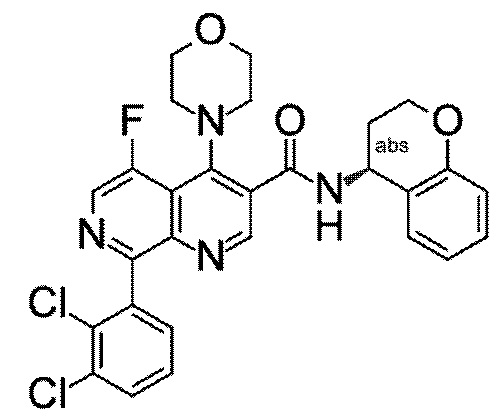






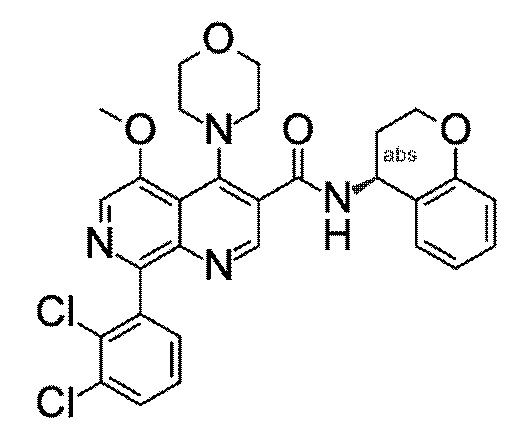

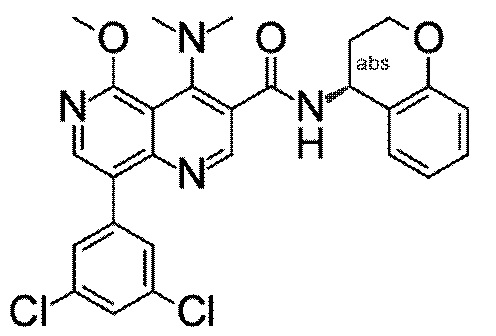


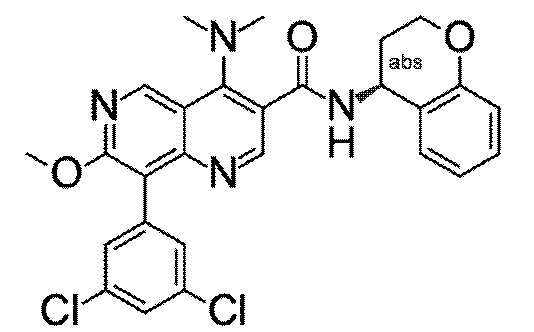
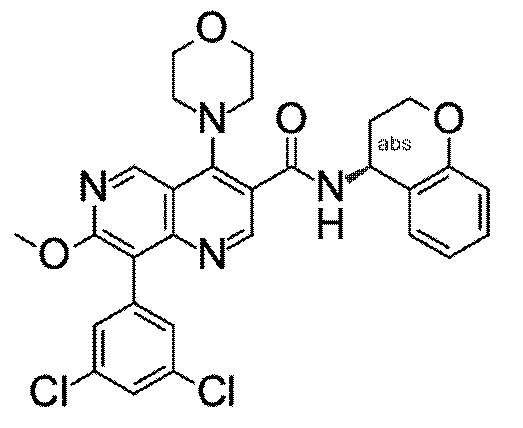

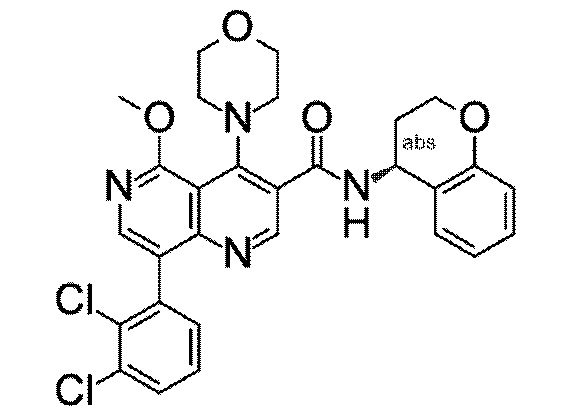



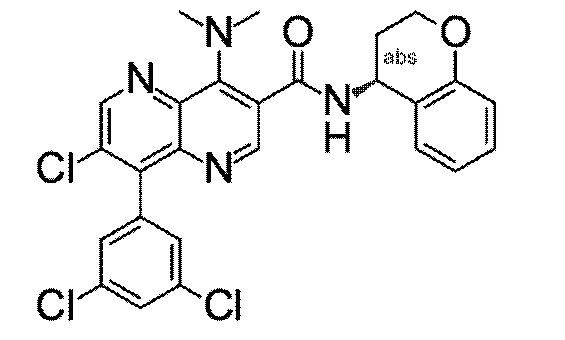


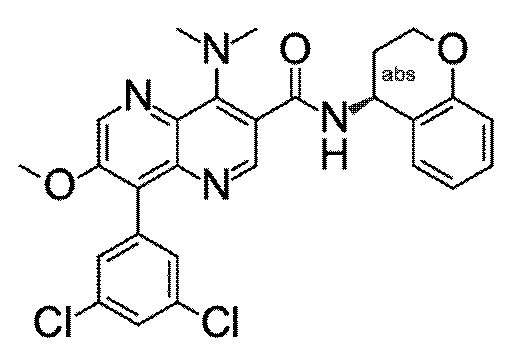



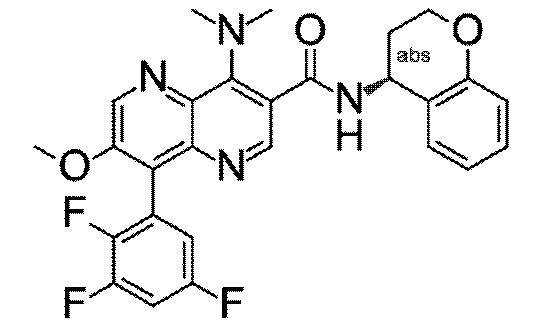

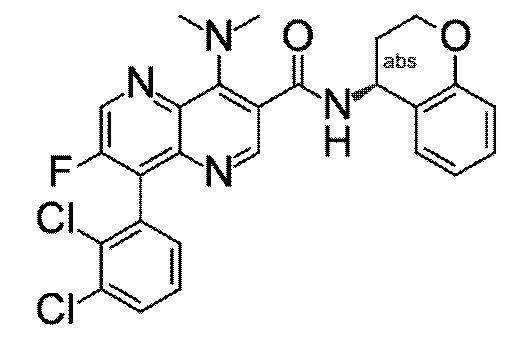
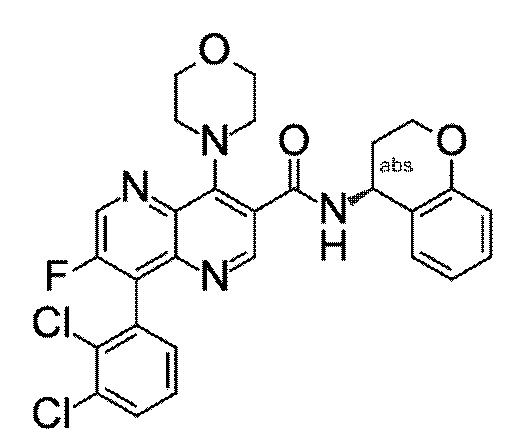


Таблица 2: Аналитические данные для примеров T1-5 - T1-15, T2-5 - T2-12 и T3-5 - T3-20
Экспериментальная часть - биологические анализы
Примеры тестировали в отдельных биологических анализах один или более раз. При тестировании более одного раза данные сообщаются как средние значения, и как медианные значения, где
среднее значение, также называемое средним арифметическим значением, представляет собой сумму полученных значений, поделенное на количество повторений тестирования, и
медианное значение представляет собой среднее число группы значений при ранжировании в порядке возрастания или убывания. Если число значений в наборе данных нечетное, медианным является среднее значение. Если число значений в наборе данных четное, медианное значение является средним арифметическим для двух средних значений.
Примеры были синтезированы один или более раз. При синтезе более одного раза данные биологических анализов представляют в виде средних значений или медианных значений, вычисленных с использованием наборов данных, полученных при тестировании одной или более синтетических партий.
in vitro активность соединений согласно настоящему изобретению может быть продемонстрирована в следующих значения:
In vitro анализ 1: C. elegans Slo-1a - действие в отношении рекомбинантной клеточной линии C. elegans
Получение стабильной клеточной линии C. elegans CHO
CHO клеточную линию получили из ATCC, код ATCC CRL-9096. Для трансфекции плазмидной ДНК, чтобы экспрессировать C. elegans Slo-1a (номер доступа AAL28102) Клетки CHO пассировали до 40% конфлюэнции перед добавлением трансфекционного раствора в культуру клеток. Трансфекционный раствор включал 300 мкмл OptiMEM (Life Technologies, Nr.: 31985), 2 мкмл (= 6 мкмг) плазмидной ДНК, содержащей ген C. elegans Slo 1 и 9 мкмл FugeneHD (Promega, Nr.: E2311), и его добавили к клеткам перед инкубацией в течение 48 часов при 37°C, 5% CO2. Трансфекционную среду заменили на среду отбора, которая содержала дополнительный G418 (2 мг/мл, Invitrogen, Nr.: 10131), и клетки высеяли в 384-луночный планшет (300 клеток/лунка). Через несколько недель оставшиеся выжившие клетки были протестированы с помощью чувствительного к напряжению красителя (Membrane Potential Analysis Kit, Molecular Devices Nr.: R8034) на экспрессии K+ канала. Клоны положительных клеток очищали методом ограниченного разбавления. Для этого клон с самым высоким и самым надежным сигналом в анализе с чувствительным к напряжению красителем дополнительно субклонировали (инкубировали) в 384-луночном планшете (0,7 клеток/лунка) для получения клональной чистоты. Это создает конечную стабильную клеточную линию СНО, экспрессирующую C. elegans Slo-1a.
Условия клеточной культуры
Клетки культивировали при 37°С и 5% CO2 в MEMalpha с Gutamax I (Invitrogen, Nr .: 32571), с добавкой 10% (об./об.) инактивированной теплом фетальной бычьей сывороткой (Invitrogen, Nr .: 10500), G418 ( 1 мг/мл, Invitrogen, Nr .: 10131). Клетки отделяли с использованием Accutase (Sigma, Nr .: A6964).
Измерения мембранного потенциала
Лабораторное тестирование соединений проводили на 384-луночных микротитровальных планшетах (MTPs, Greiner, Nr .: 781092). 8000 клеток/лунка высеевали на 384-луночные MTP и культивировали в течение 20-24 часов при 37°C и 5% CO2. После удаления клеточной культуральной среды клетки промывали один раз тиродом (150 мМ NaCl, 0.3 мМ KCl, 2 мМ CaCl2, 1мМ MgCl2, 0.8 мМ NaH2PO4, 5мМ глюкозы, 28 мМ Hepes, pH 7.4), а затем загружали чувствительный к напряжению краситель набора Membrane Potential Assay, разбавленный в тироде в течение 1 часа при комнатной температуре.
После начала измерения флуоресценции с использованием FLIPR Tetra (Molecular Devices, Exc. 510-545 нм, EмМ. 565-625 нм) тестируемые соединения добавили с последующим добавлением KCl тирода (конечная концентрация анализа: 70 мМ KCl, 2 мМ CaCl2, 1мМ MgCl2, 0.8 мМ NaH2PO4, 5мМ глюкоза, 28 мМ Hepes, pH 7.4, включая чувствительный к напряжению краситель). Измерение было завершено через 7 минут.
Статистика
Данные оценивались с использованием программного обеспечения ActivityBase XLfit (IDBS) для подгонки кривой и расчета полумаксимальной эффективной концентрации (EC50) и сообщаются как отрицательный десятичный логарифм (pE50).
Для следующих примеров pE50>6,5-7,5 было обнаружено для: T1-15, T5-4, T6-2, T6-4.
Для следующих примеров pE50>7,5-8,5 было обнаружено для: T1-1, T1-2, T1-3, T1-4, T1-5, T1-9,T1-10, T1-11, T1-14, T2-1, T2-2, T2-3, T2-4, T3-1, T3-2, T4-1, T4-2, T5-2, T5-5, T5-6, T5-8, T6-1, T6-3.
Для следующих примеров pE50>8,5 было обнаружено для: T1-6, T1-7, T2-11, T2-12,T3-1, T3-3, T3-4, T5-1, T5-3, T5-7.
In vitro анализ 2: D. immitis Slo-1 - действие на рекомбинантную клеточную линию D. immitis
Получение стабильной D. immitis Slo-1 CHO клеточной линии
Клеточная линия CHO была получена от ATCC, код ATCC CRL-9096. Для трансфекции плазмидной ДНК для экспрессии Slo-1 D. immitis (на основе последовательности белка JQ730003, кодон, оптимизированный для хомяка) клетки СНО пассировали до 40% слияния перед добавлением раствора для трансфекции в клеточную культуру. Раствор для трансфекции включал 300 мкл OptiMEM (Life Technologies, №: 31985), 2 мкл (= 6 мкг) плазмидной ДНК, содержащей ген Slo 1 D. immitis, и 9 мкл FugeneHD (Promega, №: E2311), и добавляли к клеткам до инкубации в течение 48 часов при 37°С, 5% СО2. Среду для трансфекции заменяли средой для отбора, которая содержит дополнительно G418 (2 мг/мл, Invitrogen, №: 10131), и клетки высевали в 384-луночные планшеты (300 клеток/лунку). Через несколько недель оставшиеся выжившие клетки тестировали с помощью чувствительного к напряжению красителя (Membrane Potential Assay Kit, Molecular Devices №: R8034) на экспрессию K + канала. Положительные клеточные клоны очищали методом ограниченного разведения. Для этого клон с самым высоким и наиболее устойчивым сигналом в анализе чувствительного к напряжению красителя был дополнительно субклонирован (инкубирован) в 384-луночных планшетах (0,7 клеток/лунка) для получения клональной чистоты. Это дало окончательную стабильную клеточную линию CHO, экспрессирующую Slo-1 D. immitis.
Условия культивирования клеток
Клетки культивировали при 37°C и 5% CO2 в MEMalpha с Gutamax I (Invitrogen, №: 32571), дополненной 10% (об./об.) инактивированной теплом фетальной бычьей сывороткой (Invitrogen, №: 10500), G418 ( 1 мг/мл, Invitrogen, №: 10131). Клетки отделяли, используя Accutase (Sigma, №: A6964).
Измерения мембранного потенциала
Лабораторные испытания соединений проводили на 384-луночных планшетах для микротитрования (MTP, Greiner, №: 781092). 8000 клеток/лунку высевали на 384-луночные микротитровальные планшеты и культивировали в течение 20-24 часов при 37°С и 5% CO2. После удаления среды для культивирования клеток клетки один раз промывали тиродом (150 мМ NaCl, 0,3 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 0,8 мМ NaH2PO4, 5 мМ глюкозы, 28 мМ Hepes, pH 7,4) и затем загружали чувствительный к напряжению краситель из набора для анализа мембранного потенциала, разведенного в тироде, в течение 1 ч при комнатной температуре.
После начала измерения флуоресценции с использованием FLIPR Tetra (Molecular Devices, Exc. 510-545 нм, Emm. 565-625 нм) тестируемые соединения добавляли с последующим добавлением тирода KCl (конечная концентрация для анализа: 70 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 0,8 мМ NaH2PO4, 5 мМ глюкоза, 28 мМ Hepes, pH 7,4, включая чувствительный к напряжению краситель). Измерение было завершено через 7 минут.
Статистика
Данные были оценены с использованием программного обеспечения ActivityBase XLfit (IDBS) для подбора кривой и расчета полумаксимальной эффективной концентрации (EC50) и представлены как отрицательный десятичный логарифм (pE50).
Для следующих примеров pE50>6,5-7,5 было обнаружено для: T1-1, T1-2, T1-3, T1-4, T1-5, T1-8, T1-9, T1-10, T1-11, T1-12, T1-13, T1-14, T2-1, T2-4, T2-5, T2-10, T2-11, T2-12, T4-1, T4-2, T5-1, T5-2, T5-4, T5-5, T5-6, T5-7, T5-8, T6-3, T6-4.
Для следующих примеров pE50>7,5-8,5 было обнаружено для: T1-6, T1-7, T2-3, T2-6, T2-7, T2-8, T2-9, T3-1, T3-3, T3-4, T3-5, T3-6, T3-7, T3-8, T3-9, T3-10, T3-11, T3-12, T3-14, T3-15, T3-16, T3-17, T3-18, T3-19, T3-20, T5-3.
In vitro анализ 3: Nippostrongylus brasiliensis (NIPOBR)
Взрослые Nippostrongylus brasiliensis промыли солевым буфером, содержащим 100 Ед/мл пенициллина, 0.1 мг/мл стрептомицина и 2.5 мкмкг/мл амфотерицина B. Тестируемые соединения растворили в DMSO, и червеобразных животных инкубировали в среде при конечной концентрации 10 мкмкг/мл (10 частей на миллион) соответственно 1мкг/мл (1 часть на миллион). Аликвоту среды использовали для определения активности ацетилхолинэстеразы по сравнению с отрицательным контролем. Принцип измерения ацетилхолинэстеразы как показания для антигельминтной активности был описан в Rapson et al (1986) и Rapson et al (1987).
Для следующих примеров, активность (уменьшение AChE по сравнению с отрицательным контролем) составляла более 80% при 10мкг/мл: T1-2, T1-3, T1-4, T1-5, T1-7, T1-8, T1-9, T1-10, T1-11, T1-12, T1-13, T1-14, T2-2, T2-5, T2-8, T2-9, T2-10, T2-11, T2-12, T3-8, T3-9, T3-10, T3-11, T3-12, T3-14, T3-15, T3-16, T3-17, T3-18, T3-19, T3-20, T4-1, T4-2.
Для следующих примеров, активность (уменьшение AChE по сравнению с отрицательным контролем) составляла более 80% при 10мкг/мл: T1-1, T1-2, T1-3, T1-4, T1-5, T1-6, T1-7, T1-8, T1-9, T1-11, T1-12, T1-13, T1-14, T2-1, T2-3, T2-4, T2-5, T2-8, T2-9, T2-10, T2-11, T2-12, T3-1, T3-3, T3-4, T3-8, T3-9, T3-10, T3-11, T3-12, T3-14, T3-15, T3-16, T3-17, T3-18, T3-19, T3-20, T4-1, T4-2, T5-1, T5-3, T5-5, T5-7, T6-1, T6-2, T6-3.
In vitro анализ 4: Dirofilaria immitis microfilariae (DIROIM L1)
≥250 личинок филярий Dirofilaria immitis, которые были свеже очищены от крови, добавили в лунки микротитровального планшета, содержащего питательную среду и тестируемое соединение в DMSO. Соединения протестировали в анализе зависимости от концентрации дважды. Личинки, подвергнутые воздействию DMSO, но не тестируемых соединений, применяли в качестве отрицательных контролей. Личинки оценивали через 72 часа инкубации с соединением. Эффективность определили как уменьшение подвижности по сравнению с отрицательным контролем. На основе оценки широкого диапазона концентраций, кривые концентрация-ответ, а также EC50-значения вычисляли.
Для следующих примеров EC50 составляла < 0.1 частей на миллион: T1-1, T1-2, T1-3, T1-4, T1-5, T1-6, T1-7, T1-8, T1-10, T1-11, T1-12, T1-13, T1-14, T2-1, T2-2, T2-3, T2-4, T2-5, T2-6, T2-7, T2-8, T2-9, T2-10, T2-11, T2-12, T3-1, T3-2, T3-3, T3-4, T3-5, T3-6, T3-7, T3-8, T3-9, T3-10, T3-11, T3-12, T3-14, T3-15, T3-16, T3-17, T3-18, T3-19, T3-20, T4-1, T4-2, T5-1, T5-2, T5-3, T5-4, T5-5, T5-6, T5-7, T5-8, T6-1, T6-2, T6-3.
In vitro анализ 5: Dirofilaria immitis (DIROIM L4)
10 личинок третьей стадии Dirofilaria immitis, которые только выделили из их вектора (промежуточный хозяин), добавили в лунки микротитровального планшета, содержащего питательную среду и тестовое соединение в DMSO. Соединения протестировали в анализе зависимости от концентрации дважды. Личинки, подвергнутые воздействию DMSO, но не тестируемых соединений, применяли в качестве отрицательных контролей. Личинки оценивали через 72 часа инкубации с соединением. В течение этих 72 часов инкубации большинство личинок отрицательного контроля перешли в личинки четвертой стадии. Эффективность определили как уменьшение подвижности по сравнению с отрицательным контролем. На основе оценки широкого диапазона концентраций, кривые концентрация-ответ, а также EC50-значения вычисляли.
Для следующих примеров EC50 составляла <0.1 частей на миллион: T1-1, T1-2, T1-3, T1-4, T1-5, T1-6, T1-7, T1-8, T1-9, T1-10, T1-11, T1-12, T1-13, T1-14, T2-1, T2-3, T2-4, T2-5, T2-6, T2-7, T2-8, T2-9, T2-10, T2-11, T2-12, T3-1, T3-2, T3-3, T3-4, T3-5, T3-6, T3-7, T3-8, T3-9, T3-10, T3-11, T3-12, T3-14, T3-15, T3-16, T3-17, T3-18, T3-19, T3-20, T4-1, T4-2, T5-1, T5-3, T5-5, T5-7, T6-1, T6-3.
In vitro анализ 6: Litomosoides sigmodontis (LTMOSI L3)
10 личинок третьей стадии Litomosoides sigmodontis, которые только выделили из плевральной полости инфицированного грызуна, добавили в лунки микротитровального планшета, содержащего питательную среду и тестовое соединение в ДМСО. Соединения протестировали в анализе зависимости от концентрации дважды. Личинки, подвергнутые воздействию ДМСО, но не тестируемых соединений, применяли в качестве отрицательных контролей. Личинки оценивали через 72 часа инкубации с соединением. Эффективность определили как уменьшение подвижности по сравнению с отрицательным контролем. На основе оценки широкого диапазона концентраций, кривые концентрация-ответ, а также EC50-значения вычисляли.
Для следующих примеров EC50 составляла <0.1 частей на миллион: T1-1, T1-4, T1-5, T1-10, T1-12, T2-5, T2-12, T3-1, T3-3, T3-15, T3-17, T3-20, T5-7.
In vitro анализ 6: Cooperia curticei
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мг активного соединения растворили в 0.5 мл растворителя, и концентрат разбавили с помощью “раствора Рингера” до желаемой концентрации.
Около 40 личинок нематод (Cooperia curticei) перенесли в тестовую пробирку, содержащую раствор соединения.
Через 5 дней вычислили смертность личинок. 100 % эффективность означает, что все личинки погибли; 0% эффективность означает, что ни одна личинка не погибла.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 100% при норме нанесения 20 частей на миллион: T1-1, T1-2, T1-3, T1-5, T1-6, T2-1, T2-3, T3-1, T3-3, T3-4, T5-7.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 90% при норме нанесения 20 частей на миллион: T3-2, T6-1, T6-2, T6-4.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 80% при норме нанесения 20 частей на миллион: T4-1, T5-2, T5-3, T5-5, T5-6.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 100% при норме нанесения 4 части на миллион: T1-1, T1-2, T1-3, T1-4, T1-5, T1-6, T2-1, T3-1, T3-3, T3-4, T5-7.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 90% при норме нанесения 4 части на миллион: T3-2.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 80% при норме нанесения 4 части на миллион: T2-3, T5-5.
In vitro анализ 7: Haemonchus contortus
Растворитель: диметилсульфоксид
Для получения подходящего препарата активного соединения, 10 мг активного соединения растворили в 0.5 мл растворителя, и концентрат разбавили с помощью “Раствора Рингера” до желаемой концентрации.
Около 40 личинки красного желудочного червя (Haemonchus contortus) перенесли в тестовую пробирку, содержащую раствор соединения.
Через 5 дней вычисляли процент смертности личинок. 100 % эффективность означает, что все личинки погибли, 0% эффективность означает, что ни одна личинка не погибла.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 100% при норме нанесения 20 частей на миллион: T1-1, T1-3, T1-6, T2-1, T3-1, T3-3, T3-4, T6-1.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 90% при норме нанесения 20 частей на миллион: T1-2, T2-3, T3-2, T5-7, T6-3.
В этом тесте, например, следующие соединения из примеров получения показали хорошую активность 80% при норме нанесения 20 частей на миллион: T1-5, T5-2, T5-5, T6-4.
Примеры композиции
Примерные композиции состояли из активного вещества в 10% Transcutol, 10% Cremophor EL и 80% изотоническом солевом растворе. Сначала активное вещество растворяли в Transcutol. После растворения в Transcutol добавляли Cremophor и изотонический солевой раствор. Эти композиции использовались в качестве рабочих композиций в следующем анализе in vivo.
Примером композиции согласно настоящему изобретению является следующая примерная композиция F1. Затем активное вещество растворили в Transcutol с образованием сток-раствора A. Затем 0.100 мл этого сток-раствора A взяли, и 0.100 мл Cremophor EL и 0.800 мл изотонического солевого раствора добавили. Полученная жидкая композиция (пример композиции F1) имела объем 1 мл.
Сток-раствор A:
4.0 мг соединения примера T5-1,
0.100 мл Transcutol
Пример композиции F1:
0.100 мл сток-раствора A,
0.100 мл Cremophor EL, и
0.800 мл изотонического солевого раствора.
In vivo анализ
Haemonchus contortus / Trichostrongylus colubriformis / песчанка
Песчанок, экспериментально зараженных Haemonchus и/или Trichostrongylus, обрабатывали один раз во время поздней препотентности. Тестируемые соединения получали в виде растворов или суспензий и применяли перорально или интраперитонеально. Для обоих применений использовалась одна и та же форма применения. Объем применения обычно составлял максимум 20 мл/кг. В качестве примера, песчанку с массой тела 40 г обрабатывали 0,200 мл композиции примера F1. Это соответствовало обработке 20 мг/кг массы тела.
Эффективность определяли для каждой группы как уменьшение количества червей в желудке и тонкой кишке, соответственно, после вскрытия по сравнению с количеством червей в контрольной группе, инфицированной и получавшей плацебо.
Следующие примеры были протестированы и имели активность ≥70% или выше при данной обработке:
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ СОЕДИНЕНИЯ | 2019 |
|
RU2828007C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2830113C2 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ ХИНОЛИН-3-КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2772283C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПИРАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ | 2018 |
|
RU2781426C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА | 2020 |
|
RU2839897C2 |
| ЗАМЕЩЕННЫЕ БЕНЗАМИДЫ ДЛЯ БОРЬБЫ С ЧЛЕНИСТОНОГИМИ | 2014 |
|
RU2713949C2 |
| Азолины | 2015 |
|
RU2727307C2 |
| ПРОТИВОГЕЛЬМИНТНЫЕ АЗА-БЕНЗОТИОФЕНОВЫЕ И АЗА-БЕНЗОФУРАНОВЫЕ СОЕДИНЕНИЯ | 2020 |
|
RU2833610C2 |
| АНТИГЕЛЬМИНТНЫЕ СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ СТРУКТУРУ АЗАИНДОЛОВ | 2020 |
|
RU2833563C1 |
| АРИЛЗАМЕЩЕННЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2016 |
|
RU2750293C2 |
Настоящее изобретение охватывает азахинолиновые соединения общей формулы (I):
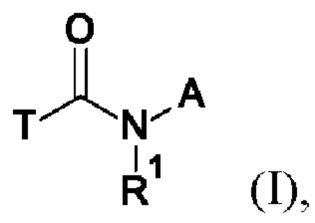
где А представляет собой:

и
где Т, R1, R2, R3, R4, R5, R6 и Q имеют значения, как определено в настоящей заявке, применяемые для контроля, лечения и/или профилактики заболевания, где заболеванием является эндо- и/или эктопаразитарная инфекция. Кроме того, изобретение также охватывает фармацевтические композиции, содержащие указанные соединения, и применение указанных соединений для получения лекарственного средства для контроля, лечения и/или профилактики заболевания, где заболеванием является эндо- и/или эктопаразитарная инфекция. 5 н. и 7 з.п. ф-лы, 43 пр., 2 табл.
1. Соединение общей формулы (I):
 (I)
(I)
где:
A представляет собой
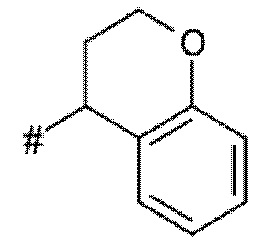 ;
;
T выбирают из T1 – T6

R1 выбирают из группы, состоящей из водорода и C1-C4-алкила,
R2 выбирают из группы, состоящей из
водорода,
–NR12R13;
–OR14;
C1-C6-алкила, C3-C6-циклоалкила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена;
моноциклического 4-6-членного гетероциклоалкила, содержащего один или два идентичных или различных кольцевых гетероатомов из ряда N и/или О, которые необязательно замещены 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, оксо, тионо, -COOH, C1-C4-алкила, C1-C4-алкокси, -NH2,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-галогенoалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R5 выбирают из группы, состоящей из водорода, галогена,
R6 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-алкокси,
R12 и R13 независимо выбирают из группы, состоящей из
водорода;
C1-C4-алкила, C3-C6-циклоалкила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH,
моноциклического 4-6-членного гетероциклоалкила, содержащего один или два идентичных или различных кольцевых гетероатомов из ряда N и/или О, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, -OH, оксо, тионо, -COOH, -C(O)-NH2, C1-C4-алкила, C1-C4-алкокси, -NH2,
R14 выбирают из группы, состоящей из
C1-C4-алкила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, циано, -COOH, -C(O)-NH2, -NH2,
Q выбирают из группы, состоящей из 6-членного арила, который необязательно замещен 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из галогена, C1-C4-алкила, C1-C4-галогенoалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
2. Соединение по п. 1, где
R1 представляет собой водород или C1-C4-алкил,
R2 выбирают из группы, состоящей из
–NR12R13;
–OR14;
C1-C6-алкила, C3-C6-циклоалкила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена,
моноциклического 4-6-членного гетероциклоалкила, содержащего один или два идентичных или различных кольцевых гетероатомов из ряда N и/или О, который необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, оксо, -COOH, C1-C4-алкила, -NH2,
R3 выбирают из группы, состоящей из водорода, галогена или C1-C4-алкила,
R4 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-галогенoалкила, имеющего от 1 до 5 атомов галогена, C1-C4-алкокси,
R5 выбирают из группы, состоящей из водорода, галогена,
R6 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила, C1-C4-алкокси,
R12 и R13 независимо выбирают из группы, состоящей из
водорода,
C1-C4-алкила, C3-C6-циклоалкила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, -COOH,
моноциклического 4-6-членного гетероциклоалкила, содержащего один или два идентичных или различных кольцевых гетероатомов из ряда N и/или О, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, оксо, циано, C1-C4-алкила, C1-C4-алкокси,
R14 выбирают из группы, состоящей из
C1-C4-алкила, который необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена и -OH,
Q представляет собой замещенное фенильное кольцо формулы (Q1)
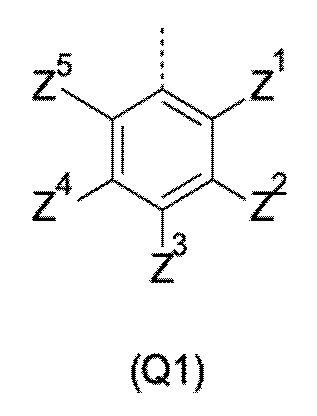
где:
Z1 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Z2 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила и C1-C4-алкокси,
Z3 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
Z4 выбирают из группы, состоящей из водорода, галогена, -OH, C1-C4-алкила, C1-C4-алкокси,
Z5 выбирают из группы, состоящей из водорода, галогена, C1-C4-алкила и C1-C4-алкокси,
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
3. Соединение по п. 1, где:
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
–NR12R13;
–OR14;
метила, этила, пропила, изопропила, циклобутила, циклопропила, циклогексила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена; и
моноциклического гетероцикла, выбранного из группы, состоящей из азетидина, пиперидина, пиперазина, тетрагидропиридина, тетрагидропирана, морфолина, тиоморфолина, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора, хлора, -OH, оксо, -COOH, метила, -NH2,
R3 представляет собой водород, хлор или метил,
R4 выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, фтора, хлора,
R6 выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
R12 и R13 независимо выбирают из группы, состоящей из
водорода,
метила, этила, пропила, изопропила, бутила, изобутила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из фтора, -OH, -COOH,
морфолина, тетрагидропирана, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора, хлора, -OH, оксо, метила;
R14 выбирают из группы, состоящей из
метила, этила, изопропила, бутила, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора и -OH,
Q представляет собой замещенное фенильное кольцо формулы (Q1)

где:
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, фтора, хлора, -OH, метила, этила, трифторметила, метокси, и
Z3 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси,
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
4. Соединение по п. 1, где:
A представляет собой:
 ,
,
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
-NH2, -NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила, циклобутила, 3-фторциклобутила; и
моноциклического гетероцикла, выбранного из группы, состоящей из азетидина, пиперазина, тетрагидропирана, морфолина, тиоморфолина, каждый из которых необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из фтора, -OH, оксо, -COOH, метила, метоксиметила-, -NH2,
R3 представляет собой водород,
R4 выбирают из группы, состоящей из водорода, хлора, фтора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, хлора, фтора,
R6 выбирают из группы, состоящей из водорода, фтора, метила и метокси,
Q представляет собой замещенное фенильное кольцо формулы (Q1)
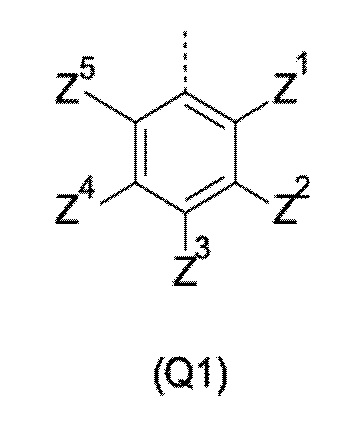
где:
Z1 и Z5 независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила и метокси,
Z2 и Z4 независимо выбирают из группы, состоящей из водорода, фтора, хлора, -OH, метила, этила, трифторметила, метокси, и
Z3 каждый независимо выбирают из группы, состоящей из водорода, фтора, хлора, метила, метокси
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
5. Соединение по п. 1, где:
R1 представляет собой водород или метил,
R2 выбирают из группы, состоящей из
-NH(CH3), -N(CH3)2,
метокси, этокси,
метила, этила, пропила, изопропила, циклопропила, циклобутила, 3-фторциклобутила; и
моноциклического гетероцикла, выбранного из группы, состоящей из азетидина, 3-фторазетидина, тетрагидропирана, морфолина и тиоморфолина,
R3 представляет собой водород,
R4 выбирают из группы, состоящей из водорода, хлора, фтора, метила, метокси и трифторметила,
R5 выбирают из группы, состоящей из водорода, хлора, фтора,
R6 выбирают из группы, состоящей из водорода, фтора, метила и метокси,
Q выбирают из группы, состоящей из фенила, 2,3,4-трифторфенила, 2,3,4-трихлорфенила, 2,3,5-трифторфенила, 2,3,5-трихлорфенила, 2,3,6-трифторфенила, 2,3,6-трихлорфенила, 2,3-дифторфенила, 2,3-дихлорфенила, 2,4,5-трифторфенила, 2,4,5-трихлорфенила, 2,4,6-трифторфенила, 2,4,6-трихлорфенила, 2,6-дифторфенила, 2,6-дихлорфенила, 2-фтор-3-хлорфенила, 2-хлор-3-фторфенила, 2-хлор-4-фторфенила, 2-фтор-4-хлорфенила, 2-хлор-5-фторфенила, 2-хлор-6-фторфенила, 2-фторфенила, 2-хлорфенила, 3,4,5-трифторфенила, 3,4,5-трихлорфенила, 3,4-дифторфенила, 3,4-дихлорфенила, 3,5-дифтор-4-хлорфенила, 3,5-дихлор-4-фторфенила, 3,5-дифторфенила, 3,5-дихлорфенила, 3-хлор-4-фторфенила, 3-хлор-5-фторфенила, 3-фторфенила, 3-хлорфенила, 5-хлор-2,4-дифторфенила, 5-фтор-2,4-дихлорфенила, 5-хлор-2-фторфенила,
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
6. Соединение по п. 1, где
T выбирают из группы, состоящей из T1, T2 и T3


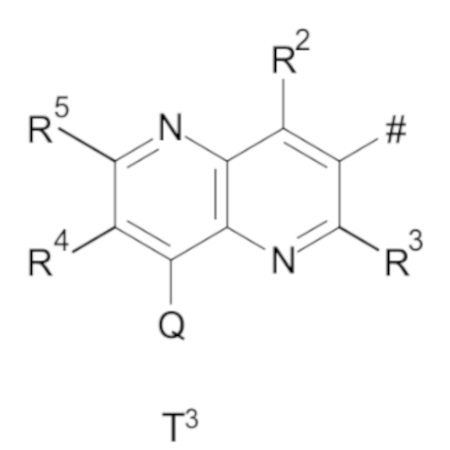
и его стереоизомеры, гидраты, сольваты и фармацевтически приемлемые соли, а также смеси указанного.
7. Соединение общей формулы (I), как определено в любом из пп. 1-6, для применения для контроля, лечения и/или профилактики заболевания, где заболеванием является эндо- и/или эктопаразитарная инфекция.
8. Соединение общей формулы (I) по п. 7, где заболеванием является гельминтная инфекция.
9. Фармацевтическая композиция для контроля, лечения и/или профилактики эндо- и/или эктопаразитарного заболевания, содержащая терапевтически эффективное количество соединения общей формулы (I) по любому из пп. 1-6 и один или более фармацевтически приемлемых эксципиентов.
10. Применение соединения общей формулы (I) по любому из пп. 1-6 для контроля, лечения и/или профилактики заболевания, где заболеванием является эндо- и/или эктопаразитарная инфекция.
11. Применение соединения общей формулы (I) по любому из пп. 1-6 для получения лекарственного средства для контроля, лечения и/или профилактики заболевания, где заболеванием является эндо- и/или эктопаразитарная инфекция.
12. Применение по п. 10 или 11, где заболеванием является гельминтная инфекция.
| WO 2016012485 A1, 28.01.2016 | |||
| US 2013150414 A1, 13.06.2013 | |||
| RU 2008122405 A, 27.01.2010 | |||
| интернет-источник https://ru.wikipedia.org/wiki/Стереоизомеры, опубликованный в Wayback Internet Archive Machine 11.06.2012 | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| интернет-источник | |||
Авторы
Даты
2022-06-01—Публикация
2018-06-22—Подача