Изобретение относится к медицинской и прикладной микробиологии, при работах с вирусами в целях обеспечения безопасных условий труда и, может быть использовано при гигиенической оценке тканей и нетканых материалов, предназначенных для изготовления средств индивидуальной защиты, а так же иной текстильной промышленности.
Предлагаемый способ позволяет в лабораторных условиях оценить в процентном соотношении проницаемость тканей и нетканых материалов бактериями и грибами.
При изготовлении средств индивидуальной защиты, предназначенных для работы с бактериями и грибами, относящимися к I-IV группам патогенности, важно учитывать высокую степень защиты от проникновения бактерий и грибов через используемый материал. Особо важно это при работе в очагах особо опасных инфекций вирусной природы, а так же при ликвидации чрезвычайных ситуаций санитарно-эпидемиологического характера, когда риск обсеменения средств индивидуальной защиты и заражения человека очень высок.
В настоящее время одним из актуальных вопросов, как для учреждений здравоохранения, так и для населения является защита от инфекций, передаваемых воздушно-капельным путем, в том числе от бактериальных, грибковых и вирусных. В этой связи особое место занимает использование средств индивидуальной защиты для органов дыхания. На сегодня Минздрав совместно с Росздравнадзором разослали в регионы письмо с разъяснениями, в котором прописано, что аптеки могут продавать гигиенические маски, выпущенные в соответствии с техническими условиями и не подлежащие государственной регистрации как медицинские изделия.
Санитарно-гигиеническая маска - это средство индивидуальной защиты, которое защищает человека от пыли, бактерий и вирусов, находящихся в окружающей среде. Такое изделие не гарантирует 100-процентную защиту, но оно эффективно в качестве дополнительной меры безопасности. В ведомстве пояснили, что под понятием «гигиеническая маска» скрывается изделие, использующееся в качестве барьерного средства для фильтрации воздуха. В сообщении Минздрава указано, что «такие маски могут быть изготовлены из текстильных материалов, трикотажа, нетканого материала и реализованы с учетом потребностей».
Технические условия для изготовления таких барьерных средств опубликованы Росстандартом. Такие маски позволят обеспечить граждан средствами защиты. Согласно определению Минпромторга России от 30 марта 2020 года, гигиенические маски - это тканевые повязки, которые могут иметь несколько вариантов исполнения: с четырьмя тесемками, с эластичной тесьмой, вшитой в боковые швы, с тесьмой по периметру. Маски при необходимости можно стерилизовать паровыми методами. Материал для изготовления таких средств защиты - марля медицинская, бязь (хлопок 100%), комбинация марля - фланель - марля, нетканый материал в три слоя (спанбонд - мельтблаун - спанбонд) или готовый SMS. Маски из марли не должны расслаиваться или распадаться, а также разрываться в процессе использования. Вариантов изготовления также несколько, указывает Минпромторг России. Вариант первый: четыре слоя марли с добавлением внутреннего слоя фланели или без него. Вариант второй: два слоя бязи. Вариант третий: из трех слоев нетканого материала. Вариант четвертый: из одного слоя готового SMS. Гигиенические маски должны быть дополнены накладным швом с двумя закрытыми срезами. Стежки не должны стягивать изделие. Гигиеническая маска должна плотно облегать нос, рот и подбородок пользователя за счет имеющихся средств фиксации.
Так как лицевые гигиенические маски не относятся к медицинским изделиям, для них не нужен сертификат. Производитель может поставлять товары в магазины и аптеки для реализации в том случае, если они соответствуют ТУ. Компания, выпускающая защитные товары, также может самостоятельно прописывать требования к выпускаемой продукции.
Санитарно-гигиенические маски для лица эффективны только вместе с другими средствами и видами индивидуальной защиты.
Несмотря на большие достижения санитарной бактериологии и профилактической медицины, способы оценки проницаемости тканей и нетканых материалов бактериями и грибами, как средств индивидуальной защиты, в отечественной нормативно-правовой базе отсутствуют.
Анализ известных технических решений из уровня техники показал, что известен способ 1 по определению проницаемости тканей и нетканых материалов бактериями, грибами и частицами в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT), рассчитанный на проведение испытаний медицинских масок как медицинских изделий, однако он трудоемкий и не имеет четкого представления по сбору технических средств для его реализации. Сущность метода заключается в том, что в качестве прибора для вакуумного фильтрования используют каскадный импактор, принцип действия которого основан на создании перепада давления со стабильными параметрами, за счет которого отбираемая проба воздуха, содержащая суспензию с заданным титром микроорганизмов подается на поверхность маски в виде аэрозоля и просасывается через прибор с учетом измерения протягиваемого объема воздуха. Значение объема отбираемой пробы воздуха пропорционально времени отбора и расхода распыления суспензии. По достижении заданного просасываемого объема воздуха аспиратор автоматически выключается. Эффективность бактериальной фильтрации маски представляет собой определение числа КОЕ, проходящих через материал маски, выраженный в процентах от числа КОЕ присутствующих в аэрозоле приготовленной суспензии микроорганизмов и контролирующийся путем подсчета выросших колоний на чашке с агаром. Бактериальную суспензию помещают в распылитель с помощью шприцевого насоса. Моделирование бактериального заражения проводят следующим образом: включив вакуумный насос, регулируют расход образованной аэрозоли из 5 мл суспензии, в котором содержится заданная исходная концентрация микроорганизмов протянутая через импактор. Пробу воздуха объемом 100 л отбирают в течение 1 мин. Поддерживают поток воздуха через импактор в течение 1 мин. Затем вынимают чашки из импактора. Убеждаются в том, что каждая чашка пронумерована с указанием положения в импакторе. Использованные в качестве фильтра отработанные исследуемые образцы масок помещают на соответствующие питательные среды той стороной, которая не контактировала с аэрозолью, содержащей микроорганизмы. Образцы масок помещают в физиологический раствор с пептоном и бусами, встряхивают в течение 10 минут, после чего делают высев на питательный агар ТСА и термостатируют при температуре (36±2)°С в течение 24-48 часов. Чашки с питательной средой после проведения исследований вынимают из импактора и помещают в термостат с последующим термостатированием при температуре (36±2)°С в течение (48±4) ч. Затем проводят обеззараживание прибора и производственный контроль. Далее стерильные чашки с питательной средой помещают в импактор, фиксируют образец и повторяют описанную процедуру для каждого испытуемого образца. Описанный способ трудоемкий и требует сбора специализированной установки, в которой используется шестиуровневый каскадный импактор, который не выпускается со времен 1950 г., а для сбора установки требуется компетентное техническое сопровождение, так как необходимо соблюдать все технические нюансы для ее правильного функционирования.
Известен также Способ 2 оценки медицинских изделий, проводимый в соответствии с пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции по определению проницаемости микроорганизмами тканей и нетканых материалов» (ГОСТ 12.4.136-84 «Система стандартов безопасности труда. Средства индивидуальной защиты». Метод определения проницаемости микроорганизмами прост, но имеет ряд ограничений и пригоден исключительно для определения проницаемости тканей и нетканых материалов бактериями, так как основывается на использовании питательных сред, рассчитанных на выращивание прокариотических клеток тест-культур Staphylococcus aureus или Escherichia coli. Сущность способа заключается в сравнении количества выросших колоний микроорганизмов, проникших через испытываемую пробу, с количеством колоний микроорганизмов, выросших на контрольных пластинках. Применение метода предусматривается при проектировании специальной одежды, средств защиты головы и рук, разработке новых тканей и материалов. С помощью контактных пластин или слайдов затвердевшая питательная среда, используемая для каждого тестируемого микроорганизма, прижимается к поверхности для адгезии живых микроорганизмов к этой среде. Пластины и слайды инкубируются до появления колоний, которые затем подсчитывают. Преимущество таких систем заключается в простоте. Результаты непосредственно относятся к поверхности контакта с твердой питательной средой. Процедура приготовления суспензии микроорганизмов предусматривает контроль наличия живых микроорганизмов в элюенте. Контактные пластины и слайды обычно применяются только для плоских поверхностей или поверхностей правильной формы, в работе используют стерильные обработанные предметные стекла. Определенное количество данного разведения распределяют на поверхности твердой питательной среды с помощью шпателя. Количество суспензии, распределенное на поверхности среды, должно быть поглощено средой так, чтобы образовались отдельные колонии; условие абсорбции определяет объем суспензии, который может использоваться на чашке Петри. Отдельные части суспензии (аликвоты) каждого разведения смешивают с расплавленным агаром при температуре, не превышающей 45°С, которые затвердевает на пластине, и размещают в стерильных чашках Петри. Залитую чашку инкубируют и подсчитывают колонии. При достаточном количестве элюента может быть был сделан ряд последовательных разведений, которые инокулируют в питательную среду так, что часть инокулированной среды не дает видимого роста при последующей инкубации. Статистическая обработка числа разведений, в которых наблюдается рост, обеспечивает оценку исходного количества микроорганизмов. Жизнеспособные частицы устанавливаются во время инокуляции. После высушивания инокулята, используют выбранный для него метод выделения микроорганизмов. Вычисление эффективности в отношение полученного титра проводят путем расчета титра исходного инокулята к полученному на пластинах. Недостатком данного способа является ряд неопределенностей, связанных с использованием разведений, питательных сред и наличием культуры в элюате.
Наиболее близких аналогов из области техники не выявлено.
Задачей изобретения является разработка простого и доступного способа, позволяющего с высокой достоверностью оценить проницаемость бактериями с разным строением клеточной стенки и грибами тканей и нетканых материалов для использования в качестве средств индивидуальной защиты от бактериального и грибкового заражения воздушно-капельным и контактно-бытовом путем, не требующего дорогостоящего оборудования и специального технического оснащения и сопровождения с использованием современного оборудования, проходящего метрологическую поверку.
Достигаемым при использовании предлагаемого изобретения техническим результатом является определение проницаемости тканей и нетканых материалов бактериями с разным строением клеточной стенки и грибами, совершенствование показателей защищенности средств индивидуальной защиты и повышение точности оценки защитных свойств при проектировании специальной одежды, средств индивидуальной защиты, различных фильтров и других изделий, где используются ткани и нетканые материалы, а так же при разработке новых тканей и материалов за счет определения проницаемости бактериями с разным строением клеточной стенки и формы и грибами.
Технический результат достигается тем, что в способе определения проницаемости бактериями с разным строением клеточной стенки и грибами ткани и нетканых материалов, первоначально проводят визуальный осмотр и выбраковку исследуемых образцов с механическими повреждениями, влияющими на проницаемость, отобранные образцы нарезают на лоскуты в форме круга диаметром 90 мм из расчета по 3 лоскута, исходя из того, что чашка Петри, на которую накладывают тестируемые образцы имеет в диаметре 90 мм, а исследование 3-х образцов обеспечивает вычисление средней ошибки погрешности при выполнении исследований каждого образца ткани, которые подвергают либо стерилизации в стеклянных чашках Петри в паровом стерилизаторе в течении 20 мин при температуре 121±1,0°С и давлении 1 Па, являющейся стандартным режимом проведения обеззараживания на которые имеются стандартные промышленные тесты для осуществления контроля соблюдения режима стерилизации, что обеспечивает обеззараживание в отношении спор, грибов, грамположительных и грамотрицательных бактерий, либо проводят обеззараживание поверхности ткани УФ-лампой открытого типа в течение 15 минут с каждой из сторон, при этом контроль стерильности образцов осуществляют путем помещения тестируемого образца после обеззараживания в пробирку с тиогликолевой средой с дальнейшей визуальной оценкой на предмет помутнения среды через сутки после термостатирования при температуре (36±2)°С. Температура термостатирования является стандартизованной и используется для культивирования разных форм микроорганизмов. Далее подготовленные стерильные лоскуты 90×90 см последовательно размещают на портативном приборе для микробиологического контроля воздуха Sartorius MD8 AirPort, расположенном в ламинарном боксе 3 класса опасности с рукавами и НЕРА-фильтром Н14 на выходе, на приборе Sartorius MD8 AirPort размещают кассету с питательной средой и сверху на кассету помещают тестируемый образец таким образом, чтобы ткань покрывала всю поверхность кассеты для предотвращения обходных воздушных потоков и накрывают воронкой с трубочкой для отвода скопившейся водной суспензии в отдельную емкость и с двумя диаметрами на концах в одном из котором должна помещаться кассета с тестируемым образцом, а противоположное отверстие предназначено для внесения аэрозоля с микроорганизмами, При этом суспензию микроорганизмов помещают в автоматический диспенсер для разбрызгивания аэрозоля и устанавливают в отверстие в воронке, предназначенное для ее вспрыскивания, затем устанавливают режим для пропускания воздуха через прибор 100 м3/минуту, что в пересчете для производственных лабораторий, проводящих бактериологические исследования воздуха на обсемененность предусматривают определение общего содержания микроорганизмов в 1 м3 воздуха и является стандартной единицей в соответствии с действующим санитарным законодательством на территории Российской Федерации (например, в соответствии с МУ 2.1.4.1057-01) для проведения исследований по оценке воздушной среды на наличие бактерий и грибов в воздухе, включают одновременно автоматический диспенсер и прибор для отбора воздуха на время равное отбору проб воздуха в течение 1 минуты, по окончании отбора воздуха прибор для отбора воздуха и диспенсер отключают одновременно, воронку аккуратно снимают, тестируемый образец из чашки Петри аккуратно снимают стерильным пинцетом и помещают, не переворачивая, в чашку Петри с питательной средой, соответствующей тестируемому микроорганизму, чашка Петри закрывается крышкой и термостатируется при температуре (36±2)°С в течение (48±4) часов, что является стандартным режимом для выращивания микроорганизмов, кассету с питательной средой снимают с прибора, закрывают крышкой, переворачивают дном вверх и помещают в термостат при температуре (36±2)°С на (48±4) ч, по истечению положенного времени посевы извлекают из термостата и подсчитывают число выросших на чашках колоний, для каждой суспензии проводят положительный контроль в качестве которого используют отбор проб воздуха с распылением бактериальной и грибковой суспензии без использования в качестве фильтра исследуемого образца, выполняют так же и отрицательный контроль с прохождением воздуха без добавления бактериальной и грибковой суспензии и образца ткани, фильтруя воздух в течение 1 минуты, оценку результата осуществляют в виде расчета эффективности бактериальной фильтрации для каждого образца в процентах исходя из того, что из ста вычитают сумму частного суммы всех колоний выросших на чашках с образцами во всех повторностях к количеству чашек, используемых для исследования, умноженному на сто и разделенному на сумму всех колоний, выросших в контрольных чашках без использования тестируемых образцов в качестве фильтра, умноженного на количество чашек, используемых для исследования.
Для имитации микробного загрязнения используют 24 часовые бактериальные с разным строением клеточной стенки и грибковые культуры тест-штаммов официальных российских и международных (АТСС) коллекций микроорганизмов, выращенные на питательном агаре при температуре (36±2)°С с типичными биохимическими свойствами: Escherichia coli 1257, Staphylococcus aureus 906, Enterococcus faecalis 29215 АТСС, Klebsiella pneumonia 700603 137474АТСС, Salmonella enteritidis 5765, Pseudomonas aeruginosa 10145 ATCC, Candida albicans 24433 ATCC.
Дополнительно проводят контроль каждой суспензии микроорганизмов, контролируя наличие роста и титра микроорганизмов из суспензии после распыления аэрозоля с микроорганизмами.
Для приготовления миллиардной взвеси суточных культур используют физиологический раствор и физиологический раствор с пептоном, титруют в соответствии с МУ 2.1.4.1057-01. Для инфицирования воздуха используют исходную концентрацию микроорганизмов в аэрозоле 104-105 КОЕ/мл и приближенную к натурной концентрации 102-103 КОЕ/мл.
Исследования проводят с каждой культурой индивидуально.
Из ткани масок вырезают испытуемые образцы (далее образцы), каждый из которых соответствует размеру 90×90 мм (по диаметру чашек Петри, используемых в исследовании). В исследованиях используют опытные образцы, соблюдая все слои маски в том порядке, в котором они находятся в готовой маске.
Каждый испытуемый образец до начала испытаний выдерживают при температуре (21±5)°С и влажности воздуха (45±5) %.
При проведении исследований используют оборудование, имеющее метрологическую поверку.
Образцы перед проведением исследований инспектируют на предмет выявления физических дефектов. Выбракованные образцы из исследования исключаются. Испытания проводят с внутренней стороны образцов масок, находящихся в контакте с суспензией микроорганизмов. После завершения количественного анализа концентрацию микроорганизмов в воздухе (X) в КОЕ/м3 или КОЕ/л вычисляют по формуле:
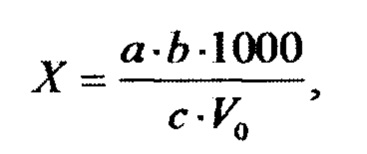
где а - количество микроорганизмов, найденное в анализируемом объеме жидкости (КОЕ /мл);
b - объем жидкости во всей пробе (мл);
с - объем жидкости, взятой для анализа (мл);
V0 - объем воздуха, отобранный для анализа и приведенный к нормальным условиям.
На Рис. 1 представлен портативный прибор для микробиологического контроля воздуха Sartorius MD8 AirPort - (в дальнейшем - AirPort), предназначенный для отбора и измерения проб атмосферного воздуха населенных мест, воздуха рабочей зоны, воздуха жилых и общественных помещений, с заданным прохождением объема воздуха через поглотитель для последующего аналитического контроля по установленным значениям расхода и времени отбора. Прибор используется для реализации предлагаемого способа.
Суспензию микроорганизмов помещают в автоматический диспенсер для разбрызгивания аэрозоли с микроорганизмами и вместе с прибором для отбора воздуха помещают в аэрозольную камеру. Кассету с питательной средой размещают на приборе. Сверху на кассету размещают тестируемый образец таким образом, чтобы ткань покрывала всю поверхность кассеты для предотвращения обходных воздушных потоков, и устанавливают режим для пропускания 100 л/мин. Включают автоматический диспенсер на 1 мин (время, равное отбору проб воздуха). По окончании отбора воздуха тестируемый образец из чашки Петри аккуратно снимают стерильным пинцетом и помещают, не переворачивая, в другую чашку Петри, закрывая крышкой с дальнейшим термостатированием. Кассету с питательной средой снимают с прибора, закрывают крышкой, переворачивают дном вверх и тоже помещают в термостат при температуре (36±2)°С в течение (48±4) ч.
Для каждой суспензии проводят положительный контроль-отбор проб воздуха без исследуемого образца с распылением бактериальной и грибковой суспензии. Выполняют так же и отрицательный контроль с прохождением воздуха без добавления бактериальной и грибковой суспензии и образца, фильтруя воздух в течение 1 мин.
Расчет эффективности бактериальной фильтрации для каждого образца рассчитывают по формуле:
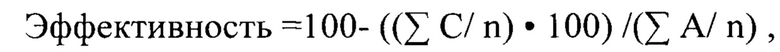 где
где
А - сумма всех колоний, выросших в контрольных чашках без использования образца в качестве фильтра. Число контролей соответствует числу исследованных образцов.
С - сумма всех колоний выросших на чашках с образцами во всех повторностях.
n - количество чашек, используемых для исследования (одинаковое для контроля и образца.
Предлагаемый способ поясняется примерами.
Пример 1.
Исследования проводили на образцах, в качестве которых использовали гигиенические маски, как средства индивидуальной защиты, приобретенные в аптеках и магазинах различных производителей. Образцам масок присваивали шифр.
Исследования каждого образца масок проводили в трех повторностях в сухом и предварительно смоченном в течение 1 минуты в дехлорированной стерильной водопроводной воде виде. Маски исследовались после стирки.
Для валидации заявленного способа использовали способ, указанный в ГОСТ ISO 11737-1-2012 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции и в ГОСТР 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT) (далее способ 1) и пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» (далее способ 2).
Способ 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT), в качестве прибора для вакуумного фильтрования использовали каскадный импактор, принцип действия которого основан на создании перепада давления со стабильными параметрами (рис. 2), за счет которого отбираемая проба воздуха, содержащая суспензию с заданным титром микроорганизмов подавалась на поверхность маски в виде аэрозоля и просасывалась через прибор с учетом измерения протягиваемого объема воздуха. Значение объема отбираемой пробы воздуха было пропорционально времени отбора и расхода распыления суспензии. По достижении заданного просасываемого объема воздуха аспиратор автоматически выключался. Эффективность бактериальной фильтрации маски представляет собой определение числа КОЕ, проходящих через материал маски, выраженный в процентах от числа КОЕ присутствующих в аэрозоле приготовленной суспензии микроорганизмов и контролирующийся путем подсчета выросших колоний на чашке с агаром. Бактериальную суспензию помещали в распылитель с помощью шприцевого насоса.
На Рис. 2 представлен используемый прибор для проведения исследования по оценке эффективности бактериальной фильтрации масок Способом 1, собранный по схеме с учетом приводного механизма; распылителя взвеси бактерий; аэрозольной камеры; источника воздуха высокого давления подключенного к баллону с манометром; тестируемого материала; микробиологического пробоотборника; откалиброванного расходомера воздуха; компрессора (вакуумный насос).
Положительный контроль осуществляли путем просасывания воздуха, содержащего аэрозоль из суспензии микроорганизмов без испытуемого образца и подсчета выросших колоний на чашке с агаром.
Моделирование бактериального заражения проводили следующим образом: включив вакуумный насос, регулировали расход образованной аэрозоли из 5 мл суспензии, в котором содержалась заданная исходная концентрация микроорганизмов, протянутой через импактор. Пробу воздуха объемом 100 л отбирали в течение 1 мин. Поддерживали поток воздуха через импактор в течение 1 мин. Затем вынимали чашки из импактора. Убеждались в том, что каждая чашка пронумерована с указанием положения в импакторе. Использованные в качестве фильтра отработанные исследуемые образцы масок помещали на соответствующие питательные среды той стороной, которая не контактировала с аэрозолью, содержащей микроорганизмы. В первой части эксперимента использованные образцы масок помещались в физиологический раствор с пептоном и бусами, встряхивались в течение 10 минут, после чего делали высев на питательные агар ТСА и термостатировали при температуре (36±2)°С в течении 24-48 часов. Чашки с питательной средой после проведения исследований вынимали из импактора и помещали в термостат с последующим термостатированием при температуре (36±2)°С в течение (48±4) ч. Затем проводили обеззараживание прибора и производственный контроль. Далее стерильные чашки с питательной средой помещали в импактор, фиксировали образец и повторяли описанную процедуру для каждого испытуемого образца. После испытания каждого образца выполняли положительный контроль.
В способе 2 в соответствии с пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» проводили с помощью контактных пластин или слайдов с затвердевшей питательной средой, используемой для каждого тестируемого микроорганизма, которая прижималась к поверхности для адгезии живых микроорганизмов к этой среде. Пластины и слайды инкубировались до появления колоний, которые затем подсчитывали.
Результаты непосредственно относятся к поверхности контакта с твердой питательной средой. Процедура приготовления суспензии микроорганизмов предусматривает контроль наличия живых микроорганизмов в элюенте. Контактные пластины и слайды обычно применяются только для плоских поверхностей или поверхностей правильной формы. В работе использовали стерильные обработанные предметные стекла.
Определенное количество данного разведения распределяли на поверхности твердой питательной среды с помощью шпателя. Количество суспензии, распределенное на поверхности среды поглощено средой так, чтобы образовались отдельные колонии; условие абсорбции определяет объем суспензии, который может использоваться на чашке Петри. Отдельные части суспензии (аликвоты) каждого разведения смешивали с расплавленным агаром при температуре, не превышающей 45°С, которые затвердевали на пластине, и размещали в стерильных чашках Петри. Залитую чашку инкубировали и подсчитывали колонии.
При достаточном количестве элюента делали ряд последовательных разведений, которые инокулировали в питательную среду так, чтобы часть инокулированной среды не дала видимого роста при последующей инкубации. Статистическая обработка числа разведений, в которых наблюдается рост, обеспечивает оценку исходного количества микроорганизмов. Проводили вычисление эффективности в отношение полученного титра путем расчета титра исходного инокулята к полученному на пластинах.
Для исключения контаминации воздуха микроорганизмами из внешней среды работы проводили в аэрозольной камере, в качестве которой использовали БМБ-III-«Ламинар-С»-0,9 PROTECT - бокс III класса биологической безопасности, согласно ГОСТ Р ЕН 12469, NSF/ANSI 49 с двухступенчатой очисткой воздуха, поступающего в рабочую камеру через предварительный фильтр грубой очистки G4 и приточный НЕРА-фильтр H14, расположенный над рабочей камерой и двухступенчатой очисткой воздуха, удаляемого из бокса через два последовательно установленных выпускных НЕРА-фильтра H14 с двумя вентиляторами для удаления воздуха со следующими параметрами: класс чистоты воздуха в рабочей камере по концентрации взвешенных частиц (аэрозолей)» по ГОСТ Р ИСО 14644-1-2017 соответствовал ИСО 5; класс установленных НЕРА-фильтров согласно ГОСТ Р ЕН 1822-1 - H14; минимальное отрицательное давление в рабочей камере 200 Па.
На Рис. 3 представлен используемый в работе в качестве аэрозольной камеры бокс III класса биологической безопасности.
При проведении исследований перед началом работ проводили контроль производственной среды - воздух и смывы с поверхностей ламинарного бокса, персонала, оборудования на предмет отсутствия микробной контаминации, а также осуществляли контроль качества питательных и дифференциальных сред, используемых в работе (ТСА, Сабуро, Эндо, ЖСА) и контроль воздуха и поверхностей после проведения дезобработки перед началом каждого нового этапа экспериментальных исследований.
Каждый подготовленный к исследованию образец подвергался двустороннему обеззараживанию с использованием ультрафиолета. Каждая сторона обрабатывалась в ламинарном боксе в течение 15 минут УФ-лампой, расположенной в верхней части рабочей зоны (30 Вт).
Для имитации микробного загрязнения использовали 24 часовые бактериальные и грибковые культуры тест-штаммов официальных российских и международных (АТСС) коллекций микроорганизмов, выращенные на питательном агаре при температуре (36±2)°С с типичными биохимическими свойствами: Escherichia coli 1257, Staphylococcus aureus 906, Enterococcus faecalis 29215 ATCC, Klebsiella pneumonia 700603 137474ATCC, Salmonella enteritidis 5765, Pseudomonas aeruginosa 10145 ATCC, Candida albicans 24433 ATCC.
Дополнительно проводили контроль каждой суспензии микроорганизмов, контролируя наличие роста и титра микроорганизмов из суспензии и после распыления аэрозоля с микроорганизмами.
Для приготовления миллиардной взвеси суточных культур использовали физиологический раствор и физиологический раствор с пептоном, титровали в соответствии с МУ 2.1.4.1057-01. Для инфицирования воздуха использовали исходную концентрацию микроорганизмов в аэрозоле 104 - 105 КОЕ/мл и приближенную к натурной концентрацию 102 - 103 КОЕ/мл.
Исследования проводили с каждой культурой индивидуально.
Из готовых масок вырезали испытуемые образцы (далее образцы), каждый из которых соответствовал размеру 90×90 мм (по диаметру чашек Петри, используемых в исследовании). В исследованиях использовали опытные образцы, соблюдая все слои маски в том порядке, в котором они находятся в готовой маске.
Каждый испытуемый образец до начала испытаний выдерживали при температуре (21±5)°С и влажности воздуха (45±5) %.
При проведении исследований использовали оборудование, имеющее метрологическую поверку.
Исходная концентрация микроорганизмов в аэрозоли составляла 104 - 105 КОЕ/мл.
Исходя из того, что микробная флора полости рта в норме состоит из стафилококков 103-104 КОЕ/мл, дрожжеподобных грибов 102-103 КОЕ/мл, Klebsiella и Escherichia 10-102 КОЕ /мл, Pseudomonas в норме не определяется, поэтому для исходного заражения при проведении исследования предлагаемым способом использовали исходную концентрацию 103-104 КОЕ /мл для определения снижения задержки бактериального роста. Для проведения исследований использовали такой же принцип, что и при исследовании Способом 1, однако стремились к условиям максимально приближенным к естественным условиям с применением прибора для микробиологического контроля воздуха AirPort (Sartorius), предназначенного для отбора и измерения проб воздуха рабочей зоны, жилых и общественных помещений, с заданным прохождением объема воздуха через поглотитель для последующего аналитического контроля по установленным значениям расхода и времени отбора.
Маски после фильтрации помещали в 10 мл физиологического раствора с пептоном и стерильными бусами. Каждый фильтр отбивался в течение 10 минут, после чего делали высев на питательные агар ТСА и термостатировали при температуре (36±2)°С в течение 24-48 часов. В результате было установлено, что в толще маски (при использовании Способа 1 не представилось возможным определить в какой части маски происходила задержка микроорганизмов) содержались бактерии E.coli в концентрации n × 103-4 КОЕ/м3. Соответственно при разбрызгивании аэрозоля часть микроорганизмов 10-102 КОЕ/мл могла осесть на поверхностях шестиступенчатого каскадного импактора или в единичных случаях пройти сквозь толщу маски под создаваемым напором. Образцы масок после каждого эксперимента проверялись на предмет содержания в толще маски тест-микроорганизмов, с которыми проводили исследования и были получены аналогичные результаты - n × 103-4 KOE/м3.
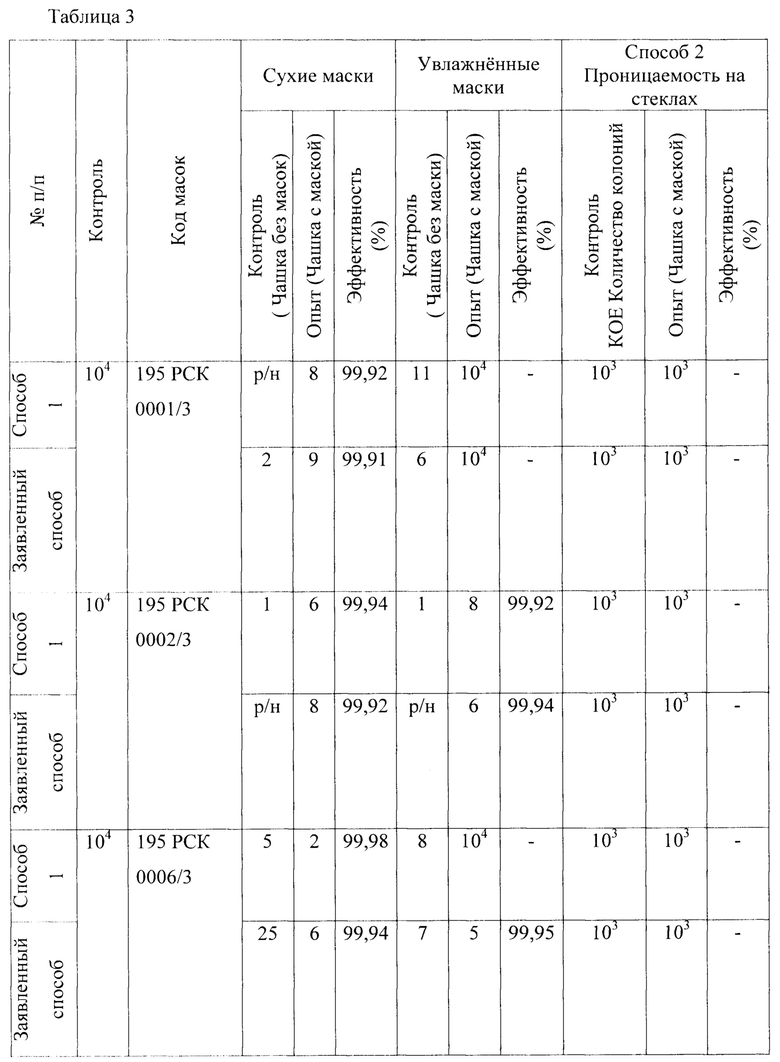
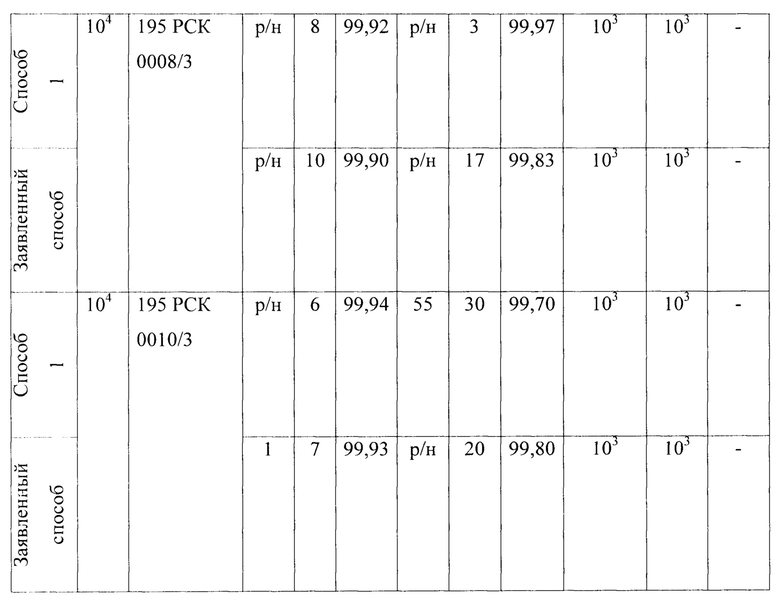
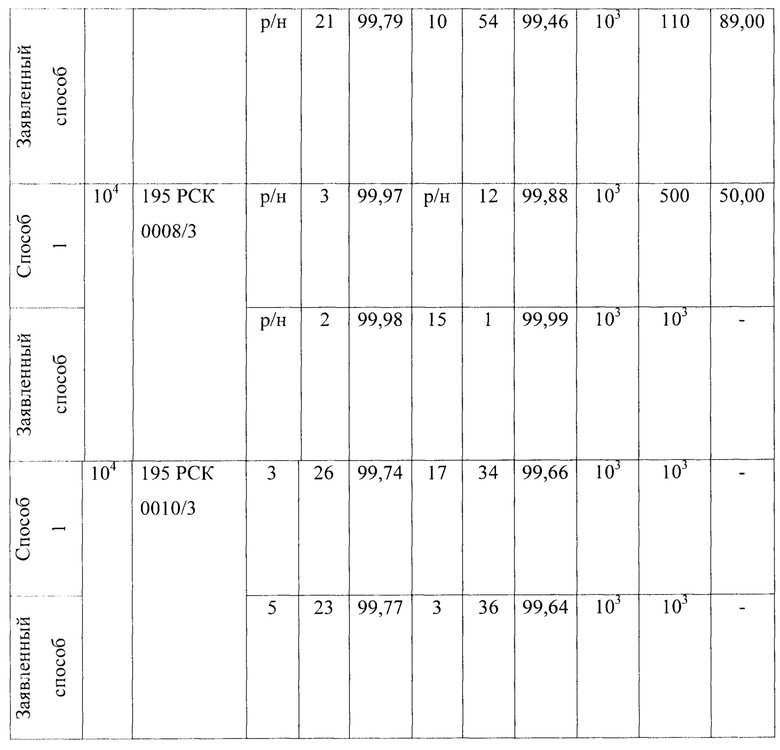
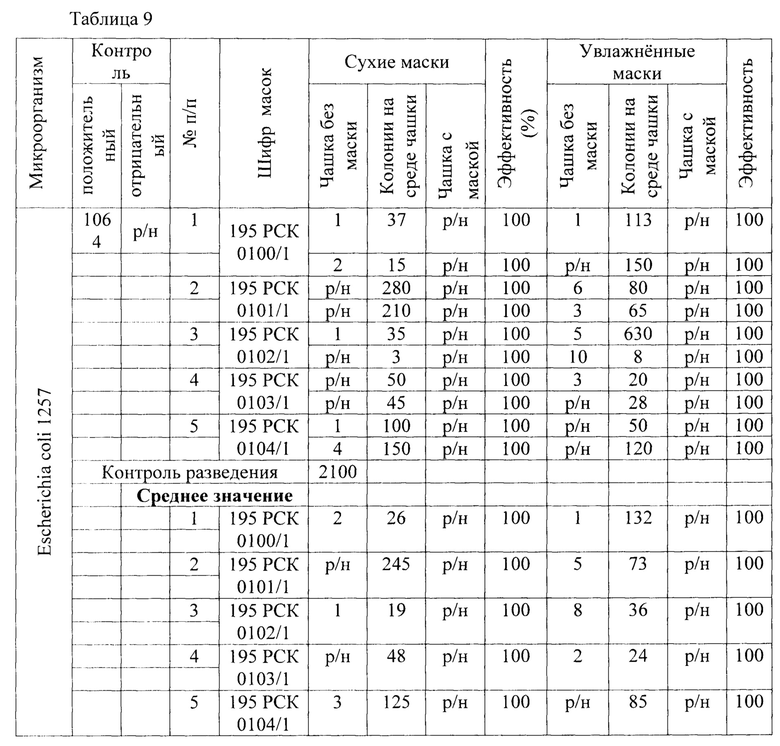
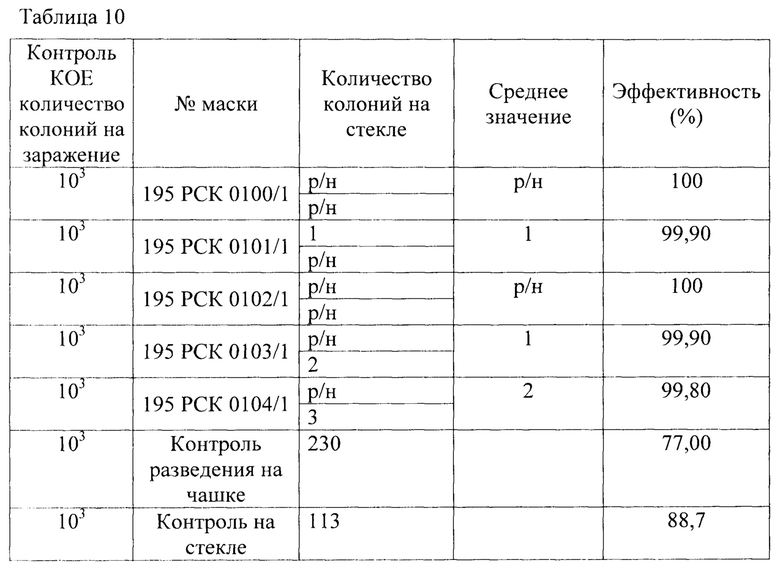
В качестве первого микроорганизма был взят Е. coli - факультативный анаэроб, грамотрицательная палочка со слегка закругленными концами, не образующая спор, размером 0,4-0,8 × 1-3 мкм, объем клетки около 0,6-0,7 мкм3. Результаты проведения исследований приведены в Таблице 1 - исследования проницаемости сухих и увлажненных масок микроорганизмом Escherichia coli 1257 первым способом, вторым способом (по проницаемости на стекле) и предлагаемым способом.
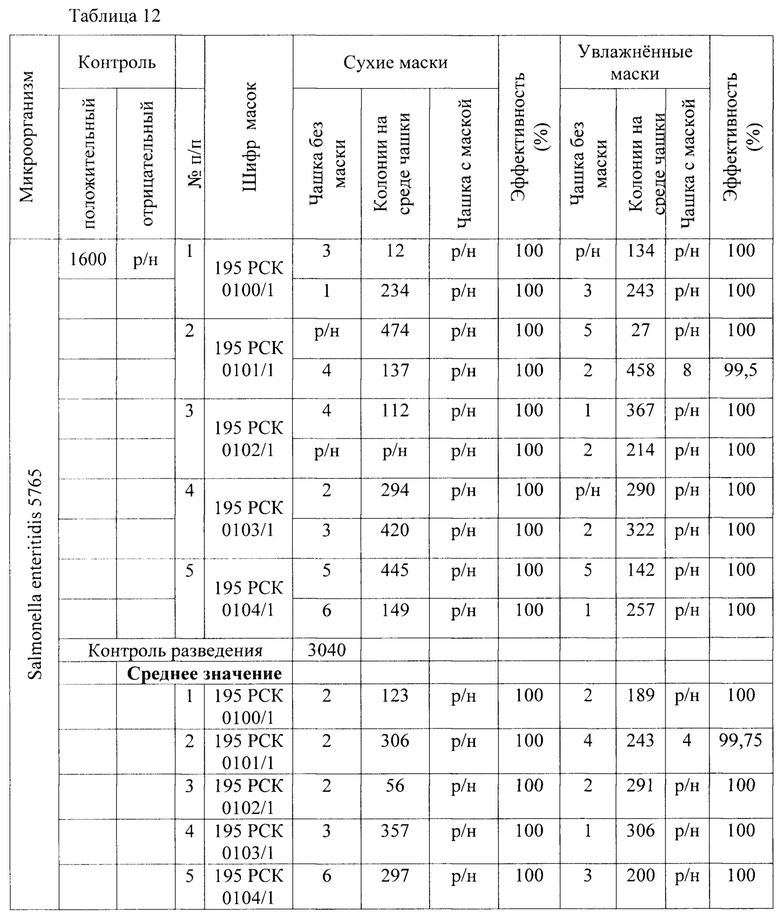
В качестве второго микроорганизма - Salmonella enteritidis - грамотрицательные, факультативные анаэробы, род неспороносных бактерий, имеющих форму палочек, длина которых 1-7 мкм, ширина около 0,3-0,7 мкм. Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Salmonella enteritidis 5765 первым, вторым и предлагаемым способами представлены в Таблице 2.
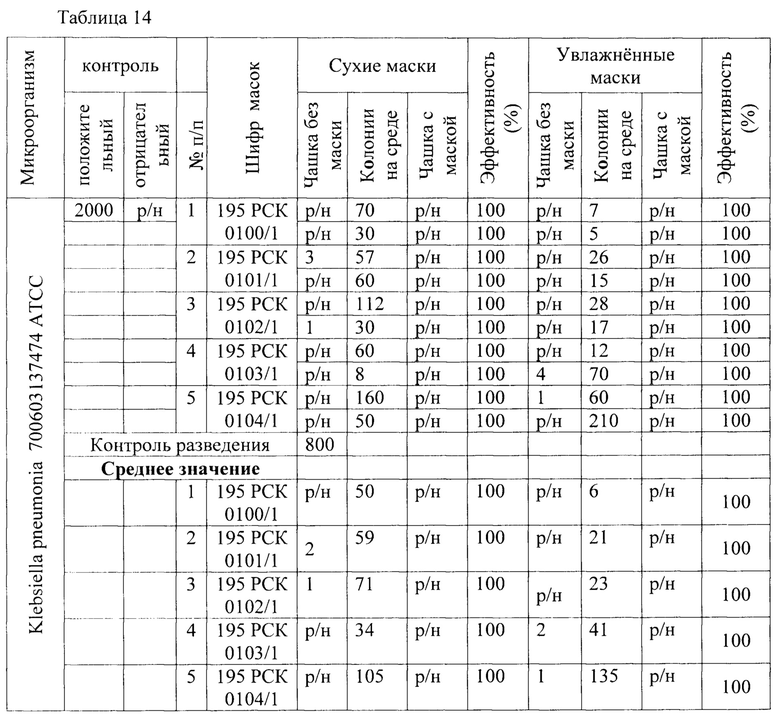
В качестве третьего микроорганизма был взят Klebsiella pneumoniae - грамотрицательные факультативно-анаэробные палочковидные капсульные неподвижные бактерии, относящийся к роду клебсиелл, прямые грамотрицательные палочки (0,3-1,0×0,6-6,0 мкм). Результаты представлены в Таблице 3 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Klebsiella pneumonia 700603137474 АТСС первым, вторым и предлагаемым способами.
В качестве четвертого микроорганизма - Pseudomonas aeruginosa -аэробные неспорообразующие бактерии, грамотрицательные подвижные палочковидные бактерии, имеющие форму прямых или изогнутых палочек длиной 1-5×0,5-1,0 мкм. Результаты представлены в Таблице 4 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Pseudomonas aeruginosa 10145 ATCC первым, вторым и предлагаемым способами.
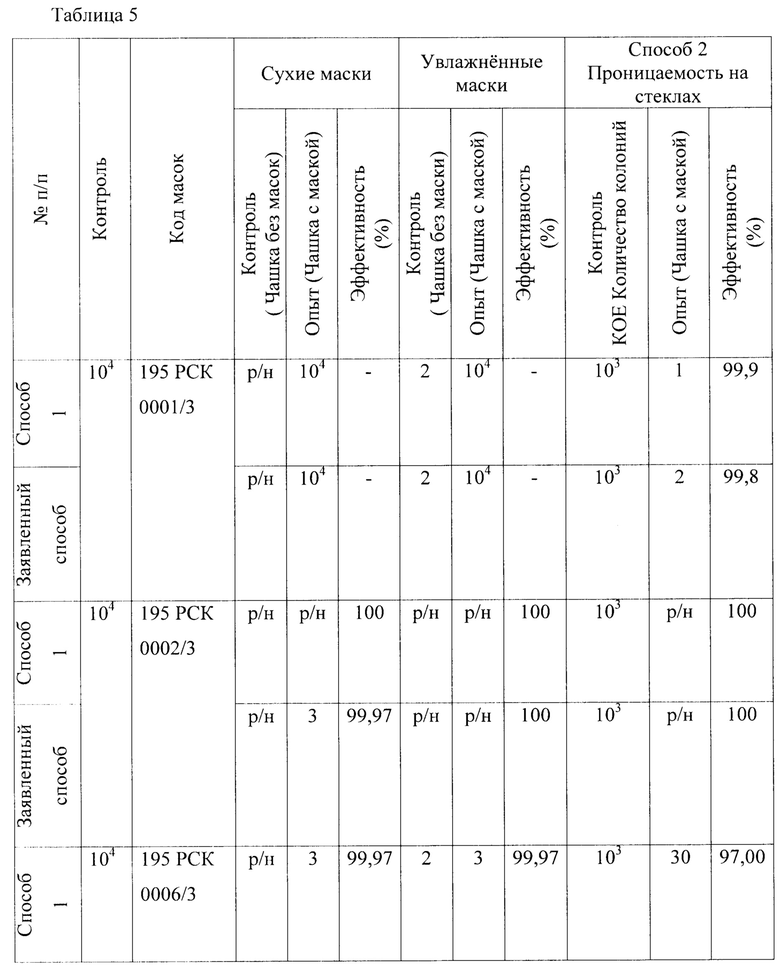
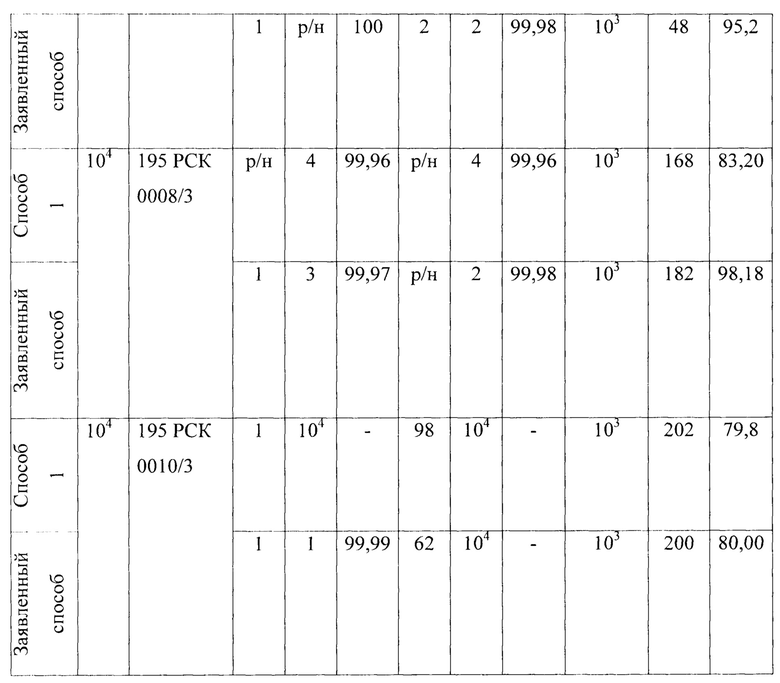
В качестве пятого микроорганизма был взят Staphylococcus aureus - факультативно анаэробные грамположительные кокки, неподвижные, каталазо- и коагулазоположительные, представлены неподвижными клетками диаметром 0,5-1,5 мкм. Результаты исследований представлены в Таблице 5 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Staphylococcus aureus 906 первым, вторым и предлагаемым способами.
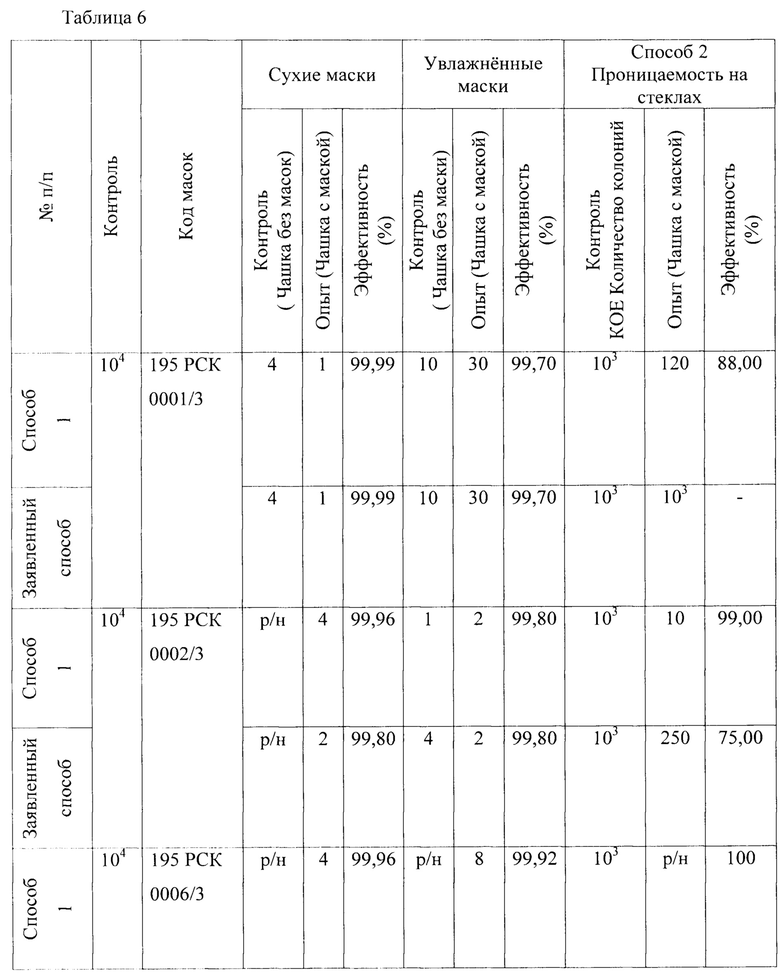
В качестве шестого микроорганизма был взят Enterococcus faecalis - факультативные анаэробы, спор не образуют, шаровидные или овальные бактерии диаметром 0,5-1 мкм. Результаты исследований представлены в Таблице 6.
В качестве седьмого микроорганизма выбран гриб Candida albicans - дрожжеподобные грибки рода Candida - одноклеточные микроорганизмы размером 6-10 мкм. Результаты исследований представлены в Таблице 7 -Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Candida albicans 24433 АТСС первым, вторым и предлагаемым способами. ВЫВОДЫ.
На основании исследований, проведенных тремя способами получены сопоставимые результаты:
1. Установлено, что маски с шифрами: 195 РСК 0001/3; 195 РСК 0006/3; 195 РСК 0008/3; 195 РСК 0010/3 после стирки теряют свою эффективность по отношению к задержанию используемых грамположительных и грамотрицательных бактерий (Escherichia coli 1257, Enterococcus faecalis 29215 ATCC, Staphylococcus aureus 906, Klebsiella pneumonia 700603 137474ATCC, Salmonella enteritidis 5765, Pseudomonas aeruginosa 10145 ATCC), исключение составляет только Candida albicans 24433 ATCC для четырех образцов масок 195 РСК 0001/3; 195 РСК 0002/3; 195 РСК 0006/3; 195 РСК 0008/3, которая является более крупным объектом и поэтому задерживается на поверхности масок.
2. Установлено, что более эффективна (100%) в сухом и в увлажненном виде в отношении Staphylococcus aureus 906 и Escherichia coli 1257 является маска после стирки под шифром 195 РСК 0002/3, что также подтверждено с применением метода проницаемости этой маски на стекле.
Пример 2
Исследования проводили на образцах, в качестве которых использовали гигиенические маски, как средства индивидуальной защиты, приобретенные в аптеках и магазинах различных производителей. Образцам масок присваивали шифр.
Исследования каждого образца масок проводили в трех повторностях в сухом и предварительно смоченном в течение 1 минуты в дехлорированной стерильной водопроводной воде виде.
Для валидации заявленного способа использовали способ, указанный в ГОСТ ISO 11737-1-2012 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции и в ГОСТР 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT) (далее способ 1) и пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» (далее способ 2).
Способ 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT), в качестве прибора для вакуумного фильтрования использовали каскадный импактор, принцип действия которого основан на создании перепада давления со стабильными параметрами (рис. 2), за счет которого отбираемая проба воздуха, содержащая суспензию с заданным титром микроорганизмов подавалась на поверхность маски в виде аэрозоля и просасывалась через прибор с учетом измерения протягиваемого объема воздуха. Значение объема отбираемой пробы воздуха было пропорционально времени отбора и расхода распыления суспензии. По достижении заданного просасываемого объема воздуха аспиратор автоматически выключался. Эффективность бактериальной фильтрации маски представляет собой определение числа КОЕ, проходящих через материал маски, выраженный в процентах от числа КОЕ присутствующих в аэрозоле приготовленной суспензии микроорганизмов и контролирующийся путем подсчета выросших колоний на чашке с агаром. Бактериальную суспензию помещали в распылитель с помощью шприцевого насоса.
На Рис. 2 представлен используемый прибор для проведения исследования по оценке эффективности бактериальной фильтрации масок Способом 1, собранный по схеме с учетом приводного механизма; распылителя взвеси бактерий; аэрозольной камеры; источника воздуха высокого давления подключенного к баллону с манометром; тестируемого материала; микробиологического пробоотборника; откалиброванного расходомера воздуха; компрессора (вакуумный насос).
Положительный контроль осуществляли путем просасывания воздуха, содержащего аэрозоль из суспензии микроорганизмов без испытуемого образца и подсчета выросших колоний на чашке с агаром.
Моделирование бактериального заражения проводили следующим образом: включив вакуумный насос, регулировали расход образованной аэрозоли из 5 мл суспензии, в котором содержалась заданная исходная концентрация микроорганизмов, протянутой через импактор. Пробу воздуха объемом 100 л отбирали в течение 1 мин. Поддерживали поток воздуха через импактор в течение 1 мин. Затем вынимали чашки из импактора. Убеждались в том, что каждая чашка пронумерована с указанием положения в импакторе. Использованные в качестве фильтра отработанные исследуемые образцы масок помещали на соответствующие питательные среды той стороной, которая не контактировала с аэрозолью, содержащей микроорганизмы. В первой части эксперимента использованные образцы масок помещались в физиологический раствор с пептоном и бусами, встряхивались в течение 10 минут, после чего делали высев на питательные агар ТСА и термостатировали при температуре (36±2)°С в течении 24-48 часов. Чашки с питательной средой после проведения исследований вынимали из импактора и помещали в термостат с последующим термостатированием при температуре (36±2)°С в течение (48±4) ч. Затем проводили обеззараживание прибора и производственный контроль. Далее стерильные чашки с питательной средой помещали в импактор, фиксировали образец и повторяли описанную процедуру для каждого испытуемого образца. После испытания каждого образца выполняли положительный контроль.
В способе 2 в соответствии с пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» проводили с помощью контактных пластин или слайдов с затвердевшей питательной средой, используемой для каждого тестируемого микроорганизма, которая прижималась к поверхности для адгезии живых микроорганизмов к этой среде. Пластины и слайды инкубировались до появления колоний, которые затем подсчитывали.
Результаты непосредственно относятся к поверхности контакта с твердой питательной средой. Процедура приготовления суспензии микроорганизмов предусматривает контроль наличия живых микроорганизмов в элюенте. Контактные пластины и слайды обычно применяются только для плоских поверхностей или поверхностей правильной формы. В работе использовали стерильные обработанные предметные стекла.
Определенное количество данного разведения распределяли на поверхности твердой питательной среды с помощью шпателя. Количество суспензии, распределенное на поверхности среды поглощено средой так, чтобы образовались отдельные колонии; условие абсорбции определяет объем суспензии, который может использоваться на чашке Петри. Отдельные части суспензии (аликвоты) каждого разведения смешивали с расплавленным агаром при температуре, не превышающей 45°С, которые затвердевали на пластине, и размещали в стерильных чашках Петри. Залитую чашку инкубировали и подсчитывали колонии.
При достаточном количестве элюента делали ряд последовательных разведений, которые инокулировали в питательную среду так, чтобы часть инокулированной среды не дала видимого роста при последующей инкубации. Статистическая обработка числа разведений, в которых наблюдается рост, обеспечивает оценку исходного количества микроорганизмов. Проводили вычисление эффективности в отношение полученного титра путем расчета титра исходного инокулята к полученному на пластинах.
Для исключения контаминации воздуха микроорганизмами из внешней среды работы проводили в аэрозольной камере, в качестве которой использовали БМБ-III-«Ламинар-С»-0,9 PROTECT - бокс III класса биологической безопасности, согласно ГОСТ Р ЕН 12469, NSF/ANSI 49 с двухступенчатой очисткой воздуха, поступающего в рабочую камеру через предварительный фильтр грубой очистки G4 и приточный НЕРА-фильтр H14, расположенный над рабочей камерой и двухступенчатой очисткой воздуха, удаляемого из бокса через два последовательно установленных выпускных НЕРА-фильтра H14 с двумя вентиляторами для удаления воздуха со следующими параметрами: класс чистоты воздуха в рабочей камере по концентрации взвешенных частиц (аэрозолей)» по ГОСТ Р ИСО 14644-1-2017 соответствовал ИСО 5; класс установленных НЕРА-фильтров согласно ГОСТ Р ЕН 1822-1 - H14; минимальное отрицательное давление в рабочей камере 200 Па.
На Рис. 3 представлен используемый в работе в качестве аэрозольной камеры бокс III класса биологической безопасности.
При проведении исследований перед началом работ проводили контроль производственной среды - воздух и смывы с поверхностей ламинарного бокса, персонала, оборудования на предмет отсутствия микробной контаминации, а также осуществляли контроль качества питательных и дифференциальных сред, используемых в работе (ТСА, Сабуро, Эндо, ЖСА) и контроль воздуха и поверхностей после проведения дезобработки перед началом каждого нового этапа экспериментальных исследований.
Каждый подготовленный к исследованию образец подвергался двустороннему обеззараживанию с использованием ультрафиолета. Каждая сторона обрабатывалась в ламинарном боксе в течение 15 минут УФ-лампой, расположенной в верхней части рабочей зоны (30 Вт).
Для имитации микробного загрязнения использовали 24 часовые бактериальные и грибковые культуры тест-штаммов официальных российских и международных (АТСС) коллекций микроорганизмов, выращенные на питательном агаре при температуре (36±2)°С с типичными биохимическими свойствами: Escherichia coli 1257, Staphylococcus aureus 906, Enterococcus faecalis 29215 ATCC, Klebsiella pneumonia 700603 137474ATCC, Salmonella enteritidis 5765, Pseudomonas aeruginosa 10145 ATCC, Candida albicans 24433 ATCC.
Дополнительно проводили контроль каждой суспензии микроорганизмов, контролируя наличие роста и титра микроорганизмов из суспензии и после распыления аэрозоля с микроорганизмами.
Для приготовления миллиардной взвеси суточных культур использовали физиологический раствор и физиологический раствор с пептоном, титровали в соответствии с МУ 2.1.4.1057-01. Для инфицирования воздуха использовали исходную концентрацию микроорганизмов в аэрозоле 104 -105 КОЕ/мл и приближенную к натурной концентрацию 102 -103 КОЕ/мл.
Исследования проводили с каждой культурой индивидуально.
Из готовых масок вырезали испытуемые образцы (далее образцы), каждый из которых соответствовал размеру 90×90 мм (по диаметру чашек Петри, используемых в исследовании). В исследованиях использовали опытные образцы, соблюдая все слои маски в том порядке, в котором они находятся в готовой маске.
Каждый испытуемый образец до начала испытаний выдерживали при температуре (21±5)°С и влажности воздуха (45±5) %.
При проведении исследований использовали оборудование, имеющее метрологическую поверку.
Исходная концентрация микроорганизмов в аэрозоли составляла 104 - 105 КОЕ/мл.
Маски после фильтрации помещали в 10 мл физиологического раствора с пептоном и стерильными бусами. Каждый фильтр отбивался в течение 10 минут, после чего делали высев на питательные агар ТСА и термостатировали при температуре (36±2)°С в течение 24-48 часов. В результате было установлено, что в толще маски (при использовании Способа 1 не представилось возможным определить в какой части маски происходила задержка микроорганизмов) содержались бактерии E.coli в концентрации n × 103-4 КОЕ/м3. Соответственно при разбрызгивании аэрозоля часть микроорганизмов 10-102 КОЕ/мл могла осесть на поверхностях шестиступенчатого каскадного импактора или в единичных случаях пройти сквозь толщу маски под создаваемым напором. Образцы масок после каждого эксперимента проверялись на предмет содержания в толще маски тест-микроорганизмов, с которыми проводили исследования и были получены аналогичные результаты - n × 103-4 КОЕ/м3.
Результаты исследования проницаемости сухих и увлажненных масок с использованием микроорганизма Escherichia coli 1257, выполненные способом 1 в соответствии с ГОСТР 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung». IDT) приведены в Таблице 8.
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Escherichia coli 1257 по заявленному способу представлены в Таблице 9.
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Escherichia coli 1257 2 в соответствии со способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле представлены в Таблице 10.
В результате сравнительной оценки при применении трех способов (Способ 1, Способ 2 и заявляемый способ) выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Escherichia coli 1257.
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Salmonella enteritidis 5765 представлены в Таблицах 11-13.
Таблица 11 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Salmonella enteritidis 5765 способом 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und Prufverfahren; Deutsche Fassung» IDT).
Таблица 12 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Salmonella enteritidis 5765 заявленным способом.
Таблица 13 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Salmonella enteritidis 5765 способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех способов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Salmonella enteritidis 5765.
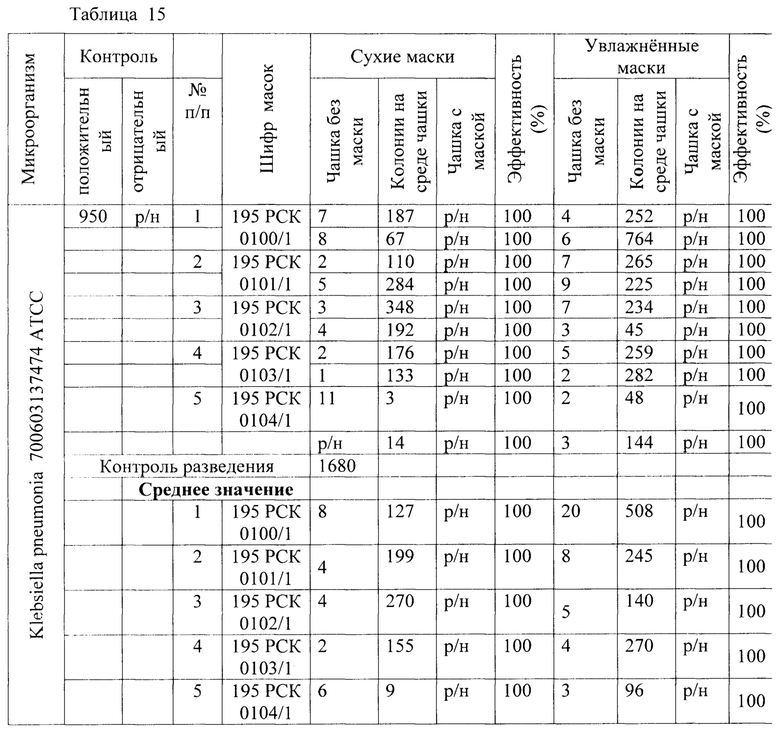
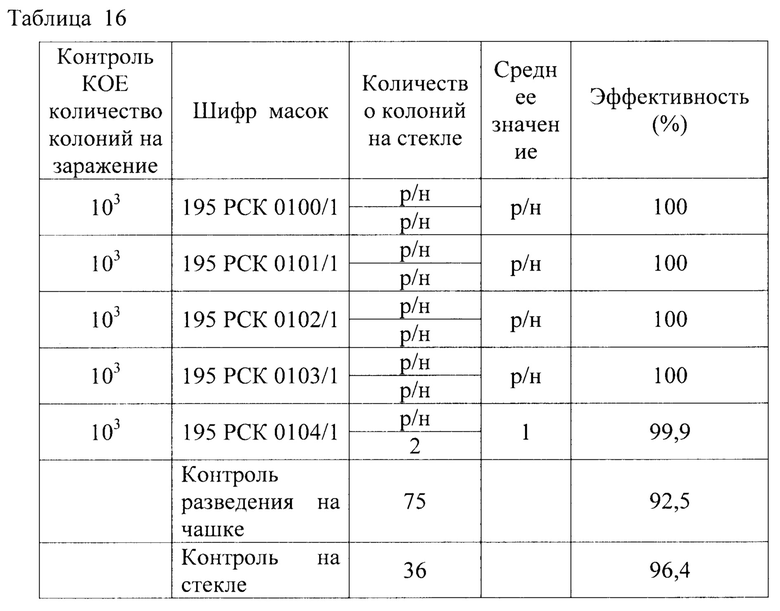
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Klebsiella pneumoniae представлены в Таблицах 14-16.
Таблица 14 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Klebsiella pneumonia 700603137474 АТСС способом 1 в соответствии с ГОСТР 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und PrufVerfahren; Deutsche Fassung» IDT).
Таблица 15 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Klebsiella pneumonia 700603137474 АТСС заявленным способом.
Таблица 16 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Klebsiella pneumonia 700603137474 АТСС способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех методов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Klebsiella pneumonia 700603137474 АТСС.
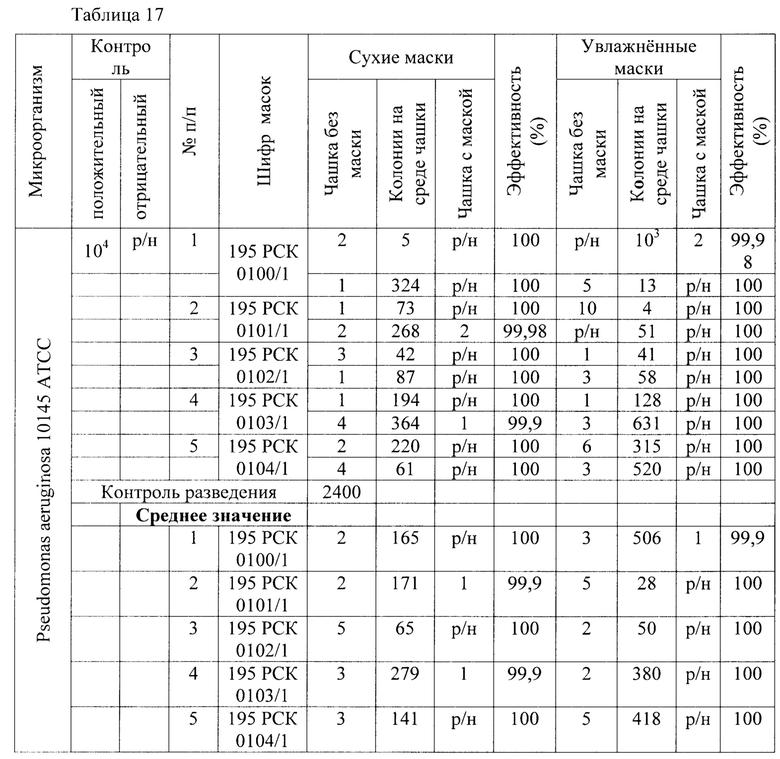
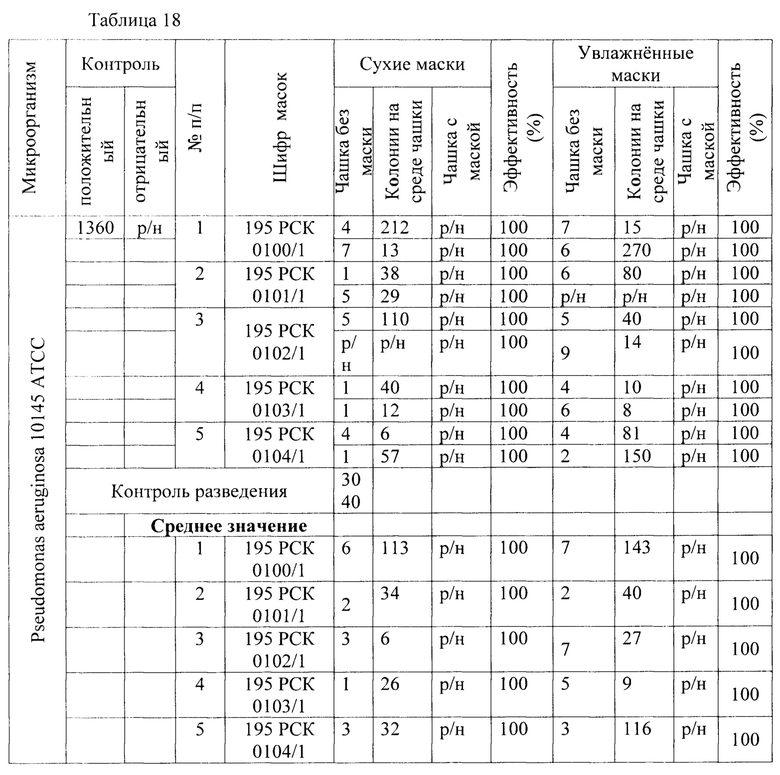
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Pseudomonas aeruginosa представлены в Таблицах 17-19.
Таблица 17 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Pseudomonas aeruginosa 10145 АТСС способом 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und PrufVerfahren; Deutsche Fassung» IDT).
Таблица 18 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Pseudomonas aeruginosa 10145 АТСС заявленным способом.
Таблица 19 - -Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Pseudomonas aeruginosa 10145 АТСС способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1
Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех методов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Pseudomonas aeruginosa 10145 АТСС.
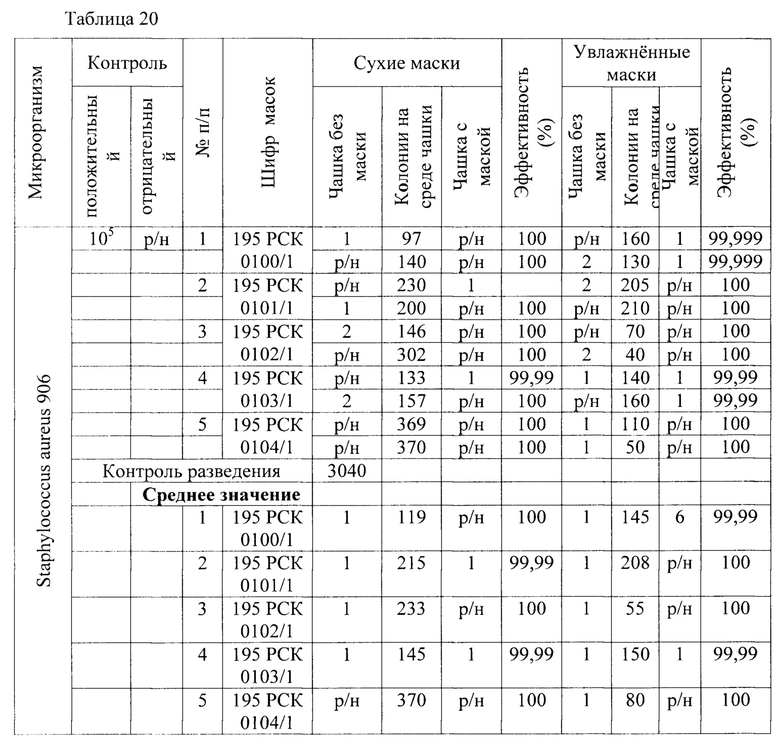
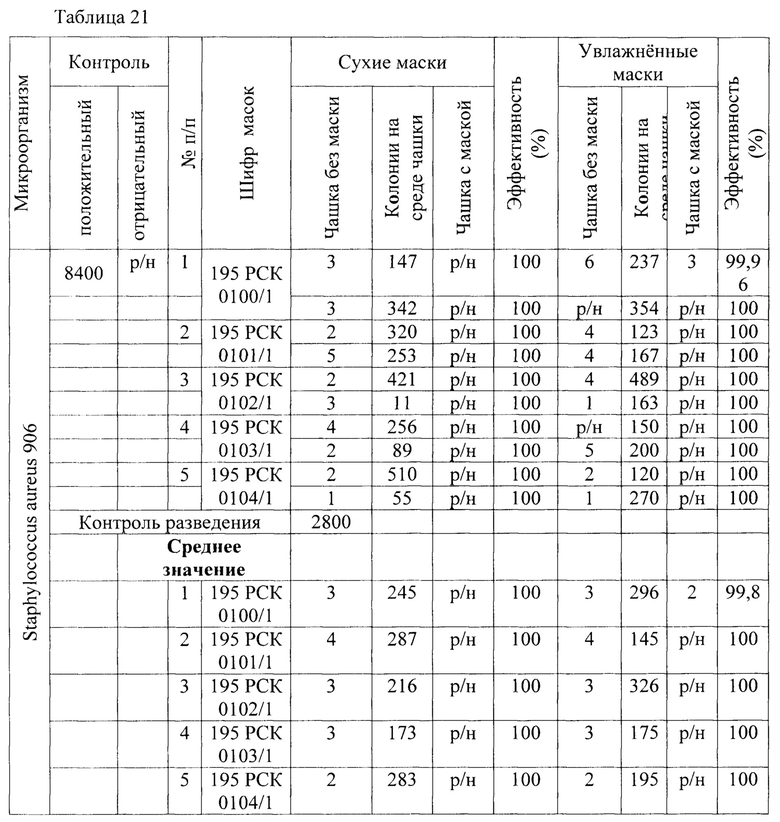
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Staphylococcus aureus 906 представлены в Таблицах 20-22.
Таблица 20 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Staphylococcus aureus 906 способом 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und PrufVerfahren; Deutsche Fassung» IDT).
Таблица 21 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Staphylococcus aureus 906 заявленным способом.
Таблица 22 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Staphylococcus aureus 906 способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех методов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Staphylococcus aureus 906.
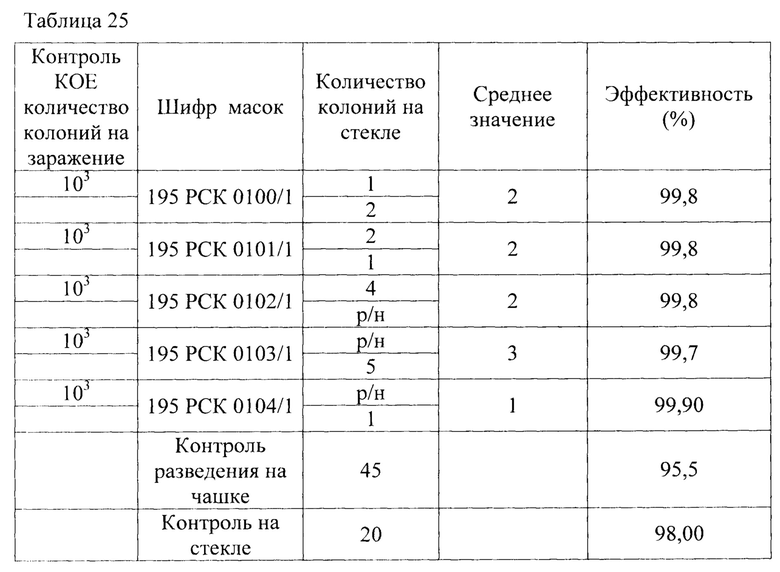
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Enterococcus faecalis представлены в Таблицах 23-25.
Таблица 23 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Enterococcus faecalis 29215 АТСС способом 1 в соответствии с ГОСТ Р 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und PrufVerfahren; Deutsche Fassung» IDT).
Таблица 24 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Enterococcus faecalis 29215 АТСС заявленным способом.
Таблица 25 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Enterococcus faecalis 29215 АТСС способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех методов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой не пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Enterococcus faecalis 29215 АТСС.
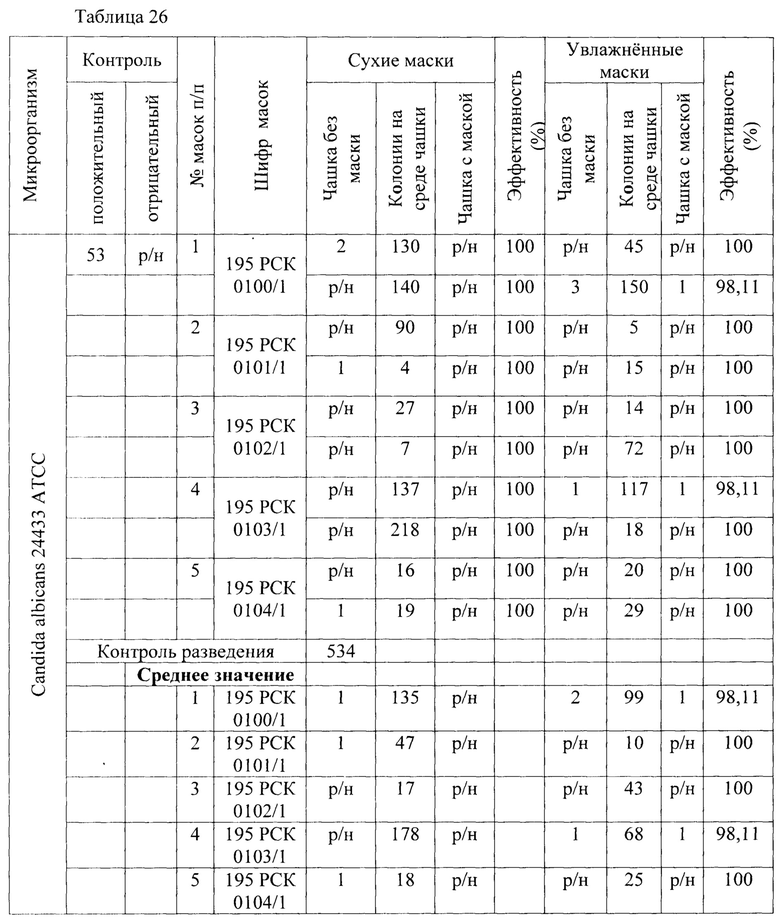
Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Candida albicans представлены в Таблицах 26-28.
Таблица 26 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Candida albicans 24433 АТСС способом 1 в соответствии с ГОСТР 58396-2019 национальный стандарт российской федерации «Маски медицинские. Требования и методы испытаний» (DIN EN 14683:2014 «Medizinische Gesichtsmasken - Anforderungen und PrufVerfahren; Deutsche Fassung» IDT).
Таблица 27 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Candida albicans 24433 АТСС заявленным способом.
Таблица 28 - Результаты исследования проницаемости сухих и увлажненных масок микроорганизмом Candida albicans 24433 АТСС способом 2 по пп. А.4.2.6.1., А.4.2.6.4 ГОСТ ISO 11737-1-2012 «Стерилизация медицинских изделий. Микробиологические методы. Часть 1 Оценка популяции микроорганизмов на продукции» по проницаемости на стекле.
В результате сравнительной оценки при применении трех методов выявлено, что представленные на исследование гигиенические маски, прошедшие обработку стиркой пригодны для дальнейшего использования как средства индивидуальной защиты в отношении Candida albicans 24433 АТСС.
ВЫВОДЫ.
На основании исследований, проведенных тремя методами, получены сопоставимые результаты:
1) Установлено, что маски с шифрами: 195 РСК 0100/1; 195 РСК 0101/1; 195 РСК 0102/1; 195 РСК 0103/1; 195 РСК 0104/1 после стирки не теряют свою эффективность по отношению к задержанию используемых грамположительных и грамотрицательных бактерий и дрожжеподобных грибов (Escherichia coli 1257, Staphylococcus aureus 906, Klebsiella pneumonia 700603 137474ATCC, Salmonella enteritidis 5765, Pseudomonas aeruginosa 10145 ATCC, Enterococcus faecalis 29215 ATCC, Candida albicans 24433 ATCC).
2) Установлено, что в результате исследований по определению эффективности средств индивидуальной защиты, в качестве которых в исследовании использовали гигиенические маски до и после стирки, приобретенные в аптеках и магазинах г. Москвы, тремя разными методами получены сопоставимые результаты, что является неопровержимым доказательством того, что предложенный способ может быть применен для оценки проницаемости тканых и нетканых материалов с целью использования в качестве средств индивидуальной защиты от разных форм бактериального и грибкового заражения воздушно-капельным и контактно-бытовом путем.

















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ сохранения бактерий в фекальной микробиоте и бактериальных культур, выращенных на плотных агаризованных питательных или дифференциальных средах в условиях низких температур с использованием составной среды для заморозки | 2019 |
|
RU2737321C1 |
| Способ длительного сохранения (консервирования) облигатно анаэробных бактерий высушиванием из замороженного состояния | 2023 |
|
RU2822476C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ АКТИВНОСТИ ЗАЩИТНЫХ БИОПРЕПАРАТОВ ПОСЛЕ ТРАНСПОРТИРОВКИ, ДЛИТЕЛЬНОГО ИЛИ НЕПРАВИЛЬНОГО ХРАНЕНИЯ | 2018 |
|
RU2683684C1 |
| Способ получения готовой лекарственной формы пробиотического средства на основе штаммов Bifidobacterium longum subsp. longum и Lacticaseibacillus paracasei subsp. paracasei | 2023 |
|
RU2829576C1 |
| Способ применения бактериофагов для изучения воздушно-капельного пути передачи вирусов медицинскому персоналу при лечении пациентов | 2024 |
|
RU2828726C1 |
| Способ определения проницаемости вирусными частицами ткани и нетканых материалов | 2020 |
|
RU2753610C1 |
| СПОСОБ ОЦЕНКИ АНТИМИКРОБНОГО ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ ДЕЗИНФЕКТАНТОВ НА ОСНОВЕ ПОЛИМЕРОВ | 2023 |
|
RU2807338C1 |
| СПОСОБ АЭРОЗОЛЬНОЙ ДЕЗИНФЕКЦИИ ЗАКРЫТЫХ ПОМЕЩЕНИЙ | 2008 |
|
RU2379058C1 |
| Штамм Bacillus mojavensis Lhv-97, обладающий фунгицидной и бактерицидной активностью | 2017 |
|
RU2648163C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИМИКРОБНОЙ АКТИВНОСТИ ГЕЛЕЙ, СОДЕРЖАЩИХ АНТИБАКТЕРИАЛЬНЫЕ КОМПОНЕНТЫ | 2021 |
|
RU2763590C1 |



Изобретение относится к биотехнологии и микробиологии. Предложен способ определения проницаемости тканых и нетканых материалов - средств индивидуальной защиты от бактериального и грибкового заражения воздушно-капельным и контактно-бытовым путем. Способ включает визуальный осмотр, выбраковку исследуемых образцов с механическими повреждениями, нарезку на лоскуты диаметром 90 мм, дальнейшей стерилизацией в паровом стерилизаторе или УФ-лампой открытого типа; далее лоскуты последовательно размещают на кассеты с питательной средой, устанавливают в прибор Sartorius MD8 AirPort с режимом пропускания воздуха 100 л/мин, накрывают воронкой; время отбора воздуха 1 мин. Затем тестируемый образец, помещенный в чашку Петри с питательной средой, соответствующей тестируемому микроорганизму, и кассету с питательной средой термостатируют при 36±2°С в течение 48±4 ч, подсчитывают число выросших на чашках колоний и рассчитывают эффективность фильтрации по представленной формуле. Изобретение обеспечивает повышение достоверности оценки проницаемости средств индивидуальной защиты человека от бактерий и грибов, распространяемых воздушно-капельным путем. 3 ил., 28 табл., 2 пр.
Способ определения проницаемости тканых и нетканых материалов для использования в качестве средств индивидуальной защиты от бактериального с разным строением клеточной стенки и грибкового заражения воздушно-капельным и контактно-бытовым путем, в котором первоначально осуществляют визуальный осмотр и выбраковку исследуемых образцов с механическими повреждениями, влияющими на проницаемость, отобранные образцы нарезают на лоскуты в форме круга диаметром 90 мм из расчета по 3 лоскута на исследование с каждого образца ткани, которые подвергают либо стерилизации в стеклянных чашках Петри в паровом стерилизаторе в течение 20 мин при температуре 121±1,0°С и давлении 1 Па, либо проводят обеззараживание поверхности ткани УФ-лампой открытого типа в течение 15 мин с каждой из сторон, при этом контроль стерильности образцов осуществляют путем помещения тестируемого образца после обеззараживания в пробирку с тиогликолевой средой с дальнейшей визуальной оценкой на предмет помутнения среды через сутки после термостатирования при температуре инкубации 36±2°С, далее стерильные лоскуты последовательно размещают на портативном приборе для микробиологического контроля воздуха Sartorius MD8 AirPort, расположенного в ламинарном боксе 3 класса опасности с рукавами и НЕРА-фильтром Н14 на выходе, на приборе Sartorius MD8 AirPort размещают кассету с питательной средой и сверху на кассету помещают тестируемый образец таким образом, чтобы ткань покрывала всю поверхность кассеты для предотвращения обходных воздушных потоков, и накрывают воронкой с трубочкой для отвода скопившейся водной суспензии в отдельную емкость и с двумя диаметрами на концах, в одном из которых помещается кассета с тестируемым образцом, а противоположное отверстие используется в устройстве для внесения аэрозоля с микроорганизмами, при этом суспензию микроорганизмов помещают в автоматический диспенсер для разбрызгивания аэрозоля и устанавливают в отверстие в воронке, предназначенное для ее вспрыскивания, затем устанавливают режим для пропускания воздуха через прибор 100 л/мин, включают одновременно автоматический диспенсер и прибор для отбора проб воздуха на время равное 1 мин, по окончании отбора воздуха прибор для отбора воздуха и диспенсер отключают одновременно, воронку снимают, тестируемый образец из чашки Петри снимают стерильным пинцетом и помещают, не переворачивая, в чашку Петри с питательной средой, соответствующей тестируемому микроорганизму, чашки Петри закрывают крышкой и помещают в термостат, посев термостатируют при температуре 36±2°С в течение 48±4 ч, кассету с питательной средой снимают с прибора, закрывают крышкой, переворачивают дном вверх и также помещают в термостат при температуре 36±2°С на 48±4 ч, по истечении положенного времени посевы извлекают из термостата и подсчитывают число выросших на чашках колоний, для каждой суспензии проводят положительный контроль, в качестве которого используют отбор проб воздуха с распылением бактериальной и грибковой суспензии без использования в качестве фильтра тестируемого образца, выполняют также и отрицательный контроль с прохождением воздуха без добавления бактериальной и грибковой суспензии и тестируемого образца ткани, фильтруя воздух в течение 1 мин, оценку результата осуществляют в виде расчета эффективности задержки бактерий и грибов на поверхности тестируемой ткани путем фильтрации для каждого образца в процентах исходя из того, что из ста вычитают сумму частного суммы всех колоний, выросших на чашках с образцами во всех повторностях, к количеству чашек, используемых для исследования, умноженному на сто и разделенному на сумму всех колоний, выросших в контрольных чашках без использования тестируемых образцов в качестве фильтра, умноженного на количество чашек, используемых для исследования.
| Инструмент для фиксации вывороченного века | 1938 |
|
SU58396A1 |
| Маски медицинские | |||
| Требования и методы испытаний | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Стандартинформ | |||
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| Стерилизация медицинских изделий | |||
| Микробиологические методы | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Оценка популяции микроорганизмов на продукции | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| RU 2012127616 A, 10.01.2014 | |||
| Прибор для анализа воздуха | 1988 |
|
SU1546481A1 |
Авторы
Даты
2022-04-14—Публикация
2021-08-23—Подача