Описание группы изобретений
Штамм Meyerozyma (Pichia) guilliermondii (варианты), используемый для изготовления пре-, про- и аутопробиотических препаратов и продуктов для человека и животных, лечебно-профилактическое средство на его основе и способ его получения (варианты)
Область техники
Группа изобретений имеет широкую сферу применения и относится к области биотехнологии, медицины, профилактики заболеваний, реабилитации и сохранения здоровья человека/животных, а также к пищевой, комбикормовой промышленности и ветеринарии.
Уровень техники
Микробиота играет важнейшую роль в обеспечении нормального гомеостаза организма и поддержании здоровья [1, 11]. Это метаболический «орган», который не только участвует в переваривании пищи, но и выделяет различные биологически активные вещества, стимулирует функции врожденного и приобретенного иммунитета, препятствует инвазии патогенных микроорганизмов, выполняет детоксикационную, антиканцерогенную, синтетическую функции [2].
Изменения микробиоты желудочно-кишечного тракта (далее - ЖКТ) при воздействии факторов внешней среды, возраста, рациона, качества пищи, приема антибиотиков могут иметь серьезные последствия. Результаты экспериментальных и клинических исследований показывают, что развитие воспалительных заболеваний кишечника, включая болезнь Крона и язвенный колит, атеросклероза, ожирения, метаболического синдрома, сахарного диабета 2-го типа каузально связаны с дисбиозом кишечника - изменением количественного и видового состава микробиоты [3, 4, 5, 6]. Также наличие определенных бактерий в ней связано с воспалительными молекулами, которые могут вызывать воспаление в различных тканях организма, приводить к каскаду воспалительных путей с участием интерлейкинов и других цитокинов [10]. Кроме того, исследования [12, 13, 14, 15, 20] дают основание предполагать, что микофлора ЖКТ влияет на возникновение и течение нейродегенеративных, онкологических заболеваний.
У многих жителей России, в том числе и у детей, имеет место выраженный дисбаланс нормальной микрофлоры кишечника [21]. С целью поддержания стабильности и нормализации состава микробиоты все чаще применяются про- и пребиотики. Глобальное руководство по пробиотикам и пребиотикам Всемирной организации гастроэнтерологов (WGO) описывает эффективность их применения в лечении и профилактики заболеваний различной природы и локализации [16].
В качестве пробиотиков повсеместно используются лактобактерии и бифидобактерии, так как эти виды микроорганизмов являются основным компонентам нормальной микрофлоры кишечника, способны продуцировать антибиотические вещества, нуклеазы, лизоцим, витамины, усиливают активность макрофагов в организме, стимулируют секрецию антител, цитокинов и так далее [17, 18, 19].
Известны промышленные штаммы лакто- и бифидобактерий, обладающие способностью влиять на физиологические и иммунобиологические процессы в организме, которые используются для приготовления лекарственных препаратов и продуктов питания (препараты, «Линекс», «Бифиформ», «Бифидумбактерин», «Наринэ», «Ацидофилин», патент Евросоюза ЕР 2990045 В1; патент США US 10716817 B2, патент США US 20160129055 A1, патент РФ 2176668 от 01.04.2001 г.; патент РФ 2103354 от 27.01.98 г.; патент РФ 2524117 от 07.08.2013 г. и так далее).
Однако существуют серьезные недостатки у подобных препаратов. При целенаправленном изучении выживаемости бифидобактерий и лактобактерий в составе коммерческих препаратов, в условиях in vitro, имитирующих пищеварение в желудке и кишечнике человека [22, 23, 25, 26], было установлено значительное снижение числа этих пробиотических микроорганизмов при их инкубации в модельных средах - до 4-х порядков. Важным аспектом является использование в части данных исследований натурального желудочного сока и дуоденального содержимого, полученных непосредственно от пациентов, что делает биологические среды максимально приближенными к реальным условиям пищеварения. Кроме того показана низкая кислотоустойчивость капсул пробиотических препаратов -кишечнорастворимые капсулы многих препаратов разрушаются в кислой модельной среде и не защищают пробиотические микроорганизмы от инактивации.
Кроме того, микрофлора кишечника каждого человека индивидуальна и характеризуется сложной структурой, различными межвидовыми соотношениями [9]. Во многих исследованиях отмечается [21, 24, 27], что положительный эффект пробиотиков даже при длительном применении носит транзиторный характер. При этом низкая эффективность пробиотикотерапии связывается с чужеродностью для человека входящих в их состав микроорганизмов. Учитывая существенное снижение численности популяции пробиотических микроорганизмов в результате преодоления защитных барьеров ЖКТ, высокая видовая специфичность индигенной микрофлоры способствует их отторжению.
Необходимость стимуляции собственной кишечной микрофлоры, преимущественно популяций бифидобактерий и лактобактерий, лежит также в основе концепции пребиотической терапии [21, 24, 31, 32]. Установлено, что в случае назначения антибиотиков, а это превалирующее число заболеваний, приоритет следует отдавать препаратам, содержащим в своем составе также инактивированную биомассу микроорганизмов, пребиотические составляющие [36, 37].
Известны композиции для обеспечения колонизационной резистентности микробиоценоза кишечника человека и способы их получения [38, 43]. Композиции состоят из комбинации метаболитов пробиотического штамма Bacillus subtilis ВКПМ № В-2335 или дополнительно включают стерилизованные высушенные культуральные жидкости, содержащие метаболиты Enterococcus faecium L-3, Lactobacillus delbrueckii TS1-06 и Lactobacillus fermentum TS3-06. В качестве пребиотической составляющей используют овсяные хлопья или комплекс полисахаридов (β-глюкан и маннан). Также в состав входят цеолит, стеарат кальция или аэросил. Их использование позволяет нормализовать микробиоценоз кишечника за счет селективного стимулирования роста и размножения лактобацилл и бифидобактерий индигенной составляющей нормофлоры биотопа и обеспечения специфической антагонистической активности в отношении патогенных и условно-патогенных микроорганизмов.
Недостатками заявленных композиций являются ограниченная биологическая активность, выражающаяся в недостаточных уровнях специфической антагонистической активности в отношении ряда патогенных и условно-патогенных микроорганизмов, что связано с использованием в его составе только инактивированных микроорганизмов, то есть отсутствием про- или аутопробиотического действия, невозможность получения быстрого лечебного эффекта, поскольку при стимулировании индигенной микрофлоры ее нарастание происходит не сразу и требует длительного времени приема композиций, отсутствие детоксикационной активности. Также следует отметить необходимость сложной технологической линий для получения композиций и трудоемкость процесса производства ввиду большого количества составляющих.
Симбиотические отношения между пребиотиками и пробиотиками позволяют значительно расширить диапазон действия на здоровье человека: могут проявлять антиканцерогенное и противомикробное действие, иммуномодулирующий и детоксикационный эффекты, улучшать всасывание и баланс минералов, нормализовывать микробиоценозы ЖКТ, предотвращать и лечить воспалительные заболевания ЖКТ [39].
Прорывные технологии сосредоточены на создании, производстве и применении персонализированных препаратов, в том числе лекарственных средств, для точечной коррекции профиля микробиоты. В настоящее время в клиническую практику внедряют новые подходы к нормализации микрофлоры кишечника, связанные в частности со стимуляцией собственной индигенной микрофлоры пациента [7, 8, 21]. Изучаются возможности аутопробиотической терапии на основе аутоштаммов или их ассоциаций [28, 29, 30]. Однако разрабатываемые в настоящее время аутопробиотики готовят в виде молочнокислых заквасок, которые предполагают пероральный прием, а следовательно, они также претерпевают отрицательное воздействие факторов ЖКТ.
При разработке инновационных решений для перорального применения с про- и аутопробиотическими свойствами встает сразу несколько серьезных задач.
Необходимо добиться высокого колонизационного потенциала. Чтобы бактерии, выделенные из конкретной микробиоты или промышленные штаммы, задерживались в кишечнике и пролиферировали в слизистую оболочку кишки, они должны быть в активном физиологическом состоянии и обладать большой сорбционной способностью, позволяющей им фиксироваться на ворсинках кишечника.
Важно получить устойчивый про- или аутопробиотический комплекс. Полезное действие на ЖКТ часто требует сопутствующего введения нескольких штаммов различной природы для расширения диапазона свойств и терапевтического эффекта. По сравнению с монокультурами консорциум более технологичен в практическом использовании. Отметим, что дрожжевые культуры способны образовывать на поверхности клетки капсулу и делать дрожже-бактериальную ассоциацию стабильной к различного рода воздействиям.
Кроме того в условиях быстро меняющейся эпидемиологической обстановки остро стоит вопрос и о детоксикации организма, поддержке, стимуляции иммунитета.
Известны препараты [40, 41], обладающие иммуномодулирующей, энтеросорбционной, антитоксической и противовоспалительной активностью, содержащий стерильные отруби и выращенные на них микробные клетки штамма дрожжей Saccharamyces cerevisae (vini) ВКМП Y-511 в количестве 109÷1010 микробных тел на 1 г отрубей, в последствие инактивированные, и способ его получения. Способ отличается тем, что при ферментации твердофазный субстрат увлажняют водой без привкуса и запаха, с мутностью менее 0,1, рН 8,7, не содержащей хлора, и окисляемостью перманганата мгО/дм3 не более 1,6 мг/дм3, жесткостью 1,5 мг/дм3, общей минерализацией не более 384 мг/дм3, а тепловую обработку при культивировании ведут путем равномерного прогрева среды.
Недостатками данных препаратов является их ограниченная биологическая активность, поскольку они не содержат живых про- или аутопробиотических микроорганизмов, способных колонизировать микрофлору кишечника при дисбиозах, отсутствие доказательств лактогенного, бифидогенного эффекта и детоксикационного эффекта на широко распространенные стафилоккоковые энтеротоксины. Также очевидна высокая энергозатратность операций по подготовке увлажняющего компонента.
Наиболее близкими прототипами к предлагаемому нами способу получения про- и аутопробиотических препаратов и продуктов по технической сущности и достигаемому результату являются патент РФ 2580002 от 19.05.2015 г. и патент РФ 2546253 от 25.04.2013 г.:
1. По патенту РФ 2546253 от 25.04.2013 г. [30]. Предложен способ получения персонифицированного аутопробиотического продукта в виде молочнокислой закваски на основе аутоштаммов лактобактерий и способ лечения синдрома раздраженной кишки, сопровождающегося дисбиозом кишечника, с его использованием. Указанный продукт получают забором пробы нативного материала, посевом и выращивание бактерий из фекалий пациента на селективной питательной среде, идентификацией и отбором типичных для лактобактерий колоний, получением чистой культуры, уточнением видовой принадлежности с использованием ПЦР, ее депонированием в криохранилище при температуре не выше -75°С со сроком хранения не более 1 года и приготовлением из полученной культуры молочнокислой закваски. В качестве лактобактерий используют аутоштаммы Lactobacillus spp. При этом 1 колонию чистой культуры засевают в стерильное молоко (10 мл) и инкубируют при 37°С 24-48 часов в анаэробных или микроаэрофильных условиях. Выбирают одну пробирку с более быстрым ростом культуры, определяя это по образованию сгустка в молоке. Полученный сгусток переносят в 1 л стерильного молока, подогретого до 37°С. Инкубируют при 37°С 24-48 часов в анаэробных или микроаэрофильных условиях. Молочнокислая закваска содержит не менее 1*108 КОЕ/мл.
2. По патенту РФ 2580002 от 19.05.2015 г. [29]. Способ получения аутопробиотика предусматривает выделение бифидобактерий и лактобактерий из фекалий хозяина путем разведений. Для выделения бифидобактерий используют среду Блаурокка, для лактобактерий - МРС-4. Через двое суток материал из изолированных колоний вновь пересевают на соответствующие селективные питательные среды. Выросшие через 2-е суток после второго пассажа изолированные колонии бифидобактерий и лактобактерий пересевают на жидкие среды МРС-4 и Блаурокка и вносят биомассу бактерий рода Bacillus в количестве 1*108÷1*1010 живых клеток на 1,0 л питательной среды и помещают в термостат при 38°С в течение 48 часов. С поверхности накопительных сред, содержащих биомассу аутоштаммов бифидо- и лактобактерий, убирают пленку с биомассой бактерий Bacillus subtilis. После этого используют биомассу бифидо- или лактобактерий в качестве аутоштаммов. Полученный продукт используется для лечения дисбактериоза кишечника. Изобретение позволяет получить аутопробиотик с повышенной физиологической активностью и содержанием бифидобактерий на уровне 5,0÷9,2*109 КОЕ/см3, лактобактерий - 7,0÷10,0*107 КОЕ/см3. Уровень кислотообразования бифидобактерий составляет 118-121°Т.
Недостатками известных способов являются низкие уровни содержания лактобактерий, то, что они позволяют увеличивать физиологическую активность аутопробиотических штаммов только в момент получения препарата, то есть до перорального приема пробиотика и его прохождения через агрессивное воздействие ЖКТ, которое инактивирует большую часть живых культур и нивелирует результат, достигаемый изобретениями. Также у полученных аутопробиотиков отсутствует детоксикационный и пребиотический эффект.
Сущность группы изобретений
Цель группы изобретений - создание нового средства комплексного действия, стимулирующего рост пробиотических микроорганизмов, в том числе индигенных, и увеличивающего их колонизационный потенциал, а также расширение арсенала эффективных препаратов/продуктов для нормализации микрофлоры ЖКТ человека и животных и/или сорбции токсинов.
Цель достигается путем получение нового штамма Meyerozyma (Pichia) guilliermondii (варианты), средства на его основе, а также способов его производства, отвечающего современным вызовам, стоящим перед пре-, про- и аутопробиотическими препаратами, пищевыми продуктами и кормами, включая наличие лактогенного и бифидогенного эффектов, детоксикационного и антагонистического действия, возможность использования в качестве носителя, который способствует поддержанию пробиотических микроорганизмов в активном физиологическом состоянии в агрессивной среде ЖКТ, таким образом способствуя их колонизации, продуцирование биомассы с высокой биологической ценностью.
Технический результат, который достигается при осуществлении группы изобретений:
по п. 1 формулы - заключается в получении штамма дрожжей (варианты), способного стимулировать рост пробиотических микроорганизмов, в том числе индигенных, поддерживать их в активном физиологическом состоянии при прохождении через ЖКТ, а также обладать детоксикационными, антагонистическими свойствами и высокой биологической ценностью;
по п.п. 2-4 формулы - заключается в получении средства - базовой субстанции «Миникор» - на основе вариантов по п. 1 формулы (далее - Средство) с содержанием дрожжевых культур не менее 109÷1010 микробных тел на единицу субстрата, обладающего:
• лактогенным и бифидогенным эффектом - Средство стимулирует рост пробиотических микроорганизмов, в том числе индигенных, почти на два порядка по сравнению с контролем,
• детоксикационным действием в отношении стафилококковых энтеротоксинов - Средство ингибирует фосфолипазную активность токсинообразующих штаммов стафилококков типа А, снижает токсинообразование в 4 раза, а количество КОЕ - в 2÷8 раз. Ингибирует рост токсинообразующих штаммов стафилококков типа В - количество КОЕ штамма стафилококка снижается в 3÷13 раз,
• поддерживающим пробиотические микроорганизмы в активном физиологическом состоянии в агрессивной среде ЖКТ, таким образом способствуя их колонизации, - увеличение выживаемости про- и аутопробиотических культур при использовании Средства во время нахождения в условиях, моделирующих ЖКТ, с 30-ти минут до 2-х часов при рН равным 1,5, с 60÷90 минут до 3-х часов при рН равным 2,0,
• пребиотическим действием - в состав Средства входит растительный компонент, содержащий пищевые волокна, и клеточные стенки дрожжей не менее 109÷1010 микробных тел на единицу субстрата, которые являются источником питательных веществ для индигенной микрофлоры ЖКТ и мощным стимулятором ее роста,
• высокой биологической ценностью - Средство содержит белок на уровне 20-25%, аминокислоты, в том числе незаменимые.
по п.п. 5-6 формулы - заключается в изготовлении за счет использования новых штаммов дрожжей или Средства про- и аутопробиотика с повышенным содержанием бифидобактерий на уровне 1010 КОЕ/см3 и/или лактобактерий - 1010÷1011 КОЕ/ см3, а также в высоком колонизационном потенциале пробиотика, полученным за счет увеличения выживаемости культур полезных микроорганизмов в присутствии биомассы указанных дрожжевых штаммов во время нахождения в условиях, моделирующих ЖКТ, с 30-и минут до 2-х часов при рН, равным 1,5, с 60÷90 минут до 3-х часов при рН, равным 2,0.
Технический результат подтверждается проведенными исследованиями.
Новый штамм дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4316, выделен из натурального коровьего молока.
Новый штамм дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4304, выделен из стационарного женского грудного молока.
Культурально-морфологические особенности штаммов. Морфология колоний и клеток: колонии гладкие, пастообразные, матовые, белого цвета со светло серым оттенком. Клетки овальные, иногда слегка удлиненные, размер клеток сильно варьирует, преимущественно имеют размер клеток (1,0÷3,5)*(3,5÷8,0) мкм, размножение вегетативное почкованием. Псевдомицелий не образуют. Для выращивания культуры дрожжей используют твердую питательную среду Сабуро. Состав среды Сабуро г/л: панкреатический гидролизат рыбной муки 10,0, панкреатический гидролизат казеина 10,0, дрожжевой экстракт 2,0, натрия фосфат однозамещенный 2,0, Д-глюкоза 40,0, агар 10,0±3,0, рН на уровне 6,0±0,3.
Физиолого-биохимические свойства.
Аэробы. Температурный диапазон роста - 20÷40°С. Растут при значениях рН среды - 5,0÷10,0. Время культивирования - 12÷72 часов. Влажность при твердофазном культивировании - 40÷90%, при глубинном культивировании количество сухих веществ - 6÷20%.
Усваивают глюкозу, галактозу, ксилозу, сахарозу, мальтозу, раффинозу, этанол, не образуют крахмал и не гидролизуют мочевину. Обладают способностью усваивать лактозу и преобразовать его в молочную кислоту.
Штаммы проявляют про- и пребиотические свойства, в зависимости от способа использования, живые или инактивированные, соответственно. Являются продуцентом белковых и биологически активных веществ, ценный компонент дрожжевой биомассы - белок, в состав которого входит значительное количество незаменимых аминокислот. Кроме того известно, что дрожжевые клетки содержат различные витамины, ферменты, макро- и микроэлементы и обладают способностью образовывать капсулу на поверхности субстрата. Мананы и глюканы являются основными полимерами клеточной стенки дрожжей. По нашему мнению, это обуславливает способность штаммов стимулировать рост про- и аутобиотических микроорганизмов, связывать токсичные метаболиты патогенных и условно-патогенных бактерий и нормализовать микробиоценозы желудочно-кишечного тракта и различные нарушения обмена веществ.
При этом дрожжи Meyerozyma (Pichia) guilliermondii, в отличие от пивных или хлебопекарных дрожжей, не являются «бродилыциками», после приема внутрь активно не размножаются ввиду неадекватности среды ЖКТ оптимальным условиям их развития (по величинам рН, доступу воздуха, температуре и др.), поэтому они не могут вызвать осложнения различных заболеваний кишечника за счет активного выделения газов или низкомолекулярных органических кислот.
Способ, условия и состав сред для длительного хранения штамма: основной способ длительного хранения штамма - это поддержание культуры путем ее периодического пересева на скошенные твердые агаризованные питательные среды или метод лиофилизации.
Штамм может храниться без потери полезных свойств при следующих условиях: выросшую культуру хранят в холодильнике при температуре 3±2°С порядка 2-х месяцев. Среды: Сабуро и сусло-агар. Состав среды Сабуро г/л: панкреатический гидролизат рыбной муки 10,0, панкреатический гидролизат казеина 10,0, дрожжевой экстракт 2,0, натрия фосфат однозамещенный 2,0, Д-глюкоза 40,0, агар 10,0±3,0, рН на уровне 6,0±0,3. Состав среды сусло-агар г/л: солодовый экстракт 15,0; пептоны 0,75; мальтоза 12,75; декстрин 2,75; глицерин 2,35; калий фосфорнокислый однозамещенный 0,4; хлорид аммония 1,0; агар-агар 20,0, рН на уровне 7,0±0,3. Обязательный пересев не реже одного раза в 2 месяца.
Генетическая характеристика штамма:
Штаммы не являются генетически модифицированными. Идентификация штаммов по последовательности рибосомальных генов проведена в ФГБУ «ГосНИИгенетика». Штаммы отнесены к Meyerozyma (Pichia) guilliermondii и задепонированы во Всероссийской коллекции промышленных микроорганизмов под номерами Y-4316 и Y-4304.
Вирулентность:
Штаммы дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4316 и Meyerozyma (Pichia) guilliermondii ВКПМ Y-4304 были выделены из натурального коровьего молока и стационарного женского грудного молока, не относятся к микроорганизмам, патогенным для человека согласно классификации, приведенных в Санитарных правилах СП 1.3.2322-08 и является безвредными для человека и животных.
Средство по п. 2 и способы его получения по пп. 3, 4.
Способ производства (варианты по пп. 3, 4 формулы)
Средства по п. 2 включает применение новых штаммов дрожжей по п. 1 формулы для биоконверсии сырья в продукты и препараты с повышенной биологической ценностью, конструирование питательных сред под конкретную задачу для выращивания этих микроорганизмов, ферментацию твердофазным или глубинным методом на отобранных средах, при необходимости проводят инактивацию конечного продукта и его концентрацию, отличающийся тем, что продуцентом микробной биомассы являются штамм или штаммы дрожжей Meyerozyma (Pichia) guilliermondii (варианты по п. 1), в качестве основного субстрата для твердофазной ферментации используют измельченное целлюлозосодержащее сырье, которое увлажняется до 40÷90%, для глубинной ферментации - жидкие гетерогенные среды с содержанием сухих веществ 6÷20%, в качестве добавок может использоваться различное углеводистое, сахаристое, крахмалсодержащее сырье, субстрат может использоваться как в стерильном виде (осуществляют автоклавированием в течение 20-ти минут при температуре 110°С), так и в нестерильном варианте, ферментацию проводят при температуре 20÷40°С в течение 12÷72 часов, при необходимости инактивации полученной культуры (способ по п. 4 формулы), ее осуществляют при температуре 70÷180°С в течение 10÷60 минут, также возможно концентрирование биомассы до содержания остаточной влажности не более 15%, в случае с получением Средства по п. 3 формулы с жизнеспособной биомассой дрожжей, сушку проводят при щадящем температурном режиме 30÷45°С.
Способ (варианты) позволяет произвести Средство с таким количеством биомассы новых штаммов дрожжей, которое необходимо для получения заявленного технического результата.
Осуществление способа (варианты) подробно рассмотрено в примерах 1-6.
Наличие у штаммов дрожжей по п. 1 и Средства на их основе лактогенного и бифидогенного эффекта
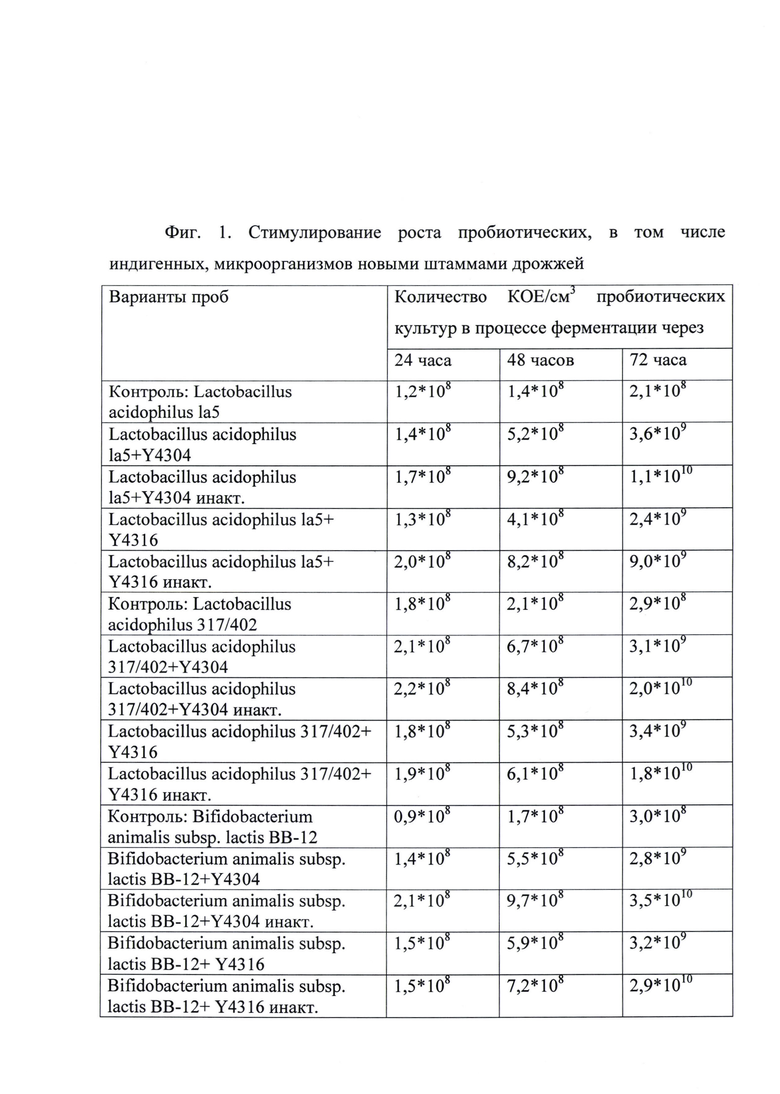
Исследовали способность новых штаммов дрожжей стимулировать рост пробиотических микроорганизмов - облигатных представителей микрофлоры ЖКТ (лактобактерий и бифидобактерий), в том числе индигенных - фиг. 1.
Поскольку пробиотические микроорганизмы являются облигатными обитателями кишечника, благоприятные условия - температура 37°С, без доступа воздуха. Для глубинного культивирования готовили жидкую среду, состоящую из молока жирностью 1% и 10% отрубей, при этом создавали анаэробные условия или микроаэрофильные. Для этого вначале в стерильную среду для глубинного культивирования вносили штаммы дрожжей (Y-4304, Y4316) со стартовым титром 107 КОЕ/см3 или Средство, полученное по п. 3, исходя из такой же посевной дозы, после этого вносили лактобактерий и бифидобактерий в количестве 0,5÷1,5*107 КОЕ/см3. В случае использования инактивированной биомассы дрожжей в субстрат вносили Средство, полученное по п. 4, исходя из посевной дозы 107 микробных тел/см3, и добавляли пробиотические культуры. Культивирование вели при температуре 37°С в течение 72 ч. Контролем служили образцы, в которые не добавляли дрожжевую культуру. При этом через 24, 48 и 72 часа определяли количество жизнеспособных клеток дрожжей и пробиотических микроорганизмов методом посева проб на плотные питательные среды.
Чтобы показать закономерность стимулирующего влияния новых штаммов дрожжей на рост пробиотических микроорганизмов использовали промышленные штаммы и аутоштаммы: производственные штаммы Lactobacillus acidophilus la5 (препарат «Линекс»), Lactobacillus acidophilus 317/402 (препарат «Наринэ»), BiHdobacterium animalis subsp.lactis BB-12 (препарат «Линекс форте»), L.rhamnosus GG (препарат «Нормобакт»), 3 штамма лактобактерий (Л1, Л7, Л08), выделенных из индигенной микрофлоры.
В процессе анаэробной ферментации создаются благоприятные условия для развития лактобактерий. Дрожжи при совместном развитии играют роль стимулятора, обогащая среду полезными метаболитами, поэтому, вначале они практически не изменяли свою численность, к концу ферментации начался их лизис и содержание жизнеспособных клеток дрожжей составило 0,4±1,0*107 КОЕ/см3.
Во всех вариантах виден активный рост про- и аутопробиотических культур при добавлении дрожжевой биомассы: к 72 часам ферментации прирост биомассы при совместной инкубации увеличился почти на два порядка по сравнению с контролем и достиг значений 2,4*109÷3,5*1010 КОЕ/см3. При этом интенсивный рост начинался на 2-е сутки, тогда как в контроле биомасса пробиотических культур нарастала после 24 часов незначительно. Метаболиты дрожжей, используемые в виде инактивированной биомассы, способствуют большему стимулированию роста про- и аутопробиотических культур.
Группа изобретений (варианты по п. 1 формулы и Средство на их основе) отличается способностью стимулировать рост пробиотических микроорганизмов, в том числе индигенных, почти на два порядка по сравнению с контролем. Метаболиты штаммов Meyerozyma (Pichia) guilliermondii ВКПМ Y-4316 и Meyerozyma (Pichia) guilliermondii BKITMY-4304, используемые в виде инактивированной биомассы, также проявляют лактогенный и бифидогенный эффект. Это обуславливает благоприятные последствия за счет нормализации микрофлоры кишечника и способствует обеспечению колонизационной резистентности микробиоты.
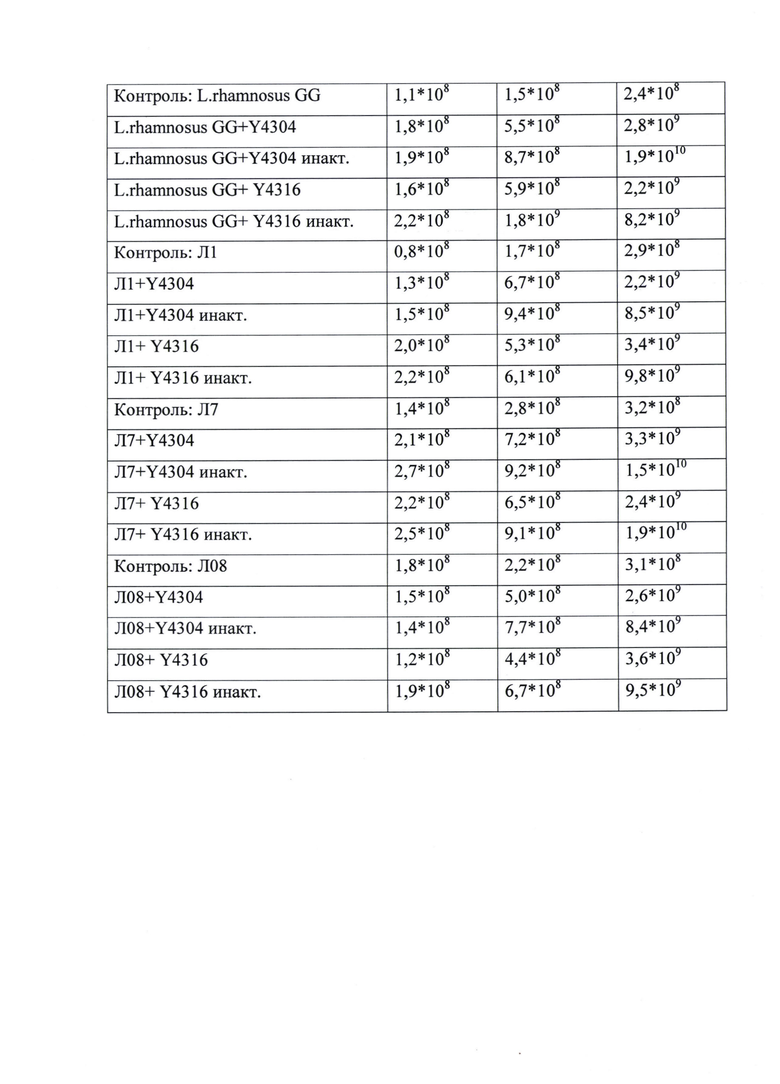
Детоксикационные свойства и антагонистическая активность новых штаммов дрожжей и Средства на их основе по отношению к токсинообразующим стафилококкам
Исследовали способность штаммов дрожжей и Средства на их основе проявлять детоксикационные свойства по отношению к стафилококковым энтеротоксинам типа А и В и ингибировать рост штаммов стафилококков.
Стафилококки продуцируют иммунологически различные типы энтеротоксинов. Обладают способностью вызывать тяжелейшие токсические явления, в том числе при достаточной концентрации могут обладать суперантигенностью и провоцировать токсический шок. Энтеротоксины стафилококков (далее - СЭ) обладают: рвотным действием, пирогенностью, способностью увеличивать токсичность эндотоксинов (липополисахаридов, продуктов грамотрицательных бактерий) в 100000 раз [33].
В работе использовали штаммы стафилококков: для продукции СЭ типа А - штамм S. aureus FRI-722, для образования СЭ типа В - штамм S. aureus S6-715H.
Способность к детоксикации СЭ регистрировали следующим образом. Готовили модельную микробиологическую систему, состоящую из жидкой питательной среды с ферментативным гидролизатом казеина (содержание аминного азота 200 мг/%), далее перед культивированием в среду добавляли 1,0% сердечно-мозговой вытяжки, рН 7,2, разливали по 4,5 в пробирки и вносили суточную культуру стафилококков с титром 107 КОЕ/см3. После инокуляции S. aureus в систему добавляли дрожжевые штаммы в виде Средства, полученного по примеру 1, в качестве субстрата использовали пшеничные отруби. Посевная доза 5*107 КОЕ/см3. Устанавливали рН равным 7,2 с помощью стерильной 1н NaOH. Выращивание проводили на шуттель-аппарате при непрерывном встряхивании 120 об/мин. в течение 24 ч при 37°С. Сразу после культивирования делали десятикратные разведения из пробирок в стерильном 0,001н фосфатном буфере с рН 7,2, перемешивали, высевали на твердые питательные среды Baird-Parker с теллуритом калия по 50 мкл из разведения 106-108 и растирали культуру стерильным шпателем по всей поверхности. Чашки затем помешали в термостат при 37°С на 24 часа, после чего проводили подсчет колоний стафилококков.
Для определения содержания СЭ микробные клетки из пробирок удаляли центрифугированием при 10000 об/мин. в течение 15 минут, надосадочную жидкость прогревали в течение 15 мин при 100°С, после чего определяли наличие СЭ иммуноферментным методом согласно МУК № 4.2.2429-08 с использованием иммуноферментных тест-систем, для определения стафилококковых энтеротоксинов типов А. Контролем служили вышеназванные штаммы-продуценты СЭА, культивируемые при тех же условиях, что и опытные образцы, но вместо добавления Средства, добавляли отруби в том же объеме. Отрицательным контролем служил субстратный буфер. Концентрацию СЭ учитывали с использованием планшетного спектрофотометра. Оптическую плотность образцов и отрицательного контроля измеряли при длине волны 492 нм. Положительными считались значения оптической плотности образцов, превышающих в два раза оптическую плотность отрицательного контроля. Фосфолипазную активность учитывали с использованием среды Baird- Parker по образованию просветления среды вокруг колоний путем отношения количества клеток обладающих фосфолипазной активностью к общему количеству выросших клеток стафилококка и выражали в %.
Установлено, что штаммы дрожжей по п. 1 формулы в составе Средства снижали образование СЭ типа А в 4 раза, а количество КОЕ штамма-продуцента СЭА снижалось в 2÷8 раз. Возможно использование как инактивированной биомассы дрожжей по п. 1 формулы и Средства, полученного по п. 4, так и живой биомассы дрожжей и Средства, полученного по п. 3. Применение инактивированной биомассы дрожжей дополнительно полностью ингибировало фосфолипазную активность - фиг. 2.
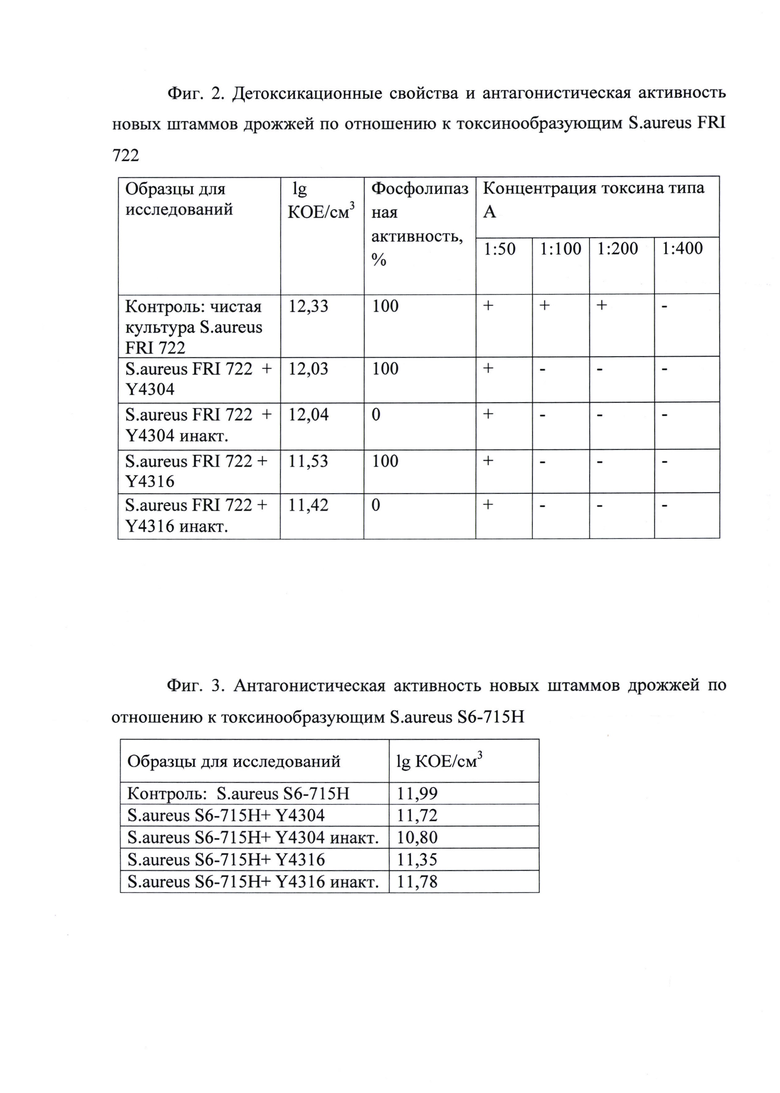
При исследовании антагонистической активности к штамму токсинообразующих стафилококков типа В показана серьезная ингибирующая способность инактивированной биомассы штамма Meyerozyma (Pichia) guilliermondii Y4304 - количество КОЕ стафилококка уменьшается в 13 раз - фиг. 3. Штамм дрожжей Meyerozyma (Pichia) guilliermondii Y4316 проявляет меньшую ингибирующую способность - количество КОЕ уменьшается в 3÷4 раза.
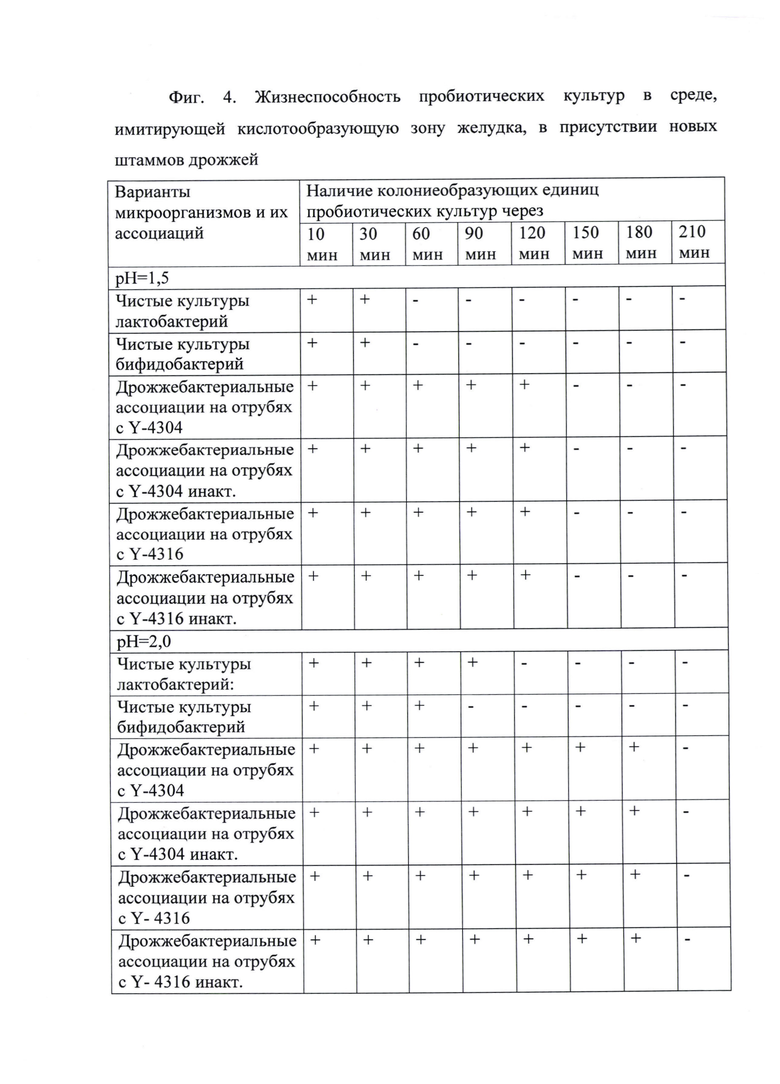
Способность новых штаммов дрожжей и Средства на их основе поддерживать про- и аутопробиотические микроорганизмы в активном физиологическом состоянии в агрессивной среде ЖКТ, таким образом способствуя их колонизации
Исследовали возможности поддержания пробиотических микроорганизмов в активном физиологическом состоянии при воздействии неблагоприятных факторов ЖКТ.
Проведены исследования выживаемости чистых культур лактобактерий, бифидобактерий и дрожжебактеиальных ассоциаций с добавлением штаммов Meyerozyma (Pichia) guilliermondii (варианты по п. 1 формулы) в среде, моделирующей кислотообразующую (верхнюю) зону желудка - фиг. 4. Такая зона характеризуется резкокислыми свойствами (рН менее 3,0): нормальная кислотность в просвете тела желудка натощак и на поверхности эпителиального слоя, обращенного в просвет желудка, рН около 1,5÷2,0. В течение желудочной фазы пищеварения происходит главным образом протеолиз (расщепление белка) при помощи фермента пепсина и кислой реакции (рН на уровне 1,0) благодаря присутствию 0,2÷0,5%-й соляной кислоты.
В экспериментах исследовали как промышленные штаммы пробиотических культур, так и индигенные: производственные штаммы Lactobacillus acidophilus la5 (препарат «Линекс»), Lactobacillus acidophilus 317/402 (препарат «Наринэ»), Bifidobacterium animalis subsp. lactis BB-12 (препарат «Линекс форте»), L.rhamnosus GG (препарат «Нормобакт»), 3 штамма лактобактерий (Л1, Л7, Л08), выделенных из микрофлоры женского грудного молока.
Выращивание индигенных пробиотических микроорганизмов проводили на плотных питательных средах рекомендованного состава: среда МРС или Блаурокка. В качестве чистой культуры использовали смывы культур микроорганизмов из пробирок со скошенной агаризованной средой после 48 часов инкубирования. Посевная доза - 5±0,2*108 КОЕ/см3. Навески лиофильно-высушенных промышленных заквасок прямого внесения восстанавливали в стерильном физиологическом растворе, после чего аликвоты полученной взвеси, рассчитанные исходя из их содержания в дозе препарата для получения посевной дозы - 5±0,2*108 КОЕ/см3, вносили в субстрат с предложенными штаммами дрожжей и далее в модельные среды.
Методом твердофазной ферментации инкубировали штаммы дрожжей (Y-4304 и Y-4316) на отрубях, как описано в примере 1, в течение 24 часов. В полученном препарате определяли количество КОЕ. Исходя из посевной дозы дрожжей - 2*108÷2*109 КОЕ/г и пробиотических культур - 5±0,2*108 КОЕ/г, делали дрожжебактериальные ассоциации. В случае использования инактивированной биомассы дрожжей (Средство, полученное по п. 4 формулы) перед добавлением пробиотических культур проферментировнный субстрат автоклавировали при температуре 120°С в течение 20-и минут. Полученные дрожжебактериальные ассоциации перемешивали, инкубировали в течение 24 часов при температуре 37°С и вносили в модельные среды.
Модельные среды, имитирующие кислотообразующую зону желудка, готовили по методике, предложенной К.Дунн (C.Dunne) и соавторами [33]. Дрожже-бактериальные ассоциации ресуспендировали в среде МРС с рН 1,5 и 2,0. Контролем служили образцы с пробиотическими микроорганизмами без добавления дрожжевых культур. Кислотность среды доводили до необходимой одномолярной соляной кислотой. Пробы отбирали с момента внесения культуры в среду (0 мин), затем через 10, 30, 60, 120, 150, 180 и 210 минут.
Количество живых микроорганизмов промышленных штаммов пробиотиков и индигенных в суспензиях до и после инкубации в модельных средах определяли высевом соответствующих десятикратных серийных разведений исследуемых пробиотиков на плотные питательные среды в чашках Петри и подсчета выросших колоний по истечении времени инкубирования. Определение содержания молочнокислых микроорганизмов проводили в соответствии с ГОСТ 10444.11-89, дрожжей - в соответствии с ГОСТ 10444.12-88.
Следует отметить более высокую чувствительность бифидобактерий к агрессивному воздействию ЖКТ: после пребывания в кислой среде число КОЕ было значительно ниже количества КОЕ у лактобактерий.
Использование новых штаммов дрожжей (варианты по п. 1 формулы) и Средства на их основе, полученного по пп. 3, 4, в про- и аутопробиотических препаратах позволяет существенно снизить влияние критических факторов на пробиотические микроорганизмы, аутоштаммы и увеличить время их нахождения в активном физиологическом состоянии с 30 минут до 2-х часов при рН равным 1,5, и с 60÷90 минут до 3-х часов при рН равным 2,0.
Пребиотические свойства Средства на основе новых штаммов дрожжей
Использование предлагаемых новых штаммов дрожжей в качестве продуцентов высокоценной биомассы с пребиотическим действием.
К пребиотикам относятся ферментируемые микробиотой субстанции, которые приводят к специфическим изменениям в составе и/или активности желудочно-кишечной микробиоты, принося, таким образом, пользу здоровью организма хозяина.
Средство, полученное по пп. 3, 4 формулы, обладает пребиотическим эффектом, в том числе ввиду наличия в нем целлюлозосодержащего компонента. Например, пшеничные и ржаные отруби - это прежде всего отличный источник клетчатки (порядка 40%), аминокислот, микроэлементов, витаминов группы В, витаминов Е и А. Овсяные хлопья также содержат пищевую клетчатку (около 15%), витамины группы В и микроэлементы, а также β-глюканы, которые обладают иммуномодулирующим действием. В состав рисовой мучки входят витамины группы В, Е, РР, минералы и микроэлементы, и клетчатка около 15%.
Пищевые волокна особенно важны для хорошей работы кишечника и нормального функционирования пищеварительной системы в целом и используется для коррекции дисбиотических состояний. Они не могут быть переварены в верхних отделах ЖКТ и в неизмененном виде достигают кишечника, где метаболизируются индигенной микрофлорой до короткоцепочечных жирных кислот, которые являются основным энергетическим субстратом для эпителиоцитов слизистой оболочки толстой кишки, стимулирующим пролиферацию, дифференциацию клеток и образование муциновой слизи [42]. Это способствует увеличению КОЕ пробиотических индигенных микроорганизмов в единице внутрикишечного объема и возрастанию метаболической активности внутрикишечной среды.
Для исследований получали биопрепараты на основе предложенных штаммов дрожжей (Y-4304 и Y-4316) методом твердофазной ферментации на отрубях, как описано в примере 1 в течение 48 часов. В полученном препарате определяли количество живых микроорганизмов методом высева на плотные питательные среды (метод Коха) и в соответствии с ГОСТ 10444.12-88, белок по ГОСТ 10846-91, содержание незаменимых аминокислот до и после инкубации и ферментативную активность. В качестве контроля использовали увлажненные до 55% пшеничные отруби без внесения микроорганизмов.
Количество биомассы дрожжей в субстрате после ферментации достигало 6,5±0,5*109 КОЕ/г, что является высоким значением. Необходимо отметить, что для биологически активных добавок с концентрацией - 109 КОЕ/г показаны значимые клинические эффекты, связанные с лечебно-профилактическим действием дрожжевых клеток (патент РФ 2475050 С2 от 17.03.2011 г., патент РФ 2427389 С2 от 09.10.2009 г., препарат «Фервитал» (регистрпионное Удостоверение 000624. Р.643.12.98, ТУ 9118-003-46812619-98) и так далее).
Если же рассматривать продукты питания, то на современном российском рынке таковые представлены в основном кисломолочными напитками смешанного бактериально-дрожжевого типа. Содержание дрожжевых клеток в таких продуктах не превышает уровня 104÷105 КОЕ/г. Аминокислотный состав полученных продуктов определяли по ГОСТ 13496.21-87 и ГОСТ 13496.22-90 на аминокислотном анализаторе «Биотроник» (ФРГ).
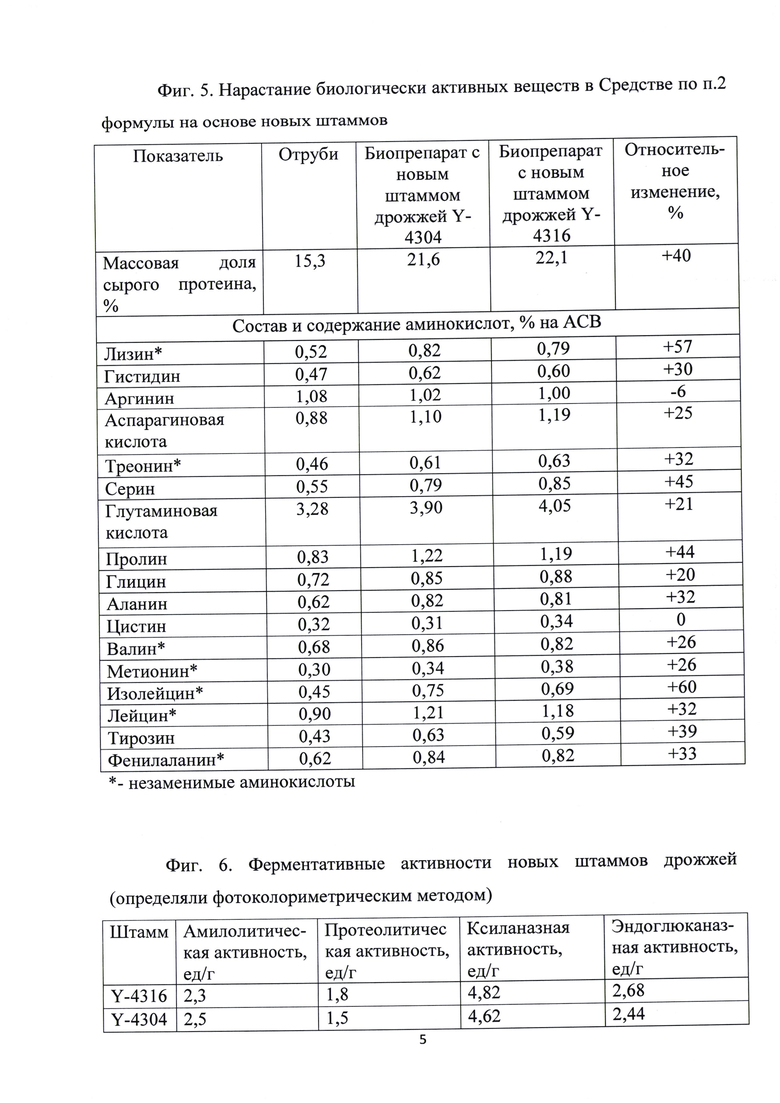
Содержание белка в субстрате после ферментации отрубей новыми штаммами дрожжей повышалось на 40% и особенно важно, что 26-57% нарастает содержание незаменимых аминокислот - фиг. 5.
Кроме того, новые штаммы обладают амилолитической, протеолетической, ксиланазной и эндоглюканазной активностью - фиг. 6, улучшая переваривание сложных углеводов и белков. Важно отметить, что расчеты проводились в ед/г полученного Средства, содержащей только порядка 10-20% биомассы дрожжей, остальное - отруби.
При использовании штаммов дрожжей с таким ферментативным комплексом наблюдается значительная эффективность процесса биоконверсии растительного, крахмалистого, молочного и сахаристого сырья. Поскольку при переработке сырья целесообразно гидролизовать не только крахмал, клеточные стенки, оболочки и пленки растительного сырья, но и белки, пептоны, полипептиды сырья до аминокислот, являющихся ценным азотистым питанием для дрожжей. Это повышает степень использования сухих веществ сырья и тем самым увеличивает выход конечного продукта.
Проведенные нами исследования показывают, что группа изобретений может быть использована для получения биомассы дрожжей, в том числе пищевых и кормовых, путем их выращивания на питательных средах, включая среды на основе отходов переработки растительного, сахаристого, молочного сырья и последующего использования в качестве биологически активной добавки с пре- или пробиотическими свойствами в рацион людей, животных и птицы.
Способ получения пробиотических препаратов и продуктов для людей и животных по пп. 5, 6 формулы на основе новых штаммов дрожжей
Способ получения пробиотических препаратов и продуктов для человека и животных, содержащих повышенные уровни жизнеспособных бифидобактерий (1010 КОЕ/на единицу субстрата) и/или лактобактерий (1010÷1011 КОЕ/на единицу субстрата), предусматривающий культивирование штаммов бифидо- и лактобактерий на жидких стерилизованных гетерогенных средах на основе молочного, сахаристого сырья, содержание св. не более 20%, посевная доза 107÷108 КОЕ/см3, с добавлением биомассы дрожжей Meyerozyma (Pichia) guilliermondii (варианты по п. 1) в количестве 1÷10,0*108 микробных тел на единицу субстрата или Средства по п. 2 формулы из расчета такой же посевной дозы и последующее применение для лечения дисбиозов. Инкубацию проводят при температуре 37°С в анаэробных или микроаэрофильнх условиях до достижения необходимых концентраций пробиотических микроорганизмов, также одновременно возможен контроль по значениям титруемой кислотности - не менее 110°Т, поскольку этот параметр также отражает физиологическую активность пробиотических культур.
При этом новые штаммы дрожжей (варианты по п. 1 формулы) или Средство на их основе является стимулятором роста пробиотических микроорганизмов и увеличивает их физиологическую активность, что выражается в высоких титрах КОЕ и значениях титруемой кислотности. Необходимо отметить, что на практике такие уровни значений КОЕ пробиотических микроорганизмов достигаются за довольно короткий промежуток времени - 48÷72 часа (пример 7). Также важной составляющей технического результата, достигаемого группой изобретений при изготовлении пробиотического препарата/продукта по п. 5 формулы, является способность новых штаммов дрожжей и Средства на их основе поддерживать пробиотические культуры в активном физиологическом состоянии во время нахождения в условиях, моделирующих ЖКТ, с 30-ти минут до 2-х часов при рН равным 1,5, с 60÷90 минут до 3-х часов при рН равным 2,0, описанная выше.
Способ получения аутопробиотических препаратов и продуктов для человека и животных по п. 6 формулы, содержащего живые бифидобактерий и/или лактобактерий с повышенной физиологической активностью, предусматривает выделение бифидобактерий и лактобактерий из фекалий хозяина путем разведений. Для выделения бифидобактерий используют среду Блаурокка, для лактобактерий - МРС-4. Далее отбирают типичные для лактобактерий и бифидобактерий колонии, уточняют видовую принадлежность с использованием ПНР. В качестве лактобактерий используют аутоштаммы Lactobacillus spp., в том числе видов acidophilus, fermentii, casei, plantarum, bulgaricus и другие; в качестве бифидобактерий - Bifidobacterium spp., в том числе видов infantis, biRdum, longum, breve, adolescentis и другие. При необходимости культуру выделенных аутоштаммов хранят для получения аутопробиотиков в лиофилизованном виде и/или на скошенных твердых агаризованных питательных средах, пересевая каждые 2 месяца. Посевной материал получают путем внесения 1 колонии чистой культуры в стерильные жидкие питательные среды, пригодные для развития используемых пробиотических культур (например, молоко, МРС, среда Блаурокка и так далее) и инкубации при 37°С 24 часа. Далее посевной материал вносят в жидкие стерильные питательные среды и добавляют Средство с титром 1÷10,0*108 микробных тел на мл среды. В случае если Средство получают, как описано в примере 3, индигенные лактобактерий и бифидобактерий можно вносить прямо в Средство в такой же посевной дозе. Инкубируют при 37°С 24-48 часов в анаэробных или микроаэрофильных условиях.
При использовании такого способа получения аутопробиотических препаратов и продуктов достигается заявленный технический результат, характеризующийся повышенной физиологической активностью аутоштаммов, выражающейся в содержании бифидобактерий на уровне 1010 КОЕ/ед. субстрата и/или лактобактерий - 1010÷1011 КОЕ/ед. субстрата (пример 8), уровнем титруемой кислотности не менее 110°Т, а также высоким колонизационным потенциалом, полученным за счет увеличения выживаемости аутопробиотических культур в присутствии биомассы указанных дрожжевых штаммов во время нахождения в условиях, моделирующих ЖКТ, с 30-ти минут до 2-х часов при рН равным 1,5, с 60÷90 минут до 3-х часов при рН равным 2,0.
Возможность использования группы изобретений иллюстрируется примерами, которые не ограничивают объем и сущность притязаний, связанных с ними.
Осуществление группы изобретений
Пример 1
Получение Средства методом твердофазной ферментации по п. 3-4 формулы. Для этого пшеничные отруби, овсяные хлопья, рисовую мучку и другие целлюлозосодержащие субстраты, при необходимости субстрат измельчали до размера фракций 1÷10 мм и стерилизовали в автоклаве 30 мин при 120°С, охлаждали до комнатной температуры. Субстраты увлажняли до 55% жидким посевным материалом (Y-4304, Y4316) на основе предварительно простерилизованной воды, молока жирностью 1%, молочной сыворотки с содержанием сухих веществ (далее - с.в.) 5÷8% (далее - МС), послеспиртовой барды 6÷9% с.в. (далее - ПСБ). Посевная доза - 107÷108 КОЕ/г субстрата. Засеянный субстрат культивировали 72 часа при температуре 30±2°С. Определение содержания дрожжей проводили методом посева на твердые питательные среды в соответствии с ГОСТ 10444.12-88.
Для получения инактивированной биомассы дрожжей после ферментации субстрат стерилизовали автоклавированием 20 минут при 110°С.
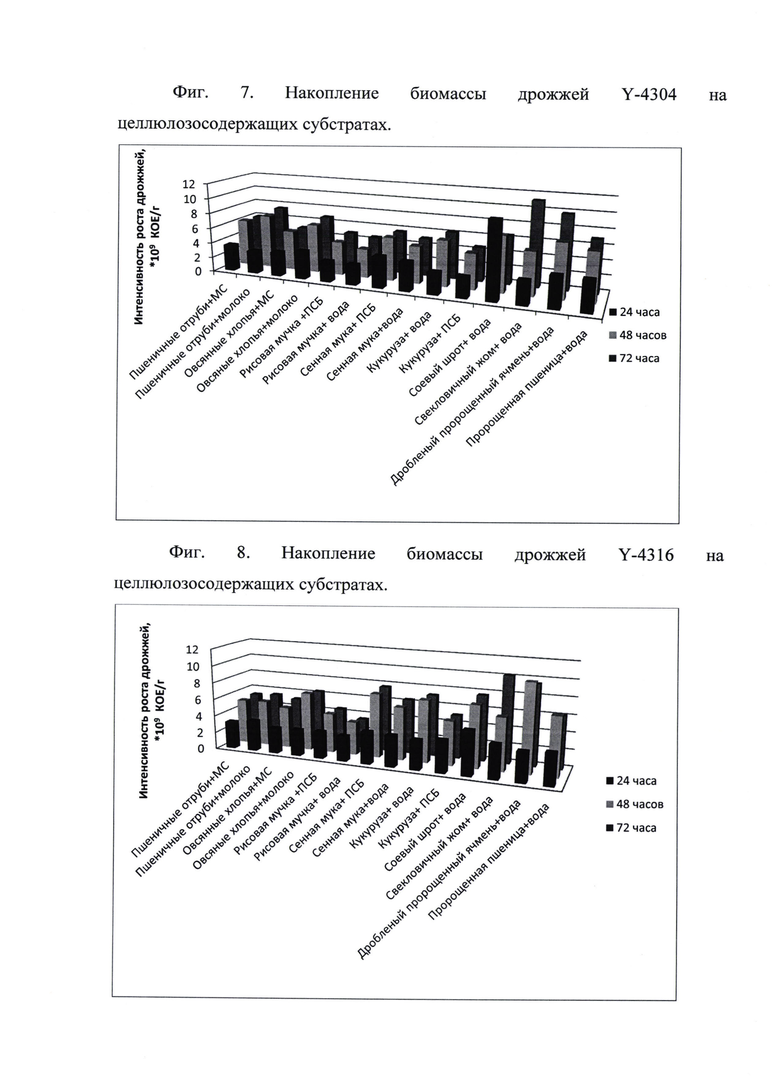
Представленные на фиг. 7 и фиг. 8 данные свидетельствуют об активном накоплении биомассы новыми штаммами дрожжей на различных целлюлозосодержащих субстратах - количество во всех вариантах не менее 109÷1010 КОЕ/г, что соответствует заявленному техническому результату. Таким образом, в зависимости от назначения Средства, региона производства, технологической линии, возможно подобрать оптимальный субстрат и увлажняющий компонент (их комбинацию), что позволит получать более конкурентоспособный конечный продукт.
Пример 2
Возможность использования углеводистых, сахаристых, крахмалсодержащих добавок при изготовлении Средства - фиг. 9. Использовали пшеничные отруби и сенную муку, стерилизовали в автоклаве 30 мин при 120°С, охлаждали до комнатной температуры. Чтобы показать влияние углеводистых и крахмалистых добавок в среду добавляли простерилизованную свеклосахарную пульпу, выжимку винограда, кукурузную муку. Контролем служил субстрат без добавок. Чтобы определить влияние сахаристых субстратов на рост новых штаммов дрожжей субстраты увлажняли до 55% жидким посевным материалом (Y-4304, Y4316) на основе предварительно простерилизованного раствора глюкозы 8%, кукурузной патоки 8%. Контролем служил субстрат с добавлением воды. Посевная доза - 1÷10*107 КОЕ/ г субстрата. Засеянный субстрат культивировали 48 часов при температуре 30°С. Определение содержания дрожжей проводили методом посева на твердые питательные среды в соответствии с ГОСТ 10444.12-88.
Для получения инактивированной биомассы дрожжей после ферментации субстрат стерилизовали автоклавированием 20 минут при 110°С.
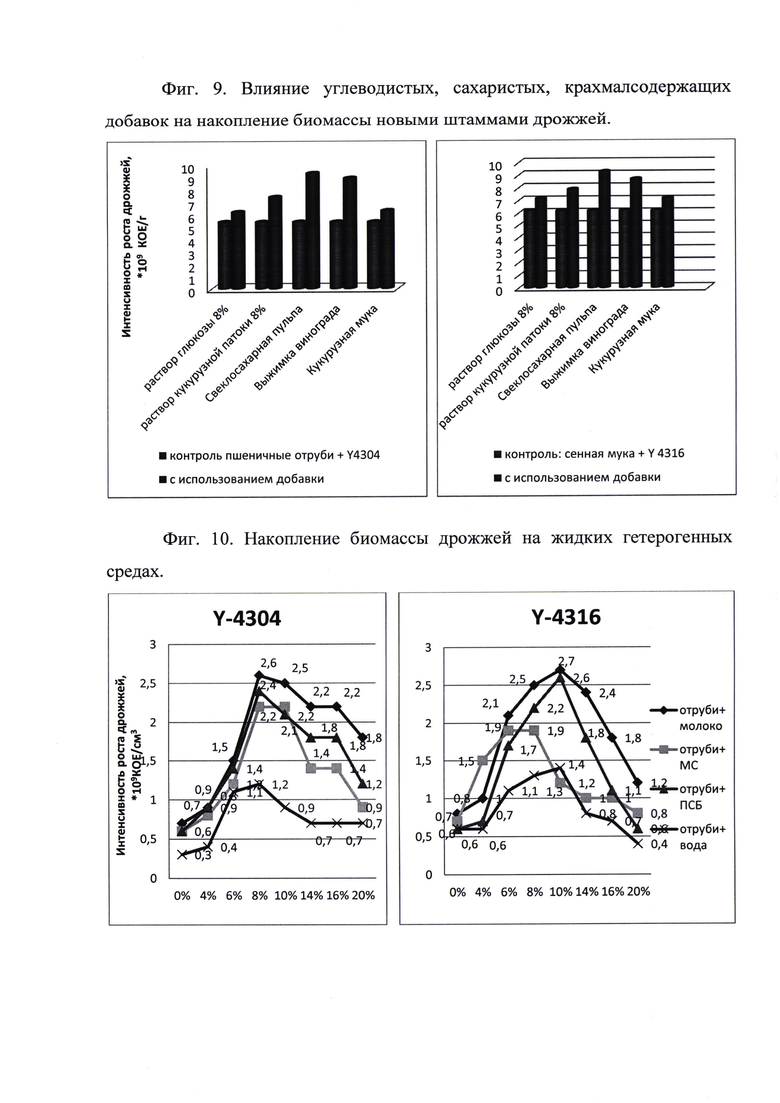
Использование различных добавок возможно, поскольку увеличивает выход биомассы и позволяет достичь лучший технический результат, выражающийся в количестве микробных тел на единицу субстрата.
Пример 3
Получение методом глубинной ферментации по п. 3-4. Для этого готовили жидкие гетерогенные среды, состоящие из жидкого компонента - например, молока 1% жирности, МС, ПСБ - и целлюлозосодержащего компонента с фракциями 1÷10 мм - например, отруби пшеничные. Содержание сухих веществ делали от 6% до 20%. При необходимости среду стерилизовали автоклавированием в течение 20-и минут при температуре 110°С. После этого в гетерогенную среду вносили штаммы дрожжей (Y-4304, Y4316) со стартовым титром 107 КОЕ/см3, ферментировали в течение 48 часов при температуре 30°С. Засеянные колбы инкубировали на качалке при 220-240 об/мин.
Для применения инактивированной биомассы дрожжей (способ по п. 4 формулы) после ферментации субстрат стерилизовали автоклавированием 20 минут при 110°С. При необходимости биомассу отделяли, полученную культуру подвергали сушке до содержания остаточной влажности не более 15%.
При глубинной ферментации максимум накопления биомассы достигается при использовании гетерогенной среды с 8÷10% с.в. и составляет в среднем 2,3*109 КОЕ/см3 - фиг. 10. Необходимо отметить, что такая концентрация дрожжевых клеток достаточна для достижения заявленного технического результата. Кроме того в зависимости от конкретных условий производства и поставленных задач у технолога имеется возможность провести концентрирование препарата и выбрать наиболее оптимальное технологическое решение, что повышает уровень применимости изобретения.
Пример 4
Возможность использования нестерильного субстрата.
Процесс стерилизации субстрата характеризуется значительными затратами электроэнергии и воды. Известно, что любой субстрат обладает собственной микрофлорой, а некоторые штаммы дрожжей способны проявлять антагонистическую активность по отношению к ряду условно патогенных микроорганизмов и подавлять их рост в борьбе за питательные вещества субстрата. При этом конечный продукт безвреден, поскольку проходит стадию инактивации.
Такой подход может быть востребован в том числе при производстве продукции для животных, включая кормовые добавки, пребиотики, так как позволяет улучшить технический результат и получить Средство с большим количеством биомассы штамма дрожжей (вариант Y-4316 по п. 1 формулы) или уменьшить затраты на производство Средства при этом сохранив заявленный технический результат (вариант Y-4304 по п. 1 формулы).
В способе по п. 4 Средство получали так, как описано в примере 1, но используемый субстрат перед ферментацией не стерилизовали автоклавированием. Контролем служили образцы с простерилизованным субстратом.
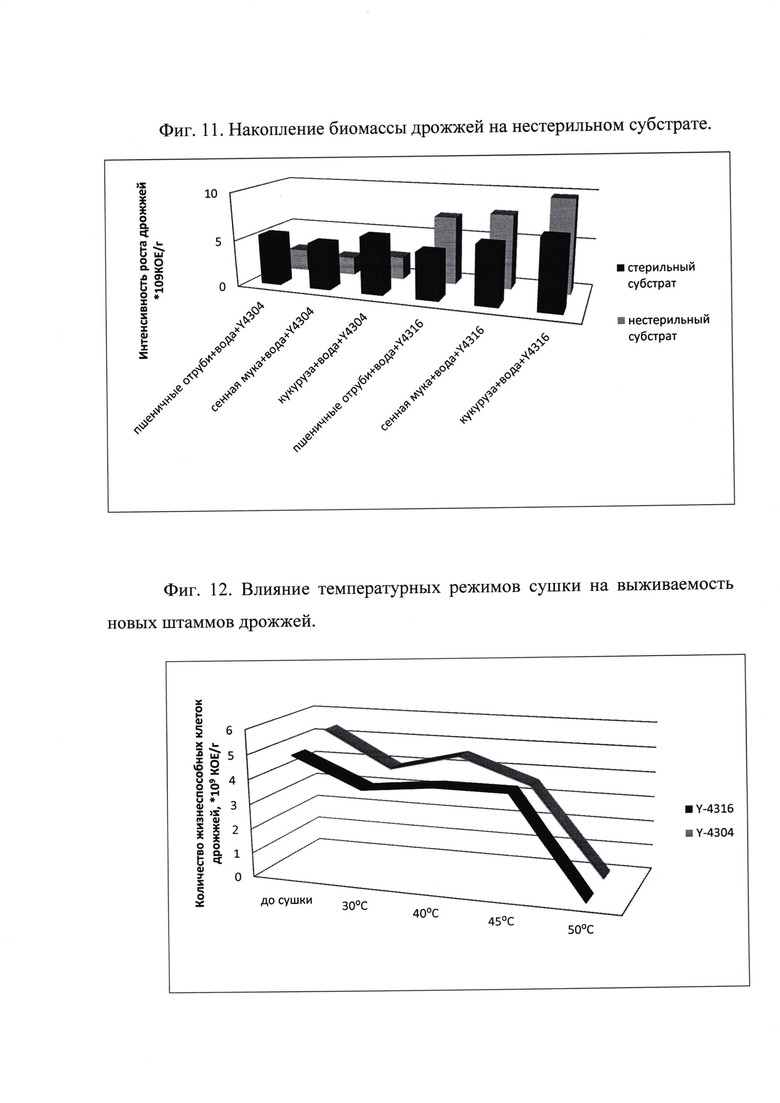
Штамм дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4316 увеличивает количество биомассы на нестерильном субстрате на 27-46% - фиг. 11. Рост штамма Meyerozyma (Pichia) guilliermondii ВКПМ Y-4304 наоборот ингибируется на 56-60%. Однако получаемой биомассы - на уровне 2÷3*109 КОЕ/г достаточно для заявленного технического результата.
Пример 5
Получение высушенного Средства по п. 2 формулы с жизнеспособной биомассой дрожжей.
Производили Средство, как описано в примере 1, в качестве субстрата использовали пшеничные отруби и воду. После ферментации в течение 48 часов, полученную культуру вместе с субстратом высушивали методом распыления до содержания остаточной влажности не более 15% при различных температурных режимах: 30, 40, 45, 50°С.
Определяли количество жизнеспособных клеток дрожжей до сушки и после методом посева проб на плотные питательные среды и в соответствии с ГОСТ 10444.12-88 - фиг. 12.
Сушка, проведенная при щадящем температурном режиме 30÷45°С, позволяет достичь заявленный технический результат.
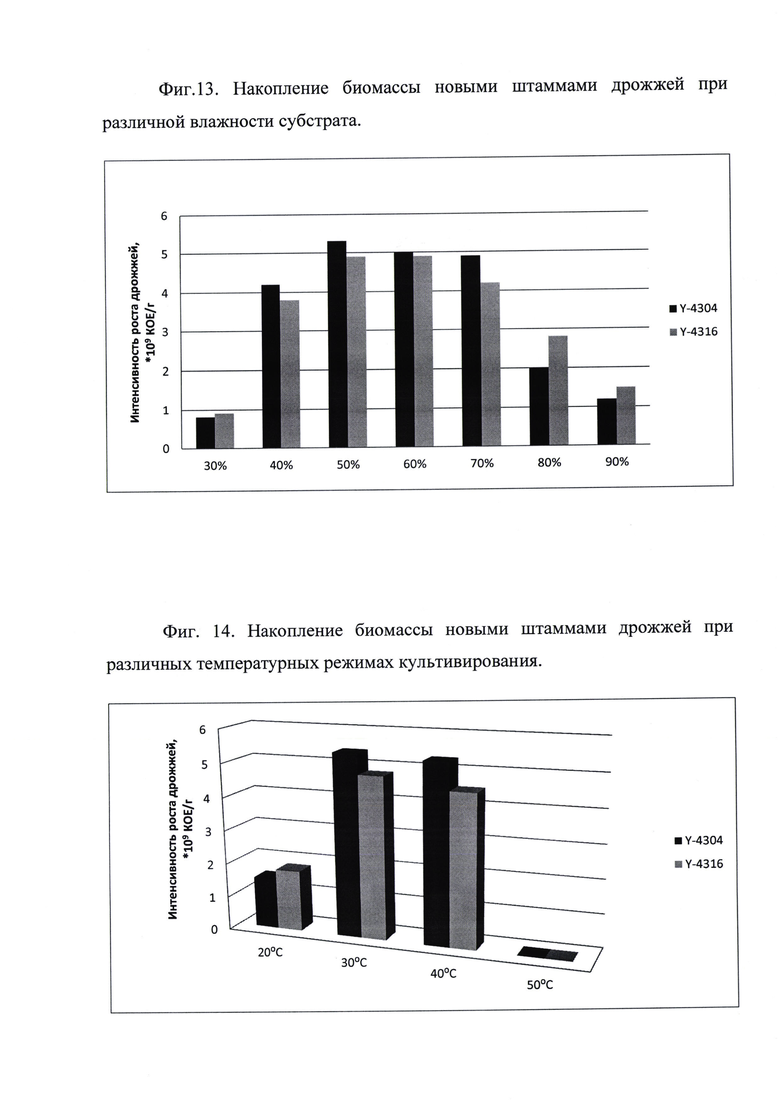
Пример 6
Диапазон технологических параметров ферментации, в котором возможно получение заявленного технического результата.
Влажность и температура процесса ферментации существенно влияют на количество продуцируемой дрожжами биомассы. Для определения диапазона этих технологических параметров производили Средство, как описано в примере 1, в качестве субстрата использовали пшеничные отруби и воду, при этом увлажняли субстрат до значений от 30 до 90%. Для того, чтобы показать температурный интервал для ферментации, получали Средство, как описано в примере 1 и 3, в качестве субстрата использовали отруби и воду, культивирование проводили при температуре от 15 до 45°С.
Далее определяли количество жизнеспособных клеток дрожжей после ферментации методом посева проб на плотные питательные среды и в соответствии с ГОСТ 10444.12-88 - фиг. 13 и фиг. 14.
Диапазон влажности от 40 до 90% и температура культивирования от 20 до 40°С позволяют достичь заявленный технический результат и подбираются в зависимости от технологической линии и поставленных задач на производстве.
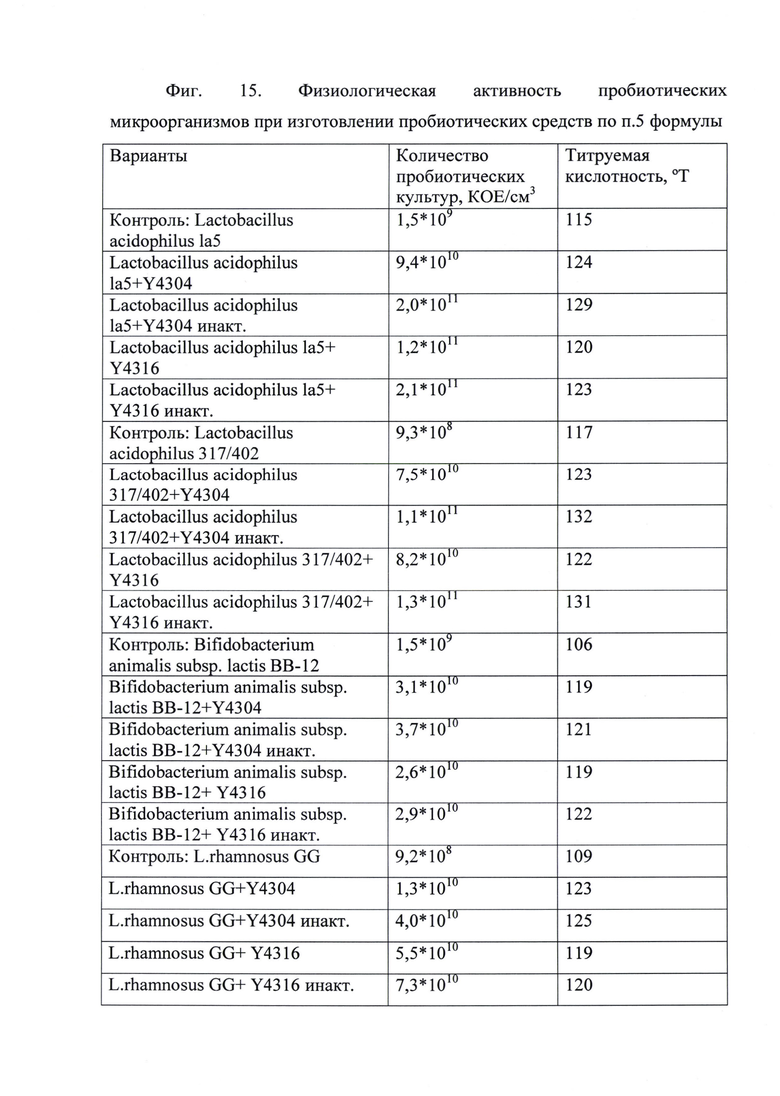
Пример 7
Способ получения пробиотического препарата и продукта, содержащего живые бифидобактерий и/или лактобактерий с повышенной физиологической активностью по п. 5 формулы
Готовили жидкие стерилизованные среды на основе молочного, сахаристого сырья (например, молоко, молочная сыворотка, раствор глюкозы и так далее) с содержанием сухих веществ 6÷20%. При этом в жидкую среду вносили штамм дрожжей варианты по п. 1 формулы или Средство по п. 2 формулы, полученное так, как описано в примере 1-4, из расчета посевной дозы 1÷10,0*108 микробных тел на мл среды. После этого вносили лактобактерий и бифидобактерий в количестве 107÷108 КОЕ/см3. Чистые культуры пробиотических микроорганизмов получали в пробирках со скошенной агаризованной средой после 48 часов инкубации или навески лиофильно-высушенных промышленных заквасок прямого внесения восстанавливали в стерильном физиологическом растворе, после чего аликвоты полученной взвеси, рассчитанные исходя из их содержания в дозе препарата для получения посевной дозы. В случае если Средство получают, как описано в примере 3, лактобактерий и бифидобактерий можно вносить прямо в Средство в такой же посевной дозе.
Использовали промышленные штаммы пробиотических микроорганизмов разных видов, чтобы показать закономерность повышения физиологической активности пробиотических культур в присутствии предлагаемых штаммов по п. 1 формулы и Средства на их основе: Lactobacillus acidophilus 1а5 (препарат «Линекс»), Lactobacillus acidophilus 317/402 (препарат «Наринэ»), BiRdobacterium animalis subsp. lactis BB-12 (препарат «Линекс форте»), L.rhamnosus GG (препарат «Нормобакт»).
Инкубацию проводили при температуре 37°С в течение 12÷72 часов в анаэробных или микроаэрофильнх условиях. При этом через 12, 24, 48 и 72 часа после начала ферментации определяли количество жизнеспособных клеток пробиотических микроорганизмов методом посева проб на плотные питательные среды.
Во всех вариантах пробиотические культуры к 72 часам инкубации при добавлении дрожжевой биомассы увеличивали прирост биомассы почти на два порядка по сравнению с контролем до 1010÷1011 КОЕ/см3 и демонстрировали высокие значения титруемой кислотности - фиг. 15.
Эта закономерность четко показывает роль новых штаммов дрожжей, как стимуляторов роста пробиотических микроорганизмов и увеличения физиологической активности культур. Также важной составляющей технического результата, достигаемого группой изобретений при изготовлении пробиотического препарата/продукта по п. 5 формулы, является способность новых штаммов дрожжей и Средства на их основе поддерживать пробиотические культуры в активном физиологическом состоянии во время нахождения в условиях, моделирующих ЖКТ, с 30-ти минут до 2-х часов при рН равным 1,5, с 60÷90 минут до 3-х часов при рН равным 2,0.
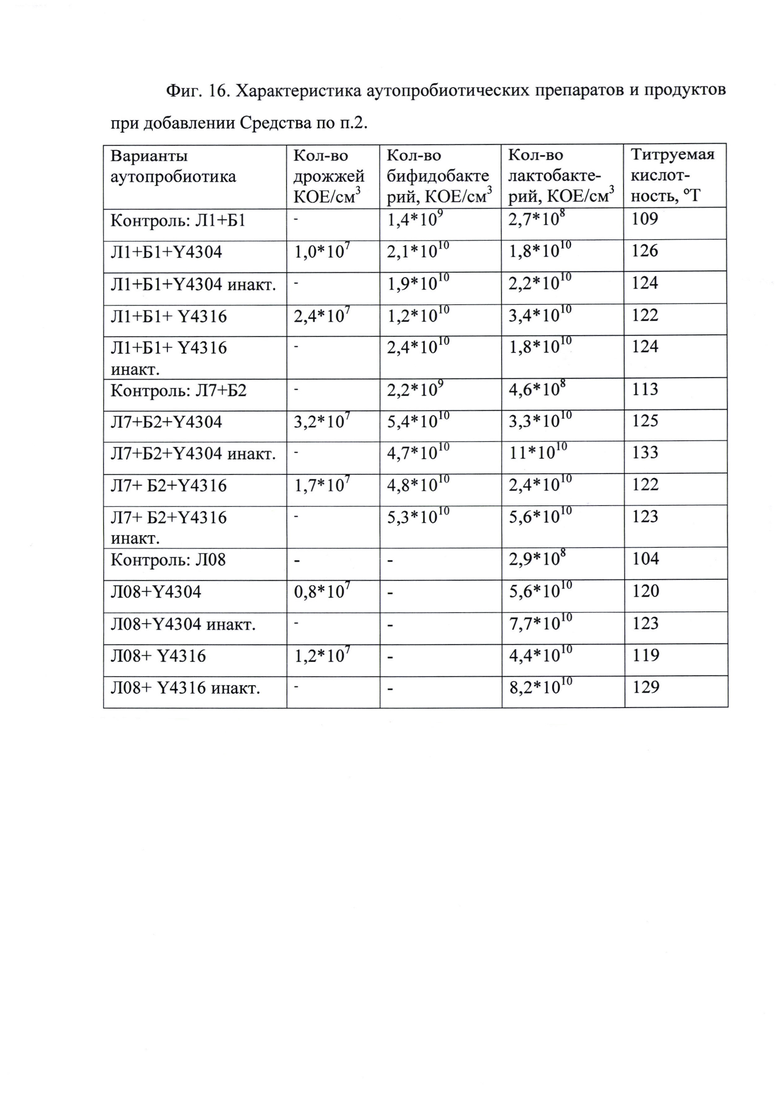
Пример 8
Способ получения аутопробиотических препаратов и продуктов для человека и животных, содержащих живые бифидобактерий и/или лактобактерий с повышенной физиологической активностью по п. 6 формулы, предусматривает выделение бифидобактерий и лактобактерий из фекалий хозяина путем разведений. Для выделения бифидобактерий использовали среду Блаурокка, для лактобактерий - МРС-4. Далее отбирали типичные для лактобактерий и бифидобактерий колонии, уточняли видовую принадлежность с использованием ПЦР.
Для исследований использовали штаммы лактобактерий, выделенные из индигенной микрофлоры (Л1, Л7, Л08), отнесенные к видам Lactobacillus acidophilus и plantarum, и бифидобактерий (Б1, Б2), отнесенных к виду bifidum. В качестве контроля получали аутопробиотические препараты без использования Средства на основе тех же аутоштаммов.
Культуру выделенных аутоштаммов хранили до получения аутопробиотиков на скошенных твердых агаризованных питательных средах, пересевая каждые 2 месяца. Посевной материал получали путем внесения 1-й колонии чистой культуры в стерильное молоко и инкубации при 37°С 24 часа. Далее посевной материал вносили в жидкие стерильные питательные среды (например, молоко) и добавляли Средство с титром 1÷10,0*108 микробных тел на мл среды. В случае если Средство получали, как описано в примере 3, индигенные лактобактерий и бифидобактерий вносили прямо в Средство в такой же посевной дозе. Инкубировали при 37°С 24-48 часов в анаэробных или микроаэрофильных условиях.
В случае использования Средства, полученного по п. 3 формулы, после инкубации подсчитывали количество КОЕ аутоштаммов в аутопробиотическом препарате методом высева на твердые питательные среды и в соответствии с ГОСТ 10444.11-89, в случае использования Средства, полученного по п. 4 формулы, также подсчитывали количество жизнеспособных дрожжей в соответствии с ГОСТ 10444.12-88.
Получали органолептически приятный кисломолочный препарат/продукт со следующими характеристиками - фиг. 16.
Во всех вариантах, полученных с использованием Средства, аутопробиотик характеризуется повышенным содержанием бифидобактерий на уровне 1,2÷5,4*1010 КОЕ/см3 и/или лактобактерий - 1,8÷11,0*1010 КОЕ/см3, содержание лактобактерий больше, чем в прототипах, описанных в разделе «Уровень техники», почти на 2 порядка, а бифидобактерий - в среднем в 4 раза. А также высоким колонизационным потенциалом, полученным за счет увеличения выживаемости аутопробиотических культур в присутствии биомассы указанных дрожжевых штаммов во время нахождения в условиях, моделирующих ЖКТ, с 30-ти минут до 2-х часов при рН равным 1,5, с 60÷90 минут до 3-х часов при рН равным 2,0. Уровень кислотообразования молочнокислых бактерий составляет 119-133°Т и отражает высокую физиологическую активность аутопробиотических микроорганизмов.
Источники информации
1. Maranduba CM, De Castro SB, de Souza GT et al. Intestinal microbiota as modulators of the immune system and neuroimmune system: impact on the host health and homeostasis. J Immunol Res. 2015. 2015:931574.
2. Кучумова С.Ю., Полуэктова E.A., Шептулин A.A., Ивашкин В.Т. Физиологическое значение кишечной микрофлоры. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2011; 21(5): 17-27.
3. Blaser M.J., Falkow S. Disappearing microbiota. Klinicheskaya farmakologiya i terapiya. 2014; 23(4): 7-16. (in Russian).
4. Айтбаев K.A., Мураталиев T.M. Манипуляции с кишечной микрофлорой как новая парадигма для диагностики, терапии и профилактики кардиоваскулярных заболеваний (Обзор литературы). Вестник Кыргызско-Российского Славянского Университета. 2015; 15(7): 10.
5. Полуэктова Е.А., Ляшенко О.С., Королев А.В., Шифрин О.С., Ивашкин В.Т. Механизмы, обеспечивающие взаимодействие бактериальных клеток с организмом хозяина, и их нарушение у пациентов с воспалительными заболеваниями кишечника. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2014; 24(5): 42-53.
6. Борщев Ю.Ю., Ермоленко Е.И. Метаболический синдром и микроэкология кишечника. Трансляционная медицина. 2014; (1): 19-28
7. Васильев А.Н., Горячев Д.В., Гавришина Е.В., Ниязов P.P., Селиверстов Ю.А., Дигтярь А.В. Трансплантация фекальной микробиоты: возможные терапевтические подходы и вопросы правового регулирования. Биопрепараты, профилактика, диагностика, лечение. 2015; (2): 15-23.
8. Rossen N.G. et al. Fecal microbiota transplantation as novel therapy in gastroenterology: A systematic review // World J. Gastroenterol. 2015. Vol. 21, № 17. P. 5359.
9. Budding A.E., Grasman M.E., Lin F., Bogaards J.A., SoeltanKaersenhout D.J., Vandenbroucke-Grauls C.M. et al. IS-pro: highthroughput molecular fingerprinting of the intestinal microbiota. FASEB J. 2010; 24(11): 4556-64.
10. Zahraa Al Bander, Marloes Dekker Nitert, Aya Mousaand Negar Naderpoor, The Gut Microbiota and Inflammation: An Overview. Int. J. Environ. Res. Public Health 2020, 17(20), 7618.
11. Кожевников A.A., Раскина К.B., Мартынова Е.Ю. и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования. РМЖ. 2017;17:1244-1247.
12. Brenner S.R. Blue-green algae or cyanobacteria in the intestinal micro-йога may produce neurotoxins such as Beta-N-Methylamino-l-Alanine (BMAA) which may be related to development of amyotrophic lateral sclerosis, Alzheimer's disease and Parkinson-Dementia-Complex in humans and Equine Motor Neuron Disease in Horses // Med. Hypotheses. 2013. Vol. 80, № 1. P. 103.
13. Scheperjans F. et al. Gut microbiota are related to Parkinson's disease and clinical phenotype // Mov. Disord. 2015. Vol. 30, № 3. P. 350-358.
14. Zeng H., Lazarova D.L., Bordonaro M. Mechanisms linking dietary fiber, gut microbiota and colon cancer prevention. // World J. Gastrointest. Oncol. Baishideng Publishing Group Inc, 2014. Vol. 6, № 2. P. 41-51.
15. Trompette A. et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis // Nat. Med. 2014. Vol. 20, № 2. P. 159-166.
16. Guamer F. et al. World gastroenterology organisation global guidelines: probiotics and prebiotics October 2011 // J. Clin. Gastroenterol. 2012. Vol. 46, № 6. P. 468-481.
17. Macfarlane GT, Cummings JH. Probiotics and prebiotics: can regulating the activities of intestinal bacteria beneRt health? BMJ. 1999; 318(7189):999-1003.
18. Magro DO, de Oliveira LM, Bemasconi I et al. Effect of yogurt containing polydextrose, Lactobacillus acidophilus NCFM and Bifidobacterium lactis HN019: a randomized, double-blind, controlled study in chronic constipation. Nutr J. 2014; 13:75
19. H.H. Мальцева, M.M. Шкарупета и др. Иммуномодулирующие свойства некоторых микробов - представителей нормальной микрофлоры кишечника. // Антибиотики и химиотерапия, 1992. - Т. 37, № 12. - С. 41-43.
20. Багиров Н.С., Петухов И.Н., Дмитриев Н.В., Григорьевская З.В. Микробном и рак: есть ли связь? Обзор литературы // Злокачественные опухоли 2018; 3s1:56-69.
21. Грачева Н.М., Ардатская М.Д., Аваков А.А., Соловьева А.И. Сравнительная оценка клинико-лабораторной эффективности современных про- и пребиотических препаратов в коррекции дисбиотических нарушений желудочно-кишечного тракта: отчет о клинико-лабораторном исследовании. М.: Московский НИИЭМ им. Г.Н. Габричевского, 2010. 23 с.
22. И.В. Дармов, И.Ю. Чичерин, И.П. Погорельский и др. Выживаемость микроорганизмов пробиотиков в условиях in vitro, имитирующих процесс пищеварения у человека. Эксперимент, и клин, гастроэнтерология. 2011, № 3. С. 6-11.
23. Патент РФ 2468087. Способ выявления жизнеспособности пробиотических микроорганизмов в условиях in vitro, имитирующих процесс пищеварения у человека. И.В. Дармов, И.Ю. Чичерин, А.С. Ердякова и др. 09.08.2011 г.
24. О.Н. Минушкин, М.Д. Ардатская, И.Ю. Чичерин. Фруктоолиго- и фруктополисахариды в коррекции и профилактике нарушений микробиоценоза кишечника у больных бронхолегочной патологией, получающих антибактериальную терапию. Эксперимент. и клин, гастроэнтерология. 2011. № 3. С. 79-87.
25. И.Ю. Чичерин, И.В. Дармов, И.П. Погорельский и др. Выживаемость бифидобактерий и лактобактерий в условиях in vitro в желудочном соке и дуоденальном содержимом людей. МА. Гастроэнтерология. 2012. № 1. С. 57-59.
26. И.В. Дармов, И.Ю. Чичерин, А.С. Ердякова и др. Сравнительная оценка выживаемости микроорганизмов пробиотиков в составе коммерческих препаратов в условиях in vitro. Эксперимент, и клин, гастроэнтерология. 2011. № 9. С. 96-101.
27. Kristensen, N.B., Bryrup, Т., Allin, К.Н. et al. Alterations in fecal microbiota composition by probiotic supplementation in healthy adults: a systematic review of randomized controlled trials. Genome Med 8, 52 (2016).
28. Патент РФ 2460778. Способ получения аутопробиотика на основе Enterococcus faecium, представителя индигенной микрофлоры кишечника хозяина. Суворов А.Н. Симаненков В.И. и др. 30.12.2010 г.
29. Патент РФ 2580002. Способ получения аутопробиотика, содержащего живые бифидобактерий и лактобактерий. Денисов Д.Е. Кузнецова Т.Н. 19.05.2015 г.
30. Патент РФ 2546253. Способ получения персонифицированного аутопробиотического продукта и способ лечения синдрома раздраженной кишки с использованием этого продукта. Суворов А.Н. Симаненков В.И. и др. 25.04.2013 г.
31. С.М. Захаренко, Ю.А. Фоминых, С.Н. Мехтиев. Инфекции, микробиота кишечника человека и метаболический синдром. Эффективная фармакотерапия. Гастроэнтерология. 2011. № 3. С. 14-20.
32. Н.М. Грачева, Н.А. Малышев, И.Ю. Чичерин и др. Фруктоолигосахариды и фруктополисахариды в комплексном лечении больных желудочно-кишечными заболеваниями с явлениями дисбактериоза кишечника. Инфекционные болезни. 2010. Т. 8. № 1. С. 107-111.
33. Marrack P., Kappler J. The staphylococcal enterotoxins and their relatives Science 1990 v 248. P. 705-711.
34. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo findings / Dunne C., O'Mahony L., Murphy L. et al. // The American Journal of Clinical Nutrition. - 2001. - V. 7 (suppl) - P. 386S-392S.
35. Ушкалова E.А., Гущина Ю.Ш. Линекс форте в профилактике и лечении желудочно-кишечных заболеваний. Терапевтический архив. 2015; 87(12):138-144.
36. Shenderov В.A. Metabiotics: novel idea or natural development of probiotic conception. Microbial Ecology in Health & Disease 2013, 24: 20399.
37. Шендеров Б.А. Медицинская микробная экология и функциональное питание: в 3 т. / Б.А. Шендеров. - Т. 1: Микрофлора человека и животных и ее функции. - М.: ГРАНТЪ, 1998. - 288 с.
38. Патент РФ 2589818. Метабиотическая композиция для обеспечения колонизационной резистентности микробиоценоза кишечника человека. Синица А.В. 10.04.2015 г.
39. Патент Евросоюза ЕР 2509450 В1. Use of 2-O-glyceryl-α-D-glucopyranoside as prebiotic. 2009-12-11.
40. Патент РФ 2 206 330. Средство, обладающее иммуномодулирующей, энтеросорбционной, антитоксической и противовоспалительной активностью и способ его получения. Кулемин Л.М., Чичерин И.Ю. 30.05.2002.
41. Патент РФ 2102903. Способ производства лечебно-профилактической добавки. Борисенко Е.Г. 27.01.1998.
42. Andoh A., Tsujikawa Т., Fujiyama Y. Role of dietary fiber and short-chain fatty acids in the colon. Curr. Pharm. Des. 2003; 9(4): 347-358.
43. Патент РФ 2476205. Композиция с противоинфекционной активностью. Синица А.В. 15.02.2012 г.
Группа изобретений относится к области биотехнологии, а именно к штаммам дрожжей рода Meyerozyma (Pichia), средствам на их основе и способам их получения. Предложены штамм дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4316, штамм дрожжей Meyerozyma (Pichia) guilliermondii ВКПМ Y-4304 и/или любые функциональные субстанции, полученные из указанных штаммов, их метаболиты, используемые для получения пре-, про- и аутопробиотических препаратов и/или продуктов, лечебно-профилактическое средство на их основе и способы его получения. Вышеназванные штаммы активно накапливают высокоценную биомассу, включающую белок и незаменимые аминокислоты, на твердофазных и жидких субстратах в количестве не менее 109÷1010 КОЕ на единицу субстрата. Штаммы и средство на их основе и/или их функциональных субстанций обладают детоксикационной и антагонистической активностью в отношении стафилококков, способностью стимулировать рост пробиотических микроорганизмов, в том числе индигенных, почти на два порядка по сравнению с контролем, поддерживать их в активном физиологическом состоянии при прохождении через желудочно-кишечный тракт - увеличивается время до инактивации про- и аутопробиотических культур с 30 минут до 2-х часов при рН 1,5, с 60÷90 минут до 3-х часов при рН 2,0, что позволяет добиться высокого колонизационного потенциала у про- и аутопробиотических препаратов. Группа изобретений может быть использована для производства пищевых, фармацевтических и кормовых композиций, при разработке пре-, про- и аутопробиотиков, а также препаратов, обладающих иммуномодулирующей, детоксикационной, противовоспалительной активностью для человека и животных. 5 н. и 2 з.п. ф-лы, 16 ил., 8 пр.
1. Штамм дрожжей Pichia guilliermondii, депонированный во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером Y-4316, обладающий детоксикационными, антагонистическими свойствами, способностью стимулировать рост пробиотических микроорганизмов, в том числе индигенных, поддерживать их в активном физиологическом состоянии при прохождении через ЖКТ и обогащать субстрат биологически активными веществами, используемый для изготовления пре-, про- и аутопроботических препаратов.
2. Штамм дрожжей Pichia guilliermondii, депонированный во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером Y-4304, обладающий детоксикационными, антагонистическими свойствами, способностью стимулировать рост пробиотических микроорганизмов, в том числе индигенных, поддерживать их в активном физиологическом состоянии при прохождении через ЖКТ и обогащать субстрат биологически активными веществами, используемый для изготовления пре-, про- и аутопроботических препаратов.
3. Способ получения биопрепарата на основе штамма дрожжей Pichia guilliermondii ВКПМ Y-4304 или Pichia guilliermondii ВКПМ Y-4316 с содержанием дрожжевых культур не менее 109÷1010 микробных тел на единицу субстрата, включающий применение штамма дрожжей для биоконверсии сырья, ферментацию твердофазным или глубинным методом на целлюлозосодержащих субстратах с последующей сушкой до остаточной влажности не более 15%, отличающийся тем, что продуцентом микробной биомассы является штамм Pichia guilliermondii ВКПМ Y-4316 или штамм Pichia guilliermondii ВКПМ Y-4304, в качестве основного субстрата для твердофазной ферментации используют измельченное целлюлозосодержащее сырье (пшеничные отруби, овсяные хлопья, рисовую мучку, кукурузу, соевый шрот, свекловичный жом, сенную муку, дробленный пророщенный ячмень, пророщенную пшеницу), которое увлажняется водой, или молоком, или молочной сывороткой, или послеспиртовой бардой до 40÷90%, в качестве добавок может использоваться углеводистое, сахаристое, крахмалсодержащее сырье, для глубинной ферментации - жидкие гетерогенные среды с содержанием сухих веществ 6÷20% на основе указанного целлюлозосодержащего сырья и воды, или молока, или молочной сыворотки, или послеспиртовой барды, ферментацию проводят на стерильном субстрате при температуре 20÷40°С в течение 24÷72 часов, при необходимости биомассу отделяют и/или полученную культуру сушат при щадящем температурном режиме 30÷45°С до содержания остаточной влажности не более 15%.
4. Способ по п. 3, отличающийся тем, что конечный продукт с биомассой используемого штамма Pichia guilliermondii ВКПМ Y-4316 или штамма Pichia guilliermondii ВКПМ Y-4304 подвергают инактивации.
5. Средство для человека и животных на основе биомассы штамма Pichia guilliermondii ВКПМ Y-4316 или штамма Pichia guilliermondii ВКПМ Y-4304 в количестве не менее 109÷1010 микробных тел на единицу субстрата, полученное способом по п. 4, обладающее повышенной биологической ценностью - содержит белок не менее 20% и незаменимые аминокислоты, - детоксикационными и пребиотическими свойствами, способностью стимулировать рост пробиотических микроорганизмов, в том числе индигенных, поддерживать их в активном физиологическом состоянии при прохождении через ЖКТ, отличающееся тем, что в качестве целлюлозосодержащего субстрата используют пшеничные отруби, а в качестве увлажняющего до 55% компонента - воду, культивирование ведут при температуре 30°С в течение 48 часов.
6. Способ получения пробиотического препарата для человека и животных, содержащего жизнеспособные бифидобактерии и/или лактобактерии с повышенной физиологической активностью в количестве бифидобактерий 1010 КОЕ/на единицу субстрата и/или лактобактерий 1010÷1011 КОЕ/на единицу субстрата, предусматривающий культивирование штаммов бифидо- и/или лактобактерий на жидких стерилизованных гетерогенных средах на основе молочного, сахаристого сырья, содержание с.в. не более 20%, посевная доза 107÷108 КОЕ/см3, инкубацию проводят при температуре 37°С в анаэробных или микроаэрофильных условиях в течение 72 часов, и последующее применение полученного пробиотического препарата для лечения дисбиозов, отличающийся тем, что пробиотические микроорганизмы ферментируют с добавлением биомассы штамма Pichia guilliermondii ВКПМ Y-4316 или штамма Pichia guilliermondii ВКПМ Y-4304 в количестве 0,1÷10,0*108 микробных тел на единицу субстрата или средства по п. 5 в посевной дозе 0,1÷10,0*108 микробных тел на единицу субстрата.
7. Способ по п. 6, отличающийся тем, что в качестве пробиотических микроорганизмов используют аутоштаммы, выделенные из организма хозяина, которые после изолирования отдельных колоний бифидобактерий и лактобактерий используют в качестве посевного материала для инкубации с добавлением биомассы штамма Pichia guilliermondii ВКПМ Y-4316 или штамма Pichia guilliermondii ВКПМ Y-4304 в количестве 0,1÷10,0*108 микробных тел на единицу субстрата или средства по п. 5 в посевной дозе 0,1÷10,0*108 микробных тел на единицу субстрата.
| БОРИСЕНКО Е.Г | |||
| и др | |||
| Производство дрожжевых продуктов широкого профиля | |||
| Научный журнал НИУ ТИМО | |||
| Серия "Процессы и аппараты пищевых производств", 2019, N 1, с | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ПОЛУЧЕНИЯ АУТОПРОБИОТИКА, СОДЕРЖАЩЕГО ЖИВЫЕ БИФИДОБАКТЕРИИ И ЛАКТОБАКТЕРИИ | 2015 |
|
RU2580002C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРСОНИФИЦИРОВАННОГО АУТОПРОБИОТИЧЕСКОГО ПРОДУКТА И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА РАЗДРАЖЕННОЙ КИШКИ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ПРОДУКТА | 2013 |
|
RU2546253C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНОГО ПРЕПАРАТА С ПРОБИОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2605626C2 |
| SCHEPERJANS F | |||
| et al., Gut microbiota are related to Parkinson's disease and clinical phenotype, Mov | |||
Авторы
Даты
2022-04-26—Публикация
2021-02-08—Подача