Область техники.
Настоящее изобретение направлено на создание препаратов для лечения грибковых заболеваний на основе органических соединений.
Уровень техники.
Инвазивные грибковые инфекции вызывают микозы различной степени тяжести, которые могут привести к летальному исходу. Резкое возрастание заболеваемости и смертности от них за последние два десятилетие вызвано увеличением числа пациентов с ослабленным иммунитетом, включая пациентов с нейтропенией, ВИЧ, хронической иммуносупрессией, ожогами, сахарным диабетом, а также тех, кто принимает антибиотики широкого спектра действия. Антибиотики уничтожают не только патогенные, но и полезные бактерии, которые образуют нормальную микрофлору, это чревато активизацией роста и размножения грибков. [W. Liu, L. Yuan, S. Wang. Recent Progress in the Discovery of Antifungal Agents Targeting the Cell Wall // J. Med. Chem., 2020, Vol. 63, P. 12429-12459; J.R. Kӧhler, B. Hube, R. Puccia, A. Casadevall, J.R. Perfect. Fungi that infect humans // Microbiol. Spectrum, 2017, Vol. 5, P. FUNK-2016/29; K. V. S. M. Chandrika, S. Sharma. Promising antifungal agents: A minireview // Bioorg. Med. Chem., 2020, Vol. 28, P. 115398].
Наиболее распространенной группой микозов являются поверхностные микозы кожи, ногтей. Их вызывают дерматофиты - плесневые грибы, которые принадлежат сразу к нескольким родам Epidermophyton, Microsporum, Trichophyton [А.Ю. Сергеев, Ю.В. Сергеев. Дерматофитии // Русский медицинский журнал, 2003, № 15, С. 845-851https://en.wikipedia.org/wiki/ISBN_(identifier)]. Патогенные микроорганизмы поражают кератинсодержащие участки тела ногти, роговой слой эпидермиса, волосяную часть головы - и являются возбудителями инфекционного заболевания дерматофитии. Она проявляется выпадением волос на ограниченных участках, шелушением, покраснением кожи, зудом. При поражении ногтевых пластинок ногти утолщаются, изменяется их форма, цвет, они могут становиться ломкими, крошиться.
Для лечения инфекций, вызванных грибами, существуют противогрибковые лекарственные средства. Однако со временем у грибов развивается резистентность по отношению к применяемым в медицинской практике антимикотическим препаратам [M.W. McCarthy, D.P. Kontoyiannis, O.A.Cornely, J.R. Perfect, T.J. Walsh. Novel agents and drug targets to meet the challenges of resistant fungi // J. Infect. Dis., 2017, Vol. 216, P. S474-S483]. Использование новых противогрибковых соединений может повлиять на улучшение лечения пациентов, особенно, с ослабленным иммунитетом.
Для создания новых антимикотических препаратов большой потенциал имеют соединения, содержащие 4-арилдиазенил-3,5-диметилпиразольный скаффолд. 4-Арилдиазенил-3,5-диметилпиразолы (1), имеющие 4-арилтиазольный заместитель при атоме N(1), обладают фунгицидным действием в отношении Candida albicans [K. Kaur, V. Kumar, V. Beniwal, V. Kumar, K.R. Aneja, V. Sharma, S. Jaglan. Solvent-free synthesis of novel (E)-2-(3,5-dimethyl-4-(aryldiazenyl)-1H-pyrazol-1-yl)-4-arylthiazoles: determination of their biological activity // Med. Chem. Res., 2015, Vol. 24, P. 3863-3875]. 4-[(3,5-Диметил-1H-пиразол-4-ил)диазенил]бензолсульфонамид (2) проявляет более выраженное противогрибковое действие в отношении дрожжеподобного гриба Candida albicans, чем нистатин [A.H. Moustafa, H.A. El-Sayed, S.M. El Rayes, H.A. Morsy, S.H. Abd-allah, H.F. Ismail, M.M. Abd El-Aal. Pyrazoles and Isoxazoles Based Sulfanilamide and Phenazone as Antimicrobial Agents: Synthesis and Biological Activity // Russ. J. Gen. Chem., 2019, Vol. 89, P. 2314-2320]. 3-{4-[(3,4-Дифторфенил)диазенил]-3,5-диметил-1H-пиразол-1-ил}-3-оксо-N-арилпропанамиды (3) обладают высокой противогрибковой активностью против Aspergillus niger [M. Shukla, D. S. Seth, H. Kulshreshtha. Green chemical approach to synthesize 1-(N-substituted aniline malonyl)-3,5-dimethyl-4-(3,4-difluorophenylazo)pyrazoles and their antimicrobial evaluation // J. Appl. Chem., 2013, Vol. 2, P. 1484-1488].
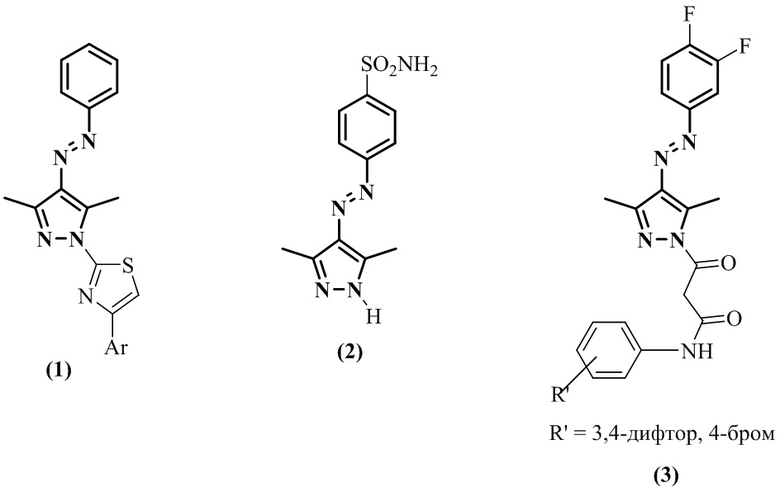

Наиболее близкими по структуре к нашему изобретению можно признать антимикотики 4-(гет)арилдиазенилпиразольного ряда, содержащие динитрофенильный заместитель при атоме N(1). Среди азопиразолов (3,5-диметил-1-(2,4-динитрофенил)-1H-пиразол-4-ил)-(6-фторбензотиазол-2-ил)диазен (4) показал наибольшие значения процента ингибирования роста двух патогенных грибов растений, а именно, Alterneria burnsii (средний процент ингибирования роста 85.23% при дозе 500 мг/л), вызывающей ожог тмина, и Macrophomina phaseolina (средний процент ингибирования роста 77.37% при дозе 500 мг/л), вызывающей гниль стеблей фасоли [V. Sareen, V. Khatri, D. Shinde, S. Sareen. Synthesis of some new derivatives of 3,5-dimethyl azopyrazole as antifungal agents // Ind. J. Chem., 2011, Vol. 50B, P. 937-940]. Азокрасители, имеющие структуру 4-[(E)-(2-гидрокси-5-нитрофенил)диазенил]-3-метил-1H-пиразол-5-ола, были исследованы на активность по отношению к микромицетам, наиболее часто встречающимся на текстильных материалах и вызывающим как механическое, так и химическое повреждение волокон. В качестве микромицетов использовали тест-культуры Aspergillus niger, Aspergillus flavus, Penicillium chrysogenum и Ulocladium ilicis. Наибольшую фунгицидную активность (60%) показало соединение (5), содержащее 2,4-динитрофенильный заместитель при атоме N(1) [D.N. Kuznetsov, A.G. Ruchkina, K.I. Kobrakov. Synthesis of 1-aryl(hetaryl)pyrazol-5-ols and azopyrazoles on their basis // Chem. Heterocycl. Compd., 2011, Vol. 47, P. 441-447].
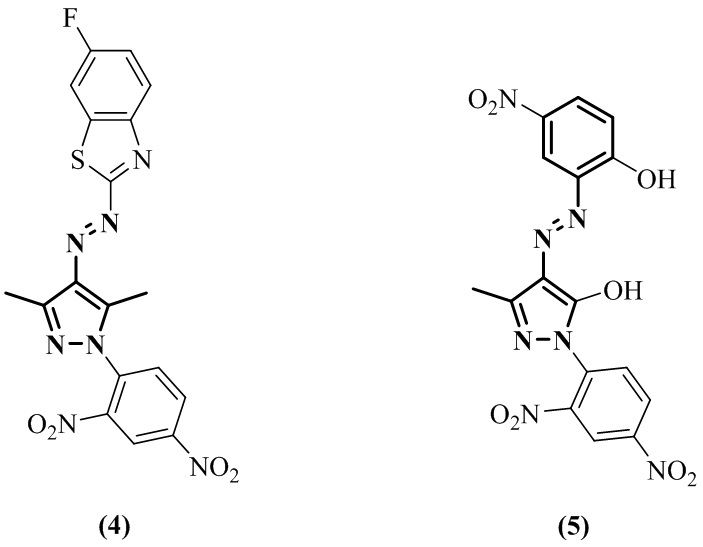
Соединения 4-(гет)арилдиазенилпиразольного ряда направлены на борьбу с дрожжеподобным грибом Candida albicans и плесневыми грибами Aspergillus niger, Aspergillus flavus, Penicillium chrysogenum и Ulocladium ilicis, а также патогенными грибами растений. Литературные данные об их активности в отношении грибов - дерматофитов отсутствуют. Этим объясняется актуальность создания соединений, активных в отношении паразитических грибов - дерматофитов, на основе 4-арилдиазенил-3,5-диметилпиразольного скаффолда.
Объект изобретения
Задача изобретения: синтезировать производное пиразола, имеющее высокую антимикотическую активность в отношении инфекций, вызванных штаммами патогенных грибов - дерматофитов.
Поставленная задача решается путем конденсации 3-[2-(4-метоксифенил)гидразинилиден]пентан-2,4-диона (6), синтезированного по известной методике [Y.V. Burgart, A.S. Fokin, O.G. Kuzueva, O.N. Chupakhin, V.I. Saloutin. Synthesis of fluorinated 2(3)-arylhydrazones of 1,2,3-tri(1,2,3,4-tetra)carbonyl compounds and their heterocyclization reactions // J. Fluorine Chem., 1998, Vol. 92, P. 101-108], с 4-нитрофенилгидразином (7).
Заявленное соединение можно синтезировать следующим образом:
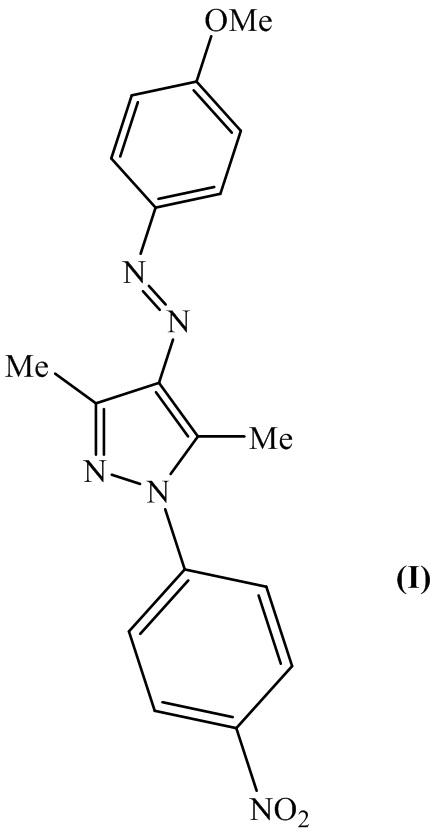
Смесь 1.17 г (5 ммоль) 3-арилгидразинилиденпентан-2,4-диона (6) и 0.8 г (5.25 ммоля) 4-нитрофенилгидразина (7) в ледяной уксусной кислоте (15 мл) кипятят 18 часов. Продукт (8) высаживают водой (15 мл), отфильтровывают. Осадок промывают водой (20 мл), ацетонитрилом (10 мл), сушат. После очистки колоночной хроматографией (элюент - хлороформ) получают 984 мг (56%) 4-(4-метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразола (8) в виде желтого порошка, т.пл. 172-174°C.
Прогресс реакции контролируют с помощью метода ТСХ на пластинах ALUGRAM® Xtra SIL G/UV254. Структуру заявляемого соединения подтверждают масс-спектром, зарегистрированным на квадрупольно-времяпролетном масс-спектрометре MaXis Impact HD (Bruker Daltonik GmbH) в режиме электрораспылительной ионизации для раствора в CHCl3 - MeOH (0.2:1.6) при скорости подачи образца 180 мкл/ч в модифицированном предустановленном методе инфузионного анализа малых молекул. Калибровка масс - внешняя HPC (high precision calibration) с применением калибровочного раствора G1969-85000 (Agilent Technologies). ИК спектр регистрируют на Фурье-спектрометре Perkin Elmer Spectrum Two в интервале 4000-400 см-1 с помощью приставки нарушенного полного внутреннего отражения c алмазным кристаллом. Спектры ЯМР измеряют в CDCl3 на спектрометре Bruker AVANCE III 500 (1H: 500 МГц, относительно SiMe4, 13C: 126 МГц, относительно сигнала растворителя CDCl3 δC = 77 м.д.). Температуру плавления измеряют в открытом капилляре на аппарате для определения точки плавления Stuart SMP30. Колоночную хроматографию проводят на силикагеле 60 (0.063-0.2 мм) марки Macherey-nagel.
Масс-спектр, найдено m/z: 352.1411 [M + H]+; вычислено для C18H17N5O3+: 352.1404. ИК спектр, ν, см-1: 2929, 2841 (C-H); 1594, 1580, 1566, 1509 (C=N, С=С). Спектр ЯМР 1H (δ, м.д., J/Гц): 2.59 (c, 3 Η, СН3); 2.77 (c, 3 Η, СН3); 3.89 (c, 3 H, OCH3); 7.00 (д, 2 Н, С6Н4, J = 9); 7.76 (д, 2 Н, С6Н4, J = 9); 7.83 (д, 2 Н, С6Н4, J = 9); 8.38 (д, 2 Н, С6Н4, J = 9). Спектр ЯМР 13C (δ, м.д.): 11.79 (СН3); 14.22 (СН3); 55.56 (OCH3); 114.12; 123.68; 123.90; 124.83; 137.02; 138.70; 144.36; 145.13; 146.11; 147.72; 161.35.
Изучение антимикотической активности in vitro заявляемого соединения (8).
Микробиологическое исследование проведено в ГБУ СО «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии». В исследовании использовали 8 тест-штаммов грибов дерматофитов из Российской коллекции патогенных грибов (РКПГ) НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова г. Санкт-Петербург. Оценку антимикотических свойств проводят методом серийных разведений, рекомендованным Институтом клинических и лабораторных стандартов (CLSI, 2014). В качестве ростовой среды используют питательную среду - агар Сабуро НИЦФ Санкт-Петербург (рег. уд. № ФСЗ 2012/14080). Идентификацию микроорганизмов с точностью 99.9% проводят на анализаторе BioMerieux VITEK MS MALDI-TOF методом времяпролетной масс-спектрометрии экстрагированных в матриксе бактериальных белков. Инокулюмы готовят с применением денситометра BioMerieux DensiCHEK Plus с оптической плотностью 0.5 McFarland, что соответствует 1,5х108 КОЕ/мл. Взвесь дерматофитов готовят из двухнедельной культуры, с предварительной гомогенизацией в стерильном физрастворе. Посевная доза для грибов составляет 105 КОЕ/мл. Тестируемое химическое соединение (8) растворяют в ДМСО, исходное разведение 1000 мкг/мл готовят на дистиллированной стерильной воде, серийные двукратные разведения (от 200 мкг/мл) готовят с применением бульона Сабуро. Для оценки антимикотической активности химического соединения применяют микрометод [А.А. Кубанова, Ж..В. Степанова, Т.А. Гуськова, Т.В. Пушкина, Л.Ю. Крылова, И.Б. Шилова, А.С. Тренин. Методические указания по изучению противогрибковой активности лекарственных средств //В кн.: Руководство по проведению доклинических исследований лекарственных средств / Под ред. А.Н. Миронова. Гриф и К, Москва, 2012, Часть 1, С. 578]. В каждом тесте используют положительный и отрицательный контроль. Критерии интерпретации результатов: новые химические соединения рассматривают перспективными для дальнейшего изучения, если значения минимальной ингибирующей концентрации (МИК) in vitro для контрольных штаммов не превышают 10-20 мкг/мл [Руководство по проведению доклинических исследований лекарственных средств / Под ред. А.Н. Миронова. Гриф и К, Москва, 2012, Часть 1, 944 с. Порядок исследования при определении спектра антимикробного действия и активности нового соединения in vitro. С. 511-513].
Пример 1.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophyton rubrum РКПГ F 1408 (T. rubrum). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально (с помощью стереомикроскопа Leica MZ 16) как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. rubrum.
Пример 2.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophyton mentagrophytes var. gypseum РКПГ F 1425 (T. mentagrophytes). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. mentagrophytes.
Пример 3.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophyton tonsurans РКПГ F 1396/228 (T. tonsurans). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. tonsurans.
Пример 4.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophiton violaceum РКПГ F 1211 (T. violaceum). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. violaceum.
Пример 5.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophyton mentagrophytes var. interdigitale РКПГ F 1459/11044 (T. interdigitale). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. interdigitale.
Пример 6.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Trichophyton schoenleinii РКПГ F 235/25 (T. schoenleinii). Планшет инкубируют в термостате при 27°С в течение 14 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба T. schoenleinii.
Пример 7.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Epidermophyton floccosum РКПГ F 1659/17 (E. floccosum). Планшет инкубируют в термостате при 27°С в течение 7 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба E. floccosum.
Пример 8.
Для постановки эксперимента используют стерильный 96-луночный плоскодонный планшет, в который вносят вначале по 100 мкл растворов серийных разведений соединения (8), а затем по 100 мкл раствора инокулюма гриба - дерматофита Microsporum canis РКПГ F 1643/1585 (M. canis). Планшет инкубируют в термостате при 27°С в течение 7 дней. МИК определяют визуально как наименьшую концентрацию, которая ингибирует рост тест-штамма гриба M. canis.
В качестве референтных соединений используют химически чистые лекарственные средства Флуконазол и Тербинафин.
 Флуконазол
Флуконазол
Флуконазол, представитель класса триазольных противогрибковых средств. Препарат обладает высокоспецифичным действием, ингибируя активность ферментов грибов, зависимых от цитохрома P450. Он блокирует превращение ланостерола клеток грибов в эргостерол, увеличивает проницаемость клеточной мембраны, нарушает её рост и репликацию. Флуконазол используется для лечения и профилактики кандидоза. Он активен при оппортунистических микозах, в том числе вызванных Candida, Cryptococcus neoformans, Coccidioides immitis, Microsporum и Trichophyton; при эндемических микозах, вызванных Blastomyces dermatidis, Histoplasma capsulatum.
 Тербинафин
Тербинафин
Тербинафин относится к аллиламинам, угнетающим рост микозов на ногах, волосах, ногтях. Он специфическим образом изменяет ранний этап биосинтеза стеролов, происходящего в грибах. Это ведет к дефициту эргостерола и внутриклеточному накоплению сквалена, что вызывает гибель клетки гриба. Действие Тербинафина осуществляется путем ингибирования фермента скваленэпоксидазы, расположенного на клеточной мембране гриба. Препарат обладает широким спектром действия в отношении дерматофитов, таких как Trichophyton, Microsporum, Epidermophyton, а также дрожжеподобных грибов рода Candida и Pityrosporum.
Результаты исследований представлены в таблице 1.
Таблица 1.
Значения минимальных ингибирующих концентраций (МИК, мкг/мл) соединения (8) в сравнении с лекарственными препаратами Флуконазол и Тербинафин в отношении контрольных штаммов патогенных грибов - дерматофитов
Заявляемое соединение (8) проявляет высокую активность в отношении всех восьми контрольных штаммов патогенных грибов - дерматофитов. При этом пиразол (8) показывает антимикотическую активность, превышающую активность референтного соединения Флуконазола в 4 - 64 раза в зависимости от тест-штамма гриба - дерматофита.
Пиразол (8) показывает антимикотическую активность в отношении штамма Trichophiton violaceum (T. violaceum), превосходящую по действию препарат сравнения Тербинафин в 10 раз. В отношении тест-штаммов Trichophyton rubrum (T. rubrum), Trichophyton mentagrophytes var. gypseum (T. mentagrophytes), Trichophyton tonsurans (T. tonsurans), Trichophyton mentagrophytes var. interdigitale (T. interdigitale), Microsporum canis (M. Canis) антимикотическая активность соединения (8) равна активности Тербинафина.
Таким образом, заявляемый 4-(4-метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразол (8) обладает более высокой антимикотической активностью в отношении 8 тест-штаммов патогенных грибов - дерматофитов по сравнению с широко применяемым в медицинской практике синтетическим противогрибковым препаратом группы триазолов Флуконазолом. Его антимикотическое действие сравнимо с активностью противогрибкового средства группы аллиламинов Тербинафина.
| название | год | авторы | номер документа |
|---|---|---|---|
| Смешанные металлокомплексы на основе 5-(4-метилфенил)-2,2'-бипиридина и (тетрафтор)салициловых кислот, обладающие антибактериальной и фунгистатической активностью | 2020 |
|
RU2737435C1 |
| НОВЫЙ АНТИБАКТЕРИАЛЬНЫЙ АГЕНТ 3-(КАРБОКСИМЕТИЛ)-1-(ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3-ИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛ-3-ИУМ ХЛОРИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО NEISSERIA GONORRHOEAE И MYCOBACTERIUM TUBERCULOSIS | 2023 |
|
RU2828876C1 |
| АРАЛКИЛБЕНЗИЛОВЫЕ ПРОСТЫЕ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ПРИМЕНЕНИЕ ТАКИХ СОЕДИНЕНИЙ, СПОСОБЫ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ | 2010 |
|
RU2548009C2 |
| 3,5-Замещенные производные тиазолидин-2,4-диона, обладающие противомикробной активностью | 2018 |
|
RU2690161C1 |
| Четвертичная аммониевая соль, обладающая антимикотической и антибактериальной активностью | 2018 |
|
RU2666544C1 |
| Способ получения 2,3,16,17,18,19-гексагидроолигомицина А и его применение для ингибирования роста дрожжей рода Candida | 2016 |
|
RU2623087C1 |
| 4-[(4-БРОМФЕНИЛ)((4-НИТРОФЕНИЛ)АМИНО)МЕТИЛИДЕН]-5-ГИДРОКСИ-5-(ТРИХЛОРМЕТИЛ)ДИГИДРОФУРАН-2,3-ДИОН, ОБЛАДАЮЩИЙ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2783242C1 |
| АНТИСЕПТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2641309C1 |
| Гибридные амиды на основе триазола и тиазолидина, обладающие антимикробной активностью | 2018 |
|
RU2703997C1 |
| 4-ИЗОПРОПИЛ-6-R-ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3(4H)-ОНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ NEISSERIA GONORRHOEAE | 2020 |
|
RU2754554C1 |
Изобретение направлено на создание препаратов для лечения грибковых заболеваний на основе органических соединений. Предложен 4-(4-метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразол. Технический результат заключается в получении 4-(4-метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1Н-пиразола, обладающего высокой антимикотической активностью в отношении инфекций, вызванных штаммами патогенных грибов – дерматофитов. 1 табл., 8 пр.
4-(4-Метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразол (I), обладающий антимикотической активностью в отношении штаммов патогенных грибов – дерматофитов:
| А.Н.ПЕРМИНОВА и др | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| — | |||
Авторы
Даты
2022-05-19—Публикация
2021-07-01—Подача