Область техники
[0001] Настоящее изобретение относится к составам, содержащим ацетаминофен и сульфоалкиловый эфир циклодекстрина.
Уровень техники
[0002] Ацетаминофен, также известный как парацетамол или АРАР, называемый по химической номенклатуре как N-ацетил-п-аминофенол, является широко используемым безрецептурным анальгетиком (обезболивающим) и антипиретическим средством (жаропонижающим средством). Ацетаминофен классифицируется как мягкий анальгетик. Его обычно применяют для облегчения головной боли и других слабых недомоганий и видов боли и он является основным компонентом во многих средствах от простуды и гриппа. В комбинации с опиоидными анальгетиками парацетамол можно также использовать для лечения более сильных болей, таких как послеоперационная боль, и для оказания паллиативной помощи больным на поздних стадиях рака.
[0003] Ацетаминофен в фармацевтическом составе подвержен гидролизу с образованием п-аминофенола, который затем может разлагаться до хинонимина (см., например, J.Е. Fairbrother, "Acetaminophen" in Analytical Profiles of Drug Substances, 1974, vol. 3, pp. 1-109). Скорость разложения парацетамола увеличивается с увеличением температуры и света. Скорость разложения является минимальной при рН около 6 (K.Т. Koshy et al., 1961, J. Pharm. Sci. 50, pp. 116-118). Способы стабилизации инъецируемых растворов ацетаминофена путем добавления буфера или поглотителя свободных радикалов имеют недостаток, который может вызывать у некоторых пациентов потенциальный раздражающий, аллергенный и/или канцерогенный эффект.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] Некоторые варианты реализации относятся к фармацевтическому составу, включающему ацетаминофен; и сульфоалкиловый эфир циклодекстрина, где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2, и где состав не содержит N-ацетилцистеин, L-метионин, L-цистеин, цистеина гидрохлорид или их смеси.
[0005] Некоторые варианты реализации относятся к стерильному одноразовому контейнеру, содержащему ацетаминофен; и сульфоалкиловый эфир циклодекстрина, где ацетаминофен и сульфоалкиловый эфир циклодекстрина находятся в твердой форме, где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2.
[0006] Некоторые варианты реализации относятся к способу уменьшения или лечения лихорадки или облегчения боли у субъекта, нуждающегося в этом, включающему введение путем инъекции субъекту эффективного количества жидкого состава, содержащего ацетаминофен и сульфоалкиловый эфир циклодекстрина, где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
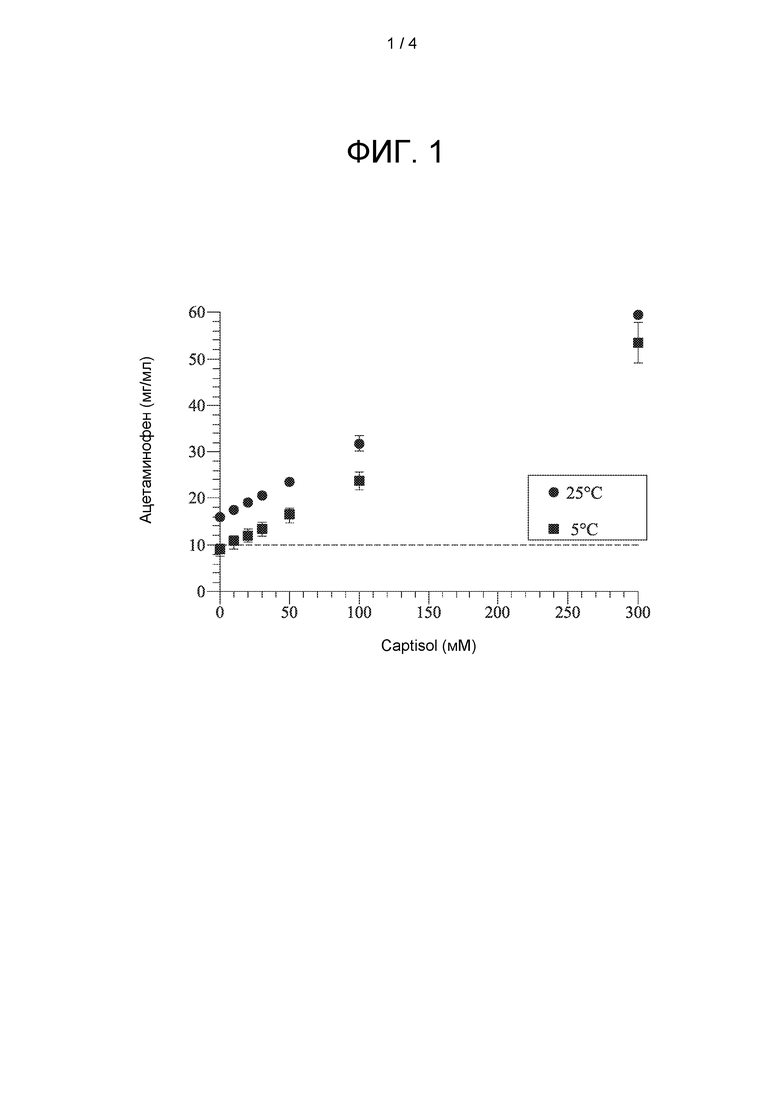
[0007] На ФИГ. 1 показана фазовая растворимость ацетаминофена в растворах CAPTISOL® при 5°С и 25°С.
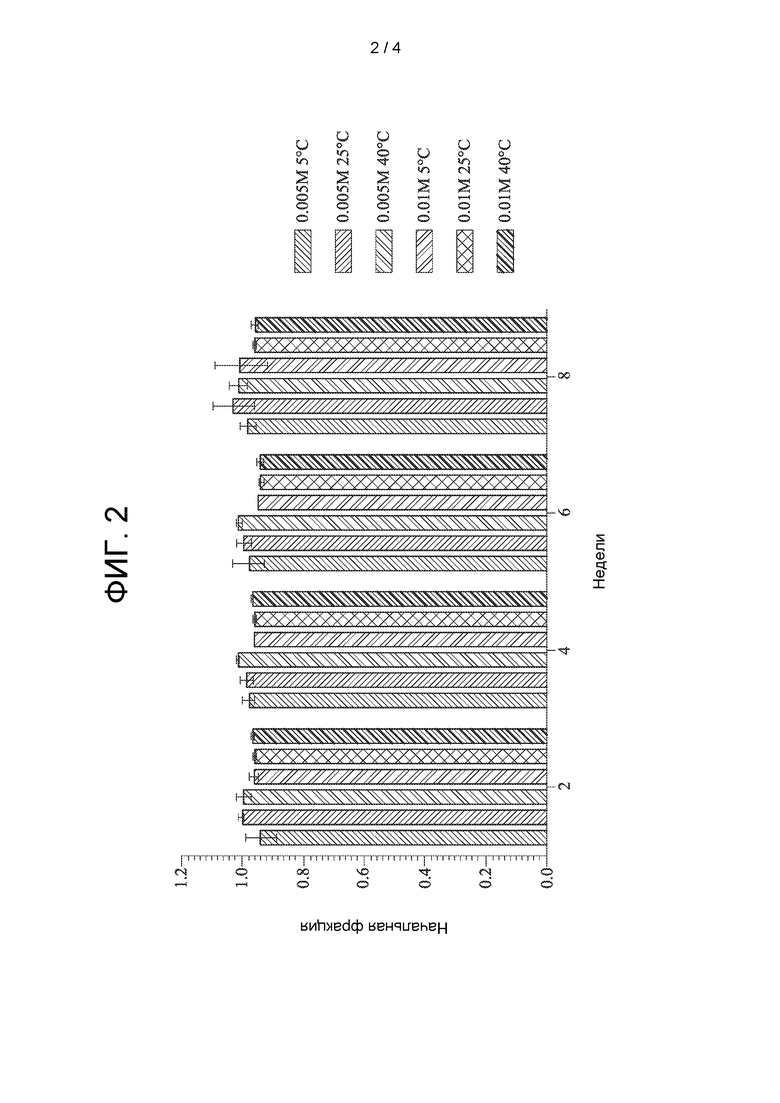
[0008] ФИГ. 2 показано исследование стабильности ацетаминофена в растворах CAPTISOL® при различных температурах в течение восьми недель.
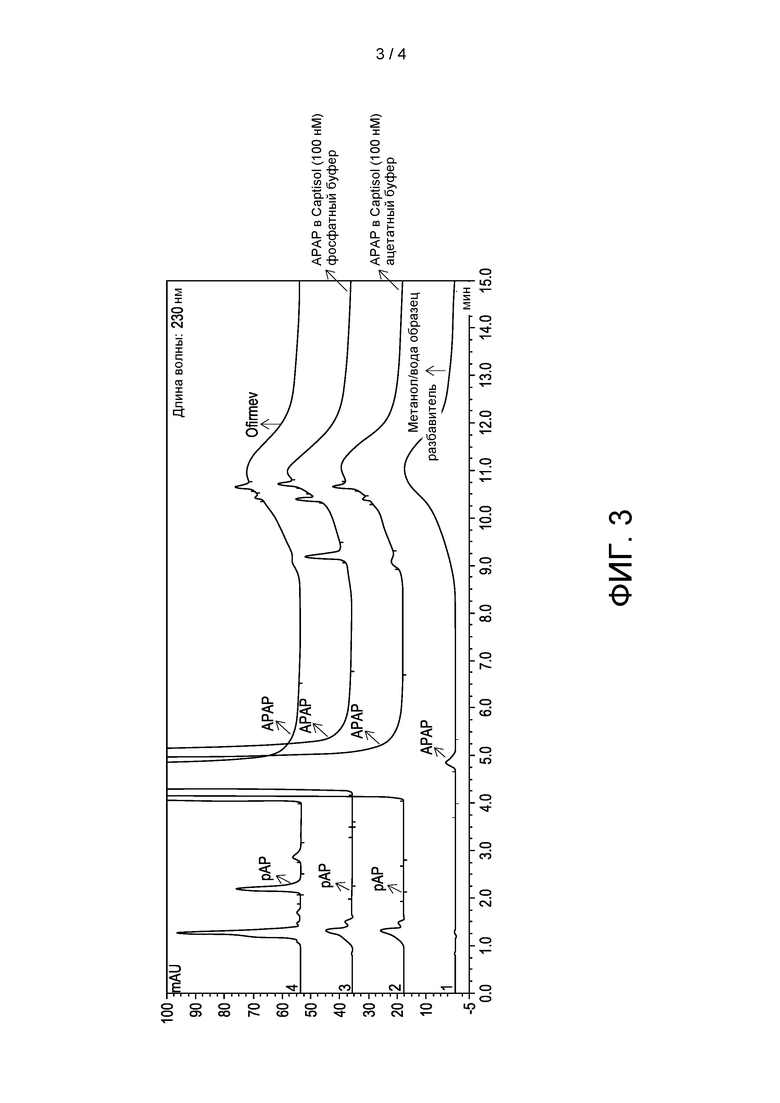
[0009] ФИГ. 3 показана хроматограмма составов ацетаминофена (10 мг/мл) в CAPTISOL® (0,1М) с ацетатным буфером и фосфатным буфером, составов Ofirmev® (10 мг/мл ацетаминофена) и контрольного метанола, которые хранили при 25°С и относительной влажности 60% в течение 6 месяцев.
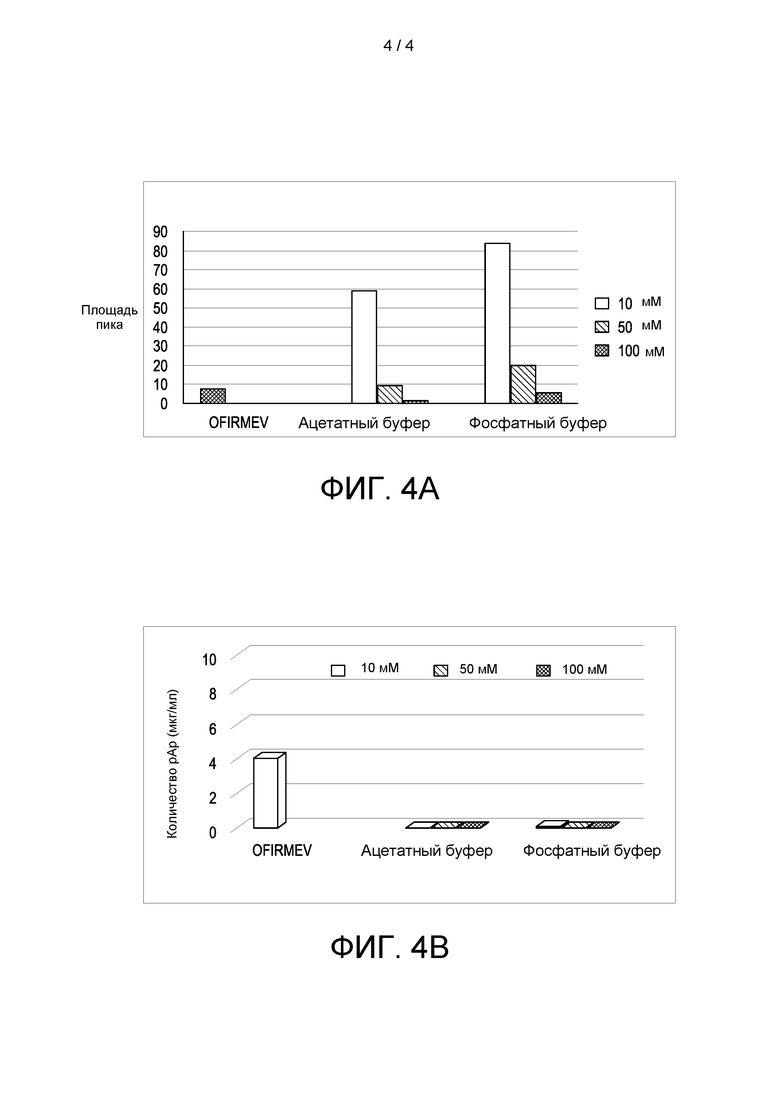
[0010] На ФИГ 4А показано количество всех родственных примесей, обнаруженных в Ofirmev®, а также в составах ацетаминофена в CAPTISOL® после хранения при 20°С и 60% влажности в течение 12 месяцев; и на ФИГ. 4В показано количество п-аминофенола, обнаруженного в Ofirmev® а также в составах ацетаминофена в CAPTISOL® после хранения при 20°С и 60% влажности в течение 12 месяцев.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА РЕАЛИЗАЦИИ
[0011] Термин «фармацевтически приемлемый катион» относится к катионам, которые сохраняют биологическую эффективность и свойства соединения и не являются биологически или иным образом нежелательными для использования в фармацевтическом препарате. Примеры катионов включают, но не ограничиваются ими, натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и тому подобное; особенно предпочтительными являются катионы аммония, калия, натрия, кальция и магния. Другие типы катионов могут включать, например, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и тому подобное, в частности, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Многие такие катионы известны в данной области техники, как описано в WO 87/05297, Johnston et al., опубликованной 11 сентября 1987 г. (полностью включена в настоящее описание посредством ссылки).
[0012] Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют биологическую эффективность и свойства соединений согласно предпочтительным вариантам реализации и которые не являются биологически или иным образом нежелательными. Во многих случаях соединения согласно предпочтительным вариантам реализации способны образовывать кислотные и/или основные соли благодаря присутствию амино и/или карбоксильных групп или подобных им групп. Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с неорганическими кислотами и органическими кислотами. Неорганические кислоты, из которых могут быть получены соли, включают, например, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и тому подобное. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и тому подобное. Фармацевтически приемлемые соли присоединения оснований могут быть образованы с неорганическими и органическими основаниями. Неорганические основания, из которых могут быть получены соли, включают, например, натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и тому подобное; особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и тому подобное, особенно такие, как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Многие такие соли известны в данной области техники, как описано в Международной публикации 87/05297, Johnston et al., опубликованной 11 сентября 1987 г. (включена в настоящий документ посредством ссылки).
[0013] В настоящем документе термин «алкил» относится к прямой или разветвленной углеводородной цепи, которая является полностью насыщенной (то есть не содержит двойных или тройных связей). Алкильная группа может содержать от 1 до 20 атомов углерода (всякий раз, когда встречается в настоящем документе, числовой диапазон, такой как «от 1 до 20», относится к каждому целому числу в данном диапазоне; например, «от 1 до 20 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до 20 атомов углерода, включительно, хотя настоящее определение также охватывает термин «алкил», где числовой диапазон не обозначен). Алкильная группа также может представлять собой алкил среднего размера, содержащий от 1 до 9 атомов углерода. Алкильная группа также может представлять собой низший алкил, содержащий от 1 до 4 атомов углерода. Алкильная группа может быть обозначена как «C1-4 алкил» или аналогичными обозначениями. Только в качестве примера «С1-4 алкил» означает, что в алкильной цепи содержится от одного до четырех атомов углерода, т.е. алкильная цепь выбрана из группы, состоящей из метила, этила, пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Типичные алкильные группы включают, но не ограничиваются ими, метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил и тому подобное.
[0014] «Сульфонильная» группа относится к группе «-SO2R», в которой R выбран из водорода, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-7 карбоциклила, С6-10 арила, 5-10-членного гетероарила и 3-10-членного гетероциклила, как определено в настоящем документе.
[0015] «Субъект» в контексте настоящего описания означает человека или млекопитающее, не являющееся человеком, например собаку, кошку, мышь, крысу, корову, овцу, свинью, козу, примата, не являющегося человеком, или птицу, например, курицу, а также любое другое позвоночное или беспозвоночное.
[0016] Термин «млекопитающее» используется в его обычном биологическом смысле. Таким образом, он конкретно включает, но не ограничивается ими, приматов, включая обезьянообразных (шимпанзе, высших обезьян, низших обезьян) и людей, крупный рогатый скот, лошадей, овец, коз, свиней, кроликов, собак, кошек, грызунов, крыс, мышей, морских свинок или тому подобное.
[0017] «Эффективное количество» или «терапевтически эффективное количество» в контексте настоящего описания относится к количеству терапевтического агента, которое эффективно для уменьшения, до некоторой степени, или уменьшения вероятности появления одного или нескольких симптомов заболевания или состояния, и включает излечение заболевания или состояния. «Излечение» означает, что симптомы заболевания или состояния устранены; тем не менее, некоторые долгосрочные или постоянные эффекты могут существовать даже после излечения (например, обширное повреждение ткани).
[0018] Термин «лечить», «лечение» или «лечащий» в контексте настоящего описания относится к введению фармацевтической композиции субъекту в профилактических и/или терапевтических целях. Термин «профилактическое лечение» относится к лечению субъекта, у которого еще нет симптомов заболевания или состояния, но который восприимчив или иным образом подвержен риску конкретного заболевания или состояния, в результате лечение снижает вероятность того, что у пациента разовьется заболевание или состояние. Термин «терапевтическое лечение» относится к осуществлению лечения субъекта, уже страдающего от заболевания или состояния.
Циклодекстрин
[0019] В настоящем документе термин «циклодекстрин» относится к α-циклодекстрину, β-циклодекстрину, γ-циклодекстрину или их соответствующим производным, включая производные, в которых одна или несколько гидроксильных групп в ядре циклодекстрина заменены алкиловым эфиром, гидроксиалкиловым эфиром или суфлоалкиловым эфиром. Примеры производного циклодекстрина могут включать, но не ограничиваются ими, циклодекстрины, перечисленные в таблице А ниже. Предпочтительно, циклодекстрин представляет собой β-циклодекстрин, гидроксипропил-β-циклодекстрин или сульфоалкиловый эфир β-циклодекстрина.
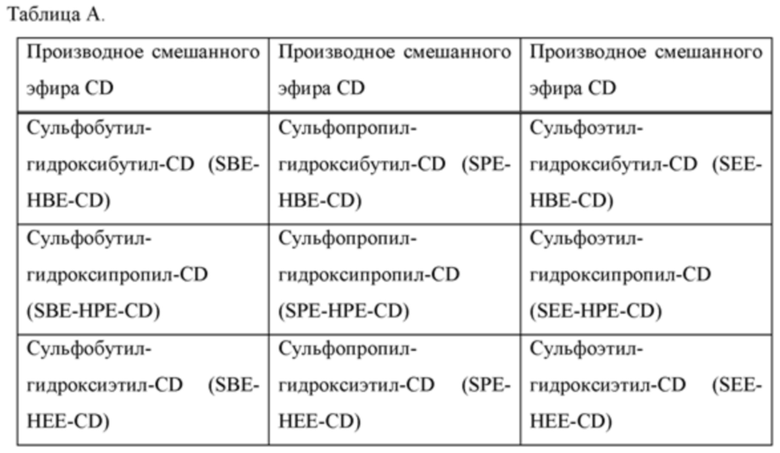
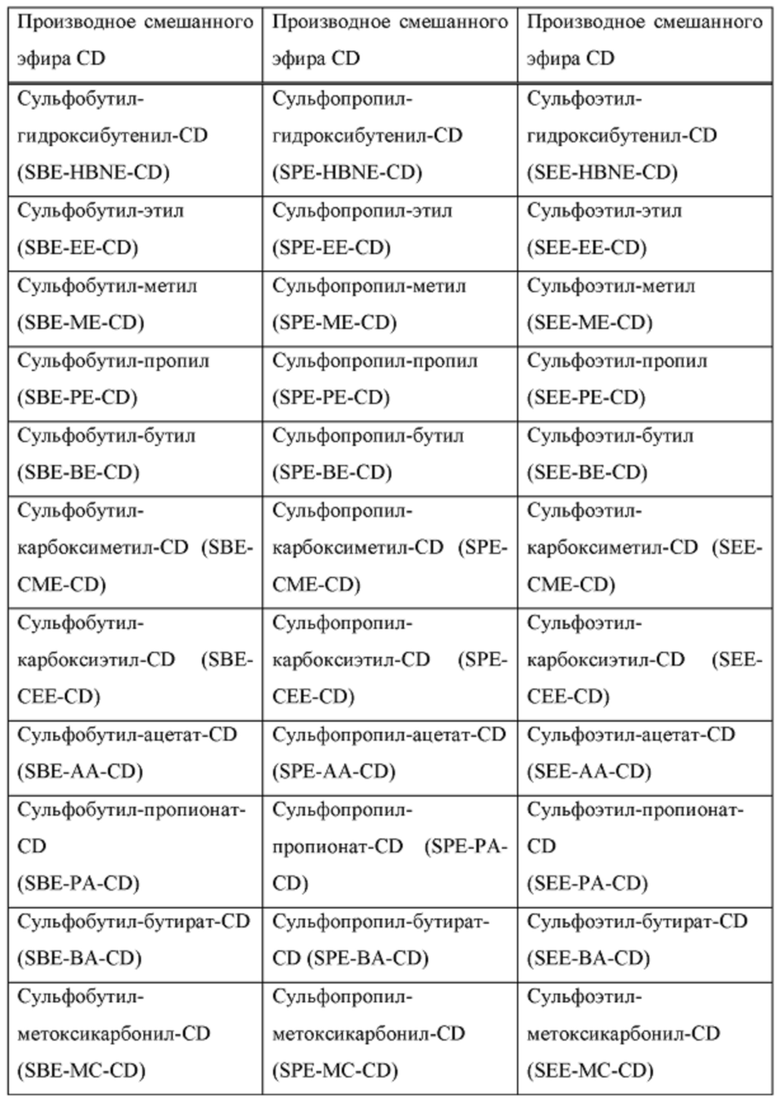
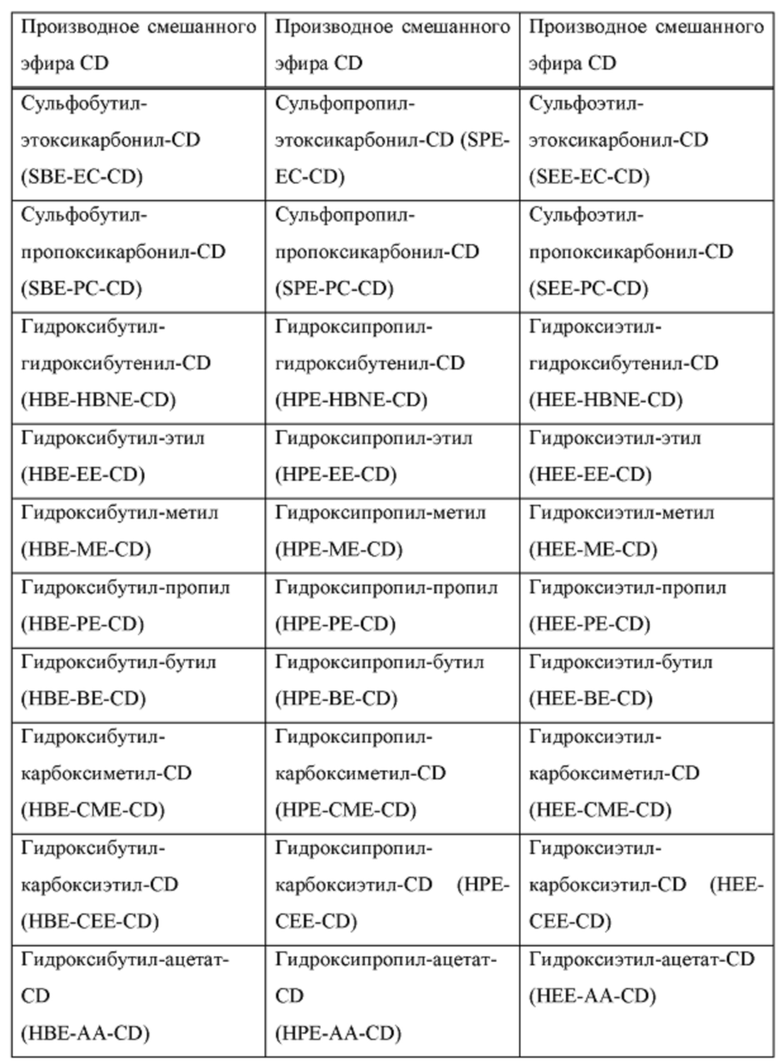
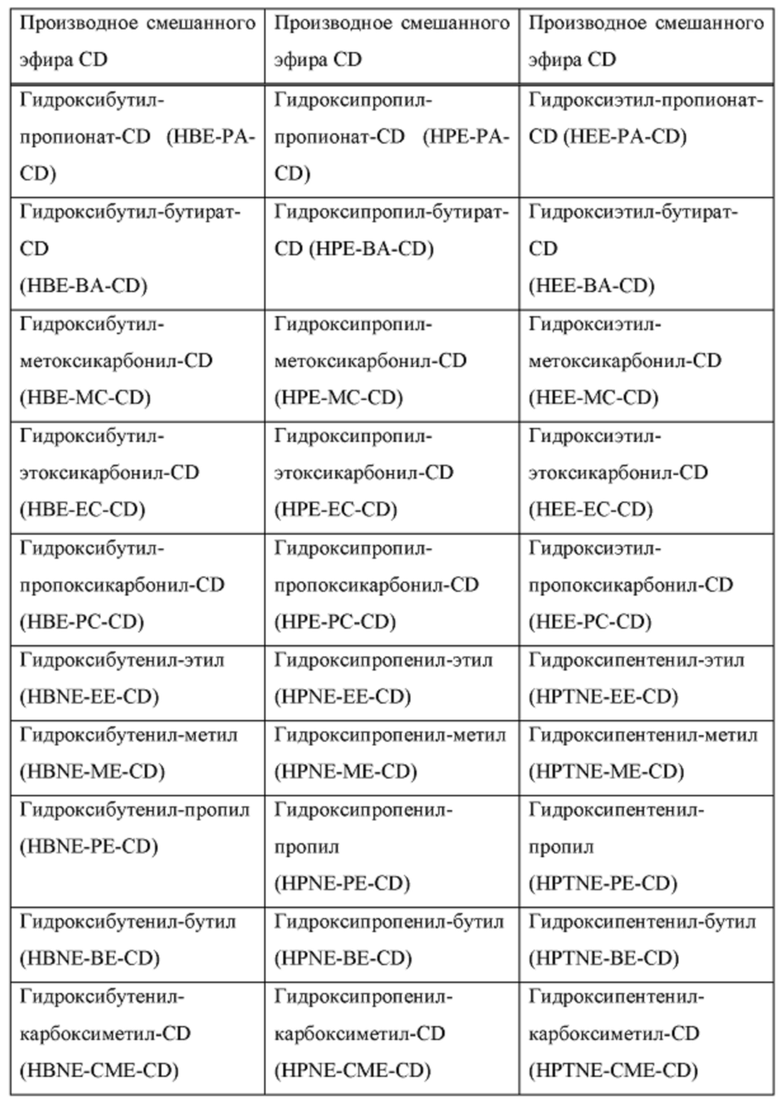

[0020] В настоящем документе термины «сульфоалкиловый эфир циклодекстрина» и «SAE-CD» относятся к производному циклодекстрина, содержащему заместитель, представляющий собой сульфоалкиловый эфир, такой как (С2-6 алкилен)-SO3-. Сульфоалкильное производное циклодекстрина может представлять собой одно производное или смесь производных. Поскольку производные циклодекстрина содержат сульфонильные группы, они могут быть заряженными. Сульфоалкиловый эфир циклодекстрина может быть либо замещен по меньшей мере по одной из первичных гидроксильных групп циклодекстрина, либо замещен как по первичным гидроксильным группам, так и по гидроксильной группе в 3 положении. Замещение в положении 2 также возможно. Примеры сульфоалкилового эфира циклодекстрина включают сульфобутиловый эфир β-циклодекстрина.
[0021] Согласно некоторым вариантам реализации циклодекстрин представляет собой соединение формулы 1:
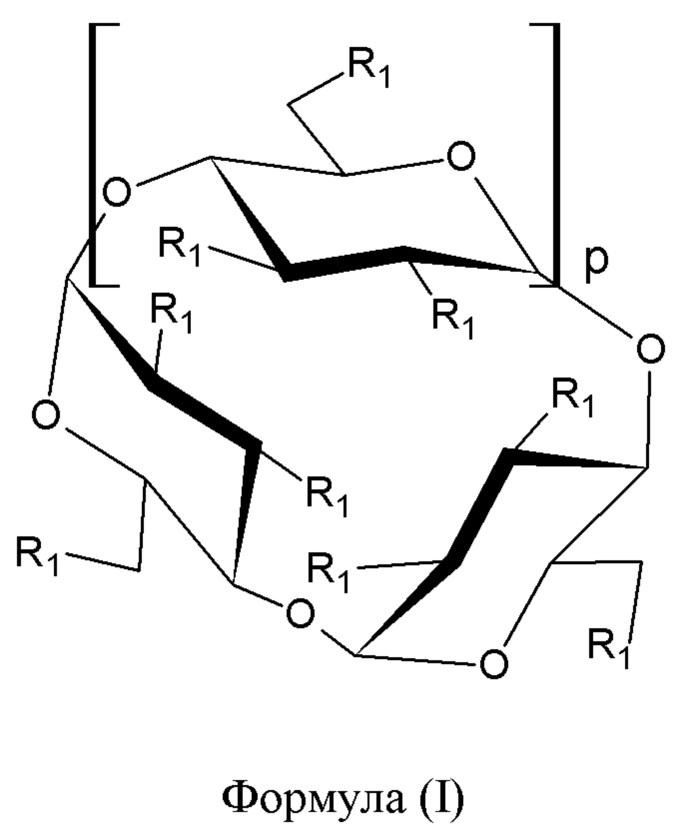
или его фармацевтически приемлемую соль, где:
р представляет собой 4, 5 или 6, и каждый R1 выбран из -ОН или -O-(C1-С8 алкилен)-SO3T, и
каждый Т независимо представляет собой водород или фармацевтически приемлемый катион,
при условии, что по меньшей мере один R1 представляет собой -ОН.
[0022] Согласно некоторым вариантам реализации каждый R1 независимо представляет собой-ОН или -O-(C1-C8 алкилен)-SO3T, при условии, что по меньшей мере один R1 представляет собой ОН и по меньшей мере один R1 представляет собой -O-(C1-C8 алкилен)-SO3T, где Т представляет собой водород или фармацевтически приемлемый катион. Согласно некоторым вариантам реализации по меньшей мере один R1 независимо представляет собой -ОН или -O-(C1-4 алкилен)-SO3T. Согласно некоторым вариантам реализации по меньшей мере один R1 независимо представляет собой группу -O-(СН2)gSO3T, где g представляет собой от 2 до 6 или от 2 до 4. Согласно некоторым вариантам реализации по меньшей мере один R1 независимо представляет собой -OCH2CH2CH2SO3T или -OCH2CH2CH2CH2SO3T. Согласно некоторым вариантам реализации Т представляет собой Н. Согласно некоторым вариантам реализации Т представляет собой Na+. Согласно некоторым вариантам реализации каждый Т независимо выбран из щелочного металла, щелочноземельного металла, ионов аммония и катионов амина и их комбинаций. Согласно некоторым вариантам реализации каждый Т независимо выбран из Li+, Na+, K+, Са+2, Mg+2, амина и любой их комбинации. Согласно некоторым вариантам реализации каждый Т независимо представляет собой катион амина, выбранный из (С1-С6)-алкиламинов, пиперидина, пиразина, (С1-С6)-алканоламина, этилендиамина и (С4-С8)-циклоалканоламина.
[0023] Согласно некоторым вариантам реализации каждый R1 независимо представляет собой -ОН или -O-(C1-C8 алкил), при условии, что по меньшей мере один R1 представляет собой ОН и по меньшей мере один R1 представляет собой -O-(C1-C8 алкил). Согласно некоторым вариантам реализации каждый R1 независимо выбран из метилового эфира, этилового эфира, пропилового эфира, бутилового эфира, пентилового эфира и гексилового эфира.
[0024] Согласно некоторым вариантам реализации каждый R1 независимо представляет собой -ОН или O-(C1-C6 алкил)-ОН, при условии, что по меньшей мере один R1 представляет собой ОН и по меньшей мере один R1 представляет собой O-(C1-С6 алкил)-ОН. Согласно некоторым вариантам реализации по меньшей мере один R1 представляет собой -O-(C1-C6 алкил)-ОН. Согласно некоторым вариантам реализации каждый R1 независимо выбран из гидроксиметилового эфира, гидроксиэтилового эфира, гидроксипропилового эфира, гидроксибутилового эфира, гидроксипентилового эфира и гидроксигексилового эфира.
[0025] Согласно некоторым вариантам реализации производное циклодекстрина, такое как сульфоалкиловый эфир циклодекстрина, алкилированный циклодекстрин или гидроксиалкиловый эфир циклодекстрина, может иметь среднюю степень замещения (ADS) от 2 до 9, от 4 до 8, от 4 до 7,5, от 4 до 7, от 4 до 6,5, от 4,5 до 8, от 4,5 до 7,5, от 4,5 до 7, от 5 до 8, от 5 до 7,5, от 5 до 7, от 5,5 до 8, от 5,5 до 7,5, от 5,5 до 7, от 5,5 до 6,5, от 6 до 8, от 6 до 7,5, от 6 до 7,1, от 6,5 до 7,1, от 6,2 до 6,9, или 6,5 на циклодекстрин, и остальные заместители представляют собой -Н.
[0026] Согласно некоторым вариантам реализации предложены композиции, содержащие единственный вид производного циклодекстрина, имеющий структуру, представленную в формуле (I), где композиция в целом содержит в среднем по меньшей мере от 1 до 3n+6 остатков алкилсульфоновой кислоты на молекулу циклодекстрина. Композиции, описанные в настоящем документе, также включают композиции, содержащие производные циклодекстрина, имеющие узкий или широкий диапазон степени замещения и высокую или низкую степень замещения. Указанные комбинации могут быть оптимизированы по мере необходимости для получения циклодекстринов, имеющих конкретные свойства.
[0027] Типичные производные SAE-CD включают SBE4-β-CD, SBE7-β-CD, SBE11-β-CD, SBE7-γ-CD и SBE5-γ-CD, которые соответствуют производным SAE-CD формулы I, где р=5, 5, 5, 6 и 6, соответственно; и в среднем присутствуют 4, 7, 11, 7 и 5 заместителей сульфоалкилового эфира, соответственно. Другие типичные производные SAE-CD включают производные формулы SAEx-R-CD (формула 2), где SAE представляет собой сульфометиловый эфир (SME), сульфоэтиловый эфир (SEE), сульфопропиловый эфир (SPE), сульфобутиловый эфир (SBE), сульфопентиловый эфир (SPtE) или сульфогексиловый эфир (SHE); х (средняя или конкретная степень замещения) составляет 1-18, 1-21 или 1-24; R (кольцевая структура исходного циклодекстрина) представляет собой α, β или γ, соответственно; и CD представляет собой циклодекстрин. Функциональная группа SAE включает катионный противоион, как описано в настоящем документе, или группу, обычно используемую в фармацевтической промышленности в качестве противоиона любой кислотной группы. Поскольку SAE-CD представляет собой полианионный циклодекстрин, он может быть представлен в различных солевых формах. Подходящие противоионы для функциональной группы (групп) SAE включают катионные органические атомы или молекулы и катионные неорганические атомы или молекулы. SAE-CD может включать противоион одного типа или смесь различных противоионов. Свойства SAE-CD могут быть изменены путем изменения вида присутствующего противоиона. Например, первая солевая форма SAE-CD может иметь больший электростатический заряд, чем другая вторая солевая форма SAE-CD. Было обнаружено, что форма кальциевой соли является более электроотрицательной, чем форма натриевой соли. Аналогично, SAE-CD, имеющий первую степень замещения, может иметь больший электростатический заряд, чем второй SAE-CD, имеющий другую степень замещения.
[0028] Согласно некоторым вариантам реализации предложены композиции SAE-CD, где SAE-CD представляет собой производное, представляющее собой сульфобутиловый эфир бета-циклодекстрина (SBE-β-CD), имеющий следующую структуру:
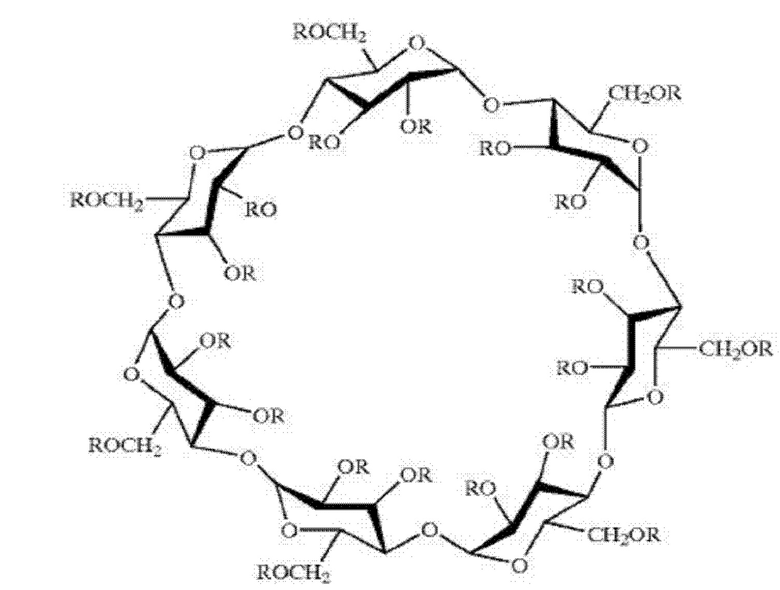
где каждый R независимо представляет собой -Н или -(CH2)4-SO3Na и средняя степень замещения группами -(CH2)4-SO3Na составляет от 6 до 7,1.
[0029] Способы получения производных SAE-CD различаются, но обычно включают общие стадии сульфоалкилирования с последующим выделением. Профиль химических свойств SAE-CD устанавливается на стадии сульфоалкилирования. Например, изменение условий реакции в ходе сульфоалкилирования может приводить к изменению средней степени замещения и среднего региохимического распределения сульфоалкильных групп в SAE-CD. Длина алкильной цепи сульфоалкильной функциональной группы определяется в соответствии с используемым сульфоалкилирующим агентом. А также использование конкретного подщелачивающего агента в ходе алкилирования может привести к образованию конкретной соли SAE-CD, если только стадия ионного обмена не была выполнена после сульфоалкилирования.
[0030] В целом, известные процессы стадии сульфоалкилирования включают, например: 1) воздействие на недериватизированный исходный циклодекстрин алкилирующим агентом в щелочных условиях, например, алкилсультоном или галогеналкилсульфонатом; 2) необязательное добавление дополнительного подщелачивающего агента в реакционную среду для расходования избытка алкилирующего агента; и 3) нейтрализацию реакционной среды подкисляющим агентом. Подавляющее большинство описанных в литературе процессов включают проведение стадии сульфоалкилирования в водных средах; однако некоторые ссылки раскрывают использование пиридина, диоксана или ДМСО в качестве реакционного растворителя для сульфоалкилирования. В литературе описано использование подщелачивающего агента для ускорения реакции сульфоалкилирования.
[0031] По завершении стадии сульфоалкилирования проводят выделение и очистку SAE-CD.
[0032] Описаны несколько различных процессов выделения SAE-CD после сульфоалкилирования и нейтрализации. В целом, водную жидкость, содержащую SAE-CD, сушат для удаления воды с образованием твердого вещества. В литературе предлагаются различные способы удаления воды из водного раствора, содержащего SAE-CD. Такие способы включают традиционную сублимационную сушку, распылительную сушку, сушку в печи, сушку в вакууме, ротационное испарение при пониженном давлении, вакуумную сушку или вакуумную сушку в барабане. См., например, Ma (S.T.P. Pharma. Sciences (1999), 9(3), 261-266), CAPTISOL® (sulfobutyl ether beta-cyclodextrin sodium; Pharmaceutical Excipients 2004; Eds. R.C. Rowe, P.J. Sheskey, S.С. Owen; Pharmaceutical Press and American Pharmaceutical Association, 2004) и другие ссылки, касающиеся получения производных SAE-CD.
[0033] Подходящие способы получения исходного вещества SAE-CD для получения композиции SAE-CD для применения, как описано в настоящем документе, раскрыты в патентах США №№5376645, 5874418 и №5134127, выданных Stella et al.; патенте США №3426011, выданному Parmerter et al.; Lammers et al. (Reel. Trav. CMm. Pays-Bas (1972), 91(6), 733-742); Staerke (1971), 23(5), 167-171); Qu et al. (J Inclusion Phenom. Macro. Chem., (2002), 43, 213-221); патенте США №5244059, выданному Yoshinaga; патенте США №6153746, выданному Shah; Международной публикации РСТ №WO 2005/042584, выданной Stella et al.; Adam et al. (J. Med. Chem. (2002), 45, 1806-1816); Международной публикации РСТ № WO 01/40316, выданной Zhang et al.; Tarver et al. (Bioorganic & Medicinal Chemistry (2002), 10, 1819-1827); Ma (S.T.P. Pharma. Sciences (1999), 9(3), 261-266); Jung et al. (J Chromat. 1996, 755, 81-88); и Luna et al. (Carbohydr. Res. 1997, 299, 103-110), полные описания которых включены в настоящее описание посредством ссылки.
[0034] Исходное вещество SAE-CD может быть включено в жидкую подачу, используемую в процессе распылительной сушки в псевдоожиженном слое, как описано в патенте США №8049003, который включен посредством ссылки для целей получения композиции SAE-CD с помощью процесса распылительной сушки в псевдоожиженном слое. Другие способы удаления воды из водного раствора, содержащего SAE-CD, могут включать традиционную лиофилизацию, распылительную сушку, сушку в печи, вакуумную сушку в печи, ротационное испарение при пониженном давлении, вакуумную сушку или вакуумную сушку в барабане. См., например, Ma (S.T.P. Pharma. Sciences (1999), 9(3), 261-266), CAPTISOL®(sulfobutyl ether beta-cyclodextrin sodium; Pharmaceutical Excipients 2004; Eds. R.C. Rowe, P.J. Sheskey, S.C. Owen; Pharmaceutical Press and American Pharmaceutical Association, 2004), которая полностью включена в настоящее описание посредством ссылки, и другие ссылки, касающиеся получения производных SAE-CD.
[0035] Описанная в настоящем документе композиция SAE-CD также может включать комбинацию дериватизированного циклодекстрина (SAE-CD) и недериватизированного циклодекстрина. Например, композиция SAE-CD может быть получена так, чтобы включать недериватизированный циклодекстрин в количестве от 0 до менее 50 мас. %. от общего количества присутствующего циклодекстрина. Типичные варианты реализации композиции SAE-CD включают композиции, которые содержат 0-5 мас. %, 5-50 мас. %, менее 5%, менее 10%, менее 20%, менее 30%, менее 40% или менее 50% недериватизированного циклодекстрина.
Композиции, содержащие ацетаминофен и сульфоалкиловый эфир циклодекстрина
[0036] Некоторые варианты реализации относятся к фармацевтическому составу, содержащему ацетаминофен; и сульфоалкиловый эфир циклодекстрина, где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2, и где состав не содержит N-ацетилцистеин, L-метионин, L-цистеин, цистеина гидрохлорид или их смеси.
[0037] Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до менее 1. Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,05 до примерно 0,5, примерно 0,05 до примерно 0,25, примерно 0,05 до примерно 0,2, примерно 0,05 до примерно 0,15 или от примерно 0,07 до примерно 0,15. Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет примерно 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2,0. Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет примерно 0,15.
[0038] Согласно некоторым вариантам реализации концентрация ацетаминофена составляет от примерно 1 мг/мл до 50 мг/мл, от примерно 5 мг/мл до примерно 20 мг/мл или от примерно 8 мг/мл до примерно 12 мг/мл. Согласно некоторым вариантам реализации концентрация ацетаминофена составляет от примерно 8 мг/мл до примерно 12 мг/мл. Согласно некоторым вариантам реализации концентрация ацетаминофена составляет примерно 10 мг/мл. Согласно некоторым вариантам реализации концентрация ацетаминофена по меньшей мере примерно 20 мг/мл. Согласно некоторым вариантам реализации концентрация ацетаминофена по меньшей мере примерно 30 мг/мл. Согласно некоторым вариантам реализации концентрация ацетаминофена составляет примерно 33 мг/мл.
[0039] Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 1 мМ до примерно 500 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 10 мМ до примерно 400 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 1 мМ до примерно 150 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию менее 200 мМ, 190 мМ, 180 мМ, 170 мМ, 160 мМ, 150 мМ, 140 мМ, 130 мМ, 120 мМ, 110 мМ, 100 мМ, 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию менее 40 мМ, 30 мМ, 20 мМ, 10 мМ, 5 мМ или 1 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 200 мМ, 190 мМ, 180 мМ, 170 мМ, 166 мМ, 160 мМ, 150 мМ, 140 мМ, 130 мМ, 120 мМ, 115 мМ, 110 мМ, 100 мМ, 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 46 мМ, 40 мМ, 30 мМ, 20 мМ, 10 мМ, 5 мМ или 1 мМ. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 10 мМ.
[0040] Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 1 мг/мл до примерно 500 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 50 мг/мл до примерно 400 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию от примерно 10 мг/мл до примерно 150 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию менее 500 мг/мл, 400 мг/мл, 360 мг/мл, 250 мг/мл, 200 мг/мл, 150 мг/мл, 120 мг/мл, 110 мг/мл, 100 мг/мл, 90 мг/мл, 80 мг/мл, 70 мг/мл, 60 мг/мл или 50 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию менее 40 мг/мл, 30 мг/мл, 20 мг/мл, 10 мг/мл, 5 мг/мл или 1 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 400 мг/мл, 360 мг/мл, 300 мг/мл, 250 мг/мл, 200 мг/мл, 190 мг/мл, 180 мг/мл, 170 мг/мл, 166 мг/мл, 160 мг/мл, 150 мг/мл, 140 мг/мл, 130 мг/мл, 120 мг/мл, 110 мг/мл, 100 мг/мл, 90 мг/мл, 80 мг/мл, 70 мг/мл, 60 мг/мл, 50 мг/мл, 40 мг/мл, 30 мг/мл, 20 мг/мл, 10 мг/мл, 5 мг/мл или 1 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 100 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 200 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 250 мг/мл. Согласно некоторым вариантам реализации сульфоалкиловый эфир циклодекстрина имеет концентрацию примерно 360 мг/мл.
[0041] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, содержит менее примерно 10 мкг/мл, 9 мкг/мл, 8 мкг/мл, 7 мкг/мл, 6 мкг/мл, 5,8 мкг/мл, 5,5 мкг/мл, 5 мкг/мл, 4 мкг/мл, 3 мкг/мл, 2,6 мкг/мл, 2 мкг/мл, 1,5 мкг/мл, 1 мкг/мл. 0,5 мкг/мл, 0,1 мкг/мл, 0,05 мкг/мл, 0,02 мкг/мл или 0,01 мкг/мл п-аминофенола. Согласно некоторым вариантам реализации состав содержит менее 2,6 мкг/мл п-аминофенола. Согласно некоторым вариантам реализации состав содержит менее 0,05 мкг/мл п-аминофенола.
[0042] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, содержит менее примерно 10%, 8%, 6%, 5%, 4%, 2%, 1%, 0,8%, 0,6%, 0,5%, 0,4%, 0,2%, 0,15%, 0,10%, 0,08%, 0,05%, 0,01%, 0,005% или 0,001% по массе п-аминофенола в расчете на общее количество ацетаминофена в составе. Согласно некоторым вариантам реализации состав содержит менее примерно 0,20% по массе п-аминофенола в расчете на общее количество ацетаминофена в составе. Согласно некоторым вариантам реализации состав содержит менее примерно 0,15% по массе п-аминофенола в расчете на общее количество ацетаминофена в составе. Согласно некоторым вариантам реализации состав содержит менее примерно 0,005% по массе п-аминофенола в расчете на общее количество ацетаминофена в составе.
[0043] Количество п-аминофенола в составе можно измерить после различных условий хранения. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 5°С. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 15°С. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 25°С. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 40°С. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при уровне влажности 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80%. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при уровне влажности 60%. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава в течение 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 15 месяцев, 20 месяцев или 24 месяцев. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 25°С, влажности 60% в течение 12 месяцев. Согласно некоторым вариантам реализации количество п-аминофенола, описанного в настоящем документе, измеряют после хранения состава при 5°С в течение 12 месяцев.
[0044] Согласно некоторым вариантам реализации состав очищен от кислорода перед хранением. Согласно некоторым вариантам реализации состав не очищен от кислорода перед хранением. Согласно некоторым вариантам реализации состав хранят в условиях атмосферы инертного газа (например, азота и аргона). Согласно некоторым вариантам реализации состав продувают инертным газом перед хранением. Согласно некоторым вариантам реализации состав хранят в герметичном контейнере, имеющем свободное пространство, заполненное инертным газом.
[0045] Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет более 0,005 ppm, 0,01 ppm, 0,025 ppm, 0,05 ppm, 0,08 ppm, 0,1 ppm, 0,5 ppm, 0,8 ppm, 1,0 ppm, 1,2 ppm, 1,5 ppm, 1,8 ppm, 2,0 ppm, 2,5 ppm, 3,0 ppm, 3,5 ppm, 4,0 ppm, 4,5 ppm, 5,0 ppm, 5,5 ppm, 6,0 ppm, 6,5 ppm, 7,0 ppm, 7,5 ppm, 8,0 ppm, 8,5 ppm, 9,0 ppm, 9,5 ppm, 10,0 ppm,12,5 ppm, 15 ppm или 20 ppm. Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет более 1 ppm. Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет более 2 ppm. Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет менее 0,005 ppm, 0,01 ppm, 0,05 ppm, 0,08 ppm, 0,1 ppm, 0,025 ppm, 0,5 ppm, 0,8 ppm, 1,0 ppm, 1,2 ppm, 1,5 ppm, 1,8 ppm, 2,0 ppm, 2,5 ppm, 3,0 ppm, 3,5 ppm, 4,0 ppm, 4,5 ppm, 5,0 ppm, 5,5 ppm, 6,0 ppm, 6,5 ppm, 7,0 ppm, 7,5 ppm, 8,0 ppm, 8,5 ppm, 9,0 ppm, 9,5 ppm, 10,0 ppm, 12,5 ppm, 15 ppm или 20 ppm. Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет менее 1 ppm. Согласно некоторым вариантам реализации количество растворенного кислорода в составе перед хранением составляет менее 2 ppm.
[0046] Согласно некоторым вариантам реализации состав представляет собой водный раствор. Согласно некоторым вариантам реализации состав представляет собой лиофилизированный или высушенный распылением порошок.
[0047] Согласно некоторым вариантам реализации состав не содержит кортикостероиды. Согласно некоторым вариантам реализации состав не содержит андрогены. Согласно некоторым вариантам реализации состав не содержит клопидогрел. Согласно некоторым вариантам реализации состав не содержит фторхинолоны. Согласно некоторым вариантам реализации состав не содержит бензгидрилпиперазины. Согласно некоторым вариантам реализации состав не содержит цетиризин. Согласно некоторым вариантам реализации состав не содержит никотин. Согласно некоторым вариантам реализации состав не содержит 17α-этинил-5α-андростан-3α,17β-диол. Согласно некоторым вариантам реализации состав не содержит аналог пирона. Согласно некоторым вариантам реализации состав не содержит флавоноиды. Согласно некоторым вариантам реализации состав не содержит кверцетины.
[0048] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, дополнительно включает одно или более фармацевтически приемлемых вспомогательных веществ.
[0049] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, дополнительно включает буфер. Согласно некоторым вариантам реализации буфер представляет собой фосфатный буфер. Согласно некоторым вариантам реализации буфер представляет собой ацетатный буфер.
[0050] Согласно некоторым вариантам реализации буфер имеет концентрацию в диапазоне от 1 мМ до примерно 150 мМ. Согласно некоторым вариантам реализации концентрация буфера составляет примерно 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мМ. Согласно некоторым вариантам реализации концентрация буфера составляет более примерно 3, 5, 7,5, 10, 15 или 20 мМ.
[0051] Согласно некоторым вариантам реализации состав имеет рН в диапазоне от примерно 5 до примерно 10. Согласно некоторым вариантам реализации рН состава составляет от примерно 5,8 до примерно 7,4. Согласно некоторым вариантам реализации рН состава составляет примерно 5, 5,5, 5,8, 6, 6,2, 6,5, 6,8, 7,0, 7,2 и 7,4. Согласно некоторым вариантам реализации состав имеет рН более примерно 5,8. Согласно некоторым вариантам реализации состав имеет рН примерно 7,0. Согласно некоторым вариантам реализации состав имеет рН примерно 5,8. Согласно некоторым вариантам реализации состав имеет рН в диапазоне от примерно 5,5 до примерно 6,0.
[0052] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, дополнительно включает соль. Согласно некоторым вариантам реализации соль представляет собой хлорид натрия.
[0053] Согласно некоторым вариантам реализации состав имеет осмоляльность в диапазоне от примерно 100 мОсмоль/кг до примерно 500 мОсмоль/кг. Согласно некоторым вариантам реализации осмоляльность состава составляет от примерно 200 мОсмоль/кг до примерно 300 мОсмоль/кг. Согласно некоторым вариантам реализации осмоляльность состава составляет примерно 200, 225, 250, 280, 290 или 300 мОсмоль/кг. Согласно некоторым вариантам реализации осмоляльность состава составляет примерно 290 мОсмоль/кг.
[0054] Некоторые варианты реализации относятся к стерильному одноразовому контейнеру, содержащему: ацетаминофен и сульфоалкиловый эфир циклодекстрина, где ацетаминофен и сульфоалкиловый эфир циклодекстрина находятся в твердой форме. Согласно некоторым таким вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2. Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно менее 1. Согласно некоторым вариантам реализации молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,05 до примерно 0,5.
[0055] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, подвергается очистке от кислорода перед хранением. Согласно некоторым вариантам реализации состав, описанный в настоящем документе, подвергается очистке от кислорода после получения.
[0056] Согласно некоторым вариантам реализации контейнер, используемый для хранения состава, описанного в настоящем документе, может иметь свободное пространство, заполненное азотом или аргоном.
[0057] Согласно некоторым вариантам реализации состав, описанный в настоящем документе, не изменяет цвет или не образует осадков даже после одного или нескольких циклов замерзания-оттаивания. Композиции, описанные в настоящем документе, имеют лучшую стабильность, чем другие композиции на основе ацетаминофена, доступные на рынке. Например, композиции, содержащие ацетаминофен и сульфоалкиловый эфир циклодекстрина, как описано в настоящем документе, после циклов замораживания-оттаивания остаются в растворе без какого-либо осаждения или изменения цвета, в то время как коммерчески доступные составы ацетаминофена претерпевают осаждение, изменение цвета или разложение и являются менее стабильными, чем композиции, содержащие ацетаминофен и сульфоалкиловый эфир циклодекстрина, как описано в настоящем документе.
[0058] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное вещество» включает любые возможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и тому подобное. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением случаев, когда какой-либо традиционный носитель или агент несовместим с активным ингредиентом, предполагается его использование в терапевтических композициях. Кроме того, могут быть включены различные адъюванты, такие как обычно используемые в данной области техники. Рекомендации относительно включения различных компонентов в фармацевтические композиции описаны, например, в Gilman et al. (Eds.) (1990); Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press, которая полностью включена в настоящее описание посредством ссылки.
[0059] Композиции, описанные в настоящем документе, предпочтительно представлены в стандартной лекарственной форме. В настоящем документе термин «стандартная лекарственная форма» представляет собой композицию, содержащую количество соединения, которое подходит для введения животному, предпочтительно млекопитающему, в однократной дозе в соответствии с хорошей медицинской практикой. Однако получение однократной или стандартной лекарственной формы не означает, что лекарственную форму вводят один раз в сутки или один раз за курс терапии. Предполагается, что такие лекарственные формы вводят один, два, три или более раз в сутки и их можно вводить в виде инфузии в течение периода времени (например, от примерно 30 минут до примерно 2-6 часов) или вводить в виде непрерывной инфузии, и можно давать более одного раза в течение курса терапии, хотя однократное введение специально не исключено. Специалисту в данной области техники должно быть понятно, что состав конкретно не предусмотрен для всего курса терапии, и такие решения оставлены на усмотрение специалиста в области лечения, а не ограничены составом.
[0060] Подходящие композиции, как описано выше, могут находится в любой из множества подходящих форм для множества способов введения, например, для перорального, назального, ректального, местного (включая трансдермальное), глазного, внутримозгового, внутричерепного, интратекального, внутриартериального, внутривенного, внутримышечного или других парентеральных способов введения. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно получить в форме твердого вещества (например, лиофилизированного порошка), которое может быть восстановлено подходящей жидкостью перед введением. Согласно некоторым вариантам реализации композиция, описанная в настоящем документе, может быть в жидкой форме, готовой для введения. Специалисту в данной области будет понятно, что пероральные и назальные композиции включают композиции, которые вводят путем ингаляции и изготавливают с использованием доступных методологий. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить через любые подходящие устройства для инфузии, переносные устройства или носимые устройства. В зависимости от конкретного желаемого пути введения может быть использовано множество фармацевтически приемлемых носителей, хорошо известных в данной области техники. Фармацевтически приемлемые носители включают, например, жидкие наполнители, разбавители, гидротропные агенты, поверхностно-активные вещества и капсулирующие вещества. Могут быть включены необязательные фармацевтически активные вещества, которые по существу не влияют на ингибирующую активность соединения ацетаминофена. Количество носителя, используемого в сочетании с соединением, является достаточным для обеспечения необходимого количества вещества для введения на стандартную дозу соединения. Методы и композиции для получения лекарственных форм, подходящих для способов, описанных в настоящем документе, описаны в следующих источниках, все из которых включены в настоящее описание посредством ссылки: Modern Pharmaceutics, 4th Ed., Chapters 9 and 10 (Banker & Rhodes, editors, 2002); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1989); and Ansel, Introduction to Pharmaceutical Dosage Forms 8th Edition (2004).
[0061] Могут быть использованы различные пероральные лекарственные формы, включая жидкие формы. Жидкие пероральные лекарственные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из нешипучих гранул, и шипучие препараты, восстановленные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгирующие агенты, суспендирующие агенты, разбавители, подсластители, плавящие агенты, красители и ароматизаторы.
[0062] Фармацевтически приемлемые носители, подходящие для получения стандартных лекарственных форм для перорального введения, хорошо известны в данной области техники. Пероральные композиции включают жидкие растворы, эмульсии, суспензии и тому подобное. Фармацевтически приемлемые носители, подходящие для получения таких композиций, хорошо известны в данной области техники. Типичные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. Для суспензии типичные суспендирующие агенты включают метилцеллюлозу, карбоксиметилцеллюлозу натрия, AVICEL RC-591, трагакант и альгинат натрия; типичные смачивающие агенты включают лецитин и полисорбат 80; и типичные консерванты включают метилпарабен и бензоат натрия. Пероральные жидкие композиции могут также содержать один или более компонентов, таких как подсластители, ароматизаторы и красители, описанные выше.
[0063] Композиции, описанные в настоящем документе, могут необязательно включать другие лекарственные активные вещества.
[0064] Жидкая композиция, которая получена для местного офтальмологического применения, может быть получена таким образом, чтобы ее можно было вводить местно в глаз. Комфорт может быть максимально увеличен, хотя иногда можно учитывать особенности состава (например, стабильность лекарственного средства) меньше, чем оптимальный комфорт. В случае, когда комфорт не может быть максимизирован, жидкость может быть получена таким образом, чтобы она была переносимой пациентом при местном офтальмологическом применении. Кроме того, офтальмологически приемлемая жидкость может быть либо упакована для одноразового использования, либо содержать консервант для предотвращения загрязнения при многократном использовании.
[0065] Для офтальмологического применения растворы или лекарственные средства часто получают с использованием физиологического солевого раствора в качестве основного носителя. Офтальмологические растворы предпочтительно можно поддерживать при комфортных значениях рН с помощью подходящей буферной системы. Составы могут также содержать традиционные фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
[0066] Консерванты, которые могут быть использованы в фармацевтических композициях, описанных в настоящем документе, включают, но не ограничиваются ими, бензалкония хлорид, РНМВ, хлорбутанол, тимеросал, фенилртуть, ацетат и нитрат фенилртути. Подходящим поверхностно-активным веществом является, например, Твин 80. Аналогично, различные подходящие носители могут быть использованы в офтальмологических препаратах, описанных в настоящем документе. Указанные носители включают, но не ограничиваются ими, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и очищенную воду.
[0067] Регуляторы тоничности могут быть добавлены по мере необходимости или удобства. Они включают, но не ограничиваются ими, соли, в частности хлорид натрия, хлорид калия, маннит и глицерин или любой другой подходящий офтальмологически приемлемый регулятор тоничности.
[0068] Могут быть использованы различные буферы и средства для регулирования рН, если полученный препарат является офтальмологически приемлемым. Для многих композиций рН будет между 4 и 9. Соответственно, буферы включают ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Кислоты или основания могут быть использованы для регулирования рН указанных составов при необходимости.
[0069] Офтальмологически приемлемые антиоксиданты включают, но не ограничиваются ими, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол.
[0070] Другими вспомогательными компонентами, которые могут быть включены в офтальмологические препараты, являются хелатирующие агенты. Подходящим хелатирующим агентом является динатрия эдетат, хотя другие хелатирующие агенты также можно использовать вместо или в сочетании с ним.
[0071] Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие композицию, описанную в настоящем документе. Композиции для местного применения обычно могут состоять из фармацевтического носителя, сорастворителя, эмульгатора, усилителя проникновения, консервирующей системы и смягчающего средства.
[0072] Для внутривенного или внутримышечного введения композиции, описанные в настоящем документе, могут быть растворены или диспергированы в фармацевтически приемлемом разбавителе, таком как физиологический раствор или раствор декстрозы. Подходящие вспомогательные вещества могут быть включены для достижения желаемого рН, включая, но не ограничиваясь ими, NaOH, карбонат натрия, ацетат натрия, HCl и лимонную кислоту. Соответственно, буферы, включающие ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы, можно использовать для регулирования рН указанных составов по мере необходимости. Вспомогательные вещества-антиоксиданты могут включать бисульфит натрия, аддукт ацетон-бисульфит натрия, формальдегид натрия, сульфоксилат, тиомочевину и эдетат динатрия. Другие неограничивающие примеры подходящих вспомогательных веществ, обнаруживаемых в конечной внутривенной композиции, могут включать фосфаты натрия или калия, лимонную кислоту, винную кислоту, желатин и углеводы, такие как декстроза, маннит и декстран. Дополнительные приемлемые вспомогательные вещества описаны в Powell, et al., Compendium of Excipients for Parenteral Formulations, PDA J Pharm Sci and Tech 1998, 52 238-311 и Nema et al., Excipients and Their Role in Approved Injectable Products: Current Usage and Future Directions, PDA J Pharm Sci and Tech 2011, 65 287-332, обе из которых включены в настоящий документ посредством ссылки во всей их полноте. Противомикробные агенты также могут быть включены для получения бактериостатического или фунгистатического раствора, включая, но не ограничиваясь ими, нитрат фенилртути, тимеросал, хлорид бензетония, хлорид бензалкония, фенол, крезол и хлорбутанол.
[0073] Композиции для внутривенного или внутримышечного введения могут предоставляться лицам, обеспечивающим уход, в форме одного или более твердых веществ, которое восстанавливают подходящим разбавителем, таким как стерильная вода, физиологический раствор или декстроза в воде, незадолго перед введением. Согласно другим вариантам реализации композиции предоставляются в растворе, готовом для парентерального введения. Согласно другим вариантам реализации композиции обеспечивают в растворе, который дополнительно разбавляют перед введением. Согласно вариантам реализации, которые включают введение комбинации композиции, описанной в настоящем документе, и другого агента, комбинация может предоставляться лицам, осуществляющим уход, в виде смеси, или лица, осуществляющие уход, могут смешивать два агента перед введением, или два агента можно вводить раздельно.
[0074] Фактическая доза активных композиций, описанных в настоящем документе, зависит от конкретной композиции и от состояния, подлежащего лечению; принцип выбора подходящей дозы находится в пределах знаний специалиста в данной области техники. Согласно некоторым вариантам реализации суточная доза может составлять от примерно 0,25 мг/кг до примерно 120 мг/кг или более от массы тела, от примерно 0,5 мг/кг или менее до примерно 100 мг/кг, от примерно 1,0 мг/кг до примерно 80 мг/кг от массы тела или от примерно 1,5 мг/кг до примерно 75 мг/кг от массы тела. Таким образом, для введения человеку весом 70 кг диапазон дозировок будет составлять от примерно 17 мг в сутки до примерно 8000 мг в сутки, от примерно 35 мг в сутки или менее до примерно 7000 мг в сутки или более, от примерно 70 мг в сутки до примерно 6000 мг в сутки, от примерно 100 мг в сутки до примерно 5000 мг в сутки или от примерно 200 мг до примерно 3000 мг в сутки.
[0075] Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить в виде 15-минутной внутривенной инфузии. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить в виде внутривенной инфузии от 5 минут до 30 минут. Композиция, описанная в настоящем документе, может быть введена в виде однократной или многократной дозы.
[0076] Согласно некоторым вариантам реализации композиция может быть введена путем подкожной инфузии. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить посредством подкожной инфузии в комбинации с рекомбинантным Hylenex®..
[0077] Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом 50 кг и более дозировка активных композиций, описанных в настоящем документе, может составлять 1000 мг каждые 6 часов или 650 мг каждые 4 часа, максимум 4000 мг в сутки. Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом 50 кг и более дозировка активных композиций, описанных в настоящем документе, может составлять от примерно 500 мг до 1500 мг каждые 6 часов или от примерно 300 мг до примерно 1000 мг каждые 4 часа. Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом 50 кг и более максимальная доза в сутки может составлять от примерно 2000 мг до примерно 6000 мг.
[0078] Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом 50 кг дозировка активных композиций, описанных в настоящем документе, может составлять 15 мг/кг каждые 6 часов или 12,5 мг/кг каждые 4 часа, максимум до 75 мг/кг в сутки. Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом менее 50 кг дозировка активных композиций, описанных в настоящем документе, может составлять от примерно 10 мг/кг до примерно 20 мг/кг каждые 6 часов или от 8 мг/кг до примерно 15 мг/кг каждые 4 часа. Согласно некоторым вариантам реализации для взрослых пациентов и подростков с весом менее 50 кг максимальная доза в сутки может составлять от примерно 50 мг/кг до примерно 100 мг/кг.
[0079] Согласно некоторым вариантам реализации для детей от 2 до 12 лет дозировка активных композиций, описанных в настоящем документе, может составлять 15 мг/кг каждые 6 часов или 12,5 мг/кг каждые 4 часа, максимум до 75 мг/кг в сутки. Согласно некоторым вариантам реализации для детей от 2 до 12 лет дозировка активных композиций, описанных в настоящем документе, может составлять от примерно 10 мг/кг до примерно 20 мг/кг каждые 6 часов или от 8 мг/кг до примерно 15 мг/кг каждые 4 часа. Согласно некоторым вариантам реализации для детей от 2 до 12 лет максимальная доза в сутки может составлять от примерно 50 мг/кг до примерно 100 мг/кг.
[0080] Согласно некоторым вариантам реализации минимальный интервал дозирования может составлять 4 часа. Согласно некоторым вариантам реализации минимальный интервал дозирования может составлять от примерно 1 часа до 8 часов. Согласно некоторым вариантам реализации минимальный интервал дозирования может составлять 1, 2, 3, 4, 5, 6, 7 или 8 часов.
Способ лечения
[0081] Некоторые варианты реализации относятся к способу уменьшения или лечения лихорадки или облегчения боли у субъекта, нуждающегося в этом, включающий введение путем инъекции субъекту эффективного количества жидкого состава, содержащего ацетаминофен и сульфоалкиловый эфир циклодекстрина, где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от примерно 0,01 до примерно 2.
[0082] Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно использовать для лечения слабой и умеренной боли. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно использовать для лечения боли от умеренной до сильной с одним или более дополнительными опиоидными анальгетиками. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить совместно с трамадолом (или трамадола гидрохлоридом).
[0083] Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить совместно с одним или более анестезирующими средствами. Согласно некоторым вариантам реализации композицию, описанную в настоящем документе, можно вводить совместно с этомидатом.
[0084] Согласно некоторым вариантам реализации жидкий состав вводят с использованием безыгольного устройства для инъекций. Примеры безыгольного устройства для инъекций можно найти в патенте США №7156823, который включен в настоящее описание посредством ссылки во всей полноте.
[0085] Введение композиций, описанных в настоящем документе, можно осуществлять посредством любого из принятых способов введения для агентов, которые служат аналогичным целям, включая, но не ограничиваясь ими, перорально, подкожно, внутривенно, интраназально, местно, трансдермально, внутрибрюшинно, внутримышечно, внутрилегочно, вагинально, ректально, интратекально или интраокулярно. Согласно некоторым вариантам реализации жидкую композицию вводят внутримышечно. Согласно некоторым вариантам реализации жидкую композицию вводят внутривенно. Согласно некоторым вариантам реализации жидкую композицию вводят подкожно.
[0086] Некоторые варианты реализации включают совместное введение композиции и/или фармацевтической композиции, описанной в настоящем документе, с дополнительным лекарственным средством. Под «совместным введением» подразумевается, что два или более агентов могут быть обнаружены в кровотоке пациента одновременно, независимо от того, когда и как их фактически ввели. Согласно одному варианту реализации агенты вводят одновременно. Согласно одному такому варианту реализации введение в комбинации осуществляют путем объединения агентов в одной лекарственной форме. Согласно другому варианту реализации агенты вводят последовательно. Согласно другому варианту реализации композицию, содержащую ацетаминофен и сульфоалкиловый эфир циклодекстрина, вводят до введения дополнительного активного агента. Согласно другому варианту реализации композицию, содержащую ацетаминофен и сульфоалкиловый эфир циклодекстрина, вводят после дополнительного активного агента. Согласно одному варианту реализации агенты вводят тем же способом, например перорально. Согласно другому варианту реализации агенты вводят различными способами, например один вводят перорально, а другой вводят внутривенно.
[0087] Примеры дополнительных лекарственных средств включают гидрокодон.
[0088] Чтобы дополнительно проиллюстрировать настоящее изобретение, включены следующие примеры. Разумеется, примеры не следует рассматривать как конкретно ограничивающие изобретение. Варианты указанных примеров в рамках объема формулы изобретения находятся в компетенции специалиста в данной области техники и считаются включенными в объем изобретения, описанного и заявленного в настоящем документе. Читателю будет понятно, что специалист в данной области техники, ознакомленный с настоящим описанием, способен получить и использовать изобретение без исчерпывающих примеров.
ПРИМЕРЫ
Пример 1. Исследование фазовой растворимости
[0089] Ацетаминофен добавляли с достижением его полной растворимости в различных растворах CAPTISOL® (10 мМ, 20 мМ, 30 мМ, 50 мМ и 100 мМ), которые были получены путем добавления различного количества CAPTISOL® к 25 мМ фосфатного буфера с рН 7,0. Растворимость ацетаминофена измеряли при 25°С и 5°С.
Кривая фазовой растворимости показана на фиг. 1.
[0090] На фиг. 1 растворимость ацетаминофена без присутствия CAPTISOL® составляет примерно 15,98±0,43 мг/мл при 25°С и примерно 8,86±1,22 мг/мл при 5°С. Данные по растворимости показали, что раствор ацетаминофена с концентрацией 10 мг/мл можно получить при 5°С с содержанием CAPTISOL® менее 0,05 М.
Пример 2. Исследование стабильности
[0091] Ацетаминофен добавляли с достижением его полной растворимости в различных растворах CAPTISOL® (10 мМ, 20 мМ, 30 мМ, 50 мМ и 100 мМ), которые были получены путем добавления различного количества CAPTISOL® к 25 мМ фосфатного буфера с рН 7,0. Растворы не очищали от кислорода в ходе получения или перед хранением. Указанные растворы сохраняли стабильность и не меняли цвет после более чем одного месяца хранения при комнатной температуре. Ожидается, что срок годности растворов ацетаминофена в CAPTISOL® составит более 2 лет при 25°С.
[0092] Сравнительный образец получали путем объединения 1000 мг ацетаминофена USP, 3850 мг маннита USP, 25 мг моногидрата гидрохлорида цистеина USP, 10,4 мг двухосновного фосфата натрия USP. рН доводили с помощью хлористоводородной кислоты и/или гидроксида натрия до приблизительно 5,5 и осмоляльность поддерживали до приблизительно 290 мОсмоль/кг. Сравнительный образец хранили при 5°С и через 12 часов наблюдали осаждение, и концентрацию ацетаминофена снижали до 8,8 мг/мл (полученную при 10 мг/мл) через 24 часа. Сравнительный образец пожелтел при хранении при комнатной температуре в течение 24 часов. Сравнительный образец содержал кристаллы, образовавшиеся через 12 недель. Когда сравнительный образец хранили при 40°С и подвергали воздействию воздуха, раствор сравнительного образца начинал желтеть через шесть дней, что указывало на то, что очистка от кислорода была важна для поддержания стабильности сравнительного образца.
Пример 3. Исследование долгосрочной стабильности
[0093] Растворы CAPTISOL® готовили путем добавления CAPTISOL® к 3 мМ фосфатному буферу с рН 7,2 с получением растворов, содержащих CAPTISOL® при 0,005М и 0,01М. Затем ацетаминофен добавляли к 0,005 М и 0,01М растворам CAPTISOL® и осмоляльность растворов доводили до 298 мОсмоль/кг и 304 мОсмоль/кг с конечной концентрацией NaCl, равной 0,11М и 0,93М, соответственно. рН растворов упал до примерно 6,8. Растворы были стабильными в течение восьми недель при температуре до 40°С, как показано на фиг. 2. Незначительное изменение цвета наблюдалось во флаконах с температурой 40°С через две недели и во флаконах с температурой 25°С через четыре недели. Указанные растворы не очищались от кислорода в ходе получения или перед хранением.
Пример 4. Стабильность с ацетатным буфером и фосфатным буфером
[0094] Растворы CAPTISOL® получали путем добавления CAPTISOL® к ацетатному буферу с рН 5,8, с получением растворов, содержащих CAPTISOL® при 0,01М, 0,05М и 0,1М; и затем ацетаминофен добавляли к 0,01М, 0,05М и 0,1М растворам CAPTISOL® до достижения концентрации 10 мг/мл. Сравнительные образцы получали путем добавления CAPTISOL® к фосфатному буферу с рН 7,0, с получением растворов, содержащих CAPTISOL® при 0,01М, 0,05М и 0,1М; и затем ацетаминофен добавляли к 0,01М, 0,05М и 0,1М растворам CAPTISOL® до достижения концентрации 10 мг/мл. Образцы хранили при 5°С, 25°С с относительной влажностью 60% (RH) или 40°С с относительной влажностью 75%. Образцы анализировали во время получения и после хранения в течение 1 месяца, 3 месяцев, 6 месяцев, 9 месяцев и 12 месяцев. Результаты приведены в таблице 1.
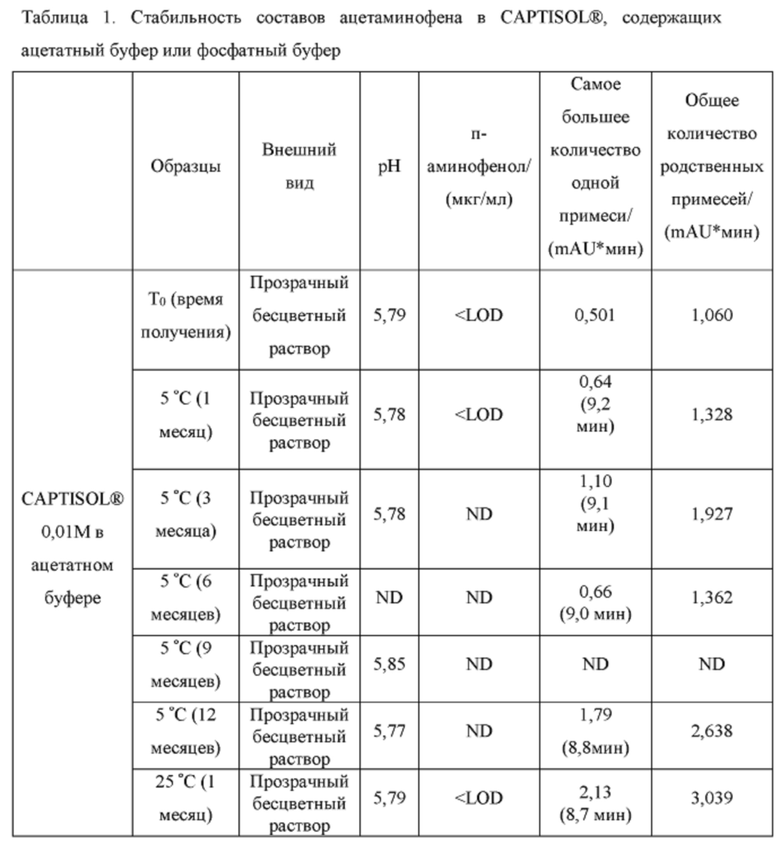
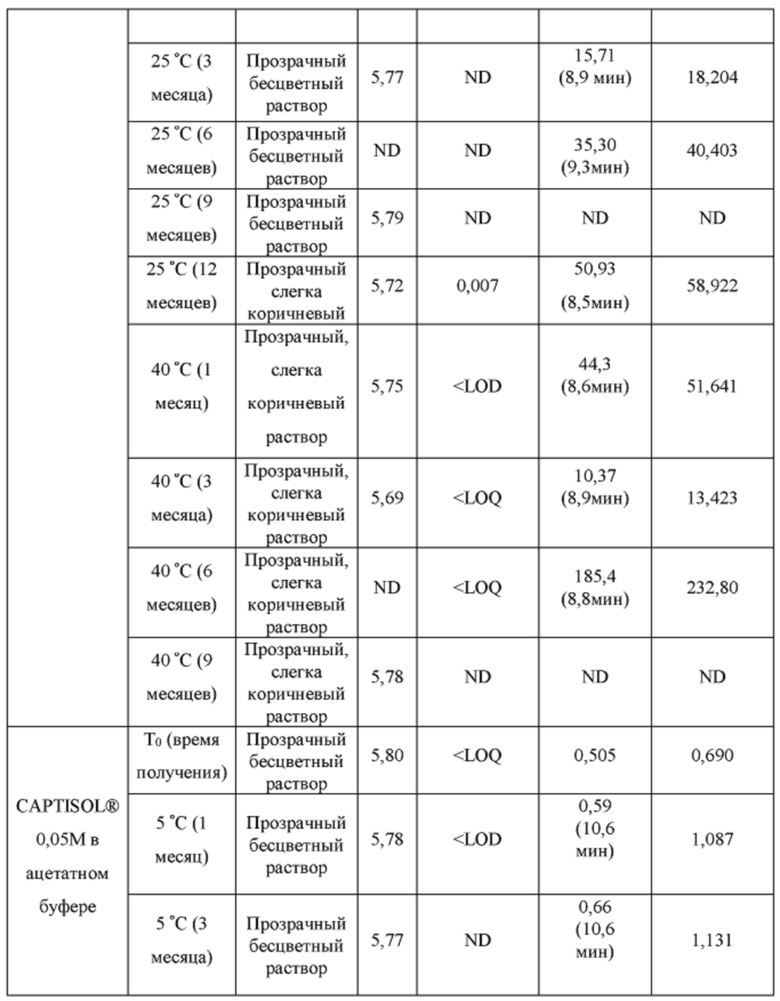
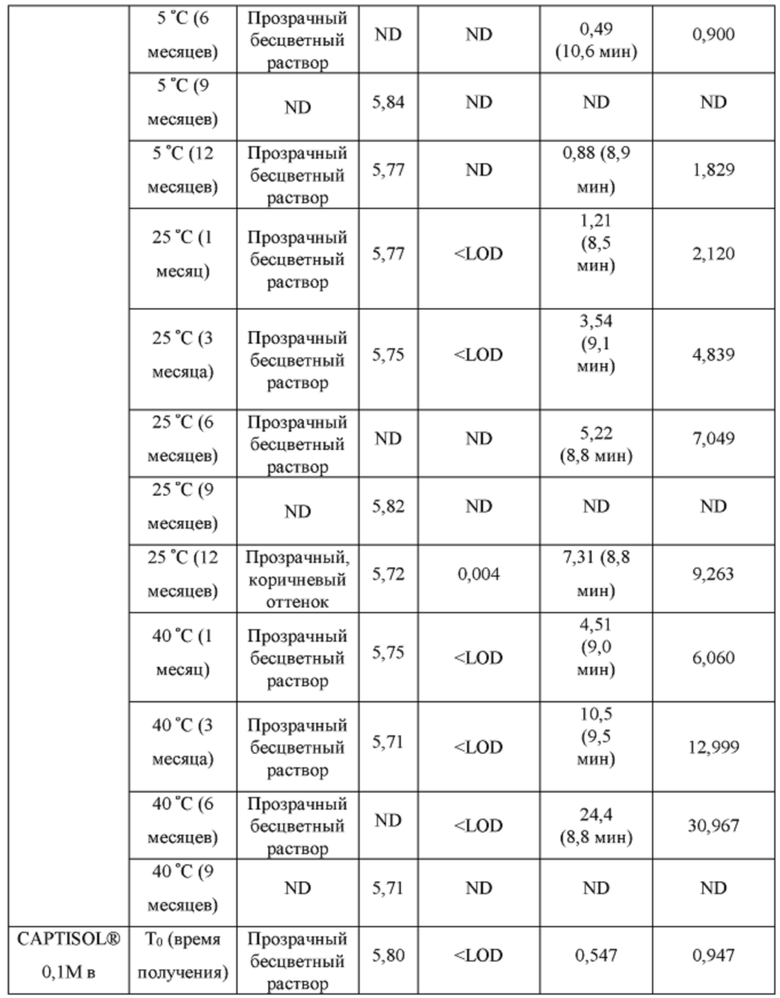
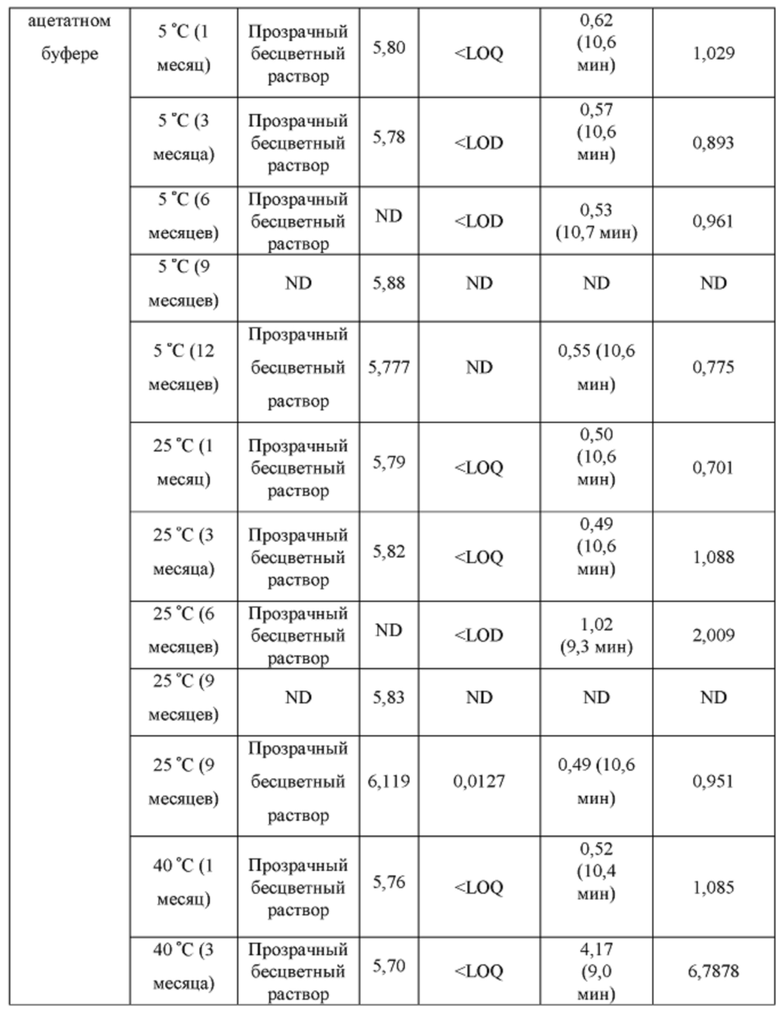
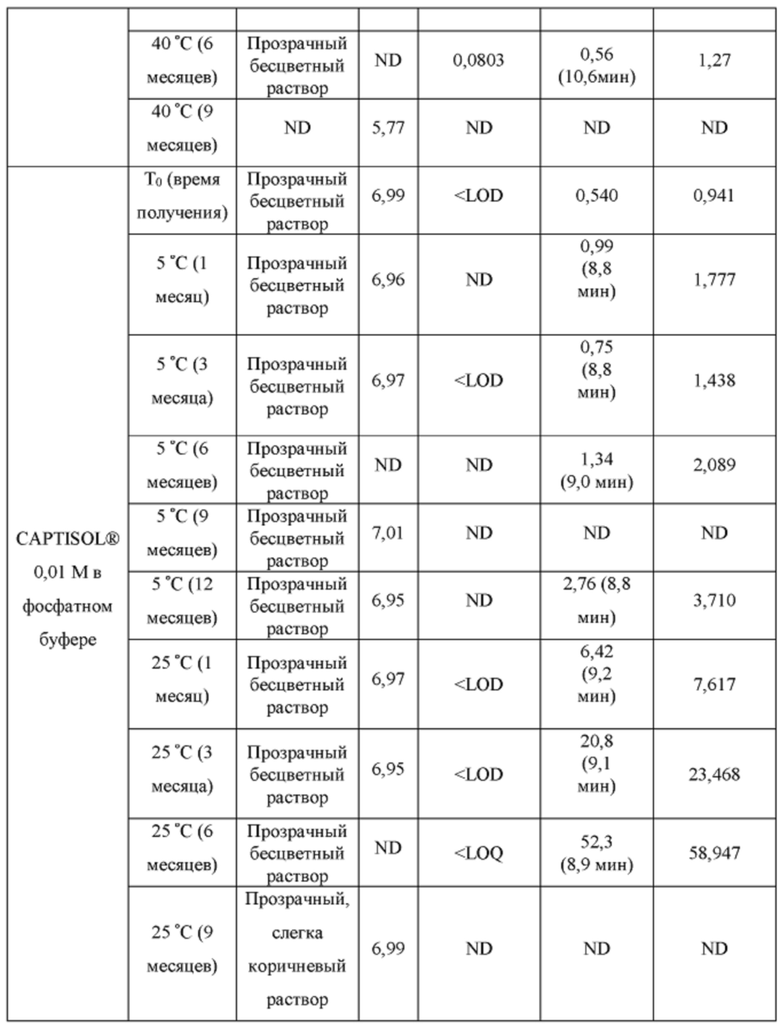
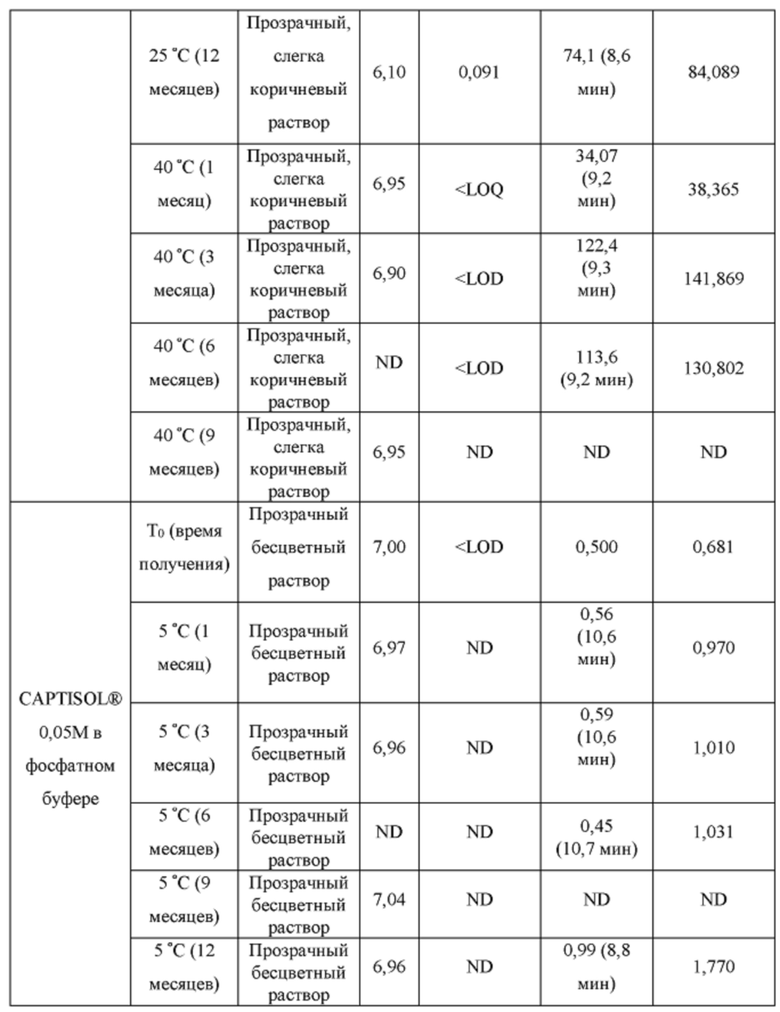
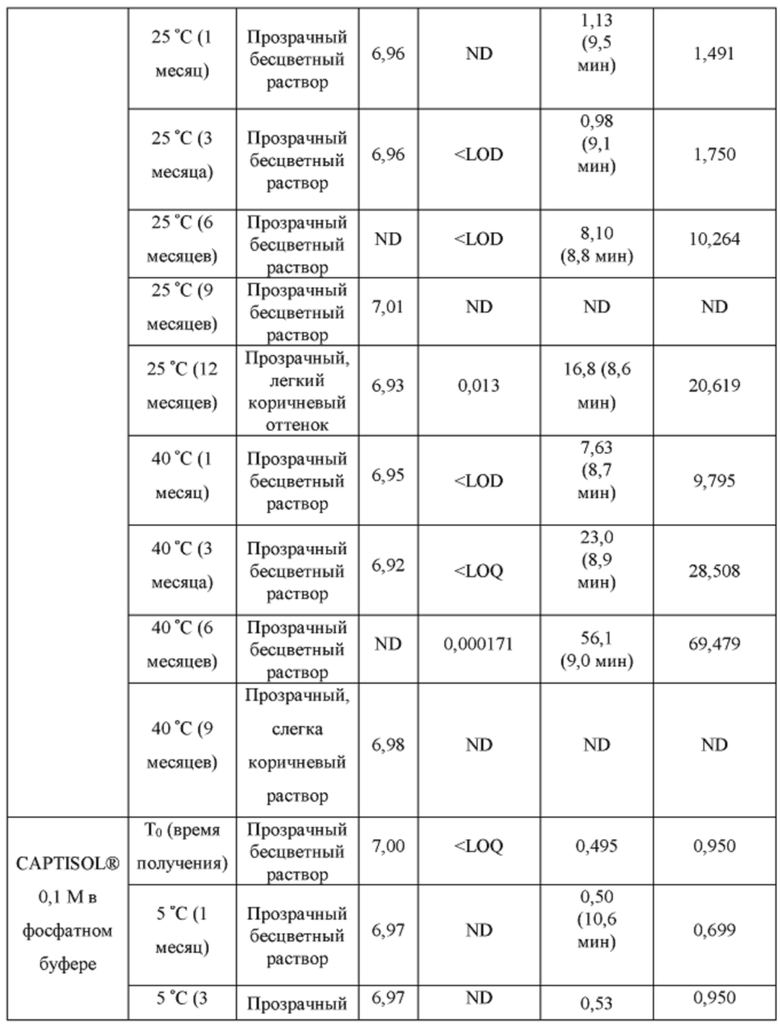
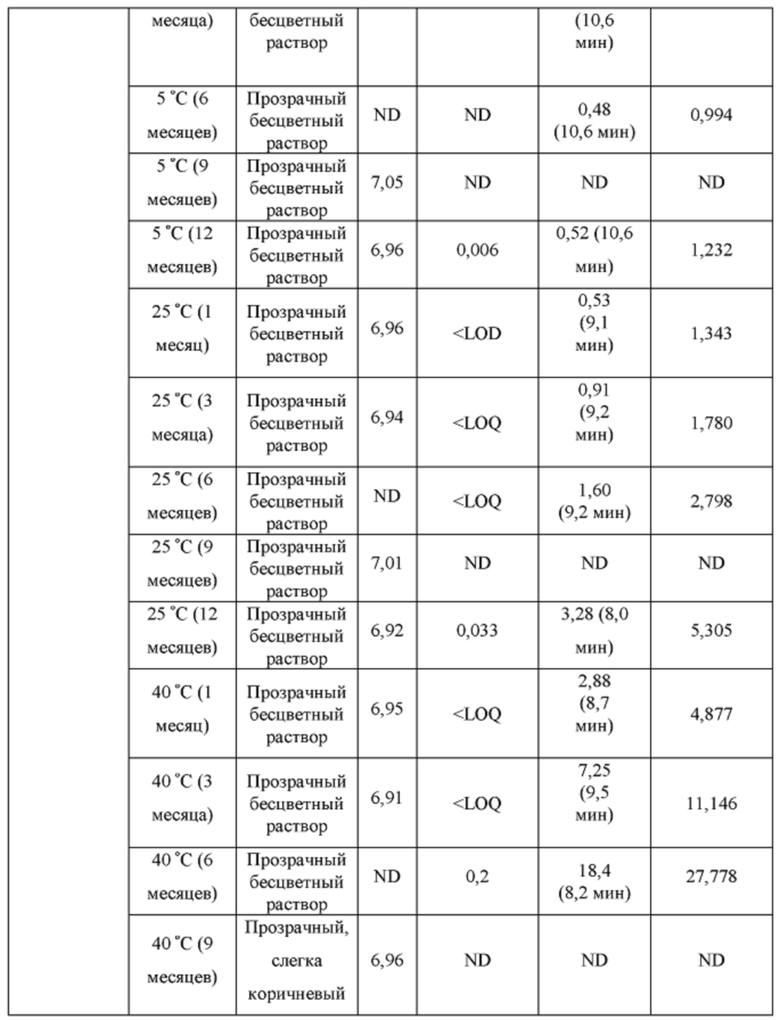

[0095] п-аминофенол: LOD (предел обнаружения) = 0,02 мкг/мл, LOQ (предел количественного определения) = 0,05 мкг/мл.
- ND: не обнаружено
[0096] Как показано в таблице 1, составы, содержащие ацетатный буфер, в целом, показали лучшую стабильность, чем составы, содержащие фосфатный буфер. Например, в ацетатных составах было меньше п-аминофенола, продукта разложения ацетаминофена, чем в фосфатных составах через 6 месяцев, как измерено для составов 0,05М CAPTISOL®, хранящихся при 40°С и относительной влажности 75%. Кроме того, общее содержание родственных примесей (примеси «TRS», отличные от п-аминофенола) для ацетатных составов, в целом, было меньше, чем для фосфатных составов (например, TRS=1,27 mAU*мин для ацетатного состава против TRS=18,4. mAU*мин для фосфатного состава для составов в 0,1М CAPTISOL®, хранящихся при 40°С и относительной влажности 75% в течение 6 месяцев). Одна самая большая примесь («SLI», примесь, отличная от п-аминофенола) различна для двух составов. Например, для составов, хранящихся при 40°С и относительной влажности 75% в течение 6 месяцев, ацетатный состав имеет время удерживания примерно 10,6 мин для SLI, тогда как фосфатный состав имеет время удерживания примерно 8,2 мин для SLI; размер площади пика SLI в ацетатном составе также значительно меньше, чем у фосфатного состава, что указывает на меньшее количество примеси, присутствующей в составе.
[0097] Кроме того, результаты в таблице 1 также показывают, что увеличение концентрации CAPTISOL® повышает стабильность состава. Как для ацетатных, так и для фосфатных составов количество TRS уменьшалось с увеличением концентрации CAPTISOL®; и в составах, хранящихся при 40°С и относительной влажности 75%, было меньше коричневого цвета с увеличением концентрации CAPTISOL®.
[0098] Кроме того, более низкая температура хранения также улучшает стабильность состава. Как показано в таблице 1, количество TRS было меньше при хранении при более низкой температуре, и цвет раствора оставался прозрачным и бесцветным для хранения при 5°С и 25°С и стал слегка коричневым через 6 месяцев при хранении при 40°С.
Пример 5. Стабильность композиций Ofirmev и ацетаминофена в CAPTISOL®
[0099] Растворы CAPTISOL® получали путем добавления CAPTISOL® к ацетатному буферу с рН 5,8, с получением растворов, содержащих CAPTISOL® при 0,1М; и ацетаминофен затем добавляли к растворам CAPTISOL® до достижения концентрации 10 мг/мл. Составы Ofirmev®, содержащие 10 мг/мл ацетаминофена, коммерческого продукта, использовали в качестве сравнительных образцов. Образцы хранили при 5°С, 25°С с относительной влажностью 60% (RH) или 40°С с относительной влажностью 75%. Образцы анализировали во время получения и после хранения в течение 1 месяца, 3 месяцев, 6 месяцев, 9 месяцев и 12 месяцев. Результаты показаны в таблице 2.
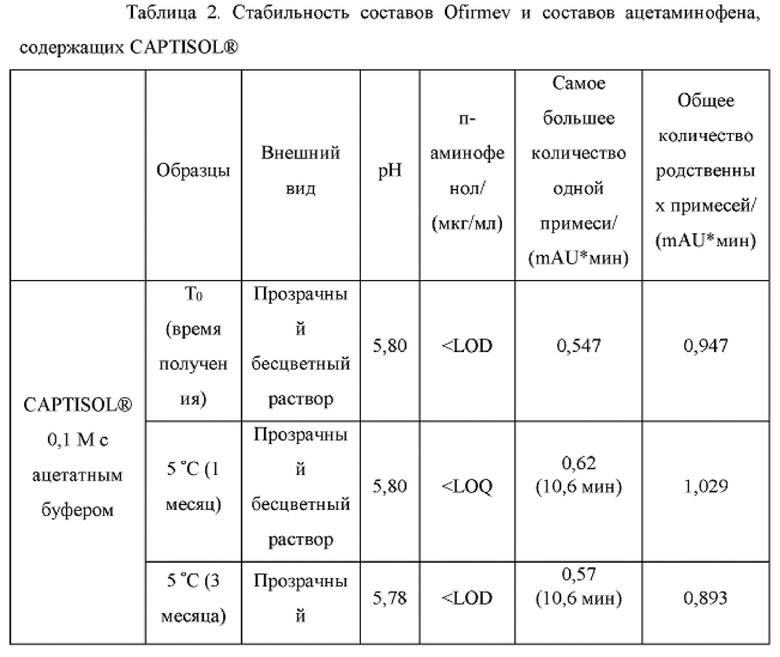
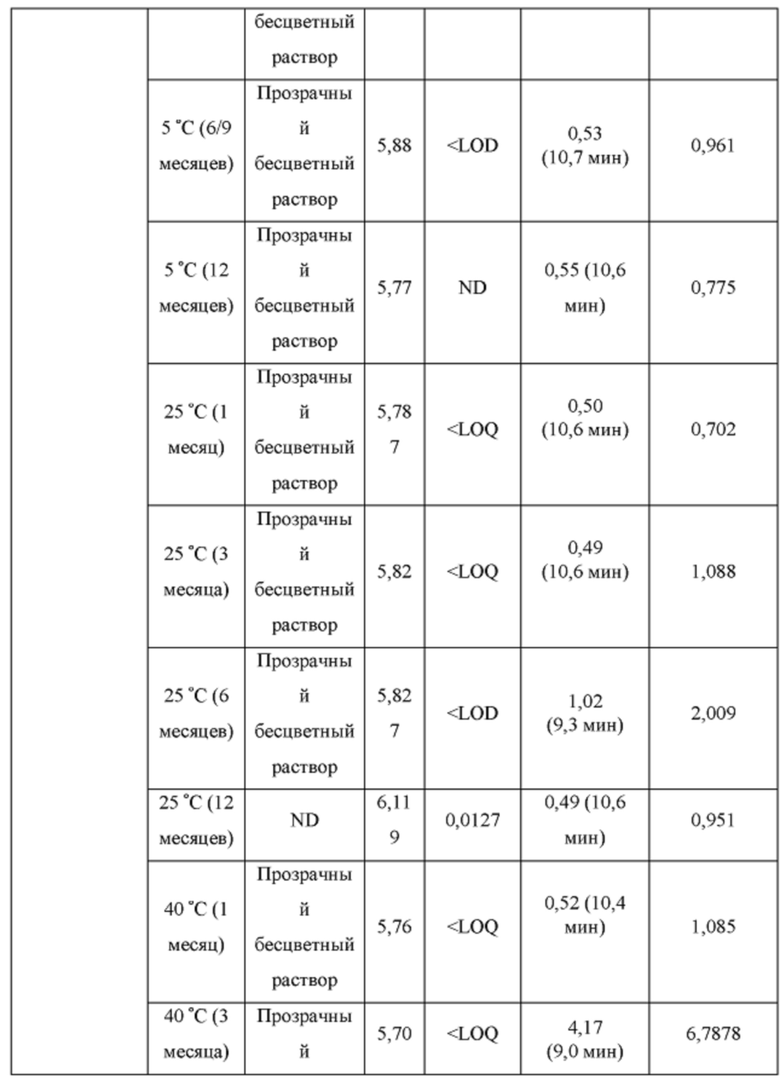
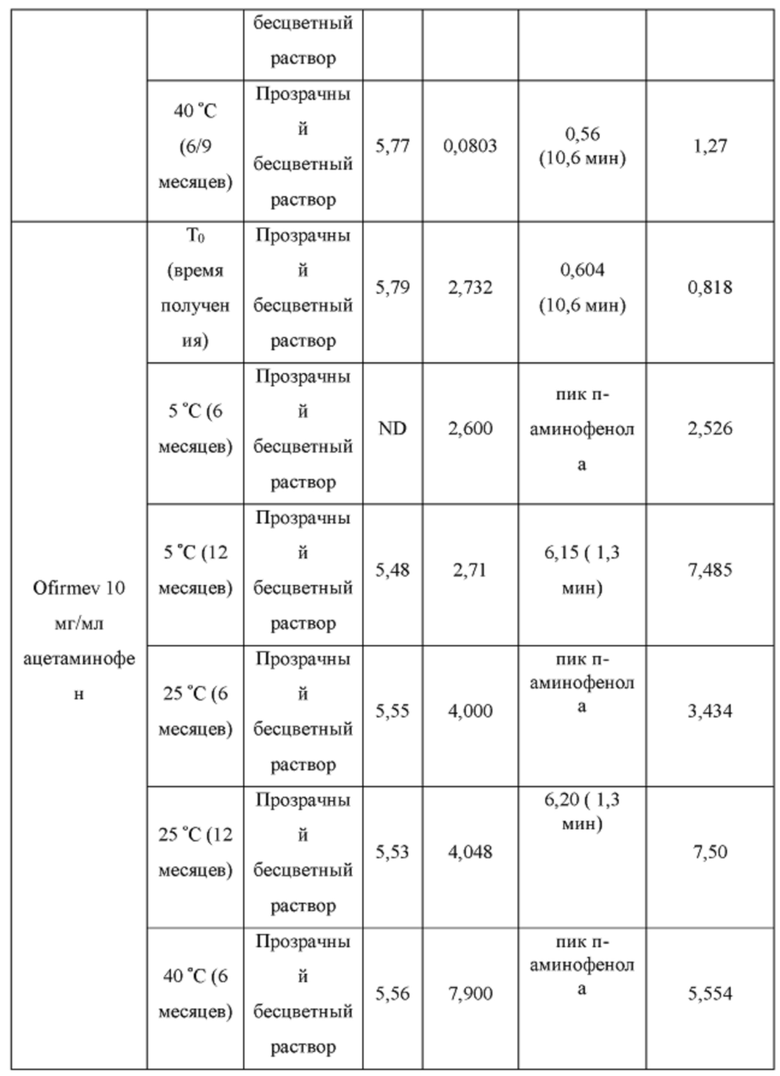
[0100] Как показано в таблице 2, ацетаминофен в растворе CAPTISOL® с ацетатным буфером показал лучшую стабильность, чем состав Ofirmev®, при 6 и 12 месяцах хранения при различных температурах. В составах CAPTISOL® было меньше общее содержание родственных примесей при всех трех условиях хранения, чем в составах Ofirmev®. Составы CAPTISOL® также показали более стабильный рН, чем составы Ofirmev®. Количество п-аминофенола, продукта разложения ацетаминофена, меньше в составах CAPTISOL®, чем в составах Ofirmev®.
[0101] На фиг. 3 показана ВЭЖХ хроматограмма составов ацетаминофена (10 мг/мл) в CAPTISOL® (0,1М) с ацетатным буфером и фосфатным буфером, составов Ofirmev (10 мг/мл ацетаминофена) и контрольного растворителя метанола, которые хранили при 25°С и 60% относительной влажности в течение 12 месяцев. Как показано на фиг. 3, состав Ofirmev имел большее содержание примеси п-аминофенола и общее содержание примесей, чем составы ацетаминофена в CAPTISOL® после хранения в течение 12 месяцев. Для составов ацетаминофена в CAPTISOL® использование ацетатного буфера привело к меньшему количеству примесей, чем использование фосфатного буфера.
[0102] В таблице 3 показано количество примесей в составах ацетаминофена после хранения при температуре 20°С и влажности 60% в течение 12 месяцев. На фигуре 4А проиллюстрировано общее содержание родственных примесей, обнаруженных в Ofirmev®, а также в составах ацетаминофена в CAPTISOL® после хранения при 20°С и 60% влажности в течение 12 месяцев; и на фигуре 4В проиллюстрировано количество п-аминофенола, обнаруженного в Ofirmev®, а также в составах ацетаминофена в CAPTISOL® после хранения при 20°С и влажности 60% в течение 12 месяцев.


[0103] Как показано в таблице 3 и на фигурах 4А и 4В количество примесей уменьшалось с увеличением концентрации CAPTISOL®. Кроме того, растворы ацетаминофена в ацетатном буфере при рН 5,8 содержали меньшее количество общих примесей, чем растворы в фосфатном буфере при рН 7. Кроме того, количество п-аминофенола в составах CAPTISOL® было значительно ниже предела обнаружения, и количество п-аминофенола в растворе Ofirmev было в восемь раз больше, чем количество, разрешенное согласно USP (фармакопея США) (например, 0,5 мкг/мл, указанное в монографии USP).
[0104] Пример 6. Составы ацетаминофена в CAPTISOL®
[0105] Состав ацетаминофена в CAPTISOL® получали сначала путем добавления CAPTISOL® в буфер (например, ацетатный буфер рН 5,8 или фосфатный буфер рН 7,0), с получением растворов, содержащих CAPTISOL® в концентрации 100 мг/мл; и затем путем добавления ацетаминофена к растворам CAPTISOL® до достижения концентрации 10 мг/мл.
[0106] Другой состав ацетаминофена в CAPTISOL® получали сначала путем добавления CAPTISOL® в буфер (например, ацетатный буфер рН 5,8 или фосфатный буфер рН 7,0), с получением растворов, содержащих 360 мг/мл CAPTISOL®; и затем путем добавления 500 мг ацетаминофена к 15 мл растворов CAPTISOL®.
[0107] Другой состав ацетаминофена CAPTISOL® получали сначала путем объединения 1 г ацетаминофена и 33,33 мл растворов CAPTISOL® (250 мг/мл), а затем путем высушивания раствора до получения высушенного распылением асептического порошка для восстановления.
[0108] Другой состав ацетаминофена CAPTISOL® получали сначала путем объединения 250 мг ацетаминофена и 12,5 мл растворов CAPTISOL® (100 мг/мл), а затем путем лиофилизации раствора с образованием порошка для восстановления.
Группа изобретений относится к фармацевтической промышленности, а именно к фармацевтическому составу для лечения лихорадки или облегчения боли, контейнеру для хранения состава и способам лечения лихорадки или облегчения боли при использовании заявленного состава. Фармацевтический состав для лечения лихорадки или облегчения боли содержит: ацетаминофен; и сульфоалкиловый эфир циклодекстрина, где сульфоалкиловый эфир циклодекстрина представляет собой соединение или их смесь определенного химического строения и состава, причем компоненты в фармацевтическом составе взяты в определенном количестве и соотношении между собой. Предлагается стерильный одноразовый контейнер для хранения состава. Способ уменьшения или лечения лихорадки у субъекта, нуждающегося в этом, включает введение путем инъекции субъекту эффективного количества жидкого состава. Способ облегчения боли у субъекта, нуждающегося в этом, включает введение путем инъекции субъекту эффективного количества жидкого состава. Вышеописанный фармацевтический состав обладает улучшенной стабильностью. 4 н. и 49 з.п. ф-лы, 4 ил., 4 табл., 6 пр.
1. Фармацевтический состав для лечения лихорадки или облегчения боли, содержащий:
ацетаминофен; и
сульфоалкиловый эфир циклодекстрина,
где сульфоалкиловый эфир циклодекстрина представляет собой соединение или их смесь формулы 1:
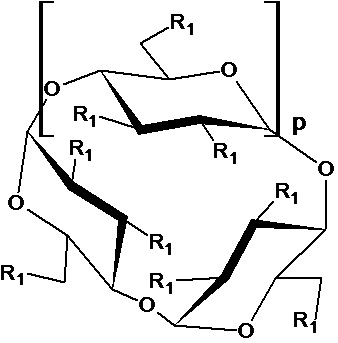 ,
,
где:
p представляет собой 4, 5 или 6;
каждый R1 независимо представляет собой –OH или -O-(C1-C8 алкилен)-SO3T, и
T представляет собой водород или фармацевтически приемлемый катион,
при условии, что по меньшей мере один R1 представляет собой –OH и по меньшей мере один R1 представляет собой -O-(C1-C8 алкилен)-SO3T;
где молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от 0,01 до 2 и где состав не содержит N-ацетилцистеин, L-метионин, L-цистеин, цистеина гидрохлорид или их смеси;
где состав представляет собой водный раствор;
где концентрация ацетаминофена составляет от 8 до 12 мг/мл; и
где сульфоалкиловый эфир циклодекстрина имеет концентрацию от 50 до 100 мМ.
2. Состав по п. 1, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от 0,05 до 0,5.
3. Состав по п. 1, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет 0,0755.
4. Состав по п. 1, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет 0,15.
5. Состав по п. 1, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от 0,01 до менее 1.
6. Состав по любому из пп. 1-5, отличающийся тем, что концентрация ацетаминофена составляет 10 мг/мл.
7. Состав по любому из пп. 1-6, дополнительно содержащий менее 2,6 мкг/мл п-аминофенола.
8. Состав по любому из пп. 1-6, дополнительно содержащий менее 0,05 мкг/мл п-аминофенола.
9. Состав по любому из пп. 1-6, дополнительно содержащий менее 0,015% п-аминофенола по массе в расчете на общее количество ацетаминофена в составе.
10. Состав по любому из пп. 7-9, отличающийся тем, что количество п-аминофенола определяют после хранения состава при 25 °C в течение 12 месяцев.
11. Состав по любому из пп. 1-10, отличающийся тем, что состав очищен от кислорода.
12. Состав по любому из пп. 1-10, отличающийся тем, что состав не очищен от кислорода.
13. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит кортикостероиды.
14. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит андрогены.
15. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит клопидогрел.
16. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит фторхинолоны.
17. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит бензгидрилпиперазины.
18. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит цетиризин.
19. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит никотин.
20. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит 17α-этинил-5α-андростан-3α,17β-диол.
21. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит аналог пирона.
22. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит флавоноиды.
23. Состав по любому из пп. 1-12, отличающийся тем, что состав не содержит кверцетины.
24. Состав по любому из пп. 1-23, дополнительно содержащий одно или более фармацевтически приемлемых вспомогательных веществ.
25. Состав по любому из пп. 1-24, дополнительно содержащий буфер.
26. Состав по п. 25, отличающийся тем, что буфер представляет собой фосфатный буфер.
27. Состав по п. 25, отличающийся тем, что буфер представляет собой ацетатный буфер.
28. Состав по п. 25, отличающийся тем, что буфер имеет концентрацию в диапазоне от 1 до 100 мМ.
29. Состав по любому из пп. 1-28, отличающийся тем, что состав имеет pH в диапазоне от 5 до 10.
30. Состав по п. 29, отличающийся тем, что pH состава составляет от 5,8 до 7,4.
31. Состав по любому из пп. 1-30, отличающийся тем, что состав имеет pH более 5,8.
32. Состав по любому из пп. 1-31, дополнительно содержащий соль.
33. Состав по п. 32, отличающийся тем, что соль представляет собой хлорид натрия.
34. Состав по любому из пп. 1-33, отличающийся тем, что состав имеет осмоляльность в диапазоне от 100 до 500 мОсмоль/кг.
35. Состав по п. 34, отличающийся тем, что осмоляльность состава составляет от 200 до 300 мОсмоль/кг.
36. Состав по п. 1, отличающийся тем, что по меньшей мере один R1 представляет собой 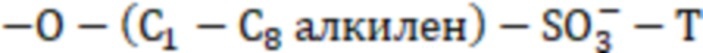 .
.
37. Состав по п. 1, отличающийся тем, что по меньшей мере один R1 независимо представляет собой -OCH2CH2CH2SO3T-.
38. Состав по п. 1, отличающийся тем, что по меньшей мере один R1 независимо представляет собой -OCH2CH2CH2CH2SO3T.
39. Стерильный одноразовый контейнер для хранения состава по п. 1.
40. Контейнер по п. 39, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от 0,05 до 0,5.
41. Контейнер по п. 40, отличающийся тем, что молярное отношение сульфоалкилового эфира циклодекстрина к ацетаминофену составляет от 0,01 до менее 1.
42. Способ уменьшения или лечения лихорадки у субъекта, нуждающегося в этом, включающий введение путем инъекции субъекту эффективного количества жидкого состава по п. 1.
43. Способ по п. 42, отличающийся тем, что жидкий состав вводят с использованием безыгольного устройства для инъекций.
44. Способ по п. 42, отличающийся тем, что жидкий состав вводят внутривенно.
45. Способ по п. 42, отличающийся тем, что жидкий состав вводят внутримышечно.
46. Способ по любому из пп. 42-45, отличающийся тем, что жидкий состав не содержит кортикостероиды.
47. Способ по любому из пп. 42-46, отличающийся тем, что жидкий состав не содержит андроген.
48. Способ облегчения боли у субъекта, нуждающегося в этом, включающий введение путем инъекции субъекту эффективного количества жидкого состава по п. 1.
49. Способ по п. 48, где жидкий состав вводят с использованием безыгольного устройства для инъекций.
50. Способ по п. 48, отличающийся тем, что жидкий состав вводят внутривенно.
51. Способ по п. 48, отличающийся тем, что жидкий состав вводят внутримышечно.
52. Способ по любому из пп. 48-51, отличающийся тем, что жидкий состав не содержит кортикостероиды.
53. Способ по любому из пп. 48-52, отличающийся тем, что жидкий состав не содержит андроген.
| WO 2012037117 A1, 22.03.2012 | |||
| ТВЕРДЫЕ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ФИЗИЧЕСКУЮ СМЕСЬ СУЛЬФОАЛКИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА И ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 1998 |
|
RU2173172C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИСИЛОКСАН-ПОЛИКАРБОНАТНЫХ БЛОК-СОПОЛОМЕРОВ | 2005 |
|
RU2277546C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОБ ДОННОГО ГРУНТА В МОРСКИХ ИССЛЕДОВАНИЯХ | 2020 |
|
RU2751875C1 |
| US 2011015273 A1, 20.01.2011 | |||
| EP 2918291 A2, 16.09.2015 | |||
| Kaulpiboon J., Rudeekulthamrong P | |||
| Effect of temperature on cyclodextrin production and characterization of paracetamol/cyclodextrin complexes // Journal of the Medical Association | |||
Авторы
Даты
2022-05-19—Публикация
2017-09-15—Подача