Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей клопидогрель и сульфоалкилциклодекстрин, к их применению при лечении расстройств и заболеваний, которые терапевтически реагируют на клопидогрель, и к другим способам их применения.
Уровень техники
Гидросульфат клопидогреля, метил-(+)-(3)-α-(2-хлорфенил)-6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ацетат сульфат (1:1), представляет собой ингибитор АДФ-индуцированной агрегации тромбоцитов, оказывающий прямое ингибирование на связывание аденозиндифосфата (АДФ) с его рецептором и последующую АДФ-опосредованную активацию комплекса гликопротеина GPIIb/IIIa. Клопидогрель селективно ингибирует связывание аденозиндифосфата (АДФ) с его рецептором тромбоцитов и последующую АДФ-опосредованную активацию комплекса гликопротеина GPIIb/IIIa, подавляя тем самым агрегацию тромбоцитов. Биопревращение клопидогреля необходимо, чтобы вызвать ингибирование агрегации тромбоцитов. Был выделен активный метаболит, ответственный за активность лекарства (Pereillo et al., Drug Metab. Disposition (2002), 30(11), 1288-1295). Клопидогрель также ингибирует агрегацию тромбоцитов, индуцируемую другими агонистами, помимо АДФ, за счет блокирования амплификации активации тромбоцитов при выделении АДФ. Клопидогрель не ингибирует активность фосфодиэстеразы.
Гидросульфат клопидогреля представляет собой порошок белого-грязно-белого цвета. Он в частности нерастворим в воде при нейтральном рН, но легко растворяется при рН 1. В патенте США №4847265 раскрывается декстроротационная форма клопидогреля. В патентах США №№7074928, 6767913, 6504030, 6429210, 6504030 раскрываются полиморфные формы гидросульфата клопидогреля. В патентах США №№6858734, 6800759 и 6737411 раскрываются различные способы приготовления клопидогреля. Солевые формы, полиморфные модификации и способы получения клопидогреля раскрыты в предыдущих публикациях патентов США №20060154957, №20060100231, №20060074242, №20060047121, №20060041136, №20050256152, №20050228012, №20050203122, №20050143414, №20050049275 и №20050049226. В международной публикации РСТ № WO 03/66637 раскрывается гидрохлоридная солевая форма клопидогреля и способ ее получения.
В настоящее время клопидогрель продается в США под торговым названием PLAVIX (Sanofi Aventis). Он поставляется в виде таблеток, содержащих 75 мг эквивалентов основания клопидогреля, хотя лекарство находится в виде гидросульфатной соли. Он также доступен в виде таблеток общего типа (Apotex, Inc.). В патенте США 6914141 раскрывается таблеточный состав, содержащий гидросульфат клопидогреля.
PLAVIX - это антитромбоцитарный препарат, одобренный Администрацией по контролю за продуктами питания и лекарствами США, для снижения атеротромботических исходов 1) у пациентов с историей недавнего инфаркта миокарда (ИМ), недавнего внезапного приступа или установленной болезнью периферических артерий (БПА) и 2) у пациентов с острым коронарным синдромом (нестабильной стенокардией/Q-необразующий ИМ), включая пациентов, которым оказывают медицинскую помощь, и пациентов, которым оказывают помощь через чрескожное вмешательство на коронарных сосудах (чрескожную транслюминальную коронарную ангиопластику (ЧКА), стент, атероэктомию и т.д.) или через аорто-коронарное шунтирование (АКШ). PLAVIX - отпускаемый по рецепту препарат, который при ежедневном приеме может способствовать снижению риска возникновения сердечного приступа и удара в будущем. В патенте США №5576328 раскрывается способ предотвращения вторичных ишемических исходов посредством введения клопидогреля после начала первичного ишемического исхода. В патенте США №6071514 раскрываются способы лечения тромботических расстройств посредством введения клопидогреля больным, нуждающимся в нем. Von Beckerath и соват. (Circulation (2005), 112, 2946-2950) раскрывают результаты клинического исследования по сравнению поглощения, метаболизма и антитромбоцитарных эффектов 300 мг, 600 мг и 900 мг ударных доз клопидогреля, вводимого путем приема внутрь дробленных таблеток Plavix®. Они сообщают, что максимальная АДФ-индуцированная агрегация тромбоцитов происходит за 4 часа. Plavix ингибировал агрегацию тромбоцитов, индуцированную 5 мкм АДФ, приблизительно на 23% (300 мг доза), 34% (600 мг доза), 39% (900 мг доза), при этом различия в антитромбоцитарном действии между 600 и 900 мг дозами оказались минимальными. Эти временные промежутки по существу схожи с временными промежутками, обычно наблюдаемыми после введения целых таблеток PLAVIX® (Weerakody et al. Am. J. Cardiol. 2007:100:331-336).
При клиническом регулировании таблетки PLAVIX® вводят через рот до проведения оперативных кардиологических процедур, таких как чрескожное вмешательство на коронарных сосудах (ЧВКС), для того чтобы уменьшить агрегацию тромбоцитов у пациента и тем самым снизить риск реокклюзии или рестеноза во время проведения процедуры или после нее. Количество клопидогреля, вводимого пациенту, связано с расчетным временем проведения процедуры для определенного пациента. В общем, чем больше количество вводимого клопидогреля, тем меньше времени требуется для достижения желаемого терапевтического эффекта (например, подавления агрегации тромбоцитов). Для средней дозы (300 мг клопидогреля в таблетке PLAVIX®) характерное время, необходимое для достижения желаемого терапевтического эффекта (например, подавления агрегации тромбоцитов) варьируется от двух до пяти часов. Если процедуру необходимо проводить незамедлительно (например, ЧВКС необходимо проводить не более, чем через два-три часа), то вводят большую дозу клопидогреля по сравнению с дозой, которую необходимо вводить в случае проведения процедуры через два, три или более часов. Например, пациенту, который подвергается проведению процедуры за 60-180 минут перед введением клопидогреля, можно вводить 600 мг дозу. В случае начала процедуры со 180 минуты или дольше после введения клопидогреля, пациенту можно вводить 300 мг дозу. Основанием использования такой схемы дозирования является наличие заметного эффекта насыщения дозы in vivo, в силу чего увеличение дозы не приводит к увеличению суммарной эффективности лекарства, но только к увеличению скорости терапевтического развития заболевания, т.е. к повышению скорости, с которой достигается целевое ингибирование агрегации тромбоцитов после введения лекарства. Тип используемого специфического протокола и время до и после введения большой или маленькой доз варьируются в различных учреждениях, но чем выше уровень используемой дозы, тем более быстро проводятся процедуры после дозировки.
Однако нежелательно вводить чрезмерно большие количества клопидогреля из-за его токсикологического действия. К побочным эффектам клопидогреля относятся кровоизлияние, расстройство желудка или боль в желудке, диарея, запор, головная боль, головокружение, быстропроходящая сыпь, гриппоподобные симптомы, боль в суставах или в спине, необычно долгое кровотечение, необычный или легкий кровоподтек или кровотечение, черный кал, рвота, боль в груди, припухлость, депрессия, лихорадка, продолжительная боль в горле, необычная слабость, изменения остроты зрения, невнятная речь, помрачение сознания, тяжелые высыпания, зуд, тяжелые головокружения или затрудненное дыхание. Более того, если у пациента имеется тяжелое кардиальное событие, например, ОКС (острый коронарный синдром), то его надо лечить как можно быстрее, для того чтобы минимизировать риск миокардиального поражения, который быстро увеличивается со временем. Клинический врач должен уметь диагностировать пациента как можно быстрее с целью определения надлежащего неотложного медицинского лечения настолько быстро, насколько это возможно. Целью является возможность излечения пациента, которому требуется ЧВКС в течение 9 минут после госпитализации из-за ОКС, но такой короткий промежуток времени нереален или ненадежен при использовании таблеток PLAVIX®. Более того, в то время как клопидогрель противопоказан в основных инвазивных неотложных хирургических процедурах, таких как аортокоронарное шунтирование (АКШ), он показан при минимально инвазивных неотложных процедурах, таких как ЧВКС. На данном этапе один из стандартных протоколов лечения включает в себя следующие стадии: 1) определение наличия у пациента ОКС; 2) оповещение зондовой лаборатории о прибытии пациента; 3) пероральное введение 300-600 мг клопидогреля (в виде таблетки(ок) PLAVIX®); 4) транспортировка пациента в зондовую лабораторию; 5) снятие коронарограммы; 6) определение того, какая из медицинских терапий по отдельности, ЧВКС или АКШ, является наиболее подходящей; и 7) если показано проведение отдельной медицинской терапии, то пациента лечат продолжительной (хронической) терапией клопидогрелем; или 8) если показано проведение ЧВКС, то проводится ЧВКС и пациента поддерживают с помощью продолжительной (хронической) терапии клопидогрелем; или 8) если показано проведение АКШ, то АКШ задерживают до тех пор, пока агрегация тромбоцитов у пациента не вернется к нормальному уровню. При проведении АКШ в течение 7 дней после принятия пациентом дозы клопидогреля высок риск обширного кровотечения, осложнений, связанных с кровоизлиянием, и появляется необходимость в переливании крови (Pickard и соавт. Pharmacotherapy (2008), 23, 376-392). К сожалению, при задержке приема таблеток PLAVIX® до тех пор, пока не будет определено, показано ли проведение ЧВКС вместо АКШ, у пациента, подвергающегося ЧВКС, существует повышенный риск реокклюзии или рестеноза. Кроме того, введение таблеток через рот пациенту, находящемуся под наркозом, затруднено, что часто встречается в случаях с больными, подвергающимися коронарографии.
Соответственно, для данной области терапии было бы очень полезным разработать состав, который бы обеспечивал более быстрое терапевтическое начало без необходимости в приеме таких излишних доз, которые вводят в настоящее время.
Клопидогрель можно принимать с другим лекарством для лечения расстройства или заболевания у больного. Клопидогрель, при принятии его вместе с аспирином, рекомендован людям, госпитализированным с болью в груди, связанной с сердцем, или имеющим определенный тип сердечного приступа - расстройство, которое на медицинском языке называется острым коронарным синдромом (ОКС). В патенте США №7018990 раскрывается совместное введение ингибитора фактора Ха и клопидогреля. В патенте США №6509348 раскрывается совместное введение антитромбоцитарного лекарства, блокирующего АДФ-рецептор, и антагониста тромбоксанового А2 рецептора и способа подавления образования тромбов за счет совместного введения. В патенте США №6248729 раскрывается совместное введение антитромбоцитарного лекарства, блокирующего АДФ-рецептор, и гипотензивного препарата для предотвращения церебрального инфаркта. В патенте США №5989578 раскрывается совместное введение клопидогреля и антитромбоцитарного средства. Совместное использование клопидогреля с другими лекарствами раскрывается в предыдущих публикациях США №20050043382 и №20040067995 и в статьях, опубликованных Wegert и соавт. (Int. J. Clin. Pharmacol. Ther. (2002), 40(4), 135-141) и Gurbel и соавт. (Circulation, (2005), 111(9):1153-1159).
В различных патентах и публикациях США раскрываются составы, содержащие клопидогрель, например, в патентах США №6923988, №6761903, №6720001, №6569463, №6451339, №6429210, №6383471, №6294192 и публикациях США №20060223845, №20060003002, №20040115287, №20030104048, №20020032149.
Циклодекстрины - это циклические углеводороды, получаемые из крахмала. Немодицифированные циклодекстрины отличаются по числу глюкопиранозных звеньев, соединенных вместе в цилиндрическую структуру. Родоначальные циклодекстрины содержат 6, 7 или 8 глюкопиранозных звеньев и называются α-, β- и γ-циклодекстринами соответственно. Каждое подзвено циклодекстрина содержит вторичные гидроксильные группы во 2- и 3-положениях и первичную гидроксильную группу в 6-положении. Циклодекстрины можно изобразить в виде полых усеченных конусов с гидрофильными внешними поверхностями и гидрофобными внутренними полостями. В водных растворах эти гидрофобные полости обеспечивают укрытие для гидрофобных органических соединений, которые могут заполнять все пространство или часть их структуры в этих полостях. Этот процесс, известный как образование комплексов включения, может приводить к заметному увеличению растворимости в воде и устойчивости закомплексованного лекарства, однако степень стабилизации будет варьироваться при переходе от одного лекарства к другому. Комплекс стабилизируется гидрофобными взаимодействиями, при этом стабилизация не включает образование каких-либо ковалентных связей.
Химическое модифицирование родоначальных циклодекстринов (обычно по гидроксильным компонентам) дало производные с немного улучшенной безопасностью при сохранении и улучшении комплексообразующей способности циклодекстрина. Среди многочисленных дериватизированных циклодекстринов, полученных на сегодняшний день, только два из них, по-видимому, являются рентабельными; это 2-гидроксипропильные производные (ГП-β-ЦД или ГПЦД), нейтральные молекулы, которые разработаны для коммерческого производства Janssen и др., и сульфоалкилэфирные производные (САЭ-β-ЦД или САЭ-ЦД), которые разработаны компанией CyDex Pharmaceuticals, Inc.

R=(-H)21-n или (-(СН2)4-SО3Nа)n,
где n=6,0-7,1
Сульфобутил-β-циклодекстрин (Captisol®)
САЭ-ЦД - это класс отрицательно заряженных циклодекстринов, которые отличаются природой алкильного спейсера, солевой формы, степенью замещения и природой исходного родоначального циклодекстрина. Натриевая соль сульфобутилэфирного производного бета-циклодекстрина, содержащая в среднем 7 заместителей на молекулу циклодекстрина (СБЭ7-β-ЦД), коммерциализирована компанией CyDex Pharmaceuticals, Inc. (Kansas) как CAPTISOL® циклодекстрин.
Анионный сульфобутилэфирный заместитель поразительно улучшает растворимость родоначального циклодекстрина в воде. Наоборот, нековалентное комплексообразование лекарств с CAPTISOL® циклодекстрином, как правило, позволяет повысить растворимость и устойчивость некоторых лекарств в водных растворах. Однако, улучшенные свойства САЭ-ЦД или ГП-β-ЦД в показателях связывания со специфическими лекарствами являются отчасти непредсказуемыми. Известно, что многие лекарства лучше связываются с САЭ-ЦД, тогда как другие лучше связываются с ГП-β-ЦД. Более того, CAPTISOL® циклодекстрин является относительно новым препаратом, и совместное его использование с клопидогрелем еще не оценивалось или не предлагалось в предшествующем уровне техники.
В различных ссылках на патенты, в которых раскрываются композиции, содержащие различные солевые, аморфные, кристаллические и/или полиморфные формы клопидогреля, необязательно в присутствии другого лекарства, высказывается мысль о возможном включении клопидогреля в такие композиции в виде комплекса с циклодекстрином. Однако, ни в одной из тех ссылок не описывается или не приводится в качестве примера САЭ-ЦД.
В словенском патенте №8121748, выданном 31 октября 2005 года Rudolf Rucman (DIAGEN D.O.O.), раскрываются комплексы включения клопидогреля, в виде свободного основания или солевой формы, и циклодекстрины, такие как β-ЦД, γ-ЦД, метилциклодекстрин и гидроксиалкилциклодекстрин, из которых последние два являются предпочтительными. В патенте также раскывается использование поли(винилпирролидона) с молекулярной массой 10000-40000 вместо циклодекстрина для солюбилизации клопидогреля. Kolbe и соавт. (J. Inclusion Phenomena and Macrocyclic Chemistry (2002 Dec), 44(1-4), рg. 183-184) раскрывают образование комплекса диметилциклодекстрина и основания клопидогреля в молярном соотношении 1:1. Комплекс осаждается из холодного раствора.
В публикации заявки на патент США №2004-0109888 под авторством Pun и соавт. раскрывается полимерный циклодекстриновый материал. В публикации заявки на патент США №2005-0109888 под авторством Fikstad и соавт. раскрывается "фармацевтическая композиция, содержащая: терапевтически эффективное количество лекарства, солюбилизатора и модулятора выделения, который способствует одновременному выделению лекарства и солюбилизатора.
В публикации заявки на патент США №2005-0276841 под авторством Davis и соавт. раскрывается "биоразлагаемое полимерное волокно с замедленным высвобожднием лекарства", при этом лекарство может быть закомплексовано циклодекстрином.
Известно, что клопидогрель обладает слабой химической устойчивостью в растворе. Его разложение обычно протекает по гидролитическому пути, при котором сложноэфирная форма превращается в производное карбоновой кислоты. Устойчивость клопидогреля к гидролизу зависит от рН, величина t90 составляет 52,7 дня при рН 5,6 в том случае, когда он хранится при 37°C в 0,1М фосфатном буфере (Drug Metab. Disposition (2000), 28(12), 1405-1410). Химически стойкий растворенный состав клопидогреля был бы полезен в данной области техники. Известно, что клопидогрель подвергается хиральной инверсии inversion in vivo и in vitro (Reist и соавт., Drug Metab. Dispos. (2000), 28(12), 1405-1410); однако (R)-энантиомер клопидогреля лишен антитромбоцитарной активности и может вызывать судороги у животных.
Вследствие того, что клопидогрель обладает токсикологическими свойствами и его, как правило, вводят в очень высоких дозах в условиях клинического процедурного кабинета, то желательно бы разработать состав, который бы позволял избегать введения ненужных больших количеств клопидогреля и в то же время обеспечивал бы необходимое повышение скорости терапевтического начала, т.е. желаемое снижение временного интервала после введения лекарства, за который это лекарство приводит к необходимому снижению агрегации тромбоцитов.
Раскрытие изобретения
Изобретение обеспечивает фармацевтическую композицию, содержащую клопидогрель (или его фармацевтически приемлемую соль), сульфоалкиловый эфир циклодекстрина (САЭ-ЦД) и необязательно один или несколько фармацевтиески приемлемых наполнителей. САЭ-ЦД в основном ответственен за солюбилизацию и стабилизацию клопидогреля, когда два этих вещества находятся в присутствии водной среды. Композиции изобретения снижают химическое разложение клопидогреля в растворе. Они также снижают скорость хиральной инверсии (S)-клопидогреля в (R)-клопидогрель. Даже если солевая форма клопидогреля может быть включена в текущий состав, от состава не требуется непременное выделение клопидогреля в сильнокислых условиях, поскольку в составе клопидогрель может использоваться скорее в виде свободного основания, а не в виде соли. Изобретение обеспечивает водный (необязательно прозрачный) жидкий состав, содержащий САЭ-ЦД, клопидогрель и водный жидкостный носитель. Состав изобретения может представлять собой состав однократного или многократного приема. Заявленный состав может также обладать самозащитой от микробного размножения в тех случаях, когда САЭ-ЦД присутствует в количествах, достаточных для остановки или снижения скорости микробного роста после заражения состава микробами. Настоящий состав также улучшает фотохимическую и термическую стойкость клопидогреля по сравнению с другими составами на основе циклодекстрина. Настоящее изобретение также обеспечивает раствор клопидогреля на основе САЭ-ЦД, который фармацевтически устойчив и не требует разведения перед введением.
В некоторых вариантах осуществления 1) сульфоалкиловый эфир циклодекстрина присутствует в количестве, достаточном для получения прозрачного раствора; 2) САЭ-ЦД присутствует в концентрации около 20-600 мг/мл, 50-500 мг/мл или 100-400 мг/мл (2-60%, 5-50% или 10-40% no отношению массы к объему, соответственно); 3)САЭ-ЦД - это СБЭх-β-ЦД, где x составляет от 6,0 до 7,1 или от 6,5 до 7; 4) САЭ-ЦД - это СБЭх-γ-ЦД, где x составляет от 6 до 8 или 6,5-7; 5) САЭ-ЦД - это соединение с формулой 1 (показанной ниже) или смесь этих соединений.
В некоторых вариантах осуществления 1) клопидогрель присутствует в терапевтически эффективных количествах; и/или 2) клопидогрель в виде эквивалентов свободного основания присутствует в концентрации около 1,5-20 мг/мл (около 4,7-62 мМ) или около 0,15-1,5 мг/мл (около 0,47-4,7 мМ). Изобретение также включает варианты изобретения, в которых: 1) молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1 или от 6:1 до 8:1 в тех случаях, когда рН равен или превышает 3,5; 2) молярное отношение САЭ-ЦД к клопидогрелю составляет менее 6:1 в тех случаях, когда рН составляет менее 3,5; 3) клопидогрель присутствует в концентрации около 7,5 мг/мл или менее в водном растворе, содержащем около 37% САЭ-ЦД (по отношению массы к объему) или менее при рН около 5,5; 4) клопидогрель присутствует в концентрации около 0,5 мг/мл или менее в водном растворе, содержащем около 2,5% САЭ-ЦД (по отношению массы к объему) или менее при рН около 5,5; 5) клопидогрель в виде эквивалентов свободного основания присутствует в концентрации около 0,15-20 мг/мл (около 0,47-62 мМ); или 6) клопидогрель в виде экивалентов гидросульфатной соли присутствует в концентрации около 0,2-26 мг/моль (0,47-62 мМ), 0,2-2 мг/мл (0,47-4,7 мМ) или 2-26 мг/мл (4,7-62 мМ).
В некоторых вариантах осуществления для состава не требуется разбавление перед введением его больному. В других вариантах осуществления жидкий состав может разводиться разбавителем на водной основе, не вызывая осаждение клопидогреля.
В некоторых вариантах осуществления состав, кроме того, содержит солюбилизатор, ароматизатор, подсластитель, агент, придающий вязкость, антиоксидант, буферное вещество, подкислитель, агент, усиливающий комплексообразование, лиофилизирующая добавка (например, наполнители или стабилизаторы), электролит, другое терапевтическое средство, подщелачивающий агент, противомикробное средство, противогрибковое средство или их комбинации.
В общем, жидкий состав обладает улучшенной фотохимической устойчивостью и подвергается меньшему фотолитическому разложению под воздействием люминесцентного излучения в сравнении с другим жидким составом, содержащим отличный циклодекстрин или производное циклодекстрина.
В некоторых вариантах осуществления состав обладает улучшенной химической стойкостью, например, улучшенной стойкостью к гидролизу клопидогреля, и подвергается меньшему гидролитическому разложению клопидогреля при воздействии водной среды по сравнению с другими составами, в которых САЭ-ЦД заменен на эквимолярные количества другого циклодекстрина, такого как ГП-β-ЦД.
Изобретение также обеспечивает способ приготовления водного (необязательно прозрачного) жидкого состава из воссоздаваемого твердого вещества, при этом способ включает в себя стадии: заготовки воссоздаваемого твердого вещества, содержащего клопидогрель, САЭ-ЦД и необязательно, по меньшей мере, один фармацевтический наполнитель, при этом твердое вещество воссоздается под действием водной жидкости, а молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1, по меньшей мере, от 6:1 до 8:1 или, по меньшей мере, 8:1 в том случае, когда рН водной жидкости превышает или равен 3,5; и воссоздания твердого вещества количеством водного жидкого носителя, по крайней мере, достаточным для суспендирования воссоздаваемого твердого вещества, посредством которого образуется водный (необязательно прозрачный) состав.
В некоторых вариантах осуществления жидкий состав приготовлен восстановлением воссоздаваемого твердого вещества, содержащего, по меньшей мере, САЭ-ЦД и клопидогрель, водный раствором, где определение воссоздаваемому твердому веществу было дано в этом документе. Наоборот, жидкий состав может быть лиофилизован или дегидратирован иным образом с образованием воссоздаваемого твердого вещества.
Некоторые варианты осуществления изобретения включают такие варианты, в которых: 1) жидким составом является суспензия; 2) количество добавляемого жидкого носителя достаточно для придания жидкому составу прозрачного вида; 3) концентрация клопидогреля в составе находится в диапазоне от 1,5 до 20 мг/мл или от 0,15 до 1,5 мг/мл; 4) рН состава приблизительно равен или меньше рКа клопидогреля; 5) рН состава приблизительно равен или больше рКа клопидогреля; 6) рН составляет от 4 до 8 в случае парентеральной доставки или при приеме через рот; 7) рН состава находится в диапазоне от 1 до 3, от 1 до 4, от 1 до 8, от 4 до 8 или от 4 до 6 в случае приема препарата через рот; 8) молярное отношение САЭ-ЦД к клопидогрелю составляет менее 6:1 в том случае, когда рН состава составляет менее 3,5; 9) молярное отношение САЭ-ЦД к клопидогрелю составляет, по меньшей мере, 6:1 или от 6:1 до 8:1 в том случае, когда рН состава равен или превышает 3,5; и/или 10) упомянутое молярное отношение составляет, по меньшей мере, 7,25:1 или 7,3:1 в том случае, когда рН состава равен или превышает 8; молярное отношение составляет, по меньшей мере, 6,5:1 или 6,6:1 в том случае, когда рН состава равен или превышает 5,5. Некоторые варианты осуществления изобретения включают такие варианты, в которых: 1) способ, кроме того, включает стадию перемешивания воссоздаваемого твердого вещества и водного жидкого носителя; и/или 2) после воссоздания жидкий состав готов для введения пациенту без необходимости в дополнительном разбавлении.
Изобретение также обеспечивает твердые лекарственные формы. Такие лекарственные формы можно вводить через рот, тонкую кишку, щеку, под язык или другими известными способами введения твердых лекарственных форм. К твердым лекарственным формам могут относиться таблетки, капсулы, порошки, воссоздаваемые твердые вещества и другие лекарственные формы такого типа. Парентеральное введение лекарственной формы можно проводить после растворения лекарственной формы в водном жидком носителе. Для твердых лекарственных форм, вводимых через рот, могут требоваться пониженные количества САЭ-ЦД в зависимости от целевого участка высвобождения лекарства в желудочно-кишечном тракте. В случае твердых лекарственных форм для приема внутрь, которые высвобождаются в области желудка, молярное отношение САЭ-ЦД к клопидогрелю может составлять менее 6 к 1, 5 к 1, 4 к 1, 3 к 1, 2 к 1, 1 к 1, 0,5 к 1, 0,25 к 1 и/или, по меньшей мере, 0,05 к 1. В случае твердых лекарственных форм для приема внутрь, которые высвобождаются в области(ях) после желудка, молярное соотношение САЭ-ЦД к клопидогрелю может составлять, по меньшей мере, 0,2 к 1, 0,5 к 1, 1 к 1, 2 к 1, 3 к 1, 4 к 1, 5 к 1, 6 к 1, 7 к 1, 8 к 1 и/или не более 100:1, 75:1, 40:1, 35:1, 30:1, 20:1, 15:1, 12:1 или не более 10:1.
Для получения отличных вариантов осуществления изобретения можно использовать комбинации различных верхних и нижних пределов молярного отношения САЭ-ЦД к клопидогрелю, изложенных в данном раскрытии. Изобретение также обеспечивает способ введения клопидогреля, который включает в себя введение готового к применению жидкого или твердого лекарственного состава для приема внутрь, содержащего сульфоалкиловый эфир циклодекстрина и клопидогрель или его фармацевтически приемлемую соль. Некоторые варианты осуществления способов изобретения включают такие варианты, в которых; 1) жидкий состав вводят парентерально, через тонкую кишку или через рот; 2) способ, кроме того, включает стадию разбавления концентрата, согласно изобретению, водным жидким носителем перед введением, что обеспечивает готовый к применению жидкий состав; 3) способ, кроме того, включает стадию образования жидкого состава при смешивании водного жидкого носителя с воссоздаваемым твердым веществом согласно изобретению; или 4) жидкий состав составляют так, как описывается в данном документе. Настоящее изобретение также обеспечивает способ лечения, предотвращения или снижения частоты появления болезни, расстройства и состояния с этиологией, связанной с агрегацией тромбоцитов, или появления болезни, расстройства и состояния, которое дает терапевтическую реакцию на терапию клопидогрелем, при этом способ включает в себя введение состава изобретения больному, нуждающемуся в нем. Некоторые варианты осуществления изобретения включают варианты, в которых тромботическое заболевание, расстройство или состояние выбрано из группы, состоящей из инфаркта миокарда, инсульта, отмирания сосудов у пациентов с установленной болезнью периферических артерий (БПА), вторичных ишемических исходов, острого коронарного синдрома (нестабильной стенокардии или Q-необразующего ИМ, сердечного приступа, стенокардии), преходящего ишемического нарушения (ПИН), цереброваскулярной болезни, сердечно-сосудистого заболевания, грудной жабы, тромбоза глубоких вен (ТГВ), легочной эмболии (ЛЭ), серповидно-клеточной анемии и аритмии сердца.
Изобретение также обеспечивает способ уменьшения времени терапевтического начала или времени, требуемого для достижения целевого терапевтического эффекта, обеспечиваемого клопидогрелем, который включает в себя парентеральное введение больному, нуждающемуся в этом, состава согласно изобретению или введение через рот или тонкую кишку больному, нуждающемуся в этом, состава согласно изобретению. Состав изобретения способствует снижению времени, требуемого для начала лечения и/или для достижения целевого терапевтического эффекта, по сравнению с твердой лекарственной формой, вводимой через рот. Состав изобретения также позволяет вводить пониженную дозу клопидогреля для достижения целевого терапевтического эффекта, например, целевого времени кровотечения или целевого ингибирования агрегации тромбоцитов, в сравнении с введением сравнительной твердой лекарственной формы, вводимой через рот и не содержащей САЭ-ЦД, для достижения того же самого целевого терапевтического эффекта.
Изобретение обеспечивает способ увеличения времени кровотечения у больного, который включает в себя введение нуждающемуся больному композиции, содержащей: САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12.5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля, или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, посредством которого время кровотечения увеличивается, по меньшей мере, на 10%, на 15%, на 20%, на 25%, на 30%, на 40%, на 50%, на 75%, на 100%, на 150%, на 200%, на 250%, на 300%, на 400%, на 500%, на 700%, на 900% или на 1000% в течение периода, составляющего не более 200 минут, 150 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут, 40 минут, 30 минут, 15 минут, 10 минут, 7,5 минут, 5 минут, 2,5 минут, или не более 1 минуты, или, по меньшей мере, 10 секунд или от 10 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут после введения состава, при этом указанное увеличение определяется путем сравнения со временем кровотечения у больного до введения композиции. Верхний предел процентного увеличения времени кровотечения может составлять вплоть до 10000%, 9000%, 7500%, 5000%, 4000%, 2500% или вплоть до 1000%. Способ может включать в себя ежедневное или постоянное введение состава нуждающемуся больному на протяжении нескольких дней, недели, нескольких недель, месяца, нескольких месяцев, трех-двенадцати месяцев или более года.
Изобретение также обеспечивает способ увеличения времени кровотечения у больного, нуждающегося в этом, непосредственно в момент перед введением больному, проходящему медицинскую процедуру, при этом способ включает в себя введение больному состава, содержащего САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12,5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, при этом состав вводят не более чем за 200, 150, 100, 75, 60, 50, 40, 30, 15, 10, 7,5, 5 или 2,5 минуты до проведения процедуры, а время кровотечения у больного увеличивается, по меньшей мере, на 10, 15, 20, 25, 30, 40, 50, 75, 100, 150, 200, 250, 300, 400, 500, 700, 900 или 1000% в течение этого времени. Способ может включать резкое введение нуждающемуся больному одной или нескольких доз прямо перед прохождением больным медицинской процедуры. Способ может также включать резкое введение нуждающемуся больному одиночной дозы прямо перед прохождением больным медицинской процедуры, например, интервенционной или неинтервенционной процедуры. Изобретение обеспечивает способ снижения степени (или возможности) агрегации тромбоцитов в крови больного, нуждающегося в этом, который включает в себя введение больному состава, содержащего САЭ-ЦД и не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12,5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля, посредством которого процентная агрегация тромбоцитов снижается, по меньшей мере, на 5, 10, 15, 30, 40, 50, 60, 70, 80, 90, 96, 98 или 100% за время не более 200 минут, 150 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут, 40 минут, 30 минут, 15 минут, 10 минут, 7,5 минут, 5 минут, 2.5 минуты или не более 1 минуты, или, по меньшей мере, 10 секунд или от 10 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут после введения состава.
Изобретение также обеспечивает способ снижения степени (или возможности) агрегации тромбоцитов, по меньшей мере, на 5, 10, 15, 30, 40, 50, 60, 70, 80, 90, 96, 98 или 100% у больного, нуждающегося в этом, при этом способ включает введение больному состава, содержащего САЭ-ЦД и не более 900, 750, 675, 600, 450, 375, 300, 225, 200, 150, 100, 75, 50, 40, 30, 25, 20, 15, 12,5, 10, 7,5, 5, 2, 1, 0,75 или 0,1 мг клопидогреля, или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клапидогреля на ежедневной основе.
Степень или возможность агрегации тромбоцитов можно измерить in vivo или ex vivo (in vitro).
Хоть и состав вводят через рот, но прозрачный жидкий состав или лекарственная форма изобретения, в частности, пригодны для парентерального введения. В частности, парентеральное введение может понадобиться тогда, когда нежелательно вводить состав через рот, т.е. в таких случаях, как допроцедурное введение, послепроцедурное введение или другие способы введения, или тогда, когда больной нетрудоспособен или неспособен иным образом принимать дозу жидкого или твердого состава через рот. Процедурой, в частном случае, является медицинская процедура. Состав изобретения можно также вводить через рот.
Настоящее изобретение также обеспечивает способы приготовления водного раствора или твердой лекарственной формы клопидогреля или его фармацевтически приемлемой соли на основе САЭ-ЦД.
Изобретение также обеспечивает набор, который включает первую фармацевтическую композицию, содержащую САЭ-ЦД, и вторую фармацевтическую композицию, содержащую клопидогрель или его фармацевтически приемлемую соль.
Изобретение также обеспечивает состав с замаскированным вкусом для приема внутрь, содержащий сульфоалкиловый эфир циклодекстрина, клопидогрель, фармацевтически приемлемый носитель и необязательно один или несколько наполнителей. Если не указано как-то иначе, то термин "клопидогрель" включает свободное основание или солевую форму и рацемическую форму, оптически чистую (R) форму, оптически чистую (S) форму или оптически обогащенную форму соединения. Он также включает твердую, суспендированную или растворенную формы соединения. Солевая форма может присутствовать в виде полугидрата, гидрата или в безводном виде. Соль может также присутствовать в чистой кристаллической форме или в полиморфной форме.
Изобретение также обеспечивает способ повышения устойчивости клопидогреля в составе, содержащем клопидогрель, при этом способ включает в себя добавление САЭ-ЦД к составу в количестве, достаточном для образования комплекса с существенной порцией клопидогреля, содержащегося в составе, с помощью чего происходит стабилизация клопидогреля.
Изобретение включает способ стабилизации жидкого состава, содержащего клопидогрель и водный жидкий носитель, при этом способ включает в себя: добавление САЭ-ЦД к составу в количестве, достаточном для образования комплекса с существенной порцией клопидогреля, с помощью чего происходит стабилизация клопидогреля. Термин "стабилизация" используется для обозначения снижения скорости, снижения степени и/или подавления разложения или хиральной инверсии клопидогреля в растворе. Молярное отношение САЭ-ЦД к клопидогрелю может варьироваться, как это описывается в данном документе, в зависимости от рН и желаемой устойчивости жидкого состава. Как правило, чем больше доля клопидогреля, образующего комплекс с САЭ-ЦД, тем выше стабилизация клопидогреля. Соответственно, изобретение также обеспечивает способ придания устойчивости (S)-клопидогрелю к хиральной инверсии в (R)-клопидогрель, при этом способ включает помещение сульфоалкилового эфира циклодекстрина в композицию состава, содержащего оптически чистую или энантиомерно обогащенную форму (S)-клопидогреля. Под термином "энантиомерно обогащенная" подразумевается композиция, содержащая (S)-клопидогрель в большем количестве по сравнению с (R)-клопидогрелем.
Поскольку САЭ-ЦД стабилизирует клопидогрель в растворе, то состав или композиция изобретения также представляют собой "стабилизированный состав" или "стабилизированную композицию". "Стабилизированный состав" или "стабилизированная композиция" обладают повышенной устойчивостью по сравнению с иными схожими составами, не содержащими САЭ-ЦД. Изобретение также обеспечивает состав, содержащий САЭ-ЦД, клопидогрель, второй терапевтический агент и фармацевтически приемлемый носитель. Вторым терапевтическим агентом могут являться нестероидное противовоспалительное лекарство, антикоагулянт, селективный ингибитор фактора Ха, прямой ингибитор тромбина, ингибитор агрегации тромбоцитов, ингибитор гликопротеина IIb/IIIa, средство против серповидно-клеточной анемии, средство для обильного кровотечения, тромболитическое средство, тромболитический фермент, тканевой активатор пламиногена или их комбинации.
Изобретение также обеспечивает способ лечения заболевания, состояния или расстройства, который включает в себя введение нуждающемуся больному: терапевтически эффективного количества клопидогреля в композиции или составе изобретения и терапевтически эффективного количества второго терапевтического агента, описанного в этом документе. Второй терапевтический агент можно включать или не включать в ту же самую композицию или состав в качестве клопидогреля. Изобретение также обеспечивает способ идентификации больных, отвечающих или не отвечающих на терапию клопидогрелем, при этом способ включает в себя: введение больному композиции, содержащей ожидаемое терапевтически эффективное количество клопидогреля, и определение воссприимчивости больного на клопидогрель за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут, или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после введения композиции больному.
Композицию можно приспособить для перорального или парентерального введения. Ожидаемое терапевтически эффективное количество клопидогреля будет, как правило, составлять от 50 до 600 мг, от 0,1 до 900 мг, от 1 до 900 мг, от 10 до 900 мг, от 0,1 до 100 мг, от 25 до 750 мг, от 50 до 600 мг, от 75 до 600 мг, от 75 до 500 мг, от 100 до 300 мг, от 100 до 400 мг, от 150 до 600 мг или от 200 до 450 мг, от 200 до 400 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, около 0,1 мг, около 0,75 мг, около 1 мг, около 2 мг, около 5 мг, около 7,5 мг, около 10 мг, около 12,5 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 40 мг, около 50 мг, около 75 мг, около 100 мг, около 150 мг, около 200 мг, около 225 мг, около 300 мг, около 375 мг, около 450 мг, около 525 мг, около 600 мг, около 675 мг, около 750 мг, около 900 мг.
Стадия определения может включать: получение образца крови больного и определение степени агрегации тромбоцитов в плазме больного агрегометрией, например, агрегометрией светопропускания или сопротивления тромбоцитов. Стадия введения может включать пероральное или парентеральное введение. Композиция может, кроме того, содержать САЭ-ЦД в количестве, достаточном для солюбилизации и/или стабилизации клопидогреля. Изобретение также обеспечивает способ снижения требуемой терапевтической дозы у больного, отвечающего на лечение и нуждающегося в клопидогреле для достижения терапевтического эффекта, при этом способ включает в себя: парентеральное или пероральное введение больному фармацевтической композиции, содержащей САЭ-ЦД и первое терапевтически эффективное количество клопидогреля, которое, по меньшей мере, в 1,1 раза, 1,2 раза, 1,25 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 7 раз, 8 раз, 10 раз, или, по меньшей мере, в 15 раз, 20 раз, от 1,1 до 20 раз, от 1,2 до 15 раз, от 1,25 до 10 раз, от 2 до 10 раз или от 3 до 8 раз меньше второго терапевтически эффективного количества, которое представляет собой количество клопидогреля, требуемое для обеспечения по существу такого же терапевтического эффекта, когда клопидогрель вводят больному через рот в сравнительной твердой фармацевтической композиции, не содержащей САЭ-ЦД. В некоторых вариантах осуществления первое терапевтически эффективное количество составляет не более 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12.5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 50 мг до 600 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг, а второе терапевтическое количество превышает или составляет от 300 до 900 мг в случае твердых таблеток для приема внутрь, таких как таблетки PLAVIX.
Изобретение также обеспечивает способ превращения не отвечающего на лечение пациента, в терминах перорального введения клопидогреля, в пациента, отвечающего на лечение, при этом способ включает в себя парентеральное введение клопидогреля нуждающемуся больному, посредством которого у больного вызывается терапевтическая реакция на клопидогрель.
Изобретение также обеспечивает способ увеличения дозы, вводимой больному для достижения целевого терапевтического эффекта, при этом способ включает в себя: парентеральное введение больному первого количества клопидогреля, которое составляет от 10 мг до 600 мг, от 50 мг до 600 мг, от 50 мг до 300 мг, около 50 мг, около 75 мг, около 100 мг, около 150 мг, около 225 мг, около 300 мг, около 375 мг, около 450 мг, около 525 мг или около 600 мг; за период менее 120 минут, менее 100 минут, менее 90 минут, менее 75 минут, менее 60 минут, менее 45 минут, менее 30 минут, менее 20 минут, менее 15 минут, менее 10 минут, менее 5 минут или от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 1 минуты до 100 минут, от 1 минуты до 90 минут, от 5 минут до 90 минут, от 10 минут до 75 минут, от 10 минут до 60 минут, от 15 минут до 60 минут, от 15 минут до 45 минут или от 15 минут до 30 минут после парентерального введения, определение первого соответствующего терапевтического эффекта, достигаемого у больного; в том случае если достигаемый терапевтический эффект меньше целевого терапевтического эффекта (например, в показателях ингибирования агрегации тромбоцитов), парентеральное введение больному второго количества клопидогреля, которое примерно в 0,5 раз, 1 раз, 1,25 раз, 1,5 раза или в 2 раза превышает первое количество, или которое составляет от 0,1 мг до 1200 мг, от 1 мг до 1000 мг, от 5 мг до 900 мг, от 10 мг до 900 мг, от 25 мг до 750 мг, от 50 мг до 750 мг, от 50 мг до 600 мг, от 0,1 мг до 100 мг, от 1 мг до 75 мг, от 100 мг до 300 мг, от 300 мг до 600 мг от 600 мг до 1200 мг; определение второго соответствующего терапевтического эффекта, достигаемого у больного после введения второго количества; и в том случае если второй соответствующий терапевтический эффект меньше целевого терапевтического эффекта, то повторение стадий "парентерального введения больному второго количества клопидогреля" и "определение второго соответствующего терапевтического эффекта, достигаемого у больного" до тех пор, пока не будет достигнут целевой терапевтический эффект.
Стадия определения может включать: получение образца плазмы крови больного и определение степени агрегации тромбоцитов в плазме крови больного агрегометрией. Стадия получения может включать: получение образца крови пациента и отделение плазмы от крови для получения образца плазмы. Клопидогрель может присутствовать в композиции, содержащей САЭ-ЦД. Изобретение также обеспечивает альтернативный способ, в котором клопидогрель водят через рот. Изобретение также обеспечивает способ лечения больного, у которого имеется сердечно-сосудистое патологическое состояние, заболевание или расстройство, при котором больной необязательно подвергается терапии клопидогрелем, этот способ включает в себя: а) определение того, нуждается ли больной или нет в интервенционном или неинтервенционном медицинском лечении; и b) если больной нуждается в малоинвазивном интервенционном медицинском лечении, то введение ему фармацевтической композиции, содержащей САЭ-ЦД и клопидогрель в количестве, достаточном для обеспечения целевого терапевтического эффекта у больного за период менее 120 минут, менее 100 минут, менее 90 минут, менее 75 минут, менее 60 минут, менее 45 минут, менее 30 минут, менее 20 минут, менее 15 минут, менее 10 минут, менее 5 минут или от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 1 минуты до 100 минут, от 1 минуты до 90 минут, от 5 минут до 90 минут, от 10 минут до 75 минут, от 10 минут до 60 минут, от 15 минут до 60 минут, от 15 минут до 45 минут или от 15 минут до 30 минут, и проведение процедуры малоинвазивного вмешательства; или с) если больной нуждается в неинтервенционном медицинском лечении, то введение ему фармацевтической композиции, содержащей САЭ-ЦД и клопидогреля в количестве, достаточном для обеспечения целевого терапевтического эффекта за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут, или от 10 минут до 20 минут или за время менее 10 секунд, менее 1 минуты, менее 2,5 минут, менее 5 минут, менее 7,5 минут, менее 10 минут, менее 15 минут, менее 20 минут, менее 30 минут, менее 120 минут, менее 100 минут, менее 90 минут, менее 75 минут, менее 60 минут, менее 50 минут, менее 45 минут или менее 40 минут, и обеспечение больного указанным неинтервенционным медицинским лечением; или d) если больной нуждается в медицинском лечении с инвазивным вмешательством, то ему не вводят клопидогрель. В некоторых вариантах осуществления малоинвазивной интервенционной процедурой является ЧВКС. В некоторых вариантах осуществления инвазивной интервенционной процедурой является АКШ. В некоторых вариантах осуществления способ лечения включает в себя: определение того, имеется ли у больного ОКС; необязательно, оповещение зондовой лаборатории о поступлении больного; необязательно, транспортировка больного в зондовую лабораторию; снятие коронарографии на больном; определение того, предписывается ли ЧВКС или АКШ; и если показано ЧВКС, то парентеральное введение жидкой композиции, содержащей клопидогрель, или введение через рот композиции, содержащей клопидогрель и САЭ-ЦД, проведение ЧВКС и необязательно поддержание больного на продолжительной (хронической) терапии клопидогрелем; и, если показано АКШ, то проведение АКШ без предварительного введения клопидогреля. Способ изобретения может включать по мере необходимости дополнительные стадии, такие как воздействие на больного седативным средством и/или любая(ые) стадия(ии), предписанная(ые) лечащим клиницистом или врачом. Изобретение обеспечивает способ уменьшения времени достижения максимального или целевого терапевтического эффекта у больного, отвечающего на лечение, которому вводили клопидогрель, при этом способ включает в себя: введение нуждающемуся больному первой композиции, содержащей САЭ-ЦД и терапевтически эффективное количество клопидогреля, достаточное для достижения целевого терапевтического эффекта, причем время, соответствующее максимальному или целевому терапевтическому эффекту, достигаемому введением первой композиции, меньше времени, за которое достигается максимальный или целевой терапевтический эффект посредством схожего введения иного аналогичного сравнительного соединения, не содержащего САЭ-ЦД и содержащего по существу такое же терапевтически эффективное количество клопидогреля. В некоторых вариантах осуществления время, за которое достигается максимальный или целевой терапевтический эффект, снижено, по меньшей мере, в 1,1 раза, 1,2 раза, 1,25 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 7 раз, 8 раз, 10 раз, 15 раз, 20 раз, 40 раз, 50 раз, 75 раз, 100 раз, 120 раз, от 1,1 до 120 раз, от 2 раз до 120 раз, от 2 до 100 раз, от 2 до 75 раз или от 2 до 50 раз.
Изобретение также включает комбинации вариантов осуществления и аспектов изобретения, подробно изложенных в этом документе. Соответственно, изобретение также включает комбинации и подкомбинации индивидуальных элементов вариантов осуществления или аспектов изобретения, подробно изложенных в этом документе. Другие особенности, преимущества и варианты осуществления изобретения будут очевидны специалистам в данной области техники из следующего описания, сопровождающегося примерами.
Краткое описание чертежей
Следующие чертежи являются частью настоящего описания и включаются для дополнительной демонстрации отдельных аспектов изобретения. Изобретение может быть лучше понято со ссылкой на один или несколько из этих чертежей в комбинации с раскрытием и подробным описанием вариантов осуществления, представленных в данном документе.
На Фиг.1 отображены данные исследования фазовой растворимости при комнатной температуре, проводившегося с использованием гидросульфата клопидогреля и различных производных САЭ-ЦД, недериватизированных циклодекстринов и 2-гидроксипропил-β-ЦЛ в воде при рН 5,5.
На Фиг.2 отображены данные исследования термической устойчивости для комбинации клопидогреля либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 5,5 и 60°C, приготовленной согласно Примеру 19.
На Фиг.3 отображены данные исследования термической устойчивости для комбинации клопидогреля либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 8,0 и 60°C, приготовленной согласно Примеру 19.
На Фиг.4 отображены данные исследования хирального превращения ((S)-клопидогреля в (R)-клопидогрель), полученные из исследования термической устойчивости для комбинации клопидогреля либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 5,5 и 40°C, приготовленной согласно Примеру 19.
На Фиг.5 отображены данные исследования хирального превращения ((S)-клопидогреля в (R)-клопидогрель), полученные из исследования термической устойчивости для комбинации клопидогреля либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 8,0 и 40°C, приготовленной согласно Примеру 19.
На Фиг.6 отображены данные исследования хирального превращения ((S)-клопидогреля в (R)-клопидогрель), полученные из исследования устойчивости к люминисцентному излучению для клопидогреля в комбинации либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 5,5 и 29°C.
На Фиг.7 отображены данные исследования хирального превращения ((S)-клопидогреля в (R)-клопидогрель), полученные из исследования устойчивости к люминесцентному излучению для клопидогреля в комбинации либо с СБЭ-β-ЦД, либо с ГП-β-ЦД, проводившегося в фосфатном буфере (0,1 и 0,2 М) при рН 8,0 и 29°C.
На Фиг.8 отображены данные, относящиеся к профилю рН растворимости гидросульфата клопидогреля при температуре окружающей среды.
На Фиг.9 отображена диаграмма фазовой растворимости для гидросульфата клопидогреля (мг/мл) в присутствии САЭ-ЦД (концентрация в % по отношению массы к объему) при 25°C в воде при рН, отрегулированном на уровне 5,5.
На Фиг.11 отображена диаграмма фазовой растворимости для гидросульфата клопидогреля (М) в присутствии САЭ-ЦД (М) при 25°C в воде при рН, отрегулированном на уровне 5,5.
На Фиг.11 отображены результаты сравнительного анализа связывания между САЭ-ЦД и солью клопидогреля в присутствии аспирина, проводившегося согласно Примеру 22.
На Фиг.12 отображены результаты in vivo исследования для определения времени кровотечения у мышей после введения (парентерального или перорального) прозрачного жидкого состава, приготовленного согласно Примеру 20. Оценка проводилась согласно Примеру 21.
На Фиг.13 отображены результаты исследования растворения таблеток, изготовленных из высушенного распылением твердого вещества, содержащего СБЭ-β-ЦД и раствор гидросульфата клопидогреля, где массовое соотношение СБЭ-β-ЦД к гидросульфату клопидогреля составляет 250 мг к 98 мг, соответственно, или изгтовленных из физической смеси СБЭ-β-ЦД и гидросульфата клопидогреля в том же соотношении. Эти таблетки сравнивали с доступной в продаже таблеткой PLAVIX®. Оценка проводилась согласно Примеру 23.
Фиг.14 - это график логарифмической зависимости средней концентрации клопидогреля в плазме крови от времени после IV введения у группы пациентов, принимающих от 0,1 до 300 мг клопидогреля в водной жидкой композиции изобретения.
Фиг.15 - это график логарифмической зависимости средней концентрации тиольного активного метаболита клопидогреля в плазме крови от времени после введения пациентам из Фиг.14.
Фиг.16 - это график логарифмической зависимости средней концентрации карбокислотного метаболита клопидогреля в плазме крови от времени после введения пациентам из Фиг.14.
Фиг.17 - это график зависимости среднего ингибирования агрегации тромбоцитов в процентах от времени после IV введения у группы пациентов, принимающих от 0,1 до 300 мг клопидогреля в водной жидкой композиции изобретения.
Фиг.18 - это график Каплана-Мейера для оценки зависимости процентной доли пациентов, у которых было достигнуто >/=15% ингибирование агрегации тромбоцитов от времени после введения пациентам из Фиг.17.
Осуществление изобретения
Если жидкий состав изобретения приготовлен в готовой к применению (т.е. готовой для введения) форме, то его не нужно разбавлять перед введением. Если настоящий состав приготовлен в виде концентрата, то его можно также разводить в разнообразных разбавителях на водной основе без образования осадка. Состав может быть пероральным, энтеральным или парентеральным.
Если не указано как-то иначе, то термин "клопидогрель", используемый в этом документе, включает все свои нейтральные, свободноосновные, солевые, кристаллические, некристаллические, аморфные, оптически чистые, оптически обогащенные, рацемические и/или полимофрные формы.
Клопидогрель может присутствовать в безводной или гидратированной форме перед использованием в настоящем составе. Солью клопидогреля может быть фармацевтически приемлемая соль. (S)-энантиомер клопидогреля может быть приготовлен согласно патенту США №4847265. (R)-энантиомер клопидогреля может быть приготовлен согласно французскому патенту FR 2769313. Рацемическая форма клопидогреля может быть приготовлена согласно патенту США №4529596 и доступна для приобретения от компании Sigma-Aldrich (St. Louis, Missouri).
Используемое в этом документе выражение "фармацевтически приемлемая соль" относится к производным клопидогреля, в которых активный агент модифицирован путем его взаимодействия с кислотой, что необходимо для образования ионно-связанной пары. К примерам фармацевтически приемлемых солей относятся традиционные нетоксичные соли или четвертичные аммониевые соли родоначального соединения, образованного, например, из нетоксичных неорганических или органических кислот. К подходящим нетоксичным солям относятся соли, полученные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфоновая, сульфаминовая, фосфорная, азотная и другие кислоты, известные специалистам в данной области техники. Другие соли получают из органических кислот, таких как аминокислоты, уксусная, пропионовая, масляная, янтарная, гликолевая, глюконовая, стеариновая, молочная, малоновая, яблочная, винная, лимонная, аскорбиновая, пальмовая, малеиновая, гидроксималеиновая, фенилуксусная, глютаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, щавелевая, изэтионовая и другие кислоты, известные обычным специалистам в данной области техники. Перечни других подходящих солей находятся в издании Remington's Pharmaceutical Sciences, 17th. ed., Mack Publishing Company, Easton, PA, 1985 или 1995, соответствующее раскрытие которого включается в данный документ по ссылке. К особым фармацевтически приемлемым солям клопидогреля относятся гидросульфат, гидробромид, напсилат, бензолсульфонат, пропилсульфат, перхлорат, нафталинсульфонат, гидрохлорид, изопропилсульфат, гидройодид и мезилат.
Используемый в этом документе термин "воссоздаваемое твердое вещество" ("воссоздаваемая композиция") обозначает твердое вещество, способное растворяться в водной жидкой среде с образованием восстановленной жидкости, при этом после растворения жидкая среда пригодна для введения. В одном варианте осуществления воссоздаваемое твердое вещество образует жидкий состав, который является явно прозрачным при смешивании твердого вещества с водным носителем. Воссоздаваемый фармацевтический состав согласно настоящему изобретению содержит клопидогрель, САЭ-ЦД и необязательно, по меньшей мере, один фармацевтический наполнитель, при этом молярное отношение САЭ-ЦД к клопидогрелю определено в данном документе. Воссоздаваемое твердое вещество может быть приготовлено удалением жидкой среды из водного жидкого раствора, содержащего САЭ-ЦД и клопидогрель, и необязательно другие компоненты для образования твердого вещества. Воссоздаваемая твердая композиция может содержать смесь твердого САЭ-ЦД, твердого вещества, содержащего клопидогрель, и необязательно, по меньшей мере, одного фармацевтического наполнителя, так что основная часть клопидогреля не образует комплекс с САЭ-ЦД до восстановления. В качестве альтернативы, композиция может содержать твердую смесь САЭ-ЦД, клопидогреля и необязательно, по меньшей мере, одного фармацевтического наполнителя, при этом основная часть клопидогреля образует комплекс с САЭ-ЦД до восстановления. Воссоздаваемое твердое вещество будет, как правило, содержать воду в количестве 8 масс.%. Эта композиция может быть восстановлена водным раствором с образованием жидкого состава, содержащего клопидогрель и другие вещества, которые можно вводить больному. Жидкий состав, используемый при приготовлении воссоздаваемого состава, может быть получен по способу, описанному в этом документе в отношении разбавленных или концентрированных жидких составов. Можно также приготовить такой состав, который будет содержать САЭ-ЦД и клопидогрель в концентрациях, превышающих значения, обычно используемые в жидком составе изобретения, при сохранении молярного отношения САЭ-ЦД к клопидогрелю на том же самом уровне. Заявители отмечают, что любая композиция согласно изобретению может быть растворена или разбавлена другой жидкостью, содержащей САЭ-ЦД.
Воссоздаваемая композиция может быть приготовлена по любому из следующих способов. Вначале готовят жидкий состав изобретения, затем получают твердое вещество лиофилизацией (сублимационной сушкой), распылительной сушкой, распылительной сублимационной сушкой, вакуумной сушкой, осаждением из растворителя, различными способами, в которых используются суперкритически или почти суперкритические жидкости, или другими методами превращения жидкого состава в порошок или твердое вещество, пригодное для восстановления, которые известны обычным специалистам в данной области техники. Как отмечено выше, воссоздаваемое твердое вещество может представлять собой смесь сухих компонентов, которую готовят посредством физического смешивания компонентов при отсутствии избыточной влажности, т.е. относительная влажность должна составлять менее 60%.
Воссоздаваемое твердое вещество может быть порошком, стеклообразным телом, пористым телом, гранулятом, пилюлей, шариком, сжатым твердым веществом, корпускулярным или лиофильным.
Термин "разбавляемый", используемый в отношении изобретенной композиции или состава, содержащей САЭ-ЦД, относится к жидкому составу, содержащему САЭ-ЦД и клопидогрель, при этом состав может дополнительно разбавляться прозрачным водным жидким носителем при комнатной температуре, например, при температуре окружающей среды, составляющей 20-28°C, предпочтительно, без значительно осаждения клопидогреля, т.е. если имеет место выпадение осадка, то оно меньше или равно 3 масс.% клопидогреля; при разбавлении до концентрации клопидогреля 0,15-10 мг/мл (в расчете на эквиваленты свободного основания) получается конечный прозрачный раствор. Когда разбавляемый состав, содержащий САЭ-ЦД и клопидогрель, разводят непрозрачным раствором, то конечная смесь может оказаться прозрачной или непрозрачной. Разбавляемая жидкость, содержащая САЭ-ЦД и клопидогрель, может разводиться другим раствором, который не содержит САЭ-ЦД; получающийся в результате разбавленный раствор имеет пониженную концентрацию солюбилизированного клопидогреля, предпочтительно, при этом не наблюдается значительного осаждения клопидогреля.
К примерным жидкостям для разбавления перорального состава изобретения относятся доступные для приобретения напитки, например, газированные или негазированные напитки, и соки. К примерным газированным напиткам относятся ароматные или неароматные содовые воды, в которых ароматической добавкой является кола, лимон, мускатное масло, жевательная резинка, вишня, апельсин и другие ароматные вещества или их смеси. К примерным сокам относятся яблочный, лимонный, липовый, апельсиновый, виноградный, вишневый, клюквенный, земляничный, киви, голубичный, черничный, ежевичный, мандариновый, ананасовый сок, сок пассифлоры лавролистной, мускусной дыни, имбиря, гуавы, манго, папайи, чернослива, абрикосовый, грушевый, персиковый, нектариновый, гранатовый и другие соки или их смеси. Соответственно, раствор, содержащий САЭ-ЦД и клопидогрель, который не разбавляется согласно изобретению, будет образовывать значительное количество (>3 масс.% активного агента) осадка при разведении его другим раствором.
Следует отметить, что состав, который не разводится только водой при комнатной температуре, может быть переведен в разбавленное состояние водным раствором, который содержит САЭ-ЦД, до тех пор, пока молярное отношение клопидогреля к САЭ-ЦД в разбавленном растворе находится в требуемом диапазоне, описанном в этом документе. Таким образом, изобретение обеспечивает способ переведения прежде неразводимого (как описывается в этом документе) раствора, содержащего клопидогрель, в разбавленное состояние, который включает в себя стадию разбавления прежде неразводимого раствора вторым раствором, содержащим САЭ-ЦД, так что молярное отношение САЭ-ЦД к клопидогрелю в разбавленном растворе находится в диапазоне, определенном в данном документе. Используемый в этом документе фармацевтически приемлемый жидкий носитель представляет собой водную жидкую среду, используемую в фармацевтических науках для разбавления или растворения парентерального или перорального составов, например, воду, водный буфер, водный органический растворитель и другие жидкости, описанные в этом документе или используемые в фармацевтической и/или пищевой промышленности. Состав изобретения содержит клопидогрель и сульфоалкиловый эфир циклодекстрина с формулой 1:
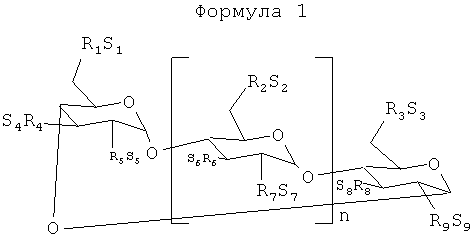
в которой:
n равняется 4, 5 или 6;
каждая из групп R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляет собой -О- или -O-(C2-C6-алкилен)-SО3- группу, в которой, по меньшей мере, одна из групп R1-R9 независимо представляет собой -O-(С2-С3-алкилен)-SO3 - группу, предпочтительно, -O-(CH2)mSО3 - группу, в которой m равняется 2-6, предпочтительно, 2-4 (например, -ОСН2СН2CH2SО3 - или -ОСН2СН2СН2СН2SО3 -);
а каждая из групп S1, S2, S3, S4, S5, S6, S7, S8 и S9 независимо представляет собой фармацевтически приемлемый катион, которым является, например, Н+, катионы щелочных металлов (например, Li+, Na+, K+), щелочноземельных металлов (например, Са+2, Мg+2), ионы аммония и катионы протонированных аминов, таких как, (С1-С6)-алкиламины, пиперидин, пиразин, (С1-С6)-алканоламины и (С4-С8)-циклоалканоламины.
В частности, к пригодным производным САЭ-ЦД относятся производные, в которых n равняется 5 или 6.
Используемый САЭ-ЦД доступен от компании CyDex Pharmaceuticals, Inc. (Lenexa, KS) и описывается в патентах США №5376645 и №5134127 под авторством Stella и соавт., полное раскрытие которых включается настоящим образом по ссылке. В патенте США №3426011 под авторством Parmerter и соавт. раскрываются анионные производные циклодекстрина, содержащие сульфоалкилэфирные заместители. Lammers и соавт. (Reel. Trav. Chim. Pays-Bas(1972), 91 (6), 733-742); (Staerke (1971), 23(5), 167-171) и Qu и соавт. (J. Inclusion Phenom. Macro. Chem., (2002), 43, 213-221) раскрывают сульфоалкилэфирные производные циклодекстринов. В патенте США №6153746 под авторством Shah и соавт. раскрывается способ получения сульфоалкилэфирных производных циклодекстрина. САЭ-ЦД может быть приготовлен по раскрытиям Stella и соавт., Parmerter и соавт., Lammers и соавт. или Qu и соавт. и при обработке с удалением основной доли (>50%) недериватизированного родоначального циклодекстрина может использоваться согласно настоящему изобретению. САЭ-ЦД может содержать недериватизированный родоначальный циклодекстрин в количестве от 0 до 50 масс.%.
Используемый в этом документе термины "алкилен" и "алкил" (например, в группе -O-(C2-C5)-alkylene)SO3 - или в алкиламинах) включает линейные, циклические и разветвленные, насыщенные и ненасыщенные (т.е. содержащие одну двойную связь) двухвалентные алкиленовые группы и одновалентные алкильные группы, соответственно. Термин "алканол", используемый в тексте таким же образом, включает линейные, циклические и разветвленные, насыщенные и ненасыщенные алкильные компоненты алканольных групп, в которых гидроксильные группы могут быть расположены в любом положении алкильной компоненты. Термин "циклоалканол" включает незамещенные или замещенные (например, метилом или этилом) циклические спирты.
Примерные варианты осуществления изобретенных САЭ-ЦД производных включают производные с формулой II (САЭх-α-ЦД), в которой "х" составляет от 1 до 18, с формулой III (САЭу-β-ЦД), в которой "у" составляет от 1 до 21, и с формулой IV (САЭz-γ-ЦД), в которой "z" составляет от 1 до 24, такие как:
Под "САЭ" обозначается сульфоалкилэфирный заместитель, связанный с циклодекстрином. Значения "х", "у" и "z" обозначают среднюю степень замещения, определенную в этом документе, в показателях количества сульфоалкилэфирных групп на молекулу ЦД. К другим примерным производным САЭ-ЦД относятся производные с формулой САЭх-β-ЦД (формула 2), в которой САЭ - это сульфометиловый эфир (СМЭ), сульфоэтиловый эфир (СЭЭ), сульфопропиловый эфир (СПЭ), сульфобутиловый эфир (СБЭ), сульфопентиловый эфир (СПтЭ) или сульфогексиловый эфир (СГЭ); x (средняя или определенная степень замещения) равняется 1-18, 1-21, 1-21, R (циклическая структура родоначального циклодекстрина) обозначает α, β или γ, соответственно, а ЦД - это циклодекстрин. К примерным производным САЭ-ЦД относятся СБЭ4-β-ЦД, СБЭ5,5-β-ЦД (Advasep® циклодекстрин), СБЭ7-β-ЦД (CAPTISOL® циклодекстрин), СПЭ5,6-β-ЦД, СБЭ6,1-γ-ЦД и СБЭ7,6-γ-ЦД. В частности, к пригодным производным САЭ-ЦД относятся САЭ-β-ЦД и САЭ-γ-ЦД.
Настоящее изобретение обеспечивает композиции, содержащие смесь производных циклодекстрина со структурой, изображенной на вышеуказанных формулах, где композиция суммарно содержит в среднем, по меньшей мере, 1 и вплоть до 3n+6 алкилсульфокислотных компонент на молекулу циклодекстрина. Настоящее изобретение также обеспечивает композиции, содержащие один тип производного циклодекстрина или, по меньшей мере, 50% одного типа производного циклодекстрина.
Следует понимать, что другие САЭ-ЦД соединения с вышеуказанными формулами можно использовать в жидком составе изобретения. Эти другие САЭ-ЦД составы отличаются от СБЭ7-β-ЦД по степени замещения сульфоалкильными группами, количеству атомов углерода в сульфоалкильной цепи, молекулярной массе, количеству глюкопиранозных звеньев, содержащихся в циклодекстриновом основании, используемом для образования САЭ-ЦД и других моделей замещения. В дополнение, дериватизация циклодекстрина сульфоалкильными группами протекает регулируемым, хотя и не точным образом. По этой причине степень замещения фактически равна количеству, отображающему среднее количество сульфоалкильных групп на молекулу циклодекстрина (например, СБЭ7-β-ЦД содержит в среднем 7 заместителей на молекулу циклодекстрина). Кроме того, региохимия замещения гидроксильных групп циклодекстрина изменяется в отношении замещения особых гидроксильных групп гексозного цикла. По этой причине замещение различных гидроксильных групп на сульфоалкильные, по-видимому, проводится во время производства САЭ-ЦД, и конкретный САЭ-ЦД будет обладать избирательной, хотя и не исключительной или особой, моделью замещения. По вышеуказанным причинам молекулярная масса конкретного САЭ-ЦД может варьироваться при переходе от одной партии к другой и будет варьироваться при переходе от одного САЭ-ЦД к другому САЭ-ЦД. Все эти вариации могут приводить к изменениям константы равновесия комплексообразования, которая, в свою очередь, будет влиять на требуемое молярное отношение САЭ-ЦД к клопидогрелю. Константа равновесия также немного изменяется с температурой, поэтому допускаются изменения молярного соотношения так, чтобы средство оставалось солюбилизированным при температурных флуктуациях, которые могут происходить во время производства, хранения, перевозки и использования. Константа равновесия также изменяется с рН, поэтому допускаются изменения молярного соотношения так, чтобы средство оставалось солюбилизированным при флуктуациях рН, которые могут происходить во время производства, хранения, перевозки и использования. Константа равновесия также изменяется в присутствии других наполнителей (например, буферов, предохраняющих средств, антиоксидантов).
Соответственно, может понадобиться варьирование соотношений САЭ-ЦД в положительную или отрицательную сторону от соотношений, изложенных в этом документе, для того чтобы компенсировать вышеупомянутые изменения. В некоторых вариантах осуществления производные циклодекстрина настоящего изобретения могут быть получены в виде очищенных композиций, т.е. композиций, содержащих производное(ые) циклодекстрина в количестве, по меньшей мере, 90 масс.% или 95 масс.% от общего количества присутствующего циклодекстрина, при этом оставшаяся часть приходится на непрореагировавший родоначальный циклодекстрин. В предпочтительном варианте осуществления получают очищенные композиции, которые содержат производное(ые) циклодекстрина в количестве, по меньшей мере, 98 масс.%. В некоторых композициях изобретения непрореагировавший циклодекстрин по существу удален, при этом оставшиеся примеси (которые составляют 5 масс.% композиции) оказывают незначительное влияние на эффективность композиции, содержащей производное циклодекстрина.
Согласно другим вариантам осуществления количество непрореагировавшего родоначального циклодекстрина, присутствующего в САЭ-ЦД, составляет менее 50 масс.%, 40 масс.%, 30 масс.% или менее 20 масс.% в расчете на общую массу циклодекстрина в сухом состоянии.
Под "комплексом клопидогреля и САЭ-ЦД", как правило, подразумевается клатрат или комплекс включения производного сульфоалкилового эфира циклодекстрина с формулой (1) и клопидогреля.
Комплексом может являться двойной или тройной комплекс (солевая форма клопидогреля закомплексована). Соотношение САЭ-ЦД: клопидогрель в молекулярном комплексе составляет 1:1 в расчете на количество молей. Однако, следует понимать, что молярное отношение САЭ-ЦД к клопидогрелю в растворе соединения в целом будет выше, так что САЭ-ЦД будет, как правило, но необязательно, присутствовать в молярном избытке по отношению к клопидогрелю.
Величина избытка будет определяться собственной растворимостью и ожидаемой дозой формы клопидогреля, а также константой связывания для образования комплексов включения между особой формой клопидогреля и особым САЭ-ЦД.
Выражение "основная часть" обозначает количество терапевтического соединения, составляющее, по меньшей мере, 50% по массе. В различных особых вариантах осуществления более 50%, 60%, 75%, 90% или 95% по массе клопидогреля может образовывать комплекс с САЭ-ЦД, находящимся в фармацевтическом составе. Фактическое содержание лекарства, образующего комплекс, будет варьироваться в зависимости от константы равновесия комплексообразования, характеризующей комплексообразование особого САЭ-ЦД с клопидогрелем, и от концентраций САЭ-ЦД и клопидогреля, доступных для комплексообразования.
На фиг.1 отображены результаты исследования фазовой растворимости по методу Higuchi и соавт., in Phase Solubility Techniques, in Advances in Analytical Chemistry and Instrumentation (Ed. C.N. Reilly, John Wiley & Sons Inc., Vol.4 (1965), pg. 117-212), в котором проводится сопоставление растворяющей способности различных циклодекстринов (СБЭ6,6-β-ЦД, СБЭ5,5-β-ЦД, СБЭ7,6-γ-ЦД, СПЭ5,8-α-ЦД, СПЭ5,6-β-ЦД, СПЭ5,4-γ-ЦД, СБЭ3,9-α-СО, СПЭ5,0-β-ЦД и СБЭ2,4-α-ЦД) по сравнению с ГП-β-ЦД и α-ЦД в расчете на количество молей, связанных с клопидогрелем. Исследование проводилось в титраторе, который поддерживал рН растворов на уровне 5,5. Образцы анализировали на содержание клопидогреля с помощью ВЭЖХ с УФ-детектированием.
Результаты, подробно показанные на фиг.1, указывают на то, что САЭ-ЦД, как правило, превосходит ГП-β-ЦД. В частности, СБЭ7-β-ЦД обеспечивает самую высокую степень растворения в условиях испытания. Производные САЭ-β-ЦД и САЭ-γ-ЦД в частности пригодны для солюбилизации клопидогреля. Следует отметить, что эффективность различных производных САЭ-ЦД может быть улучшена путем варьирования условий испытания и/или свойств раствора.
Термическая и гидролитическая устойчивость клопидогреля в водных жидких составах согласно изобретению оценивалась при различных температурах, значениях рН и концентрациях фосфатного буфера, что подробно изложено в Примере 19. Схожая оценка проводилась для жидких составов, содержащих ГП-β-ЦД, а не САЭ-ЦД. В исследованиях использовались эквимолярные количества производных циклодекстрина, несмотря на то, что посредством САЭ-ЦД можно перевести в растворенное состояние существенно большее количество клопидогреля, чем при использовании ГП-β-ЦД. Эти результаты (Фигуры 2-3) указывают на меньшую скорость термического или гидролитического разложения клопидогреля в присутствии САЭ-ЦД по сравнению с разложением клопидогреля в присутствии ГП-β-ЦД. Другой мерой устойчивости клопидогреля является скорость его хиральной инверсии в растворе. Устойчивость клопидогреля в водных жидких составах согласно изобретению оценивали при различных температурах, значениях рН и концентрациях фосфатного буфера, что подробно изложено в Примере 19. Схожая оценка проводилась для жидких составов, содержащих ГП-β-ЦД, а не САЭ-ЦД. Скорость хирального превращения (S)-клопидогреля в (R)-клопидогрель зависит от рН среды, что видно из сопоставления отношения (R) и (S) энантиомеров в составах с рН-5,5 и с рН-8 (фигуры 4-5). Следует отметить, что для составов с САЭ-ЦД наблюдается значительное улучшение стабилизации клопидогреля по сравнению с составами, содержащими ГП-β-ЦД, т.е. существенно меньшее превращение S-клопидогреля в R-клопидогрель. Результаты (фигуры 4-5) указывают на превосходство САЭ-ЦД по сравнению с ГП-β-ЦД в стабилизации клопидогреля к хиральной инверсии в растворе.
Фотохимическая устойчивость двух составов на основе САЭ-ЦД и состава на основе ГП-β-ЦД оценивалась так, как изложено в Примере 19. Порцию каждого состава подвергали воздействию люминесцентного излучения на протяжении периода в девять дней. В различные моменты времени отбирали аликвоты раствора и анализировали их методом ВЭЖХ с целью определения содержания примесей и изомеров.
На фигурах 6 и 7 отображены результаты исследования устойчивости для определения влияния люминесцентного излучения на хиральную инверсию клопидогреля. Результаты указывают на неожиданно высокую стабилизацию клопидогреля по отношению к хиральной инверсии (и конечной рацемизации) при использовании СБЭ-β-ЦД по сравнению с ограниченной степенью стабилизации, обеспечиваемой ГП-β-ЦД.
Химическая стойкость жидких составов изобретения в показателях образования осадка может быть повышена путем регулирования рН жидкого носителя. Химическая стойкость может быть также повышена превращением жидкого состава в твердый или порошковый состав.
рН воды (в случае дистиллированной и/или деионизированной воды), в которую помещают композицию или состав изобретения для восстановления, может, как правило, составлять от 1 до 8 при условии, что вода не содержит значительное количество буфера или исключает буфер; однако, также могут быть приготовлены композиции или составы с более высокими или низкими значениями рН. рН может варьироваться в зависимости от предполагаемого способа введения больному. рН парентерального состава может, как правило, варьироваться в диапазоне от рН 4 до рН 8 или от рН 4 до рН 6. рН состава для приема внутрь может, как правило, варьироваться в диапазоне от рН 1 до рН 8, от рН 4 до рН 8, от рН 4 до рН 6, от рН 1 до рН 3 или от рН 1 до рН 4. Профиль рН растворимости (Фиг.12) указывает на то, что растворимость клопидогреля (в отсутствие производного циклодекстрина) зависит от рН. В растворе с рН около 3 растворимость гидросульфата клопидогреля составляет около 5,0 мг/мл. При рН ниже 3 растворимость клопидогреля повышается поразительно, а при рН выше 3 растворимость клопидогреля понижается следующим образом:
Профили фазовой растворимости клопидогреля в САЭ-ЦД при рН-5,5 (фигура 10 и 11) указывают на то, что растворимость клопидогреля зависит от содержания циклодекстрина. Наклон линии на фиг.11 со значением 0,15 указывает на то, что приблизительное молярное отношение СБЭ-β-ЦД к клопидогрелю, необходимое для растворения клопидогреля при рН 5,5, составляет, по меньшей мере, 6:1. Чем больше концентрация САЭ-ЦД, тем большее количество клопидогреля может быть растворено и тем более концентрированные растворы клопидогреля могут быть приготовлены. Таким образом, концентрированные составы клопидогреля можно приготовить при использовании более высоких концентраций САЭ-ЦД. В случае парентеральных приложений концентрированные растворы могли бы понижать вводимый объем и, вероятно, могли бы обеспечить более быстрое введение. Концентрированные растворы могли бы также обеспечить пероральное введение доз в меньших объемах, а необходимые высокие концентрации САЭ-ЦД могли бы обеспечить улучшенное противомикробное действие, а также потенциально улучшить маскировку вкуса. Кроме того, можно также приготовить разбавленные растворы и снизить требуемое количество циклодекстрина. Разбавленные растворы могли обеспечить более медленное введение состава и потенциально улучшить регулировку дозы, вводимой со временем.
Изобретение также обеспечивает состав с замаскированным вкусом для приема внутрь, содержащий сульфоалкиловый эфир циклодекстрина, клопидогрель, фармацевтически приемлемый носитель и необязательно другие ингредиенты. В некоторых вариантах осуществления состав с замаскированным вкусом содержит САЭ-ЦД, клопидогрель, фармацевтически приемлемый носитель и водный растворитель, суспендирующий агент, буфер, поверхностно-активное вещество, сорастворитель и/или ароматизатор, такой как маннит, глюкозу, сахарозу, ксилит и другие известные ингредиенты, известные обычным специалистам в данной области техники. В примерах 15 и 17 описываются примерные составы с замаскированным вкусом, содержащие гидросульфат клопидогреля, САЭ-ЦД и сахара, такие как маннит или D-глюкозу, соответственно. Требуемое молярное отношение САЭ-ЦД к клопидогрелю может зависеть от способа введения, рН состава, содержащего эти вещества, рН предолагаемой среды для доставки. Как правило, молярное отношение находится в диапазоне от 6:1 до 8:1, от 6:1 до 10:1, от 5:1 до 12:1, от 4:1 до 15:1, от 5:1 до 14:1, от 6:1 до 13:1 или от 6:1 до 12,5:1; и/или составляет, по меньшей мере, 0,05:1, 0,25:1, 0,2:1, 0,5:1, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1 или, по меньшей мере, 8:1; и/или, не более 100:1, 75:1, 50:1, 40:1, 35:1, 30:1, 25:1, 20:1, 15:1, 14:1, 12,5:1, 12:1, 10:1, 8:1, 6:1, 5:1, 4:1, 3:1 или не более 2:1. Восстановленный рН составов может иметь низкие значения, например, рН 1-2, который пригоден для приема внутрь. Состав изобретения может содержать клопидогрель в комбинации со вторым терапевтическим средством. Второе терапевтическое средство может быть выбрано из группы, состоящей из: нестероидных противовоспалительных лекарств, таких как пироксикам или аспирин; антикоагулянтов (например, варфарина, антитромбина III, нефракционированного гепарина, гепариноидов, таких как данапароид, низкомолекулярных гепаринов, таких как эноксапарин, селективных ингибиторов фактора Ха, таких как фондапаринукс, и прямых ингибиторов тромбина, таких как аргатробан и бивалирудин); средств против серповидно-клеточной анемии, таких как гидроксимочевина; средств для обильного кровотечения, таких как пентоксифиллин; и тромболитических средств (например, модификаторов биологической реакции, таких как дротрекогин альфа и пекселизумаб, тромболитических ферментов, таких как стрептокиназа и урокиназа, и тканевых активаторов плазминогена, таких как альтеплаза и тенектеплаза). Это показано в примерах 24 и 25, где клопидогрель составлен в комбинации с моногидратом гидрохлорида тирофибана и эноксапарином натрия.
В некоторых вариантах осуществления второе терапевтическое средство используют для лечения серповидно-клеточной анемии. Примерами таких вторых терапевтических средств являются: 1) лекарства, включенные в лечебные протоколы для лечения пациентов, испытывающих боль от серповидно-клеточной анемии, острого синдрома лихорадочного заболевания в области грудной клетки, острой селезеночной секвестрации, апластической анемии, острого инсульта или неврологических нарушений; 2) добавление фолиевой кислоты, например, как часть способа лечения гидроксимочевиной; 3) НПВС, такие как ибупрофен, ацетаминофен, аспирин, кодеин, морфин, гидроморфин и кеторолак; 4) антибиотики, такие как пенициллин, производные пенициллина, цефалоспорины (такие как цефтриаксон, цефотаксим и другие препараты, известные специалистам в данной области техники) макролиды (такие как азитромицин, эритромицин), клиндамицин и ванкомицин; 5) дефероксамин, например, как часть способа хелаторной терапии из-за постоянных требований по переливанию крови; 6) бронхорасширители; 7) мочегонные средства, такие как фуросемид; 8) транквилизатор, такой как лоразепам, мидазолам или памоат гидроксизина; 9) α-агонист, такой как этилефрин, фенилэфрин, адреналин, фенилпропаноламин, псевдоэфедрин или тербуталин; 10) гидралазин; 11) пентоксифиллин; 12) дилтиазем; 13) аналог гонадотропин-рилизинг гормона (гонадолиберина), такой как лейпролид или флутамид; 14) диэтилстилбестрол и 15) их комбинации.
Количество другого присутствующего лекарства и соотношение клопидогреля к другому присутствующему лекарству будут зависеть от желаемого клинического эффекта. Однако руководство по относительным дозам каждого лекарства можно получить из источников органов государственного регулирования, таких как Администрация по контролю за продуктами питания и лекарствами США, или других аналогичных признанных органов в Канаде (Министерство здравоохранения Канады), Мексике (Департамент здравоохранения Мексики), Европе (Европейское агенство лекарственных средств (ЕМЕА)), Южной Америке (в частности, в Аргентине (Administracion Nacional de Medic amentos, Alimentos у Tecnologia Medica (ANMAT)) и Бразилии (Ministerio da Saude)), Австралии (Департамент здравоохранения и по уходу за престарелыми), Африке (в частности, в Южной Африке (Департамент здравоохранения) и Зимбабве (Министерство охраны здоровья и детского благосостояния и благополучия)), или Азии (в частности, в Японии (Министерство здравоохранения, труда и благосостояния), Тайване (Исполнительный департамент здравоохранения Тайваня) и в Китае (Министерство здравоохранения Китайской Народной Республики).
Если в водном растворе, содержащем САЭ-ЦД, наряду с клопидогрелем присутствует другое лекарство, то имеется возможность конкурентного связывания клопидогреля и другого лекарства с САЭ-ЦД. Степень протекания возможного конкуретного связывания отчасти может быть предсказана путем сопоставления константы связывания клопидогреля и константы связывания другого лекарства. Чем больше константа связывания лекарства для отдельного циклодекстрина, тем более крепко оно связывается с циклодекстрином и тем больше количество лекарства, солюбилизируемого производным циклодекстрина. Если костанта связывания другого лекарства с САЭ-ЦД намного превышает таковую величину для клопидогреля, то другое лекарство с большей вероятностью будет конкурентно связывать САЭ-ЦД. Если костанта связывания другого лекарства с САЭ-ЦД намного меньше таковой величины для клопидогреля, то другое лекарство, вероятно, не будет конкурентно связывать САЭ-ЦД.
Если константа связывания другого лекарства с САЭ-ЦД приблизительно равна константе связывания клопидогреля, то степень протекания конкурентного связывания будет больше определяться относительным молярным соотношением двух лекарств, а не их константами связывания. Другими словами, если другое лекарство вводят в существенно более высокой молярной концентрации относительно клопидогреля, то оно будет более конкурентно связывать САЭ-ЦД в сравнении с тем случаем, когда это другое лекарство вводили в существенно более низкой молярной концентрации относительно клопидогреля.
Примерные составы, содержащие САЭ-ЦД, гидросульфат клопидогреля, водный буфер и аспирин, готовят согласно Примеру 22. В этом примере к растворам, содержащим фиксированные количества САЭ-ЦД и различные количества аспирина, добавляли избыток гидросульфата клопидогреля. На фиг.12 отображены результаты исследования конкуретного связывания. Результаты указывают на то, что аспирин конкурентно связывается с САЭ-ЦД при помещении его в раствор, содержащий САЭ-ЦД и соль клопидогреля.
Таким образом, для состава, содержащего как клопидогрель, так и аспирин, может понадобиться или не понадобиться дополнительное количество САЭ-ЦД для солюбилизации обоих ингредиентов в сравнении с тем количеством, которое бы необходимо для солюбилизации какого-либо из этих компонентов по отдельности.
Хотя это и необязательно состав настоящего изобретения может содержать антиоксидант, подкислитель, подщелачивающий агент, буферное вещество, наполнитель, криозащитное вещество, модификатор плотности, электролит, ароматизаторы, душистое вещество, глюкозу, стабилизатор, пластификатор, средство для повышения растворимости, подсластители, модификатор поверхностного натяжения, модификатор летучести, модификатор вязкости и другие вспомогательные вещества, которые, как известно обычным специалистам в данной области, применяются в фармацевтических составах, или их комбинации.
К водному жидкому составу изобретения можно добавлять средство для усиления комплексообразования. Средство для усиления комплексообразования - это соединение, или соединения, которое(ые) усиливает(ют) комплексообразование клопидогреля с САЭ-ЦД. При наличии средства для усиления комплексообразования может возникнуть необходимость в изменении требуемого соотношения САЭ-ЦД к клопидогрелю так, что потребуется меньшее количество САЭ-ЦД. К подходящим средствам для усиления комплексообразования относятся один или несколько фармакологически инертных водорастворимых полимеров, гидроксикислот и другие органические соединения, обычно используемые в жидких составах для усиления комплексообразования отдельного вещества с циклодекстринами. К подходящим водорастворимым полимерам относятся водорастворимые природные полимеры, водорастворимые полусинтетические полимеры (такие как, водорастворимые производные целлюлозы) и водорастворимые синтетические полимеры. Природные полимеры включают полисахариды, такие как инулин, пектины, производные альгина и агар, и полипептиды, такие как казеин и желатин. К полусинтетическим полимерам относятся производные целлюлозы, такие как метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, их смешанные эфиры, такие как гидроксипропилметилцеллюлоза, и другие смешанные эфиры, такие как гидроксиэтилэтилцеллюлоза, гидроксипропилэтилцеллюлоза, фталат гидроксипропилметилцеллюлозы и карбоксиметилцеллюлоза и ее соли, в частности натрий карбоксиметилцеллюлоза. К синтетическим полимерам относятся полиоксиэтиленовые производные (полиэтиленгликоли), поливинильные производные (поливиниловый спирт, поливинилпироллидон и полистиролсульфонат) и разнообразные сополимеры акриловой кислоты (например, карбомер). К подходящим гидроксикислотам, в качестве примеров и без ограничений, относятся лимонная кислота, яблочная кислота, молочная кислота, винная кислота и другие кислоты, известные обычным специалистам в данной области техники.
Для улучшения характеристик составов, содержащих циклодекстрин, можно использовать гидрофильные полимеры. Loftsson раскрыл ряд полимеров, подходящих для совместного использования с циклодекстрином (недериватизированным или дериватизированным) с целью улучшения характеристик и/или свойств циклодекстрина. Подходящие полимеры раскрыты в Pharmazie (2001), 56(9), 746-747; International Journal of Pharmaceutics (2001), 212(1), 29-40; Cyclodextrin: From Basic Research to Market, International Cyclodextrin Symposium, 10th, Ann Arbor, Ml, United States, May 21-24, 2000 (2000), 10-15 (Wacker Biochem Corp.: Adrian, Mien.); Международное издание РСТ № WO 9942111; Pharmazie, (1998), 53(11), 733-740; Pharm. Technol. Eur, (1997), 9(5), 26-34; J. Pharm. Sci. (1996), 85(10), 1017-1025; Европейская заявка на патент ЕР0579435; Proceedings of the International Symposium on Cyclodextrins, 9th, Santiago de Comostela, Spain, May 31-June 3, 1998 (1999), 261-264 (Editor(s): Labandeira, J.J.Torres; Vila-Jato, J.L.Kluwer Academic Publishers, Dordrecht, Neth); S.T.P. Pharma Sciences (1999), 9(3), 237-242; ACS Symposium Series (1999), 737 (Polysaccharide Applications), 24-45; Pharmaceutical Research (1998), 15(11), 1696-1701; Drug Development and Industrial Pharmacy (1998), 24(4), 365-370; International Journal of Pharmaceutics (1998), 163(1-2), 115-121; Book of Abstracts, 216th ACS National Meeting, Boston, August 23-27 (1998), CELL-016, American Chemical Society; Journal of Controlled Release, (1997), 44/1 (95-99); Pharm. Res. (1997), 14(11), S203; Investigative Ophthalmology & Visual Science, (1996), 37(6), 1199-1203; Proceedings of the International Symposium on Controlled Release of Bioactive Materials (1996), 23rd, 453-454; Drug Development and Industrial Pharmacy (1996), 22(5), 401-405; Proceedings of the International Symposium on Cyclodextrins, 8th, Budapest, Mar. 31-Apr. 2, (1996), 373-376. (Editor(s): Szejtli, J.; Szente, L Kluwer: Dordrecht, Neth.); Pharmaceutical Sciences (1996), 2(6), 277-279; European Journal of Pharmaceutical Sciences, (1996) 4(SUPPL), S144; Third European Congress of Pharmaceutical Sciences Edinburgh, Scotland, UK September 15-17, 1996; Pharmazie, (1996), 51(1), 39-42; Eur. J. Pharm. Sci. (1996), 4(Suppl.), S143; патенты США №5472954 и №5324718; International Journal of Pharmaceutics (Netherlands), (Dec. 29, 1995) 126, 73-78; Abstracts of Papers of the American Chemical Society, (02 APR 1995) 209(1), 33-CELL; European Journal of Pharmaceutical Sciences, (1994) 2, 297-301; Pharmaceutical Research (New York), (1994) 11(10), S225; International Journal of Pharmaceutics (Netherlands), (Apr 11, 1994) 104, 181-184; и в International Journal of Pharmaceutics (1994), 110(2), 169-77, полные раскрытия которых включаются в данный документ по ссылке.
Другие подходящие полимеры являются общеизвестными наполнителями, обычно используемыми в области фармацевтических составов, и включены, например, в Remington's Pharmaceutical Sciences, 18th Edition, Alfonso R. Gennaro (editor), Mack Publishing Company, Easton, PA, 1990, pp.291-294; Alfred Martin, James Swarbrick и Arthur Commarata, Physical Pharmacy. Physical Chemical Principles in Pharmaceutical Sciences, 3rd edition (Lea & Febinger, Philadelphia, PA, 1983, pp.592-638); A.T.Florence и D.Altwood, (Physico chemical Principles of Pharmacy, 2nd Edition, MacMillan Press, London, 1988, pp.281-334. Полные раскрытия цитированных ссылок включаются настоящим образом по ссылкам. К еще одним подходящим полимерам относятся водорастворимые природные полимеры, водорастворимые полусинтетические полимеры (такие как, водорастворимые производные целлюлозы) и водорастворимые синтетические полимеры. Природные полимеры включают полисахариды, такие как инулин, пектин, производные альгина (например, альгинат натрия) и агар, и полипептиды, такие как казеин и желатин. К полусинтетическим полимерам относятся производные целлюлозы, такие как метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, их смешанные эфиры, такие как гидроксипропилметилцеллюлоза, и другие смешанные эфиры, такие как гидроксиэтилэтилцеллюлоза, гидроксипропилэтилцеллюлоза, фталат гидроксипропилметилцеллюлозы и карбоксиметилцеллюлоза и ее соли, в частности натрий карбоксиметилцеллюлоза. К синтетическим полимерам относятся полиоксиэтиленовые производные (полиэтиленгликоли), поливинильные производные (поливиниловый спирт, поливинилпироллидон и полистиролсульфонат) и разнообразные сополимеры акриловой кислоты (например, карбомер). Подобным же образом считается, что другие природные, полусинтетические и синтетические полимеры, неперечисленные в данном документе, но удовлетворяющие условию растворимости в воде, фармацевтической применимости и фармакологической инертности, находятся в пределах объема настоящего изобретения. К водному жидкому составу изобретения можно добавлять средство, повышающее растворимость. Средство, повышающее растворимость, - это соединение или соединения, которое(ые) повышает(ют) растворимость клопидогреля в жидком составе. При наличии средства, повышающего растворимость, может возникнуть необходимость в изменении требуемого соотношения САЭ-ЦД к клопидогрелю так, что потребуется меньшее количество САЭ-ЦД. К подходящим средствам, повышающим растворимость, относятся один или несколько органических растворителей, детергентов, мыльных веществ, поверхностно-активных веществ и другие органические соединения, обычно используемые в жидких составах для приема внутрь с целью повышения растворимости отдельного вещества. К подходящим органическим растворителям относятся, например, этанол, глицерин, полиэтиленгликоли, пропиленгликоль, полоксомеры и другие растворители, известные обычным специалистам в данной области техники.
Поверхностно-активные вещества, которые считаются средствами, повышающими растворимость, можно использовать для увеличения солюбилизации клопидогреля и снижения количества САЭ-ЦД, необходимого для растворения клопидогреля. Примерные составы, содержащие САЭ-ЦД, гидросульфат клопидогреля, водный буфер и поверхностно-активные вещества, готовят согласно Примеру 14. При использовании как полиэтиленгликоль-15-гидроксистеарата (Solutol®), так и полисорбата 80 (Tween 80®) наблюдается заметное увеличение растворимости клопидогреля. Другие поверхностно-активные вещества, такие как Сrеmорhоr®, полисорбат 20, 40, 60 и 80, Solutol®, Labrasol®, полоксамеры, производные полиэтиленгликоля, соли холиевой кислоты и их производные (но перечень этим не ограничивается), а также другие вещества, известные обычным специалистам в данной области техники, можно использовать в комбинации с САЭ-ЦД. Примерные вещества, повышающие растворимость, раскрываются в патенте США №6451339, однако, помимо них, можно использовать и другие вещества, повышающие растворимость и используемые в фармацевтической промышленности.
Совместное использование САЭ-ЦД и поверхностно-активного вещества может оказывать либо синергетический, аддитивный или отрицательный эффект на растворимость клопидогреля. Наблюдаемый эффект может зависеть от концентрации поверхностно-активного вещества в том смысле, что при использовании того же самого поверхностно-активного вещества в различных концентрациях могут возникать различные эффекты, как это показано в Примере 14.
Как показано в Таблицах 14а и 14b, Tween 80 оказывает аддитивный эффект при использовании в коцентрациях 1-2% (по отношению массы к объему) и отрицательный эффект при использовании в коцентрациях 0,1, 0,5, 5 и 10% (по отношению массы к объему). Solutol (таблицы 14 с и 14а) оказывает синергетический эффект на растворимость при концентрациях 1-5% (по отношению массы к объему). При использовании препарата Solutol вместе с CAPTISOL или без него с концентрацией 10% (по отношению массы к объему) растворимость не изменяется. Не стремясь связать это с каким-либо частным механизмом, отрицательная растворимость, наблюдаемая при использовании вместе с циклодекстрином поверхностно-активных веществ, может возникать из-за действия молекулы поверхностно-активного вещества в качестве конкурентного ингибитора при солюбилизации лекарства комплексантом, в данном случае циклодекстрином. Подобным же образом, комплексант (циклодекстрин) "вытягивает " поверхностно-активное вещество из раствора, делая его недоступным для солюбилизации лекарства.
Используемый в этом документе термин "ароматизатор" предназначен для обозначения соединения, используемого для придания приятного запаха и часто благоухания фармацевтическому препарату. К примерным ароматизирующим веществам или ароматизаторам относятся синтетические ароматизированные масла и душистые ароматические вещества, и/или природные масла, экстракты из растений, листьев, цветов, плодов и прочего, и их комбинации. К ним могут также относиться коричное масло, гаультериевое масло, масло перечной мяты, гвоздичное, лавровое, анисовое, эвкалиптовое, тимьяновое, американское можжевеловое масло, масло мускатного ореха, мускатного шалфея, горького миндаля и кассиевое масло. К другим приходным ароматизирующим веществам относятся ваниль, цитрусовое масло, включая лимонное, апельсиновое, виноградное, лаймовое и грейпфрутовое масло, и фруктовые эссенции, включая эссенции из яблока, груши, персика, земляники, малины, вишни, сливы, ананаса, абрикоса и так далее. К ароматизирующим веществам, которые, как было найдено, являются особо пригодными, относятся доступные для приобретения земляничные, апельсиновые, виноградные, вишневые, ванильные, мятные и цитрусовые вкусовые добавки и их смеси. Количество вкусового вещества может зависеть от ряда факторов, включая необходимый органолептический эффект. Вкусовые добавки будут присутствовать в любом желаемом количестве, которое определяется обычным специалистом в данной области техники. В частности, вкусовыми добавками являются земляничная, вишневая и цитрусовая, например, апельсиновая, вкусовые добавки.
Используемый в этом документе термин "подсластитель" предназначен для обозначения соединения, используемого для придания сладкого вкуса препарату. К таким соединениям, в качестве примеров и без ограничений, относятся аспартам, декстроза, глицерин, манит, сахарин натрия, сорбит, ксилит, фруктоза, кукурузный сироп с высоким содержанием фруктозы, мальтодекстрин, сукралоза, сахароза, другие вещества, известные обычным специалистам в данной области техники, и их комбинации.
Используемое в этом документе душистое вещество представляет собой сравнительно летучее вещество или комбинацию веществ, которая вырабатывает заметные аромат, запах или отдушку. К примерным душистым веществам относятся те вещества, которые одобрены законом о пищевых продуктах, медикаментах и косметике.
Используемый в этом документе термин "подщелачивающий агент" предназначен для обозначения соединения, используемого для обеспечения щелочной среды. К таким соединениям, в качестве примеров и без ограничений, относятся аммиачный раствор, карбонат аммония, диэтаноламин, моноэтаноламин, гидроксид калия, борат натрия, карбонат натрия, гидрокарбонат натрия, гидроксид натрия, триэтаноламин, органический амин, щелочные аминокислоты, троламин и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "подкисляющий агент" предназначен для обозначения соединения, используемого для обеспечения кислой среды. К таким соединениям, в качестве примеров и без ограничений, относятся уксусная кислота, кислые аминокислоты, лимонная, фумаровая кислота и другие альфагидроксикислоты, соляная, аскорбиновая, фосфорная, серная, винная, азотная кислота и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "предохраняющее средство" предназначен для обозначения соединения, используемого для предотвращения роста микроорганизмов. К таким соединениям, в качестве примеров и без ограничений, относятся бензалконий хлорид, бензетоний хлорид, бензойная кислота, бензиловый спирт, цетилпиридиний хлорид, хлорбутанол, фенол, фенилэтиловый спирт, фенилртутьнитрат, фенилртутьацетат, тимеросал, метакрезол, миристилгамма пиколиний хлорид, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия,сорбиновая кислота, тимол, метил-, этил-, пропил- или бутилпарабены и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "антиоксидант" предназначен для обозначения вещества, подавляющего окисление и используемого, таким образом, для предотвращения ухудшения свойств препарата из-за окислительных процессов. К таким соединениям, в качестве примеров и без ограничений, относятся уксусная кислота, кислые аминокислоты, лимонная, фумаровая кислота и другие альфагидроксикислоты, соляная, аскорбиновая, фосфорная, серная, винная, азотная кислота и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "буферное вещество" предназначен для обозначения соединения, используемого для поддержания рН на одном уровне при разбавлении или добавлении кислоты и щелочи. К таким соединениям, в качестве примеров и без ограничений, относятся уксусная кислота, ацетат натрия, адипиновая кислота, бензойная кислота, бензоат натрия, лимонная кислота, малеиновая кислота, одноосновный фосфат натрия, двухосновный фосфат натрия, молочная кислота, винная кислота, глицин, метафосфат калия, фосфат калия, одноосновный ацетат натрия, гидрокарбонат натрия, тартрат натрия, безводный цитрат натрия, дигидрат цитрата натрия и другие вещества, известные обычным специалистам в данной области техники. Используемый в этом документе термин "стабилизатор" предназначен для обозначения соединения, используемого для стабилизации терапевтического средства по отношению к физическому, химическому или биохимическому процессу, который может каким-либо образом понижать терапевтическую активность средства. К таким стабилизаторам, в качестве примеров и без ограничений, относятся альбумин, сиаловая кислота, креатинин, глицин и другие аминокислоты, никотинамид, ацетилтриптофонат натрия, оксид цинка, сахароза, глюкоза, лактоза, сорбит, манит, глицерин, полиэтиленгликоли, каприлат натрия, сахарин натрия и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "модификатор вязкости" предназначен для обозначения соединения или комбинации соединений, способных повышать или понижать вязкость жидкого состава. Некоторые из полимеров, раскрытых в данном документе, можно использовать в качестве модификаторов вязкости. Используемый в этом документе термин "модификатор тоничности" предназначен для обозначения соединения или соединений, которые могут использоваться для регулировки тоничности жидкого состава. К подходящим модификаторам тоничности относятся глицерин, лактоза, маннит, декстроза, хлорид натрия, сульфат натрия, сорбит, трегалоза и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "противовспенивающая добавка" предназначен для обозначения соединения или соединений, которые предотвращают вспенивание или снижают количество пены, образующейся на поверхности жидкого состава. К подходящим противовспенивающим добавкам, в качестве примеров и без ограничений, относятся диметикон, симетикон, октосинол и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "наполнитель" предназначен для обозначения соединения, используемого для придания объема воссоздаваемому твердому веществу и/или для содействия при регулировании свойств состава во время приготовления. К таким соединениям, в качестве примеров и без ограничений, относятся декстран, трегалоза, сахароза, поливинилпироллидон, лактоза, инозит, манит, сорбит, диметилсульфоксид, глицерин, альбумин, лактобионат кальция и другие вещества, известные обычным специалистам в данной области техники.
Используемый в этом документе термин "криозащитное средство" предназначен для обозначения соединения, используемого для защиты активного терапевтического средства от физического или химического разложения во время лиофилизации. К таким соединениям, в качестве примеров и без ограничений, относятся диметилсульфоксид, глицерин, трегалоза, пропиленгликоль, полиэтиленгликоль и другие вещества, известные обычным специалистам в данной области техники.
Следует понимать, что соединения, используемые в фармацевтической отрасли, выполняют различные функции и назначения. Так, если соединение, приведенное в данном документе, упоминается только один раз или используется при иллюстрации нескольких терминов, определенных в данном документе, то следует делать вывод, что его назначение или функция ограничиваются исключительно только названным(и) назначением(ями) или функцией(ями).
Жидкий состав изобретения может быть приготовлен по различным способам, количество которых огромно. Согласно одному способу готовят первый водный раствор, содержащий САЭ-ЦД. Затем готовят второй раствор, содержащий клопидогрель. В конце первый и второй растворы смешивают с образованием жидкого состава. Первый и второй растворы независимо друг от друга могут содержать другие вспомогательные вещества и средства, описанные в этом документе. Кроме того, вторым раствором может являться водный раствор и/или раствор на основе органического растворителя. Другой способ приготовления схож с вышеописанным способом за исключением того, что клопидогрель сразу добавляют к первому раствору, не готовя второй раствор. Третий способ приготовления жидкого состава схож с вышеописанным первым способом за исключением того, что САЭ-ЦД сразу добавляют ко второму водному раствору, содержащему клопидогрель, без приготовления первого раствора. Четвертый способ приготовления жидкого состава включает стадии добавления водного раствора, содержащего клопидогрель к порошковому или измельченному САЭ-ЦД, и перемешивания раствора до тех пор, пока САЭ-ЦД не растворится. Пятый способ приготовления жидкого состава включает стадии добавления клопидогреля прямо к порошковому или измельченному САЭ-ЦД, последующего добавления водного раствора и перемешивания до тех пор, пока САЭ-ЦД и клопидогрель не растворятся. Шестой способ приготовления жидкого состава включает стадии нагревания либо первого раствора, либо второго раствора, либо нагревания комбинации любых растворов, описанных в вышеуказанных способах, и последующую стадию охлаждения соответствующего нагретого раствора. Седьмой способ приготовления жидкого состава включает стадии регулирования рН либо первого раствора, либо второго раствора, либо регулирования рН комбинации любых растворов, описанных в вышеуказанных в способах. Восьмой способ включает стадии создания жидкого состава любым из вышеописанным способов, и последующую стадию выделения твердого материала лиофилизацией, сушкой в барабанной сушилке, распылительной сушкой, распылительной лиофильной сушкой, вакуумной сушкой, осаждением из растворителя или способом, в котором используется суперкритическая или почти суперкритическая жидкость. Любой из вышеуказанных составов может содержать фармацевтические вспомогательные вещества и ингредиенты, описанные в этом документе.
Некоторые варианты осуществления способа приготовления жидкого состава, кроме того, включают стадию(и): 1) фильтрования состава через фильтрационную среду, в которой размер пор составляет около 5 мкм или менее; 2) стерилизации жидкого состава облучением; 3) стерилизации жидкого состава обработкой оксидом этилена; 4) выделения стерильного порошка из стерилизованного жидкого состава; 5) продувки жидкости инертным газом для снижения количества растворенного кислорода в жидкости; и/или 6) нагревания одного или нескольких растворов, используемого для приготовления жидкого состава.
Изобретение обеспечивает фармацевтические наборы. В некоторых вариантах осуществления фармацевтический набор включает первую камеру, содержащую жидкую среду, и вторую камеру, содержащую воссоздаваемую твердую фармацевтическую композицию, описанную в этом документе. Первая и вторая камеры могут быть объединены, сцеплены или собраны с образованием контейнера, содержащего, по меньшей мере, две камеры, или камеры могут быть отделены с образованием раздельных контейнеров. Жидкая среда содержит водный жидкий носитель, такой как вода, дектроза, физиологический раствор, раствор Рингера с лактатом, или любую другую фармацевтически приемлемую водную жидкую среду, предназначенную для приготовления жидкого фармацевтического состава. В некоторых вариантах осуществления фармацевтический набор включает первую камеру, содержащую жидкую среду, и вторую камеру, содержащую воссоздаваемую твердую фармацевтическую композицию, описанную в этом документе. В других вариантах осуществления набор включает контейнер, содержащий, по меньшей мере, две камеры, где одна камера содержит воссоздаваемую твердую фармацевтическую композицию, а другая камера содержит жидкий носитель.
В некоторых вариантах осуществления набор включает первую камеру, которая содержит фармацевтическую композицию, содержащую САЭ-ЦД, и вторую камеру, которая содержит фармацевтическую композицию, содержащую клопидогрель. Первая и вторая камеры могут быть объединены, сцеплены или собраны с образованием контейнера, содержащего, по меньшей мере, две камеры, или камеры могут быть отделены с образованием раздельных контейнеров. Первую и вторую композицию можно смешивать с жидким носителем, который может включаться или не включаться в набор, или составлять в виде жидкой лекарственной формы перед введением больному. Любая из первой и второй фармацевтических композиций или обе эти композиции могут содержать дополнительные фармацевтические вспомогательные вещества. Набор доступен в различных формах. В первом наборе первая и вторая фармацевтические композиции заготовлены в отдельных контейнерах или отдельных камерах контейнера с двумя или более камерами. Первая и вторая фармацевтические композиции могут независимо друг от друга заготавливаться либо в твердой, либо в порошкообразной, либо в жидкой форме. Например, САЭ-ЦД может заготавливаться в воссоздаваемой порошкообразной форме, а клопидогрель может заготавливаться в порошкообразной форме. Согласно одному варианту осуществления набор мог бы, кроме того, содержать фармацевтически приемлемый жидкий носитель, используемый для суспендирования и растворения первой и/или второй фармацевтических композиций. В качестве альтернативы, жидкий носитель независимо помещают вместе с первой и/или второй фармацевтической композицией. Жидкий носитель, однако, может заготавливаться в контейнере или камере, отделенной от первой и второй фармацевтических композиций. Как указано выше, первая фармацевтическая композиция, вторая фармацевтическая композиция и жидкий носитель могут независимо друг от друга содержать предохраняющее средство, антиоксидант, буферное вещество, подкислитель, электролит, другое терапевтическое средство, подщелачивающий агент, противомикробное средство, противогрибковое средство, средство, повышающее растворимость, модификатор вязкости, вкусовую добавку, подсластитель или их комбинации.
Некоторые варианты осуществления набора включают такие варианты, в которых: 1) первая и вторая фармацевтическая композиции содержаться в отдельных контейнерах или камерах контейнера с двумя или более камерами; 2) набор, кроме того, содержит отдельный фармацевтически приемлемый носитель; 3) жидкий носитель независимо помещают при каждом случае вместе с первой и/или второй фармацевтической композицией; 4) контейнеры для фармацевтических композиций независимо выбирают при каждом случае из вакуумированного сосуда, сумки, мешочка, пузырька, флакона или любого фармацевтически приемлемого устройства, известного специалисту в данной области техники и используемого для доставки жидких составов; 5) первая и/или вторая фармацевтическая композиция, и/или жидкий носитель, кроме того, содержат антиоксидант, буферное вещество, подкислитель, солюбилизатор или средство, повышающее растворимость, средство для усиления комплексообразования, лиофилизирующие добавки (например, наполнители или стабилизаторы), электролит, другое терапевтическое средство, подщелачивающий агент, противомикробное средство, противогрибковое средство, модификатор вязкости, вкусовую добавку, подсластитель или их комбинации; 6) набор заготовлен в охлажденном виде; 8) жидкий носитель и/или камеру продули фармацевтически приемлемым инертным носителем для удаления по существу всего кислорода, растворенного в жидком носителе; 9) камеры по существу не содержат кислорода; 10) жидкий носитель, кроме того, содержит буферное вещество, способное поддерживать рН около 2-7; 11) камеры и растворы стерилизованы.
Термин "стандартная лекарственная форма" используется в этом документе для обозначения лекарственной формы однократного приема, содержащей некое количество активного ингредиента, разбавителя или носителя, при этом упомянутое количество является таковым, что для однократного терапевтического введения обычно требуется одна или несколько заранее определенных установок. В случае форм многократного приема, таких как флаконы, наполненные жидкостью, указанной заранее определенной установкой будет являться одна фракция, например, половина или четверть формы многократного приема. Подразумевается, что специфический уровень дозы для какого-либо пациента будет зависеть от различных факторов, включая тип лечимого симптома, используемое терапевтическое средство, активность терапевтического средства, серьезность симптома, состояние здоровья, возраст, пол, вес, питание, фармакологическая реакция пациента, используемая специфическая лекарственная форма и другие подобные факторы.
Фраза "фармацевтически приемлемый" используется в этом документе относительно тех соединений, материалов, композиций и/или лекарственных форм, которые в пределах объема тщательной медицинской оценки подходят для применения их в контакте с тканями организма человека и животных, не вызывая повышенную токсичность, раздражение, аллергическую реакцию или другую проблему или осложнение, соизмеримое с допустимым соотношением пользы к риску.
Используемый в этом документе термин "пациент" или "больной" использован для обозначения теплокровных животных, например, млекопитающих, таких как кошки, собаки, мышки, морские свинки, лошади, коровы, овцы, животные, не принадлежащие к человеческому роду, и люди.
Жидкий состав изобретения может быть приготовлен по различным способам, количество которых огромно. Под термином "эффективное количество" подразумевается терапевтически эффективное количество. Терапевтически эффективное количество - это количество или доза клопидогреля, которая достаточна для появления требуемой или желаемой терапевтической реакции, или, иными словами, количество, которое достаточно для появления заметной биологической реакции при введении больному препарата.
Изобретение также обеспечивает твердую лекарственную форму, содержащую терапевтически эффективное количество клопидогреля, сульфоалкилового эфира циклодекстрина (например, СБЭ7-β-ЦД) и фармацевтически приемлемый твердый носитель, в которой молярное отношение САЭ-ЦД к клопидогрелю такое, как было определено в данном документе. САЭ-ЦД и клопидогрель могут помещаться в лекарственную форму в виде смеси, в виде предварительно образованного комплекса или в виде их комбинации. Твердую лекарственную форму можно приготовить с использованием методик, традиционно используемых в фармацевтических науках. Когда твердый САЭ-ЦД и клопидогрель вводят в виде смеси, то их физически смешивают с помощью энергетического смесителя для минимизации образования комплекса. Твердый предварительно образованный комплекс можно приготовить путем смешения САЭ-ЦД и клопидогреля в жидком носителе, таком как водный жидкий носитель, приводящего к образованию комплекса, с последующим удалением жидкого носителя, получая тем самым твердый предварительно образованный комплекс. В качестве альтернативы комплекс можно приготовить с использованием интенсивного процесса измельчения САЭ-ЦД и клопидогреля, при этом любой из этих компонентов или оба эти компонента независимо заготавливаются в твердой или жидкой форме.
Молярное отношение САЭ-ЦД к клопидогрелю в композиции или составе изобретения будет варьироваться в зависимости от рН состава или рН среды, которую, предполагается, использовать в составе. Например, молярное отношение может составлять менее 6:1 в том случае, когда рН состава или используемой среды составляет менее 3,5. В качестве альтернативы, молярное отношение САЭ-ЦД к клопидогрелю может составлять, по меньшей мере, 6:1 или находиться в диапазоне от 6:1 до 8:1 в том случае, когда рН состава или используемой среды составляет около 3,5 или превышает это значение. В том случае, когда рН состава или используемой среды составляет около 5,5 или находится в диапазоне от 5,5 до 8, то молярное соотношение может составлять, по меньшей мере, около 6,5:1 или, по меньшей мере, 6,6:1. В том случае, когда рН состава или используемой среды составляет около 8, то молярное соотношение может составлять, по меньшей мере, около 7,25:1 или, по меньшей мере, 7,3:1.
Предполагаемой используемой средой может являться фармцевтический состав или часть организма больного, например, часть сердечно-сосудистой системы или пищеварительного тракта больного, которому вводят состав. Если предполагаемой используемой средой является гастральная область (это означает, что САЭ-ЦД и клопидогрель доставляются к гастральной области и выделяются в этой области, например, в желудке или двенадцатиперстной кишке), то можно использовать молярное соотношение, составляющее менее 6:1 или менее 3:1. Если предполагаемой используемой средой является область, расположенная сразу после желудка (это означает, что САЭ-ЦД и клопидогрель доставляются к тощей или подвздошной кишке), то можно использовать молярное соотношение, составляющее, по меньшей мере, 6:1 или, по меньшей мере, 8:1.
В случае перорального введения и доставки и выделения в области желудка молярное отношение САЭ-ЦД, например, СБЭ7-β-ЦД, к клопидогрелю может дополнительно снижаться до 4:1 или менее, как описано в примерах 16 и 18, или до 0,5:1 или менее, как описано в примере 23, поскольку либо 1) рН желудочно-кишечного тракта приводит к уменьшению собственной растворимости клопидогреля, посредством чего для растворения лекарства требуется более низкое молярное отношение САЭ-ЦД к клопидогрелю; либо 2) рН состава может быть слегка кислым. рН примерных воссоздаваемых составов, описанных в примерах 16 и 18, варьируется в диапазоне от 1 до 2.
Для того чтобы жидкий состав изобретения был прозрачным, молярное отношение САЭ-ЦД к клопидогрелю может варьироваться согласно рН состава. При рН около 8 молярное соотношение должно составлять, по меньшей мере, около 7,25:1 или, по меньшей мере, около 7,3:1, а при рН около 5,5 молярное соотношение должно составлять, по меньшей мере, около 6,5:1 или, по меньшей мере, около 6,6:1. Это молярное соотношение достаточно для обеспечения жидкого раствора, однако, более высокие молярные соотношения будут приводить к повышению устойчивости против гидролиза, фотолиза и хиральной инверсии за счет увеличения процентного содержания клопидогреля, связанного с САЭ-ЦД.
Определяли молярное отношение САЭ-ЦД к клопидогрелю в составах, приготовленных согласно нижеуказанным примерам. Также определяли рН жидких составов. Собранные данные представлены ниже.
Нет необходимости в обеспечении верхнего предела молярного отношения САЭ-ЦД к клопидогрелю, поскольку избыток имеющегося САЭ-ЦД будет только способствовать дополнительной стабилизации клопидогреля. Однако, изобретение включает такие варианты осуществления, в которых верхний предел молярного отношения САЭ-ЦД к клопидогрелю составляет менее 1000:1, 500:1, 250:1, 100:1, 75:1, 50:1, 40:1, 30:1, 20:1, 17,5:1, 15:1, 12,5:1, менее или около 10:1. Эти верхние пределы можно использовать в комбинации с другими нижними пределами, изложенными в данном документе.
Молярное соотношение САЭ-ЦД к клопидогрелю в композиции или способе изобретения может находиться в диапазоне от 6:1 до 8:1, от 6:1 до 10:1, от 5:1 до 12:1, от 4:1 до 15:1, от 5:1 до 14:1, от 6:1 до 13:1 или от 6:1 до 12,5:1; и/или может составлять, по меньшей мере, 0,05:1, 0,25:1,0,2:1, 0,5:1, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1 или, по меньшей мере, 8:1; и/или не более 100:1,75:1, 50:1,40:1, 35:1,30:1, 25:1, 20:1, 15:1, 14:1, 12,5:1, 12:1, 10:1, 8:1, 6:1, 5:1, 4:1, 3:1 или не более 2:1.
Таблетки, приготовленные согласно примеру 23, растворяли в одном литре лимонно-кислого или фосфатного буфера. Таблетки PLAVIX® использовали в качестве контрольных или сравнительных образцов. Каждая таблетка содержит 75 мг эквивалентов свободного основания клопидогреля. На фиг.13 можно увидеть, что таблетки как на основе предварительно образованного комплекса, так и на основе физической смеси, содержащие САЭ-ЦД, растворяются быстрее, чем таблетки PLAVIX®, а также они имеют более высокую конечную концентрацию. Такое более быстрое растворение может приводить к более быстрому поглощению и, следовательно, к более быстрому терапевтическому началу.
Типичная ежедневная доза клопидогреля для приема внутрь, выражаемая через свободное основание, составляет 75 мг. В качестве ударной дозы для определенных малоинвазинвых интервенционных процедур, таких как помещение стента, пластическая операция на сосудах, внутрисосудистый ультразвук, атерэктомия, баллонная ангиопластика и стентирование сонной артерии (CBAS), лазерный тромболизис, близкофокусная лучевая терапия, ультразвуковая эхография, использование внутриартериальных засасывающих приспособлений, использование петель или использование устройства для поиска тромба, можно вводить более высокие дозы, например, 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12,5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0.1 мг клопидогреля, или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля. Хотя титрование доз не показано для PLAVIX®, настоящий состав может быть легко поделен с целью тщательного титрования дозы, если это необходимо. Настоящие составы можно вводить согласно указаниям на листке-вкладыше, содержащимся в упаковке для таблеток PLAVIX®; это означает, что больному можно вводить дозу настоящего состава, содержащего эквивалентное количество клопидогреля, которое может составлять около 75 мг, около 300 мг или от 75 до 300 мг. В издании Physician's Desk Reference 56th ed. (pp.3084-3086; Eds. Lori Murray, Gwynned L Kelly; Medical Economics Company, Inc., Montvale, NJ 07645-1742, 2002), релевантный текст которого включен настоящим образом по ссылке, раскрывается инструкция по медицинскому применению препарата PLAVIX® и, в частности, дозировка и введение состава. Используемый в этом документе термин "время кровотечения" относится ко времени, которое требуется для остановки кровотечения у млекопитающего после регулируемой, стандартизированной пункции кожи млекопитающего, например, после регулируемой, стандартизированной пункции мочки уха или предплечья млекопитающего (или больного). Кровотечение останавливается отчасти за счет агрегации тромбоцитов in vivo; поэтому время кровотечения увеличивается по мере уменьшения скорости или суммарной величины агрегации тромбоцитов, и время кровотечения уменьшается по мере увеличения скорости или суммарной величины агрегации тромбоцитов. Взаимосвязь между временем кровотечения и агрегацией тромбоцитов не является обязательно линейной. Время кровотечения - это косвенная мера степени или возможности агрегации тромбоцитов. Оценка времени кровотечения может проводиться по стандартным методам анализа, описанным в литературе (Sramek, и соавт., Thrombosis and Haemostasis 67 (5) 514-518 (1992)), и согласно примеру 21, в котором время кровотечения измеряют после регулируемой, стандартизированной пункции кожи больного. При оценке времени кровотечения измеряется время, требуемое для блокировки малых кровеносных сосудов и прекращения кровотечения после осуществления пункции.
Процентное увеличение времени кровотечения у больного определяют измерением "времени кровотечения на исходном уровне" (ВВТ, в секундах) до введения состава или композиции изобретения. Больному затем вводят состав или композицию изобретения, и измеряют у больного "время кровотечения после лечения" (ТВТ, в секундах). Затем рассчитывают процентное увеличение (δBT, %) следующим образом:
δВТ=((ТВТ - ВВТ)/ВВТ) * 100
Для определения степени или скорости (или возможности) агрегации тромбоцитов ex vivo можно использовать известные методы анализа агрегации тромбоцитов и стандартное оборудование в месте наблюдения за пациентом. Большинство измерений проводите использованием либо метода на оптической основе или на основе измерения сопротивления (Dyszkiewicz-Korpanty и соавт., Clinical and Applied Thrombosis/Hemostasis, Vol.11, No.1, 25-35 (2005), полное раскрытие которого включается настоящим образом по ссылке). Типичное оборудование, системы и методы анализа включают агрегометр тромбоцитов (Chrono-log Corporation, Havertown, PA), агрегометрию тромбоцитов VerifyNow (Accumetrics, San Diego, CA), профилометр агрегации тромбоцитов Profiler™ (Bio/Data Corporation, Horsham, PA), тест агрегации тромбоцитов на предметном стекле (SPAT™, Analytical Control Systems, Inc., Fishers, IN), тест агрегации тромбоцитов, индуцированной гепарином, анализ агрегации тромбоцитов по титрованию ристоцетина и т.д. Анализ, как правило, основан на импедансной или оптической агрегометрии. В общем, получают образец крови больного и отделяют плазму крови от образца. Плазму обрабатывают АДФ, как описывается в этом документе, а затем определяют степень агрегации тромбоцитов в плазме крови. Анализ проводят перед и после введения клопидогреля больному.
Процентное уменьшение степени (или возможности) агрегации тромбоцитов у больного определяют вначале измерением "агрегации тромбоцитов на исходном уровне" (ВРА) до введения состава или композиции изобретения. Больному затем вводят состав или композицию изобретения, и измеряют у больного "агрегацию тромбоцитов после лечения" (ТРА). Затем рассчитывают процентное уменьшение (δPA, %) следующим образом:
δPA=((ВРА - TPA)/BPA) * 100
In vivo оценку у мышей для прозрачного жидкого состава, приготовленного согласно примеру 20, проводят согласно примеру 21. Время кровотечения у отдельных мышей измеряют периодически для определения различия в характеристиках между составом PLAVIX® (измельченная таблетка для приема внутрь), комплексом гидросульфат клопидогреля-САЭ-ЦД (вводимого внутривенно) и комплексом гидросульфат клопидогреля-САЭ-ЦД (раствор для приема внутрь). Считается, что сокращение времени, за которое достигается увеличение времени кровотечения, соответствует сокращению времени начала лечения, поскольку увеличение времени кровотечения свидетельствует о начале терапевтического действия. Результаты (фиг.12) указывают на то, что применение состава согласно изобретению приводит к ускорению терапевтического начала, при котором время после введения, которое требуется для достижения желаемого увеличения времени кровотечения, существенно уменьшается по сравнению со временем после введения твердого препарата PLAVIX® (вводимого в виде порошка, приготовленного смятием или растиранием таблетки). Состав изобретения обеспечивает более быстрое терапевтическое начало без необходимости в таких избыточных дозах, которые вводятся в настоящее время при проведении интервенционных кардиологических процедур.
К удивлению, пероральная доза изобретения может обеспечивать почти такие же скорость терапевтического начала и уровень терапевтического эффекта, которые достигаются при парентеральном внутривенном введении дозы изобретения, и при обоих способах введения доз обеспечивается более быстрое появление терапевтической пользы и более высокий уровень терапевтического эффекта, чем при введении сравнительного состава, например, таблетки для приема внутрь, содержащей эквивалентную дозу клопидогреля. Что касается снижения времени терапевтического начала, то изобретение обеспечивает сокращение времени наступления максимального или целевого терапевтического эффекта. В некоторых вариантах осуществления изобретение обеспечивает способ уменьшения времени достижения максимального или целевого терапевтического эффекта у больного, отвечающего на лечение, которому вводили клопидогрель, при этом способ включает в себя: введение нуждающемуся больному первой композиции, содержащей САЭ-ЦД и терапевтически эффективное количество клопидогреля, достаточное для достижения целевого терапевтического эффекта, причем время, соответствующее максимальному или целевому терапевтическому эффекту, достигаемому введением первой композиции, меньше времени, за которое достигается максимальный терапевтический эффект посредством схожего введения иного аналогичного сравнительного соединения, не содержащего САЭ-ЦД и содержащего по существу такое же терапевтически эффективное количество клопидогреля. Сравнительная композиция может предствалять собой таблетку. Первая композиция может быть твердой, суспензионной или жидкой.
Фигуры 14 и 16 - это графики логарифмической зависимости средней концентрации соединения в плазме крови от времени после введения таких соединений, как клопидогрель (фиг.14), тиоловый метаболит клопидогреля (фиг.15) и карбокислотный метаболит клопидогреля (фиг.16). Данные, полученные как часть клинического исследования, подробно изложены в примере 27. На фиг.14 показана взаимосвязь между чистой дозой и концентрацией в плазме крови для клопидогреля, вводимого парентерально, т.е. внутривенно, для 0,1, 1,0, 10, 30, 100 и 300 мг доз. Чем выше вводимая доза, тем выше концентрация клопидогреля в плазме крови. Время достижения максимальной концентрации в плазме крови составляло около 30 секунд или около 1-5 минут, или менее или около 10-15 минут, и превышало или соответствовало времени окончания или прекращения введения дозы. Время достижения максимальной концентрации в плазме крови может зависеть от скорости парентерального введения: чем дольше период введения, тем длинее время достижения максимальной концентрации в плазме крови. Как отмечено ниже, клопидогрель вводили внутривенно в виде болюса на протяжении периода менее или около 1 минуты (для образцов, содержащих 0,1 мг, 1 мг, 10 мг или 30 мг клопидогреля), около 3-5 минут или около 4 минут (для образцов, содержащих около 100 мг клопидогреля) и около 6-10 минут или около 8 минут (для образцов, содержащих около 300 мг клопидогреля). На фиг.15 отображена взаимозависимость между дозой и концентрацией в плазме крови для тиолового метаболита клопидогреля.
Данные, полученные как часть клинического исследования, подробно изложены в примере 27. В общем, чем выше доза клопидогреля, тем выше соответствующая концентрация метаболита в плазме крови, который, как полагается, является фармакологически активным метаболитом. Важно отметить, что низкие дозы клопидогреля могут давать терапевтическую реакцию даже, если соответствующая концентрация тиолового метаболита в плазме крови может быть ниже его предела обнаружения, по крайней мере, согласно используемому в этом документе методу анализа. Соответсвенно, для методов изобретения не требуется, чтобы тиоловый метаболит поддавался количественному определению или даже обнаружению. Необходимо только, чтобы количество клопидогреля, превращающегося in vivo в тиоловый метаболит, было достаточным для обеспечения соответствующего терапевтического эффекта у больного за указанный период времени.
На фиг.16 отображена взаимозависимость между дозой и концентрацией в плазме крови для карбокислотного метаболита клопидогреля. Данные, полученные как часть клинического исследования, подробно изложены в примере 27. В общем, чем выше доза клопидогреля, тем выше соответствующая концентрация метаболита в плазме крови, который, как полагается, является фармакологически неактивным метаболитом.
На фиг.17 показаны кривые средняя доза-реакция для больных, которым вводили клопидогрель согласно примеру 27. Реакцию определяют в виде процентного ингибирования агрегации тромбоцитов после воздействия АДФ (5 мкМ) на плазму крови больного. В общем, время начала терапевтического действия составляло менее или около 15 минут. Как описано Weerakody и соавт. 2007 (см. предыдущую ссылку), максимальное ингибирование агрегации тромбоцитов на уровне >=15% рассматривается в качестве терапевтического эффекта, позволяющего дифференцировать различные антитромбоцитарные лекарства, которые, как известно, полезны при лечении ОКС.
В результате ускорения терапевтического начала способы и композиции изобретения обеспечивают более быстрое время установления максимальной концентрации в плазме крови, более быстрое время достижения максимального терапевтического эффекта, более быстрое время достижения целевого терапевтического эффекта, а также обеспечивают несколько клинических преимуществ по сравнению сфармацевтическими композициями клопидогреля для приема внутрь в виде таблеток и способами его применения и введения. Например, композиции и способы изобретения обеспечивают сокращение времени лечения, снижения раннего риска возникновения второго сердечнососудистого исхода у больного за счет снижения времени лечения или реакции, например, за счет снижения времени достижения максимального терапевтического эффекта, времени установления максимальной концетрации в плазме крови, времени достижения целевого терапевтического эффекта и времени начала лечения.
На фиг.18 изображен график зависимости процентной доли больных, отвечающих на лечение, от времени после введения клопидогреля согласно примеру 27. Используемый в этом документе термин "больной, отвечающий на лечение" относится к больному, который прошел лечение клопидогрелем и для плазмы крови которого наблюдается, по меньшей мере, 15% ингибирование агрегации тромбоцитов при ex vivo воздействии на плазму крови больного 5 мкМ АДФ, при этом степень агрегации тромбоцитов определяют агрегометрией тромбоцитов. Согласно изобретению можно использовать любой известный метод агрегометрии тромбоцитов; однако, подходящие методы описаны в этом документе. В общем, чем выше доза, вводимая группе больных, тем выше в этой группе процентная доля больных, отвечающих на лечение. А также, чем выше доза, вводимая группе больных, тем быстрее в этой группе достигается максимальное количество больных, отвечающих на лечение. Композицию или состав изобретения можно использовать для лечения, предотвращения, улучшения, снижения частоты или снижения риска возникновения заболевания, расстройства или патологического состояния, которое дает терапевтическую реакцию на терапию клопидогрелем. Используемый в этом документе в отношении способа лечения больного термин "лечить" или "лечение" означает смягчение, улучшение, устранение, снижение тяжести, частоты или случаев возникновения или предотвращения симптомов, связанных с заболеванием, расстройством или патологическим состоянием, причинным компонентом которого является избыточная или неблагоприятная агрегация тромбоцитов. Используемый в этом документе термин "дающий терапевтическую реакцию на клопидогрель" означает, что лечение больного, имеющего такое заболевание, расстройство или патологическое состояние, терапевтически эффективным количеством клопидогреля будет давать больному клиническую или терапевтическую пользу. Способ лечения, предотвращения, улучшения, снижения частоты или снижения риска возникновения заболевания, расстройства или патологического состояния, которое дает терапевтическую реакцию на терапию клопидогрелем, у больного включает в себя введение нуждающемуся больному состава или композиции изобретения, содержащей САЭ-ЦД и дозу клопидогреля. Терапевтически эффективное количество клопидогреля может включать одну, две или несколько доз клопидогреля. В некоторых вариантах осуществления заболевание, расстройство или состояние включает тромболитическое заболевание, расстройство или состояние и может быть выбрано из группы, состоящей из инфаркта миокарда, инсульта, установленной болезни периферических артерий (БПА), вторичных ишемических исходов, острого коронарного синдрома (ОКС, например, нестабильной стенокардии или Q-необразующего ИМ), преходящего ишемического нарушения (ПИН), церебрального атеросклероза, цереброваскулярной болезни, сердечно-сосудистого заболевания, грудной жабы, тромбоза глубоких вен (ТГВ), легочной эмболии (ЛЭ), серповидно-клеточной анемии и аритмии сердца.
Композиции, способы и составы изобретения можно использовать в способах как интервенционного, так и неинтервенционного лечения больных с сердечно-сосудистым заболеванием, таким как ОСК (острый коронарный синдром), который относится к любой группе клинических симптомов, совместимых с острой ишемией миокарда. Острая ишемия миокарда - это боль в груди, возникающая из-за недостаточного притока крови к сердечной мышце и приводящая к болезни коронарных артерий. Также эти композиции и составы изобретения можно использовать в лечебных способах, в которых необходимо проведение малоинвазивной интвервенционной процедуры, такой как ЧВКС (замена стенат или баллонная ангиопластика), или в лечебных способах, для которых не требуется проведение инвазивных процедур. Для получения пользы от терапии клопидогрелем больной должен отвечать на лечение, как это определено в данном документе. Больной может подвергаться или не подвергаться хронической терапии клопидогрелем до появления у него ОКС. Способ лечения, в самом широком смысле, включает введение нуждающемуся больному фармацевтической композиции, содержащей САЭ-ЦД и клопидогрель в количестве, достаточном для обеспечения целевого терапевтического эффекта у больного за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут, или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после введения композиции.
В этом смысле целевой терапевтический эффект - это уровень ингибирования агрегации тромбоцитов или время кровотечения, которое, как полагается, достаточно для получения согласия врача-консультанта на проведение процедуры малоинвазивного вмешательства, такой как ЧВКС. Целевой терапевтический эффект может изменяться при переходе от одного больного к другому в зависимости от их способности поглощать и/или преобразовывать в процессе обмена веществ клопидогрель в его активный метаболит. Терапевтический эффект может изменяться в зависимости от типа лечимого заболевания, расстройства или патологического состояния; однако здесь рассматриваются любые клинически полезные терапевтические эффекты, достигаемые у больного в результате in vivo ингибирования агрегации тромбоцитов или увеличения времени кровотечения, вызванного клопидогрелем при его введении больному в составе композиций и/или по способам изобретения.
Способ лечения может, кроме того, включать ранюю стадию определения того, нуждается ли больной в интвервенционном или неинтервенционном медицинском лечении. После введения клопидогреля больной может проходить малоинвазивную процедуру за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут, или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после парентерального или перорального введения композиции изобретения, содержащей клопидогрель.
В случае способа лечения, в котором больному показаны неинтервенционная процедура (медицинское лечение) и введение клопидогреля, больному будут вводить клопидогрель в составе композиции изобретения и второе терапевтическое средство, например, описанное в этом документе.
В некоторых вариантах осуществления изобретение также обеспечивает способ лечения больного, у которого имеется сердечно-сосудистое патологическое состояние, заболевание или расстройство, при этом способ лечения включает в себя: а) определение того, нуждается ли больной или нет в интервенционном или неинтервенционном медицинском лечении; и b) если больной нуждается в медицинском лечении с малоинвазивным вмешательством, то введение ему фармацевтической композиции, содержащей САЭ-ЦД и клопидогрель в количестве, достаточном для обеспечения целевого терапевтического эффекта у пациента за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минут до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут или за период менее 10 секунд, менее 1 минуты, менее 2,5 минут, менее 5 минут, менее 7,5 минут, менее 10 минут, менее 15 минут, менее 20 минут, менее 30 минут, менее 120 минут, менее 100 минут, менее 90 минут, менее 75 минут, менее 60 минут, менее 50 минут, менее 45 минут или менее 40 минут после указанного введения и проведения процедуры малоинвазивного вмешательства; или с) если больной нуждается в неинтервенционном медицинском лечении, то введение ему фармацевтической композиции, содержащей САЭ-ЦД и клопидогрель в количестве, достаточном для обеспечения целевого терапевтического эффекта за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или за время менее 10 секунд, менее 1 минуты, менее 2,5 минут, менее 5 минут, менее 7,5 минут, менее 10 минут, менее 15 минут, менее 20 минут, менее 30 минут, менее 120 минут, менее 100 минут, менее 90 минут, менее 75 минут, менее 60 минут, менее 50 минут, менее 45 минут или менее 40 минут, и обеспечение больного указанным неинтервенционным медицинским лечением; или d) если больной нуждается в медицинском лечении с инвазивным вмешательством (например, в АКШ), то ему не вводят клопидогрель. В некоторых вариантах осуществления способ лечения включает в себя: 1) необязательное воздействие на имеющегося больного седативным средством; 2) определение наличия у больного высокого риска ОКС; 3) необязательно, оповещение зондовой лаборатории о поступлении больного; 4) необязательно, транспортировка больного в зондовую лабораторию; 5) проведение одного или нескольких диагностических испытаний на коронарных сосудах больного; 6) определение того, показано ли больному ЧВКС или АКШ; и 7) если показано ЧВКС, то парентеральное введение жидкой композиции, содержащей клопидогрель и необязательно САЭ-ЦД, или введение через рот композиции или состава, содержащего клопидогрель и САЭ-ЦД, проведение ЧВКС и необязательно поддержание больного на продолжительной (хронической) терапии клопидогрелем; или 8) если показано АКШ, то проведение АКШ без введения клопидогреля. Способ изобретения может включать по мере необходимости дополнительные стадии, например, любую(ые) стадию(ии), предписанную(ые) лечащим врачом. Способ воздействия седативным средством может включать введение анксиолитического вещества, НПВС, ненаркотического обезболивающего средства, наркотического обезболивающего средства, анестетика, успокоительного средства и/или противовоспалительного средства.
К подходящим диагностичеким испытаниям на коронарных сосудах относятся коронарография, электрокардиография, ЭКГ, эхокардиография, ангиография с КТ сканированием и другие тесты, известные специалистам в данной области техники и предназначенные для определения коронарной дисфункции, в результате которой может потребоваться интервенционное или неинтервенционное лечение.
Неинтервенционная процедура определяется как процедура без хирургического вмешательства. Неинтервенционной процедурой может являться введение одного или нескольких терапевтических средств больному или другая нехирургическая процедура, описанная в этом документе. Интервенционная процедура определяется как процедура с инвазивным или малоинвазивным хирургическим вмешательством. Инвазивной процедурой может быть АКШ. Малоинвазивной процедурой может быть ЧВКС.
В связи с тем, что терапия клопидогрелем будет полезна только для больного, отвечающего на лечение, то изобретение обеспечивает способ быстрого определения того, отвечает ли больной на лечение или нет. Способ включает в себя: введение больному композиции, содержащей "ожидаемое терапевтически эффективное количество" клопидогреля, и определение восприимчивости больного к клопидогрелю за период от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после введения композиции больному. Под "ожидаемым терапевтически эффективным количеством" подразумевается, что количество клопидогреля, которое, как можно было бы ожидать, обеспечивает терапевтический эффект у больного во время введения больному композиции. Ожидаемое терапевтически эффективное количество обычно составляет 900 мг, 750 мг, 675 мг, 600 мг, 450 мг, 375 мг, 300 мг, 225 мг, 200 мг, 150 мг, 100 мг, 75 мг, 50 мг, 40 мг, 30 мг, 25 мг, 20 мг, 15 мг, 12.5 мг, 10 мг, 7,5 мг, 5 мг, 2 мг, 1 мг, 0,75 мг или 0,1 мг клопидогреля или от 0,1 до 900 мг, от 0,1 до 100 мг, от 100 до 300 мг, около 300 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, от 50 до 600 мг, от 75 до 600 мг, от 150 до 600 мг или от 200 до 450 мг клопидогреля.
Согласно способу больным, отвечающим на лечение, является такой больной, у которого наблюдается >/=15% ингибирование агрегации тромбоцитов, что определяется с помощью ex vivo анализа, после введения ожидаемого терапевтически эффективного количества композиции или состава изобретения. Больным, не отвечающим на лечение (который также известен как больной со слабым ответом на лечение, с гипореактивным ответом на лечение, со средним ответом на лечение, низкоотвечающий или невосприимчивый больной), является такой больной, у которого наблюдается <15% ингибирование агрегации тромбоцитов, что определяется с помощью ех vivo анализа, после введения ожидаемого терапевтически эффективного количества композиции или состава изобретения. Ингибирование агрегации тромбоцитов определяется в виде процентной доли агрегации тромбоцитов, индуцированной 5 мкМ аденозиндифосфатом (АДФ) при проведении ех vivo анализа. Подходящие способы определения того, отвечает или не отвечает больной на лечение, раскрыты Weerakkody и соавт. (J. Cardiovascular Pharmacol. Therap. (2007), 12(3), 205-212), полное раскрытие которого включается настоящим образом по ссылке. Способ изобретения преимущественно проводят за более короткий промежуток времени по сравнению со временем, которое затрачивается в другом схожем способе, в котором клопидогрель вводят в виде твердой таблетки для приема внутрь. Другими словами, парентеральное или пероральное введение больному клопидогреля в композиции или составе изобретения будет способствовать более быстрому появлению терапевтической реакции у больного, отвечающего на лечение, по сравнению с пероральным введением твердой лекарственной формы, например, таблеток PLAVIX®, полученных не в данном изобретении, но содержащих по существу такое же количество клопидогреля.
Это означает, что период времени, за который врач способен определить отвечает ли больной или не отвечает на лечение, будет короче в том случае, когда больному вводят композицию изобретения, по сравнению с тем случаем, когда больному вводят через рот твердую лекарственную форму не из данного изобретения, например, препарат PLAVIX®. Период времени для такого определения согласно изобретению обычно составляет от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после введения композиции.
Стадия определения восприимчивости больного к клопидогрелю может включать: получение образца крови больного и определение степени агрегации тромбоцитов в плазме крови больного. К подходящим методам определения степени агрегации тромбоцитов в плазме крови больного относится, в качестве примера и без ограничений, агрегометрия, например, агрегометрия на основе измерения светопропускания и сопротивления.
Композиция или состав изобретения обеспечивает одно или несколько преимуществ по сравнению с пероральным введением таблеток, содержащих клопидогрель, например, таблеток PLAVIX®. Одним из таких преимуществ является снижения дозировки. Больному, которому перорально или парентерально вводится доза клопидогреля в композиции или составе изобретения, потребуется первое терапевтически эффективное количество с целью получения терапевтической пользы от клопидогреля. Тому же больному, которому перорально вводят дозу клопидогреля в таблеточной лекарственной форме, полученной не по изобретению, потребуется второе терапевтически эффективное количество с целью получения по существу такой же терапевтической пользы от клопидогреля. Для такого больного первое терапевтически эффективное количество может равняться или, как правило, быть меньше второго терапевтически эффективного количества. Соответственно, способ снижения требуемой терапевтической дозы для больного, отвечающего на лечение и нуждающегося в терапии клопидогрелем, включает в себя: парентеральное или пероральное введение больному первого терапевтически эффективного количества клопидогреля в фармацевтической композиции, содержащей САЭ-ЦД, при этом первое терапевтически эффективное количество, по меньшей мере, в 1,1 раза, 1,2 раза, 1,25 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 7 раз, 8 раз, 10 раз, или, по меньшей мере, в 15 раз, 20 раз, от 1,1 до 20 раз, от 1,2 до 15 раз, от 1,25 до 10 раз, от 2 до 10 раз или от 3 до 8 раз меньше второго терапевтически эффективного количества, которое представляет собой количество клопидогреля, требуемое для обеспечения по существу такого же терапевтического эффекта, когда клопидогрель вводят больному через рот в сравнительной твердой фармацевтической композиции, не содержащей САЭ-ЦД.
Парентеральное введение клопидогреля нуждающемуся больному согласно изобретению может обеспечивать альтернативные способы терапии больного, который не отвечает на лечение при пероральном введении клопидогреля. Например, возможно, что у больного, которому перорально вводят таблетку, содержащую клопидогрель (например, таблетку PLAVIX®) не будет проявляться достаточно сильная терапевтическая реакция, чтобы его можно было считать "больным, отвечающим на лечение", как это определено в данном документе. Однако, тот же самый больной может дать ответ на лечение при введении клопидогреля парентерально. В одном клиническом исследовании группе больных вводили клопидогрель (дозой 10-300 мг) через рот, при этом у них не наблюдалась достаточно сильная терапевтическая реакция, чтобы их можно было считать "больными, отвечающими на лечение". Затем тем же самым больным вводили клопидогрель парентерально, после чего у 9-25% больных наблюдалась достаточно сильная терапевтическая реакция, которая позволяет считать их "больными, отвечающими на лечение". Соответственно, изобретение обеспечивает способ преобразования больного, не отвечающего на лечение при пероральном введении клопидогреля, в больного, дающего ответ на лечение, при этом способ включает парентеральное введение клопидогреля нуждающемуся больному, посредством которого у больного проявляется терапевтическая реакция на клопидогрель, при этом терапевтическая реакция достаточна для того, чтобы признать пациента отвечающим на лечение.
Другим таким преимуществом является способность врача оттитровать дозу, вводимую больному, за более короткий период времени по сравнению со временем, которое в настоящее время затрачивается в терапии клопидогрелем для достижения целевого терапевтического эффекта у больного. Композицию или состав изобретения, содержащий определенное количество клопидогреля, вводят больному, и определяют соответсвующий терапевтический эффект, достигаемый у больного за указанный период времени. Этот период времени в том случае, когда клопидогрель вводят парентерально в виде жидкой лекарственной формы, будет короче по сравнению с тем случаем, когда клопидогрель вводят через рот в виде таблеточной лекарственной формы, например, в виде таблетки PLAVIX®. Значимость этого преимущества основывается на общепринятой клинической цели, заключающейся в переводе пациента с ОКС из кабинета неотложной помощи в операционную для начала процедуры ЧВКС в течение 90 минут, в частности, выполняя эту процедуру так, чтобы не мешать при этом проведению АКШ без лечения препаратом PLAVIX® перед коронарографией.
Соответственно, изобретение обеспечивает способ увеличения дозы, вводимой больному для достижения целевого терапевтического эффекта, при этом способ включает в себя: парентеральное введение больному некого количества клопидогреля за период задержки от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90. минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после парентерального введения определение соответствующего терапевтического эффекта, достигаемого у больного; и, если степень терапевтического эффекта, достигаемого у больного, меньше целевого терапевтического эффекта, то повторение стадий парентерального введения и определения до тех пор, пока не будет достигнут целевой терапевтический эффект. Стадии могут повторяться столько раз, сколько это необходимо для достижения целевого терапевтического эффекта. Количество вводимого клопидогреля будет, как правило, составлять от 50 до 600 мг, от 0,1 до 900 мг, от 1 до 900 мг, от 10 до 900 мг, от 0,1 до 100 мг, от 25 до 750 мг, от 50 до 600 мг, от 75 до 600 мг, от 75 до 500 мг, от 100 до 300 мг, от 100 до 400 мг, от 150 до 600 мг или от 200 до 450 мг, от 200 до 400 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, около 0,1 мг, около 0,75 мг, около 1 мг, около 2 мг, около 5 мг, около 7,5 мг, около 10 мг, около 12,5 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 40 мг, около 50 мг, около 75 мг, около 100 мг, около 150 мг, около 200 мг, около 225 мг, около 300 мг, около 375 мг, около 450 мг, около 525 мг, около 600 мг, около 675 мг, около 750 мг, около 900 мг. Период задержки обычно составляет от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут. Клопидогрель может находиться в водной жидкой композиции или составе, содержащем клопидогрель и САЭ-ЦД.
Стадия определения может включать: получение образца плазмы крови больного и определение степени агрегации тромбоцитов в плазме крови больного агрегометрией. Стадия получения может включать: получение образца крови пациента и отделение плазмы от крови для получения образца плазмы, а затем проведение агрегометрии.
Изобретение также обеспечивает способ увеличения дозы, вводимой больному для достижения целевого терапевтического эффекта, при этом способ включает в себя: введение больному через рот некого количества клопидогреля в композиции или составе, содержащем клопидогрель и САЭ-ЦД, за период задержки от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или за период менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут после перорального введения, определение соответствующего терапевтического эффекта, достигаемого у больного; и, если степень терапевтического эффекта, достигаемого у больного, меньше целевого терапевтического эффекта, то повторение стадий перорального введения и определения до тех пор, пока не будет достигнут целевой терапевтический эффект. Стадии могут повторяться столько раз, сколько это необходимо для достижения целевого терапевтического эффекта. Количество вводимого клопидогреля будет, как правило, составлять от 50 до 600 мг, от 0,1 до 900 мг, от 1 до 900 мг, от 10 до 900 мг, от 0,1 до 100 мг, от 25 до 750 мг, от 50 до 600 мг, от 75 до 600 мг, от 75 до 500 мг, от 100 до 300 мг, от 100 до 400 мг, от 150 до 600 мг или от 200 до 450 мг, от 200 до 400 мг, от 300 до 600 мг, от 300 до 900 мг, от 600 до 900 мг, около 0,1 мг, около 0,75 мг, около 1 мг, около 2 мг, около 5 мг, около 7,5 мг, около 10 мг, около 12,5 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 40 мг, около 50 мг, около 75 мг, около 100 мг, около 150 мг, около 200 мг, около 225 мг, около 300 мг, около 375 мг, около 450 мг, около 525 мг, около 600 мг, около 675 мг, около 750 мг, около 900 мг. Период задержки обычно составляет от 10 секунд до 120 минут, от 30 секунд до 120 минут, от 30 секунд до 100 минут, от 30 секунд до 90 минут, от 30 секунд до 60 минут, от 1 минуты до 60 минут, от 1 минуты до 45 минут, от 1 минуты до 30 минут, от 1 минуты до 20 минут или от 1 минуты до 15 минут, от 1 минуты до 90 минут, от 5 минут до 60 минут, от 10 минут до 60 минут, от 5 минут до 45 минут, от 10 минут до 45 минут, от 15 минут до 30 минут, от 5 минут до 30 минут, от 5 минут до 15 минут или от 10 минут до 20 минут, или менее 10 секунд, 1 минуты, 2,5 минут, 5 минут, 7,5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 120 минут, 100 минут, 90 минут, 75 минут, 60 минут, 50 минут, 45 минут или менее 40 минут. Используемый в этом документе термин "около" используется для обозначения +/- 10% отклонения от указанного значения.
Принимая во внимание вышеуказанное описание и нижеследующие примеры, специалист в данной области техники сможет осуществить изобретение на практике в заявленном виде без проведения чрезмерных экспериментов. Вышеизложенное будет лучше понято со ссылкой на следующие примеры, в которых подробно описываются конкретные методики приготовления составов согласно настоящему изобретению. Все ссылки на эти примеры даны только с целью иллюстрации. Не следует рассматривать следующие примеры исчерпывающими, поскольку они являются только иллюстрацией нескольких вариантов осуществления, предполагаемых настоящим изобретением. Пример 1
Растворимость гидросульфата клопидогреля определяют в 20% (по отношению массы к объему) растворе ГП-β-ЦД, СБЭ-γ-ЦД, Captisol® (СБЭ-β-ЦД), СБЭ-α-ЦД, СБЭ-α-ЦД, СБЭ-α-ЦД, СПЭ-α-ЦД, СПЭ-β-ЦД, СПЭ-γ-ЦД, ADVASEP™ (СПЭ-β-ЦД) и α-ЦД со степенью замещения (СЗ) 7,6, 6,1, 6,6, 2,4, 3,9, 5,4, 5, 5,6, 5,4, 5,5 и 0 (незамещенный), соответствено. Определение проводят по методикам, хорошо известным в данной области техники (Higuchi и соавт. in Phase Solubility Techniques, in Advances in Analytical Chemistry and Instrumentation (Ed. CN. Reilly, John Wiley & Sons Inc., Vol.4 (1965), pg. 117-212), релевантное раскрытие которого включено настоящим образом по ссылке). Результаты подробно изложены в следующей таблице.
клопидогреля к циклодекстрину
к циклодекстрину
Пример 2
Готовят водный раствор гидросульфата клопидогреля с рН 5,5. Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (39,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 70 мл фосфата натрия, одноосновного буфера, добавляют 39 г СБЭ-β-ЦД и растворяют перемешиванием при комнатной температуре. К этому раствору добавляют 300 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. рН раствора регулируют по мере необходимости добавлением гидроксида натрия до рН 5,5 и доводят раствор до конечного объема в 100 мл добавлением буфера.
Пример 3
Готовят водный раствор гидросульфата клопидогреля. Состав содержит СБЭ7-β-ЦД [СЗ=6,6] (39% по отношению массы к объему). Методика идентична описанной в примере 2, за исключением того, что вместо 0,2 М фосфата натрия, одноосновного буфера, используют буфер с концентрацией 0,1 М. Конечный рН составляет 5,52. Пример 4
Готовят водный раствор гидросульфата клопидогреля с рН 7,97. Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (39,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 70 мл фосфата натрия, одноосновного/двухосновного буфера, добавляют 39 г СБЭ-β-ЦД и растворяют перемешиванием при комнатной температуре. К этому раствору добавляют 300 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. рН раствора регулируют по мере необходимости добавлением гидроксида натрия до рН 7,97 и доводят раствор до конечного объема в 100 мл добавлением буфера.
Пример 5
Готовят водный раствор гидросульфата клопидогреля. Состав содержит СБЭ-β-ЦД [СЗ=6,6] (39% по отношению массы к объему). Методика идентична описаннной в примере 4 за исключением того, что вместо 0,2 М фосфата натрия, одноосновного/двухосновного буфера используют буфер с концентрацией 0,1 М. Конечный рН составляет 8,03.
Пример 6
Готовят водный раствор гидросульфата клопидогреля с рН 5,50. Состав содержит ГП-β-ЦД [СЗ=4,3] (25,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 70 мл фосфата натрия, одноосновного буфера, добавляют 25 г ГП-β-ЦД и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 300 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. рН раствора регулируют по мере необходимости добавлением гидроксида натрия до рН 5,50 и доводят раствор до конечного объема в 100 мл добавлением буфера.
Пример 7
Готовят водный раствор гидросульфата клопидогреля. Состав содержит ГП-β-ЦД [СЗ=4,3] (25% по отношению массы к объему). Методика идентична описаннной в примере 6 за исключением того, что вместо 0,2 М фосфата натрия, одноосновного буфера используют буфер с концентрацией 0,1 М. Конечный рН составляет 5,52.
Пример 8
Готовят водный раствор гидросульфата клопидогреля при рН~8,0. Состав содержит ГП-β-ЦД [СЗ=4,3] (25,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 70 мл фосфата натрия, одноосновного/двухосновного буфера, добавляют 25 г ГП-β-ЦД и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 300 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. рН раствора регулируют по мере необходимости добавлением гидроксида натрия до рН 7,97 и доводят раствор до конечного объема в 100 мл добавлением буфера.
Пример 9
Готовят водный раствор, содержащий гидросульфат клопидогреля и ГП-β-ЦД [СЗ=4,3] (25% по отношению массы к объему). Методика схожа с описаннной в примере 8 за исключением того, что вместо 0,2 М фосфата натрия, одноосновного/двухосновного буфера, используют буфер с концентрацией 0,1 М. Конечный рН составляет 8,05.
Пример 10
Готовят водный раствор гидросульфата клопидогреля при рН 5,50. Состав содержит Captisol® (СБЭ7-β-ЦД, СЗ=6,6) (37,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 200 мл 0,2 М буфера на основе лимонной кислоты и цитрата натрия добавляют 92,5 г СБЭ-β-ЦД (СЗ=6.6) и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 2,45 г гидросульфата клопидогреля, который растворяется в растворе при перемешивании. Доводят конечный объем прозрачного раствора до 250 мл добавлением буфера и до конечного рН 5,50.
Пример 11
Готовят водный раствор гидросульфата клопидогреля. Состав содержит СБЭ-β-ЦД [СЗ=6,6] (37% по отношению массы к объему). Методика идентична описанной в примере 10 за исключением того, что раствор объемом 2,5 мл помещают в 10 мл стерильные флаконы. Флаконы переносят в лиофильную сушилку, например, на сушильный поднос FTS Systems' Dura Dry, прикрепленный к конденсаторному модулю с микропроцессорным управлением Dura Dry II, и лиофилизируют. Затем лиофилизаты восстанавливают с использованием стерильной воды, получая прозрачные растворы.
Пример 12
Готовят водный раствор гидросульфата клопидогреля при рН~5,50. Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (37,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 200 мл 0,1 М буфера на основе лимонной кислоты и цитрата натрия добавляют 92,5 г СБЭ-β-ЦД и растворяют его перемешиванием при комнатной температуре.
К этому раствору добавляют 2,45 г гидросульфата клопидогреля, который растворяется в растворе при перемешивании. Доводят конечный объем прозрачного раствора до 250 мл добавлением буфера и до конечного рН 5,48.
Пример 13
Готовят водный раствор гидросульфата клопидогреля. Состав содержит СБЭ-β-ЦД (СЗ=6,6) (37% по отношению массы к объему). Методика идентична описанной в примере 12 за исключением того, что раствор лиофилизируют с помощью лиофильной сушки, например, на сушильном подносе FTS Systems' Dura Dry, прикрепленном к конденсаторному модулю с микропроцессорным управлением Dura Dry II. Лиофилизаты восстанавливают с использованием стерильной воды, получая прозрачные растворы.
Пример 14
Готовят водный раствор гидросульфата клопидогреля. Состав содержит Captisol® (СБЭ-β-ЦЦ, СЗ=6.6) в концентрации 20% (по отношению массы к объему), избыток гидросульфата клопидогреля, поверхностно-активное вещество, полисорбат 80 (Tween 80®) и полиэтиленгликоль-15-гидроксистеарат (Solutol®). Образцы поверхностно-активных веществ (Tween 80® и Solutol®) в различных концентрациях без препарата Captisol® (СБЭ-β-ЦД, СЗ=6,6) также составляют при рН около 5,5. Образцы анализируют на содержание клопидогреля после уравновешивания посредством перемешивания при комнатной температуре (20-25°C) в течение, по меньшей мере, 24 часов. Добавленные молярные количества для каждого компонента и конечные количества клопидогреля в растворе указаны в Таблицах 14а, 14b, 14с и 14d.
Пример 15
Готовят подслащенный водный раствор гидросульфата клопидогреля. Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (37,7% по отношению массы к объему), гидросульфат клопидогреля и маннит. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 7 мл стерильной профильтрованной воды добавляют 3,77 г СБЭ-β-ЦД. К этому раствору добавляют 100 мг гидросульфата клопидогреля и 1,00 г маннита и растворяют их при интенсивном перемешивании. Доводят конечный объем раствора до 10 мл. 2 мл раствора помещают в 10 мл стерильный флакон и лиофилизируют с помощью лиофильной сушилки, например, на сушильном подносе FTS Systems' Dura Stop, прикрепленном к конденсаторному модулю с микропроцессорным управлением Dura Dry II. Лиофилизат восстанавливают стерильной профильтрованной водой, получая прозрачный раствор с конечным рН 1,80.
Пример 16
Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (37%), гидросульфат клопидогреля и маннит. Методика схожа с описанной в примере 15 за исключением того, что используют 200 мг гидросульфата клопидогреля (152 мг клопидогреля). Восстановленный лиофилизат представляет собой прозрачный раствор с рН 1,52.
Пример 17
Готовят водный раствор гидросульфата клопидогреля. Состав содержит Captisol® (СБЭ-β-ЦД,СЗ=6,6) (37%), гидросульфат клопидогреля и D-глюкозу. Методика схожа с описанной в примере 15 за исключением того, что вместо маннита используют D-глюкозу, а конечный рН после восстановления составляет 1,81. Восстановленный раствор является прозрачным.
Пример 18
Состав содержит Captisol® (СБЭ-β-ЦД, СЗ=6,6) (37%), гидросульфат клопидогреля и D-глюкозу. Методика схожа с описанной в примере 17 за исключением того, что используют 200 мг гидросульфата клопидогреля (152 мг клопидогреля). Восстановленный лиофилизат представляет собой прозрачный раствор с рН 1,82.
Пример 19
Устойчивость жидких составов клопидогреля определяют после воздействия нагрузки либо нагреванием, либо люминесцентным излучением. Составы содержат гидросульфат клопидогреля и эквимолярные количества различных циклодекстринов или производных циклодекстринов. Все составы содержат гидросульфат клопидогреля в концентрации 3,0 мг/мл (эквивалентной 2,29 мг/мл клопидогреля в виде свободного основания) и циклодекстрин в концентрации 0,18 М. Составы циклодекстрина готовят растворением надлежащего количества циклодекстрина в 70 мл буфера на основе одноосновного/двухосновного фосфата натрия (0,1 М и 0,2 М), добавлением клопидогреля и перемешиванием до тех пор, пока не растворится весь клопидогрель. Доводят конечный объем растворов до 100 мл добавлением фосфатного буфера, а затем пропускают их через фильтр Millex-GV Durapore с размером пор 0,22 микрон. Растворы оценивают как при рН-5,5, так и при рН-8,0 и при двух значениях температуры, 60°C и 40°C. Каждый раствор анализируют на содержание клопидогреля и присутствие деградантов методом ВЭЖХ. 1,5 мл аликвоты каждого раствора помещают в стеклянные флаконы объемом 1 драхм с завинчивающейся крышкой, обтянутой тефлоном, и хранят при воздействии люминесцентного излучения высокой интенсивности (~25 см от ламповой панели Sylvania Cool White мощностью 15 Вт) на протяжении 9 дней. Под конец 9-дневного периода хранения каждый из образцов анализируют методом ВЭЖХ, и рассчитывают количества каждого из основных продуктов разложения в виде процентной доли площади под пиком клопидогреля, проявляемой на хроматограмме. Образцы анализируют с помощью системы ВЭЖХ Perkin-Elmer, используя β-циклодекстриновую колонку размером 200×4,0 мм и подвижную фазу, состоящую на 65% из метанола и на 35% из 0,1% раствора ацетата триэтиламмония с рН 4 и пропускаемую со скоростью 0,7 мл/мин. Детектирование проводят по УФ-поглощения при 230 нм. Время удерживания клопидогреля составляет 18 минут при использовании данной аналитической системы.
Пример 20
Готовят водный раствор гидросульфата клопидогреля. Состав содержит Captisol® (СБЭ-β-ЦД, С3=6,6) (19,0% по отношению массы к объему) и гидросульфат клопидогреля. Используемые количества указаны в следующей таблице.
Для приготовления состава к 30 мл стерильной профильтрованной воды добавляют 9,52 г СБЭ-β-ЦД и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 150,8 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. Доводят конечный объем раствора до 50 мл, а рН устанавливают на уровне 5,47.
Определяют, что плотность раствора составляет 1,011 г/см3. 2,5 мл аликвоты раствора помещают в 10 мл стеклянные флаконы фирмы Schott и высушивают сублимацией. Затем образцы используют для in vivo исследования кровотечения, описанного в примере 21.
Пример 21
Исследования времени кровотечения проводят, используя мышей в качестве модельных животных. Мышам вводят состав, содержащий клопидогрель, либо путем инъекции в хвостовую вену, либо пероральным чреззондовым питанием дозой 0,1 мл на 20 г веса мыши. Это эквивалентно дозе гидросульфата клопидогреля 6,5 мг/кг (что эквивалентно дозе основания клопидогреля 5 мг/кг). В выбранные моменты времени после дозировки проводят калиброванное рассечение (0,3 мм) конца каждой хвостовой части, а затем мышей сразу же подвешивают вертикально, опуская каждый хвост на 2 см в пробирку, содержащую физиологический раствор с температурой 37°C. Затем определяют время, требуемое для остановки кровотечения, начиная с 15 секунды от начала кровотечения. Используютя максимальное время остановки кровотечения в 180 секунд.
Составы из примера 20, содержащие комплекс СБЭ-β-ЦД-клопидогрель, готовят ресуспендированием каждого флакона в 5,1 мл стерильной воды для инъекции (объем рассчитывают, используя плотность раствора и воды), получая в результате растворы, содержащие гидросульфат клопидогреля в концентрации 1,3 мг/мл.
Растворы тщательно встряхивают до тех пор, пока не растворятся все твердые вещества. Этот растворенный состав используют как для внутривенной дозировки, так и для приема внутрь в виде раствора.
Доступный для приобретения лекарственный продукт PLAVIX® доставляют в виде пероральной суспензии в метилцеллюлозе. Растирают одну таблетку и суспендируют ее в 37,5 мл 0,5% (по отношению массы к объему) раствора метилцеллюлозы, получая суспензию, содержащую гидросульфат клопидогреля в концентрации 1,3 мг/мл. Суспензию PLAVIX® вводят через рот. Аспирин в количестве 100 мг/кг используют в качестве положительного контроля. Схема забора проб показана в следующей таблице.
Пример 22
Проводят исследование конкурентного связывания, используя гидросульфат клопидогреля и аспирин (АСК, ацетилсалициловую кислоту). Работу проводят в автотитраторе так, что рН поддерживается на уровне 5,5 с помощью гидроксида натрия. Требуемое количество СБЭ-β-ЦД и аспирина вначале солюбилизируют в воде, профильтрованной через 0,2 мкм фильтр Millipore, а затем переносят в автотитратор. К этому раствору добавляют избыток гидросульфата клопидогреля и дают ему уравновеситься в течение 2 часов при перемешивании и поддержании рН-5,5. Количества СБЭ-β-ЦД и аспирина представлены в следующей таблице.
После уравновешивания из растворов отбирают пробы, и анализируют их на содержание клопидогреля.
Пример 23
Растворение состава на основе СБЭ-β-ЦД-гидросульфата клопидогреля сравнивают с продаваемым составом PLAVIX®. Готовят две формы состава клопидогреля.
В первом составе предварительно образованный комплекс Captisol и гидросульфата клопидогреля получают солюбилизацией СБЭ-β-ЦД (2,5 г) в 100 мл стерильной профильтрованной воды. К полученному раствору добавляют гидросульфат клопидогреля (980 мг). Затем раствор высушивают распылением, используя минираспылительную сушилку Buchi 190.
Второй состав содержит физическую смесь СБЭ-β-ЦД (2,5 г) и гидросульфата клопидогреля (980 мг), при этом два ингредиента взвешивают и тщательно смешивают друг с другом в твердом состоянии непосредственно перед таблетированием. К составам перед таблетированием добавляют стеарат магния в качестве смазывающего материала.
Каждая таблетка содержит стеарат магния (0,5% по отношению массы к объему), СБЭ-β-ЦД (250 мг) и гидросульфат клопидогреля (98 мг, что эквивалентно 75 мг свободного основания клопидогреля). Это количество сопоставимо с продажным препаратом PLAVIX®, который содержит 75 мг свободного основания клопидогреля.
Проводят сравнительный анализ растворения, используя аппарат для растворения Vankel vk7000. Используют способ, в котором применяется лопастная мешалка с частотой вращения 50 об/мин, и температуру среды поддерживают при 37°C. Средой для растворения является буфер на основе лимонной кислоты и динатрийфосфата (1000 мл) с рН~5,4. Каждую таблетку проверяют три раза, а временами отбора проб являются 5, 15, 30, 45 и 60 минут, при этом каждую пробу фильтруют через 35 мкм фильтр. Затем эти пробы анализируют на содержание гидросульфата клопидогреля.
Пример 24
Готовят водный раствор гидросульфата клопидогреля и моногидрата гидрохлорида тирофибана при рН 5,50. Состав содержит Сарtisol® (СБЭ-β-ЦД, СЗ=6,6) (39,0% по отношению массы к объему), гидросульфат клопидогреля и моногидрат гидрохлорида тирофибана. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 7 мл стерильной воды добавляют 3,90 г СБЭ-β-ЦД и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 100 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. Затем в растворе растворяют 0,449 мг моногидрата гидрохлорида тирофибана, доводят рН при необходимости до ~5,5 добавлением гидроксида натрия. Доводят конечный объем раствора до 10,0 мл добавлением стерильной воды.
Пример 25
Готовят водный раствор гидросульфата клопидогреля и эноксапарина натрия тирофибана при рН 5,5. Состав содержит Сарtisоl® (СБЭ-β-ЦД,СЗ=6,6) (39,0% по отношению массы к объему), гидросульфат клопидогреля и эноксапарин натрия. Используемые количества указаны в следующей таблице.
Для приготовления состава используют следующую методику. К 7 мл стерильной воды добавляют 3,90 г СБЭ-β-ЦД и растворяют его перемешиванием при комнатной температуре. К этому раствору добавляют 100 мг гидросульфата клопидогреля, который растворяется в растворе при перемешивании. Затем растворяют 10,5 мг эноксапарина натрия и доводят рН при необходимости до -5,5 добавлением гидроксида натрия или соляной кислоты. Доводят конечный объем раствора до 10,0 мл добавлением стерильной воды.
Пример 26
Отбирают у больного свежий образец цельной крови и измеряют агрегацию тромбоцитов на месте наблюдения с помощью счетчика форменных элементов крови MICROS (ABX Diagnostics) и пластину для испытаний Plateletworks (Helena Laboratories). В счетчике форменных элементов крови используются традиционные принципы электронного подсчета клеток по сопротивлению, в которых сравнительный подсчет тромбоцитов проводят на 1 мл образце свежей цельной крови в пробирке Plateletworks, содержащей K3-EDTA в качестве антикоагулянта. Образец затем пропускают через устройство для подсчета клеток и определяют количество тромбоцитов. Это процесс повторяют со вторым 1 мл образцом свежей цельной крови в пробирке Plateletworks, содержащей как лимонно-кислую соль, так и АДФ (аденозин-5'-дифосфат, агонист) в концентрации 20 мкмоль/л. В присутствии АДФ тромбоциты соединяются и собираются в одно целое. Посольку агрегированные тромбоциты превышают пороговые ограничения на размер тромбоцитов, они уже не могут считаться индивидуальными тромбоцитами. Соотношение количества тромбоцитов между пробирками, содержащими агониста, и сравнение рассчитывают в виде процентной агрегации тромбоцитов.
Пример 27
Проводят открытое клиническое исследование с эскалацией дозировки у здоровых взрослых добровольцев с целью определения эффектов ингибирования агрегации тромбоцитов и фармакокинетики для водного жидкого состава следующим образом. Данные, полученные в исследовании, подробно изложены на фигурах 14-18 и обсуждались выше более подробно.
Цели:
Оценка безопасности и переносимости одиночных восходящих доз РМ 103 (вводимого внутривенно).
Определение дозозависимого эффекта РМ 103 (вводимого внутривенно) на ингибирование АДФ-индуцированной агрегации тромбоцитов.
Измерение концентраций клопидогреля, клопидогрель карбоновой кислоты и клопидогрель тиола в плазме крови.
Модель:
Открытое исследование с повышением доз для шести запланированных однократных внутривенных доз РМ 103, вводимых внутривенно (0,1 мг, 1,0 мг, 10 мг, 30 мг, 100 мг и 300 мг клопидогреля).
Курсы лечения:
Лечение РМ 103 внутривенно (гидросульфат клопидогреля); 0,1, 1,0, 10, 30 мг, 100 мг или 300 мг.
Пациенты:
72 здоровых мужчин или женщин-добровольцев (12 на когорту) возрастом от 18 лет и старше регистрируют по следующим запланированным когортам на основе переносимости больного.
Когорта 1: РМ103 внутривенно, 0,1 мг однократная доза
Когорта 2: РМ103 внутривенно, 1,0 мг однократная доза
Когорта 3: РМ103 внутривенно, 10 мг однократная доза
Когорта 4: РМ103 внутривенно, 100 мг однократная доза
Когорта 5: РМ103 внутривенно, 30 мг однократная доза
Когорта 6: РМ103 внутривенно, 300 мг однократная доза
Критерий включения
Пациентом должен быть здоровый мужчина или женщина в возрасте от 18 лет и старше. Женщина с детородной возможностью должна использовать приемлемую с медицинской точки зрения форму предупреждения беременности на протяжении периода испытания и должна иметь отрицательную сывороточную пробу на наличие беременности при проведении скрининга и регистрации в исследовательском учреждении.
ИМТ (индекс массы тела) должен находиться в диапазоне 18-35 кг/м2, включительно. Способность свободно общаться с исследовательским персоналом. Отсутствие существенного заболевания или отклоненных от нормы данных лабораторного анализа, определяемых по медицинской истории, объективному обследованию и лабораторным оценочным испытаниям, проводимым при посещении с целью осмотра или при поступлении в клинику.
Наличие нормальной электрокардиограммы с 12 отведениями без каких-либо клинически значимых патологий частоты пульса, ритмичности или проведения. Пациенты должны быть некурящими, это означает что они не курили на протяжении последних 6 месяцев перед дозировкой.
Адекватное информирование о характере и рисках исследования и обеспечение письменного информированного согласия перед принятием исследуемого препарата. Наличие нормального количества тромбоцитов на уровне ≥125000/мкл.
Процедуры
Предварительный скрининг препарата PLAVIX®:
Больным, которые удачно удовлетворяют критерию скрининга, составляют график осмотра с целью проверки эффективности дозы клопидогреля. Больной принмает через рот одиночную дозу PLAVIX® (300 мг), после чего проводится наблюдение за безопасностью и переносимостью и оценивание влияния введенной предварительной дозы на агрегацию тромбоцитов в начальный момент и через два часа после дозировки.
Основное исследование:
Когорты 1, 2, 3, 4 и 6 включают две фазы. Фаза 1 состоит из двух больных.
Фаза 2 дозируется не позже, чем через 24 часа после дозировки Фазы 1 (при условии, что не затрагивается фактор безопасности), и состоит из 10 больных. Для обеих фаз процедуры исследования одинаковы. Когорта 5 состоит из 12 больных, которым проводят дозировку в один и тот же день. Для данного исследования процедуры проводят следующим образом:
После минимального постскринингового периода вымывания в 14 дней (не включающего использование аспирина, других нестероидных противовоспалительных средств или других лекарств, которые, как известно, влияют на функцию тромбоцитов) каждого пригодного больного возвращают в клинику вечером 1 дня, В 1 день больные будут принимать РМ 103 внутривенно.
Приблизительно через 1 час после дозировки в область спереди от локтевого сустава (верхняя конечность №1) помещают внутривенный канал, используемый для дозирования. Для доз 0,1 мг (когорта 1), 1,0 мг (когорта 2), 10 мг (когорта 3) и 30 мг (когорта 5), в начальный момент времени к внутривенному каналу прикрепляют шприц, содержащий РМ103 (внутривенный) и вводят исследуемый состав в виде инъекции с проталкиванием шарика (внутривенное проталкивание). В случае 100 мг дозы (когорта 4), в начальный момент времени к внутривенному каналу прикрепляют стеклянный бутыль, содержащий 100 мг РМ103 (внутривенный) в 40 мл, и вводят исследуемый состав вливанием на протяжении 4 минут. В случае 300 мг дозы (когорта 6), в начальный момент времени к внутривенному каналу прикрепляют стеклянный бутыль, содержащий 300 мг РМ103 (внутривенный) в 120 мл, и вводят исследуемый состав вливанием на протяжении 8 минут. Сразу после завершения введения исследуемого лекарства внутривенный канал промывают 3 мл физиологического раствора и оставляют в плече, удаляя его через 1 час после начала дозировки. Больных выписывают из клиники на второй день после отбора 24-часовой пробы крови. Больные возвращаются в клинику приблизительно через 36 часов после дозировки (на второй день) для установления неблагоприятных явлений.
Дозирование когорты 1 (0,1 мг), когорты 2 (1,0 мг) и когорты 3 (10 мг) отодвигают, по меньшей мере, на 7 дней, чтобы обеспечить безопасность и эффективность оценок до приступления к следующему уровню дозировок. Когорту 4 (100 мг) дозируют, по меньшей мере, через 14 дней после дозирования когорты 3. Когорту 5 (100 мг) дозируют, по меньшей мере, через 7 дней после дозирования когорты 4. Когорту 6 (100 мг) дозируют, по меньшей мере, через 7 дней после дозирования когорты 5.
Фармакокинетика:
Образцы плазмы для определения концентраций клопидогреля, клопидогрель карбоновой кислоты и клопидогрель тиола отбирают из плеча №2 (не используемого для дозировки) в начальный момент (перед дозировкой), через 1, 1, 5, 10, 20 и 30 минут, а также через 1, 2, 3, 4, 6, 8, 12 и 24 часа после начала дозировки.
Фармакокинетические параметры рассчитывают для клопидогреля, клопидогрель карбоновой кислоты и клопидогрель тиола по стандартным методам без компартментализации. Расчеты проводят с помощью программы WinNonlin (версия 5.0.1). Предполагается, что стандартными параметрами являются Смакс., Тмакс. и площадь под кривой зависимости от времени. Параметры λz, T1/2 и площадь под кривой рассчитывают в тех случаях, когда имеются достаточные данные в концевой части кривой зависимости концентрации от времени.
Фармакодинамика:
Образцы плазмы для определения АД-индуцированной агрегации тромбоцитов с помощью импедансного метода (см. выше Dyszkiewicz-Korpanty и соавт.) отбирают из плеча №2 (не используемого для дозировки) в начальный момент (регистрация, 1 день), через 15 и 30 минут, а также через 2, 5 и 24 часа после начала дозировки.
Статистический анализ:
Все фармакокинетически результаты собирают по группам лечения, используя надлежащую описательную статистику. Пропорциональность доз оценивают по средней площади под кривой, площади под кривой зависимости от времени и Смакс. в зависимости от дозы.
Результаты оценки ингибирования АДФ-индуцированной агрегации тромбоцитов по импедансному методу собирают по группам лечения и моментам времени. Максимальное % ингибирование агрегации тромбоцитов и площаль под кривой % ингибирования агрегации тромбоцитов рассчитывают для каждого индивидуума и обобщают по группам лечения.
Оценки безопасности:
Все параметры безопасности (включая неблагоприятные явления, измерения основных показателей состояния организма, данные клинического лабораторного анализа, электрокардиограммы и другие параметры безопасности) сведены в список для каждого больного и области. Частоты всех неблагоприятных явлений (НЯ), неблагоприятных явлений, появившихся за время лечения и связанных с лечением, сведены в таблицу согласно медицинскому словарю регулирующей деятельности MedDRA™ по термину предпочтительного употребления, по классу системы органов и по группам лечения. Все данные лабораторного анализа, измерения основных показателей состояния организма и другие параметры безопасности собирают, используя надлежащую описательную статистику. Случаи отклонения лабораторных показателей от нормы, появившиеся за время лечения, собраны и внесены в список посредством лабораторного испытания. Проверка гипотезы не проводилась. Все цитированные здесь документы включаются по ссылке.
Все вышеизложенное представляет собой подробное описание отдельных вариантов осуществления изобретения. Надо принять во внимание, что хотя в данном документе с целью иллюстрации изобретения были описаны его особые варианты осуществления, могут быть проведены различные модификации без отклонения от сути и объема изобретения. Соответственно, изобретение не ограничивается ими, кроме как прилагаемой формулой изобретения. Все раскрытые и заявленные в этом документе варианты осуществления могут быть выполнены и реализованы без чрезмерного проведения экспериментов при принятии во внимание настоящего раскрытия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТВЕРДЫЕ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ФИЗИЧЕСКУЮ СМЕСЬ СУЛЬФОАЛКИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА И ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 1998 |
|
RU2173172C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ И ЛИПИДРЕГУЛИРУЮЩЕЙ АКТИВНОСТЯМИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2461379C2 |
| КОМПОЗИЦИИ АЛКИЛИРОВАННОГО ЦИКЛОДЕКСТРИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2831736C1 |
| НОВЫЕ СОЕДИНЕНИЯ ДЕЙСТВУЮЩИХ НАЧАЛ, СОДЕРЖАЩИХ КЛОПИДОГРЕЛ, И АНТИТРОМБИЧЕСКОЕ СРЕДСТВО | 1997 |
|
RU2184547C2 |
| ПРОИЗВОДНОЕ СЛОЖНОГО ЭФИРА ТИЕНОПИРИДИНА, СОДЕРЖАЩЕЕ ЦИАНОГРУППУ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЕГО ПРИМЕНЕНИЕ И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2526624C2 |
| КРИСТАЛЛИЧЕСКИЙ КЛОПИДОГРЕЛЬ НАФТАЛИНСУЛЬФОНАТ ИЛИ ЕГО ГИДРАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2328501C1 |
| КОМПОЗИЦИИ НА ОСНОВЕ ЦИКЛОДЕКСТРИНА И ПРОИЗВОДНОГО БУДЕСОНИДА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2722414C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СЕДАТИВНЫМ, АНКСИОЛИТИЧЕСКИМ И НООТРОПНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2405551C1 |
| АНТИТРОМБОТИЧЕСКИЕ СОЕДИНЕНИЯ | 2012 |
|
RU2604733C2 |
| ФАКТОР ФОН ВИЛЛЕБРАНДА ИЛИ ФАКТОР VIII И ФАКТОР ФОН ВИЛЛЕБРАНДА ДЛЯ ЛЕЧЕНИЯ КОАГУЛОПАТИИ, ИНДУЦИРОВАННОЙ ИНГИБИТОРАМИ ТРОМБОЦИТОВ | 2009 |
|
RU2563236C2 |

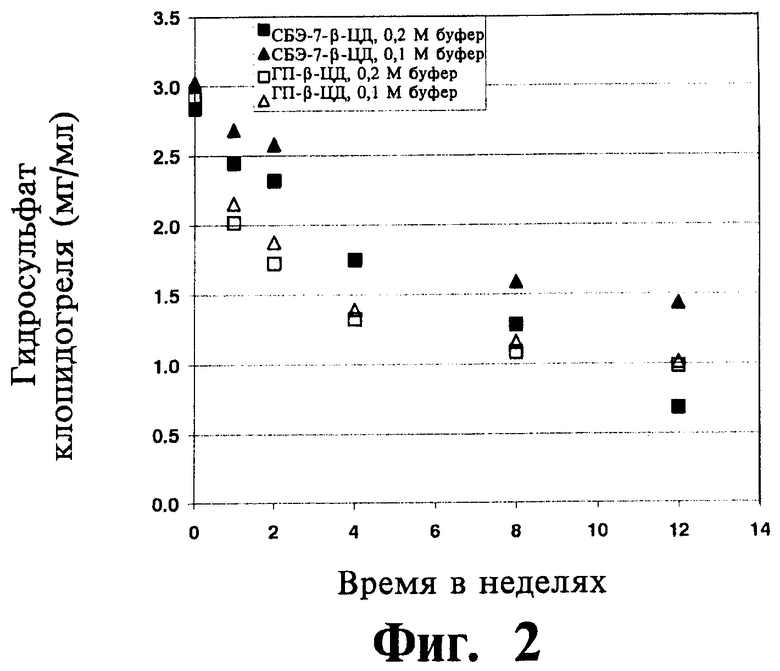
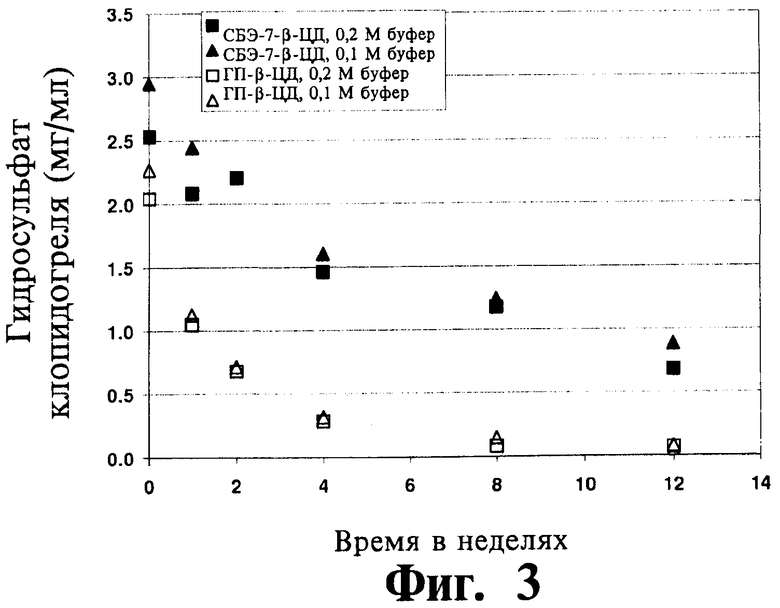
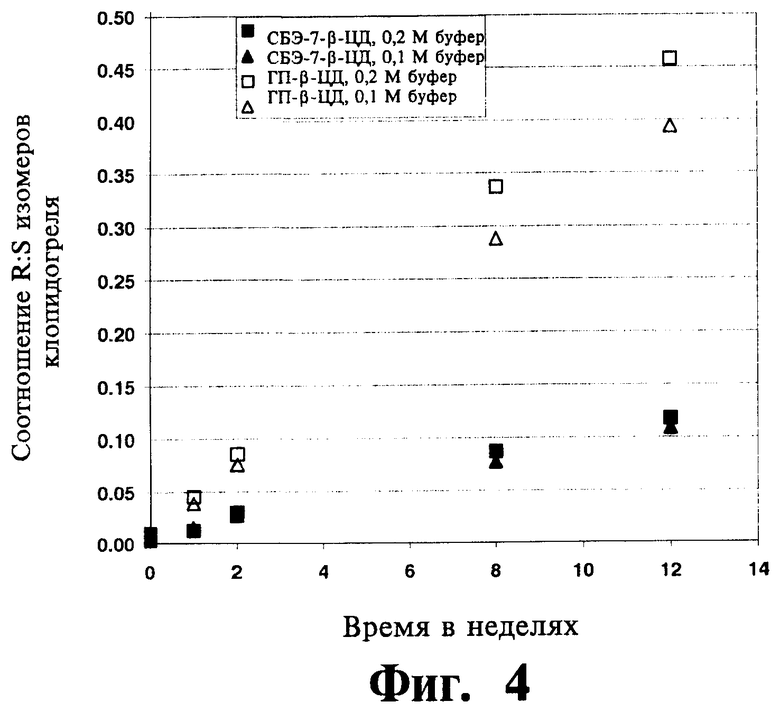
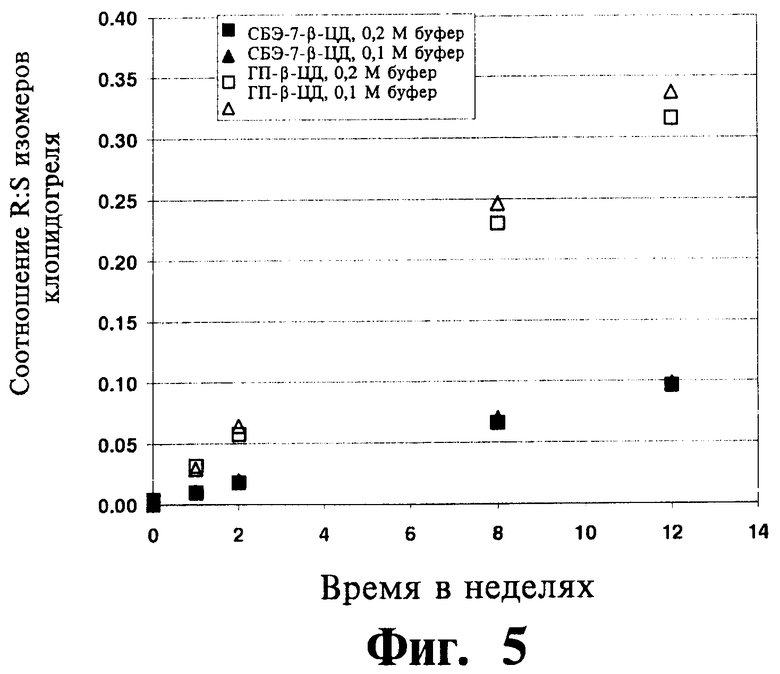
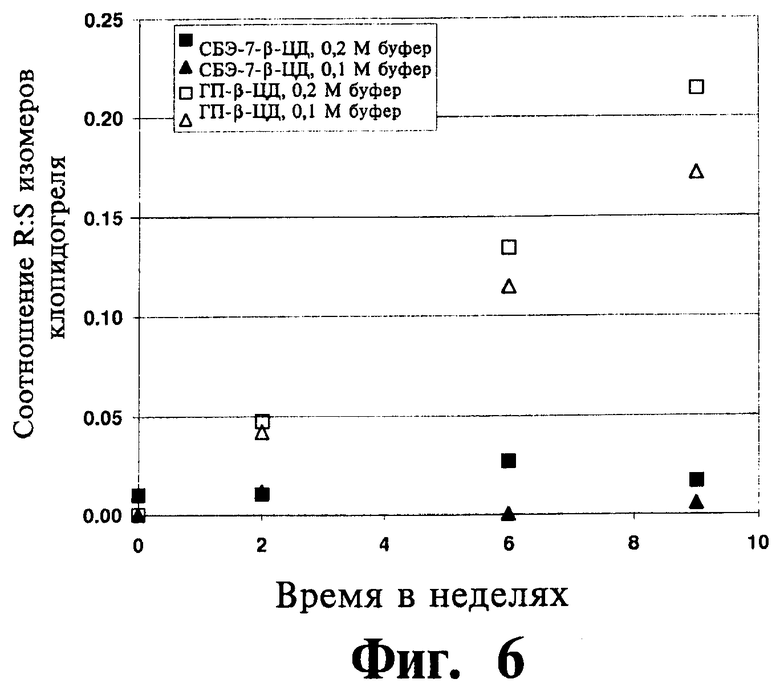
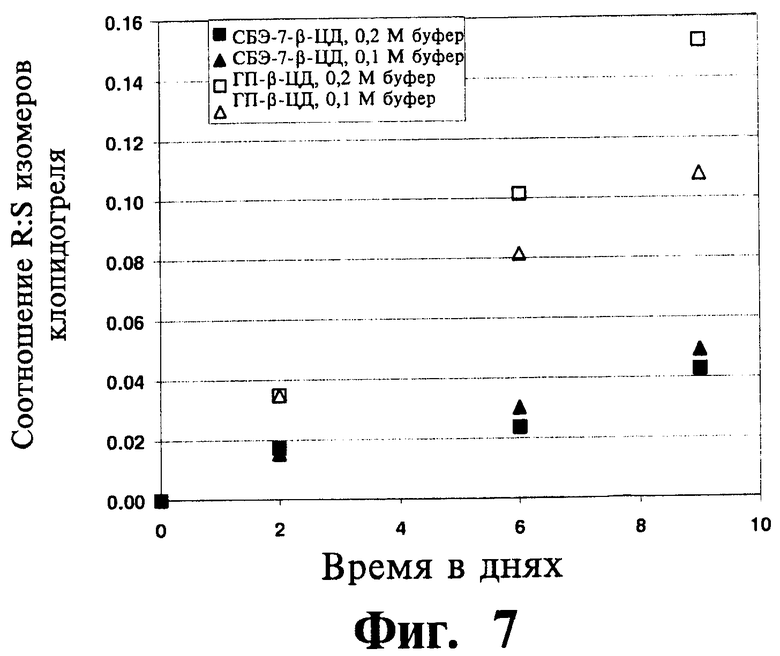
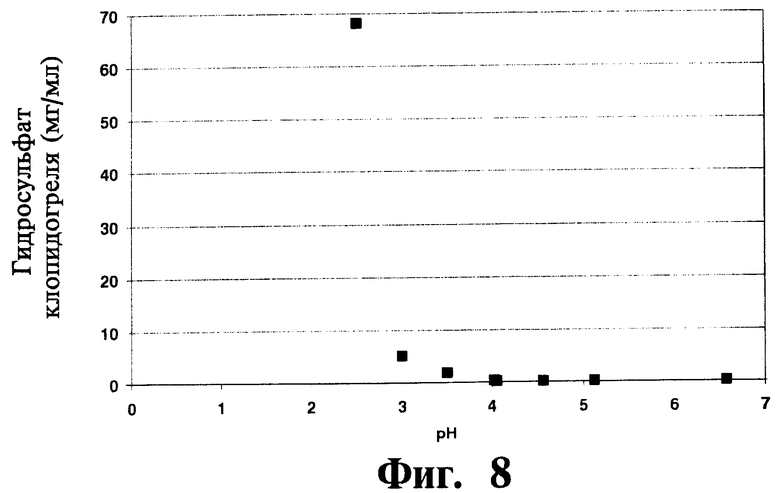
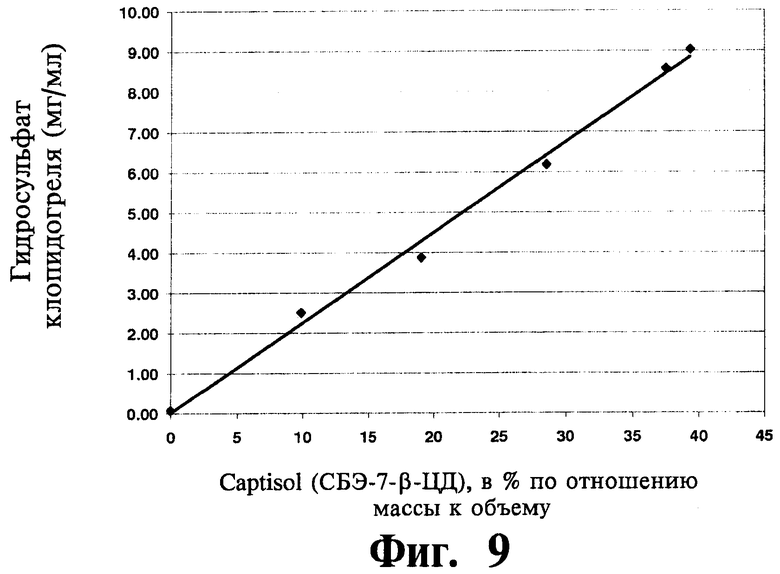
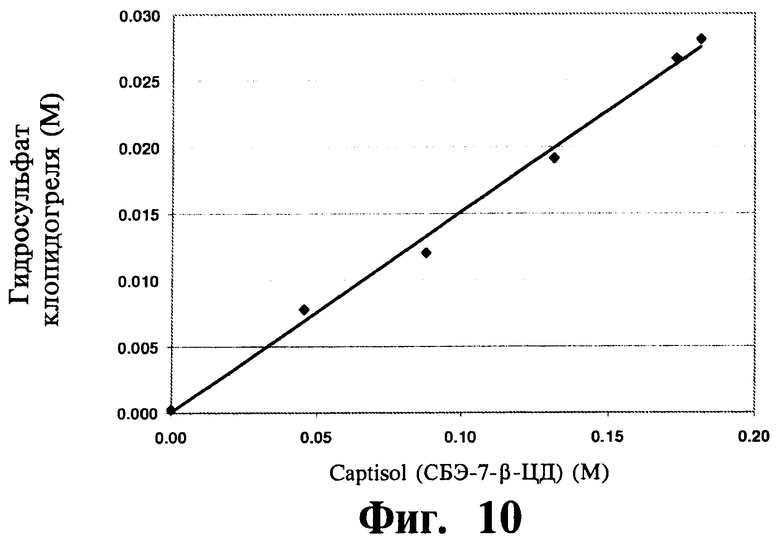
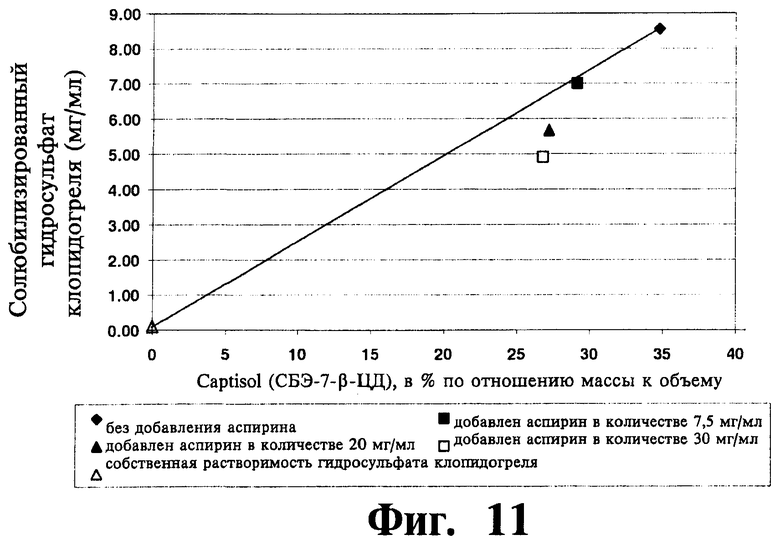
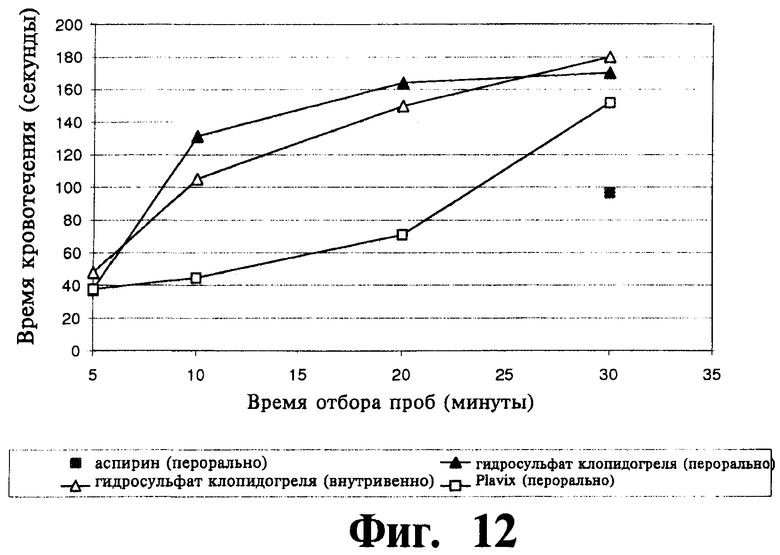


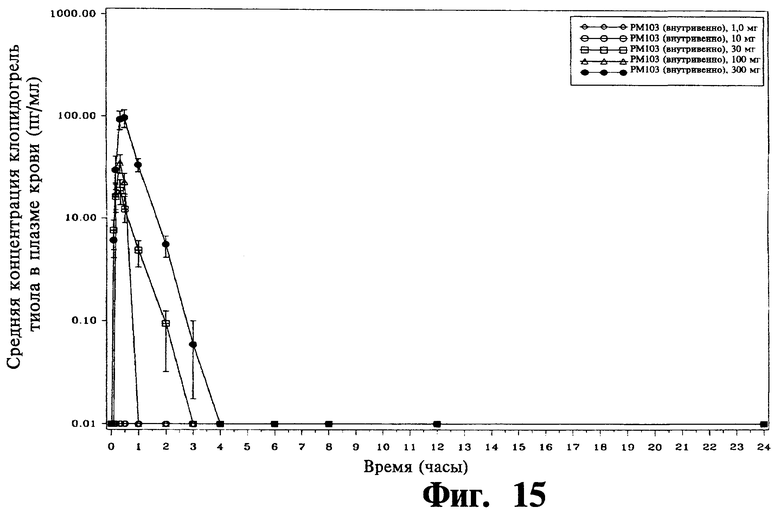
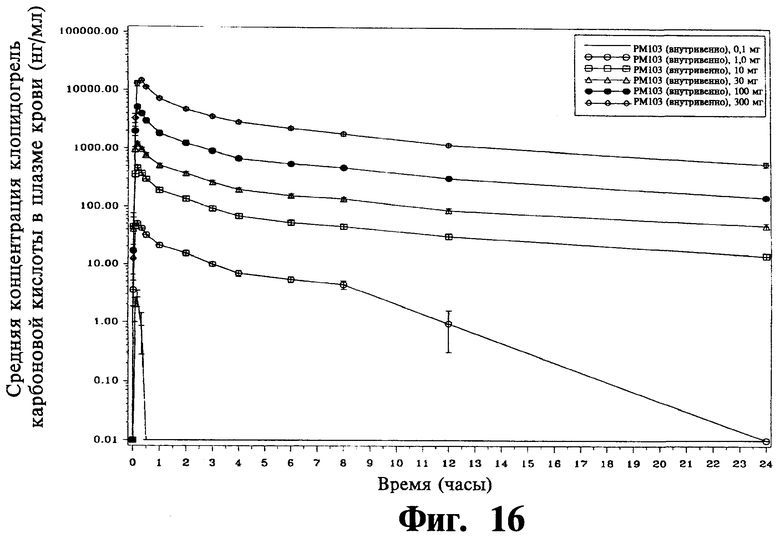
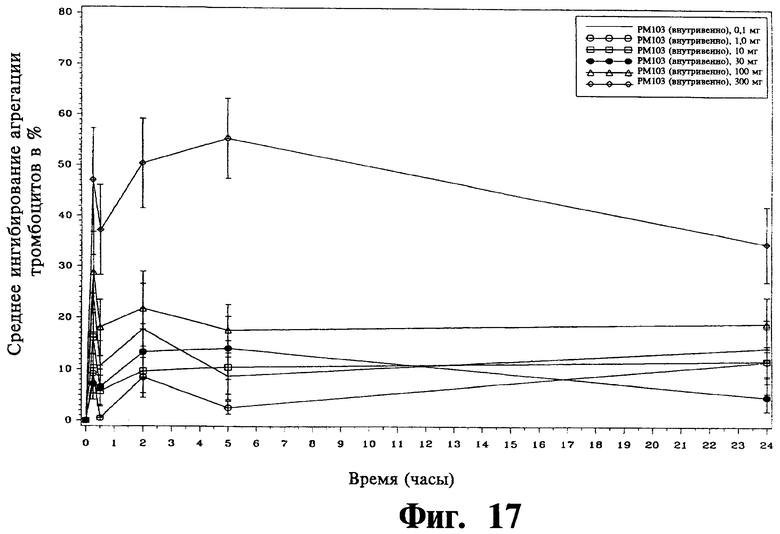
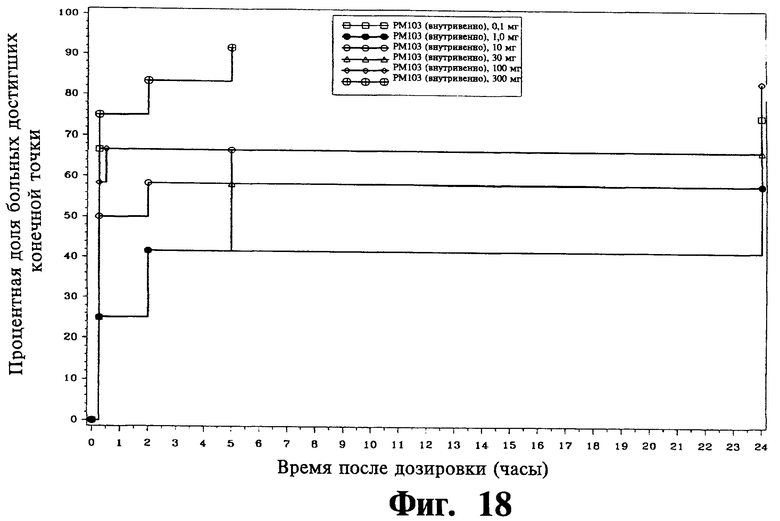
Настоящее изобретение обеспечивает композиции, содержащие клопидогрель и сульфоалкиловый эфир циклодекстрина (САЭ-ЦД), предпочтительно сульфобутиловый эфир циклодекстрина. Композиции могут быть жидкими, суспензионными или твердыми. Композиции предназначены для приема внутрь, перорального или парентерального введения. САЭ-ЦД выполняет роль средства, способствующего растворению и стабилизации клопидогреля в водных средах. Повышается устойчивость клопидогреля к гидролитическому, термическому и фотолитическому разрушению. САЭ-ЦД дает улучшенные результаты по сравнению с другими производными циклодекстрина. Композиции по изобретению снижают скорость хиральной инверсии (S)-клопидогреля в (R)-клопидогрель. Они дают существенные фармакокинетические, фармакодинамические и/или терапевтические преимущества по сравнению с таблеточной композицией, вводимой перорально и не содержащей САЭ-ЦД. 9 н. и 49 з.п. ф-лы, 18 ил., 14 табл., 27 пр.
1. Композиция, состоящая из клопидогреля и сульфоалкилового эфира циклодекстрина (САЭ-ЦД).
2. Композиция по п.1, которая дополнительно содержит подкислитель, подщелачивающий агент, водный носитель, противогрибковое средство, противомикробное средство, антиоксидант, второе терапевтическое средство, буферное вещество, наполнитель, средство для усиления комплексообразования, криозащитное вещество, модификатор плотности, электролит, вкусовую добавку, душистое вещество, лиофилизирующую добавку, предохраняющее средство, пластификатор, средство, повышающее растворимость, стабилизатор, подсластитель, модификатор поверхностного натяжения, модификатор летучести, модификатор вязкости или их комбинации.
3. Композиция по п.1, которая дополнительно содержит второе терапевтическое средство, выбранное из группы, состоящей из нестероидного противовоспалительного лекарства, антикоагулянта, селективного ингибитора фактора Ха, прямого ингибитора тромбина, ингибитора агрегации тромбоцитов, ингибитора гликопротеина IIb/IIIа, средства против серповидно-клеточной анемии, средства для обильного кровотечения, тромболитического средства, тромболитического фермента, тканевого активатора плазминогена.
4. Композиция по п.2, в которой буферное вещество выбрано из группы, состоящей из уксусной кислоты, лимонной кислоты, винной кислоты, фосфорной кислоты, борной кислоты и их солей.
5. Композиция по п.2, которая дополнительно содержит ингредиент, выбранный из группы, состоящей из поверхностно-активного вещества, совместного растворителя, полимера, масла, сахара и их комбинаций.
6. Композиция по п.1, которая предназначена для перорального, энтерального или парентерального введения.
7. Композиция по любому из пп.1-6, которая дополнительно содержит жидкий носитель, а клопидогрель присутствует в концентрации 0,15-20 мг/мл в пересчете на свободное основание клопидогреля.
8. Композиция по любому из пп.1-6, которая дополнительно содержит жидкий носитель, а САЭ-ЦД присутствует в концентрации 20-600 мг/мл.
9. Композиция по любому из пп.1-6, которая является жидкой и приготовлена восстановлением воссоздаваемого твердого вещества, содержащего по меньшей мере САЭ-ЦД и клопидогрель в водном растворе.
10. Композиция по любому из пп.1-6, которая дополнительно содержит жидкий носитель, готова к применению и не требует разбавления перед введением больному.
11. Композиция по любому из пп.1-6, которая дополнительно содержит жидкий носитель и разводится водным разбавителем без существенного осаждения клопидогреля.
12. Композиция по любому из пп.1-6, которая дополнительно содержит водный жидкий носитель, рН композиции составляет по меньшей мере 3,5, а молярное отношение САЭ-ЦД к клопидогрелю составляет от 6:1 до 40:1.
13. Композиция по любому из пп.1-6, которая дополнительно содержит водный жидкий носитель, а рН составляет по меньшей мере 5.
14. Композиция по любому из пп.1-6, которая дополнительно содержит водный жидкий носитель, а рН составляет от 5,5 до 8.
15. Композиция по п.1, в которой сульфоалкиловый эфир циклодекстрина представляет собой сульфобутиловый эфир циклодекстрина.
16. Композиция по п.1, в которой молярное соотношение сульфоалкилового эфира циклодекстрина и клопидогреля составляет по меньшей мере 6:1.
17. Композиция по п.1, в которой молярное соотношение сульфоалкилового эфира циклодекстрина и клопидогреля составляет от 6:1 до 40:1.
18. Композиция по п.1, которая обладает рН по меньшей мере 3,5, а молярное соотношение сульфоалкилового эфира циклодекстрина и клопидогреля составляет по меньшей мере 6:1.
19. Композиция по п.1, которая обладает рН по меньшей мере 5,5, а молярное соотношение сульфоалкилового эфира циклодекстрина и клопидогреля составляет по меньшей мере 6,5:1.
20. Композиция по п.1, которая обладает рН от 5,5 до 8, а молярное соотношение сульфоалкилового эфира циклодекстрина и клопидогреля составляет по меньшей мере 6,5:1.
21. Композиция по п.1, которая обладает рН от 4 до 8.
22. Композиция по п.1, которая обладает рН от 4 до 6.
23. Композиция по любому из пп.1-6, в которой молярное отношение САЭ-ЦД к клопидогрелю составляет от 6,5:1 до 12,5:1.
24. Композиция по любому из пп.1-6, которая дополнительно содержит водный жидкий носитель, рН композиции составляет от 5,5 до 8, а молярное отношение САЭ-ЦД к клопидогрелю составляет от 6,5:1 до 12,5:1.
25. Композиция по п.1, которая дополнительно содержит водный жидкий носитель.
26. Композиция по п.1, которая дополнительно содержит водный жидкий носитель, причем сульфоалкиловый эфир циклодекстрина присутствует в концентрации 20-600 мг/мл, а клопидогрель в концентрации 0,15-20 мг/мл в пересчете на свободное основание клопидогреля.
27. Композиция по п.1, которая дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель.
28. Композиция по любому из пп.1-6, которая дополнительно содержит второе терапевтическое средство, выбранное из группы, состоящей из: лекарства, которое представляет собой аналог или производное клопидогреля, аналог тиенопиридина, аспирин, варфарин, нефракционированный гепарин, низкомолекулярный гепарин, синтетический пентасахарид, гирудин, аргатробан, ибупрофен, напроксен, сулиндак, индометацин, мефенамат, дроксикам, диклофенак, сульфинпиразон, пироксикам, тиклопидин, тирофибан, эптифитабид, абциксимаб, мелагатран, дисульфатогирудин, тканевый активатор плазминогена, модифицированный тканевый активатор плазминогена, анистреплазу, урокиназу, цилостазол, дипирдамол и стрептокиназу или второе терапевтическое средство, выбранное из группы, состоящей из ацетаминофена, аскорбиновой кислоты, аспирина, азитромицина, буметанида, цефотаксина, цефтриаксона, цефалоспоринов, клиндамицина, кодеина, деферасирокса, дефероксимина, диклофенака, диэтилстильбэстрола, дильтиазема, эпинефрина, эритромицина, этилефрина, этодолака, фенопрофена, фентанила, флутамида, фолиевой кислоты, фуросемида, аналога гонадолиберина, гидралазина, гидрокодона, гидроморфина, гидроксимочевины, памоата гидрозина, ибупрофена, индометацина, кетопрофена, кеторолака, лоразепама, мелоксикама, меперидина, метадона, мидазолама, морфина, набуметона, напроксена, оксапроизна, оксикодона, производного пенициллина, пенициллинов, пентоксифиллина, фенилэфрина, фенилпропаноламина, пропоксифена, псевдоэфедрина, ремифентанила, сулиндака, тербуталина, толметина, торсемида и ванкомицина.
29. Композиция по п.1, в которой клопидогрель проявляет повышенную устойчивость в присутствии САЭ-ЦД по сравнению с клопидогрелем в присутствии эквимолярного количества гидроксипропилциклодекстрина (ГП-ЦД).
30. Композиция по п.29, в которой клопидогрель подвергается хиральной инверсии в присутствии САЭ-ЦД со скоростью, которая снижается по сравнению со скоростью хиральной инверсии клопидогреля в присутствии эквимолярного количества гидроксипропилциклодекстрина (ГП-ЦД).
31. Композиция по п.29, в которой клопидогрель подвергается разложению в присутствии САЭ-ЦД со скоростью, которая снижена по сравнению со скоростью разложения клопидогреля в присутствии эквимолярного количества гидроксипропилциклодекстрина (ГП-ЦД).
32. Композиция по п.1, в которой САЭ-ЦД - это соединение, или смесь соединений, с формулой 1:
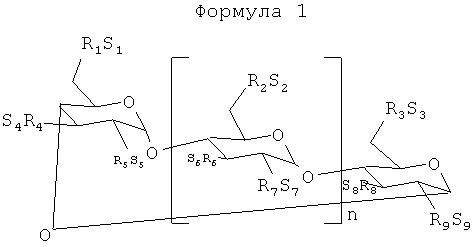
где n равняется 4, 5 или 6;
каждая из групп R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляет собой -О- или -O-(С2-С6-алкилен)-SO3 - группу, в которой по меньшей мере одна из групп R1-R9 независимо представляет собой -O-(С2-С6-алкилен)-SO3 - группу;
а каждая из групп S1, S2, S3, S4, S5, S6, S7, S8 и S9 независимо друг от друга представляет собой фармацевтически приемлемый катион.
33. Композиция по п.32, в которой каждая из групп S1, S2, S3, S4, S5, S6, S7, S8 и S9 независимо друг от друга представляет собой Н+, катион щелочного металла, катион щелочноземельного металла, ион аммония или аминокатион.
34. Композиция по п.32, в которой САЭ-ЦД выбрано из группы, включающей сульфометиловый эфир, сульфоэтиловый эфир, сульфопропиловый эфир, сульфобутиловый эфир (СБЭ), сульфопентиловый эфир и сульфогексиловый эфир.
35. Композиция по п.32, в которой САЭ-ЦД - это соединение, или смесь соединений, с формулой САЭх-R-ЦД (формула 2), в которой САЭ выбран из группы, состоящей из сульфометилового эфира, сульфоэтилового эфира, сульфопропилового эфира, сульфобутилового эфира, сульфопентилового эфира и сульфогексилового эфира, а х составляет 1-18, 1-21 или 1-24, когда R - это α, β или γ соответственно.
36. Композиция по п.35, в которой х составляет от 4 до 7.
37. Композиция по п.35, в которой САЭ-ЦД - это СБЭх-β-ЦД.
38. Композиция по п.35, в которой х составляет от 6,0 до 7,1.
39. Композиция по п.35, в которой САЭ-ЦД - это СБЭх-β-ЦД, в которой х составляет от 6,0 до 7,1.
40. Композиция по любому из пп.1-6, в которой САЭ-ЦД - это СБЭ-ЦД, которая дополнительно содержит жидкий носитель, а рН составляет от приблизительно 5,5 до приблизительно 8.
41. Композиция по любому из пп.1-6, в которой САЭ-ЦД - это СБЭ-ЦД, и молярное отношение СБЭ-ЦД к клопидогрелю составляет от 6,5:1 до 12,5:1.
42. Композиция по любому из пп.1-6, в которой САЭ-ЦД - это СБЭ-ЦД, которая дополнительно содержит жидкий носитель, а рН составляет от приблизительно 5,5 до приблизительно 8, и молярное отношение СБЭ-ЦД к клопидогрелю составляет от 6,5:1 до 12,5:1.
43. Способ лечения заболевания, расстройства и состояния с этиологией, связанной с агрегацией тромбоцитов у пациента, или заболевания, расстройства и состояния, которое терапевтически восприимчиво к клопидогрелю у пациента, включающий введение пациенту композиции по любому из пп.1-42.
44. Способ по п.43, в котором заболевание, расстройство или состояние выбрано из группы, состоящей из инфаркта миокарда, инсульта, отмирания сосудов у пациентов с установленной болезнью периферических артерий (БПА), вторичных ишемических исходов, острого коронарного синдрома (нестабильной стенокардии или Q-необразующего ИМ), преходящего ишемического нарушения (ПИН), цереброваскулярной болезни, сердечно-сосудистого заболевания, грудной жабы, тромбоза глубоких вен (ТГВ), легочной эмболии (ЛЭ), серповидно-клеточной анемии и аритмии сердца.
45. Способ по п.44, в котором осуществляют резкое введение нуждающемуся больному указанной композиции, содержащей сульфоалкиловый эфир циклодекстрина (САЭ-ЦД) и клопидогрель в количестве, достаточном для обеспечения целевого терапевтического эффекта у больного за период менее 120 мин.
46. Способ уменьшения времени начала лечения клопидогрелем после его введения, включающий пероральное или парентеральное введение нуждающемуся больному композиции по любому из пп.1-42, в котором время начала лечения клопидогрелем, обеспеченного композицией, меньше времени начала лечения клопидогрелем, обеспеченного сравнительной пероральной композицией, не содержащей САЭ-ЦД и содержащей эквивалентную дозу клопидогреля.
47. Способ по п.46, в котором время начала лечения снижается на 10-1000%.
48. Способ увеличения времени кровотечения у больного, включающий введение нуждающемуся больному композиции по любому из пп.1-42, содержащей клопидогрель в количестве 900 мг в пересчете на свободное основание клопидогреля, и в которой САЭ-ЦД и клопидогрель находятся в молярном соотношении от 6:1 до 500:1.
49. Способ по п.48, в котором время кровотечения увеличивается по меньшей мере на 10% за период, составляющий не более 120 мин после введения композиции.
50. Способ уменьшения степени или возможности агрегации тромбоцитов в крови нуждающегося больного, при этом способ включает введение больному композиции по любому из пп.1-42, содержащей клопидогрель в количестве 900 мг в пересчете на свободное основание клопидогреля.
51. Способ по п.50, в котором процентная доля агрегации тромбоцитов у больного уменьшается по меньшей мере на 5% за период, составляющий не более 120 мин после введения композиции.
52. Способ снижения требуемой терапевтической дозы у больного, отвечающего на лечение и нуждающегося в клопидогреле для достижения терапевтического эффекта, включающий парентеральное и пероральное введение больному первого терапевтически эффективного количества клопидогреля в фармацевтической композиции, содержащей САЭ-ЦД и клопидогрель, при этом первая терапевтически эффективная доза по меньшей мере в 1,25 раз меньше второй терапевтически эффективной дозы клопидогреля, которая требуется для обеспечения, по существу, такого же целевого терапевтического эффекта и которая вводится парентерально или орально в композиции, не содержащей САЭ-ЦД.
53. Способ превращения неотвечающего на лечение пациента, которому перорально вводят клопидогрель, в пациента, отвечающего на лечение, включающий парентеральное введение клопидогреля неотвечающему на лечение больному, композиции по любому из пп.1-42, посредством которого у больного вызывается терапевтическая реакция на клопидогрель.
54. Способ лечения заболевания, состояния или расстройства, который включает в себя введение нуждающемуся больному терапевтически эффективного количества клопидогреля в композиции по п.1 и терапевтически эффективного количества второго терапевтического средства.
55. Способ по п.54, в котором заболеванием является серповидно-клеточная анемия.
56. Способ по п.54, в котором второе терапевтическое средство выбрано из группы, состоящей из лекарств, включенных в способы лечения больных, испытывающих боль от серповидно-клеточной анемии, острого синдрома лихорадочного заболевания в области грудной клетки, острой селезеночной секвестрации, апластической анемии, приапизма, острого инсульта или неврологических нарушений; добавки фолиевой кислоты; гидроксимочевины; НПВС; антибиотика; железохелатирующего средства; бронхорасширителя; мочегонного средства; транквилизатора; α-агониста; гидралазина; пентоксифиллина; дилтиазема; аналога гонадотропин-рилизинг гормона (гонадолиберина); диэтилстильбэстрола и их комбинаций.
57. Способ по п.54, в котором второе терапевтическое средство выбрано из группы, состоящей из: лекарства, которое представляет собой аналог или производное клопидогреля, аналог тиенопиридина, аспирин, варфарин, нефракционированный гепарин, низкомолекулярный гепарин, синтетический пентасахарид, гирудин, аргатробан, ибупрофен, напроксен, сулиндак, индометацин, мефенамат, дроксикам, диклофенак, сульфинпиразон, пироксикам, тиклопидин, тирофибан, эптифитабид, абциксимаб, мелагатран, дисульфатогирудин, тканевый активатор плазминогена, модифицированный тканевый активатор плазминогена, анистреплазу, урокиназу, цилостазол, дипирдамол и стрептокиназу, или в котором второе терапевтическое средство выбрано из группы, состоящей из ацетаминофена, аскорбиновой кислоты, аспирина, азитромицина, буметанида, цефотаксина, цефтриаксона, цефалоспоринов, клиндамицина, кодеина, деферасирокса, дефероксимина, диклофенака, диэтилстильбэстрола, дильтиазема, эпинефрина, эритромицина, этилефрина, этодолака, фенопрофена, фентанила, флутамида, фолиевой кислоты, фуросемида, аналога гонадолиберина, гидралазина, гидрокодона, гидроморфина, гидроксимочевины, памоата гидрозина, ибупрофена, индометацина, кетопрофена, кеторолака, лоразепама, мелоксикама, меперидина, метадона, мидазолама, морфина, набуметона, напроксена, оксапроизна, оксикодона, производного пенициллина, пенициллинов, пентоксифиллина, фенилэфрина, фенилпропаноламина, пропоксифена, псевдоэфедрина, ремифентанила, сулиндака, тербуталина, толметина, торсемида и ванкомицина.
58. Способ стабилизации (S)-клопидогреля против хиральной инверсии в (R)-клопидогрель, включающий помещение сульфоалкилового эфира циклодекстрина в композицию, содержащую оптически чистую или энантиомерно обогащенную форму (S)-клопидогреля.
Авторы
Даты
2012-12-27—Публикация
2008-04-26—Подача