Настоящее изобретение относится к получению низкомолекулярного гормономиметика, который имеет селективную агонистическую активность по отношению к FSH рецептору.
Гонадотропины выполняют важные функции в различных функциях организма, включающих метаболизм, терморегуляцию и репродуктивные процессы. Гонадотропины действуют на специфические клетки гонадного типа, вызывая овариальную и тестикулярную дифференцировку и образование стероидов. Например, гонадотропин гипофиза FSH (фолликулостимулирующий гормон) играет основную роль в стимулировании развития фолликул и созревании, в то время как LH (лютеинизирующий гормон) стимулирует овуляцию (Sharp, R.M. Clin. Endocrinol. 33: 787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35: 301-342, 1979). В данный момент FSH в сочетании с LH применяется клинически для овариальной стимуляции, то есть для овариальной гиперстимуляции для оплодотворения in vitro (IVF) и возбуждения овуляции у ановуляторных бесплодных женщин (Insler V., Int. J. Fertility 33: 85-97, 1988; Navot и Rosenwaks, J. Vitro Fert. Embryo Transfer 5: 3-13, 1988), так же, как и при мужском гипогонадизме и мужском бесплодии.
Гонадотропин FSH выделяется из передней доли гипофиза под воздействием гонадолиберина и эстрогена и из плаценты во время беременности. У женщин FSH действует на яичники, стимулируя развитие фолликул, и является основным гормоном, регулирующим выделение эстрогенов. У мужчин FSH является ответственным за сохранность семенных канальцев и действует на клетки Сертоли, поддерживая гаметогенезис. Очищенный FSH клинически используется для лечения бесплодия у женщин и некоторых типов расстройств сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтических целей, могут быть выделены из человеческой мочи и являются низкой чистоты (Morse et al., Amer. J. Reproduct. Immunol. and Microbiology 17: 143, 1988). В качестве альтернативы они могут быть получены в виде рекомбинантных гонадотропинов. Рекомбинантный человеческий FSH является коммерчески доступным и используется для поддержания репродукции (Olijve et al. Mol. Hum. Reprod. 2: 371, 1996; Devroey et al. Lancet 339: 1170, 1992).
Действия гормона FSH опосредуются специфическим рецептором плазматической мембраны, которая является членом большого семейства рецепторов, связанных с G-белком. Эти рецепторы состоят из отдельного полипептида с семью трансмембранными доменами и способны взаимодействовать с Gs-белком, приводя к активации аденилатциклазы.
Рецептор FSH является высокоспецифичной мишенью в процессе роста овариального фолликула и экспрессируется исключительно в яичнике. Блокирование рецептора или ингибирование передачи сигнала, которое обычно вызывается после активации FSH-опосредованного рецептора, нарушит развитие фолликула и, таким образом, овуляцию и фертильность. Низкомолекулярные антагонисты FSH могли бы составлять основу для новых контрацептивов, в то время как низкомолекулярные агонисты FSH могут быть использованы в тех же самых клинических целях как нативные FSH, например, для лечения бесплодия и для яичниковой гиперстимуляции оплодотворения in vitro.
Низкомолекулярные миметики FSH с агонистическими свойствами были раскрыты в международных заявках WO 2000/08015 (Applied Research Systems ARS Holding N.V.) и в WO 2002/09706 (Affymax Research Institute).
Некоторые производные тетрагидрохинолина в настоящее время раскрыты в международной заявке WO2003/004028 (AKZO NOBEL N.V.) в качестве веществ, модулирующих FSH и обладающих агонистическими или антагонистическими свойствами.
Настоящее изобретение относится к получению низкомолекулярных гормономиметиков, которые селективно активируют рецепторы FSH.
Таким образом, было обнаружено, что следующий класс производных дигидропиридина формулы I или его фармацевтически приемлемых солей обладает FSH агонистической активностью:
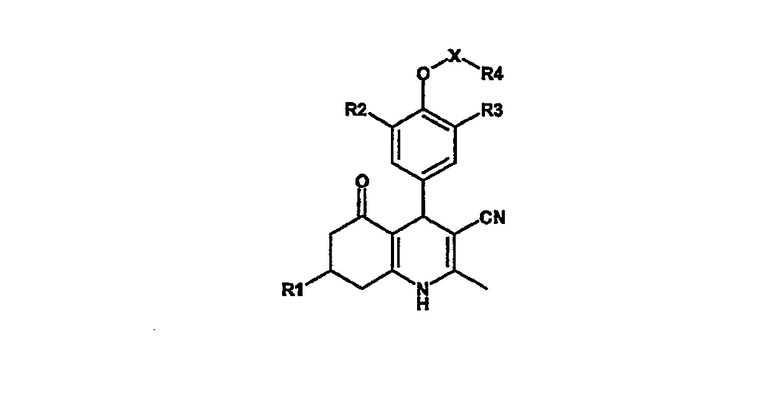
Формула I,
в которой
R1 является С1-6алкилом, С2-6алкенилом, С2-6алкинилом, фенилом или С1-5гетероарилом;
R2, R3 независимо являются С1-4алкилом, С2-4алкенилом, С2-4алкинилом, С1-4алкоксигруппой, С2-4алкенилоксигруппой, С3-4алкинилоксигруппой, галогеном;
X является SO2, CH2, C(O) или X является связью;
R4 является С1-6алкилом, С2-6алкенилом, С2-6алкинилом, С3-6циклоалкилом, С3-6циклоалкенилом, С3-6циклоалкилС1-4алкилом, С2-6гетероциклоалкилом, С2-6гетероциклоалкилС1-4алкилом, С6-10арилом, С6-10арилС1-4алкилом, С1-9гетероарилом или С1-9гетероарилС1-4алкилом.
Если Х является СН2, то R4 может дополнительно быть R5-оксиакарбонилом или R5-карбонилом.
Если R4 является фенилом, то дополнительно к заместителям С6-10арильных групп, как упомянуто в определениях, фенил может быть необязательно замещенным одним или более заместителями, выбранными из следующих групп:
С1-4алкилтио, С1-4алкилсульфонил, R5-оксиакарбонил, R5-карбонил или R5,R6-аминокарбонил;
R5, R6 независимо являются Н, С1-4алкилом, С2-4алкенилом, С2-4алкинилом, С3-6циклоалкилом, С3-6циклоалкилС1-4алкилом, С2-6гетероциклоалкилом, С2-6гетероциклоалкилС1-4алкилом, С1-4алкоксикарбонилС1-4алкилом, С1-4(ди)алкиламинокарбонилС1-4алкилом, С6-10арилом, С1-9гетероарилом, С6-10арилС1-4алкилом, С1-9гетероарилС1-4алкилом, С6-10ариламинокарбонилС1-4алкилом, С1-9гетероариламинокарбонилС1-4алкилом, или R5, R6 могут быть связаны с С2-6гетероциклоалкильным кольцом.
Соединения в соответствии с настоящим изобретением модулируют функцию рецептора FSH и могут быть использованы в тех же самых клинических целях, что нативный FSH, поскольку они ведут себя подобно агонистам с тем преимуществом, что они могут проявлять измененные свойства стабильности и могут быть применены по-разному.
Таким образом, агонисты рецептора FSH настоящего изобретения могут быть использованы для лечения бесплодия. Предпочтительно, чтобы соединения настоящего изобретения были использованы для активации рецептора FSH.
Термин «С1-4алкил», как он использован в определении, означает разветвленную или неразветвленную алкильную группу, имеющую 1-4 атома углерода, такую как метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
Термин «С1-6алкил» означает разветвленную или неразветвленную алкильную группу, имеющую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. Предпочтительными являются С1-5алкильные группы, наиболее предпочтительными являются С1-4алкилы.
Термин «С2-6алкенил» означает разветвленную или неразветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как этенил, 2-бутенил и н-пентенил.
Термин «С2-4алкенил» означает разветвленную или неразветвленную алкенильную группу, имеющую 2-4 атома углерода, такую как этенил, н-пропенил и 2-бутенил.
Термин «С2-6алкинил» означает разветвленную или неразветвленную алкинильную группу, имеющую 2-6 атомов углерода, такую как этинил, пропинил и н-пентинил.
Термин «С2-4алкинил» означает разветвленную или неразветвленную алкинильную группу, имеющую 2-4 атома углерода, такую как этинил и пропинил.
Термин «С3-6циклоалкил» означает циклоалкильную группу, имеющую 3-6 атомов углерода, такую как циклопропил, циклобутил, циклопентил и циклогексил.
Термин «С3-6циклоалкенил» означает циклоалкенильную группу, имеющую 3-6 атомов углерода, такую как циклопропенил, циклопентенил и циклогексенил.
Термин «С3-6циклоалкилС1-4алкил» означает циклоалкилалкильную группу, циклоалкильная группа которой имеет 3-6 атомов с тем же значением, как определено выше, и алкильную группу, имеющую 1-4 атома углерода с тем же значением, как определено выше.
Термин «С2-6гетероциклоалкил» означает гетероциклоалкильную группу, имеющую 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и включает, по меньшей мере, один гетероатом, выбранный из N, O и/или S, которые могут быть присоединены, если возможно, через гетероатом или атом углерода. Предпочтительными являются гетероатомы N или O. Наиболее предпочтительными являются пиперидинил, морфолинил, пирролидинил и пиперазинил.
Термин «С2-6гетероциклоалкилС1-4алкил» означает гетероциклоалкилалкильную группу, гетероциклоалкильная группа которой имеет 2-6 атомов с тем же значением, как определено выше, и алкильную группу, имеющую 1-4 атома углерода с тем же значением, как определено выше.
Термин «С1-4алкокси» означает алкоксильную группу, имеющую 1-4 атома углерода, при этом алкильная часть имеет то же значение, что определено выше. Предпочтительными являются С1-2алкоксигруппы.
Термин «С1-4алкилтио» означает алкилтиогруппу, имеющую 1-4 атома углерода, при этом алкильная часть имеет то же значение, что определено выше.
Термин «С2-4алкенилокси» означает алкенилоксильную группу, имеющую 2-4 атома углерода, при этом алкенильная часть имеет то же значение, что определено выше.
Термин «С3-4алкинилокси» означает алкинилоксильную группу, имеющую 3-4 атома углерода, при этом алкинильная часть имеет то же значение, что определено выше.
Термин «С6-10арил» означает ароматическую углеводородную группу, имеющую 6-10 атомов углерода, такую как фенил, нафтил, тетрагидронафтил или инденил, которые могут быть необязательно замещенными одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксигруппы или С1-4(ди)алкиламиногруппы, при этом алкильная часть имеет то же значение, что определено выше. Предпочтительной ароматической углеводородной группой является фенил.
Термин «С1-9гетероарил» означает замещенную или незамещенную ароматическую группу, имеющую 1-9 атомов углерода, включающую, по меньшей мере, один гетероатом, выбранный из N, O и/или S, как тетразолил, имидазолил, тиадиазолил, пиридинил, (бензо)тиенил, (бензо)фурил, (изо)хинолинил, тетрагидро(изо)хинолинил, кумаринил, хиноксалинил или индолил. Заместители в С1-9гетероарильной группе могут быть выбраны из группы заместителей, перечисленных для С6-10арильной группы. Предпочтительным является С1-5гетероарил. С1-9гетероарильная группа может быть присоединена, если возможно, через атом углерода или через гетероатом.
Термин «С1-5гетероарил» означает замещенную или незамещенную ароматическую группу, имеющую 1-5 атомов углерода, включающую, по меньшей мере, один гетероатом, выбранный из N, O и/или S, как тетразолил, имидазолил, тиадиазолил, пиридинил, тиенил или фурил, причем наиболее предпочтительным является фурил. Предпочтительными гетероарильными группами являются тиенил, фурил и пиридинил. Заместители в С1-5гетероарильной группе могут быть выбраны из группы заместителей, перечисленных для С6-10арильной группы.
Термин «С6-10арилС1-4алкил» означает арилалкильную группу, арильная группа которой содержит 6-10 атомов углерода с тем же значением, как определено выше, и алкильную группу, имеющую 1-4 атома углерода с тем же значением, как определено выше. Наиболее предпочтительным является бензил.
Термин «С1-9гетероарилС1-4алкил» означает гетероарилалкильную группу, гетероарильная группа которой содержит 1-9 атомов с тем же значением, как определено выше, и алкильную группу, имеющую 1-4 атома углерода с тем же значением, как определено выше.
Термин «С1-4алкилсульфонил» означает алкилсульфонильную группу, алкильная группа которой содержит 1-4 атома углерода с тем же значением, как определено выше.
Термин «С1-4алкоксикарбонил» означает С1-4алкоксикарбонильную группу, алкоксигруппа которой содержит 1-4 атома углерода с тем же значением, как определено выше. Предпочтительными являются С1-2алкоксикарбонильные группы.
Термин «С1-4алкоксикарбонилС1-4алкил» означает алкоксикарбонилалкильную группу, алкильная группа которой содержит 1-4 атома углерода с тем же значением, как определено выше.
Термин «С1-4(ди)алкиламинокарбонилС1-4алкил» означает (ди)алкиламинокарбонилалкильную группу, алкильная группа которой содержит 1-4 атома углерода с тем же значением, как определено выше.
Термин «галоген» означает фтор, хлор, бром и йод.
Термин «фармацевтически приемлемые соли» представляет те соли, которые являются подходящими для использования в контакте с тканями человека и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и подобного и являются соразмерными с разумным соотношением выгода/риск. Фармацевтически приемлемые соли хорошо известны в уровне техники. Они могут быть получены в процессе конечного выделения и очистки соединений изобретения или отдельно взаимодействием свободного функционального основания с подходящей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и подобное. Кислотная функциональная группа может взаимодействовать с органическим или минеральным основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития.
Изобретение также относится к соединениям формулы I, в которых R1 является С1-6алкилом, фенилом или С1-5гетероарил, все необязательно замещенные заместителями, как упомянуто в определениях. Более конкретно, изобретение относится к соединениям, в которых R1 является С1-6алкилом, фенилом, С4-гетероарилом. Изобретение также касается соединений, в которых R1 является н-пропилом или фурилом.
Другим аспектом изобретения являются соединения формулы I, в которых R2, R3 являются галогеном и/или С1-4алкокси.
В еще одном аспекте изобретение касается соединений формула I, в которых Х является СН2.
Другим аспектом изобретения является соединение, в котором R4 является фенилом, необязательно замещенным заместителями, как упомянуто в определении.
В другом аспекте изобретение относится к соединениям, в которых R4 является фенилом, который является замещенным в орто- и/или мета-положениях. В еще одном аспекте изобретение относится к соединениям формулы I, в которых R4 является фенилом, замещенным R5,R6-аминокарбонилом, С1-4алкоксигруппой и/или галогеном. В еще одном аспекте изобретение относится к соединениям, в которых R5,R6 в R5,R6-аминокарбонильной группе является С1-4(ди)алкиламиногруппой, С1-4алкоксикарбонилС1-4алкилом или С1-9гетероарилС1-4алкилом. В еще одном аспекте, по меньшей мере, один из R5, R6 в R5,R6-аминокарбонильной группе является Н.
В другом аспекте изобретение касается соединений, в которых С6-10арил, С6-10арилС1-4алкил, С1-9гетероарил или С1-9гетероарилС1-4алкил в R4 являются незамещенными.
Еще один аспект изобретения касается соединений, в которых Х=СН2 и в которых
R4 является фенилом, необязательно замещенным заместителями, как упомянуто в определениях.
Еще один аспект изобретения касается соединений, в которых все особые определения групп от R1 до R4, как здесь определено выше, объединены в соединение дигидропиридина формулы I.
Из объема изобретения исключается 2-метил-5-оксо-7-фенил-4-(3,4,5-триметоксифенил)-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил.
Исключенное соединение относится к CAS330674-72-1, доступному из коммерческих источников, подобных Cembridge Corp., MicroChemistry Ltd, Ambinter, Asinex, Scientific Exchange Inc. и ChemDiv Inc.
Пригодные способы получения соединений изобретения описаны ниже.
Производные 1,4-дигидропиридина I настоящего изобретения могут быть получены хорошо описанной трехкомпонентной циклоконденсацией по Ганчу из циклогексан-1,3-дионов общей формулы II, бензальдегидов общей формулы III и 3-аминокротонитрила IV, в которых R1, R2, R3, R4 и Х являются такими, как определено выше.

Родственные реакции циклоконденсацией по Ганчу могут быть найдены в Bioorg. Med. Chem. Lett. 12 (2002) 1481-1484, J. Chem. Soc., Perkin Trans. 1 (2002) 1141-1156, Synlett. (2002) 89-92, Drug Dev. Res. 51 (2000) 233-243, J. Med. Chem. 42 (1999) 1422-1427, ibid. 5266-5271, ibid. 41 (1998) 2643-2650, WO 9408966, Arzneim.-Forsch./Drug Res. 45 (1995) 1054-1056, J. Med. Chem. 34 (1991) 2248-2260, ibid. 17 (1974) 956-65, Chem. Rev. 72 (1972)
1-42. Вышеупомянутые реакции обычно проводятся при повышенной температуре в протонном растворителе, таком как, например, уксусная кислота, (изо)пропанол, этанол, метанол или их смеси.
В качестве альтернативы соединения общей формулы I могут быть синтезированы взаимодействием сначала циклогексан-1,3-дионов формулы II с бензальдегидами формулы III в присутствии основания, такого как, но не ограниченного, ацетат аммония, и затем взаимодействием интермедиата 2-бензилиденциклогексан-1,3-диона общей формулы V, в которой R1, R2, R3, R4 и Х имеют то же значение, как определено выше, с 3-аминокротонитрилом IV.
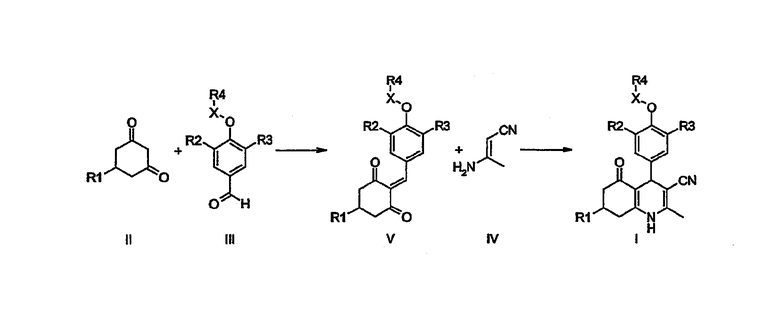
Соединения общей формулы I-a, в которых X = связь и R4=H, могут быть использованы для получения соединений I-b-e О-алкилированием, О-(гетеро)арилированием, О-ацилированием или О-сульфонилированием обычными способами, хорошо известными специалисту в данной области.

В обычном эксперименте соединения I-a взаимодействуют в таком растворителе, как дихлорметан, N,N-диметилформамид, диметилсульфоксид, этанол, тетрагидрофуран, диоксан, толуол, 1-метилпирролидин-2-он или пиридин, с алкилгалогенидом, или ацилгалогенидом, или ангидридом кислоты, или сульфонилгалогенидом, или (гетеро)арилгалогенидом в присутствии такого основания, как, но не ограничиваясь, триэтиламин, N,N-диизопропилэтиламин (DiPEA), карбонат калия, карбонат цезия или гидрид натрия, необязательно в присутствии каталитического количества йодида калия или йодида тетрабутиламмония, и/или Cu- или Pd-катализатора с образованием О-алкилированного, О-(гетеро)арилированного, О-ацилированного или О-сульфонилированного производного формулы I-b, I-c, I-d и I-e соответственно.
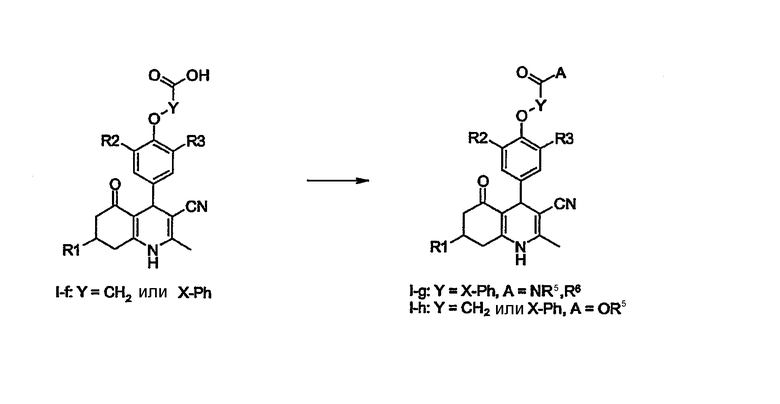
Соединения формул I-f, в которых Х=СН2 и R4=производное алкилкислоты или производное (гетеро)арилкислоты, полученное щелочным (например, NaOH) омылением соответствующего алкильного сложного эфира, могут быть конденсированы с аминами общей структуры R5,R6NH или спиртами общей формулы R5OH с использованием реагента связывания, такого как диизопропилкарбодиимид (DIC), (3-диметиламинопропил)этилкарбодиимид (EDCI), О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (TBTU) или О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HATU), и основание третичного амина (DiPEA) в таком растворителе, как N,N-диметилформамид или дихлорметан при температуре окружающей среды или повышенной температуре с образованием соединений формулы I-g и I-h.
Замещенные циклогексан-1,3-дионы общей формулы II являются коммерчески доступными или могут быть получены известными из литературы в этой области способами. Подходящие примеры найдены в J. Med. Chem. 43 (2000) 4678-4693, Tetrahedron 56 (2000) 4753-4758, J. Med. Chem. 35 (1992) 3429-3447, ibid. 24 (1981) 1026-1034, Org. Synt. Coll. Vol. V (1973) 400, Chem. Ber. 88 (1955) 316-327, Justus Liebig Ann. Chem. 570 (1950) 15-31.
Бензальдегиды общей формулы III также являются коммерчески доступными или могут быть получены в соответствии с литературными методиками: J. Chem. Soc., Perkin Trans. 2 (2000) 1119-1124, J. Chem. Soc., Chem. Commun. 4 (1993) 419-420, Synth. Commun. 20 (1990) 2659-2666, Chem. Pharm. Bull. 34 (1986) 121-129, Indian J. Chem. Sect. B 20 (1981) 1010-1013, Monatsh. Chem. 106 (1975) 1191-1201, DE 1070162, J. Org. Chem. 23 (1958) 120.
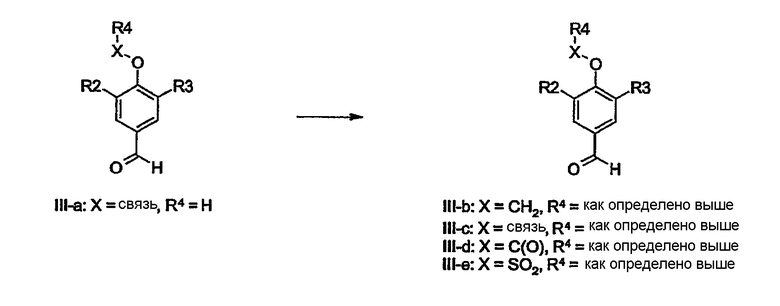
В качестве альтернативы соединения III-a, в которых Х=связь и R4=H могут быть использованы для синтеза соединений III-b-e О-алкилированием, О-(гетеро)арилированием, О-ацилированием или О-сульфонилированием с использованием стандартных условий, как описано выше для соединений I-a.
Соединения настоящего изобретения имеют, по меньшей мере, два хиральных атома углерода и поэтому могут быть получены в виде чистых энантиомеров, или в виде смеси энантиомеров, или смеси диастереомеров. Способы получения чистых энантиомеров хорошо известны в уровне техники, например кристаллизация солей, которые получены из оптически активных кислот и рацемических смесей, или хроматография с использованием хиральных колонок. Для разделения диастереомеров могут быть использованы колонки с нормальной фазой или с обращенной фазой.
Соединения изобретения могут образовывать гидраты или сольваты. Специалистам в данной области известно, что заряженные соединения образуют гидратированные фрагменты при лиофилизации с водой или образуют сольваты при концентрировании в растворе с подходящим органическим растворителем. Соединения данного изобретения включают гидраты или сольваты перечисленных соединений.
Для отбора активных соединений тестирование при 10-5М должно привести к активности более чем 20% от максимальной активности, когда FSH используется в качестве сравнения. Другим критерием может быть величина EC50, которая должна быть <10-5М, предпочтительно <10-7М, еще более предпочтительно <10-9М.
Специалисту будет ясно, что желаемые значения EC50 зависят от тестируемого соединения. Например, соединение с EC50, которое является менее чем 10-5М, является обычно рассматриваемым кандидатом на отбор лекарственного средства. Предпочтительно, чтобы значение было более низким, чем 10-7М. Однако соединение, которое имеет более высокое EC50, но является селективным для определенного рецептора, может быть даже лучшим кандидатом.
Способы определения связывания рецептора гонадотропинов, также как и оценки in vitro и in vivo для определения биологической активности, хорошо известны. В общем, экспрессированный рецептор контактирует с тестируемым соединением, и измеряется связывание, или стимуляция, или ингибирование функционального ответа.
Для измерения функционального ответа выделенную ДНК, кодирующую ген рецептора FSH, предпочтительно человеческий рецептор, экспрессируют в подходящей клетке-хозяине. Подобными клетками могут быть клетки яичника китайского хомячка, но другие клетки также пригодны. Предпочтительно, чтобы клетки были клетками млекопитающего (Jia et al., Mol. Endocrin., 5: 759-776, 1991).
Способы создания рекомбинантного FSH, экспрессирующего колонии клеток, хорошо известны в уровне техники (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, latest edition). Экспрессия рецептора достигается экспрессией ДНК, кодирующей требуемый белок. Методики целенаправленного мутагенеза, сшивание дополнительных последовательностей, ПЦР и конструирование пригодных систем экспрессии являются на данный момент хорошо известными в уровне техники. Фрагменты или вся ДНК, кодирующая желаемый белок, могут быть сконструированы синтетически по стандартным твердофазным методикам, предпочтительно включить сайты рестрикции для ослабления сшивания. Подходящие регуляторные элементы для транскрипции и трансляции, включенной кодирующей последовательности, могут быть включены в ДНК кодирующие последовательности. Хорошо известно, что в данный момент доступны системы экспрессии, которые являются совместимыми с широким кругом хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и подобное.
Клетки, экспрессирующие рецептор, затем контактируют с тестируемым соединением для наблюдения связывания, или стимуляции, или ингибирования функционального ответа.
В качестве альтернативы выделенные клеточные мембраны, содержащие экспрессированный рецептор, могут быть использованы для измерения связывания соединения.
Для измерения связывания могут быть использованы радиоактивные или флуоресцирующие соединения. В качестве соединения сравнения может быть использован человеческий рекомбинантный FSH.
В качестве альтернативы также может быть осуществлен конкурирующий анализ связывания.
Другой анализ включает скрининг соединений-агонистов рецептора FSH путем определения стимулирования опосредованного рецептором накопления cAMP. Таким образом, подобный способ включает экспрессию рецептора на клеточной поверхности клетки-хозяина и воздействие на клетку тестируемого соединения. Затем измеряется количество cAMP. Уровень cAMP будет увеличиваться вследствие стимулирующего воздействия тестируемого соединения на связывание с рецептором.
Дополнительно к прямому измерению, например, уровней cAMP в клетке, на которую оказывается воздействие, могут быть использованы клеточные линии, которые в добавление к трансфекции рецептором, кодирующим ДНК, также трансфекцируются вторичной ДНК, кодирующей ген-репортер, экспрессия которого соответствует уровню cAMP. Подобные гены-репортеры могут быть индуцируемыми cAMP или могут быть получены таким образом, чтобы они были связаны с оригинальными элементами, чувствительными к cAMP. В общем, экспрессия ген-репортера может быть контролирована любыми элементами, чувствительными к изменению уровней cAMP. Подходящими генами-репортерами являются, например, LacZ, щелочная фосфатаза, светлячковая люцифераза и зеленый флуоресцентный белок. Принципы подобных оценок трансактивации хорошо известны в уровне техники и описаны, например, в Stratowa, Ch., Himmler, A. И Czernilofsky, A. P. (1995) Curr. Opin. Biotechnol. 6: 574.
Настоящее изобретение также относится к фармацевтической композиции, содержащей производное дигидропиридина или его фармацевтически приемлемые соли, имеющее общую формулу I в смеси с фармацевтически приемлемыми вспомогательными веществами и необязательно другими терапевтическими средствами. Вспомогательные вещества должны быть «приемлемыми» в том смысле, что они являются совместимыми с другими ингредиентами композиции и не опасны для их хозяев. Фармацевтические композиции также могут содержать 2-метил-5-оксо-7-фенил-4-(3,4,5-триметоксифенил)-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил.
Композиции включают, например, пригодные для перорального, сублингвального, подкожного, внутривенного, внутримышечного, назального, местного или ректального введения и подобное, все в единицах стандартной дозы для приема.
Для перорального введения активный ингредиент может быть представлен в виде отдельных лекарственных форм, таких как таблетки, капсулы, порошки, гранулы, растворы, суспензии и подобное.
Для парентального введения фармацевтическая композиция может быть представлена в виде емкостей, содержащих одну дозу или множество доз лекарственного средства, например жидкости для инъекций в заранее определенных количествах, например, в герметичных флаконах и ампулах, и могут также храниться в вымороженном (лиофилизованном) виде, требующем перед использованием только добавления жидкого стерильного носителя, например воды.
Активный агент, смешанный с подобными фармацевтически приемлемыми вспомогательными веществами, например, как описано в стандартной ссылке Gennaro, A.R. et al., Remington: The Science and Practice of Pharmacy (20th Edition, Lippincott Williams and Wilkins, 2000, см. специально Part 5: Pharmaceutical Manufacturing), может быть спрессован в твердую стандартную дозу, такую как пилюли, таблетки, или переведен в капсулы или суппозитории. Используя фармацевтически приемлемые жидкости, активный агент может быть использован в виде жидкой композиции, например в виде раствора для инъекций, в виде растворов, суспензий, эмульсий или как спрей, например назальный спрей.
Для приготовления твердой стандартной лекарственной формы используют обычные добавки, такие как наполнители, красители, полимерные связующие вещества и подобное. Вообще могут быть использованы любые фармацевтически приемлемые добавки, которые не взаимодействуют с активными соединениями. Подходящие носители, с которыми активный агент настоящего изобретения может быть использован в качестве твердой стандартной лекарственной дозы, включают лактозу, крахмал, производные целлюлозы и подобное или их смеси, использованные в подходящих количествах. Для парентального введения могут быть использованы водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Изобретение дополнительно включает фармацевтическую композицию, как описано выше, в комбинании с упаковочным материалом, пригодным для указанной композиции, причем указанный упаковочный материал включает инструкции по использованию композиции.
Точная дозировка и режим приема активного ингредиента или его фармацевтической композиции может меняться в зависимости от конкретного соединения, пути введения и возраста, и состояния индивидуального пациента, которому прописывают лекарственное средство.
В общем парентальный прием требует более низких доз, чем другие способы приема, которые являются более зависимыми от абсорбции. Однако пригодная дозировка для людей может составить 0,05-25 мг на кг веса тела. Требуемая дозировка может быть представлена как одна доза или множество поддоз, принимаемых через соответствующие интервалы в течение дня, или, в случае пациентов-женщин, как дозы, которые следует принимать ежедневно в течение менструального цикла. Дозировка, также как и режим приема, может различаться у пациентов мужчин и женщин.
Таким образом, соединения в соответствии с изобретением могут быть использованы в терапии.
Изобретение относится также к применению производного дигидропиридина, имеющего общую формулу I, для приготовления лекарственного средства для лечения расстройств, чувствительных к метаболическим путям, опосредованных FSH рецептором, предпочтительно для лечения бесплодия.
Изобретение проиллюстрировано следующими примерами.
Пример 1
4-(3-Бром-4-этокси-5-метоксифенил)-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 4-(3-Бром-4-гидрокси-5-метоксифенил)-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь 5-фенилциклогексан-1,3-диона (0,51 г), 3-бром-5-метокси-4-гидроксибензальдегида (0,62 г) и 3-аминокротонитрила (0,22 г) в 20 мл абсолютного этанола перемешивали в течение 3 ч при 75°С. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (3/7 об./об.), Rf=0,36) получили указанное в заголовке соединение в виде не совсем белого твердого вещества.
Выход: 0,95 г.
MS-ESI: [M-H]- = 463/465.
b) 4-(3-Бром-4-этокси-5-метоксифенил)-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь продукта стадии а (15 мг), этилйодида (6,4 мкл), гидрида натрия (2,6 мг, 60% в масле) и тетрабутиламмония йодида (1,2 мг) в 0,5 мл N-метилпирролидона перемешивали в течение 2 ч при 80°С. Добавили воду и реакционную смесь экстрагировали этилацетатом. Органические фазы концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,52) получили указанное в заголовке соединение.
Выход: 2,2 мг.
MS-ESI: [M-H]- = 491/493.
Пример 2
4-(3-Бром-4-циклогексилметокси-5-метоксифенил)-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1b из продукта примера 1а (15 мг) и бромметилциклогексана (12 мкл).
Выход: 12 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,59.
MS-ESI: [M-H]- = 559/561.
Пример 3
4-[3-Бром-5-метокси-4-(3-метилбутокси)фенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1b из продукта примера 1а (15 мг) и 1-йод-3-метилбутана (4,7 мкл).
Выход: 14 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,56.
MS-ESI: [M-H]- = 533/535.
Пример 4
4-[3-Бром-4-(5-хлортиофен-2-илметокси)-5-метоксифенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь продукта из примера 1а (15 мг), 2-хлор-5-хлорметилтиофена (4,3 мкл) и карбоната цезия (21 мг) в 1 мл диоксана перемешивали при 80°С в течение 4 ч. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (3/7 об./об.), Rf=0,38) получили указанное в заголовке соединение.
Выход: 4,7 мг.
MS-ESI: [M-H]- = 593/595/597.
Пример 5
Метиловый эфир [2-бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифенокси]уксусной кислоты
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта примера 1а (0,47 г) и метилового эфира бромуксусной кислоты (1,0 мл).
Выход: 0,32 г.
Rf(гептан/этилацетат (1/4 об./об.))=0,46.
MS-ESI: [M-H]- = 535/537.
Пример 6
2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифениловый эфир 3-метоксибензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта примера 1а (15 мг) и 3-метоксибензоилхлорида (5,4 мкл).
Выход: 7,4 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,48.
MS-ESI: [M-H]- = 597/599.
Пример 7
4-[3-Бром-4-(3-цианобензилокси)-5-метоксифенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта примера 1а (15 мг) и 3-бромметилбензонитрила (7,6 мг).
Выход: 15 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,51.
MS-ESI: [M-H]- = 578/580.
Пример 8
4-[3-Бром-5-метокси-4-(нафталин-2-илметокси)фенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта примера 1а (15 мг) и 2-бромметилнафталина (8,6 мг).
Выход: 11 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,60.
MS-ESI: [M-H]- = 603/605.
Пример 9
2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифениловый эфир фенилметансульфоновой кислоты
Смесь продукта из примера 1а (15 мг), фенилметансульфонилхлорида (9,2 мг) и триэтиламин (9,4 мкл) в 1 мл дихлорметана перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,41) получили указанное в заголовке соединение.
Выход: 15 мг.
MS-ESI: [M+H]+ = 619/621.
Пример 10
2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифениловый эфир тиофен-2-сульфоновой кислоты
Указанное в заголовке соединение было получено аналогично примеру 9 из продукта примера 1а (15 мг) и тиофен-2-сульфонилхлорида (8,8 мг).
Выход: 20 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,30.
MS-ESI: [M-H]- = 611/613.
Пример 11
4-[3,5-Дибром-4-(3-метоксибензилокси)фенил]-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 3,5-Дибром-4-(3-метоксибензилокси)бензальдегид
Смесь 3,5-дибром-4-гидроксибензальдегид (0,28 г), 1-бромметил-3-метоксибензол (0,15 мл), карбонат калия (0,29 г) и йодид калия (42 мг) в 10 мл абсолютного этанола перемешивали при 80°С в течение 2 дней. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (3/7 об./об.), Rf=0,51) получили указанное в заголовке соединение в виде не совсем белого твердого вещества.
Выход: 0,24 г.
MS-ESI: [M-H]- = 463/465.
1Н ЯМР (CDCl3): δ = 9,88 (с, 1Н), 8,06 (с, 1Н), 7,34 (т, 1Н), 7,18 (ушир.с, 1Н), 7,15 (д, 1Н), 6,93 (дд, 1Н), 5,10 (с, 2Н), 3,85 (с, 3Н).
b) 4-[3,5-Дибром-4-(3-метоксибензилокси)фенил]-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-этилциклогексан-1,3-диона (8,5 мг) и продукта стадии а (24 мг).
Выход: 26 мг.
Rf(гептан/этилацетат (3/7 об./об.))=0,40.
MS-ESI: [M+H]+ = 585/587/589.
Пример 12
4-{3-Бром-5-этокси-4-[2-(3-нитрофенил)-2-оксоэтокси]фенил}-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 4-(3-Бром-5-этокси-4-гидроксифенил}-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 3-бром-5-этокси-4-гидроксибензальдегила (0,15 г).
Выход: 0,15 г.
Rf(гептан/этилацетат (4/6 об./об.))=0,18.
MS-ESI: [M+H]+ = 479/481.
b) 4-{3-Бром-5-этокси-4-[2-(3-нитрофенил)-2-оксоэтокси]фенил}-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта стадии а (15 мг) 2-бром-1-(3-нитрофенил)этанона (8,4 мг).
Выход: 14 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,58.
MS-ESI: [M+H]+ = 642/644.
Пример 13
3-[2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифеноксиметил]-N-тиофен-2-илметилбензамид
а) Метиловый эфир 3-[2-бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифеноксиметил]бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 4 из продукта примера 1а (0,35 г) и метилового эфира 3-бромметилбензойной кислоты (0,18 г).
Выход: 0,35 г.
Rf(гептан/этилацетат (3/7 об./об.))=0,34.
MS-ESI: [M+H]+ = 613/615.
b) 3-[2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифеноксиметил]бензойная кислота
Раствор продукта стадии а (0,35 г) растворяли в 20 мл диоксан/вода (7/3 об./об.) и добавили 2 мл 2М NaOH в воде. Реакционную смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь выливали в воду и подкисляли 2М HCl в воде до рН 2 и экстрагировали этилацетатом несколько раз. Органические фазы промыли водой и насыщенным рассолом, высушивали над Na2SO4 и упаривали, получив указанное в заголовке соединение.
Выход: 0,35 г.
MS-ESI: [M+H]+ = 599/601.
c) 3-[2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифеноксиметил]-N-тиофен-2-илметилбензамид
К раствору продукта стадии b (20 мг) в 2 мл дихлорметана добавили EDCI (7,0 мг), DiPEA (7 мкл) и 2-тиофенметиламин (4,1 мкл) и перемешивали реакционную смесь в течение 3 ч при комнатной температуре. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,78) получили указанное в заголовке соединение.
Выход: 11 мг.
MS-ESI: [M+H]+ = 694/696.
Пример 14
2-Морфолин-4-илэтиловый эфир 3-[2-бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-метоксифеноксиметил]бензойной кислоты
К раствору продукта стадии 13b (20 мг) в 2 мл дихлорметана добавили TBTU (12 мг), DiPEA (7 мкл) и 2-морфолин-4-илэтанол (4,8 мкл) и перемешивали реакционную смесь в течение 3 ч при комнатной температуре. Реакционную смесь концентрировали и после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,48) получили указанное в заголовке соединение.
Выход: 11 мг.
MS-ESI: [M+H]+ = 694/696.
Пример 15
4-{3-Бром-5-этокси-4-[3-(пиперидин-1-карбонил)бензилокси]фенил}-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) Метиловый эфир 3-(2-бром-6-этокси-4-формилфеноксиметил)бензойной кислоты
К раствору 5-бром-3-этокси-4-гидроксибензальдегида (0,75 г) в 10 мл ДМФ добавили метиловый эфир 3-бромметилбензойной кислоты (0,77 г), K2CO3 (1,0 г) и каталитическое количество н-Bu4NI и реакционную смесь перемешивали при 70°С в течение 1 ч. Добавили 3% раствор лимонной кислоты в воде и экстрагировали реакционную смесь этилацетатом. Органические фазы промыли водой и рассолом, сушили над MgSO4 и концентрировали. После колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,25) получили указанное в заголовке соединение.
Выход: 1,08 г.
1Н ЯМР (CDCl3): δ = 9,84 (с, 1Н), 8,20 (ушир.с, 1Н), 8,02 (ушир.д, 1Н), 7,77 (д, 1Н), 7,65 (д, 1Н), 7,47 (т, 1Н), 7,39 (д, 1Н), 5,21 (с, 2Н), 4,17 (кв., 2Н), 3,94 (с, 3Н), 1,51 (т, 3Н).
b) Метиловый эфир 3-[2-бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 1а из продукта стадии а (0,26 г).
Выход: 0,27 г.
Rf(гептан/этилацетат (3/7 об./об.))=0,34.
MS-ESI: [M+H]+ = 613/615.
c) 3-[2-Бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойная кислота
Указанное в заголовке соединение было получено аналогично примеру 13b из продукта стадии b (0,27 г).
Выход: 0,27 г.
MS-ESI: [M+H]+ = 599/601.
d) 4-{3-Бром-5-этокси-4-[3-(пиперидин-1-карбонил)бензилокси]фенил}-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 13с из продукта стадии с (20 мг) и пиперидина (3,9 мкл).
Выход: 15 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,25.
MS-ESI: [M+H]+ = 680/682.
Пример 16
Метиловый эфир N-3-[2-бром-4-(3-циано-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензоилглицин
Указанное в заголовке соединение было получено аналогично примеру 13с из продукта стадии 15с (20 мг) и гидрохлорида глицинметилового эфира (4,9 мг).
Выход: 9,9 мг.
Rf(гептан/этилацетат (3/7 об./об.))=0,16.
MS-ESI: [M+H]+ = 684/686.
Пример 17
Метиловый эфир 3-[2-бром-4-(3-циано-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-этилциклогексан-1,3-диона (0,25 г) и продукта стадии 15а (0,64 г).
Выход: 0,45 г.
Rf(гептан/этилацетат (1/4 об./об.))=0,25.
MS-ESI: [M+H]+ = 579/581.
Пример 18
3-[2-Бром-4-(3-циано-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойная кислота
Указанное в заголовке соединение было получено аналогично примеру 13b из продукта примера 17 (0,43 г).
Выход: 0,38 г.
Rf(гептан/этилацетат (1/4 об./об.))=0,17.
MS-ESI: [M+H]+ = 563/565.
Пример 19
3-[2-Бром-4-(3-циано-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]-N-трет-бутилбензамид
К раствору продукта примера 18 (0,35 г) в 10 мл дихлорметана добавили трет-бутиламин (0,12 мл), DiPEA (0,39 мл) и HATU (0,30 г) и реакционную смесь перемешивали в течение 3 ч при 35°С. Добавили 3% раствор лимонной кислоты в воде и несколько раз экстрагировали реакционную смесь этилацетатом. Органические фазы промыли водой и рассолом, сушили над MgSO4 и концентрировали. После колоночной флэш-хроматографии (силикагель, гептан/этилацетат (1/4 об./об.), Rf=0,34) получили указанное в заголовке соединение.
Выход: 0,28 г.
MS-ESI: [M+H]+ = 620/622.
Пример 20
3-[2-Бром-4-(3-циано-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]-N-циклогексилбензамид
Указанное в заголовке соединение было получено аналогично примеру 13с из продукта примера 18 (20 мг) и циклогексиламина (4,9 мкл).
Выход: 7,9 мг.
Rf(силикагель, гептан/этилацетат (1/4 об./об.))=0,43.
MS-ESI: [M+H]+ = 646/648.
Пример 21
3-[2-Бром-4-(3-циано-7-этил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]-N-(2-морфолин-4-илэтил)бензамид
Указанное в заголовке соединение было получено аналогично примеру 13c из продукта примера 18 (20 мг) и 4-(2-аминоэтил)морфолина (5,5 мкл).
Выход: 15 мг.
Rf(дихлорметан/метанол (95/5 об./об.))=0,22.
MS-ESI: [M+H]+ = 677/679.
Пример 22
4-[3-Йод-5-метокси-4-(3-метоксибензилокси)фенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 3-Йод-5-метокси-4-(3-метоксибензилокси)бензальдегид
Указанное в заголовке соединение было получено аналогично примеру 15а из 4-гидрокси-3-йод-5-метоксибензальдегида (0,70 г) и 1-бромметил-3-метоксибензола (0,39 мл).
Выход: 0,56 г.
Rf(гептан/этилацетат (4/6 об./об.))=0,42.
1Н ЯМР (CDCl3): δ = 9,83 (с, 1Н), 7,86 (д, 1Н), 7,43 (д, 1Н), 7,29 (т, 1Н), 7,16 (ушир.с, 1Н), 7,09 (д, 1Н), 6,88 (дд, 1Н), 5,14 (с, 2Н), 3,95 (с, 3Н), 3,84 (с, 3Н).
b) 4-[3-Йод-5-метокси-4-(3-метоксибензилокси)фенил]-2-метил-5-оксо-7-фенил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из продукта стадии а (24 мг).
Выход: 17 мг.
Rf(гептан/этилацетат (1/4 об./об.))=0,59.
MS-ESI: [M-H]- = 631.
Пример 23
4-[3-Бром-4-(2-хлор-3-метоксибензилокси)-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Исходное сырье было получено в соответствии со способом, описанным McCarthy и др. (J. Org. Chem. 1986 (29) 1586):
а) 2-Хлор-3-метоксибензальдегид
К раствору N,N,N'-триметилэтилендиамина (1,27 мл) в 10 мл тетрагидрофурана при -40°С добавили н-бутиллитий (6,25 мл, 1,6М раствор в гексане). Через 15 мин реакционную смесь охладили до -70°С и добавили раствор 3-метоксибензальдегида (1,22 мл) в 5 мл тетрагидрофурана. Реакционную смесь оставили нагреваться до 0°С и затем снова охладили до -70°С и добавили н-бутиллитий (6,25 мл, 1,6М раствор в гексане). До того как к раствору добавили раствор гексахлорэтана (7,10 г) в 10 мл тетрагидрофурана, реакционную смесь оставили нагреваться до 10°С и затем снова охладили до -30°С. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, выливали в 20 мл 10% HCl в воде и экстрагировали несколько раз этилацетатом. Объединенные органические фазы промыли насыщенным рассолом, сушили над MgSO4 и концентрировали. Указанное в заголовке соединение получили после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (75/25 об./об.), Rf=0,38) с последующей кристаллизацией из гептана.
Выход: 1,06 г.
1Н ЯМР (CDCl3): δ = 10,46 (с, 1Н), 7,54 (дд, 1Н), 7,35 (т, 1Н), 7,17 (д, 1Н), 3,96 (с, 3Н).
b) 2-Хлор-1-хлорметил-3-метоксибензол
Продукт стадии а (1,00 г) в 5 мл тетрагидрофурана при 0°С добавили к суспензии литийалюмогидрида (0,34 г) в 5 мл тетрагидрофурана. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и при 0°С добавили воду (0,35 мл) в 5 мл тетрагидрофурана, затем 2М раствор гидроксида натрия в воде (0,70 мл) и воду (0,70 мл). Полученную белую суспензию перемешивали в течение 0,5 час и отфильтровывали. Бесцветное масло, полученное после концентрирования фильтрата, растворили в 10 мл 1,2-дихлорпропана и добавили тионилхлорид (1,5 мл). Реакционную смесь нагревали с обратным холодильником в течение ночи и концентрировали. Указанное в заголовке соединение в виде желтого масла, которое кристаллизуется при отстаивании, получили после колоночной флэш-хроматографии (силикагель, гептан/этилацетат (75/25 об./об.), Rf=0,43).
Выход: 0,80 г.
1Н ЯМР (CDCl3): δ = 7,24 (т, 1Н), 7,09 (дд, 1Н), 6,93 (дд, 1Н), 4,72 (с, 2Н), 3,92 (с, 3Н).
c) 3-Бром-4-(2-хлор-3-метоксибензилокси)-5-этоксибензальдегид
Указанное в заголовке соединение было получено аналогично примеру 15а из продукта стадии b (0,42 г) и 5-бром-3-этокси-4-гидроксибензальдегида (0,49 г).
Выход: 0,56 г.
1Н ЯМР (CDCl3): δ = 9,85 (с, 1Н), 7,66 (дд, 1Н), 7,40 (дд, 1Н), 7,39 (д, 1Н), 7,29 (т, 1Н), 6,94 (дд, 1Н), 5,32 (с, 2Н), 4,15 (квар., 2Н), 3,93 (с, 3Н), 1,44 (т, 3Н).
d) 4-[3-Бром-4-(2-хлор-3-метоксибензилокси)-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-пропилциклогексан-1,3-диона (21 мг) и продукта стадии с (53 мг).
Выход: 60 мг.
Rf(гептан/этилацетат (4/6 об./об.))=0,19.
MS-ESI: [M-H]- = 597/599/601.
Пример 24
Метиловый эфир N-3-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензоилглицина
а) Метиловый эфир 3-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-пропилциклогексан-1,3-диона (0,95 г) и продукта примера 15а (2,4 г).
Выход: 3,0 г.
Rf(гептан/этилацетат (1/1 об./об.))=0,20.
MS-ESI: [M-H]- = 591/593.
b) 3-[2-Бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойная кислота
Указанное в заголовке соединение было получено аналогично примеру 13b из продукта стадии а (3,0 г).
Выход: 3,0 г.
MS-ESI: [M-H]- = 577/579.
c) Метиловый эфир N-3-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензоилглицина
Указанное в заголовке соединение было получено аналогично примеру 14 из продукта стадии b (90 мг) и гидрохлорида глицинметилового эфира (64 мг). Очистка была совершена препаративной ВЭЖХ (Luna C18 [5 мкм], скорость потока:
20 мл мин-1, 0→90% CH3CN, 1% TFA).
Выход: 59 мг.
Rt(CH2Cl2/MeOH (95/5 об./об.))=0,54.
MS-ESI: [M+H]+ = 650/652.
Пример 25
4-[3-Бром-5-этокси-4-(3-метоксибензилокси)фенил]-7-(4-хлорфенил)-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 3-Бром-5-этокси-4-(3-метоксибензилокси)бензальдегид
Указанное в заголовке соединение было получено аналогично примеру 15а из 3-бром-5-этокси-4-гидроксибензальдегида (0,75 г) и 1-бромметил-3-метоксибензола (0,48 мл).
Выход: 0,91 г.
Rf(гептан/этилацетат (2/1 об./об.))=0,43.
1Н ЯМР (CDCl3): δ = 9,83 (с, 1Н), 7,65 (дд, 1Н), 7,38 (дд, 1Н), 7,29 (т, 1Н), 7,13 (ушир.с, 1Н), 7,07 (д, 1Н), 6,88 (дд, 1Н), 5,16 (с, 2Н), 4,16 (квар., 2Н), 3,83 (с, 3Н), 1,56 (т, 3Н).
b) 4-[3-Бром-5-этокси-4-(3-метоксибензилокси)фенил]-7-(4-хлорфенил)-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-(4-хлорфенил)циклогексан-1,3-диона (22 мг) и продукта стадии а (37 мг).
Выход: 32 мг.
Rf(гептан/этилацетат (3/7 об./об.))=0,19.
MS-ESI: [M+H]+ = 633/635/637.
Пример 26
4-[3-Бром-5-этокси-4-(3-метоксибензилокси)фенил]-7-фуран-2-ил-2-метил-5-оксо-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-фуран-2-илциклогексан-1,3-диона (18 мг) и продукта стадии а (37 мг).
Выход: 37 мг.
Rf(гептан/этилацетат (3/7 об./об.))=0,24.
MS-ESI: [M+H]+ = 589/591.
Пример 27
4-[3,5-Диметокси-4-(3-метоксибензилокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 3,5-Диметокси-4-(3-метоксибензилокси)бензальдегид
Указанное в заголовке соединение было получено аналогично примеру 15а из 4-гидрокси-3,5-диметоксибензальдегида (0,91 г) и 1-бромметил-3-метоксибензола (0,75 мл).
Выход: 1,42 г светло-желтого масла.
Rf(гептан/этилацетат (1/1 об./об.))=0,40.
1Н ЯМР (CDCl3): δ = 9,86 (с, 1Н), 7,26 (д, 1Н), 7,23 (д, 1Н), 7,09 (ушир.с, 1Н), 7,04 (д, 1Н), 6,85 (дд, 1Н), 5,12 (с, 2Н), 3,91 (с, 6Н), 3,82 (с, 3Н)
b) 4-[3,5-Диметокси-4-(3-метоксибензилокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-пропилциклогексан-1,3-диона (11 мг) и продукта стадии а (21 мг).
Выход: 22 мг.
Rf(гептан/этилацетат (3/7 об./об.))=0,21.
MS-ESI: [M+H]+ = 503; [M+Na]+ = 525.
Пример 28
4-[3-Бром-5-этокси-4-(3-пиридинилметокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил трифторуксусной кислоты
а) 3-Бром-5-этокси-4-(3-пиридинилметокси)бензальдегид
Указанное в заголовке соединение было получено аналогично примеру 15а из 3-бром-5-этокси-4-гидроксибензальдегида (0,25 г) и 3-пиколилхлорида гидрохлорида (0,16 г).
b) 4-[3-Бром-5-этокси-4-(3-пиридинилметокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил трифторуксусной кислоты
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-пропилциклогексан-1,3-диона (0,15 г) и неочищенного продукта стадии а. Соединение было очищено полупрепаративной ВЭЖХ (Luna C18 [5 мкм], скорость потока: 20 мл мин-1, 10→90% CH3CN, 0,1% TFA) и сублимировано из смеси воды и диоксана.
Выход: 0,25 г.
MS-ESI: [M+H]+ = 536/538.
Пример 29
4-[2-Бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]-N-тиофен-2-илметилбензамид
а) Метиловый эфир 4-(2-бром-6-этокси-4-формилфеноксиметил)бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 15а из метилового эфира 4-бромметилбензойной кислоты (3,7 г).
Выход: 6,4 г.
1Н ЯМР (CDCl3): δ = 9,84 (с, 1Н), 8,06 (д, 2Н), 7,65 (д, 1Н), 7,61 (д, 2Н), 7,39 (д, 1Н), 5,03 (с, 2Н), 4,16 (кв., 2Н), 3,93 (с, 3Н), 1,48 (т, 3Н).
b) Метиловый эфир 4-[2-бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойной кислоты
Указанное в заголовке соединение было получено аналогично примеру 1а из 5-пропилциклогексан-1,3-диона (2,5 г) и продукта стадии а (6,4 г).
Выход: 6,7 г.
Rf(гептан/этилацетат (3/2 об./об.))=0,20.
MS-ESI: [M-H]- = 591/593.
c) 4-[2-Бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]бензойная кислота
Указанное в заголовке соединение было получено аналогично примеру 13b из продукта стадии b (6,7 г). Реакционную смесь перемешивали при 50°С в течение ночи.
Выход: 6,4 г.
MS-ESI: [M-H]- = 577/579.
d) 4-[2-Бром-4-(3-циано-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-4-ил)-6-этоксифеноксиметил]-N-тиофен-2-илметилбензамид
Указанное в заголовке соединение было получено аналогично примеру 14 из продукта стадии с (0,10 г) и 2-тиофенметиламина (52 мкл). Очистка была выполнена препаративной ВЭЖХ (Luna C18 [5 мкм], скорость потока: 20 мл мин-1, 10→90% CH3CN, 1% TFA).
Выход: 54 мг.
MS-ESI: [M+H]+ = 674/676.
Пример 30
4-[3-Бром-5-этокси-4-(4-нитрофенокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) 4-[3-Бром-4-гидрокси-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Указанное в заголовке соединение было получено аналогично примеру 1а из 3-бром-5-этокси-4-гидроксибензальдегида (2,0 г) 5-пропилциклогексан-1,3-диона (1,3 г).
Выход: 3,6 г.
MS-ESI: [M-H]- = 443/445.
b) 4-[3-Бром-4-мезилокси-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь неочищенного продукта стадии а (0,99 г), мезилхлорид (0,46 мл) и гидроксид натрия (0,32 г) в 4 мл ТГФ/вода (1/1, об./об.) перемешивали при комнатной температуре в течение 3 дней. Добавили воду и экстрагировали реакционную смесь дихлорметаном. Неочищенное указанное в заголовке соединение было получено после концентрирования органических фаз.
Выход: 1,0 г.
MS-ESI: [M-H]- = 521/523.
c) 4-[3-Бром-5-этокси-4-(4-нитрофенокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь продукта стадии b (0,20 г), 1-фтор-4-нитробензол (53 мкл) и карбонат цезия (0,22 г) растворили в диметилсульфоксиде (1 мл) и перемешивали при 80°С в течение 16 ч. Добавили дихлорметан и промыли реакционную смесь 1% раствором хлористоводородной кислоты в воде и насыщенным рассолом. Органическую фазу концентрировали и после колоночной флэш-хроматографии получили указанное в заголовке соединение (силикагель, гептан/этилацетат).
Выход: 0,19 г.
MS-ESI: [M-H]- = 564/566.
1Н ЯМР (CDCl3): δ = 8,17 (д, 2Н), 7,00 (д, 1Н), 6,91 (м, 3Н), 5,95 (ушир.с, 1Н), 4,63 (с, 1Н), 4,04 (дкв., 2Н), 2,52 (дд, 1Н), 2,42 (д, 2Н), 2,25 (м, 1Н), 2,20 (с, 3Н), 2,15 (дд, 1Н), 1,38 (м, 4Н), 1,20 (т, 3Н), 0,92 (т, 3Н).
Пример 31
4-[3-Бром-5-этокси-4-(5-фтор-2-пропиламинобензилокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
а) (5-Фтор-2-нитрофенил)метанол
К раствору 5-фтор-2-нитробензойной кислоты (4,58 г) в ТГФ (50 мл) при охлаждении ледяной баней добавили 1М раствор BH3∙ТГФ в ТГФ (62 мл). Охлаждающую баню убрали и продолжали перемешивание в течение 1 ч при температуре окружающей среды с последующим кипячением с обратным холодильником в течение 4 ч. Реакционную смесь охладили и для разрушения избытка борана добавили MeOH. Смесь концентрировали и добавили к остатку воду и этилацетат. Органический слой промыли рассолом, сушили и концентрировали.
Выход: 4,3 г.
b) 4-[3-Бром-5-этокси-4-(5-фтор-2-нитробензилокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Смесь неочищенного продукта стадии а (1,5 г), тионилхлорида (1,94 мл) и нескольких капель ДМФ в дихлорметане (30 мл) перемешивали в течение 72 ч. Смесь концентрировали под вакуумом и остаток растворили в ДМФ (20 мл). К оставшемуся раствору добавили соединение, описанное в примере 30а (3,9 г), K2CO3 (6,1 г) и малое количество бромида тетра-н-бутиламмония (около 50 мг). Смесь перемешивали в течение 5 ч при 60°С. Добавили воду и этилацетат и экстрагировали органический слой этилацетатом. Объединенные органические фракции промыли рассолом, сушили и концентрировали. Остаток перекристаллизовывали из толуола.
Выход: 3,8 г.
c) 4-[4-(2-Амино-5-фторбензилокси)-3-бром-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
К раствору продукта стадии b (3,8 г) в ТГФ (110 мл) добавляли уксусную кислоту (3,6 мл) и цинковую пыль (8,2 г). Суспензию нагревали в течение 1 ч при 50°С. Реакционную смесь отфильтровывали и концентрировали. Остаток растворяли в этилацетате и промывали насыщенным NaHCO3 и рассолом. Отделяли органический слой, высушивали (Na2SO4) и концентрировали. Оставшееся твердое вещество перемешивали с малым количеством этилацетата с образованием после фильтрации указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Выход: 2,8 г.
d) 4-[3-Бром-5-этокси-4-(5-фтор-2-пропиламинобензилокси)фенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Раствор соединения, описанного на стадии с (200 мг), и пропиональдегид (25 мкл) в дихлорметане (5 мл) перемешивали в течение 2 ч. Затем добавляли уксусную кислоту (81 мкл) и триацетоксиборгидрид натрия (300 мг) и дополнительно перемешивали реакционную смесь в течение 20 ч. Добавляли 2М водный раствор NaOH и продолжили перемешивание в течение 15 мин. Органический слой промывали водой и рассолом, высушивали и концентрировали в вакууме. Указанное в заголовке соединение было получено очисткой остатка препаративной ВЭЖХ (Luna C18 [5 мкм], скорость потока: 20 мл мин-1, 10→90% CH3CN, 0,1% TFA) и лиофилизацией из смеси воды и диоксана. Также могут быть выделены некоторые диалкилированные продукты (см. пример 32).
Выход: 109 мг.
MS-ESI: [M+H]+ = 610/612.
Пример 32
4-[3-Бром-4-(2-дипропиламино-5-фторбензилокси)-5-этоксифенил]-2-метил-5-оксо-7-пропил-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил
Получен из реакционной смеси примера 31d после препаративной ВЭЖХ (Luna C18 [5 мкм], скорость потока: 20 мл мин-1, 10→90% CH3CN, 0,1% TFA) и лиофилизации из смеси воды и диоксана.
Выход: 12 мг.
MS-ESI: [M+H]+ = 652/654.
Пример 33
Биоактивность СНО-FSH in vitro
FSH-активность соединений была протестирована на клетках яичника китайского хомячка (СНО), устойчиво трансфекцированных человеческим FSH рецептором и котрансфекцированных сАМР зависимым элементом (СRE)/промотор, направляющий экспрессию гена люциферазы светлячка. Связывание лиганда с Gs-связанным с FSH рецептором приведет к повышению сАМР, которое, в свою очередь, вызовет увеличение трансактивации конструкции репортера люциферазы. Сигнал люциферазы был измерен люминесцентным счетчиком. Для тестируемых соединений были рассчитаны значения ЕС50 (концентрация тестируемого соединения, вызывающая половину (50%) максимальной стимуляции). Для этих целей было использовано программное обеспечение GraphPad PRISM, версия 3,0 (GraphPad software Inc., San Diego).
Соединения всех примеров имели активность (ЕС50) менее чем при 10-5М. Соединения примеров 13, 16, 17, 19-21, 23, 26, 28 31 и 32 показали ЕС50 при между 10-7 и 10-9М. Соединения примеров 24 и 29 показали ЕС50 при менее чем 10-9М.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ФЕНИЛ-5-ОКСО-1,4,5,6,7,8-ГЕКСАГИДРОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2006 |
|
RU2412170C2 |
| ПРОИЗВОДНЫЕ 4-ФЕНИЛ-5-ОКСО-1, 4, 5, 6, 7, 8-ГЕКСАГИДРОХИНОЛИНА В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2006 |
|
RU2403243C2 |
| ПРОИЗВОДНЫЕ 4-ФЕНИЛ-5-ОКСО-1,4,5,6,7,8-ГЕКСАГИДРОХИНОЛИНА В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БЕСПЛОДИЯ | 2006 |
|
RU2403249C2 |
| ИНГИБИТОР, СОДЕРЖАЩИЙ БИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2820948C2 |
| ПИПЕРАЗИНО[1,2-А]ИНДОЛ-1-ОНЫ И [1,4]ДИАЗЕПИНО[1,2-А]ИНДОЛ-1-ОН | 2014 |
|
RU2628126C2 |
| ИНГИБИТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ПРОИЗВОДНОЕ ПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807611C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| НОВЫЕ ПИРИДАЗОНЫ И ТРИАЗИНОНЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАРАЖЕНИЯ ВИРУСОМ ГЕПАТИТА B | 2015 |
|
RU2664329C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-АЦИЛ-4-ФЕНИЛСУЛЬФОНИЛПРОЛИНАМИДА И НОВЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2615997C2 |
Изобретение относится к производным дигидропиридина, имеющим общую формулу
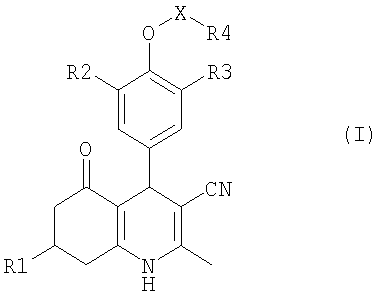
или их фармацевтически приемлемым солям, где R1 является C1-6алкилом или фенилом, С1-5гетероарилом, оба необязательно замещенные одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, циано; R2, R3 независимо являются С1-4алкилом, С1-4алкоксигруппой, С2-4алкенилоксигруппой, С3-4алкинилоксигруппой, галогеном; R4 является C1-6алкилом, С3-6циклоалкилом, С3-6циклоалкилС1-4алкилом,
С6-10арилом, С6-10арилС1-4алкилом, С1-9гетероарилом, причем (гетеро)арильная группа необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксигруппы, С1-4(ди)алкиламиногруппы, и, если R4 является фенилом, дополнительно из С1-4алкилтиогруппы, С1-4алкилсульфонила, R5-оксикарбонила, R5-карбонила или R5,R6-aминoкapбoнилa; Х является SO2, СН2, С(O) или X отсутствует, причем, если Х является СН2, R4 может дополнительно представлять собой R5-оксиакарбонил или R5-карбонил; R5, R6 независимо являются Н, С1-4алкилом, С2-4алкенилом, С2-4алкинилом, С3-6циклоалкилом, С3-6циклоалкилС1-4алкилом, С2-6гетероциклоалкилом, С2-6гетероциклоалкилС1-4алкилом, С1-4алкоксикарбонилС1-4алкилом, С1-4(ди)алкиламинокарбонилС1-4алкилом или
С6-10ариламинокарбонилС1-4алкилом, С1-9гетероариламинокарбонилС1-4алкилом,
С6-10арилом, С1-9гетероарилом, С6-10арилС1-4алкилом, С1-9гетероарилС1-4алкилом, причем (гетеро)арильная группа необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксигруппы, С1-4(ди)алкиламиногруппы или R5, R6 в R5, R6-аминокарбонильной группе могут быть связаны с С2-6гетероциклоалкильным кольцом, а также к фармацевтической композиции, обладающей агонистической активностью в отношении рецептора FSH, и к применению этих соединений для приготовления лекарственного средства. Технический результат: получены и описаны соединения, которые являются пригодными для лечения нарушений фертильности. 3 н. и 8 з.п. ф-лы.
1. Производное дигидропиридина формулы 1
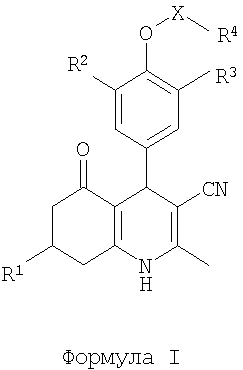
или его фармацевтически приемлемая соль, в которой
R1 является C1-6алкилом или фенилом, С1-5гетероарилом, оба необязательно замещенные одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, циано;
R2, R3 независимо являются С1-4алкилом, С1-4алкоксигруппой, С2-4алкенилоксигруппой, С3-4алкинилоксигруппой, галогеном;
R4 является C1-6алкилом, С3-6циклоалкилом, С3-6циклоалкилС1-4алкилом, С6-10арилом, С6-10арилС1-4алкилом, С1-9гетероарилом, причем (гетеро)арильная группа необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила,
С2-4алкинила, С1-4алкоксигруппы, С1-4(ди)алкиламиногруппы, и, если R4 является фенилом, дополнительно из С1-4алкилтиогруппы, С1-4алкилсульфонила, R5-оксикарбонила, R5-карбонила или R5,R6-aминoкapбoнилa;
Х является SO2, СН2, С(O) или X отсутствует, причем если Х является СН2, R4 может дополнительно представлять собой R5-оксиакарбонил, или R5-карбонил;
R5, R6 независимо являются Н, С1-4алкилом, С2-4алкенилом, С2-4алкинилом, С3-6циклоалкилом, С3-6циклоалкилС1-4алкилом, С2-6гетероциклоалкилом, С2-6гетероциклоалкилС1-4алкилом, С1-4алкоксикарбонилС1-4алкилом, С1-4(ди)алкиламинокарбонилС1-4алкилом или С6-10ариламинокарбонилС1-4алкилом, С1-9гетероариламинокарбонилС1-4алкилом, С6-10арилом, С1-9гетероарилом, С6-10арилС1-4алкилом, С1-9гетероарилС1-4алкилом, причем (гетеро)арильная группа необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкоксигруппы, С1-4(ди)алкиламиногруппы или
R5, R6 в R5, R6-аминокарбонильной группе могут быть связаны с C2-6гетероциклоалкильным кольцом;
при условии, что соединение не является 2-метил-5-оксо-7-фенил-4-(3,4,5-триметоксифенил)-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрилом.
2. Соединение по п.1, в котором R4 является фенилом, необязательно замещенным одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, С2-4алкенила, С2-4алкинила, С1-4алкокси, С1-4(ди)алкиламиногруппы, С1-4алкилтиогруппы, С1-4алкилсульфонила, R5-oкcикapбoнилa, R5-карбонила или R5,R6-аминокарбонила.
3. Соединение по п.2, в котором заместителем в фенильной группе в R4 является R5,R6-аминокарбонил, С1-4алкокси и/или галоген.
4. Соединение по п.3, в котором R5, в R5,R6-аминокарбонильной группе является
С1-4(ди)алкиламиногруппой и R6 является Н.
5. Соединение по п.3, в котором R5 в R5,R6-аминокарбонильной группе является
С1-9гетероарилС1-4алкилом, причем (гетеро)арильная группа необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, С1-4алкила, C2-4алкенила, С2-4алкинила, С1-4алкоксигруппы,
С1-4(ди)алкиламиногруппы или С1-4алкоксикарбонилС1-4алкила и R6 является Н.
6. Соединение по пп.1-5, в котором Х является СН2.
7. Соединение по пп.1-6, в котором R1 является С1-6алкилом, фенилом или С1-5гетероарилом.
8. Соединение по пп.1-7, в котором R2, R3 являются галогеном или C1-4алкоксигруппой.
9. Соединение по пп.1-8 для применения в терапии в качестве лекарственного средства для нарушения фертильности.
10. Фармацевтическая композиция, обладающая агонистической активностью в отношении рецептора FSH, содержащая соединение по любому из пп.1-8, включая 2-метил-5-оксо-7-фенил-4-(3,4,5-триметоксифенил)-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил и фармацевтически приемлемые вспомогательные вещества.
11. Применение соединения по любому из пп.1-8, включая 2-метил-5-оксо-7-фенил-4-(3,4,5-триметоксифенил)-1,4,5,6,7,8-гексагидрохинолин-3-карбонитрил, или его фармацевтически приемлемой соли, или его сольвата для приготовления лекарственного средства для лечения нарушения фертильности.
| МАТЕРИАЛ ДЛЯ МАГНИТНОЙ ЗАПИСИ | 0 |
|
SU330674A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| EP 0755931 A, 29.01.1997 | |||
| Экономайзер | 0 |
|
SU94A1 |
| ХИНОЛОНОВЫЕ И АКРИДИНОНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2124006C1 |
Авторы
Даты
2009-11-10—Публикация
2005-05-04—Подача