ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области систем культивирования клеток и клеточной технологии. Изобретение относится к композициям растительного происхождения для культивирования клеток, содержащим анионную нанофибриллярную целлюлозу.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Нейрон представляет собой специализированный тип клетки, встречающийся в организмах всех эуметазоев (т.е. всех основных групп животных, кроме губок, пластинчатых и некоторых других вымерших или малоизвестных живых организмов). Так, только губки и некоторые другие более простые животные не имеют нейронов. Характерными особенностями нейрона являются электрическая возбудимость и наличие синапсов, представляющих собой сложные мембранные контакты, через которые сигналы передаются к другим клеткам. Нейроны организма, а также глиальные клетки, которые обеспечивают им структурную и метаболическую поддержку, совместно составляют нервную систему. У позвоночных большая часть нейронов принадлежит центральной нервной системе (ЦНС), но некоторые находятся в периферических ганглиях, и многие сенсорные нейроны расположены в органах чувств, таких как сетчатка и улитка внутреннего уха.
Типичный нейрон подразделяют на три части: сому или тело клетки, дендриты и аксон. Сома обычно компактна; аксон и дендриты представляют собой филаменты, которые из нее выступают. Обычно дендриты обильно ветвятся, с каждым разветвлением становясь тоньше и простирая свои наиболее удаленные ветви на несколько сотен микрометров от сомы. Синаптические сигналы от других нейронов принимаются сомой и дендритами; сигналы к другим нейронам передаются через аксон. Нейроны передают сигналы через химические и электрические синапсы в ходе процесса, известного как нейротрансмиссия, также называемого синаптической передачей.
В большинстве случаев нейроны образуются из стволовых клеток специальных типов. Как правило, нейроны в головном мозге взрослых людей не подвергаются клеточному делению. Так, нейрогенез в значительной степени прекращается в зрелом возрасте в большинстве областей головного мозга. Астроциты представляют собой звездообразные глиальные клетки, для которых также наблюдали превращение в нейроны, благодаря характерной для стволовых клеток плюрипотентности.
Конструирование нервной ткани представляет собой новый перспективный способ терапии, и для связанного с нейронами применения были протестированы многие биоматериалы. При конструировании тканей осуществляют разработку биоматериалов с целью улучшения функционирования ткани или органа в организме человека. Конструирование нервной ткани относится к области, где объединение клеток, биоматериалов и факторов роста направлено на создание продукта, который может быть трансплантирован пациентам, страдающим от механического повреждения нерва либо заболеваний центральной или периферической нервной системы. В случае конструирования нервной ткани биоматериалы могут поддерживать рост клеток, поддерживать структуру ткани или улучшать функцию тканей/клеток. Биоматериалы для конструирования нервной ткани должны быть нетоксичными, трехмерными (3D), поддерживать рост клеток желаемого типа и обеспечивать поток питательных веществ.
Материалы на основе внеклеточного матрикса (ЕСМ), такие как коллаген, ламинин и фибронектин, чаще всего используются для структур нервных направляющих. В дополнение к этому, широко используемыми группами природных материалов для направления периферических нервов являются материалы на основе гиалуроновой кислоты и альгината. Еще более часто используемыми материалами являются синтетические полимеры. Примерами таковых являются поли(молочная кислота) (PLA), полигликолид, поли(ε-капролактон) (PCL) и сополимеры на их основе, биоразлагаемое стекло и полиэтилентерефталат (PTFE).
В случае культивирования клеток в трехмерном пространстве (3D) подходящая для культивирования матрица должна обладать способностью имитировать компоненты нативного ЕСМ, чтобы обеспечить каркас, обладающий аналогичными с нативным ЕСМ свойствами, такими как структурная поддержка для клеток и сеть взаимосообщающихся пор для эффективной миграции клеток и эффективного переноса питательных веществ в клетки.
Не так давно появившиеся гидрогели, как синтетического, так и природного происхождения, оказались подходящими каркасами для клеточной 3D-культуры. Сеть взаимосообщающихся пор в гидрогелях обеспечивает удерживание большого количества биологической жидкости, способствуя переносу кислорода, питательных веществ и отходов. Кроме того, большинство гидрогелей могут формироваться в мягких цитосовместимых условиях, а их биологические свойства можно модулировать с использованием химии поверхностных явлений.
Специально разработанные гидрогели с модифицированными механическими, химическими и биологическими свойствами потенциально могут имитировать ЕСМ, что таким образом определяет их пригодность для клеточных 3D-культур. Коммерческими продуктами для 3D-культивирования клеток являются, например, матрицы для клеточных культур PuraMatrix™ (3DM Inc.) и Матригель (BD Biosciences). PuraMatrix™ представляет собой гидрогель, состоящий из самоорганизующихся пептидных нановолокон, который напоминает структуру природного фибриллярного коллагена в ЕСМ с диаметром волокон 5-10 нм. Он также характеризуется высоким содержанием воды, в типичном случае 99,5%. Пептидные гидрогели описаны в US 7449180 и WO 2004/007683. Матригель представляет собой гелеобразную смесь белков, секретируемых опухолевыми клетками мышей. Эта смесь походит на сложную внеклеточную среду, обнаруживаемую во многих тканях, и используется специалистами в области биологии клеток в качестве субстрата для культивирования клеток. Матрица на основе ЕСМ MaxGel™ (Sigma-Aldrich), которая содержит смесь компонентов ЕСМ человека, образует гель при температуре окружающей среды.
Бактериальную целлюлозу (ВС) используют в ранозаживляющих мембранах и в качестве каркаса при культивировании клеток. Ограничением для применения бактериальной целлюлозы при культивировании клеток является структура, присущая ферментируемому материалу: при культивировании, из ВС в ферментере образуются очень плотные пленки на границе раздела «воздух-вода». Образующиеся пленки являются слишком плотными для 3D-культивирования клеток и различных модификаций. При использовании в качестве матрицы для культивирования клеток пористость матрицы на основе ВС следует повысить до значения, которое требуется для адекватного проникновения клеток и формирования кластеров клеток.
В US 5254471 описан носитель для культивирования клеток, содержащий ультратонкие волокна. В WO 2009/126980 описаны гидрогели на основе целлюлозы, каркасное вещество которых состоит по существу или полностью из целлюлозы и которые образуются посредством регенерации из органических растворителей. В ЕР1970436 В1 описано вещество-носитель для недифференцированных клеточных культур. В ЕР2633032 В1 описаны композиции растительного происхождения для культивирования и доставки клеток, содержащие нановолокна целлюлозы и/или их производные. ЕР2633033 В1 относится к композициям для культивирования и доставки клеток, содержащим нановолокна целлюлозы и/или их производные на основе микробной целлюлозы. В US9593304B2 описаны материалы для культивирования и переноса стволовых клеток в 3D-культуру. Такие материалы содержат нанофибриллярную целлюлозу в форме непрерывных 3D-структур и представляют собой биосовместимый гидрогель.
Новые биоматериалы и способы культивирования клеток млекопитающих ex vivo становятся все более необходимыми для изучения физиологии клеток и тканей и для выращивания замещающей ткани для регенеративной медицины, например, в случае трансплантации клеток. Двухмерная (2D) культура представляла собой парадигму типичной клеточной культуры in vitro; тем не менее, продемонстрировано, что клетки ведут себя более естественным образом при культивировании в 3D-средах. Пермиссивные синтетические гидрогели и стимулирующие природные гидрогели снискали популярность в качестве платформ для клеточных 3D-культур; однако, каждая из обеих этих систем все еще имеет ограничения.
Нанофибриллярная целлюлоза (NFC) представляет собой пригодный материал для 3D-культивирования клеток. NFC гидрогель (GrowDex™, UPM-Kymmene, Helsinki, Finland) на основе сорта природной нанофибриллярной целлюлозы особенно подходит для поддержания, например, образования сфероидов. Однако, типы клеток, которые в естественных условиях имеют тенденцию к росту и распространению, т.е. занимают большое пространство или являются объемными, как нервные клетки, не растут оптимальным образом на нанофибриллярной целлюлозе указанного сорта, а в некоторых случаях рост клеток ограничен.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
2D-Культуры нейронов более просты в обращении, но не имитируют ситуацию in vivo, при которой клетки взаимодействуют друг с другом и с окружающей средой, как в 3D-культурах, например, в 2D-культурах отсутствует тканеспецифичная архитектура (Geckil et al., 2010; Nisbet et al., 2008). Кроме того, нервные клетки имеют более сложную морфологию в 3D, и 3D-структуры могут усиливать созревание и ингибировать пролиферацию нервных клеток, происходящих из стволовых клеток. Таким образом, при разработке in vitro имитирующих in vivo моделей или клеточных продуктов для трансплантационной терапии очень важным является изучение клеток в 3D.
Ранее сообщалось, что анионные полимеры могут оказывать поддерживающее действие на нервные клетки (Hoffman, 2002). Авторы настоящего изобретения обнаружили, что анионная нанофибриллярная целлюлоза (aNFC) является более подходящим гидрогелем, чем нативный NFC гидрогель, для поддержания распространения и развития растущих клеток. В качестве примера, нервные клетки человека культивировали с образованием нейронных сетей. Гидрогели на основе aNFC лучше подходили для поддержания нервных клеток и в особенности для отрастания нейритов у одиночных клеток. Это улучшение основывается на двух улучшенных характеристиках гидрогеля: 1) анионном заряде на поверхности нанофибриллярной целлюлозы, индуцирующем перемещение клеток в гидрогелях. Клетки (в особенности нервные) имеют тенденцию воспринимать заряженные группы в фибриллах и распространяться вдоль/по направлению вытянутых фибрилл. 2) Прочность геля у анионного гидрогеля выше по сравнению с нативным сортом. Таким образом, культивирование клеток может быть осуществлено при более низком содержании фибрилл. Более низкое содержание твердых веществ дает возможность для более свободного перемещения клеток и образования отростков в гидрогеле, поскольку фибриллы не препятствуют перемещению клеток или, например, образованию нейритов. Оптимальное содержание твердых веществ в образце aNFC ниже 0,5 масс. %, предпочтительно ниже 0,4 масс. %.
Настоящее изобретение относится к композиции для культивирования растущих клеток, причем указанная композиция содержит aNFC растительного происхождения в форме гидрогеля. Более конкретно, изобретение относится к композиции для культивирования растущих клеток, причем указанная композиция содержит 0,05-0,5 масс. % aNFC растительного происхождения в форме гидрогеля.
Один из аспектов изобретения относится к матрице для культивирования клеток, при этом матрица содержит живые клетки и композицию для культивирования растущих клеток, причем указанная композиция содержит 0,05-0,5 масс. % aNFC растительного происхождения, и клетки присутствуют в указанной матрице в 3D- или 2D-расположении.
Один из аспектов изобретения относится к способу получения композиции для культивирования растущих клеток, причем указанная композиция содержит 0,05-0,5 масс. % aNFC растительного происхождения в форме гидрогеля, при этом указанный способ включает:
а) предоставление aNFC; и
б) смешивание указанной aNFC с водой.
Другой аспект относится к способу 3D- или 2D-культивирования клеток или тканей, включающему предоставление композиции для культивирования растущих клеток, причем указанная композиция содержит 0,05-0,5 масс. % aNFC растительного происхождения в форме гидрогеля, инокулирование указанной композиции по меньшей мере одной клеткой и культивирование с получением клеточной массы, либо в форме матрицы, содержащей живые клетки в 3D- или 2D-расположении, которые подвергают культивированию, с получением клеточной массы.
Согласно другому аспекту композицию, содержащую 0,05-0,5 масс. % aNFC растительного происхождения в форме гидрогеля, применяют для культивирования растущих клеток.
Характерные признаки данного изобретения представлены в прилагаемой формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показана классификация потерь гидрогеля в образцах: умеренная потеря геля (А) и сильная потеря геля (В). Белые стрелки-указатели указывают на области потери геля. Масштабная линейка на изображениях соответствует 500 мкм. Представлены изображения для образца 0,30%-ной aNFC объемом 60 мкл.
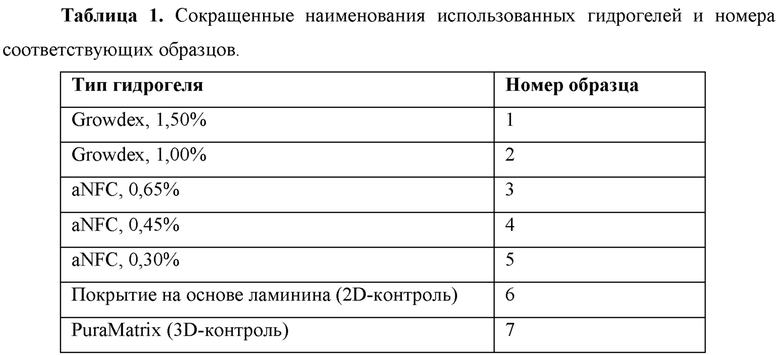
На Фиг. 2 показаны примеры образцов гидрогеля с хорошим ростом (А), умеренным ростом (В) и слабым ростом (С). Стрелки-указатели на изображениях указывают на отрастание нейритов. Маркерами на изображениях являются DAPI (4',6-диамидино-2-фенилиндол) (голубой цвет), MAP-2 (ассоциированный с микротрубочками белок 2) (зеленый цвет) и В-тубулин III (красный цвет). Масштабная линейка на изображениях соответствует 500 мкм. Гидрогелями на изображениях являются aNFC, 0,30%, 60 мкл (A), aNFC, 0,65%, 60 мкл (В) и Growdex, 1,50%, 60 мкл (С).
На Фиг. 3 показаны конфокальные изображения клеток, культивированных погруженными внутрь 1,50%-ного гидрогеля Growdex в течение двух недель. Три стека конфокальных изображений (1, 2 и 3) представлены в виде х-проекции максимальной интенсивности сверху вниз (А), проекции максимальной интенсивности сбоку и в виде визуализации в 3D. В плоскости х*у визуализируемая область составляет 377,13 мкм на 377,13 мкм на всех изображениях (А). Высота конфокальных стеков варьирует (z-направление, В). Изображения как А, так и В приведены в одном и том же масштабе. Все представленные изображения получены для образца объемом 60 мкл. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 4 показаны конфокальные изображения клеток, культивированных погруженными внутрь 1,00%-ного гидрогеля Growdex в течение двух недель. Три стека конфокальных изображений (1, 2 и 3) представлены в виде х-проекции максимальной интенсивности сверху вниз (А), проекции максимальной интенсивности сбоку и в виде визуализации в 3D. В плоскости х*у визуализируемая область составляет 377,13 мкм на 377,13 мкм на всех изображениях (А). Высота конфокальных стеков варьирует (z-направление, В). Изображения как А, так и В приведены в одном и том же масштабе. Все представленные изображения получены для образца объемом 60 мкл. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 5 показаны конфокальные изображения клеток, культивированных погруженными внутрь 0,65%-ного гидрогеля на основе aNFC в течение двух недель. Три стека конфокальных изображений (1, 2 и 3) представлены в виде х-проекции максимальной интенсивности сверху вниз (А), проекции максимальной интенсивности сбоку и в виде визуализации в 3D. В плоскости х*у визуализированная область составляет 377,13 мкм на 377,13 мкм на всех изображениях (А). Высота конфокальных стеков варьирует (z-направление, В). Изображения как А, так и В приведены в одном и том же масштабе. Все представленные изображения получены для образца объемом 60 мкл. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 6 показаны конфокальные изображения клеток, культивированных погруженными внутрь 0,45%-ного гидрогеля на основе aNFC в течение двух недель. Три стека конфокальных изображений (1, 2 и 3) представлены в виде х-проекции максимальной интенсивности сверху вниз (А), проекции максимальной интенсивности сбоку и в виде визуализации в 3D. В плоскости х*у визуализированная область составляет 377,13 мкм на 377,13 мкм на всех изображениях (А). Высота конфокальных стеков варьирует (z-направление, В). Изображения как А, так и В приведены в одном и том же масштабе. Изображения 1 и 3 получены для образца объемом 60 мкл, а изображение 2 получено для образца объемом 80 мкл. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 7 показаны конфокальные изображения клеток, культивированных погруженными внутрь 0,30%-ного гидрогеля на основе aNFC в течение двух недель. Три стека конфокальных изображений (1, 2 и 3) представлены в виде х-проекции максимальной интенсивности сверху вниз (А), проекции максимальной интенсивности сбоку и в виде визуализации в 3D. В плоскости х*у визуализированная область составляет 377,13 мкм на 377,13 мкм на всех изображениях (А). Высота конфокальных стеков варьирует (z-направление, В). Изображения как А, так и В приведены в одном и том же масштабе. Изображение 1 получено для образца объемом 60 мкл, а изображения 2 и 3 получены для образца объемом 80 мкл. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 8 в увеличенном масштабе показаны изображения отрастания нейритов для агрегатов клеток (Фиг. 4, 1А) в сравнении с одиночными клетками (Фиг. 7, 1А), представленные в виде х-проекции максимальной интенсивности сверху вниз. Маркерами на изображениях являются DAPI (голубой цвет), МАР-2 (зеленый цвет) и В-тубулин III (красный цвет).
На Фиг. 9 показано образование имеющих округлую форму сфероидов фибробластов кожи человека (HDF) в гидрогеле GrowDex (Фиг. 9А). В гидрогеле GrowDexT клетки HDF растут в виде кластеров и образуют отростки, и это позволяет предположить, что клетки воспринимают свое окружение (Фиг. 9В).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аспекты настоящего изобретения относятся к композициям для культивирования клеток, структурам клеточных 3D-культур и способам их получения и применения при культивировании клеток. Если не указано иное, то термины, использованные в описании и формуле изобретения, имеют значения, обычно применяемые в области культивирования клеток. Конкретно, приведенные далее термины имеют значения, указанные ниже.
Термин «целлюлозная масса» относится к целлюлозным фибриллам, которые выделяют из любого растительного целлюлозного или лигноцеллюлозного исходного материала с использованием химических, механических, термомеханических или химико-термомеханических способов варки целлюлозы, например, крафт-процесс, сульфатный процесс, натронная варка, органосольвентная варка. Целлюлозная масса может быть подвергнута отбеливанию с использованием традиционных способов отбеливания.
Термин «нативная целлюлозная масса» или «нативная целлюлоза» относится в данном описании к любой целлюлозной массе, которая не была химически модифицирована после процесса варки и возможного процесса отбеливания.
Термин «растительного происхождения» или «целлюлозный материал растительного происхождения» может относиться к древесине, и указанная древесина может быть древесиной хвойного дерева, такого как ель, сосна, пихта, лиственница, дугласова пихта или тсуга, либо древесиной лиственного дерева, такого как береза, осина, тополь, ольха, эвкалипт или акация, либо быть смесью древесины хвойных деревьев и древесины лиственных деревьев. Недревесные материалы растительного происхождения могут происходить, например, из сельскохозяйственных отходов, злаковых или других растительных материалов, таких как солома, листья, кора, семена, шелуха, цветки, растения или плоды хлопчатника, кукурузы, пшеницы, овса, ржи, ячменя, риса, льна, пеньки, манильской пеньки, сизальской пеньки, джута, рами, кенафа, багассы, бамбука или камыша или их смесей.
Термин «механически дезинтегрированный» относится в данном описании к тому, что для получения нанофибриллярной целлюлозы осуществляют механическую дезинтеграцию целлюлозной массы или окисленного целлюлозного исходного материала с использованием подходящего оборудования, такого как рафинер, дробилка, гомогенизатор, аппарат для получения коллоидной целлюлозы, фрикционная дробилка, ультразвуковой диспергатор, флюидизатор, такой как микрофлюидизатор, макрофлюидизатор или гомогенизатор по типу флюидизатора. Предпочтительно используют механически дезинтегрированную нанофибриллярную целлюлозу.
С использованием различных технологий производства разработаны несколько разных сортов нанофибриллярной целлюлозы. Эти сорта обладают разными свойствами, зависящими от способа получения, степени образования волокон и химического состава. Химический состав данных сортов также варьирует. В зависимости от источника исходного материала, например, HW (древесины лиственных деревьев) в сравнении с SW (древесиной хвойных деревьев), конечный продукт - нанофибриллярная целлюлоза - имеет разный полисахаридный состав. Обычно неионные или нативные сорта характеризуются большим диаметром фибрилл, в то время как фибриллы химически модифицированных сортов намного тоньше и образуют непрерывную сеть. Среднечисленный диаметр фибрилл целлюлозной нанофибриллы составляет соответственно от 1 до 200 нм, предпочтительно, чтобы среднечисленный диаметр фибрилл нативных сортов составлял от 1 до 100 нм, а химически модифицированных сортов от 1 до 20 нм. У модифицированных сортов также более узкое распределение по размерам. Для применений с целью культивирования клеток нанофибриллярная целлюлоза предпочтительно является нетоксичной для клеток.
Подразумевается, что использованный в данном описании термин «нанофибриллярная целлюлоза» охватывает нанофибриллярные структуры, высвобождаемые из целлюлозных материалов растительного происхождения, таких как целлюлозная масса из древесины лиственных пород или древесины хвойных пород.
Номенклатура, касающаяся нанофибриллярной целлюлозы, не является единообразной, и в литературе применяются противоречивые термины. Например, для нанофибриллярной целлюлозы могли бы быть использованы в качестве синонимов приведенные ниже термины: целлюлозное нановолокно (CNF), состоящая из нанофибрилл целлюлоза, нанофибриллированная целлюлоза (NFC), наноразмерная фибриллированная целлюлоза, микрофибриллярная целлюлоза, целлюлозные микрофибриллы, микрофибриллированная целлюлоза (MFC) и состоящая из фибрилл целлюлоза. Самые мелкие целлюлозные структуры из целлюлозной массы растительного происхождения, такой как целлюлоза древесины, включают молекулы целлюлозы, единичные фибриллы и микрофибриллы. Единицами микрофибрилл являются пучки из единичных фибрилл, образованные в результате физически обусловленной коалесценции, как механизма уменьшения свободной поверхностной энергии. Тем не менее, в данном описании термин «нанофибриллярная целлюлоза» или NFC относится к совокупности целлюлозных нанофибрилл, высвобождаемых из целлюлозной массы или целлюлозного материала, в частности, из единиц микрофибрилл. Их диаметры могут варьировать в зависимости от источника. Целлюлозная нанофибрилла обычно характеризуется большим значением соотношения сторон: длина превышает один микрометр, в то время как диаметр в типичном случае составляет менее 100 нм. Самые мелкие нанофибриллы сходны с так называемыми единичными фибриллами, диаметр которых обычно находится в диапазоне 2-12 нм. Размеры высвобождаемых нанофибрилл или пучков нанофибрилл зависят от исходного материала, каких-либо предварительных обработок и способа дезинтеграции. В нанофибриллярной целлюлозе могут содержаться интактные, не подвергшиеся фибриллированию единицы микрофибрилл. Подразумевается, что использованный в данном описании термин «нанофибриллярная целлюлоза» не охватывает нефибриллярные, стержнеобразные нанокристаллы или нитевидные кристаллы целлюлозы.
Термин «анионная нанофибриллярная целлюлоза» или «aNFC» относится к нанофибриллярной целлюлозе, которая была подвергнута химической дериватизации, т.е. химически модифицирована с целью придания нанофибриллярной целлюлозе анионных свойств посредством введения на ее поверхность отрицательно заряженных групп. Для aNFC растительного происхождения по изобретению химическую дериватизацию осуществляют до получения NFC, т.е. до проведения механической дезинтеграции целлюлозного исходного материала.
Нанофибриллярной целлюлозой по настоящему изобретению является aNFC. aNFC получают посредством анионизации. Анионизация представляет собой пример химической дериватизации, т.е. пример химической модификации. Анионизация или получение aNFC представляет собой модификацию с целью придания нанофибриллярной целлюлозе анионных свойств посредством введения на ее поверхность отрицательно заряженных групп. Одним из примеров анионизации является анионизация с использованием окисления в присутствии (2,2,6,6-тетраметилпиперидин-1-ил)оксила (TEMPO). Другими примерами являются карбоксиметилирование и сульфонирование. Эти реакции проводят в качестве предварительной обработки целлюлозной массы или другого целлюлозного исходного материала перед проведением механической дезинтеграции или высвобождением нанофибрилл другими способами. В результате осуществления данных способов получают заряженную aNFC. Обычно модификации подвергают весь исходный материал, и возможные количества немодифицированной целлюлозы являются незначительными.
Согласно одному из воплощений анионная нанофибриллярная целлюлоза растительного происхождения содержит карбоксиметилированную или сульфонированную нанофибриллярную целлюлозу.
Нанофибриллярные целлюлозы, особенно подходящие для применения в настоящем изобретении, выбраны из aNFC растительного происхождения и/или любых комбинаций разных aNFC. Обычно aNFC, используемые в настоящем изобретении, представляют собой нативные целлюлозы, которые были анионизированы, или альтернативно модифицированные целлюлозы, которые анионизированы.
Получение производных целлюлозы физическими методами с получением анионной целлюлозы может быть осуществлено путем физической адсорбции анионных веществ на поверхности целлюлозы.
Дериватизированные сорта обычно получают из отбеленных целлюлозных масс. Любые присутствующие молекулы гемицеллюлозы могут также подвергаться дериватизации в подвергнутых дериватизации сортах NFC.
Примеры получения нанофибриллярной целлюлозы описаны, например, в ЕР2782937А1, где описано карбоксиметилирование, и в WO 2015/015056, где описано окисление.
Дериватизированные сорта нанофибриллярной целлюлозы обычно характеризуются меньшим диаметром нанофибрилл и более узкими распределениями по размерам, чем нативные или не дериватизированные сорта нанофибриллярной целлюлозы. Чем меньше размер нанофибрилл, тем больше площадь поверхности и, следовательно, эффективная заряженная поверхность. После подвергания целлюлозы дериватизации она становится более лабильной и удобной для дезинтеграции. Как правило, нанофибриллы меньшего размера, достигнутые посредством анионной дериватизации, полезны для настоящего изобретения.
Нанофибриллы дериватизированных сортов нанофибриллярной целлюлозы обычно тоньше, чем у нативной нанофибриллярной целлюлозы. Среднечисленный диаметр нанофибрилл aNFC растительного происхождения может варьировать от 2 до 200 нм или от 2 до 100 нм. Предпочтительно, среднечисленный диаметр для aNFC растительного происхождения составляет 2-20 нм или 2-10 нм, более предпочтительно 3-6 нм. Самые мелкие нанофибриллы сходны с так называемыми единичными фибриллами, диаметр которых обычно составляет 2-12 нм. Приведенные выше значения рассчитаны на основе изображений, полученных с применением криогенной трансмиссионной электронной микроскопии (Cryo-ТЕМ). Размеры нанофибрилл или пучков нанофибрилл зависят от исходного материала и способа дезинтеграции. Выполнить точные измерения длины нанофибриллы довольно сложно. Длина нанофибрилл у aNFC растительного происхождения обычно изменяется в диапазоне от 0,3 до 50 микрометров или от 0,3 до 20 микрометров. Предпочтительно, чтобы длина составляла 0,5-20 микрометров или 0,5-10 микрометров и более предпочтительно 1-10 микрометров или 1-5 микрометров. Длина зависит от применяемого способа анионизации. Приведенные выше значения рассчитаны на основе изображений, полученных с применением электронной микроскопии или атомно-силовой микроскопии (AFM).
Степень фибриллирования можно оценить исходя из анализа фибрилл, в котором оценивают количество более крупных, подвергшихся только частичному фибриллированию структур. В случае анионной нанофибриллярной целлюлозы растительного происхождения число таких не подвергшихся фибриллированию частиц на один мг сухого образца варьирует от 1 до 10000, предпочтительно от 1 до 5000, наиболее предпочтительно от 1 до 1000. Анализ фибрилл соответственно может быть проведен с использованием метода анализа от FiberLab.
Нанофибриллярная целлюлоза образует структуры гидрогеля с желаемой вязкостью при диспергировании в водной среде, такой как вода. Для образования гидрогеля может быть использован любой подходящий аппарат для смешивания или составления смесей.
Изучение реологических свойств гидрогелей на основе нанофибриллярной целлюлозы растительного происхождения указывает на обратимое гелеобразование. При высоких уровнях напряжения наблюдается поведение, сходное с поведением жидкости, в то время как при низких уровнях напряжения и в состоянии покоя происходит поэтапный переход к поведению, сходному с поведением твердого тела. Поскольку изменение окружения не вызывает конформационных изменений полимерных цепей гидрогеля нанофибриллярной целлюлозы, прочность геля остается практически постоянной в широких интервалах температур, рН или ионной силы.
Жесткость гидрогелей на основе нанофибриллярной целлюлозы можно оценить, исходя из измерений вязкоупругих свойств гелей. Жесткость гидрогелей на основе нанофибриллярной целлюлозы также отражает легкость растекания гидрогелей. При графическом изображении вязкости как функции от приложенного напряжения сдвига резкое уменьшение вязкости наблюдается после превышения значения критического напряжения сдвига (модуль потерь G'' больше динамического модуля упругости G' и, следовательно, тангенс угла потерь более 1).
Ткани являются вязкоупругими материалами и состоят из клеток и ЕСМ. Жесткость или прочность матрикса является одним из многих механических сил, действующих на клетки, и рассматривается как важный медиатор клеточного поведения. Она регулирует передачу сигнала в клетках и оказывает влияние, например, на рост, выживаемость, расположение и подвижность клеток. Оптимальная жесткость варьирует в широких пределах для клеток разных видов. Например, сообщалось, что разные типы клеток печени по-разному реагируют на жесткость матрикса.
Также продемонстрировано, что жесткость отдельных коллагеновых фибрилл может варьировать воспроизводимым образом, и оказывает значительное влияние на клеточный фенотип.
Кроме того, известно, что клетки обладают чувствительностью к механическому воздействию на относительно коротких расстояниях, примерно равных ширине соседней клетки. Следовательно, в ткани клетка вряд ли будет ощущать действие механических сил за пределами своего ближнего соседа. Кроме того, клетки, из которых состоят ткани, обладают способностью к адгезии, прикреплены к некоторой совокупности соседствующих с ними клеток и к окружающему ЕСМ. Большинству клеток, но не всем, адгезия необходима для выживания.
Сообщалось, что нанофибриллярная целлюлоза хорошо выполняет функцию матрицы для клеточных культур. Считается, что сеть целлюлозных нанофибрилл имитирует ЕСМ, поддерживая жизнеспособность и пролиферацию клеток. Жесткость гидрогелей на основе нанофибриллярной целлюлозы можно легко корректировать путем разведения.
Нанофибриллярная целлюлоза по настоящему изобретению обладает свойствами, которые обеспечивают получение оптимальной матрицы для культивирования клеток и тканей.
Имели место затруднения при поддержании и выращивании клеток во всей толще гидрогелей. В настоящем изобретении условия поддержания и роста клеток улучшены. Нанофибриллярная целлюлоза по настоящему изобретению и гидрогель на ее основе обеспечивают оптимальную жесткость или прочность и оптимальную толщину.
В настоящем изобретении количество нанофибриллярной целлюлозы, необходимое для достижения желаемой жесткости, может быть ниже по сравнению с предшествующим уровнем техники.
Нанофибриллярная целлюлоза может иметь динамический модуль упругости в диапазоне от 1 до 40 Па, предпочтительно от 3 до 30, более предпочтительно от 5 до 20, при диспергировании в воде в концентрации 0,5 масс. %.
Согласно одному из воплощений aNFC растительного происхождения имеет тангенс угла потерь более 1, когда диапазон динамического модуля упругости составляет 1-20 Па, предпочтительно 2-10 Па, при диспергировании в воде в концентрации 0,5 масс. %).
Тангенс угла потерь для нанофибриллярной целлюлозы по настоящему изобретению составляет значение менее 0,3, предпочтительно менее 0,25, когда напряжение сдвига менее 0,5 Па.
Согласно одному из воплощений изобретения aNFC растительного происхождения содержит нанофибриллярную целлюлозу, полученную из окисленного целлюлозного исходного материала, имеющую содержание карбоксилатных групп выше 0,75 ммоль/г, предпочтительно 0,75-1,6 ммоль/г, более предпочтительно 0,9-1,2 ммоль/г из расчета на массу целлюлозного исходного материала.
Согласно одному из воплощений изобретения aNFC растительного происхождения представляет собой целлюлозу I типа (кристаллическую форму I целлюлозы). Согласно другому воплощению aNFC растительного происхождения также может содержать другие формы целлюлозы. Известно несколько разных кристаллических структур целлюлозы. Структуры соответствуют расположению водородных связей между нитями целлюлозы и внутри них. Природная целлюлоза представляет собой целлюлозу I типа. Целлюлоза в регенерированных целлюлозных фибриллах представляет собой целлюлозу II типа. Целлюлоза высших растений состоит главным образом из субструктурированной целлюлозы Iβ.
Согласно одному из воплощений aNFC растительного происхождения представляет собой окисленную в присутствии TEMPO нанофибриллярную целлюлозу. aNFC растительного происхождения может быть получена методом окисления в присутствии TEMPO, включающим стадии сначала окисления первичных спиртовых групп целлюлозы до альдегидных групп и групп карбоновых кислот путем окисления в присутствии TEMPO с использованием гипохлорита натрия в качестве основного окислителя с получением окисленной целлюлозы, характеризующейся определенным содержанием карбоксильных групп, и затем образования фибрилл из окисленной массы с получением aNFC. aNFC растительного происхождения по изобретению может представлять собой окисленную в присутствии TEMPO нанофибриллярную целлюлозу, имеющую альдегидные группы в количестве меньшем или равном 0,3 ммоль/г, предпочтительно меньшем или равном 0,2 ммоль/г, более предпочтительно меньшем или равном 0,15 ммоль/г из расчета на массу сухого вещества нанофибриллярной целлюлозы.
Химический состав или модификацию нанофибриллярной целлюлозы обычно описывают как степень замещения (DS). Получение производных путем анионизации целлюлозного исходного материала, используемого в настоящем изобретении, проводят до достижения определенных уровней степени замещения перед фибриллированием/механической дезинтеграцией. Степень замещения в способе химической дериватизации может варьировать в широких пределах.
Согласно одному из воплощений изобретения aNFC растительного происхождения содержит нанофибриллярную целлюлозу, полученную из анионизированного целлюлозного исходного материала, имеющую степень замещения (ds или DS) по меньшей мере 0,08. Степень замещения для aNFC растительного происхождения обычно находится в диапазоне уровней ds от 0,08 до 0,3. Предпочтительно, степень замещения для aNFC растительного происхождения составляет от 0,1 до 0,25 или более предпочтительно от 0,12 до 0,2. Например, степень замещения может быть равна 0,10, 0,11, 0,12, 0,13, 0,14, 0,15, 0,16, 0,17, 0,18 или 0,19. Было установлено, что в настоящем изобретении такие конкретные уровни ds являются предпочтительными, поскольку при таких уровнях ds анионная нанофибриллярная целлюлоза, полученная после механической обработки, обладает оптимальными свойствами. Получали гидрогель высокого качества, обладающий высокой вязкостью и с большим значением соотношения сторон. Помимо этого, необходимую для измельчения энергию поддерживали на среднем уровне.
Согласно одному из воплощений изобретения aNFC растительного происхождения содержит нанофибриллярную целлюлозу, получаемую из карбоксиметилированного целлюлозного исходного материала, имеющую степень замещения выше 0,1, предпочтительно от 0,1 до 0,3, более предпочтительно от 0,12 до 0,2.
Целлюлоза aNFC растительного происхождения может быть получена из целлюлозного материала, источником которого является растительный целлюлозный или лигноцеллюлозный исходный материал, с использованием химических, механических, термомеханических или химико-термомеханических способов варки целлюлозы. Согласно одному неограничивающему воплощению, такой исходный целлюлозный материал не содержит регенерированных целлюлозных фибрилл, где целлюлоза представляет собой целлюлозу II типа, и/или фибриллы вторичной переработки.
Согласно одному неограничивающему аспекту, aNFC растительного происхождения представляет собой не подвергнутую мерсеризации нанофибриллярную целлюлозу.
Термин «гидрогель», или «гель», или «гидрогель на основе нанофибриллярной целлюлозы» относится к водной дисперсии нанофибриллярной целлюлозы, имеющей гомогенную и непрерывную гелевую структуру. Гидрогель может быть образован путем объединения нанофибриллярной целлюлозы, например, с водой, буферным раствором или средой для культивирования клеток либо каким-либо другим водным раствором, возможно дополненным вспомогательными веществами. Термин «гидрогель» применительно к нанофибриллярной целлюлозе относится к форме, в которой водная дисперсия нанофибриллярной целлюлозы имеет тангенс угла потерь менее 1. Гидрогель представляет собой полимерный материал, который проявляет способность набухать и удерживать значительную долю воды в пределах своей структуры, но он не растворяется в воде. Гидрогели на основе NFC образуются спонтанно без образования ковалентных связей; поэтому их прочность без труда может быть изменена, например, в результате разбавления. Гидрогель на основе NFC обладает хорошей суспендирующей емкостью. Гидрогель на основе NFC представляет собой так называемый обратимый или физический гель с вовлечением физического перекрестного сшивания посредством переплетения фибрилл. Взаимодействия в данной сети могут быть нарушены посредством приложения усилия, поэтому гидрогели на основе NFC обладают способностью к разжижению при сдвиге. Вязкоупругие свойства каркаса на основе гидрогеля из нанофибриллярной целлюлозы растительного происхождения значительно отличаются от таковых для каркасов на основе нанофибриллярной целлюлозы из других источников, как например, для каркасов на основе бактериальной целлюлозы.
Нанофибриллярная целлюлоза по настоящему изобретению имеет мутность, 20 NTU или менее, предпочтительно 10 NTU или менее, более предпочтительно 6 NTU или менее. Значение мутности может находиться в диапазоне от 20 до 1 NTU, более предпочтительно от 10 до 1 NTU, как например 9, 8, 7, 6, 5, 4, 3, 2, наиболее предпочтительно от 6 до 1 NTU, в воде в концентрации 0,1 масс. %.
Согласно одному из аспектов нанофибриллярная целлюлоза имеет мутность, составляющую 20 NTU или менее, предпочтительно 10 NTU или менее, более предпочтительно 6 NTU или менее, предпочтительно значение мутности находится в диапазоне от 20 до 1 NTU, более предпочтительно от 10 до 2 NTU, в воде в концентрации 0,1 масс. %).
Мутность можно измерить количественно, используя оптические приборы для измерения мутности. Имеется несколько серийных турбидиметров, общедоступных для количественного измерения мутности. В случае настоящего изобретения используется способ, основанный на нефелометрии. Единицы измерения мутности в случае откалиброванного нефелометра называются нефелометрическими единицами мутности (NTU). Калибровку и регулировку измерительного прибора (турбидиметра) выполняют с использованием стандартных калибровочных образцов, после чего измеряют мутность разбавленного образца NFC.
Конечный продукт обладает отличными гелеобразующими свойствами и прозрачностью, а также гомогенной структурой. Прозрачность обусловлена отсутствием пучков фибрилл, что приводит к гомогенной структуре. Прозрачность конечного гидрогеля на основе нанофибриллярной целлюлозы дает возможность для оптической детекции клеток с помощью световой микроскопии благодаря более низкому рассеянию света. Кроме того, нанофибриллярная целлюлоза не обладает собственной флуоресценцией. Ввиду этого нанофибриллярная целлюлоза по настоящему изобретению обладает улучшенными свойствами с точки зрения визуализации. Применение нанофибриллярной целлюлозы и гидрогеля по настоящему изобретению позволяет осуществлять 3D-визуализацию, которая раньше была невозможна.
Степень кристалличности нанофибриллярной целлюлозы по настоящему изобретению может варьировать от 60% до 80%, предпочтительно от 65 до 75%. Степень кристалличности может составлять, например, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 78%, 79% или 80%.
Термин «дисперсия» применительно к нанофибриллярной целлюлозе охватывает как гидрогели на основе нанофибриллярной целлюлозы, так и более разбавленную водную систему, не отвечающую приведенному выше требованию касательно гидрогеля. Дисперсия представляет собой систему, в которой частицы диспергированы в непрерывной фазе, отличающейся от агрегатного состояния самих частиц.
Термин «водная среда» относится к любой водной среде, такой как вода, деионизованная вода, буферный раствор или питательная среда, подходящей для поддержания, транспортировки, выделения, культивирования, размножения, пассирования или дифференцировки клеток или тканей. Водная среда может дополнительно содержать различные вспомогательные вещества, такие как специальные компоненты внеклеточного матрикса, сыворотка, факторы роста, антибиотики, консерванты, пептиды и белки. Как известно в данной области техники, выбор сред для культивирования клеток зависит от типа подлежащих культивированию клеток. Существует большое количество коммерческих сред для культивирования клеток, которые поддерживают рост недифференцированных или дифференцированных клеток. Примеры сред для культивирования клеток, подходящих для применения в настоящем изобретении, включают mTeSR1 (StemCell Technologies), среды для мезенхимальных стволовых клеток (Lonza, Walkersville, MD, №РТ-3001), не содержащую сыворотки или фидера среду (SFM) для культивирования стволовых клеток человеческого эмбриона (hESC) STEMPRO® (Invitrogen), среды Уильямс Е (Invitrogen) и среды для дифференцировки.
Термин «суспендированный» или «суспензия» при использовании в контексте структур 3D-объекта или гидрогеля относится к гетерогенной смеси водной среды и гидрогеля, при этом гидрогель может быть представлен в виде отдельных или взаимосвязанных структур гидрогеля.
Термин «матрица для культивирования клеток» относится к системе, содержащей клетки и/или ткань и 3D-объект, причем клетки и/или ткань по меньшей мере частично погружены внутрь указанного объекта в 3D- или 2D-расположении. Обозначения 3D и 2D в контексте клеточных культур относятся к способу расположения клеток, например, 3D может относиться к кластере- или сфероидоподобному расположению, а 2D к расположению в виде одного или нескольких слоев. Термин «матрица для культивирования клеток» также относится к материалу, спроектированному для культивирования клеток и обеспечивающему получение матрицы для роста, которая увеличивает доступную для прикрепления клеток поверхность с тем, чтобы имитировать инфраструктуру ткани.
Термин «клеточная культура» или «культивирование клеток» относится к поддержанию, транспортировке, выделению, культивированию, размножению, пассированию или дифференцировке клеток или тканей. Клетки могут находиться в любой конфигурации, например, в виде отдельных клеток, монослоев, кластеров клеток или сфероидов либо в виде ткани.
Термин «растущая клетка» относится к клетке, которая в естественных условиях имеет тенденцию к росту, ветвлению и распространению, т.е. занимает большое пространство или является объемной. Растущая клетка может расти, например, используя образующиеся отростки или выступающие части, и/или используя выступающие части/отростки для перемещения, например, в матрикс. Растущая клетка может использовать отростки или выступающие части также для образования каркасов или сетей. Примерами растущих клеток являются нервные клетки, которые растут в том смысле, что они отращивают нейриты. Ветвление дендритов представляет собой многостадийный биологический процесс, посредством которого нейроны образуют новые дендритные деревья и ветви для создания новых синапсов. Эндотелиальные клетки, которые образуют выстилки кровеносных сосудов и лимфатических сосудов, также можно считать растущими клетками. Многие типы клеток млекопитающих могут агрегировать и дифференцироваться в многоклеточные 3D-сфероиды при культивировании в суспензии или неадгезивном окружении. Растущие клетки вместо образования сфероидов перемещаются и растут.
Термин «нервная клетка» или «нейрон» относится к трем основным фенотипам клеток ЦНС, т.е. нейронам, глиальным клеткам и астроцитам. «Нейрит» или «отросток нейрона» относится к любой выступающей части клеточного тела нейрона. Эта выступающая часть может представлять собой или аксон, или дендрит. Термин «отрастание нейритов» относится к ключевому процессу во время миграции и дифференцировки нейронов. Сложная внутриклеточная передача сигнала вовлечена в инициацию отрастания и последующего удлинения нейритов. На образование сложных нейронных сетей сильно влияет ветвление аксонов. Предпочтительно, чтобы клетками, используемыми в данном изобретении, были нервные клетки. Термин «нейроноподобные клетки» относится к клеткам, которые не считаются зрелыми нейронами. Термин «нейроноподобный» означает, что эти клетки обладают свойствами, схожими со свойствами нейронов, например, способностью к высвобождению нейромедиатора с использованием везикул.
Термин «эндотелиальные клетки» относится к клеткам сосудистого эндотелия, которые находятся в непосредственном контакте с кровью, и к лимфатическим эндотелиальным клеткам, которые находятся в непосредственном контакте с лимфой.
Производное нанофибриллярной целлюлозы может представлять собой любое химически или физически модифицированное производное нанофибриллярной целлюлозы или пучки нанофибрилл. Химическая модификация может быть основана, например, на реакции карбоксиметилирования, окисления, эфиризации или этерификации молекул целлюлозы. Описанная модификация может быть проведена до, после или во время получения нанофибриллярной целлюлозы. В результате проведения некоторых модификаций могут быть получены NFC материалы, которые разлагаются в организме человека. Производное может содержать стимулирующие рост белки, присоединенные ковалентными связями или посредством слабых связей либо с использованием адсорбции.
Микробиологическая чистота нанофибриллярной целлюлозы и гидрогелей, содержащих ее, является существенным показателем для проведения культивирования клеток. Поэтому нанофибриллярная целлюлоза может быть подвергнута стерилизации перед проведением экспериментов по культивированию клеток в гидрогелевой форме. Помимо этого, важно свести к минимуму загрязнение продукта микроогранизмами до и во время фибриллирования. Перед фибриллированием целесообразно проводить отбор целлюлозной массы с целлюлозного завода в асептических условиях незамедлительно после стадии отбеливания, когда эта масса все еще остается стерильной.
Известно, что макромолекулы целлюлозы являются молекулами, обладающими очень высокой химической стабильностью. Гидролиз целлюлозы требует применения жестких условий, и обычно используют сильные кислоты, подобные 56%-ной серной кислоте.
Размеры отдельных целлюлозных нанофибрилл у нанофибриллярной целлюлозы близки к размерам фибрилл коллагена в ЕСМ, т.е. 4-10 нм. Поэтому гидрогели на основе NFC можно использовать в качестве матрицы для клеточных 3D-культур.
В экспериментах с культивированием клеток по настоящему изобретению используют химически модифицированную aNFC, образующую оптически прозрачные гидрогели. Подробное описание материалов представлено в разделе «Примеры, материалы и методы». Концентрацию aNFC в гидрогеле адаптируют к концентрации, подходящей для клеток, подлежащих культивированию. Концентрация aNFC в общем объеме может варьировать в диапазоне 0,05-3% (масс./об.) в зависимости, например, от типа клеток и клеточной линии. При культивировании нервных клеток может быть использован диапазон 0,05-0,5% (масс/об.), например, концентрации в масс/об., составляющие 0,05%, 0,055%, 0,06%, 0,065%, 0,07%, 0,075%, 0,08%, 0,085%, 0,09%, 0,095%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45% или 0,5%. Предпочтительно, чтобы данный диапазон составлял 0,05-0,35% (масс/об.).
Нанофибриллярная целлюлоза или ее производное по настоящему изобретению может содержать химически или физически модифицированные производные нанофибриллярной целлюлозы или пучки нанофибрилл.
Нанофибриллярная целлюлоза, описанная в данном изобретении, не является тем же материалом, что и так называемые нитевидные кристаллы целлюлозы, которые также известны как: нитевидные нанокристаллы целлюлозы, нанокристаллы целлюлозы, наностержни целлюлозы, стержневидные микрокристаллы целлюлозы или нанопроволоки целлюлозы. В некоторых случаях для описания обоих видов материалов используется одинаковая терминология, например, в работе Kuthcarlapati и др. (2008), где исследуемый материал назван «целлюлозным нановолокном», хотя он явно относился к нитевидным нанокристаллам целлюлозы. Обычно эти материалы не содержат аморфных сегментов в составе такой фибриллярной структуры, как нанофибриллы целлюлозы, которые приводят к образованию более жесткой структуры. Кроме того, нитевидные кристаллы целлюлозы короче нанофибрилл целлюлозы; в типичном случае их длина составляет менее одного микрометра.
Термин «изделие для культивирования клеток» относится к любому изделию, подходящему для культивирования клеток, включая одно- и многолуночные планшеты, такие как 6-, 12-, 96-, 384- и 1536-луночные планшеты, банки, чашки Петри, колбы, многослойные колбы, химические стаканы, плоские чашки, роллерные флаконы, кассеты, такие как разделенные на камеры и многокамерные кассеты для культивирования, пробирки, покровные стекла, пакеты, мембраны, полые волокна, гранулы и микроносители, чашки, вращающиеся бутылки, перфузионные камеры, шприцы, биореакторы и ферментеры.
Термин «формирование» относится к формированию композиции, возможно во вспомогательном материале или на его поверхности. Формирование может быть осуществлено методами 3D-печати, вращения, распыления, нанесения капель, растекания, нанесения покрытия или пропитки с одновременным или последующим перекрестным сшиванием, предпочтительно формирование композиции непосредственно в условиях перекрестного сшивания или химического взаимодействия.
Термин «сформированная матрица» относится к матрице, которая имеет такую форму, как проволока, 3D-шнур, трубка, ячейка, гранула, лист, сеть, покрытие, прослойка или пропитка.
Термин «совместное культивирование» относится к культивированию клеток, при котором в одной и той же матрице для культивирования одновременно культивируют более одного типа разных клеток. Совместное культивирование дает возможность использовать разные типы клеток в одной системе для обработки. В настоящем изобретении по меньшей мере два типа клеток разного происхождения можно культивировать в качестве совместной культуры.
Термин «печать» относится к способу получения структур и образцов, содержащих aNFC в качестве печатного материала, посредством 3D-печати, лазерной печати, экструзии, формования или электроспиннинга.
Композиция для культивирования клеток, матрица для культивирования клеток или изделие по настоящему изобретению могут дополнительно содержать подходящие вспомогательные вещества, выбранные из группы, состоящей из питательных веществ, буферных агентов, рН индикаторов, компонентов внеклеточного матрикса, сыворотки, факторов роста, антибиотиков, консервантов, пептидов и белков.
В зависимости от клеточной линии и предполагаемого применения культивируемых клеток культивирование может быть осуществлено в 2D- или 3D-формате. Клетки диспергируют или инокулируют на поверхности 3D-объекта или изделия либо в 3D-объекте или изделии, что обеспечивает рост клеток в 2D- или 3D-формате на структурах гидрогеля и проникновение размножающихся клеток и внеклеточных структур культивируемых клеток внутрь структур гидрогеля.
Согласно одному из воплощений клетки, полученные из клеточной культуры, содержащей композицию по настоящему изобретению, можно использовать, например, для приготовления клеточных моделей заболеваний центральной нервной системы, 3D-печатных структур, в особенности для нервных клеток, для лечения травм спинного мозга, для диагностики болезни Альцгеймера или болезни Паркинсона, либо для тестирования лекарственных средств в клеточной культуре.
Удаление целлюлозных нанофибрилл может быть осуществлено, например, с использованием смесей ферментов, содержащих все ферменты, необходимые для полного разложения молекул целлюлозы, а также других происходящих из древесины компонентов, присутствующих в ней, таких как гемицеллюлозы. Надлежащими ферментами являются, например, разработанные для рассматриваемой NFC смеси ферментов и имеющиеся в продаже препараты целлюлаз-гемицеллюлаз. Состав смеси может варьировать в зависимости от химического состава исходного материала, используемого для получения NFC. Например, когда для получения NFC используют древесную березовую массу, смесь включает в себя по меньшей мере интактные эндо- и экзоцеллюлазы или их части, эндо-ксиланазы, β-D-гликозидазы и β-D-ксилозидазы. Для гидролиза NFC, полученной из древесины хвойных пород, эту смесь необходимо дополнить по меньшей мере эндо-маннаназами и β-D-маннозидазами. Преимущество разработанных смесей, компонентами которых являются очищенные ферменты, заключается в том, что они не содержат дополнительных белков или других нежелательных компонентов, таких как обладающие побочными активностями компоненты, дербис после культивирования микроорганизмов или остатки культуральной жидкости, что очень часто встречается в случае имеющихся в продаже ферментных препаратов. Особенно опасно, если такой препарат содержит протеазы, которые могут воздействовать на поверхности культивируемых клеток. Имеющиеся в продаже ферментные смеси, предназначенные для проведения полного гидролиза растительных материалов, тоже могут быть использованы для гидролиза NFC, но более предпочтительно после по меньшей мере стадии грубой очистки, такой как очистка с использованием гель-фильтрации или диализа. Независимо от ферментного препарата, представляющего собой либо разработанную, либо имеющуюся в продаже смесь, компоненты выбирают такими, чтобы они могли оптимально гидролизовать NFC, например, с точки зрения рН, температуры и ионной силы. В продаже имеются препараты, которые действуют либо при кислотных значениях рН (рН 3,5-5), либо при основных значениях рН (рН 6-8), и при температурах от комнатной температуры и вплоть до 60-80°С. Очень часто клетки выращивают при температуре 37°С, которая является оптимальной для большинства целлюлаз и гемицеллюлаз.
Общеизвестно, что определенные ферменты, целлюлазы, способны гидролизовать [бета]-(1-4)-связи в целлюлозе. Например, эндо-1,4-β-глюканазы (EG), которые катализируют расщепление цепей целлюлозы в случайных положениях вдали от концов цепи; экзоглюканазы или экзоцеллобиогидролазы (СВН), которые катализируют расщепление целлюлозы путем отделения молекул с обоих концов цепи с образованием димеров целлобиозы; и [бета]-глюкозидазы (BGL), которые катализируют гидролиз образуемых олигосахаридов и звеньев целлобиозы (образуемых в результате действия EG и СВН) до глюкозы. Соответственно, можно провести ферментативный гидролиз целлюлозных нанофибрилл до глюкозы с использованием целлюлаз (Ahola и др., 2008). Для полного гидролиза NFC до мономерных Сахаров необходимо, чтобы смесь ферментов содержала также эндо-действующие гемицеллюлазы, такие как ксиланазы и маннаназы, и β-D-гликозидазы, β-D-ксилозидазы и -D-маннозидазы. Когда целью является только частичный гидролиз, например, для снижения вязкости гидрогеля, то в состав смеси ферментов могут быть включены эндоглюканазы в избытке и целлобиогидролазы в меньшем количестве, или они могут вообще отсутствовать. В последнем случае в эту смесь могут быть включены гемицеллюлазы, поскольку они усиливают гидролитическое действие целлюлаз. Ферментативный гидролиз целлюлозы может быть применен в системах для культивирования клеток, содержащих целлюлозные нанофибриллы, по разным причинам. В результате гидролиза гидрогеля на основе NFC вязкость таких сред резко снижается, и структуры культивируемых клеток становятся легко доступными, например, для окрашивания. Кроме того, после гидролиза клеточные структуры могут быть перенесены или трансплантированы без целлюлозосодержащего материала. Продукт разложения, глюкоза, как правило, нетоксичен для клеток и может быть использован в качестве питательного вещества при культивировании клеток.
В случае ферментативного гидролиза, например, с использованием целлюлазы для разрушения гидрогеля на основе NFC (включая aNFC), фермент может быть инактивирован или удален из системы культивирования клеток. Специалист в состоянии без труда выбрать любой соответствующий способ инактивации или удаления фермента. Примеры подходящих методов включают инактивацию ингибиторами или нейтрализующими антителами и удаление целлюлазы путем промывки, фильтрования, аффинной очистки или любого другого способа, который подходит для выбранного применения. Инактивация или удаление фермента предохраняет от наличия активного фермента, который способен разрушить структуру геля на основе NFC, в том случае, когда клетки культивируют в матрице на основе NFC после обработки ферментом. Удаление фермента также может потребоваться для некоторых последующих применений культивируемых клеток.
Согласно одному предпочтительному воплощению, композицию ферментативно обрабатывают целлюлазой в течение периода времени, достаточного по меньшей мере для частичного высвобождения клеточной массы. Согласно другому предпочтительному воплощению целлюлазу инактивируют или удаляют из клеточной массы после ферментативной обработки.
За дифференцировкой клеток можно следить по результатам экспрессии какого-либо маркерного гена, известного в данной области техники. Например, в зависимости от конкретного применения и типа клеток можно использовать маркеры ранних или поздних генов.
Гидрогель на основе aNFC по настоящему изобретению представляет собой «прямой продукт гомогенизации указанных нанофибрилл целлюлозы», например, полученный в результате гомогенизации фибрилл влажной целлюлозной массы под высоким давлением. В водном окружении целлюлозные нанофибриллы по настоящему изобретению образуют непрерывную сеть гидрогеля из диспергированных нанофибрилл или пучков нанофибрилл. Этот гель образуют сильно гидратированные фибриллы, которые переплетены между собой даже при очень низких концентрациях. Фибриллы также могут взаимодействовать посредством образования водородных связей. Стабильные гидрогели с содержанием целлюлозных нанофибрилл всего 0,3-0,5 масс. % (полученные посредством механической дезинтеграции) могут образовываться без добавления каких-либо суспендирующих или загущающих агентов. Действительно, непосредственным продуктом данного способа является разбавленный гидрогель на основе нанофибриллярной целлюлозы. Прозрачный гидрогель на основе NFC получают аналогичным способом гомогенизации химически модифицированной (окисленной в присутствии TEMPO) целлюлозной массы.
Не все виды микрофибриллированной целлюлозы ведут себя аналогичным образом, даже подпадая под категорию «микрофибриллированная целлюлоза». То есть, не все виды микрофибриллированной целлюлозы обладают идентичными свойствами и признаками. Кроме того, способ, которым получают виды микрофибриллированной целлюлозы, существенно влияет на свойства конечного продукта. Следовательно, тот факт, что целлюлозу подвергают механической дезинтеграции, имеет особое значение и влияет на получаемую структуру целлюлозных нанофибрилл.
Выводы
Ранее сообщалось, что анионные полимеры могут оказывать поддерживающее действие на нервные клетки. Авторы настоящего изобретения обнаружили, что гидрогель, приготовленный из aNFC, является более подходящим для поддержания распространения и развития растущих клеток. В качестве примера авторы настоящего изобретения культивировали нервные клетки человека с образованием нейронных сетей. Гидрогели на основе aNFC лучше подходили для поддержания нервных клеток, и особенно для отрастания нейритов у одиночных клеток. Это улучшение по сравнению с гидрогелями предшествующего уровня техники основывается на двух улучшенных характеристиках гидрогеля: 1) анионном заряде на поверхности нанофибриллярной целлюлозы, индуцирующем перемещение клеток в гидрогелях (поскольку клетки имеют тенденцию воспринимать заряженные группы в фибриллах и распространяться вдоль/по направлению вытянутых фибрилл), и 2) прочность геля у анионного гидрогеля выше по сравнению с нативным сортом (поскольку диаметр и размер фибрилл меньше, а количество нанофибрилл больше при том же содержании твердых веществ). Таким образом, культивирование клеток может быть осуществлено при более низком содержании фибрилл. Более низкое содержание твердых веществ дает возможность для более свободного перемещения клеток в гидрогеле, поскольку фибриллы не препятствуют перемещению. Оптимальное содержание твердых веществ в aNFC ниже 0,5 масс. %, предпочтительно ниже 0,4 масс. %.
ПРИМЕРЫ
Приведенные далее примеры представляют собой иллюстрации воплощений настоящего изобретения, описанных выше, и они не предназначены для ограничения каким-либо образом данного изобретения.
Пример 1. Тестирование гидрогелей на основе нанофибриллярной целлюлозы с использованием нервных клеток человека
Материалы и методы
Нервные клетки человека культивировали в течение 2 недель инкапсулированными в гидрогели на основе нанофибриллярной целлюлозы. В экспериментах использовали клетки, представляющие собой нейроны человека, предварительно дифференцированные из линии стволовых клеток человеческого эмбриона Regea 08/023 (Lappalainen и др., 2010;  и др., 2014). Кратко, дифференцировку hESC в нервные клетки осуществляли путем переноса кластеров hESC, содержащих приблизительно 3000 клеток, в шестилуночные планшеты со сверхнизким прикреплением (Nunc, Thermo Fisher Scientific, Rochester, NY, USA) и культивирования клеток в виде плавающих агрегатов, нейросфер, в нейтральной среде для дифференцировки, содержащей смесь 1:1 DMEM/F12 (модифицированная Дульбекко среда Игла с питательной смесью Хэма F12; Gibco, Invitrogen, Finland) и нейробазальной среды, дополненную 2 мМ GlutaMax™, 1хВ27, 1xN2 (Gibco), основным фактором роста фибробластов в концентрации 20 нг/мл (bFGF, R&D Systems, Minneapolis, MN, USA) и пенициллином/стрептомицином в количестве 25 ед./мл (Cambrex, Belgium). Эту среду заменяли три раза в неделю и сферы механически разбивали один раз в неделю. Нейросферы культивировали в течение восьми недель, получая чистую популяцию нейронов.
и др., 2014). Кратко, дифференцировку hESC в нервные клетки осуществляли путем переноса кластеров hESC, содержащих приблизительно 3000 клеток, в шестилуночные планшеты со сверхнизким прикреплением (Nunc, Thermo Fisher Scientific, Rochester, NY, USA) и культивирования клеток в виде плавающих агрегатов, нейросфер, в нейтральной среде для дифференцировки, содержащей смесь 1:1 DMEM/F12 (модифицированная Дульбекко среда Игла с питательной смесью Хэма F12; Gibco, Invitrogen, Finland) и нейробазальной среды, дополненную 2 мМ GlutaMax™, 1хВ27, 1xN2 (Gibco), основным фактором роста фибробластов в концентрации 20 нг/мл (bFGF, R&D Systems, Minneapolis, MN, USA) и пенициллином/стрептомицином в количестве 25 ед./мл (Cambrex, Belgium). Эту среду заменяли три раза в неделю и сферы механически разбивали один раз в неделю. Нейросферы культивировали в течение восьми недель, получая чистую популяцию нейронов.
Получение анионной NFC
aNFC получали из отбеленной целлюлозной массы путем гомогенизации под высоким давлением, используя для фибриллирования промышленный флюидизатор. Исходный материал отбирали с целлюлозного завода в асептических условиях и тщательно очищали перед гомогенизацией на стерильном оборудовании. Таким образом, микробиологическую чистоту поддерживали на протяжении всего процесса получения. Перед фибриллированием проводили анионную модификацию очищенного материала. Анионная модификация основана на окислении целлюлозной массы. Благодаря этой модификации упрощается процесс дезинтеграции целлюлозной массы до целлюлозных нанофибрилл. Кроме того, в результате данной реакции активации на поверхности aNFC появляются функциональные альдегидные и карбоксильные группы, которые повышают гидрофильность этого материала. Такие модификации описаны в WO 09/084566 и JP 20070340371. Окисленную целлюлозную массу тщательно очищали после химической модификации. Перед фибриллированием очищенные фибриллы разбавляли стерильной водой сверхвысокого качества. Концентрация NFC в полученном гидрогеле обычно составляет 1-2 масс. %. Гидрогель на основе NFC автоклавировали (121°С/20 мин) непосредственно после фибриллирования.
Осмотическое уравновешивание
Перед проведением экспериментов по культивированию клеток материал гидрогелей инкубировали в присутствии среды для культивирования клеток в течение 5 часов при комнатной температуре для осмотического уравновешивания с окружающей средой. Пипеткой отбирали аликвоты гидрогелей объемом от 500 мкл до 1 мл в круглодонную пробирку типа эппендорф емкостью 2 мл. Поверх гидрогелей медленно добавляли по 1 мл среды для культивирования клеток. После инкубирования пробирки центрифугировали (5 мин, 1500 об/мин) и избыток среды (примерно 1 мл) сверху удаляли. Инкапсулирование клеток
Предварительно дифференцированные нейросферы отбирали в пробирки типа эппендорф и среду для культивирования клеток удаляли. Используя Tryple Select (Invitrogen, 12563-011) проводили ферментативное разъединение клеток с образованием суспензии, состоящей из небольших агрегатов клеток и отдельных клеток. Количество и жизнеспособность клеток в суспензии рассчитывали с использованием счетчика клеток Countess (Invitrogen) и трипанового синего (1:1). Плотность используемых клеток составляла 5 миллионов клеток на 1 мл гидрогеля. Рассчитанное количество клеточной суспензии отбирали пипеткой в пробирку типа эппендорф, центрифугировали (5 мин, 1500 об./мин) и среду для культивирования клеток удаляли. Клеточный осадок ресуспендировали в 50 мкл свежей среды для культивирования клеток и, используя пипетку, добавляли в виде небольших капель внутрь гидрогеля (750 мкл). Клетки смешивали с гидрогелем посредством медленного пипетирования вверх и вниз, а также перемешивания кончиком пипетки до тех пор, пока смесь не представлялась гомогенной. После этого аликвоты смеси вносили в лунки 96-луночного планшета. Поверх культур добавляли по 150 мкл среды для культивирования клеток.
Подготовку контрольных 2D-образцов с покрытием на основе ламинина и контрольных инкапсулированных 3D-образцов PuraMatrix выполняли так, как опубликовано ранее ( и др., 2014).
и др., 2014).
Культивирование клеток
Клетки культивировали в течение двух недель инкапсулированными в гидрогель. В качестве культуральной среды использовали нейтральную среду для дифференцировки (NMD), содержащую смесь DMEM/F12:нейробазальная среда (1:1), дополненную 2 мМ GlutaMax™, 1хВ27, 1xN2 и пенициллином/стрептомицином в количестве 25 ед./мл. Три раза в неделю заменяли 100 мкл среды для культивирования клеток. За культурами следили, используя фазово-контрастный микроскоп. Стабильность гидрогелей в процессе культивирования клеток оценивали визуально. Культуры для визуализации с применением конфокального микроскопа готовили в 96-луночных планшетах MatTek со стеклянным дном №1.5, Part No: P96G-1.5-5-F.
Иммуноцитохимический анализ, визуализация и получение изображений
Иммуноцитохимический анализ проводили так, как опубликовано ранее (Koivisto и др., 2017). В качестве первичных антител использовали антитело к ассоциированному с микротрубочками белку 2 (МАР2) (АВ5622, Merck Millipore, Germany) и моноклональное антитело к β-тубулину III (Т8660, Sigma-Aldrich Finland Оу, Finland). После окрашивания осуществляли визуализацию культур, используя инвертированный микроскоп Olympus IX51 с цифровой камерой Olympus DP30BW (Olympus Corporation, Japan), оснащенной объективом с 4-кратным увеличением. Изображения в оттенках серого обрабатывали, используя Adobe Photoshop CS4 (версию 11, Adobe Systems Inc. CA).
Стеки подробных конфокальных 3D-изображений получали с применением конфокального блока Zeiss LSM 780, установленного в инвертированный микроскоп Cell Observer (Carl Zeiss, Germany), используя объектив с 25-кратным увеличением (числовая апертура (N.A.)=0,80; Zeiss LD LCI Plan-Apochromat, Carl Zeiss) с глицерином. Полученные с использованием конфокального микроскопа данные деконволютировали, применяя программное обеспечение Huygens Essential (Huygens compute engine 15.10.1p564b, Scientific Volume Imaging (SVI, Netherlands)), и визуализировали, применяя программу ImageJ (версию 1.39, Национальный институт здоровья, США).
Результаты
Общий обзор эксперимента
Подготовка образцов, разбавление гидрогелей, посев клеток и культивирование клеток были успешно проведены для обоих изученных гидрогелей (Growdex и aNFC). Все протестированные гидрогели поддерживали выживаемость и рост нейронов в течение двух недель. Также успешно была проведена подготовка образцов для визуализации несмотря на то, что имела место потеря некоторого количества геля. Оба изученных гидрогеля обладали хорошими визуальными свойствами при визуализации флуоресценции, а гидрогели на основе aNFC также хорошо подходили для фазово-контрастной визуализации благодаря прозрачности.
Обращение с гидрогелями при подготовке 3D-культур
Обращение с гидрогелем Growdex очень походило на предыдущие эксперименты авторов изобретения (согласно более ранним сообщениям UPM). Материал Growdex слегка затруднительно пипетировать и перемешивать для образования гомогенного образца. Прилагаемые наконечники для пипеток с низким уровнем адгезии, сконструированные на объем 1 мл, облегчали обращение. Также прилагались инструкции по внесению пипеткой клеточной суспензии в виде капель внутрь гидрогеля, что оказывало положительный эффект на гомогенность образцов.
В отличие от Growdex новые гидрогели на основе aNFC было очень легко пипетировать и перемешивать. По сравнению с предыдущими экспериментами наблюдалось значительное улучшение удобства использования гидрогелей для пользователя.
Рост нейронов внутри гидрогелей
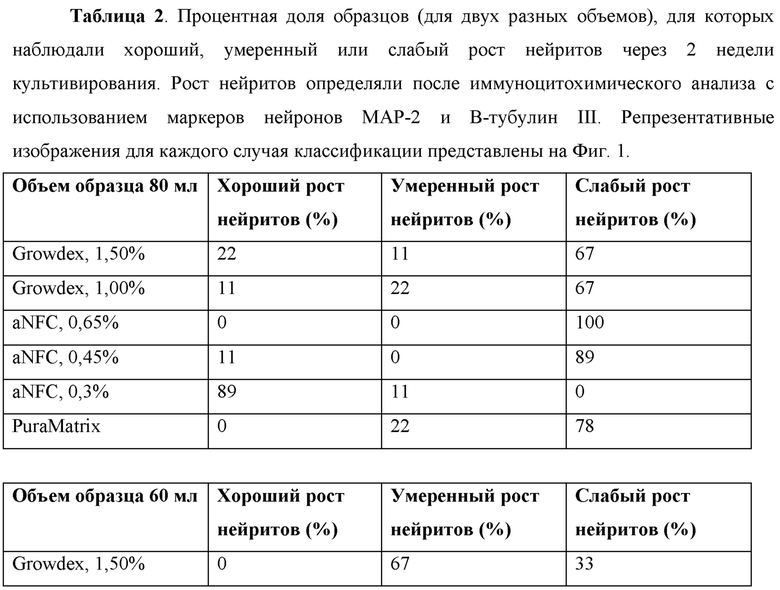
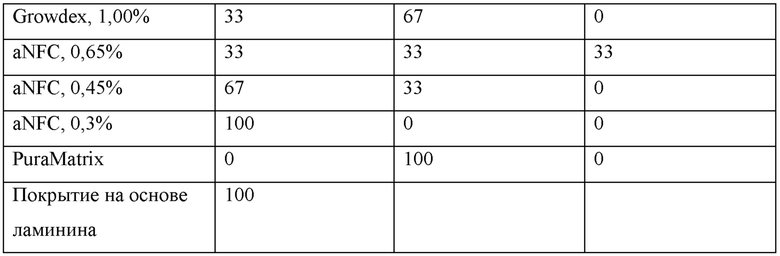
Образование нейронной сети оценивали после 2-х недельного периода культивирования, используя иммуноцитохимическое окрашивание на маркеры нейронов. Визуализацию образцов осуществляли с использованием широкопольного флуоресцентного микроскопа, оснащенного объективом с небольшим увеличением. Культуры подразделяли на три категории: как характеризующиеся хорошим, умеренным и слабым ростом нейритов согласно количеству видимых нейритов (Фиг. 1). Во всех образцах клетки демонстрировали хорошую выживаемость, даже в тех случаях, когда наблюдалось очень слабое отрастание нейритов (визуальный анализ).
В общем, для образцов меньшего объема (60 мкл) продемонстрирован более хороший рост нейронов, что можно наблюдать по уменьшению количества образцов со слабым ростом. В целом наилучшие результаты были отмечены для aNFC (0,30%).
На основании этих результатов можно сделать следующее заключение.
1. Наилучшей композицией для нервных клеток человека была таковая с самой низкой концентрацией aNFC (0,30%).
2. Образование нейронной сети более стабильно осуществляется в образце меньшего объема (60 мкл).
Анализ 3D-культур с применением конфокальной микроскопии
Для более детальной визуализации клеточной сети использовали конфокальное формирование изображений. Все исследуемые материалы были пригодны для анализа с применением конфокальной микроскопии, и никаких проблем с фоном или собственной флуоресценцией не возникало. В незначительном количестве образцов вымывание антител осуществлялось не полностью, что можно было наблюдать в виде ярких точек в гидрогеле. Гидрогели Growdex поддерживали в основном отрастание нейритов у агрегатов клеток, в то время как гидрогели на основе aNFC также поддерживали рост нейритов у одиночных клеток.
Примечание: исходный размер  одного блока гидрогеля составлял примерно 5 мкм, а высота (z) примерно 3 мкм. Конфокальная система не может охватить весь блок как одно изображение. Поэтому представленные изображения взяты из меньших по размеру выбранных областей блоков гидрогелей. Кроме того, некоторые очень хорошие области клеток и сетей, видимые с помощью флуоресцентной визуализации в режиме широкого поля, были недоступны при визуализации с использованием конфокального микроскопа. Это хорошо известные ограничивающие факторы в системах визуализации с применением систем конфокального формирования изображений.
одного блока гидрогеля составлял примерно 5 мкм, а высота (z) примерно 3 мкм. Конфокальная система не может охватить весь блок как одно изображение. Поэтому представленные изображения взяты из меньших по размеру выбранных областей блоков гидрогелей. Кроме того, некоторые очень хорошие области клеток и сетей, видимые с помощью флуоресцентной визуализации в режиме широкого поля, были недоступны при визуализации с использованием конфокального микроскопа. Это хорошо известные ограничивающие факторы в системах визуализации с применением систем конфокального формирования изображений.
Growdex, 1,50%
Массовое отрастание нейритов в основном наблюдалось для агрегатов клеток (Фиг. 3, стеки 1 и 2). В некоторых агрегатах отмечалось меньшее количество нейритов (Фиг. 3, стек 3).
Growdex, 1,00%
Почти аналогичные результаты отмечали при сравнении Growdex, 1,50%, и Growdex, 1,00%. Отрастание нейритов наблюдали для агрегатов клеток (Фиг. 4, стеки 1-3). Степень отрастания нейритов варьировала среди агрегатов. В некоторых образцах неполное вымывание антител было причиной появления ярких флуоресцентных точек (Фиг. 4, стек 2).
aNFC, 0,65%
Гидрогель на основе aNFC, 0,65%, поддерживал отрастание нейритов для агрегатов (Фиг. 5, стеки 1 и 3), а также рост нейритов у одиночных клеток (Фиг. 5, стек 2). aNFC, 0,45%
Гидрогель на основе aNFC, 0,45%, поддерживал отрастание нейритов для агрегатов (Фиг. 6, стеки 1 и 3), а также рост нейритов у одиночных клеток (Фиг. 6, стеки 2 и 3). aNFC, 0,30%
Гидрогель на основе aNFC, 0,30%, очень хорошо поддерживал рост нейритов у одиночных клеток (Фиг. 7, стек 1) и поддерживал массовое отрастание нейритов для агрегатов клеток (Фиг. 7, стеки 2 и 3).
На основании этих результатов можно сделать следующее заключение.
1. Гидрогели на основе aNFC лучше подходили для поддержания отрастания нейритов у одиночных клеток.
2. Значительное отрастание нейритов также обнаруживали для агрегатов клеток в случае как гидрогелей Growdex, так и гидрогелей на основе aNFC.
3. Объем гидрогеля (80 мкл или 60 мкл) не оказывал никакого влияния на качество визуализации.
Обращение с обоими гидрогелями было выполнено успешно, и получение гомогенной суспензии клеток внутри матрицы гидрогеля оказалось возможным. Гидрогели на основе aNFC было намного легче приготовить. Во время проведения иммуноцитохимического окрашивания имела место потеря некоторого количества геля, но ни один из образцов не был полностью утрачен в этом эксперименте. Данный эффект был ярко выражен для образцов меньшего объема (60 мкл).
И гидрогели Growdex, и гидрогели на основе aNFC содержали значительные количества живых нейронов через 2 недели культивирования. Оба гидрогеля содержали агрегаты нервных клеток с сильным отрастанием нейритов. В самых лучших случаях образованные сети заполняли целиком блок гидрогеля (Фиг. 2, А).
Основное различие, наблюдаемое между двумя исследуемыми гидрогелями, состояло в росте одиночных клеток и отрастании у них нейритов. Гидрогели Growdex в основном поддерживали отрастание нейритов только у агрегатов клеток (Фиг. 8А), в то время как гидрогели на основе aNFC также поддерживали рост нейритов у отдельных клеток (Фиг. 8 В). Для одиночных нейронов требуется больше времени для образования 3D-сетей. Таким образом, можно предположить, что в этих случаях для наблюдения за образованием более сильных сетей было бы полезно пролонгирование времени культивирования.
В зависимости от применения оба типа отрастания нейритов могут рассматриваться как полезные. На основании опыта авторов изобретения можно сказать, что эти гели продемонстрировали очень хорошие возможности в отношении поддержания отрастания нейритов, одного из самых важных признаков при 3D-культивировании нервных клеток.
Растущие клетки лучше растут в aNFC по сравнению с нативным сортом, который используется в настоящее время. Клетки любят располагаться в направлении заряженных фибрилл. Более низкое содержание твердых веществ в анионном гидрогеле обеспечивает более свободное перемещение клеток. Анионные гидрогели могли бы предпочтительно использоваться в приложениях, где необходимы сети для функциональных клеток.
Измерение мутности
Образец нанофибриллярной целлюлозы разбавляли в воде до концентрации ниже точки гелеобразования указанной нанофибриллярной целлюлозы и измеряли мутность разбавленного образца. Мутность образцов нанофибриллярной целлюлозы измеряли в концентрации 0,1%. Для измерений мутности использовали турбидиметр HACH Р2100 с сосудом для измерений емкостью 50 мл. Определяли сухую массу образца нанофибриллярной целлюлозы, и 0,5 г образца из расчета на сухое вещество загружали в сосуд для измерений, который наполняли водопроводной водой до достижения 500 г, и энергично перемешивали путем встряхивания в течение примерно 30 с. Незамедлительно водную смесь распределяли на 5 сосудов для измерений, которые были вставлены в турбидиметр. Для каждого сосуда проводили по три измерения. На основании полученных данных рассчитывали среднее значение и стандартное отклонение, и окончательный результат приводили в единицах NTU. Новый продукт, нанофибриллярная целлюлоза, в вышеупомянутых условиях измерения имел типичное значение мутности ниже 200, предпочтительно ниже 150 NTU.
Измерения реологических свойств
Для проверки успешности фибриллирования проводили измерения реологических свойств образцов в форме гидрогелей на основе нанофибриллярной целлюлозы, используя ротационный вискозиметр с регулируемым напряжением (ARG2, ТА Instruments, UK), снабженный четырехлопастной лопаткой. Образцы разбавляли деионизованной водой (200 г) до концентрации 0,5 масс. % и смешивали с использованием ручного смесителя. Для данного образца проводили измерение реологических свойств. Диаметры цилиндрической чашки для образца и лопатки составляли 30 мм и 28 мм, соответственно, а длина составляла 42 мм. Варьирование напряжения измеряли в диапазоне напряжения сдвига 0,001-100 Па при частоте 0,1 Гц и 25°С.
Пример 2. Тестирование гидрогелей на основе нанофибриллярной целлюлозы с использованием фибробластных клеток кожи человека
Фибробласты кожи человека (HDF) смешивали с гидрогелем на основе NFC GrowDex или гидрогелем на основе анионной NFC GrowDexT. Гидрогели с клетками переносили в 96-луночный планшет в количестве 60 мкл гидрогеля с клетками на одну лунку и поверх гидрогелей добавляли по 100 мкл среды для культивирования клеток (DMEM, дополненной сывороткой). Клетки культивировали при 37°С и 5% СО2 в течение 7 суток и связанные с ростом свойства (пролиферацию, морфологию, миграцию) анализировали путем визуализации живых клеток с использованием метода светлого поля на автоматизированном микроскопе Cell-IQ (Chip-Man Technologies). Результаты указывают на образование имеющих округлую форму сфероидов HDF в GrowDex (Фиг. 9А). В GrowDexT HDF клетки растут в виде кластеров и образуют отростки, и это позволяет предположить, что клетки воспринимают свое окружение (Фиг. 9В).
ссылки
Ahola, S., Turon, X., Osterberg, M., Laine, J., Rojas, O.J. 2008. Enzymatic hydrolysis of native cellulose nanofibrils and other cellulose model films: effect of surface structure. Langmuir, 24, 11592-11599.
Hoffman, A.S., 2002. Hydrogels for biomedical applications. Advanced Drug Delivery Reviews, vol. 54, №1, pp.3-12.
Geckil, H., Xu, F., Zhang, X., Moon, S. and Demirci, U. 2010. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond), 5(3): p.469-84.
Koivisto, J.Т., Joki, Т., Parraga, J.,  R.,L.,
R.,L.,  Salonen, L., Jonkkari, I., et al. 2017. Bioamine-Crosslinked Gellan Gum Hydrogel for Neural Tissue Engineering. Biomedical Materials, February, 1-38. doi:10.1088/1748-605X/aa62b0.
Salonen, L., Jonkkari, I., et al. 2017. Bioamine-Crosslinked Gellan Gum Hydrogel for Neural Tissue Engineering. Biomedical Materials, February, 1-38. doi:10.1088/1748-605X/aa62b0.
Kuthcarlapati et al., 2008, Metals Materials and Processes, 20(3): 307-314.
Lappalainen, R.S.,  M.,
M.,  L.,
L.,  T.J., Hyttinen J.K.,
T.J., Hyttinen J.K.,  K., Suuronen, R., Skottman, H., and Narkilahti, S. 2010. Similarly Derived and Cultured hESC Lines Show Variation in Their Developmental Potential towards Neuronal Cells in Long-Term Culture. Regenerative Medicine, 5 (5): 749-62. doi:10.2217/rme.10.58.
K., Suuronen, R., Skottman, H., and Narkilahti, S. 2010. Similarly Derived and Cultured hESC Lines Show Variation in Their Developmental Potential towards Neuronal Cells in Long-Term Culture. Regenerative Medicine, 5 (5): 749-62. doi:10.2217/rme.10.58.
Nisbet DR, Crompton KE, Home MK et al., 2008. Neural tissue engineering of the CNS using hydrogels. J. Biomed. Mater. Res. В Appl. Biomater., 87: 251-263.
 L., Joki, Т., Varjola, M., Skottman, H., and Narkilahti, S., 2014. Three-Dimensional Growth Matrix for Human Embryonic Stem Cell-Derived Neuronal Cells. Journal of Tissue Engineering and Regenerative Medicine, 8 (3): 186-94. doi:10.1002/term.1512.
L., Joki, Т., Varjola, M., Skottman, H., and Narkilahti, S., 2014. Three-Dimensional Growth Matrix for Human Embryonic Stem Cell-Derived Neuronal Cells. Journal of Tissue Engineering and Regenerative Medicine, 8 (3): 186-94. doi:10.1002/term.1512.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАТЕРИАЛ ДЛЯ КУЛЬТУР КЛЕТОК, ПОЛУЧЕННЫЙ ИЗ РАСТЕНИЙ | 2011 |
|
RU2597978C2 |
| ХИМИЧЕСКИЙ СПОСОБ И СИСТЕМА ДЛЯ ИЗГОТОВЛЕНИЯ НИТИ ИЗ ВОЛОКОН | 2016 |
|
RU2721513C2 |
| СПОСОБ ПРИЗВОДСТВА НАНОФИБРИЛЛЯРНЫХ ЦЕЛЛЮЛОЗНЫХ ГЕЛЕЙ | 2010 |
|
RU2530067C2 |
| Медицинский многослойный продукт, содержащий нановолокнистую целлюлозу, и способ его получения | 2016 |
|
RU2729073C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПОКРЫТЫХ ПОДЛОЖЕК | 2012 |
|
RU2560349C2 |
| СПОСОБ ПРОИЗВОДСТВА НАНОФИБРИЛЛЯРНЫХ ЦЕЛЛЮЛОЗНЫХ ГЕЛЕЙ | 2014 |
|
RU2671320C2 |
| ВЫДЕЛЯЕМЫЕ ИЗ РАСТИТЕЛЬНОГО СЫРЬЯ ЦЕЛЛЮЛОЗНЫЕ КОМПОЗИЦИИ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ БУРОВЫХ РАСТВОРОВ | 2013 |
|
RU2671650C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОВОЛОКОННОЙ НИТИ С ВЫСОКОЙ ПРОЧНОСТЬЮ НА РАСТЯЖЕНИЕ | 2015 |
|
RU2660071C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОДИФИЦИРОВАННОЙ ЦЕЛЛЮЛОЗЫ | 2010 |
|
RU2535688C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕЛЬСОДЕРЖАЩИХ КОМПОЗИТНЫХ МАТЕРИАЛОВ | 2011 |
|
RU2566894C2 |
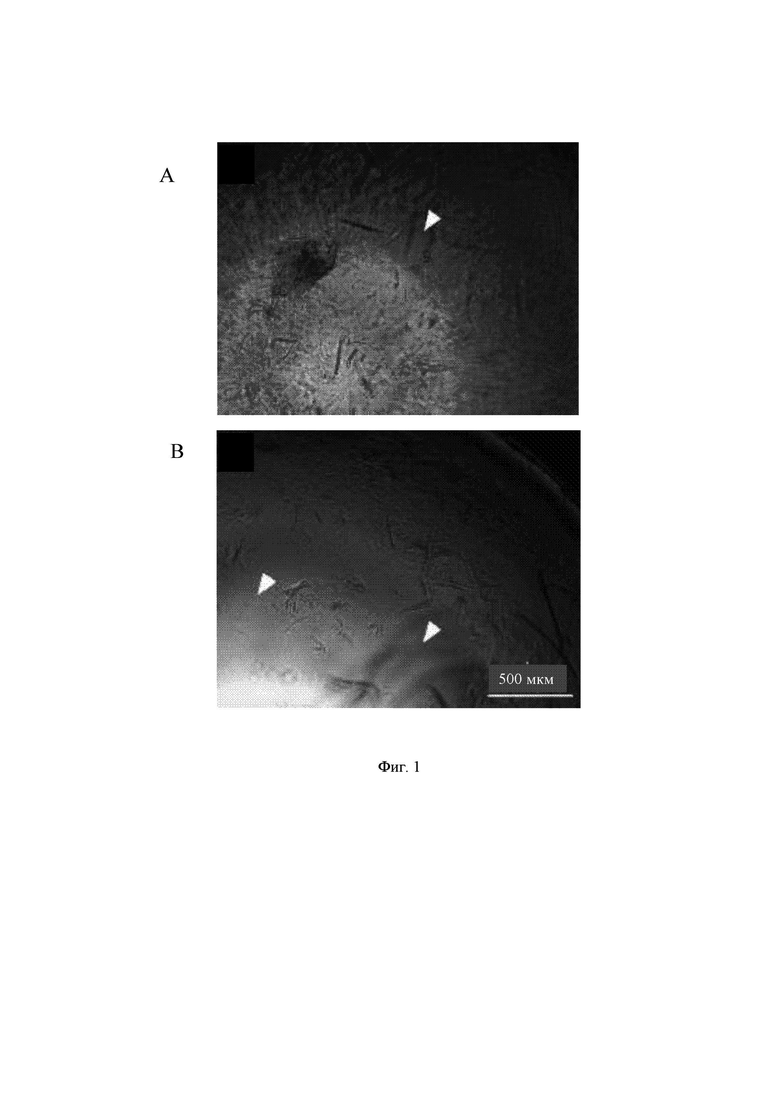
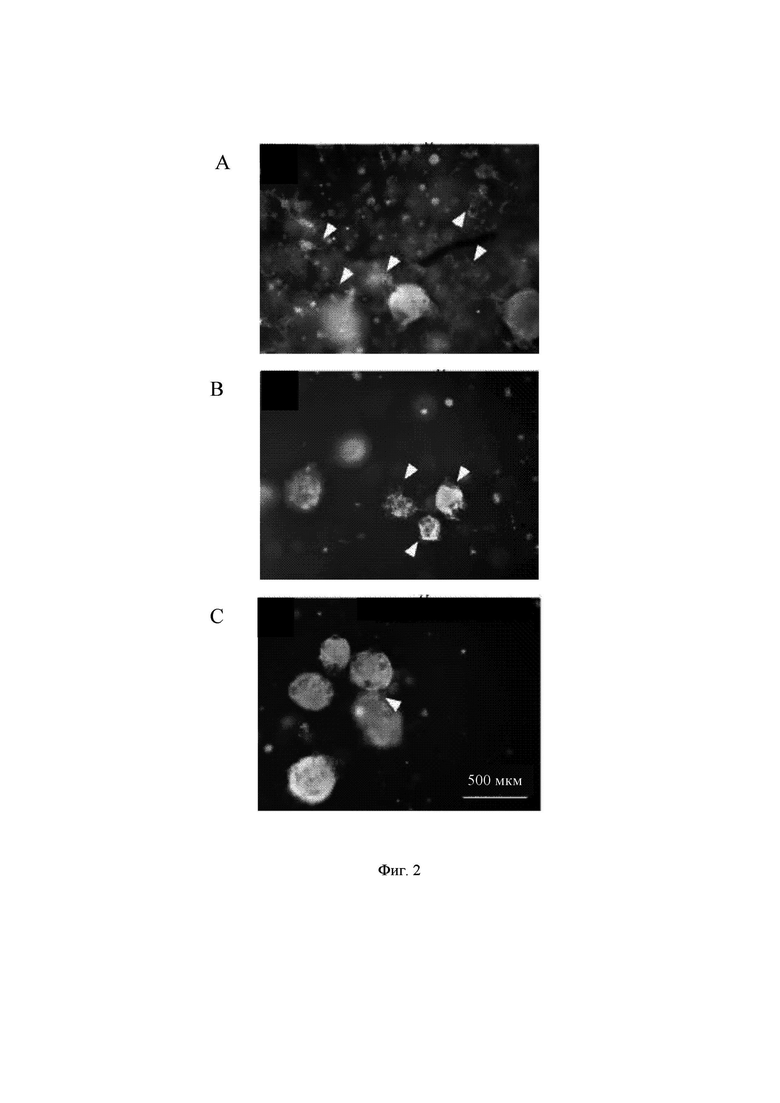
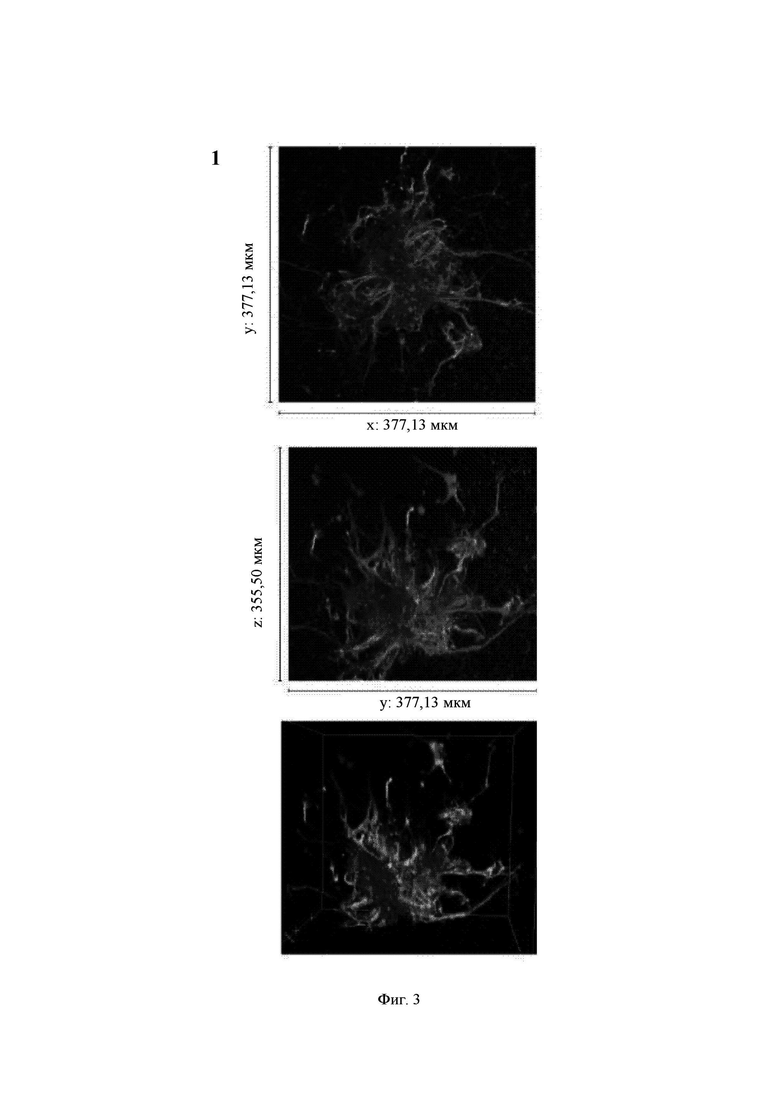
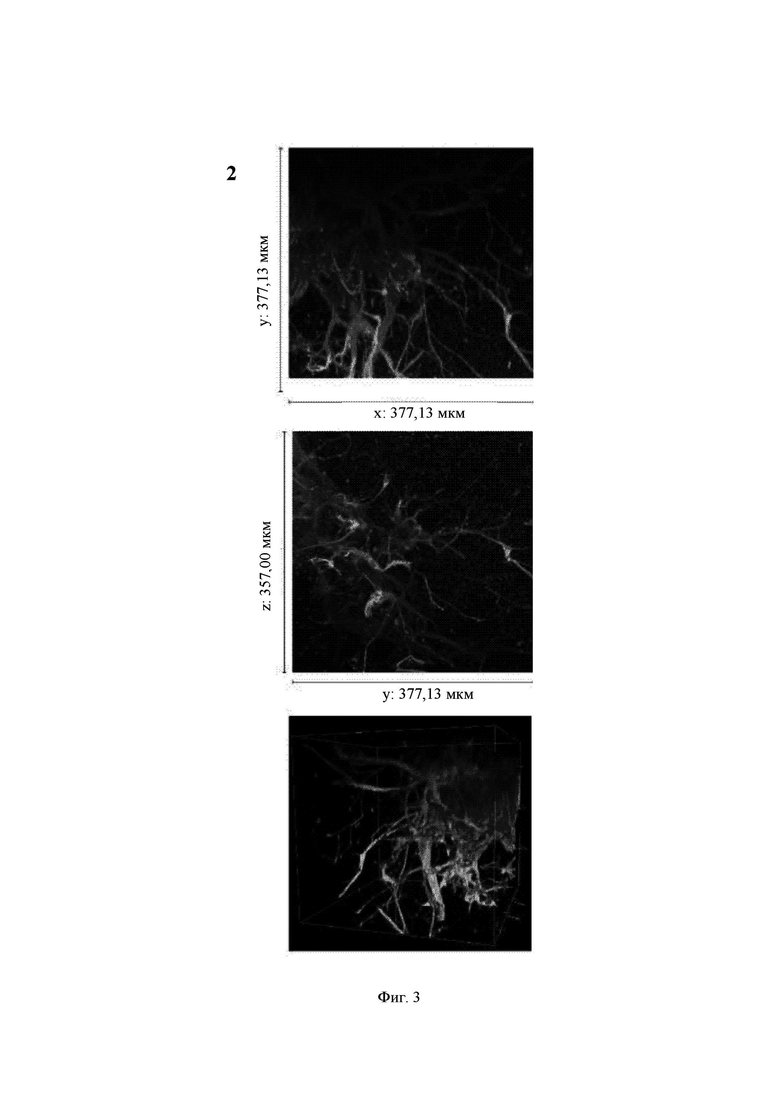
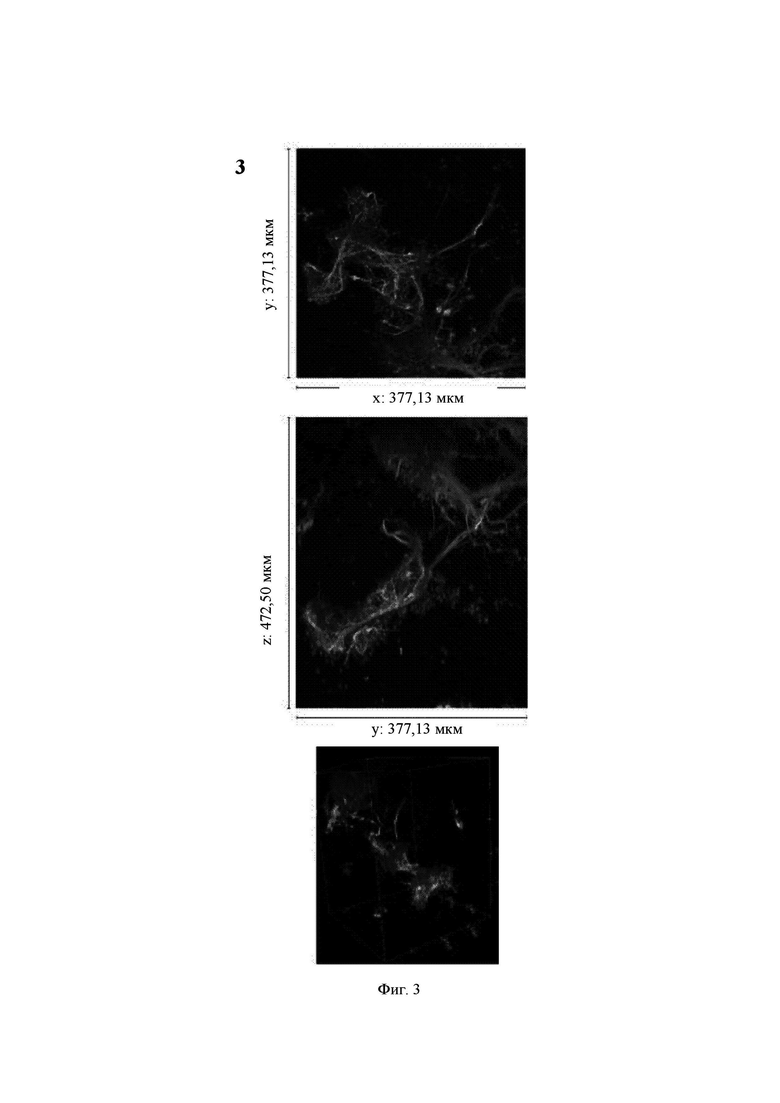
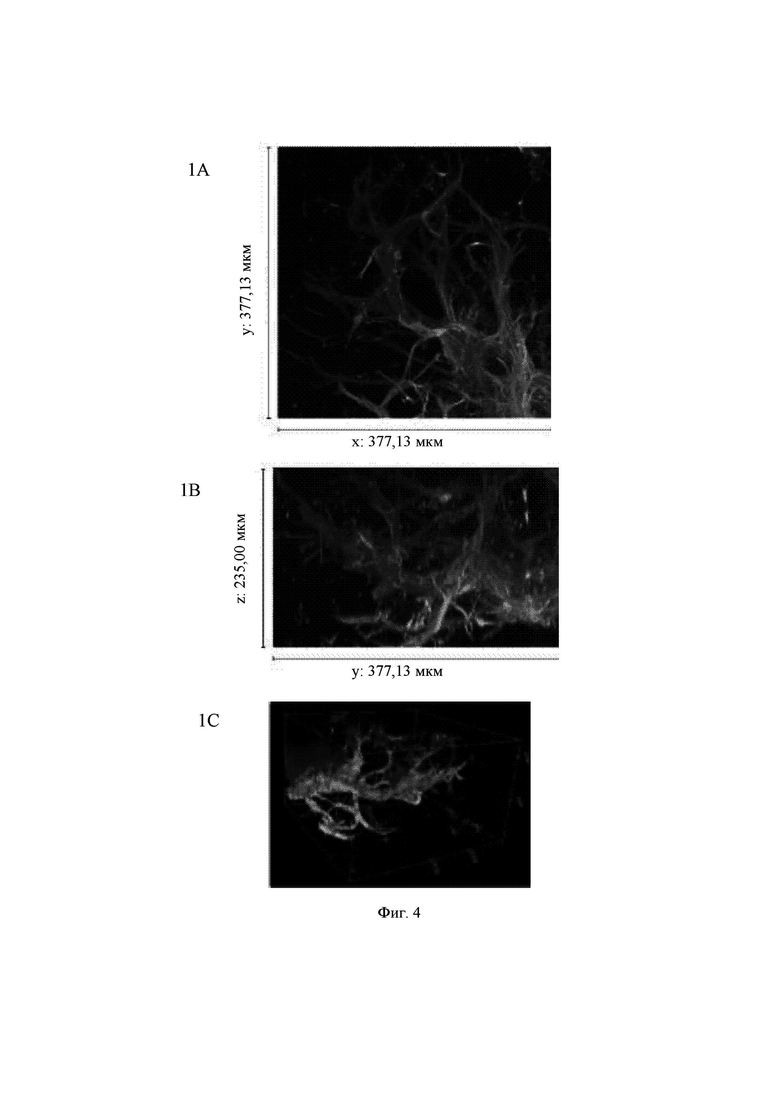
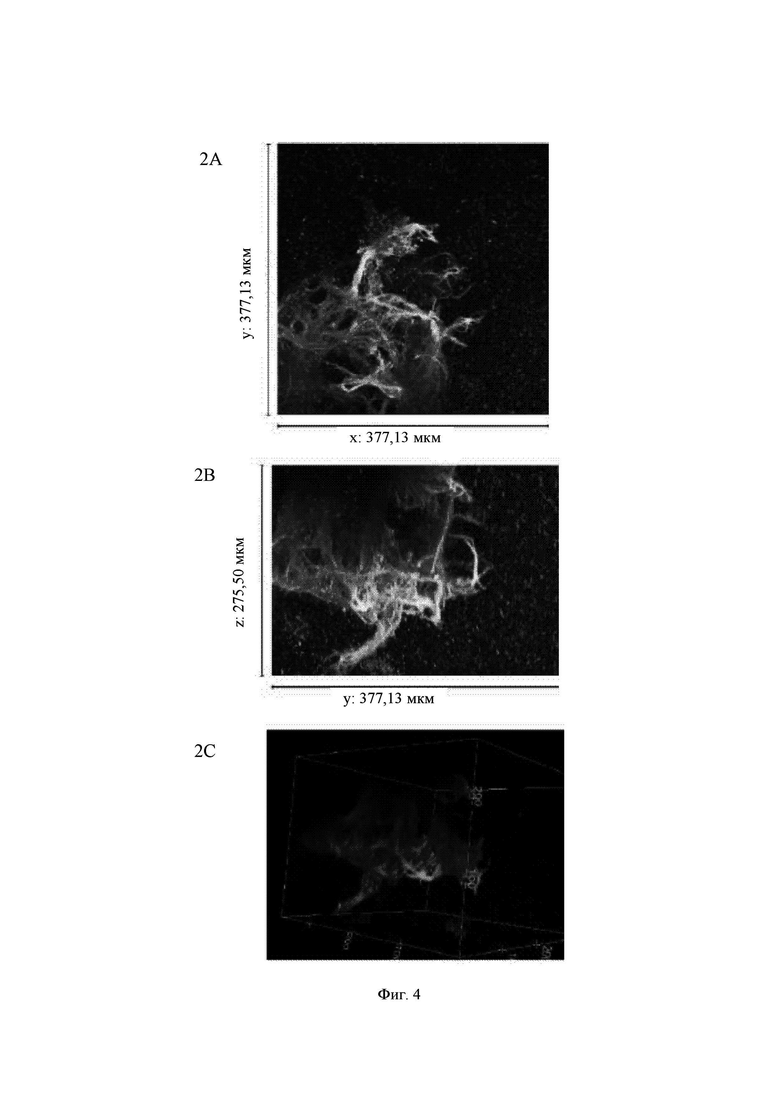
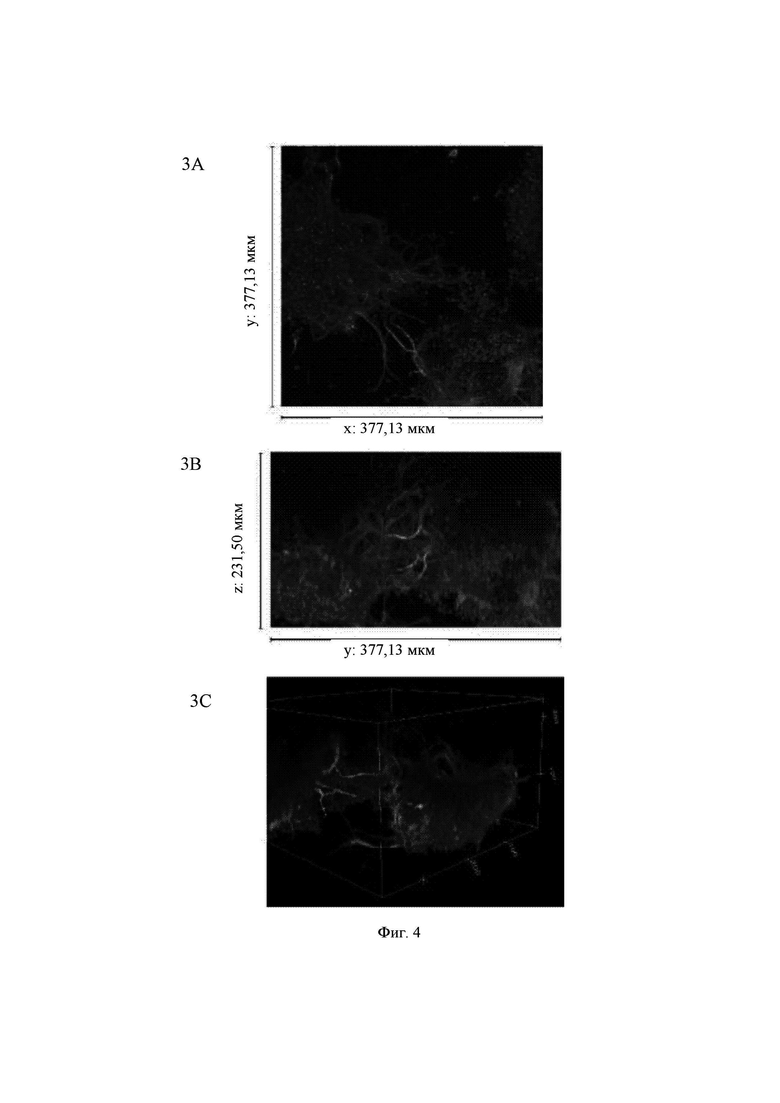
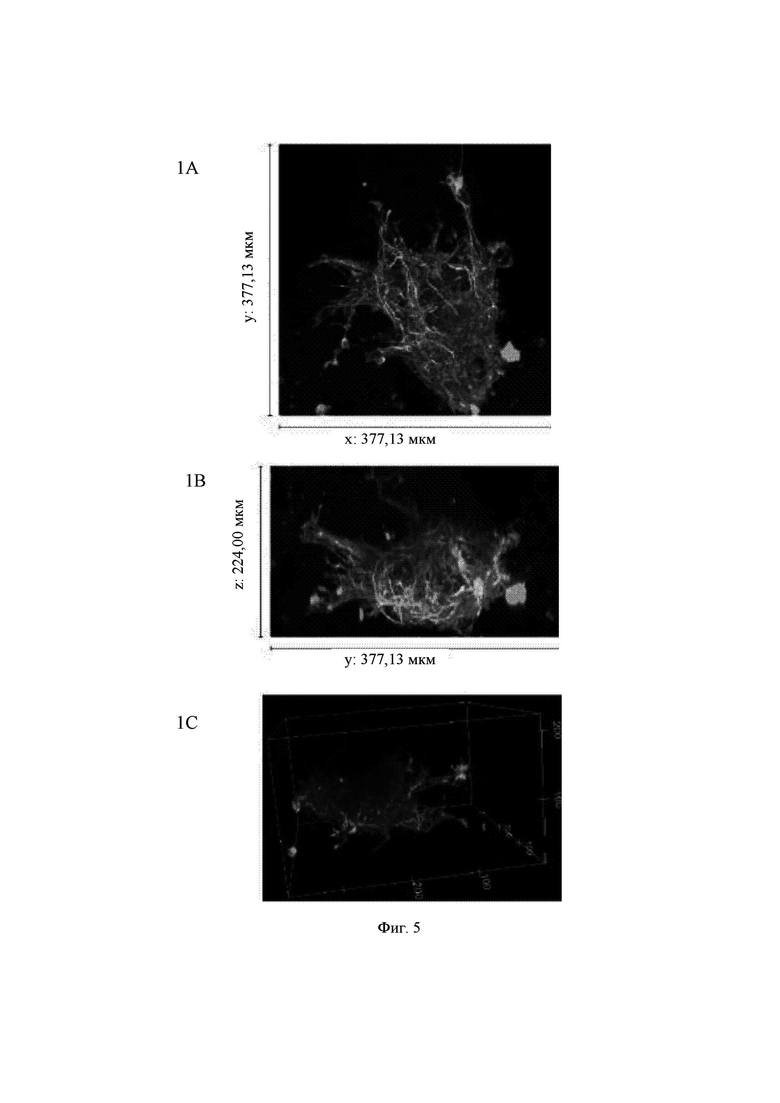
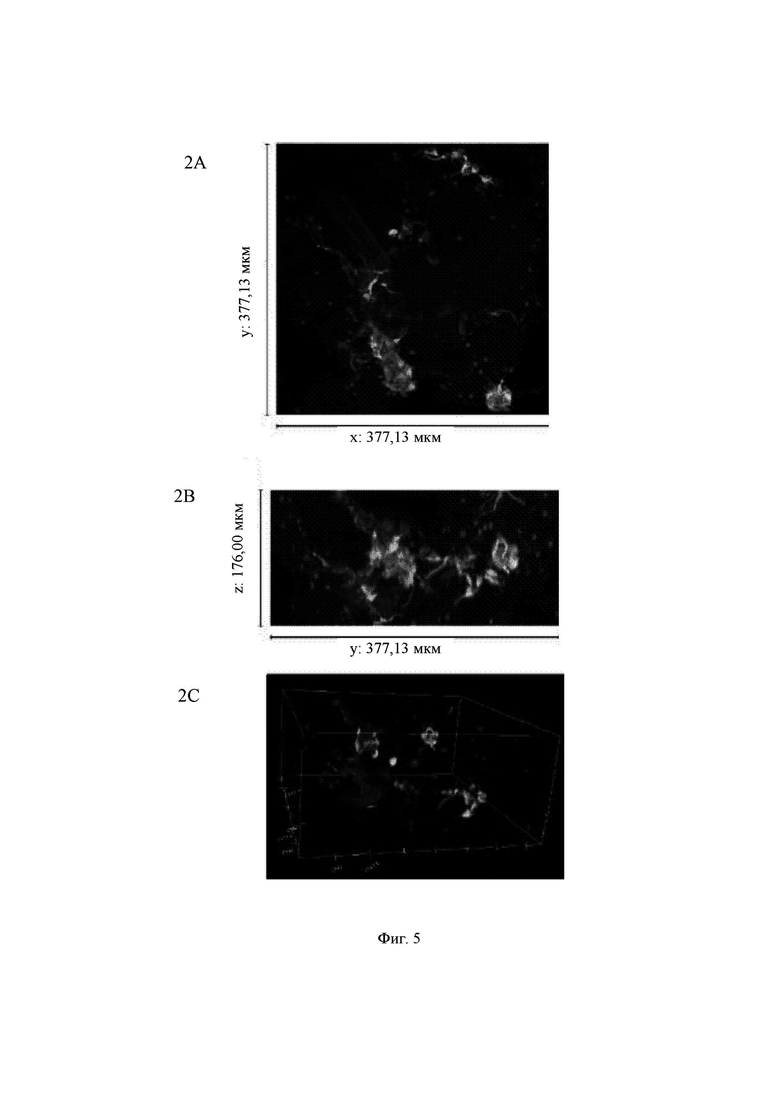
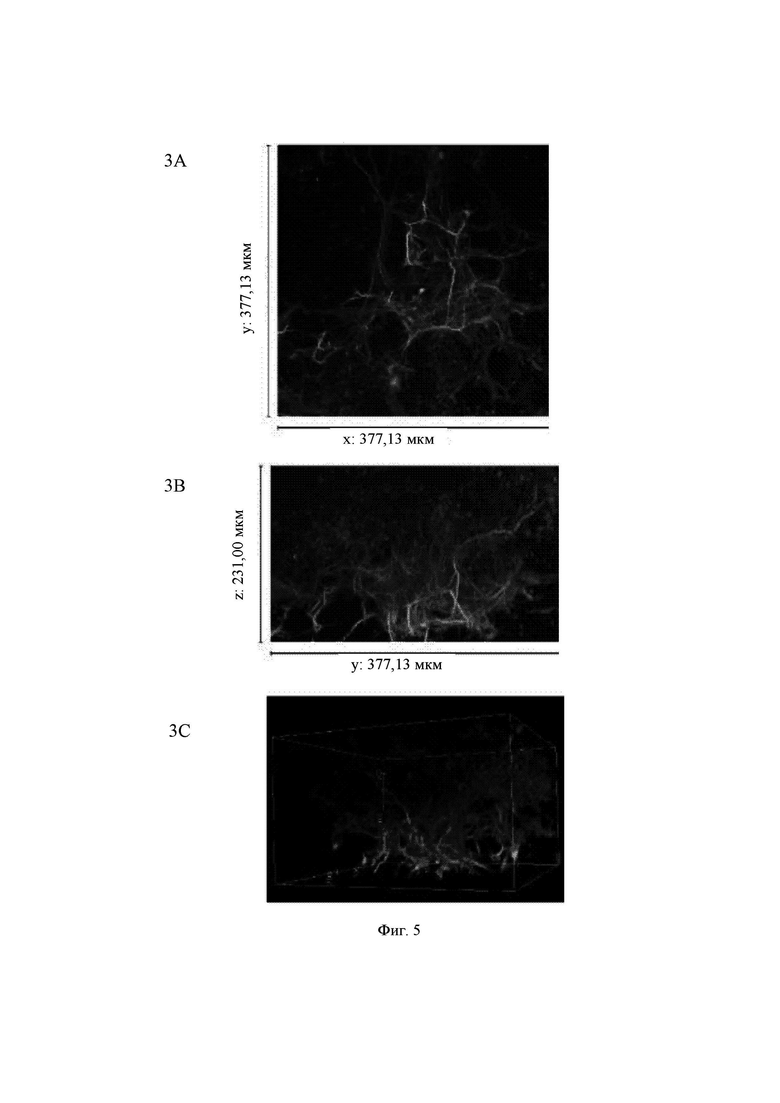
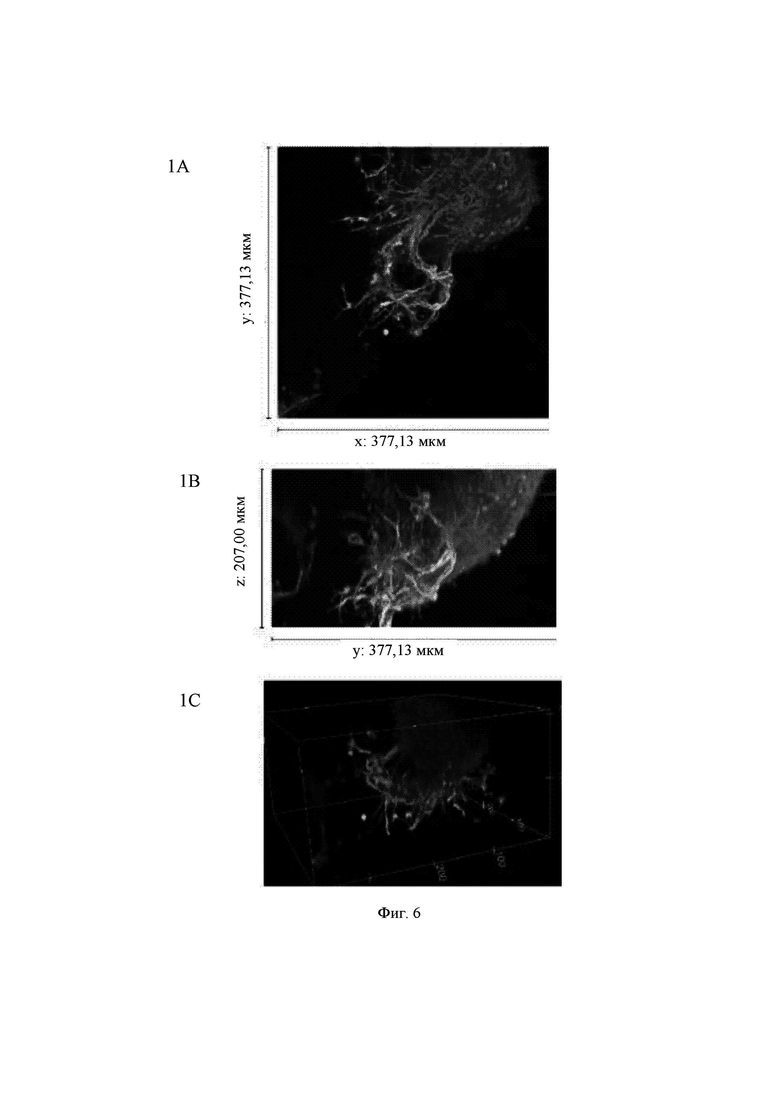
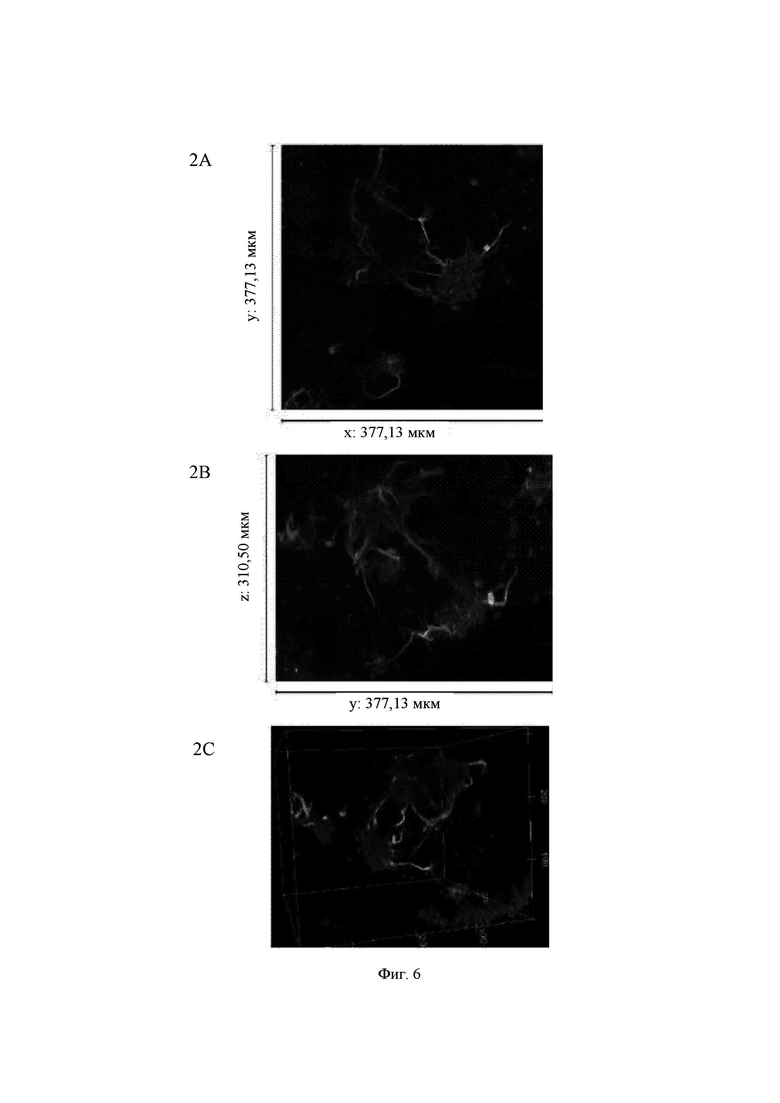
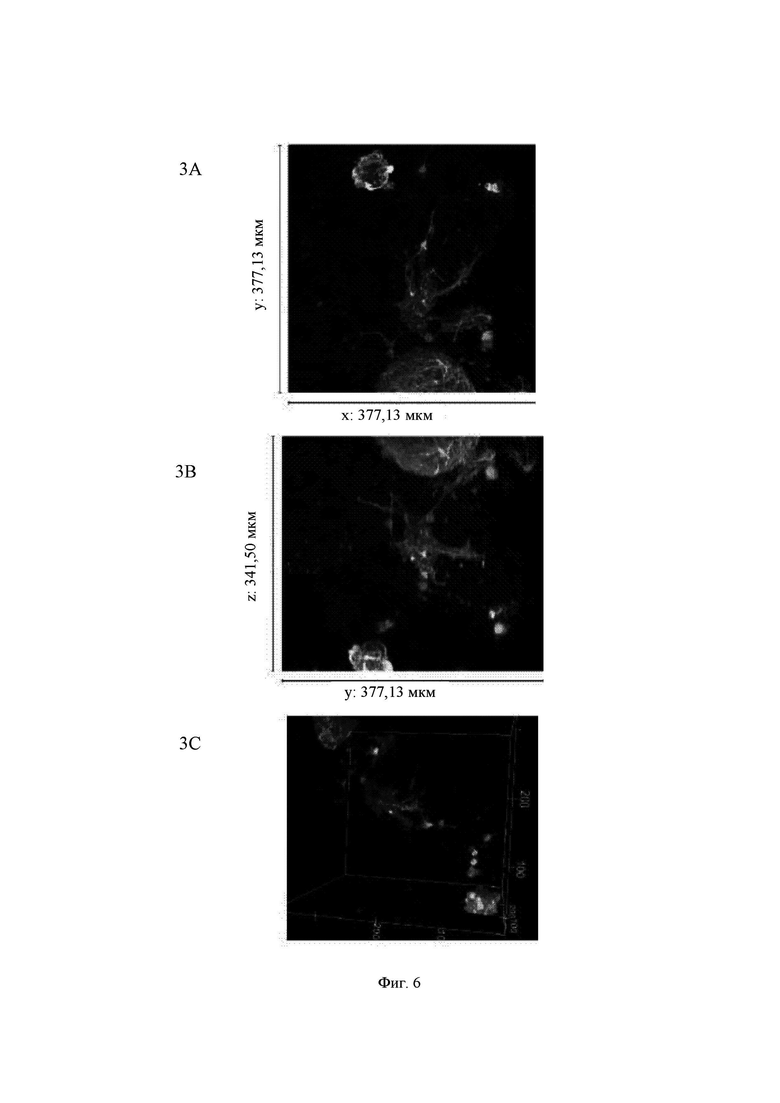
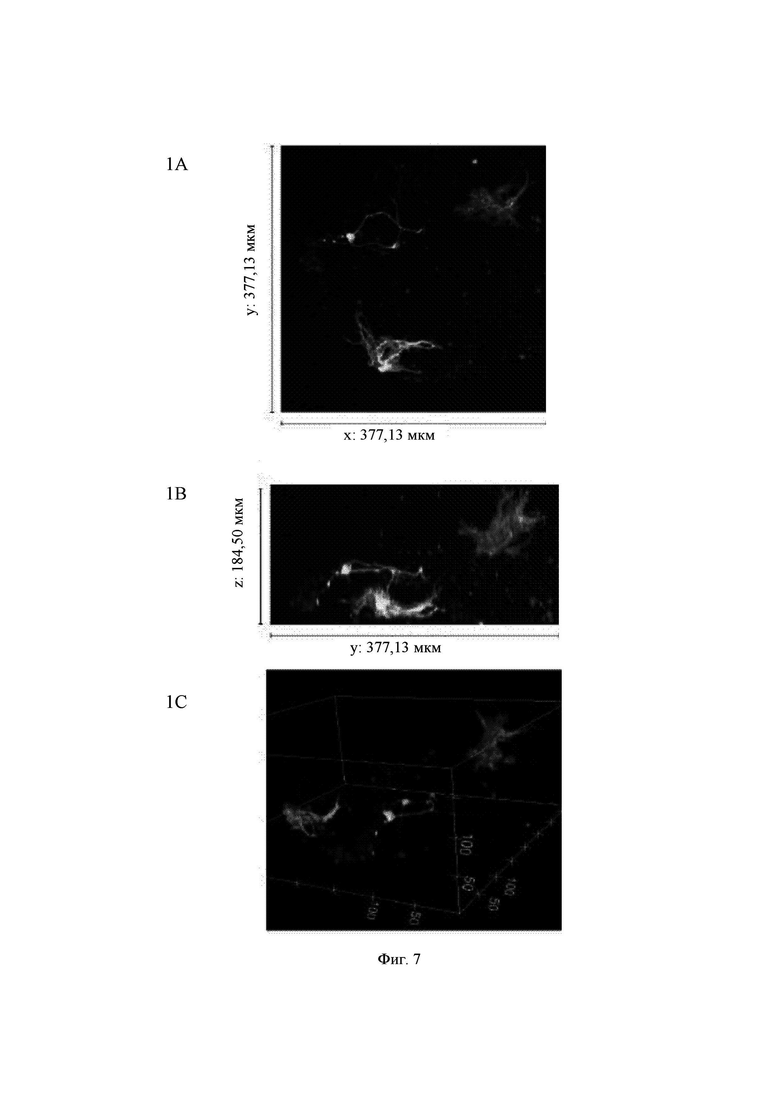
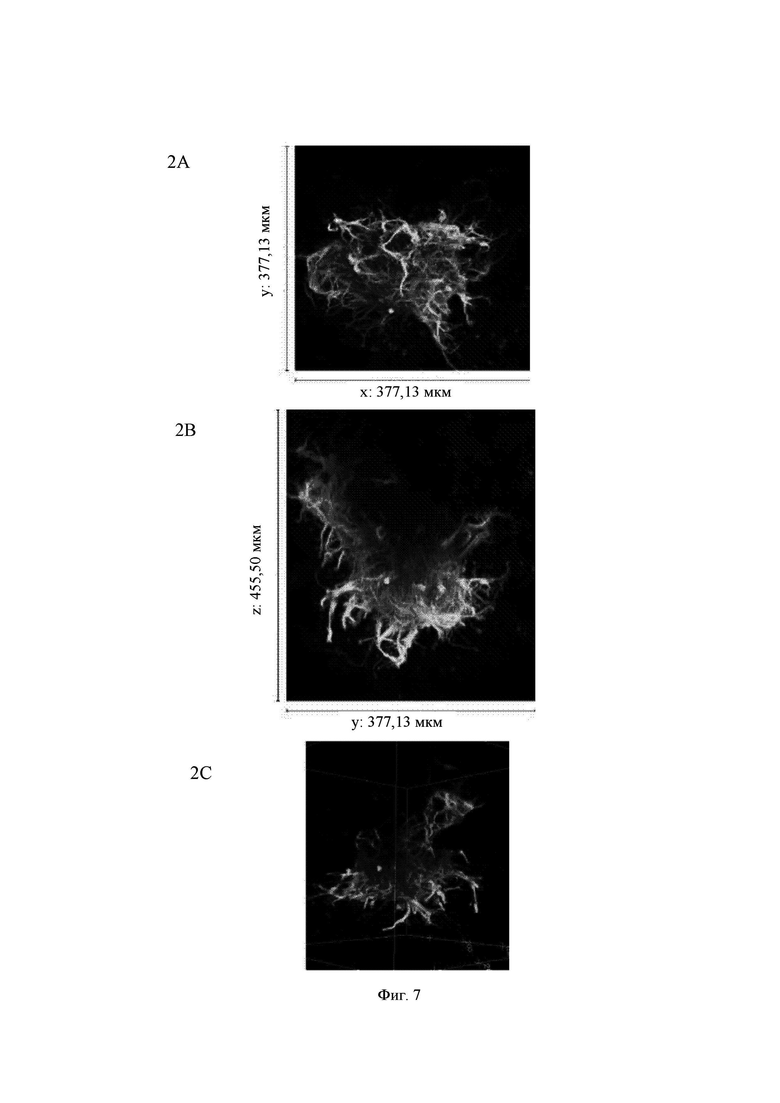
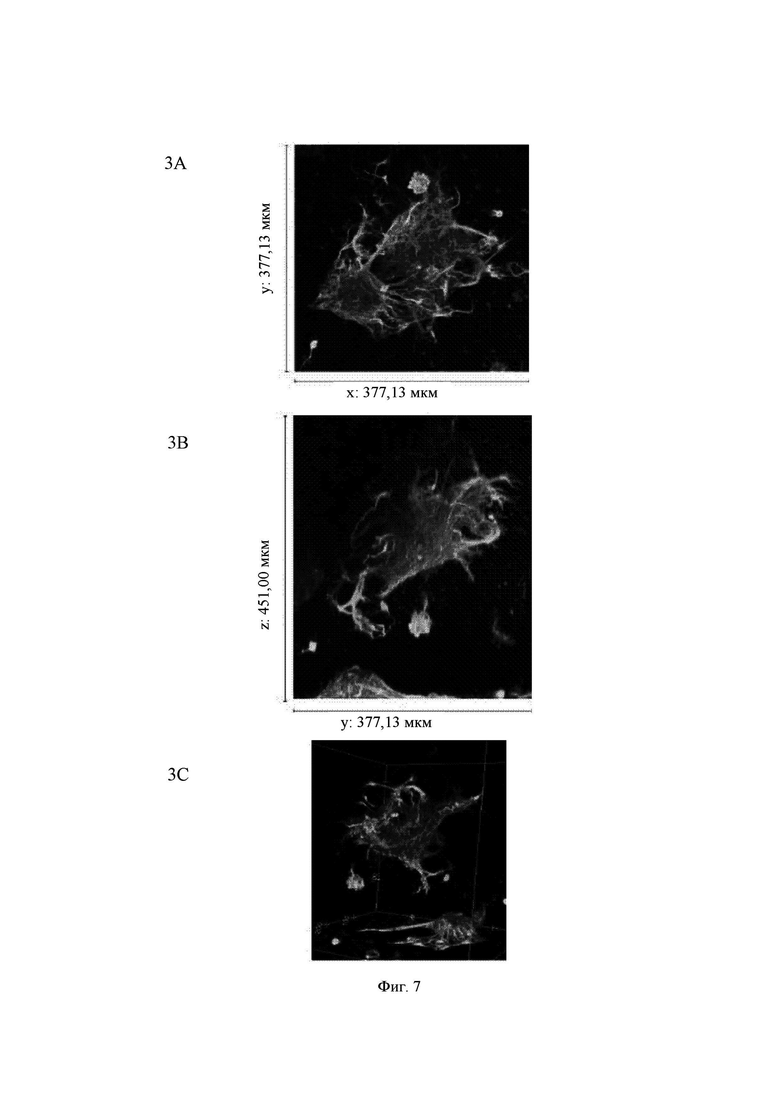
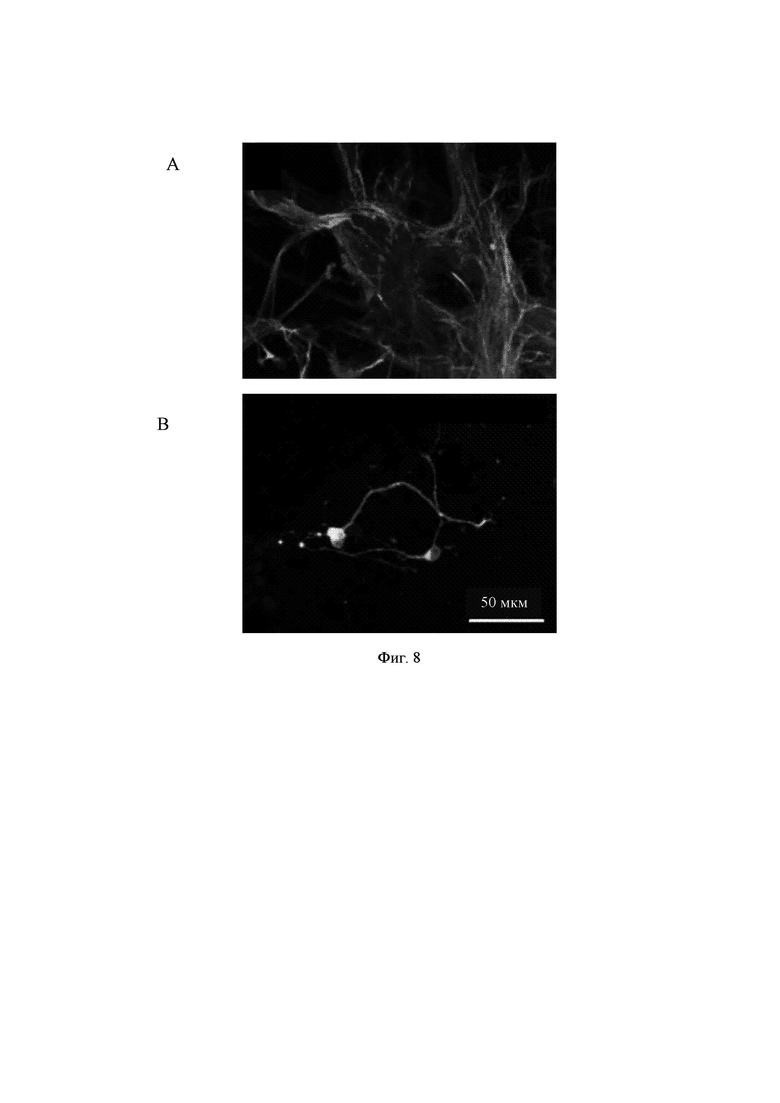
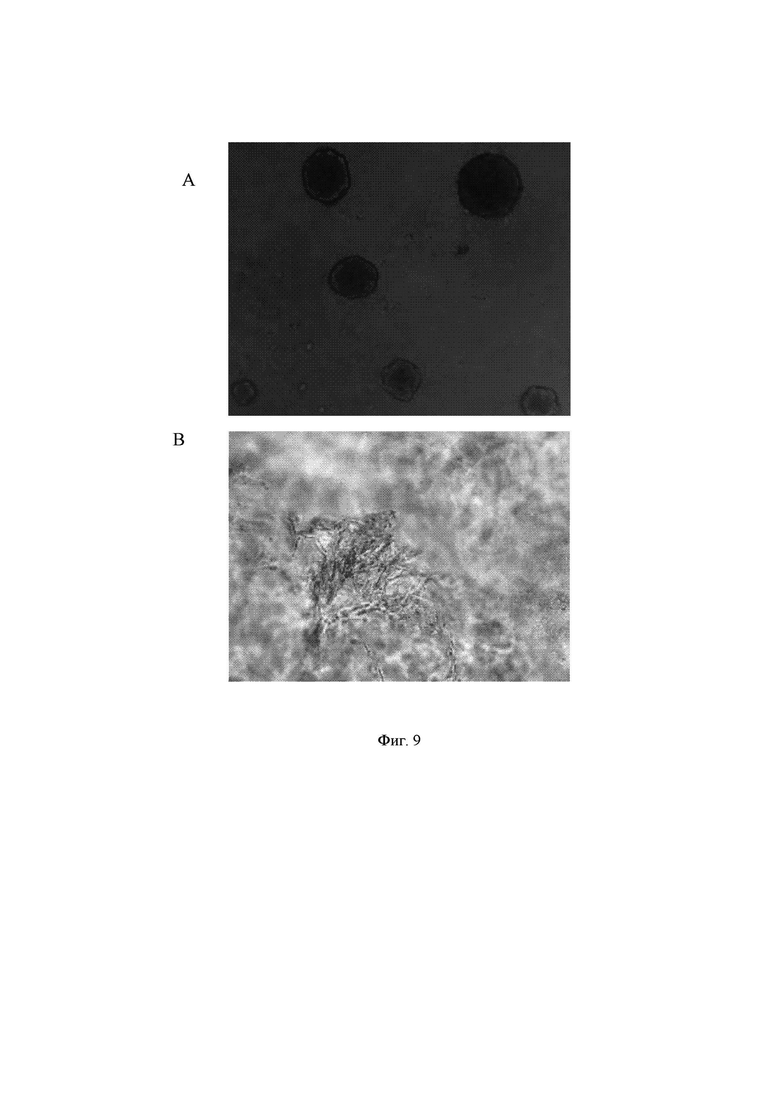
Настоящее изобретение относится к биотехнологии. Представлены композиция и ее применение, а также способы и материалы для культивирования растущих клеток в трехмерной культуре. При этом композиция содержит механически дезинтегрированную анионную нанофибриллярную целлюлозу растительного происхождения, причем эта анионная нанофибриллярная целлюлоза находится в форме гидрогеля. Изобретение применяется для эффективного культивирования клеток. 6 н. и 19 з.п. ф-лы, 2 табл., 9 ил., 2 пр.
1. Композиция для культивирования растущих клеток, содержащая 0,05-0,5 масс.% механически дезинтегрированной анионной нанофибриллярной целлюлозы растительного происхождения, имеющей степень замещения от 0,08 до 0,3 и динамический модуль упругости в диапазоне от 1 до 40 Пa при диспергировании в воде в концентрации 0,5 масс.%, в форме гидрогеля.
2. Композиция по п. 1, где у клеток вырастают отростки или выступающие части.
3. Композиция по п. 1 или 2, где клетки представляют собой нервные клетки.
4. Композиция по любому из пп. 1-3, содержащая 0,05-0,35 масс.% нанофибриллярной целлюлозы.
5. Композиция по любому из пп. 1-4, где указанная анионная нанофибриллярная целлюлоза растительного происхождения содержит нанофибриллярную целлюлозу, полученную из окисленного целлюлозного исходного материала, имеющую содержание карбоксилатных групп выше 0,5 ммоль/г, предпочтительно 0,5-1,6 ммоль/г, более предпочтительно 0,65-1,4 ммоль/г, еще более предпочтительно 0,75-1,2 ммоль/г из расчета на массу целлюлозного исходного материала.
6. Композиция по любому из пп. 1-5, где указанная анионная нанофибриллярная целлюлоза растительного происхождения содержит нанофибриллярную целлюлозу, полученную из карбоксиметилированного целлюлозного исходного материала, имеющую степень замещения выше 0,1, предпочтительно от 0,1 до 0,3, более предпочтительно от 0,12 до 0,2.
7. Композиция по любому из пп. 1-6, где указанная анионная нанофибриллярная целлюлоза растительного происхождения содержит нанофибриллярную целлюлозу, полученную из анионизированного целлюлозного исходного материала, имеющую степень замещения от 0,1 до 0,25 или предпочтительно от 0,12 до 0,2.
8. Композиция по любому из пп. 1-7, где указанная анионная нанофибриллярная целлюлоза растительного происхождения представляет собой целлюлозу I типа.
9. Композиция по любому из пп. 1-8, где указанная анионная нанофибриллярная целлюлоза растительного происхождения содержит окисленную в присутствии TEMPO ((2,2,6,6-тетраметилпиперидин-1-ил)оксила) нанофибриллярную целлюлозу.
10. Композиция по любому из пп. 1-9, где указанная анионная нанофибриллярная целлюлоза растительного происхождения содержит карбоксиметилированную или сульфонированную нанофибриллярную целлюлозу.
11. Композиция по любому из пп. 1-10, где указанная анионная нанофибриллярная целлюлоза растительного происхождения имеет динамический модуль упругости в диапазоне от 3 до 30, предпочтительно от 5 до 20, при диспергировании в воде в концентрации 0,5 масс.%.
12. Композиция по любому из пп. 1-11, где указанная анионная нанофибриллярная целлюлоза растительного происхождения имеет тангенс угла потерь менее 0,3, предпочтительно менее 0,25, когда напряжение сдвига составляет менее 0,5 Па.
13. Композиция по любому из пп. 1-12, где указанная анионная нанофибриллярная целлюлоза растительного происхождения имеет тангенс угла потерь более 1, когда диапазон динамического модуля упругости составляет 1-20 Па, предпочтительно 2-10 Па при диспергировании в воде в концентрации 0,5 масс.%.
14. Композиция по любому из пп. 1-13, где указанная анионная нанофибриллярная целлюлоза растительного происхождения имеет содержание карбоксилатных групп выше 0,75 ммоль/г, предпочтительно 0,75-1,6 ммоль/г, более предпочтительно 0,9-1,2 ммоль/г из расчета на массу целлюлозного исходного материала.
15. Композиция по любому из пп. 1-14, где указанная анионная нанофибриллярная целлюлоза растительного происхождения имеет мутность 20 NTU (нефелометрических единиц мутности) или менее, предпочтительно 10 NTU или менее, более предпочтительно 6 NTU или менее, предпочтительно значение мутности находится в диапазоне от 20 до 1 NTU, более предпочтительно от 10 до 2 NTU в воде в концентрации 0,1 масс.%.
16. Композиция по любому из пп. 1-15, где указанная композиция является прозрачной.
17. Композиция по любому из пп. 1-16, дополнительно содержащая вспомогательные вещества, выбранные из группы, состоящей из компонентов внеклеточного матрикса, сыворотки, факторов роста и белков.
18. Матрица для культивирования клеток, содержащая живые клетки и композицию по любому из пп. 1-17, причем клетки присутствуют в указанной матрице в трехмерном или двумерном расположении.
19. Способ получения композиции по любому из пп. 1-17 для культивирования растущих клеток, включающий: а) предоставление анионной нанофибриллярной целлюлозы и б) смешивание указанной анионной нанофибриллярной целлюлозы с водой.
20. Способ культивирования клеток, включающий предоставление композиции для культивирования растущих клеток по любому из пп. 1-17 и инокулирование указанной композиции по меньшей мере одной клеткой или матрицы по п. 18 и трехмерное или двумерное культивирование с получением клеточной массы.
21. Способ трехмерного культивирования тканей, включающий предоставление композиции для культивирования растущих клеток по любому из пп. 1-17 и погружение ткани внутрь указанной композиции или матрицы по п. 18 и культивирование с получением клеточной массы.
22. Способ по п. 19, где по меньшей мере два типа клеток разного происхождения культивируют в виде совместной культуры.
23. Способ по п. 19 или 20, где композицию ферментативно обрабатывают целлюлазой в течение промежутка времени, достаточного для по меньшей мере частичного высвобождения клеточной массы.
24. Способ по п. 23, где целлюлазу инактивируют или удаляют из клеточной массы после ферментативной обработки.
25. Применение композиции по любому из пп. 1-17 для культивирования растущих клеток.
| VIVIANA R | |||
| LOPES et | |||
| al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO 2014049204 A1, 03.04.2014 | |||
| W0 2014068196 A2, 08.05.2014 | |||
| W0 2015/011337 A1, 29.01.2015 | |||
| ЭЛЮИРУЮЩАЯ МАТРИЦА И ЕЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2665359C2 |
Авторы
Даты
2022-05-20—Публикация
2018-06-19—Подача