ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к композициям для культивирования и доставки клеток, содержащим целлюлозные нановолокна и/или их производные.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Здравоохранение является одной из наиболее активно разрабатываемых областей научных исследований. Необходимость открывать и разрабатывать дешевые и безопасные лекарственные средства постоянно растет. Огромное значение имеет возможность точного моделирования клеточной структуры определенной ткани или органа. Точное копирование системы in vivo в условиях in vitro может потребовать трехмерного роста клеток (3D). Перекрестная связь, возникающая между клетками в 3D культуре клеток, является имитацией роста клеток в физиологических условиях. Действительно, 3D культуры клеток приобрели значение в исследованиях, посвященных регенеративной медицине, лучшему пониманию хронических болезней и получению превосходной модельной системы in vitro для скрининга лекарственных средств и токсикологических анализов. Поэтому их появление было достаточно точно названо «новым измерением в биологии».
Проводятся интенсивные научные исследования с целью выявления и разработки «факторов и подложек», которые могут способствовать 3D росту клеток in vitro. В физиологических условиях клетки не только обмениваются информацией друг с другом, но и взаимодействуют с клеточной микросредой и экстраклеточным матриксом (ЭКМ), в котором они расположены. ЭКМ обеспечивает структурную поддержку клеток, а также участвует в передаче сигналов и определении судьбы клеток. ЭСМ преимущественно состоит из гликозаминогликанов и волокнистых белков, таких как коллаген, эластин, ламинин и фибронектин, которые самоорганизуются в нанофибриллярную сеть. Идеальная подложка для 3D роста клеток должна быть способной имитировать структурный компонент нативного ЭКМ, способствовать росту и сохранению клеток, содержать сеть взаимосвязанных пор достаточного размера для эффективной миграции клеток и переноса питательных веществ в клетки. По существу, механические и химические свойства подложки должны обеспечивать такую же функцию клеток, как в нативном состоянии.
Гидрогели, как синтетические, так и природные, оказались подходящими подложками для 3D культуры клеток. Сеть взаимосвязанных пор в гидрогелях обеспечивает удержание большого объема биологической жидкости, способствует транспортировке кислорода, питательных веществ и отходов. Кроме того, большинство гидрогелей могут формироваться при мягких цитосовместимых условиях, а их биологические свойства можно модулировать с использованием химии поверхностных явлений. Специально разработанные гидрогели с модифицированными механическими, химическими и биологическими свойствами потенциально могут имитировать ЭКМ, что определяет их пригодность для 3D клеточных культур. Коммерческими продуктами для 3D культивирования клеток являются, например, PuraMatrix™ (производства компании 3DM Inc.) и Matrigel (производства компании BD Biosciences). PuraMatrix™ - это гидрогель, состоящий из самоорганизующихся пептидных нановолокон, который напоминает структуру природного фибриллярного коллагена в ЭКМ с диаметром волокон, равным 5-10 нм. Он также имеет высокое содержание воды, в характерном случае - 99,5%. В публикациях US 7,449,180 и WO 2004/007683 описаны пептидные гидрогели. Matrigel - это гелеобразная смесь белков, секретируемых опухолевыми клетками мышей. Смесь напоминает сложную экстраклеточную среду, обнаруживаемую во многих тканях, и используется специалистами по биологии клетки в качестве подложки для культур клеток. MaxGel™ ЕСМ Matrix (производства компании Sigma-Aldrich), который содержит смесь компонентов ЭКМ человека, образует гель при температуре окружающей среды.
Бактериальную целлюлозу использовали для получения ранозаживляющих мембран и в качестве подложки для культур клеток. Ограничением использования бактериальной целлюлозы для культивирования клеток является внутренняя структура ферментированного материала; после культивирования бактериальная целлюлоза образует очень плотные мембраны на границе раздела «воздух-вода» в ферментере. Образующиеся мембраны являются слишком плотными для многих прикладных задач, связанных с 3D культивированием клеток, поэтому необходимы различные модификации для повышения их пористости, которая требуется для проникновения клеток и формирования клеточных кластеров.
Гидрогелевые материалы также широко использовали в других типах прикладных задач, связанных с культивированием клеток, где необходим гидрофильный опорный материал, например - гидроколлоиды агарового типа широко использовали для культивирования растительных клеток, бактерий и грибов для различных микробиологических целей.
В публикации US 5,254,471 описан носитель для культивирования клеток, изготовленный из ультратонких волокон. В публикации WO 2009/126980 описан гидрогель на основе целлюлозы, который содержит целлюлозу со средней степенью полимеризации в диапазоне от 150 до 6200.
Показано, что решения, соответствующие предшествующему уровню техники, были относительно неудовлетворительными для культивирования клеток. Все существующие методы и матриксы для 2D и 3D культур требуют использования химических веществ или соединений животного происхождения в средах из биологических материалов для сохранения и размножения клеток. Сохранение стволовых клеток является особенно трудной задачей, и не существует простых решений для получения матрикса, используемого с культуральной средой, который сохранял бы стволовые клетки в живом состоянии. Присутствие соединений животного происхождения в среде, окружающей культуру клеток, создает высокий риск иммунных реакций и различные проблемы с токсичностью, которая в конечном итоге убивает культивируемые клетки. Матриксы для клеточных культур, содержащие добавки животного происхождения, не пригодны для использования со стволовыми клетками, в частности, если стволовые клетки необходимо использовать для трансплантации тканей и тканевой технологии (инженерии). Кроме того, многие полимеры, предложенные для использования в среде для культивирования клеток, не выдерживают физиологическую температуру или являются токсичными для клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Существует явная необходимость в усовершенствованном материале для культивирования клеток, который мог бы обеспечить соответствующую трех- или двухмерную основу для различных типов клеток. Такие функциональные 3D клеточные модели можно использовать в качестве средств для обнаружения лекарственных средств вместо экспериментов на животных, и они являются более совершенными, чем используемые в настоящее время 2D клеточные модели. Также очень желателен перенос культивированных клеток, например, если целью является пересадка ткани или клеточная терапия. Возможность переноса культивированных кластеров клеток в 3D матриксе желательна при разработке различных клеточных моделей in vitro. Существующие биоматериалы с 3D культурами клеток не позволяют перемещать гидрогелевый матрикс с помощью иглы без существенного повреждения культивируемых клеток.
Поэтому задачей настоящего изобретения является обеспечение нового подхода, позволяющего по меньшей мере частично решить или уменьшить вышеуказанные проблемы, существовавшие на предшествующем уровне техники. Задачи настоящего изобретения решены за счет композиции для культивирования или доставки клеток, содержащей целлюлозные нановолокна или их производные, которая имеет признаки, указанные в независимых пунктах формулы изобретения. Предпочтительные варианты осуществления настоящего изобретения описаны в зависимых пунктах формулы изобретения.
Настоящее изобретение основано на использовании целлюлозных нановолокон и/или их производных в 2D или 3D матриксе для культур клеток. Настоящее изобретение обеспечивает использование целлюлозных нановолокон и/или их производных в матриксе для культур клеток. Использование целлюлозных нановолокон и/или их производных в качестве 2D или 3D матрикса для культур клеток исключает необходимость использования добавок животного происхождения для ускорения и обеспечения размножения клеток на матриксе, содержащем целлюлозные нановолокна и/или их производные.
Авторы настоящего изобретения неожиданно обнаружили, что полученный из растений гидрогель на основе целлюлозных нановолокон (ЦНВ) можно использовать без каких-либо модификаций в качестве биомиметика ЭКМ человека для 3D культур клеток. Данные о пролиферации и жизнеспособности клеток подтверждают, что ЦНВ-гидрогель является оптимальным биоматериалом для 3D подложек для клеток, позволяющим проводить высокопроизводительные скрининговые анализы с использованием функциональных клеток при разработке лекарственных средств, при исследовании токсичности лекарственных средств, в регенеративной медицине, а также для доставки клеток in vivo.
Авторы настоящего изобретения впервые описали физические свойства и свойства биосовместимости ЦНВ-гидрогеля, полученного из растений. Растительную целлюлозу широко используют в целлюлозно-бумажной и текстильной промышленности, и она широко распространена в природе. Нативный целлюлозный нановолоконный гидрогель является непрозрачным. Химическая модификация целлюлозной массы перед ее механической дезинтеграцией позволяет получить оптически прозрачные гидрогели.
Настоящее изобретение основано на экспериментальных исследованиях гидрогелей, состоящих из целлюлозных нановолокон (ЦНВ), которые диспергированы в водной среде. Нановолокна являются высокогидрофильными из-за наличия гидроксильных функциональных групп в полимерах целлюлозы и частично покрыты гемицеллюлозными полисахаридами.
Соответственно, настоящее изобретение в качестве первого аспекта обеспечивает композицию для культивирования или доставки клеток, содержащую целлюлозные нановолокна и/или их производные, причем целлюлозные нановолокна имеют форму гидрогеля или мембраны.
Важным преимуществом настоящего изобретения является то, что клетки могут сохраняться (и пролиферировать) на или в среде из биоматериала, не содержащей во внеклеточной среде химических веществ, происходящих от животного или человека. Клетки равномерно диспергированы на или в среде (матриксе), содержащей целлюлозные нановолокна или их производные. Клетки распределяются на или в среде, начинают пролиферировать, и клеточные кластеры начинают спонтанно расти без аккумуляции клеток на дне планшета для культивирования клеток. Гомогенное распределение клеток в целлюлозных нановолокнах или их производных является предпосылкой функционирования биоматериала в качестве 3D среды для культивирования клеток.
Другими преимуществами настоящего изобретения являются следующие: целлюлозные нановолокна и/или их производные являются инертными и не создают флуоресцирующего фона. Среды, содержащие целлюлозные нановолокна или их производные, можно вводить посредством инъекции. Инъецируемость объясняется их реологическими свойствами. Инъекцию можно осуществить таким образом, что клетки остаются стабильными внутри матрикса и гомогенно распределенными в матриксе после инъекции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
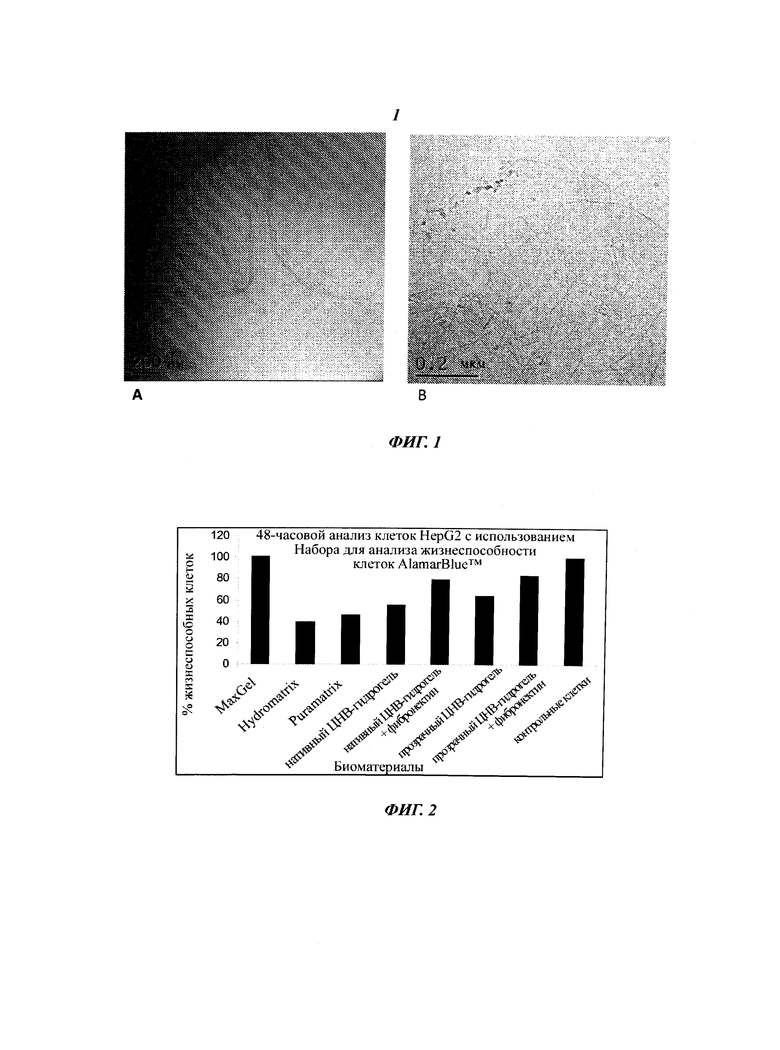
Фиг.1 изображает крио-ТЭМ снимки гидрогелей на основе целлюлозных нановолокон. Нативный ЦНВ-гидрогель изображен слева (А), а прозрачный ЦНВ-гидрогель - справа (В).
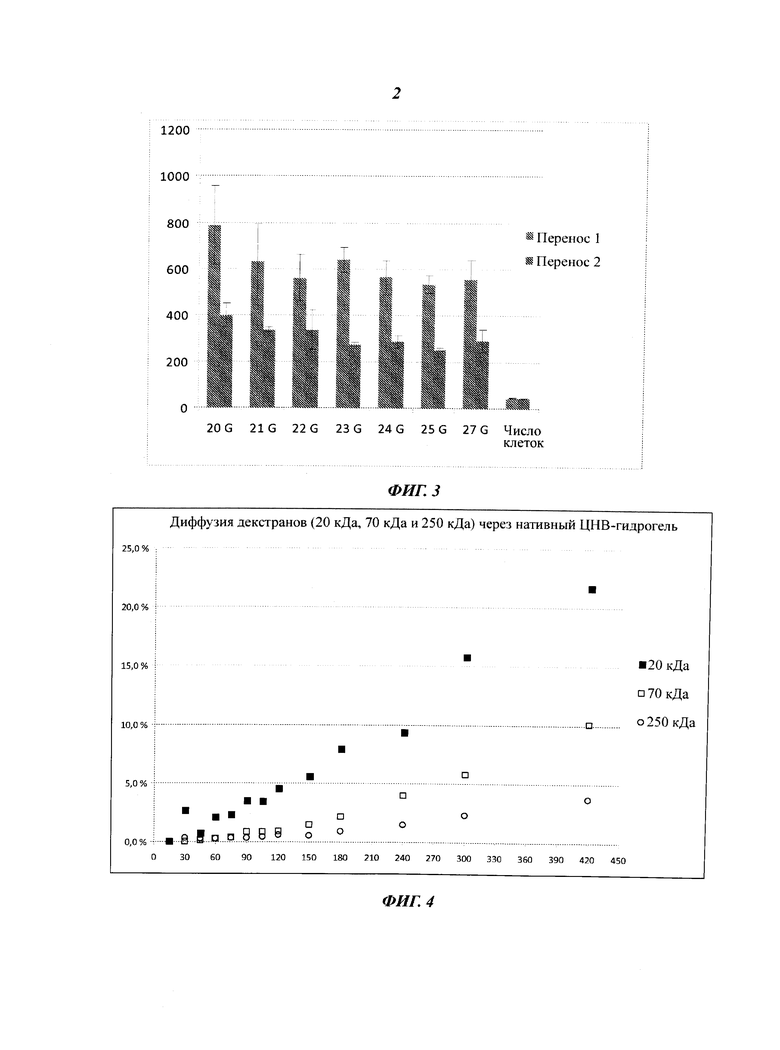
Фиг.2 демонстрирует жизнеспособность клеток HepG2 в коммерческих материалах для культивирования клеток [MaxGel™ (Sigma-Aldrich), HydroMatrix™ (Sigma-Aldrich) и PuraMatrix™ (3DM Inc.), в двух других материалах на основе целлюлозных нановолокон (нативный ЦНВ-гидрогель и прозрачный ЦНВ-гидрогель) и в ЦНВ-гидрогеле, в который добавлен фибронектин (ФН). В ходе анализа пролиферации с использованием Набора для анализа жизнеспособности клеток AlamarBlue™ клетки культивировали в течение 48 часов, а контрольные клетки культивировали в одинаковых условиях на полимерной поверхности.
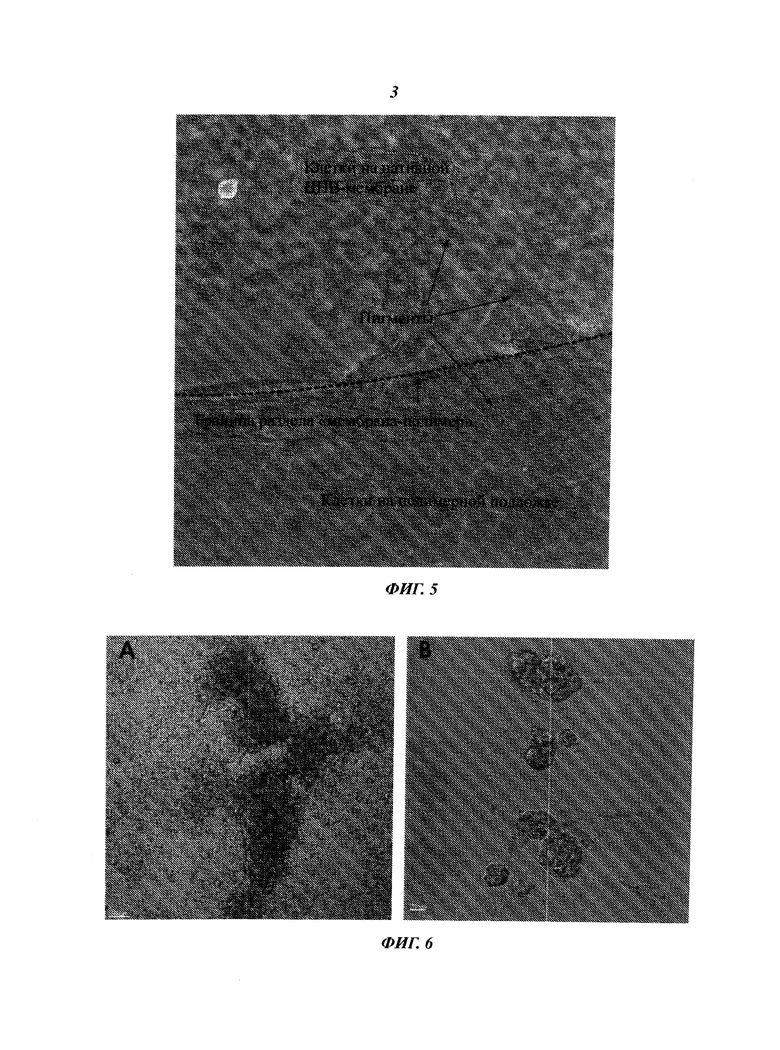
Фиг.3 демонстрирует жизнеспособность клеток ARPE-19 в нативном ЦНВ-гидрогеле после переноса клеток иглами для шприца различного размера. Жизнеспособность представлена как относительная интенсивность флуоресценции.
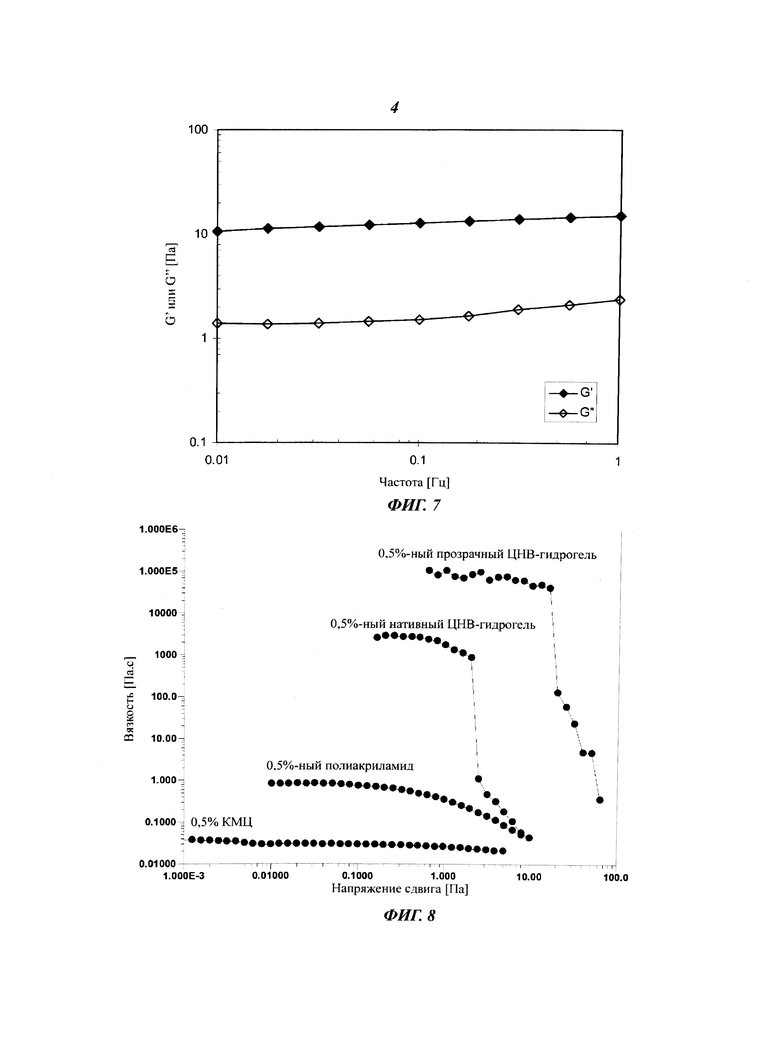
Фиг.4 демонстрирует диффузию декстранов с различной молекулярной массой (20 кДа, 70 кДа и 250 кДа) через 1%-ный нативный гидрогель на основе целлюлозных нановолокон.
Фиг.5 представляет светомикроскопическое изображение клеток ARPE-19 на нативной ЦНВ-мембране. ЦНВ-мембрана поддерживает рост клеток в верхней части снимка, в нижней части снимка клетки растут на полимерной подложке для культивирования клеток. Увеличение 20×.
Фиг.6 представляет конфокально-микроскопические изображения срезов клеток HepG2 на полимерной подложке (A) для культивирования клеток и в нативном гидрогеле (B) на основе целлюлозных нановолокон.
Фиг.7 демонстрирует вязкоупругие свойства 0,5%-ного ЦНВ-гидрогеля, определенные посредством динамических осцилляторных реологических измерений. Показаны частотная зависимость G' (модуля накопления) и G'' (модуля потерь) 0,5%-ного нативного ЦНВ-гидрогеля.
Фиг.8 демонстрирует вязкость 0,5%-ных ЦНВ-гидрогелей как функцию приложенного сдвигающего напряжения по сравнению с 0,5%-ным раствором водорастворимого полимера полиакриламида (5000 кДа) и КМЦ (250 кДа).
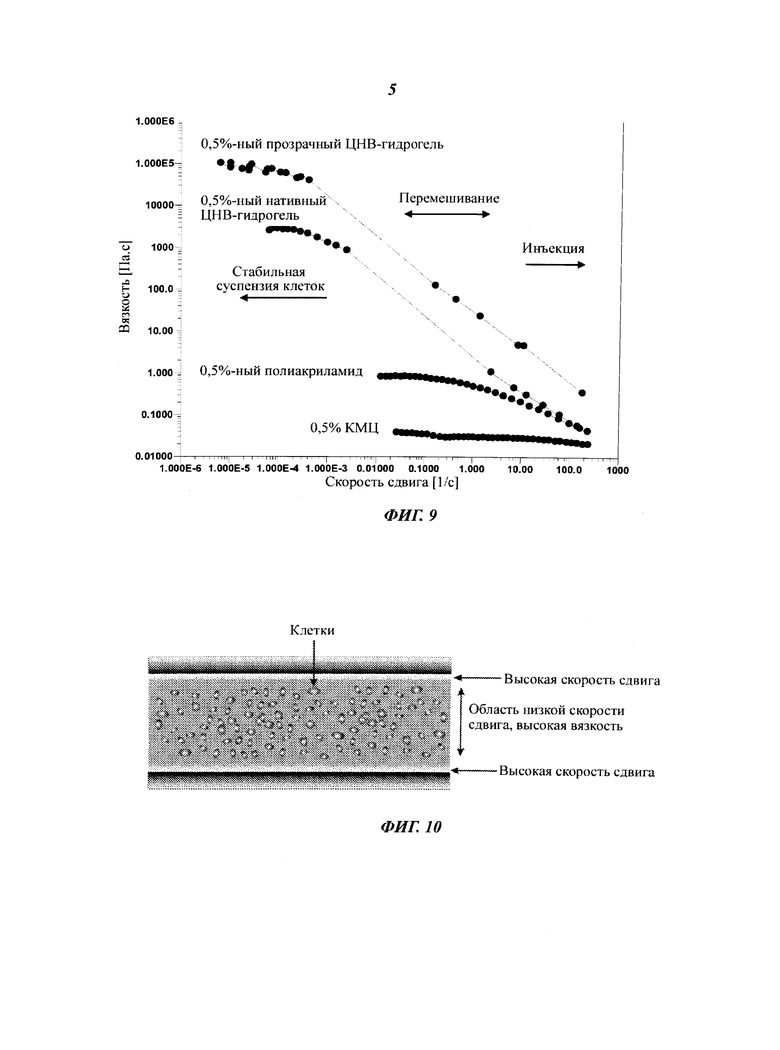
Фиг.9 демонстрирует вязкость 0,5%-ных ЦНВ-гидрогелей как функцию измеренной скорости сдвига по сравнению с 0,5%-ным раствором полиакриламида и КМЦ. Характерные зоны скорости сдвига при различных физических процессах отмечены на рисунке стрелками.
Фиг.10 является схематическим изображением ЦНВ-гидрогеля, содержащего клетки, который течет в игле. Область высокой скорости сдвига (низкой вязкости) расположена на поверхности раздела «гель-игла», а область низкой скорости сдвига (очень высокой вязкости) - в центре иглы.
Фиг.11 демонстрирует изменение скорости сдвига и вязкости, когда 0,7%-ный ЦНВ-гель сдвигают в реометре с системой концентрических цилиндров при постоянном напряжении, равном 40 Па.
Фиг.12 демонстрирует восстановление структуры дисперсии в 0,7%-ном нативном ЦНВ-гидрогеле после сдвига с высокой скоростью сдвига по сравнению с осторожным перемешиванием стеклянной палочкой.
Фиг.13 демонстрирует стабильность двух суспензий песка в 0,5%-ном нативном ЦНВ-гидрогеле (верхний ряд) и в 0,5%-ном прозрачном ЦНВ-гидрогеле (нижний ряд) в течение периода, равного 17 дням. Был использован песок, соответствующий стандарту CEN (EN 196-1), со средним размером частиц, равным 1-2 мм и 2-3 мм. Образцы хранили при комнатной температуре.
Фиг.14 демонстрирует влияние ферментативного гидролиза на способность гелей на основе целлюлозных нановолокон к образованию суспензий. Был использован песок, соответствующий стандарту CEN (EN 196-1), со средним размером частиц, равным 1-2 мм.
Фиг.15 представляет конфокально-микроскопическое изображение прогениторных клеток печени, полученных из эмбриональных стволовых клеток человека, которые погружены в нативный ЦНВ-гидрогель. Длина измерительной линии: 70 мкм.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции для культивирования или доставки клеток, содержащей целлюлозные нановолокна и/или их производные, причем целлюлозные нановолокна или их производные имеют форму гидрогеля или мембраны. Целлюлозные нановолокна или их производные можно получить из материала, не происходящего от животных, например - из сырьевого материала, содержащего растительный материал.
Если в явном виде не указано иное, то термины, которые использованы в описании и формуле изобретения, имеют значения, обычно используемые в области культивирования клеток. Более конкретно, следующие термины имеют значения, приведенные ниже.
Термин «композиция для культивирования или доставки клеток» относится к материалу, содержащему целлюлозные нановолокна или производные целлюлозных нановолокон, который используют в качестве среды для культивирования клеток или для доставки клеток. Эту композицию можно также использовать для переноса клеток или кластеров клеток. Целлюлозные нановолокна могут находиться в форме гидрогеля или мембраны. Композиция может дополнительно содержать различные добавки, такие как особые компоненты экстраклеточного матрикса, сыворотку, факторы роста и белки.
Термин «целлюлозный сырьевой материал» относится к любому источнику целлюлозного сырьевого материала, который может быть использован для получения целлюлозной массы, рафинированной целлюлозной массы или целлюлозных нановолокон. Сырьевой материал может иметь в основе любой растительный материал, содержащий целлюлозу. Растительным материалом может быть древесина. Древесина может быть получена от деревьев с мягкой древесиной, таких как ель, сосна, пихта, лиственница, дугласова пихта или хемлок, или от деревьев с твердой древесиной, таких как береза, осина, тополь, ольха, эвкалипт или акация, или быть смесью мягкой древесины и твердой древесины. Недревесный материал может происходить из сельскохозяйственных отходов, трав или других растительных веществ, таких как солома, листья, кора, семена, шелуха, цветки, растения или плоды хлопчатника, кукурузы, овса, ржи, ячменя, риса, льна, конопли, манильской конопли, сизалевой агавы, джута, китайской крапивы, кенафа, сахарного тростника, бамбука или камыша.
Термин «целлюлозная масса» относится к целлюлозным волокнам, которые выделены из любого целлюлозного сырьевого материала с использованием химических, механических, термомеханических или химикотермомеханических процессов варки целлюлозы. Обычно диаметр волокон лежит в диапазоне от 15 до 25 мкм, а их длина превышает 500 мкм, но настоящее изобретение не ограничено этими параметрами.
Целлюлоза в настоящем изобретении структурно является целлюлозой I типа.
Термин «целлюлозное нановолокно» относится к совокупности выделенных целлюлозных нановолокон (ЦНВ) или пучков нановолокон, полученных из целлюлозного сырьевого материала или целлюлозной массы. Нановолокна в характерном случае имеют большое характеристическое отношение: их длина может превышать один микрометр, тогда как среднечисловой диаметр обычно меньше 200 нм. Диаметр пучков нановолокон может быть и большим, но обычно он меньше 1 мкм. Самые мелкие нановолокна сходны с так называемыми элементарными фибриллами, которые обычно имеют диаметр в диапазоне от 2 до 12 нм. Размеры фибрилл или пучков фибрилл зависят от сырьевого материала и способа дезинтеграции. Целлюлозные нановолокна могут также содержать некоторое количество гемицеллюлоз; их содержание зависит от растительного источника.
Механическую дезинтеграцию целлюлозных нановолокон из целлюлозного сырьевого материала, целлюлозной массы или рафинированной целлюлозной массы осуществляют с использованием подходящего оборудования, например - рафинатора, дефибратора, гомогенизатора, аппарата для получения коллоидной целлюлозы, фрикционного дефибратора, ультразвукового аппарата, флюидизатора, например - микрофлюидизатора, макрофлюидизатора или гомогенизатора флюидизирующего типа. «Целлюлозные нановолокна» предпочтительно являются механически дезинтегрированным материалом.
«Целлюлозные нановолокна» или «целлюлозные нановолокна и/или их производные» могут также быть любыми химически или физически модифицированными производными целлюлозных нановолокон или пучков нановолокон. Химическая модификация может быть основана, например, на реакциях карбоксиметилирования, окисления, например - окисления с использованием TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила), эстерификации (образования сложного эфира) и этерификации (образования простого эфира) молекул целлюлозы. Модификация может быть также осуществлена посредством физической адсорбции анионных, катионных или неионногенных веществ или любой их комбинации на поверхности целлюлозы. Описанную модификацию можно осуществить до, после или во время получения целлюлозных нановолокон. Некоторые модификации могут привести к получению ЦНВ-материалов, способных разлагаться в организме человека.
Целлюлозный сырьевой материал, например - целлюлозную массу, перед механической дезинтеграцией предпочтительно предварительно обрабатывают кислотой или щелочью. Предварительную обработку проводят, подвергая целлюлозную массу обработке кислотой, предпочтительно - соляной кислотой, для удаления положительно заряженных ионов, имеющих заряд больше +1, с последующей обработкой неорганическим основанием, содержащим положительно заряженные ионы с зарядом +1, предпочтительно - NaOH, так что ионы Na+ замещают ранее присутствовавшие ионы. Такая предварительная обработка придает «целлюлозным нановолокнам» превосходные гелеобразующие свойства и прозрачность. Такой предварительно обработанный продукт называют прошедшими кислотно-щелочную обработку или ионозамещенными «целлюлозными нановолокнами».
Микробиологическая чистота «целлюлозных нановолокон» важна для качества клеточных культур. Поэтому «целлюлозные нановолокна» перед экспериментами с клеточными культурами стерилизуют в форме гидрогеля или в форме мембраны. Кроме того, важно минимизировать микробное загрязнение продукта до и во время получения волокон. Перед получением волокон предпочтительно асептически получить целлюлозную массу с целлюлозно-бумажного завода непосредственно после стадии отбеливания, пока масса еще остается стерильной.
Существует несколько широко используемых синонимов для целлюлозных нановолокон. Например: наноцеллюлоза, нанофибриллированная целлюлоза (ЦНФ), нанофибриллярная целлюлоза, целлюлозное нановолокно, целлюлоза, фибриллированная на наноуровне, микрофибриллярная целлюлоза, микрофибриллированная целлюлоза (ЦНФ) или целлюлозные микрофибриллы. Целлюлозные нановолокна, полученные с использованием некоторых микроорганизмов, также имеют различные синонимы, такие как бактериальная целлюлоза, микробная целлюлоза (МЦ), биоцеллюлоза, "nata de coco" (NDC) или "coco de nata".
Целлюлозные нановолокна, описанные в настоящем изобретении, не являются тем материалом, который называют целлюлозными вискерами, которые также известны под названиями: целлюлозные нановискеры, целлюлозные нанокристаллы, целлюлозные наноиглы, игольчатые микрокристаллы целлюлозы или целлюлозные нанонити. В некоторых случаях для обоих материалов используют одинаковую терминологию, например - в работе Kuthcarlapati et al. (Metals Materials and Processes 20(3):307-314, 2008), в которой исследованный материал был назван «целлюлозными нановолокнами», хотя они явно имели в виду целлюлозные нановискеры. Обычно эти материалы не имеют аморфных сегментов по длине волокнистой структуры, как целлюлозные нановолокна, что приводит к более жесткой структуре. Целлюлозные вискеры также короче, чем целлюлозные нановолокна; обычно их длина меньше одного микрометра.
Размеры отдельных целлюлозных нановолокон близки к указанным выше размерам коллагеновых волокон в ЭКМ, то есть 4-10 нм. Поэтому гидрогели на основе ЦНВ можно использовать в качестве 3D матрикса для культур клеток.
В экспериментах с клеточными культурами согласно настоящему изобретению было использовано два вида целлюлозных нановолокон: непрозрачные нативные ЦНВ и оптически прозрачные ЦНВ, которые представляли собой целлюлозу, окисленную с использованием TEMPO. Подробное описание материалов приведено в разделе «Описание примеров осуществления изобретения».
Термин «гидрогель на основе целлюлозных нановолокон» относится к водной дисперсии целлюлозных нановолокон.
Термин «мембрана из целлюлозных нановолокон» относится к влажной или сухой листовой структуре из целлюлозных нановолокон. Мембраны обычно получают посредством фильтрации разбавленной дисперсии целлюлозных нановолокон с использованием аппарата для вакуумной фильтрации с подходящим фильтром. Также для получения мембранных структур можно использовать формование из растворителя. Полученную мембрану можно использовать сразу же во влажном состоянии или высушить перед использованием.
Целлюлозные нановолокна или их производные согласно настоящему изобретению могут содержать химически или физически модифицированные производные целлюлозных нановолокон или пучков нановолокон.
Композиция для культивирования клеток или доставки клеток согласно настоящему изобретению может дополнительно содержать подходящие добавки, выбранные из группы, состоящей из специальных компонентов экстраклеточного матрикса, сыворотки, факторов роста и белков.
Настоящее изобретение также относится к матриксу для культивирования клеток или доставки клеток, который содержит живые клетки и композицию для культивирования клеток или доставки клеток, образующую гидрогель, причем клетки находятся в матриксе в виде трехмерной или двумерной структуры.
Клетками могут быть любые клетки. Любая эукариотическая клетка, например - животные клетки, растительные клетки или клетки грибов, входит в объем настоящего изобретения, также как и прокариотические клетки, такие как бактериальные клетки.
В зависимости от клеточной линии эксперименты проводят с использованием 2D или 3D матриксов, то есть либо клетки культивируют на ЦНВ-мембранах или ЦНВ-гелях, либо клетки равномерно диспергируют в ЦНВ гидрогелях или ЦНВ-мембранах. Конкретные примеры осуществления настоящего изобретения показывают, что спонтанно растущие клетки пигментного эпителия сетчатки (ARPE-19) образуют монослой, тогда как клетки гепатоклеточной карциномы человека (HepG2) образуют либо монослой, либо колонии клеток.
Клетки можно обнаружить с использованием любого средства обнаружения или красителя, известного в данной области техники.
Настоящее изобретение также относится к способу получения композиции согласно настоящему изобретению, включающему стадии получения целлюлозных нановолокон и/или их производных; необязательно - смешивания целлюлозных нановолокон и/или их производных с водой; и переноса или помещения целлюлозных нановолокон и/или их производных или полученной смеси в подходящую среду для культивирования или доставки клеток.
Гидрогели или мембраны на основе целлюлозных нановолокон или их производных или композицию согласно настоящему изобретению можно использовать в качестве материала для доставки клеток.
Гидрогели или мембраны на основе целлюлозных нановолокон или их производных или композицию для культивирования клеток или доставки клеток согласно настоящему изобретению можно использовать для доставки материала для клинического использования.
Настоящее изобретение относится к микробиологическому использованию целлюлозных нановолокон или их производных или композиции согласно настоящему изобретению для лабораторных и/или промышленных задач в качестве среды или компонента среды для сохранения клеток in vitro.
Композицию, содержащую целлюлозные нановолокна или их производные, можно использовать для иммобилизации клеток или ферментов.
Настоящее изобретение также относится к способу культивирования клеток, который включает стадии получения клеток; приведения в контакт клеток с композицией для культивирования клеток, содержащей целлюлозные нановолокна или их производные, с получением матрикса; и культивирования клеток в матриксе с получением трехмерной или двумерной структуры.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются эукариотическими клетками.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются прокариотическими клетками. Прокариотическими клетками являются микроорганизмы, такие как аэробные или анаэробные бактерии, вирусы или грибы, такие как дрожжевые и плесневые грибы.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются стволовыми клетками.
Удаление целлюлозных нановолокон можно произвести, например, с помощью ферментов, осуществив ферментативную деградацию молекул целлюлозы. Подходящими ферментами являются, например, коммерчески доступные целлюлазы. Культивируемые клеточные линии могут также быть модифицированы посредством генетической инженерии так, чтобы они выделяли необходимый белок-фермент в культуральную среду.
Настоящее изобретение также относится к способу удаления целлюлозных нановолокон или их производных из материала для роста клеток или культивирования клеток, который включает стадии получения материала, содержащего среду для роста клеток и клетки и, необязательно, медикамент; разбавления этого материала водной или неводной жидкостью; и удаления целлюлозных нановолокон посредством декантации. Умеренное центрифугирование можно использовать для осаждения клеток и агрегатов клеток перед декантацией.
Авторы настоящего изобретения неожиданно обнаружили, что ЦНВ-гидрогель, полученный из растений, можно использовать без каких-либо модификаций в качестве биомиметика ЭКМ человека для 3D культивирования клеток. Данные о пролиферации и жизнеспособности клеток свидетельствуют о том, что ЦНВ-гидрогель является оптимальным материалом для 3D-подложек для клеток, используемых для проведения на функциональных клетках высокопроизводительных скрининговых анализов при разработке лекарственных средств, при исследовании токсичности лекарственных средств и в регенеративной медицине, а также для доставки клеток in vivo.
Настоящее изобретение впервые описывает физические свойства ЦНВ-гидрогелей, полученных из растений, и их биосовместимость. Растительную целлюлозу широко используют в целлюлозно-бумажной и текстильной промышленности, и она широко распространена в природе. Нативный целлюлозный нановолоконный гидрогель является непрозрачным. Химическая модификация целлюлозной массы перед ее механической дезинтеграцией позволяет получить оптически прозрачные гидрогели.
Целлюлозные нановолокна согласно настоящему изобретению можно использовать в форме гидрогеля или влажной или сухой мембраны. Прочность ЦНВ-гидрогеля легко можно изменить посредством разбавления. Целлюлозные нановолокна или их производные, обладающие сходными свойствами, не токсичны для клеток.
Если сравнивать гидрогели на основе целлюлозных нановолокон с УФ-сшиваемыми гидрогелями дл культур клеток, такими как гидрогели на основе гиалуроновой кислоты или ПЭГ, то ЦНВ-материалы считаются гораздо менее токсичными. В УФ-сшиваемых гелях для инициации гелеобразования необходимо использовать вредные фотоинициаторы, тогда как ЦНВ-гидрогели образуются спонтанно. Нековалентный характер ЦНВ-гидрогелей обеспечивает также возможность регулирования их пористости посредством разбавления.
Клетки равномерно распределяются в гидрогелях на основе целлюлозных нановолокон и могут автоматически начать делиться и разрастаться с образованием 3D-кластеров без оседания на дно планшета для культивирования клеток. Все используемые в настоящее время коммерческие среды для 3D-культур клеток требуют добавления пептида адгезии для того, чтобы клетки могли сформировать 3D-структуру на планшете для культивирования клеток.
Целлюлозные нановолокна согласно настоящему изобретению или их производные можно использовать без пептида адгезии. Клетки прикрепляются к планшету и спонтанно равномерно распределяются в гидрогеле на основе целлюлозных нановолокон. Клетки образуют гомогенную суспензию в непрерывной фазе благодаря механической поддержке, обеспечиваемой целлюлозными нановолокнами. Достаточно высокий предел текучести стабилизирует клетки и растущие кластеры клеток, препятствуя их седиментации.
Гидрогели на основе целлюлозных нановолокон растительного происхождения функционируют без белка адгезии и/или искусственной пористости, тогда как бактериальные целлюлозные нановолокна требуют белка адгезии. Бактериальную целлюлозу используют непосредственно после ферментации, и в этом случае образующаяся мембранная структура является гораздо более плотной, чем гидрогель согласно настоящему изобретению, то есть гидрогель из целлюлозных нановолокон. Поэтому способы согласно предшествующему уровню техники требуют дополнительных процессов для придания гидрогелевому матриксу большей пористости.
Плотность среды для культивирования клеток, содержащей целлюлозные нановолокна, можно отрегулировать, не влияя на свойства культуры клеток. Целлюлозные нановолокна, происходящие от бактерий, также являются более толстыми, чем целлюлозные нановолокна из других источников, и поэтому они не являются свободно модифицируемыми для культивирования клеток.
Клетки растут в 3D-матриксе или на матриксе. Этот материал может быть инъецируемым или представлять собой плоскую мембрану с соответствующей топологией поверхности.
Свойства ЦНВ близки к оптимальным для 3D-культивирования клеток: прозрачные, не токсичные, высоковязкие, с высокой способностью к образованию суспензии, с высоким удержанием воды, с хорошей механической адгезией, не животного происхождения, по размерам напоминают ЭКМ, не чувствительны к солям, температуре или pH, не разлагаются, не автофлуоресцируют. ЦНВ обеспечивают пренебрежимо низкий флуоресцентный фон благодаря химической структуре материала. Кроме того, ЦНВ-гель не токсичен для клеток.
Клетки можно культивировать или выращивать на ЦНВ-гелях в течение длительного времени, например - в течение 2-7 дней или даже дольше. Клетки можно также культивировать или только суспендировать в гидрогеле в течение короткого времени, например - от нескольких минут до нескольких часов. Клетки используют наноцеллюлозные волокна как подложку/опору для роста, являющуюся платформой. Клетки образуют кластеры, что свидетельствует о пригодности целлюлозных нановолокон для использования в качестве подложки для 3D-культур клеток. Клетки растут в виде слоев или клеточных агрегатов на ЦНВ-геле или внутри него, в зависимости от метода нанесения и типа клеток.
Нетоксичный ЦНВ-гидрогель является таким же хорошим ЭКМ для исследованных клеток, как MaxGel™ на основе ЭКМ человека. Жизнеспособность клеток даже выше, чем в PuraMatrix™ или HydroMatrix™. В ЦНВ-гидрогели не добавляют компоненты ЭКМ человека или животных. Однако добавление фибронектина или коллагена IV в системы на основе ЦНВ в некоторых случаях может быть полезным. Судя по результатам исследования диффузии, ЦНВ-гидрогель является высоко проницаемым и способствует обмену кислорода, питательных веществ и водорастворимых метаболитов в клетках.
Криотрансмиссионная электронная микроскопия демонстрирует, что ЦНВ-гидрогель состоит из смеси отдельных целлюлозных нанофибрилл и пучков волокон. Размеры ЦНВ близки к размерам нативного коллагена человека, который является природным компонентом ЭКМ и обычно используется в качестве опоры для клеток. Прочность (упругость) ЦНВ-гидрогеля остается примерно постоянной в диапазоне частот от 0,01 до 1 Гц. Реологические данные показывают сдвиговую вязкость порядка нескольких сотен килопаскаль в покое (при низком сдвиговом напряжении), которая снижается до нескольких паскаль при сдвиговом напряжении, равном одному паскалю. Такое поведение уникально для гидрогелей из биоматериалов. Оно обеспечивает исключительно высокую суспендирующую способность и опору для клеток, а благодаря разжижению при сдвиге обеспечивает легкое дозирование и инъецирование клеток в ЦНВ-гидрогеле независимо от размера используемых игл; такого поведения ранее не было у других гидрогелей из биоматериалов для культивирования клеток. Механические свойства упругости и жесткости ЦНВ-гидрогелей являются оптимальными для роста 3D-культур клеток и инъектирования клеток.
Преимуществом настоящего изобретения является то, что размеры фибриллярной сети из целлюлозных нановолокон или их производных очень близки к размерам природной ЭКМ-сети из коллагеновых нановолокон. Кроме того, целлюлозные нановолокна или их производные являются материалом не животного происхождения, то есть отсутствует риск передачи болезней. В настоящее время большинство коммерческих продуктов получают от животных. Кроме того, изобретение обеспечивает возможности регулировать физическую форму, так как можно использовать ЦНВ-материалы от гидрогелей до мембран.
Инъектируемый гидрогель образует поддерживающий матрикс вокруг клеток благодаря очень высокому пределу текучести. ЦНВ-мембраны являются прозрачными и высокопористыми. Массовое производство их является легким по сравнению с альтернативными вариантами.
Нативные целлюлозные нановолокна не токсичны для клеток. Пролиферация клеток почти в два раза выше в случае целлюлозных нановолокон или их производных по сравнению с контролем (только клетки). Клетки можно контролировать на ЦНВ-гидрогелях в течение длительного времени (например, в течение 2-7 дней). Клетки используют матрикс из целлюлозных нановолокон в качестве платформы для роста. Клетки образуют кластеры, что подтверждает пригодность целлюлозных нановолокон или их производных для использования в качестве подложки для 3D культур клеток. Клетки растут внутри ЦНВ-геля в виде слоев. Целлюлозные нановолокна или их производные создают пренебрежимо малый флуоресцирующий фон. Гидрогель на основе целлюлозных нановолокон обладает оптимальной упругостью, прочностью, сдвиговым напряжением, механической адгезией и пористостью для использования в качестве матрикса для 3D и 2D культур клеток.
В водной среде целлюлозные нановолокна образуют непрерывную гидрогелевую сеть из диспергированных нановолокон или пучков нановолокон. Гель образуют высокогидратированные фибриллы, которые перепутываются друг с другом, даже при очень низких концентрациях. Фибриллы могут также взаимодействовать через водородные связи. Макроскопическая структура легко разрушается при механическом взбалтывании, то есть гель начинает течь при повышенном сдвиговом напряжении. Применение гелей на основе целлюлозных нановолокон и/или их производных в качестве материала для культивирования клеток ранее описано не было.
Применения настоящего изобретения включают получение материала для культивирования клеток для биотехнологических исследований. Среды для роста клеток или культивирования клеток, содержащие ЦНВ, могут быть использованы для сохранения и роста клеток, а также для переноса клеток. Настоящее изобретение обеспечивает среду для культивирования клеток, которую можно использовать, например, для инженерии тканей и заживления ран. Другими применениями являются, например, применения, связанные с лекарственными формами, биотехнологическими или биологическими лекарственными средствами и их лекарственными формами, а также с 3D анализами лекарственных средств с использованием функциональных клеток. Уникальные реологические свойства ЦНВ-гидрогеля обеспечивают несколько применений, которые основаны на инъецируемости гидрогеля, такие как инъекция клеток или лекарственных средств, находящихся в ЦНВ-гидрогеле, в форме внутриглазных, внутримышечных или подкожных инъекций.
Следующие примеры приведены для дальнейшей иллюстрации изобретения и не предназначены для ограничения его объема. На основании описания примеров специалист в данной области техники сможет модифицировать изобретение различными способами.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Материалы и методы
Получение ЦНВ-гидрогелей
Непрозрачный нативный ЦНВ-гидрогель (1,7 масс.%) был получен посредством гомогенизации под высоким давлением волокон влажной целлюлозной массы. Соответственно, непосредственным продуктом процесса является разбавленный гель на основе целлюлозных нановолокон. Прозрачный ЦНВ-гидрогель (0,9 масс.%) был получен с использованием сходного процесса гомогенизации химически модифицированной целлюлозной массы (окисленной с использованием TEMPO целлюлозной массы). Образцы были стерилизованы в автоклаве. Для исследований клеток ЦНВ-гидрогель разбавляли до нужной концентрации и гомогенизировали посредством механического перемешивания или обработки ультразвуком. Крио-ТЭМ изображения нативного ЦНВ-гидрогеля и прозрачного ЦНВ-гидрогеля представлены на Фиг.1. Нативный гель на основе целлюлозных нановолокон состоит из смеси отдельных целлюлозных нанофибрилл и пучков волокон (Фиг.1А). Диаметр наименьших волокон равен примерно 7 нм, однако большую часть целлюлозного материала образуют структуры в форме пучков размером 50-100 нм. Точный линейный размер невозможно определить по изображениям из-за того, что материал состоит из переплетенных волокон и пучков волокон, однако похоже, что отдельные нановолокна имеют длину, равную нескольким микрометрам. Крио-ТЭМ изображение оптически прозрачного ЦНВ-гидрогеля демонстрирует сеть, состоящую из равномерно распределенных отдельных целлюлозных нановолокон. Диаметр этих нановолокон равен примерно 7 нм, а длина превышает один микрометр. Нановолокна содержат длинные прямые сегменты длиной порядка 100-200 нм, за которыми следуют резкие изгибы вдоль оси волокна. Эти прямые сегменты состоят из высококристаллических целлюлозных доменов - места перегиба образованы аморфными частями.
Получение ЦНВ-мембран
ЦНВ-мембраны получали посредством вакуумной фильтрации водной дисперсии нативных ЦНВ с концентрацией 0,2 масс.%. После фильтрации влажные мембраны сушили под грузом в печи при 55°C в течение 48 часов. Сухие пленки были гладкими и непрозрачными и имели плотность, равную 70-80 г/м2.
Ферментативный гидролиз
Ферментативное разложение ЦНВ-гидрогелей было продемонстрировано посредством гидролиза песка, содержавшего 0,5%-ные гидрогели, препаратом Celluclast 1,5 LFG, CCN0367 (производства компании Novozymes, pHопт. 5), в концентрации 90 мг/мл. Разложение нативных ЦНВ производили при pH 5 и 50°C в течение 4 дней, а разложение прозрачных ЦНВ - при pH 7 и 21°C в течение одного часа. Доза фермента составляла 5 мг фермента на один грамм ЦНВ.
Клетки HepG2
Происхождение клеток HepG2
Клетки гепатоклеточной карциномы (HepG2) были получены из Американской коллекции типовых культур (АТСС, Манассас, Вирджиния, США).
Сохраняемая культура клеток HepG2
Клетки HepG2 сохраняли в среде Игла, модифицированной по Дальбекко (DMEM, производства компании Gibco), с добавлением 10% плодной сыворотки коров, пенициллина/стрептомицина (производства компании Gibco), 2 мМ L-глутамина (производства компании Gibco) и 100 мМ пирувата натрия (производства компании Gibco). Клетки сохраняли в колбах для клеточных культур объемом 75 см2 при 37°C в инкубаторе при относительной влажности воздуха, равной 95%, в атмосфере, содержавшей 5% CO2. Клетки пересевали 1:10 с использованием трипсинизации два раза в неделю с индексом разведения 1:10. Среду заменяли через каждые 48 часов, и клетки субкультивировали с 90%-ной конфлюентностью.
3D-культура клеток HepG2 на ЦНВ-гидрогеле
Гидрогель на основе целлюлозных нановолокон помещали на дно 96-луночного планшета для культур тканей, а суспензию HepG2 клеток в культуральной среде, содержавшую 25000-50000 клеток на ячейку, или засевали на поверхность ЦНВ-гидрогеля или смешивали с ним. Концентрации ЦНВ-гидрогеля варьировались от 0,01% до 1%.
Клетки ARPE-19
Происхождение клеток ARPE-19
Спонтанно возникающие клетки пигментного эпителия сетчатки (ARPE-19) были получены из Американской коллекции типовых культур (АТСС, Манассас, Вирджиния, США).
Сохраняемая культура клеток ARPE-19
Клетки ARPE-19 сохраняли в среде Игла, модифицированной по Дальбекко (DMEM, производства компании Gibco): питательная смесь F12, смесь в соотношении 1:1 с добавлением 10% плодной сыворотки коров (FBS), 2 мМ L-глутамина, 100 Ед./мл пенициллина и 100 Ед./мл стрептомицина. Клетки культивировали при 37°C в атмосфере, содержавшей 7% CO2. Культуральную среду заменяли через каждые 2-3 дня, и клетки использовали при пассаже 24-30.
Культивирование ARPE-19 клеток на ЦНВ-мембране
Гидрогель на основе целлюлозных нановолокон помещали на дно 96-луночного планшета для культур тканей, а суспензию клеток ARPE-19 в культуральной среде, содержавшую 25000-50000 клеток на ячейку, или засевали на поверхность ЦНВ-гидрогеля или смешивали с ним. Концентрации ЦНВ-гидрогеля варьировались от 0,01% до 1%.
Прогениторные клетки печени, полученные из эмбриональных стволовых клеток человека
Сохраняемая культура эмбриональных стволовых клеток человека
Для данного исследования были использованы эмбриональные стволовые клетки человека (hES) линии Н9 (Висконсинский международный банк стволовых клеток («WISC банк»), принадлежащий Научному институту WiCell, Мэдисон, Висконсин, США). Клетки Н9 стандартным образом культивировали на планшетах для культур тканей с покрытием из Matrigel в среде MTeSR1 и пересевали с использованием Dispase (производства компании StemCell Technologies) в концентрации 1 мг/мл. В этих условиях стволовые клетки образуют двумерные (2D) колонии в форме монослоев.
3D культура hES-клеток в ЦНВ
Колонии клеток Н9 смешивали либо с 0,3%-ным нативным ЦНВ-гидрогелем, либо с 0,3%-ным прозрачным ЦНВ-гидрогелем и культивировали в среде mTeSR1. hES-клетки в ЦНВ-гидрогеле образуют 3D агрегаты клеток. В некоторых экспериментах 0,3%-ный ЦНВ-гидрогель смешивали с 58 мкг/мл фибронектина человека (производства компании Sigma-Aldrich).
3D культура прогениторных клеток печени, полученных из клеток Н9, в ЦНВ-гидрогеле
Клетки Н9 дифференцируются в Прогениторные клетки печени через 11 дней согласно опубликованному протоколу [Hay D.C., Zhao D., Fletcher J., Hewitt Z.A., McLean D., Urruticoechea-Uriguen A., Black J.R., Elcombe C., Ross J.A., Wolf R., Cui W. Efficien differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 2008 Apr; 26(4):894-902]. Полученные прогениторные клетки печени культивировали в 3D среде с использованием либо 0,3%-ного нативного ЦНВ-гидрогеля, либо 0,3%-ного прозрачного ЦНВ-гидрогеля в течение 7 дней. В некоторых экспериментах 0,3%-ный ЦНВ-гидрогель смешивали с 13 мкг/мл коллагена типа IV мыши (производства компании Sigma-Aldrich).
Окрашивание для определения соотношения живых и мертвых клеток
Агрегаты клеток Н9 и прогениторных клеток печени в ЦНВ-гидрогеле совместно окрашивали красителем CellTracker Blue CMAC (20 мкМ) для выявления живых клеток и пропидия иодидом (25 мкг/мл) для выявления мертвых клеток. Изображения клеток получали посредством конфокальной лазерной сканирующей микроскопии (Leica TCS SP5 МР SMD FLIM) при длине волны возбуждения, равной 405 нм для CellTracker Blue CMAC и 514 нм для пропидия иодида.
Анализ жизнеспособности/пролиферации клеток с использованием AlamarBlue
Жизнеспособность клеток количественно оценивали с использованием Набора для анализа жизнеспособности клеток AlamarBlue™ (производства компании Biotium Inc., Хейворд, Калифорния, США). Гидрогель на основе целлюлозных нановолокон помещали на дно 96-луночного планшета для культур тканей, а суспензию клеток HepG2/ARPE-19 в культуральной среде, содержавшую 25.000-50.000 клеток на ячейку, или засевали на поверхность ЦНВ-гидрогеля или смешивали с ним. Концентрации ЦНВ-гидрогеля варьировали от 1% до 0,01%. Жизнеспособность и пролиферацию клеток измеряли как функцию времени в днях при культивировании клеток на гидрогеле на основе целлюлозных нановолокон в инкубаторе при 37°С в атмосфере с 5% CO2 и 95%-ной относительной влажностью.
Через 48 часов AlamarBlue добавляли непосредственно в культуральную среду 96-луночных планшетов до конечной концентрации, равной 10%. Планшеты инкубировали в течение 5 часов, возбуждали флуоресценцию при длине волны возбуждения, равной 530 нм, и измеряли излучение при длине волны, равной 590 нм с целью измерения флуоресценции. Процент жизнеспособности выражали как процентное отношение флуоресценции в присутствии ЦНВ-гидрогеля и флуоресценции в отсутствие гидрогеля на основе целлюлозных нановолокон (клетки росли на полимерной поверхности).
Измерения фоновой флуоресценции (отрицательный контроль) производили на ячейках, содержавших гидрогель и красящий реагент в культуральной среде, но в отсутствие клеток. Рассчитывали среднее значение и стандартное отклонение для всех измерений флуоресценции, которые затем корректировали с учетом фона и выражали как относительную флуоресценцию.
Конфокальная лазерная микроскопия
Жизнеспособность клеток HepG2, культивированных на гидрогеле, и образование 3D сфероидов HepG2 клетками оценивали с использованием Набора для анализа жизнеспособности Live/Dead® (производства компании Invitrogen), состоящего из кальцеина AM и гомодимера этидия.
В кратком изложении, клетки HepG2 суспендировали в 1%-ном нативном или прозрачном ЦНВ-гидрогеле с фибронектином или без фибронектина. Суспензию клеток в гидрогеле переносили в каждую ячейку вместе с клетками. В каждую ячейку добавляли культуральную среду для клеток. Клетки HepG2, инкапсулированные в гидрогеле, культивировали в течение 5 дней, причем среду освежали через каждые 48 часов. Через 5 дней среду удаляли из ячеек, а инкапсулированные клетки промывали фосфатным буфером и инкубировали в растворе «Live/Dead», содержавшем 0,2 мкМ кальцеина AM и 1,0 мкМ гомодимера этидия, в течение 45 минут при комнатной температуре. Изображения живых клеток получали с использованием конфокального лазерного сканирующего микроскопа (CLSM, инвертированный микроскоп Leica SP2, Цюрих, Швейцария), оборудованного аргоновым лазером (488 нм/35 мВт), объективами НС PL APO 10×/0,4 CS и НС PL APO 20×/0,7 CS (воздушный), инкубаторной камерой с воздухонагревательной системой (производства компании Life Imaging/Services, Швейцария) и СО2-миксером (Okolab). Изображения получали с двух детекторов (одного для кальцеина, а другого для гомодимера этидия). Изображения воспроизводили и редактировали с использованием программы Imaris 7.0 (Bitpane). Деконволюцию не производили.
Пример 1
Сравнение жизнеспособности клеток HepG2 в различных материалах для культивирования клеток
Гидрогели на основе целлюлозных нановолокон помещали на дно 96-луночного планшета для культур тканей и суспензию клеток HepG2 в среде, поддерживающей рост, содержавшую 25000-50000 клеток на ячейку, либо засевали на поверхность гидрогеля, либо смешивали с ним. Концентрация гидрогеля лежала в диапазоне от 1 до 0,01%. Интенсивность флуоресценции, которая свидетельствует о жизнеспособности и пролиферации клеток, измеряли как функцию времени в днях после культивирования клеток на гидрогеле на основе целлюлозных нановолокон в инкубаторе при 37°C в атмосфере с 5% CO2 и 95%-ной влажностью.
Три коммерчески доступных материала для культивирования клеток были использованы в качестве стандартных материалов для 3D-культур: MaxGel™ (производства компании Sigma-Aldrich), HydroMatrix™ (производства компании Sigma-Aldrich) и PuraMatrix™ (производства компании 3DM Inc.). План эксперимента был идентичным для всех исследованных материалов.
Жизнеспособность клеток HepG2 количественно оценивали с использованием Набора для анализа жизнеспособности клеток AlamarBlue™ (производства компании Biotium Inc., Хейворд, Калифорния, США), как описано выше в разделе «Материалы и методы. Анализ жизнеспособности/пролиферации клеток с использованием AlamarBlue».
Процент жизнеспособных клеток HepG2 в исследованных материалах представлен на Фиг.2. Оба типа гидрогелей на основе целлюлозных нановолокон, то есть нативный и прозрачный ЦНВ-гели, показали более высокие значения жизнеспособности, чем коммерческие стандартные материалы HydroMatrix™ и PuraMatrix™. Если к ЦНВ-гелям добавляли фибронектин, то жизнеспособность была близка к коммерческому продукту MaxGel™. Кроме того, пролиферация и жизнеспособность клеток линейно возрастала как функция концентрации клеток в обоих гидрогелях. Это наблюдение подтверждает гипотезу о том, что гидрогель имитирует компоненты ЭКМ человека. Он содержит все ключевые компоненты ЭКМ.
Пример 2
Перенос клеток ARPE-19 с помощью иглы от шприца
Клетки ARPE-19 (25.000 клеток на лунку) засевали и культивировали на ЦНВ-матриксе на дне 96-луночного планшета. Жизнеспособность клеток ARPE-19 после переноса с помощью игл от шприца различного размера представлена на Фиг.3. Можно наблюдать тот же феномен, что и в случае других клеток, таких как HepG2 и ES.
Более подробное разъяснение по поводу переноса клеток ARPE-19 с помощью иглы от шприца является следующим: при переносе 1 на Фиг.3 клетки инкубировали в течение 48 часов с 1,66%-ным ЦНВ-гелем, после чего клетки с помощью шприца (20П-27П) переносили в объеме, примерно равном 100 мкл, на 96-луночный планшет. После переноса с помощью шприца клетки инкубировали в течение 24 часов и измеряли жизнеспособность клеток в ЦНВ-гидрогеле.
При Переносе 2 клетки, инкубированные в течение 24 часов в 1,66%-ном ЦНВ-гидрогеле, переносили в свежую среду с помощью шприца калибра 27G (примерно 2 мл). После переноса клетки инкубировали в течение 24 часов, затем клетки снова переносили с помощью шприца (20G-27G) в объеме, примерно равном 100 мкл, на 96-луночный планшет, снова инкубировали в течение 24 часов и измеряли жизнеспособность клеток, дважды перенесенных в 1,66%-ном ЦНВ-гидрогеле.
Эти эксперименты подтвердили, что можно переносить клетки в ЦНВ-гидрогеле; процесс переноса был успешным, и клетки были живыми и оставались живыми в процессе переноса с помощью шприца. Этот феномен наблюдали даже при использовании иглы наименьшего калибра, равного 27G, и не наблюдали отсечки по размеру иглы, использованной в процессе переноса. Образцы, которые были перенесены два раза (Перенос 2), показали меньшие скорости пролиферации, по-видимому, обусловленные более коротким 24-часовым периодом инкубации в начале эксперимента. Перенос клеток в ЦНВ-гидрогеле подтвердил, что клетки действительно находились в гидрогеле и оставались в нем, поскольку клетки, прикрепленные к планшету, не переносились (не производилась трипсинизация). Эти эксперименты показали, что клетки остаются жизнеспособными во время переноса.
Пример 3
Стволовые клетки
Окрашивание живых и мертвых прогениторных клеток печени, полученных из hES клеток
Прогениторные клетки печени, полученные из эмбриональных стволовых клеток человека, погружали в нативный ЦНВ-гидрогель (Фиг.15) и культивировали в течение 7 дней с добавлением и без добавления коллагена IV. Не было обнаружено фона. Прогениторные клетки печени, полученные из ЭС-клеток человека, погружали в прозрачный ЦНВ-гидрогель и культивировали в течение 7 дней с добавлением и без добавления коллагена IV. Не было обнаружено фона, что делает этот материал исключительно легким для использования в данном контексте. Другие используемые материалы, например - MatriGel и MaxGel, обычно дают значительный флуоресцирующий фон, и поэтому с этими матриксами трудно работать. Эмбриональные стволовые клетки можно сохранять в ЦНВ-гидрогеле, они выживают, и данный материал пригоден для сохранения их в жизнеспособном состоянии. Кроме того, ЭС-клетки также формируют 3D-структуру, которую не наблюдали ранее при использовании других материалов.
Пример 4
Диффузия декстранов через ЦНВ-гидрогели
Важно детально знать диффузионные свойства материала для культивирования клеток. Материал для культивирования клеток должен быть достаточно пористым для того, чтобы обеспечивать диффузию питательных веществ и кислорода к культивируемым клеткам и эффективную диффузию метаболитов от клеток. Диффузионные свойства ЦНВ-гидрогеля были продемонстрированы с использованием декстранов с различной молекулярной массой следующим образом:
400 мкл прозрачного или непрозрачного ЦНВ-гидрогеля (1%) наносили через фильтр на апикальный отсек планшетов с фильтрами Transwell™ (размер пор фильтра 0,4 мкм). 1 мл фосфатного буферного раствора добавляли с базолатеральной стороны, а 100 мкл (25 мкг) декстранов с флуоресцентными метками добавляли поверх гидрогелей (с молекулярной массой 20 кДа, 70 кДа и 250 кДа). Планшеты прочно фиксировали и оставляли в покое на качалке для луночных планшетов. Образцы объемом 100 мкл брали с базолатеральной стороны и восполняли объем равным количеством фосфатного буферного раствора. Первые образцы брали через 15-минутные интервалы, последующие образцы брали в различные моменты времени, варьировавшиеся от 30 минут до 24 часов, а последние образцы - через 24 часа. Всего было взято 168 образцов. Целевой планшет (OptiPlate™-96 F) измеряли при длинах волн возбуждения и эмиссии, равных 490 нм и 520 нм, соответственно.
Диффузия декстранов с различными молекулярными массамм через 1%-ный нативный гель на основе целлюлозных нановолокон представлена на Фиг.4. Диффузия модельных соединений происходила с постоянной скоростью и очень сильно зависела от молекулярной массы (размера) соединения. Очевидно, что в ЦНВ-гидрогелях молекулы способны эффективно диффундировать, несмотря на то, что структура геля является достаточно плотной для стабилизации суспензии клеток.
Полученный профиль диффузии можно использовать в различных композициях для доставки лекарственных средств и прикладных задачах. Диффузию лекарственных средств можно регулировать как функцию размера молекулы лекарственного средства или белка (используемого в качестве лекарственного средства) или концентрации ЦНВ-гидрогеля. Явный стабильный профиль выделения особенно полезен для некоторых видов лечения, где предпочтительно длительное выделение, в частности - в случае пептидных или белковых лекарственных средств.
Пример 5
Пролиферация клеток ARPE19 на ЦНВ-мембране
Нативную ЦНВ-мембрану помещали на дно 96-луночного планшета для культивирования тканей и на поверхность мембраны засевали суспензию клеток в среде, поддерживающей рост, содержавшей 25000-50000 клеток на ячейку. Концентрация мембран варьировалась от 1,6% до 0,01%. Жизнеспособность и пролиферацию клеток измеряли как функцию количества дней культивирования клеток на нативной ЦНВ-мембране в инкубаторе при 37°C в атмосфере с 5% CO2 и 95%-ной относительной влажностью.
Изображения клеток ARPE-19 на нативной ЦНВ-мембране получали с использованием световой микроскопии. ЦНВ-мембрана поддерживает рост клеток в верхней части изображения (Фиг.5), что показывает, что клетки ARPE-19 способны к 2D-росту на ЦНВ-мембране, и что ЦНВ-мембрану можно использовать в качестве 2D-матрикса для роста клеток.
Клетки ARPE-19 хорошо пролиферировали в гидрогелях, независимо от использованной концентрации клеток. Значимых различий между гидрогелями не было. Пролиферация клеток возрастала примерно в 2 раза при культивировании на гидрогеле, по сравнению с клетками, культивировавшимися в отсутствие гидрогеля.
Пример 6
Морфология кластеров клеток HepG2 в 3D культурах
Конфокальная лазерная микроскопия
Лазерную конфокальную микроскопию использовали для получения изображений живых клеток. Сфероидная форма инкапсулированных HepG2 клеток в ЦНВ-гидрогеле отчетливо свидетельствует о том, что клетки захватываются гидрогелем и растут в трех измерениях (Фиг.6). Изображения клеток, полученные после 5 дней культивирования, представлены на Фиг.6 и показывают, что клетки жизнеспособны в 3D-сфероидах в обоих гидрогелях. Жизнеспособность клеток не зависела от концентрации клеток в гидрогелях, а размер сфероидов увеличивался как функция времени во всех культурах (Фиг.6).
Среду освежали через каждые 48 часов, и размер сфероидов в культуре увеличивался как функция времени. Если к ЦНВ-гелю добавляли фибронектин, жизнеспособность клеток в 3D-сфероидах увеличивалась. Конфокально-микроскопические снимки с Live/dead окрашиванием показали, что клетки оставались жизнеспособными в течение 5-дневного периода культивирования. Эти результаты совпадают с результатами анализа пролиферации клеток с окрашиванием Alamar blue (Фиг.2). Это наблюдение подтверждает гипотезу авторов о том, что ЦНВ-гидрогель имитирует компоненты ЭКМ человека. Он содержит все ключевые компоненты ЭКМ, за исключением фибронектина. Поэтому добавление фибронектина увеличивает жизнеспособность клеток в 3D-кластерах. Фибронектин способствовал прикреплению клеток и повышал их жизнеспособность. Ранее было показано, что фибронектин увеличивает переживание гепатоцитов и снижает апоптоз за счет связывания с интегрином р1.
Кроме того, удалось показать, что можно получить 3D-структуру из HepG2 клеток без какого-либо иного поддерживающего материала или компонентов ЭКМ, кроме ЦНВ-гидрогеля. Это доказывает применимость и легкость использования ЦНВ-гидрогеля в качестве 3D матрикса для культуры клеток.
Пример 7
Прочность геля
Важной функцией среды для 3D культур клеток является сохранение клеток в форме равномерной суспензии в матриксе и предотвращение седиментации. ЦНВ удовлетворяют этому требованию благодаря их способности формировать гелевую сеть в очень низкой концентрации (0,5%). Гелеподобная структура ЦНВ была продемонстрирована при определении их вязкоупругих свойств посредством динамических осцилляторных реологических измерений. Результаты, полученные при качании частоты, демонстрируют характерное гелеподобное поведение. Модуль накопления (G') на несколько порядков больше по величине, чем модуль потерь (G''), и почти не зависит от частоты, что означает, что упругие (напоминающие свойства твердого тела) свойства более выражены, чем вязкие (напоминающие жидкость) характеристики (Фиг.7). Характерным для гелей является также то, что G' и G'' относительно не зависят от частоты. Вязкоупругие свойства ЦНВ-гелей были определены посредством осцилляторного измерения с качанием частоты в реометре (AR-G2, производства компании ТА Instruments) при деформации, равной 0,1%.
Пример 8
Характеристики текучести ЦНВ-гидрогелей
Реологические характеристики текучести ЦНВ-гидрогелей демонстрируют ряд особенностей, которые выгодны при использовании их для культивирования клеток. Гидрогели обладают высокой вязкостью при низком сдвиговом усилии (или в покое), что обеспечивает оптимальную способность суспендировать клетки, но при более высоких сдвиговых усилиях демонстрируют разжижение, что обеспечивает их легкое дозирование и инъецирование. Способность ЦНВ проявлять такие реологические свойства была продемонстрирована в серии опытов, в которых вязкость ЦНВ-дисперсии измеряли в широком диапазоне напряжений сдвига (скоростей сдвига) в ротационном вискозиметре (AR-G2, ТА Instruments, Соединенное Королевство).
Дисперсии ЦНВ показали значительно более высокие значения вязкости при нулевом сдвиге (область постоянных значений вязкости при малых напряжениях сдвига), чем другие водорастворимые полимеры, как показано на Фиг.8. Вязкость ЦНВ при нулевом сдвиге заметно увеличивается при уменьшении диаметра нанофибрилл, вызванном предварительной химической обработкой исходного материала. Напряжение, при котором начинается разжижение при сдвиге («предел текучести»), у ЦНВ-дисперсий также заметно выше. Суспендирующая способность материала тем больше, чем выше предел текучести. Клетки эффективно стабилизируются против седиментации за счет объединенных эффектов высокой вязкости при нулевом сдвиге, высокого предела текучести и высокого модуля накопления. Сила тяжести, приложенная к клеткам, гораздо слабее, чем предел текучести. Поэтому суспендированные клетки «замораживаются» в гелевом матриксе, если они смешаны с ЦНВ, или «замораживаются» на геле, если они нанесены на поверхность геля.
На Фиг.9 вязкость изображена как функция измеренной скорости сдвига. Из этой Фиг.9 очевидно, что вязкость дисперсий ЦНВ снижается при относительно низких скоростях сдвига и достигает значений, сходных со значениями, измеренными у стандартных материалов, при скоростях сдвига порядка 200 с-1.
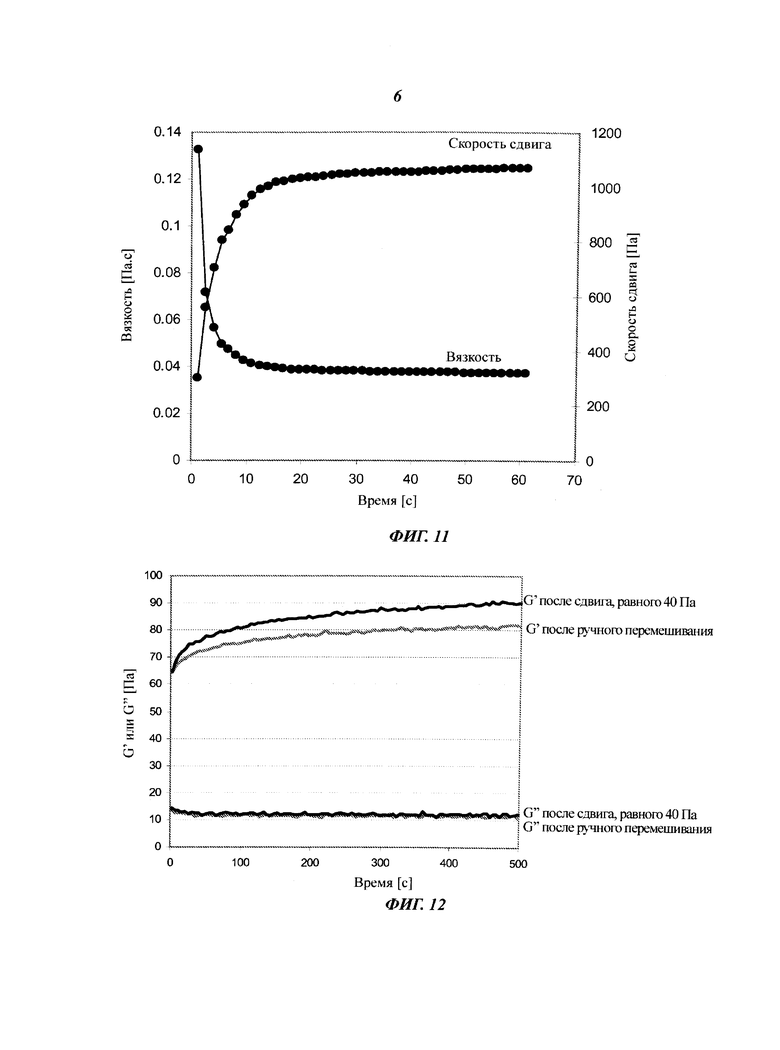
Сетчатая структура ЦНВ разрушается при сдвиге (Фиг.7). При приложении определенного напряжения вязкость системы резко снижается, и происходит переход от поведения, характерного для твердого тела, к поведению, характерному для жидкости. Такое поведение является выгодным, так как оно позволяет гомогенное смешивание клеток с суспензией ЦНВ при умеренном механическом сдвиге. При сдвиге в двухфазных жидкостях, таких как флоккулированные дисперсии ЦНВ, (например, в реометре или в трубе) дисперсная фаза имеет тенденцию к удалению от границ с твердым телом, что приводит к образованию слоя менее вязкой жидкости у стенок контейнера (Фиг.10). Это феномен означает, что сопротивление течению, то есть вязкость, меньше у стенок, чем в объеме дисперсии (Barnes, 1995). Соответственно, инъекцию ЦНВ-гидрогеля с помощью шприца с иглой или пипетки легко можно выполнить даже при высоких концентрациях (1-4%). Этот феномен обеспечивает также легкое дозирование суспензий клеток с минимальным смещением клеток, то есть большинство клеток расположено в центре иглы и практически находится в покое (Фиг.10).
Легкая инъецируемость ЦНВ-гидрогелей является важной характеристикой и в том случае, если разрабатываются инъецируемые композиции. Как описано в Примере 6, ЦНВ-гидрогели имеют профили выделения, которые можно использовать в прикладных задачах, связанных с устойчивым и регулируемым выделением лекарственных средств. Эти два свойства ЦНВ-гидрогелей обеспечивают возможность использования в различных прикладных задачах, связанных с лекарственными средствами, например - в композициях для внутриглазного, внутримышечного и подкожного введения или, например, в вязкоупругих композициях глазных капель.
Пример 9
Восстановление структуры после прекращения сдвига
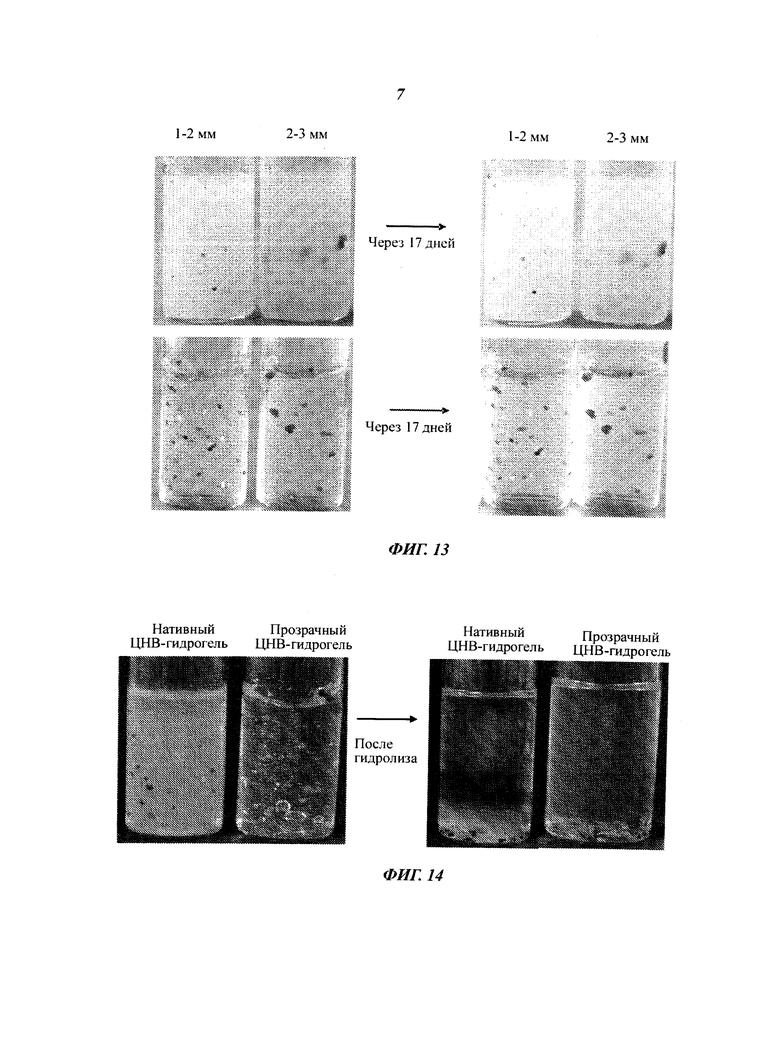
Дополнительным важным реологическим свойством ЦНВ-гидрогелей является то, что высокий уровень вязкости восстанавливается после прекращения сдвига (например, после инъекции или перемешивания). Восстановление структуры дисперсии ЦНВ было продемонстрировано в серии опытов, в которой материал вначале сдвигали в реометре (StressTech, производства компании Reologica Instruments Ab) при высокой скорости сдвига, а после прекращения сдвига контролировали восстановление прочности геля (G') посредством осцилляторного измерения с временной разверткой. Цикл сдвига осуществляли с использованием системы концентрических цилиндров при постоянном напряжении, равном 40 Па, в течение 61 с. Изменения скорости сдвига и вязкости во время этого испытания показаны на Фиг.10. Материал сдвигали при относительно высокой скорости сдвига (1000 с-1) в течение периода времени не менее 40 с, и в этот период вязкость материала падала ниже 40 мПа·с.
После прекращения сдвига за изменениями G' (мера прочности геля) наблюдали посредством осцилляторного измерения при постоянной частоте (1 Гц) и небольшом напряжении (0,5 Па). Измерение начинали ровно через 10 с после прекращения сдвига. Из Фиг.11 видно, что сетчатая структура геля очень быстро формируется после того, как гель оставляют в покое после сдвига с высокой скоростью сдвига. Существенное восстановление структуры наблюдается уже через 10 с после прекращения сдвига (что соответствует нулевому значению времени на Фиг.11). Постоянный уровень модуля накопления (G') достигается менее чем через 10 минут нахождения дисперсии ЦНВ в покое. Значение G', достигнутое у дисперсии ЦНВ при интенсивном сдвиге, было сопоставимым со значением у дисперсии ЦНВ, которую осторожно перемешивали стеклянной палочкой перед испытанием на восстановление структуры.
Изменения скорости сдвига и вязкости, полученные при сдвиге 0,7%-ной нативной дисперсии ЦНВ в реометре с системой концентрических цилиндров при постоянном напряжении, равном 40 Па, представлены на Фиг.11.
Восстановление структуры 0,7%-ной нативной дисперсии ЦНВ при сдвиге с высокой скоростью сдвига по сравнению с осторожным перемешиванием стеклянной палочкой показано на Фиг.12.
Быстрое восстановление структуры является важным для материалов для культивирования клеток гидрогелевого типа по двум причинам. Во-первых, оно обеспечивает равномерное распределение клеток в ЦНВ-гидрогелях после их смешивания с гидрогелем. Во-вторых, если ЦНВ-гидрогели используют для транспортировки культивируемых клеток, то быстрое восстановление структуры геля эффективно удерживает клетки на месте, и их миграция минимальна, например в тех случаях, когда речь идет о пересадке клеток. Быстрое восстановление структуры также является важным в инъецируемых композициях, выделяющих лекарственные средства.
Пример 10
Стабильность
Как показано в Примере 1, даже очень разбавленные дисперсии ЦНВ обладают очень высокой вязкостью при низких скоростях сдвига. Кроме того, структура гидрогеля восстанавливается после прекращения сдвига, например - после инъекции. В статических условиях ЦНВ образуют сетчатую структуру гидрогеля с высоким модулем упругости и исключительно высоким пределом текучести. Благодаря этим свойствам, ЦНВ обладают очень высокой способностью суспендировать твердые частицы даже при очень низких концентрациях.
Суспендирующая способность в статических условиях была продемонстрирована с использованием суспензий песка. 0,5%-ные дисперсии нативных ЦНВ и прозрачных ЦНВ способны стабилизировать даже частицы песка диаметром 2-3 мм в течение очень длительного времени, см. Фиг.13. Следует отметить, что прозрачный ЦНВ-гидрогель способен стабилизировать суспензии твердых частиц при меньшей концентрации, чем нативный ЦНВ-гидрогель.
Пример 11
Ферментативный гидролиз
Общеизвестно, что определенные ферменты (целлюлазы) способны гидролизовать β-(1-4)-связи в целлюлозе. Например, эндо-1,-4-β-глюканазы (ЭГ), которые расщепляют целлюлозные цепи в случайных положениях, удаленных от концов цепей; экзоглюканазы или экзоцеллобиогидролазы (ЦБГ), которые расщепляют целлюлозу путем отщепления молекул от обоих концов цепи, продуцируя димеры целлобиозы; и β-глюкозидазы (БГЛ), которые гидролизуют молекулы целлобиозы (образовавшиеся после воздействия ЭГ и ЦБГ) до глюкозы. Соответственно, целлюлозные нановолокна можно ферментативно гидролизовать до глюкозы с помощью целлюлаз (Ahola S., Turon X., Osterberg M., Laine J., Rojas O.J., Langmuir, 2008, 24, 11592-11599).
Ферментативный гидролиз целлюлозы можно использовать в системах для культивирования клеток, содержащих целлюлозные нановолокна, по различным причинам. При гидролизе ЦНВ-гидрогеля вязкость среды резко снижается, и культивируемые клеточные структуры становятся легкодоступными, например, для окрашивания. Кроме того, после гидролиза клеточные структуры можно переносить или трансплантировать без материала, содержащего целлюлозу. Продукт разложения - глюкоза - является нетоксичным для клеток, и его можно использовать в качестве питательного вещества при культивировании клеток.
Ферментативный гидролиз целлюлозных нановолокн можно провести с использованием различных целлюлаз в различных средах. На Фиг.14 продемонстрирован эффект коммерческих ферментов Cellucast на суспендирующую способность гелей. И нативный, и прозрачный ЦНВ-гели теряли суспендирующую способность из-за ферментативного разрушения структуры геля. Культивируемые линии клеток можно также подвергнуть генетическому инжинирингу, чтобы они выделяли необходимый белок-фермент в систему культуры.

Предложен материал для культивирования или доставки эукариотических клеток. Материал содержит происходящие из растений механически дезинтегрированные целлюлозные нановолокна и/или их производные в форме гидрогеля или мембраны во влажном состоянии. Диаметр целлюлозных нановолокон или пучков нановолокон в целлюлозных нановолокнах и/или их производных меньше 1 мкм, предпочтительно - меньше 200 нм, более предпочтительно - меньше 100 нм. Данный материал получают путем смешивания происходящих от растений механически дезинтегрированных целлюлозных нановолокон и/или их производных с водой. Предложен также матрикс для культивирования или доставки клеток, который содержит живые клетки и указанный материал, образующий гидрогель, при этом клетки находятся в этом матриксе в виде трехмерной или двухмерной структуры. Для культивирования клеток осуществляют контакт полученных клеток с материалом для образования матрикса, в котором культивирование клеток протекает в виде трехмерной или двухмерной структуры. Предложено также применение указанного материала для лабораторных и/или промышленных целей в качестве среды или компонента среды для сохранения клеток in vitro. Группа изобретений обеспечивает стабильность клеток в матриксе, а также гомогенное распределение их в указанном матриксе. 6 н. и 16 з.п. ф-лы, 15 ил., 11 пр.
1. Материал для культивирования или доставки эукариотических клеток, отличающийся тем, что он содержит происходящие из растений механически дезинтегрированные целлюлозные нановолокна и/или их производные в форме гидрогеля или мембраны во влажном состоянии, причем диаметр целлюлозных нановолокон или пучков нановолокон в целлюлозных нановолокнах и/или их производных меньше 1 мкм, предпочтительно - меньше 200 нм, более предпочтительно - меньше 100 нм.
2. Материал по п.1, отличающийся тем, что целлюлозные нановолокна содержат химически или физически модифицированные производные целлюлозных нановолокон или пучков нановолокон.
3. Материал по п.1, отличающийся тем, что механически дезинтегрированные целлюлозные нановолокна предварительно подвергнуты кислотно-щелочной обработке.
4. Материал по п.1, отличающийся тем, что он дополнительно содержит добавки, выбранные из группы, состоящей из компонентов экстраклеточного матрикса, сыворотки, факторов роста и белков.
5. Матрикс для культивирования клеток или доставки клеток, отличающийся тем, что он содержит живые клетки и материал по любому из пп. 1-4, образующий гидрогель, и клетки находятся в этом матриксе в виде трехмерной или двухмерной структуры.
6. Матрикс по п.5, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
7. Способ получения материала по любому из пп. 1-4, отличающийся тем, что он включает стадии:
- получения происходящих от растений механически дезинтегрированных целлюлозных нановолокон и/или их производных,
- смешивания целлюлозных нановолокон и/или их производных с водой.
8. Способ по п.7, отличающийся тем, что он дополнительно включает объединение смеси с подходящим медикаментом.
9. Способ по п.7, отличающийся тем, что механически дезинтегрированные целлюлозные нановолокна предварительно подвергнуты кислотно-щелочной обработке.
10. Микробиологическое применение происходящих из растений механически дезинтегрированных целлюлозных нановолокон и/или их производных или материала по любому из пп. 1-4 для лабораторных и/или промышленных целей в качестве среды или компонента среды для сохранения клеток in vitro.
11. Применение материала по любому из пп. 1-4 для иммобилизации клеток.
12. Способ культивирования клеток, отличающийся тем, что он включает стадии:
- получения клеток;
- приведения в контакт клеток с материалом по любому из пп. 1-4 с образованием матрикса;
- культивирования клеток в матриксе в виде трехмерной или двухмерной структуры.
13. Способ по п.12, отличающийся тем, что он дополнительно включает стадии:
- разбавления материала водной или неводной жидкостью;
- необязательно - центрифугирования материала для осаждения клеток и клеточных агрегатов;
- удаления целлюлозных нановолокон посредством декантации.
14. Способ по п.12, отличающийся тем, что он дополнительно включает стадии:
- приведения в контакт материала для культивирования клеток с разлагающим ферментом;
- необязательно - центрифугирования материала для осаждения клеток и клеточных агрегатов;
- удаления целлюлозных нановолокон посредством декантации.
15. Способ по п. 12, отличающийся тем, что перед культивированием матрикс переносят или помещают в среду для культивирования клеток или доставки клеток.
16. Материал по п.1, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
17. Способ по п.7, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
18. Способ по п.12, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
19. Способ по п.13, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
20. Способ по п.14, отличающийся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
21. Применение по п.10, отличающееся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
22. Применение по п.11, отличающееся тем, что клетки являются эукариотическими клетками или стволовыми клетками.
| CHERIAN B.M | |||
| ET AL | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ПАРОВОЗНАЯ ДРОВЯНАЯ ТОПКА | 1923 |
|
SU720A1 |
| DEGUCHI S | |||
| ET AL | |||
| Preparation and characterization of nanofibrous cellulose plate as a new solid support for microbial culture // Soft Matter, 2007, 3, pp | |||
| 1170-1175;US 20070275458 A1, 29.11.2007 | |||
| БАРМАШЕВА | |||
Авторы
Даты
2016-09-20—Публикация
2011-10-26—Подача