Область техники, к которой относится изобретение
Настоящее изобретение основано на том наблюдении, что введение полипептидов, содержащих по меньшей мере один иммуноглобулиновый одиночный вариабельный домен против vWF у людей, больных ТТП, обеспечивает существенное снижение времени ответа и уменьшение осложнений. Изобретение обеспечивает полипептид, содержащий по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF) для применения в лечении связанного с vWF заболевания у человека, нуждающегося в таком лечении. Кроме того, изобретение относится к лекарственным формам, наборам и медикаментам, применяемым для лечения ТТП.
Предшествующий уровень техники
1. Роль vWF в агрегации тромбоцитов
Мультимерный белок плазмы фактор фон Виллебранда (vWF) необходим для рекрутинга циркулирующих тромбоцитов к поврежденной сосудистой стенке при повреждении сосуда. Этот рекрутинг опосредован связыванием А1-домена vWF с гликопротеином рецептора тромбоцитов GPIb-IX-V.
При экспрессии эндотелиальными клетками vWF секретируется в кровоток в виде ультра-больших мультимеров или ультра-большого vWF (ULvWF). Эти мультимеры процессируются до меньших мультимеров постоянного размера посредством ферментативного расщепления с помощью ADAMTS13. В этих мультимерах vWF постоянного размера участок связывания рецептора тромбоцитов GPIb-IX-V в А1 домене является скрытым, и не реагирует спонтанно с тромбоцитами. Конформационная активация участка связывания рецептора тромбоцитов GPIb-IX-V в А1 домене запускается посредством иммобилизации или в условиях гемодинамического удара, приводя к адгезии тромбоцитов, а затем к образованию тромба.
2. Роль vWF и процессинга vWF в патофизиологии ТТП
Тромботическая тромбоцитопеническая пурпура (ТТП) является редким и опасным для жизни заболеванием системы гемокоагуляции, при котором отмечается накопление мультимеров ULvWF, приводящее к повышению риска образования тромба в малых кровеносных сосудах из-за избыточной агрегации тромбоцитов. Состояние характеризуется системной агрегацией тромбоцитов в микроциркуляции, приводящей к нерегулярной ишемии во многих органах. При устойчивом состоянии это может вызывать инфаркт ткани, связанный с выраженной тромбоцитопенией и фрагментацией эритроцитов.
Мультимеры ULvWF имеют естественную способность к спонтанному взаимодействию с рецептором тромбоцитов GPIb-IX-V. У здоровых субъектов эти мультимеры ULvWF немедленно процессируются до мультимеров vWF постоянного размера посредством расщепления протеазой vWF ADAMTS13. Однако было установлено, что активность ADAMTS13 сильно снижена при наследственной ТТП, а также при приобретенной идиопатической ТТП. Большинство пациентов с ТТП имеет аутоантитела против ADAMTS13, что приводит к нарушению процессинга мультимеров ULvWF. В результате А1 домен ULvWF является конститутивно активным, и быстро взаимодействует с рецептором тромбоцитов GPIb-IX-V. Это в итоге ведет к образованию характерных сгустков крови в популяции пациентов с ТТП.
Современная терапия ТТП с плазмообменом (сокращенно «ПО» или «ПФ») и трансфузией обеспечивает замену ADAMTS13 и удаление антител к ферменту, таким образом, постепенно приводя к нормализации процессинга ULvWF. Однако это лечение требует множество обменов и трансфузий в течение многих дней, при которых нет прямой фармакологической направленности на активный процесс ULvWF-опосредованной агрегации тромбоцитов.
Хотя введение ПО и трансфузии существенно снизило уровень смертности от ТТП в последние три десятилетия, это состояние все еще связано с высоким риском смертности и тяжестью заболевания. Уровень смертности при острых приступах острой идиопатической ТТП у пациентов при современных видах лечения составляет от 10% до 30% (Vesely et al. Blood 2003; 102: 60-68; Allford et al. Br.J.Haematol. 2003; 120: 556-573; Sadler et al. Hematology. Am.Soc.Hematol.Educ.Program. 2004; 407-423). В случае вторичной ТТП признано, что ПО и трансфузия являются менее эффективными, и уровень смертности значительно выше. В случаях, когда заболевание развивается при беременности, при которой ПО считается достаточно эффективным, уровень смертности при остром приступе ТТП составляет примерно 25%, повышаясь до 40% в случаях сопутствующей преэклампсии (Martin et al. Am.J.Obstet.Gynecol. 2008; 199: 98-104). Однако в случаях вторичного заболевания, например, на фоне злокачественных новообразований или трансплантации костного мозга, уровень смертности составляет от 40% до 60%, несмотря на применение таких режимов лечения (Sadler et al. 2004 supra; Elliott et al. Mayo Clin.Proc. 2003; 78: 421-430; Kremer Hovinga and Meyer Curr.Opin.Hematol. 2008; 15: 445-450).
С учетом остающегося значительного уровня смертности при ТТП и наблюдаемых обострениях при ПО и трансфузиях, имеется выраженная потребность в разработке дополнительных терапевтических подходов для дополнения, или по возможности для уменьшения потребности в этих способах лечения.
Исследования, проведенные по ТТП в течение последних трех десятилетий, улучшили понимание патофизиологии заболевания, обеспечив возможную разработку новых агентов, нацеленных на процессы, лежащие в основе заболевания. Тем не менее, в настоящее время нет принятых способов лечения ТТП, и хотя новые виды лечения в настоящее время проходят оценку, изучение этих возможных способов лечения находится на относительно раннем этапе.
Иммуноглобулиновые одиночные вариабельные домены (ISVD) против vWF описаны, например, в WO2004/015425, WO2004/062551, WO2006/074947, WO2006/122825, WO2009/115614 и WO2011/067160.
Было показано, что ISVD против vWF (например, ALX 0081) авидно связывается с мультимерным vWF, таким образом, блокируя взаимодействие мультимерного vWF любых размеров и стадий активации с рецептором тромбоцитов GPIb-IX-V. Взаимодействие ALX 0081 с vWF является высоко специфичным, и он не взаимодействует с клетками крови или тромбоцитами человека. Далее, его интерференция с рецептором тромбоцитов GPIb-IX-V является избирательной посредством связывания с А1 доменом vWF, и не влияет на способность vWF к взаимодействию с фибриллярным коллагеном или коллагеном VI типа. Также было показано, что ISVD против vWF (например, ALX 0081) не влияет на активность (оставшейся) протеазы vWF ADAMTS13, и не мешает связыванию FVIII с vWF.
В исследованиях I фазы было показано, что ALX 0081 является безопасным, и хорошо переносится здоровыми добровольцами.
Однако испытание на здоровых людях-добровольцах не обеспечивает прогноз эффективности ISVD против vWF в целом или в частности ALX 0081 при основной патологии больных ТТП. vWF является аномальным по количеству, а также по качеству у больных ТТП. Хотя принято, что ULvWF не обеспечивают нормальную функцию гемостаза у больных ТТП, механизм, лежащий в основе, непонятен. У больных ТТП более высокие уровни vWF ожидаются при острых эпизодах (Lotta et al. 2011 J Thromb Haemost 9: 1744-51; Stufano et al. 2012 J Thromb Haemost 10:728-730).
Из-за отсутствия подходящей животной модели, не была продемонстрирована активность in vivo ALX 0081 в нейтрализации ULvWF.
Таким образом, по-прежнему необходимо прояснить, действительно ли полипептиды, включающие по меньшей мере один ISVD против vWF, такой как ALX 0081, благоприятны у пациентов с ТТП, или что полипептиды, содержащие по меньшей мере один ISVD против vWF, такой как ALX 0081, оказывают положительное влияние, по сравнению с ПО, и каково эффективное лечение и режим дозирования.
Имеется потребность в усовершенствованных способах лечения пациентов с ТТП.
Изложение сущности изобретения
Настоящее изобретение основано на неожиданном наблюдении, что введение полипептидов, включающих по меньшей мере один ISVD против vWF, у людей, больных ТТП, обеспечивает снижение на 2 дня времени до ответа, о чем свидетельствовало восстановление тромбоцитов до ≥ 150,000/мкл. Повышение количества тромбоцитов является признаком снижения патологической агрегации тромбоцитов, что приводит к уменьшению тромботического процесса, инициируемого комплексами тромбоцит-vWF, характерными для данного заболевания. Отношение рисков («ОР») плацебо и полипептида из настоящего изобретения было поразительным, 2,2 с 95% ДИ (1,28; 3,78), р=0,013. Этот ответ подтвердился до 48 часов после времени до ответа. Таким образом, проверка концепции полипептида из настоящего изобретения показала статистически достоверное и клинически значимое снижение времени подтвержденного ответа тромбоцитов. Далее, отмечалось снижение числа обострений от 11 в группе плацебо до 3 в группе лечения. Не отмечалось случаев смерти в группе лечения, по сравнению с 2 случаями смерти в группе плацебо.
Далее, настоящее клиническое исследование у больных ТТП также показало, что полипептиды из настоящего изобретения (например, ALX 0081) являются хорошо переносимыми агентами, и в частности, что потенциальный риск кровотечения кажется низким и контролируемым. Таким образом, имеющиеся в настоящее время данные показывают, что снижение ПО и трансфузии и связанных с ними обострений достигается без значительных побочных эффектов от введения полипептидов из настоящего изобретения как таковых. Это представляет явную пользу для безопасности применения полипептидов из настоящего изобретения в лечении пациентов с ТТП.
Таким образом, введение полипептидов, содержащих по меньшей мере один ISVD против vWF у людей, больных ТТП, обеспечивает неожиданно сниженное время до ответа, устойчивый и пролонгированный эффект, снижение обострений, уменьшение госпитализации, снижение тяжести заболевания, снижение смертности и/или снижение числа ПО.
Современная терапия ТТП с ПО и трансфузией обеспечивает замену ADAMTS13 и удаление антител против фермента, таким образом, постепенно приводя к нормализации процессинга ULvWF. Однако это лечение требует множества обменов и трансфузий в течение многих дней, во время чего нет прямой фармакологической направленности на активный процесс ULvWF-опосредованной агрегации тромбоцитов.
Далее, в настоящее время неожиданно было показано, что полипептиды из настоящего изобретения не интерферируют с ферментом, заменяемым посредством трансфузии плазмы. Было показано, что полипептиды из настоящего изобретения (например, ALX 0081) можно применять, в комбинации с ПО и трансфузией, для прямого ингибирования длительного образования малых тромбов и захвата тромбоцитов в микрососудистой системе. Это обеспечивает более быстрый контроль основного тромботического процесса и сопутствующего захвата тромбоцитов, с полезным эффектом снижения степени ишемических и геморрагических обострений. Это также приводит к более быстрому клиническому восстановлению и снижению тяжести заболевания за более короткий период, и снижению числа ПО и трансфузий. Действительно, анализ специфических и клинически значимых биомаркеров повреждения органов ЛДГ, тропонина Т или I и креатинина позволяет предположить, что более быстрое сокращение ишемии ткани микрососудов может приносить клиническую пользу. Кроме того, продемонстрировано ингибирование ULvWF-опосредованного взаимодействия тромбоцитов посредством полипептидов из настоящего изобретения (например, ALX 0081); и наблюдаемые антитромботические эффекты повышают потенциал долговременного применения после восстановления пациента после острого приступа ТТП для предотвращения рецидивов заболевания. Снижение частоты острых приступов ТТП представляет существенную пользу, с возможностью снижения тяжести заболевания и смертности, связанной с ТТП, а также снижением потребности в ПО и трансфузиях в течение жизни пациента.
В то время как более быстрое восстановление от ТТП и снижение обострений и рецидивов является заметной клинической пользой с точки зрения эффективности лечения, снижение продолжительности и частоты ПО и трансфузий также обеспечивает дополнительную пользу с точки зрения безопасности пациента. Хотя ПО и трансфузия в настоящее время рассматриваются как стандартное лечение для контроля ТТП (Scully et al. Br.J.Haem. 2012; 158:323-335), процедуры связаны с риском существенных обострений. Процедура ПО требует больших объемов жидкости и скоростей потока, делающих необходимым применением двухпросветных катетеров центральной вены для гемодиализа. Обострения процедуры включают геморрагию при введении катетера, сепсис, тромбоз катетера, пневмоторакс, перегрузку жидкостью, гипоксию и гипотензию (Fontana et al. Semin.Hematol. 2004; 41: 48-59; George J.Intensive Care Med. 2007; 22: 82-91; Howard et al. Transfusion 2006; 46: 154-156; Rizvi et al. Transfusion 2000; 40: 896-901; Nguyen et al. Transfusion 2009; 49: 392-394). Анафилактоидные реакции осложняют от 0,25% до 0,5% процедур (Allford et al 2003 supra; George 2007 supra). Кроме того, инфузия плазмы, содержащей продукты крови, может вызывать неинфекционный СОППЛ. Это состояние считается одной из наиболее частых причин смерти, связанной с трансфузией, с частотой, составляющей от 0,02% до 0,05% на плазма-содержащую единицу со средним значением 17 единиц плазмы в сутки; суточный риск может составлять от 0,34% до 0,85%. Для большинства пациентов с ТТП требуется много ПО и трансфузий. Пациенты с острой идиопатической ТТП требуют ежедневного лечения, и в среднем примерно 16 лечений требуется для достижения ремиссии (Allford et al. 2003 supra). В трудно поддающихся лечению случаях частота лечения может быть повышена до двух раз в сутки (Allford et al. 2003 supra). В случае пациентов с семейной ТТП рекомендуются регулярные профилактические инфузии плазмы с интервалами от двух до трех недель (Lammle et al. J.Thromb.Haemost. 2005; 3: 1663-1675). Анафилаксия и СОППЛ, таким образом, представляют явный риск для пациентов с ТТП, лечение которых требует такой частоты и регулярности ПО и трансфузий. В то время как полагают, что этот риск может быть снижен, если применяют плазму, обработанную сольвент-детергентным способом (С/Д) вместо свежей замороженной плазмы, применение больших объемов С/Д плазмы может быть связано с повышенным риском венозной тромбоэмболии (Allford et al. 2003 supra; Fontana et al. 2004 supra). В целом установлено, что примерно у 30%-40% пациентов отмечаются побочные эффекты от ПО и трансфузии, и частота смертности от процедуры составляет примерно 2%-3% (George et al. Semin.Hematol. 2004; 41: 60-67; George 2007 supra). Следовательно, снижение продолжительности и частоты ПЭ и трансфузий также обеспечивает дополнительную пользу с точки зрения безопасности пациента.
После выхода из приступа ТТП у многих пациентов отмечаются когнитивные расстройства в течение многих лет, причиняющие беспокойство, проблемы с памятью, концентрацией, снижением активности и утомляемостью. Такие симптомы оказывают отрицательное влияние на качество повседневной жизни пациентов. Кроме того, это снижение качества жизни может отмечаться у всех пациентов с ТТП, независимо от этиологии и тяжести (Lewis et al. Transfusion 2009; 49: 118-124). Полагают, что эти симптомы могут отражать остаточные эффекты тканевой ишемии. Исходя из этого, было сделано обоснованное предположение, что быстрое окончание приступа ТТП и ограничение образования тромбов в системе микрососудов полипептидами из настоящего изобретения, такими как ALX 0081, позволит улучшить долговременный результат для пациентов с точки зрения их качества жизни.
Соответственно, настоящее изобретение обеспечивает способы лечения или облегчения vWF-зависимых заболеваний у индивидуума путем введения полипептида, содержащего по меньшей мере один ISVD против vWF, где количество применяемого полипептида является эффективным для снижения времени до ответа, снижения ухудшений, сокращения госпитализации, уменьшения ишемии, снижения смертности и/или уменьшения числа необходимых ПО. Настоящее изобретение обеспечивает специфический диапазон доз и схемы введения для полипептидов из изобретения, которые обеспечивают один или несколько из этих эффектов при vWF-зависимых заболеваниях. В частности, изобретение обеспечивает фармакологически активные агенты, композиции, способы и/или схемы введения, которые имеют определенные преимущества по сравнению с агентами, композициями, способами и/или схемами введения, применяемыми в настоящее время и/или известными в данной области техники, включая необходимость менее частого применения ПО. Эти преимущества станут понятными из нижеприведенного описания.
Соответственно, настоящее изобретение обеспечивает полипептид, содержащий по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF) для применения в лечении vWF-зависимых заболеваний у человека, нуждающегося в лечении, включающем введение указанному человеку первой дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанное введение указанного полипептида осуществляют от 5 минут до 8 часов путем выполнения первого обмена плазмы (ПО).
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанному введению указанной первой дозы предшествует выполнение предшествующего обмена плазмы (ПО), предпочтительно в пределах 36 ч, такого времени, как в пределах 32 ч, 30 ч, 28 ч, 26 ч, 24 ч, 22 ч, 20 ч, 18 ч, 16 ч, 14 ч, 12 ч, 10 ч, 8 ч, например, в пределах 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин. 15 мин, 10 мин или даже 5 мин от указанного первого ПО.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где после указанного первого ПО проводят введение второй дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида, предпочтительно путем подкожной инъекции, предпочтительно в пределах 1-60 минут, более предпочтительно в пределах 30 мин от указанного первого ПО.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный предшествующий ПО проводят в пределах 36 ч, предпочтительно 32, 30, 28, 26, 24, 22, 20, 18 или 16 ч, предпочтительно примерно 24 ч от указанного первого ПО.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный полипептид применяют парентерально, предпочтительно путем подкожного, интраперитонеального, внутривенного или внутримышечного введения, предпочтительно путем внутривенного (в/в) болюсного введения.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанное введение указанного полипептида сопровождается выполнением ПО в течение 5 мин- - 8 ч, такого времени, как от 10 мин до 6 ч или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин или даже 5 мин.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанное лечение vWF-зависимого заболевания у человека, нуждающегося в лечении, далее включает:
(i) проведение ПО; и (после)
(ii) введение дозы 1-80 мг, такой как 5-40 мг указанного полипептида спустя 5 мин - 4 ч после указанного ПО на этапе (i); и
(iii) при необходимости, измерение числа тромбоцитов и/или активности ADAMTS13 у указанного пациента;
где этап (i) и этап (ii) повторяют один раз в сутки, предпочтительно до тех пор, пока число тромбоцитов у указанного пациента не достигнет >150000/мкл и/или указанная активность ADAMTS13 не составит по меньшей мере 10%, такого уровня, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, дополнительно включающий введение один раз в сутки дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида в течение по меньшей мере 5, 10, 15, 20, 25, 30, 40, 50 60, 90 или даже 120 дней после того, как количество тромбоцитов у указанного пациента составит >150,000/мкл в первый раз.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, дополнительно включая введение один раз в сутки дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида до достижения ремиссии у указанного человека.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, включая введения указанного полипептида до тех пор, пока активность ADAMTS13 не составит по меньшей мере 10%, так, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанная доза составляет примерно 1-80 мг, или 5-40 мг, такое количество, как 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно примерно 10 мг указанного полипептида.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный человек страдает острым приступом ТТП, обострением ТТП или рецидивом ТТП.
В предпочтительном аспекте настоящее изобретение обеспечивает полипептид, содержащий по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF) для применения в лечении vWF-зависимого заболевания у человека, нуждающегося в лечении, включая:
(1) при необходимости, проведение предварительного плазмообмена (ПО);
(2) введение у указанного человека первой дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида, и если проводят этап (1), предпочтительно в пределах 36 ч, такого времени, как в пределах 32 ч, 30 ч, 28 ч, 26 ч, 24 ч, 22 ч, 20 ч, 18 ч, 16 ч, 14 ч, 12 ч, 10 ч, 8 ч, например, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин. 20 мин, 15 мин,10 мин или даже 5 мин от (окончания) этапа (1);
(3) проведение плазмообмена (ПО), при необходимости в пределах от 5 мин до 8 ч, таких как от 10 мин до 6 ч или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин, или даже 5 мин от этапа (2);
(4) введение дополнительно дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида, предпочтительно в пределах от 5 мин до 8 ч, таком как от 10 мин до 6 ч или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин. 20 мин, 15 мин, 10 мин или даже 5 мин от (окончания) этапа (3);
(5) повторение этапа (3) и этапа (4) один раз в сутки; при необходимости до тех пор, пока количество тромбоцитов у указанного пациента не достигнет >150000/мкл и/или указанная активность ADAMTS13 не составит по меньшей мере 10%, такого уровня, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13;
(6) при необходимости, введение один раз в сутки дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида в течение по меньшей мере 5, 10, 15, 20, 25, 30, 40, 50 60, 90 или даже 120 дней после того, как количество тромбоцитов у указанного пациента составит >150,000/мкл в первый раз, или активность ADAMTS13 составит по меньшей мере 10%, такого уровня, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% стандартной активности ADAMTS13.
Кроме того, настоящее изобретение обеспечивает полипептид, содержащий два ISVD против vWF человека, для применения в профилактике (симптомов) рецидива vWF-зависимого заболевания у человека, путем введения человеку 1-80 мг, такого количества, как 5-40 мг, предпочтительно дозы 10 мг указанного полипептида.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF человека содержит по меньшей мере один иммуноглобулиновый одиночный вариабельный домен, связывающийся с SEQ ID NO: 20. Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF человека содержит вариабельный домен тяжелой цепи, полученный из обычного четырехцепочечного антитела, или вариабельный домен тяжелой цепи, полученный из тяжелоцепочечного антитела или нанотела.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанным нанотелом является VHH.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF по существу состоит из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно), в которых:
(а) CDR1 содержит или по существу состоит из:
- аминокислотной последовательности YNPMG; или
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью YNPMG; и
(b) CDR2 содержит или по существу состоит из:
- аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AISRTGGSTYYPDSVEG;
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AISRTGGSTYYPDSVEG; и
(с) CDR3 содержит или по существу состоит из:
- аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF;
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, в котором:
a) CDR1 является YNPMG (SEQ ID NO: 20);
b) CDR2 является AISRTGGSTYYPDSVEG (SEQ ID NO: 21); и
c) CDR3 является AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 22).
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, в котором ISVD против vWF представлен SEQ ID NO: 19 (12A02H1).
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, включающий или состоящий по меньшей мере из двух ISVD против vWF.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где каждый ISVD из указанных по меньшей мере двух ISVD против vWF по существу состоит из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно), в которых:
(а) CDR1 содержит или по существу состоит из:
- аминокислотной последовательности YNPMG; или
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью YNPMG; и
(b) CDR2 содержит или по существу состоит из:
- аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AISRTGGSTYYPDSVEG;
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AISRTGGSTYYPDSVEG; и
(с) CDR3 содержит или по существу состоит из:
- аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF;
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, в котором каждый ISVD против vWF по существу состоит из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно), в которых
a) CDR1 является YNPMG (SEQ ID NO: 20);
b) CDR2 является AISRTGGSTYYPDSVEG (SEQ ID NO: 21); и
c) CDR3 является AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 22).
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный полипептид включает или состоит из SEQ ID NOs1-19, предпочтительно SEQ ID NO: 19.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF является одноцепочечным полипептидом, содержащим один или несколько иммуноглобулиновых одиночных вариабельных доменов.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF является одновалентным или поливалентным.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF является моноспецифическим или полиспецифическим.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где один или несколько иммуноглобулиновых одиночных вариабельных доменов являются CDR-привитыми, гуманизированными, камелизированными, де-иммунизированными или выбранными посредством фагового дисплея.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный ISVD против vWF содержит аминокислотную последовательность, которая является на 90% идентичной SEQ ID NO: 1.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, содержащий два иммуноглобулиновых одиночных вариабельных домена (ISVD) против vWF человека, и ISVD против сывороточного альбумина человека (HSA).
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанный полипептид составлен в виде фармацевтически пригодной композиции.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанная композиция содержит цитратный или фосфатный буфер с рН в диапазоне от 5,0 до 7,5.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанная композиция пригодна для парентерального применения, такого как одно или более, выбранное из внутривенного введения, подкожного введения, внутримышечного введения или интраперитонеального введения.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанная композиция находится в жидкой, лиофилизированной, высушенной распылением, восстановленной лиофилизированной, или замороженной форме.
Настоящее изобретение обеспечивает набор или изделие, включающее контейнер, содержащий полипептид, как описано в настоящей заявке, или композицию, как описано в настоящей заявке, и инструкции по применению.
Настоящее изобретение обеспечивает набор или изделие, где композиция присутствует во флаконе или шприце для инъекций.
Настоящее изобретение обеспечивает набор или изделие, где композиция присутствует в предварительно заполненном шприце для инъекций.
Настоящее изобретение обеспечивает набор или изделие, где шприц или флакон состоит из стекла, пластика, или полимерного материала, выбранного из циклического олефинового полимера или сополимера.
Настоящее изобретение обеспечивает композицию, включающую:
(а) агент, связывающий vWF, в концентрации примерно от 0,1 мг/мл до 80 мг/мл;
(b) наполнитель, выбранный из сахарозы, глицина, маннитола, трегалозы или NaCl в концентрации примерно от 1 до 15% (м/о);
(с) Твин-80 в концентрации примерно от 0,001 об.% до 0,5 об.%; и
(d) буфер, выбранный из цитратного буфера в концентрации примерно от 5 мМ до 200 мМ, так что рН композиции составляет примерно от 6,0 до 7,0, и фосфатного буфера в концентрации примерно от 10 мМ до 50 мМ, так что рН композиции составляет примерно от 6,5 до 7,5,
для применения в лечении vWF-зависимого заболевания у человека, нуждающегося в лечении, путем введения человеку дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг указанного полипептида, где указанную дозу вводят спустя 5-8 часов, такого времени, как от 15 минут до 4 часов после первого плазмообмена (ПО).
Настоящее изобретение обеспечивает фармацевтическую лекарственную форму, пригодную для парентерального применения у пациента, предпочтительно у пациента - человека, включающую полипептид, как описано в настоящей заявке, или композицию, как описано в настоящей заявке.
Настоящее изобретение обеспечивает полипептид, как описано в настоящей заявке, где указанное vWF-зависимое заболевание выбрано из острого коронарного синдрома (ОКС), транзиторной церебральной ишемической атаки, нестабильной или стабильной стенокардии, инсульта, инфаркта миокарда или тромботической тромбоцитопенической пурпуры (ТТП).
Настоящее изобретение обеспечивает способ лечения пациента - человека, восприимчивого или имеющего диагноз заболевания, характеризующегося как vWF-зависимое заболевание, включающий применение эффективного количества полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF) у пациента-человека.
Настоящее изобретение обеспечивает способ лечения или профилактики vWF-зависимого заболевания, такого как ТТП, включающий введение человеку дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF), обеспечивающего снижение одного или нескольких симптомов, связанных с vWF-зависимым заболеванием.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанное применение полипептида, как описано здесь, проводят спустя 5 мин- 8 часов, такое время, как от 15 мин до 4 часов после выполнения первого плазмообмена (ПО).
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанному применению полипептида, как описано в настоящей заявке, предшествует выполнение предварительного плазмообмена (ПО), в пределах 36 ч, предпочтительно 32, 30, 28, 26, 24, 22, 20, 18 или 16 ч, предпочтительно примерно 24 ч от указанного первого ПО.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанный первый ПО сопровождается введением второй дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг полипептида, как описано в настоящей заявке, в пределах от 5 мин до 8 ч, такого времени, как от 10 мин до 6 ч или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин или даже 5 мин, например, указанную вторую дозу указанного полипептида применяют в пределах 1-60 мин, такого времени, как 30 мин от указанного первого ПО, предпочтительно путем подкожного введения.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, дополнительно включающее:
(i) проведение ПО; (затем)
(ii) введение дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг полипептида, как описано в настоящей заявке, спустя 15 мин - 4 ч после указанного ПО на этапе (i); и
(iii) при необходимости, измерение числа тромбоцитов и/или активности ADAMTS13 у указанного пациента,
где этап (i) и этап (ii) повторяют один раз в сутки, при необходимости до тех пор, пока число тромбоцитов у указанного пациента не достигнет >150000/мкл и/или указанная активность ADAMTS13 не составит по меньшей мере 10%, такого уровня, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
Настоящее изобретение также обеспечивает лечение, как описано в настоящей заявке, дополнительно включающее введение один раз в сутки дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг полипептида, как описано в настоящей заявке, в течение по меньшей мере 5, 10, 15, 20, 25 или даже 30 дней после того. как количество тромбоцитов у указанного пациента достигает >150,000/мкл.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, дополнительно включающее введение один раз в сутки дозы 1-80 мг, такой как 5-40 мг, предпочтительно 10 мг полипептида, как описано в настоящей заявке, до достижения ремиссии у указанного человека.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, включающее введение указанного полипептида до достижения активности ADAMTS13 по меньшей мере 10%, такой как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или профилактики острого приступа vWF-зависимого заболевания у человека, нуждающегося в этом, включающему или состоящему из: (а) введения указанному человеку дозы 5-40 мг, предпочтительно 10 мг полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF); где применение указанного полипептида снижает риск и/или предотвращает острый приступ vWF-зависимого заболевания. Предпочтительно, указанный риск снижается в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже в 20, 50 или даже 100 раз. Предпочтительно, указанный риск снижается на 10% или даже больше, например, 20%, 30%, 40%, 50%, 60% или больше, на такой уровень, как 80% или даже 100%.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанный этап (i) введение полипептида из изобретения повторяют по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз, или даже более 10 раз, например, 20 раз, предпочтительно больше 30 раз или даже больше.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанный этап (i) введение полипептида из настоящего изобретения повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, или даже больше 10 дней, такого времени, как 20 дней, предпочтительно больше 30 дней, такого времени, как 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев или даже больше.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанную дозу применяют 1 раз в сутки или два раза в сутки.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, дополнительно включающему:
(ii) измерение активности ADAMTS13 у указанного пациента;
(iii) сравнение указанной активности ADAMTS13 со стандартной активностью ADAMTS13; и
(iv) если указанная активность ADAMTS13 составляет менее 30%, представляя такую величину, как 20%, 15% или 10% от указанной стандартной активности ADAMTS13, то проводят повторение указанного этапа (i) введение полипептида из настоящего изобретения.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанную активность ADAMTS13 у указанного пациента определяют каждый день, или каждый 2, 3, 4, 5, 6, 7, 8, 9 или 10 день, предпочтительно, по меньшей мере каждую неделю.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где этап (i) введение полипептида из настоящего изобретения повторяют до тех пор, пока активность ADAMTS13 не достигнет по меньшей мере 10%, 15%, такой, как 20%, или 30% или больше от указанной стандартной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где этап (i) введение повторяют до тех пор, пока указанная активность ADAMTS13 не достигнет по меньшей мере 10%, 15%, такой, как 20%, или 30% или больше от указанной стандартной активности ADAMTS13 по меньшей мере при 2 последовательных измерениях. Предпочтительно, указанные 2 последующих измерения проводят с интервалом по меньшей мере 24 часа, более предпочтительно по меньшей мере 48 часов, таким как по меньшей мере 3 дня, или даже больше, таким как 4, 5, 6 или 7 дней, предпочтительно недели.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанный этап (i) введение полипептида из изобретения повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, или даже больше 10 дней, такого времени, как 20 дней, предпочтительно больше 30 дней или даже больше, после того как указанная активность ADAMTS13 составит по меньшей мере 10% или 15%, такое значение, как 20% или 30% от указанной стандартной активности по меньшей мере при 2 последовательных измерениях.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, дополнительно включающему:
- измерение активности ADAMTS13 у указанного пациента;
- сравнение указанной активности ADAMTS13 с активностью стандартного ADAMTS13; и
- если указанная активность ADAMTS13 составляет > 10%, такое значение, как 15%, или больше 20% или 30% от указанной стандартной активности ADAMTS13, то повторяют указанный этап (i) введение полипептида из изобретения в течение самое большее 30 дней, такого времени, как самое большее 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней или даже 1 дня.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или профилактики острого эпизода vWF-зависимого заболевания у человека, нуждающегося в этом, включающему по меньшей мере следующие этапы:
(i) измерение активности ADAMTS13 у указанного пациента;
(ii) сравнение активности ADAMTS13 со стандартной активностью ADAMTS13; и
(iii) если указанная активность ADAMTS13 составляет меньше 30%, 20%, 15% или 10% от указанной стандартной активности, проводят введение указанному человеку дозы 5-40 мг полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен против фактора фон Виллебранда (vWF).
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где:
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается на 10%, 20%, 30%, предпочтительно по меньше мере на 40%, или даже по меньшей мере на 50%, на такую величину, как 60%, 70%, 80%, 90% или даже 100%;
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 1,2; 1,3; 1,4; 1,5; 1,75; 2 или более раз, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже больше, например, в 20, 50 или даже 100 раз;
- повреждение органов, ишемическое повреждение и/или образование микротромбов снижается предпочтительно по меньшей мере на 10%. 20%. 30%, 40% или даже по меньшей мере на 50%, например, на 60%, 70%, 80%, 90% или даже 100%;
- повреждение органов, ишемическое повреждение и/или образование микротромбов снижается в 2 раза или больше, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже больше, например, в 20, 50 или даже 100 раз;
- маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, возвращаются по меньшей мере к 40%, или даже по меньшей мере 50%, например, 60%, 70%, 80%, 90% или даже до 100% от нормальных уровней;
- маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, улучшаются по меньшей мере на 20%, например, на 30% или даже больше, например, на 40%, или даже по меньшей мере на 50%, например, на 60%, 70%, 80%, 90% или даже на 100% от нормальных уровней. Предпочтительно, указанные маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, улучшаются меньше чем за 30 дней лечения, предпочтительно, меньше чем за 20 дней лечения, такой срок, как меньше 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней, или даже за 1 день;
- количество тромбоцитов сохраняется > 150000/мкл;
- риск ухудшений снижается по меньшей мере на 10%, 20%, 30%, 40%, или даже по меньшей мере на 50%, например, на 60%, 70%, 80%, 90% или даже на 100%;
- риск ухудшений снижается в два раза или больше, например, в 3, 4, 5, 6, 7, 8, 9, или даже в 10 раз, или больше, например, в 20, 50 или даже 100 раз;
- смертность из-за указанного vWF-зависимого заболевания снижается на 10%, 20%, 30%, предпочтительно, по меньшей мере на 40%, или даже по меньшей мере на 50%, например, на 60%, 70%, 80%, 90% или даже на 100%;
- смертность из-за указанного vWF-зависимого заболевания снижается в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 или больше раз, в такой степени, как в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже больше, так как в 20, 50 или даже 100 раз.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, включающему измерение количества тромбоцитов; и если указанное количество ниже 150,000/мкл, повторение указанного этапа (i) введение полипептида из настоящего изобретения.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанное число тромбоцитов у указанного пациента измеряют каждый день, или каждые 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, предпочтительно по меньшей мере каждую неделю.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где этап (i) введение полипептида из настоящего изобретения повторяют, пока указанное число тромбоцитов не составит по меньшей мере 150,000/мкл.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где этап (i) введение полипептида из настоящего изобретения повторяют, пока указанное число тромбоцитов не составит по меньшей мере 150,000/мкл по меньшей мере в 2 последовательных измерениях. Предпочтительно, указанные 2 последовательных измерения проводят с интервалом по меньшей мере 24 ч, более предпочтительно по меньшей мере 48 ч, такого времени, как по меньшей мере 3 дня, или даже больше, как 4, 5, 6 или даже 7 дней, предпочтительно одной недели.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, где указанный этап (i) введение полипептида из настоящего изобретения повторяют по меньшей мере в течение 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, или даже больше 10 дней, такого времени, как 10 дней, такого как 20 дней, предпочтительно больше 30 дней, или даже больше, после того, как указанное количество тромбоцитов достигает по меньшей мере 150,000/мкл по меньшей мере в двух последовательных измерениях. Предпочтительно, указанные 2 последовательных измерения проводят с интервалом по меньшей мере 24 ч, более предпочтительно 48 ч, такого времени, как по меньшей мере 3 дня, или даже больше, как 4, 5, 6 или даже 7 дней, предпочтительно одной недели.
В одном варианте осуществления настоящее изобретение относится к способу, как описано в настоящей заявке, дополнительно включающему измерение числа тромбоцитов у указанного пациента; и если указанное число тромбоцитов > 150,000/мкл, повторение указанного этапа (i) введение полипептида из настоящего изобретения в течение самое большее 30 дней, такого времени, как самое большее 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней или даже 1 дня.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или профилактики острого эпизода vWF-зависимого заболевания у человека, нуждающегося в этом, включающему по меньшей мере следующие этапы:
(i) измерения числа тромбоцитов у указанного пациента; и
(ii) если указанное число тромбоцитов ниже 150,000/мкл, введение указанному человеку дозы 5-40 мг полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF);
где введение указанного полипептида снижает риск и/или предотвращает острый эпизод vWF-зависимого заболевания.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, включающему по меньшей мере следующие этапы:
(i) введение указанному человека первой дозы 5-40 мг. предпочтительно 10 мг полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF);
(ii) выполнения первого плазмообмена (ПО), предпочтительно от 5 мин до 8 ч до этапа (i).
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, как описано в настоящей заявке, где этап (i), т.е. введение указанному человеку полипептида из настоящего изобретения, предваряют выполнением предшествующего ПО, предпочтительно в пределах 24 от этапа (ii), т.е. выполняют вначале ПО.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в лечении, включающему по меньшей мере следующие этапы: (i) выполнения плазмообмена (ПО); (ii) введения указанному человеку дозы 5-40 мг, предпочтительно 10 мг полипептида, содержащего по меньше мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF). Предпочтительно, указанный этап (i), т.е. проведение ПО, и указанный этап (ii), т.е. введение указанному человеку полипептида из настоящего изобретения, повторяют один или два раза в день, в течение самое большее 1, 2, 3, 4, 5, 6 или 7 дней.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в нем, как описано в настоящей заявке, где этап (ii), т.е. введение указанному человеку указанного полипептида из настоящего изобретения, выполняют в течение от 15 мин до 4 ч от этапа (i), т.е. выполнения ПО.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в лечении, как описано в настоящей заявке, дополнительно включающему измерение числа тромбоцитов у указанного человека, предпочтительно после этапа (ii), т.е. введения указанному человеку указанного полипептида из настоящего изобретения; и если указанное число тромбоцитов составляет <150,000/мкл, повторение указанного этапа (i), т.е. проведения ПО, и указанного этапа (ii), т.е. введения указанному человеку указанного полипептида.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, как описано в настоящей заявке, дополнительно включающему измерение количества тромбоцитов у указанного человека (предпочтительно после этапа (ii), т.е. введения указанному человеку указанного полипептида из изобретения); и повторение этапа (i), т.е. проведения ПО, и этапа (ii), т.е. введения указанному человеку указанного полипептида (один/два раза в день), пока указанное число тромбоцитов не достигнет по меньшей мере 150,000/мкл по меньшей мере при двух последовательных измерениях. Предпочтительно, указанные 2 последовательных измерения проводят с интервалом по меньшей мере 24 ч, более предпочтительно 48 ч, такого времени, как по меньшей мере 3 дня, или еще больше, такого как 4, 5, 6 или даже 7 дней, предпочтительно, 1 недели.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, как описано в настоящей заявке, дополнительно включающему введение один раз в день дозы 5-40 мг, предпочтительно 10 мг указанного полипептида в течение по меньшей 1-30 дней после того, как число тромбоцитов у указанного человека составит в первый раз >150,000/мкл.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, как описано в настоящей заявке, дополнительно включающему измерение активности ADAMTS13 у указанного человека, предпочтительно после этапа (ii), т.е. введение указанному человеку указанного полипептида.
В одном варианте осуществления настоящее изобретение относится к способу лечения острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в этом, как описано в настоящей заявке, где этап (i), т.е. проведение ПО, и этап (ii), т.е. введение указанному человеку указанного полипептида из настоящего изобретения, повторяют до тех пор, пока активность ADAMTS13 не достигнет (в первый раз) более 15%, или 20%, или даже 30% от стандартной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или профилактики ишемического повреждения, повреждения органов и/или образования микротромбов (обусловленного vWF-зависимым заболеванием) у человека, нуждающегося в этом, включающему по меньшей мере следующий этап (i) введения указанному человеку в дозе 5-40 мг/сутки, предпочтительно 10 мг/сутки полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF); где введение указанного полипептида снижает риск и/или предотвращает ишемическое повреждение, повреждение органа и/или образование микротромбов на 10%, 20%, 30%, предпочтительно по меньшей мере на 40%, или даже по меньшей мере на 50%, на такое значение, как 60%, 70%, 80%, 90% или даже 100%. Предпочтительно, введение указанного полипептида снижает риск и/или предотвращает ишемическое повреждение, повреждение органа и/или образование микротромбов в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 или больше раз, так как в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже больше, так как в 20, 50 или даже 100 раз.
В одном варианте осуществления настоящее изобретение относится к способу, в котором указанный этап (i) введения указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7 суток или даже больше, такого периода, как 1 неделя, 2 недели, 3 недели, или даже больше, такого как 1 месяц или даже 2 месяца.
В одном варианте осуществления настоящее изобретение относится к способу, дополнительно включающему измерение активности ADAMTS13 у указанного пациента, предпочтительно один раз в неделю.
В одном варианте осуществления настоящее изобретение относится к способу, в котором указанный этап (i) введения указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней или даже больше, такого периода, как 1 неделя, 2 недели, 3 недели, или даже больше, такого как 1 месяц или даже 2 месяца, когда активность ADAMTS13 составляет (в первый раз) > 10%, такое значение, как больше 15%, или даже больше 20% от стандартной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу лечения симптома vWF-зависимого заболевания, такого как ТТП, у человека, страдающего указанным заболеванием, включающему введение у субъекта полипептида из изобретения, в количестве, эффективном для лечения симптома vWF-зависимого заболевания у человека, страдающего указанным заболеванием.
В одном варианте осуществления настоящее изобретение относится к способу ингибирования у человека возникновения или прогрессирования vWF-зависимого заболевания, такого как ТТП, где ингибирование осуществляют путем связывания полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF), с vWF, включающему применение у человека с предварительно установленным интервалом эффективный ингибирующих доз указанного полипептида, где при каждом введении полипептида доставляют человеку от 0,1 мг на кг до 25 мг на кг массы тела человека, так чтобы ингибировать начало или прогрессирование заболевания у человека.
В одном варианте осуществления настоящее изобретение относится к способу снижения вероятности развития у человека ишемического повреждения органов при vWF-зависимом заболевании, включающему введение человеку предварительно установленной дозы полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF), где при каждом введении полипептида доставляют человеку от 0,1 мг на кг до 25 мг на кг массы тела человека, так чтобы снизить вероятность развития у человека ишемического повреждения органов.
Обозначения на чертежах
Фигура 1. Схема-алгоритм лечения.
Фигура 2. Кривые времени до первой нормализации ЛДГ (популяция, предназначенная для лечения = субъекты с аномально высокими базовыми уровнями).
Фигура 3. Кривые времени до нормализации тропонина Т или I у субъектов с аномально высокими базовыми уровнями в популяции, предназначенной для лечения.
Фигура 4. Кривые времени до нормализации креатинина у субъектов с аномально высокими базовыми уровнями в популяции, предназначенной для лечения.
Фигура 5. Уровни vWF у пациентов с ТТП: прогнозированное на модели процентное снижение от базового уровня свободного vWF в конце периода 2 в зависимости от уровня суточной дозы, включая пациентов, принимавших плацебо. Указаны медиана, 25-й и 75-й перцентили.
Фигура 6. ФК/ФД модель каплацизумаба и свободного, общего и связанного в комплексах vWF: (А) Прогнозированные на модели профили концентрации каплацизумаба после ежедневного подкожного введения в течение периода 1 и периода 2 (с сопутствующим ежедневным ПО и без него). (В) Прогнозированные на модели уровни свободного vWF при ежедневном подкожном введении 10 мг каплацизумаба и после периода лечения. (С) Предполагаемые уровни комплекса каплацизумаб-vWF при ежедневном подкожном введении 10 мг каплацизумаба и после периода лечения. (D) Прогнозированные на модели уровни общего vWF при ежедневном подкожном введении 10 мг каплацизумаба и после периода лечения. Показаны медианные профили и 5-й и 95-й перцентили.
Подробное описание
Если не указано иное, все способы, этапы, методики и манипуляции, которые не описаны специально в деталях, могут выполняться и выполняются способом, известным как таковой, как понятно специалисту в данной области техники. Можно, например, вновь сослаться на стандартные справочники и общий предшествующий уровень техники, упомянутый в настоящей заявке, и на последующие цитированные ссылки; а также, например, на следующие обзоры: Presta, Adv. Drug Deliv. Rev. 2006, 58 (5-6): 640-56; Levin and Weiss, Mol. Biosyst. 2006, 2(1): 49-57; Irving et al., J. Immunol. Methods, 2001, 248(1-2), 31-45; Schmitz et al., Placenta, 2000, 21 Suppl. A, S106-12, Gonzales et al., Tumour Biol., 2005, 26(1), 31-43; которые описывают методики белковой инженерии, такие как созревание аффинности и другие методики улучшения специфичности и других необходимых свойств таких белков, как иммуноглобулины.
Необходимо отметить, что как применяется в настоящей заявке, формы единственного числа включают ссылки на множественное число, если только в контексте ясно не указано иное. Таким образом, например, ссылка на «реагент» включает один или несколько таких разных реагентов, а ссылка на «способ» включает ссылку на эквивалентные этапы и способы, известные специалисту в данной области техники, которые могут быть модифицированы или заменены на способы, описанные в настоящей заявке.
Если не указано иное, термин «по меньшей мере», предшествующий серии элементов, необходимо понимать как относящийся к каждому элементу в этой серии. Специалисту в данной области техники понятно, или он сможет установить с применением всего лишь рутинных экспериментов многие эквиваленты для специфических вариантов осуществления изобретения, описанных в настоящей заявке. Такие эквиваленты охватываются настоящим изобретением.
Если используется термин «и/или», он включает значение «и», «или» и «все или любые другие комбинации элементов, связанные с указанным термином».
Термин «примерно» или «приблизительно», как применяется в настоящей заявке, означает в пределах 20%, предпочтительно в пределах 15%, более предпочтительно в пределах 10%, и наиболее предпочтительно в пределах 5% от данной величины или диапазона.
На протяжении описания и последующей формулы изобретения, если в контексте не требуется иное, термин «включать» и его варианты, такие как «включает» и «включающий», необходимо понимать как включение установленного целого числа или этапа, или группы целых числе или этапов, но не исключение любого другого целого числа или этапа, или группы целых чисел или этапов. Если применяется термин «включающий», он может быть заменен термином «содержащий», или иногда термином «имеющий».
Терапевтический потенциал полипептидов из настоящего изобретения, таких как ALX 0081, в лечении ТТП был продемонстрирован в экспериментах in vitro с применением плазмы от пациентов с ТТП в экспериментах в проточной камере. В этих экспериментах эндотелиальные клетки стимулировали для продукции нитей ULVWF на их поверхности (см. Пример 2). Было показано, что полипептиды из настоящего изобретения, такие как ALX 0081, способны к ингибированию взаимодействий тромбоцит-vWF, и в частности, ULvWF-опосредованного взаимодействия тромбоцитов in vitro, а также, как было показано, не оказывают влияния на функцию ADAMTS13. В частности, было показано, что полипептиды из настоящего изобретения, такие как ALX 0081, способны к взаимодействию с vWF как на активной стадии (т.е. функциональной для взаимодействия с GPIb-IX-V в виде мультимеров регулярного размера и ультра-больших мультимеров), так и неактивной стадии (мультимеров регулярного размера перед конформационным изменением А1 домена). Исследование предоставило проверку концепции, что полипептиды из настоящего изобретения, такие как ALX 0081, можно применять для лечения пациентов с ТТП. Оно также доказало, что полипептиды из настоящего изобретения, такие как ALX 0081, не мешают активности ADAMTS13.
Настоящее изобретение по меньшей мере отчасти основано на наблюдении, что применение у людей, больных ТТП, полипептидов, содержащих по меньшей мере один ISVD против vWF (далее обозначаемых как «полипептид(ы) из настоящего изобретения), обеспечивает неожиданное снижение на 2 суток времени до ответа. Время до ответа выражается как время, необходимое для восстановления тромбоцитов до ≥ 150,000/мкл. Кроме того, настоящее изобретение обеспечивает неожиданно устойчивый и пролонгированный эффект, снижение обострений, сокращение госпитализации, снижение тяжести заболевания, снижение числа необходимых ПО, уменьшение ишемии, уменьшение повреждения органов и снижение показателя смертности.
Таким образом, изобретение относится к применению полипептидов из настоящего изобретения для лечения или облегчения vWF-зависимого заболевания у пациента путем неожиданно большого снижения времени до ответа, демонстрируемого ускоренным восстановлением тромбоцитов. Изобретение также обеспечивает снижение числа ПО, при сохранении восстановления тромбоцитов у человека - пациента в течение неожиданно пролонгированных периодов времени. Соответственно, обеспечиваются способы снижения времени до ответа у человека - пациента путем применения у пациента полипептида из настоящего изобретения, где количество применяемого полипептида эффективно для изменения одного или нескольких маркеров заболевания ТТП, таких как число тромбоцитов, тромбоцитопения, нейрокогнитивная функция, уровни дезинтегрин-подобных и металлопротеазных с тромбоспондиновыми повторов 13 (ADAMTS13) и титры анти-ADAMTS13 антител, уровни активности ADAMTS13, сердечные маркеры (тропонин Т или тропонин I), BNP (мозговой натрийуретический пептид) или N-концевой про-мозговой натрийуретический пептид (NT proBNP), и маркеры повреждения головного мозга (такие как NSE (нейрон-специфическая энолаза) и Sβ100 (S100бета)), предпочтительно, для повышения числа тромбоцитов.
Кроме того, полипептид из настоящего изобретения при применении у человека, больного ТТП, был безопасным, по результатам оценки лабораторных маркеров безопасности, таких как RICO, vWF и FVIII хромоген. Хотя имелся потенциал повышения риска кровотечения, он был полностью контролируемым.
Маркеры можно измерить с применением стандартных способов, известных и применяемых специалистами в данной области техники, таких как различные анализы на иммунологической основе, включая иммуноферментные анализы (ИФА), радиоиммуноанализы или иммуноэнзиметрические анализы. Можно применять также анализы на химической, колориметрической и ферментной основе, где это уместно.
Соответственно, настоящее изобретение обеспечивает полипептид, содержащий по меньшей мере один ISVD против vWF для применения в лечении vWF-зависимого заболевания у человека, нуждающегося в этом, путем введения человеку дозы 5-40 мг указанного полипептида, где указанная доза сопровождается в течение 15 мин - 4 ч первым плазмообменом (ПО).
Полипептиды из настоящего изобретения применяли в качестве дополнительного лечения в специфическое время относительно процедур ПО для лечения или профилактики (например, снижения или облегчения одного или нескольких симптомов, связанных с ним) vWF-зависимого заболевания, например ТТП.
Термин «лечение» означает применение терапии в количестве, способе и/или режиме, эффективном для улучшения состояния, симптома или параметра, связанного с заболеванием, или для профилактики прогрессирования заболевания, до статистически значимой степени или до степени, выявляемой специалистом в данной области техники. В случае терапевтического применения, лечение может улучшать, лечить, поддерживать, или снижать продолжительность заболевания или состояния у субъекта. При терапевтическом применении у субъекта может отмечаться частичная или полная манифестация симптомов. В типичном случае лечение облегчает заболевание или состояние у субъекта до степени, выявляемой врачом, или предотвращает ухудшение заболевания или состояния. Например, улучшаются клинические характеристики и признаки острого эпизода ТТП, как указано в таблице 1, или как приведено в указаниях по лечению ТТП (Scully et al. 2012 supra). Например, благодаря лечению, нормализуется число тромбоцитов, снижаются титры аутоантител к ADAMTS13 и/или возрастает активность ADAMTS13, как известно в данной области техники и/или подробно описано ниже (см. infra). Эффективное количество, способ или режим могут варьировать в зависимости от субъекта, и могут быть отрегулированы по субъекту.
Как применяется в настоящей заявке, термин «профилактика» означает смягчение симптома упомянутого заболевания. В частности, указанный термин охватывает полный диапазон терапевтически положительных эффектов применения полипептида из настоящего изобретения у субъекта, включая снижение, смягчение или облегчение vWF-зависимого заболевания, например, ТТП и его симптомов. Термин «профилактика» включает предотвращение или отсрочку развития заболевания, предотвращение или отсрочку развития симптомов и/или снижение тяжести таких симптомов, которые разовьются или развитие которых ожидается. Кроме того, он включает облегчение существующих симптомов, профилактику дополнительных симптомов и облегчение или профилактику основных причин симптомов.
Как применяется в настоящей заявке, термины «субъект» и «пациент» применяются взаимозаменяемо. Как применяется в настоящей заявке, термины «субъект» и «субъекты» относятся к животному, например млекопитающему, включая не-приматов (например, корову, свинью, лошадь, осла, козу, верблюда, кошку, собаку, морскую свинку, крысу, мышь, овцу) и приматов (например, макаку, такую как яванская макака, гориллу, шимпанзе, и человека). «Пациент» предпочтительно означает человека. Указанный пациент может быть пожилым пациентом, взрослым, подростком и ребенком любого возраста, например, ребенком в возрастном диапазоне от 2 лет до менее чем 12 лет, подростком в возрастном диапазоне от 12 лет до менее 18 лет, взрослым в диапазоне от 18 до менее 65, и пожилым от 65 лет и старше.
Не ограничивающие примеры vWF-зависимых заболеваний, которые можно лечить, включают, например, острый коронарный синдром (ОКС), транзиентную церебральную ишемическую атаку, нестабильную или стабильную стенокардию, инсульт, инфаркт миокарда, тромботическую тромбоцитопеническую пурпуру (ТТП) и синдром Апшо-Шульмана, предпочтительно ТТП, но не ограничивается ими.
Процедуры ПО для лечения или профилактики vWF-зависимого заболевания, например, такого как ТТП, описаны в «Указаниях по диагностике и контролю ТТП и других тромботических микроангиопатий» (Scully et al. 2012 supra), которые явно включены в настоящую заявку посредством ссылки. Полная ремиссия определяется как нормальное число тромбоцитов, т.е. > 150,000/мкл, и при необходимости отсутствие обострений (см. Scully et al. 2012, supra).
Как применяется в настоящей заявке, «время до ответа» является временем между первым лечением пациента с острым эпизодом ТТП и достижением числа тромбоцитов > 150,000/мкл, при котором первое лечение является ПО или применением полипептида из настоящего изобретения, или тем и другим, что бы не применяли первым.
Термин «плазмообмен» («ПО») означает терапевтическую процедуру, используемую для лечения различных заболеваний, включая ТТП, посредством объемного удаления плазмы, т.е. процедуру, при которой удаляют большой объем плазмы, обычно 1,5-объемов плазмы, которую заменяют замещающей жидкостью (Winters 2012 Hematology ASH Education Book 1:7-12). Посредством объемного удаления и замены плазмы, ПО удаляет патологические вещества, такие как аутоантитела против ADAMTS13 и ULvWF, но также некоторые тромбоциты. Плазму используют в качестве замещающей жидкости для замены ADAMTS13 при лечении тромботической тромбоцитопенической пурпуры (McLeod Best Pract Res Clin Haematol. 2006; 19:157-167). Объемное удаление и замена плазмы также осложняет лабораторный анализ, затрудняя тестирование пациента.
Поскольку ПО включает объемное удаление плазмы, нужно устранить любую циркуляцию плазмы. Следовательно, эта процедура является неизбирательной, удаляющей как нормальные, так и патологические компоненты плазмы, а также любые медикаменты для лечения ТТП, применяемые до ПО.
Специалисту в данной области техники хорошо знакомо определение числа тромбоцитов. Число тромбоцитов можно определить любым способом, известным в данной области техники, таким как вручную, с применением гемоцитометра, или с автоматизированного анализатора, например, электронным счетчиком. Количество можно также определить при оценке мазка крови. В микроскопическом методе применяется фазово-контрастный микроскоп для анализа крови на слайде гемоцитометра. Электронный подсчет тромбоцитов является наиболее распространенным способом. Имеется два типа электронных счетчиков, системы напряжения-импульса и электрооптического подсчета. Например, гематологический анализатор ADVIA можно применять для определения количества тромбоцитов и проверки полученного числа путем установления количества в мазке крови, окрашенном по Райту. ADVIA измеряет тромбоциты посредством проточной цитометрии на основе принципов светорассеяния. Например, тромбоциты идентифицируют по их размеру (< 30 FL, светорассеяние с малым углом) и коэффициенту преломления (от n = 1,35 до n = 1,40 или светорассеяние с большим углом).
У различных пациентов с острым эпизодом ТТП полипептид из настоящего изобретения, включающий по меньшей мере один ISVD против vWF, например, ALX 0081, применяли после проведения у указанного пациента ПО («предшествующего ПО», ПО, предшествующего применению первой дозы полипептида из настоящего изобретения). Наблюдалось, что в группе индивидуумов, получавших предшествующий ПО (также указанный как «один ПО перед рандомизацией»), медиана времени до ответа неожиданно снизилась на 2 дня от 4,31 суток в группе плацебо до 2,44 суток в группе лечения: 43% снижение (таблица 5; ПО перед рандомизацией = ДА).
Соответственно, настоящее изобретение относится к проведению ПО (предшествующего ПО) у пациента, нуждающегося в этом, например, пациента с острым эпизодом ТТП, сопровождающемуся следующим ПО в пределах 24 ч от указанного предшествующего ПО, и введению полипептида из настоящего изобретения («первой дозы» примерно за 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин, или даже 5 мин до начала указанного следующего ПО, такого времени, как от 6 ч до 15 мин перед началом указанного следующего ПО («первого ПО»). В настоящем изобретении термин «первая доза» означает первое введение полипептида из настоящего изобретения у пациента, нуждающегося в этом, например, после острого эпизода или каждого острого эпизода ТТП.
В настоящем изобретении введение полипептида из настоящего изобретения у пациента, предпочтительно, первой дозы, сопровождается ПО в пределах от 5 мин до 8 ч, такого времени, как от 10 мин до 6 ч или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин. 20 мин, 15 мин, 10 мин или даже 5 мин.
В настоящем изобретении термин «первый ПО» означает первый ПО, проводимый после (или в некоторых случаях одновременно) введения пациенту первой дозы полипептида из настоящего изобретения.
Полипептид из настоящего изобретения можно вводить или использовать для введения в форме жидкого раствора (например, растворов для инъекций и инфузий). Такие композиции можно вводить парентеральным способом (например, посредством подкожной, интраперитонеальной или внутримышечной инъекции), или путем ингаляции. Выражения «парентеральное введение» и «введенный парентерально», как используется в настоящей заявке, означают способы введения, иные, чем энтеральное и местное применение, обычно путем инъекции, и включают подкожное (п.к.) или внутримышечное введение, а также внутривенное (в.в.), интракапсулярное, интраорбитальное, интракардиальное, интардермальное, интраперитонеальное, транстрахеальное, субкутикулярное, субкапсулярное, субарахноидальное, интраспинальное, эпидуральное и интрастернальное введение и вливание. Предпочтительно, вторую или дальнейшую дозу полипептидов из настоящего изобретения, описанных в настоящей заявке, вводят подкожно.
Предпочтительно, введение первой дозы полипептида из настоящего изобретения при остром эпизоде ТТП осуществляют путем внутривенной болюсной инъекции, например, доставки полипептида через внутривенный катетер, вводимого всего сразу, в течение периода одной или двух минут. Еще более предпочтительно, введение первой дозы полипептида из настоящего изобретения при остром эпизоде ТТП осуществляют внутривенным струйным введением, например, доставкой полипептида через внутривенный катетер, с введением всего сразу, в течение периода примерно 30 секунд или меньше.
Неожиданно было установлено, что полипептиды из настоящего изобретения, вводимые до ПО (даже без предшествующего ПО), во время которого нет прямой фармакологической нацеленности на активный процесс ULvWF-опосредованной агрегации тромбоцитов, и можно ожидать, что указанный ПО удалит полипептид, все еще были способны к снижению медианы времени до ответа с неожиданно большим уменьшением на 2 дня от 4,92 суток в группе плацебо до 3,00 суток в группе каплацизумаба: 39% снижение (таблица 5: ПО перед рандомизацией = НЕТ).
Авторы настоящего изобретения считают, что полипептид из настоящего изобретения безопасен при применении, как было показано в предыдущих исследованиях на здоровых добровольцах и в настоящем исследовании на пациентах с ТПП (см. Пример 5.3), и что ТТП может плохо поддаваться диагностике, особенно острые приступы ТТП, и что любое время, потерянное до начала лечения, приводит к неблагоприятным последствиям; следовательно, что полезно начинать своевременное лечение полипептидом из настоящего изобретения, даже до поступления пациента в больницу, например, в машине скорой помощи. Предпочтительно, полипептид из настоящего изобретения, такой как ALX 081, вводят путем внутривенной струйной инъекции, поскольку это легко можно выполнить вне больницы, таким образом, экономя ценное время.
Соответственно, настоящее изобретение относится к введению пациенту, нуждающемуся в этом, например, такого как пациент с острым эпизодом (острыми приступами) ТТП, полипептида из настоящего изобретения примерно за 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин или даже 5 мин до начала ПО, такого времени, как от 6 ч до 15 мин до начала ПО («первой дозы»).
В одном варианте осуществления введение первой дозы полипептида из настоящего изобретения при остром эпизоде ТТП сопровождается ПО («первым ПО»). Этот первый ПО, предваряемый предшествующим ПО или нет, сопровождается введением второй или дальнейшей дозы полипептида из настоящего изобретения («второй дозы» или «дальнейшей дозы»). Предпочтительно, вторую дозу или дальнейшую дозу вводят в пределах 120, 90 или 60 минут, такого времени, как в пределах 1-60 мин, например, в пределах 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 4, 3, 2 или даже 1 мин после первого ПО. В некоторых случаях может быть предпочтительно вводить вторую или дальнейшую дозу вместе или одновременно с замещающей жидкостью, например, плазмой при ПО.
В дополнительных вариантах осуществления первая доза, вторая доза или дальнейшая доза полипептида из настоящего изобретения составляет примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35 или 40, 50, 60, 70 или 80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг, которую можно вводить пациенту, нуждающегося в этом, предпочтительно в сутки. Для введения молодым пациентам, например, таких как дети и подростки, дозу можно регулировать по массе тела пациента. В частных вариантах осуществления доза составляет примерно 0,01; 0,025; 0,05; 0,075; 0,1; 0,12; 0,14; 0,15; 0,16; 0,18; 0,2; 0,22; 0,24 или 0,25 мг/кг, предпочтительно 0,143 мг/кг, что соответствует дозе 10 мг на взрослого с массой тела 70 кг.
В одном варианте осуществления настоящее изобретение относится к применению примерно от 5 до 40 мг, предпочтительно 10 мг полипептида из настоящего изобретения, например, ALX 0081, в пределах 1-60 мин после процедуры ПО, например, первого ПО, второго ПО или дальнейшего ПО.
В одном варианте осуществления полипептид из настоящего изобретения, например, ALX 0081, применяют один раз в день или два раза в день у больного ТТП, нуждающегося в лечении, предпочтительно, пациента с количеством тромбоцитов ниже 100,000/мкл плазмы и/или пациента с активностью ADAMTS13 < 10%, такой как < 5%.
В другом варианте осуществления больного ТТП, нуждающегося в лечении, лечат:
(i) ПО; и
(ii) дозой 5-40 мг, предпочтительно 10 мг указанного полипептида спустя 60 мин - 1 мин после указанного этапа (i),
где этап (i) и этап (ii) повторяют один или два раза в сутки, до тех пор пока количество тромбоцитов у указанного пациента не составит по меньшей мере 50,000/мкл плазмы, такое значение, как 75,000, 100,000, 125,000 или даже 150,000 на мкл плазмы.
В некоторых случаях может быть предпочтительно повторить этап (i) и этап (ii) в течение минимум двух дней после полной ремиссии (количество тромбоцитов >150,000/мкл плазмы).
В одном варианте осуществления 5-40 мг полипептида из настоящего изобретения применяют один или два раза в день в течение по меньшей мере 5, 10, 15, 20, 25, 30, 60, 90 или даже 120 дней после того, как количество тромбоцитов у указанного пациента достигает >150,000/мкл плазмы, в частности, когда активность ADAMTS13 у указанного пациента составит < 10%, такое количество, как < 5%, или после последнего ПО.
При оценке данных в соответствии со стратификацией (1 ПО перед рандомизацией: ДА и НЕТ), общее отношение рисков для общей популяции составляет 2,197 со значением р=0,013. Это отношение рисков означает, что в любое время индивидуумы, получающие полипептид из настоящего изобретения, в два раза быстрее достигают первичной конечной точки подтвержденного восстановления тромбоцитов, по сравнению с субъектами, получающими плацебо. Кроме того, это восстановление тромбоцитов достигается на 2 дня быстрее в группе лечения.
Следовательно, применение полипептидов, включающих по меньшей мере один ISVD против vWF, такой как ALX 0081, у людей, больных ТТП, после острого эпизода ТТП обеспечивает неожиданное снижение времени до ответа, независимо от порядка применения указанного полипептида и указанного ПО, например, где ПО выполняют до или после применения первой дозы полипептида из настоящего изобретения.
Кроме того, было неожиданно установлено, что число ухудшений снизилось от 11 в группе плацебо до 3 в группе, принимавшей каплацизумаб. Следовательно, в группе плацебо было в 3 раза больше ухудшений (т.е. у больных ТТП, получавших ПО и плацебо вместо полипептида из настоящего изобретения), по сравнению с группой лечения (т.е. с больными ТТП, получавшими ПО и полипептид из настоящего изобретения; также указанными как группа каплацизумаба). Термин «обострение», как применяется в настоящей заявке, означает рецидивирующую тромбоцитопению после подтвержденного ответа тромбоцитов, и требует повторного начала лечения ПО спустя ≥ 1 дня но ≤ 30 дней после последнего ПО.
Это указывает, что полипептид из настоящего изобретения, такой как ALX 0081, может быть единственным, ответственным за лечение и/или облегчение (симптомов) ТТП.
Соответственно, настоящее изобретение относится к полипептиду, включающему по меньшей мере один ISVD против vWF, такой как ALX 0081, для применения в лечении vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в лечении, путем применения у человека дозы 1-80 мг или 5-40 мг, такой как 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно, 10 мг указанного полипептида.
На основе этого неожиданного наблюдения авторами настоящего изобретения был разработан дополнительно оптимизированный протокол лечения, по существу на основе предположения, что распределение времени подтвержденного ответа тромбоцитов короче и не наклоняется и не сдвигается вправо (к более продолжительному времени до ответа) в группе, получавшей каплацизумаб, по сравнению с группой плацебо. В дополнительно оптимизированном протоколе лечения всех индивидуумов лечили с фиксированными периодом лечения ПО, который был установлен 3-5 дней, в течение такого времени, как 3 дня, или 4 дня, или 5 дней, предпочтительно 3 дней. В этом случае период лечения ПО может быть независимым от восстановления тромбоцитов (> 150,000/мкл). В дополнительно оптимизированном протоколе лечения снижается нагрузка на пациента и затраты.
Соответственно, настоящее изобретение относится к полипептиду, включающему по меньшей мере один ISVD против vWF, такому как ALX 0081, для применения в лечении vWF-зависимого заболевания у человека, нуждающегося в лечении, включающем: (i) выполнение ПО; и (ii) применение дозы 5-40 мг, такой как 10 мг полипептида из настоящего изобретения спустя 15 мин - 4 ч после указанного ПО на этапе (i), где этап (i) и этап (ii) повторяют один раз в день в течение 3-5 дней, такого времени, как 3 дня, 4 дня или 5 дней, предпочтительно, 3 дней; с последующим дополнительным применением один раз в сутки дозы 5-40 мг, такой как 10 мг указанного полипептида в течение по меньшей мере 10 дней, такого времени, как по меньшей мере 20 дней или по меньшей мере 30 дней, и/или в течение по меньшей мере 10 дней, такого как по меньшей мере 20 дней или по меньшей мере 30 дней после того, как количество тромбоцитов у указанного пациента составит в первый раз >150,000/мкл.
В настоящем изобретении в течение одного года пациентов с ТТП наблюдали для контроля ремиссии. Термин «ремиссия», как применяется в настоящей заявке, означает подтвержденный ответ тромбоцитов и отсутствие обострений. Термин «подтвержденный ответ тромбоцитов», как применяется в настоящей заявке, означает время до ответа на лечение, определяемое по восстановлению тромбоцитов до ≥ 150,000/мкл, где ответ должен быть подтвержден спустя 48 часов после исходного определения восстановления тромбоцитов выше 150,000/мкл путем измерения тромбоцитов de novo ≥ 150,000/мкл, и предпочтительно, ЛДГ≤ 2 X ULN.
Как продемонстрировано в настоящей заявке (Пример 5.5; таблица 8), в целом у 29 пациентов в группе лечения отмечалась ремиссия, по сравнению с 18 пациентами в группе плацебо. Следовательно, в группе лечения было в 1,6 раз больше индивидуумов с полной ремиссией, по сравнению с группой плацебо.
Как отмечалось выше, количество тромбоцитов является основной мерой для оценки ремиссии. Определение активности ADAMTS13 у пациентов с наличием классической ТТП является важным, поскольку было показано, что низкие уровни прогнозируют рецидив. Однако в настоящее время неясно (и данные являются противоречивыми), действительно ли титр ингибирующих антител к ADAMTS13 является значимым, т.е. действительно ли у индивидуумов с высоким титром антител против ADAMTS13 с большей вероятностью развивается рецидив, чем у индивидуумов с низкими титрами. Специалисту в данной области техники понятно, что современные тесты ADAMTS13 проводятся в стационарных условиях, и не всегда точно отражают физиологические изменения, происходящие in vivo (http://practical-haemostasis.com/Miscellaneous/Miscellaneous%20Tests/adamts13_assays.html).
Авторы настоящего изобретения неожиданно наблюдали, что ремиссия была более выраженной в подгруппе индивидуумов с низкой базовой активностью ADAMTS13 (т.е. меньше 10%, такой как меньше 5%), в начале лечения, т.е. применения первой дозы полипептида из настоящего изобретения, такого как ALX 0081 (см. Пример 5.8).
Соответственно, настоящее изобретение относится к полипептиду, включающему по меньшей мере один ISVD против vWF, для применения в лечении vWF-зависимого заболевания у человека, нуждающегося в лечении, путем применения у указанного человека первой дозы 1-40 мг, предпочтительно 10 мг указанного полипептида, до тех пор, пока количество тромбоцитов у указанного человека не составит >150000/мкл. В предпочтительно аспекте указанный человек имеет активность ADAMTS13 меньше 10%, такую как меньше 5%, при применении указанного полипептида.
В настоящем исследовании в течение одного года пациентов с ТТП наблюдали для контроля рецидивов. Термин «рецидив», как применяется в настоящей заявке, означает развитие приступа ТТП de novo позднее 30 дней после последнего ежедневного ПО, например, спустя 0-2 дня после того, как у пациента с ТТП будет продемонстрирована полная ремиссия. Дата «позднее 30 дней» совпадает с последним применением полипептида из настоящего изобретения в настоящем исследовании.
Хотя полипептид из настоящего изобретения больше не применяли, было установлено, что число рецидивов в группе каплацизумаба было равно числу рецидивов в группе плацебо (см. таблицу 7, в Примере 5.4).
Авторы настоящего изобретения наблюдали, что в обеих анализируемых группах рецидивы были более выраженными у пациентов с базовой активностью ADAMTS13 <10%, такой как < 5%, даже хотя активность ADAMTS13 была доступна только в подгруппе пациентов. Авторы изобретения предположили (не углубляясь в теорию), что это может указывать, что пациенты с базовой активностью ADAMTS13 <10%, такой как < 5%, более склонны к рецидивам (или ухудшениям) при прекращении применения полипептида из настоящего изобретения, такого как ALX 0081.
В частности, данные поддерживают применение активности ADAMTS13 в качестве прогностического маркера для рецидивов ТТП и её потенциал для определения лечения. Активность ADAMTS13 может прогнозировать рецидивы, развивающиеся вскоре после прекращения лечения каплацизумабом. Эти рецидивы считаются рецидивами имеющегося эпизода ТТП (неразрешенной патологической активности, на основе неизменно низкой активности ADAMTS13). 30-дневный период лечения (после ПО) каплацизумабом показано существенное влияние на число обострений. Следовательно, продление периода лечения каплацизумабом для пациентов с риском рецидива (т.е. с фоновой патологической активностью на основе активности ADAMTS13) будет поддерживать защитные эффекты каплацизумаба до тех пор, пока основное заболевание не будет адекватно вылечено и разрешено. Наоборот, предварительное лечение каплацизумабом снизит риск нового острого эпизода ТТП.
Следовательно, лечение полипептидом из настоящего изобретения, таким как ALX 0081, нужно продолжать в течение более продолжительных периодов, по сравнению с пациентами с более высокой активностью. Полипептид из настоящего изобретения нужно применять у пациента с ТТП для снижения риска и/или профилактики вероятности рецидива(ов), пока активность ADAMTS13 не составит по меньшей мере 10%, такое значение, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 40%, 45%, или даже 50%, по сравнению с нормальной или стандартной активности.
Соответственно, настоящее изобретение относится к полипептиду, включающему по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF) для применения с целью снижения риска и/или для профилактики острого эпизода vWF-зависимого заболевания, например, ТТП, у человека, нуждающегося в лечении, включая этап (i) применения у указанного человека дозы 5-40 мг, предпочтительно 10 мг указанного полипептида. Предпочтительно, указанный риск снижается по меньшей мере 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или даже в 20, 50 или даже 100 раз. Предпочтительно, указанный риск снижается на 10% или даже больше, например, 20%, 30%, 40%, 50%, 60% или больше, на такой уровень, как 80% или даже 100%.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где указанный этап (i) применения полипептида из изобретения повторяют по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз, или даже более 10 раз, например, 20 раз, предпочтительно больше 30 раз или даже больше.
Способ по п. 1, где указанный этап (i) применения у указанного человека указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или даже 10 дней, или даже более 10 дней, такого времени, так 20 дней, предпочтительно больше 30 дней, такого, как 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев или еще больше.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где указанную дозу применяют один раз в день или два раза в день.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, дополнительно включая:
(ii) измерение активности ADAMTS13 у указанного пациента;
(iii) сравнение указанной активности ADAMTS13 со стандартной активностью ADAMTS13; и
(iv) если указанная активность ADAMTS13 ниже 30%, такая как 20%, 15%, 10% или 5% от указанной стандартной активности ADAMTS13, повторение указанного этапа (i) применения у указанного человека указанного полипептида.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где указанную активность ADAMTS13 у указанного пациента измеряют каждый день, или каждый 2, 3, 4, 5, 6, 7, 8, 9 или 10 день, предпочтительно, по меньшей мере один раз каждую неделю.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где этап (i) повторяют до тех пор, пока указанная активность ADAMTS13 не составит по меньшей мере 5%, 10%, 15%, такое значение, как 20%, или даже 30% или выше от указанной стандартной активности ADAMTS13.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где этап (i) применения у указанного человека указанного полипептида повторяют, пока указанная активность ADAMTS13 не составит по меньшей мере 5%, 10%, 15%, как 20% или 30% от указанной стандартной активности ADAMTS13 по меньшей мере в двух последовательных измерениях. Предпочтительно, указанные 2 последовательных измерения проводят с интервалом по меньшей мере 24 ч, более предпочтительно 48 ч, таким как по меньшей мере 3 дня, или еще больше, таким как 4, 5, 6 или даже 7 дней, предпочтительно 1 неделя.
Соответственно, настоящее изобретение относится к полипептиду, как описано в настоящей заявке, где указанный этап (i) применения у указанного человека указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, или даже больше 10 дней, такого времени, как 20 дней, предпочтительно больше 30 дней или еще больше, после того, как указанная активность ADAMTS13 составит по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, как по меньшей мере 20% или по меньшей мере 30% от указанной стандартной активности по меньшей мере в 2 последовательных измерениях.
Соответственно, настоящее изобретение относится к полипептиду, включающему по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF), для применения с целью снижения риска и/или для профилактики острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в лечении, включающего этап (i) применения у указанного человека дозы 5-40 мг. предпочтительно 10 мг указанного полипептида, дополнительно включающий:
- измерение активности ADAMTS13 у указанного пациента;
- сравнение указанной активности ADAMTS13 со стандартной активностью ADAMTS13; и
- если указанная активность ADAMTS13 составляет > 5%, как > 10%, или даже > 15%, или больше 20% или 30% от указанной стандартной активности ADAMTS13, повторение указанного этапа (i) в течение самое большее 30 дней, такого времени, как самое большее 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней или даже 1 дня.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF), для применения с целью снижения риска и/или для профилактики острого эпизода vWF-зависимого заболевания, такого как ТТП, у человека, нуждающегося в лечении, включающего по меньшей мере следующие этапы:
(i) измерение активности ADAMTS13 у указанного пациента;
(ii) сравнение указанной активности ADAMTS13 со стандартной активностью ADAMTS13; и
(iii) если указанная активность ADAMTS13 ниже 30%, 20%, 15%, 10% или 5% от указанной стандартной активности, то применение у указанного человека дозы 5-40 мг, предпочтительно 10 мг указанного полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF).
Как применяется в настоящей заявке, снижение риска или частоты включает снижение вероятности или частоты признака, симптома или результата vWF-зависимого заболевания, такого как ТТП, у индивидуума, по сравнению с соответствующей, т.е. не получающей лечения, стандартной популяцией, или тем же самым индивидуумом до лечения в соответствии с настоящим изобретением.
Признак, симптом или результат vWF-зависимого заболевания, такого как ТТП, как применяется в настоящей заявке, включает повреждение органов, ишемическое повреждение, образование микротромбов, обострение, ухудшение тяжести заболевания, рецидивы; один или несколько маркеров vWF-зависимого заболевания, такого как ТТП, включает количество тромбоцитов, тромбоцитопению, нейрокогнитивную функцию, уровни ADAMTS13 и титры анти-ADAMTS13 антител, уровни активности ADAMTS13, уровни сердечных маркеров (тропонина Т или тропонина I), BNP (мозгового натрийуретического пептида) или N-концевого про-мозгового натрийуретического пептида (NT proBNP), креатинина, и маркеров повреждения головного мозга (таких, как NSE (нейрон-специфическая энолаза) и Sβ100 (S100бета), предпочтительно, маркеров повреждения органов, такие как уровни ЛДГ, уровни тропонина Т и/или тропонина I, и/или уровни креатинина.
Снижение риска или частоты может включать замедление или профилактику развития признака, симптома или результата vWF-зависимого заболевания, такого как ТТП. Риск или частота могут также снижаться, если тяжесть признака, симптома или результата vWF-зависимого заболевания, такого как ТТП, снижается до такого уровня, который не является клинически значимым. Таким образом, признак, симптом или результат vWF-зависимого заболевания, такого как ТТП, может присутствовать, но на уровне, который не угрожает жизни, активности и/или самочувствию индивидуума. В некоторых случаях частота vWF-зависимого заболевания, такого как ТТП, снижается до такой степени, что у субъекта не отмечается каких-либо признаков vWF-зависимого заболевания, такого как ТТП, до и/или после периода лечения.
Необходимо понять, что ни одного фактического доказательства снижения риска для индивидуума не может быть получено, поскольку, если проведено лечение, нельзя сказать, мог бы возникнуть признак, симптом или результат vWF-зависимого заболевания, такого как ТТП, или мог развиться раньше, при отсутствии такого лечения. Таким образом, концепция риска и повышенный или сниженный риск относится только к статистическим величинам. Далее, снижение риска признака, симптома или результата vWF-зависимого заболевания, такого как ТТП, может быть отражено в снижении тяжести признака, симптома или результата vWF-зависимого заболевания, такого как ТТП, а также в отсутствии проявления или задержки проявления признака, симптома или результата vWF-зависимого заболевания, такого как ТТП.
Необходимо понять, что полипептид из настоящего изобретения снижает риск и/или предотвращает острый эпизод vWF-зависимого заболевания, такого как ТТП. Следовательно, признак, симптом или результат vWF-зависимого заболевания, такого как ТТП, также снижается. С учетом патофизиологии приобретенной ТТП, где нити ULvWF захватывают тромбоциты при образовании микротромбов, было сделано предположение, что восстановление количества тромбоцитов является косвенным показателем профилактики дальнейшего образования микротромбов. Тяжесть заболевания и острая смертность, связанная с приобретенной ТТП, является результатом этих микротромбов.
Действительно, этот вывод поддерживается нормализацией маркеров повреждения органов. В частности, результаты указывают, что маркеры повреждения органов, такие как тропонин I и Т, ЛДГ и креатинин, быстрее возвращаются к нормальному уровню у индивидуумов, получающих полипептид из настоящего изобретения, например, ALX 0081, чем у индивидуумов, получающих плацебо (см. Пример 5.7).
Следовательно, результаты позволяют предположить, что более быстрая нормализация этих маркеров повреждения органов связана с лучшим клиническим исходом, т.е. со снижением риска и меньшим повреждением органов из-за ишемии органов, вызванной микротромбами.
Соответственно, настоящее изобретение относится к способу, как описано в настоящей заявке, где:
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается на 10%, 20%, 30%, предпочтительно по меньшей мере на 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90% или даже на 100% (например, до отсутствия повреждения органов, ишемического повреждения и/или образования микротромбов из-за vWF-зависимого заболевания);
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или 10 раз, или еще больше, так как в 20, 50 или даже 100 раз;
- повреждение органов, ишемическое повреждение и/или образование микротромбов снижается предпочтительно по меньшей мере на 10%, 20%, 30%, 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90% или даже на 100%;
- повреждение органов, ишемическое повреждение и/или образование микротромбов снижается в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или 10 раз, или еще больше, так как в 20, 50 или даже 100 раз;
- маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, возвращаются по меньшей мере к 40%, или даже по меньшей мере к 50%. такому уровню, как 60%, 70%, 80%, 90% или даже 100% от нормальных уровней;
- маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, улучшаются по меньшей мере на 20%, так как на 30% или еще выше, так как на 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90% или даже до 100% от нормальных уровней. Предпочтительно, указанные маркеры повреждения органов, такие как уровни ЛДГ, уровни тропонина Т, тропонина I и/или уровни креатинина, улучшаются меньше чем за 30 дней лечения, предпочтительно меньше чем за 20 дней лечения, такое время, как меньше 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней, или даже за 1 день.
- количество тромбоцитов сохраняется > 150000/мкл;
- время до нормализации тромбоцитов (> 150000/мкл) снижается по меньшей мере на 10%, 20%, 30%, 35%, 39%, предпочтительно по меньшей мере на 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%;
- риск ухудшений снижается по меньшей мере на 10%, 20%, 30%, 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90%, или даже на 100%;
- риск ухудшений снижается в 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или даже в 10 раз, или еще больше, так как в 20, 50 или даже 100 раз;
- смертность из-за указанного vWF-зависимого заболевания снижается на 10%, 20%. 30%, предпочтительно по меньшей мере на 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90% или даже на 100%;
- смертность из-за указанного vWF-зависимого заболевания снижается в 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или даже 10 раз, или еще больше, так как в 20, 50 или даже 100 раз; и/или
- ремиссия повышается в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или 10 раз, или еще больше, так как в 20, 50 или даже 100 раз.
Термин «стандартная активность», как применяется в настоящей заявке, относится к средней активности ADAMTS13 у 5 здоровых индивидуумов в проводимом анализе, которая установлена равной 100%. Например, в анализе FRETS-vWF73 создают калибровочную кривую с применением пула нормальной плазмы человека, в которой рассчитывают тангенс угла наклона кривой регрессии для каждого калибровочного образца, и используют для создания калибровочной кривой (линия тренда: y = ax + b; где x = ADAMTS13 (%), а y = дельта RFU/ дельта времени). Активность ADAMTS13 (%) образца затем рассчитывают как: y - b) x 1/a. Действительно, в целом у пациентов с рецидивами отмечается более низкая активность ADAMTS13, чем у пациентов без рецидивов.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или для профилактики ишемического повреждения, повреждения органов и/или образования микротромбов, например, вызванного vWF-зависимым заболеванием, таким как ТТП, у человека, нуждающегося в лечении, включающем по меньшей мере следующий этап (i) применения у указанного человека дозы 5-40 мг/сутки, предпочтительно 10 мг/сутки полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF); где применение указанного полипептида снижает риск и/или предотвращает ишемическое повреждение, повреждение органов и/или образование микротромбов по меньшей мере на 10%, 20%, 30%, предпочтительно, по меньшей мере на 40%, или даже по меньшей мере на 50%, так как на 60%, 70%, 80%, 90% или даже на 100%. Предпочтительно, применение указанного полипептида снижает риск и/или предотвращает ишемическое повреждение, повреждение органов и/или образование микротромбов в 1,2; 1,3; 1,4; 1,5; 1,6; 1,75; 1,8; 2 раза или больше, так как в 3, 4, 5, 6, 7, 8, 9 или 10 раз, или еще больше, так как в 20, 50 или даже 100 раз.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или для профилактики ишемического повреждения, повреждения органов и/или образования микротромбов, как описано в настоящей заявке, где указанный этап (i) применения указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней, или даже дольше, такого времени, как 1 неделя, 2 недели, 3 недели или даже дольше, такого времени, как 1 месяц или даже 2 месяца.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или профилактики ишемического повреждения, повреждения органов, и/или образования микротромбов, как описано в настоящей заявке, которые дополнительно включают измерение активности ADAMTS13 у указанного пациента, предпочтительно один раз в неделю.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или профилактики ишемического повреждения, повреждения органов, и/или образования микротромбов, как описано в настоящей заявке, где указанный этап (i) применения указанного полипептида повторяют в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней, или еще дольше, такого времени, как 1 неделя, 2 недели, 3 недели или еще дольше, такого времени, как 1 месяц или даже 2 месяца, где активность ADAMTS13 составляет (вначале) > 5%, как > 10%, или даже > 15% от стандартной активности ADAMTS13.
Соответственно, настоящее изобретение относится к полипептиду из настоящего изобретения для лечения симптома vWF-зависимого заболевания, такого как ТТП, у человека, страдающего указанным заболеванием, включающего применение у индивидуума полипептида из настоящего изобретения в количестве, эффективном для лечения симптома vWF-зависимого у человека, страдающего указанным заболеванием.
Соответственно, настоящее изобретение относится к полипептиду из настоящего изобретения для ингибирования у человека возникновения или прогрессирования vWF-зависимого заболевания, такого как ТТП, ингибирование которого осуществляют путем связывания полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (vWF), с vWF, включая применение у человека с предварительно определенным интервалом эффективных ингибирующих доз указанного полипептида, где каждое применение антитела доставляет человеку от 0,1 мг/кг до 25 мг/кг массы тела человека, так чтобы ингибировать возникновение или прогрессирование заболевания у человека.
Соответственно, настоящее изобретение относится к полипептиду для снижения вероятности развития у человека ишемического повреждения органов при vWF-зависимом заболевании, которое включает применение у человека предварительно определенной дозы полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда ( vWF), где каждое применение антитела доставляет человеку от 0,1 мг/кг до 25 мг/кг массы тела человека, так чтобы снизить вероятность развития у человека ишемического повреждения органов.
Моделирование на основе этих результатов показывает, что продолжение применения полипептидов в течение длительного времени в соответствии с настоящим изобретением является эффективным для профилактики острых эпизодов. Этот предпочтительный профиль приводит к снижению угрозы для здоровья. Следовательно, можно сделать вывод, что полипептид из настоящего изобретения предотвращает рецидивы.
Соответственно, настоящее изобретение относится к применению полипептида из настоящего изобретения каждые 1, 2, 3, 4, 5, 6, 7 дней, или даже 2, 4, 6 или 8 недель в дозах в диапазоне 1-80 мг, таком как 5-40 мг, предпочтительно для профилактики острых эпизодов ТТП. Особенно эффективными являются дозы 10-20 мг. В частных вариантах осуществления доза включает примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно 10 мг полипептида, включающего по меньшей мере один ISVD против vWF, такой как ALX 0081.
В одном варианте осуществления настоящее изобретение относится к способу профилактики рецидива у больного ТТП, включающему:
(1) измерение активности ADAMTS13 у больного ТТП посредством такого анализа, как прямой или непрямой анализ;
(2) сравнение указанной активности с этапа (1) со стандартным значением (нормальным значением); и
(3) если активность ADAMTS13 с этапа (1) меньше 15%, такая, как меньше 10% или меньше 5% от стандартного значения, применение полипептида из настоящего изобретения, например, ALX 0081,
таким образом, предотвращая рецидив.
Предварительные результаты позволили предположить, что применение первой дозы полипептида из настоящего изобретения перед первым ПО уже приводит к повышению количества тромбоцитов.
Соответственно, настоящее изобретение относится к применению полипептида из настоящего изобретения у пациента, нуждающегося в лечении, например, такого как пациент с острым эпизодом ТТП, в дозе примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно 10 мг полипептида; включающего по меньшей мере один ISVD против vWF, такой как ALX 0081.
Полипептиды из настоящего изобретения, включающие по меньшей мере один ISVD против vWF, например, ALX 0081, можно применять у индивидуума (например, человеческого индивидуума) по отдельности или в комбинации со вторым агентом, например вторым терапевтически или фармакологически активным агентом, для лечения или профилактики (например, снижения или облегчения одного или нескольких связанных симптомов) vWF-зависимого заболевания, например, ТТП.
Не ограничивающие примеры агентов, которые можно совместно применять с полипептидами из настоящего изобретения, включающими по меньшей мере один ISVD против vWF, например, ALX 0081, включают, например, дополнительное иммуносупрессивное лечение (например, кортикостероиды, такие как (метил)преднизолон или (метил)-преднизон; или ритуксимаб), антитромбоцитарные агенты (например, аспирин), поддерживающую терапию с переливанием эритроцитов или дополнительным применением фолата, лечение винкристином или циклоспорином, анти-ауто-ADAMTS13 антитела, или ADAMTS13. Такое комбинированное лечение может предпочтительно применять низкие дозы терапевтических агентов, таким образом, устраняя возможную токсичность или обострения, связанные с различными монотерапиями.
В одном варианте осуществления настоящее изобретение относится к комбинированной терапии полипептидом из настоящего изобретения вместе с иммуносупрессивным лечением, в частности, ритуксимабом, который эффективно предотвращает рецидивы у больных ТТП. Предпочтительно, комбинированную терапию проводят до тех пор, пока активность ADAMTS13 не достигнет по меньшей мере >5%, такой как >10%, >15%, >20%, 25%, 30%, 35%, 40%, 45%, или даже нормализуется до такого уровня, как >50% от нормальной активности.
ТТП является диагнозом на основе клинической истории, обследования пациента и анализа мазка крови. Анализ ADAMTS13 позволяет подтвердить диагноз и контролировать течение заболевания и возможную потребность в дополнительном лечении. Острые эпизоды ТТП можно диагностировать в соответствии с таблицей 1 и руководствами, например, Scully et al. (2012 supra).
Таблица 1. Клинические характеристики и признаки острого эпизода ТТП.
Эффективность любого конкретного полипептида из настоящего изобретения или режима дозирования можно определить посредством способов, доступных для специалиста в данной области техники. Вкратце, при клинических испытаниях пациентов может наблюдать медицинский персонал, и патологическое состояние оценивается посредством любой комбинации критериев. Улучшение состояния пациента определяют на основе этих критериев во множестве моментов времени, и комбинацию этих определений в популяции пациентов строят в виде графика для оценки эффективности лечения.
В примерных вариантах осуществления оценку эффективности лечения можно определить путем анализа любого или всех из критериев, указанных ниже:
- Время до ответа на лечение, определенное по восстановлению тромбоцитов ≥ 150,000/мкл. Этот ответ должен быть подтвержден спустя 48 часов после исходного доказательства восстановления тромбоцитов выше 150,000/мкл путем определения тромбоцитов de novo ≥ 150,000/мкл, и предпочтительно, по ЛДГ ≤ 2 X ВГН.
- Число индивидуумов с полной ремиссией.
- Число (индивидуумов) обострений ТТП и время до первого обострения ТТП. Обострение определяется как рецидивирующая тромбоцитопения после ответа, требующая повторного начала ежедневного лечения ПО после ≥ 1 дня но ≤ 30 дней после последнего ежедневного ПО.
Число субъектов с рецидивом ТТП (определенным как новый приступ ТТП, развивающийся спустя более 30 дней после последнего ежедневного ПО) в течение максимум одного года, и время до первого рецидива ТТП.
- Ежедневные данные ПО, включающие тяжелые побочные реакции (ТПР), связанные с ежедневным лечением ПО.
- Нейрокогнитивная функция, определяемая по набору нейрокогнитивных тестов, при полной ремиссии и в течение 1 последующего года. Перед этим тестом проводят анализ по шкале комы Глазго для определения состояния сознания индивидуума.
- Облегчение дисфункции органов и улучшение связанных с ТТП признаков и симптомов.
- Общая смертность в пределах периода ежедневного лечения ПО и в пределах последующего периода лечения исследуемым лекарством (включая постепенное снижение дозы).
- Определение биомаркеров ТТП, включая уровни дезинтегрин-подобных и металлопротеаз с тромбоспондиновыми повторами 13 (ADAMTS13) и титры анти- ADAMTS13 антител.
Специалисту в данной области техники известно, как определить эффективность.
Например, активность ADAMTS13 можно оценить с применением электрофореза мультимеров vWF для детекции ультра-больших мультимеров, не расщепляемых протеазой (Moake et al. (1982) The New England journal of medicine 307, 1432-1435; Furlan, et al. (1997) Blood 89, 3097-3103 7, 8). Активность ADAMTS13 можно анализировать с применением FRETS-vWF73, фрагмента vWF, химически модифицированного для испускания флуоресценции при расщеплении ADAMTS13. В этом анализе FRETS-vWF73 добавляют в образец плазмы пациента, и определяют изменение флуоресценции в течение времени для определения активности ADAMTS13. Если присутствует ингибитор, он часто является нейтрализующим IgG антителом, направленным против ADAMTS13, которое можно определить посредством ELISA (Kokame et al. (2005) British journal of haematology 129, 93-100). Альтернативно или в дополнение, активность ADAMTS13 можно определить, как описано, например, в Vesely et al. (2003, supra), Fontana et al. (2004, supra) or Remuzzi et al. (Blood 2002; 100: 778-7852002). Например, непрямой анализ активности ADAMTS13 включает детекцию продуктов расщепления либо полноразмерной молекулы vWF, либо фрагмента vWF, которые охватывают участок расщепления ADAMTS13 в А2 домене vWF. (1). Анализы связывания коллагена. Нормальную плазму или очищенный vWF инкубируют с анализируемым образцом плазмы в присутствии BaCl2 и 1,5 М мочевины, которые денатурируют vWF. vWF расщепляют ADAMTS13, и оставшийся vWF определяют по его связыванию с коллагеном III типа. Связанный vWF количественно определяют с применением ИФА с конъюгированным анти-vWF антителом. (2) Ристоцетин-индуцированная агрегация. Этот тест подобен коллаген-связывающему анализу, описанному выше, но остаточный vWF определяют посредством индуцированной ристоцетином агрегации тромбоцитов с применением тромбоцитарного агрегометра. (3) Функциональный ELISA анализ. В этом анализе рекомбинантный фрагмент vWF иммобилизируют на планшете ELISA с применением антитела для добавления к vWF. Фрагмент vWF кодирует А2 домен и участок расщепления ADAMTS13 на Тир1605-Мет1606 и мечен S-трансферазой [GST]-гистидином [GST-VWF73-His]. Добавляют плазму к иммобилизированному фрагменту GST-VWF73-His, и расщепление иммобилизованного фрагмента происходит на ADAMTS13 участке расщепления. Остаточный, расщепленный фрагмент vWF определяют с применением второго моноклонального антитела, распознающего только расщепленный фрагмент vWF, но не взаимодействующий фрагмент. Таким образом, активность ADAMTS13 обратно пропорциональна концентрации остаточного субстрата. Этот метод является основой для ELISA анализа активности ADAMTS13 TECHNOZYM®.
Специалисту в данной области техники известно определение аутоантител против ADAMTS13, например, анти- ADAMTS13 можно определить посредством ELISA, такого как TECHNOZYM® ADAMTS13 INH ELISA (Technoclone).
Специалисту в данной области техники известно определение активности кофактора ристоцетина в человеческих образцах, например, кофактор ристоцетина можно определить посредством vW Select of Bio/Data corp. на агрегометре PAP-8E (Bio/Data corp.).
Специалисту в данной области техники известно определение фактора VIII в человеческих образцах, например, с применением Coamatic Factor VIII (Chromogenix) на анализаторе STA-R Еvolution (Diagnostica Stago).
Специалисту в данной области техники известно определение антигена фактора фон Виллебранда в человеческих образцах, например, с применением иммунотурбидиметрического анализа (например, с помощью STA Lia test vWF:Ag) на анализаторе STA-R Еvolution (Diagnostica Stago).
Специалисту в данной области техники известно определение уровней ЛДГ. Большинство способов основано на ферментативных анализах на основе лактат-дегидрогеназы на спектрофотометре. Подходящий обзор приведен в Medbø et al. (2000) «Examination of four different instruments for measuring blood lactate concentration». Scand J Clin Lab Invest 60:367-380 («Оценка четырех различных инструментов для определения концентрации лактат-дегидрогеназы в крови»). Разные компании предоставляют анализы, такие как Abnova (Кат.№ КА1653), которые измеряют катализ ЛДГ взаимного преобразования лактата и пирувата, т.е. не-радиоактивный колориметрический анализ ЛДГ на основе восстановления соли тетразолия МТТ в НАДН-зависимой ферментативной реакции до восстановленной формы МТТ, которая имеет максимум поглощения при 565 нм. Интенсивность образующейся фиолетовой окраски прямо пропорциональна ферментативной активности. Подобным образом, в наборе Sigma Aldrich (MAK066-1KT), ЛДГ восстанавливает НАД до НАДН, который специфически выявляется колориметрическим (450 нм) анализом. Нормальные значения приведены в таблице 1.1 ниже.
Специалисту в данной области техники известно определение тропонина I и Т. Как правило, тропонин Т и I определяют иммунологическими методами, которые доступны в виде множества различных платформ для иммуноанализа, например, PC Immulite, Abbott AxSYM, Bayer ACS:Centaur, Ortho Vitros, Roche Elecsys, третье поколение. Подходящий обзор приведен в Wu et al. (1999) «National Academy of Clinical Biochemistry Standards of Laboratory Practice: recommendations for the use of cardiac markers in coronary artery diseases». Clin Chem. Jul 1999;45(7):1104-21 («Национальная Академия клинической биохимии, правила лабораторной практики: рекомендации по применению сердечных маркеров при заболеваниях коронарных артерий»). Нормальные значения приведены в таблице 1.1 ниже.
Специалисту в данной области техники известно определение креатинина. Подходящий обзор приведен в Peake and Whiting «Measurement of Serum Creatinine - Current Status and Future Goals», Clin Biochem Rev. 2006 Nov; 27(4): 173-184 («Определение сывороточного креатинина - современный статус и будущие цели»). Например, уровни креатинина можно определить с помощью набора для анализа креатинина Abcam (ab65340) или BioVision. В этом анализе креатинин превращается креатин креатининазой, креатин превращается в саркозин, который специфически окисляется с получением продукта, реагирующего с зондом до образования красной окраски (λmax = 570 нм) и флуоресценции (Ex/Em = 538/587 нм). Нормальные значения приведены в таблице 1.1 ниже. Поскольку количество креатинина в крови возрастает с мышечной массой, у мужчин обычно более высокие уровни креатинина, чем у женщин.
Таблица 1.1. Нормальные значения.
Необходимо понять, что нормальные значения, приведенные в таблице 1.1, могут варьировать в разных лабораториях, между мужчинами и женщинами, и в зависимости от возраста. Тем не менее, специалисту в данной области техники понятно, что в зависимости от используемого анализа, нормальные значения, приведенные производителем, можно применять в качестве эталона, или альтернативно, нормальные значения, принятые врачами в специальных условиях.
Полипептиды из настоящего изобретения, как правило, содержат по меньшей мере один ISVD против vWF. Иммуноглобулиновые одиночные вариабельные домены из настоящего изобретения связываются и/или обладают аффинностью к vWF. В контексте настоящего изобретения « vWF» включает vWF яванских макак, павиана, свиньи, морской свинки, мыши и/или человека, и наиболее предпочтительно, vWF человека, т.е. SEQ ID NO: 20 или кода доступа GenBank: NP_000543.
Предпочтительно, ISVD против vWF по существу состоит из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно), где:
(а) CDR1 содержит или по существу состоит из:
- аминокислотной последовательности YNPMG; или
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью YNPMG; и
(b) CDR2 содержит или по существу состоит из:
- аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AISRTGGSTYYPDSVEG;
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AISRTGGSTYYPDSVEG; и
(с) CDR3 содержит или по существу состоит из:
- аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF; или
- аминокислотной последовательности, имеющей только 1 или 2 различия по аминокислотам с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF.
Еще более предпочтительно, ISVD против vWF по существу состоит из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно), где:
a) CDR1 является YNPMG (SEQ ID NO: 20);
b) CDR2 является AISRTGGSTYYPDSVEG (SEQ ID NO: 21); и
c) CDR3 является AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 22).
Еще более предпочтительно, ISVD против vWF представлен SEQ ID NO: 19 (12A02H1).
Предпочтительно, полипептиды из настоящего изобретения включают или состоят по меньшей мере из двух ISVD против vWF.
Еще более предпочтительно, полипептиды из настоящего изобретения включают или состоят из двух ISVD против vWF, определяемых SEQ ID NO 1-18, и наиболее предпочтительно SEQ ID NO: 1 (ALX 0081; INN Caplacizumab). ALX 0081 является двухвалентным нанотелом, состоящим из двух идентичных одновалентных стандартных блоков, нацеленных на vWF.
Полипептиды, содержащие по меньшей мере один ISVD против vWF, например, SEQ ID NO 1-19, могут применяться в лечении vWF-зависимого заболевания, в частности, тромботической тромбоцитопенической пурпуры (ТПП).
Термины «полипептид» и «аминокислотная последовательность» применяются взаимозаменяемо.
Так, например, подходящие полипептиды для применения в настоящем изобретении могут включать соединения из таблицы А-1, например, SEQ ID NO: 1-19 или 20-22, или соединение, имеющее 80% или больше, более предпочтительно 85% или больше, наиболее предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или больше, идентичность аминокислотной последовательности с соединением в таблице А-1 (см. в разделе «Определения» «идентичность последовательности»).
Предпочтительно, ISVD против vWF для применения в полипептидах из настоящего изобретения являются 12A02H1-подобными соединениями. Для целей настоящего описания, 12A02H1-подобное соединение является соединением, включающим 12A02H1 (т.е. SEQ ID NO: 19), или соединением, имеющим 80% или больше, более предпочтительно 85% или больше, наиболее предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или больше идентичности аминокислотной последовательности с 12A02H1 (SEQ ID NO: 19). Особо предпочтительным полипептидом, включающим два ISVD против vWF, является ALX 0081 (SEQ ID NO: 1).
Иммуноглобулиновые одиночные вариабельные домены, такие как верблюжьи VHH домены, камелизированные VH домены или гуманизированные VHH домены, представляют быстрорастущий класс терапевтических средств. Например, иммуноглобулиновые одиночные вариабельные домены против vWF были описаны в WO2004/015425 [P02-008], WO2004/062551 [P03-001], WO2006/074947 [P05-001], WO2006/122825 [P05-003], WO2009/115614 и [P08-013]иии WO2011/067160 [P09-024]. Другие предпочтительные иммуноглобулиновые одиночные вариабельные домены для применения в полипептидах из настоящего изобретения включают нанотела, описанные в WO06/122825.
Если не указано иное, термин «иммуноглобулиновая последовательность», используемый для обозначения тяжелоцепочечного антитела или обычного четырехцепочечного антитела, применяется в качестве общего термина для включения как полноразмерного антитела, его отдельных цепей, так и всех частей, доменов или фрагментов (включая антигенсвязывающие домены или фрагменты, такие как VHH домены или VH/VL домены, соответственно, но не ограничиваясь ими). Кроме того, термин «последовательность», как применяется в настоящей заявке (например, в таких терминах, как «иммуноглобулиновая последовательность», «последовательность антитела», «последовательность вариабельного домена», «VHH последовательность» или «белковая последовательность»), необходимо понимать, как включающий как соответствующую аминокислотную последовательность, так и нуклеиновокислотные или нуклеотидные последовательности, кодирующие её, если только в контексте не требуется более ограниченной интерпретации.
Термин «иммуноглобулиновый одиночный вариабельный домен» («ISVD»), взаимозаменяемо используемый с термином «одиночный вариабельный домен», означает молекулы, в которых антигенсвязывающий участок присутствует и образован одиночным иммуноглобулиновым доменом. Это отличает иммуноглобулиновые одиночные вариабельные домены от «обычных» иммуноглобулинов или их фрагментов, где два иммуноглобулиновых домена, в частности, два вариабельных домена, взаимодействуют с формированием антигенсвязывающего участка. Как правило, в обычных иммуноглобулинах вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) взаимодействуют с формированием антигенсвязывающего участка. В этом случае гипервариабельные области (CDR) VH и VL вносят вклад в образование антигенсвязывающего участка, т.е. всего 6 CDR вовлекается в образование антигенсвязывающего участка.
Напротив, участок связывания в иммуноглобулиновой одиночном вариабельном домене формируется одиночным VH или VL доменом. Следовательно, антигенсвязывающий участок на иммуноглобулиновом одиночном вариабельном домене образован не более чем тремя CDR.
Следовательно, термин «иммуноглобулиновый одиночный вариабельный домен» не включает обычные иммуноглобулины или их фрагменты, которые требуют взаимодействия по меньшей мере двух вариабельных доменов для формирования антигенсвязывающего участка. Это также относится к вариантам осуществления изобретения, которые «включают» или «содержат» иммуноглобулиновый одиночный вариабельный домен. В контексте настоящего изобретения такие варианты осуществления исключают обычные иммуноглобулины или их фрагменты. Таким образом, полипептид или композиция, «включающие» или «содержащие» иммуноглобулиновый одиночный вариабельный домен, могут относиться, например, к конструкциям, содержащим более одного иммуноглобулинового одиночного вариабельного домена. Альтернативно, могут быть дополнительные компоненты, иные, чем иммуноглобулиновые одиночные вариабельные домены, например, вспомогательные агенты различных видов, белковые метки, окрашивающие вещества, красители, и т.д. Однако эти термины включают фрагменты обычных иммуноглобулинов, в которых антигенсвязывающий участок образован одиночным вариабельным доменом.
Как правило, одиночные вариабельные домены являются аминокислотными последовательностями, которые по существу состоят из 4 каркасных областей (FR1-FR4, соответственно) и 3 гипервариабельных областей (CDR1-CDR3, соответственно). Такие одиночные вариабельные домены и фрагменты являются наиболее предпочтительными, поскольку они включают иммуноглобулиновую укладку цепи, или способны к формированию иммуноглобулиновой укладки цепи при подходящих условиях. Таким образом, одиночный вариабельный домен может, например, содержать последовательность вариабельного домена легкой цепи (например, VL-последовательность) или её подходящий фрагмент; или последовательность вариабельного домена тяжелой цепи (например, VН-последовательность или VНН-последовательность); или её подходящий фрагмент; с тем условием, что она способна к формированию одиночной антигенсвязывающей единицы (т.е. функциональной антигенсвязывающей единицы, которая по существу состоит из одиночного вариабельного домена, так что одиночный антигенсвязывающий домен не взаимодействует с другим вариабельным доменом для формирования функциональной антигенсвязывающей единицы, как, например, в случае вариабельных доменов, присутствующих, например, в обычных антителах и scFv фрагментах, необходимых для взаимодействия с другим вариабельным доменом - например, посредством взаимодействия VH/VL, для формирования функционального антигенсвязывающего домена).
В одном варианте осуществления настоящего изобретения иммуноглобулиновые одиночные вариабельные домены являются последовательностями вариабельных доменов легкой цепи (например, VL-последовательностью), или последовательностями вариабельного домена тяжелой цепи (например, VН-последовательностью); в частности, иммуноглобулиновые одиночные вариабельные домены могут быть последовательностями вариабельного домена тяжелой цепи, полученными из обычного четырехцепочечного антитела, или последовательностями вариабельного домена тяжелой цепи, антитела из тяжелой цепи (например, VHH).
Для общего описания тяжелоцепочечных антител и их вариабельных доменов, приводится ссылка, среди прочего, на предшествующий уровень техники, цитированный в настоящей заявке, а также на предшествующий уровень техники, упомянутый на странице 59 WO 08/020079, и на список ссылок, упомянутый на страницах 41-43 Международной заявки WO 06/040153, где предшествующий уровень техники и ссылки включены посредством ссылки. Как описано в этих ссылках, нанотела (в частности, VHH последовательности и частично гуманизированные антитела) могут быть, в частности, охарактеризованы по наличию одного или нескольких «характерных остатков»в одной или нескольких каркасных последовательностях. Подробное описание нанотел, включая гуманизацию и/или камелизацию нанотел, а также другие модификации. части фрагментов. производные или «гибриды нанотел», мультивалентные конструкции (включающие некоторые не ограничивающие примеры линкерных последовательностей) и различные модификации для повышения полужизни нанотел и их приготовления можно найти, например, в WO 08/101985 и WO 08/142164.
Например, одиночный вариабельный домен или иммуноглобулиновый одиночный вариабельный домен (или аминокислотная последовательность, пригодная для применения в качестве иммуноглобулинового одиночного вариабельного домена) могут быть (одно) доменным антителом (или аминокислотной последовательностью, пригодной для применения в качестве (одно) доменного антитела), или «dAb» или dAb (или аминокислотной последовательностью, пригодной для применения в качестве dAb) или нанотела (как применяется в настоящей заявке, и включая VHH последовательность, но не ограничиваясь ею); другими одиночными вариабельными доменами, или другим подходящим фрагментом любого из них. Для общего описания (одно) доменных антител, приводится ссылка на цитированный предшествующий уровень техники, а также на EP 0 368 684. Для термина «dAb» приводится ссылка, например, на Ward et al. 1989 (Nature 341 (6242): 544-6); Holt et al. 2003 (Trends Biotechnol. 21(11): 484-490); а также, например, на WO 04/068820, WO 06/030220, WO 06/003388 и другие опубликованные патентные заявки Domantis Ltd. Также необходимо отметить, хотя это менее предпочтительно в контексте настоящего изобретения из-за происхождения от не-млекопитающих, одиночные вариабельные домены могут быть получены от некоторых видов акул (например, так называемые «IgNAR домены», см., например, WO 05/18629).
В частности, иммуноглобулиновые одиночные вариабельные домены могут быть Нанотелом® (как определено в настоящей заявке) или его подходящим фрагментом. [Замечание: Nanobody®, Nanobodies® и Nanoclone® являются зарегистрированными товарными знаками Ablynx N.V.]. Для общего описания нанотел приводится ссылка на дальнейшее описание ниже, а также на предшествующий уровень техники, цитированный в настоящей заявке, например, как описано в WO 08/020079 (стр.16).
Аминокислотную последовательность и структуру аминокислотной последовательности, в частности, иммуноглобулиновый одиночный вариабельный домен, можно рассматривать, однако, не ограничиваясь этим, как состоящую из четырех каркасных областей или «FR», которые обозначаются в данной области техники как «каркасная область 1» или «FR1»; как «каркасная область 2» или «FR2»; как каркасная область 3» или «FR3»; и как «каркасная область 4» или «FR4», соответственно; где каркасные области перемежаются гипервариабельными областями или «CDR», которые обозначаются в данной области техники как «гипервариабельная область 1» или «CDR1»; как «гипервариабельная область 2» или «CDR2»; и как «гипервариабельная область 3» или «CDR3», соответственно.
Общее число аминокислотных остатков в иммуноглобулиновом одиночном вариабельном домене может находиться в диапазоне 110-120, предпочтительно 112-115, и наиболее предпочтительно, составляет 113. Однако необходимо отметить, что части, фрагменты, аналоги или производные иммуноглобулинового одиночного вариабельного домена не ограничиваются конкретно по их длине и/или размеру, а также такие части, фрагменты, аналоги и производные удовлетворяют требованиям, изложенным в настоящей заявке, и также являются предпочтительно пригодными для целей, описанных в настоящей заявке.
Таким образом, в настоящем изобретении термин «иммуноглобулиновый одиночный вариабельный домен» или «одиночный вариабельный домен» включает пептиды, которые получены из не человеческого источника, предпочтительно, от верблюда, предпочтительно верблюжье антитело из тяжелой цепи. Они могут быть гуманизированы, как описано ранее, например, в WO 08/101985 и WO 08/142164. Далее, термин включает полипептиды, полученные из не-верблюжьих источников, например, от мыши или человека, которые были «камелизированы», как описано ранее, например, в WO 08/101985 и WO 08/142164.
Термин «иммуноглобулиновый одиночный вариабельный домен» охватывает иммуноглобулиновые последовательности различного происхождения, включая иммуноглобулиновые последовательности мыши, крысы, кролика, осла, человека и верблюда. Он также включает полностью человеческие, гуманизированные или химерные иммуноглобулиновые последовательности. Например, он включает верблюжьи иммуноглобулиновые последовательности и гуманизированные верблюжьи иммуноглобулиновые последовательности, или камелизированные иммуноглобулиновые одиночные вариабельные домены, например, камелизированное dAb, как описано Ward et al (см., например, WO 94/04678 и Davies and Riechmann 1994, Febs Lett. 339: 285 and 1996, Protein Engineering 9: 531).
Все ISVD против vWF (или агенты, связывающие vWF), упомянутые выше, хорошо известны из литературы. Это включает их производство (см., в частности, например, WO2006/122825, а также WO2004/062551). Например, ALX 0081 готовят, как описано, например, в WO2006/122825 или WO2009/115614.
Иммуноглобулиновые одиночные вариабельные домены, обеспеченные настоящим изобретением, предпочтительно находятся в изолированной форме или в по существу изолированной форме, или образуют часть белка или полипептида из настоящего изобретения, который может включать или по существу состоять из одного или нескольких иммуноглобулиновых одиночных вариабельных доменов, и который может при необходимости дополнительно включать одну или несколько дополнительных аминокислотных последовательностей (все из которых при необходимости связаны с одним или несколькими подходящими линкерами). Например, и без ограничения, один или несколько иммуноглобулиновых одиночных вариабельных доменов могут применяться в качестве связывающей единицы в таком белке или полипептиде, который может при необходимости содержать одну или несколько дополнительных аминокислотных последовательностей, которые служат в качестве связывающей единицы (т.е. против одной или нескольких иных мишеней, чем антигены, ассоциированные с клеткой), так чтобы обеспечить одновалентный, поливалентный или полиспецифический полипептид из настоящего изобретения, соответственно, все из которых описаны в настоящей заявке. Такой белок или полипептид может также быть в изолированной или по существу изолированной форме. Таким образом, в соответствии с настоящим изобретением, иммуноглобулиновые одиночные вариабельные домены включают конструкции, содержащие две или более антигенсвязывающих единиц в форме одиночных доменов, как описано выше. Например, два (или больше) иммуноглобулиновых одиночных вариабельных домена с одной или той же или разной антигенной специфичностью могут быть связаны до образования, например, двухвалентной, трехвалентной или поливалентной конструкции. Путем комбинации иммуноглобулиновых одиночных вариабельных доменов двух или более специфичностей, можно формировать биспецифические, триспецифические и т.д. конструкции. Например, полипептид в соответствии с настоящим изобретением может включать два иммуноглобулиновых одиночных вариабельных домена, направленных против мишени А, и один иммуноглобулиновый одиночный вариабельный домен против мишени В, что делает его двухвалентным для А и одновалентным для В. Все такие конструкции и их модификации, которые легко понятны для специалиста в данной области техники, охватываются настоящим изобретением. В частных вариантах осуществления изобретение относится к би-паратопным конструкциям, включающим по меньшей мере два иммуноглобулиновых одиночных вариабельных домена, направленных к разным эпитопам в пределах одного и того же целевого антигена.
Все эти молекулы также упоминаются как «полипептид из настоящего изобретения», что является синонимом для «иммуноглобулиновых последовательностей» или «иммуноглобулиновых одиночных вариабельных доменов» из изобретения.
Кроме того, термин «последовательность», как применяется в настоящей заявке (например, в таких терминах, как «иммуноглобулиновая последовательность», «последовательность антитела», «последовательность вариабельного домена», «VHH-последовательность» или «белковая последовательность»), необходимо в целом понимать как включающий как соответствующую аминокислотную последовательность, так и последовательность нуклеиновых кислот или нуклеотидную последовательность, кодирующую её, если только в контексте не требуется более ограниченная интерпретация.
В соответствии с одним не ограничивающим вариантом осуществления изобретения, иммуноглобулиновые последовательности, Нанотело® или полипептид из настоящего изобретения являются гликозилированными. В соответствии с другим не ограничивающим вариантом осуществления изобретения, иммуноглобулиновые последовательности, Нанотело® или полипептид из настоящего изобретения являются не гликозилированными.
Как упомянуто выше, настоящее изобретение относится к полипептидам, как правило, содержащим по меньшей мере один, такое количество, как 2 или больше ISVD против vWF, т.е. ISVD, связывающих и/или обладающих аффинностью к антигену, как определено в настоящей заявке, например, фактору фон Виллебранда ( vWF), и предпочтительно, человеческому vWF (SEQ ID NO: 20).
В контексте настоящего изобретения «связывающий и/или обладающий аффинностью» к определенному антигену имеет обычное значение, как понятно, например, в контексте антител и их соответствующих антигенов.
В частных вариантах осуществления изобретения термин «связывающий и/или обладающий аффинностью» означает, что иммуноглобулиновая последовательность специфически взаимодействует с антигеном, и применяется взаимозаменяемо и иммуноглобулиновыми последовательностями «против» указанного антигена.
Термин «специфичность» относится к числу разных типов антигенов или антигенных детерминант, с которыми может связываться частная иммуноглобулиновая последовательность, антигенсвязывающая молекула или антигенсвязывающий белок (такой, как Нанотело® или полипептид из настоящего изобретения). Специфичность антигенсвязывающего белка можно определить на основе аффинности и/или авидности. Аффинность, представленная константой равновесия для диссоциации антигена и антигенсвязывающего белка (KD), является мерой силы связывания между антигенной детерминантой и антигенсвязывающим участком на антигенсвязывающем белке: чем меньше значение KD, тем больше сила связывания между антигенной детерминантой и антигенсвязывающей молекулой (альтернативно, аффинность может также быть выражена в виде константы аффинности (КА), которая равна 1/КD). Как понятно специалисту в данной области техники (например, на основе последующего описания), аффинность можно определить известным способом, в зависимости от интересующего специфического антигена. Авидность является мерой силы связывания между антигенсвязывающей молекулой (такой, как Нанотело® или полипептид из настоящего изобретения) и подходящим антигеном. Авидность относится как к аффинности между антигенной детерминантой и её антигенсвязывающим участком на антигенсвязывающей молекуле, так и к числу подходящих мест связывания, присутствующих на антигенсвязывающей молекуле.
Как правило, иммуноглобулиновые последовательности из настоящего изобретения (такие, как аминокислотные последовательности, Нанотела® и/или полипептиды из настоящего изобретения, связываются с антигеном с константной диссоциации (KD) от 10-5 до 10-12 моль/л или меньше, и предпочтительно от 10-7 до 10-12 моль/л или меньше, и более предпочтительно от 10-8 до 10-12 моль/л (т.е. с константной ассоциации (КА) от 105 до 1012 л/моль или больше, и предпочтительно от 107 до 1012 л/моль или больше, и более предпочтительно от 108 до 1012 л/моль), и/или связываются с клеточно-ассоциированными антигенами, как определено в настоящей заявке, со скоростью ассоциации от 102 М-1с-1 до примерно 107 М-1с-1, предпочтительно от 103 М-1с-1 до 107 М-1с-1, более предпочтительно от 104 М-1с-1 до 107 М-1с-1, такой как от 105 М-1с-1 до 107 М-1с-1; и/или связываются с клеточно-ассоциированными антигенами, как определено в настоящей заявке, с константой диссоциации от 1 с-1 (t1/2=0,69 с) до 10-6 с-1 (с обеспечением почти необратимого комплекса с t1/2 из множества дней), предпочтительно от 10-2 с-1 до 10-6 с-1, более предпочтительно от 10-3 с-1 до 10-6 с-1, такой как от 10-4 с-1 до 10-6 с-1.
Любое значение KD больше 10-4 М (или любое значение КА ниже 104 М-1), как правило, считается указывающим на неспецифическое связывание.
Предпочтительно, одновалентная иммуноглобулиновая последовательность из настоящего изобретения связывается с необходимым антигеном с аффинностью меньше 500 нМ, предпочтительно меньше 200 нМ, более предпочтительно меньше 10 нМ, такой как меньше 500 пМ.
Специфическое связывание антигенсвязывающего белка с антигеном или антигенной детерминантой можно определить любым подходящим способом, известным как таковой, включая, например, анализ Скетчарда и/или анализ конкурентного связывания, такой как радиоиммунные анализы (РИА), иммуноферментные анализы (ИФА) и сэндвич-конкурентные анализы, и их различные варианты, известные как таковые в данной области техники; а также другие методики, упомянутые в настоящей заявке.
Константа диссоциации (KD) может быть действительной или кажущейся константой диссоциации, как понятно для специалиста в данной области техники. Способы определения константы диссоциации понятны для специалиста в данной области техники, и включают, например, методики, упомянутые в настоящей заявке. В связи с этим, также необходимо понять, что невозможно измерить константы диссоциации больше 10-4 моль/л или 10-3 моль/л (например, 10-2 моль/л). При необходимости, как также должно быть понятно специалисту в данной области техники, (действительную или кажущую) константу диссоциации можно рассчитать на основе (действительной или кажущейся) константы (КА), посредством отношения [KD = 1/KA].
Аффинность означает силу или стабильность молекулярного взаимодействия. Аффинность обычно выражают в виде KD, или константы диссоциации, в единицах моль/л (или М). Аффинность можно также выразить в виде константы ассоциации, КА, которая равна 1/KD и выражается в единицах (моль/л)-1 или М-1. В настоящем описании стабильность взаимодействия между двумя молекулами (такими, как аминокислотная последовательность, иммуноглобулиновая последовательность, Nanobody® или полипептид из настоящего изобретения, и их назначенной мишенью) можно главным образом выразить в виде значения KD их взаимодействия; специалисту в данной области техники понятно, что с учетом соотношения KA =1/KD, указание силы молекулярного взаимодействия по его значению KD можно также применять для расчета соответствующего значения КА. Значение KD характеризует силу молекулярного взаимодействия также в термодинамическом смысле, поскольку оно относится к свободной энергии (DG) связывания по хорошо известному уравнению DG=RT.ln(KD) (эквивалентно DG=-RT.ln(KA)), где R газовой постоянной, T равно абсолютной температуре, а ln означает натуральный логарифм.
KD для биологических взаимодействий, таких как связывание иммуноглобулиновых последовательностей из настоящего изобретения с клеточно-ассоциированным антигеном, как определено в настоящей заявке, которая считается значимой (например, специфической), как правило, находится в диапазоне от 10-10 М (0,1 нМ) до 10-5 М (10000 нМ). Чем сильнее взаимодействие, тем ниже KD.
KD можно также выразить в виде отношения константы скорости диссоциации комплекса, обозначенной как koff, к скорости его ассоциации, обозначенной как kon (так что KD =koff/kon, а KA = kon/koff). Скорость диссоциации koff выражается в единицах с-1 (где с является обозначением секунды по СИ). Скорость ассоциации kon выражается в единицах М-1с-1.
Что касается иммуноглобулиновых последовательностей из настоящего изобретения, скорость ассоциации может варьировать от 102 М-1с-1 до примерно 107 М-1с-1, достигая ограниченной диффузией константы скорости ассоциации для бимолекулярных взаимодействий. Скорость диссоциации связана с полужизнью данного молекулярного взаимодействия посредством отношения t1/2=ln(2)/koff. Скорость диссоциации иммуноглобулиновых последовательностей из настоящего изобретения может варьировать от 10-6 с-1 (почти необратимого комплекса с t1/2 из множества суток) до 1 с-1 (t1/2=0,69 с).
Аффинность молекулярного взаимодействия между двумя молекулами можно измерить с помощью различных методик, известных как таковые, таких как хорошо известная биосенсорная методика поверхностного плазмонного резонанса (ППР) (см., например, Ober et al., Intern. Immunology, 13, 1551-1559, 2001), где одну молекулу иммобилизуют на биосенсорном чипе, а другую молекулу пропускают над иммобилизованной молекулой в условиях потока, обеспечивающих определение значений kon, koff, и следовательно, KD (или КА). Это, например, можно выполнить с помощью хорошо известных инструментов Biacore.
Специалисту в данной области техники также понятно, что измеренная KD может соответствовать кажущейся KD, если на процесс измерения как-либо влияет собственная аффинность связывания используемых молекул, например, артефактов, связанных с покрытием на биосенсоре с одной молекулой. Кроме того, кажущуюся KD можно измерить, если одна молекула содержит более одного участка распознавания для другой молекулы. В такой ситуации на измеренную аффинность может влиять авидность взаимодействия двух молекул.
Другим подходом, который можно применять для оценки аффинности, является 2-этапная процедура ИФА (иммуноферментный анализ) из Friguet et al. (J. Immunol. Methods, 77, 305-19, 1985). Способ обеспечивает определение равновесия твердофазового связывания, и устраняет возможные артефакты, связанные с адсорбцией одной из молекул на такой подложке, как пластик.
Однако точное измерение KD может быть достаточно трудоемким, и в результате часто определяют значения кажущейся KD для оценки силы связывания двух молекул. Необходимо отметить, что поскольку все измерения проводят согласованным образом (т.е. сохраняя постоянные условия анализа), анализ кажущейся KD можно применять для приближения к истинной KD, и, следовательно, в настоящей заявке KD и кажущаяся KD имеют равную значимость или важность.
Наконец, необходимо отметить, что во многих случаях опытный ученый может признать удобным определение аффинности связывания по отношению к некоторой эталонной молекуле. Например, для оценки силы связывания между молекулами А и В, можно, например, применять эталонную молекулу С, для которой известно её связывание с В и которая подходящим образом мечена флуорофорной или хромофорной группой или другим химическим компонентом, таким как биотин, для простой детекции в ELISA или FACS (сортировке флуоресцентно-активированных клеток) или другом формате (флуорофор для флуоресцентной детекции, хромофор для светопоглощающей детекции, биотин для стрепатвидин-опосредованной ELISA детекции). Как правило, эталонную молекулу С сохраняют в фиксированной концентрации, а концентрация А варьирует для определенной концентрации или количества В. В результате получают значение IC50, соответствующее концентрации А, при которой сигнал, измеренный для С при отсутствии А, уменьшен наполовину. Если известна KDref, KD эталонной молекулы, а также общая концентрация cref эталонной молекулы, можно получить кажущуюся KD для взаимодействия A-B по следующей формуле: KD =IC50/(1+cref/ KD ref). Отмечаем, что если cref << KD ref, KD ≈ IC50. Если измерение IC50 проводят постоянным образом (т.е. при сохранении фиксированной cref) для сравниваемых связывающих агентов, силу или стабильность молекулярного взаимодействия можно оценить с помощью IC50, и эта мера считается эквивалентом KD или кажущейся KD в данном тексте.
Настоящее изобретение относится к иммуноглобулиновым одиночным вариабельным доменам, как описано, например, или получено посредством способов, описанных в WO2004/015425 [P02-008], WO2004/062551 [P03-001], WO2006/074947 [P05-001], WO2006/122825 [P05-003], WO2009/115614 [P08-013], или WO2011/067160 [P09-024], все из которых принадлежат автору настоящей заявки.
Изобретение также охватывает оптимизированные варианты этих аминокислотных последовательностей. Как правило, «оптимизированный вариант» аминокислотной последовательности в соответствии с настоящим изобретением является вариантом, включающим одну или несколько благоприятных замен, таких как замены, включающие (i) степень «гуманизации», (ii) химическую стабильность и/или (iii) уровень экспрессии; в то время как активность (измеренная, например, путем анализа активности, описанного в экспериментальном разделе WO2006/122825, остается сопоставимой (т.е. в пределах 10% отклонения) с диким типом 12А02 (как определено в WO2006/122825), или сопоставимой с вариантом 12A02H1 (SEQ ID NO: 19), также определенным в WO2006/122825. Предпочтительно, при сравнении с последовательностью дикого типа 12А02, аминокислотная последовательность из настоящего изобретения содержит по меньшей мере одну замену, и предпочтительно по меньшей мере две таких замены, и предпочтительно по меньшей мере три гуманизирующих замены, и предпочтительно по меньшей мере 10 таких гуманизирующих замен.
В частном аспекте аминокислотные последовательности из настоящего изобретения содержат в целом от 1 до 15, предпочтительно от 2 до 14, так как от 9 до 13, например, 10, 11 или 12 аминокислотных замен, по сравнению с последовательностью дикого типа 12А02. Как упоминалось, эти различия предпочтительно по меньшей мере составляют одну, и предпочтительно по меньшей мере две, такое количество, как три, четыре или пять или десять гуманизирующих замен, и могут при необходимости включать одну или несколько дополнительных замен (таких, как любая из дополнительных замен (а)-(с), упомянутых выше, или любая комбинация из двух или более из них). Вновь, на основе описания, и при необходимости после ограниченной серии проб и ошибок, специалист в данной области техники может выбрать (подходящую комбинацию) одну или несколько таких подходящих гуманизирующих и/или дополнительных замен.
Настоящее изобретение охватывает полипептидные последовательности, высоко схожие с любым из специфических примеров, приведенных в настоящей заявке, или любым из специфических примеров, определенных ссылкой выше. Высоко схожая означает аминокислотную идентичность по меньшей мере 90%, например, 95, 97, 98 или 99%. Высоко схожие полипептидные последовательности выполняют ту же функцию, как последовательность, из которой они получены, т.е. они связываются с vWF, в частности, специфически связываются и ингибируют взаимодействие между vWF и тромбоцитами.
В частном варианте осуществления изобретение относится к последовательностям, высоко схожим с любой из SEQ ID NO: 1-19, в частности, SEQ ID NO: 1. Однако стабильность каждого варианта последовательности в композиции, как определено в настоящей заявке, необходимо оценить, так что изобретение, в частности, относится к вариантам или высоко схожим последовательностям, которые являются стабильными в композициях, как определено в настоящем изобретении.
Способы генерации полипептидных последовательностей из настоящего изобретения широко известны, и включают, например, рекомбинантную экспрессию или синтез. Специалисту в данной области техники хорошо известна подходящая технология экспрессии, например, подходящие рекомбинантные векторы и клетки-хозяева, например, бактериальные или дрожжевые клетки-хозяев. Специалисту в данной области техники хорошо знакомы подходящие методики и протоколы очистки.
Настоящее изобретение обеспечивает также композиции полипептидов, содержащие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен против vWF, например, ALX 0081, которые являются стабильными, и предпочтительно пригодными для фармацевтического применения, включая приготовление медикаментов (также называемые «фармацевтическими композициями из настоящего изобретения» или «рецептурами из настоящего изобретения»).
В частных вариантах осуществления композиция включает один или несколько полипептидов, выбранных из SEQ ID NO: 1-19, предпочтительно SEQ ID NO: 1.
Термин «фармацевтическая композиция» относится к препарату, который находится в такой форме, которая обеспечивает эффективную биологическую активность активного ингредиента (полипептида из настоящего изобретения), который не содержит дополнительных компонентов, которые могут иметь неприемлемую токсичность для индивидуума, у которого применяют композицию. Такие композиции являются стерильными. «Фармацевтически пригодные» вспомогательные вещества (растворители, добавки), являются такими, какие рационально применять у млекопитающего субъекта для обеспечения эффективной дозы применяемого активного ингредиента.
Термин «вспомогательное вещество», как применяется в настоящей заявке, означает инертное вещество, которое обычно применяют в качестве разбавителя, растворителя, консерванта, лиопротектора, сурфактанта, связующего агента, носителя или стабилизирующего агента для соединений, обеспечивающее благоприятное физиологическое свойство композиции. Специалисту в данной области техники известны вспомогательные вещества, пригодные для фармацевтических целей, которые могут выполнять определенные функции в композиции, такие как лиопротекция, стабилизация, консервация и т.д.
«Стерильная» композиция является асептической или свободной или по существу свободной от всех живых микроорганизмов и их спор. Она легко осуществляется путем фильтрации через стерилизующие фильтрационные мембраны.
«Стабильная» композиция является такой, в которой белок по существу сохраняет физическую стабильность и/или химическую стабильность и/или биологическую стабильность при хранении. Предпочтительно, композиция по существу сохраняет физическую и химическую стабильность, а также биологическую активность при хранении. Период хранения, как правило, выбирают на основе назначенного срока годности композиции. Различные аналитические методики для определения стабильности белков имеются в данной области техники, и их обзоры приводятся, например, в «Peptide and Protein Drug Delivery», 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991), и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерить при выбранной температуре и в течение выбранного периода времени. В некоторых вариантах осуществления композиция стабильна примерно при 40°С в течение по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8 или более недель. Далее, композиция предпочтительно стабильна после замораживания (например, до -20°С или до -70°С) и оттаивания композиции, например, после 1, 2, 3, 4 или 5 циклов замораживания и оттаивания. Стабильность можно оценить качественно и/или количественно множеством разных способов, известных специалисту в данной области техники. Исследования стабильности показали, что ALX 0081 стабилен при -20°C в течение по меньшей мере 3 лет.
Композиция содержит по меньшей мере один водный носитель. Водный носитель является, в частности, буфером.
Как применяется в настоящей заявке, «буфер» означает забуференный раствор, устойчивый к изменениям рН за счет действия его кислотно-основных конъюгатных компонентов. Композиция из настоящего изобретения содержит буфер, выбранный по меньшей мере из цитратного или фосфатного буфера, предпочтительно, цитратный буфер. Как определено ранее, эти буферы повышают стабильность агентов, связывающих vWF.
Композиция в соответствии с настоящим изобретением включает цитратный буфер в концентрации в диапазоне 5-200 мМ, предпочтительно 7,5-80 мМ, еще более предпочтительно 10-50, например, 10, 15, 20, 25 или 30 мМ, и наиболее предпочтительно 20 мМ, где каждое значение, как необходимо понять, при необходимости охватывает диапазон ±5 мМ. Альтернативно, композиция в соответствии с настоящим изобретением может содержать фосфатный буфер в концентрации в диапазоне 5-200 мM, предпочтительно 5-80 мM, более предпочтительно 7,5-60 мM, еще более предпочтительно 10-40, например, 10, 15, 20, 25 или 30 мM, и наиболее предпочтительно 10 мМ, где каждая величина, как нужно понимать, при необходимости охватывает диапазон ±5 мМ. Необходимо понимать, что более низкая концентрация буфера оказывает влияние на итоговую осмолярность, и соответственно, может быть необходимо добавлять дополнительные растворимые вещества.
Значение рН композиции из настоящего изобретения находится в диапазоне от 5,0 до 7,5, где каждое значение, как необходимо понимать, охватывает диапазон ±0,2. наиболее предпочтительное значение рН зависит от буфера, включенного в композицию. Следовательно, настоящее изобретение относится, в частности, к композиции, включающей фосфатный буфер, который предпочтительно имеет рН в диапазоне от 6,5 до 7,5, предпочтительно, 6,9; 7,0; 7,1; например, 7,1. Было показано, что композиция, содержащая цитратный буфер, была исключительно пригодной для хранения и применения. Следовательно, настоящее изобретение относится к композиции, содержащей цитратный буфер, которая предпочтительно имеет рН от 6,0 до 7,0, более предпочтительно 6,1; 6,2; 6,3; 6,4; 6,5; 6,6; 6,7; 6,8 или 6,9; например, 6,5, где каждое значение необходимо понимать как охватываемое, при необходимости, диапазоном ±0,2.
Композиции из настоящего изобретения содержат полипептиды из настоящего изобретения, в частности, иммуноглобулиновые одиночные вариабельные домены или полипептиды, содержащие по меньшей мере один иммуноглобулиновый одиночный вариабельный домен против vWF, такой как ALX 0081, в концентрации, пригодной или клинических целей, которая включает концентрации, используемые в стоковых растворах для разбавления перед применением у пациента. Помимо улучшения стабилизации, композиции из настоящего изобретения обеспечивают высокие концентрации полипептидов, содержащих по меньшей мере один ISVD против vWF, такой как ALX 0081.
Типичные концентрации активного агента, например, полипептидов, содержащих по меньшей мере один ISVD против vWF, такой как ALX 0081, в композициях из настоящего изобретения включают не ограничивающие примеры концентраций в диапазоне от 0,1 до 150 мг/мл, таком как 1-100 мг/мл, 5-80 мг/мл, или 10-40 мг/мл, предпочтительно, 10 мг/мл, где каждое значение необходимо понимать как охватываемое, при необходимости, диапазоном ±20% (например, значение 10 при необходимости охватывается диапазоном от 8 до 12 мг/мл).
В другом варианте осуществления изобретения композиция в соответствии с любым аспектом настоящего изобретения может дополнительно содержать детергент или сурфактант.
При этом «сурфактант» относится к поверхностно-активному агенту, предпочтительно, к неионному сурфактанту. Примеры сурфактантов в настоящей заявке включают полисорбат; полоксамер (например, полоксамер 188); Тритон, натрия додецилсульфат (ДСН); натрия лаурилсульфат; натрия октилгликозид; натрия октилгликозид; лаурил-, миристил-, линолеил-, или стеарил-сульфобетаин; лаурил-, миристил-, линолеил-, или стеарил-саркозин; линолеил-, миристил-, или цетил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил-, или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил-, или изостеарамидопропил-диметиламин; натрия метил кокоил-, или динатрия метил-олеил-таурат; и серии MONAQUAT® series (Mona Industries, Inc., Патерсон, Нью-Йорк); полиэтилгликоль, полипропилгликоль, и сополимеры этилен- и пропиленгликоля (например, Pluronics, PF68, и т.д.); и т.д. В одном варианте осуществления сурфактантом является полисорбат 80. Предпочтительные подходящие детергенты или сурфактанты для применения в настоящем изобретении включают полиоксиэтилен-сорбитановые жирнокислотные сложные эфиры, например, полисорбат 20, 40, 60, 65, 80 или 85. Общие торговые наименования для полисорбатов включают Alkest, Canarcel и Tween. Специалисту в данной области техники известны дополнительные не ограничивающие примеры детергентов, такие как те, которые перечислены, например, в WO2010/077422. В предпочтительном варианте осуществления детергентом является неионный детергент. В частности, детергентом является полисорбат-80, также обозначаемый как Твин-80. Специалист в данной области техники может легко определить подходящую концентрацию детергента для композиции из настоящего изобретения. Как правило, концентрация является как можно более низкой, при сохранении благоприятных эффектов детергентов, например, стабилизирующего эффекта в условиях сдвигового стресса, например, перемешивания, которое снижает агрегацию полипептидов композиции из настоящего изобретения. В примерных не ограничивающих вариантах осуществления концентрация детергента может быть в диапазоне от 0,001 до 0,5%, например, 0,001; 0,002; 0,003; 0,004; 0,005; 0,01; 0,015; 0,02; 0,025; 0,03; 0,035; 0,04; 0,045; 0,05%, 0,1%, 0,2%, 0,3%, 0,4% или 0,5%, предпочтительно, в концентрации от 0,01 до 0,05%, более предпочтительно от 0,01 до 0,02%, например, 0,01 об.%.
Композиция из настоящего изобретения может дополнительно содержать такие вспомогательные вещества, как консерванты.
«Консервант» является соединением, которое может быть при необходимости включено в композицию для существенного снижения бактериальной активности, таким образом, обеспечивая получение, например, композиции для многоразового применения. Примеры потенциальных консервантов включают октадецилдиметилбензил-аммония хлорид, гексаметониум хлорид, бензалкониум хлорид (смесь алкилбензилдиметиламмония хлоридов, в которых алкильные группы являются соединениями с длинной цепью), и бензетониум хлорид. Другие типы консервантов включают ароматические спирты, такие как фенольный, бутиловый и бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол, резорцинол, циклогексанол, 3-пентанол, и м-крезол. В одном варианте осуществления консервантом является бензиловый спирт.
Композиция из настоящего изобретения может дополнительно включать стабилизирующие агенты, такие как полиолы.
«Полиол» является веществом с множеством гидроксильных групп, и включает сахара (восстанавливающие и не-восстанавливающие сахара), сахароспирты и сахарные кислоты. Полиол может при необходимости быть включен в композицию, например, для улучшения стабильности. В некоторых вариантах осуществления полиолы имеют молекулярную массу меньше примерно 600 кДа (например, в диапазоне примерно от 120 до 400 кДа). «Восстанавливающий сахар» является сахаром, содержащим полуацетальную группу, которая восстанавливает ионы металлов или вступает в ковалентную реакцию с лизином и другими аминогруппами на белках, а «не-восстанавливающий сахар» является сахаром, не обладающим свойствами восстанавливающего сахара. Примерами восстанавливающих сахаров являются фруктоза, манноза, мальтоза, лактоза, арабиноза, ксилоза, рибоза, рамноза, галактоза и глюкоза. Не-восстанавливающие сахара включают сахарозу, трегалозу, сорбозу, мелезитозу и раффинозу. Маннитол, ксилитол, эритритол, треитол, сорбитол и глицерин являются примерами сахароспиртов. Что касается сахарных кислот, они включают L-глюконат и его металлические соли. Там, где необходимо, чтобы композиция была устойчива к замораживанию-оттаиванию, полиол предпочтительно является таким, который не кристаллизуется при температурах замораживания (например, -20°С), чтобы не нарушать стабильность антитела в композиции. В некоторых вариантах осуществления не-восстанавливающие сахара, такие как сахароза и трегалоза, являются примерами полиолов, где предпочтительной является сахароза, несмотря на стабильность трегалозы в растворе.
Терапевтические соединения из настоящего изобретения, используемые в соответствии с настоящим изобретением, готовят для хранения путем смешивания полипептида(ов) с необходимой степенью чистоты, с необязательными фармацевтическим пригодными носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. [1980]), в форме лиофилизированных композиций или водных растворов. Подходящие носители, наполнители или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях. Соответственно, композиции в соответствии с изобретением могут также факультативно содержать одно или несколько вспомогательных веществ.
Обычно применяемые стабилизаторы и консерванты хорошо известны специалисту в данной области техники (см., например, WO2010/077422). Фармацевтически пригодные носители, которые можно применять в этих композициях, включают ионообменники, окись алюминия, алюминия стеарат, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как сорбаты, глицин, сорбиновую кислоту, калия сорбат, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамина сульфат, динатрия гидрофосфат, калия гидрофосфат, натрия хлорид, соли цинка, коллоидный кварц, магния трисиликат; гидрофильные полимеры такие как поливинилпирролидон; вещества на основе целлюлозы, полиэтиленгликоль, натрия карбоксиметилцеллюлозу, полиакрилаты, воски, желатин, полиэтилен-полиоксипропилена блок-полимеры, полиэтиленгликоль и ланолин; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты; низкомолекулярные (меньше примерно 10 остатков) полипептиды; белки; и аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин, но не ограничиваются ими. В предпочтительных вариантах осуществления вспомогательное вещество может быть одним или несколькими, выбранными из перечня, состоящего из NaCl, трегалозы, сахарозы, маннитола или глицина.
Активные ингредиенты могут быть захвачены в микрокапсулах, приготовленных, например, посредством методик коацервации или путем полимеризации на границе фаз, например, гидроксиметилцеллюлозных или желатиновых микрокапсулах и поли-(метилметакрилатных) микрокапсулах, соответственно, в коллоидных системах доставки лекарств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методики раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Полипептиды из настоящего изобретения могут быть выполнены в виде любой фармацевтически пригодной композиции. Композиция может быть жидкой или сухой. Композиция может быть получена посредством смешивания, сушки, лиофилизации, вакуумной сушки, или любым известным способом получения фармацевтических композиций.
Предпочтительная композиция из настоящего изобретения включает полипептид, содержащий по меньшей мере один ISVD против vWF, такой как ALX 0081, в фосфатном буферном растворе (рН 7,1). Еще более предпочтительно, композиция из настоящего изобретения содержит полипептид, включающий по меньшей мере один ISVD против vWF, такой как ALX 0081, в фосфатном буферном растворе (рН 7,1), глицин (0,2 М) и полисорбат 80 (0,02 об.%).
Полипептиды из настоящего изобретения могут дополнительно быть выполнены в виде композиции, как описано в PCT/EP14/060107. Предпочтительная композиция содержит:
(а) полипептид, включающий по меньшей мере один ISVD против vWF, такой как ALX 0081, в концентрации примерно от 0,1 мг/мл до 80 мг/мл;
(b) вспомогательное вещество, выбранное из сахарозы, глицина, маннитола, трегалозы или NaCl, в концентрации примерно от 1% до 15% (м/о);
(с) Твин-80 в концентрации примерно от 0,001 об.% до 0,5 об.%; и
(d) цитратный буфер в концентрации примерно от 5 мМ до 200 мМ, так чтобы значение рН композиции составило примерно от 6,0 до 7,0.
Другая предпочтительная композиция из настоящего изобретения включает полипептид, содержащий по меньшей мере один ISVD против vWF, такой как ALX 0081, предпочтительно, в концентрации 10 мг/мл, цитратный буфер в концентрации 20 мМ (рН 6,5), дополнительно содержащую 7% сахарозы (м/о) и Твин-80 в концентрации 0,01 об.%.
В некоторых вариантах осуществления композицию хранят в виде жидкости. В других вариантах осуществления композицию готовят в виде жидкости, а затем сушат, например, путем лиофилизации или распылительной сушки, перед хранением. Сухую композицию можно применять в виде сухого соединения, например, в виде аэрозоля или порошка, или восстанавливать до исходной или другой концентрации, например, с применением воды, буфера, или другой подходящей жидкости.
Настоящее изобретение также относится к флаконам, содержащим лиофилизат, включающий 12,5 мг каплацизумаба и вспомогательные вещества для раствора для инъекций. Вспомогательные вещества (на мл восстановленного раствора): 0,21 мг лимонной кислоты, 5,58 мг тринатрия цитрата дигидрата, 70 мг сахарозы, 0,11 мг полисорбата-80 на флакон (рН 6,5±0,5). После восстановления 1 мл воды для инъекций (ВДИ) концентрация составляет 12,5 мг/мл каплацизумаба (для применения номинальной дозы 10 мг).
Настоящее изобретение также охватывает продукты, полученные путем дополнительной обработки жидкой композиции, такой как замороженный, лиофилизированный или высушенный распылением продукт. При восстановлении эти твердые продукты могут становиться жидкими композициями, как описано в настоящей заявке (но не ограничиваясь ими). Таким образом, в более широком смысле термин «композиция» охватывает как жидкие, таки и твердые композиции. Однако твердые композиции подразумевают получение из жидких композиций (например, путем замораживания, лиофилизации или распылительной сушки), и, следовательно, имеют отличающиеся характеристики, которые определяются признаками, указанными в настоящей заявке для жидких композиций. Изобретение не исключает восстановления, приводящего к составу, отклоняющемуся от оригинального состава, например, перед лиофилизацией или распылительной сушкой. Соответственно, лиофилизированная композиция может быть восстановлена для получения композиции, имеющей концентрацию, отличающуюся от исходной концентрации (т.е. до лиофилизации), в зависимости от количества воды или разбавителя, добавленного к лиофилизату, по отношению к объему жидкости, который исходно подвергали лиофилизации. Подходящие композиции можно идентифицировать путем определения одного или нескольких параметров целостности антител.
В предпочтительном варианте осуществления композиции в соответствии с настоящим изобретением являются изотоничными по отношению к крови человека. Изотонические растворы обладают тем же самым осмотическим давлением, как плазма крови, и таким образом, их можно вливать внутривенно индивидууму без изменения осмотического давления плазмы крови индивидуума. Тоничность можно выразить в терминах осмоляльности, которая может быть теоретической осмоляльностью, или предпочтительно, экспериментально определенной осмоляльностью. Как правило, осмоляльность находится в диапазоне 290±60 мОсм/кг, предпочтительно 290±20 мОсм/кг.
Композиции из настоящего изобретения могут также содержать соединения, специфически пригодные для защиты полипептидов из настоящего изобретения во время лиофилизации. Такие соединения также известны как лиопротекторы, и хорошо знакомы специалисту в данной области техники. Специфические примеры включают сахара, такие как сахароза, сорбитол или трегалоза; аминокислоты, такие как глутамат, в частности мононатрия глутамат или гистидин; бетаин, магния сульфат, сахароспирты, пропиленгликоль. полиэтиленгликоли и их комбинации, но не ограничиваются ими. При оценке изобретения специалист в данной области техники может легко определить необходимое для добавления количество такого соединения, с учетом стабильности композиции в жидкой форме и при воздействии лиофилизации. Композиции, особенно пригодные для лиофилизации, могут дополнительно содержать объемообразующие агенты. Подходящие агенты хорошо известны специалисту в данной области техники. Было показано, что композиция, содержащая сахарозу, не только особенно пригодна для сохранения физической стабильности, например, при хранении и замораживании-оттаивании агентов, связывающих vWF, но также в качестве лиопротектора.
Как описано выше, любые из вышеуказанных композиций можно дополнительно обрабатывать, например, путем лиофилизации, распылительной сушки или замораживания, например, замораживания насыпью. Полученный обработанный продукт имеет характеристики, полученные из жидкой исходной композиции, как определено выше. Если необходимо, могут быть включены дополнительные агенты для обработки, например, такие как лиопротекторы, и т.д.
Композиции из настоящего изобретения после лиофилизации обладают свойством сохранения химической и физической целостности полипептидов из настоящего изобретения, в частности, ALX 0081, т.е. даже после длительного хранения, например, в течение периодов, как определено выше, при температурах от -70°С до +40°С, профиль чистоты/примесей продукта по существу не меняется. например, длительное хранение после лиофилизации не оказывает значительного влияния на ОФ-ВЭЖХ, Э-ВЖХ, или кИЭФ профили.
Полипептиды из настоящего изобретения можно получить путем любого общепринятого способа. Типичные примеры включают рекомбинантную экспрессию в подходящей несущей системе, например, бактериальной или дрожжевой. Полипептиды из настоящего изобретения подвергают подходящему режиму очистки перед получением композиции в соответствии с настоящим изобретением.
Как правило, полипептиды из настоящего изобретения продуцируются живыми клетками-хозяевами, которые получены путем генной инженерии для выработки полипептида. Способы генетической инженерии клеток для получения белков хорошо известны в данной области техники. См., например, Ausubel et al., eds. (1990), Current Protocols in Molecular Biology (Wiley, New York). Такие способы включают введение нуклеиновых кислот, которые кодируют и обеспечивают экспрессию полипептида в живых клетках-хозяевах. Эти клетки-хозяева могут быть бактериальными клетками, грибковыми клетками, или животными клетками, выращенными в культуре. Бактериальные клетки-хозяева включают клетки Escherichia coli, но не ограничиваются ими. Примеры подходящих штаммов E. coli включают: HB101, DH5a, GM2929, JM109, KW251, NM538, NM539, и любой штамм E. coli, который не может расщеплять чужеродную ДНК, Грибковые клетки-хозяева которые можно применять, включают клетки Saccharomyces cerevisiae, Pichia pastoris и Aspergillus, но не ограничиваются ими. Некоторыми примерами животных клеточных линий, которые можно применять, являются CHO, VERO, BHK, HeLa, Cos, MDCK, 293, 3T3, и WI38. Некоторые животные клеточные линии можно получить с применением способов, хорошо известных специалистам в данной области техники (например, путем трансформации, вирусной инфекции, и/или селекции). При необходимости полипептид может быть секретирован клетками-хозяевами в среду.
В некоторых вариантах осуществления полипептиды могут быть продуцированы бактериальными клетками, например, клетками E. coli. Например, если полипептид кодируется последовательностями в векторе фагового дисплея, который включает супрессируемый стоп-кодон между отображаемым объектом и белком бактериофага (или его фрагментом), нуклеиновая кислота вектора может быть перенесена в бактериальную клетки, которая не может супрессировать стоп-кодон. В этом случае полипептид не гибридизируется с белком гена III, и секретируется в периплазму и/или в среду.
Полипептиды могут также продуцироваться в эукариотических клетках. В одном варианте осуществления полипептиды экспрессируют в дрожжевых клетках, таких как Pichia (см., например, Powers et al. J Immunol Methods 251:123-35 (2001)), Hansenula, или Saccharomyces.
В одном варианте осуществления полипептиды продуцируют в клетках млекопитающих. Типичные клетки-хозяева млекопитающих для экспрессии клонированных антител или их антигенсвязывающих фрагментов включают клетки яичников китайского хомячка (СНО клетки) (включая DHFR-СНО клетки, описанные в Urlaub and Chasin, Proc. Natl. Acad. Sci. USA 77:4216-4220(1980), с применением DHFR - селектируемого маркера, например, как описано в Kaufman and Sharp, Mol. Biol. 159:601-621 (1982)), лимфоцитарные клеточные линии, например, клетки миеломы NS0 и SP2 клетки, COS клетки и клетки от трансгенного животного, например, трансгенного млекопитающего. Например, клетка является эпителиальной клеткой млекопитающего.
В дополнение к последовательностям нуклеиновых кислот, кодирующим полипептид, векторы рекомбинантной экспрессии могут нести дополнительные последовательности, такие как последовательности, регулирующие репликацию вектора в клетках-хозяевах (например, точки начала репликации) или гены селектируемых маркеров. Ген селектируемого маркера облегчает выбор клеток-хозяев, в которые введен вектор (см., например, патенты США №№ 4,399,216; 4,634,665; и 5,179,017). Например, как правило, ген селектируемого маркера обеспечивает резистентность к лекарствам, таким как G418, гигромицин или метотрексат, клетки-хозяина, в которую введен вектор.
Стандартные методики молекулярной биологии можно применять для получения вектора рекомбинантной экспрессии, трансфекции клеток-хозяев, выбора трансформантов, культивирования клеток-хозяев и выделения молекулы антитела из культуральной среды. Например, полипептиды из настоящего изобретения могут быть выделены посредством аффинной хроматографии.
В одном варианте осуществления полипептид из настоящего изобретения очищают, как описано в WO 10/056550. В примерном варианте осуществления полипептид очищают от одного или нескольких загрязняющих компонентов путем: контакта смеси полипептидов и загрязняющего вещества (веществ) с носителем на основе Протеина А и/или с ионообменным носителем; в условиях, обеспечивающий связывание полипептида или адсорбцию на носителе; удаления одного или нескольких загрязняющих веществ путем промывания связывающего носителя в условиях, где полипептид остается связанным с носителем, и избирательной элюции полипептида с носителя путем элюции адсорбированной молекулы полипептида элюирующим буфером.
Полипептиды из настоящего изобретения могут также продуцироваться трансгенным животным. Например, патент США № 5,849,992 описывает способ экспрессии антитела в молочной железе трансгенного животного. Конструируют трансген, включающий специфичный для молока промотор и нуклеиновые кислоты, кодирующие молекулу и антитела, и сигнальную последовательность для секреции. Молоко, вырабатываемое самками таких трансгенных животных, включает интересующий секретируемый одиночный домен. Молекулу антитела можно очистить из молока, или в некоторых приложениях, использовать непосредственно.
Настоящее изобретение охватывает способы получения композиций, как определено в настоящей заявке.
Этапы очистки и изготовления композиции могут совпадать, например, когда полипептиды их настоящего изобретения элюируют с колонки с применением буфера в соответствии с настоящим изобретением. Альтернативно, композиции из настоящего изобретения можно приготовить путем замены буфера любыми подходящими способами, например, с помощью методик, широко применяемых в данной области техники, таких как диализ, ультрафильтрация, и т.д.
В некоторых вариантах осуществления способ получения композиции из настоящего изобретения может также быть связан с восстановлением лиофилизированной или высушенной распылением композиции, например, путем добавления воды или подходящего буфера (который может при необходимости включать дополнительные вспомогательные вещества).
Способы приготовления композиции в соответствии с настоящим изобретением могут включать дополнительные этапы, такие как розлив во флаконы, подходящие для клинического применения, такие как герметичные контейнеры и/или получение готовой лекарственной формы. Способы могут также включать дополнительные этапы, такие как распылительная сушка, лиофилизация или замораживание, например, замораживание насыпью. Изобретение также охватывает контейнеры, лекарственные формы, или другие продукты, полученные любыми способами, цитированными в настоящей заявке. Композиции из настоящего изобретения можно применять для хранения полипептидов из настоящего изобретения, например, полипептидов, включающих по меньшей мере один ISVD против vWF, таких как ALX 0081, как определено в настоящей заявке. Таким образом, изобретение охватывает способ хранения полипептидов из настоящего изобретения, как применяется в настоящей заявке, характеризующийся применением композиции, как определено в настоящей заявке. В частности, изобретение охватывает способы стабилизации полипептидов из настоящего изобретения для хранения, включающие, например, приготовление композиции, как описано в настоящей заявке. Хранение можно осуществлять в течение 1-36 месяцев, такого времени, как 1; 1,5; 3, 6, 9, 12, 18, 24, 30 или 36 месяцев, например, по меньшей мере 12 месяцев, при необходимости, при температуре от -70°C до +40°C, такой как -70°C, -20°C, +5°C, +25°C или +40°C, предпочтительно при температуре от -70°C до +25°C, более предпочтительно, при температуре от -20°C до +5°C. Таким образом, хранение может включать замораживание, лиофилизацию и/или распылительную сушку. Эти способы хранения могут дополнительно включать оценку физической и химической целостности агентов, связывающих vWF, как описано в настоящей заявке.
Настоящее изобретение также относится к способам анализа композиций, содержащих по меньшей мере один из агентов, связывающих vWF, как определено в настоящей заявке. В композициях можно определять любые параметры химической или физической нестабильности агентов, связывающих vWF, как определено в настоящей заявке. Например, композиции можно оценивать на присутствие продуктов деградации, например, низкомолекулярных производных, таких как протеолитические фрагменты; и/или химические производные, например, пироглутаматные варианты; и/или на крупномолекулярные производные, такие как агрегаты, агломераты, и т.д. Композицию можно также оценивать на общее содержание белка и/или активность. Каждый из различных способов анализа, упомянутых в настоящей заявке, можно применять в способе анализа из настоящего изобретения.
Таким образом, настоящее изобретение также относится к способу контроля и/или оценки качества и/или стабильности композиции, например, во время одного или более из производства, хранения и применения. Изобретение также относится к способу контроля качества композиции, например, оценки того, соответствует ли композиция спецификациям продукта, как описано в настоящей заявке. Изобретение в любом из этих аспектов включает одно или более, выбранное из сравнения с одним или несколькими эталонными образцами, анализ вариации от серии к серии, и постоянный мониторинг процесса производства.
Настоящее изобретение относится к любому продукту, связанному с композициями из настоящего изобретения, например, включающему их, или необходимому для производства или получения готовой формы, без какого-либо ограничения.
Например, настоящее изобретением относится к предмету производства, например, герметичному контейнеру, содержащему один или несколько композиций в соответствии с настоящим изобретением.
Изобретение также относится к фармацевтической лекарственной форме, например, лекарственной форме, пригодной для парентерального применения (например, интрадермального, внутримышечного, интраперитонеального, внутривенного и подкожного) пациенту, предпочтительно, пациенту - человеку, включающей одну или несколько композиций в соответствии с любым вариантом осуществления, описанным в настоящей заявке.
Лекарственная форма может быть, например, в формате предварительно заполненного шприца, ампулы, картриджа или флакона.
Также обеспечиваются наборы или изделия, включающие композицию из настоящего изобретения и инструкции по её применению, например, медицинским работником. Наборы или изделия могут включать флакон или шприц, содержащий композицию из настоящего изобретения, как описано в настоящей заявке.
Предпочтительно, флакон или шприц состоят из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера. Шприц, ампула, картридж или флакон могут быть произведены из любого подходящего материала, такого как стекло или пластик, и могут включать резиновые материалы, такие как резиновые пробки для флаконов и резиновые поршни и резиновые прокладки для шприцев и картриджей. Изобретение также относится к набору, содержащему одну или несколько композиций в соответствии с настоящим изобретением. Набор может дополнительно включать инструкции по применению и/или клиническую аннотацию к лекарству. В любом варианте осуществления продуктов, как определено в настоящей заявке, изобретение также охватывает наличие упаковочного материала, инструкций по применению, и/или клинических аннотаций к лекарству, например, как требуется особенностями регулирования.
С целью сравнения двух или более аминокислотных последовательностей, можно рассчитать процент «идентичности последовательности» между первой аминокислотной последовательностью и второй аминокислотной последовательностью (также обозначаемой как «аминокислотная идентичность») путем деления [числа аминокислотных остатков в первой аминокислотной последовательности, идентичных аминокислотным остаткам в соответствующих положениях во второй аминокислотной последовательности] на [общее число аминокислотных остатков в первой аминокислотной последовательности] и умножения на [100%], где каждая делеция, вставка, замена или добавление аминокислотного остатка во второй аминокислотной последовательности по сравнению с первой аминокислотной последовательностью считается различием по одному аминокислотному остатку (положению), т.е. «аминокислотным различием», как определено в настоящей заявке.
Альтернативно, степень идентичности последовательности между двумя аминокислотными последовательностями можно рассчитать с применением известного компьютерного алгоритма, такого как те, которые упоминались выше для определения степени идентичности последовательности для нуклеотидных последовательностей, вновь с применением стандартных установок.
Как правило, с целью определения процента «идентичности последовательности» между двумя аминокислотными последовательностями в соответствии со способом расчета, изложенным выше, аминокислотную последовательность с наибольшим числом аминокислотных остатков берут в качестве «первой» аминокислотной последовательности, а другую аминокислотную последовательность берут в качестве «второй» аминокислотной последовательности.
Кроме того, при определении степени идентичности последовательности между двумя аминокислотными последовательностями специалист в данной области техники может учитывать так называемые «консервативные» аминокислотные замены, которые могут в целом быть описаны как аминокислотные замены, в которых аминокислотный остаток замещен другим аминокислотным остатком схожей химической структуры, и которые оказывает незначительное влияние или по существу не оказывает влияния на функцию, активность или другие биологические свойства полипептида. Такие консервативные аминокислотные замены хорошо известны в данной области техник, например, из WO 04/037999, GB-A-3 357 768, WO 98/49185, WO 00/46383 и WO 01/09300; и (предпочтительные) типы и/или комбинации таких замен могут быть выбраны на основе соответствующих учений WO 04/037999, а также WO 98/49185, и из других ссылок, цитированных в настоящей заявке. Такие консервативные замены предпочтительно являются заменами, в которых одна аминокислота из следующих групп (а)-(е) заменена другим аминокислотным остатком в пределах той же самой группы: (а) малые алифатические, неполярные или слабо полярные остатки: Ala, Ser, Thr, Pro и Gly; (b) полярные, отрицательно заряженные остатки и их (незаряженные) амиды: Asp, Asn, Glu и Gln н; (с) полярные, положительно заряженные остатки: His, Arg и Lys; (d) большие алифатические, неполярные остатки: Met, Leu, Ile, Val и Cys; и (е) ароматические остатки: Phe, Tyr и Trp. Особо предпочтительными консервативными аминокислотными заменами являются следующие: Ala на Gly или на Ser; Arg на Lys; Asn на Gln или на His; Asp на Glu; Cys на Ser; Gln на Asn; Glu на Asp; Gly на Ala или на Pro; His на Asn или на Gln; Ile на Leu или на Val; Leu на Ile или на Val; Lys на Arg, на Gln или на Glu; Met на Leu, на Tyr или на Ile; Phe на Met, на Leu или на Tyr; Ser на Thr; Thr на Ser; Trp на Tyr; Tyr на Trp; and/or Phe на Val, на Ile или на Leu. Любые аминокислотные замены, применяемые к полипептидам, описанным в настоящей заявке, могут также быть основаны на анализе частот аминокислотных вариаций между гомологичными белками различных видов, разработанном Schulz et al., «Principles of Protein Structure», Springer-Verlag, 1978; на анализах структурообразующих потенциалов, разработанных Chou and Fasman, Biochemistry 13: 211, 1974 и Adv. Enzymol., 47: 45-149, 1978; и на анализе характера гидрофобности белков, разработанном Eisenberg et al., Proc. Natl. Acad. Sci. USA 81: 140-144, 1984; Kyte & Doolittle; J Molec. Biol. 157: 105-132, 1981, и Goldman et al., Ann. Rev. Biophys. Chem. 15: 321-353, 1986; все указанные источники включены во всей полноте посредством ссылки. Информация по первичной, вторичной и третичной структуре Нанотел® приведена в описании в настоящей заявке и общем предшествующем уровне техники, как цитировано выше. Кроме того, для этой цели кристаллическая структура VHH домена ламы, например, приведена в Desmyter et al., Nature Structural Biology, Vol. 3, 9, 803 (1996); Spinelli et al., Natural Structural Biology (1996); 3, 752-757; и Decanniere et al., Structure, Vol. 7, 4, 361 (1999). Дополнительную информацию о некоторых из аминокислотных последовательностей, обычных для VH доменов, образующих VH/VL интерфейс, и потенциальных камелизирующих доменах в этих положениях можно найти в предшествующем уровне техники, цитированном выше.
Настоящее изобретение также относится к способу лечения или профилактики vWF-зависимого заболевания, например, такого острый коронарный синдром (ОКС), транзиентная церебральная ишемическая атака, нестабильная или стабильная стенокардия, инсульт, инфаркт миокарда или тромботическая тромбоцитопеническая пурпура (ТТП); где указанный способ включает применение у субъекта фармацевтической композиции, содержащей композицию с соответствии с настоящим изобретением, обеспечивая снижение одного или нескольких симптомов, связанных с указанным vWF-зависимым заболеванием. В частности, указанным vWF-зависимым заболеванием является ТТП.
Кроме того, настоящее заболевание относится к способу лечения пациента - человека, восприимчивого или имеющего диагноз заболевания, характеризующегося как vWF-зависимое заболевание, включающему применение эффективного количества полипептида, содержащего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (VWF) у пациента - человека.
Настоящее изобретение обеспечивает способ лечения или профилактики vWF-зависимого заболевания, такого как ТТП, включающего применение у человека дозы 5-40 мг полипептида, включающего по меньшей мере один иммуноглобулиновый одиночный вариабельный домен (ISVD) против фактора фон Виллебранда (VWF), обеспечивающего снижение одного или нескольких симптомов, связанных с vWF-зависимым заболеванием.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанное применение полипептида, как описано в настоящей заявке, сопровождается в пределах 5 мин - 8 часов выполнением первого плазмообмена (ПО).
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанному применению полипептида, как описано в настоящей заявке, предшествует выполнение предварительного плазмообмена (ПО), в пределах 36 ч, предпочтительно 32, 30, 28, 26, 24, 22, 20, 18 или 16 ч, предпочтительно примерно 24 ч от указанного первого ПО.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, где указанный первый ПО сопровождается применением второй дозы 1-40 мг, предпочтительно 10 мг полипептида, как описано в настоящей заявке, в пределах от 5 мин до 8 ч, такого времени, как от 10 мин до 6 ч, или от 15 мин до 4 ч, например, в пределах 8 ч, 7 ч, 6 ч, 5 ч, 4 ч, 3 ч, 2 ч, 1 ч, 45 мин, 30 мин, 20 мин, 15 мин, 10 мин или даже 5 мин, например, где указанную вторую дозу указанного полипептида применяют в пределах 1-60 мин, такого времени, как 30 мин от указанного первого ПО, предпочтительно. путем подкожной инъекции.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, дополнительно включающее:
(i) проведение ПО; (сопровождающееся)
(ii) применение дозы 5-40 мг полипептида, как описано в настоящей заявке, спустя 15 мин-4 ч после указанного ПО на этапе (i); и
(iii) при необходимости, измерение количества тромбоцитов и/или активности ADAMTS13 у указанного пациента,
где этап (i) и этап (ii) повторяют один раз в сутки, пока количество тромбоцитов у указанного пациента не достигнет >150000/мкл, и/или активность ADAMTS13 не составит по меньшей мере 10%, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
Настоящее изобретение обеспечивает также лечение, как описано в настоящей заявке, дополнительно включающее применение один раз в сутки дозы 5-40 мг полипептида, как описано в настоящей заявке, в течение по меньшей мере 5, 10, 15, 20, 25, или даже 30 дней после того, как количество тромбоцитов у указанного пациента составит >150,000/мкл.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, дополнительно включающее применение один в раз в день дозы 5-40 мг полипептида, как описано в настоящей заявке, до тех пор, пока у указанного человека не будет достигнута ремиссия.
Настоящее изобретение обеспечивает лечение, как описано в настоящей заявке, включающей применение указанного полипептида, пока активность ADAMTS13 не составит по меньшей мере 10%, как по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50% от стандартной активности ADAMTS13.
В другом варианте осуществления настоящего изобретения обеспечивается изделие, содержащий материалы, пригодные для лечения заболевания, как описано выше. Изделие включает контейнер, этикетку и упаковочный вкладыш. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, эффективную для лечения состояния, и может иметь стерильный порт доступа (например, контейнер может быть мешком для внутривенного раствора или флаконом, имеющим пробку, прокалываемую иглой для гиподермальных инъекций). По меньшей мере один активный агент в композиции является полипептидом из настоящего изобретения, таким как ALX 0081. Этикетка, прикрепленная к контейнеру или связанная с ним, указывает, что композиция применяется для лечения выбранного состояния. Изделие может дополнительно включать второй контейнер, содержащий фармацевтически пригодный буфер, такой как физиологический раствор с фосфатным буфером или физиологический раствор с цитратным буфером, как описано в настоящей заявке. Он может дополнительно включать другие материалы, необходимые для потребителя или с коммерческой точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Настоящее изобретение обеспечивает набор или изделие, включающий контейнер, содержащий полипептид, как описано в настоящей заявке, или рецептуру, как описано в настоящей заявке, и инструкции по применению.
Настоящее изобретение обеспечивает набор или изделие, как описано в настоящей заявке, где композиция присутствует во флаконе или шприце для инъекций.
Настоящее изобретение обеспечивает набор или изделие, как описано в настоящей заявке, где композиция присутствует в предварительно заполненном шприце для инъекций.
Настоящее изобретение обеспечивает набор или изделие, как описано в настоящей заявке, где шприц или флакон состоит из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера.
Варианты осуществления, иллюстрированные и обсужденные в настоящем описании, предназначены только для того чтобы показать специалисту в данной области техники наилучший путь, известный авторам настоящего изобретения, для осуществления и применения изобретения. Модификации и варианты вышеописанных вариантов осуществления изобретения возможны без отдаления от изобретения, как понятно специалисту в данной области техники в свете вышеуказанных учений. Таким образом, понятно, что в пределах объема формулы изобретения и её эквивалентов изобретение может осуществляться иначе, чем это конкретно описано.
Изобретение далее описано посредством следующих не ограничивающих предпочтительных аспектов, примеров и фигур.
Полное содержание всех ссылок (включая литературные ссылки, изданные патенты, опубликованные патентные заявки, и одновременно ожидающие решения патентные заявки), цитированных на протяжении настоящей заявки, настоящим специально включено посредством ссылки, в частности, учение, упомянутое выше.
Сокращения
ПР побочные реакции
ОКС острый коронарный синдром
ADAMTS13 дезинтегрин-подобные и металлопротеазные с тромбоспондином повторы 13
ALX 0081 Каплацизумаб
ОИМ Острый инфаркт миокарда
BNP мозговой натрийуретический пептид
ИМТ Индекс массы тела
BU Единицы Bethesda
CDR Гипервариабельная область
кИЭФ Капиллярное изоэлектрофокусирование
dAb Однодоменное антитело
ELISA ТвердофазныйИммуноферментный анализ
ОР Отношение рисков
ISVD Иммуноглобулиновый одиночный вариабельный домен
ITT популяция «с назначенным исследуемым лечением»
в.в. внутривенное
FR каркасная область
KA константа ассоциации
KD константа диссоциации
ЛДГ Лактат-дегидрогеназа
НСЭ Нейрон-специфическая энолаза
NT proBNP N-концевой про-мозговой натрийуретический пептид
ПО плазмообмен
ПП «без нарушения протокола»
RICO Ристоцетин-кофакторная активность
ОФ-ВЭЖХ Обращенно-фазовая высокоэффективная жидкостная хроматография
СНЯ серьезное нежелательное явление
п.к. подкожный
scFv одноцепочечный вариабельный фрагмент
С/Д Сольвент-детергентный
Э-ВЭЖХ Эксклюзионная высокоэффективная жидкостная хроматография
ППР Поверхностный плазмонный резонанс
TnI Тропонин I
TnT Тропонин T
СОППЛ Синдром острого посттрансфузионного повреждения легких
ТТП Тромботическая тромбоцитопеническая пурпура
TTR время до ответа
ULN Верхняя граница нормы
ULvWF Ультра-большой фактор фон Виллебранда
VH вариабельный домен тяжелой цепи
VHH последовательность вариабельного домена тяжелой цепи, полученная из антитела из тяжелой цепи
VL вариабельный домен легкой цепи
vWF Фактор фон Филлебранда
Примеры
1. Действующие нормативы
Все человеческие образцы, используемые в разделе «Примеры», были получены из коммерческих источников или от здоровых добровольцев (после получения всех необходимых согласий и разрешений), и применялись в соответствии с применяемыми законодательными и нормативными требованиями (включая те, которые относятся к медицинской тайне и неразглашению информации о здоровье пациента).
Клинические испытания проводили в соответствии с применяемыми законами и требованиями (включая Хельсинкскую декларацию и принципы медицинской тайны и защиты информации о здоровье пациента) и после получения всех необходимых разрешений (включая разрешение соответствующих этических комитетов) и согласий (включая информированное согласие индивидуумов, принимающих участие).
Задачи и содержание этого клинического испытания, а также его результаты были обработаны как конфиденциальные и не были доступными для третьих лиц. Сотрудники, участвующие в исследовании, выполняли требование конфиденциальности. Все неиспользованные лекарства либо были возвращены заявителю, либо уничтожены.
2. Влияние ALX 0081 на адгезию тромбоцитов к ULvWF, полученному из эндотелиальных клеток, и на активность ADAMTS13.
Задача: задачей этого исследования была оценка того, может ли полипептид из настоящего изобретения, такой как ALX 0081, ингибировать адгезию тромбоцитов к ULvWF. Это может служить в качестве доказательства концепции для применения полипептида из настоящего изобретения, такого как ALX 0081, в лечении пациентов с острым эпизодом ТТП. В исследовании также определяли влияние полипептида из настоящего изобретения, такого как ALX 0081, на активность ADAMTS13.
Способ: использовали тест в проточной камере для оценки того, может ли полипептид из настоящего изобретения, такой как ALX 0081, ингибировать взаимодействие между тромбоцитами и ULvWF в соответствии с Sixma (Sixma et al. 1998 Thromb Res 92: S43-S46). Вкратце, эндотелиальные клетки культивировали на покровных стеклах и стимулировали, таким образом, обеспечивая секрецию ULvWF. В плазму больных ТТП добавляли тромбоциты, и перфузировали над стимулированными клетками. Нити тромбоцитов, прикрепленные к ULvWF, наблюдали посредством видеомикроскопии в режиме реального времени. Эксперимент повторяли в присутствии возрастающих концентраций полипептида из настоящего изобретения, такого как ALX 0081. Для определения влияния полипептида из настоящего изобретения, такого как ALX 0081, на расщепление ULvWF посредства ADAMTS13, использовали два типа экспериментов. В первом эксперименте расщепление тромбоцитарных нитей посредством ADAMTS13 оценивали при отсутствии избытка полипептида из настоящего изобретения, такого как ALX 0081. Во втором эксперименте рекомбинантный фрагмент, состоящий из А1-А2-А3 домена vWF, использовали для оценки ингибирующего влияния полипептида из настоящего изобретения, такого как ALX 0081, на ADAMTS13.
Результаты: ALX 0081 ингибировал формирование тромбоцитарных нитей на ULvWF при всех тестированных концентрациях, и не оказывал влияние на отделение тромбоцитарных нитей ADAMTS13. Полипептид из настоящего изобретения, такой как ALX 0081, также не оказывал влияния на расщепление фрагмента рекомбинантного А1-А2-А3 домена vWF посредством ADAMTS13. Полипептид из настоящего изобретения, такой как ALX 0081, также был не способен к удалению тромбоцитов из уже образованных нитей в этом эксперименте.
Заключение: это исследование обеспечивает доказательство предположения, что полипептид из настоящего изобретения, такой как ALX 0081, можно применять для лечения больных ТТП. Было также доказано, что полипептид из настоящего изобретения, такой как ALX 0081, не нарушает активность ADAMTS13.
3. Критерии пригодности
Пациенты должны были удовлетворять следующим критериям пригодности для участия в исследовании.
Критерии включения
1. Возраст 18 лет или старше.
2. Мужчины или женщины, готовые соблюдать требования подходящего режима контрацепции.
3. Пациенты с клиническим диагнозом ТТП.
4. Необходимость ПО (допустима одна, единственна процедура ПО перед рандомизацией в исследовании).
5. Доступность индивидуума для последующего наблюдения.
6. Полученное, подписанное и датированное информированное согласие.
Критерии исключения
1. Количество тромбоцитов, большее или равное 100,000/мкл.
2. Тяжелая острая инфекция, на которую указывает сепсис (необходимость сосудосуживающих средств с позитивными культурами крови или без них).
3. Клиническое подтверждение кишечной инфекции с E. coli 0157 или родственным организмом.
4. Анти-фосфолипидный синдром
5. Диагноз ДВС
6. Беременность или кормление грудью
7. Тромботическая микроангиопатия, ассоциированная с гемопоэтическими стволовыми клетками или трансплантацией костного мозга.
8. Известная врожденная ТТП.
9. Активное кровотечение или высокий риск кровотечения.
10. Неконтролируемая артериальная гипертензия.
11. Известное хроническое лечение антикоагулянтами, которое нельзя безопасно прекратить, включая антагонисты витамина К, гепарин или НМГ, и нестероидные противовоспалительные соединения, не связанные с ацетилсалициловой кислотой, но не ограничиваясь ими.
12. Тяжелое или опасное для жизни клиническое состояние, иное, чем ТТП, которое может препятствовать участию в испытании.
13. Индивидуумы с онкопатологией с вероятной продолжительностью жизни менее 3 месяцев.
14. Индивидуумы с известным или предполагаемым карциноматозом костного мозга.
15. Индивидуумы, которые не могут выполнять требования и процедуры протокола исследования.
16. Известная гиперчувствительность к активному веществу или к вспомогательным веществам исследуемого лекарственного средства.
17. Тяжелое повреждение печени, соответствующее 3 степени токсичности, определенной шкалой Общих терминологических критериев оценки нежелательных явлений. Для ключевых параметров печени определяется следующим образом:
- билирубин > 3 x ВГН (необходимо для дифференцировки изолированного повышения непрямого билирубина из-за гемолиза, это является не параметром исключения, а связано с заболеванием).
- АлАТ/АсАТ > 5 х ВГН
- АП > 5 х ВГН
- гамма-глутамилтрансфераза (ГГТ) > 5 х ВГН
18. Тяжелое хроническое нарушение функции почек, как определено СКФ<30 мл/мин.
4. Дизайн исследования
Настоящее исследование проводили в виде многоцентрового, односторонне слепого, параллельного, рандомизированного, плацебо-контролируемого испытания II фазы (Titan trial). Исследуемой популяцией были симптоматичные пациенты с острыми эпизодами приобретенной ТТП, которым требовалось лечение ПО. После подтверждения пригодности для участия в исследовании (см. Пример 3), пациенты были рандомизированы в отношении 1:1 для приема ALX 0081 или плацебо в виде вспомогательного лечения для ПО (Фигура 1). Пациентов рандомизировали перед началом лечения ПО. Однако в исключительных случаях (из-за необходимости или способности начала ПО во временные рамки, не позволяющие выполнить все необходимые скрининговые или базовые процедуры исследования), пациентов рандомизировали после предшествующей одиночной процедуры ПО («предшествующего ПО»), но перед началом следующей процедуры ПО («первого ПО»). Эту общую следующую процедуру ПО начинали в пределах 24 часов после окончания предшествующей процедуры ПО, и считали первым ПО при испытании («первым ПО»).
У пациентов проводили следующие фазы во время испытания:
- Скрининг и базовые анализы после поступления в больницу;
- Фаза лечения
- Одиночное в.в. болюсное исследование лекарства, применяемого посредством струйного вливания;
- Ежедневный ПО после дополнительной фазы п.к. применения;
- Фаза п.к. применения после ежедневного ПО (включая ослабление ПО, если применяется, и изучение лекарства после ПО в течение 30 дней после самого последнего ПО).
- Фаза последующего наблюдения.
Пациенты получали наилучший медицинский уход и лечение, признанное подходящим исследователем в каждом участке, и в соответствии с руководством по лечению ТТП. Максимальная общая продолжительность индивидуального участия в исследовании составила максимум 15 месяцев; фаза лечения до 90 суток и последующий период наблюдения в течение максимум 1 года после ремиссии или спустя 90 дней лечения, в зависимости от того, что отмечалось первым. В целом, пациентов госпитализировали в течение по меньшей мере 1 суток после последнего ежедневного ПО.
Исследуемое лекарство применяли в качестве вспомогательного лечения в определенное время по отношению к процедурам ПО. Исследуемое лекарство состояло из 10 мг каплацизумаба («группа лечения») или плацебо («группа плацебо»), один или два раза в день.
4.1. Первое применение лекарства
Пациенты получали первый в.в. болюс из 10 мг ALX 0081 или плацебо посредством струйного введения за 15 мин - 6 ч перед началом первого ПО. Этот первый ПО сопровождался п.к. введением 10 мг исследуемого лекарства в пределах 30 мин после окончания первой процедуры ПО.
Во время полного периода лечения ПО (включая ослабление и ПО, проведенный при обострениях), исследуемое лекарство применяли ежедневно посредством п.к. инъекций.
При запланированном 1 ПО в сутки применяли 10 мг исследуемого лекарства в пределах 30 минут после окончания процедуры ПО.
Если было запланировано 2 ПО в сутки, 10 мг исследуемого лекарства применяли в пределах 30 минут после окончания каждой процедуры ПО. Таким образом, максимальная суточная доза исследуемого лекарства составила 20 мг.
Если было запланировано менее 1 ПО в сутки (т.е. в режиме ослабления), применяли 10 мг исследуемого лекарства в сутки. В дни с ПО применение исследуемого лекарства осуществляли в пределах 30 мин после окончания процедуры ПО; в дни без ПО исследуемое лекарство применяли в пределах 24 ч (±1 ч) после предыдущего применения.
Ежедневное п.к. применение исследуемого лекарства по 10 мг продолжали в течение 30 дней после самого последнего ПО (включая ослабление).
4.2. Первичная конечная точка
Первичной конечной точкой этого исследования II фазы было время до ответа (ВДО), на основе следующих критериев: восстановление тромбоцитов ≥ 150,000/мкл. Для квалификации на соответствие конечной точке, ответ должен был подтвердиться спустя 48 часов после исходного наблюдения восстановления тромбоцитов, равного или большего 150,000/мкл путем определения de novo тромбоцитов ≥ 150,000/мкл и лактатдегидрогеназы (ЛДГ) ≤ 2 верхних границ нормы (ВГН), т.е. «подтвержденного тромбоцитарного ответа»). Количество тромбоцитов является основным лабораторным показателем для терапевтического решения для пациентов с ТТП. Это основано на том факте, ULvWF-опосредованная агрегация тромбоцитов является общим патофизиологическим механизмом, лежащим в основе ТТП, приводящим к тяжелой тромбоцитопении и микроангиопатической гемолитической анемии, которые являются основными признаками в диагностике ТТП (Scully et al. supra).
4.3. Определение активности ADAMTS13.
Активность ADAMTS13 и функциональную ингибирующую активность определяли посредством флуорогенного анализа с применением субстрата FRETS-VWF73 (Kokame et al. 2005. Br J Haematol 129(1):93-100; Kremer Hovinga et al. 2006 J Thromb Haemost 4(5):1146-8).
Вкратце, анализ FRETS-VWF73 проводили по существу, как описано (Kokame et al. 2005 supra), со следующими модификациями: Pefabloc SC (Boehringer, Мангейм, Германия) добавляли в тот же самый буфер для анализа (95 ммоль L-1 Бис-Трис, 25 ммоль L-1 СаСl2, 0,005% Твин-20, рН 6,0) в итоговой концентрации 1 ммоль L-1. Калибровку анализа проводили с применением пула нормальной плазмы человека (NHP; Swiss Red Cross Blood Services, Берн, Швейцария), разбавленной 1:25 (100%) в буфере для анализа. Дополнительные калибровочные образцы были получены путем серийных предварительных разведений NHP 3:4 (75%), 1:2 (50%), 1:4 (25%), 1:10 (10%), 1:20 (5%), 1:50 (2%) и 1:100 (1%) в инактивированной нагреванием NHP, инкубации в течение 30 минут при 56°С с последующим центрифугированием в течение 15 мин при 15000 g для коррекции эффекта матрикса плазмы в нижнем диапазоне активности стандартной кривой. Все эти стандартные образцы, а также инактивированную нагреванием NHP (0% ADAMTS13 активности) и все опытные образцы затем разбавляли 1:25 в буфере для анализа. Затем 25 мкл каждого разбавленного стандартного или взятого от пациента образца инкубировали при 37°С в 384-луночном белом планшете (NUNC, Роскилле, Дания). Спустя 10 мин добавляли 25 мкл 4 мкмоль L-1 FRETS-VWF73 пептидного субстрата, растворенного в буфере для анализа, в каждую лунку, и регистрировали развитие флуоресценции при 37°С во флуоресцентном ридере для микропланшетов (GENios, Tecan, Цюрих, Швейцария), оснащенном 340 нм фильтром возбуждения (ширина полосы 35 нм) и 450 фильтром испускания (ширина полосы 25 нм). Скорость реакции рассчитывали путем линейного регрессионного анализа (Passing-Bablok) развития флуоресценции от 5 (цикл 2) до 60 мин (цикл 13). Тангенс угла наклона регрессионной кривой рассчитывали для каждого калибровочного образца, и использовали для получения калибровочной кривой (линия тренда: y = ax + b; где x = ADAMTS13 (%), а y = дельта ОЕФ/дельта времени). Затем рассчитывали активность ADAMTS13 (%) образца как: (y - b) x 1/a.
Активность функционального ингибитора ADAMTS13 определяли тем же самым флуорогенным способом с FRETS-VWF73 путем определения остаточной ADAMTS13 активности нормальной плазмы человека после 1:1 (о/о) инкубации в течение 2 часов при 37°С с инактивированной нагреванием плазмой человека (30 мин при 56°С).
Для каждой анализируемой серии получали калибровочную кривую с применением пула нормальной плазмы человека (NHP; Swiss Red Cross Blood Services, Берн, Швейцария), разбавленной 1:25 (100%) в буфере для анализа. Дополнительные образцы для калибровки получали путем серийных предварительных разведений NHP 1:2 (50%), 1:4 (25%), 1:10 (10%), 1:20 (5%), 1:50 (2%) и 1:100 (1%) в инактивированной нагреванием NHP. Все калибровочные точки наносили в одном экземпляре. Критерии соответствия: (1) Тангенс угла наклона стандартной кривой должен быть >6,0; и (2) R² регрессии итогового графика должен быть >0,98 (или R >0,9899). В ином случае анализ отвергали.
5. Результаты у пациентов с ТТП
5.1. Характеристика индивидуумов и анализ популяций.
В исследовании II фазы участвовало 75 пациентов, которых рандомизировали, как указано в таблице 2.
Первичной популяцией для анализа была популяция «назначенного лечения» (ITT), которая состояла из всех рандомизированных индивидуумов в соответствии с рандомизированным распределением в группы лечения. Кроме того, для анализов эффективности использовали популяцию «без нарушения протокола» (ПП). Популяция ПП является подгруппой из ITT популяции, и состоит из всех рандомизированных индивидуумов, в соответствии с рандомизированным распределением в группы лечения, за исключением всех основных отклонений от протокола и нарушений протокола.
Таблица 2
В заключение, отмечалось равномерное распределение в обеих группах лечения, т.е. у пациентов, получавших каплацизумаб (группа лечения) и пациентов, получавших плацебо (группа плацебо). Исследуемые группы были также хорошо уравновешенными по возрасту, национальности/расе и ИМТ.
Базовые характеристики различных параметров оценивали у пациентов группы лечения и группы плацебо. В таблице 3 представлены базовые значения для количества тромбоцитов и ЛДГ. Повышение уровня ЛДГ является признаком усиления гемолиза и/или ишемии тканей.
Таблица 3
Отмечается слегка сниженное базовое количество тромбоцитов для группы каплацизумаба. В обеих группах среднее количество тромбоцитов было очень низким на базовом уровне, что соответствовало тяжести заболевания, но также являлось показателем того, что все представленные индивидуумы пригодны для включения, и не имелось смещения к меньшей тяжести заболевания у индивидуумов с тромбоцитопенией.
Значения ЛДГ были сопоставимыми для обеих групп лечения.
В таблице 4 представлены исходные значения vWF:Ag и активности ADAMTS13.
Таблица 4
Обе группы лечения были хорошо уравновешены по vWF: Ag и активности ADAMTS13. Более половины индивидуумов с идиопатической ТТП были определены как имеющие <5% активности ADAMTS13.
5.2. Результаты исследования: первичные конечные точки.
Время для ответа маркеров крови контролировали в условиях выживания. Первичная точка времени до ответа маркеров крови включала восстановление тромбоцитов до ≥150,000/мкл. Уровни тромбоцитов представляют надежный суррогатный маркер для активности ТТП заболевания. Период от нуля до наступления события был установлен 30 дней.
Результаты показаны в таблице 5.
Данные оценивали в соответствии со стратификацией (1 ПО перед рандомизацией: ДА и НЕТ); которые группировали до общего отношения рисков для полной популяции ТТИ 2,197 со значением р=0,013 для общей популяции ТТП. Отношение рисков означает, что в любое время индивидуумы, получавшие каплацизумаб, более чем в два раза чаще достигали первичной конечной точки подтвержденного восстановления тромбоцитов, по сравнению с индивидуумами, получавшими плацебо.
Сокращение времени до подтвержденного ответа тромбоцитов (первичная конечная точка):
- В группе индивидуумов без ПО перед рандомизацией медиана 4,94 дня в группе плацебо сокращалась до 3,00 дня в группе каплацизумаба: 39% снижение (ПО перед рандомизацией = НЕТ).
- В группе индивидуумов, получавших один ПО перед рандомизацией, медиана 4,31 дня в группе плацебо уменьшилась до 2,44 дня в группе каплацизумаба: 43% снижение (ПО перед рандомизацией = ДА).
Медианы времени 4,31 дня и 4,92 дня в группе плацебо 2 страты (1 ПО перед рандомизацией, ДА и НЕТ) были ниже, чем ожидалось из медицинской литературы и данных исследователей (6 дней, см. Bandarenko et al. Journal of Clinical Apheresis 1998; 13: 133-141). Это показывает, что даже при улучшенном стандарте лечения по сравнению с историческими данными, лечение каплацизумабом является более эффективным.
95% ДИ для времени подтвержденного ответа тромбоцитов был в 2-3 раза уже для группы каплацизумаба, по сравнению с группой плацебо. Это показывает, что время для регрессии заболевания менее вариабельно в группе лечения каплацизумабом, чем в группе плацебо.
Таблица 5
N=36
N=39
* 1 ПО перед рандомизацией.
5.3. Результаты исследования: обострения.
В пределах ITT популяции определяли долю индивидуумов с обострениями. Обострение означает рекуррентную тромбоцитопению после подтвержденного ответа тромбоцитов, требующую повторного начала ежедневного применения ПО спустя ≥ 1 день но ≤ 30 дней после последнего ПО.
Результаты изображены в таблице 6.
Таблица 6
Обострения в 3 раза чаще наблюдались в группе плацебо, по сравнению с группой каплацизумаба.
Это подтверждает наблюдение, что полипептид из настоящего изобретения, такой как ALX 0081, может быть единолично ответственным за лечение и/или облегчение (симптомов) ТТП.
5.4. Результаты исследования: рецидивы
Определяли число индивидуумов с рецидивами ТТП. Рецидив ТТП определяется как проявление ТТП de novo, отмечаемое спустя более 30 дней после последнего ежедневного ПО. В таблице 7 показана доля индивидуумов с обострениями и/или рецидивом в 1-й месяц после окончания лечения в ITT популяции.
Таблица 7
В группе каплацизумаба отмечалось больше рецидивов, чем в группе плацебо, где уравнивается общее число.
Рецидивы в группе каплацизумаба возникали часто в пределах нескольких дней после прекращения лечения каплацизумабом. Это скорее подразумевает возможное «отсроченное» обострение, чем рецидив. Таким образом, лечение каплацизумабом (КАП), возможно, имело слишком короткую продолжительность для некоторых индивидуумов. Действительно, большее число ранних рецидивов в группе КАП обосновывает защитный эффект и требует более продолжительного лечения КАП у некоторых пациентов. Это означает, что лечение каплацизумабом нужно продолжать в течение более длительных периодов.
Интересно отметить, что в обеих анализируемых группах рецидивы были более выражены у пациентов с базовой активностью ADAMTS13 < 5%, хотя даже активность ADAMTS13 определялась только у части пациентов. Это может указывать, что пациенты с базовой активностью ADAMTS13 < 5% более подвержены рецидивам (или обострениям), и лечение каплацизумабом нужно продолжать в течение еще более продолжительных периодов, по сравнению с пациентами с более высокой активностью (см. Пример 5.8).
5.5. Результаты исследования: полная ремиссия.
Оценивали число индивидуумов с полной ремиссией в ITT популяции. Полная ремиссия при этом определяется как подтвержденный ответ тромбоцитов при отсутствии обострений. Результаты показаны в таблице 8.
Таблица 8
В группе каплацизумаба было в 1,6 раз больше индивидуумов с полной ремиссией, по сравнению с группой плацебо. Большая доля полной ремиссии, вместе с более быстрым и узким распределением времени до подтвержденного ответа тромбоцитов поддерживает более высокую прогнозируемость ответа пациентов на ПО в группе КАП, и отражена в числе дней ПО. Число последующих дней ПО составило (среднее значение ± стандартное отклонение) 6,6 ± 3,4 дня для КАП против 8,1 ± 6,5 дней для ПЛЦ с общим объемом применяемой плазмы, включая ослабление лечения, 22,5 ± 15,9 литров в группе КАП против 28,4 ± 21,3 литра для ПЛЦ. Эффект выглядит более выраженным в подгруппе индивидуумов с низкой базовой активностью ADAMTS13, даже хотя данные по базовой активности ADAMTS13 являются неполными для группы каплацизумаба (см. Пример 5.8).
5.6. Результаты исследования: оценка безопасности.
Оценивали частоту нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ), обращая особое внимание на кровотечение, связанное с СНЯ и иммуно-зависимыми СНЯ. Оценка СНЯ включала геморрагию после введения катетера, сепсис, тромбоз катетера, пневмоторакс, гиперволемию, гипоксию, гипотензию, анафилактоидные реакции и СОППЛ. Число серьезных нежелательных явлений было схожим в обеих анализируемых группах: 57% в группе каплацизумаба и 51% в группе плацебо. Число нежелательных явлений было также схожим в анализируемых группах: 97% в группе каплацизумаба и 100% в группе плацебо. Число индивидуумов с НЯ, связанными с кровотечением, было слегка повышено в группе каплацизумаба (54%), по сравнению с группой плацебо (38%).
Наиболее выраженным риском применяемых в настоящее время антитромботических агентов является повышенный геморрагический диатез или явное кровотечение. Помимо любых неожиданных эффектов, кровотечение также представляет наиболее существенный фактор опасности для каплацизумаба. В этом контексте, каплацизумаб исследовали на доклинической хирургической модели кровотечения. В этом исследовании хирургическая кровопотеря у животных, получавших каплацизумаб, была сопоставимой с кровопотерей у животных, получавших Гепарин®, и в 2-3 раза меньше, чем у животных, получавших Plavix® и ReoPro®, соответственно. Хотя это является положительным признаком того, что каплацизумаб может быть безопаснее, чем Plavix® и ReoPro®, с точки зрения риска кровотечения, его оценивали у здоровых лиц. Как указано выше, больные ТТП отличаются по многим аспектам от здоровых лиц в связи с vWF. Экспериментальное лечение было прекращено из-за нежелательного явления у 4 пациентов, получавших каплацизумаб, и 2 пациентов, получавших плацебо. Однако повышение тенденции к кровотечению было хорошо контролируемым.
ТТП представляет потенциальную опасность для жизни. Отмечалось 2 случая смерти (5,4%) в испытании, оба в группе плацебо. Отмечается, что частота смерти в группе плацебо меньше описанной в литературе (10-30%). Это позволяет сделать вывод, что исход ТТП улучшился за счет более эффективных стандартов медицинской помощи (в настоящем исследовании).
5.7. Результаты исследования: дополнительно оптимизированный протокол лечения.
Дополнительно оптимизированный протокол лечения был разработан авторами настоящего изобретения, на основе идеи, что распределение времени подтвержденного ответа тромбоцитов сокращено и не асимметрично и не смещается вправо (к более продолжительному времени ответа) в группе КАП, по сравнению с группой плацебо.
В дополнительно оптимизированном протоколе лечения всех индивидуумов лечили по существу так, как изложено выше в пункте 4, «Дизайн исследования», но со следующей основной модификацией: период лечения ПО был установлен 3-5 дней, такой как 3 дня, или 4 дня, или 5 дней, предпочтительно 3 дня. Период лечения ПО не зависел от восстановления тромбоцитов (> 150,000/мкл). Ежедневное п.к. введение исследуемого лекарства продолжали в течение по меньшей мере 10 дней, такого времени, как 20 дней или 30 дней после самого последнего ПО, но предпочтительно в течение по меньшей мере 10 дней, такого времени, как 20 дней или 30 дней после восстановления тромбоцитов до > 150,000/мкл. При оценке дополнительно оптимизированного протокола лечения, первичной конечной точкой было число обострений, как определено выше.
В дополнительно оптимизированном протоколе лечение снизилась нагрузка на пациента и затраты.
5.8. Активность ADAMTS13
Анализ проводили для дополнительной оценки активности ADAMTS13 в качестве маркера активности основного заболевания и для оценки активности ADAMTS13 в качестве маркера для определения оптимальной продолжительности лечения каплацизумабом, чтобы сохранить полезный эффект лечения.
В связи с этим, когда активность ADAMTS13 была <10%, то определяли активность основного заболевания. При активности ADAMTS13 >10% полагали, что не было активности основного заболевания.
Обострения и рецидивы были связаны с доступными данными активности ADAMTS13 пациентов. Если рецидиву предшествовал постоянно низкий уровень ADAMTS13 (<10%) во время лечения, он считался рецидивом настоящего эпизода. Если рецидиву предшествовал уровень активности ADAMTS13 ≥10% во время лечения, он считался эпизодом ТТП de novo. Пациенты, исключенные из анализа, были (i) пациентами с заболеванием, не опосредованным ADAMTS13 (базовый уровень ≥10%) (n=3), и (ii) пациентами с недостаточными данными (n=12).
(i) Пациенты с обострениями или рецидивами:
- Каплацизумаб: 13/16 (81%) имели значения активности ADAMST13 ≥10% близко к прекращению лечения;
- Плацебо: 14/16 (88%) имели значения активности ADAMST13 ≥10% близко к прекращению лечения.
Следовательно, у большинства пациентов без обострений или рецидивов активность ADAMTS13 восстанавливалась до уровней выше 10%, позволяя сделать предположение о разрешение имеющегося эпизода ТТП.
(ii) Пациенты с обострениями
- Каплацизумаб: 2/3 (67%) имели значения активности ADAMST13 <10% близко к обострению;
- Плацебо: 7/8 (88%) имели значения активности ADAMST13 <10% близко к обострению;
Следовательно, у большинства пациентов с обострениями ТТП активность ADAMTS13 ниже 10%, что свидетельствовало о неразрешенной активности заболевания, ведущей к обострению.
(iii) Пациенты с рецидивами имеющегося эпизода ТТП
- Каплацизумаб: 7/7 (100%) имели значения активности ADAMST13 <10% близко к прекращению лечения; рецидивы возникали в пределах 10 дней после прекращения лечения.
- Плацебо: Не выявлено - все рецидивы были «de novo».
Следовательно, у всех индивидуумов в группе каплацизумаба с рецидивами, возникающими вскоре после окончания лечения, была постоянно низкая активность ADAMTS13 (<10%), что указывало на продолжение заболевания.
(iv) Пациенты с рецидивом de novo.
- Каплацизумаб: 4/4 (100%) имели значения активности ADAMST13 ≥10% близко к прекращению лечения; рецидивы возникали в пределах ≥30 дней после прекращения лечения (диапазон: 30-167 дней). У всех 4 пациентов активность ADAMTS13 вновь была <10% ко времени рецидива.
- Плацебо: 2/3 (67%) имели значения активности ADAMST13 ≥10% близко к прекращению лечения; рецидивы возникали в пределах ≥30 дней после прекращения лечения (диапазон: 30-167 дней). Нет данных, доступных ко времени рецидива.
Следовательно, у большинства пациентов с рецидивом de novo активность ADAMTS13 восстанавливается до уровней выше 10% близко к прекращению лечения, позволяя сделать предположение о разрешении имеющегося эпизода ТТП; значения вновь были низкими (<10%) ко времени рецидива, указывая на новый эпизод ТТП.
(v) Заключение
Данные поддерживают применение активности ADAMTS13 в качестве прогностического маркера рецидивов ТТП и его потенциал для решений о лечении.
Активность ADAMTS13 позволяет прогнозировать рецидивы, которые развиваются вскоре после прекращения лечения каплацизумабом.
Эти рецидивы считаются рецидивами имеющегося эпизода ТТП (неразрешенной активности заболевания, на основе постоянно низкой активности ADAMTS13).
Было показано, что 30-дневный период лечения (после ПО) каплацизумабом оказывает значительное влияние на число обострений.
Продление периода лечения каплацизумабом для пациентов с риском рецидива (т.е. с активностью основного заболевания на основе активности ADAMTS13) поддержит защитные эффекты каплацизумаба, пока основное заболевание не будет адекватно вылечено и разрешено.
Наоборот, профилактическое лечение каплацизумабом снизит риск острого эпизода ТТП.
5.9. Результаты исследования: маркеры повреждения органов
Характерные окклюзии микрососудов у больных ТТП могут приводить к ишемии органов в организме, включая головной мозг, сердце, и в меньшей степени почки.
Сообщалось, что острый инфаркт миокарда (ОИМ) является ранним осложнением ТТП на основе клинического диагноза ОИМ (Patschan et al. 2006 Nephrology, dialysis, transplantation 21: p.1549-54) и результатов аутопсии (Hosler et al. Archives of pathology & laboratory medicine, 2003. 127(7): p.834-9). На основе высокого уровня сывороточной лактат-дегидрогеназы (ЛДГ) и тропонина I (ТпI) было показано, что пациенты с клинически предполагаемой ТТП подвержены высокому риску развития ОИМ. Повышенные уровни тропонина Т были связаны со смертностью и острым ухудшением заболевания. Умершие индивидуумы имели более высокие уровни тропонина Т, в то время как не отмечено случаев смерти в группе с нормальными уровнями тропонина Т. Гистологически подтверждено широкое распространения тромбоза микрососудов миокарда у умерших индивидуумов (Hughes et al. 2009 J.Thromb.Haemost. 7: p.529-536). Эти результаты позволяют предположить, что более быстрое снижение ишемии микрососудов миокарда, по результатам определения тропонина при имеющемся эпизоде ТТП может оказывать положительное влияние на клинический исход, например, снизить риск повреждения органов, таких как головной мозг, сердце и почки. Другие ретроспективные отчеты показывают схожие результаты острого и долговременного поражения сердца у больных ТТП, включая инфаркты миокарда (Wahla et al. 2008 Eur. J. Haem. 81: p.311-6) и другие патологии сердца, такие как инфаркты, аритмии, кардиогенный шок и внезапную сердечную смерть (Hawkins et al. 2008 Transfusion 48: p.382-92).
В ретроспективном исследовании высокие уровни ЛДГ при поступлении были связаны с ухудшением долговременного результата (смертностью), отражали тяжелое полиорганное нарушение (Benhamou, et al. 2012 Haematologica 97: p.1181-6). Следовательно, быстрая нормализация ЛДГ как маркера гемолиза и ишемического повреждения органов может быть благоприятной для долговременного клинического результата, и снижает риск повреждения органов.
Поскольку ишемическое повреждение может приводить как к острым осложнениям, так и к ухудшению долговременных результатов, проводили анализ специфических и клинически значимых биомаркеров повреждения органов ЛДГ, тропонина Т или I и креатинина. Считается, что сердечный тропонин (I или Т) является специфическим маркером повреждения миокарда, креатинин является биомаркером почечной функции, а ЛДГ является маркером гемолиза, а также преимущественно маркером повреждения органов для этого заболевания. У больных ТТП высокие базовые уровни или замедленная нормализация некоторых из этих биомаркеров были связаны с ухудшением клинических результатов (например, смертностью, резистентным заболеванием).
Эти данные позволяют предположить, что быстрее купируемая ишемия ткани микрососудов, определяемая по биомаркерам повреждения органов, как ожидается, окажет положительное влияние на клинический результат, например, снизит риск повреждения органов. Однако необходимо отметить, что результаты определения маркеров повреждения органов в некоторой степени искажены из-за эффекта разбавления при ежедневном плазмообмене (как в опытной группе, так и в группе плацебо).
(i) Лактат-дегидрогеназа
ЛДГ является важным маркером неспецифической тканевой ишемии. Пропорции рассчитывали на основе числа индивидуумов в ITT популяции. Число и долю индивидуумов в ITT популяции со значениями ЛДГ ≤2 ВГН обобщали при запланированном лечении в течение первых 5 дней исследования. Обобщение результатов показано в таблице 9. Среднее отношение ЛДГ/ВГН в день исследования показано в таблице 10.
В 1 день 11 индивидуумов (30,6%) в группе лечения ALX-0081 и 9 индивидуумов (23,1%) в группе плацебо имели значение ЛДГ ≤2 ВГН. Доля индивидуумов оставалась выше в группе лечения ALX-0081, по сравнению с группой плацебо, на 2 день (28 индивидуумов [77,8%] и 20 индивидуумов [51,3%], соответственно) и на 3 день (33 индивидуума [91,7%] и 29 индивидуумов [74,4%], соответственно). На 4 и 5 день доля индивидуумов со значениями ЛДГ≤2 ВГН была схожей в обеих группах.
Средние значения ЛДГ/ВГН были сопоставимыми между группами ALX 0081 и плацебо на 1 день (3,93 и 3,98, соответственно) и более высокими в группе плацебо во все другие моменты времени.
Таблица 9. Число и доля индивидуумов со значениями лактат-дегидрогеназы ≤2 верхних границы нормы по дням исследования (популяция пациентов, включенных в испытание)
Таблица 10. Среднее значение лактат-дегидрогеназы/верхней границы нормы по дням исследования (популяция пациентов, включенных в испытание)
N= число индивидуумов в интересующей популяции; n= число индивидуумов с доступными данными
Анализ Каплан-Мейера проводили для сравнения времени до нормализации значений ЛДГ в соответствии с запланированным лечением. Время до нормализации кривых ЛДГ показано на фигуре 2.
Из анализа Каплана-Мейера можно предположить более быстрое возвращение к нормальным уровням ЛДГ для индивидуумов, получавших ALX 0081, по сравнению с индивидуумами, получавшими плацебо.
(ii) Тропонин
Анализ Каплана-Мейера проводили для сравнения времени до нормализации значений тропонина Т или тропонина I в соответствии с запланированным лечением. Как отмечалось выше, как ТпТ, так и ТпI являются подходящими биомаркерами повреждения клеток сердца. Кривые времени нормализации тропонина Т или I приведены на фигуре 3.
Из анализа Каплана-Мейера можно сделать вывод о более быстрым возвращениями к нормальным уровням Тропонина Т или I для индивидуумов, принимавших ALX 0081, по сравнению с индивидуумами, принимавшими плацебо.
(iii) Креатинин
Далее, в этом случае анализ Каплана-Мейера был проведен для сравнения времени до нормализации значений креатинина в соответствии с запланированным лечением. Кривые времени до нормализации креатинина приведены на фигуре 4.
Для креатинина анализ Каплана-Мейера позволяет сделать предположение о более быстром возвращении к нормальным уровням для индивидуумов, получавших ALX 0081, по сравнению с индивидуумами, получавшими плацебо.
(iv) Обсуждение
С учетом патофизиологии приобретенной ТТП, где нити ULvWF захватывают тромбоциты для образования микротромбов, было сделано предположение, что восстановление количества тромбоцитов является непрямым показателем предотвращения дальнейшего образования микротромбов. Ухудшение заболевания и острая смертность, связанная с приобретенной ТТП, является результатом этих микротромбов.
Действительно, это предположение поддерживается маркерами повреждения органов. В частности, результаты показывают, что маркеры повреждения органов тропонин I и Т, ЛДГ и креатин быстрее возвращаются к нормальному уровню у индивидуумов, получающих ALX 0081, чем у индивидуумов, получающих плацебо.
Следовательно, результаты позволяют предположить, что более быстрая нормализация этих маркеров повреждения органов связана с лучшим клиническим результатом, т.е. снижением риска и уменьшением повреждения органов из-за ишемии органов, вызванной микротромбами.
5.10. Обоснование выбора доз
Фармакология каплацизумаба является двухсторонней. Каплацизумаб влияет на функциональность vWF, приводя к неспособности vWF связываться с тромбоцитами. Он также влияет на расположение vWF, приводя к временному снижению общих уровней vWF:Аг во время лечения.
ФК/ФД модель использовали для оценки ожидаемого воздействия и соответствующего влияния на уровни общего, свободного и связанного в комплексах vWF для различных вариантов дозировки в виртуальной популяции пациентов ТТП, посредством имитаций. Виртуальную популяцию больных ТТП (n=500), с характеристиками на основе популяции из исследования TITAN, создавали путем отбора усеченных распределений массы тела (среднее значение 81,9 кг ± 22,6 СКО, диапазон 47,5-150 кг) и установленного на модели базового уровня vWF в ТТП популяции в испытаниях TITAN, а также распределения по полу (М:Ж 40:60).
Имитированные сценарии включали исходную 8-дневную процедуру ПО с одновременным п.к. ежедневным применением каплацизумаба спустя 1 ч после окончания каждого ПО в дозах 2,5; 5, 10, 20 мг (период 1). Затем предполагалось применение каплацизумаба в том же самом уровне/режиме дозы в течение еще 30 дней при отсутствии какой-либо другой процедуры ПО (период 2).
Процентное изменение свободного vWF по сравнению с базовым уровнем повышалось с дозой, но менее, чем пропорционально дозе. Большая вариабельность между индивидуумами, главным образом связанная с большой вариабельностью целевой экспрессии (vWF) при начале исследования, прогнозировалась при всех уровнях дозы. Две самых низких дозировки (2,5 и 5 мг один раз в сутки) приводили к субоптимальному целевому ингибированию, в то время как более высокая суточная доза каплацизумаба, чем та, которую тестировали в испытании TITAN (20 мг) не вызывала существенного улучшения по сравнению с общей имитированной популяцией ТТП. На Фигуре 5 показано прогнозируемое моделью процентное снижение по сравнению с базовым уровнем уровней свободного vWF:Аг в конце периода 2 в зависимости от уровня дозы, включая пациентов, леченных плацебо.
Имитированные профили в плазме для лекарства, уровней комплексов и общего vWF при суточной дозе 10 мг показаны на фигуре 6.
Вслед за изменениями уровней свободного vWF в качестве маркера для целевой нейтрализации, оценивали изменение уровней общего vWF в качестве маркера риска кровотечения. Использовали пороговый уровень 0,4 МЕ/мл (или 16 нМ), связанный с наивысшими уровнями vWF, наблюдаемыми при болезни Виллебранда I типа. Считается, что при этих уровнях vWF остаются доступными достаточные уровни FVIII. На панели Д показано, что уровни общего vWF для предполагаемой дозы 10 мг в сутки остаются выше этого порогового уровня, считаемого уровнем риска кровотечений.
На основе результатов предыдущих исследований in vitro и прогнозируемых на модели уровней биомаркеров для эффективности (свободный vWF) и безопасности (общий vWF) режим применения дозы (5-40 мг, предпочтительно 10 мг в сутки) считается адекватным для достижения необходимой супрессии тромбоцит-связывающей способности (УБ)VWF у больных ТТП, в то время как эпизоды кровотечения являются минимальными и по меньшей мере контролируемыми.
6. Заключение
Имеется большая межиндивидуальная вариабельность целевой экспрессии (vWF) при включении в исследование. Тем не менее, используемые дозы приводят к оптимальному целевому ингибированию, по существу принося пользу всей популяции ТТП, получающей лечение.
Следовательно, ALX 0081 представляет новый подход к лечению ТТП и обеспечивает существенный полезный эффект с точки зрения эффективности, безопасности и качества жизни больных ТТП.
Экспериментальная проверка концепции каплацизумаба показала статистически достоверное и клинически значимое снижение времени до подтвержденного ответа тромбоцитов. Среднее число дней до подтвержденного ответа тромбоцитов составило 3 дня для каплацизумаба и 4,9 дней для плацебо. Отношение рисков (плацебо против каплацизумаба) составило 2,2 с 95% ДИ 91,28; 3,78), р=0,013.
Отмечается снижение числа обострений до 3 в группе каплацизумаба при 11 в группе плацебо. Это подчеркивает защитный эффект лечения каплацизумабом.
Не отмечалось случаев смерти в группе каплацизумаба, по сравнению с 2 смертями в группе плацебо.
НЯ и СНЯ соответствуют тяжелому, потенциально угрожающему жизни состоянию. Отмечалось почти в два раза больше случаев кровотечения в группе каплацизумаба (66 случаев), по сравнению с группой плацебо 935 случаев), хотя лишь 5 СНЯ у двух индивидуумов в группе каплацизумаба, по сравнению с 2 СНЯ у двух индивидуумов в группе плацебо.
В целом, отношение пользы и риска для пациентов с приобретенной ТТП было очень положительным.
Посредством ингибирования ULvWF-опосредованной агрегации тромбоцитов и итогового антитромботического эффекта, полипептиды из настоящего изобретения, такие как ALX 0081, обеспечивают более быстрый контроль острых приступов ТТП при использовании в комбинации с ПО и трансфузией. Это явно уменьшает риск ишемии органов. Более быстрая нормализация числа тромбоцитов также снижает риск гемолитических осложнений. Его применение также улучшает результат у плохо отвечающих пациентов, включая больных с вторичной ТТП, у которых смертность от заболевания остается высокой.
Кроме того, полипептиды из настоящего изобретения, такие как ALX 0081, полезны для профилактики рецидивов после восстановления от острого эпизода.
Таблица А-1. Примеры полипептидов, содержащий ISVD и CDR против vWF
(ALX 0081)
Таблица A-2
вание
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ablynx N.V.
<120> Methods of treating TTP with immunoglobulin single variable
<130> P105184NL00
<140> NL 2013007
<141> 2014-06-16
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1-3a-
12A02H1
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 2
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02-3a-12A02
<400> 2
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 3
<211> 265
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02-GS9-12A02
<400> 3
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Asn Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 4
<211> 286
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02-GS30--12A02
<400> 4
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Asn Leu Lys Pro Glu Gly Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 5
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A05-3a-12A05
<400> 5
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Ala Ala Ala Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly
145 150 155 160
Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile
165 170 175
Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn
195 200 205
Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu
210 215 220
Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Gln Val Thr Val Ser Ser
245
<210> 6
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A05-GS9-12A05
<400> 6
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe
145 150 155 160
Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg
165 170 175
Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp
180 185 190
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
245 250
<210> 7
<211> 274
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A05-GS30-12A05
<400> 7
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
145 150 155 160
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala
165 170 175
Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala
180 185 190
Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser
195 200 205
Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
210 215 220
Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
225 230 235 240
Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr
245 250 255
Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val
260 265 270
Ser Ser
<210> 8
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06-3a-12B06
<400> 8
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 9
<211> 265
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06-GS9-12B06
<400> 9
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ala Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 10
<211> 286
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06-GS30-12B06
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 11
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H4-3a-12A02H4
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 12
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06H2-3a-12B06H2
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 13
<211> 265
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1-GS9-12A02H1
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 14
<211> 265
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H4-GS9-12A02H4
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 15
<211> 265
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06H2-GS9-12B06H2
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 16
<211> 286
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1-GS30-12A02H1
<400> 16
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 17
<211> 286
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H4-GS30-12A02H4
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 18
<211> 286
<212> PRT
<213> Artificial Sequence
<220>
<223> 12B06H2-GS30-12B06H2
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 19
<211> 128
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 20
<211> 2804
<212> PRT
<213> Homo sapiens
<400> 20
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1 5 10 15
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
Ala Met Asp Gly Gln Asp Ile Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro Thr
1235 1240 1245
Asp Ala Pro Val Ser Pro Thr Thr Leu Tyr Val Glu Asp Ile Ser
1250 1255 1260
Glu Pro Pro Leu His Asp Phe Tyr Cys Ser Arg Leu Leu Asp Leu
1265 1270 1275
Val Phe Leu Leu Asp Gly Ser Ser Arg Leu Ser Glu Ala Glu Phe
1280 1285 1290
Glu Val Leu Lys Ala Phe Val Val Asp Met Met Glu Arg Leu Arg
1295 1300 1305
Ile Ser Gln Lys Trp Val Arg Val Ala Val Val Glu Tyr His Asp
1310 1315 1320
Gly Ser His Ala Tyr Ile Gly Leu Lys Asp Arg Lys Arg Pro Ser
1325 1330 1335
Glu Leu Arg Arg Ile Ala Ser Gln Val Lys Tyr Ala Gly Ser Gln
1340 1345 1350
Val Ala Ser Thr Ser Glu Val Leu Lys Tyr Thr Leu Phe Gln Ile
1355 1360 1365
Phe Ser Lys Ile Asp Arg Pro Glu Ala Ser Arg Ile Ala Leu Leu
1370 1375 1380
Leu Met Ala Ser Gln Glu Pro Gln Arg Met Ser Arg Asn Phe Val
1385 1390 1395
Arg Tyr Val Gln Gly Leu Lys Lys Lys Lys Val Ile Val Ile Pro
1400 1405 1410
Val Gly Ile Gly Pro His Ala Asn Leu Lys Gln Ile Arg Leu Ile
1415 1420 1425
Glu Lys Gln Ala Pro Glu Asn Lys Ala Phe Val Leu Ser Ser Val
1430 1435 1440
Asp Glu Leu Glu Gln Gln Arg Asp Glu Ile Val Ser Tyr Leu Cys
1445 1450 1455
Asp Leu Ala Pro Glu Ala Pro Pro Pro Thr Leu Pro Pro His Met
1460 1465 1470
Ala Gln Val Thr Val Gly Pro Gly Leu Arg Asn Ser Met Val Leu
1475 1480 1485
Asp Val Ala Phe Val Leu Glu Gly Ser Asp Lys Ile Gly Glu Ala
1490 1495 1500
Asp Phe Asn Arg Ser Lys Glu Phe Met Glu Glu Val Ile Gln Arg
1505 1510 1515
Met Asp Val Gly Gln Asp Ser Ile His Val Thr Val Leu Gln Tyr
1520 1525 1530
Ser Tyr Met Val Thr Val Glu Tyr Pro Phe Ser Glu Ala Gln Ser
1535 1540 1545
Lys Gly Asp Ile Leu Gln Arg Val Arg Glu Ile Arg Tyr Gln Gly
1550 1555 1560
Gly Asn Arg Thr Asn Thr Gly Leu Ala Leu Arg Tyr Leu Ser Asp
1565 1570 1575
His Ser Phe Leu Val Ser Gln Gly Asp Arg Glu Gln Ala Pro Asn
1580 1585 1590
Leu Val Tyr Met Val Thr Gly Asn Pro Ala Ser Asp Glu Ile Lys
1595 1600 1605
Arg Leu Pro Gly Asp Ile Gln Val Val Pro Ile Gly Val Gly Pro
1610 1615 1620
Asn Ala Asn Val Gln Glu Leu Glu Arg Ile Gly Trp Pro Asn Ala
1625 1630 1635
Pro Ile Leu Ile Gln Asp Phe Glu Thr Leu Pro Arg Glu Ala Pro
1640 1645 1650
Asp Leu Val Leu Gln Arg Cys Cys Ser Gly Glu Gly Leu Gln Ile
1655 1660 1665
Pro Thr Leu Ser Pro Ala Pro Asp Cys Ser Gln Pro Leu Asp Val
1670 1675 1680
Ile Leu Leu Leu Asp Gly Ser Ser Ser Phe Pro Ala Ser Tyr Phe
1685 1690 1695
Asp Glu Met Lys Ser Phe Ala Lys Ala Phe Ile Ser Lys Ala Asn
1700 1705 1710
Ile Gly Pro Arg Leu Thr Gln Val Ser Val Leu Gln Tyr Gly Ser
1715 1720 1725
Ile Thr Thr Ile Asp Val Pro Trp Asn Val Val Pro Glu Lys Ala
1730 1735 1740
His Leu Leu Ser Leu Val Asp Val Met Gln Arg Glu Gly Gly Pro
1745 1750 1755
Ser Gln Ile Gly Asp Ala Leu Gly Phe Ala Val Arg Tyr Leu Thr
1760 1765 1770
Ser Glu Met His Gly Ala Arg Pro Gly Ala Ser Lys Ala Val Val
1775 1780 1785
Ile Leu Val Thr Asp Val Ser Val Asp Ser Val Asp Ala Ala Ala
1790 1795 1800
Asp Ala Ala Arg Ser Asn Arg Val Thr Val Phe Pro Ile Gly Ile
1805 1810 1815
Gly Asp Arg Tyr Asp Ala Ala Gln Leu Arg Ile Leu Ala Gly Pro
1820 1825 1830
Ala Gly Asp Ser Asn Val Val Lys Leu Gln Arg Ile Glu Asp Leu
1835 1840 1845
Pro Thr Met Val Thr Leu Gly Asn Ser Phe Leu His Lys Leu Cys
1850 1855 1860
Ser Gly Phe Val Arg Ile Cys Met Asp Glu Asp Gly Asn Glu Lys
1865 1870 1875
Arg Pro Gly Asp Val Trp Thr Leu Pro Asp Gln Cys His Thr Val
1880 1885 1890
Thr Cys Gln Pro Asp Gly Gln Thr Leu Leu Lys Ser His Arg Val
1895 1900 1905
Asn Cys Asp Arg Gly Leu Arg Pro Ser Cys Pro Asn Ser Gln Ser
1910 1915 1920
Pro Val Lys Val Glu Glu Thr Cys Gly Cys Arg Trp Thr Cys Pro
1925 1930 1935
Cys Val Cys Thr Gly Ser Ser Thr Arg His Ile Val Thr Phe Asp
1940 1945 1950
Gly Gln Asn Phe Lys Leu Thr Gly Ser Cys Ser Tyr Val Leu Phe
1955 1960 1965
Gln Asn Lys Glu Gln Asp Leu Glu Val Ile Leu His Asn Gly Ala
1970 1975 1980
Cys Ser Pro Gly Ala Arg Gln Gly Cys Met Lys Ser Ile Glu Val
1985 1990 1995
Lys His Ser Ala Leu Ser Val Glu Leu His Ser Asp Met Glu Val
2000 2005 2010
Thr Val Asn Gly Arg Leu Val Ser Val Pro Tyr Val Gly Gly Asn
2015 2020 2025
Met Glu Val Asn Val Tyr Gly Ala Ile Met His Glu Val Arg Phe
2030 2035 2040
Asn His Leu Gly His Ile Phe Thr Phe Thr Pro Gln Asn Asn Glu
2045 2050 2055
Phe Gln Leu Gln Leu Ser Pro Lys Thr Phe Ala Ser Lys Thr Tyr
2060 2065 2070
Gly Leu Cys Gly Ile Cys Asp Glu Asn Gly Ala Asn Asp Phe Met
2075 2080 2085
Leu Arg Asp Gly Thr Val Thr Thr Asp Trp Lys Thr Leu Val Gln
2090 2095 2100
Glu Trp Thr Val Gln Arg Pro Gly Gln Thr Cys Gln Pro Ile Leu
2105 2110 2115
Glu Glu Gln Cys Leu Val Pro Asp Ser Ser His Cys Gln Val Leu
2120 2125 2130
Leu Leu Pro Leu Phe Ala Glu Cys His Lys Val Leu Ala Pro Ala
2135 2140 2145
Thr Phe Tyr Ala Ile Cys Gln Gln Asp Ser Cys His Gln Glu Gln
2150 2155 2160
Val Cys Glu Val Ile Ala Ser Tyr Ala His Leu Cys Arg Thr Asn
2165 2170 2175
Gly Val Cys Val Asp Trp Arg Thr Pro Asp Phe Cys Ala Met Ser
2180 2185 2190
Cys Pro Pro Ser Leu Val Tyr Asn His Cys Glu His Gly Cys Pro
2195 2200 2205
Arg His Cys Asp Gly Asn Val Ser Ser Cys Gly Asp His Pro Ser
2210 2215 2220
Glu Gly Cys Phe Cys Pro Pro Asp Lys Val Met Leu Glu Gly Ser
2225 2230 2235
Cys Val Pro Glu Glu Ala Cys Thr Gln Cys Ile Gly Glu Asp Gly
2240 2245 2250
Val Gln His Gln Phe Leu Glu Ala Trp Val Pro Asp His Gln Pro
2255 2260 2265
Cys Gln Ile Cys Thr Cys Leu Ser Gly Arg Lys Val Asn Cys Thr
2270 2275 2280
Thr Gln Pro Cys Pro Thr Ala Lys Ala Pro Thr Cys Gly Leu Cys
2285 2290 2295
Glu Val Ala Arg Leu Arg Gln Asn Ala Asp Gln Cys Cys Pro Glu
2300 2305 2310
Tyr Glu Cys Val Cys Asp Pro Val Ser Cys Asp Leu Pro Pro Val
2315 2320 2325
Pro His Cys Glu Arg Gly Leu Gln Pro Thr Leu Thr Asn Pro Gly
2330 2335 2340
Glu Cys Arg Pro Asn Phe Thr Cys Ala Cys Arg Lys Glu Glu Cys
2345 2350 2355
Lys Arg Val Ser Pro Pro Ser Cys Pro Pro His Arg Leu Pro Thr
2360 2365 2370
Leu Arg Lys Thr Gln Cys Cys Asp Glu Tyr Glu Cys Ala Cys Asn
2375 2380 2385
Cys Val Asn Ser Thr Val Ser Cys Pro Leu Gly Tyr Leu Ala Ser
2390 2395 2400
Thr Ala Thr Asn Asp Cys Gly Cys Thr Thr Thr Thr Cys Leu Pro
2405 2410 2415
Asp Lys Val Cys Val His Arg Ser Thr Ile Tyr Pro Val Gly Gln
2420 2425 2430
Phe Trp Glu Glu Gly Cys Asp Val Cys Thr Cys Thr Asp Met Glu
2435 2440 2445
Asp Ala Val Met Gly Leu Arg Val Ala Gln Cys Ser Gln Lys Pro
2450 2455 2460
Cys Glu Asp Ser Cys Arg Ser Gly Phe Thr Tyr Val Leu His Glu
2465 2470 2475
Gly Glu Cys Cys Gly Arg Cys Leu Pro Ser Ala Cys Glu Val Val
2480 2485 2490
Thr Gly Ser Pro Arg Gly Asp Ser Gln Ser Ser Trp Lys Ser Val
2495 2500 2505
Gly Ser Gln Trp Ala Ser Pro Glu Asn Pro Cys Leu Ile Asn Glu
2510 2515 2520
Cys Val Arg Val Lys Glu Glu Val Phe Ile Gln Gln Arg Asn Val
2525 2530 2535
Ser Cys Pro Gln Leu Glu Val Pro Val Cys Pro Ser Gly Phe Gln
2540 2545 2550
Leu Ser Cys Lys Thr Ser Ala Cys Cys Pro Ser Cys Arg Cys Glu
2555 2560 2565
Arg Met Glu Ala Cys Met Leu Asn Gly Thr Val Ile Gly Pro Gly
2570 2575 2580
Lys Thr Val Met Ile Asp Val Cys Thr Thr Cys Arg Cys Met Val
2585 2590 2595
Gln Val Gly Val Ile Ser Gly Phe Lys Leu Glu Cys Arg Lys Thr
2600 2605 2610
Thr Cys Asn Pro Cys Pro Leu Gly Tyr Lys Glu Glu Asn Asn Thr
2615 2620 2625
Gly Glu Cys Cys Gly Arg Cys Leu Pro Thr Ala Cys Thr Ile Gln
2630 2635 2640
Leu Arg Gly Gly Gln Ile Met Thr Leu Lys Arg Asp Glu Thr Leu
2645 2650 2655
Gln Asp Gly Cys Asp Thr His Phe Cys Lys Val Asn Glu Arg Gly
2660 2665 2670
Glu Tyr Phe Trp Glu Lys Arg Val Thr Gly Cys Pro Pro Phe Asp
2675 2680 2685
Glu His Lys Cys Leu Ala Glu Gly Gly Lys Ile Met Lys Ile Pro
2690 2695 2700
Gly Thr Cys Cys Asp Thr Cys Glu Glu Pro Glu Cys Asn Asp Ile
2705 2710 2715
Thr Ala Arg Leu Gln Tyr Val Lys Val Gly Ser Cys Lys Ser Glu
2720 2725 2730
Val Glu Val Asp Ile His Tyr Cys Gln Gly Lys Cys Ala Ser Lys
2735 2740 2745
Ala Met Tyr Ser Ile Asp Ile Asn Asp Val Gln Asp Gln Cys Ser
2750 2755 2760
Cys Cys Ser Pro Thr Arg Thr Glu Pro Met Gln Val Ala Leu His
2765 2770 2775
Cys Thr Asn Gly Ser Val Val Tyr His Glu Val Leu Asn Ala Met
2780 2785 2790
Glu Cys Lys Cys Ser Pro Arg Lys Cys Ser Lys
2795 2800
<210> 21
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1 CDR1
<400> 21
Tyr Asn Pro Met Gly
1 5
<210> 22
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1 CDR2
<400> 22
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 23
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> 12A02H1 CDR3
<400> 23
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ПЕРВОНАЧАЛЬНОГО ЭПИЗОДА TTP С ПОМОЩЬЮ ОДИНОЧНЫХ ВАРИАБЕЛЬНЫХ ДОМЕНОВ ИММУНОГЛОБУЛИНОВ | 2019 |
|
RU2794143C2 |
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ СЫВОРОТОЧНЫЙ АЛЬБУМИН | 2018 |
|
RU2797270C2 |
| ПОЛИПЕПТИДЫ, СВЯЗЫВАЮЩИЕСЯ С ADAMTS5, MMP13 И АГГРЕКАНОМ | 2018 |
|
RU2786659C2 |
| ММР13-СВЯЗЫВАЮЩИЕ ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2784069C2 |
| УСОВЕРШЕНСТВОВАННЫЕ СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ ВЕЩЕСТВА | 2018 |
|
RU2789495C2 |
| СВЯЗЫВАЮЩИЕ ADAMTS ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2781182C2 |
| УЛУЧШЕННЫЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНА, СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ | 2017 |
|
RU2765384C2 |
| ПОЛИПЕПТИДЫ, МОДУЛИРУЮЩИЕ SIGLEC-ЗАВИСИМЫЕ ИММУННЫЕ ОТВЕТЫ | 2017 |
|
RU2776807C2 |
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ TNF | 2016 |
|
RU2774823C2 |
| PD1/CTLA4-СВЯЗЫВАЮЩИЕ ВЕЩЕСТВА | 2016 |
|
RU2755724C2 |
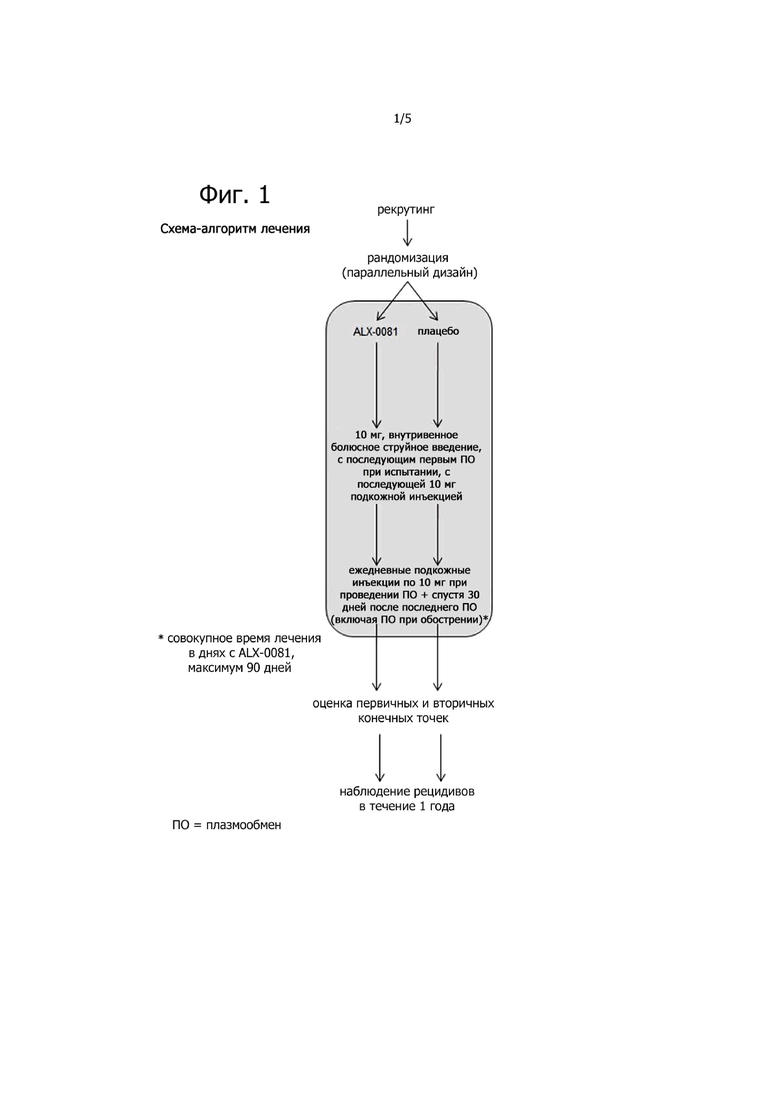
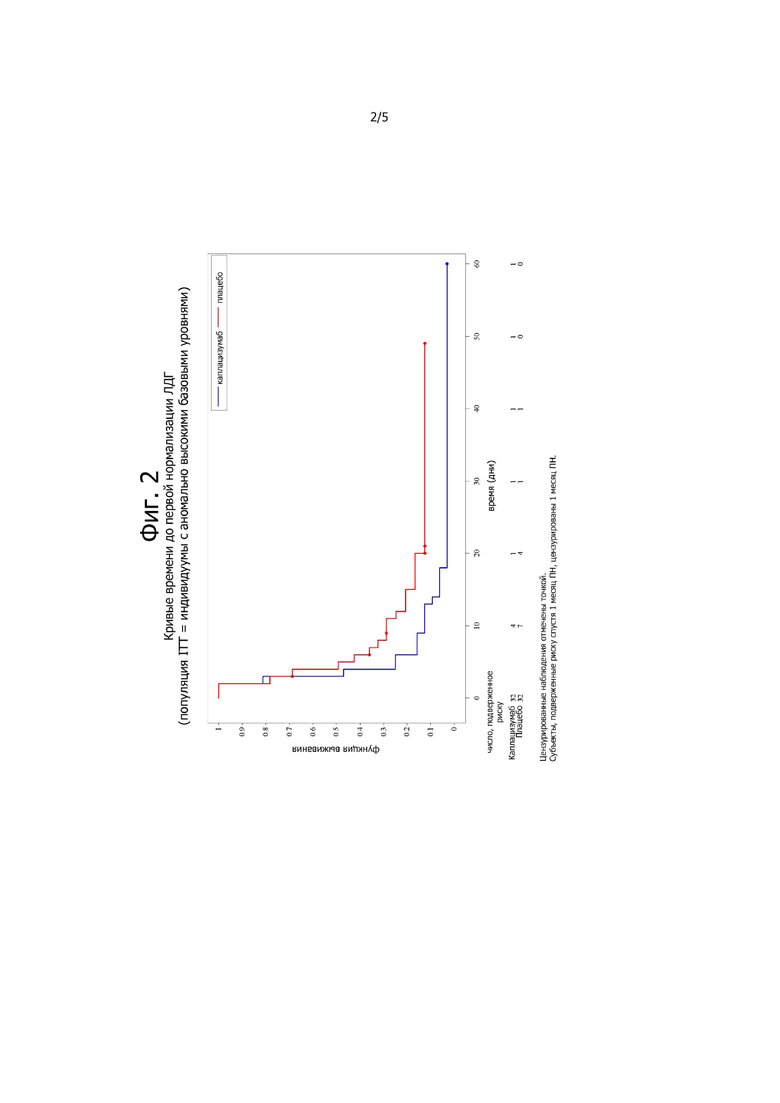
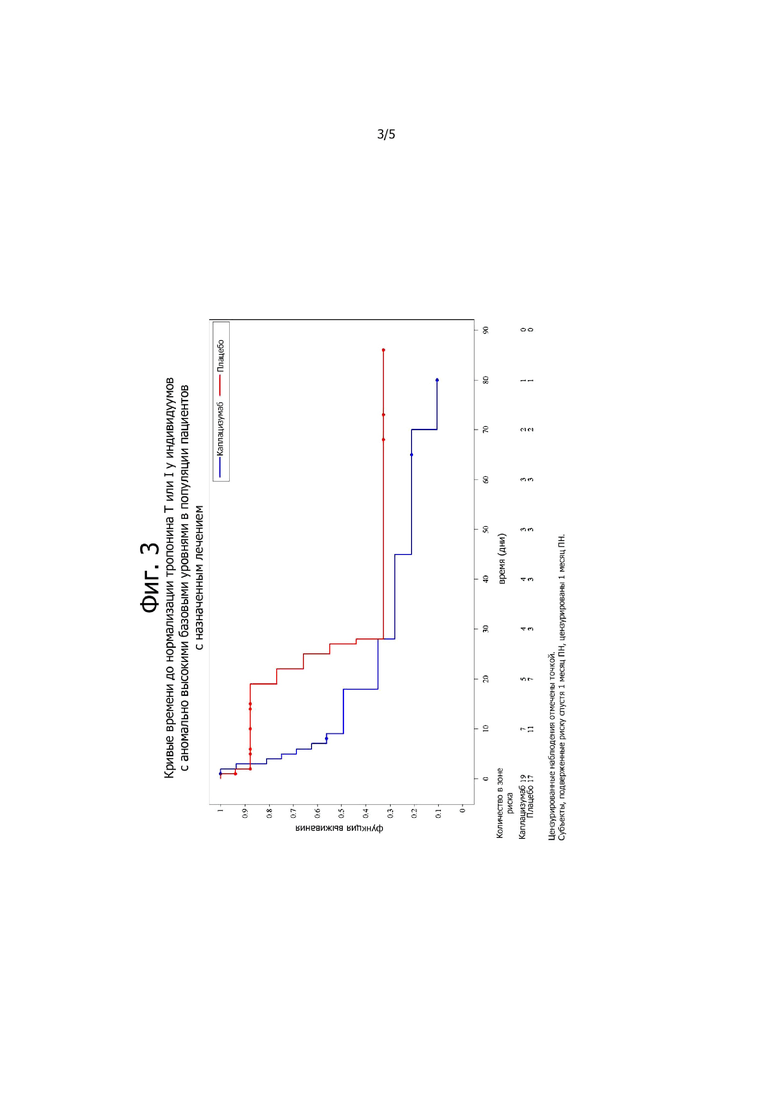
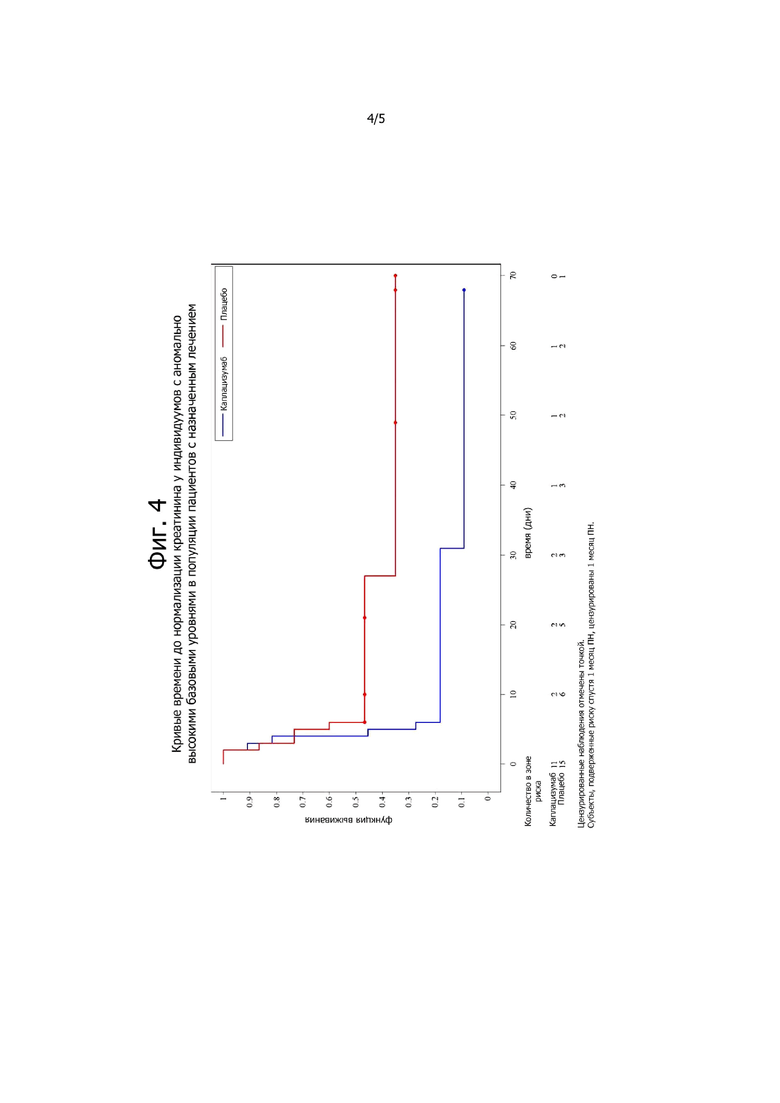

Изобретение относится к области биотехнологии. Описан способ лечения острого эпизода приобретенной тромботической тромбоцитопенической пурпуры (ТТП) у нуждающегося в этом человека. Способ включает стадии осуществления предшествующего плазмообмена (ПО), введение указанному человеку первой дозы полипептида в размере 1-80 мг, осуществление ПО, введение последующей дозы указанного полипептида в размере 1-80 мг, где указанный полипептид содержит SEQ ID NO: 1. Изобретение расширяет арсенал способов лечения острого эпизода приобретенной тромботической тромбоцитопенической пурпуры (ТТП). 2 з.п. ф-лы, 6 ил., 12 табл., 5 пр.
1. Способ лечения острого эпизода приобретенной тромботической тромбоцитопенической пурпуры (ТТП) у нуждающегося в этом человека, включающий:
(1) осуществление предшествующего плазмообмена (ПО);
(2) введение указанному человеку первой дозы полипептида в размере 1-80 мг полипептида;
(3) осуществление плазмообмена (ПО);
(4) введение последующей дозы указанного полипептида в размере 1-80 мг указанного пептида;
(5) повтор стадии (3) и стадии (4) один раз в день,
где указанный полипептид содержит SEQ ID NO: 1.
2. Способ по п.1, где первая доза полипептида составляет такой 5-40 мг, предпочтительно 10 мг или 11 мг полипептида.
3. Способ по любому из пп.1, 2, где последующая доза указанного полипептида составляет 5-40 мг, предпочтительно 10 мг или 11 мг указанного пептида.
| NANOBODIES TM ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ АГРЕГАЦИЕЙ | 2006 |
|
RU2433139C2 |
| Holz J | |||
| B | |||
| The TITAN trial-assessing the efficacy and safety of an anti-von Willebrand factor Nanobody in patients with acquired thrombotic thrombocytopenic purpura //Transfusion and apheresis science | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Питательное приспособление к трепальной машине для лубовых растений | 1923 |
|
SU343A1 |
| Войцеховский В | |||
| В | |||
| и др | |||
| Особенности диагностики и лечения тромботической | |||
Авторы
Даты
2023-11-17—Публикация
2015-06-16—Подача