Предпосылки создания изобретения
Область техники
Настоящее изобретение относится к композициям и способам получения терапевтического эффекта путем перекрытия кровотока за счет активации тромбоцитов в качестве инициирующего события.
Описание предшествующего уровня техники
Функция тромбоцитов в организме заключается в ограничении кровопотери в случае повреждения сосудов. Обычно тромбоциты циркулируют вместе с другими клеточными компонентами крови в составе смеси различных белков плазмы крови, многие из которых играют ключевую роль в процессе коагуляции. В случае обнажения субэндотелиального слоя сосуда происходит последовательность событий, ограничивающих кровопотерю из поврежденного сосуда. Циркулирующие тромбоциты, входя в контакт с компонентами обнажившегося субэндотелиального слоя, 1) связываются и сцепляются, 2) распространяются по обнажившейся поверхности, 3) активируются, что выражается в высвобождении содержащихся в них гранул, 4) группируют и привлекают другие циркулирующие тромбоциты из кровотока и 5) формируют эффективную пробку, сгусток и/или тромб, препятствующий оттоку крови из сосуда.
В отличие от каскада коагуляции, который представляет собой процесс, частично характеризующийся преобразованием фибриногена в фибрин, тромбоциты коалесцируют вокруг поврежденной области и соединяются за счет мостиковых молекул, которые связываются со специфическими рецепторами на поверхности тромбоцита. Исходное образование мостиков между тромбоцитами и субэндотелиальным слоем зависит от взаимодействия между рецептором Ib-гликопротеина (GpIb) на поверхности тромбоцита и фактором фон Виллебранда (ФФВ) в субэндотелиальном слое (т.е. иммобилизованным ФФВ). Данное взаимодействие является само по себе уникальным, поскольку обычные тромбоциты, циркулирующие в крови, часто контактируют с растворимым ФФВ, но не активируются и не связывают растворимый ФФВ. Как показали эксперименты, проводившиеся в искусственных условиях, иммобилизация растворимого ФФВ на поверхности способствует связыванию и активации тромбоцитов. После активации тромбоцитов происходит видоизменение дополнительного рецептора, IIb/IIIa-гликопротеина (GPIIb/IIIa), что способствует связыванию нескольких белков плазмы крови и тем самым связыванию тромбоцитов друг с другом. Помимо фибриногена, растворимый ФФВ связывает активизированный рецептор GPIIb/IIIa, который в очередь становится иммобилизованным и способным связывать другие тромбоциты посредством GPIb и GPIIb/IIIa.
Гиперактивные тромбоциты способны индуцировать несвоевременное тромбообразование, в результате которого сокращается снабжение кровью различных органов и тканей. Основным примером этого является тромбообразование, вызванное кровотоком, проходящим через стенотический (суженный) сосуд, питающий сердечную мышцу. Сокращение притока крови к сердечной мышце приводит к инфаркту и впоследствии параличу сердца (некрозу клеток сердечной мышцы). В том случае, если эмбол или тромб закупоривает кровеносные сосуды, питающие головной мозг, возникает ишемия головного мозга (преходящее нарушение кровообращения; инсульт).
Известны другие патологические состояния, вызванные неуместной антителоопосредуемой активацией тромбоцитов. Известна обусловленная гепарином тромбоцитопения, которая характеризуется резким сокращением числа тромбоцитов и тромбообразованием в местах ранее существовавшей патологии. У 1-5% всех пациентов, получающих нефракционированный гепарин в качестве антикоагулянта, стимулирующего кровоток, формируются антитела, связывающие гепарин в комплексе с гранулами белка тромбоцита. В результате связывания антителом гепарина и белка в комплекс, формирующийся на поверхности тромбоцитов, происходит быстрая активация тромбоцитов и локализованное тромбообразование. Это, в свою очередь, приводит к инфаркту пораженных областей.
Тромбоз является подробно описанным следствием рака. Существуют противоречивые данные относительно того, является ли состояние гиперкоагуляции предвестником рака. Было проведено множество исследований, целью которых являлось доказать протромботическую тенденцию большинства неоплазий и новообразований. Как полагают, тромбоз является наиболее часто встречающимся осложнением у пациентов, страдающих явными злокачественными заболеваниями.
Ключевым аспектом при разработке эффективных противораковых средств является возможность создать средства, которые избирательно уничтожают раковые клетки, обладая при этом относительно слабым или вообще не обладая действием на здоровые ткани. Данная задача была трудно решаемой с учетом незначительных качественных различий между новообразованиями и здоровыми тканями. Вследствие этого множество исследований, проводившихся за последнее время, имело целью установить специфические для опухолей «маркерные антигены», которые могли бы служить иммунологической мишенью при проведении химиотерапии и диагностики. Было выявлено множество специфических для опухолей или квазиспецифических для опухолей (сопутствующих опухолям) маркеров, являющихся антигенами раковых клеток, которые могут распознаваться специфическими антителами.
К сожалению, чаще всего специфические для опухолей антитела сами по себе не способны оказывать достаточное противораковое действие для того, чтобы их можно быть использовать при лечении рака. Иммунотоксины, эффективно действующие на лимфомы, относительно малоэффективны при лечении плотных опухолей, таких как карциномы. Основной причиной этого является тот факт, что плотные опухоли в целом непроницаемы для молекул, имеющих размеры, сравнимые с размерами антител; как показывают исследования на людях, часто удельное усвоение введенной дозы составляет менее 0,001% на грамм массы опухоли. Кроме того, антитела, проникающие в опухолевое образование, распределяются неравномерно, что объясняется рядом причин. Во-первых, плотно упакованные клетки опухоли и фиброзные опухолевые стромы представляют собой труднопреодолимый физический барьер для макромолекулярного переноса, что в сочетании с отсутствием лимфатического дренажа создает повышенное тканевое давление в ядре опухоли, уменьшающее экстравазацию и конвекцию тканевой жидкости. Во-вторых, распределение кровеносных сосудов в большей части опухолей является неорганизованным и неоднородным. В результате этого некоторые опухолевые клетки находятся на большом расстоянии от капилляров, в связи с чем способствующее экстравазации антитело должно диффундировать в значительном пространстве для того, чтобы достигнуть отдаленные опухолевые клетки и связать их. В-третьих, все антитела, проникающие в опухоль, поглощаются в околососудистых областях первыми опухолевыми клетками, которые им встретились, в результате чего антитела не достигают расположенные на большем удалении опухолевые клетки.
Одним из способов преодоления недостатков методики воздействия на опухоли антителами могло бы стать действие возбуждающими тромбоз средствами на сосудистую сеть опухоли, а не на саму опухоль.
Авторы настоящего изобретения предполагают, что такой подход имеет ряд преимуществ по сравнению с непосредственным действием на опухолевые клетки. Во-первых, клетки-мишени обеспечивают непосредственный доступ для сосудистого введения терапевтических средств, что позволяет быстро локализовать значительную долю введенной дозы. Во-вторых, поскольку через каждый капилляр в тысячи клеток окружающей опухоль хорды поступает кислород и питательные вещества, даже незначительное повреждение сосудистой сети опухоли способно вызвать лавинообразный некроз опухолевых клеток.
Настоящее изобретение также относится к композициям и способам лечения болезненного роста тканей, болезненного кровотечения (во время или после хирургического вмешательства, послеродового), внематочной беременности, предлежащей плаценты, приросшей плаценты и фибромы матки.
При некоторых клинических обстоятельствах желательно остановить приток крови к ткани путем перекрытия соответствующей сосудистой сети. Примерами являются геморрагический удар, наличие боковой венозной подкожной ветви при имплантации подкожного обходного сосудистого шунта, лечение аневризмы аорты, коррекция пороков развития сосудов и лечение плотных опухолей.
Для перекрытия кровотока применяются разнообразные методики и вещества, включая эмболотерапию. Примеры эмболотерапии включают использование частиц, образованных разнообразными веществами, включая поливиниловый спирт (заявка РСТ WO 0023054, Боскетти), акриламин (патент США US 5635214, Боскетти и др; патент США US 5648100, Боскетти и др.), полиметилметакрилат (патент США US 5344452, Лемперле), физические пробки из коллагена (патент США US 5456693, Констон и др.) и спирали (патент США US 5639277, Мариант и др.). Эмболотерапия предусматривает доставку таких веществ к сосудистой сети-мишени при помощи катетера. Поскольку сосудистая сеть в любой заданной области состоит из крупных артерий, артериол, метаартериол и капилляров, диаметр которых постепенно уменьшается, доставленные вещества (эмбол) продолжают перемещаться вместе с кровотоком до тех пор, пока они не окажутся в более мелком кровеносном сосуде, тем самым предотвращая приток крови к соответствующей ткани.
Настоящее изобретение отличается новизной и направлено на решение нерешенных в медицине задач за счет использования твердофазного средства, такого как микрочастицы, или спирали, или стенты, покрытые фактором фон Виллебранда (ФФВ), взятым у млекопитающих. При этом достигается терапевтический эффект путем доставки твердофазного связывающего тромбоциты средства к цели и инициирования эффективного тромбообразования, ведущего к закупориванию соответствующей сосудистой сети.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам лечения и композициям для воздействия на ткани и/или органы и соответствующую сосудистую сеть, являющиеся по своей природе гиперплазированными, или новообразованиями, или геморрагическими, для чего используются твердофазные средства, возбуждающие тромбообразование посредством локализованной активации тромбоцитов. Композиция по изобретению содержит средство для захвата тромбоцитов твердофазным средством, таким как спираль или стент, или частица. В некоторых вариантах осуществления изобретения твердофазное средство одновременно захватывает и активирует тромбоциты. В способе по изобретению используется локализация накопления тромбоцитов и активация тромбоцитов на частицах твердофазного средства с целью вызвать последующее тромбообразование и тем самым ограничить приток крови к области-мишени без индуцирования общего или системного протромботического состояния.
На первый взгляд намеренное индуцирование тромбоза у пациента алогично, поскольку хорошо известно, что тромбоз в существенной степени способствует заболеваемости и смертности. В настоящем изобретении опосредованное тромбоцитами перекрытие кровотока твердофазным средством основано на сайт-специфическом индуцировании тромбоза с использованием природной способности организма индуцировать тромбоз в ответ на действие иммобилизованного фактора фон Виллебранда (ФФВ) или иных активирующих тромбоциты средств, обладающих местным действием. Несмотря на то что ФФВ циркулирует в кровотоке в растворенном виде, он способен захватывать тромбоциты и индуцировать их активацию лишь после того, как обнажатся входящие в состав субэндотелиального слоя его молекулы или такие молекулы свяжутся с обнажившимся коллагеном субэндотелиального слоя.
Контакт твердофазного связывающего тромбоциты средства с кровью пациента (ex vivo) или кровотоком (in vivo) индуцирует связывание тромбоцитов и их локализованную активацию, ведущую к накоплению тромбоцитов вокруг твердофазного средства, что приводит к тромбозу и прекращению притока крови к ткани, которую питает закупоренный кровеносный сосуд (сосуды). Число клеток, включая опухолевые клетки или клетки гиперплазированной ткани, сокращается, либо они отмирают в результате прекращения местного притока крови. Данный подход позволяет избежать системной активации тромбоцитов и тромбоза, с учетом того факта, что иммобилизованный ФФВ (но не растворимый ФФВ) связывает и активирует циркулирующие тромбоциты. Таким образом, способы и композиции по настоящему изобретению являются косвенным средством лечения патологического состояния, такого как рак, гиперплазированные клетки, чрезмерное кровотечение или артериовенозные пороки развития.
В настоящем изобретении усовершенствованы существующие способы лечения плотных опухолей, гиперплазированных тканей, чрезмерного кровотечения и артериовенозных пороков развития, а также любых иных заболеваний или состояний, в которых лечебную роль могут играть тромбоциты (в покое и/или активированные).
Аналогично существующему патологическому состоянию (т.е. обусловленной гепарином тромбоцитопенией (ОГТ)), локализованная активация тромбоцитов может быть усилена при помощи опосредованного Fc-фрагментом процесса путем индуцирования или включения Fc-фрагмента человека в твердофазное средство либо путем направления отдельных антител в область-мишень. Активация тромбоцитов при синдроме ОГТ приводит к локализованному тромбозу и прекращению кровоснабжения пораженной области. В результате происходит некроз пораженной ткани.
Распространение или степень сайт-специфического тромбоза может контролироваться различными способами. При подавлении активации тромбоцитов с использованием антитромбоцитарных средств (например, ингибиторов GPIIb/IIIa, аспирина, дипиридамола и т.д.) происходит уменьшение предрасположенности к индуцированию тромбоза заданным, титруемым способом. В качестве средства контроля локальной активации тромбоцитов также может использоваться изменение местного кровотока, кровяного давления и температуры ткани.
Типичными васкуляризованными опухолями являются плотные опухоли, в частности карциномы, нуждающиеся в существенном кровоснабжении. Примеры плотных опухолей, к которым относится настоящее изобретение, входят, не ограничиваясь ими, первичные злокачественные опухоли легких, молочной железы, яичников, желудка, поджелудочной железы, гортани, пищевода, яичек, печени, околоушной железы, желчных путей, ободочной кишки, прямой кишки, шейки, матки, эндометрия, почек, мочевого пузыря, простаты, щитовидной железы, головы и шеи, меланомы, глиомы, нейробластомы, нейроэндокринные опухоли и тому подобные. Другие состояния, к которым относится настоящее изобретение, включают, не ограничиваясь ими, вторичные (метастатические) опухоли упомянутого выше типа, вызванные раком боли, артериовенозные пороки развития, фибромы матки, тазовую гиперемию, меноррагию, варикозные расширения вен, кровохарканье, аневризмы, аневризмы висцеральных артерий, псевдоаневризмы и внутренние истечения.
Предпочтительный способ по изобретению заключается в том, что изготавливают спираль или стент, покрытый рекомбинатным ФФВ или ФФВ млекопитающих, и вводят покрытое ФФВ средство в кровоток пациента, такого как человек, животное или подопытное животное, после чего ФФВ поступает или накапливается в заданной области-мишени. Спирали или стенты могут быть выполнены из любого приемлемого вещества, способного удерживать ФФВ внутри спирали или стента или на поверхности спирали или стента в течение неопределенного или меняющегося периода времени.
Решение проблемы неограниченного роста плотных опухолей заключается в действии на кровеносные сосуды опухоли. Данный подход имеет ряд преимуществ по сравнению со способами, в которых непосредственному действию подвергаются опухолевые клетки. Во-первых, кровеносные сосуды опухоли обеспечивают непосредственный доступ для сосудистого введения терапевтических средств, что позволяет быстро локализовать значительную долю введенной дозы. Во-вторых, поскольку через каждый капилляр в тысячи клеток окружающей опухоль хорды поступает кислород и питательные вещества, даже незначительное повреждение сосудистой сети опухоли способно вызвать обширный некроз опухолевых клеток. Наконец, кровеносные сосуды одинаковы у различных опухолей, что делает целесообразным создание единого средства для лечения многочисленных разновидностей рака.
Подробное описание изобретения
В настоящем изобретении предложены композиции и способы захвата тромбоцитов в заранее заданной области, активации тромбоцитов и использования природной функции тромбоцитов с целью достижения благоприятного терапевтического результата. Согласно настоящему изобретению тромбоциты могут представлять собой циркулирующие тромбоциты или тромбоциты, полученные из внешнего источника. Также согласно настоящему изобретению тромбоциты могут быть направлены в специфическую область, после чего с целью прервать, нарушить или сократить приток крови к такой области может быть использована природная способность тромбоцитов индуцировать тромбообразование. Сокращение притока крови сопровождается сокращением поступления питательных веществ в возбудитель заболевания или состояния, такого как опухоль, в результате чего уменьшается размер возбудителя заболевания. Очевидно, что уменьшение размера опухоли является явно благоприятным терапевтическим эффектом. В некоторых случаях сокращение кровоснабжения области-мишени облегчает боли.
В настоящем изобретение также предусмотрено целенаправленное действие тромбоцитами на определенную ткань, которая поддается избирательному целенаправленному действию, например гиперплазированную ткань, с использованием твердофазного средства, способного связывать и активировать тромбоциты. В соответствующих вариантах осуществления изобретения целенаправленное действие относится к твердой фазе, содержащей компонент, обеспечивающий направленную доставку, например лиганд или тому подобный компонент, который обладает способностью специфически связывать заданный участок или ткань. В других вариантах осуществления изобретения целенаправленное действие может заключаться в доставке композиции по настоящему изобретению к области опухоли или вблизи нее, например, при помощи катетера, стента или спирали. В результате активации тромбоцитов в предварительно выбранной области достигается благоприятный терапевтический результат за счет сокращения поступления питательных веществ в ткань или такую область.
В настоящем изобретении предложены композиции и способы индуцирования тромбообразования, в которых тромбоциты захватываются твердофазным средством, индуцируется активация тромбоцитов и происходит образование тромба. Тромбообразование в сосудистой сети-мишени приводит к сокращению кровоснабжения соответствующей ткани. Композиции и способы по настоящему изобретению, в которых содержащее ФФВ твердофазное средство (например, покрытые ФФВ частицы) захватывает тромбоциты, могут применяться для лечения рака, гиперплазии, фибром матки, тазовой гиперемии, меноррагии, артериовенозных пороков развития, нейроэмболии, варикозных расширений вен, кровохарканья, аневризм висцеральных артерий, артериальных аневризм, и внутренних истечений и тому подобного. Кроме того, композиции и способы по настоящему изобретению обеспечивают благоприятный терапевтический результат у реципиентов композиции.
В предпочтительном варианте осуществления изобретения используется ФФВ, взятый у млекопитающего. В более предпочтительном варианте осуществления изобретения ФФВ берут у человека. В наиболее предпочтительном варианте осуществления изобретения ФФВ берут у свиней.
ФФВ может иметь природное, синтетическое происхождение, являться рекомбинантным или представлять собой пептидную последовательность, соответствующую биологически активному участку ФФВ. В наиболее предпочтительном варианте осуществления изобретения ФФВ является рекомбинантным.
В настоящем изобретении также предложены композиции, которые непосредственно или косвенно через буфер связывают средство, связывающее тромбоциты (например, ФФВ), с твердофазным средством, до тех пор, пока средство, связывающее тромбоциты, сохраняет способность связывать тромбоциты. Используемый в описании термин буфер относится к группе инертных или активных молекул, которые физически разделяют средство, связывающее тромбоциты, и поверхность твердофазного средства. Ниже приведены примеры таких буферов. Непосредственное связывание может происходить ковалентно или нековалентно. Косвенное связывание происходит через буферы, которые включают, не исчерпываясь ими, пептидные «ножки», буферные антитела, буферные участки антител, буферные гибридные белки или буферные углеводы. Такие буферы обычно действуют лишь в качестве мостиков между частицей и ФФВ, тем не менее буферы могут также использоваться для изменения степени активации тромбоцитов. Например, в качестве буфера может использоваться Fc-компонент, за счет чего обеспечивается усиленная активация тромбоцитов на твердофазном средстве и вокруг твердофазного средства. Для связывания ФФВ с твердофазным средством могут использоваться способы, известные специалистам в данной области техники. Примеры связывающих средств включают, не ограничиваясь ими, глутаральдегид и карбодиимид.
В предпочтительном варианте осуществления изобретения позиционирование композиций, не имеющих целенаправленно действующего средства, внутри сосудистой системы млекопитающих осуществляется путем направленного позиционирования кровотока, которое осуществляют после доставки композиций при помощи микрокатетера сверхизбирательного действия.
Композиции по настоящему изобретению также могут включать средство или обеспечивающий направленную доставку компонент, способный связываться с антигеном-мишенью или областью-мишенью на сосудистом эндотелии или ткани-мишени, что способствует локализации твердофазного средства в выбранной области. Примеры средств или компонентов, обеспечивающих направленную доставку, хорошо известны специалистам в данной области техники и включают, не ограничиваясь ими, антитела, лиганды, рецепторы, гормоны, лектины и кадерины или их участки или фрагменты.
В предпочтительном варианте осуществления изобретения средство, обеспечивающее направленную доставку, включает молекулу антитела или подобного антителу вещества, содержащую биотиновый, биотиномиметический и/или пептидный компонент. В другом предпочтительном варианте осуществления изобретения молекулы антитела или подобного антителу вещества направлены на комплекс фактор роста-рецептор.
Композиции по изобретению также могут включать одно или несколько из следующих веществ: один или несколько модуляторов связывания тромбоцитов (например, ингибиторы или усилители), один или несколько регуляторов или модуляторов тромбообразования или один или несколько компонентов пути активации комплемента.
В ходе осуществления способов по настоящему изобретению также вводят твердофазное средство, способное связывать тромбоциты в заданной области, индуцируют активацию захваченных тромбоцитов, вводят бифунциональное связывающее средство, имеющее антигенную детерминанту и область связывания тромбоцитов, контролируют образование тромбов путем изменения температуры одной или нескольких композиций по изобретению или путем изменения температуры в заданной области.
В ходе осуществления способов по настоящему изобретению дополнительно выполняют одно или несколько из следующих действий: вводят один или несколько модуляторов связывания тромбоцитов, вводят один или несколько модуляторов тромбообразования, вводят один или несколько компонентов пути активации комплемента, вводят один или несколько лигандов и/или антилигандов для связывания твердофазного средства в заданной области и/или связывания компонента, связывающего тромбоциты, с твердофазным средством.
Настоящее изобретение также относится к комплекту, который может содержать, не ограничиваясь ими, любое или все перечисленные ниже компоненты, в том числе твердофазное средство для целенаправленного воздействия тромбоцитами на оболочку эндотелия, связывающее средство для связывания тромбоцитов, лиганд для связывания оболочки эндотелия, конъюгат лиганда, антилиганд для связывания лиганда или конъюгата лиганда, модулятор связывания тромбоцитов (усилитель и/или ингибитор), модулятор тромбообразования, компонент пути активации комплемента, индуктор компонента пути активации комплемента и связывающее средство для связывания тромбоцитов, включающее антилиганд. Комплект может также содержать бифункциональное связывающее средство и/или конъюгат связывающего средства и лиганда, и/или конъюгат связывающего тромбоциты средства и антилиганда.
Композиции и способы по настоящему изобретению включают любые механизмы доставки композиции к заданной области, включая, но не ограничиваясь ими, системный, местный, пероральный или топический.
В некоторых вариантах осуществления изобретения для захвата тромбоцитов в заданной области используются связывающие средства.
Определения
Используемый в описании термин твердофазное средство относится к любому твердому веществу, применимому для связывания, удерживания или сохранения связывающего тромбоциты средства. Связывающее тромбоциты средство может быть связано с твердофазным средством таким образом, что сохраняется его способность связывать тромбоциты, например, на или внутри области-мишени. Твердофазное средство может представлять собой спираль, стент или частицу, например гранулу или тому подобное, при этом все названные формы хорошо известны специалистам в данной области техники.
Используемый в описании термин частица относится к дискретному участку или части твердофазного средства, способной удерживать или сохранять связывающее тромбоциты средство. В предпочтительном варианте осуществления изобретения используют частицу, покрытую рекомбинатным ФФВ или ФФВ млекопитающих, и вводят покрытую ФФВ частицу в кровоток пациента, такого как человек, животное или подопытное животное. Используемый в описании термин частица относится к твердофазному средству, способному непосредственно или косвенно (например, через лиганды) связывать тромбоциты. Частицы могут быть однородными или разнородными по размеру. В частности, частицы могут иметь сферическую (включая яйцевидную) или неправильную форму. Частицы могут состоять из любого применимого вещества, способного сохранять ФФВ внутри частицы или на ее поверхности в течение неопределенного или меняющегося периода времени. В число примеров таких веществ входит поливиниловый спирт, полистирол, поликарбонат, полилактид, полигликолид, сополимеры лактида и гликолида, поликапролактон, сополимеры лактида и капролактона, полиоксибутират, полиаклилцианоакрилаты, полиангидриды, сложные полиортоэфиры, альбумин, коллаген, желатин, полисахариды, декстраны, крахмалы, метилметакрилат, метакриловая кислота, оксиалкилакрилаты, оксиалкилметакрилаты, метиленгликольдиметакрилат, бисакриламид, полимеры на основе целлюлозы, полиэтиленгликоли и их сополимеры, полиоксиэтилен и полиоксипропилен, поливинилацетат, поливинилпирролидон и поливинилпиридин, магнитные частицы, флуоресцирующие частицы, клетки животных организмов, клетки растений, макроагрегаты и микроагрегаты альбумина, агрегаты и липосомы денатурированного белка, используемые по отдельности или в сочетании. Твердофазные вещества, применимые в настоящем изобретении, хорошо известны специалистам в данной области техники и не ограничены приведенными выше примерами.
Примеры веществ, из которых изготавливают стент или спираль, включают, не ограничиваясь ими, поливиниловый спирт, полистирол, поликарбонат, полилактид, полигликолид, сополимеры лактида и гликолида, поликапролактон, сополимеры лактида и капролактона, полиоксибутират, полиалкилцианоакрилаты, полиангидриды, сложные полиортоэфиры, полисахариды, декстраны, крахмалы, метилметакрилат, метакриловую кислоту, оксиалкилакрилаты, оксиалкилметакрилаты, метиленгликольдиметакрилат, акриламид, бисакриламид, полимеры на основе целлюлозы, полиэтиленгликоли и их сополимеры, полиоксиэтилен и полиоксипропилен, поливинилацетат, поливинилпирролидон и поливинилпиридин, магнитные вещества, флуоресцирующие вещества, золото, платину, палладий, рений, родий, рутений, нержавеющую сталь, вольфрам, титан, никель и их сплавы, используемые по отдельности или в сочетании.
Предпочтительный размер твердофазного вещества зависит от типа используемого вещества. Например, специалистам в данной области техники известно, что в случае изготовления из твердофазного вещества стента или спирали они предпочтительно имеют такой диаметр, чтобы помещаться в кровеносном сосуде, таком как артерия. Обычно их диаметр составляет около 15 мм или более. Если твердофазное вещество представляет собой частицу, такую как гранула, ее диаметр может составлять до около 7 мм, предпочтительно от около 1 мкм до около 5 мм, наиболее предпочтительно от около 20 мкм до около 300 мкм. Размеры твердофазных веществ, используемых в настоящем изобретении, хорошо известны специалистам в данной области техники и не ограничены приведенными выше примерами.
Используемый в описании термин связывающее средство или компонент, обеспечивающий направленную доставку, относится к одной или нескольким молекулам или структурам твердофазного химического или биологического вещества, связывающим одно вещество с другим. В частности, связывающее средство или твердофазное средство связывает лиганд, рецептор или комплекс лиганд-рецептор на заданной популяции клеток, обычно гиперплазированной ткани и/или связанной с ней сосудистой сети, или раковой клетке, и/или связанной с ней сосудистой сети. Функция молекулы в качестве связывающего средства не ограничена структурным механизмом присоединения. Например, связывающее средство может связывать рецептор, антигенную детерминанту или эпитоп, ферментный субстрат или иную биологическую структуру, соединяющую связывающее средство с клеткой-мишенью или популяцией клеток-мишеней. Связывающее средство может представлять собой конъюгат и включает, не исчерпываясь ими, иммунологические конъюгаты, химические конъюгаты (ковалентные или нековалентные), гибридные белки и тому подобное.
Используемый в описании термин связывающее лиганд средство относится к комплементарному множеству молекул, обладающих специфической способностью связывать друг друга. Пара лиганд-антилиганд в целом обладает связывающей способностью с относительно высокой степенью сродства и благодаря этому может эффективно использоваться в настоящем изобретении. Хорошо известной парой лиганд-антилиганд является биотин и авидин. Используемый в описании термин авидин относится к авидину, стрепавидину, нейтравидину, его производным и аналогам и функциональным эквивалентам. Авидин способен многовалентно или одновалентно связывать биотин. Другие примеры пар лиганд-антилиганд включают, не ограничиваясь ими, гомофильные пептиды, гетерофильные пептиды, «лейциновые зипперы», пары цинк-фингерпринтные белки-участок двухцепочечной ДНК, пары энзим-ингибитор энзима, пары гаптен-антитело, пары лиганд-рецептор лиганда и пары фактор роста-рецептор фактора роста.
Используемые в описании термины выбранная область, заданная область, направленная доставка и предварительная направленная доставка относятся к области, в которой накопление тромбоцитов вокруг твердофазного средства обеспечивает терапевтически благоприятный результат. Обычно это связано с локализацией компонента, обеспечивающего направленную доставку, в области-мишени. Такие области включают, не ограничиваясь ими, сосудистую сеть плотных опухолей, сосудистую сеть доброкачественных опухолей, сосудистую сеть гиперплазированной ткани (тканей), артериовенозные пороки развития, аневризмы сосудов и внутренние истечения.
Упоминаемая в описании доставка твердофазного средства, содержащего связывающее тромбоциты средство, осуществляется при помощи катетера, микрокатетера или иглы и шприца. Доставка при помощи катетера или микрокатетера чаще всего осуществляется через артериальную сеть, однако также возможна доставка твердого вещества через венечную сеть. Например, твердофазное средство в виде частиц, спиралей или стентов может быть доставлено к мишени при помощи катетера через артериальную или венозную сеть. Доставка твердофазного средства через артериальную сеть является предпочтительной, поскольку капиллярное ложе, находящееся ниже по потоку введенного в ткань-мишень вещества, действует в качестве средства улавливания такого средства, за счет чего предотвращается попадание введенного средства в большой круг кровообращения. Твердофазное средство может быть также локализовано в артериальном кровообращении при помощи обеспечивающего направленную доставку средства, объединенного с твердофазным средством. Также возможна доставка твердофазного средства через венозную систему. Локализованная доставка твердофазного средства в венозную систему может осуществляться путем связывания твердофазного средства с областью-мишенью при помощи обеспечивающего направленную доставку средства, объединенного с твердофазным средством. Твердофазное средство также может быть доставлено к области-мишени в ходе хирургического вмешательства. Например, твердофазное средство в виде частиц может доставляться к области-мишени при помощи шприца и иглы. Дополнительно твердофазное средство в виде спирали или стента может быть помещено в область-мишень вручную в ходе хирургического вмешательства.
Используемый в описании термин тромб относится к любому полутвердому агрегату кровяных клеток, опутанных фибрином и слипшимися массами тромбоцитов, образованными тромбоцитами, активно связывающими твердофазное средство. Согласно изобретению образование тромба является непосредственным результатом накопления активированных тромбоцитов в заданной области. Термин тромбоз относится к тромбообразованию, обычно происходящему внутри кровеносного сосуда. Термин тромбогенный относится к веществам, склонным вызывать тромбоз или тромбообразование.
Используемый в описании термин эмбол относится к интраваскулярной массе, перемещающейся по кровотоку и впоследствие застревающей в кровеносном сосуде или капилляре, удаленном от места образования такой интраваскулярной массы. Термин эмболизация подразумевает не активный процесс, а относится к пассивному процессу, в результате которого происходит закупоривание кровеносных сосудов интраваскулярными массами, перемещающимися по кровотоку, в том месте, где они застревают в мелких кровеносных сосудах и капиллярах.
В отличие от этого, в настоящем изобретении осуществляется доставка твердофазного вещества к сосудистой сети-мишени, после чего под действием связывающего тромбоциты средства происходит активный приток тромбоцитов к поверхности твердофазного вещества. В отличие от эмболизующих веществ, описанных в противопоставленных патентах, включенных в настоящее описание в качестве ссылочных материалов, средства по настоящему изобретению должны доставляться к сосудистой сети-мишени в непосредственную близость от нее с учетом быстрого накопления тромбоцитов вокруг твердофазного вещества.
В качестве эмболизующего средства визуализации могут использоваться, например, макроагрегаты альбумина (МАА), поставляемые компанией Драксимадж (Киркланд, Квебек, Канада). МАА состоят из частиц размером от 10 мкм до 70 мкм, с максимальным размером 150 мкм с радиоактивной меткой из пертехнетата натрия Тс 99 м, обеспечивающего сцинтиграфическую визуализацию. Частицы МАА вводятся внутривенно и в виде эмбол перемещаются через кровоток, где их улавливает легочное альвеолярное капиллярное ложе. В результате иммобилизации ФФВ на МАА способом по настоящему изобретению с последующим введением частиц в сосудистую систему происходит немедленное связывание тромбоцитов с частицами и закупоривание сосудистой сети в непосредственной близости от места введения.
В настоящем изобретении усовершенствованы существующие способы перекрытия кровотока путем прикрепления тромбоцитов к поверхности твердофазного вещества при помощи связывающего тромбоциты средства, за счет чего увеличивается действительный размер твердофазного вещества. Например, на поверхности частицы, покрытой ФФВ или содержащей ФФВ, которую ввели в кровоток, быстро накапливаются тромбоциты, в результате чего происходит формирование многослойной структуры активированных тромбоцитов в непосредственной близости от места введения. Таким образом, в настоящем изобретении обеспечивается доставка минимального количества мелких частиц в кровоток, после чего размер частиц быстро увеличивается в результате накопления тромбоцитов, активно связывающих связывающее тромбоциты средство на поверхности или внутри частицы. Кроме того, связанные частицами тромбоциты взаимодействуют друг с другом, формируя агрегаты увеличивающегося размера, образующие плотную матрицу и приводящие к закупориванию сосудистой сети-мишени.
В настоящем изобретении дополнительно усовершенствованы существующие способы перекрытия кровотока путем прикрепления тромбоцитов к поверхности твердофазного вещества при помощи связывающего тромбоциты средства. Таким образом, средство по изобретению обладает следующими эффектами in vivo: а) повторение очертаний кровеносного сосуда или капилляра, в котором оно находится, b) формирование сплошной, непроницаемой трехмерной матрицы, которая в свою очередь образует герметичное уплотнение внутри сосуда, за счет чего максимально подавляется кровоснабжение расположенных ниже по потоку кровеносных сосудов и тканей.
Например, после введения в кровоток связывающей тромбоциты частицы происходит следующая последовательность событий: а) на поверхности частицы формируется один слой тромбоцитов, в результате чего образуется (i) частица увеличенного диаметра и (ii) частица, покрытая активированными тромбоцитами, способными связывать и активировать соседние суспендированные тромбоциты, при этом такая частица именуется частицей, покрытой однослойными поверхностно-активированными тромбоцитами (S-SAP-частица), b) тромбоциты, находящиеся в кровотоке, вступают во взаимодействие с тромбоцитами, связанными с S-SAP-частицей, образуя «луковичные» слои, именуемые многослойными поверхностно-активированными тромбоцитами (M-SAP), с) М-SAP вступают во взаимодействие друг с другом посредством взаимодействия типа тромбоцит-тромбоцит, в результате чего формируются более крупные агрегаты, именуемые M-SAP-матрицей.
В дополнительном примере после введения в кровоток аморфных связывающих тромбоциты частиц (например, МАА), содержащих или имеющих приповерхностное связывающее тромбоциты средство (например, ФФВ), происходит следующая последовательность событий: а) отдельные тромбоциты связываются с матрицей и внутри матрицы на частице, в результате чего образуется (i) частица увеличенного диаметра и жесткости, (ii) частица, покрытая активированными тромбоцитами и содержащая активированные тромбоциты, способные связывать и активировать соседние суспендированные тромбоциты, b) тромбоциты, находящиеся в кровотоке, вступают во взаимодействие с тромбоцитами, связанными с частицей и/или внутри частицы, за счет чего внутри частицы и/или на частице формируются агрегаты, с) частицы, содержащие и/или имеющие приповерхностные тромбоциты, вступают во взаимодействие друг с другом, формируя крупные агрегаты частиц.
Используемые в описании обороты терапевтически благоприятный, обеспечивающий благоприятное терапевтическое действие и тому подобные относятся к желательным физиологическим изменениям в организме реципиента. В предпочтительном варианте осуществления изобретения для достижения благоприятного терапевтического действия может использоваться любой биологический механизм, в котором участвуют активированные тромбоциты или который предусматривает модуляцию тромбоцитов. Примеры терапевтически благоприятного действия по настоящему изобретению включают, не ограничиваясь ими, тромбообразование, образование опосредованной тромбоцитами закупорки, уничтожение гиперплазированной ткани или клеток, уничтожение опухоли и/или опухолевых клеток, уменьшение размера гиперплазированной ткани, уменьшение размера опухоли, воздействие на ткань или опухоль с целью сделать ее восприимчивой к дополнительным видам терапии, таким как химиотерапия и/или радиационная терапия и тому подобное, ограничение или сокращение снабжения гиперплазированной ткани или раковой опухоли питательными веществами, исправление артериовенозных пороков развития, сокращение или предотвращение кровопотери из внутренних истечений и устранение аневризм сосудов.
Используемый в описании термин введение относится к любому действию, в результате которого происходит доставка композиции, содержащей твердофазное средство, к заданной клетке, клеткам или ткани обычно млекопитающего. Введение может осуществляться in vivo, in vitro или ex vivo. Например, композиция может вводиться путем впрыскивания или при помощи эндоскопа или катетера. Введение также включает непосредственное воздействие на клетки композиции по настоящему изобретению. Например, в процессе хирургического вмешательства сосудистая сеть опухоли или гиперплазированной ткани может быть обнажена. В одном из вариантов осуществления настоящего изобретения обнажившиеся клетки или сосудистая сеть может быть подвергнута непосредственному воздействию композиции по настоящему изобретению, например, путем промывания или орошения области хирургического вмешательства, сосудистой сети и/или клеток.
Твердофазное связывающее тромбоциты средство может быть локализовано в специфической области-мишени при помощи связывающего средства или средства, обеспечивающего его направленную доставку. Примеры связывающего средства или средства, обеспечивающего направленную доставку, включают, не ограничиваясь ими, моноклональные антитела, поликлональные антитела, химерные моноклональные антитела, гуманизированные антитела, антитела, полученные методами генной инженерии, участки антител, выбранные из группы, включающей F(ab)2, F(ab')2, Fab, F(ab'), Dab, Fv, sFv, scFv, Fc и минимальную рекогниционную единицу, одноцепочечные структуры, представляющие активный участок моноклональных антител (SC-Mab), связывающие опухоль пептиды, белок, в том числе рецепторные белки, пептид, полипептид, гликопротеин, липопротеин или тому подобные вещества, например факторы роста, лимфокины и цитокины, энзимы, иммуномодуляторы, гормоны, например соматостатин, лиганд (спаренный с комплементарным антилигандом), олигонуклеотиды, любое из указанных веществ в сочетании с молекулой-посредником эффекторной функции, любые мимики или фрагменты любых указанных веществ. В заявленном изобретении также могут использоваться аналоги указанных выше обеспечивающих направленную доставку компонентов, которые сохраняют способность связываться с заданной популяцией клеток-мишеней. Кроме того, могут конструироваться синтетические компоненты, обеспечивающие направленную доставку.
В число моноклональных антител, применимых для практического осуществления настоящего изобретения, входят целые антитела и их участки. Такие моноклональные антитела и участки могут быть получены обычными способами, такими как метод синтеза гибридомы, технология рекомбинантных ДНК и метод синтеза белка. Применимые моноклональные антитела и их участки могут быть получены в качестве производных в организме любого вида (включая человека) или могут быть сформированы в виде химерных белков, в которых используются последовательности организмов нескольким видов. Смотри статью «Природа», авторы Колер и Мильштайн, 256:495-97, 1975 г., Европейский журнал по иммунологии, 6:511-19, 1976 г. Предпочтительным связывающим и/или обеспечивающим направленную доставку средством, способным локализовать твердофазное средство в области-мишени, является антитело или подобная антителу молекула, предпочтительно моноклональное антитело. Более предпочтительным связывающим средством является антитело, которое связывает комплекс лиганд-рецептор на гиперплазированной ткани или клетках (например, опухоли) или сосудистой сети, связанной с гиперплазированной тканью или клетками. Наиболее предпочтительным связывающим средством является антитело или подобная антителу молекула, которая связывает комплекс фактор роста-рецептор фактора роста на опухолевом образовании, таком как сосудистая сеть опухоли или вблизи нее. В предпочтительном варианте осуществления изобретения связывающее средство (т.е. антитело или подобные антителу молекулы) связываются с комплексом VEGF-рецептор VEGF. В более предпочтительном варианте осуществления изобретения в процессе связывания антитело или подобные антителу молекулы распознают неоэпитоп (скрытый или ранее недоступный эпитоп), сформировавшийся в результате взаимодействия лиганд-рецептор (т.е. фактор роста-рецептор фактора роста). В еще более предпочтительном варианте осуществления изобретения при связывании антитела или подобных антителу молекул с комплексом фактор роста-рецептор фактора роста функция фактора роста или рецептора фактора роста остается незатронутой.
В качестве компонентов, обеспечивающих направленную доставку, при практическом осуществлении настоящего изобретения также применимы олигонуклеотиды, т.е. антисмысловые олигонуклеотиды, являющиеся комплементарными по отношению к участкам нуклеиновых кислот (ДНК или РНК) клеток-мишеней. Также применимы олигонуклеотиды, связывающиеся с поверхностью клеток.
В качестве компонентов, обеспечивающих направленную доставку, в настоящем изобретении также могут применяться функциональные эквиваленты упомянутых выше молекул. Одним из функциональных эквивалентов, служащих компонентом, обеспечивающим направленную доставку, является миметическое соединение, являющееся органохимической конструкцией, созданной с целью имитировать нужную конфигурацию и/или ориентацию для связывания компонента, обеспечивающего направленную доставку с клетками-мишенями. Еще одним функциональным эквивалентом, который служит компонентом, обеспечивающим направленную доставку, является короткий полипептид, обозначаемый как «минимальный» полипептид, сконструированный методом компьютерного молекулярного моделирования с использованием мутантов с измененным связывающим сродством, при этом такие минимальные полипептиды обнаруживают связывающее сродство компонента, обеспечивающего направленную доставку.
Fv-фрагменты иммуноглобулина обладают множеством существенных преимуществ по сравнению со всеми иммуноглобулинами при их использовании для направленной терапии опухолей, в том числе лучшей способностью проникать в ткань твердой опухоли и способностью быстрее очищать кровь, а также потенциально более низкой иммуногенностью, опосредованной Fc-фрагментами. Например, одноцепочечное Fv (scFv)-связывающее средство может быть получено методом генной инженерии из генов, выделенных из переменных областей антител, распознающих комплекс лиганд-рецептор.
В одном из вариантов осуществления используется обеспечивающее направленную доставку средство, которое обладает связывающим сродством в отношении маркера, который обнаружен, экспрессирован, доступен для связывания или иным образом локализован на поверхности эндотелиальных клеток опухолеспецифической сосудистой сети, в отличие от здоровой, не опухолеспецифической сосудистой сети. Кроме того, некоторые маркеры, в отношении которых обладает сродством средство, обеспечивающее направленную доставку, могут быть связаны с компонентами опухолеспецифической сосудистой сети, а не самими опухолеспецифическими эндотелиальными клетками. Например, такие маркеры могут располагаться на мембранах оснований или на опухолеспецифической соединительной ткани.
Желательно, чтобы полученное и используемое антитело или иное связывающее средство или компонент обладал относительно высокой степенью избирательности в отношении сосудистой сети опухоли наряду с малой или нулевой реакционной способностью в отношении поверхности здоровых эндотелиальных клеток, определенной методом иммунного окрашивания срезов ткани. Также желательно, чтобы полученное и используемое антитело или иное связывающее средство или компонент был способен связывать общий для всей сосудистой сети эпитоп.
Для достижения благоприятного терапевтического результата in vivo, т.е. инициирования тромбообразования и/или гибели или сокращения числа клеток, может использоваться любая композиция, включающая твердофазное связывающее тромбоциты средство в сочетании с обеспечивающим направленную доставку средством по настоящему изобретению или без него. Композиция может включать одно или несколько вспомогательных веществ, один или несколько носителей, один или несколько наполнителей, один или несколько стабилизаторов, одно или несколько средств проникновения (например, средств, модулирующих перемещение через клеточную мембрану), одно или несколько средств визуализации, один или несколько эффекторов и/или физиологически приемлемые физиологические растворы и буферы. В целом, вспомогательные вещества представляют собой вещества, смешанные с иммуногеном с целью выявления более выраженного иммунного ответа. Композиция может также включать фармацевтически приемлемые носители. Фармацевтически приемлемые носители включают, не ограничиваясь ими, физиологические растворы, стерилизованную воду, фосфатный буферный физиологический раствор и тому подобное. В композицию по настоящему изобретению также могут быть включены другие буферные средства, диспергаторы и инертные нетоксичные вещества, применимые для введения пациенту. Композиции могут представлять собой растворы, применимые для введения, и обычно являются стерильными, непирогенными и не содержат нежелательные частицы. Композиции могут быть стерилизованы обычными методами стерилизации.
В предпочтительном варианте осуществления изобретения приемлемая композиция включает связывающее или обеспечивающее направленную доставку средство, которое связывается с комплексом лиганд-рецептор. Примеры антигенов, применимых в качестве мишеней по настоящему изобретению, включают, не ограничиваясь ими, опухолеспецифические антигены, в том числе рака легких, ободочной кишки, прямой кишки, молочной железы, яичников, предстательной железы, головы, шеи, костей, иммунной системы, крови и любого иного анатомического расположения. Примеры антигенов и/или заданных областей включают, не ограничиваясь ими, комплекс VEGF-рецептор VEGF, комплекс FGF-рецептор FGF или комплекс TGF.beta-TGF.beta, р-селектин, сиалил-льюис X, эндотелин, рецептор эндотелин, комплекс эндотелин-рецептор эндотелина, альфа-фетопротеин, фактор адгезии тромбоцита и эндотелиальной клетки (РЕСАМ), CD31, CD34, CD36, Ib-гликопротеин (GPIb), эндоглин, тромбомодулин, фактор адгезии эндотелиального лейкоцита (ELAM), фактор межклеточной адгезии 1 (ICAM-1), MHC-I и MHC-II. Объектом может являться человек или животное.
Как указано выше, композиция или способ по настоящему изобретению включает связывающее тромбоциты средство или компонент. Примеры связывающих тромбоциты средств включают, не ограничиваясь ими, фактор фон Виллебранда (ФФВ), остетопонтин, фибриноген, фибрин, фибринонектин, витронектин, коллаген, тромбоспондин, ламинин, гепарин, гепарансульфат, хондроитинсульфат, фосфолипазу А2 (PLA2), матричные металлопротеиназы (ММР), тромбин, стекло, сиалил-льюис X, фибулин-1, фактор адгезии тромбоцита и эндотелиальной клетки (РЕСАМ), фактор межклеточной адгезии 1 (ICAM-1), фактор межклеточной адгезии 2 (ICAM-2), CD11b/CD18 (MAC-1), CD11a/CD18 (LFA-1), лиганд 1 р-селектингликопротеина (PSGL-1), по отдельности или в сочетании.
Как указано выше, композиция или способ по настоящему изобретению может включать усилитель тромбоцитарной закупорки. Усилитель тромбоцитарной закупорки может представлять собой компонент, образующий участок бифункциональной молекулы, как указано выше, ингредиент композиции по настоящему изобретению и/или может вводиться отдельно от композиции по настоящему изобретению.
Примеры усилителей тромбоцитарной закупорки включают, не ограничиваясь ими, ристоцетин, тромбин, антитела к обусловленной гепарином тромбоцитопении (HIT) или их участки, антифосфолипидные антитела (АРА) или их участки, целые молекулы антител через опосредованный Fc-фрагментом механизм, антитела к антилиганд-индуцированному месту связывания (anti-LIBS) или их участки, антитела к CD9 или их участки, эпинефрины, активирующий рецептор тромбина пептид (TRAP), агонисты активированного протеиназой рецептора (также известного как активированный протеазой рецептор, PAR), G-катепсин, эластазу, арахидонат, тромбоксан А2 (ТхА2), миметики ТхА2, фосфолипазу А2 (PLA2), активаторы протеинкиназы С (РКС), аденозиндифосфат (ADP), индукторы циклооксигеназы 1 (СОХ-1), коллаген, фактор фон Виллебранда (ФФВ), матричные металлопротеиназы (ММР), гепарин, гепарансульфат, хондроитинсульфат, ионофоры, компоненты пути активации комплемента (например, С5b-9), микрочастицы тромбоцитов, фракции мембран тромбоцитов.
Как указано выше, композиция или способ по настоящему изобретению может включать замедлитель тромбоцитарной закупорки или тому подобное средство. Замедлитель тромбоцитарной закупорки может представлять собой компонент, образующий участок бифункциональной молекулы, как указано выше, ингредиент композиции по настоящему изобретению и/или может вводиться отдельно от композиции по настоящему изобретению.
Примеры замедлителей тромбоцитарной закупорки включают, не ограничиваясь ими, аспирин, ибупрофен, ацетаминофен, кетопрофен, тиклопидин, клопидогрель, индометацин, дипиридамол, жирные омега-3 кислоты, простациклин, окись азота, индукторы окиси азота, индукторы синтазы окиси азота, ингибиторы матричной металлопротеиназы (MMPI, TIMP), средства против GPIIb/IIIa, средства против 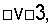 средства против D2D1, средства против CD36, средства против GPVI, ауринтрикарбоновую кислоту, антагонисты рецептора тромбина, антагонисты рецептора тромбоксана, стрептокиназу, урокиназу, активатор тканевого плазминогена (tPA).
средства против D2D1, средства против CD36, средства против GPVI, ауринтрикарбоновую кислоту, антагонисты рецептора тромбина, антагонисты рецептора тромбоксана, стрептокиназу, урокиназу, активатор тканевого плазминогена (tPA).
Кроме того, известно, что тромбоциты, охлажденные ниже температуры фазового перехода их мембран (т.е. ниже 15 градусов С), становятся необратимо активированными. Несмотря на то, что тромбоциты нормально функционируют при их трансфузии пациенту, они быстро выводятся из организма (т.е. в течение около 24 часов, в отличие от продолжительности жизни нормально циркулирующих тромбоцитов, составляющей от 7 до 10 суток). Несмотря на то, что такие тромбоциты быстро выводятся, они с высокой степенью авидности связываются с иммобилизованным ФФВ. Таким образом, трансфузия охлажденных тромбоцитов обеспечивает дополнительное средство усиления тромбообразования в области-мишени. Так, в одном из вариантов осуществления изобретения тромбоцитарную закупорку регулируют путем введения охлажденных тромбоцитов, как указано выше.
Как указано выше, компонент, обеспечивающий направленную доставку, может представлять собой один из элементов связывающей пары или быть связанным с ним. В ходе осуществления способов по настоящему изобретению может потребоваться определенное время, достаточное для накопления обеспечивающего направленную доставку компонента в области локализации, достижения оптимального отношения целевого и нецелевого накопления, накопления и связывания второго элемента связывающей пары и/или выведения несвязанных веществ.
Согласно изобретению направленная доставка или локализация могут осуществляться в ходе двух, трех или более стадий. Многие из таких процедур хорошо известны из уровня техники (смотри, например, патент США US 5578287, в котором описана процедура с использованием биотина/авидина). Примеры многостадийных процедур включают, не ограничиваясь ими, введение связывающего средства-лиганда, введение антилиганда для выведения несвязанного связывающего средства и локализации связанного связывающего средства-лиганда и введение действующего средства-лиганда. Используемый в описании термин действующее средство относится к любому терапевтическому средству, которое обладает активностью или становится активным и обеспечивает терапевтически благоприятный результат.
Согласно способу по изобретению необходимо, чтобы связывающее средство было способно связывать комплекс лиганд-рецептор и вводилось пациенту любым иммунологически приемлемым путем. Например, связывающее средство может быть введено пациенту внутривенным, внутриартериальным, подкожным, внутрибрюшинным, интратекальным, внутрипузырным, интрадермальным, внутримышечным или внутрилимфатическим путем. Композиция может находиться в твердом состоянии, в виде раствора, таблеток, аэрозоли или иметь многофазную форму дозировки. В качестве носителя, основы или системы доставки также могут использоваться липосомы, липосомы с длительным периодом циркуляции, иммунолипосомы, биологически разлагаемые микросферы, мицеллы или им подобные вещества. Кроме того, при помощи хорошо известных из уровня техники процедур ex vivo из организма пациента может быть выведена кровь, плазма или сыворотка крови; необязательно, может быть желательным очистить антиген в крови пациента, после чего кровь или сыворотка может быть смешана с композицией, включающей связывающее средство или твердофазное средство по изобретению, а очищенная кровь или сыворотка возвращена в организм пациента. Для определения наиболее эффективных путей введения специалист-клиницист может сравнить реакции, специфические для таких путей. Изобретение не ограничено ни одним из конкретных способов введения пациенту связывающего средства.
Введение может осуществляться однократно, неоднократно или в течение длительного периода времени. Поскольку композиции по настоящему изобретению могут применяться для лечения серьезных болезненных состояний у пациентов, т.е. угрожающих жизни или потенциально опасных для жизни, при желании может вводиться избыток твердофазного средства. Существующие способы и процедуры введения фармацевтических композиций, включая методики разведения композиций по настоящему изобретению для инъекций, хорошо известны или очевидны для специалистов в данной области техники. Некоторые из таких способов и процедур описаны в Справочнике Ремингтона по фармацевтике, издательство Мак Паблишинг Ко. (1982 г.).
Твердофазное средство может быть введено в сочетании с другими связывающими средствами или в сочетании с другими лечебными процедурами или средствами, например средствами химиотерапии, средствами эмболизации, такими как частицы Gelfoam или поливинилового спирта или тому подобными средствами.
Как хорошо известно из уровня техники, специфическим для введения in vivo недостатком лечебных средств или конъюгатов лечебных средств, является связывание нецелевой или нежелательной мишени. Таким образом, желательными свойствами любой вводимой композиции является обеспечение минимального нецелевого связывания, минимального нецелевого воздействия лечебного средства или действующего средства и/или максимального выведения несвязанного связывающего средства, лиганда или действующего средства. Кроме того, за счет оптимизации таких свойств обычно может быть увеличена доза вводимого действующего средства, терапевтического средства или элемента, участвующего в процессе, который активирует ранее неактивированное средство. Специалистам в данной области техники хорошо известны способы выбора оптимальных параметров введения максимально возможных безопасных доз, не превышающих порог токсичности.
Таким образом, согласно предпочтительному варианту осуществления изобретения в результате связывания с твердофазным средством происходит накопление или индуцирование накопления неактивированных тромбоцитов в заданной области, после чего должным образом локализованные тромбоциты избирательно активируются.
Согласно предпочтительному варианту осуществления изобретения в результате связывания с твердофазным средством или при помощи тромбоцитов, связанных с твердофазным средством, происходит накопление или индуцирование накопления активированных тромбоцитов в заданной области.
Для контроля эффективности настоящего изобретения могут использоваться обычные методы выявления тромбообразования, морфометрические исследования тромбообразования, некроз опухоли, размер опухоли, морфология опухоли и/или тромообразование, приводящее к некрозу опухоли, исследования кровотока (например, ангиография, ультразвуковое исследование Доплера, радиография, срез КТ, визуализация методом ЯМР) или ослабление болевых симптомов. Специалистам в данной области техники также известны другие методы оценки или контроля терапевтического результата.
Специалистам в данной области техники известно, что в случае некоторых врожденных и патологических состояний, некоторые из которых указаны ниже, желательно видоизменить композицию или способ по настоящему изобретению с тем, чтобы компенсировать предрасположенность пациента к избыточной кровоточивости или тромбозу. В данных обстоятельствах могут использоваться модифицирующие средства, усиливающие либо подавляющие способ или композицию по изобретению. Считается, что использование таких модифицирующих средств минимизирует случаи кровотечения или коагуляции. Кроме того, их использование способствует контролируемому введению композиции по изобретению в обычных условиях (т.е. при нормальном гемостазе).
Примеры протромботических или прокоагулирующих состояний, которые могут потребовать использование регуляторов, замедлителей или средств, ослабляющих действие способа или композиции по изобретению, среди прочих включают, не ограничиваясь ими, дефицит фактора VLeiden, антифосфолипидный синдром (APS), дефицит белка С, и/или белка S, и/или антитромбина III, тромбоз глубоких вен (DVT), ложную болезнь Виллебранда-Юргенса, болезнь Виллебранда-Юргенса типа Iib, заболевание периферических сосудов (PVD) и высокое кровяное давление. Примеры сопряженных с опасностью геморрагии состояний, которые могут потребовать использование усилителей или средств, усиливающих действие способа или композиции по изобретению, включают, не ограничиваясь ими, любые состояния, сопряженные с опасностью геморрагии, среди прочих включая, но не ограничиваясь ими, дефициты факторов свертывания крови, гемофилию, тромбоцитопению и антикоагулянтную терапию. Контроль зарождения тромбов включает по меньшей мере одно из следующих действий: изменение температуры в заданной области, изменение скорости кровотока в заданной области и изменение кровяного давления в определенной области.
Примером вышесказанного для специалистов в данной области техники может служить тот факт, что после инициирования процесса перекрытия кровотока может потребоваться устранить или подавить связанное с ним протромботическое состояния. В таких случаях в результате введения средств, подавляющих реакционную способность тромбоцитов, подавляется реакция на инициаторы перекрытия кровотока. Такие средства хорошо известны специалистам в данной области техники и включают, не ограничиваясь ими, аспирин или подобные аспирину соединения, ибупрофен, ацетаминофен, кетопрофен, тиклопидин, индометацин, жирные омега-3 кислоты, простациклин, окись азота, индукторы окиси азота, индукторы синтазы окиси азота, ингибиторы матричной металлопротеиназы (MMPI, TIMP), средства против GPIb, средства против GPIIb/IIIa, средства против αvβ3, средства против α2β1, средства против CD36, ауринтрикарбоновую кислоту, антагонисты рецептора тромбина, антагонисты рецептора тромбоксана, стрептокиназу, урокиназу, активатор тканевого плазминогена (tPA).
Примером состояния, при котором может потребоваться усилить или стимулировать процесс перекрытия кровотока тромбоцитами, является тромбоцитопения (низкий уровень тромбоцитов). Таким пациентам показано сопутствующее или предварительное введение (трансфузия) содержащих тромбоциты средств с целью создания соответствующего источника тромбоцитов для осуществления перекрытия кровотока. Специалистам в данной области техники известно, что в таких обстоятельствах могут использоваться все применимые для трансфузии средства, имитирующие обычные функции тромбоцитов или обладающие приближенными к ним функциями. Такие средства включают, не ограничиваясь ими, тромбоциты произвольно выбранного донора, аферезные тромбоциты, тромбоциты, взятые у той же особи, промытые тромбоциты, фракции мембран тромбоцитов, охлажденные тромбоциты, замороженные тромбоциты, частицы, содержащие или экспрессирующие компоненты мембран тромбоцитов, заменители тромбоцитов и цельную кровь.
В качестве дополнительного примера, для усиления или увеличения исходной реакционной способности тромбоцитов после их направленной доставки к области терапевтического воздействия могут использоваться специфические средства, усиливающие функции тромбоцитов. Специалистам в данной области техники известны средства, усиливающие существующую у тромбоцитов реакционную способность и/или снижающие порог, ограничивающий достаточную реакционную способность тромбоцитов, с целью способствовать необратимой адгезии тромбоцитов, и/или дегрануляции тромбоцитов, и/или связыванию тромбоцитов друг с другом, и/или нарастанию тромбоцитов вокруг существующего тромба. Такие средства включают, не ограничиваясь ими, ристоцетин, тромбин, антитела к обусловленной гепарином тромбоцитопении (HIT) или их участки, антифосфолипидные антитела (АРА) или их участки, целые молекулы антител через опосредованный Fc-фрагментом механизм, антитела к антилиганд-индуцированному месту связывания LIBS, антитела к CD9, эпинефрины, активирующий рецептор тромбина пептид (TRAP), агонисты активированного протеиназой рецептора PAR, G-катепсин, эластазу, арахидонат, активирующий тромбоциты фактор (PAF), миметики тромбоксан А2 (ТхА2), ТхА2, фосфолипазу А2 (PLA2), активаторы протеинкиназы С (РКС), аденозиндифосфат (ADP), коллаген, фактор фон Виллебранда (ФФВ), матричные металлопротеиназы (ММР), гепарин, гепарансульфат, хондроитинсульфат, ионофоры, микрочастицы тромбоцитов, фракции мембран тромбоцитов.
После попадания в кровоток животного-носителя опухоли, гиперплазированной ткани, страдающего артериовенозными пороками развития, аневризмой или внутренними истечениями, твердофазное средство локализуется в сосудистой сети-мишени, осуществляет связывание или иммобилизацию тромбоцитов, за счет которой активируются тромбоциты, после чего активированные тромбоциты связывают и активируют другие тромбоциты до тех пор, пока не произойдет перекрытие кровотока. Активация и связывание тромбоцитов облегчает связывание лейкоцитов с активированными тромбоцитами, что дополнительно способствует закупорке сосудистой сети-мишени.
Примеры
Пример 1
Получение моноклональных антител к поверхностным маркерам антигенных клеток является достаточно простым и может быть легко осуществлено с использованием методик, известных специалистам в данной области техники, например методики Колера и Мильштайна (1975 г.). Вообще говоря, получение моноклональных антител с использованием стимулированных эндотелиальных клеток предусматривает осуществление следующих процедур. Клетки или линии генетически однородных клеток, выделенных из опухолей человека, в течение четырех или более суток выращивают на тканевой культуре. Надосадочную часть тканевой культуры («приспособленную к опухоли среду») удаляют из культур опухолевых клеток и добавляют в культуры эндотелиальных клеток пупочной вены человека (HUVEC) с конечной концентрацией 50% (в объемном отношении). После культивирования в течение 2-х суток осуществляют сбор HUVEC без участия ферментов и интраперитонеально вводят мышам 1-2×106 клеток. Данную процедуру осуществляют трижды с интервалами в две недели, при этом последнюю иммунизацию осуществляют внутривенным путем. Через трое суток производят сбор клеток селезенки и их слияние с клетками миеломы SP2/0 согласно стандартным протоколам (Колер и Мильштайн, 1975 г.). Затем методом предельного разбавления клонируют гибридомы, вырабатывающие антитела с соответствующей реакционной способностью.
Из полученного в результате набора гибридом выбирают одну или несколько гибридом, вырабатывающих антитело, распознающее активированный сосудистый эндотелий в большей степени, чем оно способно распознавать неактивированный сосудистый эндотелий. Конечной задачей является идентификация антител, практически не обладающих связывающим сродством в отношении нормального эндотелия. Применимые гибридомы, вырабатывающие антитела, выявляют методом скрининга при помощи, например, ELISA, RIA, IRMA, IEF или аналогичного иммунологического обследования активированных опухолью эндотелиальных клеток одного или нескольких типов. После обнаружения таких гибридом их испытывают на отсутствие реакционной способности в отношении неактивированного или нормального эндотелия или других здоровых тканей или типов клеток. Таким способом можно исключить гибридомы, вырабатывающие антитела с нежелательно высоким уровнем нормальной перекрестной реактивности для особого применения.
Пример 2
Применяется методика получения одноцепочечных антител, специфически распознающих комплекс лиганд-рецептор, в особенности комплекс фактор роста-рецептор фактора роста, в результате чего полученные молекулы антитела распознают комплекс фактор роста-рецептор фактора роста, но по отдельности не связываются ни с фактором роста, ни с рецептором фактора роста. Такие антитела могут образовываться в результате иммунизации мышей комплексом очищенного лиганда и рецептора, такого как комплекс VEGF-рецептор VEGF, и полученными V-генами, используемыми для конструирования библиотеки антител в нитчатом фаге. Отображение фагом фрагментов антитела позволяет получать молекулы рекомбинантного антитела к антигенам активированных эндотелиальных клеток, в особенности комплексу лиганд-рецептор. Система фага имитирует иммунную систему позвоночных.
Самки мышей линии BALB/c были иммунизированы комплексом очищенного методом жидкостной хроматографии высокого давления рекомбинатного VEFG и рецептора VEFG (например, растворимого рецептора VEFG/FLT-1 или рецептора VEFG/KDR) в присутствии адъюванта, такого как Quill А. После получения соответствующего титра антитела (обычно после четвертой иммунизации) мыши были умерщвлены, и у них была извлечена селезенка. Из селезенки была выделена матричная РНК (мРНК) и транскрибирована в комплементарную ДНК (кДНК). V-гены кДНК были экстракопированы и собраны в виде «одноцепочечного Fv-фрагмента (scFv). После переваривания соответствующими рестриктазами scFv лигируют в фагомидные векторы. Затем при помощи таких фагомидных библиотек осуществляют трансформацию компетентных клеток Е.coli и после инфицирования фагом-помощником (например, М13К07, Pharmacia) получают частицы фага, отображающие scFv. Выбранные клоны подвергают скринингу для экспрессирования растворимого scFv, связывающегося с комплексом лиганд-рецептор, но не связывающегося по отдельности ни с лигандом, ни с рецептором. Указанный скрининг осуществляют при помощи стандартной методики ELISA, при этом в качестве твердофазных антигенов используют комплекс лиганд-рецептор, лиганд и рецептор соответственно.
Пример 3
Известны разнообразные маркеры эндотелиальных клеток, которые могут использоваться в качестве существующих или индуцируемых мишеней при практическом осуществлении изобретения, в том числе VEGF-VPF (фактор роста сосудистого эндотелия/фактор сосудистой проницаемости), фактор адгезии эндотелиального лейкоцита (ELAM-1, Бевилаква и др., 1987 г.), фактор адгезии клеток сосудов 1 (VCAM-1, Дастин и др., 1986 г.), фактор межклеточной адгезии 1 (ICAM-1, Осборн и др., 1989 г.), фактор адгезии лейкоцита 1 (LAM-1) или даже антиген класса II главного комплекса гистосовместимости (ГКГС), такой как HLA-DR, HLA-DP или HLA-DQ (Коллинз и др., 1984 г.). Предпочтительной из перечисленного является направленная доставка комплекса VEGF-рецептор VEGF. Моноклональные антитела или специфические пептиды, распознающие указанные выше антигены эндотелиальных клеток, могут быть связаны с твердофазным средством, таким как частицы, покрытые ФФВ, и доставлены к сосудистой сети-мишени при помощи катетера или аналогичного средства доставки. Тем самым частицы связываются с эндотелиальными клетками сосудистой сети-мишени, в результате чего происходит связывание тромбоцитов и их активация на частице, что, в свою очередь, ведет к накоплению тромбоцитов вокруг частицы и затем к тромбообразованию. Образовавшийся тромб закупоривает сосудистую сеть-мишень, препятствуя тем самым поступлению кислорода и питательных веществ в ткань, расположенную ниже по кровотоку.
Пример 4
Направленная доставка тромбоцитов к определенной области может осуществляться путем непосредственного связывания тромбоцитов с твердофазным средством при взаимодействии с ФФВ, иммобилизованным на твердофазном средстве. Например, рекомбинантный ФФВ, и/или ФФВ человека, и/или ФФВ свиней, иммобилизованный на частице с диаметром от 1 мкм до 5 мм, может быть доставлен к области-мишени различными средствами, такими как катетер. Связывание тромбоцитов может происходить после доставки покрытой ФФВ частицы к сосудистой сети-мишени, при этом тромбоциты, перемещающиеся в кровотоке, вступают в контакт с частицами, связываются с ними, распространяются по их поверхности, активируются, связывают другие тромбоциты и впоследствии образуют тромб, закупоривающий кровеносный сосуд. Связывание тромбоцитов с покрытой ФФВ частицей также может быть инициировано ex vivo, при этом тромбоциты вступают в контакт с частицами в сосуде вне организма, после чего их доставляют к области-мишени при помощи катетера или аналогичного средства доставки. Размер частиц выбирают таким образом, чтобы после инициирования процесса реакции между тромбоцитами и частицами (т.е. процесса связывания тромбоцитов с частицами) частицы не могли продвигаться за пределы капиллярного ложа из-за ограничений на размеры или из-за связанных с частицами тромбоцитов и/или связанных коагулирующих белков, взаимодействующих с рецепторами стенок сосудов. Таким образом, диаметр частиц ФФВ может находиться в пределах от 1 мкм до около 5 мм. Более предпочтительно диаметр частиц находится в пределах от 5 мкм до 2 мм. Наиболее предпочтительно диаметр частиц находится в пределах от 20 мкм до 300 мкм.
Пример 5 - Частицы
Для решения задач настоящего изобретения в качестве твердофазных средств могут использоваться частицы различных композиций. Перечисленные ниже частицы были испытаны на способность связывать средства, связывающие тромбоциты. У компании Полисайнсиз Инк. (Уоррингтон, Пенсильвания) были приобретены микросферы полистирола и покрыты фактором фон Виллебранда человека методом пассивной адгезии (инкубация в 0,2-мольном растворе карбонатного буфера, рН 9,0-9,6) или методом ковалентного сцепления с производными гранулами с использованием карбодиимида или глутаральдегида. Были испытаны гранулы нескольких типов, включая простые микросферы полистирола (номера по каталогу 07310, 17134, 17135, 07312, 07313, 07314), микросферы гранул полиамина (номер по каталогу 19118), микросферы гранул карбоксилата (номер по каталогу 17141), микросферы флуоресбрита (номера по каталогу 17155, 17156), окрашенные микросферы полистирола (номера по каталогу 15715, 15714, 15716) и парамагнитные частицы (номер по каталогу 19829). Все гранулы связывали фактор фон Виллебранда и после соответствующего испытания связывали тромбоциты. Связывание тромбоцитов с гранулами было подтверждено агрегометрией и фазоконтрастной микроскопией.
Были также испытаны другие частицы, в число которых вошли частицы поливинилового спирта (изготовитель - компания Кук, Блумингтон, Индиана) и макроагрегаты альбумина (изготовитель - компания Эдмонтон Радиофармасьютикал Сентер, Эдмонтон, Альберта, Канада). В ходе некоторых экспериментов осуществляли пассивное (при помощи карбонатного буфера, как указано выше) и ковалентное (при помощи глутаральдегидной связи) связывание фактора фон Виллебранда с частицами. Затем связывание тромбоцитов с частицами подтверждали методом агрегометрии, фазоконтрастной микроскопии и флуоресцентной микроскопии (антитело к CD61, меченное FITC).
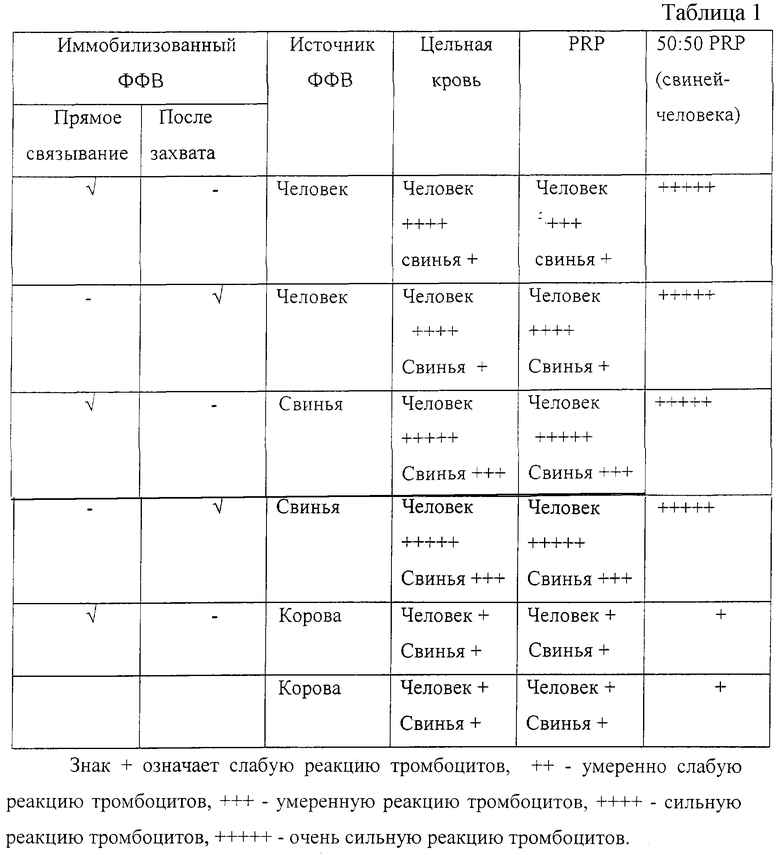
Пример 6 - Сравнение ФФВ различных млекопитающих
ФФВ свиней, коров и человека были иммобилизованы на частицах полистирола с использованием двух методик. В первой методике (прямого связывания) использовали пассивную адсорбцию материала твердофазной частицей в присутствии 0,2-мольного раствора карбоната (рН 9,35). Вторая методика (косвенного связывания) заключалась в выделении ФФВ из организмов свиней, коров и из кровяной плазмы людей, соответственно, с использованием антитела к ФФВ, которое было иммобилизовано на поверхности твердофазной частицы. Использованное во второй методике антитело (выделенное из организма кроликов) приобрели у компании Дако (Миссиссауга, Онтарио, номер по каталогу А0082) и согласно информации, предоставленной изготовителем, подтвердили его способности связывать фактор фон Виллебранда человека, коров и свиней. Антитело зафиксировали на гранулах полистирола (диаметром 4,5 мкм) методом пассивной адсорбции в карбонатном буфере (0,2 мольный раствор, рН 9,35) и в течение 60 минут при комнатной температуре инкубировали в кровяной плазме, взятой из соответствующих источников. Гранулы промыли с целью удаления несвязанного белка и использовали для контрольного заражения цельной крови и обогащенной тромбоцитами кровяной плазмы, взятой у людей и свиней. Аналогичным образом ФФВ человека, свиней и коров по отдельности связали непосредственно с гранулами (т.е. без участия связывающего антитела) методом пассивной адсорбции, как описано выше, и использовали для контрольного заражения тромбоцитов человека и свиней (цельной крови и обогащенной тромбоцитами кровяной плазмы (PRP)). В ходе некоторых экспериментов PRP свиней и человека смешивали друг с другом и подвергали контрольному заражению различными средствами (смотри ниже) - табл.1.
Пример 7 - Взаимодействие лейкоцитов
Частицы, связанные с ФФВ свиней или человека, использовали для характеристического связывания тромбоцитов человека или свиней в зависимости от источника крови. Кроме того, наблюдали взаимодействие лейкоцитов, включая моноциты, гранулоциты и лимфоциты с тромбоцитами, связанными с частицами (подтвержденное методом контрастной окраски и исследованием под микроскопом).
Активация тромбоцитов в области-мишени индуцирует вторичные эффекты, способные стимулировать уменьшение или некроз ткани-мишени. Высвобождение активированными тромбоцитами таких средств, как фактор активации тромбоцитов 4 (PF4), подавляет ангиогенез. Происходящее после активации тромбоцитов высвобождение таких хемоатрактантов, как RANTES, усиливает действие лейкоцитов (например, эозинофильных лейкоцитов, моноцитов) на ткань-мишень. Происходящая после активации экспрессия тромбоцитами таких гранулярных составляющих, как CD62, индуцирует связывание моноцитов и полиморфно-ядерных лейкоцитов (PMN), в результате чего происходит экспрессия тканевого фактора (моноцита; прокоагулянта), а также активация и атака клеток (PMN). Кроме того, высвобождение лиганда CD40 (CD40L) активированными тромбоцитами в области-мишени индуцирует экспрессию тканевого фактора моноцитами, в результате чего формируется локальное состояние гиперкоагуляции.
Пример 8
Твердофазное средство также может представлять собой спираль или стент. Рекомбинантный ФФВ или ФФВ млекопитающих может быть связан с такими твердофазными средствами и различными средствами, включающими хирургическое вмешательство и/или катетер, доставлен к сосудистой сети-мишени. Область-мишень, такая как аневризма, может быть достигнута через кровоток с использованием особых катетеров и соответствующих проволочных проводников. Проволочный проводник вводят в сосудистую систему через открытый участок, такой как бедренная артерия, и осторожно продвигают через крупные кровеносные сосуды к области-мишени. По проволочному проводнику к области-мишени доставляют катетер, после чего проводник удаляют. Затем через просвет катетера вводят твердофазную спираль, связывающую тромбоциты, и доставляют ее к аневризме, где она раскрывается. ФФВ, связанный со спиралью, специфически связывает тромбоциты, перемещающиеся в кровотоке. Тромбоциты активируются и быстро накапливаются вокруг спирали, за счет чего образуется локализованный неподвижный тромб, что в свою очередь снижает опасность разрыва аневризмы.
Пример 9 - Острое действие на организм свиней ФФВ, иммобилизованного частицами
Было осуществлено исследование с целью оценить эффективность индуцирования тромбообразования частицами, покрытыми ФФВ, в сосудистой сети почек свиней. В ходе данной процедуры почечную артерию катетеризировали при помощи ангиокатетера калибра 20-22. Хирургическим путем обнажили кровеносные сосуды почек и установили на них датчик кровотока Доплера с целью контроля притока крови к органу-мишени и оттока крови от него. Поскольку между данными измерения кровотока в почечной артерии и вене не было отмечено существенных различий, все дальнейшие измерения кровотока в почечной вене являются показательными для кровотока через почку-мишень. ФФВ человека ковалентно связали с макроагрегатами альбумина (МАА) человека путем инкубации в течение ночи с использованием глутаральдегида. В результате ранее проводившихся исследований, в которых варьировали количество ФФВ, связанного с МАА в пересчете на единицу массы белка, было установлено, что при отношении МАА к ФФВ в диапазоне от 1:5 до 1:80 обеспечивается достаточное количество ФФВ для индуцирования связывания и активации тромбоцитов. Исходя из этого, для исследований in vivo было выбрано отношение МАА к ФФВ 1:20. Анализ частиц методом фазоконтрастной микроскопии показал, что размер частиц в готовом препарате находился в пределах от 30 мкм до 250 мкм (по данным световой микроскопии с использованием микрометра/гемацитометра).
В результате введения МАА/ФФВ (500 мкл или 1 мл) с последующим введением PRP человека (500 мкл, содержащих порядка 200-400×106 тромбоцитов) в почечную артерию свиньи произошло резкое ослабление кровотока. После испытуемого средства были введены тромбоциты человека, чтобы максимально приблизить условия к существующим в организме человека. Кроме того, было отмечено очень незначительно связывание тромбоцитов свиньи с ФФВ человека (смотри выше Пример 6). Через 10 минут после введения испытуемого средства кровоток снизился менее чем до половины базового уровня. Через 15 минут кровоток упал до уровня менее чем 20% от базового значения. Приток крови к органу не возрастал в течение 90 минутного контрольного периода.
Напротив, контрольное средство (только МАА с аналогичной концентрацией белков), введенное в почечную артерию противоположной почки, привело к временному сокращению кровотока. Кровоток изначально снизился на 50%, но быстро вернулся на близкий к базовому значению уровень, т.е. через 15 минут превысил 80% исходного уровня, а через 30 минут превысил 90% исходного уровня.
Гистологическое исследование сосудистой сети-мишени выявило обширный тромб, образовавшийся в ближайших ответвлениях почечной артерии исследуемого органа и незначительный тромбоз сосудистой сети-мишени контрольной почки. В печени, легких, селезенке, головном мозге, сердечной мышце и глазах контрольных или подопытных животных тромбы не обнаружены.
Пример 10 - Хроническое действие на организм свиней ФФВ, иммобилизованного частицами
Способом, аналогичным описанному в Примере 9, почечные артерии двух подопытных и двух контрольных свиней катетеризировали при помощи ангиокатетера калибра 20-22. На почечную вену каждого животного хирургическим путем установили датчик кровотока Доплера и после того, как сделанный разрез был зашит, вывели на поверхность кожи животного проволочные направляющие. После определения базового значения кровотока через пораженную почку в почечные артерии подопытных животных ввели 1 мл частиц МАА:ФФВ (с общим содержанием белка 11 мг) и затем 1 мл обогащенной тромбоцитами кровяной плазмы человека, содержащей порядка 460×106 тромбоцитов (количество тромбоцитов 458×109/литр), а контрольным животным ввели такое же количество МАА. Животных поместили в ящики и в течение 7 суток наблюдали через различные интервалы времени. В приведенной ниже таблице 2 показаны данные кровотока, полученные в результате исследований.
Основные органы и ткани контрольных и подопытных животных были подвергнуты гистологическому исследованию на выявление тромбоза и других вызванных лечением повреждений. Тромбоз не был выявлен за исключением сосудистой сети почки-мишени.
Пример 11 - Мечение МАА/ФФВ пертехнетатом натрия Тс 99 м
Были получены частицы МАА/ФФВ путем конъюгации ФФВ человека (источник - Альфанат, компания Альфа Терапеутикс Корп.) с частицами МАА (11 мг белка, источник - МАА для инъекций, Эдмонтон Радиофармасьютикал Сентер) с использованием глутаральдегида (конечная концентрация 0,0625% в объемном отношении). Отношение белков находилось в пределах от 40:1 до 20:1 (МАА:ФФВ). Функциональность частиц была проверена путем контрольного заражения нормальной обогащенной тромбоцитами кровяной плазмы и нормальной цельной крови, полученной от здорового донора, не принимавшего лекарств (в течение более 2 недель), частицами МАА/ФФВ методом перемешивания в течение 10 минут со скоростью 500 оборотов в минуту (10 мкл частиц + 100 мкл источника тромбоцитов). Исследование реакции методом фазоконтрастной микроскопии подтвердило способность частиц связывать и активировать тромбоциты, формируя обширные скопления тромбоцитов и частиц МАА/ФФВ.
Затем частицы МАА/ФВВ подвергли мечению пертехнетатом натрия Тс 99 м с диапазоном активности от 88 MBq до 300 MBq. В течение 10 минут одинаковые объемы частиц инкубировали в физиологическом растворе и пертехнетате натрия Тс 99 м при комнатной температуре. С использованием тонкослойной хроматографии была определена эффективность мечения, которая превысила 95%.
Затем меченные Тс 99 м частицы МАА/ФФВ подвергли испытанию с целью оценить действие мечения на функциональность частиц. Фазоконтрастная микроскопия подтвердила, что меченные Тс 99 м частицы МАА/ФФВ способны связывать и активировать тромбоциты. Не было отмечено явного снижения функциональной активности меченых частиц.
Пример 12 - Рентгеноскопические исследования вызванного МАА/ФФВ тромбоза сосудистой сети почек свиней
К сосудистой сети почек свиньи через бедренную артерию доставили МАА/ФФВ. В бедренную артерию поросят весом от 18 до 20 кг, подвергнутых общей анестезии (галотаном), ввели катетер 5-Fr и при помощи рентгеноскопии направили в левую почечную артерию. Катетер был размещен таким образом, что после доставки контрастного красителя была визуализирована лишь сосудистая сеть нижней доли почки. В начальный момент времени в сосудистую сеть почки медленно (в течение более 10 секунд) доставили 1 мл частиц МАА/ФФВ (размером 30-250 микрон). Спустя 10 секунд доставили 1 мл PRP человека (420×109 на литр) и промыли катетер 1 мл физиологического раствора. Катетер оставался на месте, и по истечении 20-минутного периода ожидания к сосудистой сети-мишени снова доставили контрастное средство. Контрастное средство скопилось на конце катетера, а затем быстро переместилось в сосудистую сеть верхней доли почки. Сосудистая сеть нижней доли почки медленно накапливала контрастное средство, которое не рассеивалось (в течение более чем 20 минут), тогда как сосудистая сеть верхней доли почки быстро потеряла контрастное средство (менее чем за 5 секунд). Почку находившегося под действием анестезии животного обнажили хирургическим путем, при этом катетер оставался на месте, пережали сосудистую сеть почки непосредственно вблизи катетера и удалили почку. При помощи продольного разреза вскрыли почечную артерию и сделали рассечение в направлении почки. На дальнем конце катетера был обнаружен обширный тромб, уходящий далеко вглубь сосудистой сети нижней доли почки. В сосудистой сети верхней доли почки не было отмечено коагуляции. Кроме того, нижняя доля почки заметно побелела, что указывало на недостаток кровоснабжения, а верхняя доля почки имела обычную красную окраску.
В ходе отдельного эксперимента, проведенного после описанной выше процедуры, катетер направили к сосудистой сети нижней доли почки-мишени для доставки 1 мл частиц МАА/ФФВ, а затем 1 мл PRP человека. Через 20 минут методом рентгеноскопии выявили заметное сокращение кровоснабжения нижней доли почки. Как и ранее, контрастный краситель быстро переместился в сосудистую сеть верхней доли почки после накопления на конце катетера. Затем положение катетера изменили и доставили в сосудистую сеть верхней доли частицы МАА/ФВВ, а затем PRT человека. По окончании 20-минутного периода ожидания снова ввели контрастный краситель. Проведенная рентгеноскопия выявила отсутствие кровоснабжения сосудистой сети верхней доли почки. Контрастный краситель не проник в сосудистую сеть нижней доли. Затем животное умертвили и удалили хирургическим путем почку-мишень и ее кровеносные сосуды. Немедленно произведенное рассечение почки выявило обширный тромбоз кровеносных сосудов как верхней, так и нижней долей почки.
Несмотря на то, что настоящее изобретение описано на примере конкретных предпочтительных вариантов его осуществления, оно не ограничено такими вариантами осуществления. Специалистами в данной области техники могут быть предложены альтернативные варианты осуществления, примеры и модификации изобретения, которые также входят в его объем, в особенности, в свете описанных выше идей изобретения.
Изобретение относится к медицине, к способам и композициям для направленной доставки твердофазных связывающих тромбоциты средств, перекрывающих кровоток, для лечения васкуляризированной опухоли или гиперплазированной ткани. Твердофазное средство, кроме полистирола, покрытое связывающим тромбоциты средством, таким как фактор Виллебранда, направленно доставляют к сосудистой сети-мишени in vivo, где оно связывает и активирует тромбоциты, которые в свою очередь связывают и активируют другие тромбоциты. Вариант композиции для индуцирования in vivo тромбообразования, содержащей твердофазное связывающее тромбоциты средство, кроме полистирола, может состоять из первого связывающего компонента и второго связывающего компонента, где первый связывающий компонент имеет связывающую область для связывания твердофазного средства с комплексом лиганд-рецептор, а не лигандом или рецептором по отдельности, а второй связывающий компонент имеет связывающую область для тромбоцитов. Изобретение обеспечивает быстрое образование плотного тромба, приводящее к перекрытию кровотока в заданной области, за счет прикрепления тромбоцитов к поверхности твердофазного средства с увеличением его размеров и формированием многослойной структуры активированных тромбоцитов в виде плотной матрицы. 4 н. и 25 з.п. ф-лы, 2 табл.
| WO 00/29029 A1, 25.05.2000, весь документ | |||
| КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ПОЛИПЕПТИД, СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛИ (ВАРИАНТЫ) | 1992 |
|
RU2170589C2 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Windecker S | |||
| et al | |||
| Stent coating with titanium-nitride-oxide for reduction of neointimal hyperplasia // Circulation | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2007-03-20—Публикация
2002-09-11—Подача