Ссылка на родственные патентные заявки
По настоящей заявке испрашивается приоритет в соответствии с § 119(e) 35 U.S.С. предварительных заявок США №№62/157933, 62/273953 и 62/296032, зарегистрированных 6 мая 2015 года, 31 декабря 2015 года и 16 февраля 2016 года, соответственно, содержание каждой из которых полностью включено в настоящий документ в качестве ссылки.
Предшествующий уровень техники настоящего изобретения
Во всем объеме и в рамках настоящего изобретения представлены технические и патентные публикации, указанные идентифицирующей ссылкой или арабскими цифрами. Полные библиографические ссылки, соответствующие арабским цифрам, находятся в описании перед формулой изобретения. Описания всех цитируемых в настоящем документе ссылок включены в настоящую заявку в качестве ссылки для более полного описания предшествующего уровня техники, к которому принадлежит настоящее изобретение.
В патогенез или обострение широкого спектра заболеваний вовлечено аномальное функционирование иммунной системы. Хотя существует широкий спектр иммунотерапевтических средств, их действие из-за отсутствия направленной специфичности и/или неблагоприятных побочных эффектов часто сопряжено с ненаправленным действием.
Таким образом, для этих нарушений существует необходимость в поиске безопасных и эффективных терапевтических средств. Настоящее изобретение удовлетворяет эту потребность, а также предоставляет связанные преимущества.
Сущность изобретения
Настоящее изобретение относится к нанолекарству, которое в одном из аспектов представляет собой комплекс, содержащий сердцевину наночастицы, связанную с множеством комплексов ассоциированный с заболеванием антиген-МНС (сокращаемых в настоящем документе как "рМНС" или "комплексы рМНС"), которые пригодны для размножения и дифференцировки популяций Т-клеток и лечения заболевания при ведении индивидууму в эффективном количестве. Сердцевина наночастицы содержит ряд композиций или компонентов, как более подробно описано в настоящем документе. В соответствии с определенными аспектами диаметр сердцевины наночастицы представляет собой диаметр, выбранный из группы приблизительно от 1 нм до приблизительно 100 нм; приблизительно от 1 нм до приблизительно 75 нм; приблизительно от 1 нм до приблизительно 50 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 5 нм до приблизительно 100 нм; приблизительно от 5 нм до приблизительно 50 нм; или приблизительно от 5 нм до приблизительно 25 нм, или приблизительно от 15 нм до приблизительно 25 нм, или приблизительно 20 нм. В соответствии с определенными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм.
В соответствии с определенными аспектами количество рМНС на сердцевину наночастицы (указанное в настоящем документе как "валентность" комплекса наночастицы наночастицы) может находиться в диапазоне приблизительно от 1 комплекса рМНС на 1 сердцевину наночастицы до приблизительно 6000 комплексов рМНС на 1 сердцевину наночастицы, или, альтернативно, приблизительно от 10:1 до приблизительно 6000:1, или, альтернативно, приблизительно от 11:1 до приблизительно 6000:1, или, альтернативно, приблизительно от 12:1 до приблизительно 6000:1, или, альтернативно, по меньшей мере 2:1, или, альтернативно, по меньшей мере 8:1, или, альтернативно, по меньшей мере 9:1, или, альтернативно, по меньшей мере 10:1, или, альтернативно, по меньшей мере 11:1, или, альтернативно, по меньшей мере 12:1. В соответствии с определенными аспектами количество рМНС на сердцевину наночастицы составляет приблизительно от 10:1 до приблизительно 6000:1, или приблизительно от 20:1 до приблизительно 5500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 5000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 4000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 3500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 3000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 2500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 2000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 1500:1, или, альтернативно, приблизительно от 10:1 до 1000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 100:1, или, альтернативно, приблизительно от 20:1 до приблизительно 50:1, или, альтернативно, приблизительно от 25:1 до приблизительно 60:1; альтернативно приблизительно от 30:1 до приблизительно 50:1, или, альтернативно, приблизительно от 35:1 до приблизительно 45:1, или, альтернативно, приблизительно 40:1.
В соответствии с определенными аспектами сердцевина наночастицы обладает определенной валентностью на площадь поверхности сердцевины, также обозначаемую в настоящем документе как "плотность". В этих аспектах, плотность рМНС на наночастицу составляет приблизительно от 0,025 рМНС/100 нм2 до приблизительно 100 рМНС/100 нм2 площади поверхности сердцевины наночастицы, или, альтернативно, приблизительно от 0,406 рМНС/100 нм2 до приблизительно 50 рМНС/100 нм2; или, альтернативно, приблизительно от 0,05 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2. В соответствии с определенными аспектами плотность рМНС на наночастицу is приблизительно от 0,4 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 15 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 14 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 13 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
В соответствии с другим аспектом плотность рМНС на наночастицах может составлять приблизительно от 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В соответствии с определенными аспектами плотность рМНС на наночастице может составлять приблизительно от 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2 или 0,24 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,26 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,28 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,24 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,5 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,6 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В дополнительном аспекте, плотность рМНС на наночастице может составлять приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,3 рМНС/100 нм2, или, альтернативно, приблизительно от 0,5 рМНС/100 нм2 до приблизительно 0,9 рМНС/100 нм2, или, альтернативно, приблизительно от 0,6 рМНС/100 нм2 до приблизительно 0,8 рМНС/100 нм2.
В соответствии с определенными вариантами осуществления плотность рМНС на наночастице может составлять приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9 или 12,0 рМНС/100 нм2. В соответствии с конкретными вариантами осуществления плотность рМНС на наночастице может составлять приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2 или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2 или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2.
В еще одном аспекте плотность рМНС на наночастице как определено в настоящем документе может составлять приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,3 рМНС/100 нм2, или, альтернативно, приблизительно от 0,5 рМНС/100 нм2 до приблизительно 0,9 рМНС/100 нм2, или, альтернативно, приблизительно от 0,6 рМНС/100 нм2 до приблизительно 0,8 рМНС/100 нм2, и дополнительно, где диаметр сердцевины наночастицы составляет приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм.
В соответствии с определенными аспектами сердцевина наночастицы дополнительно содержит ряд костимулирующих молекул, костимулирующих антител, ингибирующих блокирующих рецепторы антител и/или ряд цитокинов, связанных с сердцевиной наночастицы.
Таким образом, определенные аспекты изобретения относятся к комплексу, содержащему или, альтернативно, в значительной степени состоящему, или даже еще более состоящему из сердцевин наночастиц, связанных с рядом комплексов рМНС, где сердцевины наночастиц необязательно дополнительно содержат или, более того, состоят или, альтернативно, более того, по существу состоят из одной или несколько костимулирующих молекул и/или одного или нескольких цитокинов, связанных с сердцевиной наночастицы. В этих композициях, содержащих ряд комплексов, комплексы рМНС на каждой сердцевине наночастицы являются одинаковыми или отличаются друг от друга; и/или МНС комплексов рМНС на каждой сердцевине наночастицы являются одинаковыми или отличаются друг от друга; и/или цитокины на каждой сердцевине наночастицы являются одинаковыми или отличаются друг от друга; и/или костимулирующие молекулы на каждой сердцевине наночастицы являются одинаковыми или отличаются друг от друга; и/или диаметры сердцевин наночастиц являются одинаковыми или отличаются друг от друга; и/или валентность комплексов рМНС на каждой сердцевине наночастицы являются одинаковыми или отличаются друг от друга; и/или плотность комплексов рМНС на каждой сердцевине наночастицы является одинаковой или отличается для разных комплексов; и/или валентность костимулирующих молекул на каждой сердцевине наночастицы является одинаковой или отличается для разных молекул; и/или валентность цитокинов на каждой сердцевине наночастицы является одинаковой или отличается для разных цитокинов.
В соответствии с определенными аспектами в настоящем документе предоставлены композиции, содержащие ряд комплексов, предоставленных в настоящем документе. В соответствии с определенными вариантами осуществления композиции дополнительно содержат носитель, необязательно фармацевтический носитель. В соответствии с определенными вариантами осуществления композиции, предоставленные в настоящем документе, необязательно могут содержать одну или несколько сердцевин наночастиц, связанных с одним или несколькими из костимулирующих молекул и/или цитокинов. Таким образом, В соответствии с определенными вариантами осуществления композиции содержат или, альтернативно, в значительной степени состоят, или даже более того, состоят из: 1) ряда сердцевин наночастиц, связанных с рядом комплексов антиген-МНС, где по меньшей мере одна часть сердцевин наночастиц дополнительно содержит одну или несколько костимулирующих молекул и/или один или несколько цитокинов, а вторая часть сердцевин наночастиц не содержит дополнительно костимулирующих молекул и/или цитокинов, и 2) ряда сердцевин наночастиц, связанных с одним или несколькими из костимулирующих молекул и/или цитокинов.
Дополнительные аспекты изобретения относятся к ассоциированным с конкретными заболеваниями антигенам, МНС и их сочетаниям, оптимизированным для лечения или профилактики заболеваний у являющихся человеком и животными пациентов.
Настоящее изобретение также относится к композициям и способам применения любого из указанных выше комплексов или композиций, каждый из которых необязательно комбинируют с носителем, например, фармацевтически приемлемым носителем.
Настоящее изобретение также относится к способам дифференцировки или инициации формирования регуляторных Т-клеток типа 1 (TR1) независимым от дозы рМНС способом. Заявитель выявил, что плотность рМНС на сердцевине наночастицы регулирует способность рМНС на сердцевине наночастицы инициировать формирование клеток TR1 независимым от дозы способом, хотя доза рМНС регулирует уровень размножения клеток TR1 независимым от плотности рМНС способом. Заявитель выявил, что порог плотности рМНС и независимое действие плотности рМНС по сравнению с дозой на формирование клеток TR1 по сравнению с размножением являются неожиданными результатами, которые нельзя было предполагать на основе общего знания в области иммунологии в данной области. В этих способах необходимо приведение (in vitro или in vivo) распознающих Т-клеток в контакт с эффективным количеством рМНС-NP или композиции, описываемых в настоящем документе. В соответствии с определенными аспектами зависимые от плотности способы относятся к активированным Т-клеткам или к Т-клеткам памяти дифференцирующимся в соответствующе продуцирующие IL-10 клетки TR1 необязательно, несущие маркеры CD49b и/или Lag3, и/или В-клеткам, дифференцирующимся в регуляторные В-клетки, посредством контакта активированных Т-клеток или Т-клеток памяти с эффективным количеством комплекса или композиции, описываемой в настоящем документе. В соответствии с определенными вариантами осуществления дифференцированная клетка TR1 связывается с В-клеткой, таким образом, обеспечивая дифференцировку В-клетки в регуляторную В-клетку. В соответствии с определенными аспектами способов, приведение в контакт проводят in vitro или in vivo. В соответствии с определенными вариантами осуществления pMHC-NP или композиция, содержащие ряд pMHC-NP, содержат pMHC-NP со средним диаметром сердцевины наночастицы приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм. В соответствии с определенными аспектами сердцевина наночастицы дополнительно содержит внешнее покрытие или слой, где средний диаметр сердцевины и внешнего слоя составляет приблизительно от 30 нм до приблизительно 75 нм, или приблизительно от 30 нм до приблизительно 70 нм, или приблизительно от 30 нм до приблизительно 60 нм, или приблизительно от 30 нм до приблизительно 50 нм, или приблизительно 40 нм. В соответствии с определенными аспектами средняя плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
Дополнительные аспекты изобретения относятся к способам лечения или профилактики соответствующих заболеваний или патологических состояний, как описано в настоящем документе, посредством введения эффективного количества pMHC-NP, как описано в настоящем документе. Также описаны способы детекции присутствия и эффективности лечения комплексами и композициями pMHC-NP, как описано в настоящем документе.
Краткое описание чертежей
Приводимые далее рисунки составляют часть настоящего описания и включены для дополнительной демонстрации определенных аспектов настоящего изобретения. Изобретение можно лучше понять при обращении к одному или нескольким из этих чертежей в комбинации с подробным описанием конкретных вариантов осуществления, предоставленным в настоящем документе.
На фигурах 1А-1В представлены схематические изображения комплексов NP. Фигура 1А представляет собой схематическое изображение одноцепочечной экспрессирующей конструкции рМНС-класса I (верхнее) и характерный профиль проточной цитометрии связывания соответствующего тетрамера рМНС (меченного флуорохромом) с распознающими CD8+ Т-клетками. Фигура 1В представляет собой схематическое изображение, демонстрирующее линкеры и двухмерную структуру комплексов NP. Как можно видеть, одна NP может содержат один и тот же антиген в комплексе с сердцевиной наночастицей посредством различных химических линкеров.
На фигуре 2 представлена структура типичного мономера рМНС класса II (верхняя) и характерный профиль FACS распознающих CD4+ Т-клеток, окрашенных соответствующим тетрамером рМНС или оставшихся неокрашенными.
На фигуре 3 представлена химическая структура привитого древовидного поли-L-лизина генерации 3 (DGL G3).
На фигуре 4 представлен синтез привитого древовидного поли-L-лизина G3, функционализированного PEG-азидо (DGLN).
На фигуре 5 представлен синтез pMHC-DGLN.
На фигуре 6 представлен анализ конъюгатов pMHC-DGLN в нативном и денатурирующем PAGE.
На фигуре 7 представлен анализ AFM V7CHO-DGLN.
На фигурах 8А-8В представлено, что V7CHO-DGLN обладает значительными агонистическими свойствами у распознающих CD8+ Т-клеток.
На фигурах 9A-9N представлены pMHC-NP, соответствующие T1D или ЕАЕ стимулирующие размножение распознающих супрессирующих заболевания подобных TR1 CD4+ Т-клеток in vivo. На фигурах 9А и 9В представлены профили окрашивания тетрамерами (фигура 9А) и процент тетрамер+CD4+ Т-клеток (фигура 9В). Данные соответствуют самкам NOD с преддиабетом, обрабатываемым в течение 5 недель (кровь: n=5, 8 и 6; селезенка: n=5, 18 и 6, соответственно). Тетр., тетрамер. На фигуре 9С представлено окрашивание тетрамерами CD4+ Т-клеток селезенки обработанных или необработанных мышей NOD Foxp3-eGFP. На фигуре 9D представлено, что тетрамер+CD4+ Т-клетки обработанных 2.5mi/I-Ag7-NP мышей демонстрируют подобный TR1 фенотип. На фигуре 9Е представлена частота диабета у хозяев NOD scid с восстановленными Т-клетками с трансфузией CD4+ Т-клеток от различных доноров ±2.5mi/I-Ag7-NP (n=11, 5, 7 и 6 от верха). На фигуре 9F представлен процент тетрамер+CD4+ Т-клеток у обработанных или необработанных 2.5mi/I-Ag7-NP хозяев NOD scid (n=4-5 на группу). На фигуре 9G представлена частота реверсии заболевания у мышей с диабетом, обработанных pMHC-NP (n=9, 7, 7, 7 с верха слева направо) или пептидом IGRP4-22 (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) и комплексом пептид IGRP4-22-NP (n=9). На фигуре 9Н представлен процент тетрамер+CD4+ Т-клеток у мышей с диабетом в начале заболевания в ответ на терапию 2.5mi/I-Ag7-NP и у совпадающих по возрасту контролей без диабета (n=8, 6, 2 и 7 слева). На фигуре 91 представлены индексы инсулита (n=6, 4, 3 и 6 слева). Нижние иллюстративные изображения. На фигурах 9J-9M представлены мыши C57BL/6, иммунизированные PMOG35-55. На фигуре 9J представлены индексы ЕАЕ обработанных мышей, на сутки 14 (n=4 каждая). На фигуре 9K представлены индексы ЕАЕ обработанных мышей на сутки 21 (n=10, 7 и 3 сверху). На фигуре 9L представлен процент тетрамер+CD4+ Т-клеток в селезенке и крови мышей на фигурах 9J и 9K (n=13, 14 и 5 сверху). На фигуре 9М представлены характерные профили проточной цитометрии CD4+ Т-клеток мышей, описанных на фигурах 9J и 9K. На фигуре 9N представлены характерные окрашивания микроглиальных IBA1 и относительные ранговые индексы в мозжечках мышей, описанных на фигуре 9K (n=4-5). Значения Р рассчитывали по U-критерию Манна-Уитни, лог-ранговому критерию (Мантеля-Кокса) или посредством двустороннего ANOVA. Величины ошибок, стандартная ошибка среднего.
Краткое описание таблиц
Таблица 1. Функционализированные линкеры PEG.
Таблица 2. Кодоны.
Таблицы 3А и 3В. Транскрипционный профиль размноженных под действием pMHC-NP CD4+ Т-клеток. (А) кПЦР-РВ для панели из 384 иммунологических маркеров в CD4+ Т-клетках с тетрамером 2.5mi/I-Ag7+ в сравнении с CD4+ Т-клетками с тетрамером 2.5mi/I-Ag7-, подвергнутых сортировке у мышей NOD, обработанных 10 дозами 2.5mi/I-Ag7-NP, начиная с возраста 10-15 недель (n=3 и 4 образцов, соответственно). Клетки перед получением РНК стимулировали in vitro с использованием покрытых mAb к CD3/к CD28 гранул Dynabeads. В панели приведены наиболее значимые отличия. (В) кПЦР-РВ для 8 ассоциированных с TR1 маркеров, включая маркеры, которые не представлены в наборе праймеров, используемом в (А). Данные соответствуют четырем дополнительным образцам CD4+ Т-клеток с тетрамером 2.5mi/I-Ag7+ и семи дополнительным образцам CD4+ Т-клеток с тетрамером 2.5mi/I-Ag7-.
Таблица 4А, 4В и 4С. Доноры T1D человека и исход терапии pMHC-NP у хозяев NSG с трансплантированными РВМС.
Таблица 5 представляет собой иллюстративный список ассоциированных со злокачественными опухолями антигенов для применения по настоящему изобретению.
Таблица 6 представляет собой иллюстративный список ассоциированных с диабетом антигенов для применения по настоящему изобретению.
Таблица 7 представляет собой иллюстративный список ассоциированных с рассеянным склерозом антигенов для применения по настоящему изобретению.
Таблица 8 представляет собой иллюстративный список ассоциированных с глютеновой болезнью антигенов для применения по настоящему изобретению.
Таблица 9 представляет собой иллюстративный список ассоциированных с первичным биллиарным циррозом антигенов для применения по настоящему изобретению.
Таблица 10 представляет собой иллюстративный список ассоциированных с листовидной пузырчаткой антигенов и ассоциированных с обыкновенной пузырчаткой антигенов для применения по настоящему изобретению.
Таблица 11 представляет собой иллюстративный список ассоциированных с нейромиелитом зрительного нерва со спектральным расстройством антигенов для применения по настоящему изобретению.
Таблица 12 представляет собой иллюстративный список ассоциированных с аллергической астмой антигенов для применения по настоящему изобретению.
Таблица 13 представляет собой иллюстративный список ассоциированных с воспалительным заболеванием кишечника антигенов для применения по настоящему изобретению.
Таблица 14 представляет собой иллюстративный список ассоциированных с системной красной волчанкой антигенов для применения по настоящему изобретению.
Таблица 15 представляет собой иллюстративный список ассоциированных с атеросклерозом антигенов для применения по настоящему изобретению.
Таблица 16 представляет собой иллюстративный список ассоциированных с хроническим обструктивным заболеванием легких антигенов и ассоциированных с эмфиземой антигенов для применения по настоящему изобретению.
Таблица 17 представляет собой иллюстративный список ассоциированных с псориазом антигенов для применения по настоящему изобретению.
Таблица 18 представляет собой иллюстративный список ассоциированных с аутоиммунным гепатитом антигенов для применения по настоящему изобретению.
Таблица 19 представляет собой иллюстративный список ассоциированных с увеитом антигенов для применения по настоящему изобретению.
Таблица 20 представляет собой иллюстративный список ассоциированных с синдромом Шегрена антигенов для применения по настоящему изобретению.
Таблица 21 представляет собой иллюстративный список ассоциированных со склеродермией антигенов для применения по настоящему изобретению.
Таблица 22 представляет собой иллюстративный список ассоциированных с антифосфолипидным синдромом антигенов для применения по настоящему изобретению.
Таблица 23 представляет собой иллюстративный список ассоциированных с ассоциированным с ANCA васкулитом антигенов для применения по настоящему изобретению.
Таблица 24 представляет собой иллюстративный список ассоциированных с синдромом мышечной скованности антигенов для применения по настоящему изобретению.
Подробное описание изобретения
Следует понимать, что настоящее изобретение не ограничено описанными конкретными вариантами осуществления, поскольку они, конечно, могут варьировать. Также следует понимать, что используемая в настоящем документе терминология предназначена только для цели описания конкретных вариантов осуществления и не предназначена для ограничения, так как объем настоящего изобретения определен только прилагаемой формулой изобретения.
Следует отметить, что как используют в настоящем документе и в прилагаемой формуле изобретения, формы единственного числа включают указание на множественное число, если из контекста явно не следует иначе. Таким образом, например, указание "эксципиента" включает ряд эксципиентов. Термин "по меньшей мере один" означает один или несколько.
На всем протяжении настоящей заявки термин "приблизительно" используют для указания того, что значение включает стандартное отклонение ошибок для устройства или способа, используемого для определения значения. Термин "приблизительно", когда его используют до числового обозначения, например, температуры, времени, количества и концентрации, включая диапазон, означает приблизительные значения, которые могут варьировать на (+) или (-) 10%, 5% или 1%.
Определения
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые широко известны специалистам в области, к которой принадлежит настоящее изобретение. Как используют в настоящем документе приводимые ниже термины имеют указанные ниже значения.
Как используют в настоящем документе, термин "содержащий" или "содержит" предназначен для обозначения того, что композиции и способы включают перечисляемые элементы, не исключая других. Когда используют для определения композиций и способов "в значительной степени состоящий из" должен означать исключение других элементов с любой существенной значимостью для комбинации для указанной цели. Таким образом, как определено в настоящем документе, композиция, в значительной степени состоящая из элементов, не исключает других материалов или этапов, которые не оказывают существенного влияния на основную и новую характеристику(и) заявляемого изобретения, например, как композиции для лечения или профилактики рассеянного склероза. "Состоящий из" означает исключение большего, чем следовые количества других ингредиентов и существенные этапы способа. Варианты осуществления, определенные каждым из этих переходных терминов, находятся в объеме настоящего изобретения.
Термины "ингибирование", "снижение" или "предотвращение" или любой вариант этих терминов, когда их используют в формуле изобретения и/или в описании, включают любое поддающееся определению уменьшение или полное ингибирование для достижения требуемого результата.
Под "биосовместимым" подразумевают, что компоненты системы доставки не вызывают повреждения ткани или повреждения биологической системы человека. Для придания биологической совместимости предпочтительно используют полимеры и эксципиенты, для которых существует опыт безопасного лечения у людей или есть статус GRAS (общепризнанные как безопасные). Под биологической совместимостью подразумевают, что ингредиенты и эксципиенты, используемые в композиции в конечном итоге подвергаются "биоабсорбции" или выводятся из организма без неблагоприятных воздействий на организм. Чтобы композиция была биосовместимой, и ее рассматривали, как нетоксическую, она не должна быть токсичной для клеток. Подобным образом, термин "биоабсорбируемый" относится к наночастицам, полученным из материалов, которые в течение определенного периода времени подвергаются биоабсорбции in vivo так, что длительного накопления материала у пациента не происходит. В определенном варианте осуществления биосовместимая наночастица подвергается биоабсорбции в течение периода менее 2 лет, предпочтительно менее чем 1 год и даже более предпочтительно менее 6 месяцев. Скорость биоабсорбции зависит от размера частицы, используемого материала и других факторов, широко известных специалистам в данной области. Для формирования наночастиц, используемых по настоящему изобретению, можно использовать смесь биоабсорбируемых биосовместимых материалов. В одном из вариантов осуществления можно комбинировать оксид железа и биосовместимый биоабсорбируемый полимер. Например, для формирования наночастиц можно комбинировать оксид железа и PGLA.
Как используют в настоящем документе, термин "дендример" относится к повторно ветвящейся молекуле, также обозначаемой как арборол или каскадная молекула. В отношении синтеза наночастиц, термин "сердцевина дендримера" относится к использованию дендримера в качестве центрального компонента наночастицы так, что он формирует основу структуры наночастицы. В соответствии с определенными вариантами осуществления сердцевина наночастицы, описываемой в настоящем документе, содержит дендример.
Как используют в настоящем документе, термин "полимерная мицелла" относится к амфифильной структуре, которая содержит гидрофобную сердцевину и гидрофильную оболочку, которую можно получать из блок-сополимеров. В отношении синтеза синтез наночастиц термин "сердцевина из полимерной мицеллы" относится к использованию полимерной мицеллы в качестве центрального компонента наночастицы так, что она формирует основу структуры наночастицы. В соответствии с определенными вариантами осуществления сердцевина наночастицы, описываемой в настоящем документе, содержит полимерную мицеллу.
Комплекс антиген-МНС-наночастица ("комплекс NP" или "комплекс" или рМНС-NP или "комплекс наночастицы") относится к презентации пептида, углевода, липида или другого антигенного участка, фрагмента или эпитопа антигенных молекулы или белка (т.е., аутологичного пептида или аутоантигена) на поверхности, такой как сердцевина наночастицы.
"Сердцевина наночастицы" представляет собой субстрат наночастицы, который содержит или не содержит слои или покрытия. Комплекс наночастицы содержит сердцевину по меньшей мере с комплексом антиген-МНС, связанным с сердцевиной.
"Плотность" в отношении содержания рМНС на наночастицу рассчитывают как площадь поверхности сердцевины наночастицы с внешними слоями или без, которые также могут содержать линкеры. Площадь поверхности представляет собой общую доступную площадь поверхности используемой конструкции. В одном из аспектов, когда используют линкер PEG, это может увеличивать общий диаметр сердцевины наночастицы приблизительно на 20 нм2 наночастицы, что, соответственно, увеличивает площадь поверхности общей доступной площади поверхности наночастицы. Другими словами, она представляет собой конечную площадь поверхности наночастицы без добавления одного или нескольких из рМНС, костимулирующих молекул и/или цитокинов.
Как используют в настоящем документе, "антиген" относится ко всей, части, фрагменту или участку молекулы, который может индуцировать иммунный ответ у индивидуума или размножение иммуноцитов, предпочтительно Т- или В-клеток.
Термин "алкил" относится к одновалентным насыщенным алифатическим углеводородным группам, содержащим от 1 до 10 атомов углерода (т.е., C1-С10-алкил), или от 1 до 6 атомов углерода (т.е., C1-С6-алкил), или от 1 до 4 атомов углерода. Этот термин в качестве примера включает неразветвленные и разветвленные углеводородные группы, такие как метил (СН3-), этил (СН3СН2-), н-пропил (СН3СН2СН2-), изопропил ((СН3)2СН-), н-бутил (СН3СН2СН2СН2-), изобутил ((СН3)2СНСН2-), втор-бутил ((СН3)(СН3СН2)СН-), трет-бутил ((СН3)3С-), н-пентил (СН3СН2СН2СН2СН2-) и неопентил ((СН3)3ССН2-).
Термин "алкокси" относится к -О-алкилу.
"Миметик" представляет собой аналог данного лиганда или пептид, где аналог в значительной степени сходен с лигандом. "В значительной степени сходен" означает, что аналог обладает профилем связывания, сходным с лигандом, за исключением того, что миметик содержит одну или несколько функциональных групп или модификаций, которые совместно составляют менее чем приблизительно 50%, менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20%, менее чем приблизительно 10% или менее чем приблизительно 5% молекулярной массы лиганда.
"Иммуноциты" включают, например, лейкоциты (лейкоциты), которые происходят из гемопоэтических стволовых клеток (HSC), продуцируемых в in костном мозге, лимфоциты (Т-клетки, В-клетки, естественные киллерные (NK) клетки) и происходящие из миелоидного ростка клетки (нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги, дендритные клетки). Как используют в настоящем документе, термин "В-клетка" относится к определенному типу лимфоцитов, действующих в гуморальном иммунитете адаптивной иммунной системы. В-клетки преимущественно функционируют, производя антитела, служа в качестве антигенпрезентирующих клеток, высвобождая цитокины и развиваясь в В-клетки памяти после активации при взаимодействии с антигеном. В-клетки отличаются от других лимфоцитов, таких как Т-клетки, присутствием на клеточной поверхности В-клеточного рецептора. Как используют в настоящем документе, термин "Т-клетка", относится к типу лимфоцитов, которые созревают в тимусе. Т-клетки играют важную роль в клеточном иммунитете и отличаются от других лимфоцитов, таких как В-клетки, присутствием на клеточной поверхности Т-клеточного рецептора. Т-клетки можно выделять или получать из коммерчески доступного источника. "Т-клетка" включает все типы иммуноцитов, экспрессирующих CD3, включая Т-хелперные клетки (CD4+-клетки), цитотоксические Т-клетки (CD8+-клетки), естественные киллерные Т-клетки, регуляторные Т-клетки (Трег) и гамма-дельта Т-клетки. "Цитотоксическая клетка" включает CD8+ Т-клетки, естественные киллерные (NK) клетки и нейтрофилы, которые способны к опосредованию цитотоксического ответа.
Как используют в настоящем документе, термин "эффекторные Т-клетки" относится к Т-клеткам, которые могут специфически связывать антиген и опосредовать иммунный ответ (эффекторную функцию) без необходимости к дальнейшей дифференцировке. Примеры эффекторных Т-клеток включают CTL, клетки ТН1, клетки ТН2, эффекторные клетки памяти и Т-хелперные клетки. В отличие от эффекторных Т-клеток наивные Т-клетки не сталкивались со специфичным для них комплексом антиген:МНС, не отвечали на него пролиферацией и дифференцировкой в эффекторные Т-клетки. Эффекторные Т-клетки могут являться покоящимися (находиться в фазе G0 клеточного цикла) или активированными (пролиферирующими).
Термин "антипатогенная аутореактивная Т-клетка" относится к Т-клетке с антипатогенными свойствами (т.е., к Т-клеткам, которые препятствуют аутоиммунным заболеваниям, таким как PC, родственным PC заболеваниям или нарушениям или преддиабету). Эти Т-клетки могут включать противовоспалительные Т-клетки, центральные Т-клетки памяти, эффекторные Т-клетки памяти, Т-клетки памяти, Т-клетки с низкой авидностью, Т-хелперные клетки, ауторегуляторные Т-клетки, цитотоксические Т-клетки, естественные киллерные Т-клетки, регуляторные Т-клетки, клетки TR1, супрессорные Т-клетки, CD4+-Т-клетки, СБ8+-Т-клетки и т.п.
Термин "противовоспалительная Т-клетка" относится к Т-клетке, которая способствует противовоспалительному ответу. Противовоспалительную функцию Т-клетка можно осуществлять посредством продукции и/или секреции противовоспалительных белков, цитокинов, хемокинов и т.п. Противовоспалительные белки также предназначены для включения антипролиферативных сигналов, которые подавляют иммунный ответ. Противовоспалительные белки включают IL-4, IL-10, IL-13, IL-21, IL-23, IL-27, IFN-α, TGF-β, IL-1ra, G-CSF и растворимые рецепторы TNF и IL-6.
Термин "дифференцированная" относится ко времени, когда происходит индукция развития клетки первого типа в клетку второго типа. В соответствии с определенными вариантами осуществления распознающая Т-клетка дифференцирована в регуляторную клетку TR1. В соответствии с определенными вариантами осуществления в клетку TR1 дифференцирована активированная Т-клетка. В соответствии с определенными вариантами осуществления в клетку TR1 дифференцирована Т-клетка памяти. В соответствии с определенными вариантами осуществления В-клетка дифференцирована в регуляторную В-клетку.
Как используют в настоящем документе, "выступ во впадину" относится к полипептидильной структуре, требующей выпячивания (или "выступ") на взаимодействующей поверхности первого полипептида и соответствующего углубления (или "впадины") на взаимодействующей поверхности второго полипептида так, что выпячивание может располагаться в углублении так, чтобы обеспечить гетеромультимерное формирование. Выпячивания конструируют, заменяя аминокислоты с небольшими боковыми цепями на взаимодействующей поверхности первого полипептида аминокислотами с большими боковыми цепями (например, фенилаланином или тирозином). На взаимодействующей поверхности второго полипептида получают углубления идентичных или сходных с выпячиваниями размеров, заменяя аминокислоты с большими боковыми цепями на аминокислоты с небольшими боковыми цепями (например, аланином или треонином). Выпячивания и углубления можно получать синтетическими способами, такими как замена нуклеиновых кислот, кодирующих полипептиды, или посредством пептидного синтеза, общепринятыми способами, используемыми специалистом в данной области. В соответствии с определенными вариантами осуществления взаимодействующая поверхность первого полипептида находится на домене Fc первого полипептида, а взаимодействующая поверхность второго полипептида находится на домен Fc второго полипептида. Гетеромультимеры с выступами во впадины и способы их получения и использования описаны в патентах США №№5731168; 5807706; 5821333; 7642228; 7695936; 8216805 и 8679785, которые все полностью включены в настоящий документ в качестве ссылки
Как используют в настоящем документе, "альфа-МНС-Fc/бета-МНС-Fc" относится к гетеродимеру, содержащему первый полипептид и второй полипептид, где первый полипептид содержит α-цепь МНС класса II и домен Fc антитела; второй полипептид содержит β-цепь МНС класса II и домен Fc антитела. Для альфа-МНС-Fc/бета-МНС-Fc с выступом во впадину дополнительно необходимо, чтобы домены Fc каждого полипептида взаимодействовали друг с другом посредством комплементарного расположения выпячивания на одном из доменов Fc в соответствующем углублении на другом домене Fc.
Термин "выделенный" означает отделенный от клеточных составляющих и остальных компонентов, с которыми полинуклеотид, пептид, полипептид, белок, антитело или их фрагмент(ы) в норме ассоциированы в природе. Например, в отношении полинуклеотида, выделенный полинуклеотид представляет собой полинуклеотид, который отделен от 5'- и 3'-последовательностей, с которыми он в норме ассоциирован на хромосоме. Как очевидно специалистам в данной области неприродные полинуклеотид, пептид, полипептид, белок, антитело или их фрагмент(ы) не требуют "выделения" для их отделения от их природных аналогов. Кроме того, "концентрированные", "выделенные" или "разбавленные" полинуклеотид, пептид, полипептид, белок, антитело или их фрагмент(ы) отличаются от их природных аналогов тем, что концентрация или количество молекул в определенном объеме являются более "концентрированными" или менее "отделенными", чем концентрация или количество молекул их природных аналогов. Полинуклеотид, пептид, полипептид, белок, антитело или их фрагмент(ы), которые отличаются от их природных аналогов по их первичной последовательности или, например, по их профилю гликозилирования, не требуют присутствия в их выделенных формах, так как они отличаются от их природных аналогов по их первичной последовательности или, альтернативно, другой характеристикой, такой как их профиль гликозилирования. Клетка млекопитающего, такая как Т-клетка, является выделенной, если она удалена из анатомического участка, где она находится в организме.
"Аутореактивная Т-клетка" представляет собой Т-клетку, которая распознает "аутоантиген", который представляет собой молекулу, продуцируемую тем же индивидуумом и присутствующую у того же индивидуума, который несет эту Т-клетку.
"Патогенная Т-клетка" представляет собой Т-клетку, которая вредоносна для индивидуума, несущего эту Т-клетку. При этом непатогенная Т-клетка по существу не является вредной для индивидуума, а антипатогенная Т-клетка снижает, сглаживает, ингибирует или устраняет вред патогенной Т-клетки.
Как используют в настоящем документе, термин регуляторные В-клетки ("Врег") означает клетки, которые отвечают за противовоспалительное действие, что характеризуется экспрессией CD1d, CD5 и секрецией IL-10. Врег также идентифицируют по экспрессии Tim-1 и можно индуцировать посредством лигирования Tim-1 с обеспечением толерантности. Показано, что способность существовать как Врег обусловлена множеством стимулирующих факторов, таких как Toll-подобные рецепторы, CD40-лиганд и других. Однако полная характеризация Врег продолжается. Врег также экспрессируют высокие уровни CD25, CD86 и TGF-β. Эта субпопуляция В-клеток способна подавлять пролиферацию Th1, таким образом, способствуя поддержанию аутотолерантности. Потенцирование функции Врег должна стать целью многих иммуномодулирующих лекарственных средств, что будет способствовать лучшему контролю аутоиммунных заболеваний. См., например: ncbi.nlm.nih.gov/pubmed/23707422, последний доступ 31 октября 2013 года.
Регуляторные Т-клетки типа 1 (TR1) представляют собой субпопуляция CD4+ Т-клеток с регуляторными свойствами, и они способны подавлять антигенспецифичный иммунный ответ in vitro и in vivo. Эти клетки TR1 определяют по их уникальному профилю продукции цитокинов и выработки высоких уровней IL-10 и TGF-бета, но не IL-4 или IL-2. Продуцируемые этими клетками IL-10 и TGF-бета in vitro опосредуют ингибирование первичных наивных Т-клеток. Также существуют данные, что клетки TR существуют in vivo, и зарегистрировано присутствие продуцирующих большие количества IL-10 CD4(+) Т-клеток у пациентов с тяжелым комбинированным иммунодефицитом, получавших трансплантаты аллогенных стволовых клеток. Клетки TR1 вовлечены в регуляцию периферической толерантности, и их потенциально можно использовать в качестве клеточной терапии для модуляции иммунного ответа in vivo. См., например: ncbi.nlm.nih.gov/pubmed/10887343, последний доступ 31 октября 2013 года.
Клетки TR1 определяют по их способности продуцировать IL-10 и TGF-бета на высоких уровнях. Клетки TR1, специфичные к множеству антигенов, образуются in vivo, но также могут дифференцироваться из наивных CD4+ Т-клеток в присутствии IL-10 in vitro. Клетки TR1 обладают низким пролиферативным потенциалом, что можно преодолеть действием IL-15. Клетки TR1 подавляют ответ наивных Т-клеток и Т-хелперов памяти типа 1 или 2 посредством продукции IL-10 и TGF-бета. Дальнейшая характеризация клеток TR1 на молекулярном уровне определит механизм их действия и прояснит их взаимосвязь с другими субпопуляциями TR-клеток. Можно сделать прогноз об использовании клеток TR1 для идентификации новых мишеней для разработки новых терапевтических средств и в качестве клеточной терапии для модуляции периферической толерантности. См., например, ncbi.nlm.nih.gov/pubmed/11722624, последний доступ 31 октября 2013 года.
"Эффективное количество" представляет собой количество, достаточное для достижения заданной цели, неограничивающие примеры которой включают: инициация иммунного ответа, модуляция иммунного ответа, подавление воспалительного ответа и модуляция активности Т-клеток или популяций Т-клеток. В одном из аспектов эффективное количество представляет собой количество, которое действует для достижения указанной терапевтической цели, например, терапевтически эффективное количество. Как подробно описано в настоящем документе, эффективные количество или доза, зависят от цели и композиции, и их можно определять в соответствии с настоящим описанием.
Эффективное количество терапевтической композиции определяют на основе заданной цели. Термин "стандартная доза" или "дозировка" относится к физически дискретным единицам, пригодным для использования у индивидуума, где каждая единица содержит предопределенное количество композиции, рассчитанное так, чтобы вызывать требуемый ответ, описываемый выше в связи с ее введением, т.е. соответствующими маршрутом и схемой лечения. Вводимое количество, в отношении числа лекарственных средств и стандартной дозы, зависит от требуемых результата и/или защиты. Точные количества композиции также зависят от решения практикующего врача и индивидуальны для каждого индивидуума. Факторы, влияющие на дозу, включают физическое и клиническое состояние индивидуума, маршрут введения, заданная цель лечения (облегчение симптомов по сравнению с излечением) и активность, стабильность и токсичность конкретной композиции. После составления растворы вводят способом, совместимым с дозируемым составом и в таком количестве, которое является терапевтически или профилактически эффективным. Составы легко вводить в различных лекарственных формах, таких как типы инъецируемых растворов, описанные выше.
"Мультимер МНС", как этот термин используют в настоящем документе, означает комплекс двух или более, как правило, четырех, приблизительно до пятидесяти или более мономеров МНС.
Как используют в настоящем документе, "мультимерный комплекс" относится к комплексу между популяцией клеток-мишеней и одним или несколькими комплексами рМНС, где белок МНС комплекса рМНС включает мультимерную форму белка МНС. В соответствии с определенными вариантами осуществления мультимерная форма белка МНС включает димер или тример.
Как используют в настоящем документе, фраза "иммунный ответ" относится к развитию опосредуемого клетками ответа (опосредуемого антигенспецифичными Т-клетками или продуктами их секреции). Клеточный иммунный ответ вызывает презентация полипептидных эпитопов в ассоциации с молекулами МНС класса I или класса II, с лечением или профилактикой вирусной инфекции, размножением антигенспецифичных клеток Bpeг, TC1, CD4+ Т-хелперных клеток и/или CD8+цитотоксических Т-клеток и/или порождаемых заболеванием ауторегуляторных Т-клеток и В-клеток "памяти". Также ответ может включать активацию других компонентов. В соответствии с определенными аспектами термин "иммунный ответ" можно использовать для включения формирования регуляторной сети иммуноцитов. Таким образом, термин "формирование регуляторной сети" может относиться к иммунному ответу, вызываемому так, что иммуноциты, предпочтительно Т-клетки, более предпочтительно регуляторные Т-клетки, инициируют дальнейшую дифференцировку других иммуноцитов, в качестве неограничивающих примеров таких, как В-клетки или антигенпрезентирующие клетки, неограничивающие примеры которых включают дендритные клетки, моноциты и макрофаги. В соответствии с определенными вариантами осуществления формирование регуляторной сети включает В-клетки, дифференцирующиеся в регуляторные В-клетки; В соответствии с определенными вариантами осуществления формирование регуляторной сети включает формирование толерогенных антигенпрезентирующих клеток.
Под "наносферой", "NP" или "наночастицей" в настоящем документе подразумевают небольшую дискретную частицу, которую при необходимости в единственном числе или во множественном числе вводят индивидууму, в образец клеток или образец ткани. В соответствии с определенными вариантами осуществления термин "наночастица", как используют в настоящем документе, включает любые слои вокруг сердцевины наночастицы. В соответствии с определенными вариантами осуществления форма наночастиц по существу является сферической. В соответствии с определенными вариантами осуществления наночастица не является липосомой или вирусной частицей. В соответствии с дополнительными вариантами осуществления наночастица состоит из любого подходящего материала, например, твердого вещества, твердой сердцевины, металла, дендримера, полимерной мицеллы, оксида металла или белка или его фрагмента или их сочетаний. Как используют в настоящем документе, термин "по существу сферическая" означает, что форма частиц не отклоняется от сферы более чем приблизительно на 10%. На частицы можно наносить различные известные антигенные или пептидные комплексы по изобретению. Размер наночастиц по настоящему изобретению находится в диапазоне приблизительно от 1 нм до приблизительно 1 мкм и, предпочтительно, приблизительно от 1 нм до приблизительно 500 нм, или, альтернативно, приблизительно от 1 нм до приблизительно 100 нм, или, альтернативно, приблизительно от 1 нм до приблизительно 50 нм, или, альтернативно, приблизительно от 5 нм до приблизительно 100 нм, и В соответствии с определенными аспектами относится к среднему или медианному диаметру множества наночастиц, когда множество наночастиц задано. Частицы меньшего наноразмера можно получать, например, способом фракционирования, когда более крупным частицам позволяют осаждаться в водном растворе. Затем отделяют верхнюю часть раствора известными специалистам в данной области способами. Эта верхняя часть обогащена частицами меньшего размера. Способ можно повторять до получения требуемого среднего размера. Термин "наноструктура" используют в основном для описания структур, меньших, чем приблизительно 1 мкм.
Как используют в настоящем документе, термины "воспалительный ответ" и "воспаление" означают комплексный биологический ответ сосудистой ткани индивидуума на вредоносные стимулы, так как патогены, поврежденные клетки или раздражающие вещества, и включает секрецию цитокинов, а более конкретно провоспалительных цитокинов, т.е. цитокинов, которые преимущественно продуцируют активированные иммуноциты и которые вовлечены в развитие воспалительных реакций. Иллюстративные провоспалительные цитокины в качестве неограничивающих примеров включают IL-1, IL-6, IL-10, TNF-α, IL-17, IL21, IL23, IL27 и TGF-β. Иллюстративные виды воспаления включают острое воспаление и хроническое воспаление. Острое воспаление означает кратковременный процесс, характеризуемый классическими признаками воспаления (опухание, покраснение, боль, жар и утрата функции) вследствие инфильтрации тканей плазмой и лейкоцитами. Как правило, острое воспаление происходит, когда присутствует повреждающий стимул, и прекращается, как только стимул устраняется, разрушается или ограждается посредством рубцевания (фиброза). Хроническое воспаление означает состояние, характеризуемое одновременно активными воспалением, разрушением тканей и попытками репарации. Хроническое воспаление не характеризуется классическими признаками острого воспаления, перечисленными выше. Вместо этого хронически воспаленная ткань характеризуется инфильтрацией мононуклеарными иммуноцитами (моноцитами, макрофагами, лимфоциты и плазматическими клетками), деструкцией тканей и попытками заживления, что включает ангиогенез и фиброз. Воспаление в контексте настоящего изобретения можно ингибировать, воздействуя и, в частности, ингибируя одно из событий, которые формируют комплексный биологический ответ, ассоциированный с воспалением у индивидуума.
Как используют в настоящем документе, "CD49b" или "кластер дифференцировки 49b" представляет собой белок, который представляет собой альфа-субъединицу интегрина и составляет приблизительно половину интегринового дуплекса альфа2бета1. У людей CD49b кодирует ген CD49b. CD49b может присутствовать на широком спектре типов клеток, включая Т-клетки, естественные киллерные клетки, фибробласты и тромбоциты. В соответствии с определенными вариантами осуществления Т-клетка включает клетку TR1. В соответствии с определенными вариантами осуществления экспрессия CD49b идентифицирует клетку TR1. Детекцию клеток, экспрессирующих CD49b, можно проводить общепринятыми способами, такими как использование антител к CD49b, которые являются коммерчески доступными, например, у такого поставщика, как BioLegend.
Как используют в настоящем документе, "Lag3" или "ген активации лимфоцитов 3" или "CD223" или "кластер дифференцировки 223" представляет собой белок, кодируемым геном Lag3 и принадлежащий суперсемейству иммуноглобулинов (Ig). Lag3 представляет собой белок клеточной поверхности, который экспрессирован на многих типах клеток, включая Т-клетки, естественные киллерные клетки, В-клетки и плазмацитоидные дендритные клетки. В соответствии с определенными вариантами осуществления Т-клетка включает клетку TR1. В соответствии с определенными вариантами осуществления экспрессия Lag3 идентифицирует клетку TR1. Детекцию клеток, экспрессирующих Lag3, можно проводить общепринятыми способами, такими как использование антител к Lag3, которые являются коммерчески доступными, например, у такого поставщика, как BioLegend.
Как используют в настоящем документе, термин "ассоциированный с заболеванием" антиген означает антиген или его фрагмент, выбранный для лечения указанного заболевания и вовлеченный в патологический процесс. Например, ассоциированный с диабетом антиген представляет собой антиген или его фрагмент, который, когда присутствует, обуславливает иммунный ответ, который служит для лечения диабета; таким образом, ассоциированный с диабетом антиген, обуславливающий такое действие, выбирают для лечения диабета. Ассоциированный с рассеянным склерозом (PC) антиген выбран для лечения PC. Ассоциированный с диабетом антиген нельзя выбрать для лечения PC. Подобным образом, ассоциированный с аутоиммунитетом антиген представляет собой антиген, который ассоциирован с аутоиммунным заболеванием и который нельзя выбрать для лечения нарушения или заболевания, отличного от аутоиммунитета, например, злокачественной опухоли. Неограничивающие иллюстративные ассоциированные с заболеванием антигены описаны в настоящем документе, и, кроме того, такие антигены можно определять для конкретного заболевания на основе технологий, механизмов и способов, приведенных в литературе.
"Аутоиммунное заболевание или нарушение" включают заболевания или нарушения, возникающие в собственных тканях или органах индивидуума и направленные против них или их проявления или состояния, вызываемые ими. В одном из вариантов осуществления термин относится к состоянию, которое является результатом или усугубляется продукцией Т-клеток, которые реагируют с нормальными тканями и антигенами организма. Примеры аутоиммунных заболеваний или нарушений в качестве неограничивающих примеров включают артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, острый иммунологический артрит, хронический воспалительный артрит, дегенеративный артрит, индуцированный коллагеном типа II артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, болезнь Стилла, вертебральный артрит и ревматоидный артрит с началом в юношеском возрасте, остеоартрит, хронический прогрессирующий артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковидный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, атопические заболевания, включая такие атопические заболевания, как сенная лихорадка и синдром Джоба, дерматит, включая контактный дерматит, хронический контактный дерматит, шелушащийся дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит, монетовидный дерматит, себорейный дерматит, неспецифический дерматит, первичный ирритантный контактный дерматит и атопический дерматит, х-сцепленный гипер-IgM-синдром, аллергические внутриглазные воспалительные заболевания, крапивницу, такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, миозит, полимиозит/дерматомиозит, юношеский дерматомиозит, токсический эпидермальный некролиз, склеродермию (включая системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (PC), такой как спинооптический PC, первично-прогрессирующий PC (PPMS) и ремиттирующий PC (RRMS), прогрессирующий системный склероз, атеросклероз, атеросклероз, диссеминированный склероз, атаксический склероз, нейромиелит зрительного нерва со спектральным расстройством (NMO, также известный как болезнь Девика или синдром Девика), воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммуноопосредованные желудочно-кишечные заболевания, колит, такой как язвенный колит, микроскопический колит, коллагенозный колит, полипозный колит, некротизирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), воспаление кишечника, гангренозную пиодермию, узелковую эритему, первичный склерозирующий холангит, респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых или острый респираторный дистресс-синдром (ARDS), менингит, воспаление всей или части сосудистой оболочки глаза, ирит, хориоидит, аутоиммунное гематологическое нарушение, ревматоидный спондилит, ревматоидный синовит, наследственный ангионевротический отек, повреждение черепно-мозговых нервов, как при менингите, герпес беременных, пемфигоид беременных, прурит мошонки, аутоиммунная преждевременная недостаточность яичников, резкая потеря слуха вследствие аутоиммунного расстройства, опосредованные IgE заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и энцефалит с поражением лимбической системы и/или ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромом и без, такой как хронический или острый гломерулонефрит, такой как первичный GN, иммуноопосредованный GN, мембранозный GN (мембранозная нефропатия), идиопатический мембранозный GN или идиопатическая мембранозная нефропатия, мембранозный пролиферативный GN (MPGN), включая I тип и II тип и быстро прогрессирующий GN, пролиферативный нефрит, аутоиммунную полигландулярную эндокринную недостаточность, баланит, включая опоясывающий плазмацитарный баланит, баланопостит, кольцевидную центробежную эритему, стойкую дисхромическую эритему, мультиформную эритему, кольцевидную гранулему, блестящий лишай, склероатрофический лишай, простой хронический лишай, шиловидный лишай, плоский лишай, ламеллярный ихтиоз, эпидермолитический гиперкератоз, предраковый кератоз, гангренозную пиодермию, аллергические патологические состояния и виды ответа, аллергическую реакцию, экзему, включая аллергическую или атопическую экзему, астеатозную экзему, дисгидротическую экзему и везикулярную ладонно-подошвенную экзему, астму, такую как бронхиальная астма и аутоиммунная астма, патологические состояния, включающие инфильтрацию Т-клеток и виды хронического воспалительного ответа, виды иммунного ответа на чужеродные антигены, такие как как антигены групп крови А-В-O плода при беременности, хронические легочные воспалительные заболевания, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, волчанку, включая волчаночный нефрит, волчаночный энцефалит, педиатрическую волчанку, непочечную волчанку, внепочечную волчанку, дискоидную волчанку и дискоидную красную волчанку, волчанку с алопецией, системную красную волчанку (СКВ), такую как кожная СКВ или под острая кожная СКВ, неонатальную волчанку (NLE) и диссеминированную красную волчанку, диабет I типа, диабет II типа, латентный аутоиммунный диабет взрослых (или диабет 1,5 типа). Также предусмотрены виды иммунного ответа, ассоциированные с острой и замедленной гиперчувствительностью, опосредуемой цитокинами и Т-лимфоцитами, саркоидоз, гранулематоз, включая лимфогранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулиты, включая васкулит, васкулит крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный (Такаясу) артериит), васкулит средних сосудов (включая синдром Кавасаки и узелковый полиартериит/узелковый периартериит), микроскопический полиартериит, иммуноваскулит, васкулит ЦНС, кожный васкулит, аллергический васкулит, некротизирующий васкулит, такой как системный некротизирующий васкулит и ассоциированный с ANCA васкулит, такой как васкулит или синдром Черджа-Стросс (CSS) и ассоциированный с ANCA васкулит мелких сосудов, височный артериит, апластическую анемию, аутоиммунную апластическую анемию, анемию с положительным тестом Кумбса, анемию Даймонда-Блэкфана, гемолитическую анемию или иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), болезнь Аддисона, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, включающие диапедез лейкоцитов, воспалительные нарушения ЦНС, болезнь Альцгеймера, болезнь Паркинсона, синдром полиорганной недостаточности, например, вторичный после септицемии, травмы или кровотечения, опосредуемые комплексами антиген-антитело заболевания, заболевание с образованием антител к базальной мембране клубочков, синдром антифосфолипидных антител, антифосфолипидный синдром, аллергический нейрит, болезнь/синдром Бехчета, синдром Кастлемана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пузырчатку (включая обыкновенную пузырчатку, эксфолиативную пузырчатку, пузырчатый пемфигоид слизистых мембран и эритематозную пузырчатку), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, термическую травму, преэклампсию, нарушение метаболизма иммунных комплексов, такое как иммуннокомплексный нефрит, опосредуемый антителами нефрит, полинейропатии, хроническую нейропатию, такие как полинейропатии с участием IgM или опосредованная IgM нейропатия, аутоиммунную или иммуноопосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), включая хроническую или острую ITP, приобретенную тромбоцитопеническую пурпуру, склерит, такой как идиопатический кератосклерит, эписклерит, аутоиммунные заболевания семенников и яичников, включая аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, включая тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит, аутоиммунные заболевания щитовидной железы, идиопатический гипотиреоз, болезнь Грейва, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, включая нейрологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром мышечной скованности, энцефаломиелит, такой как аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (ЕАЕ), миастения gravis, такая как ассоциированная с тимомой миастения gravis, дегенерация мозжечка, нейромиотония, опсоклонус или опсо-миоклональный синдром (OMS) и сенсорная нейропатия, мультифокальную двигательную нейропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит (LIP), облитерирующий бронхиолит (бе трансплантата) в зависимости от NSIP, синдром Гийена-Барре, болезнь Бергера (нефропатия с IgA), идиопатическая нефропатия с IgA, линейный дерматоз с IgA, острый фебрильный нейтрофильный дерматоз, субкорнеальный пустулезный дерматоз, преходящий акантолитический дерматоз, цирроз, такой как первичный биллиарный цирроз и пневмоцирроз, аутоиммунный энтеропатический синдром, целиакию, спру-целиакию (глютеновую энтеропатию), не поддающуюся лечению спру, идиопатическую спру, криоглобулинемию, боковой амиотрофический склероз (ALS; болезнь Лу Герига), ишемическую болезнь сердца, аутоиммунные заболевания ушей, такие как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунная потеря слуха, полихондрию, такую как не поддающаяся лечению или рецидивирующая полихондрия, легочно-альвеолярный протеиноз, синдром Когана/несифилитический интерстициальный кератит, паралич Белла, болезнь/синдром Свита, аутоиммунную розацеа, ассоциированную с опоясывающим лишаем боль, амилоидоз, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает моноклональный В-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неопределенного генеза, MGUS), периферическую нейропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, периодический паралич, и каналопатии ЦНС, аутизм, воспалительную миопатию, фокальный, или сегментарный, или фокально-сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное нерушение печени, фибромиалгию, множественную эндокринную недостаточность, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания и хроническая воспалительная демиелинизирующая полинейропатия, синдром Дресслера, очаговую алопецию, генерализованную алопецию, синдром CREST (кальциноз, феномен Рейно, пищеводную дискинезию, склеродактилию и телеангиэктазию), мужскую и женскую аутоиммунную бесплодность, например, вследствие присутствия антител к сперматозоидам, смешанные заболевания соединительной ткани, болезнь Чагаса, ревматическую лихорадку, привычный выкидыш, легкое фермера, полиморфную эритему, постпосткардиотомный синдром, синдром Иценко-Кушинга, легкое птицевода, аллергический гранулематозный васкулит, доброкачественный лимфоцитарный васкулит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальную легочную болезнь, трансфузионную реакцию, лепру, малярию, паразитарные заболевания, такие как лейшманиоз, трипанозомоз, шистосомоз, аскаридоз, аспергиллез, синдром Сэмптера, синдром Каплана, лихорадку денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, легочный фиброз, идиопатический легочный фиброз, муковисцидоз (кистозный фиброз), эндофтальмит, стойкую возвышающуюся эритему, эритробластоз плода, эозинофильный фасцит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хроническ циклит, гетерохронический циклит, иридоциклит (острый или хронический) или циклит Фукса, пурпура Геноха-Шенлейна, инфекцию вируса иммунодефицита человека (ВИЧ), SCID, синдром приобретенного иммунодефицита (СПИД), инфекцию эховируса, сепсис, эндотоксемию, панкреатит, тиреотоксикоз, инфекцию парвовируса, инфекцию вируса краснухи, синдромы после вакцинаций, инфекцию при врожденной краснухе, инфекцию вирусом Эпштейна-Барр, эпидемический паротит, синдром Эвана, аутоиммунную гонадную недостаточность, хорею Сиденгама, постстрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотку спинного мозга, хороидит, гигантоклеточную полимиалгию, хронический гиперчувствительный пневмонит, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефритический синдром, нефропатию минимальных изменений, доброкачественное семейное повреждение и повреждение при реперфузии после ишемии, реперфузии трансплантированного органа, ретинальный аутоиммунитет, воспаление суставов, бронхит, хронические обструктивные заболевания дыхательных путей/легких, силикоз, афты, афтозный стоматит, артериосклеротические нарушения, асперматогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактический эндофтальмит, энтерит аллергический, узловатую лепрозную эритему, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматическую лихорадку, болезнь Хаммена-Рича, сенсонейральную потерю слуха, пароксизмальную гемоглобинурию, гипогонадизм, регионарный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатическое воспаление глаз, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозную пиодермию, тиреоидит де Кервена, приобретенную атрофию селезенки, незлокачественную тимому, витилиго, синдром токсического шока, пищевое отравление, патологические состояния, включающие инфильтрацию Т-клеток, недостаточность адгезии лейкоцитов, иммунный ответ, ассоциированный с острой и замедленной гиперчувствительностью, опосредуемой цитокинами и Т-лимфоцитами, заболевания, включающие диапедез лейкоцитов, синдром полиорганной недостаточности, опосредуемые комплексами антиген-антитело заболевания, заболевание с образованием антител к базальной мембране клубочков, аллергический нейрит, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, симпатическую офтальмию, ревматизм, смешанные заболевания соединительной ткани, нефротический синдром, инсулит, полиэндокринную недостаточность, аутоиммунный полигландулярный синдром I типа, идиопатический гипопаратиреоз с началом во взрослом возрасте (AOIH), кардиомиопатию, такую как дилатационная кардиомиопатия, приобретенный буллезный эпидермолиз (ЕВА), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, синусит решетчатой, лобной, челюстной или клиновидной костей, связанные с эозинофилами нарушения, такие как эозинофилия, эозинофилия с инфильтрацией в легкие, синдром эозинофилии-миалгии, синдром Леффлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневманический аспергиллез, аспергиллома или гранулемы, содержащие эозинофилы, анафилаксию, серонегативные спондилоартриты, полиэндокринные аутоиммунные заболевания, склерозирующий холангит, хронический кандидоз склер, эписклер, слизистых и кожи, синдром Брутона, транзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдрича, синдром атаксии-телеангиэктазии, ангиэктазию, аутоиммунные нарушения, ассоциированные с коллагеновой болезнью, ревматизм, неврологические заболевания, лимфаденит, снижение реакции кровяного давления, сосудистые дисфункции, повреждения тканей, сердечнососудистую ишемию, гипералгезию, ишемию почек, ишемию головного мозга и заболевания, сопровождающие васкуляризацию, нарушения связанные с аллергической гиперчувствительностью, гломерулонефриты, реперфузионные повреждения, нарушения, связанные с реперфузией после ишемии, реперфузионные повреждения миокардиальной или других тканей, лимфоматозный трахеобронхит, воспалительные дерматозы, дерматозы с острым воспалительным компонентом, полиорганную недостаточность, буллезные заболевания, почечный кортикальный некроз, острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, воспалительные нарушения глаз и орбит, ассоциированные с переливанием гранулоцитов синдромы, индуцированную цитокинами токсичность, нарколепсию, острое тяжелое воспаление, хроническое некупируемое воспаление, пиелит, внутриартериальную гиперплазию, язвенную болезнь, вальвулит, эмфизему, очаговую алопецию, воспаление жировой ткани/диабет II типа, ассоциированные с ожирением воспаление жировой ткани/резистентность к инсулину и эндометриоз.
В соответствии с определенными вариантами осуществления аутоиммунные нарушения или заболевания в качестве неограничивающих примеров могут включать сахарный диабет I типа и II типа, преддиабет, отторжение трансплантата, рассеянный склероз, связанные с рассеянным склерозом нарушения, преждевременную недостаточность яичников, склеродермия, болезнь/синдром Шегрена, волчанку, витилиго, алопецию (плешивость), полигландулярную недостаточность, болезнь Грейва, гипотиреоз, полимиозит, пузырчатку, болезнь Крона, колит, аутоиммунный гепатит, гипопитуитаризм, миокардит, болезнь Аддисона, аутоиммунные заболевания кожи, увеит, пернициозную анемию, гипопаратиреоз и/или ревматоидный артрит. Другие представляющие интерес показания в качестве неограничивающих примеров включают астму, аллергическую астму, первичный биллиарный цирроз, цирроз, нейромиелит зрительного нерва со спектральным расстройством (болезнь Девика, спинооптический рассеянный склероз (OSMS)), обыкновенную пузырчатку, воспалительное заболевание кишечника (IBD), артрит, ревматоидный артрит, системную красную волчанку (SLE), глютеновую болезнь, псориаз, аутоиммунную кардиомиопатию, идиопатическую дилатационную кардиомиопатию (IDCM), миастению gravis, увеит, анкилозирующий спондилит, иммуноопосредованные миопатии, рак предстательной железы, антифосфолипидный синдром (ANCA+), атеросклероз, дерматомиозит, хроническое обструктивное заболевание легких (COPD), эмфизему, повреждение спинного мозга, травматическое повреждение, индуцированное табаком разрушение легких, ассоциированный с ANCA васкулит, псориаз, склерозирующий холангит, первичный склерозирующий холангит и заболевания центральной и периферической нервных системы.
В соответствии с определенными вариантами осуществления аутоиммунные нарушения или заболевания в качестве неограничивающих примеров могут включать диабет, рассеянный склероз, глютеновую болезнь, первичный биллиарный цирроз, пузырчатку, листовидную пузырчатку, обыкновенную пузырчатку, нейромиелит зрительного нерва со спектральным расстройством, артрит (включая ревматоидный артрит), аллергическую астму, воспалительное заболевание кишечника (включая болезнь Крона и язвенный колит), системную красную волчанку, атеросклероз, хроническое обструктивное заболевание легких, эмфизему, псориаз, аутоиммунный гепатит, увеит, синдром Шегрена, склеродермию, антифосфолипидный синдром, ассоциированный с ANCA васкулит и синдром мышечной скованности.
Как используют в настоящем документе, термин "воспаление жировой ткани/диабет II типа" относится к воспалению жировой ткани, выявляемое у индивидуума, страдающего диабетом II типа. Воспаление жировой ткани способствует развитию у индивидуума резистентности к инсулину.
Как используют в настоящем документе, термин "ассоциированные с ожирением воспаление жировой ткани/резистентность к инсулину" относится к воспалению жировой ткани, выявляемому у индивидуума, страдающего от ожирения. Воспаление жировой ткани способствует резистентности к инсулину у индивидуума, таким образом, увеличивая вероятность того, что воспаление жировой ткани приведет к патогенезу диабета II типа.
Как используют в настоящем документе, термин "каноническая последовательность" относится к последовательности белка, используемой в качестве эталона для нумерации аминокислот в отсутствие дополнительных руководств в описании или на предшествующем уровне техники. Как очевидно специалистам в данной области, концы антигенных фрагментов по отношению к эталонной последовательности на которой картирован фрагмент, могут варьировать. Таким образом, следует понимать, что, если конкретно не указано иначе, фрагмент идентифицирует приблизительные концы.
Как используют в настоящем документе, "PPI" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "препроинсулин", биологически неактивного предшественника биологически активного эндокринного гормона инсулина, или его биологического эквивалента. Длина канонической последовательности изоформы PPI составляет 110 аминокислот:

Как используют в настоящем документе, "IGRP" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "родственный каталитической субъединице специфичной для островков глюкозо-6-фосфатазы белок" или "глюкозо-6-фосфатаза 2", основного аутоантигена для аутоиммунного диабета 1 типа, или его биологического эквивалента. Длина канонической последовательности IGRP составляет 355 аминокислот:

Как используют в настоящем документе, "GAD" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "декарбоксилаза глутаминовой кислоты", ассоциированного с диабетом антигена, или его биологического эквивалента. GAD необязательно может относиться к GAD1, GAD2, GAD65, GAD67 или любой другой ассоциированной с диабетом декарбоксилазе глутаминовой кислоты. Длина канонической последовательности изоформы GAD2 составляет 585 аминокислот, и эта последовательность приведена ниже в настоящем документе:

Как используют в настоящем документе "периферии" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Неограничивающая иллюстративная последовательность периферина человека, ассоциированного с регистрационным номером UniProt Р41219, приведена ниже в настоящем документе:

Как используют в настоящем документе, "aGlia" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "альфа/бета-глиадин", полученного из представителя семейства пшеницы или другого ассоциированного с целиакией аллергена, или его биологического эквивалента. Неограничивающая иллюстративная последовательность альфа-глиадина, экспрессируемого в пшенице, ассоциированного с номером доступа GenBank САА10257.1, представляет собой:

Другая неограничивающая иллюстративная последовательность альфа-глиадин, экспрессируемого в пшенице, приведена ниже в настоящем документе:

Как используют в настоящем документе, "PDC-E2" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "дигидролипоамид-S-ацетилтрансфераза" или "DLAT", аутоантигена первичного биллиарного цирроза, или его биологического эквивалента. Длина канонической последовательности PDC-E2 составляет 647 аминокислот, и эта последовательность приведена ниже в настоящем документе:

Как используют в настоящем документе, "инсулин" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Неограничивающая иллюстративная последовательность инсулина человека, ассоциированная с регистрационным номером UniProt Р01308, приведена ниже в настоящем документе:
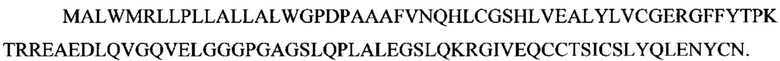
Как используют в настоящем документе, "DG1EC2" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "десмосомальный гликопротеин 1", или его биологического эквивалента. Длина канонической последовательности DG1EC2 составляет 1054 аминокислот, и она приведена ниже в настоящем документе:


Как используют в настоящем документе, "DG3" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "десмоглеин 3", или его биологического эквивалента. Неограничивающая иллюстративная последовательность десмоглеина человека 3, ассоциированная с регистрационным номером UniProt Р32926-1, приведена ниже в настоящем документе:

Как используют в настоящем документе, "AQP4" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "аквапорин 4", принадлежащего к семейству интегральных мембранных белков аквапоринов, которые пропускают воду через клеточную мембрану, и являющегося первичной аутоиммунной мишенью при нейромиелите зрительного нерва со спектральным расстройством, или его биологического эквивалента. Длина канонической последовательности AQP4 составляет 323 аминокислот, и она приведена ниже в настоящем документе:

Как используют в настоящем документе, "PLP" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "протеолипидный белок миелина", или его биологического эквивалента. Неограничивающая иллюстративная последовательность протеолипидного белка миелина человека, ассоциированная с регистрационным номером UniProt Р60201, приведена ниже в настоящем документе:

Как используют в настоящем документе, "MOG" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "олигонедроцитарный гликопротеин миелина", или его биологического эквивалента. Неограничивающая иллюстративная последовательность олигонедроцитарного гликопротеина миелина человека, ассоциированная с регистрационным номером UniProt Q16653, приведена ниже в настоящем документе:

Как используют в настоящем документе "МВР" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "основной белок миелина", или его биологического эквивалента. Неограничивающая иллюстративная последовательность основного белка миелина человека, ассоциированная с регистрационным номером UniProt Р02686, приведена ниже в настоящем документе:

Как используют в настоящем документе, "CII" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "нативный коллаген II типа", высокомолекулярной фибриллярной молекуле, вовлеченной в хронический полиартрит, или его биологического эквивалента. Неограничивающая иллюстративная консенсусная последовательность коллагена II человека, приведена ниже в настоящем документе:

Ниже в настоящем документе приведена другая неограничивающая иллюстративная последовательность коллагена II, мыши:

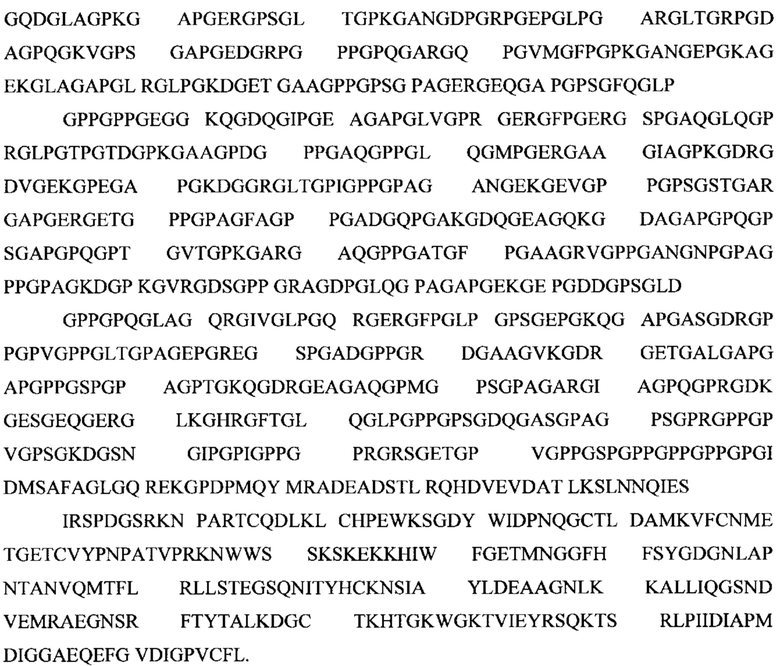
Как используют в настоящем документе, "DERP1" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "p1 Dermatophagoides pteronyssius" и известного, как вызывающего аллергическую реакцию у людей, или его биологического эквивалента. Неограничивающая иллюстративная консенсусная последовательность DERP1 приведена ниже в настоящем документе:

Как используют в настоящем документе, "DERP2" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "р2 Dermatophagoides pteronyssius" и известного, как вызывающего аллергическую реакцию у людей, или его биологического эквивалента. Неограничивающая иллюстративная консенсусная последовательность DERP2 приведена ниже в настоящем документе:

Как используют в настоящем документе, "OVA" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "овальбумин" для применения в формировании аллергического ответа у мышей, или его биологического эквивалента.
Как используют в настоящем документе "BacInt" или "интеграза бактероидов" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Длина канонической последовательности BacInt составляет 406 аминокислот и, представлена ниже в настоящем документе:

Как используют в настоящем документе, "CBir", "Fla-X" и/или "Fla-2" относятся ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с одним или несколькими бактериальными флагеллинами, вовлеченными в колит, или его биологического эквивалента. Неограничивающая иллюстративная последовательность Fla-X приведена ниже в настоящем документе:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность Fla-2:

Как используют в настоящем документе, "YIDX" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, имеющего бактериальное происхождение и вовлеченного в патогенез иммуноопосредованных заболеваний, или его биологического эквивалента. Неограничивающая иллюстративная последовательность YIDX приведена ниже в настоящем документе:

Ниже в настоящем документе приведена другая неограничивающая иллюстративная последовательность YIDX:

Как используют в настоящем документе, "AChR" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента.
Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt Q13702-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt Q04844-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt Р02708-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt Р07510-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt P11230-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора ацетилхолина, ассоциированная с регистрационным номером UniProt Q07001-1:

Как используют в настоящем документе, "пероксидаза щитовидной железы" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Неограничивающая иллюстративная последовательность пероксидазы щитовидной железы человека, ассоциированная с регистрационным номером UniProt Р07202, приведена ниже в настоящем документе:

Как используют в настоящем документе, "рецептор щитовидной железы" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. В соответствии с определенными вариантами осуществления "рецептор щитовидной железы" включает "рецептор тиреотропного гормона". Неограничивающая иллюстративная последовательность рецептора тиреотропного гормона, ассоциированная с регистрационным номером UniProt Р16473-1, приведена ниже в настоящем документе:


Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора тиреотропного гормона, ассоциированная с регистрационным номером UniProt Q59GA2-1:

Ниже в настоящем документе приведена неограничивающая иллюстративная последовательность рецептора тиреотропного гормона, ассоциированная с регистрационным номером UniProt В4Е0Н2-1:

Как используют в настоящем документе, "фосфолипидный антиген" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Один неограничивающий пример фосфолипидного антигена представляет собой "бета2-гликопротеин I", последовательность которого приведена ниже в настоящем документе:

Как используют в настоящем документе, "Н4" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "гистон Н4", или его биологического эквивалента. Каноническая последовательность Н4 приведена ниже в настоящем документе:

Как используют в настоящем документе, "Н2В" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "гистон Н2В", или его биологического эквивалента. Каноническая последовательность Н2В приведена ниже в настоящем документе:
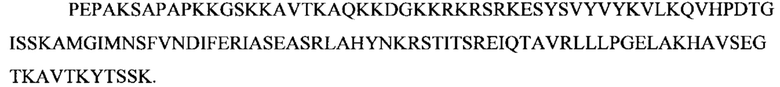
Как используют в настоящем документе, "H1" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "гистон H1", или его биологического эквивалента. Каноническая последовательность H1 приведена ниже в настоящем документе:

Как используют в настоящем документе, "АроВ" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "аполипопротеин В", или его биологического эквивалента. Каноническая последовательность АроВ приведена ниже в настоящем документе:
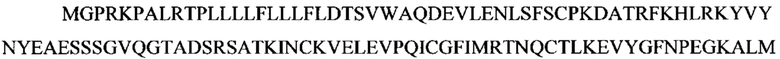



Как используют в настоящем документе, "АроЕ" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "аполипопротеин Е", или его биологического эквивалента. Неограничивающая иллюстративная последовательность ароЕ человека, ассоциированная с регистрационным номером UniProt Р02649, приведена ниже в настоящем документе:

Как используют в настоящем документе, "NMDAR" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "рецептор N-метил-D-аспартата", или его биологического эквивалента. Неограничивающая иллюстративная последовательность рецептора N-метил-D-аспартата, ассоциированная с регистрационным номером UniProt Q13224-1, приведена ниже в настоящем документе:


Как используют в настоящем документе, "потенциалозависимый калиевый канал" в основном относится к трансмембранному каналу, специфичному для калия и чувствительному к изменениям напряжения потенциала клеточной мембраны. В течение потенциала действия указанные каналы играют ключевую роль в возвращении деполяризованной клетки в покоящееся состояние. Неограничивающая иллюстративная последовательность потенциалозависимого калиевого канала, ассоциированная с регистрационным номером UniProt Р22459-1, приведена ниже в настоящем документе:

Как используют в настоящем документе, "эластин" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Длина канонической последовательности эластина составляет 786 аминокислот, и она приведена ниже в настоящем документе:


Как используют в настоящем документе, "IRBP" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "межфоторецепторный ретинол-связывающий белок", или его биологического эквивалента
Как используют в настоящем документе, "аррестиновый S-антиген сетчатки человека" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Одна из неограничивающих иллюстративньгх последовательностей приведена ниже в настоящем документе:

Как используют в настоящем документе, "миозин" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с этим названием, или его биологического эквивалента. Неограничивающая иллюстративная последовательность миозина, ассоциированная с регистрационным номером UniProt Р35580-1, приведена ниже в настоящем документе:


Ниже в настоящем документе приведена другая неограничивающая иллюстративная последовательность миозина:


Как используют в настоящем документе, "связывающие CD1d липидные антигены" в основном относятся к липидным антигенам, которые связываются с неклассическим МНС CD1d.
Как используют в настоящем документе, "HSP" относится ко всем изоформам, вариантам и их фрагментам белка, ассоциированного с названием "белок теплового шока", или его биологического эквивалента. В соответствии с определенными вариантами осуществления белки теплового шока включают белок теплового шока 60. Неограничивающая иллюстративная последовательность белка теплового шока 60, ассоциированная с регистрационным номером UniProt P10809-1, приведена ниже в настоящем документе:

Рассеянный склероз (PC), также известный как "множественный склероз" или "аллергический энцефаломиелит". PC представляет собой воспалительное заболевание, при котором повреждается липидсодержащая миелиновая оболочка вокруг аксонов головного мозга и спинного мозга, что приводит к демиелинизации и рубцеванию, а также широкому спектру проявлений и симптомов. Связанные с рассеянным склерозом нарушения включают, например, нейромиелит зрительного нерва со спектральным расстройством (NMO), увеит, невропатическую боль и т.п.
"Олигонедроцитарный гликопротеин миелина" (MOG) представляет собой гликопротеин, который, как полагают, важен в процессе миелинизация нервов в центральной нервной системе (ЦНС). У людей этот белок кодирует ген MOG. Предполагают, что он служит в качестве необходимой "молекулы адгезии" для обеспечения структурной целостности миелиновой оболочки, и известно, что он развивается на олигодендроците на поздней стадии. Номера доступа GenBank NM_001008228.2 и NP_001008229.1 представляют собой последовательности иРНК и белка, кодируемые геном MOG, соответственно. Последовательности, ассоциированные с каждым из этих номеров доступа GenBank включены в качестве ссылки для всех целей.
Как используют в настоящем документе, термины "злокачественная опухоль" и "злокачественный" представляют или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Примеры злокачественных опухолей в качестве неограничивающих примеров включают карциному, лимфому, бластому, саркому и лейкоз и их метастазы. "Метастазы" означают перенос продуцирующих заболевания организмов или злокачественных клеток в другие отделы организма по кровеносным или лимфатическим сосудам или мембранным поверхностям. Неограничивающие примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшины, печеночно-клеточный рак, желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному и различные типы рака головы и шеи.
Как используют в настоящем документе, термин "диабет" означает различные нарушения метаболизма углеводов, вызываемые комбинацией наследственных факторов и факторов окружающей среды и, как правило, характеризуется нарушенной секрецией или утилизацией инсулина, избыточной продукцией мочи, избыточными количествами сахара в крови и моче и жаждой, голодом и потерей массы. Диабет подразделяется на диабет 1 типа и диабет 2 типа. Признанной моделью на животных для изучения и лечения диабета являются страдающие диабетом без ожирения ("NOD") мыши. Диабет 1 типа (T1D) у мышей ассоциирован с аутореактивными CD8+ Т-клетками. У мышей без ожирения (NOD) развивается очень сходная с T1D человека форма T1D, что является результатом селективного разрушения β-клеток поджелудочной железы Т-клетками, распознающими растущий перечень аутоантигенов. Хотя для инициации T1D безусловно необходим вклад CD4+-клеток, существуют убедительные доказательства, что T1D зависит от CD8+ Т-клеток. Выявлено, что у значительной фракции ассоциированных с островками CD8+-клеток у мышей NOD используются инвариантные по CDR3 Vα17-Jα42+ TCR, обозначаемые как "8.3-TCR-подобные". Эти клетки, которые распознают мимеотоп NRP-А7 (определяемый с использованием комбинаторных пептидных библиотек) в контексте молекулы МНС Kd, уже являются значимым компонентом наиболее ранних инфильтратов CD8+-клеток в островках мышей NOD, вызывают диабет и их мишенью является пептид родственного каталитической субъединице специфичной для островков глюкозо-6-фосфатазы белка (IGRP), белка с неизвестной функцией. Как правило, CD8+-клетки, распознающие этот пептид (IGRP206-214, сходный с NRP-A7), часто встречаются в кровотоке (>1/200 CD8+-клеток). Причем прогрессирование инсулита в диабет у мышей NOD неизменно сопровождается циклическим увеличением циркулирующей популяции реагирующих с IGRP206-214 CD8+-клеток и созреванием авидности ее ассоциированного с островками эквивалента. В последнее время показано, что ассоциированные с островками CD8+-клетки у мышей NOD распознают несколько эпитопов IGRP, что означает, что IGRP является господствующим аутоантигеном для CD8+-клеток, по меньшей мере у мышей T1D. Ассоциированные с островками CD8+-клетки NOD, в частности клетки, выявляемые на ранних стадиях патологического процесса, также распознают эпитоп инсулина (Ins В15-23).
Как используют в настоящем документе, термин "преддиабет" означает бессимптомный период, предшествующий диабетическому состоянию, характеризуемый субклиническим повреждением бета-клеток, когда у пациента выявляют нормальные уровни глюкозы в плазме. Он также характеризуется присутствием аутоантител к клеткам островков (ICA) и при близости проявления клинических симптомов сопровождается нарушением толерантности к глюкозе.
Как используют в настоящем документе, термин "связанные с рассеянным склерозом нарушения" означают нарушения, которые совместно выявляют при предрасположенности к PC или при PC. Неограничивающие примеры таких нарушений включают нейромиелит зрительного нерва со спектральным расстройством (NMO), увеит, склероз с нейропатической болью, атеросклероз, диссеминированный склероз, системный склероз, спинооптический PC, первично-прогрессирующий PC (PPMS) и ремиттирующий PC (RRMS), прогрессирующий системный склероз и атаксический склероз.
Термины "эпитоп" и "антигенная детерминанта" используют взаимозаменяемо для обозначения участка на антигене, на который отвечают или который распознают В- и/или Т-клетки. В-клеточные эпитопы могут формироваться из смежных аминокислот или несмежных аминокислот расположенных рядом вследствие третичной укладки белка. Как правило, эпитопы, формируемые из смежных аминокислот, сохраняются после воздействия денатурирующих растворителей, тогда как эпитопы, формируемые посредством третичной укладки, как правило, при обработке денатурирующими растворителями теряются. Как правило, эпитоп включает по меньшей мере 3, а более часто, по меньшей мере 5 или 8-20 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов включают, например, рентгеноструктурную кристаллографию и 2-мерный ядерно-магнитный резонанс. См., например, Glenn Е. Morris, Epitope Mapping Protocols (1996). T-клетки распознают непрерывные эпитопы приблизительно из девяти аминокислоты для CD8+-клеток или приблизительно 13-15 аминокислот для CD4+-клеток. Т-клетки, которые распознают данный эпитоп, можно идентифицировать посредством анализов in vitro, в которых определяют антиген-зависимую пролиферацию, как определяют по включению 3Н-тимидина примированными Т-клетками в ответ на эпитоп (Burke et al., J. Inf. Dis., 170:1110-1119, 1994), по антиген-зависимой цитотоксической активности (анализ цитотоксических Т-лимфоцитов, Tigges et al., J. Immunol., 156(10):3901-3910, 1996) или по секреции цитокинов. Наличие опосредуемого клетками иммунного ответа можно определять посредством анализов пролиферации (CD4+-Т-клеток) или посредством анализов CTL (цитотоксических Т-лимфоцитов).
Необязательно, антиген или, предпочтительно, эпитоп антигена можно химически конъюгировать или экспрессировать в виде слитого белка с другими белками, такими как МНС и родственные МНС белки.
Как используют в настоящем документе, термины "пациент" и "индивидуум" используют как синонимы, и они означают млекопитающее. В соответствии с определенными вариантами осуществления пациент представляет собой человека. В других вариантах осуществления пациент представляет собой млекопитающее, нуждающееся в ветеринарном лечении, или представляет собой млекопитающее, широко используемое в лабораториях. В соответствии с определенными вариантами осуществления млекопитающее представляет собой мышь, крысу, обезьяну, собаку, кошку, корову, лошадь или овцу.
Как используют в настоящем описании, термин "полинуклеотид" относится к молекуле нуклеиновой кислоты, которая является или рекомбинантной, или выделенной из тотальной геномной нуклеиновой кислоты. В рамки термина "полинуклеотид" включены олигонуклеотиды (нуклеиновые кислоты с длиной 100 остатков или менее), рекомбинантные векторы, включая, например, плазмиды, космиды, фаги, вирусы и т.п. В соответствии с определенными аспектами полинуклеотиды включают регуляторные последовательности, по существу выделенные из содержащих их природных генов или кодирующих белок последовательностей. Полинуклеотиды могут представлять собой РНК, ДНК, их аналоги или их сочетание. Нуклеиновая кислота, кодирующая весь или часть полипептида, может содержать непрерывную последовательность нуклеиновой кислоты, кодирующую весь или часть такого полипептида, со следующими длинами: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040, 1050, 1060, 1070, 1080, 1090, 1095, 1100, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 9000, 10000 или более нуклеотидов, нуклеозидов или пар оснований. Также предусмотрено, что конкретный полипептид данного вида могут кодировать нуклеиновые кислоты, содержащие природные вариации, которые содержат немного отличающиеся последовательности нуклеиновых кислот, но, тем не менее, кодируют тот же или в значительной степени сходный белок, полипептид или пептид.
Полинуклеотид состоит из конкретной последовательности из четырех нуклеотидных оснований: аденина (А); цитозина (С); гуанина (G); тимина (Т) и урацила (U) вместо тимина, когда полинуклеотид представляет собой РНК. Таким образом, термин "полинуклеотидная последовательность" представляет собой буквенное представление полинуклеотидной молекулы. Это буквенное представление можно вносить в базы данных в компьютере с центральным процессором и использовать для биоинформатических приложений, таких как функциональная геномика и поиск гомологии.
Как используют в настоящем документе, термин "выделенная" или "рекомбинантная" в отношении нуклеиновых кислот, таких как ДНК или РНК, относится к молекулам, отделенным от других ДНК или РНК, соответственно, которые присутствуют в природном источнике макромолекул, а также от полипептидов. Термин "выделенная или рекомбинантная нуклеиновая кислота" предназначен для включения фрагментов нуклеиновых кислот, которые не являются природными в качестве фрагментов и их нельзя найти в природном состоянии. Термин "выделенные" также используют в настоящем документе для обозначения полинуклеотидов, полипептидов и белков, которые отделены от других клеточных белков, и предназначен для включения очищенных и рекомбинантных полипептидов. В других вариантах осуществления термин "выделенный или рекомбинантный" означает отделенный от составляющих, клеточных и иных, с которыми клетка, ткань, полинуклеотид, пептид, полипептид, белок, антитело или их фрагменты в норме ассоциированы в природе. Например, выделенная клетка представляет собой клетку, которая выделена из ткани или клеток с отличающимся фенотипом или генотипом. Выделенный полинуклеотид выделен из 3'- и 5'- непрерывных нуклеотидов, с которыми он в норме ассоциирован в природе или природном окружении, например, на хромосоме. Как очевидно специалистам в данной области, неприродные полинуклеотид, пептид, полипептид, белок, антитело или их фрагменты, не требуют "выделения" для их различения с их природными эквивалентами.
Полинуклеотид или область полинуклеотида (или полипептид или область полипептида) с определенным процентом (например, 80%, 85%, 90% или 95%) "идентичности последовательностей" с другой последовательностью означает, что после выравнивания такой процент оснований (или аминокислот) при сравнении двух последовательностей является одинаковым. Выравнивание можно проводить и процент гомологии или идентичность последовательностей можно определять с использованием программных продуктов, известных в данной области, например, программных продуктов, описанных в Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) Supplement 30, section 7.7.18, Table 7.7.1. Для выравнивания предпочтительно используют параметры по умолчанию. Одной из программ выравнивания является BLAST, в которой использованы параметры по умолчанию. Конкретно, определенные программы представляют собой BLASTN и BLASTP, в которых используют следующие параметры по умолчанию: генетический код = стандартный; фильтр = отсутствует; цепь = обе; порог = 60; ожидание = 10; матрица = BLOSUM62; описание = 50 последовательностей; сортировка = HIGH SCORE; базы данные = невырожденные, GenBank + EMBL + DDBJ + PDB + GenBank транслированные CDS + SwissProtein + SPupdate + PIR. Более подробные описания эти программ можно найти по следующим адресам Интернет: ncbi.nlm.nih.gov/cgi-bin/BLAST.
Без явного описания и если не указано иначе следует полагать, что когда настоящее изобретение относится к антигену, полипептиду, белку, полинуклеотиду или антителу, в объеме настоящего изобретения подразумевают наличие их эквивалентов или биологических эквивалентов. Как используют в настоящем документе, полагают, что термин "его биологический эквивалент" является синонимом "его эквиваленту" относительно исходных антигена, белка, антитела, фрагмента, полипептида или нуклеиновой кислоты и означает антиген, белок, антитело, фрагмент, полипептид или нуклеиновую кислоту с минимальной гомологией при сохранении желаемой структуры или функциональности. Если в настоящем документе конкретно не указано, предусмотрено, что любой полинуклеотид, полипептид или белок, указанные в настоящем документе, также включают их эквиваленты. В одном из аспектов эквивалентный полинуклеотид представляет собой полинуклеотид, который в жестких условиях гибридизуется с полинуклеотидом или комплементарным полинуклеотидом, как описано в настоящем документе для применения в описываемых способах. В соответствии с другим аспектом эквивалентное антитело или связывающий антиген полипептид означают антитело или связывающий антиген полипептид, которые связываются по меньшей мере с 70%, или, альтернативно, по меньшей мере с 75%, или, альтернативно, по меньшей мере с 80%, или, альтернативно, по меньшей мере с 85%, или, альтернативно, по меньшей мере с 90%, или, альтернативно, по меньшей мере с 95% аффинностью или большей аффинностью от эталонного антитела или антигенсвязывающего фрагмента. В соответствии с другим аспектом их эквивалент конкурирует с антителом или антигенсвязывающим фрагментом за связывание с их антигеном в конкурентном анализе ИФА. В соответствии с другим аспектом эквивалент означает по меньшей мере приблизительно 80% гомологию или идентичность и, альтернативно, по меньшей мере приблизительно 85%, или, альтернативно, по меньшей мере приблизительно 90%, или, альтернативно, по меньшей мере приблизительно 95%, или, альтернативно, 98% гомологию или идентичность и демонстрирует по существу эквивалентную с эталонным белком, полипептидом или нуклеиновой кислотой биологическую активность.
"Гибридизация" относится к реакции, в которой один или несколько полинуклеотидов реагируют с формированием комплекса, который стабилизирован вследствие образования водородных связей между основаниями нуклеотидных остатков. Образование водородных связей может происходить при спаривании оснований по Уотсону-Крику, связывании по Хугстину или любым другим специфичным для последовательностей способом. Комплекс может содержать две цепи, формирующие дуплексную структуру, три или более цепи, формирующие мультицепочечный комплекс, одну самогибридизующуюся цепь или любую комбинацию из них. Реакция гибридизации может представлять собой этап в боле сложном процессе, таком как инициация полимеразной цепной (PC) реакции или ферментативное расщепление полинуклеотида рибозимом.
Примеры жестких условий гибридизации включают: температуры инкубации приблизительно от 25°С до приблизительно 37°С; концентрации гибридизационного буфера приблизительно от 6× SSC до приблизительно 10× SSC; концентрации формамида приблизительно от 0% до приблизительно 25% и отмывочных растворов приблизительно от 4× SSC до приблизительно 8× SSC. Примеры умеренных условий гибридизации включают: температуры инкубации приблизительно от 40°С до приблизительно 50°С; концентрации буфера приблизительно от 9× SSC до приблизительно 2× SSC; концентрации формамида приблизительно от 30% до приблизительно 50% и отмывочных растворов приблизительно от 5× SSC до приблизительно 2× SSC. Примеры условий с высокой жесткостью включают: температуры инкубации приблизительно от 55°С до приблизительно 68°С; концентрации буфера приблизительно от 1× SSC до приблизительно 0,1× SSC; концентрации формамида приблизительно от 55% до приблизительно 75% и отмывочных растворов приблизительно 1× SSC, 0,1× SSC или они могут представлять собой деионизированную воду. Как правило, времена инкубации при гибридизации составляет от 5 минут до 24 часов, с 1, 2 или более этапами отмывки, а время инкубации при отмывке составляет приблизительно 1, 2 или 15 минут. SSC представляет собой 0,15 М NaCl и 15 мМ цитратный буфер. Следует понимать, что можно использовать эквиваленты SSC, с использованием других буферных систем.
"Гомология", или "идентичность", или "сходство" относятся к сходству последовательностей двух пептидов или двух молекул нуклеиновых кислот. Гомологию можно определять, сравнивая положения в каждой из последовательностей, которые можно выравнивать в целях сравнения. Когда положение в сравниваемой последовательности занято тем же основанием или аминокислотой, тогда молекулы являются гомологичны по этому положению. Степень гомологии последовательностей представляет собой функцию от количества совпадающих или гомологичных положений у последовательностей. Идентичность "неродственной" или "негомологичной" последовательности с какой-либо из последовательностей по настоящему изобретению составляет менее 40% или, альтернативно, менее 25%.
"Гомология", или "идентичность", или "сходство" также могут относиться к двум молекулам нуклеиновой кислоты, которые гибридизуются в жестких условиях.
Как используют в настоящем документе, термины "лечить", "лечение" и т.п. используют в настоящем документе для обозначения получения требуемого фармакологического и/или физиологического действия. Действие в отношении частичного или полного излечения нарушения и/или неблагоприятного эффекта, ассоциированного с нарушением, может являться терапевтическим. В одном из аспектов лечение означает снижение выраженности признаков заболевания по установленной шкале.
Как используют в настоящем документе, термин "лечить" или "лечение", как он относится к онкологии, означает любое лечение заболевания или состояния или ассоциированного нарушения у пациента, включая подавление заболевания или состояния, т.е. остановка или подавление развития клинических симптомов, таких как кахексия при злокачественной опухоли; и/или смягчение заболевания или состояния, т.е. обеспечение регресса клинических симптомов, например, увеличение общей продолжительности жизни или снижение опухолевой нагрузки.
В соответствии с определенными аспектами термин "лечение" относится к улучшению клинических исходов. Термин "клинический исход" относится к любому клиническому наблюдению или определению, относящемуся к реакции пациента реакция на лечение. Неограничивающие примеры клинических исходов включают ответ опухоли (TR), общую продолжительность жизни (OS), продолжительность жизни без прогрессирования (PFS), продолжительность жизни без заболевания, период до рецидива опухоли (TTR), период до прогрессирования опухоли (ТТР), относительный риск (RR), токсичность или побочный эффект. "Общая продолжительность жизни" (OS) означает продление ожидаемой продолжительности жизни по сравнению с интактными или не получавшими лечение индивидуумами или пациентами. "Продолжительность жизни без прогрессирования" (PFS) или "период до прогрессирования опухоли" (ТТР) означает длительность периода в течение и после лечения, когда злокачественная опухоль не растет. Продолжительность жизни без прогрессирования включает период времени, когда пациенты демонстрируют полный ответ или частичный ответ, а также период времени, когда течение заболевания у пациентов стабильно. Как используют в настоящем документе и как определено в National Cancer Institute, "рецидив опухоли" представляет собой рецидивирующую (возвратившуюся) злокачественную опухоль, как правило, после периода времени, в течение которого злокачественная опухоль не выявлялась. Злокачественная опухоль может рецидивировать в том же участке, что и исходная (первичная) опухоль или в другом участке организма. Ее также называют рецидивирующей злокачественной опухолью. "Период до рецидива опухоли" (TTR) определяют, как период с даты диагноза злокачественной опухоли до даты первого рецидива, гибели или до последнего контакта, если у пациента не выявили никаких рецидивов опухоли во время последнего контакта. Если рецидивов у пациента не выявляли, то TTR оценивали моментом смерти или последнего осмотра. "Относительный риск" (RR) в статистике и математической эпидемиологии относится к риску события (или развития заболевания) относительно лечения. Относительный риск представляет собой отношение вероятностей события, происходящего в подвергаемой лечению группе и не подвергаемой лечению группе.
Термин "композиция" предназначен для обозначения комбинации активного средства и другого соединения или композиции, инертных (например, детектируемое средство или метка) или активных, таких как адъювант. В соответствии с определенными вариантами осуществления композиция не содержит адъюванта.
Термин "фармацевтическая композиция" предназначен для включения комбинации активного средства с носителем, инертным или активным, делающим композицию подходящей для диагностического или терапевтического применения in vitro, in vivo или ex vivo.
Термин "функционально эквивалентный кодон" используют в настоящем документе для обозначения кодонов, которые кодируют одну и ту же аминокислоту, таких как шесть кодонов для аргинина или серин, а также относится к кодонам, которые кодируют биологически эквивалентные аминокислоты (см. таблицу 2).
Как используют в настоящем документе, "белок", или "полипептид", или "пептид" относится к молекуле, содержащей по меньшей мере пять аминокислотных остатков.
Другие объекты, характеристики и преимущества настоящего изобретения будут очевидны из приводимого далее подробного описания. Также там предоставлены дополнительные определения. Однако следует понимать, что подробное описание и конкретные примеры, указывая на конкретные варианты осуществления изобретения, приведены только в качестве иллюстрации, так как специалистам в данной области из этого подробного описания будут очевидны различные изменения и модификации в рамках смысла и объема изобретения.
Описательные варианты осуществления
Аутоиммунные заболевания, такие как диабет 1 типа (T1D), рассеянный склероз и ревматоидный артрит являются результатом хронического аутоиммунного ответа, в который вовлечены Т-клетки и В-клетки, распознающие множество антигенных эпитопов из неполностью определенных списков аутоантигенов (Santamaria, Р. (2010) Immunity 32:437-445; Babbe, Н. et al. (2000) J. Exp. Med. 192:393-404; Firestein, G.S. (2003) Nature 423:356-361). В настоящее время устранение или подавление всех поликлональных аутореактивных специфичных Т-клеток (известных и неизвестных) для каждого конкретного аутоиммунного нарушения без угрозы системному иммунитету невозможно.
В качестве альтернативного терапевтического похода предложен адоптивный перенос поликлональных FOXP3+CD4+CD25+ регуляторных Т-клеток (Трег), размноженных ex vivo (Sakaguchi, S. et al. (2006) Immunol. Rev. 212:8-27). Клиническое применение трансляция этого подхода затрудняют потенциальная побочная иммуносупрессия, отсутствие эффективных стратегий размножения антигенспецифичных клеток Трег in vitro, и нестабильность линий FOXP3+ клеток Трег (Zhou, X. et al. (2009) Nature Immunol. 10:1000-1007; Komatsu, N. et al. (2014) Nature Med. 20:62-68; Bailey-Bucktrout, S.L. et al. (2013) Immunity 39:949-962). Другую регуляторную субпопуляцию T-клеток, недавно применяемую для лечения воспалительных заболеваний человека, составляют TR1 FOXP3-CD4+CD25- Т-клетки, которые продуцируют цитокины IL-10 и IL-21 и экспрессируют поверхностные маркеры CD49b и LAG-3 и фактор транскрипции с-Maf 8 (McLarnon, A. (2012) Nature Rev. Gastroenterol. Hepatol. 9:559; Desreumaux, P. et al. (2012) Gastroenterology 143:1207-1217; Roncarolo, M.G. et al. (2011) Immunol. Rev. 241:145-163). Однако, как и для клеток FOXP3+ Трег, фармакологических подходов, по которым можно размножать специфичные для аутоантигенов или заболеваний TR1-подобные клетки in vivo, не существует.
Таким образом, регуляторные Т-клетки имеют потенциал в качестве мишеней для терапевтического вмешательства при аутоиммунитете, но подходы, с помощью которых можно размножать антигенспецифичные регуляторные Т-клетки in vivo в настоящее время недоступны. В настоящем документе заявитель демонстрирует, что системная доставка наночастиц, покрытых ассоциированными с аутоиммунным заболеванием пептидами, связанными с молекулами главного комплекса гистосовместимости класса II (pMHCII), стимулирует образование и размножение антигенспецифичных регуляторных CD4+ Т-клеток типа 1 (TR1)-подобные клетки в различных моделях на мышах, включая мышей, гуманизированных лимфоцитами пациентов, что приводит к регрессии хронических аутоиммунных симптомов. Десять основанных на pMHCII нанолекарств демонстрируют сходное биологическое действие вне зависимости от генетического окружение, доли популяции распознающих Т-клеток или рестрикции по МНС. Эти нанолекарства стимулируют дифференцировку примированных в отношении заболевания аутореактивных Т-клеток в TR1-подобные клетки, которые в свою очередь супрессируют нагруженные аутоантигеном антигенпрезентирующие клетки и направляют дифференцировку распознающих В-клеток в подавляющие заболевание регуляторные В-клетки без риска для системного иммунитета. Таким образом, основанные на pMHCII нанолекарства представляют собой новый класс лекарственных средств, потенциально пригодных для лечения широкого спектра аутоиммунных патологических состояний специфичным для заболевания способом.
Заявитель ранее выявил, что системная доставка наночастиц (NP), покрытых ассоциированными с T1D комплексами рМНС класса I (pMHC-NP) может затормозить прогрессирование T1D вследствие размножения субпопуляций CD8+ Т-клеток с регуляторным потенциалом, но обычным подобным клеткам памяти фенотипом (Tsai, S. et al. (2010) Immunity 32:568-580). Так как наночастицы можно покрывать различными комплексами рМНС класса I, заявитель полагает, что в терапии pMHC-NP можно использовать природную регуляторную петлю отрицательной обратной связи, в результате чего длительная экспозиция аутоантигена (и экспозиция на pMHC-NP) может инициировать дифференцировку аутореактивных Т-клеток в регуляторные Т-клетки-потомки. На основе этого заявитель спрогнозировал и продемонстрировал в настоящем изобретении, что NP, покрытые ассоциированными с заболеванием комплексами pMHCII, могут приводить к размножению специфичных для заболевания регуляторных CD4+ Т-клеток in vivo.
Настоящее изобретение основано на этих исходных наблюдениях посредством предоставления pMHC-NP, композиций и способов их получения, а также их применения.
Субстраты/Частицы
Под "частицей", "наночастицей", "микрочастицей", "гранулой", "микросферой" и их грамматическими эквивалентами в настоящем документе подразумевают небольшие дискретные частицы, которые можно вводить индивидууму. В соответствии с определенными вариантами осуществления форма частиц является по существу сферической. Как используют в настоящем документе, термин "по существу сферические" означает, что форма частиц не отклоняется от сферы более чем приблизительно на 10%. На частицы можно наносить различные комплексы с известными антигенами или пептидами по изобретению.
Сердцевина наночастицы pMHC-NP содержит или в значительной степени состоит или еще более состоит из сердцевины, например, твердой сердцевины, металлической сердцевины, сердцевины из дендримера, сердцевины наночастицы из полимерной мицеллы, наностержня, фуллерена, нанооболочки, сердцевины-оболочки, наноструктуры на основе белков или наноструктуры на основе липидов. В соответствии с определенными аспектами сердцевина наночастицы является биоабсорбируемой и/или биоразлагаемой. В соответствии с определенными аспектами сердцевина наночастицы представляет собой сердцевину наночастицы из дендримера, содержащую, или, альтернативно, в значительной степени состоящую, или даже еще более состоящую из высокоразветвленной макромолекулы с древообразной структурой, растущей из середины. В дополнительных аспектах сердцевина наночастицы из дендримера может содержать, или, альтернативно в значительной степени состоять, или даже еще более состоять из дендримера на основе поли(амидоамина) или дендримера на основе поли-L-лизина. В соответствии с определенными аспектами сердцевина наночастицы представляет собой сердцевину из полимерной мицеллы, содержащую, или, альтернативно, в значительной степени состоящую, или даже еще более состоящую из амфифильного блок-сополимера, составлено в структуру сердцевина-оболочка наномасштаба. В дополнительных аспектах сердцевина из полимерной мицеллы содержит, или, альтернативно, в значительной степени состоит, или еще более состоит из полимерной мицеллы, получаемой с использованием блок-сополимера полиэтиленгликоля-диастеароилфосфатидилэтаноламина. В дополнительном аспекте сердцевина наночастицы содержит, или, альтернативно, в значительной степени состоит, или еще более состоит из металла. В соответствии с другим аспектом сердцевина наночастицы не является липосомой. Дополнительные примеры материалов сердцевины в качестве неограничивающих примеров включают стандартные и специализированные стекла, диоксид кремния, полистирол, сложный полиэфир, поликарбонат, акриловые полимеры, полиакриламид, полиакрилонитрил, полиамид, фторполимеры, силикон, различные виды целлюлозы, металлы (например, железо, золото, серебро), минералы (например, рубин), наночастицы (например, золотые наночастицы, коллоидные частицы, оксиды металлов, сульфиды металлов, селениды металлов и магнитные материалы, такие как оксид железа) и их смеси. В соответствии с определенными вариантами осуществления сердцевина наночастицы из оксида железа содержит оксид железа (II, III). В зависимости от требуемых свойств сердцевина может состоять из гомогенного состава или состоять из двух или более классов материалов. В соответствии с определенными аспектами используют металлические наночастицы. Эти металлические частицы или наночастицы можно формировать из Au, Pt, Pd, Cu, Ag, Со, Fe, Ni, Mn, Sm, Nd, Pr, Gd, Ti, Zr, Si и In, прекурсоров, их бинарных сплавов, их тройных сплавов и их интерметаллических соединений. См. патент США 6712997, полностью включенный в настоящий документ в качестве ссылки. В соответствии с определенными вариантами осуществления составы и слои сердцевины (описанные ниже) могут варьировать при условии, что наночастицы являются биосовместимыми и биоабсорбируемыми. В зависимости от требуемых свойств сердцевина может состоять из гомогенного состава или состоять из двух или более классов материалов. В соответствии с определенными аспектами используют металлические наносферы. Эти металлические наночастицы можно формировать из Fe, Са, Ga и т.п. В соответствии с определенными вариантами осуществления наночастица содержит, или, альтернативно, в значительной степени состоит, или еще более состоит из сердцевины, содержащей металл или оксид металла, таких как золото или оксид железа.
Как правило, частицы состоят по существу из сферической сердцевины и необязательно одного или нескольких слоев или покрытий. Сердцевина может варьировать по размеру и составу, как описано в настоящем документе. В дополнение к сердцевине частица может содержать один или несколько слоев для обеспечения функциональности, необходимой для требуемых применений. Толщина слоев, если они присутствуют, может варьировать в зависимости от требований конкретного применения. Например, слои могут придавать подходящие оптические свойства.
Слои также могут обеспечивать химическую или биологическую функциональность, что указано в настоящем документе как химически активные или биологически активные слои. Как правило, эти слои наносят на внешнюю поверхность частиц, и они могут обеспечивать функциональность pMHC-NP. Как правило, толщина слоя или слоев может находиться в диапазоне приблизительно от 0,001 микрометра (1 нанометра) до приблизительно 10 микрометров или более (в зависимости требуемого диаметра частиц), или приблизительно от 1 нм до 5 нм, или, альтернативно, приблизительно от 1 нм до приблизительно 10 нм, или, альтернативно, приблизительно от 1 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 25 нм, или приблизительно 20 нм и находиться в диапазонах между ними.
Слой или покрытие могут содержать, или, альтернативно, в значительной степени состоять, или даже более того, состоять из биоразлагаемого сахара или другого полимера. Примеры биоразлагаемых слоев в качестве неограничивающих примеров включают декстран; поли(этиленгликоль); поли(этиленоксид); маннит; поли(сложные эфиры) на основе полилактида (PLA), полигликолида (PGA), поликапролактона (PCL); поли(гидроксиалканоата) класса PHB-PHV; и другие модифицированные поли(сахариды), такие как крахмал, целлюлоза и хитозан. Кроме того, наночастица может включать слой с подходящими поверхностями для присоединения химических функциональных групп для химического связывания или мест связывания.
Слои на наночастицах можно получать рядом способов, известных специалистам в данной области. Примеры включают способы золь-гелевой химии, например, как описано в Iler, Chemistry of Silica, John Wiley & Sons, 1979; Brinker and Scherer, Sol-gel Science, Academic Press, (1990). Дополнительные способы получения слоев на наночастицах включают способы химии на поверхности и инкапсуляции, например, как описано в Partch and Brown, J. Adhesion, 67:259-276, 1998; Pekarek et al., Nature, 367:258, (1994); Hanprasopwattana, Langmuir, 12:3173-3179, (1996); Davies, Advanced Materials, 10:1264-1270, (1998); и в ссылках в них. Также можно использовать способы осаждения испарением; см., например, Golman and Shinohara, Trends Chem. Engin., 6:1-6, (2000) и патент США №6387498. Другие подходы включают способы послойной самоагрегации, например, как описано в Sukhorukov et al., Polymers Adv. Tech., 9(10-11):759-767, (1998); Caruso et al., Macromolecules, 32(7):2317-2328, (1998); Caruso et al., J. Amer. Chem. Soc, 121(25):6039-6046, (1999); патент США №6103379 и цитируемые в них ссылки.
В соответствии с определенными аспектами сердцевина наночастицы представляет собой сердцевину наночастицы из дендримера, содержащего, или, альтернативно, в значительной степени состоящего, или даже еще более состоящего из высокоразветвленной макромолекулы с древообразной структурой, растущей из середины. В дополнительных аспектах дендримерная наночастица может содержать, или, альтернативно, в значительной степени состоять, или даже более того, состоять из дендримера на основе поли(амидоамина) или дендримера на основе поли-L-лизина. В соответствии с определенными аспектами сердцевина наночастицы представляет собой сердцевину из полимерной мицеллы, содержащую, или, альтернативно, в значительной степени состоящую, или даже еще более состоящую из амфифильного блок-сополимера, составлено в структуру сердцевина-оболочка наномасштаба. В дополнительных аспектах сердцевина из полимерной мицеллы может содержать, или, альтернативно, в значительной степени состоять, или даже более того, состоять из полимерной мицеллы, получаемой с использованием блок-сополимера полиэтиленгликоля-диастеароилфосфатидилэтаноламина. Сердцевина дендримера или сердцевина из полимерной мицеллы могут дополнительно содержать внешние покрытие или слой, как описано в настоящем документе.
В соответствии с определенными вариантами осуществления конкретные способы синтеза наночастиц с дендримерами или наночастиц с сердцевиной наночастиц из дендримера могут требовать экстракции ионов металлов внутрь дендримеров, а затем химического восстановления с получением почти монодисперсных в отношении размера частиц с размерами менее 3 нм, например, способ, описанный в Crooks et al., "Synthesis, Characterization, and Applications of Dendrimer-Encapsulated Nanoparticles". The Journal of Physical Chemistry В (109): 692-704 (2005), где полученный компонент сердцевины из дендримера служит не только в качестве матрикса для получения наночастицы, но также и для стабилизации наночастицы, делая возможным регулировку растворимости, и обеспечивает средства для иммобилизации наночастицы на твердой подложке.
Размер сердцевины наночастицы может находиться в диапазоне приблизительно от 1 нм до приблизительно 1 мкм. В соответствии с определенными вариантами осуществления диаметр сердцевины наночастицы составляет менее чем приблизительно 1 мкм. В других вариантах осуществления диаметр сердцевины наночастицы составляет менее чем приблизительно 500 нм, менее чем приблизительно 400 нм, менее чем приблизительно 300 нм, менее чем приблизительно 200 нм, менее чем приблизительно 100 нм, или менее чем приблизительно 50 нм. В соответствии с дополнительными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 1 нм до приблизительно 10 нм, 15 нм, 20 нм, 25 нм, 30 нм, 40 нм, 50 нм, 75 нм или 100 нм. В соответствии с конкретными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 1 нм до приблизительно 100 нм; приблизительно от 1 нм до приблизительно 75 нм; приблизительно от 1 нм до приблизительно 50 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 5 нм до приблизительно 100 нм; приблизительно от 5 нм до приблизительно 50 нм; или приблизительно от 5 нм до приблизительно 25 нм, или приблизительно от 15 нм до приблизительно 25 нм, или приблизительно 20 нм. В соответствии с определенными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм.
Диаметр pMHC-NP, со слоем или без, может находиться в диапазоне приблизительно от 5 нм до приблизительно 1 мкм. В соответствии с определенными вариантами осуществления диаметр комплекса pMHC-NP составляет менее чем приблизительно 1 мкм или, альтернативно, менее чем 100 нм. В других вариантах осуществления диаметр комплекса pMHC-NP составляет менее чем приблизительно 500 нм, менее чем приблизительно 400 нм, менее чем приблизительно 300 нм, менее чем приблизительно 200 нм, менее чем приблизительно 100 нм, или менее чем приблизительно 50 нм. В соответствии с дополнительными вариантами осуществления диаметр комплекса составляет приблизительно от 5 нм или 10 нм до приблизительно 50 нм, или приблизительно от 5 нм до приблизительно 75 нм, или приблизительно от 5 нм до приблизительно 50 нм, или приблизительно от 5 нм до приблизительно 60 нм, или приблизительно от 10 нм до приблизительно 50 нм, или приблизительно от 10 нм до приблизительно 60 нм, или приблизительно от 10 нм до приблизительно 70 нм, или приблизительно от 10 нм до приблизительно 75 нм, или приблизительно от 20 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 60 нм, или приблизительно от 20 нм до приблизительно 70 нм, или приблизительно от 20 нм до приблизительно 75 нм, или приблизительно от 30 нм до приблизительно 50 нм, или приблизительно от 30 нм до приблизительно 60 нм, или приблизительно от 30 нм до приблизительно 70 нм, или приблизительно от 30 нм до приблизительно 75 нм, или в одном из аспектов приблизительно 55 нм. В соответствии с конкретными вариантами осуществления диаметр комплекса pMHC-NP составляет приблизительно от 35 нм до приблизительно 60 нм, или приблизительно от 35 нм до приблизительно 70 нм, или приблизительно от 35 нм до приблизительно 75 нм. В одном из аспектов диаметр комплекса pMHC-NP составляет приблизительно от 30 нм до приблизительно 50 нм.
Комплексы антиген-МНС
Комплексы наночастиц по настоящему изобретению содержат сердцевину наночастицы, со слоем или без слоя, связанную с комплексом антиген-МНС (рМНС). Выбор антигена зависит от подлежащего лечению заболевания или состояния, как указано выше. Отдельный полипептид (например, МНС) и антигенные (например, пептид) компоненты формируют комплекс посредством ковалентного или нековалентного связывания (например, посредством водородных связей, ионных связей или гидрофобных связей). Получение таких комплексов может требовать различных степеней обработки, и такие способы хорошо известны в литературе. В соответствии с определенными аспектами антигенные компоненты можно связывать с участком полости компонента МНС нековалентно, например, смешивая МНС и антигенные компоненты; это основано на природной аффинности связывания МНС и антигена. Альтернативно, В соответствии с определенными аспектами компонент МНС можно стандартными способами связывать с антигенным компонентом ковалентно, в качестве неограничивающих примеров, такими способами, как введение известных связывающих средств или фотоаффинное мечение (См., например, Hall et al., Biochemistry 24:5702-5711 (1985)). В соответствии с определенными аспектами антигенный компонент можно функционально связывать с компонентом МНС посредством пептидных связей или другими способами, описанными в литературе, включая в качестве неограничивающих примеров, связывание посредством углеводных групп на гликопротеинах, включая, например, углеводные группы альфа- и/или бета-цепи. В соответствии с конкретными вариантами осуществления антигенный компонент можно связывать с N-концом или С-концом соответствующей молекулы МНС.Альтернативно, В соответствии с определенными вариантами осуществления комплекс МНС можно формировать рекомбинантно, встраивая последовательность, кодирующую антигенный компонент, в последовательность, кодирующую МНС, так, что оба сохраняют свои функциональные свойства.
С одной сердцевиной наночастицы могут связываться несколько комплексов антиген-МНС; эти комплексы, МНС и/или антигены могут являться одинаковыми или отличающимися друг от друга.
Валентность определена как количество комплексов рМНС на сердцевину наночастицы. В соответствии с определенными вариантами осуществления валентность наночастицы может находиться в диапазоне приблизительно от 1 комплекса рМНС на 1 сердцевину наночастицы до приблизительно 6000 комплексов рМНС на 1 сердцевину наночастицы, или, альтернативно, приблизительно от 10:1 до приблизительно 6000:1, или, альтернативно, приблизительно от 11:1 до приблизительно 6000:1, или, альтернативно, приблизительно от 12:1 до приблизительно 6000:1, или, альтернативно, по меньшей мере 2:1, или, альтернативно, по меньшей мере 8:1, или, альтернативно, по меньшей мере 9:1, или, альтернативно, по меньшей мере 10:1, или, альтернативно, по меньшей мере 11:1, или, альтернативно, по меньшей мере 12:1.
В соответствии с определенными аспектами валентность составляет приблизительно от 10:1 до приблизительно 6000:1, или приблизительно от 20:1 до приблизительно 5500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 5000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 4000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 3500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 3000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 2500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 2000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 1500:1, или, альтернативно, приблизительно от 10:1 до 1000:1, или, альтернативно, приблизительно от 10:1 до приблизительно 500:1, или, альтернативно, приблизительно от 10:1 до приблизительно 100:1, или, альтернативно, приблизительно от 20:1 до приблизительно 50:1, или, альтернативно, приблизительно от 25:1 до приблизительно 60:1; альтернативно приблизительно от 30:1 до приблизительно 50:1, или, альтернативно, приблизительно от 35:1 до приблизительно 45:1, или, альтернативно, приблизительно 40:1.
Заявитель выявил, что плотность рМНС на наночастице регулирует способность pMHC-NP инициировать или видоизменять формирование клеток TR1 независимым от дозы способом. Плотность рассчитывают как количество комплексов на единицу площади поверхности наночастицы. Площадь поверхности наночастицы можно определять со слоями или без, включая в качестве неограничивающих примеров, линкеры, которые конъюгируют комплекс рМНС с наночастицей. С целью расчета плотности соответствующее значение площади поверхности основано на конечном диаметре конструкции частицы без комплекса рМНС, с внешним слоем на сердцевине наночастицы или без.
В настоящем документе определено и описано, что плотность комплексов рМНС на наночастице способствует положительному терапевтическому эффекту независимым от дозы способом. Таким образом, как описано в настоящем документе, наночастица может иметь определенную плотность рМНС в диапазоне приблизительно от 0,01 рМНС, или, альтернативно, 0,025 молекул рМНС на 100 нм2 площади поверхности наночастицы, включая слой или комплекс, полагая по меньшей мере 2 молекулы МНС, или, альтернативно, по меньшей мере 8, или, альтернативно, по меньшей мере 9, или, альтернативно, по меньшей мере 10, или, альтернативно, по меньшей мере 11, или, альтернативно, по меньшей мере 12 молекул рМНС, образующих комплекс с наночастицей до приблизительно 100 молекул рМНС на 100 нм2 площади поверхности. В одном из аспектов плотность рМНС на наночастице составляет приблизительно от 0,05 рМНС на 100 нм2 до приблизительно 76 рМНС/100 нм2, или, альтернативно, от 0,1 рМНС/100 нм2 до приблизительно 50 рМНС/100 нм2, или, альтернативно, приблизительно от 0,3 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, или, альтернативно, приблизительно от 0,35 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, или, альтернативно, приблизительно от 0,4 рМНС/100 нм2 до приблизительно 50 рМНС/100 нм2, или, альтернативно, приблизительно от 0,4 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, или, альтернативно, приблизительно от 0,4 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, 0,4рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или, альтернативно, приблизительно от 0,5 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или, альтернативно, приблизительно от 0,5 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или, альтернативно, приблизительно от 0,6 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или, альтернативно, приблизительно от 1,0 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или, альтернативно, приблизительно от 10 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или, альтернативно, по меньшей мере приблизительно 0,4, или, альтернативно, по меньшей мере приблизительно 0,406, или, альтернативно, по меньшей мере приблизительно 0,5, или, альтернативно, по меньшей мере приблизительно 1,0, или, альтернативно, по меньшей мере приблизительно 5,0, или, альтернативно, по меньшей мере приблизительно 10,0, или, альтернативно, по меньшей мере приблизительно 15,0 рМНС/100 нм2, или, альтернативно, менее чем приблизительно 76 рМНС/100 нм2, или, альтернативно, менее чем приблизительно 50 рМНС/100 нм2, или, альтернативно, менее чем приблизительно 47,75 рМНС/100 нм2 или, альтернативно, менее чем приблизительно 25 рМНС/100 нм2, или, альтернативно, менее чем приблизительно 20 рМНС/100 нм2.
В соответствии с определенными вариантами осуществления плотность рМНС на наночастицу составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 25 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 20 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 15 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 14 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 13 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
В соответствии с дополнительными вариантами осуществления плотность рМНС на наночастицах может составлять приблизительно от 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,22 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В соответствии с определенными аспектами плотность рМНС на наночастице может составлять приблизительно от 0,22 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2 или 0,24 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,26 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,28 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,24 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,5 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,6 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В соответствии с определенными вариантами осуществления плотность рМНС на наночастице может составлять приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,3 рМНС/100 нм2, или, альтернативно, приблизительно от 0,5 рМНС/100 нм2 до приблизительно 0,9 рМНС/100 нм2, или, альтернативно, приблизительно от 0,6 рМНС/100 нм2 до приблизительно 0,8 рМНС/100 нм2.
В соответствии с дополнительными вариантами осуществления плотность наночастицы может составлять приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9 или 12,0 рМНС/100 нм2. В соответствии с конкретными вариантами осуществления плотность наночастицы составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2 или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2 или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2.
В соответствии с определенными аспектами, в настоящем документе предоставлен комплекс, содержащий сердцевину наночастицы, где с сердцевиной связано множество ассоциированных с заболеваниями комплексов антиген-МНС (рМНС); где диаметр сердцевины составляет приблизительно от 15 нм до приблизительно 25 нм и где плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2 площади поверхности наночастицы. В соответствии с определенными вариантами осуществления комплекс дополнительно содержит на сердцевине наночастицы внешний слой, где комплекс рМНС связан с сердцевиной наночастицы и/или внешним слоем, и где диаметр сердцевины наночастицы и внешнего слоя составляет приблизительно от 35 нм до приблизительно 45 нм.
Как используют в настоящем документе, термин "функционально связанный" или "покрытый" относится к ситуации, когда отдельный полипептид (например, МНС) и антигенные (например, пептид) компоненты комбинируют с формированием активного комплекса до связывания на участке-мишени, например, иммуноците. Это включает ситуацию, когда синтезируют или рекомбинантно экспрессируют отдельные полипептидные компоненты комплекса, а затем выделяют и комбинируют с формированием комплекса до введения индивидууму in vitro; ситуацию, когда синтезируют или рекомбинантно экспрессируют химерный или слитый полипептид (т.е., каждый из отдельных белковых компонентов комплекса помещают в единую полипептидную цепь) в виде интактного комплекса. Как правило, полипептидные комплексы добавляют к наночастицам с получением наночастиц с адсорбированными или связанными полипептидными комплексами с отношением количество молекул количество наночастиц приблизительно, по меньшей мере приблизительно или не более чем приблизительно 0,1, 0,5, 1, 3, 5, 7, 10, 15, 20, 25, 30, 35, 40, 50, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500 или более: 1, как правило от 0,1:1, 1:1 до 50:1 или 300:1, и в диапазонах между ними, где отношения предусматривают выбранные конечные точки в каждом из диапазонов. Содержание полипептидов в наночастице можно определять стандартными способами.
Молекулы МНС
Как используют в настоящем документе и если конкретно не указано, термин МНС в рамках комплекса рМНС означает белок классического или неклассического МНС класса I и/или белок классического или неклассического МНС класса II, любые локусы из HLA DR, HLA DQ, HLA DP, HLA-A, HLA-B, HLA-C, HLA-E, CD1d, или фрагменты или их биологические эквиваленты, конструкции с двумя или одной цепью, димеры (слияния с Fc), тетрамеры, мультимерные формы и полимерные формы MHCI или MHCII. В соответствии с определенными вариантами осуществления рМНС может представлять собой одноцепочечную конструкцию. В соответствии с определенными вариантами осуществления рМНС может представлять собой двухцепочечную конструкцию.
В соответствии с определенными вариантами осуществления белок МНС может представлять собой димер или мультимер.
В соответствии с определенными вариантами осуществления белок МНС может включать основанный на "выступе во впадину" гетеродимер или мультимер альфа-МНС-Fc/бета-MHC-Fc.
Как указано выше, "выступ во впадину" представляет собой полипептидильная архитектура, требующая выпячивания (или "выступа") на взаимодействующей поверхности первого полипептида и соответствующего углубления (или "впадины") на взаимодействующей поверхности второго полипептида так, что выпячивание может располагаться в углублении так, чтобы обеспечивать формирование гетеромультимера. Выпячивания конструируют, заменяя аминокислоты с небольшими боковыми цепями на взаимодействующей поверхности первого полипептида аминокислотами с большими боковыми цепями (например, фенилаланином или тирозином). На взаимодействующей поверхности второго полипептида получают углубления идентичных или сходных с выпячиваниями размеров, заменяя аминокислоты с большими боковыми цепями на аминокислоты с небольшими боковыми цепями (например, аланином или треонином). Выпячивания и углубления можно получать синтетическими способами, такими как замена нуклеиновых кислот, кодирующих полипептиды, или посредством пептидного синтеза, общепринятыми способами, используемыми специалистом в данной области. В соответствии с определенными вариантами осуществления взаимодействующая поверхность первого полипептида находится на домене Fc первого полипептида, а взаимодействующая поверхность второго полипептида находится на домен Fc второго полипептида.
Как указано выше, "альфа-МНС-Fc/ьета-МНС-Fc" представляет собой гетеродимер, содержащий первый полипептид и второй полипептид, где первый полипептид содержит α-цепь МНС класса II и домен Fc антитела; второй полипептид содержит β-цепь МНС класса II и домен Fc антитела. Альфа-МНС-Fc/бета-МНС-Fc с "выступом во впадину" дополнительно требует, чтобы домены Fc каждого полипептида взаимодействовали друг с другом посредством комплементарного расположения выпячивания на одном домене Fc в соответствующем углублении на другом домене Fc.
В соответствии с определенными вариантами осуществления изобретения конкретный антиген идентифицируют и презентируют в комплексе антиген-МНС-наночастица в контексте соответствующего полипептида МНС класса I или II. Презентация антигенов Т-клеткам опосредована двумя разными классами молекул, МНС класса I (MHC-I) и МНС класса II (МНС-II), для которых используются различные пути процессирования антигенов. Пептиды, происходящие из внутриклеточных антигенов, презентируются CD8+ Т-клеткам молекулами МНС класса I, которые экспрессированы практически на всех клетках, тогда как происходящие из внеклеточных антигенов пептиды презентируются CD4+ Т-клеткам молекулами МНС-II. Однако в этой дихотомии существуют определенные исключения. В нескольких исследованиях показано, что пептиды, происходящие из эндоцитированных частиц или растворимых белков, презентированы на молекулах MHC-I на макрофагах, а также на дендритных клетках. В соответствии с определенными аспектами для определения того, какой полипептид МНС следует использовать для конкретного пациента и конкретного набора пептидов можно оценивать генетический состав индивидуума. В соответствии с определенными вариантами осуществления компонент МНС класса I может содержать, в значительной степени состоять, или, альтернативно, еще более состоять из всей или части молекулы HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G или CD1. В вариантах осуществления, где компонент МНС представляет собой компонент МНС класса II, компонент МНС класса II может содержать, в значительной степени состоять, или, альтернативно, еще более состоять из всей или части HLA-DR, HLA-DQ или HLA-DP. В соответствии с определенными вариантами осуществления МНС может содержать HLA DRB1, HLA DRB3, HLA DRB4, HLA DRB5, HLA DQB1, HLA DQA1, I-Ag7, I-Ab, I-Ad, HLA-DQ, HLA-DP, HLA-A, HLA-B, HLA-C, HLA-E или CD1d.
Для применения в комплексах МНС по изобретению также предусмотрены неклассические молекулы МНС. В соответствии с определенными вариантами осуществления неклассические молекулы МНС являются неполиморфными, консервативными у различных видов и содержат узкие, глубокие, гидрофобные связывающие лиганд полости. Эти связывающие полости могут презентировать гликолипиды и фосфолипиды естественных киллерным Т (NKT) клеткам. Клетки NKT представляют собой уникальную популяцию лимфоцитов, которая коэкспрессирует маркеры NK клеток и полуинвариантный Т-клеточный рецептор (TCR). Они вовлечены в регулировку иммунного ответа, ассоциированного с широким диапазоном заболеваний.
Как указано выше, термин "МНС", когда его используют по отношению к МНС человека, можно использовать взаимозаменяемо с термином "лейкоцитарный антиген человека" (HLA); таким образом, МНС относится ко всем подтипам HLA, включая в качестве неограничивающих примеров классические гены МНС, описанные выше: HLA-А, HLA-B, HLA-C, HLA-DP, HLA-DQ и HLA-DR, а также все их варианты, изоформы, изотипы и другие биологические эквиваленты.
МНС для применения по настоящему изобретению можно получать, выделять или очищать известными в данной области способами. Общие протоколы получения МНС в качестве неограничивающих примеров включают такие этапы, как электрофорез или другие способы основанного на заряде или размере разделения, биотинилирование или другие способы мечения и очистку, или трансфекцию и индукцию векторных конструкций, экспрессирующих белки МНС. В коммерческих источниках также доступны очищенные антитела животных, включая таких ретейлеров, как eBioscience, Biolegend или Tonbo Biosciences.
В соответствии с определенными вариантами осуществления МНС комплексов антиген-МНС может представлять собой классический MHCI, неклассический MHCI, классический MHCII, неклассический MHCII, димеры (слияния посредством Fc), тетрамеры МНС или полимерные формы МНС. В соответствии с определенными вариантами осуществления мультимеры МНС получают способами, хорошо задокументированных в данной области, см., например, Bakker et al. "МНС Multimer Technology: Current Status and Future Prospects", Current Opinion in Immunology, Vol. 17, No. 4 pp. 428-433 (2005) и цитируемые в ней ссылки. Неограничивающие иллюстративные способы включают использование для связывания мономеров МНС биотинилирующего средства, в качестве неограничивающих примеров такого, как стрептавидин или авидин, получая мультимерную структуру с этим средством в качестве каркаса. Конкретно димеры МНС можно альтернативно получать посредством слияния с константными областями антител или Fc-областями; это можно проводить путем функционального связывания непосредственно или посредством линкера, например, цистеинового линкера.
Компоненты костимулирующих молекул
В соответствии с определенными аспектами NP дополнительно содержит, или, альтернативно, в значительной степени состоит, или даже более того, состоит по меньшей мере из одной костимулирующей молекулы. Костимулирующие молекулы представляют собой молекулы, которые in vivo продуцируют вторичный сигнал, который служит для активации наивных Т-клеток в антигенспецифичные Т-клетки, способные к осуществлению иммунного ответа на клетки, несущие указанный специфичный антиген. Настоящее изобретение не ограничено никакой конкретной костимулирующей молекулой. В данной области хорошо известны различные костимулирующие молекулы. Определенные неограничивающие примеры костимулирующих молекул представляют собой 4-IBBL, OX40L, CD40, IL-15/IL-15Ra, CD28, CD80, CD86, CD30L и ICOSL. С одной наночастицей может быть связана только одна конкретная костимулирующая молекула, или с одной наночастицей могут быть связаны несколько костимулирующих молекул. В соответствии с определенными вариантами осуществления костимулирующая молекула представляет собой белок, такой как антитело, способное к выступлению в роли агониста костимулирующего рецептора на Т-клетке. В этом случае антитело способно к индукции костимулирующего сигнала, который необходим для активации наивных Т-клеток и индукции иммунного ответа антигенспецифичным способом. Дополнительно или альтернативно, как используют в настоящем документе, термин "костимулирующая молекула" также может означать средство, способное к порождению костимулирующего сигнала, агонистически воздействуя на нативные костимулирующие сигнальные молекулы, например, антитело к CD28 или лиганд CD28, порождающие костимулирующий ответ CD28.
В соответствии с конкретными вариантами осуществления костимулирующие молекулы по настоящему изобретению могут представлять собой любую одну или несколько из следующих молекул: B7-1/CD80, BTLA, B7-2/CD86, CD28, B7-H1/PD-L1, CTLA-4, В7-Н2, GI24/VISTA/B7-H5, В7-Н3, ICOS, В7-Н4, PD-1, В7-Н6, PD-L2/B7-DC, В7-Н7, PDCD6, LILRA3/CD85e, LILRB2/CD85d/ILT4, LILRA4/CD85 г/ILT7, LILRB3/CD85a/ILT5, LILRB1/CD85j/ILT2, LILRB4/CD85k/ILT3, 4-1BB/TNFRSF9/CD137, лиганд GITR/TNFSF18, лиганд 4-1BB/TNFSF9, HVEM/TNFRSF14, BAFF/BLyS/TNFSF13B, LIGHT/TNFSF14, BAFFR/TNFRSF13C, лимфотоксин-альфа/TNF-бета, CD27/TNFRSF7, OX40/TNFRSF4, лиганд CD27/TNFSF7, лиганд OX40/TNFSF4, CD30/TNFRSF8, RELT/TNFRSF19L, лиганд CD30/TNFSF8, TACI/TNFRSF13B, CD40/TNFRSF5, TL1A/TNFSF15, CD40 лиганд/TNFSF5, TNF-альфа, DR3/TNFRSF25, TNFRII/TNFRSF1 В, GITR/TNFRSF18, 2B4/CD244/SLAMF4, CD84/SLAMF5, BLAME/SLAMF8, CD229/SLAMF3, CD2, CRACC/SLAMF7, CD2F-10/SLAMF9, NTB-A/SLAMF6, CD48/SLAMF2, SLAM/CD150, CD58/LFA-3, CD7, DPPIV/CD26, CD96, EphB6, CD160, интегрин альфа 4 бета 1, CD200, интегрин альфа 4 бета 7/LPAM-1, CD300a/LMIR1, LAG-3, CRTAM, TIM-1/KIM-1/HAVCR, DAP12, TIM-4, дектин-1/CLEC7A, TSLP R, ICOSL и/или их биологические эквиваленты.
Костимулирующую молекулу можно связывать с наночастицей таким же способом, как комплекс рМНС. В одном из вариантов осуществления настоящего изобретения костимулирующую молекулу и комплекс антиген/МНС связывают с наночастицей раздельно. В другом варианте осуществления изобретения сначала получают комплекс костимулирующей молекулы и комплекса рМНС, а затем получают их комплекс с наночастицей. С наночастицей можно связывать несколько костимулирующих молекул; они могут представлять собой несколько одинаковых костимулирующих молекул или несколько различных костимулирующих молекул. Как правило, полипептидные комплексы добавляют к наночастицам с получением наночастиц с адсорбированными или связанными полипептидными комплексами с отношением количество костимулирующих молекул: количество наночастиц приблизительно от 1 до 6000 молекул на наночастицу, или, альтернативно, по меньшей мере приблизительно или не более приблизительно 0,1, 0,5, 1, 10, 100, 500, 1000, 2000, 3000, 4000, 5000, 6000 или более: 1, и в диапазонах между ними, как правило, приблизительно от 0,1:1 до приблизительно 50:1. В соответствии с другим аспектом отношение костимулирующей молекулы и комплекса рМНС может составлять приблизительно 0,1, 0,5, 1, 2, 5, 10, 50 или более к 1, предпочтительно получают отношение костимулирующая молекула : комплекс рМНС 1:1, 1:2, 1:9, 1:10, 1:100, 2:1, 9:1, 10:1 или 100:1. Подобным образом, плотность костимулирующих молекул относительно площади поверхности наночастицы можно рассчитывать по той же относительной формуле, что и для комплексов рМНС. В соответствии с определенными вариантами осуществления плотность костимулирующей молекулы на единицу площади поверхности наночастицы составляет приблизительно от 0,0022 костимулирующих молекул/100 нм2 до приблизительно 13,26 костимулирующих молекул/100 нм2. В соответствии с определенными вариантами осуществления диапазон плотностей костимулирующих молекул может являться таким же или отличаться от диапазона плотностей комплексов рМНС.
В соответствии с определенными вариантами осуществления, где наночастица содержит одну или несколько костимулирующих молекул и не содержит комплекса рМНС, плотность костимулирующих молекул на наночастице составляет приблизительно 0,2 костимулирующих молекул/100 нм2 до приблизительно 6,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 5,8 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 5,75 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 5,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 3,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 1,25 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 1 костимулирующих молекул/100 нм2, или приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 0,75 костимулирующих молекул/100 нм2.
В соответствии с другим аспектом плотность костимулирующих молекул на наночастице может составлять приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 3,5 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 1 рМНС/100 нм2, или приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 0,75 костимулирующих молекул/100 нм2. В соответствии с определенными аспектами плотность костимулирующих молекул на сердцевине наночастице составляет приблизительно от 0,11 костимулирующих молекул/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2 или 0,12 костимулирующих молекул/100 нм2 до приблизительно 4,5 костимулирующих молекул/100 нм2, или приблизительно от 0,13 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,14 костимулирующих молекул/100 нм2 до приблизительно 3,5 костимулирующих молекул/100 нм2, или приблизительно от 0,12 костимулирующих молекул/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, или приблизительно от 0,25 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2, или приблизительно от 0,3 костимулирующих молекул/100 нм2 до приблизительно 0,75 костимулирующих молекул/100 нм2. В дополнительном аспекте, плотность костимулирующих молекул на сердцевине наночастице составляет приблизительно от 0,2 костимулирующих молекул/100 нм2 до приблизительно 0,65 костимулирующих молекул/100 нм2, или, альтернативно, приблизительно от 0,25 костимулирующих молекул/100 нм2 до приблизительно 0,45 костимулирующих молекул/100 нм2, или, альтернативно, приблизительно от 0,3 костимулирующих молекул/100 нм2 до приблизительно 0,4 костимулирующих молекул/100 нм2.
В соответствии с определенными вариантами осуществления, где наночастица содержит комплекс рМНС и одну или несколько костимулирующих молекул, плотность костимулирующих молекул на наночастице составляет приблизительно 0,4 костимулирующих молекул/100 нм2 до приблизительно 13 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 12 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 11,6 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 11,5 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 11 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 9 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 2,5 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 2 костимулирующих молекул/100 нм2, или приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2.
В соответствии с другим аспектом плотность костимулирующих молекул на наночастице может составлять приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 9 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 6 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 5 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2. В соответствии с определенными аспектами плотность костимулирующих молекул на сердцевине наночастице составляет приблизительно от 0,22 костимулирующих молекул/100 нм2 до приблизительно 10 костимулирующих молекул/100 нм2 или 0,24 костимулирующих молекул/100 нм2 до приблизительно 9 костимулирующих молекул/100 нм2, или приблизительно от 0,26 костимулирующих молекул/100 нм2 до приблизительно 8 костимулирующих молекул/100 нм2, или приблизительно от 0,28 костимулирующих молекул/100 нм2 до приблизительно 7 костимулирующих молекул/100 нм2, или приблизительно от 0,24 костимулирующих молекул/100 нм2 до приблизительно 4 костимулирующих молекул/100 нм2, или приблизительно от 0,5 костимулирующих молекул/100 нм2 до приблизительно 3 костимулирующих молекул/100 нм2, или приблизительно от 0,6 костимулирующих молекул/100 нм2 до приблизительно 1,5 костимулирующих молекул/100 нм2. В дополнительном аспекте плотность костимулирующих молекул на наночастице составляет приблизительно от 0,4 костимулирующих молекул/100 нм2 до приблизительно 1,3 костимулирующих молекул/100 нм2, или, альтернативно, приблизительно от 0,5 костимулирующих молекул/100 нм2 до приблизительно 0,9 костимулирующих молекул/100 нм2, или, альтернативно, приблизительно от 0,6 костимулирующих молекул/100 нм2 до приблизительно 0,8 костимулирующих молекул/100 нм2.
Цитокины
В соответствии с определенным аспектом NP дополнительно содержат, или, альтернативно, в значительной степени состоят, или еще более состоят по меньшей мере из одной молекулы цитокина. Как используют в настоящем документе, термин "цитокин" включает низкомолекулярные белки, секретируемые различными клетками иммунной системы, которые действуют в качестве сигнальных молекул, регулируя широкий диапазон биологических процессов в организме на молекулярном и клеточном уровнях. "Цитокины" включают отдельные иммуномодулирующие белки, которые попадают в классы лимфокинов, интерлейкинов или хемокинов.
В настоящем документе описаны неограничивающие примеры: например, IL-1A и IL-1B представляют собой два отдельных представителя семейства интерлейкина-1 (IL-1) человека. Зрелый IL-1A представляет собой белок массой 18 кДа, также известный как активирующий фибробласты фактор (FAF), активирующий лимфоциты фактор (LAF), активирующий В-клетки фактор (BAF), эндогенный медиатор лейкоцитов (LEM) и т.д. IL-4 представляет собой цитокин, который индуцирует дифференцировку клеток Т-хелперов 2 (Th2), и является близкородственным и обладает сходными функциями с IL-13. IL-5 продуцируют Th2-клетки и тучные клетки. Его действием является стимуляция роста В-клеток и увеличение секреции ими иммуноглобулина. Также он вовлечен в активацию эозинофилов. IL-6 представляет собой интерлейкин, который действует в качестве провоспалительного или противовоспалительного цитокина. Его секретируют Т-клетки и макрофаги для стимуляции иммунного ответа на травму или другое повреждение ткани, что приводит к воспалению. IL-6 также продуцируют мышцы в ответ на сокращение мышц. IL-8 представляет собой хемокин, продуцируемый макрофагами и другими типами клеток, такими как эпителиальные клетки и эндотелиальные клетки, и действующий в качестве важного медиатора иммунного ответа в ответе врожденной иммунной системы. IL-12 вовлечен в дифференцировку наивных Т-клеток в Т-хелперные (Th1 или Th2) клетки. Как гетеродимерный цитокин IL-12 формируется после того, как две субъединицы, кодируемые двумя разными генами, IL-12A (р35) и IL-12B (р40), димеризуются после синтеза белка. IL-12p70 указывает эту гетеродимерную композицию. IL-13, цитокин секретируемый многими типами клеток, особенно Th2-клетками, является важным медиатором аллергического воспаления и заболевания. IL-17 представляет собой цитокин, продуцируемый Т-хелперными клетками и индуцируемый IL-23, что приводит к деструктивному повреждению ткани в реакциях замедленного типа. IL-17 функционирует в качестве провоспалительного цитокина, который отвечает на инвазию иммунной системы внеклеточными патогенами и индуцирует разрушение клеточного матрикса патогена. IP-10, или индуцируемый интерфероном гамма белок 10, также известный как хемокин с С-Х-С мотивом 10 (CXCL10) или малый индуцибельный цитокин В10. Как небольшой цитокин, принадлежащий семейству СХС хемокинов, IP-10 секретируют несколько типов клеток (включая моноциты, эндотелиальные клетки и фибробласты) в ответ на IFN-γ. Воспалительные белки макрофагов (MIP) принадлежат к семейству хемокинов. Существуют две основных формы MIP человека, М1Р-1α и MIP-1β, которые также известны как лиганд хемокинов (с мотивом С-С) 3 (CCL3) и CCL4, соответственно. Оба продуцируют макрофаги после стимуляции бактериальными эндотоксинами. Гранулоцитарный колониестимулирующий фактор (G-CSF или GCSF), также известный как колониестимулирующий фактор 3 (CSF 3), представляет собой гормональный колониестимулирующий фактор. G-CSF представляет собой гликопротеин, фактор роста и цитокин, продуцируемый рядом различных тканей для стимуляции костного мозг для продукции гранулоцитов и стволовых клеток. G-CSF также стимулирует выживаемость, пролиферацию, дифференцировку и функцию предшественников нейтрофилов и зрелых нейтрофилов. Эпидермальный фактор роста или EGF представляет собой фактор роста, который играет важную роль в регуляции роста, пролиферации и дифференцировки клеток, связываясь с высокой аффинностью со своим рецептором EGFR. Фактор роста эндотелия сосудов (VEGF) представляет собой семейство факторов роста, которые представляют собой важные сигнальные белки, вовлеченные в васкулогенез (формирование циркуляторной системы эмбриона de novo) и ангиогенез (рост кровеносных сосудов из ранее существующей сосудистой системы).
Цитокин или цитокины можно связывать с наночастицей таким же способом, как комплекс рМНС. В одном из вариантов осуществления настоящего изобретения цитокин или цитокины и комплекс рМНС связывают с наночастицей раздельно. В другом варианте осуществления изобретения сначала получают комплекс молекулы цитокина или молекул цитокинов и комплекса рМНС, а затем получают их комплекс с наночастицей. С наночастицей можно связывать несколько цитокинов; могут представлять собой несколько молекул одинаковых цитокинов или различных цитокинов.
В соответствии с определенными вариантами осуществления проводят получение комплекса цитокина с антителом к цитокину с формированием комплекса цитокин/антитело к цитокину, который затем формируют в комплекс с наночастицей. В соответствии с определенными вариантами осуществления комплекс цитокин/антитело к цитокину в качестве неограничивающих примеров включает комплексы IL-2/антитело к IL-2. Комплексы IL-2/антитело к IL-2 могут обладать свойствами агониста или свойствами антагониста.
В соответствии с определенными вариантами осуществления проводят получение комплекса цитокин с рецептором цитокинов с формированием комплекса цитокин/рецептор цитокинов, который затем формируют в комплекс с наночастицей. В соответствии с определенными вариантами осуществления комплекс цитокин/рецептор цитокинов в качестве неограничивающих примеров включает IL15/IL-15Ra и/или IL-1/IL-2Ra. В соответствии с определенными вариантами осуществления комплекс IL15/IL-15Ra может функционировать в качестве костимулятора Т-клеток.
Как правило, полипептидные комплексы добавляют к наночастицам с получением наночастиц с адсорбированными или связанными полипептидными комплексами с отношением количество цитокинов:количество наночастиц приблизительно от 1 до 5999 молекул на наночастицу, или, альтернативно, по меньшей мере приблизительно или не более приблизительно 0,1, 0,5, 1, 10, 100, 500, 1000, 2000, 3000, 4000, 5000, 6000 или более: 1, и в диапазонах между ними, например, приблизительно от 0,1:1 до приблизительно 50:1. В соответствии с другими аспектами, отношение цитокина к комплексу антиген/МНС может составлять приблизительно 0,1, 0,5, 1, 2, 5, 10, 50 или более к 1, предпочтительно получают отношение цитокин : комплекс антиген/МНС 1:1, 1:2, 1:9, 1:10, 1:100, 2:1, 9:1, 10:1 или 100:1. Подобным образом, плотность цитокинов относительно площади поверхности наночастицы можно рассчитывать по той же относительной формуле, что и для комплексов антиген/МНС. В соответствии с определенными вариантами осуществления плотность цитокинов на единицу площади поверхности наночастицы составляет приблизительно от 0,0022 цитокинов/100 нм2 до приблизительно 13,26 цитокинов/100 нм2. В соответствии с определенными вариантами осуществления диапазон плотностей цитокинов может являться таким же или отличаться от диапазона плотностей комплексов антиген/МНС.
Антигенные компоненты
Определенные аспекты изобретения включают способы и композиции, относящиеся к антигенным композициям, включающим участки, фрагменты или эпитопы полипептидов, пептидов, нуклеиновых кислот, углеводов, липидов и других молекул, которые вызывают или индуцируют антигенный ответ, как правило, обозначаемых как антигены. В частности, можно идентифицировать и использовать в получении комплекса пептид-МНС/наночастица, описываемого в настоящем документе, аутоантигены или антигенные участки или фрагменты таких аутоантигенов, которые приводят к разрушению клетки посредством аутоиммунного ответа.
Хотя в настоящем документе описаны конкретные примеры антигенов и антигенных компонентов, изобретение ими не ограничено. Если конкретно не указано иначе, в настоящее изобретение включены эквиваленты выделенных или очищенных полипептидных антигенов, которые содержит, или в значительной степени состоят, или даже более того, состоят из аминокислотных последовательностей, как описано в настоящем документе, или полипептиды по меньшей мере приблизительно с 80% идентичностью последовательности, или, альтернативно, по меньшей мере с 85%, или, альтернативно, по меньшей мере с 90%, или, альтернативно, по меньшей мере с 95%, или, альтернативно, по меньшей мере с 98% идентичностью последовательности с аминокислотными последовательностями антигенов, или полипептиды, кодируемые полинуклеотидами приблизительно с 80% идентичностью последовательности, или, альтернативно, по меньшей мере с 85%, или, альтернативно, по меньшей мере с 90%, или, альтернативно, по меньшей мере с 95%, или, альтернативно, по меньшей мере с 98% идентичностью последовательности с полинуклеотидом, кодирующим аминокислотную последовательности антигена, или его комплементарным полинуклеотидом, или полипептид, кодируемый полинуклеотидом, который в условиях от средней до высокой жесткости гибридизуется с полинуклеотидом, кодирующим аминокислотную последовательность антигена, или его комплементарным полинуклеотидом. Также предоставлены выделенные и очищенные полинуклеотиды, кодирующие антигенные полипептиды, описываемые в настоящем документе, или аминокислоты по меньшей мере приблизительно с 80% идентичностью последовательности с ними, или, альтернативно, по меньшей мере с 85%, или, альтернативно, по меньшей мере с 90%, или, альтернативно, по меньшей мере с 95%, или, альтернативно, по меньшей мере с 98% идентичностью последовательности с описываемыми последовательностями, или эквиваленты, или полинуклеотиды, которые в жестких условиях гибридизуются с этими полинуклеотидами, их эквивалентами или комплементарными им полинуклеотидами и выделенные или очищенные полипептиды, кодируемые этими полинуклеотидами. Полипептиды и полинуклеотиды можно комбинировать с неприродными веществами, с которыми они не ассоциированы в природе, например, носителями, фармацевтически приемлемыми носителями, векторами и молекулами МНС.
Модифицированные пептиды и их эквиваленты
Антигенные полипептиды, белки и их фрагменты можно модифицировать посредством различных делеций, вставок и/или замен аминокислот. В соответствии с конкретными вариантами осуществления модифицированные полипептиды и/или пептиды способны к модуляции иммунного ответа у индивидуума. Как используют в настоящем документе, "белок", или "полипептид", или "пептид" относится к молекула, содержащей по меньшей мере пять аминокислотных остатков. В соответствии с определенными вариантами осуществления используют вариант белка или пептида дикого типа, однако во многих вариантах осуществления изобретения для получения комплекса пептид/МНС/наночастица используют модифицированный белок или полипептид. Комплекс пептид/МНС/наночастица можно использовать для стимуляции иммунного ответа и/или для модификации популяции Т-клеток иммунной системы (например, переобучения иммунной системы). Описанные выше термины в настоящем документе можно использовать взаимозаменяемо. "Модифицированный белок", или "модифицированный полипептид", или "модифицированный пептид" относятся к белку или полипептиду, химическая структура, в частности, аминокислотная последовательность, изменена относительно белка или полипептида дикого типа. В соответствии с определенными вариантами осуществления у модифицированных белка, или полипептида, или пептида модифицированы по меньшей мере один вид активности или функция (при понимании, что белки, или полипептиды, или пептиды могут обладать несколькими видами активности или функциями). Конкретно полагают, что у модифицированного белка, или полипептида, или пептида можно изменять один из видов активности или одну функцию, при этом сохраняя остальные виды активности или функции дикого типа, например, иммуногенность или способность взаимодействовать с другими клетками иммунной системы в контексте комплекса МНС/наночастица.
В соответствии с определенными вариантами осуществления длина белка или полипептида (дикого типа или модифицированного), включая любой комплекс представляющего интерес белка или пептида и, в частности, слияние МНС/пептид, в качестве неограничивающих примеров может составлять 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1750, 2000, 2250, 2500 аминомолекул или более, включая любой диапазон или значение, выводимые из них или их производные. В соответствии с определенными аспектами в качестве антигенов можно использовать 5, 6, 7, 8, 9, 10 или более непрерывных аминокислот, включая их производные, и фрагменты аутоантигенов, такие как аминокислотные последовательности, описанные и указанные в настоящем документе. Предусмотрено, что полипептиды можно изменять посредством укорочения, делая их короче, чем соответствующая им форма дикого типа, но их также можно изменять посредством слияния или конъюгации с гетерологичной последовательностью белка с конкретной функцией (например, для презентации в качестве белкового комплекса, для усиления иммуногенности и т.д.).
Как используют в настоящем документе, "аминомолекула" относится к любым аминокислоте, производному аминокислоты или миметику аминокислоты, известным в данной области. В соответствии с определенными вариантами осуществления остатки белковой молекулы являются последовательными без какой-либо не являющейся аминомолекулой молекулы, прерывающей последовательность остатков аминомолекул. В других вариантах осуществления последовательность может содержать одну или несколько не являющихся аминомолекулой молекул. В соответствии с конкретными вариантами осуществления последовательность остатков белковой молекулы может прерываться оной или несколькими не являющимися аминомолекулой молекулами.
Таким образом, термин "белковая композиция" включает последовательности аминомолекул, содержащие по меньшей мере одну из 20 стандартных аминокислот из синтезируемых в природе белков, или по меньшей мере одну модифицированную или нестандартную аминокислоту.
Белковые композиции можно получать любым способом, известным специалистам в данной области, включая (i) экспрессию белков, полипептидов или пептидов стандартными молекулярно-биологическими способами, (ii) выделение белковых соединений из природных источников или (iii) химический синтез белковых соединений. Нуклеотидные, а также белковые, полипептидные и пептидные последовательности для различных генов описаны ранее, и их можно найти в общепризнанных компьютеризированных базы данных. Примерами таких баз данных являются базы данных GenBank и GenPept Национального центра биотехнологической информации США (на сайте всемирной компьютерной сети ncbi.nlm.nih.gov/). Кодирующие области этих генов целиком или их части можно амплифицировать и/или экспрессировать способами, описываемыми в настоящем документе, или как известно специалистам в данной области.
Варианты аминокислотных последовательностей аутоантигенных эпитопов и других полипептидов этих композиций могут представлять собой варианты с заменами, вставками или делециями. Модификации в полипептиде по изобретению по сравнению с диким типом могут затрагивать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или более несмежных или смежных аминокислот пептида или полипептида. Для применения в способах по изобретению предусмотрены пептиды или полипептиды, которые вызывают аутоиммунный ответ, а особенно патологический аутоиммунный ответ.
Как правило, в вариантах с делецией отсутствует один или несколько остатков природной аминокислотной последовательности или аминокислотной последовательности дикого типа. Можно удалять отдельные остатки или можно удалять несколько последовательных аминокислот. Для получения укороченного белка в кодирующую последовательность нуклеиновой кислоты можно вводить стоп-кодон (посредством замещения или вставки). Как правило, инсерционные мутанты включают добавление материала в неконцевой участок полипептида. Это может включать вставку одного или нескольких остатков. Также можно получать белки с концевыми добавлениями, называемые слитыми белками.
Как правило, заместительные варианты включают замену одной аминокислоты на другую в одном или нескольких участках белка, и их можно конструировать для модуляции одного или нескольких свойств полипептида с потерей других функций или свойств или без. Замены могут являться консервативными, т.е. одну аминокислоту замещают аминокислотой со сходной формой и зарядом. Консервативные замены хорошо известны в данной области и включают, например, замены: аланина на серин; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутаминат; цистеина на серин; глутамина на аспарагин; глутамината на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фенилаланина на тирозин, лейцин или метионин; серина на треонин; треонина на серин; триптофана на тирозин; тирозина на триптофан или фенилаланин и валина на изолейцин или лейцин. Альтернативно, замены могут являться неконсервативными, такими, что затрагиваются функция или активность полипептида или пептида, такие как авидность или аффинность к клеточному рецептору(ам). Как правило, неконсервативные замены включают замену остатка на остаток, который является химически несходным, например, замену полярной или заряженной аминокислоты на неполярную или незаряженную аминокислоту и наоборот.
Белки по изобретению могут являться рекомбинантными или синтезированными in vitro. Альтернативно, рекомбинантный белок можно выделять из бактерий или других клеток-хозяев.
Термин "функционально эквивалентный кодон" используют в настоящем документе для обозначения кодонов, которые кодируют одну и ту же аминокислоту, таких как шесть кодонов для аргинина или серина, а также относится к кодонам, которые кодируют биологически эквивалентные аминокислоты (см. таблицу 2).
Также следует понимать, что последовательности аминокислот и нуклеиновых кислот могут содержать дополнительные остатки, такие как дополнительные N- или С-концевые аминокислоты, или 5'- или 3'-последовательности нуклеиновой кислоты, соответственно, и, однако, оставаться значимыми, как указано в одной из последовательностей описываемых в настоящем документе, при условии, что последовательность удовлетворяет критериям, указанным выше, включая сохранение биологической активности белка (например, иммуногенности). Добавление концевых последовательностей особенно применимо для последовательностей нуклеиновых кислот, которые могут, например, содержать различные некодирующие последовательности, фланкирующие любой из 5'- или 3'-участков кодирующей области.
Ассоциированные с заболеваниями антигены
Наночастицы пригодны в терапевтических способах, как описано в настоящем документе. Комплекс рМНС из pMHC-NP выбран для применения на основе подлежащего лечению заболевания. Например, ассоциированный с диабетом антиген представляет собой антиген или его фрагмент, который экспрессирован в клетке, ткани или органе, поражаемых этим аутоиммунным заболеванием, и на который при повреждении клетки, ткани или органа, вызываемом аутоиммунным ответом, действует иммунная система, даже если антиген не является инициирующим патологический процесс фактором или ключевым участником в его патогенезе, и при его презентации формируется иммунный ответ, который служит для лечения диабета; таким образом, для лечения диабета выбирают ассоциированный с диабетом антиген, удовлетворяющий этому определению. Для лечения PC выбирают ассоциированный с PC антиген. Ассоциированный с диабетом антиген не выбирают для лечения PC. В настоящем документе описаны неограничивающие иллюстративные ассоциированные с заболеваниями антигены, и, кроме того, такие антигены можно определять для конкретного заболевания способами, хорошо описанными в литературе.
Неограничивающие примеры представляющих интерес заболеваний включают, но не ограничиваются ими, астму, сахарный диабет I типа и II типа, преддиабет, рассеянный склероз, периферическую нейропатию, аллергическую астму, первичный биллиарный цирроз, цирроз печени, нейромиелит зрительного нерва со спектральным расстройством, ассоциированные с аутоантителами неврологические синдромы, такие как синдром мышечной скованности, аутоиммунный энцефалит, нарколепсию, обыкновенную пузырчатку, эксфолиативную пузырчатку, псориаз, болезнь/синдром Шегрена, воспалительное заболевание кишечника (IBD), артрит, ревматоидный артрит, системную красную волчанку (SLE), склеродермию, ассоциированный с ANCA васкулит, синдром Гудпасчера, болезнь Кавасаки, глютеновую болезнь, аутоиммунную кардиомиопатию, идиопатическую дилатационную кардиомиопатию (IDCM), миастению gravis, аутоиммунный Увеит, анкилозирующий спондилит, болезнь Грейва, иммуноопосредованные миопатии, антифосфолипидный синдром (ANCA+), атеросклероз, аутоиммунный гепатит, склерозирующий холангит, первичный склерозирующий холангит, дерматомиозит, хроническое обструктивное заболевание легких, повреждение спинного мозга, травматическое повреждение, индуцированное табаком разрушение легких, эмфизему, пузырчатку, увеит, любую другую соответствующую злокачественную опухоль и/или заболевания центральной и периферической нервных систем.
Ассоциированные со злокачественными опухолями/опухолями антигены
В соответствии с определенными аспектами ассоциированный с заболеванием антиген представляет собой ассоциированный со злокачественной опухолью антиген. В дополнительных аспектах злокачественная опухоль представляет собой карциному, саркому, миелому, лейкоз, лимфому и/или метастазы смешанных типов этих или других злокачественных опухолей. Иллюстративные ассоциированные со злокачественными опухолями или опухолями антигены в качестве неограничивающих примеров включают антигены, перечисленные в приводимой ниже таблице 5.




Другие ассоциированный со злокачественными опухолями антигены включают антигены, приведенные в таблицах онлайн базы данных http://cancerimmunity.org/peptide/ и включенные в настоящий документ в качестве ссылки, последняя ссылка 6 мая 2015 года.
Ассоциированные с аутоиммунными заболеваниями антигены
В соответствии с определенными аспектами ассоциированный с заболеванием антиген, содержащийся в комплексе антиген-МНС, выбран из ассоциированного с аутоиммунным заболеванием антигена, ассоциированного с воспалением антигена или ассоциированного с аллергическим заболеванием антигена. В дополнительных аспектах ассоциированный с иммунным воспалением антиген представляет собой один или несколько антигенов, выбранных из группы ассоциированного с астмой антигена, ассоциированного с диабетом антигена, ассоциированного с преддиабетом антигена, ассоциированного с рассеянным склерозом антигена, ассоциированного с аллергической астмой антигена, ассоциированного с первичным биллиарным циррозом антигена, ассоциированного с циррозом антигена, ассоциированного с нейромиелитом зрительного нерва со спектральным расстройством (болезнь Девика, NMO) антигена, ассоциированного с аутоиммунным энцефалитом антигена, ассоциированного с опосредованным аутоантителами неврологическим синдромом антигена, ассоциированного с синдромом мышечной скованности антигена, ассоциированного с паранеопластическим синдромом антигена, ассоциированных с другими заболеваниями центральной и периферической нервных систем антигенов, ассоциированного с обыкновенной пузырчаткой антигена, ассоциированного с воспалительным заболеванием кишечника (IBD) антигена, ассоциированного с болезнью Крона антигена, ассоциированного с язвенным колитом антигена, ассоциированного с артритом антигена, ассоциированного с ревматоидным артритом антигена, ассоциированного с системной красной волчанкой (SLE) антигена, ассоциированного с глютеновой болезнью антигена, ассоциированного с псориазом антигена, ассоциированного с очаговой алопецией антигена, ассоциированного с приобретенной тромбоцитопенической пурпурой антигена, ассоциированного с аутоиммунной кардиомиопатией антигена, ассоциированного с идиопатической дилатационной кардиомиопатией (IDCM) антигена, ассоциированного с миастенией gravis антигена, ассоциированного с увеитом антигена, ассоциированного с анкилозирующим спондилитом антигена, ассоциированного с заболеванием Грейва антигена, ассоциированного с тиреоидитом Хашимото антигена, ассоциированного с иммуноопосредованными миопатиями антигена, ассоциированного с антифосфолипидным синдромом (ANCA+) антигена, ассоциированного с атеросклерозом антигена, ассоциированного со склеродермией антигена, ассоциированного с аутоиммунным гепатитом антигена, ассоциированного с дерматомиозитом антигена, ассоциированного с хроническим обструктивным заболеванием легких антигена, ассоциированного с повреждением спинного мозга антигена, ассоциированного с травматическим повреждением антигена, ассоциированного с индуцированным табаком разрушением легких антигена, ассоциированного с хроническим обструктивным заболеванием легких (COPD) антигена, ассоциированного с эмфиземой легких антигена, ассоциированного со склерозирующим холангитом антигена, ассоциированного с периферической нейропатией антигена, ассоциированного с нарколепсией антигена, ассоциированного с синдромом Гудпасчера антиген, а ассоциированного с болезнью Кавасаки антигена, ассоциированного с аутоиммунным увеитом антигена, ассоциированного с колитом антигена, ассоциированного с эмфиземой антигена, ассоциированного с пузырчаткой антигена, ассоциированного с листовидной пузырчаткой антигена, ассоциированного с артритом антигена, ассоциированного с синдромом Шегрена антигена, ассоциированного с ассоциированным с ANCA васкулитом антигена, ассоциированного с первичным склерозирующим холангитом антигена, ассоциированного с воспалением жировой ткани/диабетом II типа антигена или ассоциированных с ассоциированным с ожирением воспалением жировой ткани/резистентностью к инсулину антигенов.
В соответствии с определенными аспектами ассоциированный с заболеванием антиген получают из одного или нескольких из группы: PPI, IGRP, GAD, периферии, aGlia, PDC-E2, инсулин, DG1EC2, DG3, AQP4, PLP, MOG, МВР, CII, DERP1, DERP2, OVA, BacInt, CBir, Fla-X, Fla-2, YIDX, AChR, пероксидаза щитовидной железы, рецептор щитовидной железы, фосфолипидный антиген, Н4, Н2В, H1, ДНК, АроВ, АроЕ, NMDAR, потенциалозависимый калиевый канал, эластин, аррестин, миелопероксидаза PERM_HUMAN, миелобластин PRTN3_HUMAN, цитохром Р450 2D6 CP2D6_HUMAN, O-фосфосерил-тРНК(Sec)-селентрансфераза SPCS_HUMAN, противомикробный пептид кателицидин CAMP_HUMAN, ДНК топоизомераза I, CENP-C, бета-2-гликопротеин 1 APOH_HUMAN, рибонуклеопротеин SS-A/Ro массой 60 кДа RO60_HUMAN, волчаночный белок La LA_HUMAN, IRBP, миозин, связывающие CD1d липидные антигены, Сар18, CP2D6, SPCS, RO60, RO52, LA, АРОН, МРО, PRTN3 или HSP.
В соответствии с определенными вариантами осуществления ассоциированный с заболеванием антиген представляет собой:
a) ассоциированный с диабетом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: препроинсулин (PPI), специфичная для островков глюкозо-6-фосфатаза (IGRP), глутаминатдекарбоксилаза (GAD), аутоантиген клеток островков 2 (ICA2), инсулин, проинсулин или фрагмент или эквивалент любого из них;
b) ассоциированный с рассеянным склерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: основной белок миелина, ассоциированный с миелином гликопротеин, белок миелина олигодендроцитов, протеолипидный белок, олигопротеин миелина олигодендроцитов, основный ассоциированный с миелином белок олигодендроцитов, специфичный для олигодендроцитов белок, белки теплового шока, специфичные для олигодендроцитов белки, NOGO А, гликопротеин Ро, периферический белок миелина 22, 3'-фосфодиэстераза 2'3'-циклических нуклеотидов или фрагмент или эквивалент любого из них;
c) ассоциированный с глютеновой болезнью антиген, и его получают из глиадина или его фрагмента или эквивалента;
d) ассоциированный с первичным биллиарным циррозом антиген, и его получают из PDC-E2 или его фрагмента или эквивалента;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DG1, DG3 или фрагмент или эквивалент любого из них;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, и его получают из AQP4 или его фрагмента или эквивалента;
g) ассоциированный с артритом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: белки теплового шока, связывающий иммуноглобулины белок, гетерогенные ядерные РНП, аннексии V, кальпастатин, коллаген II типа, глюкозо-6-фосфатизомераза, фактор элонгации хряща человека gp39, связывающий маннозу лектин, цитруллинированный виментин, коллаген II типа, фибриноген, альфа-енолаза, антитела к карбамилированным белкам (антитела к CarP), пептидиларгининдезиминаза 4 типа (PAD4), BRAF, гамма-цепь фибриногена, тяжелая цепь интер-альфа-ингибитора трипсина H1, альфа-1-антитрипсин, ингибитор плазматической протеазы С1, гельзолин, гликопротеин альфа-1-В, церулоплазмин, тяжелая цепь интер-альфа-ингибитора трипсина Н4, фактор комплемента Н, альфа-2-макроглобулин, сывороточный амилоид, С-реактивный белок, сывороточный альбумин, бета-цепь фибриногена, серотрансферрин, альфа-2-гликопротеин HS, виментин, компонент комплемента С3 или фрагмент или эквивалент любого из них;
h) ассоциированный с аллергической астмой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DERP1, DERP2 или фрагмент или эквивалент любого из них;
i) ассоциированный с воспалительным заболеванием кишечника антиген, и его получают из антигена, выбранного из одного или нескольких из группы: флагеллин, Fla-2, Fla-X, YIDX, интеграза бактероидов или фрагмент или эквивалент любого из них;
j) ассоциированный с системной красной волчанкой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: двухцепочечная (дц)ДНК, рибонуклеопротеин (РНП), Smith (Sm), ассоциированный с синдромом Шегрена антиген A (SS-A)/Ro, ассоциированный с синдромом Шегрена антиген В (SS-B)/La, RO60, R052, гистоны или фрагмент или эквивалент любого из них;
k) ассоциированный с атеросклерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: АроВ, АроЕ или фрагмент или эквивалент любого из них;
l) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, и его получают из эластина или его фрагмента или эквивалента;
m) ассоциированный с псориазом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: Сар 18, ADMTSL5, ATL5 или фрагмент или эквивалент любого из них;
n) ассоциированный с аутоиммунным гепатитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CYP2D6, SLA или фрагмент или эквивалент любого из них;
о) ассоциированный с увеитом антиген, и его получают из аррестина или его фрагмента или эквивалента;
р) ассоциированный с синдромом Шегрена антиген, и его получают из антигена, выбранного из одного или нескольких из группы: (SS-A)/Ro, (SS-B)/La, MR3, RO60, RO52 или фрагмент или эквивалент любого из них;
q) ассоциированный со склеродермией антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CENP-C, TOP 1, РНК-полимераза III или фрагмент или эквивалент любого из них;
г) ассоциированный с антифосфолипидным синдромом антиген, и его получают из АРОН или его фрагмента или эквивалента;
s) ассоциированный с ассоциированным с ANCA васкулитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: МРО, PRTN3 или фрагмент или эквивалент любого из них; или
t) ассоциированный с синдромом мышечной скованности антиген, и его получают из GAD или его фрагмента или эквивалента.
Ассоциированные с диабетом антигены
Ассоциированные с диабетом антигены в качестве неограничивающих примеров включают антигены, получаемые из PPI, IGRP, GAD, аутоантигена клеток островков 2 (ICA2) и/или инсулина. Аутореактивные ассоциированные с диабетом антигенные пептиды в качестве неограничивающих примеров включают пептиды, перечисленные в приводимой ниже таблице 6, приведенные в дополнение к пептидам и белкам, описанным в публикации США 2005/0202032, полностью включенной в настоящий документ в качестве ссылки, а также эквиваленты и/или комбинации каждого из них.


Ассоциированные с PC антигены
Антигены по изобретению включают антигены, ассоциированные с рассеянным склерозом. Такие антигены включают, например, антигены, описанные в публикации патентной заявки США №2012/0077686, и антигены, получаемые из основного белка миелина, ассоциированного с миелином гликопротеина, белка миелина олигодендроцитов, протеолипидного белка, олигопротеина миелина олигодендроцитов, основного ассоциированного с миелином белка олигодендроцитов, специфичного для олигодендроцитов белка, белков теплового шока, специфичных для олигодендроцитов белков NOGO А, гликопротеина Ро, периферического белка миелина 22 или 3'-фосфодиэстеразы 2'3'-циклических нуклеотидов. В соответствии с определенными вариантами осуществления антиген получают из олигонедроцитарного гликопротеина миелина (MOG).
В дополнительных аспектах пептидные антигены для лечения PC и связанных с PC нарушений в качестве неограничивающих примеров включают антигены, перечисленные в таблице 7, а также эквиваленты и/или комбинации каждого из них:


Ассоциированные с глютеновой болезнью (CD) антигены
Ассоциированные с глютеновой болезнью антигены в качестве неограничивающих примеров включают антигены, получаемые из глиадина. В соответствии с определенными вариантами осуществления неограничивающие типы глиадина включают альфа/бета-глиадин, γ-глиадин или ω-глиадин. Другиеие неограничивающие иллюстративные ассоциированные с глютеновой болезнью антигены включают антигены, перечисленные в таблице 8, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с первичным биллиарным циррозом (РВС) антигены
Ассоциированные с первичным биллиарным циррозом антигены в качестве неограничивающих примеров включают антигены, получаемые из PDC-E2. Неограничивающие примеры иллюстративных антигенов включают антигены, перечисленные в таблице 9, а также эквиваленты и/или комбинации каждого из них.
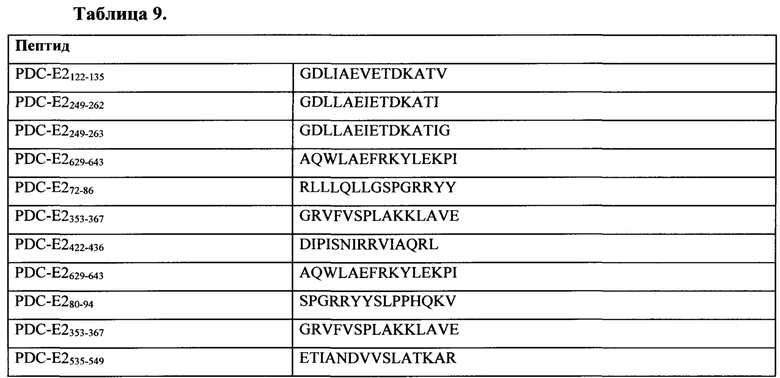
Ассоциированные с листовидной пузырчаткой (PF) и обыкновенной пузырчаткой (PV) антигены
Ассоциированные с PF и PV антигены в качестве неограничивающих примеров включают антигены, получаемые из десмоглеина 3 (DG3) и/или десмоглеина 1 (DG1). Неограничивающие примеры включают антигены, перечисленные в таблице 10, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с нейромиелитом зрительного нерва со спектральным расстройством (NMO) антигены
Ассоциированные с антигены NMO в качестве неограничивающих примеров включают антигены, получаемые из AQP4 или аквапорина 4. Неограничивающие примеры включают антигены, перечисленные в таблице 11, а также эквиваленты и/или комбинации каждого из них.


Ассоциированные с артритом антигены
Ассоциированные с артритом антигены в качестве неограничивающих примеров включают антигены, получаемые из белков теплового шока, связывающего иммуноглобулины белка, гетерогенных ядерных РНП, аннексина V, кальпастатина, коллагена II типа, глюкозо-6-фосфатизомеразы, фактора элонгации хряща человека gp39, связывающего маннозу лектина, цитруллинированного виментина, коллагена II типа, фибриногена, альфа-енолазы, антител к карбамилированным белкам (anti-CarP), пептидиларгининдезиминаз 4 типа (PAD4), BRAF, гамма-цепи фибриногена, тяжелой цепи интер-альфа-ингибитора трипсина H1, альфа-1-антитрипсина, ингибитора плазматической протеазы С1, гельзолина, гликопротеина альфа-1-В, церулоплазмина, тяжелой цепи интер-альфа-ингибитора трипсина Н4, фактора комплемента Н, альфа-2-макроглобулина, сывороточного амилоида, С-реактивного белка, сывороточного альбумина, бета-цепи фибриногена, серотрансферрина, альфа-2-гликопротеина HS, виментина, компонента комплемента С3 или фрагмента или эквивалента любого из них.
Ассоциированные с аллергической астмой антигены
Ассоциированные с аллергической астмой антигены в качестве неограничивающих примеров включают антигены, получаемые из DERP1 и DERP2. Неограничивающие примеры включают антигены, перечисленные в таблице 12, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с воспалительным заболеванием кишечника антигены
Ассоциированные с воспалительным заболеванием кишечника антигены в качестве неограничивающих примеров включают ассоциированные с болезнью Крона антигены и ассоциированные с язвенным колитом антигены. В соответствии с определенными вариантами осуществления ассоциированные с воспалительным заболеванием кишечника антигены в качестве неограничивающих примеров включают антигены, получаемые из интегразы бактероидов, флагеллина, флагеллина 2 (Fla-2/Fla-X), или неохарактеризованного белка Е. coli (YIDX). Неограничивающие примеры включают антигены, перечисленные в таблице 13, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с системной красной волчанкой (SLE) антигены
Ассоциированные со SLE антигены в качестве неограничивающих примеров включают антигены, получаемые из Н4, Н2 В, Н1', дцДНК, РНП, Smith (Sm), ассоциированного с синдромом Шегрена антигена A (SS-A)/Ro, ассоциированного с синдромом Шегрена антигена В (SS-B)/La и/или гистонов. В соответствии с определенными вариантами осуществления SS-A в качестве неограничивающих примеров включает RO60 и RO52. В соответствии с определенными вариантами осуществления гистоны включают, но не ограничены ими, Н4, Н2 В, Н1'. Неограничивающие примеры включают антигены, перечисленные в таблице 14, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с атеросклерозом антигены
Ассоциированные с атеросклерозом антигены в качестве неограничивающих примеров включают антигены, получаемые из аполипопротеина В (АроВ) или аполипопротеина Е (АроЕ). Неограничивающие примеры включают антигены, перечисленные в таблице 15, а также эквиваленты и/или комбинации каждого из них.

Ассоциированные с хроническим обструктивным заболеванием легких (COPD) и/или эмфиземой антигены
Ассоциированные с COPD и/или эмфиземой антигены в качестве неограничивающих примеров включают антигены, получаемые из эластина. Неограничивающие примеры включают антигены, перечисленные в таблице 16, а также эквиваленты и/или комбинации каждого из них.
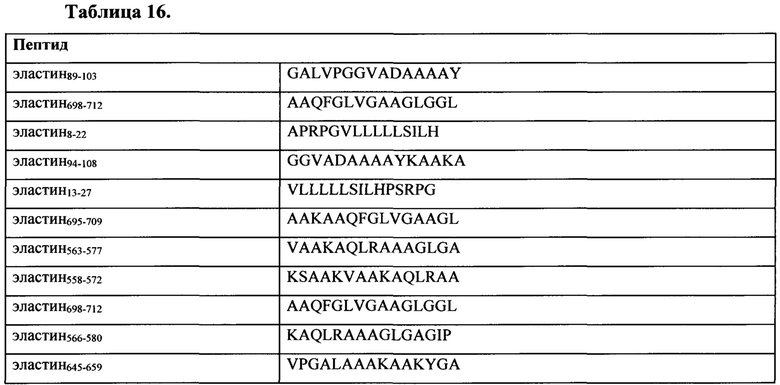
Ассоциированные с псориазом антигены
Ассоциированные с псориазом антигены в качестве неограничивающих примеров включают антигены, перечисленные в приводимой ниже таблице 17, а также эквиваленты и/или их сочетания. Другие неограничивающие иллюстративные ассоциированные с псориазом антигены можно получать из подобного adamis белка 5 человека (ATL5), противомикробного пептида кателицидина (CAP 18) и/или подобного ADAMTS белка 5 (ADMTSL5).
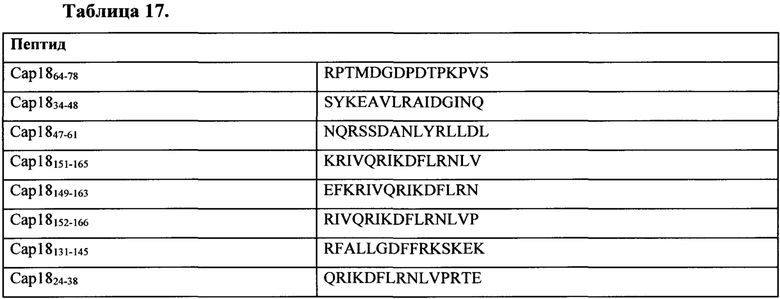

Ассоциированные с аутоиммунным гепатитом антигены
Ассоциированные с аутоиммунным гепатитом антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 18, а также эквиваленты и/или их сочетания. Другие неограничивающие иллюстративные ассоциированные с аутоиммунным гепатитом антигены можно получать из микросомального цитохрома P450IID6 (CYP2D6) и/или растворимого антигена печени (SLA).
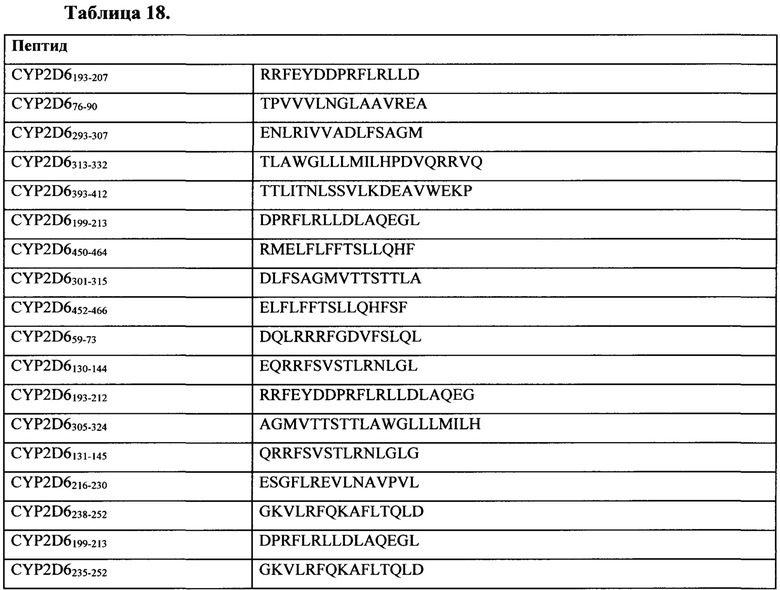

Ассоциированные с увеитом антигены
Ассоциированные с увеитом антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 19, а также эквиваленты и/или их сочетания. Другие неограничивающие иллюстративные ассоциированные с увеитом антигены можно получать из аррестина, ретинального S-антигена человека и/или межфоторецепторного ретинол-связывающего белка (IRBP).


Ассоциированные с синдромом Шегрена антигены
Ассоциированные с синдромом Шегрена антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 20, а также эквиваленты и/или их сочетания. Другие неограничивающие иллюстративные ассоциированные с синдромом Шегрена антигены можно получать из (SS-A)/Ro, (SS-B)/La, RO60, RO52 и/или мускаринового рецептора 3 (MR3).


Ассоциированные со склеродермией антигены
Ассоциированные со склеродермией антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 21, а также эквиваленты и/или их сочетания. Неограничивающие иллюстративные ассоциированные со склеродермией антигены можно получать из центромерного аутоантигенного белка С (CENP-C), ДНК-топоизомеразы I (TOP1) и/или РНК-полимеразы III. 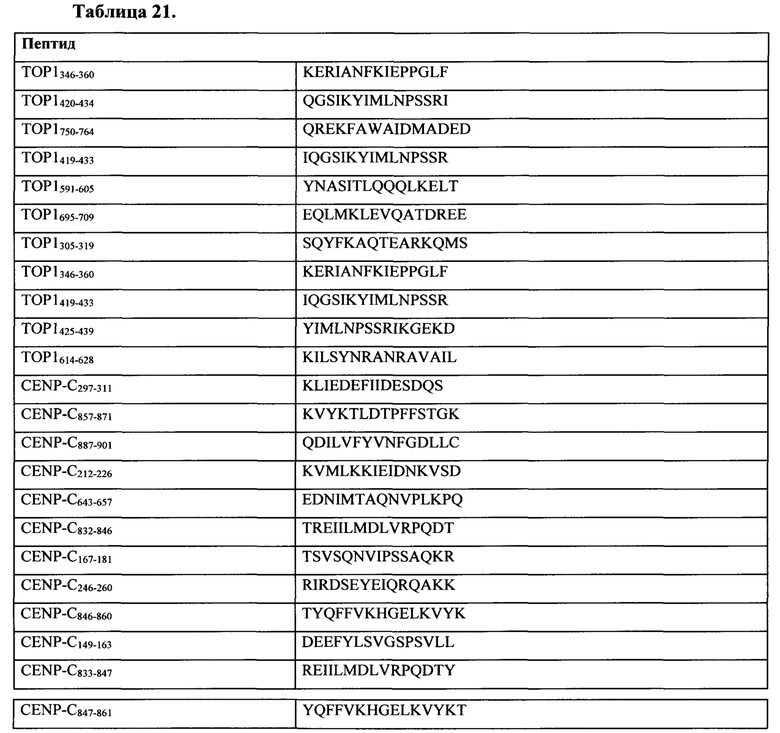
Ассоциированные с антифосфолипидным синдромом антигены
Ассоциированные с антифосфолипидным синдромом антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 22, а также эквиваленты и/или их сочетания. Неограничивающие иллюстративные ассоциированные с антифосфолипидным синдромом антигены можно получать из бета-2-гликопротеина 1 (BG2P1 или АРОН).
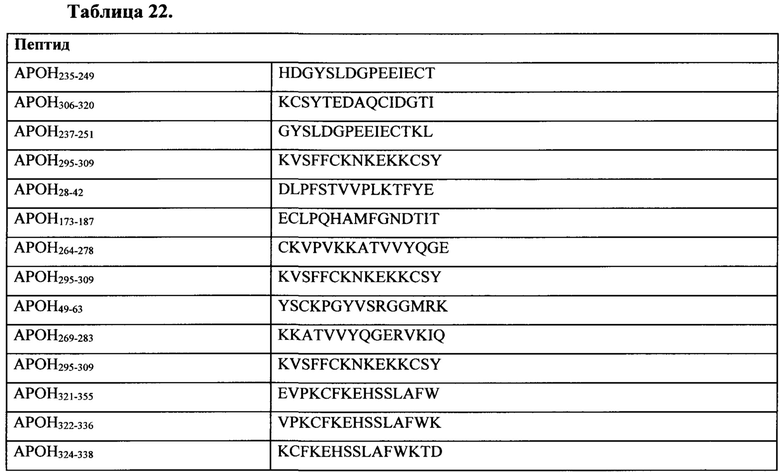
Ассоциированные с ассоциированным с ANCA васкулитом антигены
Ассоциированные с ассоциированным с ANCA васкулитом антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 23, а также эквиваленты и/или их сочетания. Неограничивающие иллюстративные ассоциированные с ассоциированным с ANCA васкулитом антигены можно получать из миелопероксидазы (МРО), протеиназы (PRTN3) или бактериального увеличивающего проницаемость фактора (BPI).


Ассоциированные с синдромом мышечной скованности антигены
Ассоциированные с синдромом мышечной скованности антигены в качестве неограничивающих примеров включают антигены, описанные в приводимой ниже таблице 24, а также эквиваленты и/или их сочетания. Неограничивающие иллюстративные ассоциированные с синдромом мышечной скованности антигены можно получать из глутаминатдекарбоксилазы (GAD). В соответствии с определенными вариантами осуществления GAD в качестве неограничивающих примеров включает GAD65.

Предусмотрено, что в композициях по изобретению, всего в композиции содержится приблизительно от 0,001 мг до приблизительно 10 мг общего белка на мл. Таким образом, концентрация белка в композиции может составлять приблизительно, по меньшей мере приблизительно или не максимум приблизительно 0,001, 0,010, 0,050, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 50, 100 мкг/мл или мг/мл или более (или любой получаемый из них диапазон). Из него приблизительно, по меньшей мере приблизительно, или максимум приблизительно 1, 2, 3, 4, 5,6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% может составлять комплекс пептид/МНС/наночастица.
По настоящему описанию предусмотрено введение комплекса пептид/МНС/наночастица для проведения диагностики, лечения или профилактики развития заболевания или состояния, ассоциированного с аутоиммунным ответом или злокачественной опухолью.
Кроме того, в патенте США №4554101 (Норр), включенном в настоящий документ в качестве ссылки, описаны идентификация и получение эпитопов из первичных аминокислотных последовательностей на основании гидрофильности. Описываемыми в Норр способами специалист в данной области может идентифицировать потенциальные эпитопы в аминокислотной последовательности и подтвердить их иммуногенность. Также прогнозированию вторичной структуры и идентификации эпитопов на основе анализа аминокислотных последовательностей посвящено множество научных публикаций (Chou & Fasman, 1974a,b; 1978a,b; 1979). При желании, для дополнения описания Норр в патенте США №4554101 можно использовать любую из них.
Другие антигенные компоненты
В качестве антигенов или антигенных фрагментов в комплексе с молекулами МНС можно использовать молекулы, отличающиеся от пептидов. Такие молекулы в качестве неограничивающих примеров включают углеводы, липиды, низкомолекулярные соединения и т.п.Углеводы являются основными компонентами внешней поверхности множества клеток. Определенные углеводы являются характеристикой различных стадий дифференцировки и очень часто эти углеводы распознают конкретные антитела. Экспрессия конкретных углеводов может быть ограничена конкретными типами клеток. Показано, что ответ аутоантителами на эндометриальные и сывороточные антигены является общим признаком эндометриоза. Ответ сывороточными аутоантителами при эндометриозе описан на ряд ранее идентифицированных антигенов, включая 2- гликопротеин Гереманс-Шмида и карбоангидразу, которая является специфичной для углеводного эпитопа.
Неограничивающие, иллюстративные комплексы антиген-МНС
В соответствии с определенными вариантами осуществления для лечения конкретного заболевания можно оптимизировать конкретные комбинации антигена и МНС. Неограничивающие примеры включают, но не ограничиваются ими, следующие примеры:
Для лечения диабета I типа, антиген комплекса рМНС можно получать из антигенов группы: PPI76-90(K88S), IGRP13-25, GAD555-567, GAD555-567(5571), IGRP23-35, В24-С36, PPI76-90 или фрагмент или эквивалент любого из них, и МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DRB1*0401/DRA, HLA-DRB1*0301/DRA или фрагмент или эквивалент любого из них.
В соответствии с определенными вариантами осуществления антиген комплекса рМНС содержит:
a) ассоциированный с диабетом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: препроинсулин (PPI), специфичная для островков глюкозо-6-фосфатаза (IGRP), глутаминатдекарбоксилаза (GAD), аутоантиген клеток островков 2 (ICA2), инсулин, проинсулин или фрагмент или эквивалент любого из них;
b) ассоциированный с рассеянным склерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: основной белок миелина, ассоциированный с миелином гликопротеин, белок миелина олигодендроцитов, протеолипидный белок, олигопротеин миелина олигодендроцитов, основный ассоциированный с миелином белок олигодендроцитов, специфичный для олигодендроцитов белок, белки теплового шока, специфичные для олигодендроцитов белки, NOGO А, гликопротеин Ро, периферический белок миелина 22, 3'-фосфодиэстераза 2'3'-циклических нуклеотидов или фрагмент или эквивалент любого из них;
c) ассоциированный с глютеновой болезнью антиген, и его получают из глиадина или его фрагмента или эквивалента;
d) ассоциированный с первичным биллиарным циррозом антиген, и его получают из PDC-E2 или его фрагмента или эквивалента;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DG1, DG3 или фрагмент или эквивалент любого из них;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, и его получают из AQP4 или его фрагмента или эквивалента;
g) ассоциированный с артритом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: белки теплового шока, связывающий иммуноглобулины белок, гетерогенные ядерные РНП, аннексин V, кальпастатин, коллаген II типа, глюкозо-6-фосфатизомераза, фактор элонгации хряща человека gp39, связывающий маннозу лектин, цитруллинированный виментин, коллаген II типа, фибриноген, альфа-енолаза, антитела к карбамилированным белкам (антитела к CarP), пептидиларгининдезиминаза 4 типа (PAD4), BRAF, гамма-цепь фибриногена, тяжелая цепь интер-альфа-ингибитора трипсина H1, альфа-1-антитрипсин, ингибитор плазматической протеазы С1, гельзолин, гликопротеин альфа-1-В, церулоплазмин, тяжелая цепь интер-альфа-ингибитора трипсина Н4, фактор комплемента Н, альфа-2-макроглобулин, сывороточный амилоид, С-реактивный белок, сывороточный альбумин, бета-цепь фибриногена, серотрансферрин, альфа-2-гликопротеин HS, виментин, компонент комплемента С3 или фрагмент или эквивалент любого из них;
h) ассоциированный с аллергической астмой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DERP1, DERP2 или фрагмент или эквивалент любого из них;
i) ассоциированный с воспалительным заболеванием кишечника антиген, и его получают из антигена, выбранного из одного или нескольких из группы: Флагеллин, Fla-2, Fla-X, YIDX, интеграза бактероидов или фрагмент или эквивалент любого из них;
j) ассоциированный с системной красной волчанкой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: двухцепочечная (дц)ДНК, рибонуклеопротеин (РНП), Smith (Sm), ассоциированный с синдромом Шегрена антиген A (SS-A)/Ro, ассоциированный с синдромом Шегрена антиген В (SS-B)/La, RO60, RO52, гистоны или фрагмент или эквивалент любого из них;
k) ассоциированный с атеросклерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: АроВ, АроЕ или фрагмент или эквивалент любого из них;
l) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, и его получают из эластина или его фрагмента или эквивалента;
m) ассоциированный с псориазом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: Сар18, ADMTSL5, ATL5 или фрагмент или эквивалент любого из них;
n) ассоциированный с аутоиммунным гепатитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CYP2D6, SLA или фрагмент или эквивалент любого из них;
о) ассоциированный с увеитом антиген, и его получают из аррестина или его фрагмента или эквивалента;
р) ассоциированный с синдромом Шегрена антиген, и его получают из антигена, выбранного из одного или нескольких из группы: (SS-A)/Ro, (SS-B)/La, MR3, RO60, RO52 или фрагмент или эквивалент любого из них;
q) ассоциированный со склеродермией антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CENP-C, TOP 1, РНК-полимераза III или фрагмент или эквивалент любого из них;
r) ассоциированный с антифосфолипидным синдромом антиген, и его получают из АРОН или его фрагмента или эквивалента;
s) ассоциированный с ассоциированным с ANCA васкулитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: МРО, PRTN3 или фрагмент или эквивалент любого из них; или
t) ассоциированный с синдромом мышечной скованности антиген, и его получают из GAD или его фрагмента или эквивалента.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть белка классического МНС класса I, белка неклассического МНС класса I, белка классического МНС класса II, белка неклассического МНС класса II, димеры МНС (слияния посредством Fc), тетрамеры МНС или полимерную форму белка МНС, где белок МНС необязательно содержит "выступ во впадину" на основе гетеродимера или мультимера альфа-МНС-Fс/бета-МНС-Fс.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA DR, HLA DQ, HLA DP, HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, CD1d или фрагмент или эквивалент любого из них.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DQ, HLA-DP или фрагмент или эквивалент любого из них.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DRB1/DRA, HLA-DRB3/DRA, HLA-DRB4/DRA, HLA-DRB5/DRA, HLA-DQA1/HLA-DQB1, HLA-DPB1/HLA-DPA1 или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС содержит:
а) ассоциированный с диабетом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15-23, PPI76-90 (K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, В24-С36, PPI76-90, INS-I9, TUM, G6Pase, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-С1, проинсулинB27-С5, проинсулинC20-28, проинсулинC25-33, проинсулинC29-А5, проинсулинA1-10, проинсулинA2-10, проинсулинА12-20 или фрагмент или эквивалент любого из них;
b) ассоциированный с рассеянным склерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, МВР110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, MPB111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент любого из них;
c) ассоциированный с глютеновой болезнью антиген, получаемый из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или фрагмент или эквивалент любого из них;
d) ассоциированный с первичным биллиарным циррозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-E280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент любого из них;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455, DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент любого из них;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, получаемый из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент любого из них;
g) ассоциированный с аллергической астмой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2 107-121 или фрагмент или эквивалент любого из них;
h) ассоциированный с воспалительным заболеванием кишечника антиген, получаемый из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактероидов183-197, антиген интегразы бактероидов146-160, антиген интегразы бактероидов175-189, антиген интегразы бактероидов1-15, антиген интегразы бактероидов183-197, антиген интегразы бактероидов30-44, антиген интегразы бактероидов70-84, антиген интегразы бактероидов337-351, антиген интегразы бактероидов171-185, антиген интегразы бактероидов4-18, антиген интегразы бактероидов256-270, Fla-2/Fla-Х366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX90-94, YIDX101-115 или фрагмент или эквивалент любого из них;
i) ассоциированный с системной красной волчанкой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Н471-94, Н474-88, Н476-90, Н475-89, Н478-92, Н480-94, Н2В10-24, H2B16-30, H1'22-42, H1'27-41 или фрагмент или эквивалент любого из них;
j) ассоциированный с атеросклерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АроВ3501-3516, АроВ1952-1966, АроВ978-993, АроВ3498-3513, АроВ210А, ApoB210B, ApoB210C или фрагмент или эквивалент любого из них;
k) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент любого из них;
l) ассоциированный с псориазом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Сар1864-78, Сар1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент любого из них;
m) ассоциированный с аутоиммунным гепатитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: (CYP2D6)193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-185, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент любого из них;
n) ассоциированный с увеитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент любого из них;
о) ассоциированный с синдромом Шегрена антиген, получаемый из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426-440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент любого из них;
р) ассоциированный со склеродермией антиген, получаемый из антигена, выбранного из одного или нескольких из группы: ТОР1346-360, ТОР1420-434, TOP1750-764, TOP1419-433, TOP1591-605, ТОР1695-709, ТОР1305-319, ТОР1346-360, ТОР1419-433, ТОР1425-439, ТОР1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, CENP-C643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент любого из них;
q) ассоциированный с антифосфолипидным синдромом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АРОН235-249, АРОН306-320, АРОН237-251, АРОН295-309, АРОН28-42, APOH173-187, APOH264-278, АРОН295-309, АРОН49-63, АРОН269-283, АРОН295-309, АРОН321-355, АРОН322-336, АРОН324-338 или фрагмент или эквивалент любого из них;
r) ассоциированный с ассоциированным с ANCA васкулитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: МРO506-520, МРО302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, МРО616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент любого из них; или
s) ассоциированный с синдромом мышечной скованности антиген, получаемый из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311 или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС содержит:
а) ассоциированный с диабетом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15-23, PPI76-90(K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, В24-С36, РРI76-90, INS-19, TUM, G6Pase, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-C1, проинсулинB27-C5, проинсулинC20-28, проинсулинC25-33, проинсулинC29-A5, проинсулинА1-10, проинсулинА2-10, проинсулинА12-20 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
b) ассоциированный с рассеянным склерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, МВР110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, MPB111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент любого из них, и белок МЫС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
c) ассоциированный с глютеновой болезнью антиген, получаемый из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DQ или его фрагмент или эквивалент;
d) ассоциированный с первичным биллиарным циррозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-Е280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455, DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, получаемый из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
g) ассоциированный с аллергической астмой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2107-121 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DP или фрагмент или эквивалент любого из них;
h) ассоциированный с воспалительным заболеванием кишечника антиген, получаемый из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактероидов183-197, антиген интегразы бактероидов146-160, антиген интегразы бактероидов175-189, антиген интегразы бактероидов1-15, антиген интегразы бактероидов183-197, антиген интегразы бактероидов30-44, антиген интегразы бактероидов70-84, антиген интегразы бактероидов337-351, антиген интегразы бактероидов171-185, антиген интегразы бактероидов4-18, антиген интегразы бактероидов256-270, Fla-2/Fla-Х366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX80-94, YIDX101-115 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
i) ассоциированный с системной красной волчанкой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Н471-94, Н474-88, Н476-90, Н475-89, Н478-92, Н480-94, Н2В10-24, H2B16-30, H1'22-42, H1'27-41 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: I-Ad, HLA-DR или фрагмент или эквивалент любого из них;
j) ассоциированный с атеросклерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АроВ3501-3516, ApoB1952-1966, ApoB978-993, АроВ3498-3513, АроВ210А, ApoB210B, ApoB210C или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть I-Ab или его фрагмент или эквивалент;
k) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
l) ассоциированный с псориазом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Сар1864-78, Сар1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
m) ассоциированный с аутоиммунным гепатитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: CYP2D6193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-185, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
n) ассоциированный с увеитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
о) ассоциированный с синдромом Шегрена антиген, получаемый из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426-440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DP или фрагмент или эквивалент любого из них;
р) ассоциированный со склеродермией антиген, получаемый из антигена, выбранного из одного или нескольких из группы: ТОР1346-360, ТОР1420-434, ТОР1750-764, TOP1419-433, ТОР1591-605, ТОР1695-709, ТОР1305-319, ТОР1346-360, ТОР1419-433, ТОР1425-439, ТОР1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, CENP-C643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
q) ассоциированный с антифосфолипидным синдромом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АРОН235-249, АРОН306-320, АРОН237-251, АРОН295-309, АРОН28-42, АРОН173-187, АРОН264-278, АРОН295-309, АРОН49-63, АРОН269-283, АРОН295-309, АРОН321-355, АРОН322-336, АРОН324-338 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
r) ассоциированный с ассоциированным с ANCA васкулитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MPO506-520, МРО302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, МРО616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент; или
s) ассоциированный с синдромом мышечной скованности антиген, получаемый из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DQ или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС предназначен для лечения:
a) диабета I типа, и комплекс рМНС выбран из группы
PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA.DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA, B24-C36-HLA-DRB1*0301/DRA или PPI76-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс рМНС выбран из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, MPB111-129-HLA-DRB5*0101/DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-HLA-DRB3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеновой болезни, и комплекс рМНС выбран из группы: aGlia57-68-HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72-HLA-DQA1*0501/HLA-DQB1*0201, aGlia217-229-HLA-DQA1*0501/HLA-DQB1*0302 или aGlia217-229-HLA.DQA1*03/HLA-DQB1*0302;
d) первичного биллиарного цирроза, и комплекс рМНС выбран из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA или PDC-E2535-549-HLA-DRB5*0101/DRA, mPDC-E2166-181-I-Ag7 или mPDC-E282-96-I-Ag7;
e) листовидной пузырчатки и/или обыкновенной пузырчатки, и комплекс рМНС выбран из группы: DG1216-229-HLA-DRB 1*0101/DRA, DG1216-229-HLA-DRB1*0102/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4*0101/DRA, DG3367-381-HLA-DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс рМНС выбран из группы: AQP4129-143-HLA-DRB1*0101/DRA, AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB1*1501/DRA;
g) аллергической астмы, и комплекс рМНС выбран из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30-HLA-DRB1*1501/DRA, DERP1171-185-HLA-DRB1*1501/DRA, DERP-1110-124-HLA-DPB1*0401/DRA, DERP-226-40-HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс рМНС выбран из группы: антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов146-160-HLA-DRB3*0101/DRA, антиген интегразы бактероидов175-189-НLА-DRB3*0101/DRA, антиген интегразы бактероидов1-15-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197- HLA-DRB3*0101/DRA, антиген интегразы бактероидов30-44-HLA-DRB5*0101/DRА, антиген интегразы бактероидoв70-84-HLA-DRB4*0101/DRA, антиген интегразы бактероидов337-351-HLA-DRB4*0101/DRA, антиген интегразы бактероидов171-185-HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/DRA, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380-HLA-DRB3*0101/DRA, Fla-2/Fla-X164-178-HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275-HLA-DRB5*0101/DRA, Fla-2/Fla-X1-15-HLA-DRB5*0101/DRA, Fla-2/Fla-X51-65-HLA-DRB4*0101/DRA, Fla-2/Fla-X269-283-HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0202/DRA, Fla-2/Fla-X271-285-HLA-DRB3*0202/DRA, YIDX78-92-HLA-DRB3*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX93-107-HLA-DRB3*0101/DRA, YIDX98-112-HLA-DRB5*0101/DRA, YIDX23-37-HLA-DRB5*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX195-209-HLA-DRB4*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) COPD и/или эмфиземы, и комплекс рМНС выбран из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин8-22-HLA-DRB5*0101/DRA, эластин94-108-HLA-DRB5*0101/DRA, эластин13-27-HLA-DRB4*0101/DRA, эластин695-709-HLA-DRB4*0101/DRA, эластин563-577-HLA-DRB4*0101/DRA, эластин558-572-HLA-DRB4*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс рМНС выбран из группы: Сар1864-78-HLA-DRB3*0101/DRA, Cap1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA-DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс рМНС выбран из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA- DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс рМНС выбран из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс рМНС выбран из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60358-372-HLA-DRB4*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB4*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB4*0101/DRA, RO60407-421-HLA-DRB4*0101/DRA, RO60407-421-HLA-DQA1*0501/HLA-DQB1*0201, RO60459-473-HLA-DRB4*0101/DRA, RO60459-473-HLA-DQA1*0501/HLA-DQB1*0201, RO60318-332-HLA-DQA1*0501/HLA-DQB1*0201, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA- DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA297-311-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DRB4*0101/DRA, LA151-165-HLA-DQA1*0501/HLA-DQB1*0201, LA151-165-HLA-DRB4*0101/DRA, LA297-311-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс рМНС выбран из группы: ТОР1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, TOP1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101/DRA, CENP-C887-901-HLA-DRB3*0101/DRA, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, CENP-C832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA или CENP-C847-861-HLA-DRB3*0202/DRA;
о) антифосфолипидного синдрома, и комплекс рМНС выбран из группы: АРОН235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, APOH173-187-HLA-DRB4*0101/DRA, APOH264-278-HLA-DRB4*0101/DRA, APOH295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
p) ассоциированного с ANCA васкулита, и комплекс рМНС выбран из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLA-DRB3*-0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178- HLA-DRB4*0101/DRA, PRTN371-85-HLA-DRB4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA, PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA; или
q) синдрома мышечной скованности, и комплекс рМНС выбран из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA или GAD297-311-HLA-DRB1*0301/DRA.
В соответствии с определенными аспектами комплекс рМНС предназначен для лечения:
a) диабета I типа, и комплекс рМНС выбран из группы
PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA.DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA или PPI76-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс рМНС выбран из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, МРВ111-129-HLA-DRB5*0101/DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-НLА-DRВ3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеновой болезни, и комплекс рМНС выбран из группы: aGlia57-68-HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72-HLA-DQA1*0501/HLA-DQB1*0201 или aGlia217-229-HLA-DQA1*0501/HLA-DQB1*0302;
d) первичного биллиарного цирроза, и комплекс рМНС выбран из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA или PDC-E2535-549-HLA-DRB5*0101/DRA;
e) листовидной пузырчатки и/или обыкновенной пузырчатки, и комплекс рМНС выбран из группы: DG1216-229-HLA-DRB1*0101/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4*0101/DRA, DG3367-381-HLA- DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс рМНС выбран из группы: AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB14501/DRA;
g) аллергической астмы, и комплекс рМНС выбран из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30-HLA-DRB1*1501/DRA, DERP1171-185-HLA-DRB1*1501/DRA, DERP-1110-124-HLA-DPB1*0401/DRA, DERP-226-40-HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс рМНС выбран из группы: антиген интегразы бактероидов1-15-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов70-84-HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/ВКА, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380-HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0101/DRA, Fla-2/Fla-X51-65-HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X26l-275-HLA-DRB5*0202/DRA, Fla-2/Fla-X271-285-HLA-DRB3*0202/DRA, YIDX78-92-HLA-DRB3*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX98-112-HLA-DRB5*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) эмфиземы, и комплекс рМНС выбран из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин558-572-HLA-DRB4*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс рМНС выбран из группы: Сар1864-78-HLA-DRB3*0101/DRA, Cap 1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA-DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс рМНС выбран из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA-DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс рМНС выбран из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс рМНС выбран из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA-DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс pMHC выбран из группы: TOP1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, TOP1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101, CENP-C887-901-HLA-DRB3*0101, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, CENP-C832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA или CENP-C847-861-HLA-DRB3*0202/DRA;
о) антифосфолипидного синдрома, и комплекс pMHC выбран из группы: АРОН235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, APOH173-187-HLA-DRB4*0101/DRA, APOH264-278-HLA-DRB4*0101/DRA, APOH295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
p) ассоциированного с ANCA васкулита, и комплекс pMHC выбран из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLADRB3*0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178-HLA-DRB4*0101/DRA, PRTN371-85-HLA-DRB4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA, PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA; или
q) синдрома мышечной скованности, и комплекс рМНС выбран из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA или GAD297-311-HLA-DRB1*0301/DRA.
Также можно подобным образом оптимизировать выбор костимулирующих молекулы или молекул для связывания с комплексом pMHC/NP и это в основном зависит от характера популяции иммуноцитов, дифференцировка или размножение которых требуется. Например, если целью является размножение и дифференцировка популяций регуляторных Т-клеток, соответствующие комбинации в качестве неограничивающих примеров могут включать такие костимулирующие молекулы и цитокины, как IL15-IL15Ra, IL-2, IL-10, IL-35, ICOS-L, комплекс IL2/mAb к IL2, TGF-бета, IL-21, ITE или ICOSL. В отличие от этого, В соответствии с определенными вариантами осуществления, таких как при определенных типах злокачественных опухолей, размножение и/или дифференцировка Т-клеток с регуляторным фенотипом может не являться требуемы ответом. Таким образом, для конкретного лечения можно оптимизировать альтернативные костимулирующие молекулы и цитокины.
Способы получения наночастиц и комплексов
МНС и наночастицы можно получать рядом способов. Приводимое ниже является исключительно иллюстративным.
МНС
Для получения комплексов МНС класса I предоставлены два иллюстративных способа. Первый включает рефолдинг тяжелых и легких цепей МНС класса I, которые экспрессируют в бактериях в присутствии пептида, с последующей очистки посредством гель-фильтрации и анионообменной хроматографии, как описано в литературе (Garboczi, D.N. et al. (1992) Proc Natl. Acad Sci USA 89:3429-3433; Altman, J.D. et al. (1996) Science 274:94-96). Второй включает экспрессию комплексов МНС класса I на высоких уровнях в трансдуцированных лентивирусами клетках СНО FreeStyle в виде одноцепочечных конструкций, в которых кодирующая пептид последовательность, легкая и тяжелая цепи МНС класса I последовательно связаны подвижными линкерами GS (Yu, Y.Y. et al. (2002) J. Immunol. 168:3145-3149) с последующим С-концевым линкером, кодирующим участок BirA, метку 6×His, оканчивающуюся свободным Cys. Секретируемые белки выделяют из супернатантов культур с использованием колонок с никелем и анионообменной хроматографии и используют непосредственно для покрытия NP или биотинилируют для получения тетрамеров рМНС с использованием конъюгированного с флуорохромом стрептавидина. Тетрамеры, получаемые с использованием соответствующих одноцепочечных комплексов рМНС, кодирующих аутоантигенный пептид IGRP206-214 или его миметик NRP-V7, эффективно связываются с распознающими моноклональными аутореактивными CD8+ Т-клетками, но не с их поликлональными вариантами, как определяют посредством проточной цитометрии.
Рекомбинантные мономеры рМНС класса II можно выделять из клеток SC2 Drosophila, трансфицированных конструкциями, кодирующими цепи I-Aβ и I-Аα, несущие лейциновые застежки с-Jun или c-Fos, соответственно, и метки BirA и 6×His, как описано ранее (Stratmann, Т. et al. (2000) J. Immunol. 165:3214-3225, Stratmann, Т. et al. (2003) J. Clin. Invest. 112:3214-3225). Так как выходы этого подхода, как правило, являются низкими, и он занимает много времени, заявитель разработал экспрессирующую систему в клетках СНО FreeStyle, трансдуцированных лентивирусами, кодирующими моноцистронный транскрипт, в котором пептидные цепи IAβ и IAα комплекса разделены последовательностью перескока рибосомы Р2А (Holst, J. et al. (2006) Nat Protoc 1:406-417). Как и для одноцепочечных конструкций рМНС класса I, описанных выше, на С-конец конструкции добавляют линкер, кодирующий участок BirA, метку 6×His и свободный Cys. Самособирающиеся комплексы рМНС класса II выделяют из супернатантов культур клеток посредством хроматографии с никелем с последующей анион-обменной хроматографией и используют для нанесения на NP или обрабатывают для биотинилирования и формирования тетрамеров, как описано выше. Тетрамеры рМНС класса II, получаемые с использованием соответствующего комплекса рМНС класса II, кодирующего аутоантигенный пептид 2.5mi специфически и эффективно связываются с распознающими моноклональными аутореактивными CD4+ Т-клетками, как определяют посредством проточной цитометрии.
Конъюгированные с РЕ тетрамеры можно получать с использованием биотинилированных мономеров рМНС, как описано (Stratmann, Т. et al. (2000) J. Immunol. 165:3214-3225; Stratmann, Т. et al. (2003) J. Clin. Invest. 112:3214-3225; Amrani, A. et al. (2000) Nature 406:739-742). Мононуклеарные клетки периферической крови, спленоциты и CD8+ или CD4+ Т-клетки лимфоузлов можно окрашивать тетрамером (5 мкг/мл) в буфере для FACS (0,1% азид натрия и 1% FBS в PBS) в течение 1 часа при 4°С, отмывать и инкубировать с конъюгированными с FITC антителами к CD8α или к CD4 (5 мкг/мл) и конъюгированными с PerCP антителами к В220 (2 мкг/мл; в качестве "бессмысленного" окна) в течение 30 мин при 4°С. Клетки отмывают, фиксируют в 1% PFA/PBS и анализируют посредством FACS.
Синтез NP
Наночастицы можно формировать посредством контакта водной фазы, содержащей костимулирующую молекулу(ы), комплекс рМНС и/или цитокин, и полимерной и неводной фазы с последующим выпариванием неводной фазы, обеспечивая связывание частиц из водной фазы, как указано в патентах США №№4589330 или 4818542. Определенные полимеры для такого получения представляют собой природные или синтетические сополимеры или полимеры, которые включают желатиновый агар, крахмал, арабиногалактан, альбумин, коллаген, полигликолевую кислоту, полимолочную кислоту, гликолид-L(-)-лактид поли(эксилон-капролактон, поли(эпсилон-капролактон-СО-молочная кислота), поли(эпсилон-капролактон-СО-гликолевая кислота), поли(β-гидроксимасляная кислота), поли(этиленоксид), полиэтилен, поли(алкил-2-цианоакрилат), поли(гидроксиэтил метакрилат), полиамиды, поли(аминокислоты), поли(2-гидроксиэтил-DL-аспартамид), поли(сложный эфир мочевины), поли(L-фенилаланин/этиленгликоль/1,6-диизоцианатогексан) и поли(метилметакрилат). Конкретно, определенные полимеры представляют собой сложные полиэфиры, такие как полигликолевая кислота, полимолочная кислота, гликолид-L(-)-лактид-поли(эксилон-капролактон), поли(эпсилон-капролактон-СО-молочная кислота) и поли(эпсилон-капролактон-СО-гликолевая кислота). Растворители, пригодные для растворения полимера включают: воду, гексафторизопропанол, метиленхлорид, тетрагидрофуран, гексан, бензол или сесквигидрат гексафторацетона.
Золотые наночастицы (GNPs) синтезируют с использованием химического восстановления хлорида золота цитратом натрия, как описано (Perrault, S.D. et al. (2009) Nano Lett 9:1909-1915). В кратком изложении, 2 мл 1% HAuCl4 (Sigma Aldrich) добавляют в 100 мл H2O при интенсивном перемешивании и раствор нагревают в масляной бане. К кипящему раствору HAuCl4 добавляют шесть (для 14 нм GNP) или два (для 40 нм GNP) мл 1% цитрата Na, перемешивают в течение дополнительных 10 мин, а затем охлаждают до комнатной температуры. GNP стабилизируют, добавлением 1 мкМ линкеров тиол-PEG (Nanocs, MA) функционализированных группами -СООН или -NH2 в качестве акцепторов МНС. Пегилированные GNP отмывают водой для удаления свободного тиол-PEG, концентрируют и хранят в воде для дальнейшего анализа. Плотность NP определяют посредством спектрофотометрии и рассчитывают по закону Бера.
Также можно получать NP из оксида железа серии SFP (IONP SFP) посредством термического разрушения ацетата железа в органических растворителях в присутствии поверхностно-активных веществ, преобразуя затем растворитель в водные буферы посредством пегилирования (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014; Xu, C. et al. (2007) Polymer International 56:821-826). В кратком изложении, 2 мМ Fe(AcAc)3 (Sigma Aldrich, Oakville, ON) растворяют в 10 мл смеси простого бензилового эфир и олеиламина и нагревают до 100°С в течение 1 часа с последующими 300°С в течение 2 часов с кипячением с обратным холодильником под защитой азотной подушки. Синтезированные NP осаждают посредством добавления этанола и ресуспендируют в гексане. Для пегилирования IONP 100 мг различных 3,5 кДа линкеров DPA-PEG (Jenkem Tech USA) растворяют в смеси CHCl3 и HCON(СН3)2 (диметилформамид (DMF)). Затем к раствору DPA-PEG добавляют раствор NP (20 мг Fe) и перемешивают в течение 4 часов при комнатной температуре. Пегилированные NP SFP осаждают в течение ночи посредством добавления гексана, а затем ресуспендируют в воде. Следов количества агрегатов удаляют посредством высокоскоростного центрифугирования (20000×g, 30 мин), и монодисперсные NP SFP хранят в воде для дальнейшей характеристики и конъюгации с рМНС. Концентрацию железа в продуктах IONP определяют посредством спектрофотометрии при А410 в 2Н HCL. На основе молекулярной структуры и диаметра NP SFP (Fe3O4; 8±1 нм диаметр) (Xie, J. et al. (2007) Adv Mater 19:3163; Xie, J. et al. (2006) Pure Appl. Chem. 78:1003-1014) заявитель рассчитывает, что растворы SFP, содержащие 1 мг железа, содержат 5×1014 NP.
Наночастицы также можно получать посредством термического разрушения или нагревания предшественника наночастиц. В одном из вариантов осуществления наночастица представляет собой наночастицу из металла или оксида металла. В одном из вариантов осуществления наночастица представляет собой наночастицу из оксида железа. В одном из вариантов осуществления наночастица представляет собой наночастицу из золота. В одном из вариантов осуществления в настоящем документе предоставлены наночастицы, получаемые в соответствии с технологией по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предоставлен способ получения наночастицы из оксида железа, включающий реакцию термического разрушения ацетилацетоната железа. В одном из вариантов осуществления получаемые наночастицы из оксида железа являются водорастворимыми. В одном из аспектов наночастицы из оксида железа подходят для конъюгации с белком. В одном из вариантов осуществления способ включает одноэтапную реакцию термического разрушения.
В одном из аспектов термическое разрушение происходит в присутствии функционализированных молекул PEG. Определенные неограничивающие примеры функционализированных линкеров PEG приведены в таблице 1.
В одном из аспектов термическое разрушение включает нагревание ацетилацетоната железа. В одном из вариантов осуществления термическое разрушение включает нагревание ацетилацетоната железа в присутствии функционализированных молекул PEG. В одном из вариантов осуществления термическое разрушение включает нагревание ацетилацетоната железа в присутствии простого бензилового эфира и функционализированных молекул PEG.
Практически, в одном из вариантов осуществления функционализированные молекулы PEG используют в качестве восстанавливающих реагентов и в качестве поверхностно-активных веществ. Способ получения наночастиц, предоставленный в настоящем документе упрощает и улучшает общепринятые способы, в которых используют поверхностно-активные вещества, которые трудно замещать, или невозможно заместить полностью, молекулами PEG, делая частицы водорастворимыми. Как правило, поверхностно-активные вещества могут быть дорогостоящими (например, фосфолипиды) или токсичными (например, олеиновая кислота или олеиламин). В соответствии с другим аспектом, способ получения наночастиц практически устраняет необходимость использования общепринятых поверхностно-активных веществ, таким образом, обеспечивая достижение высокой степени молекулярной чистоты и водорастворимости.
В одном из вариантов осуществления термическое разрушение включает ацетилацетонат железа и простой бензиловый эфир и в отсутствие общепринятых поверхностно-активных веществ, отличных от тех, что используют по настоящему документу.
В одном из вариантов осуществления температура для термического разрушения составляет приблизительно от 80°С до приблизительно 300°С, или приблизительно от 80°С до приблизительно 200°С, или приблизительно от 80°С до приблизительно 150°С, или приблизительно от 100°С до приблизительно 250°С, или приблизительно от 100°С до приблизительно 200°С, или приблизительно от 150°С до приблизительно 250°С или приблизительно от 150°С до приблизительно 250°С. В одном из вариантов осуществления термическое разрушение проводят в течение периода приблизительно от 1 до приблизительно 2 часов.
В одном из вариантов осуществления способ получения наночастицы из оксида железа включает этап очистки, например, с использованием магнитной колонки LS Miltenyi Biotec.
В одном из вариантов осуществления наночастицы являются стабильными приблизительно при 4°С в фосфатно-солевом буфере (PBS) без каких либо детектируемых разрушения или агрегации. В одном из вариантов осуществления наночастицы являются стабильными в течение по меньшей мере 6 месяцев.
В одном из аспектов в настоящем документе предоставлен способ получения комплексы наночастиц, включающий приведение рМНС в контакт с наночастицами из оксида железа, предоставленными по настоящему документу. Практически, в рМНС на его С-конце закодирован цистеин, который может реагировать с малеинимидной группой в функционализированном PEG приблизительно при от рН 6,2 до приблизительно рН 6,5 в течение приблизительно от 12 до приблизительно 14 часов.
В одном из аспектов способ получения комплексов наночастиц включает этап очистки, например, с использованием магнитной колонки LS Miltenyi Biotec.
Нанесение покрытия на наночастицы
В соответствии с определенными аспектами комплекс антиген-МНС, и/или цитокин, и/или костимулирующую молекулу можно связывать с сердцевиной наночастицы одним или несколькими из ковалентного связывания, нековалентного связывания или связывания посредством поперечных сшивок и необязательно связывать посредством линкера. В дополнительных аспектах размер линкера может составлять менее 5 кДа, и он необязательно представляет собой полиэтиленгликоль. В аспектах, включающих линкер или линкеры, линкеры на одной сердцевине наночастицы могут являться одинаковыми или отличаются друг от друга.
Для связывания субстрата или частиц комплексами антиген-МНС, и/или цитокинами, и/или костимулирующими молекулами можно использовать приводимые ниже способы.
Связывание можно проводить посредством химической модификации субстрата или частицы, что, как правило, включает получение на поверхности "функциональных групп", где указанные функциональные группы способны к связыванию с комплексом МНС, и/или связывание необязательно химически модифицированной поверхности поверхности или частицы с ковалентно или нековалентно связываемыми так называемыми "линкерными молекулами" с последующей реакцией МНС или комплекса МНС с полученными частицами.
Термин "линкерная молекула" или "линкер" означает вещество способное к связыванию с субстратом или частицей и также способное к связыванию с комплексом МНС.
Термин "функциональные группы", как использовано выше в настоящем документе, не ограничивается реакционноспособными химическими группами, формирующими ковалентные связи, а также включает химические группы, обеспечивающие ионные взаимодействия или водородные связи с комплексами МНС. Кроме того, следует отметить, что строгое различие между "функциональными группами", получаемыми на поверхности, и линкерными молекулами, несущими "функциональные группы", невозможно, так как иногда модификация поверхности требует реакции с поверхностью частицы небольших линкерных молекул, таких как этиленгликоль.
Функциональные группы или несущие их линкерные молекулы можно выбирать из аминогрупп, групп угольной кислоты, тиолов, простых тиоэфиров, дисульфидов, гуанидино, гидроксильных групп, аминогрупп, винциальных диолов, альдегидов, альфа-галогенацетильных групп, органических соединений ртути, сложноэфирных групп, галогенангидридов, сложных тиоэфиров кислот, кислотных ангидридов, изоцианатов, изотиоцианатов, сульфоновых галогенангидридов, сложных имидоэфиров, диазоацетатов, диазониевых солей, 1,2-дикетонов, фосфоновых кислот, сложных эфиров фосфорной кислоты, сульфоновых кислот, азолидов, имидазолов, индолов, N-малеинимидов, альфа-бета-ненасыщенных карбонильных соединений, арилгалогенидов или их производных.
Неограничивающие примеры других линкерных молекул с более высокими молекулярными массами представляют собой молекулы нуклеиновых кислот, полимеров, сополимеров, полимеризуемые связывающие средства, диоксид кремния, белки и цепочечные молекулы с поверхностью с противоположной относительно субстрата или частицы полярностью. Нуклеиновые кислоты могут обеспечивать связь с аффинными молекулами, которые сами содержат молекулы нуклеиновой кислоты, посредством комплементарной последовательности относительно линкерной молекулы.
В соответствии с определенными вариантами осуществления линкерная молекула содержит полиэтиленгликоль. В соответствии с определенными вариантами осуществления линкерная молекула содержит полиэтиленгликоль и малеинимид. В соответствии с определенными вариантами осуществления полиэтиленгликоль содержит одну или несколько из C1-С3-алкоксигруппы, -R10NHC(O)R-, -R10C(O)NHR-, -R10OC(O)R-, -R10C(O)OR-, где каждый R независимо представляет собой Н или C1-С6-алкил, и где каждый R10 независимо представляет собой связь или C1-С6-алкил.
В качестве примеров полимеризуемых связывающих средств можно перечислить диацетилен, стиролбутадиен, винилацетат, акрилат, акриламид, соединения винила, стирол, оксид кремния, оксид бора, оксид фосфора, бораты, пиррол, полипиррол и фосфаты.
Комплексы рМНС можно связывать с наночастицами множеством способов, один из неограничивающих примеров включает конъюгацию с NP, получаемыми с линкерами PEG, несущими дистальные группы -NH2 или -СООН, которую можно осуществлять посредством формирования амидных связей в присутствии гидрохлорида 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC). NP с группами -СООН сначала растворяют в 20 мМ буфере MES, рН 5,5. В раствор NP добавляют натриевую соль N-гидроксисульфосукцинимида (Sulpha-NHS, Thermo scientific, Waltham, MA, конечная концентрация 10 мМ) и EDC (Thermo scientific, Waltham, MA, конечная концентрация 1 мМ). Через 20 мин перемешивания при комнатной температуре, раствор NP капельно добавляют в раствор, содержащий мономеры рМНС, растворенные в 20 мМ боратном буфере (рН 8,2). Смесь перемешивают в течение дополнительных 4 часов. Для конъюгации МНС с функционализированными NH2 NP комплексы рМНС сначала растворяют в 20 мМ буфере MES, рН 5,5, содержащем 100 мМ NaCl. Затем в раствор МНС добавляют Sulpha-NHS (10 мМ) и EDC (5 мМ). Затем активированные молекулы МНС добавляют в раствор NP в 20 мМ боратном буфере (рН 8,2) и перемешивают в течение 4 часов при комнатной температуре.
Для конъюгации МНС с функционализированными малеинимидом NP комплексы рМНС сначала инкубируют с трибутилфосфином (ТВР, 1 мМ) в течение 4 часов при комнатной температуре. Затем с NP в 40 мМ фосфатном буфере, рН 6,0, содержащем 2 мМ ЭДТА, 150 мМ NaCl, смешивают рМНС, сконструированные так, чтобы содержать свободный С-концевой остаток Cys, и инкубируют в течение ночи при комнатной температуре. МНС комплексов рМНС ковалентно связывают с NP посредством формирования связи углерод-сульфид между малеимидными группами и остатком Cys.
Для конъюгации рМНС или авидина с NP, функционализированными азидными группами, можно использовать клик-химию. Для этой реакции молекулы МНС или авидина сначала инкубируют с реагентом дибензоциклооктилом (DBCO, Click chemistry Tools, Scottdale, AZ) в течение 2 часов при комнатной температуре. Свободные молекулы DBCO можно удалять посредством диализа в течение ночи. Затем конъюгаты МНС- или авидин-DBCO инкубируют с SFP-Z в течение 2 часов, что приводит к формированию триазольных связей между молекулами рМНС или авидина и NP.
Неконъюгированные комплексы рМНС в различных реакциях конъюгации МНС-NP можно удалять посредством интенсивного диализа известными в данной области способами. Неограничивающим примером является диализ против PBS, рН 7,4, при 4°С через отделяющие молекулярную массу 300 кДа мембраны (Spectrum labs). Альтернативно, конъюгированные с рМНС IONP можно очищать посредством магнитного разделения. Конъюгированные NP можно концентрировать посредством ультрафильтрации через блоки Amicon Ultra-15 (MWCO 100 кДа) и хранить в PBS.
Поверхность субстрата или частицы можно химически модифицировать, например, посредством связывания производных фосфоновых кислот с функциональными реакционноспособными группами. Одним из примеров этих фосфоновых кислот или сложноэфирных производных фосфоновых кислот является имино-бис(метиленфосфоно)угольная кислота, которую можно синтезировать в соответствии с реакцией "Манниха-Медритцера". Эту реакцию связывания можно проводить с субстратом или частицей, как непосредственно полученных в способе получения или после предварительной обработки (например, триметилсилилбромидом). В первом случае производное фосфоновой кислоты (сложноэфирное), например, может замещать компоненты реакционной среды, которые еще связаны с поверхностью. Это замещение можно усилить при повышенных температурах. С другой стороны, полагают, что триметилсилилбромид, деалкилирует содержащие алкильные группы основанных на фосфоре комплексообразователей, таким образом, образуя новые участки связывания для производного фосфоновой кислоты (сложноэфирного). Производное фосфоновой кислоты (сложноэфирное) или связанные с ним линкерные молекулы может предоставлять те же функциональные группы, как указано выше. Дополнительный пример обработки поверхности субстрата или частицы включает нагревание в диоле, таком как этиленгликоль. Следует отметить, что эта обработка может быть излишней, если синтез уже проводили в диоле. В этих условиях непосредственно полученный продукт синтеза вероятно уже предоставляет необходимые функциональные группы. Однако эта обработка применима для субстрата или частицы, которые получали в N- или Р-содержащих комплексообразователях. Если такой субстрат или частицу подвергают последующей обработке этиленгликолем, ингредиенты реакционной среды (например, комплексообразователь) все еще связанные с поверхностью, можно заместить диолом и/или можно деалкилировать.
Также N-содержащие комплексообразователи, все еще связанные с поверхностью частицы, можно замещать производными первичных аминов со второй функциональной группой. Поверхность субстрата или частицы также можно покрывать диоксидом кремния. Диоксид кремния обеспечивает относительно простую химическую конъюгацию органических молекул, так как диоксид кремния легко реагирует с органическими линкерами, такими как триэтоксисилан или хлорсилан. Поверхность частицы также можно покрывать гомо- или сополимерами. Примеры полимеризуемых связывающих средств представляют собой: N-(3-аминопропил)-3-меркаптобензамидин, 3-(триметоксисилил)пропилгидразид и 3-(триметоксисилил)пропилмалеинимид. Другие неограничивающие примеры полимеризуемых связывающих средств указаны в настоящем документе. Эти связывающие средства можно использовать по-отдельности или в комбинации в зависимости от типа сополимера, который необходимо получить в качестве покрытия.
Другой способ модификации поверхности, который можно использовать с субстратами или частицами, содержащими соединения окисленных переходных металлов, является преобразование соединений окисленных переходных металлов посредством газообразного хлора или органических хлорирующих средств в соответствующие оксихлориды. Эти оксихлориды способны к реакции с нуклеофилами, такими как гидрокси- или аминогруппы, которые часто присутствуют в биомолекулах. Этот способ обеспечивает проведение прямой конъюгации с белками, например, посредством аминогрупп боковых цепей лизина. Конъюгацию с белками после модификации поверхности оксихлоридами также можно проводить с использованием бифункционального линкера, такого как гидразид малеимидопропионовой кислоты.
Для способов нековалентного связывания особенно подходят цепочечные молекулы с противоположной относительно субстрата или поверхности частицы полярностью. Примеры линкерных молекул, которые можно нековалентно связывать с сердцевиной/оболочкой наночастиц, включают анионные, катионные или цвиттер ионные поверхностно-активные вещества, кислые или основные белки, полиамины, полиамиды, полисульфоны или поликарбоновые кислоты. Необходимую связь может обеспечить гидрофобное взаимодействие между субстратом или частицей и амфифильным реагентом с функциональной реакционноспособной группой, особенно пригодные цепочечные молекулы с амфифильным характером, такие как фосфолипиды или дериватизированные полисахариды, которые можно сшивать друг с другом. Адсорбцию этих молекул на поверхности можно проводить посредством совместной инкубации. Связывание аффинной молекулы и субстрата или частицы также может быть основано на нековалентных самоорганизующихся связях. Один из их примеров включает простые детекторные зонды с биотином в качестве линкерной молекулы и связанными с авидином или стрептавидином молекулами.
Протоколы для реакций связывания функциональных групп с биологическими молекулАми можно найти в литературе, например, в "Bioconjugate Techniques" (Greg Т. Hermanson, Academic Press 1996). Биологическую молекулу (например, молекулу МНС или ее производное) можно связывать с линкерной молекулой, ковалентно или нековалентно, стандартными способами органической химии, такими как окисление, галогенирование, алкилирование, ацилирование, присоединение, замещение или амидирование. Эти способы связывания ковалентно или нековалентно связанной линкерной молекула можно применять до связывания линкерной молекулы с субстратом или частицей или после. Кроме того, посредством инкубации можно проводить прямое связывание молекул с соответствующим образом предварительно обработанными субстратом или частицами (например, посредством триметилсилилбромида), которые вследствие этой предварительной обработки предоставляют модифицированную поверхность (например, более высокий заряд или полярную поверхность).
Фармацевтические композиции и введение
В настоящем документе предоставлены фармацевтические композиции пригодные для лечения и профилактики заболеваний. Композиции содержат, или, альтернативно, в значительной степени состоят, или даже более того, состоят из комплексов наночастиц, как описано в настоящем документе, и носителя.
Композиции можно использовать для индукции или модификации иммунного ответ на ассоциированный с заболеванием антиген, например, полипептид, пептид, углевод, липид или другую молекула или фрагмент молекулы, и против развившегося состояния или заболевания, вызванных таким аутоиммунным ответом или злокачественной опухолью.
Как правило, композиции по изобретению можно вводить парентерально, посредством инъекции, например, внутривенно, подкожно или внутримышечно. Дополнительные составы, подходящие для других способов введения, включают пероральные составы. Пероральные составы включают такие как правило применяемые эксципиенты как, например, фармацевтической степени очистки маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, карбонат магния и т.п. Эти композиции получают в форме растворов, суспензий, таблеток, пилюль, капсул, составов с длительным высвобождением или порошков, и они содержат приблизительно от 10% до приблизительно 95% активного ингредиента, предпочтительно приблизительно от 25% до приблизительно 70%. Получение водных композиций, содержащих комплекс антиген-МНС-наночастица, который модифицирует иммунный статус индивидуума, понятно специалистам в данной области с учетом настоящего изобретения. В соответствии с определенными вариантами осуществления композицию можно ингалировать (например, патент США №6651655, который конкретно полностью включен в качестве ссылки). В одном из вариантов осуществления комплекс антиген-МНС-наночастица вводят системно. В соответствии с конкретными вариантами осуществления комплекс pMHC-NP или композиции, содержащие ряд комплексов pMHC-NP, можно вводить внутривенно.
Как правило, композиции по изобретению вводят способом, совместимым с дозируемым составом, и в таком количестве количество, которое будет терапевтически эффективно и будет модифицировать иммунитет. Вводимое количество зависит от подлежащего лечению индивидуума. Точные количества активного ингредиента, требуемые для введения, зависят от решения практикующего врача. Однако подходящие диапазоны доз составляют порядка от десяти до нескольких сотен нанограмм или микрограмм комплекса антиген/МНС/наночастица на введение. Подходящие режимы для начального введения и повторных введений также варьируют, но характеризуются начальным введением с последующими введениями.
Способы применения могут широко варьировать. Применимы любые общепринятые способы введения вакцин. Полагают, что они включают пероральное применение твердой физиологически приемлемой основы или в физиологически приемлемой дисперсии, парентеральный способ, способ посредством инъекции и т.п. Доза комплекса антиген/МНС/наночастица зависит от маршрута введение и варьирует в соответствии с размерами и состоянием здоровья индивидуума.
Во многих случаях требуется проводить несколько введений комплекса пептид/МНС/наночастица, приблизительно, по меньшей мере приблизительно, или не более чем приблизительно 3, 4, 5, 6, 7, 8, 9, 10 или более введений. Интервалы между введениями в норме составляют от 1, 2, 3, 4, 5, 6 или 7 суток до двенадцати недель, как правило, от одной до двух недель. Для поддержания состояния иммунной системы требуются периодические вторичные инъекции с интервалами через сутки, дважды в неделю, раз в неделю, раз в две недели, раз в месяц или 0,1, 0,2, 0,3, 0,4, 0,5, 1, 2, 3,4 или 5 лет, как правило, два года. После курса введения можно проводить анализы на аутореактивный иммунный ответ, распознающие клетки TR1 и активность Т-клеток.
В соответствии с определенными аспектами однократная доза комплекса рМНС без включения сердцевины наночастицы и любого внешнего слоя составляет приблизительно от 0,001 мг/кг до приблизительно 2,0 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,5 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,4 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,3 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,2 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,1 мг/кг, или приблизительно от 0,001 мг/кг до приблизительно 1,0 мг/кг. В соответствии с определенными вариантами осуществления однократная доза составляет приблизительно от 0,004 мг/кг до приблизительно 1,014 мг/кг, или приблизительно от 0,02 мг/ кг до приблизительно 0,811 мг/кг, или приблизительно от 0,041 мг/кг до приблизительно 0,608 мг/кг, или приблизительно от 0,061 мг/кг до приблизительно 0,507 мг/кг, или приблизительно от 0,081 мг/кг до приблизительно 0,405 мг/кг, или приблизительно от 0,121 мг/кг до приблизительно 0,324 мг/кг, или приблизительно от 0,162 мг/кг до приблизительно 0,243 мг/кг. В соответствии с определенными вариантами осуществления однократная доза составляет приблизительно от 0,004 мг/кг до приблизительно 1,015 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 1,0 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,9 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,8 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,7 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,6 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,5 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,4 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,3 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,2 мг/кг, или приблизительно от 0,004 мг/кг до приблизительно 0,1 мг/кг.
Комбинированное лечение
Композиции и связанные способы по настоящему изобретению, в частности введение комплекса антиген/МНС/наночастица, также можно использовать в комбинации с введением традиционных терапевтических средств. Они в качестве неограничивающих примеров включают введение иммуносупрессорных или модулирующих терапевтических средств или средств для лечения. Неограничивающие примеры определенных ассоциированных с заболеваниями средств для лечения включают авонекс (интерферон бета-1а), бетасерон (интерферон бета-1b), копаксон (ацетат глатирамера), новантрон (митоксантрон), ребиф (интерферон бета-1а), тисарби (натализумаб), гилению (финголимод), глатирамер, стероиды, цитоксан, имуран, баклофен, глубокую стимуляцию головного мозга, ампиру (дальфампридин), акупунктуру и физиотерапию. При лечении злокачественной опухоли для усиления терапевтического ответа описываемых композиций и способов можно добавлять дополнительные химиотерапевтические средства, радиацию или хирургию.
В одном из аспектов предусмотрено, что комплекс антиген/МНС/наночастица используют в сочетании с лечением цитокинами. Альтернативно, введение комплекса антиген/МНС/наночастица может предшествовать или следовать за другим лечением через интервалы в диапазоне от нескольких минут до нескольких недель. В соответствии с определенными вариантами осуществления, где другие средства и/или комплексы антиген/МНС/наночастица вводят раздельно, следует обеспечить, чтобы между моментами каждой доставки не проходил значительный промежуток времени так, чтобы средство и комплекс антиген/МНС/наночастица все еще могли оказывать преимущественно комбинированное действие на индивидуума. В таких случаях предусмотрено, что можно вводить оба средства в пределах приблизительно 12-24 часов друг за другом и, более предпочтительно, в пределах приблизительно 6-12 часов друг за другом. Однако в определенных ситуациях может являться желательным значительно увеличить период времени для введения, когда между соответствующими введениями проходит от нескольких суток (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8).
Можно использовать различные комбинации, например, когда введение комплекса антиген/МНС/наночастица представляет собой "А", а дополнительное средство представляет собой "В":
А/В/А В/А/В В/В/А А/А/В А/В/В В/А/А А/В/В/В В/А/В/В
В/В/В/А В/В/А/В А/А/В/В А/В/А/В А/В/В/А В/В/А/А
В/А/В/А В/А/А/В А/А/А/В В/А/А/А А/В/А/А А/А/В/А
Введение композиций комплекса пептид-МНС по настоящему изобретению пациенту/индивидууму соответствует общим протоколам введения таких соединений, учитывая токсичность, если она существует. Полагают, что циклы лечения по мере необходимости можно повторять. Также предусмотрено, что в комбинации с описываемым лечением можно использовать различные стандартные терапевтические средства, такие как восполнение потери жидкости.
Фармацевтические носители и составы
В соответствии с определенными вариантами осуществления индивидууму вводят фармацевтические композиции. Различные аспекты настоящего изобретения включают введение индивидууму эффективного количества композиции комплекса антиген/МНС/наночастица. Кроме того, такие композиции можно вводить в комбинации с модификаторами иммунной системы. Как правило, такие композиции растворяют или диспергируют в фармацевтически приемлемом носителе или водной среде.
Фразы "фармацевтически приемлемые" или "фармакологически приемлемые" относятся к молекулярным структурам и композициям, которые при введении животному или человеку не приводят к вредным, аллергическим или другим нежелательным реакциям. Как используют в настоящем документе, "фармацевтически приемлемый носитель" включает любой и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие всасывание средства и т.п. Использование таких носителей и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда какие-либо общепринятые носители или средства несовместимы с активными ингредиентами, их использование в иммуногенных и терапевтических композициях предусмотрено.
Активные соединения по настоящему изобретению можно формулировать для парентерального введения, например, формулировать для инъекции посредством внутривенного, внутримышечного, подкожного или даже интраперитонеального маршрутов. Получение водной композиции, содержащей комплекс антиген/МНС/наночастица, который модифицирует иммунный статус индивидуума, будет понятно специалистам в данной области с учетом настоящего изобретения. Как правило, такие композиции можно получать в виде инъецируемых средств, в виде жидких растворов или суспензий; твердых форм, подходящих для получения растворов или суспензии после добавления жидкости перед инъекцией; и препараты также можно эмульгировать.
Фармацевтические формы, подходящие для использования в виде инъекций включают стерильные водные растворы или дисперсии; составы, включающие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для приготовляемых для немедленного приема препаратов стерильных инъецируемых растворов или дисперсий. Во всех случаях, форма должна быть стерильной и должна быть жидкой в такой степени, чтобы ее можно было легко инъецировать. Она должна быть стабильной в условиях производства и хранения и ее следует предохранять от загрязняющего действия микроорганизмов, таких как бактерии и грибы.
Композиции можно формулировать в нейтральной форме или в форме соли. Фармацевтически приемлемые соли, включая соли присоединения кислот (формируемые со свободными аминогруппами белка), формируют с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами как уксусная, щавелевая, винная, миндальная и т.п. Также можно получать соли, формируемые со свободными карбоксильными группами, из неорганических оснований, таких как, например, натрий, калий, аммоний, кальций, или гидроксиды железа, и органических оснований, таких как изопропиламин, триметиламин, гистидин, прокаин и т.п.
Носитель также может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и растительные масла. Необходимую текучесть можно поддерживать, например, с использованием покрытия, такого как лецитин, поддержанием требуемого размера частиц в случае дисперсии, и использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов можно обеспечить различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тимеросалом и т.п. Во многих случаях предпочтительно включать средства придания изотоничности, например, сахара или хлорид натрия. Пролонгированное всасывание инъецируемых композиций можно обеспечить использованием в композициях средств, задерживающих всасывание, например, моностеарата алюминия и желатина.
Стерильные инъецируемые растворы получают посредством добавления активных соединений в требуемое количество соответствующего растворителя с другими различными ингредиентами, перечисленными выше, как необходимо, с последующей стерилизация. Стерилизацию раствора проводят таким образом, чтобы не снизить терапевтических свойств комплекса антиген-МНС-наночастица. Как правило, дисперсии получают добавлением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную диспергирующую среду и другие требуемые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов определенные способы получения представляют собой способы вакуумной сушки и лиофилизации, которые обеспечивают получение порошка активного ингредиента с любым требуемым дополнительным ингредиентом из их ранее стерилизованных растворов. Один такой способ стерилизации раствора представляет собой стерильную фильтрацию, однако настоящее изобретение предназначено для включения любого способа стерилизации, которые в значительной степени не снижает терапевтические свойства комплексов антиген-МНС-наночастица. Способы стерилизации, включающие интенсивное нагревание и прессование, такие как автоклавирование, могут повреждать третичную структуру комплекса, таким образом, значительно снижая терапевтические свойства комплексов антиген-МНС-наночастица.
Как правило, введение композиций по настоящему изобретению проводят любым общепринятым маршрутом. В качестве неограничивающих примеров они включают ортотопическую, интрадермальную, подкожную, внутримышечную, интраперитонеальную, интраназальную или внутривенную инъекцию. В соответствии с определенными вариантами осуществления вакцинную композицию можно ингалировать (например, патент США 6651655, который конкретно включен в качестве ссылки).
Эффективное количество терапевтической или профилактической композиции определяют на основе заданной цели. Термин "стандартная доза" или "дозировка" относится к физически дискретным единицам, пригодным для использования у индивидуума, где каждая единица содержит предопределенное количество композиции, рассчитанное так, чтобы обеспечивать требуемый ответ, описанный выше в отношении ее введения, например, соответствующего маршрута и схемы лечения. Вводимое количество, относительно количества лечебных средств и стандартной дозы, зависит от требуемых результата и/или защиты. Точные количества композиции также зависят от решения практикующего врача и являются особыми для каждого индивидуума. Факторы, влияющие на дозу включают физическое и клиническое состояние индивидуума, маршрут введения, заданная цель лечения (снижение симптомов по сравнению с излечением) и активность, стабильность и токсичность конкретной композиции. После составления, растворы вводят способом, совместимым с дозируемым составом и в таком количестве, которое является терапевтически или профилактически эффективным. Составы легко вводить в различных лекарственных формах, таких как типы инъецируемых растворов, описанные выше. Типичный режим дозирования в модели на мышах включает введение 1 мкг - 50 мкг общего рМНС (нанесенного на NP) и 1 мкг - 50 мкг общего железа на дозу, что можно преобразовать в конкретную единицу дозирования у людей. В соответствии с определенными вариантами осуществления доза может находиться в диапазоне приблизительно от 0,1 мкг до приблизительно 400 мкг. Однако следует понимать, что количество рМНС на дозу может находиться в диапазоне от только 0,1 мкг до 100 мг. В качестве примера у пациента-человека массой 60 кг, количество рМНС на дозу может находиться в диапазоне от 0,24 мг до 12 мг с пониманием того, что это соответствует от 1 мкг до 50 мкг, обсуждаемых выше. Также, как указано выше, эту дозу можно менять так, чтобы она соответствовала количеству от 0,1 мкг до 100 мг, как описано выше, что соответствует эквивалентной дозе у человека от 0,0004 мг/кг до 405,4 мг/кг и колеблется между ними в зависимости от проходящего лечение пациента, его состояния и других параметров по решению лечащего врача.
Введение in vitro или ex vivo
Как используют в настоящем документе, термин введение in vitro относится к манипуляциям, проводимым на клетках, выделенных у индивидуума или находящихся вне индивидуума, включая в качестве неограничивающих примеров клетки в культуре. Термин введение ex vivo относится к клеткам, которые обрабатывали in vitro и затем вводят индивидууму. Термин введение in vivo включает все манипуляции, проводимые у индивидуума, включая введение.
В соответствии с определенными аспектами настоящего изобретения композиции можно вводить in vitro, ex vivo или in vivo. В определенных варианты осуществления in vitro аутологичные Т-клетки инкубируют с композициями по настоящему изобретению. Затем клетки используют для анализа in vitro или, альтернативно, для введения ex vivo.
Получение белковых компонентов
В настоящем описании описаны полипептиды, пептиды и белки для применения в различных вариантах осуществления настоящего изобретения. Например, конкретные пептиды и их комплексы оценивают на их способность вызывать или модулировать иммунный ответ. В соответствии с конкретными вариантами осуществления все или часть пептидов или белков по изобретению также можно общепринятыми способами синтезировать в растворе или на твердой подложке. Коммерчески доступны и можно использовать в соответствии с известными протоколами различные автоматические синтезаторы.
Альтернативно, можно использовать технологию рекомбинантных ДНК, где нуклеотидную последовательность, которая кодирует пептид по изобретению, встраивают в экспрессирующий вектор, трансформируют или трансфицируют в соответствующую клетку-хозяина и культивируют в условиях, подходящих для экспрессии.
Один из вариантов осуществления изобретения включает использование для получения белков переноса генов в клетки, включая микроорганизмы. Ген представляющего интерес белка можно переносить в соответствующие клетки-хозяева с последующим культивированием клеток в подходящих условиях. Использовать можно нуклеиновую кислоту, кодирующую практически любой полипептид. Получение рекомбинантных экспрессирующих векторов и включаемые в них элементы известны специалисту в данной области и в кратком изложении описаны в настоящем документе. Примеры линий клеток-хозяев млекопитающих в качестве неограничивающих примеров включают клетки Vero и HeLa, другие линии В- и Т-клеток, такие как СЕМ, 721, 221, Н9, Jurkat, Raji, а также линии клеток яичника китайского хомяка, клетки W138, BHK, COS-7, 293, HepG2, 3Т3, RIN и MDCK. Кроме того, можно выбирать линию клеток-хозяев, которая модулирует экспрессию вставленных последовательностей или которая модифицирует и процессирует продукт гена требуемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут являться важными для функции белка. Различные клетки-хозяева содержат характерные и специфичные механизмы посттрансляционного процессинга и модификации белков. Для обеспечения корректной модификации и процессинга экспрессируемого чужеродного белка можно выбирать соответствующие линии клеток или системы-хозяева.
Можно использовать ряд систем отбора, включая в качестве неограничивающих примеров гены тимидинкиназы HSV, гипоксантингуанинфосфорибозилтрансферазы и аденинфосфорибозилтрансферазы, в клетках tk-, hgprt- или aprt-, соответственно. Также, в качестве основы для отбора можно использовать устойчивость к антиметаболитам: dhfr, которая придает устойчивость к триметоприму и метотрексату; gpt, которая придает устойчивость к микофеноловой кислоте; neo, которая придает устойчивость к аминогликозиду G418; и hygro, которая придает устойчивость к гигромицину.
Нуклеиновые кислоты
Настоящее изобретение может включать рекомбинантные полинуклеотиды, кодирующие белки, полипептиды, пептиды по изобретению. Включены и можно использовать для получения комплексов пептид/МНС последовательности нуклеиновых кислот для аутоантигенов и молекул МНС для презентации аутоантигенов.
Как используют в настоящем описании термин "полинуклеотид" относится к молекуле нуклеиновой кислоты, которая является рекомбинантной или выделена из общей геномной нуклеиновой кислоты. В термин "полинуклеотид" включены олигонуклеотиды (нуклеиновые кислоты с длиной 100 остатков или менее), рекомбинантные векторы, включая, например, плазмиды, космиды, фаги, вирусы и т.п. В соответствии с определенными аспектами полинуклеотиды включают регуляторные последовательности, по существу отделенные от природных генов или кодирующих белки последовательностей. Полинуклеотиды могут представлять собой РНК, ДНК, их аналоги или их сочетание.
В этом отношении термин "ген", "полинуклеотид" или "нуклеиновая кислота" используют для обозначения нуклеиновых кислот, кодирующих белки, полипептиды или пептиды (включая любые последовательности, необходимые для корректной транскрипции, посттрансляционной модификации или локализации). Как понятно специалистам в данной области, этот термин включает геномные последовательности, экспрессирующие кассеты, последовательности кДНК и небольшие сконструированные участки нуклеиновых кислот, которые экспрессируют или можно адаптировать для экспрессии белков, полипептидов, доменов, пептидов, слитых белков и мутантов. Нуклеиновые кислоты, кодирующие все или части полипептидов, могут содержать непрерывные последовательности нуклеиновых кислот, кодирующих все или части таких полипептидов, со следующими длинами: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040, 1050, 1060, 1070, 1080, 1090, 1095, 1100, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 9000, 10000 или более нуклеотидов, нуклеозидов или пар оснований. Также предусмотрено, что конкретный полипептид данного вида могут кодировать нуклеиновые кислоты содержащие природные вариации, которые содержат немного отличающиеся последовательности нуклеиновых кислот, но, тем не менее, кодируют тот же или в значительной степени сходный белок, полипептид или пептид.
В соответствии с конкретными вариантами осуществления изобретение относится к выделенным участкам нуклеиновых кислот и рекомбинантным векторам, содержащим последовательности нуклеиновых кислот, которые кодируют аутоантиген и/или молекулу МНС. Термин "рекомбинантный" можно использовать в сочетании с полипептидом или названием конкретного полипептида, и, как правило, это относится к полипептиду, получаемому с молекулы нуклеиновой кислоты, которую обрабатывали in vitro или которая является продуктом репликации такой молекулы.
Участки нуклеиновых кислот, используемые в настоящем изобретении, вне зависимости от длины самой кодирующей последовательности можно комбинировать с другими последовательностями нуклеиновых кислот, такими как промоторы, сигналы полиаденилирования, дополнительные участки распознавания рестрикционных ферментов, участки множественного клонирования, другие кодирующие участки и т.п. так, что их общая длина может в значительной степени варьировать. Таким образом, предусмотрено, что можно использовать фрагмент нуклеиновой кислоты почти любой длины с общей длиной предпочтительно ограниченной простотой получения и использования требуемого протокола обработки рекомбинантных нуклеиновых кислот. В некоторых случаях последовательность нуклеиновой кислоты может кодировать полипептидную последовательность вместе с дополнительными гетерологичными кодирующими последовательностями, например, для обеспечения очистки, транспорта, секреции, посттрансляционной модификации полипептида или для положительного терапевтического действия, такого как направленное воздействие или эффективность. К кодирующей модифицированный полипептид последовательности можно добавлять кодирующую метку или другой гетерологичный полипептид последовательность, где "гетерологичный" относится к полипептиду, который не является таким же, как модифицированный полипептид.
Способы лечения
Также предоставлены медицинские и диагностические способы. В одном из аспектов предоставлен способ для обеспечения формирования, размножения и привлечения иммуноцитов, включая в качестве неограничивающих примеров, эффекторные клетки, регуляторные В-клетки и/или клетки TR1 (например, TR1 и CD4+-клетки) или CD8+-клетки, антигенспецифичным способом у нуждающегося в этом индивидуума, включающий, или, альтернативно, в значительной степени состоящий, или даже еще более состоящий из введения индивидууму эффективного количества комплекса или композиции NP, как описано в настоящем документе.
Настоящее изобретение также относится к способам дифференцировки или инициации формирования регуляторных Т-клеток типа 1 (TR1) независимым от дозы рМНС способом. Заявитель выявил, что плотность рМНС на сердцевине наночастицы регулирует способность рМНС на сердцевине наночастицы инициировать формирование клеток TR1 независимым от дозы способом, тогда как доза рМНС регулирует величину размножения клеток TR1 независимым от плотности рМНС способом. Заявитель выявил, что порог плотности рМНС и независимое действие плотности рМНС по сравнению с дозой на формирование клеток TR1 по сравнению с размножением являются неожиданными открытиями, которые было нельзя предполагать на основе общеизвестного знания в области иммунологии. Эти способы требуют контакта распознающих Т-клеток с эффективным количеством pMHC-NP или композиции рМНС-NP, описываемых в настоящем документе. В соответствии с определенными аспектами зависимые от плотности способы относятся к активированным Т-клеткам или Т-клеткам памяти, дифференцирующимся в продуцирующие IL-10 распознающие клетки TR1, необязательно несущие маркеры CD49b, и/или Lag3, и/или к В-клеткам, дифференцирующимся в регуляторные В-клетки при контакте активированных Т-клеток или Т-клеток памяти с эффективным количеством комплекса или композиции, описываемых в настоящем документе. В соответствии с определенными вариантами осуществления дифференцированная регуляторная Т-клетка связывается с В-клеткой, таким образом, обеспечивая дифференцировку В-клетки в регуляторную В-клетку. В соответствии с определенными аспектами способов приведение в контакт проводят in vitro или in vivo.
Таким образом, аспекты изобретения относятся к способу дифференцировки или инициации формирования клеток TR1 независимым от дозы рМНС способом, включающим приведение распознающих Т-клеток в контакт с эффективными количествами комплекса или композиции, описываемыми в настоящем документе. В соответствии с определенными аспектами приведение в контакт можно проводить in vitro или in vivo. В соответствии с определенными аспектами способы относятся к активированным Т-клеткам или Т-клеткам памяти, дифференцирующимся в продуцирующие IL-10 клетки TR1, необязательно экспрессирующие маркеры CD49b и/или Lag3, включая приведение активированных Т-клеток или Т-клеток памяти в контакт с эффективными количествами комплекса или композиции, описываемых в настоящем документе. На основе корреляции с соответствующим типом клеток для каждого заболевания, также вводят соответствующий оптимизированный комплекс MHC/NP и необязательно костимулирующую молекулу и/или цитокин.
С учетом указанного выше заявитель предоставляет способ дифференцировки активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, необязательно экспрессирующие маркеры CD49b и/или Lag3, и/или дифференцировки В-клеток в регуляторные В-клетки, включающий, или, альтернативно, состоящий, или даже еще более состоящий из приведения активированных Т-клеток или Т-клеток памяти в контакт с эффективным количеством комплекса или композиции, как описано в настоящем документе. Приведение в контакт можно проводить in vitro или in vivo. В соответствии с определенными вариантами осуществления pMHC-NP или композиция содержащая множество pMHC-NP содержит pMHC-NPs со средним диаметром сердцевины наночастицы приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм. В соответствии с определенными аспектами сердцевина наночастицы дополнительно содержит внешнее покрытие или слой, где диаметр сердцевины и внешнего слоя имеют средний диаметр приблизительно от 30 нм до приблизительно 75 нм, или приблизительно от 30 нм до приблизительно 70 нм, или приблизительно от 30 нм до приблизительно 60 нм, или приблизительно от 30 нм до приблизительно 50 нм, или приблизительно 40 нм. В соответствии с определенными аспектами средняя плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
Также предоставлены способы дифференцировки активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, необязательно экспрессирующие маркеры CD49b и/или Lag3, и/или дифференцировки В-клеток в регуляторные В-клетки, включающие, или, альтернативно, в значительной степени состоящие, или даже еще более состоящие из введения индивидууму эффективного количества комплекса или композиции, как описано в настоящем документе. Как используют в настоящем документе, индивидуум может включать животное, млекопитающее, мышь, корову, лошадь, собаку, кошку, овцу или человека. В соответствии с определенными вариантами осуществления pMHC-NP или композиция, содержащая множество pMHC-NP, содержат pMHC-NP со средним диаметром сердцевины наночастицы приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм. В соответствии с определенными аспектами сердцевина наночастицы дополнительно содержит внешнее покрытие или слой, где диаметр сердцевины и внешнего слоя имеют средний диаметр приблизительно от 30 нм до приблизительно 75 нм, или приблизительно от 30 нм до приблизительно 70 нм, или приблизительно от 30 нм до приблизительно 60 нм, или приблизительно от 30 нм до приблизительно 50 нм, или приблизительно 40 нм. В соответствии с определенными аспектами средняя плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
В настоящем документе предоставлены способы лечения аутоиммунного заболевания или нарушения у нуждающегося в этом индивидуума, включающие введение индивидууму эффективного количества любого из комплексов или композиций, описываемых в настоящем документе, при условии, что комплексы и композиции не содержат костимулирующих молекул.
Кроме того, в настоящем документе предоставлены способы лечения злокачественной опухоли или опухоли и/или ингибирования роста опухолевых клеток или ткани у нуждающегося в этом индивидуума, включающие введение эффективного количества любого комплекса pMHC-NP с одной или несколькими костимулирующими молекулами.
Дополнительные аспекты, предоставленные в настоящем документе, включают комплекс наночастицы с плотностью рМНС приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2 для применения в инициации дифференцировки активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, необязательно экспрессирующие маркеры CD49b и/или Lag3. В соответствии с определенными вариантами осуществления pMHC-NP или композиция, содержащая множество pMHC-NP, содержат pMHC-NP со средним диаметром сердцевины наночастицы приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм. В соответствии с определенными аспектами сердцевина наночастицы дополнительно содержит внешнее покрытие или слой, где диаметр сердцевины и внешнего слоя имеют средний диаметр приблизительно от 30 нм до приблизительно 75 нм, или приблизительно от 30 нм до приблизительно 70 нм, или приблизительно от 30 нм до приблизительно 60 нм, или приблизительно от 30 нм до приблизительно 50 нм, или приблизительно 40 нм. В соответствии с определенными аспектами средняя плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2,5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2.
В одном из аспектов в настоящем документе предоставлены способы дифференцировки активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, экспрессирующие маркер, включающий CD49b и/или LAG3, и/или дифференцировки В-клеток в регуляторные В-клетки, где способ включает приведение активированных Т-клеток или Т-клеток памяти в контакт с эффективным количеством комплекса, содержащего: сердцевину наночастицы, где: с сердцевиной наночастицы связано множество ассоциированных с заболеваниями комплексов антиген-МНС (рМНС); диаметр сердцевины составляет приблизительно от 15 нм до приблизительно 25 нм; и где плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2 площади поверхности наночастицы. В соответствии с определенными вариантами осуществления сердцевина наночастицы дополнительно содержит на сердцевине внешний слой, где комплекс рМНС связан с сердцевиной наночастицы и/или внешним слоем, и где комбинированный диаметр сердцевины наночастицы и внешнего слоя составляет приблизительно от 35 нм до приблизительно 45 нм. В соответствии с определенными вариантами осуществления, приведение в контакт проводят in vitro или in vivo.
В соответствии с другим аспектом в настоящем документе предоставлен комплекс наночастицы для применения в дифференцировке активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, экспрессирующие маркер, включающий CD49b и/или LAG3, и/или дифференцировке В-клеток в регуляторные В-клетки, где комплекс наночастицы содержит сердцевину наночастицы, где: с сердцевиной наночастицы связано множество ассоциированных с заболеваниями комплексов антиген-МНС (рМНС); диаметр сердцевины составляет приблизительно от 15 нм до приблизительно 25 нм; и где плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2 площади поверхности наночастицы.
В соответствии с другим аспектом в настоящем документе предоставлен комплекс наночастицы для применения в дифференцировке активированных Т-клеток или Т-клеток памяти в продуцирующие IL-10 клетки TR1, экспрессирующие маркер, включающий CD49b и/или LAG3, и/или дифференцировке В-клеток в регуляторные В-клетки, где комплекс наночастицы содержит сердцевину наночастицы и внешний слой на сердцевине наночастицы, где: с сердцевиной наночастицы и/или внешним слоем связано множество ассоциированных с заболеваниями комплексов антиген-МНС (рМНС); комбинированный диаметр сердцевины и внешнего слоя составляет приблизительно от 25 нм до приблизительно 45 нм; и где плотность рМНС на наночастице составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 12 рМНС/100 нм2 площади поверхности наночастицы.
В соответствии с определенными вариантами осуществления терапевтический эффект включает приблизительно от 0,1% до приблизительно 250% увеличения популяции клеток TR1. В соответствии с определенными вариантами осуществления увеличение включает приблизительно от 0,1% до приблизительно 225%, или приблизительно от 0,1% до приблизительно 200%, или приблизительно от 0,1% до приблизительно 175%, или приблизительно от 0,1% до приблизительно 150%, или приблизительно от 0,1% до приблизительно 125%, или приблизительно от 0,1% до приблизительно 100%, или приблизительно от 0,1% до приблизительно 75%, или приблизительно от 0,1% до приблизительно 50%, или приблизительно от 0,1% до приблизительно 25%, или приблизительно от 0,1% до приблизительно 20%, или приблизительно от 0,1% до приблизительно 15%, или приблизительно от 0,1% до приблизительно 10%, или приблизительно от 0,1% до приблизительно 9%, или приблизительно от 0,1% до приблизительно 8%, или приблизительно от 0,1% до приблизительно 7%, или приблизительно от 0,1% до приблизительно 6%, или приблизительно от 0,1% до приблизительно 5%, или приблизительно от 0,1% до приблизительно 4%, или приблизительно от 0,1% до приблизительно 3%, или приблизительно от 0,1% до приблизительно 2%, или приблизительно от 0,1% до приблизительно 1%, или приблизительно от 0,1% до приблизительно 0,9%, или приблизительно от 0,1% до приблизительно 0,8%, или приблизительно от 0,1% до приблизительно 0,7%, или приблизительно от 0,1% до приблизительно 0,6%, или приблизительно от 0,1% до приблизительно 0,5%, или приблизительно от 0,1% до приблизительно 0,4%, или приблизительно от 0,1% до приблизительно 0,3%, или приблизительно от 0,1% до приблизительно 0,2% увеличение популяции клеток TR1.
Для терапевтического применения можно комбинировать приводимые ниже заболевания с приводимыми ниже комплексами антиген-МНС и содержащими их композициями:
В соответствии с определенными вариантами осуществления антиген комплекса рМНС включает:
a) ассоциированный с диабетом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: препроинсулин (PPI), специфичная для островков глюкозо-6-фосфатаза (IGRP), глутаминатдекарбоксилаза (GAD), аутоантиген клеток островков 2 (ICA2), инсулин, проинсулин или фрагмент или эквивалент любого из них;
b) ассоциированный с рассеянным склерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: основной белок миелина, ассоциированный с миелином гликопротеин, белок миелина олигодендроцитов, протеолипидный белок, олигопротеин миелина олигодендроцитов, основный ассоциированный с миелином белок олигодендроцитов, специфичный для олигодендроцитов белок, белки теплового шока, специфичные для олигодендроцитов белки, NOGO А, гликопротеин Ро, периферический белок миелина 22, 3'-фосфодиэстераза 2'3'-циклических нуклеотидов или фрагмент или эквивалент любого из них;
c) ассоциированный с глютеновой болезнью антиген, и его получают из глиадина или его фрагмента или эквивалента;
d) ассоциированный с первичным биллиарным циррозом антиген, и его получают из PDC-E2 или его фрагмента или эквивалента;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DG1, DG3 или фрагмент или эквивалент любого из них;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, и его получают из AQP4 или его фрагмента или эквивалента;
g) ассоциированный с артритом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: белки теплового шока, связывающий иммуноглобулины белок, гетерогенные ядерные РНП, аннексин V, кальпастатин, коллаген II типа, глюкозо-6-фосфатизомераза, фактор элонгации хряща человека gp39, связывающий маннозу лектин, цитруллинированный виментин, коллаген II типа, фибриноген, альфа-енолаза, антитела к карбамилированным белкам (антитела к CarP), пептидиларгининдезиминаза 4 типа (PAD4), BRAF, гамма-цепь фибриногена, тяжелая цепь интер-альфа-ингибитора трипсина H1, альфа-1-антитрипсин, ингибитор плазматической протеазы С1, гельзолин, гликопротеин альфа-1-В, церулоплазмин, тяжелая цепь интер-альфа-ингибитора трипсина Н4, фактор комплемента Н, альфа-2-макроглобулин, сывороточный амилоид, С-реактивный белок, сывороточный альбумин, бета-цепь фибриногена, серотрансферрин, альфа-2-гликопротеин HS, виментин, компонент комплемента С3 или фрагмент или эквивалент любого из них;
h) ассоциированный с аллергической астмой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: DERP1, DERP2 или фрагмент или эквивалент любого из них;
i) ассоциированный с воспалительным заболеванием кишечника антиген, и его получают из антигена, выбранного из одного или нескольких из группы: Флагеллин, Fla-2, Fla-X, YIDX, интеграза бактероидов или фрагмент или эквивалент любого из них;
j) ассоциированный с системной красной волчанкой антиген, и его получают из антигена, выбранного из одного или нескольких из группы: двухцепочечная (дц)ДНК, рибонуклеопротеин (РНП), Smith (Sm), ассоциированный с синдромом Шегрена антиген A (SS-A)/Ro, ассоциированный с синдромом Шегрена антиген В (SS-B)/La, RO60, RO52, гистоны или фрагмент или эквивалент любого из них;
k) ассоциированный с атеросклерозом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: АроВ, АроЕ или фрагмент или эквивалент любого из них;
l) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, и его получают из эластина или его фрагмента или эквивалента;
m) ассоциированный с псориазом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: Сар18, ADMTSL5, ATL5 или фрагмент или эквивалент любого из них;
n) ассоциированный с аутоиммунным гепатитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CYP2D6, SLA или фрагмент или эквивалент любого из них;
о) ассоциированный с увеитом антиген, и его получают из аррестина или его фрагмента или эквивалента;
р) ассоциированный с синдромом Шегрена антиген, и его получают из антигена, выбранного из одного или нескольких из группы: (SS-A)/Ro, (SS-B)/La, MR3, RO60, RO52 или фрагмент или эквивалент любого из них;
q) ассоциированный со склеродермией антиген, и его получают из антигена, выбранного из одного или нескольких из группы: CENP-C, ТОР 1, РНК-полимераза III или фрагмент или эквивалент любого из них;
r) ассоциированный с антифосфолипидным синдромом антиген, и его получают из АРОН или его фрагмента или эквивалента;
s) ассоциированный с ассоциированным с ANCA васкулитом антиген, и его получают из антигена, выбранного из одного или нескольких из группы: МРО, PRTN3 или фрагмент или эквивалент любого из них; или
t) ассоциированный с синдромом мышечной скованности антиген, и его получают из GAD или его фрагмента или эквивалента.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть белка классического МНС класса I, белка неклассического МНС класса I, белка классического МНС класса II, белка неклассического МНС класса II, димеры МНС (слияния посредством Fc), тетрамеры МНС или полимерную форму белка МНС, где белок МНС необязательно содержит "выступ во впадину" на основе гетеродимера или мультимера альфа-МНС-Fc/бета-МНС-Fc.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA DR, HLA DQ, HLA DP, HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, CD1d или фрагмент или эквивалент любого из них.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DQ, HLA-DP или фрагмент или эквивалент любого из них.
В соответствии с определенными вариантами осуществления белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DRB1/DRA, HLA-DRB3/DRA, HLA-DRB4/DRA, HLA-DRB5/DRA, HLA-DQA1/HLA-DQB1, HLA-DPB1/HLA-DPA1 или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС содержит:
a) ассоциированный с диабетом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15-23, PPI76-90 (K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, B24-C36, PPI76-90, INS-I9, TUM, G6Pase, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-С1, проинсулинB27-С5, проинсулинС20-28, проинсулинС25-33, проинсулинС29-А5, проинсулинА1-10, проинсулинА2-10, проинсулинA12-20 или фрагмент или эквивалент любого из них;
b) ассоциированный с рассеянным склерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, MBP110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, MPB111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент любого из них;
c) ассоциированный с глютеновой болезнью антиген, получаемый из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или фрагмент или эквивалент любого из них;
d) ассоциированный с первичным биллиарным циррозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-Е280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент любого из них;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455, DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент любого из них;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, получаемый из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент любого из них;
g) ассоциированный с аллергической астмой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2107-121 или фрагмент или эквивалент любого из них;
h) ассоциированный с воспалительным заболеванием кишечника антиген, получаемый из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактероидов183-197, антиген интегразы бактероидов146-160, антиген интегразы бактероидов175-189, антиген интегразы бактероидов1-15, антиген интегразы бактероидов183-197, антиген интегразы бактероидов30-44, антиген интегразы бактероидов70-84, антиген интегразы бактероидов337-351, антиген интегразы бактероидов171-185, антиген интегразы бактероидов4-18, антиген интегразы бактероидов256-270, Fla-2/Fla-Х366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX80-94, YIDX101-115 или фрагмент или эквивалент любого из них;
i) ассоциированный с системной красной волчанкой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Н471-94, Н474-88, Н476-90, Н475-89, Н478-92, Н480-94, Н2В10-24, H2B16-30, H1'22-42, H1'27-41 или фрагмент или эквивалент любого из них;
j) ассоциированный с атеросклерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АроВ3501-3516, ApoB1952-1966, ApoB978-993, АроВ3498-3513, АроВ210А, ApoB210B, ApoB210C или фрагмент или эквивалент любого из них;
k) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент любого из них;
l) ассоциированный с псориазом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Сар1864-78, Сар1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент любого из них;
m) ассоциированный с аутоиммунным гепатитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: (CYP2D6)193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-185, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент любого из них;
n) ассоциированный с увеитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент любого из них;
о) ассоциированный с синдромом Шегрена антиген, получаемый из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426-440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент любого из них;
р) ассоциированный со склеродермией антиген, получаемый из антигена, выбранного из одного или нескольких из группы: ТОР1346-360, ТОР1420-434, TOP1750-764, ТОР1419-433, ТОР1591-605, ТОР1695-709, ТОР1305-319, ТОР1346-360, ТОР1419-433, ТОР1425-439, ТОР1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, СЕNР-С643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент любого из них;
q) ассоциированный с антифосфолипидным синдромом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АРОН235-249, АРОН306-320, АРОН237-251, АРОН295-309, АРОН28-42, APOH173-187, APOH264-278, АРОН295-309, АРОН49-63, АРОН269-283, АРОН295-309, АРОН321-355, АРОН322-336, АРОН324-338 или фрагмент или эквивалент любого из них;
r) ассоциированный с ассоциированным с ANCA васкулитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MPO506-520, МРО302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, МРО616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент любого из них; или
s) ассоциированный с синдромом мышечной скованности антиген, получаемый из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311 или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС содержит:
a) ассоциированный с диабетом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: hInsB10-18, hIGRP228-236, hIGRP265-273, IGRP206-214, hIGRP206-214, NRP-A7, NRP-I4, NRP-V7, YAI/Db, INS B15-23, PPI76-90 (K88S), IGRP13-25, GAD555-567, GAD555-567(557I), IGRP23-35, В24-С36, PPI76-90, INS-I9, TUM, G6Pase, проинсулинL2-10, проинсулинL3-11, проинсулинL6-14, проинсулинB5-14, проинсулинB10-18, проинсулинB14-22, проинсулинB15-24, проинсулинB17-25, проинсулинB18-27, проинсулинB20-27, проинсулинB21-29, проинсулинB25-C1, проинсулинB27-C5, проинсулинC20-28, проинсулинC25-33, проинсулинC29-A5, проинсулинА1-10, проинсулинА2-10, проинсулинА12-20 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
b) ассоциированный с рассеянным склерозом антиген, получаемый из антигена, Выбранного из одного или нескольких из группы: MOG35-55, MOG36-55, MAG287-295, MAG509-517, MAG556-564, МВР110-118, MOG114-122, MOG166-175, MOG172-180, MOG179-188, MOG188-196, MOG181-189, MOG205-214, PLP80-88, MAG287-295, MAG509-517, MAG556-564, MOG97-109 MOG97-109(E107S), MBP89-101, PLP175-192, PLP94-108, MBP86-98, PLP54-68, PLP249-263, MOG156-170, MOG201-215, MOG38-52, MOG203-217, PLP250-264, MPB13-32, MPB83-99, МРВ111-129, MPB146-170, MOG223-237, MOG6-20, PLP88-102, PLP139-154 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
c) ассоциированный с глютеновой болезнью антиген, получаемый из антигена, выбранного из одного или нескольких из группы: aGlia57-68, aGlia62-72, aGlia217-229 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DQ или его фрагмент или эквивалент;
d) ассоциированный с первичным биллиарным циррозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: PDC-E2122-135, PDC-E2249-262, PDC-E2249-263, PDC-E2629-643, PDC-E272-86, PDC-E2353-367, PDC-E2422-436, PDC-E2629-643, PDC-Е280-94, PDC-E2353-367, PDC-E2535-549 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
e) ассоциированный с листовидной пузырчаткой антиген и/или ассоциированный с обыкновенной пузырчаткой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: DG1216-229, DG397-111, DG3251-265, DG3441-455, DG3351-365, DG3453-467, DG3540-554, DG3280-294, DG3326-340, DG3367-381, DG313-27, DG3323-337, DG3438-452, DG148-62, DG1206-222, DG1363-377, DG13-17, DG1192-206, DG1326-340, DG11-15, DG135-49, DG1325-339 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
f) ассоциированный с нейромиелитом зрительного нерва со спектральным расстройством антиген, получаемый из антигена, выбранного из одного или нескольких из группы: AQP4129-143, AQP4284-298, AQP463-76, AQP4129-143, AQP439-53 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
g) ассоциированный с аллергической астмой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: DERP116-30, DERP1171-185, DERP1110-124, DERP-226-40, DERP-2107-121 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DP или фрагмент или эквивалент любого из них;
h) ассоциированный с воспалительным заболеванием кишечника антиген, получаемый из антигена, выбранного из одного или нескольких из группы: антиген интегразы бактероидов183-197, антиген интегразы бактероидов146-160, антиген интегразы бактероидов175-189, антиген интегразы бактероидов1-15, антиген интегразы бактероидов183-197, антиген интегразы бактероидов30-44, антиген интегразы бактероидов70-84, антиген интегразы бактероидов337-351, антиген интегразы бактероидов171-185, антиген интегразы бактероидов4-18, антиген интегразы бактероидов256-270, Fla-2/Fla-Х366-380, Fla-2/Fla-X164-178, Fla-2/Fla-X261-275, Fla-2/Fla-X1-15, Fla-2/Fla-X51-65, Fla-2/Fla-X269-283, Fla-2/Fla-X4-18, Fla-2/Fla-X271-285, YIDX78-92, YIDX93-107, YIDX98-112, YIDX23-37, YIDX78-92, YIDX195-209, YIDX22-36, YIDX80-94, YIDX101-115 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
i) ассоциированный с системной красной волчанкой антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Н471-94, Н474-88, Н476-90, Н475-89, Н478-92, Н480-94, Н2В10-24, H2B16-30, H1'22-42, H1'27-41 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: I-Ad, HLA-DR или фрагмент или эквивалент любого из них;
j) ассоциированный с атеросклерозом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АроВ3501-3516, ApoB1952-1966, ApoB978-993, АроВ3498-3513, АроВ210А, ApoB210B, ApoB210C или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть I-Ab или его фрагмент или эквивалент;
k) ассоциированный с COPD антиген и/или ассоциированный с эмфиземой антиген, каждый из которых получают из антигена, выбранного из одного или нескольких из группы: эластин89-103, эластин698-712, эластин8-22, эластин94-108, эластин13-27, эластин695-709, эластин563-577, эластин558-572, эластин698-712, эластин566-580, эластин645-659 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
l) ассоциированный с псориазом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: Сар1864-78, Сар1834-48, Cap1847-61, Cap18151-165, Cap18149-163, Cap18152-166, Cap18131-145, Cap1824-38, ADMTSL5245-259, ADMTSL5267-281, ADMTSL5372-386, ADMTSL5289-303, ADMTSL5396-410, ADMTSL5433-447, ADMTSL5142-156, ADMTSL5236-250, ADMTSL5301-315, ADMTSL5203-217, ADMTSL5404-418 или фрагмент или эквивалент любого из них, и белок MHC комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
m) ассоциированный с аутоиммунным гепатитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: CYP2D6193-207, CYP2D676-90, CYP2D6293-307, CYP2D6313-332, CYP2D6393-412, CYP2D6199-213, CYP2D6450-464, CYP2D6301-315, CYP2D6452-466, CYP2D659-73, CYP2D6130-144, CYP2D6193-212, CYP2D6305-324, CYP2D6131-145, CYP2D6216-230, CYP2D6238-252, CYP2D6199-213, CYP2D6235-252, CYP2D6293-307, CYP2D6381-395, CYP2D6429-443, SLA334-348, SLA196-210, SLA115-129, SLA373-386, SLA186-197, SLA317-331, SLA171-l85, SLA417-431, SLA359-373, SLA215-229, SLA111-125, SLA110-124, SLA299-313, SLA342-356, SLA49-63, SLA119-133, SLA260-274, SLA26-40, SLA86-100, SLA331-345 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
n) ассоциированный с увеитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: аррестин199-213, аррестин77-91, аррестин250-264, аррестин172-186, аррестин354-368, аррестин239-253, аррестин102-116, аррестин59-73, аррестин280-294, аррестин291-306, аррестин195-209, аррестин200-214 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
о) ассоциированный с синдромом Шегрена антиген, получаемый из антигена, выбранного из одного или нескольких из группы: RO60127-141, RO60523-537, RO60243-257, RO60484-498, RO60347-361, RO60369-383, RO60426-440, RO60267-281, RO60178-192, RO60358-372, RO60221-235, RO60318-332, RO60407-421, RO60459-473, RO6051-65, RO60312-326, LA241-255, LA101-115, LA153-167, LA178-192, LA19-33, LA37-51, LA133-147, LA50-64, LA32-46, LA153-167, LA83-97, LA136-150, LA297-311, LA59-73, LA151-165, LA86-100, LA154-168 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DP или фрагмент или эквивалент любого из них;
р) ассоциированный со склеродермией антиген, получаемый из антигена, выбранного из одного или нескольких из группы: ТОР1346-360, ТОР1420-434, TOP1750-764, ТОР1419-433, ТОР1591-605, ТОР1695-709, ТОР1305-319, ТОР1346-360, ТОР1419-433, TOP1425-439, ТОР1614-628, CENP-C297-311, CENP-C857-871, CENP-C887-901, CENP-C212-226, CENP-C643-657, CENP-C832-846, CENP-C167-181, CENP-C246-260, CENP-C846-860, CENP-C149-163, CENP-C833-847, CENP-C847-861 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
q) ассоциированный с антифосфолипидным синдромом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: АРОН235-249, АРОН306-320, АРОН237-251, АРОН295-309, АРОН28-42, APOH173-187, APOH264-278, АРОН295-309, АРОН49-63, АРОН269-283, АРОН295-309, АРОН321-355, АРОН322-336, АРОН324-338 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент;
г) ассоциированный с ассоциированным с ANCA васкулитом антиген, получаемый из антигена, выбранного из одного или нескольких из группы: MPO506-520, МРО302-316, MPO7-21, MPO689-703, MPO248-262, MPO444-458, MPO513-527, MPO97-111, МРО616-630, MPO462-476, MPO617-631, MPO714-728, PRTN344-58, PRTN3234-248, PRTN359-73, PRTN3117-131, PRTN3164-178, PRTN371-85, PRTN3241-255, PRTN359-73, PRTN3183-197, PRTN362-76, PRTN3118-132, PRTN3239-253 или фрагмент или эквивалент любого из них, и белок МНС комплекса рМНС содержит весь или часть HLA-DR или его фрагмент или эквивалент; или
s) ассоциированный с синдромом мышечной скованности антиген, получаемый из антигена, выбранного из одного или нескольких из группы: GAD212-226, GAD555-569, GAD297-311, и белок МНС комплекса рМНС содержит весь или часть полипептида из группы: HLA-DR, HLA-DQ или фрагмент или эквивалент любого из них.
В соответствии с определенными аспектами комплекс рМНС предназначен для лечения:
a) диабета I типа, и комплекс рМНС выбран из группы
PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA-DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA, B24-C36-HLA-DRB1*0301/DRA или PP176-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс рМНС выбран из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, МРВ111-129-HLA-DRB5*0101 /DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-HLA-DRB3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеновой болезни, и комплекс рМНС выбран из группы: aGlia57-68-HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72-HLA-DQA1*0501/HLA-DQB1*0201, aGlia217-229-HLA-DQA1*0501/HLA-DQB1*0302 или aGlia217-229-HLA-DQA1*03/HLA-DQB1*0302;
d) первичного биллиарного цирроза, и комплекс рМНС выбран из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB 1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA или PDC-E2535-549-HLA-DRB5*0101/DRA, mPDC-E2166-181-I-Ag7 или mPDC-E282-96-I-Ag7;
e) листовидной пузырчатки и/или обыкновенной пузырчатки, и комплекс рМНС выбран из группы: DG1216-229-HLA-DRB1*0101/DRA, DG1216-229-HLA-DRB1*0102/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4* 0101/DRA, DG3367-381-HLA-DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс рМНС выбран из группы: AQP4129-143-HLA-DRB1*0101/DRA, AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB1*1501/DRA;
g) аллергической астмы, и комплекс рМНС выбран из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30-HLA-DRB1*1501/DRA, DERP1171-185-HLA-DRB1*1501/DRA, DERP-1110-124-HLA-DPB1*0401/DRA, DERP-226-40-HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс рМНС выбран из группы: антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов146-160-HLA-DRB3*0101/DRA, антиген интегразы бактероидов175-189-HLA-DRB3*0101/DRA, антиген интегразы бактероидов1-15-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов30-44-HLA-DRB5*0101/DRA, антиген интегразы бактероидов70-84-HLA-DRB4*0101/DRA, антиген интегразы бактероидов337-351-HLA-DRB4*0101/DRA, антиген интегразы бактероидов171-185-HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/DRA, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380-HLA-DRB3*0101/DRA, Fla-2/Fla-X164-178-HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275-HLA-DRB5*0101/DRA, Fla-2/Fla-X1-15-HLA-DRB5*0101/DRA, Fla-2/Fla-X51-65-HLA-DRB4*0101/DRA, Fla-2/Fla-X269-283-HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0202/DRA, Flа-2/Flа-Х271-285-HLA-DRB3*0202DRA, YIDX78-92-HLA-DRB3*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX93-107-HLA-DRB3*0101/DRA, YIDX98-112-HLA-DRB5*0101/DRA, YIDX23-37-HLA-DRB5*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX195-209-HLA-DRB4*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) COPD и/или эмфиземы, и комплекс рМНС выбран из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин8-22-HLA-DRB5*0101/DRA, эластин94-108-HLA-DRB5*0101/DRA, эластин13-27-HLA-DRB4*0101/DRA, эластин695-709-HLA-DRB4*0101DRA, эластин563-577-HLA-DRB4*0101/DRA, эластин558-572-HLA-DRB4* 0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс рМНС выбран из группы: Сар1864-78-HLA-DRB3*0101/DRA, Cap1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA-DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс рМНС выбран из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA-DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс рМНС выбран из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс рМНС выбран из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60358-372-HLA-DRB4*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB4*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB4*0101/DRA, RO60407-421-HLA-DRB4*0101/DRA, RO60407-421-HLA-DQA1*0501/HLA-DQB1*0201, RO60459-473-HLA-DRB4*0101/DRA, RO60459-473-HLA-DQA1*0501/HLA-DQB1*0201, RO60318-332-HLA-DQA1*0501/HLA-DQB1*0201, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA-DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA297-311-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DQA1*0501/HLA-DQB1*0201, LA59-73-HLA-DRB4*0101/DRA, LA151-165-HLA-DQA1*0501/HLA-DQB1*0201, LA151-165-HLA-DRB4*0101/DRA, LA297-311-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс рМНС выбран из группы: ТОР1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, ТОР1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101/DRA, CENP-C887-901-HLA-DRB3*0101/DRA, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, СЕNР-С832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA или CENP-C847-861-HLA-DRB3*0202/DRA;
о) антифосфолипидного синдрома, и комплекс рМНС выбран из группы: АРОН235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, APOH173-187-HLA-DRB4*0101/DRA, APOH264-278-HLA-DRB4*0101/DRA, APOH295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
p) ассоциированного с ANCA васкулита, и комплекс рМНС выбран из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLA DRB3*0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178-HLA-DRB4*0101/DRA, PRTN371-85-HLA-DRB4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA, PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA; или
q) синдрома мышечной скованности, и комплекс рМНС выбран из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA или GAD297-311-HLA-DRB1*0301/DRA.
В соответствии с определенными аспектами комплекс рМНС предназначен для лечения:
a) диабета I типа, и комплекс рМНС выбран из группы
PPI76-90(K88S)-HLA-DRB1*0401/DRA, IGRP13-25-HLA-DRB1*0301/DRA, GAD555-567-HLA-DRB1*0401/DRA, GAD555-567(557I)-HLA-DRB1*0401/DRA, IGRP23-35-HLA-DRB1*0401/DRA или PPI76-90-HLA-DRB1*0401/DRA;
b) рассеянного склероза, и комплекс рМНС выбран из группы: MBP86-98-HLA-DRB1*1501/DRA, MBP89-101-HLA-DRB5*0101/DRA, MOG38-52-HLA-DRB4*0101/DRA, MOG97-109(E107S)-HLA-DRB1*0401/DRA, MOG203-217-HLA-DRB3*0101/DRA, PLP54-68-HLA-DRB3*0101/DRA, PLP94-108-HLA-DRB1*0301/DRA, PLP250-264-HLA-DRB4*0101/DRA, MPB13-32-HLA-DRB5*0101/DRA, MPB83-99-HLA-DRB5*0101/DRA, MPB111-129-HLA-DRB5*0101/DRA, MPB146-170-HLA-DRB5*0101/DRA, MOG223-237-HLA-DRB3*0202/DRA, MOG6-20-HLA-DRB5*0101/DRA, PLP88-102-HLA-DRB3*0202/DRA или PLP139-154-HLA-DRB5*0101/DRA;
c) глютеновой болезни, и комплекс рМНС выбран из группы: aGlia57-68-HLA-DQA1*0501/HLA-DQB1*0201, aGlia62-72-HLA-DQA1*0501/HLA-DQB1*0201 или aGlia217-229-HLA-DQA1*0501/HLA-DQB1*0302;
d) первичного биллиарного цирроза, и комплекс рМНС выбран из группы: PDC-E2122-135-HLA-DRB4*0101/DRA, PDC-E2249-262-HLA-DRB4*0101/DRA, PDC-E2249-263-HLA-DRB1*0801/DRA, PDC-E2629-643-HLA-DRB1*0801/DRA, PDC-E272-86-HLA-DRB3*0202/DRA, PDC-E2353-367-HLA-DRB3*0202/DRA, PDC-E2422-436-HLA-DRB3*0202/DRA, PDC-E2629-643-HLA-DRB4*0101/DRA, PDC-E280-94-HLA-DRB5*0101/DRA, PDC-E2353-367-HLA-DRB5*0101/DRA или PDC-E2535-549-HLA-DRB5*0101/DRA;
e) листовидной пузырчатки и/или обыкновенной пузырчатки, и комплекс рМНС выбран из группы: DG1216-229-HLA-DRB1*0101/DRA, DG397-111-HLA-DRB1*0402/DRA, DG3251-265-HLA-DRB1*0401/DRA, DG3441-455-HLA-DRB1*0402/DRA, DG3351-365-HLA-DRB3*0202/DRA, DG3453-467-HLA-DRB3*0202/DRA, DG3540-554-HLA-DRB3*0202/DRA, DG3280-294-HLA-DRB4*0101/DRA, DG3326-340-HLA-DRB4*0101/DRA, DG3367-381-HLA-DRB4*0101/DRA, DG313-27-HLA-DRB5*0101/DRA, DG3323-337-HLA-DRB5*0101/DRA, DG3438-452-HLA-DRB5*0101/DRA, DG148-62-HLA-DRB3*0202/DRA, DG1206-222-HLA-DRB3*0202/DRA, DG1363-377-HLA-DRB3*0202/DRA, DG13-17-HLA-DRB4*0101/DRA, DG1192-206-HLA-DRB4*0101/DRA, DG1326-340-HLA-DRB4*0101/DRA, DG11-15-HLA-DRB5*0101/DRA, DG135-49-HLA-DRB5*0101/DRA или DG1325-339-HLA-DRB5*0101/DRA;
f) нейромиелита зрительного нерва со спектральным расстройством, и комплекс рМНС выбран из группы: AQP4284-298-HLA-DRB1*0301/DRA, AQP463-76-HLA-DRB1*0301/DRA, AQP4129-143-HLA-DRB1*0401/DRA или AQP439-53-HLA-DRB1*1501/DRA;
g) аллергической астмы, и комплекс рМНС выбран из группы: DERP-116-30-HLA-DRB1*0101/DRA, DERP-116-30-HLA-DRB1*1501/DRA, DERP1171-185-HLA-DRB1*1501/DRA, DERP-1110-124-HLA-DPB1*0401/DRA, DERP-226-40-HLA-DRB1*0101/DRA; DERP-226-40-HLA-DRB1*1501/DRA, или DERP-2107-121-HLA-DRB1*0301/DRA;
h) воспалительного заболевания кишечника, и комплекс рМНС выбран из группы: антиген интегразы бактероидов1-15-HLA-DRB5*0101/DRA, антиген интегразы бактероидов183-197-HLA-DRB3*0101/DRA, антиген интегразы бактероидов70-84-HLA-DRB4*0101/DRA, антиген интегразы бактероидов4-18-HLA-DRB3*0202/DRA, антиген интегразы бактероидов171-185-HLA-DRB3*0202/DRA, антиген интегразы бактероидов256-270-HLA-DRB3*0202/DRA, Fla-2/Fla-X366-380-HLA-DRB3*0101/DRA, Fla-2/Fla-X261-275-HLA-DRB5*0101/DRA, Fla-2/Fla-X51-65-HLA-DRB4*0101/DRA, Fla-2/Fla-X4-18-HLA-DRB3*0202/DRA, Fla-2/Fla-X261-275-HLA-DRB3*0202/DRA, Fla-2/Fla-X271-285-HLA-DRB3*0202/DRA, YIDX78-92-HLA-DRB3*0101/DRA, YIDX78-92-HLA-DRB4*0101/DRA, YIDX98-112-HLA-DRB5*0101/DRA, YIDX22-36-HLA-DRB3*0202/DRA, YIDX80-94-HLA-DRB3*0202/DRA или YIDX101-115-HLA-DRB3*0202/DRA;
i) эмфиземы, и комплекс рМНС выбран из группы: эластин89-103-HLA-DRB3*0101/DRA, эластин698-712-HLA-DRB5*0101/DRA, эластин558-572-HLA-DRB4*0101/DRA, эластин566-580-HLA-DRB3*0202/DRA, или эластин645-659-HLA-DRB3*0202/DRA;
j) псориаза, и комплекс рМНС выбран из группы: Сар1864-78-HLA-DRB3*0101/DRA, Cap1834-48-HLA-DRB3*0101/DRA, Cap1847-61-HLA-DRB3*0101/DRA, Cap18151-165-HLA-DRB4*0101/DRA, Cap18149-163-HLA-DRB5*0101/DRA, Cap18152-166-HLA-DRB5*0101/DRA, Cap18131-145-HLA-DRB5*0101/DRA, Cap1824-38-HLA-DRB3*0202/DRA, ADMTSL5245-259-HLA-DRB3*0101/DRA, ADMTSL5267-281-HLA-DRB3*0101/DRA, ADMTSL5372-386-HLA-DRB3*0101/DRA, ADMTSL5289-303-HLA-DRB4*0101/DRA, ADMTSL5396-410-HLA-DRB4*0101/DRA, ADMTSL5433-447-HLA-DRB4*0101/DRA, ADMTSL5142-156-HLA-DRB5*0101/DRA, ADMTSL5236-250-HLA-DRB5*0101/DRA, ADMTSL5301-315-HLA-DRB5*0101/DRA, ADMTSL5203-217-HLA-DRB3*0202/DRA, ADMTSL5404-418-HLA-DRB3*0202/DRA или ADMTSL5433-447-HLA-DRB3*0202/DRA;
k) аутоиммунного гепатита, и комплекс рМНС выбран из группы: CYP2D6193-207-HLA-DRB1*0301/DRA, CYP2D676-90-HLA-DRB1*0301/DRA, CYP2D6293-307-HLA-DRB1*0301/DRA, CYP2D6313-332-HLA-DRB1*0301/DRA, CYP2D6393-412-HLA-DRB1*0301/DRA, CYP2D6199-213-HLA-DRB1*0401/DRA, CYP2D6450-464-HLA-DRB1*0401/DRA, CYP2D6301-315-HLA-DRB1*0401/DRA, CYP2D6452-466-HLA-DRB1*0701/DRA, CYP2D659-73-HLA-DRB1*0701/DRA, CYP2D6130-144-HLA-DRB1*0701/DRA, CYP2D6193-212-HLA-DRB1*0701/DRA, CYP2D6305-324-HLA-DRB1*0701/DRA, CYP2D6131-145-HLA-DRB3*0202/DRA, CYP2D6216-230-HLA-DRB3*0202/DRA, CYP2D6238-252-HLA-DRB3*0202/DRA, CYP2D6199-213-HLA-DRB4*0101/DRA, CYP2D6235-252-HLA-DRB4*0101/DRA, CYP2D6293-307-HLA-DRB4*0101/DRA, CYP2D6238-252-HLA-DRB5*0101/DRA, CYP2D6381-395-HLA-DRB5*0101/DRA, CYP2D6429-443-HLA-DRB5*0101/DRA, SLA334-348-HLA-DRB1*0301/DRA, SLA196-210-HLA-DRB1*0301/DRA, SLA115-129-HLA-DRB1*0301/DRA, SLA373-386-HLA-DRB1*0301/DRA, SLA186-197-HLA-DRB1*0301/DRA, SLA317-331-HLA-DRB1*0401/DRA, SLA171-185-HLA-DRB1*0401/DRA, SLA417-431-HLA-DRB1*0401/DRA, SLA359-373-HLA-DRB1*0701/DRA, SLA215-229-HLA-DRB1*0701/DRA, SLA111-125-HLA-DRB1*0701/DRA, SLA110-124-HLA-DRB3*0202/DRA, SLA299-313-HLA-DRB3*0202/DRA, SLA342-356-HLA-DRB3*0202/DRA, SLA49-63-HLA-DRB4*0101/DRA, SLA119-133-HLA-DRB4*0101/DRA, SLA260-274-HLA-DRB4*0101/DRA, SLA26-40-HLA-DRB5*0101/DRA, SLA86-100-HLA-DRB5*0101/DRA или SLA331-345-HLA-DRB5*0101/DRA;
l) увеита, и комплекс рМНС выбран из группы: аррестин199-213-HLA-DRB3*0101/DRA, аррестин77-91-HLA-DRB3*0101/DRA, аррестин250-264-HLA-DRB3*0101/DRA, аррестин172-186-HLA-DRB4*0101/DRA, аррестин354-368-HLA-DRB4*0101/DRA, аррестин239-253-HLA-DRB4*0101/DRA, аррестин102-116-HLA-DRB5*0101/DRA, аррестин59-73-HLA-DRB5*0101, аррестин280-294-HLA-DRB5*0101, аррестин291-306-HLA-DRB1*0301/DRA, аррестин195-209-HLA-DRB3*0202/DRA, аррестин199-213-HLA-DRB3*0202/DRA, или аррестин200-214-HLA-DRB3*0202/DRA;
m) синдрома Шегрена, и комплекс рМНС выбран из группы: RO60127-141-HLA-DRB1*0301/DRA, RO60523-537-HLA-DRB1*0301/DRA, RO60243-257-HLA-DRB1*0301/DRA, RO60484-498-HLA-DRB3*0101/DRA, RO60347-361-HLA-DRB3*0101/DRA, RO60369-383-HLA-DRB3*0101/DRA, RO60426-440-HLA-DRB4*0101/DRA, RO60267-281-HLA-DRB4*0101/DRA, RO60178-192-HLA-DRB4*0101/DRA, RO60358-372-HLA-DRB5*0101/DRA, RO60221-235-HLA-DRB5*0101/DRA, RO60318-332-HLA-DRB5*0101/DRA, RO6051-65-HLA-DRB3*0202/DRA, RO60312-326-HLA-DRB3*0202/DRA, RO60347-361-HLA-DRB3*0202/DRA, LA241-255-HLA-DRB1*0301/DRA, LA101-115-HLA-DRB1*0301/DRA, LA153-167-HLA-DRB1*0301/DRA, LA178-192-HLA-DRB3*0101/DRA, LA19-33-HLA-DRB3*0101/DRA, LA37-51-HLA-DRB3*0101/DRA, LA133-147-HLA-DRB4*0101/DRA, LA50-64-HLA-DRB4*0101/DRA, LA32-46-HLA-DRB4*0101/DRA, LA153-167-HLA-DRB5*0101/DRA, LA83-97-HLA-DRB5*0101/DRA, LA136-150-HLA-DRB5*0101/DRA, LA50-64-HLA-DRB3*0202/DRA, LA86-100-HLA-DRB3*0202/DRA или LA154-168-HLA-DRB3*0202/DRA;
n) склеродермии, и комплекс рМНС выбран из группы: ТОР1346-360-HLA-DRB3*0101/DRA, TOP1420-434-HLA-DRB3*0101/DRA, TOP1750-764-HLA-DRB3*0101/DRA, TOP1419-433-HLA-DRB4*0101/DRA, TOP1591-605-HLA-DRB4*0101/DRA, TOP1695-709-HLA-DRB4*0101/DRA, TOP1305-319-HLA-DRB5*0101/DRA, TOP1346-360-HLA-DRB5*0101/DRA, TOP1419-433-HLA-DRB5*0101/DRA, TOP1420-434-HLA-DRB3*0202/DRA, TOP1425-439-HLA-DRB3*0202/DRA, TOP1614-628-HLA-DRB3*0202/DRA, CENP-C297-311-HLA-DRB3*0101/DRA, CENP-C857-871-HLA-DRB3*0101, CENP-C887-901-HLA-DRB3*0101, CENP-C212-226-HLA-DRB4*0101/DRA, CENP-C643-657-HLA-DRB4*0101/DRA, CENP-C832-846-HLA-DRB4*0101/DRA, CENP-C167-181-HLA-DRB5*0101/DRA, CENP-C246-260-HLA-DRB5*0101/DRA, CENP-C846-860-HLA-DRB5*0101/DRA, CENP-C149-163-HLA-DRB3*0202/DRA, CENP-C833-847-HLA-DRB3*0202/DRA, или CENP-C847-861-HLA-DRB3*0202/DRA;
о) антифосфолипидного синдрома, и комплекс рМНС выбран из группы: АРОН235-249-HLA-DRB3*0101/DRA, APOH306-320-HLA-DRB3*0101/DRA, APOH237-251-HLA-DRB3*0101/DRA, APOH295-309-HLA-DRB3*0101/DRA, APOH28-42-HLA-DRB4*0101/DRA, АРОН173-187-HLA-DRB4*0101/DRA, АРОН264-278-HLA-DRB4*0101/DRA, АРОН295-309-HLA-DRB4*0101/DRA, APOH49-63-HLA-DRB5*0101/DRA, APOH269-283-HLA-DRB5*0101/DRA, APOH295-309-HLA-DRB5*0101/DRA, APOH321-355-HLA-DRB3*0202/DRA, APOH322-336-HLA-DRB3*0202/DRA или APOH324-338-HLA-DRB3*0202/DRA;
р) ассоциированного с ANCA васкулита, и комплекс рМНС выбран из группы: MPO506-520-HLA-DRB3*0101/DRA, MPO302-316-HLA-DRB3*0101/DRA, MPO7-21-HLA-DRB3*0101/DRA, MPO689-703-HLA-DRB4*0101/DRA, MPO248-262-HLA-DRB4*0101/DRA, MPO444-458-HLA-DRB4*0101/DRA, MPO513-527-HLA-DRB5*0101/DRA, MPO97-111-HLA-DRB5*0101/DRA, MPO616-630-HLA-DRB5*0101/DRA, MPO462-476-HLA-DRB3*0202/DRA, MPO617-631-HLA-DRB3*0202/DRA, MPO714-728-HLA-DRB3*0202/DRA, PRTN344-58-HLA-DRB3*0101/DRA, PRTN3234-248-HLA-DRB3*0101/DRA, PRTN359-73-HLA DRB3*0101/DRA, PRTN359-73-HLA-DRB5*0101/DRA, PRTN3117-131-HLA-DRB4*0101/DRA, PRTN3164-178-HLA-DRB4*0101/DRA, РRТМ371-85-HLA-DРВ4*0101/DRA, PRTN3241-255-HLA-DRB5*0101/DRA, PRTN3183-197-HLA-DRB5*0101/DRA,PRTN362-76-HLA-DRB3*0202/DRA, PRTN3118-132-HLA-DRB3*0202/DRA или PRTN3239-253-HLA-DRB3*0202/DRA; или
q) синдрома мышечной скованности, и комплекс рМНС выбран из группы: GAD212-226-HLA-DRB1*0801/DRA, GAD555-569-HLA-DRB1*0801/DRA или GAD297-311-HLA-DRB1*0301/DRA.
В соответствии с определенными аспектами в настоящем документе предоставлены способы лечения диабета I типа у нуждающегося в этом индивидуума, включающие введение эффективного количества комплекса или композиции, описываемых в настоящем документе, где комплекс и композиция могут содержать одну или несколько сердцевин наночастицы, связанных с множеством комплексов рМНС, где антиген комплекса рМНС представляет собой ассоциированный с диабетом антиген, где белок МНС комплекса рМНС содержит белок МНС класса II, где диаметр сердцевины наночастицы составляет приблизительно от 1 нм до приблизительно 100 нм, и где плотность рМНС на сердцевине наночастицы составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2. В соответствии с определенными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 1 нм до приблизительно 75 нм; приблизительно от 1 нм до приблизительно 50 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 1 нм до приблизительно 25 нм; приблизительно от 5 нм до приблизительно 100 нм; приблизительно от 5 нм до приблизительно 50 нм; или приблизительно от 5 нм до приблизительно 25 нм, или приблизительно от 15 нм до приблизительно 25 нм, или приблизительно 20 нм. В соответствии с определенными вариантами осуществления диаметр сердцевины наночастицы составляет приблизительно от 25 нм до приблизительно 60 нм, или приблизительно от 25 нм до приблизительно 50 нм, или приблизительно от 20 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 50 нм, или приблизительно от 15 нм до приблизительно 40 нм, или приблизительно от 15 нм до приблизительно 35 нм, или приблизительно от 15 нм до приблизительно 30 нм, или приблизительно от 15 нм до приблизительно 25 нм, или, альтернативно, приблизительно 15 нм, или приблизительно 20 нм, или приблизительно 25 нм, или приблизительно 30 нм, или приблизительно 35 нм, или приблизительно 40 нм. В соответствии с определенными вариантами осуществления плотность рМНС на сердцевине наночастицы составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 11,0 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 10 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 9 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 8 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 7 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 5 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 4 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 3 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 2 рМНС/100 нм2, или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В соответствии с определенными вариантами осуществления плотность рМНС на сердцевине наночастицы составляет приблизительно от 0,4 рМНС/100 нм2 до приблизительно 6 рМНС/100 нм2 или приблизительно от 0,4 рМНС/100 нм2 до приблизительно 1,5 рМНС/100 нм2. В соответствии с определенными вариантами осуществления комплекс рМНС содержит антиген, получаемый из одного или нескольких из IGRP или PPI. В соответствии с определенными вариантами осуществления комплекс рМНС содержит антиген, выбранный из одного или нескольких из группы: IGRP13-25, PPI76-90 или PPI76-90(K88S). В соответствии с определенными вариантами осуществления комплекс рМНС содержит HLA-DR. В соответствии с определенными вариантами осуществления комплекс рМНС содержит HLA-DR/DRA. В соответствии с определенными вариантами осуществления комплекс рМНС содержит, или, альтернативно, состоит, или даже еще более по существу состоит из одного или нескольких из IGRP13-25-HLA-DRB1*0301/DRA, PPI76-90-HLA-DRB1*0401/DRA или PPI76-90(K88S)-HLA-DRB1*0401/DRA.
В данной области известны и в настоящем документе кратко описаны способы определения и мониторинга терапии. При доставке in vitro введение осуществляют посредством приведения композиции в контакт с тканью или клетками любым подходящим способом, например, посредством введения в среду для культивирования клеток или ткани, и оно пригодно в качестве скрининга для определения пригодности терапии для индивидуума или скрининга альтернативных терапевтических средств для применения в качестве замены или в комбинации с описываемыми композициями. При введении in vivo введение проводят посредством системного или местного введения. До введения человеку способы in vivo можно проводить у не являющегося человеком животного для скрининга альтернативных терапевтических средств для применения в качестве замены или в комбинации с описываемыми композициями. У человека или не являющегося человеком млекопитающего они также пригодны для лечения заболевания или нарушения.
Указанные способы требуют введения эффективного количества комплекса антиген/МНС, функционально связанного с наночастицами, как описано выше в настоящем документе, которые необязательно могут дополнительно содержать, альтернативно в значительной степени состоять, или даже более того, состоять из костимулирующих молекул и/или цитокинов, связанных той же наночастицей. Заболевания-мишени и ассоциированные антигены описаны выше в настоящем документе.
Подробности относительно способов введения in vitro и in vivo описаны выше в настоящем документе.
Настоящее изобретение также относится к применению комплексов NP для получения лекарственных средств для лечения и/или профилактики заболеваний и нарушений, как описано в настоящем документе.
Мониторинг терапии и детекция Т-клеток
Определенные аспекты настоящего изобретения относятся к способам детекции и/или мониторинга популяции иммуноцитов, предпочтительно Т-клеток, включающим введение меченого комплекса антиген-МНС, когда индивидууму вводили pMHC-NP или композицию, как описано в настоящем документе.
В соответствии с определенными аспектами в настоящем документе предоставлены способы детекции популяции клеток TR1 и/или эффекторных Т-клеток специфичным для антигена способом у индивидуума, который получал комплекс или композицию, описываемые в настоящем документе. Способ включает, альтернативно состоит, или даже более по существу состоит из приведение образца с предположительным содержанием клеток TR1 в контакт с эффективным количеством меченого комплекса рМНС с формированием мультимерного комплекса, и детекции любого мультимерного комплекса, таким образом детектируя популяцию клеток TR1. В соответствии с определенными вариантами осуществления способ дополнительно включает, альтернативно дополнительно состоит, или даже более по существу состоит из окрашивания любой популяции Т-клеток с использованием меченого мультимерного комплекса. В соответствии с определенными вариантами осуществления этап детекции популяция клеток TR1 содержит проточную цитометрию для детекции любого мультимерного комплекса. В соответствии с определенными вариантами осуществления способ дополнительно включает, или, альтернативно, состоит, или даже более по существу состоит из введения индивидууму комплекса или композиции.
В соответствии с определенными аспектами в настоящем документе предоставлены способы детекции популяции клеток TR1 и/или эффекторных Т-клеток специфичным для антигена способом у индивидуума, который получал комплекс или композицию, описываемые в настоящем документе. Способ включает, альтернативно состоит, или даже более по существу состоит из любого из следующих анализов: анализ цитокинов ELISPOT, анализ эпитопов под контролем мультимеров или анализ осаждения мультимеров. В соответствии с определенными вариантами осуществления способ дополнительно включает, альтернативно дополнительно состоит, или даже более по существу состоит из введения комплекса или композиции, описываемых в настоящем документе.
В соответствии с другими аспектами в настоящем документе предоставлены способы мониторинга размножения популяции антигенспецифичных TR1 и/или эффекторных Т-клеток у индивидуума. Способ включает, альтернативно состоит, или даже более по существу состоит из: а) введения индивидууму эффективного количества комплекса или композиции, описываемых в настоящем документе, где для размножения антигенспецифичных TR1 и/или эффекторных Т-клеток в комплексе рМНС выбран ассоциированный с заболеванием антиген; b) выделения подходящего образца у индивидуума с предполагаемьм наличием популяции; с) приведения образца в контакт с эффективным количеством меченого комплекса рМНС с формированием мультимерного комплекса, и детекции любого мультимерного комплекса; и d) количественного определения количества популяций антигенспецифичных TR1 и/или эффекторных Т-клеток. В соответствии с определенными вариантами осуществления способ дополнительно включает, альтернативно дополнительно состоит, или даже более по существу состоит из окрашивания любого мультимерного комплекса. В соответствии с определенными вариантами осуществления этап количественного определения количества антигенспецифичных TR1 и/или эффекторных Т-клеток включает проточную цитометрию и/или ИФА. В соответствии с определенными вариантами осуществления способ дополнительно включает, альтернативно дополнительно состоит, или даже более по существу состоит из введения комплекса или композиции, описываемых в настоящем документе.
Существует множество типов иммунологических анализов, которые можно использовать. Иммунологические анализы, включаемые в настоящее изобретение в качестве неограничивающих примеров включают анализы, описанные в патенте США 4367110 (сэндвич-анализ с двумя моноклональными антителами) и патенте США 4452901 (вестерн-блоттинг). Другие анализы включают иммунопреципитацию меченых лигандов и иммуноцитохимию, in vitro и in vivo.
Один из способов количественного определения количества циркулирующих антигенспецифичных иммуноцитов представляет собой анализ тетрамеров. В этом анализе специфичный эпитоп связывается с синтетическими мультимерными формами флуоресцентно меченых молекул МНС. Так как иммуноциты распознают антигены в форме коротких пептидов, связанных с молекулами МНС, клетки с соответствующим Т-клеточным рецептором связываются с мечеными тетрамерами, и их можно количественно определять посредством проточной цитометрии. Хотя этот способ является менее времязатратным, чем анализ ELISPOT, в анализе мультимеров определяют только связывание, а не функцию. Не все клетки, которые связывают конкретный антиген, обязательно активируются. Однако корреляция между анализами ELISPOT, мультимеров и цитотоксичности продемонстрирована.
Как правило, иммунологические анализы представляют собой анализы связывания. В данной области известны определенные иммунологические анализы, включая различные типы твердофазных иммуноферментных анализов (ИФА), радиоиммунологических анализов (RIA) или анализов на основе гранул, таких как технология Luminex®. Также особенно пригодной является иммуногистохимическая детекция с использованием тканевых срезов.
В одном из примеров ИФА антитела или антигены иммобилизованы на выбранной поверхности, такой как лунка в полистироловом планшете для микротитрования, тест-полоска или носитель колонки. Затем в лунки добавляют тестируемую композицию, предположительно содержащую требуемые антиген или антитело, такую как клинический образец. После связывания и отмывки для удаления неспецифически связанных иммунных комплексов, можно детектировать связанные антиген или антитело. Как правило, детекцию проводят, добавляя другое антитело, специфичное к требуемым антигену или антителу, которое связано с детектируемой меткой. Этот тип ИФА известен как "сэндвич-ИФА". Детекцию также можно проводить, добавляя второе антитело, специфичное к требуемому антигену, с последующим добавлением третьего антитела с аффинностью связывания к второму антителу, где третье антитело связано с детектируемой меткой. Вариации способов ИФА известны специалистам в данной области.
Также возможны конкурентные ИФА, в которых тестируемые образцы конкурируют за связывание с известными количествами меченых антигенов или антител. Количество реакционноспособных молекул в неизвестном образце определяют, смешивая образец с известными мечеными молекулами до или при инкубации с покрытыми лунками. Присутствие реакционноспособных молекул в образце снижает количество меченых молекул, доступных для связывания с лунками и, таким образом, снижает конечный сигнал.
Вне зависимости от используемого формата у ИФА существуют определенных общие характеристики, такие как покрытие, инкубация или связывание, отмывка для удаления неспецифически связанных молекул и детекция связанных иммунных комплексов.
Антиген или антитела также можно связывать с твердой подложкой, например, в форме планшета, гранул, тест-полоски, мембраны или матрикса колонки, а образец для анализа наносят на иммобилизованные антиген или антитело. При покрытии планшета антигеном или антителом, как правило, лунки планшета инкубируют с раствором антигена или антитела в течение ночи или в течение определенного периода. Затем лунки планшета отмывают для удаления неполностью адсорбированного материала. Затем любые оставшиеся доступные поверхности лунок "покрывают" неспецифическими белками, которые являются антигенно нейтральными в отношении тестируемых антисывороток. Они включают бычий сывороточный альбумин (BSA), казеин и растворы порошкового молока. Покрытие позволяет блокировать участки неспецифической адсорбции на иммобилизующей поверхности и, таким образом, снижает фон, обусловленный неспецифическим связыванием антисыворотки на поверхности.
Как правило, при ИФА используют средства вторичной или третичной детекции, а не прямой способ. Таким образом, после связывания антигена или антитела с лункой, покрытие нереакционноспособным материалом для снижения фона и отмывки для удаления несвязанного материала иммобилизующую поверхность приводят в контакт с тестируемым клиническим или биологическим образцом в условиях, обеспечивающих эффективное формирование иммунных комплексов (антиген/антитело). Затем для детекции иммунных комплексов необходимы меченый вторичный связывающий лиганд или антитело или вторичный связывающий лиганд или антитело в сочетании с меченым третичным антителом или третьим связывающим лигандом.
Кроме того, проточную цитометрию можно использовать для детекции и количественного определения конкретных подтипов клеток в соответствии с поверхностными клеточными маркерами. Общие средства детекции и количественного определения посредством проточной цитометрии включают использование флуоресцентно меченых гранул, которые связываются с поверхностными клеточными маркерами, специфичными для каждого из подтипов иммуноцитов, например, специфичными к CD4 гранулами, для отбора CD4+ Т-клеток и т.д.
Наборы
Также в настоящем документе предоставлены наборы, содержащие комплексы наночастиц, как описано в настоящем документе, или композиции, как описано в настоящем документе, для диагностического, прогностического или терапевтического применения. По мере необходимости можно предоставлять дополнительные реагенты и/или инструкции.
Примеры
Приводимые ниже примеры приведены с целью иллюстрации различных вариантов осуществления изобретения и не предназначены для какого-либо ограничения настоящего изобретение. Специалист в данной области легко поймет, что настоящее изобретение хорошо адаптировано для выполнения задач и осуществления указанных целей и преимуществ, а также задач, целей и преимуществ, вытекающих из настоящего документа. Настоящие примеры, вместе со способами, описываемыми в настоящем документе, в настоящее время являются представлением вариантов осуществления и являются иллюстративными, и не предназначены для ограничения объема изобретения. Специалистам в данной области очевидны изменения в них и другие использования, которые включены в сущность изобретения, как определено областью формулы изобретения.
Пример 1. Полимерные и дендримерные сердцевины наночастиц для аутоиммунитета и иммунитета
Большая антигенная сложность аутоиммунных заболеваний и других хронических воспалительных процессов, включая аллергию, является барьером для разработки стратегий, которые могли бы избавить иммунную систему от ауто- или аллергенной активности без нарушения системного иммунитета; современные системные иммуносупрессорные подходы нарушают иммунитет к инфекциям и злокачественным опухолям.
Таким образом, в одном из аспектов в настоящем изобретении установлено, что системная доставка наночастиц (NP), покрытых молекулами аутоиммунный или ассоциированный с аллергическим заболеванием пептид-главный комплекс гистосовместимости (рМНС) класса II, инициирует размножение in vivo распознающих CD4+ Т-клеток Т-регуляторного типа 1 (TR1) в различных моделях заболеваний и при различном генетическом окружении, что приводит к разрешению различных аутоиммунных или аллергических процессов, включая спонтанный диабет 1 типа, экспериментальный аутоиммунный энцефаломиелит и индуцированную клещом домашней пыли астму. Эти нанолекарства стимулируют дифференцировку примированных в отношении заболевания предшественников аутореактивных Т-клеток в супрессирующие заболевание клетки TR1, которые затем продолжают подавлять ответ аутореактивных и аллергенспецифичных Т-клеток в пораженных тканях посредством направленного воздействия на аутоантигенные или нагруженные аллергеном антигенпрезентирующие клетки (АРС), при этом не реагируя с ненагруженными АРС в других участках организма. Супрессия заболевания не уменьшает способность хозяина устранять вирусные инфекции или производить ответ антителами на общепринятые вакцины; опосредована локальной секрецией IL-10 и TGF-бета в ответ на эти взаимодействия распознающие TR1-APC; и включает глубокое ингибирование способности локальных (но не дистальных) АРС секретировать провоспалительные цитокины и активировать другие Т-клетки. Кроме того, выявлено, что размножившиеся клетки TR1 инициируют in vivo дифференцировку распознающих В-лимфоцитов в продуцирующие IL-10 регуляторные В-клетки, которые способствуют существенной терапевтической активности этой терапевтической платформы. Важно отметить, что примеры демонстрируют, что соответствующие диабету человека 1 типа нанолекарства могут размножать клетки TR1 человека, трансплантированные с полученными у пациентов мононуклеарными клетками периферической крови, у мышей NSG, что демонстрирует трансляционный потенциал этого подхода. Таким образом, основанные на рМНС класса II нанолекарства могут представлять долго ожидаемую антигенспецифичную терапию аутоиммунного и аллергического воспаления. Подобных результатов можно достигать с основанными на рМНС класса I нанолекарствами для размножения соответствующих популяций Т-клеток.
Определено, что терапевтические свойства этих нанолекарств преимущественно представляют собой функцию плотности МНС (межмолекулярной дистанции). Математическое моделирование экспериментальных данных свидетельствует, что для любой данной валентности рМНС, небольшие, но плотно покрытые NP обладают превосходной биологической и терапевтической активностью.
В одном из аспектов превосходные результаты продемонстрированы для диаметра сердцевины NP приблизительно 8-12 нм. Способность связывания МНС NP из пегилированного оксида железа соответствует ≈55 рМНС на NP с гидродинамическим диаметром 68 нм.
При получении основанных на МНС нанолекарств с использованием основанных на поли-L-лизине дендримерах третьей генерации (DGL; 7 нм) это ограничение преодолено. Упорядоченная структура акцептирующих рМНС PEG на эти соединениях увеличивает лиганд-связывающую способность (таким образом, молекулярную плотность) в несколько раз (52 рМНС на pMHC-DGLN 19 нм с гидродинамическим диаметром в сравнении с 55 рМНС на pMHC-IONP с диаметром 68 нм, что приводит к кратному увеличению плотности рМНС, критическому параметру биологической активности).
Дендримеры представляют собой высокоразветвленные макромолекулы с древообразной структурой, с ветвями, растущими из сердцевины. Они хорошо известны по их трехмерной, монодисперсной, высокоразветвленной макромолекулярной наноскопической архитектуре с рядом реакционноспособных концевых групп.Эти свойства в дополнение ко многим другим биомедицинским применениям делают дендримеры популярными инструментами для доставки лекарственных средств, пептидов и генов.
Хорошо исследованные дендримеры в основном несут на разветвленной поверхности первичные аминогруппы, например, дендримеры на основе поли-(амидоамина) (РАМАМ) и поли-L-лизина (PLL). Эти дендримеры растворимы в воде при физиологических рН вследствие присутствия заряженных концевых групп NH3+. Однако катионные дендримеры РАМАМ демонстрируют бионесовместимость, бионеразлагаемость и положительную ассоциацию с цитотоксичностью, что ограничивает их широкое применение in vitro и in vivo.
Катионные PLL являются новыми многообещающими кандидатами вследствие их свойств биоразлагаемости. Предшествующее исследование продемонстрировало, что свободный лизин и более крупные молекулы (недендримерные) появлялись в плазме через 1 час после дозирования покрытых L-лизином дендримеров, что указывает на быстрое разрушение PLL in vivo (Bailey-Bucktrout, S.L. et al. (2013) Immunity 39:949-962). Однако быстрое разрушение не является положительным эффектом для поддержания эффективного терапевтического уровня. К счастью опубликовано, что полностью пегилированные дендримеры из PLL обладают большими способностью к увеличенной стабильности в плазме и временем циркуляции, при этом полностью маскируя положительный заряд на поверхности. Основанные на дендримеры из PLL уже использовали в конструировании систем доставки лекарственных средств. Kaminskas с коллегами конъюгировали метотрексат (МТХ) с рядом пегилированных дендримеров из PLL и продемонстрировали их потенциал в качестве длительно циркулирующих векторов для доставки и направленного на опухоль действия гидрофобных лекарственных средств. Другие исследователи ковалентно связывали камптотецин (СРТ) с пегилированными дендримерами из PLL и продемонстрировали значимо увеличенную продолжительность жизни у несущих опухоль мышей по сравнению со свободным СРТ. Однако большинство из использованных дендримеры на основе PLL синтезировали сами исследователи. Структуры этих дендримеров на основе PLL не являлись в точности одинаковыми, что значительно ограничивает распространенность этих дендримеров.
Привитой древовидный поли-L-лизин (DGL), разновидность дендримеров на основе PLL, является новым коммерчески доступным продуктом. Он на 100% состоит из L-лизина, является биоразлагаемым, монодисперсным и хорошо определенным, обладая основными свойствами дендримеров на основе PLL. Текущие исследования сфокусированы на пригодности DGL для доставки лекарственных средств или генов. Насколько известно заявителю DGL никогда ранее не использовали в области представления рМНС Т-клеткам в кровотоке. В настоящем исследовании в качестве каркаса для презентации рМНС и оценки иммунологической активности использовали DGL генерации 3 (G3) (123 аминогруппы, 7 нм).
Получение, очистка и характеристика pMHC-PEG-DGL
В настоящем исследовании в качестве векторного материала выбран DGL G3 с 123 аминогруппами. Его поверхность покрывают гетеробифункциональным сшивающим средством, NHS-PEG4-азидо (MW 388 г/моль) посредством специфической реакции между первичными аминогруппами и активированным сложным эфиром NHS. Гетеробифункциональный PEG, малеинимид-PEG-алкин (Mal-PEG-алкин, MW 2000) может конъюгировать с молекулой рМНС посредством тиол-малеинимидной реакции. Свободный алкин на конце конъюгатов pMHC-PEG может реагировать с покрытыми азидами DGL посредством клик-химии. Полученные NP очищали посредством гель-фильтрации для удаления неконъюгированных рМНС. Значительные изменения заряда DGL до и после покрытия можно наблюдать посредством Z-потенциала и электрофореза в агарозном геле. Получаемые NP можно характеризовать посредством DLS, Z-потенциала, SDS-page и ТЕМ.
Привитой древовидный поли-L-лизин генерации 3 (DGL G3)
В другом исследовании в COLCOM во Франции приобретали привитой древовидный поли-L-лизин генерации 3 (DGL G3). DGL G3 представляет собой синтетический полимер со структурой, состоящей из девяти эквивалентных дендронов, связанных с сердцевиной. Сердцевина представляет собой линейный поли-L-лизин в среднем с восемью мономерами. Каждый дендрон выглядит как традиционные дендроны Tam-типа, синтезированные из смол Меррифилда. DGL G3 представляет собой неиммуногенный носитель с молекулярной массой 22 КДа и 123 конечными первичными аминогруппами (-NH2) для функционализации и конъюгации (фигура 3).
Синтез привитого древовидного поли-L-лизиназидо (-N3) ("DGLN")
Сначала DGL функционализировали N-гидроксисукцинимид-PEG4-азидо (NHS-PEG4-азидо, MW 388,37, приобретаемым в Conju-Probe, Canada) чтобы: 1) обеспечить конъюгацию рМНС и 2) нейтрализовать положительный поверхностный заряд нефункционализированных DGL.
Функционализацию поверхности DGL проводили с использованием гетеробифункционального сшивающего средства, NHS-PEG4-азидо. Активированный сложный эфир NHS легко реагирует с первичными аминогруппами на DGL в мягких водных условиях. Приблизительно 1 мг DGL-NH2 растворяли в PBS, при рН приблизительно 8,0. В раствор добавляли приблизительно 4,3 мг NHS-PEG4-N3 (-NH2:PEG4=1:2, моль:моль) и проводили реакцию при комнатной температуре приблизительно в течение 2 часов. После реакции DGL-N3 три раза отмывали посредством ультрафильтрации (порог MW 3000) с PBS при рН приблизительно 7,4 для удаления непрореагировавшего NHS-PEG4-N3 (фигура 4).
Конъюгация рМНС с DGLN (фиг. 5)
Для конъюгации мономеров рМНС с поверхностью DGLN одноцепочечную конструкцию NRP-V7/Kd, сконструированную так, чтобы кодировать С-концевой Cys (-SH) сначала пегилировали и получали в клетках СНО (обозначая как V7CHO-Cys). В кратком изложении, 3,5 мл раствора V7CHO-Cys (3,58 мг/мл) в PBS рН 7,4 смешивали с 24 мкл 500 мМ ЭДТА, 375 мкл 1М NaCl, 500 мкл 200 мМ буфера РВ и 1,625 мл воды ETF. Затем в смесь добавляли 4 мг Малеимид-PEG2k-алкин (конечный объем реакционной смеси составлял 6,0 мл) и оставляли для реакции в течение ночи при комнатной температуре. Затем реакционный раствор подвергали диализу против PBS рН 7,4 при 4°С в течение 48 часов.
Затем раствор V7CHO-PEG2k-алкина концентрировали до конечного объема 3,5 мл в PBS рН 7,4 в атмосфере азота и добавляли 60 мкл DGLN (5 мг/мл в PBS), 150 мкл аскорбиновой кислоты (50 мМ в PBS) и 175 мкл Cu-ТВТА, что оставляли для реакции в течение 24 часов при комнатной температуре. После реакции наночастицы очищали посредством ультрафильтрации (порог MW 100 КДа) против PBS рН 7,4, 6 раз.
Биохимический и биофизический анализы конъюгатов
Конъюгаты анализировали посредством нативного и денатурирующего (SDS) PAGE. На фигуре 6 представлен присутствие заметного окрашенного кумасси синим пятна в условиях нативного PAGE (два левых панели), с детекцией конъюгированных с рМНС DLGN, в отсутствие свободного (неконъюгированного) мономера V7CHO. Электрофорез этих соединений в денатурирующих/восстановительных условиях выявил высвобождение V7CHO из NP, подтверждая успешность конъюгации рМНС с DLGN.
Затем определяли биофизические свойства соединения pMHC-DGLN с использованием атомно-силовой микроскопии (AFM) (фигура 7). В кратком изложении, раствор NP наслаивали на слюду и наблюдали с помощью AFM. V7CHO-DGLN демонстрировали сферическую конформацию со средним диаметром 19,95±0,25 нм (измерения при AFM). NP были хорошо распределены с монодисперсностью. Индекс полидисперсности (PI) и гидродинамический диаметр в водном растворе тестировали посредством DLS. Концентрация, использованная для получения образца для AFM, составляла 4 мкг DGLN/мл (эквивалентно 4,38×1013 NP/мл). Анализ проводили с использованием 5 мкл этого раствора (≈2,19×1011 NP) на площади сканирования 1 мкм × 1 мкм.
Анализ Брэдфорда продемонстрировал, что содержание рМНС соединения, описанного выше, соответствовал 52 мономерам рМНС на каждую NP.
В заключение, для определения наличия у этого соединения агонистической активности в отношении распознающих Т-клеток определяли его способность инициировать секрецию IFNγ специфичными к NRP-V7/Kd CD8+ Т-клетками, выделенными у трансгенных по 8.3-TCR мышей NOD. В кратком изложении, 8.3-CD8+ Т-клетки культивировали в присутствии свободного белка V7CHO, пегилированного V7CHO, V7CHO-DGLN или DGLN в течение 48 часов. Затем определяли содержание IFN-γ в супернатантах посредством ИФА. На фигурах 8А-8В представлено, что V7CHO-DGLN и, в значительно меньшей степени, пегилированный V7CHO, обладали очень высокой зависимой от концентрации агонистической активностью в отношении этих Т-клеток, демонстрируя функциональные свойства этих соединений.
Получение, очистка и характеристика мицелл pMHC-PEG-DSPE.
Амфифильные блок-сополимеры собираются в структуры сердцевина-оболочка наномасштаба, полимерные мицеллы, которые представляли существенный интерес для доставки лекарственных средств с плохой водорастворимостью. Блок-сополимеры поли(этиленгликоль)-дистеароилфосфатидилэтаноламин (PEG-DSPE) являются безопасными, биосовместимыми и одобрены Food and Drug Administration для клинических применений. DSPE-PEG наряду с другими широко использовали для получения липосом, полимерных наночастиц, полимерных гибридных наночастиц и твердых липидных наночастиц. Амфифильные сополимеры представляют собой наноструктуры, состоящие из гидрофобной сердцевины (DSPE) и гидрофильной оболочки (PEG). Структура сердцевина-оболочка может инкапсулировать и нести плохо растворимые в воде лекарственные средства, накапливая их в сердцевине DSPE, a оболочка PEG снижает выведение in vivo и адсорбцию белков плазмы. Таким образом, использование DSPE-PEG для формирования наноструктур может продлить циркуляцию в организме. Наиболее важно, что критическая концентрация мицелл (CMC) DSPE-PEG является экстремально низкой (10-5 М). Это свойство приводит к определенным положительным функциям формулируемых мицелл, таким как большая растворимость гидрофобных лекарственных средств и большая термодинамическая стабильность при разбавлении большим объемом крови после внутривенного введения.
Для нанесения рМНС на поверхность полимерных мицелл, в качестве сополимеров выбирали DSPE-PEG-малеинимид (DSPE-PEG-Mal). Полимерные мицеллы DSPE-PEG получают способом выпаривания растворителя, как описано в Vakil, R. et al. (2008) Mol. Pharm. 5: 98-104 и Musacchio, T. et al. (2009) Mol. Pharm. 6:468-479. В кратком изложении, DSPE-PEG-Mal растворяли в метаноле в круглодонной колбе. Смесь с органическим растворителем выпаривали в высоком вакууме с получением тонкой пленки сополимеров. Эту пленку дополнительно сушили в вакууме в течение ночи для удаления любых следов оставшихся растворителей. Затем сухую полимерную пленку растворяли в PBS рН 7,4 для самосборки в мицеллы с малеинимидными группами на поверхности. рМНС можно конъюгировать на поверхности мицелл посредством специфичной тиол-малеинимидной реакции. Полученные NP очищали посредством гель-фильтрации для удаления неконъюгированных рМНС. После этого полученные NP можно характеризовать посредством DLS, Z-потенциала, SDS-page и ТЕМ.
Пример 2
Размножение специфичных для заболевания клеток TR1
Заявитель обрабатывал страдающих диабетом мышей без ожирения (NOD) и мышей NOD Foxp3-eGFP, экспрессирующих усиленный зеленый флуоресцентный белок (eGFP) под контролем промотора Foxp3 мыши) непокрытыми наночастицами или наночастицами, покрытыми рМНС, 2.5mi/I-Ag7 (Stratmann, Т. et al. (2003) J. Clin. Invest. 112:902-914), распознаваемыми диабетогенным специфичным к BDC2.5 Т-клеточным рецептором (TCR), или мономерами 2.5mi/I-Ag7. Наночастицы, покрытые 2.5mi/I-Ag7, индуцировали размножение распознающих CD4+ Т-клеток в крови и селезенке всех мышей (фиг. 9А, 9В). Эти клетки обладали подобным клеткам памяти (CD44hiCD62Llow) FOXP3- подобным TR1 фенотипом, экспрессируя ICOS, латентно-ассоциированный TGF-β и маркеры TR1 CD49b и LAG-3 (фиг. 9С, 9D). Подобный результат наблюдали у мышей, обработанных 2.5mi/I-Ag7-NP после удаления CD4+CD25+ Т-клеток (фигура 14А). В отличие от их аналогов тетрамер-, эти клетки в ответ на дендритные клетки (DC) импульсно вводимые с пептидом 2.5mi пролиферировали и секретировали IL-10 и в меньшей степени IFNγ, но не IL-2, IL-4 или IL-17 (фигура 14В). Анализы с использованием обратной транскрипции(ОТ)-ПЦР с детекцией в реальном времени подтвердили подобный TR1 фенотип этих клеток (таблицы 3А-3В).
Для определения способности pMHCII-NP непосредственно инициировать маркер TR1 и экспрессию IL-10 на распознающих CD4+ Т-клетках заявитель культивировал наивные и предварительно активированные моноклональными антителами (mAb) к CD3 и к CD28 тетрамер 2.5mi/I-Ag7+CD4+ Т-клетки трансгенных мышей NOD BDC2.5-TCR-Foxp3-eGFP или мышей NOD Il11GFP (несущих вставку eGFP в локусе Il10) (Kamanaka, M. et al. (2006) Immunity 25:941-952) в присутствии 2.5mi/I-Ag7-NP, пептида 2.5mi или мономера 2.5mi/I-Ag7. Наивные Т-клетки не экспрессировали ни CD49b, ни LAG-3 даже после инкубации с 2.5mi/I-Ag7-NP, мономером 2.5mi/I-Ag7 или пептидом 2.5mi (фиг. 14С, 14D). Однако предварительно активированные Т-клетки повышали экспрессию обоих маркеров, а также eGFP (IL-10) только в ответ на 2.5mi/I-Ag7-NP(фиг. 14D, 14Е). В соответствии с этим экспрессия IL-10 у мышей NOD Il10GFP, обработанных 2.5mi/I-Ag7-NP, была в основном ограничена субпопуляцией CD49b+ LAG-3+ CD4+ (фигура 14F).
In vitro, тетрамер+CD4+ Т-клетки обработанных pMHC-NP мышей супрессировали пролиферацию нераспознающих (родственный каталитической субъединице специфичной для островков глюкозо-6-фосфатазы белок (IGRP)- или специфичных к Gp33 LCMV) CD8+ Т-клеток в ответ на активированные пептидами DC, зависимым от IL-10 и TGF-β образом (фигура 14G). In vivo, CD4+ Т-клетки селезенки, полученные у доноров, обработанных pMHC-NP, супрессировали развитие диабета у хозяев scid с восстановленными Т-клетками NOD (также известных как NOD Prkdcscid) (фигура 9Е), эффект, который усиливался при обработке хозяев pMHC-NP (фиг. 9Е, 9F).
Затем заявитель исследовал способность 2.5mi/I-Ag7-NPs или NP, покрытых IGRP4-22/I-Ag7 или IGRP128-145/I-Ag7, к которым направлены субдоминантные популяции аутореактивных CD4+ Т-клеток (Mukherjee, R. et al. (2005) J. Immunol. 174:5306-5315), восстанавливать нормогликемию у страдающих диабетом мышей NOD. В отличие от мышей, обработанных наночастица, покрытыми лизоцимом белка куриного яйца (HEL)14-22/I-Ag7, у 90-100% мышей, получавших наночастицы, покрытые 2.5mi/I-Ag7, IGRP4-22/I-Ag7 или IGRP128-145/I-Ag7, восстанавливалась стабильная нормогликемия (фиг. 9G, 14Н) и было показано системное размножение распознающих подобных TR1 Т-клеток (фиг. 1Н, 15A-15G). Обработка этим пептидом (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) или покрытыми пептидом наночастицами, но без МНС, не могла воспроизвести ни один из этих эффектов (фиг. 9G, 14Н, 15Н). Прекращение обработки приводило к потере нормогликемического состояния у 25-60% мышей (фигура 14I) в ассоциации с потерей популяций тетрамер+CD4+ Т-клеток (фиг. 9Н, 15А). У животных, у которых сохранялась нормогликемия наблюдали нормальные уровни инсулина в сыворотке после приема пищи, толерантность к глюкозе натощак (фиг. 14J-14M) и сниженный инсулит (фигура 9I). Кроме того, их лимфоузлы поджелудочной железы (PLN) не могли поддерживать пролиферацию специфичных к меченному сложным эфиром карбоксифлуоресцеинсукцинимидила (CFSE) IGRP206-214/Kd CD8+ Т-клеток in vivo (фигура 14N).
Затем заявитель тестировал способность наночастиц, покрытых олигонедроцитарным гликопротеином миелина (pMOG)38-49/IAb замедлять прогрессирование индуцированного pMOG35-55 экспериментального аутоиммунного энцефаломиелита (ЕАЕ, модель рассеянного склероза) у мышей C57BL/6. Терапия pMOG38-49/IAbNP замедляла прогрессирование заболевания при введении на сутки 14 после иммунизации и восстанавливала двигательную функцию у мышей с параличом при введении на сутки 21 (фиг. 9J, 9K). Эти эффекты отражались приростом массы и были ассоциированы с системным размножением распознающих подобных TR1 Т-клеток, уменьшением количества активированных макрофагов/микроголии в мозжечке, меньшим количеством воспалительных очагов и областей демиелинизация в белом веществе мозжечка и сниженной демиелинизацией спинного мозга (фиг. 9L-9N, 16A-16F). Сходные терапевтические эффекты наблюдали у трансгенных по HLA-DR4-IE мышей C57BL/6 IAbnull (нокаутные мыши MHCII, экспрессирующие трансгенную гибридную молекулу MHCII, состоящую из пептидсвязывающего домена HLA-DR4 человека и проксимального относительно мембраны домена мыши IE (DR4-IE)), иммунизированных человеческими (h) пептидами протеолипидного белка (hPLP)75-192 или hMOG97-108 и обработанных hPLP175-192/DR4-IE или hMOG97-108/DR4-IE-NP после развития паралича конечностей (фиг. 17A-17D).
Специфичность в отношении заболеваний и органов
Исследования в другой модели аутоиммунного заболевания, индуцированном коллагеном артрите (CIA), продемонстрировали, что наночастицы с экспозицией коллагена мыши (mCII)259-273/DR4-IE могли снижать воспаление суставов у трансгенных по HLA-DR4-IE мышей C57BL/10.M с артритом в ассоциации с системным размножением распознающих подобных TR1 Т-клеток (фиг. 10А-10Е, 1Е). В отличие от этого наночастицы, покрытые комплексы hMOG97-108/DR4-IE, эффекта не оказывали (фиг. 10А-10С).
Для дальнейшего исследования специфичности терапии pMHC-NP в отношении заболеваний заявитель индуцировал ЕАЕ у трансгенных по HLA-DR4-IE мышей C57BL/6 IAbnull посредством иммунизации hPLP175-192 и обрабатывал больных мышей комплексом hPLP175-192/DR4-IE-NP (положительный контроль), непокрытыми наночастицами (отрицательный контроль), комплексом ассоциированный с ЕАЕ hMOG97-108/DR4-IE-NP (которые экспонировали пептид из аутоантигена ЦНС, отличный от используемого для индукции заболевания) или комплексом ассоциированный с CIA mCII259-273/DR4-IE-NP. В то время как hMOG97-108/DR4-IE-NP замедляли ЕАЕ также эффективно, как и положительный контроль, mCII259-273/DR4-IE-NP не проявляли терапевтической активности (фиг. 10F, 17F, 17G). Здесь терапевтическая активность также ассоциирована с системным размножением распознающих подобных TR1 Т-клеток (фиг. 10G, 10Н). Введение пептида mCII259-273 (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) или покрытых пептидом mCII259-273 микрочастиц (МР) (Getts, D.R. et al. (2012) Nature Biotechnol. 30:1217-1224) трансгенным по HLA-DR4-IE мышам C57BL/10.M с артритом (фиг. 10A-10D, 17Е) или пептида hMOG97-108, мономеров hMOG97-108/DR4-IE или покрытых hMOG97-108 наночастиц или микрочастиц трансгенным по HLA-DR4-IE мышам C57BL/6 IAbnull не приводило ни к размножению распознающих подобных TR1 клеток, ни к замедлению заболевания (фиг. 10F, 10G, 17F-17I). Таким образом, биологические и терапевтические эффекты pMHCII-NP специфичны для заболеваний и отличаются от патогенной роли эпитопов (инициация заболевания в отличие от расположенных далее в цепи реакций аутоантигенных мишеней), что позволяет полагать, что эти соединения действуют на предварительно активированные аутореактивные Т-клетки и могут обеспечивать размножение подобных Тк1 клеток из редких популяций Т-клеточных предшественников.
Растворимые медиаторы
Блокада IL-10, TGF-β и IL-21R (но не IFNγ) устраняла антидиабетогенные свойства 2.5mi/I-Ag7-NP или IGRP4-22/I-Ag7-NP (фиг. 11А, 18А). За исключением блокады IL-21R (для которого известно, что он ингибирует активацию CD8+ Т-клеток), эти вмешательства также устраняли супрессию перекрестной презентации аутоантигенов посредством размноженных под действием pMHC-NP подобных TR1 Т-клеток в PLN (фиг. 18В, 18С, 19). Исследования с использованием мышей NOD Ifng-/- и NOD Il10-/- с диабетом выявили, что развитие предшественников TR1 и/или подобных TR1 клеток, которые размножаются в ответ на терапию, требует IFNγ в дополнение к IL-10 (фиг. 18D-18F, 19). mAb к IL-10, TGF-β и IL-21R также устраняли антиэнцефалитогенную активность hPLP175-192/DR4-IE-NP у трансгенных по HLA-DR4-IE мышей C57BL/6 IAbnull (фиг. 18G-18J). Иммунизироавнные pMOG35-55 мыши C57BL/6 Il27r-/- отвечали на pMOG33-49/IAb-NP подобно особям дикого типа (фиг. 9J-9N, 18K-18N). Таким образом, для развития индуцированных pMHC-NP подобных TR1 клеток необходимы IFNγ и IL-10, но не IL-27 (Pot, С. et al. (2009) J. Immunol. 183:797-801); и аутореактивные подобные TR1 Т-клетки используют IL-10, TGF-β и IL-21 (но не IFNγ) для супрессии заболевания.
Нижерасположенные эффекторы и формирование сети
PLN (но не брыжеечные лимфоузлы (MLN) или лимфоузлы селезенки) обработанных pMHC-NP мышей NOD содержат увеличенные количества В-клеток по сравнению с PLN мышей, обработанных pMHCII-NP, не ассоциированных с T1D (фигура 18O). Исследования мышей, обработанных диапазоном доз pMHC-NP, выявили, что размеры популяции В-клеток и подобных TR1 клеток в PLN (но не в селезенке) коррелировали (фигура 18Р). В отличие от их аналогов в селезенке или MLN, В-клетки в PLN этих мышей не могут эффективно презентировать пептид распознающим CD4+ Т-клеткам ex vivo (фигура 18Q). Кроме того, эти клетки продуцировали IL-10 в ответ на липополисахарид (LPS) (фигура 18R), что позволяет полагать, что индуцированные pMHC-NP подобные TR1 клетки могут инициировать в PLN формирование и размножение регуляторных В (Врег) клеток. Фактически, сенсибилизированные 2.5mi В-клетки, но не DC, размножаются у обработанных 2.5mi/I-Ag7-NP хозяев в пределах недели от переноса (фиг. 18S, 18Т).
Для дополнительного исследования этого явления заявитель проводил трансфузию В-клеток селезенки NOD Il10GFP, которые сенсибилизировали 2.5mi или пептидом отрицательного контроля (GPI282-292), обработанным 2.5mi/I-Ag7-NP хозяевам NOD или NOD Il10-/-. Через семь суток хозяев анализировали на наличие продуцирующих IL-10 (eGFP+) CD5+CD1dhigh В-клеток. Мыши NOD (но не NOD Il10-/-) обработанные 2.5mi/I-Ag7-NP эффективно специфически индуцировали формирование клеток Врег из сенсибилизированных 2.5mi В-клеток, и блокада IL-21R, но не IL-10 или TGF-β подавляла этот эффект (фиг. 11В, 11С, 18U).
In vitro, В-клетки PLN обработанных 2.5min/I-Ag7-NP мышей обладали умеренным подавляющим действием на пролиферативную активность CD4+ Т-клеток BDC2.5 в ответ на сенсибилизированные пептидом DC (фигура 18V). In vivo, эти В-клетки подавляли развитие диабета у хозяев NOD scid с восстановленными Т-клетками по сравнению с В-клетками PLN контрольных мышей (фигура 11D). Совместный перенос В-клеток PLN и всех или тетрамер 2.5mi/I-Ag7+CD4+ Т-клеток селезенки, полученных у обработанных 2.5mi/I-Ag7-NP мышей приводил к >95% подавлению по сравнению с В-клетками PLN с тетрамер-CD4+ Т-клетками, полученными у обработанных 2.5mi/I-Ag7-NP мышей или без них, с CD4+ Т-клетками с В-клетками MLN, полученными у обработанных 2.5mi/I-Ag7-NP мышей (≈40%) или без них, или с CD4+ Т-клетками, полученными у необработанных или обработанных контрольными NP мышей (0%) (фигура 11Е), что свидетельствует о синергическом действии. В соответствии с этим обработка недавно заболевших диабетом мышей NOD истощающим В-клетки mAb к CD20 устраняла антидиабетогенную активность 2.5mi/I-Ag7-NP (фиг. 11А, 18Х).
Сравнение профилей цитокинов и хемокинов клеток CD11b+, полученных из PLN или MLN обработанных pMHC-NP мышей NOD дополнительно выявило, что клетки CD11b+ из PLN продуцировали меньшие уровни провоспалительных медиаторов IL-3, IL-17, IL-6, IFNγ, CXCL9 и CXCL10 в ответ на LPS, чем их аналоги из MLN (фигура 11F). Важно отметить, что действие терапии pMHC-NP на антигенпрезентирующие клетки (АРС) из дренирующих лимфоузлов не было ассоциировано с ухудшением системного иммунитета, так как обработанные pMHC-NP мыши NOD устраняли острую вирусную инфекцию и продуцировали антитела к экзогенным антигенам также эффективно, как и необработанные мыши (фиг. 11G, 11Н).
Встретившие антиген Т-клетки в качестве мишеней
Подобный клеткам памяти фенотип и повышение экспрессии иРНК T-bet в размножающихся подобных TR1 клетках совместно с неспособностью pMHC-NP стимулировать размножение распознающих подобных TR1 клеток у незаболевших мышей или мышей NOD Ifng-/- позволяет полагать, что pMHC-NP стимулируют размножение пред существующих клеток TR1, которые происходят из встретивших антиген предшественников, и/или инициируют дифференцировку встретивших антиген клеток TH1 в подобные TR1 клетки. Фактически, хотя мыши NOD G6pc2-/- с диабетом (у которых отсутствует IGRP) отвечали на 2.5mi/I-Ag7-NP подобно мышам NOD дикого типа, они не отвечали на IGRP4-22/I-Ag7-NP (фигура 12А, 12В). In vitro, 2.5mi/I-Ag7-NP инициировали экспрессию CD49b и LAG-3 и повышение экспрессии иРНК c-maf, Il21, Il10 и Lag3 только в активированных mAb к CD3 и к CD28, но не в наивных CD4+ Т-клетках BDC2.5 (фиг. 12С, 14D).
Для дальнейшего исследования этого явления заявитель проводил трансфузию наивных (CD44lowCD62Lhi) или подобных клеткам памяти (CD44hiCD62Llow) CD4+ Т-клеток BDC2.5 хозяевам когенной линии NOD.Thy1a и определял изменение экспрессии у них белков LAG-3 и CD49b и иРНК c-maf, Il21, Il10, Ifng, Lag3 и Cd49b, после терапии 2.5mi/I-Ag7-NP и в отсутствии терапии. Следует отметить, что Т-клетки памяти необработанных pMHC-NP хозяев экспрессировали приблизительно в сто раз более высокие уровни иРНК c-maf и Il21 и, в меньшей степени, Lag3 и Cd49b, но не Il10, чем их наивные аналоги (фигура 12D). Это соответствует с наблюдаемому деметелированию Il21 и способности к экспрессии c-Maf/IL-10 и IL-21 эффекторных клеток/клеток памяти из CD4+ Т-клеток (Pot, С.et al. (2009) J. Immunol. 183:797-801; Spensieri, F. et al. (2013) Proc. Natl Acad. Sci. USA 110:14330-14335; Hale, J.S. et al. (2013) Immunity 38:805-817; Sato, K. et al. (2011) J. Biol. Chem. 286:14963-14971; Saraiva, M. et al. (2009) Immunity 31:209-219), и позволяют предположить, что популяция Т-клеток памяти обогащена некоммитированными предшественниками TR1, экспрессирующим сбалансированную TR1 транскрипционную программу. Примечательно, что хотя терапия pMHC-NP только повышает экспрессию иРНК Lag3 и, в меньшей степени, белка LAG-3 в наивных CD4+ Т-клетках BDC2.5, она стимулирует повышение экспрессии иРНК Il10 и LAG-3 и белка CD49b и пролиферацию CD4+ Т-клеток памяти BDC2.5 (фиг. 12D-12F). Сходные результаты наблюдали с использованием eGFP-(FOXP3-) CD4+ клетки памяти BDC2.5, полученные у мышей NOD Foxp3-eGFP BDC2.5 (фигура 18Y).
Это действие на встретившие антиген Т-клетки сопровождалось приобретением антидиабетогенных свойств: в то время как терапия pMHC-NP обеспечивала 100% защиту от диабета у хозяев NOD scid с восстановленными Т-клетками, несущих Т-клетки памяти BDC2.5, терапия у хозяев, получавших наивные Т-клетки BDC2.5, являлась несущественной (фигура 12G). Таким образом, терапия pMHC-NP стимулирует дифференцировку (и размножение) экспрессирующих c-Maf встретивших антиген CD4+ Т-клеток в потомство TR1.
Трансляционный потенциал
Заявитель определял способность ассоциированных с T1D человека pMHCII-NP стимулировать размножение распознающих подобных TR1 Т-клеток у хозяев NOD scid Il2rg-/- (NSG) с восстановленными мононуклеарными клетками периферической крови (РВМС) пациентов T1D (таблица 2). Разработка начального анализа была сфокусирована на хозяевах NSG с восстановленными РВМС пяти DRB1*0401+ пациентов T1D с ранним началом и обработанных наночастицами, покрытыми комплексами декарбоксилаза глутаминовой кислоты-65 человека (GAD65)555-567(F557I)/DR4 или препроинсулин (PPI)76-90(K88S)/DR4 (фиг. 13А, 13В, таблица 2). Затем заявитель повторил эти эксперименты с использованием хозяев NSG с восстановленными РВМС 7 DRB1*0301+ пациентов T1D и третьим ассоциированным с T1D типом pMHC-NP (hIGRP13-25/DR3-NP), вводимым в повышенной дозе. Заявитель наблюдал размножение тетрамер +CD49b+LAG-3+CD4+ Т-клеток в селезенке и/или PLN (эндогенный мышиный (m)IGRP13-25 высоко гомологичен hIGRP13-25) всех семи обработанных pMHC-NP мышей и ни у одной из неродственных контролей (фиг. 13С, 13D, 20А и таблица 2). Средний процент и количества тетрамер+СВ4+ Т-клеток у обработанных IGRP13-25/DR3-NP мышей являлись значительно большими, чем у необработанных особей того же помета (фигура 13D), и происходила экспрессия иРНК Il10 (фигура 13Е). Этот ответ нельзя было индуцировать пептидом или покрытыми пептидом наночастицами или микрочастицами (фиг. 13D, 20В и таблица 2).
PLN обработанных pMHC-NP мышей, содержащих повышенный процент тетрамер+СВ4+ Т-клеток, обладали повышенной насыщенностью клетками (фигура 13F). Кроме того, наблюдали корреляции между количеством тетрамер+СВ4+ Т-клеток PLN и процентом и абсолютным количеством в PLN В-клеток человека, и В-клетки PLN, в отличие от их селезеночных аналогов продуцировали IL-10 в ответ на LPS (фиг. 13G-13I), что позволяет полагать формирование и/или привлечение Врег. Такого ответа у мышей NSG с восстановленными hPBMC пациентов, обработанных пептидом или пептидом-NP/MP, не наблюдали (фигура 13F).
Обсуждение
Заявитель продемонстрировал, что системная терапия наночастицами, покрытыми ассоциированными с аутоиммунными заболеваниями комплексами рМНС класса II, инициирует размножение распознающих подобных TR1 CD4+ Т-клеток, восстанавливает нормогликемию у мышей со спонтанным диабетом и двигательную функцию у парализованных мышей с ЕАЕ, и устраняет опухание и разрушение суставов у мышей с артритом, без нарушения системного иммунитета. Заявитель продемонстрировал, что этот результат не связан с генетическим окружением и типом аутоиммунного заболевания, и его можно повторить с десятью различными ассоциированными с аутоиммунными заболеваниями людей или мышей типами pMHC-NP. Фенотип клеточной поверхности, профиль секреции цитокинов, профиль транскрипции и функция популяций подобных TR1 клеток, размножаемых посредством основанных на pMHCII нанолекарств соответствуют описанным для подобных TR1 CD4+ Т-клеток мышей и очень сходны с клетками TR1, получаемыми у здоровых индивидуумов и пациентов с аутоиммунными заболеваниями (Gagliani, N. et al. (2013) Nature Med. 19:739-746). Заявитель продемонстрировал ключевые роли предварительной стимуляции аутоантигенами и способность к экспрессии IFNγ и IL-10 в онтогенезе аутореактивных клеток TR1. Заявитель продемонстрировал, что pMHCII-NP стимулируют транскрипцию IL-10 и повышение экспрессии маркеров TR1 у сбалансированных по TR1, встретивших антиген CD4+ Т-клеток среди АРС и независимым от IL-27 способом, с последующим системным размножением. Необходимость в IFNγ, экспрессии фактора транскрипции TH1 T-bet, способности к экспрессии c-Maf/IL-10 и IL-21 эффекторных CD4+ Т-клеток и CD4+ Т-клеток памяти (Pot, С.et al. (2009) J. Immunol. 183:797-801; Spensieri, F. et al. (2013) Proc. Natl Acad. Sci. USA 110:14330-14335; Hale, J.S. et al. (2013) Immunity 38:805-817) и способность pMHCII-NP преобразовывать Т-клетки, примированные активной иммунизацией в супрессоры TR1 позволяет предположить, что эти предшественники TR1 представляют собой эффекторные клетки/клетки памяти TH1. Заявитель определил механизм действия и выявил каскад клеточных взаимодействий, происходящих после размножения подобны TR1 клеток под действием pMHC-NP, включая формирование клеток Врег, что скоординировано приводит к устранению воспаления антигензависимым, но неспецифичным в отношении антигена образом (фигура 21).
В совокупности данные заявителя поддерживают утверждение, что любой конкретный рМНС, вовлеченный в данное аутоиммунное заболевание, можно использовать для замедления комплексного аутоиммунного ответа посредством этого подхода. В соответствии с этим предположением 20 протестированных до настоящего времени основанных на pMHCI/II нанолекарств продемонстрировали сходную эффективность, вне зависимости от уровня антигена, его влияния или роли в патологическом процессе. Ни мономеры рМНС, ни пептиды, ни покрытые пептидом наночастицы/микрочастицы не стимулируют формирование/размножение распознающих клеток TR1 из репертуара поликлональных Т-клеток или не способствуют регрессии в тестируемых в данных исследованиях хронических моделях T1D, CIA или ЕАЕ. Таким образом основанные на рМНС нанолекарства представляют собой новый класс терапевтических средств для аутоиммунитета, способных к устранению клеточно и антигенно комплексного аутоиммунного ответа специфичным для заболевания и органа образом без нарушения системного иммунитета.
Способы
Мышей NOD/Ltj, NOD scid, BDC2.5-NOD, NOD Il10-/-, C57BL/6, C57BL/6 Il27r-/-, C57BL/10.M, NOD Foxp3-egfp и мышей NOD scid Il2rg-/-(NSG) приобретали в Jackson Lab. Мышей NOD Ifng-/- и трансгенных мышей NOD со специфичными к LCMV Gp33 TCR приобретали у D. Serreze (Jackson Lab). Трансгенных по HLA-DR4-IE мышей C57BL/6 IAbnull приобретали в Taconic Farms, мышей NOD Il10GFP (тигровых) получали посредством возвратного скрещивания аллеля Il10GFP мышей C57BL/6 Il10GFP (Jackson Lab) с исходными NOD/Ltj в течение 10 поколений. Мыши 8.3-NOD и NOD G6pc2-/- описаны в других источниках (Verdaguer, J. et al. (1997) J. Exp. Med. 186:1663-1676; Wang, J. et al. (2010) Proc. Natl Acad. Sci. USA 107:9317-9322). Эти исследования одобрены комитетами по контролю за обращением с животными соответствующих институтов. Статистических способов для предопределения размера образцов не использовали.
Антитела, окрашивание тетрамерами и проточная цитометрия. Конъюгированные с FITC, РЕ, PerCP или биотином mAb к CD4 (RM4-5), CD8α (53-6,7), В220 (RA36B2), CD62L (MEL-1), CD69 (H1,2F3), CD44 (IM7) и CD49b (DX5) мыши и стрептавидин-PerCP приобретали в BD Pharmingen. Антитело к LAG-3 (C9B7W) мыши приобретали в eBioscience. Антитело к латентно-ассоциированному TGF-β (TW7-16B4) приобретали в BioLegend. Конъюгированные с РЕ тетрамеры рМНС класса II получали с использованием биотинилированных мономеров рМНС. Мононуклеарн клетки периферической крови, спленоциты, CD4+ Т-клетки лимфоузлов и костного мозга инкубировали с авидином в течение 15 минут при комнатной температуре и окрашивали тетрамером (5 мкг мл-1) в буфере для FACS (0,05% азид натрия и 1% FBS в PBS) в течение 30-120 минут при 4°С или 37°С в зависимости от тетрамера, отмывали и инкубировали с конъюгированными с FITC антителами к CD4 (5 мкг мл-1) и конъюгированными с PerCP антителакми к В220 (2 мкг мл-1; в качестве "бессмысленного" канала) в течение 30 минут при 4°С. Клетки отмывали, фиксировали в 1% параформальдегиде (PFA) в PBS и анализировали с использованием проточных цитометров FACScan, FACSaria или BD LSRII. Для других анализов фенотипа суспензии отдельных клеток окрашивали тетрамерами рМНС и антителами, разбавленными 1:100 в буфере для FACS (все использовали при 4°С за исключением антитела к LAG-3, которое использовали при 37°С), отмывали, фиксировали в 1% PFA и анализировали посредством FACS. Все фенотипическое окрашивание проводили в присутствии mAb к CD16/CD32 (2.4G2; BD Pharmingen) для блокирования рецепторов Fc. Анализ проводили с использованием программного обеспечения FlowJo.
NSG с трансплантированными Т-клетки человека анализировали с использованием следующих mAb: конъюгированные с FITC mAb к CD4 (ОКТ4, BioLegend), конъюгированные с АРС mAb к CD 19 (HIB19, BD Pharmingen), конъюгированные с PerCP поликлональные антитела козы к LAG-3 IgG (R&D Systems), конъюгированные с биотином mAb к CD49b (АК7, Pierce Antibodies, Thermo Scientific) и конъюгированный с EF450 стрептавидин (eBioscience). В кратком изложении, спленоциты и клетки лимфоузлов поджелудочной железы инкубировали с авидином (0,25 мг мл-1 в буфере для FACS) в течение 30 минут при комнатной температуре, отмывали и окрашивали тетрамером (5 мкг мл-1) в течение 1 часа при 37°С, отмывали и инкубировали с конъюгированными с FITC антителами к CD4 (2/100), конъюгированными с АРС антителами к CD 19 (5/100; использованными в качестве "бессмысленного" канала), конъюгированными с PerCP антителами к LAG-3 (8/100) и конъюгированными с биотином антителами к CD49b (4/100) при 4°С в течение 45 минут. После отмывки клетки инкубировали с конъюгированным с EF450 стрептавидином в течение 30 минут при 4°С, отмывали, фиксировали в 1% PFA в PBS и клетки в окне hCD4+/hCD19- анализировали с использованием FACSCanto II (BD Bioscience).
Пептиды и рМНС. Если не указано иначе, мономеры рекомбинантных рМНС класса II выделяли из супернатантов культур индуцированных клеток SC2 Drosophila, трансфицированных конструкциями, кодирующими цепи I-Aβ и I-Аα несущие лейциновые застежки c-Jun или c-Fos, соответственно, и метки BirA и 6× His. В этих конструкциях кодирующая пептид последовательность связана с N-концом цепи I-Аβ посредством подвижного линкера Gly-Ser, как описано (Stratmann, Т. et al. (2003) J. Clin. Invest. 112:902-914). Мономеры GAD65555(557I)-567/DR4, PPI76-90(88S)/DR4 и IGRP13-25/DR3 получали посредством нагрузки соответствующих пептидов на комплексы DR4 и DR3, выделенных из супернатантов индуцированных клеток SC2, как описано (Yang, J. et al. (2006) J. Immunol. 176:2781-2789). Другие конструкции (кодирующие 2.5mi/I-Ag7, pMOG35-55/IAb, hMOG97-108/DR4-IE, hPLP175-192/DR4-IE и mСII259-273/DR4-IЕ) выделяли из супернатантов клеток китайского хомяка (СНО), трансдуцированных лентивирусами, кодирующими моноцистронный транскрипт, в котором цепи пептид-МНСβ и МНСα комплекса разделены посредством последовательности перескока рибосомы Р2А (Hoist, J. et al. (2006) Nature Protocols 1:406-417). Эти мономеры конструировали так, чтобы они кодировали участок BirA, метку 6× His и свободный Cys на С-конце конструкции. Самособирающиеся комплексы рМНС класса II очищали посредством хроматографии с никелем и использовали для нанесения на наночастицы или обрабатывали для биотинилирования и формирования тетрамеров, как описано выше. Эпитопы, кодируемые в других мономерных конструкциях, описанных в настоящем документе, включают: 2.5mi (AHHPIWARMDA) (Stratmann, Т. et al. (2003) J. Clin. Invest. 112:902-914); IGRP128-145 (TAALSYTISRMEESSVTL) и IGRP4-22 (LHRSGVLIIHHLQEDYRTY) (15); HEL14-22 (RHGLDNYRG); GAD65555(557I)-567 (NFIRMVISNPAAT) (Reijonen, H. et al. (2002) Diabetes 51:1375-1382); PPI76-90(88S) (SLQPLALEGSLQSRG) (Yang, J. et al. (2008) J. Autoimmun. 31:30-41); IGRP13-25 (QHLQKDYRAYYTF) (Yang, J. et al. (2006) J. Immunol. 176:2781-2789); pMOG38-49 (GWYRSPFSRVVH); hMOG97-108 (TCFFRDHSYQEE); hPLP175-192 (YIYFNTWTTCQSIAFPSK) и mCII259-273 (GIAGFKGDQGPKGET). Пептиды IGRP4-22, IGRP128-145 и GPI282-292 (LSIALHVGFDH) или 2.5mi, pMOG35-55 (MEVGWYRSPFSRVVHLYRNGK), pMOG38-49, hMOG97-108 и hPLP175-192 приобретали в Sigma Genosys, Mimotopes или Genscript.
Синтез и очистка наночастиц, pMHC-NP, пептид-NP и пептид-MP. Заявитель наносил рМНС на перекрестно сшитые покрытые декстраном NP или NP с пегилированным оксидом железа (CLIO- или PFM-NP, соответственно). В кратком изложении, CLIO-NP обрабатывали аммиаком с получением аминогрупп (NH2). Авидин окисляли перйодатом натрия и добавляли к амино-NP. Для получения стабильной ковалентной связи использовали дополнительную инкубацию с цианоборогидридом натрия. В заключении к наночастицам добавляли биотинилированные мономеры при молярном отношении 4 моль биотина/моль авидина (Moore, A. et al. (2004) Diabetes 53:1459-1466). PFM-NP получали посредством термического разрушения Fe(acac)3 в присутствии 2 кДа малеинимида метоксиполиэтиленгликоля (Singha, S. et al., неопубликованные данные). NP очищали с использованием магнитных (MACS) колонок (Miltenyi Biotec) или системы разделения клеток IMag (BD Biosciences). С конъюгатом рМНС или свободного пептида с PFM-NP авторы инкубировали рМНС или пептид, несущие свободный С-концевой Cys с наночастицами в 40 мМ фосфатном буфер, рН 6,0, содержащем 2 мМ ЭДТА, 150 мМ NaCl в течение ночи при комнатной температуре. Конъюгированные с РМНС наночастицы отделяли от свободного рМНС или пептида с использованием магнитных колонок, стерилизовали посредством фильтрации через 0,2 мкм фильтры и хранили в воде или PBS при 4°С. Контроль качества проводили с использованием трансмиссионной электронной микроскопии, динапического светорассеяния и нативного и денатурирующего электрофореза в геле. Содержание рМНС или пептида определяли с использованием различных подходов, включая анализ по Брэдфорду (Thermo Scientific), денатурирующий SDS-PAGE, анализ аминокислот (основанное на ВЭЖХ количественное определение 17 различных аминокислот в гидролизуемых препаратах pMHC-NP) или дот-ИФА (Singha, S. et al., неопубликованные данные).
Покрытые пептидом микрочастицы получали с использованием карбоксилированных полистироловых гранул диаметром 500 нм из Polysciences (Warrington, РА), как описано ранее (Getts, D.R. et al. (2012) Nature Biotechnol. 30:1217-1224). Пептиды конъюгировали с полистироловыми гранулами посредством карбодиимидной химии по инструкциям производителя. В кратком изложении, заявитель инкубировал 250 мкл PSB (содержащего ≈9 × 1011 гранул) с 250 мкг пептида в 0,1 М буфере MES, рН 5,0 при комнатной температуре с осторожным качанием в присутствии 1 мг EDC в течение 2 часов. Конъюгированные с пептидом полистироловые гранулы отмывали PBS с удалением неконъюгированных пептидов и анализировали с использованием нативного и денатурирующего PAGE в относительно серийных разведений неконъюгированного пептида и контрольных микрочастиц.
Терапия pMHC-NP и пептидом или комплексами пептид-NP у мышей NOD. Эксперименты у мышей NOD с преддиабетом включали обработку (в/в) групп самок мышей в возрасте 10 недель 7,5 мкг pMHC-NP или эквивалентными количествами растворимых мономеров рМНС или непокрытых наночастиц дважды в неделю в течение 5 последовательных недель. Эксперименты у мышей с диабетом включали наблюдение за развитием диабета у групп самок мышей NOD/Ltj, NOD G6pc2-/-, NOD Il10-/- или NOD Ifng-/- в возрасте 10 недель посредством определения уровней глюкозы в крови полосками Accucheck (Roche) дважды в неделю. Мышей с двумя последовательными определениями >11 мМ считали больными диабетом и дважды в неделю обрабатывали 7,5 мкг pMHC-NP, наночастицами, доставляющими молекулярный эквивалент пептида, или свободным пептидом (8 мкг на дозу) (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) до достижения стабильной нормогликемии (определяемой как 8 последовательных определений <11 мМ) или до признания гипергликемии необратимой (3 определения >25 мМ). На фигурах 9G, 12В и 14Н мышей случайно распределяли на группы с обработкой 2.5mi/I-Ag7-NP или HEL14-22/I-Ag7-NP (фигура 9G) или 2.5mi/I-Ag7-NP или IGRP4-22/I-Ag7-NP (фигура 12В). На фигуре 9G в раздельных группах мышей тестировали IGRP4-22/I-Ag7 и IGRP128-145/I-Ag7. Мыши, обработанных пептидом или комплексом пептид-NP (фигура 9G) случайно распределяли в группы с любой обработкой в рамках того же эксперимента. Эксперименты по нейтрализации цитокинов in vivo включали введение mAb к CD20 (5D2, подарок A. Chan, Genentech; три дозы 250 мкг в/в на сутки 0-2 относительно начала гипергликемии) или 500 мкг HRPN (rIgG1), IFNγ (R4-6A2), IL-10 (JES5-2A5), TGF-β (1D11) или IL-21R (4A9) (BioXcell) и/п дважды в неделю в течение 2 недель с последующими 200 мкг на дозу в течение 3 дополнительных недель. Мышей случайно распределяли в группы с обработкой блокирующими цитокины mAb (IFNγ, IL-10, TGFβ) или IgG1 к HRPN крысы. mAb к CD20 и к IL21R тестировали в раздельных группах мышей с диабетом (фигура 11А). Животных каждые сутки оценивали на гликозурию (соответствующую >16 мМ глюкозы крови) и п/к вводили инсулин человека изофан (1 ME в сутки), если тест являлся положительным. После завершения обработки мышей NOD проверяли на рецидивы гипергликемии до 50 недель возраста.
Терапия пептидом, рМНС, pMHC-NP, комплексами пептид-NP или пептид-MP при ЕАЕ. Самок мышей C57BL/6, C57BL/6 Il27r-/- или трансгенных по HLA-DR4-IE C57BL/6 IAbnull в возрасте от шести до восьми недель иммунизировали 150 мкг PMOG35-55, или hMOG97-108, или hPLP175-192, соответственно, п/к в CFA в основание хвоста, при анестезии изофлураном. Мышам в/в вводили 300 нг токсина коклюша на сутки 0 и 3. Мышей взвешивали и ежесуточно оценивали, начиная на сутки 10 после иммунизации. Используемая система оценок опубликована в других источниках 30 и наносили относительно 5-точковой шкалы. Когда у большинства мышей наблюдали признаки развернутого заболевания (сутки 14) или когда они достигали максимального индекса заболевания (сутки 21), мышей разделяли на группы с различной обработкой, синхронизировали по мессе и среднему индексу заболевания и дважды в неделю обрабатывали покрытыми рМНС и непокрытыми наночастицами, идентичными количествами мономера рМНС, покрытыми пептидом наночастицами (при эквивалентной дозе пептида), свободным пептидом (8 мкг на дозу в/в или п/к) (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747), конъюгированными с пептидом микрочастицами (15 мкг пептида на дозу) (Getts, D.R. et al. (2012) Nature Biotechnol. 30:1217-1224) или неконъюгированными микрочастицами в течение 5 недель. Мышей случайно распределяли на группы с лечением pMHC-NP (один или два различных типа в зависимости от эксперимента, как описано на фигурах 9J-9N, 10F-10H, 16A-16F, 17А-17I), непокрытыми наночастицами или без лечения. Пептид, пептид-МР, пептид-NP, мономеры рМНС и непокрытые микрочастицы тестировали вместе; мышей случайно распределяли в группы с каждым из видов лечения по мере достижения мышами указанного индекса заболевания (фиг. 10F, 17F-17I). Дополнительную контрольную группу обрабатывали однократной дозой конъюгированных пептида-микрочастицы (фигура 17Н). Исследования блокирования mAb к цитокинам и рецепторам цитокинов (фигура 18G) включали случайное распределение мыши в группы с каждым из видов обработки.
Терапия пептидом, pMHC-NP или комплексом пептид-MP при CIA. Бычий коллаген II (bСII), растворенный в 0,05М уксусной кислоте при 2 мг мл-1, эмульгировали в CFA (об./об.), содержащем 4 мг мл-1 убитых Mycobacterium tuberculosis (H37Ra). Трансгенных по HLA-DR4-IE мышей C57BL/10.M в возрасте от восьми до двенадцати недели интрадермально иммунизировали в основание хвоста 100 мкг bСII в CFA и вторично иммунизировали 100 мкг bСII в IFА на сутки 14 и 28. Размер всех четырех лап определяли с использованием циркуля перед иммунизацией (сутки 0) и ежесуточно после начала заболевания. Прогрессирование заболевания определяли как процент возрастания опухания суставов относительно суток 0. Когда это значение достигало 130%, мышей разделяли на группы с различной обработкой и в/в дважды в неделю в течение 5 недель обрабатывали pMHC-NP, покрытыми Cys (неконъюгированными с рМНС) NP (25 мкг рМНС на pMHCNP или эквивалентное количество железа для конъюгированных с Cys NP), свободным пептидом (8 мкг на дозу п/к) (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) или конъюгированными с пептидом MP (15 мкг пептида на дозу) (Getts, D.R. et al. (2012) Nature Biotechnol. 30:1217-1224). Мышей случайным образом распределяли в различные группы с лечением pMHC-NP или непокрытыми наночастицаии или пептидом или пептид-MP, соответственно (фигура 10А и фигура 14-21). У мышей также оценивали клинические признаки заболевания до максимального клинического индекса 12, как описано в других источниках (Leavenworth, J.W. et al. (2013) J. Clin. Invest. 123:1382-1389).
Терапия пептидом, pMHC-NP, комплексами пептид-NP и пептид-MP у хозяев NSG с восстановленными РВМС человека. Из РВМС у новых или недавно диагностированных пациентов T1D с HLA-DRB1* 401+ или -DRB1*0301+ (включаемых с информированного согласия, с одобрением Institutional Review Board at Hospital Clinic) выделяли CD8+ T-клетки с использованием покрытых mAb к CD8 магнитных гранул (Miltenyi Biotech) и в/в инъецировали (2 × 107) хозяевам NSG в возрасте 8-10 недель. Мышей обрабатывали pMHC-NP в указанных дозах, покрытых пептидом NP (при эквивалентной дозе пептида), только пептидом (8 мкг на п/к дозу) (Burton, B.R. et al. (2014) Nature Commun. 5:4741-4747) или конъюгированными с пептидом микрочастицами (15 мкг пептида на дозу) (Getts, D.R. et al. (2012) Nature Biotechnol. 30:1217-1224) начиная на сутки 5 после трансфузии РВМС дважды в неделю в течение 5 последовательных недель или оставляли без обработки. Образцы каждого конкретного пациента обрабатывали отдельно и инъецировали двум (в экспериментах с pMHC-NP и комплексом пептид-NP) или трем разным мышам (для экспериментов с пептидом и комплексом пептид-MP); одного или двух из двух-трех хозяев, используемых в каждом из этих экспериментов обрабатывали, а других оставляли без обработки (таблицы 4А-4С). Индуцированное терапией размножение распознающих CD4+ Т-клеток определяли в PLN и/или селезенке, как описано выше. Генотип HLA, пол, возраст, месяцы после диагноза и тип тестируемых pMHC-NP для каждого пациента приведены в таблицах 4А-4С.
Тестирование толерантности к интраперитонеальной глюкозе. Животных оставляли голодными в течение ночи и и/п стимулировали 2 мг кг-1 D-глюкозы. Анализ глюкозы крови проводили из хвостовой вены с использованием глюкометра в различные моменты времени перед и после стимуляции глюкозой. Содержание инсулина в сыворотке определяли с использованием набора Mouse Ultrasensitive Insulin ELISA (ALPCO).
Оценка системного клеточного и гуморального иммунитета. Для оценки клеточного ответа обработанным pMHC-NP и необработанным самкам мышей в/в инъецировали 2×106 бляшкообразующих единиц (БОЕ) рекомбинантного вируса коровьей оспы (rVV). Группы мышей умерщвляли на сутки 4 и 14 после инъекции и обрабатывали, окрашивая тетрамером рМНС и проводя определение титра rVV. В кратком изложении, взвешивали яичники, гомогенизировали с использованием пестика в 300 мкл RPMI-1640, содержащей 10% FBS, 3 раза проводили замораживание-оттаивание с последующими 3 циклами обработки ультразвуком (20 секунд каждый). Серийные разведения лизатов добавляли в конфлуэнтные культуры клеток BSC-1 в 6-луночных планшетах, инкубировали при 37°С в течение 2 часов, дважды отмывали PBS и культивировали в DMEM10. На сутки 2 супернатанты удаляли и слои клеток окрашивали кристаллическим фиолетовым для выявления бляшек.
Для оценки гуморального иммунитета обработанных pMHC-NP и необработанных мышей и/п иммунизировали 100 мкг DNP-KLH (Alpha Diagnostic International) в CFA. Через 3 недели проводили идентичную вторичную инъекцию. Через 10 суток мышей умерщвляли. Определяли титры антител к DNP, разбавляя образцы сыворотки в PBS, содержащей 0,05% Tween 20. Полуколичественно определяли антитела к DNP с использованием набора ИФА с Ig к DNP (Alpha Diagnostic International) по инструкциям производителя.
Анализы пролиферации и секреции цитокинов. Проводили обогащение CD4+ Т-клеток обработанных pMHC-NP мышей из периферических лимфоидных органов с использованием набора для обогащения BD Imag, их окрашивали тетрамерами рМНС, как описано выше, и сортировали посредством проточной цитометрии. Для анализов с использованием клеток памяти и наивных CD4+ Т-клеток BDC2.5 клетки обогащали с использованием набора для обогащения стволовых клеток Stem Cell Technologies, окрашивали антителами и сортировали. Отсортированные FACS клетки (2-3×104) совместно культивировали с полученными из костного мозга DC (2×104) импульсно стимулированных 2 мкг мл-1 пептида. Через 48 часов собирали супернатанты для измерения цитокинов посредством Luminex и клетки импульсно метили 1 микроКюри (мкКи) (3Н)-тимидина и собирали через 24 часа для определения включения тимидина в трех повторениях.
Для определения способности терапии pMHC-NP стимулировать формирование секретирующих IL-10 В-клеток в PLN хозяев NSG с трансплантированными РВМС заявитель окрашивал суспензии клеток PLN и селезенки каждой из мышей антителами к hCD4-FITC, антителами к hCD19-APC и тетрамером-РЕ, как описано выше, и проводил сортировку В-клетки посредством проточной цитометрии (FACSAria-BD Biosciences). Отсортированные В-клетки каждого органа стимулировали LPS (1 мкг мл-1, Sigma) в течение 24 часов в RPMI-1640, дополненной 10% сывороткой АВ человека. Содержание IL-10 в супернатантах определяли в двух повторениях посредством технологии Meso Scale с использованием набора V-PLEX Custom Human Cytokine для hIL-10 (Meso Scale Discovery). Данные нормализовали по значениям В-клеток селезенки и регистрировали в виде кратности изменения.
Выделение и стимуляция CD11b+ клеток из PLN и MLN in vitro. CD11b+ клетки LN получали посредством расщепления коллагеназой D (1,25 мкг мл-1) и ДНКазой I (0,1 мкг мл-1) в течение 15 мин при 37°С с последующей очисткой покрытыми mAb к CD11b (BD Imag) магнитными гранулами. Клетки стимулировали LPS (2 мкг мл-1) в течение 3 суток и супернатанты анализировали на содержание цитокинов с использованием мультиплексного анализа цитокинов Luminex.
Анализы супрессии in vitro. Отсортированные FACS положительные или отрицательные по тетрамеру 2.5mi/I-Ag7 клетки (2×104) совместно культивировали с полученными из костного мозга DC (2×104) импульсно стимулированными 2 мкг мл-1 "супрессирующих" (2.5mi или GPI282-292) и "отвечающих" (gp33 или NRP-V7) пептидов. Отвечающие клетки представляли собой CD8+ Т-клетки (2×104) выделенные у мышей 8.3-NOD или трансгенных по специфичному к LCMV-Gp33 TCR мышей NOD с использованием гранул BD-Imag. Эти клетки метили CFSE (5 мкМ) и добавляли к культурам DC в двух или трех повторениях. Через 48 часов определяли разбавление CFSE в отвечающих клетках посредством FACS. В других экспериментах в лунки в пределах периода 24 часов совместного культивирования с HRPN добавляли rIgG, антитела к IFNγ, антитела к IL10 или антитела к TGF-β (все 10 мкг мл-1) или ингибитор IDO, 1-метилтриптофан (1-МТ; 400 мкМ).
Супрессия перекрестной презентации in vivo. Для анализов перекрестной презентации у нетрансгенных мышей заявитель проводил трансфузию меченных CFSE 8.3-CD8+ репортерных клеток (5-10×106) необработанным или обработанным pMHC-NP мышам и определял разведение CFSE в лимфоидных органах хозяев в пределах периода 7 суток после переноса.
Адоптивный перенос супрессии. CD4+ или CD8+ Т-клетки селезенки (107) необработанных мышей или мышей, обработанных 10 дозами 2.5mi/I-Ag7-NP или непокрытыми наночастицами трансплантировали самкам NOD scid в возрасте 5-10 недель. Хозяевам через 24 часа проводили трансфузию 2 × 107 смеси CD4+ или CD8+ Т-клеток селезенки выделенных у доноров самок NOD. У хозяев наблюдали развитие диабета в течение по меньшей мере 90 суток после переноса (фигура 9Е). В другом эксперименте хозяев дважды в неделю обрабатывали 2.5mi/I-Ag7-NP (фигура 9Е). В других экспериментах (фигура 11Е) самкам NOD scid в возрасте 5-6 недель с восстановленными CD4+ или CD8+ Т-клетками проводили трансфузию 5×105 CD19+ клеток, выделенных из PLN мышей, обработанных 10 дозами непокрытых или покрытых 2.5mi/I-Ag7 NP в течение предшествующих 5 недель (фигура 11D). Выделяли В-клетки с использованием набора EasySep Mouse CD19-positive selection Kit II (StemCell Technologies). Другием группам, изучаемым отдельно (фигура 11Е), вводили CD19+ клетки (5×105) PLN или MLN и тотальные CD4+ Т-клетки селезенки (107) или тетрамер 2.5mi/I-Ag7+ (2×105) или тетрамер- CD4+ Т-клетки (107), полученные у обработанных 2.5mi/I-Ag7-NP доноров. Хозяев случайно распределяли в группы с каждой из трансфузий и совместно наблюдали за развитием диабета. Фигура 11Е включает данные соответствующих групп, описанных на фигурах 9Е и 11D. Выделение клеток тетрамер 2.5mi/I-Ag7+ и тетрамер 2.5mi/I-Ag7- из тотальных CD4+ Т-клеток селезенки обработанных 2.5mi/I-Ag7-NP мышей проводили с использованием покрытых mAb к РЕ микрогранул и колонок MACS LD (Miltenyi Biotec).
Пролиферация В-клеток и индукция Врег in vivo и супрессия Bpeг in vitro. Для выделения DC селезенки, селезенки расщепляли в коллагеназе D и ДНКазе в течение 15 минут при 37°С и DC выделяли с использованием покрытых mAb к CD11c магнитных гранул (MACS). Клетки импульсно стимулировали 10 мкг мл-1 пептидами 2.5mi или GPI282-292 в течение 2 часов при 37°С и метили CFSE (0,5 мкм) или РКН26 (2 мкм), соответственно. Меченые клетки (5-10×106; смешенные в отношении 1:1) в/в вводили обработанным или необработанным pMHC-NP мышам NOD. Через трое суток заявитель сравнивал отношения клеток CFSE+ и клеток РКН26+ в селезенках различных хозяев посредством FACS. Подобные эксперименты проводили с использованием импульсно меченных пептидами В-клеток селезенки, выделенных у самок мышей-доноров с использованием покрытых mAb к В220 магнитных гранул (MACS).
Для анализов индукции Врег in vivo проводили обогащение В-клеток мышей NOD Il10GFP (тигровых) с использованием набора обогащения по CD19 (Stem Cell Technologies) и импульсно стимулировали их пептидами 2.5mi или GPI282-292 (10 мкг мл-1) в течение 2 часов при 37°С. Импульсно стимулированные пептидом В-клетки дважды отмывали PBS, метили РКН26 и трансплантировали (1×106) обработанным или необработанным рМНС-NP мышам. Через 7 суток хозяев умерщвляли и их селезенки метили антителами к В220-АРС и биотинилированными mAb к CD1d или к CD5 и стрептавидином-PerCP. РКН26+ клетки анализировали на присутствие клеток eGFP+CD1dhigh или CD5+ посредством проточной цитометрии.
Для определения роли продуцируемых TR1 цитокинов в формировании Врег (фигура 18U) заявитель повторял описанные выше эксперименты, но с использованием 3×106 В-клеток и хозяев, обработанных 250 или 500 мкг (вводимых и/п ежесуточно начиная с суток - 3 до суток 6 относительн переноса В-клеток) mAb к HRPN (rIgG1), к IL-10 (JES5-2A5), к TGFβ (1D11) или к IL-21R (4А9) (BioXcell). Хозяев случайно распределяли в группы с обработкой каждым антителом и исследовали соместно.
Для определения способности индуцированных TR1 клеток Врег супрессировать индуцируемую антигенами активацию Т-клеток in vitro заявитель выделял CD19+ В-клетки из PLN совпадающих по возрасту необработанных мышей NOD или мышей NOD, обработанных 10 дозами 2.5mi/I-Ag7-NPs и культивировал эти клетки с LPS (10 мкг мл-1) в течение ночи. Затем заявитель культивировал эти клетки (2×104) с импульсно стимулированными пептидом 2.5mi (0,1 мкг мл-1) полученными из костного мозга DC (2×104) и меченными CFSE СD4+-клетками BDC2.5 (4×104). Через 3 суток определяли разбавление CFSE в СD4+-клетках.
Истощение CD25+CD4+Трег. Мышей NOD и/п обрабатывали 500 мкг антител к CD25 (РС61.5.3, BioXcell) 3 раза в неделю начиная с возраста 8 недель, с последующими 10 инъекциями pMHC-NP, проводимыми дважды в неделю, начиная с возраста 10 недель. Среднее истощение CD4+CD25+ и FOXP3-eGFP+CD4+ Т-клеток составляло 90% и 70%, соответственно.
Гистология. Ткани фиксировали в 10% формалине и погружали в парафин, окрашенные Н&Е поджелудочные железы оценивали на инсулит, как описано (Verdaguer, J. et al. (1997) J. Exp. Med. 186:1663-1676). В кратком изложении, инсулит оценивали как: 0, при отсутствии; 1, при периинсулите; 2, при инфильтрации, охватывающей < 25% островков; 3, при охвате 25-50% островков и 4, при охвате > 50% островков.
Ткани спинного мозга и головного мозга фиксировали в 10% забуференном формалине минимально в течение периода 24 часов, погружали в парафин и получали срезы 6 мкм. Срезы из погруженных в парафин тканей депарафинировали и подвергали демаскировке антигена, выпаривая срезы в буфере 10 мМ цитрата натрия (рН 6,0) в течение 20 мин и охлаждая при комнатной температуре в течение 20 мин. Для иммуногистохимии, срезы фиксировали 10% формалином и обрабатывали 3% Н2О2 в метаноле при - 20°С. У срезов повышали проницаемость 0,25% Triton-X 100 и блокировали блокирующим раствором из обезжиренного молока. Антитела кролика к IBA1 (Wako, 1:500) или антитела крысы к MBP (Abcam) инкубировали при 4°С в течение ночи с последующим соответствующим биотинилированнием вторичными антителами (1:500), комплексом авидин-биотин и 3,3'-диаминобензидином. Срезы контрастно окрашивали гематоксилином и эозином, ступенчато дегидратировали этанолом и монтировали акритолом. Для гистологического окрашивания миелина, срезы фиксировали 10% формалином или депарафинировали, ступенчато дегидратировали этанолом и инкубировали с 0,2% люксоловым быстрым голубым в 95% этаноле при 65°С. У срезов проводили развитие окраски в 0,05% карбонате лития, контрастно окрашивали гематоксилином и эозином и монтировали акритолом. Изображения мозжечка получали на светлопольном микроскопе Olympus. Воспалительные очаги (плотные кластеры ядросодержащих клеток или периваскулярные муфты с соответствующей демиелинизацией) подсчитывали и их размер определяли с использованием программного обеспечения ImageJ. Для количественного определения относительной интенсивности IBA1, наблюдатели вслепую ранжировали изображения от наибольшей до наименьшей интенсивности.
Коленные суставы иммунизированных bСII мышей фиксировали в 4% забфуференном формалине в течение ночи и декальцифицировали с использованием 14% ЭДТА в течение 3 недель. Декальцифицированные конечности погружали в парафин, получали срезы по 8 мкм и окрашивали гематоксилином и эозином для оценки инфильтрации и формирования паннуса по 5-бальной шкале, где 5 соответствует эрозивному артриту с тяжелой инфильтрацией и паннусом, охватывающих 60% пространства сустава. Истощение протеогликана на поверхности сустава голени и бедра оценивали по потере интенсивности окрашивания сафранином-О. Для этого срезы депарафинировали, гидратировали и окрашивали гематоксилином с последующим окрашиванием 0,05% водным быстрым зеленый в течение 5 минут. Срезы фиксировали 1% уксусной кислотой и окрашивали 0,1% водным сафранином-О в течение 2 минут, ступенчато дегидратировали этанолом, очищали ксилолом и монтировали с использованием DPX. Оценку проводили по шкале от 0 до 3 соответствующих: 0, при 0% истощении, 1, при низком ( < 25%), 2, умеренном (25-50%) и 3, тяжелом ( > 50%). Разрушение суставного хряща включало оценку присутствия мертвых хондроцитов (пустых лакун) и его оценивали по шкале от 3 (0, отсутствие пустых лакун; 3, полное отсутствие хондроцитов в суставном хряще/тяжелая эрозия сустава).
Выделение инфильтрирующих ЦНС лимфоцитов. Мышей анестезировали кетамиомн-ксилазином и проводили перфузию PBS через левый желудочек сердца. Головной мозг и спинной мозг выделяли вручную, но нарезали на небольшие фрагменты и расщепляли раствором коллагеназы D (1,25 мкг мл-1) и ДНКазы I (1% масс/об.) в HBSS в течение 30 минут при 37°С. Расщепленный ЦНС пропускали через 70 мкм клеточный фильтр. Клетки ресуспендировали в DMEM (дополненной 2% FBS и 10 мМ HEPES) и 100% перколле (до конечной концентрации перколла 30%). Раствор наслаивали на 65% перколл и центрифугировали при 380 g в течение 30 минут при комнатной температуре. Перед дальнейшими анализами слой мононуклеарных клеток, расположенный в интерфазе, отмывали RPMI.
Количественная ОТ-ПЦР. РНК выделяли из тетрамер 2.5mi/I-Ag7+ или тетрамер- CD4+ Т-клеток, отсортированных у обработанных 2.5mi/I-Ag7-NP мышей NOD и стимулированных in vitro покрытыми mAb к CD3/к CD28 гранулами DynaBeads.
Каждый образец тетрамер+, соответствовал клеткам собранным у 2-3 мышей. РНК подвергали обратной транскрипции и кДНК наносили на планшеты для кПЦР Mouse Immunology 384 StellArray (Bar Harbour BioTechnology) с использованием 2× готовой смеси SYBR Green Master Mix (Applied Biosystems). Планшет подвергали реакции в устройстве для ПЦР с детекцией в реальном времени 7900НТ Applied Biosystems, и необработанные данные анализировали с использованием инструмента для анализа Global Pattern Recognition (GPR) (http://www.gene-quantification.com/qpcr-array.html). иРНК, выделенную из дополнительных образцов, подвергали ОТ-кПЦР с использованием праймеров, специфичных для IL-21 (прямой: 5'-TCATCATTGACCTCGTGGCCC-3'; обратный: 5'-ATCGTACTTCTCCACTTGCAATCC-3'), IL-10 (прямой: 5'-CTTGCACTACCAAAGCCACA-3'; обратный: 5'-GTTATTGTCTTCCCGGCTGT-3'), c-Maf (прямой: 5'-AGCAGTTGGTGACCATGTCG-3'; обратный: 5'-TGGAGATCTCCTGCTTGAGG-3'), IFN-γ (прямой: 5'-TGAACGCTACACACTGCA TCTTGG-3'; обратный: 5'-CGACTCCTTTTCCGCTTCCTGAG-3'), LAG-3 (прямой: 5'-TCCCAAATCCTTCGGGTTAC-3'; обратный: 5'-GAGCTAGACTCTGCGGCGTA-3'), CD49b (прямой: 5'-CCGGGTGCTACAAAAGTCAT-3'; обратный: 5'-GTCGGCCACATTGAAAAAGT-3'), рецептор арильных цглеводородов (прямой: 5'-CGTCCCTGCATCCCACTACTT-3'; обратный: 5'-GGACATGGCCCCAGCATAG-3') и ICOS (прямой: 5'-TGACCCACCTCCTTTTCAAG-3'; обратный: 5'-TTAGGGTCATGCACACTGGA-3').
Индуцированное pMHC-NP повышение экспрессии транскриптов TR1 в активированных in vitro CD4+ Т-клетках проводили посредством культивирования наивных eGFP-BDC2.5-CD4+ Т-клеток BDC2.5 NOD Foxp3-eGFP мышей (CD62LhiFOXP3- eGFP-; 1,5×106 мл-1) с покрытыми mAb к CD3/к CD28 микрочастицами (1 гранула на клетку) в течение трех суток в отсутствие АРС с последующими одними сутками культивирования повторно выделенных (без микрочастиц) CD4+ Т-клеток в rhIL-2 (30 ME мл-1) и 6 сутками культивирования с пептидом 2.5mi (10 мкг мл-1), мономерами 2.5mi/I-Ag7 (25 мкг рМНС на мл), 2.5mi/I-Ag7-NP (25 мкг рМНС на мл и 50 мкг мл-1 железа) или неконъюгированными наночастицами (50 мкг железа на мл). Относительную экспрессию генов рассчитывали с использованием нестимулированных культур в качестве контроля.
Индуцированное pMHC-NP повышение экспрессии транскриптов TR1 в наивных BDC2.5 CD4+ Т-клетках по сравнению с клетками памяти in vivo проводили посредством трансфузии наивных eGFP-CD4+ Т-клеток (CD44medCD62Lhi) или eGFP-CD4+ Т-клеток памяти (CD44hiCD62Llow) трансгенных по BDC2.5-TCR мышей NOD или мышей NOD Foxp3-eGFP (Thy1b+) (1-1,5×106 клетки per host) хозяевам NOD.Thy1a и обрабатывая хозяев четырьмя дозами 2.5mi/I-Ag7-NP в течение двух недель или оставляя их необработанными. Через две с половиной недели Thy1b+CD4+ Т-клетки хозяев сортировали и стимулировали покрытыми антителами к CD3 и к CD28 магнитными гранулами DynaBeads в течение 3 суток с последующим выделением иРНК и ОТ-кПЦР с использованием праймеров, специфичных для c-Maf, IL-21, IL-10, IFNγ, LAG-3 и CD49b.
Для сравнения уровней иРНК IL-10 в тетрамер+СD4+ Т-клетках по сравнению с тетрамер- CD4+ Т-клетками обработанных pMHC-NP хозяев NSG с трансплантированными РВМС заявитель окрашивал спленоциты антителами к hCD4-FITC, к hCD19-APC и комплексом тетрамер-РЕ, как описано выше, и проводил сортировку клеток тетрамер+ и тетрамер- индивидуальных хозяев посредством FACS (FACSAria-BD Biosciences). Отсортированные клетки культивировали в течение 72 часов в RPMI-1640, содержащей 10% сыворотку АВ человека в присутствии DynaBeads с Т-активатором CD3/CD28 человека (LifeTechnologies) с использованием отношения клеток к гранулам 1:1. Тотальную РНК из клеточных осадков подвергали обратной транскрипции с использованием двойного раствора обратной транскриптазы/лизирующего раствора, содержащего 5 мМ DTT, 2 Ед мл-1 РНКазы, 500 мМ dNTP, 10 Ед мл-1 обратной транскриптазы Superscript (Invitrogen, LifeTechnologies), 100 мг мл-1 бычьего сывороточного альбумина, 1% Triton Х-100, 25 нг мл-1 олиго-dT (Invitrogen), 0,5 нМ спермидин и 1× буфер First Strant (Invitrogen) в 20 мкл в течение 60 минут при 50°С и 15 минут при 70°С. Затем авторы смешивали 1 мкл реакционного объема кДНК с 12,5 мкл раствора готовой смеси для ПЦР Power SyBRGreen (Applied Biosystem) и вносили в устройство для ПЦР с детекцией в реальном времени (7900НТ, Applied Biosystems) с использованием следующих праймеров: β-актин (прямой: 5'-CTGGAACGGTGAAGGTGACA-3'; обратный: 5'-AAGGGACTTCCTGTAACAATGCA-3'), IL-10 (прямой: 5'-ААGACCCAGACATCAAGGCG-3'; обратный: 5'-AATCGATGACAGCGCCGTAG-3').
Статистические анализы. Значения размеров выборок, описанные в легендах фигур, соответствуют количествам отдельных тестируемых мышей (без повторений) и представленные данные соответствуют объединенным данных различных экспериментов. Данные сравнивали посредством t-критерия Стьюдента, U-критерия Манна-Уитни, критерия хи-квадрат, лог-рангового критерия (Мантель-Кокса), корреляции Пирсона или двухстороннего ANOVA. Статистическую значимость полагали при Р<0,05.
Пример 3. Эффекты валентности и плотности рМНС in vivo.
Затем заявитель экспериментально тестировал прогнозы математической модели, сравнивая свойства обеспечивать размножение Трег клеток различных препаратов NP с PF-М (≈20 нм) и SFP-Z (≈8 нм), покрытых рМНС 2.5mi/I-Ag7, которые стимулировали размножение распознающих регуляторных CD4+ Т-клеток типа 1. Сравнение обеспечивающих размножение Трег свойств 7 различных препаратов 2.5mi-I-Ag7-PF-M с 29-59 pMHC/NP продемонстрировало четкое зависимое от дозы рМНС действие в рамках индивидуальных препаратов, а также отсутствие достоверного действия валентности рМНС в партиях (фигура 22А). Однако является важным, что в исследованиях с использованием менее крупных препаратов 2.5mi-I-Ag7-SFP-Z с 22-44 pMHC/NP показано значительно более сильное обеспечивающее размножение Тpeг действие во всех тестируемых дозах (0,75-1 мкг, 7,5-10 мкг и 25 мкг общего рМНС/дозу), чем у частиц 2.5mi-I-Ag7-PF-M с 29-45 pMHC/NP (фигура 22В). Эти результаты дополнительно подтверждали, получая NP из PF-M диаметром 11 нм и тестируя способность их покрытых 2.5mi-I-Ag7 аналогов обеспечивать размножение распознающих TR1 Т-клеток in vivo. Примечательно, что NP из PF-M диаметром 11 нм, доставляющие 7,5 мкг общего рМНС при 15 pMHC/NP, обеспечивали размножение распознающих клеток TR1 до 1,6±0,3% от тотальных CD4+ Т-клеток селезенки, значения, сравнимого с серией SFP NP, доставляющих 7,5 мкг 22-44 pMHC/NP.
Как указано выше, заявители продемонстрировали, что аутореактивные CD4+ Т-клетки памяти экспрессируют сбалансированную транскрипционную программу Т-регуляторного типа 1 (TR1) и экспортируют на клеточную поверхность LAG3, а не CD49b (маркеры TR1). Так как терапия 2.5mi-I-Ag7-NP инициирует экспрессию IL-10 и повышение экспрессии CD49b на сбалансированных TR1 Т-клетках памяти, таким образом, обеспечивая их преобразование в стабильные клетки TR1, заявитель задался вопросом, регулируется ли также эффективность этих процессов плотностью рМНС на поверхности NP. Примечательно, что наблюдали статистически значимую корреляцию между плотностью 2.5mi/I-Ag7 (но не общей дозой рМНС) и повышением экспрессии CD49b (но не LAG3) на подобных TR1 CD4+ Т-клетках, которые размножаются у мышей NOD дикого типа в ответ на терапию 2.5mi/I-Ag7-NP; этот эффект достигал пика при ≈0,012 рМНС/нм2 (фигура 22С). Все вместе, эти результаты поддерживают тезис, что плотность рМНС является критическим параметром при разработке основанных на рМНС нано лекарств.
Это влияние плотности рМНС на биологическую активность также наблюдали in vivo; увеличение плотности рМНС приводило к увеличенному повышению экспрессии маркер клеток TR1 CD49b у обработанных pMHC-NP мышей, что позволяет полагать, что плотность рМНС отвечает за содействие размножению Трег. Хотя общая доза рМНС была ассоциирована с обеспечивающими размножение Трег свойствами этих нанолекарств, она обладала только незначительным действием на этот фенотип, что позволяет полагать, что плотность рМНС и доза рМНС играют разные роли в обеспечении преобразования и размножение Трег, соответственно.
Эквиваленты
Следует понимать, что хотя настоящее изобретение конкретно описано посредством определенных вариантов осуществления и необязательных характеристик, специалисты в данной области могут проводить модификации, улучшения и вариации осуществляемого изобретения, описываемого в настоящем документе, и что такие модификации, улучшения и вариации рассматривают как находящиеся в объеме настоящего изобретения. Материалы, способы и примеры, предоставляемые по настоящему документу, представляют собой характеристики определенных вариантов осуществления, являются иллюстративными и не предназначены в качестве ограничений объема изобретения.
Изобретение описано в настоящем документе в широком и общем смысле. Каждый из более узких компонентов и субродовых группировок, входящих в основное изобретение, также формирует часть изобретения. Это включает общее описание изобретения с условием или отрицательным ограничением удаления любого из объектов изобретения из рода, вне зависимости от того описан ли конкретно исключаемый материал в настоящем документе или нет.
Кроме того, когда свойства или аспекты изобретения описаны в рамках групп Маркуша, специалистам в данной области понятно, что изобретение также таким образом описано в отношении любых отдельных представителей или подгрупп представителей группы Маркуша.
Использование термина "или" в формуле изобретения используют для обозначения "и/или" если явно не указано указание только альтернатив или альтернативы являются взаимоисключающими, хотя в изобретении поддерживается определение, которое относится только к альтернативам и "и/или".
Как используют в настоящем описании и формуле изобретения, слова "содержащий" (и любая форма содержания, такая как "содержат" и "содержит"), "обладающий" (и любая форма обладания, такая как "обладают" и "обладает"), "включающий" (и любая форма включения, такая как "включает" и "включают") являются инклюзивными или открытыми и не исключают дополнительных, неперечисленных элементов или этапов способов.
На всем протяжении настоящего описания проводится цитирование различных публикаций, патентов и опубликованных описаний патентов посредством идентифицирующей цитаты. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем документе явно полностью включены в качестве ссылки, в той же степени как если бы каждая была включены в качестве ссылки индивидуально. В случае конфликта руководствоваться следует настоящим описанием, включая определения.

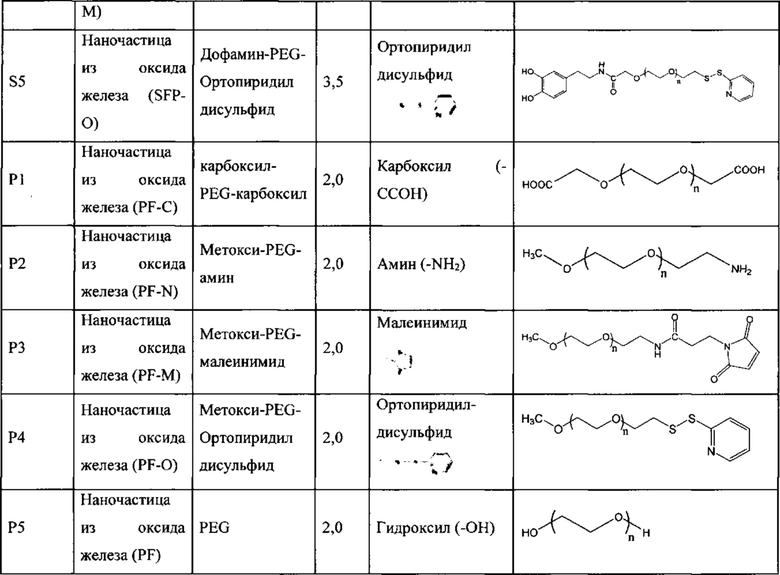
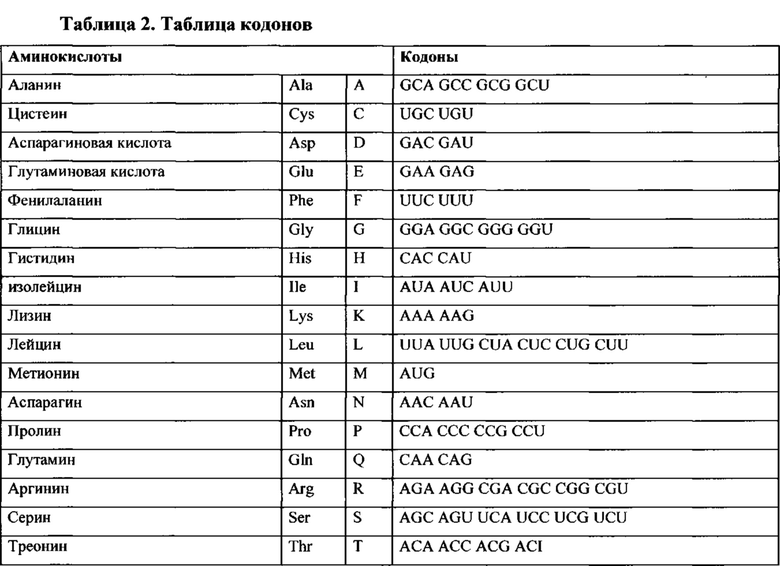
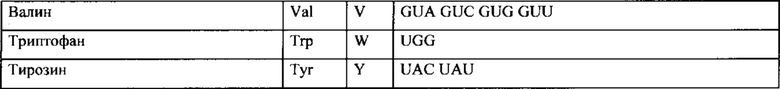


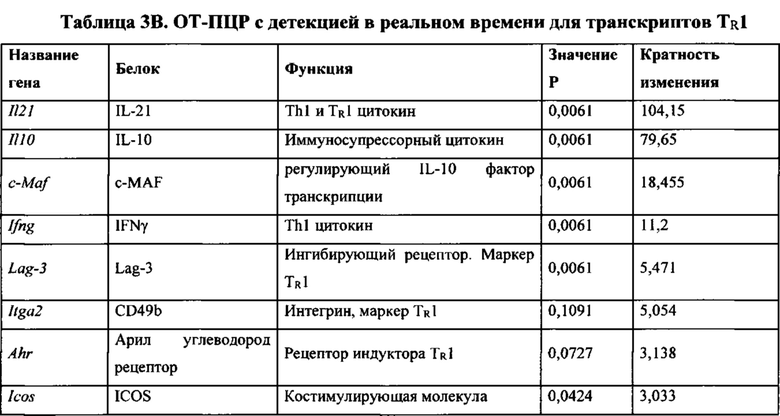

* Результат считают (+), если контрольным тетрамером окрашено более чем среднее + 3 S.E. образцов
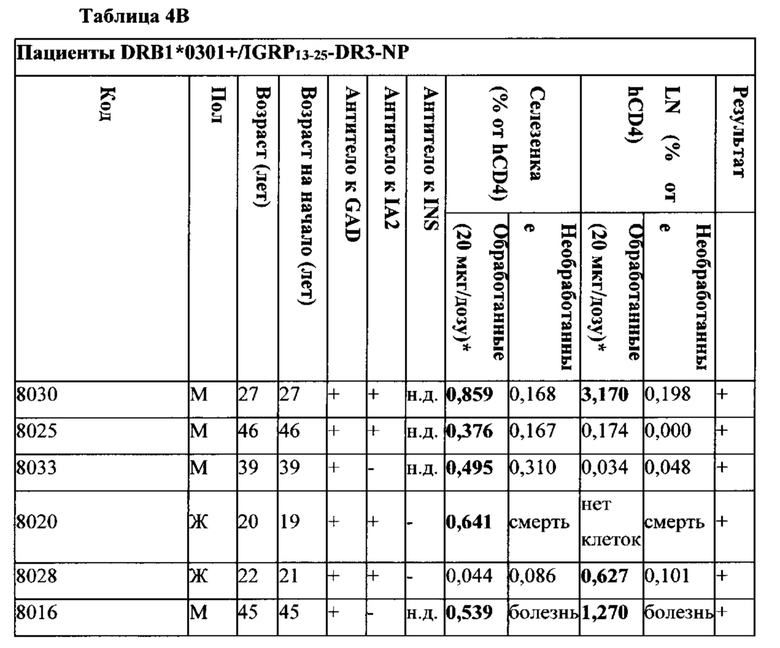
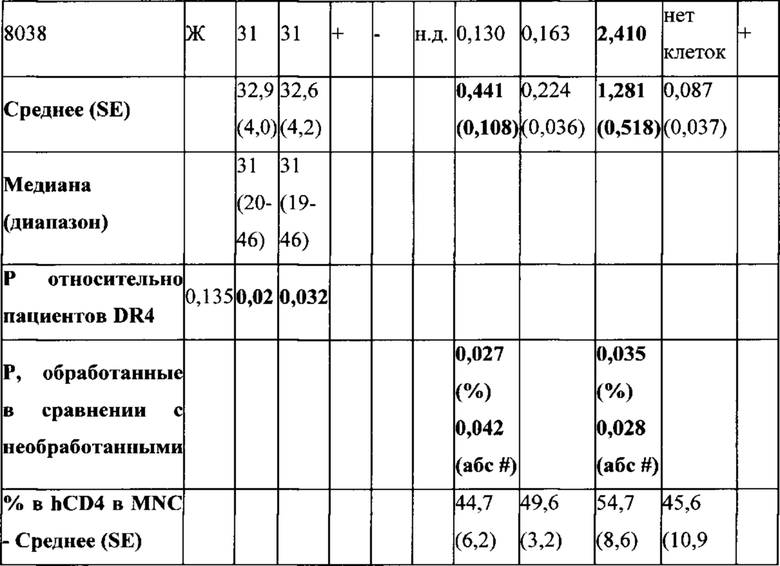
* Результат считают (+), если более чем среднее + 3 S.E. соответствуют образцам, полученным у хозяев NSG с восстановленными РВМС, но не необработанных pMHC-NP.
** Образцы PLN с увеличенным количеством IGRP 13-25/DR3 тетрамер+ клеток были значимо увеличены и обладали увеличенной насыщенностью клетками по сравнению с образцами, полученными у обработанных мышей с отсутствием такого увеличения (Р=0,048) или у необработанных мышей (Р=0,036). Существовала статистически значимая корреляция между % тетрамер+ клеток и общим количеством клеток PLN (r2=0,455; Р=0,032)

* Результат считают (+), если более чем среднее + 3 S.E. соответствуют образцам, полученным у хозяев NSG с восстановленными РВМС, но не необработанных.
Ссылки
1 Lieberman, S. & DiLorenzo, Т. A comprehensive guide to antibody and T-cell responses in type 1 diabetes. Tissue Antigens 62, 359-377 (2003).
2 Tsai, S., Shameli, A. & Santamaria, P. CD8+ T-cells in autoimmune diabetes. Adv. Immunol. 100, 79-124 (2008).
3 Santamaria, P. The long and winding road to understanding and conquering type 1 diabetes. Immunity 32, 437-445 (2010).
4 Babbe, H. et al. Clonal expansions of CD8(+) T cells dominate the T cell infiltrate in active multiple sclerosis lesions as shown by micromanipulation and single cell polymerase chain reaction. J. Exp. Med. 192, 393-404 (2000).
5 Zang, Y. C. et al. Increased CD8+ cytotoxic T cell responses to myelin basic protein in multiple sclerosis. J. Immunol. 172, 5120-5127 (2004).
6 Walter, U. & Santamaria, P. CD8+ T cells in autoimmunity. Curr. Opin. Immunol. 17, 624-631 (2005).
7 Firestein, G. S. Evolving concepts of rheumatoid arthritis. Nature 423, 356-361 (2003).
8 Sakaguchi, S. et al. Foxp3+ CD25+ CD4+ natural regulatory T cells in dominant self-tolerance and autoimmune disease. Immunol. Rev. 212, 8-27 (2006).
9 Miyara, M. et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity 30, 899-911 (2009).
10 Chen, Q., Kim, Y. C., Laurence, A., Punkosdy, G. A. & Shevach, E. M. IL-2 controls the stability of Foxp3 expression in TGF-beta-induced Foxp3+ T cells in vivo. J. Immunol. 186, 6329-6337(2011).
11 Yang, X. P. et al. Opposing regulation of the locus encoding IL-17 through direct, reciprocal actions of STAT3 and STAT5. Nat. Immunol. 12, 247-25 (2011).
12 Marwaha, A. K. et al. Cutting edge: Increased IL-17-secreting T cells in children with new-onset type 1 diabetes. J. Immunol. 185, 3814-3818 (2010).
13 McClymont, S. A. et al. Plasticity of human regulatory T cells in healthy subjects and patients with type 1 diabetes. J. Immunol. 186, 3918-3926 (2011).
14 Komatsu, N. et al. Heterogeneity of natural Foxp3+ T cells: a committed regulatory T-cell lineage and an uncommitted minor population retaining plasticity. Proc. Natl. Acad. Sci. U.S.A. 106, 1903-1908 (2009).
15 Zhou, L., Chong, M. M. & Liftman, D. R. Plasticity of CD4+ T cell lineage differentiation. Immunity 30, 646-655 (2009).
16 Zhou, X. et al. Instability of the transcription factor Foxp3 leads to the generation of pathogenic memory T cells in vivo. Nat. Immunol. 10, 1000-1007 (2009).
17 Komatsu, N. et al. Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis. Nat. Med. 20, 62-68 (2014).
18 Bailey-Bucktrout, S. L. et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity 39, 949-962 (2013).
19 Bacchetta, R. et al. High levels of interleukin 10 production in vivo are associated with tolerance in SCID patients transplanted with HLA mismatched hematopoietic stem cells. J. Exp. Med. 179, 493-502 (1994).
20 Roncarolo, M. G. et al. Interleukin-10-secreting type 1 regulatory T cells in rodents and humans. Immunol. Rev. 212, 28-50 (2006).
21 Gagliani, N. et al. Coexpression of CD49b and LAG-3 identifies human and mouse T regulatory type 1 cells. Nat. Med. 19, 739-746 (2013).
22 McLarnon, A. IBD: Regulatory T-cell therapy is a safe and well-tolerated potential approach for treating refractory Crohn's disease. Nature Rev Gastroenterol Hepatol 9, 559 (2012).
23 Desreumaux, P. et al. Safety and Efficacy of Antigen-Specific Regulatory T-Cell Therapy for Patients With Refractory Crohn's Disease. Gastroenterology 143, 1207-1217 (2012).
24 Roncarolo, M. G., Gregori, S., Lucarelli, В., Ciceri, F. & Bacchetta, R. Clinical tolerance in allogeneic hematopoietic stem cell transplantation. Immunol. Rev. 241, 145-163 (2011).
25 Tsai, S. et al. Reversal of autoimmunity by boosting memory-like autoregulatory T cells. Immunity 32, 568-580 (2010).
26 Clemente-Casares, X., Tsai, S., Yang, Y. & Santamaria, P. Peptide-MHC-based nanovaccines for the treatment of autoimmunity: a "one size fits all" approach? J. Mol. Med. 89, 733-742 (2011).
27 Stratmann, T. et al. Susceptible MHC alleles, not background genes, select an autoimmune T cell reactivity. J. Clin. Invest. 112, 902-914 (2003).
28 Mukherjee, R., Wagar, D., Stephens, Т., Le-Chan, E. & Singh, B. Identification of CD4+ T cell-specific epitopes of islet-specific glucose-6-phosphatase-catalytic subunit-related protein: a novel beta cell autoantigen in type 1 diabetes. J. Immunol. 174, 5306-5315 (2005).
29 Kamanaka, M. et al. Expression of interleukin-10 in intestinal lymphocytes detected by an interleukin-10 reporter knockin tiger mouse. Immunity 25, 941-952 (2006).
30 Yoshizaki, A. et al. Regulatory В cells control T-cell autoimmunity through IL-21 -dependent cognate interactions. Nature 491, 264-268 (2012).
31 Onoda, T. et al. Human CD4+ central and effector memory T cells produce IL-21: effect on cytokine-driven proliferation of CD4+ T cell subsets. Int. Immunol. 19, 1191-1199 (2007).
32 Pot, C. et al. Cutting edge: IL-27 induces the transcription factor c-Maf, cytokine IL-21, and the costimulatory receptor ICOS that coordinately act together to promote differentiation of IL-10-producingTRl cells. J. Immunol. 183, 797-801 (2009).
33 Spensieri, F. et al. Human circulating influenza-CD4+ ICOS1+IL-21+ T cells expand after vaccination, exert helper function, and predict antibody responses. Proc. Natl. Acad. Sci. U.S.A. 110, 14330-14335 (2013).
34 Hale, J. S. et al. Distinct memory CD4+ T cells with commitment to T follicular helper- and T helper 1-cell lineages are generated after acute viral infection. Immunity 38, 805-817(2013).
35 Sato, K. et al. Marked induction of c-Maf protein during Th17 cell differentiation and its implication in memory Th cell development. J. Biol. Chem. 286, 14963-14971 (2011).
36 Saraiva, M. et al. Interleukin-10 production by Th1 cells requires interleukin-12-induced STAT4 transcription factor and ERK MAP kinase activation by high antigen dose. Immunity 31, 209-219 (2009).
37 Verdaguer, J. et al. Spontaneous autoimmune diabetes in monoclonal T cell nonobese diabetic mice. J. Exp. Med. 186, 1663-1676 (1997).
38 Wang, J. et al. In situ recognition of autoantigen as an essential gatekeeper in autoimmune CD8+ T cell inflammation. Proc. Natl. Acad. Sci. U.S.A. 107, 9317-9322 (2010).
39 Amrani, A. et al. Progression of autoimmune diabetes driven by avidity maturation of a T-cell population. Nature 406, 739-742 (2000).
40 Stratmann, T. et al. The I-Ag7 MHC class II molecule linked to murine diabetes is a promiscuous peptide binder. J. Immunol. 165, 3214-3225 (2000).
41 Yang, J. et al. Islet-specific glucose-6-phosphatase catalytic subunit-related protein-reactive CD4+ T cells in human subjects. J. Immunol. 176, 2781-2789 (2006).
42 Hoist, J. et al. Generation of T-cell receptor retrogenic mice. Nat. Protoc. 1, 406-417 (2006).
43 Yoshida, K. et al. Evidence for shared recognition of a peptide ligand by a diverse panel of non-obese diabetic mice-derived, islet-specific, diabetogenic T cell clones. Int. Immunol. 14, 1439-1447 (2002).
44 Reijonen, H. et al. Detection of GAD65-specific T-cells by major histocompatibility complex class II tetramers in type 1 diabetic patients and at-risk subjects. Diabetes 51, 1375-1382 (2002).
45 Yang, J. et al. CD4+ T cells from type 1 diabetic and healthy subjects exhibit different thresholds of activation to a naturally processed proinsulin epitope. J. Autoimmun. 31, 30-41 (2008).
46 Moore, A., Grimm, J., Han, B. & Santamaria, P. Tracking the recruitment of diabetogenic CD8+ T cells to the pancreas in real time. Diabetes 53, 1459-1466 (2004).
47 Giuliani, F. et al. Additive effect of the combination of glatiramer acetate and minocycline in a model of MS. J. Neuroimmunol. 158, 213-221 (2005).
48 Leavenworth, J. W., Tang, X., Kim, H. J., Wang, X. & Cantor, H. Amelioration of arthritis through mobilization of peptide-specific CD8+ regulatory T cells. J. Clin. Invest. 123, 1382-1389 (2013).
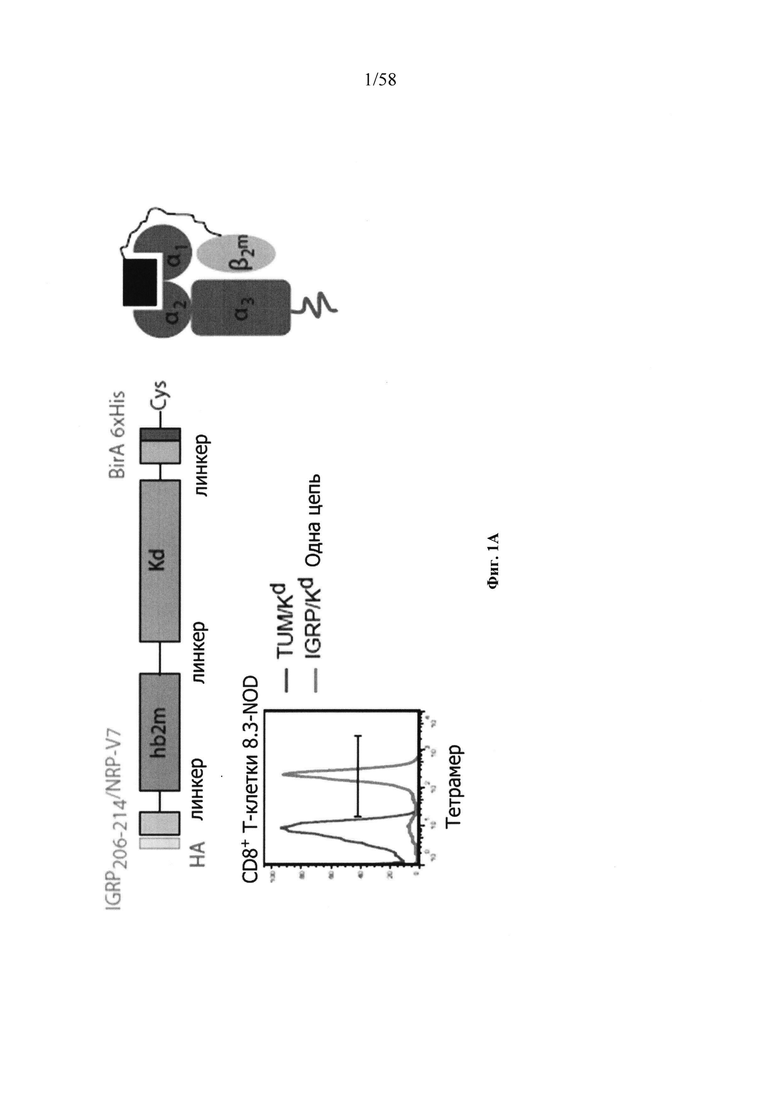


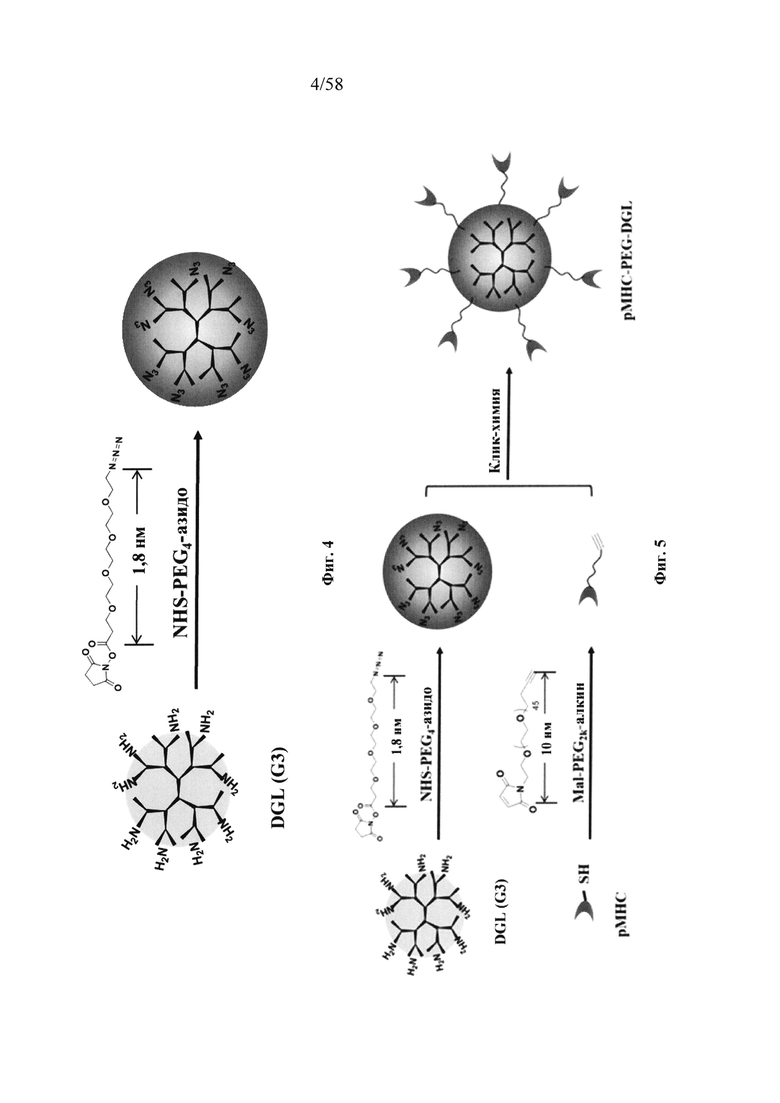


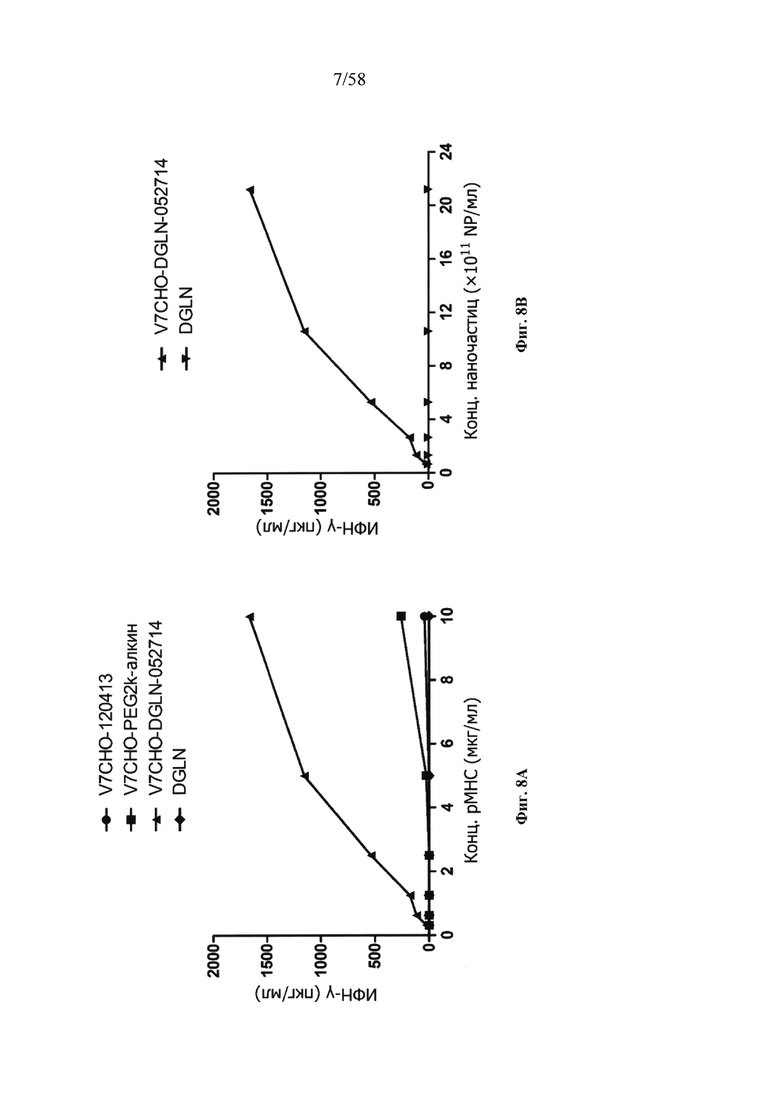
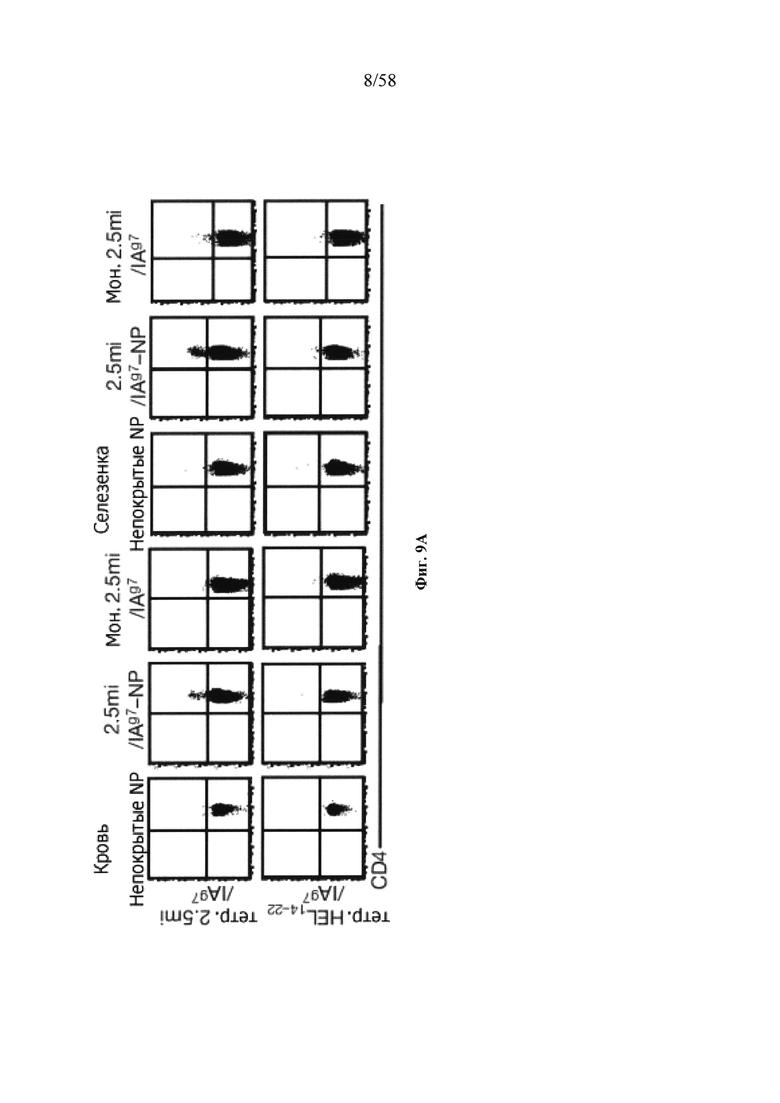
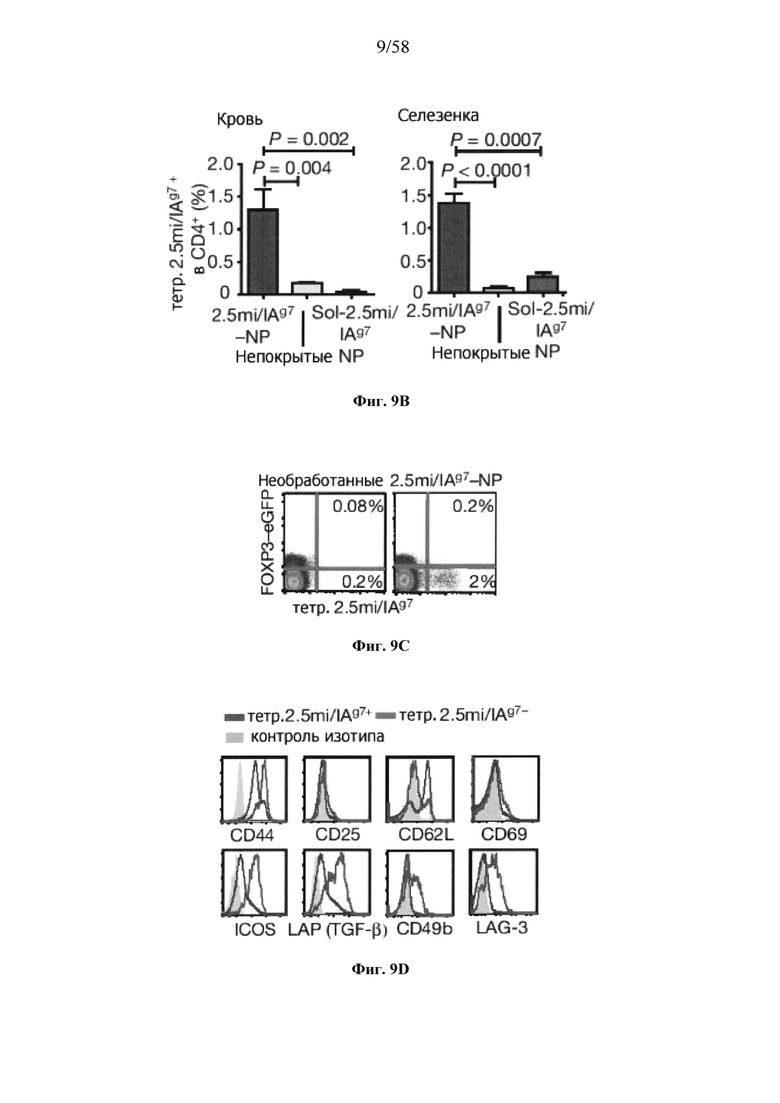
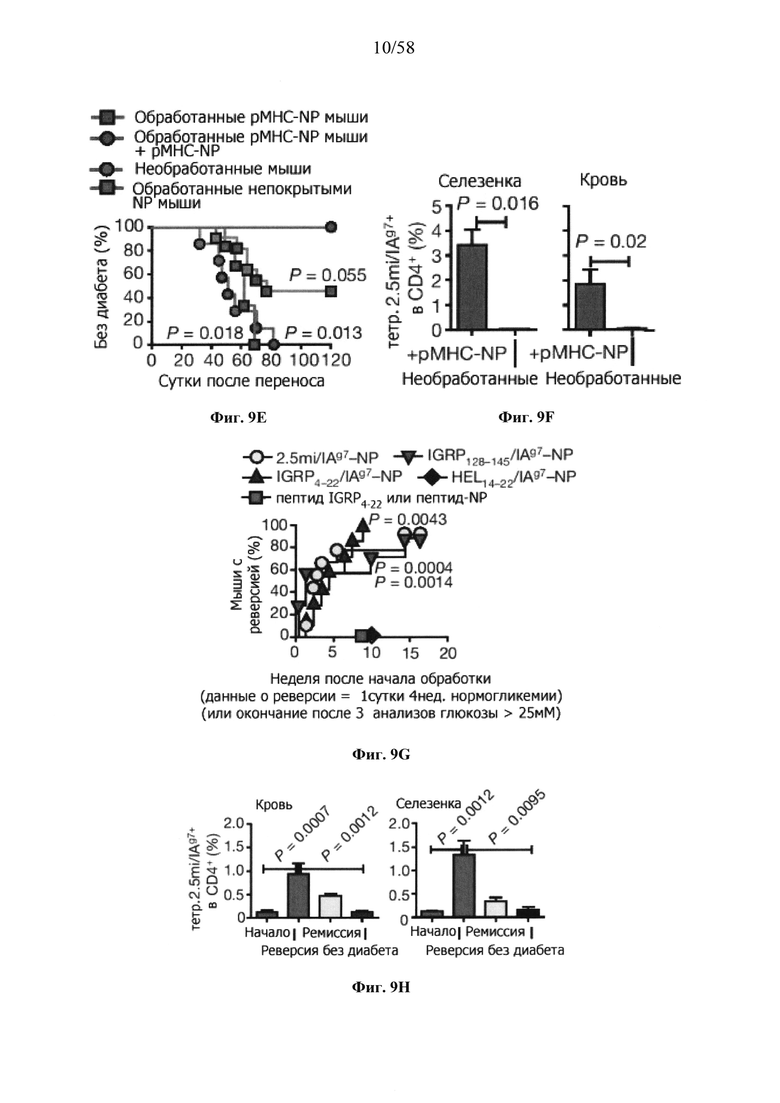

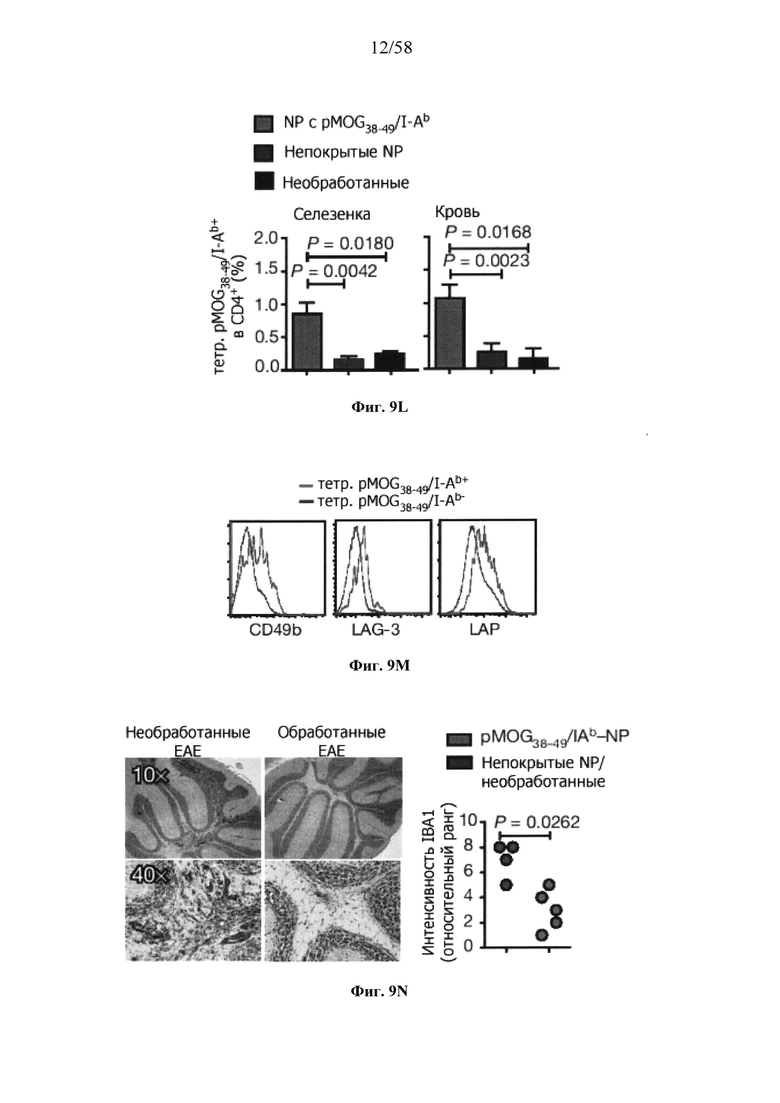

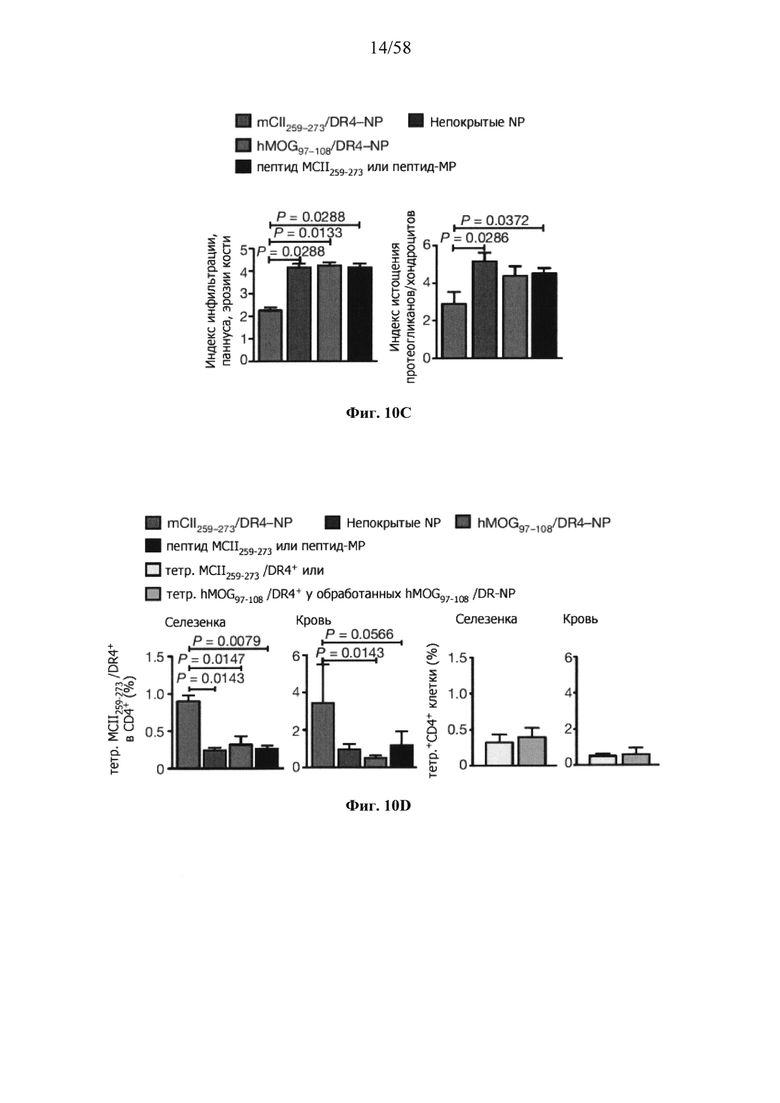

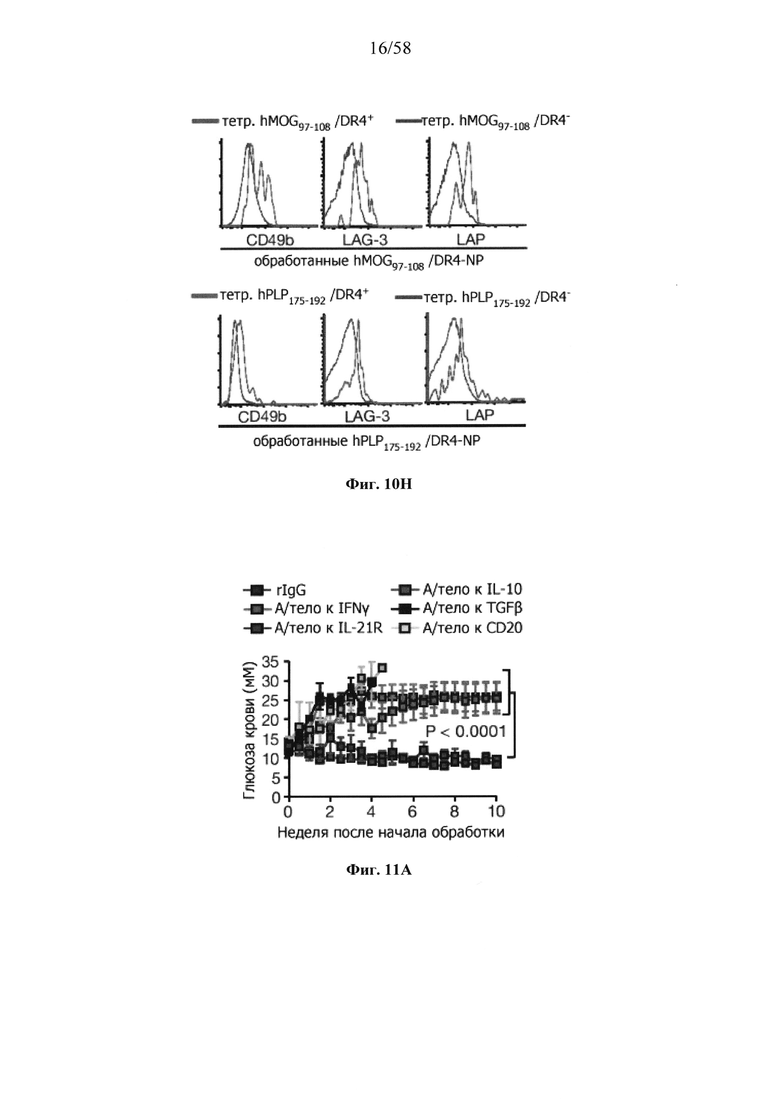

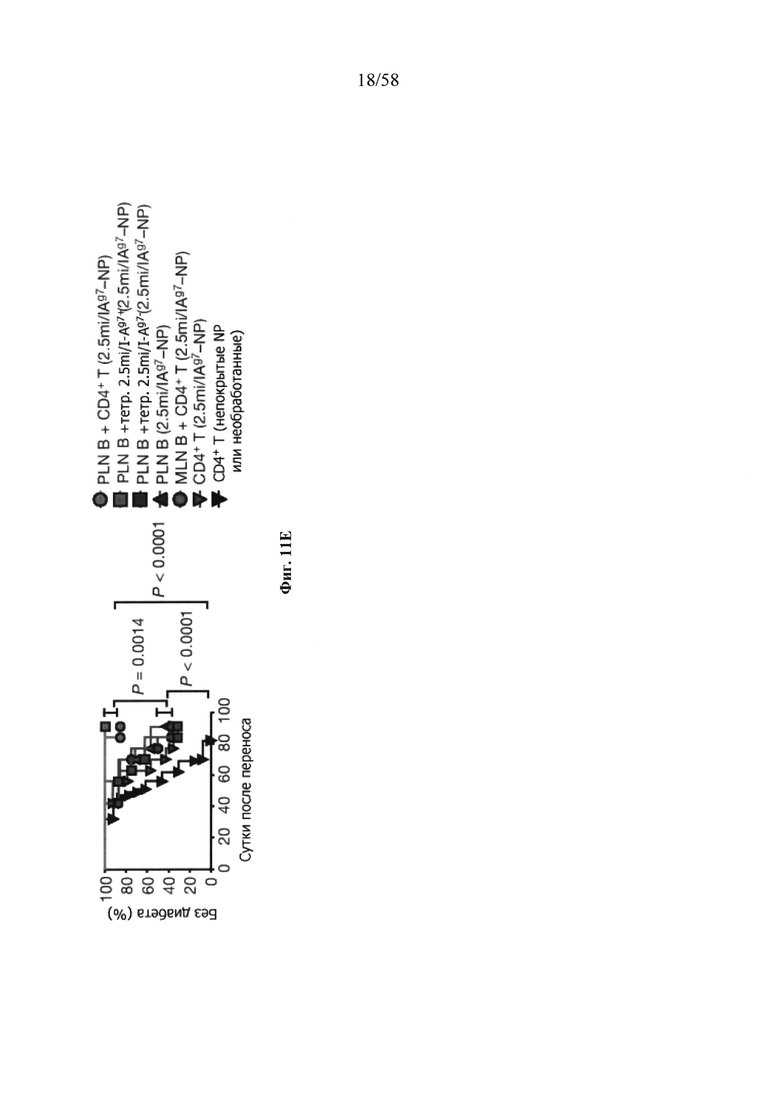
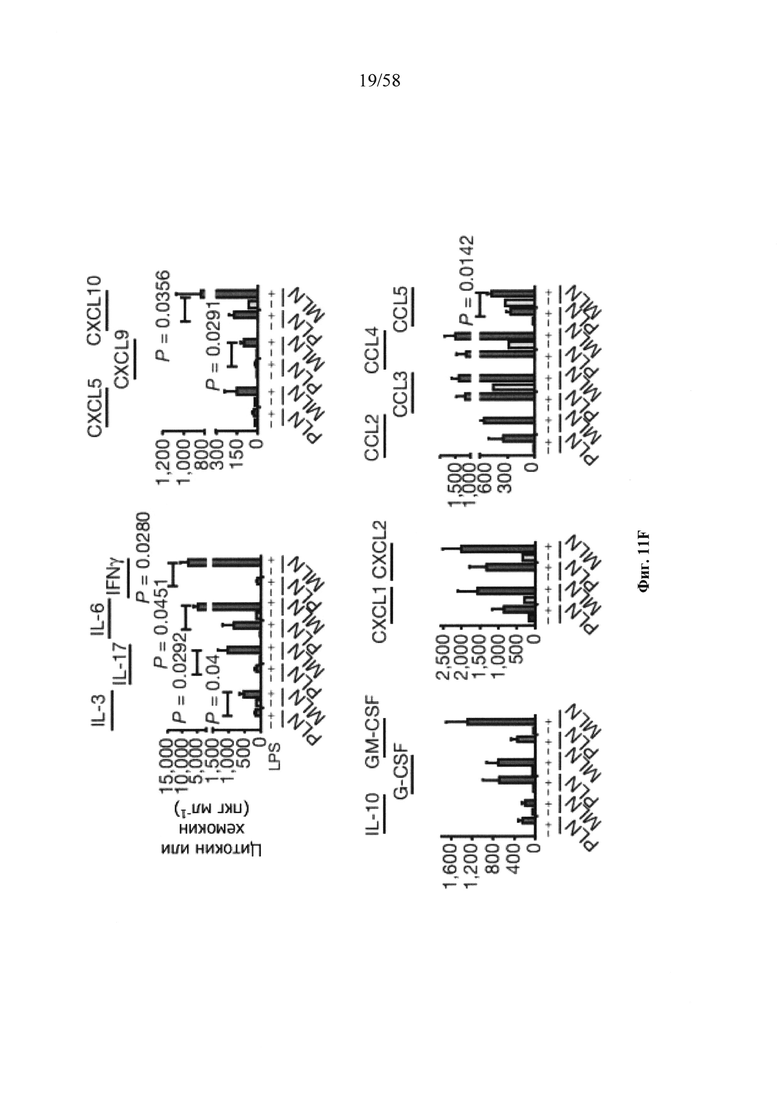
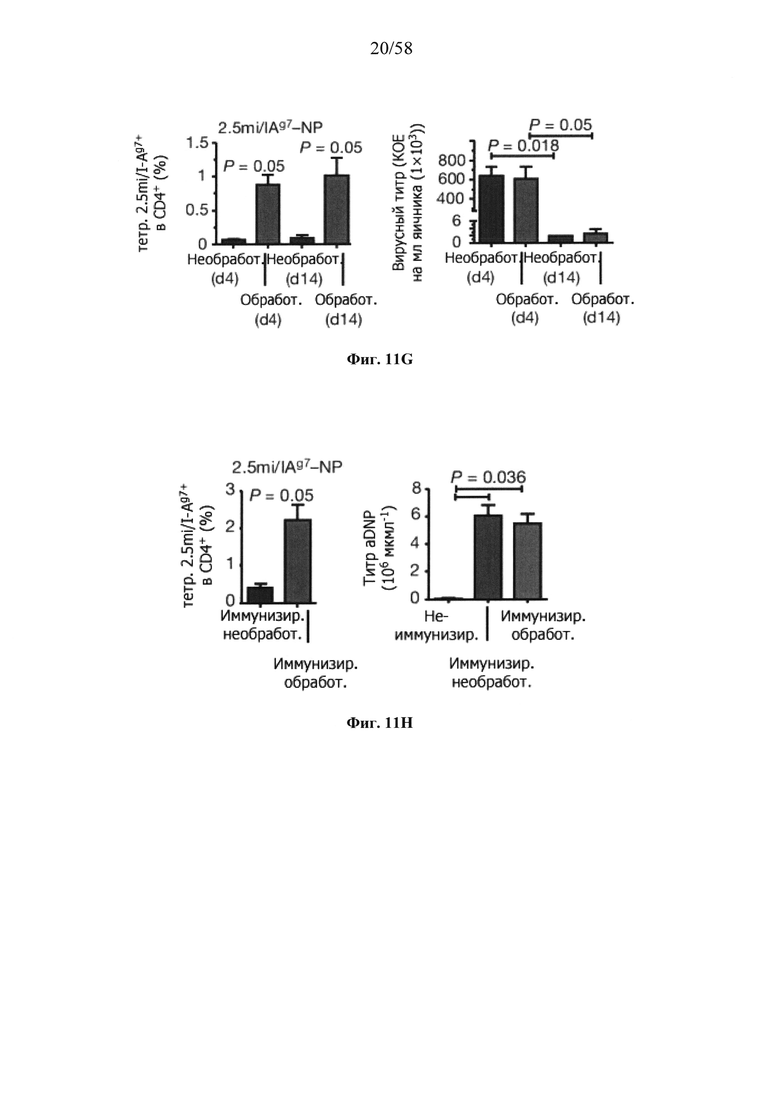






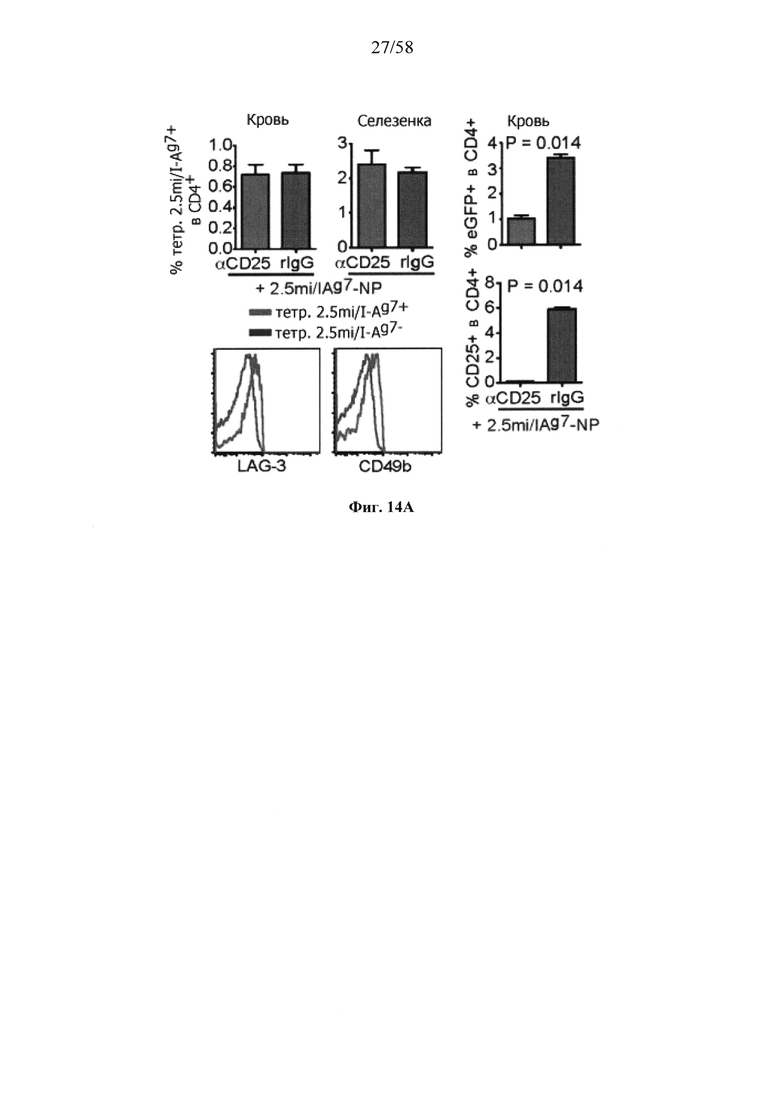



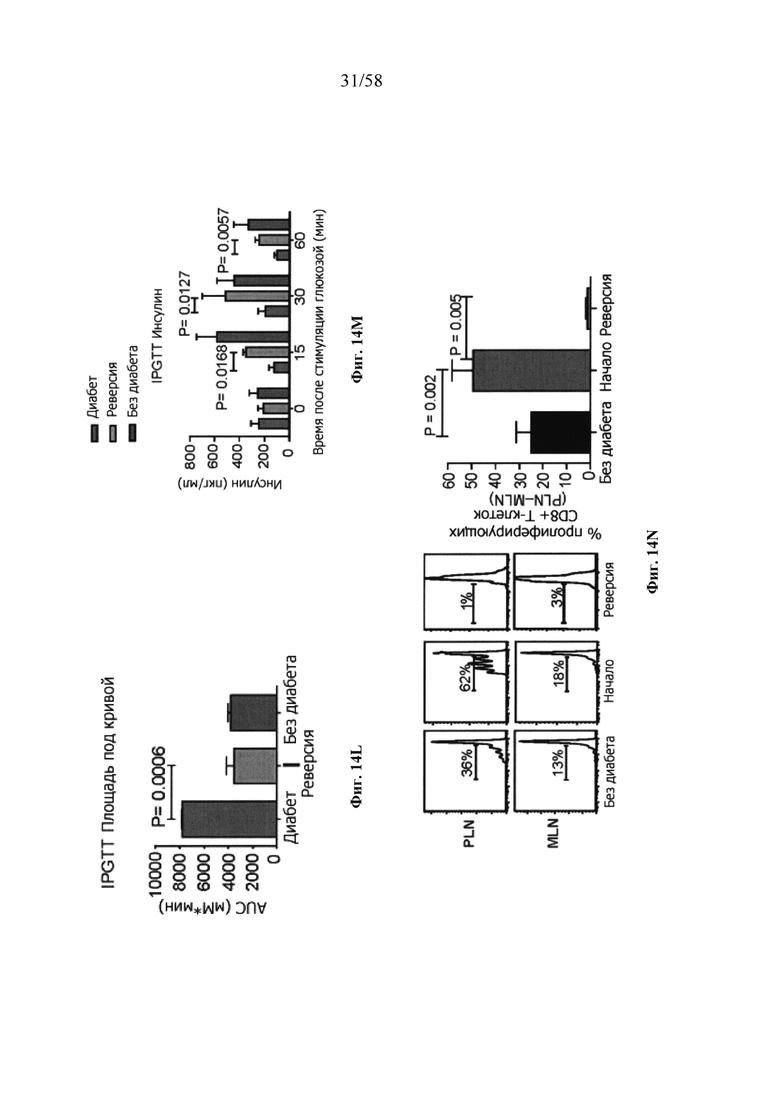
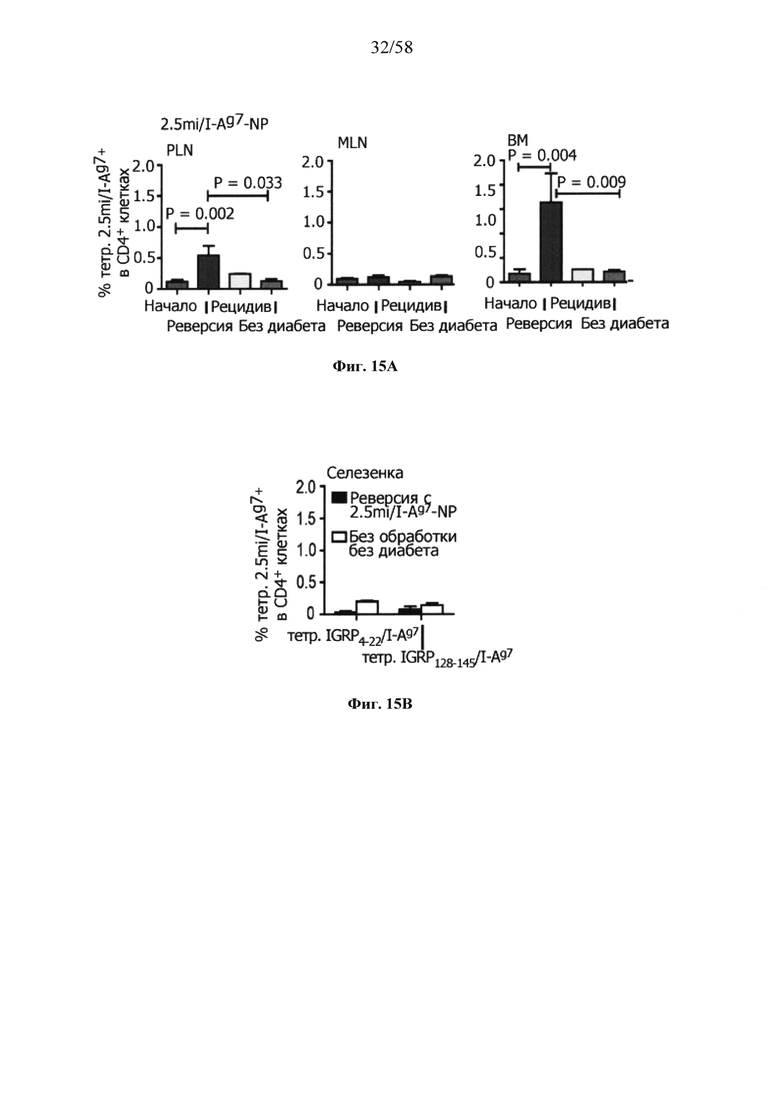






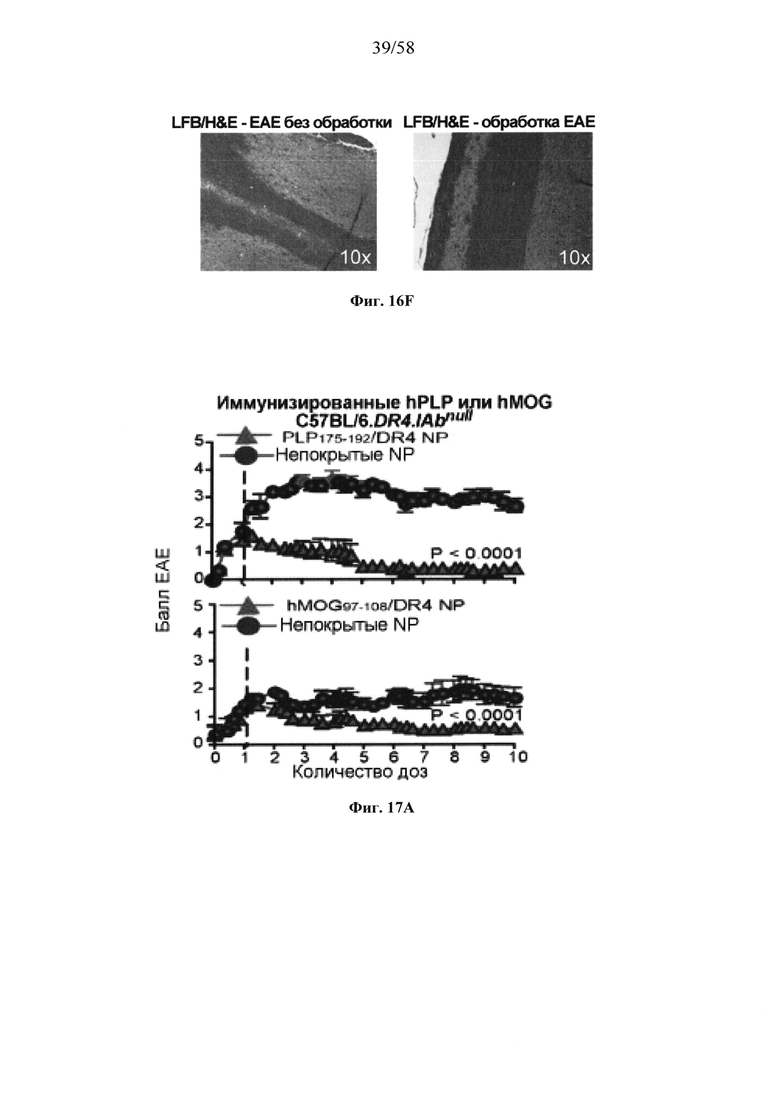
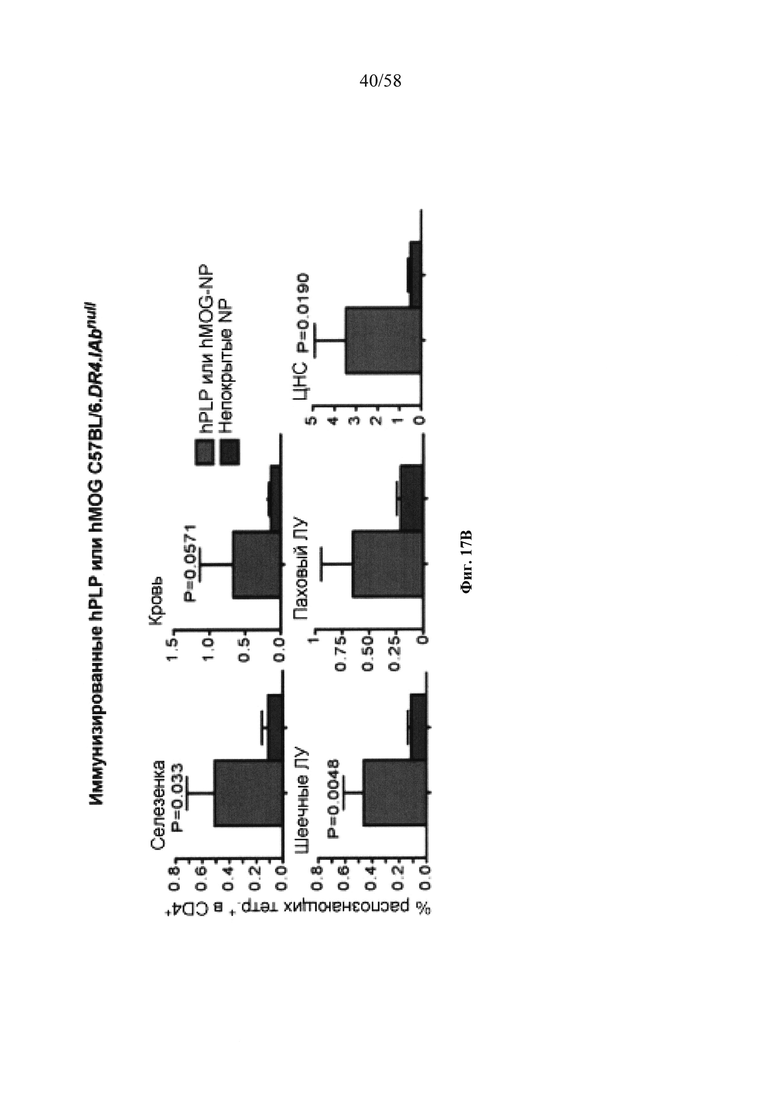

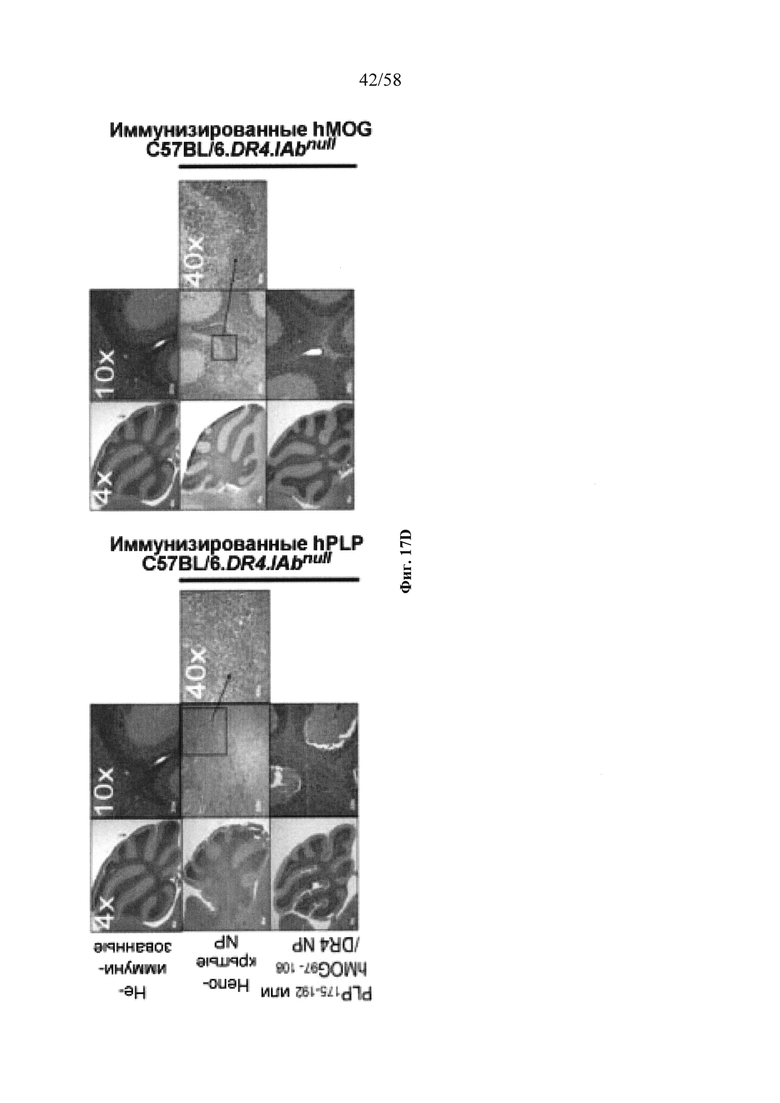

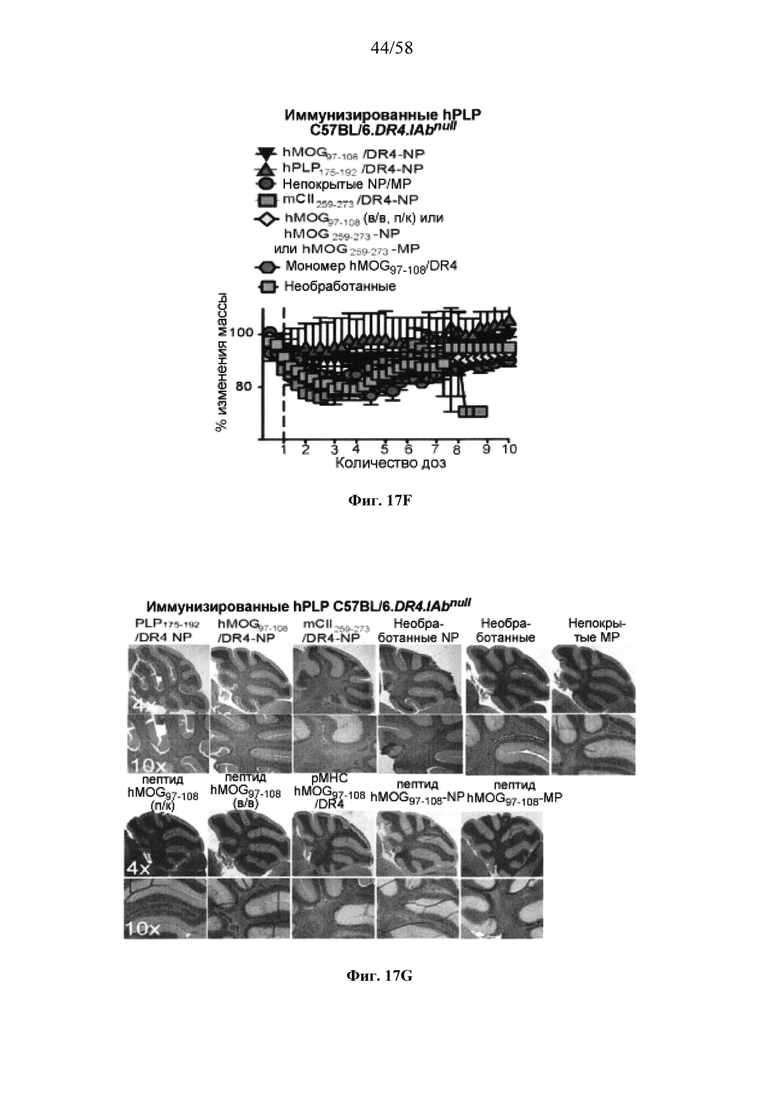

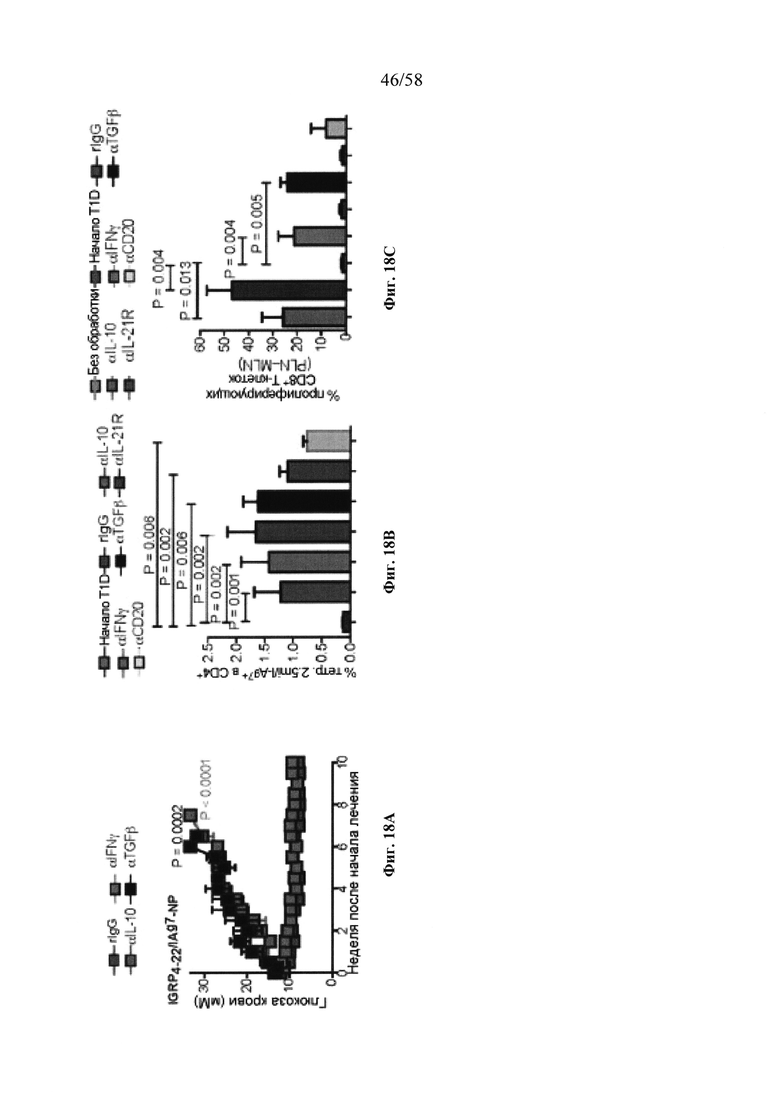


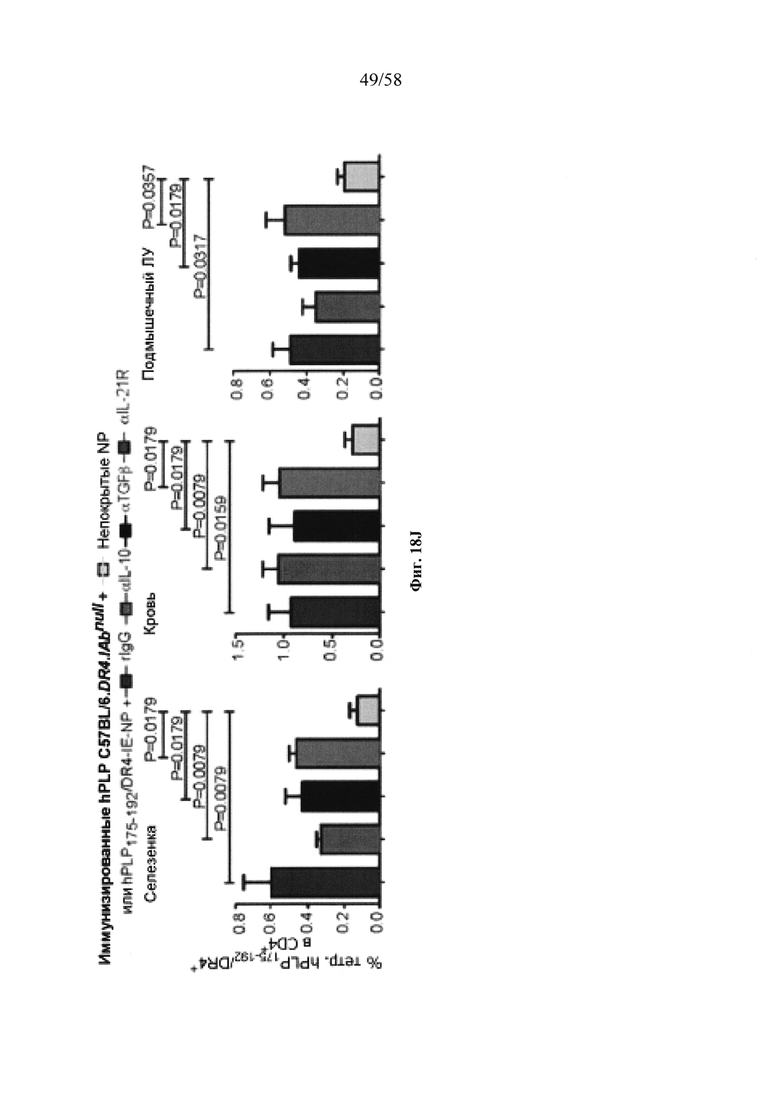
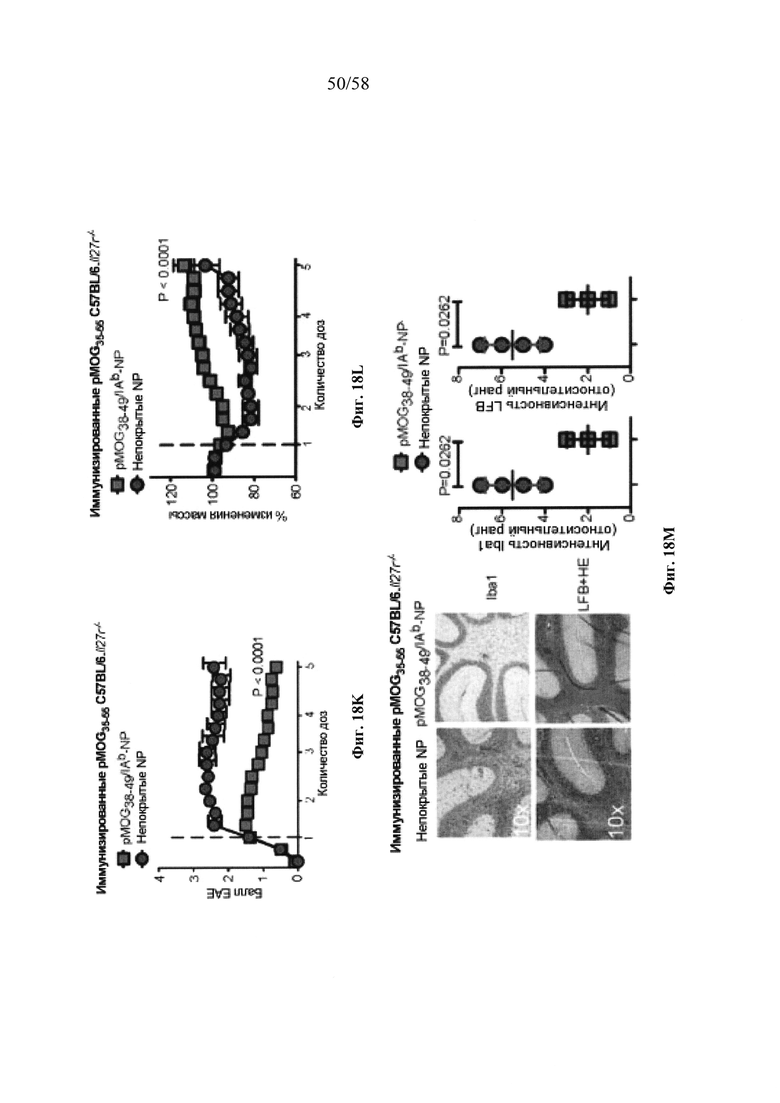





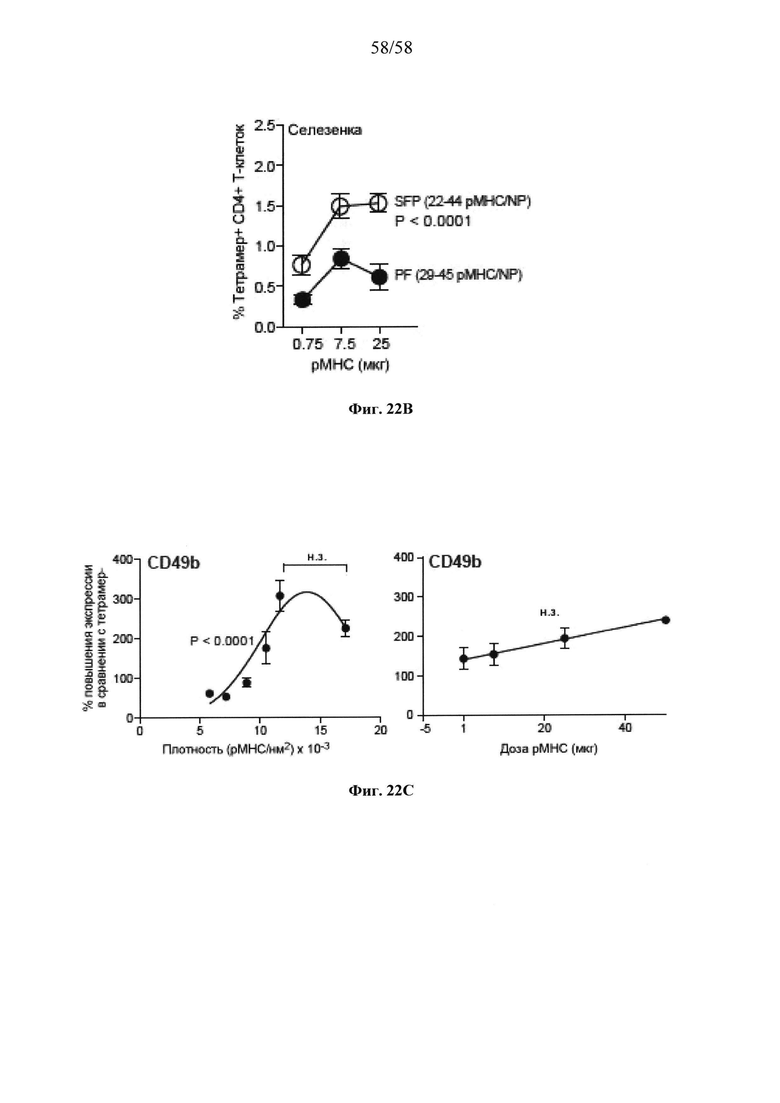
Изобретение относится к области фармацевтики и химии, а именно к фармацевтической композиции для лечения первичного билиарного цирроза у субъекта, содержащей комплекс наночастицы, сердцевина которой связана с количеством комплексов антиген-MHC класса II (pMHCII), где сердцевина содержит оксид железа и ее диаметр составляет от 1 нм до 25 нм; где антиген представляет собой PDC-E2 или его фрагмент, способный индуцировать иммунный ответ; где количество связанных pMHCII на площадь поверхности наночастицы составляет от 0,4 pMHC/100 нм2 до 12 pMHC/100 нм2, где pMHCII связаны с функционализированным малеимидом концом полиэтиленгликольного (PEG) линкера, молекулярная масса которого меньше 5 кДа, где не функционализированный малеимидом конец полиэтиленгликольного (PEG) линкера связан с поверхностью сердцевины, причем комплекс дифференцирует активированную T-клетку или T-клетку памяти в клетку TR1, продуцирующую IL-10, и где комплекс наночастицы содержится в количестве, достаточном для лечения первичного биллиарного цирроза у субъекта. Технический результат заключается в лечении первичного биллиарного цирроза у субъекта за счет способности pMHC на сердцевине наночастицы инициировать образование клеток TR1, подавляющих антигенспецифичный ответ, регулируемой плотностью pMHC на сердцевине наночастицы. 8 з.п. ф-лы, 22 ил., 24 табл., 3 пр.
1. Фармацевтическая композиция для лечения первичного билиарного цирроза у субъекта, содержащая комплекс наночастицы, сердцевина которой связана с количеством комплексов антиген-MHC класса II (pMHCII),
где сердцевина содержит оксид железа и ее диаметр составляет от 1 нм до 25 нм;
где антиген представляет собой PDC-E2 или его фрагмент, способный индуцировать иммунный ответ;
где количество связанных pMHCII на площадь поверхности наночастицы составляет от 0,4 pMHC/100 нм2 до 12 pMHC/100 нм2,
где pMHCII связаны с функционализированным малеимидом концом полиэтиленгликольного (PEG) линкера, молекулярная масса которого меньше 5 кДа, где не функционализированный малеимидом конец полиэтиленгликольного (PEG) линкера связан с поверхностью сердцевины, причем комплекс дифференцирует активированную T-клетку или T-клетку памяти в клетку TR1, продуцирующую IL-10, и
где комплекс наночастицы содержится в количестве, достаточном для лечения первичного биллиарного цирроза у субъекта.
2. Фармацевтическая композиция по п. 1, где молекула MHCII множества комплексов антиген-pMHCII содержит HLA DR, HLA DQ, HLA DP или их фрагмент.
3. Фармацевтическая композиция по п. 2, где молекула MHCII множества комплексов антиген-pMHCII содержит HLA-DRB1/DRA, HLA-DRB3/DRA, HLA-DRB4/DRA, HLA-DRB5/DRA, HLA-DQA1/HLA-DQB1, HLA-DPB1/HLA-DPA1 или их фрагмент.
4. Фармацевтическая композиция по п. 1, где комплекс дополнительно содержит внешний слой.
5. Фармацевтическая композиция по п. 1, где валентность множества комплексов антиген-pMHCII на сердцевину составляет от 10:1 до 100:1.
6. Фармацевтическая композиция по п. 1, где диаметр сердцевины наночастицы составляет от 5 нм до 25 нм.
7. Фармацевтическая композиция по п. 1, где количество связанных pMHCII на площадь поверхности наночастицы составляет от 0,4 pMHCII/100 нм2 до 6 pMHCII/100 нм2.
8. Фармацевтическая композиция по п. 1, где pMHCII ковалентно связаны с сердцевиной посредством образования связи углерод-сера между тиольной (-SH) группой остатка цистеина, добавленного к карбоксильному концу pMHCII, и малеимидом.
9. Фармацевтическая композиция по п. 1, где клетка TR1, продуцирующая IL-10, экспрессирует CD49b.
| WO 2012041968 A1, 05.04.2012 | |||
| WO 2014080286 A2, 30.05.2014 | |||
| WO 2008109852 A2, 12.09.2008 | |||
| US 2005003431 A1, 06.01.2005 | |||
| US 2006216239 A1, 28.09.2006. |
Авторы
Даты
2022-06-02—Публикация
2016-05-06—Подача